Настоящее изобретение относится к медицине, а более конкретно к фотосенсибилизаторам для фотодинамической терапии (ФДТ) новообразований и ряда других заболеваний, лекарственным формам на их основе и способу проведения фотодинамической терапии с использованием приготовленных лекарственных форм.
Метод ФДТ основан на использовании фотосенсибилизаторов, которые обладают способностью при системном, например, внутривенном введении селективно накапливаться в опухоли и при последующем световом облучении патологического участка катализировать образование цитотоксических агентов, в частности синглетного кислорода и высокореакционноспособных кислородсодержащих радикалов. Недостатком применяющихся в клинической практике фотосенсибилизаторов на основе производных гематопорфиринов, например HPD (hematoporphyrin derivative), Fotofrin-2, является невысокая интенсивность поглощения в полосе фотовозбуждения (625-640 нм) (R.Bonnett. Photosensitizers of the porphyrin and phthalocyanine series for photodynamic therapy. Chem. Soc. Rev., 24(1), 19-33, 1995). Значительное собственное поглощение биологической ткани в этой спектральной области обусловливает малую глубину проникновения излучения и затрудняет лечение опухолей больших размеров (R.Bonnett. Photosensitizers of the porphyrin and phthalocyanine series for photodynamic therapy. Chem. Soc. Rev., 24(1), 19-33, 1995).
Этот недостаток частично устранен при использовании производных фталоцианинов. Известен фотосенсибилизатор "Фотосенс" на основе сульфированного фталоцианина гидроксиалюминия, поглощающий в более длинноволновой красной области (675 нм) с коэффициентом экстинкции, превышающим 105 л×моль-1 ·см-1, благодаря чему его поглощение в рабочем диапазоне вводимых доз становится сопоставимым с собственным поглощением биологической ткани (Е.А.Лукьянец. Новые сенсибилизаторы для фотодинамической терапии. Росс. хим. журнал, 42(5), 9-16, 1998). Собственное поглощение несенсибилизированных тканей остается значительным и в области поглощения "Фотосенса", что ограничивает глубину воздействия на опухоль и снижает эффективность использования энергии светового излучения.
С целью решения задачи повышения эффективности ФДТ глубоких опухолевых тканей разрабатываюся фотосенсибилизаторы с интенсивным поглощением в спектральной области "терапевтического окна" - далее 700 нм. Так, в качестве фотосенсибилизатора для ФДТ предложены фенилтиопроизводные фталоцианина общей формулы
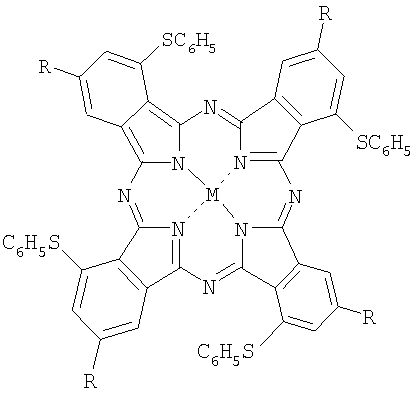
где R=H, t-С4Н9; М=НН, AlOH, Zn.
Наличие в бензольных кольцах фталоцианина фенилтиогрупп существенно смещает длинноволновую полосу поглощения в красную область, что позволяет использовать эти соединения в качестве фотосенсибилизаторов, чувствительных в ближней ИК-области спектра (Патент РФ №2257898, А61К 31/409 (2005). Они являются наиболее близким аналогом предлагаемых в настоящей заявке фотосенсибилизаторов. Предложена также липосомальная лекарственная форма этих фотосенсибилизаторов, которую используют при проведении фотодинамической терапии, представляющая собой композицию из смеси липидов (лецитина, холестерина, кардиолипина) и фотосенсибилизатора.
Недостатком указанных фотосенсибилизаторов является необходимость использовать для их солюбилизации в водных растворах смеси дорогостоящих и достаточно малоустойчивых липидов природного происхождения, что весьма затрудняет их эксплуатацию.
В предлагаемом изобретении ставится задача создания фотосенсибилизаторов для ФДТ с интенсивным поглощением в спектральной области 710-750 нм и средств на их основе в виде устойчивых водных эмульсий, а также способа проведения ФДТ с использованием этих лекарственных форм.
Указанная задача решается тем, что в качестве фотосенсибилизатора для ФДТ предлагаются алкилтиопроизводные фталоцианинов, содержащие в макрокольце в качестве заместителей от четырех до шестнадцати алкилтиогрупп, а в остающихся положениях - атомы водорода или хлора или трет-бутильные группы, общей формулы
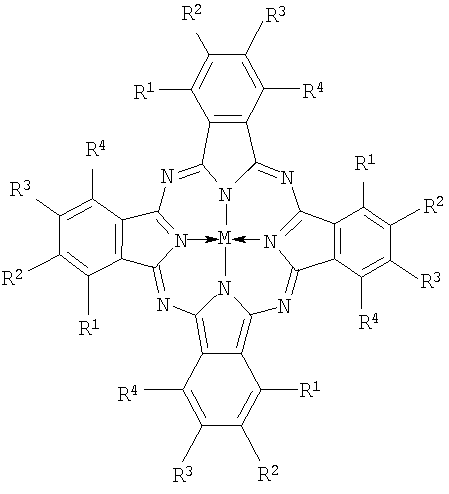
Лекарственные формы синтезированных липофильных фталоцианинов представляют собой водно-мицеллярные растворы (эмульсии) в неионогенном поверхностно-активном соединении класса плюроников - Проксаноле 268.
Задача изобретения решается также тем, что предложен способ фотодинамической терапии с использованием в качестве фотосенсибилизаторов предложенных выше лекарственных форм.
Предлагаемые замещенные фталоцианины синтезированы по разработанным нами методам. Безметальные фталоцианины получены тетрамеризацией соответствующих замещенных фталонитрилов в присутствии метилата натрия в среде н-гексанола при температуре кипения. (DecS)8Cl8PcZn и (ButS)8Cl8PcZn получены сплавлением соответствующего замещенного фталонитрила с ацетатом цинка в присутствии молибдата аммония или кипячением соответствующего замещенного фталонитрила в пентаноле в присутствии ацетата цинка и 1,8-диазабицикло[5.4.0]ундец-7-ена (ДБУ).
Предлагаемое изобретение иллюстрируется следующими примерами.
ПРИМЕР 1.
Синтез 4,5-бис(децилтио)-3,6-дихлорфталонитрила. К суспензии 1.33 г (5.0 ммоль) тетрахлорфталонитрила и 2.05 мл (10.0 ммоль) децилмеркаптана в 20 мл ДМФА прибавляют 1.40 мл (10.0 ммоль) триэтиламина. Через 1 ч реакционную массу выливают в холодную подкисленную воду и экстрагируют этилацетатом. Экстракт промывают водой, высушивают над безводным сульфатом натрия, растворитель удаляют и остаток очищают колоночной хроматографией (адсорбент - силикагель, элюент - бензол). Получают 2.36 г (87.4%) вязкого желтого масла. Найдено, %: С 62.19; Н 7.75; Cl 12.99; N 4.95; S 12.18. C28H42Cl2N2S2. Вычислено, %: С 62.08; Н 7.82; Cl 13.09; N 5.17; S 11.84. ИК-спектр (KBr), ν, см-1: 2232 (C≡N). Масс-спектр, m/z: 540 [M+; 35Cl,35Cl]. Спектр ЯМР 1Н [ДМСО-d6], δ, м. д.: 0.86 (т, 6Н), 1.40-1.54 (м, 32Н), 3.10 (т, 4Н). Спектр 13С ЯМР [ДМСО-d6], δ, м. д.: 149.2 (СAr-S), 139.8 (СAr-Cl), 117.9 (СAr-CN), 114.1 (CN), 37.2 (CH2-S), 32.0 (CH2), 29.8 (CH2), 29.6 (CH2), 29.4(СН2), 29.2 (CH2), 28.7 (CH2), 28.5 (CH2), 22.8 (CH2), 14.6 (СН3).
Синтез 2,3,9,10,16,17,23,24-октакис(децилтио)-1,4,8,11,15,18,22,25-октахлорфтало-цианина цинка [(DecS)8Cl8PcZn].
Метод А. Смесь 0,270 г (0,50 ммоль) 4,5-бис(децилтио)-3,6-дихлорфталонитрила, 0,024 г (0,13 ммоль) ацетата цинка и 2-3 мг молибдата аммония постепенно нагревают до температуры 210°С и выдерживают в течение 3 ч. Охлажденную реакционную массу обрабатывают кипящими этанолом и водой, остаток очищают колоночной хроматографией (адсорбент - силикагель, элюент - дихлорметан) и получают 0,056 г (20%) продукта в виде вязкого темно-зеленого масла. Найдено, %: С 60,36; Н 7,89; Cl 12,51; N 4,86; S 11,65. C112H168Cl8N8S8Zn. Вычислено, %: С 60.27; Н 7.59; Cl 12,71; N 5.02; S 11.49.
Метод Б. Кипятят 0,270 г (0.50 ммоль) 4,5-бис(децилтио)-3,6-дихлорфталонитрила и 0,024 г (0,13 ммоль) ацетата цинка в 5 мл пентанола или гексанола в течение 2-6 ч. После охлаждения комплекс осаждают из реакционной смеси этанолом, очищают колоночной хроматографией (адсорбент - силикагель, элюент - дихлорметан) и получают 20-28% продукта, идентичного полученному по методу А.
ПРИМЕР 2.
Синтез 3-(трет-бутилтио)фталонитрила. К раствору 3.46 г (20.00 ммоль) 3-нитрофталонитрила в 30 мл ДМФА добавляют 2.48 мл (22.00 ммоль) трет-бутилмеркаптана и 3.07 мл (22.00 ммоль) триэтиламина и перемешивают 30 минут при 50°С. Реакционную массу выливают в холодную подкисленную воду, выпавший осадок промывают на фильтре водой, перекристаллизовывают из гексана и получают 3.13 г (72.5%) белого кристаллического вещества, т.пл. 64-65°С (гексан). Найдено, %: С 67.10; Н 5.52; N 12.94; S 14.37 С12Н12N2S. Вычислено %: С 66.67; Н 5.56; N 12.96; S 14.81. ИК-спектр (KBr), ν, см-1: 2236 (C≡N). Масс-спектр, m/z: 216 [М+].
Синтез 1,8,15,22-тетракис(трет-бутилтио)фталоцианина [(ButS)4PcH2]. Смесь 0,225 г (1.040 ммоль) 3-(трет-бутилтио)фталонитрила, 0.023 г (0,426 ммоль) метилата натрия и 2 мл 1-гексанола кипятят в течение 3 ч. После охлаждения реакционной массы продукт высаживают метанолом, выпавший осадок отфильтровывают, промывают горячим метанолом и очищают колоночной хроматографией (адсорбент - SiO2, элюент - бензол). Фракцию, содержащую продукт, концентрируют, разбавляют метанолом, выпавший продукт отфильтровывают, высушивают на воздухе и получают 0.090 г (39,9%) продукта. Найдено, %: С 66.90; Н 6.12; N 12.46; S 14.32. C48H50N8S4. Вычислено, %: С 66.48; Н 5.81; N 12.92; S 14.79.
ПРИМЕР 3.
Синтез 5-трет-бутил-3-(трет-бутилтио)фталонитрила. Смесь 0.86 мл (7,60 ммоль) трет-бутилмеркаптана и 1.048 г (7.60 ммоль) свежепрокаленного поташа в 20 мл ДМФА перемешивают 30 минут, затем загружают 1.00 г (3,80 ммоль) 3-бром-5-трет-бутилфталонитрила [Михаленко С.И., Деркачева В.М., Лукьянец Е.А. - ЖОХ, 1981, 51(7), 1650] и нагревают 5 ч при 65°С. Реакционную массу выливают на холодную подкисленную воду, выпавший осадок экстрагируют этилацетатом, экстракт промывают водой, сушат над безводным сульфатом натрия и удаляют растворитель. Полученное масло затирают в гексане, кристаллический продукт перекристаллизовывают из гексана и получают 0.64 г (62.5%) белого кристаллического вещества с т.пл. 94-95°С (гексан). Найдено, %: С 70.61; Н 7.52; N 10.25; S 1.48. C16H20N2S. Вычислено, %: С 70.59; Н 7.35; N 10.29; S 11.76. ИК-спектр (KBr), ν, см-1: 2236 (C≡N). Масс-спектр, m/z: 272 [M+].
Синтез 3,10,17,24-тетра-трет-бутил-1,8,15,22-тетракис(трет-бутилтио)фталоцианина [But 4(ButS)4PcH2]. Получают аналогично примеру 2, используя в качестве исходного вещества 0.283 г (1.040 ммоль) 5-трет-бутил-3-(трет-бутилтио)фталонитрила. Получают 0.126 г (44.4%) продукта. Найдено, %: С 70.04; Н 7.22; N 10.04; S 11.24. C64H82N8S4. Вычислено, %: С 70.41; Н 7.57; N 10.27; S 11.75.
ПРИМЕР 4.
Синтез 3,5-бис(трет-бутилтио)фталонитрила. 3,5-Бис(трет-бутилтио)фталонитрил получают аналогично примеру 1, но вместо тетрахлорфталонитрила используют 0,98 г (4.50 ммоль) 3,5-динитрофталонитрила [Негримовский В.М., Деркачева В.М., Лукьянец Е.А. - ЖОХ, 1989, 59(7), 1688] и вместо децилмеркаптана используют 1.03 мл (9.10 ммоль) трет-бутилмеркаптана. Получают 1.15 г (83.9%) белого кристаллического вещества, т.пл. 92-93°С (бензол-гексан 1:2). Найдено, %: С 63.20; Н 6.69; N 9.07; S 21.04. C16H20N2S2. Вычислено, %: С 63.12; Н 6.62; N 9.20; S 21.06. ИК-спектр (KBr), ν, см-1: 2226 и 2234 (C≡N). Масс-спектр, m/z: 304 [М+].
Синтез 1,3,8,10,15,17,22,24-октакис(трет-бутилтио)фталоцианина [(ButS)8PcH2].
Получают аналогично примеру 2, но в качестве исходного вещества используют 0.316 г (1.040 ммоль) 3,5-бис(трет-бутилтио)фталонитрила. Получают 0.121 г (38.2%) продукта. Найдено, %: С 63.31; Н 7.17; N 8.83; S 21.51. C64H82N8S8. Вычислено, %: С 63.01; Н 6.78; N 9.19; S 21.03.
ПРИМЕР 5.
Синтез тетракис(трет-бутилтио)фталонитрила. Тетракис(трет-бутилтио)фталонитрил получают аналогично примеру 1, но вместо децилмеркаптана используют 2.26 мл (20.0 ммоль) трет-бутилмеркаптана и эквимолярное ему количество триэтиламина. Получают 2.16 г (89.8%) белого кристаллического вещества, т.пл. 140-142°С (этанол). Найдено, %: С 59.86; Н 7.52; N 5.91; S 26.71. C24H36N2S4. Вычислено, %: С 59.95; Н 7.55; N 5.83; S 26.68. ИК-спектр (KBr), ν, см-1: 2228 (C≡N). Масс-спектр, m/z: 480 [М+]. Спектр ЯМР 1H [ДМСО-d6], δ, м. д.: 1.25 (с, 18Н), 1.40 (с, 18Н).
Синтез гексадекакис(трет-бутилтио)фталоцианина [(ButS)16РсН2]. Получают аналогично примеру 2, используя в качестве исходного вещества 0.500 г (1.040 ммоль) тетракис(трет-бутилтио)фталонитрила. Получают 0.037 г (7.4%) продукта. Найдено, %: С 60.11; Н 7.75; N 5.71; S 26.83. C96H146N8S16. Вычислено, %: С 59.89; Н 7.64; N 5.82; S 26.65.
ПРИМЕР 6.
Синтез 4,5-бис(трет-бутилтио)-3,6-дихлорфталонитрила. 4,5-Бис(трет-бутилтио)-3,6-дихлорфталонитрил получают аналогично примеру 1, но вместо децилмеркаптана используют 1.13 мл (10.0 ммоль) трет-бутилмеркаптана. Получают 1.72 г (92,2%) белого кристаллического вещества, т.пл. 146-148°С (этанол). Найдено, %: С 51.50; Н 4.92; Cl 18.77; N 7.54; S 17.31. C16H18Cl2N2S2. Вычислено, %: С 51.47; H 4,86; Cl 18.99; N 7.50; S 17.18. ИК-спектр (KBr), ν, см-1: 2231 (C≡N). Масс-спектр, m/z: 372 [М+]. Спектр ЯМР 1Н [ДМСО-d6], δ, м. д.: 1.27-1.36 (м, 9Н) 1.42-1.38 (м, 9Н).
Синтез 2,3,9,10,16,17,23,24-октакис(трет-бутилтио)-1,4,8,11,15,18,22,25-октахлорфталоцианина цинка [(ButS)8Cl8PcZn]. Получают аналогично примеру 1 по методу Б, используя в качестве исходного вещества 0.187 г (0.50 ммоль) 4,5-бис(трет-бутилтио)-3,6-дихлорфталонитрила. Получают 0.043 г (22.0%) продукта. Найдено, %: С 49.78; Н 4.90; Cl 17.72; N 7.10; S 16.61. C64H72Cl8N8S8Zn. Вычислено, %: С 49.31; Н 4.66; Cl 18.19; N 7.19; S 16.46.
Все синтезированные фталоцианины обладают интенсивным поглощением в спектральном диапазоне 710-730 нм, в котором собственное поглощение несенсибилизированной ткани близко к минимальному (см. табл.1).
Максимумы длинноволновых полос (ε) и коэффициенты молярной экстинкции (е) в электронных спектрах поглощения алкилтиофталоцианинов в органических растворителях
Поскольку производные алкилтиофталоцианинов гидрофобны, для создания на их основе лекарственных средств для системного, в частности, внутривенного введения в настоящем изобретении предложены водно-мицеллярные растворы (эмульсии) этих соединений в присутствии поверхностно-активного вещества класса плюроников - Проксанола 268. Использование 4% водного раствора Проксанола-268 позволяет получить лекарственные средства с высоким содержанием активной субстанции (см. табл. 2).
Предельно достижимые концентрации алкилтиофталоцианинов в водных эмульсиях 4% Проксанола 268
ПРИМЕР 7.
Получение водной эмульсии и определение концентрации (ButS)16PcH2 в 4% Проксаноле 268. Растворяют 7.7 мг ((ButS)16PcH2 в 8 мл хлороформа, аликвоту разбавляют в 20 раз диметилформамидом (ДМФ), регистрируют электронный спектр поглощения и определяют молярный коэффициент экстинкции ε (ButS)16PcH2 (Табл. 1, Фиг.1). К 3 мл 4% (вес.) раствора проксанола-268 в бидистилляте при 65-70°С прибавляют в токе азота приготовленный выше раствор (ButS)16PcH2 в хлороформе. После удаления остатков хлороформа эмульсию фильтруют через мембранный фильтр "Millipore" (0.45 мкм), аликвоту разбавляют в 20 раз ДМФ, регистрируют электронный спектр поглощения и определяют значение оптической плотности в максимуме длинноволновой полосы Dmax. Концентрацию (ButS)16PcH2 в эмульсии рассчитывают по формуле 1:

где Ссол - концентрация фталоцианина в эмульсии, моль/л;
Dmax - оптическая плотность в максимуме длинноволновой полосы поглощения;
ε - молярный коэффициент экстинкции, л/(моль×см);
l - толщина кюветы, см;
N - степень разбавления аликвоты эмульсии (в данном примере N=20).
ПРИМЕР 8.
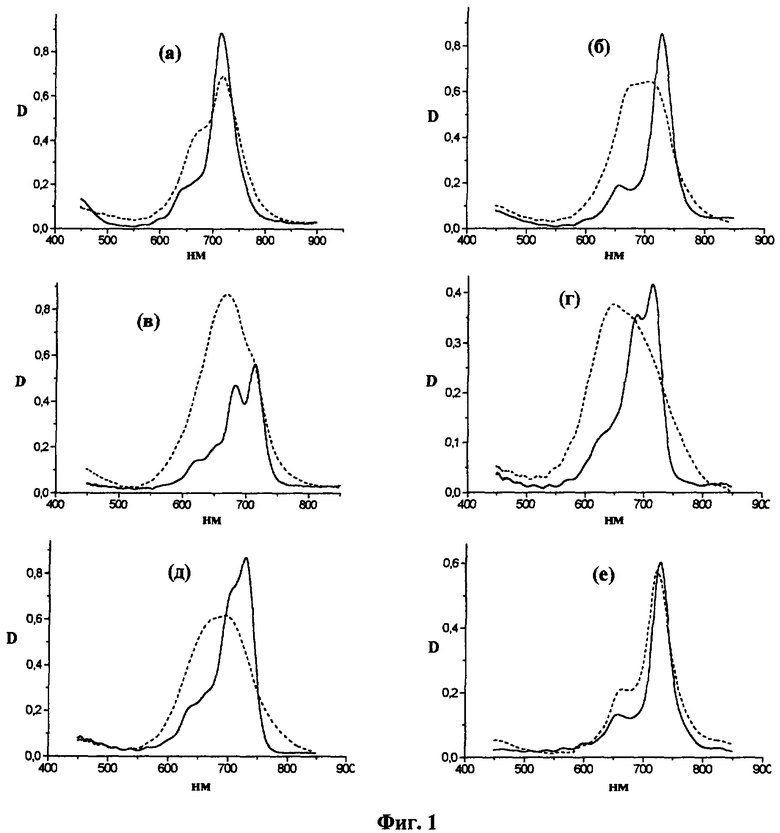
Получение водной эмульсии и определение концентрации (DecS)8Cl8PcZn в 4% Проксаноле 268. Раствор (DecS)8Cl8PcZn (22.3 мг в 20 мл хлороформа) разбавляют в 10 раз хлороформом, регистрируют электронный спектр поглощения приготовленного таким образом 5×10-5 М раствора (DecS)8Cl8PcZn и определяют молярный коэффициент экстинкции е (Табл. 1, Фиг.1). На Фиг.1 представлены электронные спектры поглощения алкилтиофталоцианинов, где сплошной линией обозначены спектры в органических растворителях, а пунктирной линией - спектры поглощения эмульсий в 4% Проксаноле 268: а - (ButS)16РсН2, 2.5×10-5 М в ДМФ+5% CHCl3 l=0.2 см, 1.13×10-4 М в 4% Проксаноле 268 l=0.05 см; б - (DecS)8Cl8PcZn, 5×10-5 М в CHCl3 l=0.1 см, 1.35×10-4 М в 4% Проксаноле 268 l=0.05 см; в - But 4(ButS)4РсН2, 5.0×10-4 М в CHCl3 l=0.009 см, 1.28×10-4 М в 4% Проксаноле 268 l=0.1 см; г - (ButS)4РсН2, 4.1×10-4 М в CHCl3 l=0.02 см; 1.15×10-4 М в 4% Проксаноле 268 l=0.1 см; д - (ButS)8PcH2, 5×10-4 М в CHCl3 l=0.02 см, 3.9×10-4 М в 4% Проксаноле 268 l=0.05 см; е - (ButS)8Cl8PcZn, 2.5×10-5 М в CHCl3 l=0.2 см, 3.2×10-4 М в 4% Проксаноле 268 l=0.02 см. К 5 мл 4% (вес.) раствора Проксанола 268 в бидистилляте прибавляют при 65-70°С и перемешивании в токе азота выше приготовленный раствор (DecS)8Cl8PcZn в хлороформе. После удаления остатков хлороформа эмульсию фильтруют через мембранный фильтр "Millipore" (0.45 мкм), аликвоту 0.1 мл экстрагируют 5 мл хлороформа, сушат CaCl2, фильтруют, регистрируют электронный спектр поглощения фильтрата и определяют значение оптической плотности в максимуме длинноволновой полосы Dmax Концентрацию (DecS)8Cl8PcZn в эмульсии определяют по формуле (1), где N=50, используя значение молярного коэффициента экстинкции ε длинноволновой полосы раствора (DecS)8Cl8PcZn в хлороформе.
Получение лекарственных средств для внутривенного введения ButS)4PcH2, But 4(ButS)4PcH2, (ButS)8Cl8PcZn и (ButS)8PcH2 в виде их водных эмульсий в 4% Проксаноле-268 и определение содержания активных субстанций в лекарственных средствах проводят аналогично примерам 7, 8.
ПРИМЕР 9.
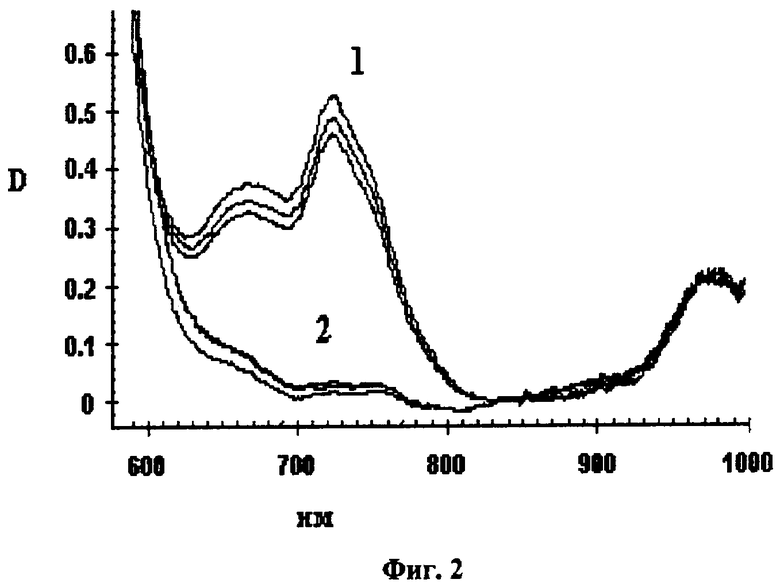
Исследование фармакокинетики пер-трет-бутилтиофталоцианина (ButS)16PcH2 при внутривенном введении его водной эмульсии в 4% Проксаноле 268 в дозе 2.0 мг/кг. Для изучения фармакокинетики (ButS)16PcH2 используют мышей породы Balb или F1 с опухолью Эрлиха (ELD), инокулированной внутримышечно за 6 дней до введения. Концентрацию фотосенсибилизатора в опухоли определяют методом диффузионного рассеяния чрезкожно с использованием спектроанализатора "ЛЭСА-01-Биоспек" (Лощенов В.Б., Стратонников А.А., Волкова А.И., Прохоров A.M. Росс. хим. журнал, 42(5), 50-53, 1998). Концентрацию фотосенсибилизатора в нормальной ткани измеряют в контралатеральной зоне левой лапы. На основе полученных данных рассчитывают значения индекса селективности накопления фотосенсибилизатора в опухоли по отношению к нормальной ткани и относительные изменения во времени концентрации фотосенсибилизатора. Спектры поглощения сенсибилизированных 2 мг/кг (ButS)16PcH2 в эмульсии водного 4% Проксанола 268 опухоли (1) и нормальной ткани (2) через 2 суток после введения приведены на Фиг.2.
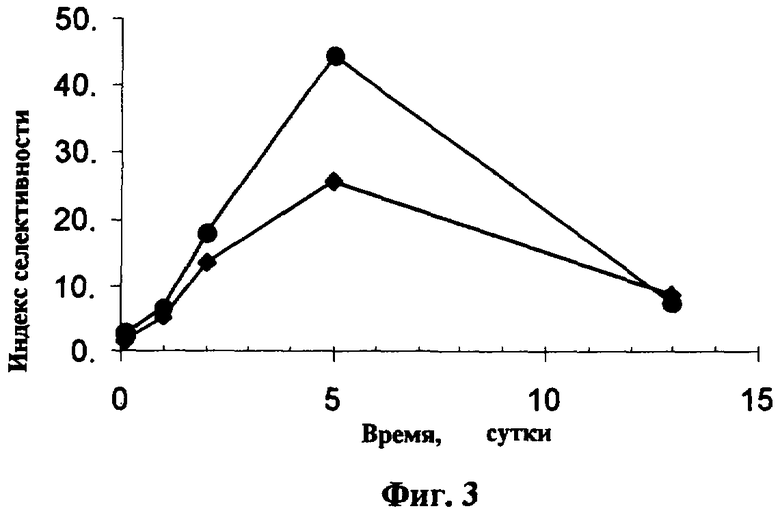
Концентрация (ButS)16PcH2 в опухоли достигает максимума через сутки и остается практически постоянной в течение 5 суток. В нормальной ткани концентрация (ButS)16PcH2 достигает максимума практически сразу после введения и существенно (в 3-4 раза) падает в течение последующих 2 суток. Динамика индекса селективности накопления (ButS)16PcH2 после внутривенного введения в дозе 2 мг/кг его водной эмульсии в 4% Проксаноле 268 двум мышам породы Balb с опухолью Эрлиха представлена на Фиг.3.
ПРИМЕР 10.
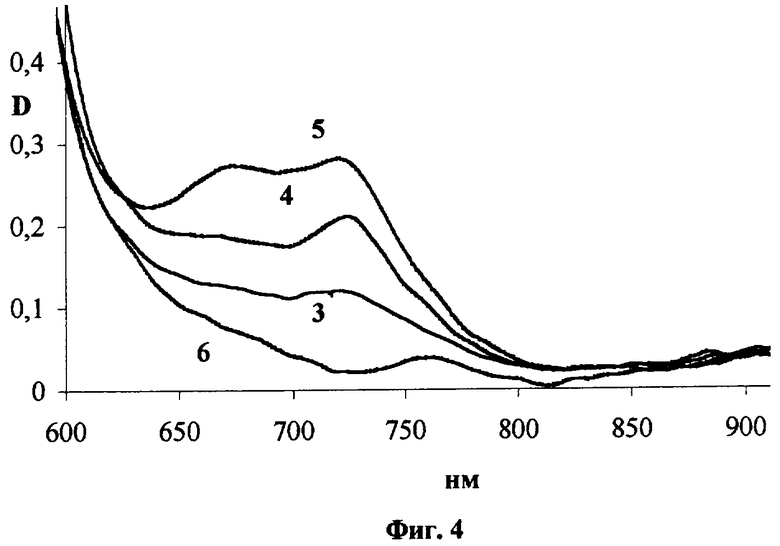
Исследование фармакокинетики окта-3,6-децилтио-4,5-октахлорфталоцианина цинка ((DecS)8Cl8PcZn] при внутривенном введении его водной эмульсии в 4% Проксаноле 268 в дозе 3.0 мг/кг. Поглощение (DecS)8Cl8PcZn in vivo исследовано на мышах F1 с перевитой внутримышечно опухолью Эрлиха (ELD). В течение первых часов после введения эмульсии (DecS)8Cl8PcZn в дозе 3 мг/кг спектр поглощения в опухоли представляет собой достаточно узкий пик со спектральным максимумом на длине волны 727 нм (Фиг.4, где 3, 4, 5 - спектры поглощения опухоли соответственно через 1, 4 и 24 часа после введения, 6 - спектр поглощения ткани до введения). В дальнейшем нарастание интенсивности этого пика замедляется, при этом появляется коротковолновый пик поглощения со спектральным максимумом около 676 нм, который может быть связан как с агрегацией фталоцианина, так и с его биодеградацией в биологической ткани.
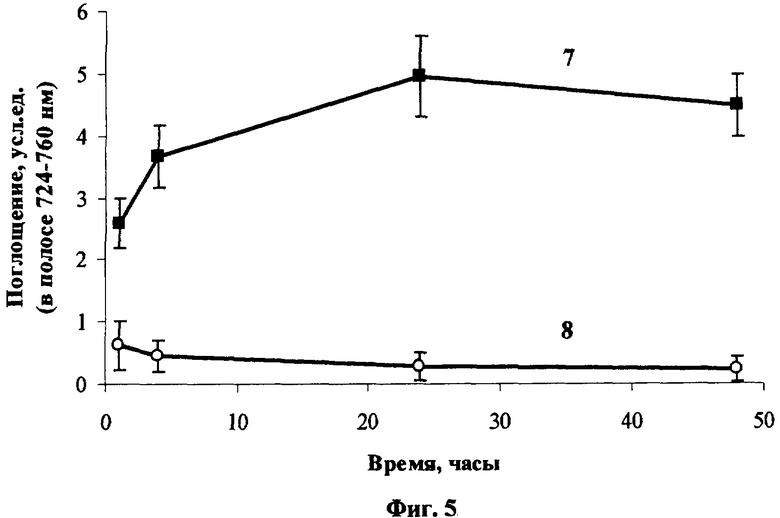
Изучение уровня накопления (DecS)8Cl8PcZn в биоткани по интегральной интенсивности поглощения основного пика при 727 нм показала, что наибольшее накопление фотосенсибилизатора в опухоли достигается примерно через сутки после введения и достаточно долго в ней удерживается. В нормальной ткани поглощение фотосенсибилизатора за 3-6 дней спадает до значений, экспериментально не обнаружимых, что свидетельствует о его практически полном удалении из нормальной ткани (Фиг.5, где 7 и 8 - накопление (DecS)8Cl8PcZn в опухоли Эрлиха и в нормальной ткани соответственно при внутривенном введении его эмульсии в 4% Проксаноле 268 мышам BDF1 в дозе 3 мг/кг).
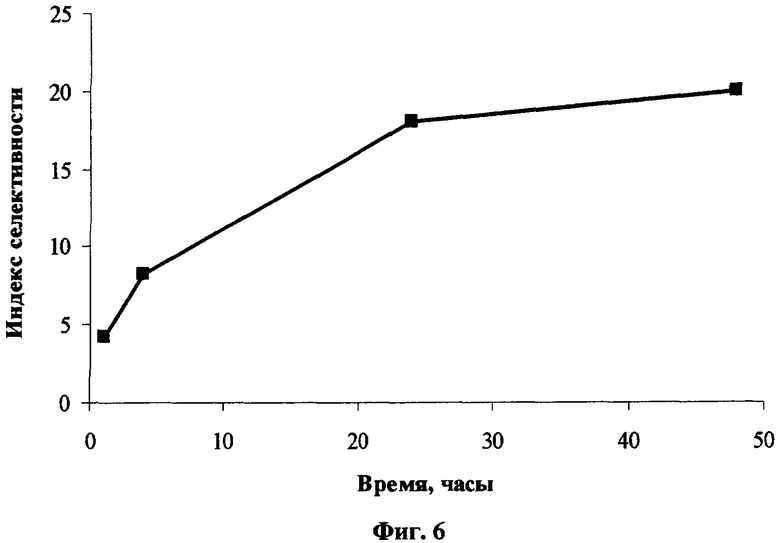
Селективность накопления (DecS)8Cl8PcZn в опухоли Эрлиха (ELD) при внутривенном введении в дозе 3 мг/кг по сравнению с нормальной тканью достигает значений ˜8 и ˜17 через 4 ч и 24 ч после введения соответственно (Фиг.6).
ПРИМЕР 11.
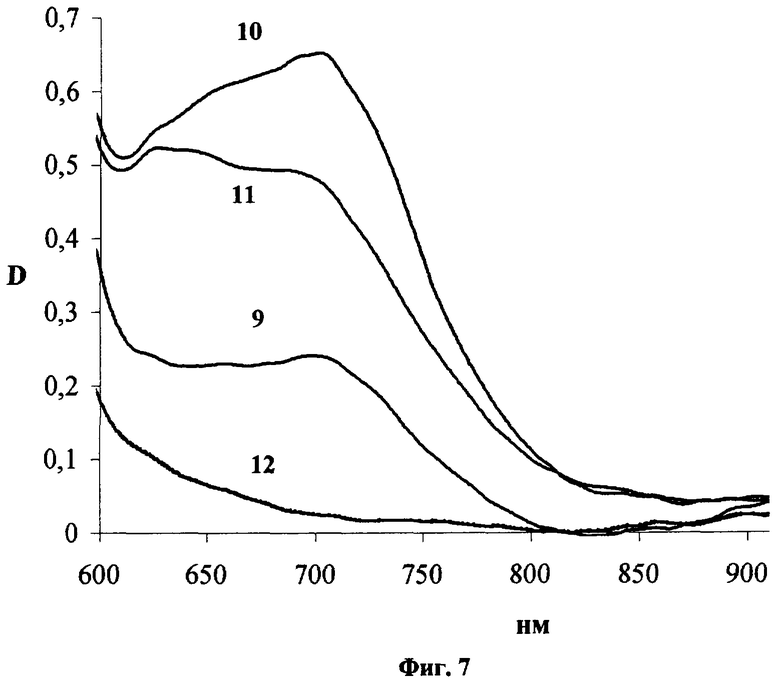
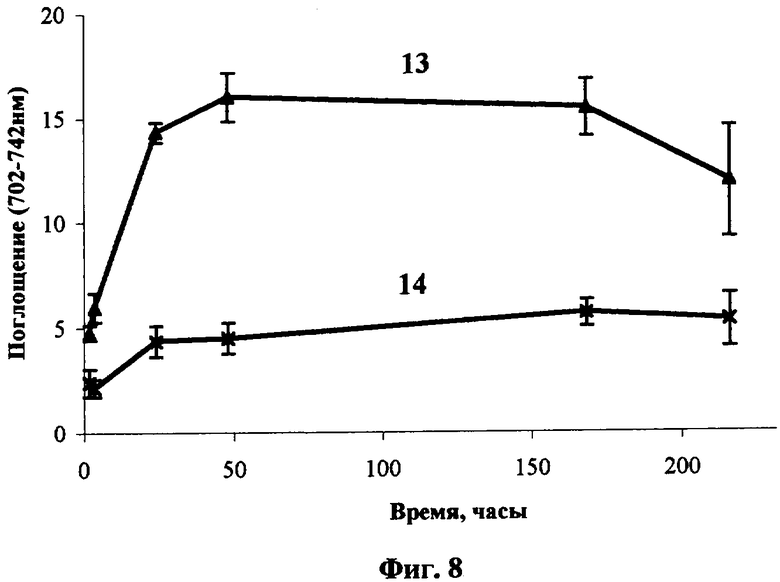
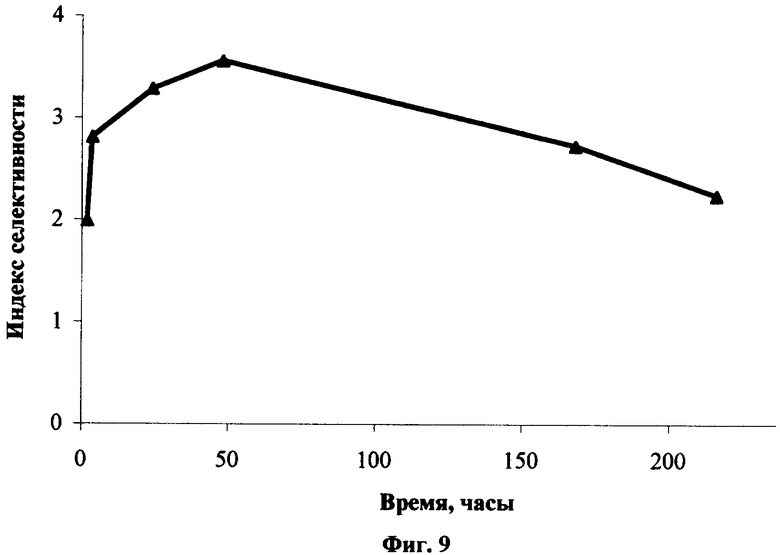
Исследование фармакокинетики окта-3,5-трет-бутилтиофталоцианина [(ButS)8PcH2] при внутривенном введении его водной эмульсии в 4% растворе Проксанола 268. Спектр поглощения (ButS)8РсН2 в биологической ткани представляет собой широкую полосу в диапазоне 670-770 нм, свидетельствующую о существенной агрегации. Структурирование полосы проявляется слабо, в основном в течение первых суток после введения в невысоких дозах (˜1 мг/кг). При увеличении дозы и времени после введения преобладает коротковолновое крыло полосы в области 670-710 нм (Фиг.7, где 9, 10, 11 - спектры поглощения сенсибилизированной опухоли Эрлиха при внутривенном введении (ButS)8РсН2 в дозе 4.7 мг/кг через 2, 24 и 120 часов после введения, 12 - спектр поглощения опухоли до введения). Уровень и селективность накопления (ButS)8РсН2 в опухоли оценивают по интегральной интенсивности полосы в спектральном диапазоне 702-742 нм. Соединение характеризуется средней селективностью накопления в опухоли (индекс селективности 2.5-3.5) и медленно выводится из биологической, в том числе нормальной, ткани [Фиг.8, динамика уровня накопления (ButS)8РсН2 в опухоли Эрлиха (13) и в нормальной ткани (14) при внутривенном введении в дозе 4.7 мг/кг мышам BDF1; Фиг.9 - динамика индекса селективности накопления (ButS)8РсН2 в опухоли Эрлиха в сравнении с нормальной тканью при его внутривенном введении в дозе 4.7 мг/кг].
ПРИМЕР 12.
Фотодинамическая активность in vivo водно-проксанольных эмульсий (ButS)16PcH2 изучают на мышах с опухолью Эрлиха или саркомой S-37, инокулированных подкожно на наружную поверхность бедра нижней конечности мышей-самок линий СВА (опухоль Эрлиха) или BDF1 (S-37).
Лекарственные средства, приготовленные по описанному в примерах 7-8 способу, вводят животным в хвостовую вену однократно на 6 день после инокуляции за 4, 24 или 48 ч до проведения ФДТ.
Сенсибилизированную опухоль облучают излучением аппарата терапевтического онкологического для фотодинамической терапии АТО-1, снабженного фильтром КС-18 и фильтром СЗС. Спектральный максимум излучения на длине волны 700 нм, плотность мощности излучения 220 мВт/см2, плотность световой дозы 120 Дж/см2. Перед облучением шерсть над опухолью удаляют. Продолжительность наблюдения за животными составляет 20-25 дней после лечения.
Эффективность воздействия оценивают по изменению объема опухоли (Von) и значениям торможения роста опухоли (ТРО), рассчитанным по формулам (2) и (3).
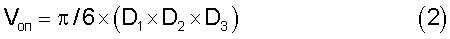
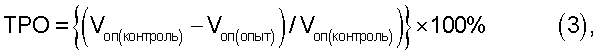
где D1, D2 и D3 - три взаимно перпендикулярных размера опухоли.
При изучении биологической активности (ButS)16PcH2 в 4% Проксаноле 268 в дозах от 0.1 до 5.0 мг/кг установлено, что исследуемые образцы препарата не обладают цитотоксичностью в отсутствие светового воздействия. Облучение опухолей без введения препарата также не приводит к подавлению роста злокачественных новообразований. При однократном проведении ФДТ с использованием (ButS)16PcH2 в дозах 0.1; 0.25; 0.5; 1.0 и 5.0 мг/кг за 48 ч до облучения во всех случаях отмечены высокие значения ТРО (57.5-100.0%) на протяжении 20-25 дней наблюдения. Сравнительный анализ данных эффективности ФДТ с использованием (ButS)16PcH2 в исследуемых дозах показал некоторое снижение значений ТРО (на 20-25%) на 15 и 20 день при уменьшении дозы препарата до 0.1 мг/кг. При проведении облучения в различные сроки после введения (ButS)16PcH2 в дозах 0.1; 0.25 или 0.5 мг/кг не отмечено значимых различий в фотодинамической эффективности соединения при проведении ФДТ через 4; 24 или 48 ч после внутривенной инъекции препарата (Табл. 3).
ПРИМЕР 13.
Фотодинамическая активность in vivo водных эмульсий But 4(ButS)4РсН2 в 4% Проксаноле 268 изучена на мышах BDF1 с перевиваемой саркомой S-37 после введения препарата в дозах 0.37, 0.75 и 1.5 мг/кг. "Темновой" цитотоксичности при введении But 4(ButS)4РсН2 в максимальной исследуемой дозе 1.5 мг/кг не наблюдается. При проведении ФДТ опухолей, сенсибилизированных за 24 ч до облучения, во всех случаях выявлено биологически значимое торможение роста опухоли (ТРО=56.2-100.0%) на протяжении всего периода наблюдения. Отмечена прямая зависимость противоопухолевого эффекта от дозы фотосенсибилизатора. Средние значения ТРО при введении фотосенсибилизатора в дозе 0.37 мг/кг составляют 56.2-75.9%; в дозе 0.75 мг/кг - 72.8-82.3%; в дозе 1.5 мг/кг - 100.0%, то есть наблюдается полная резорбция опухолевых образований на протяжении 20 дней наблюдения (Табл.3).
ПРИМЕР 14.
Фотодинамическая активность in vivo водных эмульсий (ButS)4PcH2 в 4% Проксаноле 268 изучена на мышах BDF1 с саркомой S-37 после введения препарата в дозах 8.8; 4.0; 1.0; 0.5 и 0.1 мг/кг. Установлено, что композиция (ButS)4PcH2 при введении в максимальной дозе препарата 8.8 мг/кг не обладает "темновой" цитотоксичностью. При проведении ФДТ опухолей, сенсибилизированных (ButS)4PcH2 в дозах 8.8 и 4.0 мг/кг за 24 ч до облучения, отмечено биологически значимое торможение роста опухоли (ТРО=53.5-97,1%) на протяжении 20 дней наблюдения. При использовании сенсибилизатора в меньших дозах (1.0; 0.5; 0.1 мг/кг) значимого подавления роста опухоли не установлено (Табл. 3).
ПРИМЕР 15.
Фотодинамическая активность in vivo водных эмульсий (ButS)8PcH2 в 4% Проксаноле 268 изучена на мышах BDF1 с саркомой S-37 после внутривенного введения соединения в дозах 6.0 и 1.0 мг/кг. Эмульсия (ButS)8PcH2 при введении препарата в максимальной дозе 6.1 мг/кг не обладает "темновой" цитотоксичностью. При проведении ФДТ опухолей, сенсибилизированных (ButS)8PcH2 в дозе 6.0 мг/кг за 24 ч до облучения у всех животных в опытной группе отмечена полная резорбция опухолевых образований, регистрируемая на протяжении 20 дней наблюдения. При введении соединения в дозе 1.0 мг/кг и проведении сеанса ФДТ биологически значимое торможение роста опухоли (ТРО=56.6-86.4%) сохраняется на протяжении всего периода наблюдения (Табл.3).
ПРИМЕР 16.
Фотодинамическая активность in vivo водных эмульсий (DecS)8Cl8PcZn в 4% Проксаноле 268 изучена на мышах BDF1 с саркомой S-37 после введения соединения в дозах 22.0; 5.0 и 1.0 мг/кг. Установлено, что (DecS)8Cl8PcZn в водном растворе 4% Проксанола 268 при его внутривенном введении в дозе 5.0 мг/кг в отсутствие облучения не подавляет рост экспериментальной опухоли. При проведении ФДТ опухолей, сенсибилизированных (DecS)8Cl8PcZn в дозе 1.0 мг/кг за 24 ч до облучения биологически значимое подавление роста опухоли отмечено только на 10 день после лечения (ТРО=55.4%). После введения фотосенсибилизатора в больших дозах (5.0 и 22.0 мг/кг) терапевтический эффект более выражен (ТРО=61.8-75.9%) и отмечается на протяжении 15 дней наблюдения. Сокращение временного интервала между инъекцией и облучением с 24 до 4 ч при дозах 5.0 и 1.0 мг/кг приводит к существенному возрастанию терапевтического эффекта (Табл. 3).
ПРИМЕР 17.
Фотодинамическая активность in vivo водных эмульсий (ButS)8Cl8PcZn в 4% Проксаноле 268 изучена на мышах с саркомой S-37 после введения соединения в дозах 3.7, 1.5 и 0.5 мг/кг. При проведении ФДТ опухолей, сенсибилизированных (ButS)8Cl8PcZn за 4 ч до облучения, существенное подавление роста опухоли отмечается для всех применяемых доз на протяжении всего срока наблюдения (20 дней, Табл. 3).
Торможение роста опухолей при использовании в качестве фотосенсибилизаторов для ФДТ водных эмульсий алкилтиофталоцианинов в 4% Проксаноле 268
ПРИМЕР 18.
Фотодинамическая эффективность in vivo водных эмульсий (DecS)8Cl8PcZn в 4% Проксаноле при лечении опухолей больших размеров изучена на опухоли Эрлиха (ELD). Лекарственное средство на основе (DecS)8Cl8PcZn вводят через 5 суток после инокуляции опухоли, когда средний объем опухоли достигает 0.6-1 см3, а поперечные размеры превышают 0.8 см. Облучение опухоли проводят лазером ЛФД-730/01-Биоспек с длиной волны 732 нм при плотности мощности 250 мВт/см2.
При высокой дозе фотосенсибилизатора (6.0 мг/кг) облучение опухолей больших размеров через 18 ч после введения приводит к биологически значимому, но промежуточному по уровню терапевтическому эффекту (ТРО=67%). При облучении через 3-4 ч после введения и увеличении времени облучения до 30 мин (доза облучения 450 Дж/см2) эффективность ФДТ возрастает (ТРО=77%). При уменьшении дозы препарата до 3.0 мг/кг терапевтическая эффективность композиции увеличивается и достигает высоких значений (ТРО=75% и 84% при дозе облучения 300 Дж/см2 и 450 Дж/см2 соответственно (Табл.4).
Фотодинамическая активность лекарственного средства на основе водных эмульсий (DecS)8Cl8PcZn при лечении опухолей Эрлиха больших размеров (0.7-1 см3)
Таким образом, предлагаемые в настоящем изобретении алкилтиозамещенные фталоцианины с интенсивным поглощением в спектральной области 710-730 нм представляют собой новый класс эффективных фотосенсибилизаторов ближней ИК области спектра. Лекарственные средства на их основе в виде водных эмульсий могут быть использованы для лечения опухолевых новообразований, в том числе глубоких, методом ФДТ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕТРААЗАХЛОРИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2004 |
|
RU2278119C1 |
| N,N'-ДИФТОРБОРИЛЬНЫЕ КОМПЛЕКСЫ N-(3-АРИЛ-2Н-ИЗОИНДОЛ-1-ИЛ)-N-(3-АРИЛ-1Н-ИЗОИНДОЛ-1-ИЛИДЕН)АМИНОВ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2364600C1 |
| ФОТОСЕНСИБИЛИЗАТОР НА ОСНОВЕ ПРОИЗВОДНОГО БАКТЕРИОХЛОРИНА p, СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО БАКТЕРИОХЛОРИНА p И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ИСПОЛЬЗОВАНИЕМ ЭТОГО ФОТОСЕНСИБИЛИЗАТОРА | 2009 |
|
RU2411943C2 |
| ФОТОСЕНСИБИЛИЗАТОР, ЛИПОСОМАЛЬНАЯ ФОРМА ФОТОСЕНСИБИЛИЗАТОРА И СПОСОБ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2004 |
|
RU2257898C1 |
| СРЕДСТВО ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЕЕ ПРОВЕДЕНИЯ | 2004 |
|
RU2271801C2 |
| СУЛЬФОЗАМЕЩЕННЫЕ ФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1999 |
|
RU2183635C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| ПРЕПАРАТ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2012 |
|
RU2521327C1 |
| ОКТА-4,5-КАРБОКСИФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2193563C2 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1998 |
|
RU2164136C2 |
Настоящее изобретение относится к фотосенсибилизаторам для фотодинамической терапии (ФДТ) новообразований, к лекарственным формам на их основе и способу проведения фотодинамической терапии. В качестве фотосенсибилизаторов предложены эмульсии в водном растворе Проксанола 268 алкилтиозамещенных фталоцианинов общей формулы
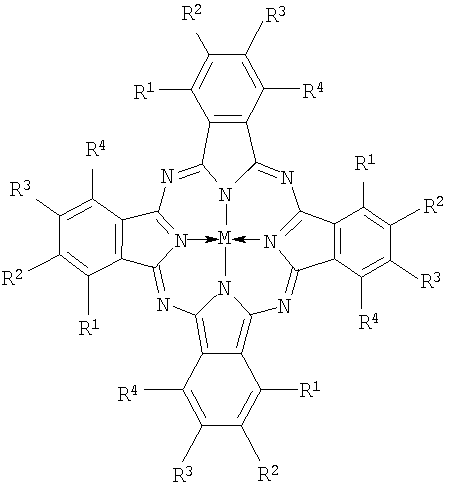
где R1=R4=Cl, R2=R3=n-C10H21S, M=Zn или R1=t-C4H9S, R2=R3=R4=H, M=HH или R1=t-C4H9S, R2=R4=H, R3=t-C4H9, М=НН или Rl=R3=t-C4H9S, R2=R4=H, М=НН или Rl=R2=R3=R4=t-C4H9S, М=НН или R1=R4=Cl, R2=R3=t-C4H9S, M=Zn. Технический результат - разработка высокоселективных и эффективных фотосенсибилизаторов для применения при фотодинамической терапии опухолей. 3 н.п. ф-лы, 4 табл., 9 ил.
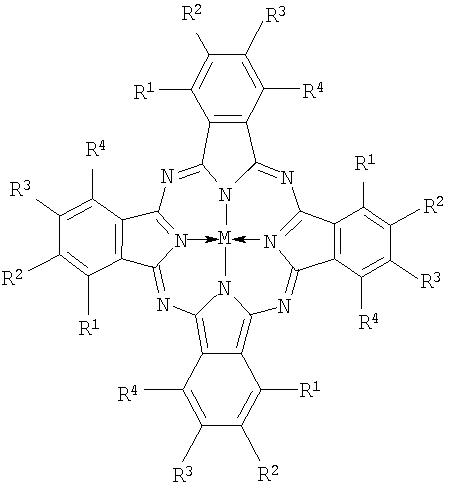
где R1=R4=Cl, R2=R3=n-C10H21S, M=Zn;
R1=t-C4H9S, R2=R3=R4=H, M=HH;
R1=t-C4H9S, R2=R4=H, R3=t-C4H9, М=НН;
Rl=R3=t-C4H9S, R2=R4=H, М=НН;
Rl=R2=R3=R4=t-C4H9S, М=НН;
R1=R4=Cl, R2=R3=t-C4H9S, M=Zn.
| ФОТОСЕНСИБИЛИЗАТОР, ЛИПОСОМАЛЬНАЯ ФОРМА ФОТОСЕНСИБИЛИЗАТОРА И СПОСОБ ПРОВЕДЕНИЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2004 |
|
RU2257898C1 |
| KAZUHIRO TAKAHASHI ET ALL, Inorganica chimica | |||
Авторы
Даты
2008-12-10—Публикация
2007-06-20—Подача