Изобретение относится к химии фосфорорганических соединений с Р-С связями, а именно к новому способу получения 4-метил-2-оксо-2-хлор-1,2-фосфолена-3 формулы (I)
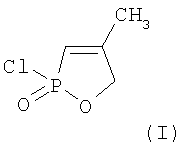
который является ценным полупродуктом фосфорорганического синтеза.
Известен способ получения 3,3,5-триметил-2-оксо-2-хлор-1,2-оксафосфолена-4, который заключается во взаимодействии треххлористого фосфора с окисью мезитила в эквимольном соотношении при температуре 90°С в запаянной трубке (ЖОХ, 1970, Т. 40, Вып.10, С.2189-2192) или диацетоновым спиртом.
Известен также способ получения 2-оксо-2-хлор-5-метилен-1,2-оксафосфолена-3, который основан на реакции пятихлористого фосфора с дивиниловым эфиром, взятых в мольном соотношении 2:1 в среде бензола при температуре 15-18°С и последующей обработкой продукта реакции диоксидом серы и уксусной кислотой при 40-45°С. Выход целевого продукта 46% (ЖОХ, 1966, Т. 36, Вып.8, С.1424-1430).
Однако описанные методы не позволяют синтезировать 4-метил-2-оксо-2-хлор-1,2-оксафосфолен-3.
При создании изобретения ставилась задача получить 4-метил-2-оксо-2-хлор-1,2-оксафосфолен-3 формулы (I),

который расширяет арсенал фосфорорганических соединений как ценный полупродукт в синтезе органических соединений фосфора.
Техническим результатом является получение 4-метил-2-оксо-2-хлор-1,2-оксафосфолена-3 формулы (I), который расширяет арсенал соединений, используемых в качестве полупродуктов фосфорорганического синтеза.
Поставленная задача достигается описанным способом получения 4-метил-2-оксо-2-хлор-1,2-фосфолена-3, который заключается в том, что аллилметаллиловый эфир подвергают взаимодействию с пятихлористым фосфором в мольном соотношении 1:2 в среде инертного органического растворителя при температуре 0-10°С с последующей обработкой образующегося аддукта ацетоном.
Такое течение процесса является новым, неожиданным и заранее непредсказуемьм направлением реакции. Например, метилметаллиловый эфир реагирует с пятихлористым фосфором в мягких условиях (0-20°С) с образованием продуктов присоединения - дихлорангидрида 2-метил-3-метокси-2-хлорпропилфосфоновой кислоты (Фосфорорганические соединения и полимеры. - Чебоксары, 1983. Вып.5. С.34-53). Однако повышение температуры реакции до 30°С вызывает полный разрыв эфирной связи и приводит к образованию дихлорангидрида 2-метил-3-хлор-1-пропенилфосфоновой кислоты (А.с. 819113, МПК С07F 9/42). Аналогичный результат наблюдается при термическом разложении промежуточных аддуктов реакции (Журн. общ. химии, 1981. Т.51. Вып.1. С.248-249).
В спектре ЯМР 31P он характеризуется единственным сигналом с δр 51 м.д. В его ИК-спектре содержатся полосы поглощения, указывающие на наличие двойной связи (3090, 1620, 820 см-1), хлорфосфорильной (1280, 605, 565 см-1) и РОС групп (1030, 1120 см-1). В спектре ЯМР 1Н спектра содержатся дуплет квадруплетов с δ 6,13 м.д., 2J (PH) 40 Гц, 4J (НН) 2 Гц и два дуплета: δ 4,80 м.д., 3J (РН) 10 Гц; δ 2,07 м.д., 4J (НН) 2 Гц.
Полученные спектральные характеристики в совокупности с литературными данными и данными элементного анализа позволили предложить следующую схему образования 4-метил-2-оксо-2-хлор-1,2-оксафосфол-3-ена.
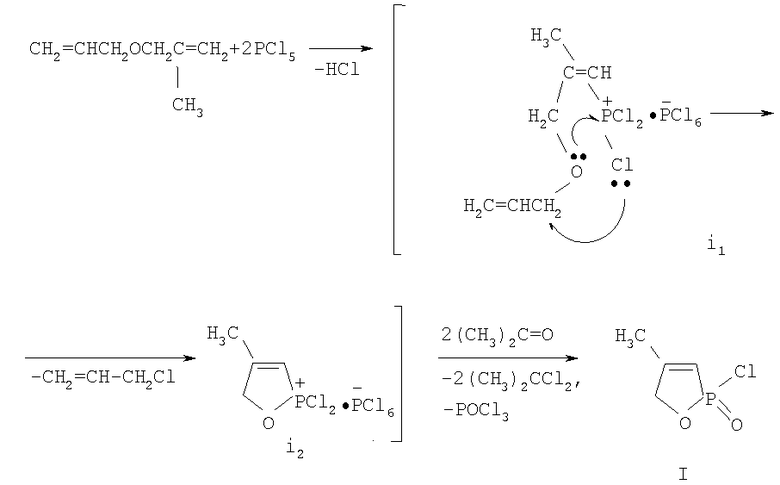
Очевидно, процесс начинается с образования гексахлорфосфората (i1), в котором вследствие близкого пространственного расположения возможно внутримолекулярное взаимодействие между атомами кислорода и фосфора, приводящее к формированию оксафосфолена (i2). Одновременно в результате нуклеофильной атаки атома хлора в аллильное положение отщепляется хлористый аллил, который был выделен из легколетучей фракции и идентифицирован методами ИК и ГЖХ. При действии ацетона аддукт (i2) превращается в оксафосфолен (I).
Для получения заявляемого 4-Метил-2-оксо-2-хлор-1,2-оксафосфолен-3 (I). оптимальным мольным соотношением при взаимодействии аллилметаллилового эфира с пятихлористым фосфором является соотношение 1:2 и температура реакции - 0-10°С. При других соотношениях и температуре не образуется заявляемое соединение.
Пример 1. Метил-2-оксо-2-хлор-1,2-оксафосфолен-3
К суспензии 62,4 г тонкоизмельченного пятихлористого фосфора в 150 мл абсолютного бензола при температуре 5°С и интенсивном перемешивании прибавляли по каплям 17 г 3-аллилокси-2-метилпропена-1. Затем выдерживали реакционную смесь при этой же температуре в течение 4 ч и обрабатывали 16,4 г ацетона. Перегонкой образовавшегося раствора получили 11 г (48%) целевого продукта, т.кип. 134-135°С (4 мм рт.ст.), 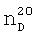 1.4986,
1.4986,  1.3591. MRD 31.02, выч. 31.21. Найдено, %: Cl 23.15, P 20.24. С4Н6Cl2OP. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3H, 2JPH 40 Гц, 4JHH 2 Гц), 4.80 д (1Н, С5H2, 3JPH 10 Гц), 2.07 д (3Н, СН3, 4JHH 2 Гц).
1.3591. MRD 31.02, выч. 31.21. Найдено, %: Cl 23.15, P 20.24. С4Н6Cl2OP. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3H, 2JPH 40 Гц, 4JHH 2 Гц), 4.80 д (1Н, С5H2, 3JPH 10 Гц), 2.07 д (3Н, СН3, 4JHH 2 Гц).
Пример 2. 4-Метил-2-оксо-2-хлор-1,2-оксафосфолен-3 (I).
К суспензии 62,4 г тонкоизмельченного пятихлористого фосфора в 150 мл абсолютного бензола при температуре 10°С и интенсивном перемешивании прибавляли по каплям 17 г 3-аллилокси-2-метилпропена-1. Затем выдерживали реакционную смесь при этой же температуре в течение 4 ч и обрабатывали 16,4 г ацетона. Перегонкой образовавшегося раствора получили 11,9 г (50%) целевого продукта, т.кип. 134-135°С (4 мм рт.ст.), 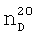 1.4988,
1.4988,  1.3592. MRD 31.02, выч. 31.22. Найдено, %: Cl 23.17, Р 20.25. С4Н6Cl2ОР. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3H, 2JРН 40 Гц, 4JНН 2 Гц), 4.80 д (1Н, С5H2, 3JРН 10 Гц), 2.07 д (3Н, СН3, 4JPH 2 Гц).
1.3592. MRD 31.02, выч. 31.22. Найдено, %: Cl 23.17, Р 20.25. С4Н6Cl2ОР. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3H, 2JРН 40 Гц, 4JНН 2 Гц), 4.80 д (1Н, С5H2, 3JРН 10 Гц), 2.07 д (3Н, СН3, 4JPH 2 Гц).
Пример 3. 4-Метил-2-оксо-2-хлор-1,2-оксафосфолен-3 (I).
К суспензии 62,4 г тонкоизмельченного пятихлористого фосфора в 150 мл абсолютного бензола при температуре 0°С и интенсивном перемешивании прибавляли по каплям 17 г 3-аллилокси-2-метилпропена-1. Затем выдерживали реакционную смесь при этой же температуре в течение 4 ч и обрабатывали 16,4 г ацетона. Перегонкой образовавшегося раствора получили 12 г (52,3%) целевого продукта, т.кип. 134-135°С (4 мм рт.ст.), 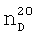 1.4988,
1.4988,  1.3592. MRD 31.02, выч. 31.22. Найдено, %: Cl 23.17, Р 20.25. С4Н6Cl2OP. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3Н, 2JPH 40 Гц, 4JHH 2 Гц), 4.80 д (1Н, С5H2, 3JPH 10 Гц), 2.07 д (3Н, СН3, 4JHH 2 Гц).
1.3592. MRD 31.02, выч. 31.22. Найдено, %: Cl 23.17, Р 20.25. С4Н6Cl2OP. Вычислено, %: Cl 23.25, Р 20.31. Спектр ЯМР 1Н (δ, м.д.): 6.13 д.к (1Н, С3Н, 2JPH 40 Гц, 4JHH 2 Гц), 4.80 д (1Н, С5H2, 3JPH 10 Гц), 2.07 д (3Н, СН3, 4JHH 2 Гц).
Таким образом, заявляемым изобретением получено неописанное в литературе фосфорорганическое соединение, которое может найти применение для использования в качестве полупродукта фосфорорганического синтеза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДА 2,3-ДИГИДРОФУРИЛ-4-ФОСФОНОВОЙ КИСЛОТЫ | 2022 |
|
RU2802467C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДОВ 2-АЛКОКСИ-1-ХЛОРЭТЕНИЛФОСФОНОВЫХ КИСЛОТ | 2018 |
|
RU2687562C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДА 2-(2,3-ДИХЛОРПРОПОКСИ)ЭТЕНИЛФОСФОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2387662C1 |
| Способ получения дихлорангидрида 2-фенил-1,1,2-трихлорэтилфосфоновой кислоты | 2023 |
|
RU2814257C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАНГИДРИДА 2,4-ДИХЛОР-2-ДИХЛОРФОСФОРИЛБУТАНОВОЙ КИСЛОТЫ | 2024 |
|
RU2838764C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДОВ 1-АЛКИЛ-2-АЛКОКСИЭТЕНИЛФОСФОНОВЫХ КИСЛОТ | 2022 |
|
RU2801052C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАНГИДРИДА 2,4-ДИХЛОР-2-ДИХЛОРФОСФОРИЛБУТАНОВОЙ КИСЛОТЫ | 2005 |
|
RU2281287C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДОВ 2-ХЛОР-2-АЛКЕНИЛФОСФОНОВЫХ КИСЛОТ | 1998 |
|
RU2140923C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРАНГИДРИДА 2,4-ДИХЛОР-2-ДИХЛОРФОСФОРИЛБУТАНОВОЙ КИСЛОТЫ | 2005 |
|
RU2290407C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИХЛОРАНГИДРИДА 7,7-ДИХЛОРБИЦИКЛО [4,1,0] ГЕПТИЛ-2-ФОСФОНОВОЙ КИСЛОТЫ | 2004 |
|
RU2266910C1 |
Настоящее изобретение относится к способу получения 4-метил-2-оксо-2-хлор-1,2-оксафосфолена-3 формулы (I) и может быть использовано для получения полупродуктов органического синтеза. Способ включает в себя взаимодействие аллилметаллилового эфира с пятихлористым фосфором при температуре 0-10°С и их мольном соотношении 1:2 с последующей обработкой образующегося аддукта ацетоном.

Технический результат - получение нового фосфорсодержащего соединения.
Способ получения 4-метил-2-оксо-2-хлор-1,2-оксафосфолена-3 формулы
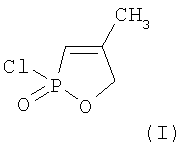
включающий взаимодействие аллилметаллилового эфира с пятихлористым фосфором при температуре 0-10°С и их мольном соотношении 1:2 с последующей обработкой образующегося аддукта ацетоном.
| НУРТДИНОВ С.Х | |||
| и др | |||
| ЖОХ, 1970, т.40, вып.10, 2189-2192 | |||
| ЦИВУНИН B.C | |||
| и др | |||
| ЖОХ, 1966, т.36, вып.8, 1424-1430 | |||
| КОРМАЧЕВ В.В | |||
| и др | |||
| ЖОХ, 1981, т.51, вып.1, 248-249. |
Авторы
Даты
2008-12-10—Публикация
2007-10-31—Подача