Описания всех цитируемых здесь ссылок включены в их полном виде в качестве ссылки.
Цитокины являются растворимыми белками, которые влияют на рост и дифференцировку многих типов клеток. Их рецепторы состоят из одного или нескольких интегральных мембранных белков, которые связывают цитокин с высокой аффинностью и трансдуцируют это событие связывания в клетку через цитоплазматические части определенных субъединиц рецептора. Рецепторы цитокинов были сгруппированы в несколько классов на основе сходства в их связывающих внеклеточный лиганд доменах. Например, цепи рецепторов, ответственные за связывание и/или трансдукцию эффекта интерферонов (IFN), являются членами семейства рецепторов цитокинов типа II (CRF2), на основе характерного состоящего из 200 остатков внеклеточного домена. Демонстрированные in vivo активности этих интерферонов иллюстрируют огромный клинический потенциал и потребность в других цитокинах, агонистах цитокинов и антагонистах цитокинов. Некоторые цитокины участвуют в воспалительном каскаде и могут стимулировать такие заболевания, как ревматоидный артрит, болезнь Крона, псориаз, сердечное заболевание и т.д. Таким образом, существует потребность в обнаружении цитокинов и их рецепторов, которые участвуют в воспалении. Затем можно использовать выделенные растворимые рецепторы цитокина для ингибирования опосредованного этим цитокином воспаления.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1-8 представляют схематическое представление различных вариантов растворимого рецептора по данному изобретению.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение удовлетворяет указанную потребность обеспечением вновь обнаруженного растворимого рецептора интерлейкина-20 (IL-20). Этот растворимый рецептор может быть использован для даун-регуляции (понижающей регуляции) IL-20 и, следовательно, лечения воспалительных заболеваний, таких как псориаз и воспалительные заболевания легких.
IL-20 был прежде назван 'Zcyto 10' (Международная патентная публикация № WO 99/27103) и имеет аминокислотные последовательности SEQ ID NO: 1-9. Рецептор для IL-20 состоит из двух цепей, альфа-цепи и бета-цепи. Альфа-цепь, далее называемая IL-20RA, прежде называлась ZcytoR7. См. Патент США №5945511. Бета-цепь, далее называемая IL-20RB, прежде называлась DIRS1. См. Международную Патентную Заявку №PCT/US99/03735. Данное изобретение представляет растворимый рецептор, состоящий из внеклеточного домена IL-20RA и внеклеточного домена IL-20RB.
Данное изобретение включает в себя выделенный растворимый рецептор, состоящий из субъединицы 'IL-20RA' и субъединицы 'IL-20RB', где субъединица IL-20RA состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, 38, 55, 63 и 65, а субъединица IL-20RB состоит из полипептида, имеющего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:15, 59, 61, 67, 68 и 69. Субъединицы IL-20RA и IL-20RB обычно связаны вместе полипептидным линкером. Связывание может быть с использованием любого способа, но обычно осуществляется пептидной связью или дисульфидной связью между полипептидом, связанным с субъединицей IL-20RA, и полипептидом, связанным с субъединицей IL-20RB. Данное изобретение относится также к выделенным полинуклеотидам, которые кодируют новые полипептиды IL-20RA и IL-20RB данного изобретения.
В одном варианте субъединица IL-20RA слита с константной областью молекулы иммуноглобулина (Ig) или ее частью, а субъединица IL-20RB слита с константной областью легкой цепи молекулы Ig таким образом, что константная область легкой цепи связана дисульфидной связью с константной областью тяжелой цепи, обычно с остатком цистеина на шарнирной области тяжелой цепи. Может быть и наоборот, т.е. субъединица IL-20RA может быть слита с константной областью легкой цепи молекулы Ig, а субъединица IL-20RB может быть слита с константной областью тяжелой цепи молекулы Ig.
В одном варианте растворимого рецептора данного изобретения субъединица IL-20RA, слитая с константной областью тяжелой цепи, содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:23, 53, 54 и 62, а субъединица IL-20RB, слитая с константной областью легкой цепи молекулы Ig, содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:21, 57, 58 и 60.
Заявлен также белок, имеющий первый полипептид и второй полипептид, где первый полипептид содержит аминокислотную последовательность SEQ ID NO:66, а второй полипептид содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:70 и 71. Полученный белок может быть использован для генерирования антител к субъединице IL-20RA и субъединице IL-20RB.
Определения
Перед более подробным изложением данного изобретения для его понимания может быть полезным определение следующих терминов.
Термины "амино-концевое" и "карбокси-концевое" используют здесь для обозначения положений в полипептидах. В тех случаях, когда это позволяет контекст, эти термины используют со ссылкой на конкретную последовательность или часть полипептида для обозначения близости или относительного положения. Например, определенная последовательность, расположенная карбокси-терминально относительно ссылочной последовательности в полипептиде, расположена проксимально к карбоксильному концу ссылочной последовательности, но не находится обязательно на карбоксильном конце полного полипептида.
В применении здесь, термин "слитый с антителом белок" относится к рекомбинантной молекуле, которая содержит компонент антитела и терапевтический агент. Примеры терапевтических агентов, пригодных для таких слитых белков, включают в себя иммуномодуляторы ("слитый белок антитело-иммуномодулятор") и токсины ("слитый белок антитело-токсин").
Термин "пара комплемент/антикомплемент" обозначает неидентичные части молекулы, которые образуют нековалентно связанную, стабильную пару при подходящих условиях. Например, биотин и авидин (или стрептавидин) являются членами-прототипами пары комплемент/антикомплемент. Другие примеры пар комплемент/антикомплемент включают в себя пары рецептор/лиганд, пары антитело/антиген (или гаптен или эпитоп), пары смысловой полинуклеотид/антисмысловой полинуклеотид и т.п. Если желательна последующая диссоциация пары комплемент/антикомплемент, пара комплемент/антикомплемент имеет аффинность связывания <109 М-1.
Термин "комплементы полинуклеотидной молекулы" обозначает полинуклеотидную молекулу, имеющую комплементарную последовательность оснований и обратную ориентацию в сравнении со ссылочной последовательностью. Например, последовательность 5' ATGCACGGG 3' является комплементарной 5' CCCGTGCAT 3'.
Термин "контиг" обозначает полинуклеотид, который имеет смежный отрезок идентичной или комплементарной последовательности в отношении другого полинуклеотида. Говорят, что смежные последовательности (контиги) "перекрывают" конкретный отрезок полинуклеотидной последовательности либо в их полном виде, либо вдоль частичного отрезка данного полинуклеотида. Например, репрезентативными контигами полинуклеотидной последовательности 5'-ATGGCTTAGCTT-3' являются последовательность 5'-TAGCTTgagtct-3' и 3'-gtcgacTACCGA-5'.
Термин "вырожденная нуклеотидная последовательность" обозначает последовательность нуклеотидов, которая включает в себя один или более вырожденных кодонов (в сравнении со ссылочной полинуклеотидной молекулой, которая кодирует полипептид). Вырожденные кодоны содержат различные триплеты нуклеотидов, но кодируют один и тот же аминокислотный остаток (т.е. каждый из триплетов GAU и GAC кодирует Asp).
Термин "экспрессирующий вектор" используется для обозначения молекулы ДНК, линейной или кольцевой, которая содержит сегмент, кодирующий представляющий интерес полипептид, функционально связанный с дополнительными сегментами, которые обеспечивают его транскрипцию. Такие дополнительные сегменты включают в себя промоторную и терминаторную последовательности и могут также включать в себя одну или несколько точек начала репликации, один или несколько селектируемых маркеров, энхансер, сигнал полиаденилирования и т.д. Экспрессирующие векторы обычно произведены из плазмидной или вирусной ДНК или могут содержать элементы обеих.
Термин "выделенный", в применении к полинуклеотиду, обозначает, что этот полинуклеотид был удален из его природной генетической среды и, следовательно, не содержит других посторонних или нежелательных кодирующих последовательностей и находится в форме, подходящей для применения в генетически сконструированных системах продуцирования белков. Такие выделенные молекулы являются молекулами, которые выделены из их природного окружения, и включают в себя кДНК-клоны и геномные клоны. Выделенные молекулы ДНК данного изобретения не содержат других генов, с которыми они обычно связаны, но могут включать в себя природно встречающиеся 5'- и 3'-нетранслируемые районы, такие как промоторы и терминаторы. Идентификация связанных районов будет очевидной лицу с обычной квалификацией в данной области (см., например, Dynan and Tijan, Nature 316:774-78, 1985).
"Выделенным" полипептидом или белком является полипептид или белок, который обнаруживается в условиях, иных, чем его природное окружение, например, отдельно от крови и ткани животного. В предпочтительной форме, выделенный полипептид является по существу не содержащим других полипептидов, в частности, других полипептидов животного происхождения. Предпочтительно обеспечение полипептидов в высокоочищенной форме, т.е. имеющих чистоту более 95%, более предпочтительно чистоту более 99%. При использовании в этом контексте, термин "выделенный" не исключает присутствия того же самого полипептида в альтернативных физических формах, таких как димеры или альтернативно гликозилированные или дериватизованные формы.
Термин "функционально (оперативно) связанные", при ссылке на ДНК-сегменты, указывает, что эти сегменты расположены таким образом, что они функционируют совместно для их предполагаемых целей, например, транскрипция инициируется в промоторе и протекает через кодирующий сегмент до терминатора.
Термин "полинуклеотид" обозначает одно- или двухцепочечный полимер дезоксирибонуклеотидных или рибонуклеотидных оснований, считываемых от 5'-конца к 3'-концу. Полинуклеотиды включают в себя РНК и ДНК и могут быть изолированы из природных источников, синтезированы in vitro или получены из комбинации природных и синтетических молекул. Размеры полинуклеотидов выражаются в парах нуклеотидов (сокращенно "п.н."), нуклеотидах ("нт") или тысячах пар нуклеотидов ("т.п.н."). Там, где позволяет контекст, два последних термина могут описывать полинуклеотиды, которые являются одноцепочечными или двухцепочечными. При использовании этого термина к двухцепочечным молекулам его используют для обозначения всей длины, и он, как будет понятно, является эквивалентным термину "пары оснований". Специалистам в данной области будет понятно, что эти две цепи двухцепочечного полинуклеотида могут слегка отличаться по длине и что их концы могут быть ступенчатыми как результат ферментативного расщепления; таким образом, не все нуклеотиды в двухцепочечной молекуле полинуклеотида могут быть спаренными. Подобные неспаренные концы обычно не превышают 20 нуклеотидов в длину.
"Полипептид" является полимером аминокислотных остатков, соединенных пептидными связями, получен ли он природным путем или синтетическим путем. Полипептиды, имеющие менее приблизительно 10 аминокислотных остатков, обычно называют "пептидами".
Термин "промотор" используется здесь в его признанном в данной области значении для обозначения части гена, содержащей последовательности ДНК, которые обеспечивают связывание РНК-полимеразы и инициацию транскрипции. Промоторные последовательности обнаруживаются обычно, но не всегда, в 5'-некодирующих районах генов.
"Белок" обозначает макромолекулу, содержащую одну или несколько полипептидных цепей. Белок может включать в себя также непептидные компоненты, такие как углеводные группы. Углеводы и другие непептидные компоненты могут быть присоединены к белку клеткой, в которой продуцируется данный белок, и будут варьироваться в зависимости от типа клетки. Белки определены здесь в терминах их аминокислотных каркасных структур; заместители, такие как углеводные группы, обычно не указаны, но тем не менее они могут присутствовать.
Термин "рецептор" используется здесь для обозначения связанного в клеткой белка, который связывается с биоактивной молекулой ("лигандом") и опосредует действие этого лиганда на клетку. Мембраносвязанные рецепторы характеризуются мультидоменной структурой, содержащей внеклеточный лигандсвязывающий домен и внутриклеточный эффекторный домен, который обычно участвует в передаче (трансдукции) сигнала. Связывание лиганда с рецептором приводит к конформационному изменению в рецепторе, которое вызывает взаимодействие между эффекторным доменом (доменами) и другой молекулой (молекулами) в клетке. Это взаимодействие, в свою очередь, приводит к изменениям в метаболизме клетки. Метаболические события, связанные с взаимодействиями рецептор-лиганд, включают в себя транскрипцию, фосфорилирование, дефосфорилирование, увеличение продуцирования циклического АМФ, мобилизацию клеточного кальция, мобилизацию мембранных липидов, клеточную адгезию, гидролиз инозитлипидов и гидролиз фосфолипидов. Обычно, рецепторы могут быть мембраносвязанными, цитозольными или ядерными, мономерными (например, рецептор тиреоидстимулирующего гормона, рецептор β-адренергического гормона) или мультимерными (например, PDGF-рецептор, рецептор гормона роста, IL-3-рецептор, GM-CSF-рецептор, G-CSF-рецептор, рецептор эритропоэтина и IL-6-рецептор).
Термин "секреторная сигнальная последовательность" обозначает здесь последовательность ДНК, которая кодирует полипептид ("секреторный полипептид"), который, как компонент большего полипептида, направляет этот больший полипептид через секреторный путь клетки, в которой он синтезируется. Этот больший полипептид обычно расщепляется с удалением секреторного пептида во время прохождения через этот секреторный путь.
Термин "сплайсинговый вариант" используется здесь для обозначения альтернативных форм РНК, транскрибированных из гена. Сплайсинговая вариация возникает природно посредством использования альтернативных сайтов сплайсинга в транскрибируемой молекуле РНК, или менее обычно между раздельно транскрибируемыми молекулами РНК, и может приводить к нескольким мРНК, транскрибируемым из одного и того же гена. Сплайсинговые варианты могут кодировать полипептиды, имеющие измененную аминокислотную последовательность. Термин сплайсинговый вариант используют здесь также для обозначения белка, кодируемого сплайсинговым вариантом мРНК, транскрибируемым из гена.
Должно быть понятно, что молекулярные массы и длины полимеров, определяемые неточными аналитическими методами (например, гель-электрофорезом), являются приблизительными величинами. Когда такая величина выражается как "около" Х или "приблизительно" X, указанная величина Х должна пониматься как величина, определенная с точностью до ±10%.
Как указывалось выше, IL-20 (ранее называемый Zcyto10) является определенным, и способы получения IL-20 и антител к IL-20 описаны в Международной Патентной Заявке №PCT/US98/25228, публикации № WO 99/27103, опубликованной 25 ноября 1998 года, и Патентной Заявке США №09/313 458, поданной 17 мая 1999 года. Полинуклеотид и полипептид IL-20 человека представлены SEQ ID NO: 1-4, а IL-20 мыши SEQ ID NO:5-9.
Был обнаружен рецептор для IL-20, и он является гетеродимером, состоящим из полипептида, называемого 'IL-20RA' (прежде называемого Zcytor7), и полипептида, называемого 'IL-20RB'. Полипептид IL-20RA, нуклеиновая кислота, кодирующая его, антитела к IL-20RA и способы его получения описаны в Патенте США №5945511, выданном 31 августа 1999 года. SEQ ID NO:10-12 являются полинуклеотидами и полипептидами IL-20RA. Внеклеточный домен IL-20RA человека состоит из полипептида, выбранного из группы, состоящей из последовательностей SEQ ID NO: 12, 55, 63 и 65, причем полноразмерная субъединица рецептора состоит из SEQ ID NO:11. Внеклеточный домен мышиного IL-20RA представляет собой SEQ ID NO:38, причем SEQ ID NO:37 является полной мышиной субъединицей IL-20RA.
Внеклеточный домен 1L-20RB (SEQ ID NO:13-14 и вариантные SEQ ID NO:18 и 19) состоит из полипептида, выбранного из группы, состоящей из последовательностей SEQ ID NO: 15, 59, 61, 67, 68 и 69. Предпочтительно, внеклеточный домен полипептида IL-20RA и внеклеточный домен полипептида 1L-20RB ковалентно связаны друг с другом. В предпочтительном варианте внеклеточный полипептид одной субъединицы имеет константную область тяжелой цепи иммуноглобулина, слитую с его карбокси-концом, а другая внеклеточная субъединица имеет константную область легкой цепи иммуноглобулина (Ig), слитую с ее карбокси-концом, так что оба эти полипептида объединяются вместе с образованием растворимого рецептора и между тяжелой и легкой цепями Ig образуется дисульфидная связь. В другом способе, пептидный линкер мог бы быть слит с двумя карбокси-концами полипептидов с образованием ковалентно связанного растворимого рецептора.
Последовательности SEQ ID NO:22 и 23 являются конструкциями внеклеточного домена IL-20RA, слитого с мутированной константной областью иммуноглобулина гамма 1 человека, полученными в соответствии с процедурой, описанной в примере 5. SEQ ID NO:62 является предсказанной зрелой последовательностью без сигнальной последовательности. SEQ ID NO:20 и 21 являются конструкциями внеклеточного домена 1L-20RB, слитого с константной областью дикого типа легкой цепи каппа иммуноглобулина человека, полученными в соответствии с процедурой примера 5. SEQ ID NO:60 является предсказанной зрелой последовательностью без сигнальной последовательности. Фиг.1 изображает гетеротетрамер, полученный в примере 5.
SEQ ID NO:52 и 53 являются конструкциями внеклеточного домена IL-20RA, слитыми с мутированной константной областью иммуноглобулина гамма 1 человека, полученными в соответствии с процедурой, описанной в примере 12. SEQ ID NO:54 является предсказанной зрелой последовательностью без сигнальной последовательности. SEQ ID NO:56 и 57 являются конструкциями внеклеточного домена IL-20RB, слитого с константной областью дикого типа легкой цепи каппа иммуноглобулина человека, полученными в соответствии с процедурой примера 12. SEQ ID NO:58 является предсказанной зрелой последовательностью без сигнальной последовательности. Полученный гетеротетрамер является почти идентичным гетеротетрамеру, полученному в примере 5, причем первичным отличием является отсутствие полипептидного линкера между внеклеточными доменами и началом константных областей Ig, 22 на фиг.1. В дальнейшем, термин "внеклеточный домен рецептора" означает внеклеточный домен рецептора или часть внеклеточного домена, которая является необходимой для связывания с его лигандом, причем в данном случае лиганд представляет собой IL-20.
Можно связать вместе внеклеточные домены IL-20RA и IL-20RB рядом способов таким образом, что полученный растворимый рецептор связывается с IL-20. Фиг.1-8 иллюстрируют репрезентативный ряд вариантов данного изобретения. Общие элементы в каждом из чертежей указываются одной и той же цифрой. Фиг.1 представляет вариант данного изобретения, полученный в соответствии с примером 5 ниже. Конструкция растворимого рецептора, обозначенная цифрой 10, состоит из двух полипептидных цепей сайта связывания IL-20, обозначенных 12 и 14. Каждый сайт связывания состоит из внеклеточного домена IL-20RA, обозначенного 16, и внеклеточного домена IL-20RB, обозначенного 18.
Внеклеточный домен, 16, IL-20RA связан с одним константным тяжелым (СН1) доменом (20) константной области тяжелой цепи иммуноглобулина гамма 1 человека через линкер 22, который представляет собой SEQ ID NO:72. Затем СН1-домен, 20, связан с Cl-12-доменом, 24, через шарнирный район 23. СН2-домен, 24, связан с СН3-доменом, 26, через шарнирный район 25.
В сравнении конструкции фиг.1 с SEQ ID NO:22, внеклеточный домен, 16, IL-20RA простирается от аминокислотного остатка 36, валина, до (и включительно) аминокислотного остатка 249, глутамина последовательности SEQ ID NO:22. Полипептидный линкер 22 простирается от аминокислотного остатка 250, глицина, до (и включительно) аминокислотного остатка 264, серина, SEQ ID NO:22. СН1-домен, 22, фиг.1 простирается от аминокислотного остатка 265, аланина, до (и включительно) аминокислотного остатка 362, валина, SEQ ID NO:22. Шарнирный район 23 фиг.1 простирается от аминокислотного остатка 363, глутаминовой кислоты, до (и включительно) аминокислотного остатка 377, пролина, SEQ ID NO:22. Цепи 12 и 14 связаны одна с другой дисульфидными связями посредством дисульфидных связей 28 и 30. Эти дисульфидные связи образованы между тяжелыми цепями цистеиновыми остатками в положениях 373 и 376 SEQ ID NO:22 каждой из двух тяжелых цепей.
Внеклеточный домен, 18, IL-20RB связан с тяжелой областью легкой цепи каппа (CL) человека, 34 фиг.1, через полипептидный линкер 32, который представляет собой полипептид SEQ ID NO:72. Внеклеточный домен, 18, IL-20RB простирается от аминокислотного остатка 30, валина, до (и включительно) аминокислотного остатка 230, аланина, SEQ ID NO:20. Полипептидный линкер, 32, простирается от аминокислотного остатка 231, глицина, до (и включительно) аминокислотного остатка 245, серина, SEQ ID NO:20. Константная область легкой цепи каппа, 34, простирается от аминокислотного остатка 246, аргинина, до (и включительно) конечного аминокислотного остатка 352, цистеина, последовательности SEQ ID NO:20. Цистеин в положении 352 SEQ ID NO:20 образует дисульфидную связь, 36 на фиг.1, с цистеином в положении 367 SEQ ID NO:22. Таким образом, константная область легкой цепи 34 связана с шарнирным районом 23 дисульфидной связью 36. Таким образом внеклеточный домен, 16, IL-20RA связан с внеклеточным доменом, 18, IL-20RB с образованием растворимого рецептора.
Если остатки цистеина в положениях 373 и 376 SEQ ID NO:22 заменяли на отличающиеся аминокислотные остатки, два IL-20-связывающих полипептида, 12 и 14, не могли быть связаны дисульфидными связями вместе и образовывали конструкцию, показанную на фиг.2, имеющую шарнирный район 27.
Фиг.3 показывает очень простой растворимый рецептор 38 данного изобретения, в котором внеклеточный домен, 16, IL-20RA связан с внеклеточным доменом, 18, IL-20RB посредством полипептидного линкера, 40. Полипептидный линкер простирается от амино-конца внеклеточного домена, 16, IL-20RA и соединен с карбоксильным концом внеклеточного домена, 18, IL-20RB. Полипептидный линкер должен иметь длину между 100-240 аминокислот, предпочтительно приблизительно длину 170 аминокислот. Подходящий линкер мог бы содержать остатки глицина и серина. Возможный линкер мог бы быть множественными единицами SEQ ID NO:72, предпочтительно приблизительно 12 единицами.
Фиг.4 показывает вариант, который имеет внеклеточный домен, 16, IL-20RA, связанный с внеклеточным доменом, 18, IL-20RB посредством линкера 40, как на фиг.3. Хотя внеклеточный домен, 16, IL-20RA связан с СH1-доменом, 20, как на фиг.1, посредством полипептидного линкера 42, который должен иметь длину приблизительно 30 аминокислотных остатков. Идеальный линкер мог бы состоять из глицина и серина, как в SEQ ID NO:72, и шарнирной последовательности 23 фиг.1.
Фиг.5 показывает возможный вариант данного изобретения. В этом варианте полипептидный линкер 44 из приблизительно 15 аминокислотных остатков, например, SEQ ID NO:72, связывает карбоксил-конец внеклеточного домена, 18, IL-20RB с амино-концом внеклеточного домена, 16, IL-20RA. Полипептидный линкер 46 из приблизительно 30 аминокислотных остатков простирается от карбокси-конца внеклеточного домена, 16, IL-20RA до СН2-домена. Карбоксильный конец линкера 46 предпочтительно содержит шарнирный район, простирающийся от аминокислотного остатка 363, глутаминовой кислоты, до (и включительно) аминокислотного остатка 377, пролина, последовательности SEQ ID NO:22. Тем не менее, полипептидный линкер 46 в идеале имеет по меньшей мере один остаток цистеина на его карбоксильном конце, так что может образовываться дисульфидная связь.
Растворимый IL-20-рецептор фиг.6 идентичен рецептору фиг.1, за исключением того, что СН3-домен, 26 фиг.1, не присутствует в варианте фиг.6. СН3-район начинается при аминокислотном остатке 488, глицине, и простирается до последнего остатка 594 SEQ ID NO:22.
Фиг.7 показывает конструкцию IL-20-рецептора, которая идентична конструкции фиг.1, за исключением того, что отсутствуют оба домена СН2 и СН3. Домены СН2 и СН3 идут от аминокислотного остатка 378, аланина, до конца полипептидной последовательности SEQ ID NO:22.
Фиг.8 показывает конструкцию, в которой как IL-20RA, 16, так и IL-20RB имеют полипептидный линкер, 48, слитый с их соответствующими карбоксильными концами. Каждый полипептидный линкер имеет два остатка цистеина, так что, когда они экспрессируются, эти цистеины образуют дисульфидные связи, 50 и 52. В этом случае полипептидный линкер содержит шарнирный район, 23 на фиг.1. Шарнирный район состоит из аминокислотных остатков 363, глутамина, и до (и включительно) аминокислотного остатка 377 SEQ ID NO:22.
В другом аспекте данного изобретения представлен способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-20RA и IL-20RB, предусматривающий (а) введение в клетку-хозяина первой ДНК-последовательности, состоящей из транскрипционного промотора, функционально связанного с первой секреторной сигнальной последовательностью, с последующими, расположенными по ходу транскрипции (справа) и в правильной рамке считывания ДНК-последовательностью, которая кодирует внеклеточную часть IL-20RA, и ДНК-последовательностью, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клетку-хозяина второй ДНК-конструкции, состоящей из транскрипционного промотора, функционально связанного со второй секреторной сигнальной последовательностью, с последующими, расположенными по ходу транскрипции (справа) и в правильной рамке считывания ДНК-последовательностью, которая кодирует внеклеточную часть IL-20RB, и ДНК-последовательностью, которая кодирует домен константной области тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из Сн1, Сн2, Сн3 и Сн4; (с) выращивание клетки-хозяина в подходящей среде для выращивания при физиологических условиях, позволяющих секрецию слитого белка, состоящего из внеклеточного домена IL-20RA и IL-20RB; и (d) выделение этого полипептида из клетки-хозяина. В одном варианте вторая ДНК-последовательность дополнительно кодирует шарнирный район тяжелой цепи иммуноглобулина, где этот шарнирный район присоединен к указанному домену константной области тяжелой цепи. В другом варианте вторая ДНК-последовательность дополнительно кодирует вариабельную область иммуноглобулина, присоединенную против хода транскрипции (слева) от константной области тяжелой цепи иммуноглобулина и в правильной рамке считывания с ней.
В альтернативном варианте представлен способ получения растворимого рецептора, состоящего из внеклеточных доменов IL-20RA и IL-20RB, предусматривающий (а) введение в клетку-хозяина первой ДНК-последовательности, состоящей из транскрипционного промотора, функционально связанного с первой секреторной сигнальной последовательностью, с последующими, расположенными по ходу транскрипции (справа) и в правильной рамке считывания ДНК-последовательностью, которая кодирует внеклеточную часть IL-20RB, и ДНК-последовательностью, которая кодирует константную область легкой цепи иммуноглобулина; (b) введение в клетку-хозяина второй ДНК-конструкции, состоящей из транскрипционного промотора, функционально связанного со второй секреторной сигнальной последовательностью, с последующими, расположенными по ходу транскрипции (справа) и в правильной рамке считывания ДНК-последовательностью, которая кодирует внеклеточную часть IL-20RA, и ДНК-последовательностью, которая кодирует домен константной области тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из Сн1, Сн2, Сн3 и Сн4; (с) выращивание клетки-хозяина в подходящей среде для выращивания при физиологических условиях, позволяющих секрецию димеризованного гетеродимерного слитого белка, состоящего из внеклеточного домена IL-20RA и IL-20RB; и (d) выделение этого димеризованного полипептида из клетки-хозяина. В одном варианте вторая ДНК-последовательность дополнительно кодирует шарнирный район тяжелой цепи иммуноглобулина, где этот шарнирный район присоединен к указанному домену константной области тяжелой цепи. В другом варианте вторая ДНК-последовательность дополнительно кодирует вариабельную область иммуноглобулина, присоединенную против хода транскрипции (слева) от константной области тяжелой цепи иммуноглобулина и в правильной рамке считывания с ней. (См. патент США №5843725).
Полинуклеотид, обычно кДНК-последовательность, кодирует описанные здесь полипептиды. кДНК-последовательность, которая кодирует полипептид данного изобретения, состоит из ряда кодонов, причем каждый аминокислотный остаток полипептида кодируется кодоном и каждый кодон состоит из трех нуклеотидов. Аминокислотные остатки кодируются их соответствующими кодонами следующим образом.
Аланин (Ala) кодируется GCA, GCC, GCG или GCT.
Цистеин (Cys) кодируется TGC или TGT.
Аспарагиновая кислота (Asp) кодируется GAC или GAT.
Глутаминовая кислота кодируется GAA или GAG.
Фенилаланин (Phe) кодируется ТТС или ТТТ.
Глицин (Gly) кодируется GGA, GGC, GGG или GGT.
Гистидин (His) кодируется САС или CAT.
Изолейцин (Ile) кодируется АТА, АТС или АТТ.
Лизин (Lys) кодируется ААА или AAG.
Лейцин (Leu) кодируется ТТА, TTG, СТА, СТС, CTG или
СТТ.
Метионин (Met) кодируется ATG.
Аспарагин (Asn) кодируется ААС или ААТ.
Пролин (Pro) кодируется ССА, ССС, CCG или ССТ.
Глутамин (Gln) кодируется САА или CAG.
Аргинин (Arg) кодируется AGA, AGG, CGA, CGC, CGG или
CGT.
Серин (Ser) кодируется AGC, AGT, TCA, TCC, TCG или ТСТ.
Треонин (Thr) кодируется АСА, АСС, ACG или ACT.
Валин (Val) кодируется GTA, GTC, GTG или GTT.
Триптофан (Тгр) кодируется TGG.
Тирозин (Туг) кодируется ТАС или TAT.
Должно быть понятно, что в соответствии с данным изобретением, когда заявляется полинуклеотид, как описано здесь, следует понимать, что заявляется тем самым смысловая цепь, антисмысловая цепь и ДНК в виде двухцепочечной ДНК, имеющей как смысловую, так и антисмысловую цепь, отожженные (гибридизованные) вместе посредством их соответствующих водородных связей. Заявляется также мессенджер-РНК (мРНК), которая кодирует полипептиды данного изобретения и которая кодируется описанной здесь кДНК. Мессенджер РНК (мРНК) будет кодировать полипептид с использованием тех же самых кодонов, что и кодоны, определенные здесь, за исключением того, что каждый нуклеотид тимин (Т) заменен нуклеотидом урацилом (U).
Специалисту с обычной квалификацией в данной области будет также понятно, что различные виды могут проявлять "предпочтительное (преферентивное) использование кодонов". В общем, см., Grantham, et al., Nuc. Acids Res. 8: 1893-1912, 1980; Haas, et al., Curr. Biol. 6: 315-324, 1996; Wain-Hobson, et al., Gene 13: 355-364, 1981; Grosjean and Fiers, Gene 18: 199-209, 1982; Holm, Nuc. Acids Res. 14: 3075-3087, 1986; Ikemura, J. Mol. Biol. 158: 573-597, 1982. В применении здесь, термин "предпочтительное (преферентивное) использование кодонов" или "предпочтительные (преферентивные) кодоны" является термином данной области, относящимся к кодонам трансляции белка, которые наиболее часто используются в клетках определенных видов, отдавая, следовательно, предпочтение одному или немногим представителям возможных кодонов, кодирующих каждую аминокислоту. Например, аминокислота треонин (Thr) может кодироваться АСА, АСС, ACG или ACT, но в клетках млекопитающих наиболее обычно используемым кодоном является АСС; в других видах, например, в клетках насекомых, дрожжей, вирусов или бактерий, могут быть предпочтительными другие кодоны Thr. Предпочтительные кодоны для конкретных видов могут быть введены в полинуклеотиды данного изобретения различными способами, известными в данной области. Введение предпочтительных последовательностей кодонов в рекомбинантную ДНК может, например, усиливать продуцирование этого белка, делая трансляцию белка более эффективной в конкретном типе клеток или виде. Последовательности, содержащие предпочтительные кодоны, могут быть тестированы и оптимизированы для экспрессии в различных видах и тестированы на функциональность, как описано здесь.
Способы синтеза аминокислот и аминоацилирования тРНК известны в данной области. Транскрипцию и трансляцию плазмид, содержащих нонсенсмутации, проводят обычно в бесклеточной системе, содержащей экстракт Е. coli S30 и коммерчески доступные ферменты и другие реагенты. Белки очищают хроматографией. См., например, Robertson et al., J. Am. Chem. Soc. 113:2722 (1991); Ellman et al., Methods Enzymol. 202:301 (1991); Chung et al., Science 259:806-809 (1993) и Chung et al., Proc. Natl. Acad. Sci. USA 90:10145-1019 (1993). Во втором способе трансляцию проводят в ооцитах Xenopus микроинъекцией мутированной мРНК и химически аминоацилированных супрессорных тРНК, Turcatti et al., J. Biol. Chem. 271:19991-19998 (1996). В третьем способе клетки Е. coli культивируют в отсутствие природной аминокислоты, которую предстоит заменить (например, фенилаланина), и в присутствии желательной природно не встречающейся аминокислоты (аминокислот) (например, 2-азафенилаланина, 3-азафенилаланина, 4-азафенилаланина или 4-фторфенилаланина). Природно не встречающаяся аминокислота включается в этот белок вместо ее природной копии. См. Koide et al., Biochem. 33:7470-3476 (1994). Природно встречающиеся аминокислотные остатки могут быть превращены в природно не встречающиеся разновидности химической модификацией in vitro. Химическая модификация может комбинироваться с сайт-направленным мутагенезом для дополнительного расширения диапазона замен, Wynn and Richards, Protein Sci. 2:395-403 (1993).
Аминокислотные остатки могут быть заменены ограниченным числом неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, не встречающихся в природе аминокислот и неприродных аминокислот.
Незаменимые аминокислоты в полипептидах данного изобретения могут быть идентифицированы в соответствии с процедурами, известными в данной области, такими как сайт-направленный мутагенез или аланинсканирующий мутагенез (Cunningham and Wells, Science 244:1081-1085 (1989); Bass et al., Proc. Natl. Acad. Sci. USA 88:4498-502 (1991). В последнем способе отдельные мутации аланина вводят при каждом остатке в молекуле и полученные в результате мутантные молекулы тестируют на биологическую активность, как описано ниже, для идентификации аминокислотных остатков, которые являются критическими для активности данной молекулы. См. также Hilton et al., J. Biol. Chem. 271: 4699-708, 1996. Сайты лиганд-рецепторного взаимодействия могут быть также определены физическим анализом структуры, как определено такими способами, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение, вместе с мутацией предполагаемого сайта контакта аминокислот. См., например, de Vos et al., Science 255:306-312 (1992); Smith et al., J. Mol. Biol. 224:899-904 (1992); Wlodaver et al., FEBS Lett. 309:59-64 (1992).
Многочисленные аминокислотные замены могут быть произведены и тестированы с использованием известных способов мутагенеза и скрининга, таких как описанные Reidhaar-Olson and Sauer, Science 241:53-57 (1988) или Bowie and Sauer, Proc. Natl. Acad. Sci. USA 86:2152-2156 (1989). Вкратце, эти авторы описывают способы одновременной рандомизации двух или более положений в полипептиде, отбора на функциональный полипептид и затем секвенирования мутагенизированных полипептидов для определения спектра допустимых замен в каждом положении. Другие способы, которые могут быть использованы, включают в себя способ фагового представления, например, Lowman et al., Biochem. 30:10832-10837 (1991); Ladner et al., U.S. Patent No. 5 223 409; Huse, WIPO Publication WO 92/06204, и район-направленный мутагенез, Derbyshire et al., Gene 46:145 (1986); Ner et al., DNA 7:127 (1988).
Варианты описанных последовательностей ДНК и полипептидных последовательностей IL-20, IL-20RA и IL-20RB могут быть образованы перетасовкой ДНК, описанной Stemmer, Nature 370: 389-391 (1994), Stemmer, Proc. Natl. Acad. Sci. USA 91:10747-107751 (1994) и в международной публикации WIPO Publication WO 97/20078. Вкратце, вариантные ДНК генерируют посредством гомологичной рекомбинации in vitro случайной фрагментацией исходной ДНК с последующей повторной сборкой при помощи ПЦР, приводящей к случайно введенным точковым мутациям. Этот способ может быть модифицирован с использованием семейства исходных молекул ДНК, таких как аллельные варианты или молекулы ДНК из различных видов, для введения дополнительной вариабельности в этот процесс. Отбор или скрининг на желательную активность с последующими дополнительными повторениями мутагенеза и анализа обеспечивает быструю "эволюцию" последовательностей посредством отбора на желательные мутации с одновременным отбором против вредных изменений.
Способы мутагенеза, описанные здесь, могут комбинироваться с высокопроизводительными автоматизированными способами скрининга для обнаружения активности клонированных мутагенизированных полипептидов в клетках-хозяевах. Мутагенизированные молекулы ДНК, кодирующие активные полипептиды, могут быть извлечены из клеток-хозяев и быстро секвенированы с использованием современного оборудования. Эти способы делают возможным быстрое определение важности индивидуальных аминокислотных остатков в представляющем интерес полипептиде и могут применяться к полипептидам неизвестной структуры.
ПОЛУЧЕНИЕ БЕЛКОВ
Полипептиды могут продуцироваться в генетически сконструированных клетках-хозяевах в соответствии с общепринятыми способами. Подходящими клетками-хозяевами являются те типы клеток, которые могут быть трансформированы или трансфицированы экзогенной ДНК и выращены в культуре, и они включают в себя бактерии, грибковые клетки и культивируемые высшие эукариотические клетки. Эукариотические клетки, в частности, культивируемые клетки многоклеточных организмов, являются предпочтительными. Способы манипулирования клонированными молекулами ДНК и введения экзогенной ДНК в различные клетки-хозяева описаны в Sambrook et al., Molecular Cloning: A Laboratory Manual, (2nd ed.) (Cold Sprind Harbor Laboratory Press, Cold Spring Harbor, NY, 1989) и Ausubel et al. (eds.) Current Protocols in Molecular Biology (John Wiley and Sons, Inc., NY, 1987).
В общих чертах, последовательность ДНК, кодирующую полипептид, функционально связывают с другими генетическими элементами, требующимися для ее экспрессии, обычно включающими в себя промотор и терминатор транскрипции, в экспрессирующем векторе. Этот вектор обычно будет также содержать один или несколько селектируемых маркеров и одну или несколько точек инициации репликации, хотя специалистам в данной области будет понятно, что в некоторых системах селектируемые маркеры могут быть обеспечены на отдельных векторах, и репликация экзогенной ДНК может быть обеспечена интеграцией в геном клетки-хозяина. Выбор промоторов, терминаторов, селектируемых маркеров, векторов и других элементов является предметом рутинного конструирования в пределах обычной квалификации в данной области. Многие такие элементы описаны в литературе и являются доступными.
Для направления полипептида в секреторный путь клетки-хозяина, в экспрессирующем векторе обеспечивают секреторную сигнальную последовательность (также известную как лидерная последовательность, препропоследовательность или пре-последовательность). Секреторная сигнальная последовательность может быть сигнальной последовательностью природных полипептидов или может быть произведена из другого секретируемого белка (например, t-PA (тканевого активатора плазминогена)) или синтезирована de novo. Секреторная сигнальная последовательность функционально связана с последовательностью данной ДНК, т.е. эти две последовательности соединены в правильной рамке считывания и правильно помещены для направления вновь синтезированного полипептида в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности обычно расположены 5' (слева) от последовательности ДНК, кодирующей представляющий интерес полипептид, хотя некоторые сигнальные последовательности могут быть расположены в другом месте в представляющей интерес последовательности ДНК (см., например, Welch et al., U.S. Patent No. 5037743; Holland et al., U.S. Patent No. 5143830).
Альтернативно, секреторная сигнальная последовательность, содержащаяся в полипептидах данного изобретения, используется для направления других полипептидов в секреторный путь. Данное изобретение обеспечивает такие гибридные (слитые) полипептиды. Секреторная сигнальная последовательность, содержащаяся в слитых (гибридных) полипептидах данного изобретения, предпочтительно слита на амино-конце с дополнительным пептидом для направления этого дополнительного пептида в секреторный путь. Такие конструкции имеют многочисленные применения, известные в данной области. Например, эти новые гибридные конструкции с секреторной сигнальной последовательностью могут направлять секрецию активного компонента обычно не секретируемого белка, такого как рецептор. Такие слитые белки могут быть использованы in vivo и in vitro для направления пептидов через секреторный путь.
Культивируемые клетки млекопитающих являются подходящими хозяевами в данном изобретении. Способы введения экзогенной ДНК в клетки-хозяева млекопитающих включают в себя опосредованную фосфатом кальция трансфекцию, Wigler et al., Cell 14:725 (1978), Corsaro and Pearson, Somatic Cell Genetics 7:603 (1981); Graham and Van der Eb, Virology 52:456 (1973), электропорацию, Neumann et al., EMBO J. 1:841-845 (1982), опосредованную ДЭАЭ-декстраном трансфекцию (Ausubel et al., ibid.) и опосредованную липосомами трансфекцию, Hawley-Nelson et al., Focus 15:73 (1993); Ciccarone et al., Focus 15:80 (1993), и вирусные векторы, Miller and Rosman, BioTechniques 7: 980 (1989); Wang and Finer, Nature Med. 2: 714 (1996). Получение рекомбинантных полипептидов в культивируемых клетках млекопитающих описано, например, Levinson et al., U.S. Patent No. 4 713 339; Hagen et al., U.S. Patent No. 4784950; Palmiter et al., U.S. Patent No. 4579821; и Ringold, U.S. Patent No. 4656134. Подходящие культивируемые клетки млекопитающих включают в себя клеточные линии COS-1 (АТСС No. CRL 1650), COS-7 (АТСС No. CRL 1651), ВНК (АТСС No. CRL 1632), ВНК 570 (АТСС No. CRL 10314), 293 (АТСС No. CRL 1573; Graham et al., J. Gen. Virol. 36:59 (1977) и линии клеток яичника китайского хомячка (например, СНО-К1; АТСС No. CCL 61). Дополнительные подходящие клеточные линии известны в данной области и доступны из общественных депозитариев, таких как Американская коллекция типовых культур (American Type Culture Collection, Rockville, Maryland). В общем, предпочтительны сильные промоторы транскрипции, такие как промоторы из SV-40 или цитомегаловируса. См., например, U.S. Patent No. 4 956 288. Другие подходящие промоторы включают в себя промоторы из генов металлотионеина (U.S. Patent No. 4 579 821 и U.S. Patent No. 4601978) и основной поздний промотор аденовируса.
Отбор с лекарственным средством обычно применяют для отбора на культивируемые клетки млекопитающих, в которые была встроена чужеродная ДНК. Такие клетки обычно называют "трансфектантами". Клетки, которые культивировались в присутствии селективного агента и способны передавать представляющий интерес ген их потомству, называют "стабильными трансфектантами". Предпочтительным селектируемым маркером является ген, кодирующий устойчивость к антибиотику неомицину. Отбор проводят в присутствии лекарственного средства типа неомицина, такого как G-418, или т.п. Системы отбора могут быть также использованы для увеличения уровня экспрессии представляющего интерес гена, способа, называемого "амплификацией". Амплификацию проводят культивированием трансфектантов в присутствии низкого уровня селективного агента и затем увеличением количества селективного агента для отбора клеток, которые продуцируют высокие уровни продуктов введенных генов. Предпочтительным амплифицируемым селектируемым маркером является дигидрофолатредуктаза, которая сообщает клеткам устойчивость к метотрексату. Другие гены устойчивости к лекарственным средствам (например, устойчивости к гигромицину, множественной устойчивости к лекарственным средствам, пуромицинацетилтрансферазе) также могут быть использованы. Альтернативные маркеры, которые вводят измененный фенотип, такие как зеленый флуоресцентный белок или белки клеточной поверхности, такие как CD4, CD8, МНС Класса I, щелочная фосфатаза плаценты, могут быть использованы для сортинга трансфицированных клеток от нетрансфицированных клеток такими способами, как FACS-сортинг (сортинг клеток с возбуждением флуоресценции) или способ разделения при помощи магнитных гранул.
Другие высшие эукариотические клетки могут быть также использованы в качестве хозяев, в том числе клетки растений, клетки насекомых и клетки птиц. Применение Agrobacterium rhizogenes в качестве вектора для экспрессии генов в клетках растений рассмотривалось в обзоре Sinkar et al., J. Biosci. (Bangalore) 11: 47 (1987). Трансформация клеток насекомых и получение в них чужеродных полипептидов описаны Guarino et al., U.S. Patent No. 5 162 222 и WIPO publication WO 94/06463. Клетки насекомых могут быть инфицированы рекомбинантным бакуловирусом, обычно произведенным из вируса ядерного полиэдроза Autographa californica (AcNPV). ДНК, кодирующую полипептид, встраивают в бакуловирусный геном вместо кодирующей последовательности гена полиэдрина (AcNPV) одним из двух способов. Первый способ является традиционным способом гомологичной рекомбинации ДНК между AcNPV дикого типа и вектором-переносчиком, содержащим ген, фланкированный последовательностями AcNPV. Подходящие клетки насекомых, например, клетки SF9, инфицируют AcNPV дикого типа и трансфицируют вектором-переносчиком, содержащим полинуклеотид, функционально связанный с промотором, терминатором и фланкирующими последовательностями гена полиэдрина AcNPV. См. King, L.A. and Possee, R.D., The Baculovirus Expression System: A Laboratory Guide (Chapman and Hall, London); O'Reilly, D.R. et al., Baculovirus Expression Vectors: A Laboratory Manual (Oxford University Press, New York, New York, 1994) и Richardson, С. D., Ed., Baculovirus Expression Protocols. Methods in Molecular Biology (Humana Press, Totowa, NJ 1995). Природная рекомбинация в клетке насекомого будет приводить к рекомбинантному бакуловирусу, который содержит кодирующие последовательности, запускаемые промотором полиэдрина. Исходные материалы рекомбинантного вируса получают способами, обычно используемыми в данной области.
Второй способ получения рекомбинантного бакуловируса использует систему на основе транспозона, описанную Luckow V.A. et al., J. Virol. 67: 4566 (1993). Эта система продается в наборе Bac-to-Bac (Life Technologies, Rockville, MD). Эта система использует вектор-переносчик, pFastBac1™ (Life Technologies), содержащий транспозон Tn7, для перемещения ДНК, кодирующей полипептид, в геном бакуловируса, поддерживаемый в E.coli, в виде большой плазмиды, названной "бакмидой". Вектор-переносчик pFastBac1™ использует промотор полиэдрина AcNPV для запуска экспрессии представляющего интерес гена. Однако pFastBac1™ может быть модифицирован до значительной степени. Промотор полиэдрина может быть удален и заменен промотором основного белка бакуловируса (также известного как Pcor, р6.9 или промотор МР), который экспрессируется раньше в инфекции бакуловирусом, и было показано, что он является предпочтительным для экспрессии секретируемых белков. См. Hill-Perkins, M.S. and Possee, R.D., J. Gen. Virol. 71: 971 (1990); Bonning, B.C. et al., J. Gen. Virol. 75: 1551 (1994) и Chazenbalk, G.D. and Rapoport, В., J. Biol. Chem. 270: 1543 (1995). В таких конструкциях векторов-переносчиков может быть использована длинная версия промотора основного белка. Кроме того, могут быть сконструированы векторы-переносчики, которые заменяют природные секреторные сигнальные последовательности секреторными сигнальными последовательностями, полученными из белков насекомых. Например, секреторная сигнальная последовательность из экдистероидглюкозилтрансферазы (EGT), Мелиттина медоносной пчелы (Invitrogen, Carlsbad, СА) или gp67 бакуловируса (PharMingen, San Diego, CA) могут быть использованы в конструкциях для замены природной секреторной сигнальной последовательности. Кроме того, векторы-переносчики могут содержать слияние в рамке считывания с ДНК, кодирующей метку эпитопа, на С- или N-конце экспрессируемого полипептида, например, метку эпитопа Glu-Glu, Grussenmeyer, Т. et al., Proc. Natl. Acad. Sci. 82: 7952- (1985). При помощи способа, известного в данной области, вектор-переносчик, содержащий рекомбинантный ген, трансформируют в Е.coli и подвергают скринингу на бакмиды, которые содержат прерванный ген lacZ, свидетельствующий о рекомбинантном бакуловирусе. Бакмидную ДНК, содержащую рекомбинантный геном бакуловируса, выделяют при помощи известных способов и используют для трансфекции клеток Spodoptera frugiperda, например, клеток Sf9. Затем получают рекомбинантный вирус, который экспрессирует рассматриваемый полипептид. Исходные материалы рекомбинантного вируса готовят способами, обычно используемыми в данной области.
Этот рекомбинантный вирус используют для инфицирования клеток-хозяев, обычно клеточной линии, полученной из осенних "походных (ратных) червей", Spodoptera frugiperda. См., в общих чертах, Glick and Pasternak, Molecular Biotechnology: Principles and Applications of Recombinant DNA (ASM Press, Washington, D.C., 1994). Другой подходящей клеточной линией является клеточная линия High FiveO™ (Invitrogen), произведенная из Trichoplusia ni (Патент США №5 300 435). Для выращивания и поддержания этих клеток используют коммерчески доступные бессывороточные среды. Подходящими средами являются Sf900 II™ (Life Technologies) или ESF 921™ (Expression Systems) для клеток Sf 9; и Ех-cellO405™ (JRH Biosciences, Lenexa, KS) или Express FiveO™ (Life Technologies) для клеток Т. ni. Клетки выращивают от плотности инокуляции приблизительно 2-5×105 клеток до плотности 1-2×106 клеток, в этот момент добавляют рекомбинантный вирусный исходный материал при множественности заражения (MOI) 0,1-10, более часто около 3. Рекомбинантные инфицированные вирусом клетки обычно продуцируют рекомбинантный полипептид при 12-72 часах после инфицирования и секретируют его с варьирующейся эффективностью в среду. Культуру обычно собирают спустя 48 часов после инфекции. Для отделения клеток из среды (супернатанта) обычно используют центрифугирование. Супернатант, содержащий полипептид, фильтруют через микропористые фильтры, обычно с размерами пор 0,45 мкм. Используемые процедуры описаны в общих чертах в доступных лабораторных справочниках (King, L.A. and Possee, R.D., ibid., O'Reilly, D.R. et al., ibid.; Richardson, C.D., ibid.). Последующая очистка полипептида из супернатанта может быть достигнута описанными здесь способами.
Грибковые клетки, в том числе дрожжевые клетки, могут быть также использованы в данном изобретении. Виды дрожжей, представляющие особый интерес в этом отношении, включают в себя Saccharomyces cerevisiae, Pichia pastoris и Pichia methanolica. Способы трансформации клеток S. cerevisiae экзогенной ДНК и получения из них рекомбинантных полипептидов описаны, например, Kawasaki, U.S. Patent No. 4599311; Kawasaki et al., U.S. Patent No. 4931373; Brake, U.S. Patent No. 4870008; Welch et al., U.S. Patent No. 5037743 и Murray et al., U.S. Patent No. 4845075. Трансформированные клетки отбирают по фенотипу, определяемому селектируемым маркером, обычно по устойчивости к лекарственному средству или по способности расти в отсутствие определенного питательного вещества (например, лейцина). Предпочтительной векторной системой для применения в Saccharomyces cerevisiae является векторная система РОТ1, описанная Kawasaki et at. (U.S. Patent No. 4931373), которая позволяет отбирать трансформированные клетки по росту в содержащей глюкозу среде. Подходящие промоторы и терминаторы для применения в дрожжах включают в себя промоторы и терминаторы из генов гликолитических ферментов (см., например, Kawasaki, U.S. Patent No. 4599311; Kingsman et al., U.S. Patent No. 4615974 и Bitter, U.S. Patent No. 4977092) и генов алкогольдегидрогеназы. См. также Патенты США 4990446, 5063154, 5139936 и 4661454. Системы трансформации для других дрожжей, в том числе Hansenula polymorpha, Schizosaccharomyces pombe, Kluyveromyces lactis, Kluyveromyces fragilis, Ustilago maydis, Pichia pastoris, Pichia methanolica, Pichia guillermondii и Candida maltosa, известны в данной области. См., например, Gleeson et al., J. Gen. Microbiol. 132:3459 (1986) и Cregg, U.S. Patent No. 4882279. Клетки Aspergillus могут быть использованы в соответствии со способами McKnight et al., U.S. Patent No. 4935349. Способы трансформации Acremonium chrysogenum описаны Sumino et al., U.S. Patent No. 5162228. Способы трансформации Neurospora описаны Lambowitz, U.S. Patent No. 4486533.
Применение Pichia methanolica в качестве хозяина для получения рекомбинантных белков описано в WIPO Publications WO 97/17450, WO 97/17451, WO 98/02536 и WO 98/02565. Молекулы ДНК для применения в трансформации Р. methanolica обычно получают в виде двухцепочечных кольцевых плазмид, которые предпочтительно линеаризуют перед трансформацией. Для получения полипептидов в Р. methanolica предпочтительно, чтобы промотор и терминатор в этой плазмиде были промотором и терминатором гена Р. methanolica, такого как ген утилизации спирта Р. methanolica (AUG1 или AUG2). Другие применимые промоторы включают в себя промоторы генов дигидроксиацетонсинтазы (DHAS), формиатдегидрогеназы (FMD) и каталазы (CAT). Для облегчения интеграции этой ДНК в хромосому хозяина предпочтительно иметь весь сегмент экспрессии этой плазмиды, фланкированный на обоих концах последовательностями ДНК хозяина. Предпочтительным селектируемым маркером для применения в Pichia methanolica является ген ADE2 Р. methanolica, который кодирует фосфорибозил-5-аминоимидазолкарбоксилазу (AIRC; ЕС 4.1.1.21), которая позволяет клеткам-хозяевам ade2 расти в отсутствие аденина. Для крупномасштабных, промышленных процессов, где желательно минимизировать применение метанола, предпочтительно использовать клетки-хозяева, в которых делетированы оба гена утилизации метанола (AUG1 и AUG2). Для получения секретируемых белков предпочтительны клетки-хозяева, дефектные по генам вакуолярных протеаз (РЕР4 и PRB1). Электропорацию используют для облегчения введения плазмиды, содержащей ДНК, кодирующую представляющий интерес полипептид, в клетки Р. methanolica. Предпочтительно трансформировать клетки Р. methanolica электропорацией с использованием экспоненциально затухающего, пульсирующего электрического поля, имеющего напряженность поля от 2,5 до 4,5 кВ/см, предпочтительно ˜3,75 кВ/см, и константу времени (t) от 1 до 40 миллисекунд, наиболее предпочтительно около 20 миллисекунд.
Прокариотические клетки-хозяева, в том числе штаммы бактерий Escherichia coli, Bacillus и других родов, также являются применимыми клетками-хозяевами в данном изобретении. Способы трансформации этих хозяев и экспрессии клонированных в них чужеродных ДНК хорошо известны в данной области (см., например, Sambrook et al., ibid.). При экспрессии полипептида в бактериях, таких как Е. coli, этот полипептид может сохраняться в цитоплазме, обычно в виде нерастворимых гранул, или может быть направлен в периплазматическое пространство бактериальной секреторной последовательностью. В первом случае эти клетки лизируют и гранулы извлекают и денатурируют при помощи, например, гуанидинизотиоцианата или мочевины. Затем денатурированный полипептид может быть повторно уложен и димеризован путем разведения продукта денатурации, например, диализом против раствора мочевины и комбинацией восстановленного и окисленного глутатиона, с последующим диализом против забуференного солевого раствора. В последнем случае этот полипептид может быть извлечен из периплазматического пространства в растворимой и функциональной форме путем разрушения этих клеток (например, обработкой ультразвуком или осмотическим шоком) для высвобождения содержимого периплазматического пространства и извлечения этого белка, посредством чего устраняется необходимость денатурации и повторной укладки.
Трансформированные или трансфицированные клетки-хозяева культивируют в соответствии с общепринятыми процедурами в культуральной среде, содержащей питательные вещества и другие компоненты, необходимые для роста выбранных клеток-хозяев. Различные подходящие среды, в том числе среды с определенным составом среды и комплексные среды, известны в данной области и обычно включают в себя источник углерода, источник азота, незаменимые аминокислоты, витамины и минеральные соединения. Среды могут также содержать такие компоненты, как факторы роста или сыворотка, если требуется. Среда для выращивания будет обычно производить отбор на клетки, содержащие экзогенно добавленную ДНК, посредством, например, отбора с использованием лекарственного средства или недостаточности незаменимого питательного компонента, который дополняется селектируемым маркером, имеющимся на экспрессирующем векторе или котрансфицируемым в клетку-хозяина. Клетки Р. methanolica культивируют в среде, содержащей адекватные источники углерода, азота и микроэлементов, при температуре приблизительно 25°С-35°С. Жидкие культуры обеспечивают достаточной аэрацией с использованием общепринятых средств, таких как встряхивание небольших колб или барботирование ферментеров. Предпочтительной культуральной средой для Р. methanolica является YEPD (2% D-глюкоза, 2% Бакто™ Пептон (Difco Laboratories, Detroit, MI), 1% Бакто™ дрожжевой экстракт (Difco Laboratories), 0,004% аденин и 0,006% L-лейцин).
Выделение белков
Предпочтительно очищать полипептиды данного изобретения до ≥80% чистоты, более предпочтительно до ≥90% чистоты, еще более предпочтительно до ≥95% чистоты и особенно предпочтительно до фармакологически чистого состояния, т.е. до чистоты более 99,9%, в отношении загрязняющих макромолекул, в частности, других белков и нуклеиновых кислот, и инфекционных и пирогенных агентов. Предпочтительно очищенный полипептид является по существу не содержащим других полипептидов, в частности, других полипептидов животного происхождения.
Экспрессируемые рекомбинантные полипептиды (или химерные полипептиды) могут быть очищены с использованием фракционирования и/или общепринятых способов и сред очистки. Для фракционирования проб могут быть использованы осаждение сульфатом аммония и кислотная или хаотропная экстракция. Примеры стадий очистки могут включать в себя применение гидроксиапатита, гель-фильтрацию, жидкостную экспресс-хроматографию белков (FPLC) и высокоэффективную жидкостную хроматографию с обращенной фазой. Подходящие хроматографические среды включают в себя производные декстрана, агарозу, целлюлозу, полиакриламид, специальные диоксиды кремния и т.п. Предпочтительными являются производные PEI, DEAE, QAE и Q. Примеры хроматографических сред включают в себя среды, дериватизованные фенильной, бутильной или октильной группами, такие как Phenyl-Sepharose FF (Pharmacia), Toyopearl butyl 650 (Toso Haas, Montgomeryville, PA), Octyl-Sepharose (Pharmacia) и т.п.; или полиакриловые смолы, такие как Amberchrom CG 71 (Toso Haas) и т.п. Подходящие твердые носители включают в себя стеклянные гранулы, смолы на основе диоксида кремния, целлюлозные смолы, агарозные гранулы, сшитые агарозные гранулы, полистироловые гранулы, сшитые полиакриламидные смолы и т.п., которые являются нерастворимыми в условиях, в которых они должны использоваться. Эти носители могут быть модифицированы реакционноспособными группами, позволяющими присоединение белков посредством аминогрупп, карбоксильных групп, сульфгидрильных групп, гидроксильных групп и/или углеводных частей молекул. Примеры химических способов связывания включают в себя активацию цианогенбромидом, активацию N-гидроксисукцинимидом, активацию эпоксидом, активацию сульфгидрильными группами, активацию гидразидом и карбоксил- и аминопроизводные для способов сочетания с использованием карбодиимида. Эти и другие твердые среды являются хорошо известными и широко используемыми в данной области и доступны из коммерческих источников. Способы связывания рецепторных полипептидов со средами-носителями хорошо известны в данной области. Выбор конкретного способа является рутинным и определяется отчасти свойствами выбранного носителя. См., например, Affinity Chromatography: Principles & Methods (Pharmacia LKB Biotechnology, Uppsala, Sweden, 1988).
Полипептиды могут быть выделены путем использования их свойств. Например, адсорбционная хроматография с иммобилизованным ионом металла (IMAC) может быть использована для очистки богатых гистидином белков, в том числе белков, имеющих полигистидиновые метки. Вкратце, гель сначала загружают ионами двухвалентного металла с образованием хелата, Sulkowski, Trends in Biochem. 3:1 (1985). Богатые гистидином белки будут адсорбироваться на этом матриксе с различными аффинностями в зависимости от используемого иона металла и будут элюироваться конкурентной элюцией, понижением рН или применением сильных хелатообразователей. Другие способы очистки включают в себя очистку гликозилированных белков аффинной хроматографией с иммобилизованным лектином и ионообменной хроматографией. Белок, слитый с Fc-частью иммуноглобулина, может быть очищен с использованием 'Протеин А-колонки'. Methods in Enzymol., Vol.182, "Guide to Protein Purification", M. Deutscher, (ed.), page 529-539 (Acad. Press, San Diego, 1990). В дополнительных вариантах данного изобретения может быть сконструирован гибрид (слияние) представляющего интерес полипептида и аффинной метки (например, мальтозусвязывающего белка, домена иммуноглобулина) для облегчения очистки.
В применении здесь, термин "антитела" включает в себя поликлональные антитела, аффинно-очищенные поликлональные антитела, моноклональные антитела, и антигенсвязывающие фрагменты, такие как протеолитические F(ab')2- и Fab-фрагменты. Также включены генетически сконструированные интактные антитела или фрагменты, такие как химерные антитела, Fv-фрагменты, одноцепочечные антитела и т.п., а также синтетические антигенсвязывающие пептиды и полипептиды. Антитела не из человека могут быть "очеловечены" (гумманизированы) прививкой CDR не человека на каркасные и константные области иммуноглобулина человека или включением полных вариабельных доменов не человека (необязательно "окутыванием" их подобной человеческой поверхностью путем замены экспонированных остатков, результатом чего является "облицованное" антитело). В некоторых случаях "гумманизированные" антитела могут сохранять остатки иммуноглобулина не человека в каркасных доменах вариабельной области человека для усиления характеристик правильного связывания. Посредством "гумманизирования" антител может быть увеличен биологический полупериод существования в организме, а потенциал неблагоприятных иммунных реакций при введении людям уменьшается.
Различные анализы, известные лицам с обычной квалификацией в данной области, могут быть использованы для детектирования антител, которые связываются с белком или полипептидом. Примеры анализов описаны подробно в Antibodies: A Laboratory Manual, Harlow and Lane (Eds.) (Cold Spring Harbor Laboratory Press, 1988). Репрезентативные примеры таких анализов включают в себя: конкурентный иммуноэлектрофорез, радиоиммуноанализ, радиоиммунопреципитацию, твердофазный иммуноферментный анализ (ELISA), дот-блот- или Вестерн-блот-анализ, ингибиторный или конкурентный анализ и сэндвич-анализ.
Растворимые рецепторы данного изобретения могут быть использованы для понижающей регуляции IL-20, который, как было показано, участвует в ряде воспалительных процессов. Конкретно, было показано, что IL-20 положительно реуглирует (повышает активность) IL-8. Воспалительными заболеваниями, в которых существенную роль играет IL-8 и для которых было бы полезным уменьшение IL-8, являются респираторное заболевание взрослых (ARD), септический шок, недостаточность множественных органов, воспалительное заболевание легких, например, астма или бронхит, бактериальная пневмония, псориаз, экзема, атопический и контактный дерматит и воспалительное заболевание пищеварительного тракта, такое как язвенный колит и болезнь Крона. Таким образом, растворимый рецептор IL-20 данного изобретения может вводиться пациенту для лечения этих заболеваний.
Биология IL-20, его рецептор и его роль в псориазе
Два orphan-рецептора класса II цитокинов, оба из которых экспрессируются в коже, были идентифицированы как субъединицы IL-20-рецептора. Обе субъединицы IL-20-рецептора необходимы для связывания лиганда, что отличает их роль от роли субъединиц в четырех других известных рецепторах цитокинов класса II. IL-20RA и IL-20RB коэкспрессируются также в ряде тканей человека, наряду с кожей, в том числе яичнике, надпочечниках, яичке, слюнной железе, легком, почке, сердце и в меньшей степени в тонкой кишке, что предполагает наличие дополнительных тканей-мишеней для действия IL-20. Авторы сделали вывод, что гетеродимерный IL-20-рецептор является структурно сходным с другими рецепторами цитокинов класса II и экспрессируется в коже, где авторы продемонстрировали активность IL-20-лиганда.
Две линии доказательств указывают на то, что IL-20 и его рецептор участвуют в псориазе. Это мультигенное кожное заболевание характеризуется увеличенной пролиферацией кератиноцитов, измененной дифференцировкой кератиноцитов и инфильтрацией иммунных клеток в кожу. Первая линия доказательства роли IL-20 в псориазе состоит в наблюдении гиперкератоза и утолщенного эпидермиса в трансгенных мышах, которые были сходны с псориатическими нарушениями человека. Уменьшенные количества тонофиламентов, которые, как считают, связаны с дефектной кератинизацией, являются ярким признаком псориаза человека. Внутримитохондриальные включения были обнаружены как в индуцированных химически, так и в природно встречающихся кожных состояниях у мышей. Причина этих включений и их действия на митохондриальную функцию, если они имеются, неизвестна. Авторы сделали вывод, что IL-20-трансгенные мыши проявляют многие из характеристик, наблюдаемых в случае псориаза человека.
Второй линией доказательства, предполагающей участие IL-20-рецептора в псориазе, является то, что мРНК как IL-20RA, так и IL-20RB заметно положительно регулируются (ап-регулируются) в псориатической коже человека в сравнении с нормальной кожей. Обе субъединицы рецептора IL-20 экспрессируются в кератиноцитах по всему эпидермису и экспрессируются также в субпопуляции иммунных и эндотелиальных клеток. Авторы предполагают, что увеличенная экспрессия активированного IL-20-рецептора может изменять взаимодействия между эндотелиальными клетками, иммунными клетками и кератиноцитами, приводя к нарушенной регуляции пролиферации и дифференцировке кератиноцитов.
Решающей стадией в понимании функции нового цитокина является идентификация и характеристика его родственного рецептора. Был успешно использован подход на основе структуры для выделения нового интерлейкина, что в конечном счете привело к выделению его рецептора. IL-20 стимулирует трансдукцию сигнала в клеточной линии НаСаТ кератиноцитов человека с подтверждением прямого действия этого нового лиганда в коже. Кроме того, известно, что IL-1β, EGF и TNF-α, белки, которые, как известно, являются активными в кератиноцитах и участвуют в трансдукции пролиферативных и провоспалительных сигналов в коже, усиливают реакцию на IL-20. Как в клетках НаСаТ, так и в клетках ВНК, экспрессирующих IL-20-рецептор, IL-20 передает сигналы через STAT3. Таким образом, IL-20 связывает свой рецептор на кератиноцитах и стимулирует содержащий STAT3 путь трансдукции сигнала.
Применение антагониста к IL-20 для лечения псориаза
Как указывалось выше и показано в примерах ниже, IL-20 участвует в патологии псориаза. Таким образом, растворимые рецепторы данного изобретения могут вводиться индивидууму для понижающей регуляции IL-20 и, следовательно, лечения псориаза.
Псориаз является одним из наиболее обычных дерматологических заболеваний, поражающих 1-2 процента населения мира. Он представляет собой хроническое воспалительное кожное расстройство, характеризующееся эритематозными, резко разграниченными папулами (узелками) и округлыми бляшками, покрытыми серебристой слюдоподобной чешуйкой. Кожные повреждения псориаза являются в разной степени зудящими. Травматические зоны часто развивают псориатические повреждения. Кроме того, дополнительные внешние факторы могут обострять псориаз, в том числе инфекции, стресс и лекарственные средства, например, литий, бета-блокаторы и противомалярийные агенты.
Наиболее обычную разновидность псориаза называют псориазом типа бляшек (пустулезным псориазом). Пациенты с псориазом типа бляшек имеют стабильные, медленно растущие бляшки, которые остаются по существу неизменными в течение продолжительных периодов времени. Наиболее обычными зонами для псориаза типа бляшек являются зоны под коленками, ягодичная щель и скальп (волосистая часть кожи головы). Пораженные зоны имеют тенденцию к симметрии. Отклоняющийся от нормального расположения псориаз поражает области внутри складок, в том числе подмышечные ямки, паховую область, область под молочными железами и пупок, и он также склонен поражать волосистую кожу головы, ладони и подошву ступни. Отдельные повреждения являются резко разграниченными бляшками, но они могут быть влажными вследствие их местоположения. Псориаз типа бляшек обычно развивается медленно и протекает безболезненно. Он редко обнаруживает спонтанную ремиссию.
Псориаз с высыпаниями (псориаз каплевидный) является наиболее частым у детей и молодых взрослых людей. Он развивается в виде острого заболевания у индивидуумов без псориаза и у пациентов с хроническим псориазом типа бляшек. Пациенты обнаруживают многочисленные небольшие эритематозные, чешуйчатые папулы, часто после инфекции верхних дыхательных путей бета-гемолитическими стрептококками. Пациенты с псориазом могут также развивать пустулярные повреждения. Они могут быть локализованы на ладонях и подошвах ног или могут быть генерализованными и ассоциированными с лихорадкой, недомоганием, диареей и артралгией (болью в суставах).
Примерно половина всех пациентов с псориазом имеют поражения ногтей пальцев, имеющие вид точечных углублений, утолщение ногтей или подногтевой гиперкератоз. Около 5-10 процентов пациентов с псориазом имеют ассоциированные жалобы на суставы, и их часто находят среди пациентов с поражениями ногтей. Хотя некоторые из них имеют совпадающее присутствие классического ревматоидного артрита, многие имеют заболевание суставов, которое подпадает под один из пяти типов, ассоциируемых с псориазом: (1) заболевание, ограниченнное единственным небольшим суставом или небольшим количеством небольших суставов (70 процентов случаев); (2) серонегативное подобное ревматоидному артриту заболевание; (3) вовлечение дистальных межфаланговых суставов; (4) тяжелый деструктивный артрит с развитием "калечащего артрита" и (5) заболевание, ограниченное позвоночником.
Псориаз может лечиться введением антагонистов IL-20. Предпочтительными антагонистами являются либо растворимый рецептор IL-20, либо антитела, фрагменты антител или одноцепочечные антитела, которые связываются либо с IL-20-рецептором, либо с IL-20. Антагонисты относительно IL-20 могут вводиться отдельно или в комбинации с другими разработанными терапиями, например, со смазывающими агентами, кератолитическими агентами, кортикостероидами для местного применения, производными витамина D для местного применения, антралином, системными антиметаболитами, такими как метотрексат, терапией с использованием псоралена-ультрафиолета (PUVA), этретината, изотретиноина, циклоспорина и наносимого локально производного витамина D3 кальципотриола. Антагонисты, в частности, растворимый рецептор или антитела, которые связывают IL-20 или IL-20-рецептор, могут вводиться индивидууму подкожно, внутривенно или трансдермально при помощи крема или трансдермального пластыря, который содержит антагонист IL-20. При подкожном введении антагонист может инъецироваться в одну или несколько псориатических бляшек. При трансдермальном введении антагонисты могут вводиться непосредственно на бляшки при помощи крема, содержащего антагонист к IL-20.
Применение антагонистов к IL-20 для лечения воспалительных состояний легкого
Растворимый рецептор IL-20 данного изобретения может вводиться лицу, имеющему астму, бронхит или муковисцидоз или другое воспалительное легочное заболевание, для лечения данного заболевания. Антагонисты могут вводиться любым подходящим способом, в том числе внутривенно, подкожно, бронхиальным лаважем и с использованием ингаляционной лекарственной формы, содержащей антагонист к IL-20.
Введение растворимого рецептора IL-20
Количество растворимого IL-20-рецептора, необходимое для эффективной терапии, будет зависеть от многих различных факторов, в том числе способа введения, участка-мишени, физиологического состояния пациента и других вводимых лекарственных средств. Таким образом, дозы для лечения должны титроваться для оптимизации безопасности и эффективности. Обычно, дозы, используемые in vitro, могут обеспечить полезное руководство в отношении количеств, применимых для введения in vivo этих реагентов. Испытание на животных эффективных доз для лечения конкретных нарушений обеспечит дополнительное прогнозирующее указание в отношении дозы для человека. Способы введения включают в себя пероральное, внутривенное, перитонеальное, внутримышечное, трансдермальное введение или введение в легкое или трахею в форме спрея с использованием распылителя или пульверизатора. Фармацевтически приемлемые носители будут включать в себя воду, солевой раствор, буферы, среди прочих. Обычно ожидаемыми являются диапазоны доз от 1 мкг до 1000 мкг на килограмм веса тела в день. Дозой растворимого рецептора IL-20 для среднего взрослого пациента может быть доза приблизительно 25 мг, предоставляемая два раза в неделю в виде подкожной инъекции. Инъекции могут производиться в участке псориатического повреждения в случае лечения псориаза. Для подкожного или внутривенного введения антагониста в отношении IL-20, антитело или растворимый рецептор могут находиться в забуференном фосфатом солевом растворе. В случае кожных заболеваний, таких как псориаз, антагонист к IL-20 может также вводиться через мазь или трансдермальный пластырь. Дозы могут быть более высокими или более низкими, как может быть определено врачом с обычной квалификацией в данной области. В отношении полного обсуждения лекарственных препаратов и диапазонов доз см. Remington's Pharmaceutical Sciences, 18th Ed. (Mack Publishing Company, Easton, Penn. 1996) и Goodman and Oilman's: The Pharmacological Bases of Therapeutics, 9th Ed. (Pergamon Press 1996).
Далее данное изобретение иллюстрируется следующими неограничительными примерами.
Пример 1
Повышающая регуляция IL-8 посредством IL-20
Способы:
Эпидермальные неонатальные кератиноциты здорового человека (NHEK) (Clontech) при пассаже 2 высевали и выращивали до конфлюентности в 12-луночных планшетах для культуры ткани. KGM (среду для выращивания кератиноцитов) покупали из Clontech. При достижении клетками конфлюентности их промывали средой KGM без факторов роста = КВМ (базальная среда для кератиноцитов). Клетки голодали по сыворотке в КВМ в течение 72 часов перед добавлением тест-соединений. Тромбин при 1 МЕ/мл и трипсин при 25 нМ использовали в качестве положительных контролей. Добавляли 1 мл среды на лунку. Только КВМ использовали в качестве отрицательного контроля.
IL-20 готовили в среде КВМ и добавляли при варьирующихся концентрациях от 2,5 мкг/мл со снижением до 618 нг/мл в первом эксперименте и от 2,5 мкг/мл со снижением до 3 нг/мл во втором эксперименте.
Клетки инкубировали при 37°С, 5% CO2 в течение 48 часов. Супернатанты удаляли и замораживали при -80°С в течение нескольких дней перед анализом на уровни IL-8 и GM-CSF. Для определения продуцирования цитокинов использовали набор для иммуноанализа человеческого IL-8 №D8050 (RandD Systems, Inc.) и набор для иммуноанализа человеческого GM-CSF №HSGMO (RandD Systems, Inc.) в соответствии с инструкциями изготовителя.
Результаты
Результаты показали, что экспрессия IL-8 и GM-CSF индуцировалась IL-20.
Пример 2
Клонирование IL-20RB
Клонирование кодирующего района IL-20RB
Два ПЦР-праймера были сконструированы на основе последовательности из Международной Патентной Заявки №PCT/US99/03735 (номер публикации WO 99/46379), поданной 8 марта 1999 года. SEQ ID NO: 16 содержит кодон ATG (Met1) с сайтом рестрикции EcoRI, SEQ ID NO: 17 содержит стоп-кодон (TAG) с сайтом рестрикции Xhol. ПЦР-амплификацию проводили с использованием ДНК кДНК-библиотеки кератиноцитов человека (НаСаТ) в качестве матрицы и SEQ ID NO: 16 и SEQ ID NO: 17 в качестве праймеров. ПЦР-реакцию выполняли следующим образом: инкубирование при 94°С в течение 1 мин с последующими 30 циклами 94°С в течение 30 сек и 68°С в течение 2 мин, после дополнительных 68°С в течение 4 мин реакцию выдерживали при 4°С. ПЦР-продукты подвергали электрофорезу на 1% агарозном геле и наблюдали полосу ДНК 1 т.п.н. ПЦР-продукты вырезали из геля и ДНК очищали с использованием набора для экстракции геля QIAquick Gel Extraction Kit (Qiagen). Очищенную ДНК расщепляли EcoRI и Xhol и клонировали в вектор pZP, который был назван pZP7N. Плазмида pZP является экспрессирующим вектором млекопитающих, содержащим экспрессионную кассету, имеющую мышиный промотор металлотионеина-1, лидерный пептид tPA человека, множественные сайты рестрикции для встраивания кодирующих последовательностей, Glu-Glu-метку и терминатор гормона роста человека. Эта плазмида имеет также начало репликации Е. coli, экспрессионную единицу селектируемого маркера млекопитающих, имеющую промотор, энхансер и начало репликации SV40, а также ген DHFR и терминатор SV40. Секвенировали несколько клонов IL-20RB-pZP7N. Все они содержат три неконсервативные мутации в сравнении с последовательностью IL-20RB в PCT/US99/03735: (последовательность IL-20RB-pZP7N), 146 Рго(ССС) - Thr(ACC), 148 His (CAT) - Asp (GAT) и 171 Thr (ACG) - Arg (AGG).
Для подтверждения этих трех замен в клоне IL-20RB-pZP7N ПЦР-амплификации проводили с использованием трех различных кДНК-источников - marathon кДНК (кожи эмбриона), ДНК кДНК-библиотеки НаСаТ и ДНК кДНК-библиотеки гладких мышц предстательной железы - в качестве матриц. ПЦР-продукты очищали из геля и секвенировали. Последовательность каждого из трех ПЦР-продуктов совпадала с последовательностью клона IL-20RB-pZP7N. IL-20RB представляет собой SEQ ID NO:13 и 14, а зрелый внеклеточный домен представляет собой SEQ ID NO:15.
Пример 3
Связывание IL-20 с гетеродимером IL-20RB/IL-20RA
Для подтверждения того, что IL-20 связывается с гетеродимером IL-20RA/IL-20RB, использовали анализ связывания на основе клеток.
Экспрессирующие векторы, содержащие известные и orphan-рецепторы цитокинов Класса II (в том числе IL-20RA и IL-20RB), временно трансфицировали в клетки COS в различных комбинациях, которые затем анализировали на их способность связывать меченый биотином белок IL-20. Эти результаты показывают, что гетеродимер IL-20RB-IL-20RA является рецептором для IL-20. Используемая процедура описана ниже.
Трансфекцию клеток COS выполняли в 12-луночном планшете для культуры ткани следующим образом: 0,5 мкг ДНК смешивали со средой, содержащей 5 мкл липофектамина в 92 мкл бессывороточной модифицированной Дульбекко среде Игла (DMEM) (55 мг пирувата натрия, 146 мг L-глутамина, 5 мг трансферрина, 2,5 мг инсулина, 1 мкг селена и 5 мг фетуина в 500 мл DMEM), инкубировали при комнатной температуре в течение 30 минут и затем добавляли к 400 мкл бессывороточной среды DMEM. Затем эту смесь 500 мкл добавляли к 1,5×105 клеток COS на лунку и инкубировали в течение 5 часов при 37°С. Добавляли 500 мкл среды DMEM с 20% фетальной телячьей сывороткой (ФТС) и инкубировали в течение ночи.
Анализ, модификацию "секреторной ловушки" (Davis, S., et al., Cell 87: 1161-1169 (1996), выполняли следующим образом: клетки промывали смесью ЗФР/1% бычий сывороточный альбумин (БСА) и блокировали в течение 1 часа TNB (0,1 М Трис-HCI, 0,15 М NaCI и 0,5% Блокирующий Реагент (набор NEN Renaissance TSA-Direct Kit Cat# NEL701) в воде). После этого инкубировали в течение одного часа с 3 мкг/мл биотинилированного белка IL-20 в TNB. Клетки промывали ЗФР/1%БСА и инкубировали еще в течение часа с разведенным 1:300 стрептавидином-HRP (набор NEN) в TNB. После второй промывки клетки фиксировали в течение 15 минут 1,8% формальдегидом в забуференном фосфатом солевом растворе (ЗФР). Затем клетки промывали TNT (0,1 М ТРис-HCI, 0,15 М NaCI и 0,05% Твин-20 в воде). Положительные сигналы связывания детектировали после пятиминутного инкубирования с флуоресцеинтирамидным реагентом, разбавленным 1:50 в буфере для разведения (набор NEN). Клетки промывали TNT, консервировали средой для приготовления препаратов Vectashield Mounting Media (Vector Labs), разведенной 1:5 в TNT, и визуализировали на фильтре FITC под инвертированным флуоресцентным микроскопом.
Пример 4
Повышающая регуляция воспалительных цитокинов при помощи IL-20
Обработка клеток
Клеточную линию кератиноцитов человека, НаСаТ, выращивали при 37°С до нескольких дней после конфлюентности в колбах для культуры ткани Т-75. В этой точке нормальную среду для выращивания (DMEM + 10% ФТС) удаляли и заменяли бессывороточной средой. Затем клетки инкубировали в течение двух дней при 37°С. После этого DMEM удаляли и четыре колбы клеток на одну обработку обрабатывали одним из следующих условий в течение четырех часов при 37°С: рекомбинантный (rh) IL-1 альфа при 5 нг/мл, rh IL-1 альфа при 20 нг/мл, rh IL-1 альфа при 5 нг/мл + IL-20 при 1 мкг/мл, IL-20 при 1 мкг/мл или rh IL-10 при 10 нг/мл.
Выделение РНК
После обработки цитокинами среду удаляли и клетки лизировали при помощи раствора гуанидинийтиоцианата. Тотальную РНК выделяли из клеточного лизата откручиванием в течение ночи на градиенте хлорида цезия. На следующий день осадок РНК ресуспендировали в растворе ТЭ/ДСН и осаждали этанолом. Затем РНК определяли количественно с использованием спектрофотометра с последующей обработкой ДНКазой, как описано в руководстве для пользователя по экспрессии кДНК в Section V.B. of Clontech's Atlas™ cDNA Expression Arrays User Manual (version PT3140-1/PR9X390, published 11/5/99). Качество проб РНК подтверждали расчетами чистоты на основании спектрофотометрических данных и визуализацией на агарозном геле. Геномную примесь проб РНК исключали ПЦР-анализом гена бета-актина.
Синтез зондов
Использовали протоколы Clontech для полиА+ обогащения, синтеза зондов и гибридизации с матрицами Atlas™ (см. выше, плюс руководство для пользователя по системе мечения чистой тотальной РНК Atlas™ Pure Total RNA Labeling System User Manual, PT3231-1/PR96157, published 6/22/99). Вкратце, полиА+РНК выделяли из 50 мг тотальной РНК с использованием покрытых стрептавидином магнитных гранул (Clontech, Palo Alto, CA) и сепаратора магнитных частиц. Затем полиА+РНК метили α-32P-dATP посредством ОТ-ПЦР. CDS-праймеры Clontech, специфические для 268 генов, на матрице цитокин человека/рецептор Atlas™ (Кат. №7744-1) использовали в этой реакции. Меченый зонд выделяли с использованием колоночной хроматографии и считали в сцинтилляционной жидкости.
Гибридизация на мембранах-матрицах
Atlas™ - матрицы предгибридизовали с Clontech ExpressHyb плюс 100 мг/мл денатурированной нагреванием ДНК спермы лосося в течение по меньшей мере тридцати минут при 68°С с непрерывным перемешиванием. Затем мембраны гибридизовали с 1,9×106 имп/мин/мл (всего 1,14×107 имп/мин) в течение ночи при 68°С при непрерывном перемешивании. На следующий день мембраны промывали в течение тридцати минут ×4 в 2Х SSC, 1% ДСН при 68°С плюс тридцать минут × 1 в 0,1Х SSC, 0,5% ДСН при 68°С с последующей одной конечной промывкой при комнатной температуре в течение пяти минут в 2Х SSC. Затем мембраны-матрицы помещали в пластиковые мешочки Kodak, герметизировали и экспонировали против фосфорного люминесцентного (фосфоресцирующего) экрана в течение ночи при комнатной температуре. На следующий день люминесцентные экраны сканировали на приборе для получения изображения и анализировали с использованием программы Atlaslmage™ 1.0 (Clontech).
Результаты
Гены, положительно регулируемые IL-20
1. Фактор некроза опухолей (TNF) положительно регулировался в 1,9-2,4 раза IL-20.
2. Факторы роста плаценты 1 и 2 (PLGF) положительно регулировались в 1,9-2,0 раза IL-20.
3. Рецептор фактора II коагуляции положительно регулировался в 2,0-2,5 раза IL-20.
4. Рецептор кальцитонина положительно регулировался в 2,2-2,3 раза IL-20.
5. TNF-индуцируемый гиалуронатсвязывающий белок TSG-6 положительно регулировался в 2,1-2,2 раза IL-20.
6. Предшественник рецептора-1 васкулярного эндотелиального фактора роста (VEGF), рецептор тирозин-протеинкиназы (FLT-1) (SFLT) положительно регулировался в 2,1-2,7 раза IL-20.
7. MRP-8 (MIF-родственный кальцийсвязывающий белок в макрофагах) положительно регулировался в 2,9-4,1 раза IL-20.
8. MRP-14 (MIF-родственный кальцийсвязывающий белок в макрофагах) положительно регулировался в 3,0-3,8 раза IL-20.
9. Релаксин Н2 положительно регулировался в 3,14 раза IL-20.
10. Рецептор III 300 кДа трансформирующего фактора роста положительно регулировался в 2,4-3,6 раза IL-20.
Гены, обнаруживающие синергизм с обработкой IL-20 + IL-1
1. Костный морфогенный белок 2а положительно регулировался в 1,8 раза обработкой одним IL-20, в 2,5 раза обработкой только IL-1 и в 8,2 раза обработкой вместе IL-20 и IL-1.
2. MRP-8 положительно регулировался в 2,9 раза обработкой одним IL-20, в 10,7 раза обработкой только IL-1 и в 18 раз обработкой вместе IL-20 и IL-1.
3. Белок дифференцировки эритроидов (EDF) положительно регулировался в 1,9 раза обработкой одним IL-20, в 9,7 раза обработкой только IL-1 и в 19,0 раз обработкой вместе IL-20 и IL-1.
4. MRP-14 (кальцийсвязывающий белок в макрофагах, родственный MIF) положительно регулировался в 3,0 раза обработкой одним IL-20, в 12,2 раза обработкой только IL-1 и в 20,3 раза обработкой вместе IL-20 и IL-1.
5. Гепаринсвязывающий EGF-подобный фактор роста положительно регулировался в 2,0 раза обработкой одним IL-20, в 14 раз обработкой только IL-1 и в 25,0 раз обработкой вместе IL-20 и IL-1.
6. Бета-тромбоглобулин-подобный белок положительно регулировался в 1,5 раза обработкой одним IL-20, в 15 раз обработкой только IL-1 и в 27 раз обработкой вместе IL-20 и IL-1.
7. Полученный из головного мозга нейротрофический фактор (BDNF) положительно регулировался в 1,7 раза обработкой одним IL-20, в 25 раз обработкой только IL-1 и в 48 раз обработкой вместе IL-20 и IL-1.
8. Моноцитарный хемотактический и активирующий фактор MCAF положительно регулировался в 1,3 раза обработкой одним IL-20, в 32 раза обработкой только IL-1 и в 56 раз обработкой вместе IL-20 и IL-1.
Пример 5
Слитый гетеротетрамер IL-20RA/RB-рецептор-lg
Экспрессирующий вектор pEZE3 использовали для экспрессии рекомбинантного слитого белка IL-20-рецептор-lg. Плазмида pEZE3 произведена из pDC312. pDC312 получали по лицензии из Immunex Corporation. Плазмиды pDC312 и pEZE3 содержат EASE-сегмент, как описано в WO 97/25420. Присутствие EASE-сегмента в экспрессирующем векторе может улучшать экспрессию рекомбинантных белков в два-восемь раз в стабильных пулах клеток.
Плазмида pEZE3 является трехцистронным экспрессирующим вектором, который может быть использован для экспрессии до трех различных белков в клетках млекопитающих, предпочтительно в клетках яичника Китайского хомячка (СНО). Экспрессионная единица pEZE3 содержит энхансер/промотор цитомегаловируса (CMV), аденовирусную, состоящую из трех частей, лидерную последовательность, сайт множественного клонирования для встраивания кодирующего района для первого рекомбинантного белка, внутренний сайт вхождения рибосомы полиовируса типа 2, второй сайт множественного клонирования для встраивания кодирующего района для второго рекомбинантного белка, внутренний сайт вхождения рибосомы вируса энцефаломиокардита, кодирующий сегмент для мышиной дигидрофолатредуктазы и терминатор транскрипции SV40. Кроме того, pEZE3 содержит точку начала репликации Е. coli и бактериальный ген бета-лактамазы.
Слитый белок IL-20-рецептор-Ig является связанным дисульфидными связями гетеротетрадимером, состоящим из двух цепей внеклеточного домена IL-20RB человека, слитого с константной областью дикого типа легкой цепи каппа иммуноглобулина человека, и двух цепей внеклеточного домена белка IL-20RA человека, слитых с мутированной константной областью иммуноглобулина гамма 1 человека. Константная область иммуноглобулина гамма 1 человека содержит аминокислотные замены для уменьшения связывания FcγRI и фиксации C1q-комплемента.
Слитую конструкцию IL-20RВ-константная область легкой цепи каппа иммуноглобулина человека получали перекрывающейся ПЦР. Кодирующий сегмент IL-20RB состоит из аминокислот 1-230. Матрицу, используемую для ПЦР-амплификации IL-20RВ-сегмента, получали в виде экспрессионной конструкции IL-20RВ-константная область легкой цепи каппа человека, как описано ниже в примере 12. Для амплификации IL-20RВ-сегмента использовали олигонуклеотидные праймеры SEQ ID NO:24 и SEQ ID NO:25. Использовали полную константную область дикого типа легкой цепи каппа иммуноглобулина человека. Матрицу, используемую для ПЦР-амплификации сегмента константной области дикого типа легкой цепи каппа иммуноглобулина человека, получали в виде экспрессионной конструкции IL-20RВ-константная область легкой цепи каппа иммуноглобулина человека, как описано в примере 12. Для амплификации константной области дикого типа легкой цепи каппа иммуноглобулина человека использовали олигонуклеотидные праймеры SEQ ID NO:26 и SEQ ID NO:27. Кодирующие домены этих двух белков связывали перекрывающейся ПЦР с использованием олигонуклеотидов SEQ ID NO:24 и SEQ ID NO:27. Пептидный линкер (Gly4Ser)3 (SEQ ID NO:72) встраивали между этими двумя белковыми доменами. Пептидный линкер (GIy4Ser)3 кодировался на ПЦР-праймерах SEQ ID NO:26 и SEQ ID NO:25. Полученная слитая конструкция внеклеточный домен IL-20RB-константная область легкой цепи каппа показана SEQ ID NO:20 и 21. Предсказанный зрелый полипептид, минус сигнальная последовательность, является SEQ ID NO:60. Часть внеклеточного домена IL-20RB, которую фактически использовали, состояла из аминокислотной последовательности SEQ ID NO:61. N-концевое секвенирование привело к предсказанной аминокислотной последовательности.
Слитую конструкцию IL-20RA человека-константная область тяжелой цепи иммуноглобулина гамма 1 человека генерировали перекрывающейся ПЦР четырех отдельных ДНК-фрагментов, каждый из которых получали с использованием отдельных реакций ПЦР-амплификации. Первый фрагмент содержал оптимизированную сигнальную последовательность тканевого активатора плазминогена (tPA). Сигнальную последовательность tPA амплифицировали с использованием олигонуклеотидных праймеров SEQ ID NO:28 и SEQ ID NO:29 с применением ранее генерированного в лаборатории экспрессирующего вектора в качестве матрицы. Второй фрагмент содержал кодирующий район внеклеточного домена IL-20RA, состоящий из аминокислот 30-243 SEQ ID NO: 11. Олигонуклеотидные праймеры SEQ ID NO:30 и SEQ ID NO:31 использовали для амплификации этого IL-20RА-сегмента с использованием ранее генерированного клона IL-20RA в качестве матрицы.
Константную область тяжелой цепи иммуноглобулина гамма 1 человека генерировали из 2 сегментов. Первый сегмент, содержащий Сн1-домен, амплифицировали с использованием олигонуклеотидных праймеров SEQ ID NO:32 и SEQ ID NO:33 с применением клона дикого типа константной области тяжелой цепи иммуноглобулина гамма 1 человека в качестве матрицы. Второй сегмент, содержащий остальные шарнирный домен, Сн2- и Сн3-домены константной области тяжелой цепи иммуноглобулина гамма 1 человека, генерировали ПЦР-амплификацией с использованием олигонуклеотидных праймеров SEQ ID NO:34 и SEQ ID NO:35. Матрица, используемая для этой ПЦР-амплификации, происходила из генерированной ранее Fc-конструкции иммуноглобулина гамма 1 человека, которая содержала кодоны для аминокислотных замен для уменьшения связывания FcγRI и фиксации C1q-комплемента, как описано в примере 12.
Эти кодирующие домены четырех белков связывали при помощи перекрывающейся ПЦР с использованием олигонуклеотидов SEQ ID NO:28 и SEQ ID NO:35. Пептидный линкер (Gly4Ser)3 встраивали между белковыми доменами IL-20RA и СН1. Пептидный линкер (Gly4Ser)3 кодировался на ПЦР-праймерах SEQ ID NO:32 и SEQ ID NO:31. Слитый белок внеклеточный домен IL-20RА/домен константной области тяжелой цепи иммуноглобулина гамма 1 человека и ДНК-последовательность показаны в SEQ ID NO:22 и 23. Предсказанная последовательность зрелого полипептида, минус сигнальная последовательность, представлена в SEQ ID NO:62. Часть внеклеточного домена IL-20RA, которую фактически использовали, состояла из SEQ ID NO:63.
Кодирующий сегмент слияния внеклеточный домен IL-20RB-константная область легкой цепи каппа иммуноглобулина человека клонировали во второй MCS, тогда как кодирующий сегмент слияния внеклеточный домен IL-20RA человека-константная область тяжелой цепи иммуноглобулина гамма 1 человека клонировали в первый MCS pEZE3. Эту плазмиду использовали для трансфекции клеток СНО. Клетки отбирали в среде без гипоксантина или тимидина и трансген амплифицировали с использованием метотрексата. Присутствие белка анализировали Вестерн-блоттингом с использованием антител против константной области тяжелой цепи иммуноглобулина гамма 1 человека и против легкой цепи каппа человека. N-концевое секвенирование выявило, что оптимизированная лидерная последовательность tPA не была полностью отщеплена. Наблюдаемая масса указывала на то, что первым остатком этой полипептидной последовательности является пироглутаминовая кислота, а N-концевой последовательностью, по-видимому, является 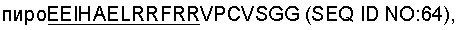 причем подчеркнутая часть является остатками лидерной последовательности tPA.
причем подчеркнутая часть является остатками лидерной последовательности tPA.
Пример 6
Трансгенный фенотип IL-20
Как человеческий, так и мышиный IL-20 сверхэкспрессировали в трансгенных мышах с использованием различных промоторов. Печень-специфический мышиный промотор альбумина, направляющий экспрессию человеческого IL-20, использовали первоначально в попытке получить циркулирующие уровни белка (в кровотоке). Последующие исследования проводили с использованием промотора кератина 14 (К14), который прежде всего нацеливает экспрессию на эпидермис и другие многослойные плоские эпителии; мышиного промотора металлотионеина-1, который дает широкий спектр экспрессии, и промотора EμLCK, который запускает экспрессию в клетках лимфоидной линии дифференцировки. Сходные результаты получали во всех четырех случаях, возможно, потому, что все эти промоторы приводят к циркулирующим уровням IL-20.
Во всех случаях трансгенные детеныши, экспрессирующие IL-20, были менее крупными, чем не-трансгенные однопометные детеныши, имели лоснящийся вид с туго натянутой, морщинистой кожей и умирали в первые дни после рождения. Детеныши имели молоко в их желудках, что указывало на то, что они были способны сосать молоко. Эти мыши имели распухшие конечности, хвост, области ноздрей и рта и имели затруднения в перемещении. Кроме того, эти мыши были слабыми, не имели видимой жировой ткани и имели задержанное развитие ушей и пальцев на конечностях. Низкие уровни в печени (менее 100 молекул мРНК на клетку) были достаточными как для неонатальной смертности, так и для кожных нарушений. Трансгенные мыши без видимого фенотипа либо не экспрессировали трансген, либо не экспрессировали его в достаточных уровнях, либо были мозаичными (т.е. имели часть клеток, генетически отличающихся от другой части клеток).
Гистологический анализ кожи IL-20-трансгенных мышей показал утолщенный эпидермис, гиперкератоз и компактный роговой слой в сравнении с не-трансгенными однопометными животными. Иногда наблюдали сероцеллюлярную корку (струпья). Электрономикроскопический анализ (ЭМ) кожи из трансгенных животных показал внутримитохондриальные липоидные включения, пятнистые кератогиалиновые гранулы и относительно мало тонофиламентов, что было сходно с картиной, наблюдаемой в псориатической коже человека и в мышиных моделях кожных заболеваний. Кроме того, многие трансгенные мыши имели апоптотические тимусные лимфоциты. Никаких других отклонений от нормы не детектировали гистопатологическим анализом. Эти гистологические и ЭМ-результаты подтверждают и расширяют наблюдаемые макроскопические изменения кожи.
Пример 7
Специфичность и аффинность IL-20 в отношении его рецептора
Специфичность и аффинность IL-20 в отношении его рецептора определяли с использованием клеток ВНК, стабильно трансфицированных IL-20RA, IL-20RB или обеими субъединицами рецептора. Анализы связывания с использованием радиоактивно меченого лиганда продемонстрировали, что IL-20 связывался с трансфектантами ВНК, экспрессирующими как IL-20RA, так и IL-20RB, но ни с нетрансфицированными клетками, ни с трансфектантами, экспрессирующими только одну субъединицу рецептора. Связывание 125I-меченого IL-20 исключалось в присутствии 100-кратного избытка немеченого IL-20, но не 100-кратного избытка постороннего цитокина, IL-21, Было определено, что аффинность связывания (kD) IL-20 с гетеродимерным рецептором IL-20RA/IL-20RB была приблизительно 1,5 нМ.
Пример 8
Активация IL-20-рецептора
Для определения, приводит ли связывание IL-20 к активации рецептора, фактор-зависимую линию клеток-предшественников В-клеток BaF3 котрансфицировали IL-20RA и IL-20RB и обрабатывали IL-20 в различных концентрациях. IL-20 стимулировал пролиферацию зависимым от дозы образом и давал детектируемый сигнал при 1,1 пМ с полумаксимальной реакцией при 3,4 пМ. Авторы отмечают, что концентрация IL-20 для полумаксимальной пролиферативной реакции в клетках BaF3 является в 1000 раз более низкой, чем концентрация для полумаксимальной аффинности связывания в клетках ВНК. Возможные объяснения этого большого различия включают в себя применение отличающихся клеточных линий, различные уровни экспрессии рецептора и различные результаты анализов. IL-20 стимулировал также трансдукцию сигнала в биологически релевантной клеточной линии НаСаТ кератиноцитов человека, которая природно зкспрессирует IL-20RA и IL-20RB. Таким образом, IL-20 связывает и активирует гетеродимерный рецептор IL-20RA/IL-20RB в концентрациях, ожидаемых для цитокина.
Пример 9
Анализ экспрессии IL-20RA и IL-20RB
RT-ПЦР-анализ выполняли на различных тканях человека для определения распределения экспрессии IL-20RA и IL-20RB. Обе субъединицы рецептора в наибольшей степени экспрессировались в коже и яичке. Существенным результатом является то, что IL-20RA и IL-20RB, оба, экспрессируются в коже, где они, как было показано, опосредуют индуцированную IL-20 реакцию. Как IL-20RA, так и IL-20RB экспрессируются, оба, в моноцитах, легком, яичнике, мышцах, яичке, надпочечниках, сердце, слюнных железах и плаценте. IL-20RA экспрессируется также в головном мозгу, почке, печени, ободочной кишке, тонкой кишке, желудке, щитовидной железе, поджелудочной железе, матке и предстательной железе, тогда как IL-20RB не экспрессируется в этих органах.
Пример 10
мРНК IL-20RA и IL-20RB положительно регулируются при псориазе
Для определения, изменяется ли экспрессия IL-20-рецептора в случае псориаза, использовали гибридизацию in situ. Пробы кожи из четырех пациентов с псориазом и трех не пораженных псориазом пациентов анализировали с использованием зондов, специфических для мРНК двух субъединиц рецептора. Все четыре пробы псориатической кожи имели высокие уровни мРНК IL-20RA и IL-20RB в кератиноцитах, в то время как пробы здоровой кожи не имели детектируемых уровней мРНК ни одной из субъединиц рецептора. Положительные сигналы в псориатической коже наблюдали также в мононуклеарных иммунных клетках и в эндотелиальных клетках в субпопуляции сосудов. Таким образом, как IL-20RA, так и IL-20RB экспрессируются в кератиноцитах, иммунных клетках и эндотелиальных клетках, основных клеточных типах, которые, как считают, взаимодействуют в псориазе.
Пример 11
Клонирование мышиного IL-20RA
Генерировали перекрестный межвидовой гибридизационный зонд, который содержал фрагмент полноразмерной кДНК, кодирующий IL-20RA человека. Выполняли Саузерн-блот мышиной геномной ДНК и Нозерн-блоты мышиной РНК для демонстрации, что кДНК IL-20RA человека может гибридизоваться с мышиными последовательностями. Результаты Нозерн-блота показали, что мышиная РНК IL-20RA присутствовала в мышином эмбрионе в день 15 и 17, а также в сердце, головном мозгу, легком, печени, почке, яичках, селезенке, тимусе, печени, желудке и тонкой кишке.
Для скрининга мышиной геномной библиотеки использовали гибридизационный зонд полноразмерной ДНК IL-20RA человека. Эту библиотеку, которая была получена из Clontech (Palo Alto, CA), генерировали из продукта частичного расщепления Mbol мышиной геномной ДНК и клонировали в сайт BamHI бактериофага Лямбда EMBL3 SP6/T7. Положительный бактериофаг очищали из бляшек и ДНК бактериофага получали с использованием системы очистки ДНК Promega's Wizard Lambda Preps. Два геномных фрагмента, полученных с использованием рестрикционных ферментов, EcoRI-фрагмент 5,7 т.п.н. и Sacl-фрагмент 8,0 т.п.н., получали из положительного бактериофага и субклонировали в pBluescript. Анализ ДНК-последовательности выявил присутствие 3 экзонов из мышиного ортолога человеческого IL-20RA.
Конструировали ПЦР-праймеры из 5'-UTR, SEQ ID NO:40, и 3'-UTR, SEQ ID NO:41, для генерирования полноразмерной последовательности мышиного IL-20RA посредством ПЦР-амплификации. кДНК мышиного эмбриона 15 дней плюс 17 дней использовали в качестве матрицы для этой ПЦР-амплификации. ПЦР-продукты субклонировали и секвенировали для проверки. Мышиные последовательности были SEQ ID NO:36 и 37. Зрелый внеклеточный домен представлен в SEQ ID NO:38.
Пример 12
Конструирование гетеротетрамера IL-20-рецептора
Конструировали вектор, экспрессирующий секретируемый гетеродимер hIL-20RA/hlL-20RB. В этой конструкции внеклеточный домен DIL-20RA сливали с тяжелой цепью IgG гамма 1 (IgGγ1), тогда как внеклеточную часть IL-20RB сливали с легкой цепью каппа человека (легкой цепью κ человека).
Конструирование слитых векторов IgG гамма 1 и легкой цепи κ человека
Тяжелую цепь IgGγ1 клонировали в экспрессирующий вектор млекопитающих Zem229R (АТСС-депозитный номер 69447), так что любая внеклеточная часть рецептора, имеющая 5'-сайт EcoRI и 3'-сайт Nhel, могла быть клонирована в него, с получением слияния N-концевой внеклеточный домен-С-концевой IgGγ1. IgGγ1-фрагмент, используемый в данной конструкции, получали с использованием ПЦР для выделения IgGγ1-последовательности из кДНК-библиотеки фетальной печени человека (Clontech) в качестве матрицы. ПЦР-реакция, использующая олигонуклеотиды SEQ ID NO:42 и SEQ ID NO:43, проходила следующим образом: 40 циклов 94°С в течение 60 сек, 53°С в течение 60 сек и 72°С в течение 120 сек и 72°С в течение 7 мин. ПЦР-продукты разделяли электрофорезом в агарозном геле и очищали с использованием набора для экстракции геля QiaQuick™ (Qiagen Inc., Valencia, CA). Выделенный ДНК-фрагмент, 990 т.п.н., расщепляли Mlul и EcoRI (Boehringer Mannheim), экстрагировали с использованием набора для экстракции геля QiaQuick™ и лигировали с олигонуклеотидами SEQ ID NO:44 и SEQ ID NO:45, которые содержат линкер Mlul/EcoRI, в плазмиду ZEM229R, предварительно расщепленную Mlul и EcoRI, с использованием стандартных способов молекулярной биологии, описанных здесь. Этот общий клонирующий вектор был назван Vector #76 hIGqamma1 w/Ch1 #786 Zem229R (Vector #76). Полинуклеотидная последовательность внеклеточного домена hlL-20RA, слитая с тяжелой цепью IgG гамма 1, показана в SEQ ID NO:52, a соответствующая полипептидная последовательность показана в SEQ ID NO:53, причем зрелый полипептид минус сигнальная последовательность содержится в SEQ ID NO:54. Используемая часть внеклеточного домена IL-20RA содержится в SEQ ID NO:55.
Легкую цепь каппа иммуноглобулина человека клонировали в экспрессирующий вектор млекопитающих Zem228R (депозитный номер АТСС 69446), так что любая внеклеточная часть рецептора, имеющая 5'-сайт EcoRI и 3'-сайт Kpnl, может быть клонирована с получением слияния N-концевой внеклеточный домен-С-концевая легкая цепь каппа человека. Фрагмент легкой цепи каппа человека, использованный в данной конструкции, получали с использованием ПЦР для выделения последовательности легкой цепи каппа человека из той же самой библиотеки к ДНК фетальной печени человека (Clontech), которую использовали в приведенных выше примерах. ПЦР-реакцию проводили с использованием олигонуклеотидов SEQ ID NO:46 и SEQ ID NO:47. ПЦР-продукты разделяли электрофорезом в агарозном геле и очищали с использованием набора для экстракции геля QiaQuick™ (Qiagen). Выделенный ДНК-фрагмент, 315 п.н., расщепляли Mlul и EcoRI (Boehringer Mannheim), экстрагировали с использованием набора для экстракции геля QiaQuick™ и лигировали с линкером Mlul/EcoRI, описанным выше, в плазмиду ZEM228R, предварительно расщепленную Mlul и EcoRI, с использованием стандартных способов молекулярной биологии, описанных здесь. Этот общий клонирующий вектор был назван Vector #77 hκlight #774 Zem228R (Vector #77). Полинуклеотидная последовательность внеклеточного домена hlL-20RB, слитая с легкой цепью каппа человека, показана в SEQ ID NO:56, а соответствующая полипептидная последовательность показана в SEQ ID NO:57, причем зрелый полипептид минус сигнальная последовательность содержится в SEQ ID NO:58. Используемая часть внеклеточного домена IL-20RB содержится в SEQ ID NO:59.
Инсертирование внеклеточных доменов hll-20RA и IL-20RB в слитые векторные конструкции
С использованием сконструированных, как описано выше, векторов получали конструкцию, имеющую IL-20RA человека, слитый с IgGγ1. Эту конструкцию получали с использованием ПЦР для получения IL-20РА-рецептора человека из вектора #102 hlL-20RA/lgG с олигонуклеотидами SEQ ID NO:48 и SEQ ID NO:49 в следующих условиях: 30 циклов 94°С в течение 60 сек, 57°С в течение 60 сек и 72°С в течение 120 сек; и 72°С в течение 7 мин. Полученный ПЦР-продукт расщепляли EcoRI и Nhel, очищали из геля, как описано здесь, и лигировали в предварительно расщепленный и очищенный из полосы на геле вектор #76 (см. выше). Полученный вектор секвенировали для подтверждения, что слияние IL-20RA человека/lgG гамма 1 (hlL-20RA/Ch1 IgG) было правильным. Вектор ZEM229R #1825 hlL-20RA/Ch1 IgG гамма 1 был назван вектором #195. Полученная таким образом последовательность IL-20RA/Ch1 IgGγ1 изображена в SEQ ID NO:52 и 53. N-концевое секвенирование показало присутствие предсказанной зрелой полипептидной последовательности SEQ ID NO:54.
Конструировали также отдельную конструкцию, имеющую IL-20RB, слитый с легкой цепью κ. Конструирование конструкции 11-20RB/легкая цепь κ человека выполняли, как описано выше, ПЦР-реакцией из DR1/7N-4 с олигонуклеотидами SEQ ID NO:50 и SEQ ID NO:51, расщеплением полосы EcoRI и Kpnl и лигированием этого продукта в предварительно расщепленный EcoRI и Kpnl очищенный из полосы на геле Вектор №77 (выше). Полученный вектор секвенировали для подтверждения, что слияние IL-20RB/легкая цепь κ человека (IL-20RB/κlight (легкая)) было правильным. Эта конструкция IL-20RB/κlight (легкая) показана в SEQ ID NO:56 и 57. N-концевое секвенирование полученного полипептида показало присутствие предсказанной зрелой аминокислотной последовательности, содержащей SEQ ID NO:58. SEQ ID NO:59 является зрелой частью внеклеточного домена использованного IL-20RB.
Коэкспрессия рецепторов IL-20RA человека и IL-20RB человека
Приблизительно 16 мкг каждого из векторов #194 и #195, описанных выше, котрансфицировали в клетки ВНК-570 (АТСС №CRL-10314) с использованием реагента Липофектамина™ (Gibco/BRL) в соответствии с инструкциями изготовителя. Трансфицированные клетки отбирали в течение 10 дней в DMEM + 5% ФТС (Gibco/BRL), содержащей 1 мкМ метотрексат (МТХ) (Sigma, St. Louis, МО) и 0,5 мг/мл G418 (Gibco/BRL), в течение 10 дней. Полученный пул трансфектантов опять отбирали в 10 мкМ МТХ и 0,5 мг/мл G418 в течение 10 дней.
Полученный пул дважды подвергнутых отбору клеток использовали для генерирования белка. Три клеточные фабрики (кассеты биореакторов для крупномасштабного производства клеток) (Nunc, Denmark) этого пула использовали для генерирования 8 л бессывороточной кондиционированной среды. Эту кондиционированную среду пропускали через протеин-А-колонку (1 мл) и элюировали во фракции (10 фракций) по 750 микролитров. 4 из этих фракций, которые, как было обнаружено, имели наивысшую концентрацию, объединяли и диализовали (предельная величина MW 10 кДа) против ЗФР. Наконец, диализованный материал анализировали по способу с БСА (Pierce) и нашли, что он имел концентрацию 317 мкг/мл. Из очистки этих 8 л получали всего 951 мкг белка.
Пример 13
Связывание IL-20 активирует STAT3 в клеточной линии кератиноцитов НаСаТ
IL-20 связывает клеточные линии, трансфицированные обеими субъединицами его рецептора. Однако эти клеточные линии сверхэкспрессируют IL-20-рецептор в сравнении с его нормальным уровнем и их связь с физиологической ролью IL-20 является неясной. Линию клеток кератиноцитов НаСаТ человека, которая экспрессирует эндогенные IL-20RA и IL-20RB, использовали для испытания трансдукции сигнала IL-20 в биологически релевантном типе клеток. Клетки НаСаТ инфицировали рекомбинантным аденовирусом, содержащим репортерную конструкцию, позволяющую детектировать внутриклеточную трансдукцию сигнала. Эта конструкция состоит из гена люциферазы светляка, запускаемого последовательностями промотора/энхансера, состоящими из элемента ответа на сыворотку (SRE) и трансдукторов и активаторов элементов трансдукции (STAT). Эта система анализа детектирует продуктивные лиганд-рецепторные взаимодействия и указывает возможные расположенные по ходу процесса компоненты трансдукции сигнала, участвующие в активации рецептора. Обработка одним IL-20 приводила к зависимому от дозы увеличению люциферазной активности с полумаксимальной реакцией, имеющей место при приблизительно 2,3 нМ. Последующие анализы с люциферазным репортером с использованием аденовирусных векторов, содержащих только элемент SRE или только элементы STAT, производили детектируемую активацию репортера только через STAT.
Для определения, действуют ли другие цитокины вместе с IL-20, клетки НаСаТ обрабатывали одним IL-20 или в комбинации с единственной субмаксимальной дозой EGF, IL-1β или TNFα. В присутствии каждого из этих трех белков обработка IL-20 приводила к зависимому от дозы увеличению люциферазной активности. IL-20 в комбинации с IL-1β приводил к полумаксимальной реакции при приблизительно 0,5 нМ, примерно в пять раз более низкой концентрации, чем с одним IL-20. Кроме того, активация репортерного гена является детектируемой при 0,1 нМ IL-20 дозе, которая является по меньшей мере в 10 раз более низкой, чем доза IL-20, требуемая при его отдельном применении.
Клетки ВНК, трансфицированные IL-20RA, IL-20RB или обеими субъединицами рецептора, использовали для определения, было ли необходимым спаривание рецептора для стимуляции IL-20 STAT-люциферазы. Как это было в анализах связывания, только клетки, трансфицированные обеими субъединицами рецептора, отвечали на IL-20 и делали это с полумаксимальной реакцией при 5,7 пМ. Авторы отмечают, что концентрация IL-20 для полумаксимальной реакции в клетках ВНК является в 400 раз более низкой, чем для полумаксимальной реакции в клетках НаСаТ. Вероятно, более низкая концентрация IL-20 необходима для полумаксимальной реакции в клетках ВНК в сравнении с клетками НаСаТ вследствие более высоких уровней рецептора в содержащих IL-20-рецептор трансфектантах ВНК.
Анализ ядерной транслокации использовали для идентификации белков STAT, участвующих в действии IL-20. Как клетки НаСаТ с эндогенными IL-20-рецепторами, так и клетки ВНК, трансфицированные IL-20RA и IL-20RB, обрабатывали белком IL-20 и транслокацию факторов транскрипции STAT3 и STAT1 из цитоплазмы в ядро оценивали по иммунофлуоресценции.
В нестимулированных клетках НаСаТ SТАТ3-окрашивание наблюдали преимущественно в цитозоле. Обработка клеток НаСаТ IL-20 приводила к явному накоплению STAT3 в ядре. Ядерная транслокация STAT3 в ответ на увеличение концентраций IL-20 происходила с полумаксимальной концентрацией IL-20 7 нМ. В противоположность транслокации STAT3, клетки НАСАТ, обработанные IL-20, не обнаружили какого-либо детектируемого ядерного накопления STAT1.
Клетки ВНК, трансфицированные IL-20RA и IL-20RB, использовали для подтверждения, что IL-20-рецептор был необходим для стимуляции посредством IL-20 ядерной транслокации STAT3. В клетках ВНК, не имеющих IL-20-рецептора, STAT3 оставался в цитозоле после обработки IL-20. В противоположность этому, в клетках ВНК, трансфицированных IL-20-рецептором, STAT3 транслоцировался в ядро в ответ на IL-20. Опять, STAT1 оставался в цитозоле, несмотря на обработку IL-20 или экспрессию IL-20-рецептора. Авторы сделали вывод, что IL-20-рецептор является необходимым для опосредованной IL-20 активации STAT3.






























































| название | год | авторы | номер документа |
|---|---|---|---|
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из функционального фрагмента человеческого IL-1RA и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2821896C1 |
| СЛИТНЫЕ БЕЛКИ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2530168C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2012 |
|
RU2650775C2 |
| СЛИТЫЕ БЕЛКИ С FC-ФРАГМЕНТОМ ИММУНОГЛОБУЛИНА ДЛЯ ПОВЫШЕНИЯ ИММУНОГЕННОСТИ БЕЛКОВЫХ И ПЕПТИДНЫХ АНТИГЕНОВ | 2000 |
|
RU2248214C2 |
| БИОЛОГИЧЕСКИ АКТИВИРУЕМЫЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ОСНОВЕ ЦИТОКИНОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2819307C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-R[альфа] ДОМЕНА SUSHI | 2012 |
|
RU2644671C2 |
| ДИСПЛЕЙ ИНТЕГРАЛЬНОГО МЕМБРАННОГО БЕЛКА НА ВНЕКЛЕТОЧНЫХ ОБОЛОЧЕЧНЫХ ВИРИОНАХ ПОКСВИРУСА | 2017 |
|
RU2759846C2 |
| Нуклеотидная последовательность, кодирующая слитый белок, состоящий из растворимого экстраклеточного фрагмента человеческого IL-6R и константной части тяжелой цепи человеческого IgG4 | 2023 |
|
RU2818329C1 |
| МОДИФИЦИРОВАННЫЙ БЕЛОК ИНТЕРЛЕЙКИНА-7 И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2016 |
|
RU2708160C2 |
| СЛИТЫЕ БЕЛКИ IL-7 | 2004 |
|
RU2369616C2 |
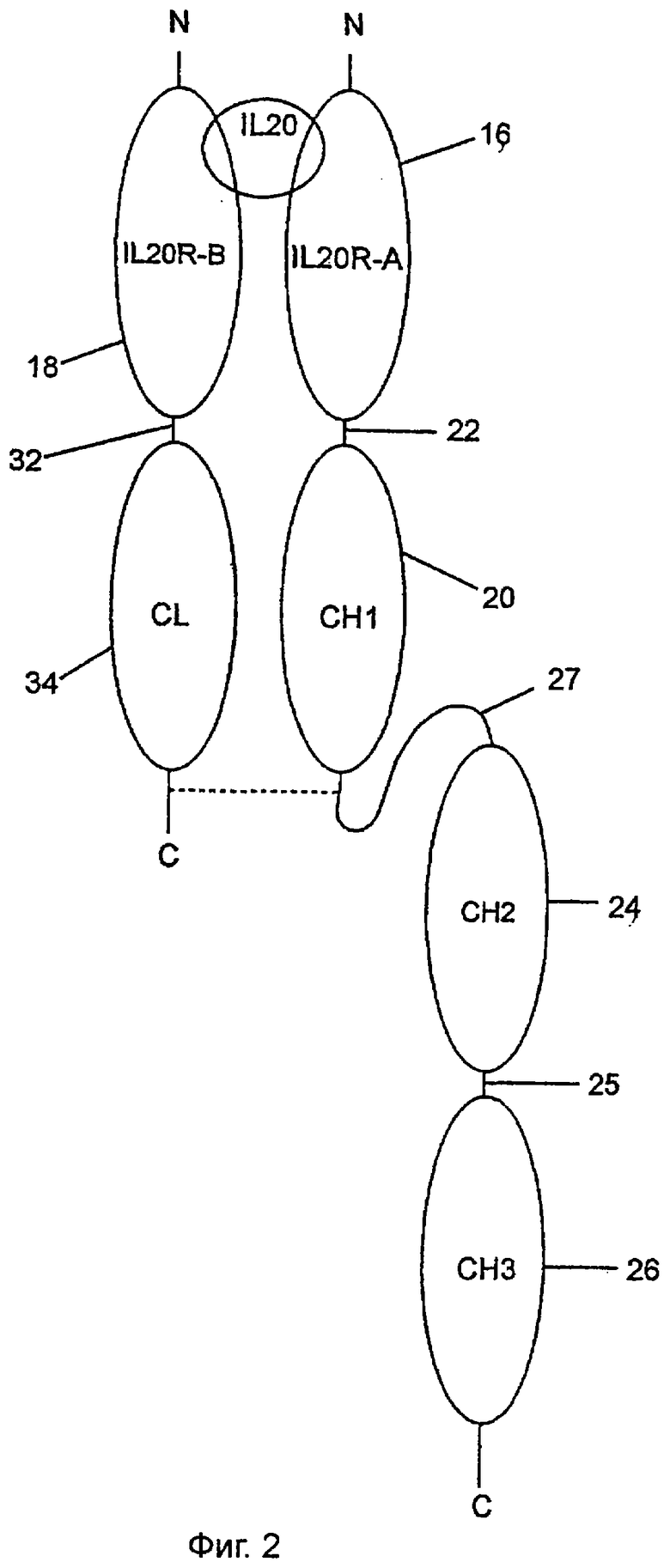
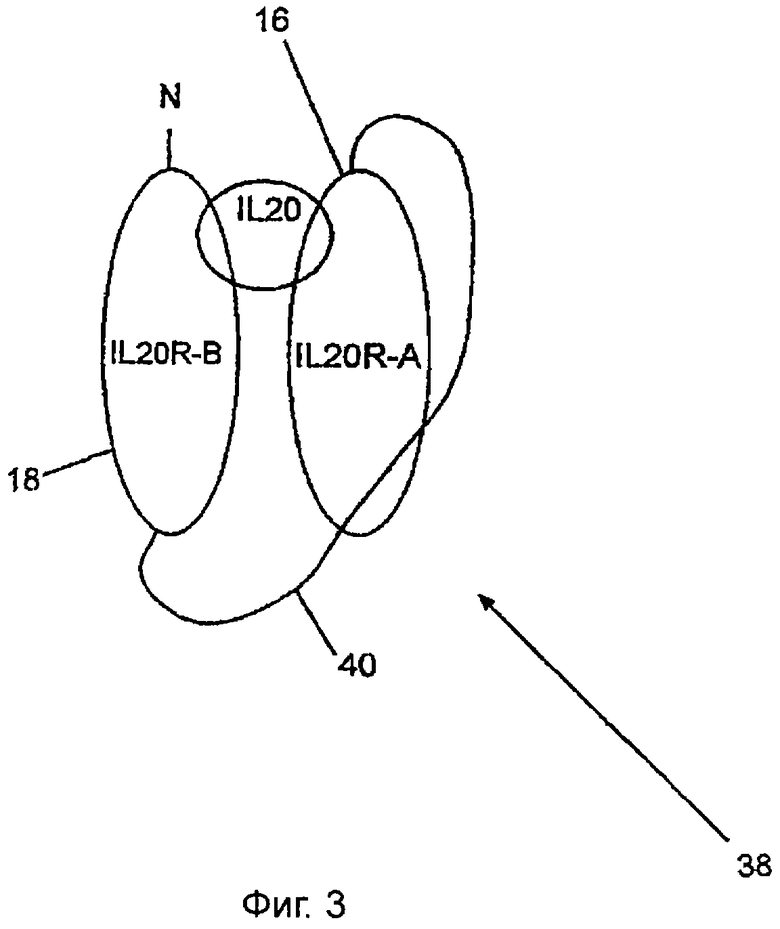
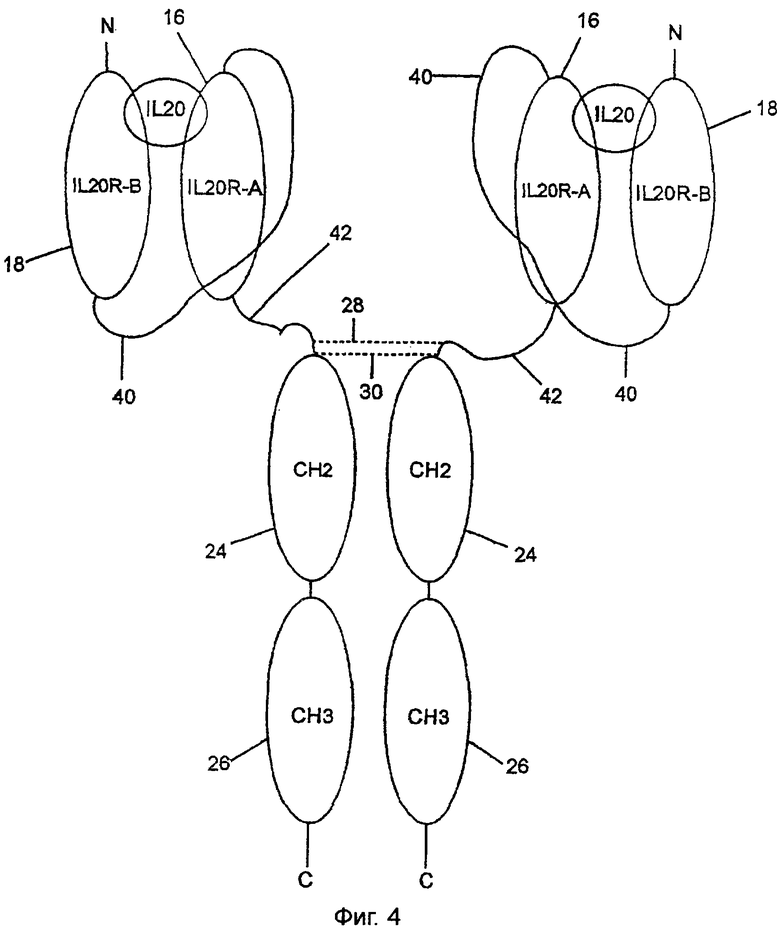
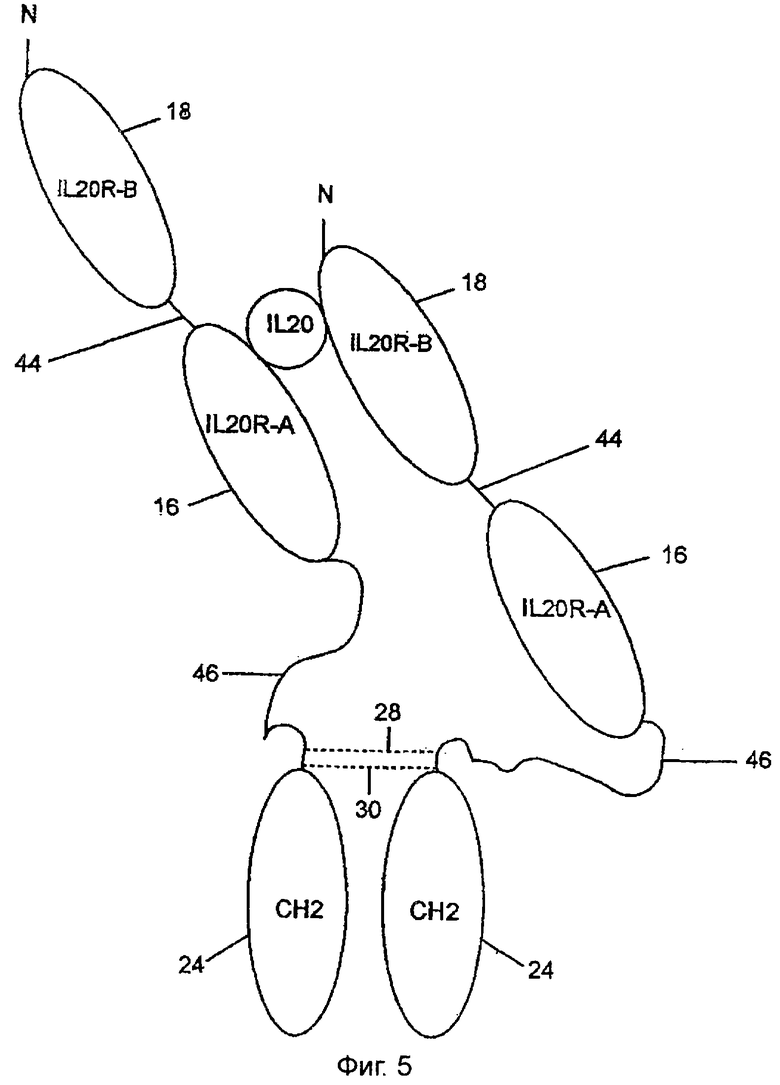
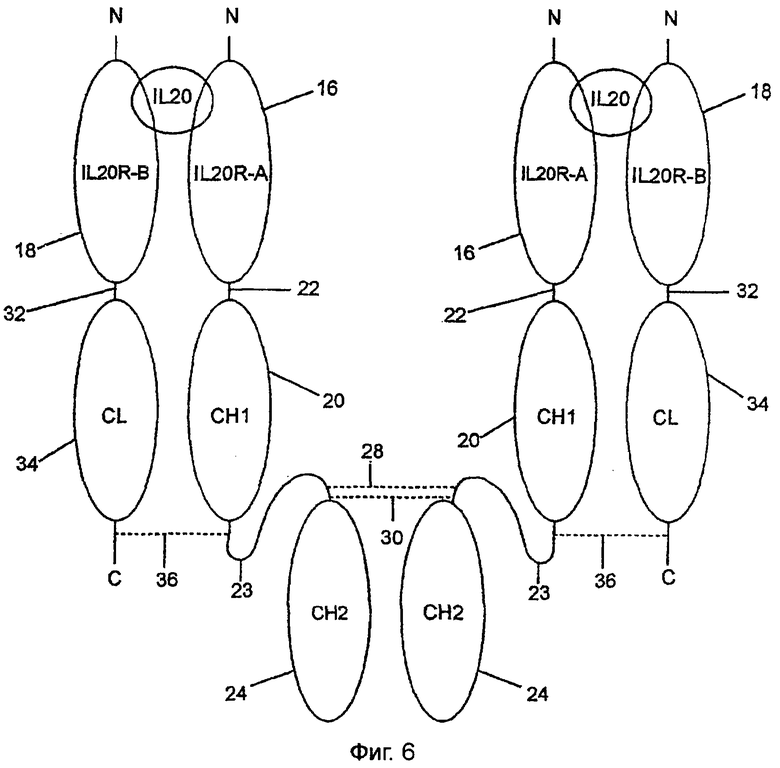
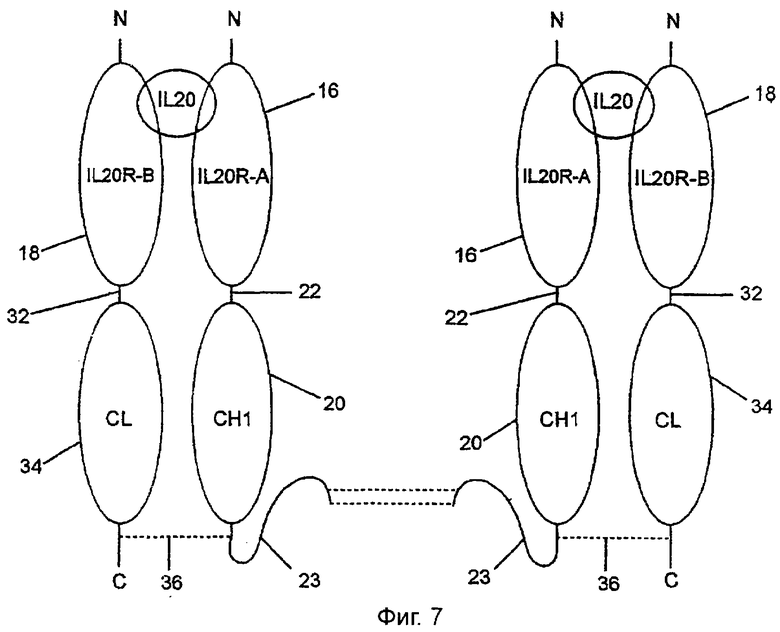
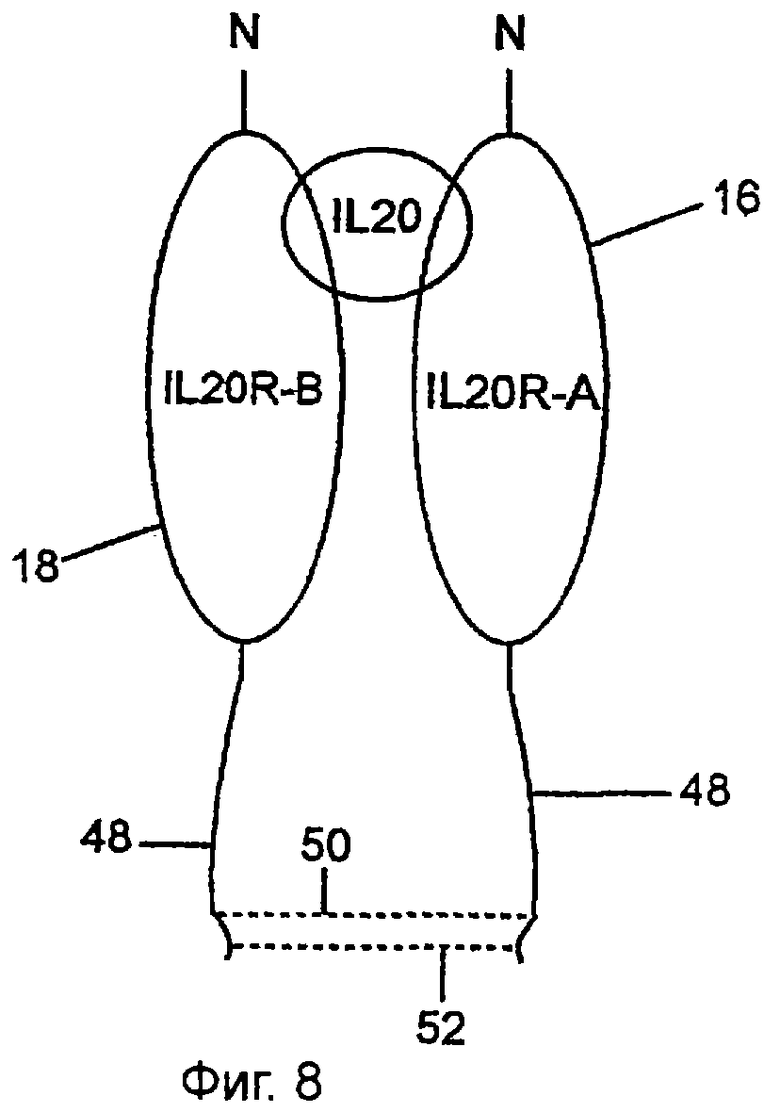
Изобретение относится к генной инженерии, конкретно, к рецепторам интерлейкина-20 и может быть использовано в медицине для лечения воспалительных заболеваний. Сконструированы растворимые рецепторы для интерлейкина-20 (IL-20), состоящие из двух полипептидных субъединиц IL-20RA и IL-20RB. Субъединицы в составе рецептора IL-20 связаны между собой дисульфидными связями. Также получены варианты рецептора IL-20, в которых одна субъединица слита с константной областью легкой цепи иммуноглобулина, а другая субъединица слита с константной областью тяжелой цепи иммуноглобулина, причем цепи иммуноглобулина соединены через дисульфидную связь. Изобретение позволяет применять новые рецепторы IL-20 для понижающей регуляции IL-20. 5 н. и 4 з.п. ф-лы, 8 ил.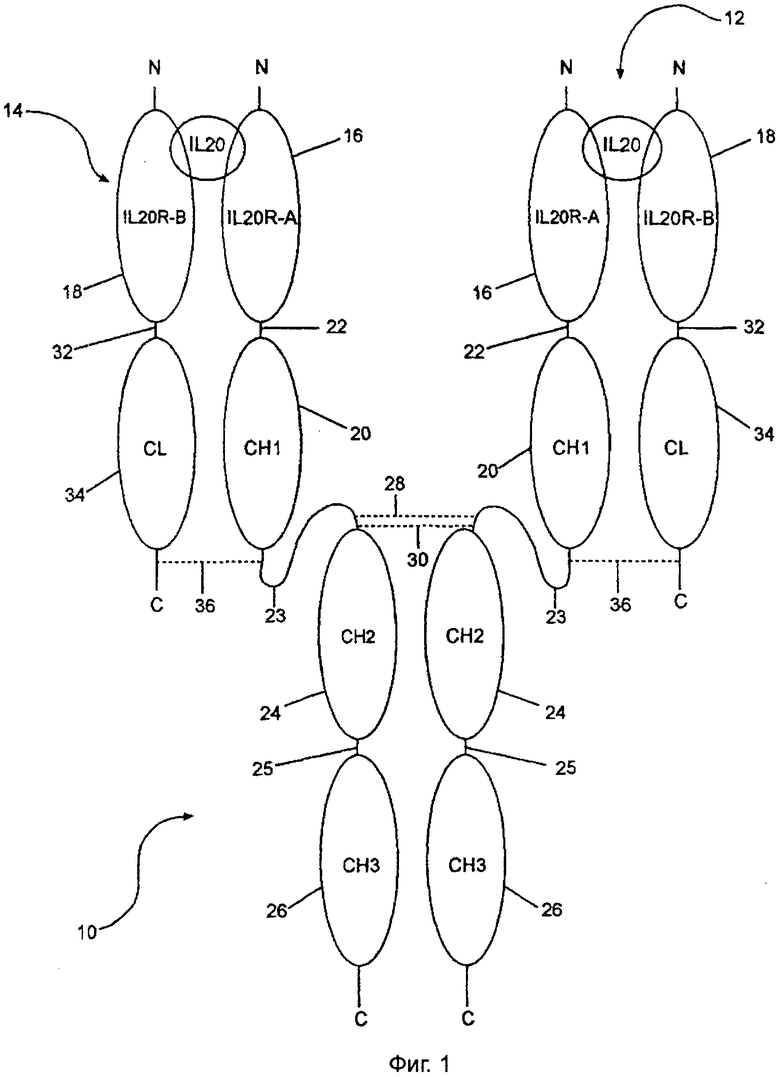
| WO 9903982 A, 28.01.1999 | |||
| US 5945511 A, 31.08.1999 | |||
| WO 9946379 A, 16.09.1999 | |||
| WO 9937772 A, 29.07.1999 | |||
| WO 9961630 A, 02.12.1999 | |||
| ИММУНОКОНЬЮГАТ, СПОСОБ ПОЛУЧЕНИЯ ИММУНОКОНЬЮГАТА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2129018C1 |
Авторы
Даты
2006-07-10—Публикация
2000-12-22—Подача