Описание
Настоящее изобретение относится к способу идентификации ингибиторов или агонистов протеинкиназы IRS, а также к выбранным пептидам IRS, содержащим сайты фосфорилирования для PKC-ζ и других сериновых киназ IRS, и к применению этих пептидов для идентификации фармацевтического состава для лечения диабета типа 2.
Инсулин-независимый сахарный диабет (NIDDM) встречается преимущественно у взрослых и характеризуется пониженной чувствительностью тканей, способных к очистке крови от глюкозы. В отличие от инсулин-зависимого сахарного диабета (IDDM, диабета типа I), диабет типа II не характеризуется пониженной секрецией инсулина бэта-клетками поджелудочной железы.
Молекулярный механизм, приводящий к пониженной чувствительности к инсулину или даже резистентности к инсулину, еще не известен, несмотря на усиленные попытки исследователей в Университетах и в фармацевтической промышленности. Недавние исследования прояснили, что в диабете типа II нарушаются пути вторичных мессенджеров, соединяющие активированный инсулиновый рецептор с транслокацией GLUT4 и транспортом глюкозы. Конкретно, у белков субстрата инсулинового рецептора (IRS) множество остатков тирозина фосфорилируется активированным инсулиновым рецептором, рецептором инсулиноподобного фактора роста и JAK1/2 и играют центральную роль в процессе нисходящей передачи сигнала инсулина (1, 2, 3). Фосфотирозиновые мотивы, конкретно в IRS-1 и IRS-2, служат сайтами посадки для ряда адапторных белков, которые обладают гомологией домена Src 2 (SH2), включая Grb2, внутриклеточную РТРазу SHP-2, Nck, Crk и фосфатидилинозитол-3 киназу (PI-3 киназу) (4-6). PI-3 киназа состоит из каталитической 110 кДа субъединицы (p110) и регуляторной 85 кДа субъединицы (p85), содержащей два домена SH2, которые связываются с тирозин-фосфорилированными мотивами pYMXM и pYXXM в белках IRS и индуцируют активацию PI-3 киназы (7). Это приводит к стимуляции дополнительных нисходящих киназ, включая серин/треониновую киназу PKB/Akt (8,9) и атипичные изоформы-ζ и-λ протеинкиназы C (PKC-ζ/λ) (10, 11) фосфоинозитид-зависимой киназой 1. Показано, что активация PKB и PKC-ζ/λ и их нисходящих сигналов играет важную роль в обеспечении метаболических действий инсулина таких, как транслокация GLUT4 и транспорт глюкозы (10, 11), фосфорилирование серина GSK3 и синтез гликогена (12), фосфорилирование серина PDE и антилиполиз (13, 14) и активация mTOR и синтез белков (15, 16).
Дисрегуляция сигнальной системы инсулина представляет собой многофакторный процесс, приводящий к резистентности к инсулину и диабету типа 2 с белками IRS, потенциально представляющими основную мишень (17). Таким образом, было предположено, что фосфорилирование серин/треониновых белков IRS играет ключевую роль как в ингибировании сигнала инсулина по принципу обратной связи, так и в развитии клеточной резистентности к инсулину (обзор см. в 17-19). Показано, что ковалентная модификация IRS-1 на серине/треонине ухудшает индуцированные инсулином фосфорилирование тирозина, активацию PI 3-киназы и стимуляцию транспорта глюкозы (20). В нестимулированном состоянии фосфорилирование серина/треонина IRS-1 происходит в клетке конститутивно (21), и оно дополнительно активируется цитокинами и метаболитами, которые ингибируют трансдукцию сигналов таких, как фактор некроза опухоли (TNF)α (22), свободные жирные кислоты, глюкоза или церамид (23). Кроме того, на остатках серина/треонина обычно обнаруживают гиперфосфорилирование IRS-1 при резистентности к инсулину и диабете типа 2 (24).
Несмотря на ключевую роль в развитии резистентности к инсулину, фосфорилирование серина IRS-1 остается не до конца понятным, главным образом, в силу того, что IRS-1 содержит более 100 потенциальных сайтов фосфорилирования серина и того, что, как показано, представляет субстрат для многих протеинкиназ, включая N-концевую киназу c-Jun (JNK) (25), IkappaB киназу-β (26), MAP-киназу (27), киназу казеина (28), киназу гликогенсинтазы (29), фосфоинозитол-3-киназу (30), протеинкиназу А (31), протеинкиназу C (32), протеинкиназу B (PKB) (33) и АМФ-активируемую протеинкиназу (AMPK) (34). Интересно, что PKB и AMPK, как обнаружено, действуют в качестве положительного регулятора функции IRS-1, что говорит в пользу представления о том, что серин/треониновое фосфорилирование IRS-1 играет двойную роль либо усиления, либо прекращения передачи сигнала инсулина (35). Идентификация остатков в различных доменах IRS-1, претерпевающих фосфорилирование серина в ответ на различные стимулы, улучшила понимание этого чрезвычайно сложного регуляторного этапа в действии инсулина. Таким образом, Ser307, расположенный вблизи фосфотирозин-связывающего домена (PTB), идентифицировали как мишень для киназ, активизируемых при стрессе, включая JNK (25), и может также играть роль в качестве регулятора действия инсулина с отрицательной обратной связью (36). Ser789 является мишенью для AMPK и положительно модулирует действие инсулина (34), однако также было обнаружено, что фосфорилирование Ser789 неидентифицированными киназами ослабляет передачу сигнала инсулина (37). Ser612, Ser632, Ser662 и Ser731 расположены внутри или вблизи домена взаимодействия с PI 3-киназой, однако, функциональное значение этих сайтов остается неясным (38-40).
В отличие от описанных выше протеинкиназ, протеинкиназа C (PKC)-ζ, которая является атипичным членом семейства PKC серин/треониновых киназ, как представляется, участвует как в нисходящей трансдукции сигнала инсулина, так и в контроле функции IRS-1 с отрицательной обратной связью (11, 41-44). Таким образом, было обнаружено, что PKC-ζ локализуется совместно с GLUT4 и является существенным для регулируемых инсулином транслокации GLUT4 и транспорта глюкозы в скелетной мышце (41) и адипоцитах (11). Дополнительно, дефектная активация PKC-ζ может внести свой вклад в зависимое от ожирения развитие резистентности скелетной мышцы к инсулину (42). Недавние данные Quon и сотрудников (43) показали, что IRS-1 представляет новый субстрат для PKC-ζ, и в параллельном исследовании Zick и сотрудники (44) нашли, что этот процесс ингибирует активацию PI 3-киназы, что говорит о том, что PKC-ζ представляет ключевой элемент в контроле действия инсулина с отрицательной обратной связью.
В общих словах, несмотря на то, что в уровне техники известно, что IRS, особенно IRS-1, взаимодействует с PKC-ζ, природа этого взаимодействия не известна. Следовательно, нет агентов, известных в уровне техники, взаимодействующих с IRS-PKC-ζ. Однако такие агенты были бы весьма полезными, так как вероятно, что торможение взаимодействия IRS и PKC-ζ привело бы к отрицательной регуляции торможения IRS и вниз по пути передачи сигнала, PI 3-киназы, которая в свою очередь приводит к улучшению транслокации GLUT4 и транспорта глюкозы.
Следовательно, целью настоящего изобретения является обеспечение способа идентификации ингибиторов или агонистов протеинкиназы IRS.
В соответствии с настоящим изобретением, данной цели соответствует способ идентификации ингибитора протеинкиназы IRS, предусматривающий этапы:
a) введение PKC-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого ингибитора, и
b) измерение степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования.
Настоящее изобретение основано на неожиданной идентификации специфичных сайтов фосфорилирования серина в последовательности IRS, которые специфично узнаются PKC-ζ. Следовательно, в контексте настоящего изобретения был идентифицирован молекулярный механизм, обеспечивающий взаимодействие IRS-PKC-ζ. Кроме того, вероятно, что другие протеинкиназы такие, как c-Jun N-концевая киназа (JNK), IkappaB киназа-β, MAP-киназа, киназа казеина, киназа гликогенсинтазы, фосфоинозитол-3-киназа, протеинкиназа A, протеинкиназа C, протеинкиназа B 8PKB) и АМФ-активируемая протеинкиназа (AMPK), могут узнавать эти сайты фосфорилирования. Поэтому определение сериновых сайтов, фосфорилируемых протеинкиназами, особенно PKC-ζ, обеспечивает идентификацию молекул, препятствующих этому взаимодействию, либо по пути антагонистов, либо по пути агонистов.
В контексте настоящего изобретения, термин "ингибитор протеинкиназы IRS" относится к веществу, которое препятствует взаимодействию между IRS и протеинкиназой, например, PKC-ζ.
В контексте настоящего изобретения, термин "пептид IRS" относится к пептиду, содержащему отрезок, по меньшей мере, из 5, предпочтительно, из 7, предпочтительно, по меньшей мере, из 10 аминокислот IRS. Термин "пептид IRS" подразумевает, что IRS-пептид кроме аминокислотного отрезка, полученного из IRS, может включать дополнительные аминокислоты, которые получены не из IRS.
Все способы в соответствии с изобретением предпочтительно проводят in vitro.
PKC-ζ коммерчески доступна, например от CalBiochem (San Diego, CA, USA). Кроме того, способы выделения PKC-ζ описаны в литературе, процитированной в настоящей заявке.
Последовательности IRS, особенно IRS-1 и IRS-2, различных видов известны в уровне техники. Последовательность IRS-1 крысы представлена как SEQ ID NO: 16.
Способы получения белков и, следовательно, IRS известны в уровне техники и включают, например, экспрессию белка в подходящих клетках из кДНК, или получение путем последовательного добавления аминокислот к начальной аминокислоте (см. Current Protocols, John Wiley & Sons, Inc., New-York).
Кроме того, в уровне техники известны способы получения белковых фрагментов (см. выше) и включают расщепление белка подходящими протеазами, или получения фрагментов нуклеиновой кислоты, кодирующих белковые фрагменты, и последующей экспрессии фрагментов в подходящих клетках.
В уровне техники известны способы получения мутантных белков, например, путем замещения одной или более аминокислот или путем делеции аминокислотного отрезка (см. выше). Эти способы включают сайтнаправленный мутагенез гена IRS и экспрессию модифицированного гена в подходящих клетках.
В соответствии с предпочтительным вариантом осуществления, сокращение фосфорилирования сайта PKC-ζ-Ser-фосфорилирования по сравнению с фосфорилированием в отсутствие, по меньшей мере, одного предполагаемого ингибитора указывает на ингибирующие свойства предполагаемого ингибитора.
Предпочтительно, PKC-ζ получают от млекопитающего, предпочтительно, грызуна или человека, более предпочтительно, крысы или человека.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, пептид IRS получают из IRS, предпочтительно IRS-1, от млекопитающих, предпочтительно человека или грызуна, более предпочтительно, от крысы.
Предпочтительно, IRS-1 получают от крысы, и, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования выбирают из группы, состоящей из Ser 458, 469, 481, 498, 522, 526, 530, 536, 538, 539, 542, 560, 570, 577, 599, 600, 612, 620, 632, 635, 662 и 664, в которой номера в последовательности соответствуют IRS-1 крысы, как отражено в SEQ ID NO:16. Кроме того, IRS-1 можно получать от человека, и, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования выбирают из числа остатков Ser, соответствующих приведенным выше остаткам Ser IRS-1 крысы.
Предпочтительно, сайт PKC-ζ-Ser-фосфорилирования в контексте настоящего изобретения может быть выбран из группы, состоящей из Ser498, Ser570 и Ser612, более предпочтительно, Ser570.
В соответствии с наиболее предпочтительным вариантом осуществления настоящего изобретения, данный пептид представляет собой rIRS449-664 (SEQ ID NO: 17).
Предпочтительно, ингибитор выбирают из группы, состоящей из связывающих пептидов, антител и низкомолекулярных соединений (LMWs).
Термин "связывающий белок" или "связывающий пептид" обозначает класс белков или пептидов, которые связывают и ингибируют IRS, включая, без ограничения, поликлональные или моноклональные антитела, фрагменты антитела и белковые каркасы, направленные против IRS, например антикалины, которые направлены против IRS.
Процедуру получения антитела или фрагмента антитела выполняют в соответствии со способами, известными специалисту, например, путем иммунизации млекопитающего, например, кролика с помощью IRS, где является уместным в присутствии, например, адъюванта Фрейнда и/или гелей гидроксида алюминия (см., например, Diamond, B.A. et al. (1981) New England Journal of Medicine: 1344-1349). Поликлональные антитела, которые образуются у животных в результате иммунологической реакции, впоследствии можно выделить из крови с применением известных способов и, например, очистить посредством колоночной хроматографии. Моноклональные антитела, например, можно получить в соответствии с известным способом Winter & Milstein (Winter, G. & Milstein, C. (1991) Nature, 349, 293-299).
В соответствии с настоящим изобретением термин антитело или фрагмент антитела также следует понимать как обозначающий антитела или их антиген-связывающие части, которые получили рекомбинантным способом и, где является уместным, модифицировали, такие, как химерные антитела, гуманизированные антитела, многофункциональные антитела, биспецифичные или олигоспецифичные антитела, одноцепочечные антитела и фрагменты F(ab) или F(ab)2 (см., например, EP-B1-0 368 684, USA 4 816 567, USA 4 816 397, WO 88/01649, WO 93/06213 или WO 98/24884).
В качестве альтернативы классическим антителам также можно, например, использовать белковые каркасы против IRS, например антикалины, которые основаны на липокалине (Beste et al. (1999) Proc. Natl. Acad. Sci. USA, 96, 1898-1903). Естественные лиганд-связывающие сайты липокалинов, например ретинол-связывающий белок или билин-связывающий белок, можно изменить, например, посредством "комбинаторного белкового дизайна"-подхода, в котором они связываются с выбранными гаптенами, здесь с IRS (Skerra, 2000, Biochim. Biophys. Acta, 1482, 337-50). Другие известные белковые каркасы известны в качестве альтернативы к антителам для молекулярного узнавания (Skerra (2000) J. Mol. Recognit., 13, 167-187).
LMWs представляют собой молекулы, которые не являются белками, пептидами, антителами или нуклеиновыми кислотами и которые обладают молекулярным весом меньше, чем 5000 Да, предпочтительно, меньше, чем 2000 Да, более предпочтительно, меньше, чем 2000 Да, наиболее предпочтительно, меньше, чем 500 Да. Такие LMWs можно идентифицировать в высокопроизводительных процедурах, начинающихся с библиотек.
Ингибитор может быть в форме естественного экстракта продукта, как в неочищенной, так и в очищенной форме. Экстракт может быть получен в соответствии со стандартными процедурами такими, как экстракция водного и/или спиртового и/или органического растворителя и/или колоночная хроматография и/или осаждение из животного, растительного или микробного источника такого, как змеиный яд, листья или микробные жидкие среды ферментации.
В контексте настоящего изобретения, IRS и PKC-ζ обеспечивают, например, в системе пробы и прямо или косвенно вводят в контакт с тестируемым соединением, в частности, с биохимическим или химическим тестируемым соединением, например, в форме библиотеки химических соединений. Затем измеряют или обнаруживают влияние тестируемого соединения на фосфорилирование IRS. После этого можно анализировать и/или выделять подходящие ингибиторы. Для скрининга библиотек химических соединений, предпочтительно применение высокопроизводительных проб, известных специалисту или которые являются промышленно доступными.
В соответствии с настоящим изобретением, термин "библиотека химических соединений" обозначает множество химических соединений, которые собирали из любого из множества источников, включая химически синтезируемые молекулы и естественные продукты, или которые производили с помощью методик комбинаторной химии.
В целом, влияние тестируемого соединения на взаимодействие измеряют или обнаруживают путем определения степени фосфорилирования пептида IRS. Это можно проделать при использовании фосфор-специфичных антител. Такие антитела известны в уровне техники и доступны, например, от Clonetech, Santa-Cruz и Cellsignal.
В качестве альтернативы, степень фосфорилирования можно измерять с применением радиоактивно меченой АТФ в пробе. АТФ можно метить с помощью 32-P или 33-P, и количество радиоактивного фосфата, включенного в IRS, можно измерять способами, известными в уровне техники (см. примеры 2, 9.). Например, интенсивность сигнала, измеренного с помощью авторадиографии, может указывать на степень фосфорилирования.
Преимущественно способ настоящего изобретения осуществляют в системе робототехники, например, включающей автоматизированную систему высевания на плашки и автоматизированную систему переноса жидкостей, например, с применением микроструйной техники, то есть с канальной структурой.
В другом варианте осуществления настоящего изобретения, способ выполняют в форме высокопроизводительной системы скрининга. Преимущественно в такой системе способ скрининга автоматизирован и выполнен в уменьшенных масштабах, в частности в нем используют уменьшенные лунки и микроструйную технику, которой управляют роботы.
Изобретение дополнительно относится к способу идентификации агониста IRS, предусматривающему этапы
a) введения PKC-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого агониста, содержащего, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования, и
b) измерения степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования предполагаемого агониста.
Для этого способа в соответствии с изобретением, в отношении PKC-ζ и IRS применяют те же варианты осуществления, что и для приведенного выше раскрытого способа.
В предпочтительном варианте осуществления, агонист представляет собой пептид. Библиотеки пептидов, которые можно использовать в контексте настоящего изобретения, известны в уровне техники.
В соответствии с предпочтительным вариантом осуществления данного способа изобретения, увеличение степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования агониста по сравнению с фосфорилированием сайта PKC-ζ-Ser-фосфорилирования пептида IRS свидетельствует об агонистических свойствах предполагаемого агониста.
Изобретение дополнительно относится к способу определения активности PKC-ζ, предусматривающему этапы
a) введения PKC-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого ингибитора, и
b) измерения степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования.
Следовательно, настоящее изобретение обеспечивает способ измерения активности PKC-ζ. Такой способ является особенно полезным в случае, если активность PKC-ζ от различных пациентов необходимо измерить для получения большего количества информации о сигнальной системе трансдукции у пациентов, в частности у пациентов с диабетом.
В данном способе изобретения, PKC-ζ получают предпочтительно от млекопитающего, более предпочтительно от человека.
В отношении данного способа изобретения и используемых в нем IRS, применяют то же, что и для другого способа изобретения, раскрытого выше.
Изобретение дополнительно относится к пептиду IRS-1, содержащему Ser570, предпочтительно IRS-1449-664, как показано в SEQ ID NO: 17, или к его человеческому гомологу.
В рамках настоящего изобретения, оказалось, что данный пептид в соответствии с изобретением особенно полезен для идентификации аналогов или ингибиторов IRS.
Изобретение дополнительно обеспечивает набор, содержащий
a) по меньшей мере, один пептид IRS,
b) препарат PKC-ζ и
c) по меньшей мере, один предполагаемый ингибитор или агонист протеинкиназы IRS.
Как уже обсуждалось выше, такой набор чрезвычайно полезен для идентификации ингибиторов протеинкиназы IRS. Его отдельные компоненты уже обсуждались выше.
В дополнительном аспекте настоящее изобретение обеспечивает пептид IRS-1, в котором Ser570 и/или Ser612 являются мутированными, предпочтительно, с заменой на аланин. Такой пептид полезен для блокировки активности PKC-ζ in vitro или in vivo.
Изобретение дополнительно относится к применению пептида IRS, определенного выше, для получения антител, предпочтительно, против сайта PKC-ζ-Ser-фосфорилирования, предпочтительно, против Ser498, Ser570 и Ser612, более предпочтительно, против Ser570. Следовательно, с помощью пептидов IRS, определенных в настоящем изобретении, можно получить IRS-специфичные антитела, в частности антитела, направленные против сайтов фосфорилирования PKC-ζ. Такие антитела могут служить как в in vitro диагностиках, так и в фармацевтических композициях.
В дополнительном аспекте настоящее изобретение относится к применению пептида IRS, определенного выше, или пептида IRS-1 с мутировавшими Ser-сайтами, определенными выше для получения фармацевтической композиции для лечения диабета типа 2. Такие пептиды могут ингибировать взаимодействие между IRS и PKC-ζ и, следовательно, могут служить антагонистами фосфорилирования IRS.
Для получения фармацевтической композиции ингибиторы или агонисты протеинкиназы IRS, идентифицированные в настоящем изобретении, или пептиды в соответствии с настоящим изобретением обычно составляют с одной или более фармацевтически приемлемой добавкой или вспомогательным веществом таким, как физиологический буферный раствор, например раствор хлорида натрия, деминерализованная вода, стабилизаторы, такие как ингибиторы протеазы или нуклеазы, предпочтительно апротинин, ε-аминокапроновая кислота или пепстатин A или секвестирующие агенты такие, как EDTA, гелевые составы такие, как белый вазелин, парафин с низкой вязкостью и/или желтый воск и т.д. в зависимости от типа введения.
Подходящими дополнительными добавками, например, являются детергенты такие, как, например, Triton X-100 или дезоксихолат натрия, а также полиолы такие, как, например, полиэтиленгликоль или глицерин, сахара такие, как, например, сахароза или глюкоза, цвиттерионные соединения такие, как, например, аминокислоты такие, как глицин или, в особенности, таурин или бетаин и/или белок такой, как, например, сывороточный альбумин быка или человека. Предпочтительными являются детергенты, многоатомные спирты и/или цвиттерионные соединения.
Физиологический буферный раствор предпочтительно имеет pH приблизительно 6,0-8,0, в особенности pH приблизительно 6,8-7,8, в особенности pH приблизительно 7,4, и/или осмолярность приблизительно 200-400 миллиосмоль/литр, предпочтительно приблизительно 290-310 миллиосмоль/литр. pH фармацевтической композиции, в целом, доводят с применением подходящего органического или неорганического буфера, например, предпочтительно с применением фосфатного буфера, трис-буфера (трис(гидроксиметил)аминометана), буфера HEPES ([4-(2-гидроксиэтил)пиперазино]этансульфоновой кислоты) или буфера MOPS (3-морфолино-1-пропансульфоновой кислоты). Выбор соответствующего буфера, в целом, зависит от требуемой молярности буфера. Фосфатный буфер является подходящим, например, для инфузионных растворов и инъекции.
Фармацевтическая композиция может вводиться обычным способом, например, посредством пероральных лекарственных форм таких, как, например, таблетки или капсулы, через слизистые, например носовой или ротовой полости, в форме депозиториев, имплантируемых под кожу, посредством инъекций, вливаний или гелей, которые содержат фармацевтические композиции в соответствии с изобретением. Можно также вводить фармацевтическую композицию местно и локально, если является уместным, в форме липосомных комплексов. Кроме того, лечение можно проводить посредством трансдермальной терапевтической системы (TTS), которая делает возможным управляемое во времени высвобождение фармацевтических композиций. TTS известна, например, из EP 0 944 398 A1, EP 0 916 336 A1, EP 0 889 723 A1 или EP 0 852 493 A1.
В целом, инъекционные растворы используют, если в тело необходимо вводить лишь относительно малые количества раствора или суспензии, например, от приблизительно 1 до приблизительно 20 мл. Инфузионные растворы, в целом, используют, если необходимо вводить большее количество раствора или суспензии, например один или более литров. Поскольку, в отличие от инфузионного раствора, в случае инъекционных растворов вводят лишь несколько миллилитров, малые отличия от pH и от осмотического давления крови или тканевой жидкости в инъекции не становятся заметными или становятся заметными лишь в незначительной степени в отношении болевых ощущений. Следовательно, разбавление композиции в соответствии с изобретением перед применением, в целом, не является необходимым. Однако в случае введения относительно больших количеств, композицию в соответствии с изобретением следует быстро разбавить перед введением до такой степени, чтобы получить, по меньшей мере, приблизительно изотонический раствор. Примером изотонического раствора является раствор хлорида натрия с концентрацией 0,9%. В случае вливания, разбавление можно выполнять, например, с применением стерилизованной воды, в то время как введение можно выполнять, например, посредством так называемого искусственного кровообращения.
Изобретение дополнительно относится к способу получения фармацевтической композиции, предусматривающему этапы:
a) идентификации ингибитора или агониста протеинкиназы IRS, определенного выше,
b) обеспечения адекватных количеств ингибитора протеинкиназы IRS и
c) составления фармацевтической композиции с ингибитором протеинкиназы IRS, необязательно в сочетании с фармацевтически приемлемым носителем.
Изобретение дополнительно описано следующими примерами и чертежами, которые, как подразумевается, не ограничивают объем настоящего изобретения.
ПРИМЕРЫ
Пример 1
МАТЕРИАЛЫ
Олигонуклеотидные праймеры были получены от MWG-Biotech (Ebersberg, Germany). BL21 Codon Plus и набор сайт-направленного мутагенеза QuikChange™ были закуплены в Stratagene (La Jolla, CA, USA). Компетентные клетки One Shot TOP 10 были от Invitrogen (Karlsruhe, Germany). Набор плазмид miniprep был получен от Qiagen (Hilden, Germany). Поликлональная anti-IRS-1 иммунная сыворотка была подарена доктором Dr. J. A. Maassen (Leiden, The Netherlands). Анти-фосфотирозиновое антитело (RC20), связанное с пероксидазой хрена, и anti-p85α антитело было получено от Transduction Laboratories, Inc (Lexington, KY, USA). Моноклональное anti-IRb антитело поставлялось от Oncogene (Cambridge, MA, USA). Anti-IRS-1 pS616 антитело было от Biosource (Camarillo, CA, USA). Детекция HRP-конъюгированного антитела IgG анти-кролик и анти-мышь в качестве вторичного антитела для усиленной хемилюминесценции (ECL) была от Promega Corp. (Mannheim, Germany). Протеинкиназа C из мозга крысы (PKC-rb), рекомбинантная протеинкиназа C-ζ человека, бисиндолилмалеимид I (BIM) и ингибитор псевдосубстрата PKC-ζ были получены от Calbiochem (San Diego, CA, USA). Альфа Тромбин был куплен в Upstate Biotechnology Inc (Lake Placid, NY, USA). Ферменты для молекулярной биологии, полная смесь ингибиторов протеаз и модифицированный трипсин марки секвенирования были получены от Roche (Mannheim, Germany). Окадаиновая кислота, фосфатидилсерин и агглютинин зародыша пшеницы (Triticum vulgaris) были куплены в SIGMA (München, Germany). Пептиды IRS-1 синтезировал доктор Hoffmann (BMFZ, University of Düsseldorf, Düsseldorf, Germany). Химические вещества для SDS-PAGE, вектор pGEX-5X-3 слияния генов GST, глютатионовая Sepharose® 4B и [γ-32P]АТФ были закуплены в Amersham Biosciences (Freiburg, Germany). Реактив синего красителя GelCode, очищающий буфер Restore™ для Вестерн-блоттинга и субстрат SuperSignal были получены от Pierce (Rockford, USA). Biacore X и сенсорный чип CM5 являются продуктами Biacore (Freiburg, Germany). Все другие химические вещества были высшей коммерчески доступной марки.
Пример 2
СПОСОБЫ
1. Конструирование и экспрессия составных белков
Регуляторная субъединица p85α PI 3-киназы быка, клонированная в вектор экспрессии pGEX-2T, была любезным подарком доктора P. Shepherd (London, UK). Составной белок глютатионовой S-трансферазы (GST), содержащий аминокислоты 449-664 из IRS-1 крысы (rIRS-1449-664, Mw 51,2 кДа), получили на основании способа, описанного Smith и Johnson (40) с применением вектора pGEX-5X-3. Соответствующую кДНК крысы получили из РНК, выделенной из сердца крысы с помощью обратной транскрипции с применением обратной транскриптазы птичьего вируса миелобластоза и последующей амплификации путем полимеразной цепной реакции с применением Pwo ДНК полимеразы и следующих олигонуклеотидных праймеров: 5'-праймер, ATATTGTCGACCAC-ACCCCACCAGCCAGG, 3'-праймер, ATGTACTACTACAGAGGGTC-ACGCCGGCGTAAGAATA (SEQ ID NO: 1 и 2). Продукты PCR выделяли, расщепляли подходящими ферментами рестрикции и субклонировали в pGEX-5X-3. Идентичность клона IRS-1 крысы проверяли путем анализа эндонуклеазы рестрикции и секвенирования нуклеотидов. Данный вектор и конструкцию p85α-pGEX-2T использовали для трансформации Escherichia coli BL21. Трансформированные клетки выращивали до значения A600 нм 0,6-0,8 в 2x среде YTA (16 г/л триптон, 10 г/л дрожжей, NaCl 5 г/л) с добавкой 0,1 мг/мл ампициллина и индуцировали в течение 2 часов 0,1 мМ изопропил-b-D-тиогалактозидом (IPTG). Составные белки очищали с помощью афинной хроматографии на колонках глютатионовой сефарозы и элюировали 10 мМ глютатионом в 50 мМ трис-HCl (pH 8,0). GST часть p85α GST - составного белка протеолитически удаляли с применением бычьего тромбина в PBS. Протеазу добавляли к составному белку, связанному с колонкой глютатионовой сефарозы, культивировали в течение 2 часов при комнатной температуре, и затем собирали элюат. Белок определяли с применением модификации пробы белка Bio-Rad. Все составные белки GST обладали ожидаемым молекулярным весом при анализе электрофореза в полиакриламидном геле (PAGE) с додецилсульфатом натрия (SDS).
2. Приготовление киназы инсулинового рецептора
Печень крысы быстро удалили, сразу заморозили в жидком азоте и обработали, как описано (41). Вкратце, добавили 3,5 об./вес. ледяного буфера, состоящего из 50 мМ Hepes (pH 7,4), 1% Triton X-100 и 2x полных ингибиторов протеаз и гомогенизировали печень с применением Ultraturrax и гомогенизатора Potter-Elvehjem с последующим центрифугированием при 10 000 x g в течение 10 минут при 4°C. Получающийся супернатант медленно перемешивали при комнатной температуре в течение 60 минут, затем снова центрифугировали при 100 000 x g в течение 90 минут при 4°C. Затем супернатант вносили в колонку со связанным с агарозой агглютинином зародыша пшеницы (WGA). Колонку промывали 50 мМ Hepes (pH 7,4), 0,1% Triton X-100 и связанные гликопротеиды элюировали из колонки WGA данным буфером, содержащим 0,3 М N-ацетилглюкозамина.
3. Проба фосфорилирования in vitro
Для фосфорилирования rIRS-1449-664 инсулиновым рецептором, 5 мкг WGA-очищенной фракции гликопротеида предварительно выдерживали в течение 30 минут при 30°C с 100 нМ инсулином в буфере фосфорилирования, содержащем 20 мМ Hepes (pH 7,4), 1 мМ DTT,10 мМ MgCl2, 100 мкг/мл бычьего сывороточного альбумина,0,2 мМ Na3VO4,1,7 мМ CaCl2, 0,6 мг/мл фосфатидилсерина и 0,5 мкг/мкл окадаиновой кислоты. Автофосфорилирование инициировали добавлением АТФ при концентрации 50 мкМ и продолжали в течение 10 минут при 30°C. Фосфорилирование субстрата инициировали добавлением равных объемов rIRS-1449-669 (1 мкг) с предварительной обработкой (30 минут) изоформами PKC или без них в том же буфере в присутствии 50 мкМ АТФ и давали ему протекать в течение 10 минут при 30°C в конечном объеме 50 мкл. Реакцию завершали добавлением 6x буфера для образца (0,35 М трис-HCl (pH 6,8), 10,28% (вес./об.) SDS, 36% (об./об.) глицерина; 0,6 М DTT, 0,012% (вес./об.) бромфенола синего) и кипятили в течение 5 мин. Белки разделяли с помощью SDS-PAGE и анализировали с помощью иммунодетекции антифосфотирозиновым антителом после переноса на нитроцеллюлозу. Серин/треониновое фосфорилирование rIRS-1449-664 различными изоформами PKC оценивали путем выдерживания 1 мкг rIRS-1449-664 с 0,5 мкг PKC-rb или PKC-ζ в буфере фосфорилирования в течение 30 минут при 30°C в присутствии 50 мкМ АТФ плюс 2 мкКи [g-32P]АТФ в объеме 20 мкл. Белки анализировали с помощью SDS-PAGE, окрашенные, и высушенные гели подвергали авторадиографии. Степень включения фосфата определяли путем измерения рассеченных фрагментов счетчиком Черенкова.
4. Проба разъединения GST
In vitro фосфорилированный rIRS-1449-664 выдерживали с гранулами глютатионовой сефарозы во вращательном устройстве в течение 1 часа при 4°C. Гранулы промывали три раза буфером связывания (50 мМ трис (pH 7,4), 150 мМ NaCl, 1% (об./об.) Nonidet P-40, 1 мМ EDTA, 1 мМ NaF,Na3VO4 1 мМ). Затем добавляли 0,5 мкг рекомбинантных p85α и обработку продолжали в течение 2 часов при 4°C. После трехкратного промывания связанные белки элюировали 20 мкл 2x буфера для образца и разделяли с помощью SDS-PAGE.
5. Иммуноблоттинг
Белки разделяли с помощью SDS-PAGE с применением гелей с градиентом 8-18%, с последующим переносом на нитроцеллюлозу в полусухом приборе блоттинга. Затем мембрану блокировали в течение 60 минут в трис-забуференном солевом растворе, содержащем 0,05% Tween 20 и 1% BSA или 5% нежирное сухое молоко, и исследовали с применением подходящих антител (anti-IRS-1, anti-pTyr, anti-p85α). После обширного промывания мембраны выдерживали со вторичными антителами, сопряженными с пероксидазой хрена, снова промывали, и затем полосы белков визуализировали с помощью способа усиленной хемилюминесценции (ECL) на рабочей станции LumiImager (Boehringer, Mannheim, Germany). Все пятна подвергали количественному анализу с применением программного обеспечения LumiImager. Значение представленных разностей оценивали с применением нулевой гипотезы и t-статистики для непарных данных. Предполагалось, что значение p меньше 0,05 являлось статистически значимым.
6. Картирование фосфопептидов с помощью высокоэффективной жидкостной хроматографии (HPLC) и масс-спектрометрии электрораспылительной ионизации (ESI-MS)
С применением 50 ед. (40 мкг) PKC-ζ, фосфорилировали 5 нмоль белка rIRS-1449-664 с помощью 50 мкМ АТФ плюс 0,25 мКи/мл [γ-32P] АТФ в течение 60 минут при условиях, описанных выше. Белки разделяли с помощью SDS-PAGE и фосфорилированный rIRS-1449-664 расщепляли с помощью 100 мкг трипсина в отделенных частях геля в течение ночи при 30°C. Пептиды элюировали 50 мМ NH4HCO3, 50% ацетонитрилом и разделяли на анионообменной колонне (Nucleogel SAX 1000-8/46, 50 x 4,6 мм, Macherey & Nagel, Düren, Germany) с применением системы доставки растворителя Beckman gold. Скорость потока HPLC составляла 0,5 мл/мин. После инжекции образца, пептиды элюировали, начиная со 100% буфера A (20 мМ NH4CH3COOH, pH 7,0) и 0% буфера B (1 М KH2PO4, pH 4,0). Количество буфера B увеличивали до 10% в течение 40 минут и от 10 до 50% в течение следующих 75 мин. Собирали 0,5 мл фракции и измеряли радиоактивность с помощью счетчика Черенкова. Радиоактивные фракции подвергали обратнофазной HPLC. Пептиды разделяли на C18 обратнофазной колонке (Nucleosil 300-5 C18, 250 мм x 2 мм, размер частиц 5 мкм, размер пор 300 Å, Macherey & Nagel, Düren, Germany). Скорость потока HPLC доводили до 0,33 мл/мин. После внесения образца элюцию начинали со 100% раствора А (0,1% TFA) и 0% раствора B (ацетонитрил/TFA (84/0,1; об./об.)). Долю раствора B увеличивали до 100% в течение 120 мин. Радиоактивность собранных фракций повторно измеряли. Фракции, содержащие радиоактивно меченые пептиды, подвергали масс-спектрометрии ESI TOF. Масс-спектры регистрировали на электрораспылительном квадрупольном времяпролетном масс-спектрометре (QSTAR Pulsar I, Applied Biosystems, Foster City, CA, USA), с применением nanospray-источника (Protana, Odense, Denmark). Выбранные пептиды анализировали в режиме тандемной масс-спектрометрии и последовательность и посттрансляционные модификации находили путем ручной интерпретации.
7. Сайт-направленный мутагенез
Мутантов rIRS-1449-664 с заменой серина 570 на аланин и серина 612 на аланин получали путем сайт-направленного мутагенеза с применением набора сайт-направленного мутагенеза QuikChange™ в соответствии с инструкциями фирмы - производителя с применением pGEX-5X-3/rIRS-1449-664 в качестве матрицы. Использовали следующие праймеры: С570А,
5'-CCCGGCTACCGGCATGCCGCCTTCGTGCCCACC (SEQ ID NO:3) и
3'-GGGCCGATGGCCGTACGGCGGAAGCACGGGTGG (SEQ ID NO:4); S612A,
5'-GGCTACATGCCCATGGCTCCCGGAGTGGCTCC (SEQ ID NO:5) и
3'-CCGATGTACGGGTACCGAGGGCCTCACCGAGG (SEQ ID NO:6).
Наличие требуемых мутаций было подтверждено секвенированием рекомбинантных молекул с помощью Qiagen Sequencing Services (Hilden, Germany).
8. Изучение взаимодействия с помощью технологии поверхностного плазмонного резонанса
Принцип действия биосенсора BIAcore™ (Biacore, Freiburg, Germany) был предварительно описан (42). Во избежание мешающей димеризации GST-части составного белка, его расщепили с помощью тромбина в ходе очистки. В силу известной чрезвычайно высокой скорости связывания SH2-доменов с фосфопептидами, относительные степени сродства оценивали с помощью пробы конкуренции (43). В связи с этим, p85α с постоянной концентрацией (100 нМ) выдерживали в проточном буфере (0,01 М Hepes pH 7,4, 0,15 М NaCl, EDTA 3 мМ, 0,005% сурфактант P20 (HBS-EP)) с переменной концентрацией пептида-конкурента (50 нМ - 10 мкМ), который был идентичен таковому, связанному с поверхностью сенсорного чипа CM5. Затем, после 1-часовой предварительной выдержки при комнатной температуре, последовательно вводили различные смеси при скорости потока 5 мкл/мин при 25°C в буфере HBS-EP. Используемые пептиды DDGYMPMSPGV (SEQ ID NO: 7), DDGpYMPMSPGV, DDGYMPMpSPGV и DDGpYMPMpSPGV, представляющие аминокислоты 605-615 из IRS-1 крысы, синтезировали на синтезаторе пептидов Applied Biosystems model 433. Все пептиды иммобилизировали при концентрации 5 мг/мл в 100 мМ H3BO4 (NaOH pH 8,5) в 1 мкл/мин с помощью стандартной процедуры сочетания аминов, как описано фирмой-производителем. Восстановление после каждого эксперимента связывания выполняли путем инжекции 6 М гидрохлорида гуанидина в течение 2 мин. Кинетический анализ p85α с взаимодействием pY608 и pY606-pS612 выполняли с применением программного обеспечения BIAevaluation 3.1 (Biacore, Freiburg, Germany) и GraphPad Prism 3.0 (San Diego, CA, USA).
9. Измерение степени фосфорилирования серина/треонина rIRS-1449-664 с помощью PKC
Фосфорилирование серина/треонина rIRS-1449-664 различными изоформами PKC оценивали путем пипетирования подходящих объемов 1 мкг rIRS-1449-664 и 0,1 - 1,0 мкг PKC-ζ или PKC мозга крысы в 10 мкл 2x буфера фосфорилирования (20 мМ Hepes (pH 7,4), 1 мМ DTT, 10 мМ MgCl2, 100 мкг/мл бычьего сывороточного альбумина,0,2 мМ Na3VO4, 1,7 мМ CaCl2, 0,6 мг/мл фосфатидилсерина и 0,5 мкг/мл окадаиновой кислоты, 50 мкМ АТФ + 2 мкКи [γ-32P] АТФ). С помощью воды смесь доводили до конечного объема 20 мкл минус необходимый объем АТФ. Затем начинали реакцию фосфорилирования путем добавления АТФ из основного раствора до конечной концентрации 50 мкМ АТФ плюс 2 мкКи [γ-32P] АТФ и выдерживали в течение 30 минут при 30°C. Реакцию останавливали путем добавления 4 мкл 6x буфера для образца (0,35 М трис-HCl (pH 6,8), 10,28% (вес./об.) SDS, 36% (об./об.) глицерина; 0,6 М DTT, 0,012% (вес./об.) бромфенола синего) и кипячения в течение 5 мин. Затем белки исследовали с помощью SDS-Page и окрашенные и высушенные гели для анализа подвергали авторадиографии.
Пример 3
Домен IRS-1 фосфорилировали с помощью инсулинового рецептора, и он взаимодействовал с PI 3-киназой
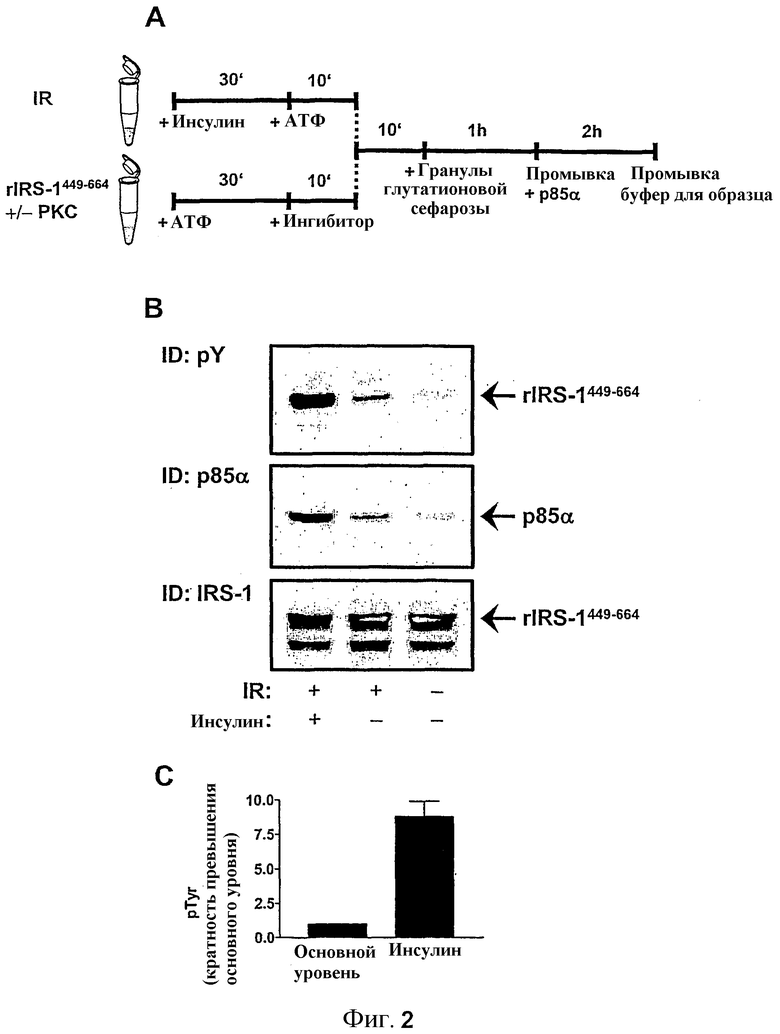
Для определения действия фосфорилирования серина/треонина на взаимодействие IRS-1 с инсулиновым рецептором и PI3-киназой, авторы изобретения разработали пробу in vitro фосфорилирования и взаимодействия с PI 3-киназой с применением рекомбинантного p85α и подхода GST-разъединения. Выбранную часть белка IRS-1 крысы клонировали, экспрессировали как GST - составной белок и очищали от E. coli. Данный GST - составной белок (rIRS-1449-664) включает домен из 216 аминокислот (449-664) белка IRS-1 крысы, содержащий потенциальные сайты фосфорилирования тирозина в консенсусных мотивах YMXM или YXXM, включая главные сайты связывания PI3-киназы Tyr608 и Tyr628 (39) (см. фиг.1). На основании структуры кодируемого составного белка рассчитывали массу молекулы, составившую 51,2 кДа, наблюдаемую массу 55 кДа определяли с помощью SDS-PAGE. Порядок проведения эксперимента in vitro фосфорилирования и пробы взаимодействия p85α представлен на фиг.2A.
Обеспечение действия WGA-очищенного инсулинового рецептора на составной белок приводило к заметному фосфорилированию тирозина rIRS-1449-664, стимулируемому инсулином (фиг.2 B, верхняя рамка). Количественный анализ продемонстрировал 8,8±1,1-кратную стимуляцию выше основного уровня (n=10, фиг.2C). Проба GST-разъединения демонстрировала значительное увеличение взаимодействия регуляторной субъединицы p85α PI3-киназы с rIRS-1449-664 с фосфорилированным тирозином (фиг.2B, средняя рамка).
Пример 4
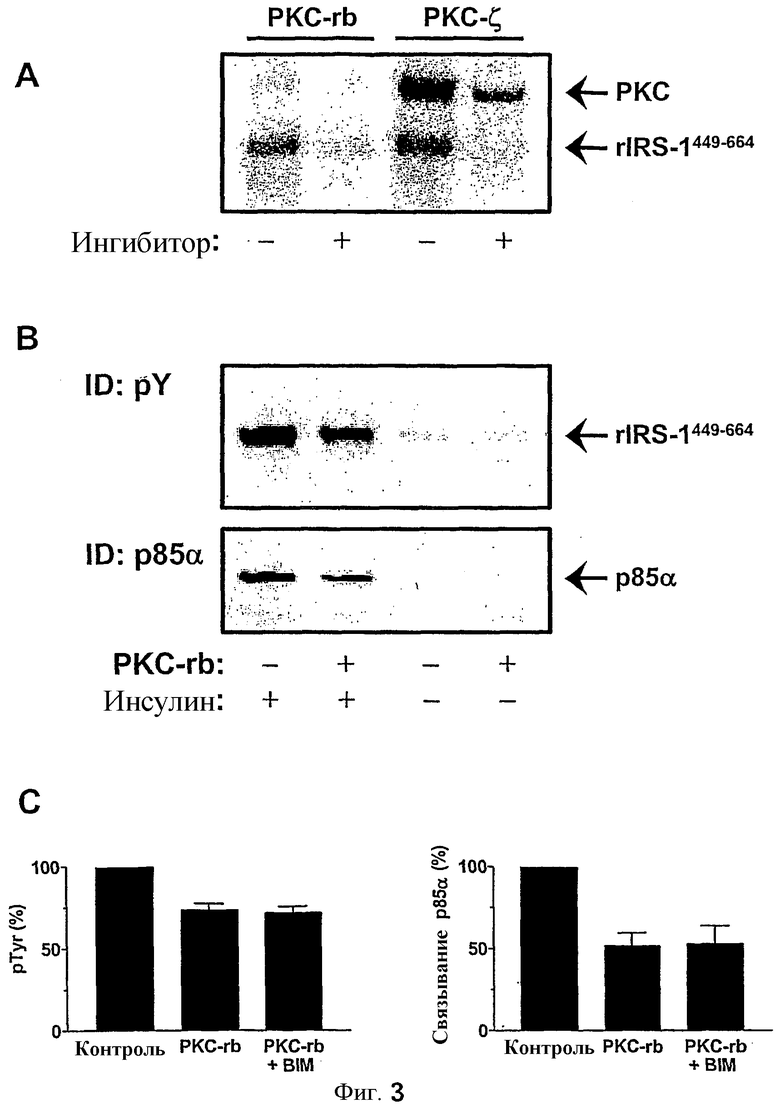
Различные изоформы PKC ингибируют стимулируемое инсулином фосфорилирование тирозина rIRS-1449-664 и последующее связывание с p85α.
Для оценки способности протеинкиназы C к фосфорилированию rIRS-1449-664 in vitro, авторы изобретения сначала культивировали составной белок с PKC мозга крысы и PKC-ζ в присутствии [32P] АТФ. Затем rIRS-1449-664 анализировали с помощью SDS-PAGE и авторадиографии (фиг.3 A), и заметное фосфорилирование rIRS-1449-664, с помощью PKC становилось детектируемым. rIRS-1449-664, выдерживаемое с тем же количеством PKC в присутствии ингибиторов PKC, не демонстрировало значительного включения фосфата (фиг.3 A). Затем определили, что кривая ответа на дозу с увеличением количества PKC устанавливает условия максимального фосфорилирования, которое наблюдали при 0,5 мкг PKC мозга крысы или PKC-ζ (данные не показаны). Затем, используя это условие, авторы изобретения исследовали влияние фосфорилирования серина rIRS-1449-664 на последующую активацию с помощью автофосфорилированного IR. В связи с этим, rIRS-1449-664 обрабатывали с PKC или без него и затем выдерживали с WGA-очищенным IR. Впоследствии определяли связывания p85α путем связывания rIRS-1449-664 с гранулам глютатионовой сефарозы через часть GST и выдерживания с 0,5 мкг p85α, как подчеркнуто на фиг.2A. Образцы анализировали с помощью SDS-PAGE и иммуноблоттинга с антителами против фосфотирозина (pTyr), p85α и IRS-1. Как показано на фиг.3B, предварительная обработка rIRS-1449-664 с помощью PKC мозга крысы вызывала уменьшение стимулируемого инсулином фосфорилирования тирозина и взаимодействия с p85α. Tyr-фосфорилирование rIRS-1449-664 уменьшалось на 27±4% (n=9) с более заметным ингибированием связывания p85α (49±8%) (фиг.3C). Ингибирование PKC-rb после фосфорилирования rIRS-1449-664 путем добавления бисиндолилмалеимида (BIM) не влияло на данный результат (фиг.3C).
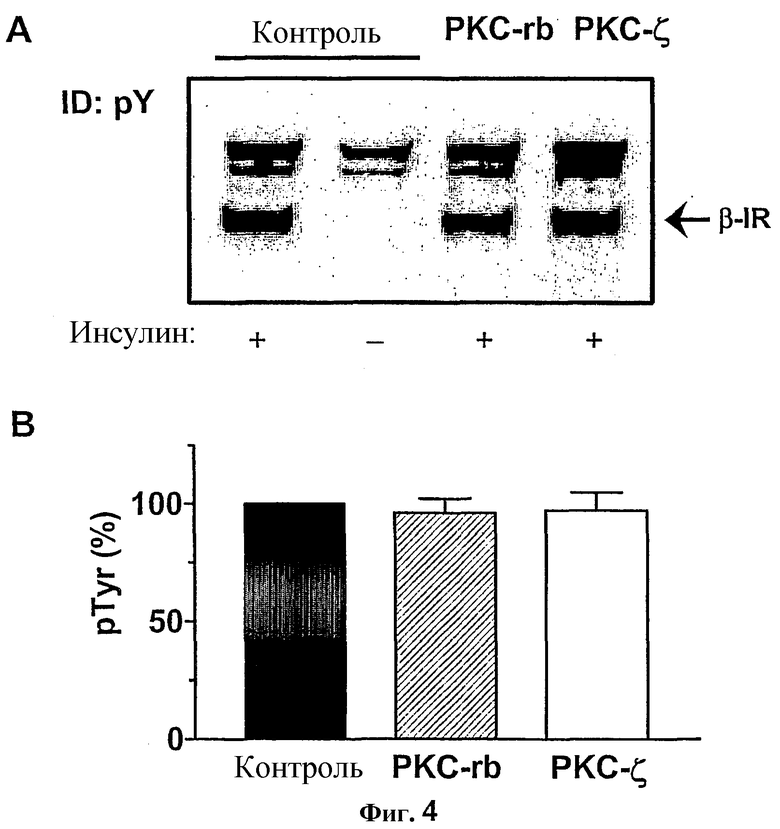
Для дополнительного исключения эффектов PKC на уровне IR, исследовали автофосфорилирование β-субъединицы. При выдерживании самоактивировавшегося рецептора в течение 10 минут при 30°C в присутствии PKC-rb или PKC-ζ не регистрировали значительного изменения автофосфорилирования IR по сравнению с контролями (фиг.4).
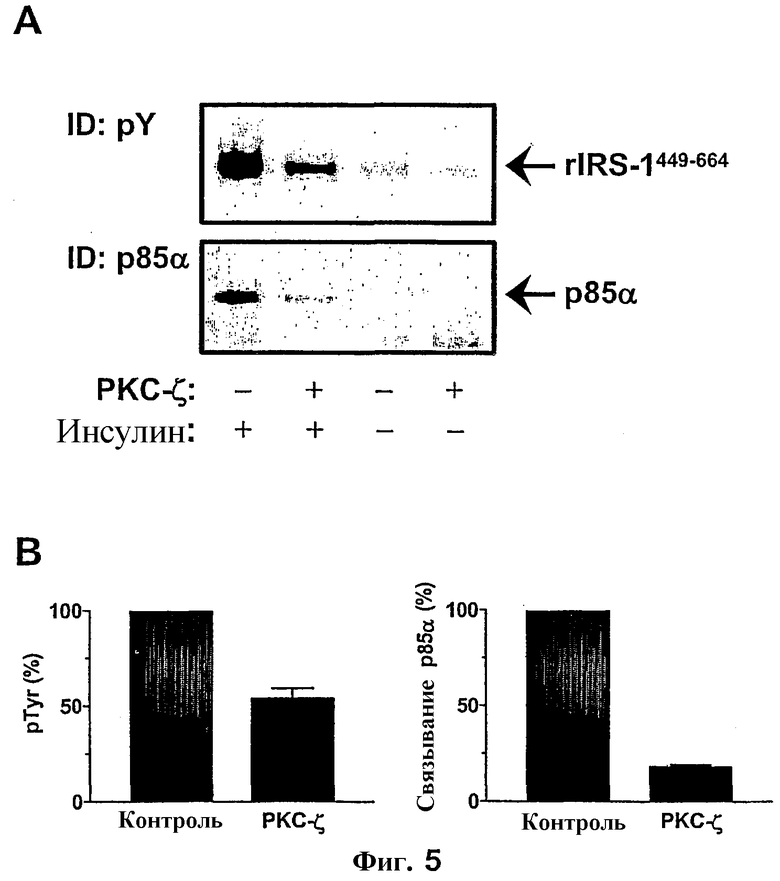
Затем экспериментальный подход, описанный на фиг.3B, повторили для PKC-ζ. По сравнению с PKC-rb наблюдали еще более заметное понижение фосфорилирования тирозина rIRS-1449-664 и взаимодействия с p85α (фиг.5A). Количественный анализ данных продемонстрировал ингибирование фосфорилирования тирозина на 46±5% (n=3) и сопутствующего ингибирования связывания p85α с IRS-1 на 81±1% (фиг.5B).
Пример 5
Идентификация и функциональный анализ сайтов фосфорилирования серина IRS-1, являющихся мишенью PKC
Предшествующие исследования продемонстрировали, что отрицательная регуляция передачи сигнала инсулина протеинкиназой C включает активизированную митогеном протеинкиназу и фосфорилирование серина 612 в IRS-1 (26). Серин 612 расположен в непосредственном соседстве с главным мотивом YMXM в Y608, который описывают, как являющийся одним из главных сайтов взаимодействия для PI 3-киназы (39).
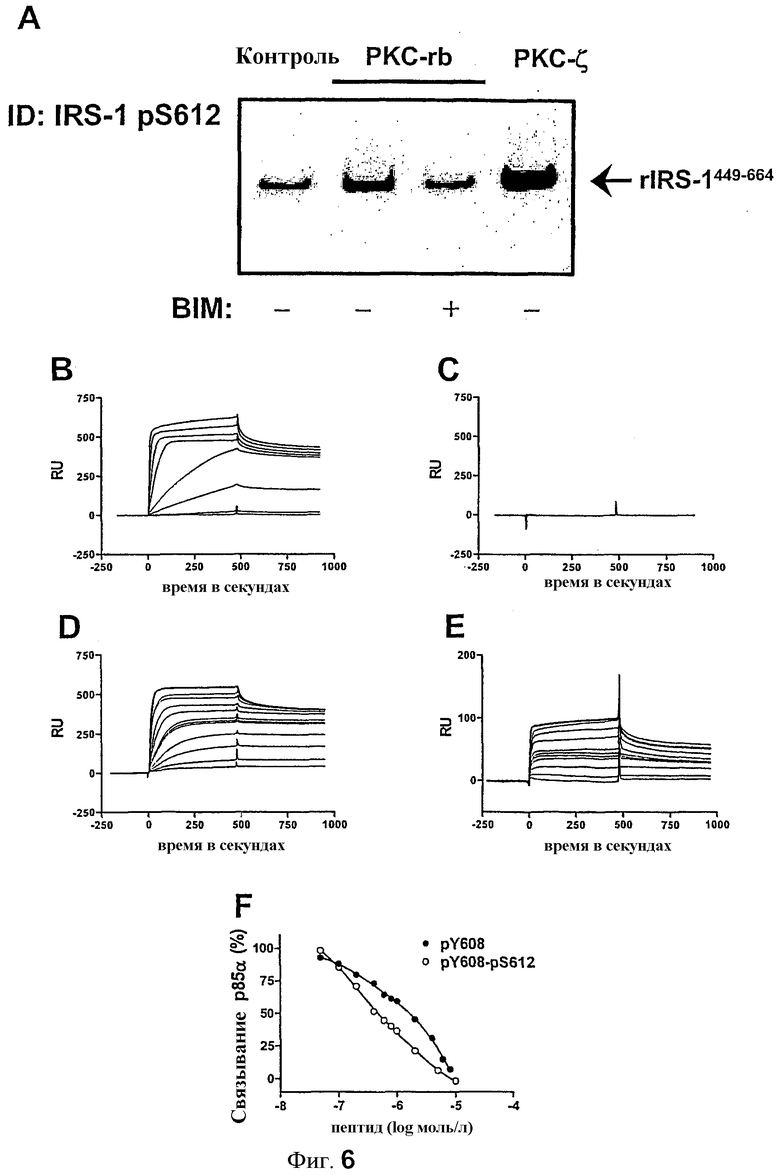
Авторы изобретения оценили модификацию этого сайта с помощью PKC с применением специфичного антитела фосфосерина 612 IRS-1 (αpS612). После выдерживания с PKC из мозга крысы и PKC-ζ в течение 30 минут при 30°C, rIRS-1449-664 в значительной степени подвергался иммуноблоттингу с apS612 (фиг.6A); ингибирование PKC с помощью BIM явным образом предотвращало фосфорилирование данного серина.
Для характеризации влияния фосфосерина 612 из IRS-1 на взаимодействие с PI 3-киназой использовали методику поверхностного плазмонного резонанса (SPR). С этой целью пептиды синтезировали с последовательностью DDGYMPMSPGV (SEQ ID NO:7), представляющей аминокислоты 605 - 615 из IRS-1 крысы, и иммобилизировали на поверхности чипа путем стандартного сочетания аминов. Сообщалось, что слияние доменов SH2 к GST может повредить их связыванию с фосфопептидами, что приводит к переоценке сродства связывания (44). В связи с этим, расщепляли GST-часть рекомбинантного p85α составного белка. Связывание p85α с пептидами изучали при нанесении различных концентраций очищенного p85α на биосенсорный чип, с которым были связаны пептиды в различных формах фосфорилирования. Эти эксперименты показали, что p85α связывается только с формой пептида с фосфорилированным тирозином (фиг.6B и C), что согласовалось с литературой (45).
Затем авторы изобретения определили относительное сродство связывания этой реакции путем мониторинга связывания 100 нМ p85α с пептидами pY608 (DDGpYMPMSPGV) и pY608-pS612(DDGpYMPMpSPGV) в присутствии конкурирующих растворимых пептидов (фиг.6D, E, F). Полумаксимальные ингибирующие концентрации (IC50) получали путем построения графика ответа SPR 440 s после инжекции при равновесии по отношению к логарифму концентрации пептида. Оба пептида демонстрировали измеримую активность связывания (фиг.6D против 6E). Солюбилизированные пептиды ингибировали связывание p85α с иммобилизированными пептидами в микромолярных концентрациях. Полное ингибирование достигалось при концентрации пептида ˜10 мкМ. Аппроксимация определенных считываний уравнением для конкуренции за два сайта дала IC50 для pY608 0,26 мкмоль/л и 16,56 мкмоль/л (r2=0,9983) и для pY608-pS612 0,15 мкмоль/л, 2,88 мкмоль/л (r2=0,9989). Из этих данных ясно, что пептид pY608-pS612 ингибировал связывание p85α с лучшей эффективностью, указывая на то, что наличие остатка фосфосерина в положении +4 фосфотирозиновых даже увеличивает сродство p85α SH2-домена к фосфопептиду IRS-1.
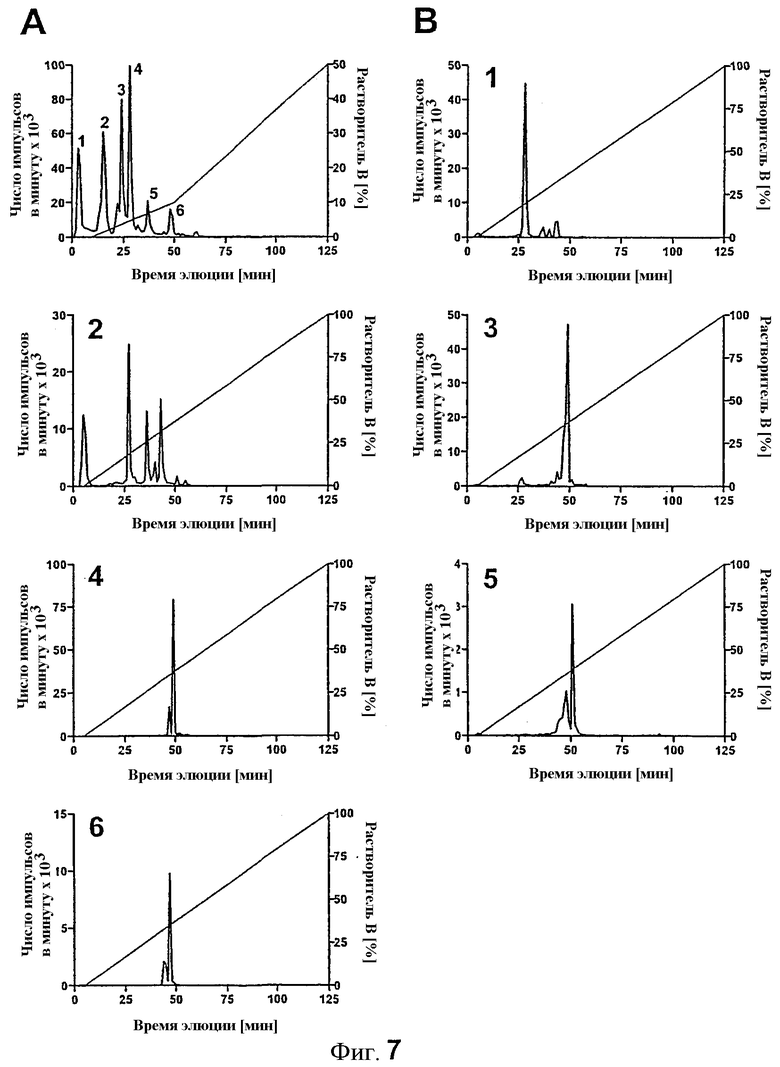
Для идентификации дополнительных сайтов фосфорилирования PKC-ζ на rIRS-1449-664, которые могли бы вызывать ингибирование стимулируемого инсулином фосфорилирования тирозина в системе in vitro, rIRS-1449-664 выдерживали с PKC-ζ и разделяли с помощью SDS-PAGE. Фосфорилированный rIRS-1449-664 расщепляли с помощью трипсина и извлекали из геля. Пептиды, получающиеся в результате расщепления, исследовали с помощью двумерной HPLC и содержание радиоактивности во фракциях отслеживали с помощью счета со счетчиком Черенкова.
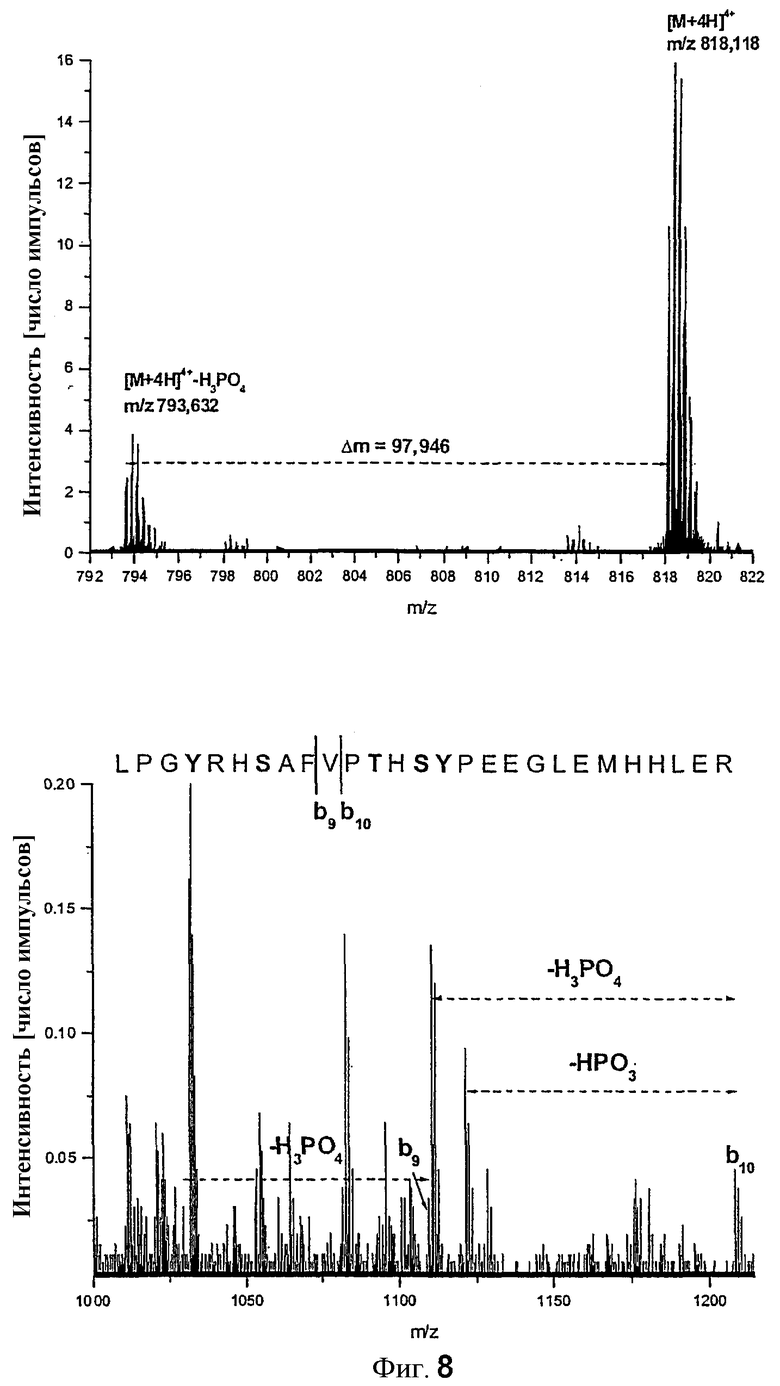
Профиль HPLC первого разделения с применением анионообменной колонки продемонстрировал 6 воспроизводимых главных пиков (фиг.7 A). Для разделения совместно мигрирующих пептидов радиоактивные фракции каждого пика объединяли в соответствии с профилем элюции и подвергали обратнофазной (RP)-HPLC (фиг.7 B). Это приводило к 10 различным радиоактивно меченым фракциям RP-HPLC, которые впоследствии подвергали электрораспылительной ионизационной масс-спектрометрии (ESI-MS). Результаты, полученные с помощью анализа MS, сведены в таблице. Можно было идентифицировать восемь пептидов, содержащих 37% последовательности rIRS-1449-664. Обнаружили два фосфосерина, серин 358 (серин 570 в полном IRS-1) (LPGYRHpSAFVPTHSYPEEGLEMHHLER (SEQ ID NO:8)) в пике 4 анионообменой HPLC и серин 286 (серин 498) (YIPGATMGTpSPALTGDEAAGAADLDNR (SEQ ID NO:9)) в пиках 5 и 6. Фосфопептид с серином 358/570 соответствовал приблизительно 19% введенной радиоактивности. Пептид с фосфосерином 286/498 составлял 11% полной измеренной радиоактивности.
Фосфосерин 358 идентифицировали с помощью ESI-MS/MS. Фрагментный ион с разностью масс 97,9 Да по оношению к исходному иону указывает на фосфопептид (фиг.8A). Разность масс 97,9 Да коррелирует с потерей фосфорной кислоты. Сайт фосфорилирования идентифицировали потерей фосфорнокислой группы (HPO3) и фосфорной кислоты (H3PO4) ионами фрагмента b9 и b10. Данное дефосфорилирование фрагментных ионов указывает на то, что фосфорилирование могло иметь место только на Y355 или S358. S358 представляет собой фосфоаминокислоту, поскольку дефосфорилирования на ионе b4 не было обнаружено, что указывает на фосфорилирование на Y355 (данные не показаны).
Фосфосерин 612 не мог быть обнаружен с помощью масс-спектрометрии несмотря на то, что он обнаруживался с помощью фосфосайт-специфичного антитела (фиг.6 A), но пептид, включающий данный сайт, был найден в пике 2 вместе с тремя дополнительными пептидами. Пик 1 и пик 3 содержал только один пептид, содержащий 13% и 21% радиоактивности, соответственно (THSAGTSPTISHQK и TPSQSSVVSIEEY-TEMMPAAYPPGGGSGGR). (SEQ ID NO:10 и 11)
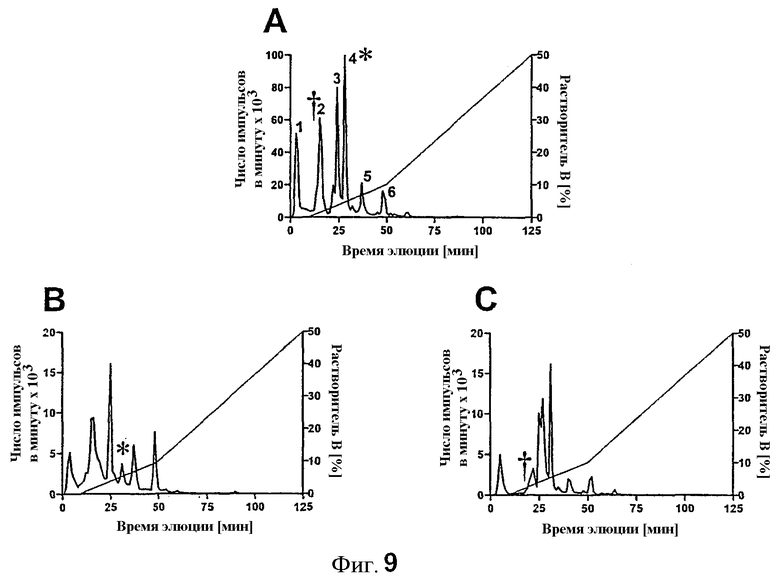
Для дальнейшего подтверждения, что обнаруженные сайты фосфорилирования представляли собой серины 570 и 612, получали два дополнительных составных белка GST с мутацией серина на аланин. Эти составные белки GST подвергали воздействию PKC-ζ и фосфорилировали ферментом на уровне, сопоставимом с диким типом (данные не показаны). С другой стороны, преобразование серина 358/570 на аланин в значительной степени уменьшило пик 4 в анионообменной HPLC (фиг.9 B), что демонстрировало, что серин 570 из IRS-1 представляет собой новый сайт фосфорилирования, являющийся мишенью PKC-ζ. Мутация серина 400/612 на аланин приводит к уменьшению пика 2 (фиг.9 C), что подтверждает данные, полученные с фосфоспецифичной антисывороткой.
Пример 6
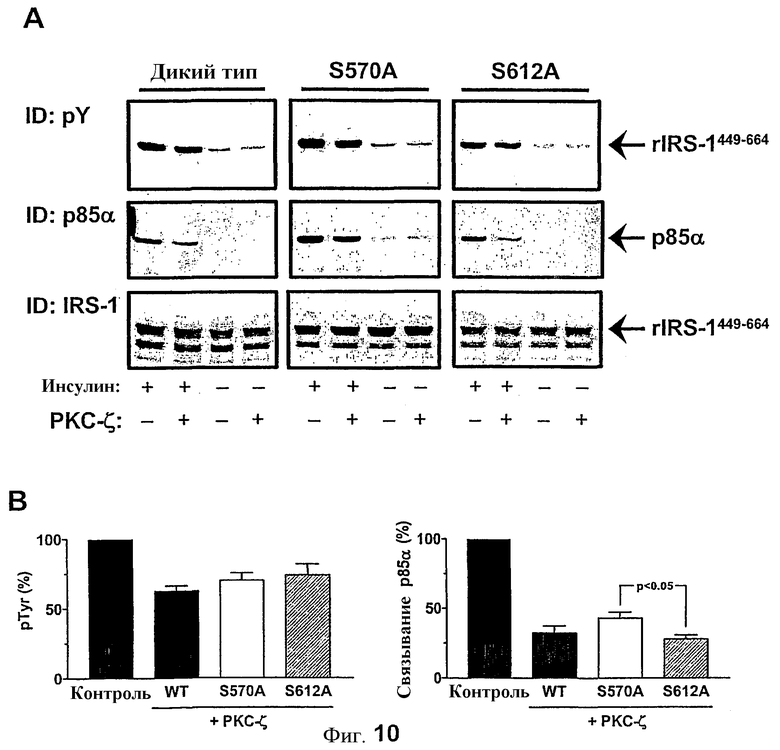
Функциональное значение остатков серина 570 и 612 в rIRS-1449-664
Для определения функционального значения идентифицированных фосфосайтов rIRS-1449-664 мутанты серина 358/570 на аланин и серина 400/612 тестировали в пробе in vitro фосфорилирования и взаимодействия p85α (фиг.10A). Сравнение результатов фосфорилирования тирозина с помощью IR после предварительной обработки PKC-ζ продемонстрировало сопоставимое понижение (30-40%) для rIRS-1449-664 дикого типа и двух данных мутантов (фиг.10B, левая рамка). Однако значительную разницу наблюдали при сравнении взаимодействия двух данных мутантов с p85α. Таким образом, связывание p85α c S570A уменьшилось до 43±4% (n=3) контроля посредством обработки PKC-ζ, с уменьшением до 28±3% для мутанта S612A rIRS-1449-664 (фиг.10B, правая рамка).
ИСПОЛЬЗУЕМЫЕ АББРЕВИАТУРЫ: GST, ГЛЮТАТИОН-S-ТРАНСФЕРАЗА; HPLC, ВЫСОКОЭФФЕКТИВНАЯ ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ; IR, ИНСУЛИНОВЫЙ РЕЦЕПТОР; IRS, СУБСТРАТ ИНСУЛИНОВОГО РЕЦЕПТОРА; ESI-MS, ЭЛЕКТРОРАСПЫЛИТЕЛЬНАЯ ИОНИЗАЦИОННАЯ МАСС-СПЕКТРОМЕТРИЯ; P85, РЕГУЛЯТОРНАЯ СУБЪЕДИНИЦА ФОСФАТИДИЛИНОЗИТОЛ-(PI)-3 КИНАЗЫ; PAGE, ЭЛЕКТРОФОРЕЗ В ПОЛИАКРИЛАМИДНОМ ГЕЛЕ; PI 3-КИНАЗА, ФОСФАТИДИЛИНОЗИТОЛ-3-КИНАЗА; RP, ОБРАТНОФАЗНЫЙ; PKC, ПРОТЕИНКИНАЗА C; PKB, ПРОТЕИНКИНАЗА B; RTKS, ТИРОЗИНОВЫЕ КИНАЗЫ РЕЦЕПТОРА; SH2, ДОМЕН 2 SRC-ГОМОЛОГИИ; WGA, АГГЛЮТИНИН ЗАРОДЫША ПШЕНИЦЫ; SDS, ДОДЕЦИЛСУЛЬФАТ НАТРИЯ; ECL, УСИЛЕННАЯ ХЕМИЛЮМИНЕСЦЕНЦИЯ.
ИСТОЧНИКИ ИНФОРМАЦИИ




 КРАТКОЕ ОПИСАНИЕ ФИГУР
КРАТКОЕ ОПИСАНИЕ ФИГУР
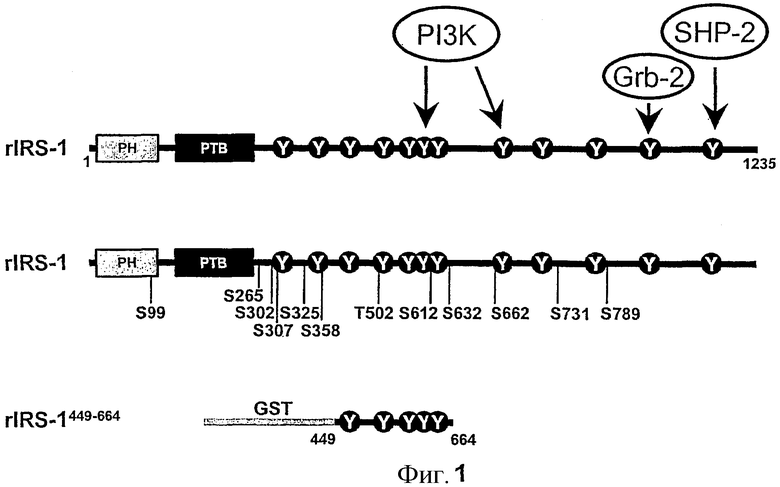
Фиг.1: Схематический обзор IRS-1 с известными партнерами взаимодействия и известными сайтами фосфорилирования серина/треонина.
Верхняя рамка: обозначены относительные положения гомологии плекстрина (PH) и фосфотирозин-связывающий (PTB) домен со следующим за ними C-концевым хвостом, который содержит многочисленные сайты фосфорилирования тирозина. Также показаны потенциальные партнеры связывания, включая PI 3-киназу, Grb2 и SHP-2. Средняя рамка: выделены известные (S307, 612, 632, 789) и потенциальные сайты фосфорилирования серина. Нижняя рамка: Конструкция GST-составного белка, содержащего аминокислоты 449-664 из IRS-1 крысы, включая главный сайт связывания PI 3-киназы.
Фиг.2: фосфорилирование Тирозина rIRS-1449-664 и взаимодействие с субъединицей p85α PI 3-киназы.
(A) Принципиальная схема порядка проведения эксперимента. 5 мкг IR подвергали автофосфорилированию в течение 10 минут при 30°C в буфере фосфорилирования после 30 минут предварительной выдержки с 100 нМ инсулина. Затем фосфорилирование субстрата инициировали добавлением автофосфорилированного IR в аликвоты 1 мкг rIRS-1449-664. Реакцию продолжали в течение 10 минут и затем добавляли гранулы глютатионовой сефарозы и образцы выдерживали при 4°C во вращательном аппарате в течение 1 часа. Гранулы промывали буфером связывания три раза, добавляли 0,5 мкг рекомбинантного p85α и продолжали выдерживание в течение 2 часов. После промывания связанные белки элюировали путем добавления 2x буфера для образца с последующим кипячением в течение 5 мин. (B) Элюируемые белки исследовали с помощью SDS-PAGE и анализировали с помощью иммуноблоттинга с применением антител против фосфотирозина, p85α и IRS-1, как подробно описано в разделе Способов. Показаны репрезентативные иммуноблоты из шести отдельных экспериментов. (C) Количественный анализ rIRS-1449-664 фосфорилирования тирозина осуществляли с применением программного обеспечения Lumi Imager. Данные представляют собой средние значения ± SEM (n=10).
Фиг.3: Действие PKC из мозга крысы на фосфорилирование тирозина rIRS-1449-664 и взаимодействие с p85α.
(A) 1 мкг rIRS-1449-664 выдерживали с 0,5 мкг PKC из мозга крысы (PKC-rb) или 0,5 мкг PKC-ζ в присутствии 2 мкКи (32P)-АТФ (конечная конц. 50 мкМ), как подробно описано в разделе Способов. Реакцию ингибировали с помощью бисиндолилмалеимида I (BIM) или пептида псевдосубстрата для PKC-rb или PKC-ζ, соответственно. Белки исследовали с помощью SDS-PAGE и подвергали авторадиографии. (B) Фосфорилирование тирозина rIRS-1449-664 с помощью IR и взаимодействие с p85α устанавливали, как описано на фиг.2. rIRS-1449-664 предварительно выдерживали с 0,5 мкг PKC-rb в течение 30 мин. Показаны репрезентативные иммуноблоты. (C) Количественный анализ ингибирующего действия PKC-rb на стимулированное инсулином фосфорилирование тирозина и взаимодействие p85α со стимулируемым инсулином значением принимали за 100%. Если присутствует, BIM добавляли в течение 10 минут перед начальным фосфорилированием субстрата с помощью IR (см. фиг.2). Данные представляют собой средние значения ± SEM (n=6-9).
Фиг.4: Действие изоформ PKC на автофосфорилирование IR.
(A) Автофосфорилирование IR проводили, как изложено на фиг.2. PKC-rb или PKC-ζ прибавляли после автофосфорилирования в течение 10 минут, и продолжали выдерживание в течение еще 10 мин. Затем анализировали фосфорилирование тирозина β-субъединицы IR с помощью иммуноблоттинга. (B) Количественный анализ иммуноблотов осуществляли с применением программного обеспечения Lumi Imager. Данные представляют собой средние значения ± SEM (n=4-6).
Фиг.5: Действие PKC-ζ на фосфорилирование тирозина rIRS-1449-664 и взаимодействие с p85α.
(A) rIRS-1449-664 предварительно выдерживали с PKC-ζ (0,5 мкг) в течение 30 мин. Фосфорилирование тирозина IR и взаимодействие с p85α определяли с помощью иммуноблоттинга, как подробно описано на фиг.2. (B) Количественный анализ ингибирующего действия PKC-ζ выполняли, как описано на фиг.3. Данные представляют собой средние значения ± SEM (n=3).
Фиг.6: Идентификация серина 612 IRS-1 как мишени PKC и анализ взаимодействия с p85α с применением поверхностного плазмонного резонанса.
(A) 0,5 мкг rIRS-1449-664 выдерживали с 0,5 мкг различных PKCs в течение 30 минут при 30°C и подвергали иммуноблоттингу с антителом против фосфосерина 612. Показан репрезентативный эксперимент. (B) Связывание p85α с иммобилизированными пептидами, соответствующими аминокислотам 605-615 из IRS-1 с фосфотирозином 608 или (C) без фосфотирозина с применением поверхностного плазмонного резонанса (pY608-DDGpYMPMSPGV и Y608-DDGYMPMSPGV). Используемые концентрации белка p85α составляли (снизу вверх): 1, 5, 10, 25, 50, 100, 250, 500 нМ. (D) Ингибирование связывания p85α за счет конкуренции с растворимыми пептидами pY608-DDGpYMPMSPGV или (E) pY608-pS612-DDGpYMPMpSPGV. Растворимые пептиды также иммобилизировали на чипе. (F) Полумаксимальные ингибирующие концентрации (IC50) получали путем построения графика ответа SPR в равновесии (440 с после инжекции) по отношению к логарифму концентрации пептида. IC50 для pY608: 0,26 мкмоль/л, 16,56 мкмоль/л и для pY608-pS612: 0,15 мкмоль/л, 2,88 мкмоль/л.
Фиг.7: Анализ HPLC трипсиновых фосфопептидов, полученных из rIRS-1449-664, фосфорилированных с помощью PKC-ζ.
Пять наномолей rIRS-1449-664 фосфорилировали в течение 60 минут с применением 0,5 нмоль PKC-ζ. Белки разделяли с помощью SDS-PAGE, и отделенный rIRS-1449-664 расщепляли трипсином. Восстановленную 32P-радиоактивно меченую смесь пептида разделяли с помощью ионобменной (A) и C18 обратнофазной HPLC (B). Радиоактивность собранных фракций определяли с помощью счета со счетчиком Черенкова. После обратнофазной HPLC радиоактивные фракции анализировали с помощью масс-спектрометрии.
Фиг.8: Спектры ESI-MS/MS фосфопептида 352-378.
(A) Потеря фосфорной кислоты исходным ионом [M+4H]4+=818,11, указывающая на фосфорилирование. (B) Дефосфорилирование фрагментного иона b9 и b10, указывающее на сайт фосфорилирования.
Фиг.9: анализ HPLC трипсиновых фосфопептидов rIRS-1449-664 и мутантов S570A и S612A.
Показан анализ HPLC трипсиновых пептидов, полученных из rIRS-1449-664 дикого типа (A), rIRS-1449-664 S570A (B) и rIRS-1449-664 S612A (C), фосфорилированных рекомбинантным PKC-ζ. Представлены репрезентативные профили HPLC.
Фиг.10: Функциональный анализ серина 570 и серина 612.
(A) rIRS-1449-664 и обозначенные мутанты предварительно выдерживали с PKC-ζ и подвергали фосфорилированию тирозина с помощью IR и взаимодействия с p85α, как отмечено на фиг.5. Показаны репрезентативные Вестерн-блоттинги. (B) Вестерн-блоты подвергали количественному анализу с применением программного обеспечения Lumi Imager, и данные выражены относительно стимулируемого инсулином контрольного значения, принятого за 100%. Результаты представляют собой средние значения ± SEM (n=3).
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
(SEQ ID NO:9)
(SEQ ID NO: 8)
c Пики анионообменной хроматографии HPLC (номера) (см. фиг.7A).
d Общее количество радиоактивности, включенной в идентифицированные фосфопептиды, принимали за 100%, и данное процентное соотношение представляет собой интегрированную область пика.
















Изобретение относится к медицине и биохимии и касается способов идентификации ингибитора или агониста протеинкиназы IRS, содержащих этапы а) введения РКС-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого ингибитора или агониста, и b), измерения степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования. А также пептида IRS-1, характеризующегося заменой остатка 570 в результате мутации на аланин. Изобретение обеспечивает идентификацию ингибиторов или агонистов IRS для лечения диабета типа II. 3 н. и 6 з.п. ф-лы, 10 ил., 1 табл.
a) введения РКС-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого ингибитора, причем по меньшей мере один сайт PKC-ζ-Ser-фосфорилирования выбран из остатка 498 и 570, где номера в последовательности соответствуют IRS-1 крысы, как отражено в SEQ ID NO:16, или соответствующего сайта РКС-ζ-Ser-фосфорилирования млекопитающего, предпочтительно человека или грызуна, и
b) измерения степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования, в котором пониженное фосфорилирование по меньшей мере одного из сайтов PKC-ζ-Ser-фосфорилирования по сравнению с фосфорилированием в отсутствии, по меньшей мере, одного предполагаемого ингибитора служит признаком ингибирующих свойств предполагаемого ингибитора.
a) введения РКС-ζ в контакт, по меньшей мере, с одним пептидом IRS, содержащим, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования в присутствии, по меньшей мере, одного предполагаемого агониста, содержащего, по меньшей мере, один сайт PKC-ζ-Ser-фосфорилирования, причем по меньшей мере один сайт PKC-ζ-Ser-фосфорилирования по меньшей мере одного пептида IRS выбран из остатка 498 и 570, где номера в последовательности соответствуют IRS-1 крысы, как отражено в SEQ ID NO:16, или соответствующего сайта PKC-ζ-Ser-фосфорилирования млекопитающего, предпочтительно человека или грызуна, и
b) измерения степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования предполагаемого агониста, в котором увеличение степени фосфорилирования сайта PKC-ζ-Ser-фосфорилирования агониста по сравнению с фосфорилированием сайта PKC-ζ-Ser-фосфорилирования пептида IRS служит признаком агонистических свойств предполагаемого агониста.
| Lingamanaidu V | |||
| Ravichandran et al, "Protein Kinase C-ζ Phosphorylates Insulin Receptor Substrate-1 and Impairs Its Ability to Activate Phosphatidylinositol 3-Kinase in Response to Insulin." J.Biol | |||
| Chem., Vol.276, Issue 5, 3543-3549, February 2, 2001 | |||
| SUN Gang, Phillip J.ROBINSON "Inhibition of protein kinases A and G by hydralazine but not |
Авторы
Даты
2008-12-10—Публикация
2004-07-16—Подача