Настоящая заявка испрашивает приоритет временной заявки на патент США № 61/262790, поданной 19 ноября 2009 г, которая полностью включена в настоящее описание путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к пептидам, обладающим биологической и терапевтической активностью. В частности, изобретение относится к коротким пептидам, которые защищают против вызванного мутагенами токсического действия на клетки/ткани. Например, пептиды по изобретению защищают против токсического действия на кожу, которое происходит после воздействия УФ света. Одна функция пептидов по изобретению заключается в блокировании фосфорилирования и поэтому активации определенных регуляторных белков клеточного цикла. Изобретение, кроме того, относится к способам применения пептидов по изобретению для снижения уровня токсического действия на клетки/ткани после воздействия мутагенов (например, УФ света).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Когда на кератиноциты действуют повреждающие ДНК элементы (мутагены), такие как ультрафиолетовое (УФ) излучение, контрольные точки клеточного цикла активируются, посредством этого блокируя клеточное деление. Остановка клеточного цикла в фазе G2 после вызванного мутагеном повреждения обеспечивает предоставление времени для репарации ДНК. Однако если ключевой процесс прерывается или ингибируется, то снижается частота вызывающих канцерогенез явлений (например, мутаций ДНК). Это было продемонстрировано in vitro и in vivo посредством нанесения кофеина на кожу перед и после УФ облучения (Lu et al., 2008, Cancer Res. 68:2523-2529; Heffernan et al, 2009, J. Invest. Dermatol. 129:1805-1815). Основой данного феномена является то, что кофеин ингибирует митотический путь контрольной точки, обеспечивая клеткам с поврежденной ДНК возможность приступить к митозу и погибнуть вследствие апоптоза, поскольку их ДНК неспособна к удовлетворительной репликации. Обеспечение возможности продолжения клеточного цикла, несмотря на мутацию/повреждение ДНК, и апоптозная гибель клеток, которая в результате происходит, предотвращает фиксацию вызванных мутагенами мутаций в пораженной ткани. Данный процесс посредством этого уменьшает число генетически измененных клеток, которые иначе могли бы развиться в конкрозные поражения, такие как карцинома.
Способность кофеина снижать канцерогенные эффекты УФ света на кожу вызвали интерес к использованию данного средства при терапевтических и косметических видах применения для ухода за кожей. Однако использование кофеина в продуктах для ухода за кожей проблематично с учетом отсутствия его специфичности. Кроме его оздоровительных эффектов, кофеин может вызвать нежелательные воздействия на кожу (например, расширение сосудов, сухость и т.д.). С учетом указанных недостатков, был предпринят поиск других подходов для предотвращения повреждающих эффектов мутагенов на кожу и связанных с ней тканей.
Использование коротких пептидов для разработки продуктов для ухода за кожей очень популярно вследствие их структуры на основе естественных аминокислот, специфичности, отсутствия токсичности и отсутствия побочных эффектов. Указанные качества делают пептиды подходящим исходным пунктом для разработки новых химиопревентивных средств для добавления к композициям для ухода за кожей. В настоящей патентной заявке описаны пептиды, обладающие хемопревентивными и химиотерапевтическими свойствами, могут применяться для защиты кожи от повреждающих эффектов солнечного света.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Вариант осуществления настоящего изобретения направлен на способ снижения активности киназы контрольной точки клеточного цикла. Такой способ может включать воздействие на киназу контрольной точки пептида, который имеет длину от пяти до девяти аминокислотных остатков и содержит SEQ ID NO:13. Киназа контрольной точки клеточного цикла в данном и других вариантах осуществления может находиться в активированном состоянии. Примеры пептидов, которые могут применяться в данном или других способах, описанных в настоящей патентной заявке, включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Другими примерами пептидов, которые могут использоваться в способах, описанных в настоящей патентной заявке, являются те, которые имеют гистидиновый остаток, непосредственно прилегающий к последовательности SEQ ID NO:13. Другие пептиды могут быть амидированы на их карбокси-конце. Определенными примерами таких амидированных пептидов являются те, которые включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Киназы контрольных точек, являющиеся мишенями описанных способов, могут включать или состоять из киназы-1 контрольной точки (Chkl) или киназы-2 контрольной точки (Chk2). Киназа контрольной точки может активироваться в результате повреждения ДНК в клетке. Такое повреждение ДНК может быть причинено мутагенным агентом. Примерами мутагенных агентов являются те, которые способны вызвать повреждение ДНК в коже (например, ультрафиолетовое излучение). Описанные способы могут также включать воздействие на фосфатазу cdc25 (цикла 25 клеточного деления) пептидом, описанным в настоящей патентной заявке; cdc25c является примером cdc25c, которая может быть мишенью в настоящем изобретении.
Другой вариант осуществления настоящего изобретения направлен на способ лечения кожи млекопитающего. Такой способ может включать снижение активности киназы контрольной точки клеточного цикла (например, Chk2) в коже путем воздействия на киназу контрольной точки описанным пептидом. Другой вариант осуществления настоящего изобретения направлен на лечение кожи млекопитающего нанесением описанного пептида на кожу.
Другой вариант осуществления настоящего изобретения направлен на пептид, который имеет длину от пяти до девяти аминокислотных остатков и включает SEQ ID NO:13. Примеры такого пептида включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10. Другие примеры пептидов по изобретению имеют гистидиновый остаток, который непосредственно примыкает к последовательности SEQ ID NO:13. Другие пептиды могут быть амидированы на их карбокси-конце. Определенными примерами таких амидированных пептидов являются те, которые включают или состоят из SEQ ID NO:2, 3, 5, 6, 8 или 10.
Другой вариант осуществления настоящего изобретения направлен на композицию, включающую пептид по настоящему изобретению, и фармацевтически приемлемый носитель. Композиция может быть представлена в форме аэрозоля, эмульсии, жидкости, лосьона, крема, пасты, мази, порошка или пены.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показаны аминокислотные последовательности определенных пептидов по изобретению (SEQ ID NO:l-10) при их совмещении друг с другом и SEQ ID NO:l1 (человеческой тирозиназой). Подчеркнутые остатки в определенных пептидах (SEQ ID NO:l-7) составляют консервативные аминокислотные замещения в отношении SEQ ID NO:11.
На фиг. 2 показано ингибирование активности киназы-2 контрольной точки (Chk2) стауроспорином или определенными пептидами по изобретению. Контрольная активность Chk2 показана первым столбиком. Пептиды, показанные на чертеже (SEQ ID NO:2-6 и 8-10) являются амидированными на корбокси-конце (-CON2).
На фиг. 3 показана аминокислотная последовательность человеческой Chk2 (SEQ ID NO:17). Эта последовательность такая же как последовательность, описанная на сетевом сайте Национального Центра Биотехнологической Информации США (NCBI) (или в Генном Банке) под номером доступа AAH04207.
На фиг. 4 показана аминокислотная последовательность человеческой Chkl (SEQ ID NO:18). Эта последовательность такая же, как последовательность, описанная на сетевом сайте NCBI (или в Генном Банке) под номером доступа AAC51736.
На фиг. 5 показана аминокислотная последовательность человеческой cdc25c (SEQ ID NO: 19). Эта последовательность такая же как последовательность, описанная на сетевом сайте NCBI (или в Генном Банке) под номером доступа AAR32098.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Пептиды по изобретению (например, те, которые перечислены в таблице 1 и на фиг. 1) могут включать энантиомеры L- или D-аминокислот, или содержащие остатки одной энантиомерной формы, или комбинацию обеих форм. Пептиды могут, кроме того, наращиваться или модифицироваться, как описано в следующих не ограничивающих примерах, только до тех пор, пока их первичные аминокислотные последовательности остаются не измененными; таким образом, пептиды состоят из определенной аминокислотной последовательности, но могут включать определенные модификации. Карбокси-конец пептидов может быть кислотным (-COOH) или амидированным (например, -CONH2, -CONHR или -CONR2). Амидирование карбокси-конца может придать пептидам по изобретению меньшую восприимчивость к разрушению протеазами и увеличить их растворимость, по сравнению с их формами свободных кислот, обеспечивая поэтому повышенную терапевтическую активность. Пептиды могут также быть липидированными, что может обеспечить усиленное проникновение через кожу. Одна или более молекулярных связей, которые соединяют аминокислоты каждого пептида, могут представлять собой не пептидную связь. Такие не пептидные связи включают без ограничения имидо, эфиргидразиновые, семикарбазидные и азо связи.
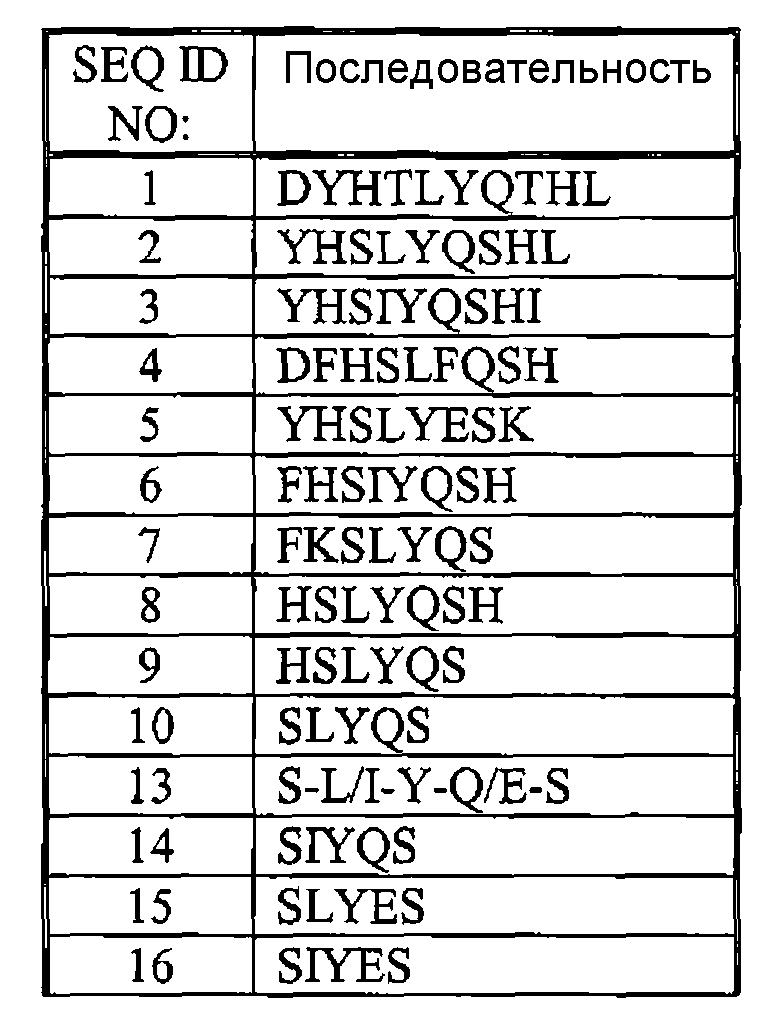
Разнообразные модификации могут быть внесены в пептиды по изобретению, пока сохраняются их первичные аминокислотные последовательности. Некоторые модификации могут использоваться для увеличения активности пептида, хотя другие модификации могут облегчать манипулирование пептидом. Функциональные группы пептидов, которые могут типично модифицироваться, включают гидроксильные, амино-, гуанидиновые, карбоксильные и амидные группы. Типичные, не ограничивающие реакции этих групп включают следующие: ацетилирование гидроксильных групп алкилгалидами; этерификацию, амидирование или гидрогенизацию (т.е., восстановление в спирт) карбоксильных групп; деамидирование, ацилирование, арилирование аминогрупп (например, первичной аминогруппы пептида или аминогруппы лизиновых остатков). SEQ ID NO:l-10 и/или 13, например, может быть амидирована на корбокси-конце (-CONH2).
Несмотря на приведенное выше обсуждение, пептиды по изобретению могут быть сконструированы с введением определенных аминокислотных изменений в одно или более положений аминокислотных остатков. Например, один, два или три остатка заменяются на сохраненный остаток или остатки. Стратегии сохранения аминокислот хорошо известны в данной области, например, хорошо известно, что лизин, фенилаланин, изолейцин, треонин и глутамат могут замещаться соответственно гистидином, тирозином, лейцином, серином и глутамином без значимого воздействия на структуру и функцию первоначального пептида. Необязательно, пептид по изобретению может иметь на одну аминокислоту меньше, по сравнению с любой из SEQ ID NO:l-10 или 13; или иметь на две аминокислоты меньше (прилегающих или не прилегающих). Вариантные формы пептида по изобретению должны быть, по меньшей мере, на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичны любой из SEQ ID NO:l-10 или 13. Вариантные формы пептидов по изобретению должны иметь, по меньшей мере, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90% или 95% активности или функции, которыми обладает любая из SEQ ID NO:l-10 или 13.
Примерами активности или функции, которыми обладают SEQ ID NO:l-10 и 13, являются хемопревентивное действие против онкологических заболеваний (например, карциномы, саркомы, меланомы, рака кожи), предотвращающее развитие предраковой клеточной популяции в ткани (например, коже), подвергнутой воздействию мутагенного/канцерогенного агента (например УФ излучения), блокирование остановки клеточного цикла и репарацию ДНК после воздействия на клетку (например, клетку кожи, кератиноцит, меланоцит или фибробласт) мутагенного/канцерогенного агента (например УФ излучения), блокирование активации cdc25c путем репарации повреждения ДНК, таким как путь, регулируемый через киназу контрольной точки (например, киназу-2 контрольной точки [Chk2]), блокирование и снижение токсичности (например в коже), связанной или вызванной воздействием мутагена/канцерогена (например, УФ излучения), блокирование или уменьшение негативных воздействий мутагена/канцерогена на характеристики здоровой кожи (например, тонус, эластичность, гидратацию, окрашивание, плотность, гладкость). Хемопревенция (хемопрофилактика) может относиться к применению агентов, таких как пептиды по изобретению, для снижения риска или задержки развития или рецидива неоплазии (например, злокачественных заболеваний, предраковых поражений, доброкачественных поражений в виде разрастания ткани). Токсическое действие на кожу, вызванное мутагенным агентом или любым другим агентом (например, химиотерапевтическим средством, раздражающим агентом), может проявляться в форме эритемы, алопеции (потери волос), фоточувствительности (повышенной чувствительности к солнечному свету), анамнестических реакций (например, воздействия химиотерапии на участок, ранее подвергнутый воздействию облучению), угревых (подобных пустулам) сыпей, некроза кожи, нейтрофильного эккринного гидраденита, эккринной плоскоклеточной метаплазии, гиперпигментации, изменений ногтей, мукозита, склеротических дермальных реакций, сосудистого повреждения, ксероза, отека (набухания), сыпи, старения кожи (например, истончения, сниженной эластичности, сморщивания, свисания, увеличенной пигментации (например, веснушчатость, солнечное лентиго, капельный гипомеланоз), телангиэктазий, ангиомы, пурпуры, солнечных угрей, коллоидной дегенерации кожи, себоррейных кератозов, образования пузырей, дерматита, вегетирующих/разрастающихся узелков (приподнятых над уровнем кожи плотных объемных образований), экссудативных бляшек, вегетирующей или некротической язвы с пустулами, рубцевания, панникулита, изъязвления, боли и/или ожогов. Под терминами «уменьшение», «ингибирование», «блокирование» или «предотвращение», используемыми в настоящем описании, подразумевается, что пептид по изобретению снижает частоту, тяжесть, величину, частоту осложнений или связанных симптомов состояния, по меньшей мере, на 7,5%, 10%, 12,5%, 15%, 17,5%, 20%, 22,5%, 25%, 27,5%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 90% или 100%, по сравнению с тем, как состояние обычно протекало без применения пептида или композиции, содержащей пептид.
Хотя пептид по изобретению может быть получен без добавления других последовательностей, существует вариант включения последовательностей по изобретению внутрь более крупной последовательности. Например, пептид по изобретению может иметь дополнительные аминокислотные остатки, добавленные к любому из или обоим его N- и C-концам. Примером мог бы быть маркерный эпитоп, такой как Flag, который обычно используется для прослеживания белков; маркерные эпитопы, хорошо известные в данной области, включают, например, myc, His, HA (гемагглютинин). Таким образом, настоящее изобретение охватывает пептиды, которые или состоят из или содержат пептиды по изобретению. Хотя пептиды по изобретению могут быть предоставлены внутри более крупной последовательности (т.е., содержаться внутри нее), комбинация последовательности пептида по изобретению с дополнительной последовательностью (последовательностями) не должна составлять какой-либо белок или пептидную последовательность, которая естественно экспрессирована клеткой животного (например, клеткой человека). Когда формулировка, используемая в настоящей патентной заявке для описания, что пептид «состоит» из последовательности, то такой пептид, хотя и ограничивается определенной прилегающей аминокислотной последовательностью, может включать (т.е., быть конъюгирован) не аминокислотные части или другие пептиды/белки (такие пептиды/белки будут конъюгированы с пептидом по изобретению через не пептидную связь).
Пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8 или 9 смежных аминокислот и включать или состоять из SEQ ID NO:13 (S-L/I-Y-Q E-S). Не ограничивающими примерами таких пептидов являются SEQ ID NO:2, 3 и 5-10. Другими не ограничивающими примерами таких пептидов являются фрагменты SEQ ID NO:2, 3 и 5-8, которые содержат SEQ ID NO:13. Исходя из формулы SEQ ID NO:13, другие пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8, или 9 смежных аминокислот и включать или состоять из SEQ ID NO:14 (S-I-Y-Q-S), SEQ ID NO:15 (S-L-Y-E-S) или SEQ ID NO:16 (S-I-Y-E-S). Другие пептиды по настоящему изобретению могут содержать SEQ ID NO:13, где гистидиновый остаток непосредственно примыкает к последовательности SEQ ID NO:13; примерами таких пептидов являются SEQ ID NO:2, 3, 5, 6, 8 и 9. Все короткие пептиды, содержащие SEQ ID NO:13, связаны друг с другом на структурном уровне с учетом структурного/химического сходства между лейцином и изолейцином (т.е., положением 2 SEQ ID NO:13) и между глутамином и глутаматом (т.е., положением 4 SEQ ID NO:13). Другие аминокислоты, кроме лейцина и изолейцина, могут занимать положение 2 SEQ ID NO:13, такие как аланин, валин, глицин или метионин. Другие аминокислоты, кроме глутамина и глутамата, могут занимать положение 4 SEQ ID NO:13, такие как аспарагин, аспартат, аргинин или лизин.
Альтернативно, пептиды по настоящему изобретению могут иметь длину 5, 6, 7, 8 или 9 смежных аминокислот и содержать или состоять из SEQ ID NO:10 (S-L-Y-Q-S). Не ограничивающими примерами таких пептидов являются SEQ ID NO:2 и 7-9. Другими не ограничивающими примерами таких пептидов являются фрагменты SEQ ID NO:2, 7 и 8, которые содержат SEQ ID NO: 10. Другие пептиды по настоящему изобретению могут содержать SEQ ID NO:10, где гистидиновый остаток (H) непосредственно примыкает к последовательности SEQ ID NO:10; примерами таких пептидов являются SEQ ID NO:2, 8 и 9.
Все варианты осуществления пептидов по изобретению могут быть в «изолированном» состоянии. Например, «изолированный» пептид представляет собой пептид, который был полностью или частично очищен. В некоторых случаях, изолированный пептид является частью большей композиции, буферной системы или смеси реагентов. В других обстоятельствах, изолированный пептид может представлять собой очищенную t гомогенность. Композиция может включать пептид на уровне, по меньшей мере, примерно 50, 80, 90, или 95% (на молярной основе) всех других макромолекулярных видов, которые также присутствуют в ней. Пептиды по изобретению могут содержать гетерологичные комбинации компонентов. При осуществлении изобретения могут использоваться смеси пептидов по изобретению.
Пептиды по изобретению могут быть при необходимости конъюгированы с молекулами растворимого или нерастворимого носителя для модификации их свойств растворимости и для увеличения локальной концентрации пептидов в тканях-мишенях. Примеры молекул растворимых носителей включают полимеры полиэтиленгликоля (PEG) и поливинилпирролидона; примеры нерастворимых полимеров включают силикаты, полистирол и целлюлозу. Пептиды могут также быть микроинкапсулированы для увеличения их растворимости во время и после терапевтического применения; обычно, для инкапсулирования и стабилизации пептидов используются полиэфир и микросферы PEG.
Могут использоваться различные способы получения микросфер для инкапсулирования пептидов, в зависимости от гидрофильной или гидрофобной природы пептидной композиции, подлежащей инкапсулированию. Примеры последовательностей операций для таких способов можно найти в публикации Wang et al. (J Control. Release 17:23, 1991) и патенте США № 4324683, которые полностью включены в настоящую патентную заявку путем ссылки. Исследования высвобождения пептидов in vitro могут выполняться для определения относительной доступности пептида после включения в микросферу. Микросферы (200 мг) суспендируют в 2,5 мл забуференного фосфатом солевого раствора (PBS, pH 7,2) и перемешивают при 37°C и 100 об/мин в шейкере инкубаторного типа, используемом для экологического контроля (G-24, New Brunswick Scientific Co., Edison, N.J.). В определенные точки времени взятия проб (ежедневно в течение первых 4 дней и через день в последующем) буферный раствор полностью удаляют и замещают свежим PBS. Содержание пептида в PBS измеряют, используя способ Bradford или другой подходящий количественный анализ, обычно используемый для белкового анализа.
Следующие процедуры и параметры представлены только в целях рекомендаций, и они все хорошо известны специалистам в данной области. Все описанные пептиды могут быть синтезированы с использованием стандартной твердофазной химии синтеза пептидов с использованием Fmoc (9-фторенилметоксикарбонила) на пептидном синтезаторе Advanced ChemTech Apex 396 Multiple Peptide Synthesizer. Синтезатор Apex 396 оборудован реакционным блоком 40-луночного формата для получения до 40 пептидов одновременно в масштабе 0,15 ммоль. Пептиды могут быть получены в амидированной форме или в форме свободной кислоты с использованием стандартных аминокислот. Смолу сначала промывают и предварительно вызывают ее разбухание N,N-диметилформамидом (DMF). Для амидных смол Ринка, время набухания составляет один час. Защитную группу Fmoc удаляют 25% пиперидином в DMF (диметилформамиде) в течение 25 минут, после чего пиперидин полностью вымывается из смолы. Для регулирования процессов рацемизации, Fmoc аминокислотные мономеры предварительно активируют в эквимолярном растворе l-гидрокси-7-аза-бензотриазола (HOAt) в 0,5 M DMF. Амидные соединения получают с использованием 0-(7-азабензотриазол-l-ил)-1,1,3,3-тетраметилурония гексафторфосфата (HATU) PyBop® или 2-(lH-бензотриазол-l-ил-)-1,1,3,3-тетраметилурония гексафторфосфата (HBTU) в качестве активирующего агента и 2,5-5,0-кратного молярного избытка аминокислоты в основных условиях с использованием защищенного основания (диизопропилэтиламина). Время соединения составляет 1-1,5 часа с последующим промыванием и повторным соединением для осуществления двойного или тройного соединения перед снятием защиты и продолжением растущей пептидной цепи. Эффективность соединения контролируется с использованием стандартного теста Кайзера. После завершения пептидного синтеза на смоле, конечную Fmoc группу удаляют, как указано выше, и последовательности оставляют в форме свободного основания.
Расщепление кислотно-лабильной связи пептида со смолой осуществляют с использованием 95% трифторуксусной кислоты (TFA) и воды с добавлением соответствующего акцептора. После предоставления возможности расщеплению продолжаться в течение периода от примерно 30 минут до одного часа, высвободившиеся пептиды немедленно удаляют из блока расщепления и переносят в пробирки для удаления TFA под пониженным давлением. Затем пептиды готовы для очистки и анализа с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием колонки C18 с обращенной фазой и масс спектрометрии. Подтверждение первичной последовательности и препаративную очистку осуществляют с использованием системы LC/MS/MS (жидкостной хроматографии/масс спектрометрии/масс спектрометрии) (ABI API2000).
Обычно, в соответствии с приведенным выше протоколом, пептиды могут быть получены с использованием любого способа, известного специалистам в данной области, такого как способы, описанные в публикациях Merrifield (J Am Chem Soc. 85:2149, 1963); Carpino et al. (J Org Chem. 51:3732, 1986); Merrifield et al. (Anal Chem. 38:1905, 1966); или Kent et al. [High Yield Chemical Synthesis Of Biologically Active Peptides On An Automated Peptide Synthesizer Of Novel Design, EN: PEPTIDES 1984 (Ragnarsson, ed.) Almqvist and Wiksell Int., Stockholm (Sweden), pp. 185-188], которые все полностью включены в настоящую патентную заявку путем ссылки. Пептиды могут быть получены устройством, способным последовательно добавлять аминокислоты у растущей пептидной цепи. Однако пептиды могут быть также получены с использованием стандартной методологии фаз раствора, которая может использоваться для достижения крупномасштабного производства.
Дополнительные варианты осуществления настоящего изобретения направлены на способы применения описанных выше пептидов, такие как в препаративных формах или в качестве терапевтических средств. Эти способы могут включать применение одного пептида или множества пептидов в комбинации (т.е., смеси).
В определенных случаях, композиция по изобретению может располагаться внутри устройства, помещенного на кожу или под кожу. Такие устройства включают трансдермальные системы, имплантаты и инъекционные растворы, которые высвобождают вещества таким образом, чтобы они контактировали с кожей или волосяным фолликулом или пассивными, или активными механизмами высвобождения. Вещество может наноситься, например, местно на эпидермис через равномерные интервалы, например, один или два раза в день, в подходящем носителе в эффективной концентрации. Одна или более инъекций в кожу является другим путем введения пептидов по изобретению в кожу или любую другую ткань.
Композиции, используемые для доставки пептидов в способах, описанных в настоящей патентной заявке, могут быть представлены в форме аэрозоля, эмульсии, жидкости, лосьона, крема, пасты, мази, порошка, пены или другой фармацевтически приемлемой препартивной формы. Кроме того, пептиды могут доставляться с использованием менее сложных препаративных форм, таких как деионизированная/дистиллированная вода, PBS или стандартные медицинские солевые растворы. В целом, фармацевтически приемлемая препаративная форма включает любой носитель, подходящий для нанесения на кожу человека или слизистую оболочку. Такие фармацевтически приемлемые носители включают этанол, диметилсульфоксид, глицерол, диоксид кремния, крахмал и эквивалентные носители разбавители. Препаративная форма может необязательно иметь косметическую привлекательность и/или содержать другие агенты, такие как ретиноиды или другие пептиды, которые могут действовать в качестве адъювантов для терапевтического действия пептидов по изобретению. Антибиотики могут также добавляться к препаративной форме для отражения инфекции, посредством этого, максимального обеспечения возможности протекания процессов заживления. Концентрация пептида в композиции может составлять от примерно 0,1 мкг/мл до примерно 50 мкг/мл от примерно 0,1 мкг/мл до примерно 20 мкг/мл; однако окончательная используемая концентрация может варьироваться за указанные диапазоны, в зависимости от природы ткани-мишени, биологической активности пептида по изобретению и применения любого адъюванта или методики получения усиленного всасывания композиции. Такие определения находятся в пределах обычной практики в данной области. Например, концентрация пептида (пептидов), используемых при осуществлении настоящего изобретения, может составлять примерно 0,1, 1, 2, 5, 10, 15, 20, 25, 50, 75, 100, 200, 500 или 1000 мкг/мл.
Введение пептидов по изобретению и связанных композиций может осуществляться людям и животным, включая всех млекопитающих (например, свиней, коров, лошадей, овец, коз, мышей, крыс, кошек, собак, хорьков, приматов). Нанесение может также осуществляться в комбинации с типичными и/или экспериментальными материалами, такими как тканевые трансплантаты, продукты культуры ткани, кислород и перевязочные материалы. В целом, композиция может вводиться местно, перорально, трансдермально, системно или любым другим известным специалистам в данной области способом, который может использоваться для доставки пептидов по изобретению в ткань-мишень. Композиции могут также применяться в режиме in vitro или ex vivo, например, внесением или в клетки, или в трансплантаты пациента, растущие в культуре.
Ввиду их небольшого размера, ожидается, что пептиды способны самостоятельно увеличивать уровень проницаемости через кожу; однако определенные методики могут использоваться для усиления этого движения. Например, к пептидам могут добавляться липофильные (неполярные) группы или пептиды могут доставляться к коже в липофильном эксципиенте для усиления достижения пептидом рогового слоя для обеспечения возможности перемещения в нижние эпидермальные слои. Таким образом, такие липофильные модификации могут считаться имеющими пролекарственный эффект. Усилители проникновения, такие как известные растворители и поверхностно-активные вещества, могут использоваться в эксципиенте для обеспечения возможности лучшего всасывания пептида. Специальные методики, которые предусмотрены как используемые при усилении доступа пептида к являющейся мишенью ткани/повреждению, включают схемы инъекций, ионтофорез, электрофорез и ультразвук. Ионтофоретическое устройство состоит из двух электродов, погруженных в раствор электролита, и помещенных на кожу. Когда электрический ток подается через электроды, то через роговой слой создается электрическое поле, которое стимулирует доставку пептидов. Электропорация включает подачу высоковольтных электрических импульсов для увеличения проникновения через липидные бислои. Это отличается от ионтофореза по длительности и интенсивности подачи электрического тока (в ионтофорезе используется относительно постоянное низковольтное электрическое поле). Считается, что высоковольтный электрический импульс электропорации вызывает обратимое образование гидрофильных пор в липидных пластинчатых мембранах, которые могут обеспечить высокую степень усиления проникновения. Ультразвук подает на кожу звуковые волны, имеющие частоту более чем 16 кГц, что вызывает сжатие и расширение ткани, через которую проходят звуковые волны. Получаемые в результате изменения давления вызывают ряд процессов (например, кавитацию, смешивание, увеличение температуры), которые могут усилить проникновение пептидов.
Настоящее изобретение может включать один или более ингибиторов протеазы. Ингибитор протеазы может быть выбран для специфического нацеливания на протеазы, которые, как ожидается, разрушают выбранный биоактивный пептид; такой выбор может быть определен на основании длины и/или последовательности биоактивного пептида. Однако ингибиторы протеазы необязательно должны выбираться каким-то определенным образом; например, в настоящем изобретении может использоваться смесь ингибиторов протеазы, которая содержит два или более ингибитора. В определенных вариантах осуществления изобретения, ингибитор протеазы не представляет собой ингибитор, который специфичен для ингибирования вируса. В изобретение могут быть включены следующие типы ингибиторов протеазы: ингибиторы серин-протеазы, ингибиторы цистеин-протеазы, ингибиторы аспартат-протеазы, ингибиторы металлопротеазы, ингибиторы тиол-протеазы и ингибиторы треонин-протеазы.
Ингибиторы протеазы хорошо известны в данной области. Не ограничивающие примеры ингибиторов протеаз, которые могут быть включены в настоящее изобретение, включают ацетил-пепстатин, AEBSF (4-[2-Аминоэтил]бензолсульфонилфторид) гидрохлорид, ALLM (N-Ацетил-Leu-Leu-Met), ALLN (N-Ацетил-Leu-Leu-Nle-CHO), амастатин (Streptomyces sp.), ε-амино-n-капроновую кислоту, ингибитор аминопептидазы N, α1-антихимотрипсин, антипаин (гидрохлорид или дигидрохлорид), α2-антиплазмин, антитромбин ΙII α1-антитрипсин, p-APMSF (4-Амидинфенил-метансульфонилфторид) гидрохлорид, апротинин (например, из бычьих легких), ATBI (пептид из 11 аминокислотных остатков), бензамидин гидрохлорид, бестатин, сложный метиловый эфир бестатина, калпастатин, калпептин, ингибитор карбоксипептидазы, ингибитор каспазы, ингибитор II катепсина B, ингибитор I катепсина G, ингибитор Π катепсина, ингибитор III катепсина, ингибитор I катепсина, ингибитор I катепсина K, ингибитор II катепсина K, ингибитор III катепсина K, ингибитор I катепсина L, ингибитор II катепсина L, ингибитор IV катепсина L, ингибитор V катепсина L, ингибитор VI катепсина L, ингибитор катепсина S, ингибитор катепсина/субтилизина, химостатин, ингибитор I химотрипсина, цистатин, 1,5-дансил-glu-gly-arg хлорметилкетон дигидрохлорид, 3,4-дихлоризокумарин, диизопропилфторфосфат, ингибитор дипептидилпептидазы II, ингибитор I дипептидилпептидазы IV, ингибитор Π дипептидилпептидазы IV, ингибитор протеазы E-64, экотин, динатрий дигидрат EDTA (этилендиаминтетрауксусной кислоты), тетранатриеввая соль EDTA, EGTA (этиленгликольтетрауксусная кислота), ингибитор I эластазы, ингибитор II эластазы, ингибитор III эластазы, эластатинал, 6-амидин-2-нафтил-4-гуанидинбензоат диметансульфонат, glu-gly-arg-хлорметилкетон, 2-гуанидинэтилмеркаптоянтарная кислота, гексадецилсульфонилфторид, α-йодацетамид, кининоген, лейгистин, лейпептингемисульфат, α2-макроглобулин, DL-2-меркаптометил-3-гуанидинэтилтиопропаноевая кислота, пепстатин A, фенилметилсульфонилфторид, динатриевая соль фосфорамидона, трифторацетат PPack II, дигидрохлорид PPack, ингибитор II пропилэндопеепидазы, Na-тосил-lys хлорметилкетон гидрохлорид, Na-тосил-phe хлорметилкетон, ингибитор II трипептидилпептидазы, ингибитор трипсина (из кукурузы или сои), D-val-phe-lys хлорметилкетон гидрохлорид, l,3-di-(N-карбоксибензоил-L-лейцил-L-лейцил)аминоацетон, o-фенантролин, урсоловая кислота (например, экстракт розмарина), транексамовая кислота (4-[аминометил]циклогексан-l-карбоновая кислота) (продаваемая в США для клинического применения в виде Циклокапрона, и в Азии в виде Трансамина), Fmoc-Lys(Boc), Fmoc-Arg(Pmc), бензоил-Arg-нитроанилид, бензоил-Arg-нафтиламид и α-2-макроглобулин.
Ингибитор протеазы, используемый в изобретении, может представлять собой пептид или белок, такой как фермент. Не ограничивающими примерами таких ингибиторов являются серпины, которые включают альфа-1-анитрипсин, ингибитор комплемента I, антитромбин, альфа-1-антихимотрипсин, ингибитор I активатора плазминогена и нейросерпин.
Компоненты, которые обычно включаются в препараты для ухода за кожей, хорошо известны в данной области. Кроме компонента в виде биоактивного пептида, компоненты по настоящему изобретению могут содержать другие активные агенты, такие как ниацинамид, фитантриол, фарнезол, бисаболол и салициловая кислота. Ожидается, что определенные дополнительные активные агенты будут действовать синергично с компонентом в виде биоактивного пептида или продлят срок хранения препаративной формы.
Когда предполагается контакт композиции с кожей животного или человека, то должны быть выбраны дополнительные компоненты, которые подходят для нанесения на кератинозную ткань (т.е., устойчивые, имеющие низкую токсичность и гипоаллергенные). В Руководстве по ингредиентам косметических средств CTFA (Ассоциации косметических, парфюмерных и ароматизирующих средств) Cosmetic Ingredient Handbook, второе издание (1992), которое полностью включено в настоящую патентную заявку путем ссылки, описано широкое разнообразие не ограничивающих косметических и фармацевтических ингредиентов, обычно используемых в промышленности, выпускающей средства для ухода за кожей, которые подходят для использования в композициях по настоящему изобретению. Примеры данных ингредиентов включают: абразивные вещества, абсорбенты, эстетические компоненты, такие как отдушки, пигменты, красящие агенты, эссенциальные масла, средства для снижения чувствительности кожи, вяжущие средства и т.д. (например, гвоздичное масло, ментол, камфору, эвкалиптовое масло, эвгенол, ментиллактат, дистиллят гамамелиса), средства против угревой сыпи (например, резорцин, серу, салициловую кислоту, бензоилпероксид, эритромицин, цинк), агенты против спекания, агенты против пенообразования, антимикробные средства (например, йодпропилбутилкарбамат), антиоксиданты, связывающие агенты, биологические добавки, забуферивающие агенты, наполнители, хелатирующие агенты, химические добавки, денатурирующие агенты, наружные анальгетики, полимеры (например, сополимерэйкозена и винилпирролидона), агенты, придающие материалу непрозрачность, регуляторы pH, пропелленты, восстанавливающие агенты, вещества, усиливающие секрецию, средства для отбеливания и осветления кожи (например, гидрохинон, койевая кислота, аскорбиновая кислота [витамин C], аскорбилфосфат магния, аскорбилглюкозамин), средства, нормализующие состояние кожи (например, увлажнители, включая смешанные и окклюзивные), средства для смягчения и/или заживления кожи (например, пантенол и его производные [например, этилпантенол], алоэ вера, пантотеновую кислоту и ее производные, аллантоин, бисаболол, динатрий глицирризинат), загустители, материалы в виде частиц, структурирующие агенты и витамины. Многие из указанных агентов подробно описаны В патенте США № 6492326, который полностью включен в настоящую патентную заявку путем ссылки, в частности, в отношении описаний различных ингредиентов.
Композиции по настоящему изобретению могут содержать материал в виде частиц, такой как оксид металлов. Данные материалы в виде частиц могут быть покрытыми или непокрытыми, заряженными или незаряженными. Не ограничивающие примеры материалов в виде частиц, которые могут использоваться для получения композиций по настоящему изобретению, включают оксихлорид висмута, оксид железа, слюду, слюду, обработанную сульфатом бария и Ti02, диоксид кремния, нейлон, полиэтилен, тальк, стирол, полипропилен, сополимер этилена/акриловой кислоты, серицит, оксид алюминия, силиконовая смола, сульфат бария, карбонат кальция, ацетат целлюлозы, диоксид титана, полиметилметакрилат и их смеси. Неорганические материалы в виде частиц, такие как Ti02, ZnO (оксид цинка) или Zr02 имеются в продаже из ряда источников. Материалы в виде частиц могут присутствовать в композиции на уровнях от 0,01% до 2% масс., или от 0,05% до 1,5% масс., или от 0,1% до 1% масс. (все показатели приблизительные).
Композиции по настоящему изобретению могут содержать кондиционирующий агент, выбранный из увлажнителей, смачивающих агентов или кондиционеров кожи. Могут использоваться различные из указанных материалов, и каждый из них может присутствовать на уровне примерно от 0,01% до 20%, или примерно от 0,1% до 10%, или примерно от 0,5% до 7% масс. композиции (все показатели приблизительные). Указанные материалы включают без ограничения гуанидин; мочевину; гликолевую кислоту и гликоляты (например, аммония и четвертичного алкиламмонния); салициловую кислоту; молочную кислоту и лактаты (например, аммония и четвертичного алкиламмония); алоэ вера в любой из его разнообразных форм (например, гель алоэ вера); полигидроксиспирты, такие как сорбит, маннит, ксилит, эритрит, глицерол, гексантриол, бутантриол, пропиленгликоль, бутиленгликоль и гексиленгликоль; полиэтиленгликоли; сахара (например, мелибиоза) и крахмалы; сахар и производные крахмала (например, алкоксилированная глюкоза, фруктоза, глюкозамин); гиалуроновую кислоту; лактамидмоноэтаноламин; ацетамидмоноэтаноламин; пантенол; аллантоин; вазелин и их смеси.
Композиции по настоящему изобретению могут содержать структурирующий агент, который может использоваться для получения эмульсии масла в воде. Без ограничения какой-либо теорией, считается, что структурирующий агент содействует обеспечению реологических характеристик композиции, которые вносят вклад в устойчивость композиции. Например, структурирующий агент имеет тенденцию содействовать образованию жидких кристаллических гелевых сетевых структур. Структурирующий агент может также функционировать в качестве эмульгатора или поверхностно-активного вещества. Композиции по настоящему изобретению могут содержать примерно от 0,1% до 20%, примерно от 0,1% до 10%, или примерно от 0,5% до 9% одного или более структурирующих агентов по массе композиции (все показатели приблизительные).
Структурирующие агенты, которые могут быть включены в композиции по настоящему изобретению, выбираются из стеариновой кислоты, пальмитиновой кислоты, стеарилового спирта, цетилового спирта, бегенилового спирта, простого полиэтиленгликолевого эфира стеарилового спирта, имеющего в среднем от примерно 1 до примерно 5 этиленоксидных звеньев, простого полиэтиленгликолевого эфира цетилового спирта, имеющего в среднем от примерно 1 до примерно этиленоксидных звеньев и их смесей. Другие структурирующие агенты, которые могут использоваться в настоящем изобретении, выбираются из стеарилового спирта, цетилового спирта, бегенилового спирта, простого полиэтиленгликолевого эфира стеарилового спирта, имеющего в среднем от примерно 2 этиленоксидных звена (стеарет-2), простой полиэтиленгликолевого эфира этилового спирта, имеющего в среднем примерно 2 этиленоксидных звена, и их смесей.
Дополнительные признаки, способы получения и применения пептидов по изобретению описаны, например, в патентах США №№ 6974799 и 5492894. Оба эти патента полностью включены в настоящую патентную заявку путем ссылки.
Способы
Настоящее изобретение может быть также отнесено к способу ингибирования или предотвращения неопластического роста в ткани млекопитающего введением пептидов, описанных в настоящей патентной заявке. Хотя это и не проходит по какому-либо конкретному механизму действия, антинеопластическая активность раскрытых пептидов связана со способностью ингибировать активность киназ контрольной точки клеточного цикла, таких как киназа-2 контрольной точки (Chk2). Ингибирование белков Chk, которые активируются после повреждения ДНК клетки, предотвращает вступление клеток в остановку клеточного цикла, и в течение этого времени происходит репарация ДНК. Хотя репарация ДНК может возвратить последовательности назад к их исходному состоянию (т.е, не мутированному), этого обычно недостаточно при больших генетических повреждений. При последней ситуации, процесс репарации часто фиксирует (делает постоянными) генетические изменения, которые могут способствовать онкогенным процессам (например, активации онкогена, инактивации опухолевого супрессора или «гена-контролера»). Путем блокировки или уменьшения остановки клеточного цикла посредством ингибирования активности белка Chk, клетки могут продолжить цикл деления с переходом в митотическую фазу, во время которой, вследствие разрушительных воздействий определенных явлений повреждения ДНК (например, двухнитевых разрывов ДНК) после процесса деления, вызывается апоптоз. Повреждение ДНК может также именоваться генотоксическим стрессом. Поэтому апоптоз устраняет клетки, несущие вредные генетические изменения; такие клетки потенциально выжили бы и служили в качестве предшественников неопластического развития, если остановке клеточного цикла предоставлена возможность полностью активироваться, посредством этого, обеспечивая возможность осуществления «репарации» ДНК. Таким образом, настоящее изобретение может использоваться для уменьшения накопления мутаций в ткани вследствие воздействий повреждающих ДНК агентов.
Неопластический рост, предотвращаемый, ингибируемый или излечиваемый пептидами по изобретению, может быть доброкачественным, предраковым или канкрозным (т.е. злокачественным). По этой причине, раскрытые пептиды могут считаться имеющими хемопревентивную, хемопрофилактичекую, противораковую, антинеопластическую, антиканцерогенную или химиотерапевтическую активность. В отношении предотвращения или ингибирования неопластического роста или поражения ткани, один или более пептидов могут вводиться в ткань, которая иначе не проявляет очевидных (макроскопических) признаков неоплазии. Например, пептиды могут вводиться в здоровую ткань перед возникновением мутагенного поражения (например, в пределах 1, 2, 3, 4, 8, 12, 16, 20, 24, 48, 72, 96 или 120 часов до поражения) (например, наноситься местно на кожу перед воздействием солнечного излучения) или вскоре после воздействия мутагенного поражения (например, в пределах 1, 2, 3, 4, 8, 12, 16, 20, 24, 48, 72, 96 или 120 часов после поражения) (например, наноситься местно на кожу после воздействия солнечного излучения). В отношении ухода за кожей, пептиды могут наноситься или в солнцезащитном средстве или в препарате, применяемые после воздействия солнечного излучения. Пептиды могут также применяться для предотвращения или ингибирования увеличения мутаций в ткани, или если она совершенно здорова, или содержит небольшие доброкачественные и/или предраковые поражения. Такое применение может предотвратить или ингибировать переход доброкачественного или предракового поражения в раковое/злокачественное поражение (т.е., предотвратить или ингибировать онкогенез), и могут, таким образом, применяться для лечения доброкачественных или предраковых поражений. В другом аспекте, настоящее изобретение может использоваться для предотвращения или ингибирования гиперплазии в коже или другой ткани.
Примерами доброкачественных и/или предраковых поражений кожи, возникновение которых может быть предотвращено или ингибировано, или подвергаться лечению, являются дермофибромы, эпидермальные кисты, гемангиомы, капиллярные гемангиомы, лимфангиомы, пиогенные гранулемы, паукообразные ангиомы (nevus araneus), келоиды, кератокантомы, липомы, невусы, диспластический невус, себоррейные кератозы, папилломы, гиперплазия сальных желез, псориас и актиновый кератоз (солнечный кератоз). Примерами злокачественных кожных поражений/опухолей кожи (т.е., рака кожи), возникновение которых может быть предотвращено или ингибировано пептидами по настоящему изобретению, или которые могут быть подвергнуты лечению, являются базальноклеточная карцинома (например, узловая базальноклеточная карцинома, кистозная базальноклеточная карцинома, рубцовая базальноклеточная карцинома, инфильтративная базальноклеточная карцинома, микроузловая базальноклеточная карцинома, поверхностная базальноклеточная карцинома, пигментированная базальноклеточная карцинома, некротизирующаяся базальноклеточная карцинома (язва Якоби), фиброэпителиома Пинкуса, полипоидная базальноклеточная карцинома, пороподобная базальноклеточная карцинома, аберрантная базальноклеточная карцинома, плоскоклеточная карцинома (например, аденоидная плоскоклеточная карцинома [псевдожелезистая плоскоклеточная карцинома], прозрачноклеточная плоскоклеточная карцинома, веретеноклеточная плоскоклеточная карцинома, перстневидноклеточная плоскоклеточная карцинома, базалоидная плоскоклеточная карцинома, бородавчатая карцинома, кератоакантома), меланома (например, злокачественная лентиго-меланома, поверхностно распространяющаяся меланома, акральная лентигинозная меланома, меланома слистых оболочек, узловая меланома, полипоидная меланома, десмопластическая меланома, амеланотическая меланома, меланома мягких тканей, увеальная меланома), выступающая дерматофибросаркома, карцинома из клеток Меркеля, саркома Капоши, кератоакантома, веретеноклеточные опухоли, карциномы сальных желез, микрокистозная аднексальная карцинома, атипичная фиброксантома, лейомиосаркома и ангиосаркома.
Соответственно, настоящее изобретение относится к предотвращению, ингибированию или лечению развития и/или прогрессирования новообразований кожи, при которых пораженная клетка (т.е., тип клеток, из которых развивается новообразование) представляет собой эпителиальную клетку, мезенхимальную клетку, кератиноцит, фибробласт, меланоцит, стволовая клетка кожи или клетка-предшественник кожи. Ткани кожи, являющиеся мишенью пептидов по настоящему изобретению, представляют собой эпидермис, который содержит слой stratum basale (основной слой), stratum spiNOum (шиповидноклеточный слой), stratum granulosum (гранулезный слой), stratum licidum (блестящий слой) и stratum corneum (ороговевающий слой); дерму, которая содержит папиллярный и ретикулярный слои; и подкожная ткань, которая содержит жировую ткань, нервную ткань и кровеносные сосуды. Все указанные выше ткани, слои и клеточные типы являются мишенями пептидов по настоящему изобретению.
Другими примерами доброкачественных и/или предраковых неопластических поражений или профилей роста, возникновение которых предотвращаются или ингибируются пептидами по настоящему изобретению, или которые можно лечить ими, являются гиперплазия, дисплазия и метаплазия. Другими примерами канкрозных неопластических поражений, которые предотвращаются, ингибируются или лечатся пептидами по настоящему изобретению, являются рак легких, рак костей, рак поджелудочной железы, желудка, головы и шеи, рак матки, к яичников, гинекологический рак, рак прямой кишки, рак желудка, рак ободочной кишки, рак молочных желез, рак матки, карцинома фаллопиевых труб, рак эндометрия, рак шейки матки, рак влагалища, рак вульвы, болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак ободочной кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркома мягкой ткани, рак уретры, рак пениса, рак предстательной железы, хронический или острый лейкоз, лимфоцитарные лимфомы, рак мочевого пузыря, рак почек и мочеточников, почечноклеточная карцинома, карцинома почечной лоханки, новообразования центральной нервной системы (ЦНС), первичная лимфома ЦНС, опухоли спинальной оси, рак мозга, аденома гипофиза, гемангиома, глиома или бластома.
Настоящее изобретение может быть осуществлено в виде косметического средства или при косметической обработке кожи. Соответственно, настоящее изобретение относится к действию для поддержание нормальных, здоровых признаков кожи, таких как тонус, эластичность, гидратация, окрашивание, плотность и гладкость. Все эти качества могут деградировать с увеличением количества поврежденных клеток в коже, таких как поврежденные клетки в результате воздействий мутагенов и/или накопления мутаций в коже. Соответственно, пептиды по настоящему изобретению могут использоваться для предотвращения, ингибирования или лечения воздействий старения кожи; одним примером является фотостарение, при котором кожа стареет частично в зависимости от степени подверженности воздействию УФ излучения. Эффекты фотостарения, являющиеся мишенями пептидов по изобретению, включают, например, морщины, пятнистое поражение кожи и/или гиперпигментацию, грубую или жесткую кожу, опущение/свисание, пожелтение, сухость и различные новообразования.
Ткани, которые могут являться мишенями при осуществлении настоящего изобретения, представляют собой кожу и связанные ткани слизистых оболочек кожи. Связанная ткань слизистой оболочки кожи представляет собой любую ткань, организованную подобным коже образом, содержит эпителиальные клетки, и в которую непосредственно переходит кожа. Примерами таких тканей являются ротовая, носоглоточная, ушная и мочеполовая поверхности, а также конъюнктива глазных век. Другие ткани, которые могут являться мишенями при осуществлении настоящего изобретения, представляют собой те, которые происходят из эктодермы, мезодермы и эндодермы, или содержат эпителиальные клетки, мезенхимальные клетки (например, фибробласты), мышечные клетки или нервные клетки (например, нейроны). Другие органы, системы органов и ткани, являющиеся мишенями пептидов по настоящему изобретению, представляют собой, например, систему кровообращения (например, сердце, кровь, кровеносные сосуды), пищеварительная система (например, слюнные железы, пищевод, желудок, печень, желчный пузырь, поджелудочную железу, тонкий и толстый кишечник, прямую кишку), эндокринную систему (например, гипоталамус, гипофиз, шишковидную железу, щитовидную железу, паращитовидную железу, надпочечники), покровную систему (например, кожу, волосы, ногти), лимфатическую систему (например, лимфатические узлы и сосуды), иммунную систему (например, небные миндалины, аденоиды, вилочковую железу, селезенку), мышечную систему (например, сердечную мышцу, гладкие мышцы, скелетные мышцы), нервную систему (например, головной мозг, спинной мозг, периферические нервы, нервы), репродуктивную систему (например, яичники, фаллопиевы трубы, матку, влагалище, молочные железы, семенники, семявыносящие протоки, семенные пузырьки, предстательную железу, пенис), дыхательную систему (например, глотку, гортань, трахею, бронхи, легкие, диафрагму), скелетную систему (например, кости, хрящ, связки, сухожилия), и выделительную систему (например, почки, мочеточники, мочевой пузырь, уретру).
Описанные пептиды при использовании в настоящем изобретении могут действовать для ограничения возникновения неоплазии (например, гиперплазии) путем снижения накопления мутаций в ткани в результате воздействия мутагенов эндогенного или эктопического (из окружающей среды) происхождения. Время воздействия мутагенов может быть или острым, или хроническим. В целом, настоящее изобретение может быть направлено на блокирование накопления мутаций в результате воздействия эктопического мутагена/канцерогена. Примерами эктопических мутагенов, обсужденных в настоящей патентной заявке (т.е., тех, которые происходят из внешней среды, окружающей животного) являются ультрафиолетовое (УФ) излучение (т.е., УФ свет) (УФ-A, УФ-B, УФ-C), ионизирующее излучение (например, рентгеновское излучение, гамма лучи, альфа частицы), аналоги оснований (например, 5-бромурацил), деаминирующие агенты (например, азотной кислоты [нитрит]), нитроамины, интеркалирующие агенты (например, этидийбромид, профлавин, дауномицин, доксорубицин [адриамицин], талидомид, дактиномицин, афлатоксины, акридин), алкилирующие агенты (например, этилнитромочевина), бром, нагревание, азид натрия, псорален, бензол, бензопирены, мышьяк, асбест, кадмий, хром, этиленоксид, никель, радон, винилхлорид, олово и вирусы. Примерами эндогенных мутагенов являются 5-метилцитозин, реактивные виды кислорода (например, оксид азота, супероксид) и транспозоны. Настоящее изобретение также направлено на блокирование накопления мутаций в ткани, которые могут возникать в результате применения определенных раздражающих агентов. Например, раздражающие агенты могут стимулировать состояния хронического воспаления, которое может привести к образованию злокачественного поражения в различных тканях.
При осуществлении настоящего изобретения с раскрытыми пептидами можно вводить другие хемопревентивные и/или противораковые средства. Такое введение может включать раскрытый пептид и другое хемопревентивное средство вместе в одной и той же композиции или включать схему, где пептид и средство применяются в различные точки времени во время схемы лечения/предотвращения. Применение и раскрытого пептида, и другого хемопревентивного средства может обеспечить синергическую хемопревентивную активность. Примерами хемопревентивных и/или противораковых средств, которые могут применяться в сочетании с пептидами по настоящему изобретению, являются фитохимические средства, кофеин, кофеиновая кислота, генистеин, ресвератрол, диалилсульфид, S-аллилцистеин, аллицин, ликопен, капсаицин, куркумин, 6-гингерол, эллагиновая кислота, урсоловая кислота, силимарин, анетол, катехины, эмодин, сульфорафан, эвгенол, изоэвгенол, бета-каротин, олеандарин, полифенолы, индолы (например, ди-индолилметан, индол-3-карбинол), изотиоцианаты (например, фенэтилизоцианат), нестероидные противовоспалительные средства (NSAEDS) (например, целекоксиб, ибупрофен, сулиндак, аспирин), агонист PPAR-гамма рецепторов (например, пиоглитазон, росиглитазон), резихимод, имихимод, ретиноиды (например, трансретиноевая кислота, 9-цис- или 13-цис-ретиноевая кислота, 4-гидроксиретинамид, бексаротен, тараротен, селен, соевые изофлавоны, статины (например, аторвастатин), серосодержащие антиоксиданты и аналоги витамина D (например, эргокальциферол, холекальциферол).
Одной целью причинения повреждения ДНК в раковых клетках с использованием определенных химиотерапевтических средств или других средств (например, гамма-излучения) является индукция апоптоза раковых клеток, посредством этого достигая обратного развития опухолей. Однако индукция остановки клеточного цикла в ответ на повреждение ДНК может подавить данный желательный исход. Поэтому, другим аспектом настоящего изобретения является использование раскрытых пептидов в комбинации с повреждающим ДНК агентом для лечения злокачественного поражения (например, рака кожи) или любого другого типа новообразования. Как обсуждается ниже, основой данного способа является способность раскрытых пептидов сенсибилизировать клетки с поврежденной ДНК к апоптозу (т.е., стимулировать клетки подвергаться апоптозу вместо остановки клеточного цикла, которая обеспечивает возможность выживания раковых клеток). Повреждающими ДНК агентами, которые могут использоваться при осуществлении настоящего изобретения, являются, например, алкилирующие агенты, цисплатин, карбоплатин, оксалиплатин, мехлортамин, циклофосфамид, хлорамбуцил, азотистые иприты, мехлорэтамин, ифосфамид, мелфалан, нитрозомочевина, стрептозоцин, кармустин (BCNU), ломустин, алкилсульфонаты, бусульфан, бендамустин, триазины, дакарбазин (DTIC), темозоломид, этиленимины, тиотепа, алтретамин, гексаметилмеламин, антиметаболиты, 6-меркаптопурин, дакарбазин, флударабин, 5-фторурацил (5-FU), капецитабин, метотрексат, гемцитабин, цитарабин, пеметрексед, арабинозилцитозин, децитабин, противоопухолевые антибиотики, антрациклины, даунорубицин, доксорубицин (например, Адриамицин®), эпирубицин, идарубицин, актиномицин-D, блеомицин, митомицин-C, неокарзиностатин, митоксантрон, ингибиторы топоизомеразы, ингибиторы топоизомеразы I, топотекан, иринотекан, ингибиторы топоизомеразы II, этопозид, тенипозид, растительные алкалоиды, таксаны, паклитаксел, доцетаксел, эпотилоны, иксабепилон, алкалоиды винки, винбластин, винкристин, винорелбин, эстрамустин, излучение, гамма лучи, рентгеновское излучение и УФ излучение. Один или более из этих агентов может наноситься на повреждение в комбинации с раскрытым пептидом или альтернативно, может быть использована схема, где пептид и повреждающий ДНК агент применяются в различные точки времени во время схемы лечения.
Один аспект настоящего изобретения представляет собой ингибирование активности киназы контрольной точки (Chk). Например, изобретение направлено на ингибирование Chk2 которая была активирована повреждением ДНК в клетке млекопитающего, такой как клетка кожи. Такое повреждение ДНК и/или активности Chk может быть, например, вызвано в клетке посредством воздействия УФ излучения или любого другого мутагена, присутствующего в окружающей среде. Повреждение ДНК, вызванное УФ светом, в целом включает димеры циклобутанпиримидин и продукты 6-4 пиримидин-пиримидона. Хотя и без сдерживания какой-либо конкретной теорией или механизмом, Chk ингибируется способностью раскрытых пептидов блокировать или подавляюще регулировать/подавляюще модулировать ее ингибирующую киназную активность в отношении cdc25 (25 цикла клеточного деления) фосфатаз, таких как cdc25c. В нормальных состояниях клеток (небольшое или отсутствующее повреждение ДНК), cdc25c запускает каскад сигналов, ведущих к митозу, но в условиях повреждения ДНК, активированная Chk ингибирует cdc25c. Поэтому, блокирование активности Chk увеличивает шансы того, что cdc25c будет способна передать сигналы для митоза, даже в условиях повреждения ДНК, которое обычно (т.е., когда Chk не ингибирована) подавляет cdc25c. Клеткам с поврежденной ДНК, которым предоставлена возможность вступить в митоз, позднее устраняются апоптозом, с учетом несовместимости повреждения ДНК с нормальными митотическими процессами. Соответственно, один аспект настоящего изобретения направлен на индукцию устранения клеток с поврежденной ДНК через апоптоз. Другой аспект настоящего изобретения направлен на ингибирование остановки клеточного цикла, который обычно происходит в ответ на повреждение ДНК.
Примерами ферментов Chk, нацеливаемых настоящим изобретением, являются Chkl и Chk2, которые оба хорошо известны в данной области. Эти серин/треонин-киназы структурно и функционально сохранны у эукариотических видов, человеческие варианты которых фосфорилируют человеческую фосфатазу cdc25c в положении серина-216 (или эквивалентного остатка серина, в зависимости от того, где нацеленная на Chk последовательность находится внутри варианта cdc25c [например, сплайсовый вариант]). Способ применения пептидов по изобретению для ингибирования опосредованного Chkl- и/или Chk2 фосфорилирования cdc25c (например, в положении серина-216 или эквивалентном остатке серина) является частью настоящего изобретения. Настоящее изобретение может быть нацелено на белки Chk, поскольку они естественно существуют в клетках in vivo.
Активированные ферменты Chk (такие, какими они существуют в ответ на повреждение ДНК) могут быть активированы фосфорилированием факторами выше по ходу транскрипции (например, ATM [мутированный белок атаксии телеангиэктазии], ATR [белок, связанный с ATM-RAD3]) в путях, улавливающих повреждение ДНК, или посредством аутофосфорилирования. Не активированные формы Chk могут иметь небольшую или отсутствующую активность киназы, по сравнению с активированными формами Chk. Например, активированные ферменты Chk могут фосфорилировать cdc25c. Пример участков фосфорилирования Chk2, которые могут активировать этот фермент, находятся в положениях остатков треонина-26, серина-50, треонина-68, треонина-383 и/или треонина-387 (или в их эквивалентных положениях внутри варианта Chk2 [например, сплайсовый вариант]). Пример участков фосфорилирования Chkl, которые могут активировать этот фермент, находятся в положениях остатков серина-286, серина-301, серина-317 и/или серина-345 (или в их эквивалентных положениях внутри варианта Chk2 [например, сплайсовый вариант]).
Chk2, которая кодируется геном CHEK2 у людей, имеет аминокислотную последовательность, показанную на фиг. 3 (SEQ ID NO:17). Человеческая Chk2 также известна в данной области как «гомолог контрольной точки CHK2 (S. pombe)», CDS1 и Rad53. SEQ ID NO:17 представлена только в целях ссылки, поскольку человеческая Chk2 и другие последовательности белка Chk2 млекопитающих известны. Например, на сайте в интернете Национального Центра Биотехнологической Информации США (NCBI) (или Генного Банка) раскрыты аминокислотные последовательности человеческой Chk2 под номерами доступа AAH04207, BAB17231, NP_009125, NP_001005735, NP_665861, 096017, AAS58460, AAD48504, AAC83693, EAW59757, EAW59756, EAW59754, CAX11959, CAX11958, CAX11957, CAX14028, CAX14027, CAX14026, CAH73823, CAH73875, AAV41895 и BAF83443, и все указанные последовательности полностью включены в настоящую патентную заявку путем ссылки. В целях практического осуществления настоящего изобретения, Chk2 может содержать или состоять из аминокислотной последовательности, которая, по меньшей мере, примерно на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO:17.
Chkl, которая кодируется геном CHEK1 у людей, имеет аминокислотную последовательность, показанную на фиг. 4 (SEQ ID NO:18). Человеческая Chkl также известна в данной области как «гомолог контрольной точки CHK1 (S. pombe)». SEQ ID NO:18 представлен только в целях ссылки, поскольку человеческая Chkl и последовательности белка Chkl других млекопитающих известны. Например, на сайте в интернете NCBI (или Генного Банка) раскрыты аминокислотные последовательности человеческой Chk1 под номерами доступа AAC51736, AAW02681, AAH04202, BAF85238, BAA84577, CAB70558, 014757, AAM58752, AAM78553, CAD10662, AAH17575, AAE84492, CAZ65679, AAB88852, ABM83833, ABM87141, AAE67465, AAE67917, AAX36253, BAI45672, NP_001107594 и 001265, и все указанные последовательности полностью включены в настоящую патентную заявку путем ссылки. В целях практического осуществления настоящего изобретения, Chk1 может содержать или состоять из аминокислотной последовательности, которая, по меньшей мере, примерно на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% и 99% идентична SEQ ID NO:18.
cdc25c (цикла клеточного деления 25C), которая представляет собой тирозин-фосфатазу, кодируется геном CDC25C у людей и имеет аминокислотную последовательность, показанную на фиг. 5 (SEQ ID NO:19). Человеческая cdc25c также известна в данной области как «индуктор фосфатазы 3 M-фазы» и «гомолог C 25 цикла клеточного деления» (S. pombe). SEQ ID NO:19 представлена только в целях ссылки, поскольку человеческая cdc25c и последовательности белка cdc25c других млекопитающих известны. Например, на сайте интернета NCBI (или Генного Банка) раскрыты аминокислотные последовательности cdc25c под номерами доступа AAR32098, P30307, NP_001781, AAX36531, EAW62145, EAW62149, AAX29802, AAX29802, ABP29523, EAW62148, BAG63273, AAA75741, AAE74714, AAH19089 и AAA35666, которые все полностью включены в настоящую патентную заявку путем ссылки. В целях практического осуществления настоящего изобретения, cdc25c может содержать или состоять из аминокислотной последовательности, которая, по меньшей мере, примерно на 50%, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична SEQ ID NO:19.
Хотя один аспект настоящего изобретения относится к блокированию подавляющей активности активированной Chk2 против cdc25c, оно аналогичным образом относится к блокированию активности Chk2 против одного или более из ее других белковых мишеней. Дополнительными мишенями белка Chk2 являются, например, E2F-1, p53, cdc25a, BRCA-1, PML, Che-1, Hdmx, Trf2, FoxMl, pRB или mdm2. Кроме того, изобретение относится к блокированию подавляющей активности Chkl не только против cdc25c, но также, например, p53, cdc25a, cdc25b, Rad51, поли-A-связывающего белка, аврора-B, подобной «взъерошенной» киназы-1, wee-1 или BLM.
Следующие примеры включены для демонстрации определенных вариантов осуществления изобретения.
ПРИМЕРЫ
Провели исследование для идентификации коротких пептидов, применимых для предотвращения или уменьшения токсичности в коже, которая может возникнуть в результате воздействия мутагена или раздражающего агента. С учетом предшествующих известных ингибирующих эффектов кофеина на путь репарации повреждения ДНК и противораковые эффекты данного ингибирования в эпидермисе, определенные родственные пептиды анализировали для выявления их способности аналогичным образом ингибировать путь репарации повреждения ДНК. Для этого, пептиды тестировали для выявления их способности блокировать плечо Chk2 (киназу 2 контрольной точки) - cdc25c (белок гомолога C 25 цикла клеточного деления) пути репарации повреждения ДНК.
Chk2, которая активируется белками, улавливающими повреждение ДНК, вызывает остановку клеточного цикла фосфорилированием и, посредством этого, ингибирование cdc25c, которая представляет собой фосфатазу, участвующую в стимуляции циклин-зависимой активности киназы, ведущей к митозу. Взаимодействие этих белков с путем репарации повреждения ДНК и их взаимодействие с агентами, обсужденными ниже, суммировано в следующей схеме:

Пептиды были разработаны для ингибирования деактивации cdc25c под действием Chk2 с использованием следующей методологии. Все пептиды были синтезированы с использованием стандартной химии Fmoc на пептидном синтезаторе Advanced ChemTech (Louisville, KY) Apex 396 Multiple Peptide Synthesizer. После расщепления, пептиды очищали посредством ВЭЖХ, используя колонку C-18 на обращенной фазе, и затем анализировали масс спектрометрией. Первичное подтверждение последовательности и препаративную очистку осуществляли с использованием системы LC/MS/MS (ABI API2000). Все пептиды, используемые в данном конкретном примере (SEQ ID NO:2-6 и 8-10) были амидированы на карбокси-конце (-CONH2).
Ингибиторную активность SEQ ID NO:2-6 и 8-10 в отношении фосфорилирования cdc25c под действием Chk2 измеряли с использованием набора для определения активности киназы контрольной точки K-LISA™ Checkpoint Activity Kit, выпускаемый компанией Calbiochem EMD Biosciences (San Diego, CA) в соответствии с инструкциями Активированный человеческий фермент Chk2 для этих тестов получали от компании Sigma (St. Louis, MO). Общий ингибитор киназы, стауроспорин (конечная концентрация 10 мкМ) использовали в качестве положительного контроля для ингибирования активности Chk2. Отдельные тестируемые пептиды (SEQ ID NO:2-6, 8-10) инкубировали с Chk2 в конечной концентрации 50 мкг/мл. Вкратце, в анализе K-LISA™ использовали биотинилированный пептидный субстрат (KKKVSRSGLYRSPSMPENLNRPR, SEQ ID NO:12), который может быть фосфорилирован на третьем серине Chk2 (может быть также фосфорилирован белком Chkl). Данный субстрат служит в качестве суррогата для cdc25c, поскольку SEQ ID NO:12 содержит последовательность, являющуюся мишенью для фосфорилирования серина Chk2.
Биотинилированный пептидный субстрат и образец, содержащий Chk2 с добавленными агентами или без них (стауроспорином или одним из SEQ ID NO:2-6, 8-10) инкубировали в присутствии АТФ в лунках покрытого стрептавидином 96-луночного планшета. Данная инкубация обеспечивала возможность фосфорилирования субстрата Chk2 и захвата субстрата в одной стадии. После инкубации, фосфорилированный субстрат выявляли с использованием анти-фосфосеринового первичного антитела, конъюгированного с пероксидазой хрена (HRP) вторичного антитела и субстрата TMB (тетраметилбензидина) для проявления цвета (первичное и вторичное антитела и TMB были включены в набор K-LISA). Чувствительность анализа увеличивали добавлением останавливающего раствора, содержащегося в наборе. Относительную активность Chk2 определяли считыванием величины спектральной поглощательной способности каждой лунки при двойной длине волн 450/540 нм.
Все SEQ ID NO:2, 3, 5, 6, 8 и 10 ингибировали активность Chk2 против пептидного субстрата (фиг. 2). Например, SEQ ID NO:10 снижала активность фосфорилирования под действием Chk2 примерно на 48%, что приближалось к ингибирующей активности, проявляемой стауроспорином (примерно 69%). SEQ ID NO:5, 6 и 8 имели одинаковую способность ингибирования Chk2. В целом, эти данные указывают на то, что определенные пептиды могут снизить активность Chk2 в отношении его субстрата (т.е., cdc25c), дополнительно указывая на способность снижения уровня остановки клеточного цикла, который был бы инициирован in vivo после воздействия на клетки повреждающих ДНК агентов.
Все раскрытые и заявленные в настоящей патентной заявке композиции или способы могут быть получены и исполнены без ненужного экспериментирования в свете настоящего описания. Хотя композиции и способы по настоящему изобретению были описаны с точки зрения определенных вариантов осуществления, для специалистов в данной области будет очевидно, что в композиции и/или способах и в стадии или в последовательности стадий способов, описанных в настоящей патентной заявке, без отхода от концепции, сущности и объема изобретения. Конкретнее, будет очевидно, что определенные агенты, которые являются и химически, и физиологически связанными, могут быть замещены агентами, раскрытыми в настоящей патентной заявке, хотя были бы достигнуты такие же или аналогичные результаты. Считается, что все такие аналогичные замещения и модификации, очевидные для специалистов в данной области находятся в пределах объема настоящего изобретения.
Все патенты и публикации, идентифицированные в настоящей заявке, полностью включены в нее путем ссылки.

















Группа изобретений относится к области биохимии. Предложен пептид длиной 5-9 аминокислот, состоящий из последовательности SEQ ID NO: 3, 5, 6, 8 или 10, необязательно амидированный на его карбокси-конце. Также с использованием вышеуказанного пептида предложен способ снижения активности активированной киназы контрольной точки клеточного цикла и способ снижении клеточной или тканевой токсичности, индуцированной воздействием УФ света. Предложена композиция и косметическое средство, которые включают вышеуказанный пептид. Группа изобретений позволяет защищать от токсического воздействия на кожу и/или мутагенеза, которые возникают в результате воздействия ультрафиолетового света. 9 н. и 13 з.п. ф-лы, 5 ил., 1 табл., 1 пр.
1. Способ снижения активности активированной киназы контрольной точки клеточного цикла, где указанный способ включает воздействие на указанную киназу контрольной точки пептида, где указанная пептидная последовательность представляет собой SEQ ID NO:2, 3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце.
2. Способ по п. 1, где указанный пептид представляет собой SEQ ID NO:10.
3. Способ по п. 1, где указанный пептид представляет собой SEQ ID NO:2, 3, 5, 6 или 8.
4. Способ по п. 1, где указанный пептид амидирован на его карбокси-конце.
5. Способ по п. 1, где указанная киназа контрольной точки представляет собой киназу-2 контрольной точки (Chk2).
6. Способ по п. 1, где указанная киназа контрольной точки активирована в результате повреждения ДНК, причиненного ультрафиолетовым излучением.
7. Способ по п. 1, где указанная киназа контрольной точки присутствует в коже человека.
8. Способ снижения клеточной или тканевой токсичности, индуцированной воздействием ультрафиолетового света, где указанный способ включает нанесение пептида на кожу, где указанная пептидная последовательность представляет собой SEQ ID NO:2, 3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце.
9. Пептид, снижающий активность активированной киназы контрольной точки клеточного цикла, состоящий из последовательности SEQ ID NO:3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце.
10. Пептид по п. 9, где указанный пептид представляет собой SEQ ID NO:10.
11. Пептид по п. 9, где указанный пептид амидирован на его карбокси-конце.
12. Композиция для снижения клеточной или тканевой токсичности, индуцированной воздействием ультрафиолетового света, включающая пептид по любому из пп. 9-11 и фармацевтически приемлемый носитель.
13. Композиция по п. 12, где композиция представлена в форме аэрозоля, эмульсии, жидкости, лосьона, крема, пасты, мази, порошка или пены.
14. Композиция по п. 12 или 13, которая дополнительно включает солнцезащитное или хемопревентивное средство.
15. Композиция по п. 14, где солнцезащитное или хемопревентивное средство представляют собой кофеин, аспирин, салициловую кислоту, кофеиновую кислоту, генистеин, ресвератрол, диалилсульфид, S-аллилцистеин, аллицин, ликопен, капсаицин, куркумин, 6-гингерол, эллагиновую кислоту, урсоловую кислоту, силимарин, анетол, катехины, эмодин, сульфорафан, эвгенол, изоэвгенол, бета-каротин, олеандарин, полифенол, индол, изотиоцианат, нестероидные противовоспалительные средства (NSAIDS), агонист PPAR-гамма рецепторов, резиквимод, имиквимод, ретиноид, бексаротен, тараротен, селен, соевые изофлавоны, статины, серосодержащие антиоксиданты или аналоги витамина D.
16. Применение композиции по п. 12 или 13 для ухода за кожей.
17. Применение композиции по п. 12 или 13 для поддержания характеристик здоровой кожи, таких как тонус, эластичность, гидратация, окрашивание, плотность и гладкость.
18. Применение пептида для снижения или предотвращения вызванной мутагенами токсичности в тканях кожи, связанной с активностью активированной киназы контрольной точки клеточного цикла, где последовательность указанного пептида представляет собой SEQ ID NO: 2, 3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце.
19. Применение по п. 18, где примерами указанной токсичности в тканях кожи являются рак кожи, предраковые поражения, эритема, алопеция, фоточувствительность, анамнестические реакции, образование пузырей, некроз кожи, угревая сыпь, ксероз, увеличенная пигментация, дерматит или язвы кожи.
20. Применение по п. 18, где примерами указанной токсичности в тканях кожи являются морщины, пятнистое поражение и/или гиперпигментация, грубая или жесткая кожа, опущение или свисание кожи, пожелтение, сухость и новообразования кожи.
21. Применение пептида, выбранного из группы, состоящей из SEQ ID NO: 2, 3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце, в качестве косметического средства.
22. Косметическое средство для снижения клеточной или тканевой токсичности, индуцированной воздействием ультрафиолетового света, содержащее эффективное количество пептида, выбранного из группы, состоящей из SEQ ID NO: 2, 3, 5, 6, 8 или 10, где указанный пептид необязательно амидирован на его карбокси-конце.
| PARK H.-Y | |||
| et al., Topical Application of a Protein Kinase C Inhibitor Reduces Skin and Hair Pigmentation, Journal of Investigative Dermatology Vol.122, Issue 1, pp | |||
| Катодное реле | 1918 |
|
SU159A1 |
| WO9735998 A1, 02.10.1997 | |||
| BLACK J.D., Proteine kinase C-mediated regulation of the cell cycle, Frontiers in Bioscience Vol.5, pp | |||
| Электрическая лампа накаливания с двумя нитями | 1923 |
|
SU406A1 |
| WO2008120202 A2, 09.10.2008 | |||
| Устройство для автоматической сигнализации звонком абонентам телефонной станции о подъеме воды | 1924 |
|
SU3934A1 |
Авторы
Даты
2015-10-20—Публикация
2010-11-18—Подача