Область техники, к которой относится данное изобретение
Данное изобретение в целом относится к стероидным гормонам и, более точно, к новым сульфаматпроизводным бензотиофена, которые являются ингибирами фермента стероидной сульфатазы. Изобретение также относится к фармацевтическим композициям, содержащим данные производные, и способам их применения.
Уровень техники
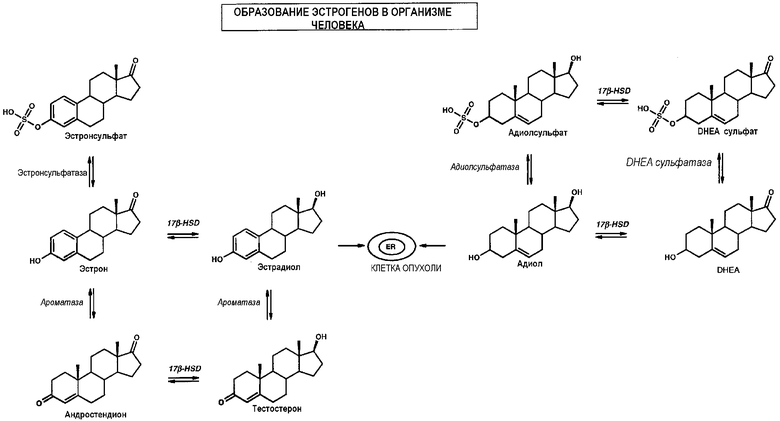
Фермент стероидная сульфатаза (Е.С. 3.1.6.2., STS) катализирует гидролиз эстронсульфата до эстрона и DHEA-сульфата до DHEA (Dibbelt l., Biol. Chem., Hoppe-Seyler, 1991, 372, 173-185; Stein C., J. Biol. Chem., 1989, 264, 13865-13872).
Путь метаболизма стероидной сульфатазы до недавнего времени привлекал интерес с точки зрения изучения рака молочной железы в связи с локальным межтканевым образованием эстрогенов из обильного пула циркулирующего эстронсульфата (E1S) (Pasqualini J.R., J. Steroid Biochem. Mol. Biol., 1999, 69, 287-292; Purohit A., Mol. Cell. Endocrinol., 2001, 171, 129-135).
Ингибирование данного фермента предотвратило бы превращение E1S в свободный эстрон (E1), который, в свою очередь, может быть превращен в эстрадиол (Е2) ферментативным восстановлением. В настоящее время считается, что помимо метаболического пути эстронсульфатазы другой сильный эстроген - андростендиол (адиол), образующийся из DHEA после гидролиза DHEA-S, может быть другим важным маршрутом, составляющим основу роста и развитие гормонозависимых опухолей молочной железы.
Образование эстрогенов у людей схематически представлено на чертеже.
В настоящее время для предотвращения синтеза эстрогена у пациентов с гормонозависимыми раковыми заболеваниями используются ингибиторы ароматазы. Однако клинические испытания показали относительное снижение эффективности у пациентов с опухолями, позитивными по рецепторам эстрогена (Castiglione-Gertsch M., Eur. J. Cancer, 1996, 32A, 393-395; Jonat W., Eur. J. Cancer, 1996, 32A, 404-412). Как объяснено, метаболический путь с участием стероидной сульфатазы может быть еще одним важным маршрутом образования эстрогена в опухолях молочной железы.
EMATE (Ahmed S., Curr. Med. Chem., 2002, 9, 2, 263-273), эстрон-3-сульфамат, является традиционным стандартным ингибитором стероидной сульфатазы, но обладает значительным недостатком, являясь эстрогенным ввиду его механизма ингибирования: сульфаматный фрагмент расщепляется в процессе инактивации фермента, который высвобождает Е1 не из E1S, но из самого ЕМАТЕ (Ahmed S., J. Steroid Biochem. Mol. Biol., 2002, 80, 429-440).
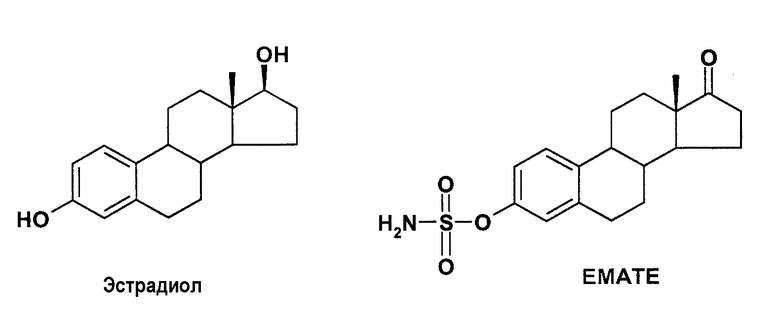
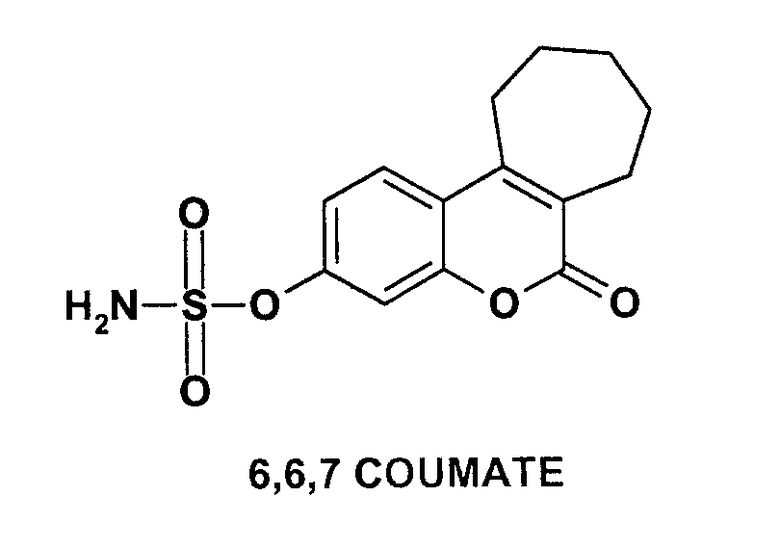
Другие нестероидные сульфаматпроизводные, которые высвобождают производные без эстрогенных свойств, представлены в литературе в качестве приемлемых кандидатов лекарственных средств, например 6,6,7-COUMATE, стандартный неэстрогенный ингибитор сульфатазы (Purohit A., Cancer Res., 2000, 60, 3394-3396).
Таким образом, существует потребность в ингибиторах стероидной сульфатазы для лечения, в частности, эстрогензависимых заболеваний.
Сущность изобретения
Предметом данного изобретения является предоставление сульфаматпроизводных бензотиофена, которые являются мощными ингибиторами стероидной сульфатазы.
Другим предметом данного изобретения является предоставление фармацевтической композиции, содержащей в качестве активного ингредиента сульфаматпроизводное бензотиофена, описанное выше.
Еще одним предметом данного изобретения является применение сульфаматпроизводного бензотиофена для производства лекарственного средства для лечения или профилактики различных заболеваний и контроля репродуктивных функций у женщин, у мужчин, а также у самок и самцов диких и домашних животных.
Производные сульфаматбензотиофена данного изобретения могут быть представлены следующей общей формулой (I):
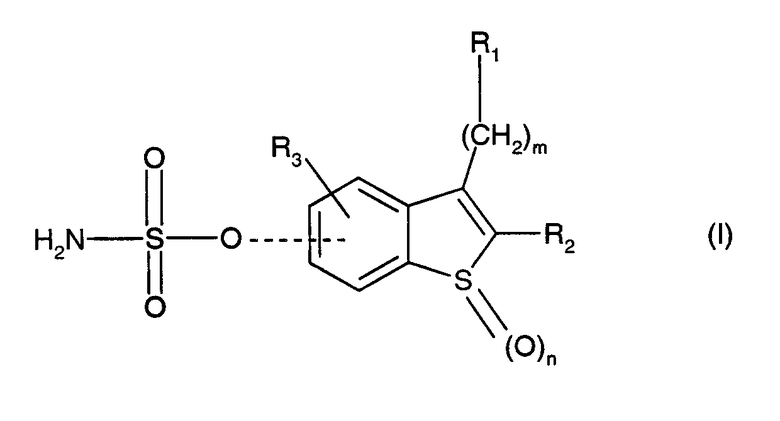
где
- R1 представляет собой водород, (С1-С6)алкил, (С2-С6)алкен, (С3-С12)циклоалкил или (С3-С12)циклоалкен, где циклоалкил и циклоалкен являются необязательно моно- или дизамещенными (С1-С4)алкилом;
- R2 представляет собой водород, (С1-С6)алкил или С3-С12)циклоалкил;
- R3 представляет собой водород, (С1-С6)алкокси или галоген;
- m равно 0, 1, 2;
- n равно 0, 1, 2;
- когда m равно 0, R1 и R2 вместе могут также образовывать группу -(СН2)р-, где р равно 3, 4 или 5;
- пунктирная линия показывает, что сульфаматная группа (OSO2(NH2)) находится в положении 5- или 6- бензотиофенового кольца.
Среди соединений формулы (I), которые удовлетворяют, по меньшей мере, одному из следующих условий, особенно предпочтительными являются следующие:
- R1 представляет собой водород, (С1-С6)алкил или (С3-С12)циклоалкил, необязательно моно- или дизамещенный (С1-С4)алкилом, предпочтительно R1 представляет собой (С3-С10)циклоалкил, необязательно моно- или дизамещенный (С1-С4)алкилом;
- m равно 0 или 1;
- R2 представляет собой водород;
- R3 представляет собой водород;
- n равно 0 или 2;
- сульфаматная группа находится в положении 6 бензотиофеновой группы.
В описании и прилагаемой формуле изобретения подразумевается, что термин «(С1-С4)-» или «(С1-С6)алкил» означает линейную или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 4, или от 1 до 6 атомов углерода, соответственно. Таким алкильным радикалом является, например, метильный, этильный, пропильный, изопропильный, бутильный, изобутильный, трет-бутильный, пентильный, изопентильный или гексильный радикал.
Подразумевается, что термин «(С1-С6)алкокси» означает группу -OR, в которой R представляет собой (С1-С6)алкил, который определен выше.
Подразумевается также, что термин «(С3-С12)циклоалкил» означает насыщенный моно- или бициклический углеводород, содержащий от 3 до 12 атомов углерода. (С3-С12)циклоалкильным радикалом является, например, циклопропильный, циклобутильный, циклопентильный, циклогексильный, циклогептильный, циклооктильный, циклодецильный или адамантильный радикал.
Термин «галоген» означает атом хлора, брома, фтора или йода.
Термин «(С2-С6)алкен» означает линейную или разветвленную ненасыщенную углеводородную цепь, содержащую от 2 до 6 атомов углерода. (С2-С6)алкеновым радикалом является, например, этиленовый, пропеновый, бутеновый, пентеновый или гексеновый радикал.
Термин «(С3-С12)циклоалкен» означает ненасыщенный моно- или бициклический углеводород, содержащий от 3 до 12 атомов углерода. (С3-С12)циклоалкеновым радикалом является, например, циклопропеновый, циклобутеновый, циклопентеновый, циклогексеновый, циклооктеновый, циклодеценовый или адамантеновый радикал.
Принимая во внимание при сравнении соединений данного изобретения с ингибиторами ароматазы их способность ингибировать стероидную сульфатазу и, таким образом, приводить к расходованию других источников эндогенных эстрогенов, соединения данного изобретения могут использоваться сами по себе или в комбинации с одним или несколькими другими половыми эндокринными терапевтическими средствами, такими как антиэстрогены, селективные модуляторы эстрогеновых рецепторов (Selective Estrogen Receptor Modulators - SERM), антиароматазы, антиандрогены, ингибиторы лиазы, прогестины или LH-RH агонисты или антагонисты, для лечения или профилактики эстрогензависимых расстройств или заболеваний. Соединения данного изобретения могут также применяться для контроля или воздействия на эстрогенрегулируемые репродуктивные функции, такие как мужская или женская фертильность, беременность, выкидыш или роды у людей, а также диких и домашних животных, сами по себе или в комбинации с одним или несколькими другими терапевтическими средствами, такими как LH-RH агонисты или антагонисты, эстропрогестативные контрацептивы, прогестины, антипрогестины или простагландины.
Молочные железы являются чувствительными мишенями эстрогенстимулируемой пролиферации и/или дифференциации, и соединения данного изобретения могут применяться при лечении или профилактике доброкачественных заболеваний груди у женщин, гинекомастии у мужчин и доброкачественных или злокачественных опухолей груди с метастазом или без него у мужчин и женщин или у самцов и самок домашних животных. Соединения данного изобретения могут также применяться при лечении или профилактике доброкачественных или злокачественных заболеваний матки или яичников. В каждом случае соединения данного изобретения могут использоваться сами по себе или в комбинации с одним или несколькими другими половыми эндокринными терапевтическими средствами, которые перечислены выше.
Поскольку фермент, стероидная сульфатаза, трансформирует DHEA-сульфат в DHEA, предшественник активных андрогенов (тестостерона и дигидротестостерона), соединения данного изобретения могут применяться для лечения или профилактики андрогензависимых заболеваний, таких как андрогенная алопеция (облысение у женщин по мужскому типу) (Hoffman R. et al., J. Invest. Dermatol., 2001, 117, 1342-1348) или акне (Billich A. et al., 1999, WO 9952890), доброкачественные или злокачественные заболевания предстательной железы или яичка (Reed M.J., Rev. Endocr. Relat. Cancer, 1993, 45, 51-62), сами по себе или в комбинации с одним или несколькими другими половыми эндокринными терапевтическими средствами, такими как антиандрогены, антиэстрогены, SERM, антиароматаза, прогестины, ингибиторы лиазы или LH-RH агонисты или антагонисты.
Ингибиторы стероидной сульфатазы также потенциально вовлечены в лечение расстройства познавательной способности, поскольку они способны повышать память обучения и пространственную память у крыс (Johnson D.A., Brain Res., 2000, 865, 286-290). DHEA-сульфат в качестве нейростероида воздействует на ряд нейротрансмиттерных систем, включая системы, в которые вовлечены ацетилхолин, глутамат и GABA, что приводит к повышенной нейронной возбудимости (Wolf O.T., Brain Res. Rev., 1999, 30, 264-288).
Кроме того, эстрогены вовлечены в регулирование равновесия между преобладающими иммунными функциями Th1 и Th2 и, следовательно, могут применяться при лечении или профилактике зависящих от пола аутоиммунных заболеваний, таких как волчанка, рассеянный склероз, ревматоидный артрит и т.п. (Daynes R.A., J. Exp. Med., 1990, 171, 979-996). Ингибирование стероидной сульфатазы, как было показано, является защитой в моделях контактной аллергии и коллаген-индуцированного артрита у грызунов (Suitters A.J., Immunology, 1997, 91, 314-321).
Исследования с использованием 2-MeOEMATE показали, что ингибиторы стероидной сульфатазы обладают значительным эстрадиолнезависимым ростингибиторным действием (MacCARTHY-MOOROGH L., Cancer Research, 2000, 60, 5441-5450). Неожиданно при использовании соединений данного изобретения наблюдалось снижение объема опухоли при слабом ингибировании стероидсульфатазы опухоли. Таким образом, соединения данного изобретения могут приводить к снижению клеточного деления благодаря значительному взаимодействию между такими новыми химическими веществами и сетью микротрубочек внутри раковой клетки безотносительно вида ткани, включая ткани молочной железы, эндометрия, матки, предстательной железы, яичка или их метастазы. Следовательно, соединения данного изобретения могут быть полезны при лечении эстрогеннезависимого рака.
Соответственно, в качестве другого объекта, изобретение предоставляет способ лечения перечисленных выше заболеваний или расстройств, в частности эстрогензависимых заболеваний или расстройств, то есть эстрогениндуцируемых или эстрогенстимулируемых заболеваний или расстройств (GOLOB T., Bioorg. Med. Chem., 2002, 10, 3941-3953). Способ включает введение субъекту (человеку или животному), нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I).
Фармацевтические композиции, содержащие активный(ые) ингредиент(ы), могут быть представлены в форме, подходящей для перорального введения, например, в виде таблеток, пастилок, лепешек, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, сиропов или эликсиров. Композиции, предназначенные для перорального применения, могут быть получены в соответствии с любым способом, известным в области производства фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, включающей подслащивающие агенты, флаворанты, красители и консерванты, для получения прекрасных с фармацевтической точки зрения и приятных на вкус препаратов. Таблетки включают активный(ые) ингредиент(ы) в смеси с нетоксичным фармацевтически приемлемыми эксципиентами, которые подходят для производства таблеток. Такими эксципиентами могут быть, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например, кукурузный крахмал или альгиновая кислота; связующие агенты, например, крахмал, желатин или акация; и лубриканты, например, стеарат магния, стеариновая кислота или тальк. Таблетки могут не иметь покрытия или могут быть покрыты известными методами для отсрочки дезинтеграции и абсорбции в желудочно-кишечном тракте и, таким образом, обеспечения поддерживаемого действия в течение более продолжительного периода. Например, могут применяться такие материалы для отсроченного высвобождения, как глицерилмоностеарат или глицерилдистеарат. Покрытия также могут наноситься на таблетки методом, описанным в Патентах США №№ 4256108, 4166452 или 4265874, для получения осмотических терапевтических таблеток контролируемого высвобождения.
Композиции для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный(ые) ингредиент(ы) смешан(ы) с твердым инертным разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный(ые) ингредиент(ы) смешан(ы) с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом.
Водные суспензии содержат активный(ые) ингредиент(ы) в смеси с эксципиентами, подходящими для производства водных суспензий. Такие эксципиенты представляют собой суспендирующие агенты, например, натрийкарбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантову смолу и аравийскую камедь; диспергирующие или смачивающие агенты, такие как природный фосфатид, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, такие как полиоксиэтиленсорбитмоноолеат, продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гексита, например полиэтиленсорбитанмоноолеат. Водные суспензии могут также содержать один или несколько консервантов, например, этил- или н-пропил-п-гидроксибензоат, один или несколько красителей, один или несколько флаворантов и один или несколько подслащивающих агентов, таких как сахароза, сахарин или аспартам.
Масляные суспензии могут приготавливаться суспендированием активного(ых) ингредиента(ов) в растительном масле, например, арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например, пчелиный воск, твердый парафин или цетиловый спирт. Подслащивающие агенты, которые перечислены выше, и флаворанты могут быть добавлены для получения препарата, приятного на вкус при пероральном введении. Такие композиции могут сохраняться добавлением антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии добавлением воды, получают смешением активного(ых) ингредиента(ов) с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Примеры подходящих дипергирующих или смачивающих агентов или суспендирующих агентов приведены выше. Могут также присутствовать дополнительные эксципиенты, например подслащивающие агенты, флаворанты и красители. Фармацевтические композиции данного изобретения могут быть представлены также в форме эмульсий типа «вода в масле». Масляная фаза может представлять собой растительное масло, например оливковое или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Подходящие эмульгаторы могут представлять собой природные фосфатиды, например, сою, лецитин, и сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и ангидридов гексита, такие как сорбитанмоноолеат, а также продукты конденсации указанных неполных сложных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитанмоноолеат. Эмульсии также могут содержать подслащивающие агенты и флаворанты.
Фармацевтические композиции данного изобретения могут быть представлены в форме стерильной водной или масляной суспензии для инъекций. Такая суспензия может быть приготовлена в соответствии с известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые перечислены выше. Стерильный препарат для инъекций может также представлять собой стерильный раствор или стерильную суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как 1,3-бутандиол. Подходящими разбавителями и растворителями, которые могут применяться, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспензионной среды традиционно применимы стерильные жирные масла. Для этой цели может применяться любое мягкое жирное масло, включая синтетические моно- или диглицериды. При приготовлении препаратов для инъекций также могут применяться жирные кислоты, такие как олеиновая кислота.
Соединения данного изобретения могут применяться при лечении указанных выше заболеваний или расстройств, при уровнях доз порядка от примерно 0,0001 мг до примерно 10 мг/кг массы тела в сутки или, альтернативно, от примерно 0,01 мг до примерно 100 мг в сутки на одного пациента.
Количество активного(ых) ингредиента(ов), которое может объединяться с материалами носителя для получения единичной дозированной формы, будет изменяться в зависимости от особенностей организма-хозяина, подлежащего лечению, и конкретного способа введения.
Однако следует представлять, что уровень конкретных доз для любого конкретного пациента будет зависеть от различных факторов, включая возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, способ введения и скорости выделения, комбинации с другими лекарственными средствами и тяжести конкретного заболевания, подлежащего терапевтическому лечению.
Производные сульфаматбензотиофена формулы (I) могут быть получены в соответствии с представленной далее общей схемой 1.
Схема 1
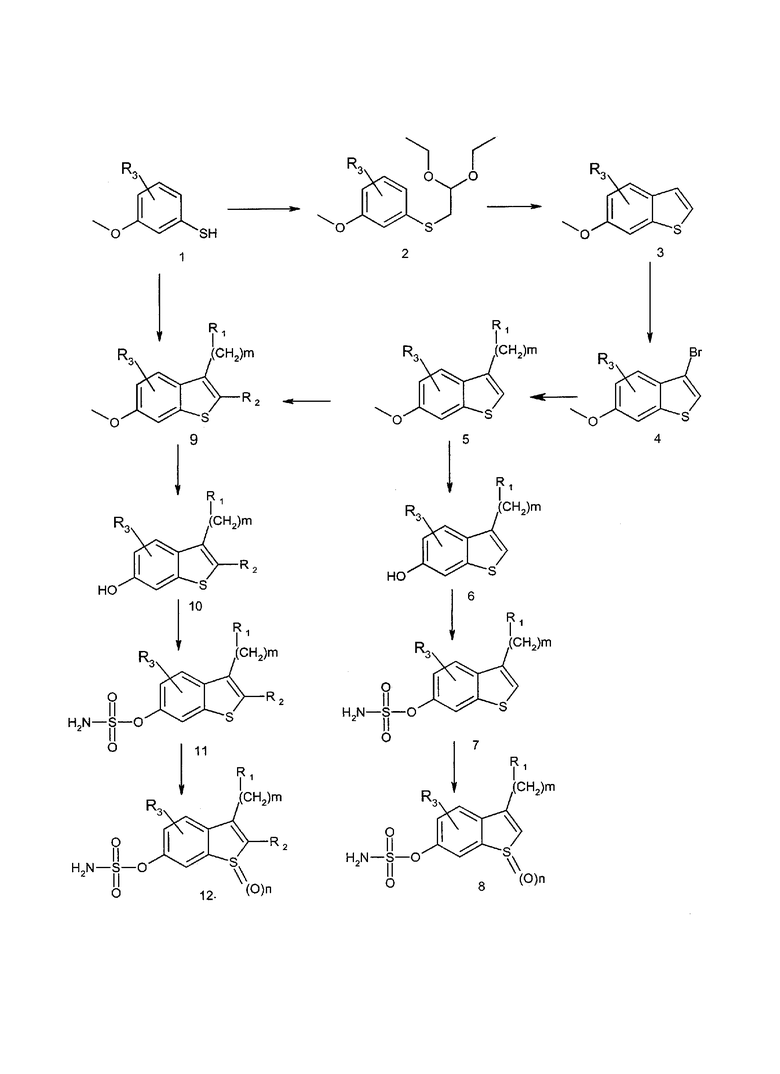
В соответствии со схемой 1 3-метокситиофенол (1) подвергается конденсации с 2-бром-1,1-диэтоксиэтаном и полученное промежуточное тиопроизводное (2) подвергается циклизации с различными кислотами: полифосфорной кислотой (Bioor. Med. Chem. Lett., 1999, 9, 759-64) или метансульфоновой кислотой - для получения 6-метоксибензотиофена (3). Данное соединение также может быть получено взаимодействием кислоты Льюиса, трифторборана, с соединением (2) в условиях, описанных в публикации S. Graham, J. Med. Chem., 1989, 32, 2548-54.
6-Метоксибензотиофен (3) подвергается превращению в бромпроизводное (4) с использованием N-бромсукцинимида и APTS в условиях, описанных в публикации Y. Fort (Tetrahedron., 1994, 50, 11893-902). Соединение (4) подвергается превращению в магнийорганический бромид и затем подвергается конденсации с кетоном или альдегидом для получения монозамещенного бензотиофена (5) в стандартных условиях.
Дизамещенный бензотиофен (9) может быть получен алкилированием монозамещенного соединения (5) в условиях, описанных в публикации Kano S. (Heterocycles, 1982, 19, 6, 1033-37).
Соединения, в которых R1 и R2 вместе образуют группу -(СН2)р-, такие как 7-метокси-1,2,3,4-тетрагидродибензотиофен (р = 4), могут быть получены в условиях, описанных в публикации Oliveira M. (Tetrahedron, 2002, 58, 1709-18).
Удаление защиты из метоксибензотиофена, монозамещенного (5) иди дизамещенного (9), с помощью трибромборана приводит к получению гидроксисоединений (5) и (10) в условиях, описанных в публикации McOmie, J.F.W. (Tetrahedron, 1968, 24, 2289-92). Данные соединения подвергаются превращению в соответствующие сульфаматы (7) и (11) обработкой гидридом натрия и амидхлорсульфоновой кислотой (Nussbaumer P., J. Med. Chem., 2002, 45, 4310-20) или взаимодействием с сульфамоилхлоридом в диметилацетамиде (DMAc) (Makoto O., Tetrahedron Letters, 2000, 41, 7047-51).
Окисление (7) и (11) пероксидом водорода в трифторуксусной кислоте в соответствии с методикой публикации Grivas S., Ronne E., Acta Chemica Scandinavia, 1995, 49, 225-229 приводит к получению конечных бензотиофенов (8) и (12).
Соединения формулы (I), в которых сульфаматная группа находится в положении 5 бензотиофенового цикла, могут быть получены таким же способом, но исходя из 4-метокситиофенола.
Приведенные далее примеры предназначены только для иллюстрации объема данного изобретения, но никоим образом не ограничивают его.
Получение 3-бром-6-метоксибензотиофена (4)
Пример 1: 6-Метоксибензотиофен (3)
Диэтилацеталь бромацетальдегида (16,50 мл, 0,11 моль) по каплям при комнатной температуре добавляют к смеси м-метоксибензолтиола (1) (15 мл, 0,12 моль) и К2СО3 (16,60 г, 0,12 моль) в ацетоне (150 мл). Реакционную смесь перемешивают в течение 16 часов и затем фильтруют. Твердый продукт промывают ацетоном и объединенные фильтраты концентрируют в вакууме. Остаток разбавляют водой и экстрагируют Et2O. Органическую фазу промывают 0,5 М КОН, водой и насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 27,40 г соединения (2) в виде темно-желтого масла.
1Н-ЯМР (CDCl3): 1,18 (т, 6Н), 3,13 (д, 2Н), 3,43-3,73 (м, 4Н), 3,77 (с, 3Н), 4,67 (т, 1Н), 6,60-7,27 (м, 4Н).
Раствор соединения (2) (13,00 г, 0,051 моль) в СН2Cl2 (100 мл) при комнатной температуре в атмосфере азота по каплям добавляют к раствору BF3·Et2O (6,70 мл, 0,054 моль) в СН2Cl2 (1000 мл). После гидролиза реакционную смесь перемешивают до тех пор, пока обе фазы не станут прозрачными. СН2Cl2 слой отделяют и водный слой экстрагируют СН2Cl2. Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 8,68 г смесь 4- и 6-метоксибензотиофена (3) (1:10) в виде темно-коричневого масла. Сырой продукт используют без дополнительной очистки.
Основной изомер (3) 1Н-ЯМР (CDCl3): 3,85 (с, 3Н), 6,98 (дд, 1Н), 7,23 (с, 2Н), 7,35 (д, 1Н), 7,68 (д, 1Н).
Пример 2: 3-Бром-6-метоксибензотиофен (4)
N-бромсукцинимид (14,70 г, 82,59 ммоль) и п-толуолсульфоновую кислоту (2,70 г, 15,68 ммоль) добавляют к раствору бензотиофена (3) (15,10 г, 92,07 ммоль) в 1,2-дихлорэтане (300 мл). Смесь выдерживают при 70°С в течение 35 минут, охлаждают на ледяной бане и сукцинимид удаляют фильтрацией. Раствор экстрагируют насыщенным раствором бикарбоната натрия, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая22,00 г продукта в виде масла. Кристаллизация из пентана приводит к получению твердого белого вещества (16,50 г, 74%, т. пл. 62°С).
1Н-ЯМР (CDCl3): 3,85 (с, 3Н), 6,9 (дд, 1Н), 7,50 (м, 2Н), 7,65 (д, 1Н).
Получение монозамещенного бензотиофена (5)
Пример 3: 3-Циклогексил-6-метоксибензотиофен
В атмосфере аргона к Mg (0,22 г, 9,05 ммоль) в Et2O (20 мл) по каплям добавляют раствор бромида (4) (2,00 г, 8,23 ммоль) в Et2O (20 мл). Смесь кипятят с обратным холодильником в течение 2 часов, добавляют раствор циклогексанона (1,00 мл, 9,87 ммоль) в Et2O (5 мл) и полученную смесь кипятят с обратным холодильником в течение 2 часов. Реакционную смесь выливают в ледяную воду. Раствор экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая8,00 г продукта в виде масла. Растирание в диизопропиловом эфире приводит к получению 3-(1-гидроксициклогексил)-6-метоксибензотиофена в виде белого порошка (0,90 г, 65%).
1Н-ЯМР (ДМСО-d6): 1,20-2,00 (м, 10Н), 3,80 (с, 3Н), 5,30 (с, 1Н), 6,93 (дд, 1Н), 7,10 (с, 1Н), 7,42 (д, 1Н), 7,60 (д, 1Н).
К раствору 3-(1-гидроксициклогексил)-6-метоксибензотиофена (0,30 г, 1,14 ммоль) в дихлорметане (10 мл) в атмосфере аргона по каплям добавляют триэтилсилан (0,22 мл, 1,37 ммоль). После этого раствор перемешивают при 0°С и добавляют трифторуксусную кислоту (5,00 мл, 67,31 ммоль). Смесь перемешивают в течение 2 часов при комнатной температуре и выливают в насыщенный водный раствор NaHCO3 со льдом, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая0,30 г продукта в виде масла (100%). Кристаллизация из диизопропилового эфира приводит к получению продукта в виде белого кристаллического вещества (0,20 г, 70%).
1Н-ЯМР (ДМСО-d6): 1,00-2,20 (м, 11Н), 2,72 (м, 1Н), 3,75 (с, 3Н), 6,93 (дд, 1Н), 7,01 (с, 1Н), 7,43 (д, 1Н), 7,58 (д, 1Н).
В соответствии с описанной выше методикой, но заменяя циклогексанон на
- циклопентанон;
- циклогептанон;
- циклооктанон;
- циклодеканон;
- 4-метилциклогексанон;
- 2-метилциклогексанон;
- 2,2-диметилциклопентанон;
- 2-адамантанон;
- пропанон;
- гексанон;
- циклогексанкарбоксальдегид;
- циклогептанкарбоксальдегид (полученный в соответствии с методикой публикации J.G. Traynham et al., Tetrahedron, 7, 1959, 165-72)
получают, соответственно, следующие соединения
Пример 4: 3-Циклопентил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,40-2,20 (м, 8Н), 2,72 (м, 1Н), 3,80 (с, 3Н), 6,94 (дд, 1Н), 7,13 (с, 1Н), 7,45 (д, 1Н), 7,64 (д, 1Н).
Пример 5: 3-Циклогептил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,40-2,20 (м, 12Н), 3,05 (м, 1Н), 3,80 (с, 3Н), 6,90 (дд, 1Н), 7,00 (с, 1Н), 7,41 (д, 1Н), 7,57 (д, 1Н).
Пример 6: 3-Циклооктил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,20-2,15 (м, 14Н), 3,10 (м, 1Н), 3,77 (с, 3Н), 6,92 (дд, 1Н), 7,01 (с, 1Н), 7,41 (д, 1Н), 7,58 (д, 1Н).
Пример 7: 3-Циклодецил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,20-2,15 (м, 18Н), 3,12 (м, 1Н), 3,75 (с, 3Н), 6,92 (дд, 1Н), 7,01 (с, 1Н), 7,40 (д, 1Н), 7,55 (д, 1Н).
Пример 8: 3-(4-Метилциклогексил)-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,70-2,15 (м, 12Н), 2,72 (м, 0,5Н, диастереоизомер), 2,99 (м, 0,5Н, диастереоизомер), 3,76 (с, 3Н), 6,92 (дд, 1Н), 7,02 (с, 1Н), 7,41 (д, 1Н), 7,58 (д, 1Н).
Пример 9: 3-(2-Метилциклогексил)-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,70-2,20 (м, 12Н), 2,70 (м, 0,5Н, диастереоизомер), 3,02 (м, 0,5Н, диастереоизомер), 3,75 (с, 3Н), 6,92 (дд, 1Н), 7,02 (с, 1Н), 7,40 (д, 1Н), 7,55 (д, 1Н).
Пример 10: 3-(2,2-Диметилциклопентил)-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,70 (с, 3Н), 1,10 (с, 3Н), 1,45-2,20 (м, 6Н), 2,93 (м, 1Н), 3,78 (с, 3Н), 7,02 (дд, 1Н), 7,04 (с, 1Н), 7,43 (д, 1Н), 7,60 (д, 1Н).
Пример 11: 3-(2-Адамантил)-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,40-2,40 (м, 14Н), 3,19 (уш. с, 1Н), 3,79 (с, 3Н), 6,92 (дд, 1Н), 7,08 (с, 1Н), 7,43 (д, 1Н), 7,60 (д, 1Н).
Пример 12: 3-Пропил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,95 (т, 3Н), 1,68 (м, 2Н), 2,78 (т, 2Н), 3,79 (с, 3Н), 6,92 (дд, 1Н), 7,00 (с, 1Н), 7,43 (д, 1Н), 7,58 (д, 1Н).
Пример 13: 3-Гексил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,85 (т, 3Н), 1,10-1,80 (м, 8Н), 2,82 (т, 2Н), 3,79 (с, 3Н), 6,92 (дд, 1Н), 7,01 (с, 1Н), 7,45 (д, 1Н), 7,58 (д, 1Н).
Пример 14: 3-Циклогексилметил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 0,75-1,85 (м, 11Н), 2,70 (д, 2Н), 3,80 (с, 3Н), 6,92 (дд, 1Н), 7,00 (с, 1Н), 7,42 (д, 1Н), 7,59 (д, 1Н).
Пример 15: 3-Циклогептилметил-6-метоксибензотиофен
1Н-ЯМР (ДМСО-d6): 1,00-1,90 (м, 13Н), 2,71 (д, 2Н), 3,80 (с, 3Н), 6,93 (дд, 1Н), 7,00 (с, 1Н), 7,42 (д, 1Н), 7,59 (д, 1Н).
Получение монозамещенного бензотиофенола (6)
Пример 16: 3-Циклогексилбензотиофен-6-ол
Раствор 3-циклогексил-6-метоксибензотиофена (4,00 г, 16,0 ммоль) в 40 мл дихлорметана при комнатной температуре добавляют к раствору трибромида бора (24 мл, 24 ммоль). Смесь выдерживают в течение 2 часов и затем гидролизуют насыщенным водным раствором NaHCO3, экстрагируют дихлорметаном, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получаяспирт (3,60 г в виде масла, 97%).
1Н-ЯМР (CDCl3): 1,10-2,10 (м, 10Н), 2,80 (м, 1Н), 6,78 (дд, 1Н), 6,94 (с, 1Н), 7,17 (д, 1Н), 7,48 (д, 1Н), 9,42 (с, 1Н, ОН).
В соответствии с описанной методикой, но заменяя 3-циклогексил-6-метоксибензотиофен на
- 3-циклопентил-6-метоксибензотиофен;
- 3-циклогептил-6-метоксибензотиофен;
- 3-циклооктил-6-метоксибензотиофен;
- 3-циклодецил-6-метоксибензотиофен;
- 3-(4-метилциклогексил)-6-метоксибензотиофен;
- 3-(2-метилциклогексил)-6-метоксибензотиофен;
- 3-(2,2-диметилциклопентил)-6-метоксибензотиофен;
- 3-(2-адамантил)-6-метоксибензотиофен;
- 3-пропил-6-метоксибензотиофен;
- 3-гексил-6-метоксибензотиофен;
- 3-циклогексилметил-6-метоксибензотиофен;
- 3-циклогептилметил-6-метоксибензотиофен,
получают, соответственно, следующие соединения
Пример 17: 3-Циклопентилбензотиофен-6-ол
Т. пл. 116°С
1Н-ЯМР (ДМСО-d6): 1,45-2,20 (м, 8Н), 3,25 (м, 1Н), 6,78 (дд, 1Н), 6,96 (с, 1Н), 7,15 (д, 1Н), 7,47 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 18: 3-Циклогептилбензотиофен-6-ол
Т. пл. 140°С
1Н-ЯМР (ДМСО-d6): 1,35-2,15 (м, 12Н), 3,00 (м, 1Н), 6,79 (дд, 1Н), 6,94 (с, 1Н), 7,17 (д, 1Н), 7,48 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 19: 3-Циклооктилбензотиофен-6-ол
Т. пл. 100°С
1Н-ЯМР (ДМСО-d6): 1,35-2,10 (м, 14Н), 3,07 (м, 1Н), 6,78 (дд, 1Н), 6,95 (с, 1Н), 7,15 (д, 1Н), 7,47 (д, 1Н), 9,42 (с, 1Н, ОН).
Пример 20: 3-Циклодецилбензотиофен-6-ол
Т. пл. 108°С
1Н-ЯМР (ДМСО-d6): 1,30-2,10 (м, 18Н), 3,22 (м, 1Н), 6,79 (дд, 1Н), 6,99 (с, 1Н), 7,15 (д, 1Н), 7,48 (д, 1Н), 9,42 (с, 1Н, ОН).
Пример 21: 3-(4-Метилциклогексил)бензотиофен-6-ол
Т. пл. 132°С
1Н-ЯМР (ДМСО-d6): 0,70-2,10 (м, 12Н), 2,70 (м, 1Н), 6,80 (дд, 1Н), 6,92 (с, 1Н), 7,15 (д, 1Н), 7,48 (д, 1Н), 9,42 (с, 1Н, ОН).
Пример 22: 3-(2-Метилциклогексил)бензотиофен-6-ол
Т. пл. 125°С
1Н-ЯМР (ДМСО-d6): 0,60-2,20 (м, 12Н), 3,05 (м, 1Н), 6,80 (дд, 1Н), 6,90 (с, 1Н), 7,16 (д, 1Н), 7,50 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 23: 3-(2,2-Диметилциклопентил)бензотиофен-6-ол
Т. пл. 90°С
1Н-ЯМР (ДМСО-d6): 0,70 (с, 3Н), 1,09 (с, 3Н), 1,45-2,20 (м, 6Н), 2,92 (дд, 1Н), 6,80 (дд, 1Н), 6,99 (с, 1Н), 7,17 (д, 1Н), 7,51 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 24: 3-(2-Адамантил)бензотиофен-6-ол
Т. пл. 184°С
1Н-ЯМР (ДМСО-d6): 1,40-2,40 (м, 14Н), 3,16 (уш. с, 1Н), 6,80 (дд, 1Н), 7,00 (с, 1Н), 7,17 (д, 1Н), 7,50 (д, 1Н), 9,43 (с, 1Н, ОН).
Пример 25: 3-Пропилбензотиофен-6-ол
Т. пл. 56°С
1Н-ЯМР (ДМСО-d6): 0,97 (т, 3Н), 1,68 (м, 2Н), 2,79 (т, 2Н), 6,80 (дд, 1Н), 6,96 (с, 1Н), 7,17 (д, 1Н), 7,50 (д, 1Н), 9,46 (с, 1Н, ОН).
Пример 26: 3-Гексилбензотиофен-6-ол
Т. пл. 68°С
1Н-ЯМР (ДМСО-d6): 0,85 (т, 3Н), 1,10-1,80 (м, 8Н), 2,78 (т, 2Н), 6,79 (дд, 1Н), 6,95 (с, 1Н), 7,16 (д, 1Н), 7,48 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 27: 3-Циклогексилметилбензотиофен-6-ол
Т. пл. 97°С
1Н-ЯМР (ДМСО-d6): 0,75-1,80 (м, 11Н), 2,68 (д, 2Н), 6,78 (дд, 1Н), 6,91 (с, 1Н), 7,16 (д, 1Н), 7,49 (д, 1Н), 9,45 (с, 1Н, ОН).
Пример 28: 3-Циклогептилметилбензотиофен-6-ол
Т. пл. 82°С
1Н-ЯМР (ДМСО-d6): 1,00-1,90 (м, 13Н), 2,72 (д, 2Н), 6,80 (дд, 1Н), 6,92 (с, 1Н), 7,18 (д, 1Н), 7,49 (с, 1Н), 9,48 (с, 1Н, ОН).
Получение монозамещенного бензотиофенилового эфира сульфаминовой кислоты (7)
Пример 29: 3-Циклогексилбензотиофен-6-иловый эфир сульфаминовой кислоты
Гидрид натрия (0,60 г, 24,8 ммоль) осторожно добавляют к раствору 3-циклогексилбензотиофен-6-ола (3,60 г, 15,50 ммоль) в сухом ДМФА (36 мл) при 0°С. Смесь перемешивают при комнатной температуре в течение 30 минут и при 50°С в течение 30 минут, смесь затем охлаждают (лед/вода) и добавляют амидохлорсульфоновую кислоту (4,45 г, 38,00 ммоль). Смесь выдерживают при комнатной температуре в течение 3 часов, гидролизуют насыщенным водным раствором NH4Cl, экстрагируют этилацетатом, сушат над Na2SO4, фильтруют и концентрируют в вакууме, получаясырой продукт (4,80 г) в виде масла. Продукт очищают флэш-хроматографией на силикагеле (толуол/1,2-диоксан: 8/2) с получением прозрачного масла, которое перекристаллизовывают из этанола, получая указанное в заголовке соединение (0,50 г, 10%, т.пл. 128°С).
1Н-ЯМР (CDCl3): 1,15-2,20 (м, 10Н), 2,90 (м, 1Н), 7,18 (с, 1Н), 7,24 (дд, 1Н), 7,30 (д, 1Н), 7,32 (с, 1Н), 7,98 (с, 2Н, NH2).
В соответствии с описанной выше методикой, но заменяя 3-циклогексилбензотиофен-6-ол на
- 3-циклопентилбензотиофен-6-ол;
- 3-циклогептилбензотиофен-6-ол;
- 3-циклооктилбензотиофен-6-ол;
- 3-циклодецилбензотиофен-6-ол;
- 3-(4-метилциклогексил)бензотиофен-6-ол;
- 3-(2-метилциклогексил)бензотиофен-6-ол;
- 3-(2,2-диметилциклопентил)бензотиофен-6-ол;
- 3-(2-адамантил)бензотиофен-6-ол;
- 3-пропилбензотиофен-6-ол;
- 3-гексилбензотиофен-6-ол;
- 3-циклогексилметилбензотиофен-6-ол;
- 3-циклогептилметилбензотиофен-6-ол,
получают, соответственно, следующие соединения:
Пример 30: 3-Циклопентилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 110°С
1Н-ЯМР (ДМСО-d6): 1,50-2,30 (м, 8Н), 3,39 (м, 1Н), 7,20 (с, 1Н), 7,72 (дд, 1Н), 7,78 (д, 1Н), 7,95 (с, 2Н, NH2).
Пример 31: 3-Циклогептилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 132°С
1Н-ЯМР (ДМСО-d6): 1,35-2,20 (м, 12Н), 3,12 (м, 1Н), 7,19 (с, 1Н), 7,24 (дд, 1Н), 7,75 (д, 1Н), 7,80 (д, 1Н), 7,95 (с, 2Н, NH2).
Пример 32: 3-Циклооктилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 126°С
1Н-ЯМР (ДМСО-d6): 0,90-2,20 (м, 14Н), 3,18 (м, 1Н), 7,17 (с, 1Н), 7,23 (дд, 1Н), 7,76 (д, 1Н), 7,80 (д, 1Н), 7,95 (с, 2Н, NH2).
Пример 33: 3-Циклодецилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 98°С
1Н-ЯМР (ДМСО-d6): 1,30-2,10 (м, 18Н), 3,31 (м, 1Н), 7,20 (с, 1Н), 7,23 (дд, 1Н), 7,76 (д, 1Н), 7,79 (д, 1Н), 7,96 (с, 2Н, NH2).
Пример 34: 3-(4-Метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 132°С
1Н-ЯМР (ДМСО-d6): 0,75-2,15 (м, 12Н), 2,55 (м, 1Н), 7,25 (с, 1Н), 7,55 (дд, 1Н), 7,60 (д, 1Н), 7,70 (д, 1Н), 8,25 (с, 2Н, NH2).
Пример 35: 3-(2-Метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 110°С
1Н-ЯМР (ДМСО-d6): 0,65-2,30 (м, 12Н), 3,15 (м, 1Н), 7,05-7,35 (м, 2Н), 7,70-7,89 (м, 2Н), 7,97 (с, 2Н, NH2).
Пример 36: 3-(2,2-Диметилциклопентил)бензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 72°С
1Н-ЯМР (ДМСО-d6): 0,70 (с, 3Н), 1,10 (с, 3Н), 1,45-2,30 (м, 6Н), 3,02 (дд, 1Н), 7,20 (с, 1Н), 7,23 (дд, 1Н), 7,78 (д, 1Н), 7,80 (с, 1Н), 7,96 (с, 2Н, NH2).
Пример 37: 3-(2-Адамантил)бензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 185°С
1Н-ЯМР (ДМСО-d6): 1,50-2,40 (м, 12Н), 3,37 (уш.с, 1Н), 7,24 (м, 2Н), 7,80 (д, 1Н), 7,82 (с, 1Н), 7,97 (с, 2Н, NH2).
Пример 38: 3-Пропилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 112°С
1Н-ЯМР (ДМСО-d6): 0,96 (т, 3Н), 1,70 (м, 2Н), 2,88 (т, 2Н), 7,19 (с, 1Н), 7,24 (дд, 1Н), 7,78 (д, 1Н), 7,80 (с, 1Н), 7,97 (с, 2Н, NH2).
Пример 39: 3-Гексилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 125°С
1Н-ЯМР (ДМСО-d6): 0,95 (т, 3Н), 1,10-1,80 (м, 8Н), 2,88 (т, 2Н), 7,19 (с, 1Н), 7,22 (дд, 1Н), 7,77 (д, 1Н), 7,79 (с, 1Н), 7,96 (с, 2Н, NH2).
Пример 40: 3-Циклогексилметилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 115°С
1Н-ЯМР (ДМСО-d6): 0,80-1,80 (м, 11Н), 2,78 (д, 2Н), 7,16 (с, 1Н), 7,24 (дд, 1Н), 7,77 (д, 1Н), 7,79 (с, 1Н), 7,97 (с, 2Н, NH2).
Пример 41: 3-Циклогептилметилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 90°С
1Н-ЯМР (ДМСО-d6): 1,00-2,00 (м, 13Н), 2,82 (д, 2Н), 7,18 (с, 1Н), 7,22 (дд, 1Н), 7,78 (д, 1Н), 7,80 (с, 1Н), 7,97 (с, 2Н, NH2).
Получение моно- или диоксидов монозамещенных производных (8)
Пример 42: 3-Циклогексилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1-оксид
К раствору 3-циклогексилбензотиофен-6-илового эфира сульфаминовой кислоты (1,00 г, 3,21 ммоль) в дихлорметане (20 мл) и трифторуксусной кислоте (5 мл) добавляют 35% водный раствор пероксида водорода (0,35 мл, 3,42 ммоль, 1,05 экв.). Смесь выдерживают в течение 2 часов при 50°С и затем гидролизуют насыщенным водным раствором NaHCO3, экстрагируют дихлорметаном, сушат над Na2SO4, фильтруют и концентрируют в вакууме с получениемсырого продукта. Продукт очищают флэш-хроматографией на силикагеле (толуол/1,4-диоксан: 6/4) с получением прозрачного масла, которое кристаллизуют из этанола, получая указанный в заголовке продукт (0,25 г, 24%, т.пл. 110°С).
1Н-ЯМР (ДМСО-d6): 1,10-2,15 (м, 10Н), 2,72 (м, 1Н), 7,10 (с, 1Н), 7,45 (дд, 1Н), 7,64 (д, 1Н), 7,84 (д, 1Н), 8,16 (с, 2Н, NH2).
В соответствии с описанной методикой, но заменяя 3-циклогексилбензотиофен-6-иловый эфир на
- 3-циклодецилбензотиофен-6-иловый эфир сульфаминовой кислоты
получают следующие соединения:
Пример 43: 3-Циклодецилбензофитофен-6-иловый эфир сульфаминовой кислоты, 1 оксид
Т. пл. 146°С
1Н-ЯМР (ДМСО-d6): 1,35-2,10 (м, 18Н), 3,12 (м, 1Н), 7,15 (с, 1Н), 7,45 (дд, 1Н), 7,62 (д, 1Н), 7,83 (д, 1Н), 8,15 (с, 2Н, NH2).
В соответствии с методикой, описанной в примере 43, но используя 2,2 эквивалентный пероксид водорода, получают следующие соединения:
Пример 44: 3-Циклогексилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 180°С
1Н-ЯМР (ДМСО-d6): 1,15-2,15 (м, 10Н), 2,52 (м, 1Н), 7,30 (с, 1Н), 7,53 (дд, 1Н), 7,63 (д, 1Н), 7,71 (д, 1Н), 8,25 (с, 2Н, NH2).
В соответствии с описанной выше методикой, но заменяя 3-циклгексилбензотиофен-6-иловый эфир сульфаминовой кислоты на
- 3-циклогептилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-циклооктилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-циклодецилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-(4-метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-(2-метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-(2,2-диметилциклопентил)бензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-(2-адамантил)бензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-пропилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-гексилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-циклогексилметилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-циклогептилметилбензотиофен-6-иловый эфир сульфаминовой кислоты,
получают, соответственно, следующие соединения:
Пример 45: 3-Циклогептилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 137°С
1Н-ЯМР (ДМСО-d6): 1,35-2,15 (м, 12Н), 2,75 (м, 1Н), 7,32 (с, 1Н), 7,52 (дд, 1Н), 7,61 (д, 1Н), 7,70 (д, 1Н), 8,25 (с, 2Н, NH2).
Пример 46: 3-Циклооктилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 122°С
1Н-ЯМР (ДМСО-d6): 1,35-2,10 (м, 14Н), 2,81 (м, 1Н), 7,32 (с, 1Н), 7,52 (дд, 1Н), 7,61 (д, 1Н), 7,70 (д, 1Н), 8,22 (с, 2Н, NH2).
Пример 47: 3-Циклодецилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 102°С
1Н-ЯМР (ДМСО-d6): 1,35-2,10 (м, 18Н), 2,97 (м, 1Н), 7,38 (с, 1Н), 7,52 (дд, 1Н), 7,60 (д, 1Н), 7,70 (д, 1Н), 8,22 (с, 2Н, NH2).
Пример 48: 3-(4-Метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 170°С
1Н-ЯМР (ДМСО-d6): 0,75-2,20 (м, 12Н), 2,83 (м, 1Н), 7,18 (с, 1Н), 7,22 (дд, 1Н), 7,78 (д, 1Н), 7,80 (д, 1Н), 7,95 (с, 2Н, NH2).
Пример 49: 3-(2-Метилциклогексил)бензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 92°С
1Н-ЯМР (ДМСО-d6): 0,70-2,45 (м, 12Н), 2,85 (м, 1Н), 7,25 (с, 1Н), 7,52 (м, 3Н), 8,25 (с, 2Н, NH2).
Пример 50: 3-(2,2-Диметилциклопентил)бензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 172°С
1Н-ЯМР (ДМСО-d6): 0,90 (с, 3Н), 1,16 (с, 3Н), 1,50-2,15 (м, 6Н), 2,66 (т, 1Н), 7,49 (с, 1Н), 7,52 (дд, 1Н), 7,61 (д, 1Н), 7,70 (д, 1Н), 8,24 (с, 2Н, NH2).
Пример 51: 3-(2-Адамантил)бензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 230°С
1Н-ЯМР (ДМСО-d6): 1,45-2,45 (м, 14Н), 3,04 (уш.с, 1Н), 7,38 (с, 1Н), 7,53 (д, 1Н), 7,64 (д, 1Н), 7,70 (д, 1Н), 8,25 (с, 2Н, NH2).
Пример 52: 3-пропилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 159°С
1Н-ЯМР (ДМСО-d6): 0,99 (т, 3Н), 1,70 (м, 2Н), 2,49 (т, 2Н), 7,29 (с, 1Н), 7,52 (дд, 1Н), 7,63 (д, 1Н), 7,73 (д, 1Н), 8,50 (с, 2Н, NH2).
Пример 53: 3-Гексилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 98°С
1Н-ЯМР (ДМСО-d6): 0,85 (т, 3Н), 1,10-1,80 (м, 8Н), 2,50 (т, 2Н), 7,30 (с, 1Н), 7,52 (дд, 1Н), 7,62 (д, 1Н), 7,73 (д, 1Н), 8,27 (с, 2Н, NH2).
Пример 54: 3-Циклогексилметилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 132°С
1Н-ЯМР (ДМСО-d6): 0,80-1,95 (м, 11Н), 2,40 (д, 2Н), 7,30 (с, 1Н), 7,53 (дд, 1Н), 7,62 (д, 1Н), 7,72 (д, 1Н), 8,25 (с, 2Н, NH2).
Пример 55: 3-Циклогептилметилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 135°С
1Н-ЯМР (ДМСО-d6): 1,00-2,15 (м, 13Н), 2,45 (д, 2Н), 7,29 (с, 1Н), 7,53 (дд, 1Н), 7,62 (д, 1Н), 7,73 (д, 1Н), 8,25 (с, 2Н, NH2).
Получение дизамещенного 6-метоксибензотиофена (9)
Пример 56: 3-Циклогептил-6-метокси-2-метилбензотиофена
К раствору 3-Циклогептил-6-метоксибензотиофена (2,00 г, 7,69 ммоль) в сухом ТГФ (20 мл) при -70°С по каплям добавляют 2,5 М раствор н-бутиллития в гексане (5 мл, 12,16 ммоль). После этого смесь нагревают до -30°С в течение 10 минут и охлаждают до -70°С для добавления йодметана (1,0 мл, 15,38 ммоль). Смесь нагревают до комнатной температуры в течение ночи, затем гидролизуют насыщенным водным раствором NH4Cl, экстрагируют этилацетатом, сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением 2,1 г масла. Масло очищают флэш-хроматографией на силикагеле (гептан/этилацетат: 1/1), получая продукт в виде прозрачного масла (1,50 г, 72%), которое используют без дополнительной очистки.
1Н-ЯМР (ДМСО-d6): 1,35-2,15 (м, 12Н), 2,29 (с, 3Н), 3,00 (м, 1Н), 3,80 (с, 3Н), 7,00 (с, 1Н), 7,04 (д, 1Н), 7,49 (д, 1Н).
В соответствии с описанной методикой, но заменяя йодметан на
- бромбутан
получают следующее соединение:
Пример 57: 3-Циклогептил-6-метокси-2-бутилбензотиофен
1Н-ЯМР (ДМСО-d6): 0,90 (т, 3Н), 1,10-2,20 (м, 16Н), 2,75 (т, 2Н), 3,04 (м, 1Н), 3,80 (с, 3Н), 7,00 (с, 1Н), 7,05 (д, 1Н), 7,51 (д, 1Н).
Пример 58: 7-Метокси-1,2,3,4-тетрагидродибензотиофен
Данное соединение получают в соответствии с методикой, описанной в публикации Oliveira M. (Tetrahedron, 2002, 58, 1709-18).
1Н-ЯМР (CDCl3): 1,92 (м, 4Н), 2,72 (м, 2Н), 2,83 (м, 2Н), 3,89 (с, 3Н), 6,97 (дд, 1Н), 7,30 (д, 1Н), 7,47 (д, 1Н).
Получение дизамещенного бензотиофенола (10)
В соответствии с методикой, используемой для монозамещенных производных, но заменяя 3-циклогексил-6-метоксибензотиофен на
- 3-циклогептил-2-метил-6-метоксибензотиофен;
- 3-циклогептил-6-метокси-2-бутилбензотиофен;
- 7-метокси-1,2,3,4-тетрагидродибензотиофен
получают, соответственно, следующие соединения:
Пример 59: 3-Циклогептил-2-метилбензотиофен-6-ол
Т. пл. 96°С
1Н-ЯМР (ДМСО-d6): 1,30-2,15 (м, 12Н), 2,44 (с, 3Н), 3,01 (м, 1Н), 6,87 (д, 1Н), 6,97 (с, 1Н), 7,34 (д, 1Н), 9,31 (с, 1Н, ОН).
Пример 60: 3-Циклогептил-2-бутилбензотиофен-6-ол
Прозрачное масло.
1Н-ЯМР (ДМСО-d6): 0,92 (т, 3Н), 1,15-2,20 (м, 16Н), 2,80 (т, 2Н), 3,02 (м, 1Н), 6,85 (д, 1Н), 6,95 (с, 1Н), 7,32 (д, 1Н), 9,22 (с, 1Н, ОН).
Пример 61: 1,2,3,4-Тетрагидродибензотиофен-7-ол
Т. пл. 116°С
1Н-ЯМР (CDCl3): 1,90 (м, 4Н), 2,68 (м, 2Н), 2,79 (м, 2Н), 4,98 (уш.с, 1Н, ОН), 6,88 (дд, 1Н), 7,20 (д, 1Н), 7,42 (д, 1Н).
Получение дизамещенного бензотиофенилового эфира сульфаминовой кислоты (11)
В соответствии с методикой, используемой для получения монозамещенных производных, но заменяя 3-циклогексилбензотиофен-6-ол на
- 3-циклогептил-2-метилбензотиофен-6-ол;
- 3-циклогептил-2-бутилбензотиофен-6-ол;
- 1,2,3,4-тетрагидродибензотиофен-7-ол
получают, соответственно, следующие соединения:
Пример 62: 3-Циклогептил-2-метилбензотиофен-6-иловый эфир сульфаминовой кислоты
Т. пл. 107°С
1Н-ЯМР (ДМСО-d6):1,40-2,20 (м, 12Н), 2,46 (с, 3Н), 3,14 (м, 1Н), 7,20 (с, 1Н), 7,30 (дд, 1Н), 7,60 (д, 1Н), 8,00 (с, 2Н, NH2).
Пример 63: 3-Циклогептил-2-бутилбензотиофен-6-иловый эфир сульфаминовой кислоты
Прозрачное масло.
1Н-ЯМР (ДМСО-d6): 0,91 (т, 3Н), 1,15-2,20 (м, 16Н), 2,77 (т, 2Н), 3,11 (м, 1Н), 7,15 (с, 1Н), 7,32 (д, 1Н), 7,59 (д, 1Н), 8,04 (с, 2Н, NH2).
Пример 64: 1,2,3,4-Тетрагидродибензотиофен-7-иловый эфир сульфаминовой кислоты
Т. пл. 165°С
1Н-ЯМР (ДМСО-d6): 1,87 (м, 4Н), 2,70 (м, 2Н), 2,82 (м, 2Н), 7,28 (дд, 1Н), 7,66 (д, 1Н), 7,72 (д, 1Н).
Получение дизамещенных диоксидпроизводных (12)
В соответствии с методикой, используемой для получения монозамещенных производных, но заменяя 3-циклогептилбензотиофен-6-иловый эфир сульфаминовой кислоты на
- 3-циклогептил-2-метилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 3-циклогептил-2-бутилбензотиофен-6-иловый эфир сульфаминовой кислоты;
- 1,2,3,4-тетрагидродибензотиофен-7-иловый эфир сульфаминовой кислоты
получают, соответственно, следующие соединения:
Пример 65: 3-Циклогептил-2-метилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 90°С
1Н-ЯМР (ДМСО-d6): 1,30-2,20 (м, 12Н), 2,48 (с, 3Н), 2,76 (м, 1Н), 7,28 (с, 1Н), 7,41 (д, 1Н), 7,52 (д, 1Н), 8,27 (с, 2Н, NH2).
Пример 66: 3-Циклогептил-2-бутилбензотиофен-6-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Прозрачное масло.
1Н-ЯМР (ДМСО-d6): 0,91 (т, 3Н), 1,15-2,15 (м, 16Н), 2,75 (м, 1Н), 2,90 (т, 2Н), 7,25 (с, 1Н), 7,40 (д, 1Н), 7,56 (д, 1Н), 8,31 (с, 2Н, NH2).
Пример 67: 1,2,3,4-Тетрагидродибензотиофен-7-иловый эфир сульфаминовой кислоты, 1,1-диоксид
Т. пл. 229°С
1Н-ЯМР (ДМСО-d6): 1,78 (м, 4Н), 2,30 - 2,70 (м, 4Н), 7,54 (дд, 1Н), 7,61 (д, 1Н), 7,74 (д, 1Н).
РЕЗУЛЬТАТЫ БИОЛОГИЧЕСКИХ ИСПЫТАНИЙ
Ингибирование стероидной сульфатазы in vitro
Эстронсульфат (E1S) представляет собой основной циркулирующий в плазме эстроген, который под действием фермента стероидной сульфатазы превращается в эстрон (Е1), который, в свою очередь, может подвергаться трансформации в эстрадиол (Е2) ферментативным восстановлением. Активность стероидной сульфатазы представлена в большинстве тканей (матка, печень, молочная железа и т.д.) и значительно выше в злокачественной, чем в нормальной ткани молочной железы. Тесная связь эстрогенов с ускорением роста и развития рака молочной железы давно признана, следовательно, стероиднная сульфатаза оказывается потенциальной мишенью для ингибирования in situ образования эстрогенов.
Были синтезированы высокоэффективные ингибиторы данного фермента, содержащие сульфаматный фрагмент, который, как полагают, вовлечен в необратимое ингибирование стероидной сульфатазы. До настоящего времени наиболее активным соединением данного класса являлся ЕМАТЕ, эстрон-3-сульфамат, но эстрогенная активность данного соединения делает его неподходящим для применения в лечении гормонозависимых опухолей. Было описано большое количество отличающихся по структуре ингибиторов стероидной сульфатазы, к которым относится и 6,6,7-COUMATE, используемый в качестве стандартного нестероидного ингибитора, не обладающего эстрогенными свойствами.
Результаты испытания in vitro
Используют две in vitro модели испытания на цельных клетках. JEG-3 клеточная линия, полученная из плацентарной хориокарциномы, изначально содержит значительное количество эстронсульфатазы человека, поэтому может применяться в качестве практической биологической системы для скрининга в формате 96-луночного микропланшета значительного количества соединений и оценки предполагаемых ингибиторов стероидной сульфатазы in vitro. Несмотря на более низкую активность стероидной сульфатазы, MCF-7 клетки составляют другую подходящую модель для испытания ингибиторов стероидной сульфатазы на клетках аденокарциномы молочной железы человека. Кроме того, данные клетки используют в in vivo модели гормонозависимо индуцированных ксенотрансплантатов.
Испытание эстронсульфатазы на клетках
Испытание на цельных клетках проводят в соответствии с оригинальной методикой, описанной в публикации Duncan et al., (Cancer Res., 1993, 53:298-303), в монослоях интактных MCF-7 клеток. Испытание проводят на клетках в логарифмической фазе роста в 96-луночных (JEG-3) или 24-луночных (MCF-7) микропланшетах. За 24 часа (JEG-3) или за 72 часа (MCF-7) до начала исследования клетки высевают в среду, дополненную декомплементированной фетальной телячьей сывороткой (dFCS). Затем высевную среду удаляют и клетки промывают PBS для удаления каких-либо следов dFCS. После этого добавляют 3Н-Е1S с последующим добавлением испытываемых соединений с концентрацией в интервале от 10-12 М до 10-5 М. Спустя 4 часа (JEG-3) или 20 часов (MCF-7) после обработки среду переносят либо глубокие 96-луночные микропланшеты (JEG-3) или в пластиковые пробирки (MCF-7) и центрифугируют при 200хg в течение 10 минут с получением осадка клеток перед экстракцией толуолом. Для толуольной экстракции используют фракцию среды для отделения сопряженного субстрата и несопряженных продуктов. Радиоактивность толуольной фазы определяют жидкостно-сцинтилляционным методом. И, наконец, активность эстронсульфатазы выражают в пмолях 3Н-Е1 + 3Н-Е2, образованных за 4 часа и за 20 часов, на мкг ДНК, и ингибирование эстронсульфатазы - в процентах от контрольной активности без ингибитора. Для определения концентрации 50% ингибирования (IC50) используют нелинейный анализ соответствия (GraphPad Prim Software) зависимости % ингибирования от концентраций ингибитора: самое низкое значение IC50 соответствует наиболее активным ингибиторам (Таблица 1).
Ингибирование эстронсульфатазы в испытании на цельных клетках
Среди испытанных соединений соединения примеров 42, 44, 48, 49, 50, 54 и 55 показали значительное ингибирование (IC50 примерно 10 нМ) активности эстронсульфатазы человека в JEG-3 клетках.
Указанные соединения проверяют на остаточную эстрогенную активность in vivo в классическом утеротрофическом испытании после 3-дневного перорального введения самкам крыс препубератного возраста.
Ингибирование стероидной сульфатазы in vivo
Остаточная эстрогенная активность in vivo
Самкам крыс препубератного возраста в течение трех дней перорально вводят 1 мг/крыса/сутки соединения. На следующий день после последнего введения матки удаляют и определяют массу во влажном состоянии.
Результаты представляют в виде % стимулирования массы матки по сравнению с контролем.
Остаточная эстрогенная активность
Антиутеротрофическая/антисульфатазная активность
Для оценки in vivo неэстрогенных ингибиторов стероидной сульфатазы разработана урезанная модель метода Purohit.
Самок крыс (Wistar) подвергают овариектомии и оставляют отдыхать в течение 4 недель. Перед обработкой отсутствие цикла проверяют влагалищными мазками.
Животным вводят только эстронсульфат (E1S) в дозе 50 мкг/кг/сутки подкожно или эстронсульфат в сочетании с пероральным введением потенциальных ингибиторов сульфатазы в дозе 1 мг/кг/сутки в течение 4 дней. Матки удаляют, освобождают от прилегающих тканей и определяют массу во влажном состоянии.
Результаты выражают в виде % ингибирования Е1S индуцированной стимуляции.
Антиутеротрофическая активность
Соединение примера 55 выбирают в качестве потенциального ингибитора активности стероидной сульфатазы ввиду отсутствия эстрогенности и значительного ингибирования Е1S стимулированного роста массы матки. Данные результаты испытания in vivo хорошо согласуются с результатами испытания in vitro на цельных клетках.
Оценка эффективности соединения примера 55
Активность соединения примера 55 в отношении E1S стимулированного роста массы матки оценивают в сравнении со стандартным ингибитором 6,6,7-COUMATE в интервале доз от 0,03 до 1 мг/кг/сутки перорально.
В данном исследовании через 24 часа после последнего введения проводят аутопсию для определения содержания E1S и Е2 в сыворотке. Матки удаляют, освобождают от прилегающих тканей, определяют массу во влажном состоянии и сразу подвергают глубокому замораживанию до определения сульфатазной активности.
Ингибирование E1S стимулированного роста массы матки
мг/кг/сутки
Определение активности эстронсульфатазы в матке
Активность эстронсульфатазы определяют в соответствии с методом, описанным в публикации Purohit et al., с небольшими модификациями. Коротко, матки оттаивают, взвешивают и гомогенизируют. Аликвоты супернатанта обрабатывают активированным углем, покрытым декстраном, и оценивают активность сульфатазы. Е1S активность оценивают после инкубирования в течение 30 минут с 5 нМ 3Н-Е1S и 20 мкМ немеченого E1S в качестве субстрата. Радиоактивность определяют жидкостно-сцинтилляционным методом.
Активность эстронсульфатазы выражают в виде пмоль/час/мг белка и пересчитывают в процент ингибирования в зависимости от E1S.
мг/кг/сутки
Содержание эстрогена в сыворотке
Содержание E1S и E2 определяют в соответствии с методом компании поставщика (DSL, Webster, TX, USA).
Содержание E1S (нг/мл)
мг/кг/сутки
Содержание Е2 (пг/мл)
мг/кг/день
Гормонозависимые индуцированные ксенотрансплантаты
MCF-7 клетки, выделенные из аденокарциномы молочной железы человека, вводят подкожно безтимусным, голым мышам с удаленными яичниками, снабженным эстронсульфатом (осадок клеток скоростью высвобождения 0,5 мг/90 дней). Объемы ксенотрансплантатов определяют один раз в неделю. Когда объемы опухолей значительно увеличиваются, начинают перорально вводить 6,6,7-COUMATE и соединение примера 55 в дозах 0,1 мг/кг/сутки и введение осуществляют в течение 6 недель.
Ксентрансплантаты измеряют, удаляют, взвешивают и подвергают глубокой заморозке до определения активности стероидной сульфатазы.
Объем ксенотрансплантатов (мм3)
90 дней)
0,1 мг/кг/сутки
0,1 мг/кг/сутки
6,6,7-COUMATE не ингибирует E1S индуцированное стимулирование после 6 недель перорального введения в дозе 0,1 мг/кг/день. В то же время при применении в такой же дозе соединения примера 55 наблюдают 18% ингибирование.
Масса ксенотрансплантатов (мг)
0,1 мг/кг/сутки
0,1 мг/кг/сутки
6,6,7 COUMATE не ингибирует массу ксенотрансплантата, в то время как при применении соединения примера 55 получают 35% ингибирование.
Активность стероидной сульфатазы ксенотрансплантатов (пмоль/час/мг белка)
90 дней)
0,1 мг/кг/день
0,1 мг/кг/день
Значительное повышение ингибирования активности внутриопухолевой стероидной сульфатазы наблюдается при применении соединения примера 55 (84%) по сравнению с применением 6,6,7 COUMATE (67%).
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФАМАТПРОИЗВОДНЫЕ БЕНЗОТИОФЕНА В КАЧЕСТВЕ ИНГИБИТОРОВ СТЕРОИДНОЙ СУЛЬФАТАЗЫ | 2006 |
|
RU2424237C2 |
| ПРОИЗВОДНЫЕ 1-N-ФЕНИЛАМИНО-1Н-ИМИДАЗОЛА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2004 |
|
RU2365586C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2198878C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2182574C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| СУЛЬФОНАМИДЫ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2182904C2 |
| ПРОИЗВОДНЫЕ 4-МЕРКАПТОПИРРОЛИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАРНЕЗИЛТРАНСФЕРАЗЫ | 1996 |
|
RU2191773C2 |
| Способ получения 7-замещенных 4,4-диметил-9-оксо-4,4а-дигидро-9Н-ксантен-2-карбоновых кислот и их цитотоксическая активность | 2017 |
|
RU2645679C1 |
| ФОТОХРОМНЫЕ ПОЛИМЕРЫ ДЛЯ ТРЕХМЕРНОЙ ОПЕРАТИВНОЙ ОПТИЧЕСКОЙ ПАМЯТИ | 2004 |
|
RU2345997C2 |
| ПРОИЗВОДНЫЕ ЭТИЛЕНДИАМИНА И СОДЕРЖАЩИЕ ИХ ИНГИБИТОР FXa И АНТИКОАГУЛЯНТ | 2001 |
|
RU2268259C2 |
Настоящее изобретение относится к сульфаматпроизводным бензотиофена, полученным способом, включающим стадии:
1) превращение 6-метоксибензотиофена (3):
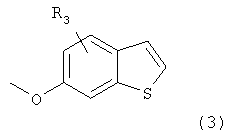
где R3 представляет собой водород, в соответствующее монобромпроизводное с использованием N-бромсукцинимида и APTS в стандартных условиях;
2) превращение указанного монобромпроизводного взаимодействием с Mg в Et2O в атмосфере аргона в магнийорганический бромид и последующая конденсация его с кетоном или альдегидом, выбранными из группы, состоящей из циклопентанона, циклогексанона, циклогептанона, циклооктанона, циклодеканона, 4-метилциклогексанона, 2-метилциклогексанона, 2,2-диметилциклопентанона, 2-адамантанона, пропаналя, гексаналя, циклогексанкарбоксальдегида, циклогептанкарбоксальдегида в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработку указанного гидроксизамещенного метоксибензотиофена с триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) необязательное алкилирование соответствующего замещенного метоксибензотиофена при использовании стандартных условий с получением соответствующего замещенного метоксибензотиофена, несущего (С1-С6)алкил или (С3-С12)циклоалкил;
5) удаление защитной группы из замещенного метоксибензотиофена, полученного на стадии 3) или стадии 4) в присутствии трибромборана в стандартных условиях;
6) превращение полученного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидохлорсульфоновой кислотой, или взаимодействием с сульфамоилхлоридом в диметилацетамиде;
7) необязательное окисление полученного соединения пероксидом водорода в трифторуксусной кислоте в стандартных условиях.
Соединения могут быть использованы в качестве ингибиторов фермента стероидной сульфатазы при производстве лекарственного средства для лечения или профилактики эстрогензависимых расстройств. Описаны также фармацевтическая композиция на основе соединений I и применение последних. 9 н. и 34 з.п. ф-лы, 1 ил., 10 табл.
1) превращение 6-метоксибензотиофена (З):
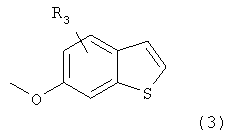
где R2 представляет собой водород, в соответствующее монобромпроизводное с использованием N-бромсукцинимида и APTS в стандартных условиях;
2) превращение указанного монобромпроизводного взаимодействием с Mg в Et2O в атмосфере аргона в магнийорганический бромид и последующая конденсация его с кетоном или альдегидом, выбранными из группы, состоящей из циклопентанона, циклогексанона, циклогептанона, циклооктанона, циклодеканона, 4-метилциклогексанона, 2-метилциклогексанона, 2,2-диметилциклопентанона, 2-адамантанона, пропаналя, гексаналя, циклогексанкарбоксальдегида, циклогептанкарбоксальдегида в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработку указанного гидроксизамещенного метоксибензотиофена с триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) необязательное алкилирование соответствующего замещенного метоксибензотиофена при использовании стандартных условий с получением соответствующего замещенного метоксибензотиофена, несущего (С1-С6)алкил или (С3-С12) циклоалкил;
5) удаление защитной группы из замещенного метоксибензотиофена, полученного на стадии 3) или стадии 4) в присутствии трибромборана в стандартных условиях;
6) превращение полученного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидохлорсульфоновой кислотой, или взаимодействием с сульфамоилхлоридом в диметилацетамиде;
7) необязательное окисление полученного соединения пероксидом водорода в трифторуксусной кислоте в стандартных условиях.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензитиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 1,05 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклодеканоном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклодеканоном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 1,05 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклооктаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклооктаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклодеканоном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 4-метилциклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 4-метилциклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2-метилциклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2-метилциклогексаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2,2-диметилциклопентаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2,2-диметилциклопентаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2-адамантаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с 2-адамантаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с пропаналем в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с пропаналем в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с гексаналем в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с гексаналем в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработкой указанного гидрозамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогексанкарбоксальдегидом в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогексанкарбоксальдегидом в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептанкарбоксальдегидом в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептанкарбоксальдегидом в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
6) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) алкилирование соответствующего замещенного метоксибензотиофена путем добавления йодометана к смеси указанного монозамещенного метоксибензотиофена в растворе н-бутиллития в гексане с получением соответствующего метоксибензотиофена;
5) добавление замещенного метоксибензотиофена, полученного на стадии 4) в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
6) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) алкилирование соответствующего замещенного метоксибензотиофена путем добавления йодометана к смеси указанного монозамещенного метоксибензотиофена в растворе н-бутиллития в гексане с получением соответствующего метоксибензотиофена;
5) добавление замещенного метоксибензотиофена, полученного на стадии 4), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
6) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
7) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) алкилирование соответствующего замещенного метоксибензотиофена путем добавления бромбутана к смеси указанного монозамещенного метоксибензотиофена в растворе н-бутиллития в гексане с получением соответствующего метоксибензотиофена;
5) добавление замещенного метоксибензотиофена, полученного на стадии 4), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
6) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклогептаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) алкилирование соответствующего замещенного метоксибензотиофена путем добавления бромбутана к смеси указанного монозамещенного метоксибензотиофена в растворе н-бутиллития в гексане с получением соответствующего метоксибензотиофена;
5) добавление замещенного метоксибензотиофена, полученного на стадии 4), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
6) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой;
7) окисление полученного соединения 2,2 эквивалентами пероксида водорода в трифторуксусной кислоте и дихлорметане.
1) превращение 6-метоксибензотиофена (3) в соответствующее монобромпроизводное взаимодействием с N-бромсукцинимидом и n-толуолсульфоновой кислотой;
2) превращение указанного монобромпроизводного взаимодействием с Mg в атмосфере аргона в Et2O в магнийорганический бромид и последующая конденсация его с циклопентаноном в Et2O с получением соответствующего гидроксизамещенного метоксибензотиофена в стандартных условиях;
3) обработка указанного гидроксизамещенного метоксибензотиофена триэтилсиланом в атмосфере аргона в дихлорметане с получением соответствующего замещенного метоксибензотиофена;
4) добавление замещенного метоксибензотиофена, полученного на стадии 3), в растворе дихлорметана к раствору трибромида бора с получением соответствующего гидроксибензотиофена;
5) превращение указанного гидроксисоединения в соответствующий сульфамат обработкой гидридом натрия и амидхлорсульфоновой кислотой.
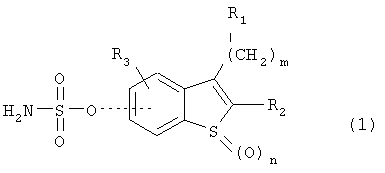
где R1 и R2 вместе образуют группу -(СН2)р-, в которой р равно 4;
R3 представляет собой водород;
n равно 0, 1, 2;
m равно 0;
пунктирная линия показывает, что сульфаматная группа находится в положении 6-бензотиофенового кольца.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2008-12-27—Публикация
2003-05-16—Подача