Изобретение относится к новым ароматическим соединениям и их фармацевтически приемлемым солям, обладающим ценными фармакологическими свойствами. Более конкретно, соединения по изобретению являются антагонистами болеусиливающего действия простагландинов Е-типа. Изобретение относится также к способам получения ароматических соединений и их фармацевтически приемлемых солей; к содержащим их новым фармацевтическим композициям и к использованию соединений для ослабления боли.
Соединения по изобретению могут быть использованы для ослабления боли, такой как боль, связанная с заболеванием суставов (например, ревматоидный артрит и остеоартрит), послеоперационная боль, послеродовая боль, боль, связанная с заболеванием зубов (например, кариес зубов и гингивит), боль, связанная с ожогами (включая солнечный ожог); для лечения заболеваний костей (таких, как остеопороз, злокачественная гиперкальцемия и болезнь Педжета); для ослабления боли, связанной со спортивными травмами и растяжением связок, а также для лечения любых других болезненных состояний, в которых простагландины Е-типа целиком или частично играют патофизиологическую роль.
Нестероидные противовоспалительные средства (НСПВС) и опиаты представляют собой основной класс болеутоляющих препаратов. Однако обе эти группы соединений оказывают нежелательное побочное действие. Известно, что НСПВС вызывают раздражение желудочно-кишечного тракта, а опиаты, как известно, являются наркотическими средствами.
Заявители обнаружили класс соединений, которые структурно отличаются от НСПВС и опиатов и которые могут быть использованы в качестве болеутоляющих средств.
Соединения по изобретению могут также обладать противовоспалительным, жаропонижающим и противопоносным свойствами и быть эффективными при лечении других состояний, в которых простагландин Е2-(PGE2) целиком или частично играет патофизиологическую роль.
В Европейской патентной заявке 0000816 (Пример 28) описана 2-[2-метоксибензиламино] пиридин-5-карбоновая кислота, которая, как указывается, может быть использована для лечения диабета. В патенте США 4 362 892 (Пример 8) описана 4-[2-метоксибензиламино] бензойная кислота и указывается, что это соединение обладает гиполипидемической активностью. 3-[2-Метоксибензиламино] -4-хлор-5-сульфамоилбензойная кислота и 3-[2,3-диметоксибензиламино]-4-хлор-5-сульфамоилбензойная кислота описаны Р. Feit и др. (J. Med. Chem., 1970, 13, 1071) как диуретические средства. 5-[2,5-Диметоксибензиламино]-2-гидроксибензойная кислота описана Р. Nussbaumer и др. (J. Med. Chem., 1994, 34, 4079) как антипролиферативное средство.
Настоящее изобретение относится к соединению формулы I: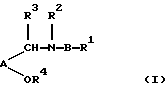
где А представляет необязательно замещенные:
фенил, нафтил, пиридил, пиразинил, пиридазинил, пиримидил, тиенил, тиазолил, оксазолил или тиадиазолил, имеющие, по крайней мере, два смежных кольцевых атома углерода;
при условии, что группы -CH(R3)N(R2)B-R1 и -OR4 находятся в 1,2-положениях по отношению друг к другу на кольцевых атомах углерода и кольцевой атом углерода, находящийся в ортоположении по отношению к ОR4-присоединенной группе (и, следовательно, в 3-положении по отношению к -CHR3NR2 - присоединенной группе), является незамещенным;
В представляет необязательно замещенные:
фенил, пиридил, тиазолил, оксазолил, тиенил, тиадиазолил, имидазолил, пиразинил, пиридазинил или пиримидил;
R1 находится в кольце B в 1,3- или 1,4-положении по отношению к -CH(R3)N(R2)-присоединенной группе и представляет карбокси, карбоксиС1-3алкил, тетразолил, тетразолилС1-3алкил, тетроновую кислоту, гидроксамовую кислоту, сульфоновую кислоту, либо R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или C1-6алкил и Ra1 представляет водород, C1-6алкил (необязательно замещенный галогеном, амино, С1-4алкиламино, ди-С1-4алкиламино, гидрокси, нитро, циано, трифторметилом, С1-4алкокси или C1-4алкоксикарбонилом), С2-6алкенил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), карбоксифенил, 5- или 6-членный гетероциклилС1-3алкил, 5- или 6-членный гетероарилС1-3алкил, 5- или 6-членный гетероциклил или 5- или 6-членный гетероарил; либо Ra и Ra1, взятые вместе с атомом азота амидной группы, к которому они присоединены (NRaRa1), образуют аминокислотный остаток или его сложный эфир, либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет C1-6алкил (необязательно замещенный галогеном, гидрокси, нитро, циано, трифторметилом, C1-4алкокси, амино, С1-4алкиламино, ди-С1-4алкиламино или С1-4алкоксикарбонилом), С2-6алкенил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), 5- или 6-членный гетероциклилС1-3алкил, 5- или 6-членный гетероарилС1-3алкил, фенилС1-3алкил, 5- или 6-членный гетероциклил, 5- или 6-членный гетероарил или фенил;
где любая гетероциклическая или гетероарильная группа в Ra1 является необязательно замещенной галогеном, гидрокси, нитро, циано, трифторметилом, С1-4алкокси или С1-4алкоксикарбонилом и любая фенильная, гетероциклическая или гетероарильная группа в Rb является необязательно замещенной галогеном, трифторметилом, нитро, гидрокси, амино, циано, C1-6алкокси, С1-6алкилS(O)р- (р=0, 1 или 2), C1-6алкилом, карбамоилом, С1-4алкилкарбамоилом, ди(С1-4алкил) карбамоилом, С2-6алкенилом, С2-6алкинилом, С1-4алкоксикарбониламино, С1-4алканоиламино, С1-4алканоил(N-С1-4алкил) амино, С1-4алкансульфонамидо, бензолсульфонамидо, аминосульфонилом, С1-4алкиламиносульфонилом, ди(С1-4алкил) аминосульфонилом, С1-4алкоксикарбонилом, С1-4алканоилокси, C1-6алканоилом, формилС1-4алкилом, гидроксииминоС1-6алкилом, С1-4алкоксииминоС1-6алкилом или C1-6алкилкарбамоиламино; или R1 представляет группу формулы -SO2N(Rc)Rc1, где Rc представляет водород или С1-4алкил и Rc1 представляет водород или С1-4алкил;
или R1 представляет группу формулы (IA), (IB) или (IC):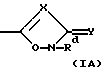
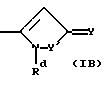
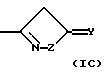
где X представляет СН или азот, Y представляет кислород или серу, Y' представляет кислород или NRd и Z представляет CH2, NRd или кислород, при условии, что в кольце имеется не более одного атома кислорода и, по крайней мере, имеется два гетероатома, и где Rd представляет водород или C1-4алкил.
R2 представляет водород, C1-6алкил, необязательно замещенный гидрокси, циано или трифторметилом; С2-6алкенил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), фенил C1-3алкил или пиридилС1-3алкил;
R3 представляет водород, метил или этил;
R4 представляет необязательно замещенные: C1-6алкил, С3-7циклоалкилС1-3алкил или С3-7циклоалкил;
и N-оксиды группы -NR2, где это химически возможно;
и S-оксиды серусодержащих колец, где это химически возможно;
и их фармацевтически приемлемые соли и in vivo-гидролизуемые сложные эфиры и амиды, за исключением 2-[2-метокси-бензиламино]пиридин-5-карбоновой кислоты, 4-[2-метоксибензил-амино] бензойной кислоты, 3-[2-метоксибензиламино] -4-хлор-5-сульфамоилбензойной кислоты, 3-[2,3-диметоксибензиламино]-4-хлор-5-сульфамоилбензойной кислоты и 5-[2,5-диметокси-бензиламино]-2-гидроксибензойной кислоты.
5- или 6-членной гетероарильной кольцевой системой является моноциклическая арильная кольцевая система, имеющая 5 или 6 кольцевых атомов, где 1, 2 или 3 кольцевых атома выбраны из атомов азота, кислорода и серы.
5- или 6-членным насыщенным или частично насыщенным гетероциклическим кольцом является кольцевая система, имеющая 5 или 6 кольцевых атомов, где 1, 2 или 3 кольцевых атома выбраны из атомов азота, кислорода и серы.
Конкретными 5- или 6-членными моноциклическими гетероарильными кольцами являются пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, тиазолил, тиадиазолил, тиенил, фурил и оксазолил.
Конкретными 5- или 6-членными насыщенными или частично насыщенными гетероциклическими кольцевыми системами являются пирролидинил, пирролинил, имидазолидинил, пиразолидинил, пиперидил, пиперазинил и морфолинил.
Конкретные заместители у кольцевых атомов углерода в А (гетероциклические и гетероарильные кольца) включают галоген, трифторметил, нитро, гидрокси, амино, С1-4алкиламино, ди-С1-4алкиламино, циано, C1-6алкокси, С1-6алкил S(O)р- (р=0, 1 или 2), C1-6алкил (необязательно замещенный гидрокси, амино, галогеном, нитро или циано), СF3S(O)р- (р=0, 1 или 2), карбамоил, С1-4алкилкарбамоил, ди(С1-4алкил) карбамоил, С2-6алкенил, С2-6алкинил, C1-4алкоксикарбониламино, С1-4алканоиламино, С1-4алканоил (N-С1-4алкил) амино, C1-4алкансульфонамидо, бензолсульфонамидо, аминосульфонил, С1-4алкиламиносульфонил, С1-4алканоиламиносульфонил, ди(С1-4алкил) аминосульфонил, С1-4алкоксикарбонил, С1-4алканоилокси, C1-6алканоил, формилС1-4алкил, трифторС1-3алкилсульфонил, гидроксииминоС1-6алкил, C1-4алкоксииминоС1-6алкил и C1-6алкилкарбамоиламино.
В случае, когда кольцевой атом азота в А может быть замещен, но не кватернизован, он является незамещенным или замещенным С1-4алкилом.
Конкретные заместители у кольцевых атомов углерода в В включают галоген, трифторметил, нитро, гидрокси, C1-6алкокси, C1-6алкил, амино, С1-4алкиламино, ди(C1-4алкил)амино, циано, С1-6алкилS(O)р- (р=0, 1 или 2), карбамоил, С1-4алкилкарбамоил и ди(С1-4алкил) карбамоил.
В случае, когда кольцевой атом азота в B может быть замещен, но не кватернизован, он является незамещенным или замещенным С1-4алкилом.
Термин "алкил", используемый в настоящем описании, означает заместители с прямой или разветвленной цепью, например метил, этил, н-пропил, изопропил, н-бутил и изобутил; и функциональные группы на алкильной цепи могут присутствовать в любой части этой цепи, так, например, гидроксииминоС1-4алкилом является 1-(гидроксиимино)пропил и 2-(гидроксиимино)пропил.
C1-6алкилом, замещенным галогеном, является трифторметил.
Аминокислотными остатками, образованными из Ra и Ra1, взятыми вместе с атомом азота, к которому они присоединены, являются остатки (-NHCH(R)COOH), производные природных или не встречающихся в природе аминокислот. Примеры подходящих аминокислот включают глицин, аланин, серин, треонин, фенил-аланин, глутаминовую кислоту, тирозин, лизин и диметилглицин.
Подходящие кольцевые системы формул (1А), (1В) или (1С) включают 5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил, 3-оксо-2,3-дигидро-1,2,4-оксадиазол-5-ил, 3-тиоксо-2,3-дигидро-1,2,4-оксадиазол-5-ил, 5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил, 5-оксо-4,5-дигидро-1,2,4-триазол-3-ил, 5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил, 1,3,4-оксадиазол-2-ил, 3-гидрокси-2-метилпиразол-5-ил, 3-оксо-2,3-дигидроизоксазол-5-ил, 5-оксо-1,5-дигидроизоксазол-3-ил и 5-оксо-2,3-дигидропиразол-3-ил.
Примерами C1-6алкоксикарбонила являются метоксикарбонил, этоксикарбонил и трет-бутоксикарбонил; примерами карбоксиС1-3алкила являются карбоксиметил, 2-карбоксиэтил, 1-карбоксиэтил и 3-карбоксипропил; примерами C1-6алкоксикарбонилС1-3алкила являются метоксикарбонилметил, этоксикарбонилметил и метоксикарбонилэтил; примерами тетразолилС1-3алкила являются тетразолилметил и 2-тетразолилэтил; примерами C1-4aлкокси являются метокси, этокси, пропокси и изопропокси; примерами С2-6алкенила являются винил и аллил; примерами С2-6алкинила являются этинил и пропинил; примерами C1-4алканоила являются формил, ацетил, пропионил и бутирил; примерами галогена являются фтор, хлор, бром и иод; примерами C1-4алкиламино являются метиламино, этиламино, пропиламино и изопропиламино; примерами ди(С1-4алкил) амино являются диметиламино, диэтиламино и этилметиламино; примерами C1-6алкил S(O)p - являются метилтио, метилсульфинил и метилсульфонил; примерами С1-4алкилкарбамоила являются метилкарбамоил и этилкарбамоил; примерами ди(С1-4алкил) карбамоила являются диметилкарбамоил, диэтилкарбамоил и этилкарбамоил; примерами C1-6алкила являются метил, этил, пропил и изопропил; примерами С1-4алкоксикарбониламино являются метоксикарбониламино и этоксикарбониламино; примерами С1-4алканоиламино являются ацетамидо и пропионамидо; примерами С1-4алканоил(N-С1-4алкил) амино являются N-метилацетамидо и N-метилпропионамидо; примерами С1-4алкансульфонамидо являются метансульфонамидо и этансульфонамидо; примерами C1-4aлкиламиносульфонила являются метиламиносульфонил и этиламиносульфонил; примерами ди(С1-4алкил) аминосульфонила являются диметиламиносульфонил, диэтиламиносульфонил и этилметиламино-сульфонил; примерами С1-4алканоилокси являются ацетилокси и пропионилокси; примерами формилС1-4алкила являются формилметил и 2-формилэтил; примерами гидроксииминоС1-6алкила являются гидроксииминометил и 2-(гидроксиимино) этил и примерами С1-4алкоксииминоС1-6алкила являются метоксииминометил, этоксииминометил и 2-(метоксиимино)этил.
При этом следует отметить, что, если соединения формулы I имеют хиральный центр, то соединения по изобретению могут существовать и могут быть выделены в оптически активной или рацемической форме. Изобретение включает любую оптически активную или рацемическую форму соединения формулы I, которая обладает болеутоляющими свойствами. Синтез оптически активных форм может быть осуществлен с помощью стандартных методов органической химии, хорошо известных специалистам, например, путем разделения рацемической формы, путем синтеза из оптически активных исходных соединений или путем асимметрического синтеза. Кроме того, следует отметить, что некоторые соединения формулы I могут существовать в виде геометрических изомеров. Настоящее изобретение включает любой геометрический изомер соединения формулы I, который обладает болеутоляющими свойствами.
Следует также отметить, что некоторые соединения настоящего изобретения могут существовать в сольватированной, например гидратированной, и в несольватированной форме. Кроме того, настоящее изобретение включает все указанные сольватированные формы, обладающие болеутоляющими свойствами.
Следует также отметить, что в объем настоящего изобретения входят таутомеры соединений формулы (I).
Предпочтительно А представляет необязательно замещенные: фенил, нафтил, тиадиазолил, тиенил, пиридил или пиримидил.
Предпочтительно В представляет необязательно замещенные: пиридил, фенил, тиазолил, тиенил, пиридазинил или оксазолил.
Наиболее предпочтительно А представляет необязательно замещенные фенил или тиенил.
Более предпочтительно В представляет необязательно замещенные: пиридил, фенил, тиенил, пиридазинил или тиазолил.
В частности, А представляет необязательно замещенный фенил.
В частности, В представляет необязательно замещенные: пирид-2,5-диил, пиридазин-3,6-диил, фен-1,4-диил или тиен-2,5-диил.
Особенно предпочтительно В представляет необязательно замещенный пиридазин-3,6-диил или пирид-2,5-диил.
Особенно предпочтительно В является пиридазинилом.
Предпочтительными необязательными заместителями для кольцевых атомов углерода в А являются галоген, нитро, трифторметил, циано, амино, C1-6алкокси, карбамоил, С1-4алкилкарбамоил, ди(C1-4алкил) карбамоил, С1-4алканоиламино, C1-6алкилS(O)р-, С1-4алкансульфонамидо, бензолсульфонамидо, C1-6алканоил, С1-4алкоксииминоС1-4алкил и гидроксииминоС1-4алкил.
Если А представляет 6-членное кольцо, то А является предпочтительно незамещенным или замещенным в 4-положении по отношению к группе -OR4.
Предпочтительными необязательными заместителями для кольцевых атомов углерода в В являются галоген, трифторметил, С1-4алкил, амино, C1-4алкиламино, диС1-4алкиламино, нитро, гидрокси, C1-6алкокси и циано.
Предпочтительно А является незамещенным или замещенным одним заместителем.
Более предпочтительно А является незамещенным или замещенным бромом, метансульфонилом, фтором или хлором.
Наиболее предпочтительно А является незамещенным или замещенным бромом или хлором.
Предпочтительно В является незамещенным или замещенным одним заместителем.
Наиболее предпочтительно В является незамещенным.
Предпочтительно R1 представляет карбокси, карбамоил или тетразолил или R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или C1-6алкил, и Ra1 представляет C1-6алкил, необязательно замещенный гидрокси; С2-6алкенил; 1-морфолинил; 1-пиперидинил; 1-пирролидинил; пиридилС1-3алкил; либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет необязательно замещенные: C1-6алкил, фенил или 5- или 6-членный гетероарил.
В частности, R1 представляет карбокси, тетразолил или группу формулы -CONRaRa1, где Ra представляет водород, а Ra1 представляет C1-6алкил, необязательно замещенный гидрокси или пиридилметил; либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет C1-6алкил (необязательно замещенный гидрокси или фтором), фенил (необязательно замещенный ацетамидо), изоксазолил (необязательно замещенный метилом) или 1,3,4-тиадиазолил (необязательно замещенный ацетамидо).
Наиболее предпочтительно R1 представляет карбокси, тетразол или группу формулы -CONHRa1, где Ra1 представляет пиридилметил; или С1-4алкил, необязательно замещенный гидрокси; или группу формулы -CONHSO2Rb, где Rb представляет С1-4алкил, 3,5-диметилизоксазол-4-ил или 5-ацетамидо-1,3,4-тиадиазол-2-ил.
В другом аспекте настоящего изобретения R1 представляет карбокси, карбамоил или тетразолил; или R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или C1-6алкил, a Ra1 представляет C1-6алкил, необязательно замещенный гидрокси, С2-6алкенил; 1-морфолинил; 1-пиперидинил; 1-пирролидинил; пиридилС1-3алкил; либо R1 представляет группу формулы -CONHSO2Rb, где Rb является C1-6алкилом или фенилом.
Предпочтительно R2 представляет водород, метил, этил, 2,2,2-трифторэтил, цианометил, аллил или 3-пропинил.
Более предпочтительно R2 представляет водород, метил, этил или пропил.
Еще более предпочтительно R2 представляет водород или этил.
Наиболее предпочтительно R2 является этилом.
Предпочтительно R3 является водородом.
Предпочтительно R4 необязательно замещен галогеном, гидрокси, С1-4алкокси, амино, карбокси, С1-4алкилS(O)р (р=0, 1 или 2), карбамоилом, трифторметилом, оксо или циано.
Более предпочтительно R4 необязательно замещен фтором, хлором или бромом.
Наиболее предпочтительно R4 необязательно замещен фтором, трифторметилом, циано или гидрокси.
Предпочтительно R4 представляет С1-4алкил, С3-6циклоалкил или С3-6циклоалкилметил.
Более предпочтительно R4 представляет пропил, изобутил, бутил, 2-этилбутил, 2(R)-метилбутил, 2(S)-метилбутил, 2,2,2-трифторэтил, циклопентилметил, циклопропилметил, циклопропил или циклопентил.
Наиболее предпочтительно R4 представляет пропил, изобутил, бутил, 2-этилбутил, циклопентил, циклопропилметил или циклопропил.
Предпочтительным классом соединений являются соединения формулы (II):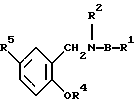
где R1 и R2 определены выше; R4 представляет С1-4алкил, С3-6циклоалкил или С3-6циклоалкилметил; R5 представляет водород или, как определено выше для заместителей кольцевых атомов углерода в А и В, представляет фенил, тиенил, пиридазинил, пиридил или тиазолил.
При этом следует отметить, что поскольку соединения формулы (I), определенные выше, могут существовать в оптически активной или рацемической формах благодаря тому, что соединения формулы (I) содержат асимметрический атом углерода, то определение активного ингредиента настоящего изобретения включает любую такую оптически активную или рацемическую форму, которая обладает болеутоляющими свойствами. Синтез таких оптически активных форм может быть осуществлен стандартными методами органической химии, хорошо известными специалистам, например, путем синтеза из оптически активных исходных соединений или путем разделения рацемической формы. Аналогично, болеутоляющие свойства соединения могут быть оценены с использованием стандартной лабораторной техники, описанной ниже.
In vivo-гидролизуемым сложным эфиром соединения формулы (I), содержащим карбоксигруппу, является, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с образованием исходной кислоты, например, фармацевтически приемлемый сложный эфир, образованный (C1-6)спиртом, таким как метанол, этанол, этиленгликоль, пропанол или бутанол, либо фенолом или бензиловым спиртом, таким как фенол или бензиловый спирт или замещенный фенол или бензиловый спирт, где заместителями являются, например, галоген (такой, как фтор или хлор), (С1-4)алкил (такой, как метил) или (C1-4) алкоксигруппа (такая, как этоксигруппа). Этот термин также включает α-ацилоксиалкиловые сложные эфиры и исходные соединения, которые разлагаются с образованием исходной гидроксигруппы. Примерами α-ацилоксиалкиловых сложных эфиров являются ацетоксиметоксикарбонил и 2,2-диметилпропионилоксиметоксикарбонил.
In vivo-гидролизуемым сложным эфиром соединения формулы (I), содержащим гидроксигруппу, является, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с образованием исходного спирта. Этот термин включает неорганические сложные эфиры, такие как сложные эфиры фосфорной кислоты и α-ацилоксиалкиловые простые эфиры, а также исходные соединения, которые образуются в результате in vivo-гидролиза сложного эфира, разлагаемого с получением исходной гидроксигруппы. Примерами простых α-ацилоксиалкиловых эфиров являются ацетоксиметокси и 2,2-диметоксипропионилоксиметокси. Группы, образующие in vivo-гидролизуемый сложный эфир с высвобождением гидроксигруппы, выбраны из алканоила, бензоила, фенилацетила и замещенного бензоила и фенилацетила, алкоксикарбонила (с образованием сложных эфиров алкилкарбоновой кислоты), диалкил-карбамоила и N-(диалкиламиноэтил)-N-алкилкарбамоила (для образования карбаматов), диалкиламиноацетила и карбоксиацетила.
Подходящим in vivo-гидролизуемым амидом соединения формулы I, содержащего карбоксигруппу, является, например, N-(1-6С)алкил- или N, N-ди-(1-6С)алкиламид, такой как N-метиламид, N-этиламид, N-пропиламид, N,N-диметиламид, N-этил-N-метиламид или N,N-диэтиламид.
Подходящей фармацевтически приемлемой солью соединения формулы (I) является, например, кислотно-аддитивная соль соединения формулы (I), которое является достаточно основным, например кислотно-аддитивная соль, образованная неорганической или органической кислотой, такой как хлороводородная, бромоводородная, серная, трифторуксусная, лимонная или малеиновая кислота; или, например, соль соединения формулы (I), которое является достаточно кислотным, например соль щелочного или щелочноземельного металла, такая как соль кальция или магния, или соль аммония, либо соль, образованная органическим основанием, таким как метиламин, диметиламин, триметиламин, пиперидин, морфолин или трис-(2-гидроксиэтил)амин.
В другом своем аспекте настоящее изобретение относится к способу получения соединений формулы (I) или их фармацевтически приемлемых солей или их in vivo-гидролизуемых амидов или сложных эфиров; причем указанный способ предусматривает удаление защиты у соединения формулы (III):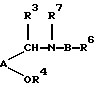
где R6 представляет R1 или защищенный R1; R7 представляет R2 или защищенный R2; R3, R4, А и В являются такими, как они были определены выше; причем любые необязательные заместители являются необязательно защищенными; и кроме того, присутствует, по крайней мере, одна защитная группа;
а затем, если это необходимо:
i) получение фармацевтически приемлемой соли;
ii) получение in vivo гидролизуемого сложного эфира или амида;
iii) преобразование одного необязательного заместителя в другой необязательный заместитель.
Защитные группы могут быть выбраны из любых подходящих групп, описанных в литературе, и могут быть введены стандартными методами.
Защитные группы могут быть удалены любым известным методом, подходящим для удаления данной защитной группы, причем этот метод должен быть выбран так, чтобы он эффективно удалял защитную группу с минимальным воздействием на какие-либо другие группы в молекуле.
Подходящей группой для защиты гидроксигруппы является, например, арилметильная группа (в частности, бензил), три-(C1-4) алкилсилильная группа (в частности, триметилсилил или трет-бутилдиметилсилил), арилди-(C1-4) алкилсилильная группа (в частности, диметилфенилсилил), диарил(С1-4) алкилсилильная группа (в частности, трет-бутилдифенилсилил), (C1-4) алкильная группа (в частности, метил), (С2-4) алкенильная группа (в частности, аллил), (C1-4) алкоксиметильная группа (в частности, метоксиметил) или тетрагидропиранильная группа (в частности, тетрагидропиран-2-ил). Условия удаления вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группы. Так, например, арилметильная группа, такая как бензильная группа, может быть удалена путем гидрирования в присутствии катализатора, такого как палладий-на-угле. Альтернативно, триалкилсилильная или арилдиалкилсилильная группа, такая как трет-бутилдиметилсилильная или диметилфенилсилильная группа, может быть удалена, например, путем обработки подходящей кислотой, такой как соляная, серная, фосфорная или трифторуксусная кислота, или фторидом щелочного металла или аммония, таким как фторид натрия или предпочтительно фторидтетрабутиламмония. Альтернативно, алкильная группа может быть удалена, например, путем обработки (C1-4) алкилсульфидом щелочного металла, таким как тиоэтоксид натрия, или, например, путем обработки диарилфосфида щелочного металла, такого как дифенилфосфид лития, или, например, путем обработки тригалогенидом бора или алюминия, таким как трибромид бора. Альтернативно, (C1-4) алкоксиметильная группа или тетрагидропиранильная группа может быть удалена, например, путем обработки подходящей кислотой, такой как соляная кислота или трифторуксусная кислота.
Альтернативно, подходящей защитной группой для гидроксигруппы является, например, ацильная группа, например (C2-4) алканоильная группа (в частности, ацетил) или ароильная группа (в частности, бензоил). Условия удаления вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная или ароильная группа, может быть удалена, например, путем гидролиза с использованием основания, такого как гидроксид щелочного металла, например гидроксид лития или натрия.
Подходящей защитной группой для амино-, имино- или алкиламиногруппы является, например, ацильная группа, такая как (С2-4) алканоильная группа (в частности, ацетил), (C1-4) алкоксикарбонильная группа (в частности, метоксикарбонил, этоксикарбонил или трет-бутоксикарбонил), арилметоксикарбо-нильная группа (в частности, бензилоксикарбонил) или ароильная группа (в частности, бензоил). Условия удаления вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая как алканоильная, алкоксикарбонильная или ароильная группа может быть удалена, например, путем гидролиза с использованием подходящего основания, такого как гидроксид щелочного металла, например гидроксид лития или натрия. Альтернативно, ацильная группа, такая как трет-бутоксикарбонильная группа, может быть удалена, например, путем обработки подходящей кислотой, такой как соляная, серная или фосфорная кислота или трифторуксусная кислота, и арилметоксикарбонильная группа, такая как бензилоксикарбонильная группа, может быть удалена, например, путем гидрирования в присутствии катализатора, такого как палладий-на-угле.
Подходящей защитной группой для карбоксигруппы является, например, этерифицирующая группа, например (C1-4)aлкильная группа (в частности, метил или этил), которая может быть удалена путем гидролиза с использованием подходящего основания, такого как гидроксид щелочного металла, например гидроксид лития или натрия; и трет-бутильная группа может быть удалена, например, путем обработки подходящей кислотой, такой как соляная, серная, фосфорная или трифторуксусная кислота.
В другом аспекте настоящего изобретения соединения формул (I) или (III) могут быть получены:
а) восстановлением соединения формулы (IV):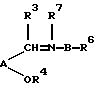
b) когда В представляет активированный гетероцикл и R7 представляет водород или C1-6алкил, взаимодействием соединения формулы (V) с соединением формулы (VI):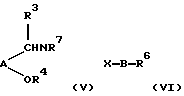
с) взаимодействием соединения формулы (VII) с соединением формулы (VIII):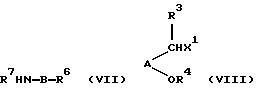
d) преобразованием X2 в R6 в соединении формулы (IX)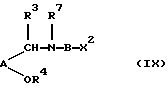
е) когда R7 не является водородом, взаимодействием соединения формулы R7X3 с соединением формулы (X):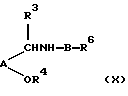
f) взаимодействием соединения формулы (XI) с соединением формулы (XII):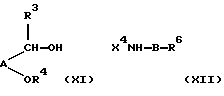
g) взаимодействием соединения формулы (XIII) с соединением формулы (XIV):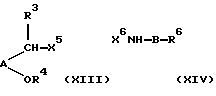
h) взаимодействием соединения формулы (XV) с соединением формулы Х7R4: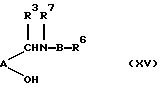
где R3, R4, R7, R9, А и В определены выше, а Х и X1 являются уходящими группами, X2 является предшественником R7; X3 является уходящей группой, X4 является удаляемой активирующей группой, X5 является уходящей группой, X6 является активирующей группой, а X7 является уходящей группой;
а затем, если необходимо:
i) удалением любых защитных групп;
ii) получением фармацевтически приемлемой соли;
iii) получением in vivo-гидролизуемого сложного эфира или амида;
iv) преобразованием необязательного заместителя в другой необязательный заместитель.
Конкретными уходящими группами являются галоген, например хлор, бром и иод, сульфонаты, например тозилат, п-бромбензолсульфонат, п-нитробензолсульфонат, метансульфонат и трифторацетат, или сложные эфиры фосфорной кислоты, такие как сложный эфир диарилфосфорной кислоты.
Соединения формулы (IV) могут быть восстановлены с использованием таких агентов, как боргидрид натрия или циангидрид натрия. Соединения формулы (IV) могут быть получены путем взаимодействия соединения формулы (VII) с соединением формулы (XV):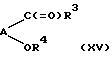
где A, R3 и R4 определены выше.
Взаимодействие между соединениями формул (VII) и (XV) может происходить в стандартных условиях, которые обычно используют для получения имина (основания Шиффа), который может быть восстановлен in situ. Так, например, образование имина и восстановление in situ может быть осуществлено в инертном растворителе, таком как толуол или тетрагидрофуран, в присутствии восстановителя, такого как цианборгидрид натрия (NаСNВН3) в кислотных условиях (Synthesis 135, 1975; Org. Prep. Proceed. Int. 11, 201, 1979).
Соединения формул (V) и (VI) могут быть подвергнуты взаимодействию в стандартных условиях, например в апротонном растворителе, таком как ДМФ, в присутствии слабого основания при температуре в пределах от комнатной температуры до 180oС. Подходящими Х являются галоген, тозилат, мезилат и трифторацетат. В частности, Х представляет хлор или бром.
Соединения формул (VII) и (VIII) могут быть подвергнуты взаимодействию в апротонном растворителе, таком как ДМФ, в присутствии основания, такого как карбонат калия или гидрид натрия, при температуре от 0oС до 100oС. Подходящими Х1 являются галоген, тозилат, мезилат и трифторацетат. В частности, Х1 является бромом.
Предшественником группы R7 является группа, которая может быть преобразована в R7.
Конкретно, X2 означает циано, карбамоил, алкоксикарбонил, карбокси и активированные карбоксигруппы, такие как хлорангидрид и активированные сложные эфиры.
Цианогруппа может быть преобразована в тетразольное кольцо путем взаимодействия, например, с азидом аммония или олова в апротонном растворителе, таком как ДМФ, при температуре от 100oС до 130oС. Дополнительные сведения о синтезе тетразола можно найти в работах S.J. Wittenberger & В.J. Donner JOC, 1993, 58, 4139-4141; B.E. Huff et al., Tet. Lett, 1993, 50, 8011-8014 и J.V. Duncia et al., JOC, 1991, 56, 2395-2400.
Алкоксикарбонил может быть преобразован в карбоксигруппу путем кислотного или основного гидролиза. Так, например, основный гидролиз может быть осуществлен в органическом растворителе, таком как метанол или тетрагидрофуран (ТТФ) при температуре в пределах от комнатной температуры до 100oC в присутствии гидроксида натрия или гидроксида калия.
Кислотный гидролиз может быть осуществлен, например, в чистой муравьиной кислоте или чистой трифторуксусной кислоте, необязательно, в инертном растворителе, таком как дихлорметан.
Алкоксикарбонил или активированная карбоксигруппа, такая как хлорангидрид или активированный сложный эфир, или ацильная группа, такая как алканоильная группа, могут быть преобразованы в амидную группу путем взаимодействия с соответствующим амином в инертном растворителе, таком как ДМФ или дихлорметан, при температуре от 0oС до 150oС и предпочтительно при комнатной температуре в присутствии основания, такого как триэтиламин.
Соединения формул (X) и R7X3 могут быть подвергнуты взаимодействию в апротонном растворителе, таком как ДМФ, в присутствии основания, такого как карбонат натрия или гидрид натрия. Подходящими для X3 являются галоген, тозилат, мезилат и трифторацетат, и особенно галоген, такой как иод.
Взаимодействие между соединениями формул (XI) и (XII) обычно осуществляют в мягких условиях, известных как реакция Мицуноби, например, в присутствии ди(С1-4алкил)азокарбоксилата и трифенилфосфина или 11, 11 -(азодикарбонил)дипиперидина и трибутилфосфина (Tet. Lett, 34, 1993, 1639-1642) в инертном растворителе, таком как толуол, бензол, тетрагидрофуран или диэтилэфир, в частности толуол. Примерами удаляемых активирующих групп являются трет-бутоксикарбонил и трифторацетил.
Взаимодействие между соединениями формул (XIII) и (XIV) обычно происходит в присутствии сильного основания, такого как гидрид натрия, диизопропиламид лития или LiN(SiMe3)2, в ДМФ или эфирном растворителе, таком как этиловый эфир или ТГФ, при температуре в пределах от -78oС до комнатной температуры. Подходящим X5 является, например, галоген, метансульфонат или тозилат. Примерами активирующих групп X6 являются трет-бутоксикарбонил, галоген и трифторацетил.
Взаимодействие между соединениями формул (XV) и Х7R4 может быть осуществлено в инертном органическом растворителе, таком как ацетон или ДМФ, при температуре в пределах от комнатной температуры до 60oС в присутствии слабого основания. Подходящими уходящими группами являются тозилат, мезилат, трифторацетат и галоген, например хлор или бром. Альтернативно, может быть использована межфазная система. X7 может быть гидроксигруппой, которая активируется in situ в условиях реакции Мицуноби (О. Synthesis, 1981, 1).
Соединения формулы (XV), где R6 является R1 и R7 является R2, сами по себе обладают болеутоляющими свойствами.
Соединения формул (IV), (V), (VIII), (IX), (X), (XI), (XIII) и (XV) могут быть получены способом, используемым для образования низшей связывающей группы -OR4 (аналогично способу 1) из соответствующих исходных соединений.
Соединения формулы (IX) могут быть получены способами а), b), с), е), f), g) или h) из соответствующего исходного соединения, в котором R6 заменен на X2.
Соединения формулы (X) могут быть получены одним из способов а), b), с), d), f), g) или h) из соответствующих исходных соединений, где R7 представляет водород.
Соединения формулы (XII) могут быть легко получены из соединений формулы (VII).
Соединения формул (VI), (VII), (XII) и (XIV) являются в основном известными соединениям, либо они могут быть получены методами, описанными в примерах, или методами, которые обычно используются для получения родственных соединений. Некоторые соединения формулы (VI), в которых Х является хлором или бромом, могут быть получены путем преобразования оксогруппы в кольцевой системе в группу хлора или брома путем взаимодействия оксокольцевой системы с хлорирующим агентом, таким как сульфонилхлорид, трихлорид фосфора, пентахлорид фосфора или Р(O)Сl3, или с бромирующим агентом, таким как трибромид фосфора или Р(O)Br3, в инертном апротонном растворителе.
Можно также синтезировать некоторые промежуточные соединения и даже защищенные соединения, используя сначала синтез кольца. Для справки см. краткое руководство "The Chemistry of Heterocyclic Compounds' E.C. Taylor и А. Veissberger (опубликованное John & Sons) и "Comprehensive Heterocyclic Chemistry", A.P. Katritsky &. C.W. Rees (опубликованное Pergamon Press).
Необязательные заместители могут быть преобразованы в другие необязательные заместители. Так, например, алкилтиогруппа может быть окислена с образованием алкилсульфинильной или алкилсульфонильной группы, нитрогруппа может быть восстановлена с образованием аминогруппы, гидроксигруппа может быть алкилирована с образованием метоксигруппы, либо группа брома может быть преобразована в алкилтиогруппу.
В соединения формулы (I) и формулы (III) и в промежуточные соединения, образующиеся при получении соединений формул (I) и (III), если это необходимо, могут быть введены различные заместители с использованием обычных методов, известных специалистам. Так, например, ацильная группа или алкильная группа может быть введена в активированное бензольное кольцо путем реакции Фриделя-Крафтса; формильная группа может быть введена путем реакции формилирования с использованием тетрахлорида титана и дихлорметилового простого эфира; нитрогруппа может быть введена путем реакции нитрования с использованием концентрированной азотной и концентрированной серной кислоты, а бром может быть введен путем бромирования с использованием брома или трибромида тетра(н-бутил)аммония.
При этом следует отметить, что для предупреждения побочных реакций на некоторых стадиях реакционной схемы получения соединения формулы (I) может оказаться необходимым обеспечить защиту некоторых функциональных групп в промежуточных соединениях. Затем, если защита больше не нужна, то на соответствующей стадии реакционной схемы может быть осуществлено удаление защиты.
Как указывалось выше, соединения формулы (I) являются антагонистами болеусиливающего действия простагландинов группы Е и обладают способностью устранять слабую или умеренную боль, сопровождающую, например, воспалительные заболевания, такие как ревматоидный артрит или остеоартрит. Некоторые свойства соединений настоящего изобретения могут быть продемонстрированы с помощью нижеописанных тестов:
(a) in vitro-анализ с использованием подвздошной кишки морских свинок, который проводят для оценки ингибирующих свойств испытуемого соединения, направленных против РGЕ2-индуцированных сокращений подвздошной кишки. Для этого подвздошную кишку погружают в насыщенный кислородом раствор Кребса, содержащий индометацин (4 мкг/мл) и атропин (1 мкМ), и выдерживают при 37oС; подвздошную кишку подвергают напряжению в 1 г, затем строят контрольную кривую дозовой зависимости для PGE2-индуцированного сокращения подвздошной кишки; после чего в раствор Кребса добавляют испытуемое соединение (растворенное в диметилсульфоксиде) и строят кривую дозовой зависимости для PGE2-индуцированного сокращения подвздошной кишки в присутствии испытуемого соединения; а затем вычисляют величину рА2 для испытуемого соединения;
(b) in vivo анализ на мышах, который проводят для оценки ингибирующих свойств испытуемого соединения, направленных против реакции абдоминального сокращения, индуцированного внутрибрюшинным введением токсического фактора, такого как разбавленная уксусная кислота или фенилбензохинон (обозначаемый далее (PBQ); при этом указанный анализ проводят с использованием методики, описанной в Европейской патентной заявке 0218077.
Хотя фармакологические свойства соединений формулы I могут изменяться в зависимости от их структуры, однако в основном активность этих соединений может быть продемонстрирована в одном или двух из вышеуказанных Тестов (а) и (b) при следующих концентрациях или дозах:
Тест (а): рА2>5,3;
Тест (b): ED50 в интервале, например, 0,01-100 мг/кг перорально.
В тесте (b) при введении соединений формулы I в дозах, которые в несколько раз превышают их минимальную ингибирующую дозу, какой-либо заметной токсичности или других неблагоприятных эффектов не наблюдалось.
Рецепторы простагландина и, в частности, рецепторы для PGE2 были ориентировочно охарактеризованы Kennedy и др. (Advances in Prostaglandin, Thromboxane and Leukotriene Research, 1983, 11, 327). Известный антагонист простагландина PGE2 SC-19220 блокирует действие PGE2 в некоторых тканях, таких как подвздошная кишка морских свинок или брюшины собак, однако в других тканях, например в трахее кошек или в подвздошной кишке цыпленка, такого эффекта не наблюдается. Было установлено, что ткани, являющиеся восприимчивыми к SC-19220-опосредованным эффектам, имеют рецепторы для EP1. Исходя из этого можно утверждать, что соединения по настоящему изобретению, обладающие активностью в тесте (а), являются антагонистами EP1.
В соответствии с другим своим аспектом настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I), или его in vivo-гидролизуемый сложный эфир или амид, или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым разбавителем или носителем.
Эта композиция может быть получена в форме, подходящей для перорального введения, например в виде таблетки, капсулы, водного или масляного раствора, суспензии или эмульсии; для местного применения, например, в виде крема, мази, геля, аэрозоля, масляного или водного раствора или суспензии; для интраназального введения, например, в виде препарата для вдыхания через нос, аэрозолей или капель в нос; для вагинального или ректального введения, например, в виде суппозитория или ректального аэрозоля; для введения путем ингаляции, например, в виде тонкодисперсного порошка или жидкого аэрозоля; для подъязычного и трансбуккального (через щеку) введения, например, в виде таблетки или капсулы; или для парентерального введения (включая внутривенные, подкожные, внутримышечные, внутрисосудистые инъекции или вливания), например, в виде стерильных водных или масляных растворов или суспензий. В основном вышеуказанные композиции могут быть получены стандартными способами с использованием стандартных наполнителей.
Количество активного ингредиента (т.е. соединения формулы (I) или его фармацевтически приемлемой соли), которое объединяют с одним или несколькими наполнителями для получения нужной разовой лекарственной формы, может варьироваться в зависимости от конкретного пациента, подвергаемого лечению, а также от способа введения. Так, например, композиция, предназначенная для перорального введения человеку, обычно содержит от 0,5 мг до 2 г активного соединения, смешанного с соответствующим количеством наполнителей, которое может варьироваться в пределах от около 5 до около 98% от массы всей композиции.
В соответствии с другим аспектом настоящее изобретение относится к соединению формулы (I), или к его in vivo-гидролизуемому сложному эфиру или амиду, или его фармацевтически приемлемой соли, которые могут быть использованы при терапевтическом лечении животных (включая человека).
В соответствии с еще одним аспектом настоящее изобретение относится к способу ослабления боли у животного (включая человека), предусматривающему введение этому животному эффективного количества соединения формулы I, или его in vivo-гидродизуемого сложного эфира или амида, или его фармацевтически приемлемой соли.
Как указывалось выше, соединение формулы (I) может быть использовано для устранения боли, которой, например, сопровождаются воспалительные заболевания, такие как ревматоидный артрит и остеоартрит. Ежедневная доза соединения формулы I, используемого в терапевтических или профилактических целях, обычно составляет, например, от 0,1 мг до 75 мг на кг массы тела и может быть введена, если это необходимо, в виде раздельных доз. Для парентерального введения используют в основном более низкие дозы. Так, например, для внутривенного введения может быть использована доза, составляющая, например, от 0,05 до 30 мг на кг массы тела. Аналогично, для введения путем ингаляции может быть использована доза, составляющая, например, от 0,05 мг до 25 мг на кг массы тела.
Хотя соединения формулы (I) обычно представляют собой терапевтические средства, предназначенные для введения теплокровным животным (включая человека), однако они могут быть использованы во всех случаях, в которых требуется ингибирование действия PGE2 в рецепторе EP1, исходя из теста (а). Таким образом, эти соединения могут быть использованы в качестве фармакологических стандартов для разработки новых биологических тестов и новых фармакологических средств.
Благодаря своей способности устранять боль соединения формулы I являются эффективными средствами для лечения некоторых воспалительных и невоспалительных заболеваний, которые в настоящее время лечат нестероидными противовоспалительными препаратами (НСПВС), ингибирующими действие циклооксигеназы, такими как индометацин, кеторолак, ацетилсалициловая кислота, ибупрофен, сулиндак, толметин и пироксикам. Совместное введение соединения формулы I с НСПВС может привести к снижению количества НСПВС, необходимого для продуцирования терапевтического эффекта. При этом снижается также вероятность возникновения побочных эффектов, вызываемых НСПВС, например желудочно-кишечных расстройств. Таким образом, в соответствии с другим аспектом настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы I, или его in vivo-гидролизуемый сложный эфир или амид, или его фармацевтически приемлемую соль в сочетании или в смеси с нестероидным противовоспалительным средством и фармацевтически приемлемым разбавителем или носителем.
Соединения по настоящему изобретению могут быть также использованы в сочетании с другими противовоспалительными средствами, такими как ингибитор фермента 5-липоксигеназы (например, описанными в Европейских патентных заявках 0351194, 0375368, 0375404, 0375452, 037547, 0381375, 0385662, 0385663, 0385679, 0385680).
Соединения формулы (I) могут быть также использованы для лечения таких заболеваний, как ревматоидный артрит, при применении их в сочетании с противоартритными средствами, такими как золото, метотрексат, стероиды и пенициллинамин; а для лечения таких заболеваний, как остеоартрит, они могут быть использованы в сочетании со стероидами.
Соединения настоящего изобретения могут быть также введены при дегенеративных заболеваниях, например при остеоартрите, в сочетании с хондропротективными, антидегенеративными и/или репаративными агентами, такими как Диацергеин, препараты гиалуроновой кислоты, такие как гуалан, румалон, артепарон, и глюкозаминовые соли, такие как антрил.
Композиции по настоящему изобретению могут, кроме того, содержать одно или несколько других терапевтических средств или профилактических средств, которые, как известно, обладают болеутоляющим действием. Так, например, в фармацевтической композиции по настоящему изобретению могут также присутствовать известные опиатные болеутоляющие средства (такие как декстропропоксифен, дегидрокодеин или кодеин), или антагонисты других медиаторов боли или медиаторов воспаления, таких как брадикинин, такикинин и пептиды, связанные с геном кальцитонина (CGRP), или агонист α2-адренорецептора, агонист GABAB-рецептора, блокатор кальциевых каналов, антагонист ССКB-рецептора, антагонист нейрокинина или антагонист и модулятор действия глутамата на NMDA-рецептор.
Соединения по настоящему изобретению могут быть также введены при заболеваниях костей, таких как остеопороз, в сочетании с кальцитонином и бифосфонатами.
Более подробно, настоящее изобретение проиллюстрировано в нижеследующих, но не ограничивающих его объема примерах, в которых, если это не оговорено особо:
(i) упаривание осуществляли в роторном вакуумном испарителе, а процедуры по обработке осуществляли после удаления остаточных твердых веществ путем фильтрации;
(ii) выходы даны лишь для иллюстрации и не должны рассматриваться как максимально достижимые;
(iii) конечные продукты формулы I имеют удовлетворительные данные микроанализа и их структуры были в основном подтверждены анализами, проведенными методами ЯМР и масс-спектроскопии.
(iv) температуры плавления приводятся без поправок и были определены с помощью автоматического специального прибора Mettler SP62 или прибора с использованием масляной бани; причем температуры плавления для конечных продуктов были определены после перекристаллизации из стандартного органического растворителя, такого как этанол, метанол, ацетон, эфир или гексан, взятых отдельно или в смеси друг с другом;
(v) при этом были использованы следующие сокращения:
ДМФ - N,N-диметилформамид;
ТГФ - тетрагидрофуран;
ДМСО - диметилсульфоксид;
ТСХ - тонкослойная хроматография;
ЖХСД - жидкостная хроматография среднего давления.
ПРИМЕР 1
2-[N-(5-Бром-2-пропоксибензил)-N-этиламино]пиридин-5-карбоновая кислота
Раствор метил-2-[N-(5-бром-2-пропоксибензил)-N-этил-амино]пиридин-5-карбоксилата (сравнительный пример 1) (0,12 г, 0,29 ммоль) в ТГФ (3 мл) и метаноле (3 мл) обрабатывали водным раствором гидроксида натрия (1 н., 1,8 мл). Реакционную смесь нагревали до 40oС в течение 18 часов. Растворитель упаривали и остаток разбавляли водой (3 мл) и подкисляли уксусной кислотой (1 н. , 3 мл). Твердый продукт отфильтровывали и получали указанное в заголовке соединение (0,1 г, 88%) в виде белого твердого продукта.
МС (CI+) : 393/395 (М+Н)+.
ЯМР (200 МГЦ, ДМСО-d6) δ: 1,0 (т, J=7Гц, 3Н); 1,12 (т, J=7Гц, 3Н); 1,75 (м, 2Н); 3,6 (кв, J=7Гц, 2Н); 3,98 (т, J=7Гц, 2Н); 4,73 (с, 2Н), 6,65 (д, J= 9Гц, 1Н); 7,02 (м, 2Н); 7,4 (дд, J=2,9Гц, 1Н); 7,92 (дд, J=2,9Гц, 1Н), 8,6 (д, J=2Гц, 1Н).
ПРИМЕР 2
2-[N-(5-Бром-2-(метил)пропоксибензил)-N-этиламино] -5-пиридин-карбоновая кислота
Указанное в заголовке соединение получали способом, подобным описанному в примере 1, за исключением того, что использовали соответствующий сложный эфир (сравнительный пример 2).
МС (CI+): 407 (М+H)+.
ЯМР (250 МГЦ, ДМСО-d6) δ: 1,0 (д, J=6Гц, 6Н); 1,05 (т, J=7ГЦ, 3Н); 2,02 (м, 1Н); 3,59 (кв, J=7Гц, 2Н); 3,8 (д, J=6Гц, 2Н); 4,75 (c, 2Н); 6,64 (д, J= 9Гц, 1Н); 6,96 (д, J=9Гц, 1Н); 7,05 (д, J=2Гц, 1Н); 7,36 (дд, J=2,9Гц, 1Н); 7,9 (дд, J=2,9Гц, 1Н); 8,61 (д, J=2Гц, 1Н); 12,35 (шир. с, 1Н).
ПРИМЕР 3
6-[N-(5-Бром-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали способом, аналогичным описанному в примере 1, за исключением того, что использовали соответствующий сложный бутиловый эфир (сравнительный пример 4).
Т.пл. 73-80oС.
МС (FAB+): 406 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6+HOAc-d4) δ: 0,15 (м, 2Н); 0,38 (м, 2Н); 1,02 (м, 4Н); 3,55 (кв, J=7Гц, 2Н); 3,7 (д, J=7Гц, 2Н); 4,68 (с, 2Н); 6,78 (м, 1Н); 7,0 (м, 2Н); 7,22 (д, J=9Гц, 1Н); 7,5 (д, J=9Гц, 1Н).
ПРИМЕР 4
2-[N-(5-Бром-2-(циклопентилметокси)бензил)-N-этиламино] пиридин-5-карбоновая кислота
Раствор метил-2-[N-(5-бром-2-(циклопентилметокси)бензил)-N-этиламино]пиридин-5-карбоксилата (см. сравнительный пример 5) (0,37 г, 0,83 ммоль) в ТГФ (4 мл) и метаноле (4 мл) обрабатывали 1 н. водным раствором гидроксида натрия (4 мл). Реакционную смесь нагревали при 40oС в течение 18 часов. Растворители упаривали при пониженном давлении и остаток подкисляли 1 н. уксусной кислотой (4 мл) и оставляли для перемешивания на 2 дня. Осадок фильтровали, промывали водой и сушили в вакууме при температуре 45oС с получением указанного в заголовке соединения в виде белого твердого продукта (0,32 г, 89%).
МС (ESP+): 433 (М+H)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,2 (т, J=7Гц, 3Н); 1,35 (м, 2Н); 1,58 (м, 4Н); 1,75 (м, 2Н); 2,30 (м, 1Н); 3,60 (кв, J=7Гц, 2Н); 3,9 (д, J=7Гц, 2Н); 4,74 (с, 2Н); 6,65 (д, J=9Гц, 1Н); 6,98 (д, J=9Гц, 1Н); 7,10 (д, J=2Гц, 1Н); 7,88 (дд, J= 2,9Гц, 1Н); 7,92 (д, J=2,9Гц, 1Н); 8,62 (д, J=2Гц, 1Н), 12,4 (прибл. 1Н).
ПРИМЕР 5
6-[N-(5-Бром-2-пропоксибензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали из бутил-6-[N-(5-бром-2-пропоксибензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 6) способом, подобным описанному в примере 1.
МС (ESP+): 394/396 (M+H)+.
ЯМР (200 МГц ДМСО-d6) δ: 0,97 (т, J=6,7Гц, 3Н); 1,16 (т, J=6,7Гц, 3Н); 1,73 (м, J= 6,7Гц, 2Н); 3,7 (кв, J=6,7Гц, 2Н), 3,98 (т, J=6,7Гц, 2Н); 4,82 (с, 2Н); 7,0 д, J=9,3Гц, 1Н); 7,12 (д, J=9,3Гц, 1Н); 7,17 (д, J=2,0Гц, 1Н); 7,40 (дд, J=2,0, 10,0Гц, 1Н); 7,83 (д, J=10,0Гц, 1Н).
ПРИМЕР 6
6-[N-(5-Бром-2-н-бутоксибензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали из бутил-6-[N-(5-бром-2-н-бутоксибензил)-N-этиламино]пиридазин-3-карбоксилата (сравнительный пример 7) способом, аналогичным описанному в примере 1.
МС (ESP+): 408/410 (М+Н)+.
ЯМР (200 МГЦ, ДМСО-d6) δ: 0,9 (т, J=6,7Гц, 3Н); 1,14 (т, J=6,7Гц, 3Н); 1,40 (м, J=6,7Гц, 2Н); 1,67 (м, J=6,7Гц, 2Н); 3,67 (кв, J=6,7Гц, 2Н); 4,00 (т, J=6,7Гц, 2Н); 4,8 (с, 2Н); 7,0 (д, J=8,3Гц, 1Н); 7,11 (д, J=10,0Гц, 1Н); 7,15 (д, J=1,7Гц, 1Н); 7,40 (дд, J=1,7, 8,3Гц, 1Н); 7,84 (д, J=10,0Гц, 1Н).
ПРИМЕР 7
[N-(3,6-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-(циклопропилметокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Раствор 6-[N-(5-бром-2-(циклопропилметокси)бензил)-N-этиламино]пиридазин-3-карбоновой кислоты (пример 3) (0,166 г, 0,409 ммоль) в ДМФ (4 мл) обрабатывали 3,5-диметил-4-сульфонамидоизоксазолом (0,08 г, 0,455 ммоль), диметиламинопиридином (0,15 г, 1,23 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимидогидрохлоридом (0,12 г, 0,627 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. ТСХ (10% MeOH/CH2Cl2+1% НОАс) показала, что реакция не была завершена. Дополнительно добавляли диметиламинопиридин (0,05 г, 0,409 ммоль) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,08 г, 0,418 ммоль) и реакционную смесь перемешивали в течение 60 часов при комнатной температуре. Реакционную смесь распределяли между водой и этилацетатом. Органический слой сушили (MgSO4) и упаривали и остаток очищали с помощью хроматографии (элюент: метанол/дихлорметан/уксусная кислота) с получением указанного в заголовке соединения в виде пены (0,073 г).
МС (ESP+): 564 (M+H)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,3 (м, 2Н); 0,53 (м, 2Н); 1,55 (м, 4Н); 2,40 (с, 3Н); 2,70 (с, 3Н); 3,70 (кв, J=7Гц, 2Н); 3,87 (д, J=7Гц, 2Н); 4,85 (с, 2Н); 6,98 (д, J= 9Гц, 1Н); 7,22 (д, J=2Гц, 1Н); 7,24 (д, J=9Гц, 1Н); 7,39 (дд, J=2,9Гц, 1Н); 7,83 (д, J=9ГЦ, 1Н).
ПРИМЕР 8
Соединения, представленные в таблице (см. в конце текста), получали из соответствующей карбоновой кислоты и соответствующего сульфонамидного производного способом, аналогичным описанному в примере 7.
Примечания к таблице
а) ЯМР (200 МГц, ДМСО-d6) δ: 0,97 (д, 6Н); 1,15 (т, 3Н); 2,02 (м, 1Н); 2,40 (с, 3Н); 2,69 (с, 3Н); 3,70 (кв, 2Н); 3,80 (д, 2Н); 4,85 (с, 2Н); 7,03 (м, 2Н); 7,20 (д, 1Н); 7,27 (дд, 1Н); 7,82 (д, 1Н).
Элементный анализ для C23H28ClN5O5S + 0,13 моль толуола:
Теоретич. (%): C - 53,8; H - 5,5; N - 13,1.
Найдено (%): C - 53,4; H - 5,5; N - 12,7.
b) ЯМР (200 МГц, ДМСО-d6) δ: 0,95 (д, 6Н); 1,14 (т, 3Н); 2,00 (м, 1Н); 2,23 (с, 3Н); 3,67 (кв, 2H); 3,80 (д, 2Н); 4,83 (с, 2Н); 7,04 (Д, J=8Гц, 1Н); 7,14 (д, J=3Гц, 1Н); 7,28 (дд, J=8, 3ГЦ, 1Н); 7,57 (д, J=9Гц, 1Н); 8,05 (д, J=9Гц, 1Н); 12,84 (с, 1Н).
Элементный анализ для C22H26ClN7O5S2 + 0,1 моль CH2Cl2 + 0,2 моль H2O:
Теоретич. (%): C - 45,8; H - 4,6; N - 16,9.
Найдено (%): C - 45,4; H - 4,5; N - 16,8.
Т. пл. 240-242oС.
с) ЯМР (200 МГц, ДМСО-d6) δ: 1,00 (м, 9Н); 1,15 (т, 3Н); 1,75 (м, 2H); 2,03 (м, 1Н); 3,45 (т, 2H); 3,70 (кв, 2H); 3,81 (д, 2Н); 4,86 (с, 2Н); 7,03 (м, 2Н); 7,20 (д, 1Н); 7,27 (дд, 1Н); 7,87 (д, 1Н).
Элементный анализ для C21H29ClN4O4S:
Теоретич. (%): C - 53,8; H - 6,2; N - 11,9.
Найдено (%): C - 53,9; H - 6,2; N - 11,9.
d) MC (ESP+): 534/536 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, 3Н); 1,65 (шир. м); 1,88 (шир. м, 2Н); 2,38 (с, 3Н); 2,68 (с, 3Н); 3,65 (кв, 2Н); 4,76 (с, 2Н); 4,85 (м, 1Н); 7,00 (д, 1Н); 7,03 (д, 1Н); 7,18 (д, 1Н); 7,24 (дд, 1Н); 7,82 (д, 1Н).
e) MC (ESP+): 507/509 (МН+).
ЯМР (200 МГц, ДMCO-d6) δ: 1,11 (т, 3Н); 1,60 (шир. м, 6Н); 1,88 (м, 2Н); 3,63 (кв, 2Н); 4,75 (с, 2Н); 4,85 (м, 1Н); 7,02 (д, 1Н); 7,30 (м, 2Н); 7,88 (д, 2Н); 8,20 (д, 2Н).
f) Т.пл. 111-113oС.
ЯМР (МГц, ДМСО-d6) δ: 0,92 (т, 3Н); 1,1 (т, 3Н); 1,5-2,2 (м, 8Н); 2,65 (м, 1Н); 3,25 (м, 2Н); 3,68 (кв, 2Н); 3,95 (д, 2Н); 4,8 (с, 2Н); 7,0 (м, 2Н); 7,15 (д, 1Н); 7,25 (дд, 1Н); 7,82 (д, 1Н).
Элементный анализ для C22H29ClSN4O4S • 0,75 H2O:
Теоретич. (%): C - 53,4; H - 6,2; N - 11,3.
Найдено (%): C - 53,3; H - 5,8; N - 11,4.
g) Т.пл. 140-142oС.
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н); 1,75-2,2 (м, 6Н); 2,25 (с, 3Н); 2,55 (с, 3Н); 2,70 (м, 1Н); 3,65 (кв, 2Н); 4,0 (д, 2Н); 4,75 (с, 2Н); 7,0 (м, 3Н); 7,25 (дд, 1Н); 7,8 (д, 1Н).
Элементный анализ для C24H28SClN5O5 • H2O:
Теоретич. (%): C - 52,2; H - 5,4; N - 12,7.
Найдено (%): C - 51,8; H - 5,0; N - 12,5.
ПРИМЕР 9
6-[N-(5-Бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Бутил-6-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоксилат (сравнительный пример 10) (0,22 г, 0,47 ммоль) в ТГФ (3 мл) и метаноле (3 мл) обрабатывали 1 н. водным раствором гидроксида натрия (3 мл) и оставляли на 1,5 часа при комнатной температуре (после чего ТСХ (диэтиловый эфир/гексан 1:1) указывала на отсутствие сложного эфира). Реакционную смесь упаривали до меньшего объема, обрабатывали небольшим количеством воды и подкисляли уксусной кислотой с получением смолы. Эта смола не отверждалась, поэтому ее экстрагировали этилацетатом (х2) и объединенные экстракты промывали солевым раствором, сушили (MgSO4) и упаривали с получением смолы. Смолу подвергали упариванию из толуола и дихлорметана с получением указанного в заголовке соединения в виде пены (140 мг, 73%).
МС (CI+): 408,410 (М+Н)+.
МС (EI+): 408,410 (M+H)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,00 (д, J=10Гц, 6Н); 1,16 (т, J=8,3Гц, 3Н); 1,93-2,15 (м, 1Н); 3,69 (кв, J=8,3Гц, 2Н); 3,80 (д, J=6,67Гц, 2Н); 4,84 (с, 2Н); 6,98 (д, J=10Гц, 1Н); 7,12 (м, 2Н); 7,40 (дд, J=2, 8,3Гц, 1Н); 7,84 (д, J=10Гц, 1Н).
ПРИМЕР 10
6-[N-(5-Хлор-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали путем гидролиза бутил-6-[N-(5-хлор-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 12) способом, подобным описанному в примере 1.
ЯМР (250 МГц, ДМСО-d6) δ: 1,00 (д, 6Н); 1,15 (т, 3Н); 2,04 (м, 1Н); 3,69 (кв, 2Н); 3,80 (д, 2Н); 4,84 (с, 2Н); 7,03 (м, 2Н); 7,11 (д, 1Н); 7,27 (дд, 1Н); 7,83 (д, 1Н).
МС (ES+): 362 (М-Н)-.
Элементный анализ для C18H22ClN3O3:
Теоретич. (%): C - 59,4; H - 6,1; N - 11,5.
Найдено (%): C - 59,4; H - 5,9; N - 11,4.
Т.пл. 132-134oС.
МС (CI+): 181 (М+Н)+.
ПРИМЕР 11
6-[N-(5-Бром-2-(циклопропилметокси)бензил)-N-этил] пиридазин-3-карбоксамид
N-Этил-5-бром-2-(циклопропилметокси)бензиламин (сравнительный пример 13) (12,56 г) растворяли в NМП (59 мл) в атмосфере аргона. Прибавляли 6-хлорпиридазин-3-карбоксамид (6,17 г, 3,9 ммоль) и бикарбонат натрия (8,24 г, 98 ммоль) и смесь нагревали при 110oС в течение 24 часов. Затем смесь охлаждали и разбавляли этилацетатом и выливали в смесь насыщенного водного раствора хлорида аммония и 1 н. соляной кислоты (50 мл). Образовавшийся белый осадок отфильтровывали и промывали этилацетатом и диэтиловым эфиром с получением указанного в заголовке соединения, которое сушили в вакуумной печи при 55oС (11,46 г, 72,1%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,34 (м, 2Н); 0,55 (м, 2Н); 1,17 (м, 4Н); 3,69 (кв, 2Н); 3,88 (д, 2Н); 4,80 (с, 2Н); 6,96 (д, 1Н); 7,15 (м, 2Н); 7,37 (дд, 1Н); 7,42 (шир. с, 1Н); 7,84 (д, 1Н); 8,14 (шир. с, 1Н).
МС (ESP+): 405 (М+Н)-.
ПРИМЕР 12
5-[6-(N-[5-Бром-2-(циклопропилметокси)бензил] -N-этиламино) пиридазин-3-ил]тетразол
6-[N-(5-бром-2-(циклопропилметокси)бензил] -N-этиламино]-3-цианпиридазин (сравнительный пример 14) (1,63 г) растворяли в диметилацетамиде (ДМА) (17 мл) в атмосфере аргона. Добавляли гидрохлорид триэтиламина (0,87 г, 6,3 ммоль) и азид натрия (0,82 г, 12,6 ммоль) и смесь нагревали при 95-110oС в течение 3 часов. Затем охлаждали и распределяли между насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой промывали 10% 2 н. НСl, насыщенным водным раствором хлорида аммония (x 2) и солевым раствором (х 2), сушили над Na2SO4, фильтровали и упаривали. Остаток перекристаллизовывали из ацетонитрила с получением указанного в заголовке соединения (1,34 г, 74,0%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,34 (м, 2Н); 0,56 (м, 2Н); 1,20 (м, 4Н); 3,74 (кв, 2Н); 3,88 (д, 2Н); 4,84 (с, 2Н); 6,96 (д, 1Н); 7,25 (д, 1Н); 7,29 (д, 1Н); 7,37 (дд, 1Н); 8,03 (д, 1Н).
Элементный анализ для C18H20BrN7O:
Теоретич. (%): C - 50,2; H - 4,7; N - 22,8.
Найдено (%): C - 50,2; H - 4,8; N - 22,8.
МС (ESP+): 430 (М+Н)+.
ПРИМЕР 13
5-(6-[N-(5-Хлор-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-тетразол
Указанное в заголовке соединение получали из 6-[N-(5-хлор-2-(2-метилпропокси)бензил)-N-этиламино] -3-цианпиридазина (сравнительный пример 15) способом, аналогичным описанному в примере 12.
ЯМР (200 МГц, ДМСО-d6) δ: 0,99 (д, 6Н); 1,18 (т, 3Н); 2,04 (м, 1Н); 3,72 (кв, 2Н); 3,82 (д, 2Н); 4,86 (с, 2Н); 7,04 (д, 1Н); 7,09 (д, 1Н); 7,27 (м, 2Н); 8,03 (д, 1Н).
Элементный анализ для C18H22ClN7O:
Теоретич. (%): C - 55,7; H - 5,7; N - 25,3.
Найдено (%): C - 55,6; H - 5,7; N - 24,9.
MC (ES+): 388 (М+Н)+.
Т.пл. 204-206oС.
ПРИМЕР 14
N-Пропансульфонил-6-[N-(5-бром-2-(циклопропилметокси)бензил] -N-этиламино]пиридазин-3-карбоксамид
6-[N-(5-Бром-2-(циклопропилметокси)бензил] -N-этиламино] пиридазин-3-карбоновую кислоту (пример 3) (1,0 г, 2,46 ммоль) смешивали с пропилсульфонамидом (0,32 г, 2,6 ммоль), 4-(диметиламино)пиридином (0,90 г, 7,38 ммоль) и гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,71 г, 3,7 ммоль) в атмосфере аргона. Прибавляли ДМФ (12,0 мл) и смесь перемешивали в течение ночи при комнатной температуре.
Реакционную смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом (х 2). Объединенные органические экстракты промывали 5% 2 н НСl в насыщенном водном растворе хлорида аммония, насыщенным водным раствором бикарбоната натрия (х 1) и солевым раствором (х 1), сушили над Na2SO4, фильтровали и упаривали. Остаток очищали с помощью жидкостной хроматографии среднего давления (ЖХСД) с использованием 2,5% ИПА/дихлорметан + 0,2% уксусная кислота. Фракции, содержащие указанное в заголовке соединение, упаривали и остаток подвергали совместной отгонке с толуолом, изогексаном и, наконец, эфиром, в результате чего после сушки в высоком вакууме было получено указанное в заголовке соединение в виде белой пены (100 г, 79,4%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,30 (м, 2Н); 0,55 (м, 2Н); 1,00 (т, 3Н); 1,16 (м, 4Н); 1,75 (м, 2Н); 3,45 (т, 3Н); 3,73 (кв, 2Н); 3,87 (д, J=7,5Гц, 2Н); 4,85 (с, 2Н); 6,97 (д, J=8,3Гц, 1Н); 7,18 (д, J=3,1Гц, 1Н); 7,24 (д, J= 8,7Гц, 1Н); 7,39 (дд, J=8,3, 3,1Гц, 1Н); 7,86 (д, J=8,7Гц, 1Н).
Элементный анализ для C21H27BrN4O4S:
Теоретич. (%): C - 49,3; H - 5,3; N - 11,0.
Найдено (%): C - 49,7; H - 5,6; N - 10,7.
ПРИМЕР 15
6-[N-(5-Бром-2-(2-гидрокси-3,3,3-трифторпропокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали из н-бутилового эфира (сравнительный пример 16) способом, подобным описанному в примере 1.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н); 3,68 (м, 2Н); 4,20 (м, 2Н); 4,44 (м, 1Н); 4,89 (с, 2Н); 7,08 (м, 3Н); 7,4 (дд, 1Н); 7,83 (д, 1Н).
МС: 463 (М+Н)+.
ПРИМЕР 16
5-[6-(N-[2-(Циклопропилметокси)-5-метансульфонилбензил] -N-этиламино)пиридазин-3-ил]тетразол
Указанное в заголовке соединение получали из соответствующего цианопроизводного (сравнительный пример 17) способом, подобным описанному в примере 12, за исключением того, что смесь нагревали при 85oС приблизительно в течение 20 часов и ход реакции контролировали с помощью ТСХ. Выход: 80%.
ЯМР (200 МГц, ДМСО-d6) δ: 0,36 (м, 2Н); 0,57 (м, 2Н); 1,14-1,35 (м, 4Н); 3,08 (с, 3Н); 3,78 (кв, 2H); 4,03 (д, J=6,2Гц, 2H); 4,93 (с, 2H); 7,25 (д, J=8,3Гц, 1Н); 7,35 (д, J=8,3Гц, 1Н); 7,68 (Д, J=2,1Гц, 1Н); 7,83 (дд, J=2,1, 8,3Гц, 1Н); 8,05 (Д, J=8,3Гц, 1Н).
МС (ESP+): 430 (M+H)+.
ПРИМЕР 17
5-[6-(N-[5-Бром-2-пропоксибензил]-N-этиламино)пиридазин-3-ил]тетразол
6-[N-(5-Бром-2-пропоксибензил)-N-этиламино]-3-цианпиридазин (сравнительный пример 18) (1,0 г, 2,67 ммоль) растворяли в ДМА (15 мл) и обрабатывали азидом натрия (520 мг, 8,0 ммоль), а затем триэтиламмонийхлоридом (550 мг, 4,0 ммоль) и смесь нагревали в течение 3 часов при 110oС. Полученный раствор выливали в 2М соляную кислоту (50 мл), экстрагировали этилацетатом и дихлорметаном (100 мл каждого) и объединенные экстракты промывали водой (3х100 мл), сушили над МgSO4 и концентрировали в вакууме. Добавление эфира и гексана вызывает образование твердого осадка, который растирали в ацетонитриле/толуоле с получением указанного в заголовке соединения (965 мг, 87%).
МС (ESP+): 418 (М+Н)+, 390 (M+H-N2)-.
Элементный анализ для C17H20BrN7O:
Вычислено: (%) C - 48,8; H - 4,82; N - 23,4.
Найдено: (%) C - 49,1; H - 4,7; N - 23,5.
ЯМР (250 МГц, ДМСО-d6) δ: 0,99 (т, J=7Гц, 3Н); 1,17 (т, J=6Гц, 3Н); 1,72 (м, 2Н); 3,72 (кв, J=6Гц, 2Н); 4,0 (т, J=7Гц, 2Н); 4,82 (с, 2Н), 6,98 (д, J= 8,5Гц, 1Н); 7,22 (д, J=2Гц, 1Н); 7,27 (д, J=8Гц, 1Н); 7,40 (дд, J=2,8Гц, 1Н); 8,03 (д, J=8,5Гц, 1Н).
ПРИМЕР 18
6-(N-[5-Бром-2-пропоксибензил]-N-этиламино)пиридазин-3-карбоновая кислота
6-[N-(5-Бром-2-пропоксибензил]-N-этиламино]-3-цианопиридазин (сравнительный пример 18) (1,5 г, 4 ммоль) в этаноле (100 мл) обрабатывали водным раствором гидроксида натрия (20 мл, 2М, 40 ммоль) и нагревали до 70oС в течение 16 часов. Растворители упаривали при пониженном давлении, остаток растворяли в воде, подкисляли уксусной кислотой и четыре раза экстрагировали этилацетатом. Объединенные органические фазы промывали водой и солевым раствором, сушили над MgSO4 и концентрировали в вакууме. Полученную смолу растирали в эфире с получением указанного в заголовке соединения в виде твердого продукта (1,24 г, 79%).
Т.пл. 135-137oС.
МС (ESP-): 392 (МН)-.
Элементный анализ для C17H20BrN7O:
Вычислено: (%) C - 51,8; H - 5,1; N - 10,7.
Найдено: (%) C - 51,9; H - 5,3; N - 10,6.
ПРИМЕР 19
N-Пропил-6-(N-[5-бром-2-пропоксибензил] -N-этиламино) пиридазин-3-карбоксамид
6-(N-[5-Бром-2-пропоксибензил]-N-этиламино)пиридазин-3-карбоновую кислоту (пример 18) (500 мг, 1,27 ммоль) растворяли в дихлорметане (50 мл), добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDAC) (365 мг, 2,07 ммоль), диметиламинопиридин (ДМАП) (465 мг, 3,81 ммоль) и пропансульфонамид (190 мг, 1,54 ммоль). Смесь перемешивали при комнатной температуре в течение ночи в атмосфере аргона, после чего данные ТСХ (5% метанол/дихлорметан) подтверждали завершение реакции. Реакционную смесь загружали непосредственно на ЖХСД-колонку (силикагель) и в результате элюирования 5% метанолом/дихлорметаном получали указанное в заголовке соединение в виде пены (380 мг, 60%).
MC (ESP+): 499 (M+H)+.
Элементный анализ для C20H27BrN4O4S:
Вычислено: (%) C - 48,1; H - 5,45; N - 11,2.
Найдено: (%) C - 48,2; H - 5,8; N - 10,8.
ЯМР (250 МГц, ДМСО-d6) δ: 0,95 (м, 6Н); 1,17 (т, J=6Гц, 3Н); 1,7 (м, 2Н); 3,37 (т, J=8Гц, 2Н); 3,67 (кв, J=6Гц, 2Н); 3,95 (т, J=6Гц, 2Н); 4,82 (с, 2Н); 6,98 (д, J=8,5Гц, 1Н); 7,12 (Д, J=2Гц, 1Н); 7,17 (д, J=8Гц, 1Н); 7,37 (дд, J=2,8Гц, 1Н); 7,83 (д, J=8,5Гц, 1Н).
ПРИМЕР 20
N-(3,5-Диметилизоксазо-4-илсульфонил)-6-(N-[5-бром-2-пропоксибензил] -N-этиламино)пиридазин-3-карбоксамид
6-(N-[5-Бром-2-пропоксибензил]-N-этиламино)пиридазин-3-карбоновую кислоту (пример 18) (500 мг, 1,27 ммоль) растворяли в дихлорметане (50 мл). Добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDAC) (365 мг, 2,07 ммоль), диметиламинопиридин (ДМАП) (465 мг, 3,81 ммоль) и 3,5-диметилоксазоли-4-илсульфонамид (270 мг, 1,53 ммоль). Смесь перемешивали при комнатной температуре в течение ночи в атмосфере аргона, после чего данные ТСХ (5% метанол/дихлорметан) подтверждали завершение реакции. Реакционную смесь помещали непосредственно на ЖХСД-колонку (силикагель) и после элюирования 5% метанолом/дихлорметаном получали указанное в заголовке соединение в виде смолы, которое затем очищали путем растирания в эфире с получением требуемого продукта в виде твердого продукта (180 мг, 33%).
Т.пл. 122-124oС.
МС (ESP+): 552 (М+Н)+.
Элементный анализ для C22H26BrN5O5S • 1,1 H2O:
Вычислено: (%) C - 47,8; H - 4,7; N - 12,7.
Найдено: (%) C - 46,2; H - 4,9; N - 12,2.
ЯМР (250 МГц, ДМСО-d6) δ: 0,95 (м, J=6Гц, 3Н); 1,12 (т, J=7Гц, 3Н); 1,72 (м, 2Н); 2,27 (с, 3Н); 2,55 (с, 3Н); 3,62 (кв, J=7Гц, 2Н); 3,95 (т, J=6Гц, 2Н); 4,72 (с, 2Н); 6,93 (д, J=8,5Гц, 1Н); 6,97 (д, J=8Гц, 1Н); 7,17 (д, J= 2Гц, 1Н); 7,37 (дд, J=2, 8Гц, 1Н); 7,77 (д, J=8,5Гц, 1Н).
ПРИМЕР 21
6-[N-(5-Хлор-2-(2-циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоксамид
Смесь N-этил-5-хлор-2-(циклопропилметокси)бензиламина (сравнительный пример 20) (4,4 г, 18,4 ммоль), 6-хлорпиридазин-3-карбоксамида (3,0 г, 19 ммоль), диизопропилэтиламина (5,0 мл, 29 ммоль) и ДМФ (25 мл) перемешивали в течение 16 часов при нагревании с обратным холодильником. Смесь охлаждали и разбавляли водой (50 мл), смолу оставляли для отстаивания, супернатантную жидкость сливали. Смолу растворяли в дихлорметане и перемешивали при добавлении 2 н. соляной кислоты (50 мл). Через 10 минут образовывался осадок. Твердый продукт отфильтровывали и промывали дихлорметаном (10 мл) и эфиром (20 мл) с получением темно-желтого твердого продукта (3,8 г, 61%), т.пл. 177-8oС.
МС (ESP+): 361/363 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,34 (м, 2Н); 0,57 (м, 2Н); 1,16 (т, J=7Гц, 3Н); 1,25 (м, 1Н); 3,70 (кв, J=7Гц, 2Н); 3,78 (д, 2Н); 4,81 (с, 2Н); 7,00 (д, J= 8Гц, 1Н); 7,05 (д, J=2Гц, 1Н); 7,17 (д, J=9Гц, 1Н); 7,25 (дд, J=2, 8Гц, 1Н); 7,45 (шир. с, 1Н); 7,85 (д, J=9Гц, 1Н), 8,07 (шир. с, 1Н).
ПРИМЕР 22
6-[N-(5-Хлор-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали в виде белого порошка из 6-[N-(5-хлор-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоксамида (пример 21) способом, подобным описанному в примере 26.
Выход: 86%.
Т.пл. 119-120oС.
МС (ESP+): 362/364 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,34 (м, 2Н); 0,56 (м, 2Н); 1,17 (т, J=7Гц, 3Н); 1,22 (м, 1Н); 3,72 (кв, J=7Гц, 2Н); 3,90 (д, J=7Гц, 2Н); 4,83 (с, 2Н); 7,02 (д, J= 8Гц), 7,08 (д, J=2Гц, 1Н); 7,14 (д, J=9Гц, 1Н); 7,26 (дд, J=2, 8Гц, 1Н); 7,84 (д, J=9Гц, 1Н).
Элементный анализ:
Вычислено: (%) C - 59,8; H - 5,6; N - 11,6, Cl 9,8.
Найдено: (%) C - 59,3; H - 5,6; N - 11,7, Cl 9,9.
ПРИМЕР 23
5-[6-(N-[5-Хлор-2-циклопропилметоксибензил]-N-этиламино) пиридазин-3-ил] тетразол
Указанное в заголовке соединение получали из 6-[N-(5-хлор-2-циклопропилметоксибензил] -N-этиламино] -3-цианопиридазина (сравнительный пример 21) способом, подобным описанному в примере 12. Выход: 41%.
Т.пл. 190-192oС.
МС (ESP+): 386/388 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,35 (м, 2Н); 0,57 (м, 2Н); 1,20 (т, J=7ГЦ, 3Н); 3,77 (кв, J=7Гц, 2Н); 3,90 (Д, J=7Гц, 2Н); 4,85 (с, 2Н); 7,01 (д, J= 8Гц, 1Н); 7,14 (д, J=2Гц, 1Н); 7,25 (дд, J=2,8Гц, 1Н); 7,29 (д, J=8Гц, 1Н); 8,04 (д, J=8Гц, 1Н).
Элементный анализ:
Вычислено: (%) C - 56,0; H - 5,2; N - 25,4.
Найдено: (%) C - 55,9; H - 5,3; N - 25,0.
ПРИМЕР 24
N-Трифторметансульфонил-6-[N-(5-хлор-2-циклопропилметоксибензил)-N-этиламино]пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из 6-[N-(5-хлор-2-циклопропилметоксибензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 22) и трифторметансульфонамида способом, подобным описанному в примере 7. Выход: 18%.
Т.пл. 150oС (с разл.).
МС (ESP+): 493/495 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,35 (м, 2Н); 0,57 (м, 2Н); 1,15 (т, J=7Гц, 3Н); 3,67 (кв, J=7Гц, 2Н); 3,88 (д, J=7Гц, 2Н); 4,80 (с, 2Н); 6,95-7,10 (м, Н); 7,24 (дд, J=2, 8Гц, 1Н); 7,80 (д, J=8Гц, 1Н).
ПРИМЕР 25
6-[N-(5-Хлор-2-циклопентоксибензил)-N-этиламин]пиридазин-3-карбоксамид
N-Этил-5-хлор-2-циклопентоксибензиламин (сравнительный пример 22; используемый без дополнительной очистки) (4,27 г, 16,8 ммоль) в диметилформамиде (25 мл) затем обрабатывали 6-хлорпиридазин-3-карбоксамидом (описанным в сравнительном примере 3) (3,03 г, 19,2 ммоль) и этилдиизопропиламином (5 мл, 29 ммоль) и оставляли кипятиться с обратным холодильником при 140oС в течение 16 часов. Добавляли воду (50 мл) и продукт экстрагировали дихлорметаном и эфиром, сушили над безводным сульфатом магния, фильтровали и очищали с помощью колоночной хроматографии (2% пропан-2-ол в дихлорметане) с получением 1,44 г желтой смолы. Растирание в эфире дает указанное в заголовке соединение (790 мг, 13%).
МС (ESP+): 375/377 (МH+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,08 (т, 3Н); 1,60 (м, 6Н); 1,87 (м, 2Н); 3,62 (кв, 2Н); 4,74 (с, 2Н); 4,85 (м, 1Н); 7,03 (м, 2Н); 7,13 (д, 1Н); 7,24 (дд, 1Н); 7,42 (шир. с, 1Н); 7,82 (д, 1Н); 8,08 (шир. с, 1Н).
ПРИМЕР 26
6-[N-(5-Хлор-2-циклопентоксибензил)-N-этиламин] пиридазин-3-карбоновая кислота
6-[N-(5-Хлор-2-циклопентоксибензил)-N-этиламин] пиридазин-3-карбоксамид (пример 25) (0,75 г, 2,0 ммоль) растворяли в этаноле (50 мл), добавляли 2 н. гидроксид натрия (15 мл) и раствор нагревали с обратным холодильником при 80oС в течение 16 часов. После охлаждения растворитель удаляли в вакууме и добавляли воду (100 мл). Раствор подкисляли ледяной уксусной кислотой и указанное в заголовке соединение экстрагировали дихлорметаном, промывали водой (2х100 мл) и сушили над безводным сульфатом магния. Растворитель упаривали и продукт перекристаллизовывали из дихлорметана, эфира и гексана при стоянии (100 мг, 13%).
МС (ESP+): 376/378 (МН+).
ЯМР (200 МГц, ДМСО-d6, 373К) δ: 0,79 (т, 3Н); 1,62 (м, 6Н); 1,88 (м, 2Н); 3,15 (м, 2Н); 4,38 (с, 2Н); 4,80 (м, 1Н); 6,80 (шир. с, 1Н); 6,95 (д, 1Н); 7,22 (дд, 1Н); 7,32 (д, 1Н); 7,93 (д, 1Н).
ПРИМЕР 27
5-[6-(N-[5-Хлор-2-циклопентоксибензил] -N-этиламино)пиридазин-3-ил] тетразол
Указанное в заголовке соединение получали из 6-(N-[5-хлор-2-циклопентоксибензил] -N-этиламино)-3-цианпиридазина (сравнительный пример 23) способом, подобным описанному в примере 12, за исключением того, что реакционную смесь перемешивали 9 часов при 150oС, раствор подкисляли 1 н. соляной кислотой и полученный продукт экстрагировали дихлорметаном (2х100 мл), очищали с помощью колоночной хроматографии (10% пропан-2-ол, 0,1% метановая кислота в дихлорметане). Растирание в эфире дало указанный в заголовке продукт (225 мг, 18%).
МС (ESP+): 400/402 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,14 (т, 3Н); 1,60 (м, 4Н); 1,70 (м, 2Н); 1,88 (м, 2Н); 3,65 (кв, 2Н); 4,78 (с, 2Н); 4,87 (м, 1Н); 7,02 (д, 1Н); 7,13 (д, 1Н); 7,28 (м, 2Н); 8,03 (д, 1Н).
ПРИМЕР 28
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Указанное в заголовке соединение было получено из 6-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 9) и 3,5-диметилизоксазол-4-илсульфонамида способом, подобным описанному в примере 14.
ЯМР (200 МГц, ДМСО-d6) δ: 0,98 (д, 6Н); 1,15 (т, 3Н); 1,95-2,06 (м, 1Н); 2,38 (с, 3Н); 2,7 (с, 3Н); 3,69 (кв, 2Н); 3,8 (д, 2Н); 4,85 (с, 2Н); 6,98 (д, 1Н); 7,13 (д, 1Н); 7,2 (д, 1Н); 7,39 (дд, 1Н); 7,8 (д, 1Н).
ПРИМЕР 29
6-[N-(5-Метансульфонил-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
6-[N-(5-Метансульфонил-2-(циклопропилокси)бензил)-N-этиламино]-3-цианпиридазин (900 мг, 2,3 ммоль) в этаноле (30 мл) и воде (6 мл) обрабатывали гранулированным гидроксидом натрия (0,93 г, 23 ммоль) и полученный раствор нагревали при 80oС в течение ночи (ход реакции контролировали с помощью ВЭЖХ). Затем смесь упаривали до меньшего объема, добавляли воду и смесь экстрагировали этилацетатом (х 3) (небольшое количество нерастворившегося вещества не учитывалось). Водный слой подкисляли уксусной кислотой и экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, сушили и упаривали до оставшейся смолы. Смолу растворяли в дихлорметане и упаривали с получением указанного в заголовке соединения в виде пены (0,56 г, 60%).
МС (ESP-): 404 (М-Н-).
ЯМР (200 МГц, ДМСО-d6) δ: 0,3-0,4 (м, 2Н); 0,52-0,6 (м, 2Н); 1,1-1,3 (м + т, 4Н); 3,05 (с, 3Н); 3,72 (кв, 2Н); 4,0 (д, 2Н); 4,87 (с, 2Н); 7,18 (д, 1Н); 7,24 (д, 1Н); 7,58 (д, 1Н); 7,8 (дд, 1Н); 7,84 (д, 1Н).
ПРИМЕР 30
N-(Пропансульфонил)-6-[N-(5-метансульфонил-2-(циклопропилметокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из 6-[N-(5-метансульфонил-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 29) способом, подобным описанному в примере 14.
МС (ESP+): 511,2 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,29-0,38 (м, 2Н); 0,5-0,62 (м, 2Н); 0,98 (т, 3Н); 1,3-1,1 (м + т, 4Н); 1,65-1,82 (м, 2Н);
3,05 (с, 3Н); 3/43 (т, 2Н); 3,75 (кв, 2H); 4,0 (д, 2Н); 4,9 (с, 2H); 7,23 (д, 1Н); 7,27 (д, 1H); 7,56 (д, 1Н); 7,8 (дд, 1H); 7,85 (д, 1H).
ПРИМЕР 31
N-Пропансульфонил-6-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из соответствующей кислоты (пример 9) способом, аналогичным описанному в примере 7.
ЯМР (250 МГц, ДМСО-d6) δ: 1,00 (м, 9Н); 1,15 (т, 3Н); 1,75 (м, 2H); 2,03 (м, 1H); 3,45 (м, 2H); 3,70 (кв, 2H); 3,80 (д, 2H); 4,86 (с, 2H); 7,0 (д, 1H); 7,13 (д, 1H); 7,21 (д, 1H); 7,40 (дд, 1H); 7,87 (д, 1H).
ПРИМЕР 32
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-(3,3,3-трифтор-2-гидроксипропокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из 6-[N-(5-бром-2-(3,3,3-трифтор-2-гидроксипропокси) бензил)-N-этил-амино] пиридазин-3-карбоновой кислоты (пример 15) способом, подобным описанному в примере 7.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н); 2,35 (с, 3Н); 2,63 (с, 3Н); 3,68 (кв, 2H); 4,2 (м, 2H); 4,40 (м, 1H); 4,82 (с, 2H); 6,65 (д, 1H); 7,05 (м, 2H); 7,2 (м, 1H); 7,40 (дд, 1H); 7,80 (д, 1H).
MC (ESP+): 622(М+Н)+.
ПРИМЕР 33
6-[N-(5-Бром-2-(циклобутокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали из соответствующего нитрила (сравнительный пример 24) способом, подобным описанному в примере 29.
MC (ESP+): 406 (M+H)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н); 1,73 (м, 2Н); 2,00 (м, 2Н); 2,42 (м, 2Н); 3,69 (кв, 2Н); 4,72 (квинтет, 1Н); 4,81 (с, 2Н); 6,82 (д, 1Н); 7,12 (д, 1Н); 7,16 (д, 1Н); 7,36 (дд, 1Н); 7,83 (д, 1Н).
ПРИМЕР 34
5-[6-(N-[5-Бром-2-(3,3,3-трифтор-2-гидроксипропокси)бензил)-N-этиламино] пиридазин-3-ил]тетразол
Указанное в заголовке соединение получали из соответствующего нитрила (сравнительный пример 25) способом, подобным описанному в примере 12.
MC (ESP+): 488 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,18 (т, 3Н); 3,72 (кв, 2H); 4,16 (м, 1Н); 4,27 (м, 1Н); 4,44 (м, 1Н); 4,84 (с, 2H); 6,66 (шир. д, 1Н); 7,08 (д, 1Н); 7,19 (д, 1Н); 7,25 (д, 1Н); 7,41 (дд, 1Н); 8,03 (д, 1Н).
ПРИМЕР 35
2-[N-(5-Бром-2-циклопропилметоксибензил)-N-этиламино] пиридин-5-карбоновая кислота
2-[N-(5-Бром-2-циклопропилметоксибензил)-N-этиламино] -5-цианпиридин (сравнительный пример 26) (7,5 г, 19,43 ммоль) растворяли в этаноле (400 мл) и добавляли гидроксид натрия (7,8 г, 174 ммоль), затем воду (80 мл). Смесь нагревали с обратным холодильником в течение 16 часов, этанол удаляли в вакууме и остаток экстрагировали этилацетатом (4х100 мл). Органические экстракты подкисляли уксусной кислотой и промывали водой (100 мл) с получением твердого продукта (6,8 г). Этот твердый продукт растворяли в н-бутаноле (400 мл) и добавляли гидроксид натрия (6,75 г, 169 ммоль) и воду (80 мл). Смесь нагревали с обратным холодильником в течение 72 часов, бутанол удаляли в вакууме, добавляли 100 мл воды и остаток экстрагировали этилацетатом (4х100 мл). Органические экстракты подкисляли уксусной кислотой и промывали водой (100 мл). Объединенные водные слои затем подкисляли и экстрагировали этилацетатом (4х100 мл) с получением указанного в заголовке соединения в виде твердого продукта (2,4 г, 30%).
Т.пл. 175-177oС.
МС: 404 (М-Н)-
ЯМР (МГц, ДМСО-d6) δ: 0,30 (м, 2Н); 0,55 (м, 2Н); 1,12 (м, 4Н); 3,55 (кв, 2Н); 3,85 (д, 2Н); 4,68 (с, 2Н); 6,62 (д, 1Н); 6,92 (д, 1Н); 7,05 (д, 1Н); 7,35 (дд, 1Н); 7,88 (дд, 1Н); 8,58 (д, 1Н); 12,30 (с, 1Н).
Элементный анализ для C19H21BrN2O3 (%):
Вычислено: C - 56,3; H - 5,2; N - 6,9.
Найдено: C - 56,1; H - 5,3; N - 6,8.
ПРИМЕР 36
6-[N-(5-Хлор-2-циклобутилметоксибензил)-N-этиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали способом, подобным описанному в примере 18, путем обработки 6-[N-(5-хлор-2-циклобутилметоксибензил)-N-этиламино] -3-цианпиридазина (сравнительный пример 27) (2,3 г, 6,46 ммоль) гидроксидом натрия (2,6 г, 65 ммоль) в воде (20 мл) и этаноле (100 мл) с получением смолы, которая отверждается при растирании в эфире (1,15 г, 47%).
Т.пл. 140-142oС.
МС: 374 (М-Н)-.
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н); 1,95 (м, 6Н); 2,70 (м, 1Н); 3,68 (кв, 2Н); 4,0 (д, 2Н); 4,8 (с, 2Н); 7,0 (м, 3Н); 7,25 (дд, 1Н); 7,82 (д, 1Н).
Элементный анализ для C19H22ClN3O3 (%):
Вычислено: C - 60,5; H - 5,9; N - 11,2.
Найдено: C - 60,5; H - 6,0; N - 10,9.
ПРИМЕР 37
6-[N-(5-Бром-2-циклопропилметоксибензил)-N-пропиламин] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали из соответствующего сложного эфира [полученного способом, подобным описанному в сравнительном примере 3, с использованием пропиламина вместо этиламина, и сравнительном примере 4] способом, аналогичным описанному в примере 1. Выход: 20%.
МС (ESP+): 420/422 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 0,25 (м, 2Н); 0,57 (м, 2Н); 0,91 (т, 3Н); 1,21 (м, 1Н); 1,61 (м, 2Н); 3,63 (т, 2Н); 3,88 (д, 2Н); 4,83 (с, 2Н); 6,96 (д, J= 8Гц, 1Н); 7,13 (д, J=9Гц, 1Н); 7,16 (д, J=2Гц, 1Н); 7,38 (дд, J=2Гц, 8Гц, 1Н); 7,82 (д, J=9Гц, 1Н).
ПРИМЕР 38
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-циклопропилметоксибензил)-N-пропиламин]пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из 6-[N-(5-бром-2-циклопропилметоксибензил)-N-этиламин] пиридазин-3-карбоновой кислоты (пример 37) способом, подобным описанному в примере 7, за исключением того, что в качестве растворителя использовали дихлорметан и в очистке на колонке не было необходимости. Перекристаллизация (диэтиловый эфир/гексан) давала указанное в заголовке соединение (340 мг, 49%).
МС (ESP+): 578/580 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 0,33 (м, 2Н); 0,54 (м, 2Н); 0,88 (т, 3Н); 1,19 (м, 1Н); 1,60 (м, 2Н); 2,40 (с, 3Н); 2,68 (с, 3Н); 3,60 (т, 2Н); 3,87 (д, 2Н); 4,84 (с, 2Н); 6,96 (д, J=8Гц, 1Н); 7,17 (д, J=2ГЦ, 1Н); 7,23 (д, J=9Гц, 1Н); 7,38 (дд, J=2Гц, 8Гц, 1Н); 7,81 (д, J=9Гц, 1Н).
ПРИМЕР 39
6-[N-(5-Бром-2-циклопропилметоксибензил)-N-метиламино] пиридазин-3-карбоновая кислота
Указанное в заголовке соединение получали способом, подобным описанному в примере 37, из соответствующего N-метилового соединения.
МС (ESP+): 392/394 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 0,33 (м, 2Н); 0,55 (м, 2Н); 1,19 (м, 1Н); 3,38 (д, 2Н); 4,86 (с, 2Н); 6,97 (д, J=8Гц, 1Н); 7,17 (д, J=10Гц, 1Н); 7,20 (д, J=2Гц, 1Н); 7,37 (дд, J=8Гц, 2Гц, 1Н); 7,84 (д, J=10Гц).
ПРИМЕР 40
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-циклопропилметоксибензил)-N-метиламино]пиридазин-3-карбоксамид
Указанное в заголовке соединение получали из соответствующей карбоновой кислоты способом, подобным описанному в примере 38.
МС (ESP+): 550/552 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 0,30 (м, 2Н); 0,52 (м, 2Н); 1,16 (м, 1Н); 2,39 (с, 3Н); 2,69 (с, 3Н); 3,22 (с, 3Н); 3,85 (д, 2Н); 5,87 (с, 2Н); 6,95 (д, J= 8Гц, 1Н); 7,20 (д, J=2Гц, 1Н); 7,27 (д, 1Н); 7,39 (дд, J=2Гц, 8Гц, 1Н); 7,84 (д, 1Н).
Сравнительный пример 1
Метил-2-[N-(5-бром-2-пропоксибензил)-N-этиламино]пиридин-5-карбоксилат
6-Хлорникотиновую кислоту (100 г, 0,63 моль) обрабатывали этиламином (70% в воде, 500 мл). Реакционную смесь загружали в автоклав, герметично закрывали и нагревали при 170oС в течение 6 часов. Реакционную смесь упаривали, частично нейтрализовали концентрированной HCl и устанавливали pH 5 с помощью ледяной уксусной кислоты. Твердый продукт отфильтровывали и сушили в вакууме в течение 18 часов с получением 6-(этиламино)никотиновой кислоты (87,8 г, выход 84%).
МС (CI+): 167 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, J=7Гц, 3Н); 3,3 (кв, J=7Гц, 2Н); 6,45 (д, J=9Гц, 1Н); 7,25 (шир. т, 1Н); 7,78 (дд, J=2, 9Гц, 1Н); 8,54 (д, J=2Гц, 1Н); 11,6 (шир. с, 1Н).
Суспензию 6-(этиламино)никотиновой кислоты (50 г, 0,3 ммоль) в метаноле (500 мл) обрабатывали концентрированной H2SO4 (30 мл). Реакционную смесь нагревали с обратным холодильником в течение 18 часов. Затем реакционную смесь упаривали, выливали в ледяную воду (1 л) и устанавливали pH 8 с помощью твердого бикарбоната натрия (с образованием пены). Водную смесь экстрагировали этилацетатом (3х300 мл) и органические слои объединяли, сушили (MgSO4) и упаривали с получением метил-6-(этиламино)-никотиноата в виде не совсем белого твердого продукта (45,5 г, 84%).
ЯМР (200 МГц, ДМСО-d6) δ: 1,14 (т, J=7Гц, 3Н); 3,3 (кв, J=7Гц, 2Н); 3,76 (с, 3Н); 6,46 (д, J=9Гц, 1Н); 7,39 (шир. т, 1Н); 7,80 (дд, J=3, 9Гц, 1Н); 8,56 (д, J=3Гц, 1Н).
Раствор 5-бромсалицилальдегида (12,0 г, 59,7 ммоль) в ДМФ (50 мл) обрабатывали К2СО3 (16,5 г, 120 ммоль) и бензилбромидом (11,2 г, 65,6 ммоль). Реакционную смесь перемешивали в течение 18 часов при комнатной температуре, разбавляли этилацетатом и фильтровали. Фильтрат промывали НСl (0,05М), насыщенным водным раствором гидрокарбоната натрия и солевым раствором. Органическую фазу сушили (Na2SO4) и упаривали, остаток растирали в гексане/диэтиловом эфире. Продукт фильтровали и получали 2-бензилокси-5-бромбензальдегид в виде белого твердого продукта (15,8 г, 90%), т. пл. 70-72oС.
МС (CI+): 291 (M+H)+.
ЯМР (200 МГц, ДМСО-d6) δ: 5,38 (с, 2Н); 7,5 (м, 6Н); 7,9 (м, 2Н); 10,41 (с, 1Н).
Суспензию 2-бензилокси-5-бромбензальдегида (14,5 г, 50,2 ммоль) в абсолютном этаноле (250 мл) обрабатывали боргидридом натрия (2,6 г, 68,8 ммоль). Реакционную смесь перемешивали и температуру медленно поднимали до 33oС. Через 1 час реакционную смесь упаривали и остаток растворяли в этилацетате и выливали в смесь ледяной воды (200 мл) и 1 н. НСl (25 мл). Органический слой отделяли, промывали водным раствором гидрокарбоната натрия, солевым раствором, сушили (Na2SO4) и упаривали с получением 2-бензилокси-5-бромбензилового спирта в виде бледно-желтого масла (14,85 г, количественный выход).
МС (CI+): 292 (М+).
ЯМР (200 МГц, ДМСО-d6) δ: 4,52 (д, J=5Гц, 2Н); 5,12 (с, 2Н); 5,17 (т, J= 5Гц, 1Н); 6,98 (д, J=9Гц, 1Н); 7,4 (м, 6Н); 7,5 (д, 2Н, 1Н).
Раствор 2-бензилокси-5-бромбензилового спирта (14,75 г, 50,2 ммоль) в безводном этиловом эфире (150 мл) охлаждали до 4oС. Добавляли по каплям раствор РВr3 (13,68 г, 50 ммоль) в безводном эфире (40 мл), поддерживая температуру ниже 10oС. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа. Реакционную смесь фильтровали через силикагель (200 г). Силикагель промывали этиловым эфиром для удаления всех продуктов. Фильтрат промывали водой (1х150 мл), насыщенным водным раствором гидрокарбоната натрия (1х150 мл) и солевым раствором (1х150 мл). Органический слой сушили (Na2SO4) и упаривали с получением 2-бензилокси-5-бромбензилбромида (15,2 г, 85%) в виде бледно-желтого масла, которое кристаллизуется при стоянии.
MC (EI+): 354 (М+).
ЯМР (200 МГц, ДМСО-d6) δ: 4,65 (с, 2Н); 5,2 (с, 2Н); 7,05 (Д, J=9ГЦ, 1Н); 7,4 (м, 6Н); 7,66 (д, J=3Гц, 1Н).
Раствор метил-6-этиламиноникотиноата (15,2 г, 84,4 ммоль) в ДМФ (50 мл) охлаждали до температуры 0oС и обрабатывали гидридом натрия (60%, 75 ммоль). Реакционную смесь перемешивали 1 час и добавляли раствор 2-бензилокси-5-бромбензилбромида (25 г, 70,2 ммоль) в ДМФ (50 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 18 часов. Реакционную смесь гасили водой и экстрагировали этилацетатом (три раза). Органические слои объединяли, промывали водой и солевым раствором дважды, сушили (MgSO4) и упаривали с получением белого твердого продукта. Перекристаллизация из этилацетата/гексана дала метил-2-[N-(2-бензилокси-5-бромбензил)-N-этиламино]пиридин-5-карбоксилат (22,7 г, 71%).
MC (CI+): 455/457 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,1 (т, J=7Гц, 3Н); 3,5 (кв, J=7Гц, 2Н); 3,78 (с, 3Н); 4,77 (с, 2Н); 5,18 (с, 2Н); 6,55 (д, J=9Гц, 1Н); 7,08 (м, 2Н); 7,4 (м, 6Н); 7,9 (дд, J=2, 9Гц, 1Н); 8,62 (д, 1Н).
Раствор метил-2-[N-(2-бензилокси-5-бромбензил)-N-этил-амино]пиридин-5-карбоксилата (10,0 г, 22 моль) в дихлорметане (950 мл) обрабатывали комплексом диметилсульфидтрихлорид бора (40 мл, 2М, 80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 48 часов. Добавляли насыщенный водный раствор гидрокарбоната натрия и слои промывали дихлорметаном. Органические слои объединяли, сушили (MgSO4) и упаривали с получением не совсем белого твердого продукта, который подвергали хроматографии (элюент: этилацетат/гексан) с получением метил-2-[N-(5-бром-2-гидроксибензил)-N-этил-амино]пиридин-5-карбоксилата (6,02 г, 75%).
МС (CI+): 365 (M+H)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,14 (т, J=7Гц, 3Н); 3,61 (кв, J=7Гц, 2Н); 3,78 (с, 3Н); 4,66 (с, 2Н); 6,65 (д, J=9Гц, 1Н); 6,8 (д, J=9Гц, 1Н); 7,02 (Д, J=2Гц, 1Н); 7,2 (дд, J=2, 9Гц, 1Н); 7,93 (дд, J=2, 9Гц, 1Н); 8,64 (д, J= 2Гц, 1Н); 10, 13 (с, 1Н).
1-Бромпропан (0,12 г, 0,69 ммоль) обрабатывали раствором метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино] -5-пиридилкарбоксилата (0,2 г, 0,55 ммоль) в ДМФ (4 мл). К этому раствору добавляли карбонат калия (230 мг, 1,7 ммоль) и реакционную смесь перемешивали в течение 18 часов. Растворитель упаривали и остаток обрабатывали водой (4 мл) и экстрагировали этилацетатом (3х3 мл). Объединенные экстракты упаривали и остаток подвергали хроматографированию (элюент: этилацетат/гексан) с получением указанного в заголовке соединения в виде бледно-желтого масла (0,122 г, 54%), которое использовали на последующей стадии без дополнительной очистки.
Сравнительный пример 2
Метил-2-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридин-5-карбоксилат
Раствор метил-2-[N-(5-бром-2-(гидроксибензил)-N-этиламино] пиридин-5-карбоксилата (сравнительный пример 1, абзац 7) (0,5 г, 1,37 ммоль) в ТГФ (15 мл) обрабатывали трифенилфосфином (0,39 г, 1,49 ммоль) и диазоэтилдикарбоксилатом. Реакционную смесь перемешивали в течение пяти минут при комнатной температуре и затем добавляли изобутиловый спирт (0,152 г, 2,06 ммоль). Затем реакционную смесь перемешивали в течение 18 часов при комнатной температуре, распределяли между этилацетатом и водой и водный слой промывали этилацетатом (х 2). Органические слои объединяли, промывали водой и солевым раствором, сушили (MgSO4) и упаривали. Остаток подвергали хроматографированию (элюент: этилацетат/гексан) с получением указанного в заголовке соединения (0,35 г, 60%) в виде не совсем белого твердого продукта.
МС (CI+): 421 (M+H)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,0 (д, J=6Гц, 3Н); 1,12 (т, J=7Гц, 6Н); 2,04 (м, 1Н); 3,6 (кв, J=7Гц, 2Н); 3,78 (с, 3Н); 3,80 (с, 2Н); 4,75 (с, 2Н); 6,66 (д, J= 9Гц, 1Н); 6,97 (д, J=9Гц, 1Н); 7,05 (д, J=2Гц, 1Н); 7,37 (дд, J=2, 9Гц, 1Н); 7,93 (дд, J=2, 9Гц, 1Н); 8,73 (д, J=2Гц, 1Н).
Сравнительный пример 3
Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат
Раствор 6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (Британский патент 856409) (52 г, 0,33 ммоль) в н-ВuОАс (80 мл) и бутаноле (80 мл) обрабатывали концентрированной серной кислотой (5 мл). Смесь нагревали с ловушкой Дина-Старка. Через 5 часов образование воды прекращалось. Реакционной смеси давали остыть до комнатной температуры и после стояния в течение ночи осадок фильтровали, промывали диэтиловым эфиром и сушили с получением бутил-6-оксо-1,6-дигидропиридазин-3-карбоксилата в виде белого твердого продукта (55,2 г, 85%), т. пл. 81-83oС.
Раствор вышеуказанного бутилового эфира (55,2 г, 0,28 моль) в ацетонитриле (220 мл) осторожно добавляли к РОСl3 (55,2 мл, 0,60 моль). Полученный раствор перемешивали при 100oС в течение 2 часов. Реакционную смесь охлаждали и упаривали при пониженном давлении. Остаток растворяли в дихлорметане (280 мл) и добавляли к холодному перемешанному раствору карбоната натрия (55 г) в воде (280 мл). Полученную смесь перемешивали до полного прекращения выделения пузырьков газа, затем слои разделяли и органический слой сушили (МgSО4) и фильтровали через пад из силикагеля. Раствор упаривали с получением бутил-6-хлорпиридазин-3-карбоксилата в виде бледно-розового твердого продукта (51 г, 85%).
Раствор хлорпиридазинового соединения с предыдущей стадии (51 г, 0,238 моль) в ТГФ (375 мл) обрабатывали метанольным аммиаком (насыщ., 80 мл). Реакционную смесь оставляли стоять ночь при комнатной температуре. Осадок фильтровали и сушили с получением 6-хлорпиридазин-3-карбоксамида в виде твердого розового продукта (18,2 г, 49%). [Дополнительно продукт может быть получен при упаривании фильтрата (при пониженном давлении) и обработке остатка ТГФ (100 мл) метанольным аммиаком (40 мл). Продукт был выделен, как и выше, с получением розового твердого продукта (17,4 г). Общий выход (35,6 г, 95%)].
Суспензию 6-хлорпиридазин-3-карбоксамида (28,5 г, 0,18 моль) в метаноле (200 мл) обрабатывали водным раствором этиламина (70% раствор, 77 мл). Реакционную смесь нагревали с обратным холодильником в течение 3,5 часов. Реакционной смеси давали охладиться до комнатной температуры и оставляли на ночь. Образовавшийся осадок фильтровали и промывали небольшим объемом воды и сушили с получением 6-(этиламино)пиридазин-3-карбоксамида в виде розового твердого продукта (8,9 г). [Фильтраты упаривали до небольшого объема, разбавляли холодной водой (100 мл) и дополнительное количество желаемого твердого продукта отфильтровывали, промывали водой и сушили (12,8 г). Общий выход (21,7 г, 72%)].
Раствор 6-(этиламино)пиридазин-3-карбоксамида (21,7 г, 0,131 моль) в н-бутаноле (109 мл) и BF3•Et2O (54 мл) нагревали с воздушным холодильником (давая испаряться Et2O) при 120oС в течение 18 часов. Реакционную смесь упаривали при пониженном давлении и остаток растворяли в воде со льдом (400 мл) и нейтрализовали твердым бикарбонатом натрия при перемешивании. Маслянистый осадок экстрагировали дихлорметаном (250 мл), содержащим метанол (50 мл). Экстракты сушили (МgSО4) и упаривали (в вакууме) с получением слегка вязкого твердого продукта, который перекристаллизовывали из этилацетата (~ 250 мл) с получением бутил-6-(этиламино)пиридазин-3-карбоксилата в виде не совсем белого твердого продукта (22,0 г, 75%).
Суспензию бутилового эфира предыдущей стадии (21 г, 0,094 моль) в уксусной кислоте (400 мл) обрабатывали 4-бромфенолом (65,5 г, 0,378 моль) и параформальдегидом (3,15 г, 0,105 моль). Реакционную смесь нагревали при 100oС в течение 4,5 часов и добавляли еще одну порцию параформальдегида (6,3 г, 0,21 моль) и реакционную смесь нагревали при 100oС в течение 16 часов. Полученную реакционную смесь, окрашенную в темный цвет, упаривали и получали темное масло. Хроматографирование (элюент: диэтиловый эфир/гексан) дало быстро идущие продукты в виде коричневого масла. Это масло растворяли в этилацетате (~ 70 мл) и оставляли стоять ночь при комнатной температуре с получением белого твердого осадка, который фильтровали и промывали этилацетатом и сушили с получением бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилата в виде продукта (12,3 г, 32%).
Сравнительный пример 4
Бутил-6-[N-(5-бром-2-циклопропилметоксибензил)-N-этиламино] пиридазин-3-карбоксилат
Раствор н-бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 3) (0,286 г, 0,69 ммоль) в ДМФ (3,5 мл) обрабатывали бромметилциклопропаном (0,1 г, 0,78 ммоль) и карбонатом калия (0,473 г, 3,4 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 60 часов. Растворитель упаривали при пониженном давлении (вакуумный насос) и остаток распределяли между этилацетатом и водой. Водный слой экстрагировали этилацетатом (2х10 мл). Органические слои объединяли, сушили (MgSO4) и упаривали. Остаток очищали посредством хроматографии (элюент: этилацетат/гексан) и получали указанное в заголовке соединение в виде светло-желтого масла (0,3 г, 94%).
МС (ESP+): 462 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,32 (м, 2Н); 0,55 (м, 2Н); 0,93 (т, J=7Гц, 3Н); 1,15 (м, 4Н); 1,42 (м, 2Н); 1,7 (м, 2Н); 3,7 (кв, J=7Гц, 2Н); 3,89 (д, J= 7Гц, 2Н); 4,3 (т, J=7Гц, 2Н); 4,84 (с, 2Н); 6,98 (д, J=8Гц, 1Н); 7,15 (м, 2Н); 7,4 (дд, J=3,9Гц); 7,82 (д, J=8Гц, 1Н).
Сравнительный пример 5
Метил-2-[N-(5-бром-2-(циклопентилметокси)бензил)-N-этиламино] пиридин-5-карбоксилат
Указанное в заголовке соединение получали способом, подобным описанному в сравнительном примере 2 (из фенола в сравнительном пример 1, абзац 7), с использованием циклопентилметанола вместо изобутилового спирта (выход: 60%).
MC (ESP+): 447 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,11 (т, J=7Гц, 3Н); 1,35 (м, 2Н); 1,58 (м, 4Н); 1,77 м, 2Н); 2,3 (м, 1Н); 3,6 (кв, J=7Гц, 2Н); 3,79 (с, 3Н); 3,9 (д, J= 7Гц, 2Н); 4,75 (с, 2Н); 6,68 (д, J=9Гц, 1Н); 6,8 (д, J=9Гц, 1Н); 7,07 (д, J= 2Гц, 1Н); 7,38 (дд, J=2, 9Гц, 1Н); 7,94 (дд, J=2, 9Гц, 1Н); 8,65 (д, J=2Н, 1Н).
Сравнительный пример 6
Бутил-6-[N-(5-бром-2-пропоксибензил)-N-этиламино]пиридазин-3-карбоксилат
Указанное в заголовке соединение получали путем взаимодействия 1-иодпропана с бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилатом (сравнительный пример 3) способом, подобным описанному в сравнительном примере 4.
MC (ESP1+): 450/452 (М+Н)+.
Сравнительный пример 7
Бутил-6-[N-(5-бром-2-бутоксибензил)-N-этиламино]пиридазин-3-карбоксилат
Указанное в заголовке соединение получали путем взаимодействия 1-иодбутана с бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилатом способом, подобным описанному в сравнительном примере 4.
MC (ESP+): 464/466 (M+H)+.
Сравнительный пример 8
6-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоновая кислота
Раствор бутил-6-[N-(5-Бром-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 3) (0,36 г, 1,0 ммоль) в ТГФ (4 мл) и метаноле (4 мл) обрабатывали 1 н. водным раствором гидроксида натрия (4 мл) и выдерживали в течение 1,5 часов при комнатной температуре. Реакционную смесь упаривали до небольшого объема, разбавляли водой и подкисляли уксусной кислотой. После выдерживания в течение 18 часов осадок фильтровали, промывали водой и эфиром и сушили (МgSO4) с получением указанного в заголовке соединения в виде белого твердого продукта (0,26 г, 71%).
МС (ESP+): 352/354 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, J=6,67Гц, 3Н); 3,68 (кв, J=6,67Гц, 2Н); 4,75 (с, 2Н); 6,83 (д, J=8,34Гц, 1Н); 7,10 (д, J=8,34Гц, 1Н); 7,13 (д, J=2,33Гц, 1Н); 7,25 (дд, J=10,00, 2,33Гц, 1Н); 7,83 (д, J=10,00Гц, 1Н).
Сравнительный пример 9
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоновая кислота
Раствор метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридин-5-карбоксилата (см. сравнительный пример 1) (10,2 г, 0,55 ммоль) в ТГФ (3 мл) и метаноле (5 мл) обрабатывали 1 н. водным раствором гидроксида натрия (2,7 мл) и нагревали до 40oС в течение 24 часов. Растворители упаривали при пониженном давлении, остаток обрабатывали 1 н. уксусной кислотой (2,7 мл) и осадок фильтровали, промывали водой и сушили воздухом с получением указанного в заголовке соединения (0,17 г, 92%).
МС (FAB+): 351 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,12 (т, J=7Гц, 3Н); 3,6 (кв, J=7Гц, 2Н); 4,64 (с, 2Н); 6,6 (д, J=9Гц, 1Н); 6,83 (д, J=9Гц, 1Н); 7,06 (д, J=2Гц, 1Н); 7,23 (дд, J=2, 9Гц, 1Н); 7,92 (дд, J=2, 9Гц, 1Н); 8,59 (д, J=2Гц, 1Н).
Сравнительный пример 10
Бутил-6-[N-(5-бром-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоксилат
Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридин-3-карбоксилат (см. сравнительный пример 3) (1,12 г, 2,76 ммоль) в диметилформамиде (16 мл) обрабатывали карбонатом калия, а затем 1-бром-2-метилпропаном (0,16 мл, 770 мг, 5,6 ммоль) и перемешивали в течение ночи при комнатной температуре. ТСХ указывала на то, что реакция не была завершена, и к реакционной смеси добавляли дополнительное количество карбоната калия (1,12 г) и 1-бром-2-метилпропана. Полученную смесь перемешивали при комнатной температуре в течение 2 дней. Затем смесь упаривали до меньшего объема и остаток очищали прямо путем ЖХСД с получением указанного в заголовке соединения в виде бесцветной смолы. Выход: 98% (1,26 г).
ЯМР (250 МГц, ДМСО-d6) δ: 0,90 (м, 9Н); 1,15 (т, 3Н); 1,42 (м, 2Н); 1,70 (м, 2Н); 2,03 (м, 1Н); 3,73 (кв, 2Н); 3,80 (д, 1Н); 4,28 (т, 2Н); 4,82 (с, 2Н); 6,97 (д, 1Н); 7,1 (м, 2Н); 7,38 (дд, 1Н); 7,81 (д, 1Н).
Сравнительный пример 11
Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат
Указанное в заголовке соединение получали из бутил-6-(этиламино)пиридазин-3-карбоксилата и 4-хлорфенола способом, подобным описанному в сравнительном примере 3, за исключением того, что к реакционной смеси было добавлено 0,4 эквивалента трифторуксусной кислоты.
ЯМР (250 МГц, ДМСО-d6) δ: 0,94 (т, 3Н); 1,17 (т, 3Н); 1,43 (м, 2Н); 1,70 (м, 2Н); 3,7 (кв, 2Н); 4,28 (т, 2Н); 4,75 (с, 2Н); 6,85 (д, 1Н); 6,97 (д, 1Н); 7,1 (м, 2Н); 7,82 (д, 1Н); 10,1 (шир. с, 1Н).
Сравнительный пример 12
Бутил-6-[N-(5-бром-2-(2-метоксипропокси)бензил)-N-этиламино] пиридазин-3-карбоксилат
Указанное в заголовке соединение получали путем взаимодействия бутил-6-[N-(5-хлор-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 11) и 1-бром-2-метилпропана способом, подобным описанному в сравнительном примере 4.
ЯМР (200 МГЦ, ДМСО-d6) δ: 0,95 (м, 9Н); 1,15 (т, 3Н); 1,43 (м, 2Н); 1,70 (м, 2Н); 2,03 (м, 1Н); 3,68 (кв, 2Н); 3,80 (д, 2Н); 4,28 (т, 2Н); 4,83 (с, 2Н); 6,99 (д, 1Н); 7,04 (д, 1Н); 7,10 (д, 1Н); 7,26 (дд, 1Н); 7,83 (д, 1Н).
МС (ES+): 420 (М+Н)+.
Сравнительный пример 13
N-Этил-5-бром-2-(циклопропилметокси)бензиламин
1-Метил-2-пирролидинон (90 мл) (NМП) добавляли к безводному карбонату калия (27,6 г, 0,2 моль) в атмосфере аргона. К перемешиваемой смеси порциями добавляли 5-бромсалицилальдегид (20,1 мл, 0,1 моль) и смесь перемешивали в течение 10 минут. Бромметилциклопропан (14,4 мл, 0,15 моль) растворяли в NМП и добавляли по каплям в течение более 15 минут при температуре ниже 30oС. Реакционную температуру повышали до 35-40oС в течение 3 часов, а затем повышали до 70oС в течение 1 часа и затем охлаждали до 35oС. Гидрохлорид этиламина (13,85 г, 0,17 моль) растворяли в метаноле (60 мл) и быстро добавляли к смеси, которую затем нагревали при температуре 35-40oС в течение 3 часов и перемешивали в течение ночи (для охлаждения до комнатной температуры). После этого реакционную смесь охлаждали на льду. К этой реакционной смеси по каплям добавляли боргидрид натрия (5,3 г, 0,14 моль), растворенный в NМП (58 мл) [выделение пузырьков газа и разогревание до 15oС], и смесь нагревали при 40-45oС в течение 2 часов. К этой смеси по каплям добавляли 2 н. соляную кислоту (250 мл), поддерживая при этом температуру ниже 30oС. Полученную смесь переносили в делительную воронку и экстрагировали этилацетатом (х 2). Объединенные органические слои промывали 20% солевым раствором/водой (х 3) и солевым раствором (х 1), сушили над Na2SO4, фильтровали и упаривали. Остаток растворяли в этилацетате (100 мл) и охлаждали на льду. Затем в перемешиваемый раствор барботировали газообразный хлористый водород. Указанное в заголовке соединение в виде гидрохлоридной соли осаждали, фильтровали, промывали этилацетатом (х 2) и сушили в высоком вакууме (12,6 г, 28,5%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,37 (м, 2Н); 0,58 (м, 2Н); 1,27 (м, 4Н); 2,95 (кв, 2Н); 3,89 (д, 2Н); 4,07 (с, 2Н); 7,02 (д, J=8,0Гц, 1Н); 7,53 (дд, J= 8,0, 2,9Гц, 1Н); 7,73 (д, J=2,9Гц, 1Н); 9,25 (шир. с, 2Н).
МС (ESP+): 284 (М+Н)+.
Сравнительный пример 14
6-[N-(5-Бром-2-(циклопропилметокси)бензил)-N-этиламино]-3-цианпиридазин
6-[N-(5-Бром-2-(циклопропилметокси)бензил)-N-этиламино] пиридазин-3-карбоксамид (пример 11) (2,03 г) суспендировали в пиридине (25 мл) и охлаждали в атмосфере аргона при 4oС. К суспензии по каплям добавляли метансульфонилхлорид (4,6 мл, 59,5 ммоль) (реакция с выделением тепла до -8oС), а затем пиридин (20 мл). Реакционную смесь нагревали и перемешивали в течение ночи. После удаления пиридина при пониженном давлении остаток распределяли между этилацетатом и 1 н. соляной кислотой. Органический слой промывали 50% 1 н. НСl/насыщенным водным раствором хлорида аммония (х 1), насыщенным водным раствором бикарбоната натрия (х 1) и солевым раствором (х 1), сушили над Na2SO4, фильтровали и упаривали. Остаток очищали с помощью колоночной хроматографии (элюент: 2,5% этилацетат/дихлорметан), и фракции, содержащие указанный в заголовке продукт, упаривали до смолы (1,65 г, 85,0%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,30 (м, 2Н); 0,54 (м, 2Н); 1,15 (м, 4Н); 3,69 (кв, 2Н); 3,85 (д, 2Н); 4,80 (с, 2Н); 6,95 (д, 1Н); 7,20 (м, 2Н); 7,38 (дд, 1Н); 7,80 (д, 1Н).
МС (ESP-): 386,8 (М-Н)-.
Сравнительный пример 15
6-[N-(5-Хлор-2-(2-метилпропокси)бензил)-N-этиламино]-3-цианпиридазин
6-[N-(5-Хлор-2-(2-метилпропокси)бензил)-N-этиламино] пиридазин-3-карбоновую кислоту (пример 10) (2,0 г) растворяли в пиридине (30 мл) в атмосфере аргона и охлаждали до 4oС. Добавляли метансульфонилхлорид (0,75 мл, 9,7 ммоль), смесь перемешивали в течение 1,5 часов при температуре 4oС и получали темно-пурпурный раствор. В раствор в течение 2 минут барботировали газообразный аммиак (разогревание до +15oС) и получали темно-красный раствор, который затем упаривали при пониженном давлении. Остаток растворяли в пиридине (30 мл) и охлаждали в потоке аргона до 4oС. После добавления по каплям метансульфонилхлорида (5,1 мл, 66 ммоль) (разогревание до 10oС) полученную коричневую суспензию перемешивали в течение ночи при комнатной температуре. Затем коричневый раствор упаривали и остаток распределяли между насыщенным водным раствором хлорида аммония и этилацетатом. Органический слой промывали 10% 2 н. НСl/насыщенным водным раствором хлорида аммония (х 2), насыщенным водным раствором бикарбоната натрия (х 1) и солевым раствором (х 1), сушили над Na2SO4, фильтровали и упаривали. Указанный в заголовке продукт выделяли с помощью колоночной хроматографии с использованием в качестве элюента 20% этилацетата/изогексана (1,18 г, 62,2%). [OPPI 14: 396-9 (1982)].
ЯМР (200 МГц, ДМСО-d6) δ: 0,97 (д, 6Н); 1,12 (т, 3Н); 2,00 (м, 1Н); 3,67 (кв, 2Н); 3,79 (д, 2Н); 4,85 (с, 2Н); 7,05 (м, 2Н); 7,19 (д, 1Н); 7,29 (дд, 1Н); 7,84 (д, 1Н).
МС (ES+): 345(М+Н)+.
Сравнительный пример 16
н-Бутил-6-[N-(5-бром-2-(2-гидрокси-3,3,3-трифторпропокси) бензил)-N-этиламино]пиридазин-3-карбоксилат
Указанное в заголовке соединение получали путем взаимодействия 3-бром-1,1,1-трифторпропан-2-ола и бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата способом, подобным описанному в сравнительном примере 4.
ЯМР (250 МГц, ДМСО-d6) δ: 0,95 (т, 3Н); 1,15 (т, 3Н); 1,42 (м, 2Н); 1,68 (м, 2Н); 3,7 (кв, 2Н); 4,20 (м, 4Н); 4,42 (м, 1Н); 4,83 (с, 2Н); 6,65 (д, 1Н); 7,1 (м, 3Н); 7,42 (дд, 1Н); 7,63 (д, 1Н).
Сравнительный пример 17
6-[N-(2-(Циклопропилметокси)-5-метансульфонилбензил)-N-этиламино] -3-цианпиридазин
4-Метилмеркаптофенол (8,96 г, 64 ммоль) суспендировали в толуоле (80 мл) и добавляли к раствору метилата магния в метаноле (5,5 мл, 8%, 41,4 ммоль) и реакционную смесь перемешивали в течение 1 часа при нагревании с обратным холодильником. После этого желтый раствор обрабатывали толуолом (80 мл) и из реакционной смеси отгоняли метанол до достижения температуры реакционной смеси приблизительно 95oС. Образовывалось небольшое количество твердого осадка. К смеси добавляли параформальдегид (5,84 г, 194 ммоль) в толуоле (60 мл), которую перемешивали в течение 3,5 часов в атмосфере аргона при нагревании с обратным холодильником (температура должна составлять, по крайней мере, 95oС). Реакционную смесь, содержащую небольшое количество твердого продукта, охлаждали и обрабатывали 2 н. серной кислотой (80 мл), толуолом (80 мл), перемешивали в течение 15 минут и разделяли. Органический слой промывали водой (х 3), сушили и упаривали до остатка в виде оранжевого масла (9,6 г). Это масло очищали с помощью ЖХСД, используя 5% эфир/изогексан, с получением 2-гидрокси-5-метилтиобензальдегида (3,3 г).
ЯМР (200 МГц, ДМСО-d6) δ: 2,45 (с, 3Н); 6,98 (д, J=9Гц, 1Н); 7,48 (дд, J=2,3, 9,0Гц, 1Н); 7,55 (д, J=2,3Гц, 1Н); 10,25 (с, 1Н); 10,67 (с, 1Н).
МС (CI+): 168 (М+).
2-Гидрокси-5-метилтиобензальдегид алкилировали бромметилциклопропаном способом, подобным описанному в сравнительном примере 4, с получением 2-циклопропилметокси-5-метилтиобензальдегида.
ЯМР (200 МГц, ДМСО-d6) δ: 0,36 (м, 2Н); 0,6 (м, 2Н); 1,26 (м, 1Н); 2,46 (с, 3Н); 4,0 (д, J=8,25 Гц, 2Н); 7,2 (д, J=9,2Гц, 1Н); 7,52-7,62 (м, 2Н); 10,38 (с, 1Н).
МС (CI+): (М+Н)+ 223,3.
N-Этил-2-циклопропилметокси-5-метилтиобензиламин получали путем восстановительного аминирования 2-циклопропил-метокси-5-метилтиобензиламина способом, подобным описанному в сравнительном примере 19 (1).
ЯМР (200 МГц, ДМСО-d6) δ: 0,32 (м, 2Н); 0,55 (м, 2Н); 1,03 (т, J=7,3Гц, 3Н); 1,30-1,13 (м, 1Н); 2,4 (с, 3Н); 2,53 (кв, J=7,3Гц, 2Н); 3,65 (с, 2Н); 3,82 (д, J=6,25Гц, 2Н); 6,88 (д, J=8,3Гц, 1Н); 7,10 (дд, J=2,5, 8,3Гц, 1Н); 7,25 (д, J=2,5Гц, 1Н).
МС (ESP+): 252,4 (М+Н)+.
N-Этил-2-циклопропилметокси-5-метилтиобензиламин подвергали взаимодействию с 3-хлор-6-цианпиридазином (полученным в сравнительном примере 18) способом, подобным описанному в примере 11, в результате чего получали 6-[N-(2-циклопропилметокси)-5-метилтиобензил)-N-этиламино]-3-цианпиридазин.
ЯМР (200 МГц, ДМСО-d6) δ: 0,28 (м, 2Н); 0,52 (м, 2Н); 1,20-1,08 (м, 4Н); 2,35 (с, 3Н); 3,70 (кв, 2H); 3,84 (д, J=8,3Гц, 2H); 4,8 (с, 2H); 6,95 (д, J= 8,3Гц, 1Н); 7,03 (д, J=2,1Гц, 1Н); 7,19 (дд, J=10,4, 2,1Гц, 2H); 7,8 (д, J= 10,4Гц).
МС (ESP+): 355 (М+Н)+.
6-[N-(2-Циклопропилметокси-5-метилтиобензил)-N-этиламино] -3-цианпиридазин (201 мг, 0,57 ммоль) в дихлорметане (5 мл) охлаждали на льду приблизительно до -10oС и обрабатывали 50% м-хлорпербензойной кислотой (196 мг, 0,57 ммоль). Реакционную смесь перемешивали в течение 1 часа при температуре от -10oС до 0oС, затем разбавляли дихлорметаном и экстрагировали насыщенным водным раствором бикарбоната натрия (х 2). Органические экстракты сушили и упаривали с образованием бледно-коричневой пены (180 мг). Пену (180 мг, 0,49 ммоль) в дихлорметане (5 мл) охлаждали до -10oС, обрабатывали м-хлорпербензойной кислотой (170 мг, 0,49 ммоль) и перемешивали в течение 1,25 часа, повышая температуру до 0oС. Добавляли дополнительное количество дихлорметана, смесь экстрагировали водным насыщенным раствором бикарбоната натрия (х 2), сушили и упаривали с получением пены, которую очищали с помощью ЖХСД, используя 2:1 этилацетат/гексан в качестве элюента, с получением указанного в заголовке продукта (100 мг, 53%).
ЯМР (200 МГц, ДМСО-d6) δ: 0,32 (м, 2Н); 0,54 (м, 2Н); 1,27-1,08 (м, 4Н); 3,08 (с, 3Н); 3,7 (кв, 2Н); 3,98 (д, J=8,3Гц, 2Н); 4,88 (с, 2Н); 7,22 (д, J= 10,4Гц, 1Н); 7,26 (д, J=10,4Гц, 1Н); 7,61 (д, J=2,1Гц, 1Н); 7,77-7,78 (м, J= 10,21Гц, 2Н).
МС (ESP+): (М+Н)+ 387,2.
Сравнительный пример 18
6-[N-(5-Бром-2-пропоксибензил)-N-этиламино]-3-цианпиридазин
(1) Смесь 6-хлорпиридазин-3-карбоксамида (описанного в сравнительном примере 3) (15 г, 95,5 ммоль) и пиридина (22,6 г, 23,1 мл, 286,6 ммоль) суспендировали в дихлорметане и охлаждали до -30oС в атмосфере аргона. К перемешанной смеси по каплям добавляли ТФУА, поддерживая внутреннюю температуру ниже -20oС. Реакционную смесь перемешивали в течение 19,5 часов для нагревания до комнатной температуры. Смесь выливали в воду (500 мл) и промывали водой (4х500 мл) до тех пор, пока водная фаза не приобретала светло-желтый оттенок. Органическую фазу сушили над МgSO4, фильтровали через пад из силикагеля (диаметр 50 мм, глубина 30 мм) и концентрировали в вакууме. Полученный твердый продукт очищали с помощью ЖХСД (40% дихлорметан/20% этилацетат/гексан) и получали 3-хлор-6-цианпиридазин в виде бесцветного твердого продукта (5,25 г, 59%).
МС (EI+): 139 (М+).
ЯМР (250 МГц, CDCl3) δ: 7,71 (д, J=8Гц, 1Н); 7,83 (д, J=8 Гц, 1Н).
(2) Раствор 5-бромсалицилальдегида (20 г, 100 ммоль) в NMП (100 мл) обрабатывали К2СО3 (41,4 г, 300 ммоль) в течение 30 минут при температуре 40oС. Добавляли н-пропилиодид (25,5 г, 150 ммоль) и реакционную смесь перемешивали в течение 19 часов при 40oС. Добавляли раствор гидрохлорида этиламина (11,41 г, 140 ммоль) в этаноле (50 мл), смесь перемешивали еще 3 часа при 40oС, а затем в течение 1 часа по каплям добавляли раствор боргидрида натрия (5,292 г, 140 ммоль) в NMП (20 мл). (Осторожно: образуется большое количество пены). Реакционную смесь перемешивали в течение 19 часов при 40oС, охлаждали до комнатной температуры и добавляли 5М соляную кислоту (500 мл). Затем раствор обрабатывали 5М раствором гидроксида натрия до рН 14 и экстрагировали этилацетатом (3х300 мл). Объединенные органические фазы промывали водой (4х500 мл), сушили над карбонатом калия и через раствор пропускали сухой газ НСl. Взвесь концентрировали в вакууме и получали желтый твердый продукт, который перекристаллизовывали из ацетонитрила/толуола, в результате чего был получен гидрохлорид N-этил-2-пропокси-5-бромбензиламина в виде белого твердого продукта (15,47 г, 50%).
MC (ESP): 375 (МН-).
ЯМР (250 МГц, CDCl3) δ: 1,02 (т, J=7Гц, 3Н); 1,25 (т, J=6Гц, 3Н); 1,80 (м, 2Н); 3,77 (кв, J=6Гц, 2Н); 3,92 (т, J=7Гц, 2Н); 4,80 (шир. с, 2Н); 6,67 (д, J= 8,5Гц, 1Н); 6,75 (д, J=Гц, 1Н); 7,12 (д, J=2Гц, 1Н); 7,34 (дд, J=8, 2Гц, 1Н); 7,38 (д, J=8,5Гц, 1Н).
(3) N-Этил-2-пропокси-5-бромбензиламина гидрохлорид 2 (5,17 г, 16,8 ммоль) и 3-хлор-6-цианпиридазин (2,65 г, 16,8 ммоль) растворяли в NМП (25 мл) и добавляли бикарбонат натрия (3,54 г, 42,1 ммоль). Полученную смесь нагревали при 110oС в атмосфере аргона в течение 7,5 часов, затем давали остыть до комнатной температуры. Смесь выливали в этилацетат (200 мл), промывали водой (5х200 мл) и солевым раствором (200 мл), органическую фазу сушили над MgSO4 и концентрировали в вакууме. Остаток очищали с помощью ЖХСД (20% этилацетат/гексан) и затем кристаллизовали из эфира/гексана с получением указанного в заголовке продукта (4,80 г, 76%).
MC (ESP): 272 (МН+), 227 (M-EtNH2)+.
ЯМР (250 МГц, ДМСО-d6) δ: 0,99 (т, J=6Гц, 3Н); 1,26 (т, J=7Гц, 3Н); 1,78 (м, 2Н); 2,92 (кв, J=7Гц, 2Н); 3,95 (т, J=6Гц, 2Н); 4,02 (с, 2Н); 7,02 (д, J=8Гц, 1Н); 7,52 (дд, J=8,2Гц, 1Н); 7,75 (д, J=2Гц, 1Н); 9,32 (шир. с, 2Н).
Сравнительный пример 19
6-[N-(5-Бром-2-гидроксибензил)-N-этиламино]-3-цианпиридазин
(1) Раствор 5-бромсалицилальдегида (20,1 г, 0,1 ммоль) в ТГФ (150 мл) обрабатывали раствором этиламина в метаноле (2М, 70 мл, 0,14 ммоль). Реакционную смесь перемешивали в течение 1,5 часов при комнатной температуре. После охлаждения в ледяной бане порциями добавляли боргидрид натрия (5,3 г, 0,14 ммоль). Реакционную смесь выдерживали в течение ночи при комнатной температуре. Добавляли воду и растворитель удаляли при пониженном давлении. Остаток растворяли в этилацетате и промывали водой, органический слой сушили над MgSO4 и подкисляли газообразным НСl. Гидрохлорид N-этил-5-бром-2-гидроксибензиламина собирали путем фильтрации и получали белый твердый продукт (17,53 г, 66%).
ЯМР (250 МГц, ДМСО-d6) δ: 1,23 (т, 3Н); 2,94 (кв, 2Н); 4,60 (т, 2Н); 6,96 (д, 1Н); 7,37 (дд, 1Н); 7,63 (д, 1Н); 9,02 (шир. с, 1Н); 10,59 (с, 1Н).
МС (ESP+): 230/232 (М+Н)+.
(2) Указанное в заголовке соединение получали путем взаимодействия гидрохлорида N-этил-5-бром-2-гидроксибензиламина с 3-хлор-6-цианпиридазином способом, подобным описанному в сравнительном примере 18, за исключением того, что в хроматографии в качестве элюента использовали 2% диэтиловый эфир/дихлорметан (выход: 50%).
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н); 8,37 (кв, 2Н); 4,75 (с, 2Н); 6,81 (д, 1Н); 7,07 (д, 1Н); 7,15 (д, 1Н); 7,25 (дд, 1Н); 7,82 (д, 1Н); 10,12 (шир. с, 1Н).
Сравнительный пример 20
N-Этил-5-хлор-2-(циклопропилметокси)бензиламин
Указанное в заголовке соединение получали путем взаимодействия 5-хлор-2-гидроксибензальдегида с бромметилциклопропаном способом, подобным описанному в сравнительном примере 4.
МС (CI+): 240/242 (М+Н)+.
ЯМР (200 МГц, СDСl3) δ: 0,34 (м, 2Н); 0,63 (м, 2Н); 1,13 (т, J=7Гц, 23Н); 1,26 (м, 1Н); 2,65 (кв, J=7Гц, 2Н); 3,78 (д, 2Н); 3,80 (д, 2Н); 6,72 (д, J=8Гц, 1Н); 7,13 (дд, J=2, 8Гц, 1Н); 7,21 (д, J=2Гц, 1Н).
Сравнительный пример 21
6-[N-(5-Хлор-2-(циклопропилметокси)бензил)-N-этиламино]-3-цианпиридазин
К перемешанной смеси 6-[N-(5-Хлор-2-(циклопропилметокси) бензил)-N-этиламино]пиридазин-3-карбоксамида (3,5 г, 9,7 ммоль) в пиридине (120 мл) при температуре 20oС в течение 20 минут по каплям добавляли метансульфонилхлорид (10,0 мл, 124 ммоль). Полученную смесь перемешивали при температуре 20oС в течение 60 часов и выливали на лед (300 г), добавляли 10 н. соляную кислоту (100 мл) и эту смесь энергично перемешивали, после чего экстрагировали эфиром (500 мл). Органический слой промывали 1 н. соляной кислотой (500 мл), сушили над безводным сульфатом магния и упаривали, в результате чего получали указанный в заголовке продукт в виде светло-коричневой смолы (3,3 г, 99%).
МС (ESP+): 343/345 (М+Н)+.
ЯМР (200 МГц, CDCl3) δ: 0,32 (м, 2Н); 0,60 (м, 2Н); 1,20 (м, 1Н); 1,25 (т, J= 7Гц, 3Н); 3,82 (д, 2Н); 3,85 (кв, J=7Гц, 2Н); 4,85 (с, 2Н); 6,78 (д, J= 8Гц, 1Н); 7,06 (д, J=8Гц, 1Н); 7,09 (д, J=2Гц, 1Н); 7,22 (дд, J=2, 8Гц, 1Н); 7,52 (д, J=8Гц, 1Н).
Сравнительный пример 22
N-Этил-5-хлор-2-(циклопентокси)бензиламин
К 5-хлорсалицилальдегиду (20,3 г, 130 ммоль) и бромциклопентану (22,0 г, 148 ммоль) в диметилформамиде (100 мл) добавляли безводный карбонат калия (23,4 г, 169 ммоль) и раствор перемешивали в течение 16 часов при 50oС. Неорганическое твердое вещество экстрагировали, а растворитель удаляли в вакууме. Полученный продукт экстрагировали дихлорметаном из воды (200 мл) и органический слой последовательно сушили над безводным сульфатом магния, фильтровали и растворитель удаляли при пониженном давлении. Растворенный продукт очищали на колонке с силикагелем путем промывания дихлорметаном и 2 н. раствором гидроксида натрия (3•100 мл), в результате чего получали 5-хлор-2-циклопентоксибензальдегид (19,22 г, 66%).
MC (CI+): 225/227 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,80 (м, 8Н); 4,98 (м, 1Н); 7,24 (д, J=8Гц, 1Н); 7,58 (д, J=2Гц, 1Н); 7,62 (дд, J=2,8Гц, 1Н); 10,28 (с, 1Н).
5-Хлор-2-циклопентоксибензальдегид (9,35 г, 41,6 ммоль) и гидрохлорид этиламина (18,6 г, 229 ммоль) в метаноле (100 мл) перемешивали 30 минут при комнатной температуре, а затем добавляли цианборгидрид натрия (5,6 г, 88 ммоль) и реакционную смесь нагревали с обратным холодильником при 70oС в течение 70 часов при периодическом подкислении ледяной уксусной кислотой до рН 6. Добавляли по каплям нормальную соляную кислоту (100 мл) и полученную смесь подщелачивали 2 н раствором гидроксида натрия до рН 11, продукт экстрагировали дихлорметаном (250 мл х 2) и этилацетатом (250 мл х 2). Органические слои объединяли, сушили над безводным сульфатом магния, фильтровали и растворитель удаляли с получением указанного в заголовке соединения (8,5 г, 80%).
Сравнительный пример 23
6-(N-[5-Хлор-2-(циклопентокси)бензил]-N-этиламино)-3-цианпиридазин
Указанное в заголовке соединение получали путем взаимодействия соединения сравнительного примера 22 и 3-хлор-6-цианпиридазина (сравнительный пример 18 (1)) способом, подобным описанному в сравнительном примере 18 (3).
Сравнительный пример 24
6-(N-[5-Бром-2-(циклобутилокси)бензил]-N-этиламино)-3-цианпиридазин
Указанное в заголовке соединение было получено путем алкилирования соответствующего нитрила (сравнительный пример 18) бромциклобутаном, используя способ, подобный описанному в сравнительном примере 4, за исключением того, что реакционную смесь перемешивали в течение 10 дней при комнатной температуре.
МС (ESP+): 387 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,14 (т, 3Н); 1,73 (м, 2Н); 1,98 (м, 2Н); 2,40 (м, 2Н); 3,68 (кв, 2Н); 4,72 (квинтет, 1Н); 4,81 (с, 2Н); 6,82 (д, 1Н); 7,2 (м, 2Н); 7,37 (дд, 1Н); 7,83 (д, 1Н).
Сравнительный пример 25
6-[N-(5-Бром-2-(3,3,3-трифтор-2-гидроксипропокси)бензил] -N-этиламино)-3-цианпиридазин
Указанное в заголовке соединение было получено путем взаимодействия 6-[N-(5-бром-2-гидроксибензил)-N-этиламино] -3-цианпиридазина с 1,1,1-трифтор-3-бромпропан-2-олом способом, подобным описанному в сравнительном примере 4.
МС (ESP+): 445 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н); 3,68 (кв, 2Н); 4,16 (м, 1Н); 4,25 (м, 1Н); 4,4 (м, 1Н); 4,85 (с, 2Н); 6,65 (д, 1Н); 7,14 (м, 3Н); 7,43 (дд, 1Н); 7,83 (д, 1Н).
Сравнительный пример 26
2-[N-(5-Бром-2-циклопропилметоксибензил)-N-этиламино]-5-цианпиридин
Указанное в заголовке соединение было получено путем взаимодействия N-этил-5-бром-2-циклопропилметоксибензиламина (сравнительный пример 13) с 2-хлор-5-цианпиридином способом, подобным описанному в сравнительном примере 18.
МС: 386 (М+H)+.
ЯМР (МГЦ, ДМСО-d6) δ: 0,33 (м, 2Н); 0,55 (м, 6,70 (д, 1Н); 6,95 (д, 1Н); 7,05 (д, 1Н); 7,35 (дд, 1Н); 7,75 (дд, 1Н); 8,45 (д, 1Н).
Сравнительный пример 27
6-[N-(5-Хлор-2-циклобутилметоксибензил]-N-этиламино)-3-цианпиридазин
Циклобутанметанол (5 г, 58 ммоль) растворяли в дихлорметане (150 мл) и охлаждали на ледяной водной бане. К раствору добавляли триэтиламин (10,5 мл, 75,6 ммоль), а затем по каплям добавляли раствор тозилхлорида (13,3 г, 69,8 ммоль) в дихлорметане (50 мл). После удаления охлаждающей бани смеси давали нагреться до комнатной температуры в течение более 16 часов. Смесь промывали водой (2х100 мл), сушили (MgSO4) и концентрировали в вакууме с получением тозилата циклобутанметанола в виде желтого масла, которое использовали без дополнительной очистки.
МС: 241 (М+Н)+.
5-Хлорсалицилальдегид (7,7 г, 49,4 ммоль) растворяли в ДМФ (20 мл) с карбонатом калия (7,5 г, 54,1 ммоль) и тозилатом циклобутанметанола (13 г, 54,1 ммоль). Смесь перемешивали в течение 16 часов в атмосфере аргона при 50oС. Выливали в воду (500 мл), экстрагировали этилацетатом (4х100 мл) и объединенные органические фракции промывали 1М раствором гидроксида натрия (100 мл), водой (100 мл), насыщенным солевым раствором (100 мл), сушили (MgSO4) и концентрировали в вакууме, в результате чего получали 5-хлор-2-(циклобутилметокси)бензальдегид в виде коричневого масла (13 г), которое использовали без дополнительной очистки.
МС: 225 (М+Н)+.
5-Хлор-2-(циклобутилметокси)бензальдегид (13 г) растворяли в ДМФ (100 мл), добавляли карбонат калия (16 г, 116 ммоль) и гидрохлорид этиламина (9,5 г, 117 ммоль). Смесь нагревали в течение 1 часа при 40oС, затем охлаждали на ледяной водной бане и по каплям добавляли раствор боргидрида натрия (4,3 г, 116 ммоль) в минимальном количестве ДМФ. После завершения добавления охлаждающую баню удаляли и реакционную смесь нагревали при 40oС в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и осторожно добавляли 5М соляную кислоту до тех пор, пока рН смеси не становился равным 2. К полученной смеси добавляли твердый гидроксид натрия до рН 14 и смесь экстрагировали этилацетатом (3х300 мл), объединенные органические фракции промывали водой (100 мл), насыщенным солевым раствором (100 мл), сушили (MgSO4) и концентрировали в вакууме с получением масла (15 г). Это масло очищали с помощью ЖХСД (5% метанол/дихлорметан) и получали N-этил-5-хлор-2-(циклобутилметокси)бензиламин в виде смолы, которая кристаллизуется при стоянии (2,1 г, 17%).
МС: 254 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 1,05 (т, 3Н); 1,95 (м, 6Н); 2,50 (м, 1Н); 2,75 (кв, 2Н); 3,65 (с, 2Н); 3,92 (д, 2Н); 6,95 (д, 1Н); 7,20 (дд, 1Н); 7,28 (д, 1Н).
N-Этил-5-хлор-2-(циклобутилметокси)бензиламин (2,1 г, 8,3 ммоль) подвергали реакции связывания с 3-хлор-5-цианпиридазином (1,3 г, 8,25 ммоль) с помощью бикарбоната натрия (0,71 г, 8,45 ммоль) в NMП (10 мл), способом, аналогичным описанному в сравнительном примере 18. Указанное в заголовке соединение очищали посредством ЖХСД (дихлорметан, 1% МеОН/дихлорметан) (2,3 г, 78%) с получением твердого продукта.
МС: 357 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н); 1,95 (м, 6Н); 2,60 (м, 1Н); 3,65 (кв, 2Н); 3,95 (д, 2Н); 4,8 (с, 2Н); 6,95 (д, 1Н); 7,00 (д, 1Н); 7,18 (д, 1Н); 7,26 (дд, 1Н); 7,82 (д, 1Н).
Сравнительный пример 28
N-Этил-5-бром-2-(циклопропилметокси)бензиламин
К 5-бромсалицилальдегиду (15,0 г, 74 ммоль) в диметилформамиде добавляли безводный карбонат калия (36,8 г, 266 ммоль) и бромметилциклопропан (9 мл, 93 ммоль) и раствор перемешивали в течение 60 часов при 50oС. Затем добавляли пропиламин (26,5 г, 450 ммоль) и раствор оставляли перемешиваться при комнатной температуре в течение 2 часов, после чего добавляли диэтиловый эфир (50 мл) и боргидрид натрия (2,6 г, 68 ммоль) и раствор выдерживали в течение 1 часа. После добавления по каплям 6 н. соляной кислоты (150 мл) раствор оставляли для перемешивания на 16 часов. Примеси экстрагировали диэтиловым эфиром (200 мл х 2), раствор подщелачивали жидкой каустической содой и продукт экстрагировали диэтиловым эфиром (250 мл). Органический слой сушили над безводным сульфатом магния, фильтровали и растворитель удаляли в вакууме с получением указанного в заголовке соединения (4,8 г, 22%).
МС (EI+): 298/300 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 0,34 (м, 2Н); 0,56 (м, 2Н); 0,88 (т, 3Н); 1,22 (м, 1Н); 1,44 (м, 2Н); 2,47 (т, 2Н); 3,66 (с, 2Н); 3,82 (д, 2Н); 6,86 (д, J= 8Гц, 1Н); 7,31 (дд, J=2Гц, 8Гц, 1Н); 7,46 (д, J=2Гц, 1Н).
| название | год | авторы | номер документа |
|---|---|---|---|
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2198878C2 |
| ПРОИЗВОДНЫЕ 4-МЕРКАПТОПИРРОЛИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАРНЕЗИЛТРАНСФЕРАЗЫ | 1996 |
|
RU2191773C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ДОСТИЖЕНИЯ АНТИАНГИОГЕННОГО И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ ПРОНИЦАЕМОСТИ КРОВЕНОСНЫХ СОСУДОВ У ТЕПЛОКРОВНОГО ЖИВОТНОГО | 1997 |
|
RU2198879C2 |
| ГЕРБИЦИДЫ ДЛЯ СОРНЯКОВ, УСТОЙЧИВЫХ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СПОСОБ БОРЬБЫ С СОРНЯКАМИ, УСТОЙЧИВЫМИ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СОЕДИНЕНИЯ | 2003 |
|
RU2292139C2 |
| ВОДОРАСТВОРИМЫЕ ПРОИЗВОДНЫЕ ФЕНИЛПИРИДАЗИНА И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2302413C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ, И СПОСОБ ПОЛУЧЕНИЯ АНТИАНГИОГЕННОГО ЭФФЕКТА И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ СОСУДИСТОЙ ПРОНИЦАЕМОСТИ С ИХ ПРИМЕНЕНИЕМ | 1996 |
|
RU2194701C2 |
| ПРОИЗВОДНЫЕ N-ГЕТЕРОАРИЛ-ПИРИДИНСУЛЬФОНАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРОТИВОДЕЙСТВИЯ ОДНОМУ ИЛИ БОЛЕЕ ВОЗДЕЙСТВИЯМ ЭНДОТЕЛИНА | 1996 |
|
RU2172738C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА КАК ИНГИБИТОРЫ RSV | 2016 |
|
RU2738232C2 |
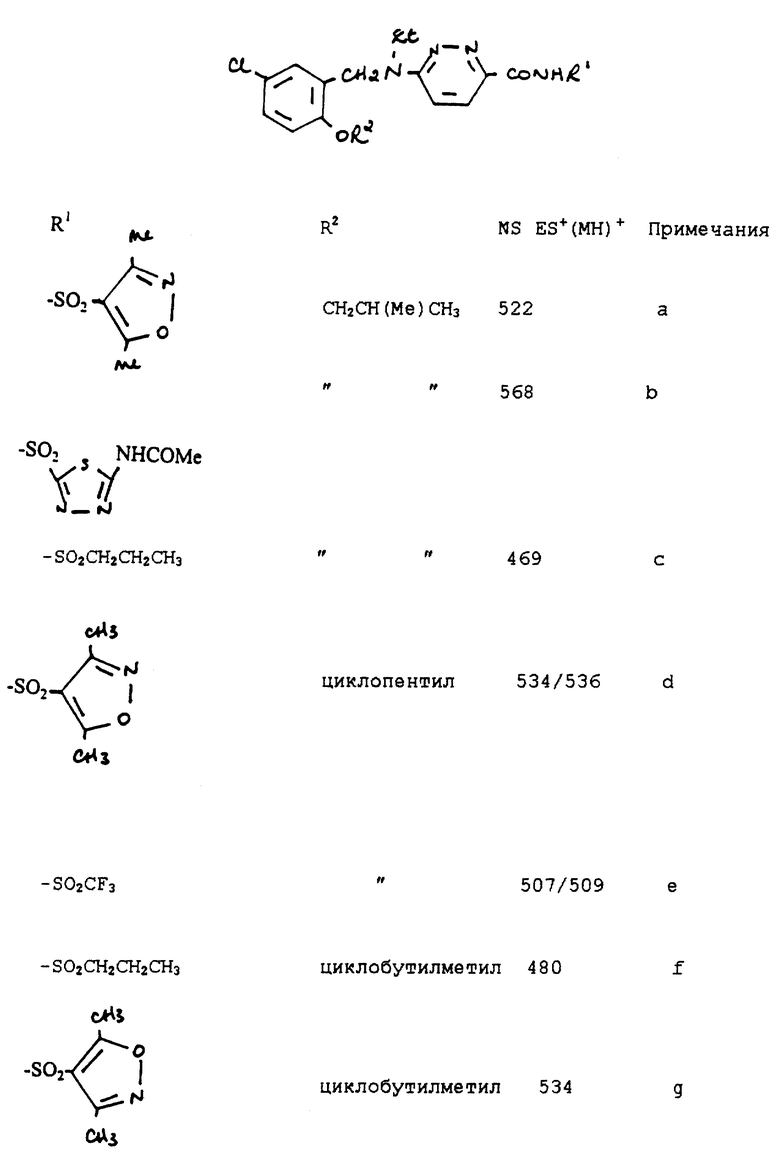
Изобретение относится к соединениям формулы (I) R4-A-CH(R3)N(R2)B-R1, где А представляет необязательно замещенную фенильную группу при условии, что группы -CH(R3)N(R2)B-R1 и -OR4 находятся в 1,2-положении по отношению друг к другу на атомах углерода кольца, и при условии, что атом кольца, находящийся в ортоположении по отношению к OR4 - присоединенной группе (и, следовательно, в 3-положении по отношению к -CHR3NR2-связывающей группе), является незамещенным; В - пиридил или пиридазинил; R1 находится на кольце В в 1,3- или 1,4-положении по отношению к -CH(R3)N(R2)-связывающей группе и представляет собой карбокси, карбамоил или тетразолил, или R1 представляет группу формулы -СОNRaRa1, где Ra - водород или С1-6алкил и Ra1 - С1-6алкил, или R1 представляет группу формулы -CONHSO2Rb, где Rb - С1-6алкил, трифторметил или 5-членный гетероарил, выбранный из изооксазолила и тиадиазолила, необязательно замещенного С1-6алкилом или С1-4алканоиламиногруппой; R2 - С1-6алкил; R3 - водород; R4 - С1-4алкил, С3-7циклоалкил, С1-3алкил или С3-7циклоалкил, где указанный С1-6алкил необязательно замещен гидроксигруппой или галогеном, или их фармацевтически приемлемой соли или in vivo-гидролизуемым сложным эфирам. Соединения являются антагонистами болеусиливающего действия простагландинов типа Е. Раскрываются также способ получения указанных соединений, промежуточные соединения для их получения, фармацевтическая композиция для устранения боли и способ устранения боли. 5 с. и 6 з.п. ф-лы, 1 табл.
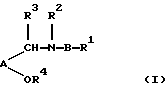
где А - необязательно замещенный фенил при условии, что группы -CH(R3)N(R2)B-R1 и -OR4 находятся в 1,2-положении по отношению друг к другу на атомах углерода кольца и атом кольца, находящийся в ортоположении по отношению к OR4-присоединенной группе (и, следовательно, в 3-положении по отношению к -CHR3NR2-связывающей группе) является незамещенным; и где указанные необязательные заместители атомов углерода кольца выбраны из галогена, трифторметила, нитро, гидрокси, амино, С1-4алкиламино, диС1-4алкиламино, циано, С1-6алкокси, С1-6алкилS(O)р (р = 0, 1 или 2), С1-6алкила (необязательно замещенного гидрокси, амино, галогеном, нитро или циано), CF3S(O)р (р = 0, 1 или 2), карбамоила, С1-4алкилкарбамоила, ди(С1-4алкил)карбамоила, С2-6алкенила, С2-6алкинила, С1-4алкоксикарбониламино, С1-4алканоиламино, С1-4алканоил(N-С1-4алкил)-амино, С1-4алкансульфониламидо, бензолсульфониламидо, аминосульфонила, С1-4алкиламиносульфонила, С1-4алканоиламиносульфонила, ди(С1-4алкил)аминосульфонила, С1-4алкоксикарбонила, С1-4алканоилокси, С1-6алканоила, формилС1-4алкила, трифтор С1-3алкил-сульфонила, гидроксииминоС1-6алкила, С1-4алкоксииминоС1-6алкила и C1-6алкилкарбамоиламино;
В - пиридил или пиридазинил;
R1 находится на кольце В в 1,3- или 1,4-положении по отношению к -CHR3NR2-связывающей группе и представляет собой карбокси, карбамоил или тетразолил, или R1 представляет группу формулы -СОNRaRa1, где Ra - водород или С1-6алкил и Ra1 - С1-6 алкил, или R1 - группа формулы -CONHSO2Rb, где Rb - С1-6алкил, трифторметил или 5-членный гетероарил, где 5-членный гетероарил выбран из изоксазолила и тиадиазолила, необязательно замещенного С1-6алкилом или С1-4алканоиламиногруппой;
R2 - С1-6 алкил;
R3 - водород;
R4 - С1-4алкил, С3-7циклоалкилС1-3алкил или С3-7циклоалкил, где указанный С1-6алкил необязательно замещен гидроксигруппой или галогеном,
или их фармацевтически приемлемая соль, или in vivo гидролизуемый сложный эфир, где или in vivo гидролизуемый сложный эфир карбоксигруппы выбран из фармацевтически приемлемого сложного эфира, образованного С1-6спиртом, фенолом или бензиловым спиртом, замещенным фенолом или бензиловым спиртом, где заместителем являются С1-4алкил или С1-4алкокси; или α-ацилоксиалкилового сложного эфира;
in vivo гидролизуемый сложный эфир гидроксигруппы выбран из алканоила, бензоила, фенилацетила и замещенного бензоила и фенилацетила, алкоксикарбонила (чтобы получить сложные эфиры алкилкарбоната), диалкилкарбамоила и N-(диалкиламиноэтил)-N-алкилкарбамоила (чтоб получить карбаматы), диалкиламиноацетила и карбоксиацетила; и за исключением 2-[2-метоксибензиламино] пиридин-5-карбоновой кислоты.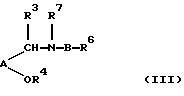
в которой R6 означает защищенную карбоксигруппу;
R7 имеет значения, указанные для R2 в п. 1 формулы;
R3, R4, А и В имеют значения, указанные в п. 1,
удаляют карбоксизащитную группу с получением соединения формулы I, где R1 - карбокси, с последующим в случае необходимости преобразованием полученного соединения в соединение формулы I, где R1 - карбамоил, или группа -СОNRаRа1, или группа СОNHSO2R6, и преобразованием в случае необходимости полученных соединений в фармацевтически приемлемую соль или in vivo гидролизуемый сложный эфир.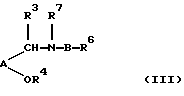
где R6 означает карбоксигруппу, защищенную этерифицирующей С1-4алкильной группой;
R7 имеет значения, указанные для R2 в п. 1 формулы;
R3, R4, А и В имеют значения, указанные в п. 1.
Приоритет по пунктам и признакам:
20.06.1995 по пп. 1-4 для соединений, где R4 - незамещенный С1-6алкил; по п. 5, где R4 - незамещенный С1-4алкил; по п. 8, где фармацевтическая композиция содержит указанные выше соединения; по п. 9 где используют эти соединения, и по п. 10 способ получения этих соединений;
25.01.1996 по пп. 1-4 для соединений, где R4 - С1-6алкил, замещенный гидрокси и галогеном, или С3-7циклоалкил; по п. 5, где R4 - С1-4алкил, замещенный гидрокси и галогеном, или С3-6циклоалкил; по п. 8, где фармацевтическая композиция содержит эти соединения; по п. 9 с использованием этих соединений и по п. 10 в части получения этих соединений;
17.06.1996 (по дате подачи заявки РСТ/GB 96/01442) по пп. 1-4 для соединений, где R4 - С3-7циклоалкилС1-3алкил; по п. 5, где R4 - С3-6циклоалкилметил; по пп. 6 и 7, п. 8, где фармацевтическая композиция содержит эти соединения; по п. 9, где используют эти соединения; по п. 10, где получают эти соединения и по п. 11.
| Двухимпульсиый регулятор давления пара в системе концевых уплотнений турбины | 1960 |
|
SU135087A1 |
| Топка генеративного типа для мелкого топлива | 1923 |
|
SU816A1 |
| Способ получения солей щелочных металлов производных 2-пиридил- или 2-пиримидиламинобензойной кислоты | 1979 |
|
SU886743A3 |
| Способ получения фталазино (2,3-в) фталазин-5(14н), 12(7н)-диона | 1974 |
|
SU576933A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДАЗО (1,2-B)ПИРИДАЗИНА ИЛИ ИХ СОЛЕЙ И ПРОИЗВОДНЫЕ ИМИДАЗО (1,2-B)ПИРИДАЗИНА ИЛИ ИХ СОЛИ | 1990 |
|
RU2036924C1 |
| US 5037815 А, 06.08.1991. | |||
Авторы
Даты
2002-05-20—Публикация
1996-06-17—Подача