Настоящее изобретение относится к соединениям, которые ингибируют фарнезилирование продуктов мутантных генов ras путем ингибирования фермента фарнезилпротеинтрансферазы (FPT-аза). Изобретение относится также к способам получения соединений, фармацевтическим композициям и способам лечения болезней, особенно рака, которые медиируются путем фарнезилирования ras.
Полагают, что рак включает изменение в экспрессии или функции генов, регулирующих рост и дифференциацию клеток. Не претендуя на теоретические соображения, следующий текст представляет научную основу для роли ras в раковых опухолях. Гены ras в опухолях часто мутируют. Гены ras кодируют связывающие гуанозинтрифосфат (GTP) белки, которые, как полагают, участвуют в сигнальной трансдукции, пролиферации и злокачественной трансформации. Гены Н-, К- и N-ras были идентифицированы как мутантные формы ras (Barbacid. M. Ann. Rev. Biochem. 1987, 56, 779-827). Послетрансляционная модификация белка ras требуется для биологической активности. Полагают, что фарнезилирование ras, катализируемое FPT-азой, является неотъемлемой стадией в процессировании ras. Он протекает путем переноса фарнезильной группы фарнезилпирофосфата (FPP) к цистеину у С-концевого тетрапептида ras в структурном мотиве, названном блоком СААХ. После дальнейших послетрансляционных модификаций, включающих протеолитическое расщепление у цистеинового остатка блока СААХ и метилирование карбоксила цистеина, ras способен связываться с клеточной мембраной для передачи сигналов роста во внутреннюю часть клетки. Полагают, что в нормальных клетках активированный ras действует вместе с факторами роста для стимуляции роста клеток. Полагают, что в опухолевых клетках мутации в ras заставляет его стимулировать деление клеток даже в отсутствие факторов роста (Travis J. Science 1993, 260, 1877-1878), возможно благодаря тому, что он постоянно присутствуют в GTP-активированной форме, а не превращается по циклу обратно в GDP-неактивированную форму. Ингибирование фарнезилирования продуктов мутантного гена ras остановит или снизит активацию.
Один класс известных ингибиторов фарнезилтрансферазы основан на аналогах фарнезилпирофосфата (см. , например, заявку на Европейский патент ЕР 534546 от Merck). Описаны ингибиторы фарнезилтрансферазы, основанные на мимикрии блока СААХ. Reiss (1990) в Cell 62, 81-8, описал тетрапептиды, такие как CVIM (Cys-Val-Ile-Met). James (1993) в Science 260, 1937-1942, описал основанные на бензодиазепинах пептидомиметические соединения. После самой ранней даты приоритета настоящего изобретения Lerner (1995) в J. Biol. Chem., 270, 26802, и Eisai в заявке на Международный патент WO 95/25086 описали следующие пептидомиметические соединения, основанные на Суs в качестве первого остатка. Кроме того, после самой ранней даты приоритета настоящего изобретения Bristol-Myers Squibb в заявке на Европейский патент ЕР 696593 впервые описал ингибиторы фарнезилтрансферазы, имеющие остаток 4-сульфанилпирролидина в первом положении.
Согласно одному аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая ингибитор фарнезилирования ras формулы I
где R1 выбран из группы, включающей Н; -С1-4алкил; -C1-3алкилен-Рh, необязательно моно- или дизамещенный в Ph заместителями, выбранными из группы, включающей С1-4алкил, галоген, ОН, С1-4алкокси, С1-4алканоил, С1-4алканоилокси, амино, С1-4алкиламино, ди(С1-4алкил) амино, С1-4алканоиламино, нитро, циано, карбокси, карбамоил, C1-4алкоксикарбонил, тиол, C1-4алкилсульфанил, С1-4алкилсульфинил, C1-4алкилсульфонил и сульфонамидо; -СО-С1-4алкил; -СО-О-С1-4алкил; -СО-O-С2-4алкенил; -СО-O-(СН2)nРh, необязательно замещенный в Ph, как определено выше для замещения в Ph для R1 = -С1-3алкилен-Рh, и n равно 0-4; -C1-4aлкилeн-CONR4R5, где R4 и R5 независимо выбраны из Н и С1-4алкила; и -С1-4алкилен-СООR6, где R6 выбран из Н, C1-4алкила;
R2 выбран из группы, включающей Н; -С1-4алкил; -C1-3алкилен-Рh, необязательно замещенный в Ph, как определено выше для замещения в Ph в R1 = -С1-3алкилен-Рh; -СОС1-4алкил и -СООС1-4алкила;
R3 выбран из группы, включающей Н; ОН; CN; СF3; NO2; -С1-4алкила; -С1-4алкилен-R7, где R7 выбран из фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 5 гетероатомов, выбранных из О, N и S, и любое арильное кольцо в R7 необязательно замещено, как определено выше для замещения в Ph-группе в R1 = -C1-3алкилен-Ph; R7; С2-4алкенил; галоген; -(CH2)nCOOR8, где = 0-3 и R8 представляет Н, С2-4алкил или С2-4алкенил; -CONR9R10, где R9 и R10 независимо представляют Н, С1-4алкил, С2-4алкенил, O-C1-4алкил, O-С2-4алкенил, -C1-3алкилен-Рh, необязательно замещенный, как определено для этой группы в указанном выше R1;
-CON(R11)OR12, где R11 и R12 независимо представляют Н, C1-4алкил и С2-4алкенил;
группу формулы II: -CONR13-CHR14-COOR17, где R13 представляет Н или С1-4алкил, R17 представляет Н или C1-6алкил, R14 выбран из группы, включающей боковую цепь липофильной аминокислоты, карбамоилС1-4алкил, N-(моноС1-4алкил)карбамоил С1-4алкил и N-(диС1-4алкил)карбамоилС1-4алкил, причем группа формулы II имеет L- или D-конфигурацию у хирального альфа-углерода в соответствующей свободной аминокислоте; лактон формулы
монозамещенного С1-4алкилом у углерода с =N-OH;
группу формулы -X-R15, где Х выбран из О, СО, СН2, S, SO, SO2 и R15 выбран из C1-6алкила, фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 5 гетероатомов, выбранных из О, N и S, и любое арильное кольцо в R15 необязательно замещено, как определено для группы Ph для R1 = С1-3алкилен-Рh;
р равно 0-3, причем значения R3 могут быть одинаковыми или различными;
L представляет связывающую группу, выбранную из следующих групп, написанных в формуле I слева направо:
-CO-NR16-, где R16 выбран из Н, С1-4алкила, С1-4алкилен-Z,
-СО-С1-4алкилен-Z, -CO-C1-6алкила, -COZ, Z и Z выбран из
-О-С1-4алкила, фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 5 гетероатомов, выбранных из О, N и S, и любое арильное кольцо в R16 необязательно замещено, как определено для группы Ph для R1 = C1-3алкилен-Рh; -CH2-NR18-, где R18 имеет любое значение, определенное для R16; -CH2S-; -CH2O-; -CH2-CHR19, где R19 имеет любое значение, определенное для R16; -CH=CR20-, где R20 имеет любое значение, определенное для R16; -CH2NR21-T-, где R21 имеет любое значение, определенное для R16, Т представляет -(CH2)n-, где n равно 1-4 и Т необязательно монозамещен R22, где R22 имеет любое значение для R16, кроме Н; -CH2NR23-SO2-, где R23 имеет любое значение, определенное для R16; -CH2-NR24-CO-T-, где R24 имеет любое значение, определенное для R16, Т представляет -(CH2)n-, где n равно 0-4, и Т необязательно монозамещен R29, где R29 имеет любое значение для R16, кроме Н; -CO-NR25-T-, где R23 имеет любое значение, определенное для R16, Т представляет -(CH2)n-, где n равно 1-4, и Т необязательно монозамещен R26, где R26 имеет любое значение для R16, кроме Н; -CH2S-T, где Т представляет -(СН2)n-, где n равно 1-4, и Т необязательно монозамещен R27, где R27 имеет любое значение для R16, кроме Н; -СН2О-Т-, где Т представляет -(СН2)n-, где n равно 1-4, и Т необязательно монозамещен R28, где R28 имеет любое значение для R16, кроме Н;
А выбран из фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 5 гетероатомов, где гетероатомы независимо выбраны из О, N и S;
или его -S-S-димер, когда R2 = Н; или его N-оксид;или его энантиомер, диастереоизомер, фармацевтически приемлемая соль, пролекарство или сольват вместе с фармацевтически приемлемым разбавителем или носителем.
R1 предпочтительно выбран из Н; -СО-O-(CH2)nPh, необязательно замещенного в Ph, как определено для R1 = -C1-3алкилен-Рh, где n=0-4; -СО-O-С1-4алкенил; -СО-С1-4алкил; -С1-4алкилен-CONR4R5, где R4 и R5 независимо выбраны из Н, С1-4алкила.
R2 предпочтительно выбран из Н и -СО-С1-4алкил.
L предпочтительно выбран из -CH2-NR18-; -CH2NR21-T-.
А предпочтительно выбран из фенила, нафтила, пиридила и тиенила.
Сочетания R3 и р предпочтительно выбраны из следующих сочетаний:
i) R3 выбран из группы формулы II; -С1-4алкил-R7; -O-R7 и R7; р равно 1-3 при условии, что одним из значений R3 является группа формулы II;
ii) р = 0 при условии, что А представляет нафтил и L представляет -CH2NR21-T;
iii) р = 1 при условии, что R3= группе формулы II и А представляет нафтил.
В другом осуществлении изобретения предпочтительно, когда R1 выбран из группы, включающей Н; -С1-4алкил; -C1-4алкилен-Рh, необязательно моно- или дизамещенный в Ph заместителями, выбранными из группы, включающей С1-4алкил, галоген, ОН, С1-4алкокси, С1-4алканоил, С1-4алканоилокси, амино, С1-4алкиламино, ди(С1-4алкил) амино, С1-4алканоиламино, тиол, С1-4алкилтио, нитро, циано, карбокси, карбамоил, С1-4алкоксикарбонил, С1-4алкилсульфинил, (C1-4алкилсульфонил, сульфонамидо; -CO-C1-4 алкил; -СО-O-С1-4алкил; -СО-O-С2-4алкенил; -CO-O-CH2-Ph, необязательно моно- или дизамещенный в фениле заместителями, выбранными из группы, включающей С1-4алкил, галоген, ОН, C1-4алкокси, С1-4алканоил, С1-4алканоилокси, амино, С1-4алкиламино, ди(С1-4алкил)амино, С1-4алканоиламино, тиол, С1-4алкилтио, нитро, циано, карбокси, карбамоил, С1-4алкоксикарбонил, С1-4алкилтионо, С1-4алкилсульфонил, сульфонамидо; -С1-4алкилен-CONR4R5, где R4 и R5 независимо выбраны из Н, C1-4алкила; -С1-4алкилен-СООR6, где R6 выбраны из Н, С1-4алкила;
R2 выбран из группы, включающей Н; -С1-4алкил; -C1-3алкилен-Рh; -СОС1-4алкил; -СООС1-4алкил;
R3 выбраны из группы, включающей Н; ОН; CN; СF3; NO2; -C1-4aлкил, -С1-4алкилен-R7, где R7 выбран из фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 3 гетероатомов, выбранных из О, N и S; С2-4алкенил; галоген; - (CH2)nCOOR8, где n= 0-3 и R8 представляет Н, С1-4алкил, С1-4алкенил; -CONR9R10, где R9 и R10 независимо представляют Н, C1-4алкил, С2-4алкенил, -O-С1-4алкил, -О-С2-4алкенил;
-CON(R11)OR12, где R11 и R12 независимо представляют Н, С1-4алкил и С2-4алкенил; группу формулы II, -CONR13-CHR14-COOR17, где R13 представляет Н или C1-4алкил, R17 представляет Н или C1-6алкил, R14 представляет боковую цепь липофильной аминокислоты с L- или D-конфигурацией у хирального альфа-углерода в соответствующей свободной аминокислоте; С1-4алкил, монозамещенный у углерода с =N-OH; -SО-С1-4алкил; -SO2-С1-4алкил;
группу формулы -X-R15, где Х выбран из СО, CH2, S, SO, SO2 и R15 выбран из C1-6алкила, фенила, нафтила, 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 3 гетероатомов, выбранных из О, N и S;
р равно 0-3, причем значения R3 могут быть одинаковыми или различными.
L представляет связывающую группу, выбранную из следующих групп, написанных в формуле слева направо:
-CO-NR16-, где R16 выбран из Н, С1-4алкила, С1-4алкилен-Z и Z выбран из группы, включающей -О-С1-4алкил, фенил, нафтил, 5-10-членное моноциклическое или бициклическое гетероарильное кольцо, содержащее вплоть до 3 гетероатомов, выбранных из О, N и S; -СН2-NR18-, где R18 имеет любое значение, определенное для R16; -CH2S-; -CH2O-; -СН2-CHR19-, где R19 имеет любое значение, определенное для R16; -CH-CR20-, где R20 имеет любое значение, определенное для R16; -CH2NR21-T-, где R21 имеет любое значение, определенное для R16, Т представляет -(СН2)n-, где n равно 1-4 и Т необязательно замещен R22, где R22 имеет любое значение для R16, кроме Н, при условии, что, по меньшей мере, один из R21 и R22 представляет Н; -CH2NR23-SO2-, где R23 имеет любое значение, определенное для R16; -CH2-NR24-CO-T-, где R24 имеет любое значение, определенное для R16, Т представляет -(СН2)n-, где п равно 0-4 и Т необязательно монозамещен R29, где R29 имеет любое значение для R16, кроме Н, при условии, что, по меньшей мере, один из R24 и R25 представляет Н; -CO-NR25-T-, где R23 имеет любое значение, определенное для R16, Т представляет -(CH2)n-, где n равно 1-4, и Т необязательно монозамещен R26, где R26 имеет любое значение для R16, кроме Н, при условии, что по меньшей мере один из R24 и R25 представляет Н; -CH2S-T-, где Т представляет -(СН2)n-, где n равно 1-4 и Т необязательно монозамещен R27, где R27 имеет любое значение для R16, кроме Н; -СНО-Т-, где Т представляет -(СН2)n-, где n равно 1-4, и Т необязательно монозамещен R28, где R28 имеет любое значение для R16, кроме Н;
А выбран из фенила; нафтила; 5-10-членного моноциклического или бициклического гетероарильного кольца, содержащего вплоть до 3 или 5 гетероатомов в случае моноциклических и бициклических колец соответственно, где гетероатомы независимо выбраны из О, N и S, или его -S-S-димер, когда R2=Н.
Предпочтительная фармацевтическая композиция имеет форму таблетки.
Соответственно другому аспекту изобретения предложено соединение формулы I, III, IV или V для использования в качестве лекарственного средства.
Соответственно другому аспекту изобретения предложено соединение формулы I, III, IV или V для использования при получении лекарственного препарата для лечения болезни, медиированной через фарнезилирование ras.
Многие соединения формулы I являются отличительным признаком этого изобретения, и соответственно другому аспекту изобретения особенно предложено соединение любого из следующих классов i), ii) или iii):
где X1 выбран из группы, включающей Н; C1-6алкил; гидроксиС1-6алкил; С1-6алкоксиС1-6алкил; C1-6алкилкарбонил; гидрокси С1-6алкилкарбонил; С1-6алкоксиС1-6алкилкарбонил;
А выбран из группы, включающей фенил, нафтил и 5-10-членное гетероарильное кольцо, содержащее вплоть до 5 гетероатомов, выбранных из О, N и S;
X2 выбран из группы, включающей Н; фенил; фенилС1-6алкил; 5-6-членное гетероарильное кольцо, содержащее вплоть до 3 гетероатомов, выбранных из О, N и S, необязательно связанное с А С1-6алкилом, и X2 необязательно замещен в любом кольце, как определено для фенила в R1 = -C1-3алкилен-Рh в п.1;
X3 выбран из Н; C1-6алкила;
X4 выбран из группы, включающей C1-6алкилсульфанил; C1-6алкилсульфинил; C1-6алкилсульфонил; карбамоил; N-(C1-6алкил)карбамоил; N-(диС1-6алкил)карбамоил; гидрокси или его С1-4алкиловый эфир;
где X5 выбран из группы, включающей -СО-С1-4алкил-Рh; -CO-C1-6алкил; -СО-С1-4алкилгетероарил, где гетероарил представляет 5-10-членное гетероарильное кольцо, содержащее вплоть до 5 гетероатомов, выбранных из О, N и S, и Ph или гетероарил необязательно замещен, как определено для Ph в R1 = -C1-3алкилен-Ph; С1-4алкилоксиС1-4алкил;
А представляет нафтил или 10-членное гетероциклическое кольцо, имеющее вплоть до 5 гетероатомов, выбранных из О, N и S;
R3 и р такие, как определены в п.1;
где X6 имеет любое значение, определенное выше для X5 в ii);
X7 представляет Ph, необязательно замещенный, как определено для Ph в R1 = -С1-3алкилен-Рh;
А представляет Ph или нафтил, или 5-10-членное гетероциклическое кольцо, имеющее вплоть до 5 гетероатомов, выбранных из О, N и S;
R3 и р такие, как определены выше;
или его N-оксид, фармацевтически приемлемая соль, пролекарство или сольват.
Предпочтительные значения для соединений класса i) включают:
X1 выбран из Н и С1-6алкоксиС1-6алкила;
X2 выбран из Н; фенила или фенилС1-6алкила;
X4 представляет C1-6алкилсульфанил;
А выбран из фенила или нафтила.
Другими предпочтительными значениями для X4 являются -ОМе и лактон, который может образоваться, когда X4 представляет ОН и X3 представляет Н.
Предпочтительные значения для соединений класса ii) включают р, равное 0.
Предпочтительные значения для соединений класса iii) включают:
X7 представляет Ph;
А представляет Ph;
р равно 0.
В другом осуществлении изобретения предложено соединение формулы I, где R1 выбран из Н или С1-4алкила; R2 выбран из группы, включающей Н, С1-4алкил, -СОС1-4алкил; -C1-4алкилРh, L выбран из следующих значений, как определено здесь: CONR16, CH2S, CH2O, CH2CHR19, CH=CHR20, CH2NR24COT, CONR25T, CH2ST, и CH2OT и значения для А, R3 и р такие, как определены здесь, при условии, что исключены 2-(бензилкарбамоил)-4-сульфанилпирролидин и 4-(ацетилсульфонил)-2-(бензилкарбамоил)пирролидин. Полагают, что исключенные соединения были описаны в качестве промежуточных продуктов для синтеза бета-лактамных антибиотиков в заявке на патент Японии 60233076 (Sumitomo Chemical).
Соответственно другому аспекту настоящего изобретения предложено любое одно из следующих индивидуальных соединений или их фармацевтически приемлемых солей:
метиловый эфир (2S)-2-{ 2-бензил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]бензоиламино}-4-метилсульфанилмасляной кислоты;
(2S)-2-{ 2-бензил-5-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино] бензоиламино}-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-({ 2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты;
(2S)-2-({2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-({ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино]нафталин-1-карбонил}амино)-4-метилсульфа-нилмасляной кислоты;
(2S)-2-({ 3-[([2S,4S]-4-cyльфaнилпиppoлидин-2-илмeтил)амино]нафталин-1-карбонил}амино)-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-({ 3-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты;
(2S)-2-({3-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляная кислота;
(2S, 4S)-2-[{ N-(4-метоксибензил)-N-(нафталин-1-илметил)амино}метил]пирролидин-4-тиол;
N-(нафталин-1-илметил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)пентамид;
N-(нафталин-1-илметил)-п-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-2-(пиридин-3-ил)ацетамид;
N-((2S, 4S)-4-сульфанилпирролидин-2-илметил)-3-метил-N-(2-нафталин-1-илэтил)бутирамид;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-N-(2-нафталин-1-илэтил)-2-пиридин-3-илацетамид;
(2S, 4S)-2-[{(3-метоксипропил)-(2-нафталин-1-илэтил)амино]метил}пирролидин-4-тиол;
N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-2-(4-метоксифе-нил)-N-(2-нафталин-1-илэтил)ацетамид;
(2S, 4S)-2-{ [(2-(4-метоксифенил)этил)-(2-нафталин-1-илэтил)амино]метил} пирролидин-4-тиол;
N-(2,2-дифенилэтил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-3-метилбутирамид;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-2-илэтил)бутирамид;
N-(2,2-дифенилэтил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илме-тил)-3,3-диметилбутирамид;
(2S)-2-{ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)-(3-метоксипропил)амино]бензоиламино}-4-метилсульфанилмасляная кислота;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-1-илэтил)бутирамид;
(2S)-4-карбамоил-2-({ 2-фенил-5-[([2S, 4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)масляная кислота;
метиловый эфир (2S)-4-карбамоил-2-({2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)масляной кислоты.
Соответственно другому аспекту изобретения предложена фармацевтическая композиция, содержащая соединение, как определено в любой одной из формул III, IV или V, или перечисленное выше индивидуальное соединение вместе с фармацевтически приемлемым разбавителем или носителем.
Соответственно другому аспекту изобретения предложен способ получения соединений классов i), ii) или iii), как определено выше, который заключается в удалении защитной группы у соединения формулы VI
где X8 представляет правую часть соединения класса i), ii) или iii), как определено выше,
Рr1 представляет Н или аминозащитную группу; Рr2 представляет Н или тиозащитную группу и любые функциональные группы в X8 необязательно защищены, при условии, что имеется, по меньшей мере, одна защитная группа, и необязательно, если необходимо, превращении полученного таким образом продукта в его фармацевтически приемлемую соль.
В примере осуществления изобретения:
примеры значений для R1 включают метил; -CH2-Ph; -CH2-Ph, замещенный в Ph нитро, особенно 4-нитро; ацетил; ВОС; аллилоксикарбонил; -CO-O-CH2-Ph, замещенный в Ph нитро, особенно 4-нитро; -CH2CONH2;
примеры значений для R2 включают -СОМе и -СОО-трет-бутил;
примеры значений для R3 включают Cl; -COOH; -CONH2; -SOMe и -SO2Me;
когда R3 представляет -(СН2)n-COOR8, подходящая величина для n равна 0;
примеры липофильных аминокислот, которые предоставляют их боковую цепь (обозначены R14 в пределах определения значений для R3), включают метионин, фенилглицин, фенилаланин, серин, лейцин, изолейцин или валин. В соответствующей свободной аминокислоте предпочтительна L-конфигурация. Примеры аминокислотных боковых цепей представлены ниже. Предпочтительным значением для R14 является -CH2-CH2-S-СН3. Другими предпочтительными значениями для R14 являются -СН2-ОМе и -CH2-CH2-OMe.
Когда R17 представляет Н, т.е. в формуле II присутствует группа COOH, и R14 представляет -CH2-CH2-OH, можно образовать лактон, где R17 и R14 вместе образуют часть дигидрофуран-2-онового гетероциклического кольца. Такой же лактон можно образовать из соединений формулы III, где X4 представляет ОН и X3 представляет Н.
Аминокислота - Боковая цепь
Метионин - -СН2-СН2-S-СН3
Фенилглицин - Ph
Фенилаланин - -СН2-Ph
Серин - -СН2ОН или его С1-4алкиловый (предпочтительно метиловый) эфир
Лейцин - -СН2-СНМе2
Гомосерин - -СН2-СН2-ОН или его С1-4алкиловый (предпочтительно метиловый) эфир
Предпочтительная величина для р равна 2.
Когда L представляет -CH2NR21-T-, подходящая величина для n равна 1. Когда L представляет -CH2-NR24-CO-T-, подходящая величина для n равна 1. Когда L представляет -CH2-NR25-T-, подходящая величина для n равна 1. Когда L представляет -СН2-S-T-, подходящая величина для n равна 1. Когда L представляет -СН2-O-Т-, подходящая величина для n равна 1. L в особенности представляет -CONH-, -CH2-NH-, -CH2NHSO2-, -CH2NHCO-. Примерами значений для А, когда А представляет гетероарил, являются тиенил, пиридил, хинолил и хиноксалинил. Дополнительные предпочтительные значения представлены ниже.
Для R1: 4-нитробензилоксикарбонил; аллилоксикарбонил; карбамоилметил; ацетил; феноксикарбонил; Н.
Для R2: ацетилсульфанил; Н.
Для R3: метоксикарбонил, N-метил-N-метоксикapбaмоил; нитро; аллилоксикарбонил; N-метилаллилоксикарбамоил; этоксикарбонил; 3,4-дихлорбензилкарбамоил; гидрокси; карбокси; метиловый эфир (2S)-4-метилсульфанилмасляной кислоты-2-илкарбамоил; (2S)-4-метилсульфанилмасляная кислота-2-илкарбамоил; фенокси.
Для р: 1-2, особенно 2, следующая предпочтительная величина равна 0.
Для L: -C(O)-NH-; -CH2-C(O)-NH; -СН2-NH-C(О); -CH2-NH-SO2, в особенности -C(O)-NH-.
Для А: фенил; пиридил; тиенил; нафтил.
Для R16 и R18-26: Н, С1-4алкил, в особенности Н.
В другом примере осуществления изобретения предпочтительные значения приводятся ниже.
В соединениях формулы III: X1 представляет Н или метоксиС1-4алкил (в особенности Н); X2 представляет Н, фенил или бензил (в особенности бензил); X3 представляет Н или С1-4алкил (в особенности Н); X4 представляет C1-4алкилсульфанил (в особенности метилсульфанил) и А представляет фенил. Когда А представляет 6-членное арильное или гетероарильное кольцо, то группы -NX1- и заместитель, содержащий X4, предпочтительно находятся в мета-положении относительно друг друга; X2, если присутствует, предпочтительно находится в пара-положении относительно -NX1-. Хиральный углерод, к которому присоединен -СООХ3, предпочтительно имеет S-конфигурацию. Хиральные углероды в положениях 2 и 4 кольца пирролидина предпочтительно имеют S-конфигурацию.
В соединениях формулы IV: X5 представляет -CO-C1-4алкил (в особенности -CO-CH2-CHMe2) или -СН2-Рh-О-С1-4алкил (в особенности -СН2-Рh-ОМе); гетероарил предпочтительно представляет пиридил и предпочтительный заместитель арила или гетероарила представляет -О-С1-4алкил (в особенности метокси) и А представляет нафтил. Хиральные углероды в положениях 2 и 4 кольца пирролидина предпочтительно имеют S-конфигурацию. Место присоединения А относительно -(СН2)1-2 предпочтительно находится в положении 1 нафталина и эквивалентном положении гетероциклических значений для А (независимо от нумераций колец, обычных для гетероциклов). Предпочтительным значением для (СН2) 1-2 является -(СН2)2-.
В соединениях формулы V: X6 представляет -СО-С1-5алкил (более предпочтительно -СО-СН2-СНМе2 или -СО-СН2-трет-бутил, особенно -СО-СН2-СНМе2) или -СН2-Рh-О-С1-4алкил (особенно -СН2-Ph-OMe); гетероарил предпочтительно представляет пиридил и предпочтительный заместитель арила представляет -О-С1-4алкил (особенно метокси) и А представляет фенил или нафтил (особенно фенил). Хиральные углероды в положениях 2 и 4 кольца пирролидина предпочтительно имеют S-конфигурацию. Предпочтительным значением для -(СН2)1-2- является -(СН2)1-.
Подходящая пара значений для R3, когда р=2, представляет -СООМе, -CON(Me)OMe; NO2, -CON(Me)OMe; -СООМе, аллилоксикарбонил; -CON(Me)OMe, аллилоксикарбонил; аллилоксикарбонил, -CON(Me)OCH2CH= CH2; ОН, СООН; -СООМе, -СООМе; Ph, -CON-метиловый эфир метионина; Ph, -CON-метионин; бензил, -CON-метиловый эфир метионина; бензил, -CON-метионин; бензил, -CON-изопропиловый эфир метионина; Ph, -CON-метиловый эфир α-глутамина; Ph, -СО N-α-глутамин.
Подходящие значения для L=CHNR21T включают CH2N(COCH2CHMe2)CH2CH2; CH2N (СН2СН2СН2OМе)СН2СН2; CH2N(CH2-п-PhOMe)СН2СН2; CH2N(СОСН2СНМе2)СН2; CH2N (СОСН2СН2СН2Ме)СН2; CH2N(СОСН2СНМеСН2Ме)СН2; CH2N (СОСН2СН2OМе)СН2; CH2N(СОСН2пиридин-3-ил CH2; CH2N(4 -метоксибензил)СН2; CH2N(СОСН2СНМе2)СН2СН2СН(Ph); CH2N(СОСН3)СН2СН2СН(Ph); CH2N(СОСН2СНМе2)CH2;
CH2N(СОСН3)СН2; CH2N(СОСН2СНМе2)CH2CH (Ph); CH2N(COCH2CMe3)CH2CH(Ph);
СН2N(СОСН2пиридин-3-ил)CH2CH( Ph); СН2N(СО-1-гидрокси-6-метоксипиридин-3-ил)CH2CH (Ph); CH2N(СОСН2СНМе2 )СН2СН2; СН2N(СОСН2СМе3)СН2СН2;
CH2N(СОСН2пиридин -3-ил)СН2СН2; CH2N(СО-4 -метоксибензил)СН2СН2.
Подходящие значения для L = -CH2NR18 включают CH2NH; CH2NMe; CH2N(СОСН2СНМе2) и CH2N(СОСН2СН2ОМе).
Различные формы пролекарств хорошо известны в данной области. Примеры таких пролекарственных производных см. в следующих ссылках:
a) Design of Prodrugs, edited by H. Bundgaard (Elsevier. 1985); Methods in Enzymology, Vol. 42, p. 309-396, edited by K. Widder et al. (Academic Press, 1985);
б) A Texbook of Drug Design and Development, edited by Krogsgaard-Larsen and H. Bundgaard, Chapter 5 "Design and Prodrugs" by H. Bundgaard, p. 113-191 (1991);
в) H. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992);
г) H. Bundgaard et al. , Journal of Pharmaceutical Sciences, 77, 285 (1988) and
д) N. Kakeya et al., Chem. Pharm. Bull., 32, 692 (1984).
Примеры пролекарств включают гидролизуемые in vivo сложные эфиры соединения формулы I. Гидролизуемый in vivo эфир соединения формулы (I), содержащего карбоксигруппу, представляет, например, фармацевтически приемлемый эфир, который гидролизуется в теле человека или животного с образованием исходной кислоты. Подходящие фармацевтически приемлемые эфиры для карбокси включают C1-6алкоксиметиловые эфиры, например метоксиметиловый эфир, C1-6алканоилоксиметиловые эфиры, например, пивалоилоксиметиловый эфир, фталидиловые эфиры, С3-8циклоалкоксикарбонилоксиС1-6алкиловые эфиры, например 1-циклогексилкарбонилоксиэтиловый эфир; 1,3-диоксолен-2-онилметиловые эфиры, например 5-метил-1,3-диоксолен-2-онилметиловый эфир, и C1-6алкоксикарбонилоксиэтиловые эфиры, например 1-метоксикарбонилоксиэтиловый эфир, их можно образовать у любой карбоксигруппы в соединениях этого изобретения.
Особенные заместители в А для 6-членных колец находятся в мета- или пара-положении.
Некоторые соединения в пределах объема формулы I известны в качестве промежуточных продуктов в синтезе боковой цепи карбапенемов, но полагают, что они не были ранее описаны в формах, подходящих в качестве фармацевтических композиций, и не имели никакой фармацевтической активности, связанной непосредственно с ними. Читателя в связи с этим, а также в связи с синтетическими подробностями получения соединений отсылают к следующим публикациям: Matsumura, Heterocycles (1995), 41, 147-59; заявка на Европейский патент ЕР 590885 (Zeneca; Betts et al); заявка на Европейский патент ЕР 592167 (Zeneca; Siret); заявка на Европейский патент ЕР 562855 (Zeneca; Jung et al); заявка на Международный патент WO 92/17480 (Jmperial Chemical Industries; Betts et al); заявка на Европейский патент ЕР 508682 (Jmperial Chemical Industries; Betts et al); заявка на Европейский патент ЕР 280771 (Fujisawa Pharmaceutical, Murata et al) и заявка на Международный патент WO 92/17479 (Jmperial Chemical Industries; Betts et al).
В этом описании родовой термин "алкил" включает алкильные группы как с неразветвленной, так и разветвленной цепью. Однако ссылки на индивидуальные алкильные группы, такие как "пропил", являются конкретными только для варианта неразветвленной цепи и ссылки на индивидуальные алкильные группы с разветвленной цепью, такие как "изопропил", являются конкретными только для варианта разветвленной цепи. Аналогичную условность применяют для других родовых терминов.
Должно быть понятно, что поскольку некоторые соединения формулы I, определенные выше, могут существовать в оптически активных или рацемических формах вследствие одного или нескольких асимметричных атомов углерода, изобретение включает в свое определение любую такую оптически активную или рацемическую форму, которая обладает свойствами ингибирования FТРазы. Синтез оптически активных форм можно проводить стандартными способами органической химии, хорошо известными в данной области, например синтезом из оптически активных исходных продуктов или расщеплением рацемической формы на оптические антиподы. Аналогично этому ингибирующие свойства против FТРазы можно оценить с использованием стандартных лабораторных способов, указанных ниже.
Термин "галоген" относится к фтору, хлору, брому и йоду. Термин "карбамоил" относится к -C(O)NH2. Термин "ВОС" относится к трет-бутил-О-С(О)-. Термин "аллил" относится к CH2=CH-CH2-. Бициклические арильные и бициклические гетероарильные кольца относятся к циклическим системам, в которых оба кольца бициклической системы ароматические.
Примеры C1-6алкила включают метил, этил, пропил, изопропил, втор-бутил, трет-бутил и пентил; примеры С1-4алкила включают метил, этил, пропил, изопропил, втор-бутил и трет-бутил; примеры C1-3алкила включают метил, этил, пропил и изопропил; примеры -C1-3алкиленРh включают бензил, фенилэтил, фенилпропил; примеры С1-4алкокси (называемого здесь также -O-С1-4алкил) включают метокси, этокси и пропокси; примеры С1-4алканоила включают формил, ацетил и пропионил; примеры С1-4алканоилокси включают ацетилокси и пропионилокси; примеры С1-4алкиламино включают метиламино, этиламино, пропиламино, изопропиламино, втор-бутиламино и трет-бутиламино; примеры ди(С1-4алкил)амино включают диметиламино, диэтиламино и N-этил-N-метиламино; примеры С1-4алканоиламино включают ацетамидо и пропиониламино; примеры С1-4алкоксикарбонила включают метоксикарбонил, этоксикарбонил и пропоксикарбонил; примеры С1-4алкилсульфанила включают метилсульфанил, этилсульфанил, пропилсульфанил, изопропилсульфанил, втор-бутилсульфанил и трет-бутилсульфанил; примеры С1-4алкилсульфинила включают метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, втор-бутилсульфинил и трет-бутилсульфинил; примеры С1-4алкилсульфонила включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, втор-бутилсульфонил и трет-бутилсульфонил; примеры -СО-С1-4алкил включают формил, ацетил, пропионил, бутирил и валерил; примеры -СО-O-С1-4алкил включают этилоксикарбонил, пропилоксикарбонил и трет-бутилоксикарбонил (ВОС); примеры -СО-O-С2-4алкенил включают аллилоксикарбонил и винилоксикарбонил; примеры -СО-O-(CH2)nPh, где n=0-4, включают фенилоксикарбонил, бензилоксикарбонил, фенилэтилоксикарбонил и фенилпропилоксикарбонил; примеры -C1-4алкилен-СОR4R5 включают карбамоилметил, карбамоилэтил, N-метилкарбамоилэтил, N-метил-N-этилкарбамоилэтил; примеры -С1-4алкилен-СООR6 включают карбоксиметил, карбоксиэтил, карбоксипропил, метиловый эфир пропионовой кислоты, этиловый эфир уксусной кислоты; примеры С2-4алкенила включают аллил и винил; примеры --O-С2-4алкенил включают аллилокси и винилокси; примеры липофильных аминокислот включают валин, лейцин, изолейцин, метионин, фенилаланин, серии, треонин и тирозин; примеры карбамоилС1-4алкила включают карбамоилметил, карбамоилэтил и карбамоилпропил; примеры N-(моноС1-4алкил)карбамоилС1-4алкила включает N-метилкарбамоилметил и N-этилкарбамоилэтил; примеры N-(диС1-4алкил)карбамоилС1-4алкила включает N, N-диметилкарбамоилметил и N-метил-N-этилкарбамоилэтил; примеры С1-4алкила, монозамещенного у углерода с =N-OH, включает оксим бутиральдегида и оксим пропионового альдегида; примеры гидроксиС1-6алкила включают гидроксиметил, гидроксиэтил, гидроксипропил, 2-гидроксипропил, 2-(гидроксиметил)пропил и гидроксипентил; примеры С1-6алкоксиС1-6алкила включают метоксиэтил, этоксиэтил и метоксибутил; примеры C1-6алкилкарбонила включают метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил и пентилкарбонил;
примеры гидроксиС1-6алкилкарбонила включают гидроксиацетил, гидроксипропионил, гидроксибутирил, 3-гидроксибутирил и гидроксипентаноил; примеры С1-6алкоксиС1-6алкилкарбонила включают метоксиацетил, метоксипропионил, этоксибутирил и бутоксиацетил; примеры фенилС1-6алкила включают бензил, фенилэтил и фенилпропил; примеры -СО-С1-4алкил-Рh включают фенилацетил и фенилпропионил; примеры -СО-С1-4алкилгетероарил включают 2-(3-пиридил)ацетил и 2-(3-тиенил)ацетил; примеры N-(C1-6алкил)карбамоила включают N-метилкарбамоил и N-этилкарбамоил; примеры N-(диС1-6алкил)карбамоила включают N,N-диметилкарбамоил и N-метил-N-этилкарбамоил.
Примеры 5-10-членных моноциклических или бициклических гетероарильных колец, содержащих вплоть до 5 гетероатомов, выбранных из О, N и S, включают следующие. Примеры 5- или 6-членных гетероарильных циклических систем включают имидазол, триазол, пиразин, пиримидин, пиридазин, пиридин, изоксазол, оксазол, изотиазол, тиазол и тиофен. 9- или 10-членная бициклическая гетероарильная циклическая система представляет ароматическую бициклическую систему, содержащую 6-членное кольцо, конденсированное либо с 5-членным кольцом, либо с другим 6-членным кольцом. Примеры бициклических систем 5/6 и 6/6 включают бензофуран, бензимидазол, бензтиофен, бензтиазол, бензизотиазол, бензоксазол, бензизоксазол, пиридоимидазол, пиримидоимидазол, хинолин, изохинолин, хиноксалин, хиназолин, фталазин, циннолин и нафтиридин.
Моноциклические гетероарильные кольца предпочтительно содержат вплоть до 3 гетероатомов и бициклические гетероарильные кольца предпочтительно содержат вплоть до 5 гетероатомов. Предпочтительными гетероатомами являются N и S, особенно N. Обычно гетероциклические кольца соединяются с другими группами через атомы углерода. Подходящими значениями гетероциклов, содержащих только N в качестве гетероатома, являются пиррол, пиридин, индол, хинолин, изохинолин, имидазол, пиразин, пиримидин, пурин и птеридин.
Любые хиральные атомы углерода в положениях 2 и 4 кольца пирролидина в формулах I и III-V предпочтительно имеют S-конфигурацию.
Соединения формулы I и III-V могут образовать соли, которые находятся в пределах сферы изобретения. Предпочтительны фармацевтически приемлемые соли, хотя могут быть полезны другие соли, например, для выделения и очистки соединений.
Когда соединение содержит основную часть (группу основного характера), оно может образовать фармацевтически приемлемые соли с различными неорганическими или органическими кислотами, например хлористоводородной, бромистоводородной, серной, фосфорной, трифторуксусной, лимонной или малеиновой кислотой. Подходящей фармацевтически приемлемой солью изобретения, когда соединение содержит кислотную часть, является соль щелочного металла, например соль натрия или калия, соль щелочноземельного металла, например соль кальция или магния, аммониевая соль или соль с органическим основанием, которое образует фармацевтически приемлемый катион, например соль с метиламином, диметиламином, триметиламином, пиперидином, морфолином или трис-(2-гидроксиэтил)амином.
Сольваты, например гидраты, также находятся в пределах сферы изобретения, их можно получить обычно известными способами.
Соответственно другому аспекту настоящего изобретения предложено соединение формулы I для использования в качестве лекарственного средства.
Соответственно другому аспекту настоящего изобретения предложено соединение формулы I для получения лекарственного препарата для лечения медиированных ras болезней, особенно рака.
Соответственно другому аспекту настоящего изобретения предложен способ лечения медиированных ras болезней, особенно рака, введением эффективного количества соединения формулы I млекопитающему, нуждающемуся в таком лечении.
Соответственно другой особенности настоящего изобретения предложено соединение формулы I или его фармацевтически приемлемая соль для использования в способе лечения человека или животного терапией.
Изобретение включает также способ лечения болезни или медицинского состояния, медиированного полностью или частично фарнезилированным ras, который заключается в введении млекопитающему, нуждающемуся в таком лечении, эффективного количества активного ингредиента, как определено выше. Изобретение предлагает также использование такого активного ингредиента для получения нового лекарственного препарата для использования при лечении медиированной фарнезилированным ras болезни или медицинского состояния.
Конкретные, представляющие интерес раковые болезни включают:
- карциному, включая карциному мочевого пузыря, молочной железы, ободочной кишки, почки, печени, легкого, яичника, поджелудочной железы, желудка, шеи, щитовидной железы и кожи;
- гемопоэтические опухоли лимфоидного происхождения, включая острый лимфолейкоз, В-клеточную лимфому и лимфому Беркитта;
- гемопоэтические опухоли миелоидного происхождения, включая острые и хронические миелогенные лейкозы и промиелоцитный лейкоз;
- опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому, и
- другие опухоли, включая меланому, семиному, тетратокарциному, нейробластому и глиому.
Соединения формулы I особенно полезны при лечении опухолей, имеющих высокую частоту мутации ras, таких как опухоли ободочной кишки, легкого и поджелудочной железы. Путем введения композиции, имеющей одно (или сочетание) из соединений указанного изобретения, уменьшается развитие опухолей у млекопитающего-хозяина.
Соединения формулы I могут также быть полезны при лечении болезней, других чем рак, которые могут быть ассоциированы с путями сигнальной трансдукции, действующими через ras, например нейрофиброматоза.
Соединения формулы I могут быть также полезны при лечении болезней, связанных с СААХ-содержащими белками, другими, чем ras (например, ядерными ламинами и трансдуцином), которые также послетрансляционно модифицируются ферментом фарнезилпротеинтрансферазой.
Композиции изобретения могут быть в форме, подходящей для перорального использования (например, в виде таблеток, лепешек, твердых или мягких капсул, водных или масляных суспензий, эмульсий, диспергируемых порошков или гранул, сиропов или эликсиров), для местного использования (например, в виде кремов, мазей, гелей или водных или масляных растворов или суспензий), для введения ингаляцией (например, в виде тонко измельченного порошка или жидкого аэрозоля), для введения инсуффляцией (например, в виде тонко измельченного порошка) или для парентерального введения (например, в виде стерильного водного или масляного раствора для внутривенного, подкожного или внутримышечного дозированного введения или в виде суппозиториев для ректального дозированного введения).
Композиции изобретения можно получить обычными способами с использованием обычных фармацевтических наполнителей, хорошо известных в данной области. Так, композиции, предназначенные для перорального использования, могут содержать, например, один или несколько окрашивающих, подслащивающих, ароматизирующих и/или консервирующих агентов.
Подходящие фармацевтически приемлемые наполнители для готовой препаративной формы в виде таблетки включают, например, инертные разбавители, такие как лактоза, карбонат натрия, фосфат кальция или карбонат кальция, гранулирующие и дезинтегрирующие агенты, такие как кукурузный крахмал или альгиновая кислота; связывающие агенты, такие как крахмал; смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк; консервирующие агенты, такие как этил- или пропил-п-гидроксибензоат, и антиокислители, такие как аскорбиновая кислота. Таблетированные готовые препаративные формы могут быть непокрытыми или покрытыми либо для
модификации их дезинтеграции и последующей абсорбции активного ингредиента в пределах желудочно-кишечного тракта, либо для улучшения их стабильности и/или внешнего вида, причем в любом случае используют обычные агенты для получения покрытия и способы, хорошо известные в данной области.
Композиции для перорального использования могут быть в форме твердых желатиновых капсул, в которых активный ингредиент смешивают с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешивают с водой или маслом, таким как арахисовое масло, жидкий парафин или оливковое масло.
Водные суспензии обычно содержат активный ингредиент в тонко измельченной порошкообразной форме вместе с одним или несколькими суспендирующими агентами, такими как натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь или аравийская камедь; диспергирующими или смачивающими агентами, такими как лецитин или продукты конденсации алкиленоксида с жирными кислотами (например, полиоксиэтиленстеарат) или продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксицетанол, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и гексита, такие как моноолеат полиоксиэтиленсорбита, или продукты конденсации этиленоксида с неполными сложными эфирами, полученными из жирных кислот и ангидридов гекситов, например моноолеат полиоксиэтиленсорбитана. Водные суспензии могут содержать также один или несколько консервантов (такие как этил- или пропил-п-гидроксибензоат), антиокислители (такие как аскорбиновая кислота), красящие агенты, ароматизирующие агенты и/или подслащивающие агенты (такие как сахароза, сахарин или аспартам).
Масляные суспензии можно изготовить суспендированием активного ингредиента в растительном масле (таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло) или минеральном масле (таком как жидкий парафин). Масляные суспензии могут содержать также загущающий агент, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятного на вкус перорального препарата можно добавить подслащивающие агенты, такие, как приведены выше, и ароматизирующие агенты. Эти композиции можно консервировать добавлением антиокислителя, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, пригодные для получения водной суспензии добавлением воды, обычно содержат активный ингредиент вместе с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Примерами подходящих диспергирующих или смачивающих агентов и суспендирующих агентов являются агенты, уже упоминавшиеся выше. Могут также присутствовать дополнительные наполнители, такие как подслащивающие, ароматизирующие и окрашивающие агенты.
Фармацевтические композиции изобретения могут быть также в форме эмульсии типа масло в воде. Масляной фазой может быть растительное масло, такое как оливковое масло или арахисовое масло, или минеральное масло, такое как, например, жидкий парафин, или смесь любых из них. Подходящими эмульгирующими агентами могут быть, например, существующие в природе камеди, такие как аравийская камедь или трагакантная камедь, существующие в природе фосфатиды, такие как соевые бобы, лецитин, сложные эфиры или неполные эфиры, полученные из жирных кислот и ангидридов гекситов (например, моноолеат сорбитана) и продукты конденсации этих неполных эфиров с этиленоксидом, такие как моноолеат полиоксиэтиленсорбитана. Эмульсии могут также содержать подслащивающие, ароматизирующие и консервирующие агенты.
Сиропы и эликсиры можно изготовить с использованием подслащивающих агентов, таких как глицерин, пропиленгликоль, сорбит, аспартам или сахароза, они могут содержать средство, снижающее раздражение, консервирующий, ароматизирующий и/или красящий агент.
Фармацевтические композиции могут быть также в форме стерильной инъецируемой водной или масляной суспензии, которую можно изготовить в соответствии с известными способами с использованием одного или нескольких подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые упоминались выше. Стерильным инъецируемым препаратом может также быть стерильный инъецируемый раствор или суспензия в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле.
Готовые препаративные формы в виде суппозиториев можно получить смешиванием активного ингредиента с подходящим не раздражающим наполнителем, который твердый при обычных температурах, но жидкий при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Подходящие наполнители включают, например, масло какао и полиэтиленгликоли.
Местные готовые препаративные формы, такие как кремы, мази, гели и водные или масляные растворы или суспензии, обычно можно получить сочетанием активного ингредиента с обычным, топически приемлемым наполнителем или разбавителем с использованием обычного способа, хорошо известного в данной области.
Композиции для введения инсуффляцией могут быть в форме тонко измельченного порошка, содержащего частицы со средним диаметром, например, 30 мк или значительно меньше, причем сам порошок содержит либо только активный ингредиент, либо этот ингредиент, разбавленный одним или несколькими физиологически приемлемыми носителями, такими как лактоза. Порошок для инсуффляции затем обычно сохраняют в капсуле, содержащей, например, 1-50 мг активного ингредиента, для использования в турбоингаляционном устройстве, таком, как используют для инсуффляции известного агента, кромогликата натрия.
Композиции для введения ингаляцией могут быть в форме обычного, находящегося под давлением аэрозоля, приспособленного для подачи активного ингредиента либо в виде аэрозоля, содержащего тонко измельченные твердые частицы, или жидких капелек. Можно использовать обычные пропелланты для аэрозолей, такие как летучие фторированные углеводороды или углеводороды, и аэрозольное устройство обычно приспособлено для подачи измеренного количества активного ингредиента.
Для получения дополнительной информации по готовой препаративной форме читателя отсылают к Chapter 25.2 in Volume 5 of Comprehensive Medicinal Chemistry (corwin Hansch; Chairman of Editorial Board), Pergamon Press, 1990.
Количество активного ингредиента, которое смешивают с одним или несколькими наполнителями для получения лекарственной формы с разовой дозой, будет обязательно изменяться в зависимости от хозяина, которого лечат, и определенного пути введения. Например, готовая препаративная форма, предназначенная для перорального введения людям, будет обычно содержать от 0,5 мг до 2 г активного агента, смешанного с подходящим и пригодным количеством наполнителей, которое может изменяться от около 5 до около 98 мас. % от массы всей композиции. Унифицированные лекарственные формы обычно содержат от около 1 мг до около 500 мг активного ингредиента. Для получения дополнительной информации по путям введения и схемам приема лекарственного средства читателя отсылают к Chapter 25.2 in Volume 5 of Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press, 1990.
Величина дозы соединения формулы I для терапевтических или профилактических целей будет естественно изменяться в соответствии с природой и тяжестью состояний, возрастом и полом животного или пациента и путями введения, согласно хорошо известным принципам медицины. Как упоминалось выше, соединения формулы I полезны при лечении болезней или медицинских состояний, которые обусловлены полностью или частично влиянием фарнезилирования ras.
При использовании соединения формулы I для терапевтических или профилактических целей его обычно будут вводить так, чтобы принимать суточную дозу в диапазоне, например, от 0,5 мг до 75 мг на 1 кг массы тела, если требуется, данную в разделенных дозах. Когда применяют парентеральный путь введения, обычно вводят меньшие дозы. Так, например, для внутривенного введения обычно будут использовать дозу в диапазоне, например, от 0,5 мг до 30 мг на 1 кг массы тела. Аналогично этому для введения ингаляцией будут использовать дозу в диапазоне, например, от 0,5 мг до 25 мг на 1 кг массы тела. Однако предпочтительно пероральное введение.
Соединения этого изобретения могут быть пригодными в сочетании с известными противораковыми и цитотоксическими агентами. Если такие комбинированные продукты изготавливают с фиксированной дозой, используют соединения этого изобретения в пределах описанного здесь диапазона доз и другой фармацевтически активный агент в пределах его одобренного диапазона доз. Когда применение комбинированной готовой препаративной формы нецелесообразно, предполагается их последовательное применение.
Хотя соединения формулы I ценны главным образом в качестве терапевтических средств для применения для теплокровных животных (включая человека), они полезны также, всякий раз, когда это требуется, для ингибирования действия активации ras путем фарнезилирования. Так, они полезны в качестве фармакологических стандартов для использования в развитии новых биологических испытаний и в поисках новых фармацевтических средств.
Соответственно другому аспекту настоящего изобретения предложены индивидуальные соединения, полученные в качестве конечных продуктов в примерах, представленных ниже, и их соли.
Соединение изобретения или его соль можно получить любым способом, который, как известно, пригоден для получения таких соединений или структурно родственных соединений. Такие способы иллюстрируются следующими репрезентативными схемами, в которых изменяемые группы имеют любое из значений, определенных для формулы I, если не оговорено особо. Функциональные группы можно защитить и освободить от защитных групп, используя обычные способы. Примеры защитных групп, таких как амино- и карбоксизащитные группы (а также средств для образования и возможного удаления защитных групп) см. у T.W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Second Edition, John Wiley and Sons, New York, 1991. Использованные аббревиатуры перечисляются непосредственно перед приведенными ниже примерами.
Защитные группы можно удалить любым обычным способом, описываемым в литературе или известным химику, являющемуся специалистом в данной области, как подходящим для удаления рассматриваемой защитной группы, причем такие способы выбирают так, чтобы осуществить удаление защитной группы с минимальным нарушением групп, находящихся в молекуле где-нибудь в другом месте.
Для удобства ниже приводятся конкретные примеры защитных групп, в которых термин "низший" обозначает, что группа, к которой его применяют, предпочтительно имеет 1-4 атома углерода. Должно быть понятно, эти примеры не исчерпывающие. Ниже приводятся конкретные примеры способов удаления защитных групп, они также не исчерпывающие. Использование защитных групп и способов удаления защитных групп, конкретно не упоминавшихся, конечно, находится в пределах объема данного изобретения.
Карбоксизащитная группа может быть остатком эфирообразующего алифатического или аралифатического спирта или эфирообразующего силанола (этот спирт или силанол предпочтительно содержит 1-20 атомов углерода).
Примеры карбоксизащитных групп включают (1-12С)алкильные группы с неразветвленной или разветвленной цепью (например, изопропил, трет-бутил); низшие (низший алкокси)алкильные группы (например, метоксиметил, этоксиметил, изобутоксиметил); низшие (низший алифатический ацилокси)алкильные группы (например, ацетоксиметил, пропионилоксиметил, бутирилоксиметил, пивалоилоксиметил); низшие (низший алкоксикарбонилокси)алкильные группы (например, 1-метоксикарбонилоксиэтил, 1-этоксикарбонилоксиэтил); низшие (арил)алкильные группы (например, п-метоксибензил, о-нитробензил, п-нитробензил, бензгидрил и фталидил); три(низший алкил)силильные группы (например, триметилсилил и трет-бутилдиметилсилил); три(низший алкил)силилированные низшие алкильные группы (например, триметилсилилэтил) и (2-6С)алкенильные группы (например, аллил и винилэтил).
Способы, особенно подходящие для удаления карбоксизащитных групп, включают, например, гидролиз, катализируемый кислотой, металлом или ферментом.
Примеры гидроксизащитных групп включают низшие алкенильные группы (например, аллил); низшие алканоильные группы (например, ацетил); низшие алкоксикарбонильные группы (например, трет-бутоксикарбонил); низшие алкенилоксикарбонильные группы (например, аллилоксикарбонил); низший (арил)алкоксикарбонильные группы (например, бензоилоксикарбонил, п-метоксибензилоксикарбонил, о-нитробензилоксикарбонил, п-нитробензилоксикарбонил); три(низший алкил/арил)силильные группы (например, триметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил); низшие (арил)алкильные группы (например, бензильные группы) и низшие (триарил)алкильные группы (например, трифенилметил).
Примеры аминозащитных групп включают формил, аралкильные группы (например, бензил и замещенный бензил, например п-метоксибензил, нитробензил и 2,4-диметоксибензил и трифенилметил); ди-п-анизилметильные и фурилметильные группы; низший алкоксикарбонил (например, трет-бутоксикарбонил); низший алкенилоксикарбонил (например, аллилоксикарбонил); низший (арил)алкоксикарбонильные группы (например, бензилоксикарбонил, п-метоксибензилоксикарбонил, о-нитробензилоксикарбонил, п-нитробензилоксикарбонил); триалкилсилил (например, триметилсилил и трет-бутилдиметилсилил); алкилиден (например, метилиден); бензилиденовая и замещенная бензилиденовая группы.
Способы, подходящие для удаления гидрокси- и аминозащитных групп, включают, например, гидролиз, катализируемый кислотой, основанием, металлом или ферментом, или фотолитические способы для групп, таких как о-нитробензил-оксикарбонил, или обработку фторид-ионами для силильных групп.
Примеры защитных групп для амидных групп включают аралкоксиметил (например, бензилоксиметил и замещенный бензилоксиметил); алкоксиметил (например, метоксиметил и триметилсилилэтоксиметил); три(алкил/арил)силил (например, триметилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил); три(алкил/арил)силилоксиметил (например, трет-бутилдиметилсилилоксиметил, трет-бутилдифенилсилилоксиметил); 4-алкоксифенил (например, 4-метоксифенил); 2,4-ди(алкокси)фенил (например, 2,4-диметоксифенил); 4-алкоксибензил (например, 4-метоксибензил); 2,4-ди(алкокси)бензил (например, 2,4-ди(метокси)бензил) и алк-1-енил (например, аллил, бут-1-енил и замещенный винил, например 2-фенилвинил).
Аралкоксиметильные группы можно ввести в амидную группу реакцией последней группы с подходящим аралкоксиметилхлоридом и удалить каталитическим гидрированием. Алкоксиметильные, три(алкил/арил)силильные и триалкилсилилоксиметильные группы можно ввести реакцией амида с подходящим хлоридом и удалить кислотой или, в случае силилсодержащих групп, обработкой фторид-ионами. Алкоксифенильные и алкоксибензильные группы удобно вводят арилированием или алкилированием подходящим галогенидом и удаляют окислением смешанным нитратом церия (IV) и аммония. И, наконец, алк-1-енильные группы можно ввести реакцией амида с подходящим альдегидом и удалить кислотой.
Соединения формулы I, где L представляет -CO-NR16-, можно получить образованием амидной связи между соединениями 1 и 2, как изображено на схеме 23. Соединения формулы I, где L представляет -CO-NR23-T-, можно получить аналогичным способом. Подходящие условия сочетания включают следующие условия.
i) Использование EEDQ при комнатной температуре в органическом растворителе (например, дихлорметане, метаноле).
ii) Использование оксалилхлорида в органическом растворителе (например, ДМФ, CH2Cl2) в присутствии органического основания (например, NMM, триэтиламина, DMAP) при температуре от 0oС до комнатной температуры в течение 0,5-16 ч.
iii) Использование EDC/HOBT в органическом растворителе (например, ДМФ, CH2Cl2).
iv) Использование DCCI/HOBT в органическом растворителе (например, ДМФ, CH2Cl2) в присутствии органического основания (например, триэтиламина).
v) Использование реакций смешанных ангидридов в стандартных условиях, например изопропилхлорформиата в органическом растворителе (например, ДМФ, DMA, дихлорметане) в присутствии органического основания (например, NMM, DMAP, триэтиламина).
vi) Путем активного сложного эфира в стандартных условиях, например пентафторфенилового эфира, в органическом растворителе (например, дихлорметане) в присутствии органического основания (например, триэтиламина).
vii) Путем хлорангидрида кислоты в стандартных условиях, например использования тионилхлорида и нагревания в течение около 150 мин с последующей обработкой органическим основанием (например, триэтиламином) в присутствии органического растворителя (например, ацетонитрила).
Соединения формулы I, где L представляет -CH2NR18-, -CH2O- или -CH2S-, можно получить, как изображено на схеме 24. LG представляет уходящую группу (например, мезилокси, тозилокси, галоген) и Х представляет S, О или NR18. Подходящие условия сочетания включают следующие условия.
i) Использование неорганического основания (например, NaHCO3, NaH, К2СО3, бутиллития) в органическом растворителе (например, ТГФ, ДМФ, ДМСО) и температуры от около 70 до 150oС.
ii) Использование органического основания (например, триэтиламина, DNAP) в органическом растворителе (например, ТГФ, дихлорметане, DMA, ДМФ) при температурном диапазоне от комнатной температуры до 150oС.
iii) Использование неорганического основания (например, КОН, NaOH, К2СО3) в водном (например, воде) и органическом растворителях (например, дихлорметане) в двухфазной системе, необязательно в присутствии катализатора переноса фаз (например, бромида тетрабутиламмония).
Соединения формулы I, где L представляет -CH=CR20-, можно получить с использованием реакции Виттига, как изображено на схеме 25. Подходящие условия реакции включают следующие условия.
i) Использование основания (например, карбоната калия, гидрида металла, алкоксида металла) в присутствии органического растворителя (например, ТГФ, толуола, ДМСО), необязательно в присутствии водного растворителя (двухфазная система) и необязательно в присутствии образующего комплекс с катализатором агента, который растворяет ионы щелочного металла в неполярных растворителях, таких как 1,4,7,10,13-пентаоксациклопентадекан (называется также 15-краун-5) или 1,4,7, 10,13,16-гексаоксациклооктадекан (называется также 18-краун-6).
Соединения формулы I, где L представляет -СН2-NR18-, можно получить, как изображено на схеме 26, сочетанием альдегида (2) с соединением 4. Подходящие условия сочетания включают следующие условия.
i) Использование восстановителя (например, NaCNBH3, ВН3, водорода плюс катализатора, LiHBEt3, диизобутилалюминийгидрида, литийалюминийгидрида, борогидрида натрия) в присутствии подходящего растворителя, например этанола и уксусной кислоты.
Альдегид (2) можно получить окислением соответствующего спирта (1) в подходящих условиях, таких как использование окислителя (например, ТРАР, NMM-O) в присутствии органического растворителя (например, ацетонитрила, дихлорметана) при комнатной температуре. Другие подходящие окислители включают оксид хрома, хлорхромат пиридиния, дихромат пиридиния, дихромат натрия и гипохлорит натрия.
Альдегид (2) можно также получить восстановлением соответствующего сложного эфира (1) в стандартных условиях с использованием, например, диизобутилалюминийгидрида.
Соединения формулы I, где L представляет -CH2NR21-T-, -СН2-О-Т- или -СН2-S-Т-, можно получить, как изображено на схеме 27, в которой LG представляет уходящую группу (например, мезилокси, тозилокси, галоген) и Х представляет О, S или NR21. Подходящие условия сочетания указаны выше для схемы 24. Положения LG и ХН в соединениях 1 и 2 на схеме 27 необязательно можно обращать для получения того же конечного продукта.
Соединения формулы I, где L представляет -CH2NR23-SO2-, можно получить, как изображено на схеме 28. Соединения 1 и 2 можно сочетать в стандартных условиях, таких как следующие.
i) Использование органического основания (например, диизо-пропилэтиламина, триэтиламина, 4-метилморфолина) в присутствии органического растворителя (например, дихлорметана) при диапазоне температур 0 - 40oC.
ii) Использование неорганического основания (например, карбоната калия) в присутствии органического растворителя (например, ДМФ) при диапазоне температур 0 - 150oC.
Соединения формулы, где L представляет -CH2-NR24-CO-T-, можно получить, как изображено на схеме 29. Соединения 1 и 2 можно сочетать в стандартных условиях, таких как описаны выше для L=-CO-NR16-.
Соединения формулы I, где L представляет -CH2-CHR19-, можно получить, например, восстановлением соединений типа, указанного как соединение 3 в схеме 25, но с замещением R19 вместо R20. Восстановление проводят в стандартных условиях стандартными реагентами, например, с использованием гидрирования в присутствии катализатора, такого как палладий на угле, при комнатной температуре.
Биологическую активность испытывали следующим образом. Фарнезилпротеинтрансферазу (FPT) частично очищали от плаценты человека фракционированием сульфатом аммония с последующей однократной анионообменной хроматографией на Q-сефарозе® (Pharmacia. Jnc), по существу так же, как описано Ray and Lopez-Belmonte (Ray К. Р. and Lopez-Belmonde (1992), J. Biochemical Society Translations, 20, 494-497). Субстратом для FPT был Kras (С-концевая последовательность CVIM). кДНК для онкогенного vа112-варианта c-Ki-ras-2 4B человека получали из плазмиды pSW11-1 (АТСС). Ее затем субклонировали в полилинкер подходящего вектора экспрессии, например рIС147. Kras получали после экспрессии в штамме Е. Coli BL21. Экспрессия и очистка c-KI-ras-2 4B и vа112-варианта в Е. Coli описана также Lowe et al (Lowe P. N. et al. J. Biol. Chem. (1991), 266, 1672-1678).
Инкубацию проводили с содержащим фермент 300 нМ меченного тритием фарнезилпирофосфата (DuPont/New England Nuclear), 120 нМ ras-CVIM, 50 мМ Трис-НС1 с рН 8,0, 5 мM MgCl2, 10 мкМ ZnCl2, 5 мМ дитиотрейтола, и соединения добавляли в подходящих концентрациях в ДМСО (конечная концентрация 3% в испытаниях и контрольном опыте с наполнителем). Инкубацию проводили в течение 20 минут при 37oС и останавливали кислотным этанолом, как описано Pompliano et al. (Pompiiano D. L. et al (1992), 31, 3800-3807). Осажденный белок затем собирали на фильтрах из стекловолокна (В) с использованием коллектора клеток Tomtec® и метку трития измеряли в счетчике сцинтилляции Betaplate 1204 Wallac®.
Хотя фармакологические свойства соединений формулы I, как и предполагалось, изменяются в соответствии со структурным изменением, в общем соединения формулы I имеют IC50 в указанном выше испытании в диапазоне, например, от 0,01 до 200 мкМ. Так в качестве примера соединение аллиловый эфир 5-{[(2S, 4S)-ацетилсульфанил-1-(4-нитробензилоксикарбонил)пирролидин-2-карбонил] амино} -3-(N-метилметоксикарбамоил)бензойной кислоты (см. пример 7) имеет IC50 приблизительно 0,5 мкМ. Для испытанных при эффективных дозах соединений по настоящему изобретению не наблюдали физиологически неприемлемую токсичность.
Изобретение будет теперь иллюстрировано следующими не ограничивающими его примерами, в которых, если не оговорено особо:
(i) выпаривание проводили на роторном испарителе в вакууме и операции обработки проводили после удаления остаточного твердого продукта фильтрованием;
(ii) операции проводили при комнатной температуре, которая находится в диапазоне 18-25oС, и в атмосфере инертного газа, такого как аргон;
(iii) колоночную хроматографию (флэш-способом) и жидкостную хроматографию при среднем давлении (MPLC) проводили на диоксиде кремния Merck Kieselgel (art. 9385) или диоксиде кремния с обращенной фазой Merck Lichroprep RP-18 (art. 9303), полученных от Е. Merck, Darmstadt, Germany;
(iv) выходы даются только для иллюстрации и необязательно являются максимально достижимыми;
(v) конечные продукты формулы I имеют удовлетворительные результаты микроанализов, их структуры подтверждали способами ядерного магнитного резонанса (ЯМР) и масс-спектроскопии; величины химических сдвигов измеряли на дельта-шкале; использовали следующую аббревиатуру: с - синглет, д - дублет, т или тр - триплет, м - мультиплет, шир. - широкий;
(vi) промежуточные продукты обычно полностью не характеризовали и чистоту их определяли тонкослойной хроматографией, инфракрасной (ИК) спектроскопией или ЯМР;
(vii) приводятся некорректированные точки плавления, их определяли с использованием автоматического устройства для определения точки плавления Mettler SP62 или устройства с масляной баней; точки плавления для конечных продуктов формулы I определяли после кристаллизации из обычных органических растворителей, таких как этанол, метанол, ацетон, простой эфир или гексан, в чистом виде или в виде их смеси и
(viii) использовали следующие аббревиатуры:
БОС - трет-бутоксикарбонил
DCCI - 1,3-дициклогексилкарбодиимид
DMA - N,N-диметилацетамид
DMAP - 4-диметиламинопиридин
ДМФ - N,N-диметилформамид
ДМСО - диметилсульфоксид
EDS - 1-(3-диметиламинопропил)-3-этилкарбодиимид
EEDQ - 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин
НОВТ - 1-гидроксибензотриазол
NMM - N-метилморфолин
NMM-Q - 4-метилморфолин-N-оксид
ТФУ - трифторуксусная кислота
ТГФ - тетрагидрофуран
TMSI - триметилсилилйодид
ТРАР - перрутенат тетрапропиламмония
Примите во внимание, что в схемах приведены только те атомы водорода, которые, как полагают, помогут внести ясность в схему (т.е. приведены не все атомы водорода).
Пример 1 (см. схему 1).
4-Нитробензиловый эфир (2S, 4S)-4-ацетилсульфанил-2-[3-нитро-5-(N-метокси-N-метилкарбамоил)фенилкарбамоил]пирролидин-1-карбоновой кислоты.
Смесь 1-(4-нитробензилового) эфира 4-ацетилсульфанилпирролидин-1,2-дикарбоновой кислоты (1(с)) (0,2 г) и 3-амино-N-метокси-N-метил-5-нитробензамида (1b)) (0,122 г) и EEDQ (0,201 г) в дихлорметане (20 мл) перемешивают при комнатной температуре в течение 16 часов. Раствор затем перемешивают с 0,3 М соляной кислотой (20 мл) в течение десяти минут. Органическую фазу отделяют, сушат над сульфатом магния и выпаривают при пониженном давлении, получая смолу. Ее очищают хроматографией с использованием 1) смеси этилацетат/гексан (50: 50) и 2) смеси этилацетат/гексан (75:25), получая целевой продукт (1) в виде бесцветной смолы (0,132 г).
ЯМР-спектр (CDCl3): δ 2,35 (с, 3Н), 2,62 (м, 2Н), 3,4 (с, 3Н), 3,44 (м, 1Н), 3,6 (с, 3Н), 4,1 (м, 2Н), 4,59 (т, 1Н), 5,3 (м, 2Н), 7,55 (д, 2Н), 8,09 (м, 1Н), 8,25 (д, 2Н), 8,3 (м, 1Н), 8,6 (м, 1Н), 9,55 (шир. с, 1Н).
Исходный продукт (1(с)) синтезируют, как описано в ссылочном примере 1-4 в Европейском патенте No 126587 (Sumitото).
Исходный продукт (1(b)) получают следующим образом. Смесь 3-амино-5-нитробензойной кислоты (10 г), пентафторфенола (10 г) и DCCI (11,3 г) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь фильтруют и фильтрат выливают на хроматографическую колонку, которую затем элюируют смесью этилацетат/гексан (10:90), получая 2,3,4,5,6-пентафторфениловый эфир 3-амино-5-нитробензойной кислоты (1(а)) в виде желтого твердого продукта (5,8 г).
ЯМР-спектр (CDCl3): δ 4,3 (шир. с, 2Н), 7,7 (тр, 1Н), 7,8 (тр, 1Н), 8,36 (тр, 1Н).
Смесь (1(а)) (1,0 г) соли с НСl N,O-диметилгидроксиламина (0,84 г) и триэтиламина (1,82 мл) в дихлорметане (50 мл) перемешивают при комнатной температуре в течение 48 часов. Добавляют воду (50 мл) и смесь перемешивают в течение дополнительных 5 минут. Органическую фазу отделяют, сушат над сульфатом магния и выпаривают при пониженном давлении, получая смолу. Ее очищают хроматографией с использованием 1) смеси этилацетат/гексан (10:90) и 2) смеси этилацетат/гексан (50: 50) в качестве элюента, получая исходный продукт, 3-амино-N-метокси-N-метил-5-нитробензамид, (1b)) в виде желтого твердого продукта (0,55 г).
ЯМР-спектр (CDCl3): δ 3,36 (с, 3Н) 3,58 (с, 3Н), 7,26 (тр, 1Н), 7,56 (тр, 1Н), 7,90 (тр, 1Н).
Пример 2 (см. схему 2).
Аллиловый эфир (2S,4S)-4-ацетилсульфанил-2-[3-(N-метокси-N-метилкарбамоил)-5-нитрофенилкарбамоил]пирролидин-1-карбоновой кислоты.
Смесь 1-аллилового эфира (2S,4S)-4-ацетилсульфанилпирролидин-1,2-дикарбоновой кислоты (1(d)) (0,2 г), 1(b) (0,165 г) и EEDQ (0,271 г) в дихлорметане (20 мл) перемешивают при комнатной температуре в течение 16 часов. Раствор затем перемешивают с 0,3 М соляной кислотой в течение дополнительных 10 минут. Органическую фазу затем отделяют, сушат над сульфатом магния и выпаривают при пониженном давлении. Полученный продукт очищают колоночной хроматографией с использованием смеси этилацетат/гексан (50:50) в качестве элюента, получая целевой продукт (2) в виде бесцветной смолы (0,152 г).
ЯМР-спектр (СDСl3): δ 2,33 (с, 3Н) 2,62 (м, 2Н), 3,38 (м, 1Н), 3,4 (с, 3Н), 3,6 (с, 3Н), 4,05 (м, 2Н), 4,59 (тр, 1Н), 4,69 (д, 2Н), 5,3 (м, 2Н), 5,95 (м, 1Н), 8,14 (т, 1Н), 8,28 (тр, 1Н), 8,6 (тр, 1Н), 9,7 (шир. с, 1Н).
Синтез исходного продукта (1(d)) как "соединение (А)" описывается на странице 31 заявки на Международный патент No WO 92/17479 (Imperial Chemical Industries). Синтез исходного продукта (1(b)) описывается в примере 1.
Пример 3 (см. схему 3).
1-Аллиловый эфир-3-метиловый эфир-5-{[(2S,4S)-4-ацетилсульфанил-1-(4-нитробензилоксикарбонил)пирролидин-2-карбонил]амино}изофталевой кислоты.
ДМФ (0,07 мл) добавляют к перемешиваемому раствору оксалилхлорида (0,078 мл) в дихлорметане (20 мл), охлажденному до -20oC, в атмосфере аргона. Через 15 минут добавляют раствор (1(с)) (0,3 г; см. пример 1) в дихлорметане и затем раствор N-метилморфолина (0,099 мл) в дихлорметане (2 мл). Через дополнительные 15 минут добавляют раствор метилового эфира 5-аминоизофталевой кислоты (3(b)) (0,192 г) в дихлорметане (5 мл) и затем снова раствор N-метилморфолина (0,099 мл) в дихлорметане (2 мл). Смеси дают нагреться до комнатной температуры и перемешивают в течение 16 часов. Реакционную смесь выливают в колонку для флэш-хроматографии и элюируют с смесью 1) этилацетат/гексан (50:50) и 2) этилацетат/гексан (75:25), получая целевой конечный продукт (3) в виде бесцветной смолы (0,24 г).
ЯМР-спектр (СDСl3): δ 2,33 (с, 3Н), 2,62 (м, 2Н) 3,45 (м, 1Н), 3,95 (с, 3Н), 4,03 (м, 1Н), 4,17 (м, 1Н), 4,57 (тр, 1Н), 4,85 (м, 2Н), 5,32 (м, 2Н), 5,36 (м, 2Н), 6,05 (м, 1Н), 7,51 (м, 2Н), 8,20 (м, 2Н), 8,32 (м, 2Н), 8,34 (с, 1Н), 9,2 (шир. с, 1Н).
Исходный продукт (3(b)) синтезируют следующим образом. Смесь монометил-5-нитроизофталата (13,8 г), аллилбромида (7,96 г), карбоната калия (13,94 г) и ДМФ (160 мл) перемешивают при комнатной температуре в течение 4,5 часа. Твердую часть отделяют фильтрованием и ДМФ из фильтрата выпаривают при пониженном давлении. Остаток растворяют в диэтиловом эфире (300 мл) и воде (100 мл) и перемешивают в течение пяти минут. Органический слой отделяют и промывают насыщенным раствором бикарбоната натрия (220 мл), солевым раствором (200 мл), сушат над сульфатом магния и выпаривают при пониженном давлении, получая аллиловый эфир-метиловый эфир 5-нитроизофталевой кислоты (3(а)) в виде желтого масла (14,74 г).
ЯМР-спектр (СDСl3): δ 4,0 (с, 3Н), 4,9 (м, 2Н), 5,4 (м, 2Н), 6,1 (м, 1Н), 9,0 (м, 3Н).
Смесь (3(а)) (15,46 г), дигидрата хлорида олова (II) (65,78 г) и метанола (200 мл) перемешивают при кипячении с обратным холодильником в течение 4 часов. Метанол выпаривают при пониженном давлении и остаток снова растворяют в этилацетате (400 мл). По каплям добавляют раствор аммиака (удельный вес 0,880) до тех пор, пока рН смеси не достигнет 8 и не будет больше происходить образования осадка. Твердую часть отделяют фильтрованием и фильтрат промывают водой (100 мл), солевым раствором (100 мл), сушат над сульфатом магния и выпаривают при пониженном давлении, получая исходный продукт 3(b) в виде желтого твердого продукта (13,56 г).
ЯМР-спектр (СDСl3): δ 3,91 (с, 3Н), 3,94 (с, 2Н), 4,82 (м, 2Н), 5,35 (м, 2Н), 6,05 (м, 1Н), 7,52 (м, 2Н), 8,08 (м, 1Н).
Пример 4 (см. схему 4).
1-Аллиловый эфир-3-метиловый эфир 5-{ [(2S, 4S)-4-ацетилсульфанил-1-(карбамоилметил)пирролидин-2-карбонил]амино}изофталевой кислоты.
Смесь соли 1-аллилового эфира-3-метилового эфира 5-{[(2S,4S)-4-ацетилсульфанилпирролидин-2-карбонил] амино}изофталевой кислоты с ТФУ (4(е)) (0,12 г), йодацетамида (0,085 г), бикарбоната натрия (0,058 г) и ДМФ (3,0 мл) перемешивают при комнатной температуре в течение 16 ч. ДМФ выпаривают при пониженном давлении и остаток очищают хроматографией с использованием 1) смеси этилацетат/гексан (60:40), 2) этилацетата и 3) смеси метанол/этилацетат (5:95) в качестве элюентов, получая целевой продукт 4 в виде желтого твердого продукта (0,055 г).
ЯМР-спектр: δ 2,19 (2 тр, 1Н), 2,29 (с, 3Н), 2,82 (м, 1Н), 3,22 (м, 2Н), 3,48 (к, 2Н), 3,6 (м, 1Н), 3,94 (с, 3Н), 4,05 (м, 1Н), 4,85 (м, 2Н), 5,35 (м, 2Н), 6,04 (м, 1Н), 6,1 (шир. с, 1Н), 6,30 (шир. с, 1Н), 8,43 (м, 1Н), 8,55 (м, 1Н), 10,46 (шир. с, 1Н).
Исходный продукт 4(е) получают следующим образом. Смесь 1-трет-бутилового эфира (2S, 4S)-4-гидроксипирролидин-1,2-дикарбоновой кислоты (1,0 г), EEDQ (1,6 г), соединения (3(b)) (см. пример 3) и дихлорметана (100 мл) перемешивают при комнатной температуре в течение 16 часов. Смесь выливают на колонку для флэш-хроматографии и элюируют 1) смесью этилацетат/гексан (80:20) и 2) этилацетатом, получая 1-аллиловый эфир-3-метиловый эфир 5-([(2S,4S)-4-гидрокси-1-(трет-бутоксикарбонил)пирролидин-2-карбонил] амино} изофталевой кислоты (4(а)) в виде бесцветной смолы (0,85 г).
ЯМР-спектр (ДМСО-d6): δ 1,34 (2с, 9Н), 1,97 (м, 1Н), 2,15 (м, 1Н), 3,30 (м, 1H), 3,46 (м, 1Н), 3,9 (с, 3Н), 4,32 (м, 2Н), 4,84 (д, 2Н), 5,06 (д, 1H), 5,35 (м, 2Н), 6,07 (м, 1H), 8,18 (м, 1H), 8,54 (м, 2Н).
Смесь (4(а)) (0,8 г), метансульфонилхлорида (0,152 мл), триэтиламина (0,256 мл) и дихлорметана (20 мл) перемешивают при 5oС в атмосфере аргона в течение 10 минут и затем при комнатной температуре в течение 2 ч. Затем добавляют воду (20 мл) и смесь перемешивают в течение еще 5 минут. Органическую фазу отделяют, сушат над сульфатом магния и выпаривают при пониженном давлении. Продукт очищают хроматографией с использованием смесей 1) этилацетат/гексан (30: 70) и 2) этилацетат/гексан (80:20) в качестве элюентов, получая 1-аллиловый эфир-3-метиловый эфир 5-{[(2S,4S)-4-метансульфанилокси-1-(трет-бутоксикарбонил)пирролидин-2-карбонил] амино} изофталевой кислоты (4(b)) в виде светлого масла (0,8 г).
ЯМР-спектр (СDСl3): δ 1,5 (с, 9Н), 2,4 (м, 1H), 2,92 (м, 1H), 3,07 (с, 3Н), 3,63 (м, 1H), 3,9 (м, 1H), 3,95 (с, 3Н), 4,66 (м, 1H), 4,85 (м, 2Н), 5,27 (м, 1H), 5,36 (м, 2Н), 6,05 (м, 1H), 8,37 (м, 3Н), 9,64 (шир. с, 1H).
Смесь 4(b) (0,74 г), тиоацетата калия (0,32 г) и ацетона (25 мл) кипятят с обратным холодильником в течение 18 часов. Смесь затем охлаждают до комнатной температуры и ацетон выпаривают при пониженном давлении. Остаток растворяют в смеси этилацетата (50 мл), 1,5 М соляной кислоты (25 мл) и льда (25 мл). Органическую фазу отделяют, сушат над сульфатом магния и выпаривают при пониженном давлении, получая красную смолу. Ее очищают хроматографией с использованием смеси 1) этилацетат/гексан (30:70) и 2) этилацетат/гексан (70: 30), получая 1-аллиловый эфир-3-метиловый эфир 5-{[(2S,4S)-4-ацетилсульфанил-1-(трет-бутоксикарбонил)пирролидин-2-карбонил] амино} изофталевой кислоты (4(с)) в виде оранжевой смолы (0,48 г).
ЯМР-спектр (СDСl3): δ 1,5 (с, 9Н), 2,32 (с, 3Н), 2,56 (м, 2Н), 3,33 (м, 1Н), 3,93 (с, 3Н), 4,04 (м, 2Н), 4,52 (тр, 1Н), 4,85 (м, 2Н), 5,35 (м, 2Н), 6,05 (м, 1Н), 8,38 (м, 3Н), 9,63 (шир. с, 1Н).
Смесь (4 (с)) (3,6 г) и ТФУ (80 мл) перемешивают при комнатной температуре в течение 10 минут. ТФУ выпаривают при пониженном давлении и остаток растворяют в этилацетате (200 мл) и насыщенном растворе бикарбоната натрия (100 мл). Раствор затем перемешивают в течение 10 минут, органическую фазу отделяют, промывают водой (100 мл) и солевым раствором (100 мл) и сушат над сульфатом магния. Этилацетат удаляют при пониженном давлении и остаток очищают хроматографией с использованием смесей 1) этилацетат/гексан (30:70) и 2) этилацетат/гексан (80: 20) в качестве элюентов, получая 4(f) (свободное основание, которое используют в примере 6) в виде коричневого масла (2,3 г).
ЯМР-спектр (СDСl3): δ 2,05 (м, 1Н), 2,30 (с, 3Н), 2,42 (шир. с, 1Н), 2,78 (м, 2Н), 3,58 (м, 1Н), 3,85 (м, 1Н), 3,94 (с, 3Н), 3,99 (м, 1Н), 4,84 (м, 2Н), 5,35 (м, 2Н), 6,05 (м, 1Н), 8,47 (м, 3Н), 9,83 (шир. с, 1Н).
Смесь (4 (с)) (0,45 г) и ТФУ (10 мл) перемешивают при комнатной температуре в течение 10 минут. ТФУ выпаривают при пониженном давлении и остаток очищают колоночной хроматографией с использованием 1) смеси этилацетат/гексан (30:70), 2) смеси этилацетат/гексан (60:40), 3) этилацетата и 4) смеси метанол/этилацетат (10:90) в качестве элюентов, получая целевой исходный продукт (4(е)) в виде коричневой смолы (0,46 г).
ЯМР-спектр (СDСl3): δ 2,15 (м, 1Н), 2,33 (с, 3Н), 2,97 (м, 1Н), 3,44 (м, 1H), 3,91 (с, 3Н), 3,97 (м, 1Н), 4,08 (м, 1Н), 4,82 (д, 2Н), 4,98 (тр, 1H), 5,35 (м, 2Н), 6,03 (м, 1H), 8,12 (м, 2Н), 8,26 (м, 1H).
Пример 5 (см. схему 5).
1-Аллиловый эфир-3-метиловый эфир 5-{[(2S,4S)-4-ацетилсульфанил-1-ацетилпирролидин-2-карбонил]амино}изофталевой кислоты.
Смесь (4(е)) (0,08 г; см. пример 4), триэтиламина (,083 мл), уксусного ангидрида (0,056 мл) и дихлорметана (5 мл) кипятят с обратным холодильником в течение 16 часов. Смесь охлаждают, выпаривают при пониженном давлении и очищают хроматографией с использованием 1) смеси этилацетат/гексан (70:30), 2) этилацетата и 3) смеси метанол/дихлорметан (5:95), получая целевой продукт 5 в виде бесцветной смолы (0,048 г).
ЯМР-спектр (СDСl3): δ 2,18 (с, 3Н), 2,35 (с, 3Н), 2,48 (м, 1H), 2,77 (м, 1H), 3,42 (м, 1H), 3,95 (с, 3Н), 4,1 (м, 2Н), 4,85 (м, 3Н), 5,35 (м, 2Н), 6,06 (м, 1H), 8,40 (м, 3Н), 9,88 (шир. с, 1H).
Исходный продукт 4(е) получают, как описано в примере 4.
Пример 6 (см. схему 6).
1-Аллиловый эфир-3-метиловый эфир 5-{[(2S,4S)-4-ацетилсульфанил-1-фенилоксикарбонилпирролидин-2-карбонил]амино}изофталевой кислоты.
Смесь (4(f)) (0,07 г), фенилхлорформиата (0,026 мл), триэтиламина (0,07 мл) и дихлорэтана (3 мл) перемешивают при комнатной температуре в течение 16 часов. Смесь затем выпаривают при пониженном давлении, получая смолу, которую очищают хроматографией с использованием 1) дихлорметана, 2) смеси этилацетат/гексан (30:70) и 3) смеси этилацетат/гексан (60:40), получая целевой продукт в виде бесцветной смолы (0,048 г).
ЯМР-спектр (ДМСО-d6): δ 1,93-2,24 (м, 1Н), 2,38 (с, Н), 2,70 (м, 1Н), 3,63 (м, 1Н), 3,91 (д, 3Н), 4,18 (м, 2Н), 4,60 (м, 1Н), 4,87 (тр, 2Н), 5,38 (м, 1Н), 6,08 (м, 1Н), 6,70-7,69 (м, 5Н), 8,20-8,53 (м, 3Н), 10,61 (д, 1Н).
Исходный продукт (4(f)) получают, как описано в примере 4.
Пример 7 (см. схему 7).
Аллиловый эфир 5-{ [(2S,4S)-4-ацетилсульфанил-1-(4-нитробензилоксикарбонил)пирролидин-2-карбонил] амино} -3-(N-метилметоксикарбамоил)бензойной кислоты.
Смесь (1(с)) (0,02 г; см. пример 1), аллилового эфира 3-амино-5-(N-метилметоксикарбамоил)бензойной кислоты (7 (d)) (0,16 г), EEDQ (0,25 г) и дихлорметана (20 мл) перемешивают в течение 16 ч при комнатной температуре. Смесь затем промывают 0,3 М соляной кислотой (30 мл), органическую фазу отделяют, сушат над сульфатом магния и выпаривают досуха при пониженном давлении. Остаток очищают колоночной хроматографией с использованием смеси этилацетат/гексан (75: 25) в качестве элюента, получая целевой продукт 7 в виде желтого твердого продукта (0,053 г).
ЯМР-спектр (СDСl3): δ 2,33 (с, 3Н), 2,60 (м, 2Н), 3,38 (с, 3Н), 3,42 (м, 1Н), 3,60 (с, 3Н), 4,04 (м, 1Н), 4,15 (м, 1Н), 4,55 (м, 1Н), 4,83 (м, 2Н), 5,30 (м, 2Н), 5,35 (м, 2Н), 6,04 (м, 1Н), 7,52 (м, 2Н), 8,10 (м, 3Н), 8,18 (м, 2Н), 9,12 (шир. с, 1Н).
Исходный продукт (1(с)) получают, как описано в примере 1. Исходный продукт 7(d) получают следующим образом. Смесь карбоната калия (17,00 г), 5-нитроизофталевой кислоты (52,00 г), аллилбромида и диметилацетамида (400 мл) перемешивают при 90oС в течение 4 ч. Диметилацетамид выпаривают при пониженном давлении и остаток растворяют в этилацетате, промывают водой (2•300 мл) и затем экстрагируют водным насыщенным раствором бикарбоната натрия (3•300 мл). Экстракты объединяют, подкисляют до рН 4 концентрированной соляной кислотой и снова экстрагируют этилацетатом (2•300 мл). Экстракты объединяют, промывают водой (300 мл), сушат над сульфатом магния и выпаривают при пониженном давлении, получая 3-аллиловый эфир 5-нитроизофталевой кислоты (7(а)) в виде кремового твердого продукта (39,48 г).
ЯМР-спектр (СDСl3/ДМСО-d6): δ 4,90 (м, 2Н), 5,42 (м, 2Н), 6,08 (м, 1Н), 9,00 (м, 3Н).
Раствор 7(а) (10,00 г), N-гидроксисукцинимида (5,04 г) и DCCI (9,03 г) в дихлорметане (400 мл) перемешивают при комнатной температуре в течение 3,5 ч. Образуемый белый осадок отделяют фильтрованием и фильтрат выпаривают при пониженном давлении, получая желтое масло. Его очищают флэш-хроматографией при элюировании смесью этилацетат/гексан (75:25), получая 5-(2,5-диоксопирролидин-1-иловый) эфир-3-аллиловый эфир 5-нитроизофталевой кислоты (7(b)) в виде желтого твердого продукта (7,58 г).
ЯМР-спектр (СDСl3): δ 2,95 (с, 4Н), 4,92 (м, 2Н), 5,43 (м, 2Н), 6,07 (м, 1Н), 9,12 (м, 3Н).
Смесь (7(b)) (2,00 г), гидрохлорида N,O-диметилгидроксиламина (0,62 г), триэтиламина (0,86 мл) и дихлор-метана (60 мл) перемешивают при 5oС в течение 30 мин и затем дают нагреться до комнатной температуры и перемешивают в течение дополнительных 16 ч. Смесь выливают в колонку для флэш-хроматографии и элюируют смесью этилацетат/гексан (40:60), получая аллиловый эфир 3-(N-метилметоксикарбамоил)-5-нитробензойной кислоты (7(с)) в виде желтого масла.
ЯМР-спектр (СDСl3): δ 3,43 (с, 3Н), 3,58 (с, 3Н), 4,90 (м, 2Н), 5,40 (м, 2Н), 6,07 (м, 1Н), 8,71 (м, 1Н), 8,76 (м, 1Н), 8,95 (м, 1Н).
Смесь (7(с)) (1,11 г), дигидрата хлорида олова (II) (4,26 г) и метанола (60 мл) нагревают для кипячения с обратным холодильником в течение 1 часа. Реакционную смесь охлаждают и метанол выпаривают при пониженном давлении.
Остаток снова растворяют в этилацетате (100 мл) и по каплям добавляют раствор аммиака (удельный вес 0,880) до достижения рН раствора 8. Остаток, который образуется, отделяют фильтрованием и промывают этилацетатом (2•100 мл). Объединенный фильтрат и промывные жидкости выпаривают при пониженном давлении, получая целевой исходный продукт, аллиловый эфир 3-амино-5-(N-метилметоксикарбамоил)бензойной кислоты, (7(d)) в виде белого твердого продукта (0,610 г).
ЯМР-спектр (СDСl3): δ 3,35 (с, 3Н), 3,59 (с, 3Н), 3,90 (шир. с, 2Н), 4,82 (м, 2Н), 5,35 (м, 2Н), 6,04 (м, 1Н), 7,15 (м, 1Н), 7,45 (м, 1), 7,72 (м, 1Н).
Пример 8 (см. схему 8).
Аллиловый эфир 5-{[(2S,4S)-4-ацетилсульфанил-1-(4-нитро-бензилоксикарбонил)пирролидин-2-карбонил] амино} -3-(N-ме-тилаллилоксикарбамоил)бензойной кислоты.
Смесь (1(с)) (0,293 г; см. пример 1), аллилового эфира 3-амино-5-(N-метилаллилоксикарбамоил)бензойной кислоты (8(с)) (0,210 г), EEDQ (0,268 г) и дихлорметана (20 мл) перемешивают в течение 16 ч при комнатной температуре. Смесь затем промывают 0,3 М соляной кислотой (30 мл), сушат над сульфатом магния и сразу помещают в колонку для флэш-хроматографии, элюируя смесью этилацетат/гексан (75:25). Полученный продукт помещают в колонку для флэш-хроматографии и элюируют смесью метанол/дихлорметан (2,5:97,5), получая целевой продукт 8 в виде светлой смолы (0,153 г).
ЯМР-спектр (СDСl3): δ 2,33 (с, 3Н), 2,61 (м, 2Н), 3,40 (с, 3Н), 3,42 (м, 1H), 4,04 (м, 1H), 4,15 (м, 1H), 4,26 (д, 2Н), 4,55 (м, 1H), 4,83 (м, 3Н), 5,30 (м, 6Н), 5,75 (м, 1Н), 6,04 (м, 1Н), 7,53 (м, 2Н), 8,12 (м, 2Н), 8,21 (м, 3Н), 9,12 (шир. с, 1Н).
Исходный продукт (8(с)) получают следующим образом. Смесь 7(b) (2,00 г; см. пример 7), гидрохлорида N-метилгидроксиламина (1,06 г), триэтиламина (1,72 мл) и дихлорметана (60 мл) перемешивают при 5oC в течение 30 минут. Смеси затем дают нагреться до комнатной температуры и перемешивают в течение дополнительных 16 часов. Реакционную смесь затем сразу выливают в колонку для флэш-хроматографии и элюируют смесью этилацетат/гексан (50:50), получая аллиловый эфир 3-(N-метилгидроксикарбамоил)-5-нитробензойной кислоты (8(а)) в виде кремового твердого продукта (1,43 г).
ЯМР-спектр: (СDСl3) δ 3,48 (с, 3Н), 4,90 (м, 2Н), 5,42 (м, 2Н), 6,05 (м, 1Н), 8,28 (шир. с, 1Н), 8,55 (м, 1Н), 8,63 (м, 1Н), 8,96 (м, 1Н).
Смесь (8(а)), аллилбромида (0,28 г), карбоната калия (0,59 г) и ДМФ (20 мл) перемешивают в течение 3 часов при комнатной температуре в атмосфере аргона. Затем диметилформамид выпаривают при пониженном давлении и остаток растворяют в этилацетате (50 мл) и воде (50 мл). Органическую фазу отделяют, промывают солевым раствором (50 мл), сушат над сульфатом магния и выпаривают при пониженном давлении досуха, получая аллиловый эфир 3-(N-метилаллилоксикарбамоил)-5-нитробензойной кислоты (8(b)) в виде желтого масла (0,571 г).
ЯМР-спектр: δ 3,47 (с, 3Н), 4,25 (м, 2Н), 4,90 (м, 2Н), 5,35 (м, 4Н), 5,65 (м, 1H), 6,06 (м, 1H), 8,73 (м, 1Н), 8,78 (м, 1H), 8,95 (м, 1H).
Смесь (8(b)) (0,523 г), дигидрата хлорида олова (II) (1,84 г) и этилацетата (50 мл) нагревают при кипячении с обратным холодильником в течение 6 часов. Смеси дают охладиться до комнатной температуры и по каплям добавляют раствор аммиака (удельный вес 0,880) до достижения раствором рН 8. Белый осадок, который образуется, отделяют фильтрованием, промывают этилацетатом (2•50 мл) и объединенные промывные жидкости и фильтрат выпаривают досуха, получая целевой исходный продукт (8 (с)) в виде желтого масла (0,472 г).
ЯМР-спектр: (СDСl3) δ 3,38 (с, 3Н), 3,88 (м, 2Н), 4,25 (д, 2Н), 4,80 (м, 2Н), 5,32 (м, 4Н), 5,75 (м, 1H), 6,03 (м, 1H), 7,15 (м, 1H), 7,45 (м, 1H), 7,75 (м, 1H).
Пример 9 (см. схему 9).
Аллиловый эфир 5-{ [(2S, 4S)-1-(аллилоксикарбонил)-4-сульфанилпирролидин-2-карбонил]амино}-3-(N-метилаллилоксикарбамоил)бензойной кислоты.
Водный раствор 0,1 М гидроксида натрия (4,41 мл) добавляют к раствору аллилового эфира 5-{[(2S,4S)-4-ацетилсульфанил-1-(аллилоксикарбонил)пирролидин-2-карбонил] -амино} -3-(N-метилаллилоксикарбамоил)бензойной кислоты (9(а)) в аллиловом спирте (15 мл) и смесь затем перемешивают при комнатной температуре в течение 1 часа. Затем добавляют соляную кислоту (1,5 М) для установления рН раствора 3 и затем его выпаривают досуха при пониженном давлении. Остаток растворяют в этилацетате (40 мл) и промывают водой (2•40 мл). Органическую фазу отделяют, сушат над сульфатом магния и выпаривают досуха, получая желтую пену. Ее очищают хроматографией с использованием смеси этилацетат/гексан 75:25) в качестве элюента, получая целевой продукт 9 в виде желтой смолы (0,148 г).
ЯМР-спектр: (СDСl3) δ 1,88 (д, 2Н), 2,62 (м, 2Н), 3,37 (с, 3Н), 3,45 (м, 2Н), 3,60 (с, 3Н), 4,08 (м, 1Н), 4,52 (тр, 1Н), 4,65 (м, 2Н), 4,83 (м, 2Н), 5,35 (м, 4Н), 6,00 (м, 2Н), 8,10 (м, 1Н), 8,15 (м, 1Н), 8,21 (м, 1Н), 9,15 (шир. с, 1Н).
Исходный продукт 9(а) получают следующим образом. Смесь 7(d) (0,568 г; см. пример 7), 1(d) (0,645г; см. пример 20), EEDQ (0,585 г) и дихлорметана (50 мл) перемешивают при комнатной температуре в течение 16 часов. Смесь затем промывают 0,3 М соляной кислотой (50 мл), сушат над сульфатом магния и вводят в колонку для флэш-хроматографии, элюируя смесью этилацетат/гексан (75: 25). Продукт далее очищают на второй колонке при элюировании смесью этилацетат/гексан (50: 50), получая целевой исходный продукт (9(а)) в виде бесцветной смолы (0,401 г).
ЯМР-спектр (СDСl3): δ 2,33 (с, 3Н), 2,60 (м, 2Н), 3,37 (с, 3Н), 3,40 (м, 1Н), 3,61 (с, 3Н), 4,02 (м, 1Н), 4,13 (м, 1Н), 4,58 (тр, 1Н), 4,68 (м, 2Н), 4,83 (м, 2Н), 5,35 (м, 4Н), 6,00 (м, 2Н), 8,10 (м, 1Н), 8,14 (м, 1Н), 8,22 (м, 1Н), 9,30 (шир. с, 1Н).
Пример 10 (см. схему 10).
Метиловый эфир 5-[((2S,4S)-1-аллилоксикарбонил-4-сульфанилпирролидин-2-илметил)карбамоил]пиридин-2-карбоновой кислоты.
К перемешиваемому раствору метилового эфира 5-[((2S,4S)-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)карбамоил] пиридин-2-карбоновой кислоты (10(а)) (991 мг; 2,07 ммоль) в дихлорметане по каплям добавляют ТФУ (6 мл; 78 ммоль). Раствор перемешивают в атмосфере аргона в течение 4 часов. Растворитель и избыток ТФУ удаляют в вакууме. Остаток подвергают азеотропной перегонке с толуолом (2•10 мл). При минимальном воздействии воздуха получаемое масло растирают с диэтиловым эфиром (20 мл). Получаемое твердое вещество промывают холодным диэтиловым эфиром (10 мл) и сушат в вакууме, получая целевой продукт 10 в виде кремового твердого продукта, 654 мг (76%).
[4] имеет ЯМР (СDСl3; 250 МГц): δ 1,70 (м, 1Н), 1,75 (д, 1Н), 2,63-2,77 (м, 1Н), 3,15-3,50 (м, 3Н), 3,90-4,00 (м, 1Н), 4,05 (с, 3Н), 4,07-4,23 (м, 2Н), 4,63 (м, 2Н), 5,23-5,37 (м, 2Н), 5,85-6,03 (м, 1Н), 8,22 (д, 1Н), 8,35 (дд, 1Н), 8,95 (шир.с), 1Н), 9,20 (с, 1Н).
МС (FAB) m/z 380 (М+Н)+.
Анализ. C17H21N3O5S•0,33С2НF3О2 417: С 50,9 (50,8), Н 5,3 (5,1), N 10,1 (10,1).
Исходный продукт (10(с)) получают следующим образом. 2-Метиловый эфир пиридин-2,5-дикарбоновой кислоты (10(а)) (9,0 г, 0,05 моль) добавляют к перемешиваемому тионилхлориду (25 мл) и смесь осторожно кипятят с обратным холодильником в течение 2,5 часа. Избыток тионилхлорида удаляют в вакууме и остаточный твердый продукт подвергают азеотропной перегонке с толуолом (2•25 мл), получая метиловый эфир 5-хлоркарбонилпиридин-2-карбоновой кислоты (10(b)), который используют сырым в следующей реакции.
К перемешиваемому раствору соединения (15(b)) (пример 15)(220 мг; 0,7 ммоль) в ацетонитриле (6 мл) добавляют раствор (10(b)) (0,7 ммоль) в ацетонитриле (4 мл). Добавляют триэтиламин (0,29 мл; 2,1 ммоль) и раствор перемешивают в течение 23 часов. Растворитель и избыток триэтиламина удаляют в вакууме и остаток распределяют между хлороформом и водой. Органическую фазу промывают водой, водным раствором гидрокарбоната натрия и солевым раствором, сушат над сульфатом магния и выпаривают досуха. Остаточную оранжевую смолу подвергают флэш-хроматографии на кизельгеле 9385, элюируя сначала изогексаном, затем изогесаном с повышаемым содержанием этилацетата. Целевой исходный продукт 10(с) выделяют в виде белой пены (200 мг; 60%).
ЯМР (СDСl3; 250 МГц): δ 1,50 (с, 9Н), 1,80 (м, 1Н), 2,62-2,75 (м, 1Н), 3,30-3,37 (м, 1Н), 3,39-3,50 (м, 1Н), 3,68-3,80 (м, 1Н), 3,83-3,95 (м, 1Н), 4,03 (с, 3Н), 4,13-4,28 (м, 2Н), 4,62 (м, 2Н), 5,20-5,37 (м, 2Н), 5,87-6,02 (м, 1Н), 8,2 (д, 1Н), 8,3 (дд, 1Н), 8,87 (с, 1Н), 9,2 (с, 1Н).
МС (FAB) m/z 480 (M+H)+.
Анализ. C22H29N3O7S 479: С 55,1 (55,1), Н 6,4 (6,1), N 8,5 (8,8).
Пример 11 (см. схему 11).
Аллиловый эфир (2S, 4S)-2-{ [(5-этоксикарбонилтиофен-2-карбонил)амино] метил}-4-сульфанилпирролидин-1-карбоновой кислоты.
К перемешиваемому раствору аллилового эфира (2S,4S)-2-{[(5-этоксикарбонилтиофен-2-карбонил)амино] метил} -4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (11(b)) (130 мг; 0,26 ммоль) в дихлорметане (20 мл) добавляют ТФУ (2 мл; 26 ммоль). Раствор перемешивают в атмосфере аргона в течение 19 часов. Растворитель и избыток ТФУ удаляют в вакууме и остаток сушат в высоком вакууме, получая целевой продукт 11 в виде белой смолы (64%).
ЯМР (СDСl3; 250 МГц): δ 1,38 (т, 3Н), 1,55-1,70 (м, 1Н), 1,75 (д, 1Н), 2,60-2,76 (м, 1Н), 3,10-3,50 (м, 3Н), 3,80-3,95 (м, 1Н), 4,05-4,25 (м, 2Н), 4,38 (к, 2Н), 4,70 (м, 2Н), 5,20-5,40 (м, 2Н), 5,85-6,05 (м, 1Н), 7,47 (д, 1Н), 7,73 (д, 1Н), 8,52 (шир.с, 1Н).
МС (FAB) m/z 399 (M+H)+.
Анализ. C17H22N2O3S2•0,5С2НF3O2 455: С 47,6 (47,5), Н 5,2 (4,9), N 6,1 (6,15).
Исходный продукт 11(b) получают аналогично эквивалентной стадии в примере 10, но с добавлением этилового эфира 5-хлоркарбонилтиофен-2-карбоновой кислоты (11(а)) к соединению (15(b)) (пример 15) и с подобной хроматографической обработкой. 11b является липкой белой смолой. Выход 60%. Получение (11(а)) описывается в Journal of the Amtrican Pharmaceutical Association (Sci. Ed.), Vol. 41, pp. 273-276 (1952).
ЯМР 11(b) (СDСl3; 250 МГц): δ 1,4 (т, 3Н), 1,5 (с, 9Н), 1,70-1,85 (м, 1Н), 2,57-2,73 (м, 1Н), 3,26-3,36 (м, 1Н), 3,38-3,50 (м, 1Н), 3,65-3,87 (м, 2Н), 4,10-4,25 (м, 2Н), 4,35 (к, 2Н), 4,65 (м, 2Н), 5,20-5,38 (м, 2Н), 5,85-6,04 (м, 1Н), 7,47 (д, 1Н), 7,72 (д, 1Н), 8,45 (шир.c, 1Н).
MC (FAB) m/z 499 (М+Н)+, другой m/z 183.
Анализ. C22H30N2O7S2 498: С 53,4 (53,0), Н 6,3 (6,1), N 5,5 (5,6).
Пример 12 (см. схему 12).
N-(3,4-Дихлорбензил)-N'-((2S,4S)-4-сульфанилпирролидин-2-илметил)тиофен-2,5-дикарбоксамид.
К перемешиваемому раствору N-(3,4-дихлорбензил)-N'-((2S,4S)-1-аллилоксикарбонил-4-сульфанилпирролидин-2-илметил)тиофен-2,5-дикарбоксамида (12(е)) (59 мг; 0,1 ммоль) в дихлорметане (10 мл) в атмосфере аргона добавляют триметилсилилйодид (0,35 мл; 0,25 ммоль). После выдерживания 20 часов при комнатной температуре дихлорметан и избыток триметилсилилйодида удаляют в вакууме и остаток обрабатывают метанолом (3 мл). Нерастворимый продукт обрабатывают дополнительным метанолом (2•3 мл) и затем растирают с диэтиловым эфиром, получая твердый продукт, который фильтруют и сушат, получая целевой продукт 12 в виде светло-коричневого твердого продукта (59%).
ЯМР (ДМСО-d6; 250 МГц): δ 1,65-1,90 (м, 1Н), 2,50-2,62 (м, 1Н), 3,20-3,40 (м, 2Н), 3,55-3,70 (м, 2Н), 3,75-3,90 (м, 2Н), 4,45 (д, 2Н), 7,32 (м, 1Н), 7,58 (м, 2Н), 7,73 (д, 1Н), 7,78 (д, 1Н), 8,68 (шир., 1Н), 8,88 (т, 1Н), 9,22 (т, 1Н).
MC (FAB) m/z 444 (M+H)+, другой 111, 312. Анализ. C18H19Cl2N3O2S2•1,25HI•0,5С4Н10О 640: С 37,6 (37,5), Н 3,5 (3,9), N 6,5 (6,6).
Исходный продукт (12(е)) получают следующим образом. К перемешиваемому раствору 3,4-дихлорбензиламина (0,53 мл; 4,0 ммоль) в ацетоне (10 мл) добавляют триэтиламин (1,67 мл; 12,0 ммоль) и раствор (11(а)) (0,87 г; 4,0 ммоль, см. пример 11) в ацетонитриле (20 мл). Раствор перемешивают при комнатной температуре в атмосфере аргона а течение 22 часов. Растворитель и избыток триэтиламина удаляют в вакууме и остаток распределяют между хлороформом и водой. Органическую фазу промывают водой и солевым раствором, сушат над сульфатом магния и выдерживают в вакууме досуха, получая этиловый эфир 5-(3,4-дихлорбензилкарбамоил)тиофен-2-карбоновой кислоты (12(а)) в виде кремового твердого продукта (90%).
ЯМР (СDСl3; 250 МГц): δ 1,40 (т, 3Н), 4,38 (к, 2Н), 4,57 (д, 2Н), 6,47 (шир.т, 1Н), 7,28 (м, 1Н), 7,42 (м, 2Н), 7,48 (д, 1Н), 7,73 (д, 1Н).
MC (CI) m/z 358 (M+H)+.
Анализ. C15H13Cl2NO3S 358: С 50,4 (50,3), Н 3,8 (3,7), N 3,9 (3,9).
Водный 1 М гидроксид натрия (16,3 мл; 16,3 ммоль) добавляют к перемешиваемому раствору (12(а)) (1,17 г; 3,3 ммоль) в этаноле (70 мл). Реакционную смесь перешивают при комнатной температуре в течение 19 часов, выпаривают до небольшого объема, разбавляют водой и устанавливают рН 2 добавлением 2 М соляной кислоты. Отфильтрованную твердую часть промывают водой и сушат в вакууме, получая 5-(3,4-дихлорбензилкарамоил)тиофен-2-карбоновую кислоту (12(b)) в виде твердого продукта (83%).
ЯМР (ДМСО-d6; 200 МГц): δ 4,43 (д, 2Н), 1,3 (дд, 1Н), 7,58 (м, 2Н), 7,68 (д, 1Н), 7,78 (д, 1Н), 9,28 (т, 1Н).
МС (CI) m/z 330 (M+H)+.
Анализ. C13H9Cl2NO3S 330: С 47,3 (47,3), Н 2,7 (2,7), N 4,2 (4,2).
Перемешиваемый раствор (12(b)) (495 мг; 1,5 ммоль) в дихлорметане (25 мл) охлаждают на ледяной бане и добавляют ДМФ (1 каплю) и по каплям добавляют оксалилхлорид (0,175 мл; 2,0 ммоль). Раствор перемешивают при комнатной температуре в атмосфере аргона в течение 4 часов. Дихлорметан и избыток оксалилхлорида удаляют в вакууме. Остаток подвергают азеотропной перегонке с толуолом (2•15 мл), получая 5-(3,4-дихлорбензилкарбамоил)тиофен-2-карбонилхлорид (12(с)), который используют сырым в следующей стадии.
К перемешиваемой смеси (12(с)) (1,5 ммоль) в ацетонитриле (15 мл) добавляют триэтиламин (0,83 мл; 4,5 ммоль) и раствор соединения (15(b)) (пример 15) (316 мг; 1,0 ммоль) и смесь перемешивают при комнатной температуре в атмосфере аргона в течение 19 часов. Ацетонитрил и избыток триэтиламина удаляют в вакууме и остаток распределяют между хлороформом и водой. Органическую фазу промывают водой и солевым раствором, сушат над сульфатом магния и выпаривают в вакууме досуха, получая N-(3,4-дихлорбензил)-N'-(2S, 4S)-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)тиофен-2,5-дикарбоксамид (12(d)) в виде клейкого коричневого твердого продукта (95%).
ЯМР (СDСl3; 200 МГц): δ 1,5 (с, 9Н), 1,65-1,85 (м, 1H), 2,47-2,73 (м, 1Н), 3,25-3,50 (м, 2Н), 3,65-3,85 (м, 2Н), 4,10-4,23 (м, 2Н), 4,57 (д, 2Н), 4,64 (м, 2Н), 5,20-5,40 (м, 2Н), 5,85-6,05 (м, 1Н), 6,45 (т, 1Н), 7,20 (дд, 1Н), 7,40 (м, 2Н), 7,46 (д, 1Н), 7,53 (д, 1Н), 8,47 (шир., 1Н).
MC (FAB) m/z 628 (М+Н)+.
Анализ. С27Н31Сl2N3О6S•H2O 646: С 50,2 (50,2), Н 4,9 (5,1), N 6,5 (6,5).
ТФУ (5 мл; 65 ммоль) добавляют к перемешиваемому раствору (12(d)) (600 мг; 0,93 ммоль) в дихлорметане (25 мл). Раствор перемешивают при комнатной температуре в атмосфере аргона в течение 4 часов, растворитель и избыток ТФУ удаляют в вакууме и остаток подвергают азеотропной перегонке с толуолом, получая целевой исходный продукт (12(е)).
ЯМР (СDСl3; 250 МГц): δ 1,55-1,75 (м, 1Н), 1,75 (д, 1Н), 2,50-2,72 (м, 1H), 3,12-3,43 (м, 1Н), 3,65-3,90 (м, 2Н), 4,03-4,20 (м, 2Н), 4,54 (д, 2Н), 4,63 (м, 2Н), 5,17-5,37 (м, 2Н), 5,85-6,03 (м, 1H), 6,63 (шир. 1H), 7,10-7,55 (м, 5Н), 8,5 (шир. 2Н).
MC (FAB) m/z 528 (М+Н)+.
Анализ. С22Н23Сl2N3O4S2•0,33С4Н10О•0,3С2НF3O2 586,5: С 49,0 (49,0), Н 4,5 (4,6), N 7,2 (7,2).
Пример 13 (см. схему 13).
5-[N-(3,4-Дихлорбензил)карбамоил] -N-((2S, 4S)-4-сульфанилпирролидин-2-илметил)пиридин-2-карбоксамид.
5-[N-(3,4-Дихлорбензил)карбамоил] -N-((2S, 4S)-1-аллилоксикарбонил-4-сульфанилпирролидин-2-илметил)пиридин-2-карбоксамид (13(е)) обрабатывают триметилсилилйодидом способом, подобным обработке соединения (12(е)) в примере 12. Целевой продукт 13 получают в виде твердого продукта средне-коричневого цвета (26%).
ЯМР (ДМСО-d6; 200 МГц): δ 1,70-1,82 (м, 1Н), 3,15-3,40 (м , 2Н), 3,55-3,90 (м, ?Н), 4,52 (д, 2Н), 7,35 (дд, 1Н), 7,60 (м, 2Н), 8,18 (д, 1Н), 8,47 (дд, 1Н), 8,75 (шир., 1Н), 9,10 (д, 1Н), 9,28 (т +?, 2Н), 9,42 (т, 1Н). МС (FAB) m/z 439 (М+Н)+.
Анализ. C19H20Cl2N4O2S•1,5НI•0,33 С4Н10О 655,7: С 37,4 (37,2), Н 3,4 (3,7), N 8,1 (8,5).
Исходный продукт (13(е)) получают следующим образом. Метиловый эфир 5-хлоркарбонилпиридин-2-карбоновой кислоты подвергают реакции с 3,4-дихлорбензиламином способом, аналогичным получению соединения (12(а)) в примере 12, получая метиловый эфир 5-(3,4-дихлорбензилкарбамоил)пиридин -2-карбоновой кислоты (13(а)) в виде кремового твердого продукта (61%).
ЯМР (СDСl3; 250 МГц): δ 4,05 (с, 3Н), 4,62 (д, 2Н), 6,80 (шир.т, 1Н), 7,22 (дд, 1Н), 7,43 (м, 2Н), 8,20 (д, 1Н), 8,30 (м, 1Н), 9,08 (д, 1Н).
МС (CI) m/z 339 (М+Н)+. Анализ. C15H12Cl2N2O3 339: С 53,2 (53,1), Н 3,5 (3,6), N 8,1 (8,3).
Соединение (13(а)) обрабатывают аналогично соединению 12(а) в примере 12, получая 5-(3,4-дихлорбензилкарбамоил)пи-ридин-2-карбоновую кислоту (13(b)) в виде не совсем белого твердого продукта (82%).
ЯМР (ДМСО-d6; 200 МГц): δ 4,50 (д, 2Н), 7,33 (дд, 1Н), 7,58 (м, 2Н), 8,13 (д, 1Н), 8,37 (дд, 1Н), 9,12 (д, 1Н), 9,40 (т, 1Н). МС (CI) m/z 325 (М+Н)+.
Анализ. С14Н10Сl2N2O3•Н2O 343: С 48,9 (48,9), Н 3,5 (3,5), N 8,0 (8,2).
Соединение (13(b)) обрабатывают аналогично соединению (12(b)) в примере 12, получая 5-(3,4-дихлорбензилкарбамоил)-пиридин-2-карбонилхлорид (13(с)), который используют сырым в следующей реакции.
Соединение (13(с)) подвергают реакции с соединением (15(b)) (пример 15) подобно соединению (12(с)) в примере 12, получая 5-[N-(3,4-дихлорбензил)карбамоил] -N-(2S, 4S)-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)пиридин-2-карбоксамид в виде светло-коричневого твердого продукта (13(d)) (81%).
ЯМР (СDСl3; 250 МГц): δ 1,50 (с, 9Н), 1,73-1,90 (м, 1Н), 2,50-2,65 (м, 1Н), 3,20-3,30 (м, 1Н), 3,62-3,80 (м, 2Н), 4,10-4,27 (м, 2Н), 4,65 (д?, 4Н), 5,18-5,38 (м, 2Н), 5,83-6,05 (м, 1Н), 6,80 (шир.т, 1Н), 7,20-7,28 (м, 2Н), 7,40-7,48 (м, 2Н), 8,23 (с, 2Н), 8,75 (шир., 1Н), 8,98 (д?, 1Н).
МС (FAB) m/z 623 (М+Н)+.
Анализ. С28Н32Сl2N4O6S 623: С 53,8 (53,9), Н 5,1 (5,2), N 8,9 (9,0); т. пл. 136-137,5oС.
Соединение (13(d)) обрабатывают аналогично соединению 12(d)) в примере 12, получая целевой исходный продукт (13(е)) в виде бледно-коричневого твердого продукта (64%).
ЯМР (СDСl3; 250 МГц): δ 1,70 (д, 1Н), 1,80-2,00 (м, 1Н), 2,52-2,65 (м, 1Н), 3,05-3,25 (м, 2Н), 3,60-3,85 (м, 2Н), 4,05-4,20 (м, 2Н), 4,60 (д?, 4Н), 5,18-5,33 (м, 2Н), 5,85-6,03 (м, 1Н), 6,80 (шир., 1Н), 7,20 (дд, 1Н), 7,40-7,47 (м, 2Н), 8,23 (с, 2Н), 8,78 (шир., 1Н), 9,0 (с, 1Н).
МС (FAB) m/z 523 (М+Н)+.
Анализ. С23Н24Сl2N4O4S•0,1С2НF3O2 534,4: С 52,4 (52,1), Н 4,6 (4,5), N 10,3 (10,5); т.пл. 101-105oС.
Пример 14 (см. схему 14).
1-Гидрокси-4-[((2S, 4S)-4-сульфанилпирролидин-2-илметил)аминосульфонил] нафталин-2-карбоновая кислота.
К перемешиваемому раствору 1-гидрокси-4-[((2S, 4S)-1-ал-лилоксикарбонил-4-сульфанилпирролидин-2-илметил)аминосульфонил] нафталин-2-карбоновой кислоты (14(с)) (47,5 мг; 0,1 ммоль) в дихлорметане (10 мл) добавляют TMSI (0,56 мл; 0,4 ммоль). Растворитель и избыток TMSI удаляют в вакууме через 6 часов. К остатку добавляют метанол (5 мл) и затем его из раствора удаляют в вакууме. Остаток растирают с диэтиловым эфиром, фильтруют и сушат в вакууме, получая целевой продукт 14 в виде коричневого твердого продукта (74%).
ЯМР (ДМСО-d6; 250 МГц): δ 1,45-1,62 (м, 1Н), 2,25-2,45 (м, 1Н), 2,90-3,25 (м, 3Н), 3,45-3,70 (м, 2Н), 7,72 (м, 1Н), 7,85 (м, 1Н), 8,12 (м, 1Н), 8,38-8,60 (м, 2Н), 9,15 (шир., 1Н).
МС (FAB) m/z 389 (М+Н)+.
Анализ. C16H18N2O5S2•1,25HI•0,5С4Н10О 579: С 37,0 (37,3), Н 4,1 (4,2), N 4,8 (4,8).
Исходный продукт (14(с)) получают следующим образом. Соединение (15(b)) (пример 15) и 1-гидрокси-4-хлорсульфонил-нафталин-2-карбоновую кислоту (14(а)) сочетают аналогично эквивалентной стадии в примере 15, получая 1-гидрокси-4-[((2S, 4S)-1-аллилоксикарбонил-4-ВОС-сульфонилпирролидин-2-илметил)аминосульфонил]нафталин-2-карбоновую кислоту (14(b)) в виде светло-коричневого твердого продукта (80%).
ЯМР (СDСl3; 250 МГц): δ 1,45 (с, 9Н), 1,50-1,75 (м, 1Н), 2,28-2,42 (м, 1Н), 2,96-3,10 (м, 2Н), 3,48-3,60 (м, 1Н), 3,80-3,90 (м, 1Н), 3,95-4,05 (м, 1Н), 4,47 (м, 2Н), 4,53-4,63 (м, 1Н), 7,55 (м, 1Н), 7,67 (м, 1Н), 8,50 (м, 2Н), 8,70 (м, 1Н). МС (FAB) M+Na+ 589, другой 317, 261. Анализ. C25H30N2O9S2•Н2О•0,8C3H15N 664,8: С 53,7 (53,8), Н 6,7 (6,6), N 5,9 (5,9). 2М водный гидроксид натрия (5 мл; 10,0 ммоль) добавляют к перемешиваемому раствору (14(b)) (333 мг; 0,5 ммоль) в метаноле (5 мл). Через 42 часа раствор выпаривают досуха и остаток растворяют в воде (10 мл). При помощи 2 М соляной кислоты устанавливают рН раствора 2 и твердую часть отделяют фильтрованием, промывают водой и сушат в вакууме, получая целевой исходный продукт (14(с)) в виде белого твердого продукта (72%).
ЯМР (СDСl3; 200 МГц): δ 1,48-1,70 (м, 2Н), 2,38-2,52 (м, 1Н), 2,85-3,40 (м, ?Н), 3,90-4,05 (м, 2Н), 4,40-4,60 (м, 3Н), 5,10-5,35 (м, 3Н), 5,70-5,95 (м, 2Н), 6,20-6,45 (шир., 1Н), 7,57-7,90 (м, 3Н), 8,43-8,70 (м, 4Н).
МС (FAB) m/z 467 (М+Н)+.
Анализ. C20H22N2O7S2•0,5Н2О 475: С 50,6 (50,5), Н 4,8 (4,8), N 6,0 (5,9).
Пример 15 (см. схему 15).
Метиловый эфир (2S)-2-{ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)сульфамоил]бензоиламино}-4-метилсульфанилмасляной кислоты.
ТФУ (2,0 мл) добавляют к перемешиваемому раствору метилового эфира (2S)-2-{ 3-[([2S, 4S]-4-ВОС-сульфанилпирролидин-2-илметил)сульфамоил]бензоиламино} -4-метилсульфанилмасляной кислоты (15(d)) (101 мг, 0,18 ммоль) в CH2Cl2 (2,0 мл) при комнатной температуре в атмосфере аргона. Через 1 час реакционную смесь концентрируют досуха, подвергают азеотропной перегонке с толуолом (3•10 мл) и сушат, получая целевой продукт 15 в виде бесцветной смолы; 101,8 мг (99%).
1H ЯМР (СDСl3; 250 МГц): δ 1,6-1,8 (1H, м), 2,0 (1Н, д, SH), 2,1-2,4 (5Н, м), 2,52-2,65 (3Н, м), 3,15-3,4 (3Н, м), 3,45-3,65 (1Н, м), 3,7-3,85 (4Н, м), 3,9-4,1 (1Н, м), 4,85-5,0 (1H, м), 7,55-7,7 (2Н, м), 7,8 (1H, с), 8,0 (1Н, д), 8,1 (1H, д), 8,3 (1H, с), 9,0-9,4 (1H, с), 10,0-10,4 (1H, с).
MC (ESP+) m/z 462 (М+Н)+.
Исходный продукт (15(d)) получают следующим образом. Триэтиламин (3,0 мл; 21,5 ммоль) добавляют к перемешиваемой суспензии метилового эфира L-метионина как соли с НС1 (4,37 г, 21,8 ммоль) в CH2Cl2 (50 мл). Получаемую смесь перемешивают в течение 30 мин при комнатной температуре, затем фильтруют. Фильтраты затем добавляют к перемешиваемому раствору 3-хлорсульфонилбензоилхлорида (5,23 г, 21,9 ммоль) и триэтиламина (7,6 мл, 54,7 ммоль) в CH2Cl2 (50 мл) при 0oС в атмосфере аргона. Реакционной смеси дают нагреться до комнатной температуры и тушат смесью лед-вода (100 мл). Органическую фазу сушат над MgSO4, фильтруют и концентрируют до получения вязкой коричневой смолы. Ее затем очищают флэш-хроматографией на SiO2 9385 при элюировании 50% EtOAc/изогексан, получая метиловый эфир (2S)-2-(3-хлорсульфонилбензоиламино)-4-метилсульфонилмасляной кислоты (15(а)) в виде вязкого оранжевого масла; 2,88 г (36%).
1Н ЯМР (СDСl3; 250 МГц): δ 2,1-2,2 (5Н, м), 2,65 (2Н, т), 3,83 (3Н, с), 4,95 (1Н, м), 7,23 (1Н, д), 7,74 (1Н, т), 8,2 (2Н, м), 8,47 (1Н, м).
МС (CI) m/z 366 (М+Н)+, 332, 300.
Раствор 15 (а) (1,53 г, 4,18 ммоль) в CH2Cl2 (20 мл) добавляют к перемешиваемому раствору аллилового эфира (2S,4S)-2-аминометил-4-ВОС-сульфанилпиррролидин-1-карбоновой кислоты (15(b)) (получен, как описано в заявке на Международный патент WO 92/17480, см. страницы 39-41) (1,32 г, 4,18 ммоль) и (i-Pr)2NEt (1,5 мл, 9,0 ммоль) в CH2Cl2 (30 мл) при 0oС в атмосфере аргона. Получаемому раствору дают нагреться до комнатной температуры и перемешивают в течение 18 часов. Реакционную смесь затем промывают водой (100 мл), сушат над МgSO4, фильтруют и концентрируют до получения вязкой белой смолы. Ее затем очищают флэш-хроматографией на SiO2 9385 при элюировании смесью EtOAc/изогексан с градиентом EtOAc 35-50%, получая аллиловый эфир (2S, 4S)-4-ВОС-сульфанил-2-{ [3-([1S]-1-метоксикарбонил-3-метилсульфанилпропилкарбамоил)бензолсульфониламино] метил} пирролидин-1-карбоновой кислоты (15(с)) в виде бесцветной пены; 2,19 г (81,3%).
1H ЯМР (СDСl3; 200 МГц): δ 1,5 (9Н, с), 1,65-1,9 (1Н, с), 2,05-2,35 (5Н, м), 2,4-2,7 (3Н, м), 3,3-3,4 (3Н, м), 3,55-3,75 (1Н, м), 3,8 (3Н, с), 3,9-4,2 (2Н, м), 4,55 (2Н, д), 4,98 (1Н, м), 5,15-5,35 (2Н, м), 5,8-6,0 (1Н, м), 6,5 (1Н, с), 7,4 (1Н, с), 7,55 (1Н, т), 7,9-8,05 (2Н, м), 8,25(1Н, м).
МС (FAB) m/z 646 (М+Н)+, 590, 568, 546, 230.
Анализ. Вычислено для С27Н39N3O9S3•0,3CH2Cl2,%: С 48,8; Н 5,95; N 6,26.
Найдено,%: С 48,9; Н 6,2; N 6,0.
Три-н-бутилоловогидрид (565 мл, 2,1 ммоль) добавляют к перемешиваемому раствору (15(с)) (1,18 г, 1,8 ммоль) и (PPh)3PdCl2 (13 мг, 0,018 ммоль) в смеси воды (0,5 мл) и CH2Cl2 (100 мл). Реакционную смесь перемешивают в течение 10 минут, сушат над МgSO4, фильтруют и концентрируют до образования коричневого масла. Его затем очищают флэш-хроматографией на SiO2 9385 при элюировании смесью EtOAc/изогексан с градиентом EtOAc 0-10%, получая целевой исходный продукт 15(d) в виде белой пены; 751 мг (73%).
1H ЯМР (СDСl3+СD3СООD; 250 МГц): δ 1,5 (9Н, с), 1,85-1,97 (1Н, м), 2,1-2,35 (5Н, м), 2,45-2,7 (3Н, м), 3,1-3,4 (3Н, м), 3,65-4,25 (6Н, м), 4,9-5,0 (1Н, м), 7,63 (1Н, т), 7,97-8,05 (1Н, м), 8,1-8,17 (1Н, м), 8,35-8,42 (1Н, м).
МС (ESP+) m/z 562 (М+Н)+, 462.
Анализ. Вычислено для C23H35N3O7S3,%: С 49,2; Н 6,28; N 7,48.
Найдено,%: С 49,4; Н 6,3; N 7,2.
Пример 16 (см. схему 16).
(2S)-2-{ 3-[([2S, 4S]-4-Сульфанилпирролидин-2-илметил)сульфамоил]бензоиламино}-4-метилсульфанилмасляная кислота.
2 н. NaOH (2,0 мл, 4,0 ммоль) добавляют к перемешиваемому раствору соединения (15(d)) (получен в примере 15) (200 мг, 0,36 ммоль) в МеОН при комнатной температуре в атмосфере аргона. Через 18 ч реакционную смесь концентрируют для удаления МеОН. Получаемый остаток растворяют в Н2О (2,0 мл) и подкисляют до рН 3 при помощи 2 н. НСl. Получаемый раствор очищают ВЭЖХ с обращенной фазой (препаративная колонка, 8 мк, С18, Dynamax), элюируя смесью МеОН/Н2О с градиентом МеОН 0-40%. Фракции продукта концентрируют и подвергают азеотропной перегонке с толуолом (3•25 мл), получая бесцветное стеклообразное вещество, которое затем растирают с Et2O (25 мл), фильтруют и сушат, получая целевой продукт 16 в виде белого порошка; 85,2 мг (54%).
1H ЯМР (ДМСО-d6+CD3COOD; 250 МГц): δ 1,45-1,65 (1H, м), 2,0-2,2 (5Н, м), 2,3-2,7 (3Н+ДМСО, м), 2,95-3,2 (3Н, м), 3,35-4,2 (3Н, м), 4,5-4,65 (1H, м), 7,65-7,8 (1H, м), 7,9-8,05 (1H, м), 8,1-8,25 (1H, м), 8,3-8,4 (1H, м).
MC (FAB) m/z 448 (М+Н)+.
Анализ. Вычислено для C17H25N3O5S3,%: С 45,6; Н 5,63; N 9,39.
Найдено,%: С 45,5; Н 5,8; N 9,1.
Пример 17 (см. схему 17).
N-(3,4-Дихлорфенил)-3-[([2S,4S]-4-сульфанилпирролидин-2-ил-метил)сульфамоил]бензамид.
N-(3,4-Дихлорбензил)-3-[([2S, 4S] -4-ВОС-сульфанилпирролидин-2-илметил)сульфамоил] бензамид (17(с)) освобождают от защитной группы при помощи ТФУ (аналогично соединению (15 (d)) в примере 15), получая целевой продукт 17 с выходом 97% после растирания с Et2O.
1Н ЯМР (СDСl3, 200 МГц): δ 1,5-1,8 (1H, м), 1,8-2,2 (2H+H2O, м, SH, NH), 2,5-2,7 (1H, м), 3,1-3,35 (3Н, м), 3,4-4,1 (3Н, м), 4,55 (2Н, д), 7,15 (1H, дд), 7,2 (1H, с), 7,32 (1H, д), 7,4 (1H, д), 7,65 (1Н+ РРh3РО, м), 7,9 (1H, м), 8,2 (1H, м), 8,35 (1Н, м), 8,5-9,3 (1H, с, NH), 10,3-10,7 (1H, с, NH).
MC (ESP+) m/z 474 (М+Н)+, 279 (Рh3РО).
Исходный продукт (17(с)) получают следующим образом. 3,4-Дихлорбензиламин сочетают с 3-хлорсульфонилбензоилхлоридом (аналогично, как для соединения (15 (а)) в примере 15), получая 3-(3,4-дихлорбензилкарбамоил)бензолсульфонилхлорид (17(а)) с выходом 28%.
1H ЯМР (СDСl3, 250 МГц): δ 4,6 (2Н, д), 6,6 (1H, с, NH), 7,2 (1H, дд), 7,4-7,5 (2Н, м), 7,75 (1H, т), 8,15-8,25 (2Н, м), 8,4 (1H, м).
МC (FAB) m/z 378 (М+Н)+, 380.
Соединение 15(b) (пример 15) сочетают с (17(а)) аналогично эквивалентной стадии в примере 15, получая N-(3,4-дихлорбензил)-3-[([2S,4S]-4-ВОС-сульфанилпирролидин-2-илметил)сульфамоил]бензамид (17(b)) с выходом 72,5%.
1H ЯМР (СDСl3, 200 МГц): δ 1,5 (9Н, с), 1,6-1,9 (1H+H2O, м), 2,4-2,6 (1H, м), 3,1-3,3 (3Н, м), 3,6-3,7 (1H, м), 3,8-4,1 (2Н, м), 4,4 (2Н, д), 4,6 (2Н, д), 5,1-5,3 (2Н, м), 5,7-5,95 (1H, м), 6,08 (1H, с, NH), 7,2 (1H, дд), 7,35-7,7 (4Н, м), 7,95 (1H, д), 8,15 (1H, д), 8,25-8,35 (1H, с, NH).
MC (FAB) m/z 658 (М+Н)+.
Анализ. Вычислено для C28H33N3Cl2O7S2,%: С 51,1; Н 5,05; N 6,38.
Найдено,%: С 50,8; Н 5,2; N 6,2.
Соединение (17(b)) освобождают от защитной группы аналогично эквивалентной стадии в примере 15, получая целевой исходный продукт (17(с)) с выходом 70%.
1H ЯМР (СDСl3, 250 МГц): δ 1,15-1,45 (1H, м), 1,5 (9Н, с), 2,25-2,4 (1H, м), 2,6-2,9 (4Н, м), 3,02 (1Н, дд), 3,25-3,4 (2Н, м), 3,45-3,6 (1Н, м), 4,6 (2Н, м), 7,05 (1Н, м), 7,2 (1Н, дд), 7,4 (1Н, д), 7,45 (1Н, д), 7,6 (1Н, т), 7,95 (1Н, д), 8,1 (1Н, д), 8,25 (1Н, с).
MC (ESP+) m/z 574 (М+Н)+, 574, 279 (PPh3O).
Пример 18 (см. схему 18).
N-(3,4-Дихлорбензил)-N'-([2S,4S]-4-сульфанилпирролидин-2-илметил)изофталамид.
N-(3,4-Дихлорбензил)-N'-([2S, 4S] -4-ВОС-сульфанилпирролидин-2-илметил)изофталамид (18(е)) освобождают от защитной группы при помощи ТФУ (аналогично эквивалентной стадии в примере 15), получая целевой продукт 18 с выходом 100% после растирания с Et2O.
1H ЯМР (СDСl3+СD3СООD; 250 МГц): δ 1,75-1,9 (1Н, м), 2,6-2,75 (1H, м), 3,2-3,35 (1Н, м), 3,45-3,65 (1H, м), 3,7-3,95 (3Н, м), 4,05-4,15 (1H, м), 4,6 (2Н, с), 7,2 (1H, дд), 7,4 (1H, д), 7,55 (1H, т), 7,95-8,05 (1H, м), 8,1-8,2 (1H, м), 8,4 (1H, м).
MC (ESP+) m/z 438 (М+Н)+.
Исходный продукт (18(е)) получают следующим образом. Суспензию монометилового эфира изофталевой кислоты (18(а)) (2,65 г, 14,7 ммоль) в CH2Cl2 (100 мл) и ДМФ (10 капель) обрабатывают оксалилхлоридом (2,6 мл, 29,8 ммоль) при 0oС в атмосфере аргона. Реакционной смеси дают нагреться до комнатной температуры в течение 18 ч. Получаемый раствор концентрируют и подвергают азеотропной перегонке с толуолом, получая кристаллическое желтое твердое вещество. Его затем снова растворяют в CH2Cl2 (100 мл) и добавляют по каплям в перемешиваемый раствор 3,4-дихлорбензиламина (2,6 г, 14,7 ммоль) и Et3N (5 мл, 35,9 ммоль) в CHCl2 (100 мл) при 0oС в атмосфере аргона. Получаемому раствору дают нагреться до комнатной температуры в течение 4 часов, промывают 1 н. НСl (50 мл), насыщенным водным раствором NaHCO3 (50 мл), сушат над MgSO4, фильтруют и концентрируют до образования оранжевого масла. Его затем очищают флэш-хроматографией на SiO2 9385 при элюировании смесью EtOAc/изогексан с градиентом EtOAc 25-50%, получая метиловый эфир 3-(3,4-дихлорбензилкарбамоил)бензойной кислоты (18(b)) в виде бледно-желтого масла; 3,99 г (80%).
1H ЯМР (СDСl3, 200 МГц): δ 3,9 (3Н, с), 4,6 (2Н, д), 6,6-6,8 (1Н, т, NH), 7,18 (1Н, дд), 7,38-7,45 (2Н, м), 7,54 (1Н, т), 8,0-8,1 (1Н, м), 8,13-8,23 (1Н, м), 8,35-8,42 (1Н, м).
МС (CI) m/z 338 (М+Н)+.
Перемешиваемый раствор (18(b)) (3,85 г, 11,4 ммоль) в МеОН (100 мл) при комнатной температуре в атмосфере аргона обрабатывают 1 н. NaOH (12 мл, 24 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч, концентрируют до 1/5 объема и подкисляют до рН 4 при помощи 2 н. НСl. Получаемый осадок затем собирают фильтрованием, промывают водой (2•25 мл) и сушат в вакууме, получая 3-(3,4-дихлорбензилкарбамоил)бензойную кислоту (18(с)) в виде белого порошка, 2,9 г (79%).
1Н ЯМР (ДМСО-d6, 200 МГц): δ 4,49 (2Н, д), 7,32 (1Н, дд), 7,5-7,7 (3Н, м), 8,0-8,2 (2Н, м), 8,42-8,53 (1Н, м), 9,27 (1Н, т, NH), 13,0-13,4 (1Н, с, СООН).
МС (ESP+) m/z 324 (М+Н)+, 159.
Анализ. Вычислено для C15H11NO3Cl2•0,4Н2О,%: С 54,4; Н 3,59; N 4,23.
Найдено.%: С 54,0; Н 3,2; N 4,2.
1-(3-Диметиламинопропил)-3-этилкарбодиимид как соль с НС1 (655 мг, 3,4 ммоль) и 1-гидроксибензтриазол (463 мг, 3,4 ммоль) добавляют по частям в перемешиваемый раствор (18(с)) (1,0 г, 3,1 ммоль) в ДМФ (20 мл) при 0oС в атмосфере аргона. Через 30 мин по каплям добавляют раствор соединения (15(b)) (пример 15) (1,13 г, 3,57 ммоль) в ДМФ (20 мл), затем N-метилморфолин (375 мл, 3,4 ммоль). Смеси затем дают нагреться до комнатной температуры в течение 4 часов. Получаемую реакционную смесь концентрируют до 1/5 объема и разбавляют EtOAc (100 мл). Этот раствор затем промывают последовательно 1 н. лимонной кислотой (100 мл), насыщенным водным NaHCO3 (100 мл), водой (100 мл) и солевым раствором (100 мл), сушат над MgSO4, фильтруют и концентрируют до образования белой пены. Ее затем очищают флэш-хроматографией на SiO2 9385 при элюировании смесью EtOAc/изогесан с градиентом EtOAc 50-75%, получая аллиловый эфир (2S,4S)-4-ВОС-сульфанил-2-{[3-(3,4-дихлорбензилкарбамоил)бензоиламино]метил}пирролидин-1-карбоновой кислоты (18(d)) в виде белой пены; 1,57 г (82%).
1Н ЯМР (СDСl3, 250 МГц): δ 1,5 (9Н, с), 1,6-1,9 (1Н, м), 2,55-2,75 (1Н, м), 3,2-3,6 (2Н, м), 3,65-3,9 (2Н, м), 4,1-4,25 (2Н, м), 4,5-4,65 (4Н, м), 5,15-5,35 (2Н, м), 5,38-6,0 (1Н, м), 6,87 (1Н, т, NH), 7,2 (1Н, дд), 7,4 (1Н, д), 7,45 (1Н, д), 7,55 (1Н, т), 7,95 (1Н, д),8,07 (1Н, д), 8,25 (1Н, с), 8,35-8,6 (1Н, с, NH).
MC (ESP+) m/z 622 (М+Н)+, 566, 522.
Анализ. Вычислено для C29H33N3Cl2O6S,%: С 55,9; Н 5,34; N 6,75.
Найдено,%: С 56,1; Н 5,6; N 6,6.
Соединение (18 (d)) освобождают от защитной группы (аналогично эквивалентной стадии в примере 15), получая целевой исходный продукт (18(е)) с выходом 67%.
1H ЯМР (СDСl3, 200 МГц): δ 1,2-1,6 (10Н, м), 2,25-2,55 (2Н, м 1Н+1NH), 2,9 (1Н, к), 3,3-3,75 (5Н, м), 4,6 (2Н, д), 6,9-7,05 (1Н, м, NH), 7,05-7,15 (1Н, м, NH), 7,2 (1Н, дд), 7,4 (1H, д), 7,45 (1Н, д), 7,52 (1H, т), 7,9-8,05 (2Н, м), 8,23 (1H, м).
MC (ESP+) m/z 538 (M+H)+, 438.
Пример 19 (см. схему 19).
Аллиловый эфир (2S, 4S)-4-сульфанил-2-[(3-метоксикарбонилбензоиламино)метил]пирролидин-1-карбоновой кислоты
Аллиловый эфир (2S, 4S)-4-ВОС-сульфанил-2-[(3-метоксикарбонилбензоиламино)метил] пирролидин-1-карбоновой кислоты (19 (а)) (300 мг, 0,63 ммоль) растворяют в ТФУ (5 мл) при комнатной температуре в атмосфере аргона. Реакционную смесь концентрируют и подвергают азеотропной перегонке с толуолом (3•20 мл), получая целевой продукт (19) в виде бесцветной вязкой смолы; 250 мг (105%).
1H ЯМР (СDСl3, 200 МГц): δ 1,6-1,85 (2Н, м, CH+SH), 2,55-2,85 (2Н, м), 3,1-3,6 (3Н, м), 3,92 (3Н, шир. с), 4,0-4,4 (2Н, м), 4,65 (2Н, д), 5,15-5,4 (2Н, м), 5,8-6,1 (1H, м), 7,53 (1H, т), 8,0-8,1 (1Н, м), 8,1-8,25 (1H, м), 8,3-8,7 (2Н, м, ароматический Н + NH).
МС (FAB) m/z 379 (М+Н)+, 163.
Исходный продукт (19(а)) получают следующим образом. Суспензию монометилового эфира изофталевой кислоты (соединение 18(а), пример 18), (2,5 г, 13,89 ммоль) в CH2Cl2 (50 мл) и ДМФ (10 капель) обрабатывают оксалилхлоридом (1,35 мл, 15,5 ммоль) при 0oС в атмосфере аргона. Реакционной смеси дают нагреться до комнатной температуры в течение 18 ч. Получаемый раствор концентрируют и подвергают азеотропной перегонке с толуолом, получая кристаллическое желтое твердое вещество. Его затем снова растворяют в CH2Cl2 (50 мл) и по каплям добавляют к перемешиваемому раствору аллилового эфира (2S,4S)-2-аминометил-4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (соединение 15(b), пример 15) (2,0 г, 6,33 ммоль) и (i-Pr)2NEt (2,2 мл, 12,66 ммоль) в CH2Cl2 (50 мл) при 0oC в атмосфере аргона. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов, затем промывают водой (2•50 мл), сушат над MgSO4, фильтруют и концентрируют до образования темно-коричневого масла. Его затем очищают флэш-хроматографией на SiO2 9385 при элюировании смесью EtOAc/изогексан с градиентом EtOAc 25-50%, получая целевой исходный продукт (19(а)) в виде бледно-желтого вязкого масла; 1,81 г (60%).
1Н ЯМР (СDСl3, 200 МГц): δ 1,5 (9Н, с), 1,65-1,9 (1H, м), 2,55-2,8 (1H, м), 3,3 (1H, к), 3,4-3,65 (1H, м), 3,65-3,9 (2Н, м), 3,95 (3Н, с), 4,05-4,35 (2Н, м), 4,6-4,7 (2Н, м), 5,15-5,4 (2Н, м), 5,8-6,1 (1H, м), 7,52 (1Н, т), 8,02 (1Н, дд), 8,15 (1Н, дд), 8,25-8,5 (1Н, шир. с, NH), 8,55 (1Н, шир. с).
МС (FAB) m/z 479 (М+Н)+, 423, 163.
Анализ. Вычислено для C23H30N2O7S,%: С 57,7; Н 6,32; N 5,85.
Найдено,%: С 57,5; Н 6,4; N 5,7.
Пример 20 (см. схему 20).
N-([2S,4S]-4-сульфанилпирролидин-2-илметил)-3-феноксибензамид.
3-Феноксибензойную кислоту сочетают с аллиловым эфиром (2S,4S)-2-аминометил-4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (соединение (15(b), пример 15), затем селективно удаляют защитную N-аллилоксикарбонильную группу и удаляют группу ВОС (аналогично эквивалентным стадиям в примере 15), получая целевой продукт 20.
ЯМР (СDСl3): δ 1,8 (1Н, м), 2,72 (1H, м), 3,01-3,31 (1Н, шир. д), 3,69-3,97 (4Н, м), 4,3 (1H, шир. с), 6,92-7,17 (4,5Н, м, ароматические), 7,23-7,45 (5,5 Н, м, ароматические), 7,56 (1H, м), 7,68 (1H, т), 8,02-8,29 (1H, 2т), 9,02-9,29 (1H, 2 шир. с + простой эфир).
Анализ. Вычислено для С18Н20N2О2S•HI,%: С 47,33; Н 4,6; N 6,13.
Найдено,%: C 47,8; Н 4,5; N 6,1.
Пример 21 (см. схему 21).
Диметиловый эфир 5-{ ([2S, 4S]-1-аллилоксикарбонил-4-сульфанилпирролидин-2-илметил)карбамоил}изофталевой кислоты.
Диметиловый эфир бензол-1,3,5-трикарбоновой кислоты сочетают с аллиловым эфиром (2S,4S)-2-аминометил-4-ВОС-суль-фанилпирролидин-1-карбоновой кислоты (соединение 15(b)), пример 15), затем удаляют группу ВОС (аналогично эквивалентным стадиям в примере 15), получая целевой продукт 21.
ЯМР (СDСl3), %: δ 1,67 (1Н, м), 1,75 (1H, д), 2,66-2,89 (3Н, м), 3,21 (1H, к), 3,27-3,37 (1H, м), 3,5 (1H, м), 3,9 (2Н, шир. с), 3,97 (6Н, с), 4,08-4,27 (2Н, м), 4,68 (2Н, д), 5,2-5,4 (2Н, м), 5,88-6,06 (1H, м), 8,68 (2Н, шир. с), 8,8 (1H, д).
Анализ. Вычислено для C20H24N2O7S,%: С 55,0; Н 5,54; N 6,42.
Найдено,%: С 54,9; Н 5, 6; N 5,75.
Пример 22 (см. схему 22).
Метиловый эфир (2S)-2-{ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино]бензоиламино}-4-метилсульфанилмасляной кислоты.
Метиловый эфир (2S)-2-{ 3-[([2S, 4S]-4-ВОС-сульфанилпирролидин-2-илметил)амино] бензоиламино}-4-метилсульфанилмасляной кислоты (22 г) освобождают от защитной группы (аналогично эквивалентной стадии в примере 15), получая целевой конечный продукт (22).
1Н ЯМР (СDСl3+CD3COOD): δ 1,7-1,9 (1H, м), 2,0-2,4 (6Н+СН3СООН, м), 2,5-2,8 (3Н, м), 3,23 (1H, к), 3,45-3,7 (2Н, м), 3,7-3,9 (4Н, м), 3,95-4,15 (1H, м), 4,8-4,95 (1H, м), 6,8 (1H, д), 7,05-7,18 (2Н, м), 7,23 (1H, т).
МС (ЕSР) m/z 398 (М+Н)+, 235.
Анализ. Вычислено для С18Н27N3О3S2•1,25ТФУ,%: С 45,6; Н 5,27; N 7,78.
Найдено,%: С 45,2; Н 5,3; N 7,4.
Исходный продукт 22g получают следующим образом.
i) Получение аллилового эфира (2S,4S)-ВОС-сульфанил-2-формилпирролидин-1-карбоновой кислоты (22b).
ТРАР (5,5 мг, 0,0156 ммоль) добавляют к перемешиваемой смеси аллилового эфира (2S, 4S)-ВОС-сульфанил-2-гидроксиметилпирролидин-1-карбоновой кислоты (22а) (100 мг, 0,31 ммоль) и NММ-O (56 мг, 0,478 ммоль) в CH2Cl2 (2,0 мл) и СН3СN (100 мкл), содержащей высушенное порошкообразное молекулярное сито 4 ангстрема (200 мг). Реакционную смесь перемешивают в течение 1 ч, затем концентрируют досуха. Остаток затем очищают флэш-хроматографией на SiO2 (Varian Mega Bond Elut Column) при элюировании смесью 50% EtOAc/изогексан, получая соединение 22b в виде бесцветной смолы; 66,3 мг (66,7%).
1H ЯМР (СDСl3, 250 МГц): δ 1,4-1,6 (9Н, м), 2,0-2,25 (1Н, м), 2,45-2,75 (1Н, м), 3,45-3,6 (1Н, м), 3,75-3,9 (1Н, м), 3,9-4,1 (1Н, м), 4,1-4,35 (1H, м), 4,5-4,7 (2Н, м), 5,15-5,4 (2Н, м), 5,75-6,05 (1H, м), 9,4 (1H, с, СНО).
МС (CI) m/z 316 (М+Н)+,260, 216.
ii) Получение метилового эфира (2S)-2-[(3-аминобензоил)амино]-4-метилсульфанилмасляной кислоты (22е).
3-Нитробензойную кислоту (22с) (2,0 г, 11,9 ммоль) сочетают с гидрохлоридом метилового эфира L-метионина (2,6 г, 13 ммоль) в соответствии со способом, использованным для синтеза соединения 18а, получая метиловый эфир (2S)-2-[(3-нитробензоил)амино]-4-метилсульфанилмасляной кислоты (22d) в виде белого твердого продукта; 3,15 г (93,4%).
1H ЯМР (СDСl3, 200 МГц): Δ 2,05-2,45 (5Н, м), 2,63 (2Н, т), 3,82 (3Н, c), 4,96 (1H, м), 7,2 (1H, д, NH), 7,65 (1H, т), 8,18 (1H, м), 8,39 (1H, м), 8,65 (1H, м).
MC (ESP) m/z 313 (M+H)+, 265, 253.
Анализ. Вычислено для C13H16N2O5S,%: С 50,0; Н 5,16; N 8,97.
Найдено,%: С 50,3; Н 5,1; N 8,9.
Перемешиваемый раствор 22d (500 мг, 1,62 ммоль) в МеОН (10 мл) обрабатывают добавляемым по частям обесцвечивающим углем (50 мг) и гексагидратом хлорида железа (III) (7 мг, 0,026 ммоль). Затем по каплям добавляют N,N-диметилгидразин (1,5 мл, 19,8 ммоль) и получаемую суспензию нагревают для кипячения с обратным холодильником в течение общего времени 18 ч. Реакционную смесь затем концентрируют досуха и остаток очищают флэш-хроматографией на SiO2 (Varian Mega Bond Elut Column) при элюировании раствором 50% EtOAc/изогексан. Фракции продукта затем концентрируют, получая бесцветное масло, которое кристаллизуется при стоянии. Продукт затем растирают с Et2O, получая 22е в виде белого порошка, который собирают фильтрованием и сушат; 367 мг (81,2%).
1H ЯМР (СDСl3, 250 МГц): δ 2,0-2,4 (5Н, м), 2,5-2,65 (2Н, м), 3,8 (3Н, с), 4,9 (1Н, м), 6,75-6,95 (2Н, м, ArH+CONH), 7,05-7,3 (3Н, м).
MC (ESP) m/z 283 (М+Н)+, 251, 235, 223.
Анализ. Вычислено для C13H18N2O3S,%: С 55,3; Н 6,43; N 9,92.
Найдено,%: С 55,5; Н 6,6; N 9,8.
iii) Получение 22q.
Раствор, содержащий 22е (50 мг, 0,17 ммоль) и 22b (54 мг, 0,17 ммоль) в EtOH (2,5 мл), обрабатывают порошкообразными молекулярными ситами 4 ангстрем (100 мг) и получаемую суспензию перемешивают при комнатной температуре в течение 1 ч. Добавляют уксусную кислоту (10 мкл) и цианоборогидрид натрия (17 мг, 0,27 ммоль) и реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Реакционную смесь затем распределяют между EtOAc (50 мл) и насыщенным водным раствором NaHCO3 (50 мл). Водную фазу затем промывают EtOAc (50 мл) и объединенные органические фазы сушат над МgSO4, фильтруют и концентрируют до образования бесцветной смолы. Ее затем очищают флэш-хроматографией на SiO2 (Varian Mega Bond Elut Column) при элюировании 25-40% раствором EtOAc/изогексан, получая метиловый эфир (2S)-2-(3-[([2S,4S]-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)амино] бензоиламино} -4-метилсульфанилмасляной кислоты (22f) в виде бесцветной смолы; 60,1 мг (60,3%).
1H ЯМР (СDСl3, 200 МГц): δ 1,45 (9Н, с, трет-бутил), 1,7-1,9 (1Н, м), 2,0-2,4 (5Н, м), 2,45-2,7 (3Н, м), 3,1-3,35 (2Н, м), 3,4-3,6 (1Н, м), 3,6-3,85 (4Н, м), 4,0-4,3 (2Н, м), 4,6 (2Н, м), 4,8-4,95 (1Н, м), 5,15-5,4 (2Н, м), 5,8-6,1 (1Н, м), 6,75 (1Н, д), 6,5-7,3 (5Н, м).
МС (ESP) m/z 582 (М+Н)+, 482.
Соединение 22f освобождают от защитной группы (аналогично эквивалентной стадии в примере 15), получая целевой исходный продукт 22g с выходом 64%.
1Н ЯМР (СDСl3+D2O): δ 1,15-1,95 (10Н, м), 1,95-2,15 (4Н, м, SMe+H), 2,15-2,35 (1H, м), 2,35-2,5 (1Н, м), 2,55 (2Н, т), 2,75-2,95 (1Н, м), 2,95-3,15 (1H, м), 3,15-3,55 (3Н, м), 3,55-3,7 (1H, м), 3,78 (3Н, с, СОМе), 4,9 (1H, м), 6,73 (1H, м), 6,98-7,13 (2Н, м), 7,2 (1H, т).
MC (ESP) m/z 498 (M+H)+, 398.
Анализ. Вычислено для C23H35N3O5S2•0,35СН2Сl2,%: С 52,3; Н 6,82; N 7,97.
Найдено,%: С 53,5; Н 7,1: N 7,5.
Пример 23 (см. схему 30).
Получение
N-((2S, 4S)-4-сульфанилпирролидин-2-илметил)-3-метил-N-(2-нафталин-1-илэтил)бутирамида (соединение 9);
(2S, 4S)-2-{ [(3-метоксипропил)-(2-нафталин-1-илэтил)амино] метил}пирролидин-4-тиола (соединение 10) и
(2S, 4S)-2-{[(2-(4-метоксифенил)метил)-(2-нафталин-1-илэтил)амино]метил} пирролидин-4-тиола (соединение 11).
Получение соединения 9.
Раствор исходного продукта, N-((2S,4S)-4-ВОС-сульфанилпирролидин-2-илметил) -3-метил-N-(2-нафталин-1-илэтил)бутирамида (6) (770 мг) в трифторуксусной кислоте (40 мл) перемешивают при комнатной температуре в течение 10 минут. Трифторуксусную кислоту выпаривают при пониженном давлении и остаток снова растворяют в диэтиловом эфире (90 мл). Добавляют эфирный НС1 (1М, 10 мл) и получаемую суспензию центрифугируют. Диэтиловый эфир декантируют и к остатку добавляют еще эфир (90 мл). Эту смесь перемешивают в течение пяти минут и затем снова центрифугируют. Процедуру промывание/центрифугирование повторяют еще раз и получаемое белое твердое вещество сушат при пониженном давлении, получая соединение (9), (600 мг).
Данные по ЯМР в ДМСО-d6: δ 0,6 (2д, 6Н), 0,95 (д, 1Н), 1,7 (м, 3Н), 2,15 (м, 1Н), 1,9 (м, 1Н), 3,0-3,85 (м, 10Н), 7,3-8,4 (м, 7Н), 8,9 (шир. с, 1Н), 9,5 (шир. с, 1Н).
Микроанализ. Вычислено,%: С 64,9, Н 7,7, N 6,9. (1,00 HCl).
Найдено,%: С 64,7, H7,9, N 6,8.
Исходное соединение (6) получают следующим образом. Аллиловый эфир (2S, 4S)-2-формил-4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (1) (1,84 г) в дихлорметане (20 мл) добавляют по каплям в течение 10 минут к смеси 2-нафталин-1-илэтиламина (1,0 г), триацетоксиборогидрида натрия (1,36 г) и порошкообразного молекулярного сита 4 ангстрема (3,0 г) в дихлорметане (130 мл), охлажденной до -20oС и перемешиваемой в атмосфере аргона. После завершения добавления реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение дополнительных 18 часов. Молекулярное сито отделяют фильтрованием и фильтрат перемешивают с насыщенным водным раствором бикарбоната натрия (100 мл) в течение 5 минут. Смесь разделяют, органическую фазу сушат над сульфатом магния и вводят в колонку для флэш-хроматографии с диоксидом кремния, которую затем элюируют 1) смесью этилацетат/гексан (50:50), 2) смесью этилацетат/гексан (80:20), 3) этилацетатом, получая аллиловый эфир (2S, 4S)-4-ВОС-сульфанил-2-[(2-нафталин-1-илэтиламино)метил] пирролидин-1-карбоновой кислоты (2) (2,2 г) в виде бесцветной смолы.
Данные по ЯМР в СDСl3: δ 1,5 (с, 9Н), 1,85 (м, 1Н), 2,5 (м, 1Н), 2,8 (м, 1Н), 3,0 (м, 3Н), 3,2 (м, 3Н), 3,7 (м, 1Н), 4,05 (м, 2Н), 4,55 (д, 2Н), 5,25 (м, 2Н), 5,9 (м, 1Н), 7,43 (м, 4Н), 7,7 (д, 1Н), 7,83 (м, 1Н), 8,05 (м, 1Н).
Смесь соединения (2) (1,2 г), изовалерилхлорида (0,61 г) и триэтиламина (0,77 г) в дихлорметане (75 мл) перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь затем вводят в колонку для флэш-хроматографии с диоксидом кремния, которую элюируют смесью этилацетат/гексан (20:80), получая соединение (3) в виде бесцветной смолы (1,3 г).
Трибутилоловогидрид (6,46 г) добавляют по каплям в течение 5 минут к перемешиваемой смеси соединения (3) (1,23 г) и бис(трифенилфосфин)палладий(0)хлорида (20 мг) в дихлорметане (75 мл). Эту смесь перемешивают при комнатной температуре в течение 30 минут и затем вводят в колонку для флэш-хроматографии с диоксидом кремния, которую элюируют 1) смесью этилацетат/гексан (50:50), 2) этилацетатом, 3) смесью этилацетат/метанол (95: 5). Полученный продукт вводят в колонку с Isolute® C18 (10 г) и элюируют смесью метанол/вода (80:20), получая исходный продукт, соединение (6), в виде белого твердого продукта (769 мг), т.пл. 86oC.
Данные по ЯМР: (СDСl3) δ 0,9 (2д, 6Н), 1,3 (м, 1Н), 1,5 (с, 9Н), 1,8-2,5 (м, 6Н), 2,9 (м, 1Н), 3,05-3,9 (м, 9Н), 7,25-8,35 (м, 7Н).
Получение соединения (10).
Раствор исходного продукта, (2S,4S)-2-{[(3-метоксипропил)-2-(нафталин-1-илэтил)амино]метил}пирролидин-4-ВОС-тиола (соединение 7) (78 мг) в трифторуксусной кислоте перемешивают при комнатной, температуре в течение 30 минут. Трифторуксусную кислоту удаляют при пониженном давлении и остаток обрабатывают диэтиловым эфиром (5 мл). Эфир декантируют и остаток сушат при пониженном давлении в течение 24 часов, получая целевой конечный продукт в виде бесцветной смолы (соединение 10) (70 мг).
Данные по ЯМР (СDСl3): δ 1,95 (м, 4Н), 2,05 (м, 1Н), 3,16-3,62 (м, 10Н), 3,29 (с, 3Н), 3,7 (м, 1Н), 4,15 (м, 2Н), 7,3-7,65 (м, 4Н), 7,68 (д, 1Н), 7,88 (д, 1Н), 7,98 (д, 1Н), 11,2 (шир. с, 2Н).
Микроанализ. Вычислено,%: С 48,2, Н 5,13, N 4,32 (2,5ТФУ, 0,25H2O). Найдено,%: С 48,5, Н 5,20, N 4,40.
Исходный продукт (соединение 7) получают следующим образом.
Раствор 4-метоксимасляного альдегида (140 мг) в дихлорметане (10 мл) добавляют по каплям к смеси соединения (2)(250 мг), триацетоксиборогидрида натрия (338 мг) и молекулярных сит 4 ангстрем (1,0 г) в дихлорметане (30 мл), перемешиваемой в атмосфере аргона при -20oС. После завершения добавления (5 минут) реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов. Молекулярные сита отделяют фильтрованием и фильтрат промывают насыщенным раствором бикарбоната натрия (20 мл), затем солевым раствором и сушат над сульфатом магния. Раствор затем вводят в колонку с диоксидом кремния и элюируют смесью этилацетат/гексан (50:50), получая светлую смолу, соединение (4) (260 мг).
Соединение (7) синтезируют из соединения (4) аналогично получению соединения (6).
Данные по ЯМР: (СDСl3) δ 1,35 (м, 1Н), 1,48 (с, 9Н), 1,74 (м, 2Н), 2,31 (м, 1Н), 2,42-3,1 (м, 7Н), 3,15-3,5 (м, 9Н), 3,65 (м, 1Н), 7,28-8,1 (м, 7Н).
Получение соединения (11).
Соединение (11) синтезируют из исходного продукта, (2S,4S)-2-{[(2-(4-метоксифенил)метил)-(2-нафталин-1-илэтил)амино] метил}пирролидин-4-ВОС-тиола (соединение 8), способом, описанным для эквивалентной стадии получения соединения (10).
Данные по ЯМР: (СDСl3) δ 1,9 (м, 1Н), 2,05 (м, 1Н), 2,3 (м, 1Н), 3,1-3,8 (м, 8Н), 3,82 (с, 3Н), 4,25 (м, 3Н), 6,96 (д, 2Н), 7,42 (м, 6Н), 7,83 (м, 3Н).
Микроанализ. Вычислено, %: С 55,7, Н 5,77, N 4,06 (2 ТФУ, 0,75 диэтилового эфира).
Найдено,%: С 56,0, Н 5,40, N 4,50.
Исходный продукт для соединения (11) получают следующим образом.
Смесь соединения (2) (200 мг), п-метоксибензилхлорида (133 мг), насыщенного водного бикарбоната натрия (5 мл) и дихлорметана (20 мл) перемешивают при комнатной температуре в течение 24 часов. Слои разделяют и органический слой сушат, вводят в колонку для флэш-хроматографии с диоксидом кремния, которую затем элюируют смесью этилацетат/гексан (80:20), получая (2S,4S)-1-аллилоксикарбонил-2-{ [(2-(4-метоксифенил)метил)-(2-нафталин-1-илэтил)амино] метил} пирролидин-4-ВОС-тиол, соединение (5), в виде бесцветной смолы (140 мг).
Данные по ЯМР: (СDСl3) δ 1,45 (с, 9Н), 2,0 (м, 1Н), 2,35 (м, 1Н), 2,53-4,15 (м, 10Н), 3,8 (с, 3Н), 4,6 (м, 4Н), 5,25 (м, 2Н), 5,9 (м, 1Н), 6,85 (м, 3Н), 7,3 (м, 6Н), 7,75 (м, 2Н).
Целевой исходный продукт (соединение (8)) синтезируют из соединения (5) таким же способом, как используют для получения соединения (6) из соединения (3).
Масс-спектр (ESP+) m/е 507,0.
Пример 24 (см. схему 31).
Получение
а) 3-метил-N-(нафталин-1-илметил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)бутанамида (соединение 23);
б) N-(нафталин-1-илметил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)пентанамида (соединение 24);
в) N-(нафталин-1-илметил)-N-([2S,4S]-4-сульфанилпирролидин-2-илметил)-2-(пиридин-3-ил)ацетамида (соединение 27);
г) 3-метил-N-(нафталин-1-илметил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)пентанамида (соединение 25);
д) 3-метокси-N-(нафталин-1-илметил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)пропанамида (соединение 26) и
е) (2S, 4S)-2-[{ N-(4-метоксибензил)-N-(нафталин-1-илметил)амино}метил] пирролидин-4-тиола (соединение 54).
а) Получение соединения 23.
Раствор исходного продукта, 3-метил-N-(нафталин-1-илметил)-N-([2S,4S]-4-ВОС-сульфанилпирролидин-2-илметил)бутанамид (соединение (18)) (187 мг) в трифторуксусной кислоте (10 мл) перемешивают при комнатной температуре в течение 5 минут. Трифторуксусную кислоту выпаривают при пониженном давлении и получаемый остаток снова растворяют в этилацетате (5 мл). К раствору добавляют раствор хлорида водорода (2 мл/1,0 М), затем диэтиловый эфир (5 мл). Смесь центрифугируют, растворитель декантируют и остаток промывают дополнительным количеством диэтилового эфира (2•15 мл) и сушат, получая гидрохлоридную соль соединения (23) в виде не совсем белого твердого продукта (43 мг).
Данные по ЯМР (ДМСО-d6): δ 0,83 (м, 6Н), 0,95 (д, 1Н), 1,68 (м, 1Н), 2,10 (м, 3Н), 2,42 (м, 1Н), 3,10 (м, 1Н), 3,28-3,90 (м, 5Н), 5,20 (м, 2Н), 7,08 (д, 1Н), 7,57 (м, 3Н), 7,87 (д, 1Н), 8,00 (м, 2Н), 9,10-9,80 (2 шир. с, 2Н).
Микроанализ. Вычислено,%: С 62,7, Н 7,52, N 6,97 (1 HC1, 0,5 Н2О).
Найдено,%: С 62,4, Н 7,6, N 6,7.
Исходный продукт, соединение (18), получают следующим образом.
Раствор аллилового эфира (2S,4S)-2-формил-ВОС-сульфанилпирролидин-1-карбоновой кислоты (соединение (1)) (3,11 г) в дихлорметане (60 мл) добавляют по каплям к перемешиваемой смеси 1-нафталинметиламина (1,71 г), молекулярных сит 4 ангстрема (12 г) и триацетоксиборогидрида натрия (2,3 г) в дихлорметане (200 мл) в атмосфере аргона при -20oС. Смесь перемешивают в течение дополнительных 30 минут при -20oС и затем дают нагреться до комнатной температуры и перемешивают в течение еще 16 часов. Смесь фильтруют и промывают водным раствором бикарбоната натрия (2•200 мл), органическую фазу далее промывают водой (200 мл), отделяют, сушат над сульфатом магния и очищают колоночной хроматографией с использованием смеси этилацетат/гексан (30:70) в качестве элюента, получая аллиловый эфир (2S,4S)-2-{[нафталин-1-илметил]амино)метил}-4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (соединение (12)) в виде бледно-желтого масла (2,09 г).
Данные по ЯМР (СDСl3): δ 1,50 (с, 9Н), 1,55 (м, 1Н), 1,90 (м, 1Н), 2,50 (м, 1Н), 2,90 (м, 1Н), 3,05 (м, 1Н), 3,20 (м, 1Н), 3,68 (м, 1Н), 4,08 (м, 2Н), 4,23 (с, 2Н), 4,55 (д, 2Н), 5,20 (м, 2Н), 5,90 (м, 1Н), 7,47 (м, 4Н), 7,77 (м, 1Н), 7,86 (м, 1Н), 8,13 (м, 1Н).
Смесь соединения (12) (507 мг), триэтиламина (0,3 мл) и изовалерилхлорида (0,271 мл) в дихлорметане (30 мл) перемешивают при комнатной температуре в течение 1,5 часа и затем сразу вводят в колонку для флэш-хроматографии. Колонку элюируют смесью этилацетат/гексан (25:75) и этилацетат/гексан (35: 65), получая 3-метил-N-(нафталин-1-илметил)-N-([2S,4S]-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)бутанамид (соединение (13)) в виде смолы (475 мг).
Данные по ЯМР (ДМСО-d6, 373oК): δ 0,90 (м, 6Н), 1,45 (с, 9Н), 1,78 (м, 1Н), 2,18 (м, 3Н), 2,50 (м, 1Н), 3,15 (к, 1Н), 3,45 (м, 1Н), 3,70 (м, 2Н), 4,03 (к, 1Н), 4,20 (м, 1Н), 4,45 (м, 2Н), 5,10 (м, 4Н), 5,80 (м, 1Н), 7,20 (д, 1Н), 7,50 (м, 3Н), 7,80 (д, 1Н), 7,92 (м, 1Н), 8,00 (м, 1Н).
Трибутилоловогидрид (2,22 мл) добавляют по каплям к смеси соединения (13) (446 мг), бистрифенилфосфинпалладийхлорида (5,8 мг) в дихлорметане (10 мл). Смесь перемешивают при комнатной температуре в атмосфере аргона в течение 70 минут и затем сразу вводят в колонку для флэш-хроматографии, которую элюируют (1) смесью этилацетат/гексан (50:50) и (2) этилацетатом. Полученный продукт снова хроматографируют на колонке с Isolute® C18 (10 г) при элюировании смесью метанол/вода (1) (70:30), (2)(75:25) и (3)(80:20), получая целевой исходный продукт (соединение (18)) в виде смолы (197 мг).
Данные по ЯМР (ДМСО-d6, 373oК): δ 0,90 (м, 6Н), 1,45 (м, 5Н), 1,60 (м, 1Н), 1,68 (м, 2Н), 2,12 (м, 2Н), 2,25 (д, 2Н), 2,40 (м, 1Н), 2,60-3,85 (м, 8Н), 5,14 (с, 2Н), 7,20 (д, 1Н), 7,50 (м, 3Н), 7,83 (м, 1Н), 7,93 (м, 1Н), 8,03 (м, 1Н).
б) Получение соединения 24.
Соединение (24) синтезируют тем же самым способом, который используют для соединения (23), но заменяя подходящими соединениями, как указано на схеме 31.
Соединение 24.
Данные по ЯМР (ДМСО-d6): δ 0,85 (м, 3Н), 1,15-1,75 (м, 5Н), 2,28 (т, 2Н), 3,10 (м, 1Н), 3,33-3,95 (м, 6Н), 5,18 (м, 2Н), 7,20 (2д, 1Н), 7,55 (м, 3Н), 7,85 (д, 1Н), 8,00 (м, 2Н), 8,95-9,90 (2 шир. с, 2Н).
Микроанализ. Вычислено,%: С 62,7, Н 7,52, N 6,97 (1 HCl, 0,5 H2O).
Найдено,%: С 62,5, Н 7,80, N 6,8.
Соединение (14).
Данные по ЯМР (СDСl3): δ 0,90 (м, 3Н), 1,12-2,10 (м, 6Н), 1,48 (с, 9Н), 2,26 (м, 1Н), 2,50 (м, 1Н), 3,00-5,70 (м, 12Н), 5,87 (м, 1Н), 7,07-8,06 (м, 7Н).
Соединение (19).
Данные по ЯМР (ДМСО-d6, 373oK): δ 0,84 (м, 3Н), 1,30 (м, 3Н), 1,45 (с, 9Н), 1,55 (м, 2Н), 2,34 (м, 3Н), 2,80 (м, 2Н), 3,45 (м, 5Н), 5,10 (м, 2Н), 7,25 (д, 1Н), 7,50 (м, 3Н), 7,80 (д, 1Н), 7,90 (м, 1Н), 8,03 (м, 1Н).
в) Получение соединения (27).
Соединение (27) синтезируют тем же способом, как в эквивалентной стадии для соединения (23), из исходного продукта, N-(нафталин-1-илметил)-N-([2S, 4S]-4-ВОС-сульфанилпирролидин-2-илметил)-2-(пиридин-3-ил)ацетамида (соединение (22)).
Соединение (27).
Данные по ЯМР (ДМСО-d6): δ 1,70 (м, 1Н), 2,50 (м, 1Н), 3,14 (м, 1Н), 3,28-5,10 (м, 7Н), 5,35 (м, 2Н), 7,20-9,00 (м, 11Н), 9,20 (шир. с, 1Н), 10,05-10,50 (2 шир. с, 1Н).
Микроанализ. Вычислено,%: С 55,10, Н 6,60, N 7,97 (2 HCl, 2,25 H2O, 0,3 диэтилового эфира).
Найдено,%: С 54,80, Н 6,10, N 7,60.
Исходный продукт (соединение (22)) синтезировали следующим образом.
Смесь соединения (12) (345 мг), 4-диметиламинопиридина (305 мг), гидрохлорида 3-пиридилуксусной кислоты (262 мг) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (348 мг) в дихлорметане (30 мл) перемешивают при комнатной температуре в атмосфере аргона в течение 16 часов. Смесь затем очищают флэш-хроматографией на колонке с диоксидом кремния при элюировании смесью этилацетат/гексан (75:25) и затем этилацетатом, получая N-(нафталин-1-илметил)-N-([2S, 4S] -1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)-2-(пиридин-3-ил)ацетамид (соединение (17)) в виде бесцветной смолы (394 мг).
Соединение (17).
Данные по ЯМР (ДМСО-d6, 373oК): δ 1,46 (с, 9Н), 1,75 (м, 1Н), 2,50 (м, 1Н), 3,17 (к, 1Н), 3,50 (м, 1Н), 3,75 (м, 4Н), 4,04 (м, 1Н), 4,27 (м, 1Н), 4,45 (м, 2Н), 5,15 (м, 4Н), 5,83 (м, 1Н), 7,25 (м, 2Н), 7,43 (т, 1Н), 7,52 (м, 2Н), 7,58 (м, 1Н), 7,82 (д, 1Н), 7,95 (м, 2Н), 8,40 (д, 2Н).
Используя способ, ранее описанный для эквивалентной стадии в синтезе соединения 23, из соединения (17) синтезируют целевой исходный продукт (соединение (22)).
Соединение (22).
Данные по ЯМР (ДМСО-d6, 373oК): δ 1,45 (с, 9Н), 2,38 (м, 1Н), 2,55-4,00 (м, 10Н), 5,20 (м, 2Н), 7,25 (м, 2Н), 7,50 (м, 4Н), 7,90 (м, 3Н), 8,40 (м, 2Н).
(г) Получение соединения (25).
Соединение (25) синтезируют с использованием соединений 12, 15 и 20 в качестве промежуточных продуктов таким же способом, как в эквивалентных стадиях синтеза соединения (27) (см схему 31).
Соединение (25).
Данные по ЯМР (ДМСО-d6): δ 0,80 (м, 6Н), 0,95-4,80 (м, 14Н), 5,18 (м, 2Н), 7,08 (д, 1Н), 7,55 (м, 3Н), 7,95 (м, 3Н), 8,90-10,15 (2 шир. д, 2Н).
Микроанализ. Вычислено,%: С 59,1, Н 7,30, N 6,27 (2 HCl, 0,2 H2O). \
Найдено,%: С 59,1, Н 6,90, N 5,9.
Соединение (15).
Данные по ЯМР(ДМСО-d6, 373oК): δ 0,85 (м, 6Н), 1,15 (м, 1Н), 1,35 (м, 1Н), 1,45 (с, 9Н), 1,75 (м, 1Н), 1,90 (м, 1Н), 2,17 (м, 1Н), 2,30 (м, 1Н), 2,50 (м, 1Н), 3,15 (к, 1Н), 3,45 (м, 1Н), 3,70 (м, 2Н), 4,03 (к, 1Н), 4,20 (м, 1Н), 4,44 (д, 2Н), 5,10 (м, 4Н), 5,80 (м, 1Н), 7,20 (д, 1Н), 7,50 (м, 3Н), 7,80 (д, 1Н), 7,90 (м, 1Н), 8,00 (м, 1Н).
Соединение (20).
Данные по ЯМР (ДМСО-d6, 373oК): δ 0,85 (м, 6Н), 1,25 (м, 3Н), 1,45 (с, 9Н), 1,93 (м, 1Н), 2,27 (м, 3Н), 3,40 (м, 6Н), 5,13 (м, 2Н), 7,25 (д, 1Н), 7,50 (м, 3Н), 7,80 (д, 1Н), 7,90 (м, 1Н), 8,04 (м, 1Н).
д) Получение соединения (26).
Соединение (26) синтезируют с использованием соединений 12, 16 и 21 в качестве промежуточных продуктов таким же способом, как в эквивалентных стадиях синтеза соединения (27) (см. схему 31).
Соединение (26).
Данные по ЯМР (ДМСО-d6): δ 1,70 (м, 1Н), 2,40-4,15 (м, 14Н), 5,20 (м, 2Н), 7,20 (2д, 1Н), 7,55 (м, 3Н), 7,85 (м, 1Н), 8,00 (м, 2Н), 9,05-10,25 (2 шир. д, 2Н).
Микроанализ. Вычислено,%: С 59,5, Н 6,99, N 6,93 (2 НСl, 0,2 Н2О).
Найдено,%: С 59,3, Н 7,30, N 6,70.
Соединение (16).
Данные по ЯМР: (ДМСО-d6, 373oК) δ 1,45 (с, 9Н), 1,78 (м, 1Н), 2,40-3,80 (м, 12Н), 4,00 (м, 1Н), 4,20 (м, 1Н), 4,45 (м, 2Н), 5,10 (м, 4Н), 5,80 (м, 1Н), 7,20 (д, 1Н), 7,45 (т, 1Н), 7,50 (м, 2Н), 7,80 (д, 1Н), 7,90 (м, 1Н), 8,00 (м, 1Н).
Соединение (21).
Данные по ЯМР (ДМСО-d6, 373oК): δ 1,30 (м, 1Н), 1,48 (с, 9Н), 2,30 (м, 1Н), 2,56-3,70 (м, 14Н), 5,15 (м, 2Н), 7,30 (д, 1Н), 7,47 (т, 1Н), 7,53 (м, 2Н), 7,83 (д, 1Н), 7,94 (м, 1Н), 8,05 (м, 1Н).
е) Получение соединения (54).
Смесь исходного продукта, (2S,4S)-2-[{N-(4-метоксибензил)-N-(нафталин-1-илметил)амино} метил] пирролидин-4-ВОС-тиола (соединение (53)) (100 мг), и трифторуксусной кислоты (5 мл) перемешивают при комнатной температуре в течение 1 часа. Трифторуксусную кислоту удаляют при пониженном давлении и остаток выпаривают вместе с диэтиловым эфиром, получая соединение (54) в виде бесцветной смолы (83 мг).
Данные по ЯМР (СDСl3): δ 1,5 (м, 1Н), 1,75 (шир. д, 1Н), 1,95 (м, 1Н), 2,6 (т, 1Н), 3,05 (м, 1Н), 3,2 (д, 1Н), 3,35 (м, 2Н), 3,85 (с, 3Н), 4,2 (с, 2Н), 4,6 (2д, 2Н), 6,95 (д, 2Н), 7,4 (д, 2Н), 7,6 (м, 4Н), 7,9 (м, 3Н).
Микроанализ. Вычислено,%: С 52,0, Н 5,40, N 3,90 (2,5 ТФУ, 0,4 диэтилового эфира).
Найдено,%: С 52,0, Н 4,92, N 3,96.
Исходный продукт получают следующим образом.
Смесь соединения (12) (240 мг), диметилформамида (20 мл), безводного карбоната калия (80 мг) и п-метоксибензилхлорида (0,143 мл) перемешивают при 70oС в атмосфере аргона в течение 4 часов. Растворитель удаляют при пониженном давлении и остаток очищают колоночной хроматографией при элюировании смесью этилацетат/гексан (20:80), получая бесцветную смолу, (2S,4S)-1-аллилоксикарбонил-2-[{ N-(4-метоксибенил)-N-(нафталин-1-илметил)амино} метил] пирролидин-4-ВОС-тиол (соединение (52)), (213 мг).
Данные по ЯМР (СDСl3): δ 1,45 (с, 9Н), 2,15 (м, 1Н), 2,5 (м, 1Н), 2,8 (м, 1Н), 3,05 (м, 1Н), 3,5 (м, 2Н), 3,8 (шир. с, 7Н), 3,9 (м, 1Н), 4,2 (м, 1Н), 4,6 (с, 2Н), 5,25 (м, 2Н), 5,9 (м, 1Н), 6,85 (д, 2Н), 7,2 (д, 2Н), 7,4 (м, 4Н), 7,8 (2д, 2Н), 8,1 (д, 1Н).
Трибутилоловогидрид (0,77 мл) добавляют к смеси соединения (52) и бис(трифенилфосфин)палладий(0)хлорида (2 мг) в дихлорметане (10 мл). Раствор перемешивают при комнатной температуре в течение 30 минут. Добавляют вторую порцию трибутилоловогидрида (0,335 мл) и бис(трифенилфосфин)палладий(0)хлорида (2 мг) и перемешивание продолжают в течение дополнительных 30 минут. Смесь вводят прямо в колонку для флэш-хроматографии с диоксидом кремния, которую элюируют смесью этилацетат/гексан (25: 75), (50: 50) и в конце этилацетатом. Полученный продукт далее очищают ВЭЖХ с обращенной фазой на колонке с С18 при элюировании смесью вода/метанол/ТФУ (20: 80: 0,2), получая целевой исходный продукт (соединение (53)) в виде бесцветной смолы (168 мг).
Данные по ЯМР (СDСl3): δ 1,45 (с, 9Н), 1,55 (м, 1Н), 2,0 (м, 1Н), 2,5 (м, 1Н), 3,1 (д, 1Н), 3,4 (м, 3Н), 3,6 (т, 1Н), 3,8 (с, 3Н), 4,1 (2д, 2Н), 4,4 (д, 1Н), 4,6 (д, 1Н), 6,95 (д, 2Н), 7,4 (д, 2Н), 7,5 (м, 4Н), 7,9 (м, 3Н).
Микроанализ. Вычислено,%: С 54,4 Н 5,40, N 3,70 (2 ТФУ).
Найдено,%: С 55,0, Н 5,31, N 3,89.
Пример 25 (см. схему 32).
Получение
а) (2S, 4S)-2-[(N-метилнафталин-1-иламино)метил]-4-сульфанилпирролидина (соединение 36) и
б) N-(нафталин-1-ил)-N-((2S, 43)-4-сульфанилпирролидин-2-илметил)-3-метилбутанамида (соединение 37).
Получение соединения 36.
Смесь исходного продукта, (2S,4S)-2-[(N-метилнафталин-1-иламино)метил] -4-ВОС-сульфанилпирролидина (соединение (34)) (110 мг) и трифторуксусной кислоты (5 мл) перемешивают при комнатной температуре в течение 1 часа. Трифторуксусную кислоту удаляют при пониженном давлении и остаток сушат при высоком вакууме, получая соединение (36) в виде бесцветной смолы (110 мг).
Данные по ЯМР (СDСl3): δ 1,7 (м, 1Н), 1,9 (д, 1Н), 2,6 (м, 1Н), 2,95 (с, 3Н), 3,1 (2д, 1Н), 3,5 (м, 1Н), 3,65 (м, 3Н), 4,05 (м, 1Н), 7,0 (шир. с, 1Н), 7,4 (т, 1Н), 7,55 (м, 3Н), 7,7 (д, 1Н), 7,85 (м, 1Н), 8,2 (м, 1Н).
Микроанализ. Найдено,%: С 45,5, Н 4,2, N 5,0 (2,0 ТФУ, 1,0 H2O).
Вычислено,%: С 46,3, Н 4,67, N 5,4.
Исходный продукт для соединения (36) получают следующим образом.
Смесь аллилового эфира (2S,4S)-2-формил-4-ВОС-сульфанилпирролидин-1-карбоновой кислоты (соединение (1)) (711 мг), этанола (25 мл), 1-нафтиламина (333 мг) и молекулярных сит 3 ангстрема (4,5 г) перемешивают в атмосфере аргона при комнатной температуре в течение 6 часов. Добавляют уксусную кислоту (0,4 мл) и затем цианоборогидрид натрия (170 мг). Смесь затем перемешивают в течение дополнительных 20 часов, после чего сита удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и остаток вводят в колонку с диоксидом кремния и элюируют смесью этилацетат/гексан (20: 80), получая (2S,4S)-1-аллилоксикарбонил-2-[(нафталин-1-иламино)метил] -4-ВОС-сульфанилпирролидин (соединение (31)) в виде светлого масла (560 мг).
Данные по ЯМР (СDСl3): δ 1,5 (с, 9Н), 1,85 (м, 1Н), 2,7 (м, 1Н), 3,35 (м, 2Н), 3,5 (м, 1Н), 3,8 (м, 1Н), 4,2 (м, 1Н), 4,5 (м, 1Н), 4,65 (д, 2Н), 5,3 (2д, 2Н), 5,95 (м, 1Н), 6,55 (м, 1Н), 7,2 (д, 1Н), 7,3 (т, 1Н), 7,4 (м, 2Н), 7,75 (м, 1Н), 7,9 (м, 1Н).
Смесь (соединения (31)) (218 мг), диметилформамида (40 мл), иодметана (0,6 мл) и безводного карбоната калия (150 мг) перемешивают при 80oС в течение 20 часов. Растворитель удаляют при пониженном давлении и остаток растворяют в этилацетате (30 мл) и промывают водой (20 мл). Органическую фазу сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении, получая (2S,4S)-1-аллилоксикарбонил-2-[(N-метилнафталин-1-иламино)метил] -4-ВОС-сульфанилпирролидин (соединение (32)) в виде желтой смолы (183 мг).
Данные по ЯМР (СDСl3): δ 1,45 (с, 9Н), 2,0 (м, 1Н), 2,4 (м, 1Н), 2,85 (с, 3Н), 3,0 (2д, 1Н), 3,25 (м, 1Н), 3,7 (2д, 1Н), 3,8 (м, 1Н), 4,1 (м, 2Н), 4,6 (д, 2Н), 5,3 (9м, 2Н), 5,95 (м, 1Н), 7,45 (м, 5Н), 7,8 (м, 1Н), 8,25 (м, 1Н).
К раствору соединения (32) (178 мг) в дихлорметане (10 мл) добавляют три-н-бутилоловогидрид (0,2 мл), затем бис(трифенилфосфин)палладийхлорид (2 мг) и смесь затем перемешивают при комнатной температуре. Через 10 мин и 20 мин добавляют вторую и третью порции три-н-бутилоловогидрида (0,2 мл) и бис(трифенилфосфин)палладийхлорида (2 мг) и перемешивание продолжают в течение дополнительных 90 мин. Реакционный раствор вводят сразу в колонку с диоксидом кремния и элюируют смесью этилацетат/гексан (25:75), (50:50) и этилацетатом. Продукт далее очищают ВЭЖХ с обращенной фазой на колонке с С18, которую элюируют смесью вода/метанол/трифторуксусная кислота (20:80:0,2), получая исходный продукт (соединение (34)) (160 мг) в виде бесцветной смолы.
Данные по ЯМР (СDСl3): δ 1,45 (с, 9Н), 2,2 (с, 1Н), 2,39 (м, 1Н), 2,85 (с, 3Н), 2,9 (2д, 1Н), 3,1 (2д, 1Н), 3,25 (м, 2Н), 3,4 (м, 1Н), 3,6 (м, 1Н), 7,15 (д, 1Н), 7,45 (м, 4Н), 7,8 (м, 1Н), 8,35 (м, 1Н).
Микроанализ. Найдено,%: С 50,8, Н 5,20, N 4,6 (2,0 ТФУ, 0,5 H2O).
Вычислено,%: С 49,3, Н 5,13, N 4,6.
б) Получение соединения (37).
Смесь исходного продукта (соединения (35)) (187 мг) и трифторуксусной кислоты (5 мл) перемешивают при комнатной температуре в течение 1 часа. Трифторуксусную кислоту удаляют при пониженном давлении и остаток сушат в высоком вакууме, получая бесцветную смолу, соединение (37) (200 мг).
Данные по ЯМР (СDСl3): δ 0,8 (м, 6Н), 1,6-2,2 (м, 5Н), 2,6 (м, 1Н), 3,2-5,0 (м, 6Н), 7,6 (м, 5Н), 8,0 (м, 2Н).
Микроанализ. Найдено,%: С 48,4, Н 4,80, N 4,5 (2,0 ТФУ, 1,0 H2O).
Вычислено,%: С 49,0, Н 5,14, N 4,76.
Исходный продукт получают следующим образом.
Изовалерилхлорид (0,164 мл) добавляют по каплям в течение 10 минут к перемешиваемому раствору соединения (31) (297 мг), дихлорметана (50 мл) и триэтиламина (0,136 мл). Раствор перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют при пониженном давлении и остаток вводят сразу в колонку с диоксидом кремния и элюируют смесью этилацетат/гексан (25: 75), получая белую пену, N-(нафталин-1-ил)-N-((2S,4S)-1-аллилоксикарбонил-4-ВОС-сульфанилпирролидин-2-илметил)-3-метилбутанамид (соединение (33)) (329 мг).
Данные по ЯМР (СDСl3): δ 0,75 (м, 6Н), 1,5 (с, 9Н), 1,65-2,7 (м, 5Н), 3,15-6,0 (м, 9Н), 7,25 (м, 1Н), 7,5 (м, 3Н), 7,7 (м, 1Н), 7,9 (м, 2Н).
К раствору соединения (33) (296 мг) в дихлорметане (10 мл) добавляют три-н-бутилоловогидрид (0,3 мл), затем бис(трифенилфосфин)палладийхлорид (2 мг). Раствор перемешивают при комнатной температуре. Через 10 мин и 20 мин добавляют вторую и третью порции три-н-бутилоловогидрида (0,3 мл) и бис(трифенилфосфин)палладийхлорида (2 мг) и перемешивание продолжают в течение дополнительных 30 минут. Реакционный раствор сразу вводят в колонку с диоксидом кремния, который затем элюируют смесью этилацетат/гексан (25:75), (50:50) и этилацетатом. Продукт далее очищают ВЭЖХ с обращенной фазой на колонке с С18 при элюировании смесью вода/метанол/трифторуксусная кислота (20: 80:0,2), получая целевой исходный продукт (соединение (35)) (216 мг).
Данные по ЯМР (СDСl3): δ 0,8 (м, 6Н), 1,49 (с, 9Н), 1,1-2,2 (м, 6Н), 2,9-5,6 (м, 6Н), 7,4-8,0 (м, 7Н).
Микроанализ. Найдено,%: С 57,0, Н 6,20, N 4,80 (1,0 ТФУ, 0,75 Н2O).
Вычислено,%: С 56,9, Н 6,45, N 4,91.
Пример 26 (см схему 33).
Получение
а) 3-метил-N-(3,3-дифенилпропил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)бутанамида (соединение 43) и
б) N-(3,3-дифенилпропил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)бутанамида (соединение 44).
Соединения (43) и (44) синтезируют с использованием способа, описанного в примере 23, применяя подходящие исходные продукты и промежуточные продукты, указанные в схеме 33.
а) Получение соединения (43).
Соединение (43).
Данные по ЯМР (ДМСО-d6 при 373oК): δ 0,9 (д, 6Н), 1,7 (м, 1Н), 2,1 (м, 1Н), 2,33 (м, 2Н), 2,45 (м, 1Н), 2,9-4,00 (м, 9Н), 4,2-4,95 (м, 2Н), 7,3-8,1 (м, 10Н), 9,65 (v. шир. с, 2Н).
Микроанализ. Вычислено,%: С 64,8, Н 7,7, N 5,9 (1,00 HCl, 1 Н2О%).
Найдено,%: С 64,5, Н 7,9, N 6,0.
Исходный продукт, 3-метил-N-(3,3-дифенилпропил)-N-([2S,4S]-4-ВОС-сульфанилпирролидин-2-илметил)бутанамид (соединение 41), синтезируют из соединения (1) и 3,3-дифенилпропиламина с использованием способа, подобного способу, указанному в примере 23.
Соединение (38).
Данные по ЯМР (СDСl3): δ 1,5 (с, 9Н), 1,8 (м, 1Н), 2,19 (м, 2Н), 2,42 (м, 1Н), 2,55 (м, 2Н), 2,7 (м, 1Н), 2,82 (м, 1Н), 3,19 (м, 1Н), 3,67 (м, 1Н), 4,0 (м, 3Н), 4,55 (д, 2Н), 5,2 (2д, 2Н), 5,9 (м, 1Н), 7,2 (м, 10Н).
Соединение (39).
Данные по ЯМР (СDСl3): δ 0,7-1,0 (м, 6Н), 1,22 (м, 1Н), 1,5 (с, 9Н), 1,78-2,02 (м, 2Н), 2,3 (м, 4Н), 3,2 (м, 3Н), 3,4-4,2 (м, 6Н), 4,52 (м, 2Н), 5,21 (м, 2Н), 5,9 (м, 1Н), 7,2 (м, 10Н).
Соединение (41).
Данные по ЯМР (СDСl3): δ 0,75-1,00 (м, 6Н), 1,25 (м, 1Н), 1,5 (с, 9Н), 1,85-2,4 (м, 6Н), 2,83 (м, 1Н), 3,05-3,47 (м, 6Н), 3,6 (м, 1Н), 3,87 (2т, 1Н), 7,25 (м, 10Н).
б) Получение соединения (44).
Характеристические данные приводятся ниже.
Соединение (44).
Данные по ЯМР (ДМСО-d6 при 373oК): δ 1,65 (м, 1Н), 1,85 (с, 3Н), 2,32 (к, 2Н), 2,45 (м, 1Н), 2,69-4,3 (м, 9Н), 7,2 (м, 10Н), 9,37 (v., шир. с, 2Н).
Микроанализ. Вычислено,%: С 63,3, Н 7,3, N 6,6 (1,00 HCl, 0,75 H2O).
Найдено,%: С 63,1, Н 7,3, N 6,7.
Соединение (40).
Данные по ЯМР (СDСl3): δ 1,5 (с, 9Н), 1,82 (с, 3Н), 1,6-2,5 (м, 4Н), 3,2 (м, 3Н), 3,32-4,25 (м, 6Н), 4,54 (м, 2Н), 5,23 (м, 2Н), 5,9 (м, 1Н), 7,23 (м, 10Н).
Соединение (42).
Данные по ЯМР (СDСl3): δ 1,48 (с, 9Н), 1,8 (м, 1Н), 1,87 (с, 2Н), 2,07 (с, 1Н), 2,33 (м, 3Н), 2,83 (м, 1Н), 3,28 (м, 6Н), 3,6 (м, 1Н), 3,85 (м, 1Н), 7,25 (м, 10Н).
Пример 27 (см. схему 34).
Получение
а) 3-метил-N-(нафталин-2-илметил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)бутанамида (соединение 50) и
б) N-(нафталин-2-илметил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)ацетамида (соединение 51).
Соединения (50) и (51) синтезируют с использованием способа, описанного в примере 23, применяя подходящие исходные продукты и промежуточные продукты, указанные в схеме 34.
а) Получение соединения (50).
Соединение 50.
Данные по ЯМР (ДМСО-d6): δ 0,75-1,1 (м, 6Н), 1,63 (м, 1Н), 2,1 (м, 1Н), 2,48 (м, 1Н), 2,83 (м, 3Н), 3,0-4,95 (м, 8Н), 7,17 (м, 7Н).
Микроанализ. Вычислено,%: С 64,2, Н 7,44, N 7,13 (1,0 HC1).
Найдено,%: С 64,0, Н 7,40, N 7,10.
Исходный продукт, 3-метил-N-(нафталин-2-илметил)-N-([2S,4S]-4-ВОС-сульфанилпирролидин-2-илметил)бутанамид (соединение 48), синтезируют из соединения (1) и 2-нафтилметиламина.
Соединение (45).
Данные по ЯМР (СDСl3): δ 1,48 (с, 9Н), 1,92 (м, 1Н), 2,5 (м, 1Н), 2,82 (м, 1Н), 2,96 (м, 1Н), 3,2 (2д, 1Н), 3,7 (м, 1Н), 3,96 (с, 2Н), 4,08 (м, 2Н), 4,54 (м, 2Н), 5,2 (м, 2Н), 5,9 (м, 1Н), 7,42 (м, 3Н), 7,8 (м, 4Н).
Соединение (46).
Данные по ЯМР (СDСl3): δ 0,96 (2д, 6Н), 1,48 (с, 9Н), 1,9 (м, 1Н), 2,13-2,6 (м, 4Н), 3,3 (м, 1Н), 3,72 (м, 2Н), 4,15 (м, 2Н), 4,5 (м, 2Н), 4,76 (м, 1Н), 5,2 (м, 2Н), 5,9 (м, 1Н), 7,48 (м, 3Н), 7,73 (м, 4Н).
Соединение (48).
Данные по ЯМР (СDСl3): δ 0,98 (2д, 6Н), 1,3 (м, 1Н), 1,48 (с, 9Н), 2,3 (м, 4Н), 2,9 (м, 1Н), 3,1-3,7 (м, 5Н), 4,85 (м, 2Н), 7,15-7,9 (м, 7Н).
б) Получение соединения (51).
Характеристические данные приводятся ниже.
Соединение 51.
Данные по ЯМР (ДМСО-d6 при 373oК): δ 1,7 (м, 1Н), 2,14 (с, 3Н), 2,47 (м, 1Н), 2,8-4,00 (м, 6Н), 4,8 (м, 2Н), 7,32-8,1 (м, 7Н).
Микроанализ. Вычислено,%: С 64,2, Н 7,44, N 7,13 (1,00 НС1).
Найдено,%: С 64,0, Н 7,40, N 7,10.
Соединение (47).
Данные по ЯМР (СDСl3): δ 1,5 (с, 9Н), 1,9 (м, 1Н), 2,12 (с, 2Н), 2,29 (с, 1Н), 2,5 (м, 1Н), 3,18-5 (м, 10Н), 5,2 (м, 2Н), 5,95 (м, 1Н), 7,2-7,89 (м, 7Н).
Соединение (49).
Данные по ЯМР (СDСl3): δ 1,3 (м, 1Н), 1,47 (с, 9Н), 2,15 (с, 2Н), 2,3 (с, 1Н), 2,35 (м, 1Н), 2,88 (м, 1Н), 3,1-3,7 (м, 5Н), 4,85 (м, 2Н), 7,4-7,9 (м, 7Н).
Пример 28 (см. схему 35).
Метиловый эфир (2S)-2-({ 4-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино] нафталин-2-карбонил} амино)-4-метилсульфанилмасляной кислоты (соединение 30).
Исходный продукт, метиловый эфир (2S)-2-({4-[([2S,4S]-4-ВОС-сульфанилпирролидин-2-илметил)амино] нафталин-2-карбо-нил} амино)-4-метилсульфанилмасляной кислоты (30е) (72,1 мг, 0,132 ммоль), освобождают от защитной группы (аналогично способу эквивалентной стадии в примере 15), получая указанное в заголовке соединение 30, 76 мг (97,8%).
1H ЯМР (СDСl3+CD3COOD, 200 МГц): δ 1,75-2,0 (1Н, м), 2,0-2,5 (5Н+ ДМСО, м), 2,55-3,0 (3Н, м), 3,15-3,4 (1Н, м), 3,5-3,7 (1Н, м), 3,7-3,9 (6Н, м), 4,2-4,4 (1Н, м), 4,9-5,05 (1Н, м), 7,0-8,1 (6Н, м, ArH).
МС (ESP+) m/z 448 (М+Н)+.
Анализ. Вычислено для С22Н29N3S2О3•1,25ТФУ,%: С 49,9; Н 5,17; N 7,12.
Найдено,%: С 49,6; Н 5,3; N 6,7.
Исходный продукт 30е получают следующим образом.
Соединение 30а.
2-Нафтойную кислоту нитруют конц. НNО3 (Tetrahedron 49, 17, 3655, 1993), получая смесь нитрокислот 30а, содержащую целевую 4-нитро-2-нафтойную кислоту.
МС (ESP-) m/z 216 (М-Н)+.
Соединение 30b.
Оксалилхлорид (6,0 мл, 68,7 ммоль) добавляют по каплям в перемешиваемый раствор смеси нитрокислот 30а (7,3 г, 33,6 ммоль) в смеси ДМФ (1,0 мл) и CH2Cl2 (100 мл) при 0oС в атмосфере аргона. Раствору дают нагреться до комнатной температуры, перемешивают в течение 18 часов, выпаривают досуха и подвергают азеотропной перегонке с толуолом (2•25 мл). Получаемый остаток снова растворяют в CH2Cl2 (100 мл) и охлаждают до 0oС в атмосфере аргона. Добавляют Et3N (7,0 мл, 50 ммоль), затем по порциям добавляют гидрохлорид метилового эфира L-метионина (7,4 г, 37 ммоль) так, чтобы внутренняя температура не превышала 10oС. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 18 часов, промывают водой (100 мл), сушат над МgSO4, фильтруют и концентрируют до получения вязкой коричневой смолы. Ее затем очищают флэш-хроматографией на SiO2 (Merck 9385), элюируя смесью 25% EtOAc/изогексан. Подходящие фракции объединяют и выпаривают, получая 30b в виде вязкой оранжевой смолы, 490 мг (4%).
1H ЯМР (СDСl3, 200 МГц): δ 2,1-2,5 (5Н, м), 2,55-2,75 (2Н, м), 3,85 (3Н, с), 4,9-5,1 (1Н, м), 7,32 (1Н, д), 7,6-8,0 (2Н, м), 8,05 (1Н, дд), 8,5-8,7 (3Н, м).
МС (ESD+) m/z 363 (М+Н)+.
Соединение 30с.
30b (450 мг, 1,24 ммоль) восстанавливают (аналогично способу эквивалентной стадии в примере 22), получая соответствующий анилин 30с в виде желтой смолы, 310 мг (75,3%).
1H ЯМР: (СDСl3, 250 МГц) δ 2,0-2,45 (5Н, м), 2,5-2,75 (2Н, м), 3,83 (3Н, с), 4,3 (2Н, шир. с, NH2), 4,9-5,05 (1Н, м), 7,0 (1H, д, NHCO), 7,2 (1H, д), 7,45-7,65 (2Н, м), 7,72 (1H, с), 7,8-8,0 (2Н, м).
МС (ESP+) m/z 333 (M+H)+, 271, 170.
Соединение 30d.
30с (300 мг, 0,9 ммоль) сочетают с альдегидом 22b (428 мг, 1,36 ммоль) в условиях, используемых для синтеза 22g, с применением МеОН в качестве растворителя и в присутствии молекулярных сит 3 ангстрема в качестве осушающего агента, получая 30d в виде желтой смолы, 460 мг (76,5%).
МС (ЕSР+) m/z 632 (М+Н)+.
Соединение 30е.
30d (450 мг, 0,7 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая целевой исходный продукт 30е, 220 мг (56,4%).
1H ЯМР (СDСl3, 200 МГц): δ 1,4-1,9 (10Н+Н2О, м), 2,0-2,75 (9Н, м), 2,95 (1H, к), 3,1-3,35 (1H, м), 3,35-3,55 (2Н, м), 3,55-3,8 (2Н, м), 3,82 (3Н, с, CO2Me), 4,98 (1H, м), 5,15 (1H, шир. с, NH), 6,9-7,1 (2Н, м, АrН+NHCO), 7,4-7,6 (2Н, м), 7,61 (1H, д), 7,8-8,0 (2Н, м).
МС (ESP+) m/z 548 (М+Н)+, 448.
Пример 29 (см. схему 36).
Получение
а) метилового эфира (2S)-2-({3-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] нафталин-1-карбонил} амино)-4-метилсульфанилмасляной кислоты (соединение 31) и
б) (2S)-2-({3-[([2S,4S]-4-сульфанилпирролидин-2-илметил)-амино]нафталин-1-карбонил}амино)-4-метилсульфанилмасляной кислоты (соединение 31f).
а) Получение соединения 31.
31е (55 мг, 0,1 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии в примере 15), затем обрабатывают Et2O HCl, получая указанное в заголовке соединение 31 в виде белого твердого продукта (37 мг, 64,8%).
1H ЯМР (ДMCO-d6+CD3CO2D, 250 МГц):  1,05 (1H, т, (СН3СH2)2О), 1,6-1,8 (1H, м), 1,9-2,15 (4Н, м), 2,3-2,7 (4Н+ДМСО, м), 3,0-4,0 (9Н+(СН3СН2)2O), 4,55-4,7 (1Н, м), 6,95 (1Н, с), 7,1 (1Н, с), 7,15 (1Н, т), 7,32 (1Н, т), 7,62 (1Н, д), 7,92 (1Н, д).
1,05 (1H, т, (СН3СH2)2О), 1,6-1,8 (1H, м), 1,9-2,15 (4Н, м), 2,3-2,7 (4Н+ДМСО, м), 3,0-4,0 (9Н+(СН3СН2)2O), 4,55-4,7 (1Н, м), 6,95 (1Н, с), 7,1 (1Н, с), 7,15 (1Н, т), 7,32 (1Н, т), 7,62 (1Н, д), 7,92 (1Н, д).
MC (ESP+ )m/z 448 (M+H)+.
Анализ. Вычислено для С22Н29Н3S2O3•2,7НСl,•0,3Et2O,%: С 49,0; Н 6,15; N 7,39.
Найдено,%: С 49,1; Н 6,1; N 7,2.
Соединение 31а.
3-Нитро-1-нафтойную кислоту (31а) синтезируют из 3-нитро-1,8-нафталевого ангидрида в соответствии со способом G.J.Leuck et al (Journal of the American Chemical Society, 51, 1831, 1929).
Соединение 31b.
3-Нитро-1-нафтойную кислоту (31а) (5,0 г, 23,04 ммоль) сочетают с гидрохлоридом метилового эфира L-метионина (аналогично способу эквивалентной стадии в примере 22), получая 31b в виде белого кристаллического твердого продукта, 2,53 г (30,3%).
1H ЯМР (СDСl3, 200 МГц): δ 2,0-2,5 (5Н, м), 2,55-2,75 (2Н, м), 3,85 (3Н, с), 5,05 (1Н, м), 6,9 (1Н, д, NH), 7,6-7,85 (2Н, м), 8,0-8,15 (1Н, м), 8,3-8,5 (2Н, м), 8,83 (1Н, м).
MC (ESP+) m/z 363 (М+Н)+.
Соединение 31с.
31b (2,3 г, 6,35 ммоль) восстанавливают (аналогично способу эквивалентной стадии примера 22), получая соответствующий анилин 31с в виде желтой смолы, 1,75 г (83%).
1H ЯМР (СDСl3, 250 МГц): δ 2,05-2,2 (4Н, м), 2,25-2,45 (1Н, м), 2,63 (2Н, м), 3,83 (3Н, с), 5,03 (1Н, м), 6,66 (1Н, д), 7,05 (1Н, м), 7,15 (1Н, м), 7,28 (1Н, м), 7,39 (1Н, м), 7,6 (1Н, м), 8,15 (1H, м).
MC (ESP+) m/z 333 (М+Н)+, 170.
Соединение 31d.
31с (1,7 г, 5,12 ммоль) сочетают с альдегидом 22b (1,76 г, 5,59 ммоль) (аналогично способу эквивалентной стадии примера 30), получая 31d в виде не совсем белой пены, 2,95 г (91,3%).
1H ЯМР (СDСl3+CD3COOD, 250 МГц): δ 1,5 (9Н, с), 1,9 (1Н, м), 2,0-2,25 (4Н+СН3СООН, м), 2,25-2,44 (1Н, м), 2,55-2,75 (3Н, м), 3,25-3,53 (2Н, м), 3,55-3,7 (1Н, м), 3,7-3,95 (4Н, м), 4,1-4,25 (1Н, м), 4,25-4,4 (1Н, м), 4,55-4,8 (2Н, м), 5,03 (1Н, м), 5,15-5,45 (2Н, м), 5,96 (1Н, м), 6,9-7,5 (4Н+СНСl3, м), 7,66 (1Н, м), 8,1 (1Н, м).
MC (ЕSР+) m/z 632 (М+Н)+.
Соединение 31е.
31d (2,0 г, 3,17 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая целевой исходный продукт 31е в виде бледно-желтой пены, 1,62 г (93,4%).
1H ЯМР (СDСl3, 300 МГц): δ 2,4-2,6 (10Н, м), 1,85 (4Н, шир. с), 2,0-2,2 (4Н, м), 2,35 (1Н, м), 2,5 (1Н, м), 2,65 (2Н, т), 2,9 (1Н, м), 3,1 (1Н, м), 3,3 (1Н, м), 3,4 (1Н, м), 3,55 (1Н, м), 3,65 (1Н, м), 3,8 (3Н, с), 5,02 (1Н, м), 6,65 (1Н, д), 6,9 (1Н, м), 7,1 (1Н, м), 7,2-7,3 (1Н+СНСl3, м), 7,4 (1Н, м), 7,62 (1Н, м), 8,1 (1H, м).
MC (ESP+) m/z 548 (M+H)+,448.
б) Соединение 31f.
31е (180 мг, 0,33 ммоль) гидролизуют (аналогично примеру 16), затем очищают ВЭЖХ с обращенной фазой (препаративная колонка 8 м, C18, Dynamax® 60A) при элюировании смесью 50% MeOH/H2O (0,1% ТФУ), получая продукт 31f в виде белой пены, 126 мг (65,9%).
1H ЯМР: (ДМСО-d6+CD3COOD, 300 МГц) δ 1,5-1,8 (1H, м), 1,9-2,1 (5Н, м), 2,4-2,7 (3Н+ДМСО, м), 3,0-3,1 (1H, м), 3,4-3,7 (4Н, м), 3,75-3,9 (1H, м), 4,57 (1H, м), 6,9 (1H, м), 7,07 (1H, м), 7,17 (1H, м), 7,35 (1Н, м), 7,63 (1Н, м), 7,95(1Н, м).
МС (ESP+) m/z 434 (М+Н)+ 285.
Анализ. Вычислено для C21H27N3S2O3•1,3ТФУ,%: С 48,7; Н 4,9; N 7,22.
Найдено,%: С 48,6; Н 4,9; N 7,1.
Пример 30 (см. схему 37).
Получение
а) метилового эфира (2S)-2-({ 3-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил} амино)-4-метил-сульфанилмасляной кислоты (соединение 32) и
б) (2S)-2-({ 3-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты (соединение 32f).
а) Получение соединения 32.
Исходный продукт, соединение 32е (55 мг, 0,096 ммоль), освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая указанное в заголовке соединение 32 в виде белой пены (56 мг).
1H ЯМР (СDСl3, 250 МГц): δ 1,6-1,85 (1Н, м), 1,9-2,4 (6Н+СН3С5Н6), 2,45-2,7 (3Н, м), 3,1-3,25 (1Н, м), 3,35-4,1 (11Н+Н2О, м), 4,75-4,95 (1Н, м), 6,8 (1H, м), 6,9-7,05 (1Н, м), 7,1-7,55 (6Н+СН3С6Н5+СНСl3, м).
МС (ESP+) m/z 474 (М+Н)+.
Анализ. Вычислено для С24Н31N3S2O3•2ТФУ•0,75 толуола,%: С 51,8; Н 5,1; N 5,45.
Найдено,%: С 51,6; Н 5,2; N 5,1.
Исходный продукт 32е получают следующим образом.
Соединение 32а.
Насыщенный водный раствор NaHCO3 (90 мл) добавляют к перемешиваемому раствору метил-3-бром-5-нитробензоата (4,0 г, 15,38 ммоль) (Mindl and Vecera, Coll. Czech. Chem. Comm. 38, 3496, 1973) и фенилбороновой кислоты (2,0 г, 16,38 ммоль) в диметоксиэтане (180 мл). Добавляют тетракис(трифенилфосфин)палладий(0) (444 мг, 0,38 ммоль) и смесь нагревают для кипячения с обратным холодильником в течение 1 ч. Получаемому черному раствору дают охладиться до комнатной температуры и затем тушат насыщенным водным раствором NаНСО3 (400 мл). Водную фазу экстрагируют EtOAc (200 мл), затем подкисляют до рН 3 при помощи 2 н. НСl. Получаемую суспензию фильтруют, промывают водой и подвергают азеотропной перегонке с толуолом (3•25 мл), получая 32а в виде не совсем белого твердого продукта, которое растирают с изогексаном, фильтруют и сушат, получая 2,6 г (69,5%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 7,5 (3Н, м), 7,8 (2Н, м), 8,4-8,7 (3Н, м).
MC (ESP-) m/z 242 (M-H)-.
Анализ. Вычислено для С13Н9NO4,%: С 64,2; Н 3,73; N 5,76.
Найдено,%: С 64,0; Н 3,7; N 5,6.
Соединение 32b.
32а (3,1 г, 12,76 ммоль) сочетают с гидрохлоридом метилового эфира L-метионина (аналогично способу эквивалентной стадии примера 22), получая 32b, 4,9 г (99%).
1H ЯМР (СDСl3, 200 МГц): δ 2,1-2,45 (5Н, м), 2,65 (2Н, т), 3,83 (3Н, с), 4,99 (1Н, м), 7,2-7,35 (1Н+СНСl3, м), 7,4-7,6 (3Н, м), 7,6-7,7 (2Н, м), 8,38 (1Н, м), 8,58 (2Н, м).
MC (ESP+) m/z 389 (М+Н)+.
Анализ. Вычислено для C19H20N2O5S,%: С 58,8; Н 5,19; N 7,21. Найдено,%: 58,8; Н 5,1; N 7,2.
Соединение 32с.
32b (3,0 г, 7,73 ммоль) восстанавливают (аналогично способу эквивалентной стадии примера 30), получая соответствующий анилин, 32с, 2,43 г (87,8%).
1H ЯМР (СDСl3, 250 МГц): δ 2,0-2,2 (4Н, м), 2,2-2,4 (1Н, м), 2,6 (2Н, м), 3,8 (3Н, с), 3,9 (2Н, шир. с, NH2), 4,93 (1Н, м), 6,93 (1H, д, NHCO), 7,03 (1H, м), 7,12 (1Н, м), 7,3-7,5 (4Н, м), 7,5-7,65 (2Н, м).
MC (ESP+) m/z 359 (М+Н)+.
Соединение 32d.
32с (1,0 г, 2,8 ммоль) сочетают с альдегидом 22b (880 мг, 2,8 ммоль) (аналогично способу эквивалентной стадии примера 30), получая 32d, 1,51 г (82,3%).
1H ЯМР (СDСl3+СD3СООО, 250 МГц): δ 1,5 (9Н, с), 1,8-2,0 (1H,
м), 2,0-2,4 (5Н+СН3СООН, м), 2,5-2,75 (3Н, м), 3,2-3,45 (2Н, м), 3,5-3,7 (1Н, м), 3,7-3,9 (4Н, м), 4,0-4,4 (2Н, м), 4,5-4,75 (2Н, м), 4,9-5,05 (1Н, м), 5,1-5,45 (2Н, м), 5,8-6,1 (1Н, м), 7,03 (1Н, м), 7,1-7,5 (5Н+СНСl3, м), 7,55-7,72Н, м).
МС (ESP+) m/z 658 (М+Н)+.
Анализ. Вычислено для C33H43N3O7S2•0,1H2O,%: С 59,9; Н 6,61; N 6,35.
Найдено,%: С 59,7; Н 6,8; N 6,2.
Соединение 32е.
32d (1,1 г, 1,67 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая целевой исходный продукт 32е, 800 мг (83,4%).
1H ЯМР (СDСl3, 250 МГц): δ 1,25 (1,5Н, т, СН3СОСН3), 1,4-1,6 (10Н, м), 1,9 (2Н, шир. с, NH+H20), 2,0-2,22 (4Н+СН3СН2СО2СН3), 2,23-2,55 (2Н, м), 2,51-2,65 (2Н, м), 2,9 (1Н, м), 3,12 (1Н, м), 3,2-3,75 (4Н, м), 3,8 (3Н, м), 4,13 (1,3Н, к, СН3СН2СО2СН3), 4,45 (1Н, шир. с, NH), 4,95 (1Н, м), 6,85-7,0 (2Н, м, ArH+NHCO), 7,07 (1Н, м), 7,2-7,5 (4Н+СНСl3, м), 7,5-7,65 (2Н, м).
МС (ЕSР+) m/z 574 (М+Н)+, 474.
Анализ. Вычислено для C29H39N3O5S2•0,5 EtOAc,%: С 60,3; Н 7,02; N 6,8.
Найдено,%: С 59,9; Н 7,1; N 6,6.
б) Получение соединения 32f.
Исходный продукт 32е (140 мт, 0,244 ммоль) гидролизуют (аналогично способу эквивалентной стадии примера 31), получая целевой продукт 32f в виде белой пены, 96,3 мг (64,9%).
1H ЯМР (ДМСО-d6+СD3СOOD, 250 МГц): δ 1,5-1,8 (1Н, м), 1,9-2,2 (5Н, м), 3,05 (1Н, к), 3,15-3,6 (7Н, м), 3,65-3,9 (1Н, м), 4,45-4,65 (1Н, м), 6,95-7,05 (1Н, м), 7,05-7,2 (1Н, м), 7,25-7,5 (4Н, м), 7,55-7,7 (2Н, м).
MC (ESP+) m/z 460 (М+Н)+,279.
Анализ. Вычислено для С23Н29N3S2О3•1,3ТФУ,%: С 50,6; Н 5,02; N 6,91.
Найдено,%: С 50,6; Н 5,1; N 7,2.
Исходный продукт получают, как описывается в последнем указанном выше разделе а).
Пример 31 (см. схему 38).
Получение
а) метилового эфира (2S)-2-({ 2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил} амино)-4-метил-сульфанилмасляной кислоты (соединение 33) и
б) (2S)-2-({ 2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты (соединение 33f).
а) Получение соединения 33.
Исходное соединение 33е (53,4 мг, 0,093 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 31), получая указанное в заголовке соединение 33 в виде белого твердого продукта, 43,2 мг (87%).
1H ЯМР (ДМСО-d6+CD3COOD, 300 МГц): δ 1,5-1,9 (3Н+ СН3СООН, м), 1,95 (3Н, с), 2,0-2,3 (2Н, м), 2,4-2,65 (1Н+ДМСО, м), 3,0-3,15 (1Н, м), 3,3-3,9 (8Н, м), 4,25-4,4 (1Н, м), 6,7 (1Н, м), 6,78 (1Н, м), 7,1-7,4 (6Н, м).
МС (CI+) m/z 474 (M+H)+.
Анализ. Вычислено для С24Н31N3S2О3•1,75ТФУ,%: С 53,6; Н 6,14; N 7,82.
Найдено,%: С 53,6; Н 6,3; N 7,7.
Исходный продукт получают следующим способом.
Соединение 33а.
2-Бром-5-нитробензойную кислоту (12,28 г, 0,05 ммоль) сочетают с бензолбороновой кислотой (6,7 г, 0,055 ммоль) (аналогично способу эквивалентной стадии примера 32), получая 33а в виде белого твердого продукта, 10,95 г (90,3%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 7,3-7,5 (5Н, м), 7,65 (1Н, м), 8,35 (1Н, м), 8,45 (1Н, м).
МС (ESP-) m/z 242 (М-Н)-, 198.
Соединение 33b.
33а (3,58 г, 14,7 ммоль) сочетают с гидрохлоридом метилового эфира L-метионина (3,25 г, 16,2 ммоль) (аналогично способу эквивалентной стадии примера 32), получая 33b в виде бледно-желтого твердого продукта, 3,02 г (52,6%).
1H ЯМР (СDСl3, 300 МГц): δ 1,7-2,2 (7Н, м), 3,7 (3Н, с), 4,7 (1Н, м), 6,05 (1Н, м, NH), 7,35-7,6 (6Н, м), 8,33 (1Н, м), 8,55 (1Н, м).
МС (ESP+) m/z 389 (М+Н)+.
Соединение 33с.
33b (1,0 г, 2,6 ммоль) восстанавливают (аналогично способу эквивалентной стадии примера 30), получая соответствующий анилин 33с, 725 мг (78,6%).
1H ЯМР (СDСl3, 300 МГц): δ 1,6-1,8 (1Н, м), 1,8-2,15 (6Н, м), 3,6 (3Н, с), 3,7-3,9 (2Н, шир. с, NH2), 4,6-4,7 (1H, м), 5,85 (1Н, д, NHCO), 6,79 (1H, м), 7,0 (1H, м), 7,15 (1H, д), 7,2-7,45 (5Н+СНСl3, м).
MC (ESP+) m/z 359 (M+H)+,196.
Соединение 33d.
33с (710 мг, 1,98 ммоль) сочетают с альдегидом 22b (625 мг, 1,98 ммоль) (аналогично способу эквивалентной стадии примера 30), получая 33d, 1,1 г (84,4%).
1H ЯМР (СDСl3+CD3COOD, 250 МГц): δ 1,5 (9Н, с), 1,6-2,2 (8Н+СН3СООН, м), 2,5-2,75 (1H, м), 3,2-3,4 (2Н, м), 3,45-3,9 (5Н, м), 4,05-4,35 (2Н, м), 4,5-4,8 (3Н, м), 5,15-5,45 (2Н, м), 5,8-6,1 (1H, м), 6,75-6,9 (1H, м), 6,9-7,05 (1H, м), 7,1-7,23 (1H, м), 7,25-7,45 (5Н+СНСl3, м).
MC (ESP+) m/z 658 (M+H)+.
Анализ. Вычислено для С33Н43N3S2O7,%: С 60,3; Н 6,59; N 6,39.
Найдено,%: С 60,0; Н 6,9; N 6,2.
Соединение 33е.
33d (1,0 г, 1,52 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая целевой исходный продукт 33е, 658 мг (75,4%).
1H ЯМР (СDСl3+СD3СООD, 250 МГц): δ 1,5 (9Н, с), 1,6-2,2 (8Н+ СН3СООН, м), 2,55-2,75 (1H, м), 3,25-3,4 (1H, м), 3,5-3,75 (5Н, м), 3,75-4,2 (3Н, м), 4,55-4,75 (1H, м), 6,7-6,85 (1H, м), 6,85-6,97 (1H, м), 7,1-7,25 (1Н, м), 7,25-7,48 (5Н+СНС13, м).
MC (ESP+) m/z 574 (М+Н)+, 474.
Анализ. Вычислено для C29H39N3O5S2,%: С 60,7; Н 6,85; N 7,32.
Найдено,%: С 60,7; Н 7,20; N 7,30.
б) Получение соединения 33f.
Исходный продукт 33е (100 мг, 0,174 ммоль) гидролизуют (аналогично способу эквивалентной стадии примера 31), получая 33f в виде белой пены, 64,6 мг (59,8%).
1H ЯМР (ДМСО-d6+CD3COOD, 300 МГц): δ 1,5-2,0 (6Н+СН3СООН, м), 2,0-2,3 (2Н, м), 2,3-2,7 (1Н+ДМСО), 3,0-3,1 (1Н, м), 3,2-3,9 (5Н, м), 4,2-4,35 (1Н, м), 6,6-6,9 (2Н, м), 7,1-7,4 (6Н, м).
МС (ESP+) m/z 460 (М+H)+,311.
Анализ. Вычислено для C23H29N3O3S2•1,4ТФУ,%: С 50,0; Н 4,95; N 6,79.
Найдено,%: С 49,9; Н 5,1; N 6,7.
Исходный продукт 33е получают, как описывается в последнем указанном выше разделе а).
Пример 32 (см. схему 39).
Получение
а) метилового эфира (2S)-2-{2-бензил-5-[(4-сульфанилпирролидин-2-илметил)амино]бензоиламино}-4-метилсульфанилмасляной кислоты (соединение 34) и
б) (2S)-2-{ 2-бензил-5-[(4-сульфанилпирролидин-2-илметил)амино] бензоиламино}-4-метилсульфанилмасляной кислоты (соединение 34h).
а) Получение соединения 34.
Исходное соединение 34 (500 мг, 85 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 31), получая указанное в заголовке соединение 34 в виде белого твердого продукта, 454 мг (89,3%).
1H ЯМР (ДМСО-d6 + CD3COOD, 300 МГц): δ 1,5-1,7 (1Н, м), 1,85-2,1 (5Н, м), 2,35-2,6 (3Н+ДМСО, м), 2,9-3,1 (1Н, м), 3,1-3,8 (8Н, м), 3,9 (2Н, к), 4,4-4,6 (1Н, м), 6,5-6,7 (>1Н, м), 6,9-7,0 (1Н, м), 7,0-7,3 (6Н, м).
МС (ESP+) m/z 488 (M+H)+,325.
Анализ. Вычислено для C25H33N3S2O3•HCl,%: С 50,3; Н 6,08; N 7,04.
Найдено,%: С 50,4; Н 6,3; N 7,3.
Исходный продукт 34g получают следующим образом.
Соединение 34а.
Раствор 2-бром-5-нитробензойной кислоты (9,0 г, 36,6 ммоль) в МеОН (200 мл) обрабатывают SO2Cl2 (2,0 мл) и получаемый раствор нагревают для кипячения с обратным холодильником в течение 18 часов. Реакционную смесь затем выпаривают, предварительно абсорбируют на SiO2 (Merck, 9385) и хроматографируют, элюируя смесью 10% EtOAc/изогексан. Подходящие фракции объединяют и выпаривают, получая 34а в виде кристаллического белого продукта, 8,38 г (88,1%).
1H ЯМР (СDСl3, 300 МГц): δ 4,0 (3Н, с, СО2СН3), 7,85 (1Н, м), 8,18 (1Н, м), 8,63 (1Н, м).
Соединение 34b.
Раствор бензилбромида (2,0 мл, 17,3 ммоль) в ТГФ (10 мл) добавляют по каплям при 0oС к перемешиваемой суспензии цинковой пыли (1,7 г, 26 ммоль) в ТГФ (10 мл), которую активируют в соответствии со способом, описанным Knochel (J.O.C., 53, 2392, 1988). Смеси дают нагреться до комнатной температуры и перемешивают в течение 3 часов. Аликвоту (6,5 ммоль) отстоявшейся жидкости, содержащей реагент бензилцинк, затем добавляют к перемешиваемому раствору 34а (1,0 г, 3,85 ммоль) и Pd(PPh3)2Cl2 (27 мг, 0,0385 ммоль) в ТГФ (10 мл) при комнатной температуре в атмосфере аргона. Через 1 ч добавляют вторую аликвоту (6,5 ммоль) реагента бензилцинк. Получаемую черную реакционную смесь тушат 2н. НС1 (250 мл) и экстрагируют EtOAc (2•100 мл). Объединенные органические слои промывают водой (50 мл) и солевым раствором (50 мл), фильтруют через бумагу, разделяющую фазы, и выпаривают до образования оранжевой смолы. Ее хроматографируют на SiO2 (Merck, 9385) при элюировании смесью 10%ЕtOАс/изогесан, получая 34b в виде желтого масла, 590 мг (56,6%).
1H ЯМР (СDСl3, 300 МГц): δ 3,9 (3Н, с, СO2СН3), 4,48 (2Н, с, СН2Рh), 7,0-7,5 (6Н, м), 8,23 (1Н, м), 8,75 (1Н, м).
МС (ESP-) m/z 270 (М-Н)-, 210.
Соединение 34с.
2 н. NaOH (2,0 мл, 4 ммоль) добавляют к раствору 34b (560 мг, 2,06 ммоль) в МеОН (10 мл) при комнатной температуре. Через 2 часа реакционную смесь выпаривают для удаления МеОН и затем распределяют между Et2O (20 мл) и 2 н. NaOH (20 мл). Водный слой подкисляют до рН 2-3 при помощи 2 н. НСl и экстрагируют EtOAc (3•20 мл). Объединенные органические слои промывают водой (20 мл) и солевым раствором (20 мл), фильтруют через бумагу, разделяющую фазы, и выпаривают, получая 34с в виде белого твердого продукта, 453 мг (85,3%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 4,45 (2Н, с, CH2Ph), 7,0-7,4 (5Н, м), 7,55 (1Н, м), 8,3 (1Н, м), 8,53 (1Н, м).
МС (ESP-) m/z 256 (М-Н)-, 212.
Соединение 34d.
34с (630 мг, 2,45 ммоль) сочетают с гидрохлоридом метилового эфира L-метионина (540 мг, 2,7 ммоль) (аналогично способу эквивалентной стадии примера 32), получая 34d в виде бледно-желтого твердого продукта, 900 мг (91,3%).
1H ЯМР (ДМСО-d6, 250 МГц): δ 1,9-2,25 (5Н, м), 2,5-2,75 (2Н+ ДМСО, м), 3,74 (3Н, с, СО2СН3), 4,28 (2Н, к, CH2Ph), 4,55-4,75 (1Н, м), 7,15-7,5 (5Н, м), 7,6 (1Н, м), 8,2-8,35 (2Н, м), 9,13 (1Н, д, NHCO).
МС (ESP+) m/z 403 (М+Н)+.
Соединение 34е.
SnCl2•2H2O (2,5 г, 11,08 ммоль) добавляют к перемешиваемому раствору 34d (900 мг, 2,24 ммоль) в EtOAc (50 мл) и получаемую смесь нагревают для кипячения с обратным холодильником в течение 18 час. Реакционную смесь охлаждают до комнатной температуры и обрабатывают по каплям водным NН3 SG 0,88SO до рН 8. Получаемый тяжелый белый осадок удаляют фильтрованием через целит (545). Фильтраты выпаривают и очищают хроматографией (Меgа Bond Elut, SiO2) при элюировании CH2Cl2 и затем смесью 50%ЕtOАс/изогексан, получая соответствующий анилин 34е, 595 мг (71,4%).
1H ЯМР (СDСl3, 300 МГц): δ 1,75-2,2 (5Н, м), 2,25-2,45 (2Н, м), 3,6-3,8 (5Н, м, CO2CH3+NH2), 4,08 (2Н, к, CH2Ph), 4,65-4,85 (1H, м), 6,24 (1Н, д, NHCO), 6,7 (1Н, м), 6,78 (1H, м), 7,0 (1H, м), 7,05-7,3 (5Н+СНСl3, м).
МС (ESP+) m/z 373 (М+Н)+, 210.
Соединение 34f.
34е (570 мг, 1,53 ммоль) сочетают с альдегидом 22b (580 мг, 1,84 ммоль) (аналогично способу эквивалентной стадии примера 30), получая 34f в виде сырой бледно-зеленой пены (1,54 г).
МС (ESP+) m/z 672 (М+Н)+.
Соединение 34g.
34f (1,5 г, 2,24 ммоль) освобождают от защитной группы (аналогично способу эквивалентной стадии примера 15), получая целевой исходный продукт 34g в виде бледно-коричневого стеклообразного продукта, 550 мг (41,9%).
1H ЯМР (СDСl3, 300 МГц): δ 1,3-1,65 (10Н, м), 1,7-2,2 (5H+H2O, м), 2,25-2,6 (3Н, м), 2,8-3,9 (9Н, м), 3,9-4,25 (2Н, м), 4,6-4,9 (1Н, м), 6,3 (1H, д, NHCO), 6,55-6,8 (2Н, м), 6,9-7,4 (5Н+СНСl3,м).
МС (ESP+) m/z 588 (М+Н)+, 488.
б) Получение соединения 34h.
Исходный продукт 34g (52 мг, 0,087 ммоль) гидролизуют (аналогично способу эквивалентной стадии примера 16), затем очищают ВЭЖХ с обращенной фазой (препаративная колонка 8 м, C18 Dynamax® 60A) при элюировании смесью 50%МеОН/Н2О (0,1% ТФУ), получая 34h в виде бесцветного стеклообразного продукта, 38,2 мг (56,6%).
1H ЯМР (ДМСО-d6+CD3COOD, 300 МГц): δ 1,5-1,7 (1H, м), 1,8-2,1 (5Н+СН3СООН, м), 2,3-2,6 (3Н+ДМСО, м), 2,9-3,1 (1H, м), 3,2-4,1 (7Н, м), 4,3-4,5 (1H, м), 6,5-6,7 (2Н, м), 6,9-7,0 (1H, м), 7,05-7,25 (5Н, м).
MC (ESP+) m/z 474 (М+Н)+.
Анализ. Вычислено для С24Н31N3S2О3•1,4ТФУ,%: С 50,8; Н 5,16; N 6,14.
Найдено,%: С 51,0; Н 5,3; N 6,7.
Исходный продукт получают, как описано в только что приведенном выше разделе а).
Пример 33 (см. схему 40).
Получение
а) метилового эфира (2S)-{2-бензил-4-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] бензоиламино} -4-метилсульфанилмасляной кислоты (соединение 35) и
б) (2S)-{ 2-бензил-4-[([2S, 4S]-4-сульфанилпирролидин-2-илметил) амино] бензоиламино}-4-метилсульфанилмасляной кислоты (соединение 35g).
а) Получение соединения 35.
Указанное в заголовке соединение 35 синтезируют из метил-2-бром-4-нитробензоата с использованием методики, описываемой в примере 32, но применяя Рd2(dbа)3 в качестве источника каталитического палладия в реакции бензилирования.
1H ЯМР (ДМСО-d6+CD3COOD, 300 МГц): δ 1,5-1,7 (1Н, м), 1,8-2,1 (5Н, м), 2,3-2,6 (3Н+ДМСО, м), 2,9-3,1 (1Н, м), 3,2-3,8 (8Н, м), 4,05 (2Н, м), 4,4-4,6 (1Н, м), 6,4-6,6 (2Н, м), 7,0-7,35 (6Н, м).
MC (ESP+) m/z 488 (М+Н)+, 325.
Анализ. Вычислено для С25Н33N3S2О3•НСl,%: С 53,6; Н 6,29; N 7,5. Найдено,%: С 53,5; Н 6,5; N 7,3.
б) Получение соединения 35g.
Соединение 35 (100 мг, 0,18 ммоль, см. а)) гидролизуют (аналогично способу эквивалентной стадии примера 32), получая 35g в виде белого твердого продукта, 85,8 мг (67,3%).
1H ЯМР (ДМСО-d6+СD3СООD, 300 МГц): δ 1,5-1,7 (1Н, м), 1,8-2,1 (5Н, м), 2,3-2,6 (3H+DMSO, м), 2,9-3,9 (6Н, м), 3,95-4,2 (2Н, м), 4,3-4,6 (1Н, м), 6,4-6,5 (2Н, м), 7,0-7,3 (6Н, м).
МС (ESP+) m/z 474 (M+H)+, 325.
Анализ. Вычислено для С24Н31N3S2О3•1,3ТФУ,%: С 51,4; Н 5,24; N 6,76.
Найдено,%: С 51,2; Н 5,4; N 6,7.
Пример 34 (см. схему 41).
Изопропиловый эфир (2S)-2-{2-бензил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино] бензоиламино} -4-метилсульфанилмасляной кислоты (соединение 36).
Нитросоединение 36b восстанавливают в соответствующий анилин, сочетают с тиопролиновым альдегидом 22b с использованием IPA в качестве растворителя и освобождают от защитной группы совершенно аналогично, как в примере 32, получая указанное в заголовке соединение 36.
1H ЯМР (ДМСО-d6 + CD3COOD, 300 МГц): δ 1,0-1,3 (6Н, м), 1,5-1,7 (1H, м), 1,8-2,1 (5Н, м), 2,3-2,6 (3Н+ДМСО, м), 2,9-4,1 (8Н, м), 4,3-4,6 (1H, м), 4,8-5,0 (1H, м), 6,5-6,7 (2Н, м), 6,8-7,3 (6Н, м).
МС (ESP+) m/z 516 (М+Н)+, 325.
Анализ. Вычислено для C27H37N3S2O3•2HCl,%: С 55,1; Н 6,68; N 7,14.
Найдено,%: С 54,9; Н 7,0; N 7,1.
Соединение 36а.
Раствор 34d (25,24 г, 62,78 ммоль) в МеОН (500 мл) обрабатывают 2 н. NaOH (35 мл, 70 ммоль). Получаемый раствор затем выпаривают досуха и твердый остаток распределяют между Et2O (200 мл) и водой (500 мл). Водную фазу затем подкисляют до рН 2 при помощи 2 н. НС1 и экстрагируют EtOAc (2•250 мл). Объединенные органические слои промывают водой (2•100 мл), солевым раствором (100 мл), фильтруют через бумагу, разделяющую фазы, и выпаривают, получая 36а в виде белого твердого продукта, 23,57 г (96,8%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 1,8-2,2 (5Н, м), 2,3-2,6 (2Н+ДМСО, м), 4,1-4,3 (2Н, м), 4,4-4,6 (1Н, м), 7,1-7,3 (5Н, м), 7,4-7,6 (1Н, м), 8,1-8,3 (2Н, м), 8,9-9,0 (1Н, м, NHCO).
МС (ESP-) m/z 387 (М-Н)+.
Соединение 36b.
Сульфурилхлорид (5,0 мл, 62 ммоль)добавляют к перемешиваемой суспензии 36а (19,2 г, 50 ммоль) в IPA (500 мл). Получаемую смесь затем нагревают для кипячения с обратным холодильником в течение 16 час. Реакционную смесь затем выпаривают до 1/5 объема и распределяют между EtOAc (1л) и насыщенным водным раствором NаНСО3 (500 мл). Органические фазы затем промывают водой (200 мл), солевым раствором (200 мл), фильтруют через бумагу, разделяющую фазы, и выпаривают, получая 36b в виде белого твердого продукта, 21,25 г (100%).
1H ЯМР (ДМСО-d6, 300 МГц): δ 1,0-1,3 (6Н, м), 1,8-2,2 (5Н, м), 2,3-2,6 (2Н+ДМСО, м), 4,1-4,3 (2Н, м), 4,4-4,6 (1Н, м), 4,8-5,0 (1Н, м), 7,1-7,3 (5Н, м), 7,4-7,6 (1Н, м), 8,1-8,3 (2Н, м), 9,0 (1H, м, NHCO).
MC (ESP+) m/z 43 (М+Н)+.
Пример 35 (см. схему 42).
Изопропиловый эфир (2S)-2-{ 2-бензил-5-[N-([2S,4S]-4-сульфанилпирролидин-2-илметил)-N-(3-метоксипропионил)амино] бензоиламино} -4-метилсульфанилмасляной кислоты (соединение 37).
Исходный продукт 37b освобождают от защитной группы с использованием методики эквивалентной стадии, описанной в примере 32, получая указанное в заголовке соединение 37.
1H ЯМР (ДМСО-d6+CD3COOD, 300 МГц): δ 1,0-1,3 (6Н, м), 1,5-1,7 (1H, м), 1,8-2,1 (5Н, м), 2,2-2,6 (5Н+ДМСО, м), 2,9-3,95 (10Н, м), 4,0-4,2 (3Н, м), 4,4-4,6 (1H, м), 4,8-5,0 (1H, м), 7,0-7,5 (8Н, м).
MC (ESP+) m/z 602 (М+Н)+.
Анализ. Вычислено для C31H43N3S2O3•1,5НСl,%: С 56,7; Н 6,83; N 6,4.
Найдено,%: С 56,7; Н 7,0; N 6,0.
Исходное соединение получают следующим образом.
EEDQ (530 мг, 2,15 ммоль) добавляют к перемешиваемому раствору 36d (1,5 г, 2,15 ммоль; см. пример 34) и 3-метоксипропионовой кислоты (220 мл, 2,36 ммоль) в CH2Cl2 (15 мл). Смесь перемешивают в течение 18 час при комнатной температуре и затем выпаривают. Остаток затем распределяют между 1 н. водной лимонной кислотой (200 мл) и EtOAc (100 мл). Органические слои промывают насыщенным водным NаНСО3 (50 мл), водой (50 мл) и солевым раствором (50 мл), фильтруют через бумагу, разделяющую фазы, и выпаривают, получая бледно-желтую смолу. Ее затем очищают флэш-хроматографией на SiO2 (Merck 9385) при элюировании смесью EtOAc/изогексан с градиентом EtOAc 0-50%. Подходящие фракции фильтруют и выпаривают, получая исходный продукт 37b в виде бесцветной смолы, 1,14 г (67,7%).
МС (ESP+) m/z 786 (М+Н)+.
Пример 36 (см. схему 43).
Получение
а) N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-1-илэтил)бутирамида (соединение 56) и
б) N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-N-(2-нафталин-1-илэтил)-2-пиридин-3-илацетамида (соединение 57).
а) Получение соединения 56.
Способ, описанный в примере 23 для синтеза соединения (6), используют для получения соединения (56), как указано в схеме 43.
Данные по ЯМР в СDСl3: δ 0,91 (с, 9Н), 1,5 (м, 1Н), 1,75 (м, 1Н), 1,82 (д, 1Н), 1,91 (д, 1Н), 2,52 (м, 1Н), 2,92 (м, 1Н), 3,33 (м, 3Н), 3,72 (м, 4Н), 4,15 (м, 1Н), 7,26 (д, 1Н), 7,41 (т, 1Н), 7,56 (м, 2Н), 7,8 (д, 1Н), 7,9 (2д, 2Н), 9,08 (шир. с, 1Н).
Микроанализ: % теоретический С 64,2, Н 7,97, N 6,5 (1,00 HCl, 0,5 H2O); % найденный С 64,4, Н 7,90, N 6,3.
Исходный продукт, соединение (54), синтезируют аналогично примеру 23, используя подходящие промежуточные продукты:
Соединение (52).
Данные по ЯМР в СDСl3: δ 1,00 (2с, 9Н), 1,46 (д, 9Н), 1,95 (м, 2Н), 2,4 (м, 2Н), 3,3 (м, 4Н), 3,7 (м, 3Н), 4,00 (м, 3Н), 4,57 (д, 2Н), 5,22 (2д, 2Н), 5,90 (м, 1Н), 7,24-8,4 (м, 7Н).
Соединение (54).
Данные по ЯМР в СDСl3: δ 1,00 (2с, 9Н), 1,35 (м, 1Н), 1,49 (с, 9Н), 1,89 (шир. с, 1Н), 1,95 (д, 1Н), 2,3 (м, 1Н), 2,32 (д, 1Н), 2,88 (2к, 1Н), 3,1-3,9 (м, 9Н), 7,25-8,31 (м, 7Н).
б) Получение соединения 57.
Способ, описанный в примере 24 для синтеза соединения (27), используют подобным образом для получения соединения (57).
Данные по ЯМР в СDСl3: δ 1,2 (м, 1Н), 2,00 (м, 1Н), 2,6 (м, 2Н), 3,15-4,40 (м, 10Н), 7,28-8,70 (м, 11Н), 9,4 (шир. с, 1Н).
Микроанализ: % теоретический С 56,0, Н 6,20, N 8,17 (2 HCl, 2 H2O); % найденный С 56,4, Н 6,46, N 7,70.
Исходный продукт, соединение (55), синтезируют аналогично способу примера 24, используя подходящие промежуточные продукты.
Соединение (53).
Данные по ЯМР в СDСl3: δ 1,48 (с, 9Н), 1,84 (м, 1Н), 2,42 (м, 1Н), 2,87-3,45 (м, 5Н), 3,63-4,26 (м, 7Н), 4,55 (д, 2Н), 5,22 (2д, 2Н), 5,9 (м, 1Н), 7,1-8,7 (м, 11Н).
Соединение (55).
Данные по ЯМР в СDСl3: δ 1,34 (м, 1Н), 1,5 (с, 9Н), 1,95 (м, 1Н), 2,32 (м, 2Н), 2,72-4,00 (м, 10Н), 7,1-8,6 (м, 11Н).
Пример 37 (см. схему 44).
Получение
а) N-(2,2-дифенилэтил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3-метилбутирамида (соединение 67);
б) N-(2,2-дифенилэтил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-3,3-диметилбутирамида (соединение 68);
в) N-(2,2-дифенилэтил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-2-пиридин-3-илацетамида (соединение 69) и
г) N-(2,2-дифенилэтил)-N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-6-метоксиникотинамида (соединение 70).
а) Получение соединения 67.
Способ, описанный в примере 23 для синтеза соединения (6), используют аналогичным образом для получения соединения (67) с использованием подходящих промежуточных продуктов, см. схему 44.
Данные по ЯМР в ДМСО-d6: δ 0,75 (м, 6Н), 1,55 (м, 1Н), 1,87 (м, 2Н), 2,05-2,45 (м, 1Н), 3,05 (м, 1Н), 3,25-3,70 (м, 6Н), 4,05 (м, 2Н), 4,20-4,55 (м, 1Н), 7,30 (м, 10Н), 8,80-9,80 (2 шир. с, 2Н).
Микроанализ: % теоретический С 63,9, Н 7,82, N 6,21 (1,00 HCl, 1,00 Н2О); % найденный С 64,1, Н 7,70, N 6,00.
Соединение (58).
Данные по ЯМР в СDСl3: δ 1,50 (с, 9Н), 1,77 (м, 1Н), 2,40 (м, 1Н), 2,75 (м, 1Н), 3,00 (м, 1Н), 3,14 (к, 1Н), 3,24 (д, 2Н), 3,67 (м, 1Н), 3,93 (м, 1Н), 4,10 (м, 2Н), 4,54 (д, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 7,25 (м, 10Н).
Соединение (59).
Данные по ЯМР в СDСl3: δ 0,85 (м, 6Н), 1,48 (м, 9Н), 1,80 (м, 2Н), 2,10 (м, 2Н), 2,40 (м, 1Н), 2,80-4,35 (м, 9Н), 4,55 (м, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 7,25 (м, 10Н).
Соединение (63).
Данные по ЯМР в СDСl3: δ 0,85 (2д, 6Н), 1,24 (м, 1Н), 1,48 (с, 9Н), 1,68 (м, 1Н), 1,81 (д, 1Н), 1,95-2,35 (м, 3Н), 2,75-3,65 (м, 6Н), 3,90-4,55 (м, 3Н), 7,25 (м, 10Н).
б) Получение соединения 68.
Соединение (68) синтезируют подобным образом из соединения (60), как указано на схеме 44.
Соединение (68).
Данные по ЯМР в ДМСО-d6: δ 0,85 (м, 9Н), 1,55 (м, 1Н), 1,74-2,27 (м, 2Н), 2,37 (м, 1Н), 3,05 (м, 1Н), 3,45 (м, 6Н), 4,05 (м, 2Н), 4,18-4,55 (м, 1Н), 7,28 (м,10Н), 8,90-9,90 (м, 2Н).
Микроанализ: % теоретический С 64,6, Н 8,02, N 6,02 (1,0 HCl, 1,0 H2O);% найденный С 64,8, Н 8,30, N 5,70.
Соединение (60).
Данные по ЯМР в СDСl3: δ 0,93 (м, 9Н), 1,50 (с, 9Н), 1,82 (м, 2Н), 2,35 (м, 3Н), 2,90-4,35 (м, 8Н), 4,55 (м, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 7,25 (м, 10Н).
Соединение (64).
Данные по ЯМР в СDСl3: δ 0,93 (с, 9Н), 1,24 (м, 1Н), 1,48 (с, 9Н), 1,80 (к, 1Н), 2,23 (д, 1Н), 2,30 (м, 1Н), 2,75-3,70 (м, 6Н), 3,90-4,60 (м, 3Н), 7,25 (м, 10Н).
в) Получение соединения 69.
Соединение (69) синтезируют из соединения (61) (см. схему 44) аналогично способу, описанному в примере 24 для получения соединения (27).
Данные по ЯМР в СDСl3: δ 1,95 (м, 1Н), 2,40 (м, 1Н), 2,60 (м, 1Н), 3,15-4,50 (м, 11Н), 7,28 (м, 10Н), 7,67 (м, 1Н),8,05 (м, 1Н), 8,50 (м, 1Н), 8,71 (м, 1Н), 9,10-10,20 (шир. д, 2Н).
Микроанализ: % теоретический С 55,1, Н 5,51, N 7,01 (2,0 HCl, 0,75 ТФУ, 0,5 H2O); % найденный С 55,0, Н 5,60, N 6,90.
Соединение (61).
Данные по ЯМР в СDСl3: δ 1,47 (с, 9Н), 1,80 (м, 1Н), 2,30-4,65 (м, 14Н), 5,23 (м, 2Н), 5,90 (м, 1Н), 7,25 (м, 12Н), 8,10-8,55 (м, 2Н).
Соединение (65).
Данные по ЯМР в СDСl3: δ 1,25 (м, 1Н), 1,48 (с, 9Н), 2,30 (м, 1Н), 2,70-4,55 (м, 12Н), 7,30 (м, 12Н), 8,28 (2д, 1Н), 8,45 (м, 1Н).
г) Получение соединения 70.
Аналогичным образом соединение (70) синтезируют из соединения (62), используя подходящие промежуточные продукты.
Данные по ЯМР в СDСl:3 δ 1,67 (м, 1Н), 2,15 (д, 1Н), 2,47 (м, 1Н), 3,16 (шир. с, 1Н), 3,50 (м, 2Н), 3,85-4,40 (м, 8Н), 5,22 (шир. с, 1Н), 6,56 (д, 1Н), 7,00-7,35 (м, 11Н), 7,90 (с, 1Н), 8,85-10,75 (2 шир. с, 2Н).
Микроанализ: % теоретический С 57,2, Н 5,91, N 7,70 (2,0 HC1, 0,5 H2O)%; найденный С 57,5, Н 5,60, N 7,30.
Соединение (62).
Данные по ЯМР в СDСl3: δ 1,50 (с,9Н), 1,60 (м, 1Н), 2,47 (м, 1Н), 3,00-4,50 (м, 12Н), 4,58 (д, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 6,53 (д, 1H), 6,95 (м, 1Н), 7,25 (м, 11Н).
Соединение (66).
Данные по ЯМР в СDСl3: δ 1,20 (м, 1Н), 1,45 (с, 9Н), 2,30 (м, 1Н), 2,66 (м, 1H), 3,00-3,45 (м, 4Н), 3,55 (м, 1Н), 3,95-4,25 (м, 5Н), 4,47 (м, 1H), 6,55 (д, 1H), 7,25 (м, 11Н), 7,65 (м, 1H).
Пример 38 (см. схему 45).
Получение
а) N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3-метил-N-(2-нафталин-2-илэтил)бутирамида (соединение 80);
б) N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-2-илэтил)бутирамида (соединение 81);
в) N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-N-(2-нафталин-2-илэтил)-2-пиридин-3-илацетамида (соединение 82) и
г) N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-2-(4-метоксифенил)-N-(2-нафталин-2-илэтил)ацетамида (соединение 83).
а) Получение соединения 80.
Способ, описанный в примере 23 для синтеза соединения (6), используют для получения соединения (80).
Данные по ЯМР в ДМСО-d6: δ 0,87 (д, 1Н), 1,65 (м, 1Н), 1,92 (м, 1Н), 2,02 (д, 1Н), 3,03 (м, 3Н), 3,20-3,80 (м, 9Н), 7,48 (м, 3Н), 7,75 (д, 1Н), 7,85 (м, 3Н), 8,90-9,90 (шир. д, 2Н).
Микроанализ: % теоретический С 64,9, Н 7,68, N 6,88 (1,00 HCl); % найденный С 64,9, Н 7,50, N 6,80.
Исходный продукт, соединение (76), синтезируют аналогично примеру 23, используя подходящие промежуточные продукты, см. схему 45.
Соединение (71).
Данные по ЯМР в СDСl3: δ 1,50 (с, 9Н), 1,85 (м, 1Н), 2,50 (м, 1Н), 2,80 (м, 1Н), 3,00 (м, 5Н), 3,20 (м, 1Н), 3,65 (м, 1Н), 4,00 (м, 1Н), 4,10 (м, 1Н), 4,53 (д, 2Н), 5,20 (м, 2Н), 5,90 (м, 1Н), 7,32 (м, 1Н), 7,42 (м, 2Н), 7,63 (с, 1Н), 7,80 (м, 3Н).
Соединение (72).
Данные по ЯМР в СDСl3: δ 0,90 (м, 7Н), 1,00-2,60 (м, 14Н), 3,00 (м, 2Н), 3,10-4,20 (м, 7Н), 4,60 (м, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 7,30-7,50 (м, 2Н), 7,60 (м, 1Н), 7,80 (м, 3Н).
Соединение (76).
Данные по ЯМР в СDСl3: δ 0,90 (м, 6Н), 1,10-2,50 (м, 15Н), 2,80-3,80 (м, 9Н), 7,26-7,50 (м, 3Н), 7,60 (м, 1Н), 7,80 (м, 3Н).
б) Получение соединения 81.
Соединение (81) синтезируют из соединения (73), как указано на схеме 45, аналогично способу получения соединения 80 (см. выше).
Данные по ЯМР в ДМСО-d6: δ 1,08 (д, 9Н), 1,80 (м, 1Н), 2,15 (м, 2Н), 2,65 (м, 1Н), 3,00-4,00 (м, 10Н), 7,63 (м, 3Н), 7,90 (с, 1Н), 8,03 (м, 3Н), 9,50 (шир. д, 2Н).
Микроанализ: % теоретический С 64,9, Н 7,93, N 6,58 (1,0 HCl, 0,25 Н2O); % найденный С 64,8, Н 8,10, N 6,50.
Соединение (73).
Данные по ЯМР в СDСl3: δ 1,00 (с, 9Н), 1,47 (с, 9Н), 1,80-2,55 (м, 4Н), 3,00 (м, 2Н), 3,10-4,20 (м, 8Н), 4,60 (д, 2Н), 5,25 (м, 2Н), 5,90 (м, 1Н), 7,30-7,85 (м, 7Н).
Соединение (77).
Данные по ЯМР в ДМСО-d6 (100oС): δ 0,95 (м, 9Н), 1,35-1,75 (м, 9Н), 2,15 (с, 2Н), 2,40 (м, 1Н), 2,60-3,90 (м, 12Н), 7,40 (м, 3Н), 7,70 (м, 1Н), 7,80 (м, 3Н).
в) Получение соединения 82.
Соединение (82) синтезируют из соединения (74), как указывается на схеме 45, способом, подобным способу, описанному в примере 24 для получения соединения (27).
Соединение (82).
Данные по ЯМР в ДМСО-d6: δ 1,65 (м, 1Н), 2,90-4,15 (м, 14Н), 7,35-8,90 (м, 11Н), 9,50 (шир. д, 2Н).
Микроанализ: % теоретический С 51,9, Н 5,19, N 6,99 (2,0 HCl, 1,0 ТФУ, 0,5% H2O); найденный С 52,2, Н 5,40, N 7,00.
Соединение (74).
Данные по ЯМР в ДМСО-d6 (100oС): δ 1,45-1,75 (м, 10Н), 2,85-3,85 (м, 11Н), 4,03 (м, 1Н), 4,20 (м, 1Н), 4,45-4,65 (м, 2Н), 5,20 (м, 2Н), 5,90 (м, 1H), 7,23 (м, 1Н), 7,45 (м, 4Н), 7,67 (с, 1H), 7,80 (м, 3Н), 8,35 (м, 2Н).
Соединение (78).
Данные по ЯМР в ДМСО-d6 (100oС): δ 1,30-1,75 (м, 9Н), 2,40 (м, 1H), 2,55-3,90 (м, 14Н), 7,10-8,45 (м, 11Н).
г) Получение соединения 83.
Аналогичным образом соединение (83) синтезируют из соединения (75) с использованием подходящих промежуточных продуктов, как указывается в схеме 45.
Соединение (85).
Данные по ЯМР в ДМСО-d6: δ 1,65 (м, 1H), 2,95 (м, 2Н), 3,08 (м, 1H), 3,25-4,00 (м, 13Н), 6,80 (м, 2Н), 7,06 (2д, 2Н), 7,47 (м, 3Н), 7,68 (д, 1H), 7,85 (м, 3Н), 9,35 (шир. д, 2Н).
Микроанализ: % теоретический С 62,7, Н 6,57, N 5,62 (1,5 HCl, 0,5 H2O); % найденный С 62,4, Н 6,50, N 5,40.
Соединение (75).
Данные по ЯМР в ДМСО-d6 (100oС):  1,45 (с, 9Н), 1,75 (м, 1H), 2,75-3,85 (м, 14Н), 4,00 (м, 1H), 4,14 (м, 1H), 4,45-4,65 (м, 2Н), 5,20 (м, 2Н), 5,90 (м, 1H), 6,80 (м, 2Н), 7,05 (м, 2Н), 7,33 (м, 1H), 7,45 (м, 2Н), 7,63 (с, 1H), 7,80 (м, 3Н).
1,45 (с, 9Н), 1,75 (м, 1H), 2,75-3,85 (м, 14Н), 4,00 (м, 1H), 4,14 (м, 1H), 4,45-4,65 (м, 2Н), 5,20 (м, 2Н), 5,90 (м, 1H), 6,80 (м, 2Н), 7,05 (м, 2Н), 7,33 (м, 1H), 7,45 (м, 2Н), 7,63 (с, 1H), 7,80 (м, 3Н).
Соединение (79).
Данные по ЯМР в ДМСО-d6 (100oС): δ 1,30-1,75 (м, 9Н), 2,35 (м, 1H), 2,60-3,90 (м, 17Н), 6,78 (м, 2Н), 7,05 (м, 2Н), 7,40 (м, 3Н), 7,65 (м, 1H), 7,80 (м, 3Н).
Пример 39 (см. схему 46).
Получение
а) метиловый эфир (2S)-2-({2-фенил-4-[((2S,4S)-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил} амино)-4-метил-сульфанилмасляной кислоты (соединение 38) и
б) (2S)-2-({ 2-фенил-4-[((2S,4S)-4-сульфанилпирролидин-2-илметил)амино] фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты (соединение 38f).
а) Получение соединения 38.
Метил-2-бром-4-нитробензоат сочетают с фенилбороновой кислотой (аналогично эквивалентной стадии примера 30), затем сочетают и освобождают от защитной группы, как ранее описано в примере 32, получая указанное в заголовке соединение 38.
1H ЯМР: (ДМСО-d6, 250 МГц) δ 1,35-1,75 (3Н, м), 1,8 (3Н, с), 1,9-2,2 (2Н, м), 2,25-2,5 (2Н+ДМСО, м), 2,75-3,9 (10Н, м), 4,0-4,25 (1Н, м), 5,0-5,9 (5Н, шир. с, Н2О), 6,3-6,6 (2Н, м), 7,0-7,3 (7Н, м), 7,95 (1Н, м), 9,2-9,8 (2Н, шир. д).
МС (ESP+) m/z 474 (М+Н)+,311, 196.
Анализ. Вычислено для С24Н31N3О3S2•2НСl•1,5 Н2О,%: С 50,3; Н 6,3; N 7,3.
Найдено,%: С 50,4; Н 6,1; N 7,3.
б) Получение соединения 38f.
Соединение 38 гидролизуют в соответствующую кислоту (аналогично эквивалентной стадии примера 33), получая 38f.
1H ЯМР (ДМСО-d6+СD3СООD, 300 МГц): δ 1,5-1,9 (3Н+СD3СООD, м), 1,95 (3Н, с), 2,05-2,35 (2Н, м), 2,4-2,6 (2Н+ДМСО, м), 3,0-3,1 (1Н, м), 3,2-3,9 (4Н, м), 4,2-4,3 (1Н, м), 6,5-6,7 (2Н, м), 7,2-7,4 (6Н, м).
MC (ESP+) m/z 460 (M+H)+, 311.
Анализ. Вычислено для С23Н29N3О3S2•1,35ТФУ,%: С 50,3; Н 4,99; N 6,85.
Найдено,%: С 50,2; Н 5,1; N 6,8.
Пример 40. Фармацевтические композиции.
Ниже представлены репрезентативные фармацевтические формы изобретения, как определено здесь (активный ингредиент называется "Соединением X"), для терапевтического или профилактического использования для людей:
а) Таблетка I - мг/таблетку
Соединение Х - 100
Лактоза Ph.Eur. - 182,75
Натриевая соль кроскармеллозы - 12,0
Паста маисового крахмала (5% мас./об.) - 2,25
Стеарат магния - 3,0
б) Таблетка II - мг/таблетку
Соединение Х - 50
Лактоза Ph. Eur. - 223,75
Натриевая соль кроскармеллозы - 6,0
Маисовый крахмал - 15,0
Поливинилпирролидон (5%, мас./об. паста) - 2,25
Стеарат магния - 3,0
в) Таблетка III - мг/таблетку
Соединение Х - 1,0
Лактоза Ph. Eur. - 93,25
Натриевая соль кроскармеллозы - 4,0
Паста маисового крахмала (5% мас./об.) - 0,75
Стеарат магния - 1,0
г) Капсула - мг/капсулу
Соединение X - 10
Лактоза Ph. Eur. - 488,5
Магний - 1,5
Инъекция I - (50 мг/мл)
Соединение X - 5,0% мас./об.
1 М раствор гидроксида натрия, 0,1 М соляная кислота (до установления рН 7,6) - 15% мас./об.
Полиэтиленгликоль 400 - 4,5% мас./об.
Вода для инъекции - до 100%
Инъекция II - (10 мг/мл)
Соединение Х - 1,0% мас./об.
Фосфат натрия ВР - 3,6% мас./об.
0,1 М раствор гидроксида натрия - 15,0% об./об.
Вода для инъекции - до 100%
Инъекция III - 1 мг/мл, забуференный до рН 6
Соединение X - 0,1% мас./об.
Фосфат натрия ВР - 2,26% мас./об.
Лимонная кислота - 0,38% мас./об.
Полиэтиленгликоль 400 - 3,5% мас./об.
Вода для инъекции до 100% -
Аэрозоль I - мг/мл
Соединение Х - 10,0
Триолеат сорбитана - 13,5
Трихлорфторметан - 910,0
Дихлордифторметан - 490,0
Аэрозоль II - мг/мл
Соединение Х - 0,2
Триолеат сорбитана - 0,27
Трихлорфторметан - 70,0
Дихлордифторметан - 280,0
Дихлортетрафторэтан - 1094,0
Аэрозоль III - мг/мл
Соединение Х - 2,5
Триолеат сорбитана - 3,38
Трихлорфторметан - 67,5
Дихлордифторметан - 1086,0
Дихлортетрафторэтан - 191,6
Аэрозоль IV - мг/мл
Соединение Х - 2,5
Соевый лецитин - 2,7
Трихлорфторметан - 67,5
Дихлордифторметан - 1086,0
Дихлортетрафторэтан - 191,6
Мазь - мл
Соединение Х - 40 мг
Этанол - 300 мкл
Вода - 300 мкл
1-Додецилазациклогептан-2-он - 50 мкл
Пропиленгликоль - до 1 мл
Примечание. Указанные выше готовые препаративные формы можно получить обычными способами, хорошо известными в фармацевтической области. Таблетки (а)-(с) могут быть покрыты энтеросолюбильной оболочкой обычными способами, например, для образования оболочки из смешанного ацетата и фталата целлюлозы. Аэрозольные готовые препаративные формы (h)-(k) можно использовать вместе со стандартными аэрозольными приспособлениями для поставки измеренной дозы и суспендирующие агенты триолеат сорбитана и соевый лецитин можно заменить другим суспендирующим агентом, таким как моноолеат сорбитана, сесквиолеат сорбитана, полисорбат 80, олеат полиглицерина или олеиновая кислота.
Пример 41 (см. схему 47).
Получение
а) (2S)-4-карбамоил-2-({ 2-фенил-5-[([2S, 4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)масляной кислоты (соединение 39е) и
б) метилового эфира (2S)-4-карбамоил-2-({2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)маляной кислоты (соединение 39).
а) Получение соединения 39.
Соединение 39а.
32а (1,5 г, 6,2 ммоль) сочетают с метиловым эфиром L-глутамина (аналогично эквивалентной стадии примера 30), получая соединение 39а в виде белого твердого продукта, 1,2 г (50,5%).
МС (ЕSР)+ m/z 386 (М+Н)+.
Соединения 39.
39а восстанавливают, сочетают с альдегидом (22b) и селективно освобождают от защитной группы с использованием такой же методики, как ранее описана для примера 32, получая указанное в заголовке соединение 39.
МС (ЕSР+) m/z 471 (М+Н)+.
Анализ. Вычислено для С24Н30N4O4S•3НСl•0,25Н2О,%: С 49,3; Н 5,8; N 9,6.
Найдено,%: С 49,2; Н 5,9; N 9,2.
б) Получение соединения 39е.
39 гидролизуют (аналогично эквивалентной стадии примера 32), получая указанное в заголовке соединение 39е.
МС (ESP-) m/z 455 (М-Н)+.
Анализ. Вычислено для С23Н28N4O4S•2ТФУ,%: С 47,4; Н 4,4; N 8,2.
Найдено,%: С 47,0; Н 4,5; N 7,9.
| название | год | авторы | номер документа |
|---|---|---|---|
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2198878C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2182574C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ, И СПОСОБ ПОЛУЧЕНИЯ АНТИАНГИОГЕННОГО ЭФФЕКТА И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ СОСУДИСТОЙ ПРОНИЦАЕМОСТИ С ИХ ПРИМЕНЕНИЕМ | 1996 |
|
RU2194701C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ДОСТИЖЕНИЯ АНТИАНГИОГЕННОГО И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ ПРОНИЦАЕМОСТИ КРОВЕНОСНЫХ СОСУДОВ У ТЕПЛОКРОВНОГО ЖИВОТНОГО | 1997 |
|
RU2198879C2 |
| АНТИБАКТЕРИАЛЬНЫЕ АГЕНТЫ | 1999 |
|
RU2246941C2 |
| ЦИТОСТАТИЧЕСКИЕ АГЕНТЫ | 1998 |
|
RU2187499C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛИРОВАННОГО ИНДОЛА И (2-НИТРОФЕНИЛ)-АЦЕТАЛЬДЕГИД | 1991 |
|
RU2054417C1 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ АУТОИММУННЫХ ИЛИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2196770C2 |
| ФЕНИКОЛОВЫЕ ПРОТИВОБАКТЕРИАЛЬНЫЕ СРЕДСТВА | 2013 |
|
RU2593204C2 |
| НОВЫЕ ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2443687C2 |

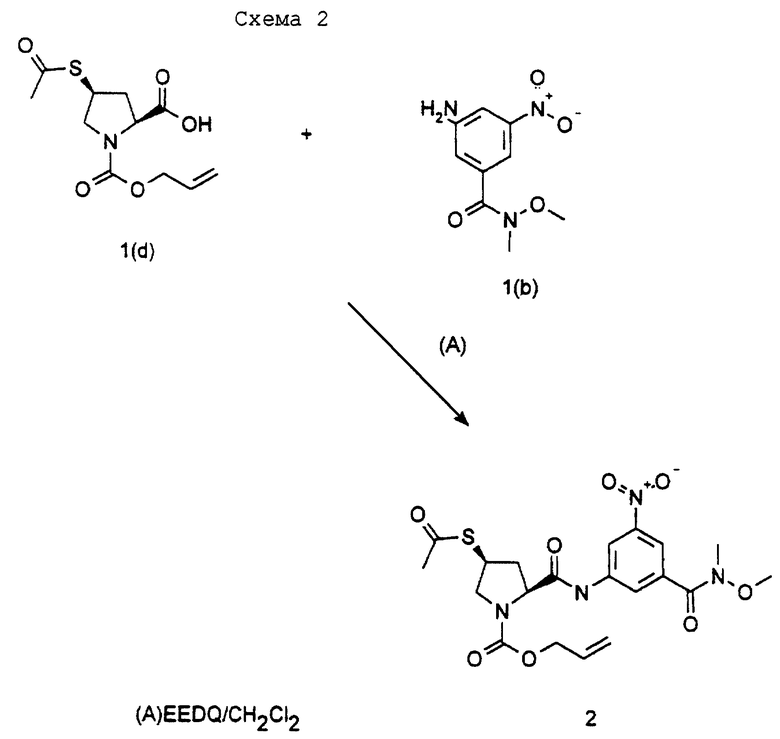



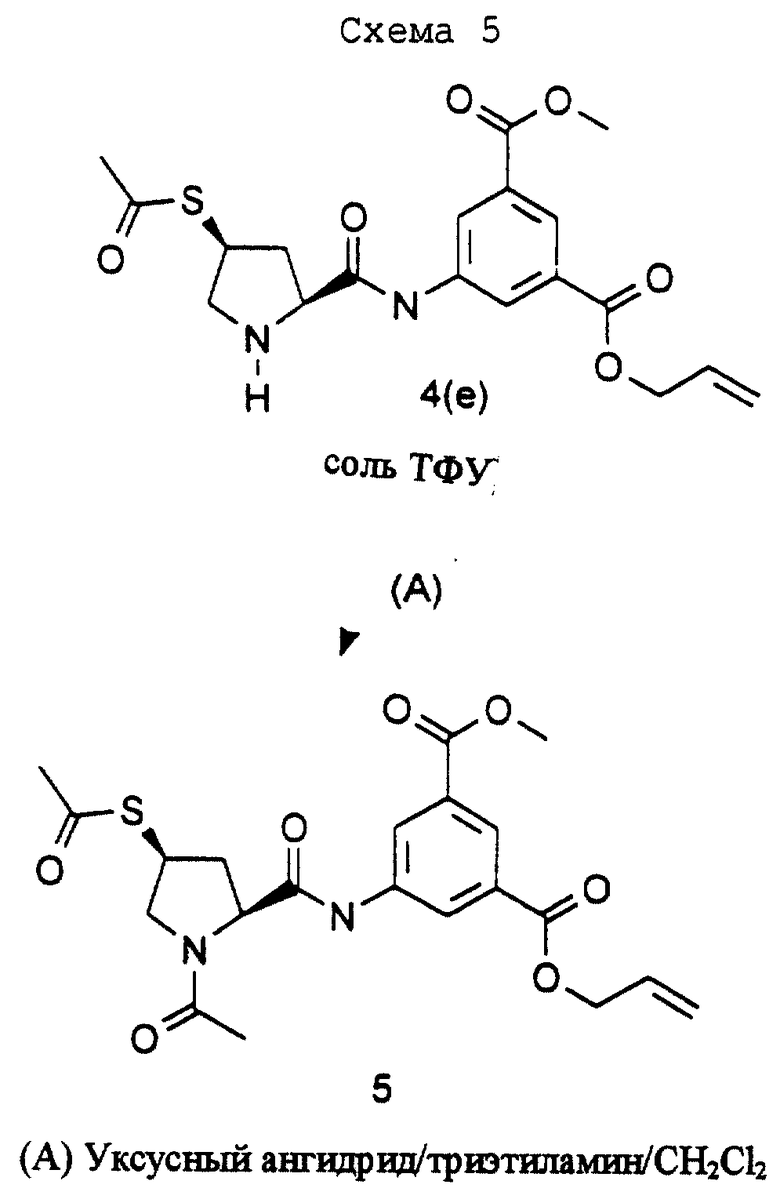































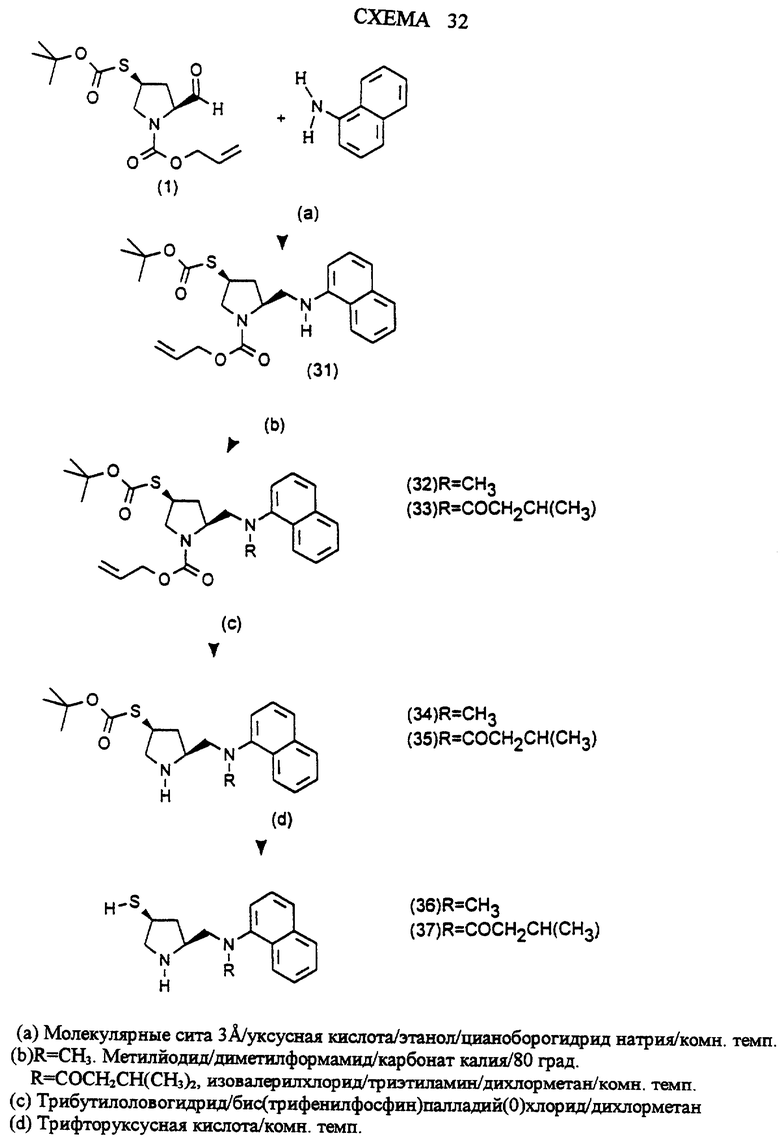









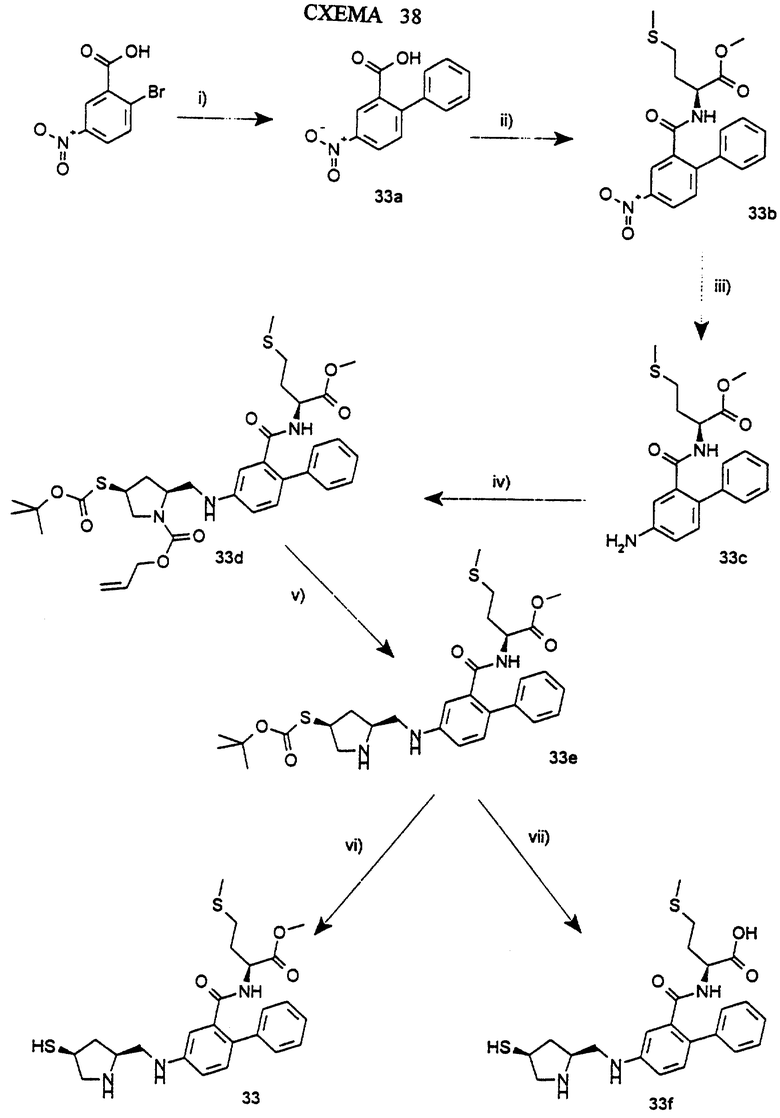

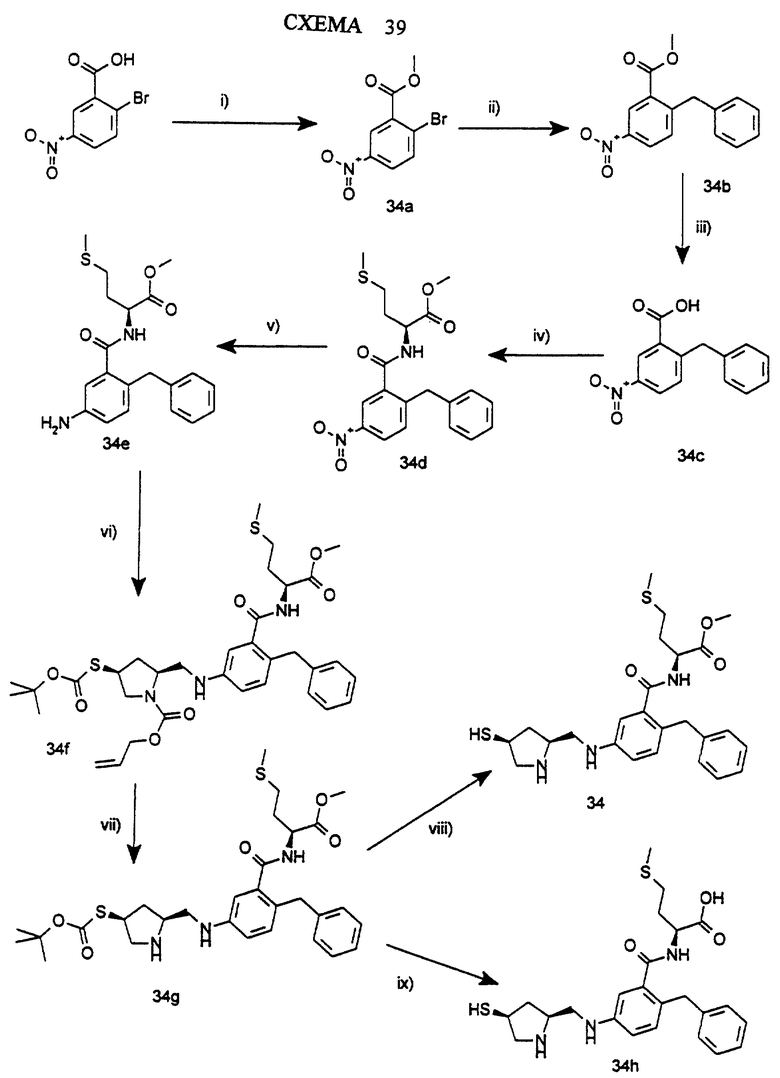












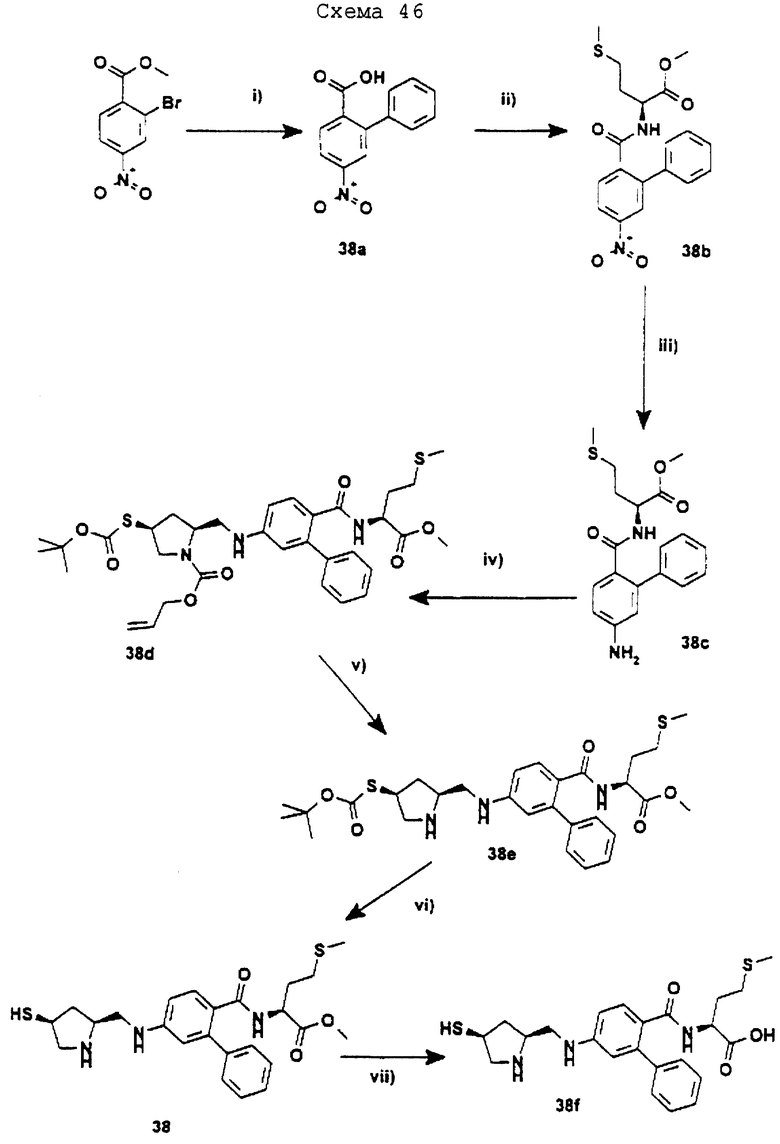



Изобретение относится к производным 4-меркаптопирролидина формулы следующих классов i), ii) и iii), представленное следующей формулой:
где X1 означает Н; С1-6алкоксиС1-6алкил; С1-6алкоксиС1-6алкилкарбонил; А означает фенил, нафтил; Х2 означает Н, фенил, фенил С1-6алкил; X3 означает Н; С1-6алкил; X4 означает С1-6алкилсульфанил, карбамоил;
где X5 означает -C(O)-С1-4алкил-Ph; -С(O)-С1-6алкил; -C(O)-С1-4алкилпиридил, и Ph и пиридил необязательно замещены С1-4алкилом, С1-4алкокси, С1-4алкилоксиС1-4алкилом; А представляет нафтил; R3 выбран из группы, включающей Н; ОН; NO2; -(CH2)nCOOR8, где n равно 0 - 3 и R8 представляет Н, С1-4алкил, С2-4алкенил; -CONR9R10, где R9 и R10 независимо представляют Н, С1-4алкил, С2-4алкенил, -CON(R11)OR12, где R11 и R12 независимо представляют Н, С1-4алкил и С2-4 алкенил; группу формулы II: -CONR13-CHR14-COOR17, где R13 представляет Н или С1-4алкил; R17 представляет Н или С1-6алкил; R14 означает карбамоилС1-4 алкил; р равно 0 - 3, причем значения R3 могут быть одинаковыми или различными;
где X6 имеет любое значение, определенное выше для X5 в ii); X7 представляет Ph, необязательно замещенный заместителем (заместителями), выбранными из группы, включающей С1-4алкокси; А представляет Ph или нафтил; R3 и р такие, как определены выше, или его N-оксид, сольват, сложный эфир, фармацевтически приемлемая соль. 3 с. и 3 з.п.ф-лы, 47 схем.

где X1 выбран из группы, включающей Н, С1-6-алкоксиС1-6-алкил, С1-6алкоксиС1-6-алкилкарбонил;
А выбран из фенила, нафтила;
X2 выбран из группы, включающей Н, фенил, фенилС1-6алкил;
X3 выбран из Н, C1-6алкила;
X4 выбран из C1-6алкилсульфанила, карбамоила;
где Х5выбран из -С (О) -С1-4алкил-Рh, -С (О)- C1-6алкила, -С (О)-C1-С1-4алкилпиридила, Ph и пиридил необязательно замещены заместителем, выбранным из С1-4алкила, С1-4алкокси, С1-4алкилоксиС1-4алкила;
А означает нафтил;
R3 выбран из группы, включающей Н; ОН; NO2; (CH2)nCOOR8, где n равно 0-3 и R8 представляет Н, С1-4алкил, С2-4алкенил;
-CONR9R10, где R9 и R10 независимо представляют Н, С1-4алкил, C1-3алкилен Ph, необязательно моно- или дизамещенный галогеном;
-CON(R11)OR12, где R11 и R12 независимо представляют Н, С1-4алкил, С2-4алкенил, группу формулы II
- CONR13 - CHR14 - COOR17,
где R13 представляет Н или С1-4алкил, R17 представляет Н или C1-6алкил, R14 означает карбамоилС1-4алкил;
р равно 0-3, причем значения R3 могут быть одинаковыми или различными;
где X6 имеет любое значение, определенное выше для X5 в ii);
X7 представляет Ph, необязательно замещенный заместителем (заместителями), выбранным из группы, включающей С1-4алкил, С1-4алкокси;
А представляет Ph или нафтил;
R3 и р такие, как определены выше,
или его N-оксид, сольват, сложный эфир, фармацевтически приемлемая соль.
метиловый эфир (2S)-2-{ 2-бензил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]бензоиламино}-4-метилсульфанилмасляной кислоты;
(2S)-2-{ 2-бензил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]бензоиламино}-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-(2-фенил-5-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)- 4-метилсульфанилмасляной кислоты;
(2S)-2-({2-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-({ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)амино]нафталин-1-карбонил}амино)-4-метилсульфанилмасляной кислоты;
(2S)-2-({ 3-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]нафталин-1-карбонил}амино)-4-метилсульфанилмасляная кислота;
метиловый эфир (2S)-2-(3-фенил-5-[([2S,4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)-4-метилсульфанилмасляной кислоты;
(2S)-2-({ 3-фенил-5-[([2S, 4S] -4-сульфанилпирролидин-2-ил-метил) амино] фенилкарбониламино)-4-метилсульфанилмасляная кислота;
(2S, 4S)-2-[{N-(4-метоксибензил)-N-(нафталин-1-илметил)-амино}метил]пирролидин-4-тиол;
N-(нафталин-1-илметил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)пентамид;
N-(нафталин-1-илметил)-н-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-2-(пиридин-3-ил)ацетамид;
N-((2S, 4S)-4-сульфанилпирролидин-2-илметил)-3-мeтил-N-(2-нафталин-1-илэтил)бутирамид;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-N-(2-нафталин-1-илэтил)-2-пиридин-3-илацетамид;
(2S,4S)-2-[{(3-метоксипропил)-(2-нафталин-1-илэтил)амино] метил}пирролидин- 4 -тиол;
N([2S, 4S] -4-сульфанилпирролидин-2-илметил)-2-(4-метоксифенил)-N-(2-нафталин-2-илэтил)ацетамид;
N-(2,2-дифенилэтил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-3-метилбутирамид;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-2-илэтил)бутирамид;
N-(2,2-дифенилэтил)-N-([2S, 4S] -4-сульфанилпирролидин-2-илметил)-3,3-диметилбутирамид;
(2S)-2-{ 3-[([2S, 4S] -4-сульфанилпирролидин-2-илметил)-(3-метоксипропил)амино]бензоиламино}-4-метилсульфанилмасляная кислота;
N-([2S, 4S]-4-сульфанилпирролидин-2-илметил)-3,3-диметил-N-(2-нафталин-1-илэтил)бутирамид;
(2S)-4-карбамоил-2-({ 2-фенил-5-[([2S, 4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)масляная кислота;
метиловый эфир (2S)-4-карбамоил-2-({ 2-фенил-5-[([2S, 4S]-4-сульфанилпирролидин-2-илметил)амино]фенилкарбонил}амино)масляной кислоты;
или их фармацевтически приемлемые соли.
где X8 представляет правую сторону соединений класса i), ii) или iii), как определено в п.1;
Рr1 представляет Н или аминозащитную группу;
Рr2 представляет Н или тиозащитную группу и любые функциональные группы в X8 необязательно защищены, при условии, что имеется, по меньшей мере, одна защитная группа,
и, необязательно, если необходимо, последующем преобразовании полученного таким образом продукта в его фармацевтически приемлемую соль.
| Экономайзер | 0 |
|
SU94A1 |
| Устройство модуляции телефонного канала с импульсно-кодовой модуляцией | 1976 |
|
SU590855A2 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Система автоматического регулирования уровня крови в оксигенаторе аппарата искусственного кровообращения | 1969 |
|
SU280771A1 |
| Лентопротяжный механизм | 1976 |
|
SU581501A1 |
| Способ получения производных бен-зАМидА или иХ СОлЕй или РАцЕМичЕСКиХСМЕСЕй, или СТЕРЕОизОМЕРОВ | 1979 |
|
SU818481A3 |
Авторы
Даты
2002-10-27—Публикация
1996-07-30—Подача