Область техники, к которой относится изобретение
Настоящее изобретение относится к твердой фармацевтической композиции, пригодной для лечения опухолевых заболеваний и содержащей комплекс четырехвалентной платины в качестве активного вещества. Указанная фармацевтическая композиция обеспечивает высокую стабильность активного вещества и его энтеросолюбильное и/или контролируемое высвобождение. Настоящее изобретение относится также к способу получения упомянутой фармацевтической композиции.
Уровень техники
Общеизвестно, что комплексы платины обладают широким противоопухолевым действием, которое используют для лечения многих опухолевых заболеваний. Комплексы двухвалентной платины, особенно цисплатин, карбоплатин или оксалиплатин, до настоящего времени используются в терапевтической практике. Указанные комплексы двухвалентной платины являются нестабильными в желудочно-кишечном тракте и/или всасываются с трудом. Данный факт делает применение комплексов двухвалентной платины в пероральной дозированной форме (которая была бы более удобной для пациентов) невозможным. Впоследствии было установлено, что некоторые комплексы четырехвалентной платины не имеют упомянутого недостатка и сохраняют свою противоопухолевую эффективность даже при пероральном введении. Указанные комплексы четырехвалентной платины были описаны как новые химические соединения для перорального введения в патентных документах, а именно RP 0328274, EP 0423707 и PCT/CZ99/00015.
Комплексы четырехвалентной платины, тем не менее, обычно являются почти нерастворимыми в воде (приблизительно 0,03 г/100 г), имеют небольшую объемную плотность приблизительно 0,2 г/мл, малый объем утряски приблизительно 0,4 г/мл и крайне высокий электростатический заряд. Указанные физические свойства представляют значительную проблему при изготовлении твердой фармацевтической композиции. Помимо этого, комплексы четырехвалентной платины являются химически нестабильными при контакте с металлами или многими широко используемыми фармацевтическими эксципиентами; данный факт уменьшает стабильность активного вещества в фармацевтической композиции. Упомянутые выше проблемы были частично успешно решены в патентном документе PCT/CZ99/00015, где описано получение твердой фармацевтической композиции комплекса четырехвалентной платины в форме ее растворимых комплексов включения с циклодекстринами, с последующей ее лиофилизацией. Тем не менее, данный препарат является достаточно сложным и дорогостоящим. Кроме того, количество циклодекстринов значительно уменьшает содержание комплекса платины, который содержится в упомянутом выше комплексе включения.
Из уровня техники очевидно, что проблема получения твердых фармацевтических композиций комплексов четырехвалентной платины, имеющих хорошую стабильность и достаточное содержание активного вещества, до сих пор успешно не решена.
Сущность изобретения
Настоящее изобретение относится к фармацевтической композиции, содержащей комплекс платины формулы (I) в качестве активного вещества:
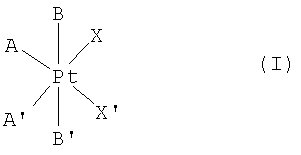
где А и А' независимо друг от друга представляют собой группу NH3, или аминогруппу, или диаминогруппу, содержащую от 1 до 18 атомов углерода,
В и В' независимо друг от друга представляют собой атом галогена, гидроксильную группу, или группу -O-C-(O)-R, или -O-C(O)-R', где R и R' независимо друг от друга представляют собой атом водорода или алкильную, алкенильную, арильную, аралкильную, алкиламиновую или алкоксильную группу, содержащую от 1 до 10 атомов углерода, или функциональные производные указанных групп, и
Х и X' независимо друг от друга представляют собой атом галогена или монокарбоксилатную группу, содержащую от 1 до 20 атомов углерода, или
Х и X' вместе образуют дикарбоксилатную группу, содержащую от 2 до 20 атомов углерода,
в смеси с по меньшей мере одним фармацевтически приемлемым эксципиентом, отличающейся тем, что она образована из гранулята с размером частиц менее 0,5 мм, полученного влажным гранулированием смеси платинового комплекса четырехвалентной платины формулы (I), увлажненного водой, по меньшей мере одного нейтрального сахарида и по меньшей мере одного нативного и/или модифицированного полисахарида.
Фармацевтическая композиция по настоящему изобретению предпочтительно образована из гранулята, полученного влажным гранулированием смеси комплекса платины формулы (I), увлажненного водой, по меньшей мере одного нейтрального сахарида в количестве, равном по меньшей мере 5% масс., и по меньшей мере одного нативного и/или модифицированного полисахарида в количестве, равном по меньшей мере 2% масс., относительно общей массы гранулята.
Фармацевтическая композиция по настоящему изобретению предпочтительно содержит по меньшей мере один фармацевтически приемлемый высвобождающий агент и/или по меньшей мере один фармацевтически приемлемый агент, обеспечивающий скольжение.
Фармацевтическая композиция по настоящему изобретению предпочтительно содержит (ОС-6-43)-бис(ацетат)-(1-адамантиламин)аминдихлорплатиновый комплекс в качестве активного вещества.
Смесь, предназначенная для влажного гранулирования, предпочтительно содержит лактозу, маннит, сорбит, фруктозу, глюкозу и/или сахарозу в качестве нейтрального сахарида.
Смесь, предназначенная для влажного гранулирования, предпочтительно содержит маисовый, пшеничный и/или картофельный крахмал в качестве нативного и/или модифицированного полисахарида.
Фармацевтическая композиция по настоящему изобретению предпочтительно содержится в капсуле или пакетике или ее прессуют в таблетки.
Поверхность гранулята, капсулы или таблетки предпочтительно покрывают слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, и/или слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества.
Поверхность гранулята или таблетки предпочтительно отделена от слоя по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, и/или от слоя по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества, инертным запирающим (экранирующим) слоем, состоящим из по меньшей мере одного нейтрального сахарида, например сахарозы, и/или по меньшей мере одного нативного и/или модифицированного полисахарида, например нативного или модифицированного маисового, пшеничного или картофельного крахмала или желатина, или аравийской камеди; при этом масса инертного запирающего слоя не превышает 15% масс., от общей массы гранулята или таблетки.
Слой по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества, предпочтительно формируют из этилцеллюлозы и/или метакриловой кислоты и/или ее соединений, предпочтительно полимеров и/или сополимеров метакриловой кислоты; при этом масса указанного слоя равна не более 40% масс. от общей массы гранулята, капсулы или таблетки.
Слой по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, предпочтительно формируют из ацетата целлюлозы, и/или ацетилфталата целлюлозы, и/или ацетосукцината целлюлозы, и/или фталата гидроксипропилметилцеллюлозы, и/или сукцината гидроксипропилметилцеллюлозы, и/или фталата поливинилового спирта, и/или бензофенилсалицилата, и/или сополимера стирола и малеиновой кислоты и/или шеллака, и/или метакриловой кислоты, и/или ее соединений, предпочтительно полимеров или сополимеров метакриловой кислоты; при этом масса указанного слоя равна не более 15% масс. от общей массы гранулята, капсулы или таблетки.
Изобретение относится также к способу получения фармацевтической композиции по настоящему изобретению, отличающемуся тем, что смесь комплекса платины формулы (I), увлажненного водой, по меньшей мере одного нейтрального сахарида и по меньшей мере одного нативного и/или модифицированного полисахарида гранулируют при условиях влажности с получением гранулята, имеющего размер частиц менее 0,5 мм.
Влажное гранулирование предпочтительно осуществляют с получением гранулята, имеющего такое распределение частиц по размеру, что 90% частиц имеют размер менее 2,0 мм и не более 20% частиц имеют размер менее 0,09 мм.
Влажное гранулирование предпочтительно осуществляют с использованием оборудования, поверхность которого при контакте с гранулируемой смесью является инертной по отношению к указанной смеси.
Гранулятом предпочтительно наполняют капсулы или пакетики или, после того как к грануляту добавляют по меньшей мере один высвобождающий агент и/или по меньшей мере один агент, обеспечивающий скольжение, гранулят прессуют в таблетки.
Процедуру наполнения капсул и пакетиков, а также получения таблеток предпочтительно осуществляют с использованием оборудования, поверхность которого при контакте со смесью, которой наполняют капсулы или пакетики, или со смесью, предназначенной для получения таблеток, является инертной по отношению к указанной смеси.
Поверхность гранулята, поверхность гранулята, предназначенного для наполнения пакетика, поверхность таблетки и поверхность гранулята, предназначенного для наполнения капсулы, и/или поверхность упомянутой капсулы предпочтительно покрывают слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, и/или слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества.
Поверхность гранулята, поверхность гранулята, предназначенного для наполнения пакетика, поверхность гранулята, предназначенного для наполнения капсулы и поверхность таблетки предпочтительно перед нанесением слоя по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, и/или от слоя по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества, снабжают инертным запирающим слоем, состоящим из по меньшей мере одного нейтрального сахарида, например сахарозы, и/или по меньшей мере одного нативного и/или модифицированного полисахарида, например нативного или модифицированного маисового, пшеничного или картофельного крахмала или желатина, или аравийской камеди.
Покрытие гранулята и таблеток инертным запирающим слоем, слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, или слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества, предпочтительно осуществляют с использованием оборудования, поверхность которого при контакте с гранулятом или таблетками, предварительно покрыта материалом, образующим инертный запирающий слой.
Примером соединения четырехвалентной платины формулы (I) является (ОС-6-43)-бис(ацетат)-(1-адамантиламин)аминдихлорплатиновый комплекс формулы (II)
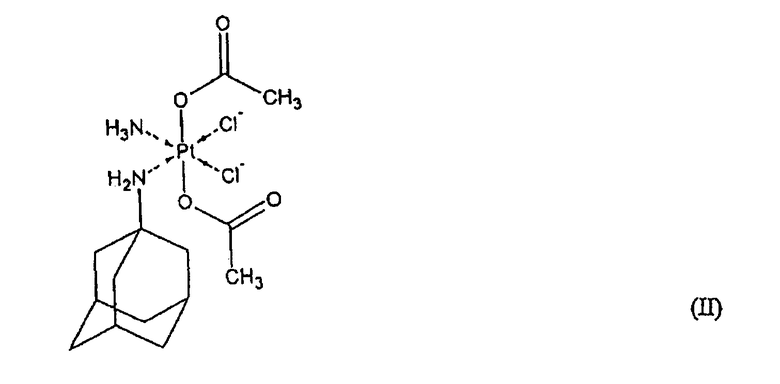
описанный в патентной заявке PCT/CZ99/00015.
В рамках настоящего изобретения было установлено, что комплекс платины формулы (I) является нестабильным при контакте со многими массообразующими эксципиентами, такими как, например, фосфаты, сульфаты или карбонаты, стандартные агенты, обеспечивающие скольжение, связующие агенты и пленкообразующие вещества, например сложные эфиры акриловой кислоты и ее сополимеры, целлюлозные производные эфиров, сложных эфиров и сополимеров или виниловые сложные эфиры. Нейтральные сахариды, используемые в качестве наполнителей, нативные и/или модифицированные полисахариды, используемые в качестве связующих агентов, или, возможно, стеарат магния, используемый в качестве агента, обеспечивающего скольжение, и/или нативные и/или модифицированные полисахариды, используемые в качестве экстрагранулятных высвобождающих агентов, как было установлено, являются обязательными эксципиентами, с которыми комплекс платины формулы (I) является совместимым и в присутствии которых указанный комплекс является стабильным.
Полученный гранулят, таблетку или капсулу затем предпочтительно покрывают по меньшей мере одним слоем пленкообразующего вещества, обеспечивающего энтеросолюбильное и/или контролируемое высвобождение активного вещества. В силу несовместимости активного вещества со многими широко используемыми пленкообразующими веществами гранулят и таблетки перед нанесением указанного пленкообразующего вещества предпочтительно защищают покрытием, состоящим из инертного запирающего слоя, который защищает активное вещество от разложения и предотвращает миграцию пленкообразующего вещества в гранулят или ядро таблетки. Нейтральный сахарид, например, сахарозу, и/или нативный и/или модифицированный полисахарид, например, нативный и/или модифицированный маисовый, пшеничный или картофельный крахмал, или желатин, или аравийскую камедь или, возможно, их смеси в различных соотношениях, в форме водного или водно-спиртового гидрогеля, можно использовать в качестве материала для инертного запирающего слоя. Указанный запирающий слой обеспечивает защиту активного вещества от энтеросолюбильного покрытия и/или покрытия, обеспечивающего контролируемое высвобождение активного вещества. Сухой вес инертного запирающего слоя не превышает 15% масс., предпочтительно составляет 4-12% масс., относительно общей массы гранулята или таблетки. Желатиновая капсула не нуждается в подобной защите, поскольку сам материал капсулы эффективно защищает активное вещество от неблагоприятного воздействия пленкообразующего вещества.
Для того чтобы защитить активное вещество от значительно кислотного окружения в желудке и/или для того чтобы перенести зону всасывания активного вещества дальше по ходу желудочно-кишечного тракта и таким образом увеличить величину Tmax, гранулят, покрытый инертным запирающим слоем, и таблетку, покрытую инертным запирающим слоем, или, возможно, капсулу покрывают кислотоустойчивым, т.е. энтеросолюбильным, покрытием, обеспечивающим высвобождение активного вещества только в тонком кишечнике, т.е. в среде, имеющей величину рН в пределах 4,5-8, в зависимости от состава энтеросолюбильного покрытия. Фармацевтическая композиция, полученная данным способом, соответствует требованиям для тестирования энтеросолюбильных дозированных форм Европейской Фармакопеей и/или Фармакопеей США с внесенными поправками или изменениями. Ацетат целлюлозы (СА), ацетофталат целлюлозы (СРА), ацетилсукцинат целлюлозы (CAS), фталат гидроксипропилметилцеллюлозы (МРМСР), сукцинат гидроксипропилметилцеллюлозы (HPMCS), фталат поливинилового спирта (PVAP), бензофенилсалицилат (BPS), сополимер стирола и малеиновой кислоты, шеллак или сополимеры метакриловой кислоты, например Eudragit L, Eudragit L-55 и Eudragit S, а именно в форме их пластифицированных водных дисперсий - Eudragit L 30 D или L-55 30 D и Eudragit S 30 D - или в форме органических или водно-спиртовых растворов - Eudragit L 12,5 или Eudragit S 12,5 - или, возможно, их смеси в различных соотношениях можно, например, использовать в качестве пленкообразующего вещества; при этом сухая масса энтеросолюбильного слоя не превышает 15% масс., предпочтительно 8-10% масс., относительно массы гранулята, капсулы или таблетки. Гранулят, покрытый инертным запирающим слоем, или таблетки, покрытые инертным запирающим слоем, можно непосредственно помещать в капсулы, которые уже обработаны для энтеросолюбильного применения.
В ходе экспериментов на собаках и свиньях было установлено, что кратковременная высокая концентрация активного вещества в плазме наблюдается спустя приблизительно один час после однократного применения фармацевтической композиции, с последующим ее быстрым уменьшением. Для того чтобы добиться более стабильных уровней активного вещества в плазме, что делает возможным увеличение интервала между отдельными применениями фармацевтической композиции и, таким образом, для того чтобы уменьшить неблагоприятные эффекты от относительно высоких и короткодействующих уровней активного вещества в плазме, которые наблюдаются после применения фармацевтической композиции с немедленным высвобождением, гранулят, защищенный инертным запирающим слоем, или таблетки, защищенные инертным запирающим слоем, или капсулы можно, кроме того, покрывать слоем, обеспечивающим контролируемое высвобождение активного вещества. Высвобождение активного вещества из фармацевтической композиции, обработанной, как указано выше, подчиняется двум лимитам, А и В, согласовываясь с количеством высвободившегося активного вещества за период времени, описанный тестом на растворение при следующих условиях, описанных в лопастном способе согласно USP: растворяющая среда: 0,1 М HCl; объем растворяющей среды: 900 мл; скорость вращения лопастей: 100 об/мин; температура растворяющей среды: 37°С. Лимит «А» в данном случае составляет 5%-25% за 30 минут; 15%-65% за 60 минут, 40%-85% за 120 минут и по меньшей мере 85% за 180 минут, в то время как лимит «В» составляет 5%-25% за 60 минут, 15%-65% за 180 минут, 40%-85% за 360 минут и по меньшей мере 85% за 720 минут.
Этилцеллюлозу (ЕС) или ее водные дисперсии - Surrelease или Aquacoat - или акрилатные сополимеры, например Eudragit NE или Eudragit RL или Eudragit RS, как в форме их пластифицированных водных дисперсий - Eudragit NE 30 D, Eudragit RD 30 D, Eudragit RL, так и в форме их органических растворов - Eudragit RS 12,5 и Eudragit RL 12,5 - или, возможно, их смеси в различных соотношениях можно, например, использовать в качестве пленкообразующего вещества в случае слоя, обеспечивающего контролируемое высвобождение активного вещества; при этом сухая масса слоя, обеспечивающего контролируемое высвобождение активного вещества, не превышает 40% масс., предпочтительно 8-30% масс., относительно массы гранулята, капсулы или таблетки.
Гранулят, покрытый слоем для контролируемого высвобождения активного вещества, или таблетки, покрытые слоем для контролируемого высвобождения активного вещества, также можно непосредственно помещать в капсулы, которые уже обработаны для энтеросолюбильного применения, или можно дополнительно покрывать энтеросолюбильным слоем. Неожиданно, во время изготовления влажного гранулята фармацевтической композиции по настоящему изобретению было установлено, что неблагоприятные химические реакции наблюдаются на поверхности металлов, из которых обычно изготавливают фармацевтическое технологическое оборудование, предназначенное для обработки и изготовления твердых фармацевтических композиций. Данный факт препятствует использованию стандартных технологий производства, таких как, например, прессование во время производства гранулята или изготовления таблеток, без необходимой обработки поверхностей штампов. Влажный гранулят фармацевтической композиции по настоящему изобретению, таким образом, предпочтительно следует обрабатывать на оборудовании, поверхность которого, контактирующая с гранулированной смесью, является инертной по отношению к указанной смеси. Стекло, фарфор, тефлон или эмаль оказались подходящими инертными материалами.
В случае, когда гранулят или таблетка не покрыты инертным запирающим слоем, или когда гранулят или таблетка покрыты упомянутым слоем, и инертный запирающий слой, предназначенный для защиты активного вещества в грануляте или таблетке от воздействия материалов слоев, обеспечивающих энтеросолюбильность и/или контролируемое высвобождение активного вещества, поврежден во время процедуры нанесения на гранулят или таблетку слоев, обеспечивающих энтеросолюбильность или контролируемое высвобождение, активное вещество контактирует с металлами, если используется обычное оборудование для нанесения покрытий, имеющее металлические поверхности, например барабанное оборудование для нанесения покрытий, сушилки с псевдоожиженным слоем и верхней загрузкой, Wusters или ротопроцессоры. Этого, тем не менее, можно избежать, если поверхность оборудования, контактирующая с обрабатываемой фармацевтической композицией, покрыта слоем инертного материала, который образует в то же самое время материал инертного запирающего слоя. Когда покрытие инертным слоем, энтеросолюбильным слоем и/или слоем, предназначенным для контролируемого высвобождения, осуществляют на идентичном оборудовании, то упомянутая поверхность оборудования может уже иметь покрытие до нанесения инертного запирающего слоя.
Способ, используемый для получения гранулята, образующего основу фармацевтической композиции по настоящему изобретению, представляет собой влажное гранулирование, во время которого смесь комплекса платины формулы (I), по меньшей мере одного нейтрального сахарида и по меньшей мере одного нативного и/или модифицированного полисахарида увлажняют водой и смешивают с использованием подходящего смесителя с подходящей скоростью и в течение подходящего периода времени. Полученный гранулят затем сушат в условиях вакуума или при атмосферном давлении. Было установлено, что скорость растворения гранулята является обратно пропорциональной размеру отдельных гранул, и, таким образом, гранулят предпочтительно измельчают, чтобы добиться такого распределения частиц по размеру, когда 90% частиц имеют размер менее 2,0 мм и не более 20% частиц имеют размер менее 0,09 мм. Измельчение осуществляют, например, размалыванием с использованием шаровой мельницы или растиранием вручную или автоматически, с использованием подходящих устройств.
Оборудование, предназначенное для наполнения капсул гранулятом, или таблетировочный пресс, предназначенный для прессования гранулята в таблетки, должно быть инертным на контактирующих поверхностях по отношению к упомянутому выше грануляту, как уже упоминалось выше.
Фармацевтическая композиция по настоящему изобретению отличается тем, что она имеет хорошую стабильность при температуре 40°С и относительной влажности 75%; это подтверждает тот факт, что в течение 6 месяцев не наблюдалось относительного увеличения содержания примесей, превышающего 2% масс., и что содержание любой отдельной неизвестной примеси на превышает 0,1% масс., относительно массы исходного комплекса платины формулы (II), по истечении упомянутого периода времени. Не наблюдалось увеличения содержания известной примеси комплекса платины формулы (II), которая представляет собой (ацетат)-(1-адамантиламин)аминтрихлорплатиновый комплекс, имеющий формулу [PtCl3(ac)(am)(NH3)].
Изобретение будет объяснено более подробно в примерах актуальных вариантов осуществления настоящего изобретения; данные примеры являются только иллюстративными и не ограничивают объем настоящего изобретения, который однозначно определен в формуле изобретения и описании.
Примеры
Пример 1:
Композиция и способ получения гранулята фармацевтической композиции комплекса платины формулы (II)
Величины веса в примерах даны в массовых частях.
Процедура
- Смешивают соединения №№ 1-3 в высокоскоростном смесителе.
- Добавляют 72-84 массовых части воды.
- Перемешивают смесь в высокоскоростном смесителе в течение 2 минут.
- Сушат гранулят при температуре 70°С до достижения содержания воды 2%-4%.
- Размалывают сухой гранулят, например, на вибрационной мельнице до тех пор, пока 100% частиц не будут иметь размер менее 0,5 мм.
- Добавляют соединения №№ 4 и 5 и перемешивают в кубическом смесителе в течение 15 минут.
Пример 2:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 000. Вес гранулята, помещенного в капсулу, составляет 815,85 мг, что соответствует 350 мг активного соединения.
Пример 3:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 00 или 000 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 582,75 мг, что соответствует 250 мг активного соединения.
Пример 4:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 00 или 0 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 466,20 мг, что соответствует 200 мг активного соединения.
Пример 5:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 0 или 1 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 349,65 мг, что соответствует 150 мг активного соединения.
Пример 6:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 1 или 2 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 233,10 мг, что соответствует 100 мг активного соединения.
Пример 7:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 2 или 3 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 174,825 мг, что соответствует 75 мг активного соединения.
Пример 8:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 1.
- Наполняют гранулятом, полученным согласно примеру 1 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,6 г/мл и от 0,5 г/мл до 0,7 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 3 или 4 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 116,55 мг, что соответствует 50 мг активного соединения.
Пример 9:
Композиция и способ получения гранулята фармацевтической композиции комплекса платины формулы (II) Величины веса в примерах даны в массовых частях.
Процедура
- Смешивают соединения №№ с 1 по 3 в высокоскоростном смесителе.
- Добавляют 80-120 массовых частей воды.
- Перемешивают смесь в высокоскоростном смесителе в течение 2 минут.
- Сушат гранулят при температуре 70°С до достижения содержания воды 2%-4%.
- Размалывают сухой гранулят, например, на вибрационной мельнице до тех пор, пока 90% частиц не будут иметь размер менее 2,0 мм и не более 20% частиц будут иметь размер менее 0,09 мм.
- Добавляют соединение № 4 и перемешивают в кубическом смесителе в течение 15 минут.
Пример 10:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 000 или 00. Вес гранулята, помещенного в капсулу, составляет 815,85 мг, что соответствует 350 мг активного соединения.
Пример 11:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера между 000 и 0 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 582,75 мг, что соответствует 250 мг активного соединения.
Пример 12:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера 00 или 0 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 466,20 мг, что соответствует 200 мг активного соединения.
Пример 13:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера между 0 и 2 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 349,65 мг, что соответствует 150 мг активного соединения.
Пример 14:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера между 1 и 3 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 233,10 мг, что соответствует 100 мг активного соединения.
Пример 15:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера между 2 и 4 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 174,825 мг, что соответствует 75 мг активного соединения.
Пример 16:
Способ наполнения гранулятом фармацевтической композиции комплекса платины формулы (II), полученным согласно примеру 9.
- Наполняют гранулятом, полученным согласно примеру 9 и имеющим объемную плотность и объем утряски в пределах от 0,4 г/мл до 0,7 г/мл и от 0,5 г/мл до 0,8 г/мл, соответственно, вручную или автоматически, твердые, нормальные или энтеросолюбильные, желатиновые или НРМС капсулы размера между 3 и 5 или прессуют его в таблетки. Вес гранулята, помещенного в капсулу, составляет 116,55 мг, что соответствует 50 мг активного соединения.
Пример 17:
Способ нанесения запирающего слоя на гранулят фармацевтической композиции комплекса платины формулы (II), полученный согласно примеру 9, в псевдоожиженном слое
Оборудование: Wurster
Загрузка гранулята: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 30°С-50°С
Скорость инжекции: 6-25 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 4-20% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 64% масс. раствора сахарозы или 8% масс. гидрогеля крахмала, полученного из модифицированного маисового крахмала, растворенного на холоде, или из нативного маисового крахмала, растворенного при температуре 70°С. Альтернативно используют гидрогель смеси 4% масс. аравийской камеди и 5% масс. желатина А или В.
Для получения описанного выше можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 18:
Способ нанесения запирающего слоя на таблетки фармацевтической композиции комплекса платины формулы (II), полученные согласно примерам 2-16, в псевдоожиженном слое
Оборудование: Wurster
Загрузка ядер: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 40°С-60°С
Скорость инжекции: 6-18 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 4-8% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 64% масс. раствора сахарозы или 8% масс. гидрогеля крахмала, полученного из модифицированного маисового крахмала, растворенного на холоде, или из нативного маисового крахмала, растворенного при температуре 70°С. Альтернативно используют гидрогель смеси 4% масс. аравийской камеди и 5% масс. желатина А или В.
Для получения описанного выше можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 19:
Способ нанесения энтеросолюбильного слоя на гранулят фармацевтической композиции комплекса платины формулы (II), полученный согласно примеру 17, в псевдоожиженном слое
Оборудование: Wurster
Загрузка гранулята: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 24°С-50°С
Скорость инжекции: 6-25 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 8-12% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 20% масс. водной дисперсии Eudragit L или 10% масс. водной дисперсии НРМСР.
Для получения описанного выше можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 20:
Способ нанесения энтеросолюбильного слоя на таблетки и капсулы фармацевтической композиции комплекса платины формулы (II), полученные согласно примеру 18 (таблетки), и согласно примерам 2-16 (капсулы), в псевдоожиженном слое
Оборудование: Wurster
Загрузка ядер: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 25°С-60°С
Скорость инжекции: 6-18 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 8-10% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 20% масс. водной дисперсии Eudragit L или 10% масс. водной дисперсии НРМСР.
Для получения описанного выше можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 21:
Способ нанесения слоя, предназначенного для контролируемого высвобождения, на гранулят фармацевтической композиции комплекса платины формулы (II), полученный согласно примеру 17, в псевдоожиженном слое
Оборудование: Wurster
Загрузка гранулята: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 24°С-50°С
Скорость инжекции: 6-25 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 10-30% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 15% масс. водной дисперсии этилцеллюлозы (Surrelease) для нанесения. Альтернативно можно использовать 20% (масс./масс.) пластифицированной лаковой дисперсии Eudragit RS или RP или их смеси в подходящем соотношении.
Для получения, описанного выше, можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 22:
Способ нанесения слоя, предназначенного для контролируемого высвобождения, на таблетки и капсулы фармацевтической композиции комплекса платины формулы (II), полученные согласно примеру 18 (таблетки) и согласно примерам 2-16 (капсулы), в псевдоожиженном слое
Оборудование: Wurster
Загрузка ядер: 0,50 кг
Температура воздуха на входе: 50°С-70°С
Температура воздуха на выходе: 24°С-50°С
Скорость инжекции: 4-18 г в минуту
Диаметр сопла: 0,8 мм
Вес покрывающего слоя: 8-20% масс.
Осуществляют инжекцию до достижения намеченного веса гранулята, соответствующего требуемому весу покрывающего слоя.
Используют 15% масс. водной дисперсии этилцеллюлозы (Surrelease) для нанесения. Альтернативно можно использовать 20% (масс./масс.) пластифицированной водной дисперсии Eudragit RS или RP или их смеси в подходящем соотношении.
Для получения описанного выше можно использовать также стандартное барабанное оборудование для нанесения покрытий.
Пример 23:
Гранулятом и таблетками, полученными согласно примерам 21 и 22, можно наполнять твердые желатиновые капсулы, обработанные для высвобождения в кишечнике.
Пример 24:
Грануляты, покрытые слоем, предназначенным для контролируемого высвобождения, согласно примеру 21, можно дополнительно покрывать слоем, предназначенным для энтеросолюбильного высвобождения, согласно примеру 19.
Пример 25:
Таблетки, покрытые слоем, предназначенным для контролируемого высвобождения, согласно примеру 22, можно дополнительно покрывать слоем, предназначенным для энтеросолюбильного высвобождения, согласно примеру 20.
Пример 26:
Тестирование на стабильность гранулята фармацевтической композиции комплекса платины формулы (II), полученного согласно примеру 1.
Капсулы, полученные с использованием процедуры примера 4 и примера 8, помещенные в контейнеры HDPE, которые хранили при температуре 40°С и относительной влажности 75% в течение 6 месяцев, использовались для тестирования на стабильность. Сумма неизвестных примесей не превышала 2% масс. в течение упомянутого периода, и ни одна отдельная неизвестная примесь не превышала 0,1% масс. относительно исходного комплекса платины формулы (II).
Пример 27:
Высвобождение с течением времени активного вещества из фармацевтической композиции, имеющей форму твердых желатиновых капсул, полученных согласно примеру 4 и примеру 8
Условия теста на растворение - согласно USP, лопастной способ
Среда: 0,1 М HCl, 900 мл
Скорость: 100 об/мин
Температура среды: 37°С
Количество высвободившегося активного вещества дано в % масс.
Содержимое капсул, содержащих 50 мг
Содержимое капсул, содержащих 200 мг
Пример 28:
Лимиты времени, А и В, для высвобождения активного вещества из фармацевтической композиции, имеющей форму гранулятов, твердых желатиновых капсул и таблеток, полученных согласно примерам 21 и 22, предназначенной для контролируемого высвобождения лекарственного средства
Условия теста на растворение - согласно USP, лопастной способ
Среда: 0,1 М HCl, 900 мл
Скорость: 100 об/мин
Температура среды: 37°С
Количество высвободившегося активного вещества дано в % масс.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИСФОСФОНАТОВ | 2005 |
|
RU2359678C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВКЛЮЧАЮЩИЕ В СЕБЯ ТВЕРДЫЕ РАСТВОРЫ СЛАБООСНОВНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2434630C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ, ВКЛЮЧАЮЩАЯ ФЕБУКСОСТАТ | 2011 |
|
RU2602188C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С НАБУХАЮЩИМ ПОКРЫТИЕМ | 2004 |
|
RU2375048C2 |
| ТВЕРДЫЕ ТАБЛЕТКИ И КАПСУЛЫ МОДИФИЦИРОВАННОГО ВЫСВОБОЖДЕНИЯ БЕНЗОНАТАТА | 2014 |
|
RU2673239C2 |
| ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ С ОТСРОЧЕННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЕ ВАЛЬПРОЕВУЮ КИСЛОТУ, И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2760304C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ РИЗЕДРОНАТА | 2005 |
|
RU2381791C2 |
| ПРЕПАРАТ ЛАМОТРИДЖИН С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ | 2003 |
|
RU2328274C2 |
| ТАБЛЕТКИ ТАМЗУЛОСИНА | 2002 |
|
RU2311903C2 |
| КОМПОЗИЦИИ СТАБИЛЬНЫХ ТИАКУМИЦИНОВ | 2008 |
|
RU2484829C2 |
Настоящее изобретение относится к химико-фармацевтической промышленности и касается композиции, содержащей комплекс платины в качестве активного вещества с по меньшей мере одним фармацевтически приемлемым эксципиентом, отличающейся тем, что она образована из гранулята с размером частиц менее 0,5 мм, полученного влажным гранулированием смеси комплекса четырехвалентной платины, увлажненного водой, по меньшей мере одного нейтрального сахарида и по меньшей мере одного нативного и/или модифицированного полисахарида, необязательно, содержится в капсуле или пакетике или, необязательно, прессуется в форму таблетки, в то время как поверхность гранулята, капсулы или таблетки, необязательно, покрыта слоем по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего энтеросолюбильное растворение активного вещества только в кишечнике, и/или по меньшей мере одного фармацевтически приемлемого вещества, обеспечивающего контролируемое высвобождение активного вещества. Изобретение относится также к способу получения указанной фармацевтической композиции. 2 н. и 16 з.п. ф-лы.
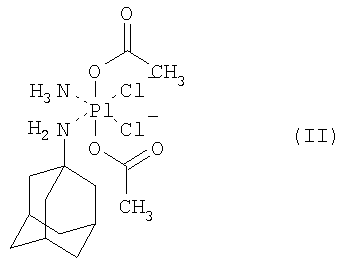
в качестве активного вещества в смеси с по меньшей мере одним фармацевтически приемлемым эксципиентом, отличающаяся тем, что она образована из гранулята с размером частиц менее 0,5 мм, полученного влажным гранулированием смеси платинового комплекса четырехвалентной платины формулы (II), увлажненного водой, по меньшей мере одного нейтрального моно- или олигосахарида и по меньшей мере одного нативного и/или модифицированного полисахарида.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 6136336 A, 24.10.2000 | |||
| Электростатическая установка для производства шлифовальной шкурки | 1983 |
|
SU1093530A1 |
| ПЛАТИНОВЫЕ ФАРМАЦЕВТИЧЕСКИЕ СРЕДСТВА | 1990 |
|
RU2074861C1 |
Авторы
Даты
2009-01-20—Публикация
2004-03-30—Подача