Настоящее изобретение относится к производным имидазола общей формулы
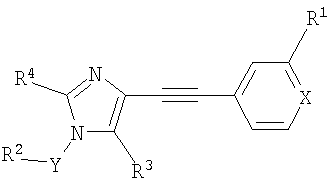
где R1 означает галоген, (низш.)алкил, (низш.)алкокси, CF3 или цианогруппу,
R2 означает арил или гетероарил, необязательно содержащий один или несколько заместителей, выбранных из группы, включающей (низш.)алкил, галоген, (низш.)алкокси, CF3 или циано,
R3 означает водород, С(O)Н или CH2R5, где R5 означает водород, ОН, С1-С6алкил или С3-С12циклоалкил,
R4 означает (низш.)алкил или С3-С12циклоалкил,
Х означает N или СН,
Y означает -(CHR)1, 2 или 3,
R означает водород или (низш.)алкил,
или к их фармацевтически приемлемым солям.
Неожиданно было установлено, что соединения общей формулы I являются антагонистами метаботропного глютаматного рецептора. Соединения формулы I обладают значительным терапевтическим действием. Они могут использоваться для лечения или профилактики заболеваний, опосредованных рецептором mGluR5.
В центральной нервной системе (ЦНС) передача нервного импульса происходит при взаимодействии нейромедиатора, который высвобождается из нейрона, с нейрорецептором.
В большинстве случаев нейромедиатором в ЦНС является глютамат, который играет основную роль во множестве функций ЦНС. Глютамат-зависимые импульсные рецепторы подразделяются на две основные группы. В первую группу включены инотропоные рецепторы, которые образуют лиганд-управляемые ионные каналы. Метаботропные глютаматные рецепторы (mGluR) относятся ко второй группе и, более того, к семейству связанных с G-белком рецепторов.
В настоящее время известно восемь различных членов семейства mGluR, причем некоторые из них подразделяются на подтипы. С учетом структурной гомологии, механизмов передачи сигнала и селективности антагонистов указанные восемь рецепторов подразделяются на три подгруппы: рецепторы mGluR1 и mGluR5 относятся к группе I, рецепторы mGluR2 и mGluR3 к группе II, а рецепторы mGluR4, mGluR6, mGluR7 и mGluR8 к группе III.
Лиганды метаботропных глютаматных рецепторов первой группы можно использовать для лечения или профилактики острых и/или хронических неврологических заболеваний, таких как психоз, шизофрения, болезнь Альцгеймера, нарушение познавательной способности и недостаток памяти, а также хронические и острые боли.
К другим показаниям для лечения относятся также ограничение мозговой функции, вызванное шунтированием или трансплантатом, ограниченное кровоснабжение мозга, травмы спинного мозга, травмы головы, гипоксия при беременности, остановка сердца и гипогликемия. Еще один ряд излечиваемых показаний включает хорею Гентингтона, боковой амиотрофический склероз, дименцию, вызванную СПИД, глазные травмы, ретинопатию, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, а также состояния, связанные с недостатком глютамата, такие, как мышечные спазмы, судороги, мигрень, недержание мочи, привыкание к никотину, привыкание к опиатам, тревога, рвота, дискинезия и депрессия.
Заболевания полностью или частично опосредованные рецепторами mGluR5 включают, например, острые, травматические и хронические дегенеративные процессы, протекающие в нервной системе, такие как болезнь Альцгеймера, старческое слабоумие, болезнь Паркинсона, хорея Гентингтона, боковой амиотрофический склероз и рассеянный склероз, психиатрические расстройства, такие как шизофрения и тревога, депрессия, боль, наркотическая зависимость, отказ от курения и алкогольная зависимость (Expert Opin. Ther. Patents, 12, (12) (2002)).
Селективные антагонисты рецепторов mGluR5 применяют прежде всего для лечения тревоги и боли.
Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, описанным выше, соединениям в качестве фармацевтически активных субстанций и к их получению.
Настоящее изобретение также относится к способам получения соединения общей формулы I по общей методике, как описано выше для соединений формулы I.
Кроме того, настоящее изобретение относится к лекарственным средствам, содержащим одно или несколько соединений по настоящему изобретению и фармацевтически приемлемые носители, и предназначенным для лечения и профилактики заболеваний, опосредованных рецептором mGluR5, таких как острые и/или хронические неврологические заболевания, в частности тревога и хроническая или острая боль.
Настоящее изобретение также относится к применению соединения по настоящему изобретению, а также к его фармацевтически приемлемой соли для получения лекарственных средств, предназначенных для лечения и профилактики заболеваний, опосредованных рецептором mGluR5, как описано выше.
Приведенные ниже определения общих терминов используются в настоящем описании независимо от упоминания данного термина отдельно или в сочетании. Термин «(низш.)алкил», использованный в данном описании, означает неразветвленный или разветвленный насыщенный углеводородный остаток, содержащий от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил и и.п.
Термин «(низш.)алкокси» означает группу -O-(С1-С6)алкил (причем термин алкил определен выше), такую как метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, трет-бутилокси, пентилокси, гексилокси, включая их изомеры.
Термин «циклоалкил» означает насыщенную карбоциклическую группу, содержащую от 3 до 12, предпочтительно от 3 до 6 атомов углерода.
Термин «галоген» означает фтор, хлор, бром и иод.
Термин «арил» означает моновалентный циклический ароматический углеводородный радикал, содержащий одно или несколько конденсированных колец, в котором по крайней мере одно кольцо является ароматическим и который содержит в цикле от 5 до 12 атомов углерода, например фенил, бензил, нафтил, бифенил или инданил.
Термин «гетероарил» означает моновалентный ароматический карбоциклический радикал, содержащий по крайней мере один гетероатом и содержащий в цикле от 3 до 11 атомов углерода и один, два или три гетероатома, например пиридил, пиразинил, пиримидинил, пиридазинил или триазинил.
Термин «фармацевтически приемлемая соль» относится к любой соли неорганической или органической кислоты или основания.
Предпочтительными являются соединения, в которых R4 означает (низш.)алкил, наиболее предпочтительно метил.
Среди описанных соединений наиболее предпочтительными являются соединения, в которых
R1 означает галоген, (низш.)алкил, (низш.)алкокси, CF3 или циано,
R2 означает арил или гетероарил, необязательно содержащий один или несколько заместителей, выбранных из группы, включающей (низш.)алкил, галоген, (низш.)алкокси, CF3 или циано,
R3 означает Н,
R4 означает метил,
Х означает N или СН,
Y означает -(CHR)1, 2 или 3, а
R означает водород или (низш.)алкил,
а также их фармацевтически приемлемые соли.
Наиболее предпочтительными являются соединения, в которых R1, R3, R4, Y и R определены выше, Х означает CH, а R2 означает пиридил, необязательно замещенный группами (низш.)алкил или галоген, например, следующие соединения:
2-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]пиридин,
2-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]-6-метилпиридин,
5-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]-2-метилпиридин и
3-[1-(5-хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]бензонитрил.
Наиболее предпочтительными являются следующие соединения, в которых R1, R3, R4, Y и R определены выше, Х означает N, R2 означает пиридил, необязательно замещенный группами (низш.)алкил или галоген, например, следующие соединения:
4-[1-(6-метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин,
4-[1-(6-метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин, 4-[1-(2-метилпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин, 4-[1-(5-хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин, 4-[1-(2-хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин и 4-[1-(2-хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин.
Еще более предпочтительными являются соединения, в которых R1, R3, R4, Y и R определены выше, Х означает N, а R2 означает фенил, необязательно замещенный атомом галогена, например, следующие соединения:
4-(1-бензил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
4-(1-бензил-2-метил-1Н-имидазол-4-илэтинил)-2-хлорпиридин,
рац.-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
(+)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
(-)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
рац.-2-хлор-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин,
4-[3-(4-фторбензил)-2-метил-3Н-имидазол-4-илэтинил]-2-метилпиридин,
4-[3-(3,4-дифторбензил)-2-метил-3Н-имидазол-4-илэтинил]-2-метилпиридин и
2-метил-4-(2-метил-1-фенетил-1Н-имидазол-4-илэтинил)пиридин.
Еще более предпочтительными являются соединения, в которых R1, R3, R4 и Х определены выше, Y означает -(CHR)1, 2 или 3, где R означает (низш.)алкил. В этом случае Y образует 1, 2 или 3 хиральных центра. В связи с наличием таких хиральных центров соединения по настоящему изобретению существуют в виде оптических изомеров, таких как энантиомеры или рацемические смеси. Подразумевается, что данное изобретение включает указанные оптические изомеры или рацемические смеси. Примеры энантиомеров или рацемических смесей перечисленных выше соединений включают следующие соединения: рац.-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин, (+)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин, (-)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин и рац.-2-хлор-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин.
Соединения общей формулы I и их фармацевтически приемлемые соли получают по общей методике, описанной ниже:
а) взаимодействие соединения формулы

с соединением формулы R2YHal
с образованием соединения формулы
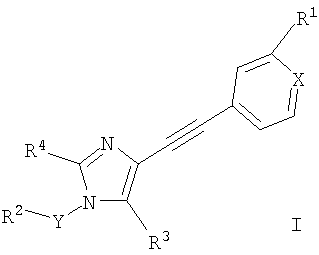
где R1, R2, R3, R4, X и Y определены выше, «Hal» означает галоген, предпочтительно хлор, бром или иод и,
при необходимости, превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
Исходными веществами служат стандартные реактивы или их получают по известным методикам.
Соединения получают по методике, показанной на приведенной ниже схеме.
Схема 1
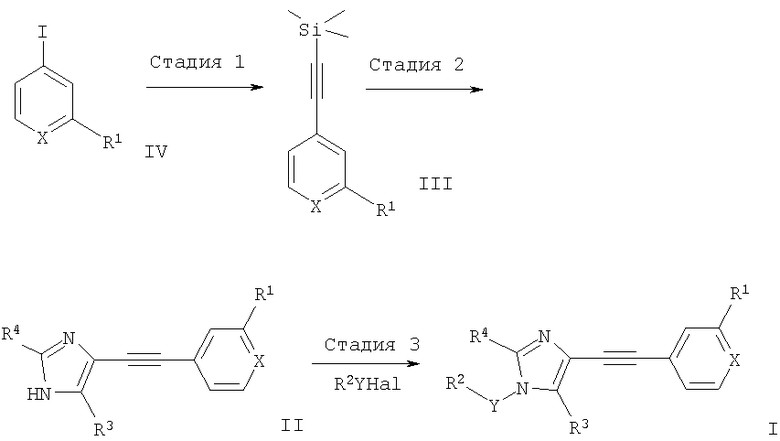
где R1, R2, R3, R4, X и Y определены выше.
Стадия 1
Соединение формулы IV, например 2-хлор-4-иодпиридин, растворяют в сухом ТГФ и триэтиламине. Смесь несколько раз вакуумируют/заполняют аргоном для удаления кислорода из раствора. Затем добавляют трифенилфосфин и хлорид бис(трифенилфосфин)палладия (II), реакционную смесь перемешивают при КТ в течение приблизительно 1 ч, добавляют иодид меди (I) и триметилсилилацетилен, реакционную смесь перемешивают в течение ночи. Растворитель упаривают, продукт формулы III высушивают и очищают хроматографией.
Стадия 2
Раствор 1
Раствор соединения формулы III, например 2-хлор-4-триметилсиланилэтинилпиридина, и 2-замещенный 5-иод-1H-имидазол (например, 5-иод-2-метил-1Н-имидазол (получение описано в статье: M.D.Cliff, S.G.Pyne, Synthesis, cc.681-682 (1994)) растворяют в сухом ТГФ и сухом ДМФА. Смесь несколько раз вакуумируют/заполняют аргоном для удаления кислорода из раствора.
Раствор 2
Трифенилфосфин, хлорид бис(трифенилфосфин)палладия (II), иодид меди (I) и триэтиламин растворяют в сухом ТГФ. Смесь несколько раз вакуумируют/заполняют аргоном для удаления кислорода из раствора. Раствор 2 нагревают до 40°С и по каплям добавляют раствор 1. Реакционную смесь нагревают до приблизительно 60°С и по каплям в течение 45 мин добавляют раствор фторида тетрабутиламмония. Реакционную смесь перемешивают при КТ в течение ночи. Растворитель упаривают, остаток высушивают и очищают хроматографией, при этом получают соединение формулы II.
Стадия 3
Гидрид натрия суспензируют в ТГФ, добавляют раствор соединения формулы II, например 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина, в сухом ТГФ и реакционную смесь перемешивают при КТ в течение 30 мин, добавляют соответствующее соединение формулы R2YHal, например гидробромид 2-(бромметил)пиридина, гидрохлорид 2-хлорметил-6-метилпиридина или (2-бромэтил)бензола, и смесь продолжают перемешивать в течение ночи. Реакционную смесь выливают в воду, экстрагируют, сушат и очищают экспресс-хроматографией, при этом получают смесь двух региоизомеров соединения формулы I. Смесь разделяют кристаллизацией.
Фармацевтически приемлемые соли соединений формулы I получают по известным методикам, при этом необходимо принимать во внимание природу соединения, соль которого необходимо получить. Для получения фармацевтически приемлемых солей соединения формулы I в виде основания используют неорганические или органические кислоты, такие как, например, соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная или лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфокислота, пара-толуолсульфокислота и т.п. Для получения фармацевтически приемлемых солей соединений в форме кислот используют соединения, которые содержат щелочные или щелочноземельные металлы, например натрий, калий, кальций, магний и т.п., основные амины или основные аминокислоты.
Соединения формулы I и их фармацевтически приемлемые соли являются, как указано выше, антагонистами метаботропного глютаматного рецептора и используются для лечения или профилактики заболеваний, опосредованных рецептором mGluR5, таких как острые и/или хронические неврологические заболевания, нарушения познавательной способности и недостаток памяти, а также острая и хроническая боль. Неврологические заболевания, для лечения которых используются соединения по настоящему изобретению, включают, например, эпилепсию, шизофрению, тревогу, острые травматические или хронические дегенеративные процессы в нервной системе, такие как болезнь Альцгеймера, старческое слабоумие, хорея Гентингтона, боковой амиотрофический склероз, рассеянный склероз, слабоумие, вызванное СПИД, травмы глаз, ретинопатию, идиопатический паркинсонизм или болезнь Паркинсона, вызванную приемом лекарственных средств, а также состояния, вызванные дефицитом глютамата, такие как мышечные спазмы, судороги, мигрень, недержание мочи, алкогольная зависимость, курение, психозы, наркотическая зависимость, страх, рвота, дискинезия и депрессия. Другие показания к применению включают нарушения функции мозга, вызванные операцией шунтирования или введением трансплантатов, нарушение кровоснабжения мозга, повреждение спинного мозга, травмы головы, гипоксию, вызванную беременностью, остановку сердечной деятельности и гипогликемию.
Соединения формулы I и их фармацевтически приемлемые соли можно использовать в качестве болеутоляющих средств. Виды боли, поддающиеся лечению, включают воспалительные боли, такие как артрит и ревматологические заболевания, васкулиты, невропатические боли, такие как тригеминальная или герпетическая невралгия, диабетическая невропатическая боль, каузалгия, гипералгезия, боль при тяжелых хронических заболеваниях, послеоперационную боль и боль, связанную с различными заболеваниями, такими как рак, стенокардия, почечные или печеночные колики, менструальная боль, мигрень и подагра.
Фармацевтическую активность соединений определяли по следующим методикам.
Для экспериментов по связыванию препарат кДНК, кодирующий рецептор mGlu5a человека, временно трансфектировали в клетки EBNA по методике, описанной в статье Schlaeger и Christensen, Cytotechnology, 15, с.1-13 (1998). Гомогенизированные клеточные мембраны до проведения анализа хранили при - 80°С и за сутки перед анализом размораживали, ресуспендировали и гомогенизировали в политроне в буферном растворе для связывания (15 мМ Трис-HCl, 120 мМ NaCl, 100 мМ KCl, 25 мМ CaCl2 25 мМ MgCl2, pH 7,4) до конечной концентрации 20 мкг белка/лунка.
Изотермы насыщения определяли при добавлении к указанным мембранам [3Н]МРЕР при 12 различных концентрациях (0,04-100 нМ) в 200 мкл и выдерживании смеси в течение 1 ч при 4°С. Эксперименты по конкурирующему связыванию проводили при фиксированной концентрации [3H]МРЕР (2 нМ), значения IC50 для исследуемых соединений рассчитывали, используя 11 концентраций (0,3-10000 нМ). Образцы выдерживали в течение 1 ч при 4°С.
После завершения инкубации мембраны фильтровали через фильтр Unifilter (96-луночный белый микропланшет с фильтром GF/C, который предварительно выдерживали в течение 1 ч в буферном растворе для промывки 0,1% PEI фирмы Packard BioScience, Meriden, СТ) с использованием сборщика клеток Filtermate 96 harvester (фирмы Packard BioScience) и промывали 3 раза холодным буферным раствором 50 мМ трис-HCl, pH 7,4. Неспецифическое связывание измеряли в присутствии 10 мкМ МРЕР. Радиоактивность на фильтре измеряли (3 мин) на сцинцилляционном счетчике радиоактивности Packard Top-count, при этом проводили коррекцию тушения после добавления 45 мкл реагента Microscint 40 (фирмы Canberra Packard S.A., Цюрих, Швейцария) и встряхивания в течение 20 мин.
Для оценки функциональной активности определяли приток кальция [Са+]i, как описано в статье Porter и др., Br. J. Pharmacol, 128, с.13-20 (1999), с использованием рекомбинантных рецепторов mGlu5a человека в клетках НЕК-293. Клетки окрашивали, используя реагент Fluo 4-AM (фирмы FLUKA, конечная концентрация 0,2 мкМ). Величину [Са+]i определяли на планшетном флуориметре (FLIPR, Molecular Devices Corporation, La Jolla, СА, США). Активность антагониста определяли после предварительного выдерживания в присутствии исследуемых соединений в течение 5 мин и последующего добавления максимального количества антагониста.
Кривые ингибирования (антагонисты) получали с использованием логистического уравнения с четырьмя параметрами и рассчитывали значение IC50 и коэффициент Хилла с использованием программного обеспечения (Xcel fit) и итеративного нелинейного метода.
Полученные величины Ki для исследованных соединений, полученные при анализе связывания, представлены ниже. Значение Ki определяли по формуле
Ki=IC50/[1+L/Kd],
где IC50 означает концентрацию соединения, при которой происходит 50% ингибирование конкурентного связывания с радиоактивным лигандом ([3Н]МРЕР). L означает концентрацию радиоактивного лиганда, который использовали при анализе связывания, а значение Кd радиоактивного лиганда определяли эмпирически для каждого препарата.
Соединения по настоящему изобретению являются антагонистами рецептора mGluR5. Активность соединений формулы I, определенная, как описано выше, находится в диапазоне Кi<100 нМ.
Соединения формулы I и их фармацевтически приемлемые соли используют в качестве лекарственных средств, например, в форме различных фармацевтических препаратов. Фармацевтические препараты вводят пероральным способом, например, в форме таблеток с покрытием, драже, мягких и твердых желатиновых капсул, растворов, эмульсий или суспензий. Однако их можно вводить и ректальным способом, например, в форме суппозиториев или парентеральным способом, например, в форме растворов для инъекций.
При получении фармацевтических препаратов соединения формулы I и их фармацевтически приемлемые соли смешивают с фармацевтически инертными неорганическими или органическими носителями. В качестве таких носителей при получении таблеток, таблеток с покрытием, драже и твердых желатиновых капсул используют, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.п. Пригодными носителями для мягких желатиновых капсул являются, например, минеральные масла, воски, жиры, полутвердые и жидкие полиолы и т.п., однако в случае мягких желатиновых капсул в зависимости от природы активного соединения обычно не требуется никакого носителя. Пригодными носителями для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.п. Для водных инъекционных растворов водорастворимых солей соединений формулы I используют адьюванты, такие как спирты, полиолы, глицерин, минеральные масла и т.п., но, как правило, в этом нет необходимости. Пригодными носителями для суппозиториев являются, например, природные или отвержденные масла, воски, жиры, полужидкие или жидкие полиолы и т.п.
Кроме того, фармацевтические препараты содержат консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферные вещества, маскирующие агенты или антиоксиданты. Препараты также могут содержать другие терапевтически ценные вещества.
Как уже упоминалось выше, объект настоящего изобретения также включает лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, а также способ получения таких лекарственных средств, которые включают одно или несколько соединений формулы I или их фармацевтически приемлемые соли и при необходимости одно или несколько других терапевтически ценных соединений в смеси с одним или несколькими терапевтически инертными носителями в составе галеновой лекарственной формы.
Дозы варьируют в широких пределах и их подбирают с учетом индивидуальных требований в каждом конкретном случае. В основном эффективные дозы для перорального или парентального введения составляют 0,01-20 мг/кг в сутки, предпочтительно 0,1-10 мг/кг в сутки для всех описанных показаний. Суточная доза для взрослого человека с массой тела 70 кг составляет от 0,7 до 1400 мг/сут, предпочтительно от 7 до 700 мг/сут.
Приведенные ниже примеры представлены для более подробного описания изобретения.
Пример 1
4-[1-(Пиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Гидрид натрия (69 мг, 55%, 1,59 ммоля) суспендировали в 2 мл сухого ТГФ, добавляли раствор 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридина (95 мг, 0,48 ммоля) в 8 мл сухого ТГФ и реакционную смесь перемешивали при КТ в течение 30 мин, затем добавляли гидробромид 2-(бромметил)пиридина (162 мг, 0,63 ммоля) и продолжали перемешивание в течение ночи. Реакционную смесь выливали в 70 мл воды и три раза экстрагировали этилацетатом (по 70 мл). Объединенные органические экстракты сушили над сульфатом натрия, фильтровали и растворитель упаривали. Неочищенный продукт очищали экспресс-хроматографией на силикагеле (элюент: дихлорметан/метанол, градиент 100:0→90:10), при этом получали смесь двух региоизомеров. Смесь разделяли кристаллизацией из диэтилового эфира, при этом получали указанное в заголовке соединение в виде твердого вещества белого цвета (35 мг, 25%). МС: m/е 289,1 (М+Н+).
Пример 2
4-[1-(Пиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 309,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидробромид 2-(бромметил)пиридина.
Пример 3
2-[4-(3-Хлорфенилэтинил)-2-метилимидазол-1-илметил]пиридин
Указанное в заголовке соединение, МС: m/е 308,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 4-(3-хлорфенилэтинил)-2-метил-1Н-имидазол и гидробромид 2-(бромметил)пиридина.
Пример 4
4-[1-(6-Метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 303,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 2-хлорметил-6-метилпиридина.
Пример 5
4-[1-(6-Метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 323,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 2-хлорметил-6-метилпиридина.
Пример 6
2-[4-(3-Хлорфенилэтинил)-2-метилимидазол-1-илметил]-6-метилпиридин
Указанное в заголовке соединение, МС: m/е 322,4 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 4-(3-хлорфенилэтинил)-2-метил-1Н-имидазол и гидрохлорид 2-хлорметил-6-метилпиридина.
Пример 7
3-[2-Метил-1-(6-метилпиридин-2-илметил)-1Н-имидазол-4-илэтинил]бензонитрил
Указанное в заголовке соединение, МС: m/е 313,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 3-(2-метил-1Н-имидазол-4-илэтинил)бензонитрил и гидрохлорид 2-хлорметил-6-метилпиридина.
Пример 8
4-[1-(2-Метилпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 323,4 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 5-хлорметил-2-метилпиридина.
Пример 9
4-[1-(3-Метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 303,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 2-хлорметил-3-метилпиридина.
Пример 10
3-[2-Метил-1-(3-метилпиридин-2-илметил)-1Н-имидазол-4-илэтинил]бензонитрил
Указанное в заголовке соединение, МС: m/е 313,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 3-(2-метил-1Н-имидазол-4-илэтинил)бензонитрил и гидрохлорид 2-хлорметил-3-метилпиридина.
Пример 11
4-[1-(Пиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 288,9 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидробромид 3-(бромметил)пиридина.
Пример 12
4-[1-(Пиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 309,3 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидробромид 3-(бромметил)пиридина.
Пример 13
3-(2-Метил-1-пиридин-3-илметил-1Н-имидазол-4-илэтинил)бензонитрил
Указанное в заголовке соединение, МС: m/е 299,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 3-(2-метил-1Н-имидазол-4-илэтинил)бензонитрил и гидробромид 3-(бромметил)пиридина.
Пример 14
4-[1-(2-Метилпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 303,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 5-хлорметил-2-метилпиридина.
Пример 15
5-[4-(3-Хлорфенилэтинил)-2-метилимидазол-1-илметил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 322,5 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 4-(3-хлорфенилэтинил)-2-метил-1Н-имидазол и гидрохлорид 5-хлорметил-2-метилпиридина.
Пример 16
4-[1-(5-Хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 323,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и 2-хлор-5-хлорметилпиридин.
Пример 17
4-[1-(2-Хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 323,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 3-хлор-5-хлорметилпиридина.
Пример 18
3-[1-(5-Хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил] бензонитрил
Указанное в заголовке соединение, МС: m/е 333,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 3-(2-метил-1Н-имидазол-4-илэтинил)бензонитрил и гидрохлорид 3-хлор-5-хлорметилпиридина.
Пример 19
4-[1-(Пиридин-4-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 333,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 4-(хлорметил)пиридина.
Пример 20
4-[1-(2-Метилпиридин-4-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 323,3 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и гидрохлорид 4-хлорметил-2-метилпиридина.
Пример 21
4-(1-Бензил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 288,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и бензилбромид.
Пример 22
4-(1-Бензил-2-метил-1Н-имидазол-4-илэтинил)-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 308,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и бензилбромид.
Пример 23
рац.-2-Метил-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил] пиридин
Указанное в заголовке соединение, МС: m/е 302,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и (1-бромэтил)бензол.
Пример 24
(+)-2-Метил-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин
рац.-2-Метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин разделяли на энантиомеры при помощи хиральной ЖХВР (Chiralpac AD, элюент: 10% изопропанол в гептане). Энантиомер с меньшим временем удерживания (в.у.) является (+)-энантиомером.
Пример 25
(-)-2-Метил-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин
рац.-2-Метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин разделяли на энантиомеры при помощи хиральной ЖХВР (Chiralpac AD, элюент: 10% изопропанол в гептане). Энантиомер с большим в.у. является (-)-энантиомером.
Пример 26
рац.-2-Хлор-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин
Указанное в заголовке соединение, МС: m/e 322,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и (1-бромэтил)бензол.
Пример 27
4-[1-(4-Фторбензил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 306,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и 4-фторбензилбромид.
Пример 28
4-[1-(3,4-Дифторбензил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин
Указанное в заголовке соединение, МС: m/е 324,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и 3,4-дифторбензилбромид.
Пример 29
2-Метил-4-(2-метил-1-фенетил-1Н-имидазол-4-илэтинил)пиридин
Указанное в заголовке соединение, МС: m/е 302,2 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и (2-бромэтил)бензол.
Пример 30
4-[1-(2-Хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин
Указанное в заголовке соединение, МС: m/е 343,1 (М+Н+), получали по методике, описанной выше в примере 1, в качестве исходных соединений использовали 2-хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин и 2-хлор-5-хлорметилпиридин.
Получение промежуточных соединений
Пример А
2-Хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин
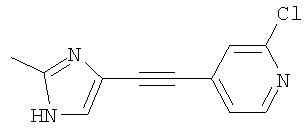
Стадия 1
2-Хлор-4-триметилсиланилэтинилпиридин
2-Хлор-4-иодпиридин (10,0 г, 41,8 ммоля) растворяли в 200 мл сухого ТГФ и 17,5 мл триэтиламина. Смесь несколько раз вакуумировали/заполняли аргоном для удаления кислорода из раствора, добавляли трифенилфосфин (329 мг, 1,25 ммоля) и хлорид бис(трифенилфосфин)палладия (II) (1,47 г, 2,09 ммоля), реакционную смесь перемешивали при КТ в течение 1 ч, затем добавляли иодид меди (I) (239 мг, 1,25 ммоля) и триметилсилилацетилен (6,28 г, 6,39 ммоля), реакционную смесь перемешивали при КТ в течение ночи. Растворитель упаривали, остаток переносили в 500 мл воды и три раза экстрагировали этилацетатом (по 500 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали хроматографией на силикагеле (элюент: циклогексан/этилацетат, 80:20). Указанное в заголовке соединение получали в виде полутвердого вещества светло-коричневого цвета (10 г, >100%). Полученное вещество использовали на следующей стадии без дополнительной очистки.
Стадия 2
2-Хлор-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин
Раствор 1
2-Хлор-4-триметилсиланилэтинилпиридин (8,9 г, чистота <100%, как указано при описании стадии 1) и 5-иод-2-метил-1Н-имидазол (13,24 г, 64 ммоля, получение описано в статье M.D.Cliff, S.G.Pyne, Synthesis, с.681-682 (1994)) растворяли в 75 мл сухого ТГФ и 20 мл сухого ДМФА. Смесь несколько раз вакуумировали/заполняли аргоном для удаления кислорода из раствора.
Раствор 2
Трифенилфосфин (223 мг, 0,85 ммоля), хлорид бис(трифенилфосфин)палладия (II) (1,79 г, 2,55 ммоля), иодид меди (I) (81 мг, 0,43 ммоля) и триэтиламин (8,87 мл, 64 ммоля) растворяли в 75 мл сухого ТГФ. Смесь несколько раз вакуумировали/заполняли аргоном для удаления кислорода из раствора.
Раствор 2 нагревали до 40°С и по каплям добавляли раствор 1.
Реакционную смесь нагревали до 60°С и по каплям в течение 45 мин добавляли раствор фторида тетрабутиламмония (1 М в ТГФ, 55 мл, 55 ммолей). Реакционную смесь перемешивали при комнатной температуре в течение ночи, растворитель упаривали. Остаток переносили в 200 мл воды и три раза экстрагировали этилацетатом (3×200 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и упаривали. Неочищенный продукт очищали хроматографией на силикагеле (элюент: хлористый метилен/метанол, 95:5) и перекристаллизовывали из смеси хлористого метилена и этилацетата. Указанное в заголовке соединение получали в виде твердого вещества светло-коричневого цвета (2,89 г, 31%).
Пример В
2-Метил-4-(2-метил-1Н-имидазол-4-илэтинил)пиридин
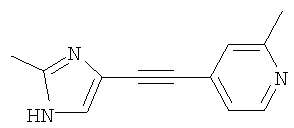
Указанное в заголовке соединение получали по методике, описанной выше в примере А (стадии 1 и 2), в качестве исходных соединений использовали 4-иод-2-метилпиридин и 5-иод-2-метил-1Н-имидазол.
Пример С
4-(3-Хлорфенилэтинил)-2-метил-1Н-имидазол
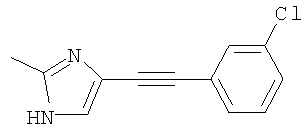
Указанное в заголовке соединение получали по методике, описанной выше в примере А (стадии 1 и 2), в качестве исходных соединений использовали 3-хлориодбензол и 5-иод-2-метил-1Н-имидазол.
Пример D
3-(2-Метил-1Н-имидазол-4-илэтинил)бензонитрил
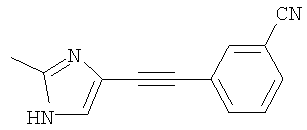
Указанное в заголовке соединение получали по методике, описанной выше в примере А (стадии 1 и 2), в качестве исходных соединений использовали 3-бромбензонитрил и 5-иод-2-метил-1Н-имидазол.
Пример Е
Гидрохлорид 2-хлорметил-6-метилпиридина
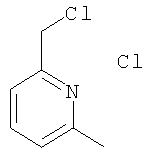
К тионилхлориду (35 мл, 477 ммолей) при 0°С порциями добавляли 2-(гидроксиметил)-6-метилпиридин (3,7 г, 29,4 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч, избыток тионилхлорида удаляли в вакууме, неочищенный гидрохлорид 2-хлорметил-6-метилпиридина (5,1 г, твердое вещество светло-коричневого цвета) использовали без дополнительной очистки.
Пример F
Гидрохлорид 2-хлорметил-3-метилпиридина
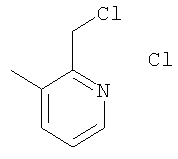
Указанное в заголовке соединение получали по методике, описанной выше в примере Е, в качестве исходных соединений использовали 2-(гидроксиметил)-3-метилпиридин и тионилхлорид.
Пример G
Гидрохлорид 5-хлорметил-2-метилпиридина
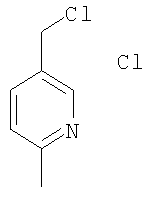
Указанное в заголовке соединение получали по методике, описанной выше в примере Е, в качестве исходных соединений использовали 5-(гидроксиметил)-2-метилпиридин и тионилхлорид.
Пример Н
Гидрохлорид 3-хлор-5-(хлорметил)пиридина
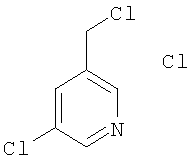
Указанное в заголовке соединение получали по методике, описанной выше в примере Е, в качестве исходных соединений использовали 5-(гидроксиметил)-3-хлорпиридин и тионилхлорид.
Пример I
Гидрохлорид 4-хлорметил-2-метилпиридина
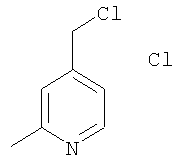
Указанное в заголовке соединение получали по методике, описанной выше в примере Е, в качестве исходных соединений использовали 4-(гидроксиметил)-2-метилпиридин и тионилхлорид.
Получение фармацевтических композиций
Пример I
Таблетки указанного состава получали стандартным способом,
мг/таблетка:
Пример II
Таблетки указанного состава получают стандартным способом,
мг/таблетка:
Пример III
Получали капсулы следующего состава,
мг/капсула:
Активный ингредиент с пригодным размером частиц, кристаллическую лактозу и микрокристаллическую целлюлозу смешивали до гомогенного однородного состояния, просеивали и затем добавляли тальк и стеарат магния. Полученной смесью заполняли твердые желатиновые капсулы пригодного размера.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ ГЛУТАМАТНЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2327697C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ АМИНОПИРИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ mGIuR5 | 2004 |
|
RU2330020C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА III | 2004 |
|
RU2360911C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR5 | 2010 |
|
RU2527106C2 |
| ФЕНИЛЭТЕНИЛ- ИЛИ ФЕНИЛЭТИНИЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ГЛУТАМАТНОГО РЕЦЕПТОРА | 2001 |
|
RU2284323C9 |
| ПРОИЗВОДНЫЕ БЕНЗОТИАЗОЛА | 2001 |
|
RU2251419C2 |
| АМИНОПИРАЗИНОВЫЕ СОЕДИНЕНИЯ СО СВОЙСТВАМИ АНТАГОНИСТА A2A | 2015 |
|
RU2727805C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПРОСТОГО ЭФИРА ИЗОКСАЗОЛИЛА В КАЧЕСТВЕ ПАМ ГАМК A АЛЬФА5 | 2019 |
|
RU2800160C2 |
| АРИЛ-ИЗОКСАЗОЛ-4-ИЛ-ИМИДАЗО[1,2-a]ПИРИДИН, ПРИГОДНЫЙ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА ЧЕРЕЗ ПОСРЕДСТВО GABA-РЕЦЕПТОРОВ | 2007 |
|
RU2426732C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ, ОБЛАДАЮЩЕЕ СЕЛЕКТИВНОЙ БЛОКИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ПОДВИДА NMDA-РЕЦЕПТОРОВ | 2002 |
|
RU2303037C2 |
Изобретение относится к новым соединениям общей формулы
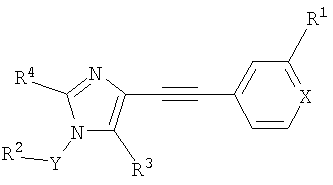
где R1 означает галоген, (низш.)алкил, (низш.)алкокси, CF3 или циано, R2 означает арил или гетероарил, необязательно содержащий один или несколько заместителей, выбранных из группы, включающей (низш.)алкил, галоген, R3 означает водород или CH2R5, где R5 означает водород или C1-С6алкил, R4 означает (низш.)алкил, X означает N или СН, Y означает -(CHR)1, 2 или 3, R означает водород или (низш.)алкил, и к его фармацевтически приемлемым солям. Изобретение также относится к способу получения соединения формулы I, к лекарственному средству, а также к применению соединений по любому из пп.1-8. Технический результат - получение новых биологически активных соединений, предназначенных для лечения и профилактики нарушений, опосредованных рецептором mGluR5. 4 н. и 10 з.п. ф-лы.
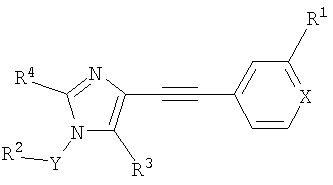
где R1 означает галоген, (низш.)алкил, (низш.)алкокси, CF3 или циано,
R2 означает арил или гетероарил, необязательно содержащий один или несколько заместителей, выбранных из группы, включающей (низш.)алкил, галоген,
R3 означает водород или CH2R5, где R5 означает водород или С1-С6алкил,
R4 означает (низш.)алкил,
X означает N или СН,
Y означает -(CHR)1, 2 или 3,
R означает водород или (низш.)алкил,
и его фармацевтически приемлемые соли.
R1 означает галоген, (низш.)алкил, (низш.)алкокси, CF3 или циано,
R2 означает арил или гетероарил, необязательно содержащий один или несколько заместителей, выбранных из группы, включающей (низш.)алкил, галоген,
R3 означает Н,
R4 означает метил,
X означает N или СН,
Y означает -(CHR)1, 2 или 3,
R означает водород или (низш.)алкил,
и его фармацевтически приемлемые соли.
2-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]пиридин,
2-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]-6-метилпиридин,
5-[4-(3-хлорфенилэтинил)-2-метилимидазол-1-илметил]-2-метилпиридин и
3-[1-(5-хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]бензонитрил.
4-[1-(6-метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин,
4-[1-(6-метилпиридин-2-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин,
4-[1-(2-метилпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин,
4-[1-(5-хлорпиридин-3-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин,
4-[1-(2-хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-хлорпиридин и
4-[1-(2-хлорпиридин-5-илметил)-2-метил-1Н-имидазол-4-илэтинил]-2-метилпиридин.
4-(1-бензил-2-метил-1Н-имидазол-4-илэтинил)-2-метилпиридин,
4-(1-бензил-2-метил-1Н-имидазол-4-илэтинил)-2-хлорпиридин,
рац.-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
(+)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
(-)-2-метил-4-[2-метил-3-(1-фенилэтил)-3Н-имидазол-4-илэтинил]пиридин,
рац.-2-хлор-4-[2-метил-1-(1-фенилэтил)-1Н-имидазол-4-илэтинил]пиридин,
4-[3-(4-фторбензил)-2-метил-ЗН-имидазол-4-илэтинил]-2-метилпиридин,
4-[3-(3,4-дифторбензил)-2-метил-ЗН-имидазол-4-илэтинил]-2-метилпиридин и
2-метил-4-(2-метил-1 -фенэтил-1 Н-имидазол-4-илэтинил)пиридин.
а) взаимодействие соединения формулы
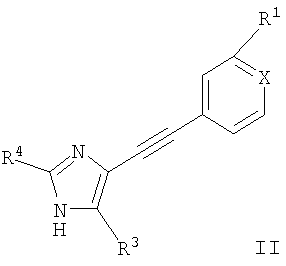
с соединением формулы R2YHal
с образованием соединения формулы
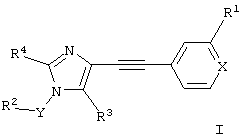
где R1, R2, R3, R4, X и Y определены выше, Hal означает галоген, предпочтительно хлор, бром или иод, и
при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| RU 2001120723 A, 27.06.2003. | |||
Авторы
Даты
2009-01-27—Публикация
2004-08-27—Подача