Область техники, к которой относится изобретение
Данное изобретение относится к усовершенствованному способу получения ингибиторов протонного насоса, к ингибиторам протонного насоса, полученным данным способом, композициям, содержащим данные лекарственные средства, и их применению.
Уровень техники
Желудочные ингибиторы протонного насоса (PPI) включают замещенные 2-(2-пиридилметил)сульфинил-1Н-бензимидазолы, такие как лансопразол (2-[[[3-метил-4-(2,2,2-трифторэтокси)-2-пиридинил]метил]сульфинил]-1H-бензимидазол), омепразол (5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]-1H-бензимидазол), пантопразол (5-(дифторметокси)-2-[[(3,4-диметокси-2-пиридинил)метил]сульфинил]-1Н-бензимидазол) и рабепразол (2-[[[4-(3-метоксипропокси)-3-метил-2-пиридинил]метил]сульфинил]-1H-бензимидазол). Данные соединения могут давать эффективное и стойкое ингибирование секреции желудочной кислоты, причем ответные реакции на PPI являются более быстрыми по сравнению с реакциями, наблюдаемыми при использовании других анти-секреторных лекарственных средств. PPI действуют, ингибируя продуцирование желудочной кислоты подавлением работы в желудке системы, известной как протонный насос, полное название которой гидрокалиевая аденозинтрифосфатная ферментная система. PPI являются лекарственными средствами, используемыми при диспепсии и язвенных болезнях, а также синдроме Золлингена-Эллисона. В частности, при лечении пептических язв скорости ответных реакций на PPI превосходят скорости ответных реакций, наблюдаемые при использовании других лекарственных средств.
Описанный в предшествующем уровне синтез замещенных 2-(2-пиридилметил)сульфинил-1Н-бензимидазолов обычно включает окисление сульфидного соединения до соответствующего сульфинил-производного. Точнее, описанные ранее способы получения 2-(2-пиридилметил)сульфинил-1-бензимидазолов обычно включают синтез соответствующего простого тиоэфира и его последующее окисление до сульфинил- или сульфокси-производного различными способами, например взаимодействием с пероксидом водорода в присутствии ванадиевого катализатора или взаимодействием с надкислотами, эфирами надкислот или озоном. Такие известные способы получения страдают некоторыми недостатками, связанными, прежде всего, с природой тиоэфира (или сульфида), подлежащего окислению.
В патенте США № 4628098 (Nohara, et al.) описывается способ получения лансопразола окислением сульфидного производного с использованием надкислот (м-хлорнадбензойной кислоты).
В патенте США № 5840552 (Holt, et al.) описывается способ получения лансопразола, в котором сульфидный предшественник подвергался селективному окислению биологическим способом для выделения фармацевтически активного энантиомера или энантиомерно обогащенной сульфоксидной формы с использованием микроорганизмов или микробной ферментной системы.
В патенте США № 5374730 (Slemon, et al.) описывается способ получения омепразола и лансопразола, в котором амидные аналоги простых тиоэфиров легко подвергались окислению до соответствующих сульфинил-производных, и сульфинил-производные подвергались гидролизу в щелочной среде до соответствующих солей карбоновых кислот. После этого соли подвергались декарбоксилированию с получением омепразола или лансопразола, соответственно. В качестве преимуществ заявлены чистота конечных продуктов и простота методик очистки. Амидные производные, которые подвергались взаимодействию на стадии окисления, представляли собой твердые кристаллические вещества, а не масла, и сами по себе могли быть легко очищены до высокой степени чистоты в соответствии с относительно простыми методиками осаждения, кристаллизации и промывки. Карбоксилаты и соли карбоновых кислот, которые образовывались на следующей за окислением стадии синтеза, были растворимы в воде, в то время как конечные продукты, омепразол и лансопразол, являются нерастворимыми в воде. Таким образом, любые непрореагировавшие остатки, а также другие незначительные примеси в конечных продуктах могли легко удаляться промывкой водой. Еще одним заявленным преимуществом было предотвращение значительного изменения цвета продукта.
В патенте США № 5470983 (Slemon, et al.) описываются способы получения лансопразола из ацетамидсульфидных производных окислением с получением амидсульфинил-производного, с последующим щелочным гидролизом и получением сульфинилкарбоксилата или его соли, и декарбоксилированием.
В патенте США № 5502195 (Slemon, et al.) описывается способ получения лансопразола, где сульфид ацетамида подвергался окислению до соответствующего амидсульфинил-производного, который далее подвергался гидролизу в щелочной среде до соли карбоновой кислоты и затем декарбоксилированию с получением лансопразола.
В патенте США № 6423846 (Moon, et al.) обсуждаются проблемы, связанные с методами окисления, описанными в способах предшествующего уровня техники превращения соединений-предшественников в лансопразол, в которых происходило образование ряда побочных продуктов, и выход лансопразола был низким. В Европейской заявке на патент EP 134400, в патенте Великобритании № 2134523, в патенте США № 4628098 и в патенте Кореи № 52837 описывается применение в качестве окислителя м-хлорнадбензойной кислоты. В патентах Испании №№ 550057, 540147 и 539793 описывается применение в качестве окислителей периодата натрия, йодозометилбензола и йодозобензола соответственно. Эти способы предшествующего уровня техники приведены в качестве примеров способов, которые не имеют перспективы промышленного применения вследствие высокой стоимости окислителей, используемых в них, образования большого количества примесей и низкого выхода продукта, который составляет примерно от 60 до 80%.
Во всех описанных выше способах предшествующего уровня техники используются либо дорогостоящие катализаторы, либо опасные окислители, такие как надкислоты, которые не подходят для производства данных соединений в промышленном масштабе. Кроме того, общей проблемой, характерной для способов предшествующего уровня техники, является избыточное окисление тиоэфирного производного до соответствующего сульфонового аналога.
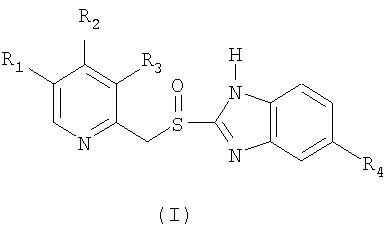
Таким образом, давно существовала необходимость в эффективных и безопасных способах селективного окисления сульфидного соединения формулы (II)
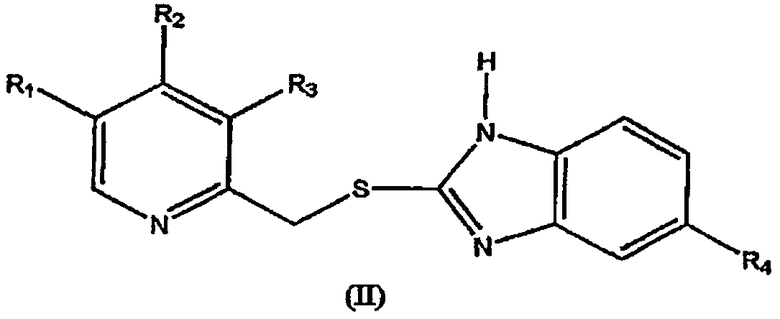
с получением сульфинил-производного формулы (I)
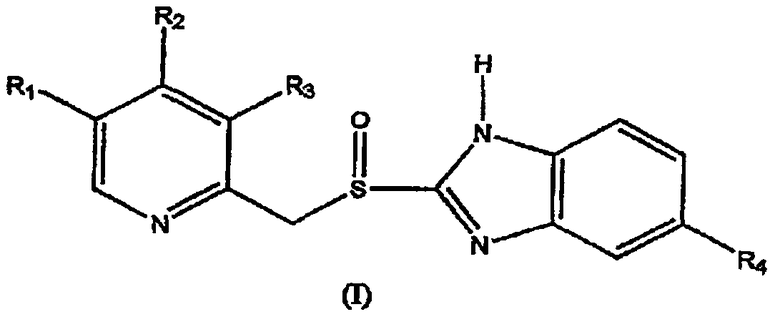
где в формулах (I) и (II) R1 и R3 выбраны из группы, включающей водород, метил или C1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный С1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный C1-4алкокси.
Раскрытие изобретения
В настоящее время данное изобретение предоставляет эффективный, безопасный и применимый в промышленном масштабе способ получения различных замещенных 2-(2-пиридилметил)сульфинил-1Н-бензимидазолов.
В частности, задачей данного изобретения является предоставление улучшенного способа окисления 2-[[[3-метил-4-(2,2,2-трифторэтокси)-2-пиридинил]метил]тио]-1Н-бензимидазола с получением 2-[[[3-метил-4-(2,2,2-трифторэтокси)-2-пиридинил]метил]сульфинил]-1H-бензимидазола (лансопразола), предпочтительно с использованием экологически безопасного, недорогого и легко доступного реагента.
Другой задачей данного изобретения является предоставление улучшенного способа окисления 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]тио]-1Н-бензимидазола с получением соответствующего 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]-1Н-бензимидазола (омепразола), предпочтительно с использованием экологически безопасного, недорогого и легкодоступного реагента.
Еще одной задачей данного изобретения является предоставление улучшенного способа окисления 5-(дифторметокси)-2-[[(3,4-диметокси-2-пиридинил)метил]тио]-1H-бензимидазола с получением соответствующего 5-(дифторметокси)-2-[[(3,4-диметокси-2-пиридинил)метил]сульфинил]-1Н-бензимидазола (пантопразола), предпочтительно с использованием экологически безопасного, недорогого и легкодоступного реагента.
Еще одна задача данного изобретения состоит в предоставлении улучшенного способа окисления 2-[[[4-(3-метоксипропокси)-3-метил-2-пиридинил]метил]тио]-1H-бензимидазола с получением соответствующего 2-[[[4-(3-метоксипропокси)-3-метил-2-пиридинил]метил]сульфинил]-1Н-бензимидазола (рабепразола), предпочтительно с использованием экологически безопасного, недорогого и легко доступного реагента.
В частности, данное изобретение предоставляет способ получения сульфинильного производного формулы (I) или его фармацевтически приемлемой соли, гидрата или сольвата,

который включает окисление сульфидного соединения формулы (II)

где в формулах (I) и (II) R1 и R3 выбраны из группы, включающей водород, метил или C1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный C1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный С1-4алкокси;
в котором соединение формулы (II) добавляют в растворитель или смесь растворителей с получением реакционной смеси, в указанную смесь добавляют окислитель и указанное окисление проводят при контролируемой температуре и контролируемом рН с получением соединения формулы (I) и, необязательно, превращают сульфинильное производное формулы (I) в его фармацевтически приемлемую соль, гидрат или сольват;
отличающийся тем, что в реакционной смеси присутствует щелочь, по меньшей мере, во время указанного окисления, в результате чего значение рН реакционной смеси, по меньшей мере, в процессе указанного окисления находится в интервале от 9 до 12. Предпочтительно окислитель включает водный раствор гипогалогенита.
Данное изобретение предоставляет также способ получения сульфинильного соединения формулы (I) или его фармацевтически приемлемой соли, гидрата или сольвата,

который включает окисление сульфидного производного формулы (II)

где в формулах (I) и (II) R1 и R3 выбраны из группы, включающей водород, метил или C1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный C1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный С1-4алкокси;
отличающийся тем, что указанное соединение формулы (II) подвергают взаимодействию с окислителем, включающим водный раствор гипогалогенита,
и, необязательно, превращают сульфинильное производное формулы (I) в его соответствующую фармацевтически приемлемую соль, гидрат или сольват.
Соединение формулы (II) необязательно подвергают взаимодействию с водным раствором гипогалогенита в присутствии катализатора, подходящим образом выбранного из группы, включающей пиридин, диизопропилэтиламин и N,N-диметиламинопиридин. Применение такого катализатора необходимо для предотвращения последующего образования нежелательных побочных продуктов.
Обычно способ согласно данному изобретению включает растворение или суспендирование сульфидного предшественника формулы (II) в соответствующем растворителе или смеси растворителей. Подходящий растворитель включает воду, низшие алкиловые спирты, сложные эфиры, простые эфиры, хлорированные растворители или их смеси. Предпочтительный растворитель выбран из группы, включающей воду, метанол, этанол, изопропанол, диизопропиловый эфир, дихлорметан, ацетонитрил и этилацетат или смеси двух или нескольких из указанных растворителей. После этого контролируемым образом добавляется водный раствор гипогалогенита, предпочтительно гипохлорита натрия, при подходящих температурных условиях с получением после обработки в соответствии с простыми методиками сульфинильного производного формулы (I) с очень высоком выходом и чистотой.
Способ согласно данному изобретению обычно проводится при температуре в интервале от -30 до 50°C. Предпочтительная температура процесса находится в интервале от 0 до 30°C.
Водный раствор гипогалогенита, подходящий для использования в способе согласно данному изобретению, обычно включает водный раствор гипогалогенита щелочного металла или щелочно-земельного металла и предпочтительно выбран из группы, включающей гипохлорит натрия, гипобромит натрия и гипохлорит кальция. Гипохлорит натрия наиболее предпочтителен. Концентрация водного раствора гипогалогенита, подходящего для использования в способе согласно данному изобретению, обычно находится в интервале от 2% до 30%. Однако, с точки зрения простоты обработки, предпочтительно использовать водный раствор гипогалогенита с концентрацией в интервале от 2% до 5%.
Водный раствор гипогалогенита обычно добавляют к реакционной смеси, включающей сульфидный предшественник формулы (II), растворенный или суспендированный в подходящем растворителе или смеси растворителей, в течение периода времени от нескольких минут до нескольких часов в зависимости от концентрации раствора гипогалогенита и экзотермичности реакции. Предпочтительно проводить добавление медленно в течение периода времени в интервале от 30 минут до 4 часов, причем для обеспечения полноты реакции требуется от 2 до 10 часов.
Может быть использован коммерчески доступный раствор гипогалогенита, однако полезно использовать свежеприготовленный раствор, обычно содержащий примерно от 0,5% до 5% соответствующего свободного гидроксида щелочного или щелочно-земельного металла. Присутствие свободного гидроксида щелочного или щелочно-земельного металла не только стабилизирует гипогалогенит, но и проявляет преимущественное стабилизирующее действие на сульфинилбезимидазольные продукты, которые, как известно, являются неустойчивыми в кислотных условиях. Альтернативно, раствор гидроксида щелочного или щелочно-земельного металла или другой подходящей щелочи может быть добавлен к суспензии или раствору сульфидного предшественника формулы (II) в растворителе или смеси растворителей перед добавлением окислителя.
Сульфинильное производное формулы (I) может быть подходящим образом выделено из реакционной массы регулированием значения рН с использованием водной органической или минеральной кислоты. Как правило, рН регулируется так, чтобы его значение находилось в интервале от 6,0 до 9,5, более предпочтительно в интервале от 7 до 7,5, с помощью водной уксусной кислоты с последующим фильтрованием для выделения сульфинильного производного формулы (I).
Сульфинильное соединение формулы (I) может быть далее очищено растворением в смеси C1-4алканола, обычно метанола, и водного раствора гидроксида щелочного металла, обычно раствора гидроксида натрия. рН полученного прозрачного раствора доводят до значения в интервале от 9,0 до 9,5 обычно с использованием водного раствора ацетата аммония и сульфинильное соединение формулы (I) выделяют фильтрованием.
Способ согласно данному изобретению, по существу, описанный выше, может далее включать превращение сульфинильного соединения формулы (I) в соответствующую фармацевтически приемлемую соль, гидрат или сольват, в особенности в фармацевтически приемлемую солевую форму. Подходящие соли включают соли щелочных или щелочно-земельных металлов, например соли Mg2+, Ca2+, Na+, K+ или Li+, особенно соли Mg2+ или Na+.
В случае, когда R2 представляет собой замещенный алкокси, как, по существу, описано выше, подходящие заместители включают один или несколько галогеновых заместителей, например один или несколько атомов фтора, или один или несколько алкоксизаместителей, таких как C1-3алкокси, в частности метокси.
В случае, когда R4 представляет собой замещенный алкокси, как, по существу, описано выше, соответствующие заместители включают один или несколько атомов галогенов, например один или несколько атомов фтора.
Предпочтительным соединением, полученным согласно способу по данному изобретению, является лансопразол, когда в формуле (I) R1 представляет собой метил, R2 представляет собой трифторэтокси, R3 представляет собой водород и R4 представляет собой водород.
Еще одним предпочтительным соединением, полученным согласно способу по данному изобретению, является омепразол, когда в формуле (I) R1 представляет собой метил, R2 представляет собой метокси, R3 представляет собой метил и R4 представляет собой метокси.
Еще одним предпочтительным соединением, полученным согласно способу по данному изобретению, является пантопразол, когда в формуле (I) R1 представляет собой метокси, R2 представляет собой метокси, R3 представляет собой водород и R4 представляет собой дифторметокси.
Еще одним предпочтительным соединением, полученным согласно способу по данному изобретению, является рабепразол, когда в формуле (I) R1 представляет собой метил, R2 представляет собой ОСН2СН2CH2ОМе, R3 представляет собой водород и R4 представляет собой водород.
Данное изобретение дополнительно предоставляет лансопразол, полученный способом, по существу, описанным выше. Предпочтительно лансопразол, полученный в соответствии с данным изобретением, по существу, свободен от загрязнений, представляющих собой побочные продукты окисления.
Данное изобретение предоставляет также омепразол, полученный способом, по существу, описанным выше. Предпочтительно омепразол, полученный в соответствии с данным изобретением, по существу, свободен от загрязнений, представляющих собой побочные продукты окисления.
Данное изобретение предоставляет также пантопразол, полученный способом, по существу, описанным выше. Предпочтительно пантопразол, полученный в соответствии с данным изобретением, по существу, свободен от загрязнений, представляющих собой побочные продукты окисления.
Данное изобретение предоставляет также рабепразол, полученный способом, по существу, описанным выше. Предпочтительно рабепразол, полученный в соответствии с данным изобретением, по существу, свободен от загрязнений, представляющих собой побочные продукты окисления.
Данное изобретение предоставляет также фармацевтическую композицию, включающую сульфинильное соединение формулы (I)

где R1 и R3 выбраны из группы, включающей водород, метил или С1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный C1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный C1-4алкокси; указанное соединение формулы (I) получено способом, по существу, описанным выше; в сочетании с фармацевтически приемлемым носителем или наполнителем. Предпочтительная композиция согласно данному изобретению включает лансопразол, полученный способом, по существу, описанным выше, в сочетании с фармацевтически приемлемым носителем или наполнителем. Другая предпочтительная композиция согласно данному изобретению включает омепразол, полученный способом, по существу, описанным выше, в сочетании с фармацевтически приемлемым носителем или наполнителем. Еще одна предпочтительная композиция согласно данному изобретению включает пантопразол, полученный способом, по существу, описанным выше, в сочетании с фармацевтически приемлемым носителем или наполнителем. Еще одна предпочтительная композиция согласно данному изобретению включает рабепразол, полученный способом, по существу, описанным выше, в сочетании с фармацевтически приемлемым носителем или наполнителем.
Данное изобретение предоставляет также лансопразол, полученный способом, по существу, описанным выше, для применения в терапии. Данное изобретение предоставляет также омепразол, полученный способом, по существу, описанным выше, для применения в терапии. Данное изобретение предоставляет также пантопразол, полученный способом, по существу, описанным выше, для применения в терапии. Данное изобретение предоставляет также рабепразол, полученный способом, по существу, описанным выше, для применения в терапии.
Данное изобретение предоставляет также лансопразол, полученный способом, по существу, описанным выше, для применения в производстве лекарственного средства для лечения язв желудка и связанных с ними состояний. Данное изобретение предоставляет также омепразол, полученный способом, по существу, описанным выше, для применения в производстве лекарственного средства для лечения язв желудка и связанных с ними состояний. Данное изобретение предоставляет также пантопразол, полученный способом, по существу, описанным выше, для применения в производстве лекарственного средства для лечения язв желудка и связанных с ними состояний. Данное изобретение предоставляет также рабепразол, полученный способом, по существу, описанным выше, для применения в производстве лекарственного средства для лечения язв желудка и связанных с ними условий.
Данное изобретение предоставляет также способ лечения язв желудка и связанных с ними состояний, который включает введение больному, нуждающемуся в таком лечении, лансопразола, полученного способом, по существу, описанным выше. Данное изобретение предоставляет также способ лечения язв желудка и связанных с ними состояний, который включает введение больному, нуждающемуся в таком лечении, омепразола, полученного способом, по существу, описанным выше. Данное изобретение предоставляет также способ лечения язв желудка и связанных с ними состояний, который включает введение больному, нуждающемуся в таком лечении, пантопразола, полученного способом, по существу, описанным выше. Данное изобретение предоставляет также способ лечения язв желудка и связанных с ними состояний, который включает введение больному, нуждающемуся в таком лечении, рабепразола, полученного способом, по существу, описанным выше.
Осуществление изобретения
Далее настоящее изобретение будет иллюстрировано представленными примерами, которые никоим образом не ограничивают область изобретения. Хотя данное изобретение описано выше со ссылками на предпочтительные или иллюстративные варианты его осуществления, эти варианты не предназначены для ограничения данного изобретения. Напротив, подразумевается, что изобретение охватывает все варианты, модификации и эквиваленты, включенные в его объем, который определен в прилагаемой формуле изобретения.
Примеры
Пример 1
Получение натриевой соли 2-[[[4-(3-метоксипропокси)-3-метил-2-пиридинил]метил]сульфинил]-1Н-бензимидазола (натриевой соли рабепразола)
2-[[[4-(3-Метоксипропокси)-3-метил-2-пиридинил]метил]тио]-1Н-бензимидазол (10 г) суспендируют в 200 мл очищенной воды, гидроксиде натрия (примерно 2 г) и пиридине (4 мл). К полученной смеси медленно, в течение 2 часов, добавляют примерно 75 г приблизительно 3,8% раствора гипохлорита натрия. Реакционную массу выдерживают при 5-8°C в течение 4 часов. После завершения реакции избыток гипохлорита натрия разлагают, используя 5% водный раствор тиосульфата натрия. рН доводят до значения в интервале от 8,0 до 9,0 с помощью 10% раствора ацетата аммония.
После этого соединение выделяют из водного слоя добавлением этилацетата с последующей экстракцией. Концентрирование органического слоя в вакууме приводит к получению остатка, к которому добавляют изопропилацетат и полученную смесь перемешивают в течение примерно 1 часа, получая целевой продукт. Продукт очищают растворением в смеси ацетона и триэтиламина. Полученный таким образом рабепразол в форме свободного основания растворяют в смеси этилацетата и метанольного аммиака, к смеси добавляют метанольный раствор гидроксида натрия и смесь отгоняют при низкой температуре до густого остатка. Остаток снова растворяют в этилацетате и натриевую соль рабепразола выделяют добавлением смеси н-гептан/н-гексан и сушат.
Пример 2
Получение 5-(дифторометокси)-2-[[[(3,4-диметокси-2-пиридинил)метил]сульфинил]-1H-бензимидазола (пантопразола)
5-(Дифторметокси)-2-[[(3,4-диметокси-2-пиридинил)метил]тио]-1H-бензимидазол (10 г) растворяют в очищенной воде (100 мл) и метаноле (10 мл). К полученной смеси добавляют 80 г 3,5% водного раствора гипохлорита натрия с содержанием гидроксида натрия 2,4-2,8% и полученную смесь выдерживают при температуре 5-8°C в течение приблизительно 1 часа. Избыток гипохлорита разлагают, используя 5% водный раствор тиосульфата натрия. рН реакционной смеси доводят до значения в интервале 8,0-9,5 с помощью ацетата аммония. Твердые вещества отфильтровывают, промывают охлажденной водой и сушат в печи, получая 8,5 г указанного в заголовке соединения.
Пример 3
Получение 2-[[[3-метил-4-(2,2,2-трифторэтокси)-2-пиридинил]метил]сульфинил]-1Н-бензимидазола (лансопразола)
2-[[[3-Метил-4-(2,2,2-трифторэтокси)-2-пиридинил]метил]тио]-1H-бензимидазол (10 г) суспендируют в 100 мл смеси ацетонитрила и воды (7:3). К полученной суспензии добавляют раствор гидроксида натрия. В течение 4 часов добавляют 61 г раствора гипохлорита натрия (4,2%), поддерживая температуру смеси на уровне 5°C-10°C. Избыток гипохлорита разлагают, используя 3% водный раствор метабисульфита натрия. Добавляют ацетон (50 мл) и рН доводят до значения в интервале от 7,5 до 8,5 с помощью разбавленной уксусной кислоты. Твердые вещества отфильтровывают, промывают охлажденной водой и сушат в печи, получая 8 г указанного в заголовке соединения. Продукт суспендируют в ацетоне и затем очищают растворением в смеси ацетона и водного раствора гидроксида натрия. рН прозрачного раствора доводят до значения примерно 7,0-8,0 с помощью разбавленного раствора уксусной кислоты, продукт выделяют фильтрованием, промывают водой и сушат в печи, получая примерно 7 г целевого продукта.
Пример 4
Получение 5-метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]сульфинил]-1H-бензимидазола (омепразола)
5-Метокси-2-[[(4-метокси-3,5-диметил-2-пиридил)метил]тио]-1Н-бензимидазол (20 г) суспендируют в 200 мл дихлорметана. К полученной смеси в течение 3 часов добавляют 140 г раствора гипохлорита натрия (содержание хлора: 3,6%-4,2%; содержание гидроксида натрия: 2,8-3,0%), поддерживая температуру в интервале от -5°C до 0°C. Органический слой отделяют и экстрагируют 200 мл 5% раствора гидроксида натрия. рН водного слоя доводят до значения в интервале 8-8,5 с помощью разбавленной уксусной кислоты. Твердые вещества отфильтровывают, промывают охлажденной водой и сушат в печи, получая 17 г указанного в заголовке соединения.
Данное изобретение относится к усовершенствованному способу получения сульфинильного соединения формулы (I) или его фармацевтически приемлемой соли, гидрата или сольвата, который включает окисление сульфидного соединения формулы (II), где в обеих формулах (I) и (II) R1 и R3 выбраны из группы, включающей водород, метил или С1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный C1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный С1-4алкокси; отличающемуся тем, что в суспензию или раствор сульфидного соединения формулы (II) добавляют окислитель, включающий водный раствор гипогалогенита щелочного или щелочно-земельного металла в концентрации от 2 до 5%, с получением реакционной смеси, в которой, по меньшей мере, во время указанного окисления присутствует раствор гидроксида щелочного или щелочно-земельного металла, при этом значение рН реакционной смеси, по меньшей мере, во время указанного окисления находится в интервале от 9 до 12; и, необязательно, превращают сульфинильное соединение формулы (I) в его фармацевтически приемлемую соль, гидрат или сольват. Технический результат: данный способ позволяет получить сульфинильные соединения формулы (I) с большим выходом и с меньшим количеством примесей. 13 з.п. ф-лы.
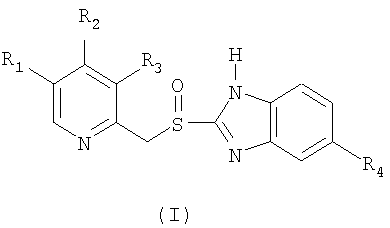
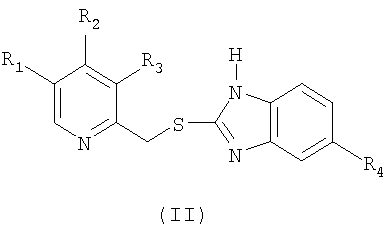
который включает окисление сульфидного соединения формулы (II)
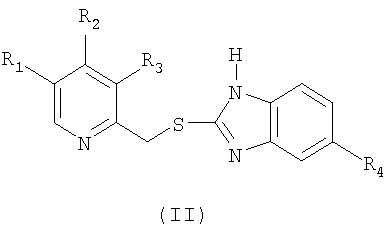
где в обеих формулах (I) и (II) R1 и R3 выбраны из группы, включающей водород, метил или С1-4алкокси, R2 выбран из группы, включающей замещенный или незамещенный С1-4алкокси, и R4 выбран из группы, включающей водород или замещенный или незамещенный С1-4алкокси;
отличающийся тем, что в суспензию или раствор сульфидного соединения формулы (II) добавляют окислитель, включающий водный раствор гипогалогенита щелочного или щелочноземельного металла в концентрации от 2 до 5%, с получением реакционной смеси, в которой, по меньшей мере, во время указанного окисления присутствует раствор гидроксида щелочного или щелочноземельного металла, при этом значение рН реакционной смеси, по меньшей мере, во время указанного окисления находится в интервале от 9 до 12; и необязательно превращают сульфинильное соединение формулы (I) в его фармацевтически приемлемую соль, гидрат или сольват.
| US 5708013 А, 13.01.1998 | |||
| ТИОПИРИДИНЫ ДЛЯ БОРЬБЫ С БАКТЕРИЯМИ HELICOBAKTER | 1995 |
|
RU2142459C1 |
| US 6017560 A, 25.01.2000 | |||
| VYAS К ЕТ AL: «LANSOPRAZOLE, AN ATIULCERATIVE DRUG» АСТА CRYSTALOGRAPHICA SECTION C | |||
| CRYSTAL | |||
| STRUCTURE COMMUNICATIONS, MUNCSGAARD, COPENHAGEN, DK, vol.C56, no.12, 2000, pages E572-573 | |||
| GRAUL A ЕТ AL: «ESOMEPRAZOLE MAGNESIUM | |||
| (-)-OMEPRAZOLE MAGNESIUM PERPRAZOLE | |||
Авторы
Даты
2009-01-27—Публикация
2004-01-12—Подача