Изобретение относится к области биотехнологии и иммунологии и может быть использовано в технологии изготовления референс-панелей сывороток, содержащих антигены наиболее опасных вирусных инфекций.
Образцы крови доноров в России обязательно скринируют на присутствие маркеров HIV 1+2, гепатитов В и С и сифилиса. Приблизительно 1% всех образцов посылается на повторное подтверждение в контрольные лаборатории. Однако эффективность подтверждения результатов зависит не только от качества тест-систем, но и от наличия в контрольных лабораториях стандартных препаратов на анализируемые инфекционные маркеры [1, 2].
При использовании высокочувствительных HBsAg скриннинговых тестов носители гепатита В с низкой концентрацией HBsAg могут быть выявлены, в частности, среди лиц, которые являются носителями анти-НВс антител.
Использование в каждодневной работе референс-препаратов различных генотипов и субтипов HBsAg позволит расширить спектр диагностируемых маркеров и использовать эти материалы для контроля качества выполнения анализов препаратов крови на выявление инфекции гепатита В.
По оценке экспертов по молекулярной биологии количество и виды мутаций в биомолекулах в значительной мере определяются региональными особенностями: климата, набора продуктов питания, представительностью химических элементов Fe, Co, Cr, Ni и Cu.
Эта гипотеза нашла свое подтверждение в работах Dr. H.Fields, который при формировании Мастер-панели HBV собрал коллекцию из 1000 образцов плазмы пациентов всех 6 генотипов HBV DNA. При секвенировании этих образцов H.Fields обнаружил, что почти в 100% случаев генотип D встречается в сыворотках из Tunisia и Jordan, генотип А имеет распространение в Египте и в США. В России распределение генотипов: 90% генотип D и 5% генотип А.
Таким образом, при решении проблемы оценки качества диагностики вирусных инфекций в России следует собирать коллекцию плазмы пациентов с установленным диагнозом, главным образом, из местных инфекционных клиник. И на основе этого материала формировать национальные панели сывороток. Этот вывод имеет и статистическое обоснование, т.к. через диагностические лаборатории проходит более 90% проб от коренного населения, число проб от приезжих и туристов не превышает 5-7%.
Следовательно, национальные стандартные панели должны включать образцы плазмы с генотипами и субтипами, характерными для России.
Для того чтобы решать такие проблемы, разработан способ изготовления и способ аттестации сывороток крови человека, содержащих различные генотипы HBV и субтипы HBs Ag в концентрации выше 0.06 IU/мл. Такие панели предназначены для контроля анализа HBV DNA и для анализа концентрации HBsAg в образцах крови и ее компонентов.
Из литературы известны способы изготовления панелей, например способ приготовления панелей сывороток, разработанный в лаборатории стандартов Красного Креста (Голландия) для приготовления референс-панелей PELICHECK и PELISPY RUN controls [1]. Эти панели представляют собой образцы референс-препаратов AY и AD субтипов HBs Ag, разведенных в пуле донорских сывороток, не содержащих маркеров опасных вирусных инфекций, в титрах о 0.1 IU/мл. Способ включает приготовление стандартных сывороток, содержащих HBs Ag и имеющих разную концентрацию этого белка.
Наиболее близким техническим решением (прототипом) является способ приготовления панелей сывороток HBV DNA Genotype Performance Panel, разработанный в лаборатории Boston Biomedical Inc. (США). Эта панель включает 10 образцов с генотипами A-D [2]. Образцы панели представляют HBV DNA сыворотки, разведенные в пуле донорских сывороток, не содержащих маркеров опасных вирусных инфекций.
Однако эти панели предназначены для использования только во внутрилабораторных исследованиях. Кроме того, сыворотки, входящие в состав этих панелей, представлены в жидкой форме и поэтому должны храниться в замороженном состоянии. Сыворотки панели-прототипа не стабилизированы и не лиофилизированы. Рассылка и хранение BBI панелей требуют строгого соблюдения низкотемпературных режимов [3].
Следует представлять, что задачей диагностики является выявление носителей инфекции гепатита В, а не только DNA HBV или HBsAg. Таким образом, исследователи, вооруженные одним методом ПЦР или ИФА, могут выявлять носителей гепатита В в общей популяции только частично. Для полноты анализа каждый образец крови должен тестироваться и на HBV DNA и на HBsAg. Следовательно, необходим стандарт, который позволяет одновременно регистрировать качество ПЦР диагностикумов и ИФА тест-систем. Такую роль может выполнять национальная панель субтипов, сыворотки которой аттестованы по содержанию DNA HBV и по концентрации HBsAg.
Настоящая панель построена на выборке из 80 первично HBsAg положительных образцов плазмы, генотипированных и субтипированных для HBV DNA.
Специфичность ПЦР и ИФА диагностикумов на выявление маркеров HBV может быть аттестована на выборке из 6 пулов отрицательных сывороток доноров и лиц группы крови.
Таким образом разработана и изготовлена панель субтипов для выполнения государственного контроля и для проведении национальных испытаний ИФА тест-систем для выявления различных субтипов HBsAg. При дополнительной аттестации стандартная панель может быть использована для сертификации ПЦР диагностикумов на количественное выявление ДНК ВГВ.
Задачей данного изобретения является создание такого способа, который обеспечивал бы изготовление образцов панели с аттестованной концентрацией различных субтипов HBsAg и позволил сохранить специфические характеристики этих образцов в течение длительного времени (не менее 2 лет) при хранении их при 2-6°С.
Поставленная задача решается тем, что используют способ изготовления панелей сывороток, содержащих HBV DNA и HBsAg для контроля качества тест-систем и вакцин против гепатита В, включающий отбор донорских сывороток, не содержащих специфические антитела к основным маркерам вирусных инфекций, изготовление разводящих растворов на основе отобранных сывороток, выполнение молекулярных анализов для определения субтипов HBsAg, разведение их в разводящем растворе, проведение теста термодеградации для установления сроков годности панели, согласно изобретению отбор разводящих сывороток проводят путем анализа донорских сывороток методами иммуноферментного анализа и полимеразной цепной реакции на наличие ДНК вируса гепатита В, антиHIV и HBs антител, неспецифического связывания HBsAg, причем в качестве разводящих сывороток выбирают сыворотки с отрицательным результатом в данных методах. Проводят титрование образцов HBsAg в разводящем стабилизированном растворе до требуемой концентрации HBsAg в диапазоне 0.06-1.0 IU/мл. В качестве препаратов HBsAg используют сыворотки пациентов с установленным диагнозом вирусный гепатит и положительных в ПЦР исследованиях на HBV DNA.
Для формирования панели отбирают 30 образцов кандидатов, содержащих HBsAg субтипов adw2 и ayw1, awy2, ayw3 and ayw4 (ayw1-4). Эти образцы разводят в стабилизированном пуле донорских сывороток до концентрации HBsAg от 1,0 IU/мл до 0,06 IU/мл. Для контроля специфичности в состав панели включены 6 образцов нативных донорских сывороток, отрицательных в ПЦР и не содержащих анти-НВс антитела.
Приготовленные образцы панели субтипов лиофильно высушивают до остаточной влажности не более 1,5 мас.%.
Такая модель выбрана на основании следующих предпосылок. Из литературы известно, что основными субтипами HBsAg в России являются ayw2 и ayw3, реже встречаются ayw1 и ayw4 [5]. Однако в Европе и в Японии основным субтипом является adw2 [6]. Поэтому все указанные субтипы включены в состав российской панели субтипов.
К сожалению, лучшие российские тест-системы имеют чувствительность 0,1-0,2 IU/мл, но только для AY субтипа HBsAg. Зачастую чувствительность тестов к AD субтипу обычно не превышает 0.3 IU/мл. Именно этим обусловлена актуальность создания панели субтипов HBsAg.
Для определения субтипа HBsAg следует использовать методику секвенирования ПЦР положительных образцов плазмы.
В данной работе выделение ДНК ВГВ проводят с использованием наборов для выделения вирусной ДНК из сыворотки крови фирмы "QIAGEN".
Секвенирование/генотипирование нуклеотидной последовательности длиной 404 п.н., включающей детерминанту А, проводят по методике и с использованием праймеров, разработанных Dr H.Fields (CDC, USA). Были рассчитаны четыре праймера с использованием компьютерной программы "Oligo v.5.0" и синтезированы (см. табл.1). Длина ПЦР-продукта первого раунда с использованием праймеров RMB1 и RMB2 составляет 467 п.н. Длина ПЦР-продукта второго раунда с использованием праймеров RMB3 и RMB4 составляет 454 п.н. Секвенирование проводят с использованием CEQ DTCS Kit на автоматическом секвенаторе Beckman CEQ2000XL..
Знание нуклеотидной последовательности в исследуемом регионе представляет возможность для реального определения субтипа HBsAg в образце. В настоящей работе определение субтипа антигена проводят по результатам нуклеотидного сиквенса с использованием компьютерной программы "subtyper", представленной Д-ром X.Филдсом
В качестве примера мы приводим несколько сиквенсов.






В ходе работы определяют генотипы и субтипы для 80 образцов, отобранных для изготовления панели (распределение по генотипам и регионам представлено в табл.2).

В ходе выполнения работы были выявлены генотипы А и D и субтипы adw2, ayw2, ayw3 и ayw4.
Для установления связи между величиной аналитического сигнала ИФА и количеством HBsAg в разводящем растворе необходимо использовать ИФА тест-системы, которые в диапазоне от 1.0 до 0.1 IU/мл сохраняют прямолинейную связь между оптической плотностью и титром раствора HBsAg.
Предлагаемая нами модель панели субтипов HBsAg предназначена для контроля эффективности тест-систем выявлять различные субтипы и концентрацию антигена и для контроля профессионального уровня работников диагностических лабораторий.
Таким образом, полный набор панели субтипов должен включать 36 образцов: 6 образцов пулов донорских сывороток и 30 образцов различных субтипов HBsAg, приготовленных разведением образцов нативной плазмы в стабилизированном пуле донорских сывороток до клинически значимых концентраций антигена.
Использование 6-ти пулов с различным уровнем неспецифического связывания в качестве отрицательных образцов позволяет дифференцировать коммерческие тест-системы по специфичности на более высоком уровне, чем в случае панелей BBI, включающих только 1 или 2 отрицательных образца.
Важной проблемой при использовании HBsAg тест-систем в клинических диагностических лабораториях является правильность результатов анализа. Основным критерием правильности результатов серологического анализа служит аттестованное значение аналитического сигнала (например, ОП в ИФА) для каждого образца панели. При этом обязательным условием годности тест-систем является неизменный уровень этого аналитического сигнала в процессе длительного хранения.
Вопрос о сохранении специфических свойств сывороток панели, содержащих IgG-антитела, решен в [7]. В настоящем изобретении для стабилизации уровня HBsAg предлагается использовать стабилизатор, включающий не более 1.0 мас.% пептона гидролизованного (ферментативного). Введение пептона является важным методическим приемом. Дело в том, что пептон ферментативный обладает 2-мя положительными качествами, выделяющими его в ряду прочих белковых добавок: он обладает низкой специфической вязкостью (0.029) [5] и содержит около 10% свободных аминокислот. Низкая вязкость раствора стабилизатора для стандартной панели является критичным параметром для выявления HBsAg на практике, т.к. многие производители тест-системы стараются сократить время анализа. В этих условиях большое значение приобретает снижение диффузионного торможения процесса взаимодействия МКА + HBsAg, обусловленное, в первую очередь, уменьшением вязкости раствора.
Применимость созданных по настоящему изобретению референс-препаратов - сывороток различного субтипа с нормированным уровнем HBs Ag - была подтверждена при анализе панелей в научных лабораториях и в контрольных лабораториях службы предприятий-производителей тест-систем в соответствии с программой их аттестации, разработанной национальным органом контроля РФ - ГИСК им. Л.А.Тарасевича. По результатам, представленным аналитическими лабораториями-участниками, будет окончательно установлена эффективность выявления различных субтипов в использованных для анализа тест-системах и на этой основе будут установлены аттестованные значения концентраций HBsAg в образцах панели.
Таким образом, процедура аттестации сывороток панели включает три этапа, результаты которых независимы и позволяют надежно идентифицировать различные субтипы HBsAg. Сравнение референс панелей субтипов, приготовленных в соответствии с заявляемым способом, с панелями-прототипом того же назначения, показало, что отличная от прототипа совокупность существенных признаков обеспечивает новое ранее неизвестное свойство: возможность изготовления панелей субтипов в лиофильной форме с аттестованной концентрацией различных субтипов HBsAg, что позволяет оценивать чувствительность тест-систем и специфичность к различным субтипам HBsAg и контролировать уровень профессионального мастерства работников клинических диагностических лабораторий.
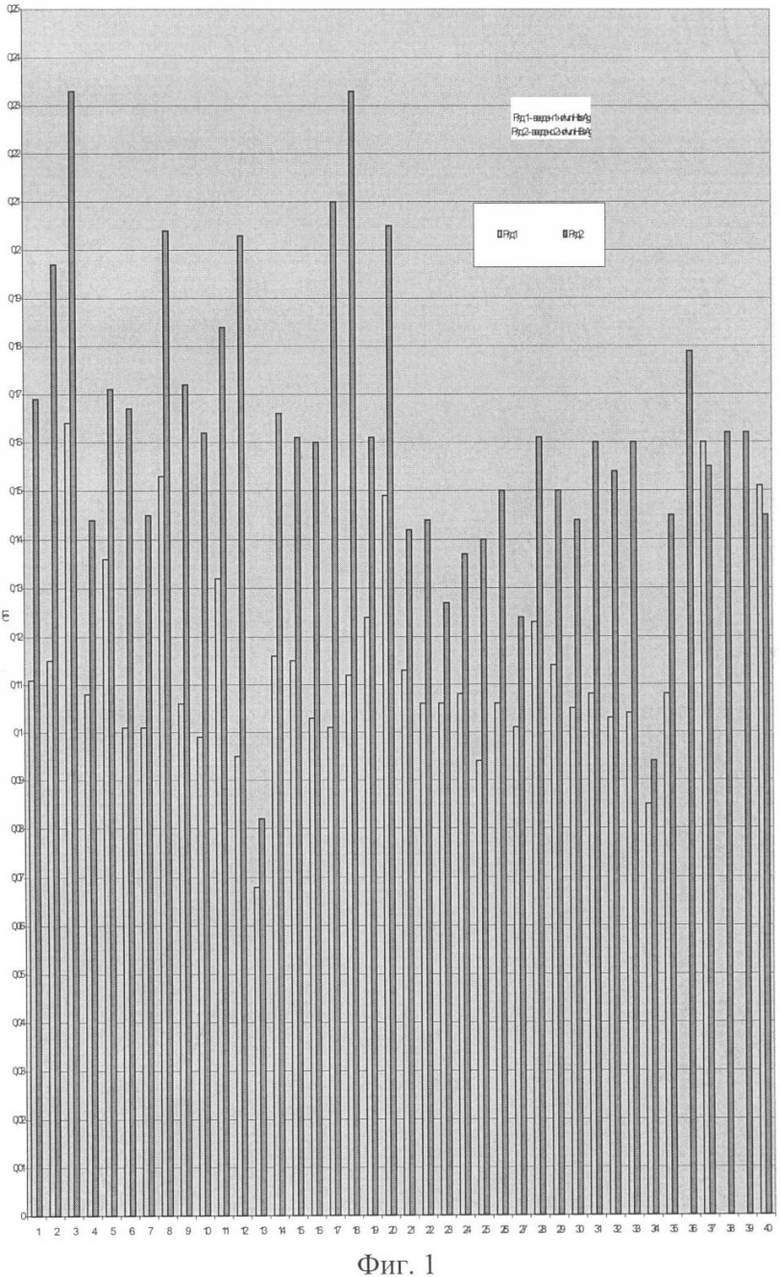
Фиг.1 - Результаты теста подавления HBsAg в сыворотках донорской крови.
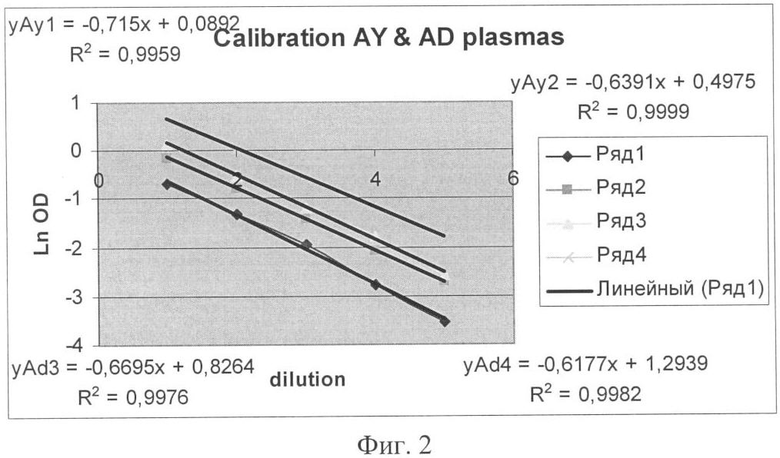
Фиг.2 - Средневзвешенные кривые титрования AY & AD образцов HBsAg.
Пример выполнения способа
Приготовление пулов сывороток. Отбор донорских сывороток проводят в несколько этапов:
а) Отбор сывороток, не содержащих антитела к ВИЧ, вирусам гепатита В и С, сифилису; каждую сыворотку анализируют на присутствие ДНК ВГВ. Результаты анализа ДНК ВГВ для всех донорских сывороток отрицательные.
б) Контроль донорских сывороток, предназначенных для разведения HBsAg препаратов, на содержание общего белка (норма 6.5-8.5%).
в) Определение уровня неспецифического связывания HBsAg в тестируемых сыворотках.
г) Формирование пулов сывороток с равными значениями уровня неспецифического связывания.
Донорские сыворотки, отобранные после проведения 3-х этапов, объединяются в пул. В пул вносят стабилизатор в сухой форме, компоненты которого не оказывают эффекта на аналитический сигнал HBsAg и на вязкость сыворотки. Стабилизированный пул сывороток является разводящим раствором (РР) для приготовления положительных образцов панели субтипов.
Приготовление разводящего раствора
В качестве РР для получения положительных образцов панели с определенной концентрацией HBsAg в работе используют стабилизированные донорские сыворотки, не содержащие маркеров вирусных инфекций. Сыворотки готовят сразу после забора крови. Центрифугируют со скоростью 1800-2000*g цельную кровь при температуре 10-12°С в течение 15 мин и декантируют надосадочный раствор. Хранят до использования при 2-4°С. Для приготовления панели отбирают образцы сывороток янтарного цвета, прозрачные на свету. Всего отобраны 65 качественных сывороток.
После приготовления все сыворотки анализируют на анти-HBs антитела и вирусную контаминацию. Было обнаружено 9 сывороток, содержащих антитела, они были забракованы.
На следующем этапе ставят тест на подавление. С этой целью отбирают аликвоты по 1 мл от каждого номера сыворотки и вводят в них одинаковое количество HBsAg, рассчитанное на конечную концентрацию 2 IU/ml и 1 мг/мл для каждой сыворотки (фиг.1). Как следует из фиг.1 почти каждая сыворотка неспецифически взаимодействует с HBsAg. Учет результатов теста подавления позволяет разделить сыворотки на 3 пула, близких по величине ОП в ИФА.
Готовят стабилизатор по рецептуре, приведенной в предыдущих патентах [7].
Каждый пул доводят до рН 6,8-7,1 с помощью 0,1 М NaCl. В качестве бактерицидной добавки вводят мертиолят в количестве 0,01% и гентамицин - 0,02% от массы раствора. РР разливают в емкости по 250-500 см3 и используют сразу или хранят при температуре 2-8°С в течение не более 1 месяца.
Приготовление положительных образцов стандартной панели. Для приготовления образцов стандартной панели субтипов отбирают 30 образцов плазмы (подготовлено по 6 образцов каждого субтипа ayw(1-4) и субтипа adw2)
Для отбора кандидатов в СП было генотипировано и субтипировано 80 образцов плазмы, положительных на содержание HBV DNA. По результатам субтипирования и ИФА были отобраны по 6 образцов указанных субтипов, имеющих наибольшую концентрацию HBsAg.
Методом матстатистики из отдельных кривых титрования строят средневзвешенную кривую (фиг.2). По усредненной кривой определяют, какое количество препарата HBsAg необходимо ввести в каждый РР, чтобы конечная концентрация антигена соответствовала 0.5-1.0 IU/мл. Определение ОП сывороток всех номеров проводят в ИФА тест-системах различного формата российского и иностранного производства.
Свойства образцов панели субтипов HBsAg представлены в табл.3.
На последнем этапе все образцы панели фильтруют последовательно через фильтры 0.8 мкм и 0.45 мкм.
Профильтрованные образцы панели субтипов разливают в ламинарном шкафу по 0.8 мл во флаконы объемом 2 мл, закрывают резиновыми пробками и размещают в металлические кассеты для замораживания. Режим лиофильной сушки аналогичен [7]. Замораживание препарата во флаконах проводят при температуре прилавка - 50-60°С в течение 10-12 ч. Замороженные образцы во флаконах переносят в сублимационную камеру лиофильной установки TG-50, полки которой охлаждены до минус 30°С. Температуру препарата на стадии сублимационного обезвоживания поддерживают ниже температуры его стеклования (-30°С). Включают компрессор установки для охлаждения десублиматора и полок сушильной камеры. На каждую из пяти полок помещают по кассете с флаконами, в один из которых вморожен датчик измерения температуры материала. Заданная температура на всем протяжении сушки поддерживается автоматически с погрешностью 3-5 град. Значения температуры каждой полки, температуру материала на каждой полке, а также температуры сублиматора записываются постоянно самописцем КП-35. Температура материала в момент включения вакуум-насоса не должна превышать минус 30°С. Через 24 ч после установления на полках температуры 10°С поднимают задатчиком РП-32 температуру досушивания материала до 27°С. Выдерживают при этой температуре материал в течение 6-8 ч. Средняя скорость нагревания материала на этапе досушивания составляет 6°С/мин, время термостатирования при 27°С составляет 10 ч. Флаконы с препаратом укупоривают под вакуумом. Контроль окончания процесса сушки осуществляют по показаниям датчика остаточного давления. Лиофильно высушенный препарат имеет остаточное содержание воды около 1,0-2,0 мас.%. Определение проводят по методике [7]. Общее среднее время сушки составляет 32 ч.
Объединенная выборка лиофилизованных кандидатов AY & AD субтипов была исследована в тесте ускоренной термодеградации. Образцы термостатировали в условиях контролируемой температуры, извлекали через определенные промежутки времени, растворяли в бидистиллированной воде и анализировали в дублях в тест-системе «Рекоматгеп В(Вектор). Активность термостатированных образцов определялась относительно активности образцов, хранившихся при -20°С.
Оценки активности препаратов, хранившихся при повышенных температурах, были далее использованы для предсказания стабильности их при длительном хранении при различных температурах с использованием формальной кинетики Аррениуса [8]. Рассчитанные % потери активности за месяц и за год приведены в табл.4. Образцы продемонстрировали высокую стабильность. Предсказываемая потеря их активности за год при 4°С составляет около 0.3%. Предсказанная потеря активности за месяц составляет примерно 4% при 37°С, давая возможность кратковременному хранению при повышенных температурах, например при транспортировке образцов.
Предсказание активности образцов МП на основе ускоренных испытаний
Рекомендуется использовать растворенные образцы МП при хранении при 4°С в течение месяца. Стабильность жидких образцов МП испытывали в тесте замораживание-оттаивание. Результаты испытаний показали, что специфические свойства кандидатов не изменяются в течение 4-х циклов замораживания-оттаивания.
Экономическая эффективность применения предлагаемого способа изготовления HbsAg образцов панели различных субтипов заключается в том, что указанные антигены используются как прогностические маркеры гепатита В. Они циркулируют в крови инфицированных на 2-3 недели раньше, чем появляются антитела. Именно сокращение сроков установления диагнозов для инфицированных пациентов и более ранняя медицинская помощь и контролируемое по количеству и субтипам HbsAg лечение составляют социально значимую и экономическую эффективность, связанные с сокращением сроков лечения и сроков трудовой недееспособности людей.
Введение российской панели субтипов значительно уменьшит расходы средств контролирующих организаций здравоохранения на приобретение дорогостоящих заграничных аналогов.
Литература
1. VQC Pelispy Multi-Marker, run control. Central Laboratory of Red Cross, Netherlands, 1998.
2. Product catalog 2003/2004 Boston Biomedica, Inc., 2004, p.28.
3. Damen, M., Cuypers, H.T.M., Zaaijer, H.L., Reesink, H.W., Schaasberg, W.P., Gerlich, W.H., Niesters, H.G.M., Lelie P.N. (1996). International collaborative study on the second EUROHEP HCV-RNA reference panel. J.Virol. Methods 58, 175-185.
4. Thon E.V., van Loon A., Schrim J. et al. (2001). European Proficiency Testing Program for molecular detection and quantitation of hepatitis В virus DNA. 39, 12, 4407-4412.
5. Netesova I.G., Swenson P.D., Osipova L.P., Gubina M.A., Posukh O.L., Netesov S.V. (2003). Determination of HBsAg subtypes in Western Siberian part of Russia. // J Med Virol 71, 183-187.
6. H.A.Fields. Diagnosis of Viral Hepatitis in the Blood Transfusion Services: NAT or NOT. CDC, Atlanta 2004.
7. Kanev A.N., Fields H.A., Bektimirov T.A., Shalunova N.V., Maksyutov A.Z., Yudina I.V., Cherepanova N.S., Musina E.E., Bocharova N.G. Способ изготовления контрольной панели сывороток AY & AD субтипов HBsAg для контроля качества диагностики гепатита В, патент РФ №2265028, опубликован 2003.
8. Kirkwood, T.B.L. Принципы приготовления и утверждения международных и других стандартов и эталонных материалов биологических препаратов. Сер.техн. докл. N 37. ВОЗ, Женева, 1990. 14а // J.biol. Standardization. - 1984. - Vol.12. - P.207-224.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАСТЕР ПАНЕЛИ СЫВОРОТОК, СОДЕРЖАЩИХ И НЕ СОДЕРЖАЩИХ HBsAg, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2005 |
|
RU2314540C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАБОЧИХ СТАНДАРТОВ СЫВОРОТОК, СОДЕРЖАЩИХ AY И AD СУБТИПЫ HBsAg | 2004 |
|
RU2271011C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПАНЕЛИ СЫВОРОТОК С HBsAg AD- И AY-СУБТИПОВ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА В | 2011 |
|
RU2463610C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ПАНЕЛИ СЫВОРОТОК ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА В | 2007 |
|
RU2367960C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОНТРОЛЬНОЙ ПАНЕЛИ СЫВОРОТОК AY ЭНД AD СУБТИПОВ HBsAg ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА B | 2003 |
|
RU2265028C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ КОНТРОЛЬНЫХ ПАНЕЛЕЙ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА В | 1999 |
|
RU2179726C2 |
| ПАНЕЛЬ СЫВОРОТОК, СОДЕРЖАЩИХ АНТИТЕЛА К АНТИГЕНАМ HCV РАЗНЫХ СУБТИПОВ | 2010 |
|
RU2456617C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕФЕРЕНС-ПАНЕЛИ ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ВАКЦИН ПРОТИВ ГЕПАТИТА В | 1999 |
|
RU2181893C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛАБОПОЛОЖИТЕЛЬНОЙ КОНТРОЛЬНОЙ СЫВОРОТКИ, СОДЕРЖАЩЕЙ AD И AY СУБТИПЫ HBsAg | 2011 |
|
RU2473913C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ НИЗКОТИТРАЖНОЙ ПАНЕЛИ СЫВОРОТОК ДЛЯ КОНТРОЛЯ КАЧЕСТВА ТЕСТ-СИСТЕМ И ИММУНОБЛОТОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ДИАГНОСТИКИ АНТИТЕЛ К РАЗНЫМ СУБТИПАМ ВГС | 2009 |
|
RU2408024C1 |
Изобретение относится к области биотехнологии и иммунологии и может быть использовано в технологии изготовления стандартных панелей сывороток, содержащих ДНК и антигены вирусов наиболее опасных инфекций, и в производстве тест-систем для определения ДНК HBV и антигенов в качестве контрольных положительных сывороток. Панель субтипов содержит 30 образцов с концентрацией HBsAg от 1,0 IU/мл до 0,06 IU/мл, в том числе 24 образца AY субтипа, приготовленных на основе плазменного антигена, и 6 образцов AD субтипа, приготовленных на основе плазменного антигена. Введение в практику серологии стандартной панели с аттестованной концентрацией HBsAg различных субтипов создают основу для контроля правильности анализов на содержание этих маркеров в крови. 1 з.п. ф-лы, 4 табл., 2 ил.
| СПОСОБ ИЗГОТОВЛЕНИЯ КОНТРОЛЬНОЙ ПАНЕЛИ СЫВОРОТОК AY ЭНД AD СУБТИПОВ HBsAg ДЛЯ КОНТРОЛЯ КАЧЕСТВА ДИАГНОСТИКИ ГЕПАТИТА B | 2003 |
|
RU2265028C2 |
| Instructions for use Pelispy Multi-Marker run control type | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| NETESOVA I.G | |||
| at al | |||
| Determination of HBsAg subtypes in Western Siberian part of Russia | |||
| J | |||
| Med | |||
| Virol | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| KATO H | |||
| at al | |||
| Eight genotypes (A-H) of hepatitis В virus infecting patients from San Francisco and their | |||
Авторы
Даты
2009-02-10—Публикация
2006-10-09—Подача