Изобретение относится к процессам обезвреживания сточных вод с использованием фотокаталитической системы Фентона. Фотокаталитическое разложение органических загрязнений с использованием фотокаталитической системы Фентона может быть более эффективным при проведении процесса в гетерогенном режиме и становится важным для современных окислительных технологий (СОТ).
Гомогенная фотокаталитическая система Фентона (H2O2+Fe+hν) широко исследована и описана в литературе как перспективный метод обезвреживания сточных вод (Hislop, К. and Bolton, J. (1999). Environ. Sci. Technol., 33, 3119-3126; Trapido, M., Kallas, J. (2000). Environ. Technol. 21, 799-808; Vicente, J., Rosal, R. and Diaz, M. (2002). Ind. Eng. Chem. Res., 41, 46-51; Kavitha, V., Palanivelu, K. (2004). Chemosphere 55, 1235-1243). Основным недостатком такой системы является необходимость проведения реакций в кислой среде (рН<3) и сложность отделения осадка, содержащего после обработки ионы Fe.
Хорошей альтернативой гомогенной фотокаталитической системе Фентона может быть гетерогенный фотокатализ. Эффективность систем сопоставляется с помощью измерения разложения уксусной кислоты в разных экспериментальных условиях. Проводились исследования гетерогенных фотокаталитических систем Фентона, в частности Fe на цеолите HY, для разложения поливинилового спирта (Bossmann, S.H., Oliveros, E., Gob, S., Kantor, M., Goppert, A., You, L., Yue, P.L., Braun, A.M. (2001), Water Sci. Technol. 44 (5), 257.262). Также сообщалось об исследованиях мембран Nafion с закрепленными ионами Fe как фотокатализаторов для разложения органических примесей (Maletzky, P.; Bauer, R.; Lahnsteiner, J.; Pouresmael, В. (1999) Chemosphere, 38 (10), 2315-2325; Sabhi and Kiwi (2001). Water Research 35 (8), 1994-2001); глин, бентонитов и лапонитов с закрепленными ионами Fe для обезвреживания азокрасителя Orange II (Feng, J.; Hu, X.; Yue, P.L. (2005). Water Research 39, 89.96).
Наиболее близким является использование мембран Nafion с закрепленными ионами Fe как фотокатализаторов для разложения органических примесей (Maletzky, Р.; Bauer, R.; Lahnsteiner, J.; Pouresmael, В. (1999) Chemosphere, 38 (10), 2315-2325; Sabhi and Kiwi (2001). Water Research 35 (8), 1994-2001).
Недостатком является нестабильность катализатора в кислых средах и низкая степень конверсии.
Изобретение направлено на разработку гетерогенного фотокаталитического процесса Фентона для очистки сточных вод с использованием экологически безопасных катализаторов с высокой стабильностью и высокой степенью конверсии.
Другой задачей изобретения является обеспечение более полного разложения примесей в гетерогенной фотокаталитической системе по сравнению с гомогенной фотокаталитической системой Фентона, а также обеспечение управляемости разложением на основе анализа состава газа, выделяемого во время фотоокисления.
Наконец, изобретение позволяет регенерировать катализатор с невысокими затратами без образования осадков.
Сущностью изобретения является применение стабильного гетерогенного перовскитсодержащего фотокатализатора Фентона для разложения вредных промышленных выбросов, в том числе для разложения бионеразлагаемых органических соединений.
Задача решается двумя вариантами состава катализатора.
По первому варианту.
Катализатор для гетерогенного фотокаталитического процесса Фентона для очистки сточных вод, в том числе от бионеразлагаемых органических соединений, представляет собой порошок или монолит, содержащий перовскит LnFeO3, где Ln=La, Се, Pr, Nd, Sm, и структурообразующую добавку или связующее.
Содержание перовскита в катализаторе составляет 2,0-90,0 мас.%, остальное - структурообразующая добавка (связующее), в качестве которой он содержит оксид алюминия (Al2O3).
Содержание перовскита предпочтительно 45,0-90,0 мас.%, лучше всего 48,0-88,0 мас.%.
Массивный катализатор в виде порошка или монолита готовят методом смешения.
По второму варианту.
Катализатор для гетерогенного фотокаталитического процесса Фентона для очистки сточных вод, в том числе от бионеразлагаемых органических соединений, представляет собой перовскит LaMeO3, или Pt/LaMeO3, где Me=Mn, Co, Fe, Ni, Cu, нанесенный на структурированный носитель, например кордиерит в виде блоков сотовой структуры, пену на основе оксида алюминия или карбид кремния (SiC).
Содержание перовскита в нанесенном катализаторе составляет 2,0-30,0 мас.%, предпочтительно 3,0-10,0 мас.%, наиболее предпочтительно 4,0 мас.%.
Содержание платины в нанесенном катализаторе составляет 0,05-10,0 мас.%, предпочтительно 0,05-3,0 мас.% и наиболее предпочтительно 0,1 мас.%.
Нанесенные катализаторы готовят нанесением перовскита LaMeO3 или Pt/LaMeO3 на структурированный носитель, например кордиерит в виде блоков сотовой структуры, пену на основе оксида алюминия или SiC.
Благородный металл (Pt) наносят пропиткой из раствора платинохлористоводородной соли на кордиеритовую подложку, либо чистую, либо с предварительно нанесенным перовскитом. После нанесения платины образцы либо сушились на воздухе, либо подвергались обработке гидразингидратом перед сушкой.
Не исследовались структурированные фотокатализаторы Фентона для окисления.
Не изучалось применение перовскитов для фотоокисления Фентона.
Краткое описание чертежей.
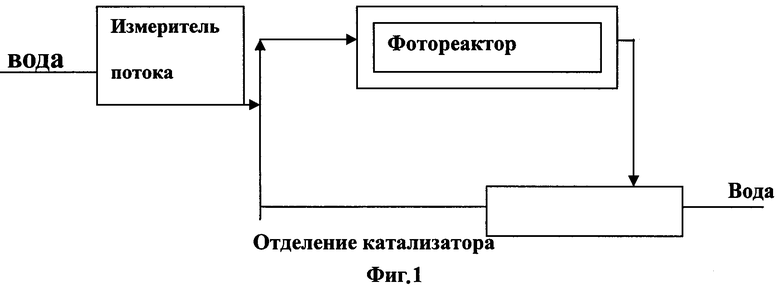
Фиг.1 представляет схему однопроходного реактора для фотокаталитического окисления Фентона.
Обезвреживание загрязнений достигается за один проход обезвреживаемых вод и измельченного до порошка катализатора через область реактора, облучаемого светом. Загрязненная вода через датчик расхода поступает в фотореактор, затем катализатор отделяется и вновь поступает в реактор, а очищенная вода выходит из системы.
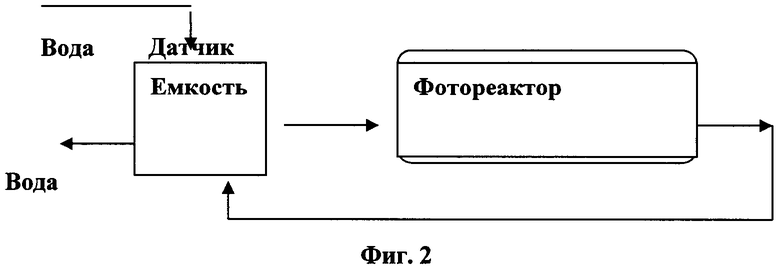
Фиг.2 представляет схему периодического реактора для фотокаталитического окисления Фентона.
Реактор работает следующим образом. Загрязненная вода собирается в накопителе, затем она циркулирует через фотореактор и после очистки сливается из накопителя.
Фиг.3 представляет схему лабораторной установки для фотокаталитического окисления Фентона.
Установка работает следующим образом. В реактор со структурированным катализатором, освещаемым ртутной лампой, заливается раствор, через который подают воздух. Температура раствора контролируется термопарой. Выделяющиеся продукты окисления органических примесей (СО и CO2) после осушки отходящего газа анализируются газоанализаторами. Отбор жидкой пробы на анализ производится из циркуляционного контура.
Фиг.4. представляет фотокаталитическое окисление Фентона в потоке азота на нанесенном катализаторе - LaMnO3 (3,67%) на кордиерите.
По оси ординат степень разложения уксусной кислоты (левая ось, %) и степень разложения перекиси (правая ось, %), по оси абсцисс - время реакции (час). Условия эксперимента: V суммарный 100 мл; mкат=4,9 г; С0 CH3COOH=0,021 моль/л; C0 H2O2=0,083 моль/л; Р=1 атм; Т=25°С; рН-3,9, QN2=250 см3/мин.
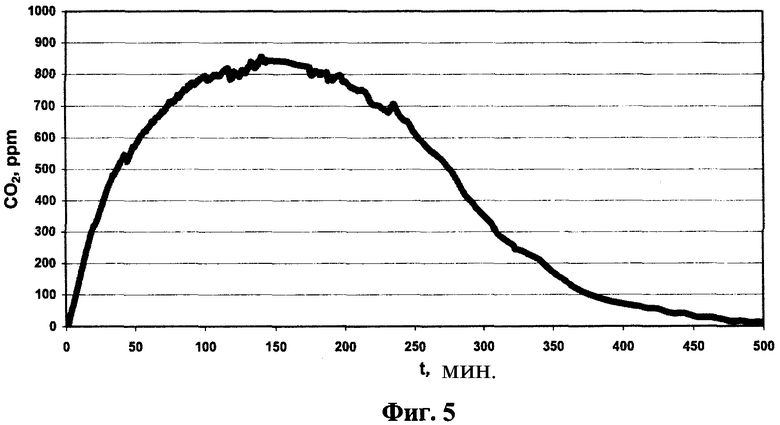
Фиг.5 представляет изменение концентрации двуокиси углерода (ось ординат), образующегося при фотокаталитическом окислении Фентона в потоке азота на нанесенном катализаторе - LaMnO3 (3,67%) на кордиерите - от времени (ось абсцисс, мин). Условия эксперимента: V суммарный 100 мл; mкат=4,9 г; С0 CH3COOH=0,021 моль/л; С0 H2O2=0,083 моль/л; Р=1 атм; Т=25°С; рН=3,9, QN2=250 см3/мин.
Каталитическую активность исследуют с использованием уксусной кислоты в качестве модельного соединения. Оптимальные условия реакции определяют, изменяя экспериментальные характеристики.
Присутствие перовскита оказывает благоприятное влияние на процесс фоторазложения примесей благодаря адсорбции молекул загрязнителя на поверхности катализатора, таким образом облегчая их выведение с помощью гидроксильных радикалов, образующихся при фоторазложении Н2О2.
Используют два варианта катализаторов:
а) массивный (ненанесенный) катализатор, который готовят смешением порошков смешанных оксидов, содержащих перовскит LnMeO3, оксиды лантаноидов (например, La, Се, Nd, Pr, Sm и т.д.) и переходного металла (Me=Fe) со связующим (или структурообразующей добавкой) на основе оксида алюминия в кислой среде с последующей экструзией пластичной массы в виде монолитов (блоков сотовой структуры), сушкой при Т=120°С и прокаливанием при Т=900°С в течение 4 ч с общей формулой LnMeO3·nAl2О3, где n изменяется в пределах от 10 до 98%. Каталитическую активность LnFeO3 содержащего катализатора исследуют с использованием уксусной кислоты в качестве модельного соединения. Оптимальные условия реакции определяют, изменяя экспериментальные характеристики;
б) нанесенный катализатор готовят нанесением активной фазы на огнеупорный сотовый носитель (кордиерит) или пену на основе оксида алюминия или SiC. Перовскиты (LaMeO3), где Me=Mn и/или Со, и/или Fe, и/или Ni, и/или Cu готовят пропиткой носителей растворами азотнокислых солей металлов в этиленгликоле с добавками лимонной кислоты. Образцы вынимают из раствора, сушат на воздухе и прокаливают при 900°С в течение 4 ч. Нанесенный катализатор может дополнительно содержать платину, которую дополнительно наносят из H2PtCl6 после нанесения перовскита. После нанесения платины образцы либо сушат на воздухе, либо до сушки подвергают обработке гидразингидратом или другими восстановителями.
Задача решается также способом проведения/осуществления гетерогенного фотокаталитического процесса Фентона для разложения сточных вод, содержащих бионеразлагаемые органические соединения, такие как уксусная кислота, и, в общем случае, органические загрязнения сточных вод с использованием описанных выше катализаторов, в том числе при дозированной подаче Н2O2 во время процесса. Дозированная подача способствует более полному разложению органических примесей.
Процесс Фентона проводят при комнатной температуре и атмосферном давлении.
Также его можно проводить при повышенных температуре и давлении.
Процесс осуществляют при рН больше 5.
Сточные воды могут содержать уксусную кислоту, метил-трет-бутиловый эфир (МТБЭ), этанол, метанол, их смеси, отходы виноделия.
Процесс осуществляют в трубчатом облучаемом фотореакторе Фентона с закрепленным слоем и рециркуляцией, или в однопроходном реакторе непрерывного действия, или периодического действия, или непрерывно-рециркуляционном.
Постепенное добавление Н2О2 осуществляют введением малых объемов концентрированного раствора Н2O2 через каждый час.
Постепенное добавление Н2О2 можно осуществлять непрерывным введением концентрированного раствора Н2О2.
Для аппаратурного оформления фотокаталитической реакции Фентона требуется технически простое оборудование.
Для осуществления фотокаталитической реакции Фентона могут применяться суспензионные реакторы с взвесью частиц катализатора в загрязненной воде.
Такая система обладает следующими основными достоинствами:
- высокая дисперсность катализатора, частицы которого обладают развитой поверхностью;
- хорошее равномерное облучение катализатора;
- эффективный перенос разлагаемых веществ к поверхности катализатора.
Далее необходимо отделить продукт (очищенную воду) от частиц катализатора, для чего нужны дополнительные отстойники и фильтры.
Для осуществления фотокаталитической реакции Фентона могут использоваться также реакторы с неподвижным слоем перовскитсодержащего катализатора в виде таблеток, блоков сотовой структуры или пены, или тонких пленок, закрепленных на механически проницаемых носителях. В этом случае нет необходимости применения сепараторов. Более того, такой реактор может быть:
- однопроходным непрерывного действия;
- периодического действия;
- непрерывный рециркуляционный.
В однопроходном реакторе (Фиг.1) обезвреживание загрязнений достигается за один прохода сточных вод через область реактора, облучаемого светом. В этом случае необходимо оптимизировать управление объемной скоростью воды, чтобы уменьшить длину реактора.
В периодическом реакторе (Фиг.2) загрязненная вода хранится в резервуаре и непрерывно рециркулирует через фотореактор.
Реакционный блок на Фиг.3 представляет собой трубчатый герметичный реактор со структурированным закрепленным слоем облучаемого катализатора.
В реакционной системе используют источник УФ-излучения с длиной волны, большей или равной 254 нм. Оценивают каталитическую активность в разложении уксусной кислоты, метил-трет-бутилового эфира (МТБЭ, СН3ОС(СН3)3), метанола, этанола, их смесей и синтетических сточных вод виноделия (используют разбавленное красное вино «Кьянти»). Далее исследуют влияние дозированной подачи H2O2 и рН на фотокаталитическую реакцию Фентона.
Полученные результаты явно указывают на то, что наиболее эффективным в фотокаталитической реакции Фентона по сравнению с гомогенной реакцией является катализатор на основе LaFeO3.
Более высокая скорость реакции указывает на активность перовскита. Более того, гетерогенный способ проведения фотокаталитической реакции Фентона обеспечивает более широкой диапазон рН реакции по сравнению с узким рН, характерным для гомогенной реакции. При этом установлено незначительное вымывание металлов из перовскита после использования в процессе.
Для исследования каталитической активности фотокатализатора Фентона фрагмент нанесенного на кордиерит блочного сотового катализатора (2,5 г) на основе LaFeO3 (2,24 мас.%) помещают в 100 мл раствора уксусной кислоты (0,021 моль/л, суммарное содержание органического углерода (СОУ)=500 мг/л) и перекиси водорода (0,083 моль/л) (в молярном отношении Н2O2/СН3СООН=4) под лампой в герметичном фотореакторе из нержавеющей стали. Газ, выделяемый во время реакции из герметичного фотореактора, анализируют с целью установления степени разложения. Исходный рН раствора равен 3,9.
До начала экспериментов с облучением раствор пропускают через реактор без облучения в течение 10 мин. Затем раствор облучают УФ-светом с помощью ртутной лампы мощностью 8 Вт. Образцы для анализа отбирают очень малыми порциями (500 μл) через равные интервалы времени. Отобранные образцы отфильтровывают и анализируют на общее содержание органического углерода (СОУ) методом сжигания при Т=850°С. Для анализа содержания Н2O2 используется спектрофотометрический анализ в ультафиолетовой и видимой областях (UV-Vis) на комплекс H2O2/TiOSO4 (λ=405 нм), выполняемый на спектрометре Perkin-Elmer лямбда 35.
Предварительные эксперименты по фотолизу (СН3СООН/Н2O2/УФ) показывают примерно 32%-ное снижение СОУ.
В присутствии массивного блочного катализатора на основе LnFeO3 и при облучения УФ наблюдается снижение СОУ на ≈54% при недозированной подаче Н2O2 и ≈100% при дозировании Н2O2. В присутствии Н2O2 и облучения реакция идет очень быстро. Скорость реакции увеличивается за счет генерации ОН. радикалов под действием катализатора. Снижение СОУ очень мало в отсутствие УФ-облучения.
Далее проводят сравнительные исследования гетерогенной фотокаталитической реакции Фентона в присутствии катализатора на основе LaFeO3 и гомогенной системы с оксалатом железа (СFe3+=0,0296 моль/л) в качестве катализатора.
Данные таблицы 1 явно указывают, что использование гетерогенной системы повышает степень очистки от органического углерода и эффективность перекиси водорода по сравнению с гомогенной системой.
Это происходит благодаря адсорбции органических субстратов на поверхности катализатора. Действительно, молекулы загрязнений, адсорбированные на поверхности катализатора, легче реагируют с генерируемыми радикалами ОН. с последующим их разложением.
Было установлено, что железо очень мало растворяется в растворе во время реакции.
Примеры
Примеры 1-10 демонстрируют результаты по каталитической активности, полученные для реакции фотокаталитического окисления Фентона на массивных катализаторах на основе LnFeO3 и нанесенных на носители катализаторах на основе LaMnO3, LaFeO3, LaNiO3, LaCoO3, LaCuO3 и Pt/LaMnO3.
Материалы и реактивы
Ледяная уксусная кислота (СН3СООН) чистотой 99,8% была предоставлена фирмой Carlo Erba, оксалат железа (Fe2(C2O4)3·6H2O) чистотой 99% - фирмой Aldrich, метил-трет-бутиловый эфир (СН3ОС(СН3)3) чистотой 99,9% - фирмой Aldrich, этанол (С2Н5OH) чистотой 99,9% предоставлен J.T. Baker, а метанол (СН3ОН) чистотой 99,9% - фирмой Aldrich.
Синтетические отходы виноделия готовят разбавлением товарного красного вина (Chianti) сверхчистой водой для получения содержания органических веществ 500 мг С/л (как СОУ). Все растворы готовят с использованием сверхчистой воды (18 μS·см-1).
Сотовые катализаторы на основе перовскита, разработанные Институтом катализа им. Г.К. Борескова СО РАН, имеют поверхность 4-6 м2/г для нанесенных катализаторов и 4-18 м2/г для ненанесенных катализаторов.
Растворы органических соединений (например, СН3СООН, СН3ОС(СН3)3, С2Н5OH, СН3ОН и отходов виноделия) и перекиси водорода готовят непосредственно перед экспериментами по изучению реакции Фентона и фотокаталитической реакции Фентона. Для фотокаталитических экспериментов используют ртутную лампу мощностью 8 Вт с длиной волны, большей или равной 254 нм. До начала экспериментов с облучением проводят эксперименты в темноте при постоянном перемешивании.
В типичном эксперименте 100 мл раствора органического соединения (например, СН3СООН, СН3ОС(СН3)3, C5H5OH, СН3ОН) (СОУ 500 мг/л) помещают в фотореактор с блочным катализатором сотовой структуры. После этого добавляют концентрированный раствор H2O2 до получения стабильного соотношения Н2O2 / органическое соединение.
Каталитические тесты проводят при подаче воздуха (250 см3/мин) в нижнюю часть герметичного фотореактора из нержавеющей стали. Газ, выделяемый из фотореактора во время реакции, анализируют с помощью ИК-анализатора СО/CO2. Каталитические тесты проводят при температуре 25°С и атмосферном давлении. Исходный рН раствора регулируют, добавляя HCl или NaOH для достижения необходимой величины.
Суммарное содержание органических соединений (СОС) оценивают по выделению СОX при каталитическом сжигании при температуре Т=850°С. Концентрацию Н2О2 определяют по комплексу H2O2/TiOSO4 (λ=405 нм) с помощью UV-Vis спектрометра Perkin-Elmer Lambda 35. Тесты на вымывание проводят для выяснения вероятности вымывания металла из перовскита во время каталитических тестов; для этого анализируют модельный раствор или синтетические сточные воды виноделия с применением ICP-AES Varian "Liberty II".
Пример 1. Влияние рН.
Влияние рН на разложение уксусной кислоты в присутствии нанесенного на кордиерит катализатора LaMnO3 (4 мас.%) показано в таблице 2. Эксперименты проводят при рН=3,9, 6,0 и 8,0 и молярном отношении R=Н2O2/СН3СООН=4. Максимальная степень очистки от органических соединений (уменьшение СОС, % = 57%) наблюдается при рН=6,0. Дальнейшее повышение рН (до 8) приводит к снижению степени очистки до 22%. При рН=6 конверсия Н202 проходит медленнее, чем при рН=9, тогда как в более щелочных условиях разложение шло быстрее, но было неполным (70%).
Известно, что в гомогенных системах оптимальное рН для фотокаталитической реакции Фентона составляет 3-4.
При изменениях рН наблюдается небольшое растворение Mn из перовскита.
Пример 2. Влияние концентрации Н2О2 на фотокаталитическую реакцию Фентона.
Разложение уксусной кислоты на нанесенном на кордиерит катализаторе LaMnO3 (4%) при рН=3,9 изучали при изменении исходной концентрации перекиси водорода, в частности изменяя молярное отношение R=H2O2/CH3COOH от 2 до 8 (см. таблицу 3).
С увеличением молярного отношения R скорость удаления СОС снижается, тогда как итоговое обезвреживание растет за счет увеличения содержания радикалов ОН. в растворе. В то же время после реакции наблюдается незначительное растворение Mn перовскита.
Пример 3. Влияние дозирования Н2О2.
Для конкурентоспособности фотокаталитических процессов Фентона важно то, что их применение не требует больших затрат и реализуется обычно с низкими расходами H2O2. Регулируемое изменение концентрации Н2О2 позволяет достичь большее снижение СОУ за более короткое время за счет эффекта «самопоглощения» Н2O2, при котором захватываются радикалы ОН., генерируемые при фотолизе. Радикалы ОН. реагируют с H2O2 с образованием HO2, которые менее реакционноспособны, чем радикалы ОН., и поэтому непригодны для разрушения загрязнений в растворах.
В результате высокие исходные концентрации Н2O2 не дают возможности использовать ОН. в фотореакции Фентона, тогда как их низкие концентрации не дают достаточное для реакции количество радикалов ОН.. Таким образом, необходимо проводить реакцию с регулируемой концентрацией Н2O2 в течение всей реакции. Поэтому целью исследования является выбор дозируемого количества H2O2, оптимального для осуществления фотокаталитической реакции Фентона.
Для фотокаталитической реакции Фентона окисления уксусной кислоты на массивном/ненанесенном катализаторе LnFeO3, содержащем 88 мас.% LnFeO3 и 12 мас.% оксида алюминия, суммарное количество постепенно добавляемой перекиси водорода составляет CH2O2/t=0,01÷0,1 моль/ч, предпочтительно CH2O2/t=0,022 моль/ч, что увеличивает суммарное удаление органических соединений с 29% при исходном молярном отношении Н2O2/СН3СООН=4 до 100% с минимальным удельным расходованием Н2О2 (см. таблицу 4); в частности, оно изменяется в области 1 г Н2O2/г С - 10 г Н2О2 /г С. После реакции отмечается незначительный выход железа из перовскита.
Пример 4. Оценка разложения в фотокаталитической реакции Фентона.
Для оценки степени разложения проводят исследование каталитического окисления уксусной кислоты (R=4) в присутствии нанесенного катализатора 4 мас.% LaMnO3/кордиерит с подачей азота (250 см3/мин) в нижнюю часть герметичного фотореактора из нержавеющей стали. После 5-часового облучения степень очистки от СОУ составляет 30% (Фиг.4).
Изменение концентрации CO2 в газовой фазе в течение фотокаталитической реакции Фентона на нанесенном катализаторе LaMnO3/кордиерит показано на Фиг.5. Не наблюдается образования СО. Концентрация CO2 достигает максимального уровня примерно 850 м.д. после облучения в течение 150 мин и затем снижается до нуля после 500 мин облучения, указывая на полное удаление выделенного CO2.
Далее, исходя из данных по снижению СОУ и концентрации образовавшегося диоксида углерода, составляют материальный баланс по углероду, близкий к 98%. Это указывает, что в реакции фотокаталитического окисления Фентона достигнуто полное разложение уксусной кислоты.
Пример 5. Оценка стабильности катализатора.
Устойчивость каталитической системы изучается на примере нанесенного катализатора LaMnO3 (2 мас.%)/кордиерит в различных циклах (до 250 ч эксперимента) фотоокисления уксусной кислоты на том же катализаторе при одинаковых условиях эксперимента (H2O2/CH3COOH=4). Отмечено, что катализатор, восстановленный при Т=120°С и используемый повторно для окисления уксусной кислоты, проявляет такую же активность, что и свежеприготовленный катализатор. Растворение Mn из перовскита после реакции было незначительным.
Пример 6. Влияние состава катализатора при дозированной подаче перекиси.
Для фотокаталитической реакции Фентона окисления уксусной кислоты на массивном/ненанесенном (описание способа приготовления на стр.4) катализаторе LnFeO3, содержащем 55 мас.% LnFeO3 и 45 мас.% оксида алюминия, суммарное количество постепенно добавляемой перекиси водорода составляет СH2O2/t=0,01÷0,1 моль/ч, предпочтительно CH2O2/t=0,022 моль/ч, суммарное удаление органических соединений при исходном молярном отношении Н2O2/СН3СООН=4 составляет 100%. После реакции отмечается незначительный выход железа из перовскита.
Пример 7. Влияние состава катализатора при дозированной подаче перекиси.
Для фотокаталитической реакции Фентона окисления уксусной кислоты на массивном/ненанесенном (описание способа приготовления на стр.4) катализаторе LnFeO3, содержащем 25 мас.% LnFeO3 и 75 мас.% оксида алюминия, суммарное количество постепенно добавляемой перекиси водорода составляет СH2O2/t=0,01÷0,1 моль/ч, предпочтительно СH2O2/t=0,022 моль/ч, суммарное удаление органических соединений при исходном молярном отношении H2О2/СН3СООН=4 составляет 100%. После реакции отмечается незначительный выход железа из перовскита.
Пример 8. Влияние состава катализатора.
Разложение уксусной кислоты в присутствии нанесенного на SiC катализатора LaMnO3 (6 мас.%) выполнено при рН=6,0 и молярном отношении R=Н2О2/СН3СООН=4 (без дозирования). Степень очистки от органических соединений составляет 60%. Растворения перовскита не наблюдают.
Пример 9. Влияние состава катализатора.
Разложение уксусной кислоты в присутствии нанесенного на кордиерит катализатора LaMnO3 (16 мас.%) выполнено при рН=6,0 и молярном отношении R=Н2O2/СН3СООН=4 (без дозирования). Степень очистки от органических соединений составляет 70%. Растворения перовскита не наблюдают.
Пример 10. Влияние состава катализатора.
Разложение уксусной кислоты в присутствии нанесенного на пену из Al2О3 (пенокерамику) катализатора 0,1% Pt/4% LaMnO3 выполнено при рН=6,0 и молярном отношении R=Н2O2/СН3СООН=4 (без дозирования). Степень очистки от органических соединений составляет 70%. Растворения перовскита не наблюдали.
Пример 11. Влияние состава катализатора.
Разложение уксусной кислоты в присутствии нанесенного на пену оксида алюминия катализатора LaMnO3 (25 мас.%) выполнено при рН=6,0 и молярном отношении R=Н2O2/СН3СООН=4 (без дозирования). Степень очистки от органических соединений составляет 70%. Растворения перовскита не наблюдают.
Преимущества изобретения
- Простой метод приготовления катализаторов на основе перовскита для фотокаталитической реакции Фентона.
- Активность катализаторов на основе перовскита оценивалась по результатам исследований разложения уксусной кислоты, МТБЭ, метанола, этанола, их смесей и сточных вод виноделия.
- Различные параметры реакции, такие как влияние рН, концентрации Н2О2 и дозирования Н2О2, оптимизированы; они применимы для переработки бионеразлагаемых сточных вод.
- Катализаторы на основе перовскита проявляют высокую активность в разложении уксусной кислоты при рН=6.
- Катализаторы на основе перовскита проявляют высокую способность к разложению органических загрязнений при комнатной температуре и атмосферном давлении.
- Катализаторы на основе перовскита с сотовой структурой более эффективны в фотокаталитической реакции Фентона, чем гомогенные системы фото-Фентона.
- Синергический эффект перовскита и Н2O2 проявляется в адсорбции молекул загрязнений, таким образом облегчая разложение органических загрязнений.
- Изобретение дает возможность создания экологически безопасного метода приготовления гетерогенных фотокаталитических систем Фентона с использованием стабильного и эффективного фотокатализатора Фентона для обезвреживания бионеразлагаемых сточных вод.
Фотокаталитическое разложение органических загрязнений с использованием фотокаталитической системы Фентона может быть более эффективным при проведении процесса в гетерогенном режиме и становится важным для современных окислительных технологий (СОТ). В частности, данное изобретение представляет собой эффективную технологию удаления органических загрязнений без образования осадков и при коротких временах запуска с использованием структурированных гетерогенных катализаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР И СПОСОБ РАЗЛОЖЕНИЯ МОНООКСИДА ДИАЗОТА И СПОСОБ И УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ | 2006 |
|
RU2397810C2 |
| СПОСОБ ОКИСЛЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В ПРИСУТСТВИИ ПЕРОКСИДА ВОДОРОДА (ВАРИАНТЫ) | 2005 |
|
RU2301790C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОВСКИТОВ | 2009 |
|
RU2440292C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЦЕЛЛЮЛОЗНОГО ПОЛУФАБРИКАТА | 2001 |
|
RU2181807C1 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОМОЛЕКУЛЯРНОГО ХИТОЗАНА | 2010 |
|
RU2417088C1 |
| СПОСОБ ХИМИЧЕСКОЙ ДЕЗАКТИВАЦИИ ОБОРУДОВАНИЯ АТОМНЫХ ЭЛЕКТРИЧЕСКИХ СТАНЦИЙ | 2007 |
|
RU2340965C1 |
| СПОСОБ ОЧИСТКИ ВОДЫ ОТ РАСТВОРЕННЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ | 1996 |
|
RU2117517C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДОРАСТВОРИМЫХ ОЛИГОМЕРНЫХ ГОМОЛОГОВ ХИТОЗАНА В ГЕТЕРОГЕННОЙ СИСТЕМЕ | 2011 |
|
RU2479590C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕРОКСИДА ВОДОРОДА | 2001 |
|
RU2237614C1 |
| КАТАЛИЗАТОР, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ ПОЛНОГО ОКИСЛЕНИЯ ФЕНОЛА | 2004 |
|
RU2256498C1 |


Изобретение представляет собой эффективную гетерогенную фотокаталитическую систему Фентона для обезвреживания органических загрязнений сточных вод с помощью гетерогенных катализаторов на основе перовскита, как порошковых, так структурированных, при комнатной температуре и атмосферном давлении. Система применяется для разложения уксусной кислоты, метил-трет-бутилового эфира (МТБЭ), метанола, этанола, их смесей и отходов виноделия. Удаление органических веществ проводится с помощью окисления до газообразного CO2. Установлено влияние концентрации Н2O2 и рН. Дальнейшее увеличение эффективности очистки достигается дозированной подачей Н2O2. Гетерогенная фотокаталитическая система Фентона позволяет расширить рабочий диапазон рН (2-8) по сравнению с гомогенной системой (рН 2-4) без образования осадка. 3 н. и 12 з.п. ф-лы, 4 табл., 5 ил.
| US 2003031585 А, 02.07.2003 | |||
| ЕР 0431932 А, 12.06.1991 | |||
| US 2006076299 A, 13.04.2006 | |||
| WO 9921801 A, 06.05.1999 | |||
| DE 10009894 A, 06.09.2001 | |||
| Способ очистки сточных вод органических соединений | 1975 |
|
SU718376A1 |
| RU 2005120433 C1, 10.01.2007 | |||
| RU 2006106714 C1, 10.08.2006 | |||
| КАТАЛИЗАТОР ОКИСЛЕНИЯ НА ОСНОВЕ ОКСИДА СО СТРУКТУРОЙ ПЕРОВСКИТА И СПОСОБЫ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 1993 |
|
RU2065325C1 |
Авторы
Даты
2009-02-27—Публикация
2007-07-05—Подача