Область техники, к которой относится изобретение
Настоящее изобретение относится к 12-членному циклическому макролидному соединению, которое может быть использовано в качестве лекарственного средства, его получению и его применению.
Предпосылки создания изобретения
Соединения, обладающие цитотоксичностью, уже были использованы в качестве противоопухолевых средств, и уже было проведено много исследований методом скрининга с использованием цитотоксичности в качестве показателя. Результаты показали, что большинство уже существующих противоопухолевых средств оказывает влияние на раковые клетки и одновременно на нормальные ткани, в которых активна пролиферация клетки, например на костный мозг, кишечный эпителий и тому подобное. Таким образом, улучшение QOL пациентов еще в достаточной мере не обеспечено.
Кроме того, хотя можно надеяться, что лечение противоопухолевыми средствами будет довольно эффективным при лейкозе, не всегда можно сказать, что оно будет эффективным для сулидной злокачественной опухоли. Поэтому существовала большая потребность в создании противоопухолевых средств, эффективных по отношению к сулидной опухоли и в высокой степени безопасных.
Уже проводились исследования методом скрининга ферментационных продуктов микроорганизмов с использованием цитотоксичности in vitro в качестве показателя в надежде, что их можно также использовать как противоопухолевые средства. Было найдено много соединений, обладающих цитотоксичностью, но большинство из них проявляет цитотоксическую активность только in vitro, малая часть из них проявляет противоопухолевую активность in vivo и среди них совсем мало тех соединений, которые эффективны в отношении сулидной злокачественной опухоли.
Сущность изобретения
Целью настоящего изобретения является получение соединений, проявляющих противоопухолевую активность не только in vitro, но и in vivo и обладающих противоопухолевой активностью по отношению к сулидной злокачественной опухоли, из ферментационных продуктов микроорганизма или их производных.
Считается, что онкогенез нормальной клетки вызывают мутация гена в клетке и экспрессия анормального гена. Поэтому авторами настоящего изобретения были проведены интенсивные исследования на основе заключения, что рост опухолевой клетки можно подавить, изменяя экспрессию гена опухолевой клетки, то есть рост опухолевой клетки можно регулировать, изменяя экспрессию онкогена или гена-супрессора опухоли или изменяя экспрессию гена, участвующего в клеточном цикле. Авторы изобретения посчитали, что соединение, изменяющее экспрессию гена, в частности соединение, угнетающее продукцию VEGF (сосудистый эндотелиальный фактор роста) в гипоксических условиях, могло бы подавлять вызываемый опухолью ангиогенез и обладать противоопухолевой активностью по отношению к сулидной злокачественной опухоли. Потом они провели скрининг ферментационных продуктов микроорганизма и их производных, использовав в качестве показателя продукцию VEGF клеткой U251 в условиях гипоксической стимуляции. В результате были найдены новые физиологически активные соединения, 12-членные циклические макролидные соединения, под названием 11107 и их аналоги, которые подавляют продукцию VEGF в гипоксических условиях in vitro и, кроме того, подавляют рост сулидных опухолевых клеток in vivo.
Было также обнаружено, что 11107D среди аналогов 11107 устойчиво даже в водном растворе и что соединения, полученные путем химических модификаций 11107D (далее их называют как производные 11107D), наследуют от 11107D свойство стабильности в водном растворе и ингибируют рост сулидных опухолевых клеток в экспериментах in vivo во много большей степени. На основе указанных находок и было создано настоящее изобретение.
В качестве родственного 12-членного циклического макролидного соединения, наиболее структурно подобного соединениям по настоящему изобретению, известно 12-членное циклическое макролидное соединение FD-895 (JP-A 4-352783), представленное формулой (XIV):

В публикации раскрыто, что FD-895 обладает ингибирующей рост клетки активностью in vitro против клетки Р388 мышиного лейкоза, клетки L-1210 мышиного лейкоза и клетки HL-60 человеческого лейкоза в среде RPM-1640 (колонка 6, таблица 2). Однако уже сообщалось, что FD-895 не проявляет противоопухолевой активности в эксперименте in vivo с использованием клетки Р388 мышиного лейкоза (Seki-Asano M. et al., J. Antibiotics, 47, 1395-1401, 1994).
Кроме того, FD-895 неустойчиво в водном растворе, как описано позже, и, как ожидается, непригодно для смешивания с инфузионным раствором при введении. Таким образом, нельзя сказать, что FD-895 обладает достаточными для противоопухолевого средства свойствами.
Поэтому в соответствии с настоящим изобретением предложены:
(1) соединение, представленное формулой (I):

(в формуле R3, R6, R7 и R21 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3, R6, R7 и R21, при условии, что R6 ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
4) необязательно замещенную С7-22 аралкилоксигруппу,
5) необязательно замещенную 5-14-членную гетероаралкилоксигруппу,
6) RCO-O- (где R представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную С7-22 аралкильную группу,
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
h) необязательно замещенную С1-22 алкоксигруппу,
i) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
j) необязательно замещенную С6-14 арилоксигруппу или
k) необязательно замещенную 5-14-членную гетероарилоксигруппу),
7) RS1RS2RS3SiO- (где RS1, RS2 и RS3 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) С1-6 алкильную группу или
b) С6-14 арильную группу),
8) атом галогена,
9) RN1RN2N-RМ- (где RМ представляет собой
а) одинарную связь,
b) -СО-О-,
с) -SO2-O-,
d) -CS-O- или
е) -СО-NRN3- (где RN3 представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу), при условии, что каждая крайняя левая связь в b)-e) присоединена к атому азота; и
RN1 и RN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную алифатическую С2-22 ацильную группу,
е) необязательно замещенную ароматическую С7-15 ацильную группу,
f) необязательно замещенную С6-14 арильную группу,
g) необязательно замещенную 5-14-членную гетероарильную группу,
h) необязательно замещенную С7-22 аралкильную группу,
i) необязательно замещенную С1-22 алкилсульфонильную группу,
j) необязательно замещенную С6-14 арилсульфонильную группу,
k) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RN1 и RN2 вместе с атомом азота, к которому присоединены RN1 и RN2, причем неароматическая гетероциклическая группа может иметь заместители,
l) необязательно замещенную 5-14-членную гетероаралкильную группу,
m) необязательно замещенную С3-14 циклоалкильную группу или
n) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу),
10) RN4SO2-O- (где RN4 представляет собой
а) необязательно замещенную С1-22 алкильную группу,
b) необязательно замещенную С6-14 арильную группу,
с) необязательно замещенную С1-22 алкоксигруппу,
d) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
е) необязательно замещенную С6-14 арилоксигруппу,
f) необязательно замещенную 5-14-членную гетероарилоксигруппу,
g) необязательно замещенную С7-22 аралкилоксигруппу или
h) необязательно замещенную 5-14-членную гетероаралкилоксигруппу),
11) (RN5О)2РО-О- (где RN5 представляет собой
а) необязательно замещенную С1-22 алкильную группу,
b) необязательно замещенную ненасыщенную С2-22 алкильную группу,
с) необязательно замещенную С6-14 арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
е) необязательно замещенную С7-22 аралкильную группу или
f) необязательно замещенную 5-14-членную гетероаралкильную группу),
12) (RN1RN2N)2РО-О- (где RN1 и RN2 имеют такие же значения, как определенные выше) или
13) (RN1RN2N)(RN5О)РО-О- (где RN1, RN2 и RN5 имеют такие же значения, как определенные выше), при условии, что исключено соединение, в котором R3, R6, R7 и R21 все представляют собой гидроксильные группы, и соединение, в котором R3, R6 и R21 все представляют собой гидроксильные группы и R7 представляет собой ацетоксигруппу), его фармакологически приемлемая соль или их гидрат;
(2) соединение по пункту (1), представленное формулой (I-а):

(в формуле R3а, R6а, R7а и R21а являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3а, R6а, R7а и R21а, при условии, что R6а ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) RаCO-O- (где Rа представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную С7-22 аралкильную группу,
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
h) необязательно замещенную С1-22 алкоксигруппу,
i) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
j) необязательно замещенную С6-14 арилоксигруппу или
k) необязательно замещенную 5-14-членную гетероарилоксигруппу),
4) RaS1RaS2RaS3SiO- (где RaS1, RaS2 и RaS3 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) С1-6 алкильную группу или
b) С6-14 арильную группу),
5) атом галогена или
6) RaN1RaN2N-RaM- (где RaM представляет собой
а) одинарную связь,
b) -СО-О-,
с) -SO2-O-,
d) -CS-O- или
е) -СО-NRaN3- (где RaN3 представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу), при условии, что каждая крайняя левая связь в b)-e) присоединена к атому азота; и
RaN1 и RaN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную алифатическую С2-22 ацильную группу,
е) необязательно замещенную ароматическую С7-15 ацильную группу,
f) необязательно замещенную С6-14 арильную группу,
g) необязательно замещенную 5-14-членную гетероарильную группу,
h) необязательно замещенную С7-22 аралкильную группу,
i) необязательно замещенную С1-22 алкилсульфонильную группу,
j) необязательно замещенную С6-14 арилсульфонильную группу,
k) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RaN1 и RaN2 вместе с атомом азота, к которому присоединены RaN1 и RaN2, причем неароматическая гетероциклическая группа может иметь заместители,
l) необязательно замещенную 5-14-членную гетероаралкильную группу,
m) необязательно замещенную С3-14 циклоалкильную группу или
n) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу)), его фармакологически приемлемая соль или их гидрат;
(3) соединение по пункту (1), представленное формулой (I-b):

(в формуле R3b, R6b, R7b и R21b являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3b, R6b, R7b и R21b, при условии, что R6b ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) RbCO-O- (где Rb представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную С7-22 аралкильную группу,
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
h) необязательно замещенную С1-22 алкоксигруппу,
i) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
j) необязательно замещенную С6-14 арилоксигруппу или
k) необязательно замещенную 5-14-членную гетероарилоксигруппу),
4) RbS1RbS2RbS3SiO- (где RbS1, RbS2 и RbS3 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) С1-6 алкильную группу или
b) С6-14 арильную группу) или
5) RbN1RbN2N-RbM- (где RbM представляет собой
а) -СО-О- или
b) -CS-O-, при условии, что каждая крайняя левая связь в a) и b) присоединена к атому азота; и
RbN1 и RbN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную алифатическую С2-22 ацильную группу,
е) необязательно замещенную ароматическую С7-15 ацильную группу,
f) необязательно замещенную С6-14 арильную группу,
g) необязательно замещенную 5-14-членную гетероарильную группу,
h) необязательно замещенную С7-22 аралкильную группу,
i) необязательно замещенную С1-22 алкилсульфонильную группу,
j) необязательно замещенную С6-14 арилсульфонильную группу,
k) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RbN1 и RbN2 вместе с атомом азота, к которому присоединены RbN1 и RbN2, причем неароматическая гетероциклическая группа может иметь заместители,
l) необязательно замещенную 5-14-членную гетероаралкильную группу,
m) необязательно замещенную С3-14 циклоалкильную группу или
n) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу)), его фармакологически приемлемая соль или их гидрат;
(4) соединение по пункту (1), представленное формулой (I-c):

(в формуле R3c, R6c, R7c и R21c являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3c, R6c, R7c и R21c, при условии, что R6c ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) RcCO-O- (где Rc представляет собой
a) необязательно замещенную С1-22 алкильную группу,
b) необязательно замещенную С6-14 арильную группу,
c) необязательно замещенную С7-22 аралкильную группу или
d) необязательно замещенную С6-14 арилоксигруппу),
4) RсS1RсS2RсS3SiO- (где RсS1, RсS2 и RсS3 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) С1-6 алкильную группу или
b) С6-14 арильную группу) или
5) RсN1RсN2N-RcM- (где RсМ представляет собой
а) -СО-О- или
b) -CS-O-, при условии, что каждая крайняя левая связь в a) и b) присоединена к атому азота; и
RсN1 и RсN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RсN1 и RсN2 вместе с атомом азота, к которому присоединены RсN1 и RсN2, причем неароматическая гетероциклическая группа может иметь заместители,
d) необязательно замещенную 5-14-членную гетероаралкильную группу,
e) необязательно замещенную С3-14 циклоалкильную группу или
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, причем неароматическая гетероциклическая группа может иметь заместители)), его фармакологически приемлемая соль или их гидрат;
(5) соединение по пункту (1), представленное формулой (I-d):

(в формуле R3d представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен R3d,
2) необязательно замещенную С1-22 алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
4) необязательно замещенную С7-22 аралкилоксигруппу,
5) RdCO-O- (где Rd представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную С7-22 аралкильную группу,
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
h) необязательно замещенную С1-22 алкоксигруппу,
i) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
j) необязательно замещенную С6-14 арилоксигруппу или
k) необязательно замещенную 5-14-членную гетероарилоксигруппу) или
6) RdN1RdN2N-CO-О- (где RdN1 и RdN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
а) атом водорода,
b) необязательно замещенную С1-22 алкильную группу,
с) необязательно замещенную ненасыщенную С2-22 алкильную группу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную С7-22 аралкильную группу,
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
h) необязательно замещенную С3-14 циклоалкильную группу,
i) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу или
j) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RdN1 и RdN2 вместе с атомом азота, к которому присоединены RdN1 и RdN2, причем неароматическая гетероциклическая группа может иметь заместители),
и
R6d, R7d и R21d являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R6d, R7d и R21d, при условии, что R6d ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
4) необязательно замещенную С7-22 аралкилоксигруппу,
5) RdCO-O- (где Rd имеет такое же значение, как определенное выше),
6) RdN1RdN2N-CO-О- (где RdN1 и RdN2 имеют такие же значения, как определенные выше),
7) RdN1RdN2N-SO2-О- (где RdN1 и RdN2 имеют такие же значения, как определенные выше),
8) RdN1RdN2N-CS-О- (где RdN1 и RdN2 имеют такие же значения, как определенные выше),
9) RdN3-SO2-О- (где RdN3 представляет собой
a) необязательно замещенную С1-22 алкильную группу,
b) необязательно замещенную С1-22 алкоксигруппу,
с) необязательно замещенную ненасыщенную С2-22 алкоксигруппу,
d) необязательно замещенную С6-14 арильную группу,
е) необязательно замещенную С6-14 арилоксигруппу,
f) необязательно замещенную 5-14-членную гетероарилоксигруппу,
g) необязательно замещенную С7-22 аралкилоксигруппу или
h) необязательно замещенную 5-14-членную гетероаралкилоксигруппу,
10) (RdN5О)2РО- (где RdN5 представляет собой
а) необязательно замещенную С1-22 алкильную группу,
b) необязательно замещенную ненасыщенную С2-22 алкильную группу,
с) необязательно замещенную С6-14 арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
е) необязательно замещенную С7-22 аралкильную группу или
f) необязательно замещенную 5-14-членную гетероаралкильную группу),
11) (RdN1RdN2N)2РО- (где RdN1 и RdN2 имеют такие же значения, как определенные выше) или
12) (RdN1RdN2N)(RdN5О)РО- (где RdN1, RdN2 и RdN5 имеют такие же значения, как определенные выше), при условии, что исключены соединение, в котором R3d, R6d, R7d и R21d все представляют собой гидроксильные группы, и соединение, в котором R3d, R6d и R21d все представляют собой гидроксильные группы и R7d представляет собой ацетоксигруппу), его фармакологически приемлемая соль или их гидрат;
(6) соединение по пункту (1), где R6 и/или R7 представляют(ет) собой RN1RN2N-RM- (где RM представляет собой
а) -СО-О- или
b) -CS-O-; и
RN1 и RN2 имеют такие же значения, как определенные выше, при условии, что каждая крайняя левая связь в a) и b) присоединена к атому азота), его фармакологически приемлемая соль или их гидрат;
(7) соединение по пункту (1), его фармакологически приемлемая соль или их гидрат, где R21 представляет собой оксогруппу, образованную вместе с атомом углерода, к которому присоединен R21;
(8) соединение по пункту (5), представленное формулой (I-е):

(в формуле R3е и R21е являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3е и R21е,
2) необязательно замещенную С1-6 алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-10 алкоксигруппу,
4) необязательно замещенную С7-10 аралкилоксигруппу,
5) необязательно замещенную алифатическую С2-6 ацилоксигруппу или
6) ReN1ReN2N-CO-O- (где ReN1 и ReN2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
А) атом водорода или
В) необязательно замещенную С1-6 алкильную группу); и
R6е и R7е являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R6е и R7е, при условии, что R6е ограничен до гидроксильной группы,
2) необязательно замещенную С1-6 алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-10 алкоксигруппу,
4) необязательно замещенную С7-10 аралкилоксигруппу,
5) необязательно замещенную алифатическую С2-6 ацилоксигруппу или
6) ReC(=Yе)-O- (где Yе представляет собой атом кислорода или атом серы и Re представляет собой
а) атом водорода,
b) необязательно замещенную С1-6 алкильную группу,
с) необязательно замещенную С7-10 аралкильную группу,
d) необязательно замещенную 5-14-членную гетероаралкильную группу,
е) группу формулы (III):

(в формуле
А) n представляет собой целое число от 0 до 4;
Хе представляет собой
i) -CHReN4-,
ii) -NReN5-,
iii) -O-,
iv) -S-,
v) -SO- или
vi) -SO2-;
RеN1 представляет собой
i) атом водорода или
ii) С1-6 алкильную группу;
RеN2 представляет собой
i) атом водорода или
ii) С1-6 алкильную группу;
RеN3 и ReN4 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
i) атом водорода,
ii) необязательно замещенную С1-6 алкильную группу,
iii) необязательно замещенную ненасыщенную С2-10 алкильную группу,
iv) необязательно замещенную С6-14 арильную группу,
v) необязательно замещенную 5-14-членную гетероарильную группу,
vi) необязательно замещенную С7-10 аралкильную группу,
vii) необязательно замещенную С3-8 циклоалкильную группу,
viii) необязательно замещенную С4-9 циклоалкилалкильную группу,
ix) необязательно замещенную 5-14-членную гетероаралкильную группу,
x) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу,
xi) -NReN6ReN7 (где ReN6 и ReN7 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу) или
xii) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, образованную ReN3 и ReN4 вместе с атомом углерода, к которому присоединены ReN3 и ReN4, причем неароматическая гетероциклическая группа может иметь заместители; и
RеN5 представляет собой
i) атом водорода,
ii) необязательно замещенную С1-6 алкильную группу,
iii) необязательно замещенную ненасыщенную С2-10 алкильную группу,
iv) необязательно замещенную С6-14 арильную группу,
v) необязательно замещенную 5-14-членную гетероарильную группу,
vi) необязательно замещенную С7-10 аралкильную группу,
vii) необязательно замещенную С3-8 циклоалкильную группу,
viii) необязательно замещенную С4-9 циклоалкилалкильную группу,
ix) необязательно замещенную 5-14-членную гетероаралкильную группу,
x) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу или
xi) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, образованную ReN3 и ReN4 вместе с атомом азота, к которому присоединены ReN3 и ReN4, причем неароматическая гетероциклическая группа может иметь заместители,
В) Хе, n, ReN3, ReN4 и ReN5 представляют каждый группу, определенную выше, и ReN1 и ReN2 вместе образуют необязательно замещенную 5-14-членную неароматическую гетероциклическую группу,
С) Хе, n, ReN2, ReN4 и ReN5 представляют каждый группу, определенную выше, а ReN1 и ReN3 вместе образуют необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, или
D) Хе, n, ReN1, ReN4 и ReN5 представляют каждый группу, определенную выше, и ReN2 и ReN3 вместе образуют необязательно замещенную 5-14-членную неароматическую гетероциклическую группу) или
f) группу формулы (IV):
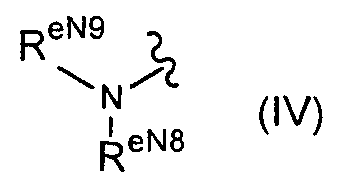
(в формуле RеN8 и ReN9 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
i) атом водорода,
ii) необязательно замещенную С1-6 алкильную группу,
iii) необязательно замещенную С6-14 арильную группу,
iv) необязательно замещенную 5-14-членную гетероарильную группу,
v) необязательно замещенную С7-10 аралкильную группу или
vi) необязательно замещенную 5-14-членную гетероаралкильную группу))), его фармакологически приемлемая соль или их гидрат;
(9) соединение по пункту (5), где R6d и/или R7d представляют(ет) собой Rd1C(=Yd1)-O- (где Yd1 представляет собой атом кислорода или атом серы и Rd1 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную С7-10 аралкильную группу или
4) необязательно замещенную 5-14-членную гетероаралкильную группу), его фармакологически приемлемая соль или их гидрат;
(10) соединение по пункту (5), где R6d и/или R7d представляют(ет) собой Rd2C(=Yd2)-O- (где Yd2 представляет собой атом кислорода или атом серы и Rd2 представляет собой группу формулы (III'):

(в формуле n представляет собой целое число от 0 до 4, Х1 представляет собой
1) -CHRdN7-,
2) -NRdN8-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-;
RdN4 и RdN5 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) атом водорода или
2) С1-6 алкильную группу;
RdN6 и RdN7 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу,
10) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу,
11) -NRdN9RdN10 (где RdN9 и RdN10 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу) или
12) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, образованную вместе RdN6 и RdN7, причем неароматическая гетероциклическая группа может иметь заместители; и
RdN8 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу,
10) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу,
11) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, образованную RdN4, RdN5 или RdN6 вместе с атомом азота, к которому присоединен каждый из RdN4, RdN5 и RdN6, причем неароматическая гетероциклическая группа может иметь заместители, или
12) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу, образованную двумя заместителями, выбранными из группы, состоящей из RdN4, RdN5 и RdN6, вместе с атомом азота, к которому они присоединены, причем неароматическая гетероциклическая группа может иметь заместители)), его фармакологически приемлемая соль или их гидрат;
(11) соединение по пункту (10), его фармакологически приемлемая соль или их гидрат, где Х1 представляет собой -NRdN8- (где NRdN8 имеет такие же значения, как определенные выше);
(12) соединение по пункту (5), представленное формулой (I-f):
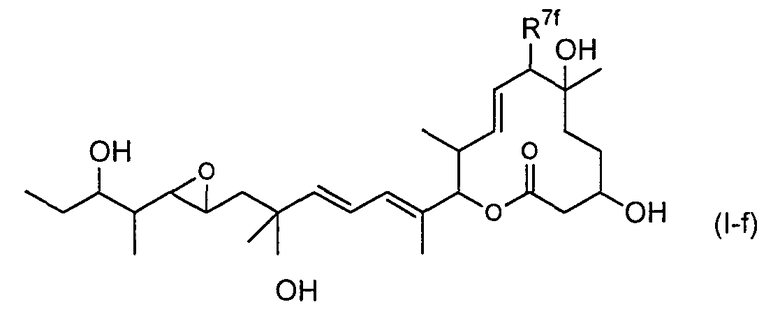
(в формуле R7f представляет собой RfC(=Yf)-O- (где Yf представляет собой атом кислорода или атом серы и Rf представляет собой группу формулы (V):
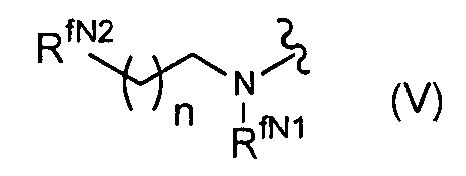
(где n представляет собой целое число от 0 до 4,
RfN1 представляет собой
1) атом водорода,
2) метильную группу или
3) этильную группу и
RfN2 представляет собой
1) атом водорода,
2) метиламиногруппу,
3) диметиламиногруппу,
4) этиламиногруппу,
5) диэтиламиногруппу,
6) этилметиламиногруппу,
7) пиридинильную группу,
8) пирролидин-1-ильную группу,
9) пиперидин-1-ильную группу,
10) морфолин-4-ильную группу или
11) 4-метилпиперазин-1-ильную группу))), его фармакологически приемлемая соль или их гидрат;
(13) соединение по пункту (5), где R6d и/или R7d представляют(ет) собой Rd3CO-O- (где Rd3 представляет собой группу формулы (VI):

(где n1 и n2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой целое число от 0 до 4,
Х2 представляет собой
1) -CHRdN13-,
2) -NRdN14-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-;
RdN11 представляет собой
1) атом водорода или
2) необязательно замещенную С1-6 алкильную группу;
RdN12 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную С6-14 арильную группу или
4) необязательно замещенную С7-10 аралкильную группу;
RdN13 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу,
10) -NRdN15RdN16 (где RdN15 и RdN16 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу) или
11) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу; и
RdN14 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу или
10) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу)), его фармакологически приемлемая соль или их гидрат;
(14) соединение по пункту (5), представленное формулой (I-g):
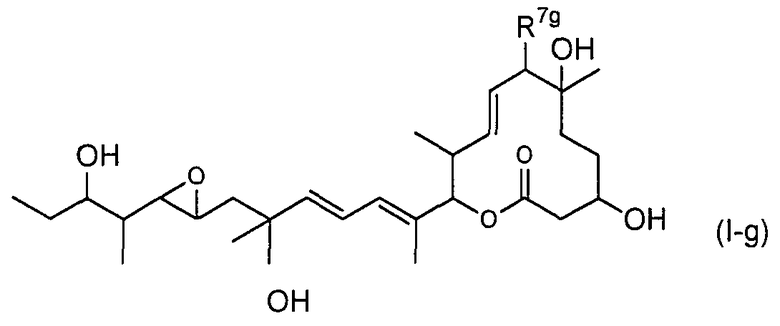
(в формуле R7g представляет собой RgCO-O- (где Rg представляет собой группу формулы (VII):

(где n3 равно 1 или 2,
RdN17 представляет собой
1) атом водорода,
2) метильную группу или
3) этильную группу и
RdN18 представляет собой
1) атом водорода,
2) метильную группу или
3) этильную группу))), его фармакологически приемлемая соль или их гидрат;
(15) соединение по пункту (5), где R6d и/или R7d представляют(ет) собой Rd4CO-O- (где Rd4 представляет собой группу формулы (VIII):
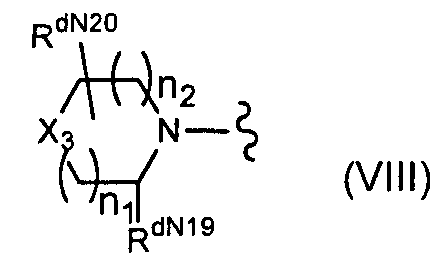
(где n1 и n2 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой целое число от 0 до 4,
Х3 представляет собой
1) -CHRdN21-,
2) -NRdN22-,
3) -O-,
4) -S-,
5) -SO- или
6) -SO2-;
RdN19 представляет собой
1) атом водорода или
2) С1-6 алкильную группу;
RdN20 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную С6-14 арильную группу или
4) необязательно замещенную С7-10 аралкильную группу;
RdN21 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С1-6 алкоксигруппу,
5) необязательно замещенную С6-14 арильную группу,
6) необязательно замещенную 5-14-членную гетероарильную группу,
7) необязательно замещенную С7-10 аралкильную группу,
8) необязательно замещенную С3-8 циклоалкильную группу,
9) необязательно замещенную С4-9 циклоалкилалкильную группу,
10) необязательно замещенную 5-14-членную гетероаралкильную группу,
11) -NRdN23RdN24 (где RdN23 и RdN24 являются одинаковыми или отличающимися друг от друга и каждый из них представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу) или
12) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу; и
RdN22 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу или
10) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу)), его фармакологически приемлемая соль или их гидрат;
(16) соединение по пункту (5), представленное формулой (I-h):
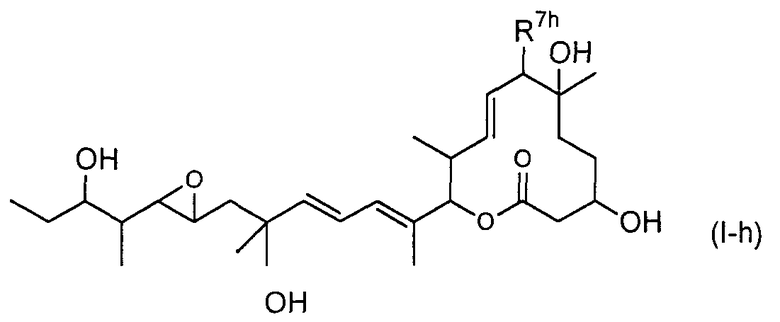
(в формуле R7h представляет собой RhCO-O- (где Rh представляет собой группу формулы (IX):

(где n4 представляет собой целое число от 1 до 3 и
RdN25 представляет собой
1) аминогруппу,
2) метиламиногруппу,
3) диметиламиногруппу,
4) пирролидин-1-ильную группу,
5) пиперидин-1-ильную группу или
6) морфолин-4-ильную группу))), его фармакологически приемлемая соль или их гидрат;
(17) соединение по пункту (5), представленное формулой (I-i):
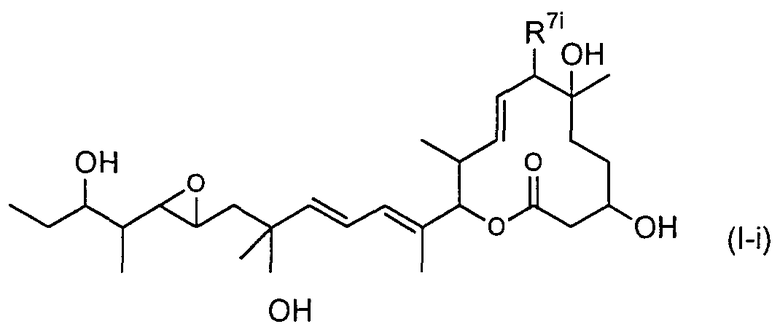
(в формуле R7i представляет собой RiCO-O- (где Ri представляет собой группу формулы (X):

(где n4 представляет собой целое число от 1 до 3,
RdN26 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную С6-14 арильную группу или
4) необязательно замещенную С7-10 аралкильную группу;
RdN27 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную С3-8 циклоалкильную группу,
4) необязательно замещенную 3-8-членную неароматическую гетероциклическую группу,
5) необязательно замещенную С6-14 арильную группу,
6) необязательно замещенную 5-14-членную гетероарильную группу,
7) необязательно замещенную С7-10 аралкильную группу,
8) необязательно замещенную 5-14-членную гетероаралкильную группу или
9) необязательно замещенную С4-9 циклоалкилалкильную группу))), его фармакологически приемлемая соль или их гидрат;
(18) соединение по пункту (5), представленное формулой (I-j):

(в формуле R7j представляет собой RjCO-O- (где Rj представляет собой группу формулы (XI):

(где n4 представляет собой целое число от 1 до 3 и
RdN28 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) С3-8 циклоалкильную группу,
4) С4-9 циклоалкилалкильную группу,
5) С7-10 аралкильную группу,
6) пиридинильную группу или
7) тетрагидропиранильную группу))), его фармакологически приемлемая соль или их гидрат;
(19) соединение по пункту (5), представленное формулой (I-k):

(в формуле R7k представляет собой RkCO-O- (где Rk представляет собой группу формулы (XII):
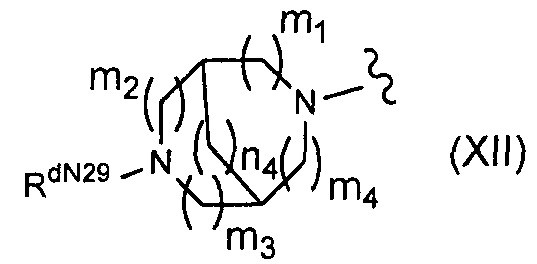
(где m1, m2, m3 и m4 являются одинаковыми или отличающимися друг от друга и каждый из них равен 0 или 1,
n4 представляет собой целое число от 1 до 3 и
RdN29 представляет собой
1) атом водорода,
2) необязательно замещенную С1-6 алкильную группу,
3) необязательно замещенную ненасыщенную С2-10 алкильную группу,
4) необязательно замещенную С6-14 арильную группу,
5) необязательно замещенную 5-14-членную гетероарильную группу,
6) необязательно замещенную С7-10 аралкильную группу,
7) необязательно замещенную С3-8 циклоалкильную группу,
8) необязательно замещенную С4-9 циклоалкилалкильную группу,
9) необязательно замещенную 5-14-членную гетероаралкильную группу или
10) необязательно замещенную 5-14-членную неароматическую гетероциклическую группу))), его фармакологически приемлемая соль или их гидрат;
(20) соединение по пункту (5), представленное формулой (I-m):

(в формуле R7m представляет собой RmCO-O- (где Rm представляет собой группу формулы (XIII):

(где m5 представляет собой целое число от 1 до 3 и n5 равно 2 или 3))), его фармакологически приемлемая соль или их гидрат;
(21) соединение по пункту (5), представленное формулой (I-n):

(в формуле R7n представляет собой RnCO-O- (где Rn представляет собой группу формулы (XIV):

его фармакологически приемлемая соль или их гидрат;
(22) соединение по пункту (1), которое выбрано из:
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 6);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 9);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 12);
(8Е,12Е,14Е)-7-((4-бутилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 16);
(8Е,12Е,14Е)-7-((4-этилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 21);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 25);
(8Е,12Е,14Е)-7-((4-циклогексилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 26);
(8Е,12Е,14Е)-7-((4-(циклопропилметил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 27);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 31);
(8Е,12Е,14Е)-7-((4-(циклопропилметил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 36);
(8Е,12Е,14Е)-7-((4-циклопентилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 38);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 44);
(8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 45);
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диэтиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 75);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изобутилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 54);
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 63);
(8Е,12Е,14Е)-7-((4-бутилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 64);
(8Е,12Е,14Е)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 85);
(8Е,12Е,14Е)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(пиперидинин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 109);
(8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 69); и
(8Е,12Е,14Е)-3,6,16-тригидрокси-21-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 131);
(23) соединение по пункту (1), которое выбрано из:
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 9);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 12);
(8Е,12Е,14Е)-7-((4-циклогексилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 26);
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 44);
(8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 45); и
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диэтиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение 75);
(24) лекарственное средство, содержащее соединение по любому из пунктов (1)-(23), его фармакологически приемлемую соль или их гидрат в качестве активного компонента;
(25) фармацевтическая композиция, содержащая соединение по любому из пунктов (1)-(23), его фармакологически приемлемую соль или их гидрат в качестве активного компонента;
(26) лекарственное средство по пункту (24), которое является средством для профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена;
(27) лекарственное средство по пункту (24), которое является средством для профилактики или лечения заболевания, против которого эффективно угнетение продукции VEGF;
(28) лекарственное средство по пункту (24), которое является средством для профилактики или лечения заболевания, против которого эффективен антиангиогенный эффект;
(29) лекарственное средство по пункту (24), которое является ингибитором ангиогенеза;
(30) лекарственное средство по пункту (24), которое является противоопухолевым средством;
(31) лекарственное средство по пункту (24) в качестве терапевтического средства для лечения ангиомы;
(32) лекарственное средство по пункту (24), которое является ингибитором метастаза рака;
(33) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения ретинальной реваскуляризации или диабетической ретинопатии;
(34) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения воспалительного заболевания;
(35) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения воспалительных заболеваний, состоящих из деформирующего артрита, ревматоидного артрита, псориаза и гиперчувствительности замедленного типа;
(36) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения атеросклероза;
(37) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения сулидной злокачественной опухоли;
(38) лекарственное средство по пункту (37), где сулидной злокачественной опухолью является рак легкого, опухоль головного мозга, рак молочной железы, рак предстательной железы, рак яичника, рак ободочной кишки или меланома;
(39) лекарственное средство по пункту (24), которое является терапевтическим средством для лечения лейкоза;
(40) лекарственное средство по пункту (24), которое является противоопухолевым средством, основанным на регуляции экспрессии гена;
(41) лекарственное средство по пункту (24), которое является противоопухолевым средством, основанным на угнетении продукции VEGF;
(42) лекарственное средство по пункту (24), которое является противоопухолевым средством, основанным на эффекте ингибирования ангиогенеза;
(43) способ профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена, содержащий введение пациенту фармакологически эффективной дозы лекарственного средства по пункту (24);
(44) способ профилактики или лечения заболевания, против которого эффективно угнетение продукции VEGF, содержащий введение пациенту фармакологически эффективной дозы лекарственного средства по пункту (24);
(45) способ профилактики или лечения заболевания, против которого эффективно ингибирование ангиогенеза, содержащий введение пациенту фармакологически эффективной дозы лекарственного средства по пункту (24);
(46) применение соединения по любому из пунктов (1)-(23), его фармакологически приемлемой соли или их гидрата для изотовления средства для профилактики или лечения заболевания, против которого эффективна регуляция экспрессии гена;
(47) применение соединения по любому из пунктов (1)-(23), его фармакологически приемлемой соли или их гидрата для изотовления средства для профилактики или лечения заболевания, против которого эффективно угнетение продукции VEGF;
(48) применение соединения по любому из пунктов (1)-(23), его фармакологически приемлемой соли или их гидрата для изотовления средства для профилактики или лечения заболевания, против которого эффективно ингибирование ангиогенеза; и
(49) применение соединения по любому из пунктов (1)-(23), его фармакологически приемлемой соли или их гидрата для изотовления средства для профилактики или лечения сулидных злокачественных опухолей.
Ниже проиллюстрированы термины, символы и тому подобное, использованные в данном описании.
В данном описании химическая формула соединения по настоящему изобретению показана для удобства в виде планиметрической формулы, но соединение может включать некоторые изомеры, выведенные из данной химической формулы. Настоящее изобретение может охватывать все изомеры и смеси изомеров, таких как геометрический изомер, порожденный конфигурацией соединения, оптический изомер на основе асимметрического углеродного атома, ротамер, стереоизомер и таутомер. Настоящее изобретение не ограничивается подходящим для данного случая описанием химической формулы и может охватывать любые изомеры или их смеси. Таким образом, когда соединение по настоящему изобретению содержит в формуле асимметрический углеродный атом и существуют его оптически активное вещество и рацемат, изобретение охватывает их. Кроме того, когда существуют полиморфные кристаллы, кристаллическая форма по настоящему изобретению особо не ограничивается одной формой и любая из кристаллических форм может существовать в отдельности или в смеси кристаллических форм. Соединение, представленное формулой (I) в соответствии с настоящим изобретением, или его соль может представлять собой ангидрат или гидрат, и оба они включены в настоящее изобретение. Метаболиты, образующиеся in vivo в результате разложения соединения формулы (I) по настоящему изобретению, и пролекарство соединения формулы (I) по настоящему изобретению или его соли также включены в настоящее изобретение.
Термин "атом галогена", использованный в данном описании, означает атом фтора, атом хлора, атом брома и атом иода. Среди них предпочтительным является, например, атом фтора, атом хлора или атом брома, из которых обычно предпочтительным является атом фтора или атом хлора.
"С1-22 алкильная группа", использованная в данном описании настоящего изобретения, представляет собой неразветвленную или разветвленную алкильную группу, содержащую 1-22 углеродных атома, такую как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, 2,2-диметилпропильная группа, 1-этилпропильная группа, н-гексильная группа, 1-этил-2-метилпропильная группа, 1,1,2-триметилпропильная группа, 1-пропилпропильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 2,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,3-диметилбутильная группа, 2-этилбутильная группа, 2-метилпентильная группа, 3-метилпентильная группа, н-гептильная группа, н-октильная группа, н-нонильная группа или н-децильная группа; предпочтительно неразветвленную или разветвленную алкильную группу, содержащую 1-6 углеродных атомов, такую как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа или н-пентильная группа; более предпочтительно, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, или трет-бутильную группу.
"Ненасыщенная С2-22 алкильная группа", использованная в данном описании по настоящему изобретению, представляет собой неразветвленную или разветвленную алкенильную группу, содержащую 2-22 углеродных атома, или неразветвленную или разветвленную алкинильную группу, содержащую 2-22 углеродных атома, такую как винильная группа, аллильная группа, 1-пропенильная группа, изопропенильная группа, 2-метил-1-пропенильная группа, 2-метил-2-пропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа, 1-пентенильная группа, 1-гексенильная группа, 1,3-гексадиенильная группа, 1,5-гексадиенильная группа, этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-этинил-2-пропинильная группа, 2-метил-3-бутинильная группа, 1-пентинильная группа, 1-гексинильная группа, 1,3-гександиинильная группа или 1,5-гександиинильная группа. Предпочтительно она представляет собой неразветвленную или разветвленную алкенильную группу, содержащую 2-10 углеродных атома, или неразветвленную или разветвленную алкинильную группу, содержащую 2-10 углеродных атома, такую как винильная группа, аллильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 3-метил-2-бутенильная группа, 3,7-диметил-2,6-октадиенильная группа, этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 2-бутинильная группа, 3-бутинильная группа или 3-метил-1-пропинильная группа.
"С6-14 арильная группа", использованная в описании к данной заявке, означает ароматическую циклическую углеводородную группу, содержащую 6-14 углеродных атомов, и включающую моноциклическую группу и конденсированные циклы, такие как бициклическая группа и трициклическая группа. Примерами ее являются фенильная группа, инденильная группа, 1-нафтильная группа, 2-нафтильная группа, азуленильная группа, гепталенильная группа, индаценильная группа, аценафтильная группа, флуоренильная группа, феналенильная группа, фенантренильная группа и антраценильная группа, из которых предпочтительным примером является фенильная группа, 1-нафтильная группа или 2-нафтильная группа.
"5-14-Членная гетероарильная группа", использованная в описании к данной заявке, означает моноциклическую, бициклическую или трициклическую 5-14-членную ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Предпочтительными примерами группы являются азотсодержащая ароматическая гетероциклическая группа, такая как пирролильная группа, пиридинильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, триазолильная группа, тетразолильная группа, бензотриазолильная группа, пиразолильная группа, имидазолильная группа, бензимидазолильная группа, индолильная группа, изоиндолильная группа, индолизинильная группа, пуринильная группа, индазолильная группа, хинолинильная группа, изохинолинильная группа, хинолизинильная группа, фталазинильная группа, нафтиридинильная группа, хиноксалинильная группа, хиназолинильная группа, циннолинильная группа, птеридинильная группа, имидазотриазинильная группа, пиразинопиридазинильная группа, акридинильная группа, фенантридинильная группа, карбазолильная группа, карбазолинильная группа, пиримидинильная группа, фенантролинильная группа, феназинильная группа, имидазопиридинильная группа, имидазопиримидинильная группа или пиразолопиридинильная группа; серосодержащая ароматическая гетероциклическая группа, такая как тиенильная группа или бензотиенильная группа; и кислородсодержащая ароматическая гетероциклическая группа, такая как фурильная группа, пиранильная группа, циклопентапиранильная группа, бензофурильная группа или изобензофурильная группа; ароматическая гетероциклическая группа, содержащая два или более разных гетероатомов, такая как тиазолильная группа, изотиазолильная группа, бензотиазолильная группа, бензотиадиазолильная группа, фенотиазинильная группа, изоксазолильная группа, фуразанильная группа, феноксазинильная группа, оксазолильная группа, изоксазолильная группа, бензоксазолильная группа, оксадиазолильная группа, пиразолооксазолильная группа, имидазотиазолильная группа, тиенофуранильная группа, фуропирролильная группа или пиридоксазинильная группа, из которых предпочтительным примером является тиенильная группа, фурильная группа, пиридинильная группа, пиридазинильная группа, пиримидинильная группа или пиразинильная группа.
"3-14-Членная неароматическая гетероциклическая группа", использованная в описании к данной заявке, означает моноциклическую, бициклическую или трициклическую 3-14-членную неароматическую гетероциклическую группу, которая может содержать один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Предпочтительными примерами ее являются азиридинильная группа, азетидинильная группа, пирролидинильная группа, пирролильная группа, пиперидинильная группа, пиперазинильная группа, гомопиперидинильная группа, гомопиперазинильная группа, имидазолильная группа, пиразолидинильная группа, имидазолидинильная группа, морфолинильная группа, тиоморфолинильная группа, имидазолинильная группа, оксазолинильная группа, 2,5-диазабицикло-[2.2.1]гептильная группа, 2,5-диазабицикло[2.2.2]октильная группа, 3,8-диазабицикло[3.2.1]октильная группа, 1,4-диазабицикло[4.3.0]нонильная группа, хинуклидинильная группа, тетрагидрофуранильная группа и тетрагидротиофенильная группа. Неароматическая гетероциклическая группа также включает группу, производную от пиридонового цикла, и неароматический конденсированный цикл (например, группу, производную от фталимидного цикла или сукцинимидного цикла).
"С7-22 аралкильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе", замещаемая часть которой замещена определенной выше "С6-14 арильной группой". Конкретными примерами ее являются бензильная группа, фенетильная группа, 3-фенилпропильная группа, 4-фенилбутильная группа, 1-нафтилметильная группа и 2-нафтилметильная группа, из которых предпочтительной является аралкильная группа, содержащая 7-10 углеродных атомов, такая как бензильная группа или фенетильная группа.
"5-14-Членная гетероаралкильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе", замещаемая часть которой замещена определенной выше "5-14-членной гетероарильной группой". Конкретными примерами ее являются тиенилметильная группа, фурилметильная группа, пиридинилметильная группа, пиридазинилметильная группа, пиримидинилметильная группа и пиразинилметильная группа, из которых предпочтительным примером является тиенилметильная группа, фурилметильная группа или пиридинилметильная группа.
"С3-14 циклоалкильная группа", использованная в данном описании, означает циклоалкильную группу, содержащую 3-14 углеродных атомов, и подходящими примерами ее являются циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа и циклооктильная группа, из которых предпочтительным примером является циклопентильная группа, циклогексильная группа, циклогептильная группа или циклооктильная группа.
"С4-9 циклоалкилалкильная группа", использованная в данном описании, означает группу, соответствующую определенной выше.
"С1-22 алкильной группе", замещаемая часть которой замещена определенной выше "С3-14 циклоалкильной группой". Конкретными примерами ее являются циклопропилметильная группа, циклобутилметильная группа, циклопентилметильная группа, циклогексилметильная группа, циклогептилметильная группа и циклооктилметильная группа, из которых предпочтительным примером является циклопропилметильная группа, циклобутилметильная группа или циклопентилметильная группа.
"С1-22 алкоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе", к концу которой присоединен атом кислорода. Подходящими примерами ее являются метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, н-пентилоксигруппа, изопентилоксигруппа, втор-пентилоксигруппа, н-гексилоксигруппа, изогексилоксигруппа, 1,1-диметилпропоксигруппа, 1,2-диметилпропоксигруппа, 2,2-диметилпропоксигруппа, 1-метил-2-этилпропоксигруппа, 1-этил-2-метилпропоксигруппа, 1,1,2-триметилпропоксигруппа, 1,2,2-триметилпропоксигруппа, 1,1-диметилбутоксигруппа, 1,2-диметилбутоксигруппа, 2,2-диметилбутоксигруппа, 2,3-диметил-бутоксигруппа, 1,3-диметилбутоксигруппа, 2-этилбутоксигруппа, 2-метилпентилоксигруппа, 3-метилпентилоксигруппа и гексилоксигруппа, из которых предпочтительным примером является метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, изобутоксигруппа или 2,2-диметилпропоксигруппа.
"Ненасыщенная С2-22 алкоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "ненасыщенной С2-22 алкильной группе", к концу которой присоединен атом кислорода. Подходящими примерами ее являются винилоксигруппа, аллилоксигруппа, 1-пропенилоксигруппа, 2-пропенилоксигруппа, изопропенилоксигруппа, 2-метил-1-пропенилоксигруппа, 2-метил-2-пропенилоксигруппа, 1-бутенилоксигруппа, 2-бутенилоксигруппа, 3-бутенилоксигруппа, 1-пентенилоксигруппа, 1-гексенилоксигруппа, 1,3-гексадиенилоксигруппа, 1,5-гексадиенилоксигруппа, пропаргилоксигруппа и 2-бутинилоксигруппа, из которых предпочтительным примером является аллилоксигруппа, пропаргилоксигруппа или 2-бутинилоксигруппа.
"С6-14 арилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "С6-14 арильной группе", к концу которой присоединен атом кислорода. Конкретными примерами ее являются фенилоксигруппа, инденилоксигруппа, 1-нафтилоксигруппа, 2-нафтилоксигруппа, азуленилоксигруппа, гепталенилоксигруппа, индаценилоксигруппа, аценафтилоксигруппа, флуоренилоксигруппа, феналенилоксигруппа, фенантренилоксигруппа и антраценилоксигруппа, из которых предпочтительным примером является фенилоксигруппа, 1-нафтилоксигруппа или 2-нафтилоксигруппа.
"С7-22 аралкилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "С7-22 аралкильной группе", к концу которой присоединен атом кислорода. Конкретными примерами ее являются бензилоксигруппа, фенетилоксигруппа, 3-фенилпропилоксигруппа, 4-фенилбутилоксигруппа, 1-нафтилметилоксигруппа и 2-нафтилметилоксигруппа, из которых предпочтительным примером является бензилоксигруппа.
"5-14-Членная гетероаралкилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "5-14-членной гетероаралкильной группе", к концу которой присоединен атом кислорода. Конкретными примерами ее являются тиенилметилоксигруппа, фурилметилоксигруппа, пиридинилметилоксигруппа, пиридазинилметилоксигруппа, пиримидинилметилоксигруппа и пиразинилметилоксигруппа, из которых предпочтительным примером является тиенилметилоксигруппа, фурилметилоксигруппа или пиридинилметилоксигруппа.
"5-14-Членная гетероарилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "5-14-членной гетероарильной группе", к концу которой присоединен атом кислорода. Конкретными примерами ее являются пирролилоксигруппа, пиридинилоксигруппа, пиридазинилоксигруппа, пиримидинилоксигруппа, пиразинилоксигруппа, триазолилоксигруппа, тетразолилоксигруппа, бензотриазолилоксигруппа, пиразолилоксигруппа, имидазолилоксигруппа, бензимидазолилоксигруппа, индолилоксигруппа, изоиндолилоксигруппа, индолизинилоксигруппа, пуринилоксигруппа, индазолилоксигруппа, хинолинилоксигруппа, изохинолинилоксигруппа, хинолизинилоксигруппа, фталазинилоксигруппа, нафтиридинилоксигруппа, хиноксалинилоксигруппа, хиназолинилоксигруппа, циннолинилоксигруппа, птеридинилоксигруппа, имидазотриазинилоксигруппа, пиразинопиридазинилоксигруппа, акридинилоксигруппа, фенантридинилоксигруппа, карбазолилоксигруппа, карбазолинилоксигруппа, перимидинилоксигруппа, фенантролинилоксигруппа, феназинилоксигруппа, имидазопиридинилоксигруппа, имидазопиримидинилоксигруппа, пиразолопиридинилоксигруппа, тиенилоксигруппа, бензотиенилгруппа, фурилоксигруппа, пиранилоксигруппа, циклопентапиранилоксигруппа, бензофурилоксигруппа, изобензофурилоксигруппа, тиазолилоксигруппа, изотиазолилоксигруппа, бензотиазолилоксигруппа, бензтиадиазолилоксигруппа, фенотиазинилоксигруппа, изоксазолилоксигруппа, фуразанилоксигруппа, феноксазинилоксигруппа, оксазолилоксигруппа, изоксазолилоксигруппа, бензоксазолилоксигруппа, оксадиазолилоксигруппа, пиразолооксазолилоксигруппа, имидазотиазолилоксигруппа, тиенофуранилоксигруппа, фуропирролилоксигруппа и пиридооксазинилоксигруппа, из которых предпочтительным примером является тиенилоксигруппа, пиридинилоксигруппа, пиримидинилоксигруппа или пиразинилоксигруппа.
"Алифатическая С2-22 ацильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе" или "ненасыщенной С2-22 алкильной группе", к концу которой присоединена карбонильная группа. Примерами ее являются ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, изовалерильная группа, пивалоильная группа, капроильная группа, деканоильная группа, лауроильная группа, миристоильная группа, пальмитоильная группа, стеароильная группа, арахидоильная группа, акрилоильная группа, пропиолоильная группа, кротоноильная группа, изокротоноильная группа, олеоильная группа и линоленоильная группа, из которых предпочтительным примером является ацильная группа, содержащая 2-6 углеродных атомов, такая как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа или акрилоильная группа.
"Ароматическая С7-15 ацильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "С6-14 арильной группе" или "5-14-членной гетероарильной группе", к концу которой присоединена карбонильная группа. Примерами ее являются бензоильная группа, 1-нафтоильная группа, 2-нафтоильная группа, пиколиноильная группа, никотиноильная группа, изоникотиноильная группа, фуроильная группа и тиофенкарбонильная группа, из которых предпочтительным примером является бензоильная группа, пиколиноильная группа, никотиноильная группа или изоникотиноильная группа.
"С1-22 алкилсульфонильная группа", использованная в данном описании, означает сульфонильную группу, к которой присоединена определенная выше "С1-22 алкильная группа". Конкретными примерами ее являются метансульфонильная группа, этансульфонильная группа, н-пропансульфонильная группа и изопропансульфонильная группа, из которых предпочтительным примером является метансульфонильная группа.
"С6-14 арилсульфонильная группа", использованная в данном описании, означает сульфонильную группу, к которой присоединена определенная выше "С6-14 арильная группа". Конкретными примерами ее являются бензолсульфонильная группа, 1-нафталинсульфонильная группа и 2-нафталинсульфонильная группа, из которых предпочтительным примером является бензолсульфонильная группа.
"Алифатическая С2-22 ацилилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "алифатической С2-22 ацильной группе", к концу которой присоединен атом кислорода. Конкретными примерами ее являются ацетоксигруппа, пропионилоксигруппа и акрилоксигруппа, из которых предпочтительным примером является ацетоксигруппа или пропионилоксигруппа.
"С2-22 алкоксикарбонильная группа", использованная в данном описании, означает группу, соответствующую определенной выше
"С1-22 алкоксигруппе", к концу которой присоединена карбонильная группа. Примерами ее являются метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа, изобутоксикарбонильная группа, втор-бутоксикарбонильная группа и трет-бутоксикарбонильная группа, из которых предпочтительным примером является этоксикарбонильная группа, изопропоксикарбонильная группа или трет-бутоксикарбонильная группа.
"Ненасыщенная С3-22 алкоксикарбонильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "ненасыщенной С2-22 алкоксигруппе", к концу которой присоединена карбонильная группа. Примерами ее являются винилоксикарбонильная группа, аллилоксикарбонильная группа, 1-пропенилоксикарбонильная группа, изопропенилоксикарбонильная группа, пропаргилоксикарбонильная группа и 2-бутинилоксикарбонильная группа, из которых предпочтительным примером является аллилоксикарбонильная группа.
"С1-22 алкилтиогруппа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе", к концу которой присоединен атом серы. Примерами ее являются метилтиогруппа, этилтиогруппа, н-пропилтиогруппа и изопропилтиогруппа, из которых предпочтительным примером является метилтиогруппа или этилтиогруппа.
"С1-22 алкилсульфинильная группа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкильной группе", к концу которой присоединена сульфинильная группа. Примерами ее являются метансульфинильная группа, этансульфинильная группа, н-пропансульфинильная группа и изопропансульфинильная группа, из которых предпочтительным примером является метансульфинильная группа или этансульфинильная группа.
"С1-22 алкилсульфонилоксигруппа", использованная в данном описании, означает группу, соответствующую определенной выше "С1-22 алкилсульфонильной группе", к концу которой присоединен атом кислорода. Примерами ее являются метансульфонилоксигруппа, этансульфонилоксигруппа, н-пропансульфонилоксигруппа и изопропансульфонилоксигруппа, из которых предпочтительным примером является метансульфонилоксигруппа.
Заместитель выражения "необязательно замещенную", использованного в данном описании, может представлять собой одну или более групп, выбранных из:
(1) атома галогена,
(2) гидроксильной группы,
(3) тиоловой группы,
(4) нитрогруппы,
(5) нитрозогруппы,
(6) цианогруппы,
(7) карбоксильной группы,
(8) гидроксисульфонильной группы,
(9) аминогруппы,
(10) С1-22 алкильной группы (например, метильной группы, этильной группы, н-пропильной группы, изопропильной группы, н-бутильной группы, изобутильной группы, втор-бутильной группы и трет-бутильной группы),
(11) ненасыщенной С2-22 алкильной группы (например, винильной группы, аллильной группы, 1-пропенильной группы, 2-пропенильной группы, изопропенильной группы, этинильной группы, 1-пропинильной группы, 2-пропинильной группы, 1-бутинильной группы, 2-бутинильной группы и 3-бутинильной группы),
(12) С6-14 арильной группы (например, фенильной группы, 1-нафтильной группы и 2-нафтильной группы),
(13) 5-14-членной гетероарильной группы (например, тиенильной группы, фурильной группы, пиридинильной группы, пиридазинильной группы, пиримидинильной группы и пиразинильной группы),
(14) 3-14-членной неароматической гетероциклической группы, (например, азиридинильной группы, азетидинильной группы, пирролидинильной группы, пирролильной группы, пиперидинильной группы, пиперазинильной группы, гомопиперидинильной группы, гомопиперазинильной группы, имидазолильной группы, пиразолидинильной группы, имидазолидинильной группы, морфолинильной группы, тиоморфолинильной группы, имидазолинильной группы, оксазолинильной группы и хинуклидинильной группы),
(15) С3-14 циклоалкильной группы (например, циклопропильной группы, циклобутильной группы, циклопентильной группы, циклогексильной группы, циклогептильной группы и циклооктильной группы),
(16) С1-22 алкоксигруппы (например, метоксигруппы, этоксигруппы, н-пропоксигруппы, изопропоксигруппы, втор-пропоксигруппы, н-бутоксигруппы, изобутоксигруппы, и трет-бутоксигруппы),
(17) ненасыщенной С2-22 алкоксигруппы (например, винилоксигруппы, аллилоксигруппы, 1-пропенилоксигруппы, 2-пропенилоксигруппы, изопропенилоксигруппы, этинилоксигруппы, 1-пропинилоксигруппы, 2-пропинилоксигруппы, 1-бутинилоксигруппы и 2-бутинилоксигруппы),
(18) С6-14 арилоксигруппы (например, фенилоксигруппы, 1-нафтилоксигруппы и 2-нафтилоксигруппы),
(19) С7-22 аралкилоксигруппы (например, бензилоксигруппы, фенетилоксигруппы, 3-фенилпропилоксигруппы, 4-фенилбутилоксигруппы, 1-нафтилметилоксигруппы и 2-нафтилметилоксигруппы),
(20) 5-14-членной гетероаралкилоксигруппы (например, тиенилметилоксигруппы, фурилметилоксигруппы, пиридинилметилоксигруппы, пиридазинилметилоксигруппы, пиримидинилметилоксигруппы и пиразинилметилоксигруппы),
(21) 5-14-членной гетероарилоксигруппы (например, тиенилоксигруппы, фурилоксигруппы, пиридинилоксигруппы, пиридазинилоксигруппы, пиримидинилоксигруппы и пиразинилоксигруппы),
(22) алифатической С2-22 ацильной группы (например, ацетильной группы, пропионильной группы, бутирильной группы, изобутирильной группы, валерильной группы, изовалерильной группы, пивалоильной группы, капроильной группы, деканоильной группы, лауроильной группы, миристоильной группы, пальмитоильной группы, стеароильной группы, арахидоильной группы, акрилоильной группы, пропиолоильной группы, кротоноильной группы, изокротоноильной группы, олеоильной группы и линоленоильной группы),
(23) ароматической С7-15 ацильной группы (например, бензоильной группы, 1-нафтоильной группы и 2-нафтоильной группы),
(24) алифатической С2-22 ацилоксигруппы (например, ацетоксигруппы, пропионилоксигруппы и акрилоксигруппы),
(25) С2-22 алкоксикарбонильной группы (например, метоксикарбонильной группы, этоксикарбонильной группы, н-пропоксикарбонильной группы, изопропоксикарбонильной группы, н-бутоксикарбонильной группы, изобутоксикарбонильной группы, втор-бутоксикарбонильной группы и трет-бутоксикарбонильной группы),
(26) ненасыщенной С3-22 алкоксикарбонильной группы (например, винилоксикарбонильной группы, аллилоксикарбонильной группы, 1-пропенилоксикарбонильной группы, 2-пропенилоксикарбонильной группы, изопропенилоксикарбонильной группы, пропаргилоксикарбонильной группы и 2-бутинилоксикарбонильной группы),
(27) С1-22 алкилтиогруппы (например, метилтиогруппы, этилтиогруппы, н-пропилтиогруппы и изопропилтиогруппы),
(28) С1-22 алкилсульфинильной группы (например, метансульфинильной группы, этансульфинильной группы, н-пропансульфинильной группы и изопропансульфинильной группы),
(29) С1-22 алкилсульфонильной группы (например, метансульфонильной группы, этансульфонильной группы, н-пропансульфонильной группы и изопропансульфонильной группы),
(30) С6-14 арилсульфонильной группы (например, бензолсульфонильной группы, 1-нафталинсульфонильной группы и 2-нафталинсульфонильной группы),
(31) С1-22 алкилсульфонилоксигруппы (например, метансульфонилоксигруппы, этансульфонилоксигруппы, н-пропансульфонилоксигруппы и изопропансульфонилоксигруппы),
(32) карбамоильной группы и
(33) формильной группы.
Из них предпочтительным примером является аминогруппа, С1-22 алкильная группа, ненасыщенная С2-22 алкильная группа, С6-14 арильная группа, 5-14-членная гетероарильная группа, 3-14-членная неароматическая гетероциклическая группа и С3-14 циклоалкильная группа, а более предпочтительным примером является аминогруппа, С1-22 алкильная группа, 3-14-членная неароматическая гетероциклическая группа и С3-14 циклоалкильная группа. Каждая из указанных выше (9) аминогруппы и (31) карбамоильной группы в качестве заместителя в "необязательно замещенной" группе может быть дополнительно замещенной одной или двумя из С1-22 алкильной группы, ненасыщенной С2-22 алкильной группы или С6-14 арильной группы.
Соединения формулы (I) по настоящему изобретению объяснены ниже.
Соединения формулы (I) угнетают продукцию VEGF в гипоксических условиях и обладают ингибирующей активностью по отношению к росту клеток сулидной опухоли in vivo. Среди них предпочтительными являются соединения формулы (I-а), из которых более предпочтительны соединения формулы (I-b), а соединения формулы (I-с) являются типичными выгодными соединениями.
Соединения формулы (I) структурно характеризуются боковой цепью в положении 6 и/или боковой цепью в положении 7, и группу более предпочтительных соединений можно определить как соединения формулы (I-d). Кроме соединений формулы (I-d) к группе соединений, обладающих хорошей активностью, относятся соединения формулы (I), в которых R21 образует оксогруппу вместе с атомом углерода, к которому присоединен R21. В качестве примеров конкретных вариантов более предпочтительных соединений среди соединений формулы (I-d) можно указать соединения по пунктам (5)-(19) настоящего изобретения.
Предпочтительные примеры соединений формулы (I) представлены ниже. Группа предпочтительных соединений, включая соединения, описанные далее в примерах, включает, например, соединение 6, соединение 9, соединение 12, соединение 15, соединение 16, соединение 20, соединение 21, соединение 22, соединение 25, соединение 26, соединение 27, соединение 31, соединение 34, соединение 36, соединение 38, соединение 39, соединение 40, соединение 41, соединение 43, соединение 44, соединение 45, соединение 48, соединение 51, соединение 53, соединение 54, соединение 55, соединение 57, соединение 58, соединение 62, соединение 63, соединение 64, соединение 65, соединение 69, соединение 70, соединение 72, соединение 74, соединение 75, соединение 77, соединение 79, соединение 85, соединение 88, соединение 105, соединение 106, соединение 108, соединение 109 и соединение 131. Среди них примерами более предпочтительных соединений являются соединение 6, соединение 9, соединение 12, соединение 16, соединение 21, соединение 25, соединение 26, соединение 27, соединение 31, соединение 36, соединение 38, соединение 44, соединение 45, соединение 54, соединение 63, соединение 64, соединение 69, соединение 75, соединение 85, соединение 109 и соединение 131, из которых, например, соединение 9, соединение 12, соединение 26, соединение 44, соединение 45 и соединение 75 являются типичными предпочтительными соединениями.
Далее поясняется получение соединения формулы (I) по настоящему изобретению.
Соединение формулы (I) может быть получено культивированием штамма, относящегося к роду Streptomyces, который способен продуцировать биоактивное вещество 11107D [соединение формулы (I), в котором R3, R6 и R21 представляют собой гидроксильные группы, а R7 представляет собой ацетоксигруппу] в аэробных условиях, собиранием соединения из клеток микроорганизма и культуры и химическим модифицированием полученного соединения традиционным методом.
Далее сначала описан способ получения 11107D.
Вместо микроорганизма для продуцирования 11107D может быть использован следующий депозитный штамм микроорганизма. Штамм был сдан на международное хранение в International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan). В частности, Streptomyces sp. Mer-11107 был депонирован как FERM P-18144 в the National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology (1-3, Higashi 1-chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan). Затем он был перенесен в International Deposit FERM BP-7812 at International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan).
Штамм для продукции 11107D особо не ограничивается и включает также варианты таких штаммов, лишь бы он относился к роду Streptomyces и обладал способностью продуцировать 11107D. Примерами штамма являются Streptomyces sp. A-1532, Streptomyces sp. A-1533 и Streptomyces sp. A-1534 в дополнение к указанному выше штамму. Указанные штаммы были также сданы на международное хранение в International Patent Organism Depositary (IPOD) National Institute of Advanced Industrial Science and Technology (Tsukuba Central 6, 1-1, Higashi 1-Chome Tsukuba-shi, Ibaraki-ken 305-8566 Japan) как FERM BP-7849, FERM BP-7850 и FERM BP-7851 соответственно.
Ниже приводится подробное описание: 1. свойства выделенного микроорганизма, 2. метода ферментации микроорганизма и 3. метода очистки активного вещества при получении 11107D.
1. Свойство выделенного микроорганизма
Что касается штамма для применения в настоящем изобретении, то ожидается, что может быть использован любой из штаммов, принадлежащий к роду Streptomyces и обладающий способностью продуцировать 11107D. Однако в качестве типичного штамма, используемого в настоящем изобретении, авторы предлагают, например, штамм под названием "штамм Mer-11107". Указанный штамм имеет следующие таксономические свойства.
(1) Морфологические характеристики
В указанном штамме от вегетативной гифы отходят надземные гифы в виде винтовых спиралей. На конце зрелых надземных гиф образована цепь спор, состоящая из примерно 10-20 столбчатых спор. Размер спор составляет примерно 0,7 х 1,0 мкм, поверхность спор гладкая, и специфические органы, такие как спорангий, склероций и жгутик не наблюдаются.
(2) Культуральные характеристики на различных средах
Ниже показаны культуральные характеристики штамма после инкубации при 28°С в течение двух недель на различных средах. Цветовой тон описан названием цвета и кодами, которые показаны в круглых скобках в Color Harmony Manual (Container Corporation of America).
1) Агаровая среда с дрожжевым и солодовым экстрактами
Наблюдались хорошо разросшийся штамм, надземные гифы, выросшие на поверхности, и светло-серые споры (Light gray; d). Противоположная сторона колонии имела желтый цвет Light melon yellow (3еа). Растворимый пигмент не был выработан.
2) Агаровая среда с овсяной мукой
Наблюдались штамм, разросшийся на среднем уровне, надземные гифы, слегка проросшие на поверхности, и серые споры (Gray; g). Противоположная сторона колонии имела рыжевато-коричневый цвет Nude (4gс) или цвет Putty (1 1/2ес). Растворимый пигмент не был выработан.
3) Агаровая среда с неорганической солью и крахмалом
Наблюдались хорошо разросшийся штамм, надземные гифы, выросшие на поверхности, и серые споры (Gray; e). Противоположная сторона колонии имела цвет Fawn (4ig) или Gray (g). Растворимый пигмент не был выработан.
4) Агаровая среда с глицерином и аспарагином
Наблюдались хорошо разросшийся штамм, надземные гифы, выросшие на поверхности, и белые споры (White; а). Противоположная сторона колонии имела цвет Pearl pink (3са). Растворимый пигмент не был выработан.
5) Агаровая среда с пептоном, дрожжевым экстрактом и железом
Рост штамма был плохим, и надземные гифы на поверхности не вырастали. Противоположная сторона колонии имела желтый цвет Light melon yellow (3еа). Растворимый пигмент не был выработан.
6) Тирозиновая агаровая среда
Наблюдались хорошо разросшийся штамм, надземные гифы, выросшие на поверхности, и белые споры (White; а). Противоположная сторона колонии имела цвет Pearl pink (3са). Растворимый пигмент не был выработан.
(3) Использование различных источников углерода
Различные источники углерода добавляют в агаровую среду Придхама-Готтлиба (Pridham-Gottlieb), ниже показан рост штамма после инкубации при 28°С в течение двух недель.
(+: положительный, ±: слегка положительный, -: отрицательный)
(4) Физиологические свойства
Физиологические свойства штамма являются такими, как показанные ниже.
(а) Интервал температуры культивирования (агаровая среда с дрожжевым и солодовым экстрактами, инкубация в течение 2 недель): 12°С-37°С
(b) Интервал оптимальной температуры (агаровая среда с дрожжевым и солодовым экстрактами, инкубация в течение 2 недель): 21°С-33°С
(с) Разжижение желатина (агаровая среда с глюкозой, пептоном и желатином): отрицательное
(d) Свёртывание молока (агаровая среда с сепарированным молоком): отрицательное
(е) Пептонизация молока (агаровая среда с сепарированным молоком): отрицательная
(f) Гидролиз крахмала (агаровая среда с неорганической солью и крахмалом): положительный
(g) Образование меланоидного пигмента (агаровая среда с пептоном, дрожжевым экстрактом и железом): отрицательное,
(тирозиновая среда): отрицательное
(h) Продукция сероводорода (агаровая среда с пептоном, дрожжевым экстрактом и железом): отрицательная
(i) Снижение содержания нитрата (бульон, содержащий 0,1% нитрат калия): отрицательное
(j) Толерантность к хлориду натрия (агаровая среда с дрожжевым и солодовым экстрактами, инкубация в течение 2 недель): росла при содержании соли 4% или ниже
(5) Хемотаксономия
Были обнаружены LL-диаминопимеловая кислота и глицин из клеточных оболочек данного штамма.
Исходя из описанных выше характеристик микроорганизма считают, что данный штамм является штаммом рода Streptomyces. Поэтому авторы настоящего изобретения назвали данный штамм микроорганизма как Streptomyces sp. Mer-11107 и депонировали его как FERM P-18144 в the National Institute of Bioscience and Human-Technology Agency of Industrial Science and Technology.
2. Метод ферментации микроорганизма-продуцента
Физиологически активное вещество 11107D по настоящему изобретению может быть получено инокуляцией штамма на питательной среде и осуществлением аэробной ферментации. Штамм для продуцирования физиологически активного вещества 11107D не ограничивается штаммом, указанным выше, и любой штамм, относящийся к роду Streptomyces и обладающий способностью продуцировать вещество 11107D, может быть использован в настоящем изобретении.
Метод ферментации указанного выше микроорганизма соответствует обычному методу ферментации микроорганизма, но предпочтительно ее осуществляют в аэробных условиях, таких как культивирование со встряхиванием или ферментация с аэрированием и перемешиванием с использованием жидкой среды. Средой, используемой для культивирования, может быть среда, содержащая источник питания, который может быть использован микроорганизмом, относящимся к роду Streptomyces, следовательно, может быть использована любая из сред синтетических, полусинтетических, органических и тому подобных. В качестве источника углерода в составе среды могут быть использованы отдельно или в сочетании глюкоза, сахароза, фруктоза, глицерин, декстрин, крахмал, меласса, соевое масло и тому подобное. В качестве источника азота могут быть использованы отдельно или в сочетании органические источники азота, такие как фармацевтические среды, пептон, мясной экстракт, соевый порошок, казеин, аминокислота, дрожжевой экстракт и мочевина, и неорганические источники азота, такие как нитрат натрия и сульфат аммония. Кроме того, например, могут быть добавлены и использованы соли, такие как хлорид натрия, хлорид калия, карбонат кальция, сульфат магния, фосфат натрия, фосфат калия и хлорид кобальта, соли тяжелых металлов, витамины, такие как витамин В или биотин, если это необходимо. И еще, когда во время культивирования становится заметным вспенивание, то при необходимости могут быть добавлены в среду различные пеногасители. При добавлении пеногасителя необходимо назначить концентрацию, не оказывающую вредного влияния на продукцию целевого вещества, желательно, например, концентрацию 0,05% или ниже.
Условия культивирования могут быть соответственно подобраны в интервале, в котором микробный штамм хорошо растет и может продуцировать указанное выше вещество. Например, рН среды равен примерно 5-9 и предпочтительно близок, как правило, к нейтральному. Температуру ферментации держат обычно в интервале 20°С-40°С, предпочтительно 28°С-35°С. Время ферментации составляет примерно 2-8 суток, обычно примерно 3-5 суток. Указанные условия ферментации могут быть нужным образом изменены в соответствии с видом и свойствами используемого микроорганизма, внешними условиями и тому подобным, не говоря уже о том, что может быть подобран оптимальный режим. Физиологически активное вещество 11107D, накопившееся в жидкой питательной среде, может быть собрано обычными методами разделения с использованием его свойств, такими как метод экстракции растворителем и метод абсорбции смолой.
Физиологически активное вещество 11107D может быть также получено, например, путем использования микроорганизма, принадлежащего к роду Streptomyces (например, штамм Streptomyces sp. АВ-1704 (FERM P-18999) и использования вещества 11107В (соединение, описанное в примере А4 в WO 02/060890), как показано в ссылочных примерах 6-10.
3. Метод очистки биологически активного вещества
Для сбора 11107D из питательной среды после ферментации могут быть использованы общие методы разделения и очистки, применяемые для выделения микробных метаболитов из жидкой питательной среды. Например, для этого годятся все соответствующие методы, такие как экстракция органическим растворителем, обычно с использованием метанола, этанола, бутанола, этилацетата или хлороформа; различные виды ионообменной хроматографии; гель-фильтрационная хроматография с использованием Сефадекса LH-20; обработка методом адсорбции и десорбции с помощью абсорбционной хроматографии, обычно с использованием активного угля или силикагеля, или тонкослойной хроматографии; или высокоэффективная жидкостная хроматография, обычно с использованием обращенно-фазовой колонки. Кроме того, методы очистки вещества 11107D особо не ограничиваются указанными выше методами.
Соединение 11107D может быть выделено и очищено применением указанных методов в отдельности или в сочетании или многократным их применением.
Далее поясняется получение соединений формулы (I), отличных от 11107D.
Соединения формулы (I) могут быть синтезированы из выделенного и очищенного соединения 11107D в качестве исходного материала преобразованием гидроксильной группы и/или ацетоксигруппы указанного соединения по общим методикам органического синтеза. Типичными примерами методов синтеза являются: А. получение производного уретана, В. получение производного тиоуретана, С. получение производного простого эфира, D. получение производного сложного эфира, Е. получение производного сложного эфира фосфорной кислоты или сложного эфира амидофосфорной кислоты, F. получение производного сложного эфира серной кислоты или сложного эфира амидосерной кислоты, G. получение галогенсодержащего производного, Н. получение производного сложного эфира сульфоновой кислоты, I. получение производного амина и J. получение оксопроизводного окислением гидроксильной группы. Введение или удаление защитной группы для гидроксигруппы может быть осуществлено при необходимости методом, описанным в материале (Protective Groups in Organic Synthesis, T. W. Greene, John Wiley & Sons, Inc. 3rd Edition), или аналогичным ему методом в зависимости от типа защитной группы и устойчивости соединения, участвующего в конкретном получении. Соединения формулы (I) могут быть получены путем использования реакций введения и удаления гидроксилзащитной группы и описанного выше получения в подходящем сочетании. В частности, соединения формулы (I), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 9), могут быть получены методом получения производного уретана, производного тиоуретана, производного сложного эфира амидосерной кислоты или производного амина; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзацах 2)-5), могут быть получены методом получения производного простого эфира; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 6), могут быть получены методом получения производного сложного эфира; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзацах 11)-13), могут быть получены методом получения производного сложного эфира фосфорной кислоты или сложного эфира амидофосфорной кислоты; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 10), могут быть получены методом получения производного сложного эфира серной кислоты или сложного эфира сульфоновой кислоты; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 8), могут быть получены методом получения галогенсодержащего производного; соединение формулы (1), в которых R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 7), могут быть получены применением реакций введения или удаления гидроксилзащитной группы; и оксопроизводное, в котором R3, R6, R7 и R21 представляют собой заместители, перечисленные выше в абзаце 1), может быть получено методом получения оксопроизводного окислением гидроксильной группы.
Далее поясняются методы синтеза, применяемые для получения соединений формулы (I).
А. Получение производного уретана

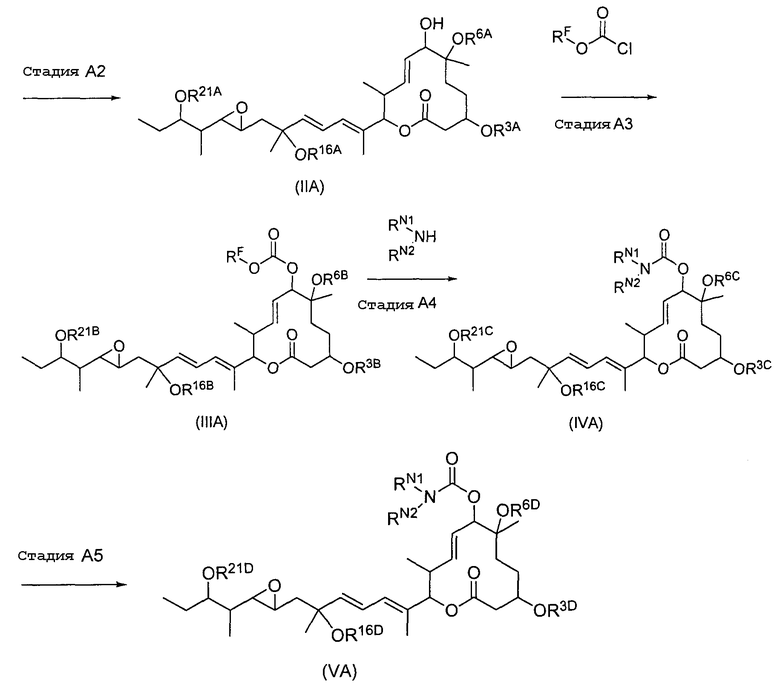
В формулах каждый из R3А, R6А, R16А и R21А представляет собой атом водорода или защитную группу, при условии, что R3А, R6А, R16А и R21А не представляют собой атомы водорода все одновременно; каждый из R3В, R6В, R16В и R21В представляет собой атом водорода, защитную группу или группу, представленную формулой RFО-СО- (где RF представляет собой необязательно замещенную С6-14 арильную группу), при условии, что R3В, R6В, R16В и R21В не представляют собой атомы водорода все одновременно; каждый из R3С, R6С, R16С и R21С представляет собой атом водорода, защитную группу или группу, представленную формулой RN1RN2N-СО- (где каждый из RN1 и RN2 представляет собой группу, определенную ранее), и каждый из R3D, R6D, R16D и R21D представляет собой атом водорода или группу, представленную формулой RN1RN2N-СО- (где каждый из RN1 и RN2 представляет собой группу, определенную ранее).
Стадия А1 является стадией получения соединения формулы (IA). Данную стадию проводят, защищая гидроксильную группу(ы) соединения 11107D.
Реакцию защиты гидроксильной группы или групп осуществляют по методике, хорошо известной в химии органического синтеза, выбрав ее в зависимости от типа защитной группы.
Примерами защитной группы являются 1-этоксиэтил, тетрагидропиранил, 1-метил-l-метоксиэтил, l-(2-хлорэтокси)этил, 1-метоксициклогексил, 4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил, S,S-диоксид 4-метокситетрагидротиопиранила, метоксиметил, метилтиометил, метоксиэтоксиметил, трихлорэтоксиметил, триметилсилилэтил, триметилсилилэтоксиметил, трет-бутилдиметилсилил, триэтилсилил, диэтилизопропилсилил, триметилсилил, триизопропилсилил, метилди-трет-бутилсилил, дифенилметилсилил, бензил, п-метоксибензил, п-метилбензил, п-нитробензил, п-хлорбензил и трифенилметил. Все или часть гидроксильных групп могут быть подходящим образом защищены указанными защитными группами.
Например, производные с гидроксильными группами, защищенными 1-этоксиэтилом, тетрагидропиранилом, 1-метоксициклогексилом, 4-метокситетрагидропиранилом, 4-метокситетрагидротиопиранилом или S,S-диоксидом 4-метокситетрагидротиопиранила, могут быть синтезированы обработкой соединения 11107D соответствующим простым виниловым эфиром, таким как этилвиниловый эфир или дигидропиран, в присутствии кислоты. Примерами кислоты являются обычные кислоты, включающие органические кислоты, такие как п-толуол сульфонат пиридиния (PPTS), п-толуолсульфоновая кислота, камфорсульфоновая кислота, уксусная кислота, трифторуксусная кислота или метансульфоновая кислота, и неорганические кислоты, такие как хлороводород, азотная кислота, хлороводородная кислота или серная кислота. Из них предпочтительным примером является п-толуол сульфонат пиридиния (PPTS), п-толуолсульфоновая кислота или камфорсульфоновая кислота. Растворитель, используемый в реакции, особо не ограничивают, но желателен инертный растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются простые эфиры, такие как тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, диоксан и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода и 1,2-дихлорэтан; углеводороды, такие как гексан, бензол и толуол; кетоны, такие как ацетон и метилэтилкетон; нитрилы, такие как ацетонитрил; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, N-метил-2-пиридон и гексаметилфосфорамид, и сульфоксиды, такие как диметилсульфоксид, из которых предпочтительным примером является дихлорметан, хлороформ или тетрагидрофуран. Время реакции составляет от 10 минут до 5 суток, предпочтительно 1-2 суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно равна комнатной температуре. Количество винилового эфира и кислоты, используемых в реакции, равно по отношению к соединению 11107D 1-200 эквивалентам и 0,05-2 эквивалентам и предпочтительно 30-50 эквивалентам и 0,1-0,3 эквивалента соответственно.
Примерами других защитных групп являются метоксиметил, метилтиометил, метоксиэтоксиметил, трихлорэтоксиметил, триметилсилилэтил, триметилсилилэтоксиметил, трет-бутилдиметилсилил, триэтилсилил, триметилсилил, диэтилизопропилсилил, триизопропилсилил, ди-трет-бутилметилсилил, дифенилметилсилил, бензил, п-метоксибензил, п-метилбензил, п-нитробензил, п-хлорбензил и трифенилметил. Такие производные с защищенными гидроксильными группами могут быть синтезированы осуществлением взаимодействия исходного материала с хлоридом, бромидом или трифторметансульфонатом соответственных защитных групп в присутствии основания. Основание является обычным органическим основанием или неорганическим основанием. Примерами органического основания являются ароматическое основание, такое как имидазол, 4-(N,N-диметиламино)пиридин (4-диметиламинопиридин, N,N-диметиламинопиридин и диметиламинопиридин означают то же самое), пиридин, 2,6-лутидин или коллидин; третичный амин, такой как N-метилпиперидин, N-метилпирролидин, триэтиламин, триметиламин, диизопропилэтиламин, циклогексилдиметиламин, N-метилморфолин или 1,8-бис(диметиламино)нафталин; вторичный амин, такой как диизобутиламин или дициклогексиламин; алкиллитий, такой как метиллитий или бутиллитий; алкоксид металла, такой как метоксид натрия или этоксид натрия. Примерами неорганического основания являются гидрид щелочного металла, такой как гидрид натрия или гидрид калия; гидрид щелочноземельного металла, такой как гидрид кальция; гидроксид щелочного металла, такой как гидроксид натрия или гидроксид калия; карбонат щелочного металла, такой как карбонат натрия, карбонат калия или карбонат цезия, и гидрокарбонат щелочного металла, такой как бикарбонат натрия. Предпочтительными примерами основания для защиты гидроксильной группы силильной защитной группой являются ароматическое основание, такое как имидазол или 4-диметиламинопиридин, и третичный амин, такой как триэтиламин. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительным примером является тетрагидрофуран, дихлорметан или N,N-диметилформамид. Время реакции составляет от 10 минут до 3 суток, предпочтительно 1-2 суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С. Количество хлорида, бромида или трифторметансульфата и основания, используемых в реакции, равно по отношению к соединению 11107D 1-20 эквивалентам и 0,5-30 эквивалентам, предпочтительно 1-15 эквивалентам и 0,5-20 эквивалентам соответственно.
Гидроксильные группы соединения 11107D могут быть избирательно защищены путем выбора реагента и его эквивалентности, используемых для защиты гидроксильных групп. Например, соединение, в котором избирательно защищают гидроксильные группы в положении 3 и положении 21, могут быть получены проведением реакции при комнатной температуре с использованием хлортриэтилсилана, триэтиламина и 4-диметиламинопиридина в дихлорметане или трет-бутилхлордиметилсилана и имидазола в N,N-диметилформамиде. По этой методике, например, гидроксильная группа в положении 3 может быть избирательно защищена регулированием эквивалентности хлортриэтилсилана или трет-бутилхлордиметилсилана. Кроме того, можно защищать две или три из четырех гидроксильных групп силильной группой, а затем другие две или одну гидроксильную группу защищать указанным выше этоксиэтилом или тому подобным.
Стадия А2 является стадией получения соединения формулы (IIA). Эту стадию осуществляют превращением ацетоксигруппы соединения формулы (IA) в гидроксильную группу обработкой основания в инертном растворителе.
Примерами основания, используемого на данной стадии, являются неорганические основания, включающие гидрид щелочного металла, такой как гидрид натрия или гидрид калия; гидрид щелочноземельного металла, такой как гидрид кальция; гидроксид щелочного металла, такой как гидроксид лития, гидроксид натрия или гидроксид калия; карбонат щелочного металла, такой как карбонат лития, карбонат натрия или карбонат калия, гидрокарбонат щелочного металла, такой как бикарбонат натрия, и алкоксид металла, такой как метоксид лития, метоксид натрия, этоксид натрия или трет-бутоксид калия, а также такие основания, как гуанидин или аммиак. Предпочтительными примерами основания являются карбонат калия и гуанидин.
Примеры инертного растворителя, используемого в реакции, включают кроме указанных выше растворителей спиртовой растворитель, такой как метанол, этанол, изопропанол или трет-бутанол, и вода. Указанные растворители могут быть использованы в сочетании в виде смеси. Предпочтительным растворителем является спиртовой растворитель или смесь спирта и галогенсодержащего растворителя. Время реакции составляет от 10 минут до 5 суток, предпочтительно от 30 минут до 1 суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно равна комнатной температуре. Количество основания, используемого в реакции, по отношению к соединению формулы (IA) равно 1-10 эквивалентам и предпочтительно 2-5 эквивалентам.
Стадия А3 является стадией получения соединения формулы (IIIA). Данную стадию осуществляют обработкой гидроксильной группы соединения формулы (IIA) производным хлорформиата или карбонилдиимидазолом в присутствии основания. Примерами производного хлорформиата являются 4-нитрофенилхлорформиат, фенилхлорформиат, 4-хлорфенилхлорформиат, 4-бромфенилхлорформиат и 2,4-динитрофенилхлорформиат. Примерами основания являются указанные выше органические основания и неорганические основания, из которых предпочтительно используют, например, диизопропилэтиламин, 4-диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, дихлорметан или N,N-диметилформамид. Количество производного хлорформиата и основания, используемых в реакции, по отношению к соединению формулы (IIA) равно 1-10 эквивалентам и 1-20 эквивалентам, предпочтительно 1-5 эквивалентам и 1-10 эквивалентам соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-4 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Что касается гидроксильного соединения (IA), в котором одна-три из групп OR3А, OR6А, OR16А и OR21А не были защищены на стадии А1, то гидроксильные группы могут быть превращены в сложноэфирные группы угольной кислоты на стадии А3. В частности, гидроксильные группы соединения (IA), отличные от гидроксильной группы в положении 7, могут быть превращены в сложноэфирные группы угольной кислоты так же, как и гидроксильные группы в положении 7, обработкой основанием и производным хлорформиата эквивалентами, соответствующими числу гидроксильных групп, превращаемых в сложноэфирные группы угольной кислоты.
Стадия А4 является стадией получения соединения формулы (IVA). Данную стадию осуществляют обработкой сложного эфира угольной кислоты формулы (IIIA) амином (RN1RN2H), которая может образовать требуемое соединение формулы (I) в инертном растворителе в присутствии основания или одним только амином.
Примерами амина, используемого на данной стадии, являются метиламин, этиламин, пропиламин, бутиламин, октиламин, дециламин, циклопропиламин, циклопентиламин, циклогексиламин, диметиламин, диэтиламин, этилметиламин, этилендиамин, 1,3-пропандиамин, 1,4-бутандиамин, N,N-диметилэтилендиамин, N,N-диметил-1,3-пропандиамин, N,N-диметил-1,4-бутандиамин, N,N-диэтилэтилендиамин, N,N-диэтил-1,3-пропандиамин, N,N-диэтил-1,4-бутандиамин, N,N,N'-триметилэтилендиамин, N,N,N'-триметил-1,3-пропандиамин, N,N,N'-триметил-1,4-бутандиамин, N-этил-N',N'-диметилэтилендиамин, N-этил-N',N'-диметил-1,3-пропандиамин, N-этил-N',N'-диметил-1,4-бутандиамин, N,N,N'-триэтилэтилендиамин, N,N,N'-триэтил-1,3-пропандиамин, N,N,N'-триэтил-1,4-бутандиамин, N,N-диэтил-N'-метилэтилендиамин, N,N-диэтил-N'-метил-1,3-пропандиамин, N,N-диэтил-N'-метил-1,4-бутандиамин, N,N'-диметил-N-фенилэтилендиамин, N,N'-диметил-N-фенил-1,3-пропандиамин, N-бензил-N,N'-диметилэтилендиамин, N-бензил-N,N'-диметил-1,3-пропандиамин, морфолин, тиоморфолин, тиоморфолин-S-оксид, тиоморфолин-S,S-диоксид, пирролидин, пиперидин, пиперазин, гомопиперазин, 4-гидроксипиперидин, 4-метоксипиперидин, 1-метилпиперазин, 1-этилпиперазин, 1-пропилпиперазин, 1-бутилпиперазин, 1-изопропилпиперазин, 1-циклобутилпиперазин, 1-циклопентилпиперазин, 1-циклогексилпиперазин, 1-циклогептилпиперазин, 1-циклооктилпиперазин, 1-(циклопропилметил)пиперазин, 1-бензилпиперазин, 1-метилгомопиперазин, 1-этилгомопиперазин, 1-(2-аминоэтил)пирролидин, 1-(2-(N-метиламино)этил)пирролидин), 1-(3-аминопропил)пирролидин, 1-(3-(N-метиламино)пропил)пирролидин), 1-(2-аминоэтил)пиперидин, 1-(2-(N-метиламино)этил)пиперидин), 1-(3-аминопропил)пиперидин, 1-(3-(N-метиламино)пропил)пиперидин), 4-(2-аминоэтил)морфолин, 4-(2-(метиламино)этил)морфолин), 4-(3-аминопропил)морфолин, 4-(3-(N-метиламино)пропил)морфолин), 1-(2-аминоэтил)-4-метилпиперазин, 1-(3-аминопропил)-4-метилпиперазин, 1-(3-(N-метиламино)пропил)-4-метилпиперазин, 1-амино-4-метилпиперидин, 1-метиламино-4-метилпиперидин, 1-этил-4-(N-метиламино)пиперидин, 1-метиламино-4-пропилпиперидин, 1-бутил-4-(N-метиламино)пиперидин, 1-(N,N-диметиламино)пиперидин, 1-(N,N-диэтиламино)пиперидин, 4-(пирролидин-1-ил)пиперидин, 4-(пиперидин-1-ил)пиперидин, 3-аминохинуклидин, 3-(N-метиламино)хинуклидин, анилин, N-метиланилин, N,N-диметил-п-фенилендиамин, N,N-диметил-м-фенилендиамин, N,N,N'-триметил-п-фенилендиамин, N,N,N'-триметил-м-фенилендиамин, 1-нафтиламин, 2-нафтиламин, бензиламин, N-метилбензиламин, фенетиламин, N-метилфенетиламин, 2-пиколиламин, 3-пиколиламин, 4-пиколиламин, N-метил-2-пиколиламин, N-метил-3-пиколиламин, N-метил-4-пиколиламин, 2,5-диазабицикло[2.2.1]гептан, 2-метил-2,5-диазабицикло[2.2.1]гептан, 3,8-диазабицикло[3.2.1]октан и 1,4-диазабицикло[4.3.0]нонан.
Примерами основания являются указанные выше органические основания и неорганические основания, из которых предпочтительно используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, дихлорметан или N,N-диметилформамид. Количество амина и основания, используемых в реакции, по отношению к соединению формулы (IIIA) равно 1-10 эквивалентам и 2-20 эквивалентам, предпочтительно 1,5-5 эквивалентам и 2-10 эквивалентам соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-2 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Соединение формулы (IVA) может быть также получено обработкой соединения формулы (IIA) изоцианатом в инертном растворителе в присутствии основания и/или хлорида меди(1). Изоцианат особо не ограничивают, и он включает, например, этилизоцианат, метилизоцианат и фенилизоцианат. Примерами основания являются указанные выше органические основания и неорганические основания, из которых предпочтительно используют, например диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, дихлорметан или N,N-диметилформамид. Количество основания и изоцианата, используемых в реакции, по отношению к соединению формулы (IIIA) равно 3-100 эквивалентам и 1-20 эквивалентам, предпочтительно 5-20 эквивалентам и 3-10 эквивалентам соответственно. В случае использования хлорида меди(1) его количество равно 1-10 эквивалентам, предпочтительно 2-6 эквивалентам. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-2 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Гидроксильное соединение, в котором одна-три из групп OR3А, OR6А, OR16А и OR21А не были защищены на стадии А1, может быть превращено в производное, содержащее несколько уретановых структур, путем превращения указанных гидроксильных групп в сложноэфирные группы угольной кислоты на стадии А3 и затем превращения их в карбамоилоксигруппы на стадии А4.
Стадия А5 является стадией получения соединения формулы (VA). Данную стадию осуществляют, подвергая производное уретана формулы (IVA) описанной ниже обработке для снятия защиты в инертном растворителе. Реакция удаления защитных групп гидроксильных групп изменяется в зависимости от типа защитной группы, но осуществляют ее методом, хорошо известным в химии органического синтеза.
Что касается соответственной гидроксильной группы, защищенной, например, 1-этоксиэтилом, тетрагидропиранилом, 1-метоксициклогексилом, 4-метокситетрагидропиранилом, 4-метокситетрагидротиопиранилом или 4-метокситетрагидротиопиранил-S,S-диоксидом, то реакция снятия защиты может быть легко осуществлена обработкой кислотой в инертном растворителе. Примерами кислоты являются указанные выше органические кислоты и неорганические кислоты, из которых предпочтительной является, например, п-толуолсульфонат пиридиния, п-толуолсульфоновая кислота или камфорсульфоновая кислота. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Предпочтительными примерами его являются спиртовой растворитель, такой как метанол, этанол, изопропанол или трет-бутанол, или смесь спирта и указанного выше инертного растворителя. Количество кислоты, используемой в реакции, по отношению к соединению формулы (IVA) равно 0,5-5 эквивалентам и предпочтительно 1-3 эквивалентам. Время реакции составляет от 10 минут до 10 суток, предпочтительно 1-4 суток. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Когда гидроксильная группа защищена другой защитной группой, такой как трет-бутилдиметилсилил, триэтилсилил, диэтилизопропилсилил, триметилсилил, триизопропилсилил, ди-трет-бутилметилсилил или дифенилметилсилил, защита с нее может быть снята обработкой фториданионом или кислотой. Примерами фториданиона являются тетрабутиламмонийфторид, фтороводород, фторид калия и фтороводородпиридин. Примерами кислоты являются указанные выше органические кислоты и неорганические кислоты, из которых предпочтительным примером является уксусная кислота, муравьиная кислота, трифторуксусная кислота, п-толуолсульфонат пиридиния или камфорсульфоновая кислота. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются указанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, диэтиловый эфир или воду. Количество фторид-аниона и кислоты, используемых в реакции, по отношению к соединению формулы (IVA) равно 1-5 эквивалентам и 0,5-5 эквивалентам, предпочтительно 1-4 эквивалентам и 0,5-3 эквивалентам соответственно. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-2 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Сочетанием различных способов защиты гидроксильных групп, описанных на стадии А1, и различных способов защиты, описанных на стадии А5, соответственные гидроксильные группы в положении 3, положении 6 и положении 21 могут быть избирательно превращены в производные уретана. Например, производное уретана, содержащее гидроксильную группу в положении 6, может быть синтезировано подверганием гидроксильной группы в положении 6 соединения (IA), в котором R3А, R16А и R21А представляют собой триэтилсилильные группы, реакциям на стадии А3, стадии А4 и стадии А5 соответственно.
Избирательная модификация гидроксильной группы в положении 3, положении 6 или положении 21, осуществляемая сочетанием методик защиты и снятия защиты, может быть также применена к другим способам модификации, описанным ниже.
В. Получение производного тиоуретана

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее; каждый из R3Е, R6Е, R16Е и R21Е представляет собой атом водорода, защитную группу или группу, представленную формулой RN1RN2N-CS- (где каждый из RN1 и RN2 представляет собой такую же группу, как определенная ранее), при условии, что R3Е, R6Е, R16Е и R21Е не представляют собой атомы водорода все одновременно; и каждый из R3F, R6F, R16F и R21F представляет собой атом водорода или группу, представленную формулой RN1RN2N-CS- (где каждый из RN1 и RN2 представляет собой такую же группу, как определенная ранее).
Стадия В1 является стадией получения соединения формулы (IB) с использованием тиоизоцианата или тиокарбамоилхлорида вместо изоцианата. Данную стадию осуществляют обработкой соединения формулы (IIA) изотиоцианатом или тиокарбамоилхлоридом в инертном растворителе в присутствии основания или бис(трибутилолово)оксида. Изотиоцианат, используемый в данной реакции, особо не ограничивают, и он включает, например, этилизотиоцианат, метилизотиоцианат, фенилизотиоцианат, бензилизотиоцианат, аллилизотиоцианат, 2-(N,N-диметиламино)этилизотиоцианат, 2-(N,N-диэтиламино)этилизотиоцианат, 3-(N,N-диметиламино)пропилизотиоцианат, 3-(N,N-диэтиламино)пропилизотиоцианат, 2-(морфолин-4-ил)этилизотиоцианат, 2-(пиперидин-1-ил)этилизотиоцианат и 2-(пирролидин-1-ил)этилизотиоцианат. Тиокарбамоилхлорид, используемый в данной реакции, особо не ограничивают, и он включает, например, N,N-диметилтиокарбамоилхлорид, N-фенил-N-метилтиокарбамоилхлорид, (морфолин-4-ил)тиокарбамоилхлорид, (4-метилпиперазин-1-ил)тиокарбамоилхлорид и (4-метилгомопиперазин-1-ил)тиокарбамоилхлорид. Примерами основания являются указанные выше органические основания и неорганические основания, из которых предпочтительно используют, например, диизопропилэтиламин, 4-диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами таких растворителей являются описанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, дихлорметан, N,N-диметилформамид или толуол. Количество основания или бис(трибутилолово)оксида и изотиоцианата или тиокарбамоилхлорида по отношению к соединению формулы (IIA) равно 1-5 эквивалентам и 1-10 эквивалентам, предпочтительно 1-3 эквивалентам и 2-5 эквивалентам соответственно. Время реакции составляет от 10 минут до 72 часов, предпочтительно 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 70°С.
Соединение формулы (IB), содержащее несколько тиокарбамоильных групп, может быть синтезировано превращением гидроксильной группы или групп соединения, представленного формулой (IIA), где один-три из OR3А, OR6А, OR16А и OR21А не защищены, в тиокарбамоилоксигруппу(ы) на стадии В1.
Производное тиоуретана формулы (IIB) может быть синтезировано удалением защитной группы гидроксильной группы в соответствии со стадией А5.
С. Получение производного простого эфира

В формулах каждый из R3G, R6G, R16G и R21G представляет собой атом водорода или защитную группу, при условии, что R3G, R6G, R16G и R21G не представляют собой атомы водорода все одновременно и по крайней мере один из них представляет атом водорода и каждый из R3Н, R6Н, R16Н и R21Н представляет собой защитную группу или необязательно замещенную С1-22 алкильную группу.
Стадия С1 является стадией синтезирования соединения формулы (IC). Данную стадию осуществляют таким же образом, как реакцию стадии А1 получения А, за исключением того, что защищать нужно одну-три гидроксильные группы.
В соответствии с другим вариантом на данной стадии соединение, в котором в положении 3, положении 6 или положении 21 находится гидроксильная группа, а другие гидроксильные группы защищены, может быть синтезировано сочетанием различных способов защиты гидроксильной группы, соответствующих стадии А1, и способов снятия защиты с защищенной гидроксильной группы, соответствующих стадии А5 получения.
Стадия С2 является стадией синтезирования соединения формулы (IIC). Данную стадию осуществляют алкилированием незащищенной гидроксильной группы или групп соединения (IC).
Алкилирование может быть осуществлено обработкой алкилирующим агентом формулы Rm-Х в присутствии основания. Заместитель Rm представляет собой С1-22 алкильную группу, которая может иметь заместители, и включает, например, метильную группу, этильную группу и бензильную группу. Х представляет собой удаляемую группу. Примерами удаляемой группы являются хром, бром, иод и трифторметансульфонильная группа. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительными примерами являются гидрид натрия, бис(триметилсилил)амид лития, диизопропиламид лития, дициклогексиламид лития, карбонат калия, карбонат цезия и 1,8-бис(N,N-диметиламино)нафталин. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются описанные выше инертные растворители, из которых предпочтительно используют, например, диэтиловый эфир, тетрагидрофуран, диметоксиэтан или толуол. Количество алкилирующего агента и основания, используемых в реакции, по отношению к соединению формулы (IC) равно 3-20 эквивалентам и 5-30 эквивалентам, предпочтительно 3-5 эквивалентам и 5-10 эквивалентам соответственно. Время реакции составляет от 10 минут до 48 часов, предпочтительно 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 70°С.

В формулах каждый из R3J, R6J, R16J и R21J представляет собой алкильную группу или защитную группу, каждый из R3K, R6K, R16K и R21K представляет собой алкильную группу или атом водорода и R7К представляет собой карбамоильную группу или тиокарбамоильную группу, каждая из которых может содержать заместители у атома азота.
Если требуется, производное, содержащее карбамоильную группу, введенную в гидроксильную группу в положении 7, и алкильную группу, введенную в одну или две гидроксильные группы в положении 3, положении 6 и положении 21, может быть получено дальнейшим подверганием соединения формулы (IIC) реакциям стадий А2, А3, А4 и А5.
В соответствии с другим вариантом производное, содержащее тиокарбамоильную группу, введенную в гидроксильную группу в положении 7, и алкильную группу, введенную в одну или две гидроксильные группы в положении 3, положении 6 и положении 21, может быть получено подверганием соединения формулы (IIIC) реакции стадии В1 и затем реакции стадии А5.

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, и каждый из R3L, R6L, R7L R16L и R21L представляет собой атом водорода или алкильную группу.
Производное простого эфира, представленное формулой (IIC'), где гидроксильная группа в положении 7 алкилирована, может быть получено подверганием соединения формулы (IIA) реакции стадии С2 и затем реакции стадии А5 способом, подобным описанному выше.
Кроме того, соответствующее производное простого эфира может быть получено использованием алкилирующего агента с ненасыщенным алкилом, аралкилирующего агента или гетероаралкилирующего агента вместо алкилирующего агента, что даст требуемое соединение формулы (I).
D. Получение производного сложного эфира

В формулах каждый из R3G, R6G, R16G и R21G представляет собой такую же группу, как определенная ранее, и каждый из R3М, R6М, R16М и R21М представляет собой атом водорода, защитную группу или группу, представленную формулой RСОСО- (где RСО представляет собой атом водорода, необязательно замещенную С1-22 алкильную группу, необязательно замещенную ненасыщенную С2-22 алкильную группу, необязательно замещенную С6-14 арильную группу, необязательно замещенную 5-14-членную гетероарильную группу, необязательно замещенную С7-22 аралкильную группу или необязательно замещенную 5-14-членную гетероаралкильную группу), при условии, что R3M, R6M, R16M и R21M не представляют собой атомы водорода все одновременно.
Стадия D1 является стадией превращения незащищенной гидроксильной группы в сложноэфирную группу с использованием соединения формулы (IC), синтезированного на стадии CI, в качестве исходного материала.
Этерификацию осуществляют, например, используя ангидрид кислоты с основанием, галогенангидирид с основанием, карбоновую кислоту с конденсирующим агентом или проводя реакцию Мицунобу (Mitsunobu). В качестве ангидрида кислоты используют различные ангидриды карбоновых кислот. Примерами их являются смешанный ангидрид, содержащий, например, уксусную кислоту, пропионовую кислоту, масляную кислоту, валериановую кислоту и бензойную кислоту; симметричный ангидрид; циклический ангидрид, такой как сукциновый ангидрид, глутаровый ангидрид или адипиновый ангидрид. Предпочтительными примерами являются уксусный ангидрид, пропионовый ангидрид, масляный ангидрид и бензойный ангидрид. В качестве галогенангидрида используют, например, различные хлорангидриды и бромангидриды, из которых предпочтительным примером является ацетилхлорид, пропионилхлорид, бензоилхлорид или бензоилбромид. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительным примером является имидазол, 4-диметиламинопиридин, пиридин или гидрид натрия. В качестве карбоновой кислоты используют различные карбоновые кислоты, из которых предпочтительным примером является уксусная кислота или пропионовая кислота. Предпочтительными примерами конденсирующего агента являются, например, дициклогексилкарбодиимид, трифторуксусный ангидрид, карбонилдиимидазол, N,N-диизопропилкарбодиимид и 1-этил-3-(3-диметиламинопропил)карбодиимид. В реакции Мицунобу различные карбоновые кислоты могут быть замещены в присутствии трифенилфосфина и диэтилазодикарбоксилата или диизопропилазодикарбоксилата. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются описанные выше инертные растворители, из которых предпочтительно используют, например, дихлорметан, хлороформ или тетрагидрофуран. Количество ангидрида кислоты с основанием, галогенангидирида с основанием и карбоновой кислоты с конденсирующим агентом по отношению к соединению формулы (IC) равно 1-10 эквивалентам с 3-20 эквивалентами, 1-10 эквивалентам с 3-20 эквивалентами и 1-20 эквивалентам с 1-20 эквивалентами, предпочтительно 1-5 эквивалентам с 2-10 эквивалентами, 1-5 эквивалентам с 2-10 эквивалентами и 1-5 эквивалентам с 1-5 эквивалентами соответственно. Реакция может быть, когда это потребуется, ускорена добавлением 0,2-2 эквивалентов 4-диметиламинопиридина. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-2 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Соединение формулы (ID) может быть получено подверганием синтезированного описанным выше образом сложноэфирного производного реакции, подобной той, которую проводят на стадии А5, чтобы удалить защитную группу гидроксильной группы.
Можно также этерифицировать одну-четыре гидроксильные группы, проводя этерификацию способом, подобным проведенному на стадии D1, с использованием соединения 11107D в качестве исходного материала.

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, и каждый из R3N, R6N, R7N R16N и R21N представляет собой атом водорода или группу, представленную формулой RСОСО- (где RСО представляет собой такую же группу, как определенная ранее).
Производное сложного эфира, представленное формулой (ID'), где гидроксильная группа в положении 7 этерифицирована, может быть синтезировано подверганием соединения формулы (IIA) реакции стадии D1 и затем реакции стадии А5 способом, подобным описанному выше.
Е. Получение производного сложного эфира фосфорной кислоты или сложного эфира амидофосфорной кислоты

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, каждый из R3Р, R6Р, R7Р R16Р и R21Р представляет собой атом водорода, группу, представленную формулой (RN3О)2PO-, формулой (RN1RN2N)2PO- или формулой (RN1RN2N)(RN3О)PO- (где каждый из RN1, RN2 и RN3 представляет собой такую же группу, как определенная выше).
Стадия Е1 является стадией превращения гидроксильной группы соединения формулы (IIA) как исходного материала в сложный эфир фосфорной кислоты или сложный эфир амидофосфорной кислоты.
Этерификацию фосфорной кислоты осуществляют, например, используя фосфорилгалогенид и основание. Можно использовать различные фосфорилгалогениды, примерами которых являются диалкоксифосфорилхлорид, дифенилоксифосфорилхлорид, алкокси(N,N-дизамещенный амино)фосфорилхлорид, аллилокси(N,N-дизамещенный амино)фосфорилхлорид, алкокси(N-замещенный амино)фосфорилхлорид и аллилокси(N-замещенный амино)фосфорилхлорид. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительным примером являются пиридин, 4-диметиламинопиридин, триэтиламин, этилдиизопропиламин, гидрид натрия, н-бутиллитий, карбонат калия или карбонат натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются описанные выше инертные растворители, из которых предпочтительно используют, например, дихлорметан, хлороформ, тетрагидрофуран или N,N-диметилформамид. Время реакции составляет от 10 минут до 72 часов, предпочтительно 1-24 часа. Количество фосфорилгалогенида и основания, используемых в реакции, по отношению к соединению формулы (IIA) равно 1-10 эквивалентам и 2-20 эквивалентам, предпочтительно 1-5 эквивалентам и 2-10 эквивалентам соответственно. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Соединение формулы (IE) может быть получено подверганием синтезированного описанным выше образом производного сложного эфира фосфорной кислоты реакции, подобной той, которую проводят на стадии А5, чтобы удалить защитную группу гидроксильной группы.
Можно также преобразовать одну-четыре гидроксильные группы в сложные эфиры фосфорной кислоты, проводя этерификацию фосфорной кислоты соединения 11107D как исходного материала способом, подобным проведенному на стадии Е1.
F. Получение производного сложного эфира серной кислоты или сложного эфира амидосерной кислоты

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, и каждый из R3Q, R7Q, R6Q, R16Q и R21Q представляет собой атом водорода или группу, представленную формулой RN1RN2N-SO2- или формулой RN3О-SO2- (где каждый из RN1, RN2 и RN3 представляет собой такую же группу, как определенная выше).
Стадия F1 является стадией превращения гидроксильной группы соединения формулы (IIA) как исходного материала в сложный эфир серной кислоты.
Этерификацию серной кислоты осуществляют, например, используя сульфонилгалогенид и основание. Можно использовать различные сульфонилгалогениды, примерами которых являются алкоксисульфонилхлорид и N,N-дизамещенный сульфамоилхлорид. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительным примером являются пиридин, 4-диметиламинопиридин, триэтиламин, этилдиизопропиламин, гидрид натрия, н-бутиллитий, карбонат калия или карбонат натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются описанные выше инертные растворители, из которых предпочтительно используют, например, дихлорметан, хлороформ, тетрагидрофуран или N,N-диметилформамид. Количество сульфонилгалогенида и основания, используемых в реакции, по отношению к соединению формулы (IIA) равно 1-10 эквивалентам и 2-20 эквивалентам, предпочтительно 1-5 эквивалентам и 2-10 эквивалентам соответственно. Время реакции составляет от 10 минут до 72 часов, предпочтительно 1-24 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником и предпочтительно от -10°С до 50°С.
Соединение формулы (IF) может быть синтезировано подверганием синтезированного описанным выше образом производного сложного эфира серной кислоты реакции, подобной той, которую проводят на стадии А5, чтобы удалить гидроксилзащитную группу.
Можно также преобразовать одну-четыре гидроксильные группы в сложные эфиры серной кислоты, подвергая соединение 11107D как исходный материал этерификации серной кислоты с получением эфира серной кислоты способом, подобным проведенному на стадии F1.
G. Получение галогенсодержащего производного

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, каждый из R3R, R6R, R16R и R21R представляет собой гидроксильную группу или атом галогена.
Стадия G1 является стадией превращения гидроксильной группы соединения формулы (IA) как исходного материала в галоген.
Галогенирование осуществляют, например, обработкой диэтиламиносератрифторида (DAST) или трифенилфосфина тетрабромидом углерода, бромом, трибромидом фосфора, иодом или тетрахлоридом углерода в присутствии основания. Основание, используемое в данной реакции, включает, например, обычные органические и неорганические основания, такие как диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются тетрагидрофуран, дихлорметан и N,N-диметилформамид. Предпочтительным является фторирование диэтиламиносератрифторидом. Количество диэтиламиносератрифторида (DAST) по отношению к соединению формулы (IIA) равно 1-5 эквивалентам и предпочтительно 1-3 эквивалентам. Время реакции составляет от 10 минут до 10 часов. Температура реакции находится в интервале от -78°С до комнатной температуры.
Соединение формулы (IG) может быть синтезировано подверганием синтезированного описанным выше образом галогенсодержащего производного процедуры стадии А5, чтобы тем самым удалить защитную группу гидроксильной группы.
Н. Получение производного сложного эфира сульфоновой кислоты


В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, и каждый из R3S, R6S, R7S, R16S и R21S представляет собой атом водорода или группу, представленную формулой RN3SO2- (где RN3 представляет собой такую же группу, как определенная ранее).
Стадия Н1 является стадией сульфонилирования гидроксильной группы соединения формулы (IIA) как исходного материала.
Сульфонилирование может быть осуществлено, например, обработкой сульфонилхлоридом, таким как п-толуолсульфонилхлорид, метансульфонилхлорид или бензолсульфонилхлорид, в присутствии основания. Примерами основания являются например, обычные органические и неорганические основания, такие как диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин и гидрид натрия. Растворитель, используемый в каждой из реакций, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются тетрагидрофуран, дихлорметан и N,N-диметилформамид. Количество сульфонилхлорида и основания, используемых в реакции, по отношению к соединению формулы (IIA) равно 1-5 эквивалентам и 2-10 эквивалентам, предпочтительно 1-3 эквивалентам и 2-6 эквивалентам соответственно. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Производное, представленное формулой (IH), в котором сульфонилирована гидроксильная группа в положении 7, может быть синтезировано подверганием синтезированного описанным выше образом производного сложного эфира сульфоновой кислоты реакции стадии А5, чтобы удалить защитную группу гидроксильной группы.
Можно также подвергать сульфонилированию соединение 11107D как исходный материал способом, подобным описанному на стадии Н1, чтобы сульфонилировать одну-четыре гидроксильные группы.
I. Получение производного амина

В формулах каждый из R3А, R6А, R16А и R21А представляет собой такую же группу, как определенная ранее, и каждый из R3T, R6T, R7T, R16T и R21T представляет собой гидроксильную группу или группу формулы RN1RN2N- (где каждый из RN1 и RN2 представляет собой такую же группу, как определенная выше).
Стадия I1 является стадией превращения гидроксильной группы соединения формулы (IIA) непосредственно в амин или в подходящую удаляемую группу, затем в азид и потом в амин путем восстановления.
В случае, когда гидроксильную группу превращают в азид, примерами реагентов, используемых в реакции, являются 1) дифенилфосфорилазид (DPPA), диэтилазодикарбоксилат и трифенилфосфин, 2) DPPA и 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 3) азид водорода, диэтилазодикарбоксилат и трифенилфосфин, 4) DPPA, тетраметилазодикарбоксамид (TMAD) и трибутилфосфин и 5) азид натрия в присутствии основания. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительно используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Указанную гидроксильную группу можно также превращать в азид обработкой азидом натрия в присутствии палладиевого катализатора. Примером катализатора является Pd(PPh3)4. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются тетрагидрофуран, дихлорметан, N,N-диметилформамид, толуол и бензол. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Восстановление азида до амина может быть осуществлено использованием, например, трифенилфосфина или литийалюминийгидрида. Азид может быть также восстановлен до амина, например, использованием катализатора, такого как палладий на углероде или катализатор Линдлара, в атмосфере водорода. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются тетрагидрофуран, диэтиловый эфир и этанол. Время реакции составляет от 10 минут до 30 часов. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником.
Превращение гидроксильной группы в подходящую удаляемую группу может быть осуществлено по методике, подобной описанной на стадии G1 (галогенирование) или на стадии Н1 (сульфонилирование). Примерами подходящей удаляемой группы являются хром, бром, иод, ментансульфонильная группа и п-толуолсульфонильная группа. Кроме того, обработкой преобразованного соединения, содержащего удаляемую группу, амином в инертном растворителе в присутствии основания можно синтезировать соединение, в котором гидроксильная группа превращена в аминогруппу или в замещенную аминогруппу.
Примерами амина, используемого в данной реакции, являются метиламин, этиламин, диметиламин и диэтиламин. Примерами основания являются указанные выше органические и неорганические основания, из которых предпочтительно используют, например, диизопропилэтиламин, диметиламинопиридин, триэтиламин, пиридин, 2,6-лутидин или гидрид натрия. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются указанные выше инертные растворители, из которых предпочтительно используют, например, тетрагидрофуран, дихлорметан или N,N-диметилформамид. Время реакции составляет от 10 минут до 30 часов, предпочтительно 1-2 часа. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником, предпочтительно от -10°С до 50°С.
Соединение формулы (II) может быть получено подверганием синтезированного описанным выше образом производного амина реакции удаления защитной группы гидроксильной группы, подобной описанной на стадии А5. Можно также превращать одну или две гидроксильные группы соединения 11107D как исходного материала в аминогруппы способом, подобным описанному на стадии I1.
Соединение формулы (I) может быть также получено алкилированием, ацилированием, карбамоилированием или сульфонилированием аминогруппы соединения формулы (II) по методам, хорошо известным в химии органического синтеза, и методам, описанным выше.
J. Получение оксосоединения (окисление гидроксильной группы)
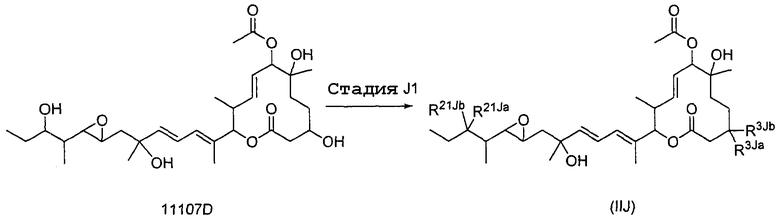
В формулах либо один из R3Ja и R3Jb представляет собой гидроксильную группу, а другой представляет собой атом водорода или R3Ja и R3Jb вместе с атомом углерода, к которому R3Ja и R3Jb присоединены, представляют собой оксогруппу, либо один из R21Ja и R21Jb представляет собой гидроксильную группу, а другой представляет собой атом водорода или R21Ja и R21Jb вместе с атомом углерода, к которому R21Ja и R21Jb присоединены, представляют собой оксогруппу.
Стадия J1 является стадией синтезирования оксосоединения, представленного формулой (IIJ), окислением гидроксильной группы соединения 11107D как исходного материала.
Примерами окислителя, используемого на данной стадии, являются диоксид марганца, хлорхромат пиридиния, дихромат пиридиния, реактив Десса-Мартина и реактивы, используемые в окислении по Сверну. Растворитель, используемый в реакции, особо не ограничивают, но желателен растворитель, который не может легко взаимодействовать с исходным материалом. Примерами его являются тетрагидрофуран, дихлорметан, хлороформ и толуол. Температура реакции находится в интервале от -78°С до температуры кипения с обратным холодильником. Время реакции составляет от 10 минут до 78 часов. Среди указанных реакций предпочтительной является, например, реакция с использованием реактива Десса-Мартина, диоксида марганца или реактивов, используемых в окислении по Сверну, из которых более предпочтительной является реакция с использованием реактива Десса-Мартина. В качестве растворителя для окисления с использованием реактива Десса-Мартина обычно предпочтительным является дихлорметан или хлороформ. Количество окислителя, используемого в реакции, относительно указанного соединения (11107D) равно 1-20 эквивалентам, предпочтительно 1-5 эквивалентам. Температура реакции находится в интервале от 0°С до комнатной температуры. Время реакции составляет от 30 минут до 24 часов, предпочтительно 1-8 часов.
Соединение, в котором гидроксильная группа в положении 3 или положении 21 указанных производных превращена в оксофрагмент, может быть синтезировано подверганием вместо 11107D, например, уретанового производного, тиоуретанового производного, сложноэфирного производного или алкилпроизводного, полученного ранее описанными выше способами, процедуре стадии J1. Кроме того, окислением гидроксильной группы в положении 7 соединения, представленного формулой (IIA), может быть получено 7-оксосоединение.
И еще, гидроксильная группа в положении 3, положении 7 и/или положении 21 может быть избирательно превращена в оксофрагмент различными комбинациями условий реакций защиты и снятия защиты на стадии А1 и стадии А5 с процедурой стадии J1. Кроме того, соединение, которое содержит и оксофрагмент, и уретановый, тиоуретановый, сложноэфирный или алкильный фрагмент, может быть соответственно получено синтезом соединения, ранее превращенного в оксофрагмент, способами, описанными выше в связи с получением уретанового производного, тиоуретанового производного, сложноэфирного производного или алкилпроизводного.
Соединения, представленные формулой (I), могут быть синтезированы подходящей комбинацией реакций А-J и реакций защиты и освобождения от защиты гидроксильной группы.
По окончании реакции целевой продукт соответственной реакции выделяют из реакционной смеси по традиционной методике. Например, целевое соединение может быть выделено фильтрованием, если имеется нерастворимый материал, и выпариванием растворителя или разбавлением реакционной смеси органическим растворителем, таким как этилацетат, промывкой органического слоя водой, сушкой над безводным сульфатом магния и выпариванием растворителя. Соединение при необходимости может быть затем очищено традиционным методом, таким как колоночная хроматография, тонкослойная хроматография или высокоэффективная жидкостная хроматография.
Для иллюстрации полезности настоящего изобретения определяли, в частности, угнетающую активность в отношении транскрипции VEGF, ингибирующую активность в отношении роста человеческой клетки WiDr рака ободочной кишки, ингибирующей активности в отношении роста сулидной злокачественной опухоли, потерю массы тела (острая токсичность) и устойчивость в водном растворе репрезентативных соединений из соединений формулы (I) по настоящему изобретению.
Пример 1 испытаний. Конструирование репортерной системы для отбора соединения, угнетающего транскрипцию VEGF
Чтобы получить репортерную систему, отражающую транскрипцию от VEGF промотора, клонировали последовательность VEGF промотора и вставляли ее в вектор секреторной щелочной фосфатазы (PLAR) для конструирования репортерного вектора.
Для получения промоторной области человеческого VEGF клонировали из библиотеки фагов VEGF геномную ДНК. На основе кДНК VEGF (GenBank accession number: Х62568) определяли ПЦР(PCR)-праймеры, содержащие последовательности, описанные в Sequence Numbers 1 и 2, и осуществлением ПЦР получали фрагмент, содержащий примерно 340 п.о. Отбирали библиотеку геномных фагов человека (Human genomic library, Clontech Co.) и использовали ее в качестве зонда для получения геномной ДНК VEGF. Используя EcoRI, расщепляли ДНК и полученные фрагменты вставляли в EcoRI-сайт pUC18. И наконец получали pUC18-VEGFA, содержащий примерно 5,4 т.о. 5'-фланкирующей области VEGF. Используя KpnI/NheI, расщепляли pUC18-VEGFA и полученную VEGF промоторную область около 2,3 т.о. вставляли в мультиклонирующий сайт KpnI/NheI вектора секреторной щелочной фосфатазы (PLAP) (Goto et al, Mol. Pharmacol., 49, 860-873, 1996), и таким образом конструировали вектор VEGF-PLAP.
Полученный вектор VEGF-PLAP трансфектировали в клетке U251, культивированной в модифицированной Дульбекко среде Игла (DMEM; фирма-изготовитель SIGMA Co. Ltd.), содержащей 10% фетальную телячью сыворотку, и клетки культивировали в присутствии 1 мг/мл G418 (Merck Co.), чтобы создать устойчивый к G418 стабильный клон (клетка U251/1-8).
Было подтверждено, что клетка U251/1-8, секретированная PLAP в гипоксических условиях (2% О2 инкубатор) так, как уже описано (Cell. Mol. Biol. Res. 40, 35-39, 1994), и была репортерной системой, отражающей транскрипцию от VEGF промотора. Используя клон, далее осуществляли отбор соединения, угнетающего продукцию VEGF, вызываемую гипоксической стимуляцией.
Пример 2 испытаний. VEGF транскрипцию угнетающая активность различных аналогов и производных 11107
Чтобы устранить влияние щелочной фосфатазы в сыворотке, клетки U251/1-8 промывали два раза достаточным количеством PBS (фосфатный буферный раствор), разбавляли в среде DMEM, содержавшей 10% сыворотки, в которой щелочную фосфатазу инактивировали обработкой при 65°С в течение 20 мин, и распределяли в 96-луночных планшетах по 4 х 104 клеток/180 мкл.
После культивирования при 37°С в течение ночи в СО2 инкубаторе (5% СО2) добавляли 20 мкл описанного выше инкубационного растора, содержавшего испытуемое соединение, разведенное 3-кратным разведением, и затем клетки инкубировали в гипоксическом (2% СО2) инкубаторе в течение 18 часов. Что касается PLAP активности в культуральных супернатантах, то к 50 мкл 0,28 М Na2CO3-NaHCO3 буферного раствора (рН 10,0, 8,0 мМ MgSO4) добавляли 10 мкл супернатантов и затем 50 мкл щелочнофосфатазного субстрата (LUMISTEIN, Genomescience Co.). После осуществления взаимодействия в течение одного часа измеряли щелочнофосфатазную PLAP активность детектированием химической люминесценции с помощью микропланшетного считывающего устройства (Perkin Elmer Co.). PLAP активность при нормоксии устанавливали как 0%, PLAP активность клетки, обработанной в условиях гипоксии, устанавливали как 100% и концентрацию, угнетающую PLAP активность на 50% устанавливали как IC50-значение PLAP. Измеряли IC50-значения производных 11107D, показанных в примерах, представив в таблице 1 IC50-значения репрезентативных производных 11107D. Производные 11107D показали высокую угнетающую активность в отношении транскрипции VEGF.
Пример 3 испытаний. Ингибирующая активность в отношении роста человеческих клеток WiDr рака ободочной кишки
Человеческие клетки WiDr рака ободочной кишки, культивированные в модифицированной Дульбекко среде Игла (DMEM; фирма-изготовитель SIGMA Co. Ltd.), содержавшей 10% фетальную телячью сыворотку, пенициллин (100 единиц/мл) и стрептомицин (100 мкг/мл), распределяли в 96-луночных планшетах по 2х303 клеток/лунку. После культивирования в течение ночи в СО2 - инкубаторе добавляли 20 мкл описанного выше инкубационного растора, содержавшего испытуемое соединение, разведенное 3-кратным разведением, и затем клетки инкубировали. Через три дня добавляли 50 мкл раствора 3,3 мг/мл МТТ, после чего культивировали еще один час. Затем формазан, образованный восстановлением под действием живых клеток, экстрагировали 100 мкл ДМСО, определяли оптическую плотность (А540/А660) и устанавливали в качестве показателя числа живых клеток.
Определяли концентрацию соединений формулы (I), при которых рост человеческих клеток WiDr рака ободочной кишки ингибирован на 50%. Значения IC50 для репрезентативных соединений показаны в таблице 2. Соединения формулы (I) показали высокую ингибирующую активность по отношению к росту человеческих клеток WiDr рака ободочной кишки.
(IC50: нМ)
Пример 4 испытаний. Ингибирующая активность по отношению к росту сулидной опухоли
Чтобы исследовать ингибирующую активность по отношению к росту сулидной опухоли соединений формулы (I) in vivo, подкожно имплантировали человеческие клетки WiDr рака ободочной кишки в бока оголенных мышей. Животных разбивали на группы, так что среднее значение объемов в соответственных группах становилось одинаковым, когда оно достигало примерно 100 мм3. Контрольные группы состояли из 10 мышей, а группы с введенными соединениями 11107D - из 5 мышей. Производные вводили мышам в группах для введения в течение 5 последовательных дней внутривенной инъекцией с какой-либо из доз 0,625 мг, 1,25 мг, 2,5 мг, 5 мг и 10 мг/кг/сутки, а контрольной группе вводили носитель. Измеряли объемы опухолей на день 15 и определяли относительные коэффициенты объема опухолей (Т/С%), взяв объем опухоли контрольной группы за 100%. Т/С% репрезентативных соединений формулы (I) показаны в таблице 3. Измеряли массу тела на день 1, день 5, день 8, день 12 и день 15 (или 16) и определяли относительные изменения массы тела, взяв массу тела на день 1 за 100%. Определяли относительные коэффициенты массы тела на день, когда маса тела достигала минимума, как минимальные коэффициенты массы тела, которые показаны в таблице 3.
(Т/С%)
Соединения формулы (I) показали сходную по величине ингибирующую рост активность в отношении модели опухоли WiDr ободочной кишки человека без заметной потери массы тела также in vivo.
Пример 5 испытания. Устойчивость в водном растворе
Соединения формулы (I) растворяли в ДМСО в концентрациях 10-20 мМ и полученный раствор разбавляли примерно 500-кратно буферным раствором Бриттона-Робинсона с рН 7. Каждый из растворов, служащих в качестве растворов-образцов, инкубировали при 25°С в течение 24 часов.
Растворы-образцы анализировали высокоэффективной жидкостной хроматографией до и после инкубации и из площадей пиков полученных хроматограмм определяли показатели остатка испытуемых веществ в растворах-образцах после инкубации.
Результаты показывают, что содержание FD895 уменьшилось до 83% через 24 часа, а содержания соединений 9, 12 и 22 как репрезентативных соединений из соединений формулы (I) остались на уровне 95-96%, указывая, что производные 11107D устойчивы в водном растворе.
Как видно из примеров фармакологических испытаний, соединения формулы (I) по настоящему изобретению, в частности, угнетают продукцию VEGF, изменяя экспрессию генов, и, как ожидается, могут быть применены в качестве противоопухолевого средства, в частности лекарственного средства для лечения сулидной злокачественной опухоли, супрессора метастаза карциномы, а также средства для лечения диабетической ретинопатии, ревматоидного артрита и ангиномы. Кроме того, из примера 4 испытания на токсичность видно, что соединения формулы (I) проявляют ингибирующую рост активность в модели опухоли WiDr ободочной кишки человека в такой мере, что не вызывают заметной потери массы тела тестируемой мыши, и являются безопасными соединениями. Следовательно, они эффективны в качестве средства для профилактики или лечения заболевания, против которого эффективно регулирование экспрессии генов, заболевания, против которого эффективна угнетающая активность по отношению к продукции VEGF, и заболевания, против которого эффективна ангиогенез ингибирующая активность. "Профилактика или лечение" означает либо профилактику, либо лечение или и то, и другое. В частности, соединения формулы (I) по настоящему изобретению эффективны в качестве противоопухолевого средства и особенно в качестве противоопухолевого средства и супрессора метастазы карциномы для сулидной злокачественной опухоли. В качестве сулидной злокачественной опухоли можно назвать, например, рак поджелудочной железы, рак желудка, рак ободочной кишки, рак молочной железы, рак предстательной железы, рак легкого, рак почки, опухоль головного мозга, рак головы и шеи, рак пищевода, рак кожи, рак печени, рак матки, рак шейки матки, рак мочевого пузыря, рак щитовидной железы, рак яичка, хориокарцинома, остеосаркома, саркома мягких тканей и рак яичника, из которых предпочтительным является рак, такой как рак ободочной кишки, рак молочной железы, рак предстательной железы, рак легкого, рак головы и шеи или рак яичника. Кроме того, они эффективны также в качестве противоопухолевого средства для лечения лейкоза. Еще они эффективны в качестве средства для лечения гематомы. И еще они эффективны также в качестве средства для лечения диабетической ретинопатии, ревматоидного артрита и гематомы, что основано на угнетающем действии на продукцию VEGF. Кроме того, они эффективны также как средство для лечения воспалительных заболеваний, включающих остеоартрит, псориаз и аллергическую реакцию замедленного типа, и атеросклероза.
Когда соединения приготавливают в виде инъекционного раствора, то к основному лекарству добавляют, если это необходимо, регулятор рН, буфер, стабилизатор, солюбилизатор и тому подобное с получением по традиционной методике раствора для подкожной, внутримышечной, внутрисуставной или внутривенной инъекции.
Когда соединение применяют как профилактическое или лечебное средство против различных заболеваний, его можно вводить перорально в виде таблеток, порошков, гранул, капсул, сиропов и тому подобного или парентерально в виде аэрозоля, суппозитория, инъекционного раствора, наружного препарата или капель. Доза заметно меняется в соответствии с тяжестью симптома, возрастом, типом болезни печени и т.д. и составляет в общем приблизительно от 1 мг до 100 мг в сутки для врослого при одноразовом или многоразовом введении.
Для изготовления лекарственных средств используют традиционные инертные вспомогательные вещества и традиционные методы изготовления. То есть когда изготавливают твердую лекарственную форму для перорального применения, к основному лекарственному веществу добавляют наполнитель и, если необходимо, связующее вещество, разрыхлитель, смазывающее вещество, краситель, корригирующее вещество и тому подобное и затем изготавливают таблетки, таблетки с покрытием, гранулы, порошки, капсулы и тому подобное. Нет нужды говорить, что при необходимости на таблетки и гранулы может быть нанесено сахарное покрытие, желатиновое покрытие или другое подходящее покрытие.
В соответствии с настоящим изобретением соединения формулы (I) по настоящему изобретению угнетают, в частности, продукцию VEGF изменением экспрессии генов и проявляют высокую противоопухолевую активность в моделях in vivo сулидных опухолей. Кроме того, соединения формулы (I) по настоящему изобретению устойчивы в водном растворе и могут дать, например, средство для лечения рака, в частности средство для лечения сулидного рака, супрессор метастазы карциномы, средство для лечения диабетической ретинопатии, ревматического артрита и ангиомы.
Примеры
Настоящее изобретение описано далее более подробно на примерах и ссылочных примерах, которые не следует считать ограничивающими объем настоящего изобретения.
Ниже показаны значения символов, использованных в химических структурных формулах в примерах.
DEIPS: диэтилизопропилсилильная группа
Et: этильная группа
ЕЕ: 1-этоксиэтильная группа
Ме: метильная группа
TES: триэтилсилильная группа.
Пример 1. Ферментация штамма Mer-11107 и очистка 11107D
Одну полную петлю выращенной на скошенной питательной среде культуры (ISP-2) штамма Mer-11107 вносили в 500 мл колбу Эрленмейера, содержавшую 50 мл среды для посева (2% глицерина, 2% глюкозы, 2% соевой муки (ESUSAN-MEAT производства Ajinomoto Co. Ltd.), 0,5% дрожжевого экстракта, 0,25% хлорида натрия, 0,32% карбоната кальция, 0,0005% сульфата меди, 0,0005% хлорида марганца, 0,0005% сульфата цинка, рН 7,4), и культивировали при 28°С в течение трех суток на шейкере, что дало первую посевную культуру. Посевную культуру (0,6 мл) вносили в 500 мл колбу Эрленмейера, содержавшую 60 мл продуцирующей среды (5% растворимого крахмала, 0,5% жидкого кукурузного экстракта, 0,5% сухих дрожжей, 0,5% муки из клейковины, 0,1% карбоната кальция), и ферментировали при 28°С в течение четырех суток на роторном шейкере, что дало ферментационный культивированный бульон.
Культивированный бульон (10 л) экстрагировали 1-бутанолом (10 л), затем полученный при этом бутаноловый слой упаривали досуха с получением 100 г неочищенной активной фракции. Неочищенную активную фракцию наносили на Sephadex LH-20 (1500 мл; фирма-изготовитель Pharmacia Co. Ltd.) и элюировали смесью тетрагидрофуран-метанол (1:1) в качестве растворителя. Элюированную фракцию от 540 мл до 660 мл концентрировали досуха с получением остатка (660 мг). Полученный остаток растворяли в смеси этилацетата и метанола (9:1, об./об.) и подвергали колоночной хроматографией на силикагеле (WAKO GEL C-200, 50 г). Колонку элюировали смесью (2 л), состоявшей из н-гексана и этилацетата (1:9, об./об.), элюированные фракции от 1440 мл до 1566 мл собирали и упаривали с получением 15 мг неочищенной активной фракции.
Полученную неочищенную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) в следующих условиях (А) препаративной ВЭЖХ и собирали фракции, элюированные при времени удерживания 17 минут. После удаления ацетонитрила соответственные фракции обессоливали с помощью ВЭЖХ в следующих условиях (В) препаративной ВЭЖХ с получением 11107D (время удерживания: 36 минут, 1,8 мг).
Условия (А) препаративной ВЭЖХ:
Колонка: YMC-PACK ODS-AM F20 мм х 250 мм (фирма-изготовитель YMC Co.)
Скорость потока: 10 мл/мин.
Детектирование: 240 нм.
Элюент: ацетонитрил/0,15% водный дигидрофосфат калия (рН 3,5) (2:8-8:2, об./об., 0-50 мин, линейный градиент).
Условия (В) препаративной ВЭЖХ:
Колонка: YMC-PACK ODS-AM F20 мм х 250 мм (фирма-изготовитель YMC Co.).
Скорость потока: 10 мл/мин.
Детектирование: 240 нм.
Элюент: метанол/вода (2:8-10:0, об./об., 0-40 мин, линейный градиент).
Пример 2. Физико-химические свойства 11107D
Физико-химические свойства 11107D показаны ниже. Определяли структуру 11107D, показанную ниже.
1. Внешний вид: бесцветный порошок.
2. Молекулярная масса: 552, ESI-MC m/z 551 (M-H)-, 575 (М+Na)+.
3. Молекулярная формула: С30Н48О9.
4. Растворимость: растворимо в диметилсульфоксиде, пиридине, метаноле и ацетоне и незначительно растворимо в воде.
5. Цветная реакция: положительная для иода и серной кислоты.
6. Ультрафиолетовый спектр поглощения (метанол, максимальное значение) нм: 239 (ε 33100).
7. Инфракрасный спектр поглощения (KBr) см-1: 3417, 2967, 1732, 1714, 1455, 1372, 1248, 1176.
8. 1Н-ЯМР-спектр (CD3OD, 500 МГц): δ м.д. (интегральная интенсивность, мультиплетность, константа связывания J (Гц)): 0,93 (3H, д, J=7,0 Гц), 0,95 (3H, д, J=6,8 Гц), 0,98 (3H, т, J=8,0 Гц), 1,23 (3H, с), 1,30 (1H, м), 1,36-1,66 (9H, м), 1,70 (1H, дд, J=6,4, 14,2 Гц), 1,82 (3H, д, J=1,0 Гц), 1,90 (1H, дд, J=6,4, 14,2 Гц), 2,10 (3H, с), 2,52 (2H, м), 2,62 (1H, м), 2,72 (1H, дд, J=2,4, 8,3 Гц), 2,94 (1H, дт, J=2,4, 5,7 Гц), 3,55 (1H, дт, J=8,3, 4,4 Гц), 3,82 (1H, м), 5,10 (1H, д, J=9,8 Гц), 5,11 (1H, д, J=10,8 Гц), 5,60 (1H, дд, J=9,8, 15,2 Гц), 5,74 (1H, дд, J=8,3, 15,2 Гц), 5,92 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=10,8 Гц), 6,57 (1H, дд, J=10,8, 15,2 Гц).
9. 13Н-ЯМР-спектр (CD3OD, 125 МГц): δ м.д. (мультиплетность): 10,52 (кв), 10,82 (кв), 11,98 (кв), 16,84 (кв), 21,07 (кв), 24,21 (кв), 28,62 (т), 28,79 (кв), 30,46 (т), 37,53 (т), 40,10 (т), 41,80 (д), 42,58 (д), 45,97 (т), 55,99 (д), 62,53 (д), 70,42 (д), 73,09 (с), 74,11 (с), 75,30 (д), 80,31 (д), 84,19 (д), 123,64 (д), 127,10 (д), 131,76 (д), 133,81 (с), 141,61 (д), 143,22 (д), 171,75 (с), 172,18 (с).
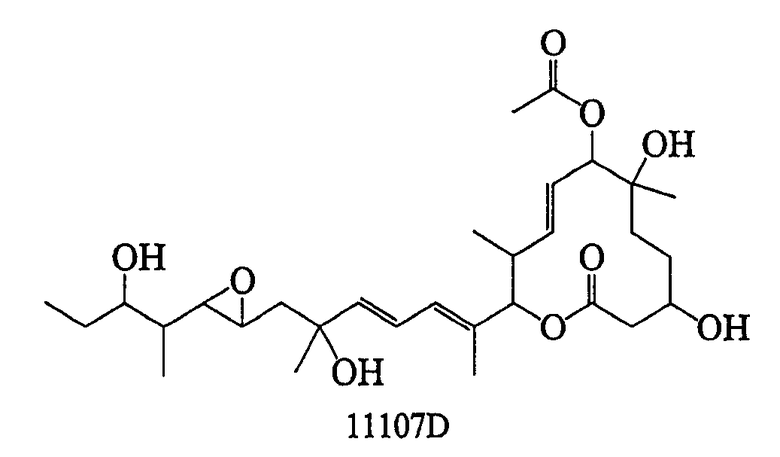
Пример 3. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(пирролидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 3)

Пример 3-1. (8Е,12Е,14Е)-7-Ацетокси-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (формула XV) и (8Е,12Е,14Е)-7-ацетокси-3,16,21-трис(1-этоксиэтокси)-6-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (формула XVI)

К раствору (8Е,12Е,14Е)-7-ацетокси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (50 мг, 0,09 ммоль) в дихлорметане (2,5 мл) добавляли простой этилвиниловый эфир (326 мг, 4,5 ммоль) и п-толуолсульфонат пиридиния (6,8 мг, 27 мкмоль) при комнатной температуре с последующим перемешиванием при той же температуре в течение 19 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=30:70) с получением (8Е,12Е,14Е)-7-ацетокси-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (60 мг, 79%) в виде бесцветного масла (формула XV).
ESI-MC m/z 863 (М+Na)+.
Затем получали (8Е,12Е,14Е)-7-ацетокси-3,16,21-трис(1-этоксиэтокси)-6-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (6 мг, 9%) в виде бесцветного масла (формула XVI) из элюированной фракции смеси этилацетат:гексан=50:50.
ESI-MC m/z 791 (М+Na)+.
Пример 3-2. (8Е,12Е,14Е)-3,6,16,21-Тетракис(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид

К раствору (8Е,12Е,14Е)-7-ацетокси-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (145 мг, 0,17 ммоль) в метаноле (2,5 мл) добавляли карбонат калия (95 мг, 0,69 ммоль) при комнатной температуре с последующим перемешиванием при той же температуре в течение двух часов и 30 минут. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=40:60) с получением указанного в заголовке соединения (128 мг, 93%) в виде бесцветного масла.
ESI-MC m/z 821 (М+Na)+.
Пример 3-3. (8Е,12Е,14Е)-3,6,16,21-Тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-18,19-эпокситрикоза-8,12,14-триен-11-олид

К раствору (8Е,12Е,14Е)-3,6,16,21-тетракис(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (139 мг, 0,17 ммоль) в дихлорметане (2,5 мл) добавляли триэтиламин (88 мг, 0,87 ммоль), N,N-диметиламинопиридин (64 мг, 0,52 ммоль) и 4-нитрофенилхлорформиат (105 мг, 0,52 ммоль) при охлаждении льдом с последующим перемешиванием при комнатной температуре в атмосфере азота в течение одного часа. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=20:80) с получением указанного в заголовке соединения (134 мг, 80%) в виде бесцветного масла.
ESI-MC m/z 986 (М+Na)+.
Пример 3-4. (8Е,12Е,14Е)-3,6,16,21-Тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-(пирролидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид

К (8Е,12Е,14Е)-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-18,19-эпокситрикоза-8,12,14-триен-11-олиду (11,4 мг, 0,12 мкмоль) добавляли раствор 4-(пирролидин-1-ил)пиперидина (2,4 мг, 16 мкмоль) в тетрагидрофуране (0,5 мл) при комнатной температуре. К смеси добавляли триэтиламин (2,3 мг, 24 мкмоль) при комнатной температуре с последующим перемешиванием при той же температуре в течение трех часов. Реакционную смесь упаривали с получением соединения (11 мг) в виде неочищенного продукта (бледно-желтое масло).
Пример 3-5. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(пирролидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 3)
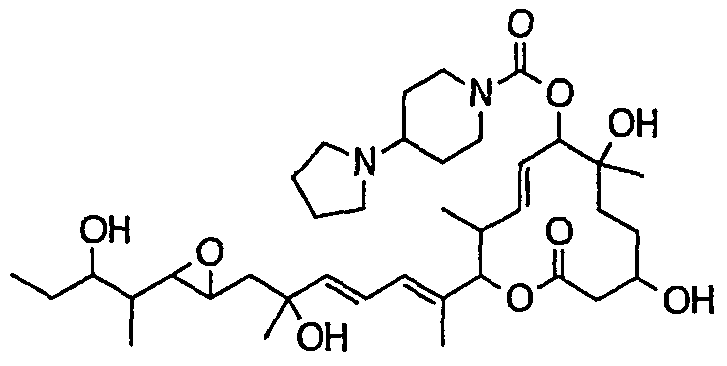
К неочищенному продукту (8Е,12Е,14Е)-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-(пирролидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олиду (11 мг, 11 мкмоль) добавляли раствор п-толуолсульфоната пиридиния (11,4 мг, 45 мкмоль) в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (1 мл) при комнатной температуре. К смеси добавляли молекулярные сита 4Å (10 мг) с последующим перемешиванием при комнатной температуре в течение 18,5 часов. Еще добавляли п-толуолсульфонат пиридиния (11,4 мг, 45 мкмоль) с последующим перемешиванием при комнатной температуре в течение 72 часов. Реакционную смесь упаривали и полученный остаток разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия, фильтровали и упаривали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel Plate, метанол:дихлорметан=1:19) с получением указанного в заголовке соединения (2,88 мг, 35%, две стадии) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,92 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,22-1,68 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,78-2,00 (9H, м), 2,48-2,62 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,68-2,92 (9H, м), 3,46-3,54 (1H, м), 3,72-3,82 (1H, м), 4,24-4,40 (1H, м), 4,92 (1H, д, J=10,8 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 14,8 Гц), 5,72 (1H,дд, J=9,2, 14,8 Гц), 5,86 (1H, д, J=14,8 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-MC m/z 691(M+H)+.
Пример 4. (8Е,12Е,14Е)-7-(N-Этилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 4)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,10 (3H, т, J=7,6 Гц), 1,20 (3H, с), 1,22-1,62 (7H, м), 1,34 (3H, с), 1,65 (1H, дд, J=6,6, 13,7 Гц), 1,77 (3H, с), 1,86 (1H, дд, J=5,7, 13,7 Гц), 2,50-2,53 (2H, м), 2,53-2,60 (1H, м), 2,67 (1H, дд, J=2,4, 7,6 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,12 (2H, кв, J=7,2 Гц), 3,49-3,54 (1H, м), 3,74-3,81 (1H, м), 4,82-4,98 (1H, перекрытый пиком H2O), 5,06 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=9,6, 15,2 Гц), 5,69 (1H, дд, J=9,2, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 604(М+Na)+.
Пример 5. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-(3-морфолин-4-ил)пропил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 5)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,20 (3H, с), 1,26-1,73 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,4, 14,1 Гц), 2,35-2,60 (9H, м), 2,67 (1H, дд, J=2,4, 7,6 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,15 (2H, т, J=7,2 Гц), 3,48-3,54 (1H, м), 3,68 (4H, т, J=4,8 Гц), 3,74-3,82 (1H, м), 4,82-4,98 (1H, перекрытый пиком H2O), 5,06 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=10,0, 15,2 Гц), 5,69 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,4 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 681 (М+H)+.
Пример 6. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диметиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 6)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,22 (3H, с), 1,24-1,68 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,28 (6H, с), 2,45-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,86-2,99 (4H, м), 3,49-3,56 (1H, м), 3,75-3,82 (1H, м), 4,92 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,6 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=14,8 Гц), 6,14 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 639 (М+H)+.
Пример 7. (8Е,12Е,14Е)-(7-N-(3-(N',N'-Диметиламино)пропил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 7)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,24-1,75 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,9, 13,7 Гц), 2,28 (6H, с), 2,37 (2H, т, J=7,6 Гц), 2,48-2,62 (5H, м), 2,67 (1H, дд, J=2,4, 7,6 Гц), 2,86-2,99 (4H, м), 3,48-3,58 (1H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=10, 4 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 653 (М+H)+.
Пример 8. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диметиламино)этил)карбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 8)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,22-1,68 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1Н, дд, J=5,7, 14,3 Гц), 2,29 (6H, с), 2,44-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1Н, дт, J=2,0, 6,0 Гц), 3,49-3,56 (1Н, м), 3,74-3,82 (1Н, м), 4,82-4,98 (1H, перекрытый пиком H2О), 5,06 (1H, д, J=10,8 Гц), 5,55 (1Н, дд, J=10,4, 15,2 Гц), 5,69 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1Н, д, J=15,2 Гц), 6,13 (1Н, д, J=10,8 Гц), 6,52 (1Н, дд, J=11,2, 15,2 Гц); ESI-МС m/z 625 (М+H)+.
Пример 9. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 9)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,887 (3H, д, J=6,6 Гц), 0,894 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,23-1,27 (4H, м), 1,33 (3H, с), 1,33-1,68 (7H, м), 1,77 (3H, д, J=0,7 Гц), 1,82-1,91 (3H, м), 2,35 (3H, с), 2,50-2,66 (7H, м), 2,66 (1H, дд, J=2,2, 7,7 Гц), 2,89 (1Н, дт, J=2,2, 5,5 Гц), 3,49-3,56 (3H, м), 3,58-3,67 (2H, м), 3,75-3,81 (1Н, м), 4,94 (1H, д, J=9,5 Гц), 5,06 (1H, д, J=10,6 Гц), 5,57 (1Н, дд, J=9,9, 15,0 Гц), 5,72 (1H, дд, J=9,5, 15,0 Гц), 5,86 (1Н, д, J=15,0 Гц), 6,13 (1Н, д, J=9,9 Гц), 6,52 (1Н, дд, J=11,0, 15,0 Гц); ESI-МС m/z 651 (М+H)+.
Пример 10. (8Е,12Е,14Е)-7-(N-(3-(N',N'-Диметиламино)пропил)карбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 10)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,20 (3H, с), 1,20-1,26 (1Н, м), 1,33 (3H, с), 1,33-1,71 (9H, м), 1,77 (3H, с), 1,86 (1Н, дд, J=5,5, 14,3 Гц), 2,25 (6H, с), 2,36 (2H, т, J=7,3 Гц), 2,49-2,61 (3H, м), 2,66 (1Н, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,13 (2H, т, J=6,6 Гц), 3,52 (1Н, дт, J=4,4, 8,1 Гц), 3,75-3,81 (1Н, м), 4,89 (1Н, д, J=9,5 Гц), 5,05 (1H, д, J=10,6 Гц), 5,55 (1H, дд, J=9,5, 15,4 Гц), 5,69 (1Н, дд, J=9,5, 15,4 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1Н, д, J=10,6 Гц), 6,52 (1Н, дд, J=10,6, 15,4 Гц); ESI-МС m/z 639 (М+H)+.
Пример 11. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-((пиридин-4-ил)метил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 11)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=5,1 Гц), 0,89 (3H, д, J=7,0 Гц), 0,94 (3H, т, J=7,3 Гц), 1,23 (3H, с), 1,23-1,27 (1Н, м), 1,33 (3H, с), 1,33-1,62 (6H, м), 1,65 (1H, дд, J=6,2, 14,3 Гц), 1,77 (3H, с), 1,86 (1Н, дд, J=6,2, 14,3 Гц), 2,48-2,65 (3H, м), 2,66 (1Н, дд, J=2,2, 8,1 Гц), 2,89 (1Н, дт, J=2,2, 6,2 Гц), 3,52 (1Н, дт, J=4,4, 8,1 Гц), 3,74-3,80 (1Н, м), 4,35 (2H, с), 4,93 (1Н, д, J=9,5 Гц), 5,06 (1Н, д, J=10,6 Гц), 5,56 (1H, дд, J=9,5, 15,4 Гц), 5,73 (1Н, дд, J=9,5, 15,4 Гц), 5,86 (1H, д, J=15,0 Гц), 6,13 (1Н, д, J=11,0 Гц), 6,52 (1Н, д, J=11,0, 15,0 Гц), 7,33 (2H, д, J=5,9 Гц), 8,45 (2H, дд, J=1,5, 4,4 Гц); ESI-МС m/z 645 (М+H)+.
Пример 12. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 12)

Первая стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-3,6,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 12-1)

Раствор соединения 46-4 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,6,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (628 мг, 0,575 ммоль), полученного на четвертой стадии примера 46, в тетрагидрофуране (7 мл) охлаждали до 5°С и к нему добавляли по каплям раствор 1-метилпиперазина (118 мг, 1,152 ммоль) в тетрагидрофуране (1,5 мл) и раствор триэтиламина (236 мг, 2,305 ммоль) в тетрагидрофуране (1,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат:гексан:метанол, 1:1:0 4:1:0 9:1:0 1:0:0 39:0:1 19:0:1) с получением указанного в заголовке соединения (514 мг, 85%) в виде бесцветного масла.
Вторая стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 12-2)

Раствор соединения 12-1 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-3,6,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (514 мг, 0,489 ммоль), полученного на первой стадии, в тетрагидрофуране (10 мл) охлаждали до 5°С и к нему добавляли по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 1,62 мл, 1,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение двух часов. Еще добавляли по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 0,3 мл, 0,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение часа. Реакционную смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH silica gel, 200-350 меш; этилацетат:гексан:метанол, 1:1:0 4:1:0 1:0:0 49:0:1 19:0:1) с получением указанного в заголовке соединения (364 мг, 99%) в виде бесцветного масла.
ESI-MC m/z 709 (М+Na)+.
Третья стадия
(8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 12)
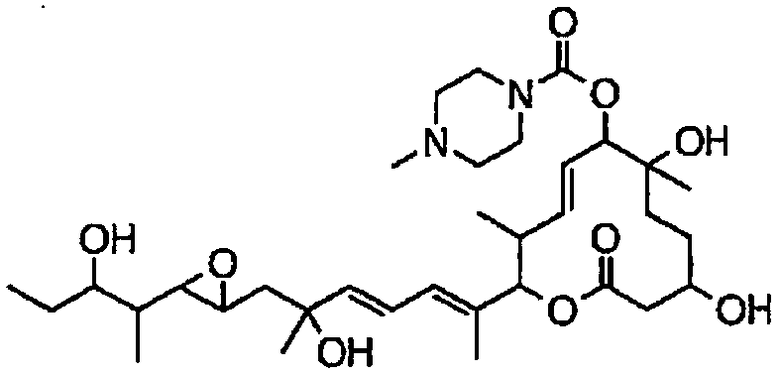
К раствору соединения 12-2 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида (364 мг, 0,489 ммоль), полученного на второй стадии, в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (10 мл) добавляли п-толуолсульфонат пиридиния (184 мг, 0,734 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 19 часов. Затем к реакционной смеси добавляли по каплям триэтиламин (75 мг, 0,374 ммоль) и смесь упаривали. Полученный остаток растворяли в этилацетате и промывали насыщенным водным раствором бикарбоната натрия. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH silica gel, 200-350 меш; этилацетат:гексан:метанол, 1:1:0 > 2:1:0 > 4:1:0 > 1:0:0 > 39:0:1 > 29:0:1 > 19:0:1). Неочищенную фракцию упаривали и остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel Plate, метанол:дихлорметан=1:29) с получением указанного в заголовке соединения (286 мг, 92%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,28 (4H, м), 1,32-1,68 (10H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1Н, дд, J=5,6, 14,4 Гц), 2,30 (3H, с), 2,36-2,44 (4H, м), 2,50-2,64 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1Н, дт, J=2,4, 6,0 Гц), 3,38-3,70 (5H, м), 3,75-3,81 (1Н, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1Н, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1Н, д, J=15,2 Гц), 6,13 (1Н, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 637 (М+H)+.
Пример 13. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 13)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,20-1,30 (4H, м), 1,32-1,68 (10H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1Н, дд, J=5,6, 14,4 Гц), 2,50-2,64 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,76 (4H, т, J=5,2 Гц), 2,89 (1H, дт, J=2,4, 5,6 Гц), 3,34-3,68 (5H, м), 3,75-3,81 (1Н, м), 4,94 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1Н, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1Н, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1Н, дд, J=11,2, 15,2 Гц); ESI-МС m/z 623 (М+H)+.
Пример 14. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(пиридин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 14)
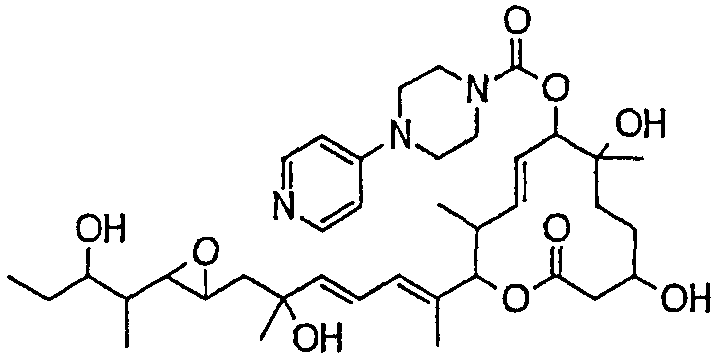
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,20-1,30 (4H, м), 1,32-1,69 (10H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,6, 14,4 Гц), 2,50-2,64 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1Н, дт, J=2,4, 6,0 Гц), 3,38-3,46 (4H, м), 3,49-3,84 (6H, м), 4,97 (1H, д, J=10,0 Гц), 5,06 (1Н, д, J=10,8 Гц), 5,59 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1Н, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1Н, д, J=10,8 Гц), 6,53 (1Н, дд, J=11,2, 15,2 Гц), 6,86 (2H, д, J=6,8 Гц), 8,13 (2H, д, J=6,8 Гц); ESI-МС m/z 700 (М+H)+.
Пример 15. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-(метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 15)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (12H, м), 1,72-1,90 (6H, м), 2,06-2,22 (2H, м), 2,28 (3H, с), 2,50-2,64 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,7 6-2,98 (6H, м), 3,52 (1Н, дт, J=4,4, 8,4 Гц), 3,75-3,82 (1Н, м), 3,85-4,14 (1Н, м), 4,95 (1Н, д, J=10,0 Гц), 5,06 (1Н, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1Н, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1Н, д, J=10,8 Гц), 6,53 (1Н, дд, J=11,2, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 16. (8Е,12Е,14Е)-7-((4-Бутилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 16)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,69 (18H, м), 1,77 (3H, д, J=1,2 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,34-2,64 (9H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1Н, дт, J=2,4, 6,4 Гц), 3,38-3,72 (5H, м), 3,75-3,82 (1Н, м), 4,93 (1Н, д, J=9,6 Гц), 5,06 (1Н, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1Н, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1Н, д, J=10,8 Гц), 6,53 (1Н, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 17. (8Е,12Е,14Е)-7-((4-Бензилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 17)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,85-0,92 (6H, м), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (10H, м), 1,78 (3H, с), 1,79-1,90 (3H, м), 2,50-2,72 (8H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,4 2-3,68 (7H, м), 3,75-3,82 (1H, м), 4,91-4,97 (1H, м), 5,06 (1H, д, J=10,8 Гц), 5,53-5,62 (1H, м), 5,67-5,77 (1H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц), 7,21-7,35 (5H, м); ESI-МС m/z 727 (М+H)+.
Пример 18. (8Е,12Е,14Е)-7-((4-(3-Хлорпропил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 18)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (10H, м), 1,77 (3H, д, J=0,8 Гц), 1,80-1,96 (5H, м), 2,49-2,74 (10H, м), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,41-3,69 (7H, м), 3,75-3,81 (1H, м), 4,92-4,97 (1H, м), 5,07 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 713 (М)+.
Пример 19. (8Е,12Е,14Е)-7-((4-(N,N-Диметиламино)пиперидин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 19)
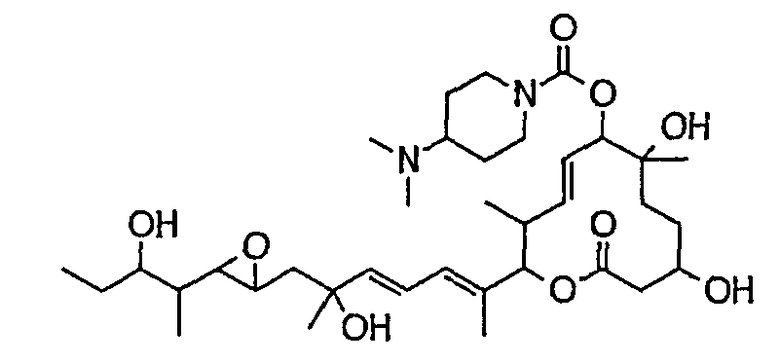
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,68 (16H, м), 1,77 (3H, д, J=0,8 Гц), 1,83-1,93 (3H, м), 2,28 (6H, с), 2,38 (1H, тт, J=3,6, 11,6 Гц), 2,49-2,62 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,71-2,88 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,75-3,82 (1H, м), 4,08-4,45 (2H, м), 4,92 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 20. (8Е,12Е,14Е)-7-((1,4-Диазабицикло[4,3,0]нонан-4-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 20)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (10H, м), 1,7 3-2,02 (6H, м), 2,09-2,22 (2H, м), 2,49-2,71 (6H, м), 2,87-3,12 (6H, м), 3,52 (1H, дт, J=4,4, 8,0 Гц), 3,75-3,82 (1H, м), 4,01-4,51 (2H, м), 4,88-4,99 (1H, м), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 14,8 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 663 (М+H)+.
Пример 21. (8Е,12Е,14Е)-7-((4-Этилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 21)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,11 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,22-1,64 (7H, м), 1-34 (3H, с), 1,65 (1H, дд, J=6,2, 14,2 Гц), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,39-2,49 (6H, м), 2,50-2,53 (2H, м), 2,53-2,62 (1H, м), 2,66 (1H, дд, J=2,4, 7,6 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,34-3,72 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 651 (М+H)+.
Пример 22. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(пиперидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 22)
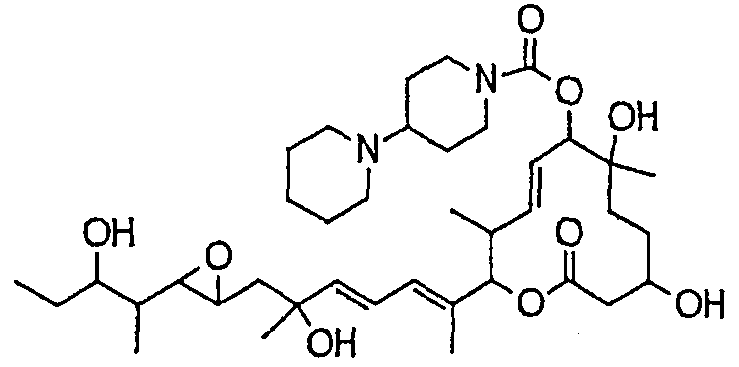
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,20-1,69 (16H, м), 1,34 (3H, с), 1,77 (3H, с), 1,83-1,93 (3H, м), 2,45-2,65 (8H, м), 2,66 (1H, дд, J=2,4, 7,6 Гц), 2,70-2,85 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,51 (1H, тд, J=4,4, 8,0 Гц), 3,74-3,82 (1H, м), 4,12-4,25 (1H, м), 4,30-4,45 (1H, м), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 23. (8Е,12Е,14Е)-7-((Гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 23)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,4 Гц), 1,23 (3H, с), 1,24-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,78-1,90 (3H, м), 2,48-2,62 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,72-2,93 (5H, м), 3,43-3,67 (5H, м), 3,74-3,82 (1Н, м), 4,94 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,4, 15,2 Гц), 5,72 (1H, дд, J=9,8, 15,4 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 637 (М+H)+.
Пример 24. (8Е,12Е,14Е)-7-((4-Бензилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 24)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,20 (3H, с), 1,22-1,65 (7H, м), 1,34 (3H, с), 1,65 (1H, дд, J=6,2, 14,2 Гц), 1,77 (3H, с), 1,87 (1H, дд, J=5,4, 14,2 Гц), 2,39-2,49 (4H, м), 2,50-2,64 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 5,6 Гц), 3,36-3,72 (7H, м), 3,74-3,83 (1H, м), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц), 7,22-7,37 (5H, м); ESI-МС m/z 713 (М+H)+.
Пример 25. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 25)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,86-0,97 (12H, м), 1,21 (3H, с), 1,21-1,68 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,87 (1H, дд, J=5,2, 14,0 Гц), 2,30-2,36 (2H, м), 2,38-2,47 (4H, м), 2,49-2, 63 (3H, м), 2,66 (1H, дд, J=2,4, 7,6 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,35-3,72 (5H, м), 3,74-3,83 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=1,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,0 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 26. (8Е,12Е,14Е)-7-((4-Циклогексилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 26)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,10-1,69 (15H, м), 1,21 (3H, с), 1,34 (3H, с), 1,78 (3H, с), 1,78-1,93 (4H, м), 2,26-2,35 (1H, м), 2,47-2,64 (7H, м), 2,67 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,36-3,70 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 27. (8Е,12Е,14Е)-7-((4-(Циклопропилметил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 27)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,12-0,17 (2H, м), 0,52-0,58 (2H, м), 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,90-0,97 (4H, м), 1,21 (3H, с), 1,21-1,69 (8H, м), 1,34 (3H, с), 1,78 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,29 (2H, д, J=6,8 Гц), 2,47-2,64 (7H, м), 2,67 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,40-3,72 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 28. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-морфолин-4-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 28)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,31-1,68 (12H, м), 1,77 (3H, д, J=1,2 Гц), 1,83-1,95 (3H, м), 2,34-2,43 (1H, м), 2,50-2,64 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,73-2,89 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,52 (1H, тд, J=4,4, 8,0 Гц), 3,66-3,72 (4H, м), 3,75-3,81 (1H, м), 4,07-4,44 (2H, м), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Пример 29. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(3,3,3-трифторпропил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 29)
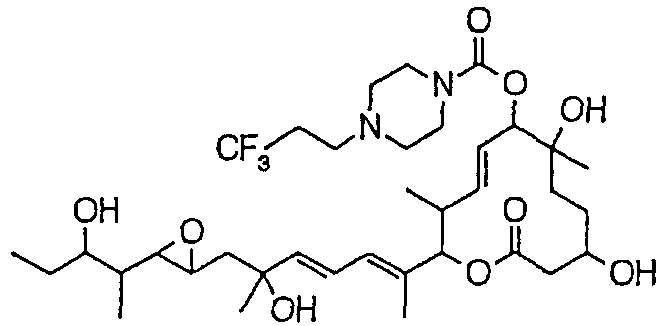
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,31-1,69 (10H, м), 1,77 (3H, д, J=1,2 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,35-2,66 (11H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,38-3,71 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 719 (М+H)+, 741 (М+Na)+.
Пример 30. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(4,4,4-трифторбутил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 30)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (10H, м), 1,70-1,81 (5H, м), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,14-2,28 (2H, м), 2,38-2,49 (6H, м), 2,50-2,64 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,39-3,72 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8,15,2 Гц); ESI-МС m/z 733 (М+H)+, 755 (М+Na)+.
Пример 31. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 31)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87-0,92 (9H, м), 0,94 (3H, т, J=7,6 Гц), 1,20-1,30 (4H, м), 1,32-1,69 (12H, м), 1,77 (3H, д, J=0,8 Гц), 1,82-1,91 (3H, м), 2,41-2,49 (2H, м), 2,50-2,77 (8H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,42-3,67 (5H, м), 3,75-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 32. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-((4-(2-метоксиэтил)пиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 32)
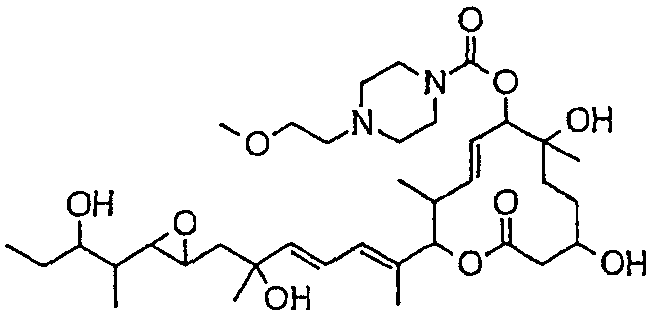
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,31-1,69 (10H, м), 1,77 (3H, д, J=1,2 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,44-2,64 (9H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,33 (3H, с), 3,39-3,71 (7H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 681 (М+H)+.
Пример 33. (8Е,12Е,14Е)-7-((4-Циклобутилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 33)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,32-1,69 (10H, м), 1,70-1,81 (5H, м), 1,83-1,95 (3H, м), 2,02-2,11 (2H, м), 2,27-2,37 (4H, м), 2,49-2,64 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,72-2,81 (1H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,37-3,71 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1Н, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц),5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 34. (8Е,12Е,14Е)-7-((4-(1-Этилпропил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 34)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87-0,97 (15H, м), 1,19-1,69 (18H, м), 1,77 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,15-2,23 (1H, м), 2,45-2,64 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,34-3,65 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 35. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(тетрагидропиран-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 35)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,21-1,69 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,77-1,90 (3H, м), 2,42-2,62 (8H, м), 2,66 (1H, дд, J=2,0, 7,6 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,34-3,71 (7H, м), 3,74-3,82 (1H, м), 3,94-4,02 (2H, м), 4,93 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,4 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Пример 36. (8Е,12Е,14Е)-7-((4-(Циклопропилметил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 36)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,08-0,14 (2H, м), 0,48-0,54 (2H, м), 0,83 (3H, д, J=6,8 Гц), 0,88 (3H, д, J=7,2 Гц), 0,89-0,94 (4H, м), 1,20-1,67 (8H, м), 1,21 (3H, с), 1,31 (3H, с), 1,75 (3H, с), 1,80-1,90 (3H, м), 2,37 (2H, д, J=6,4), 2,47-2,61 (3H, м), 2,62-2,82 (5H, м), 2,87 (1H, дт, J=2,4, 6,0 Гц), 3,43-3,69 (5H, м), 3,73-3,80 (1H, м), 4,92 (1H, д, J=9,6 Гц), 5,04 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=10,0, 15,2 Гц), 5,70 (1H, дд, J=9,6, 15,2 Гц), 5,84 (1H, д, J=15,2 Гц), 6,11 (1H, д, J=11,2 Гц), 6,50 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 37. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(2,2,2-трифторэтил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 37)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,20-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,4 Гц), 2,50-2,69 (8H, м), 2,86-2,92 (1H, м), 3,38-3,72 (2H, м), 3,04-3,14 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,05 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 727 (М+Na)+.
Пример 38. (8Е,12Е,14Е)-7-((4-Циклопентилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 38)
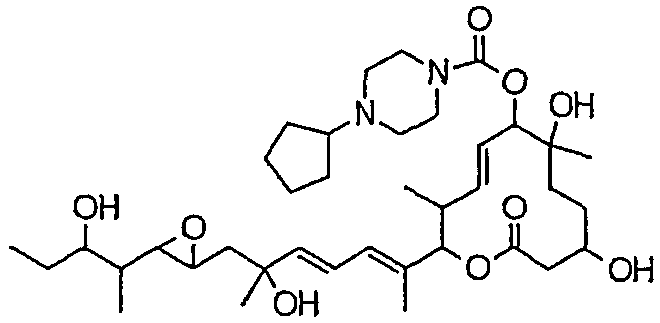
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,21-1,76 (14H, м), 1,34 (3H, с), 1,77 (3H, с), 1,83-1,95 (3H, м), 2,46-2,62 (8H, м), 2,66 (1H, дд, J=2,4, 7,6 Гц), 2,88 (1H, дт, J=2,4, 6,4 Гц), 3,34-3,72 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,05 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 39. (8Е,12Е,14Е)-7-((4-Изобутилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 39)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87-0,97 (15H, м), 1,21 (3H, с), 1,21-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,78-1,90 (2H, м), 2,11 (2H, д, J=7,2 Гц), 2,32-2,41 (4H, м), 2,50-2,63 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0,6,0 Гц), 3,38-3,70 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 40. (8Е,12Е,14Е)-7-(((1S,4S)-5-Бензил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 40)
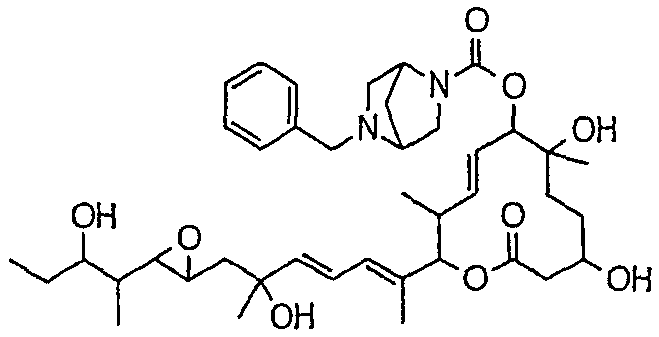
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,84 (3H, д, J=7,0 Гц), 0,85 (3H, д, J=7,0 Гц), 0,89 (3H, т, J=7,3 Гц), 1,14-1,27 (4H, м), 1,27-1,65 (7H, м), 1,30 (3H, с), 1,65-1,92 (6H, м), 2,44-2,66 (5H, м), 2,79-2,88 (2H, м), 3,16 (0,6H, дд, J=1,8, 10,3 Гц), 3,25-3,31 (0,4H, м), 3,45-3,78 (6H, м), 4,29 (0,4H, шир.с), 4,52 (0,6H, шир.с), 4,8 9 (1H, д, J=9,9 Гц), 5,02 (1H, д, J=10,6 Гц), 5,54 (1H, дд, J=9,9, 15,0 Гц), 5,68 (0,6H, дд, J=9,9, 15,0 Гц), 5,73 (0,4H, дд, J=9,9, 15,0 Гц), 5,82 (1H, д, J=15,4 Гц), 6,09 (1H, д, J=11,0 Гц), 6,48 (1H, д, J=11,0, 15,4 Гц), 7,16-7,32 (5H, м); ESI-МС m/z 725 (М+H)+.
Пример 41. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диметиламино)этил)-N-этилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 41)
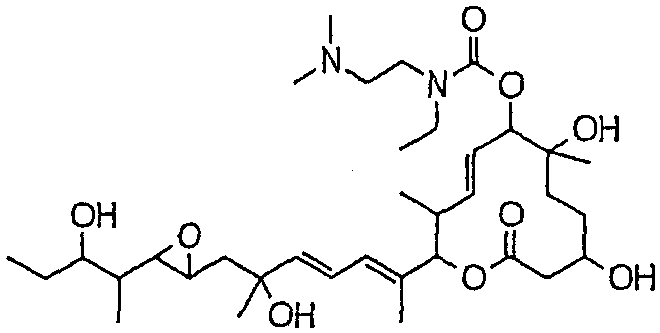
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,08-1,14 (3H, м), 1,20-1,29 (1H, м), 1,22 (3H, с), 1,31-1,68 (7H, м), 1,33 (3H, с), 1,77 (3H, д, J=0,7 Гц), 1,86 (1H, дд, J=5,5, 14,3 Гц), 2,28 (6H, с), 2,43-2,62 (5H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,23-3,52 (4H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,74-3,82 (1H, м), 4,92 (1H, д, J=9,9 Гц), 5,06 (1H, д, J=10,6 Гц), 5,56 (1H, дд, J=9,9, 15,0 Гц), 5,73 (1H, дд, J=9,9, 15,0 Гц), 5,86 (1H, д, J=15,0 Гц), 6,13 (1H, дд, J=1,1, 11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 653 (М+H)+.
Пример 42. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диэтиламино)этил)-N-этилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 42)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,06 (6H, т, J=7,0 Гц), 1,06-1,15 (3H, м), 1,20-1,29 (1H, м), 1,22 (3H, с), 1,31-1,68 (7H, м), 1,33 (3H, с), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5, 5,14, 3 Гц), 2,48-2,66 (5H, м), 2,59 (4H, кв, J=7,0 Гц), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,21-3,60 (4H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,74-3,81 (1H, м), 4,93 (1H, д, J=9,9 Гц), 5,06 (1H, д, J=10,6 Гц), 5,57 (1H, дд, J=9,9, 15,0 Гц), 5,73 (1H, дд, J=9,9, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 681 (М+H)+.
Пример 43. (8Е,12Е,14Е)-7-Ацетокси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 43)

(8Е,12Е,14Е)-7-Ацетокси-3,16,21-трис(1-этоксиэтокси)-6-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (34 мг, 44 мкмоль), полученный в примере 3, и 1,8-бис(N,N-диметиламино)нафталин (57 мг, 266 мкмоль) растворяли в толуоле (2 мл). К полученному раствору добавляли метилтрифторметансульфонат (22 мг, 133 мкмоль) и реакционную смесь перемешивали при 65°С в течение 11 часов. После удаления осадка фильтрованием реакционную смесь разбавляли этилацетатом и добавляли водный раствор хлорида аммония с последующим интенсивным перемешиванием в течение 5 минут. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, нейтральный, 40-100 мкм; гексан:этилацетат=1:1) с получением (8Е,12Е,14Е)-7-ацетокси-3,16,21-трис(1-этоксиэтокси)-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (14 мг) в виде бесцветного масла.
Полученное соединение подвергали процедуре удаления защитной этоксиэтильной группы способом, подобным описанному в примере 3, с получением указанного в заголовке соединения (5,7 мг, 22,9%, две стадии) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,5 Гц), 0,91 (3H, д, J=7,5 Гц), 0,94 (3H, т, J=7,5 Гц), 1,21 (3H, с), 1,22-1,32 (1H, м), 1,34 (3H, с), 1,40-1,70 (7H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,5, 14,0 Гц), 2,06 (3H, с), 2,46-2,63 (3H, м), 2,67 (1H, д, J=8,5 Гц), 2,99 (1H, шир.с), 3,33 (3H, с), 3,50-3,56 (1H, м), 3,78-3,86 (1H, м), 5,06 (1H, д, J=10,5 Гц), 5,12 (1H, д, J=10,0 Гц), 5,56 (1H, дд, J=10,0, 15,5 Гц), 5,72 (1H, дд, J=10,5, 15,5 Гц), 5,87 (1H, д, J=15,5 Гц), 6,14 (1H, д, J=10,5 Гц), 6,53 (1H, дд, J=10,5, 15,5 Гц); ESI-МС m/z 589 (М+Na)+.
Пример 44. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44)
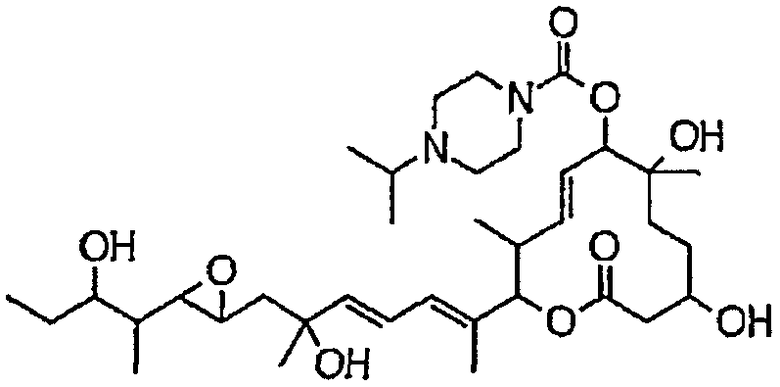
Первая стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44-1)

К раствору соединения 46-4 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,27 г, 1,16 ммоль), полученного на четвертой стадии примера 46, в тетрагидрофуране (25 мл) добавляли триэтиламин (470 мг, 4,64 ммоль) и изопропилпиперазин (298 мг, 2,32 ммоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; гексан:этилацетат=1:1 этилацетат этилацетат:метанол=97:3) с получением указанного в заголовке соединения (1,12 г, 89%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,58-0,70 (27H, м), 0,80-1,72 (53H, м), 1,76 (3H, с), 1,88-1,98 (1H, м), 2,33-2,64 (8H, м), 2,64-2,76 (1H, м), 2,80-2,90 (1H, м), 3,38-3,66 (6H, м), 3,68-3,7 8 (1H, м), 3,85-3,98 (1H, м), 4,88-4,99 (2H, м), 5,05 (0,4H, кв, J=5,2 Гц), 5,13 (0,6H, кв, J=5,2 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72-5,80 (1H, м), 5,82 (1H, д, J=14,8 Гц), 6,13 (1H, д, J=10,8 Гц), 6,50 (1H, дд, J=10,8, 15,2 Гц).
Вторая стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44-2)

К раствору соединения 44-1 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,12 г, 1,03 ммоль), полученного на первой стадии, в тетрагидрофуране (20 мл) добавляли тетрабутиламмонийфторид (4,1 мл, 1,0 М тетрагидрофурановый раствор) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 4 часов. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel, 200-350 меш; этилацетат > этилацетат:метанол=95:5) с получением указанного в заголовке соединения (0,76 г, 99%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0, 90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,0 6 (6H, д, J=6,4 Гц), 1,12-1,70 (20H, м), 1,78 (3H, с), 1,86 (1H, дд, J=2,4, 7,6 Гц), 2,42-2,62 (7H, м), 2,64-2,76 (2H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,38-3,66 (7H, м), 3,75-3,84 (1H, м), 4,98 (1H, д, J=9,6 Гц), 5,02-5,16 (2H, м), 5,56 (1H, дд, J=10,0, 15,6 Гц), 5,72-5,80 (1H, м), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 737 (М+H)+.
Третья стадия
(8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 44)
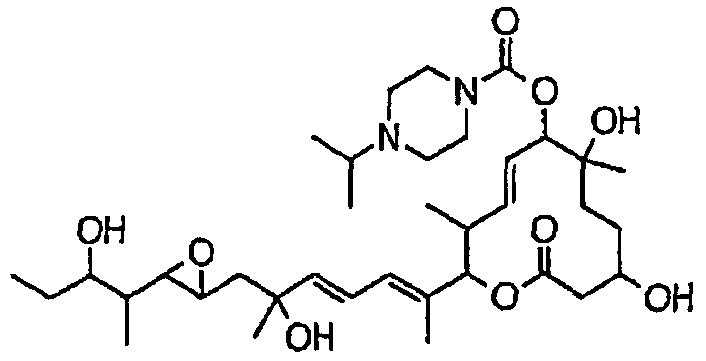
К раствору соединения 44-2 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-3,16,21-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (0,76 г, 1,03 ммоль), полученного на второй стадии, в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (20 мл) добавляли п-толуолсульфонат пиридиния (0,39 г, 1,55 ммоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 16 часов. К реакционной смеси добавляли при комнатной температуре триэтиламин (0,25 г, 3,10 ммоль) и органический растворитель выпаривали. Полученный остаток разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel, 200-350 меш; этилацетат > этилацетат:метанол=95:5) с получением указанного в заголовке соединения (0,76 г, 85%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,6 Гц), 0,90 (3H, д, J=6,9 Гц), 0,94 (3H, т, J=7,4 Гц), 1,07 (6H, д, J=6,4 Гц), 1,14-1,67 (14H, м), 1,77 (3H, шир.с), 1,86 (1H, дд, J=5,4, 14,2 Гц), 2,46-2,63 (7H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,64-2,79 (1H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,36-3,67 (5H, м), 3,72-3,81 (1H, м), 4,93 (1H, д, J=9,7 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,7, 15,1 Гц),5,71 (1H, дд, J=9,7, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 45. (8Е,12Е,14Е)-7-((4-Циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 45)

Первая стадия
(8Е,12Е,14Е)-7-((4-Циклогептилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 45-1)

К раствору соединения 46-4 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,368 г, 1,254 ммоль), полученного на четвертой стадии примера 46, в тетрагидрофуране (20 мл) последовательно добавляли по каплям 1-циклогептилпиперазин (462 мг, 2,51 ммоль) и триэтиламин (513 мг, 5,02 ммоль). Затем к полученной смеси добавляли тетрагидрофуран (8 мл) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; смесь этилацетат-гексан, 1:9 1:4 1:3) с получением указанного в заголовке соединения (1,455 г, 99%) в виде бесцветного масла.
Вторая стадия
(8Е,12Е,14Е)-7-((4-Циклогептилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 45-2)
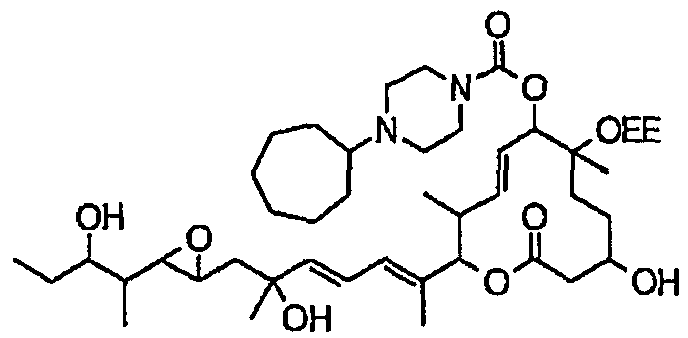
Раствор соединения 45-1 (8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,454 г, 1,254 ммоль), полученного на первой стадии, в тетрагидрофуране (30 мл) охлаждали до 5°С, добавляли к нему по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 4,5 мл, 4,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Еще добавляли по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 0,52 мл, 0,52 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel, 200-350 меш; смесь этилацетат-гексан, 1:1 4:1 9:1 1:0) с получением указанного в заголовке соединения (965 мг, 97%) в виде бесцветного масла.
ESI-MC m/z 791 (М+Н)+.
Третья стадия
(8Е,12Е,14Е)-7-((4-Циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 45)

К раствору соединения 45-2 (8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (964 мг, 1,218 ммоль), полученного на второй стадии, в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (22 мл) добавляли п-толуолсульфонат пиридиния (459 мг, 1,827 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли этилацетатом и промывали водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel, 200-350 меш; смесь этилацетат-гексан-метанол, 2:1:0 4:1:0 99:0:1 98:0:1 97:0:1) и неочищенную фракцию концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; смесь метанол-дихлорметан, 1:29 1:19 1:17 1:14 1:9) с получением указанного в заголовке соединения (866 мг, 99%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,10-1,77 (24H, м), 1,77 (3H, шир.с), 1,79-1,90 (3H, м), 2,42-2,74 (9H, м), 2,85-2,92 (1H, м), 3,36-3,70 (5H, м), 3,72-3,84 (1H, м), 4,92 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 719 (М+H)+.
Пример 46. (8Е,12Е,14Е)-7-((4-Аллилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46)

Первая стадия
(8Е,12Е,14Е)-7-Ацетокси-6-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46-1)

К раствору (8Е,12Е,14Е)-7-ацетокси-6,3,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (100 мг, 0,18 ммоль) в дихлорметане (6 мл) добавляли N,N-диметиламинопиридин (221 мг, 1,8 ммоль) и хлортриэтилсилан (272 мг, 1,8 ммоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 18 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=20:80) с получением указанного в заголовке соединения (159 мг, 98%) в виде бесцветного масла.
ESI-MC m/z 918 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-7-Ацетокси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46-2)

К раствору соединения 46-1 (8Е,12Е,14Е)-7-ацетокси-6-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,6 г, 1,8 ммоль), полученного на первой стадии, в дихлорметане (35 мл) добавляли простой этилвиниловый эфир (2,6 г, 36 ммоль) и п-толуолсульфонат пиридиния (22 мг, 89 мкмоль) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение 19 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (1,6 г, 93%) в виде бесцветного масла.
ESI-MC m/z 990 (М+Na)+.
Третья стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46-3)

К соединению 46-2 (8Е,12Е,14Е)-7-ацетокси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олиду (1,6 г, 1,7 ммоль), полученному на второй стадии, добавляли гуанидин/нитрат гуанидина (41 мл, 0,2 М раствор в смеси дихлорметан:метанол=10:90) при комнатной температуре с последующим перемешиванием при той же температуре в течение трех часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=20:80) с получением указанного в заголовке соединения (1,3 г, 84%) в виде бесцветного масла.
ESI-MC m/z 948 (М+Na)+.
Четвертая стадия
(8Е,12Е,14Е)-6-(1-Этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46-4)
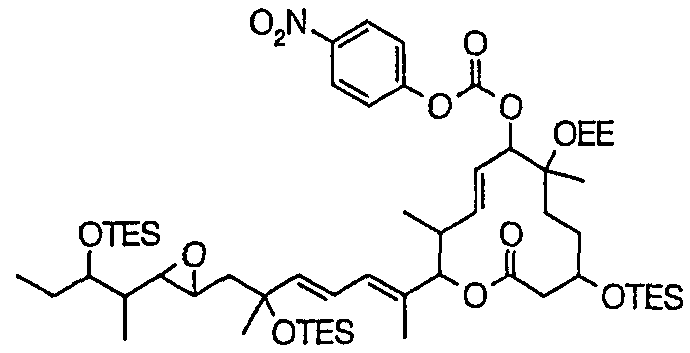
К раствору соединения 46-3 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (1,3 г, 1,4 ммоль), полученного на третьей стадии, в дихлорметане (30 мл) добавляли триэтиламин (826 мг, 8,2 ммоль), N,N-диметиламинопиридин (831 мг, 6,8 ммоль) и 4-нитрофенилхлорформиат (823 мг, 4,1 ммоль) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение 1,5 часов. Реакционную смесь разбавляли дихлорметаном и промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (1,4 г, 97%) в виде бесцветного масла.
ESI-MC m/z 1114 (М+Na)+.
Пятая стадия
(8Е,12Е,14Е)-7-((Аллилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46-5)

К раствору соединения 46-4 (8Е,12Е,14Е)-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (37 мг, 34 мкмоль), полученного на четвертой стадии, в тетрагидрофуране (2 мл) добавляли триэтиламин (14 мг, 0,14 ммоль) и аллилпиперазин (8,5 мг, 68 мкмоль) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=30:70) с получением указанного в заголовке соединения (28 мг, 77%) в виде бесцветного масла.
ESI-MC m/z 1078 (М+Н)+.
Шестая стадия
(8Е,12Е,14Е)-7-((4-Аллилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 46)

К раствору соединения 46-5 (8Е,12Е,14Е)-7-((аллилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (26 мг, 24 мкмоль), полученного на пятой стадии, в тетрагидрофуране (2,5 мл) добавляли тетрабутиламмонийфторид (79 мкл, 1 М тетрагидрофурановый раствор) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение трех часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel Plate; метанол:дихлорметан=5:95) с получением указанного в заголовке соединения (13 мг, 72%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,85-0,90 ( 6H, м), 0,94 (3H, т, J=7,6 Гц), 1,12-1,68 (20H, м), 1,78 (3H, с), 1,86 (1H, дд, J=2,4, 7,6 Гц), 2,38-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,03 (2H, д, J=6,4 Гц), 3,44-3,62 (7H, м), 3,76-3,84 (1H, м), 4,94-5,14 (3H, м), 5,16-5,26 (2H, м), 5,56 (1H, дд, J=10,0, 15,6 Гц), 5,70-5,82 (3H, м), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 735 (М+H)+.
Пример 47. (8Е,12Е,14Е)-7-((4-Аллилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 47)
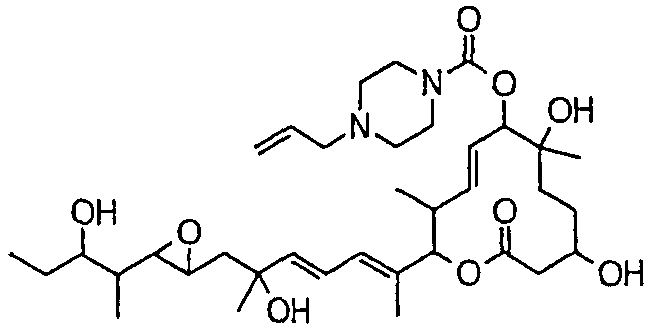
К соединению 46 (8Е,12Е,14Е)-7-((аллилпиперазин-1-ил)карбонил)окси-6-(1-этоксиэтокси)-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (8,7 мг, 12 мкмоль), полученного в примере 46, добавляли раствор п-толуолсульфоната пиридиния (3,3 мг, 13 мкмоль) в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (1 мл) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 17 часов. Реакционную смесь концентрировали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel Plate; метанол:дихлорметан=5:95) с получением указанного в заголовке соединения (5,5 мг, 70%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,22-1,68 (8H, м), 1,78 (3H, с), 1,86 (1H, дд, J=2,4, 7,6 Гц), 2,38-2,46 (4H, м), 2,48-2,60 (3H, м), 2,67 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,0, 5,6 Гц), 3,04 (2H, д, J=6,8 Гц), 3,42-3,64 (5H, м), 3,74-3,82 (1H, м), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,16-5,2 6 (2H, м), 5,57 (1H, дд, J=10,0, 15,6 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,82-5,92 (2H, м), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 663 (М+H)+.
Пример 48. (8Е,12Е,14Е)-7-((4-(3,7-Диметил-2,6-октадиен-1-ил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 48)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,24-1,68 (8H, м), 1,60 (3H, с), 1,66 (6H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,04-2,16 (4H, м), 2,40-2,46 (4H, м), 2,48-2,62 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 5,2 Гц), 3,02 (2H, д, J=6,8 Гц), 3,42-3,64 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,02-5,12 (2H, м), 5,24 (1H, т, J=7,2 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 760 (М+H)+.
Пример 49. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пентилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 49)
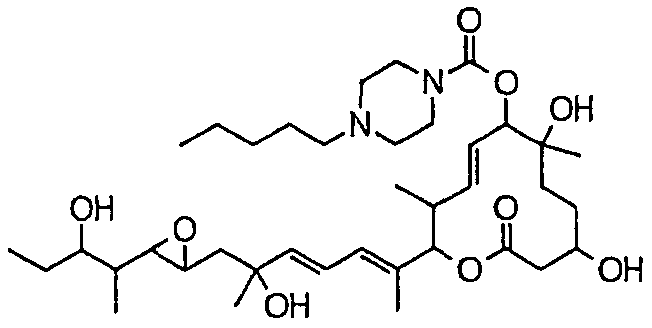
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=7,2 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,22-1,68 (20H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 13,7 Гц), 2,32-2,60 (9H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=1,6, 5,6 Гц), 3,40-3,70 (5H, м), 3,74-3,82 (1Н, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,8, 15,2 Гц), 5,72 (1H, дд, J=10,8, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=9,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 50. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-(((1S,4S)-5-изопропил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 50)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,06-1,12 (6H, м), 1,18-1,68 (16H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,7, 13,7 Гц), 2,47-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,05 (1H, т, J=10,0 Гц), 3,19 (1H, дд, J=2,4, 10,8 Гц), 3,48-3,68 (2H, м), 3,78 (1H, шир.с), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,68-5,78 (1H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 51. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(3-метил-2-бутен-1-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 51)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,24-1,64 (8H, м), 1,67 (3H, с), 1-75 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,38-2,48 (4H, м), 2,50-2,53 (2H, м), 2,54-2,62 (1H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,00 (2H, д, J=6,8 Гц), 3,42-3,66 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,25 (1H, т, J=6,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,4 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 52. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((морфолин-4-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 52)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,93 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,24-1,70 (8H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,50-2,62 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,86-2,92 (1H, м), 3,42-3,56 (5H, м), 3,58-3,68 (4H, м), 3,76-3,82 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 646 (М+Na)+.
Пример 53. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 53)
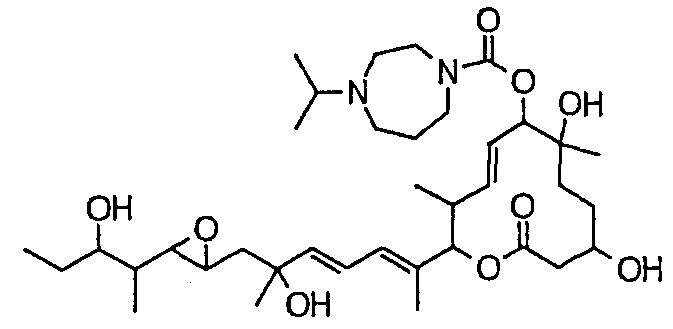
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,04 (6H, д, J=6,4 Гц), 1,23 (3H, с), 1,23-1,69 (9H, м), 1,34 (3H, с), 1,77 (3H, с), 1,77-1,90 (2H, м), 2,47-2,76 (8H, м), 2,84-2,98 (2H, м), 3,42-3,68 (5H, м), 3,74-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,6 Гц), 5,73 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 679 (М+H)+.
Пример 54. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-((4-изобутилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 54)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87-0,97 (15H, м), 1,23 (3H, с), 1,23-1,69 (10H, м), 1,34 (3H, с), 1,77 (3H, с), 1,69-1,90 (2H, м), 2,23 (2H, д, J=6,8 Гц), 2,50-2,70 (8H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,43-3,66 (5H, м), 3,74-3,82 (1H, м), 4,94 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,6 Гц), 5,73 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 693 (М+H)+.
Пример 55. (8Е,12Е,14Е)-7-((4-Циклопентилметил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 55)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,15-2,20 (20H, м), 1,23 (3H, с), 1,34 (3H, с), 1,77 (3H, с), 2,42 (2H, д, J=7,2 Гц), 2,46-2,74 (8H, м), 2,86-2,92 (1H, м), 3,40-3,68 (5H, м), 3,75-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,6 Гц); ESI-МС m/z 719 (М+H)+.
Пример 56. (8Е,12Е,14Е)-7-(N-((3S)-1-Этилпирролидин-3-ил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 56)
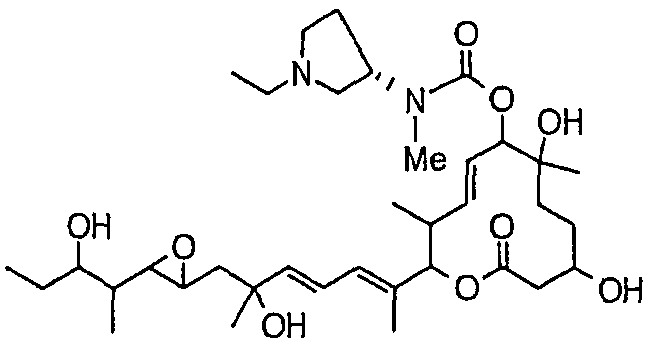
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,12 (3H, т, J=7,6 Гц), 1,23 (3H, с), 1,23-1,70 (9H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,08-2,22 (1H, м), 2,38-2,90 (11H, м), 2,90 (3H, с), 3,28-3,33 (1H, перекрытый CD3OD), 3,49-3,56 (1H, м), 3,75-3,82 (1H, м), 4,87-4,93 (1H, перекрытый H2O), 5,06 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 665 (М+H)+.
Пример 57. (8Е,12Е,14Е)-7-((4-Циклобутилметил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 57)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (6H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,23-1,96 (16H, м), 1,34 (3H, с), 1,77 (3H, с), 2,02-2,12 (2H, м), 2,50-2,64 (8H, м), 2,64-2,70 (2H, м), 2,86-2,92 (1H, м), 3,40-3,68 (5H, м), 3,75-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц),5,72 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 58. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(((2S)-2-((пирролидин-1-ил)метил)пирролидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 58)
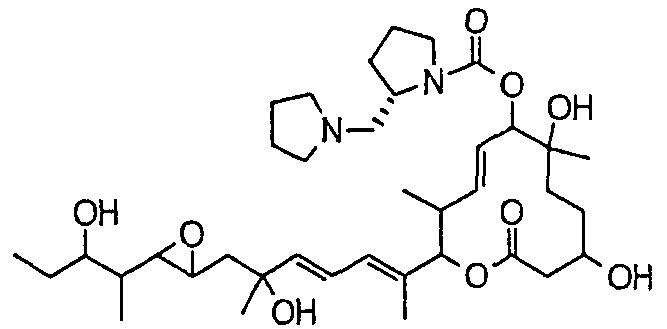
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,20-2,03 (17H, м), 1,23 (3H, с), 1,34 (3H, с), 1,77 (3H, с), 2,38-2,70 (10H, м), 2,85-2,92 (1H, м), 3,33-3,44 (1H, м), 3,49-3,56 (1H, м), 3,75-3,82 (1H, м), 3,93-4,08 (2H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1Н, д, J=10,4 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 59. (8Е,12Е,14Е)-7-(((3S)-3,4-Диметилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 59)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,08 (3H, д, J=6,4 Гц), 1,21 (3H, с), 1,221-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,02-2,23 (2H, м), 2,30 (3H, с), 2,46-2,84 (6H, м), 2,89 (1H, дт, J=2,0, 5,6 Гц), 2,94-3,12 (1H, м), 3,48-3,55 (1H, м), 3,75-3,82 (1H, м), 3,82-4,20 (2H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 651 (М+H)+.
Пример 60. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(проп-2-ин-1-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 60)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,22-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,50-2,64 (7H, м), 2,64-2,70 (2H, м), 2,89 (1H, дт, J=2,0, 5,6 Гц), 3,30 (2H, д, J=2,4 Гц), 3,40-3,74 (5H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 661 (М+H)+.
Пример 61. (8Е,12Е,14Е)-7-((4-(Бут-2-ин-1-ил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 61)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,22-1,69 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,80 (3H, т, J=2,4 Гц), 1,86 (1H, дд, J=14,0, 5,6 Гц), 2,45-2,64 (7H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,25 (2H, кв, J=2,4 Гц), 3,40-3,72 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=10,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 675 (М+H)+.
Пример 62. (8Е,12Е,14Е)-7-((4-Циклобутилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 62)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,25-1,29 (1H, м), 1,34 (3H, с), 1,34-1,71 (9H, м), 1,77 (3H, шир.с), 1,80-1,90 (5H, м), 2,01-2,12 (2H, м), 2,38-2,62 (7H, м), 2,66 (1H, дд, J=2,0, 7,6 Гц), 2,86-2,97 (2H, м), 3,42-3,67 (5H, м), 3,75-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц),5,57 (1H, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 63. (8Е,12Е,14Е)-7-((4-Этилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 63)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,09 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,23-1,30 (1H, м), 1,34 (3H, с), 1,34-1,69 (7H, м), 1,77 (3H, с), 1,83-1,92 (3H, м), 2,47-2,78 (10H, м), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,44-3,68 (5H, м), 3,75-3,83 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 64. (8Е,12Е,14Е)-7-((4-Бутилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 64)
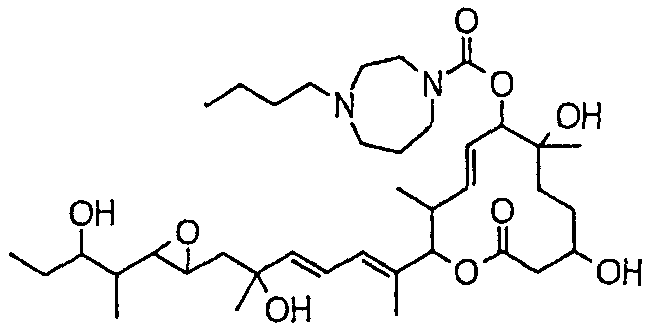
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 0,95 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,23-1,30 (1H, м), 1-34 (3H, с), 1,30-1,69 (11H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 1,90-1,98 (2H, м), 2,47-2,62 (3H, м), 2,62-2,73 (3H, м), 2,78-2,98 (5H, м), 3,44-3,73 (5H, м), 3,76-3,82 (1H, м), 4,95 (1H, д, J=10,4 Гц), 5,06 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 65. (8Е,12Е,14Е)-7-((4-Циклогексилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 65)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,06-1,69 (20H, м), 1,74-1,90 (10H, м), 2,44-2,85 (9H, м), 2,89 (1H, дт, J=2,0, 5,6 Гц), 3,40-3,67 (5H, м), 3,74-3,83 (1H, м), 4,94 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 719 (М+H)+.
Пример 66. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-(3-метил-2-бутен-1-ил)гомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 66)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,16-1,67 (14H, м), 1,67 (3H, с), 1,76 (3H, с), 1,77 (3H, с), 1,82-1,93 (3H, м), 2,44-2,80 (8H, м), 2,89 (1H, дд, J=2,4, 5,6 Гц), 3,17 (2H, д, J=7,2 Гц), 3,43-3,70 (5H, м), 3,72-3,83 (1H, м), 4,95 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,20-5,30 (1H, м), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 67. (8Е,12Е,14Е)-7-((4-(2-(N,N-Диметиламино)этил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 67)
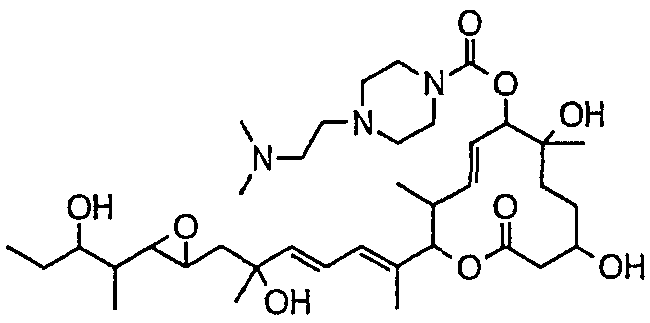
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,98-1,69 (14H, м), 1,77 (3H, с), 1,86 (1H, дд, J=6,0, 15,2 Гц), 2,33 (6H, с), 2,40-2,62 (11H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,38-3,70 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=10,0, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 694 (М+H)+.
Пример 68. (8Е,12Е,14Е)-7-((4-(2-(N,N-Диэтиламино)этил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 68)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,08 (6H, т, J=7,2 Гц), 1,21 (3H, с), 1,22-1,30 (1H, м), 1,34 (3H, с), 1,34-1,68 (7H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,40-2,72 (16H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,38-3,70 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 722 (М+H)+.
Пример 69. (8Е,12Е,14Е)-7-((4-(2,2-Диметилпропил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 69)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,85 (6H, с), 0,86 (3H, с), 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,18-1,68 (14H, м), 1,72-1,82 (5H, м), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,28 (2H, с), 2,46-2,62 (3H, м), 2,66 (1H, дд, J=2,4,8,O Гц), 2,68-2,75 (2H, м), 2,81 (2H, дд, J=5,2, 10,4 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,36-3,68 (5H, м), 3,72-3,82 (1H, м), 4,94 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 14,8 Гц), 5,73 (1H, дд, J=9,6, 14,8 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Пример 70. (8Е,12Е,14Е)-7-((4-Циклопентилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 70)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,18-1,68 (18H, м), 1,70-1,77 (2H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 1,88-2,02 (4H, м), 2,46-2,62 (3H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,82-3,02 (5H, м), 3,08-3,22 (1H, м), 3,42-3,73 (5H, м), 3,73-3,84 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 705 (М+Н)+.
Пример 71. (8Е,12Е,14Е)-7-((4-Циклопропилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 71)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,34-0,52 (4H, м), 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,13-1,70 (15H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,35-2,72 (8H, м), 2,80-2,92 (1H, м), 3,30-3,68 (5H, м), 3,70-3,82 (1H, м), 4,92 (1H, д, J=10,0 Гц), 5,05 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,70 (1H, дд, J=9,6, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 663 (М+H)+, 685 (М+Na)+.
Пример 72. (8Е,12Е,14Е)-7-((4-(1,1-Диметилэтил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 72)
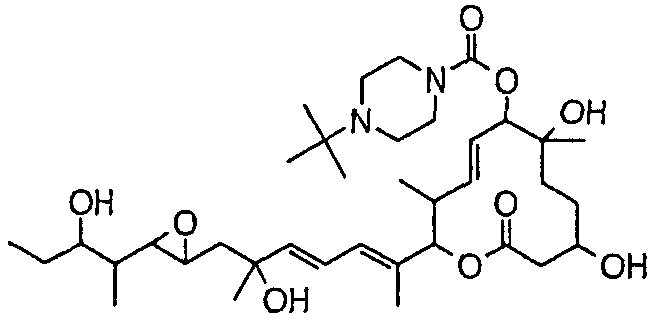
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,10 (9H, с), 1,22 (3H, с), 1,22-1,30 (1H, м), 1,34 (3H, с), 1,35-1,69 (7H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,50-2,64 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,38-3,68 (5H, м), 3,74-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 73. (8Е,12Е,14Е)-7-((4-Циклопропилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 73)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,32-0,54 (4H, м), 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,14-1,68 (15H, м), 1,69-1,93 (6H, м), 2,42-2,62 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,70-2,92 (5H, м), 3,38-3,68 (5H, м), 3,68-3,82 (1H, м), 4,94 (1H, д, J=10,4 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 74. (8Е,12Е,14Е)-7-((4-(2,2-Диметилпропил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 74)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87-0,92 (15H, м), 0,94 (3H, т, J=7,6 Гц), 1,20-1,29 (4H, м), 1,31-1,69 (10H, м), 1,77 (3H, д, J=1,2 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,09 (2H, с), 2,45-2,64 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,36-3,67 (5H, м), 3,75-3,83 (1H, м), 4,92 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,6, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 75. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диэтиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 75)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,06 (6H, шир.т, J=7,0 Гц), 1,15-1,65 (7H, м), 1,22 (3H, шир.с), 1,33 (3H, с), 1,65 (1H, дд, J=6,2, 14,3H), 1,77 (3H, с), 1,86 (1H, дд, J=6,2, 14,3 Гц), 2,46-2,65 (5H, м), 2,59 (4H, кв, J=7,0 Гц), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 6,2 Гц), 2,92 (1,6H, с), 2,99 (1,4H, с), 3,28-3,40 (1H, м), 3,52 (1H, дт, J=4,0, 8,4 Гц), 3,52-3,62 (1H, м), 3,74-3,81 (1H, м), 4,92 (1H, д, J=9,5 Гц), 5,06 (1H, д, J=10,6 Гц), 5,56 (1H, дд, J=9,9, 15,0 Гц), 5,72 (1H, дд, J=9,5, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 667 (М+H)+.
Пример 76. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 76)
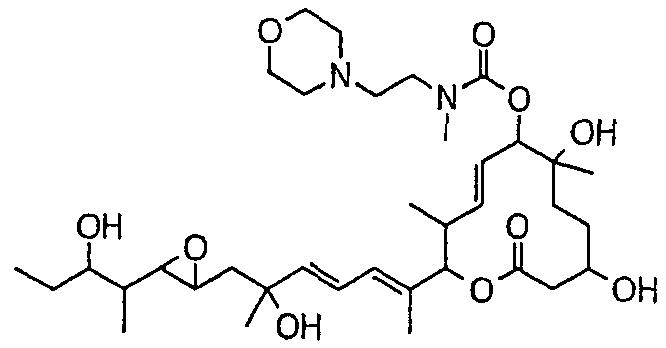
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,888 (3H, д, J=6,6 Гц), 0,894 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,19-1,65 (7H, м), 1,22 (3H, с), 1,33 (3H, с), 1,65 (1H, дд, J=6,6, 13,9 Гц), 1,77 (3H, д, J=0,7 Гц), 1,86 (1H, дд, J=6,2, 13,9 Гц), 2,45-2,61 (9H, м), 2,66 (1H, дд, J=2,6, 7,7 Гц), 2,89 (1H, дт, J=2,6, 6,2 Гц), 2,91 (1,6H, с), 2,98 (1,4H, с), 3,30-3,45 (1H, м), 3,52 (1H, дт, J=4,4, 8,1 Гц), 3,60-3,71 (5H, м), 3,74-3,81 (1H, м), 4,92 (1H, д, J=9,9 Гц), 5,06 (1H, д, J=10,6 Гц), 5,51-5,60 (1H, м), 5,67-5,77 (1H, м), 5,86 (1H, д, J=15,0 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 681 (М+H)+.
Пример 77. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пиперидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 77)
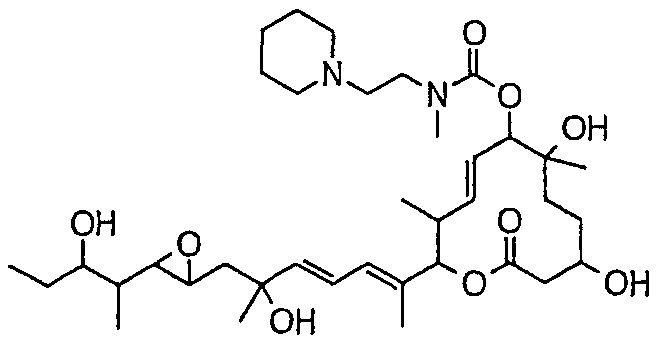
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,0 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,19-1,68 (17H, м), 1,33 (3H, с), 1,77 (3H, д, J=0,7 Гц), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,41-2,62 (9H, м), 2,66 (1H, дд, J=2,6, 7,7 Гц), 2,87-2,92 (1H, м), 2,90 (1,6H, с), 2,98 (1,4H, с), 3,36-3,45 (1H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,55-3,62 (1H, м), 3,74-3,81 (1H, м), 4,86-4,93 (1H, м), 5,05 (1H, д, J=10,6 Гц), 5,56 (1H, дд, J=9,9, 15,0 Гц), 5,71 (1H, дд, J=10,6, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 679 (М+H)+.
Пример 78. (8Е,12Е,14Е)-7-(N-Этил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 78)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,886 (3H, д, J=6,6 Гц), 0,893 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,08-1,17 (3H, м), 1,18-1,65 (7H, м), 1,22 (3H, с), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 13,9 Гц), 1,77 (3H, д, J=1,1 Гц), 1,86 (1H, дд, J=5,5, 13,9 Гц), 2,44-2,62 (9H, м), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,89 (1H, дт, J=2,2, 5,5 Гц), 3,30-3,54 (3H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,54-3,71 (5H, м), 3,73-3,81 (1H, м), 4,92 (1H, шир.д, J=9,5 Гц), 5,06 (1H, д, J=10,6 Гц), 5,57 (1H, дд, J=9,9, 15,0 Гц), 5,67-5,78 (1H, м), 5,86 (1H, д, J=15,0 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 695 (М+H)+.
Пример 79. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 79)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,19-1,65 (10H, м), 1,33 (3H, с), 1,65 (1H, дд, J=5,5, 14,3 Гц), 1,74-1,85 (4H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,5, 14,3 Гц), 2,49-2,68 (10H, м), 2,86-2,92 (1H, м), 2,91 (1,6H, с), 2,99 (1,4H, с), 3,39-3,60 (2H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,73-3,81 (1H, м), 4,91 (1H, д, J=9,5 Гц), 5,05 (1H, д, J=10,6 Гц), 5,56 (1H, дд, J=9,9, 15,4 Гц), 5,72 (1H, дд, J=9,5, 15,4 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 665 (М+H)+.
Пример 80. (8Е,12Е,14Е)-7-(N-(3-(N',N'-Диэтиламино)пропил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 80)
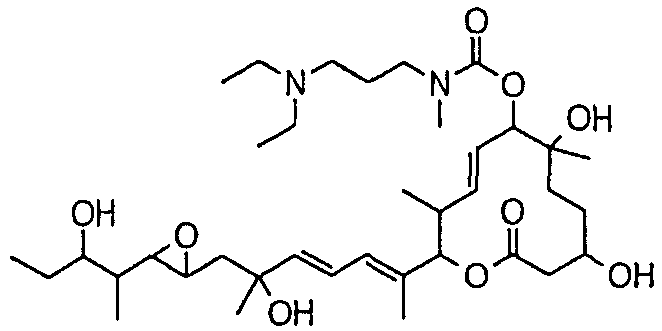
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,05 (6H, т, J=7,3 Гц), 1,21-1,81 (10H, м), 1,21 (3H, с), 1,33 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=5,5, 13,6 Гц), 2,46-2,62 (5H, м), 2,58 (4H, кв, J=7,3 Гц), 2,66 (1H, дд, J=2,2, 8,1 Гц), 2,87-2,95 (1H, м), 2,89 (1,6H, с), 2,97 (1,4H, с), 3,20-3,32 (1H, м), 3,50-3,59 (1H, м), 3,52 (1H, дт, J=4,4, 8,4 Гц), 3,74-3,82 (1H, м), 4,93 (1H, д, J=9,9 Гц), 5,06 (1H, д, J=10,6 Гц), 5,56 (1H, дд, J=9,9, 15,0 Гц), 5,73 (1H, дд, J=9,9, 15,0 Гц), 5,86 (1H, д, J=15,4 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,4 Гц); ESI-МС m/z 681 (М+H)+.
Пример 81. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 81)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 3.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,6 Гц), 0,89 (3H, д, J=7,0 Гц), 0,93 (3H, т, J=7,3 Гц), 1,19-1,70 (7H, м), 1,20 (1,2H, с), 1,22 (1,8H, с), 1,33 (3H, с), 1,65 (1H, дд, J=6,2, 14,3 Гц), 1,72-1,77 (1H, м), 1,77 (3H, д, J=0,7 Гц), 1,86 (1H, дд, J=6,2, 14,3 Гц), 1,86-1,92 (1H, м), 2,38 (1,2H, с), 2,40 (1,8H, с), 2,50-2,62 (3H, м), 2,63-2,7 0 (2H, м), 2,74-2,83 (1H, м), 2,89 (1H, дт, J=2,2, 6,2 Гц), 3,21 (0,6H, дд, J=1,8, 10,6 Гц), 3,36 (0,4H, дд, J=1,8, 10,6 Гц), 3,47-3,59 (3H, м), 3,75-3,82 (1H, м), 4,32 (0,4H, с), 4,55 (0,6H, с), 4,91 (1H, д, J=9,9 Гц), 5,06 (1H, д, J=10,6 Гц), 5,68-5,77 (1H, м), 5,51-5,61 (1H, м), 5,86 (1H, д, J=15,0 Гц), 6,13 (1H, д, J=11,0 Гц), 6,52 (1H, дд, J=11,0, 15,0 Гц); ESI-МС m/z 649 (М+H)+.
Пример 82. (8Е,12Е,14Е)-7-(((1S,4S)-5-Этил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 82)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,93 (3H, д, J=6,8 Гц), 0,94 (3H, д, J=6,8 Гц), 0,98 (3H, т, J=7,2 Гц), 1,10-1,18 (3H, м), 1,22-1,74 (14H, м), 1,80 (1H, шир.с), 1,82 (3H, с), 1,87-1,95 (2H, м), 2,51-2,77 (7H, м), 2,87-2,97 (2H, м), 3,23-3,29 (0,5H, м), 3,37-3,43 (0,5H, м), 3,51-3,63 (2H, м), 3,63-3,69 (1H, м), 3,79-3,87 (1H, м), 4,37 (0,5H, шир.с), 4,60 (0,5H, шир.с), 4,96 (1H, д, J=9,6 Гц), 5,11 (1H, д, J=10,4 Гц), 5,57-5,67 (1H, м), 5,72-5,67 (1H, м), 5,91 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=11,2 Гц), 6,57 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 663 (М+H)+.
Пример 83. (8Е,12Е,14Е)-7-((4-Циклооктилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 83)
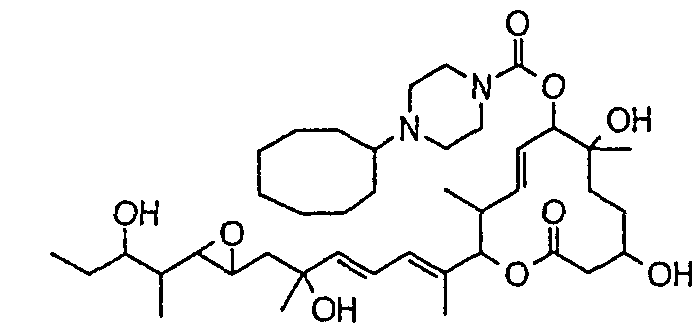
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,94 (3H, д, J=6,8 Гц), 0,94 (3H, д, J=6,8 Гц), 0,98 (3H, т, J=7,2 Гц), 1,25 (3H, с), 1,25-1,87 (28H, м), 1,91 (1H, дд, J=5,6, 14,4 Гц), 2,50-2,76 (9H, м), 2,93 (1H, дт, J=2,0, 6,0 Гц), 3,42-3,74 (5H, м), 3,78-3,88 (1H, м), 4,97 (1H, д, J=9,6 Гц), 5,11 (1H, д, J=10,4 Гц), 5,61 (1H, дд, J=9,6, 15,2 Гц), 5,76 (1H, дд, J=9,6, 15,2 Гц), 5,91 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=11,2 Гц), 6,57 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 733 (М+H)+.
Пример 84. (8Е,12Е,14Е)-7-((4-(Этоксикарбонилметил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 84)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примерах 46 и 47.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,20-1,42 (3H, м), 1,21 (3H, с), 1,26 (3H, т, J=7,2 Гц), 1,34 (3H, с), 1,44-1,54 (2H, м), 1,56-1,64 (2H, м), 1,65 (1H, дд, J=6,5, 14,4 Гц), 1,78 (3H, с), 1,86 (1H, дд, J=5,0, 14,4 Гц), 2,50-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,87-2,91 (1H, м), 3,26 (2H, с), 3,40-3,70 (4H, м), 3,50-3,55 (1H, м), 3,75-3,81 (1H, м), 4,17 (2H, кв, J=7,2 Гц), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,8, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=10,0 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 731 (М+Na)+.
Пример 85. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85)

Первая стадия
(8Е,12Е,14Е)-7-Ацетокси-6-метокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85-1)

К раствору соединения 46-1 (8Е,12Е,14Е)-7-ацетокси-6-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (171 мг, 0,19 ммоль), полученного на первой стадии примера 46, в толуоле (6 мл) добавляли метилтрифторметансульфонат (188 мг, 1,14 ммоль) и 1,8-бис(N,N-диметиламино)нафталин (368 мг, 1,71 ммоль) при комнатной температуре и реакционную смесь перемешивали при 65°С в течение 14 часов. Затем к полученной смеси еще добавляли метилтрифторметансульфонат (304 мг, 1,9 ммоль) и 1,8-бис(N,N-диметиламино)нафталин (400 мг, 1,9 ммоль) при комнатной температуре и реакционную смесь перемешивали при 65°С в течение 6 часов. Реакционную смесь разбавляли диэтиловым эфиром и фильтровали через стеклянный фильтр. Фильтрат смешивали с 28% водным аммиаком (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение часа и последовательно промывали насыщенным раствором соли, 0,1 М водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (141 мг, 84%) в виде бесцветного масла.
ESI-MC m/z 932 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-7-Гидрокси-6-метокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85-2)

К раствору соединения 85-1 (8Е,12Е,14Е)-7-ацетокси-6-метокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (158 мг, 0,17 ммоль), полученного на первой стадии, в метаноле (5 мл) добавляли карбонат калия (120 мг, 0,87 ммоль) при комнатной температуре, после чего реакционную смесь перемешивали при той же температуре в течение трех часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали. Неочищенный продукт очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (91 мг, 61%) в виде бесцветного масла.
ESI-MC m/z 890 (М+Na)+.
Третья стадия
(8Е,12Е,14Е)-6-Метокси-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85-3)

К раствору соединения 85-2 (8Е,12Е,14Е)-7-гидрокси-6-метокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (91 мг, 0,11 ммоль), полученного на второй стадии, в дихлорметане (4 мл) добавляли триэтиламин (64 мг, 0,52 ммоль), N,N-диметиламинопиридин (64 мг, 0,52 ммоль) и 4-нитрофенилхлорформиат (63 мг, 0,31 ммоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение 2,5 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (97 мг, 89%) в виде бесцветного масла.
ESI-MC m/z 1055 (М+Na)+.
Четвертая стадия
(8Е,12Е,14Е)-6-Метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85-4)

К раствору соединения 85-3 (8Е,12Е,14Е)-6-метокси-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (30 мг, 29 мкмоль), полученного на третьей стадии, в тетрагидрофуране (2 мл) добавляли триэтиламин (11 мг, 0,12 ммоль) и 1-метилпиперазин (5,8 мг, 58 мкмоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в течение часа. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; метанол:дихлорметан=3:97) с получением указанного в заголовке соединения (26 мг, 89%) в виде бесцветного масла.
ESI-MC m/z 994 (М+Н)+.
Пятая стадия
(8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 85)

К раствору соединения 85-4 (8Е,12Е,14Е)-6-метокси-6,10,12,16,20-пентаметил-7-(4-метилпиперазин-1-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (25 мг, 25 мкмоль), полученного на четвертой стадии, в тетрагидрофуране (3 мл) добавляли тетрабутиламмонийфторид (83 мкл, 1,0 М тетрагидрофурановый раствор) при комнатной температуре, после чего реакционную смесь перемешивали при той же температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel Plate; метанол:дихлорметан=5:95) с получением указанного в заголовке соединения (11 мг, 67%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,22-1,69 (8H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,29 (3H, с), 2,36-2,44 (4H, м), 2,45-2,60 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,86-2,92 (1H, м), 3,34 (3H, с), 3,44-3,58 (5H, м), 3,78-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=11,2 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=9,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 651 (М+H)+.
Пример 86. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 86)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,22-1,82 (8H, м), 1,34 (3H, с), 1,77 (3H, с), 1,86 (1H, дд, J=6,0, 14,0 Гц), 2,44-2,62 (3H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,70-2,82 (4H, м), 2,89 (1H, дт, J=2,4, 5,6 Гц), 3,25-3,36 (3H, перекрытый CD3OD), 3,38-3,55 (5H, м), 3,78-3,86 (1H, м), 5,02 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,6 Гц), 5,73 (1H, дд, J=9,6, 15,6 Гц), 5,86 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 637 (М+H)+.
Пример 87. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диэтиламино)этил)карбамоилокси)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 87)
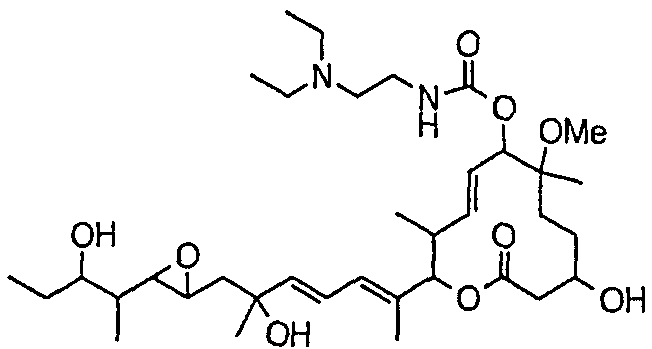
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,06 (6H, т, J=7,2 Гц), 1,22 (3H, с), 1,22-1,70 (8H, м), 1,34 (3H, с), 1,78 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,44-2,64 (9H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,21 (2H, т, J=7,2 Гц), 3,25-3,36 (3H, перекрытый CD3OD), 3,48-3,56 (1H, м), 3,77-3,85 (1H, м), 4,97 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,54 (1H, дд, J=10,0, 15,2 Гц), 5,71 (1H, дд, J=9,6, 15,6 Гц), 5,86 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 667 (М+H)+.
Пример 88. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(1-метилпиперидин-4-ил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 88)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,17-1,69 (16H, м), 1,72-1,90 (6H, м), 2,10-2,2 6 (2H, м), 2,33 (3H, с), 2,44-2,62 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,82 (3H, с), 2,89 (1H, дт, J=2,4, 6,0 Гц), 2,95-3,03 (2H, м), 3,35 (3H, с), 3,52 (1H, дт, J=4,4, 8,0 Гц), 3,78-3,85 (1H, м), 3,92-4,04 (1H, м), 5,03 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 89. (8Е,12Е,14Е)-7-((4-(N,N-Диметиламино)пиперидин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 89)
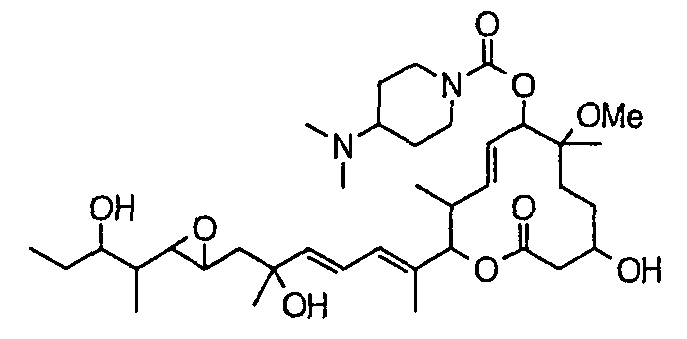
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,17-1,68 (16H, м), 1,78 (3H, с), 1,81-1,94 (3H, м), 2,29 (6H, с), 2,34-2,63 (4H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,73-2,89 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,33 (3H, с), 3,52 (1H, дт, J=4,4, 7,6 Гц), 3,78-3,85 (1H, м), 4,10-4,30 (2H, м), 5,01 (1H, д, J=9,2 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 90. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-пропилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 90)
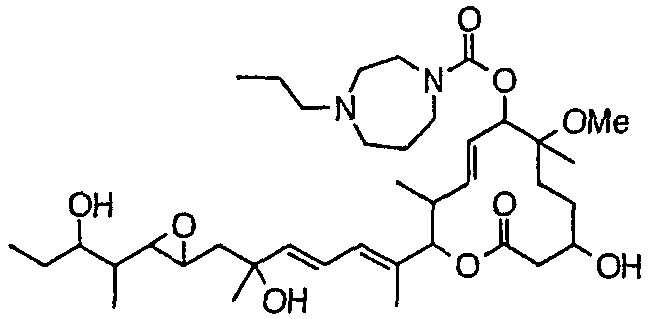
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,84-0,92 (9H, м), 0,94 (3H, т, J=7,2 Гц), 1,24 (3H, с), 1,34 (3H, с), 1,22-1,69 (10H, м), 1,78 (3H, д, J=0,8 Гц), 1,82-1,90 (3H, м), 2,4 0-2,72 (10H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,24-3,36 (3H, перекрытый CD3OD), 3,44-3,60 (5H, м), 3,78-3,86 (1H, м), 5,03 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,6 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,6 Гц); ESI-МС m/z 693 (М+H)+.
Пример 91. (8Е,12Е,14Е)-7-((4-Бутилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 91)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,86-0,98 (12H, м), 1,23 (3H, шир.с), 1,34 (3H, с), 1,22-1,70 (12H, м), 1,78 (3H, д, J=0,8 Гц), 1,82-1,89 (3H, м), 2,44-2,74 (10H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,30 (3H, с), 3,42-3,58 (5H, м), 3,79-3,85 (1H, м), 5,03 (1H, д, J=9,2 Гц), 5,07 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Пример 92. (8Е,12Е,14Е)-7-((4-Циклопропилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 92)
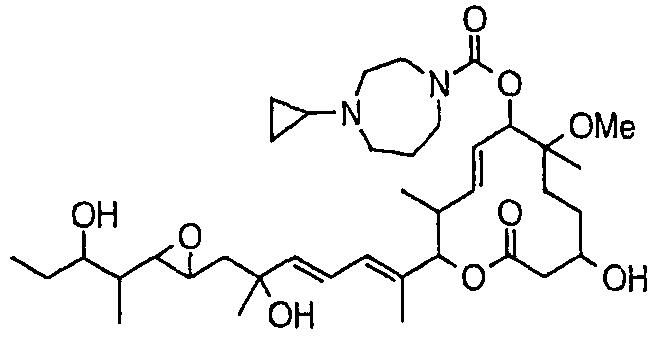
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,38-0,42 (2H, м), 0,47-0,52 (2H, м), 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,34 (3H, с), 1,22-1,68 (9H, м), 1,78 (3H, д, J=0,8 Гц), 1,80-1,92 (3H, м), 2,44-2,60 (3H, м), 2,66 (1H, дд, J=2,0, 7,6 Гц), 2,74-2,87 (4H, м), 2,89 (1H, дт, J=1,6, 5,6 Гц), 3,33 (3H, с), 3,44-3,60 (5H, м), 3,78-3,86 (1H, м), 5,03 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,6 Гц), 5,74 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 93. (8Е,12Е,14Е)-7-((4-Циклобутилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 93)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,23 (3H, с), 1,34 (3H, с), 1,22-1,72 (10H, м), 1,78 (3H, с), 1,80-1,90 (5H, м), 2,02-2,10 (2H, м), 2,41-2,60 (7H, м), 2,67 (1H, дд, J=2,4,8,O Гц), 2,86-2,94 (2H, м), 3,24-3,36 (3H, перекрытый CD3OD), 3,44-3,60 (5H, м), 3,78-3,86 (1H, м), 5,03 (1H, дд, J=2,0, 9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 94. (8Е,12Е,14Е)-7-((4-Циклопентилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 94)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,23 (3H, с), 1,34 (3H, с), 1,36-1,72 (16H, м), 1,78 (3H, д, J=0,8 Гц), 1,82-1,90 (3H, м), 2,44-2,60 (3H, м), 2,64-2,70 (3H, м), 2,73-2,82 (2H, м), 2,84-2,94 (2H, м), 3,24-3,36 (3H, перекрытый CD3OD), 3,44-3,60 (5H, м), 3,78-3,86 (1H, м), 5,04 (1H, д, J=11,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,6 Гц), 5,74 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 719 (М+H)+.
Пример 95. (8Е,12Е,14Е)-7-((4-Циклогексилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 95)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,34 (3H, с), 1,12-1,68 (18H, м), 1,78 (3H, д, J=0,8 Гц), 1,75-1,89 (3H, м), 2,42-2,60 (4H, м), 2,64-2,72 (3H, м), 2,75-2,82 (2H, м), 2,89 (1H, дт, J=1,2, 5,2 Гц), 3,26-3,36 (3H, перекрытый CD3OD), 3,42-3,56 (5H, м), 3,78-3,86 (1H, м), 5,03 (1H, дд, J=3,2, 9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=10,0, 14,8 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 733 (М+H)+.
Пример 96. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-((4-изопропилгомопиперазин-1-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 96)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,03 (6H, д, J=6,4 Гц), 1,24 (3H, с), 1,34 (3H, с), 1,22-1,69 (8H, м), 1,78 (3H, с), 1,76-1,90 (3H, м), 2,44-2,74 (8H, м), 2,86-2,94 (2H, м), 3,33 (3H, с), 3,44-3,60 (5H, м), 3,79-3,86 (1H, м), 5,03 (1H, дд, J=4,4, 9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,8, 16,0 Гц), 5,74 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,6 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 97. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-((4-изобутилгомопиперазин-1-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 97)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,84-0,95 (15H, м), 1,26 (3H, с), 1,34 (3H, с), 1,22-1,76 (9H, м), 1,78 (3H, с), 1,78-1,90 (3H, м), 2,23 (2H, д, J=6,8 Гц), 2,44-2,72 (8H, м), 2,89 (1H, дт, J=2,0, 5,2 Гц), 3,24-3,38 (3H, перекрытый CD3OD), 3,42-3,58 (5H, м), 3,78-3,86 (1H, м), 5,03 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,2, 14,8 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Пример 98. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(морфолин-4-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 98)
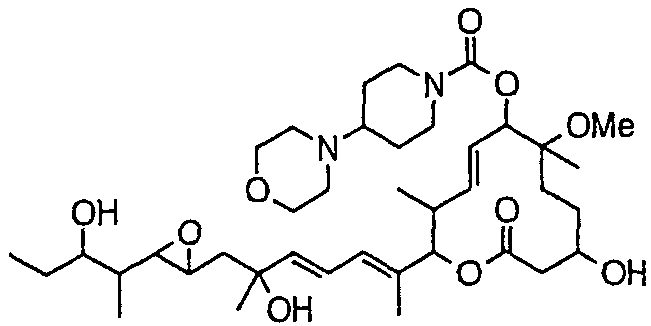
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=5,2 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,24-1,68 (10H, м), 1,78 (3H, д, J=1,2 Гц), 1,82-1,96 (3H, м), 2,32-2,43 (1H, м), 2,44-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,74-2,92 (3H, м), 3,32 (3H, с), 3,52 (1H, дт, J=3,6, 8,0 Гц), 3,64-3,74 (4H, м), 3,78-3,86 (1H, м), 4,08-4,28 (2H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,54 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 721 (М+H)+.
Пример 99. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(пирролидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 99)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=5,6 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,34 (3H, с), 1,23-1,70 (10H, м), 1,78 (3H, с), 1,79-1,90 (5H, м), 1,92-2,00 (2H, м), 2,20-2,30 (1H, м), 2,44-2,68 (8H, м), 2,76-2,92 (3H, м), 3,24-3,36 (3H, перекрытый CD3OD), 3,52 (1H, дт, J=4,8, 8,0 Гц), 3,77-3,86 (1H, м), 4,04-4,24 (2H, м), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 100. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-((4-(4-гидроксипиперидин-1-ил)пиперидин-1-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 100)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,21 (3H, с), 1,34 (3H, с), 1,22-1,69 (12H, м), 1,78 (3H, с), 1,82-1,93 (5H, м), 2,28-2,38 (2H, м), 2,43-2,58 (4H, м), 2,67 (1H, дд, J=2,0, 7,6 Гц), 2,72-2,83 (5H, м), 3,24-3,39 (3H, перекрытый CD3OD), 3,52 (1H, дт, J=4,8, 8,0 Гц), 3,56-3,64 (1Н, м), 3,78-3,86 (1Н,м), 4,10-4,30 (2H, м), 5,00 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=10,4, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 735 (М+H)+.
Пример 101. (8Е,12Е,14Е)-7-(N-(3-(N',N'-Диметиламино)пропил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 101)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,34 (3H, с), 1,20-1,78 (10H, м), 1,78 (3H, с), 1,86 (1H, дд, J=6,3, 14,5 Гц), 2,24 (6H, с), 2,31 (2H, т, J=8,8 Гц), 2,44-2,60 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,85-2,96 (4H, м), 3,22-3,38 (5H, перекрытый CD3OD), 3,52 (1H, дд, J=3,6, 8,0 Гц), 3,78-3,85 (1H, м), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,55 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 667 (М+H)+.
Пример 102. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(морфолин-4-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 102)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,22 (3H, с), 1,34 (3H, с), 1,23-1,69 (8H, м), 1,78 (3H, с), 1,86 (1H, дд, J=4,6, 12,7 Гц), 2,44-2,56 (9H, м), 2,66 (1H, дд, J=2,4, 7,6 Гц), 2,86-2,96 (4H, м), 3,22-3,38 (2H, перекрытый CD3OD), 3,34 (3H, с), 3,52 (1H, дт, J=4,0, 8,0 Гц), 3,62-3,72 (4H, м), 3,78-3,84 (1H, м), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=10,0, 15,2 Гц), 5,68-5,79 (1H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,4 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 695 (М+H)+.
Пример 103. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-(N-метил-N-(2-(пирролидин-1-ил)этил)карбамоилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 103)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,22 (3H, с), 1,34 (3H, с), 1,23-1,68 (8H, м), 1,78 (3H, д, J=0,8 Гц), 1,78-1,83 (4H, м), 1,86 (1H, дд, J=5,4, 13,1 Гц), 2,44-2,68 (10H, м), 2,86-2,97 (4H, м), 3,34 (3H, с), 3,40-3,48 (2H, м), 3,52 (1H, дт, J=4,0, 7,6 Гц), 3,78-3,86 (1H, м), 5,00 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,55 (1H, дд, J=10,0, 14,8 Гц), 5,74 (1H, дд, J=9,6, 14,8 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 104. (8Е,12Е,14Е)-7-(N-(3-(N',N'-Диэтиламино)пропил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 104)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,05 (6H, т, J=7,2 Гц), 1,22 (3H, с), 1,34 (3H, с), 1,20-1,82 (10H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,6, 14,4 Гц), 2,42-2,60 (9H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,84-2,96 (4H, м), 3,22-3,40 (5H, перекрытый CD3OD), 3,52 (1H, дт, J=3,6, 8,0 Гц), 3,78-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,55 (1H, дд, J=10,0, 15,6 Гц), 5,74 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,0 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 695 (М+H)+.
Пример 105. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 105)
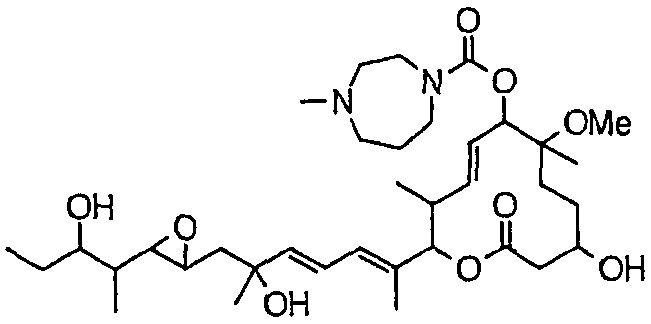
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,83-1,93 (3H, м), 2,35 (3H, с), 2,45-2,65 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (1,5H, с), 3,33 (1,5H, с), 3,46-3,62 (5H, м), 3,79-3,86 (1H, м), 5,01-5,06 (1H, м), 5,07 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 106. (8Е,12Е,14Е)-7-((4-Этилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 106)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,11 (3H, т, J=7,6 Гц), 1,20-1,29 (4H, м), 1,34 (3H, с), 1,37-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,41-2,63 (9H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,43-3,59 (5H, м), 3,79-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 107. (8Е,12Е,14Е)-7-((4-Этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 107)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,08 (3H, т, J=7,2 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,70 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,82-1,90 (3H, м), 2,45-2,73 (10H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,33 (1,5H, с), 3,33 (1,5H, с), 3,46-3,62 (5H, м), 3,79-3,85 (1H, м), 5,00-5,06 (1H, м), 5,07 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 108. (8Е,12Е,14Е)-7-(N-(2-(N',N'-Диметиламино)этил)-N-метилкарбамоилокси)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 108)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,70 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,27 (6H, с), 2,45-2,63 (5H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,87-2,97 (4H, м), 3,30-3,36 (3H, м), 3,37-3,46 (2H, м), 3,52 (1H, тд, J=4,4, 8,0 Гц), 3,78-3,85 (1H, м), 5,00 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,55 (1H, дд, J=9,6, 15,2 Гц), 5,69-5,79 (1H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 653 (М+H)+.
Пример 109. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(пиперидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 109)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,31-1,69 (18H, м), 1,78 (3H, с), 1,83-1,93 (3H, м), 2,41-2,61 (8H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,70-2,88 (2H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,33 (3H, с), 3,52 (1H, тд, J=4,4, 8,0 Гц), 3,78-3,85 (1H, м), 4,11-4,29 (2H, м), 5,00 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц),5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 719 (М+H)+.
Пример 110. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-((4-(изопропилпиперазин-1-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 110)
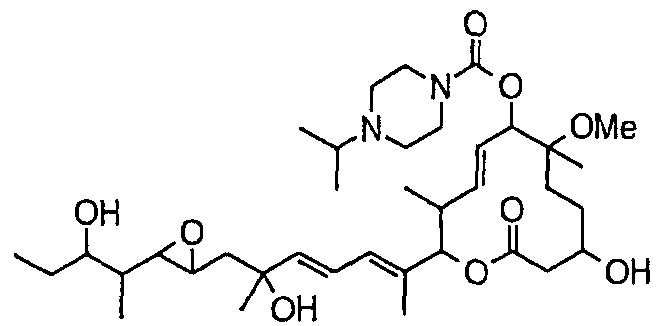
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,07 (6H, д, J=6,8 Гц), 1,20-1,29 (4H, м), 1,32-1,76 (10H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,45-2,63 (7H, м), 2,64-2,75 (2H, м), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,42-3,59 (5H, м), 3,78-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 111. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-пропилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 111)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,93 (3H, т, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,20-1,30 (4H, м), 1,34 (3H, с), 1,39-1,69 (9H, м), 1,78 (3H, д, J=1,2 Гц), 1,87 (1H, дд, J=5,2, 14,0 Гц), 2,31-2,37 (2H, м), 2,40-2,63 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,90 (1H, дт, J=2,0, 6,0 Гц), 3,32 (3H, с), 3,42-3,60 (5H, м), 3,79-3,86 (1H, м), 5,02 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 112. (8Е,12Е,14Е)-7-((4-Бутилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 112)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,19-1,29 (4H, м), 1,29-1,69 (14H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,34-2,39 (2H, м), 2,40-2,63 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,32 (3H, с), 3,41-3,60 (5H, м), 3,79-3,85 (1H, м), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 113. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-((4-изобутилпиперазин-1-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 113)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,91 (6H, д, J=6,4 Гц), 0,94 (3H, т, J=7,6 Гц), 1, 19-1,29 (4H, м), 1,34 (3H, с), 1,39-1,69 (7H, м), 1,76-1,90 (5H, м), 2,11 (2H, д, J=7,2 Гц), 2,33-2,41 (4H, м), 2,45-2,63 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,40-3,58 (5H, м), 3,79-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 693 (М+H)+.
Пример 114. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-7-((4-(2-метоксиэтил)пиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 114)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,44-2,63 (9H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,32 (3H, с), 3,33 (3H, с), 3,41-3,59 (7H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 695 (М+H)+.
Пример 115. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(тетрагидропиран-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 115)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,69 (9H, м), 1,77-1,85 (5H, м), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,43-2,63 (8H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,35-3,43 (2H, м), 3,43-3,59 (5H, м), 3,78-3,85 (1H, м), 3,98 (2H, дд, J=4,4, 11,2 Гц), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 721 (М+H)+.
Пример 116. (8Е,12Е,14Е)-7-((4-Циклопропилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 116)
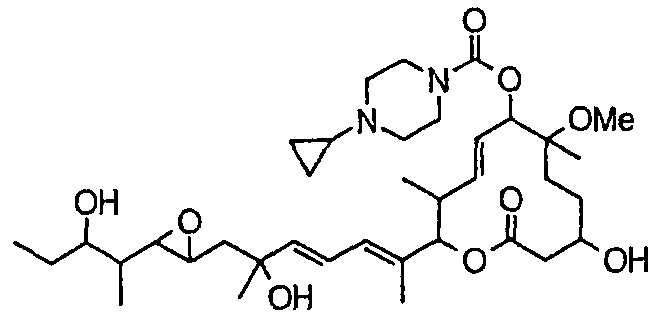
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,40-0,46 (2H, м), 0,46-0,53 (2H, м), 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,70 (8H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,45-2,63 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,37-3,56 (5H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 117. (8Е,12Е,14Е)-7-((4-Циклобутилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 117)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,39-1,78 (9H, м), 1,78 (3H, д, J=0,8 Гц), 1,83-1,95 (3H, м), 2,02-2,10 (2H, м), 2,31 (4H, т, J=4,8 Гц), 2,45-2,63 (3H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,72-2,81 (1H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,31 (3H, с), 3,40-3,58 (5H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 118. (8Е,12Е,14Е)-7-((4-Циклопентилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 118)
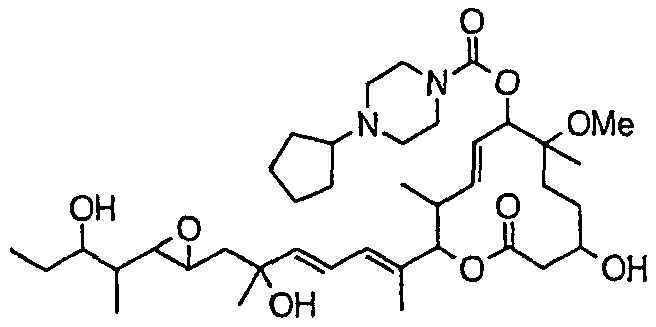
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,36-1,77 (13H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 1,86-1,95 (2H, м), 2,44-2,63 (8H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,32 (3H, с), 3,42-3,59 (5H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 705 (М+H)+.
Пример 119. (8Е,12Е,14Е)-7-((4-Циклогексилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 119)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,09-1,33 (10H, м), 1,34 (3H, с), 1,39-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,78-1,93 (5H, м), 2,27-2,35 (1H, м), 2,45-2,65 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,39-3,58 (5H, м), 3,79-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 719 (М+H)+.
Пример 120. (8Е,12Е,14Е)-7-((4-Циклогептилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 120)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,34 (3H, с), 1,38-1,75 (17H, м), 1,78 (3H, д, J=0,8 Гц), 1,79-1,86 (2H, м), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,45-2,64 (8H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 6,0 Гц), 3,32 (3H, с), 3,39-3,57 (5H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 733 (М+H)+.
Пример 121. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-(((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 121)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,20-1,29 (4H, м), 1,34 (3H, с), 1,40-1,69 (7H, м), 1,74-1,82 (4H, м), 1,83-1,93 (2H, м), 2,38 (1,2H, с), 2,41 (1,8H, с), 2,44-2,63 (3H, м), 2,65-2,71 (2H, м), 2,75-2,85 (1H, м), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,20-3,30 (1H, м), 3,33 (1,8H, с), 3,34 (1,2H, с), 3,46-3,59 (3H, м), 3,79-3,85 (1H, м), 4,32 (0,4H, с), 4,42 (0,6H, с), 4,98-5,04 (1H, м), 5,06 (1H, д, J=10,4 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 663 (М+H)+.
Пример 122. (8Е,12Е,14Е)-7-(((1S,4S)-5-Этил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 122)
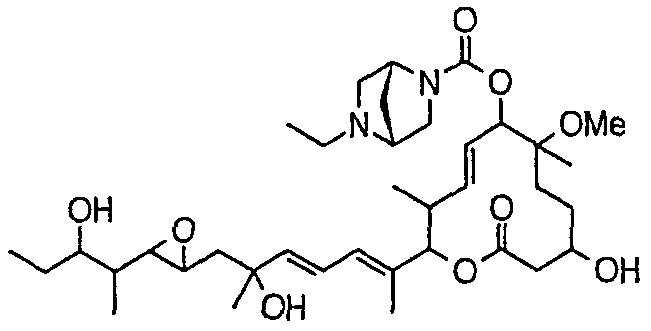
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,05-1,13 (3H, м), 1,20-1,30 (4H, м), 1,34 (3H, с), 1,38-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,83-1,91 (2H, м), 2,45-2,72 (8H, м), 2,82-2,93 (2H, м), 3,20-3,31 (1H, м), 3,33 (1,5H, с), 3,34 (1,5H, с), 3,50-3,64 (3H, м), 3,79-3,85 (1H, м), 4,32 (0,5H, с), 4,42 (0,5H, с), 4,98-5,04 (1H, м), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,74 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 677 (М+H)+.
Пример 123. (8Е,12Е,14Е)-3,16,21-Тригидрокси-7-(((1S,4S)-5-изопропил-2,5-диазабицикло[2.2.1]гептан-2-ил)карбонил)окси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 123)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,05-1,11 (6H, м), 1,19-1,30 (4H, м), 1,34 (3H, с), 1,37-1,69 (7H, м), 1,73-1,90 (5H, м), 2,45-2,65 (6H, м), 2,67 (1H, дд, J=2,4, 8,0), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,01-3,20 (1H, м), 3,18-3,29 (1H, м), 3,32-3,35 (3H, м), 3,52 (1H, тд, J=4,4, 8,4 Гц), 3,54-3,65 (1H, м), 3,76-3,86 (2H, м), 4,30 (0,5H, с), 4,40 (0,5H, с), 4,98-5,09 (2H, м), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,70-5,79 (1H, м), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 691 (М+H)+.
Пример 124. (8Е,12Е,14Е)-7-((4-(2-(N,N-Диметиламино)этил)пиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 124)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,34 (3H, с), 1,37-1,69 (7H, м), 1,78 (3H, д, J=0,8 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,27 (6H, с), 2,43-2,48 (4H, м), 2,48-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,32 (3H, с), 3,41-3,59 (5H, м), 3,78-3,85 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 708 (М+H)+.
Пример 125. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(1-метилпиперидин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 125)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,30 (4H, м), 1,34 (3H, с), 1,39-1,69 (9H, м), 1,78 (3H, д, J=1,2 Гц), 1,83-1,90 (3H, м), 1,98-2,07 (2H, м), 2,24-2,33 (1H, м), 2,25 (3H, с), 2,45-2,62 (7H, м), 2,67 (1H, дд, J=2,4, 8,0 Гц), 2,87-2,96 (3H, м), 3,32 (3H, с), 3,41-3,58 (5H, м), 3,79-3,86 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=10,0, 15,2 Гц), 5,73 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 734 (М+H)+.
Пример 126. (8Е,12Е,14Е)-3,16,21-Тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(пиридин-4-ил)пиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 126)
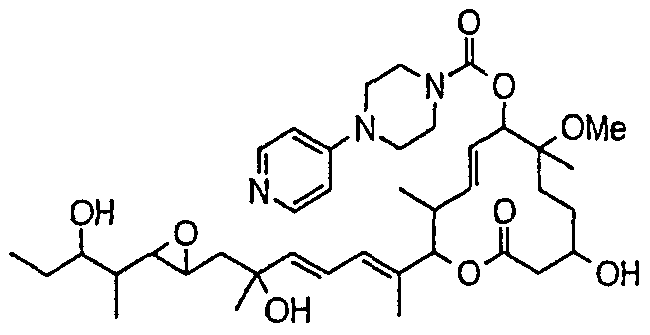
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,19-1,29 (4H, м), 1,34 (3H, с), 1,38-1,69 (7H, м), 1,78 (3H, д, J=1,2 Гц), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,45-2,63 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,34 (3H, с), 3,40-3,47 (4H, м), 3,52 (1H, тд, J=4,4, 8,4 Гц), 3,56-3,72 (4H, м), 3,80-3,87 (1H, м), 5,05 (1H, д, J=9,2 Гц), 5,07 (1H, д, J=10,4 Гц), 5,58 (1H, дд, J=10,0, 15,2 Гц), 5,76 (1H, дд, J=10,0, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 11,2 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц), 6,86 (2H, д, J=6,4 Гц), 8,02-8,04 (2H, м); ESI-МС m/z 714 (М+H)+.
Пример 127. (8Е,12Е,14Е)-6-Этокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 127)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 85, за исключением использования этилтрифторметансульфоната на первой стадии.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,16 (3H, т, J=7,2 Гц), 1,22 (3H, с), 1,22-1,60 (7H, м), 1,34 (3H, с), 1,65 (1H, дд, J=6,4, 14,0 Гц), 1,78 (3H, с), 1,86 (1H, дд, J=5,6, 13,6 Гц), 2,30 (3H, с), 2,36-2,43 (4H, м), 2,43-2,69 (4H, м), 2,89 (1H, дт, J=2,4, 5,6 Гц), 3,43-3,61 (7H, м), 3,77-3,84 (1H, м), 4,98 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,55 (1H, дд, J=10,0, 15,2 Гц), 5,7 6 (1H, дд, J=9,6, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 128. (8Е,12Е,14Е)-6-Этокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-7-((4-(пиперидин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 128)
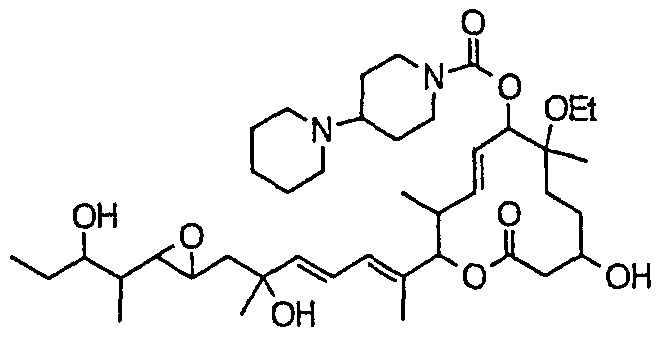
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 127.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,0 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,17 (3H, т, J=6,8 Гц), 1,22 (3H, с), 1,22-1,69 (16H, м), 1,34 (3H, с), 1,78 (3H, с), 1,83-1,93 (3H, м), 2,42-2,63 (8H, м), 2,67 (1H, дд, J=2,4, 7,6 Гц), 2,70-2,92 (3H, м), 3,49-3,62 (3H, м), 3,77-3,84 (1H, м), 4,13-4,27 (2H, м), 4,98 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,54 (1H, дд, J=10,0, 15,2 Гц), 5,76 (1H, дд, J=9,6, 15,6 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,0 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 733 (М+H)+.
Пример 129. (8Е,12Е,14Е)-7-Ацетокси-6,16-дигидрокси-6,10,12,16,20-пентаметил-3,21-бис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 129)

Раствор (8Е,12Е,14Е)-7-ацетокси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (221 мг, 0,4 ммоль), N,N-диметиламинопиридина (25 мг, 0,2 ммоль) и триэтиламина (613 мг, 6 ммоль) в дихлорметане (7 мл) охлаждали до 5°С, добавляли по каплям к нему раствор хлортриэтилсилана (609 мг, 4 ммоль) в дихлорметане (3 мл) и реакционную смесь перемешивали при комнатной температуре в течение часа. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:9 > 1:4 > 1:3) с получением указанного в заголовке соединения (320 мг, количественный) в виде бесцветного масла.
ESI-MC m/z 803 (М+Na)+.
Пример 130. (8Е,12Е,14Е)-3,6,16-Тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130)

Первая стадия
(8Е,12Е,14Е)-7-Ацетокси-6,16-бис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,21-бис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-1)

К раствору соединения 129 (8Е,12Е,14Е)-7-ацетокси-6,16-дигидрокси-6,10,12,16,20-пентаметил-3,21-бис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (320 мг, 0,41 ммоль), полученного в примере 129, и простого этилвинилового эфира (589 мг, 8 ммоль) в дихлорметане (6 мл) добавляли раствор п-толуолсульфоната пиридиния (5 мг, 20 мкмоль) в дихлорметане (1 мл) при комнатной температуре и полученную смесь перемешивали при той же температуре в течение ночи. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:9 1:7) с получением указанного в заголовке соединения (252 мг, 67%) в виде бесцветного масла.
ESI-MC m/z 947 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-7-Ацетокси-6,16-бис(1-этоксиэтокси)-3,21-дигидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-2)

Раствор соединения 130-1 (8Е,12Е,14Е)-7-ацетокси-6,16-бис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-3,21-бис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (107 мг, 0,1156 ммоль), полученного на первой стадии, в тетрагидрофуране (6 мл) охлаждали до 5°С, добавляли к нему по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 0,25 мл, 0,25 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом и затем промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:1 > 2:1) с получением указанного в заголовке соединения (81 мг, 100%) в виде бесцветного масла.
ESI-MC m/z 719 (М+Na)+.
Третья стадия
(8Е,12Е,14Е)-7-Ацетокси-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-3)
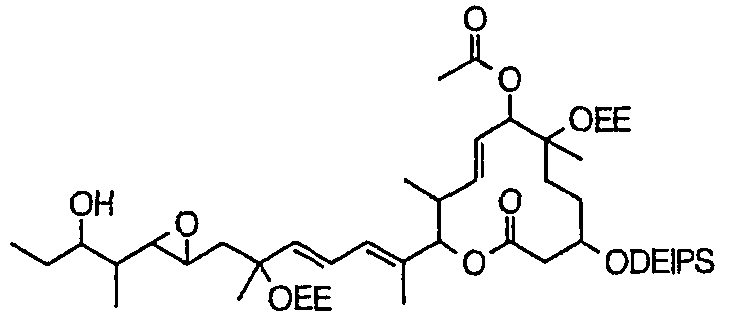
Раствор соединения 130-2 (8Е,12Е,14Е)-7-ацетокси-6,16-бис(1-этоксиэтокси)-3,21-дигидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (33,2 мг, 47,6 мкмоль), полученного на второй стадии, N,N-диметиламинопиридина (3 мг, 23,8 мкмоль) и триэтиламина (49 мг, 0,476 ммоль) в дихлорметане (1 мл) охлаждали до -20°С, добавляли к нему по каплям диэтилизопропилсилилхлорид (10,3 мг, 59,5 мкмоль) и реакционную смесь перемешивали при температуре от -20°С до 5°С в течение 1,2 часа. Затем к реакционной смеси добавляли по каплям при той же температуре диэтилизопропилсилилхлорид (31 мг, 179 мкмоль) с последующим перемешиванием в течение 4,5 часов. Еще добавляли к реакционной смеси по каплям при той же температуре диэтилизопропилсилилхлорид (41,2 мг, 238 мкмоль) с последующим перемешиванием в течение 1,3 часа и затем перемешиванием при комнатной температуре в течение одного часа. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали тонкослойной хроматографией (Merck Art 1,05628; этилацетат-гексан, 1:2) с получением указанного в заголовке соединения (19,1 мг, 49%) в виде бесцветного масла.
ESI-MC m/z 847 (М+Na)+.
Четвертая стадия
(8Е,12Е,14Е)-7-Ацетокси-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-4)

Раствор соединения 130-3 (8Е,12Е,14Е)-7-ацетокси-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (33,2 мг, 40 мкмоль), полученного на третьей стадии, и 1,8-бис(N,N-диметиламино)нафталина (51,4 мг, 0,24 ммоль) в толуоле (),7 мл) охлаждали до 5°С и добавляли к реакционной смеси по каплям метилтрифторметансульфонат (20 мг, 0,12 ммоль) с последующим добавлением 0,5 мл толуола. Реакционную смесь перемешивали при 50°С в течение 12,5 часов. Реакционную смесь охлаждали до комнатной температуры, разбавляли толуолом и добавляли при 5°С 0,06 н. водный аммиак (5 мл) с последующим перемешиванием при комнатной температуре в течение примерно 20 минут. К смеси добавляли этилацетат, воду и насыщенный водный раствор хлорида аммония, смесь перемешивали некоторое время и отделяли органический слой. Органический слой промывали последовательно 0,05 М водным раствором лимонной кислоты и водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:9 > 1:7 > 1:4 > 1:3) с получением указанного в заголовке соединения (15,8 мг, 47%) в виде бесцветного масла.
ESI-MC m/z 861 (М+Na)+.
Пятая стадия
(8Е,12Е,14Е)-3-Диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-7-гидрокси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-5)
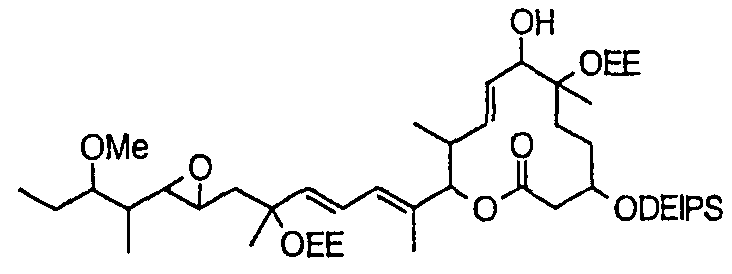
К соединению 130-4 (8Е,12Е,14Е)-7-ацетокси-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (21,5 мг, 25,6 мкмоль), полученному на четвертой стадии, добавляли 0,2 М раствор гуанидина/нитрата гуанидина (смесь метанол-дихлорметан, 9:1) (0,26 мл, 52 мкмоль) с последующим перемешиванием при комнатной температуре в течение 12,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; этилацетат-гексан, 1:7 > 1:5 > 1:4) с получением указанного в заголовке соединения (19,3 мг, 95%) в виде бесцветного масла.
ESI-MC m/z 819 (М+Na)+.
Шестая стадия
(8Е,12Е,14Е)-3-Диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-метокси-6,10,12,16,20-пентаметил-7-(4-нитрофенокси)карбокси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-6)

Раствор соединения 130-5 (8Е,12Е,14Е)-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-7-гидрокси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (19,3 г, 24,2 мкмоль), полученного на пятой стадии, N,N-диметиламинопиридина (3 мг, 24,2 мкмоль) и триэтиламина (25 мг, 0,242 ммоль) в дихлорметане (1,2 мл) охлаждали до 5°С, добавляли к нему по каплям раствор 4-нитрофенилхлорформиата (25 мг, 121 мкмоль) в дихлорметане (0,3 мл) и затем полученную смесь перемешивали при комнатной температуре в течение трех часов. Реакционную смесь разбавляли этилацетатом и затем промывали водным раствором бикарбоната натрия. Затем органический слой промывали последовательно водным раствором хлорида аммония, водным раствором бикарбоната натрия и водой в указанном порядке. Органический слой сушили над безводным сульфатом магния и упаривали с получением в остатке указанного в заголовке соединения (40,7 мг) в виде бледно-желтого твердого вещества.
Полученное твердое вещество подвергали последующей реакции без очистки.
Седьмая стадия
(8Е,12Е,14Е)-3-Диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-7)
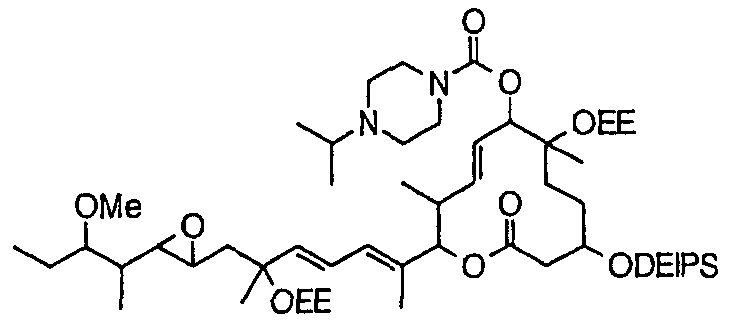
Раствор неочищенного соединения 130-6 (8Е,12Е,14Е)-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-21-метокси-7-(4-нитрофенокси)карбокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (20,4 мг, 12,1 мкмоль), полученного на шестой стадии, в тетрагидрофуране (0,9 мл) охлаждали до 5°С и добавляли к нему по каплям раствор 1-изопропилпиперазина (2,4 мг, 18,2 мкмоль) в тетрагидрофуране (0,1 мл) и триэтиламин (3,7 мг, 36,3 мкмоль) с последующим перемешиванием при комнатной температуре в течение 6,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate; смесь этилацетат-гексан, 1:3) с получением указанного в заголовке соединения (10,0 мг, 87%, две стадии) в виде бесцветного масла.
ESI-MC m/z 951 (М+Н)+.
Восьмая стадия
(8Е,12Е,14Е)-6,16-Бис(1-этоксиэтокси)-3-гидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130-8)
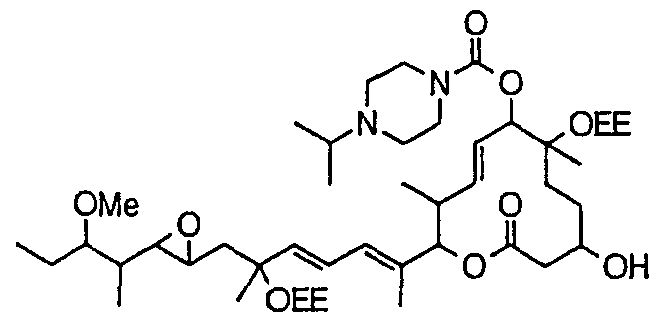
Раствор соединения 130-7 (8Е,12Е,14Е)-3-диэтилизопропилсилокси-6,16-бис(1-этоксиэтокси)-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (10 мг, 10,5 мкмоль), полученного на седьмой стадии, в тетрагидрофуране (1,0 мл) охлаждали до 5°С и добавляли к нему по каплям тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 11,6 мкл, 11,6 мкмоль), после чего перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали тонкослойной хроматографией (Merck Art 1,05628; метанол-дихлорметан, 1:29) с получением указанного в заголовке соединения (7,4 мг, 86%) в виде бесцветного масла.
ESI-MC m/z 823 (М+Н)+.
Девятая стадия
(8Е,12Е,14Е)-3,6,16-Тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 130)

К раствору соединения 130-8 (8Е,12Е,14Е)-6,16-бис(1-этоксиэтокси)-3-гидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (7,4 мг, 9 мкмоль), полученного на восьмой стадии, в смеси тетрагидрофуран:2-метил-2-пропанол=1:1 (0,7 мл) добавляли п-толуолсульфонат пиридиния (6,8 мг, 27 мкмоль), после чего перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали тонкослойной хроматографией (Fuji Silysia, NH Silica gel plate, смесь метанол:дихлорметан=1:39) с получением указанного в заголовке соединения (4,2 мг, 69%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,88 (3H, т, J=7,6 Гц), 0,89 (3H, д, J=6,8 Гц), 1,07 (6H, д, J=6,4 Гц), 1,21 (3H, с), 1,28-1,70 (11H, м), 1,77 (3H, д, J=1,2 Гц), 1,85 (1H, дд, J=5,2, 14,0 Гц), 2,47-2,62 (7H, м), 2,64 (1H, дд, J=2,4, 8,0 Гц), 2,67-2,74 (1H, м), 2,88 (1H, дт, J=2,4, 6,0 Гц), 3,14-3,19 (1H, м), 3,38 (3H, с), 3,42-3,70 (4H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 131. (8Е,12Е,14Е)-3,6,16-Тригидрокси-21-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 131)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 130.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,88 (3H, т, J=7,6 Гц), 0,89 (3H, д, J=6,8 Гц), 1,21 (3H, с), 1,29-1,70 (11H, м), 1,77 (3H, д, J=1,2 Гц), 1,85 (1H, дд, J=5,2, 14,0 Гц), 2,30 (3H, с), 2,35-2,63 (7H, м), 2,64 (1H, дд, J=2,4, 8,0 Гц), 2,88 (1H, дт, J=2,4, 6,0 Гц), 3,14-3,20 (1H, м), 3,38 (3H, с), 3,39-3,71 (4H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=10,0 Гц), 5,06 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, дд, J=1,2, 10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 651 (М+H)+.
Пример 132. (8Е,12Е,14Е)-3,6,16-Тригидрокси-21-метокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 132)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 130.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,88 (3H, т, J=7,6 Гц), 0,89 (3H, д, J=6,8 Гц), 1,22 (1,2H, с), 1,23 (1, 8H, с), 1,28-1,71 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,81-1,93 (3H, м), 2,34 (1,2H, с), 2,35 (1,8H, с), 2,50-2,67 (8H, м), 2,88 (1H, дт, J=2,0, 6,0 Гц), 3,14-3,20 (1H, м), 3,38 (3H, с), 3,47-3,56 (2H, м), 3,58-3,67 (2H, м), 3,75-3,82 (1H, м), 4,95 (1H, д, J=10,0 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц),6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 665 (М+H)+.
Пример 133. (8Е,12Е,14Е)-7-((4-Этилгомопиперазин-1-ил)карбонил)окси-3,6,16-тригидрокси-21-метокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 133)
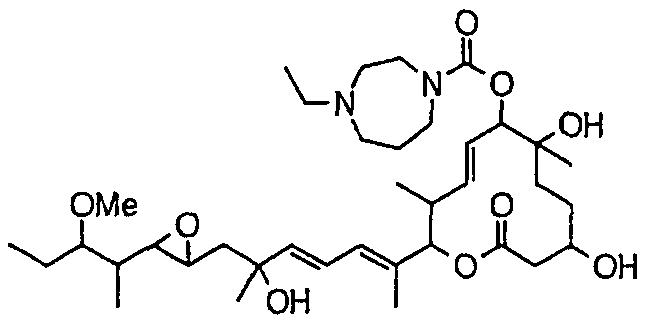
Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 130.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=7,2 Гц), 0,88 (3Н, т, J=7,6 Гц), 0,89 (3H, д, J=6,8 Гц), 1,08 (1,5H, т, J=7,2 Гц), 1,09 (1,5H, т, J=7,2 Гц), 1,22 (1,5H, с), 1,23 (1,5H, с), 1,28-1,70 (11H, м), 1,77 (3H, д, J=1,2 Гц), 1,82-1,91 (3H, м), 2,47-2,76 (10H, м), 2,88 (1H, дт, J=2,4, 6,0 Гц), 3,14-3,19 (1H, м), 3,38 (3H, с), 3,45-3,67 (4H, м), 3,75-3,82 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,8 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,73 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 134. (8Е,12Е,14Е)-7-Ацетокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-6-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 134)

Первая стадия
(8Е,12Е,14Е)-7-Ацетокси-6,10,12,16,20-пентаметил-6-(4-нитрофенокси)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 134-1)
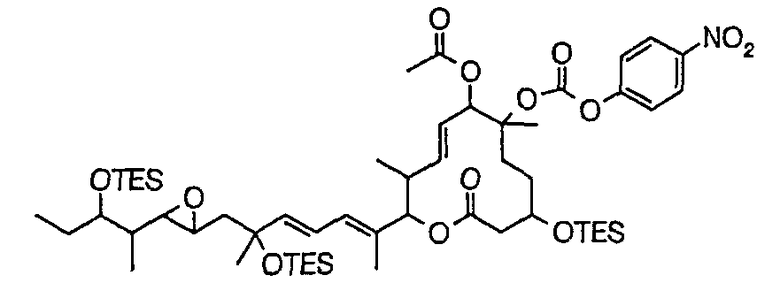
К раствору соединения 46-1 (8Е,12Е,14Е)-7-ацетокси-6-гидрокси-6,10,12,16,20-пентаметил-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (44 мг, 49 мкмоль), полученного на первой стадии примера 46, в дихлорметане (2,0 мл) добавляли триэтиламин (30 мг, 0,29 ммоль), N,N-диметиламинопиридин (90 мг, 0,73 ммоль) и 4-нитрофенилхлорформиат (90 мг, 0,44 ммоль) при охлаждении льдом и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение трех суток. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=10:90) с получением указанного в заголовке соединения (19 мг, 36%) в виде бесцветного масла.
ESI-MC m/z 1082 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-7-Ацетокси-6,10,12,16,20-пентаметил-6-((4-метилпиперазин-1-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 134-2)

К раствору соединения 134-1 (8Е,12Е,14Е)-7-ацетокси-6,10,12,16,20-пентаметил-6-(4-нитрофенил)карбокси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (9 мг, 8,5 мкмооль), полученного на первой стадии, в тетрагидрофуране (1 мл) добавляли триэтиламин (8 мг, 85 мкмоль) и 1-метилпиперазин (1,7 мг, 17 мкмоль) при комнатной температуре с последующим перемешиванием при той же температуре в атмосфере азота в течение 4 часов. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=50:50) с получением указанного в заголовке соединения (8,6 мг, 100%) в виде бесцветного масла.
ESI-MC m/z 1021 (М+Н)+.
Третья стадия
(8Е,12Е,14Е)-7-Ацетокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-6-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 134)
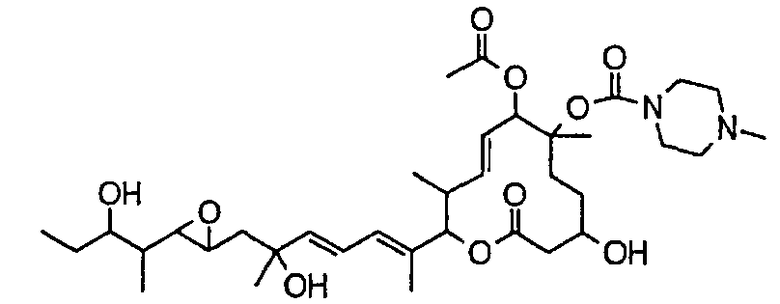
К раствору соединения 134-2 (8Е,12Е,14Е)-7-ацетокси-6,10,12,16,20-пентаметил-6-((4-метилпиперазин-1-ил)карбонил)окси-3,16,21-трис(триэтилсилокси)-18,19-эпокситрикоза-8,12,14-триен-11-олида (9 мг, 8,5 мкмоль), полученного на второй стадии, в тетрагидрофуране (1 мл) добавляли тетрабутиламмонийфторид (1,0 М тетрагидрофурановый раствор, 48 мкл, 48 мкмоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в атмосфере азота в течение 5 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия, фильтровали и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; метанол:дихлорметан=5:95) с получением указанного в заголовке соединения (4,4 мг, 77%) в виде бесцветного масла.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (6H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,20-1,28 (1H, м), 1,34 (3H, с), 1,38-1,70 (10H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,04 (3H, с), 2,31 (3H, с), 2,38-2,48 (4H, м), 2,48-2,52 (2H, м), 2,56-2,65 (1H, м), 2,66 (1H, дд, J=2,0, 7,6 Гц), 2,89 (1H, дт, J=2,0, 6,4 Гц), 3,42-3,62 (5H, м), 3,76-3,84 (1H, м), 5,01 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,8 Гц), 5,63 (1H, дд, J=9,6, 15,2 Гц), 5,75 (1H, дд, J=9,2, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 679 (М+H)+.
Пример 135. (8Е,12Е,14Е)-7-Ацетокси-6-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 135)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 134.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,22-1,32 (1H, м), 1,34 (3H, м), 1,40-1,78 (20H, м), 1,79 (3H, с), 1,82-1,93 (3H, м), 2,05 (3H, с), 2,39-2,47 (1H, м), 2,50 (2H, д, J=3,6 Гц), 2,54-2,66 (6H, м), 2,89 (1H, дт, J=2,0, 6,4 Гц), 3,37-3,64 (5H, м), 3,76-3,83 (1H, м), 5,07 (1H, д, J=10,8 Гц), 5,15 (1H, д, J=9,2 Гц), 5,63 (1H, дд, J=9,2, 15,2 Гц), 5,71 (1H, дд, J=9,2, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 761 (М+H)+.
Пример 136. (8Е,12Е,14Е)-7-Ацетокси-6-((4-этилгомопиперазин-1-ил)карбонил)окси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 136)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 134.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (6H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,08 (3H, т, J=7,2 Гц), 1,20-1,28 (1H, м), 1,34 (3H, с), 1,38-1,70 (10H, м), 1,78 (3H, с), 1,83-1,91 (3H, м), 2,03 (3H, с), 2,33-2,42 (1H, м), 2,50 (2H, д, J=3,9 Гц), 2,58-2,80 (7H, м), 2,89 (1H, дт, J=2,4, 6,4 Гц), 3,45-3,65 (5H, м), 3,75-3,84 (1H, м), 5,02 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,4 Гц), 5,63 (1H, дд, J=9,6, 15,2 Гц), 5,76 (1H, дд, J=9,6, 15,6 Гц), 5,87 (1H, д, J=15,6 Гц), 6,14 (1H, д, J=11,2 Гц), 6,53 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 707 (М+H)+.
Пример 137. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-(N-изопропилтиокарбамоилокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 137)
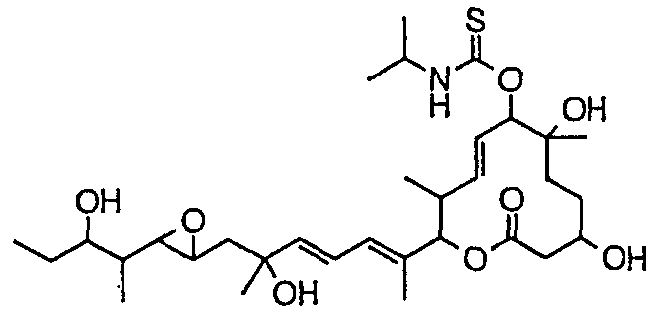
Первая стадия
(8Е,12Е,14Е)-3,6,16,21-Тетракис(1-этоксиэтокси)-7-(N-изопропилтиокарбамоилокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 137-1)

К суспензии гидрида натрия (60% масляная дисперсия, 2 мг, 0,052 ммоль) в тетрагидрофуране (0,5 мл) добавляли по каплям раствор (8Е,12Е,14Е)-3,6,16,21-тетра(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (19 мг, 0,019 ммоль), полученного в примере 3-(2), в тетрагидрофуране (0,5 мл) при охлаждении льдом и перемешивании и реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Затем к смеси добавляли по каплям изопропилизотиоцианат (6,6 мг, 0,066 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение трех часов. Добавляли к реакционной смеси воду при охлаждении льдом, чтобы прекратить реакцию, после чего смесь разбавляли этилацетатом и промывали насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; смесь этилацетат:гексан=25:75) с получением указанного в заголовке соединения (10 мг, 60%) в виде бесцветного масла.
ESI-MC m/z 922 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-7-(N-изопропилтиокарбамоилокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 137)
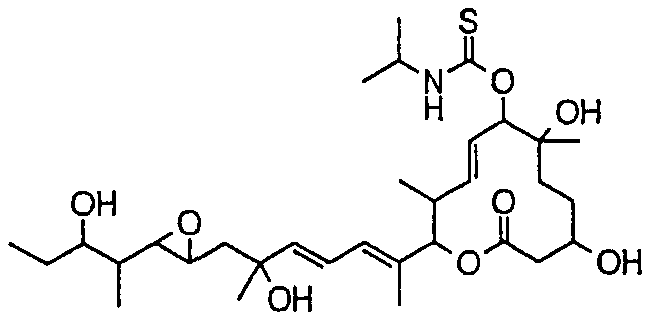
Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 3-5.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,89 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,14-1,69 (20H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,48-2,60 (3H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,49-4,08 (1H, м), 3,73-3,83 (1H, м), 4,23-4,34 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,4 Гц), 5,60-5,92 (3H, м), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 634 (М+Na)+.
Пример 138. (8Е,12Е,14Е)-7-(N-Бутилтиокарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 138)

Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 137.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,937 (3H, т, J=7,2 Гц), 0,942 (3H, т, J=7,2 Гц), 1,19 (3H, с), 1,19-1,69 (15H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,49-2,62 (3H, м), 2,66 (1H, дд, J=2,0, 8,0 Гц),2,89 (1H, дт, J=2,0, 6,0 Гц), 3,42-3,57 (3H, м), 3,73-3,83 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,07 (1H, д, J=10,4 Гц), 5,62-5,92 (3H, м), 6,14 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 648 (М+Na)+.
Пример 139. (8Е,12Е,14Е)-7-(N-(3-(N',N'-Диэтиламино)пропил)тиокарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 139)

Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 137.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,14 (6H, т, J=6,8 Гц), 1,19 (3H, с), 1,21-1,69 (13H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,48-2,61 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 3,70-3,86 (6H, м),2,89 (1H, дт, J=2,4, 5,6 Гц), 3,44-3,58 (3H, м), 3,75-3,83 (1H, м), 4,96 (1H, д, J=8,4 Гц), 5,07 (1H, д, J=10,4 Гц), 5,64-5,92 (3H, м), 6,14 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 683 (М+H)+.
Пример 140. (8Е,12Е,14Е)-7-Бензоилокси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 140)

Первая стадия
(8Е,12Е,14Е)-7-Бензоилокси-3,6,16,21-тетракис(1-этоксиэтокси)-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 140-1)
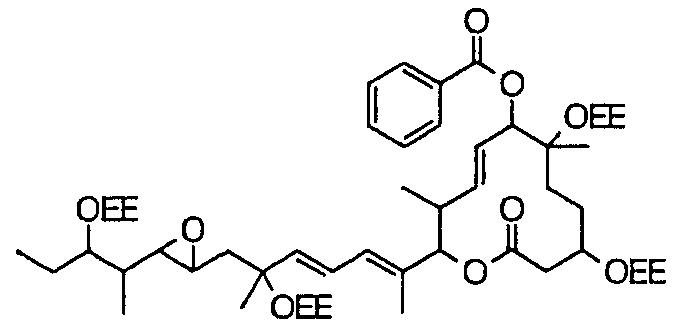
К раствору (8Е,12Е,14Е)-3,6,16,21-тетракис(1-этоксиэтокси)-7-гидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (10 мг, 12,5 мкмоль), полученного в примере 3-2, в пиридине (0,5 мл) добавляли N,N-диметиламинопиридин (8 мг, 62,5 мкмоль) и бензилхлорид (17,6 мг, 125 мкмоль) при комнатной температуре и реакционную смесь перемешивали при той же температуре в атмосфере азота в течение 12 часов. Реакционную смесь разбавляли этилацетатом и промывали насыщенным водным раствором хлорида аммония и насыщенным раствором соли. Органический слой сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; этилацетат:гексан=25:75) с получением указанного в заголовке соединения (6 мг, 55%) в виде бесцветного масла.
ESI-MC m/z 925 (М+Na)+.
Вторая стадия
(8Е,12Е,14Е)-7-Бензоилокси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 140)
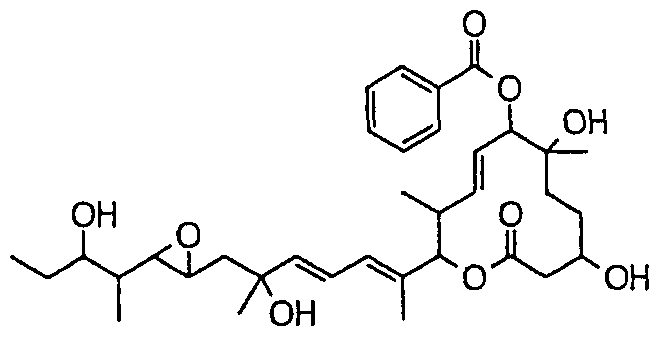
Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 3-5.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,93 (3H, т, J=7,2 Гц), 1,20-1,76 (14H, м), 1,78 (3H, с), 1,86 (1H, дд, J=5,6, 14,0 Гц), 2,53-2,64 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,4, 5,6 Гц), 3,52 (1H, дт, J=4,8, 8,0 Гц), 3,78-3,85 (1H, м), 5,09 (1H, д, J=10,8 Гц), 5,29 (1H, д, J=9,6 Гц), 5,69 (1H, дд, J=9,6, 15,2 Гц), 5,83 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=10,4 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц), 7,47 (2H, дд, J=7,6, 7,6 Гц), 7,60 (1H, дд, J=7,6, 7,6 Гц), 8,12 (2H, д, J=7,6 Гц); ESI-МС m/z 637 (М+Na)+.
Пример 141. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-пропаноилокси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 141)

Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 140.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 0,89 (3H, д, J=7,2 Гц), 0,94 (3H, т, J=7,2 Гц), 1,11 (3H, т, J=8,0 Гц), 1,18 (3H, с), 1,22-1,68 (11H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,28-2,45 (2H, м), 2,50-2,61 (3H, м), 2,66 (1H, дд, J=2,4, 8,0 Гц), 2,89 (1H, дт, J=2,0, 6,0 Гц), 3,52 (1H, дт, J=4,8, 8,0 Гц), 3,75-3,82 (1H, м), 4,95 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=9,6 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,70 (1H, дд, J=9,6, 15,2 Гц), 5,87 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=10,8 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 589 (М+Na)+.
Пример 142. (8Е,12Е,14Е)-3,6,16,21-Тетрагидрокси-6,10,12,16,20-пентаметил-7-(3-фенилпропаноил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 142)

Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 140.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,86 (3H, д, J=6,8 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,2 Гц), 1,09 (3H, с), 1,20-1,69 (11H, м), 1,77 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,46-2,59 (3H, м), 2,62-2,70 (3H, м), 2,85-2,96 (3H, м), 3,48-3,56 (1H, м), 3,72-3,80 (1H, м), 5,03 (1H, д, J=9,2 Гц), 5,05 (1H, д, J=10,8 Гц), 5,54 (1H, дд, J=9,6, 15,2 Гц), 5,66 (1H, дд, J=9,2, 15,2 Гц), 5,87 (1H, д, J=14,8 Гц), 6,13 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 14,8 Гц), 7,12-7,28 (5H, м); ESI-МС m/z 665 (М+Na)+.
Пример 143. (8Е,12Е,14Е)-7-(Гексаноил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 143)

Указанное в заголовке соединение (бесцветное масло) получали способом, подобным описанному в примере 140.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,76-0,83 (9H, м), 0,98 (3H, т, J=7,2 Гц), 1,23 (3H, с), 1,24-1,74 (17H, м), 1,82 (3H, шир.с), 1,91 (1H, дд, J=5,6, 14,4 Гц), 2,32-2,44 (2H, м), 2,52-2,69 (3H, м), 2,71 (1H, дд, J=2,4, 8,0 Гц), 2,94 (1H, дт, J=2,4, 6,0 Гц), 3,53-3,60 (1H, м), 3,78-3,86 (1H, м), 5,10 (1H, д, J=9,6 Гц), 5,11 (1H, д, J=9,6 Гц), 5,61 (1H, дд, J=9,6, 15,2 Гц), 5,74 (1H, дд, J=9,6, 15,2 Гц), 5,91 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=11,2 Гц), 6,57 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 631 (М+Na)+.
Пример 144. (8Е,12Е,14Е)-7,21-Диацетокси-3,6,16-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 144-1) и 8Е,12Е,14Е)-3,7,21-триацетокси-6,16-дигидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 144-2)
Соединение 144-1

Соединение 144-2

Раствор (8Е,12Е,14Е)-7-ацетокси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (276 мг, 0,5 ммоль), N,N-диметиламинопиридина (31 мг, 0,25 ммоль) и триэтиламина (256 мг, 2,5 ммоль) в дихлорметане (15 мл) охлаждали до -20°С, добавляли к нему по каплям в течение 30 минут раствор уксусного ангидрида (53 мг, 0,5 ммоль) в дихлорметане (2 мл) и реакционную смесь перемешивали при той же температуре в течение 30 минут. К реакционной смеси добавляли по каплям за 30 минут раствор уксусного ангидрида (10,5 мг, 0,1 ммоль) в дихлорметане (1 мл), после чего реакционную смесь перемешивали при той же температуре в течение 2,5 часов. Далее опять добавляли по каплям к реакционной смеси за 30 минут раствор уксусного ангидрида (10,5 мг, 0,1 ммоль) в дихлорметане (1 мл), после чего смесь перемешивали при той же температуре в течение 30 минут. И еще добавляли к реакционной смеси по каплям за 5 минут раствор уксусного ангидрида (21 мг, 0,2 ммоль) в дихлорметане (1 мл) с последующим перемешиванием при той же температуре в течение 30 минут. Реакционную смесь разбавляли этилацетатом, промывали водой и насыщенным водным раствором бикарбоната натрия, сушили над безводным сульфатом магния и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-50 мкм; смесь этилацетат-гексан, 2:1 3:1 4:1 9:1) с получением в остатке соединения 144-1 в виде бесцветного масла и соединения 144-2 (67,7 мг, 21%) в виде бесцветных кристаллов. Остаток соединения 144-1 затем очищали тонкослойной хроматографией (Merck Art 1,13792; этилацетат-гексан, 8:1 9:1) с получением соединения 144-1 (214,3 мг, 72%) в виде бесцветного масла.
Соединение 144-1
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, т, J=7,6 Гц), 0,88 (3H, д, J=7,2 Гц), 0,92 (3H, д, J=6,8 Гц), 1,18 (3H, с), 1,31-1,68 (11H, м), 1,77 (3H, д, J=0,8 Гц), 1,82 (1H, дд, J=5,2, 14,0 Гц), 2,05 (3H, с), 2,06 (3H, с), 2,46-2,63 (4H, м), 2,88 (1H, дт, J=2,0, 6,0 Гц), 3,75-3,81 (1H, м), 4,84-4,92 (1H, перекрытый H2O), 5,04 (1H, д, J=9,6 Гц), 5,05 (1H, д, J=10,8 Гц), 5,56 (1H, дд, J=9,6, 15,2 Гц), 5,70 (1H, дд, J=9,6, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 617 (М+Na)+.
Соединение 144-2
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, т, J=7,6 Гц), 0,89 (3H, д, J=6,8 Гц), 0,91 (3H, д, J=6,8 Гц), 1,18 (3Н, с), 1,33 (3H, с), 1,34-1,73 (8H, м), 1,77 (3H, д, J=0,8 Гц), 1,83 (1H, дд, J=5,6, 14,0 Гц), 2,04 (3H, с), 2,05 (3H, с), 2,06 (3H, с), 2,53-2,68 (4H, м), 2,88 (1H, дт, J=2,0, 6,0 Гц), 4,78-4,96 (2H, перекрытый H2O), 4,99 (1H, д, J=10,4 Гц), 5,02 (1H, д, J=9,6 Гц), 5,57 (1H, дд, J=9,6, 15,2 Гц), 5,72 (1H, дд, J=9,6, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,14 (1H, дд, J=1,2, 10,8 Гц), 6,52 (1H, дд, J=11,2, 15,2 Гц); ESI-МС m/z 659 (М+Na)+.
Пример 145. (8Е,12Е,14Е)-21-Ацетокси-3,6,16-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 145-1) и (8Е,12Е,14Е)-3,21-диацетокси-6,16-дигидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 145-2)
Соединение 145-1

Соединение 145-2

Указанные в заголовке соединения (каждый представляет собой бесцветное масло) синтезировали способом, подобным описанному в примере 144, за исключением использования соединения 44, полученного в примере 44.
Соединение 145-1
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,91 (3H, т, J=7,2 Гц), 0,93 (3H, д, J=6,8 Гц), 0,96 (3H, д, J=7,2 Гц), 1,12 (6H, д, J=6,4 Гц), 1,26 (3H, с), 1,30-1,56 (6H, м), 1,58-1,76 (5H, м), 1,82 (3H, с), 1,87 (1H, дд, J=5,6, 14,0 Гц), 2,10 (3H, с), 2,48-2,70 (8H, м), 2,70-2,82 (1H, м)2,93 (1H, дт, J=2,0, 5,6 Гц), 3,44-3,76 (4H, м), 3,78-3,88 (1H, м), 4,86-4,98 (1H, перекрытый H2O), 4,97 (1H, д, J=9,6 Гц), 5,10 (1H, д, J=10,8 Гц), 5,62 (1H, дд, J=10,0, 15,2 Гц), 5,76 (1H, дд, J=9,6, 15,2 Гц), 5,90 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=10,8 Гц), 6,57 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 707 (М+H)+.
Соединение 145-2
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,91 (3H, т, J=7,6 Гц), 0,93 (3H, д, J=6,8 Гц), 0,96 (3H, д, J=7,2 Гц), 1,12 (6H, д, J=6,4 Гц), 1,25 (3H, с), 1,30-1,92 (15H, м), 2,088 (3H, с), 2,094 (3H, с), 2,50-2,80 (9H, м), 2,93 (1H, дт, J=2,0, 6,0 Гц), 3,40-3,76 (4H, м), 4,80-4,96 (2H, перекрытый H2O), 4,96 (1H, д, J=9,6 Гц), 5,04 (1H, д, J=10,8 Гц), 5,63 (1H, дд, J=10,0, 15,2 Гц), 5,78 (1H, дд, J=9,6, 15,2 Гц), 5,91 (1H, д, J=15,2 Гц), 6,18 (1H, д, J=10,8 Гц), 6,56 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 749 М+.
Пример 146. (8Е,12Е,14Е)-6,16-Дигидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-3,21-диоксо-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 146-1) и (8Е,12Е,14Е)-3,6,16-тригидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-21-оксо-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 146-2)
Соединение 146-1

Соединение 146-2
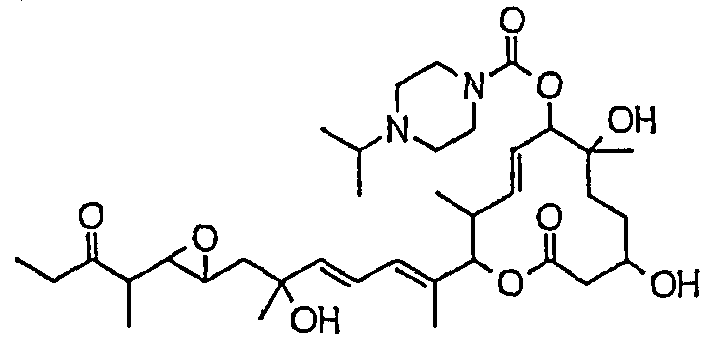
К раствору соединения 44 (20 мг, 30 мкмоль), полученного в примере 44, в дихлорметане (2,0 мл) добавляли реактив Десса-Мартина (43 мг, 0,101 ммоль) при охлаждении льдом и перемешивании и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение шести часов. Реакционную смесь разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Органический слой сушили над безводным сульфатом натрия и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Kanto silica gel 60N, 40-100 мкм; дихлорметан:метанол=95:5 90:10) с получением указанных в заголовке соединений: соединения 146-1 (9,6 мг, 48%) и соединения 146-2 (8,9 мг, 45%) в виде бесцветного масла каждое.
Соединение 146-1
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,91 (3H, д, J=6,8 Гц), 1,00 (3H, т, J=7,2 Гц), 1,07 (3H, д, J=7,2 Гц), 1,10 (6H, д, J=6,4 Гц), 1,30 (3H, с), 1,33 (3H, с), 1,63 (1H, дд, J=6,8, 14,4 Гц), 1,74-1,80 (1H, м), 1,80 (3H, с), 1,89 (1H, дд, J=5,6, 14,4 Гц), 2,00-2,08 (1H, м), 2,28-2,37 (1H, м), 2,46 (2H, д, J=12,4 Гц), 2,52-2,70 (7H, м), 2,72-2,84 (3H, м), 2,92 (1H, дт, J=2,0, 6,4 Гц), 3,31-3,33 (1H, м), 3,42-3,64 (4H, м), 4,94 (1H, д, J=8,0 Гц), 4,96 (1H, д, J=10,8 Гц), 5,23 (1H, дд, J=8,8, 15,6 Гц), 5,50 (1H, дд, J=8,4, 15,6 Гц), 5,86 (1H, д, J=15,2 Гц), 6,10 (1H, д, J=10,8 Гц), 6,54 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 661 (М+H)+, 683 (М+Na)+.
Соединение 146-2
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,88 (3H, д, J=6,8 Гц), 1,00 (3H, т, J=7,2 Гц),1,07 (3H, д, J=6,8 Гц), 1,10 (6H, д, J=7,2 Гц), 1,21 (3H, с), 1,38-1,42 (5H, м), 1,54-1,68 (3H, м), 1,77 (3H, с), 1,89 (1H, дд, J=4,8, 14,0 Гц), 2,28-2,36 (1H, м), 2,50-2,64 (8H, м), 2,75 (1H, дд, J=2,0, 8,4 Гц), 2,76-2,84 (1H, м), 2,91 (1H, дт, J=2,4, 7,6 Гц), 3,31-3,33 (1H, м), 3,42-3,64 (4H, м), 3,75-3,82 (1H, м), 4,93 (1H, д, J=9,6 Гц), 5,06 (1H, д, J=10,4 Гц), 5,57 (1H, дд, J=10,0, 15,2 Гц), 5,72 (1H, дд, J=10,0, 15,2 Гц), 5,86 (1H, д, J=15,2 Гц), 6,14 (1H, д, J=10,8 Гц), 6,53 (1H, дд, J=10,8, 15,2 Гц); ESI-МС m/z 663 (М+H)+, 685 (М+Na)+.
Пример 147. (8Е,12Е,14Е)-7-Ацетокси-6-этокси-3,16,21-тригидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олид (соединение 147)

Указанное в заголовке соединение (бесцветное масло) синтезировали способом, подобным описанному в примере 43, за исключением использования этилтрифторметансульфоната.
1H-ЯМР-спектр (CD3OD, 400 МГц) δ (м.д.): 0,87 (3H, д, J=6,4 Гц), 0,90 (3H, д, J=6,8 Гц), 0,94 (3H, т, J=7,6 Гц), 1,17 (3H, т, J=7,2 Гц), 1,20 (3H, с), 1,22-1,60 (7H, м), 1,34 (3H, с), 1,65 (1H, дд, J=6,4, 14,0 Гц), 1,78 (3H, с), 1,86 (1H, дд, J=5,2, 14,0 Гц), 2,04 (3H, с), 2,44-2,68 (4H, м), 2,89 (1H, дт, J=2,4, 5,2 Гц), 3,49-3,66 (3H, м), 3,77-3,84 (1H, м), 5,06 (1H, д, J=10,4 Гц), 5,10 (1H, д, J=9,6 Гц), 5,55 (1H, дд, J=9,6, 15,6 Гц), 5,75 (1H, дд, J=10,0, 15,6 Гц), 5,86 (1H, д, J=15,2 Гц), 6,13 (1H, д, J=11,2 Гц), 6,52 (1H, дд, J=11,2, 15,6 Гц); ESI-МС m/z 603 (М+Na)+.
Примеры изготовления лекарственных форм
Ниже показаны примеры изготовления лекарственных форм из соединений по настоящему изобретению, но указанные примеры не ограничивают изготовление лекарственных форм из соединений по настоящему изобретению.
Пример 1 изготовления лекарственных форм
Соединение примера 44 45 (частей)
Тяжелый оксид магния 15
Лактоза 75
были подвергнуты гомогенному смешиванию с образованием порошкообразного лекарственного средства в форме порошка или тонких гранул размером 350 мкм или менее. Порошкообразное лекарственное средство загружали в капсулы с получением капсулированной лекарственной формы.
Пример 2 изготовления лекарственных форм
Соединение примера 75 45 (частей)
Крахмал 15
Лактоза 16
Кристаллическая целлюлоза 21
Поливиниловый спирт 3
Дистиллированная вода 30
были подвергнуты гомогенному смешиванию, распылению, гранулированию, сушке и затем просеиванию с образованием гранул размером 1410-177 мкм.
Пример 3 изготовления лекарственных форм
Получив гранулы способом, подобным описанному в примере 2 изготовления лекарственных форм, добавляли 4 части стеарата кальция к 96 частям гранул, прессовали и формовали с получением таблеток диаметром 10 мм.
Пример 4 изготовления лекарственных форм
К 90 частям гранул, полученных способом примера 2 изготовления лекарственных форм, добавляли 10 частей кристаллической целлюлозы и 3 части стеарата кальция, прессовали и формовали с получением таблеток диаметром 8 мм. Затем наносили на них смешанную суспензию сиропа, желатина и осажденного карбоната кальция, получив в результате таблетки с сахарным покрытием.
Пример 5 изготовления лекарственных форм
Соединение примера 45 0,6 (части)
Неионогенное ПАВ 2,4
Изотонический раствор хлорида натрия 97
нагревали, смешивали и загружали в ампулу, ампулу стерилизовали с получением инъекционной лекарственной формы.
Ссылочные примеры
Соединения были получены путем следующего трехстадийного синтеза.
Ссылочный пример 1-1
Бензил 4-(циклопропилкарбонил)пиперазин-1-карбоксилат

В 35 мл N,N-диметилформамида растворяли бензил 1-пиперазинкарбоксилат (5,00 г, 22,7 ммоль) и циклопропанкарбоновую кислоту (2,54 г, 29,5 ммоль) и к полученному раствору добавляли при комнатной температуре гидрохлорид 1-этил-3-(3-(N,N-диметиламино)пропил)карбодиимида (6,53 г, 34,1 ммоль), 1-гидроксибензотриазол (4,52 г, 29,5 ммоль) и триэтиламин (3,60 г, 35,9 ммоль) с последующим перемешиванием при той же температуре в течение трех часов. Реакционную смесь смешивали с водой и экстрагировали дважды этилацетатом. Органический слой промывали последовательно водой два раза, насыщенным водным раствором бикарбоната натрия один раз и насыщенным раствором соли один раз, после чего сушили над безводным сульфатом натрия. Органический слой пропускали через колонку с силикагелем (Fuji Silysia, NH Silica gel) и упаривали с получением указанного в заголовке соединения (6,10 г, 93,1%) в виде белого аморфного вещества.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 0,75-0,83 (2H, м), 0,95-1,03 (2H, м), 1,65-1,75 (1H, м), 3,40-3,80 (8H, м), 5,16 (2H, с), 7,30-7,40 (5H, м).
Ссылочный пример 1-2. 1-(Циклопропилкарбонил)пиперазин

В 100 мл этанола растворяли бензил 4-(циклопропилкарбонил)пиперазин-1-карбоксилат (3,00 г, 10,4 ммоль) и к полученному раствору добавляли 1,5 г 10% палладия на углероде с последующим перемешиванием при комнатной температуре в атмосфере водорода в течение ночи. Удаляли фильтрованием палладий на углероде и фильтрат упаривали с получением указанного в заголовке соединения (1,50 г, 97,3%) в виде бесцветного масла.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 0,73-0,80 (2H, м), 0,96-1,03 (2H, м), 1,67-1,77 (1H, м), 2,82-2,97 (4H, м), 3,60-3,71 (4H, м).
Ссылочный пример 1-3. 1-(Циклопропилметил)пиперазин

Литийалюминийгидрид (770 мг, 20,3 ммоль) суспендировали в тетрагидрофуране (150 мл), к полученной суспензии постепенно добавляли 1-(циклопропилкарбонил)пиперазин (1,56 г, 10,1 ммоль) и реакционную смесь кипятили с обратным холодильником в течение 30 минут. Реакционную смесь охлаждали до комнатной температуры и постепенно добавляли к ней последовательно 0,8 мл воды, 0,8 мл 15% водного раствора гидроксида натрия и 2,3 мл воды. Выпавший в осадок нерастворимый материал удаляли фильтрованием через Целит и фильтрат упаривали с получением указанного в заголовке соединения (1,40 г) в виде бесцветного масла. Продукт использовали для синтеза (8Е,12Е,14Е)-7-((4-циклопропилметилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида (соединение примера 27) без дальнейшей очистки.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 0,09-0,15 (2H, м), 0,48-0,56 (2H, м), 0,82-0,93 (1H, м), 2,25 (2H, д, J=7,2 Гц) 2,48-2,65 (4H, м), 2,90-2,99 (4H, м).
Ссылочный пример 2. 1-Изобутилпиперазин

Бензил 1-пиперазинкарбоксилат (1,1 г, 5,00 ммоль) и изобутилальдегид (0,91 мл, 10,0 ммоль) растворяли в 30 мл тетрагидрофурана и к полученному раствору добавляли уксусную кислоту (0,57 мл, 10,0 ммоль) и триацетоксиборогидрид натрия (2,11 г, 10,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь смешивали с 1 н. водным раствором гидроксида натрия, экстрагировали этилацетатом два раза и объединенные органические слои промывали насыщенным раствором соли один раз. Смесь сушили над безводным сульфатом натрия и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel; этилацетат:гексан=50:50) с получением бензил 4-изобутилпиперазин-1-карбоксилата (1,05 г) в виде бесцветного масла.
Полученный бензил 4-изобутилпиперазин-1-карбоксилат (1,05 г) растворяли в 35 мл этанола, к раствору добавляли 10% палладий на углероде (750 мг) и реакционную смесь перемешивали при комнатной температуре в атмосфере водорода (1 атм) в течение 12 часов. Удаляли фильтрованием палладий на углероде и фильтрат упаривали с получением указанного в заголовке соединения (610 мг) в виде бесцветного масла.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 0,90 (6H, д, J=6,8 Гц), 1,71-1,86 (1H, м), 2,07 (2H, д, J=7,6 Гц), 2,33-2,4 3 (4H, м), 2,86-2,93 (4H, м).
Ссылочный пример 3. 1-(Тетрагидропиран-4-ил)пиперазин

Указанное в заголовке соединение синтезировали способом, подобным описанному для соединения ссылочного примера 2 (1-изобутилпиперазин).
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 1,50-1,64 (2H, м), 1,72-1,80 (2H, м), 2,36-2,46 (1H, м), 2,54-2,64 (4H, м), 2,91-2,97 (4H, м), 3,37 (2H, дт, J=2,0, 11,6, Гц), 4,03 (2H, дд, J=4,4, 11,6 Гц).
Ссылочный пример 4. 1-(Циклопропилметил)гомопиперазин

Бензил 1-гомопиперазинкарбоксилат (1,95 г, 8,32 ммоль) и циклопропанкарбоксиальдегид (700 мг, 10,0 ммоль) растворяли в 40 мл тетрагидрофурана. К раствору добавляли уксусную кислоту (600 мг, 10,0 ммоль) и триацетоксиборогидрид натрия (2,11 г, 10,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение двух часов. Реакционную смесь смешивали с 1 н. водным раствором гидроксида натрия, экстрагировали этилацетатом два раза и объединенные органические слои промывали насыщенным раствором соли один раз. Смесь сушили над безводным сульфатом натрия и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel; этилацетат:гексан=50:50) с получением бензил 4-(циклопропилметил)гомопиперазин-1-карбоксилата (2,5 г) в виде бесцветного масла.
Полученный бензил 4-(циклопропилметил)гомопиперазин-1-карбоксилат (2,5 г) растворяли в 50 мл этанола, к раствору добавляли 10% палладий на углероде (500 мг) и реакционную смесь перемешивали при комнатной температуре в атмосфере водорода (1 атм) в течение 12 часов. Удаляли фильтрованием палладий на углероде и фильтрат упаривали с получением указанного в заголовке соединения (1,4 г) в виде бесцветного масла.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 0,08-0,15 (2H, м), 0,47-0,56 (2H, м), 0,82-0,95 (1H, м), 1,80-1,89 (2H, м), 2,44 (2H, д, J=6,4 Гц) 2,75-2,85 (4H, м), 2,94-3,03 (4H, м).
Ссылочный пример 5. 1-(2,2,2-Трифторэтил)пиперазин

Бензил 1-пиперазинкарбоксилат (2,0 г, 9,08 ммоль), 2,2,2-трифторэтилтрифторметансульфонат (2,5 г, 10,8 ммоль) и триэтиламин (1,9 мл, 13,8 ммоль) растворяли в 50 мл тетрагидрофурана и реакционную смесь перемешивали при 60°С в течение двух часов. После охлаждения до комнатной температуры реакционную смесь смешивали с насыщенным водным раствором бикарбоната натрия и экстрагировали этилацетатом два раза. Объединенные органические слои промывали последовательно водой и насыщенным раствором соли в указанном порядке. Смесь сушили над безводным сульфатом натрия и упаривали. Полученный остаток очищали колоночной хроматографией на силикагеле (Fuji Silysia, NH Silica gel; этилацетат:гексан=50:50) с получением бензилового эфира 4-(2,2,2-трифторэтил)пиперазин-1-карбоновой кислоты (3,1 г) в виде бесцветного масла.
Полученный бензил 4-(2,2,2-трифторэтил)пиперазин-1-карбоксилат (3,1 г) растворяли в 50 мл этанола и к раствору добавляли 10% палладий на углероде (900 мг) с последующим перемешиванием при комнатной температуре в атмосфере водорода (1 атм) в течение ночи. Удаляли фильтрованием палладий на углероде и фильтрат упаривали с получением указанного в заголовке соединения (1,4 г) в виде бесцветного масла.
1H-ЯМР-спектр (CDCl3, 400 МГц) δ (м.д.): 2,64-2,77 (4H, м), 2,90-3,01 (6H, м).
Ссылочный пример 6
Одну полную петлю выращенной на скошенной питательной среде культуры [0,5% растворимого крахмала, 0,5% глюкозы, 0,1% экстракта из мяса рыбы (фирма-изготовитель Wako Pure Chemical Industries, Ltd.), 0,1% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.), 0,2% NZ-оболочки (фирма-изготовитель Humko Sheffield Chemical Co.), 0,2% хлорида натрия, 0,1% карбоната кальция и 1,6% агара (фирма-изготовитель Wako Pure Chemical Industries, Ltd.)] штамма Streptomyces sp. AB-1704 (FERM P-18999), выделенного из почвы, вносили в 65-мл пробирку, содержавшую 7 мл среды для посева [2,0% растворимого крахмала, 1,0% глюкозы, 0,5% полипептона (фирма-изготовитель Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.) и 0,1% карбоната кальция], и культивировали при 28°C в течение трех суток во встряхивающем инкубаторе с получением посевной культуры.
Затем 0,5 мл посевной культуры инокулировали в 65-мл пробирку, содержавшую 7 мл продукционной среды [2,0% растворимого крахмала, 1,0% глюкозы, 0,5% полипептона (фирма-изготовитель Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.) и 0,1% карбоната кальция], и культивировали при 28°С в течение трех суток во встряхивающем инкубаторе.
Далее приготавливали раствор (25 мг/мл) субстратного вещества 11107В (соединение примера А4 в WO 02/060890) в этаноле и 0,2 мл раствора добавляли в культуру. После добавления культуру встряхивали при 28°С в течение 48 часов для осуществления реакции превращения.
По окончании реакции реакционную смесь анализировали методом ВЭЖХ при следующих условиях (а) анализа методом ВЭЖХ, чтобы подтвердить образование вещества 11107D в реакционной смеси.
Условия (а) анализа методом ВЭЖХ:
Колонка: CAPCELL PACK C18 SG120 Ш4,6 мм х 250 мм (фирма-изготовитель SHISEIDO Co.)
Температура: 40°С
Скорость потока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/0,15% дигидрофосфат калия (рН 3,5) (3:7-5:5, об./об., 0-18 мин, линейный градиент), ацетонитрил/0,15% дигидрофосфат калия (рН 3,5) (5:5-85:15, об./об., 18-22 мин, линейный градиент)
Время удерживания: вещество 11107D - 9,9 мин, вещество 11107В - 19,4 мин.
Ссылочный пример 7
Одну полную петлю выращенной на скошенной питательной среде культуры (агаровая среда с дрожжами и солодом) штамма А-1545 (FERM P-18944), выделенного из почвы, инокулировали в 250-мл колбу Эрленмейера, содержавшую 20 мл среды для посева [2,4% растворимого крахмала, 0,1% глюкозы, 0,5% соевой муки (ESUSAN-MEAT, фирма-изготовитель Ajinomoto Co., Ltd.), 0,3% говяжьего экстракта (фирма-изготовитель Difco), 0,5% дрожжевого экстракта (фирма-изготовитель Difco), 0,5% триптон-пептона (фирма-изготовитель Difco) и 0,4% карбоната кальция], и культивировали при 28°C в течение трех суток во встряхивающем инкубаторе с получением посевной культуры.
Затем 0,6 мл посевной культуры инокулировали в 500-мл колбу Эрленмейера, содержавшую 60 мл продукционной среды [2% растворимого крахмала, 2% глюкозы, 2% соевой муки (ESUSAN-MEAT, фирма-изготовитель Ajinomoto Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.), 0,25% хлорида натрия, 0,32% карбоната кальция, 0,0005% сульфата меди, 0,0005% хлорида марганца, 0,0005% сульфата цинка, рН 7,4 перед стерилизацией], и культивировали при 28°С в течение четырех суток во встряхивающем инкубаторе. Каждые 2 мл полученной культуры вносили в 15-мл пробирки. Затем приготавливали раствор (20 мг/мл) вещества-субстрата 11107В в диметилсульфоксиде и добавляли 0,05 мл полученного раствора. После добавления культуру встряхивали при 28°С в течение 23 часов для осуществления реакции превращения. По окончании реакции реакционную смесь анализировали методом ВЭЖХ при следующих условиях (b) анализа методом ВЭЖХ, чтобы подтвердить образование вещества 11107D в реакционной смеси.
Условия (b) анализа методом ВЭЖХ:
Колонка: CAPCELL PACK C18 SG120 Ш4,6 мм х 250 мм (фирма-изготовитель SHISEIDO Co.)
Температура: 40°С
Скорость потока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (50:50, об./об.), изократическое элюирование
Время удерживания: вещество 11107В - 7,2 мин, вещество 11107D - 3,6 мин.
Ссылочный пример 8
Одну полную петлю выращенной на скошенной питательной среде культуры [0,5% растворимого крахмала, 0,5% глюкозы, 0,1% экстракта из мяса рыбы (фирма-изготовитель Wako Pure Chemical Industries, Ltd.), 0,1% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.), 0,2% NZ-оболочки (фирма-изготовитель Humko Sheffield Chemical Co.), 0,2% хлорида натрия, 0,1% карбоната кальция и 1,6% агара (фирма-изготовитель Wako Pure Chemical Industries, Ltd.)] штамма Streptomyces sp. AB-1704 (FERM P-18999), выделенного из почвы, вносили в 500-мл колбу Эрленмейера, содержавшую 100 мл среды для посева [2,0% растворимого крахмала, 1,0% глюкозы, 0,5% полипептона (фирма-изготовитель Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.) и 0,1% карбоната кальция], и культивировали при 28°C в течение трех суток во встряхивающем инкубаторе с получением посевной культуры. Затем каждые 2 мл посевной культуры инокулировали в 500-мл колбы Эрленмейера (150 колб), содержавшие каждая 100 мл продукционной среды [2,0% растворимого крахмала, 1,0% глюкозы, 0,5% полипептона (фирма-изготовитель Nihon Pharmaceutical Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.) и 0,1% карбоната кальция], и культивировали при 28°С в течение двух суток во встряхивающем инкубаторе.
Приготавливали раствор (20 мг/мл) вещества-субстрата 11107В в этаноле и каждые 0,44 мл раствора добавляли в культуру (100 мл/500-мл колбу Эрленмейера, 150 колб). После добавления культуру встряхивали при 28°С в течение 9 часов для осуществления реакции превращения. По окончании реакции культуры собирали и разделяли на супернатант культуры и осадок мицелия центрифугированием при 2700 об/мин в течение 10 минут. Осадок мицелия экстрагировали 5 л метанола и фильтровали с получением метанолового экстракта. Метаноловый экстракт упаривали для удаления метанола, объединяли с супернатантом культуры и экстрагировали 10 л этилацетата. Полученный этилацетатный раствор упаривали с получением 2090 мг неочищенной активной фракции. Неочищенную активную фракцию растворяли в 4 мл смеси тетрагидрофуран-метанол (1:1, об./об.) и 6 мл 50% водного раствора ацетонитрила, подвергали хроматографии на колонке ODS (фирма-изготовитель YMC Co., ODS-AM 120-S50 Ш3,6 см х 43 см) и элюировали 40% водным раствором ацетонитрила. Элюированную фракцию от 336 мл до 408 мл концентрировали досуха при пониженном давлении с получением 560 мг остатка. Затем остаток растворяли в 10 мл 50% водного раствора метанола, подвергали хроматографии на колонке ODS (фирма-изготовитель YMC Co., ODS-AM 120-S50 Ш3,6 см х 40 см) и элюировали 50% водным раствором метанола. Элюированную фракцию от 1344 мл до 1824 мл концентрировали досуха при пониженном давлении с получением 252 мг вещества 11107D.
Ссылочный пример 9
Одну полную петлю выращенной на скошенной питательной среде культуры (агаровая среда с дрожжами и солодом) штамма А-1544 (FERM P-18943), выделенного из почвы, инокулировали в 250-мл колбу Эрленмейера, содержавшую 25 мл среды для посева [2% растворимого крахмала, 2% глюкозы, 2% соевой муки (ESUSAN-MEAT, фирма-изготовитель Ajinomoto Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Difco), 0,25% хлорида натрия и 0,32% карбоната кальция, рН 7,4 перед стерилизацией], и культивировали при 28°C в течение двух суток во встряхивающем инкубаторе с получением посевной культуры. Каждые 0,75 мл культуры вносили в 2-мл пробирки с сывороткой (фирма-изготовитель Sumitomo Bakelite Co., Ltd.) и добавляли равное количество 40% водного раствора глицерина. После перемешивания содержимое замораживали при -70°С с получением замороженной посевной культуры. Замороженную посевную культуру оттаивали, 0,25 мл ее инокулировали в 250-мл колбу Эрленмейера, содержавшую 25 мл среды для посева [2% растворимого крахмала, 2% глюкозы, 2% соевой муки (ESUSAN-MEAT, фирма-изготовитель Ajinomoto Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.), 0,25% хлорида натрия и 0,32% карбоната кальция, рН 7,4 перед стерилизацией], и культивировали при 28°С в течение двух суток во встряхивающем инкубаторе с получением посевной культуры. Затем посевную культуру (0,5 мл) инокулировали в 500-мл колбу Эрленмейера, содержавшую 100 мл продукционной среды [2% растворимого крахмала, 2% глюкозы, 2% соевой муки (ESUSAN-MEAT, фирма-изготовитель Ajinomoto Co., Ltd.), 0,5% дрожжевого экстракта (фирма-изготовитель Oriental Yeast Co., Ltd.), 0,25% хлорида натрия и 0,32% карбоната кальция, рН 7,4 перед стерилизацией] и культивировали при 28°С в течение трех суток во встряхивающем инкубаторе.
Каждую из полученных культур (100 мл/500-мл колба Эрленмейера, 10 колб) подвергали центрифугированию при 3000 об/мин в течение 10 минут, чтобы собрать клетки, и клетки суспендировали в 100 мл 50 мМ фосфатного буферного раствора (рН 6,0). Затем приготавливали раствор (100 мг/мл) вещества-субстрата 11107В в диметилсульфоксиде и добавляли каждые 0,5 мл полученного раствора. После добавления культуру встряхивали при 28°С в течение 24 часов для осуществления реакции превращения. По окончании реакции реакционные смеси собирали и разделяли на супернатант и осадок мицелия центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Осадок мицелия экстрагировали 500 мл метанола и затем фильтровали с получением метанолового экстракта. Метаноловый экстракт упаривали для удаления метанола и экстрагировали 1 л этилацетата. Каждый из этилацетатных слоев промывали водой, сушили над безводным сульфатом натрия и объединенные слои упаривали с получением 937 мг неочищенной активной фракции. Неочищенную активную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 1200 мл смеси этилацетата и н-гексана (90:10, об./об.) с получением 234 мг активной фракции. Полученную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при следующих условиях (С) препаративной ВЭЖХ и полученный элюат анализировали методом ВЭЖХ при следующих условиях (c) анализа методом ВЭЖХ. Удаляли растворитель из фракции, содержавшей полученное при этом вещество 11107D, с получением 80 мг вещества 11107D.
Условия (С) препаративной ВЭЖХ:
Колонка: CAPCELL PACK C18 UG120 Ш30 х 250 мм (фирма-изготовитель SHISEIDO Co.)
Скорость потока: 20 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (30:70, об./об.), изократическое элюирование
Условия (c) анализа методом ВЭЖХ:
Колонка: CAPCELL PACK C18 SG120 Ш4,6 мм х 250 мм (фирма-изготовитель SHISEIDO Co.)
Температура: 40°С
Скорость потока: 1 мл/мин
Детектирование: 240 нм
Элюент: ацетонитрил/вода (35:65, об./об.), изократическое элюирование
Время удерживания: вещество 11107D - 7,8 мин.
Ссылочный пример 10
Каждую из культур штамма А-1545 (FERM P-18944), (100 мл/500-мл колба Эрленмейера, 10 колб), полученных способом, подобным описанному в ссылочном примере 9, подвергали центрифугированию при 3000 об/мин в течение 10 минут, чтобы собрать клетки, и клетки суспендировали в 100 мл 50 мМ фосфатного буферного раствора (рН 6,0). Затем приготавливали раствор (100 мг/мл) субстрата 11107В в диметилсульфоксиде и добавляли каждый 1 мл полученного раствора. После добавления культуру встряхивали при 28°С в течение 24 часов для осуществления реакции превращения. По окончании реакции реакционные смеси собирали и разделяли на супернатант и осадок мицелия центрифугированием при 5000 об/мин в течение 20 минут. Супернатант экстрагировали 1 л этилацетата. Осадок мицелия экстрагировали 500 мл ацетона и затем фильтровали с получением ацетонового экстракта. Ацетоновый экстракт упаривали для удаления ацетона и экстрагировали 1 л этилацетата. Каждый из этилацетатных слоев промывали водой, сушили и дегидратировали над безводным сульфатом натрия и объединенные слои упаривали с получением 945 мг неочищенной активной фракции. Неочищенную активную фракцию подвергали колоночной хроматографии на силикагеле (Kiesel gel 60, 50 г) и элюировали 100 мл смеси этилацетата и н-гексана (50:50, об./об.), 200 мл смеси этилацетата и н-гексана (75:25, об./об.) и 600 мл смеси этилацетата и н-гексана (90:10, об./об.) с получением 463 мг активной фракции. Полученную активную фракцию подвергали препаративной высокоэффективной жидкостной хроматографии (ВЭЖХ) при условиях (С) препаративной ВЭЖХ, описанных в примере 4, и полученный элюат анализировали методом ВЭЖХ при следующих условиях анализа методом ВЭЖХ, описанных в примере 4. Удаляли растворитель из фракции, содержавшей полученное при этом вещество 11107D, с получением 304 мг вещества 11107D.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ФИЗИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА | 2003 |
|
RU2338741C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ MAT2A И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2809987C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ ДИГИДРОПИРАН-2-ОНА | 2007 |
|
RU2444519C2 |
| 15,15-ДИАЛКИЛСТЕРОИДНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2147306C1 |
| ПИРИДИНОВЫЕ СОЕДИНЕНИЯ ПЛАДИЕНОЛИДА И СПОСОБЫ ПРИМЕНЕНИЯ | 2015 |
|
RU2807278C2 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2528393C9 |
| ПРОТИВООПУХОЛЕВЫЕ СОЕДИНЕНИЯ | 2008 |
|
RU2489429C2 |
| ОБЩИЙ СИНТЕЗ МИРИАПОРОНОВ | 2003 |
|
RU2328492C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ МУСКАРИНОВЫЕ АГОНИСТЫ И КОМПОЗИЦИИ, ИХ ПРИМЕНЕНИЕ И СПОСОБЫ ЛЕЧЕНИЯ | 2002 |
|
RU2292346C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ МОРФОЛИНИЛАНТРАЦИКЛИНА | 2014 |
|
RU2666356C2 |
Настоящее изобретение относится к новым макроциклическим соединениям, представленным формулой (I):

(где R3, R6, R7 и R21 являются одинаковыми или отличающимися друг от друга и каждый из них представляет значения, указанные в описании), их фармакологически приемлемым солям или их гидрату. Соединения формулы I обладают способностью угнетать ангиогенез, в частности угнетать продукцию VEGF в гипоксических условиях, и полезны в качестве терапевтического средства для лечения солидной злокачественной опухоли. Изобретение также относится к лекарственному средству на основе этих соединений, способу профилактики и лечения и применению этих соединений для изготовления средств для профилактики и лечения злокачественных заболеваний. 10 н. и 25 з.п. ф-лы., 3 табл.

(в формуле R3, R6, R7 и R21 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3, R6, R7 и R21, при условии, что R6 ограничен до гидроксильной группы,
2) необязательно замещенную С1-22алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22алкоксигруппу,
4) RCO-O- (где R представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную С6-14арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
e) необязательно замещенную C7-22аралкильную группу,
f) необязательно замещенную 5-14-членную гетероаралкильную группу,
g) необязательно замещенную С6-14арилоксигруппу
5) RS1RS2RS3SiO - (где RS1, RS2 и RS3 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) С1-6алкильную группу или
b) С6-14арильную группу),
6) RN1RN2N-RM (где RM представляет собой
a) одинарную связь,
b) -СО-O-,
c) -CS-O- или
d) -CO-NRN3- (где RN3 представляет собой атом водорода или необязательно замещенную C1-6алкильную группу), при условии, что каждая крайняя левая связь в b)-е) присоединена к атому азота; и
RN1 и RN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой а) атом водорода, b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную ненасыщенную C2-22 алкильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RN1 и RN2 вместе с атомом азота, к которому присоединены RN1 и RN2, причем неароматическая гетероциклическая группа может иметь заместители, или
g) необязательно замещенную 5-14-членную гетероаралкильную группу,
i) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу),
при условии, что исключено соединение, в котором R3, R6, R7 и R21 все представляют собой гидроксильные группы; соединение, в котором R3, R6 и R21 все представляют собой гидроксильные группы и R7 представляет собой ацетоксигруппу и соединение в котором R3, R6 представляют собой гидроксильные группы, R7 представляет собой ацетоксигруппу и R21 представляет собой оксо группу образованную вместе с атомом углерода, к которому присоединен R21), его фармакологически приемлемая соль или их гидрат.

(в формуле R3а, R6а, R7а и R21a являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3a, R6a, R7a и R21a, при условии, что R6a ограничен до гидроксильной группы,
2) необязательно замещенную С1-22 алкоксигруппу,
3) RaCO-O- (где Ra представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную С6-14арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
е) необязательно замещенную С7-22аралкильную группу,
g) необязательно замещенную С6-14арилоксигруппу или
h) необязательно замещенную 5-14-членную гетероарилоксигруппу),
4) RaS1RaS2RaS3SiO- (где RaS1, RaS2 и RaS3 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) C1-6алкильную группу или
b) С6-14арильную группу),
5) RaN1RaN2N-RaM- (где RaM представляет собой
a) одинарную связь,
b) -СО-O-,
c) -CS-O- или
е) -CO-NRaN3- (где RaN3 представляет собой атом водорода или необязательно замещенную С1-6алкильную группу, при условии, что каждая крайняя левая связь в b)-е) присоединена к атому азота); и
RaN1 и RaN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную ненасыщенную C1-22алкильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RaN1 и RaN2 вместе с атомом азота, к которому присоединены RaN1 и RaN2, причем неароматическая гетероциклическая группа может иметь заместители,
g) необязательно замещенную 5-14-членную гетероаралкильную группу, или
i) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, его фармакологически приемлемая соль или их гидрат.

(в формуле R3b, R6b, R7b и R21b являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3b, R6b, R7b и R21b, при условии, что R6b ограничен до гидроксильной группы,
2) необязательно замещенную С1-22алкоксигруппу,
3) RbCO-O- (где Rb представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную С6-14арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
e) необязательно замещенную C7-22аралкильную группу,
g) необязательно замещенную С6-14 арилоксигруппу,
4) RbS1RbS2RbS3SiO- (где RbS1, RbS2 и RbS3 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) С1-6алкильную группу или
b) С6-14арильную группу) или
5) RbN1RbN2N-RbM- (где RbM представляет собой
a) -СО-O- или
b) -CS-O-, при условии, что каждая крайняя левая связь в а) и b) присоединена к атому азота;
и
RbN1 и RbN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную ненасыщенную C2-22алкильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RbN1 и RbN2 вместе с атомом азота, к которому присоединены RbN1 и RbN2, причем неароматическая гетероциклическая группа может иметь заместители,
g) необязательно замещенную 5-14-членную гетероаралкильную группу или
i) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу)), его фармакологически приемлемая соль или их гидрат.

(в формуле R3c, R6c R7c и R21c являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3c, R6c, R7c и R21c, при условии, что R6c ограничен до гидроксильной группы,
2) необязательно замещенную С1-22алкоксигруппу,
3) RcCO-O- (где Rc представляет собой
a) необязательно замещенную С1-22алкильную группу,
b) необязательно замещенную С6-14арильную группу,
е) необязательно замещенную С6-14арилоксигруппу),
4) RcS1RcS2RcS3SiO- (где RcS1, RcS2 и RcS3 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) С1-6алкильную группу или
b) С6-14арильную группу) или
5) RcN1RcN2N-RcM- (где RcM представляет собой
a) -СО-O- или
b) -CS-O-, при условии, что каждая крайняя левая связь в а) и b) присоединена к атому азота;
и
RcN1 и RcN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
c) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RcN1 и RcN2 вместе с атомом азота, к которому присоединены RcN1 и RcN2, причем неароматическая гетероциклическая группа может иметь заместители,
d) необязательно замещенную 5-14-членную гетероаралкильную группу,
e) необязательно замещенную С3-14циклоалкильную группу или
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, его фармакологически приемлемая соль или их гидрат.

(в формуле R3d представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен R3d,
2) необязательно замещенную С1-22алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22алкоксигруппу,
4) RdCO-O- (где Rd представляет собой
а) атом водорода,
b) необязательно замещенную С1-22алкильную группу,
с) необязательно замещенную С6-14арильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
е) необязательно замещенную С6-14арилоксигруппу
или
5) RdN1RdN2N-CO-O- (где RdN1 и RdN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
a) атом водорода,
b) необязательно замещенную С7-22алкильную группу,
c) необязательно замещенную ненасыщенную C2-22алкильную группу,
d) необязательно замещенную 5-14-членную гетероарильную группу,
f) необязательно замещенную 3-14-членную неароматическую гетероциклическую группу, образованную RdN1 и RdN2 вместе с атомом азота, к которому присоединены RdN1 и RdN2, причем неароматическая гетероциклическая группа может иметь заместители), и
R6d, R7d и R21d являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R6d, R7d и R21d, при условии, что R6d ограничен до гидроксильной группы,
2) необязательно замещенную С1-22алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-22алкоксигруппу,
5) RdCO-O- (где Rd имеет такое же значение, как определенное выше),
6) RdN1RdN2N-CO-O- (где RdN1 и RdN2 имеют такие же значения, как определенные выше),
8) RdN1RdN2N-CS-O- (где RdN1 и RdN2 имеют такие же значения, как определенные выше),
его фармакологически приемлемая соль или их гидрат.
a) -СО-O- или
b) -CS-O-; и
RN1 и RN2 имеют такие же значения, как определенные выше, при условии, что каждая крайняя левая связь в а) и b) присоединена к атому азота), его фармакологически приемлемая соль или их гидрат.

(в формуле R3e и R21e являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R3e и R21e, при условии что R6e ограничен до гидроксильной группы,
2) необязательно замещенную C1-6алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-10апкоксигруппу,
4) необязательно замещенную алифатическую С2-6ацилоксигруппу или
5) ReN1ReN2N-CO-O- (где ReN1 и ReN2 являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
A) атом водорода или
B) необязательно замещенную C1-6алкильную группу); и
R6e и R7e являются одинаковыми или отличающимися друг от друга, и каждый из них представляет собой
1) гидроксильную группу или оксогруппу, образованную вместе с атомом углерода, к которому присоединен каждый из R6e и R7е, при условии, что R6е ограничен до гидроксильной группы,
2) необязательно замещенную C1-6алкоксигруппу,
3) необязательно замещенную ненасыщенную С2-10алкоксигруппу,
5) необязательно замещенную алифатическую C2-6ацилоксигруппу,
его фармакологически приемлемая соль или их гидрат.
1) атом водорода,
2) необязательно замещенную C1-6алкильную группу, его фармакологически приемлемая соль или их гидрат.

(в формуле R7f представляет собой RfC(=Yf)-O- (где Yf представляет собой атом кислорода и R представляет собой группу формулы (V)

(где n представляет собой целое число 0,
RfN1 представляет собой
1) атом водорода,
2) метильную группу или
3) этильную группу, и RfN2 представляет собой 1) атом водорода,
7) пиридинильную группу,
8) пирролидин-1-ильную группу,
9) пиперидин-1-ильную группу,
10) морфолин-4-ильную группу или
11) 4-метилпиперазин-1-ильную группу))), его фармакологически приемлемая соль или их гидрат.
(8Е,12Е,14E)-7-(N-(2-(N',N'-диметиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-бутилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-этилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-циклогексилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-(циклопропилметил)пиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-пропилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-(циклопропилметил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-циклопентилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-(N-(2-(N',N'-диэтиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изобутилгомопиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-этилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-бутилгомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,16,21-тригидрокси-6-метокси-6,10,12,16,20-пентаметил-7-((4-(пиперидинин-1-ил)пиперидин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-(2,2-диметилпропил)гомопиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида; и
(8Е,12Е,14Е)-3,6,16-тригидрокси-21-метокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида.
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилгомопиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-7-((4-метилпиперазин-1-ил)карбонил)окси-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-циклогексилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-3,6,16,21-тетрагидрокси-7-((4-изопропилпиперазин-1-ил)карбонил)окси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида;
(8Е,12Е,14Е)-7-((4-циклогептилпиперазин-1-ил)карбонил)окси-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида; и
(8Е,12Е,14E)-7-(N-(2-(N',N'-диэтиламино)этил)-N-метилкарбамоилокси)-3,6,16,21-тетрагидрокси-6,10,12,16,20-пентаметил-18,19-эпокситрикоза-8,12,14-триен-11-олида.
Приоритет от 23.05.2002 по пп.9,10,14-36
по дате подачи заявки от 29.05.2003 по пп.1-8, 11-13.
| Пловучая установка для сбора нефти с водной поверхности | 1947 |
|
SU75126A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| RU 2000102893 A, 10.12.2001 | |||
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА И ПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2132848C1 |
Авторы
Даты
2009-02-27—Публикация
2003-05-29—Подача