Настоящее изобретение относится к новым аналогам мириапоронов и к их использованию для лечения рака. Настоящее изобретение относится также к общему синтезу мириапоронов и аналогов.
Уровень техники
Мириапороны представляют собой новый класс производных поликетидов морских веществ, выделенных из бриозоанов Myriapora truncata.

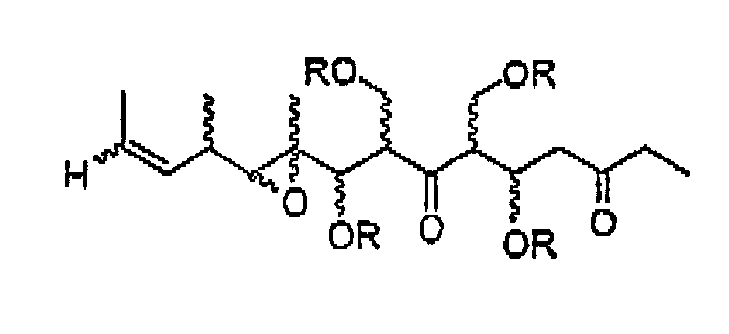
Описано, что мириапороны обладают противоопухолевой активностью. Полная структура данных родственных соединений была приведена K. L. Rinehart et al., J. Nat. Prod. 1995, 58, 344 и в патенте США № 5514708. Описанные там мириапороны 3 и 4 находятся в форме равновесной смеси между свободным гидроксикетоном и полукеталем, как изображено выше.
Было предпринято несколько безуспешных попыток синтеза мириапоронов, см., например, Taylor, R. E.; Ciavarri, J. C.; Hearn, B. R. "A Divergent Approach the Myriaporones and Tedanolide: Enantioselective Preparation of the Common Intermediate" Tetrahedron Lett. 1998, 39, 9361; Taylor et al., Org. Lett. 2002, 4, 2853, доступные на Web с 02 августа 2002 г.
Ввиду их интересных биологических свойств существует потребность в предоставлении эффективного стереоконтролируемого общего синтеза мириапоронов и родственных соединений.
Сущность изобретения
В первом аспекте настоящее изобретение направлено на соединения общей формулы I, или их фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры

в которых каждый из заместителей, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил;
группу R' выбирают из замещенной или незамещенной алкильной, замещенной или незамещенной алкенильной, замещенной или незамещенной алкинильной, аминоалкильной, арильной, аралкильной и гетероциклической групп, а
группу R'' выбирают из группы, включающей H, OH, OR', OCOR', SH, SR', SOR', SO2R', NO2, NH2, NHR', N(R')2, NHCOR', N(COR')2, NHSO2R', CN, галогена, C(=O)H, C(=O)R', CO2H, CO2R',CH2OR,замещенный или незамещенный алкил, замещенный или незамещенный галогеналкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкилиден, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный аралкил, или замещенный или незамещенный гетероароматический радикал;
при условии, что соединение не является соединением 1, 3 или 4 патента США № 5514708.
Соединение 1 патента США № 5514708 соответствует приведенной выше формуле 1 в описании предшествующего уровня техники.
Согласно исследованиям авторов изобретения, природные соединения 3 и 4 патента США № 5514708 соответствуют соединениям 3а и 4а, описанным в приведенных ниже примерах.
В том случае, когда R'' представляет собой СН2ОН, соединения формулы I могут существовать в виде смеси изомера кетона и изомера полукеталя (5),
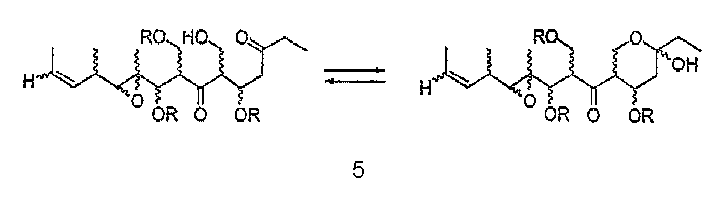
в которых заместители, обозначенные R, являются определенными выше.
В частности, авторы изобретения предпочитают, чтобы, по меньшей мере, один из заместителей R не являлся водородом. Авторами изобретения найдено, что подобные соединения проявляют повышенную цитотоксичность.
Мириапороны получают из природных источников. Следующей целью настоящего изобретения является предоставление синтетического подхода к получению мириапоронов и их производных. Таким образом, настоящее изобретение направлено на синтез соединений формулы I, определенных выше, включая те из них, в которых все группы R являются Н, и на промежуточные соединения, используемые в процессе синтеза.
Согласно настоящему изобретению предлагаемый способ включает в себя снятие защитной группы в соединении формулы 5а, в котором, по меньшей мере, одна группа R представляет собой защитную группу, с получением соответствующего соединения формулы 5b, в котором, по меньшей мере, одна указанная группа R представляет собой водород. Данный синтетический подход можно использовать для новых и известных мириапоронов.
Следующий вариант осуществления настоящего изобретения представляет собой фармацевтическую композицию, включающую в себя соединение формулы I или его фармацевтически приемлемую соль, производное, пролекарство, или стереоизомер, или промежуточное соединение для его синтеза, и фармацевтически приемлемый носитель.
Следующий вариант осуществления настоящего изобретения представляет собой использование соединений формулы I, или их фармацевтически приемлемых солей, производных, пролекарств, или стереоизомеров в качестве противоопухолевых агентов.
Подробное описание изобретения
Настоящее изобретение относится к соединениям формулы I, определенным выше.
В данных соединениях заместители могут быть выбраны согласно следующему принципу.
Алкильные группы предпочтительно содержат от 1 до 12 атомов углерода. Один из более предпочтительных классов алкильных групп содержит от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и наиболее предпочтительно 1, 2, 3, или 4 атома углерода. В соединениях настоящего изобретения метил, этил и пропил, включая изопропил, являются особенно предпочтительными алкильными группами. Как использовано здесь, термин алкил, если нет иных изменений, относится как к циклическим, так и к ациклическим группам, хотя циклические группы будут содержать, по меньшей мере, три углеродных члена цикла.
Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения содержат одну или более ненасыщенных связей и от 2 до 12 атомов углерода, более предпочтительно от 2 до 8 атомов углерода, еще более предпочтительно от 2 до 6 атомов углерода и даже более предпочтительно 2, 3, или 4 атома углерода. Используемые здесь термины алкенил и алкинил относятся как к циклическим, так и к ациклическим группам, хотя линейные или разветвленные ациклические группы, как правило, более предпочтительны.
Алкилиденовые группы могут быть разветвленными или неразветвленными и предпочтительно содержат от 1 до 12 атомов углерода. Один из более предпочтительных классов алкилиденовых групп содержит от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и наиболее предпочтительно 1, 2, 3, или 4 атома углерода. В соединениях настоящего изобретения метилиденовая, этилиденовая и пропилиденовая, включая изопропилиденовую, являются особенно предпочтительными алкилиденовыми группами.
Предпочтительные алкилсульфинильные группы в соединениях настоящего изобретения включают в себя группы, содержащие одну или более сульфоксидных (SO) групп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. В особенности предпочтительны алкилсульфинильные группы, содержащие 1, 2, 3, или 4 атома углерода.
Предпочтительные алкилсульфонильные группы в соединениях настоящего изобретения включают в себя группы, содержащие одну или более сульфонильных (SO2) групп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода и еще более предпочтительно от 1 до 6 атомов углерода. В особенности предпочтительны алкилсульфонильные группы, содержащие 1, 2, 3, или 4 атома углерода.
Предпочтительные аминоалкильные группы включают в себя группы, содержащие одну или более первичных, вторичных и/или третичных аминогрупп и от 1 до 12 атомов углерода, более предпочтительно от 1 до 8 атомов углерода, еще более предпочтительно от 1 до 6 атомов углерода и еще более предпочтительно 1, 2, 3, или 4 атома углерода. Обычно вторичные и третичные аминогруппы более предпочтительны, чем первичные аминогруппы.
Подходящие гетероциклические группы включают в себя гетероароматические и гетероалициклические группы. Подходящие гетероароматические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранных из N, O или S атомов, и включают в себя, например, кумаринил, включая 8-кумаринил, хинолинил, включая 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазол. Подходящие гетероалициклические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранных из N, O или S атомов, и включают в себя, например, тетрагидрофуранильную, тетрагидропиранильную, пиперидинильную, морфолино- и пирролидинильную группы.
Подходящие арильные группы в соединениях настоящего изобретения включают в себя моно- и полициклические соединения, включая полициклические соединения, содержащие отдельные и/или конденсированные арильные группы. Обычные арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 до около 18 атомов углерода цикла. Особенно предпочтительные арильные группы включают в себя замещенный или незамещенный фенил, нафтил, дифенил, фенантрил и антрацил.
Приведенные здесь ссылки на замещенные группы в соединениях настоящего изобретения относятся к конкретной группе, обычно алкилу или алкенилу, которые могут быть замещены в одном или более возможных положениях одной или более подходящими группами, например галогеном, таким как фтор, хлор, бром или йод, циано, гидроксилом, нитро, азидо, карбоксамидо, алкильными группами, включая группы, содержащие от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода и более предпочтительно 1-3 атома углерода, алкенильными и алкинильными группами, включая группы, содержащие одну или более ненасыщенных связей и от 2 до около 12 атомов углерода, или от 2 до около 6 атомов углерода, алкоксигруппами, включая группы, содержащие одну или более связей с кислородом и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, арилокси, таким, как фенокси, алкилтиогруппами, включая группы, содержащие одну или более тиоэфирных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, алкилсульфинильными группами, включая группы, содержащие одну или более сульфинильных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, алкилсульфонильными группами, включая группы, содержащие одну или более сульфонильных связей и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, аминоалкильными группами, такими, как группы, содержащие один или более N атомов и от 1 до около 12 атомов углерода, предпочтительно от 1 до около 6 атомов углерода, арилом, содержащим 6 и более атомов углерода, в частности фенилом, аралкилом, таким, как бензил, гетероциклическими группами, включая гетероалициклические и гетероароматические группы, в особенности содержащие от 5 до 10 атомов цикла, из которых от 1 до 4 являются гетероатомами, более предпочтительно гетероциклическими группами, содержащими 5 или 6 атомов цикла и 1 или 2 гетероатома, или содержащими 10 атомов цикла и от 1 до 3 гетероатомов.
Предпочтительные группы R включают алкил, алкенил и алкинил, которые могут быть замещены в одном или более возможных положениях одной или более подходящими группами, например галогеном, таким, как фтор, хлор, бром и йод, в особенности, ω-хлор или перфтор, аминоалкильными группами, такими, как группы, содержащие один или более атомов N и от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода, арилом, содержащим 6 или более атомов углерода, в частности фенилом, аралкилом, таким, как бензил, гетероциклическими группами, включая гетероалициклические и гетероароматические группы, в особенности содержащие от 5 до 10 атомов цикла, из которых от 1 до 4 являются гетероатомами, более предпочтительно гетероциклическими группами, содержащими 5 или 6 атомов цикла и 1 или 2 гетероатома или содержащими 10 атомов цикла и от 1 до 3 гетероатомов, при этом гетероциклические группы необязательно замещены одним или более заместителями, в особенности амино, таким, как диметиламино или кето.
Термин «фармацевтически приемлемые соли, производные, пролекарства» относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению, которое при введении реципиенту способно дать (непосредственно или косвенно) описанное здесь соединение. Однако понятно, что в рамки данного изобретения входят также не фармацевтически приемлемые соли, поскольку их можно использовать для получения фармацевтически приемлемых солей. Получение солей, пролекарств и производных можно осуществить способами, известными в данной области техники.
Например, фармацевтически приемлемые соли предоставленных здесь соединений получают из исходных соединений, содержащих основную или кислотную группу, обычными химическими способами. Как правило, подобные соли получают, например, вводя во взаимодействие данные соединения в форме свободной кислоты или свободного основания со стехиометрическим количеством соответствующего основания или кислоты в воде или органическом растворителе, или в их смеси. Обычно предпочитают неводные среды, например эфир, этилацетат, этанол, изопропанол или ацетонитрил. Примеры солей присоединения кислоты включают в себя соли присоединения минеральных кислот, например такие, как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, и соли присоединения органических кислот, такие, например, как ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры солей присоединений оснований включают в себя неорганические соли, например такие, как соли натрия, калия, кальция и аммония, и соли органических оснований, например таких, как этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот.
Соединения данного изобретения могут находиться в кристаллическом состоянии либо в виде свободных соединений, либо в виде сольватов (например, гидратов) и подразумевается, что в рамки настоящего изобретения входят обе формы. Методы сольватирования общеизвестны в данной области техники.
Любое соединение, являющееся пролекарством соединения формулы I, соответствует рамкам и духу настоящего изобретения. Термин «пролекарство» использован в его самом широком смысле и включает в себя такие производные, которые превращаются in vivo в соединения данного изобретения. Подобные производные легко может представить себе специалист в данной области техники и они включают, например, соединения, в которых свободная гидроксигруппа переведена в сложноэфирное производное.
Соединения настоящего изобретения, представленные описанной выше формулой I, могут включать энантиомеры в зависимости от их асимметрии или диастереоизомеры. Отдельные изомеры и смеси изомеров входят в рамки настоящего изобретения.
В одном из аспектов настоящее изобретение распространяется на соединения формулы I, отличающиеся от известных мириапоронов в том, что касается одного или более положений стереохимии. Таким образом, в данном аспекте соединения представляют собой изомеры и изомерные производные.
Предпочтительной стереохимией соединений формулы I является

В случае, когда R'' является СН2ОН, предпочтительной стереохимией соединений формулы (5) является

Особенно предпочтительными являются соединения со следующей стереохимией:

и
Авторами изобретения найдено, что данные конкретные группы соединений проявляют улучшенные биологические свойства.
В следующем предпочтительном варианте осуществления R'' представляет собой замещенный или незамещенный алкилиден.
В одном из предпочтительных вариантов осуществления соединений формулы (5), по меньшей мере, один из заместителей R является С(=О)R'. Особенно предпочтительным является соединение формулы (47):
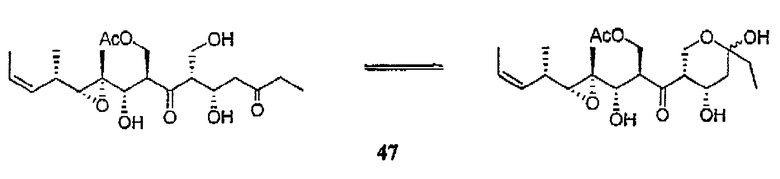
В следующем варианте осуществления соединений формулы I или формулы (5), по меньшей мере, один из заместителей R не является водородом. Подходящим образом каждая группа, не являющаяся водородом, представляет собой защитную группу, которая может быть одинаковой или различной.
Предпочтительны соединения следующей формулы:
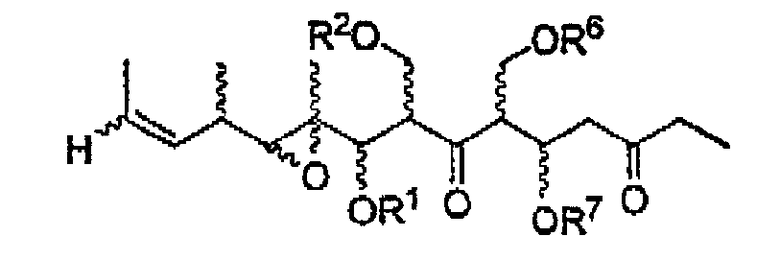
в которой R1, R2, R6 и R7 являются защитными группами для гидрокси.
В особенности предпочтительными являются соединения формулы (19):

в которой R1, R2, R6 и R7 являются защитными группами для гидрокси;
и формулы (30):

в которой R1, R2, R6 и R7 являются защитными группами для гидрокси.
Подходящим образом R1, R2, R6 и R7 являются одинаковыми защитными группами. Их можно выбрать из числа TBS (tBuMe2Si-), TBDPS (tBuPh2Si-), TES (Et3Si-), MOM (CH3OCH2-), MEM (CH3OCH2CH2OCH2-), SEM ((CH3)3SiCH2CH2OCH2-) и Ac- (CH3CO-). Особенно предпочтительными являются TBS (tBuMe2Si-) или TBDPS (tBuPh2Si-).
Предпочтительными являются также соединения следующей формулы:

в которой R1 является защитной группой для гидрокси.
В особенности предпочтительны соединения формул (20) и (31):


В приведенных выше соединениях R1 подходящим образом является TBS (tBuMe2Si-).
В настоящем изобретении также предоставлен способ синтеза мириапоронового соединения формулы (5):

которое может существовать в виде смеси изомера кетона и изомера полукеталя или в виде одной из этих двух изомерных форм;
в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил, и в котором, по меньшей мере, одна группа R является водородом;
и в котором группу R' выбирают из замещенной или незамещенной алкильной, замещенной или незамещенной алкенильной, замещенной или незамещенной алкинильной, аминоалкильной, арильной, аралкильной и гетероциклической групп;
который включает снятие защитной группы в промежуточном соединении формулы:
в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил или аралкил, и в котором одна или каждая группа R, которая должна стать водородом в соединении 5, в промежуточном соединении является защитной группой;
и в котором группа R' аналогична определенной.
Подходящим образом в промежуточном соединении более одной группы R являются защитными.
Способ изобретения может включать в себя снятие, по меньшей мере, одной защитной группы в соединении формулы (19):

в котором R1, R2, R6 и R7 являются защитными группами для гидрокси.
Родственный способ данного изобретения может включать в себя снятие, по меньшей мере, одной защитной группы в соединении формулы (30):

в котором R1, R2, R6 и R7 являются защитными группами для гидрокси.
Подходящим образом R1, R2, R6 и R7 являются одинаковыми защитными группами и их удаляют.
Другой способ изобретения включает в себя снятие защитной группы в соединении формулы (20):

в котором R1 является защитной группой для гидрокси.
Родственный способ данного изобретения включает в себя снятие защитной группы в соединении формулы (31):

в котором R1 является защитной группой для гидрокси.
Кроме того, в изобретении предоставлен способ синтеза мириапоронового соединения формулы I:

в котором заместители R и R'' аналогичны описанным выше для формулы I;
который включает в себя получение производного соединения формулы (5):

которое может существовать в виде смеси изомера кетона и изомера полукеталя или в виде одной из этих двух изомерных форм;
и в котором заместители аналогичны описанным в п. 25.
Кроме того, в изобретении предоставлены соединения следующей формулы:

в котором R1, R2 и R4 являются защитными группами для гидрокси, а L представляет собой стереоспецифическую уходящую группу, наводящую хиральность.
Предпочтительными являются соединения формул (10) и (22):


Кроме того, в изобретении предоставлены соединения следующей формулы:
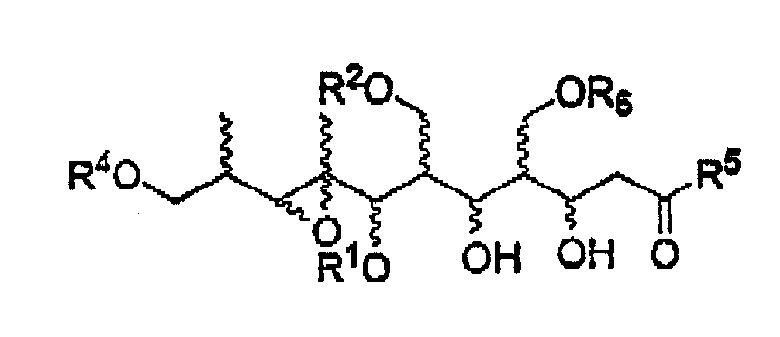
в которых R1, R2, R4 и R6 являются защитными группами для гидрокси;
R5 выбирают из группы, включающей H, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил или аралкил;
а R' имеет значение, аналогичное определенному в п. 1.
Предпочтительными являются соединения формул (14) и (26):

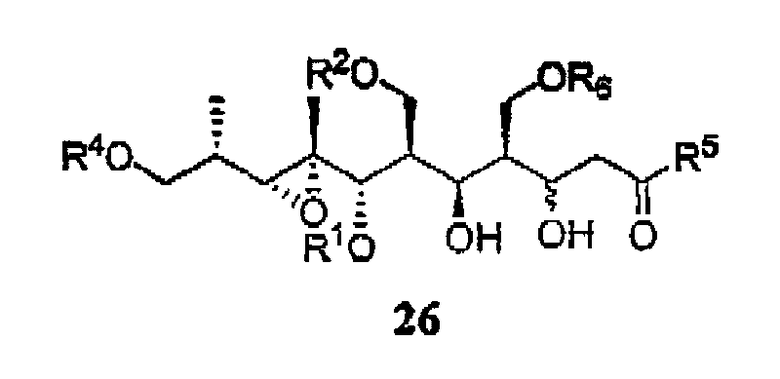
В изобретении также предоставлен способ получения соединения формулы (14), включающий в себя наращивание цепи в соединении формулы (13), способ получения соединения формулы (26), включающий в себя наращивание цепи в соединении формулы (25), способ получения соединения формулы (19), включающий в себя наращивание цепи в соединении формулы (18) и способ получения соединения формулы (30), включающий в себя наращивание цепи в соединении формулы (29).
Кроме того, в изобретении представлены соединения следующей формулы:

в которых R1, R2 и R4 являются защитными группами для гидрокси.
Предпочтительными являются соединения формул (11) и (23):


Кроме того, в изобретении представлены соединения следующей формулы:

в которых R1, R2 и R4 являются защитными группами для гидрокси.
Предпочтительными являются соединения формулы (8):
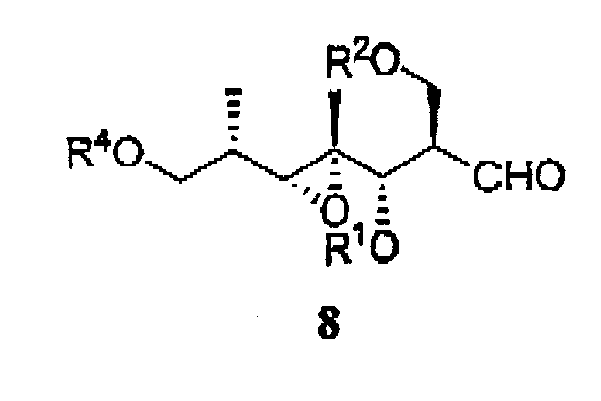
Соединения настоящего изобретения можно синтезировать из промежуточного соединения 6, описанного W. R. Roush et al., Org. Lett. 1999, 1, 95, или из его стереоизомеров.

Способ получения соединений формулы I приведен на схеме 1.

Схема 1
Для обсуждения данной схемы атомам углерода в каждой взятой в отдельности молекуле приписан номер, соответствующий их конечному положению в конечном продукте формулы I с использованием системы нумерации, приведенной ранее для известного соединения 3/4. Схема 1 включает
- защиту соединения 6 с получением защищенного соединения 7. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSCl, TESOTf, MOMBr или tBu2Si(OTf)2) в условиях, соответствующих известным методикам органического синтеза (например, имидазол, DIPEA, или 2,6-лутидин в ДМФА или CH2Cl2), рассматриваются также альтернативные защитные группы,
- превращение терминальной винильной группы при 6 и 7 атомах углерода в альдегид в соединении (8). Это превращение осуществляют озонолизом данной винильной группы (например, при действии О3 в CH2Cl2 при -78°С) или за счет образования соответствующего дигидроксипроизводного (например, при действии NMO, OsO4 в смеси ТГФ:Н2О) и расщепления данного диола (например, NaIO4 в смеси ТГФ:Н2О) в соответствующий альдегид,
- взаимодействие с оксазолидиноном 9 с получением соединения 10. Оксазолидинон 9 переводят в соответствующий енолят (например, при действии Bu2BOTf и Et3N в CH2Cl2 при -78°С) и прибавляют к 8 при низкой температуре (-30°С), получая 10. В рамках защиты данного изобретения рассматриваются также другие стереоспецифические уходящие группы, наводящие требуемую хиральность,
- восстановление соединения 10 с получением 17-гидроксиметильной боковой цепи в соединении 11. Данное восстановление проводят при действии соответствующего реагента (такого, как LiBH4) в условиях (например, в смеси ТГФ:Н2О, или в CH2Cl2) по известным методикам органического синтеза, хотя в рамках защиты данного изобретения рассматриваются также другие восстанавливающие агенты,
- последующую защиту 17-гидроксигруппы с получением соединения 12. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSCl, TESCl, MEMCl или SMCl) в условиях, соответствующих известными методиками органического синтеза (например, имидазол, DIPEA, DMAP, или Et3N в ДМФА, или CH2Cl2), при этом в изобретении рассматриваются также другие защитные группы,
- превращение терминальной винильной группы при 4 и 5 атомах углерода в альдегид в соединении 13. Данное превращение осуществляют озонолизом данной винильной группы (например, при действии О3 в CH2Cl2 при -78°С), или за счет образования соответствующего дигидроксипроизводного (например, при действии NMO, OsO4 в смеси ТГФ:Н2О) и расщепления данного диола (например, NaIO4 в смеси ТГФ:Н2О или Pb(OAc)4 в толуоле) в соответствующий альдегид,
- наращивание цепи при 5 атоме углерода с получением соединения 14. В иллюстративном примере выбранный реагент (СН3С(О)N(CH3)OCH3) переводят в соответствующий енолят ([(СН3)3Si]2NLi в ТГФ при -78°С) и прибавляют к 13 при низкой температуре (-78°С), получая 14, при этом для достижения той же цели также можно использовать альтернативные методики наращивания цепи, известные специалисту в данной области техники,
- последующую защиту 5-гидроксигруппы с получением соединения 15. Данную защиту осуществляют при помощи соответствующего реагента для выбранной защитной группы (такого, как TBSOTf) в условиях (2,6-лутидин в CH2Cl2), соответствующих известным методикам. Можно также использовать альтернативные защитные группы,
- окисление гидроксигруппы при 7 атоме углерода для получения соединения 16. Данное окисление проводят при помощи соответствующего реагента (такого, как перйодинан Десс-Мартина) в условиях, соответствующих известным методикам органического синтеза (например, в CH2Cl2),
- снятие защиты с 13-защищенной гидроксигруппы с получением соединения 17 со снятой терминальной защитой. Данное снятие защиты проводят при помощи соответствующего реагента (например, DDQ) для выбранной защитной группы (например, РМВ) в условиях, соответствующих известным методикам (например, в смеси CH2Cl2:H2O),
- формирование терминальной олефиновой группы путем наращивания цепи за счет 14 и 15 атомов углерода с получением соединения 18. Данное превращение осуществляют в две стадии: а) окисление первичной гидроксигруппы в соответствующий альдегид при действии выбранного реагента (например, перйодинана Десс-Мартина) и b) образование цис-двойной связи по реакции Виттига или Хорнера-Водсворта-Эммонса в стандартных условиях, при этом для достижения той же цели также можно использовать альтернативные методы наращивания цепи, известные специалисту в данной области техникик,
- образование, в том случае, если таковой еще отсутствует, 7-кето-заместителя в соединении 19. Данное окисление проводят при помощи соответствующего реагента (такого, как перйодинан Десс-Мартина) в условиях, соответствующих известным методикам органического синтеза (например, в CH2Cl2),
- наращивание цепи за счет атомов углерода 1 и 2, если оно еще отсутствует в соединении 19. Данное расширение проводят при помощи соответствующего реагента (такого, как BrMgEt) в условиях, соответствующих известным методикам органического синтеза (например, в ТГФ),
- частичное или полное снятие защиты, приводящее к соединению 20 или 4/3. Данное снятие защиты проводят при помощи соответствующего реагента (такого, как TBAF или AcOH) для выбранной защитной группы (например, TBS) в условиях, соответствующих известным методикам (например, в CH2Cl2),
- и необязательная дериватизация с получением производного, представленного как соединение (I), в котором, по меньшей мере, один R не является водородом, например, реакцией с Ас2О, любым алкилкарбонилхлоридом, или ангидридом в присутствии соответствующего основания (например, Et3N) в любом подходящем растворителе, например таком, как CH2Cl2.
Кроме того, из промежуточного соединения 8 получают различные изомерные синтетические мириапороны при использовании другой стереоспецифической уходящей группы, например при использовании (S)-оксазолидинона вместо (R)-оксазолидинона. Способ получения данных соединений представлен на схеме 2.

Схема 2
В схему реакции 2 входят те же реакции, что и реакции из схемы 1, с другой стереохимией оксазолидинона 9.
Цель данного изобретения состоит в предоставлении первого общего синтеза мириапоронов 3 и 4 и получении из этих соединений или предшествующих промежуточных соединений других соединений формулы I. Данный синтез предпочтительно позволил бы получать наибольшие возможные количества мириапоронов 3 и 4 при помощи простых подходов и способов. Данный синтез также дал бы возможность получать наибольшее возможное число определенных производных мириапоронов 3 и 4. Кроме того, данный синтез предпочтительно происходил бы стереоселективно, так что можно было бы получать четыре диастереоизомера мириапоронов 3 и 4 в индивидуальном состоянии. Следующая цель изобретения заключается в предоставлении некоторых промежуточных соединений общего синтеза, что сделает синтез гибким, насколько это возможно и, таким образом, позволит получать широкий ряд производных.
В предыдущих схемах реакций защитные группы для гидроксигрупп R1, R2, R4, R6 и R7 могут представлять собой любой пример защитной группы для гидроксигруппы, приведенный в "Protective Groups in Organic Synthesis", T.W. Green, P.G. Wuts, Ed. Wiley-Interscience, 3rd Edition. Примеры защитных групп для гидроксигрупп приведены в следующем перечне:
(Аббревиатура)
Предпочтительными R2, R4, R6 и R7 являются TBS (tBuMe2Si-), TBDPS (tBuPh2Si-), TES (Et3Si-), MOM (CH3OCH2-), MEM (CH3OCH2CH2OCH2-), SEM ((CH3)3SiCH2CH2OCH2-) и Ас-, а более предпочтительными являются TBS и TBDPS. Кроме того, предпочтительно, чтобы R2, R4, R6 и R7 являлись одинаковыми защитными группами. Предпочтительным R1 является PMB (п-МеО-Ph-CH2-). Реакции защиты и снятия защиты, представленные на предшествующих схемах реакций, проводят согласно состоянию данной области техники.
Представленную на схемах группу R3 выбирают из группы, включающей H, OH, =O, OR', OSiR', OSOR', OSO2R', OCOR', OCOOR', CONR', NHR' и NR'R'. R' имеет значение, аналогичное определенному в формуле I. Предпочтительный R3 является гидрокси или =О.
Группу, представленную на схемах как R5, выбирают из группы, включающей H, SOR', SO2R', C(=O)R', C(=O)OR', C(=O)NR', замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, арил, гетероарил, или аралкил. И R' имеет значение, аналогичное определенному в формуле I. Предпочтительный R5 является С1-С6, а более предпочтительный - этилом.
Тождественность соединений 9 и 21 можно изменить, получая соединения 11 и 23 из соединения 8 другими способами, в соответствии с состоянием данной области техники.
Относительную стереохимию при атомах С-8-С-12 соединений 3 и 4 считают аналогичной той, которая описана в патенте № 5514708, 1996, исходя из сопоставления приведенных там констант спин-спинового взаимодействия. Кроме того, стереохимия описанного выше исходного соединения 6 была уже указана W.R. Roush et al., Org. Lett. 1999, 1, 95.
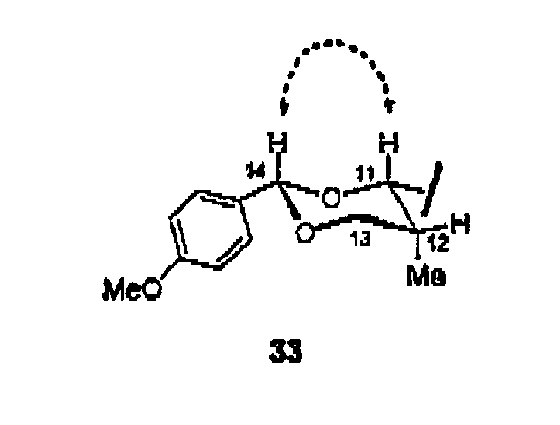
Для подтверждения данной информации стереохимия указанных атомов углерода была установлена на основании экспериментов NOESY и COSY на продукте 33 раскрытия внутримолекулярного эпоксида, полученного в две стадии из 11а (схема 3).

Схема 3
Абсолютная конфигурация атомов от С-8 до С-12 была легко установлена при помощи NOE экспериментов. Вывод об относительной син-конфигурации при С-11-С-12 был сделан на основании константы спин-спинового взаимодействия (J=1,5 Гц). Сигнал NOE между Н-11 и Н-14 указывает на то, что оба атома должны находиться в аксиальных положениях.
Вывод об относительной антиконфигурации при С-6-С-7 был сделан на основании небольшой величины константы спин-спинового взаимодействия ацетонида 34, полученного из соединения 11а (схема 4).

Схема 4
Наконец, стереохимия соединений 3а, 3b, 4a и 4b при С-5 была установлена при помощи превращения 1,3-диола 15а и 15b в 1,3-син и антиацетониды соответственно (схема 5).

Схема 5
Стереохимия ацетонидов син- и анти-1,3-диолов была установлена в соответствии с S.D. Rychnovsky et al., J. Org. Chem, 1993, 58, 3511-3515 исходя из химических сдвигов 13С метильных групп ацеталя. Как правило, сдвиги ацетальных метилов ацетонидов син-1,3-диола находятся при 19 и 30 м.д. соответственно, тогда как сдвиги обоих метилов анти-ацетонидов находятся примерно при 25 м.д. В самом деле, авторы изобретения проверили надежность данного метода, поскольку в спектре ЯМР 13С син-ацетонида 35b аксиальная метильная группа проявляется приблизительно при 20,2 м.д, а экваториальная метильная группа приблизительно при 30,0 м.д., тогда как в спектре 13С антиацетонида 35а обе метильные группы проявляются при 24,4 и 25,2 м.д.
К сожалению, определить стереохимию 3с, 3d, 4c и 4d, получив ацетониды 26а и 26b, оказалось невозможно, поскольку данные соединения нельзя было разделить обычными методами. В этих случаях конфигурация положения С-5 была установлена при помощи превращения 11а в 1,3-диолы 38а и 38b, которые можно легко разделить. После нескольких реакций данные соединения приводят к известным промежуточным соединениям 27с и 27d соответственно. Стереохимия этих соединений была установлена на основании химических сдвигов 13С соответствующих ацетонидов 36а (δ=24,1, 25,0 м.д.) и 36b (δ=19,7, 29,9 м.д.) (схема 6).

Схема 6
Вывод об относительной стереохимии Н-5 и Н-6 в мириапоронах 3 и 4 был сделан при изучении констант спин-спинового взаимодействия между протонами шестичленных циклов полукетальных монозащищенных мириапоронов 20 и 31 (схема 7).
В случае 20а и 31b, Н-4 при δ=1,73 и 1,58 м.д. соответственно, где оба имеют константы спин-спинового взаимодействия 14,5, 3,5 Гц, была приписана аксиальная конфигурация. Прочие Н-4 со смещенным в сильное поле химическим сдвигом при δ 2,02 и 2,03 м.д. для каждого соединения, имеют константы спин-спинового взаимодействия 14,0, 3,5 Гц и 14,5, 3,5 Гц соответственно. Данные величины указывают на то, что протон Н-5 должен быть экваториальным.
Аналогичным образом, константы спин-спинового взаимодействия между Н-5 и Н-6 в обоих случаях составляют около 2 Гц, вновь свидетельствуя о том, что Н-5 должен быть экваториальным. Таким образом, был сделан вывод о син относительной стереохимии Н-5 и Н-6.
С другой стороны, спектры ЯМР 1Н соединений 20b и 31а отличаются от соединений 20а и 31b по величине констант спин-спинового взаимодействия и, в первую очередь, по химическому сдвигу. Для данных соединений константы спин-спинового взаимодействия между Н-4(акс) и Н-5 составляют около 12, 13 Гц, указывая на то, что Н-5 должен быть аксиальным.
Кроме того, константы спин-спинового взаимодействия между Н-5 и Н-6 согласуются с тем фактом, что Н-6 находится в аксиальном положении для минимального взаимодействия и, следовательно, делается вывод об антиотносительной стереохимии Н-5 и Н-6.

Схема 7
Стереохимию при С-3 в полукетальных соединениях нельзя было определить при помощи NOE экспериментов. На схеме 7 полукетальную гидроксильную группу при С3 произвольно поместили в экваториальном положении.
Другим, в особенности предпочтительным, вариантом осуществления настоящего изобретения являются фармацевтические композиции, применимые в качестве противоопухолевых агентов, содержащие в качестве активного ингредиента соединение или соединения данного изобретения, а также способы их получения.
Важной особенностью описанных выше соединений формулы I является их биологическая активность и, в частности, их цитотоксическая активность. При помощи данного изобретения авторы предоставляют новые фармацевтические композиции соединений общей формулы I, обладающие цитотоксической активностью, и их использование в качестве противоопухолевых агентов. Таким образом, в настоящем изобретении предоставлены также фармацевтические композиции, содержащие соединение данного изобретения, его фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры с фармацевтически приемлемым носителем.
Примеры фармацевтических композиций включают в себя любую твердую форму (таблетки, пилюли, капсулы, гранулы и так далее) или жидкость (растворы, суспензии, или эмульсии) с подходящей композицией для перорального, местного или парентерального введения.
Введение соединений или композиций настоящего изобретения можно осуществлять при помощи любого подходящего способа, такого как внутривенное вливание, пероральный препарат, внутрибрюшинный и внутривенный препарат. Авторы предпочитают, чтобы использовались продолжительности вливаний до 24 часов, более предпочтительно 2-12 часов, при этом наиболее предпочтительно 2-6 часов. В особенности предпочтительны небольшие продолжительности вливаний, которые позволят проводить лечение без ночного пребывания в больнице. Однако при необходимости вливание может длиться от 12 до 24 часов или даже дольше. Вливание можно проводить с подходящими интервалами, скажем, от 1 до 4 недель. Фармацевтические композиции, содержащие соединения изобретения, можно доставлять путем липосомного или наносферного инкапсулирования, при помощи препаратов с продолжительным высвобождением или другими стандартными способами доставки.
Точная дозировка соединений будет изменяться в соответствии с конкретным препаратом, способом применения и конкретным участком, хозяином и опухолью, подлежащей лечению. Во внимание будут приниматься другие факторы, такие, как возраст, масса тела, пол, питание, время введения, скорость экскреции, состояние хозяина, сочетания лекарственных препаратов, чувствительности реакций и тяжесть заболевания. Введение можно осуществлять непрерывно или периодически в пределах максимально переносимой дозы.
Соединения и композиции данного изобретения можно применять совместно с другими лекарственными средствами для получения комбинационной терапии. Другие лекарственные средства могут составлять часть той же композиции или представлять собой отдельную композицию для введения в то же время или в другое время.
Противоопухолевая активность данных соединений включает, помимо прочего, лейкемию, рак легких, рак ободочной кишки, рак почки, рак предстательной железы, рак матки, рак груди, рак поджелудочной железы, рак шейки матки, саркомы и меланомы.
Далее настоящее изобретение будет объяснено при помощи следующих примеров, которые не являются ограничивающими. Можно видеть, что данная методология позволяет проводить синтез мириапороновых соединений с требуемой стереспецифичностью.
ПРИМЕРЫ
Пример 1: Соединение 7а

К раствору 6 (3,51 г, 7,8 ммоль) в CH2Cl2 (40 мл) добавляли имидазол (1,59 г, 23,4 ммоль) и TBSCl (1,76 г, 11,7 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Прибавляли 0,1 N HCl до рН 4-5 и экстрагировали смесь CH2Cl2 (2х). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 7а (3,44 г, 78%) в виде бесцветного масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 5,83 (м, 1H), 4,99 (дд, J= 10,5, 1,8 Гц, 1H), 4,86 (дд, J= 17,4, 2,1 Гц, 1H), 4,42 (c, 2H), 3,80 (c, 3H), 3,44 (м, 2H), 3,33 (д, J= 6,6 Гц, 1H), 2,47 (д, J= 9,6 Гц, 1H), 2,24 (м, 1H), 1,75 (м, 1H), 1,08 (д, J= 6,6 Гц, 3H), 0,91 (c, 9H), 0,88 (c, 9H), 0,13 (c, 3H), 0,04 (c, 3H), 0,02 (c, 3H), 0,01 (c, 3H).
13C ЯМР (75 МГц, CDCl3) δ 159,1, 136,2, 130,3, 129,1, 117,1, 113,7, 72,9, 72,6, 64,9, 64,6, 63,9, 55,2, 51,3, 33,1, 25,9, 25,8, 18,2, 18,1, 14,9, 13,3, -4,2, -5,3, -5,4, -5,5. MC (ESI) m/z: 587 (М+23)+.
[α]25 D -9,5 (c 0,52, CH2Cl2).
Rf = 0,61 (Hex:EtOAc, 4:1).
Пример 2: Соединение 7b
Соединение 7b получали в виде бесцветного масла так же, как 7b из соответствующего предшественника 6 по методике, описанной W. Roush et al., Org. Lett. 1999, 1, 95, при использовании TESOTf вместо TBSOTf в эквивалентных количествах на стадии защиты вторичного спирта.
1H ЯМР (300 МГц, CDCl3) δ 7,24 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 5,92-5,80 (м, 1H), 5,02 (дд, J= 10,2, 1,8 Гц, 1H), 4,90 (дд, J= 17,4, 1,8 Гц, 1H), 4,42(с, 2H), 3,78 (с, 3H), 3,56-3,42 (м, 3H), 3,38-3,34 (м, 2H), 2,52 (д, J= 9,0 Гц, 1H), 2,27-2,23 (м, 1H), 1,81-1,76 (м, 1H), 1,27 (с, 3H), 1,10 (д, J= 6,6 Гц, 3H), 0,98 (т, J= 7,8 Гц, 9H), 0,90 (с, 9H), 0,71-0,62 (м, 6H), 0,05 (с, 3H), 0,04 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,1, 136,4, 130,2, 129,0, 116,8, 113,6, 76,9, 72,8, 72,6, 64,7, 64,6, 63,8, 55,0, 51,1, 33,2, 25,7, 18,0, 14,8, 13,1, 6,9, 4,8, -5,3, -5,5.
МС (ESI) m/z: 587 (М+23)+, 565 (М+1)+.
Rf= 0,62 (Hexane:EtOAc, 4:1).
Пример 3: Соединение 7с

К раствору 6 (450 мг, 1 ммоль) в CH2Cl2 (20 мл) добавляли DIPEA (1,74 мл, 10 ммоль) и MOMBr (0,45 мл, 5 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 4 ч. Затем прибавляли насыщенный раствор NH4Cl и экстрагировали смесь CH2Cl2 (2×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 7с (250 мг, 51%) в виде бесцветного масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,24 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 5,90-5,78 (м, 1H), 5,04 (дд, J= 10,2, 2,1 Гц, 1H), 4,95 (дд, J= 17,4, 2,1 Гц, 1H), 4,56 (с, 2H), 4,43 (с, 2H), 3,80 (с, 3H), 3,51-3,40 (м, 1H), 3,37-3,34 (м, 4H), 3,33 (с, 3H), 2,52 (д, J= 9,3 Гц, 1H), 2,43-2,40 (м, 1H), 1,79-1,65 (м, 1H), 1,25 (с, 3H), 1,09 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,14 (с, 3H), 0,04 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,4, 136,4, 130,6, 129,4, 117,6, 114,0, 96,8, 78,2, 73,1, 72,7, 69,0, 64,8, 64,7, 55,6, 55,5, 49,2, 33,4, 26,2, 18,5, 15,2, 13,5, -3,9, -5,3.
Rf = 0,52 (Нех:EtOAc, 4:1).
Пример 4: Соединение 7d

К раствору соответствующего диола (581 мг, 1,73 ммоль) в CH2Cl2 (20 мл) добавляли 2,6-лутидин (0,61 г, 5,2 ммоль) и t-Bu2Si(OTf)2 (9,48 мл, 2,6 ммоль) при 0°С. Затем прибавляли насыщенный водный раствор NH4Cl и экстрагировали смесь CH2Cl2 (2×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 7d (330 мг, 40%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 6,40 (ддд, J= 17,1, 9,9, 8,7 Гц, 1H), 5,10 (дд, J= 10,5, 1,8 Гц, 1H), 5,06 (дд, J= 17,1, 1,8 Гц, 1H), 4,41 (с, 2H), 4,35 (дд, J= 11,1, 3,0 Гц, 1H), 4,06 (д, J= 3,0 Гц, 1H), 4,00 (дд, J= 11,1, 2,4 Гц, 1H), 3,80 (с, 3H), 3,34 (д, J= 6,3 Гц, 2H), 2,72 (д, J= 9,3 Гц, 1H), 2,41-2,37 (м, 1H), 1,78-1,73 (м, 1H), 1,28 (с, 3H), 1,09 (д, J= 6,6 Гц, 3H), 1,07 (с, 9H), 1,05 (с, 9H).
13C ЯМР (75 МГц, CDCl3) δ 159,4, 136,9, 130,7, 129,2, 116,9, 114,0, 79,6, 73,1, 72,8, 70,4, 63,7, 62,3, 55,5, 47,0, 33,3, 28,6, 27,7, 23,5, 21,0, 15,1.
МС (ESI) m/z: 499 (М+23)+.
Rf= 0,41 (Hex:EtOAc, 4:1).
Пример 5: Соединение 8а

В раствор 7а (21,94 г, 38,7 ммоль) в CH2Cl2 (150 мл) барботировали ток О3 в течение 50 мин при -78°С. После этого прибавляли Ph3P (30,45 г, 116,1 ммоль) и оставляли смесь нагреться до комнатной температуры и продолжали перемешивание в течение 12 ч. Смесь концентрировали при пониженном давлении и очищали остаток колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая соединение 8а (15,82 г, 72%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 9,67 (д, J= 3,0 Гц, 1H), 7,20 (д, J= 8,4 Гц, 2H), 6,84 (д, J= 8,4 Гц, 2H), 4,38 (м, 2H), 3,84 (дд, J= 10,2, 5,1 Гц, 1H), 3,80 (с, 3H), 3,69 (м, 2H), 3,41 (дд, J= 9,3, 5,1 Гц, 1H), 3,31 (т, J= 9,0 Гц, 1H), 2,59 (д, J= 9,3 Гц, 1H), 2,50 (м, 1H), 1,81 (м, 1H), 1,30 (с, 3H), 1,06 (д, J= 6,3 Гц, 3Н), 0,86 (с, 18Н), 0,14 (с, 3H), 0,04 (с, 3H), 0,02 (с, 3H), 0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 203,8, 159,5, 130,3, 129,4, 114,0, 76,5, 73,2, 73,0, 65,1, 64,0, 60,1, 57,9, 55,4, 33,6, 26,0, 26,0, 18,3, 15,0, 13,0, -4,0, -5,2, -5,3, -5,5.
МС(ESI) m/z:589(М+23)+.
[α]25 D -11,6 (c 0,50, CH2Cl2).
Rf= 0,59 (Hex:EtOAc, 4:1).
Пример 6: Соединение 8b

К раствору 7b (0,86 г, 1,52 ммоль) в смеси ТГФ:Н2О (10:1, 22 мл) добавляли NMO (0,623 г, 5,32 ммоль) и OsO4 (4,56 мл, 0,456 ммоль, 0,1 М в tBuOH) при 23°С и перемешивали реакционную смесь при 23°С в течение ночи. Прибавляли флоризил (6 г), NaHSO3 (6 г) и EtOAc (100 мл) и энергично перемешивали смесь в течение 30 мин. Смесь фильтровали через слой целита и концентрировали фильтрат, получая соответствующий диол. К раствору данного диола в ТГФ (10 мл) добавляли раствор NaIO4 (1,95 г, 9,12 ммоль) в Н2О (8 мл) при 0°С и перемешивали реакционную смесь при 23°С в течение 1 ч. Реакцию гасили, добавляя насыщенный водный раствор NH4Cl (20 мл), а затем экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 8b (0,67 г, 78%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 9,68 (д, J= 2,4 Гц, 1H), 7,17 (д, J= 8,4 Гц, 2H), 6,83 (д, J= 8,4 Гц, 2H), 4,36 (кв, J= 11,4 Гц, 2H), 3,83 (дд, J= 10,2, 5,1 Гц, 1H), 3,76 (с, 3H), 3,74 (д, J= 6,3 Гц, 1H), 3,67 (дд, J= 10,2, 5,7 Гц, 1H), 3,39 (дд, J= 9,3, 5,1 Гц, 1H), 3,30 (т, J= 9,0 Гц, 1H), 2,60 (д, J= 9,3 Гц, 1H), 2,47-2,40 (м, 1H), 1,82-1,78 (м, 1H), 1,28 (с, 3H), 1,04 (д, J= 6,6 Гц, 3H), 0,92 (т, J= 7,8 Гц, 9H), 0,85 (с, 9H), 0,62 (кв, J= 7,8 Гц, 6H), 0,01 (с, 3H), 0,00 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 203,4, 159,1, 129,9, 129,0, 113,6, 75,9, 72,8, 72,6, 64,9, 63,5, 59,7, 57,4, 55,0, 33,3, 25,6, 17,9, 14,6, 12,5, 6,7, 4,6, -5,5, -5,7.
МС (ESI) m/z: 589 (М+23)+.
Rf= 0,54 (Hexane:EtOAc, 4:1).
Пример 7: Соединение 9

Соединение 9 получали по методике, описанной D.A. Evans et al., J. Am. Chem. Soc, 1984, 106, 4261-4263.
1Н ЯМР (300 МГц, CDCl3) δ 7,21 (м, 1H), 7,12 (м, 1H), 4,44 (м, 1H), 4,20 (м, 2H), 2,36 (м, 1H), 1,91 (дд, J= 6,6, 1,2 Гц, 3H), 0,88 (д, J= 6,9 Гц, 3H), 0,83 (д, J= 6,9 Гц, 3H).
Пример 8: Соединение 10а

К раствору 9 (17,75 г, 0,09 моль) в CH2Cl2 (270 мл) добавляли Bu2BOTf (99 мл, 1М в CH2Cl2, 0,099 моль) и Et3N (17,56 мл, 0,126 моль) при -78°С. Реакционную смесь перемешивали 1 ч при -78°С, 15 мин при 0°С и повторно охлаждали до -78°С. Данный раствор прибавляли в виде трех порций в течение 5 ч к раствору 8а (17,18 г, 0,03 моль) в CH2Cl2 (100 мл) при 0°С и перемешивали смесь при -30°С еще в течение 12 ч. После этого прибавляли насыщенный водный раствор NH4Cl (300 мл) и экстрагировали реакционную смесь CH2Cl2 (2×200 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в 400 мл эфира, 200 мл буферного раствора и 200 мл Н2О2 и перемешивали смесь при 0°С в течение 1 ч. Затем реакционную смесь экстрагировали и промывали органическую фазу насыщенным водным раствором NaHCO3 (200 мл) и насыщенным раствором соли (200 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 10:1 до 2:1), получая соединение 10а (21 г, 92%) в виде бесцветного масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,19 (д, J= 8,4 Гц, 2H), 6,85 (д, J= 8,4 Гц, 2H), 5,93 (м, 1H), 5,41 (д, J= 17,1 Гц, 1H), 5,28 (д, J= 9,3 Гц, 1H), 4,92 (т, J= 9,6 Гц, 1H), 4,63 (дддд, J= 9,3, 6,3, 5,1, 1,5 Гц, 1H), 4,43 (с, 3H), 4,34 (м, 1H), 4,12 (м, 2H), 3,85 (м, 1H), 3,80 (с, 3Н), 3,73 (м, 2H), 4,44 (м, 2H), 2,58 (д, J= 9,3 Гц, 1H), 2,30 (м, 1H), 1,81 (м, 1H), 1,38 (с, 3Н), 1,10 (д, J= 6,6 Гц, 3Н), 0,93 (с, 9H), 0,87 (с, 9H), 0,84 (д, J= 7,5 Гц, 3Н), 0,80 (д, J= 6,9 Гц, 3Н), 0,17 (с, 3Н), 0,12 (с, 3Н), 0,09 (с, 3Н), 0,04 (с, 3Н).
13C ЯМР (75 МГц, CDCl3) δ 172,0, 159,0, 153,3, 135,3, 129,9, 128,6, 113,7, 77,4, 72,6, 71,0, 64,0, 63,4, 62,6, 59,8, 58,4, 58,0, 55,2, 51,2, 45,2, 40,1, 33,6, 26,7, 28,3, 27,8, 26,1, 25,8, 18,3, 17,9, 15,1, 14,6, 14,3, 13,1, -4,4, -5,4, -5,5, -5,6.
МС (ESI) m/z: 786 (М+23)+.
[α]25 D+3,1 (c 0,53, CH2Cl2).
Rf= 0,35 (Hex:EtOAc, 4:1).
Пример 9: Соединение 10b

Указанное в заголовке соединение получали аналогично описанному выше из 8b (1,2 г, 2,11 ммоль). После хроматографии (SiO2) получали 10b (1,16 г, 80%) в виде бесцветного масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,4 Гц, 2H), 6,84 (д, J= 8,4 Гц, 2H), 5,85-6,03 (м, 1H), 5,19-5,44 (м, 2H), 4,93 (т, J= 9,3 Гц, 1H), 4,59-4,64 (м, 1H), 4,42-4,46 (м, 1H), 4,42 (с, 2H), 4,19-4,36 (м, 4H), 4,05-4,15 (м, 2H), 3,80 (с, 3H), 3,65-3,83 (м, 3H), 3,40-3,46 (м, 1H), 2,57 (д, J= 9,3 Гц, 1H), 2,27-2,36 (м, 1H), 1,78-1,86 (м, 1H), 1,56-1,64 (м, 1H), 1,37 (с, 3H), 1,28-1,38 (м, 6H), 0,92 (с, 9H), 0,88-0,99 (м, 6H), 0,62-0,68 (м, 9H), 0,09 (с, 3H), 0,04 (с, 3H).
Rf = 0,42 (Hex:EtOAc, 4:1).
Пример 10: Соединение 11а

К раствору 10а (14,5 г, 18,9 ммоль) в смеси ТГФ:Н2О (5:1, 120 мл) прибавляли LiBH4 (141,9 мл, 2,0 М в ТГФ, 283,7 ммоль) при 0°С. Реакционную смесь перемешивали в течение 30 мин при 0°С и 6 ч при 23°С. Добавляли насыщенный водный раствор NH4Cl (150 мл) и экстрагировали смесь EtOAc (3×150 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в 400 мл эфира, 200 мл буферного раствора и 200 мл Н2О2 и перемешивали смесь при 0°С в течение 2 ч. Затем реакционную смесь экстрагировали и промывали органическую фазу насыщенным водным раствором NaHCO3 (2×200 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 5:1), получая соединение 11а (10,5 г, 87%) в виде бесцветного масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 5,84 (м, 1H), 5,21 (д, J= 8,7 Гц, 1H), 5,14 (д, J= 17,4 Гц, 1H), 4,42 (с, 2H), 4,19 (м, 1H), 3,84 (м, 1H), 3,80 (с, 3H), 3,75 (м, 1H), 3,61 (м, 2H), 3,48 (м, 2H), 3,36 (м, 2H), 2,53 (д, J= 9,3 Гц, 1H), 2,27 (м, 1H), 1,80 (м, 1H), 1,32 (с, 3H), 1,05 (д, J= 6,9 Гц, 3H), 0,91 (с, 9H), 0,88 (с, 9H), 0,15 (с, 3H), 0,09 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 159,5, 137,6, 130,3, 129,4, 118,3, 114,0, 73,2, 73,0, 71,2, 64,9, 64,4, 60,4, 55,5, 51,1, 47,0, 33,5, 29,9, 26,4, 26,3, 26,0, 18,4, 18,2, 15,0, 14,0, -4,2, -5,1, -5,2.
МС (ESI) m/z: 662 (М+23)+.
[α]25 D+0,7 (c 0,54, CH2Cl2).
Rf= 0,2 (Hex:EtOAc, 4:1).
Пример 11: Соединение 11b

Указанное в заголовке соединение получали аналогично описанному выше из 10b (1,53 г, 2 ммоль). После хроматографии (SiO2) получали 11b (1 г, 80%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2Н), 5,92-5,80 (м, 1H), 5,92-5,80 (м, 1H), 5,21 (дд, J= 10,2, 2,1 Гц, 1H), 5,14 (дд, J= 17,1, 2,1 Гц, 1H), 4,40 (с, 2Н), 4,19-4,16 (м, 1H), 3,84 (дд, J= 6,0, 1,5, 1H), 3,80 (с, 3Н), 3,72 (дд, J= 6,3, 2,4 Гц, 1H), 3,62 (д, J= 4,5 Гц, 1H), 3,56 (д, J= 3,6, 1H), 3,52-3,48 (м, 1H), 3,38-3,33 (м, 2Н), 2,53 (д, J= 9,0 Гц, 1H), 2,27-2,22 (м, 1H), 1,83-1,78 (м, 1H), 1,73-1,67 (м, 1H), 1,30 (с, 3Н), 1,04 (д, J= 6,9 Гц, 3Н), 0,95 (т, J= 7,8 Гц, 9H), 0,87 (с, 9H), 0,67 (кв, J= 7,8 Гц, 6H), 0,05 (с, 3Н), 0,04 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 159,2, 137,4, 130,1, 129,1, 118,0, 113,7, 77,4, 72,9, 72,7, 71,1, 64,9, 64,3, 64,2, 60,2, 55,2, 51,0, 46,6, 33,3, 25,7, 17,9, 14,8, 13,5, 6,8, 4,7, -5,3, -5,5.
Rf= 0,18 (Hex:EtOAc 4:1).
Пример 12: Соединение 12а
К раствору 11а (7,43 г, 11,6 ммоль) в CH2Cl2 (100 мл) добавляли имидазол (3,16 г, 46,4 ммоль) и TBSCl (3,48 г, 23,2 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 4 ч. Прибавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2×150 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле (Hex:EtOAc, от 10:1 до 4:1), получая соединение 12а (8,47 г, 97%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,6 Гц, 2H), 6,86 (д, J= 8,6 Гц, 2H), 5,86 (м, 1H), 5,07 (м, 2H), 4,41 (м, 2H), 4,29 (уш. с, 1H), 3,88 (м, 1H), 3,80 (с, 3H), 3,74 (м, 1H), 3,62 (м, 2H), 3,48 (м, 1H), 3,34 (д, J= 6,8 Гц, 2H), 3,17 (д, J= 4,9 Гц, 1H), 2,55 (д, J= 9,2 Гц, 1H), 2,26 (м, 1H), 1,78 (м, 2H), 1,32 (c, 3Н), 1,06 (д, J= 6,6 Гц, 3Н), 0,92 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,16 (с, 3Н), 0,10 (с, 3Н), 0,05 (с, 3Н), 0,03 (с, 9H).
13C ЯМР (75 МГц, CDCl3) δ 159,4, 138,0, 130,5, 129,2, 117,1, 114,0, 77,4, 73,1, 72,8, 69,4, 65,0, 64,8, 64,5, 60,7, 55,4, 51,9, 46,9, 33,7, 29,9, 26,3, 26,2, 26,1, 18,6, 18,5, 18,1, 15,1, 13,5, -4,3, -5,0, -5,1, -5,2.
МС (ESI) m/z: 775 (М+23)+, 753 (М+1)+.
[α]25 D+3,0 (c 0,54, CH2Cl2).
Rf= 0,66 (Нех:EtOAc, 4:1).
Пример 13: Соединение 12b

К раствору 12а (500 мг, 0,663 ммоль) в CH2Cl2 (30 мл) добавляли перйодинан Десс-Мартина (562 мг, 1,32 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. После этого добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 12b (414 мг, 83%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,24 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 5,78 (м, 1H), 5,23 (м, 2H), 4,42 (дд, J= 16,2, 11,4, 2H), 4,02 (дд, J= 10,2, 4,8 Гц, 1H), 3,81 (c, 3Н), 3,74 (м, 1H), 3,61 (м, 2H), 3,33 (м, 3Н), 2,48 (д, J= 9,3 Гц, 1H), 1,77 (м, 1H), 1,29 (с, 3Н), 1,06 (д, J= 6,6 Гц, 3Н), 0,87(с, 9H), 0,86 (с, 9H), 0,84 (с, 9H), 0,11 (с, 3Н), 0,04 (с, 3Н), 0,03 (с, 3Н), 0,02 (с, 3Н), -0,01 (с, 3Н), -0,03 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 209,2, 159,1, 134,3, 130,2, 129,0, 119,3, 113,7, 77,5, 72,7, 72,2, 64,3, 63,0, 62,3, 62,2, 61,1, 55,9, 55,2, 33,6, 29,7, 26,0, 25,9, 25,8, 18,2, 18,1, 15,0, 12,2, -4,5, -5,2, -5,3, -5,4, -5,4, -5,5.
МС (ESI) m/z: 773 (М+23)+.
Пример 14: Соединение 12с

К раствору 12а (1,5 г, 1,99 ммоль) в CH2Cl2 (30 мл) прибавляли Et3N (5,55 мл, 39,82 ммоль), DMAP (24 мг, 0,119 ммоль) и Ас2О (1,88 мл, 19,91 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 12 ч. После этого добавляли насыщенный водный раствор NaHCO3 (50 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои промывали 0,1 N HCl, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 12с (1,12 г, 71%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,5 Гц, 2H), 6,86 (д, J= 8,5 Гц, 2H), 5,66 (м, 1H), 5,48 (м, 2H), 5,09 (м, 2H), 4,42 (м, 2H), 3,80 (с, 3Н), 3,60 (м, 2H), 3,46 (м, 2H), 3,34 (м, 4Н), 2,61 (м, 1H), 2,48 (д, J= 9,1 Гц, 1H), 1,95 (с, 3Н), 1,77 (м, 1H), 1,34 (с, 3Н), 1,06 (д, J= 6,6 Гц, 3Н), 0,91 (с, 9H), 0,88 (с, 9H), 0,86 (с, 9H), 0,11 (с, 3Н), 0,05 (с, 3Н), 0,03 (с, 6H), 0,01 (с, 3Н), -0,01 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 169,8, 159,4, 136,7, 130,6, 129,3, 118,3, 114,0, 76,9, 73,0, 72,6, 70,6, 64,4, 59,9, 55,4, 52,5, 47,1, 33,4, 26,3, 26,1, 26,1, 21,4, 18,6, 18,3, 15,2, 13,3, -4,1, -4,9, -5,0, -5,1, -5,2, -5,2.
МС (ESI) m/z: 817 (М+23)+, 812 (М+18)+.
Rf= 0,63 (Нех:EtOAc, 4:1).
Пример 15: Соединение 12d

К раствору 12а (215 мг, 0,285 ммоль) в ТГФ (5 мл) прибавляли Py (0,46 мл, 5,7 ммоль), DMAP (53 мг, 0,427 ммоль) и (CF3CO)2О (0,40 мл, 2,85 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 12 ч. После этого добавляли насыщенный водный раствор NaHCO3 (7 мл) и экстрагировали реакционную смесь CH2Cl2 (3×10 мл). Объединенные органические слои промывали 0,1 N HCl (2×4 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 18:1), получая соединение 12d (221 мг, 91%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 5,75 (м, 1H), 5,65 (м, 1H), 5,09 (м, 2H), 4,42 (с, 2H), 3,81 (с, 3H), 3,47 (м, 8H), 2,78 (м, 1H), 2,51 (д, J= 9,0 Гц, 1H), 2,11 (м, 1H), 1,78 (м, 1H), 1,33 (с, 3H), 1,06 (д, J= 6,9 Гц, 3H), 0,91 (с, 9H), 0,88 (с, 18H), 0,12 (с, 3H), 0,06 (с, 3H), 0,03 (с, 3H), 0,01 (с, 6H), 0,00 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,2, 156,0 (д, JC-F= 41,0 Гц), 134,6, 130,2, 129,1, 119,4, 113,8, 76,0, 75,4, 72,9, 72,7, 64,3, 64,0, 63,8, 59,3, 55,2, 51,6, 46,2, 33,1, 26,1, 25,9, 18,3, 18,0, 14,8, 14,1, 13,2, -4,5, -5,0, -5,4, -5,5, -5,6, -5,7.
МС (ESI) m/z: 866(М+18)+.
Rf = 0,45 (Hex:EtOAc, 4:1).
Пример 16: Соединение 12е

Указанное в заголовке соединение получали аналогично описанному выше в примере 12 исходя из 11b (0,7 г, 1,09 ммоль). После хроматографии (SiO2, Hex:EtOAc, 15:1) получали 12е (661 г, 80%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 5,95-5,82 (м, 1H), 5,13-5,03 (м, 2H), 4,41 (дд, J= 15,6, 11,7 Гц, 2H), 4,30-4,26 (м, 1H), 3,86 (дд, J= 13,8, 3,6 Гц, 1H), 3,79 (с, 3H), 3,74 (дд, J= 10,5, 6,3 Гц, 1H), 3,64 (д, J= 5,7 Гц, 1H), 3,61 (д, J= 6,3 Гц, 1H), 3,50 (дд, J= 9,9, 5,1 Гц, 1H), 3,34 (д, J= 7,5 Гц, 2H), 3,18 (д, J= 4,8 Гц, 1H), 2,56 (д, J= 9,0 Гц, 1H), 2,32-2,23 (м, 1H), 1,85-1,79 (м, 1H), 1,74-1,71 (м, 1H), 1,31 (с, 3H), 1,06 (д, J= 6,9 Гц, 3H), 0,97 (т, J= 7,5 Гц, 9H), 0,89 (с, 9H), 0,88 (с, 9H), 0,68 (кв, 7,2, 6H), 0,05 (с, 3H), 0,04 (с, 6H), 0,03 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 158,9, 137,6, 130,0, 128,8, 116,6, 113,5, 77,0, 72,6, 72,4, 69,1, 64,7, 64,6, 64,0, 60,2, 54,9, 51,3, 46,2, 33,3, 25,7, 25,6, 18,0, 17,7, 14,7, 12,9, 6,7, 4,5, -5,5, -5,7.
МС (ESI) m/z: 775 (M+23)+, 773 (М+1)+.
Rf = 0,6 (Hex:EtOAc, 4:1).
Пример 17: Соединение 12f

К раствору 11а (500 мг, 0,78 ммоль) в CH2Cl2 (10 мл) добавляли DIPEA (327 мкл, 1,87 ммоль) и MEMCl (107 мкл, 0,94 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 14 ч. После этого реакционную смесь экстрагировали 0,1 N HCl (10 мл) и сушили органический слой над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 12f (445 мг, 78%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 5,92-5,79 (м, 1H), 5,16-5,09 (м, 2H), 4,67 (с, 2H), 4,42 (дд, J= 15,3, 11,7 Гц, 2H), 4,23-4,18 (м, 1Н), 4,85 (дд, J= 10,5, 4,8 Гц, 1H), 3,80 (c, 3H), 3,67-3,64 (м, 2H), 3,60 (д, J= 5,7 Гц, 2Н), 3,57-3,51 (м, 2H), 3,49-3,40 (м, 2H), 3,37 (3, 3H), 2,56 (д, J= 9,3 Гц, 1H), 2,45-2,40 (м, 1H), 1,85-1,77 (м, 1H), 1,74-1,72 (м, 1H), 1,30 (с, 3H), 1,06 (д, J= 6,6 Гц, 3Н), 0,91 (с, 9H), 0,87 (с, 9H), 0,15 (с, 3H), 0,09 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H).
МС (ESI) m/z:749(М+23)+.
Rf= 0,25 (Hex:EtOAc, 4:1).
Пример 18: Соединение 12g

К раствору 12f (438 мг, 0,6 ммоль) в CH2Cl2 (10 мл) прибавляли Et3N (1,67 мл, 12 ммоль), DMAP (74 мг, 0,6 ммоль) и Ас2О (567 мкл, 6 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 12 ч. После этого реакционную смесь экстрагировали 0,1 N HCl (10 мл) и сушили органический слой над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 7:1), получая соединение 12g (343 мг, 74%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,1 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 5,74 (дт, J= 19,8, 9,9 Гц, 1H), 5,52-5,49 (м, 1H), 5,13-5,07 (м, 2H), 4,65 (с, 2H), 4,42 (дд, J= 13,5, 12,0 Гц, 2H), 3,80 (с, 3H), 3,66-3,62 (м, 2H), 3,60-3,57 (м, 1H), 3,54-3,47 (м, 4H), 3,40-3,34 (м, 1H), 3,38 (с, 3H), 3,28 (д, J= 5,7 Гц, 1H), 2,81-2,76 (м, 1H), 2,48 (д, J= 8,7 Гц, 1H), 1,97 (с, 3H), 1,83-1,73 (м, 1H), 1,56 (уш.с, 1H), 1,31 (c, 3H), 1,07 (д, J= 6,9 Гц, 3H), 0,91 (с, 9H), 0,88 (с, 9H), 0,12 (с,3H), 0,06 (с, 3H), 0,03 (с, 6H).
МС (ESI) m/z: 791 (M+23)+.
Rf = 0,26 (Нех:EtOAc, 4:1).
Пример 19: Соединение 12h
К раствору 11а (75 мг, 0,117 ммоль) в CH2Cl2 (3 мл) добавляли DIPEA (82 мкл, 0,47 ммоль) и TESCl (40 мкл, 0,234 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. После этого добавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2х10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 12:1), получая соединение 12h (77 мг, 87%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 5,94-5,82 (м, 1H), 5,11 (дд, J= 9,9, 2,1 Гц, 1Н), 5,08 (дд, J= 16,8, 2,1 Гц, 1H), 4,41 (дд, J= 17,1, 11,7 Гц, 2H), 4,33-4,29 (м, 1H), 3,87 (дд, 1H), 3,80 (с, 3H), 3,65-3,60 (м, 2Н), 3,49 (дд, J= 9,9, 5,1 Гц, 1H), 3,33 (д, J= 6,9 Гц, 2H), 3,24 (д, J= 4,5 Гц, 1H), 2,56 (д, J= 9,3 Гц, 1H), 2,30-2,25 (м, 1H), 1,82-1,75 (м, 2H), 1,31 (с, 3H), 1,03 (д, J= 6,6 Гц, 3H), 0,93-0,90 (м, 9H), 0,92 (с, 9H), 0,87 (с, 9H), 0,57(кв, J= 7,8Гц, 6H), 0,16 (с, 3H), 0,10 (с, 3H), 0,07 (с, 3H), 0,05 (с, 3H).
МС (ESI) m/z: 775 (М+23)+.
Rf = 0,58 (Hex:EtOAc, 4:1).
Пример 20: Соединение 12i

К раствору 11а (128 мг, 0,2 ммоль) в CH2Cl2 (10 мл) добавляли DIPEA (104 мкл, 0,6 ммоль), DMAP (2 мг, 0,02 ммоль) и SEMCl (53 мкл, 0,3 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 6 ч. После этого добавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 12i (142 мг, 92%) в виде бледно-желтого масла.
1Н ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,5 Гц, 2H), 6,86 (д, J= 8,5 Гц, 2H), 5,79-5,88 (м, 1H), 5,10-5,17 (м, 2H), 4,61 (с, 2H), 4,42 (дд, J= 15,9, 11,5 Гц, 2H), 4,17-4,22 (м, 1Н), 3,76-3,87 (м, 1H), 3,79 (с, 3Н), 3,42-3,62 (м, 3Н), 3,36 (д, J= 6,8 Гц, 1H), 2,56 (д, J= 9,3 Гц, 1H), 2,40-2,45 (м, 1H), 1,72-1,83 (м, 2H), 1,25 (с, 3H), 1,06 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,87 (с, 9H), 0,15 (с, 3H), 0,09 (с, 3Н), 0,05 (с, 3H), 0,04 (с, 3H), 0,00 (с, 9H).
13C-ЯМР (75 МГц, CDCl3) δ 159,4, 137,8, 130,4, 129,3, 117,4, 114,0, 95,2, 73,1, 72,8, 70,3, 69,4, 65,3, 64,8, 64,2, 60,6, 55,4, 49,2, 47,0, 33,8, 29,9, 26,3, 26,0, 18,5, 18,3, 18,1, 15,1, 13,7, -1,2, -4,2, -5,1, -5,2.
МС (ESI) m/z: 792 (М+23)+.
Rf= 0,56 (Hex:EtOAc, 4:1).
Пример 21: Соединение 12j

К раствору 11а (600 мг, 0,93 ммоль) в CH2Cl2 (10 мл) прибавляли Et3N (2,61 мл, 18,76 ммоль), DMAP (115 мг, 0,93 ммоль) и Ас2О (887 мкл, 9,39 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. После этого добавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 10:1 до 5:1), получая соединение 12j (592 г, 87%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 5,72-5,60 (м, 1H), 5,53-5,50 (м, 1H), 5,16-5,07 (м, 2H), 4,42 (с, 2H), 4,03 (дд, J= 11,1, 6,3 Гц, 1H), 3,90 (дд, J= 11,1, 6,9 Гц, 1H), 3,80 (с, 3H), 3,58 (дд, J= 10,2, 5,7 Гц, 1Н), 3,47 (дд, J= 10,2, 6,3 Гц, 1H), 3,38-3,34 (м, 3H), 2,88-2,83 (м, 1H), 2,48 (д, J= 9,3 Гц, 1H), 2,01 (с, 3H), 1,98 (с, 3H), 1,95-1,90 (м, 1H), 1,83-1,74 (м, 1H), 1,32 (с, 3H), 1,06 (д, J= 6,6 Гц, 3H), 0,88 (с, 9H), 0,87 (с, 9H), 0,12 (с, 3H), 0,06 (с, 3H), 0,03 (с, 3H), 0,02 (с, 3H).
МС (ESI) m/z: 745 (М+23)+.
Rf= 0,34 (Hex:EtOAc, 4:1).
Пример 22: Соединение 12к

К раствору сырого 12е (545 мг, 0,73 ммоль) в смеси CH2Cl2:Н2О (8:0,4 мл) добавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (329 мг, 1,45 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 45 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (70 мг, 1,9 ммоль). Смесь перемешивали при 23°С в течение 2 ч, а затем концентрировали реакционную смесь при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 12k (300 мг, 65%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 5,88-5,80 (м, 1H), 5,15-5,09 (м, 2Н), 4,18-4,17 (м, 1H), 3,92 (дд, J= 10,5, 4,5 Гц, 1H), 3,86-3,68 (м, 1H), 3,66-3,56 (м, 3H), 3,50-3,47 (м, 1H), 3,33 (д, J= 3,9, 1H), 2,54 (д, 7= 9,3 Гц, 1H), 2,38-2,34 (м, 1H), 1,87-1,86 (м, 1H), 1,71-1,62 (м, 1H), 1,33 (с, 3H), 1,03 (д, J= 6,9 Гц, 3H), 0,95 (т, J= 8,1 Гц, 9H), 0,87 (с, 9H), 0,87 (с, 9H), 0,67 (кв, J= 8,4 Гц, 6H), 0,05 (с, 3H), 0,04 (с, 3H), 0,03 (с, 5H), 0,02 (с, 3H).
МС (ESI) m/z: 655 (М+23)+, 633 (М+1)+.
Rf= 0,38 (Hex:EtOAc, 4:1).
Пример 23: Соединение 12l

К раствору 12е (100 мг, 0,13 ммоль) в CH2Cl2 (6 мл) добавляли перйодинан Десс-Мартина (113 мг, 0,26 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 2 ч. После этого добавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая 12l (110 мг, 96%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,27 (д, J= 8,7 Гц, 2H), 6,90 (д, J= 8,7 Гц, 2H), 5,78 (ддд, J= 16,8, 10,2, 9,0 Гц, 1H), 5,29-5,22 (м, 2H), 4,43 (кв, J= 11,4 Гц, 2H), 4,04 (дд, J= 10,2, 4,2 Гц, 1H), 3,84 (с, 3Н), 3,77-3,72 (м, 1H), 3,66-3,60 (м, 2H), 3,45-3,30 (м, 5H), 2,50 (д, J= 9,3 Гц, 1H), 1,85-1,75 (м, 1H), 1,32 (с, 3H), 1,09 (д, J= 6,6 Гц, 1H), 0,95 (т, J= 7,8 Гц, 9H), 0,91 (с, 9H), 0,87 (с, 9H), 0,63 (кв, J= 7,8 Гц, 6H), 0,08 (с, 3H), 0,07 (с, 3H), 0,01 (с, 3H), 0,00 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 209,9, 159,1, 134,3, 130,2, 129,0, 119,3, 113,7, 78,0, 72,3, 72,1, 64,8, 63,0, 62,6, 62,3, 61,1, 56,1, 55,2, 33,6, 29,7, 25,9, 25,8, 18,2, 18,1, 15,1, 11,9, 6,8, 4,6, -5,3, -5,4, -5,5.
МС (ESI) m/z: 773 (М+23)+.
Rf= 0,57 (Hex:EtOAc, 4:1).
Пример 24: Соединение 12m

К раствору 12к (280 мг, 0,44 ммоль) в ТГФ (5 мл) прибавляли Et3N (368 мкл, 2,64 ммоль), DMAP (5 мг, 0,04 ммоль) и Ас2О (125 мкл, 1,32 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 1 ч. После этого добавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 15:1), получая соединение 12m (258 мг, 87%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 5,90 (ддд, J= 17,1, 10,8, 9,6 Гц, 1H), 5,16-5,09 (м, 2H), 4,32-4,28 (м, 1H), 4,09 (дд, J= 11,1, 5,7 Гц, 1H), 3,89-3,76 (м, 3Н), 3,70-3,67 (м, 2H) 3,56 (дд, J= 9,9, 5,1 Гц, 1H), 3,08, (д, J= 4,5 Гц, 1H), 2,57 (д, J= 9,3 Гц, 1H), 2,40-2,31 (м, 1H), 2,05 (с, 3Н), 1,30 (с, 3Н), 1,10 (д, J= 6,9 Гц, 3Н), 0,96 (т, J= 8,1 Гц, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,69 (кв, J= 8,1 Гц, 6H), 0,05 (с, 3Н), 0,03 (с, 6H), 0,02 (с, 3H).
Rf=0,66(Hex:EtOAc, 4:1).
Пример 25: Соединение 12n

К раствору 11а (110 мг, 0,17 ммоль) в CH2Cl2 (50 мл) добавляли PhB(OH)2 (33 мг, 0,26 ммоль) и перемешивали реакционную смесь при 23°С в течение 1 ч. После этого раствор фильтровали через слой целита. Фильтрат сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 20:1 до 10:1), получая соединение 12n (94 мг, 75%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,81 (дд, J= 7,8, 1,2 Гц, 2H), 7,65-7,60 (м, 1H), 7,56-7,42 (м, 2H), 7,24 (д, J= 8,7 Гц, 2H), 6,83 (д, J= 8,7 Гц, 2 Гц), 5,88 (ддд, J= 18,9, 10,2, 8,7 Гц, 1H), 5,23-5,17 (м, 2 H), 4,54 (дд, J= 6,6, 2,4 Гц, 1H), 4,39 (дд, J= 18,0, 11,1 Гц, 2H), 4,27 (дд, J= 11,1, 3,3 Гц, 1H), 4,03 (уш.д, J= 0,5 Гц, 1H), 3,97 (дд, J= 10,2, 6,3 Гц, 1H), 3,82 (д, J= 5,1 Гц, 1H), 3,68 (с, 3H), 3,65 (дд, J= 10,5, 3,6 Гц, 1H), 3,46-3,35 (м, 2H), 2,87 (уш.д, J= 8,4 Гц, 1H), 2,70 (д, J= 9,3 Гц, 1H), 1,93-1,83 (м, 2H), 1,30 (с, 3H), 1,11 (д, J= 6,6 Гц, 3H), 0,95 (с, 9H), 0,92 (с, 9H), 0,18 (с, 3H), 0,14 (с, 3H), 0,08 (с, 3H), 0,07 (с, 3H).
Rf= 0,46 (Hex:EtOAc, 4:1).
Пример 26: Соединение 12о
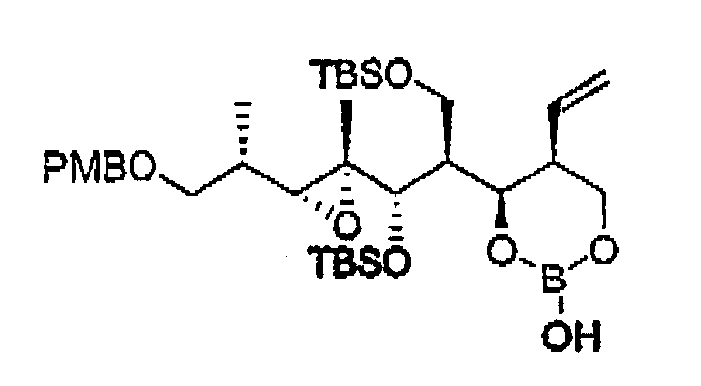
Указанное в заголовке соединение получали как соединение-предшественник 11а реакцией восстановления 10а перед обработкой Н2О2.
1Н ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,4 Гц, 2H), 6,85 (д, J= 8,4 Гц, 2H), 5,87-5,79 (м, 1H), 5,22-5,17 (м, 2H), 4,38 (дд, J= 10,8 Гц, 13,2 Гц, 2H), 4,30 (дд, J= 6,6, 2,7 Гц, 1H), 4,07 (дд, J= 10,8, 3,0 Гц, 1H), 3,83-3,72 (м, 2H), 3,80 (с, 3H), 3,69 (д, J= 5,1 Гц, 1H), 3,50 (дд, J= 9,9, 3,0 Гц, 1H), 3,37-3,32 (м, 2H), 2,67 (уш.д, J= 8,4 Гц, 1H), 2,62 (д, J= 9,3 Гц, 1H), 1,81-1,76 (м, 2H), 1,21 (с, 3H), 1,06 (д, J= 6,9 Гц, 3H), 0,91 (с, 9H), 0,89 (с, 9H), 0,12 (с, 3H), 0,05 (с, 3H), 0,03 (с, 3H), 0,02 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 159,1, 134,0, 130,2, 129,1, 118,4, 113,7, 76,2, 72,9, 70,0, 67,1, 64,8, 59,5, 55,2, 45,7, 43,9, 33,4, 26,4, 26,0, 25,9, 25,5, 18,2, 14,9, 14,0, 13,3, -4,3, -4,9, -5,3, -5,4.
МС (ESI) m/z: 661 (М+23)+.
Rf = 0,50 (Нех:EtOAc, 4:1).
Пример 27: Соединение 12р

К раствору 11а (119 мг, 0,18 ммоль) в ТГФ (10 мл) добавляли CDI (49 мг, 0,3 ммоль) и NaH (8 мг, 0,2 ммоль) и перемешивали реакционную смесь при 23°С в течение 3 ч. После этого добавляли насыщенный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 5:1), получая соединение 12р (97 мг, 78%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,19 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 5,79-5,70 (м, 1H), 5,32-5,26 (м, 2H), 4,67 (дд, J= 7,5, 2,4 Гц, 1H), 4,43 (дд, J= 10,5, 3,6 Гц, 1H), 4,35 (кв, J= 10,2 Гц, 2H), 4,25 (дд, J= 16,2, 15,3 Гц, 2H), 3,80 (с, 3H), 3,77-3,69 (м, 2H), 3,54 (дд, J= 10,5, 3,0 Гц, 1H), 3,42 (дд, J= 9,3, 4,8 Гц, 1H), 3,30 (т, J= 9,3 Гц, 1H), 2,92 (уш.д, J= 8,4 Гц, 1Н), 2,66 (д, J= 9,6 Гц, 1H), 1,95-1,92 (м, 1Н), 1,21 (с, 3H), 1,05 (д, J= 6,9 Гц, 3H), 0,89 (с, 9H), 0,88 (с, 9H), 0,11 (с, 3H), 0,07 (с, 6H), 0,05 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 173,8, 159,4, 154,1, 130,5, 129,4, 114,0, 99,3, 76,5, 73,0, 72,6, 68,0, 66,0, 64,7, 64,6, 63,6, 61,2, 59,5, 58,8, 55,4, 44,5, 42,1, 41,6, 33,7, 29,7, 28,8, 26,3, 26,3, 26,2, 26,1, 19,0, 18,6, 18,3, 18,2, 15,2, 14,9, 13,7, -4,1, -4,2, -5,1, -5,2.
МС (ESI) m/z: 687 (М+23)+.
Rf= 0,47 (Hex:EtOAc, 4:1).
Пример 28: Соединение 12q

Указанное в заголовке соединение получали как соединение-предшественник 11b в реакции восстановления 10b перед обработкой Н2О2.
1H ЯМР (300 МГц, CDCl3) δ 7,16 (д, J= 8,4 Гц, 2H), 6,82 (д, J= 8,7 Гц, 2H), 5,86-5,74 (м, 1H), 5,20-5,15 (м, 2H), 4,40-4,34 (м, 2H), 4,18-4,15 (м, 1H), 4,09-4,03 (м, 1H), 3,85-3,79 (м, 1H), 3,76 (с, 3H), 3,66 (д, J= 7,8 Гц, 1H), 3,58 (кв, J= 7,2 Гц, 1H), 3,47 (дд, J= 9,9, 2,4 Гц, 1H), 3,37-3,27 (м, 1H), 2,87 (уш. д, J= 8,7 Гц, 1H), 2,74 (кв, J= 7,5 Гц, 1H), 2,63 (д, J= 9,3 Гц, 1H), 1,72-1,65 (м, 2H), 1,18 (с, 3H), 1,03 (д, J= 6,3 Гц, 3H), 0,91-0,85 (м, 9H), 0,84 (с, 9H), 0,60 (кв, J= 7,8Гц, 6H), -0,01 (с, 3H), -0,02 (с, 3H).
Rf = 0,65 (Hex:EtOAc, 4:1).
Пример 29: Соединение 13а

В раствор 12а (5,91 г, 7,85 ммоль) в CH2Cl2 (80 мл) барботировали ток О3 в течение 15 мин при -78°С. После этого прибавляли Ph3P (6,29 г, 24 ммоль), давали смеси нагреться до комнатной температуры и продолжали перемешивание в течение 12 ч. Смесь концентрировали при пониженном давлении и очищали остаток колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая соединение 13а (4,99 г, 84%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 9,80 (д, J= 3,0 Гц, 1Н), 7,20 (д, J= 8,7 Гц, 2H), 6,85 (д, J= 8,7 Гц, 2H), 4,66 (м, 1H), 4,39 (с, 2H), 3,84 (м, 2H), 3,78 (с, 3H), 3,68 (м, 2H), 3,61 (м, 2H), 3,37 (м, 2H), 2,58 (д, J= 9,0 Гц, 1H), 2,44 (м, 1H), 1,82 (м, 1H), 1,72 (м, 1H), 1,29 (с, 3H), 1,05 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,87 (с, 9H), 0,85 (с, 9H), 0,15 (с, 3H), 0,11 (с, 3H), 0,06 (с, 6H), 0,00 (с, 6H).
13С ЯМР (75 МГц, CDCl3) δ 205,3, 159,2, 130,0, 129,0, 113,7, 76,4, 72,8, 72,7, 67,9, 64,6, 63,9, 60,8, 60,1, 57,7, 55,1, 44,4, 33,5, 26,1, 25,7, 18,3, 18,1, 17,8, 14,8, 12,9, -4,6, -5,3, -5,5, -5,5, -5,7, -5,7.
[α]25 D+2,3(с 0,50, CH2Cl2).
Rf= 0,46 (Нех:EtOAc, 4:1).
Пример 30: Соединение 13b

К раствору 12с (2,25 г, 2,84 ммоль) в смеси ТГФ:Н2О (70:30, 105 мл) добавляли NMO (1,16 г, 9,94 ммоль) и OsO4 (5,68 мл, 0,568 ммоль, 0,1 М в tBuOH) при 23°С и перемешивали реакционную смесь при 23°С в течение ночи. Прибавляли флоризил (16 г), NaHSO3 (16 г) и EtOAc (160 мл) и энергично перемешивали смесь в течение 30 мин. Смесь фильтровали через слой целита и концентрировали фильтрат, получая соответствующий диол. Данный диол растворяли в безводном толуоле (50 мл) и добавляли Pb(OAc)4 (1,57 г, 3,55 ммоль) при 0°С, перемешивали в течение 30 мин, фильтровали через слой целита, промывали EtOAc и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая соединение 13b (0,97 г, 43%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 9,61 (д, J= 3,9 Гц, 1Н), 7,22 (д, J= 8,5 Гц, 2H), 6,87 (д, J= 8,5 Гц, 2H), 5,56 (дд, J= 10,3, 6,6 Гц, 1H), 4,42 (с, 2H), 3,95 (м, 1H), 3,80 (с, 3H), 3,54 (м, 2H), 3,38 (д, J= 7,0 Гц, 2H), 3,24 (д, J= 6,8 Гц, 1H), 3,04 (м, 1H), 2,49 (д, J= 9,0 Гц, 1H), 1,98 (с, 3H), 1,79 (м, 1H), 1,31 (с, 3H), 1,06 (д, J= 6,8 Гц, 3H), 0,92 (с, 9H), 0,88 (с, 9H), 0,85 (с, 9H), 0,13 (с, 3H), 0,06 (с, 6H), 0,04 (с, 3H), 0,03 (с, 6H).
13С ЯМР (75 МГц, CDCl3) δ 203,3, 170,1,159,4, 130,4, 129,3, 114,0, 76,6, 73,1, 72,7, 69,1, 64,4, 63,9, 61,3, 60,0, 58,4, 55,4, 46,4, 33,4, 29,9, 26,4, 26,1, 26,0, 21,2, 18,6, 18,4, 18,3, 15,1, 12,8, -4,1, -5,0, -5,1, -5,2, -5,3, -5,4.
МС (ESI) m/z: 819 (М+23)+.
Rf= 0,47 (Hex:EtOAc, 4:1).
Пример 31: Соединение 13с
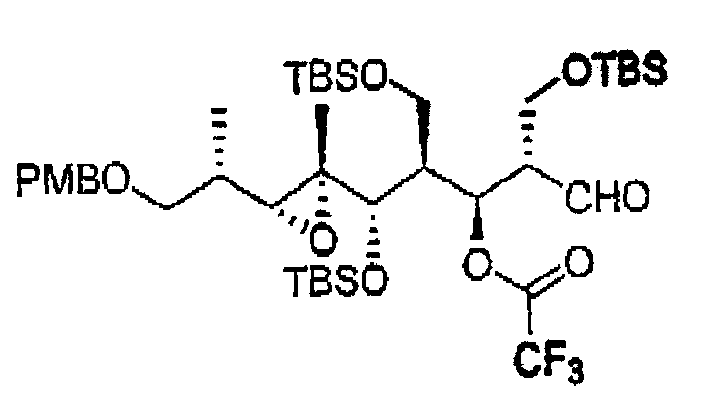
К раствору 13а (90 мг, 0,12 ммоль) в CH2Cl2 (10 мл) добавляли Py (0,19 мл, 2,4 ммоль), DMAP (22 мг, 0,18 ммоль) и (CF3CO)2O (0,17 мл, 1,2 ммоль) при 0°С и перемешивали реакционную смесь при 0°С в течение 2 ч. После этого реакционную смесь концентрировали при пониженном давлении, получая 13с, который использовали на последующих стадиях без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 9,63 (д, J= 2,4 Гц, 1H), 7,19 (д, J= 8,6 Гц, 2H), 6,85 (д, J= 8,6 Гц, 2H), 5,75-5,79 (м, 1H), 4,34-4,42 (м, 2H), 3,86-3,90 (м, 2H), 3,78 (с, 3H), 3,48 (д, J= 5,4 Гц, 1H), 3,30-3,38 (м, 3H), 3,08-3,13 (м, 1H), 2,51 (д, J= 9,0 Гц, 1H), 2,21-2,27 (м, 1H), 1,77-1,82 (м, 1H), 1,25 (с, 3H), 1,05 (д, J= 6,8 Гц, 3H), 0,91 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,13 (с, 3H), 0,07 (с, 3H), 0,06 (с, 3H), 0,02 (с, 6H), 0,00 (с, 3H).
Rf = 0,70 (Hex:EtOAc, 4:1).
Пример 32: Соединение 13d

По методике, описанной в примере 29, 12h (1 г, 1,32 ммоль) переводили в 13d (715 мг, 72%, бесцветное масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, 20:1).
1H ЯМР (300 МГц, CDCl3) δ 9,81 (д, J= 3,0 Гц, 1H), 7,21 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,4 Гц, 2H), 4,70-4,64 (м, 1H), 4,40 (с, 2H), 3,89-3,81 (м, 1H), 3,80 (с, 3H), 3,75-3,66 (м, 2H), 3,64 (д, J= 6,6 Гц, 2H), 3,38-3,35 (м, 2H), 2,60 (д, J= 9,3 Гц, 1H), 2,50-2,46 (м, 1H), 1,85-1,80 (м, 1H), 1,77-1,68 (м, 1H), 1,29 (с, 3H), 1,06 (д, J= 6,6 Гц, 3H), 0,94-0,87 (м, 9H), 0,92 (с, 9H), 0,87 (с, 9H), 0,55 (кв, J= 7,8 Гц, 6H), 0,16 (с, 3H), 0,11 (с, 3H), 0,07 (с, 3H), 0,06 (с, 3H).
МС (ESI) m/z: 777 (М+23)+.
Rf= 0,5 (Hex:EtOAc, 4:1).
Пример 33: Соединение 13е

По методике, описанной в примере 29, 12j (590 мг, 0,81 моль) переводили в 13е (420 мг, 71%, светло-желтое масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, 10:1).
1H ЯМР (300 МГц, CDCl3) δ 9,58 (д, J= 20,0 Гц, 1H), 7,19 (д, J= 8,4 Гц, 2H), 6,82 (д, J= 8,4 Гц, 2H), 5,58 (дд, J= 5,1, 4,6 Гц, 1H), 4,38 (с, 2H), 4,30-4,23 (м, 2H), 3,76 (с, 3H), 3,50 (дд, J= 6,9, 5,1 Гц, 2H), 3,30 (д, J= 7,0 Гц, 2H), 3,25-3,22 (м, 2H), 2,44 (д, J= 9,3 Гц, 1H), 2,15-2,12 (м, 1H), 1,93 (с, 3H), 1,92 (с, 3H), 1,23 (с, 3H), 1,12 (д, J= 6,6 Гц, 3H), 0,84 (с, 9H), 0,82 (с, 9H), 0,09 (с, 3H), 0,02(с, 3H), 0,01 (с, 3H), 0,00 (с,3H).
Rf= 0,26 (Нех:EtOAc, 4:1).
Пример 34: Соединение 13f

По методике, описанной в примере 29, 12g (342 мг, 0,44 моль) переводили в 13f (306 мг, 90%, бледно-желтое масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 0:1).
1H ЯМР (300 МГц, CDCl3) δ 9,64 (д, J= 3,3 Гц, 1H), 7,22 (д, J= 8,1 Гц, 2H), 6,86 (д, J= 8,4 Гц, 2H), 5,64 (дд, J= 6,6, 3,9 Гц, 1H), 4,63 (с, 2H), 4-40 (с, 2H), 3,86 (дд, J= 9,9 7,5 Гц, 1H), 3,79 (c, 3H), 3,74 (дд, J= 10,2, 4,5 Гц, 1H), 3,65-3,61 (м, 2H), 3,53-3,50 (м, 4H), 3,85-3,34 (м, 1Н), 3,37 (с, 3H), 3,21 (д, J= 7,2 Гц, 1Н), 3,15-3,13 (м, 1H) 2,48 (д, J= 9,0 Гц, 1H), 1,98 (с, 3H), 1,80-1,75 (м, 1H), 1,28 (с, 3H), 1,05 (д, J= 6,9 Гц, 3H), 0,90 (с, 9H), 0,87 (с, 9H), 0,11 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H), 0,03 (c, 3H).
МС (ESI) m/z: 793(М+23)+.
Rf=0,1(Hex:EtOAc, 4:1).
Пример 35: Соединение 13g

По методике, описанной в примере 29, 12m (200 мг, 0,3 ммоль) переводили в 13g (173 мг, 86%, бледно-желтое масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, 15:1).
1H ЯМР (300 МГц, CDCl3) δ 9,84 (д, J= 2,7 Гц, 1H), 4,67-4,61 (м, 1H), 4,08 (дд, J= 11,1, 5,7 Гц, 1H), 3,95-3,84 (м, 3H), 3,81 (д, J= 5,1 Гц, 2H), 3,70 (д, J= 6,9 Гц, 1H), 3,47 (д, J= 5,4 Гц, 1H), 2,64-2,61 (м, 1H), 2,26 (д, J= 9,3 Гц, 1H), 2,04 (с, 3H), 1,85-1,80 (м, 1H), 1,30 (с, 3H), 1,11 (д, J= 6,6 Гц, 3H), 0,96 (т, J= 8,1 Гц, 9H), 0,87 (с, 9H), 0,85 (с, 9H), 0,68 (кв, J= 8,1 Гц, 6H), 0,07 (с, 3H), 0,06 (с, 3H), 0,03 (с, 6H).
МС (ESI) m/z: 699 (М+23)+, 677 (М+1)+.
Rf= 0,52 (Hex:EtOAc, 4:1).
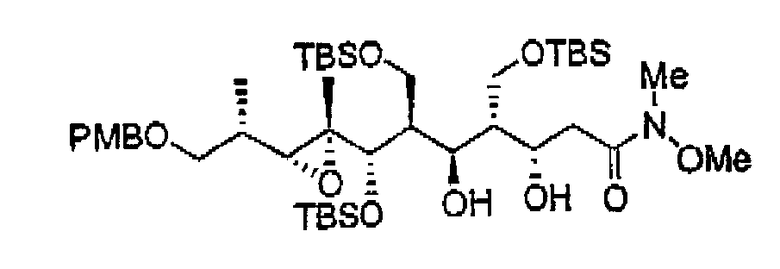
Пример 36: Соединения 14а и 14b
К раствору N-метокси-N-метилацетамида (0,8 мл, 7,56 ммоль) в ТГФ (2 мл) при -78°С прибавляли бис(триметилсилил)амид лития (7,56 мл, 1,0 М в ТГФ, 7,56 ммоль) и перемешивали реакционную смесь в течение 1 ч при -78°С. После этого к предшествующему раствору добавляли раствор 13а (1,61 г, 2,13 ммоль) в ТГФ (10 мл) и перемешивали реакционную смесь еще в течение 1 ч при -78°С. Затем добавляли насыщенный водный раствор NH4Cl (50 мл) и экстрагировали реакционную смесь EtOAc (3х60 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 2:1), получая 14а и 14b (25:75) в виде бесцветных масел (1,67 г с общим выходом 91%).
14a: 1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,7 Гц, 2H), 6,85 (д, J= 8,7 Гц, 2Н), 4,46-4,43 (м, 1H), 4,39 (с, 2H), 4,33 (м, 1H), 4,14 (д, J= 7,2 Гц, 1H), 3,92-3,88 (м, 2H), 3,83 (д, J= 3,6 Гц, 1H), 3,78 (с, 3Н), 3,63 (с, 3H), 3,61-3,57 (м, 3Н), 3,41-3,30 (м, 2H), 3,17 (с, 3Н), 3,0-2,91 (м, 1H), 2,63-2,62 (м, 1H), 2,58 (д, J= 9,0 Гц, 1H), 2,02-1,96 (м, 1H), 1,85-1,78 (м, 1H), 1,75-1,72 (м, 1H), 1,27 (с, 3Н), 1,06 (д, J= 6,6 Гц, 3Н), 0,91 (с, 9H), 0,86 (с, 18H), 0,14 (с, 3Н), 0,11 (с, 3Н), 0,08 (с, 3Н), 0,05 (с, 3Н), 0,02 (с, 3Н), 0,01 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 173,8, 159,4, 130,3, 129,3, 114,0, 76,3, 73,0, 72,6, 70,4, 70,1, 64,8, 64,0, 61,9, 61,4, 60,6, 55,4, 47,9, 44,4, 36,9, 34,0, 32,1, 29,9, 26,5, 26,4, 26,1, 26,0, 18,6, 18,3, 18,0, 15,3, 12,8, -4,3, -5,0, -5,1, -5,2, -5,4.
МС (ESI) m/z: 858 (М+1)+.
[α]25 D-10,7 (c0,5, CH2Cl2).

14b: 1H ЯМР (300 МГц, CDCl3) δ 7,17 (д, J= 8,4 Гц, 2H), 6,83 (д, J= 8,4 Гц, 2H), 4,52-4,51 (м, 1H), 4,45 (с, 3Н), 4,37 (с, 2H), 4,28-4,23 (м, 1H), 3,91-3,88 (м, 1Н), 3,81 (м, 1H), 3,76 (с, 3Н), 3,64 (с, 3Н), 3,61-3,52 (м, 3Н), 3,48-3,43 (дд, J= 10,5, 3,3 Гц, 1H), 3,38-3,35 (м, 2H), 3,15 (с, 3Н), 2,84-2,79 (м, 1H), 2,57 (д, J= 9,0 Гц, 1H), 1,94-1,92 (м, 1H), 1,83-1,81 (м, 1H), 1,72-1,69 (м, 1H), 1,24 (с, 3Н), 1,05 (д, J= 6,3 Гц, 3H), 0,89 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,13 (с, 3H), 0,08 (c, 3H), 0,07 (с, 3H), 0,04 (с, 3H), 0,01 (с, 3H), -0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 174,8, 159,4, 130,3, 129,2, 113,9, 76,4, 73,0, 72,8, 69,2, 68,5, 64,9, 64,1, 61,4, 60,8, 60,1, 55,4, 47,8, 43,7, 34,1, 26,5, 26,3, 26,2, 26,1, 26,0, 25,9, 18,7, 18,2, 17,9, 15,2, 12,7, -4,6, -4,9, -5,0, -5,2, -5,4, -5,5.
МС (ESI) m/z: 880 (М+23)+, 858 (М+1)+.
[α]25 D+12,8 (c 0,50, CH2Cl2).
Rf = 0,44 (Hex:EtOAc,2:1).
Пример 37: Соединения 14с и 14d
К раствору бензилацетата (38 мкл, 0,53 ммоль) в сухом ТГФ (5 мл) при -78°С прибавляли бис(триметилсилил)амид лития (264 мкл, 1,0 М в ТГФ, 0,264 ммоль) и перемешивали реакционную смесь в течение 1 ч при -78°С. После этого к предшествующему раствору добавляли раствор 13а (150 мг, 0,17 ммоль) в ТГФ (5 мл) и перемешивали реакционную смесь в течение 5 ч при -78°С. Затем добавляли насыщенный водный раствор NH4Cl (30 мл) и экстрагировали сырую реакционную смесь EtOAc (3×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 20:1 до 5:1), получая 14с (34 мг, 20%) и 14d (77 мг, 44%) в виде бесцветных масел.

14c: 1H ЯМР (300 МГц, CDCl3) δ 7,28-7,39 (м, 5H), 7,19 (д, J= 8,7 Гц, 2H), 6,82 (д, J= 8,7 Гц, 2H), 5,20 (с, 2H), 5,17 (с, 2H), 4,58-4,64 (м, 1Н), 4,38 (с, 2H), 3,78 (с, 3H), 3,58-3,82 (м, 4H), 3,50 (с, 2H), 3,28-3,41 (м, 3H), 2,60 (дд, J= 15,0 и 9,6 Гц, 1Н), 2,53 (д, J= 9,3 Гц, 1Н), 2,25 (дд, J= 153, 4,7 Гц, 1Н), 1,76-1,86 (м, 1Н), 1,59-1,62 (м, 1Н), 1,26 (с, 3H), 1,05 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,88 (с, 9H), 0,17 (с, 3H), 0,11 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H).
Rf= 0,33 (Hex:EtOAc, 4:1).

14d: 1H ЯМР (300 МГц, CDCl3) δ 7,32-7,55 (м, 5H), 7,20 (д, J= 8,7 Гц, 2H), 6,84 (д, J= 8,7 Гц, 2H), 5,19 (с, 2H), 4,43-4,48 (м, 1H), 4,40 (с, 2H), 4,32-4,40 (м, 1H), 4,19-4,23 (м, 1H), 3,81 (с, 3H), 3,75-3,98 (м, 3Н), 3,42-3,64 (м, 3Н), 3,39 (д, J= 7,8 Гц, 2H), 2,60 (д, J= 9,3 Гц, 1H), 2,61-2,79 (м, 1H), 1,78-1,93 (м, 2H), 1,74-1,77 (м, 1H), 1,25 (с, H), 1,05 (д, J= 6,7 Гц, 3Н), 0,92 (с, 9H), 0,88 (с, 9H), 0,82-0,92 (м, 6H), 0,49-0,60 (м, 12H), 0,09 (с, 3Н), 0,05 (с, 3Н), 0,04 (с, 3Н), 0,03(с, 3H).
МС (ESI) m/z: 927 (М+23)+.
Rf= 0,30 (Нех:EtOAc, 4:1).
Пример 38: Соединение 15а

К раствору 14а (1,09 г, 1,26 ммоль) в CH2Cl2 (20 мл) добавляли 2,6-лутидин (443 мкл, 3,8 ммоль) и TBSOTf (437 мкл, 1,9 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 40 мин. Затем прибавляли насыщенный водный раствор NH4Cl (30 мл) и экстрагировали реакционную смесь CH2Cl2 (2×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 20:1 до 4:1), получая соединение 15а (1,05 г, 85%) в виде бледно-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 4,87-4,83 (м, 1H), 4,48-4,37 (м, 2H), 4,17-4,14 (м, 2H), 3,86 (дд, J= 10,2, 7,0 Гц, 1H), 3,80 (с, 3Н), 3,66 (с, 3Н), 3,64-3,63 (м, 1H), 3,54 (дд, J= 10,2, 3,6 Гц, 1H), 3,53 (дд, J= 9,0, 5,1 Гц, 1H), 3,35-3,29 (м, 2H), 3,17 (с, 3Н), 3,11-3,05 (м, 1H), 2,56-2,55 (м, 1H), 2,52 (д, J= 8,1 Гц, 1H), 2,31-2,28 (м, 1H), 1,84-1,82 (м, 1H), 1,81-1,78 (м, 1H), 1,29 (с, 3Н), 1,09 (д, J= 6,6 Гц, 3H), 0,92 (с, 9H), 0,89 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,15 (с, 6H), 0,1 (с, 3Н), 0,09 (с, 3Н), 0,06 (с, 3H), 0,04 (с, 6H), 0,02 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 173,4, 159,4, 130,4, 129,4, 114,0, 76,0, 72,9, 72,4, 69,5, 68,8, 64,6, 64,1, 61,4, 61,0, 59,3, 55,4, 50,1, 43,6, 34,3, 29,9, 26,5, 26,2, 26,1, 26,0, 18,7, 18,3, 17,9, 15,4, 12,7, -4,4, -4,5, -4,6, -4,9, -5,0, -5,2, -5,4, -5,5.
МС (ESI) m/z: 994 (М+23)+, 972 (М+1)+.
[α]25 D-20,0 (с 0,5, СН2Cl2).
Rf = 0,43 (Нех:EtOAc, 4:1).
Пример 39: Соединение 15b

По методике, описанной в примере 38, 14b (2,18 г, 2,52 ммоль) переводили в 15b (2,02 г, 82%, твердое белое вещество) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, 10:1).
1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 4,85-4,82 (м, 1H), 4,44-4,35 (м, 2H), 4,09 (т, J= 9,0 Гц, 1H), 3,80 (с, 3H), 3,77-3,73 (м, 1H), 3,65 (с, 3H), 3,63-3,60 (м, 1H), 3,42-3,30 (м, 3H), 3,15 (с, 3H), 2,75-2,72 (м, 1H), 2,61 (д, J= 9,3 Гц, 1H), 2,48 (дд, J= 15,3, 2,1 Гц, 1H), 1,93-1,88 (м, 1H), 1,84-1,81 (м, 1H), 1,77-1,74 (м, 1H), 1,27 (с, 3H), 1,08 (д, J= 6,6 Гц, 3H), 0,90 (с, 3H), 0,88 (с, 18H), 0,85 (с, 9H), 0,13, (с, 3H), 0,09 (с, 3H), 0,08 (с, 6H), 0,04 (с, 3Н), 0,03 (с, 3Н), 0,01 (с, 6H).
13С ЯМР (75 МГц, CDCl3) δ 173,3, 159,4, 130,4, 129,4, 114,0, 76,0, 72,9, 69,5, 68,8, 64,6, 64,1, 61,3, 61,1, 59,3, 55,4, 50,1, 43,5, 34,3, 29,9, 26,5, 26,2, 26,1, 26,0, 18,7, 18,3, 18,2, 17,9, 15,4, 12,7, -4,4, -4,5, -4,6, -4,9, -5,0.
МС (ESI) m/z: 994 (М+23)+, 972 (М+1)+.
[α]25 D+23,1 (с 0,50, СН2Cl2).
Rf= 0,37 (Hex:EtOAc, 4:1).
Пример 40: Соединение 16а
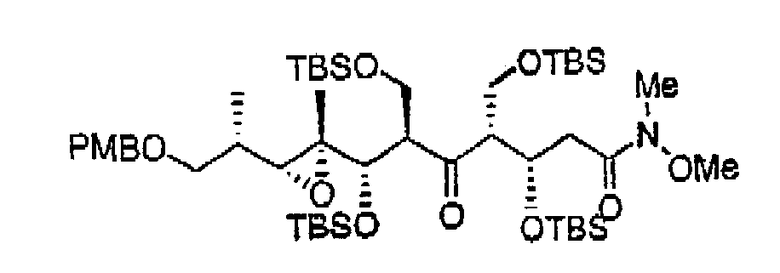
К раствору 15а (184 мг, 0,189 ммоль) в CH2Cl2 (5 мл) добавляли перйодинан Десс-Мартина (325 мг, 0,76 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 16а (150 мг, 81%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 4,72-4,67 (м, 1H), 4,43 (кв, J= 11,7 Гц, 2H), 3,80 (с, 3H), 3,78-3,77 (м, 2H), 3,72-3,66 (м, 3H), 3,63 (с, 3H), 3,43-3,38 (м, 1H), 3,32-3,26 (м, 3H), 3,15 (с, 3H), 2,72 (д, J= 9,0 Гц, 1H), 2,65 (уш.д, J= 8,7 Гц, 1H), 2,59-2,51 (м, 1Н), 1,79-1,72 (м, 1H), 1,32 (с, 3H), 1,06 (д, J= 6,6 Гц, 3H), 0,89 (с, 9H), 0,87 (с, 9H), 0,86 (с, 18H), 0,14 (с, 3H), 0,09 (с, 3H), 0,06 (с, 3H), 0,05 (с, 6H), 0,04 (с, 3H), 0,00 (с, 6H).
13C ЯМР (75 МГц, CDCl3) δ 210,7, 172,1, 159,1, 130,3, 129,0, 113,7, 75,9, 72,6, 72,1, 68,1, 63,7, 63,3, 61,4, 61,1, 60,1, 59,9, 57,6, 55,1, 37,2, 33,8, 29,7, 26,1, 26,0, 25,9, 25,8, 18,2, 18,1, 18,0, 15,2, 13,2, -4,3, -4,5, -4,7, -4,9, -5,2, -5,3, -5,4, -5,5.
МС (ESI) m/z: 993 (М+23)+.
[α]25 D-20,3 (с 0,50, СН2Cl2).
Rf= 0,40 (Hex:EtOAc, 4:1).
Пример 41: Соединение 16b

К раствору 15b (725 мг, 0,745 ммоль) в CH2Cl2 (15 мл) добавляли перйодинан Десс-Мартина (1,26 г, 2,98 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 2 ч. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток (720 мг) использовали в следующей реакции без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 7,21 (д, J= 8,7 Гц, 2H), 6,83 (д, J= 8,7 Гц, 2H), 4,68-4,64 (м, 1H), 4,41 (кв, J= 11,7 Гц, 2H), 3,98-3,85 (м, 3H), 3,76 (с, 3H), 3,67 (дд, J= 9,9, 3,0 Гц, 1H), 3,63 (с, 3H), 3,58 (д, J= 7,8 Гц, 1H), 3,43 (дд, J= 9,3, 6,9 Гц, 1H), 3,30-3,23 (м, 2H), 3,11 (с, 3H), 3,93-2,88 (м, 1H), 2,62-2,57 (м, 2H), 2,55 (д, J= 9,3 Гц, 1H), 1,75-1,70 (м, 1H), 1,26 (с, 3H), 1,03 (д, J= 6,6 Гц, 3H), 0,87 (с, 9H), 0,84 (с, 9H), 0,83 (с, 9H), 0,82 (с, 9H), 0,10 (с, 3H), 0,08 (с, 3H), 0,05 (с, 6H), 0,01 (с, 3H), 0,00 (с, 3H), -0,02 (с, 3H), -0,03 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 208,4, 171,3, 159,4, 130,6, 129,3, 114,0, 76,0, 72,9, 66,9, 64,1, 63,0, 61,4, 60,7, 60,6, 58,7, 58,5, 55,4, 34,1, 26,4, 26,3, 26,2, 26,1, 26,0, 18,5, 18,4, 18,3, 18,2, 15,5, 14,4, 13,0, -4,3, -4,4, -4,6, -4,7, -4,9, -5,1, -5,2.
МС (ESI) m/z:992(М+23)+.
[α]25 D+39,7 (с 0,5, СН2Cl2).
Rf= 0,45 (Hex:EtOAc, 4:1).
Пример 42: Соединение 17а

К раствору 16а (289 мг, 0,3 ммоль) в смеси CH2Cl2:Н2О (10:0,5 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (200 мг, 0,89 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 45 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (35 мг, 0,95 ммоль) и перемешивали реакционную смесь при 23°С в течение 30 мин. Затем реакционную смесь концентрировали при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 6:1), получая 17а (153 мг, 60%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 4,56-4,51 (м, 1H), 3,98-3,74 (м, 4H), 3,64 (с, 3H), 3,61 (уш.с, 1H) 3,53 (д, J= 3,9 Гц, 1H), 3,51-3,46 (м, 1H), 3,42-3,37 (м, 1H), 3,23-3,18 (м, 1H) 3,14 (с 3H), 2,69 (уш.д, J= 6,3 Гц, 1H), 2,65 (уш.д, J= 5,1 Гц, 1H), 2,58 (д, J= 9,6 Гц, 1H), 1,72-1,64 (м, 1H), 1,32 (с, 3H), 0,95 (д, J= 6,9 Гц, 3H), 0,90 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,85 (c, 9H), 0,13 (с, 3H), 0,09 (с, 3H), 0,05 (с, 9H), 0,04 (с, 3H), 0,03 (с,3H), 0,00 (с,3H).
13С ЯМР (75 МГц, CDCl3) δ 212,7, 171,9, 75,6, 67,6, 65,5, 64,2, 63,2, 61,4, 61,1, 60,9, 60,6, 60,4, 38,1, 35,7, 32,1, 31,9, 29,7, 26,0, 25,9, 18,4, 18,3, 18,1, 18,0, 14,2, 14,2, -4,5, -4,6, -4,7, -5,2, -5,3, -5,4, -5,5.
МС (ESI) m/z: 872 (М+23)+.
[α]25 D-29,5 (с 0,5, СН2Cl2).
Rf = 0,20 (Hex:EtOAc, 4:1).
Пример 43: Соединение 17b

К раствору сырого 16b (0,745 ммоль) в смеси CH2Cl2:Н2О (10:0,5 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (507 мг, 2,23 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 40 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (35 мг, 0,95 ммоль) порциями в течение 2 ч при 23°С. После этого реакционную смесь концентрировали при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 6:1), получая 17b (474 мг, 75% после двух стадий) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 4,58 (дт, J= 9,9, 3,0 Гц, 1H), 4,13-3,99 (м, 3H), 3,88 (тд, J= 9,0, 2,4 Гц, 2H), 3,64 (с, 3H), 3,60 (дд, J= 8,7, 4,0 Гц, 1H), 3,54-3,45 (м, 1H), 3,43 (д, J= 3,6 Гц, 1H), 3,24 (дт, J= 9,9, 3,0 Гц, 1H), 3,15-3,13 (м, 1H), 3,11 (с, 3H), 2,56-2,48 (м, 1H), 2,42 (д, J= 9,6 Гц, 1H), 2,30 (дд, J= 16,2, 2,4 Гц, 1H), 1,27 (с, 3H), 0,93 (с, 9H), 0,91 (м, 3H), 0,88 (с, 9H), 0,86 (с, 18H), 0,15 (с, 3H), 0,14 (с, 3H), 0,12 (с, 3H), 0,07 (с, 6H), 0,04 (с, 6H), 0,01 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 213,0, 171,4, 74,6, 65,7, 65,5, 64,1, 63,6, 63,5, 62,3, 61,1, 60,1, 59,1, 35,9, 34,8, 32,0, 29,6, 26,1, 26,0, 25,8, 25,7, 18,5, 18,3, 17,9, 14,2, 14,0, -4,5, -4,7, -5,0, -5,2, -5,3, -5,5, -5,6.
МС (ESI) m/z: 872 (М+23)+.
[α]25 D-14,4 (с 0,5, СН2Cl2).
Rf= 0,30 (Нех:EtOAc, 4:1).
Пример 44: Соединение 17с

К раствору 15b (289 мг, 0,3 ммоль) в смеси CH2Cl2:Н2О (10:0,5 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (200 мг, 0,89 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 30 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (35 мг, 0,95 ммоль) и перемешивали реакционную смесь при 23°С в течение 30 мин. После этого реакционную смесь концентрировали при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 7:1), получая 17с (61 мг, 24%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 4,70-4,66 (м, 1Н), 4,05-4,03 (м, 2H), 3,85-3,81 (м, 3Н), 3,68 (с, 3Н), 3,67-3,65 (м, 1H), 3,50 (уш.т, J= 9,3 Гц, 2H), 3,38 (д, J= 7,5 Гц, 1H), 3,18 (уш.с, 3Н), 2,64 (д, J= 8,7 Гц, 1H), 2,50 (дд, J= 15,0, 1,8 Гц, 1H), 2,09-2,07 (м, 1H), 2,00-1,95 (м, 1H), 1,78-1,77 (м, 1H), 1,27 (с, 3Н), 1,09 (д, J= 6,9 Гц, 3Н), 0,91 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,14 (с, 3Н), 0,08 (с, 3Н), 0,07 (с, 3Н), 0,06 (с, 3Н), 0,05 (с, 3Н), 0,04 (с, 3Н), 0,03 (с, 3Н), -0,02 (с, 3Н).
MC (ESI) m/z: 874 (M+23)+.
Rf= 0,26 (Hex:EtOAc, 4:1).
Пример 45: Соединение 18а
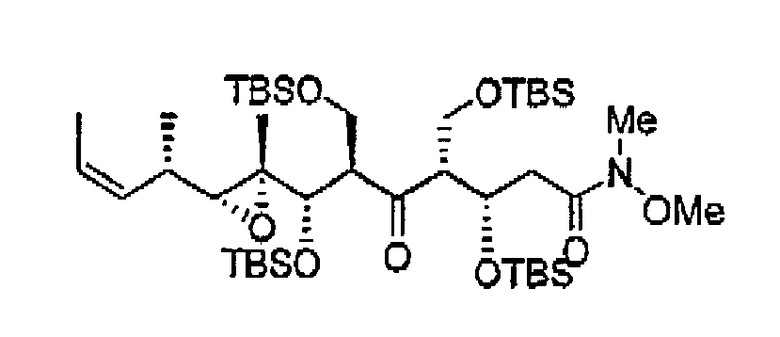
К раствору 17а (113 мг, 0,13 ммоль) в CH2Cl2 (2 мл) добавляли перйодинан Десс-Мартина (141 мг, 1,33 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 40 мин. Добавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая соответствующий альдегид (Rf=0,33 Hex:EtOAc, 4:1). Тем временем к суспензии бромида трифенилэтилфосфония (395 мг) в толуоле (7 мл) прибавляли 1 М/ТГФ третбутилата калия (0,85 мл) при 0°С. Полученный оранжевый раствор перемешивали при 0°С в течение 25 мин, а затем охлаждали до -78°С. Затем раствор свежего сырого альдегида в толуоле (5 мл) прибавляли по каплям к предшествующей суспензии при -78°С и оставляли смесь нагреваться до 23°С в течение 14 ч. Реакционную смесь разбавляли CH2Cl2 (10 мл) и промывали насыщенным раствором NaHCO3 (15 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 15:1), получая 18а (80 мг, 70% после 2 стадий) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 5,52-5,41 (м, 1H), 5,26 (тд, J=10,2, 1,5 Гц, 1H), 4,73-4,68 (м, 1H), 3,81 (дд, J= 10,5, 4,5 Гц, 1H), 3,75-3,69 (м, 2H), 3,63 (с, 3H), 3,60 (с, 2H), 3,29-3,24 (м, 1H), 3,22-3,16 (м, 1H), 3,14 (с, 3H), 2,71 (д, J= 9,3 Гц, 1H), 2,65 (уш.д, J= 7,2 Гц, 1H), 2,52 (дд, J= 15,9, 3,3 Гц, 1H), 2,44-2,35 (м, 1H), 1,61 (дд, J= 6,9, 1,5 Гц, 3H), 1,29 (с, 3H), 1,10 (д, J= 6,3 Гц, 3H), 0,89 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,86 (с, 9H), 0,14 (с, 3H), 0,10 (с, 3H), 0,06 (с, 3H), 0,05 (с, 6H), 0,04 (с, 3H), 0,01 (с, 3H), 0,00 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 211,2, 172,2, 130,9, 124,2, 76,7, 67,7, 64,9, 62,8, 62,2, 61,1, 60,7, 59,5, 57,3, 37,7, 31,8, 29,7, 26,2, 26,0, 25,9, 25,8, 18,9, 18,3, 18,2, 18,1, 18,1, 13,1, 12,3, -4,3, -4,4, -4,7, -4,9, -5,3, -5,4, -5,5.
МС (ESI) m/z: 882 (М+23)+.
Rf = 0,52 (Hex:EtOAc, 4:1).
Пример 46: Соединение 18b
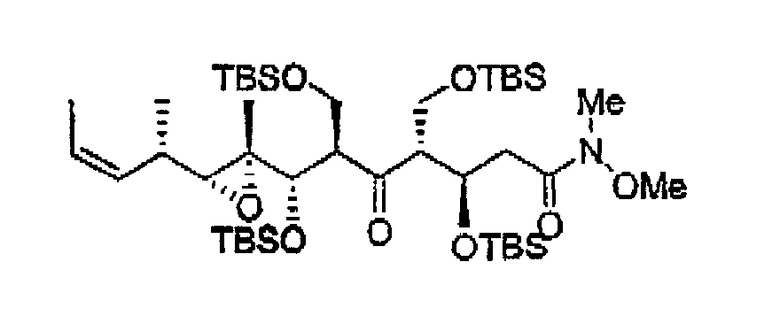
К раствору 17b (474 мг, 0,557 ммоль) в CH2Cl2 (10 мл) добавляли перйодинан Десс-Мартина (590 мг, 1,39 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 40 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая соответствующий альдегид (Rf=0,38 Hex:EtOAc, 4:1). Тем временем к суспензии бромида трифенилэтилфосфония (1,64 мг) в толуоле (15 мл) прибавляли 1М/ТГФ третбутилата калия (3,56 мл) при 0°С. Полученный оранжевый раствор перемешивали при 0°С в течение 25 мин, а затем охлаждали до -78°С. Затем раствор свежего сырого альдегида в толуоле (10 мл) прибавляли по каплям к предшествующей суспензии при -78°С и оставляли смесь нагреваться до 23°С в течение 14 ч. Реакционную смесь разбавляли CH2Cl2 (20 мл) и промывали насыщенным раствором NaHCO3 (30 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 15:1 до 10:1), получая 18b (347 мг, 72% после 2 стадий) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 5,51-5,45 (м, 1H), 5,29 (тд, J= 11,1, 1,5 Гц, 1H), 4,76-4,71 (м, 1H), 3,98 (дд, J= 9,6, 3,3 Гц, 1H), 3,90 (дд, J= 9,6, 7,2 Гц, 1H), 3,69-3,68 (м, 2H), 3,65 (с, 3H), 3,59 (д, J= 8,7 Гц, 1H), 3,36-3,30 (м, 1H), 3,15 (с, 3H), 2,92-2,88 (м, 1H), 2,62 (д, J= 9,3 Гц, 1H), 2,58 (д, J= 2,1 Гц, 1H), 2,55-2,52 (м, 1H), 2,43-2,35 (м, 1H), 1,61 (дд, J= 6,6, 1,5 Гц, 3H), 1,26 (с, 3H), 1,10 (д, J=6,6 Гц, 3H), 0,92 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,12 (с, 3H), 0,09 (с, 9H), 0,03 (с, 3H), 0,00 (с, 9H).
13С ЯМР (75 МГц, CDCl3) δ 208,63, 172,3, 130,9, 124,2, 76,2, 66,7, 65,0, 62,5, 61,3, 61,1, 60,0, 56,8, 36,7, 31,8, 29,7, 26,2, 25,9, 25,9, 18,9, 18,3, 18,2, 18,1, 18,0, 13,1, 12,0, -4,5, -4,7, -4,8, -4,9, -5,2, -5,3, -5,5.
MC (ESI) m/z: 882 (М+23)+.
[α]25 D+73,9 (с 0,5, СН2Cl2).
Rf= 0,50 (Нех:EtOAc, 4:1).
Пример 47: Соединение 18с

По методике, описанной в примере 45, 17с (60 мг, 0,07 ммоль) переводили в 18с (30 мг, 50%, светло-желтое масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, 10:1).
1H ЯМР (300 МГц, CDCl3) δ 5,48-5,40 (м, 1H), 5,32-5,25 (м, 1H), 4,85-4,80 (м, 1H), 4,10 (дд, J= 11,1, 2,4 Гц, 1H), 4,01 (уш.т, J= 9,0 Гц, 1H), 3,83 (дд, J= 10,2, 5,4 Гц, 1Н), 3,76 (уш. д, J= 10,8 Гц, 1Н), 3,66 (с, 3H), 3,62 (д, J= 10,2 Гц, 1H), 3,52 (дд, J= 10,2, 6,0 Гц, 1H), 3,37 (д, J= 8,4 Гц, 1H), 3,16 (с, 3H), 2,71 (д, J= 9,3 Гц, 1H), 2,61-2,58 (м, 1H), 2,50-2,39 (м, 2Н), 2,03-2,00 (м, 1H), 1,77 (уш.д, J= 8,4 Гц, 1H), 1,59 (дд, J= 6,6, 1,5 Гц, 3H), 1,24 (с, 3H), 1,13 (д, J= 6,9 Гц, 3H), 0,91 (с, 9H), 0,90 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,15 (с, 3H), 0,13 (с, 3H), 0,10 (с, 6H), 0,08 (с, 3H), 0,03 (с, 3H), 0,01 (с, 3H).
МС (ESI) m/z: 862 (М+1)+.
Rf= 0,48 (Hex:EtOAc, 4:1).
Пример 48: Соединение 19а

К раствору 18а (80 мг, 0,093 ммоль) в ТГФ (1,5 мл) добавляли BrMgEt (0,28 мл, 1,0 М в ТГФ, 0,28 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Прибавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 30:1), получая 19а (57 мг, 75%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 5,53-5,43 (м, 1H), 5,26 (тд, J= 10,2, 1,5 Гц, 1H), 4,71-4,66 (м, 1H), 3,77 (дд, J= 10,8, 4,5 Гц, 1H), 3,67 (д, J= 5,7 Гц, 2H), 3,60 (т, J= 9,3 Гц, 1H), 3,50 (д, J= 8,7 Гц, 1H), 3,34-3,27 (м, 1H), 3,20-3,14 (м, 1H), 2,64 (д, J= 9 Гц, 1H), 2,58-2,56 (м, 2H), 2,41-2,34 (м, 3H), 1,61 (дд, J= 6,6, 1,8 Гц, 3H), 1,29 (с, 3H), 1,10 (д, J= 6,3 Гц, 3H), 1,00 (т, J= 7,5 Гц, 3H), 0,89 (с, 18H), 0,87 (с, 9H), 0,86 (с, 9H), 0,15 (с, 3H), 0,10 (с, 3H), 0,05 (с, 3H), 0,04 (с, 6H), 0,03 (с, 6H), 0,00 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 211,9, 209,2, 130,9, 124,4, 77,3, 67,4, 65,0, 62,7, 62,1, 60,8, 59,8, 57,6, 47,2, 37,1, 31,7, 29,7, 26,3, 26,0, 25,9, 25,8, 18,9, 18,4, 18,3, 18,1, 18,0, 13,1, 12,2, 7,5, -4,2, -4,3, -4,7, -5,0, -5,3, -5,5, -5,6.
МС (ESI) m/z: 851 (М+23)+.
[α]25 D-11,3 (с 0,5, СН2Cl2).
Rf = 0,74 (Hex:EtOAc, 4:1).
Пример 49: Соединение 19b

К раствору 18b (347 мг, 0,4 ммоль) в ТГФ (4 мл) прибавляли 1 М/ТГФ BrMgEt (1,5 мл, 1,5 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Прибавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 40:1), получая 19b (280 мг, 84%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 5,54-5,44 (м, 1H), 5,30 (тд, J= 10,2, 1,5 Гц, 1H), 4,71-4,67 (м, 1H), 3,95 (дд, J=9,6, 3,3 Гц, 1H), 3,91-3,85 (м, 1H), 3,69 (д, J= 1,5 Гц, 1H), 3,67 (с, 3H), 3,57 (д, J= 9,0 Гц, 1H), 3,34-3,27 (м, 1H), 2,89-2,84 (м, 1Н), 2,62-2,58 (м, 1H), 2,60 (д, J= 9,3 Гц, 1H), 2,44-2,30 (м, 4H), 1,61 (дд, J= 6,9, 1,5 Гц, 3H), 1,25 (с, 3H), 1,11 (д, J= 6,6 Гц, 3H), 1,02 (т, J= 7,5 Гц, 3H), 0,90 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,82 (с, 9H), 0,13 (с, 3H), 0,10 (с, 3H), 0,09 (с, 6H), 0,01 (с, 3H), 0,00 (с, 9H).
13С ЯМР (75 МГц, CDCl3) δ 209,0, 208,7, 130,9, 124,1, 76,0, 65,8, 64,9, 62,3, 61,3, 58,0, 57,2, 46,7, 36,7, 31,8, 26,2, 25,9, 25,8, 18,8, 18,3, 18,2, 18,1, 18,0, 13,1, 12,1, 7,5, -4,5, -4,6, -4,8, -4,9, -5,3, -5,4, -5,5.
МС (ESI) m/z: 851 (М+23)+.
[α]25 D+69,5 (с 0,5, СН2Cl2).
Rf = 0,76 (Нех:EtOAc, 4:1).
Пример 50: Соединения 20а и 20с
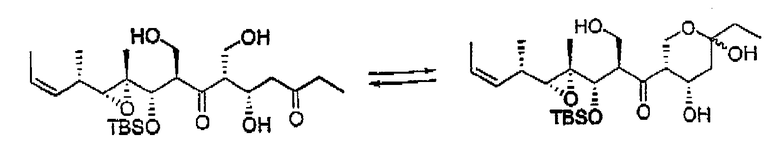
К раствору 19а (160 мг, 0,19 ммоль) в ТГФ (6 мл) одновременно прибавляли TBAF (1,52 мл, 1,0 М в ТГФ, 1,52 ммоль) и АсОН (77 мкл, 1,35 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 16 ч. Добавляли Н2О (10 мл) и экстрагировали смесь EtOAc (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 1:1), получая равновесную смесь таутомеров 20а и 20с (77 мг, 82%) в виде твердого белого вещества.
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,54-5,49 (м, 1H), 5,24 (м, 1H), 4,79 (д, J= 2,5 Гц, 1H), 4,30 (дд, J= 12,0 Гц, 1H), 3,84 (дд, J= 12,5, 4,0 Гц, 1H), 3,67-3,66 (м, 2H), 3,33 (д, J= 10,0 Гц, 1H), 3,30-3,26 (м, 1H), 2,77 (ддд, J= 11,5, 5,0, 2,5 Гц, 1H), 2,51 (д, J= 8,5 Гц, 1H), 2,45-2,39 (м, 1H), 2,02 (дд, J= 14,0, 3,5 Гц, 1H), 1,73 (дд, J= 14,0, 3,0 Гц, 1H), 1,63 (дд, J= 7,0, 1,5 Гц, 3H), 1,61-1,58 (м, 2H), 1,31 (с, 3H), 1,12 (д, J= 6,5 Гц, 3H), 0,93 (т, J= 7,5 Гц, 3H), 0,86 (с, 9H), 0,11 (с, 3H), -0,04 (с, 3H).
13C ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 213,1, 130,5, 124,8, 97,3, 78,6, 65,3, 65,2, 62,2, 61,3, 55,5, 55,2, 54,7, 37,3, 34,5, 31,6, 29,7, 26,0, 18,7, 13,3, 11,4, 7,4, -4,4, -5,2.
МС (ESI) m/z: 509 (М+23)+, 451 (М+Н-2×H2О)+.
Rf= 0,56 (Hex:EtOAc, 1:2).
Пример 51: Соединения 20b и 20d

По методике, описанной в примере 50, 19b (35 мг, 0,04 ммоль) переводили в равновесную смесь таутомеров 20b и 20d (12 мг, 60%, бледно-желтое масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 1:1).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,56-5,50 (м, 1H), 5,32-5,26 (м, 1H), 4,38 (ддд, J= 15,5, 11,5, 5,0 Гц, 1H), 3,86-3,76 (м, 4Н), 3,53 (д, J= 9,5 Гц, 1H), 3,24-3,20 (м, 1H), 2,89 (ддд, J= 14,5, 11,0, 4,5 Гц, 1H), 2,59 (д, J= 9,5 Гц, 1H), 2,46-2,41 (м, 1H), 2,08 (дд, J= 12,5, 5,0 Гц, 1H), 1,69-1,66 (м, 2H), 1,64 (дд, J= 7,0, 2,0 Гц, 3Н), 1,46 (дд, J= 13,0, 12,0 Гц, 1H), 1,30 (с, 3H), 1,13 (д, J= 7,0 Гц, 3H), 0,97 (т, J= 7,5 Гц, 3H), 0,86 (с, 3H), 0,14 (с, 3H), 0,00 (с, 3H).
13C ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 213,1, 130,6, 124,7, 98,8, 77,0, 66,8, 65,1, 62,2, 60,8, 60,0, 59,0, 40,1, 35,5, 31,5, 29,7, 26,1, 18,8, 18,2, 13,3, 11,5, 7,4, -4,3, -5,0.
МС (ESI) m/z: 509 (М+23)+, 451 (М+Н-2×Н2О)+.
[α]25 D+55,0 (с 0,5, СН2Cl2).
Rf=0,51(Hex:EtOAc, 1:2).
Пример 52: Соединения 3а и 4а

К раствору 19а (238 мг, 0,29 ммоль) в ДМФА (5 мл) одновременно прибавляли TBAF (2,9 мл, 1,0 М в ТГФ, 2,9 ммоль) и АсОН (116 мкл, 2 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 7 ч. Добавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь EtOAc (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 0:1), получая равновесную смесь таутомеров 3а и 4а (25 мг, 23%) в виде бесцветного масла.
1H ЯМР (500 МГц, CD3OD) (данные основного продукта) δ 5,56-5,51 (м, 1H), 5,31-5,26 (м, 1H), 4,75 (м, 1Н), 4,29 (дд, J= 11,5, 11,5, Гц, 1H), 3,72 (дд, J= 12,5, 4,0 Гц, 1H), 3,67-3,62 (м, 2H), 3,29-3,27 (м, 1Н), 3,16 (д, J= 10,0 Гц, 1H), 2,89 (ддд, J= 11,5, 4,5, 2,0 Гц, 1H), 2,59 (д, J= 9,5 Гц, 1H), 1,93 (дд, J= 14,0, 3,0 Гц, 1H), 1,75 (дд, J= 14,5, 3,0 Гц, 1Н), 1,65 (дд, J= 6,5, 2,0 Гц, 3H), 1,56 (кв, J= 7,5 Гц, 2H), 1,34 (с, 3H), 1,09 (д, J= 7,0 Гц, 3H), 0,92 (т, J= 7,5 Гц, 3H).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,55-5,48 (м, 1Н), 5,27-5,20 (м, 1Н), 4,74 (уш.д, J= 2,0 Гц, 1Н), 4,32 (дд, 7= 13,0, 13,0 Гц, 1Н), 3,89 (дд, J= 12,5, 4,0 Гц, 1Н), 3,76 (дд, J= 10,0, 9,0 Гц, 1Н), 3,63 (дд, J= 10,5, 3,5 Гц, 1Н), 3,33 (д, J= 9,5 Гц, 1Н), 3,29 (дд, J= 9,5, 4,0 Гц, 1Н), 2,94 (ддд, J= 11,5, 5,0, 2,5 Гц, 1H), 2,68 (д, J= 9,0 Гц, 1Н), 2,44-2,39 (м, 1Н), 2,02 (дд, J= 14,0, 3,0 Гц, 1Н), 1,73 (дд, J= 14,0, 3,0 Гц, 1Н), 1,62 (дд, J= 7,0, 1,5 Гц, 3H), 1,59-1,56 (м, 2H), 1,33 (с, 3H), 1,11 (д, J= 6,0 Гц, 3H), 0,94 (т, J= 7,5 Гц, 3H).
13C ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 214,2, 130,0, 125,0, 97,3, 77,2, 66,8, 66,7, 65,2, 63,0, 55,6, 54,6, 52,9, 37,1, 34,5, 31,3, 18,6, 13,3, 11,6, 7,4.
МС (ESI) m/z: 767 (2×М+23)+, 395 (М+23)+, 377 (М+23-Н2О)+.
Rf=0,24(Hex:EtOAc, 1:2).
Пример 53: Соединения 3b и 4b
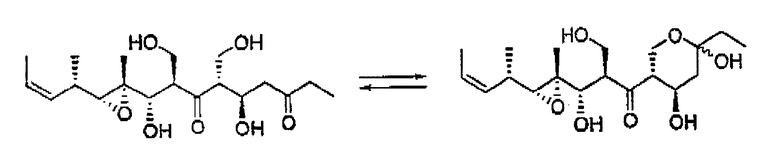
По методике, описанной в примере 52, 19b (200 мг, 0,24 ммоль) переводили в равновесную смесь таутомеров 3b и 4b (20 мг, 21%) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 0:1).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,56-5,48 (м, 1Н), 5,28-5,22 (м, 1Н), 4,41-4,37 (м, 1Н), 3,97-3,73 (м, 5Н), 3,34-3,22 (м, 1Н), 2,98 (ддд, J= 4,5 Гц, 11,5 Гц, 14,5 Гц, 1Н), 2,73 (д, J= 9 Гц, 1Н), 2,46-2,42 (м, 1Н), 2,09 (дд, J= 5 Гц, 13 Гц, 1Н), 1,67 (кв, J= 7 Гц, 2H), 1,63 (дд, J= 1,5 Гц, 7 Гц, 3H), 1,48-1,42 (м, 1Н), 1,35 (с,3H), 1,11 (д, J= 7 Гц,3H), 0,96 (т, J= 7 Гц, 3H).
МС (ESI) m/z: 395 (М+23)+, 767 (2М+23)+, 377 (М+23-H2О)+, 337 (М+1-2H2O)+, 319 (М+1-3H2O)+. HRMS (TOF)
Вычислено для C19Н32О7Na: 395,2046.
Найдено: 395,2019.
Rf = 0,15 (Hex:EtOAc, 1:2).
Пример 54: Соединение 21

Соединение 21 получали по методике, описанной D.A. Evans et al., J. Am. Chem. Soc, 1984, 106, 4261-4163.
1H ЯМР (300 МГц, CDCl3) δ 7,21 (м, 1H), 7,12 (м, 1H), 4,44 (м, 1H), 4,20 (м, 2H), 2,36 (м, 1H), 1,91 (дд, J= 6,6, 1,2 Гц, 3Н), 0,88 (д, J= 6,9 Гц, 3Н), 0,83 (д, J= 6,9 Гц, 3Н).
Пример 55: Соединение 22

К раствору 21 (9,39 г, 0,047 моль) в CH2Cl2 (75 мл) прибавляли Bu2BOTf (52,4 мл, 1,0 М в CH2Cl2, 52,4 ммоль) и Et3N (9,3 мл, 0,067 моль) при -78°С. Реакционную смесь перемешивали 1 ч при -78°С, 15 мин при 0°С и повторно охлаждали до -78°С. Данный раствор прибавляли к раствору 8а (9 г, 0,016 моль) в CH2Cl2 (25 мл) при -50°С и перемешивали смесь при -50°С еще в течение 10 дней. После этого прибавляли насыщенный водный раствор NH4Cl (150 мл) и экстрагировали реакционную смесь CH2Cl2 (2×100 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 15:1 до 2:1), получая соединение 22 наряду приблизительно с 15% другого диастереоизомера (12 г, 80%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J=8,7 ГЦ, 2H), 6,86 (д, J= 8,7 Гц, 2H), 6,20 (дт, J= 17,4, 10,2 Гц, 1H), 5,25 (дд, J= 11,1, 0,6 Гц, 1H), 5,20 (дд, J= 19,2, 0,6 Гц, 1H), 4,47-4,33 (м, 3H), 4,28-4,09 (м, 3H), 3,95 (уш.д, J= 3,6 Гц, 1Н), 3,80 (с, 3H), 3,65-3,56 (м, 2H), 3,33 (уш.д, J= 7,2 Гц, 2H), 2,90 (д, J= 9,3 Гц, 1H), 2,45-2,35 (м, 1H) 2,33-2,23 (кв, J= 6,9 Гц, 1H), 1,83-1,73 (м, 1H), 1,56-1,46 (м, 1H), 1,28 (с, 3H), 1,03 (д, J= 6,9 Гц, 3H), 0,90 (с, 9H), 0,87 (с, J= 6,9 Гц, 3H), 0,83 (с, J= 6,9 Гц, 3H), 0,82 (с, 9H), 0,09 (с, 3H), 0,08 (с, 3H), 0,06 (с, 3H), 0,05 (с, 3H).
13C ЯМР(75 МГц, CDCl3) δ 172,9, 158,7, 153,0, 132,1, 128,7, 128,3, 118,8, 113,3, 77,0, 74,6, 72,3, 69,0, 64,7, 64,5, 63,0, 62,9, 62,7, 60,0, 58,5, 58,1, 58,0, 54,7, 50,4, 47,1, 32,9, 32,2, 30,9, 28,1, 27,9, 27,3, 25,6, 25,5, 17,8, 17,6, 14,3, 14,3, 14,2, 14,1, -5,1, -5,3, -5,8, -5,9.
МС (ESI) m/z: 786 (М+23)+, 764 (М+Н)+.
Rf= 0,32 (Нех:EtOAc, 4:1).
Пример 56: Соединение 23

К раствору смеси диастереоизомеров (5:1) 22 (3,9 г, 5,1 ммоль) в смеси ТГФ:Н2О (5:1, 75 мл) прибавляли LiBH4 (13 мл, 2,0 М в ТГФ, 26 ммоль) при 0°С. Реакционную смесь перемешивали в течение 30 мин при 0°С и 2,5 ч при 23°С. Прибавляли насыщенный водный раствор NH4Cl (100 мл) и экстрагировали реакционную смесь EtOAc (3×150 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток 23 (3,4 г) использовали на следующей стадии без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3) δ 7,17 (д, J= 8,4 Гц, 2H), 6,85 (д, J= 9,0 Гц, 2H), 6,17-6,05 (м, 1H), 5,20 (дд, J= 10,5, 1,8 Гц, 1H), 5,13 (дд, J= 17,7, 1,8 Гц, 1H), 4,40-4,35 (м, 2H), 4,02 (д, J= 9,6 Гц, 1H), 3,85-3,73 (м, 2H), 3,80 (с, 3H), 3,48-3,47 (м, 2Н), 3,39-3,34 (м, 1H), 3,30-3,24 (м, 1H), 2,66 (д, J= 9,3 Гц, 1H), 2,31-2,28 (м, 1H), 1,81-1,74 (м, 2H), 1,28 (с, 3H), 1,05 (д, J= 6,6 Гц, 3H), 0,92 (с, 9H), 0,86 (с, 9H), 0,17 (с, 3H), 0,12 (с, 3H), 0,00 (с, 3H), -0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,4, 135,8, 130,3, 129,2, 118,3, 114,0, 79,1, 73,2, 73,0, 72,3, 67,2, 65,6, 64,4, 60,4, 55,4, 47,7, 46,7, 33,6, 26,2, 18,5, 18,2, 15,0, 12,9, -4,1, -5,0, -5,1, -5,4.
МС (ESI) m/z: 661 (М+23)+, 639 (М+H)+.
Rf =0,18 (Hex:EtOAc, 4:1).
Пример 57: Соединение 24
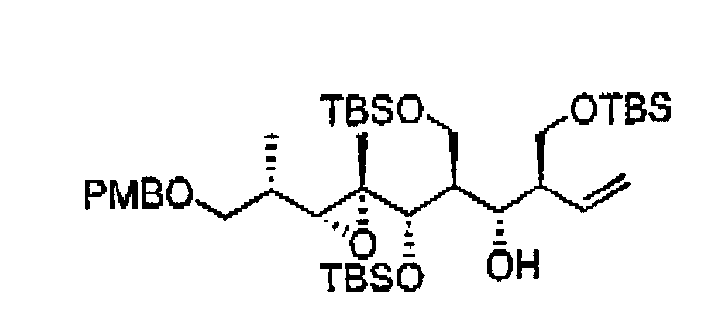
К раствору сырого 23 (5 ммоль) в CH2Cl2 (60 мл) прибавляли имидазол (1,02 г, 15 ммоль) и TBSCl (1,13 г, 7,5 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 15 мин. Прибавляли насыщенный водный раствор NH4Cl (70 мл) и экстрагировали реакционную смесь CH2Cl2 (2×100 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая чистое соединение 24 (1,7 г, 43% после двух стадий) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,19 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 5,96-5,84 (м, 1H), 5,12-5,05 (м, 2H), 4,37 (кв, J= 11,4 Гц, 2H), 4,0 (д, J= 9,3 Гц, 1H), 3,92 (с, 1H), 3,86-3,77 (м, 2H), 3,80 (с, 3H), 3,57-3,46 (м, 3H), 3,37-3,29 (м, 2H), 2,67 (д, J= 9,3 Гц, 1H), 2,42-2,36 (м, 1H), 1,83-1,76 (м, 2H), 1,30 (с, 3H), 1,06 (д, J= 6,9 Гц, 3H), 0,93 (с, 9H), 0,88 (с, 9H), 0,87 (с, 9H), 0,17 (с, 3H), 0,12 (с, 3H), 0,03 (с, 9H), 0,00 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,4, 136,0, 130,4, 129,2, 118,0, 114,0, 79,2, 73,1, 72,9, 68,2, 65,3, 64,7, 64,6, 60,7, 55,4, 49,1, 47,1, 33,6, 26,3, 26,2, 26,1, 18,5, 15,1, 12,9, -4,1, -4,9,-5,1,-5,2,-5,3.
МС (ESI) m/z: 775 (М+23)+, 753 (М+H)+.
[α]25 D-8,0 (с 0,5, СН2Cl2).
Rf= 0,65 (Hex:EtOAc, 4:1).
Пример 58: Соединение 25а

В раствор 24 (1,58 г, 2,09 ммоль) в CH2Cl2 (40 мл) барботировали ток О3 в течение 2 мин при -78°С. После этого прибавляли Ph3P (1,65 г, 6,27 ммоль) и оставляли смесь нагреваться до комнатной температуры и продолжали перемешивание в течение 1,5 ч. Смесь концентрировали при пониженном давлении и очищали остаток колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая соединение 25а (1,34 г, 85%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 9,77 (д, J= 3,0 Гц, 1H), 7,21 (д, J= 8,7 Гц, 2H), 6,89 (д, J= 8,7 Гц, 2H), 4,39 (с, 2H), 4,18 (дд, J= 9,9, 7,8 Гц, 1H), 4,08 (м, 1H), 4,04-4,03 (м, 1H), 3,90 (дд, J= 9,9, 6,0 Гц, 1H), 3,81 (с, 3H), 3,73-3,68 (м, 2H), 3,55-3,50 (дд, J= 10,5, 3,3 Гц, 1H), 3,40-3,27 (м, 2H), 2,67 (д, J= 9,3 Гц, 1H), 2,62 (м, 1H), 1,98-1,92 (м, 1H), 1,83-1,74 (м, 1H), 1,27 (с, 3H), 1,05 (д, J= 6,9 Гц, 3H), 0,92 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,17 (с, 3H), 0,11 (с, 3H), 0,05 (с, 6H), 0,02 (с, 3H), 0,00 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 205,6, 159,4, 130,3, 129,4 114,1, 79,2, 73,2, 72,9, 70,4, 65,5, 64,0, 61,7, 60,9, 55,8, 55,4, 47,4, 33,6, 26,2, 26,0, 18,4, 18,2, 15,0, 12,9, -4,1, -5,0, -5,2, -5,3, -5,3, -5,4.
МС (ESI) m/z: 777(М+23)+.
[α]25 D-7,9 (с 0,52, СН2Cl2).
Rf= 0,67 (Hex:EtOAc, 4:1).
Пример 59: Соединение 25b

К раствору 25а (1,34 г, 1,78 ммоль) в CH2Cl2 (50 мл) добавляли перйодинан Десс-Мартина (1,5 мг, 3,56 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 50 мин. Добавляли насыщенный водный раствор NaHCO3 (60 мл) и экстрагировали смесь CH2Cl2 (3×70 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая альдегид 25b, который использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (300 МГц, CDCl3) δ 9,59 (д, J= 2,7 Гц, 1H), 7,23 (д, J= 8,6 Гц, 2H), 6,88 (д, J= 8,6 Гц, 2H), 4,36-4,48 (м, 2H), 4,22-4,29 (м, 1H), 3,98-4,07 (м, 1H), 3,81-3,88 (м, 1H), 3,80 (с, 3H), 3,64-3,78 (м, 2H), 3,32-3,45 (м, 4H), 2,47 (д, J= 9,3 Гц, 1H), 1,68-1,81 (м, 1H), 1,24 (с, 3H), 1,03 (д, J= 6,7 Гц, 3H), 0,92 (с, 9H), 0,91 (с, 9H), 0,90 (с, 9H), 0,06 (с, 3H), 0,05 (с, 3H), 0,03 (с, 3H), 0,02 (с, 3H), -0,01 (с, 3H), -0,02 (с, 3H).
Rf = 0,69 (Hex:EtOAc, 4:1).
Пример 60: Соединения 26а и 26b

К раствору N-метокси-N-метилацетамида (70 мкл, 0,65 ммоль) в ТГФ (2 мл) при -78°С прибавляли бис(триметилсилил)амид лития (0,65 мл, 1,0 М в ТГФ, 0,65 ммоль) и перемешивали реакционную смесь в течение 1 ч при данной температуре. После этого раствор 25а (165 мг, 0,22 ммоль) в ТГФ (4 мл) прибавляли к предшествующему раствору и перемешивали реакционную смесь еще в течение 1 ч при -78°С. Затем добавляли насыщенный водный раствор NH4Cl (30 мл) и экстрагировали сырую реакционную смесь EtOAc (3×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 1:1), получая 26а и 26b (1:2) в виде бесцветных масел (139 мг, с общим выходом 74%).
1H ЯМР (300 МГц, CDCl3) смесь диастереоизомеров δ 7,19-7,25 (м, 2H), 6,82-6,89 (м, 2H), 4,58-4,63 (м, 1H), 4,36-4,55 (м, 2H), 4,01-4,08 (м, 1H), 5,75-5,98 (м, 3H), 3,80 (с, 1,98 H), 3,79 (с, 1,02H), 3,65 (с, 1,98H), 3,64 (с, 1-02H), 3,44-3,65 (м, 2H), 3,25-3,32 (м, 2H), 3,17 (с, 1,02H), 3,16 (с, 1,98H), 2,80-2,88 (м, 1Н), 2,69 (д, J= 9,3 Гц, 0,66Н), 2,68 (д, J= 9,0 Гц, 0,34H), 2,65-2,74 (м, 1Н), 2,00-2,09 (м, 1Н), 1,74-1,88 (м, 2H), 1,69 (уш.с, 1Н), 1-34 (с, 1,02H), 1,25 (с, 1,98H), 1,07 (м, 3H), 0,92 (с, 5,94H), 0,90 (с, 3,06Н), 0,89 (с, 3,06H), 0,88 (с, 5,94H), 0,85 (с, 3,06H), 0,83 (с, 5,94Н), -0,02-0,18 (м, 18H).
МС (ESI) m/z: 880 (М+23)+, 858 (М+1)+.
Rf= 0,09 (Hex:EtOAc, 4:1).
Пример 61: Соединения 26с и 26d
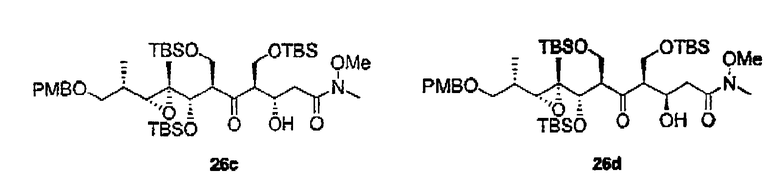
К раствору N-метокси-N-метилацетамида (568 мкл, 5,34 ммоль) в ТГФ (15 мл) при -78°С прибавляли бис(триметилсилил)амид лития (1,0 М в ТГФ) (5,34 мл, 5,34 ммоль) и перемешивали реакционную смесь в течение 1 ч при данной температуре. После этого к предшествующему раствору прибавляли раствор сырого 25b (1,78 ммоль) в ТГФ (25 мл) и перемешивали реакционную смесь еще в течение 3 ч при -78°С. Затем добавляли насыщенный водный раствор NH4Cl (50 мл) и экстрагировали реакционную смесь EtOAc (3×60 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 2:1), получая 26с и 26d (1:1,9) в виде бесцветных масел (910 мг, с общим выходом 60% после двух стадий).
1H ЯМР (300 МГц, CDCl3) смесь диастереоизомеров δ 7,25 (д, J=8,7 Гц, 4H), 6,88 (д, J= 8,4 Гц, 4H), 4,64-4,60 (м, 1Н), 4,48-4,36 (м, 6H), 4,10-3,82 (м, 6H), 3,80 (с, 6H), 3,76-3,71 (м, 2H), 3,66 (с, 6H), 3,61 (д, J= 3,3 Гц, 1Н), 3,53-3,48 (м, 2Н), 3,44-3,29 (м, 6H), 3,18 (с, 6H), 3,01-2,80 (м, 3H), 2,61 (м, 1Н), 2,57 (д, J= 9,0 Гц, 1Н), 2,53(д, J= 9,0 Гц, 1Н), 1,81-1,67 (м, 2H), 1,32 (с, 3H), 1,31 (с, 3H), 1,05 (д, J= 6,9 Гц, 6H), 0,89 (с, 18 H), 0,87 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,1 (с, 6H), 0,07 (с, 9H), 0,06 (с, 3H), 0,02 (с, 3H), 0,01 (с, 6H), 0,00 (с, 3H), -0,01 (с, 3H), -0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 211,0, 172,4, 159,0, 130,1, 128,9, 113,6, 77,0, 72,6, 72,0, 71,9, 67,4, 66,1,64,1, 64,0, 63,1, 63,0, 61,0, 60,8, 60,5, 60,1, 59,8, 58,9, 56,7, 55,1, 36,3, 33,5, 26,0, 25,7, 18,2, 18,0, 15,0, 12,5, -4,6, -4,7, -5,0, -5,1, -5,5, -5,6.
МС (ESI) m/z: 878 (М+23)+.
Rf= 0,44 (Hex:EtOAc, 2:1). Также Rf= 0,16 (Hex:EtOAc, 4:1).
Пример 62: Соединения 27а и 27b
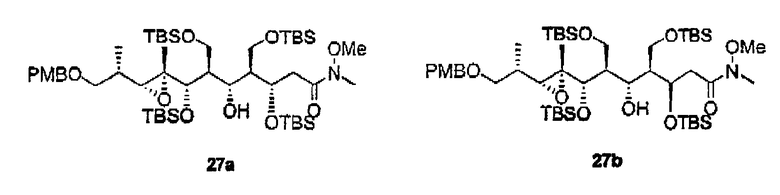
К раствору смеси 26а и 26b (139 мг, 0,16 ммоль) в CH2Cl2 (8 мл) добавляли 2,6-лутидин (57 мкл, 0,49 ммоль) и TBSOTf (56 мкл, 0,24 ммоль) при 0°С. Реакционную смесь перемешивали при 0°С в течение 30 мин. Затем прибавляли насыщенный водный раствор NH4Cl (30 мл) и экстрагировали смесь CH2Cl2 (2×25 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 27а (белое твердое вещество) и 27b (бесцветное масло) (1:2) (113 мг с общим выходом 72%).
27a: 1H ЯМР (300 МГц, CDCl3) δ 7,28 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 4,66 (уш.д, J= 9,9 Гц, 1H), 4,50 (дд, J= 11,7 Гц, 2H), 4,10 (уш.д, J= 9,6 Гц, 1H), 3,92 (д, J= 6,6 Гц, 2H), 3,80 (с, 3H), 3,66 (с, 3H), 3,64-3,59 (м, 2H), 3,42-3,85 (м, 1H), 3,35-3,32 (м, 1H), 3,15 (с, 3H), 3,01-2,96 (м, 1H), 2,74 (д, J= 9,3 Гц, 1H), 2,70-2,67 (м, 1H), 2,08-2,03 (м, 1H), 1,92 (уш.с, 1H), 1,79-1,70 (м, 1H), 1,37 (с, 3H), 1,07 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,90 (с, 9H), 0,88 (с, 9H), 0,85 (с, 9H), 0,16 (с, 3H), 0,12 (с, 3H), 0,08 (с, 3H), 0,03 (с, 6H), 0,02 (с, 6H), 0,00 (с, 3H).
МС (ESI) m/z: 994 (М+23)+.
Rf = 0,34 (Hex:EtOAc, 4:1).
27b:1H ЯМР (300 МГц, CDCl3) δ 7,24 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 4,82-4,80 (м, 1H), 4,43 (кв, J= 11,4 Гц, 2H), 3,96-3,92 (м, 1H), 3,80 (с, 3H), 3,76-3,75 (м, 1H), 3,66 (с, 3H), 3,69-3,58 (м, 3H), 3,46 (дд, J= 9,0, 6,3 Гц, 1H), 3,31 (дд, J= 9,0, 7,2 Гц, 1H), 3,15 (с, 3H), 3,00-2,93 (м, 1H), 2,69 (д, J= 8,7 Гц, 1H), 2,69-2,62 (м, 1H), 2,02-1,94 (м, 2H), 1,80-1,73 (м, 1H), 1,65 (с, 1H), 1,33 (с, 3H), 1,09 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,89 (с, 9H), 0,87 (с, 9H), 0,85 (с, 9H), 0,17 (с, 3H), 0,12 (с, 3H), 0,10 (с, 3H), 0,07 (с, 3H), 0,05 (с, 3H), 0,03 (с, 3H), 0,02 (с, 3H), 0,02 (с, 3H).
МС (ESI) m/z: 994 (М+23)+.
Rf= 0,46 (Hex:EtOAc, 4:1).
Пример 63: Соединение 27с
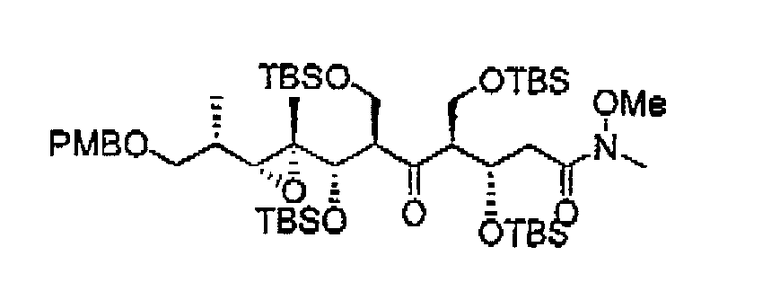
К раствору 27а (36 мг, 0,04 ммоль) в CH2Cl2 (4 мл) добавляли перйодинан Десс-Мартина (63 мг, 0,15 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 1,5 ч. Добавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 27с (26 мг, 72%) в виде бледно-желтого масла. Данное соединение также получается при защите 26с при помощи TBSOTf и лутидина с количественным выходом в стандартных условиях.
1H ЯМР (300 МГц, CDCl3) δ 7,22 (д, J= 8,7 Гц, 2H), 6,86 (д, J= 8,7 Гц, 2H), 4,80-4,78 (м, 1H), 4,41 (кв, J= 11,4 Гц, 2H), 4,15 (д, J= 4,5 Гц, 2H), 3,80 (с, 3H), 3,75-3,67 (м, 2H), 3,64 (с, 3H), 3,61-3,50 (м, 3H), 3,39 (дд, J= 9,3, 7,2 Гц, 1H), 3,29 (дд, J= 9,3, 6,6 Гц, 1H), 3,15 (уш.с, 3H), 2,99-2,96 (м, 1H), 2,67 (д, J= 9,3 Гц, 1H), 2,54 (уш.д, J= 5,1 Гц, 1H), 1,33 (с, 3H), 1,06 (д, J= 6,3 Гц, 3H), 0,90 (с, 9H), 0,85 (с, 18H), 0,84 (с, 9H), 0,09 (с, 3H), 0,08 (с, 3H), 0,06 (с, 3H), 0,02 (с, 3H), 0,01 (с, 6H), -0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 210,2, 172,5, 159,1, 130,2, 128,9, 113,7, 76,1, 72,6, 72,1, 67,0, 64,0, 63,8, 61,5, 61,0, 60,8, 58,1, 55,1, 54,2, 36,7, 33,6, 29,6, 26,0, 25,9, 25,8, 25,7, 18,2, 18,1, 18,0, 17,9, 15,1, 13,4, -4,8, -4,9, -4,9, -5,4, -5,5, -5,5, -5,6.
МС (ESI) m/z: 992 (М+23)+, 970 (М+1)+.
[α]25 D-45,1 (с 0,50, СН3Cl).
Rf=0,38(Hex:EtOAc,4:1).
Пример 64: Соединение 27d
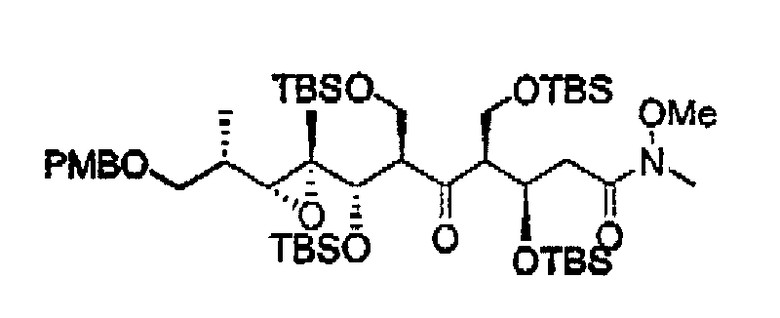
К раствору 27b (77 мг, 0,08 ммоль) в CH2Cl2 (3 мл) добавляли перйодинан Десс-Мартина (63 мг, 0,15 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 1,5 ч. Добавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 27d (51 мг, 66%) в виде бледно-желтого масла. Данное соединение также получается при защите 26d при помощи TBSOTf и лутидина с количественным выходом в стандартных условиях.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,7 Гц, 2H), 6,87 (д, J= 8,7 Гц, 2H), 4,47 (д, J= 12,0 Гц, 1H), 4,36 (д, J= 12,0 Гц, 1H), 3,99-3,83 (м, 3H), 3,80 (с, 3H), 3,69-3,58 (м, 2H), 3,68 (с, 3H), 3,42-3,36 (м, 2H), 3,26 (дд, J= 9,3, 6,3 Гц, 1H), 3,17 (уш.с, 3H), 3,07 (дт, J= 9,3, 3,3 Гц, 1H), 2,90-2,87 (м, 1H), 2,59 (д, J= 9,0 Гц, 1H), 2,17 (уш. д, J= 14,1 Гц, 1H), 1,31 (с, 3H), 1,05 (д, J= 6,6 Гц, 3H), 0,90 (с, 9H), 0,88 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,18 (с, 3H), 0,12 (с, 3H), 0,08 (с, 3H), 0,07 (с, 3H), 0,06 (с, 3H), -0,01 (с, 6H), -0,02 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 209,2, 172,1, 159,2, 130,2, 129,0, 113,8, 76,3, 72,5, 71,8, 68,2, 64,2, 63,0, 61,3, 60,9, 60,0,59,3, 57,7, 55,1, 36,4, 34,0, 29,6, 26,4, 25,9, 25,8, 25,7, 18,7, 18,1, 17,9, 15,3, 12,4, -4,3, -4,4, -5,1, -5,2, -5,5,-5,6, -5,7.
МС (ESI) m/z: 992 (М+23)+.
[α]25 D+47,6 (с 0,5, СН3Cl).
Rf = 0,45 (Hex:EtOAc, 4:1).
Пример 65: Соединение 28а

К раствору 27с (390 мг, 0,4 ммоль) в смеси CH2Cl2:Н2О (4:0,2 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (274 мг, 1,2 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 18 мин. Добавляли насыщенный водный раствор NaHCO3 (15 мл) и экстрагировали смесь CH2Cl2 (3×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (74 мг, 2 ммоль) и перемешивали реакционную смесь при 23°С в течение 30 мин. После этого реакционную смесь концентрировали при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 4:1), получая 28а (220 мг, 65%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 4,77-4,72 (м, 1Н), 4,10-3,99 (м,2Н), 3,86-3,84 (м, 2Н), 3,65 (с, 3Н), 3,62-3,59 (м, 1Н), 3,56-3,48 (м, 3Н), 3,15 (с, 3H), 2,99-2,95 (м, 1Н), 2,76-2,75 (м, 1Н), 2,58-2,55 (м, 1Н), 2,52 (уш.д, J= 3,3 Гц, 1Н), 2,46 (д, J= 9,3 Гц, 1Н), 1,67 (уш.с, 1Н), 1,37(с, 3Н), 1,01 (д, J= 6,9 Гц, 3Н), 0,90(с, 9H), 0,89 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,12 (с, 3Н), 0,11 (с, 3Н), 0,08 (с, 3Н), 0,07 (с, 3Н), 0,06 (с, 3Н), 0,03 (с, 3Н), 0,02 (с, 3Н), 0,01 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 211,8, 172,1, 76,9, 67,1, 65,1, 64,8, 63,4, 61,5, 61,2, 61,1, 58,5, 57,3, 36,6, 35,8, 32,0, 29,6, 26,0, 25,9, 25,8, 25,7, 18,2, 18,1, 17,9, 14,3, 13,7, -4,6, -4,8, -5,2, -5,4, -5,5, -5,6,
МС (ESI) m/z: 872 (М+23)+.
[α]25 D-32,9 (с 0,5, СН3Cl).
Rf=0,31(Hex:EtOAc, 4:1).
Пример 66: Соединение 28b

К раствору 27d (718 мг, 0,74 ммоль) в смеси CH2Cl2:Н2О (10:0,5 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (504 мг, 2,22 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 17 мин. Добавляли насыщенный водный раствор NaHCO3 (15 мл) и экстрагировали смесь CH2Cl2 (3×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в МеОН и добавляли NaBH4 (110 мг, 3 ммоль) и перемешивали реакционную смесь при 23°С в течение 20 мин. После этого реакционную смесь концентрировали при пониженном давлении. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (3×30 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 4:1), получая 28b (374 мг, 60%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 4,75-4,72 (м, 1H), 4,02-3,92 (м, 2H), 3,88 (дд, J= 10,5, 3,9 Гц, 1H), 3,71-3,65 (м, 1H), 3,67 (с, 3H), 3,61-3,54 (м, 2H), 3,49 (д, J= 6,3 Гц, 1H), 3,45-3,39 (м, 1H), 3,16 (уш.с, 3H), 3,13-3,08 (м, 1H), 2,84 (уш. дд, J= 15,9, 8,7 Гц, 1H), 2,48 (д, J= 9,0 Гц, 1H), 2,46-2,44 (м, 1H), 1,72-1,67 (м, 1H), 1,31 (с, 3H), 1,09 (д, J= 6,6 Гц, 3H), 0,90 (с, 9H), 0,89 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,16 (с, 3H), 0,12 (с, 3H), 0,09 (с, 3H), 0,08 (с, 3H), 0,07 (с, 3H), 0,06 (с, 3H), 0,02 (с, 3H), 0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 212,6, 172,0, 76,4, 67,6, 65,2, 65,0, 62,9, 61,2, 61,1, 60,8, 59,9, 59,5, 37,1, 36,2, 32,0, 29,6, 26,0, 25,9, 25,8,25,6, 18,3, 18,1, 18,0, 18,0, 14,4, 13,5, -3,6, -4,4, -4,8, -4,9, -5,0,-5,5, -5,6, -5,7.
МС (ESI) m/z: 872 (М+23)+.
[α]25 D+21,6 (с 0,52, СН3Cl).
Rf= 0,31 (Нех:EtOAc, 4:1).
Пример 67: Соединение 29а

К раствору 28а (162 мг, 0,19 ммоль) в CH2Cl2 (5 мл) добавляли перйодинан Десс-Мартина (202 мг, 0,47 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 40 мин. Добавляли насыщенный водный раствор NaHCO3 (15 мл) и экстрагировали смесь CH2Cl2 (3×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая соответствующий альдегид (Rf=0,32, Hex:EtOAc, 4:1). Тем временем к суспензии бромида трифенилэтилфосфония (565 мг, 1,94 ммоль) в толуоле (7 мл) добавляли третбутилат калия (1,24 мл, 1,0 М в ТГФ, 1,24 ммоль) при 0°С. Полученный оранжевый раствор перемешивали при 0°С в течение 25 мин, а затем охлаждали до -78°С. После этого раствор свежего сырого альдегида в толуоле (5 мл) прибавляли по каплям к предшествующей суспензии при -78°С и оставляли смесь нагреваться до 23°С в течение 14 ч. Реакционную смесь разбавляли CH2Cl2 (20 мл) и промывали насыщенным раствором NaHCO3 (30 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 20:1), получая 29а (105 мг, 64% после двух стадий) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 5,52-5,46 (м, 1H), 5,26-5,19 (м, 1H), 4,88-4,87 (м, 1H), 4,20-4,09 (м, 2H), 3,70-3,65 (м, 1H), 3,64 (с, 3H), 3,60-3,57 (м, 3H), 3,42 (д, J= 8,4 Гц, 1H), 3,15 (уш.с, 3H), 2,79-2,75 (м, 1H), 2,58 (д, J= 9,6 Гц, 1H), 2,43-2,39 (м, 2H), 1,62 (дд, J= 6,6, 1,5 Гц, 3H), 1,29 (с, 3H), 1,10 (д, J= 6,6 Гц, 3H), 0,91 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,10 (с, 3H), 0,09 (с, 6H), 0,08 (с, 3H), 0,01 (с, 3H), 0,00 (с, 3H), -0,01 (с, 3H), -0,02 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 211,0, 171,9, 130,5, 124,0, 66,6, 64,8, 62,6, 61,9, 61,6, 60,6, 57,0, 53,7, 36,2, 31,1, 29,2, 25,7, 25,5, 25,4, 25,3, 18,4, 17,8, 17,7, 17,6, 12,7, 11,8, -5,1, -5,2, -5,3, -5,4, -5,8, -5,9, -6,0.
МС (ESI) m/z: 882 (М+23)+.
[α]25 D-26,1 (с 0,50, СН2Cl2).
Rf = 0,44 (Hex:EtOAc, 4:1).
Пример 68: Соединение 29b

К раствору 28b (318 мг, 0,37 ммоль) в CH2Cl2 (8 мл) добавляли перйодинан Десс-Мартина (397 мг, 0,93 ммоль) и каталитическое количество NaHCO3 при 23°С. Реакционную смесь перемешивали при 23°С в течение 40 мин. Добавляли насыщенный водный раствор NaHCO3 (30 мл) и экстрагировали смесь CH2Cl2 (3×40 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении, получая соответствующий альдегид (Rf=0,42, Hex:EtOAc, 4:1). Тем временем к суспензии бромида трифенилэтилфосфония (1,1 г, 3,77 ммоль) в толуоле (12 мл) добавляли третбутилат калия (2,43 мл, 1,0 М в ТГФ, 2,34 ммоль) при 0°С. Полученный оранжевый раствор перемешивали при 0°С в течение 25 мин, а затем охлаждали до -78°С. После этого раствор свежего сырого альдегида в толуоле (6 мл) прибавляли по каплям к предшествующей суспензии при -78°С и оставляли смесь нагреваться до 23°С в течение 15 ч. Реакционную смесь разбавляли CH2Cl2 (20 мл) и промывали насыщенным раствором NaHCO3 (30 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая 29b (195 мг, 60% после двух стадий) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 5,50-5,42 (м, 1H), 5,29-5,25 (м, 1H), 4,81-4,78 (м, 1H), 3,93 (дд, J= 11,4, 3,6 Гц, 1H), 3,81 (м, 2H), 3,67 (с, 3H), 3,64-3,56 (м, 2H), 3,43-3,39 (м, 1H), 3,17 (уш.с, 3H), 3,03-3,00 (м, 1H), 2,96-2,88 (м, 1H), 2,65 (д, J= 9,0 Гц, 1H), 2,46-2,35 (м, 1H), 2,10 (уш. д, J= 14,7 Гц, 1H), 1,61 (дд, J= 6,9, 1,8 Гц, 1H), 1,28 (с, 3H), 1,11 (д, J= 6,9 Гц, 3H), 0,90 (с, 9H), 0,87 (с, 9H), 0,85 (с, 9H), 0,84 (с, 9H), 0,18 (с, 3H), 0,14 (с, 3H), 0,08 (с, 3H), 0,06 (с, 3H), 0,06 (с, 3H), 0,01 (с, 3H), -0,02 (с, 3H), -0,03 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 209,0, 172,0, 131,0, 124,2, 76,3, 68,1, 65,0, 62,6, 61,4, 61,3, 59,6, 59,4, 57,2, 36,3, 31,8, 29,7, 26,4, 25,9, 25,8, 25,7, 18,9, 18,7, 18,1, 18,0, 17,9, 13,2, 11,9, -4,3, -4,4, -5,1, -5,2, -5,4, -5,5, -5,6.
МС (ESI) m/z: 882 (М+23)+.
[α]25 D+70,2 (с 0,5, СН2Cl2).
Rf =0,77 (Нех:EtOAc, 4:1).
Пример 69: Соединение 30а

К раствору 29а (80 мг, 0,093 ммоль) в ТГФ (1,5 мл) прибавляли BrMgEt (0,28 мл, 1М в ТГФ, 0,28 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Прибавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая 30а (54 мг, 71%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) δ 5,54-5,44 (м, 1H), 5,26-5,18 (м, 1H), 4,83 (ддд, J= 9,6, 4,2, 21, Гц, 1H), 4,13 (дд, J= 9,6, 7,2 Гц, 1H), 4,05 (дд, J= 9,6, 3,9 Гц, 1H), 3,67 (дд, J= 8,7, 6,6 Гц, 1H), 3,59-3,57 (м, 2Н), 3,38 (д, J= 9,0 Гц, 1H), 2,75-70 (м, 1H), 2,55 (д, J= 9,3 Гц, 1H), 2,46-2,43 (м, 5H), 1,62 (дд, J= 6,6, 1,8 Гц, 3H), 1,28 (с, 3Н), 1,10 (д, J= 6,3 Гц, 3Н), 1,01 (т, J= 7,2 Гц, 3Н), 0,91 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,82 (с, 9H), 0,10 (с, 3Н), 0,09 (с, 6H), 0,08 (с, 3Н), 0,01 (с, 3Н), 0,00 (с, 3Н), -0,01 (с, 3Н), -0,03(с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 212,5, 209,2, 131,1, 124,7, 78,2, 66,6, 65,5, 63,2, 62,6, 62,4, 57,5, 54,3, 53,6, 47,3, 36,7, 31,8, 29,9, 26,3, 26,1, 26,0, 19,0, 18,5, 18,3, 18,2, 13,4, 12,4, 7,8, -4,3, -4,4, -4,7, -4,8, -5,1, -5,2, -5,3.
МС (ESI) m/z:851(М+23)+.
[α]25 D-25,4 (с 0,50, СН2Cl2).
Rf= 0,86 (Hex:EtOAc, 4:1).
Пример 70: Соединение 30b

К раствору 29b (110 мг, 0,13 ммоль) в ТГФ (1,5 мл) прибавляли BrMgEt (0,38 мл, 1М в ТГФ, 0,38 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 4 ч. Прибавляли насыщенный водный раствор NaHCO3 (10 мл) и экстрагировали смесь CH2Cl2 (3×15 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 20:1), получая 30b (70 мг, 65%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 5,52-5,41 (м, 1H), 5,28-5,20 (м, 1H), 4,76-4,72 (м, 1H), 3,85-3,73 (м, 3Н), 3,70 (д, J= 10,2 Гц, 1H), 3,48-3,41 (м, 2H), 3,05-3,00 (дт, J= 10,2, 3,3 Гц, 1Н), 2,80 (дд, J= 15,6, 10,5 Гц, 1Н), 2,64 (д, J= 9,3 Гц, 1H), 2,45-2,40 (м, 3H), 2,38-2,12 (м, 1Н), 1,61 (дд, J= 6,9, 1,8 Гц, 3H), 1,29 (с, 3H), 11,1 (д, J= 6,3 Гц, 3H), 1,01 (т, J= 7,2 Гц, 3H), 0,89 (с, 18H), 0,84 (с, 18H), 0,19 (с, 3H), 0,14 (с, 3H), 0,05 (с, 3H), 0,03 (с, 6H), 0,01 (с, 3H), 0,00 (с, 3H), -0,04 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 209,5, 209,3, 131,0, 124,3, 76,0, 67,6, 64,9, 62,4, 61,3, 59,8, 58,9, 57,3, 45,5, 38,1, 31,9, 29,7, 26,3, 25,9, 25,8, 25,7, 19,0, 18,7, 18,1, 18,0, 17,8, 13,3, 11,9, 7,4, -4,1, -4,2, -5,1, -5,2, -5,4, -5,5, -5,6, -5,7.
МС (ESI) m/z: 851 (М+23)+.
[α]25 D+80,9 (с 0,50, СН2Cl2).
Rf =0,71 (Hex:EtOAc,4:1).
Пример 71: Соединения 31а и 31с

По методике, описанной в примере 50, 30а (48 мг, 0,058 ммоль) переводили в равновесную смесь таутомеров 31а и 31с (20 мг, 70%, бесцветное масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 1:1).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,55-5,49 (м, 1Н), 5,29-5,24 (м, 1Н), 4,28 (ддд, J= 15,5, 11,0, 4,5 Гц, 1Н), 3,97 (дд, J= 11,5, 11,5 Гц, 2H), 3,76 (дд, J= 11,5, 3,5 Гц, 1Н), 3,67-3,65 (м, 1H), 3,62 (д, J= 10,0 Гц, 1Н), 3,35-3,31 (м, 1Н), 2,86-2,80 (м, 1Н), 2,60 (д, J= 9,0 Гц, 1Н), 2,44-2,37 (м, 1Н), 2,09 (дд, J= 12,5, 4,5 Гц, 1Н), 1,70-1,65 (м, 2H), 1,62 (дд, J= 7,0, 2,0 Гц, 3H), 1,45 (уш. т, J= 11,5 Гц, 1Н), 1,30 (с, 3H), 1,11 (д, J= 7,0 Гц, 3H), 0,96 (т, J= 7,5 Гц, 3H), 0,89 (с, 9H), 0,16 (с, 3H), 0,05 (с, 3H).
13С ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 214,7, 130,5, 124,8, 98,7, 78,2, 66,9, 65,0, 61,8, 60,5, 59,6, 59,2, 57,7, 39,9, 35,6, 31,4, 26,1, 18,7, 18,4, 13,3, 11,6, 7,4, -4,4, -4,7.
МС (ESI) m/z: 509 (M+23)+, 451 (M+1-2×H2O)+.
Rf =0,4 (Hex:EtOAc, 1:2).
Пример 72: Соединения 31b и 31d

По методике, описанной в примере 50, 30b (45 мг, 0,054 ммоль) переводили в равновесную смесь таутомеров 31b и 31d (13 мг, 50%, бесцветное масло) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 1:1).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,59-5,46 (м, 1H), 5,28 (м, 1H), 4,62 (уш.с, 1H), 4,22 (дд, J= 11,5, 11,5 Гц, 1H), 4,10 (дд, J= 12,0, 5,0 Гц), 3,70-3,60 (м, 2H), 3,48 (д, J= 10,0 Гц, 1H), 3,24-3,17 (м, 1H), 2,94 (ддд, J= 11,5, 5,0, 2,0 Гц, 1H), 2,61 (д, J= 9,5 Гц, 1H), 2,47-2,41 (м, 1H), 2,03 (дд, J= 14,5, 3,5 Гц), 1,66 (дд, J= 7,0, 1,5 Гц, 3H), 1,63-1,61 (м, 2H), 1,58 (дд, J= 14,0, 3,0 Гц, 1H), 1,32 (с, 3H), 1,14 (д, J= 6,0 Гц, 3H), 0,97 (т, J= 7,5 Гц, 3H), 0,87 (с, 9H), 0,15 (с, 3H), 0,00 (с, 3H).
13С ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 216,3, 130,5, 124,9, 97,2, 78,4, 65,9, 65,2, 62,0, 60,7, 55,7, 55,4, 54,7, 37,1, 34,2, 31,4, 26,0, 18,7, 18,2, 13,3, 11,4, 7,4, -4,3, -5,2.
МС (ESI) m/z: 509 (М+23)+, 451 (М+1-2×H2O)+.
Rf =0,42 (Hex:EtOAc, 1:2).
Пример 73: Соединения 3с и 4с

По методике, описанной в примере 52, 31а (48 мг, 0,058 ммоль) переводили в равновесную смесь таутомеров 3с и 4с (5 мг, 22%) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 0:1).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,56-5,49 (м, 1H), 5,28-5,23 (м, 1H), 4,36 (ддд, J= 15,0, 11,0, 5,0 Гц, 1H), 3,97-3,66 (м, 4H), 3,62 (д, J= 10,0 Гц, 1H), 3,25-3,18 (м, 1H), 2,98 (ддд, J= 14,0, 10,0, 4,0 Гц, 1H), 2,78 (д, J= 9,0 Гц, 1H), 2,45-2,40 (м, 1H), 2,09 (дд, J= 13,0, 5,0 Гц, 1H), 1,67 (кв, J= 7,5 Гц, 2H), 1,63 (дд, J= 1,5 Гц, 7 Гц, 3H), 1,48-1,42 (м, 1H), 1,33 (с, 3H), 1,12 (д, J= 7,0 Гц, 3H), 0,96 (т, J= 7,5 Гц, 3H).
13С ЯМР (125 МГц, CDCl3) (данные основного продукта) δ 215,4, 130,0, 125,0, 98,7, 77,3, 67,0, 62,8, 60,8, 60,0, 59,0, 40,1, 35,5, 31,3, 23,9, 19,7, 18,6, 13,3, 11,3, 7,4.
МС (ESI) m/z: 767 (2×М+23)+, 395 (М+23) +, 337 (М+1-2×H2O)+.
Rf= 0,16 (Hex:EtOAc, 1:2).
Пример 74: Соединения 3d и 4d

По методике, описанной в примере 52, 31b (150 мг, 0,18 ммоль) переводили в равновесную смесь таутомеров 3d и 4d (10 мг, 15%) после очистки сырого продукта колоночной флэш-хроматографией (Hex:EtOAc, от 4:1 до 0:1).
1H ЯМР (500 МГц, CH3OD) (данные основного продукта) δ 5,57-5,51 (м, 1H), 5,32-5,26 (м, 1H), 4,80 (м, 1H), 4,26 (дд, J= 11,5, 11,5 Гц, 1H), 3,98-3,60 (м, 3H), 3,31-3,29 (м, 1H), 3,24 (д, J= 10 Гц, 1H), 2,80 (ддд, J= 11,5, 4,5, 2,5 Гц, 1H), 2,59 (д, J=9,5 Гц, 1H), 1,95 (дд, J= 14,0, 3,5 Гц, 1H), 1,75 (дд, J= 14,5, 3,0 Гц, 1H), 1,65 (дд, J= 6,5, 15, Гц, 3H), 1,56 (кв, J= 7,5 Гц, 2H), 1,34 (с, 3H), 1,10 (д, J= 7,0 Гц, 3H), 0,92 (т, J= 7,5 Гц, 3H).
1H ЯМР (500 МГц, CDCl3) (данные основного продукта) δ 5,56-5,50 (м, 1H), 5,36 (с, 1H), 5,27-5,21 (м, 1H), 4,76 (уш.с, 1H), 4,29 (дд, J= 11,5, 11,5 Гц, 1H), 3,87 (дд, J= 12,5, 4,0 Гц, 1H), 3,73-3,62 (м, 3Н), 3,46 (д, J= 10,0 Гц, 1H), 2,90 (ддд, J= 11,5, 4,5, 2,0 Гц, 1H), 2,74 (д, J= 9,5 Гц, 1H), 2,01 (дд, J= 13,5, 3,5 Гц, 1H), 1,70 (дд, J=14,0, 2,5 Гц, 1H), 1,62 (дд, J= 7,0, 2,0 Гц, 3Н), 1,61-1,59 (м, 2H), 1,34 (с, 3Н), 1,11 (д, J=6,5 Гц, 3Н), 0,95 (т, J= 7,0 Гц, 3Н).
13C ЯМР, (125 МГц, CDCl3) (данные основного продукта) δ 214,9, 130,0, 125,1, 96,9, 77,1, 67,1, 65,4, 62,8, 60,9, 55,3, 54,9, 52,7, 37,4, 34,2, 31,3, 18,6, 13,3, 11,4, 7,5.
МС (ESI) m/z: 767,2 (2×М+23)+, 395,3 (М+23)+, 377,3 (М+23-Н2О)+, 337 (М+1-2×Н2O)+, 319,3 (М+1-3×Н2O)+.
Rf =0,22 (Hex:EtOAc, 1:2).
Пример 75: Соединение 32
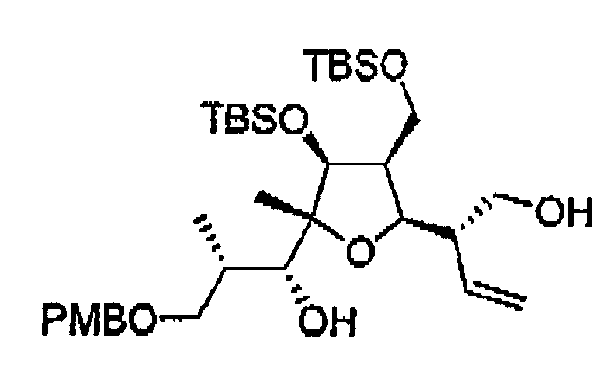
Данное соединение было получено в качестве побочного продукта при синтезе 34 из 11а. К раствору 11а (1,72 г, 2,69 ммоль) в ацетоне (10 мл) прибавляли диметоксипропан (10 мл) и камфорсульфокислоту (94 мг, 0,4 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (0,56 мл, 4 ммоль) и перемешивали смесь в течение 30 мин. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, от 10:1 до 3:1), получая фуран 32 (0,6 г, 35%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,8 Гц, 2H), 6,87 (д, J= 8,8 Гц, 2H), 5,72-5,65 (м, 1H), 5,09-5,06 (м, 2H), 4,42 (с, 2H), 4,44-4,39 (м, 1H), 3,90 (дд, J= 10,0, 2,0 Гц, 1H), 3,84-3,78 (м, 2H), 3,80 (с, 3Н), 3,60 (дд, J= 6,0, 5,5 Гц, 1H), 3,51-3,42 (м, 3Н), 3,36-3,32 (м, 2H), 2,76-2,73 (м, 1H), 2,63-2,58 (м, 1H), 2,13-2,09 (м, 1H), 1,98 (д, J= 4,5 Гц, 1H), 1,02 (д, J= 6,8 Гц, 3H), 0,99 (с, 3H), 0,92 (с, 9H), 0,90 (с, 9H), 0,11 (с, 3H), 0,10 (с, 3H), 0,09 (с, 3H), 0,07 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,1, 137,4, 130,5, 129,1, 116,3, 113,7, 83,6, 78,7, 77,7, 77,1, 75,4, 72,7, 64,9, 58,6, 55,2, 49,6, 34,4, 25,8, 25,7, 18,1, 18,0, 17,5, 12,5, -4,7, -5,1, -5,5 -5,6.
МС (ESI) m/z: 661,4 (М+23)+.
Rf =0,35 (Hex:EtOAc, 4:1).
Пример 76: Соединения 33 и 42

К раствору фурана 32 (246 мг, 0,346 ммоль) в CH2Cl2 (10 мл) и воды (0,5 мл) прибавляли 2,3-дихлор-5,6-дициано-1,4-бензохинон (236 мг, 1,04 ммоль) и энергично перемешивали реакционную смесь в течение 1 ч при 23°С. Реакционную смесь гидролизовали добавлением водного NaHCO3 (20 мл) и экстрагировали раствор CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток растворяли в МеОН (5 мл) и обрабатывали NaBH4 (30 мг) в течение 30 мин при 23°С. После этого растворители удаляли при пониженном давлении, а остаток растворяли в CH2Cl2, гидролизовали водным NH4Cl и экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 2:1), получая соединения 33 (88 мг, 40%) и 42 (77 мг, 42%) в виде бесцветных масел.
33: 1H ЯМР (300 МГц, CDCl3) δ 5,82-5,75 (м, 1Н), 5,46 (с, 1Н), 5,13-5,09 (с, 2H), 4,48 (д, J= 6,5 Гц, 1H), 4,07-4,04 (м, 1H), 3,99 (дд, J= 4,5, 4,0 Гц, 1H), 3,97-3,94 (м, 1H), 3,91 (д, J= 2,5 Гц, 1H), 3,88-3,79 (м, 2Н), 3,81 (с, 3H), 3,62 (дд, J= 6,0, 5,0 Гц, 1H), 3,50-3,43 (м, 1H), 3,28-3,22 (м, 1H), 2,76-2,67 (м, 2Н), 1,76-1,71 (м, 1H), 1,26 (д, J= 7,0 Гц, 3H), 1,08 (с, 3H), 0,91 (с, 9H), 0,87 (с, 9H), 0,10 (с, 3H), 0,08 (с, 3H), 0,04 (с, 3H), -0,07 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 159,8, 137,4, 131,3, 127,4, 116,3, 113,5, 102,1, 86,4, 83,4, 79,4, 77,0, 75,4, 65,1, 58,7, 55,2, 49,9, 46,2, 30,6, 29,7, 25,8, 18,6, 18,1, 13,3, -4,3, -5,2, -5,4, -5,5.
МС (ESI) m/z: 659,2 (М+23)+.
Rf = 0,31 (Hex:EtOAc, 4:1).
42: 1H ЯМР (300 МГц, CDCl3) δ 5,68-5,55 (м, 1H), 5,18-5,12 (м, 2H), 4,41 (д, J= 6,7 Гц, 1H), 3,94-3,77 (м, 3H), 3,70-3,36 (м, 3H), 3,14 (д, J= 8,6 Гц, 1H), 2,82-2,77 (м, 1H), 2,64-2,59 (м, 1H), 2,04-2,03 (м, 1H), 1,89-1,82 (м, 1H), 1,04 (с, 3H), 0,97 (д, J= 6,7 Гц, 3H), 0,92 (с, 9H), 0,90 (с, 9H), 0,13 (с, 3H), 0,11 (с, 6H), 0,09 (с, 3H).
13C ЯМР (75 МГц, CDCl3) δ 136,3, 118,4, 82,9, 80,3, 79,7, 79,1, 66,4, 64,7, 58,4, 49,5, 47,0, 39,1, 26,1, 26,0, 18,4, 18,3, 16,5, 15,2, -4,4, -5,0, -5,2, -5,3.
МС (ESI) m/z: 541,2 (М+23)+, 519,3 (М+1)+.
Rf = 0,06 (Hex:EtOAc, 4:1).
Пример 77: Соединение 34
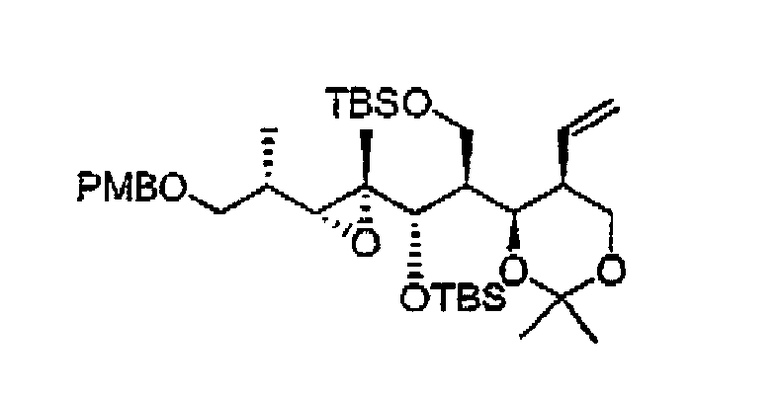
К раствору 11а (1,72 г, 2,69 ммоль) в ацетоне (10 мл) прибавляли диметоксипропан (10 мл) и камфорсульфокислоту (94 мг, 0,4 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (0,56 мл, 4 ммоль) и перемешивали смесь в течение 30 мин. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, от 10:1 до 3:1), получая ацетонид 34 (1,16 г мг, 64%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,4 Гц, 2H), 6,87 (д, J= 8,4 Гц, 2H), 6,30-6,17 (м, 1H), 5,13 (дд, J= 10,2, 2,1 Гц, 1H), 5,09 (дд, J= 16,8, 2,1 Гц, 1H), 4,37 (сс, J= 15,6, 1,7 Гц, 2H), 4,19 (дд, J= 7,2, 2,1 Гц, 1H), 4,10 (дд, J= 11,4, 2,7 Гц, 1H), 3,80 (с, 3Н), 3,68 (д, 7= 6,0 Гц, 1Н), 3,64-3,57 (м, 2H), 3,49 (дд, J= 10,2, 6,0 Гц, 1H), 3,39-3,28 (м, 2H), 2,55 (д, J= 9,3 Гц, 1H), 2,27 (д, J= 9,6 Гц, 1H), 2,04-1,72 (м, 2H), 1,43 (с, 3Н), 1,36 (с, 3Н), 1,27 (с, 3Н), 1,06 (д, J= 6,9 Гц, 3Н), 0,92 (с, 9H), 0,86 (с, 9H), 0,12 (с, 3Н), 0,07 (с, 3Н), 0,00 (с, 3Н), -0,01 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 159,1, 137,2, 130,1, 129,1, 117,1, 113,7, 98,8, 76,5, 72,9, 72,7, 67,8, 66,2, 64,8, 64,5, 58,4, 55,2, 44,9, 44,0, 33,5, 29,8, 26,1, 25,9, 18,8, 18,3, 18,0, 14,9, 13,2, -4,5, -4,6, -5,3, -5,5.
МС (ESI) m/z: 701 (М+23)+.
Rf =0,67 (Нех:EtOAc, 4:1).
Пример 78: Соединение 35а

К раствору 14а (32 мг, 0,037 ммоль) в ацетоне (1,5 мл) прибавляли диметоксипропан (1,5 мл) и камфорсульфокислоту (0,85 мг, 0,0037 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (14 мкл, 0,01 ммоль) и перемешивали смесь в течение 30 мин. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, 4:1), получая ацетонид 35а (27 мг, 81%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,25 (д, J= 8,8 Гц, 2H), 6,87 (д, J= 8,8 Гц, 2H), 4,49-4,38 (м, 3Н), 3,82-3,74 (м, 2H), 3,80 (с, 3Н), 3,70-3,30 (м, 3Н), 3,18 (с, 3Н), 2,96 (д, J= 9,1 Гц, 1H), 2,74-2,60 (м, 1H), 2,52 (д, J= 8,6 Гц, 1H), 2,56-2,46 (м, 1H), 2,42-2,36 (м, 1H), 2,04-1,90 (м, 1H), 1,82-1,58 (м 2H), 1,32 (с, 3Н), 1,30 (с, 3Н), 1,25 (с, 3Н), 1,12 (д, J= 6,5 Гц, 3Н), 0,92 (с, 9H), 0,89 (с, 9H), 0,87 (с, 9H), 0,17 (с, 3Н), 0,10 (с, 3Н), 0,08 (с, 3Н), 0,05 (с, 3Н), 0,03 (с, 3Н), 0,02 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 173,1, 159,4, 130,7, 129,4, 114,0, 100,9, 78,2, 73,0, 72,2, 67,2, 65,6, 64,0, 63,4, 61,4, 60,8, 59,8, 55,5, 50,5, 46,5, 39,0, 33,4, 30,0, 26,5, 26,3, 25,2, 25,5, 18,7, 18,4, 18,3, 15,4, 12,0, -3,4, -4,8, -5,2, -5,4, -5,7.
МС (ESI) m/z: 921 (М+23)+.
Rf = 0,24 (Hex:EtOAc, 4:1).
Пример 79: Соединение 35b

К раствору 14b (40 мг, 0,047 ммоль) в ацетоне (1,5 мл) прибавляли диметоксипропан (1,5 мл) и камфорсульфокислоту (1 мг, 0,0047 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (14 мкл, 0,01 ммоль) и перемешивали смесь в течение 30 мин. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, 4:1), получая ацетонид 35b (40 мг, 95%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,25 (д, J= 8,8 Гц, 2H), 6,87 (д, J= 8,8 Гц, 2H), 4,42 (дд, J= 22,7, 11,3 Гц, 2H), 4,36-4,20 (м, 1H), 4,05 (д, J= 11,5 Гц, 1H), 3,80 (с, 3H), 3,82-3,74 (м, 1H), 3,70 (с, 3H), 3,52-3,42 (м, 4H), 3,38-3,33 (м, 1H) 3,19 (с, 3H), 3,07 (д, J= 8,0 Гц, 1H) 2,70 (уш. с, 1H), 2,48 (д, J= 8,6 Гц, 1H), 2,04-1,92 (м, 2H), 1,86-1,76 (м, 1H), 1,28 (с, 3H), 1,27 (с, 3H), 1,25 (с, 3H), 1,10 (д, J= 6,7 Гц, 3H), 0,91 (с, 9H), 0,90 (с, 9H), 0,87 (с, 9H), 0,15 (с, 3H), 0,09 (с, 3H), 0,07 (с, 3H), 0,03 (с, 3H), 0,02 (с, 3H), 0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 172,8, 159,4, 130,7, 129,4, 114,0, 97,7, 77,5, 73,1, 72,6, 69,4, 67,7, 64,2, 63,9, 61,7, 61,4, 60,0, 55,5, 47,4, 42,7, 33,3, 30,0, 29,9, 26,4, 26,3, 26,2, 20,2, 18,6, 18,4, 18,3, 15,3, 12,0, -3,4, -3,6, -4,8, -5,2, -5,4, -5,7.
МС (ESI) m/z: 921 (М+23)+.
Rf = 0,27 (Нех:EtOAc, 4:1).
Пример 80: Соединение 36а

К раствору 38а (26 мг, 0,035 ммоль) в ацетоне (1 мл) прибавляли диметоксипропан (1 мл) и камфорсульфокислоту (1 мг, 0,0047 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (14 мкл, 0,01 ммоль) и перемешивали смесь в течение 30 мин. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, 3:1), получая ацетонид 36а (18 мг, 70%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 5,784-5,71 (м, 1H), 5,11-4,97 (м, 2H), 4,41-4,30 (м, 2H), 4,12 (дд, J= 7,0, 5,2 Гц, 1H), 3,96-3,90 (м, 1H), 3,81 (с, 3H), 3,68 (с, 3H), 3,70-3,61 (м, 2H), 3,46-3,41 (м, 1H), 3,33 (д, J= 6,7 Гц, 2H), 3,17 (с, 3H), 2,82-2,74 (м, 1Н), 2,56 (д, J= 9,3 Гц, 1H), 2,54-2,49 (м, 1H), 2,41-2,34 (м, 1H), 1,85-1,60 (м, 2H), 1,34 (с, 3H), 1,29 (с, 3H), 1,25 (с, 3H), 1,07 (д, J= 6,7 Гц, 3H), 0,94 (с, 9H), 0,86 (с, 9H), 0,12 (с, 3H), 0,10 (с, 3H), 0,01 (с, 3H), 0,00 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 172,8, 159,4, 137,1, 130,5, 129,3, 118,7, 114,0, 101,6, 73,1, 72,8, 68,9, 66,2, 65,2, 64,7, 61,4, 59,0, 55,5, 53,5, 43,8, 33,8, 29,9, 26,5, 26,2, 25,0, 24,1, 18,7, 18,3, 15,3, 13,8, -4,1, -4,3, -5,0, -5,1.
МС (ESI) m/z: 802 (М+23)+, 780 (М+1)+.
Rf= 0,18 (Hex:EtOAc, 4:1).
Пример 81: Соединение 36b

К раствору 38b (34 мг, 0,046 ммоль) в ацетоне (1 мл) прибавляли диметоксипропан (1 мл) и камфорсульфокислоту (1 мг, 0,0047 ммоль) и перемешивали смесь в течение 1 ч при 23°С (до тех пор, пока методом ТСХ не обнаруживали полного израсходования исходного вещества). После этого добавляли Et3N (14 мкл, 0,01 ммоль) и перемешивали смесь в течение 30 мин при 23°С. Растворители удаляли при пониженном давлении и подвергали смесь колоночной флэш-хроматографии на силикагеле (Hex:EtOAc, 3:1), получая ацетонид 36b (33 мг, 92%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,20 (д, J= 8,6 Гц, 2H), 6,86 (д, J= 8,6 Гц, 2H), 5,95-6,08 (м, 1H), 5,02-5,25 (м, 2H), 4,42-4,53 (м, 1H), 4,38 (с, 2H), 4,26-4,28 (м, 1H), 3,80 (с, 3H), 3,58-3,69 (м, 2H), 3,65 (с, 3H), 3,41-3,46 (м, 1H), 3,32 (д, J= 6,7 Гц, 2H), 3,14 (с, 3H), 2,59-2,67 (м, 1Н), 2,55 (д, J= 9,1 Гц, 1H), 2,31 (д, J= 10,4 Гц, 1H), 2,17-2,29 (м, 1H), 1,64-1,80 (м, 2H), 1,47 (с, 3H), 1,33 (с, 3H), 1,25 (с, 3H), 1,06 (д, J= 6,7 Гц, 3H), 0,92 (с, 9H), 0,86 (с, 9H), 0,11 (с, 3H), 0,08 (с, 3H), 0,00 (с, 3H), -0,02 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 171,2, 159,4, 134,5, 130,6, 129,3, 113,9, 99,5, 76,5, 73,0, 72,9, 69,2, 64,4, 61,4, 58,7, 55,4, 48,3, 45,5, 36,6, 33,7, 30,1, 29,9, 26,3, 26,1, 19,7, 18,6, 15,2, 13,6, -4,3, -5,1, -5,2.
МС (ESI) m/z: 780,7 (М+1)+, 802,7 (М+23)+.
Rf= 0,20 (Нех:EtOAc, 4:1).
Пример 82: Соединение 37
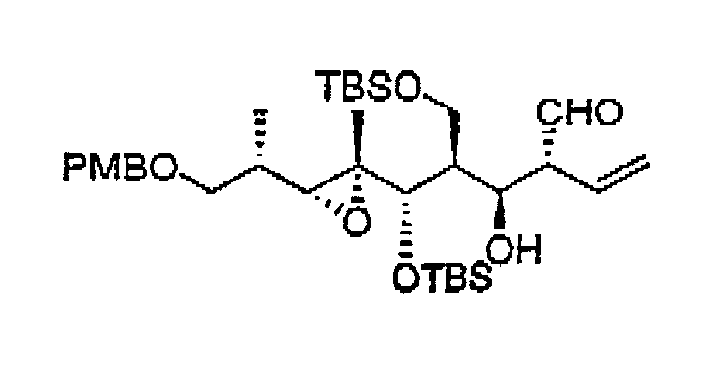
К раствору диола 11а (300 мг, 0,47 ммоль) в CH2Cl2 (10 мл) добавляли перйодинан Десс-Мартина (DMP) (0,24 г, 0,56 ммоль) и перемешивали смесь при 0°С в течение 1 ч и еще 30 мин при 23°С. Добавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении. Остаток 37 использовали на следующей стадии без дополнительной очистки.
1H-ЯМР (300 МГц, CDCl3) δ 9,45 (д, J= 2,6 Гц, 1H), 7,21 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 5,75-5,84 (м, 1H), 5,19-5,37 (м, 2H), 4,55-4,58 (м, 1H), 4,40 (с, 2H), 3,81 (с, 3H), 3,45-3,88 (м, 4Н), 3,38 (д, J= 8,7 Гц, 2H), 3,15-3,20 (м, 1H), 2,55 (д, J= 9,1 Гц, 1H), 1,67-1,84 (м, 2H), 1,25 (с, 3H), 1,06 (д, J= 6,5 Гц, 3H), 0,91 (с, 9H), 0,87 (с, 9H), 0,16 (с, 3H), 0,10 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H).
МС (ESI) m/z: 659,7 (М+23).
Rf= 0,56 (Hex:EtOAc, 4:1).
Пример 83: Соединения 38а и 38b
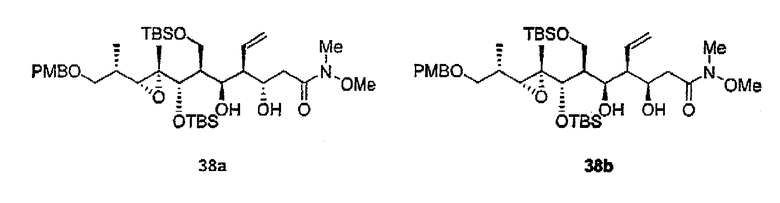
К раствору N-метокси-N-метилацетамида (0,158 мл, 1,41 ммоль) в сухом ТГФ (5 мл) при -78°С прибавляли бис(триметилсилил)амид лития (1,41 мл, 1,0 М в ТГФ, 1,41 ммоль) и перемешивали реакционную смесь в течение 1 ч при данной температуре. После этого к предшествующему раствору прибавляли раствор сырого альдегида 37 (0,47 ммоль) в ТГФ (10 мл) и перемешивали реакционную смесь еще в течение 1 ч при -78°С. Затем добавляли насыщенный водный раствор NH4Cl (30 мл) и экстрагировали реакционную смесь EtOAc (3×50 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 5:1 до 1:1), получая 38а и 38b (38:62) в виде бесцветных масел (146 мг, общий выход 42% после двух стадий из 11а).
38a: 1H ЯМР (300 МГц, CDCl3) δ 7,25 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 5,81-5,86 (м, 1H), 5,07-5,22 (м, 2H), 4,46-4,50 (м, 1H), 4,44 (дд, J= 24,4 и 11,5 Гц, 2H), 4,05-4,16 (м, 1H), 3,65-3,94 (м, 3Н), 3,79 (с, 3H), 3,53 (д, J= 4,7 Гц, 1H), 3,32-3,44 (м, 2H), 3,15-3,23 (м, 1H), 3,17 (с, 3H), 2,68-2,75 (м, 1H), 2,62 (д, J= 9,3 Гц, 1H), 2,18-2,24 (м, 1H), 2,09-2,15 (м, 1H), 1,82-1,93 (м, 2H), 1,24 (с, 3H), 1,04 (д, J= 6,7 Гц, 3H), 0,91 (с, 9H), 0,86 (с, 9H), 0,14 (с, 3H), 0,08 (с, 3H), 0,04 (с, 3H), 0,02 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 174,5, 159,3, 139,5, 136,4, 130,7, 129,3, 118,9, 114,0, 77,0, 73,0, 72,7, 69,9, 68,4, 64,9, 64,2, 61,4, 61,3, 55,4, 55,0, 48,7, 36,5, 33,8, 32,1, 29,9, 26,3, 26,0, 18,4, 18,1, 15,1, 14,1, -4,2, -5,0, -5,1, -5,2.
МС (ESI) m/z: 740,5 (М+1)+, 762,6 (М+23)+.
Rf =0,08 (Нех:EtOAc, 4:1).
38b: 1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,6 Гц, 2H), 6,85 (д, J= 8,6 Гц, 2H), 5,95-6,08 (м, 1H), 5,04-5,30 (м, 2H), 4,43 (дд, J= 11,8, 11,8 Гц, 2H), 4,29-4,33 (м, 1H), 4,12 (уш. с, 1H), 3,78-3,89 (м, 2H), 3,79 (с, 3H), 3,57-3,72 (м, 1H), 3,65 (с, 3Н), 3,33-3,44 (м, 2H), 3,15 (с, 3Н), 2,59 (д, J= 9,1 Гц, 1H), 2,46-2,62 (м, 1H), 1,73-1,89 (м, 2H), 1,24 (с, 3Н), 1,06 (д, J= 6,7 Гц, 3Н), 0,91 (с, 9H), 0,86 (с, 9H), 0,15 (с, 3Н), 0,08 (с, 3Н), 0,04 (с, 3Н), 0,03 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 171,4, 159,3, 135,4, 130,6, 129,4, 119,2, 113,9, 77,6, 73,0, 72,8, 72,7, 70,3, 64,8, 64,3, 61,4, 60,8, 55,4, 52,8, 47,4, 36,7, 33,6, 29,9, 26,3, 18,4, 18,2, 15,0, 14,0, -4,2, -5,0, -5,1, -5,2.
МС (ESI) m/z: 740,6 (М+1)+, 762,6 (М+23)+.
Rf= 0,10 (Hex:EtOAc, 4:1).
Пример 84: Соединение 39а
К раствору 38а (106 мг, 0,143 ммоль) в CH2Cl2 (8 мл) при 0°С последовательно прибавляли 2,6-лутидин (0,051 мл, 0,44 ммоль) и TBSOTf (0,05 мкл, 0,22 ммоль). Реакционную смесь перемешивали при данной температуре в течение 1 ч. Затем прибавляли водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 39а (79 мг, 65%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,6 Гц, 2H), 6,88 (д, J= 8,6 Гц, 2H), 5,82-5,94 (м, 1H), 5,07-5,20 (м, 2H), 4,44 (дд, J= 18,8, 11,9 Гц, 1H), 4,37-4,41 (м, 2H), 3,91-3,95 (м, 1Н), 3,80 (с, 3Н), 3,67-3,79 (м, 2H), 3,64 (с, 3Н), 3,30-3,40 (м, 2H), 3,13 (с, 3Н), 3,07 (д, J= 4,4 Гц, 1H), 2,66-2,76 (м, 1H), 2,59 (д, J= 9,1 Гц, 1H), 2,47 (дд, J= 15,6, 3,4 Гц, 1H), 2,27-2,34 (м, 1H), 1,68-1,82 (м, 2H), 1,25 (с, 3Н), 1,05 (д, J= 6,7 Гц, 3Н), 0,91 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,14 (с, 3Н), 0,05 (с, 3Н), 0,03 (с, 3Н), 0,02 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 172,5, 159,1, 135,8, 130,4, 129,0, 118,4, 113,8, 76,7, 72,9, 72,6, 70,3, 69,0, 64,6, 61,4, 60,4, 56,0, 55,4, 47,3, 33,8, 29,9, 26,4, 26,1, 26,0, 18,5, 18,3, 18,1, 15,2, 14,0, -4,1, -4,2, -4,5, -5,0, -5,1.
МС (ESI) m/z: 854,4 (М+1)+, 876,2 (М+23)+.
Rf= 0,53 (Нех:EtOAc, 4:1).
Пример 85: Соединение 39b

К раствору 38b (89 мг, 0,12 ммоль) в CH2Cl2 (8 мл) при 0°С последовательно прибавляли 2,6-лутидин (0,042 мл, 0,36 ммоль) и TBSOTf (0,041 мл, 0,18 ммоль). Реакционную смесь перемешивали при данной температуре в течение 1 ч. Затем прибавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая 39b (86 мг, 84%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,24 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 5,89-6,01 (м, 1H), 5,03-5,25 (м, 2H), 4,40 (дд, J= 18,4, 11,4 Гц, 2H), 4,16-4,22 (м, 3Н), 3,79-3,86 (м, 1Н), 3,79 (с, 3Н), 3,63-3,70 (м, 1H), 3,67 (с, 3Н), 3,27-3,44 (м, 3Н), 3,16 (с, 3Н), 2,70-2,80 (м, 1Н), 2,6 (д, J= 9,1 Гц, 1Н), 2,51-2,58 (м, 1Н), 2,27-2,32 (м, 1H), 1,65-1,89 (м, 2H), 1,26 (с, 3Н), 1,09 (д, J= 6,7 Гц, 3Н), 0,92 (с, 9H), 0,87 (с, 9H), 0,86 (с, 9H), 0,13 (с, 3Н), 0,10 (с, 3Н), 0,09 (с, 3Н), 0,06 (с, 3Н), 0,04 (с, 3Н), 0,03 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 172,7, 159,4, 137,5, 130,5, 129,5, 118,5, 114,0, 76,4, 73,1, 72,7, 69,1, 64,8, 64,1, 61,5, 61,0, 55,4, 54,4, 44,4, 37,3, 34,4, 32,1, 29,9, 26,6, 26,2, 26,0, 18,9, 18,2, 17,9, 15,4, 12,7, -4,0, -4,2, -4,7, -5,0, -5,1.
МС (ESI) m/z: 854,4 (М+1)+, 876,3 (М+23)+.
Rf= 0,43 (Hex:EtOAc, 4:1).
Пример 86: Соединение 40а

В раствор 39а (79 мг, 0,09 ммоль) в CH2Cl2 (15 мл) при -78°С барботировали озон до тех пор, пока прозрачный раствор не превратился в светло-синий (2 мин). После этого прибавляли МеОН (15 мл) и NaBH4 (15 мг, 0,4 ммоль) и оставляли раствор нагреваться до 23°С в течение 2 ч. По истечении этого времени растворители удаляли при пониженном давлении, а остаток растворяли в CH2Cl2, гидролизовали водным NH4Cl и экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 2:1), получая соединение 40а (10 мг, 13%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,6 Гц, 2H), 6,89 (д, J= 8,6 Гц, 2H), 4,43 (дд, J= 19,6, 11,7 Гц, 2H), 4,20-4,33 (м, 2H), 3,61-4,07 (м, 5H), 3,81 (с, 3H), 3,68 (с, 3Н), 3,31-3,45 (м, 2H), 3,16 (с, 3H), 2,77-2,89 (м, 1Н), 2,65 (д, J= 9,3 Гц, 1Н), 2,03-2,16 (м, 2H), 1,76-1,81 (м, 2H), 1,62-1,68 (м, 2H), 1,25 (с, 3Н), 1,07 (д, J= 6,5 Гц, 3Н), 0,90 (с, 9H), 0,88 (с, 9H), 0,86 (с, 9H), 0,15 (с, 3Н), 0,12 (с, 3Н), 0,11 (с, 3Н), 0,10 (с, 3Н), 0,08 (с, 3Н), 0,00 (с, 3Н).
МС (ESI) m/z: 880 (М+23)+.
Rf = 0,15 (Hex:EtOAc, 4:1).
Пример 87: Соединение 40b
В раствор 39b (86 мг, 0,1 ммоль) в CH2Cl2 (15 мл) при -78°С барботировали озон до тех пор, пока прозрачный раствор не превратился в светло-синий (2 мин). После этого прибавляли МеОН (15 мл) и NaBH4 (15 мг, 0,4 ммоль) и оставляли раствор нагреваться до комнатной температуры в течение 2 ч. По истечении этого времени растворители удаляли при пониженном давлении, а остаток растворяли в CH2Cl2, гидролизовали водным NH4Cl и экстрагировали CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 4:1 до 2:1), получая соединение 40b (50 мг, 58%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,25 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 4,41 (дд, J= 19,3, 11,4 Гц, 2H), 4,18-4,40 (м, 3Н), 3,64-3,95 (м, 6H), 3,79 (с, 3H), 3,71 (с, 3Н), 3,30-3,42 (м, 2H), 3,16 (с, 3Н), 2,90-2,98 (м, 1H), 2,60 (д, J= 9,1 Гц, 1H), 2,55-2,62 (м, 1H), 1,78-1,87 (м, 3Н), 1,27 (с, 3Н), 1,08 (д, J= 6,7 Гц, 3Н), 0,92 (с, 9H), 0,86 (с, 9H), 0,85 (с, 9H), 0,14 (с, 3H), 0,12 (с, 3Н), 0,09 (с, 3Н), 0,05 (с, 3H), 0,05 (с, 3Н), 0,03 (с, 3H).
13С ЯМР (75 МГц, CDCl3) δ 171,8, 159,2, 130,2, 129,4, 113,8, 75,8, 72,8, 72,5, 72,2, 68,7, 64,5, 63,6, 63,2, 61,4, 60,7, 55,2, 48,5, 43,0, 37,4, 34,2, 31,9, 29,7, 26,3, 25,9, 25,7, 18,6, 17,9, 17,6, 15,2, 12,5, -4,4, -4,5, -5,1, -5,2, -5,4, -5,5.
МС (ESI) m/z: 880 (М+23)+.
Rf= 0,13 (Hex:EtOAc, 4:1).
Пример 88: Соединение 41b

В раствор 40b (50 мг, 0,06 ммоль) в CH2Cl2 (8 мл) при 0°С последовательно прибавляли 2,6-лутидин (0,021 мл, 0,18 ммоль) и TBSOTf (0,021 мл, 0,09 ммоль). Реакционную смесь перемешивали при данной температуре в течение 1 ч. Затем прибавляли насыщенный водный раствор NaHCO3 (20 мл) и экстрагировали смесь CH2Cl2 (2×20 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 10:1), получая соединение 41b (57 мг, 98%) в виде бесцветного масла.
1H ЯМР (300 МГц, CDCl3) δ 7,23 (д, J= 8,6 Гц, 2H), 6,87 (д, J= 8,6 Гц, 2H), 4,65 (м, 1H), 4,41 (дд, J= 15,9, 11,7 Гц, 2H), 4,17-4,21 (м, 1H), 4,04-4,11 (м, 2H), 3,79-3,86 (м, 1H), 3,80 (с, 3H), 3,66 (с, 3H), 3,25-3,31 (м, 1H), 3,16 (с, 3H), 2,72-2,84 (м, 1H), 2,62 (д, J= 93 Гц, 1H), 2,46-2,54 (м, 1H), 1,82-2,05 (м, 1H), 1,62-1,82 (м, 2H), 1,25 (с, 3Н), 1,10 (д, J= 6,7 Гц, 3Н), 0,92 (с, 9H), 0,91 (с, 9H), 0,87 (с, 9H), 0,83 (с, 9H), 0,16 (с, 3Н), 0,11 (с, 3Н), 0,10 (с, 3Н), 0,08 (с, 3Н), 0,07 (с, 3Н), 0,05 (с, 3H), 0,03 (с, 3Н).
13С ЯМР (75 МГц, CDCl3) δ 173,1, 159,4, 130,0, 129,4, 114,0, 76,2, 72,8, 72,0, 69,2, 68,7, 64,5, 63,7, 61,9, 61,5, 55,4, 51,2, 44,5, 34,4, 29,9, 26,5, 26,2, 26,1, 18,8, 18,4, 18,1, 17,9, 15,6, 12,3, -3,8, -4,6, -4,7, -5,0, -5,1, -5,2.
МС (ESI) m/z: 972,6 (М+1)+, 994,6 (М+23)+.
Rf = 0,56 (Hex:EtOAc, 4:1).
Пример 89: Соединения 43 и 44
К раствору 20b (14 мг, 0,024 ммоль) в CHCl3 (3 мл) добавляли Et3N (28 мкл, 0,2 ммоль) и Ас2О (10 мкл, 0,1 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 16 ч. После этого растворитель удаляли при пониженном давлении, а остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 2:1 до 1:1), получая чистые соединения 43 (6 мг, 47%) в виде желтого масла и 44 (6 мг, 44%) в виде твердого белого вещества.

43: 1H ЯМР (300 МГц, CDCl3) (данные основного продукта) δ 5,53-5,45 (м, 1H), 5,31-5,19 (м, 1H), 4,45-4,40 (м, 2H), 3,92-3,80 (м, 3H), 3,53 (д, J= 9,9 Гц, 1H), 3,27-3,21 (м, 1H), 2,76-2,66 (м, 1H), 2,56 (д, J= 9,3 Гц, 1H), 2,49-2,41 (м, 1H), 2,06-2,00 (м, 1H), 2,03 (с, 3H), 1,68-1,66 (м, 3H), 1,62 (дд, J= 12,0, 6,6 Гц, 3H), 1,32 (с, 3H), 1,13 (д, J= 6,6 Гц, 3H), 0,97 (т, J= 7,5 Гц, 3H), 0,86 (с, 9H), 0,13 (с, 3H), -0,01 (с, 3H).
МС (ESI) m/z: 551 (М+23)+.
Rf= 0,39 (Нех:EtOAc, 50:50).

44: 1H ЯМР (300 МГц, CDCl3) δ 5,52-5,46 (м, 1H), 5,22-5,15 (м, 1H), 4,50 (дд, J= 11,0, 4,5 Гц, 1H), 4,47-4,43 (м, 1H), 4,34-4,33 (м, 1H) 4,13-4,07 (м, 1H), 3,90-3,81 (м, 1H), 3,70-3,65 (м, 1H), 3,56 (д, J= 9,3 Гц, 1H), 3,33-3,26 (м, 1H), 3,13-3,11 (м, 1H), 2,69-2,64 (м, 2H), 2,55 (д, J= 9,0 Гц, 1H), 2,48-2,39 (м, 2H), 2,09 (с, 3H), 2,00 (с, 3H), 1,67-1,61 (м, 3H), 1,32 (с, 3H), 1,13 (д, J= 6,3 Гц, 3H), 1,05 (т, J= 7,2 Гц, 3H), 0,85 (с, 9H), 0,15 (с, 3H), -0,01 (с, 3H).
МС (ESI) m/z: 593 (M+23)+.
Rf = 0,53 (Hex:EtOAc, 50:50).
Пример 90: Соединение 45

К раствору 20b (34 мг, 0,07 ммоль) в CH2Cl2 (0,7 мл) добавляли Et3N (11,5 мкл, 0,82 ммоль), DMAP (5 мг, 0,041 ммоль) и Ас2О (39 мкл, 0,41 ммоль) при 0°С. Реакционную смесь перемешивали при 23°С в течение 3 ч. Затем добавляли 0,1 N HCl до рН 4-5 и экстрагировали реакционную смесь CH2Cl2 (2×5 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, 3:1), получая соединение 45 (17 мг, 40%) в виде желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 5,60-5,56 (м, 1H), 5,54-5,44 (м, 1H), 5,26-5,19 (м, 1H), 4,46 (дд, J= 11,1, 5,7 Гц, 1H), 4,35 (дд, J= 11,4, 3,3 Гц, 1H), 4,14 (дд, J= 12,0, 6,9 Гц, 1H), 3,87 (дд, J= 11,4, 8,1 Гц, 1H), 3,55-3,49 (м, 2Н), 3,46-3,38 (м, 2H), 2,79-2,76 (м, 2Н), 2,52 (д, J= 9,3 Гц, 1H), 2,45-2,38 (м, 3Н), 2,06 (с, 3H), 1,99 (с, 6H), 1,62 (дд, J= 6,9, 1,8 Гц, 1H), 1,33 (с, 3Н), 1,11 (д, J= 6,3 Гц, 3Н), 1,03 (т, J= 7,2 Гц, 3Н), 0,85 (с, 9H), 0,13 (с, 3Н), 0,00 (с, 3Н).
МС (ESI) m/z: 635 (М+23)+.
Rf= 0,54 (Hex:EtOAc, 50:50).
Пример 91: Соединение 46

К раствору 20а (18 мг, 0,037 ммоль) в CH2Cl2 (3 мл) добавляли Et3N (21 мкл, 0,15 ммоль) и Ас2О (7 мкл, 0,074 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 16 ч. Затем добавляли NaHCO3 (5 мл) и экстрагировали реакционную смесь CH2Cl2 (2х5 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 3:1 до 2:1), получая соединение 46 (16 мг, 82%) в виде твердого белого вещества.
1H ЯМР (300 МГц, CDCl3) (данные основного продукта) δ 5,55-5,45 (м, 1H), 5,26-5,19 (м, 1H), 5,06 (с, 1H), 4,56 (уш.с, 1H), 4,45 (дд, J= 11,4, 3,6 Гц, 1H), 4,22 (т, J= 11,7 Гц, 1H), 4,06 (уш.с, 1H), 3,97-3,82 (м, 2H), 3,47 (д, J= 9,6 Гц, 1H), 3,21-3,14 (м, 1H), 2,94-2,89 (м, 1H), 2,56 (д, J= 9,0 Гц, 1H), 2,06-2,98 (м, 1H), 2,02 (с, 3H), 1,63-1,58 (м, 6H), 1,30 (с, 3H), 1,13 (д, J= 6,6 Гц, 3H), 0,94 (т, J= 7,5 Гц, 3H), 0,85 (с, 9H), 0,13 (с, 3H), -0,01 (с, 3H).
13С ЯМР (75 МГц, CDCl3) (данные основного продукта) δ 212,2, 170,4, 130,5, 125,3, 97,5, 77,5, 66,0, 65,6, 62,2, 62,1, 55,9, 54,2, 54,1, 37,4, 34,6, 31,6, 29,9, 26,2, 20,9, 18,9, 13,5, 11,8, 7,7, -4,2, -4,6.
МС (ESI) m/z: 551 (М+23)+.
Rf= 0,38 (Hex:EtOAc, 2:1).
Пример 92: Соединения 47 и 1
К раствору сырого 4а (20 мг, 0,054 ммоль) в CHCl3 (3 мл) добавляли Et3N (22 мкл, 0,16 ммоль) и Ас2О (8 мкл, 0,081 ммоль) при 23°С. Реакционную смесь перемешивали при 23°С в течение 16 ч. Затем растворитель удаляли при пониженном давлении и очищали остаток колоночной флэш-хроматографией на силикагеле (Hex:EtOAc, от 2:1 до 1:1), получая чистые соединения 47 (10 мг, 48%) и 1 (4 мг, 44%) в виде желтых масел.

47: 1H ЯМР, (500 МГц CD3OD) (данные полукетального продукта) δ 5,50 (м, 1H), 5,26 (м, 1H), 4,57 (м, 1H), 4,28 (дд, J= 12,5, 12,0 Гц, 1H), 4,15 (дд, J= 11,0, 4,0 Гц, 1H), 4,00 (дд, J= 11,0, 9,5 Гц, 1H), 3,69 (дд, J= 12,5, 5,0 Гц, 1H), 3,40 (м, 1H), 3,13 (д, J= 10,5 Гц, 1H), 2,97 (ддд, J= 12,0, 5,0, 2,5 Гц, 1H), 2,62 (д, J= 9,5 Гц, 1H), 2,47 (м, 1H), 1,97 (с, 3H), 1,93 (дд, J= 14,0, 3,0 Гц, 1H), 1,72 (дд, J= 14,0, 3,0 Гц, 1H), 1,64 (уш.д, J= 7,0 Гц, 3H), 1,57 (д, J= 7,5 Гц, 2H), 1,37 (с, 3H), 1,09 (д, J= 7,0 Гц, 3H), 0,92 (т, J=7,5 Гц,3H).
13С ЯМР (125 МГц CD3OD) (данные полукетального продукта) δ 212,6, 172,6, 131,5, 126,1, 98,8, 78,6, 67,6, 66,1, 64,3, 62,9, 56,8, 56,0, 52,2, 38,6, 35,6, 32,3, 20,8, 18,8, 13,6, 11,6, 7,9.
МС (ESI) m/z: 437 (М+23)+.

1: 1H ЯМР (500 МГц MeOD) δ 6,27 (с, 1H), 6,22 (д, J= 1,2 Гц, 1H), 5,55-5,46 (м, 1H), 5,30-5,23 (м, 1H), 5,04-5,01 (м, 1H), 4,32 (дд, J= 10,5, 3,9 Гц, 1H), 3,88 (дд, J=9,9, 9,9 Гц, 1H), 3,76 (ддд, J= 19,8, 9,9, 3,6 Гц 1H), 3,34 (д, J= 9,9 Гц), 1,94 (с, 3H), 1,65 (дд, J= 6,9, 1,8 Гц, 1H), 1,38 (д, J= 6,6 Гц, 3H), 1,01 (т, J= 7,5 Гц, 3H).
МС (ESI) m/z: 419(М+23)+.
Rf = 0,37 (Hex:EtOAc, 1:2).
Пример 93: Биоанализ для противоопухолевого скрининга
Заключение данных анализов состояло в прекращении роста клеточной культуры опухоли "in vitro" за счет непрерывного проявления клеток в подлежащем тестированию образце.
Ингибирование роста клеток методом колориметрического анализа
Колориметрический вид анализа с использованием реакции сульфородамина В (SRB) адаптировали для количественного определения роста и жизнеспособности клеток (в соответствии с методикой, описанной P.A. Skehan, et al., J. Natl. Cancer Inst. 1990, 82, 1107-1112).
В данном виде анализа использовали 96-луночные микропланшеты для клеточных культур диаметра 9 мм (T. Mosmann et al., J. of Immunological Methods 1983, 65, 55-63; G.T. Faircloth et al., J. of Tissue and Culture Methods 1988, 11, 201-205). Большинство клеточных линий получено из американского банка типов культур (АТСС), выведенных из различных типов рака человека.
Клетки выдерживают в RPMI 1640 10% FBS, дополненного 0,1 г/л пенициллина и 0,1 г/л сульфата стрептомицина, а затем инкубируют при 37°С, 5% СО2 и влажности 98%. В данных экспериментах клетки получали из субконфлюентных культур при использовании трипсина и повторно суспендировали в свежую среду перед посевом.
Клетки высевают в 96-луночные микротитровочные планшеты в количестве 5×103 клеток на лунку при аликвотах 195 мкл среды и дают им достигнуть поверхности планшета за счет роста в не содержащей лекарственного препарата среде в течение 18 часов. После этого образцы, растворенные в ДМСО/EtOH/PBS (0,5:0,5:99), прибавляют к аликвотам 5 мкл в пределах от 10 до 10-8 мкг/мл. После 48 часов выдержки противоопухолевый эффект определяют при помощи методологии SRB: клетки фиксируют, прибавляя 50 мкл холодной 50%-ной (мас./об.) трихлоруксусной кислоты (ТСА) и инкубируют в течение 60 минут при 4°С. Планшеты промывают деионизированной водой и сушат. В каждую микротитровочную лунку добавляют 100 мкл раствора SRB (0,4% мас./об. в 1%-ной уксусной кислоте) и инкубируют в течение 10 минут при комнатной температуре. Несвязанный SRB удаляют промыванием 1%-ной уксусной кислотой. Планшеты сушат, а связанный краситель растворяют при помощи Трис буфера. Значения оптической плотности регистрируют на автоматическом спектрофотометрическом считывателе планшетов при единичной длине волны 490 нм.
Рассчитывают значения среднего +/- SD для данных от троекратных значений лунок. Некоторые параметры клеточного ответа можно вычислить: GI = ингибирование роста, TGI = общее ингибирование роста (цитостатический эффект) и LC = убивание клеток (цитотоксический эффект).
В таблице 1 представлены данные по биологической активности соединений настоящего изобретения.
Таблица 1. Данные активности (молярные)



| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОТИВООПУХОЛЕВЫЕ АНАЛОГИ ЛАМЕЛЛАРИНА | 2003 |
|
RU2328500C2 |
| ПРОИЗВОДНЫЕ ЭКТЕИНАСЦИДИНОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ | 2003 |
|
RU2306316C9 |
| ПОЛУСИНТЕТИЧЕСКИЙ СПОСОБ И НОВЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2237063C9 |
| ПРОИЗВОДНЫЕ ВАРИОЛИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ | 2002 |
|
RU2302419C2 |
| ПРОИЗВОДНЫЕ ТАКСАНА, ФУНКЦИОНАЛИЗИРОВАННЫЕ ПО 14-ПОЛОЖЕНИЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2320652C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2711502C2 |
| 4-ГИДРОКСИБЕНЗОМОРФАНЫ | 2005 |
|
RU2415131C2 |
| 4-ГИДРОКСИБЕНЗОМОРФАНЫ | 2005 |
|
RU2480455C2 |
| НОВЫЕ 2',5'-ДИАРИЛСПИРО[ИНДОЛ-3,3'-ПИРРОЛИДИН]-2(1Н)-ОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730287C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТАГОНИСТОВ РЕЦЕПТОРОВ CGRP | 2013 |
|
RU2672056C2 |
Изобретение относится к соединению формулы I, где R выбран из Н, SiR'3, SOR', SO2R', C(=O)R' или необязательно замещенного C1-С6алкила; R' выбран из C1-С6алкильной группы; R'' выбран из CH2OR, C1-С6алкила, C1-С6галогеналкила, С2-С6алкенила или C1-С6алкилидена; заместителями являются алкоксигруппы. Изобретение также относится к соединению формулы (I-31), (I-34), (I-43), (I-46), где R1, R2, R4 и R6 выбраны из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS, TES, TBDPS, TIPS и TMS; R5 выбран из OR', N(R')2, N(R')(C1-C4алкокси); и R' выбран из C1-С6алкила и С7-С10аралкила, L является стереоспецифической уходящей группой. Предложен способ синтеза соединения формулы 5, включающий удаление защитных групп с гидроксильных групп предшественника. Предложены способ получения соединения формулы 14 и способ получения соединения формулы 26, которые включают наращивание цепи предшественника путем взаимодействия с соединением СН3С(O)R5, где R5 представляет собой группу, выбранную из OR', N(R')2, N(R')(С1-С4алкокси); и R' представляет собой C1-С6алкил и С7-С10аралкил. Предложены способ получения соединения формулы 19 и способ получения соединения формулы 30, которые включают наращивание цепи предшественника путем взаимодействия с этилмагнийбромидом. Предложена фармацевтическая композиция с цитотоксической активностью на основе соединения формулы I. Предложено применение соединения формулы I для получения лекарственного препарата для лечения опухоли. Технический результат - соединение формулы I с цитотоксической активностью, способ их получения. 12 н. и 35 з.п. ф-лы, 1 табл.
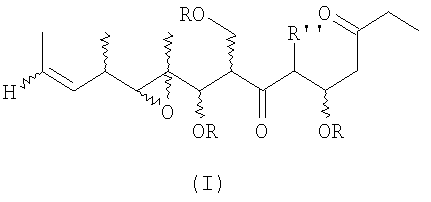
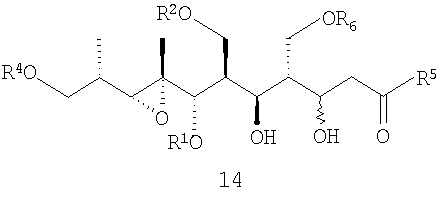


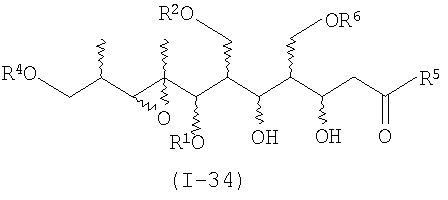







в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей H, SiR'3, SOR', SO2R', C(=O)R' или незамещенный или замещенный C1-С6алкил;
группу R' выбирают из C1-С6алкильной группы; а
группу R'' выбирают из группы, включающей CH2OR, C1-С6алкил, C1-С6галогеналкил, C2-С6алкенил или C1-С6алкилиден;
заместителями являются алкоксигруппы, при условии, что соединение не является одним из следующих соединений

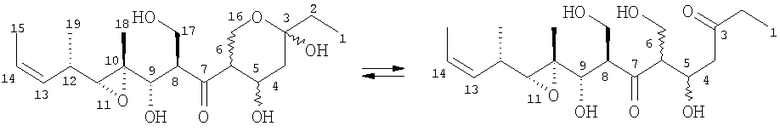

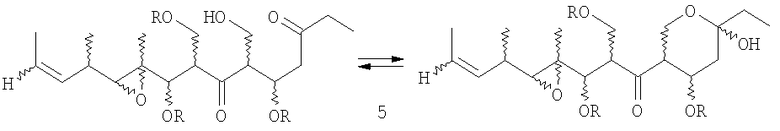
которое может существовать в виде смеси изомера кетона и изомера полукеталя, или в виде одной из двух изомерных форм.





в котором R1, R2, R6 и R7 представляют собой защитные группы для гидрокси, независимо выбранные из TBS (третбутилдиметилсилил), TES (триэтилсилил), TBDPS (третбутилдифенилсилил), TIPS (триизопропилсилил), ТМС (триметилсилил), MOM (СН3ОСН2), MEM (СН3ОСН2СН2OCH2), SEM ((СН3)3SiCH2СН2OCH2), ВОМ (бензилоксиметил) или Ас (СН3СО).

в котором R1, R2, R6 и R7 представляют собой защитные группы для гидрокси.

в котором R1, R2, R6 и R7 представляют собой защитные группы для гидрокси.

в котором R1 представляет собой защитную группу для гидрокси независимо выбранную из TBS (третбутилдиметилсилил), TES (триэтилсилил), TBDPS (третбутилдифенилсилил), TIPS (триизопропилсилил), ТМС (триметилсилил), MOM (СН3ОСН2), MEM (СН3ОСН2СН2ОСН2), SEM ((CH3)3SiCH2CH2OCH2), ВОМ (бензилоксиметил) или Ас (СН3СО).



которое может существовать в виде смеси изомера кетона и изомера полукеталя, или в виде одной из двух изомерных форм;
в котором каждая из замещающих групп, обозначенных R, принимает значения, определенные в п.1;
указанный способ включает снятие защитной группы в промежуточном соединении формулы

в котором каждую из замещающих групп, обозначенных R, независимо выбирают из группы, включающей Н, SiR'3, SOR', SO2R', C(=O)R', незамещенный или замещенный C1-С6алкил, и в котором одна или каждая группа R, которая станет водородом в соединении 5, в промежуточном соединении является защитной группой;
и в котором группа R' является C1-С6алкилом и заместителями являются алкоксигруппы.

в котором R1, R2, R6 и R7 представляют собой защитные группы для гидрокси.
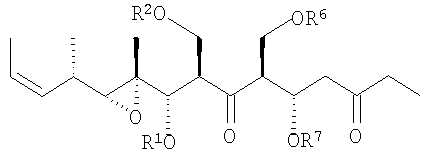
в котором R1, R2, R6 и R7 представляют собой защитные группы для гидрокси.
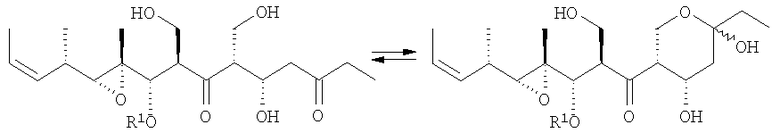
в котором R1 представляет собой защитную группу для гидрокси.
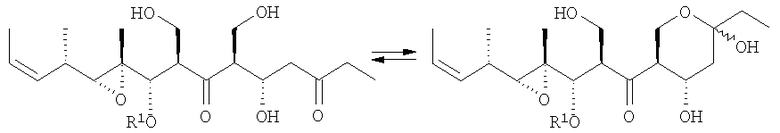
в котором R1 представляет собой защитную группу для гидрокси.
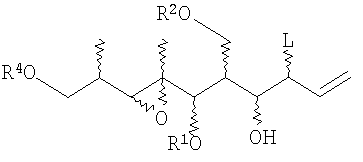
в котором R1, R2 и R4 представляют собой защитные группы для гидрокси, выбранные из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS (трет-бутилдиметилсилил), TES (триэтилсилил), TBDPS (трет-бутилдифенилсилил), TIPS (триизопропилсилил) и TMS (гриметилсилил), а L является стереоспецифической уходящей группой, которая обуславливает хиральность.


в котором R1, R2, R4 и R6 представляют собой защитные группы для гидрокси, независимо выбранные из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS (трет-бутилдиметилсилил), TES (триэтилсилил), TBDPS (трет-бутилдифенилсилил), TIPS (триизопропилсилил) и TMS (триметилсилил); R5 выбирают из группы, включающей OR', N(R')2, N(R')(С1-С4алкокси); и
R' выбирают из C1-С6алкила и С7-С10аралкила.

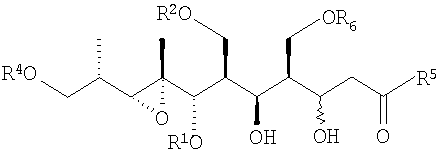

в котором R1, R2 и R4 представляют собой защитные группы для гидрокси, независимо выбранные из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS (трет-бутилдиметилсилил), TES (триэтилсилил), TBDPS (трет-бутилдифенилсилил), TIPS (триизопропилсилил) и TMS (триметилсилил).

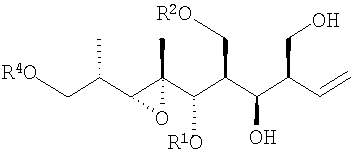
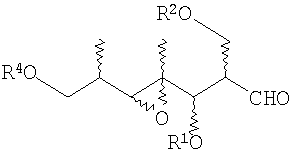
в котором R1, R2 и R4 представляют собой защитные группы для гидрокси независимо выбранные из РМВ, бензила, 2,6-диметилбензила, о-нитробензила, 2,6-дихлорбензила, 3,4-дихлорбензила, TBS (трет-бутилдиметилсилил), TES (триэтилсилил), TBDPS (трет-бутилдифенилсилил), TIPS (триизопропилсилил) и TMS (триметилсилил).

| US 5514708, 07.05.1996 | |||
| TAYLOR R | |||
| et al | |||
| A divergent approach to the Myriaporones and tedanolide: enantioselective prepapation of the common intermediate | |||
| Tetrahedron Letters, 1998, 39(51):9361-4 | |||
| ROUSH W.R | |||
| et al | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2008-07-10—Публикация
2003-07-30—Подача