urn:schemas:contacts1. Область техники, к которой относится изобретение
Данное изобретение относится к способам лечения, профилактики и/или поддержания состояния при специфических видах рака и других заболеваниях, включая, но не ограничиваясь указанным, заболевания, связанные или отличающиеся нежелательным ангиогенезом, включающим введение одного или нескольких иммуномодулирующих соединений по отдельности или в сочетании с другими лекарственными средствами. В частности, изобретение охватывает применение специфических комбинаций или «коктейлей» лекарственных средств и других видов терапии, например, облучения, для лечения таких специфических видов рака, включая те, которые не поддаются лечению с помощью общепринятой терапии. Изобретение также относится к фармацевтическим композициям и режимам дозировки.
2. Уровень техники.
2.1.Патобиология рака и других заболеваний
Рак характеризуется в первую очередь увеличением числа аномальных клеток, образующихся из данной обычной ткани, проникновением данных аномальных клеток в смежные ткани или распространением за счет лимфатического или кровяного перенесения злокачественных клеток в периферические лимфатические узлы и отдаленные места (метастазы). Клинические данные и молекулярные биологические исследования указывают, что рак представляет собой многостадийный процесс, который начинается с минимальных преднеопластических изменений, которые могут при определенных условиях прогрессировать в новообразования. Неопластическое повреждение может клонировано эволюционировать и развивать повышенную способность для проникновения, роста, метастазов и неоднородности, особенно в условиях, в которых неопластические клетки избегают иммунного надзора хозяина. Roitt I., Brosroff J. and Kale D., Immunology, 17.1-17.12 (3rd ed., Mosby, St. Louis, Mo., 1993).
Существует огромное множество видов рака, которые подробно описаны в медицинской литературе. Примеры включают рак легкого, толстой кишки, прямой кишки, предстательной железы, молочной железы, мозга и кишечника. Заболеваемость раком продолжает расти с общим возрастом населения, появлением новых видов рака и ростом восприимчивого населения (например, люди, зараженные СПИДом или избыточно подвергавшиеся действию солнечного света). Поэтому существует острая необходимость в новых способах и композициях, которые можно использовать для лечения пациентов, болеющих раком.
Многие типы рака связаны с образованием новых кровеносных сосудов, процессом, известным как ангиогенез. Было выявлено несколько механизмов, вовлеченных в индуцированный опухолью ангиогенез. Наиболее прямой из данных механизмов представляет собой секрецию опухолевыми клетками цитокинов с ангиогенными свойствами. Примеры данных цитокинов включают кислотные и основные факторы роста фибробластов (a,b-FGF), ангиогенин, сосудистый эндотелиальный фактор роста (VEGF) и TNF-α. Альтернативно, опухолевые клетки могут высвобождать ангиогенные пептиды посредством продуцирования протеаз и последующего распада межклеточного матрикса, где хранятся некоторые цитокины (например, b-FGF). Ангиогенез также может быть индуцирован косвенно через увеличение численности воспалительных клеток (особенно макрофагов) и последующее высвобождение ими ангиогенных цитокинов (например, TNF-α, bFGF).
Множество других заболеваний и нарушений также связано или характеризуется нежелательным ангиогенезом. Например, повышенный или нерегулируемый ангиогенез влечет за собой ряд заболеваний и медицинских состояний, включая, но не ограничиваясь указанными, глазные неоваскулярные (связанные с образованием новых сосудов) заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки, покраснение радужки (неоваскуляризация угла передней камеры глазного яблока), вирусные заболевания, генетические заболевания, воспалительные заболевания, аллергические заболевания и аутоиммунные заболевания. Примеры таких заболеваний и состояний включают, но не ограничиваются указанным: диабетическую ретинопатию; ретинопатию недоношенных; отторжение трансплантата роговицы; неоваскулярную глаукому; ретролентальную фиброплазию; и пролиферативную ретинопатию стекловидного тела.
Соответственно, соединения, которые могут контролировать ангиогенез или ингибировать продуцирование определенных цитокинов, включая TNF-α, могут быть полезными для лечения или профилактики различных заболеваний и состояний.
2.2. Способы лечения рака
В настоящее время лечение рака может включать хирургическое вмешательство, химиотерапию, гормональную терапию и/или лучевую терапию для уничтожения неопластических клеток у пациента (смотри, например, Stockdale, 1998, Medicine, vol.3, Rubenstein and Federman, eds., Chapter 12, Section IV). Недавно терапия рака также смогла включать биологическую терапию или иммунотерапию. Все данные подходы обладают значительными недостатками для пациента. Хирургия, например, может быть противопоказана вследствие состояния здоровья пациента или может быть не приемлема для пациента. Кроме того, при хирургическом вмешательстве неопластическая ткань может быть удалена не полностью. Лучевая терапия эффективна только в том случае, когда непластическая ткань проявляет более высокую чувствительность к облучению по сравнению с обычной тканью. Лучевая терапия также может вызывать серьезные побочные действия. Гормональная терапия редко назначается в качестве единственного агента. Хотя гормональная терапия может быть эффективной, ее часто используют для предотвращения и замедления рецидива рака после того, как большинство раковых клеток было удалено с помощью других методов лечения. Биологическая терапия и иммунотерапия ограничены в своем числе и могут вызывать побочные действия, такие как сыпь или отеки, напоминающие симптомы гриппа, включая лихорадку, озноб и утомление, проблемы желудочного тракта или аллергические реакции.
Что касается химиотерапии, существует множество химиотерапевтических агентов, доступных для лечения рака. Большинство химиотерапевтических противораковых лекарственных средств действует путем ингибирования синтеза ДНК, непосредственно или косвенно, путем ингибирования биосинтеза дезоксирибонуклеотидных трифосфатных предшественников, для предотвращения репликации ДНК и сопутствующего деления клеток. Gilman et al., Goodman and Gilman's: The Pharmacological Basis of Therapeutics, Tenth Ed., (McGraw Hill, New York).
Несмотря на доступность множества химиотерапевтических агентов, химиотерапия имеет множество недостатков. Почти все химиотерапевтические агенты являются токсичными, и химиотерапия вызывает заметные и часто опасные побочные действия, включая сильную тошноту, депрессию костного мозга и иммуносупрессию. Кроме того, даже при введении комбинации химиотерапевтических агентов многие опухолевые клетки являются устойчивыми или развивают устойчивость к химиотерапевтическим агентам. Действительно, те клетки, которые устойчивы к определенным химиотерапевтическим агентам, используемым в протоколе лечения, часто оказываются устойчивыми к действию других лекарственных средств, даже если те действуют по механизму, отличающемуся от механизма лекарств, используемых в конкретном лечении. Данное явление упоминается как плейотропное лекарственное средство или мультилекарственная резистентность. Вследствие устойчивости к лекарственным средствам, многие виды рака оказываются не восприимчивыми к стандартным химиотерапевтическим лечебным протоколам.
Другие заболевания или состояния, связанные или отличающиеся нежелательным ангиогенезом также трудно поддаются лечению. Однако некоторые соединения, такие как протамин, гепаин и стероиды, были предложены как полезные при лечении некоторых конкретных заболеваний. Taylor et al., Nature, 297:307 (1982); Folkman et al., Science 221:719 (1983); и патенты США №№ 5001116 и 4994443. Талидомид и некоторые его производные также были предложены для лечения таких заболеваний и состояний. См. патенты США №№ 5593990, 5629327, 5712291, 6071948 и 6114355, выданные D'Amato.
Все еще существует значительная необходимость в безопасных и эффективных способах лечения, профилактики и оказания помощи больному при раке и других заболеваниях и состояниях, особенно при заболеваниях, которые не поддаются лечению стандартными способами, такими как хирургия, лучевая терапия, химиотерапия и гормональная терапия, при снижении или исключении токсичности и/или побочных действий, связанных с обычным лечением.
2.3.IMIDS
Был проведен ряд исследований с целью обнаружения соединений, которые могут безопасно и эффективно использоваться для лечения заболеваний, связанных с аномальным продуцированием TNF-α. См., например, Marriott J.B., et al., Expert Opin.Biol.Ther. 1(4): 1-8 (2001); G.W. Muller et al., Journal of Medicinal Chemistry 39(17): 3238-3240 (1996); и G.W. Muller et al., Bioorganic & Medicinal Chemistry Letters 8: 2669-2674 (1998). Некоторые исследования были сфокусированы на группе соединений, выбранных благодаря их способности эффективно ингибировать продуцирование TNF-α посредством LPS, стимулированных РВМС. L.G.Corral et al., Ann.Rheum. Dis. 58: (Suppl.I) 1107-1113 (1999). Данные соединения, которые упоминаются как ImiDsTM (Celgene Corporation) или иммуномодулирующие лекарственные средства, демонстрируют не только эффективное ингибирование TNF-α, но и заметное ингибирование индуцированного LPS продуцирования моноцитов IL1β и IL12. IL6, индуцированный LPS, также ингибируется иммуномодулирующими соединениями, хотя и частично. Данные соединения являются мощными стимуляторами IL10, индуцированного LPS. Конкретные примеры ImiDsTM включают, но не ограничиваются указанным, замещенные 2-(2,6-диоксопиперидин-3-ил)фталимиды и замещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолы, описанные в патентах США №№ 6281230 и 6316471, оба из которых выданы G.W. Muller et al.
3. Краткое изложение сущности изобретения
Данное изобретение охватывает способы лечения и профилактики некоторых типов рака, включая первичный и метастатический рак, а также виды рака, которые являются трудноизлечимыми или устойчивыми к общепринятому химиотерапевтическому лечению. Способы включают введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства. Изобретение также охватывает способы поддержания состояния пациента при некоторых видах рака (например, предотвращение или продление периода до рецидива, или продление времени ремиссии), которые включают введение пациенту, нуждающемуся в таком поддержании состояния, профилактически эффективного количества иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В определенных способах по изобретению иммуномодулирующее соединение вводят в сочетании с терапией, общепринято используемой для лечения, профилактики или поддержания состояния больного раком. Примеры такой терапии включают, но не ограничиваются указанным, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию.
Данное изобретение охватывает способы лечения, поддержания состояния больного или профилактики заболеваний или нарушений, отличающихся от рака, которые связаны или характеризуются нежелательным ангиогенезом, включающие введение пациенту, нуждающемуся в таком лечении, поддержании состояния или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В других способах лечения иммуномодулирующее соединение вводят в сочетании с терапией, обычно используемой для лечения, профилактики или поддержания состояния больного при заболеваниях или нарушениях, связанных или характеризуемых нежелательным ангиогенезом. Примеры такой терапии включают, но не ограничиваются указанным, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию.
Данное изобретение охватывает фармацевтические композиции, единичные препаративные лекарственные формы, режимы дозировки и наборы, которые включают иммуномодулирующее соединение или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство, и второй дополнительный активный агент. Второй активный агент включает специфические комбинации или «коктейли» лекарственных средств.
Краткое описание чертежа
На чертеже показано сравнение влияния 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона (REVLIMIDTM) и талидомида при ингибировании пролиферации клеточной линии множественной миеломы (ММ) при исследовании in vitro. В качестве индикатора пролиферации клеток измеряли поглощение [3H]тимидина клетками различных клеточных линий ММ (MM.1S, Hs Sultan, U266 и RPMI-8226).
Подробное описание изобретения
Первый вариант осуществления изобретения относится к способам лечения, поддержания состояния больного или профилактики рака, включающим введение пациенту, нуждающемуся в таком лечении или профилактике, терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
В конкретных способах лечения, охватываемых данным вариантом осуществления, иммуномодулирующее соединение вводят в сочетании с другим лекарственным средством («второй активный агент») или в сочетании с другим способом лечения, поддержания состояния больного или профилактики рака. Второй активный агент включает небольшие молекулы и большие молекулы (например, белки и антитела), примеры которых приведены в данном описании, а также стволовые клетки. Способы или терапия, которые можно использовать в сочетании с введением иммуномодулирующего соединения, включают, но не ограничиваются указанным, хирургию, переливание крови, иммунотерапию, биологическую терапию, лучевую терапию и другие виды терапии не на основе лекарственных средств, которые используются в настоящее время для лечения, профилактики или поддержания состояния при раке.
Другой вариант осуществления изобретения относится к способам лечения, поддержания состояния больного или профилактики заболеваний или нарушений, отличающихся от рака, которые характеризуются нежелательным ангиогенезом. Данные способы включают введение терапевтически или профилактически эффективного количества иммуномодулирующего соединения или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства.
Примеры заболеваний и нарушений, связанных или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются указанным, воспалительные заболевания, аутоиммунные заболевания, вирусные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания, неоваскулярные заболевания сетчатки и покраснение радужки (неоваскуляризация угла передней камеры глазного яблока). Конкретные примеры заболеваний и нарушений, связанных или характеризуемых нежелательным ангиогенезом, включают, но не ограничиваются указанным, эндометриоз, болезнь Крона, сердечную недостаточность, прогрессирующую сердечную недостаточность, почечную недостаточность, эндотоксемию (наличие в крови эндотоксинов), синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарное нарушение, связанную со злокачественным новообразованием гиперкальцимию, шок, циркуляторный шок, периодонтит, гингивит, рефрактерную анемию и 5q-синдром.
В конкретных способах, охватываемых данным вариантом осуществления, иммуномодулирующее соединение вводят в сочетании со вторым активным агентом или в сочетании со способом лечения, поддержания состояния или профилактики заболевания или состояния. Второй активный агент включает небольшие молекулы и большие молекулы (например, белки и антитела), примеры которых приведены в данном описании, а также стволовые клетки. Способы или терапия, которые можно использовать в сочетании с введением иммуномодулирующего соединения включают, но не ограничиваются указанным, хирургию, переливание крови, иммунотерапию, биологическую терапию, лучевую терапию и другие виды терапии не на основе лекарственных средств, которые используются в настоящее время для лечения, поддержания состояния или профилактики поддержания состояния при заболеваниях или состояниях, связанных или отличающихся нежелательным ангиогенезом.
Данное изобретение также охватывает фармацевтические композиции (например, единичные препаративные лекарственные формы), которые можно использовать в раскрываемых в данном описании способах. Конкретные фармацевтические композиции включают иммуномодулирующее соединение или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство, и второй активный агент.
5.1. Иммуномодулирующие соединения
Соединения по изобретению могут быть либо приобретены коммерчески, либо получены в соответствии со способами, описанными в патентах или патентных публикациях, раскрываемых в данном изобретении. Кроме того, оптически чистые композиции могут быть асимметрически синтезированы или разделены с использованием известных разделяющих реагентов или хиральных колонок, а также с помощью других стандартных методов синтетической органической химии. Соединения, используемые по изобретению, могут включать иммуномодулирующие соединения, которые являются рацемическими, стереомерно обогащенными или стереомерно чистыми, а также их фармацевтически приемлемые соли, сольваты, стереоизомеры, клатраты и пролекарства.
Как использовано в данном описании, если не указано другого, термин «сольваты» включает гидраты соединений по изобретению.
Предпочтительные соединения, используемые в данном изобретении, представляют собой небольшие органические молекулы, имеющие молекулярную массу менее чем примерно 1000 г/моль, и не являются белками, пептидами, олигонуклеотидами, олигосахаридами или другими макромолекулами.
Как использовано в данном описании, и если не указано другого, термины «иммуномодулирующие соединения» и «ImiDsTM» (Celgrene Corporation) относятся к небольшим молекулам, которые в значительной степени ингибируют TNF-α, индуцированные LPS моноциты IL1β и IL12, и частично ингибируют продуцирование IL6. Конкретные иммуномодулирующие соединения обсуждаются ниже.
TNF-α представляет собой воспалительный цитокин, продуцируемый макрофагами и моноцитами во время острого воспаления. TNF-α является ответственным за диапазон разнообразных сигналов внутри клеток. TNF-α может играть патологическую роль при раке. Не ограничиваясь теорией, одно из биологических действий, вызываемых иммуномодулирующими соединениями по изобретению, может заключаться в снижении синтеза TNF-α. Иммуномодулирующие соединения по изобретению усиливают распад мРНК TNF-α.
Кроме того, не ограничиваясь теорией, иммуномодулирующие соединения, используемые в данном изобретении, также могут представлять собой эффективные со-стимуляторы Т-клеток и резко увеличивать пролиферацию клеток доза-зависимым образом. Иммуномодулирующие соединения по изобретению также могут оказывать большее со-стимулирующее действие на CD8+ подтип Т-клеток, чем на CD4+ подтип Т-клеток. Кроме того, соединения предпочтительно обладают противовоспалительными свойствами и рационально со-стимулируют Т клетки.
Конкретные примеры иммуномодулирующих соединений включают, но не ограничиваются указанными, циано- и карбоксильные производные замещенных стиролов, такие как описанные в патенте США 5929117; 1-оксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины и 1,3-диоксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины, такие как описанные в патентах США №№ 5874448 и 5955476; тетразамещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолины, описанные в патенте США 5798368; 1-оксо- и 1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)изоиндолины (например, 4-метильные производные талидомида), включая, но не ограничиваясь указанным, описанные в патентах США №№ 5635517, 6476052, 6555554 и 6403613; 1-оксо- и 1,3-диоксоизоиндолины, замещенные в 4- или 5-положении индолинового кольца (например, 4-(4-амино-1,3-диоксоизоиндолин-2-ил)-4-карбамоилбутановая кислота), описанные в патенте США 6380239; изоиндолин-1-он и изоиндолин-1,3-дион, замещенные во 2-положении 2,6-диоксо-3-гидроксипиперидин-5-илом (например, 2-(2,6-диоксо-3-гидрокси-5-фторпиперидин-5-ил)-4-аминоизоиндолин-1-он), описанные в патенте США № 6458810; класс неполипептидных циклических амидов, описанный в патентах США №№ 5698579 и 5877200; аминоталидомид, а также аналоги, продукты гидролиза, метаболиты, производные и предшественники аминоталидомида и замещенные 2-(2,6-диоксопиперидин-3-ил)фталимиды и замещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолы, такие как описанные в патентах США №№ 6281230 и 6316417; и изоиндол-имидные соединения, такие как описанные в заявке на патент США № 09/972487, поданной 5 октября 2001 г., заявке на патент США № 10/032286, поданной 21 декабря 2001 г., и Международной заявке № РСТ/US01/50401 (Международная публикация № WO 02/059106). Все указанные в данном описании патенты и патентные заявки включены в данное описание во всей полноте путем ссылки. Иммуномодулирующие соединения не включают талидомид.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанным, 1-оксо- и 1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)изоиндолины, замещенные аминогруппой в бензольном кольце, как описано в патенте США 5635517, который включен в данное описание путем ссылки. Данные соединения имеют структуру I:
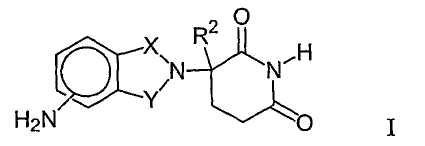
в которой один из Х и Y представляет собой С=О, другой из Х и Y представляет собой С=О или СН2, и R2 представляет собой водород или низший алкил, в частности метил. Конкретные иммуномодулирующие соединения включают, но не ограничиваются указанным:
1-оксо-2-(2,6-диоксопиперидин-3-ил)-4-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-5-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-6-аминоизоиндолин;
1-оксо-2-(2,6-диоксопиперидин-3-ил)-7-аминоизоиндолин;
1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)-4-аминоизоиндолин и
1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)-5-аминоизоиндолин.
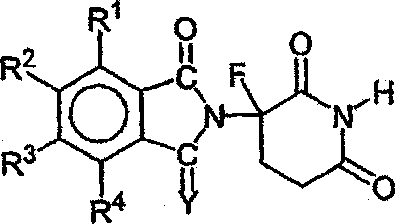
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу замещенных 2-(2,6-диоксопиперидин-3-ил)фталимидов и замещенных 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолов, таких как описанные в патентах США №№ 6281230; 6316471; 6335349 и 6476052, и международной патентной заявке № РСТ/US97/13375 (Международная публикация No. WO98/03502), все из которых включены в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
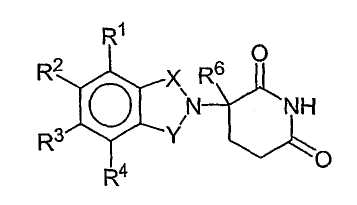
в которой
один из Х и Y представляет собой С=О, другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные из R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензил или галоген;
при условии, что R6 отличается от водорода, если Х и Y представляют собой С=О и (i) каждый из R1, R2, R3 и R4 представляет собой фтор, или (ii) один из R1, R2, R3 и R4 представляет собой амино.
Соединения, являющиеся представителями данного класса, имеют формулы:
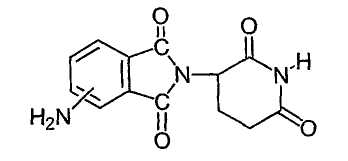
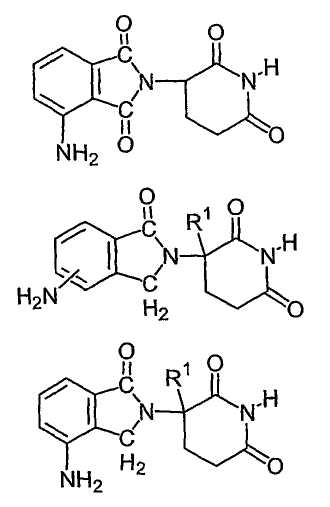
где R1 представляет собой водород или метил. В отдельном варианте осуществления изобретение охватывает применение энантиомерно чистых форм (например, оптически чистые (R) или (S) энантиомеры) данных соединений.
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу изоиндол-имидов, описанному в публикациях патентных заявок США №№ US 2003/0096841 и US 2003/0045552 и международной патентной заявке № РСТ/US01/50401 (Международная публикация No. WO 02/059106), каждая из которых включена в данное описание путем ссылки. Иллюстративные соединения имеют формулу II:
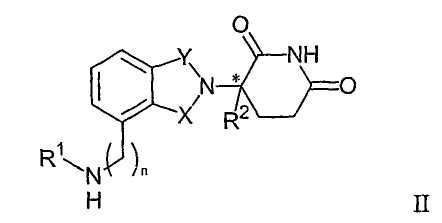
и их фармацевтически приемлемые соли, гидраты, сольваты, клатраты, энантиомеры, диастереомеры, рацематы и смеси стереоизомеры, где:
один из Х и Y представляет собой С=О, и другой представляет собой СН2 или С=О;
R1 представляет собой Н, (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, C(O)R3, C(S)R3, C(O)OR4, (C1-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, C(O)NHR3, C(S)NHR3, C(O)NR3R3', C(S)NR3R3' или (C1-C8)алкил-O(CO)R5;
R2 представляет собой Н, F, бензил, (С1-С8)алкил, (С2-С8)алкенил или (С2-С8)алкинил;
R3 и R3' независимо представляют собой (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C0-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5;
R4 представляет собой (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, (C1-C4)алкил-OR5, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил или (С0-С4)алкил-(С2-С5)гетероарил;
R5 представляет собой (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил или (С2-С5)гетероарил;
при каждом появлении R6 независимо представляет собой Н, (С1-С8)алкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С2-С5)гетероарил или (C0-C8)алкил-С(O)О-R5, или группы R6 могут быть объединены с образованием гетероциклоалкильной группы;
n равно 0 или 1; и
* представляет собой хиральный углеродный центр.
В конкретных соединениях формулы II, если n равно 0, то R1 представляет собой (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, C(O)R3, C(O)OR4, (C1-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, C(S)NHR3 или (C1-C8)алкил-O(CO)R5;
R2 представляет собой Н или (С1-С8)алкил; и
R3 представляет собой (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C5-C8)алкил-N(R6)2, (С0-С8)алкил-NH-C(O)O-R5; (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5; и другие переменные имеют те же самые определения.
В других конкретных соединениях формулы II, R2 представляет собой Н или (С1-С4)алкил.
В других конкретных соединениях формулы II, R1 представляет собой (С1-С8)алкил или бензил.
В других конкретных соединениях формулы II, R1 представляет собой Н, (С1-С8)алкил, бензил, СН2ОСН3, СН2СН2ОСН3 или
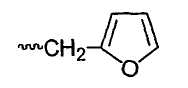
В другом варианте осуществления соединений формулы II, R1 представляет собой
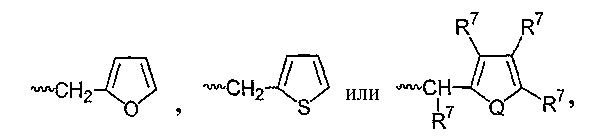
где Q представляет собой О или S, и при каждом появлении R7 независимо представляет собой Н, (С1-С8)алкил, (С3-С7)циклоалкил, (С2-С8)алкенил, (С2-С8)алкинил, бензил, арил, галоген, (С0-С4)алкил-(С1-С6)гетероциклоалкил, (С0-С4)алкил-(С2-С5)гетероарил, (C0-C8)алкил-N(R6)2, (C1-C8)алкил-OR5, (C1-C8)алкил-C(O)OR5, (C1-C8)алкил-O(CO)R5 или C(O)OR5; или при расположении в смежных положениях R7 могут, вместе взятые, образовывать бициклическое алкильное или арильное кольцо.
В других конкретных соединениях формулы II, R1 представляет собой C(O)R3.
В других конкретных соединениях формулы II, R3 представляет собой (С0-С4)алкил-(С1-С6)гетероарил, (С1-С8)алкил, арил или (C0-C4)алкил-OR5.
В других конкретных соединениях формулы II, гетероарил представляет собой пиридил, фурил или тиенил.
В других конкретных соединениях формулы II, R1 представляет собой C(O)OR4.
В других конкретных соединениях формулы II, Н в C(O)NHC(O) может быть заменен на (С1-С4)алкил, арил или бензил.
Следующие примеры соединений данного класса включают, но не ограничиваются указанным: [2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]амид; трет-бутиловый эфир (2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил]карбаминовой кислоты; 4-(аминометил)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-дион; N-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-илметил)ацетамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}циклопропилкарбоксамид; 2-хлор-N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}ацетамид; N-(2-(2,6-диоксо-(3-пиперидил)-1,3-диоксоизоиндолин-4-ил)-3-пиридилкарбоксамид; 3-{1-оксо-4-(бензиламино)изоиндолин-2-ил}пиперидин-2,6-дион; 2-(2,6-диоксо-(3-пиперидил))-4-(бензиламино)изоиндолин-1,3-дион; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}пропанамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}-3-пиридилкарбоксамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}гептанамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}-2-фурилкарбоксамид; {N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)карбамоил}метилацетат; N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)пентанамид; N-(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)-2-тиенилкарбоксамид; N-{(2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил)метил}(бутиламино)карбоксамид; N-{[2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил]метил}(октиламино)карбоксамид; и N-{[2-(2,6-диоксо-(3-пиперидил))-1,3-диоксоизоиндолин-4-ил]метил}(бензиламино)карбоксамид.
Другие конкретные иммуномодулирующие соединения по изобретению принадлежат к классу изоиндол-имидов, описанному в публикации патентной заяки США № 2002/0045643, Международной публикации № WO 98/54170 и патенте США № 6395754, все из которых включены в данное описание путем ссылки. Иллюстративные соединения имеют формулу III:
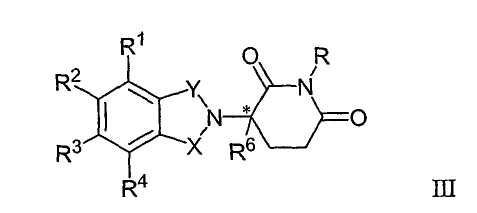
и их фармацевтически приемлемые соли, гидраты, сольваты, клатраты, энантиомеры, диастереомеры, рацематы и смеси стереоизомеров, где:
один из Х и Y представляет собой С=О, и другой представляет собой СН2 или С=О;
R представляет собой Н или CH2OCOR';
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой нитрогруппу или -NHR5, а остальные из R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
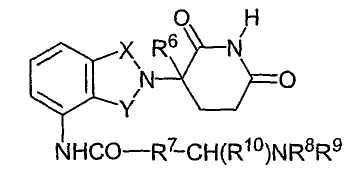
R' представляет собой R7CHR10-N(R8R9);
R7 представляет собой м-фенилен или п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметилен, пентаметилен, гексаметилен или -CH2CH2X1CH2CH2-, где Х1 представляет собой -О-, -S- или -NH-;
R10 представляет собой водород, алкил, содержащий до 8 атомов углерода, или фенил; и
* представляет собой хиральный углеродный центр.
Другие иллюстративные соединения имеют формулу:

где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород или алкил, содержащий 1-8 атомов углерода;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
R7 представляет собой м-фенилен или п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметилен, пентаметилен, гексаметилен или -CH2CH2X1CH2CH2-, где Х1 представляет собой -О-, -S- или -NH-;
R10 представляет собой водород, алкил, содержащий до 8 атомов углерода, или фенил.
Другие иллюстративные соединения имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой нитрогруппу или защищенную аминогруппу, а остальные R1, R2, R3 и R4 представляют собой водород;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор;
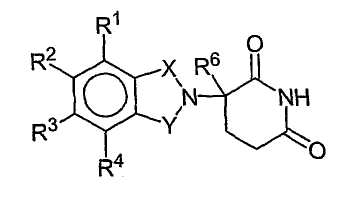
Другие иллюстративные соединения имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
(i) каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода, или (ii) один из R1, R2, R3 и R4 представляет собой -NHR5, а остальные R1, R2, R3 и R4 представляют собой водород;
R5 представляет собой водород, алкил, содержащий 1-8 атомов углерода, или CO-R7-CH(R10)NR8R9, в которой каждый из R7, R8, R9 и R10 является таким, как определено в данном описании; и
R6 представляет собой алкил, содержащий 1-8 атомов углерода, бензо, хлор или фтор.
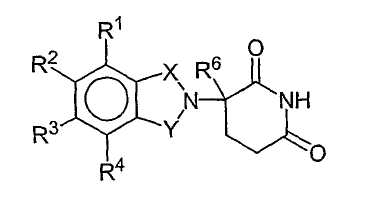
Конкретные примеры соединений имеют формулу:
где:
один из Х и Y представляет собой С=О, а другой из Х и Y представляет собой С=О или СН2;
R6 представляет собой водород, алкил, содержащий 1-8 атомов углерода, бензил, хлор или фтор;
R7 представляет собой м-фенилен, п-фенилен, или -(CnH2n)-, где n имеет значение от 0 до 4;
каждый из R8 и R9, взятый независимо от другого, представляет собой водород или алкил, имеющий 1-8 атомов углерода, или R8 и R9, взятые вместе, представляют собой тетраметилен, пентаметилен, гексаметилен или -CH2CH2X1CH2CH2-, где Х1 представляет собой -О-, -S- или -NH-; и
R10 представляет собой водород, алкил, содержащий 1-8 атомов углерода, или фенил.
Наиболее предпочтительными иммуномодулирующими соединениями по изобретению являются 4-(амино)-2-(2,6-диоксо-(3-пиперидил)изоиндолин-1,3-дион и 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион. Соединения могут быть получены стандартными синтетическими способами (смотри, например, патент США № 5635517, включенный в данное описание путем ссылки). Соединения доступны от Celgene Corporation, Warren, NJ. 4-(Амино)-2-(2,6-диоксо-(3-пиперидил)изоиндолин-1,3-дион имеет следующую химическую структуру:
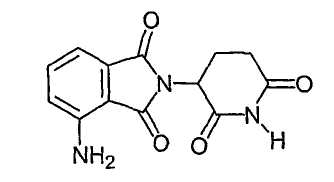
Соединение - 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион, имеет следующую химическую структуру:
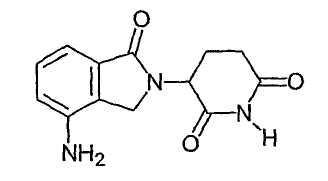
В другом варианте осуществления конкретные иммуномодулирующие соединения по изобретению охватывают полиморфные формы 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона, такие как формы А, В, С, D, E, F, G и Н, описанные в предварительной заявке на патент США № 60/499723, поданной 4 сентября 2003 г., которая включена в данное описание путем ссылки. Например, форма А 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой несольватное кристаллическое вещество, которое может быть получено из систем неводных растворителей. Форма А характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 8, 14,5, 16, 17,5, 20,5, 24 и 26 градусах 2θ, и характеризуется эндотермой, полученной методом дифференциальной сканирующей калориметрии, имеющей температуру примерно 270°С.
Форма В 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой полугидратное кристаллическое вещество, которое может быть получено из различных систем растворителей, включая, но не ограничиваясь указанным, гексан, толуол и воду. Форма В характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 16, 18, 22 и 27 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 146°С и примерно 268°С.
Форма С 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой полусольватное кристаллическое вещество, которое может быть получено из таких растворителей как, но не ограничиваясь указанным, ацетон. Форма С характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 15,5 и 25 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 150°С и примерно 269°С.
Форма D 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой кристаллический сольватированный полиморф, полученный из смеси ацетонитрила и воды. Форма D характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 27 и 28 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 122°С и примерно 270°С.
Форма Е 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой дигидратированное кристаллическое вещество, которое может быть получено при получении суспензии 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона в воде и путем медленного упаривания 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона в системе растворителей ацетон:вода в соотношении примерно 9:1. Форма Е характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 20, 24, 5 и 29 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 99°С, примерно 161°С и примерно 269°С.
Форма F 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой несольватированное кристаллическое вещество, которое может быть получено при дегидратации формы Е. Форма F характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 19, 19,5 и 25 градусах 2θ, и характеризуется эндотермой, полученной методом дифференциальной сканирующей калориметрии, имеющими температуру 269°С.
Форма G 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой несольватированное кристаллическое вещество, которое может быть получено при суспендировании форм В и Е в растворителе, таком как, но не ограничиваясь указанным, тетрагидрофуран (ТГФ). Форма G характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 21, 23 и 24,5 градусах 2θ, и характеризуется эндотермой, полученной методом дифференциальной сканирующей калориметрии, имеющей температуру примерно 248°С.
Форма Н 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой частично гидратированное кристаллическое вещество, которое может быть получено при воздействии 0%-ной относительной влажности на форму Е. Форма Н характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 15, 26 и 31 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуру примерно 125°С и примерно 269°С.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанным, 1-оксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины и 1,3-диоксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины, такие как описанные в патентах США №5874448 и 5955476, каждый из которых включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
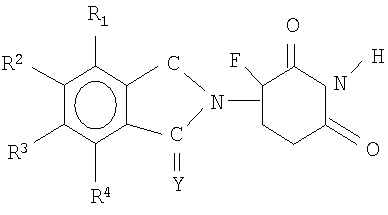
где Y представляет собой кислород или Н2, и каждый из R1, R2, R3 и R4, независимо от других, представляет собой водород, галоген, алкил, имеющий 1-4 атома углерода, алкокси, имеющий 1-4 атома углерода, или амино.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанными, тетразамещенные 2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолины, описанные в патенте США № 5798368, который включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
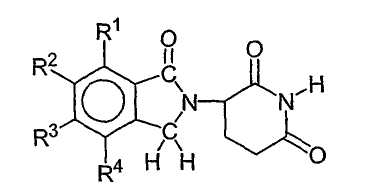
где каждый из R1, R2, R3 и R4, независимо от других, представляет собой галоген, алкил, имеющий 1-4 атома углерода, или алкокси, имеющий 1-4 атома углерода.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанными, 1-оксо- и 1,3-диоксо-2-(2,6-диоксопиперидин-3-ил)изоиндолины, описанные в патенте США № 6403613, который включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
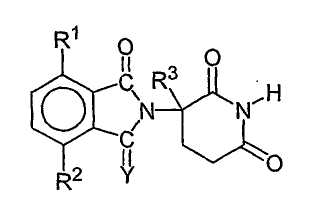
где Y представляет собой кислород или Н2,
первый из R1 и R2 представляет собой галоген, алкил, алкокси, алкиламино, диалкиламино, циано или карбамоил, второй из R1 и R2, независимо от первого, представляет собой водород, галоген, алкил, алкокси, алкиламино, диалкиламино, циано или карбамоил, и
R3 представляет собой водород, алкил или бензил.
Конкретные примеры соединения имеют формулу:
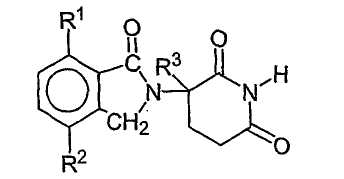
где первый из R1 и R2 представляет собой галоген, алкил, имеющий от 1 до 4 атомов углерода, алкокси, имеющий от 1 до 4 атомов углерода, диалкиламино, в котором каждый алкил содержит от 1 до 4 атомов углерода, циано или карбамоил,
второй из R1 и R2, независимо от первого, представляет собой водород, галоген, алкил, имеющий от 1 до 4 атомов углерода, алкокси, имеющий от 1 до 4 атомов углерода, алкиламино, в котором алкил содержит от 1 до 4 атомов углерода, диалкиламино, в котором каждый алкил содержит от 1 до 4 атомов углерода, циано или карбамоил, и
R3 представляет собой водород, алкил, содержащий от 1 до 4 атомов углерода, или бензил. Другие иллюстративные соединения имеют формулу:
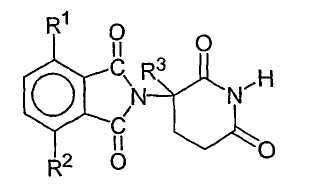
где первый из R1 и R2 представляет собой галоген, алкил, имеющий от 1 до 4 атомов углерода, алкокси, имеющий от 1 до 4 атомов углерода, диалкиламино, в котором каждый алкил содержит от 1 до 4 атомов углерода, циано или карбамоил,
второй из R1 и R2, независимо от первого, представляет собой водород, галоген, алкил, имеющий от 1 до 4 атомов углерода, алкокси, имеющий от 1 до 4 атомов углерода, алкиламино, в котором алкил содержит от 1 до 4 атомов углерода, диалкиламино, в котором каждый алкил содержит от 1 до 4 атомов углерода, циано или карбамоил, и
R3 представляет собой водород, алкил, содержащий от 1 до 4 атомов углерода, или бензил.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанными, 1-оксо и 1,3-диоксоизоиндолины, замещенные в 4- или 5-положении индолинового кольца, описанные в патенте США 6380239, который включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
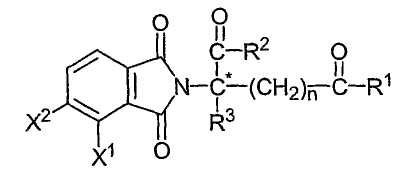
в которой атом углерода, обозначенный С*, представляет собой центр хиральности (когда n не равно нулю, и R1 не является таким же как R2); один из Х1 и Х2 представляет собой амино, нитро, алкил из одного-шести атомов углерода или NH-Z, а другой из Х1 и Х2 представляет собой водород; каждый из R1 и R2, независимо от другого, представляет собой гидрокси или NH-Z; R3 представляет собой водород, алкил, содержащий один-шесть атомов углерода, галоген или галогеналкил; Z представляет собой водород, арил, алкил, содержащий один-шесть атомов углерода, формил или ацил, содержащий от одного до шести атомов углерода, и n имеет значение 0, 1 или 2; при условии, что если Х1 представляет собой амино, и n равно 1 или 2, то оба R1 и R2 не представляют собой гидрокси; и их соли. Следующие иллюстративные соединения имеют формулу:
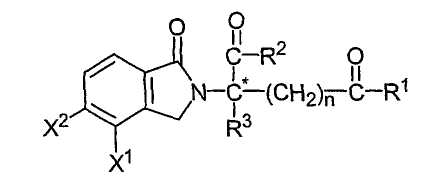
в которой атом углерода, обозначенный С*, представляет собой центр хиральности, когда n не равно нулю, и R1 не является таким же как R2; один из Х1 и Х2 представляет собой амино, нитро, алкил, содержащий один-шесть атомов углерода, или NH-Z, а другой из Х1 и Х2 представляет собой водород; каждый из R1 и R2, независимо от другого, представляет собой гидрокси или NH-Z; R3 представляет собой алкил, содержащий один-шесть атомов углерода, галоген или водород; Z представляет собой водород, арил или алкил или ацил, содержащий от одного до шести атомов углерода, и n имеет значение 0, 1 или 2.
Другие иллюстративные соединения имеют формулу:
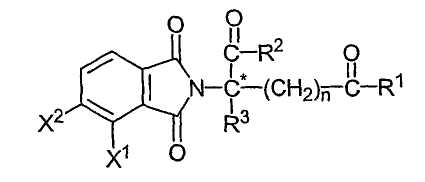
в которой атом углерода, обозначенный С*, представляет собой центр хиральности, когда n не равно нулю, и R1 не является таким же, как R2; один из Х1 и Х2 представляет собой амино, нитро, алкил, содержащий один-шесть атомов углерода, или NH-Z, а другой из Х1 или Х2 представляет собой водород; каждый из R1 и R2, независимо от другого, представляет собой гидрокси или NH-Z; R3 представляет собой алкил, содержащий один-шесть атомов углерода, галоген или водород; Z представляет собой водород, арил или алкил или ацил, содержащий от одного до шести атомов углерода, и n имеет значение 0, 1 или 2; и их соли. Конкретные соединения имеют формулу:
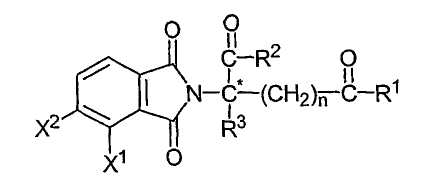
где один из Х1 и Х2 представляет собой нитро или NH-Z, а другой из Х1 или Х2 представляет собой водород;
каждый из R1 и R2, независимо от другого, представляет собой гидрокси или NH-Z;
R3 представляет собой алкил, содержащий один-шесть атомов углерода, галоген или водород;
Z представляет собой водород, фенил, ацил, имеющий один-шесть углеродов, или алкил, имеющий один-шесть углеродов; и
и n имеет значение 0, 1 или 2;
при условии, что если один из Х1 и Х2 представляет собой нитро, и n равно 1 или 2; то R1 и R2 отличаются от гидрокси; и
если COR1 и -(CH2)nCOR2 являются разными, атом углерода, обозначенный С*, представляет собой центр хиральности. Другие иллюстративные соединения имеют формулу:
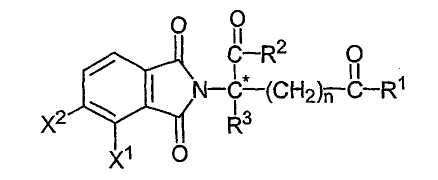
где один из Х1 и Х2 представляет собой алкил, имеющий от одного до шести углеродов;
каждый из R1 и R2, независимо от другого, представляет собой гидрокси или NH-Z;
R3 представляет собой алкил из одного-шести атомов углерода, галоген или водород;
Z представляет собой водород, фенил, ацил, имеющий один-шесть атомом углерода, или алкил, имеющий один-шесть атомов углерода; и
и n имеет значение 0, 1 или 2; и
если COR1 и -(CH2)nCOR2 являются разными, атом углерода, обозначенный С*, представляет собой центр хиральности.
Еще другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанным, изоиндолин-1-он и изоиндолин-1,3-дион, замещенные во 2 положении 2,6-диоксо-3-гидроксипиперидин-5-илом, описанные в патенте США 6458810, который включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
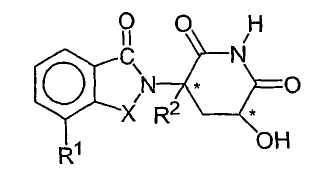
атомы углерода, обозначенные С*, представляют собой центры хиральности,
Х представляет собой -С(О)- или -СН2-;
R1 представляет собой алкил, содержащий 1-8 атомов углерода, или -NHR3;
R2 представляет собой водород, алкил, содержащий 1-8 атомов углерода, или галоген;
и
R3 представляет собой водород,
алкил, содержащий 1-8 атомов углерода, незамещенный или замещенный алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода;
циклоалкил, содержащий от 3 до 18 атомов углерода,
фенил, незамещенный или замещенный алкилом, содержащим 1-8 атомов углерода, алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода;
бензил, незамещенный или замещенный алкилом, сдержащим 1-8 атомов углерода, алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода или COR4, в котором
R4 представляет собой водород,
алкил, содержащий 1-8 атомов углерода, незамещенный или замещенный алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода,
циклоалкил, содержащий от 3 до 18 атомов углерода,
фенил, незамещенный или замещенный алкилом, содержащим 1-8 атомов углерода, алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода, или
бензил, незамещенный или замещенный алкилом, содержащим 1-8 атомов углерода, алкоксильной группой, содержащей от 1 до 8 атомов углерода, галогеном, амино или алкиламино, имеющим от 1 до 4 атомов углерода.
Соединения по изобретению либо могут быть коммерчески доступными, либо могут быть получены в соответствии со способами, описанными в указанных в данном описании патентах или патентных публикациях. Кроме того, оптически чистые соединения могут быть либо получены с помощью асимметрического синтеза, или разделены с использованием известных разделяющих агентов или на хиральных колонках, а также с помощью других стандартных методов синтетической органической химии.
Как использовано в данном описании, и если не указано другого, термин «фармацевтически приемлемая соль» охватывает нетоксичные кислотно-аддитивные и основно-аддитивные соли соединения, к которому относится данный термин. Приемлемые нетоксичные кислотно-аддитивные соли включают соли, полученные из органических и неорганических кислот или оснований, известных в данной области, которые включают, например, хлористоводородную кислоту, бромистоводородную кислоту, фосфорную кислоту, серную кислоту, метансульфоновую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, янтарную кислоту, лимонную кислоту, яблочную кислоту, малеиновую кислоту, сорбиновую кислоту, аконитовую кислоту, салициловую кислоту, фталевую кислоту, эмболиновую кислоту, энантовую кислоту и тому подобные.
Соединения, которые являются кислотными по своей природе, способны к образованию солей с различными фармацевтически приемлемыми основаниями. Основания, которые можно использовать для получения фармацевтически приемлемых основно-аддитивных солей таких кислотных соединений представляют собой те, которые образуют нетоксичные основно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые катионы, такие как, но не ограничиваясь указанным, соли щелочных металлов или щелочно-земельных металлов и, в частности, соли кальция, магния, натрия или калия. Подходящие органические основания включают, но не ограничиваются указанными, N,N-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумаин (N-метилглукамин), лизин и прокаин.
Как использовано в данном описании, и если не указано другого, термин «пролекарство» означает производное соединения, которое может претерпевать гидролиз, окисление или каким-либо другим образом реагировать в биологических условиях (in vitro или in vivo), образуя соединение. Примеры пролекарств включают, но не ограничиваются указанными, производные иммуномодулирующих соединений по изобретению, которые включают биогидролизуемые фрагменты, такие как биогидролизуемые амиды, биогидролизуемые сложные эфиры, биогидролизуемые карбаматы, биогидролизуемые карбонаты, биогидролизуемые мочевины и биогидролизуемые аналоги фосфатов. Другие примеры пролекарств включают производные иммуномодулирующих соединений по изобретению, которые включают фрагменты -NO, -NO2, -ONO или -ONO2. Пролекарства обычно могут быть получены хорошо известными способами, такими, как описанные в 1 Burger's Medicinal Chemistry and Drug Discovery, 172-178, 949-982 (Manfred E. Wolff ed., 5th ed., 1995) и Design of Prodrugs (H.Bundgaard ed., Elselvier, New York, 1985).
Как использовано в данном описании, и если не указано другого, термины «биогидролизуемый амид», «биогидролизуемый сложный эфир», «биогидролизуемый карбамат», «биогидролизуемый карбонат», «биогидролизуемая мочевина», «биогидролизуемый фосфат» означают соответственно амид, сложный эфир, карбамат, карбонат, мочевину или фосфат соединения, которое либо: 1) не влияет на биологическую активность соединения, но может придавать соединению благоприятные свойства in vivo, такие как поглощение, продолжительность действия или начало действия; или 2) является биологически не активным, но превращается in vivo в биологически активное соединение. Примеры биогидролизуемых сложных эфиров включают, но не ограничиваются указанными, низшие алкиловые сложные эфиры, низшие ацилоксиалкиловые сложные эфиры (такие как ацетоксиметиловый, ацетоксиэтиловый, аминокарбонилоксиметиловый, пивалоилоксиметиловый и пивалоилоксиэтиловый сложные эфиры), лактониловые сложные эфиры (такие как фталидиловый и тиофталидиловый сложные эфиры), низшие алкоксиацилоксиалкиловые сложные эфиры (такие как метоксикарбонилоксиметиловый, этоксикарбонилоксиэтиловый и изопропоксикарбонилоксиэтиловый сложные эфиры), алкоксиалкиловые сложные эфиры, сложные эфиры холина и ациламиноалкиловые сложные эфиры (такие как ацетамидометиловые сложные эфиры). Примеры биогидролизуемых амидов включают, но не ограничиваются указанными, низшие алкиламиды, амиды α-аминокислот, алкоксиациламиды и алкиламиноалкилкарбониламиды. Примеры биогидролизуемых карбаматов включают, но не ограничиваются указанными, низшие алкиламины, замещенные этилендиамины, аминокислоты, гидроксиалкиламины, гетероциклические и гетероароматические амины и полиэфирные амины.
Различные иммуномодулирующие соединения по изобретению содержат один или несколько хиральных центров и могут существовать в качестве рацемических смесей энантиомеров или смесей диастереомеров. Данное изобретение охватывает применение стереоизомерно чистых форм таких соединений, а также применение смесей данных форм. Например, в способах и композициях по изобретению можно использовать смеси, содержащие равные или неравные количества энантиомеров конкретного иммуномодулирующего соединения по изобретению. Данные изомеры могут быть получены асимметрическим синтезом или разделены на оптические изомеры с использованием стандартных методов, таких как разделение на хиральных колонках или с использованием хиральных разделяющих агентов. Смотри, например, Jacques J., et al., Enantiomers, Racemates and Resolutions (Wiley-Interscience, new-York, 1981); Wilen S.H. et al., Tetrahedron 33: 2725 (1977); Eliel E.L., Stereochemistry of Carbon Compounds (McGraw-Hill, NY, 1962) и Wilen S.H., Tables of Resolving Agents and Optical Resolutions, p.268 (E.L.Eliel, Ed., Univ. Of Notre Dame press, Notre Dame, IN, 1972).
Как использовано в данном описании, и если не указано другого, термин «стереоизомерно чистый» означает композицию, которая включает один стереоизомер соединения, и по существу не содержит другого стереоизомера соединения. Например, стереоизомерно чистая композиция соединения, имеющего один хиральный центр, по существу не будет содержать противоположного энантиомера соединения. Стереоизомерно чистая композиция соединения, имеющего два хиральных центра, по существу не будет содержать других диастереомеров соединения. Типичное стереоизомерно чистое соединение включает больше, чем примерно 80% по весу одного стереоизомера соединения, и меньше чем примерно 20% по весу других стереоизомеров соединения, более предпочтительно, больше, чем примерно 90% по весу одного стереоизомера соединения, и меньше чем примерно 10% по весу других стереоизомеров соединения, еще более предпочтительно, больше, чем примерно 95% по весу одного стереоизомера соединения, и меньше чем примерно 5% по весу других стереоизомеров соединения, и наиболее предпочтительно, больше, чем примерно 97% по весу одного стереоизомера соединения, и меньше чем примерно 3% по весу других стереоизомеров соединения. Как использовано в данном описании, и если не указано другого, термин «стереоизомерно обогащенный» означает композицию, которая включает больше, чем примерно 60% по весу одного стереоизомера соединения, предпочтительно, больше, чем примерно 70% по весу, более предпочтительно больше, чем примерно 80% по весу одного стереоизомера соединения. Как использовано в данном описании, и если не указано другого, термин «энантиомерно чистый» означает стереоизомерно чистую композицию соединения, имеющего один хиральный центр. Аналогично, термин «энантиомерно обогащенный» означает стереоизомерно обогащенную композицию соединения, имеющего один хиральный центр.
Следует отметить, что если имеется расхождение между изображенной структурой и названием, данным структуре, изображенную структуру следует считать более значимой. Кроме того, если стереохимия структуры или части структуры не обозначены, например, жирными и пунктирными линиями, структуру или часть структуры следует интерпретировать как охватывающую все ее стереоизомеры.
5.2. Вторые активные агенты
Иммуномодулирующие соединения могут быть объединены с другими фармакологически активными соединениями («вторые активные агенты») в способах и композициях по изобретению. Предполагается, что некоторые комбинации работают синергистически при лечении конкретных типов рака и некоторых заболеваний и состояний, связанных с или отличающихся нежелательным ангиогенезом. Иммуномодулирующие соединения также могут работать, облегчая неблагоприятные действия, связанные с некоторыми вторыми активными агентами, и некоторые вторые активные агенты можно использовать для облегчения действия, связанного с иммуномодулирующими соединениями.
Вместе с иммуномодулирующими соединениям в способах и композициях по изобретению можно использовать один или несколько вторых активных ингредиентов или агентов. Вторые активные агенты могут представлять собой большие молекулы (например, белки) или маленькие молекулы (например, синтетические неорганические металлоорганические или органические молекулы).
Примеры активных агентов, имеющих большую молекулу, включают, но не ограничиваются указанным, гематопоэтические факторы роста, цитокины и моноклональные и поликлональные антитела. Конкретными примерами активных агентов являются анти-CD40 моноклональные антитела (такие как, например, SGN-40); ингибиторы гистон-деацетилазы (такие, например, как SAHA и LAQ824); ингибиторы белка-90 теплового шока (такие как, например, 17-AAG); ингибиторы киназы рецептора инсулиноподобного фактора роста-1; ингибиторы киназы рецептора сосудистого эндотелиального фактора роста (такие, например, как РТК787); ингибиторы рецепторов фактора роста инсулина; ингибиторы ацилтрансферазы лизофосфатидиновой кислоты; ингибиторы IkB киназы; ингибиторы р38МАРК; ингибиторы EGFR (такие, например, как гефиниб и эрлотиниб HCL); антитела HER-2 (такие как, например, транстузумаб (Herceptin®) и пертузумаб (OmnitargTM)); антитела VEGFR (такие как, например, бевацизумаб (AvastinTM); ингибиторы VEGFR (такие как, например, flk-1 специфические ингибиторы киназы, SU5416 и ptk787/zk222584); ингибиторы Р13К (такие как, например, вортманнин); ингибиторы С-Met (такие как, например, РНА-665752); моноклональные антитела (такие как, например, ритуксимаб (Rituxan®), тозитумомаб (Bexxar®), эдреколомаб (Panorex®) и G250); и антитела против TNF-α.
Типичные активные агенты, имеющие большую молекулу, представляют собой биологические молекулы, такие как природные или искусственно полученные белки. Белки, которые являются особенно полезными в данном изобретении, включают белки, которые стимулируют выживание и/или пролиферацию гематопоэтических клеток-предшественников и иммунологически активных поэтических клеток in vitro или in vivo. Другие стимулируют деление и дифференциацию подтвержденных предшественников эритроцитов в клетках in vitro или in vivo. Конкретные белки включают, но не ограничиваются указанными: интерлейкины, такие как IL-2 (включая рекомбинантный IL-II ("rIL2") и канарипоксный IL-2), IL-10, IL-12 и IL-18; интерфероны, такие как интерферон альфа-2а, интерферон альфа-2b, интерферон альфа-n1, интерферон альфа-n3, интерферон бета-Ia и интерферон гамма-Ib; GM-CF и GM-CSF; и EPO.
Конкретные белки, которые можно использовать в способах и композициях данного изобретения, включают, но не ограничиваются указанными: филграстим, который продается в Соединенных Штатах Америки под торговым названием Neupogen® (Amgen, Thousand Oaks, CA); саграмостим, который продается в Соединенных Штатах Америки под торговым названием Leukine® (Immunex, Seattle, WA) и рекомбинантный ЕРО, который продается в Соединенных Штатах Америки под торговым названием Epogen® (Amgen, Thousand Oaks, CA).
Рекомбинантные и мутированные формы GM-CSF могут быть получены, как описано в патентах США №№ 5391485, 5393870 и 5229496, все из которых включены в данное описание путем ссылки. Рекомбинантные и мутированные формы G-CSF могут быть получены, как описано в патентах США №№ 4810643, 4999291, 5528823 и 5580755, все из которых включены в данное описание путем ссылки.
Данное изобретение охватывает применение природных, существующих в природе и рекомбинантных белков. Изобретение, кроме того, охватывает мутанты и производные (например, модифицированные формы) природно существующих белков, которые проявляют, in vivo, по крайней мере некоторую фармакологическую активность белков, на основе которых они были получены. Примеры мутантов включают, но не ограничиваются указанными, белки, которые содержат один или несколько аминокислотных остатков, которые отличаются от соответствующих остатков существующих в природе форм белков. Термин «мутанты» также включает белки, которые не содержат углеводные фрагменты, обычно присутствующие в их существующих в природе формах (например, негликозилированные формы). Примеры производных включают, но не ограничиваются указанными, скрепленные производные и слитые белки, такие как белки, образованные при слиянии IgG1 или IgG3 с белком или активной частью белка, представляющего интерес. См., например, Penichet M.L. and Morrison S.L. J.Immunol Methods 248:91-101 (2001).
Активные агенты, имеющие большие молекулы, могут быть введены в виде противораковых вакцин. Например, вакцины, которые секретируют или вызывают секрецию цитокинов, таких как IL-2, G-CSF и GM-CSF, можно использовать в данных способах, фармацевтических композициях и наборах по изобретению. См., например, Emens L.A. et al., Curr. Opinion Mol. Ther., 3(1): 77-84 (2001).
В одном варианте осуществления изобретения активные агенты, имеющие большие молекулы, снижают, исключают или предотвращают неблагоприятное действие, связанное с введением иммуномодулирующего соединения. В зависимости от конкретного иммуномодулирующего соединения и заболевания или нарушения, подвергаемого лечению, неблагоприятные действия могут включать, но не ограничиваются указанным, состояние дремы и сонливость, головокружение и ортостатическую гипотензию, нейтропению, инфекции, возникающие в результате нейтропении, повышенную ВИЧ-вирусную нагрузку, брадикардию, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, и приступы (например, основные конвульсии). Конкретным неблагоприятным действием является нейтропения.
Второй активный агент, имеющий небольшие молекулы, также можно использовать для облегчения неблагоприятных действий, связанных с введением иммуномодулирующего соединения. Однако предполагается, что аналогично некоторым большим молекулам, многие такие агенты способны обеспечивать синергистический эффект при введении вместе (например, до, после или одновременно) с иммуномодулирующим соединением. Примеры вторых агентов, имеющих небольшие молекулы, включают, но не ограничиваются указанным, противораковые агенты, антибиотики, иммуноподавляющие агенты и стероиды.
Примеры противораковых агентов включают, но не ограничиваются указанными: семаксаниб; циклоспорин; этанерцепт; доксициклин; бортезомиб; ацивицин; акларубицин; акодазол гидрохлорид; акронин; адозелезин; альдезлейкин; алтретамин; амбомицин; аметантрон ацетат; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитинид; азетера; азотомицин; батимастат; бензодепа; бикалутамид; бизантрен гидрохлорид; биснафид димезилат; бизелезин; блеомицин сульфат; бреквинар натрия; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин; кармустин; карубицин гидрохлорид; карзелезин; цедефингол; целекоксиб; хлорамбуцил; циролемицин; цисплатин; кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин гидрохлорид; децитабин; дексормаплатин; дезагуанин; дезагуанин мезилат; диазиквон; доцетаксель; доксорубицин; доксорубицин гидрохлорид; дролоксифен; дролоксифен цитрат; дромостанолон пропионат; дуазомицин; эдатрексат; эфлорнитин гидрохлорид; элсамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин гидрохлорид; эрбузол; эзорубицин гидрохлорид; эстрамустин; эстрамустин фосфат натрия; этанидазол; этопозид; этопозид фосфат; этоприн; фадрозол гидрохлорид; фазарабин; фенретинид; флоксуридин; флударабин фосфат; фторурацил; фторцитабин; фосквидон; фостриецин натрия; гемцитабин; гемцитабин гидрохлорид; гидроксимочевину; идарубицин гидрохлорид; ифосфамид; илмофозин; ипроплатин; иринотекан; иринотекан гидрохлорид; ланреотид ацетат; летрозол; леупролид ацетат; лиарозол гидрохлорид; лометрексол натрия; ломустин; лозоксантрон гидрохлорид; мазопрокол; майтанзин; мечлоретамин гидрохлорид; мегестрол ацетат; меленгестрол ацетат; мелфалан; меногарил; меркаптопурин; метотрексат; метотрексат натрия; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомальцин; митомицин; митоспер; митотан; митоксантрон гидрохлорид; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксель; пегаспаргаза; пелиомицин; пентамустин; пепломицин сульфат; перфосфамид; пипоброман; пипосульфан; пироксантрон гидрохлорид; пликамицин; пломестан; порфимер натрия; порфиромицин; преднимустин; прокарбазин гидрохлорид; пуромицин; пуромицин гидрохлорид; пиразофурин; рибоприн; сафингол; сафингол гидрохлорид; семустин; симтразен; спарфосат натрия; спарсомицин; спирогерманий гидрохлорид; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; текогалан натрия; таксотер; тегафур; телоксантрон гидрохлорид; темопорфин; тенипозид; тероксирон; тестолактон; путем ссылки. Например, форма А 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой несольватное кристаллическое вещество, которое может быть получено из систем неводных растворителей. Форма А характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 8, 14,5, 16, 17,5, 20,5, 24 и 26 градусах 2θ, и характеризуется эндотермой, полученной методом дифференциальной сканирующей калориметрии, имеющей температуру примерно 270°С.
Форма В3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой полугидратное кристаллическое вещество, которое может быть получено из различных систем растворителей, включая, но не ограничиваясь указанным, гексан, толуол и воду. Форма В характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 16, 18, 22 и 27 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 146°С и примерно 268°С.
Форма С3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой полусольватное кристаллическое вещество, которое может быть получено из таких растворителей как, но не ограничиваясь указанным, ацетон. Форма С характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 1.5,5 и 25 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуры примерно 150°С и примерно 269°С.
Форма D3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой кристаллический сольватированный полиморф, полученный из смеси ацетонитрила и воды. Форма D характеризуется порошковой дифрактограммой, изобенгазол; изохомогаликондрин В; итазетрон; джазплакинолид; кагалалид F; ламелларин-N триацетат; ланреотид; лейнамицин; ленограстим; лентинан сульфат; лептостатин; летрозол; фактор ингибирования лейкемии; лейкоцитарный альфа-интерферон; леупролид+эстроген+прогестерон; леупрорелин; левамизол; лиарозол; аналог линейного полиамина; липофильный дисахаридный пептид; липофильные соединения платины; лиссоклинамид 7; лобаплатин; ломбрицин; лометрексол; лонидамин; лозоксантрон; локсорибин; луртотекан; тексафирин лутетий; лизофиллин; литические пептиды, майтанзин; манностатин А; маримастат; мазопрокол; маспин; ингибиторы матрилизина; ингибиторы матриксной металлопротеазы; меногарил; мербарон; метерелин; метиониназа; метоклопрамид; ингибитор MIF; мифепристон; милтефозин; миримостим; митогуазон; митолактол; аналоги митомицина; митонафид; митотоксиновый фактор роста фибробластов-сапорин; митоксантрон; мофаротен; молграмостим; Эрбитукс; хорионический гонадотропин человека; монофосфорилированнный липид А + sk стенок миобактериальных клеток; мопидамол; горчичный противораковый агент; микапероксид В; экстракт стенок миобактериальных клеток; мириапорон; N-ацетилдиналин; N-замещенные бензамиды; нафарелин; нагрестип; налоксон+пентазоцин; напавин; нафтерпин; нартограстим; недаплатин; неморубицин; неридроновую кислоту; нилутамид; низамицин; модуляторы оксида азота; нитроксидный антиоксидант; облимерзен (Genasense®); O6-бензилгуанин; октреотид; окиценон; олигонуклеотиды; онапристон; ондасетрон; орацин; пероральный цитокиновый индуктор; ормаплатин; озатерон; оксалиплатин; оксауномицин; паклитаксел; аналоги паклитаксела; производные паклитаксела; палауамин; пальмитоилризоцин; памидроновая кислоты; панакситриол; паномифен; парабактин; паззелиптин; пегазпаргаз; пелдезин; пентозан полисульфат натрия; пентостатин; пентрозол; перфлуброн; перфосфамид; периллиловый спирт; феназиномицин; фенилацетат; ингибиторы фосфатазы; пицибанил; пилокарпин гидрохлорид; пирарубицин; пиритрексим; плацетин А; плацетин В; ингибитор активатора плазминогена; комплекс платины; соединения платины; комплекс платина-триамин; порфимер натрия; порфиромицин; преднизон; пропилбис-акридон; простагландин J2; ингибиторы протеасома; иммунный модулятор на основе белка А; ингибитор протеинкиназы С; ингибиторы протеинкиназы С; микроалгал; ингибиторы протеинтирозинфосфатазы; ингибиторы пуриннуклеозидфосфорилазы; пурпурины; пиразолоакридин; конъюгат пиридоксилированного гемоглобина-полиоксиэтилена; антагонисты raf; ралтитрексед; рамосетрон; ингибиторы ras-фарнезилпротеинтрансферазы; ras-ингибиторы; ингибитор ras-GAP; деметилированный ретеллиптин; этидронат рения Re186; ризоксин; рибозимы; ретинамид RII; рохитукин; ромуртид; роквинимекс; рубигинон В1; рубоксил; сафингол; сайнтопин; SarCNU; саркофитол А; сарграмостим; миметики Sdi 1; семустин; полученный из ингибитор 1 продукт старения; смысловые олигонуклеотиды; ингибиторы сигнальной трансдукции; сизофиран; собузоксан; борокаптат натрия; фенилацетат натрия; солверол; соматомедин-связывающий белок; сонермин; спарфосовая кислота; спикамицин D; иромустин; спленопентин; спонгистатин 1; скваламин; стипиамид; ингибиторы стромелизина; сульфинозин; суперактивный сосудистоактивный антагонист кишечного пептида; сурадиста; сурамин; свайзонин; таллимустин; тамоксифен метилиодид; тауромустин; тазаротен; текогалан натрия; тегафур; теллурапирилий; ингибиторы теломеразы; темопорфин; тенипозид; тетрахлордекаоксид; тетразомин; сканирующей калориметрии, имеющей температуру примерно 248°С.
Форма Н3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона представляет собой частично гидратированное кристаллическое вещество, которое может быть получено при воздействии 0%-ной относительной влажности на форму Е. Форма Н характеризуется порошковой дифрактограммой, включающей значимые пики приблизительно при 15, 26 и 31 градусах 2θ, и характеризуется эндотермами, полученными методом дифференциальной сканирующей калориметрии, имеющими температуру примерно 125°С и примерно 269°С.
Другие конкретные иммуномодулирующие соединения по изобретению включают, но не ограничиваются указанным, 1-оксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины и 1,3-диоксо-2-(2,6-диоксо-3-фторпиперидин-3-ил)изоиндолины, такие как описанные в патентах США №5874448 и 5955476, каждый из которых включен в данное описание путем ссылки. Иллюстративные соединения имеют формулу:
где Y представляет собой кислород или Н2, и указанным, раки мочевого пузыря, костей или крови, мозга, молочной железы, шеи, грудной клетки, ободочной кишки, эндометрия, пищевода, глаза, головы, почки, печени, лимфатических узлов, легкого, ротовой полости, шеи, яичников, поджелудочной железы, предстательной железы, прямой кишки, желудка, яичек, горла и матки. Конкретные виды рака включают, но не ограничиваются указанным, злокачественное новообразование на поздней стадии, амилоидоз, нейробластому, менингиому, атипичную менингиому, гемангиоперицитому, множественные метастазы в мозг, мультиформную глиобластому, глиобластому, глиому ствола мозга, злокачественную опухоль мозга с неблагоприятным прогнозом, злокачественную глиому, рецидив злокачественной глиомы, анапластическую астроцитому, анапластическую олигодендроглиому, нейроэндокринную опухоль, ректальную аденокарциному, стадии С и Д по Дюку колоректального рака, нерезектабельную колоректальную карциному, метастатическую гепатоклеточную карциному, саркому Капоши, кариотипическую острую миелобластную лейкемию, лимфому Ходкина, лимфому типа нон-Ходкина, кожную Т-клеточную лимфому, кожную В-клеточную лимфому, диффузную крупноклеточную В-клеточную лимфому, фолликуликулярную лимфому низкой степени, метастатическую меланому, (локализованную меланому, включая, но не ограничиваясь указанным, глазную меланому), злокачественную мезотелиому, синдром плеврального выпота при злокачественной мезотелиоме, перитонеальную карциному, папиллярную серозную карциному, гинекологическую саркому, саркому мягких тканей, склеродермию, кожный васкулит, гистиоцитоз клеток Лангерганса, лейомиосаркому, оссифицирующую прогрессирующую фибродисплазию, гормоно-рефрактерный рак предстательной железы, саркому мягких тканей с высоким риском при резекции, нерезектабельную гепатоклеточную карциному, макроглобулинемию Вальденстрема, вялотекущую миелому, хроническую миелому, рак фаллопиевых труб, андроген-независимый рак предстательной железы, андроген-зависимый неметастатический рак предстательной железы IV стадии, гормонально-нечувствительный рак предстательной железы, не чувствительный к химиотерапии рак предстательной железы, папиллярную тироидную карциному, фолликулярную тироидную карциному, медуллярную тироидную карциному и лейомиому. В конкретном варианте осуществления рак является метастатическим. В другом варианте осуществления рак является трудно излечимым или устойчивым к химиотерапии или облучению; в частности трудно поддающийся лечению с помощью талидомида.
Как использовано в данном описании в отношении заболеваний и состояний, отличающихся от рака, термины «заболевания или нарушения, отличающиеся или характеризуемые нежелательным ангиогенезом», «заболевания или нарушения, связанные с нежелательным ангиогенезом» и «заболевания или нарушения, характеризуемые нежелательным ангиогенезом» относятся к заболеваниям, нарушениям и состояниям, которые вызваны, опосредованы или которым сопутствует неблагоприятный, нежелательный или неконтролируемый ангиогенез, включая, но не ограничиваясь указанными, воспалительные заболевания, аутоиммунные заболевания, генетические заболевания, аллергические заболевания, бактериальные заболевания, глазные неоваскулярные заболевания, хороидальные неоваскулярные заболевания и неоваскулярные заболевания сетчатки.
Примеры таких заболеваний или нарушений, связанных с нежелательным ангиогенезом, включают, но не ограничиваются указанными, эндометриоз, болезнь Крона, сердечную недостаточность, прогрессирующую сердечную недостаточность, почечную недостаточность, диабетическую ретинопатию, ретинопатию недоношенных, отторжение трансплантата роговицы, неоваскулярную глаукому, ретролентальную фиброплазию, пролиферативную витреоретинопатию, трахому, близорукость, ямки диска зрительного нерва, эпидемический кератоконъюнктивит, атопический кератит, поверхностный краевой кератит, сухой кератит птеригиум, синдром Шенгрена, красные угри, филектенулез, сифилис, липидную дегенерацию, бактериальную язву, грибковую язву, инфекцию вируса простого герпеса, инфекцию вируса опоясывающего герпеса, протозойную инфекцию, саркому Капоши, язву Морена, краевую дегенерацию Терриена, краевой кератолиз, ревматоидный артрит, системную волчанку, полиартрит, травму, саркоидоз Вегенера, склерит, синдром Стивена-Джонсона, перифигоидную радиальную кератотомию, серповидноклеточную анемию, саркоид, эластическую псевдоксантому, болезнь Пагета, венозную окклюзию, артериальную окклюзию, обструктивное заболевание каротидных артерий, хронический увеит, хронический витрит, болезнь Лима, болезнь Илза, болезнь Бекета, ретинит, хороидит, предполагаемый глазной синдром гистоплазмоза, болезнь Беста, болезнь Старгарта, промежуточный увеит, хроническое отслоение сетчатки, синдромы гипервязкости, токсоплазмоз, покраснение роговицы, саркоидоз, склероз, сориат, псориаз, первичный склерозирующий холангит, проктит, первичный желчный серроз, идиопатический легочный фиброз, алкогольный гепатит, эндотоксемию, синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, связанную со злокачественным новообразованием гиперкальцемию, циркуляторный шок, циркулирующий шок, периодонтит, гингивит, макроцитарную анемию, рефрактерную анемию, 5q-синдром и ветеринарное нарушение, вызванное вирусом кошачьего иммунодефицита, лошадиным вирусом инфекционной анемии, вирусом козлиного артрита, виснавирусом, маэдивирусом или лентивирусом.
В конкретных вариантах осуществления изобретения заболевания или нарушения, связанные с нежелательным ангиогенезом не включают застойную сердечную недостаточность, кардиомиопатию, отек легких, опосредованный эндотоксинами септический шок, острый вирусный миокардит, отторжение сердечного трансплантата, инфаркт миокарда, ВИЧ, гепатит, респираторный дистрес-синдром взрослых, рассасывание костей, хронические обструктивные заболевания легких, хронические воспалительные заболевания легких, дерматит, циститный фиброз, септический шок, сепсис, эндотоксический шок, гемодинамический шок, синдром сепсиса, постишемическое реперфузионное повреждение, фиброзное заболевание, кахексию, отторжение трансплантата, ревматоидный спондилит, остеопороз, язвенный колит, воспалительное заболевание кишечника, рассеянный склероз, системную красную волчанку, узловатую чешуйчатую эритему при проказе, радиационное повреждение, астму, гипероксидное альвеолярное повреждение, малярию, микробактериальную инфекцию и условно-патогенные инфекции, вызванные ВИЧ.
Данное изобретение охватывает способы лечения пациентов, которые ранее подвергались лечению по поводу рака, или заболеваний, или нарушений, связанных или характеризуемых нежелательным ангиогенезом, но которые не дают ответной реакции на стандартную терапию, а также тех пациентов, которые ранее не подвергались лечению. Изобретение также относится к способам лечения пациентов, не зависящим от возраста пациента, хотя некоторые заболевания или нарушения являются более обычными в определенных возрастных группах. Изобретение дополнительно относится к способам лечения пациентов, которые подвергались хирургическому вмешательству с целью излечить рассматриваемое заболевание или состояние, а также тех пациентов, которые не подвергались такому лечению. Поскольку пациенты, болеющие раком, или заболеваниями, или нарушениями, характеризуемыми нежелательным ангиогенезом, имеют разнообразные клинические проявления и различный клинический результат, лечение, даваемое пациенту может изменяться в зависимости от его/ее прогноза. Квалифицированный клиницист будет способен легко определить без чрезмерного экспериментирования конкретные вторичные агенты, тип хирургии и типы стандартной терапии не на основе лекарственных средств, которые можно эффективно использовать для лечения отдельного пациента, болеющего раком и другими заболеваниями или нарушениями.
Способы, охватываемые данным изобретением, включают введение одного или нескольких иммуномодулирующих соединений по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства пациенту (например, человеку), страдающему или возможно страдающему раком или заболеванием или нарушением, опосредованным неблагоприятным ангиогенезом.
В одном варианте осуществления изобретения иммуномодулирующее соединение по изобретению можно вводить перорально в виде одноразовой или раздельных дневных дозировок в количестве примерно от 0,10 до примерно 150 мг/день. В конкретном варианте осуществления 4-(амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-дион можно вводить в количестве примерно от 0,1 до примерно 1 мг в сутки или, альтернативно, через день в количестве примерно от 0,1 до примерно 5 мг. В предпочтительном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион можно вводить в количестве примерно от 1 до примерно 25 мг в сутки или, альтернативно, примерно от 10 до примерно 50 мг через день.
В конкретном варианте осуществления 4-(амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-дион можно вводить в количестве примерно 1, 2 или 5 мг в день пациентам с рецидивирующей множественной миеломой. В конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион можно вводить первоначально в количестве 1 мг/день и доза может повышаться каждую неделю до 10, 20, 25, 30 и 50 мг/день. В конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион можно вводить в количестве до 30 мг/день пациентам с плотными опухолями. В конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион можно вводить в количестве до 40 мг/день пациентам с глиомой.
В конкретном варианте осуществления 4-(амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-дион можно вводить в количестве от 0,1 до примерно 1 мг в день или, альтернативно, в количестве примерно от 0,1 до примерно 5 мг через день пациентам, имеющим заболевания или нарушения, связанные с нежелательным ангиогенезом или отличающиеся нежелательным ангиогенезом, включая, но не ограничиваясь указанным, эндотоксемию, синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарное нарушение, связанную со злокачественным новообразованием гиперкальцемию, инсульт, ишемический удар, периодонтит, гингивит, макроцитарную анемию, рефрактерную анемию и 5q-синдром.
В другом конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион можно вводить в количестве примерно от 1 до примерно 25 мг в сутки или, альтернативно, примерно от 10 до примерно 50 мг через день пациентам, имеющим заболевания или нарушения, связанные с нежелательным ангиогенезом или отличающиеся нежелательным ангиогенезом, включая, но не ограничиваясь указанным, эндотоксемию, синдром токсического шока, остеоартрит, репликацию ретровируса, истощение, менингит, индуцированный диоксидом кремния фиброз, индуцированный асбестом фиброз, ветеринарное нарушение, связанную со злокачественным новообразованием гиперкальцемию, инсульт, ишемический удар, периодонтит, гингивит, макроцитарную анемию, рефрактерную анемию и 5q-синдром.
5.3.1. Комбинированная терапия со вторым активным агентом
Конкретные способы изобретения включают введение иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства в сочетании с одним или несколькими другими активными агентами и/или в комбинации с лучевой терапией, переливаниями крови или хирургией. Примеры иммуномодулирующих соединений по изобретению приведены в данном описании (смотри, например, раздел 5.1). Примеры других активных агентов также приведены в данном описании (смотри, например, раздел 5.2).
Введение иммуномодулирующих соединений и других активных агентов пациенту можно проводить одновременно или последовательно с использованием одних и тех же или различных путей введения. Пригодность конкретного пути введения, используемого для конкретного активного агента, будет зависеть от самого активного агента (например, от того можно ли будет вводить его перорально без разложения перед поступлением в кровоток) и заболевания, подвергаемого лечению. Предпочтительным путем введения для иммуномодулирующего соединения по изобретению является пероральный. Предпочтительные пути введения других активных агентов или ингредиентов по изобретению известны специалистам в данной области. Смотри, например, Physician's Desk Reference, 1755-1760 (56th ed., 2002).
В одном варианте осуществления изобретения второй активный агент вводят внутривенно или подкожно и один или два раза в день в количестве примерно от 1 до примерно 1000 мг, примерно от 5 до примерно 500 мг, примерно от 10 до примерно 350 мг или примерно от 50 до примерно 200 мг. Конкретное количество второстепенного активного агента будет зависеть от конкретного используемого агента, типа заболевания, подвергаемого лечению или устранению, серьезности и стадии заболевания и количества иммуномодулирующих соединений по изобретению и любых необязательных дополнительных активных агентов, одновременно вводимых пациенту. В конкретном варианте осуществления второй активный агент представляет собой облимерзен (Genasense®), GM-CSF, G-CSF, EPO, таксотер, иринотекан, дакарбазин, трансретиноевую кислоту, топотекан, пентоксифиллин, ципрофлаксин, дексаметазон, винкристин, доксорубицин, ингибитор СОХ-2, IL2, IL8, IL18, IFN, Ara-C, винорелбин или их комбинацию.
В конкретном варианте осуществления GM-CSF, G-CSF или EPO вводят подкожно в течение примерно пяти дней в течение четырех или шестинедельного цикла в количестве примерно от 1 до примерно 750 мг/м2/день, предпочтительно в количестве примерно от 25 до примерно 500 мг/м2/день и наиболее предпочтительно в количестве примерно от 50 до примерно 200 мг/м2/день. В определенном варианте осуществления GM-CSF можно вводить в количестве примерно от 60 до примерно 500 мкг/м2 внутривенно в течение 2 часов или примерно от 5 до примерно 12 мкг/м2/день подкожно. В конкретном варианте осуществления G-CSF можно вводить подкожно в количестве примерно 1 мкг/кг/день первоначально и это количество можно регулировать в зависимости от общего количества гранулоцитов. Поддерживающую дозу G-CSF можно вводить в количестве примерно 300 (для небольших пациентов) или 480 мкг подкожно. В определенном варианте осуществления EPO можно вводить подкожно в количестве примерно 10000 Единиц 3 раза в неделю.
В другом варианте осуществления иммуномодулирующее соединение вводят в количестве примерно от 0,1 мг до примерно 150 мг/день по отдельности или в сочетании со вторым активным агентом пациентам с метастатической меланомой (локализованная меланома, включая, но не ограничиваясь указанным, глазную меланому). В одном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион в количестве примерно от 1 до примерно 25 мг/день и дакарбазин в количестве примерно от 200 до 1000 мг/м2/день вводят пациентам с метастатической или локализованной меланомой. В другом варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион в количестве примерно от 1 до примерно 25 мг/день и темозоломид вводят пациентам с метастатической или локализованной меланомой. В другом варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион в количестве примерно от 1 до примерно 25 мг/день вводят пациентам с метастатической или локализованной меланомой, заболевание у которых прогрессировало при лечении дакарбазином, IL-2 и/или IFN. В конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион вводят пациентам с рецидивирующей или рефрактерной множественной миеломой в количестве примерно 15 мг/день дважды в день или примерно 30 мг/день четыре раза в день в сочетании с дексаметазоном.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с мелфаланом и дексаметазоном пациентам с амилоидозом. В конкретном варианте осуществления иммуномодулирующее соединение и стероиды можно вводить пациентам с амилоидозом.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с гемцитабином и цисплатином пациентам с локальным на поздней стадии или метастатическим переходно-клеточным раком мочевого пузыря.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании со вторым следующим активным ингредиентом: темозоломид в случае педиатрических пациентов с рецидивирующими или прогрессирующими опухолями мозга или возвратной нейробластомой; целекоксиб, этопозид и циклофосфамид в случае рецидивирующего или прогрессирующего рака ЦНС; темодар в случае пациентов с рецидивирующей или прогрессирующей менингиомой, злокачественной менингиомой, гемангиоперицитомой, множественными метастазами в мозг, рецидивирующими опухолями мозга или вновь диагностированной мультиформенной глиобластомой; иринотекан в случае пациентов с возвратной глиобластомой; карбоплатин в случае педиатрических пациентов с глиомой мозгового ствола; прокарбазин в случае педиатрических пациентов с прогрессирующими злокачественными глиомами; циклофосфамид в случае пациентов с неутешительным прогнозом злокачественных опухолей мозга, вновь диагностированной или возвратной мультиформенной глиобластомой; Глиадель (Gliadel®) в случае высококачественных возвратных злокачественных глиом; темозоломид и тамоксифен в случае анапластической астроцитомы, или топотекан в случае глиом, глиобластомы, анапластической астроцитомы или анапластической олигодендроглиомы.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с метотрексатом и циклофосфамидом пациентам с метастатическим раком молочной железы.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с темозоломидом пациентам с нейроэндокринными опухолями.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с гемцитабином пациентам с возвратным или метастатическим раком головы или шеи. В другом варианте осуществления иммуномодулирующее соединение вводят вместе с гемцитабином пациентам с раком поджелудочной железы.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с раком прямой кишки в сочетании с Arisa®, таксолом и/или таксотером.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с капецитабином пациентам с рефрактерным колоректальным раком или пациентам, для которых терапия первой линии не удалась или оказалась неэффективной при аденокарциноме ободочной или прямой кишки.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с фторурацилом, лейковорином и иринотеканом пациентам с колоректальным раком стадии С и Д по Дюку или пациентам, которые прежде подвергались лечению метастатического колоректального рака.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с рефрактерным колоректальным раком в сочетании с капецитабином, кселодой и/или СРТ-11.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с капецитабином и иринотеканом пациентам с рефрактерным колоректальным раком или пациентам с нерезектабельной или метастатической колоректальной карциномой.
В другом варианте осуществления иммуномодулирующее соединение вводят само по себе или в сочетании с альфа-интерфероном или капецитабином пациентам с нерезектабельной или метастатической печеночно-клеточной карциномой; или вместе с цисплатином и тиотерой пациентам с первичным или метастатическим раком печени.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с пегилированным альфа-интерфероном пациентам с саркомой Капоши.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с флударабином, карбоплатином и/или топотеканом пациентам с рефрактерной, или рецидивирующей, или при высоком риске обострения миеломной лейкемии.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с липосомальным дунорубицином, топотеканом и/или цитарабином пациентам с неблагоприятной кариотипической острой миелобластной лейкемией.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с гемцитабином и иринотеканом пациентам с не мелкоклеточным раком легких. В одном варианте осуществления иммуномодулирующее соединение вводят в сочетании с карбоплатином и иринотеканом пациентам с немелкоклеточным раком легких. В одном варианте осуществления иммуномодулирующее соединение вводят вместе с доксетаксолом пациентам с немелкоклеточным раком легких, которые прежде подвергались лечению с использованием карбо/VP16 лучевой терапии.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с карбоплатином и/или таксотером или в сочетании с карбоплатином, пацилитакселем и/или грудной лучевой терапией пациентам с немелкоклеточным раком легких. В конкретном варианте осуществления иммуномодулирующее соединение вводят в сочетании с таксотером пациентам со стадией IIIB или IV немелкоклеточного рака легких.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с облимерсеном (Genasense®) пациентам с мелкоклеточным раком легких.
В другом варианте осуществления иммуномодулирующее соединение вводят само по себе или в сочетании со вторым активным ингредиентом, таким как винбластин или флударабин, пациентам с различными типами лимфомы, включая, но не ограничиваясь указанным, лимфому Ходкина, лимфому типа нон-Ходкина, кожную Т-клеточную лимфому, кожную В-клеточную лимфому, диффузную крупноклеточную В-клеточную лимфому или рецидивирующую или рефрактерную фолликулярную лимфому низкой степени.
В другом варианте осуществления иммуномодулирующее соединение вводят в сочетании с таксотером, IL-2, IFN, GM-CSF и/или дакарбазином пациентам с различными типами и стадиями меланомы.
В другом варианте осуществления иммуномодулирующее соединение вводят само по себе или в сочетании с винорелбином пациентам со злокачественной мезотелиомой или немелкоклеточным раком легких стадии IIIB с плевральными имплантатами или синдромом злокачественной плевральной эффузионной мезотелиомы.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями множественной миеломы в сочетании с дексаметазоном, золедроновой кислотой, палмитронатом, GM-CSF, биаксином, винбластином, мелфаланом, бузульфаном, циклофосфамидом, IFN, палмидронатом, преднизоном, бисфосфонатом, целекоксибом, триоксидом мышьяка, ПЭГ ИНТРОН-А, винкристином или их комбинацией.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с рецидивирующей или рефрактерной множественной миеломой в сочетании с доксорубицином (Doxil®), винкристином и/или дексаметазоном (Decadron®).
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями рака яичников, такого как перитонеальная карцинома, папиллярная серозная карцинома, рефрактерный рак яичников или рецидивирующий рак яичников, в сочетании с таксолом, карбоплатином, докосорубицином, гемцитабином, цисплатином, кселодой, паклитакселем, дексаметазоном или их комбинациями.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями рака предстательной железы в сочетании с кселодой, 5FU/LV, гемцитабином, иринотеканом плюс гемцитабин, циклофосфамидом, винкристином, дексаметазоном, GM-CSF, целекоксибом, таксотером, ганцикловиром, паклитакселем, адриамицином, доцетакселем, эстрамустином, эмцитом или их комбинациями.
В другом варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион вводят вместе с таксотером пациентам с раком предстательной железы.
В другом варианте осуществления 4-(амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-дион вводят вместе с GM-CSF пациентам с раком предстательной железы.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями почечно-клеточного рака в сочетании с капецитабином, IFN, тамоксифеном, IL-2, GM-CSF, Celebrex® или их комбинациями.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями гинекологического рака, саркомы матки или мягких тканей в сочетании с IFN, ингибитором СОХ-2, таким как Celebrex®, и/или сулиндаком.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам с различными типами или стадиями плотных опухолей в сочетании с целебрексом, этопозидом, циклофосфамидом, доцетакселем, IFN, тамоксифеном, IL-2, GM-CSF или их комбинациями.
В другом варианте осуществления иммуномодулирующее соединение вводят пациентам со склеродермой или кожным васкулитом в сочетании с целебрексом, этопозидом, циклофосфамидом, доцетакселем, апецитабином, IFN, тамоксифеном, IL-2, GM-CSF или их комбинациями.
Данное изобретение также относится к способу повышения дозировки противоракового лекарственного средства или агента, которое можно безопасно и эффективно вводить пациенту, который включает введение пациенту (например, человеку) иммуномодулирующего соединения по изобретению или его фармацевтически приемлемого производного, соли, сольвата, клатрата, гидрата или пролекарства. Пациенты, для которых данный способ может оказаться благоприятным, представляют собой тех, кто страдает от неблагоприятного действия, связанного с противораковыми лекарственными средствами для лечения специфического рака кожи, подкожной ткани, лимфатических узлов, мозга, легкого, костей, кишечника, прямой кишки, сердца, поджелудочной железы, надпочечников, почек, предстательной железы, молочной железы, ободочной и прямой кишки или их сочетаний. Введение иммуномодулирующего соединения по изобретению облегчает или уменьшает неблагоприятное действие, которое может быть столь серьезным, что могло бы в противном случае ограничивать количество противоракового лекарственного средства.
В одном варианте осуществления иммуномодулирующее соединение по изобретению можно вводить перорально и ежедневно в количестве примерно от 0,1 до примерно 150 мг и предпочтительно примерно от 1 до примерно 50 мг, более предпочтительно примерно от 2 до примерно 25 мг перед, во время и после появления неблагоприятного действия, связанного с введением противоракового средства пациенту. В конкретном варианте осуществления иммуномодулирующее соединение по изобретению вводят в сочетании со специфическими агентами, такими как гепарин, аспирин, коумадин или G-CSG для того, чтобы избежать действий, которые связаны с противораковыми лекарственными средствами, таких как нейтропения или тромбоцитопения.
В одном варианте осуществления иммуномодулирующее соединение по изобретению можно вводить пациентам с заболеваниями или нарушениями, связанными с или характеризуемыми нежелательным ангиогенезом в сочетании с дополнительными активными ингредиентами, включая, но не ограничиваясь указанным, противораковые лекарственные средства, противовоспалительные лекарственные средства, антигистамины, антибиотики и стероиды.
В другом варианте осуществления данное изобретение охватывает способ лечения, профилактики и/или оказания помощи больному раком, который включает введение иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства в сочетании с (например, до, во время или после) обычной терапии, включая, но не ограничиваясь указанным, хирургическое вмешательство, иммунотерапию, биологическую терапию, лучевую терапию или другую терапию не на основе лекарственных средств, используемую в настоящее время для лечения, профилактики и/или оказания помощи больному раком. Комбинированное применение иммуномодулирующих соединений по изобретению и обычной терапии может обеспечить уникальный терапевтический режим, который является неожиданно эффективным для некоторых пациентов. Не ограничиваясь теорией, предполагается, что иммуномодулирующие соединения по изобретению могут обеспечить аддитивное или синергистическое действие при одновременном применении вместе с обычной терапией.
В другом варианте осуществления данное изобретение охватывает способ лечения, профилактики и/или оказания помощи больному при заболеваниях и нарушениях, связанных или характеризуемых нежелательным ангиогенезом, который включает введение иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства в сочетании с (например, до, во время или после) обычной терапией, включая, но не ограничиваясь указанным, хирургическое вмешательство, иммунотерапию, биологическую терапию, лучевую терапию или другую терапию не на основе лекарственных средств, используемую в настоящее время для лечения, профилактики и/или оказания помощи больному при заболеваниях и нарушениях, связанных или характеризуемых нежелательным ангиогенезом. Комбинированное применение иммуномодулирующих соединений по изобретению и обычной терапии может обеспечить уникальный терапевтический режим, который является неожиданно эффективным для некоторых пациентов. Не ограничиваясь теорией, предполагается, что иммуномодулирующие соединения по изобретению могут обеспечить аддитивное или синергистическое действие при одновременном применении вместе с обычной терапией.
Как обсуждалось в других местах в данном описании, изобретение относится к способу снижения, лечения и/или профилактики неблагоприятных или нежелательных побочных действий, связанных с обычной терапией, включая, но не ограничиваясь указанным, хирургию, химиотерапию, лучевую терапию, гормональную терапию, биологическую терапию и иммунотерапию. Один или несколько иммуномодулирующих соединений по изобретению и другой активный ингредиент можно вводить пациенту до, во время или после появления неблагоприятного действия, связанного с обычной терапией.
В одном варианте осуществления иммуномодулирующее соединение по изобретению можно вводить в количестве примерно от 0,1 до примерно 150 мг и, предпочтительно, примерно от 1 до примерно 25 мг, более предпочтительно примерно от 2 до примерно 10 мг перорально и ежедневно, само по себе или в сочетании со вторым активным агентом, раскрытым в данном описании (смотри, например, раздел 5.2), перед, во время или после применения обычной терапии.
В конкретном варианте осуществления данного способа иммуномодулирующее соединение по изобретению и доксетаксол вводят пациентам с немелкоклеточным раком легких, которых предварительно лечили с использованием карбо/VP16 и лучевой терапии.
5.3.2. Применение с трансплантационной терапией
Соединения по изобретению можно использовать для снижения риска болезни трансплантат-против-хозяина (GVHD). Следовательно, изобретение относится к способу лечения, профилактики и поддержания состояния больного при раке, включающему введение иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства в сочетании с трансплантационной терапией.
Как будет очевидно специалисту в данной области, лечение рака часто зависит от стадий и механизмов заболевания. Например, поскольку неизбежная лейкемическая трансформация развивается на некоторых стадиях рака, может потребоваться трансплантация стволовых клеток периферической крови, препаратов гематопоэтических стволовых клеток или костного мозга. Комбинированное применение иммуномодулирующего соединения по изобретению и трансплантационной терапии обеспечивает уникальный и неожиданный синергизм. В частности, иммуномодулирующее соединение по изобретению проявляет иммуномодулирующую активность, которая может обеспечить дополнительные или синергистические действия при проведении одновременно с трансплантационной терапией у пациентов, страдающих раком.
Иммуномодулирующее соединение по изобретению может работать в сочетании с трансплантационной терапией, снижая осложнения, связанные с инвазивной процедурой трансплантации и риском GVHD. Данное изобретение относится к способу лечения, профилактики и поддержания состояния больного при раке, включающему введение пациенту (например, человеку) иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства до, во время или после трансплантации пуповинной крови, плацентарной крови, стволовых клеток периферической крови, препарата гематопоэтических стволовых клеток или костного мозга. Примеры стволовых клеток, подходящих для применения в способах изобретения, описаны в патентной заявке США № 10/411655, поданной 11 апреля 2003 г., R.Hariri и др., включенной в данное описание путем ссылки во всей своей полноте.
В другом варианте осуществления данное изобретение относится к способу лечения, профилактики и поддержания состояния больного при заболеваниях и нарушениях, связанных или характеризуемых нежелательным ангиогенезом, включающему введение пациенту (например, человеку) иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, клатрата или пролекарства до, во время или после трансплантации пуповинной крови, плацентарной крови, стволовых клеток периферической крови, препарата гематопоэтических стволовых клеток или костного мозга.
В одном варианте осуществления данного способа иммуномодулирующее соединение по изобретению вводят пациентам со множественной миеломой до, во время или после трансплантации аутогенных клеток-предшественников периферической крови.
В одном варианте осуществления данного способа иммуномодулирующее соединение по изобретению вводят пациентам с рецидивной множественной миеломой после трансплантации стволовых клеток.
В другом варианте осуществления иммуномодулирующее соединение и преднизон вводят в качестве поддерживающей терапии пациентам со множественной миеломой после трансплантации аутогенных стволовых клеток.
В другом варианте осуществления иммуномодулирующее соединение и дексаметазон вводят в качестве спасающей терапии для снижения риска после трансплантации пациентам со множественной миеломой.
В другом варианте осуществления иммуномодулирующее соединение и дексаметазон вводят в качестве поддерживающей терапии пациентам со множественной миеломой после трансплантации аутогенного костного мозга.
В другом варианте осуществления иммуномодулирующее соединение вводят после введения высокой дозы мелфалана и трансплантации аутогенных стволовых клеток пациентам с дающей ответную реакцию на химиотерапию множественной миеломой.
В другом варианте осуществления иммуномодулирующее соединение и ПЭГ ИНТРО-А вводят в качестве поддерживающей терапии пациентам со множественной миеломой после трансплантации CD34-отобранных периферических стволовых клеток.
В другом варианте осуществления иммуномодулирующее соединение вводят вместе с пост-трансплантационной объединенной химиотерапией пациентам со вновь диагностированной множественной миеломой для оценки анти-антиогенеза.
В другом варианте осуществления иммуномодулирующее соединение и дексаметазон вводят в качестве поддерживающей терапии после DCEP консолидации с последующим лечением высокими дозами мелфалана и трансплантацией стволовых клеток периферической крови пациентам со множественной миеломой в возрасте 65 лет и старше.
5.3.3. Циклическая терапия
В некоторых вариантах осуществления профилактические или терапевтические агенты по изобретению вводят пациенту циклически. Циклическая терапия включает введение активного агента в течение некоторого промежутка времени с последующим перерывом на некоторое время и повторением такого последующего введения. Циклическая терапия может снижать развитие устойчивости к одному или нескольким лекарственным препаратам, исключать или уменьшать побочное действие одного из лекарственных препаратов и/или повышать эффективность лечения.
Следовательно, в одном конкретном варианте осуществления изобретения иммуномодулирующее соединение по изобретению вводят ежедневно в виде одноразовой или раздельных дневных дозировок в течение четырех-шести недельного цикла с перерывом примерно в неделю или две недели. Изобретение дополнительно позволяет увеличивать частоту, число и продолжительность циклов дозировки. Таким образом, другой конкретный вариант осуществления изобретения охватывает введение иммуномодулирующего соединения по изобретению в течение большего количества циклов, чем обычно, когда его вводят по отдельности. Еще в одном конкретном варианте осуществления изобретения иммуномодулирующее соединение по изобретению вводят в течение большего числа циклов, чем то, которое типично вызывало бы доза-ограниченную токсичность для пациента, которому также не вводится второй активный ингредиент.
В одном варианте осуществления иммуномодулирующее соединение по изобретению вводят ежедневно и непрерывно в течение трех или четырех недель в дозе примерно от 0,1 до примерно 150 мг/день с последующим перерывом в течение от одной до двух недель. 4-(Амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-дион предпочтительно вводят ежедневно и непрерывно в первоначальной дозе от 0,1 до 5 мг/день с повышением дозировки (каждую неделю) до 1-10 мг/день до максимальной дозы в 50 мг/день в течение столь долгого промежутка времени, сколько будет переноситься лечение. В конкретном варианте осуществления 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион вводят в количестве примерно 1, 5, 10 или 25 мг/день, предпочтительно в количестве примерно 10 мг/день в течение трех-четырех недель с последующим перерывом в одну-две недели на протяжении четырех-шестинедельного цикла.
В одном варианте осуществления изобретения иммуномодулирующее соединение по изобретению и второй активный ингредиент вводят перорального, при этом введение иммуномодулирующего соединения по изобретению осуществляют за 30-60 минут перед введением второго активного ингредиента во время цикла из четырех-шести недель. В другом варианте осуществления изобретения комбинацию иммуномодулирующего соединения по изобретению и второго активного ингредиента вводят путем внутривенного вливания в течение примерно 90 минут в каждом цикле. В конкретном варианте осуществления один цикл включает введение от примерно 1 до примерно 25 мг/день 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-диона и примерно от 50 до примерно 200 мг/м2/день второго активного ингредиента ежедневно в течение трех-четырех недель с последующим перерывом на одну-две недели. В другом конкретном варианте осуществления каждый цикл включает введение примерно от 5 до примерно 10 мг/день 4-(амино)-2-(2,6-диоксо(3-пиперидил)изоиндолин-1,3-диона и примерно от 50 до примерно 200 мг/м2/день второго активного ингредиента ежедневно в течение трех-четырех недель с последующим перерывом на одну-две недели. Обычно число циклов, во время которых комбинаторное лечение вводят пациенту, будет составлять от примерно одного до примерно 24 циклов, более типично примерно от двух до примерно 16 циклов и еще более типично примерно от четырех до примерно трех циклов.
5.4. Фармацевтические композиции и препаративные лекарственные формы
Фармацевтические композиции можно использовать для получения отдельных единичных препаративных лекарственных форм. Фармацевтические композиции и препаративные лекарственные формы по изобретению включают иммуномодулирующее соединение по изобретению или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство. Фармацевтические композиции и препаративные лекарственные формы по изобретению могут дополнительно включать один или несколько эксципиентов.
Фармацевтические композиции и препаративные лекарственные формы по изобретению также могут включать один или несколько вторых активных ингредиентов. Следовательно, фармацевтические композиции и препаративные лекарственные формы по изобретению включают указанные в данном описании активные ингредиенты (например, иммуномодулирующее соединение и второй активный агент). Примеры необязательного второго, или дополнительного, активного ингредиента раскрыты в данном описании (смотри, например, раздел 5.2).
Единичные препаративные лекарственные формы по изобретению подходят для перорального, слизистого (например, назального, сублингвального, влагалищного, буккального или ректального), парентерального (например, подкожного, внутривенного, болюсной инъекции, внутримышечного или внутриартериального), наружного (например, глазные капли или другие офтальмологические препараты), трансдермального или чрезкожного введения пациенту. Примеры препаративных лекарственных форм включают, но не ограничиваются указанным: таблетки; каплеты; капсулы, такие как мягкие эластичные желатиновые капсулы; каше; троше; пастилки; дисперсии; суппозитории; порошки; аэрозоли (например, назальные спреи или ингаляторы); гели; жидкие лекарственные формы, подходящие для перорального или слизистого введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии масло-в-воде или жидкие эмульсии вода-в-масле), растворы и эликсиры; жидкие лекарственные формы, подходящие для парентерального введения пациенту; глазные капли или другие офтальмологические препараты, подходящие для наружного введения; и стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), влагосодержание которых может быть восстановлено для получения жидких препаративных лекарственных форм, подходящих для парентерального введения пациенту.
Состав, форма и тип препаративных лекарственных форм по изобретению обычно изменяются в зависимости от их применения. Например, препаративная лекарственная форма, используемая при лечении острых случаев заболевания, может содержать большие количества одного или нескольких активных ингредиентов, чем препаративная лекарственная форма, используемая при хроническом лечении одного и того же заболевания. Аналогично, парентеральная препаративная форма может содержать меньшие количества одного или нескольких активных агентов, чем включает пероральная препаративная лекарственная форма, используемая для лечения тех же заболеваний. Эти и другие аспекты, в которых конкретные препаративные лекарственные формы, охватываемые данным изобретением, будут изменяться от одной к другой легко будут очевидны для специалистов в данной области. Смотри, например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Типичные фармацевтические композиции и препаративные лекарственные формы включают один или несколько эксципиентов. Подходящие эксципиенты хорошо известны специалистам в области фармацевтики, и неограничивающие примеры подходящих эксципиентов приведены в данном описании. Является ли конкретный эксципиент подходящим для введения в фармацевтическую композицию или препаративную лекарственную форму будет зависеть от различных факторов, хорошо известных в данной области, включая, но не ограничиваясь указанным, способ, с помощью которого препаративная лекарственная форма будет вводиться пациенту. Например, пероральные препаративные лекарственные формы, такие как таблетки, могут содержать эксципиенты, не подходящие для применения в парентеральных препаративных лекарственных формах. Пригодность конкретного эксципиента также может зависеть от конкретных активных ингредиентов в препаративной лекарственной форме. Например, разложение некоторых активных ингредиентов может ускоряться некоторыми эксципиентами, такими как лактоза, или при действии воды. Активные ингредиенты, которые включают первичные или вторичные амины, особенно подвержены такому ускоренному разложению. Следовательно, данное изобретение охватывает фармацевтические композиции и препаративные лекарственные формы, которые содержат в незначительном количестве, если вообще содержат, лактозу и другие моно- и дисахариды. Как использовано в данном описании термин «не содержащий лактозы» означает, что количество присутствующей лактозы, если она вообще присутствует, является недостаточным для существенного увеличения скорости разрушения активного ингредиента.
Не содержащие лактозы композиции по изобретению могут включать эксципиенты, которые хорошо известны в данной области и перечислены, например, в U.S.Pharmacopea (USP) 25-NF20 (2002). Обычно не содержащие лактозы композиции включают активные ингредиенты, связующее вещество/наполнитель и лубрикант в фармацевтически совместимых и фармацевтически приемлемых количествах. Предпочтительные не содержащие лактозы препаративные лекарственные формы включают активные ингредиенты, микрокристаллическую целлюлозу, желатинизированный крахмал и стеарат магния.
Данное изобретение, кроме того, охватывает безводные фармацевтические композиции и препаративные лекарственные формы, включающие активные ингредиенты, поскольку вода может облегчать разрушение некоторых соединений. Например, добавление воды (например, 5%) широко принято в области фармацевтики в качестве средства симулирования продолжительного хранения с целью определения таких характеристик как период срока годности при хранении или стабильность препаратов во времени. Смотри, например, Jens T. Carstensen, Drug Stability: Principles & Practice, 2d. Ed., Marcel Dekker, NY, NY, 1995, pp.379-80. В сущности вода и тепло ускоряют разложение некоторых соединений. Таким образом влияние воды на препарат может иметь большое значение, поскольку влага и/или влажность обычно встречаются при производстве, обработке, упаковке, хранении, перевозке и применении препаратов.
Безводные фармацевтические композиции и препаративные формы по изобретению могут быть получены с использованием безводных или с низким содержанием влаги ингредиентов и условий низкой влажности или с низким содержанием влаги. Фармацевтические композиции и препаративные лекарственные формы, которые включают лактозу и по крайней мере один активный ингредиент, который включает первичный или вторичный амин, предпочтительно являются безводными, если ожидается заметный контакт с влагой или влажностью во время производства, упаковки и/или хранения.
Безводную фармацевтическую композицию следует получать и хранить таким образом, чтобы поддерживать ее безводный характер. Соответственно, безводные композиции предпочтительно упаковывают с использованием тех материалов, которые, как известно, предотвращают действие воды, так что они могут быть включены в наборы для подходящей технологии для получения лекарственного средства. Примеры подходящих упаковок включают, но не ограничиваются указанным, герметически закупоренные упаковки из фольги, пластики, контейнеры для одноразовой дозы (например, ампулы), блистерные упаковки и контурные упаковки для штучных изделий.
Изобретение, кроме того, охватывает фармацевтические композиции и препаративные лекарственные формы, которые включают одно или несколько соединений, которые снижают скорость разложения активного ингредиента. Такие соединения, которые упоминаются в данном описании как «стабилизаторы», включают, но не ограничиваются указанным, антиоксиданты, такие как аскорбиновая кислота, рН буферы или солевые буферы.
Как и количества и типы эксципиентов, количества и конкретные типы активных ингредиентов в препаративной форме могут изменяться в зависимости от таких факторов, но не ограничиваясь указанным, как путь введения пациенту. Однако типичные препаративные формы изобретения включают иммуномодулирующее соединение по изобретению или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство в количестве примерно от 0,10 до примерно 150 мг. Типичные препаративные лекарственные формы включают иммуномодулирующее соединение по изобретению или его фармацевтически приемлемую соль, сольват, гидрат, стереоизомер, клатрат или пролекарство в количестве примерно 0,1, 1, 2, 5, 7,5, 10, 12,5, 15, 17,5, 20, 25, 50, 100, 150 или 200 мг. В конкретном варианте осуществления предпочтительная препаративная лекарственная форма включает 4-(амино)-2-(2,6-диоксо-3-пиперидил)изоиндолин-1.3-дион в количестве примерно 1, 2, 5, 10, 25 или 50 мг. В конкретном варианте осуществления предпочтительная препаративная лекарственная форма включает 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион в количестве примерно 5, 10, 25 или 50 мг. Типичные препаративные лекарственные формы включают второй активный ингредиент в количестве примерно от 1 до примерно 1000 мг, примерно от 5 до примерно 500 мг, примерно от 10 до примерно 350 мг или примерно от 50 до примерно 200 мг. Конечно, конкретное количество противоракового лекарственного средства будет зависеть от конкретного используемого соединения, типа рака, подвергаемого лечению или сдерживанию, и количества(количеств) иммуномодулирующего соединения по изобретению и любых необязательных дополнительных активных агентов, одновременно вводимых пациенту.
5.4.1. Пероральные препаративные лекарственные формы
Фармацевтические композиции по изобретению, подходящие для перорального введения, могут быть представлены в виде дискретных препаративных лекарственных форм, таких как, но не ограничиваясь указанным, таблетки (например, жевательные таблетки), пилюли, капсулы и жидкости (например, ароматизированные сиропы). Такие препаративные лекарственные формы содержат предварительно определенные количества активных ингредиентов и могут быть получены с помощью фармацевтических методов, хорошо известных специалистам в данной области. Смотри, в общем виде, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton PA (1990).
Типичные препаративные пероральные лекарственные формы по изобретению получают путем объединения активных ингредиентов с получением однородной смеси вместе с по крайней мере одним эксципиентом в соответствии с обычными методами фармацевтического компаундирования. Эксципиенты могут иметь множество форм в зависимости от формы препарата, требуемой для введения. Например, эксципиенты, подходящие для применения в пероральных жидких или аэрозольных лекарственных формах включают, но не ограничиваются указанным, воду, гликоли, масла, спирты, ароматизаторы, консерванты и красители. Примеры эксципиентов, подходящих для применения в твердых препаративных пероральных лекарственных формах (например, порошки, таблетки, капсулы и пилюли) включают, но не ограничиваются указанным, крахмалы, сахара, микрокристаллическую целлюлозу, разбавители, гранулирующие агенты, лубриканты, связующие вещества и дезинтегрирующие агенты.
Благодаря легкости введения таблетки и капсулы представляют наиболее эффективные пероральные единичные лекарственные формы, и в этом случае используются твердые эксципиенты. При необходимости, таблетки могут быть покрыты оболочкой с использованием стандартных водных или неводных технологий. Такие препаративные лекарственные формы могут быть получены любым способом фармацевтики. Обычно фармацевтические композиции и препаративные лекарственные формы получают путем равномерного и тщательного перемешивания активных ингредиентов с жидкими носителями, тонкодисперсного измельчения твердых носителей, или обоих, а затем, при необходимости, придания продукту формы для желаемого внешнего вида.
Например, таблетка может быть получена путем прессования или формования. Прессованные таблетки могут быть получены путем прессования в подходящем устройстве активных ингредиентов в свободно-текущей форме, такой как порошки или гранулы, необязательно смешанных с эксципиентом. Формованные таблетки могут быть получены путем формования в специальном устройстве смеси порошкообразного соединения, увлажненного инертным жидким разбавителем.
Примеры эксципиентов, которые можно использовать в препаративных лекарственных формах по изобретению, включают, но не ограничиваются указанным, связующие вещества, наполнители, дезинтегрирующие агенты и смазочные вещества. Связующие вещества, подходящие для применения в фармацевтических композициях и препаративных лекарственных формах включают, но не ограничиваются указанным, кукурузный крахмал, картофельный крахмал или другие крахмалы, желатин, природные и синтетические камеди, такие как гуммиарабик, альгинат натрия, альгиновая кислота, другие альгинаты, порошкообразная трагакантовая камедь, гуаровая камедь, целлюлозу и ее производные (например, этилцелюлоза, ацетат целлюлозы, кальция карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу), поливинилпирролидон, метилцеллюлозу, желатинизированный крахмал, гидроксипропилметилцеллюлозу (например, №№ 2208, 2906, 2910), микрокристаллическую целлюлозу и их смеси.
Подходящие формы микрокристаллической целлюлозы включают, но не ограничиваются указанным, вещества, продаваемые как AVICEL-PH-101, AVICEL-PH-103, AVICEL-RC-581, AVICEL-PH-105 (доступны от FMC Corporation, American Viscose Division, Avisel Sales, Marcus Hook, PA) или их смеси. Конкретное связующее вещество представляет собой смесь микрокристаллической целлюлозы и карбоксиметилцеллюлозы натрия, продаваемой как AVICEL-RC-581. Подходящие безводные или имеющие низкую влажность эксципиенты или вспомогательные добавки включают AVICEL-PH-103ТМ и крахмал 1500 LM.
Примеры наполнителей, подходящих для применения в раскрытых в настоящем описании фармацевтических композициях и препаративных лекарственных формах, включают, но не ограничиваются указанным, тальк, карбонат кальция (например, гранулы или порошок), микрокристаллическую целлюлозу, порошкообразную целлюлозу, дектраны, каолин, маннит, кремниевую кислоту, сорбит, крахмал, желатинизированный крахмал и их смеси. Связующее вещество или наполнитель в фармацевтических композициях по изобретению обычно присутствует в количестве примерно от 50 до примерно 99 весовых процентов фармацевтической композиции или препаративной лекарственной формы.
Дезинтегрирующие агенты используются в композициях по изобретению для придания таблетке свойства разлагаться при действии водной окружающей среды. Таблетки, которые содержат слишком много дезинтегрирующего агента, могут разлагаться при хранении, тогда как те, которые содержат слишком мало дезинтегрирующего агента могут не разлагаться с желаемой скоростью или при желаемых условиях. Таким образом, для получения твердой пероральной лекарственной формы по изобретению следует использовать достаточное количество дезинтегрирующего агента, которое не слишком велико и не слишком мало для неблагоприятного высвобождения активных ингредиентов. Количество используемого дезинтегрирующего агента изменяется в зависимости от типа рецептур, и весьма очевидно для обычного специалиста в данной области. Типичные фармацевтические композиции включают примерно от 0,5 до примерно 15 весовых процентов дезинтегрирующего вещества, предпочтительно примерно от 1 до примерно 5 весовых процентов дезинтегрирующего вещества.
Дезинтегрирующие агенты, которые можно использовать в фармацевтических композициях и препаративных лекарственных формах по изобретению, включают, но не ограничиваются указанным, агар-агар, альгиновую кислоту, карбонат кальция, микрокристаллическую целлюлозу, кроскармеллозу натрия, кросповидон, полакрилин калия, крахмал-гликолят натрия, картофельный или тапиоковый крахмал, другие крахмалы, желатинизированный крахмал, другие крахмалы, глины, другие альгины, другие целлюлозы, камеди и их смеси.
Лубриканты (смазочные вещества), которые можно использовать в фармацевтических композициях и препаративных лекарственных формах по изобретению, включают, но не ограничиваются указанным, стеарат кальция, стеарат магния, минеральное масло, светлое минеральное масло, глицерин, сорбит, маннит, полиэтиленгликоль другие гликоли, стеариновую кислоту, лаурилсульфат натрия, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и рапсовое масло), стеарат цинка, этилолеат, этиллаурат, агар и их смеси. Дополнительные лубриканты включают, например, syloid силикагель (AEROSIL200, производимый W.R.Grace Co., Baltimore, MD), коагулированный аэрозоль синтетического диоксида кремния (производимый Degussa Co, Plano, TX), CAB-O-SIL (продукт пирогенного диоксида кремния, продаваемый Cabot Co., Boston, MA) и их смеси. Если они, в принципе, используются, лубриканты применяют в количестве менее примерно 1 весового процента фармацевтической композиции или препаративной лекарственной формы, в которые его вводят.
Предпочтительная твердая пероральная препаративная лекарственная форма по изобретению включает иммуномодулирующее соединение по изобретению, безводную лактозу, микрокристаллическую целлюлозу, поливинилпирролидон, стеариновую кислоту, коллоидный безводный диоксид кремния и желатин.
5.4.2. Препаративные лекарственные формы замедленного высвобождения
Активные ингредиенты по изобретению можно вводить средствами контролируемого высвобождения или с помощью устройств доставки, хорошо известных специалистам в данной области. Примеры включают, но не ограничиваются указанным, те, которые описаны в патентах США №№ 3845770, 3916899, 3536809, 3598123 и 4008719, 5674533, 5059595, 5591767, 4120548, 5073543, 5639476, 5354556 и 5733566, каждый из которых включен в данное описание путем ссылки. Такие препаративные лекарственные формы можно использовать для обеспечения медленного или контролируемого высвобождения одного или нескольких активных ингредиентов с использованием, например, гидроксипропилметилцеллюлозы, других полимерных матриц, гелей, проницаемых мембран, осмотических систем, многослойных покрытий, микрочастиц, липосомов, микросфер или их сочетания в различных пропорциях для обеспечения требуемого профиля высвобождения. Подходящие рецептуры контролируемого высвобождения, известные специалистам в данной области, включая указанные в данном описании, легко могут быть выбраны для применения с активными ингредиентами по изобретению. Таким образом, изобретение охватывает отдельные препаративные лекарственные формы, подходящие для перорального введения, такие как, но не ограничиваясь указанным, таблетки, капсулы, желатиновые капсулы и каплеты (таблетки в виде капсул), которые приспособлены для контролируемого высвобождения.
Все фармацевтические продукты контролируемого высвобождения имеют общую цель улучшения терапевтического эффекта лекарственного средства по сравнению с таковым, достигаемым с использованием их двойников с неконтролируемым высвобождением. Идеально применение оптимальным образом разработанного препарата контролируемого высвобождения в медицинском лечении отличается применением минимального количества лекарственного вещества для излечения или контролирования состояния в течение минимального количества времени. Преимущества препаратов контролируемого высвобождения включают более длительную активность лекарственного вещества, пониженную частоту дозировки и повышенное соответствие для пациента. Кроме того, препараты контролируемого высвобождения можно использовать для влияния на время начала действия или другие характеристики, такие как уровни в крови лекарственного средства, и таким образом оказывать влияние на появление побочных (например, неблагоприятных) действий.
Большинство препаратов контролируемого высвобождения разработано для первоначального высвобождения такого количества лекарственного средства (активного ингредиента), которое сразу производит желаемое терапевтическое действие и постепенно и непрерывно высвобождает другие количества лекарственного средства для поддержания данного уровня лекарственного или профилактического действия на протяжении продолжительного промежутка времени. Для поддержания данного постоянного уровня лекарственного средства в теле, лекарственное средство должно высвобождаться из препаративной лекарственной формы с такой скоростью, которая будет заменять количество лекарственного средства, которое метаболизирует и выводится из организма. Контролируемое высвобождение активного ингредиента можно стимулировать с помощью различных условий, включая, но не ограничиваясь указанным, рН, температуру, ферменты, воду или другие физиологические условия или соединения.
5.4.3. Парентеральные препаративные лекарственные формы.
Парентеральные препаративные лекарственные формы можно вводить пациентам с использованием различных путей, включая, но не ограничиваясь указанным, подкожный, внутривенный (включая болюсную инъекцию), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит природную защиту пациента против загрязняющих веществ, парентеральные препаративные лекарственные формы предпочтительно являются стерильными или способны подвергаться стерилизации перед введением пациенту. Примеры парентеральных препаративных лекарственных форм включают, но не ограничиваются указанным, готовые для инъекции растворы, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции, готовые для инъекции суспензии и эмульсии.
Подходящие носители, которые можно использовать для получения парентеральных лекарственных форм по изобретению, хорошо известны специалистам. Примеры включают, но не ограничиваются указанным, воду для инъекций USP; водные носители, такие как, но не ограничиваясь указанным, хлорид натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера с добавлением лактатов для инъекций; смешиваемые с водой носители, такие как, но не ограничиваясь указанным, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь указанным, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
Соединения, которые увеличивают растворимость одного или нескольких раскрытых в данном описании активных ингредиентов, также могут быть включены в состав парентеральных препаративных лекарственных форм по изобретению. Например, циклодекстрин и его производные можно использовать для повышения растворимости иммуномодулирующего соединения по изобретению и его производных. Смотри, например, патент США № 5134127, который включен в данное описание путем ссылки.
5.4.4. Наружные и чрезслизистые препаративные лекарственные формы
Местные и чрезслизистые препаративные лекарственные формы по изобретению включают, но не ограничиваются указанным, спреи, аэрозоли, растворы, эмульсии, суспензии, глазные капли или другие офтальмологические препараты, или другие формы, известные специалистам в данной области. Смотри, например, Remington's Pharmaceutical Sciences, 16-е и 18-е издание, Mack Publishing, Easton PA (1980 и 1990); и Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea &. Febiger, Philadelphia (1985). Препаративные лекарственные формы для лечения слизистых тканей в ротовой полости могут быть получены в виде полосканий для полости рта и гелей для полости рта.
Подходящие эксципиенты (например, носители и разбавители) и другие материалы, которые можно использовать для создания наружных и чрезслизистых препаративных лекарственных форм, охватываемых данным изобретением, хорошо известны специалистам в области фармацевтики, и их выбор зависит о конкретной ткани, на которую будут наносить данную фармацевтическую композицию или препаративную лекарственную форму. Учитывая это, типичные эксципиенты включают, но не ограничиваются указанным, воду, ацетон, этанол, этиленгликоль, пропиленгликоль бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их смеси, образующие растворы, эмульсии или гели, которые являются нетоксичными и фармацевтически приемлемыми. При желании к фармацевтическим композициям и препаративным лекарственным формам также могут быть добавлены увлажнители или увлажняющие агенты. Примеры таких дополнительных ингредиентов хорошо известны в данной области. Смотри, например, Remington's Pharmaceutical Sciences, 16-е и 18-е издание, Mack Publishing, Easton PA (1980 и 1990).
рН фармацевтической композиции или препаративной лекарственной формы также может быть отрегулировано для улучшения доставки одного или нескольких активных ингредиентов. Аналогично, полярность растворителя-носителя, его ионная сила или тоничность могут быть отрегулированы для улучшения доставки. Соединения, такие как стеараты, также могут быть добавлены к фармацевтическим композициям или препаративным лекарственным формам для изменения благоприятным образом гидрофильности или липофильности одного или нескольких активных ингредиентов таким образом, чтобы улучшить их доставку. В этом отношении стеараты могут служить в качестве липидного носителя для препаративной формы, в качестве эмульгирующего агента или поверхностно-активного вещества и в качестве усиливающего доставку или усиливающего проникновение агента. Различные соли, гидраты или сольваты активных ингредиентов можно использовать для дополнительного регулирования свойств полученной композиции.
5.4.5. Наборы
Обычно активные ингредиенты по изобретению предпочтительно не вводят пациенту в одно и тоже время или одним и тем же путем введения. Следовательно, данное изобретение относится к наборам, которые, при использовании лечащим врачом, могут упростить введение подходящих количеств активных ингредиентов пациенту.
Типичный набор по изобретению включает препаративную лекарственную форму иммуномодулирующего соединения по изобретению или его фармацевтически приемлемой соли, сольвата, гидрата, стереоизомера, пролекарства или клатрата. Наборы, охватываемые данным изобретением, могут также включать дополнительные активные ингредиенты, такие как облимерсен (Genasense®), мелфалан, G-CSF, GM-CSF, EPO, топотекан, дакарбазин, иринотекан, таксотер, IFN. Ингибитор СОХ-2, пентоксифиллин, ципрофлоксацин, дексаметазон, IL-2, IL-8, IL-18, Ara-C, винорелбин, изотретиноин, 13 цис-ретиноевую кислоту или их фармацевтически активный мутант или производное, или их комбинацию. Примеры дополнительных активных ингредиентов включают, но не ограничиваются указанным, те, которые раскрыты в данном описании (см., например, раздел 5.2).
Наборы по изобретению могут дополнительно включать устройства, которые используются для введения активных ингредиентов. Примеры таких устройств включают, но не ограничиваются указанным, шприцы, капельницы, пластыри и ингаляторы.
Наборы по изобретению могут дополнительно включать клетки или кровь для трансплантации, а также фармацевтически приемлемые носители, которые можно использовать для введения одного или нескольких активных ингредиентов. Например, если активный ингредиент обеспечен в твердом виде, содержание влаги в котором следует восстановить для парентерального введения, набор может включать герметически закупоренный контейнер с подходящим носителем, в котором активный ингредиент может быть растворен для образования не содержащего частиц стерильного раствора, подходящего для парентерального введения. Примеры фармацевтически приемлемых носителей включают, но не ограничиваются указанным: воду для инъекций USP; водные носители, такие как, но не ограничиваясь указанным, хлорид натрия для инъекций, раствор Рингера для инъекций, раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций и раствор Рингера с добавлением лактатов для инъекций; смешиваемые с водой носители такие как, но не ограничиваясь указанным, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные носители, такие как, но не ограничиваясь указанным, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат.
6. Примеры
Некоторые варианты осуществления изобретения проиллюстрированы следующими неограничивающими примерами.
6.1. Модулирование продуцирования цитокина
Для подкрепления клинической оценки иммуномодулирующего соединения по изобретению на людях был проведен ряд неклинических фармакологических и токсикологических исследований. Данные исследования были проведены в соответствии с международно принятыми указаниями плана исследования и в соответствии с требованиями практики квалифицированной лаборатории (Good Laboratory Practice, GLP), если не указано другого.
Исследовали ингибирование in vitro продуцирования TNF-α после LPS-стимуляции РВМС человека и цельной крови человека с помощью 4-(амино)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-диона, 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона и талидомида (Muller et al., Bioorg. Med.Chem.let. 9: 1625-1630, 1999). Величины IC50 для ингибирования продуцирования TNF-α после LPS-стимулирования для РВМС человека и цельной крови человека для 4-(амино)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-диона составляли ˜24нМ (6,55 нг/мл) и ˜25нМ (6,83 нг/мл), соответственно. Исследования in vitro предлагают профиль фармакологической активности 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона подобный, но по крайней мере в 200 раз более эффективный, чем профиль талидомида. Исследования in vitro также продемонстрировали, что концентрации 4-(амино)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-диона, равные 2,73 и 27,3 нг/мл (от 0,01 до 0,1 мкМ) приводят к 50% ингибированию пролиферации клеток MM.IS и HsSultan.
Величины IC50 для ингибирования продуцирования TNF-α после LPS-стимуляции для РВМС человека и цельной крови человека для 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона составляли ˜100нМ (25,9 нг/мл) и ˜480нМ (103,6 нг/мл), соответственно. Напротив, талидомид показал IC50, составляющую ˜194мкМ (50,2 мкг/мл) для ингибирования продуцирования TNF-α после LPS-стимуляции РВМС человека. Исследования in vitro предлагают профиль фармакологической активности 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона подобный, но от 50 до 2000 раз более эффективный, чем профиль талидомида. Было показано, что соединение приблизительно в 50-100 раз более активно, чем талидомид при стимулировании пролиферации Т-клеток после первичной индукции с помощью активации рецептора Т-клеток (TCR). 3-(4-Амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион также приблизительно от 50 до 100 раз более эффективен, чем талидомид при пополнении продуцирвоания IL-2 и IFN-γ после TCR-активации РВМС (IL-2) или Т-клеток (IFN-γ). Кроме того, 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион проявляет доза-зависимое ингибирование LPS-стимулированного продуцирования провоспалительных цитокинов TNF-α, IL-1β и IL-6 с помощью РВМС, в то время как он увеличивает продуцирование противовоспалительного цитокина IL-10.
6.2. Ингибирование пролиферации ММ клеток
Способность 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона и талидомида, для сравнения, влиять на пролиферацию ММ клеточных линий была изучена в исследовании in vitro. В качестве индикатора пролиферации клеток измеряли поглощение [3H]тимидина различными клеточными линиями ММ (MM.1S, Hs Sultan, U266 и RPMI-8226). Клетки инкубировали в присутствии соединений в течение 48 часов; [3H]тимидин включали в течение последних 8 часов периода инкубации. Добавление 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона к клеткам MM.1S и Hs Sultan приводило к 50%-ному ингибированию пролиферации клеток в концентрациях 0,4 мкм и 1 мкм, соответственно. Например, добавление талидомида в концентрациях вплоть до 100 мкм приводило только к 15%-ному и 20%-ному ингибированию пролиферации клеток MM.1S и Hs Sultan, соответственно. Эти данные суммированы на фиг.1.
6.3. Токсикологические исследования
Влияние 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона на сердечно-сосудистую и дыхательную функцию исследовали на анестезированных собаках. Использовали две группы собак Бигль (2/пол/группа). Одна группа получала только три дозы носителя, а другие получали три повышающихся дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона (2, 10 и 20 мг/кг). Во всех случаях, дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона или носителя последовательно вводили путем инфузии через яремную вену с разделяющими интервалами по крайней мере в 30 минут.
Сердечно-сосудистые и дыхательные изменения, индуцированные 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дионом являются минимальными при всех дозах по сравнению с контрольной группой носителя. Единственная статистически значимая разница между носителем и группой обработки заключается в небольшом увеличении артериального давления крови (от 94 мм рт.ст. до 101 мм рт.ст.) после введения 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона в низкой дозе. Данный эффект долится примерно 15 минут и не проявляется при более высоких дозах. Девиации в токе бедренной крови, дыхательных параметрах и интервалах Qtc являются общими как для контрольной группы, так и для групп обработки, и не могут рассматриваться как зависимые от обработки.
6.4. Циклическая терапия у пациентов
В конкретном варианте осуществления иммуномодулирующее соединение по изобретению циклически вводят пациентам, страдающим раком. Циклическая терапия включает введение первого агента в течение промежутка времени с последующим перерывом на некоторый промежуток времени и повторением такого последовательного введения. Циклическая терапия может снизить развитие устойчивости к одному или нескольким терапевтическим агентам, исключить или уменьшить побочное действие одного из лекарственных средств и/или улучшить эффективность лечения.
В конкретном варианте осуществления профилактические или терапевтические агенты вводят в течение цикла, составляющего от 4 до 6 недель, примерно один или дважды в день. Один цикл может включать введение терапевтического или профилактического агента от трех до четырех недель и по крайней мере неделю или две недели перерыва. Число циклов введения составляет примерно от одного примерно 24 циклов, более типично примерно от двух до примерно 16 циклов и более типично примерно от четырех до примерно восьми циклов.
Например, в цикле из четырех недель, в день 1, начинают введение 25 мг/день 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона. В день 22 введение соединения приостанавливают на неделю перерыва. В день 29 начинают введение 25 мг/день 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона.
6.5. Клинические исследования на пациентах
6.5.1. Лечение рецидивирующей множественной миеломы
4-(Амино)-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-дион (ActimidTM) вводили пациентам с рецидивирующей/не поддающейся лечению множественной миеломой. Исследование проводили в соответствии с практикой квалифицированной клиники. Пациенты имели возраст по крайней мере 18 лет, у них был поставлен диагноз множественной миеломы (с парабелком в сыворотке крови и/или моче) и их рассматривали как трудно поддающихся лечению после по крайней мере двух циклов лечения или у них наблюдался рецидив после двух циклов лечения.
Пациенты с прогрессирующим заболеванием при предшествующем режиме лечения в соответствии с критерием юго-западной онкологической группы рассматривали как не поддающиеся лечению. Рецидив после ремиссии определяли как > 25% увеличение М компонента относительно базовых уровней; повторное появление парабелка М, который ранее исчезал; или определенное увеличение размера и числа литических костных поражений, выявленных при рентгенографии. Предшествующая терапия пациентов могла включать талидомид, при условии, что они были способны переносить лечение. Для всех пациентов требовался статус нормы Зуброда (Zubrod) от 0 до 2.
4-(Амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-дион вводят пациентам в дозах 1, 2, 5 или 10 мг/сутки в течение до четырех недель; при каждом уровне дозировки три пациента первоначально вносятся в список. Дозирование осуществляют приблизительно в одно и то же время каждое утро; все дозы вводят на голодный желудок (пациенты не ели в течение, по крайней мере, двух часов перед дозированием и в течение двух часов после дозирования). Дозы 4-(амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-диона вводят по восходящей линии, так что пациенты в первой группе получают минимальную дозу 4-(амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-диона (1 мг/сутки) и повышение до следующего более высокого уровня дозировки проводят только после установления безопасности и переносимости настоящей дозы. Если один из трех пациентов при любом уровне дозировки ощущает доза-лимитирующую токсичность (DLT), трех дополнительных пациентов записывают в группу сданной дозой. Если ни один из трех дополнительный пациентов не испытывает DLT, проводят повышение до следующего уровня дозировки, повышение дозировки продолжают аналогичным образом до тех пор, пока не устанавливают MTD (максимально-переносимая доза) или максимальную дневную дозировку (10 мг/сутки). Однако если один из трех дополнительных введенных в состав группы пациентов испытывает DLT, доза MTD считается достигнутой. Если два или более из трех дополнительных введенных в состав группы пациентов испытывает DLT, предполагается, что доза MTD была превышена, то трех дополнительных пациентов вводят в состав группы на предшествующий уровень дозировки для подтверждения MTD. После того, как MTD была идентифицирована, четырех дополнительных пациентов вводят в состав группы при данном уровне дозировки, так что всего 10 пациентов получало MTD.
Пробы крови для анализа фармакокинетических параметров отбирают в день 1 и 28 в соответствии со следующим расписанием отбора проб: перед дозированием, через 0,25, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 4, 6, 8,10, 12, 18 и 24 часа после дозирования. Дополнительные пробы крови собирают при каждом еженедельном визите пациента для определения уровней 4-(амино-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-диона. Общую мочу также собирают и объединяют в соответствии со следующими временными интервалами после дозирования: 0-4, 4-8, 8-12 и 12-24 часа. Оценку безопасности проводят путем контролирования неблагоприятных случаев, жизненных признаков, ЭКГ, клинических лабораторных оценок (биохимия крови, гематология, фенотипирование лимфоцитов и анализ мочи) и физического осмотра в определенные моменты времени во время исследования.
Результаты промежуточного полученного фармакокинетического анализа после однократного и многократного введения 4-(амино-2-(2,6-диоксо-(3-пиперидил))изоиндолин-1,3-диона пациентам со множественной миеломой представлены ниже в таблицах 1 и 2. Данные результаты показывают, что 4-(амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-дион постоянно поглощается при всех уровнях дозировки у пациентов с рецидивирующей множественной миеломой. Максимальные концентрации в плазме крови наблюдались при занимающем срединное положение Тмакс между 2,5 и 2,8 часами после дозирования в день 1 и между 3 и 4 часами после дозирования в течение 4 недель. При всех дозах концентрации в плазме крови снижаются монофазным образом после достижения Смакс. Начало устранения фазы происходило между 3 и 10 часами после введения дозы в день 1 и на неделе 4, соответственно.
Эти данные также показывают, что после 4 недель введения дозировки 4-(амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-дион накапливается в небольшой степени (средние коэффициенты накопления составляют от ˜1,02 до 1,52 и от ˜0,94 до 1,62 для Смакс и AUC(0-τ) (площадь под кривой), соответственно. Это соответствовало почти доза-пропорциональному повышению для величин AUC(0-τ) и Смакс при повышении дозы. Пятикратно более высокая доза 4-(амино-2-(2,6-диоксо(3-пиперидил))изоиндолин-1,3-диона приводила к 3,2- и 2,2-кратному повышению Смакс в день 1 и неделю 4, соответственно. Аналогично, 5-кратное повышение уровня дозировки приводило к 3,6- и 2,3-кратному увеличению в AUC(0-τ) в день 1 и неделю 4, соответственно.
Фармакокинетические параметры АктимидаТМ (ActimidTM) у пациентов с рецидивирующей множественной миеломой
Фармакокинетические параметры АктимидаТМ (ActimidTM) после многократного перорального дозирования (дозы 1, 2 и 5 мг/день) у пациентов с рецидивирующей множественной миеломой
6.5.2. Лечение рецидивирующей множественной миеломы
Два клинических испытания фазы 1 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона проводили для идентификации максимально переносимой дозы (MTD) на пациентах с рефрактерной или рецидивирующей множественной миеломой. Данные исследования также характеризовали профиль безопасности 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона, когда повышающиеся дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона давали перорально в течение вплоть до 4 недель. Пациенты начинали лечение 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дионом при дозе 5 мг/день с последующим повышением до 10, 25 и 50 мг/день. Пациентов вносили в список на 28 дней при предписанной им дозе, при праве выбора продленного лечения для тех, кто не проявил прогрессирования заболевания или не ощущал доза-лимитирующей токсичности (DLT). Пациентов оценивали на неблагоприятные случаи при каждом визите пациента, и серьезность данных случаев классифицировали в соответствии с общими критериями токсичности Национального Института рака (NCI). Лечение пациентов приостанавливали, если для них наблюдалась DLT (степень 3 или большая негематологической или степень 4 гематологической токсичности).
В данном исследовании в группе использовали 27 пациентов. Все пациенты имели рецидив множественной миеломы и 18 (72%) не поддавались лечению с использованием спасающей терапии. Среди данных пациентов 15 человек перед лечением подверглись трансплантации аутогенных стволовых клеток, и 16 пациентов до этого лечили талидомидом. Среднее число предшествующих режимов составляло 3 (диапазон от 2 до 6).
Пробы крови и мочи собирали для анализа фармакокинетических параметров в дни 1 и 28. Пробы крови отбирали в соответствии со следующим расписанием отбора проб: перед дозированием, через 0,25, 0,5, 0,75, 1, 1,5, 2, 2,5, 3, 4, 6, 8,10, 12, 18 и 24 часа после дозирования. Кроме того, пробы крови собирают при каждом еженедельном визите пациента к врачу для определения уровней 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона. Общую мочу также собирают и объединяют в соответствии со следующими временными интервалами после дозирования: 0-4, 4-8, 8-12 и 12-24 часа. Ответную реакцию на лечение оценивали путем количественной оценки М-белка (с помощью иммуноэлектрофореза) в сыворотке и моче, собранной за 24 часа, при выведении креатинина и 24-часовых подсчетах белка, предпринятых для скрининга, базовой линии, в 2 и 4 недели и через месяц после (или при раннем прекращении). Отбор костного мозга и/или биопсию тканей также проводили в месяцы 3, 6 и 12, если концентрация парапротеина в сыворотке крови пациента или выделение белка в 24-часовой моче падало до следующего более низкого уровня, основываясь на критерии лучшей ответной реакции. Предварительные результаты для периода лечения в течение 28 дней суммированы ниже.
Предварительные фармакокинетические анализы на основании данных двух исследований показали, что величины AUC(0-τ) и Смакс увеличиваются пропорционально после однократной и многократной доз у пациентов со множественной миеломой (как было видно на здоровых добровольцах). Кроме того, не имелось доказательств накопления при многократном дозировании, поскольку однократная доза AUC(0-00) была сравнима с многократной дозой AUC(0-τ) после получения одинаковой дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона. Подобно исследованиям на здоровых добровольцах наблюдались двойные пики. Воздействие на пациентов со множественной миеломой проявлялось несколько более высоко на основании величин Смакс и AUC по сравнению со здоровыми мужчинами добровольцами, тогда как выведение у пациентов со множественной миеломой было ниже, чем у здоровых добровольцев, что соответствует их более слабой функции почек (вследствие как их возраста, так и заболевания). Наконец, период полураспада 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона у пациентов был короче, чем у здоровых добровольцев (в среднем 8 часов, колеблясь до 17 часов).
В данном исследовании первую группу из 3 пациентов обрабатывали в течение 28 дней при дозе 5 мг/день без какой-либо доза-ограничивающей токсичности (DLT). Вторую группу из 3 пациентов впоследствии подвергали лечению при дозе 10 мг/день. Пациенты второй группы с дозой 10 мг/день хорошо переносили 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион.
6.5.3. Лечение плотных опухолей
Исследование для 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона проводили для пациентов с различными типами плотных опухолей, включая метастатическую меланому (13), карциному поджелудочной железы (2) карциноидное неизвестное первичное новообразование (1), почечную карциному (1), карциному молочной железы (1) и NSCLC (2). Пациенты получали 5 мг/день 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона в течение семи дней и доза впоследствии повышалась каждые семь дней до 10 мг/день, 25 мг/день и 50 мг/день всего в течение 4 недель лечения. Пациенты, которые проявляли клиническое преимущество, продолжали лечение в качестве пациентов-кандидатов.
Для исследования первоначально отбирали 20 пациентов и впоследствии вносили изменения, включая 16 дополнительных пациентов (карцинома надпочечников, NSCLC, злокачественная мезотелиома, рак молочной железы, метастатическая меланома (8) почечно-клеточный рак (4) при более высокой дозе. 16 дополнительным пациентам давали ежедневно повышающиеся дозы, составляющие 25 мг/день, 50 мг/день, 75 мг/день, 100 мг/день, 125 мг/день и 150 мг/день в течение 6-недельного периода при продолжающемся лечении в течение дополнительных шести недель.
Исследование фазы 1 проводили для определения максимально переносимой дозы (MTD) 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона у пациентов с рефрактерными плотными опухолями и/или лимфомой, а также для того, чтобы охарактеризовать фармакокинетические профили и профили побочных действий 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона у данной популяции пациентов. Разработанная схема исследования предполагала, что, по крайней мере, 3 пациента должны быть включены в группу при данном уровне дозировки, и их лечение должно быть проведено полностью в течение 28 дней, перед тем как включать пациентов в группы со следующим более высоким уровнем дозировки. Пациенты в первой группе начинали получать 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион при дозе 5 мг/день. Дозировку у пациентов повышали до 10, 20, 25 и 30 мг/день при условии, что здесь не наблюдалось токсичности.
В данном исследовании MTD определяли как наиболее высокий уровень дозировки, при котором менее двух из шести подвергающихся лечению пациентов не проявляло степени 3 и более высокой негематологической токсичности или степени 4 или выше гематологической токсичности. Если, при любом данном уровне дозировки в каждом исследовании для одного из трех пациентов проявлялась токсичность, трех дополнительных пациентов следовало подвергать лечению при данной конкретной дозе. Если, однако, для двух из шести пациентов наблюдалась DLT, считали, что MTD было превышено. Дополнительного повышения дозировки не проводили, и дополнительных пациентов следует включать в список на предшествующем уровне дозировки. Дозу вводимого 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона повышают до тех пор, пока не достигается MTD или до получения максимальной суточной дозы.
В первоначальной группе из 20 пациентов, занесенных в список для данного исследования, о DLT не сообщалось. Тринадцать из первоначальных 20 пациентов, наряду с 2 не входящими в исследование пациентами, продолжали исследование как пациенты-кандидаты при дозах вплоть до 150 мг/день.
6.5.4. Лечение глиом
Лечение проводили для определения токсичности для пациентов с рецидивными глиомами высокой степени. Исследование было разработано таким образом, что пациенты получали повышающиеся более высокие дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона до тех пор, пока не устанавливали максимально переносимую дозу (MTD). В исследовании также предпринимается попытка получить предварительную информацию о токсичности и фармакокинетических данных для 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона, а также разработать исследовательские данные, касающиеся заменяющих концевых точек ангиогенной активности in vivo c использованием функциональных нейро-отображающих исследований и in vitro анализа ангиогенных пептидов в сыворотке крови.
Пациенты, приписанные к первой группе, получали 2,5 мг/м2/день в течение 4-недельного цикла. Во время каждого 4-недельного цикла лечения, 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион вводили один раз в день в течение 3 недель с последующей одной неделей отдыха. Пациенты, которые завершили цикл лечения, могут получить другой цикл лечения с использованием 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона, если они отвечают двум критериям. Во-первых, пациенты должны иметь стабильные заболевания или проявлять частичную ответную реакцию или полную ответную реакцию, или пациент должен получать преимущество от терапии с использованием 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона, что подтверждается уменьшением относящихся к опухоли симптомов, таких как нейрологический дефицит. Во-вторых, пациент должен восстанавливаться от токсичности, связанной с 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дионом, которая возникает в предшествующем цикле на 42 день или раньше (28-дневный цикл плюс 2 недельный лимит для восстановления), что подтверждается возвращением к степени уровня токсичности ≤ 1. Для пациентов, которые проявили DLT на предшествующем цикле, их доза должна быть модифицирована. DLT определяют как негематологический случай токсичности степени ≥ 3 или гематологический случай токсичности степени 4, несмотря на то, что он относится к исследователькому лечению. Пациентов, которые проявили DLT в первом цикле и не давали ответной реакции на лечение, удаляют из исследования.
Дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона впоследствии повышали до 5, 8, 11, 15 и 20 мг/м2/день до максимальной общей дневной дозы, составляющей 40 мг. Пациенты продолжали получать 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дион в течение 4-недельного цикла на уровень дозировки до тех пор, пока не наблюдался один из критериев исключения исследования.
Трех пациентов включали в состав каждой группы. Если наблюдался по крайней мере один случай DLT, в группу добавляли трех дополнительных пациентов на данном конкретном уровне дозировки. Если наблюдалось два случая DLT, MTD, определенная при дозе, при которой меньше чем одна треть пациентов при каждом уровне дозировки проявляет DLT, была превышена, и четырех дополнительных пациентов подвергали лечению на прежнем уровне дозировки.
Пациентов, для которых наблюдалась DLT в течение первого 4-недельного цикла, удаляли из данного исследования, за исключением случаев, когда они проявляли ответную реакцию на лечение. Для пациентов, которые завершили первый 4-недельный цикл без DLT, но которые впоследствии проявили степень 3 или 4 гематологической и/или негематологической токсичности, лечение приостанавливали минимум на неделю. Если токсичность рассматривается как < степени 2 в течение трех недель, пациент получает лечение при двух уровнях дозировки, более низких, чем доза, которая вызывала токсичность (или при 50% снижении дозировки, если пациента подвергали лечению при первом или втором уровне дозировки). Пациентов, у которых токсичность степени 3 или 4 не проявлялась < стадии 1 в течение трех недель, или у тех, которые проявляли другую токсичность стадии 3 при пониженном уровне дозировки, удаляли из данного исследования.
Фармакокинетический отбор проб проводили перед введением первой дозы 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона (день 1) и через 0,5, 1, 2, 4, 6, 8, 24 и 48 часов после этого. Отбор образцов также проводили перед введением дозы в дни 7 и 21 и через 0,5, 1, 2, 4, 6, 8 и 24 часа после введения дозы в день 21 для оценки установившихся уровней 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-диона.
6.5.5. Лечение метастатической меланомы
Пациентам с метастатической меланомой лечение 3-(4-амино-1-оксо-1,3-дигидро-изоиндол-2-ил)пиперидин-2,6-дионом начинали при дозе 5 мг/день в течение семи дней. Затем дозу повышали каждые семь дней до 10 мг/день, 25 мг/день и 50 мг/день, соответственно, всего в течение четырех недель лечения. Пять из 13 пациентов с меланомой, которых лечили при данном режиме продемонстрировали или стабилизацию заболевания, или частичную ответную реакцию в первые четыре недели лечения. Ответная реакция опухоли была видна в кожном и подкожном поражениях (пять пациентов), лимфатических узлах (два пациента) и печени (один пациент). Продолжительность ответной реакции составляла приблизительно шесть месяцев. Результаты позволяют предположить, что соединение является обещающим новым противораковым агентом и обладает как антиангиогенными, так и иммуномодулирующими свойствами.
6.5.6. Лечение рецидивирующей или рефрактерной множественной миеломы
Пациентов с рецидивирующей или рефрактерной множественной миеломой Дюна-Сальмона стадии III, которые или не смогли выдержать три предшествующих режима лечения или имели плохой статус исполнения, нейтропению или тромбоцитопению, лечили с использованием вплоть до четырех циклов с использованием комбинации мелфалана (50 мг внутривенно), иммуномодулирующего соединения по изобретению (примерно от 1 до 150 мг перорально ежедневно) и дексаметазона (40 мг/день перорально в дни с 1 по 4) в каждые четыре недели из шести. Поддерживающую терапию, состоящую из ежедневного приема иммуномодулирующего соединения по изобретению и ежемесячного приема дексаметазона продолжали до прогрессирования заболевания. Терапия с использованием иммуномодулирующего соединения по изобретению в сочетании с мелфаланом и дексаметазоном является высоко эффективной и обычно переносится пациентами со множественной миеломой после предшествующего тяжелого лечения, прогноз для которых в противном случае является неблагоприятным.
Описанные выше варианты осуществления изобретения следует рассматривать как только иллюстративные, и специалистам в данной области должно стать очевидно, или они смогут установить, не используя ничего, кроме простого экспериментирования, многочисленные эквиваленты конкретных соединений, веществ и способов. Все такие эквиваленты рассматриваются как входящие в объем изобретения и охватываются прилагаемой формулой изобретения.
Изобретение относится к медицине и может быть использовано для лечения различных онкологических заболеваний. Предложены фармацевтические композиции в твердой форме, включающие иммуномодулирующее соединение, а именно 3-(4-амино-1-оксо-1,3-дигидроизоиндол-2-ил)пиперидин-2,6-дион. Композиции характеризуются многообразными модификациями кристаллической решетки данного иммуномодулирующего соединения. Изобретение позволяет обеспечить стабильность кристаллического состояния содержащегося в фармацевтических композициях иммуномодулятора в процессе изготовления и хранения лекарственных форм наряду с хорошей растворимостью в водной среде. 8 н. и 26 з.п. ф-лы, 2 табл., 1 ил.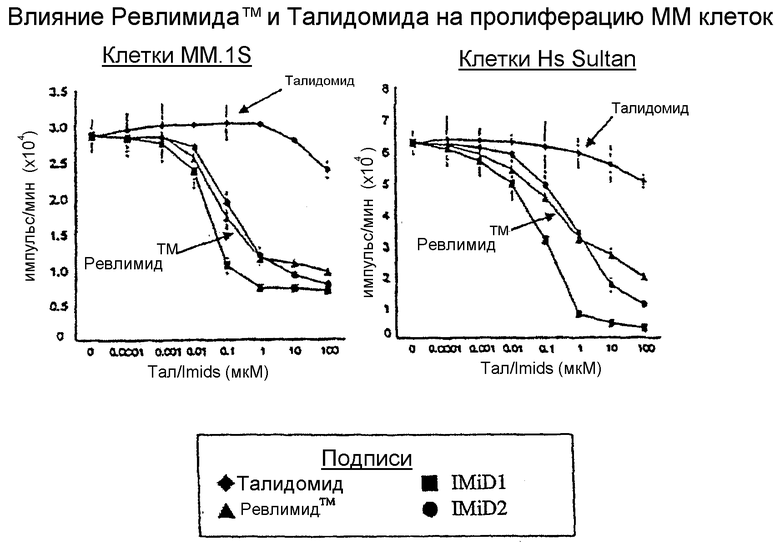
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ЗАМЕЩЕННЫЕ 2,6-ДИОКСОПИПЕРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ СНИЖЕНИЯ УРОВНЕЙ TNF-α | 1997 |
|
RU2177944C2 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Справочник по онкологии | |||
| /Под ред | |||
| д.м.н | |||
| Б.Е.ПЕТЕРСОНА | |||
| - М.: Медицина, 1964, см | |||
| Способ и прибор для акустического исследования земных напластований | 1923 |
|
SU488A1 |
| КУЛЬМАН А.Г | |||
| Общая химия | |||
| Учебник | |||
| - М.: Изд-во сельскохозяйственной литературы, журналов и | |||
Авторы
Даты
2009-03-10—Публикация
2004-05-05—Подача