[001] Настоящая заявка представляет собой международную заявку и испрашивает преимущество и приоритет на основании предварительной заявки на патент США №61/979351, поданной 14 апреля 2014 года, озаглавленной «МОДУЛЯТОРЫ ПРОТЕОЛИЗА НА ОСНОВЕ ИМИДОВ И СПОСОБЫ, СВЯЗАННЫЕ С ИХ ПРИМЕНЕНИЕМ» («IMIDE-BASED MODULATORS OF PROTEOLYSIS AND ASSOCIATED METHODS OF USE»), содержание которой включено в настоящую заявку во всей полноте посредством ссылки.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
[002] В соответствии с параграфом 1.52(е) раздела 37 Свода правил США совместно с настоящей заявкой подана информация о перечне последовательностей в машиночитаемой форме в формате.txt, название файла: Sequence_Listing_ST25.txt, размер 2 кБ; создан: 14 апреля 2015 года с использованием PatantIn-3.5, содержание которого включено в настоящую заявку во всей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[003] В настоящем описании предложены соединения на основе имидов, включая бифункциональные соединения, содержащие имидные группы, и способы их применения. Указанные бифункциональные соединения можно применять в качестве модуляторов направленного убиквитинирования, в частности в отношении различных полипептидов и других белков, которые разрушаются и/или иным образом ингибируются под действием бифункциональных соединений согласно настоящему изобретению.
УРОВЕНЬ ТЕХНИКИ
[004] Большинство низкомолекулярных лекарственных средств связывает ферменты или рецепторы в узких и вполне определенных карманах. С другой стороны, общеизвестно, что при помощи малых молекул трудно направленно воздействовать на белок-белковые взаимодействия, так как белки имеют большую площадь контакта и полые «канавки» или плоские поверхности. Е3 убиквитин-лигазы (сотни которых изучены у человека) придают субстрату специфичность к убиквитинированию и, таким образом, являются более привлекательными терапевтическими мишенями по сравнению с традиционными ингибиторами протеасом благодаря своей специфичности в отношении определенных белковых субстратов. Разработка лигандов Е3 лигаз, как было показано, является непростой задачей, отчасти из-за того, что они должны препятствовать белок-белковым взаимодействиям. Тем не менее, недавно были предложены специфические лиганды, которые связываются с указанными лигазами. Например, со времен открытия нутлинов - первых низкомолекулярных ингибиторов Е3 лигаз - были описаны дополнительные соединения, которые направленно действуют на Е3 лигазы, но данная область остается недостаточно исследованной.
[005] Одной из Е3 лигаз, обладающих терапевтическим потенциалом, является супрессор опухоли фон Хиппеля-Линдау (VHL). VHL содержит комплекс VCB субъединицы, распознающей субстрат/Е3 лигазы, который включает элонгины В и С, и комплекс, включающий куллин-2 и Rbx1. Первичным субстратом VHL является фактор, индуцируемый при гипоксии, 1α (HIF-1α), фактор транскрипции, который повышает регуляцию генов, таких как проангиогенный фактор роста VEGF, и красных кровяных телец, таких как цитокин эритропоэтин, в ответ на низкий уровень кислорода. Авторы настоящего изобретения создали первые низкомолекулярные лиганды фон Хиппеля-Линдау (VHL) для субстрат-распознающей субъединицы Е3 лигазы, VCB, которая является важной мишенью при раке, хронической анемии и ишемии2, и получили кристаллические структуры, при помощи которых подтвердили, что указанное соединение имитирует режим связывания фактора транскрипции HIF-1α, основного субстрата VHL.
[006] Цереблон представляет собой белок, который кодируется геном CRBN у человека. Ортологи CRBN сохранились в высококонсервативной форме у организмов от растений до человека, что подчеркивает их физиологическую значимость. Цереблон образует комплекс Е3 убиквитин-лигазы с белком 1, связывающим поврежденную ДНК (DDB1), куллином-4А (CUL4A) и регулятором куллинов 1 (ROC1). Указанный комплекс убиквитинирует различные другие белки. Несмотря на то, что механизм до конца не выяснен, убиквитинирование белковых мишеней цереблоном приводит к повышению уровня фактора роста фибробластов 8 (FGF8) и фактора роста фибробластов 10 (FGF10). FGF8, в свою очередь, регулирует ряд процессов развития, таких как образование конечностей и статоакустического пузырька. Указанный комплекс убиквитин-лигазы в конечном счете важен для роста конечностей у эмбриона. В отсутствие цереблона DDB1 образует комплекс с DDB2, который функционирует как белок, связывающийся с поврежденной ДНК.
[007] Талидомид, который был одобрен для лечения различных иммунологических показаний, также был одобрен для лечения некоторых неопластических заболеваний, включая множественную миелому. В настоящее время также проходят исследования применения талидомида и некоторых его аналогов для лечения различных других типов рака помимо множественной миеломы. Несмотря на то, что точный механизм противоопухолевой активности талидомида до конца еще не выяснен, известно, что он подавляет ангиогенез. Недавние работы, в которых обсуждается биология имидов, включают Lu et al Science 343, 305 (2014), и Krönke et al Science 343, 301 (2014).
[008] Важно отметить, что, как известно, талидомид и его аналоги, например, помалидомид и леналидомид, связывают цереблон. Указанные агенты связываются с цереблоном, изменяя специфичность указанного комплекса с индуцированием убиквитинирования и разложения факторов транскрипции Ikaros (IKZF1) и Aiolos (IKZF3), играющих ключевую роль в развитии множественной миеломы. Действительно, повышенную экспрессию цереблона связывают с увеличением эффективности имидных лекарственных средств для лечения множественной миеломы.
[009] В данной области техники сохраняется необходимость в эффективных способах лечения заболеваний, в частности гиперплазии и раковых заболеваний, таких как множественная миелома. Тем не менее, неспецифическое действие и невозможность направленного действия и модуляции определенных классов белков, таких как факторы транскрипции, по-прежнему затрудняют создание эффективных противораковых агентов. Таким образом, весьма ценными были бы низкомолекулярные терапевтические агенты, которые повышают или усиливают специфичность цереблона к субстрату и, в то же время, могут быть адаптированы для нацеливания и специфичного модулирования широкого диапазона различных классов белков.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] В настоящем изобретении описаны бифункциональные соединения, которые обеспечивают рекрутинг эндогенных белков к убиквитин-лигазе Е3 для их разрушения, и способы их применения. В частности, в настоящем изобретении предложены бифункциональные или направленно воздействующие на протеолиз химерные соединения (PROTAC), которые можно применять в качестве модуляторов направленного убиквитинирования различных полипептидов и других белков, которые затем разрушаются и/или иным образом ингибируются под действием бифункциональных соединений, описанных в настоящей заявке. Преимущество соединений, предложенных в настоящем описании, заключается в обеспечении широкого диапазона фармакологической активности, согласующегося с разрушением/ингибированием полипептидных мишеней, которые могут принадлежать практически к любому классу или семейству белков. Кроме того, в описании предложены способы применения эффективного количества соединений, описанных в настоящей заявке, для лечения или ослабления болезненного состояния, такого как рак, например множественная миелома.
[0011] Таким образом, согласно одному из аспектов в изобретении предложены новые соединения на основе имида, такие как описано в настоящей заявке.
[0012] Согласно дополнительному аспекту в изобретении предложены бифункциональные соединения или PROTAC, которые содержат фрагмент, связывающий Е3 убиквитин-лигазу (т.е. лиганд Е3 убиквитин-лигазы или группу «ULM»), и фрагмент, связывающий белковую мишень (т.е. лиганд, нацеливающий на белок/полипептид, или группу «PTM»), такой, что целевой белок/полипептид расположен поблизости от убиквитин-лигазы для обеспечения разрушения (и ингибирования) указанного белка. В предпочтительном варианте реализации ULM представляет собой фрагмент, связывающий цереблон убиквитин-лигазу Е3, (т.е. «CLM»). Например, структура бифункционального соединения может быть изображена как:
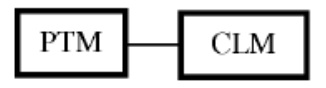
[0013] Соответствующее расположение фрагментов PTM и CLM, а также их количество, проиллюстрированное в настоящем описании, предложено исключительно в качестве примера и не ограничивает соединения каким-либо образом. Специалистам в данной области техники будет понятно, что бифункциональные соединения, такие как описано в настоящей заявке, можно синтезировать, и, таким образом, при желании можно изменять количество и расположение соответствующих функциональных фрагментов.
[0014] В определенных вариантах реализации бифункциональное соединение дополнительно содержит химический линкер («L»). В указанном примере структура бифункционального соединения может быть изображена как:
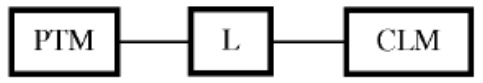
где PTM представляет собой фрагмент, нацеливающий на белок/полипептид, L представляет собой линкер, и CLM представляет собой фрагмент, связывающий цереблон убиквитин-лигазу Е3.
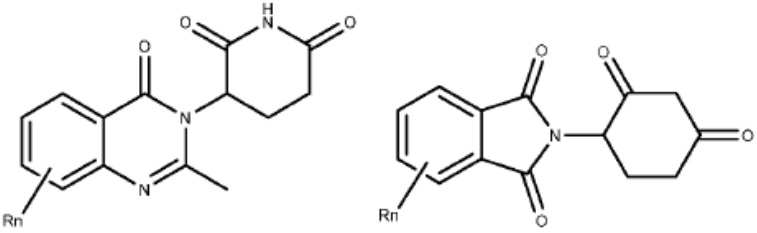
[0015] В определенных предпочтительных вариантах реализации Е3 убиквитин-лигаза представляет собой цереблон. Таким образом, в определенных дополнительных вариантах реализации CLM в бифункциональном соединении содержит химические группы, такие фрагменты на основе имида, амида, тиоамида, тиоимида. В дополнительных вариантах реализации CLM содержит фталимидогруппу или ее аналог или производное. В дополнительных вариантах реализации CLM содержит фталимидоглутарамидную группу или ее аналог или производное. В других вариантах реализации CLM содержит член группы, состоящей из талидомида, леналидомида, помалидомида и их аналогов или производных.
[0016] В определенных вариантах реализации соединения, описанные в настоящей заявке, содержат несколько CLM, несколько PTM, несколько химических линкеров или их комбинацию.
[0017] Согласно дополнительному аспекту в изобретении предложены терапевтические композиции, содержащие эффективное количество соединения, описанного в настоящей заявке, или его солевой формы и фармацевтически приемлемый носитель. Терапевтические композиции модулируют разрушение белка у пациента или субъекта, например, у животного, такого как человек, и их можно применять для лечения или ослабления заболеваний или болезненных состояний, которые модулируются посредством разрушаемого белка. В определенных вариантах реализации терапевтические композиции, такие как описано в настоящей заявке, можно применять для разрушения указанных белков для лечения или ослабления заболевания, например, рака. Согласно другому аспекту в настоящем изобретении предложен способ убиквитинирования/разрушения белковой мишени в клетке. Согласно определенным вариантам реализации способ включает введение бифункционального соединения, такого как описано в настоящей заявке, содержащего CLM и PTM, предпочтительно соединенных друг с другом посредством линкерного фрагмента, что также описано в настоящей заявке, где CLM присоединен к PTM, и CLM распознает белок пути убиквитина (например, убиквитин-лигазу, предпочтительно Е3 убиквитин-лигазу, такую как, например, цереблон), и PTM распознает белковую мишень, и при этом при размещении белковой мишени поблизости от убиквитин-лигазы происходит разрушение белковой мишени, что, таким образом, приводит к разрушению/подавлению действия белковой мишени и контролированию уровня белка. Контролирование уровня белка, достигаемое согласно настоящему изобретению, обеспечивает способ лечения заболевания или болезненного состояния, которое модулируется посредством белковой мишени, за счет снижения уровня указанного белка в клетках пациента.
[0018] Согласно дополнительному аспекту в изобретении предложен способ оценки (т.е. определения и/или измерения) аффинности связывания CLM. В определенных вариантах реализации способ включает обеспечение исследуемого агента или соединения, например, агента или соединения, содержащего имидный фрагмент, например, фталимидогруппу, фталимидоглутаримидную группу, производное талидомида, производное леналидомида или производное помалидомида, и сравнение аффинности связывания и/или ингибирующей активности исследуемого агента или соединения в отношении цереблона по сравнению с агентом или соединением, для которого установлено связывание и/или ингибирование активности цереблона.
[0019] Согласно другому аспекту в изобретении предложены способы лечения или ослабления заболевания, нарушения или симптома у субъекта или пациента, например, у животного, такого как человек, включающие введение субъекту, нуждающемуся в этом, композиции, содержащей эффективное количество, например, терапевтически эффективное количество, соединения, описанного в настоящей заявке, или его солевой формы и фармацевтически приемлемый носитель, где композиция является эффективной в отношении лечения или ослабления заболевания или нарушения или симптома у субъекта.
[0020] Согласно другому аспекту в изобретении предложены способы выявления действия соединений согласно настоящему изобретению в отношении разрушения указанных белков в биологической системе.
[0021] Приведенные выше общие области применения приведены исключительно в качестве примера и не ограничивают объем настоящего изобретения и прилагаемой формулы изобретения. Дополнительные задачи и преимущества, связанные с композициями, способами и процессами согласно настоящему изобретению, будут понятны специалистам в данной области техники после изучения формулы изобретения, описания и примеров. Например, различные аспекты и варианты реализации согласно настоящему изобретению можно применять в различных комбинациях, все из которых явным образом охвачены настоящим изобретением. Указанные дополнительные преимущества, задачи и варианты реализации явным образом включены в объем настоящего изобретения. Содержание публикаций и других материалов, используемых в настоящем описании для освещения уровня техники и в конкретных случаях для обеспечения более подробного описания, связанного с реализацией, включено в настоящую заявку посредством ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0022] На прилагаемых чертежах, которые включены в настоящее описание и составляют его часть, проиллюстрированы некоторые варианты реализации настоящего изобретения, и они совместно с описанием служат для объяснения основ изобретения. Чертежи приведены исключительно для иллюстрации одного из вариантов реализации изобретения, и их не следует рассматривать как ограничивающие изобретение. Дополнительные задачи, отличительные признаки и преимущества изобретения будут очевидными после изучения последующего подробного описания, а также прилагаемых фигур, на которых приведены иллюстративные варианты реализации изобретения, где:
[0023] На фигуре 1 проиллюстрированы общие принципы действия PROTAC. (А) Типовые PROTAC содержат фрагмент, нацеливающий на белки (PTM; темный прямоугольник), фрагмент, связывающий убиквитин-лигазу (ULM; светлый треугольник), и необязательно линкерный фрагмент (L; черная линия), связывающий или объединяющий PTM и ULM. (В) Проиллюстрировано функциональное применение PROTAC, таких как описано в настоящей заявке. Вкратце, ULM распознает и связывается со специфической Е3 убиквитин-лигазой, и PTM связывает и рекрутирует белковую мишень и перемещает ее вплотную к Е3 убиквитин-лигазе. Как правило, Е3 убиквитин-лигаза образует комплекс с Е2 убиквитин-сопряженным белком, и по отдельности или посредством белка Е2 катализирует присоединение убиквитина (темные круги) к лизину в белковой мишени посредством изопептидной связи. Поли-убиквитинированный белок (крайний справа) затем подвергается направленному разрушению посредством протеасомного механизма клетки.
ПОДРОБНОЕ ОПИСАНИЕ
[0024] Далее приведено подробное описание, которое будет полезным для специалистов в данной области техники при реализации настоящего изобретения. Специалисты в данной области техники могут осуществлять модификации и изменения вариантов реализации, описанных в настоящей заявке, не выходя за рамки сущности или объема настоящего изобретения. Содержание всех публикаций, заявок на патент, патентов, фигур и других источников, указанных в настоящем описании, явным образом включено в настоящую заявку во всей полноте посредством ссылок.
[0025] В настоящей заявке описаны композиции и способы, которые основаны на удивительном и неожиданном открытии того, что белок Е3 убиквитин-лигаза, например, цереблон, убиквитинирует белковую мишень после сближения указанного белка и белковой мишени посредством бифункционального или химерного конструкта, который связывает белок Е3 убиквитин-лигазу и белковую мишень. Соответственно, в настоящем изобретении предложены указанные соединения и композиции, содержащие фрагмент, связывающий Е3 убиквитин-лигазу («ULM»), присоединенный к фрагменту, связывающему белковую мишень («PTM»), что приводит к убиквитинированию выбранной белковой мишени и приводит к разрушению белковой мишени под действием протеасомы (см. фигуру 1). В настоящем изобретении также предложена библиотека композиций и их применение.
[0026] Если отсутствуют иные определения, все технические и научные термины, используемые в настоящем описании, имеют значения, традиционно используемые специалистами в области техники, к которой принадлежит настоящее изобретение. Терминология, используемая в описании, предназначена для описания исключительно конкретных вариантов реализации и не ограничивает изобретение.
[0027] Следует понимать, что в случае указания диапазона значений изобретение охватывает каждое промежуточное значение с точностью до десятой от значения нижнего предела, если согласно контексту явным образом не следует иное (например, как в случае группы, содержащей количество атомов углерода, где предложено каждое целочисленное количество атомов углерода, включенное в рамки указанного диапазона), между верхним и нижним пределами указанного диапазона и любое другое указанное или промежуточное значение внутри указанного диапазона. Верхний и нижний пределы указанных более мелких диапазонов могут быть независимо включены в более мелкие диапазоны и также охвачены настоящем изобретением с учетом наличия каких-либо исключенных пределов в указанном диапазоне. Если указанный диапазон включает один или более пределов, то диапазоны, в которых исключены один или оба указанных включенных предела, также включены в объем изобретения.
[0028] Последующие термины используют для описания настоящего изобретения. В случаях, где конкретное описание термина отсутствует, указанный термин приведен в значении, общепринятом специалистами в данной области техники, которые применяют указанный термин в контексте использования для описания настоящего изобретения.
[0029] Формы единственного числа, используемые в настоящем описании и прилагаемой формуле изобретения, применяют в настоящей заявке для описания одного или более чем одного (т.е. по меньшей мере одного) грамматического объекта, если из контекста не следует явным образом иное. Например, «элемент» обозначает один элемент или более чем один элемент.
[0030] Следует понимать, что фраза «и/или» при использовании в настоящем описании и формуле изобретения обозначает «один или оба» элемента, объединенных при помощи указанного союза, т.е. элементы, которые в некоторых случаях присутствуют совместно и в других случаях присутствуют по отдельности. Несколько элементов, перечисленных при помощи «и/или», следует рассматривать таким же образом, т.е. как «один или более» элементов, объединенных указанным образом. Могут присутствовать и другие элементы, отличающиеся от элементов, конкретно указанных условием «и/или», которые могут быть связаны или не связаны с конкретно указанными элементами. Таким образом, в качестве неограничивающего примера указание на «А и/или В», при использовании совместно с открытым термином, таким как «содержащий», может относиться в одном варианте реализации только к А (необязательно включая элементы, отличные от В); в другом варианте только к В (необязательно включая элементы, отличные от А); в другом варианте реализации к А и В (необязательно включая другие элементы); и т.д.
[0031] Следует понимать, что при использовании в описании и формуле изобретения «или» имеет такое же значение, что и «и/или», определенный выше. Например, при разделении элементов списка «или» или «и/или» следует интерпретировать как включительные термины, т.е. в значении включая по меньшей мере один, но также включая более чем один из списка элементов и необязательно дополнительных не перечисленных элементов списка. Только термины, в которых явным образом указано противоположное, такие как «только один из» или «точно один из» или в случае формулы изобретения «состоящий из», относятся к включению точно одного элемента из числа или списка элементов. В общем случае термин «или» при использовании в настоящем описании следует интерпретировать как указание на исключающие альтернативные варианты (т.е. «один или другой, но не оба») только если перед ним используют термины исключительности, такие как «любой один», «один из», «только один из» или «точно один из».
[0032] Следует понимать, что в формуле изобретения, а также в описании, все переходные фразы, такие как «содержащий», «включающий», «переносящий», «имеющий», «состоящий», «задействующий», «удерживающий», «состоящий из» и т.д., являются открытыми, т.е. обозначают «включая, но не ограничиваясь ими». Только переходные фразы «состоящий из» и «состоящий по существу из» следует рассматривать как закрытые или полузакрытые переходные фразы, соответственно, что определено в Руководстве по порядку проведения патентной экспертизы патентного ведомства США, раздел 2111.03.
[0033] Следует понимать, что при использовании в описании и формуле изобретения фраза «по меньшей мере один», относящаяся к списку одного или более элементов, обозначает по меньшей мере один элемент, выбранный из любых одного или более элементов, приведенных в списке элементов, но необязательно включает по меньшей мере один из всех элементов, конкретным образом указанных в списке элементов, не исключая любые комбинации элементов из списка элементов. Указанное определение также позволяет необязательное наличие элементов, отличающихся от элементов, конкретным образом указанных в списке элементов, к которому относится фраза «по меньшей мере один», независимо от того, относятся другие элементы к конкретным указанными в списке элементам или нет. Таким образом, в качестве неограничивающего примера «по меньшей мере один из А и В» (или в качестве эквивалента «по меньшей мере один из А или В» или в качестве эквивалента «по меньшей мере один из А и/или В») может относиться в одном варианте реализации по меньшей мере к одному А, необязательно включая более чем один А, но к отсутствию В (необязательно включая элементы, отличные от В); в другом варианте реализации по меньшей мере к одному В, необязательно включая более чем один В, но к отсутствию А (необязательно включая элементы, отличные от А); в другом варианте реализации по меньшей мере к одному А, необязательно включая более чем один А, и по меньшей мере к одному В, необязательно включая более чем один В, (и необязательно включая другие элементы), и т.д.
[0034] Также следует понимать, что в определенных способах, описанных в настоящей заявке, которые включают более одной стадии или действия, порядок стадий или действий в способе необязательно ограничен порядком, в котором указаны стадии или действия способа, если в контексте явным образом не указано иное.
[0035] Термины «совместное введение» и «вводить совместно» или «комбинированная терапия» относятся к одновременному введению (к введению двух или более терапевтических агентов в одно время) и разделенному во времени введению (к введению одного или более терапевтических агентов в момент времени, отличающийся от времени введения дополнительного(-ых) терапевтического(-их) агента или агентов), если терапевтические агенты присутствуют у пациента одновременно в некоторых количествах, предпочтительно в эффективных количествах. Согласно определенным предпочтительным аспектам одно или более соединений, описанных в настоящей заявке, вводят совместно в комбинации по меньшей мере с одним дополнительным биоактивным агентом, включая в частности противораковый агент. Согласно особенно предпочтительным аспектам совместное введение соединений обеспечивает синергическую активность и/или терапию, включая противораковую активность.
[0036] Термин «соединение» при использовании в настоящем описании, если не указано иное, относится к любому специфическому химическому соединению, раскрытому в настоящем описании, и включает таутомеры, региоизомеры, геометрические изомеры и, если это возможно, стереоизомеры, включая оптические изомеры (энантиомеры) и другие стереоизомеры (диастереомеры), а также фармацевтически приемлемые соли и производные (включая формы пролекарств), если это возможно по контексту. При контекстном использовании термин «соединение» в общем случае относится к отдельному соединению, но также может включать другие соединения, такие как стереоизомеры, региоизомеры и/или оптические изомеры (включая рацемические смеси), а также отдельные энантиомеры или смеси, обогащенные энантиомерами предложенных соединений. Термин также относится согласно контексту к формам пролекарств соединений, которые модифицированы для облегчения введения и доставки соединений к месту действия. Следует отметить, что при описании соединений согласно настоящему изобретению помимо прочего описаны разнообразные заместители и переменные, связанные заместителями. Специалистам в данной области техники должно быть понятно, что молекулы, которые описаны в настоящей заявке, представляют собой стабильные соединения, в общем случае описанные далее. Если указана связь, то она в контексте показанного соединения представляет собой двойную связь и простую связь.
[0037] Термин «убиквитин-лигаза» относится к семейству белков, которые ускоряют перенос убиквитина к специфическому белку-субстрату и направленное разрушение белка-субстрата. Например, цереблон представляет собой белок Е3 убиквитин-лигазу, который отдельно или в комбинации с Е2 убиквитин-сопряженным ферментом, обеспечивает присоединение убиквитина к лизину в белковой мишени и затем «отмечает» специфические белковые субстраты для разрушения протеасомой. Таким образом, Е3 убиквитин-лигаза отдельно или в комплексе с Е2 убиквитин-сопряженным ферментом отвечает за перенос убиквитина к белковым мишеням. В общем случае убиквитин-лигаза задействована в полиубиквитинировании, при котором происходит присоединение второго убиквитина к первому; третьего ко второму и т.д. Полиубиквитинирование помечает белки для разрушения под действием протеасомы. Тем не менее, некоторые явления убиквитинирования сведены к моно-убиквитинированию, при котором только одна молекула убиквитина присоединяется посредством убиквитин-лигазы к молекуле субстрата. Моно-убиквитинированные белки не помечаются для разрушения протеасомой, но вместо этого может происходить изменение их расположения в клетке или функции, например, посредством связывания с другими белками, которые содержат домены, способные связывать убиквитин. Дополнительный осложняющий фактор заключается в том, что Е3 может отмечать различные лизины в убиквитине для создания цепей. Наиболее распространенным лизином является Lys48 в цепи убиквитина, который представляет собой лизин, задействованный при синтезе полиубиквитина, который распознается протеасомой.
[0038] Термин «пациент» или «субъект» используют в настоящей заявке для описания животного, предпочтительно человека или домашнего животного, которому проводят лечение, включая профилактическое лечение, с применением композиций согласно настоящему изобретению. В случае лечения инфекций, состояний или болезненных состояний, которые являются специфическими для конкретного животного, такого как пациент-человек, термин «пациент» относится к указанному конкретному животному, включая домашнее животное, такое как собака или кошка, или сельскохозяйственное животное, такое как лошадь, корова, овца и т.д. В общем случае в настоящем изобретении термин «пациент» относится к пациенту-человеку, если по контексту использования термина не указано или не следует иное.
[0039] Термин «эффективный» используют для описания количества соединения, композиции или компонента, которые при использовании в контексте целевого применения обеспечивают предполагаемый результат. Термин «эффективный» включает все другие термины, связанные с эффективным количеством или эффективной концентрацией, которые описаны или применяются иным образом в настоящей заявке.
Соединения и композиции
[0040] Согласно одному из аспектов в изобретении предложены соединения, содержащие фрагмент, связывающий Е3 убиквитин-лигазу («ULM»), представляющий собой фрагмент, связывающий цереблон Е3 убиквитин-лигазу («CLM»). В одном из вариантов реализации CLM соединен с химическим линкером (L) согласно следующей структуре:
(I) L-CLM
где L представляет собой химическую линкерную группу, и CLM представляет собой фрагмент, связывающий цереблон Е3 убиквитин-лигазу. Количество и/или относительное расположение фрагментов в соединениях, проиллюстрированных в настоящем описании, приведены исключительно в качестве примеров. Специалистам в данной области техники должно быть понятно, что можно синтезировать соединения, описанные в настоящей заявке, имеющие любое желательное количество и/или относительное расположение соответствующих функциональных фрагментов.
[0041] Термины ULM и CLM используют как включительные, если в контексте не указано иное. Например, термин ULM включает все ULM, включая ULM, которые связывают цереблон (т.е. CLM). Кроме того, термин CLM включает все возможные фрагменты, связывающие цереблон Е3 убиквитин-лигазу.
[0042] Согласно другому аспекту в настоящем изобретении предложены бифункциональные или мультифункциональные соединения PROTAC, подходящие для регуляции активности белка путем индуцирования разрушения белковой мишени. В определенных вариантах реализации соединение содержит CLM, который, например, напрямую или опосредованно ковалентно связан с фрагментом, который связывается с белковой мишенью (т.е. фрагмент, нацеливающий на белок, или «PTM»). В определенных вариантах реализации CLM и PTM объединены или соединены посредством химического линкера (L). CLM распознает цереблон убиквитин-лигазу Е3, и PTM распознает белковую мишень, и взаимодействие соответствующих фрагментов со своими мишенями способствует разрушению белковой мишени за счет размещения белковой мишени поблизости от белка убиквитин-лигазы. Типовое бифункциональное соединение может быть изображено как:
(II) PTM-CLM
[0043] В определенных вариантах реализации бифункциональное соединение дополнительно содержит химический линкер («L»). Например, бифункциональное соединение может быть изображено как:
(III) PTM-L-CLM
где PTM представляет собой фрагмент, нацеливающий на белок/полипептид, L представляет собой линкер, и CLM представляет собой фрагмент, связывающий цереблон Е3 лигазу.
[0044] В определенных вариантах реализации соединения, описанные в настоящей заявке, содержат несколько PTM (которые направленно действуют на одинаковые или различные белковые мишени), несколько CLM, один или более ULM (т.е. фрагментов, которые специфически связываются с другой Е3 убиквитин-лигазой, например, VHL) или их комбинацию. Согласно любому из аспектов вариантов реализации, описанных в настоящей заявке, PTM, CLM и ULM могут быть соединены напрямую или посредством одного или более химических линкеров или их комбинации. В дополнительных вариантах реализации, если соединение содержит несколько ULM, то ULM могут связывать одинаковые Е3 убиквитин-лигазы, или каждый соответствующий ULM может специфически связываться с отличающейся Е3 убиквитин-лигазой. В дополнительных вариантах реализации, если соединение содержит несколько PTM, то PTM могут связывать одинаковые белковые мишени, или каждый соответствующий PTM может специфически связываться с отличающейся белковой мишенью.
[0045] В другом варианте реализации в изобретении предложено соединение, содержащее совокупность CLM, соединенных напрямую или посредством химического линкерного фрагмента (L). Например, соединение, содержащее два CLM, может быть изображено как:
(IV) CLM-CLM, или
(V) CLM-L-CLM
[0046] В определенных вариантах реализации, если соединение содержит несколько CLM, то CLM являются одинаковыми. В дополнительных вариантах реализации соединение, содержащее совокупность CLM, дополнительно содержит по меньшей мере один PTM, соединенный с CLM напрямую или посредством химического линкера (L) или при помощи обоих указанных способов. В определенных дополнительных вариантах реализации соединение, содержащее совокупность CLM, дополнительно содержит несколько PTM. В дополнительных вариантах реализации PTM являются одинаковыми или необязательно различными. В дополнительных вариантах реализации, где PTM являются различными, соответствующие PTM могут связывать одинаковые белковые мишени или специфически связываться с различными белковыми мишенями.
[0047] В дополнительных вариантах реализации в изобретении предложено соединение, содержащее по меньшей мере два различных CLM, соединенных напрямую или посредством химического линкера (L) или при помощи обоих указанных способов. Например, указанное соединение, содержащее два различных CLM, может быть изображено как:
(VI) CLM-CLM' или
(VII) CLM-L-CLM'
где CLM' обозначает фрагмент, связывающий цереблон Е3 убиквитин-лигазу, который структурно отличается от CLM. В определенных вариантах реализации соединение может содержать совокупность CLM и/или совокупность CLM'. В дополнительных вариантах реализации соединение, содержащее по меньшей мере два различных CLM, совокупность CLM и/или совокупность CLM', дополнительно содержит по меньшей мере один PTM, соединенный с CLM или CLM' напрямую или посредством химического линкера, или при помощи обоих указанных способов. В любом из вариантов реализации, описанных в настоящей заявке, соединение, содержащее по меньшей мере два различных CLM, может дополнительно содержать несколько PTM. В дополнительных вариантах реализации PTM являются одинаковыми или необязательно различными. В дополнительных вариантах реализации, где PTM являются различными, соответствующие PTM могут связывать одинаковые белковые мишени или специфически связываться с различными белковыми мишенями. В дополнительных вариантах реализации PTM, как таковой, представляет собой ULM или CLM (или ULM' или CLM').
[0048] В предпочтительном варианте реализации CLM содержит фрагмент, который является лигандом цереблона убиквитин-лигазы Е3 (CRBN). В определенных вариантах реализации CLM содержит химическую группу, принадлежащую к «имидному» классу молекул. В определенных дополнительных вариантах реализации CLM содержит фталимидогруппу или ее аналог или производное. В других вариантах реализации CLM содержит фталимидо-глутаримидогруппу или ее аналог или производное В других вариантах реализации CLM содержит член группы, состоящей из талидомида, леналидомида, помалидомида и их аналогов и производных.
[0049] В дополнительных вариантах реализации в изобретении предложены соединения, описанные в настоящей заявке, включая их энантиомеры, диастереомеры, сольваты и полиморфы, включая формы фармацевтически приемлемых солей, например, соли присоединения кислоты и основания.
Неоимидные соединения
[0050] Согласно одному из аспектов в изобретении предложены соединения, подходящие для связывания и/или ингибирования цереблона. В определенных вариантах реализации соединение выбрано из группы, состоящей из следующих химических структур:
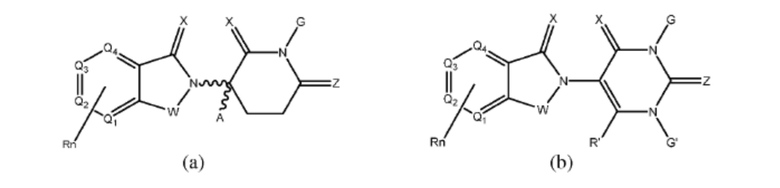
W независимо выбран из группы, состоящей из СН2, CHR, C=O, SO2, NH и N-алкила;
X независимо выбран из группы, состоящей из О, S и H2;
Y независимо выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-циклоалкила, N-гетероциклила, О и S;
Z независимо выбран из группы, состоящей из О и S или H2, с тем исключением, что X и Z оба не могут являться Н2;
G и G' независимо выбраны из группы, состоящей из Н, алкила, ОН, СН2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1 - Q4 представляют собой атом углерода С, замещенный группой, независимо выбранной из R', N или N-оксида;
А независимо выбран из группы, состоящей из алкила, циклоалкила, Cl и F;
R содержит, но не ограничивается ими: -CONR'R'', -OR', -NR'R'', -SR', -SO2R', -SO2NR'R'', -CR'R''-, -CR'NR'R''-, -арил, -гетероарил, -алкил, -циклоалкил, -гетероциклил, - P(O)(OR')R'', -P(O)R'R'', -OP(O)(OR')R'', -OP(O)R'R'', -Cl, -F, -Br, -I, -CF3, -CN, NR'SO2NR'R'', -NR'CONR'NR'', -CONR'COR'', -NR'C(=N-CN)NR'R'', -C(=N-CN)NR'R'', -NR'C(=N-CN)R'', -NR'C(=C-NO2)NR'R'', -SO2NR'COR'', -NO2, -CO2R', - C(C=N-OR')R'', -CR'=CR'R'', -CCR', -S(C=O)(C=N-R')R'', -SF5 и -OCF3;
R' и R'' независимо выбраны из связи, Н, алкила, циклоалкила, арила, гетероарила и гетероциклила;
n представляет собой целое число от 1 до 4;
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
Rn содержит 1-4 независимых функциональных групп или атомов.
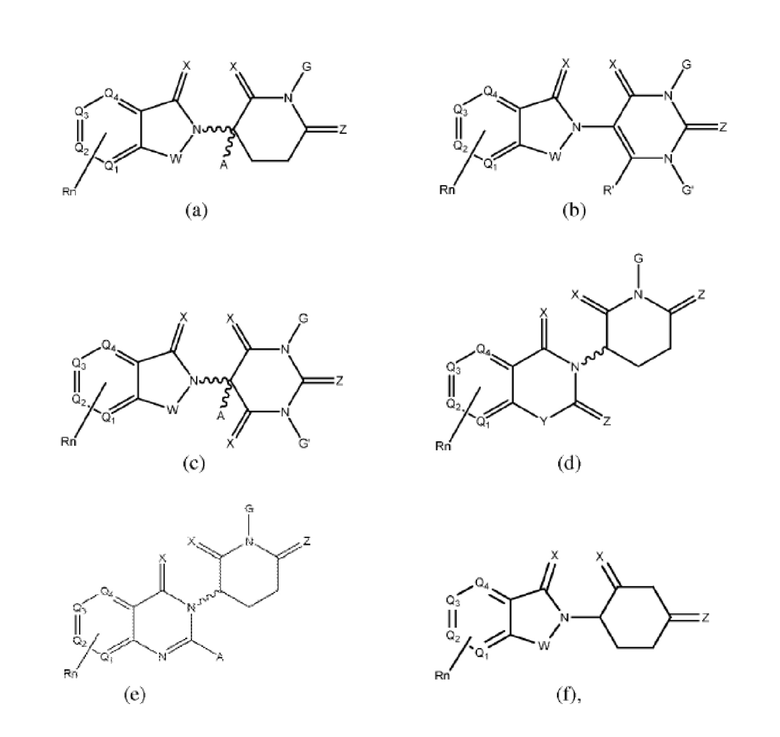
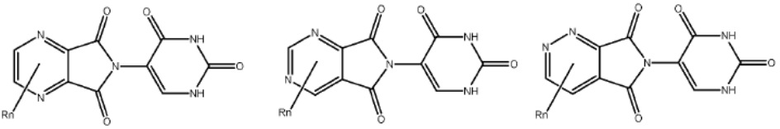
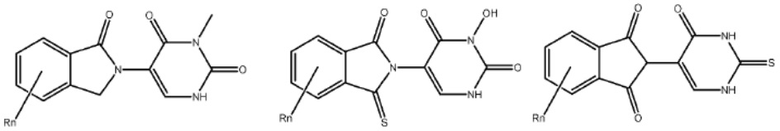
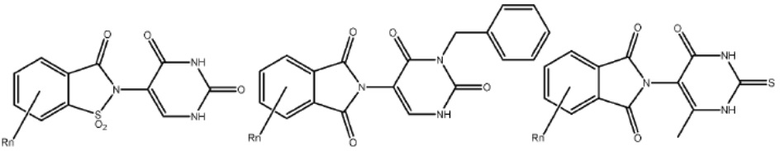
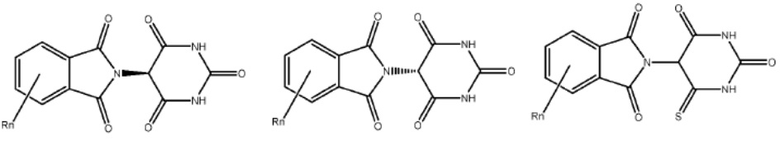
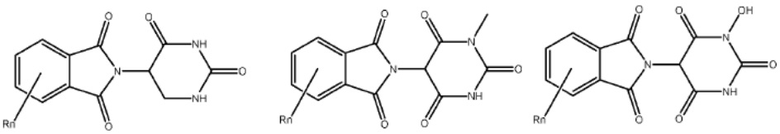
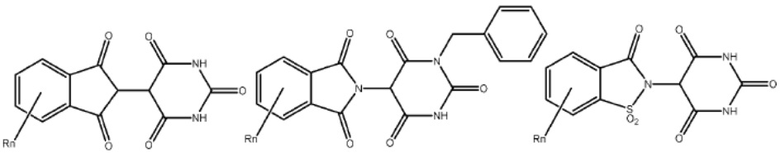
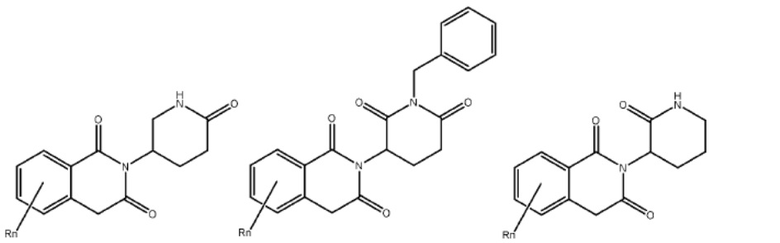
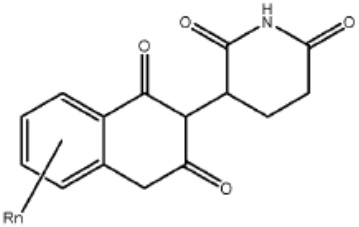
Типовые CLM
[0051] В любом из соединений, описанных в настоящей заявке, CLM содержит химическую структуру, выбранную из группы, состоящей из:
где
W независимо выбран из группы, состоящей из СН2, CHR, C=O, SO2, NH и N-алкила;
X независимо выбран из группы, состоящей из О, S и Н2;
Y независимо выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-циклоалкила, N-гетероциклила, О и S;
Z независимо выбран из группы, состоящей из О и S или Н2, с тем исключением, что X и Z оба не могут являться Н2;
G и G' независимо выбраны из группы, состоящей из Н, алкила, ОН, СН2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1 - Q4 представляют собой атом углерода С, замещенный группой, независимо выбранной из R', N или N-оксида;
А независимо выбран из группы, состоящей из алкила, циклоалкила, Cl и F;
R содержит, но не ограничивается ими: -CONR'R'', -OR', -NR'R'', -SR', -SO2R', -SO2NR'R'', -CR'R''-, -CR'NR'R''-, -арил, -гетероарил, -алкил, -циклоалкил, -гетероциклил, - P(O)(OR')R'', -P(O)R'R'', -OP(O)(OR')R'', -OP(O)R'R'', -Cl, -F, -Br, -I, -CF3, -CN, NR'SO2NR'R'', -NR'CONR'NR'', -CONR'COR'', -NR'C(=N-CN)NR'R'', -C(=N-CN)NR'R'', -NR'C(=N-CN)R'', -NR'C(=C-NO2)NR'R'', -SO2NR'COR'', -NO2, -CO2R', - C(C=N-OR')R'', -CR'=CR'R'', -CCR', -S(C=O)(C=N-R')R'', -SF5 и -OCF3;
R' и R'' независимо выбраны из связи, Н, алкила, циклоалкила, арила, гетероарила и гетероциклила;
n представляет собой целое число от 1 до 4;
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
Rn содержит 1-4 независимых функциональных групп или атомов, один из которых необязательно модифицирован для соединения с PTM, химической линкерной группой (L), ULM, CLM (или CLM') или их комбинацией посредством ковалентной связи.
[0052] Термин «независимо» используют в настоящем описании для указания на то, что переменная, которую применяют независимо, независимо изменяется от применения к применению.
[0053] Термин «алкил» согласно контексту обозначает линейный(-ую), разветвленный(-ую) или циклический(-ую) полностью насыщенный(-ую) углеводородный радикал или алкильную группу, предпочтительно С1-С10, более предпочтительно С1-С6, в качестве альтернативы С1-С3 алкильную группу, которая может быть необязательно замещена. Примерами алкильных групп помимо прочих являются метил, этил, н-бутил, втор-бутил, н-гексил, н-гептил, н-октил, н-нонил, н-децил, изопропил, 2-метилпропил, циклопропил, циклопропилметил, циклобутил, циклопентил, циклопентилэтил, циклогексилэтил и циклогексил. В определенных вариантах реализации алкильная группа содержит концевую галогеновую группу (At, Br, Cl, F или I). В определенных предпочтительных вариантах реализации соединения согласно настоящему изобретению можно применять для ковалентного связывания с ферментами дегалогеназами. Указанные соединения в общем случае содержат боковую цепь (часто присоединенную посредством группы полиэтиленгликоля), дальний конец которой завершается алкильной группой, содержащей галогеновый заместитель (часто хлор или бром), что приводит к ковалентному связыванию соединения, содержащего указанный фрагмент, с белком.
[0054] Термин «алкенил» относится к линейным, разветвленным или циклическим С2 С10 (предпочтительно С2-С6) углеводородным радикалам, содержащим по меньшей мере одну связь С=С.
[0055] Термин «алкинил» относится к линейным, разветвленным или циклическим С2 С10 (предпочтительно С2-С6) углеводородным радикалам, содержащим по меньшей мере одну связь С≡С.
[0056] Термин «алкилен», если его используют, относится к группе -(СН2)n- (n в общем случае представляет собой целое число от 0 до 6), которая может быть необязательно замещенной. В случае наличия заместителей алкиленовая группа предпочтительно замещена по одной или более метиленовым группам С1-С6 алкильной группой (включая циклопропильную группу или трет-бутильную группу), но также может быть замещена одной или более галогеновыми группами, предпочтительно 1-3 галогеновыми группами или одной или двумя гидроксильными группами, О-(С1-С6 алкильными) группами или боковыми цепями аминокислот, что также раскрыто в настоящем описании. В определенных вариантах реализации алкиленовая группа может быть замещена уретановой или алкоксигруппой (или другой группой), которая дополнительно замещена цепью полиэтиленгликоля (от 1 до 10, предпочтительно от 1 до 6, часто от 1 до 4 звеньев этиленгликоля), при которой в качестве заместителя (расположенного предпочтительно, но не исключительно, при дальнем конце цепи полиэтиленгликоля) содержится алкильная цепь, замещенная одной галогеновой группой, предпочтительно хлором. В других вариантах реализации алкиленовая (как правило, метиленовая) группа может быть замещена группой боковой цепи аминокислоты, такой как группа боковой цепи природной или искусственной аминокислоты, например, аланина, β-аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, цистина, глютаминовой кислоты, глютамина, глицина, фенилаланина, гистидина, изолейцина, лизина, лейцина, метионина, пролина, серина, треонина, валина, триптофана или тирозина.
[0057] Термин «незамещенный» обозначает замещение исключительно атомами водорода. Диапазон атомов углерода, который включает С0, означает, что атом углерода отсутствует или заменен на Н. Таким образом, диапазон атомов углерода, составляющий С0-С6, включает 1, 2, 3, 4, 5 и 6 атомов углерода, и в случае С0 вместо атома углерода содержится Н.
[0058] Термин «замещенный» или «необязательно замещенный» независимо обозначает (т.е. если содержится более одного заместителя, каждый заместитель выбран независимо от другого заместителя) наличие одного или более заместителей (независимо не более пяти заместителей, предпочтительно не более трех заместителей, как правило, 1 или 2 заместителя при фрагменте в соединении согласно настоящему изобретению, могут быть включены заместители, которые сами по себе могут быть дополнительно замещены) при атоме углерода (или азота), содержащегося в любой части данной молекулы, и в качестве заместителей включены гидроксил, тиол, карбоксил, циано (C≡N), нитро (NO2), галоген (предпочтительно 1, 2 или 3 атома галогена, в частности при алкиле, например, при метильной группе, такой как трифторметил), алкильная группа (предпочтительно С1-С10, более предпочтительно С1-С6), арил (в частности фенил и замещенный фенил, например, бензил или бензоил), алкоксигруппа (предпочтительно С1-С6 алкил или арил, включая фенил и замещенный фенил), простой тиоэфир (С1-С6 алкил или арил), ацил (предпочтительно С1-С6 ацил), сложный эфир или тиоэфир (предпочтительно С1-С6 алкил или арил), включая сложный алкиленовый эфир (где точка присоединения находится при алкиленовой группе, но не при сложноэфирной функциональной группе, которая предпочтительно замещена С1-С6 алкильной или арильной группой), предпочтительно С1 С6 алкил или арил, галоген (предпочтительно F или Cl), амин (включая пяти- или шести-членный циклический алкиленамин, дополнительно включая С1-С6 алкиламин или С1-С6 диалкиламин, где алкильные группы могут быть замещены одной или двумя гидроксильными группами) или необязательно замещенная -N(C0-C6 алкил)С(О)(О-С1-С6 алкильная) группа (которая может быть необязательно замещена цепью полиэтиленгликоля, к которой дополнительно присоединена алкильная группа, содержащая один атом галогена, предпочтительно хлор в качестве заместителя), гидразин, амидо, который предпочтительно замещен одной или двумя С1-С6 алкильными группами (включая карбоксамид, который необязательно замещен одной или двумя С1-С6 алкильными группами), алканол (предпочтительно С1-С6 алкил или арил) или алкановая кислота (предпочтительно С1-С6 алкил или арил). Заместители согласно настоящему изобретению могут включать, например, группы -SiR1R2R3, где каждый из R1 и R2 такой, как дополнительно описано в настоящей заявке, и R3 представляет собой Н или С1-С6 алкильную группу, предпочтительно R1, R2, R3 в указанном контексте представляют собой С1-С3 алкильную группу (включая изопропильную или трет-бутильную группу). Каждая из описанных выше групп может быть напрямую присоединена к замещенному фрагменту, или в качестве альтернативы заместитель может быть присоединен к замещенному фрагменту (предпочтительно в случае арильного или гетероарильного фрагмента) посредством необязательно замещенной группы -(СН2)m- или в качестве альтернативы необязательно замещенного -(ОСН2)m-, -(ОСН2СН2)m- или -(СН2СН2О)m-, которые могут быть замещены одним или более описанными выше заместителями. Алкиленовые группы -(СН2)m- или -(СН2)n- или другие цепи, такие как цепи этиленгликоля, такие как указано выше, могут быть замещены по любому положению цепи. Предпочтительные заместители алкиленовых групп включают галоген или С1-С6 (предпочтительно С1-С3) алкильные группы, которые могут быть необязательно замещены одной или двумя гидроксильными группами, одной или двумя простыми эфирными группами (группами О-С1-С6), не более чем тремя галогеновыми группами (предпочтительно F) или боковой цепью аминокислоты, что также описано в настоящей заявке, и необязательно замещенным амидом (предпочтительно замещенным карбоксамидом, как описано выше) или уретановыми группами (как правило, содержащими один или два С0-С6 алкильных заместителя, которые могут быть дополнительно замещены). В определенных вариантах реализации алкиленовая группа (как правило, отдельная метиленовая группа) замещена одной или двумя необязательно замещенными С1-С6 алкильными группами, предпочтительно С1-С4 алкильной группой, как правило, метильной или О-метильной группами или боковой цепью аминокислоты, что также определено в настоящем описании. Согласно настоящему изобретению фрагмент в молекуле может быть необязательно замещен не более чем пятью заместителями, предпочтительно не более чем тремя заместителями. Чаще всего, фрагменты согласно настоящему изобретению, которые содержат заместители, замещены одним или двумя заместителями.
[0059] Термин «замещенный» (где каждый заместитель выбран независимо от любого другого заместителя) также согласно используемому контексту обозначает С1-С6 алкил, С1 С6 алкокси, галоген, амидо, карбоксамидо, сульфон, включая сульфонамид, кето, карбокси, С1-С6 сложный эфир (сложный оксиэфир или сложный карбониловый эфир), С1 С6 кето, уретан -О-С(О)-NR1R2- или -N(R1)-C(O)-O-R1, нитро, циано и амин (в частности, включая С1-С6 алкилен-NR1R2, моно- или ди-С1-С6 алкил-замещенные амины, которые могут быть необязательно замещены одной или двумя гидроксильными группами). Согласно контексту каждая из указанных групп содержит, если не указано иное, от 1 до 6 атомов углерода. В определенных вариантах реализации предпочтительные заместители включают, например, -NH-, -NHC(O)-, -O-, =O, -(CH2)m- (в указанном контексте m и n равны 1, 2, 3, 4, 5 или 6), -S-, -S(O)-, SO2- или -NH-C(O)-NH-, -(CH2)nOH, -(CH2)nSH, -(CH2)nCOOH, С1-С6 алкил, -(CH2)nO-(С1-С6 алкил), -(СН2)nC(O)-(С1-С6 алкил), -(СН2)nOC(О)-(С1-С6 алкил), -(СН2)nC(О)О-(С1-С6 алкил), -(СН2)nNHC(О)-R1, -(CH2)nC(O)-NR1R2, -(OCH2)nOH, - (CH2O)nCOOH, С1-С6 алкил, -(OCH2)nO-(С1-С6 алкил), -(CH2O)nC(O)-(С1-С6 алкил), - (OCH2)nNHC(O)-R1, -(CH2O)nC(O)-NR1R2, -S(O)2-RS, -S(O)-RS (RS представляет собой С1 С6 алкил или группу -(CH2)m-NR1R2), NO2, CN или галоген (F, Cl, Br, I, предпочтительно F или Cl) в зависимости от контекста применения заместителя. Каждый R1 и R2 согласно контексту представляет собой Н или С1-С6 алкильную группу (которая может быть необязательно замещена одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами, предпочтительно фтором). Термин «замещенный» также обозначает в контексте химических особенностей определенного соединения и применяемого заместителя необязательно замещенную арильную или гетероарильную группу или необязательно замещенную гетероциклическую группу, что также описано в настоящей заявке. Алкиленовые группы также могут быть предпочтительно замещены, что также описано в настоящей заявке, необязательно замещенными С1-С6 алкильными группами (предпочтительными являются метил, этил или гидроксиметил или гидроксиэтил, что тем самым обеспечивает хиральный центр), группой боковой цепи аминокислоты, что также описано в настоящей заявке, амидогруппой, такой как описано выше в настоящей заявке, или уретановой группой О-С(О)-NR1R2, где R1 и R2 такие, как определено в настоящей заявке, при этом в качестве заместителей можно применять различные другие группы. Различные необязательно замещенные фрагменты могут быть замещены 3 или более заместителями, предпочтительно не более чем 3 заместителями и более предпочтительно 1 или 2 заместителями. Следует отметить, что в тех случаях, где при конкретном положении в молекуле соединения требуется наличие заместителя (обязательно, в соответствии с правилом валентности), но заместитель не указан, то подразумевается, или следует понимать, что заместитель представляет собой Н, если согласно контексту не предполагается наличие иного заместителя.
[0060] Термин «арил» или «ароматическая группа» согласно контексту относится к замещенному (что также описано в настоящей заявке) или незамещенному одновалентному ароматическому радикалу, содержащему одно кольцо (например, к бензолу, фенилу, бензилу) или конденсированные кольца (например, к нафтилу, антраценилу, фенантренилу и т.д.), который может быть присоединен к соединению согласно настоящему изобретению по любому доступному стабильному положению в кольце(-ах) или по иному положению, указанному в приведенной химической структуре. Другие примеры арильных групп согласно контексту могут включать системы гетероциклических ароматических колец, «гетероарильные» группы, содержащие один или более атомов азота, кислорода или серы в кольце (моноциклическом), такие как имидазол, фурил, пиррол, фуранил, тиен, тиазол, пиридин, пиримидин, пиразин, триазол, оксазол, или конденсированные системы колец, такие как индол, хинолин, индолизин, азаиндолизин, бензофуразан и т.д., помимо прочего, которые могут быть необязательно замещены, как описано выше. В число гетероарильных групп, которые необходимо отметить, включены азотсодержащие гетероарильные группы, такие как пиррол, пиридин, пиридон, пиридазин, пиримидин, пиразин, пиразол, имидазол, триазол, триазин, тетразол, индол, изоиндол, индолизин, азаиндолизин, пурин, индазол, хинолин, дигидрохинолин, тетрагидрохинолин, изохинолин, дигидроизохинолин, тетрагидроизохинолин, хинолизин, фталазин, нафтиридин, хиноксалин, хиназолин, циннолин, птеридин, имидазопиридин, имидазотриазин, пиразинопиридазин, акридин, фенантридин, карбазол, карбазолин, пиримидин, фенантролин, фенацен, оксадиазол, бензимидазол, пирролопиридин, пирролопиримидин и пиридопиримидин; серосодержащие ароматические гетероциклы, такие как тиофен и бензотиофен; кислородсодержащие ароматические гетероциклы, такие как фуран, пиран, циклопентапиран, бензофуран и изобензофуран; и ароматические гетероциклы, содержащие 2 или более гетероатомов, выбранных из азота, серы и кислорода, такие как тиазол, тиадиазол, изотиазол, бензоксазол, бензотиазол, бензотиадиазол, фенотиазин, изоксазол, фуразан, феноксазин, пиразолоксазол, имидазотиазол, тиенофуран, фуропиррол, пиридоксазин, фуропиридин, фуропиримидин, тиенопиримидин и оксазол, помимо прочих, все из которых могут быть необязательно замещены.
[0061] Термин «замещенный арил» относится к ароматической карбоциклической группе, содержащей по меньшей мере одно ароматическое кольцо или несколько конденсированных колец, по меньшей мере одно из которых является ароматическим, где кольцо(-а) замещено(-ы) одним или более заместителями. Например, арильная группа может содержать заместитель(-и), выбранный(-е) из: -(CH2)nOH, -(CH2)n-O-(C1-C6)алкила, - (СН2)n-O-(CH2)n-(С1-С6)алкила, -(СН2)n-C(O)(C0-C6)алкила, -(СН2)n-C(O)O(C0-C6)алкила, - (СН2)n-OC(O)(C0-C6)алкила, амина, моно- или ди-(С1-С6 алкил)амина, где алкильная группа при амине необязательно замещена 1 или 2 гидроксильными группами или не более чем тремя галогеновыми (предпочтительно F, Cl) группами, ОН, СООН, С1-С6 алкилом, предпочтительно СН3, CF3, ОМе, OCF3, NO2 или CN группой (каждая из которых может представлять собой заместитель в орто-, мета- и/или пара-положении фенильного кольца, предпочтительно в пара-положении), необязательно замещенной фенильной группы (фенильная группа, как таковая, предпочтительно замещена линкерной группой, присоединенной к группе PTM, включая группу ULM), и/или по меньшей мере одной группы, выбранной из F, Cl, OH, COOH, CH3, CF3, OMe, OCF3, NO2 или CN (в орто-, мета- и/или пара-положении фенильного кольца, предпочтительно в пара-положении), нафтильной группы, которая может быть необязательно замещенной, необязательно замещенного гетероарила, предпочтительно необязательно замещенного изоксазола, включая метилзамещенный изоксазол, необязательно замещенного оксазола, включая метилзамещенный оксазол, необязательно замещенного тиазола, включая метилзамещенный тиазол, необязательно замещенного изотиазола, включая метилзамещенный изотиазол, необязательно замещенного пиррола, включая метилзамещенный пиррол, необязательно замещенного имидазола, включая метилимидазол, необязательно замещенного бензимидазола или метоксибензилимидазола, необязательно замещенного оксимидазола или метилоксимидазола, необязательно замещенной диазольной группы, включая метилдиазольную группу, необязательно замещенной триазольной группы, включая метилзамещенную триазольную группу, необязательно замещенной пиридиновой группы, включая галоген- (предпочтительно F-) или метилзамещенную пиридиновую группу или оксапиридиновую группу (где пиридиновая группа присоединена к фенильной группе посредством атома кислорода), необязательно замещенного фурана, необязательно замещенного бензофурана, необязательно замещенного дигидробензофурана, необязательно замещенного индола, индолизина или азаиндолизина (2-, 3- или 4-азаиндолизина), необязательно замещенного хинолина и их комбинаций.
[0062] «Карбоксил» обозначает группу -C(O)OR, где R представляет собой водород, алкил, замещенный алкил, арил, замещенный арил, гетероарил или замещенный гетероарил, причем указанные группы заместителей имеют значения, идентичные тем, что определены в настоящем описании для соответствующих групп.
[0063] Термин «гетероарил» или «гетарил» может обозначать, но не ограничен ими каким-либо образом, необязательно замещенный хинолин (который может быть присоединен к фармакофору или замещен по любому атому углерода хинолинового кольца), необязательно замещенный индол (включая дигидроиндол), необязательно замещенный индолизин, необязательно замещенный азаиндолизин (2-, 3- или 4-азаиндолизин), необязательно замещенный бензимидазол, бензодиазол, бензоксофуран, необязательно замещенный имидазол, необязательно замещенный изоксазол, необязательно замещенный оксазол (предпочтительно метилзамещенный), необязательно замещенный диазол, необязательно замещенный триазол, тетразол, необязательно замещенный бензофуран, необязательно замещенный тиофен, необязательно замещенный тиазол (предпочтительно метил- и/или тиол-замещенный), необязательно замещенный изотиазол, необязательно замещенный триазол (предпочтительно 1,2,3-триазол, замещенный метильной группой, триизопропилсилильной группой, необязательно замещенной -(СН2)m-О-С1-С6 алкильной группой или необязательно замещенной -(СН2)m-C(O)-O-C1-C6 алкильной группой), необязательно замещенный пиридин (2-, 3- или 4-пиридин) или группу, соответствующую химической структуре:

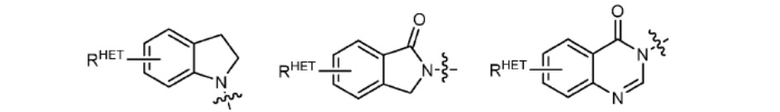
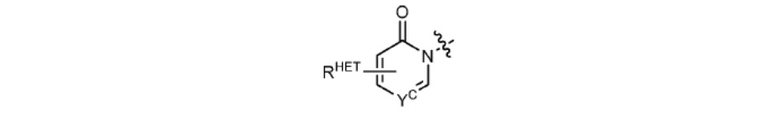
где
SC представляет собой CHRSS, NRURE или О;
RHET представляет собой Н, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный С1-С6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами, например, CF3), необязательно замещенный О(С1-С6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами) или необязательно замещенную ацетиленовую группу -С≡С-Ra, где Ra представляет собой Н или С1-С6 алкильную группу (предпочтительно С1-С3 алкил);
RSS представляет собой Н, CN, NO2, галоген (предпочтительно F или Cl), необязательно замещенный С1-С6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами), необязательно замещенный О-(С1-С6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами) или необязательно замещенный -С(О)(С1-С6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами);
RURE представляет собой Н, С1-С6 алкил (предпочтительно Н или С1-С3 алкил) или - С(О)(С1 С6 алкил), каждый из которых необязательно замещен одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами, предпочтительно фтором, или необязательно замещенный гетероцикл, например, пиперидин, морфолин, пирролидин, тетрагидрофуран, тетрагидротиофен, пиперидин, пиперазин, каждый из которых необязательно замещен, и
YC представляет собой N или C-RYC, где RYC представляет собой Н, ОН, CN, NO2, галоген (предпочтительно Cl или F), необязательно замещенный С1-С6 алкил (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами (например, CF3)), необязательно замещенный О(С1-С6 алкил) (предпочтительно замещенный одной или двумя гидроксильными группами или не более чем тремя галогеновыми группами) или необязательно замещенную ацетиленовую группу -С≡С-Ra, где Ra представляет собой Н или С1-С6 алкильную группу (предпочтительно С1-С3 алкил).
[0064] Термины «аралкил» и «гетероарилалкил» относятся к группам, содержащим арил или, соответственно, гетероарил, а также алкил и/или гетероалкил и/или карбоциклические и/или гетероциклоалкильные системы колец согласно приведенным выше определениям.
[0065] Термин «арилалкил» при использовании в настоящем описании относится к арильной группе, такой как определено выше, присоединенной к алкильной группе, определенной выше. Арилалкильная группа присоединена к исходному фрагменту через алкильную группу, где алкильная группа содержит от одного до шести атомов углерода. Арильная группа в арилалкильной группе может быть замещена, как определено выше.
[0066] Термин «гетероцикл» относится к циклической группе, которая содержит по меньшей мере один гетероатом, например, N, O или S, и может быть ароматической (гетероарил) или неароматической. Таким образом, гетероарильные фрагменты включены в определение гетероцикла в зависимости от контекста, в котором используют указанный термин. Типовые гетероарильные группы описаны выше в настоящей заявке.
[0067] Типовые гетероциклические группы включают помимо прочих: азетидинил, бензимидазолил, 1,4-бензодиоксанил, 1,3-бензодиоксолил, бензоксазолил, бензотиазолил, бензотиенил, дигидроимидазолил, дигидропиранил, дигидрофуранил, диоксанил, диоксоланил, этиленмочевину, 1,3-диоксолан, 1,3-диоксан, 1,4-диоксан, фурил, гомопиперидинил, имидазолил, имидазолинил, имидазолидинил, индолинил, индолил, изохинолинил, изотиазолидинил, изотиазолил, изоксазолидинил, изоксазолил, морфолинил, нафтиридинил, оксазолидинил, оксазолил, пиридон, 2-пирролидон, пиридин, пиперазинил, N-метилпиперазинил, пиперидинил, фталимид, сукцинимид, пиразинил, пиразолинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, хинолинил, тетрагидрофуранил, тетрагидропиранил, тетрагидрохинолин, тиазолидинил, тиазолил, тиенил, тетрагидротиофен, оксан, оксетанил, оксатиоланил, тиан.
[0068] Гетероциклические группы могут быть необязательно замещены членом группы, состоящей из алкокси, замещенного алкокси, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, ацила, ациламино, ацилокси, амино, замещенного амино, аминоацила, аминоацилокси, оксиаминоацила, азидо, циано, галогена, гидроксила, кето, тиокето, карбокси, карбоксиалкила, тиоарилокси, тиогетероарилокси, тиогетероциклоокси, тиола, тиоалкокси, замещенного тиоалкокси, арила, арилокси, гетероарила, гетероарилокси, гетероциклической группы, гетероциклоокси, гидроксиамино, алкоксиамино, нитро, -SO-алкила, -SO-замещенного алкила, -SO-арила, -SO-гетероарила, -SO2-алкила, -SO2-замещенного алкила, -SO2-арила, оксо (=О) и -SO2-гетероарила. Указанные гетероциклические группы могут содержать одно кольцо или несколько конденсированных колец. Примеры азотсодержащих гетероциклов и гетероарилов включают, но не ограничиваются ими, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол, феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин, пиперидин, пиперазин, индолин, морфолино, пиперидинил, тетрагидрофуранил и т.д., а также N-алкокси-азотсодержащие гетероциклы. Термин «гетероциклический» также включает бициклические группы, в которых какое-либо из гетероциклических колец конденсировано с бензольным кольцом или циклогексановым кольцом или с другим гетероциклическим кольцом (например, индолил, хинолил, изохинолил, тетрагидрохинолил и т.д.).
[0069] Термин «циклоалкил» может обозначать, но не ограничен ими каким-либо образом, одновалентные группы, полученные из моноциклических или полициклических алкильных групп или циклоалканов, таких как определено в настоящей заявке, например, насыщенные моноциклические углеводородные группы, содержащие от трех до двадцати атомов углерода в кольце, включая, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.д. Термин «замещенный циклоалкил» может обозначать, но не ограничен ими каким-либо образом, моноциклическую или полициклическую алкильную группу и замещен одним или более заместителями, например, амино, галогеном, алкилом, замещенным алкилом, карбилокси, карбилмеркапто, арилом, нитро, меркапто или сульфо, где указанные общие группы заместителей имеют значения, идентичные тем, что определены для соответствующих групп, определенных в настоящем описании.
[0070] «Гетероциклоалкил» относится к моноциклической или полициклической алкильной группе, в которой по меньшей мере один атом углерода в циклической структуре кольца заменен на гетероатом, выбранный из группы, состоящей из N, O, S или P. «Замещенный гетероциклоалкил» относится к моноциклической или полициклической алкильной группе, в которой по меньшей мере один атом углерода в циклической структуре кольца заменен на гетероатом, выбранный из группы, состоящей из N, O, S или P, и группа содержит один или более заместителей, выбранных из группы, состоящей из галогена, алкила, замещенного алкила, карбилокси, карбилмеркапто, арила, нитро, меркапто или сульфо, где указанные общие группы заместителей имеют значения, идентичные тем, что определены для соответствующих групп, определенных в настоящем описании.
[0071] Термин «гидрокарбил» обозначает соединение, которое содержит атомы углерода и водорода и может быть полностью насыщенным, частично ненасыщенным или ароматическим, и включает арильные группы, алкильные группы, алкенильные группы и алкинильные группы.
[0072] В любом из вариантов реализации, описанных в настоящей заявке, W, X, Y, Z, G, G', R, R', R'', Q1-Q4, A и Rn независимо могут быть ковалентно присоединены к линкеру и/или к линкеру, к которому присоединены одна или более групп PTM, ULM, CLM или CLM'.
[0073] Более конкретно, неограничивающие примеры CLM включают группы, показанные ниже, а также «гибридные» молекулы, имеющие комбинацию 1 или более различных отличительных признаков, показанных в приведенных ниже молекулах.
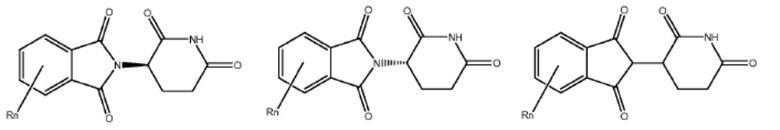
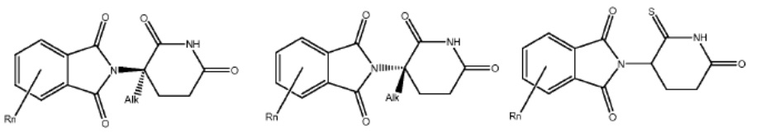
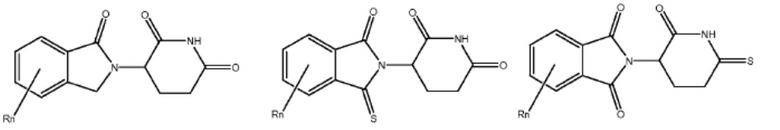
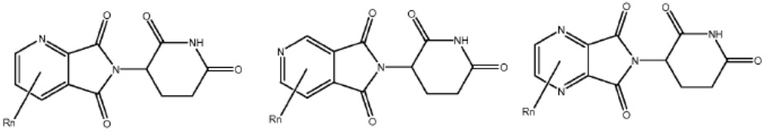
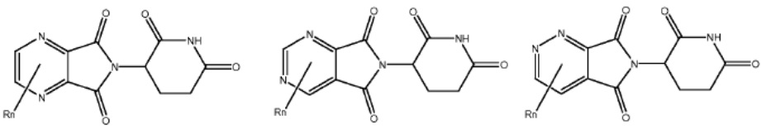
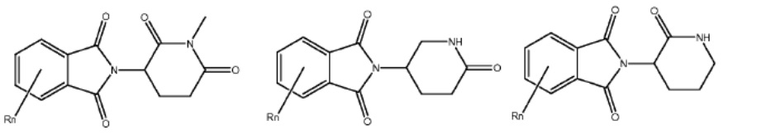
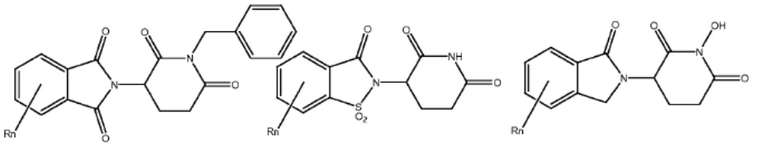

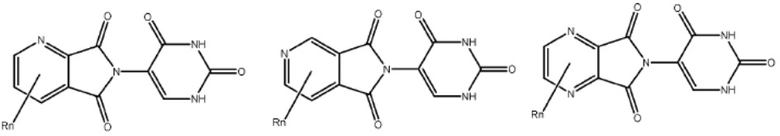
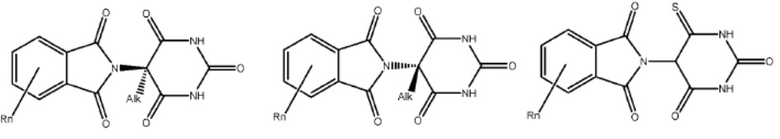
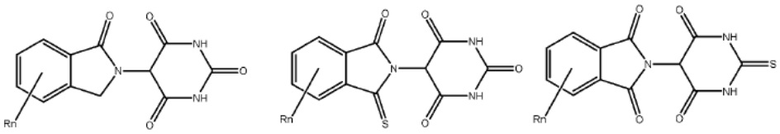
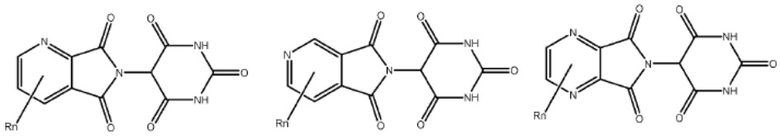
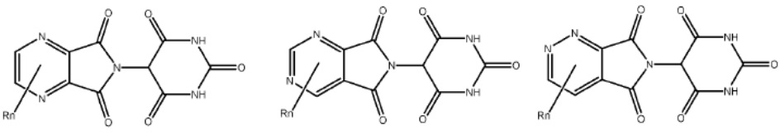

Типовые линкеры
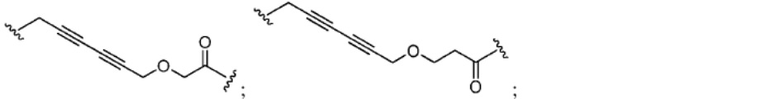
[0074] В определенных вариантах реализации соединения, описанные в настоящей заявке, могут быть химически присоединены или связаны посредством химического линкера (L). В определенных вариантах реализации линкерная группа L представляет собой группу, содержащую одно или более ковалентно связанных структурных звеньев А (например, -А1…Aq-), где A1 представляет собой группу, связанную по меньшей мере с одним из ULM, PTM или их комбинацией. В определенных вариантах реализации А1 напрямую соединяет ULM, PTM или их комбинацию с другим ULM, PTM или их комбинацией. В других вариантах реализации А1 соединяет ULM, PTM или их комбинацию с другим ULM, PTM или их комбинацией посредством Aq.
[0075] В определенных вариантах реализации каждый из A1 - Aq независимо представляет собой связь, CRL1RL2, O, S, SO, SO2, NRL3, SO2NRL3, SONRL3, CONRL3, NRL3CONRL4, NRL3SO2NRL4, CO, CRL1=CRL2, C≡C, SiRL1RL2, P(O)RL1, P(O)ORL1, NRL3C(=NCN)NRL4, NRL3C(=NCN), NRL3C(=CNO2)NRL4, C3-11 циклоалкил, необязательно замещенный 0-6 группами RL1 и/или RL2, C3-11 гетероциклил, необязательно замещенный 0 6 группами RL1 и/или RL2, арил, необязательно замещенный 0-6 группами RL1 и/или RL2, гетероциклил, необязательно замещенный 0 6 группами RL1 и/или RL2, где каждый RL1 или RL2 независимо может быть объединен с другими группами А с образованием циклоалкильного и/или гетероциклильного фрагмента, который может быть дополнительно замещен 0-4 группами RL5; причем
каждый RL1, RL2, RL3, RL4 и RL5 независимо представляет собой Н, галоген, С1-8 алкил, ОС1 8 алкил, SC1-8 алкил, NHC1-8 алкил, N(С1-8 алкил)2, С3-11 циклоалкил, арил, гетероарил, С3-11 гетероциклил, ОС1-8 циклоалкил, SC1-8 циклоалкил, NHC1-8 циклоалкил, N(C1-8 циклоалкил)2, N(С1-8 циклоалкил)(С1-8 алкил), ОН, NH2, SH, SO2C1-8 алкил, Р(О)(ОС1 8 алкил)(С1-8 алкил), Р(О)(ОС1-8 алкил)2, СС-С1-8 алкил, ССН, СН=СН(С1-8 алкил), С(С1 8 алкил)=СН(С1-8 алкил), С(С1-8 алкил)=С(С1-8 алкил)2, Si(OH)3, Si(С1-8 алкил)3, Si(OH)(С1-8 алкил)2, СОС1-8 алкил, СО2Н, галоген, CN, CF3, CHF2, CH2F, NO2, SF5, SO2NHC1-8 алкил, SO2N(С1-8 алкил)2, SONHC1-8 алкил, SON(C1-8 алкил)2, CONHC1-8 алкил, CON(C1-8 алкил)2, N(C1-8 алкил)CONH(С1-8 алкил), N(C1-8 алкил)CON(C1-8 алкил)2, NHCONH(С1-8 алкил), NHCON(С1-8 алкил)2, NHCONH2, N(C1-8 алкил)SO2NH(С1-8 алкил), N(С1-8 алкил)SO2N(С1-8 алкил)2, NHSO2NH(C1-8 алкил), NHSO2N(С1-8 алкил)2, NHSO2NH2.
[0076] В определенных вариантах реализации q представляет собой целое число, равное 0 или более. В определенных вариантах реализации q представляет собой целое число, равное 1 или более.
[0077] В определенных вариантах реализации, например, где q равен более 2, Aq представляет собой группу, присоединенную к фрагменту ULM или ULM', и A1 и Aq соединены посредством структурных звеньев А (количество указанных структурных звеньев А: q-2).
[0078] В определенных вариантах реализации, например, где q равен 2, Aq представляет собой группу, соединенную с А1 и фрагментом ULM или ULM'.
[0079] В определенных вариантах реализации, например, где q равен 1, структура линкерной группы L представляет собой -А1-, и группа А1 представляет собой группу, которая соединена с фрагментом ULM или ULM' и фрагментом PTM.
[0080] В дополнительных вариантах реализации q представляет собой целое число от 1 до 100, от 1 до 90, от 1 до 80, от 1 до 70, от 1 до 60, от 1 до 50, от 1 до 40, от 1 до 30, от 1 до 20 или от 1 до 10.
[0081] В определенных вариантах реализации линкер (L) выбран из группы, состоящей из:











[0084] Несмотря на то, что группа CLM (или ULM) и группа PTM могут быть ковалентно присоединены к линкерной группе посредством любой подходящей группы, которая является стабильной с учетом химии линкера, согласно предпочтительным аспектам настоящего изобретения линкер независимо ковалентно связан с группой CLM и группой PTM предпочтительно посредством амида, сложного эфира, сложного тиоэфира, кетогруппы, карбамата (уретана), атома углерода или простого эфира, где каждая из указанных групп может быть встроена по любому участку группы CLM и группы PTM для обеспечения максимального связывания группы CLM с убиквитин-лигазой и группы PTM с белковой мишенью, для которой требуется разрушение. (Следует отметить, что согласно определенным аспектам, если группа PTM представляет собой группу ULM, то белковая мишень, для которой требуется разрушение, представляет собой убиквитин-лигазу, как таковую). Согласно определенным предпочтительным аспектам линкер может быть присоединен к необязательно замещенному алкилу, алкилену, алкену или алкиновой группе, арильной группе или гетероциклической группе при группах CLM и/или PTM.
Типовые PTM
[0085] Согласно предпочтительным аспектам изобретения группа PTM представляет собой группу, которая связывается с белковыми мишенями. Группа PTM направленно действует на разнообразные мишени, которые выбраны из белков, экспрессируемых в клетке, где по меньшей мере часть последовательностей присутствует в клетке и может связываться с группой PTM. Термин «белок» включает последовательности олигопептидов и полипептидов, имеющие достаточную длину, чтобы они могли связываться с группой PTM согласно настоящему изобретению. Любые белки эукариотической системы или микробной системы, включая вирусы, бактерии и грибки, что также определено в настоящем описании, являются мишенями для убиквитинирования, опосредованного соединениями согласно настоящему изобретению. Предпочтительно белковая мишень представляет собой эукариотический белок. Согласно определенным аспектам фрагмент, связывающий белок, представляет собой галогеналкан (предпочтительно С1-С10 алкильную группу, замещенную по меньшей мере одной галогеновой группой, предпочтительно галогеновой группой при дальнем конце алкильной группы (т.е. удаленном от линкера или группы CLM)), который может ковалентно связываться с ферментом дегалогеназой у пациента или субъекта или в диагностическом исследовании.
[0086] Группы PTM согласно настоящему изобретению включают, например, любые фрагменты, которые специфически связываются с белком (связываются с белковой мишенью), и включают в качестве неограничивающих примеров фрагменты небольших молекул, направленно действующие на белки: ингибиторы Hsp90, ингибиторы киназ, ингибиторы HDM2 и MDM2, соединения, направленно действующие на бромодоменсодержащие белки ВЕТ человека, ингибиторы HDAC, ингибиторы лизин-метилтрансферазы человека, ингибиторы ангиогенеза, соединения ядерного гормонального рецептора, иммуноподавляющие соединения и соединения, направленно действующие на арил-углеводородный рецептор (AHR), среди многих прочих. Соединения, описанные ниже, являются примерами некоторых членов указанных девяти типов фрагментов небольших молекул, связывающих белковые мишени. Указанные фрагменты небольших молекул, связывающих белковые мишени, также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы указанных композиций, а также другие небольшие молекулы, которые могут направленно действовать на указанный белок. Указанные связывающие фрагменты присоединены к фрагменту, связывающему убиквитин-лигазу, предпочтительно посредством линкера для размещения белковой мишени (к которой присоединен фрагмент, нацеливающий на белок) поблизости от убиквитин-лигазы для убиквитинирования и разрушения.
[0087] Любой белок, который может связываться с фрагментом, нацеливающим на белок, или группой PTM, который поддается воздействию и разрушается убиквитин-лигазой, представляет собой белковую мишень согласно настоящему изобретению. В общем случае белковые мишени могут включать, например, структурные белки, рецепторы, ферменты, белки клеточной поверхности, белки, участвующие в разнообразных клеточных функциях, включая белки, задействованные при каталитической активности, активности ароматазы, моторной активности, активности геликазы, метаболических процессах (анаболизм и катаболизм), антиокислительной активности, протеолизе, биосинтезе, белки, обладающие киназной активностью, активностью оксиредуктазы, активностью трансферазы, активностью гидролазы, активностью лиазы, активностью изомеразы, активностью лигазы, ферментной регуляторной активностью, активностью сигнального трансдуктора, активностью структурной молекулы, активностью связывания (белков, липидов, углеводов), рецепторной активностью, активностью в процессах клеточной подвижности, мембранного синтеза, клеточной коммуникации, регуляции биологических процессов, развития, дифференцировки клеток, ответа на стимул, белки поведенческих реакций, белки клеточной адгезии, белки, задействованные при гибели клеток, белки, задействованные в транспорте (включая белки, имеющие активность транспортера белков, ядерного транспорта, активность транспортера ионов, активность транспортера каналов, активность носителя, активность пермеазы, секреторную активность, активность транспортера электронов, патогенеза, активность регулятора теплового шока, активность связывания нуклеиновых кислот, активность регулятора транскрипции, активность внеклеточной организации и биогенеза, активность регулятора трансляции). Указанные белки могут включать белки эукариотов и прокариотов, включая человека, в качестве мишеней для медикаментозной терапии, белки других животных, включая домашних животных, микроорганизмы для определения мишеней для антибиотиков и других противомикробных средств и растений, и даже белки вирусов среди многих прочих.
[0088] В других вариантах реализации группа PTM представляет собой галогеналкильную группу, где указанная алкильная группа в общем случае имеет длину в диапазоне от примерно 1 или 2 атомов углерода до примерно 12 атомов углерода, часто, от примерно 2 до 10 атомов углерода, часто, от примерно 3 атомов углерода до примерно 8 атомов углерода, как правило, от примерно 4 атомов углерода до примерно 6 атомов углерода. Галогеналкильные группы в общем случае представляют собой линейные алкильные группы (при этом также можно применять разветвленные алкильные группы) и содержат на конце по меньшей мере одну галогеновую группу, предпочтительно одну галогеновую группу, как правило, одну хлоридную группу. Галогеналкильные РТ группы для применения согласно настоящему изобретению предпочтительно представлены химической структурой -(СН2)v-галоген, где v представляет собой любое целое число от 2 до примерно 12, часто от примерно 3 до примерно 8, как правило, от примерно 4 до примерно 6. Галоген может представлять собой любой галоген, но предпочтительно представляет собой Cl или Br, как правило, Cl.
[0089] В другом варианте реализации в настоящем изобретении предложена библиотека соединений. Библиотека содержит более одного соединения, где каждая композиция имеет формулу А-В, причем А представляет собой фрагмент, связывающий белок пути убиквитина (предпочтительно фрагмент, связывающий Е3 убиквитин-лигазу, что также раскрыто в настоящей заявке), и В представляет собой член молекулярной библиотеки, связывающий белок, и А соединен (предпочтительно посредством линкерного фрагмента) с В, причем фрагмент, связывающий белок пути убиквитина, распознает белок пути убиквитина, в частности Е3 убиквитин-лигазу, такую как цереблон. В конкретном варианте реализации библиотека содержит фрагмент, специфически связывающий цереблон Е3 убиквитин-лигазу, присоединенный к элементам, связывающим случайную белковую мишень (например, к библиотеке химических соединений). Таким образом, белковая мишень предварительно не определена, и способ можно применять для определения активности предполагаемого элемента, связывающего белок, и его фармакологической значимости в качестве мишени по разрушению под действием убиквитин-лигазы.
[0090] Настоящее изобретение можно применять для лечения различных заболеваний и/или болезненных состояний, включая любое заболевание и/или болезненное состояние, при котором происходит дисрегуляция белков, и при котором разрушение белков может оказывать благоприятное действие на пациента.
[0091] Согласно дополнительному аспекту в изобретении предложены терапевтические композиции, содержащие эффективное количество соединения, описанного в настоящей заявке, или его солевой формы и фармацевтически приемлемый носитель, добавку или вспомогательное вещество и необязательно дополнительный биоактивный агент. Терапевтические композиции модулируют разрушение белка у пациента или субъекта, например, у животного, такого как человек, и их можно применять для лечения или ослабления заболеваний или болезненных состояний, которые модулируются разрушаемым белком. В определенных вариантах реализации терапевтические композиции, описанные в настоящей заявке, можно применять для разрушения указанных белков для лечения или ослабления заболевания, например, рака. В определенных дополнительных вариантах реализации заболевание представляет собой множественную миелому.
[0092] Согласно альтернативным аспектам настоящее изобретение относится к способу лечения болезненного состояния или ослабления симптомов заболевания или состояния у субъекта, нуждающегося в этом, путем разрушения белка или полипептида, который модулирует заболевание или болезненное состояние, включающему введение указанному пациенту или субъекту эффективного количества, например, терапевтически эффективного количества, по меньшей мере одного соединения, описанного выше в настоящей заявке, необязательно в комбинации с фармацевтически приемлемым носителем, добавкой или вспомогательным веществом и необязательно дополнительного биоактивного агента, где композиция является эффективной в отношении лечения или ослабления заболевания или нарушения или симптома у субъекта. Способ согласно настоящему изобретению можно применять для лечения большого числа заболеваний или болезненных состояний, включая рак, посредством введения эффективных количеств по меньшей мере одного соединения, описанного в настоящей заявке. Заболевание или болезненное состояние может представлять собой заболевание, вызванное микробным агентом или другим экзогенным агентом, таким как вирус, бактерия, грибок, простейший организм или другой микроорганизм, или может представлять собой болезненное состояние, вызванное повышенной экспрессией белка, которая вызывает заболевание и/или болезненное состояние.
[0093] Согласно другому аспекту в изобретении предложены способы выявления действия соединений согласно настоящему изобретению в отношении разрушения указанных белков в биологической системе.
[0094] Термин «белковая мишень» используют для описания белка или полипептида, который является мишенью для связывания с соединением согласно настоящему изобретению и разрушения под действием убиквитин-лигазы согласно настоящему описанию. Указанные фрагменты небольших молекул, направленно действующие на белковую мишень, также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы указанных композиций, а также другие небольшие молекулы, которые могут направленно действовать на указанный белок. Указанные связывающие фрагменты при соединены к группам CLM или ULM посредством линкерных групп L.
[0095] Белковые мишени, которые могут присоединяться к фрагменту, нацеливающему на белок, и разрушаться под действием лигазы, к которой присоединен фрагмент, связывающий убиквитин-лигазу, включают любые белки или пептиды, включая их фрагменты, аналоги и/или гомологи. Белковые мишени включают белки и пептиды, имеющие любую биологическую функцию или активность, включая структурную, регуляторную, гормональную, ферментную, генетическую, иммунологическую, сократительную функцию, функцию хранения, транспортировки и сигнальной трансдукции. В определенных вариантах реализации белковые мишени включают структурные белки, рецепторы, ферменты, белки клеточной поверхности, белки, участвующие в разнообразных клеточных функциях, включая белки, задействованные при каталитической активности, активности ароматазы, моторной активности, активности геликазы, метаболических процессах (анаболизм и катаболизм), антиокислительной активности, протеолизе, биосинтезе, белки, обладающие киназной активностью, активностью оксиредуктазы, активностью трансферазы, активностью гидролазы, активностью лиазы, активностью изомеразы, активностью лигазы, ферментной регуляторной активностью, активностью сигнального трансдуктора, активностью структурной молекулы, активностью связывания (белков, липидов, углеводов), рецепторной активностью, активностью в процессах клеточной подвижности, мембранного синтеза, клеточной коммуникации, регуляции биологических процессов, развития, дифференцировки клеток, ответа на стимул, белки поведенческих реакций, белки клеточной адгезии, белки, задействованные при гибели клеток, белки, задействованные в транспорте (включая белки, имеющие активность транспортера белков, ядерного транспорта, активность транспортера ионов, активность транспортера каналов, активность носителя, активность пермеазы, секреторную активность, активность транспортера электронов, патогенеза, активность регулятора теплового шока, активность связывания нуклеиновых кислот, активность регулятора транскрипции, активность внеклеточной организации и биогенеза, активность регулятора трансляции). Указанные белки могут включать белки эукариотов и прокариотов, включая микроорганизмы, вирусы, грибки и паразиты, включая человека, микроорганизмы, вирусы, грибки и паразиты, в качестве мишеней для медикаментозной терапии, белки других животных, включая домашних животных, микроорганизмы для определения мишеней для антибиотиков и других противомикробных средств и растений, и даже белки вирусов среди многих прочих.
[0096] Более конкретно, некоторые мишени для лекарственных терапевтических средств для применения у человека представляют собой белковые мишени, с которыми может связываться фрагмент, нацеливающий на белок, и которые встраиваются в соединения согласно настоящему изобретению. Указанные мишени включают белки, которые можно применять для восстановления функции при разнообразных полигенных заболеваниях, включая, например, B7.1 и B7, TINFRlm, TNFR2, НАДФН оксидазу, BclIBax и другие партнеры в пути апоптоза, рецептор С5а, HMG-CoA редуктазу, фосфодиэстеразутипа ФДЭ-V, фосфодиэстеразу 4 типа ФДЭ-IV, ФДЭ-I, ФДЭ-II, ФДЭ-III, ингибитор скваленциклазы, CXCR1, CXCR2, синтазу оксида азота (NO), циклооксигеназу 1, циклооксигеназу 2, рецепторы 5HT, рецепторы дофамина, G белки, т.е. Gq, рецепторы гистамина, 5-липоксигеназу, триптазу, сериновую протеазу, тимидилат-синтазу, пурин-нуклеозидфосфорилазу, трипаносомальный GAPDH, гликоген-фосфорилазу, карбоангидразу, рецепторы хемокинов, JAW STAT, RXR и аналоги, протеазу 1 ВИЧ, интегразу 1 ВИЧ, белки вируса гриппа, нейраминидазу, обратную транскриптазу вируса гепатита В, натриевый канал, белок множественной лекарственной устойчивости (MDR), P-гликопротеин (и MRP), тирозинкиназы, CD23, CD124, тирозинкиназу р56, lck, CD4, CD5, рецептор IL-2, рецептор IL-1, рецептор ФНО-альфа, ICAM1, каналы Cat+, VCAM, интегрин VLA-4, селектины, CD40/CD40L, нейрокинины и рецепторы, инозинмонофосфатдегидрогеназу, р38 МАР киназу, путь RaslRaflMEWERK, интерлейкин-1-превращающий фермент, каспазу, протеазу NS3 ВГС, РНК геликазу NS3 ВГС, глицинамидрибонуклеотидформилтрансферазу, протеазу 3С риновируса, протеазу вируса простого герпеса-1 (ВПГ-I), протеазу цитомегаловируса (ЦМВ), поли(АДФ-рибоза)полимеразу, циклин-зависимые киназы, фактор роста эндотелия сосудов, рецептор окситоцина, ингибитор микросомального транспортного белка, ингибитор транспорта желчных кислот, ингибиторы 5-альфа-редуктазы, ангиотензин 11, рецептор глицина, рецептор повторного захвата норадреналина, рецепторы эндотелина, нейропептид Y и рецептор, рецепторы эстрогена, рецепторы андрогена, рецепторы аденозина, аденозинкиназу и АМФ-деаминазу, пуринергические рецепторы (P2Y1, P2Y2, P2Y4, P2Y6, P2X1-7), фарнезилтрансферазы, геранилгеранилтрансферазу, рецептор TrkA NGF, бета-амилоид, тирозинкиназу Flk-IIKDR, рецептор витронектина, рецептор интегрина, Her-21 neu, ингибитор теломеразы, цитозольную фосфолипазу А2 и рецепторную тирозинкиназу EGF. Дополнительные белковые мишени включают, например, экдизон-20-монооксигеназу, ионный канал GABA-зависимого хлоридного канала, ацетилхолинэстеразу, белок потенциалозависимого натриевого канала, канал высвобождения кальция и хлоридные каналы. Дополнительные белковые мишени включают ацетил-СоА карбоксилазу, аденилсукцинат-синтетазу, протопорфириноген-оксидазу и енолпирувил-шикимат-фосфат-синтазу.
[0097] Ферменты галогеналкандегалогеназы являются другой мишенью для специфических соединений согласно настоящему изобретению. Соединения согласно настоящему изобретению, которые содержат хлоралкановые фрагменты, связывающие пептид (С1-С12, как правило, примерно С2-С10 галогеналкильные группы), можно применять для ингибирования и/или разрушения фермента галогеналкандегалогеназы, который применяют в химерных белках или родственных диагностических белках, таких как описано в заявке PCT/US2012/063401, поданной 6 декабря 2011 года и опубликованной как WO 2012/078559 14 июня 2012 года, содержание которой включено в настоящую заявку посредством ссылки.
[0098] Указанные различные белковые мишени можно применять для скрининга, при помощи которого выявляют фрагменты соединений, которые связываются с белком, и в зависимости от уровня встраивания фрагмента в соединения согласно настоящему изобретению можно изменять уровень активности белка для достижения конечного терапевтического результата.
[0099] Термин «фрагмент, нацеливающий на белок» или PTM используют для описания небольшой молекулы, которая связывается с белковой мишенью или другим указанным белком или полипептидом и размещает/обеспечивает указанный белок или полипептид поблизости от убиквитин-лигазы, за счет чего может происходить разрушение белка или полипептида под действием убиквитин-лигазы. Неограничивающие примеры фрагментов небольших молекул, связывающих белковую мишень, включают ингибиторы Hsp90, ингибиторы киназ, ингибиторы MDM2, соединения, направленно действующие на бромодоменсодержащие белки ВЕТ человека, ингибиторы HDAC, ингибиторы лизин-метилтрансферазы человека, ингибиторы ангиогенеза, иммуноподавляющие соединения и соединения, направленно действующие на арил-углеводородный рецептор (AHR), среди многих прочих. Композиции, описанные ниже, содержат некоторые представители указанных девяти типов малых молекул, нацеливающих на белки.
[00100] Типовые фрагменты, направленно действующие на белки, согласно настоящему изобретению включают ингибиторы галогеналкангалогеназы, ингибиторы Hsp90, ингибиторы киназ, ингибиторы MDM2, соединения, направленно действующие на бромодоменсодержащие белки ВЕТ человека, ингибиторы HDAC, ингибиторы лизин-метилтрансферазы человека, ингибиторы ангиогенеза, иммуноподавляющие соединения и соединения, направленно действующие на арил-углеводородный рецептор (AHR).
[00101] Композиции, описанные ниже, содержат некоторые члены указанных типов фрагментов небольших молекул, связывающих белковую мишень. Указанные фрагменты небольших молекул, связывающие белковую мишень, также включают фармацевтически приемлемые соли, энантиомеры, сольваты и полиморфы указанных композиций, а также другие небольшие молекулы, которые могут направленно действовать на указанный белок. Содержание работ, приведенных в настоящем описании, включено в настоящую заявку во всей полноте посредством ссылок.
I. Ингибиторы белка теплового шока 90 (HSP90)
[00102] Ингибиторы HSP90, применяемые в настоящем изобретении, включают следующие, но не ограничиваются ими:
[00103] 1. Ингибиторы HSP90, описанные в Vallee, et al., ''Tricyclic Series of Heat Shock Protein 90 (HSP90) Inhibitors Part I: Discovery of Tricyclic Imidazo[4,5-C]Pyridines as Potent Inhibitors of the HSP90 Molecular Chaperone (2011) J.Med.Chem. 54: 7206'', включая YKB (N-[4-(3Н-имидазо[4,5-C]пиридин-2-ил)-9Н-флуорен-9-ил]сукцинамид):
их производные, где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальную амидную группу;
[00104] 2. Ингибитор HSP90 p54 (модифицированный) (8-[(2,4-диметилфенил)-сульфанил]-3-пент-4-ин-1-ил-3Н-пурин-6-амин):
где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальную ацетиленовую группу;
[00105] 3. Ингибиторы HSP90 (модифицированные), описанные в Brough, et al., ''4,5-Diarylisoxazole HSP90 Chaperone Inhibitors: Potential Therapeutic Agents for the Treatment of Cancer'', J.MED.CHEM. vol: 51, стр. 196 (2008), включая соединение 2GJ (5-[2,4-дигидрокси-5-(1-метилэтил)фенил]-н-этил-4-[4-(морфолин-4-илметил)фенил]изоксазол-3-карбоксамид), имеющее структуру:
его производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через амидную группу (по амину или алкильной группе при амине);
[00106] 4. Ингибиторы HSP90 (модифицированные), описанные в Wright, et al., Structure-Activity Relationships in Purine-Based Inhibitor Binding to HSP90 Isoforms, Chem Biol. 2004 Jun;11(6):775-85, включая ингибитор HSP90 PU3, имеющий структуру:
где линкерная группа L или -(L-CLM) присоединена, например, через бутильную группу; и
[00107] 5. Ингибитор HSP90 гелданамицин ((4E,6Z,8S,9S,10E,12S,13R,14S,16R)-13-гидрокси-8,14,19-триметокси-4,10,12,16-тетраметил-3,20,22-триоксо-2-азабицикло[16.3.1] (производное) или любое из его производных (например, 17-алкиламино-17-десметоксигелданамицин («17-AAG») или 17-(2-диметиламиноэтил)амино-17-десметоксигелданамицин («17-DMAG»))) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через амидную группу).
II. Ингибиторы киназ и фосфатазы
[00108] Ингибиторы киназ, применяемые в настоящем изобретении, включают следующие, но не ограничиваются ими:
[00109] 1. Ингибитор тирозинкиназы на основе эрлотиниба:
где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, через простую эфирную группу;
[00110] 2. Ингибитор киназы сунитиниб (производное):
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фрагменту пиррола);
[00111] 3. Ингибитор киназы сорафениб (производное):
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к амидному фрагменту);
[00112] 4. Ингибитор киназы десатиниб (производное):
(производное, где R представляет собой линкерную группу L или -(L-CLM), присоединенную, например, к пиримидину);
[00113] 5. Ингибитор киназы лапатиниб (производное):
(производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальный метил сульфонилметильной группы);
[00114] 6. Ингибитор киназы U09-CX-5279 (производное):

производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через амин (анилин), карбоновую кислоту или альфа-амин относительно циклопропильной группы или через циклопропильную группу;
[00115] 7. Ингибиторы киназ, описанные в Millan, et al., Design and Synthesis of Inhaled P38 Inhibitors for the Treatment of Chronic Obstructive Pulmonary Disease, J.MED.CHEM. vol:54, стр.: 7797 (2011), включая ингибиторы киназ Y1W и Y1X (производные), имеющие структуры:
Y1X (1-этил-3-(2-{[3-(1-метилэтил)[1,2,4]триазоло[4,3-a]пиридин-6-ил]сульфанил}бензил)мочевина)
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через изопропильную группу;
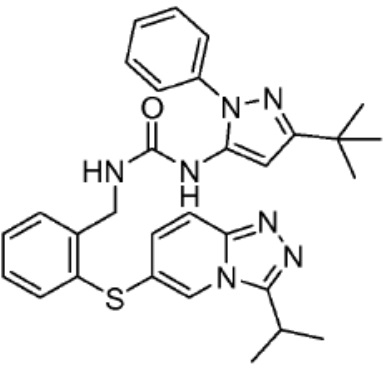
Y1W
1-(3-трет-бутил-1-фенил-1Н-пиразол-5-ил)-3-(2-{[3-(1-метилэтил)[1,2,4]триазоло[4,3-a]пиридин-6-ил]сульфанил}бензил)мочевина
производное, где линкерная группа L или группа -(L-CLM) предпочтительно присоединена, например, через изопропильную группу или трет-бутильную группу;
[00116] 8. Ингибиторы киназ, описанные в Schenkel, et al., Discovery of Potent and Highly Selective Thienopyridine Janus Kinase 2 Inhibitors J. Med. Chem., 2011, 54 (24), стр. 8440-8450, включая соединения 6TP и 0TP (производные), имеющие структуры:
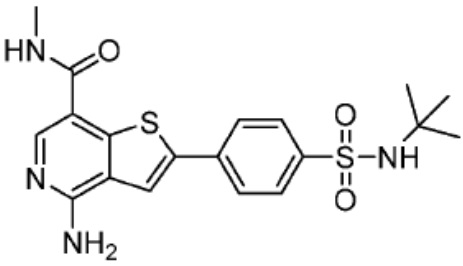
6ТР
4-амино-2-[4-(трет-бутилсульфамоил)фенил]-N-метилтиено[3,2-c]пиридин-7-карбоксамид
тиенопиридин 19
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальную метильную группу, присоединенную к амидному фрагменту;
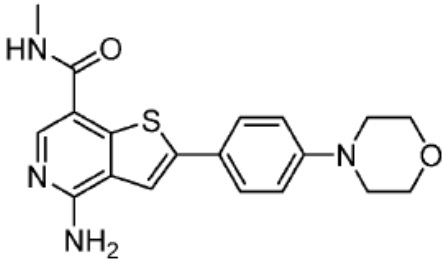
0TP
4-амино-N-метил-2-[4-(морфолин-4-ил)фенил]тиено[3,2-c]пиридин-7-карбоксамид
тиенопиридин 8
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальную метильную группу, присоединенную к амидному фрагменту;
[00117] 9. Ингибиторы киназ, описанные в Van Eis, et al., ''2,6-Naphthyridines as potent and selective inhibitors of the novel protein kinase C isozymes'', Biorg. Med. Chem. Lett. 2011 Dec 15;21(24):7367-72, включая ингибитор киназы 07U, имеющий структуру:
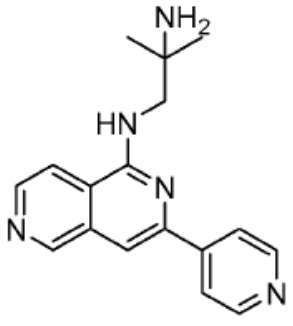
07U
2-метил-N~1~[3-(пиридин-4-ил)-2,6-нафтиридин-1-ил]пропан-1,2-диамин
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через вторичный амин или терминальную аминогруппу;
[00118] 10. Ингибиторы киназ, описанные в Lountos, et al., ''Structural Characterization of Inhibitor Complexes with Checkpoint Kinase 2 (Chk2), a Drug Target for Cancer Therapy'', J.STRUCT.BIOL. vol:176, стр.:292 (2011), включая ингибитор киназы YCF, имеющий структуру:
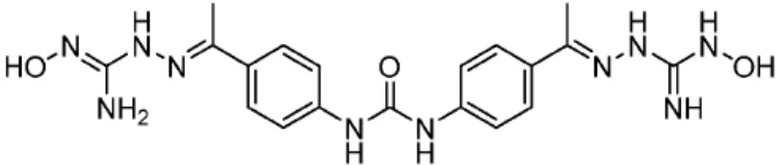
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через любую из терминальных гидроксильных групп;
[00119] 11. Ингибиторы киназ, описанные в Lountos, et al., ''Structural Characterization of Inhibitor Complexes with Checkpoint Kinase 2 (Chk2), a Drug Target for Cancer Therapy'', J.STRUCT.BIOL. vol:176, стр.:292 (2011), включая ингибиторы киназ XK9 и NXP (производные), имеющие структуры:
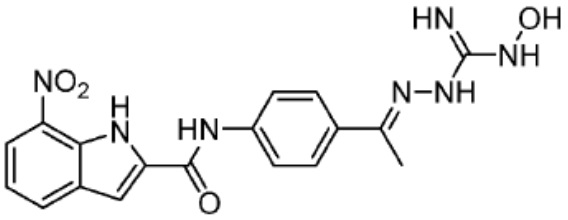
XK9
N-{4-[(1E)-N-(N-гидроксикарбамимидоил)этангидразоноил]фенил}-7-нитро-1Н-индол-2-карбоксамид
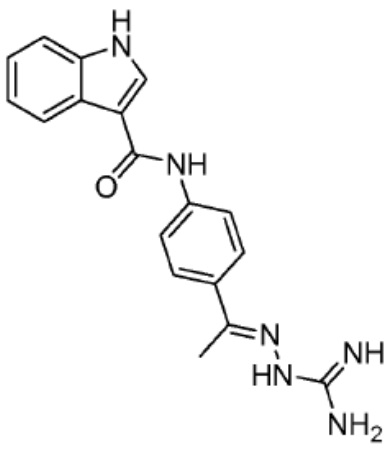
NXP
N-{4-[(1E)-N-карбамимидоилэтангидразоноил]фенил}-1Н-индол-3-карбоксамид
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через терминальную гидроксильную группу (XK9) или группу гидразона (NXP);
[00120] 12. Ингибитор киназы афатиниб (производное) (N-[4-[(3-хлор-4-фторфенил)амино]-7-[[(3S)-тетрагидро-3-фуранил]окси]-6-хиназолинил]-4-(диметиламино)-2-бутенамид) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через алифатическую аминогруппу);
[00121] 13. Ингибитор киназы фостаматиниб (производное) ([6-({5-фтор-2-[(3,4,5-триметоксифенил)амино]пиримидин-4-ил}амино)-2,2-диметил-3-оксо-2,3-дигидро-4Н-пиридо[3,2-b]-1,4-оксазин-4-ил]метил динатрия фосфата гексагидрат) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метоксигруппу);
[00122] 14. Ингибитор киназы гефитиниб (производное) (N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолин-4-илпропокси)хиназолин-4-амин):
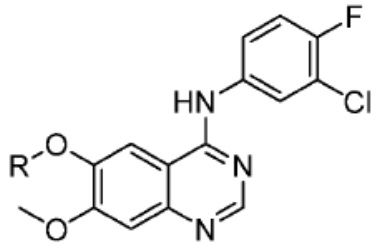
(производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метокси или простую эфирную группу);
[00123] 15. Ингибитор киназы ленватиниб (производное) (4-[3-хлор-4-(циклопропилкарбамоиламино)фенокси]-7-метоксихинолин-6-карбоксамид) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через циклопропильную группу);
[00124] 16. Ингибитор киназы вандетаниб (производное) (N-(4-бром-2-фторфенил)-6-метокси-7-[(1-метилпиперидин-4-ил)метокси]хиназолин-4-амин) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метокси или гидроксильную группу);
[00125] 17. Ингибитор киназы вемурафениб (производное) ({3-[5-(4-хлорфенил)-1Н-пирроло[2,3-b]пиридин-3-карбонил]-2,4-дифторфенил}амид пропан-1-сульфокислоты) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через сульфонилпропильную группу);
[00126] 18. Ингибитор киназы Gleevec (производное):
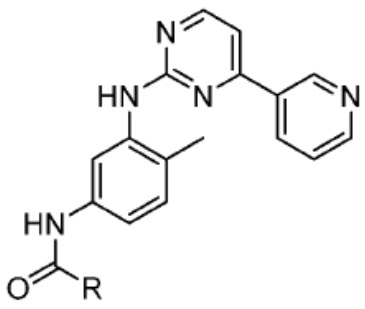
(производное, где R в качестве линкерной группы L или группы -(L-CLM) присоединен, например, через амидную группу или аминогруппу анилина);
[00127] 19. Ингибитор киназы пазопаниб (производное) (ингибитор VEGFR3):

(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту или через аминогруппу анилина);
[00128] 20. Ингибитор киназы AT-9283 (производное), ингибитор Aurora-киназы

(где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту);
[00129] 21. Ингибитор киназы TAE684 (производное), ингибитор ALK
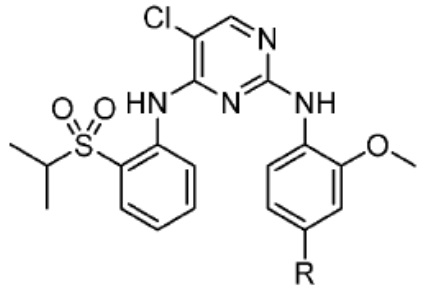
(где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту);
[00130] 22. Ингибитор киназы нилотаниб (производное), ингибитор Abl:
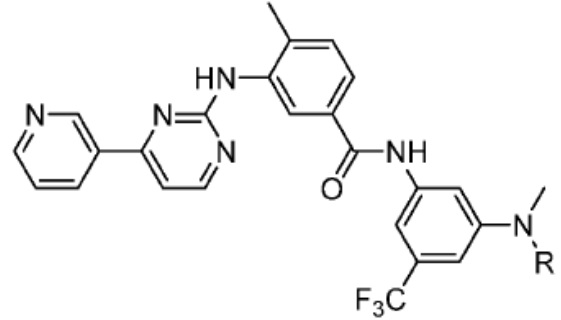
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту или аминогруппе анилина);
[00131] 23. Ингибитор киназы NVP-BSK805 (производное), ингибитор JAK2
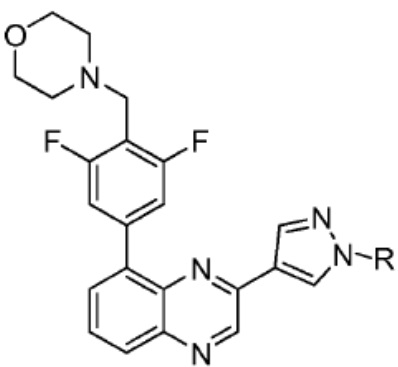
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту или диазольной группе);
[00132] 24. Ингибитор киназы кризотиниб (производное), ингибитор Alk
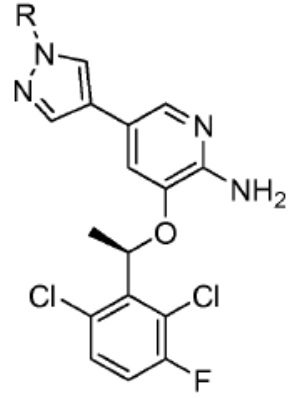
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту или диазольной группе);
[00133] 25. Ингибитор киназы JNJ FMS (производное)
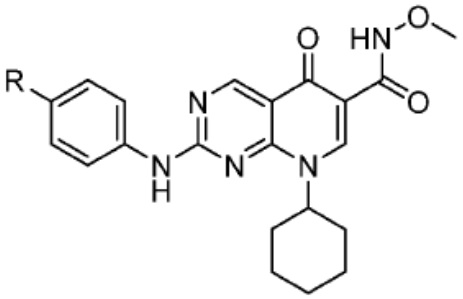
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту);
[00134] 26. Ингибитор киназы форетиниб (производное), ингибитор Met
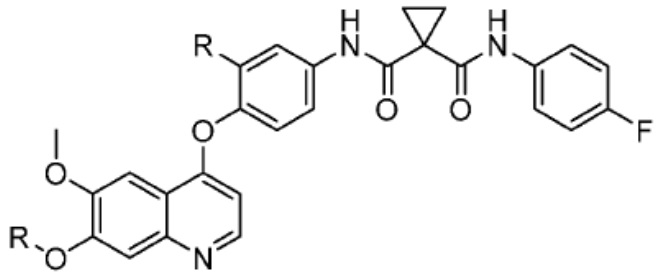
(производное, где R представляет собой линкерную группу L или группу -(L-CLM), присоединенную, например, к фенильному фрагменту или гидроксилу или простой эфирной группе при фрагменте хинолина);
[00135] 27. Аллостерический ингибитор протеинтирозинфосфатазы PTP1B (производное):

где линкерная группа L или группа -(L-CLM) присоединена, например, по указанному положению R;
[00136] 28. Ингибитор домена SHP-2 тирозинфосфатазы (производное):
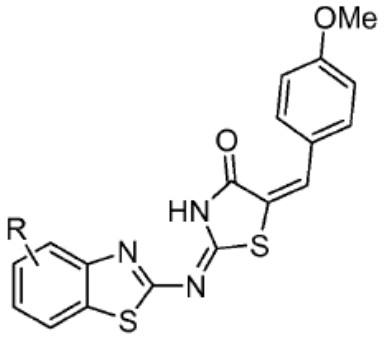
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R;
[00137] 29. Ингибитор (производное) BRAF (BRAFV600E)/MEK:
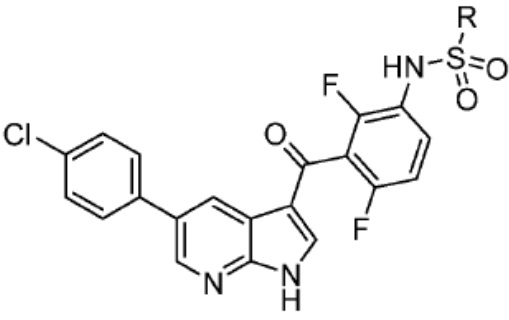
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R;
[00138] 30. Ингибитор (производное) тирозинкиназы ABL
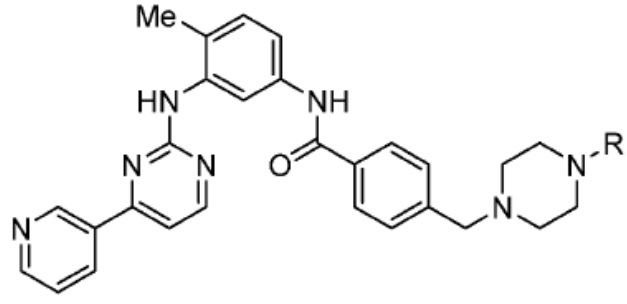
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R;
[00139] 31. Ингибитор киназы OSI-027 (производное), ингибитор mTORC1/2
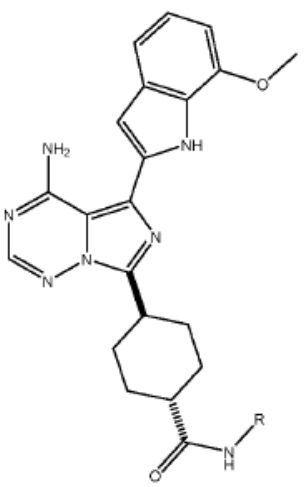
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R;
[00140] 32. Ингибитор киназы OSI-930 (производное), ингибитор c-Kit/KDR
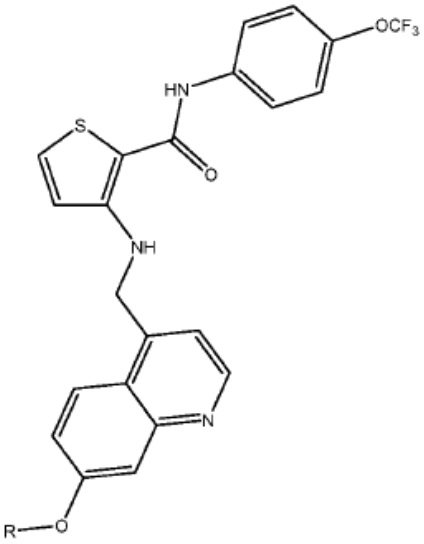
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R; и
[00141] 33. Ингибитор киназы OSI-906 (производное), ингибитор IGF1R/IR
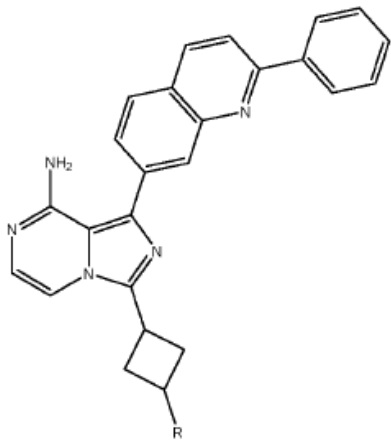
производное, где линкерная группа L или группа -(L-CLM) присоединена, например, по положению R; (производное, где «R» обозначает место присоединения линкерной группы L или группы -(L-CLM) к фрагменту пиперазина).
III. Ингибиторы HDM2/MDM2:
[00142] Ингибиторы HDM2/MDM2, применяемые согласно настоящему изобретению, включают следующие, но не ограничиваются ими:
[00143] 1. Ингибиторы HDM2/MDM2, описанные в Vassilev, et al., In vivo activation of the p53 pathway by small-molecule antagonists of MDM2, SCIENCE vol:303, стр.:844-848 (2004), и Schneekloth, et al., Targeted intracellular protein degradation induced by a small molecule: En route to chemical proteomics, Bioorg. Med. Chem. Lett. 18 (2008) 5904-5908, включая (или в дополнение) соединения нутлин-3, нутлин-2 и нутлин-1 (производные), описанные ниже, а также все их производные и аналоги:
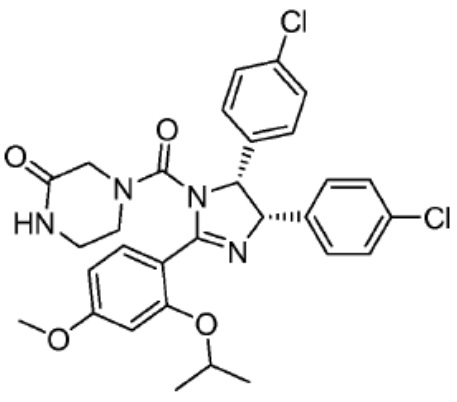
(производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метоксигруппу или как гидроксильная группа);
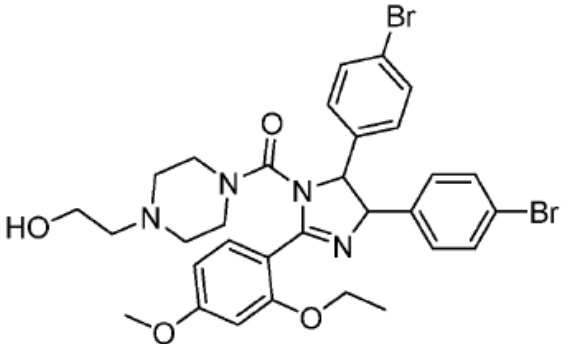
(производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метоксигруппу или гидроксильную группу);
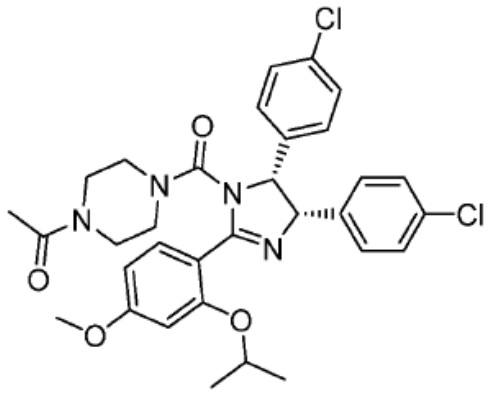
(производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через метоксигруппу или как гидроксильная группа); и
[00144] 2. Транс-4-йод-4'-боранилхалкон
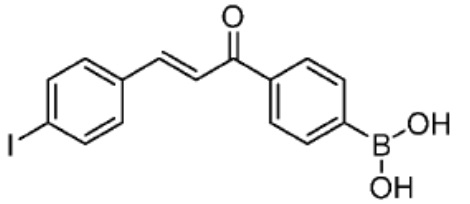
(производное, где линкерная группа L или группа L -(L-CLM) присоединена, например, через гидроксигруппу).
IV. Соединения, направленно действующие на бромодоменсодержащие белки ВЕТ человека:
[00145] Соединения, направленно действующие на бромодоменсодержащие белки ВЕТ человека, включают, но не ограничиваются ими, соединения, ассоциированные с мишенями, такие как описано ниже, где «R» обозначает место для присоединения линкерной группы L или группы -(L-CLM), например:
[00146] 1. JQ1, Filippakopoulos et al. Selective inhibition of BET bromodomains. Nature (2010):
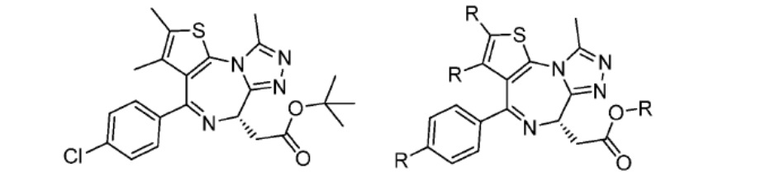
[00147] 2. I-BET, Nicodeme et al. Supression of Inflammation by a Synthetic Histone Mimic. Nature (2010). Chung et al. Discovery and Characterization of Small Molecule Inhibitors of the BET Family Bromodomains. J. Med Chem. (2011):

[00148] 3. Соединения, описанные в Hewings et al. 3,5-Dimethylisoxazoles Act as Acetyl-lysine Bromodomain Ligands. J. Med. Chem. (2011) 54 6761-6770.
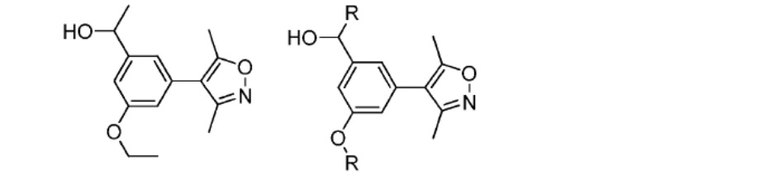
[00149] 4. I-BET151, Dawson et al. Inhibition of BET Recruitment to Chromatin as an Effective Treatment for MLL-fusion Leukemia. Nature (2011):
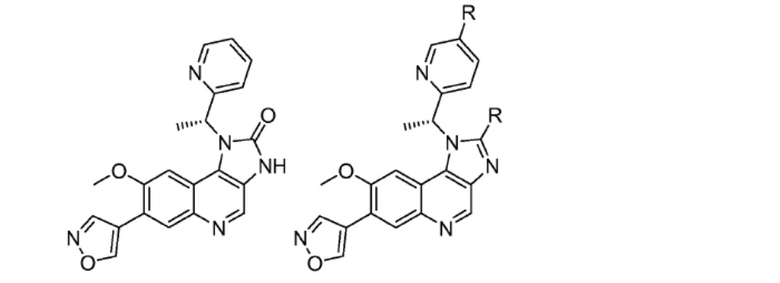
[00150] (где R в каждом случае обозначает место присоединения, например, линкерной группы L или группы -(L-CLM)).
V. Ингибиторы HDAC
[00151] Ингибиторы HDAC (производные) включают следующие, но не ограничиваются ими:
[00152] 1. Finnin, M. S. et al. Structures of Histone Deacetylase Homologue Bound to the TSA and SAHA Inhibitors. Nature 40, 188-193 (1999).

(производное, где «R» обозначает место присоединения, например, линкерной группы L или группы -(L-CLM); и)
[00153] 2. Соединения, такие как определено в формуле (I) в РСТ WO0222577 («ИНГИБИТОРЫ ДЕАЦЕТИЛАЗЫ» («DEACETYLASE INHIBITORS»)) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через гидроксильную группу).
VI. Ингибиторы лизин-метилтрансферазы человека
[00154] Ингибиторы лизин-метилтрансферазы человека включают следующие, но не ограничиваются ими:
[00155] 1. Chang et al. Structural Basis for G9a-like protein Lysine Methyltransferase Inhibition by BIX-1294. Nat. Struct. Biol. (2009) 16(3) 312.

(производное, где «R» обозначает место присоединения, например, линкерной группы L или группы -(L-CLM));
[00156] 2. Liu, F. et al. Discovery of a 2,4-Diamino-7-aminoalkoxyquinazoline as a Potent and Selective Inhibitor of a Histone Methyltransferase G9a. J. Med. Chem. (2009) 52(24) 7950.

(производное, где «R» обозначает возможное место присоединения, например, линкерной группы L или группы -(L-CLM));
[00157] 3. Азацитидин (производное) (4-амино-1-β-D-рибофуранозил-1,3,5-триазин-2(1Н)-он) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через гидрокси- или аминогруппы); и
[00158] 4. Децитабин (производное) (4-амино-1-(2-деокси-b-D-эритропентофуранозил)-1,3,5-триазин-2(1Н)-он) (производное, где линкерная группа L или группа -(L-CLM) присоединена, например, через любую из гидроксильных групп или по аминогруппе).
VII. Ингибиторы ангиогенеза:
[00159] Ингибиторы ангиогенеза включают следующие, но не ограничиваются ими:
[00160] 1. GA-1 (производное) и его производные и аналоги, имеющее(-ие) структуру( ы) и присоединенное(-ые) к линкерам, как описано в Sakamoto, et al., Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation, Mol Cell Proteomics 2003 Dec;2(12):1350-8;
[00161] 2. Эстрадиол (производное), который может быть присоединен к линкерной группе L или группе -(L-CLM), как описано в общем случае в Rodrigues-Gonzalez, et al., Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer, Oncogene (2008) 27, 7201-7211;
[00162] 3. Эстрадиол, тестостерон (производное) и родственные производные, включая, но не ограничиваясь ими, ДГТ и его производные и аналоги, имеющие структуру(-ы) и присоединенные к линкерной группе L или группой -(L-CLM), как описано в общем случае в Sakamoto, et al., Development of Protacs to target cancer-promoting proteins for ubiquitination and degradation, Mol Cell Proteomics 2003 Dec; 2(12):1350-8; и
[00163] 4. Овалицин, фумагиллин (производное) и их производные и аналоги, имеющие структуру(-ы) и присоединенные к линкерной группе L или группе -(L-CLM), как описано в общем случае в Sakamoto, et al., Protacs: chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation Proc Natl Acad Sci USA. 2001 Jul 17;98(15):8554-9, и в патенте США №7208157.
VIII. Иммуноподавляющие соединения:
[00164] Иммуноподавляющие соединения включают следующие, но не ограничиваются ими:
[00165] 1. AP21998 (производное), имеющее структуру(-ы) и присоединенное к линкерной группе L или группе -(L-CLM), как описано в общем случае в Schneekloth, et al., Chemical Genetic Control of Protein Levels: Selective in Vivo Targeted Degradation, J. AM. CHEM. SOC. 2004, 126, 3748-3754;
[00166] 2. Глюкокортикоиды (например, гидрокортизон, преднизон, преднизолон и метилпреднизолон) (производные, где линкерная группа L или группа -(L-CLM) присоединена, например, к любому из гидроксилов) и беклометазона дипропионат (производное, где линкерная группа или -(L-CLM) присоединена, например, к пропионату);
[00167] 3. Метотрексат (производное, где линкерная группа или группа -(L-CLM) может быть присоединена, например, к любому из терминальных гидроксилов);
[00168] 4. Циклоспорин (производное, где линкерная группа или группа -(L-CLM) может быть присоединена, например, по любой из бутильных групп);
[00169] 5. Такролимус (FK-506) и рапамицин (производное, где линкерная группа L или группа -(L-CLM) может быть присоединена, например, по одной ил метоксигрупп); и
[00170] 6. Актиномицины (производное, где линкерная группа L или группа -(L-CLM) может быть присоединена, например, по одной из изопропильных групп).
IX. Соединения, направленно действующие на арил-углеводородный рецептор (AHR):
[00171] Соединения, направленно действующие на арил-углеводородный рецептор (AHR), включают следующие, но не ограничиваются ими:
[00172] 1. Апигенин (измененный для присоединения к линкерной группе L или группе -(L-CLM), как в общем случае проиллюстрировано в Lee, et al., Targeted Degradation of the Aryl Hydrocarbon Receptor by the PROTAC Approach: A Useful Chemical Genetic Tool, ChemBioChem Volume 8, Issue 17, стр. 2058-2062, November 23, 2007); и
[00173] 2. SR1 и LGC006 (измененные для присоединения линкерной группы L или -(L-CLM)), как описано в Boitano, et al., Aryl Hydrocarbon Receptor Antagonists Promote the Expansion of Human Hematopoietic Stem Cells, Science 10 September 2010: Vol. 329 no. 5997, стр. 1345-1348.
Х. Соединения, направленно действующие на рецептор RAF (киназа):
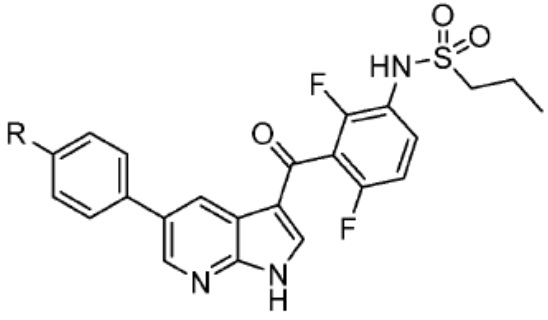
PLX4032
(производное, где «R» обозначает место присоединения, например, линкерной группы L или группы -(L-CLM)).
XI. Соединения, направленно действующие на FKBP:
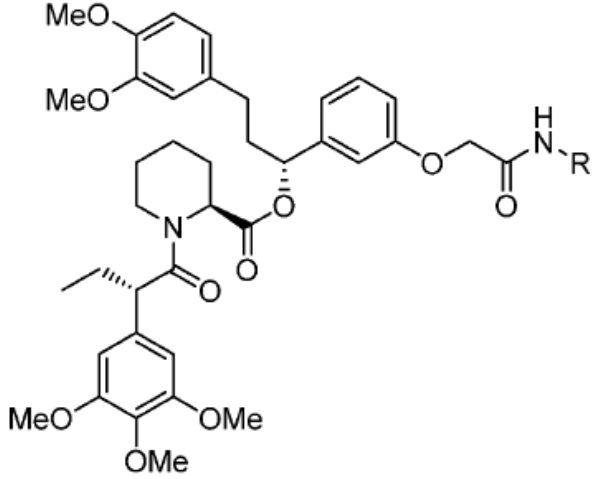
(производное, где R обозначает место присоединения, например, к линкерной группе L или группе -(L-CLM)).
XII. Соединения, направленно действующие на рецептор андрогена (AR)
[00174] 1. Лиганд RU59063 (производное) рецептора андрогена
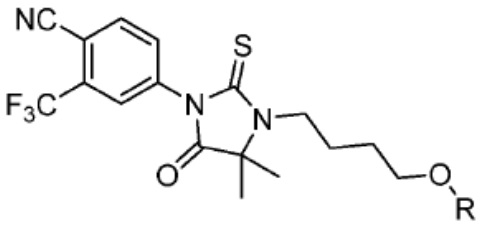
(производное, где «R» обозначает место присоединения, например, к линкерной группе L или группе -(L-CLM)).
[00175] 2. Лиганд SARM (производное) рецептора андрогена

(производное, где «R» обозначает место присоединения, например, к линкерной группе L или группе -(L-CLM)).
[00176] 3. Лиганд ДГТ рецептора андрогена (производное)
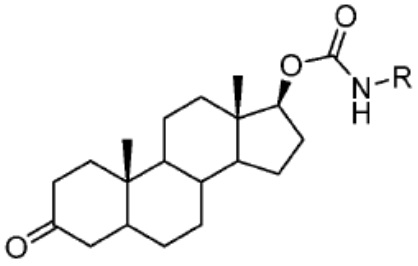
(производное, где «R» обозначает место присоединения, например, к линкерной группе L или группе -(L-CLM)).
[00177] 4. Лиганд MDV3100 (производное)

[00178] 5. Лиганд ARN-509 (производное)

[00179] 6. Гексагидробензизоксазолы

[00180] 7. Тетраметилциклобутаны

XIII. Соединения, направленно действующие на рецептор эстрогена (ER) ICI-182780
[00181] 1. Лиганд рецептора эстрогена
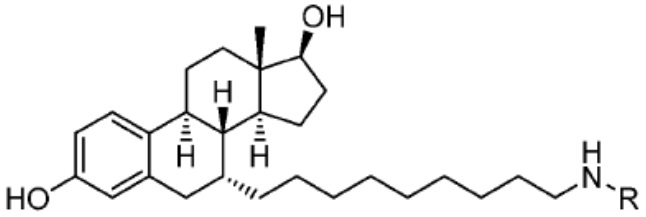
(производное, где «R» обозначает место присоединения линкерной группы L или группы - (L-CLM)).
XIV. Соединения, направленно действующие на рецептор гормона щитовидной железы (TR)
[00182] 1. Лиганд рецептора гормона щитовидной железы (производное)

(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM), и МОМО обозначает метоксиметоксигруппу).
XV. Соединения, направленно действующие на протеазу ВИЧ
[00183] 1. Ингибитор протеазы ВИЧ (производное)
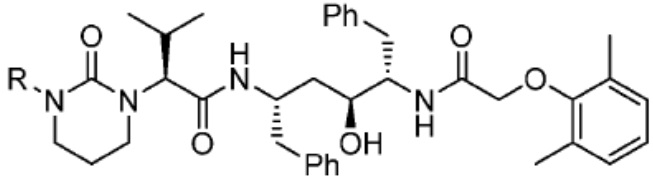
(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM)). См., J. Med. Chem. 2010, 53, 521-538.
[00184] 2. Ингибитор протеазы ВИЧ
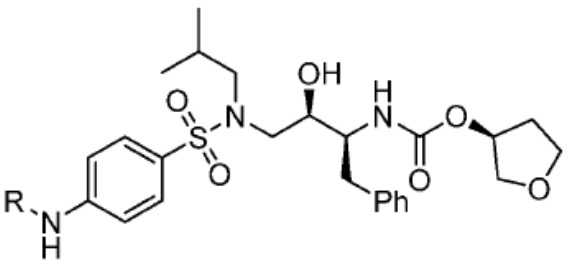
(производное, где «R» обозначает возможное время присоединения к линкерной группе L или группе -(L-CLM)). См., J. Med. Chem. 2010, 53, 521-538.
XVI. Соединения, направленно действующие на интегразу ВИЧ
[00185] 1. Ингибитор интегразы ВИЧ (производное)

(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM)). См., J. Med. Chem. 2010, 53, 6466.
[00186] 2. Ингибитор интегразы ВИЧ (производное)

[00187] 3. Ингибитор интегразы ВИЧ Isetntress (производное)
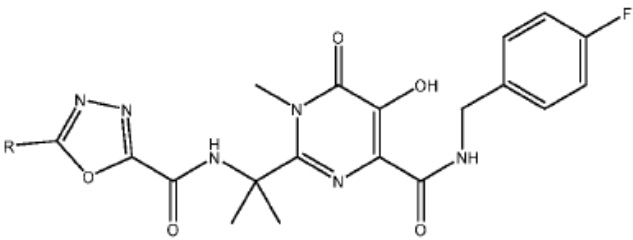
(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM)). См., J. Med. Chem. 2010, 53, 6466.
XVII. Соединения, направленно действующие на протеазу ВГС
[00188] 1. Ингибиторы протеазы ВГС (производное)
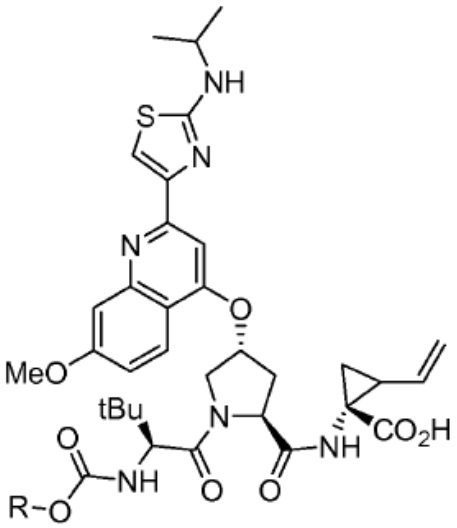
(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM)).
XVIII. Соединения, направленно действующие на ацил-протеинтиоэстеразу-1 и -2 (APT1 и APT2)
[00189] 1. Ингибитор APT1 и APT2 (производное)
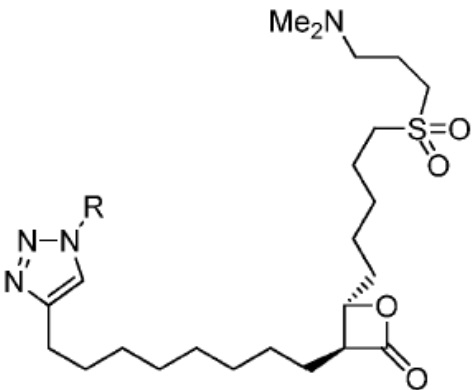
(производное, где «R» обозначает место присоединения к линкерной группе L или группе - (L-CLM)). См., Angew. Chem. Int. Ed. 2011, 50, 9838-9842, где L представляет собой линкерную группу, также описанную в настоящей заявке, и указанная группа CLM также описана в настоящей заявке, и -(L-CLM) соединяет группу CLM с группой PTM, что также определено в настоящей заявке.
Терапевтические композиции
[00190] Фармацевтические композиции, содержащие комбинации эффективного количества по меньшей мере одного бифункционального соединения, описанного в настоящей заявке, и одно или более соединений, также описанных в настоящей заявке, каждое из которых содержится в эффективном количестве, с фармацевтически эффективным количеством носителя, добавки или вспомогательного вещества, представляют собой дополнительный аспект настоящего изобретения.
[00191] Настоящее изобретение включает, если это возможно, композиции, содержащие фармацевтически приемлемые соли, в частности, соли присоединения кислоты или основания соединений, описанных в настоящей заявке. Кислоты, которые применяют для получения фармацевтически приемлемых солей присоединения кислоты вышеуказанных основных соединений, подходящие согласно указанному аспекту, представляют собой кислоты, которые образуют нетоксичные соли присоединения кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис(2-гидрокси-3-нафтоат)] среди многих прочих.
[00192] Фармацевтически приемлемые соли присоединения основания также можно применять для получения фармацевтически приемлемых солевых форм соединений или производных согласно настоящему изобретению. Химические основания, которые можно применять в качестве реагентов для получения фармацевтически приемлемых солей присоединения основания соединений согласно настоящему изобретению, которые по природе являются кислотными, представляют собой основания, которые образуют нетоксичные соли присоединения основания с указанными соединениями. Указанные нетоксичные соли присоединения основания включают, но не ограничиваются ими, соли, полученные из фармакологически приемлемых катионов, таких как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, кальция, цинка и магния), соли присоединения аммония или водорастворимых аминов, такие как соли N-метилглюкамина (меглумина) и низшего алканоламмония и других фармацевтически приемлемых органических аминов, помимо прочего.
[00193] Соединения, описанные в настоящей заявке, можно вводить согласно настоящему изобретению в виде единственной дозы или разделенных доз при помощи перорального, парентерального или местного способов. Введение активного соединения охватывает непрерывное введение (внутривенная капельница) и несколько пероральных введений в день (например, Q.I.D.) и может включать пероральное, местное, парентеральное, внутримышечное, внутривенное, подкожное, чрескожное (которое может включать применение агента, увеличивающего проницаемость), трансбуккальное, подъязычное введение и введение в виде суппозитория, помимо других способов введения. Для увеличения биодоступности соединений при пероральном способе введения также можно применять пероральные таблетки с кишечнорастворимым покрытием. Наиболее эффективная лекарственная форма зависит от фармакокинетики конкретного выбранного агента, а также тяжести заболевания у пациента. Также можно применять способы введения соединений согласно настоящему изобретению в виде спреев, распыляемых составов или аэрозолей для интраназального, интратекального или внутрилегочного введения. Настоящее изобретение, таким образом, также относится к фармацевтическим композициям, содержащим эффективное количество соединения, описанного в настоящей заявке, необязательно в комбинации с фармацевтически приемлемым(-ой) носителем, добавкой или вспомогательным веществом. Соединения согласно настоящему изобретению можно вводить в формах с немедленным высвобождением, промежуточным высвобождением или замедленным или контролируемым высвобождением. Формы с замедленным или контролируемым высвобождением предпочтительно вводят перорально, но также в виде суппозиториев и чрескожных или других местных форм. Внутримышечные инъекции в виде липосом также можно применять для контролируемого или замедленного высвобождения соединения в месте инъекции.
[00194] Композиции, описанные в настоящей заявке, можно получать традиционным образом с применением одного или более фармацевтически приемлемых носителей, и их также можно вводить в виде составов с контролируемым высвобождением. Фармацевтически приемлемые носители, которые можно применять в указанных фармацевтических композициях, включают, но не ограничиваются ими, ионообменные материалы, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как альбумин сыворотки человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как проламина сульфат, гидрофосфат динатрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воски, блоксополимеры полиэтилена-полиоксипропилена, полиэтиленгликоль и ланолин.
[00195] Композиции, описанные в настоящей заявке, можно вводить перорально, парентерально, с применением ингалируемого спрея, местно, ректально, интраназально, трансбуккально, внутривагинально или посредством имплантируемого резервуара. Термин «парентеральный» при использовании в настоящем описании включает способы подкожной, внутривенной, внутримышечной, внутрисуставной, интрасиновиальной, интрастернальной, интратекальной, внутрипеченочной, внутриочаговой и интракраниальной инъекции или инфузии. Предпочтительно композиции вводят перорально, интраперитонеально или внутривенно.
[00196] Стерильные инъецируемые формы композиций, описанных в настоящей заявке, могут представлять собой водную или масляную суспензию. Указанные суспензии можно получать согласно способам, известным в данной области техники, с применением подходящих диспергирующих агентов или увлажнителей и суспендирующих агентов. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, раствор в 1,3-бутандиоле. В число приемлемых носителей или растворителей, которые можно применять, входят вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды традиционно применяют стерильные нелетучие масла. Для указанной задачи можно применять любые мягкие нелетучие масла, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, подходят для получения инъецируемых препаратов так же, как и природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, в частности в полиоксиэтилированных формах. Указанные масляные растворы или суспензии также могут содержать разбавитель или диспергирующий агент на основе длинноцепочечного спирта, такого как описано в Ph. Helv. (фармакопея Швейцарии) или схожего спирта.
[00197] Фармацевтические композиции, описанные в настоящей заявке, можно вводить перорально в любой пероральной приемлемой лекарственной форме, включая, но не ограничиваясь ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения традиционно применяемые носители включают лактозу и кукурузный крахмал. Также, как правило, добавляют смазывающие агенты, такие как стеарат магния. Разбавители, подходящие для перорального введения в виде капсулы, включают лактозу и высушенный кукурузный крахмал. Если для перорального применения требуются водные суспензии, то активный ингредиент объединяют с эмульгаторами или суспендирующими агентами. При желании, также можно добавлять определенные подсластители, вкусоароматические добавки или красители.
[00198] В качестве альтернативы фармацевтические композиции, описанные в настоящей заявке, можно вводить в виде суппозиториев для ректального введения, которые можно получать путем смешения агента с подходящим нераздражающим вспомогательным веществом, которое является твердым при комнатной температуре, но жидким при температуре в прямой кишке и, таким образом, плавится в толстой кишке для высвобождения лекарственного средства. Указанные вещества включают масло какао, пчелиный воск и полиэтиленгликоли.
[00199] Фармацевтические композиции, описанные в настоящей заявке, также можно вводить местно. Подходящие местные составы можно легко получать для каждого из указанных участков или органов. Местное введение для нижних отделов кишечного тракта можно проводить в виде состава в форме ректального суппозитория (см. выше) или подходящего состава в форме клизмы. Также можно применять чрескожные пластыри, приемлемые для местного введения.
[00200] В случае местного нанесения фармацевтические композиции можно получать в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений согласно настоящему изобретению включают, но не ограничиваются ими, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, соединения полиоксипропилена, эмульгирующий воск и воду. Согласно определенным предпочтительным аспектам изобретения соединения можно наносить в качестве покрытия стента, который хирургически имплантируют пациенту для подавления или снижения вероятности возникновения окклюзии в стенте у пациента.
[00201] В качестве альтернативы фармацевтические композиции можно получать в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одной или более фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются ими, минеральное масло, сорбитана моностеарат, полисорбат 60, воск на основе сложных цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
[00202] Для офтальмологического применения фармацевтические композиции можно получать в виде измельченных суспензий в изотоническом стерильном растворе с регулируемым рН или предпочтительно в виде растворов в изотоническом стерильном солевом растворе с регулируемым рН с добавлением консерванта, такого как хлорид бензалкония, или без него. В качестве альтернативы для офтальмологического применения можно получать фармацевтические композиции в виде мази, например, в вазелине.
[00203] Фармацевтические композиции, описанные в настоящей заявке, также можно вводить в виде интраназального аэрозоля или ингалируемого состава. Указанные композиции получают согласно способам, хорошо известным в области получения фармацевтических составов, и их можно получать в виде растворов в солевом растворе с применением бензилового спирта или других подходящих консервантов, ускорителей всасывания для увеличения биодоступности, фторуглеродов и/или других традиционных агентов, увеличивающих растворимость, или диспергирующих агентов.
[00204] Количество соединения в фармацевтической композиции, описанной в настоящей заявке, которое можно объединять с веществами-носителями для получения лекарственной формы с однократной дозировкой, может быть различным в зависимости от хозяина и заболевания, подвергающегося лечению, конкретного способа введения. Предпочтительно композиции следует получать таким образом, чтобы они содержали от примерно 0,05 миллиграмма до примерно 750 миллиграммов, более предпочтительно от примерно 1 миллиграмма до примерно 600 миллиграммов и еще более предпочтительно от примерно 10 миллиграммов до примерно 500 миллиграммов активного ингредиента отдельно или в комбинации по меньшей мере с одним другим соединением согласно настоящему изобретению.
[00205] Также следует понимать, что конкретная дозировка и схема лечения для любого конкретного пациента зависят от различных факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, рацион, время введения, скорость выведения, комбинацию лекарственных средств, выбор лечащего врача и тяжесть конкретного заболевания или состояния, подвергающегося лечению.
[00206] Пациента или субъекта, нуждающегося в терапии с применением соединений согласно способам, описанным в настоящей заявке, можно подвергать лечению путем введения пациенту (субъекту) эффективного количества соединения согласно настоящему изобретению, включая его фармацевтически приемлемые соли, сольваты или полиморфы, необязательно в фармацевтически приемлемом носителе или разбавителе отдельно или в комбинации с другими известными агентами, стимулирующими эритропоэз, которые также определены в настоящей заявке.
[00207] Указанные соединения можно вводить при помощи любого соответствующего способа, например, перорально, парентерально, внутривенно, внутрикожно, подкожно или местно, включая чрескожное введение, введение в виде жидкости, крема, геля или твердой формы или в виде аэрозоля.
[00208] Активное соединение вводят в фармацевтически приемлемый носитель или разбавитель в количестве, которое является достаточным для доставки пациенту терапевтически эффективного количества для целевого показания в отсутствие серьезных токсических эффектов у пациента, подвергающегося лечению. Предпочтительная доза активного соединения для всех указанных в настоящей заявке состояний находится в диапазоне от примерно 10 нг/кг до 300 мг/кг, предпочтительно от 0,1 до 100 мг/кг в день, как правило, от 0,5 до примерно 25 мг на килограмм массы тела потребителя/пациента в день. Типовая местная дозировка находится в диапазоне 0,01-5% (масс./масс.) в подходящем носителе.
[00209] Соединение эффективно вводят в любой подходящей стандартной лекарственной форме, включая, но не ограничиваясь ими, форму, содержащую менее 1 мг, от 1 мг до 3000 мг, предпочтительно от 5 до 500 мг активного ингредиента в стандартной лекарственной форме. Как правило, эффективной является пероральная дозировка, составляющая 25-250 мг.
[00210] Активный ингредиент предпочтительно вводят для обеспечения максимальной концентрации активного соединения в плазме, составляющей примерно 0,00001-30 мМ, предпочтительно 0,1-30 мкМ, что можно обеспечивать, например, путем внутривенной инъекции раствора или состава активного ингредиента необязательно в солевом растворе или в водной среде, или вводят в виде болюса активного ингредиента. Пероральное введение также подходит для обеспечения эффективной концентрации активного агента в плазме.
[00211] Концентрация активного соединения в композиции лекарственного средства зависит от скорости всасывания, распределения, инактивации и выведения лекарственного средства, а также других факторов, известных специалистам в данной области техники. Следует отметить, что дозировки также могут быть различными в зависимости от тяжести состояния, для которого требуется ослабление. Также следует понимать, что для любого конкретного субъекта со временем можно регулировать конкретную схему введения в соответствии с индивидуальными требованиями и профессиональным выбором персонала, который вводит или контролирует введение композиций, и что диапазоны концентрации, приведенные в настоящем описании, приведены исключительно в качестве примеров, и они не ограничивают объем или варианты реализации предложенной композиции. Активный ингредиент можно вводить за один раз или разделять на несколько более мелких доз, которые вводят с различными интервалами.
[00212] Пероральные композиции в общем случае содержат инертный разбавитель или пищевой носитель. Композиции могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для задач перорального терапевтического введения активное соединение или его пролекарственное производное можно включать в состав совместно со вспомогательными веществами и применять в виде таблеток, пастилок или капсул. В качестве компонентов композиции можно включать фармацевтические совместимые связывающие агенты и/или вещества-адъюванты.
[00213] Таблетки, пилюли, капсулы, пастилки и т.д. могут содержать любые из следующих ингредиентов или соединения схожей природы: связывающие вещества, такие как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательные вещества, такие как крахмал или лактоза, диспергирующий агент, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающие вещества, такие как стеарат магния или Sterotes; глиданты, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; или вкусоароматические добавки, такие как перечная мята, метилсалицилат или апельсиновая вкусовая добавка. Если стандартная лекарственная форма представляет собой капсулу, она может содержать помимо веществ определенного выше типа жидкий носитель, такой как жирное масло. Кроме того, стандартные лекарственные формы могут содержать различные другие вещества, которые модифицируют физический вид стандартной лекарственной формы, например, покрытия из сахара, шеллака или кишечнорастворимых агентов.
[00214] Активное соединение или его фармацевтически приемлемую соль можно вводить в качестве компонента эликсира, суспензии, сиропа, облатки, жевательного леденца и т.д. Сироп может содержать помимо активных соединений сахарозу в качестве подсластителя и определенные консерванты, красящие вещества и красители и вкусоароматические добавки.
[00215] Активное соединение или его фармацевтически приемлемые соли также можно смешивать с другими активными веществами, которые не нарушают целевое действие, или с веществами, которые дополняют целевое действие, такими как агенты, стимулирующие эритропоэтин, включая ЭПО и дарбэпоэтин альфа помимо прочих. Согласно определенным предпочтительным аспектам изобретения одно или более соединений согласно настоящему изобретению вводят совместно с другим биоактивным агентом, таким как агент, стимулирующий эритропоэтин, или агент для заживления ран, включая антибиотик, что также описано в настоящей заявке.
[00216] Растворы или суспензии, применяемые для парентерального, внутрикожного, подкожного или местного введения, могут содержать следующие компоненты: стерильный разбавитель, такой как вода для инъекции, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие агенты, такие как этилендиаминтетрауксусная кислота; буферные агенты, такие как ацетаты, цитраты или фосфаты и агенты для регулировки тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат можно вводить в ампулы, одноразовые шприцы или пробирки, содержащие несколько доз, изготовленные из стекла или пластика.
[00217] В случае внутривенного введения предпочтительными носителями являются физиологический солевой раствор или фосфатный буферный солевой раствор (PBS).
[00218] В одном из вариантов реализации активные соединения получают совместно с носителями, которые защищают соединение от быстрого выведения из организма, например, в составе с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно применять биоразлагаемые биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения указанных составов хорошо известны специалистам в данной области техники.
[00219] Суспензии липосом также могут представлять собой фармацевтически приемлемые носители, и их можно получать согласно способам, известным специалистам в данной области техники, например, описанным в патенте США №4522811 (содержание которого включено в настоящую заявку во всей полноте посредством ссылки). Например, составы в виде липосом можно получать путем растворения соответствующего(-их) липида(-ов) (такого как стеароилфосфатидилэтаноламин, стеароилфосфатидилхолин, арахадоилфосфатидилхолин и холестерин) в неорганическом растворителе, который затем выпаривают с получением тонкой пленки высушенного липида на поверхности контейнера. Затем водный раствор активного соединения вводят в контейнер. Затем контейнер перемешивают вручную для удаления липидного материала от стенок контейнера и диспергирования агрегатов липидов и образования тем самым суспензии липосом.
Терапевтические способы
[00220] Согласно дополнительному аспекту в изобретении предложены терапевтические композиции, содержащие эффективное количество соединения, описанного в настоящей заявке, или его солевой формы и фармацевтически приемлемый носитель. Терапевтические композиции модулируют разрушение белка у пациента или субъекта, например, у животного, такого как человек, и их можно применять для лечения или ослабления заболеваний или болезненных состояний, которые модулируются разрушаемым белком.
[00221] Термины «лечить», «лечение» и «способ лечения» и т.д., при использовании в настоящем описании относятся к любому воздействию, обеспечивающему благоприятное действие у пациента, для чего можно вводить соединения согласно настоящему изобретению, включая лечение любого заболевания или болезненного состояния, которое модулируется белком, с которым связываются соединения согласно настоящему изобретению. Заболевания или болезненные состояния, включая рак, которые можно подвергать лечению с применением соединений согласно настоящему изобретению, приведены выше в настоящем описании.
[00222] В изобретении предложены терапевтические композиции, описанные в настоящей заявке, для разрушения указанных белков для лечения или ослабления заболевания, например, рака. В определенных дополнительных вариантах реализации заболевание представляет собой множественную миелому. Таким образом, согласно другому аспекту в изобретении предложен способ убиквитинирования/разрушения белковой мишени в клетке. В определенных вариантах реализации способ включает введение бифункционального соединения, описанного в настоящей заявке, содержащего, например, CLM и PTM, предпочтительно соединенных посредством линкерного фрагмента, что также описано в настоящей заявке, где CLM присоединен к PTM, и CLM распознает белок пути убиквитина (например, убиквитин-лигазу, предпочтительно Е3 убиквитин-лигазу, такую как, например, цереблон), и PTM распознает белковую мишень, где разрушение белковой мишени происходит при размещении белковой мишени поблизости от убиквитин-лигазы, что приводит к разрушению/подавлению действия белковой мишени и контролю уровня белка. Контролирование уровня белка, достигаемое согласно настоящему изобретению, обеспечивает способ лечения заболевания или болезненного состояния, которое модулируется белковой мишенью, за счет снижения уровня указанного белка в клетке, например, в клетке пациента. В определенных вариантах реализации способ включает введение эффективного количества соединения, описанного в настоящей заявке, необязательно совместно с фармацевтически приемлемым вспомогательным веществом, носителем, адъювантом, другим биоактивным агентом или их комбинацией.
[00223] В дополнительных вариантах реализации в изобретении предложены способы лечения или ослабления заболевания, нарушения или симптома у субъекта или пациента, например, у животного, такого как человек, включающие введение субъекту, нуждающемуся в этом, композиции, содержащей эффективное количество, например, терапевтически эффективное количество, соединения, описанного в настоящей заявке или его солевой формы, и фармацевтически приемлемое вспомогательное вещество, носитель, адъювант, другой биоактивный агент или их комбинацию, где композиция является эффективной в отношении лечения или ослабления заболевания или нарушения или симптома у субъекта.
[00224] Согласно другому аспекту в изобретении предложены способы выявления действия соединений согласно настоящему изобретению в отношении разрушения указанных белков в биологической системе.
[00225] В другом варианте реализации настоящее изобретение относится к способу лечения у пациента-человека, нуждающегося в этом, заболевания или болезненного состояния, модулируемого посредством белка, где разрушение указанного белка обеспечивает терапевтическое действие у указанного пациента, включающему введение пациенту, нуждающемуся в этом, эффективного количества соединения согласно настоящему изобретению необязательно в комбинации с другим биоактивным агентом. Заболевание или болезненное состояние может представлять собой заболевание, вызванное микробным агентом или другим экзогенным агентом, таким как вирус, бактерия, грибок, простейший организм или другой микроорганизм, или может представлять собой болезненное состояние, вызванное повышенной экспрессией белка, которая вызывает заболевание и/или болезненное состояние.
[00226] Термин «заболевание или болезненное состояние» используют для описания любого заболевания или болезненного состояния, при котором происходит дизрегуляция белка (т.е. повышение количества белка, экспрессируемого у пациента), и разрушение одного или более белков у пациента может обеспечивать эффективную терапию или ослабление симптомов у пациента, нуждающегося в этом. В определенных случаях заболевание или болезненное состояния можно излечивать.
[00227] Заболевание или болезненные состояния, которые можно подвергать лечению с применением соединений согласно настоящему изобретению, включают, например, астму, аутоиммунные заболевания, такие как рассеянный склероз, различные раковые заболевания, цилиопатии, расщелину неба, диабет, заболевание сердца, гипертензию, воспалительную болезнь кишечника, умственную отсталость, расстройства настроения, ожирение, аномалию рефракции, бесплодие, синдром Ангельмана, болезнь Канавана, глютеновую болезнь, болезнь Шарко-Мари-Тута, кистозный фиброз, мышечную дистрофию Дюшенна, гемохроматоз, гемофилию, синдром Клайнфельтера, нейрофиброматоз, фенилкетонурию, поликистозное заболевание почек (PKD1) или 4 (PKD2), синдром Прадера-Вилли, серповидноклеточную анемию, болезнь Тея-Сакса, синдром Тернера.
[00228] Дополнительные заболевания или болезненные состояния, которые можно подвергать лечению при помощи соединений согласно настоящему изобретению, включают болезнь Альцгеймера, амиотрофический латеральный склероз (болезнь Лу Герига), нервную анорексию, тревожное расстройство, атеросклероз, синдром дефицита внимания и гиперактивности, аутизм, биполярное расстройство, синдром хронической усталости, хроническую обструктивную болезнь легких, болезнь Крона, коронарную болезнь сердца, деменцию, депрессию, сахарный диабет 1 типа, сахарный диабет 2 типа, эпилепсию, синдром Гийенна-Барре, синдром раздраженного кишечника, волчанку, метаболический синдром, рассеянный склероз, инфаркт миокарда, ожирение, обсессивно-компульсивное расстройство, паническое расстройство, болезнь Паркинсона, псориаз, ревматоидный артрит, саркоидоз, шизофрению, инсульт, облитерирующий тромбангиит, синдром Туретта, васкулит.
[00229] Дополнительные заболевания или болезненные состояния, которые можно подвергать лечению при помощи соединений согласно настоящему изобретению, включают ацерулоплазминемию, ахондрогенез II типа, ахондроплазию, акроцефалию, болезнь Гоше 2 типа, острую перемежающуюся порфирию, болезнь Канавана, аденоматозный полипоз толстой кишки, дефицит ALA-дегидратазы, дефицит аденилсукцинат-лиазы, адреногенитальный синдром, адренолейкодистрофию, ALA-D порфирию, дефицит ALA-дегидратазы, алкаптонурию, болезнь Александера, алкаптонурический охроноз, дефицит альфа-1-антитрипсина, ингибитор альфа-1-протеиназы, эмфизему, амиотрофический латеральный склероз, синдром Альстрема, болезнь Александера, несовершенный амелогенез, дефицит ALA-дегидратазы, болезнь Андерсона-Фабри, сидром нечувствительности к андрогену, анемию, диффузную ангиокератому туловища, ангиоматоз сетчатки (болезнь фон Хиппеля-Линдау), синдром Аперта, арахнодактилию (синдром Марфана), синдром Стиклера, наследственную гиперэластическую кожу (синдром Элерса-Данлоса по типу артрохалазии), атаксию-телеангиэктазию, синдром Ретта, первичную легочную гипертензию, болезнь Сэндхоффа, нейрофиброматоз II типа, синдром складчатой пахидермии Бира-Стивенсона, семейную средиземноморскую лихорадку, синдром Бенджамина, бета-талассемию, двусторонний акустический нейрофиброматоз (нейрофиброматоз II типа), тромбофилию, вызванную фактором Лейдена V, синдром Блоха-Сульцбергера (недержание пигмента), синдром Блума, X-сцепленную сидеробластную анемию, синдром Бонневи-Ульриха (синдром Тернера), болезнь Бурневилля (туберозный склероз), прионную болезнь, синдром Берта-Хога-Дьюба, болезнь хрупких костей (незавершенный остеогенез), синдром широкого большого пальца кистей и стоп (синдром Рубинштейна-Тейби), бронзовый диабет/бронзовый цирроз (гемохроматоз), бульбоспинальную мышечную атрофию (болезнь Кеннеди), синдром Бюргера-Грютца (дефицит липопротеинлипазы), хроническую гранулематозную болезнь ХГБ, кампомелическую дисплазию, дефицит биотинидазы, кардиомиопатию (синдром Нунан), синдром кошачьего крика, CAVD (врожденное отсутствие семявыводящего протока), кардио-фациальный синдром Кейлора (CBAVD), врожденную эритропоэтическую порфирию (ВЭП), кистозный фиброз, врожденный гипотиреоз, синдром хондродистрофии (ахондроплазию), отоспондиломегаэпифизарную дисплазию, синдром Леша-Нихана, галактосемию, синдром Элерса-Данлоса, танатофорическую дисплазию, синдром Коффина-Лоури, синдром Коккейна, (наследственный аденоматозный полипоз), врожденную эритропоэтическую порфирию, врожденное заболевание сердца, метгемоглобинемию/врожденную метгемоглобинемию, ахондроплазию, X-сцепленную сидеробластную анемию, заболевание соединительных тканей, вело-кардио-фациальный синдром, анемию Кули (бета-талассемию), болезнь хранения меди (болезнь Вильсона), болезнь транспорта меди (болезнь Менкеса), наследственную копропорфирию, синдром Коудена, краниофациальный дизартроз (синдром Крузона), болезнь Крейтцфельдта-Якоба (прионную болезнь), синдром Коккейна, синдром Коудена, синдром Куршмана-Баттена-Штейнерта (миотоническую дистрофию), синдром складчатой пахидермии Бира-Стивенсона, первичную гипероксалурию, спондилоэпиметафизарную дисплазию (Страдвика), мышечную дистрофию Дюшенна и Бекера (DBMD), синдром Ушера, дегенеративные нервные заболевания, включая синдром де Груши и синдром Дежерина-Сотта, нарушение развития, дистальную спинальную мышечную атрофию V типа, синдром нечувствительности к андрогену, диффузный инфантильный склероз (болезнь Краббе), синдром Ди Джорджи, дефицит рецептора дигидротестостерона, синдром нечувствительности к андрогену, синдром Дауна, карликовость, эритропоэтическую протопорфирию, дефицит эритроидной 5-аминолевулинатсинтетазы, эритропоэтическую порфирию, эритропоэтическую протопорфирию, эритропоэтическую уропорфирию, атаксию Фридрейха, семейный пароксизмальный полисерозит, позднюю кожную порфирию, семейную чувствительную нейропатию при нажиме, первичную легочную гипертензию (ПЛГ), фиброкистозную болезнь поджелудочной железы, синдром ломкой X-хромосомы, галактосемию, генетические нарушения мозга, гигантоклеточный гепатит (неонатальный гемохроматоз), синдром Гренблад-Страндберга (эластическую псевдоксантому), болезнь Гюнтера (наследственную эритропоэтическую порфирию), гемохроматоз, синдром Холлгрена, серповидноклеточную анемию, гемофилию, печеночную эритропоэтическую порфирию (ПЭП), болезнь Хиппеля-Линдау (фон Хиппеля-Линдау), болезнь Хантингтона, синдром прогерии Хатчинсона-Гилфорда (прогерии), гиперандрогению, гипохондроплазию, гипохромную анемию, нарушения иммунной системы, включая X-сцепленный тяжелый комбинированный иммунодефицит, синдром Инсли-Эстли, синдром Джексона-Вейса, синдром Жубера, синдром Леша-Нихана, синдром Джексона-Вейса, заболевания почек, включая гипероксалурию, синдром Клайнфельтера, дисплазию Книста, лакунарную деменцию, ахондрогенез Лангера-Салдино, атаксию-телеангиэктазию, синдром Линча, дефицит лизил-гидроксилазы, болезнь Мачадо-Джозефа, метаболические нарушения, включая дисплазию Книста, синдром Марфана, нарушения движений, синдром Моуат-Вильсона, кистозный фиброз, синдром Мюнке, множественный нейрофиброматоз, синдром Нэнси-Инсли, хондродисплазию Нэнси-Суини, болезнь Ниманна-Пика, синдром Ноака (синдром Пфайффера), болезнь Ослера-Вебера-Рандю, синдром Пейтца-Егерса, поликистозную болезнь почек, полиоссальную фиброзную дисплазию (синдром Мак-Кьюна-Олбрайта), синдром Пейтца-Егерса, синдром Прадера-Лабхарта-Вилли, гемохроматоз, синдром первичной урикемии (синдром Леша-Нихана), первичную легочную гипертензию, первичную старческую дегенеративную деменцию, прионную болезнь, прогерию (синдром прогерии Хатчинсона-Гилфорда), прогрессирующую хорею, хроническую наследственную болезнь Хантингтона (болезнь Хантингтона), прогрессирующую мышечную атрофию, спинальную мышечную атрофию, пропионовую ацидемию, протопорфирию, проксимальную миотоническую дистрофию, гипертензию легочных артерий, PXE (эластическую псевдоксантому), РБ (ретинобластому), болезнь Реклингхаузена (нейрофиброматоз I типа), рецидивирующий полисерозит, нарушения сетчатки, ретинобластому, синдром Ретта, RFALS 3 типа, синдром Рикера, синдром Райли-Дея, синдром Русси-Леви, тяжелую ахондроплазию с задержкой развития и пигментной сосочковой дистрофией кожи (SADDAN), синдром Ли-Фраумени, синдром саркомы, рака груди, лейкоза и рака надпочечников (SBLA), туберозный склероз (эпилойю), SDAT, наследственную СЭД (наследственную спондилоэпофизарную дисплазию), СЭД Страдвика (спондилоэпиметафизарную дисплазию Страдвика), нСЭД (наследственную спондилоэпифизарную дисплазию), СЭМД Страдвика (спондилоэпиметафизарную дисплазию Страдвика), синдром Шпринтцена, нарушения пигментации кожи, синдром Смита-Лемли-Опица, южно-африканскую генетическую порфирию (смешанную порфирию), наследственный спастический паралич, проявляющийся в младенчестве, расстройства речи и общения, сфинголипидоз, болезнь Тея-Сакса, спинально-церебеллярную атаксию, синдром Стиклера, инсульт, синдром нечувствительности к андрогену, дефицит тетрагидробиоптерина, бета-талассемию, заболевание щитовидной железы, томакулезную нейропатию (врожденную нейропатию со склонностью к параличам от сдавливания), синдром Тричера-Коллинза, синдром трипло-Х (синдром тройной Х-хромосомы), трисомию 21 (синдром Дауна), трисомию Х, синдром VHL (болезнь фон Хиппеля-Линдау), нарушение зрения и слепоту (синдром Альстрема), болезнь Вролика, синдром Ваарденбурга, синдром Варбурга-Сьо-Фледелиуса, синдром Вайзенбахера-Цваймюллера, синдром Вольфа-Хиршхорна, периодическую болезнь Вольфа, синдрома Вайзенбахера-Цваймюллера и пигментозную ксеродермию помимо прочих.
[00230] Термин «неоплазия» или «рак» используют в настоящем описании для обозначения патологического процесса, который приводит к образованию и росту ракового или злокачественного новообразования, т.е. аномальной ткани, которая растет за счет пролиферации клеток, как правило, быстрее по сравнению с нормальной тканью, и продолжает расти после исчезновения стимула, который изначально вызывал рост. Злокачественные новообразования имеют частичную структурную организацию и функциональную координацию с нормальной тканью или не имеют ее вовсе, и большая их часть затрагивает окружающие ткани, образует метастазы в нескольких участках, с большой вероятностью они появляются повторно после удаления и вызывают гибель пациента в отсутствие подходящего лечения. Согласно настоящему описанию термин «неоплазия» используют для описания всех раковых болезненных состояний, и он обобщает или охватывает патологические процессы, связанные со злокачественными образующимися в крови, асцитическими и солидными опухолями. Типовые раковые заболевания, которые можно подвергать лечению при помощи соединений согласно настоящему изобретению по отдельности или в комбинации по меньшей мере с одним дополнительным противораковым агентом, включают плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, печеночноклеточные карциномы и почечноклеточные карциномы, рак мочевого пузыря, кишечника, груди, шейки матки, толстой кишки, пищевода, головы, почки, печени, легкого, шеи, яичников, поджелудочной железы, простаты и желудка; лейкозы; доброкачественные и злокачественные лимфомы, в частности лимфому Беркитта и неходжкинскую лимфому; доброкачественные и злокачественные меланомы; миелопролиферативные заболевания; саркомы, включая саркому Юинга, гемангиосаркому, саркому Капоши, липосаркому, миосаркомы, периферическую нейроэпителиому, синовиальную саркому, глиомы, астроцитомы, олигодендроглиомы, эпендимомы, глиобластомы, нейробластомы, ганглионевромы, ганглиоглиомы, медуллобластомы, опухоли из клеток шишковидного тела, менингиомы, менингеальные саркомы, нейрофибромы и шванномы; рак кишечника, рак груди, рак простаты, рак шейки матки, рак матки, рак легкого, рак яичников, рак яичек, рак щитовидной железы, астроцитому, рак пищевода, рак поджелудочной железы, рак желудка, рак печени, рак толстой кишки, меланому; карциносаркому, болезнь Ходжкина, опухоль Вильмса и тератокарциномы. Дополнительные раковые заболевания, которые можно подвергать лечению с применением соединений согласно настоящему изобретению, включают, например, острый Т-лимфобластный лейкоз (Т-ОЛЛ), Т-клеточную лимфобластную лимфому (Т-ЛЛ), периферическую Т-клеточную лимфому, Т-клеточный лейкоз взрослых, пре-В ОЛЛ, пре-В лимфомы, крупноклеточную В-клеточную лимфому, лимфому Беркитта, В-клеточный ОЛЛ, ОЛЛ с положительной филадельфийской хромосомой и ХМЛ с положительной филадельфийской хромосомой.
[00231] Термин «биоактивный агент» используют для описания агента, отличающегося от соединения согласно настоящему изобретению, который применяют в комбинации с соединениями согласно настоящему изобретению в качестве агента, обладающего биологической активностью, для помощи в осуществлении предполагаемой(-ого) терапии, ингибирования и/или предотвращения/профилактики, для которой(-ого) применяют соединения согласно настоящему изобретению. Предпочтительные биоактивные агенты для применения в настоящем изобретении включают агенты, которые имеют фармакологическую активность, схожую с активностью, для проявления которой применяют или вводят соединения согласно настоящему изобретению, и включают, например, противораковые агенты, противовирусные агенты, в частности включая агенты против ВИЧ и агенты против ВГС, противомикробные агенты, противогрибковые агенты и т.д.
[00232] Термин «дополнительные противораковые агент» используют для описания противоракового агента, который можно объединять с соединениями согласно настоящему изобретению для лечения рака. Указанные агенты включают, например, эверолимус, трабектедин, абраксан, TLK 286, AV-299, DN-101, пазопаниб, GSK690693, RTA 744, ON 0910.Na, AZD 6244 (ARRY-142886), AMN-107, TKI-258, GSK461364, AZD 1152, энзастаурин, вандетаниб, ARQ-197, MK-0457, MLN8054, PHA-739358, R-763, AT-9263, ингибитор FLT-3, ингибитор VEGFR, ингибитор EGFR TK, ингибитор аурора-киназы, модулятор PIK-1, ингибитор Bcl-2, ингибитор HDAC, ингибитор c-MET, ингибитор PARP, ингибитор Cdk, ингибитор EGFR TK, ингибитор IGFR TK, антитело к HGF, ингибитор PI3 киназы, ингибитор AKT, ингибитор mTORC1/2, ингибитор JAK/STAT, ингибитор контрольной точки 1 или 2, ингибитор киназы фокальной адгезии, ингибитор Map киназы киназы (mek), антитело, захватывающее VEGF, пеметрексед, эрлотиниб, дасатаниб, нилотиниб, декатаниб, панитумумаб, амрубицин, ореговомаб, Lep-etu, нолатрексед, azd2171, батабулин, офатумумаб, занолимумаб, эдотекарин, тетрандрин, рубитекан, тесмилифен, облимерсен, тицилимумаб, ипилимумаб, госсипол, Bio 111, 131-I-TM-601, ALT-110, BIO 140, CC 8490, циленгитид, гиматекан, IL13-PE38QQR, INO 1001, IPdR1 KRX-0402, лукантон, LY317615, нейрадиаб, витеспан, Rta 744, Sdx 102, талампанел, атрасентан, Xr 311, ромидеспин, ADS-100380, сунитиниб, 5-фторурацил, вориностат, этопозид, гемцитабин, доксорубицин, липосомальный доксорубицин, 5'-деокси-5-фторуридин, винкристин, темозоломид, ZK-304709, селициклиб; PD0325901, AZD-6244, капецитабин, гептагидрат динатриевой соли N-[4-[2-(2-амино-4,7-дигидро-4-оксо-1Н-пирроло[2,3-d]пиримидин-5-ил)этил]бензоил]-L-глутаминовой кислоты, камптотецин, иринотекан, меченный ПЭГ, тамоксифен, торемифена цитрат, анастрозол, эксеместан, летрозол, DES (диэтилстилбестрол), эстрадиол, эстроген, сопряженный эстроген, бевацизумаб, IMC-1C11, CHIR-258; 3-[5-(метилсульфонилпиперадинметил)индолил]хинолон, ваталаниб, AG-013736, AVE-0005, госерелина ацетат, леупролида ацетат, трипторелина памоат, медроксипрогестерона ацетат, гидроксипрогестерона капроат, мегестрола ацетат, ралоксифен, бикалутамид, флутамид, нилутамид, мегестрола ацетат, CP-724714; TAK-165, HKI-272, эрлотиниб, лапатаниб, канертиниб, антитело ABX-EGF, эрбитукс, EKB-569, PKI-166, GW-572016, лонафарниб, BMS-214662, типифарниб; амифостин, NVP-LAQ824, субероиланилидгидроксамовую кислоту, вальпроевую кислоту, трихостатин А, FK-228, SU11248, сорафениб, KRN951, аминоглутетимид, амсакрин, анагрелид, L-аспарагиназу, вакцину бациллы Кальметта-Герена (БЦЖ), адриамицин, блеомицин, бусерелин, бусульфан, карбоплатин, кармустин, хлорамбуцил, цисплатин, кладрибин, клодронат, ципротерон, цитарабин, дакарбазин, дактиномицин, даунорубицин, диэтилстилбестрол, эпирубицин, флударабин, флудрокортизон, флуоксиместерон, флутамид, гливек, гемцитабин, гидроксимочевину, идарубицин, ифосфамид, иматиниб, леупролид, левамизол, ломустин, мехлорэтамин, мелфалан, 6-меркаптопурин, месна, метотрексат, митомицин, митотан, митоксантрон, нилутамид, октреотид, оксалиплатин, памидронат, пентостатин, пликамицин, порфимер, прокарбазин, ралитрексед, ритуксимаб, стрептозоцин, тенипозид, тестостерон, талидомид, тиогуанин, тиотепа, третиноин, виндесин, 13-цис-ретиноевую кислоту, фенилаланиновый иприт, урациловый иприт, эстрамустин, алтретамин, флоксуридин, 5-деоксиуридин, цитозина арабинозид, 6-меркаптопурин, деоксикоформицин, кальцитриол, валрубицин, митрамицин, винбластин, винорелбин, топотекан, разоксин, маримастат, COL-3, неовастат, BMS-275291, скваламин, эндостатин, SU5416, SU6668, EMD121974, интерлейкин-12, IM862, ангиостатин, витаксин, дролоксифен, идоксифен, спиронолактон, финастерид, цимитидин, трастузумаб, денилейкин, дифтитокс, гефитиниб, бортезимиб, паклитаксел, паклитаксел, не содержащий кремофор, доцетаксел, эпотилон В, BMS-247550, BMS-310705, дролоксифен, 4-гидрокситамоксифен, пипендоксифен, ERA-923, арзоксифен, фулвестрант, аколбифен, лазофоксифен, идоксифен, TSE-424, HMR-3339, ZK186619, топотекан, PTK787/ZK 222584, VX-745, PD 184352, рапамицин, 40-О-(2-гидроксиэтил)рапамицин, темсиролимус, AP-23573, RAD001, ABT-578, BC-210, LY294002, LY292223, LY292696, LY293684, LY293646, вортманнин, ZM336372, L-779,450, ПЭГ-филграстим, дарбэпоэтин, эритропоэтин, гранулоцитарный колониестимулирующий фактор, золендронат, преднизон, цетуксимаб, гранулоцитарно-макрофагальный колониестимулирующий фактор, гистрелин, пэгилированный интерферон альфа-2а, интерферон альфа-2а, пэгилированный интерферон альфа-2b, интерферон альфа-2b, азацитидин, ПЭГ-L-аспарагиназу, леналидомид, гемтузумаб, гидрокортизон, интерлейкин-11, дексразоксан, алемтузумаб, полностью транс-ретиноевую кислоту, кетоконазол, интерлейкин-2, мегестрол, иммунноглобулин, азотистый иприт, метилпреднизолон, ибритумомаб тиуксетан, андрогены, децитабин, гексаметилмеламин, бексаротен, тозитумомаб, триоксид мышьяка, кортизон, эдитронат, митотан, циклоспорин, липосомальный даунорубицин, Edwina-аспарагиназу, стронций 89, касопитант, нетупитант, антагонист рецептора NK-1, палоносетрон, апрепитант, дифенгидрамин, гидроксизин, метоклопрамид, лоразепам, алпразолам, галоперидол, дроперидол, дронабинол, дексаметазон, метилпреднизолон, прохлорперазин, гранисетрон, ондансетрон, доласетрон, трописетрон, пэгфилграстим, эритропоэтин, эпоэтин альфа, дарбэпоэтин альфа и их смеси.
[00233] Термин «агент против ВИЧ» или «дополнительный агент против ВИЧ» включает, например, нуклеозидные ингибиторы обратной транскриптазы (NRTI), другие ненуклеозидные ингибиторы обратной транскриптазы (т.е. ингибиторы, которые не являются типовыми для настоящего изобретения), ингибиторы протеазы, ингибиторы слияния помимо прочих, и типовые соединения могут включать, например, 3TC (ламивудин), AZT (зидовудин), (-)-FTC, ddI (диданозин), ddC (залцитабин), абакавир (ABC), тенофовир (PMPA), D-D4FC (реверсет), D4T (ставудин), рацивир, L-FddC, L-FD4C, NVP (невирапин), DLV (делавирдин), EFV (эфавиренц), SQVM (саквинавира мезилат), RTV (ритонавир), IDV (индинавир), SQV (саквинавир), NFV (нелфинавир), APV (ампренавир), LPV (лопинавир), ингибиторы слияния, такие как T20 помимо прочих, фузеон и их смеси, включая соединения против ВИЧ, находящиеся в настоящее время на стадии клинических испытаний или в разработке.
[00234] Другие агенты против ВИЧ, которые можно вводить совместно с соединениями согласно настоящему изобретению, включают, например, другие NNRTI (т.е. отличающиеся от NNRTI согласно настоящему изобретению), которые могут быть выбраны из группы, состоящей из невирапина (BI-R6-587), делавирдина (U-90152S/T), эфавиренца (DMP-266), UC-781 (N-[4-хлор-3-(3-метил-2-бутенилокси)фенил]-2-метил-3-фуранкарботиамида), этравирина (TMC125), тровирдина (Ly300046.HCl), MKC-442 (эмивирина, коактинона), HI-236, HI-240, HI-280, HI-281, рилпивирина (TMC-278), MSC-127, HBY 097, DMP266, баикалина (TJN-151), ADAM-II (метил-3',3'-дихлор-4',4"-диметокси-5',5"-бис(метоксикарбонил)-6,6-дифенилгексеноата), метил-3-бром-5-(1-(5-бром-4-метокси-3-(метоксикарбонил)фенил)гепт-1-енил)-2-метоксибензоата (аналог алкенилдиарилметана, аналог Adam), (5-хлор-3-(фенилсульфинил)-2'-индолкарбоксамида), AAP-BHAP (U-104489 или PNU-104489), каправирина (AG-1549, S-1153), атевирдина (U-87201E), ауринтрикарбоновой кислоты (SD-095345), 1-[(6-циано-2-индолил)карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазина, 1-[5-[[N-(метил)метилсульфониламино]-2-индолил]карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазина, 1-[3-(этиламино)-2-[пиридинил]-4-[(5-гидрокси-2-индолил)карбонил]]пиперазина, 1-[(6-формил-2-индолил)-карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазина, 1-[[5-(метилсульфонилокси)-2-индолил]карбонил]-4-[3-(изопропиламино)-2-пиридинил]пиперазина, U88204E, бис(2-нитрофенил)сульфона (NSC 633001), каланолида А (NSC675451), каланолида В, 6-бензил-5-метил-2-(циклогексилокси)пиримидин-4-она (DABO-546), DPC 961, E-EBU, E-EBU-dm, E-EPSeU, E-EPU, фоскарнета (фоскавира), HEPT (1-[(2-гидроксиэтокси)метил]-6-(фенилтио)тимина), HEPT-M (1-[(2-гидроксиэтокси)метил]-6-(3-метилфенилтио)тимина), HEPT-S (1-[(2-гидроксиэтокси)метил]-6-(фенилтио)-2-тиотимина), инофиллума Р, L-737,126, мичелламина А (NSC650898), мичелламина В (NSC649324), мичелламина F, 6-(3,5-диметилбензил)-1-[(2-гидроксиэтокси)метил]-5-изопропилурацила, 6-(3,5-диметилбензил)-1-(этоксиметил)-5-изопропилурацила, NPPS, E-BPTU (NSC 648400), олтипраза (4-метил-5-(пиразинил)-3Н-1,2-дитиол-3-тиона), N-[2-(2-хлор-6-фторфенэтил)-N'-(2-тиазолил)]тиомочевины (Cl,F-производное PETT), N-{2-(2,6-дифторфенэтил)-N'-[2-(5-бромпиридил)]}тиомочевины (производное РЕТТ), N-{2-(2,6-дифторфенэтил)-N'-[2-(5-метилпиридил)]}тиомочевины (пиридильное производное РЕТТ), N-[2-(3-фторфуранил)этил]-N'-[2-(5-хлорпиридил)]тиомочевины, N-[2-(2-фтор-6-этоксифенэтил)]-N'-[2-(5-бромпиридил)]тиомочевины, N-(2-фенэтил)-N'-(2-тиазолил)тиомочевины (LY-73497), L-697,639, L-697,593, L-697,661, 3-[2-(4,7-дифторбензоксазол-2-ил)этил]-5-этил-6-метилпиридин-2(1Н)-тиона (производное 2-пиридинона), 3-[[(2-метокси-5,6-диметил-3-пиридил)метил]амин]-5-этил-6-метилпиридин-2(1Н)-тиона, R82150, R82913, R87232, R88703, R89439 (ловирида), R90385, S-2720, сурамина натрия, TBZ (тиазолобензимидазола, NSC 625487), тиазолоизоиндол-5-она, (+)-(R)-9b-(3,5-диметилфенил)-2,3-дигидротиазоло[2,3-a]изоиндол-5(9bH)-она, тивирапина (R86183), UC-38 и UC-84, помимо прочих.
[00235] Термин «фармацевтически приемлемая соль» используют в настоящей заявке для описания, если это возможно, солевой формы одного или более соединений, описанных в настоящей заявке, которую обеспечивают для увеличения растворимости соединения в кишечном соке в желудочно-кишечном тракте пациента для ускорения растворения и увеличения биодоступности соединений. Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых неорганических или органических оснований и кислот, если это возможно. Подходящие соли включают соли, полученные из щелочных металлов, таких как калий и натрий, щелочноземельных металлов, таких как кальция, магний, и соли аммония, помимо многочисленных других кислот и оснований, хорошо известных в области фармацевтики. Соли натрия и калия являются особенно предпочтительными в качестве солей нейтрализации фосфатов согласно настоящему изобретению.
[00236] Термин «фармацевтически приемлемое производное» используют в настоящей заявке для описания любой фармацевтически приемлемой формы пролекарства (такой как сложноэфирное, амидное пролекарство или пролекарство, содержащее другую группу), которая при введении пациенту обеспечивает, напрямую или косвенно, соединение согласно настоящему изобретению или активный метаболит соединения согласно настоящему изобретению.
Общий подход к синтезу
[00237] Реализацию и оптимизацию синтеза бифункциональных молекул, описанных в настоящей заявке, можно осуществлять при помощи постадийного или модульного способа. Например, выявление соединений, которые связываются с целевыми молекулами, может включать методики высоко- или среднескоростного скрининга, если подходящие лиганды непосредственно не доступны. Достаточно часто для начальных лигандов требуется проведение повторяющихся циклов разработки и оптимизации для улучшения неоптимальных аспектов, что определяют при помощи данных, полученных в подходящих исследованиях in vitro и фармакологических и/или ADMET. Частью методики оптимизации/SAR является исследование положений лиганда, которые допускают замещение и могут представлять собой подходящее место, к которому присоединяют химический линкер, описанный выше в настоящем описании. В случае если доступны данные кристаллографии или ЯМР, их можно применять для описания указанного синтетического подхода.
[00238] Аналогично можно выявлять и оптимизировать лиганды для Е3 лигазы, т.е. ULM/CLM.
[00239] После получения информации о PTM и ULM (например, CLM) специалисты в данной области техники могут применять известные способы синтеза для их объединения с применением линкерного фрагмента или без него. Можно синтезировать линкерные фрагменты, имеющие диапазон композиции, длины и гибкости и функционализации, где группы PTM и ULM можно присоединять последовательно к противоположным концам линкера. Таким образом, может быть реализована библиотека бифункциональных молекул, профиль которой можно определять в фармакологических и ADMET/PK исследованиях in vitro и in vivo. Как и в случае групп PTM и ULM, можно проводить повторяющиеся циклы разработки и оптимизации конечных бифункциональных молекул для выявления молекул, обладающих желаемыми свойствами.
[00240] Некоторые неограничивающие типовые способы получения CLM, таких как описано в настоящей заявке, в общем случае показаны ниже.
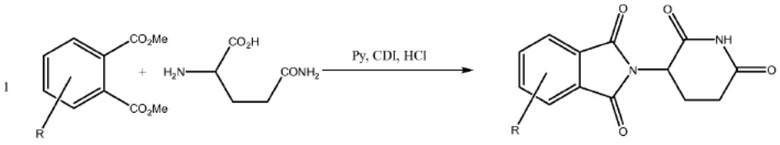
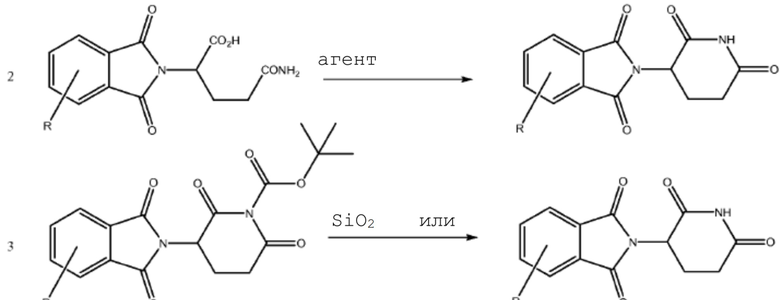
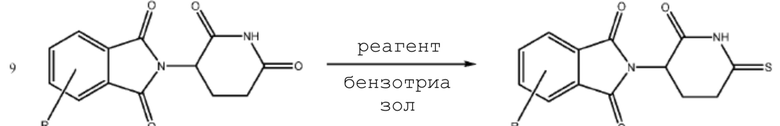

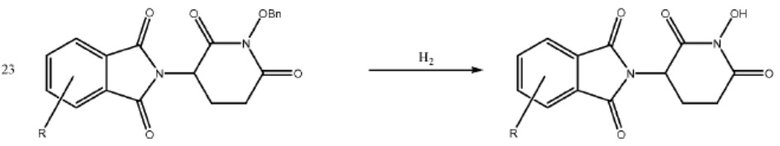
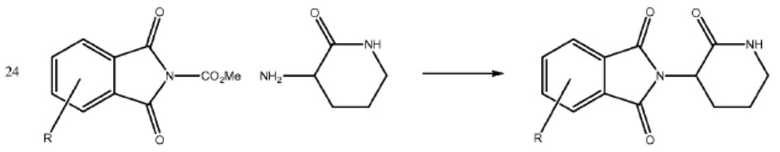
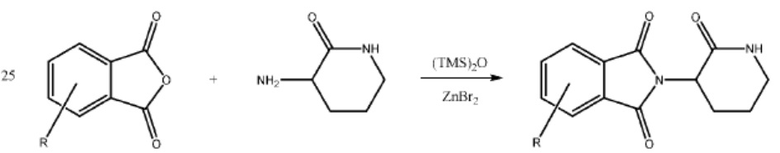


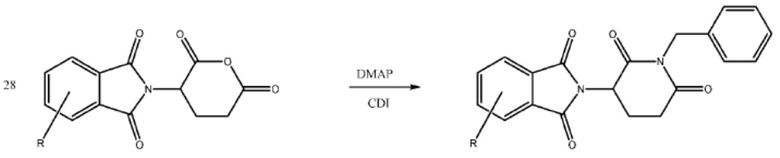

[00241] Как показано в типовом взаимодействии 1, можно проводить конденсацию диметилфталатных производных с глутамином (рацематом или энантиомером) или аналогами глутамина, а затем проводить взаимодействие с агентами, такими как карбонилдиимидазол, для получения производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона.
[00242] В качестве альтернативы, как показано в типовом взаимодействии 2, промежуточный фталимид, получаемый в первоначальной конденсации, описанной выше, можно получать и/или выделять отдельно, а затем проводить взаимодействие с дегидратирующими агентами, такими как трифторацетамид, POCl3 или уксусный ангидрид, для получения целевых производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона. Также можно проводить взаимодействие промежуточного фталимида указанного типа с реагентом Лавессона перед стадией дегидратации для обеспечения тио-аналогов, таких как те, что показаны в типовых взаимодействиях 8 и 9.
[00243] Можно удалять защитные группы в защищенных примерах производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона, такие как частицы N1-BOC, показанные в типовом примере 3, для получения целевых производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона с применением, в указанном случае, реагентов, таких как ТФУ или оксид кремния.
[00244] Можно раскрывать кольцо фталевых ангидридов, таких как те, что показаны в типовом примере 4, путем взаимодействия с аминами, такими как 3-аминопиперидин-2,6-дион, для получения промежуточных карбоксилатных частиц, из которых после обработки карбонилдиимидазолом и бензотриазолом получают целевые производные 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона. В качестве альтернативы можно объединять два компонента в присутствии уксусной кислоты для получения целевого продукта, как показано в типовом взаимодействии 13.
[00245] Аналогично можно проводить взаимодействие производных ангидрида, таких как те, что показаны в типовом взаимодействии 5, с аминами (с аммиаком в показанном примере), затем с карбонилдиимидазолом для получения целевых производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона.
[00246] Если доступны фталоилхлориды, то возможно проведение прямой конденсации с глутамином (рацематом или энантиомером) или аналогами глутамина, затем можно проводить дополнительное взаимодействие с агентами, такими как карбонилдиимидазол, для получения производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона, как показано в типовом взаимодействии 6.
[00247] Можно проводить взаимодействие о-бромбензамидов с источником СО, таким как хлорангидрид, показанный в типовом взаимодействии 7, в присутствии палладиевого катализатора и ассоциированного фосфинового лиганда для получения целевых производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона. В качестве альтернативы можно применять непосредственно газообразный СО совместно с катализаторами на основе родия (II) и карбонатом серебра для получения целевых продуктов.
[00248] Производные 2-(2,4-диоксо-1,2,3,4-тетрагидропиримидин-5-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона и 5-(1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-ил)-1,3-диазинан-2,4,6-триона можно получать аналогично некоторым способам, описанным выше для получения производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона. В типовых взаимодействиях 20 и 21 можно проводить взаимодействие фталевого ангидрида с производными 5-амино-1,2,3,4-тетрагидропиримидин-2,4-диона или 5-амино-1,3-диазинан-2,4,6-триона, соответственно, в присутствии уксусной кислоты для получения целевых продуктов.
[00249] В качестве альтернативы производные 5-(1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-ил)-1,3-диазинан-2,4,6-триона можно получать путем взаимодействия производных 5-амино-1,3-диазинан-2,4,6-триона с моно-трет-бутиловыми сложными эфирами фталевой кислоты в присутствии основания Хюнига, карбодиимида и бензотриазола, как показано в типовом взаимодействии 12. В схожих условиях можно проводить получение производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона из моно-трет-бутиловых сложных эфиров фталевой кислоты, как показано в типовом взаимодействии 14.
[00250] Соединения, такие как 3-(2,6-диоксопиперидин-3-ил)-1,2,3,4-тетрагидрохиназолин-2,4-дион, можно получать из производных антраниловой кислоты путем взаимодействия 3-аминопиперидин-2,6-дионов с карбодиимидом, как показано в типовом взаимодействии 16. Можно выделять (или получать отдельно) промежуточный бензамидный продукт и проводить дополнительное взаимодействие с карбодиимидом для получения производных 3-(2,6-диоксопиперидин-3-ил)-1,2,3,4-тетрагидрохиназолин-2,4-диона, как показано в типовом взаимодействии 15.
[00251] Аналоги 3-(2,6-диоксопиперидин-3-ил)-3,4-дигидро-2Н-1,3-бензоксазин-2,4-диона можно получать путем активации салициловых кислот хлорформиатами и последующей конденсации с 3-аминопиперидин-2,6-дионами, как показано в типовом взаимодействии 17.
[00252] 3,3-дихлор-2,1λ6-бензоксатиол-1,1-дионы, как показано в типовом взаимодействии 18, можно получать путем взаимодействия 2-сульфобензойных кислот с POCl3 и PCl5. Можно проводить взаимодействие указанных соединений с амино-производными для получения, например, целевых производных 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1λ6,2-бензотиазол-1,1,3-триона.
[00253] Как показано в типовом взаимодействии 19, можно алкилировать анионы производных сахарина с применением электрофилов, таких как 3-бром-3-метилпиперидин-2-он, для получения целевых производных 2-(3-метил-2-оксопиперидин-3-ил)-2,3-дигидро-1λ6,2-бензотиазол-1,1,3-триона.
[00254] Аналоги 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1λ6,2-бензотиазол-1,1,3-триона также можно получать путем взаимодействия метил-2-[(2,6-диоксопиперидин-3-ил)сульфамоил]бензоата с сильными основаниями, такими как гидрид натрия (см. типовое взаимодействие 20).
[00255] Депротонирование производных 2-метил-2,3-дигидро-1Н-инден-1,3-диона с применением этоксида натрия и последующее взаимодействие с электрофилами, такими как 3-бромпиперидин-2,6-дион, приводят к получению 3-(2-метил-1,3-диоксо-1Н-инден-2-ил)пиперидин-2,6-диона, как показано в типовом взаимодействии 21.
[00256] N1-замещенные соединения, такие как 2-[1-(бензилокси)-2,6-диоксопиперидин-3-ил]-2,3-дигидро-1Н-изоиндол-1,4-дион (типовое взаимодействие 22), можно получать путем взаимодействия 2-(1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-ил)пентандиовой кислоты с N-бензилгидроксиламином и ангидридом трифторуксусной кислоты.
[00257] В свою очередь, можно удалять бензил в молекулах, таких как 2-[1-(бензилокси)-2,6-диоксопиперидин-3-ил]-2,3-дигидро-1Н-изоиндол-1,4-дион (типовое взаимодействие 23), в условиях гидрирования для получения N1-гидрокси-аналогов, таких как 2-(1-гидрокси-2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-дион.
[00258] В типовом взаимодействии 24 проводят взаимодействие метил-1,3-диоксо-2,3-дигидро-1Н-изоиндол-2-карбоксилата (и его аналогов) с 3-аминопиперидин-2-оном для получения 2-(2-оксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-дионов.
[00259] Также можно проводить взаимодействие указанного амина с производными фталевого ангидрида в присутствии кислоты Льюиса, такой как бромид цинка, и простым триметилсилильным эфиром для получения продукта указанного типа, как показано в типовом взаимодействии 25. Промежуточные продукты указанного взаимодействия, если их выделяют или получают иным образом (типовое взаимодействие 26), можно обрабатывать до полной циклизации с применением дегидратирующего агента.
[00260] Изомерные производные, такие как 2-(6-оксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-дион, показанные в типовом взаимодействии 27, можно получать путем взаимодействия фталевой кислоты с 5-аминопиперидин-2-оном.
[00261] N1-замещенные соединения, такие как 2-(1-бензил-2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,4-дион (типовые взаимодействия 28 и 29), можно получать при помощи нескольких способов. Например, можно проводить конденсацию ангидрида (2-(2,6-диоксооксан-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-дион) с 3-аминопиперидин-2,6-дионом в присутствии DMAP и карбонилдиимидазола (типовое взаимодействие 28), или производные 2-(2,6-диоксопиперидин-3-ил)-2,3-дигидро-1Н-изоиндол-1,3-диона можно алкилировать с применением электрофилов, таких как бензилбромид, в присутствии основания, как показано в типовом взаимодействии 29.
[00262] В некоторых случаях для упрощения получения целевых веществ может требоваться стратегия использования защитных групп и/или взаимных превращений функциональных групп (FGI). Указанные химические способы хорошо известны специалистам в области синтетической органической химии, и многие из них можно найти в текстах, таких как «Greene's Protective Groups in Organic Synthesis» Peter G. M. Wuts and Theodora W. Greene (Wiley), и «Organic Synthesis: The Disconnection Approach» Stuart Warren and Paul Wyatt (Wiley).
Контролирование уровня белка
[00263] В настоящем описании также предложены способы контролирования уровня белка в клетке, которые основаны на применении соединений, описанных в настоящей заявке, которые взаимодействуют со специфической белковой мишенью, в результате чего разрушение белковой мишени in vivo приводит к контролированию количества белка в биологической системе, предпочтительно к конкретному терапевтическому благоприятному действию.
[00264] Последующие примеры предложены для помощи в описании настоящего изобретения, но их не следует рассматривать как ограничивающие каким-либо образом настоящее изобретение.
Конкретные варианты реализации настоящего изобретения
[00265] Настоящее изобретение охватывает следующие конкретные варианты реализации. Указанные последующие варианты реализации могут включать все отличительные признаки, указанные в предшествующем варианте реализации, что указано отдельно. Если это возможно, последующие варианты реализации также могут включать отличительные признаки, указанные в любом предшествующем варианте реализации, включительно или в качестве альтернативы (например, вариант реализации (8) может включать отличительные признаки, указанные в варианте реализации (1), как это указано, и/или отличительные признаки любого из вариантов реализации (2) -(7)).
(1) Соединение, имеющее химическую структуру, содержащую
L-CLM,
или его фармацевтически приемлемая соль, энантиомер, стереоизомер, сольват или полиморф, где
L представляет собой линкерную группу; и
CLM представляет собой фрагмент, связывающийся с цереблон убиквитин-лигазой Е3,
причем линкерная группа химически связана с CLM.
(2) Соединение согласно (1), отличающееся тем, что соединение имеет химическую структуру, содержащую:
PTM-L-CLM,
где
PTM представляет собой фрагмент, нацеливающий на белок, который связывается с белковой мишенью или целевым полипептидом,
причем PTM химически связан с CLM посредством линкерной группы.
(3) Соединение согласно (1), отличающееся тем, что CLM содержит химическую группу, полученную из имида, тиоимида, амида или тиоамида.
(4) Соединение согласно (1), отличающееся тем, что химическая группа представляет собой фталимидогруппу или ее аналог или производное.
(5) Соединение согласно (1), отличающееся тем, что CLM представляет собой талидомид, леналидомид, помалидомид, их аналоги, изостеры или производные.
(6) Соединение согласно (1), отличающееся тем, что соединение дополнительно содержит ULM, второй CLM, CLM' или несколько фрагментов или их комбинацию, где
ULM представляет собой фрагмент, связывающий Е3 убиквитин-лигазу,
второй CLM имеет такую же химическую структуру, что и CLM,
CLM' представляет собой фрагмент, связывающийся с цереблон убиквитин-лигазой Е3, который структурно отличается от CLM,
причем ULM, второй CLM, CLM' или несколько из указанных фрагментов или их комбинация необязательно присоединена к дополнительной линкерной группе.
(7) Соединение согласно (1), отличающееся тем, что CLM имеет химическую структуру:
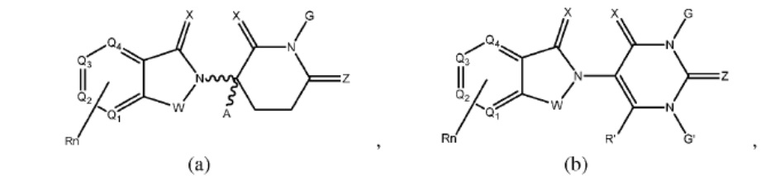
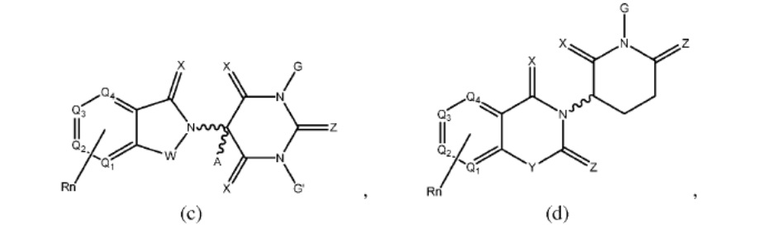
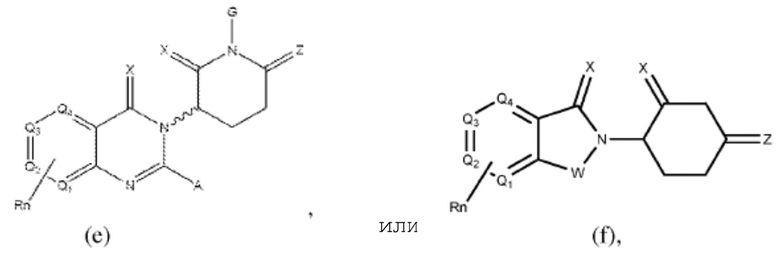
где
W выбран из группы, состоящей из СН2, CHR, C=O, SO2, NH и N-алкила;
каждый X независимо выбран из группы, состоящей из О, S и H2;
Y выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-циклоалкила, N-гетероциклила, О и S;
Z выбран из группы, состоящей из О, S и Н2;
G и G' независимо выбраны из группы, состоящей из Н, алкила, ОН, СН2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1, Q2, Q3 и Q4 представляют собой атом углерода, замещенный группой, независимо выбранной из R', N или N-оксид;
А независимо выбран из группы, состоящей из алкила, циклоалкила, Cl и F;
R содержит -CONR'R'', -OR', -NR'R'', -SR', -SO2R', -SO2NR'R'', -CR'R''-, -CR'NR'R''-, - арил, -гетероарил, -алкил, -циклоалкил, -гетероциклил, -P(O)(OR')R'', -P(O)R'R'', - OP(O)(OR')R'', -OP(O)R'R'', -Cl, -F, -Br, -I, -CF3, -CN, -NR'SO2NR'R'', -NR'CONR'R'', -CONR'COR'', -NR'C(=N-CN)NR'R'', -C(=N-CN)NR'R'', -NR'C(=N-CN)R'', -NR'C(=C-NO2)NR'R'', -SO2NR'COR'', -NO2, -CO2R', -C(C=N-OR')R'', -CR'=CR'R'', -CCR', - S(C=O)(C=N-R')R'', -SF5 и -OCF3;
R' и R'' независимо выбраны из группы, состоящей из связи, Н, алкила, циклоалкила, арила, гетероарила, гетероциклила;
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
Rn содержит функциональную группу или атом,
причем n представляет собой целое число 1-4, и
если n равен 1, Rn модифицирован для присоединения к линкерной группе (L) посредством ковалентной связи, и
если n равен 2, 3 или 4, то один Rn модифицирован для присоединения к линкерной группе (L) посредством ковалентной связи, и любой другой Rn необязательно модифицирован для присоединения посредством ковалентной связи к PTM, ULM, второму CLM, имеющему одинаковую химическую структуру с CLM, CLM', второму линкеру или любым нескольким из указанных фрагментов или их комбинации.
(8) Соединение согласно (1), отличающееся тем, что CLM выбран из группы, состоящей из:
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3S)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3R)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-[3-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатетрадекан-14-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида;
4-{4,4-диметил-3-[4-({1-[2-(3-метил-2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{4-[(5-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пентил)окси]фенил}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]-этокси}фенил)ацетамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]амино}пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
4-(4-{[(5Z)-3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этил}-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[3-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-пропил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропил)-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{2-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]пиримидин-5-ил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-пропокси]-3-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-2-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-3-фторфенил}ацетамида; и
2-[(9R)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида.
(9) Соединение согласно (1), отличающееся тем, что линкерная группа (L) содержит химическое структурное звено, представленное формулой:
-Aq-
где
q представляет собой целое число более 1; и
A независимо выбран из группы, состоящей из связи, CRL1RL2, O, S, SO, SO2, NRL3, SO2NRL3, SONRL3, CONRL3, NRL3CONRL4, NRL3SO2NRL4, CO, CRL1=CRL2, C≡C, SiRL1RL2, P(O)RL1, P(O)ORL1, NRL3C(=NCN)NRL4, NRL3C(=NCN), NRL3C(=CNO2)NRL4, C3-11 циклоалкила, необязательно замещенного 0-6 группами RL1 и/или RL2, C3-11 гетероциклила, необязательно замещенного 0-6 группами RL1 и/или RL2, арила, необязательно замещенного 0-6 группами RL1 и/или RL2, гетероарила, необязательно замещенного 0-6 группами RL1 и/или RL2; причем
каждый RL1, RL2, RL3, RL4 и RL5 независимо выбран из группы, состоящей из Н, галогена, С1-8 алкила, ОС1-8 алкила, SC1-8 алкила, NHC1-8 алкила, N(С1-8 алкил)2, С3-11 циклоалкила, арила, гетероарила, С3-11 гетероциклила, ОС1-8 циклоалкила, SC1-8 циклоалкила, NHC1-8 циклоалкила, N(C1-8 циклоалкил)2, N(С1-8 циклоалкил)(С1-8 алкила), ОН, NH2, SH, SO2C1-8 алкила, Р(О)(ОС1-8 алкил)(С1-8 алкила), Р(О)(ОС1-8 алкил)2, СС-С1-8 алкила, ССН, СН=СН(С1-8 алкила), С(С1-8 алкил)=СН(С1-8 алкила), С(С1-8 алкил)=С(С1-8 алкил)2, Si(OH)3, Si(С1-8 алкил)3, Si(OH)(С1-8 алкил)2, СОС1-8 алкила, СО2Н, галогена, CN, CF3, CHF2, CH2F, NO2, SF5, SO2NHC1-8 алкила, SO2N(С1-8 алкил)2, SONHC1-8 алкила, SON(C1-8 алкил)2, CONHC1-8 алкила, CON(C1-8 алкил)2, N(C1-8 алкил)CONH(С1-8 алкила), N(C1-8 алкил)CON(C1-8 алкил)2, NHCONH(С1-8 алкила), NHCON(С1-8 алкил)2, NHCONH2, N(C1-8 алкил)SO2NH(С1-8 алкила), N(С1-8 алкил)SO2N(С1-8 алкил)2, NHSO2NH(C1-8 алкила), NHSO2N(С1-8 алкил)2 и NHSO2NH2; и
если q равен более чем 1, то каждый RL1 или RL2 может быть независимо связан с другой группой А с образованием циклоалкильного и/или гетероциклильного фрагмента, который может быть дополнительно замещен 0-4 группами RL5.
(10) Соединение согласно (2), отличающееся тем, что PTM представляет собой фрагмент, нацеливающий на белок, который связывается с белковой мишенью, целевым полипептидом или его фрагментом, где белковая мишень, целевой полипептид или его фрагмент имеют биологическую функцию, выбранную из группы, состоящей из структурной, регуляторной, гормональной, ферментной, генетической, иммунологической, сократительной, функции хранения, транспортировки и сигнальной трансдукции.
(11) Соединение согласно (2), отличающееся тем, что указанная группа PTM представляет собой фрагмент, который связывается с белковой мишенью, где указанная белковая мишень выбрана из группы, состоящей из B7.1 и B7, TINFRlm, TNFR2, НАДФН оксидазы, BclIBax и других партнеров в пути апоптоза, рецептора С5а, HMG-CoA редуктазы, фосфодиэстеразы типа ФДЭ-V, фосфодиэстеразы 4 типа ФДЭ-IV, ФДЭ-I, ФДЭ-II, ФДЭ-III, ингибитора скваленциклазы, CXCR1, CXCR2, синтазы оксида азота (NO), циклооксигеназы 1, циклооксигеназы 2, рецепторов 5HT, рецепторов дофамина, G белков, т.е. Gq, рецепторов гистамина, 5-липоксигеназы, триптазы, сериновой протеазы, тимидилат-синтазы, пурин-нуклеозидфосфорилазы, трипаносомального GAPDH, гликоген-фосфорилазы, карбоангидразы, рецепторов хемокинов, JAW STAT, RXR и аналогов, протеазы 1 ВИЧ, интегразы 1 ВИЧ, белков вируса гриппа, нейраминидазы, обратной транскриптазы вируса гепатита В, натриевого канала, белка множественной лекарственной устойчивости (MDR), P-гликопротеина (и MRP), тирозинкиназ, CD23, CD124, тирозинкиназы р56, lck, CD4, CD5, рецептора IL-2, рецептора IL-1, рецептора ФНО-альфа, ICAM1, каналов Cat+, VCAM, интегрина VLA-4, селектинов, CD40/CD40L, нейрокининов и рецепторов, инозинмонофосфатдегидрогеназы, р38 МАР киназы, пути Ras/Raf/ME/ERK, интерлейкин-1-превращающего фермента, каспазы, протеазы NS3 ВГС, РНК геликазы NS3 ВГС, глицинамидрибонуклеотидформилтрансферазы, протеазы 3С риновируса, протеазы вируса простого герпеса-1 (ВПГ-I), протеазы цитомегаловируса (ЦМВ), поли(АДФ-рибоза)полимеразы, циклин-зависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, мишени рапамицина у млекопитающих, SHP2, рецептора андрогенов, рецептора окситоцина, ингибитора микросомального транспортного белка, ингибитора транспорта желчных кислот, ингибиторов 5-альфа-редуктазы, ангиотензина 11, рецептора глицина, рецептора повторного захвата норадреналина, рецептора эстрогена, рецепторов, связанных с эстрогеном, киназы фокальной адгезии, Src, рецепторов эндотелина, нейропептида Y и рецептора, рецепторов аденозина, аденозинкиназы и АМФ-деаминазы, пуринергических рецепторов (P2Y1, P2Y2, P2Y4, P2Y6, P2X1-7), фарнезилтрансфераз, геранилгеранилтрансферазы, рецептора TrkA NGF, бета-амилоида, тирозинкиназы Flk-IIKDR, рецептора витронектина, рецептора интегрина, Her-21 neu, ингибитора теломеразы, цитозольной фосфолипазы А2 и рецепторной тирозинкиназы EGF. Дополнительные белковые мишени включают, например, экдизон-20-монооксигеназу, ионный канал GABA-зависимого хлоридного канала, ацетилхолинэстеразу, белок потенциалозависимого натриевого канала, канал высвобождения кальция и хлоридные каналы. Дополнительные белковые мишени включают ацетил-СоА карбоксилазу, аденилсукцинат-синтетазу, протопорфириноген-оксидазу и енолпирувил-шикимат-фосфат-синтазу.
(12) Соединение согласно (2), отличающееся тем, что указанная группа PTM представляет собой ингибитор Hsp90; ингибитор киназы, ингибитор фосфатазы, ингибитор HDM2/MDM2, соединение, направленно действующее на бромодомен-содержащие белки ВЕТ, ингибитор HDAC, ингибитор лизин-метилтрансферазы человека, соединение, направленно действующее на рецептор RAF, соединение, направленно действующее на FKBP, ингибитор ангиогенеза, иммуноподавляющее соединение, соединение, направленно действующее на арил-углеводородный рецептор, соединение, направленно действующее на рецептор андрогена, соединение, направленно действующее на рецептор эстрогена, соединение, направленно действующее на рецептор, связанный с эстрогеном, соединение, направленно действующее на рецептор гормона щитовидной железы, соединение, направленно действующее на протеазу ВИЧ, соединение, направленно действующее на интегразу ВИЧ, соединение, направленно действующее на протеазу ВГС, или соединение, направленно действующее на белок ацил-протеин-тиоэстеразу 1 и/или 2.
(13) Соединение согласно (2), отличающееся тем, что группа PTM выбрана из группы, состоящей из TANK-связывающей киназы 1 (TBK1), рецептора эстрогена α (ERα), бромодомен-содержащего белка 4 (BRD4), рецептора андрогена (AR) и c-Myc.
(14) Композиция, содержащая соединение согласно (2).
(15) Фармацевтическая композиция, содержащая соединение согласно (2) и фармацевтически приемлемый носитель, добавку и/или вспомогательное вещество.
(16) Фармацевтическая композиция согласно (15), дополнительно содержащая биоактивный агент.
(17) Фармацевтическая композиция согласно (16), отличающаяся тем, что биоактивный агент представляет собой противовирусный агент.
(18) Фармацевтическая композиция согласно (17), отличающаяся тем, что противовирусный агент представляет собой агент против ВИЧ.
(19) Фармацевтическая композиция согласно (18), отличающаяся тем, что агент против ВИЧ представляет собой нуклеозидные ингибиторы обратной транскриптазы (NRTI), ненуклеозидный ингибитор обратной транскриптазы, ингибиторы протеазы, ингибитор слияния или их смесь.
(20) Фармацевтическая композиция согласно (17), отличающаяся тем, что противовирусный агент представляет собой агент против ВГС.
(21) Фармацевтическая композиция согласно (16), отличающаяся тем, что биоактивный агент выбран из группы, состоящей из противовоспалительного агента, иммунологического агента, сердечно-сосудистого агента и неврологического агента.
(22) Фармацевтическая композиция согласно (16), отличающаяся тем, что биоактивный агент представляет собой противораковый агент.
(23) Композиция согласно (22), отличающаяся тем, что указанный противораковый агент выбран из группы, состоящей из эверолимуса, трабектедина, абраксана, TLK 286, AV-299, DN-101, пазопаниба, GSK690693, RTA 744, ON 0910.Na, AZD 6244 (ARRY-142886), AMN-107, TKI-258, GSK461364, AZD 1152, энзастаурина, вандетаниба, ARQ-197, MK-0457, MLN8054, PHA-739358, R-763, AT-9263, ингибитора FLT-3, ингибитора VEGFR, ингибитора EGFR TK, ингибитора аурора-киназы, модулятора PIK-1, ингибитора Bcl-2, ингибитора HDAC, ингибитора c-MET, ингибитора PARP, ингибитора Cdk, ингибитора EGFR TK, ингибитора IGFR TK, антитела к HGF, ингибитора PI3 киназы, ингибитора AKT, ингибитора mTORC1/2, ингибитора JAK/STAT, ингибитора контрольной точки 1 или 2, ингибитора киназы фокальной адгезии, ингибитора Map киназы киназы (mek), антитела, захватывающего VEGF, пеметрекседа, эрлотиниба, дасатаниба, нилотиниба, декатаниба, панитумумаба, амрубицина, ореговомаба, Lep-etu, нолатрекседа, azd2171, батабулина, офатумумаба, занолимумаба, эдотекарина, тетрандрина, рубитекана, тесмилифена, облимерсена, тицилимумаба, ипилимумаба, госсипола, Bio 111, 131-I-TM-601, ALT-110, BIO 140, CC 8490, циленгитида, гиматекана, IL13-PE38QQR, INO 1001, IPdR1 KRX-0402, лукантона, LY317615, нейрадиаба, витеспана, Rta 744, Sdx 102, талампанела, атрасентана, Xr 311, ромидеспина, ADS-100380, сунитиниба, 5-фторурацила, вориностата, этопозида, гемцитабина, доксорубицина, липосомального доксорубицина, 5'-деокси-5-фторуридина, винкристина, темозоломида, ZK-304709, селициклиба; PD0325901, AZD-6244, капецитабина, гептагидрата динатриевой соли N-[4-[2-(2-амино-4,7-дигидро-4-оксо-1Н-пирроло[2,3-d]пиримидин-5-ил)этил]бензоил]-L-глутаминовой кислоты, камптотецина, иринотекана, меченного ПЭГ, тамоксифена, торемифена цитрата, анастрозола, эксеместана, летрозола, DES (диэтилстилбестрола), эстрадиола, эстрогена, сопряженного эстрогена, бевацизумаба, IMC-1C11, CHIR-258; 3-[5-(метилсульфонилпиперадинметил)-индолил]хинолона, ваталаниба, AG-013736, AVE-0005, ацетатной соли [D-Ser(But)6,Azgly 10] (пиро-Glu-His-Trp-Ser-Tyr-D-Ser(But)-Leu-Arg-Pro-Azgly-NH2 ацетат [C59H84N18Oi4-(C2H4O2)x, где x=от 1 до 2,4]), госерелина ацетата, леупролида ацетата, трипторелина памоата, медроксипрогестерона ацетата, гидроксипрогестерона капроата, мегестрола ацетата, ралоксифена, бикалутамида, флутамида, нилутамида, мегестрола ацетата, CP-724714; TAK-165, HKI-272, эрлотиниба, лапатаниба, канертиниба, антитела ABX-EGF, эрбитукса, EKB-569, PKI-166, GW-572016, лонафарниба, BMS-214662, типифарниба; амифостина, NVP-LAQ824, субероиланилидгидроксамовой кислоты, вальпроевой кислоты, трихостатина А, FK-228, SU11248, сорафениба, KRN951, аминоглутетимида, амсакрина, анагрелида, L-аспарагиназы, вакцины бациллы Кальметта-Герена (БЦЖ), адриамицина, блеомицина, бусерелина, бусульфана, карбоплатина, кармустина, хлорамбуцила, цисплатина, кладрибина, клодроната, ципротерона, цитарабина, дакарбазина, дактиномицина, даунорубицина, диэтилстилбестрола, эпирубицина, флударабина, флудрокортизона, флуоксиместерона, флутамида, гливека, гемцитабина, гидроксимочевины, идарубицина, ифосфамида, иматиниба, леупролида, левамизола, ломустина, мехлорэтамина, мелфалана, 6-меркаптопурина, месна, метотрексата, митомицина, митотана, митоксантрона, нилутамида, октреотида, оксалиплатина, памидроната, пентостатина, пликамицина, порфимера, прокарбазина, ралитрекседа, ритуксимаба, стрептозоцина, тенипозида, тестостерона, талидомида, тиогуанина, тиотепа, третиноина, виндесина, 13-цис-ретиноевой кислоты, фенилаланинового иприта, урацилового иприта, эстрамустина, алтретамина, флоксуридина, 5-деоксиуридина, цитозина арабинозида, 6-меркаптопурина, деоксикоформицина, кальцитриола, валрубицина, митрамицина, винбластина, винорелбина, топотекана, разоксина, маримастата, COL-3, неовастата, BMS-275291, скваламина, эндостатина, SU5416, SU6668, EMD121974, интерлейкина-12, IM862, ангиостатина, витаксина, дролоксифена, идоксифена, спиронолактона, финастерида, цимитидина, трастузумаба, денилейкина, дифтитокса, гефитиниба, бортезимиба, паклитаксела, паклитаксела, не содержащего кремофор, доцетаксела, эпотилона В, BMS-247550, BMS-310705, дролоксифена, 4-гидрокситамоксифена, пипендоксифена, ERA-923, арзоксифена, фулвестранта, аколбифена, лазофоксифена, идоксифена, TSE-424, HMR-3339, ZK186619, топотекана, PTK787/ZK 222584, VX-745, PD 184352, рапамицина, 40-О-(2-гидроксиэтил)рапамицина, темсиролимуса, AP-23573, RAD001, ABT-578, BC-210, LY294002, LY292223, LY292696, LY293684, LY293646, вортманнина, ZM336372, L-779,450, ПЭГ-филграстима, дарбэпоэтина, эритропоэтина, гранулоцитарного колониестимулирующего фактора, золендроната, преднизона, цетуксимаба, гранулоцитарно-макрофагального колониестимулирующего фактора, гистрелина, пэгилированного интерферона альфа-2а, интерферона альфа-2а, пэгилированного интерферона альфа-2b, интерферона альфа-2b, азацитидина, ПЭГ-L-аспарагиназы, леналидомида, гемтузумаба, гидрокортизона, интерлейкина-11, дексразоксана, алемтузумаба, полностью транс-ретиноевой кислоты, кетоконазола, интерлейкина-2, мегестрола, иммунноглобулина, азотистого иприта, метилпреднизолона, ибритумомаб тиуксетана, андрогенов, децитабина, гексаметилмеламина, бексаротена, тозитумомаба, триоксида мышьяка, кортизона, эдитроната, митотана, циклоспорина, липосомального даунорубицина, Edwina-аспарагиназы, стронция 89, касопитанта, нетупитанта, антагонистов рецептора NK-1, палоносетрона, апрепитанта, дифенгидрамина, гидроксизина, метоклопрамида, лоразепама, алпразолама, галоперидола, дроперидола, дронабинола, дексаметазона, метилпреднизолона, прохлорперазина, гранисетрона, ондансетрона, доласетрона, трописетрона, пэгфилграстима, эритропоэтина, эпоэтина альфа, дарбэпоэтина альфа и их смесей.
(24) Способ индуцирования разрушения белковой мишени в клетке, включающий
введение эффективного количества соединения согласно (2) в клетку.
(25) Способ индуцирования разрушения белковой мишени в клетке, включающий
введение эффективного количества соединения согласно (10) в клетку.
(26) Способ индуцирования разрушения белковой мишени в клетке, включающий
введение эффективного количества соединения согласно (11) в клетку.
(27) Способ индуцирования разрушения белковой мишени у пациента, включающий
введение эффективного количества соединения согласно (2) пациенту.
(28) Способ лечения заболевания или болезненного состояния у пациента, где активность белка с нарушенной регуляцией вызывает указанное заболевание или болезненное состояние, включающий
введение эффективного количества соединения согласно (2).
(29) Способ согласно (28), отличающийся тем, что заболевание или болезненное состояние представляет собой астму, рассеянный склероз, рак, цилиопатии, расщелину неба, диабет, заболевание сердца, гипертензию, воспалительную болезнь кишечника, умственную отсталость, расстройства настроения, ожирение, аномалию рефракции, бесплодие, синдром Ангельмана, болезнь Канавана, глютеновую болезнь, болезнь Шарко-Мари-Тута, кистозный фиброз, мышечную дистрофию Дюшенна, гемохроматоз, гемофилию, синдром Клайнфельтера, нейрофиброматоз, фенилкетонурию, поликистозное заболевание почек (PKD1) или 4 (PKD2), синдром Прадера-Вилли, серповидноклеточную анемию, болезнь Тея-Сакса, синдром Тернера.
(30) Способ согласно (28), отличающийся тем, что указанное заболевание или болезненное состояние представляет собой болезнь Альцгеймера, амиотрофический латеральный склероз (болезнь Лу Герига), нервную анорексию, тревожное расстройство, атеросклероз, синдром дефицита внимания и гиперактивности, аутизм, биполярное расстройство, синдром хронической усталости, хроническую обструктивную болезнь легких, болезнь Крона, коронарную болезнь сердца, деменцию, депрессию, сахарный диабет 1 типа, сахарный диабет 2 типа, эпилепсию, синдром Гийенна-Барре, синдром раздраженного кишечника, волчанку, метаболический синдром, рассеянный склероз, инфаркт миокарда, ожирение, обсессивно-компульсивное расстройство, паническое расстройство, болезнь Паркинсона, псориаз, ревматоидный артрит, саркоидоз, шизофрению, инсульт, облитерирующий тромбангиит, синдром Туретта, васкулит.
(31) Способ согласно (28), отличающийся тем, что указанное заболевание или болезненное состояние представляет собой ацерулоплазминемию, ахондрогенез II типа, ахондроплазию, акроцефалию, болезнь Гоше 2 типа, острую перемежающуюся порфирию, болезнь Канавана, аденоматозный полипоз толстой кишки, дефицит ALA-дегидратазы, дефицит аденилсукцинат-лиазы, адреногенитальный синдром, адренолейкодистрофию, ALA-D порфирию, дефицит ALA-дегидратазы, алкаптонурию, болезнь Александера, алкаптонурический охроноз, дефицит альфа-1-антитрипсина, ингибитор альфа-1-протеиназы, эмфизему, амиотрофический латеральный склероз, синдром Альстрема, болезнь Александера, несовершенный амелогенез, дефицит ALA-дегидратазы, болезнь Андерсона-Фабри, сидром нечувствительности к андрогену, анемию, диффузную ангиокератому туловища, ангиоматоз сетчатки (болезнь фон Хиппеля-Линдау), синдром Аперта, арахнодактилию (синдром Марфана), синдром Стиклера, наследственную гиперэластическую кожу (синдром Элерса-Данлоса по типу артрохалазии), атаксию-телеангиэктазию, синдром Ретта, первичную легочную гипертензию, болезнь Сэндхоффа, нейрофиброматоз II типа, синдром складчатой пахидермии Бира-Стивенсона, семейную средиземноморскую лихорадку, синдром Бенджамина, бета-талассемию, двусторонний акустический нейрофиброматоз (нейрофиброматоз II типа), тромбофилию, вызванную фактором Лейдена V, синдром Блоха-Сульцбергера (недержание пигмента), синдром Блума, X-сцепленную сидеробластную анемию, синдром Бонневи-Ульриха (синдром Тернера), болезнь Бурневилля (туберозный склероз), прионную болезнь, синдром Берта-Хога-Дьюба, болезнь хрупких костей (незавершенный остеогенез), синдром широкого большого пальца кистей и стоп (синдром Рубинштейна-Тейби), бронзовый диабет/бронзовый цирроз (гемохроматоз), бульбоспинальную мышечную атрофию (болезнь Кеннеди), синдром Бюргера-Грютца (дефицит липопротеинлипазы), хроническую гранулематозную болезнь ХГБ, кампомелическую дисплазию, дефицит биотинидазы, кардиомиопатию (синдром Нунан), синдром кошачьего крика, CAVD (врожденное отсутствие семявыводящего протока), кардио-фациальный синдром Кейлора (CBAVD), врожденную эритропоэтическую порфирию (ВЭП), кистозный фиброз, врожденный гипотиреоз, синдром хондродистрофии (ахондроплазию), отоспондиломегаэпифизарную дисплазию, синдром Леша-Нихана, галактосемию, синдром Элерса-Данлоса, танатофорическую дисплазию, синдром Коффина-Лоури, синдром Коккейна, (наследственный аденоматозный полипоз), врожденную эритропоэтическую порфирию, врожденное заболевание сердца, метгемоглобинемию/врожденную метгемоглобинемию, ахондроплазию, X-сцепленную сидеробластную анемию, заболевание соединительных тканей, вело-кардио-фациальный синдром, анемию Кули (бета-талассемию), болезнь хранения меди (болезнь Вильсона), болезнь транспорта меди (болезнь Менкеса), наследственную копропорфирию, синдром Коудена, краниофациальный дизартроз (синдром Крузона), болезнь Крейтцфельдта-Якоба (прионную болезнь), синдром Коккейна, синдром Коудена, синдром Куршмана-Баттена-Штейнерта (миотоническую дистрофию), синдром складчатой пахидермии Бира-Стивенсона, первичную гипероксалурию, спондилоэпиметафизарную дисплазию (Страдвика), мышечную дистрофию Дюшенна и Бекера (DBMD), синдром Ушера, дегенеративные нервные заболевания, включая синдром де Груши и синдром Дежерина-Сотта, нарушение развития, дистальную спинальную мышечную атрофию V типа, синдром нечувствительности к андрогену, диффузный инфантильный склероз (болезнь Краббе), синдром Ди Джорджи, дефицит рецептора дигидротестостерона, синдром нечувствительности к андрогену, синдром Дауна, карликовость, эритропоэтическую протопорфирию, дефицит эритроидной 5-аминолевулинатсинтетазы, эритропоэтическую порфирию, эритропоэтическую протопорфирию, эритропоэтическую уропорфирию, атаксию Фридрейха, семейный пароксизмальный полисерозит, позднюю кожную порфирию, семейную чувствительную нейропатию при нажиме, первичную легочную гипертензию (ПЛГ), фиброкистозную болезнь поджелудочной железы, синдром ломкой X-хромосомы, галактосемию, генетические нарушения мозга, гигантоклеточный гепатит (неонатальный гемохроматоз), синдром Гренблад-Страндберга (эластическую псевдоксантому), болезнь Гюнтера (наследственную эритропоэтическую порфирию), гемохроматоз, синдром Холлгрена, серповидноклеточную анемию, гемофилию, печеночную эритропоэтическую порфирию (ПЭП), болезнь Хиппеля-Линдау (фон Хиппеля-Линдау), болезнь Хантингтона, синдром прогерии Хатчинсона-Гилфорда (прогерии), гиперандрогению, гипохондроплазию, гипохромную анемию, нарушения иммунной системы, включая X-сцепленный тяжелый комбинированный иммунодефицит, синдром Инсли-Эстли, синдром Джексона-Вейса, синдром Жубера, синдром Леша-Нихана, синдром Джексона-Вейса, заболевания почек, включая гипероксалурию, синдром Клайнфельтера, дисплазию Книста, лакунарную деменцию, ахондрогенез Лангера-Салдино, атаксию-телеангиэктазию, синдром Линча, дефицит лизил-гидроксилазы, болезнь Мачадо-Джозефа, метаболические нарушения, включая дисплазию Книста, синдром Марфана, нарушения движений, синдром Моуат-Вильсона, кистозный фиброз, синдром Мюнке, множественный нейрофиброматоз, синдром Нэнси-Инсли, хондродисплазию Нэнси-Суини, болезнь Ниманна-Пика, синдром Ноака (синдром Пфайффера), болезнь Ослера-Вебера-Рандю, синдром Пейтца-Егерса, поликистозную болезнь почек, полиоссальную фиброзную дисплазию (синдром Мак-Кьюна-Олбрайта), синдром Пейтца-Егерса, синдром Прадера-Лабхарта-Вилли, гемохроматоз, синдром первичной урикемии (синдром Леша-Нихана), первичную легочную гипертензию, первичную старческую дегенеративную деменцию, прионную болезнь, прогерию (синдром прогерии Хатчинсона-Гилфорда), прогрессирующую хорею, хроническую наследственную болезнь Хантингтона (болезнь Хантингтона), прогрессирующую мышечную атрофию, спинальную мышечную атрофию, пропионовую ацидемию, протопорфирию, проксимальную миотоническую дистрофию, гипертензию легочных артерий, PXE (эластическую псевдоксантому), РБ (ретинобластому), болезнь Реклингхаузена (нейрофиброматоз I типа), рецидивирующий полисерозит, нарушения сетчатки, ретинобластому, синдром Ретта, RFALS 3 типа, синдром Рикера, синдром Райли-Дея, синдром Русси-Леви, тяжелую ахондроплазию с задержкой развития и пигментной сосочковой дистрофией кожи (SADDAN), синдром Ли-Фраумени, синдром саркомы, рака груди, лейкоза и рака надпочечников (SBLA), туберозный склероз (эпилойю), SDAT, наследственную СЭД (наследственную спондилоэпофизарную дисплазию), СЭД Страдвика (спондилоэпиметафизарную дисплазию Страдвика), нСЭД (наследственную спондилоэпифизарную дисплазию), СЭМД Страдвика (спондилоэпиметафизарную дисплазию Страдвика), синдром Шпринтцена, нарушения пигментации кожи, синдром Смита-Лемли-Опица, южно-африканскую генетическую порфирию (смешанную порфирию), наследственный спастический паралич, проявляющийся в младенчестве, расстройства речи и общения, сфинголипидоз, болезнь Тея-Сакса, спинально-церебеллярную атаксию, синдром Стиклера, инсульт, синдром нечувствительности к андрогену, дефицит тетрагидробиоптерина, бета-талассемию, заболевание щитовидной железы, томакулезную нейропатию (врожденную нейропатию со склонностью к параличам от сдавливания), синдром Тричера-Коллинза, синдром трипло-Х (синдром тройной Х-хромосомы), трисомию 21 (синдром Дауна), трисомию Х, синдром VHL (болезнь фон Хиппеля-Линдау), нарушение зрения и слепоту (синдром Альстрема), болезнь Вролика, синдром Ваарденбурга, синдром Варбурга-Сьо-Фледелиуса, синдром Вайзенбахера-Цваймюллера, синдром Вольфа-Хиршхорна, периодическую болезнь Вольфа, синдрома Вайзенбахера-Цваймюллера и пигментозную ксеродермию.
(32) Способ согласно (28), отличающийся тем, что заболевание или болезненное состояние представляет собой рак.
(33) Способ согласно (32), отличающийся тем, что рак представляет собой плоскоклеточную карциному, базальноклеточную карциному, аденокарциному, печеночноклеточные карциномы и почечноклеточные карциномы, рак мочевого пузыря, кишечника, груди, шейки матки, толстой кишки, пищевода, головы, почки, печени, легкого, шеи, яичников, поджелудочной железы, простаты и желудка; лейкозы; доброкачественные и злокачественные лимфомы, в частности лимфому Беркитта и неходжкинскую лимфому; доброкачественные и злокачественные меланомы; миелопролиферативные заболевания; множественную миелому, саркомы, включая саркому Юинга, гемангиосаркому, саркому Капоши, липосаркому, миосаркомы, периферическую нейроэпителиому, синовиальную саркому, глиомы, астроцитомы, олигодендроглиомы, эпендимомы, глиобластомы, нейробластомы, ганглионевромы, ганглиоглиомы, медуллобластомы, опухоли из клеток шишковидного тела, менингиомы, менингеальные саркомы, нейрофибромы и шванномы; рак кишечника, рак груди, рак простаты, рак шейки матки, рак матки, рак легкого, рак яичников, рак яичек, рак щитовидной железы, астроцитому, рак пищевода, рак поджелудочной железы, рак желудка, рак печени, рак толстой кишки, меланому; карциносаркому, болезнь Ходжкина, опухоль Вильмса и тератокарциномы.
(34) Способ согласно (32), отличающийся тем, что указанное раковое заболевание представляет собой острый Т-лимфобластный лейкоз (Т-ОЛЛ), Т-клеточную лимфобластную лимфому (Т-ЛЛ), периферическую Т-клеточную лимфому, Т-клеточный лейкоз взрослых, пре-В ОЛЛ, пре-В лимфомы, крупноклеточную В-клеточную лимфому, лимфому Беркитта, В-клеточный ОЛЛ, ОЛЛ с положительной филадельфийской хромосомой и ХМЛ с положительной филадельфийской хромосомой.
(35) Библиотека соединений, содержащая более чем одно соединение согласно (1).
(36) Способ выявления соединения, содержащего фрагмент, связывающий Е3 убиквитин-лигазу, который распознает цереблон (CRBN), включающий:
инкубацию исследуемого соединения с белком CRBN;
определение количества исследуемого соединения, связывающегося с белком CRBN.
(37) Фрагмент, связывающий цереблон Е3 убиквитин-лигазу (CLM), имеющий химическую структуру:
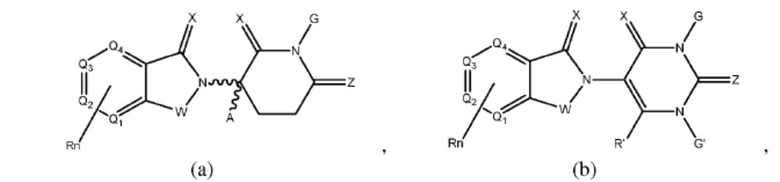
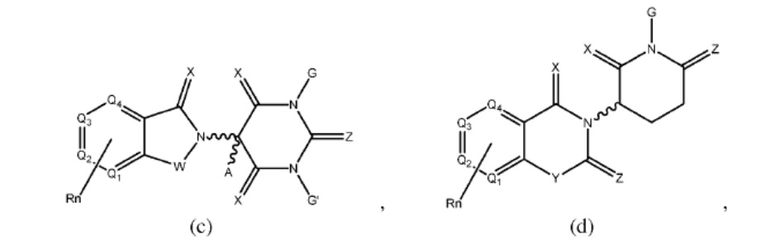

где
W выбран из группы, состоящей из CH2, CHR, C=O, SO2, NH и N-алкила;
каждый X независимо выбран из группы, состоящей из О, S и H2;
Y выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-циклоалкила, N-гетероциклила, О и S;
Z выбран из группы, состоящей из О, S и H2;
G и G' независимо выбраны из группы, состоящей из Н, алкила, ОН, CH2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1, Q2, Q3 и Q4 представляют собой атом углерода C, замещенный группой, независимо выбранной из R', N или N-оксид;
А независимо выбран из группы, состоящей из алкила, циклоалкила, Cl и F;
R содержит -CONR'R'', -OR', -NR'R'', -SR', -SO2R', -SO2NR'R'', -CR'R''-, -CR'NR'R''-, - арил, -гетероарил, -алкил, -циклоалкил, -гетероциклил, -P(O)(OR')R'', -P(O)R'R'', - OP(O)(OR')R'', -OP(O)R'R'', -Cl, -F, -Br, -I, -CF3, -CN, -NR'SO2NR'R'', -NR'CONR'R'', -CONR'COR'', -NR'C(=N-CN)NR'R'', -C(=N-CN)NR'R'', -NR'C(=N-CN)R'', -NR'C(=C-NO2)NR'R'', -SO2NR'COR'', -NO2, -CO2R', -C(C=N-OR')R'', -CR'=CR'R'', -CCR', - S(C=O)(C=N-R')R'', -SF5 и -OCF3;
R' и R'' независимо выбраны из группы, состоящей из связи, Н, алкила, циклоалкила, арила, гетероарила, гетероциклила;
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической; и
Rn содержит функциональную группу или атом,
причем n представляет собой целое число 1-4.
(38) CLM согласно (37), отличающийся тем, что Rn содержит функциональную группу или атом, которая(-ый) ковалентно присоединена(-н) к линкерной группе (L), фрагменту, нацеливающему на белок (PTM), фрагменту, связывающемуся с убиквитин-лигазой Е3 (ULM), или нескольким указанным фрагментам или их комбинации.
(39) CLM согласно (38), отличающийся тем, что ULM представляет собой второй CLM, CLM' или любую их комбинацию или несколько фрагментов, где
второй CLM имеет такую же химическую структуру, что и CLM, и
CLM' имеет структуру, отличающуюся от CLM.
ПРИМЕРЫ
А. Исследования
1. Исследование CRBN - клонирование, экспрессия и очистка CRBN и DDB1 человека
[00266] Использовали стандартный способ, известный в данной области техники, такой как приведен в описании Lopez-Girona et al. (Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide, A Lopez-Girona, D Mendy, T Ito, K Miller, A K Gandhi, J Kang, S Karasawa, G Carmel, P Jackson, M Abbasian, A Mahmoudi, B Cathers, E Rychak, S Gaidarova, R Chen, P H Schafer, H Handa, T O Daniel, J F Evans and R Chorpa, Leukemia 26: 2326-2335, 2012).
[00267] кДНК для генов CRBN и DDB1 можно амплифицировать путем ПЦР с применением Pfusion (NEB) в качестве полимеразы и следующих последовательностей праймера:
(SEQ ID NO: 1)
(SEQ ID NO: 2)
(SEQ ID NO: 3)
(SEQ ID NO: 4)
(SEQ ID NO:5)
[00268] CRBN можно клонировать в pBV-ZZ-HT-LIC, pBV-GCT-LIC, pMA-HT-LIC, и DDBI - в pBV-без метки-LIC путем безлигазного клонирования 26. В случае клонирования в вектор млекопитающих pMA-HT-LIC олигомер CRBN-Flag-обращенный встраивает C-терминальную метку FLAG для иммунодетектирования. DDB1-обр встраивает StrepTag 27. Метка ZZ-tag 28 является необходимой для обеспечения высокой экспрессии растворимого CRBN; в ее отсутствие экспрессия His-CRBN находится на низком уровне, при этом GST-CRBN обеспечивает агрегированный белок. Рекомбинантные бакуловирусы с ZZ-His-CRBN и DDB1-StrepTag (ST) получали и амплифицировали с использованием системы экспрессии бакуловирусов Bac-to-Bac производства Invitrogen в клетках насекомых Sf9. Проводили совместную экспрессию ZZ-His-CRBN и DDB1-ST в клетках насекомых High Five (Tni) в реакторах Wave Bag 10L при 27°С с использованием среды ESF921, не содержащей добавок, производства Expression Systems. Клетки собирали через 48 часов после инфицирования путем центрифугирования и повторно суспендировали пасту в PBS, содержащем 5Х коктейль ингибиторов протеазы (Roche, Indianapolis, IN).
[00269] Все последующие стадии очистки белка проводили при 4°С. Размораживали замороженные клетки, повторно суспендировали в 5 объемах лизисного буфера (50 мМ Tris HCl, pH 8,0, 0,5 М NaCl, 10% глицерина, 2 мМ DTT), содержащего 20 мМ имидазола и ингибиторов протеаз, проводили лизис и центрифугировали с получением прозрачной надосадочной жидкости. CRBN-DDB1 очищали на системе ÄKTA-xpress (GE Healthcare) путем хроматографии с использованием никель-сефарозы и сефакрила S200. Затем комплекс дополнительно очищали путем анионообменной хроматографии на 8 мл колонке MonoQ и второй раз фильтровали через гель S-200. CRBN-DDB1 выявляли путем ДСН-ПААГ, фракции, содержащие CRBN-DDB1, объединяли и хранили при -70°С.
2. Термическое исследование флуоресценции расплава для измерения связывания соединений с рекомбинантным CRBN
[00270] Использовали стандартное исследование, известное в данной области техники, такое как приведено в описании Lopez-Girona et al. (Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide, A Lopez-Girona, D Mendy, T Ito, K Miller, A K Gandhi, J Kang, S Karasawa, G Carmel, P Jackson, M Abbasian, A Mahmoudi, B Cathers, E Rychak, S Gaidarova, R Chen, P H Schafer, H Handa, T O Daniel, J F Evans and R Chorpa, Leukemia 26: 2326-2335, 2012).
[00271] Термическую стабильность CRBN-DDB1 в присутствии исследуемых соединений или без них определяли в присутствии Sypro Orange с использованием микропланшетов согласно Pantoliano et al. (Pantoliano MW, Petrella EC, Kwasnoski JD, Lobanov VS, Myslik J, Graf E et al. High-density miniaturized thermal shift assays as a general strategy for drug discovery. J Biomol Screen 2001; 6: 429-440). Два мг белка в 20 мл буфера для исследования (25 мМ Tris HCl, pH 8,0, 150 мМ NaCl, 2 мкМ Sypro Orange) подвергали воздействию путем постадийного повышения температуры от 20 до 70°С и определяли флуоресценцию через каждый 1°С на ABIPrism 7900HT (Applied Biosystems Carlsbad, CA, USA). Соединения растворяли в ДМСО (1% конечная концентрация в исследовании) и исследовали в четырех повторностях в концентрации в диапазоне от 30 нМ до 1000 мкМ; контроль содержал только 1% ДМСО.
3. Метод ЖХМС
[00272] Анализ проводили на колонке Poroshell 120 EC C18 (50 мм х 3,0 мм внутренний диаметр, 2,7 мкм диаметр упакованных частиц) при 45°С.
[00273] В качестве растворителей применяли:
А=0,1% (об./об.) раствор муравьиной кислоты в воде.
В=0,1% (об./об.) раствор муравьиной кислоты в ацетонитриле.
[00274] Применяли следующий градиент:
[00275] УФ-детектирование проводили по среднему сигналу в диапазоне длин волн от 210 нм до 350 нм, масс-спектры получали на масс-спектрометре с использованием ионизации электронным распылением в режиме детектирования положительных ионов.
[00276] Далее проиллюстрированы мобильные фазы и градиенты, применяемые при очистке соединений путем препаративной ВЭЖХ.
4. Препаративная ВЭЖХ (модификатор муравьиная кислота)
[00277] Анализ ВЭЖХ проводили на колонке X Bridge RP18 OBD (150 мм х 19 мм внутренний диаметр, 5 мкм диаметр упакованных частиц) при температуре окружающей среды.
[00278] В качестве растворителей применяли:
А=0,1% (об./об.) раствор муравьиной кислоты в воде.
В=ацетонитрил
5. Препаративная ВЭЖХ (модификатор бикарбонат аммония)
[00279] Анализ ВЭЖХ проводили на колонке X Bridge RP18 OBD (150 мм х 19 мм внутренний диаметр, 5 мкм диаметр упакованных частиц) при температуре окружающей среды.
[00280] В качестве растворителей применяли:
А=10 мМ бикарбонат аммония в воде.
В=ацетонитрил
[00281] Для каждой очистки путем препаративной ВЭЖХ, независимо от применяемого модификатора, применяемый градиент зависел от времени удерживания конкретного соединения, для которого проводили очистку, что указано в способе аналитической ЖХМС. Расход составлял 20 мл/мин.
[00282] УФ-детектирование проводили по сигналу при длине волны 254 нм или 220 нм.
[00283] Несмотря на то, что в настоящей заявке были показаны и описаны предпочтительные варианты реализации изобретения, следует понимать, что указанные варианты реализации предложены исключительно в качестве примеров. Специалистам в данной области техники будут понятны многочисленные вариации, изменения и замещения, которые можно проводить, не выходя за рамки сущности изобретения. Соответственно, предполагается, что прилагаемая формула изобретения охватывает все указанные вариации, не выходящие за рамки сущности и объема изобретения.
В. Синтез
Подробное описание синтеза, приведенное ниже в примерах, является типовым для общих способов и включает информацию о синтезе более широкой группы примеров.
1. 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-дион
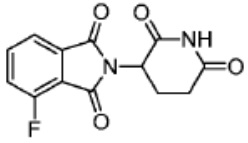
Стадия 1: 4-фторизобензофуран-1,3-дион
Смесь 3-фторфталевой кислоты (50 г, 271,7 ммоль) в ангидриде уксусной кислоты (400 мл) кипятили с обратным холодильником в течение 2 часов. Удаляли летучие вещества в вакууме и кристаллизовали остатки в ангидриде уксусной кислоты с получением 4-фторизобензофуран-1,3-диона (40 г, неочищенный) в виде коричневого твердого вещества. ЖХ-МС: 167,1 [MH]+. 1Н ЯМР (400 МГц, CDCl3): δ 7,58 (t, J=8,0 Гц, 1Н), 7,86 (d, J=7,2 Гц, 1Н), 7,92-7,97 (m, 1H).
Стадия 2: 5-амино-2-(4-фтор-1,3-диоксоизоиндолин-2-ил)-5-оксопентановая кислота

Смесь полученного выше 4-фторизобензофуран-1,3-диона (40 г, неочищенный) и L-глутамина (35 г, 239 ммоль) в сухом ДМФ (200 мл) перемешивали при 90°С в течение 8 часов. Удаляли растворитель при пониженном давлении. Остаток перерастворяли в 4н. HCl (200 мл) и перемешивали в течение еще 8 часов. Полученный осадок собирали путем фильтрования, промывали водой и сушили с получением 5-амино-2-(4-фтор-1,3-диоксоизоиндолин-2-ил)-5-оксопентановой кислоты (37 г, неочищенная) в виде беловатого твердого вещества. ЖХ-МС: 295,2 [MH]+. 1Н ЯМР (400 МГц, CDCl3): δ 2,16-2,20 (m, 2H), 2,31-2,43 (m, 2H), 4,79-4,83 (m, 1H), 6,79 (шир., 1Н), 7,26 (шир., 1Н), 7,77-7,85 (m, 2H), 7,98-8,03 (m, 1H), 13,32 (шир., 1Н).
Стадия 3: 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-дион

Смесь полученной выше 5-амино-2-(4-фтор-1,3-диоксоизоиндолин-2-ил)-5-оксопентановой кислоты (37 г, неочищенная), 1,1'-карбонилдиимидазола (CDI) (24,2 г, 149,4 ммоль) и 4-диметиламинопиридина (DMAP) (1,3 г, 11,5 ммоль) в ацетонитриле (80 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры. Собирали полученное твердое вещество путем фильтрования и промывали ацетонитрилом (100 мл) с получением неочищенного продукта, который очищали путем хроматографии на силикагеле с использованием смесей 1-10% МеОН в ДХМ в качестве элюента с получением 2-(2,6-диоксопиперидин-3-ил)-4-фторизоиндолин-1,3-диона (9,0 г, выход 12% за три стадии) в виде светло-желтого твердого вещества. ЖХ-МС: 277,2 [MH]+. 1Н ЯМР (400 МГц, CDCl3): δ 2,14-2,19 (m, 1H), 2,75-2,95 (m, 3H), 4,97-5,01 (m, 1H), 7,43 (t, J=8,4 Гц, 1Н), 7,10-7,81 (m, 2H), 8,08 (шир., 1Н).
2. N-(3-(5-бром-2-хлорпиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамид
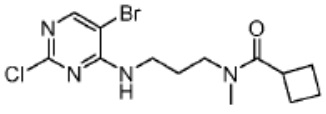
Стадия 1: трет-бутил-N-{3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}-N-метилкарбамат

Смесь трет-бутил-N-(3-аминопропил)-N-метилкарбамата (826 мг, 4,40 ммоль) и 5-бром-2,4-дихлорпиримидина (400 мг, 1,76 ммоль) в МеОН (10 мл) перемешивали при КТ в течение 1 часа. Затем реакционную смесь концентрировали в вакууме и очищали остаток путем хроматографии на Teledyne ISCO [0→35% EtOAc/гептаны] с получением трет-бутил-N-{3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}-N-метилкарбамата (615 мг, выход 92%). ЖХ-МС (ИЭР+): m/z=381,05/383,05 [MH+], tR=2,55 мин.
Стадия 2: {3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}(метил)амин
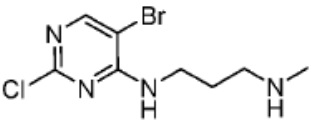
В раствор трет-бутил-N-{3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}-N-метилкарбамата (615 мг, 1,62 ммоль) в ДХМ (5 мл) добавляли трифторуксусную кислоту (0,54 мл, 6,5 ммоль) при КТ. После перемешивания в течение 1 часа концентрировали смесь в вакууме. Остаток очищали путем хроматографии Teledyne ISCO [0→15% метанола в ДХМ] с получением {3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}(метил)амина (371 мг, выход 82%). ЖХ-МС (ИЭР+): m/z=280,99/282,99 [MH+], tR=1,13 мин.
Стадия 3: N-{3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамид
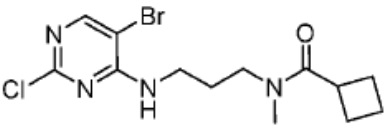
В раствор {3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}(метил)амина (371 мг, 1,33 ммоль) и циклобутанкарбонилхлорида (188 мг, 1,60 ммоль) в ДХМ (10 мл) при КТ добавляли триэтиламин (0,41 мл, 2,92 ммоль). Реакционную смесь оставляли перемешиваться при КТ в течение 16 часов, затем концентрировали в вакууме. Остаток очищали путем хроматографии Teledyne ISCO [0→100% EtOAc/гептаны] с получением N-{3-[(5-бром-2-хлорпиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида (268 мг, 56%). ЖХ-МС (ИЭР+): m/z=363,04/365,04 [MH+], tR=2,18 мин.
3. (S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)уксусная кислота

Титульное соединение получали согласно способам, описанным в WO2011/143660.
4. (Z)-4-(4-((2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрил
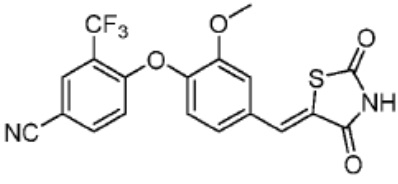
Титульное соединение получали согласно способам, описанным в Patch, R. J. et al. J. Med. Chem. 2011, 54, 788-808.
5. 4-[3-(4-гидроксифенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрил
Титульное соединение получали согласно способам, описанным в Jung, M. E. et al J Med. Chem. 2010, 53, 2779-2796.
6. Гидрохлоридная соль 2-хлор-4-(транс-3-амино-2,2,4,4-тетраметилциклобутокси)бензонитрила
Титульное соединение получали согласно способам, описанным в Guo, C, et al J. Med. Chem. 2011, 54, 7693-7704.
7. [N-(3-(5-бром-2-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фениламино)пиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамид]
(структура соединения №17, показана в таблице 1)
Стадия 1: 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этил-4-метилбензолсульфонат

Смесь 2,2'-(2,2'-окси-бис(этан-2,1-диил)бис(окси))бис(этан-2,1-диил)бис(4-метилбензолсульфоната) (3 г, 5,96 ммоль), 4-нитрофенола (813 мг, 5,84 ммоль) и карбоната калия (1,65 г, 11,94 ммоль) в сухом N,N-диметилформамиде (20 мл) перемешивали при 50°С в течение ночи. Смесь охлаждали до комнатной температуры и выливали в воду (60 мл), затем экстрагировали этилацетатом (80 мл х3). Объединенные органические фазы промывали водой (50 мл) и солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали 10-20% смесями этилацетата в гексане) с получением 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этил-4-метилбензолсульфоната (2,65 г, выход 95%) в виде желтой маслянистой жидкости. ЖХ-МС (ИЭР+): m/z 470,2 [MH+] (tR=2,83 мин).
Стадия 2: [1-(2-(2-(2-(2-азидоэтокси)этокси)этокси)этокси)-4-нитробензол]
Смесь 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этил-4-метилбензолсульфоната (2,65 г, 5,64 ммоль) и азида натрия (734 мг, 11,29 ммоль) в этаноле (30 мл) кипятили с обратным холодильником в течение 16 часов. Смесь охлаждали до комнатной температуры, гасили водой (50 мл) и экстрагировали дихлорметаном (50 мл х3). Объединенные органические фазы промывали водой (50 мл) и солевым раствором (40 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного 1-(2-(2-(2-(2-азидоэтокси)этокси)этокси)этокси)-4-нитробензола (865 мг) в виде желтой маслянистой жидкости.
Стадия 3: [2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этанамин]
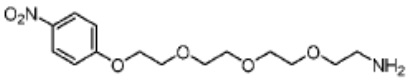
Смесь полученного выше 1-(2-(2-(2-(2-азидоэтокси)этокси)этокси)этокси)-4-нитробензола (865 мг, 2,54 ммоль), трифенилфосфина (999 мг, 3,81 ммоль) и воды (69 мг, 3,83 ммоль) в тетрагидрофуране (10 мл) перемешивали при комнатной температуре в течение 14 часов в атмосфере азота. Удаляли летучие вещества при пониженном давлении с получением неочищенного остатка, который очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 3-5% метанола в дихлорметане) с получением 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этанамина (661 мг, выход 83%) в виде желтой маслянистой жидкости. 1Н ЯМР (400 МГц, CDCl3): δ 2,86 (t, J=5,2 Гц, 2Н), 3,51 (t, J=5,6 Гц, 2Н), 3,63-3,75 (m, 8H), 3,90 (t, J=4,4 Гц, 2Н), 4,23 (t, J=4,8 Гц, 2Н), 6,97-6,99 (m, 2H), 8,18-8,22 (m, 2H).
Стадия 4: трет-бутил-2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этилкарбамат

Смесь 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этанамина (661 мг, 2,1 ммоль), триэтиламина (449 мг, 4,43 ммоль) и ди-трет-бутилдикарбоната (505 мг, 2,31 ммоль) в дихлорметане (25 мл) перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли дихлорметаном (100 мл), промывали водой (30 мл х2) и солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 20-40% этилацетата в гексане) с получением трет-бутил-2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этилкарбамата (818 мг, выход 94%) в виде желтой маслянистой жидкости. 1Н ЯМР (400 МГц, CDCl3): δ 1,44 (s, 9H), 3,37 (d, J=5,2 Гц, 2Н), 3,54 (t, J=5,2 Гц, 2Н), 3,62-3,70 (m, 6H), 3,73-3,76 (m, 2H), 3,90 (t, J=4,4 Гц, 2Н), 4,23 (t, J=4,8 Гц, 2Н), 5,01 (шир., 1Н), 6,96-7,00 (m, 2H), 8,18-8,22 (m, 2H).
Стадия 5: трет-бутил-2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)этилкарбамат
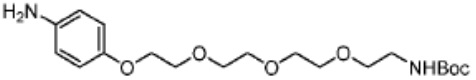
Смесь трет-бутил-2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этилкарбамата (818 мг, 1,97 ммоль), порошка железа (1,1 г, 0,65 ммоль) и хлорида аммония (528 мг, 9,87 ммоль) в этаноле (20 мл) и воде (5 мл) перемешивали при 80°С в течение 1 часа. Смесь охлаждали до комнатной температуры, удаляли твердый осадок путем фильтрования и промывали этилацетатом (20 мл х2). Фильтрат разделяли в этилацетате (120 мл) и воде (30 мл). Органическую фазу промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюировали смесями 30-40% этилацетата в гексане) с получением трет-бутил-2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)этилкарбамата (512 мг, выход 67%) в виде желтой маслянистой жидкости.
Стадия 6: трет-бутил-2-(2-(2-(2-(4-(5-бром-4-(3-(N-метилциклобутанкарбоксамидо)-пропиламино)пиримидин-2-иламино)фенокси)этокси)этокси)этокси)этилкарбамат
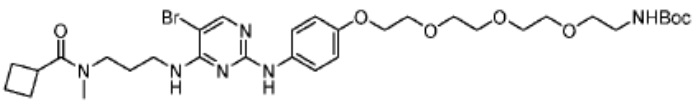
Смесь трет-бутил-2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)этилкарбамата (130 мг, 0,34 ммоль), N-(3-(5-бром-2-хлорпиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамида (24 мг, 0,06 ммоль) и п-толуолсульфокислоты (11,6 мг, 0,07 ммоль) в диоксане (1,5 мл) кипятили с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, гасили водным раствором бикарбоната натрия (1,0 н., 30 мл) и экстрагировали этилацетатом (30 мл х3). Объединенные органические фазы промывали водой (30 мл) и солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали 50% смесью этилацетата в гексане) с получением трет-бутил-2-(2-(2-(2-(4-(5-бром-4-(3-(N-метилциклобутанкарбоксамидо)пропиламино)пиримидин-2-иламино)фенокси)этокси)этокси)этокси)этилкарбамата (40 мг, выход 17%) в виде желтой маслянистой жидкости.
Стадия 7: N-(3-(2-(4-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этокси)фениламино)-5-бромпиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамид

Смесь трет-бутил-2-(2-(2-(2-(4-(5-бром-4-(3-(N-метилциклобутанкарбоксамидо)-пропиламино)пиримидин-2-иламино)фенокси)этокси)этокси)этокси)этилкарбамата (40 мг, 0,06 ммоль) в 2,2,2-трифторуксусной кислоте (1 мл) и дихлорметане (1 мл) перемешивали при комнатной температуре в течение 2 часов. Удаляли летучие вещества при пониженном давлении. Остаток разделяли в дихлорметане (60 мл) и водном растворе бикарбоната натрия (2,0 н., 30 мл). Органический слой промывали солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением N-(3-(2-(4-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этокси)фениламино)-5-бромпиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамида (18 мг, выход 52%) в виде желтой маслянистой жидкости.
Стадия 8: N-(3-(5-бром-2-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фениламино)пиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамид
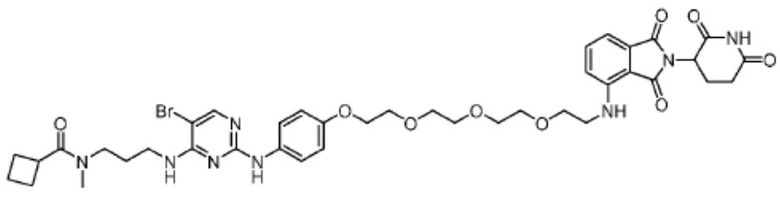
Смесь N-(3-(2-(4-(2-(2-(2-(2-аминоэтокси)этокси)этокси)этокси)фениламино)-5-бромпиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамида (130 мг, 0,03 ммоль), 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-диона (8,2 мг, 0,03 ммоль) и N-этил-N-изопропилпропан-2-амина (7,6 мг, 0,06 ммоль) в сухом N,N-диметилформамиде (1 мл) перемешивали при 90°С в течение 12 часов. Реакционную смесь охлаждали до комнатной температуры, разделяли в этилацетате (100 мл) и воде (30 мл). Органическую фазу промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали путем препаративной ТСХ с получением N-(3-(5-бром-2-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фениламино)-пиримидин-4-иламино)пропил)-N-метилциклобутанкарбоксамида (10,2 мг, выход 40%) в виде желтого твердого вещества. ЖХ-МС (ИЭР+): m/z=865,27/867,27 (1:1) [MH]+. tR=2,06 мин. 1Н ЯМР (400 МГц, CD3OD): δ 1,68-1,77 (m, 3H), 1,89-1,92 (m, 3H), 2,08-2,15 (m, 3H), 2,60-2,79 (m, 7H), 3,28-3,35 (m, 6H), 3,55-3,61 (m, 10H), 3,69-3,72 (m, 2H), 3,96-3,99 (m, 2H), 4,91-4,95 (m, 1H), 6,75-6,78 (m, 2H), 6,91-6,94 (m, 2H), 7,34-7,42 (m, 3H), 7,76 (d, J=12,8 Гц, 1Н).
8. 2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фенил)ацетамид
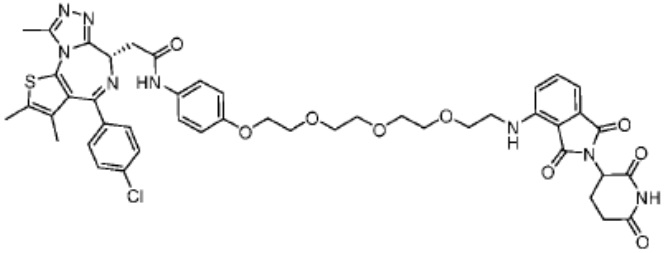
(Структура соединения №14, показана в таблице 1)
Стадия 1: 2-(2,6-диоксопиперидин-3-ил)-4-(2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)-этокси)этиламино)изоиндолин-1,3-дион
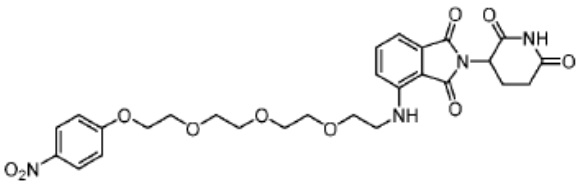
Смесь 2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этанамина (128 мг, 0,41 ммоль), 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-диона (112,5 мг, 0,41 ммоль) и N-этил-N-изопропилпропан-2-амина (105 мг, 0,81 ммоль) в сухом N,N-диметилформамиде (2 мл) перемешивали при 90°С в течение 12 часов. Смесь охлаждали до комнатной температуры, выливали в воду (20 мл) и экстрагировали этилацетатом (35 мл х2). Объединенные органические фазы промывали водой (30 мл) и солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем препаративной ТСХ с получением 2-(2,6-диоксопиперидин-3-ил)-4-(2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)этокси)этиламино)-изоиндолин-1,3-диона (73 мг, выход 31%) в виде желтого твердого вещества. ЖХ-МС (ИЭР+): m/z 571,3 [MH+], tR=2,46 мин.
Стадия 2: (4-(2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)этиламино)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-дион)
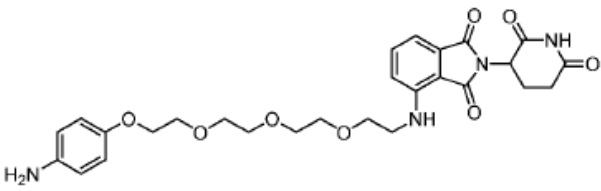
В суспензию 2-(2,6-диоксопиперидин-3-ил)-4-(2-(2-(2-(2-(4-нитрофенокси)этокси)этокси)-этокси)этиламино)изоиндолин-1,3-диона (73 мг, 0,128 ммоль) и порошка железа (71,6 мг, 1,28 ммоль) в этаноле (2 мл) добавляли раствор хлорида аммония (68 мг, 1,26 ммоль) в воде (0,5 мл) при комнатной температуре, полученную смесь перемешивали при 80°С в течение 1 часа. После охлаждения смеси до комнатной температуры отфильтровывали твердый осадок и промывали этилацетатом (10 мл х2). Фильтрат разделяли в этилацетате (60 мл) и воде (30 мл). Органический слой промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 4-(2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)этиламино)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (66,5 мг, неочищенный) в виде желтой маслянистой жидкости. ЖХ-МС (ИЭР+): m/z 541,5 [MH+], tR=1,593 мин.
Стадия 3: 2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фенил)ацетамид
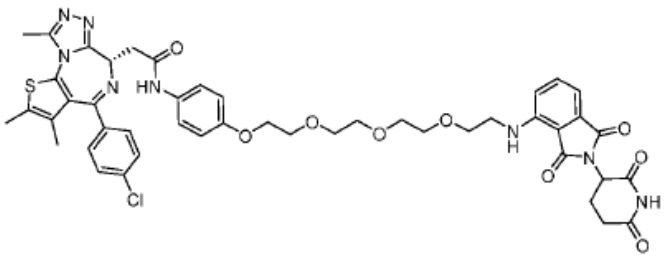
В перемешиваемый раствор 4-(2-(2-(2-(2-(4-аминофенокси)этокси)этокси)этокси)-этиламино)-2-(2,6-диоксопиперидин-3-ил)изоиндолин-1,3-диона (58,4 мг, 0,11 ммоль), (S)-2-(4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)уксусной кислоты (43,3 мг, 0,11 ммоль) и N-этил-N-изопропилпропан-2-амина (41,8 мг, 0,32 ммоль) в сухом N,N-диметилформамиде (1 мл) добавляли гексафторфосфат (2-(7-аза-1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония) (82 мг, 0,21 ммоль) при 0°С. Полученную смесь оставляли нагреваться до комнатной температуры и перемешивали при комнатной температуре в течение 20 минут. Смесь выливали в воду (25 мл), экстрагировали этилацетатом (35 мл х2). Объединенные органические фазы промывали водой (20 мл) и солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем препаративной ТСХ с получением 2-((S)-4-(4-хлорфенил)-2,3,9-триметил-6Н-тиено[3,2-f][1,2,4]триазоло[4,3-a][1,4]диазепин-6-ил)-N-(4-(2-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этокси)этокси)фенил)ацетамида (52 мг, выход 52%) в виде желтого твердого вещества. ЖХ-МС (ИЭР+): m/z 923,29/925,29 (3:1) [MH+], tR=2,689 мин. 1Н ЯМР (400 МГц, CDCl3): δ 1,67 (s, 3H), 2,05-2,12 (m, 1H), 2,40 (s, 3H), 2,65-2,85 (m, 6H), 3,41-3,54 (m, 4H), 3,65-3,74 (m, 10H), 3,81-3,85 (m, 2H), 4,06-4,11 (m, 2H), 4,63-4,69 (m, 1H), 4,85-4,93 (m, 1H), 6,38-6,55 (m, 1H), 6,83 (d, J=8,8 Гц, 2Н), 6,92 (d, J=8,8 Гц, 1Н), 7,09 (d, J=7,2 Гц, 1Н), 7,33 (d, J=8,4 Гц, 2Н), 7,39-7,51 (m, 5H), 8,59 (d, J=5,2 Гц, 1Н), 8,77 (d, J=3,2 Гц, 1Н).
9. (Z)-4-(4-((3-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрил

(Структура соединения №22, показана в таблице 1)
Стадия 1: (Z)-2-(2-(2-(5-(4-(4-циано-2-(трифторметил)фенокси)-3-метоксибензилиден)-2,4-диоксотиазолидин-3-ил)этокси)этокси)этил-4-метилбензолсульфонат
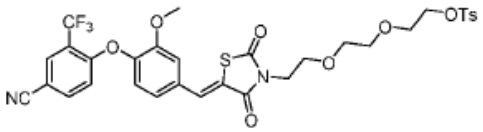
Смесь (Z)-4-(4-((2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (1,0 г, 2,3 ммоль), карбоната калия (1,0 г, 6,9 ммоль) и 2,2'-(этан-1,2-диил-бис(окси))бис(этан-2,1-диил)бис(4-метилбензолсульфоната) (1,3 г, 2,7 ммоль) в N,N-диметилформамиде (10 мл) перемешивали при 80°С в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, гасили водой (10 мл) и экстрагировали этилацетатом (40 мл х3). Объединенные органические фазы промывали водой (50 мл) и солевым раствором (50 мл), сушили над сульфатом натрия и выпаривали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 10-30% этилацетата в гексане) с получением (Z)-2-(2-(2-(5-(4-(4-циано-2-(трифторметил)фенокси)-3-метоксибензилиден)-2,4-диоксотиазолидин-3-ил)этокси)этокси)этил-4-метилбензолсульфоната (1,0 г, выход 61%) в виде светло-желтого твердого вещества.
Стадия 2: (Z)-4-(4-((3-(2-(2-(2-азидоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрил
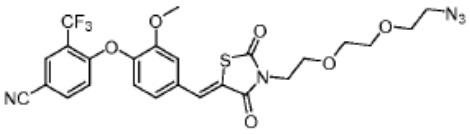
Смесь (Z)-2-(2-(2-(5-(4-(4-циано-2-(трифторметил)фенокси)-3-метоксибензилиден)-2,4-диоксотиазолидин-3-ил)этокси)этокси)этил-4-метилбензолсульфоната (1,0 г, 1,4 ммоль) и азида натрия (185 мг, 2,8 ммоль) в этаноле (20 мл) кипятили с обратным холодильником в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры и разделяли в этилацетате (100 мл) и воде (20 мл). Органический слой промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением (Z)-4-(4-((3-(2-(2-(2-азидоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (130 мг, неочищенный) в виде светло-желтой маслянистой жидкости, который использовали на следующей стадии без дополнительной очистки.
Стадия 3: (Z)-4-(4-((3-(2-(2-(2-аминоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрил
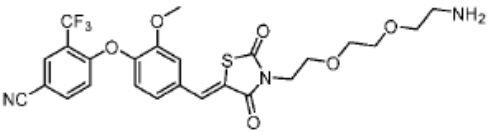
Смесь полученного выше (Z)-4-(4-((3-(2-(2-(2-азидоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (130 мг, неочищенный), трифенилфосфина (100 мг, 0,34 ммоль) в воде (0,2 мл) и тетрагидрофуране (20 мл) перемешивали при комнатной температуре в течение 14 часов. Концентрировали смесь при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 3-5% метанола в дихлорметане) с получением (Z)-4-(4-((3-(2-(2-(2-аминоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (60 мг, выход 8% за две стадии) в виде желтой маслянистой жидкости. ЖХ-МС (ИЭР+): m/z 552,1 [MH+], tR=2,15 мин.
Стадия 4: (Z)-4-(4-((3-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрил
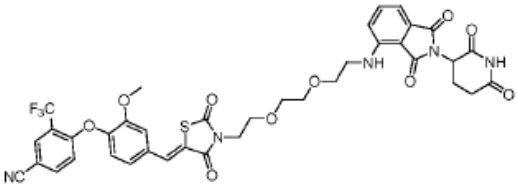
Смесь (Z)-4-(4-((3-(2-(2-(2-аминоэтокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (60 мг, 0,10 ммоль), 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-диона (30 мг, 0,13 ммоль) и N-этил-N-изопропилпропан-2-амина (50 мг, 0,39 ммоль) в 1-метилпирролидин-2-оне (1 мл) перемешивали при 90°С в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, гасили водой (5 мл) и экстрагировали этилацетатом (20 мл х3). Объединенные органические слои промывали водой (10 мл х2) и солевым раствором (10 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем препаративной ТСХ с получением (Z)-4-(4-((3-(2-(2-(2-(2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-иламино)этокси)этокси)этил)-2,4-диоксотиазолидин-5-илиден)метил)-2-метоксифенокси)-3-(трифторметил)бензонитрила (9,5 мг, выход 11,8%) в виде желтого твердого вещества. ЖХ-МС (ИЭР+): m/z 808,19 [MH+], tR=3,022 мин. 1Н ЯМР (400 МГц, CDCl3): δ 2,12-2,16 (m, 1H), 2,73-2,91 (m, 3H), 3,42 (s, 2H), 3,67-3,80 (m, 11H), 3,99 (s, 2H), 4,91-4,95 (m, 1H), 6,51 (s, 1H), 6,76-6,86 (m, 2H), 7,02-7,19 (m, 4H), 7,43 (t, J=7,6 Гц, 1Н), 7,68 (d, J=8,0 Гц, 1Н), 7,85-8,12 (m, 3H).
10. 4-(3-(4-(3-(2-(2-(2-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)амино)этокси)этокси)этокси)пропокси)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
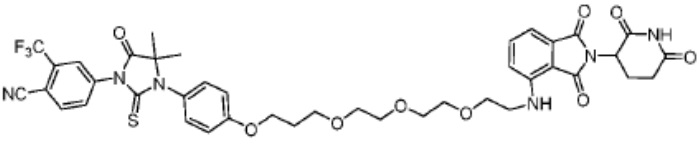
(Структура соединения №1, показана в таблице 1)
Стадия 1: 1,1,1,16-тетрафенил-2,5,8,11,15-пентаоксагексадекан
В раствор 2-(2-(2-(тритилокси)этокси)этокси)этанола (7 г, 17,7 ммоль) в N,N-диметилформамиде (50 мл) медленно добавляли гидрид натрия (60% в минеральном масле, 707 мг, 17,7 ммоль) при 0°С. После перемешивания смеси при КТ в течение 30 минут за один раз добавляли 3-(бензилокси)пропил-4-метилбензолсульфонат (5,8 г, 18,0 ммоль) при 0°С, полученную смесь оставляли перемешиваться при 70°С на ночь. После охлаждения смеси до КТ реакцию осторожно гасили водой (40 мл), экстрагировали смесь этилацетатом (60 мл х3). Объединенные органические фазы промывали солевым раствором (80 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем флэш-хроматографии на силикагеле (элюировали смесями 5-10% этилацетата в гексане) с получением 1,1,1,16-тетрафенил-2,5,8,11,15-пентаоксагексадекана (4,8 г, выход 50%) в виде бесцветной маслянистой жидкости. 1Н ЯМР (400 МГц, CDCl3): δ 1,85-1,92 (m, 2H), 3,23 (t, J=5,2 Гц, 2Н), 3,53-3,59 (m, 6H), 3,64-3,68 (m, 8H), 4,47 (s, 2H), 7,19-7,33 (m, 15H), 7,45-7,47 (m, 5H).
Стадия 2: 1-фенил-2,6,9,12-тетраоксатетрадекан-14-ол
В раствор 1,1,1,16-тетрафенил-2,5,8,11,15-пентаоксагексадекана (4,8 г, 8,8 ммоль) в метилендихлориде (10 мл) и метаноле (10 мл) добавляли водную хлороводородную кислоту (37%, 2,5 мл) при 0°С. Реакционную смесь перемешивали при КТ в течение 2 часов. Реакционную смесь выливали в воду (30 мл) и экстрагировали дихлорметаном (20 мл х3). Объединенные органические фазы промывали водным бикарбонатом натрия (1н., 50 мл), водой (30 мл), солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 20-40% этилацетата в гексане) с получением 1-фенил-2,6,9,12-тетраоксатетрадекан-14-ола (1,9 г, выход 73%) в виде бесцветной маслянистой жидкости.
Стадия 3: 1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил-4-метилбензолсульфонат
Смесь 1-фенил-2,7,10,13-тетраоксапентадекан-15-ола (1,9 г, 6,3 ммоль), триэтиламина (1,3 мл, 9,5 ммоль), N,N-диметилпиридин-4-амина (75 мг, 0,63 ммоль) и 4-метилбензол-1-сульфонилхлорида (1,45 г, 7,65 ммоль) в дихлорметане (20 мл) перемешивали при КТ в течение 3 часов. Добавляли воду (20 мл) для гашения реакции и экстрагировали продукт дихлорметаном (40 мл х3). Объединенные органические фазы промывали солевым раствором (50 мл), сушили над сульфатом натрия и выпаривали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 10-30% этилацетата в гексане) с получением 1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил-4-метилбензолсульфоната (2,2 г, выход 78%) в виде бесцветной маслянистой жидкости. 1Н ЯМР (400 МГц, CDCl3): δ 1,87-1,92 (m, 2H), 2,43 (s, 3H), 3,54-3,60 (m, 12H), 3,67 (t, J=5,2 Гц, 2Н), 4,15 (t, J=5,0 Гц, 2Н), 4,48 (s, 2H), 7,27-7,33 (m, 7H), 7,79 (d, J=8,4 Гц, 2Н).
Стадия 4: 14-азидо-1-фенил-2,6,9,12-тетраоксатетрадекан
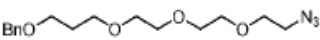
Смесь 1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил-4-метилбензолсульфоната (2,2 г, 4,9 ммоль) и азида натрия (420 мг, 6,3 ммоль) в этаноле (10 мл) кипятили с обратным холодильником в течение 5 часов. Реакционную смесь охлаждали до КТ, выливали в воду (10 мл) и экстрагировали дихлорметаном (50 мл х3). Объединенные органические слои промывали солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 14-азидо-1-фенил-2,6,9,12-тетраоксатетрадекана (1,4 г, неочищенный) в виде бесцветной маслянистой жидкости, который использовали на следующей стадии без дополнительной очистки.
Стадия 5: трет-бутил-(1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил)карбамат
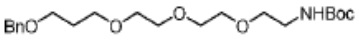
Смесь полученного выше 14-азидо-1-фенил-2,6,9,12-тетраоксатетрадекана (1,4 г, неочищенный) и трифенилфосфина (1,7 г, 6,5 ммоль) в тетрагидрофуране (15 мл) и воде (0,5 мл) перемешивали при КТ в течение ночи в атмосфере азота. В реакционную смесь добавляли триэтиламин (0,9 мл, 6,5 ммоль) и ди-трет-бутилдикарбонат (1,1 г, 5,2 ммоль) при 0°С. Полученную смесь оставляли нагреваться до КТ и перемешивали при КТ в течение 2 часов. Выпаривали летучие вещества при пониженном давлении и разделяли остаток в дихлорметане (100 мл) и воде (50 мл). Органическую фазу промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем флэш-хроматографии на силикагеле (элюировали смесями 30-50% этилацетата в гексане) с получением трет-бутил-(1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил)карбамата (1,2 г, выход 50% за две стадии) в виде бесцветной маслянистой жидкости.
Стадия 6: трет-бутил-2-(2-(2-(3-гидроксипропокси)этокси)этокси)этилкарбамат
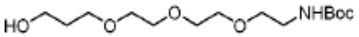
Смесь трет-бутил-(1-фенил-2,6,9,12-тетраоксатетрадекан-14-ил)карбамата (1,2 г, 3 ммоль) и палладия на углеродной подложке (10%, 200 мг) в этаноле (50 мл) перемешивали при КТ в атмосфере водорода (баллон с водородом). Удаляли палладий на углеродной подложке путем фильтрования и промывали этанолом (20 мл). Концентрировали фильтрат при пониженном давлении с получением трет-бутил-2-(2-(2-(3-гидроксипропокси)этокси)-этокси)этилкарбамата (900 мг, неочищенный) в виде бесцветной маслянистой жидкости, который использовали на следующей стадии без дополнительной очистки.
Стадия 7: 2,2-диметил-4-оксо-3,8,11,14-тетраокса-5-азагептадекан-17-ил-4-метилбензолсульфонат
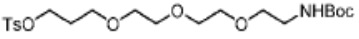
Смесь полученного выше трет-бутил-2-(2-(2-(3-гидроксипропокси)этокси)этокси)-этилкарбамата (900 мг, неочищенный), триэтиламина (0,6 мл, 4,35 ммоль), N,N-диметилпиридин-4-амина (16 мг, 0,14 ммоль) и 4-метилбензол-1-сульфонилхлорида (660 мг, 3,5 ммоль) в безводном дихлорметане (15 мл) перемешивали при КТ в течение 3 часов. Добавляли воду (20 мл) для гашения реакции и экстрагировали продукт дихлорметаном (50 мл х3). Объединенные органические фазы промывали солевым раствором (50 мл), сушили над безводным сульфатом натрия и выпаривали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 20-30% этилацетата в гексане) с получением 2,2-диметил-4-оксо-3,8,11,14-тетраокса-5-азагептадекан-17-ил-4-метилбензолсульфоната (650 мг, выход 77%) в виде светло-желтой маслянистой жидкости. 1Н ЯМР (400 МГц, CDCl3): δ 1,44 (s, 9H), 1,88-1,95 (m, 2H), 2,45 (s, 3H), 3,29-3,33 (m, 2H), 3,48-3,61 (m, 12H), 4,09-4,15 (m, 2H), 5,04 (шир.s, 1H), 7,34 (d, J=8,0 Гц, 2Н), 7,79 (d, J=8,0 Гц, 2Н).
Стадия 8: трет-бутил-(2-(2-(2-(3-(4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенокси)пропокси)этокси)этокси)этил)карбамат
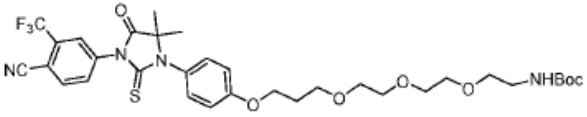
Смесь 2,2-диметил-4-оксо-3,8,11,14-тетраокса-5-азагептадекан-17-ил-4-метилбензолсульфоната (115 мг, 0,25 ммоль), карбоната калия (69 мг, 0,50 ммоль) и 4-(3-(4-гидроксифенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)-бензонитрила (100 мг, 0,25 ммоль) в ацетонитриле (5 мл) перемешивали при 80°С в течение 16 часов. Реакционную смесь охлаждали до комнатной температуры, гасили водой (30 мл) и экстрагировали этилацетатом (30 мл х3). Объединенные органические фазы промывали водой (30 мл) и солевым раствором (30 мл), сушили над сульфатом магния и выпаривали при пониженном давлении. Неочищенный остаток очищали путем колоночной флэш-хроматографии на силикагеле (элюировали смесями 10-30% этилацетата в гексане) с получением трет-бутил-(2-(2-(2-(3-(4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенокси)пропокси)этокси)этокси)этил)карбамата (150 мг, выход 82%) в виде желтой маслянистой жидкости. ЖХ-МС (ИЭР+): m/z 695,40 [MH+], tR=2,79 мин.
Стадия 9: 4-(3-(4-(3-(2-(2-(2-аминоэтокси)этокси)этокси)пропокси)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
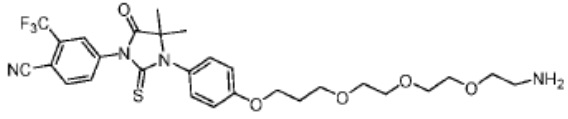
Смесь трет-бутил-(2-(2-(2-(3-(4-(3-(4-циано-3-(трифторметил)фенил)-5,5-диметил-4-оксо-2-тиоксоимидазолидин-1-ил)фенокси)пропокси)этокси)этокси)этил)карбамата (150 мг, 0,21 ммоль) в безводном дихлорметане (2 мл) и 2,2,2-трифторуксусной кислоте (1 мл) перемешивали при КТ в течение 1 часа. Выпаривали летучие вещества при пониженном давлении, остаток выливали в водный бикарбонат натрия (1н., 20 мл) и экстрагировали дихлорметаном (50 мл х3). Объединенные органические фазы промывали солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 4-(3-(4-(3-(2-(2-(2-аминоэтокси)этокси)этокси)-пропокси)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)-бензонитрила (115 мг, неочищенный) в виде коричневой маслянистой жидкости, который использовали на следующей стадии без дополнительной очистки.
Стадия 10: 4-(3-(4-(3-(2-(2-(2-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)амино)этокси)этокси)этокси)пропокси)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрил
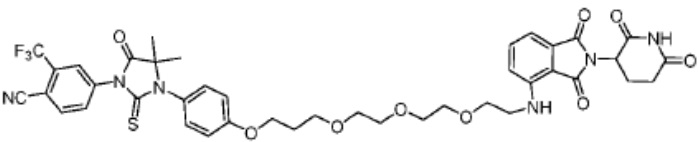
Раствор полученного выше 4-(3-(4-(3-(2-(2-(2-аминоэтокси)этокси)этокси)пропокси)-фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (115 мг, неочищенный), 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-диона (41 мг, 0,15 ммоль) и N-этил-N-изопропилпропан-2-амина (58 мг, 0,44 ммоль) в N,N-диметилформамиде (2 мл) перемешивали при 90°С в течение 16 часов. Реакционную смесь охлаждали до КТ, гасили водой (3 мл) и экстрагировали этилацетатом (30 мл х3). Объединенные органические слои промывали водой (30 мл х2) и солевым раствором (20 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный остаток очищали путем препаративной ТСХ с получением 4-(3-(4-(3-(2-(2-(2-((2-(2,6-диоксопиперидин-3-ил)-1,3-диоксоизоиндолин-4-ил)амино)этокси)-этокси)этокси)пропокси)фенил)-4,4-диметил-5-оксо-2-тиоксоимидазолидин-1-ил)-2-(трифторметил)бензонитрила (34,5 мг, выход 27%) в виде желтого твердого вещества. ЖХ-МС (ИЭР+): m/z 851,25 [MH+], tR=2,652 мин. 1Н ЯМР (400 МГц, CD3OD): δ 1,57 (s, 6H), 2,07-2,11 (m, 3H), 2,70-2,90 (m, 3H), 3,46-3,72 (m, 14H), 4,10 (t, J=6,2 Гц, 2Н), 4,88-4,92 (m, 1H), 6,48-6,49 (m, 1H), 6,91-7,26 (m, 6H), 7,49 (t, J=7,8 Гц, 1Н), 7,83-7,85 (m, 1H), 7,97-8,02 (m, 3H).
11. 4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамид

Стадия 1: 3-[(5-гидроксипентил)окси]пропаннитрил
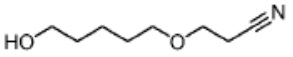
Пентан-1,5-диол (2,98 г, 28,6 ммоль) добавляли в суспензию гидрида натрия (60% дисперсия в минеральном масле, 820 мг, 34,2 ммоль) в ТГФ (50 мл). После перемешивания смеси при КТ в течение 20 минут ее охлаждали до 0°С и по каплям добавляли акрилонитрил (1,20 г, 22,8 ммоль). Полученную смесь перемешивали при КТ в течение 10 часов. Удаляли часть растворителя в вакууме и выливали остаток в воду. Смесь экстрагировали ДХМ (3х). Органический слой фильтровали через универсальный разделитель фаз Biotage и концентрировали в вакууме. Неочищенное вещество очищали путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями МеОН/ДХМ (от 0:100 до 3:97), с получением 3-[(5-гидроксипентил)окси]пропаннитрила (635 мг, выход 18%). 1Н ЯМР (400 МГц, CDCl3) δ 3,60-3,73 (m, 4H), 3,45-3,55 (m, 2H), 2,60 (dt, J=4,1, 6,4 Гц, 2Н), 2,06 (d, J=3,9 Гц, 1Н), 1,57-1,69 (m, 4H), 1,43-1,50 (m, 2H).
Стадия 2: трет-бутил-N-{3-[(5-гидроксипентил)окси]пропил}карбамат
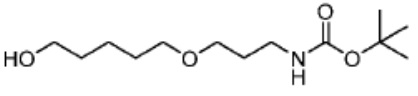
В раствор 3-[(5-гидроксипентил)окси]пропаннитрила (400 мг, 2,54 ммоль) в МеОН (12 мл) и H2O (2,0 мл) добавляли хлорид никеля (II) (393 мг, 3,04 ммоль), затем по частям боргидрид натрия (360 мг, 9,52 ммоль). Смесь перемешивали при КТ в течение 3 часов, затем реакцию гасили MeOH (12 мл). Смесь фильтровали через целит и промывали MeOH. Концентрировали фильтрат в вакууме. В раствор полученного выше неочищенного продукта в ТГФ (5 мл) добавляли 6М водн. NaOH (0,5 мл) и ди-трет-бутилдикарбонат (831 мг, 3,81 ммоль), полученную смесь перемешивали при КТ в течение 3 часов, затем концентрировали в вакууме. Неочищенное вещество очищали путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями МеОН/ДХМ (от 0:100 до 4:96), с получением трет-бутил-N-{3-[(5-гидроксипентил)окси]пропил}карбамата (366 мг, выход 55%). 1Н ЯМР (400 МГц, CDCl3) δ 4,91 (шир.s, 1Н), 3,66 (шир.s, 2Н), 3,49 (t, J=5,9 Гц, 2Н), 3,43 (t, J=6,3 Гц, 2Н), 3,24 (q, J=5,9 Гц, 2Н), 1,75 (квинтет, J=6,2 Гц, 2Н), 1,57-1,65 (m, 5H), 1,41-1,52 (m, 11H).
Стадия 3: трет-бутил-N-[3-({5-[(4-метилбензолсульфонил)окси]пентил}окси)-пропил]карбамат

В раствор трет-бутил-N-{3-[(5-гидроксипентил)окси]пропил}карбамата (300 мг, 3,88 ммоль) в ДХМ (10 мл) добавляли DIPEA (599,3 мкл, 3,44 ммоль), тозилхлорид (262,3 мг, 1,38 ммоль) и 4-диметиламинопиридин (14,0 мг, 0,115 ммоль). Полученную смесь перемешивали при КТ в течение 20 часов. Реакцию гасили полунасыщенным бикарбонатом натрия, экстрагировали смесь ДХМ (2х), фильтровали через универсальный разделитель фаз Biotage и концентрировали в вакууме. Неочищенное вещество очищали путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями EtOAc/гептан (от 0:100 до 30:70), с получением трет-бутил-N-[3-({5-[(4-метилбензолсульфонил)окси]пентил}окси)пропил]карбамата (914 мг, выход 26%). 1Н ЯМР (400 МГц, CDCl3) δ 7,78 (d, J=8,2 Гц, 2Н), 7,34 (d, J=8,2 Гц, 2Н), 4,02 (d, J=6,5 Гц, 2Н), 3,44 (t, J=6,1 Гц, 2Н), 3,35 (t, J=6,3 Гц, 2Н), 3,19 (q, J=5,9 Гц, 2Н), 2,44 (s, 3H), 1,64-1,74 (m, 5H), 1,49-1,54 (m, 2H), 1,42 (s, 9H), 1,33-1,40 (m, 2H). ЖХ-МС (ИЭР+): m/z 438,19 [MNa+], tR=2,65 мин.
Стадия 4: метил-4-{[5-(3-{[(трет-бутокси)карбонил]амино}пропокси)пентил]окси}-бензоат
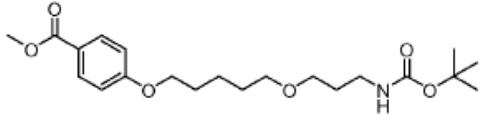
Смесь трет-бутил-N-[3-({5-[(4-метилбензолсульфонил)окси]пентил}окси)пропил]-карбамата (340 мг, 0,82 ммоль), метил-4-гидроксибензоата (117 мг, 0,77 ммоль), карбоната калия (203 мг, 1,47 ммоль) в MeCN (10 мл) перемешивали при 80°С в течение 24 часов. Реакционную смесь разбавляли EtOAc, промывали полунасыщенным раствором бикарбоната натрия (1х), водой (2х), солевым раствором (1х), а затем фильтровали через универсальный разделитель фаз Biotage. Концентрировали фильтрат в вакууме и очищали остаток путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями EtOAc/гептан (от 0:100 до 50:50), с получением метил-4-{[5-(3-{[(трет-бутокси)карбонил]амино}пропокси)пентил]окси}бензоата (300 мг, выход 93%). ЖХ-МС (ИЭР+): m/z 418,21 [MNa+], tR=2,74 мин.
Стадия 5: 4-{[5-(3-{[(трет-бутокси)карбонил]амино}пропокси)пентил]окси}бензойная кислота
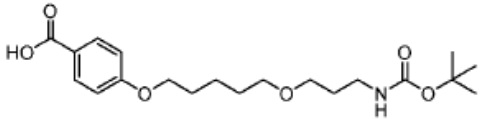
В раствор метил-4-{[5-(3-{[(трет-бутокси)карбонил]амино}пропокси)пентил]окси}-бензоата (150 мг, 0,38 ммоль) в смеси 1:1:1 ТГФ/вода/МеОН (6,0 мл, об./об./об.) добавляли гидроксид лития (81,6 мг, 3,41 ммоль). Полученную смесь перемешивали в течение ночи при КТ, затем подкисляли до рН 2-3 при помощи 6н. водной HCl. Концентрировали смесь в вакууме для удаления большей части растворителей, затем разбавляли EtOAc, промывали водой (2х), солевым раствором (2х), фильтровали через универсальный разделитель фаз Biotage и концентрировали в вакууме. Неочищенный продукт использовали на следующей стадии без дополнительной очистки (123 мг). ЖХ-МС (ИЭР+): m/z 404,20 [MNa+], tR=2,40 мин.
Стадия 6: трет-бутил-N-(3-{[5-(4-{[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]карбамоил}фенокси)пентил]окси}пропил)карбамат
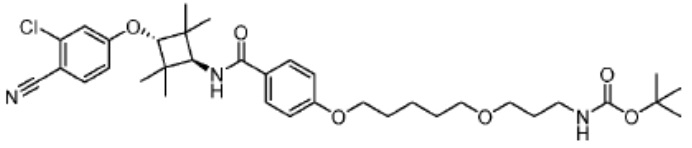
В раствор 4-{[5-(3-{[(трет-бутокси)карбонил]амино}пропокси)пентил]окси}бензойной кислоты (124 мг, 0,322 ммоль), 2-хлор-4-(транс-3-амино-2,2,4,4-тетраметилциклобутокси)-бензонитрила (89,8 мг, 0,322 ммоль) в ДМФ (5 мл) добавляли DIPEA (112 мкл, 0,65 ммоль) и TBTU (155 мг, 0,48 ммоль). Полученную смесь перемешивали при КТ в течение 1 часа, затем разбавляли EtOAc, промывали водой (3х), солевым раствором (1х), фильтровали через универсальный разделитель фаз Biotage и концентрировали в вакууме. Остаток очищали путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями МеОН/ДХМ (от 0:100 до 5:95), с получением трет-бутил-N-(3-{[5-(4-{[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]карбамоил}фенокси)-пентил]окси}пропил)карбамата (169 мг, выход 82%). ЖХ-МС (ИЭР+): m/z 643,32/645,31 (3:1) [MH+], tR=3,04 мин.
12. 4-{[5-(3-аминопропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамид
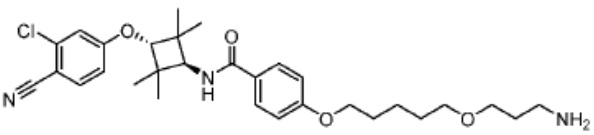
В раствор трет-бутил-N-(3-{[5-(4-{[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]карбамоил}фенокси)пентил]окси}пропил)карбамата (124 мг, 0,192 ммоль) в ДХМ (5 мл) добавляли трифторуксусную кислоту (372 мкл, 4,86 ммоль) и грели при 45°С в течение 1 часа до завершения взаимодействия. Затем концентрировали реакционную смесь в вакууме с получением твердого вещества, которое использовали на следующей стадии без дополнительной очистки (104 мг, выход 99%). ЖХ-МС (ИЭР+): m/z 543,27/545,26 (3:1) [MH+], tR=2,26 мин.
13. 4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамид

(структура соединения №11, показана в таблице 1)
В раствор 4-{[5-(3-аминопропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида (30,0 мг, 0,0553 ммоль) в 1,4-диоксане (2 мл) добавляли диизопропилэтиламин (384 мкл, 2,21 ммоль), 2-(2,6-диоксопиперидин-3-ил)-4-фтор-2,3-дигидро-1Н-изоиндол-1,3-дион (18,3 мг, 0,0664 ммоль). Полученную смесь кипятили с обратным холодильником в течение 16 часов, затем разбавляли EtOAc, промывали полунасыщенным солевым раствором (2х), фильтровали через универсальный разделитель фаз Biotage и концентрировали в вакууме. Остаток очищали путем хроматографии на силикагеле на системе Teledyne Combiflash ISCO, элюируя смесями МеОН/ДХМ (от 0:100 до 7:93), с получением 4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида (12 мг, выход 28%). ЖХ-МС (ИЭР+): m/z 799,31/801,31 (3:1) [MH+], tR=2,97 мин. 1Н ЯМР (400 МГц, CDCl3) δ 8,03 (s, 1H), 7,72 (d, J=9,0 Гц, 2Н), 7,58 (d, J=8,6 Гц, 1Н), 7,48 (dd, J=7,2, 8,4 Гц, 1Н), 7,07 (d, J=7,0 Гц, 1Н), 6,98 (d, J=2,3 Гц, 1Н), 6,89-6,96 (m, 3H), 6,82 (dd, J=2,5, 8,8 Гц, 1Н), 6,18 (d, J=8,2 Гц, 1Н), 4,89 (dd, J= 5,1, 12,1 Гц, 1Н), 4,16 (d, J=7,8 Гц, 1Н), 4,06 (s, 1H), 4,02 (t, J=6,7 Гц, 2Н), 3,56 (t, J=5,9 Гц, 2Н), 3,50 (s, 2H), 3,46-3,48 (m, 1H), 3,41 (t, J=6,5 Гц, 2Н), 2,82-2,90 (m, 1H), 2,76-2,81 (m, 1H), 2,67-2,75 (m, 1H), 2,07-2,14 (m, 1H), 1,94 (квинтет, J=6,1 Гц, 2Н), 1,82-1,87 (m, 2H), 1,67-1,73 (m, 2H), 1,53-1,59 (m, 2H), 1,28 (s, 6H), 1,20-1,25 (m, 6H).
С. Биоисследования разрушения белка
Следующие биоисследования проводили для оценки уровня разрушения белка, наблюдаемого в различных типах клеток при применении типовых соединений, раскрытых в настоящем описании.
В каждом биоисследовании клетки обрабатывали различными количествами соединений, охваченных настоящим изобретением, таких как показано в таблице 1. В указанном исследовании проводили оценку разрушения следующих белков: TANK-связывающая киназа 1 (TBK1), рецептор эстрогена α (ERα), бромодомен-содержащий белок 4 (BRD4), рецептор андрогена (AR) и c-Myc.
1. Протокол вестерн-анализа TBK1
Клетки Panc02.13 приобретали в ATCC и выращивали в среде RPMI-1640 (Gibco), дополненной 15% ЭБС (ATCC) и 10 единиц/мл рекомбинантного инсулина человека (Gibco). Проводили исследование контроля ДМСО и обработки соединениями (0,1 мкМ, 0,3 мкМ и 1 мкМ) в 12-луночных планшетах в течение 16 часов. В заключительные 3 часа добавляли агонист TLR3 Poly I:C (Invitrogen; tlrl-pic). Собирали клетки и проводили лизис в буфере RIPA (50 мМ Tris рН 8, 150 мМ NaCl, 1% Tx-100, 0,1% ДСН, 0,5% деоксихолата натрия), дополненном ингибиторами протеазы и фосфатазы. Лизаты отделяли от примесей при 16000g в течение 10 минут и выделяли надосадочную жидкость путем ДСН-ПААГ. Проводили иммуноблоттинг при помощи стандартных протоколов. В качестве антител использовали TBK1 (Cell Signaling, кат.№3504), pIRF3 (abcam, кат.№ab76493) и ГАДФН (Cell Signaling, кат.№5174). Проводили количественную оценку полос при помощи системы визуализации Biorad ChemiDoc MP.
2. Протокол вестерн-анализа ERRα
Клетки NAMALWA (ATCC) выращивали в среде RPMI-1640 (Life Technologies), дополненной 15% ЭБС (Life Technologies). Проводили исследование контроля ДМСО и инкубации в присутствии соединений (0,1 мкМ, 0,3 мкМ и 1 мкМ) в 24-луночных планшетах в течение 16 часов. Собирали клетки и проводили лизис в буфере для клеточного лизиса (Cell Signaling Technologies), содержащем ингибиторы протеазы (Thermo Scientific). Лизаты отделяли от примесей при 16000g в течение 10 минут и выделяли надосадочную жидкость путем ДСН-ПААГ. Проводили иммуноблоттинг при помощи стандартных протоколов. В качестве антител использовали ERRα (Cell Signaling, кат.№8644), и ГАДФН (Cell Signaling, кат.№5174). Проводили количественную оценку полос при помощи системы визуализации Biorad ChemiDoc MP.
3. Протокол вестерн-анализа BRD4
Клетки VCaP приобретали в ATCC и выращивали в среде Иглза в модификации Дульбекко (ATCC), дополненной 10% ЭБС (АТСС) и пенициллином/стрептомицином (Life Technologies). Проводили исследование контроля ДМСО и обработки соединениями (0,003 мкМ, 0,01 мкМ, 0,03 мкМ и 0,1 мкМ) в 12-луночных планшетах в течение 16 часов. Собирали клетки и проводили лизис в буфере RIPA (50 мМ Tris рН 8, 150 мМ NaCl, 1% Tx-100, 0,1% ДСН, 0,5% деоксихолата натрия), дополненном ингибиторами протеазы и фосфатазы. Лизаты отделяли от примесей при 16000g в течение 10 минут и определяли концентрацию белка. Равное количество белка (20 мкг) использовали в анализе ДСН-ПААГ, а затем проводили иммуноблоттинг согласно стандартным протоколам. В качестве антител использовали BRD4 (Cell Signaling, кат.№13440) и актин (Sigma, кат.№5441). В качестве детектирующих реагентом использовали субстрат Clarity Western ECL (Bio-rad, кат.№170-5060).
4. Протокол ELISA AR
Клетки VCaP приобретали в АТСС и выращивали в среде Иглза в модификации Дульбекко (ATCC), дополненной 10% ЭБС (АТСС) и пенициллином/стрептомицином (Life Technologies). Проводили исследование контроля ДМСО и обработки соединениями (0,0001 мкМ - 1 мкМ) в 96-луночных планшетах в течение 16 часов. Собирали клетки и проводили лизис с использованием буфера для клеточного лизиса (кат.№9803) (20 мМ Tris-HCl (pH 7,5), 150 мМ NaCl, 1 мМ Na2ЭДТА, 1 мМ ЭГТА, 1% Triton, 2,5 мМ пирофосфат натрия, 1 мМ В-глицерофосфат, 1 мМ Na3VO4, 1 мкг/мл лейпептина). Лизаты отделяли от примесей при 16000g в течение 10 минут и помещали в систему ELISA AR PathScan (Cell Signaling, кат.№12850). Набор для «сэндвич»-анализа ELISA общего рецептора андрогена PathScan® представляет собой набор для твердофазного иммуноферментного анализа (ELISA) по типу «сэндвич», при помощи которого определяют общий эндогенный уровень белка рецептора андрогена. В микролунки наносили покрытие кроличьего mAb рецептора андрогена. После инкубации с клеточными лизатами антитело, нанесенное в качестве покрытия, захватывало белок-рецептор андрогена. После избыточной промывки для детектирования захваченного белка-рецептора андрогена добавляли детектирующее мышиное mAb рецептора андрогена. Затем для выявления уровня связанного детектирующего антитела использовали антимышиное IgG, HRP-связанное антитело. Для проявления окраски добавляли субстрат HRP, TMB. Величина поглощения проявившейся окраски пропорциональна общему количеству белка-рецептора андрогена.
Антитела, содержавшиеся в наборе, были включены в виде составов, специально подобранных для каждого набора.
5. Протокол исследования ELISA c-Myc
Клетки 22RV-1 приобретали в АТСС и выращивали в среде RPMI+10% ЭБС. Клетки собирали при помощи трипсина (Gibco, кат.№25200-114), подсчитывали количество и высеивали в 96-луночные планшеты в концентрации 30000 клеток/лунку в среде RPMI+10% ЭБС объемом 75 мкл/лунку. В клетки вводили соединения, разбавленные в 0,1% ДМСО, инкубировали в течение 18 часов, затем промывали и проводили лизис в 50 мкл буфера RIPA (50 мМ Tris, рН 8, 150 мМ NaCl, 1% Tx-100, 0,1% ДСН, 0,5% деоксихолата натрия), дополненного ингибиторами протеазы и фосфатазы. Лизаты отделяли от примесей при 4000 об./мин при 4°С в течение 10 минут, затем добавляли аликвоты в 96-луночный планшет ELISA из набора ELISA для c-myc человека Novex производства Life Technologies, кат.№ KHO2041. В каждую лунку добавляли 50 мкл антитела, детектирующего c-Myc, планшеты инкубировали при комнатной температуре в течение 3 часов, затем промывали промывочным буфером ELISA. В каждую лунку добавляли 100 мкл антикроличьего вторичного антитела IgG-HRP и инкубировали при комнатной температуре в течение 30 минут. Планшеты промывали промывочным буфером ELISA, в каждую лунку добавляли 100 мкл TMB и затем каждый 5 минут отслеживали изменение окраски. Добавляли 100 мкл останавливающего раствора и анализировали планшеты при 450 нм.
D. Результаты
В таблице 1 приведены результаты, основанные на экспериментальных данных, полученных для репрезентативной выборки соединений, охваченных настоящим изобретением. В частности, клетки различных типов обрабатывали соединениями, перечисленными в таблице 1, которые определены при помощи химической структуры, данных масс-спектрометрии и названия соединения.
В таблице 1 показано, что (А) в клетках, которые обрабатывали 1 мкМ соединениями 1, 6-9, 12 и 17, наблюдали 10-30% разрушение; (В) в клетках, которые обрабатывали 1 мкМ соединениями 2-5, 10 и 20, наблюдали 31-50% разрушение; и (С) в клетках, которые обрабатывали 1 мМ соединениями 11, 13-16, 18-19, 21 и 22, наблюдали >50% разрушение. В таблице 1 также показано, что (D) соединения 24 и 26-35 имели IC50<50 нМ, тогда как (Е) соединения 23 и 25 имели IC50 > 50 нМ.
Содержание всех справочных документов, патентов, заявок на патент, находящихся на рассмотрении, и опубликованных патентов, приведенных в настоящем описании, явным образом включено в настоящую заявку посредством ссылок.
Специалисты в данной области техники могут предложить или, не проводя излишнюю экспериментальную работу, определить множество эквивалентов конкретных вариантов реализации изобретения, описанных в настоящей заявке. Предполагается, что указанные эквиваленты охвачены последующей формулой изобретения. Следует понимать, что подробное описание примеров и вариантов реализации, описанных в настоящей заявке, приведено в качестве примера исключительно для иллюстрации, и его нельзя рассматривать как ограничивающее каким-либо изобретение. Различные модификации или изменения изобретения будут очевидны специалистам в данной области техники и не выходят за рамки сущности и объема защиты настоящей заявки, и их следует рассматривать в рамках объема прилагаемой формулы изобретения. Например, можно изменять относительные количества ингредиентов для оптимизации целевых эффектов, можно добавлять дополнительные ингредиенты, и/или один или более описанных ингредиентов можно заменять на схожие ингредиенты. Дополнительные эффективные отличительные признаки и функциональные возможности, связанные с системами, способами и процессами согласно настоящему изобретению, станут очевидны из прилагаемой формулы изобретения. Кроме того, специалисты в данной области техники могут предложить или, не проводя излишнюю экспериментальную работу, определить множество эквивалентов конкретных вариантов реализации изобретения, описанных в настоящей заявке. Предполагается, что указанные эквиваленты охвачены последующей формулой изобретения.
Таблица 1
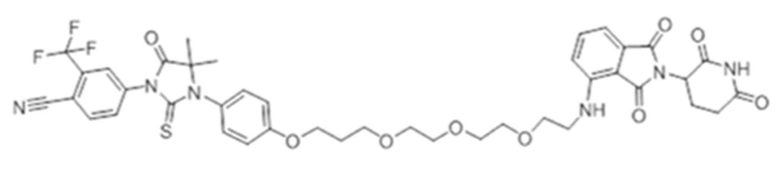
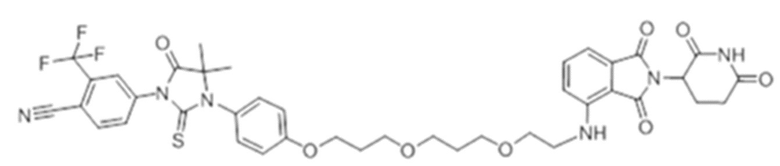
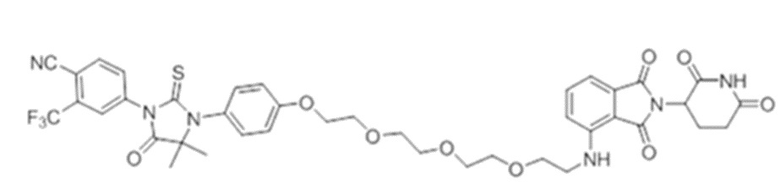
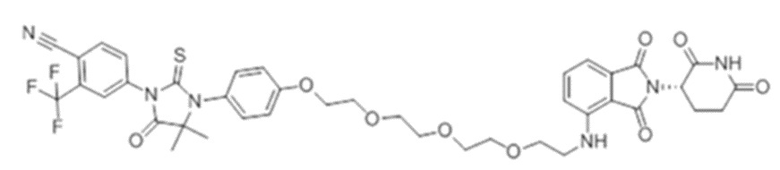

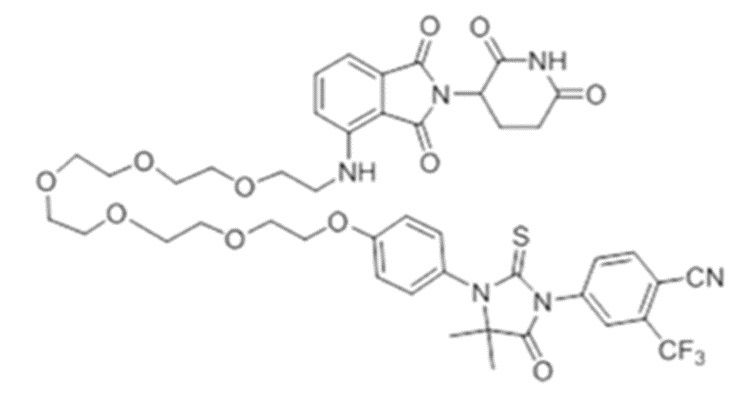
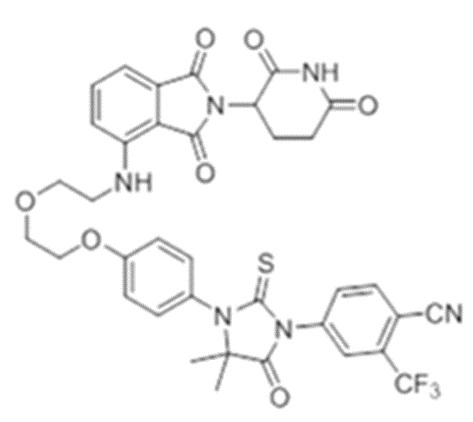


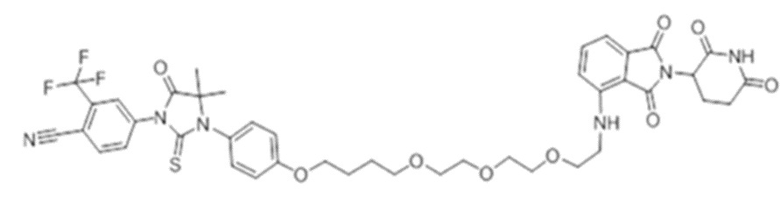
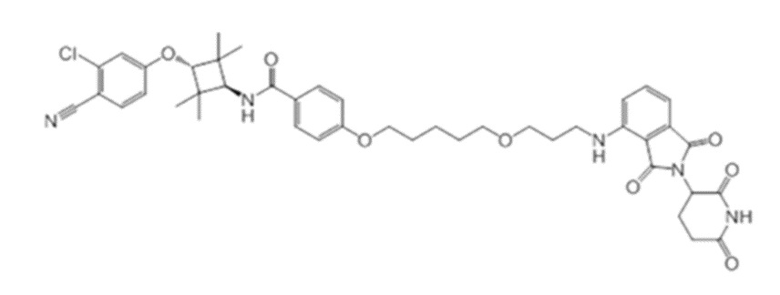
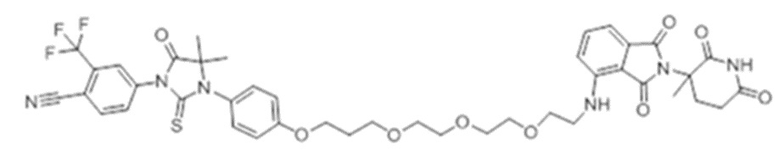
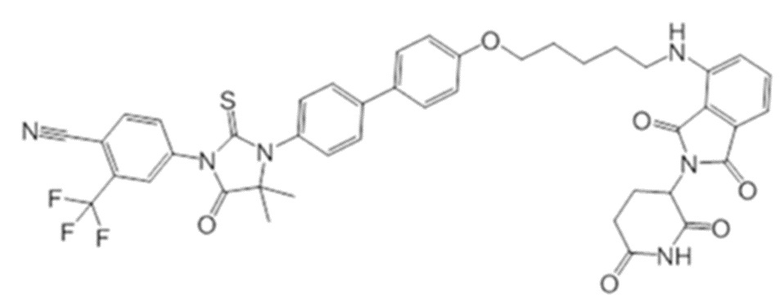
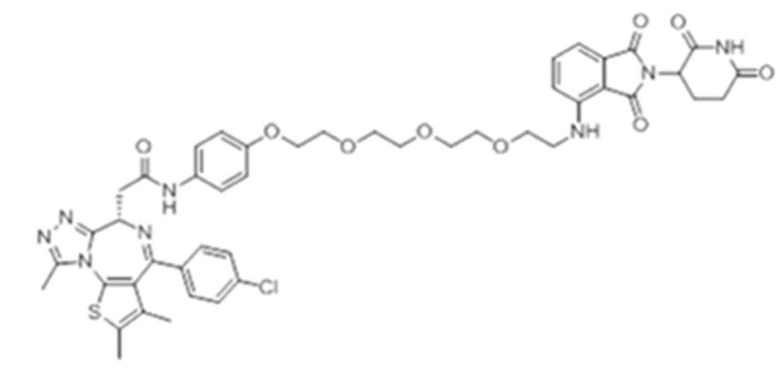
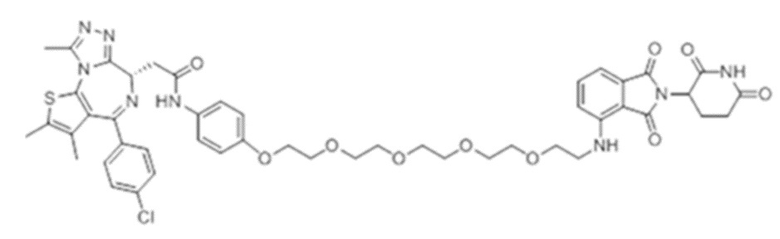
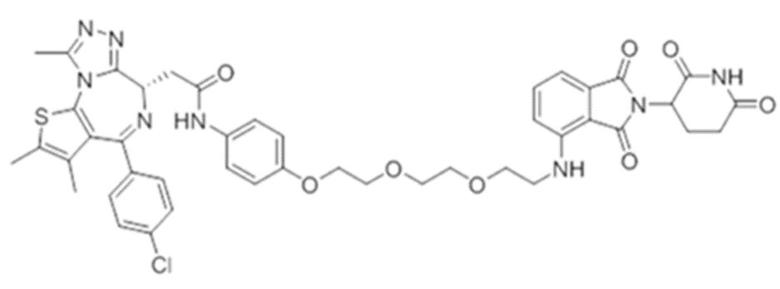
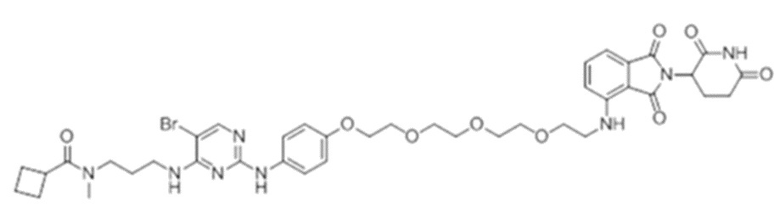
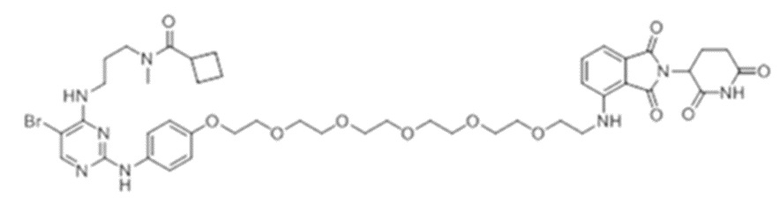
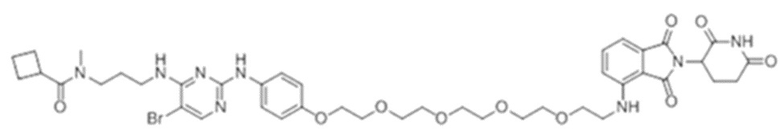
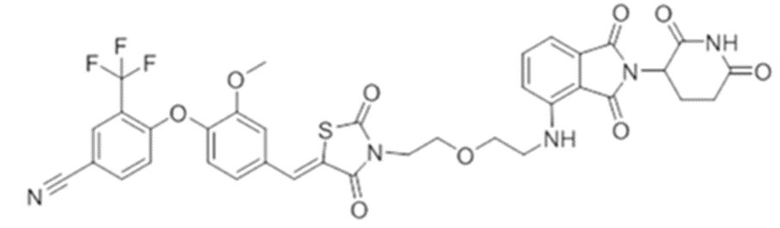
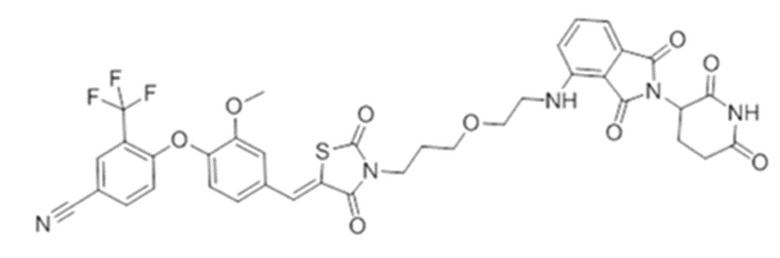
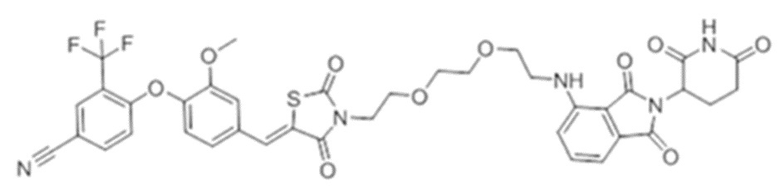
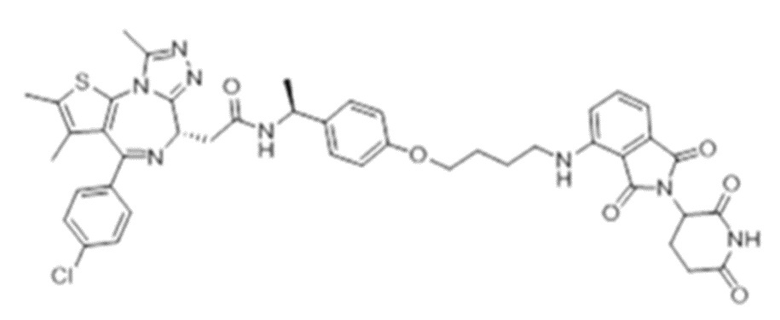
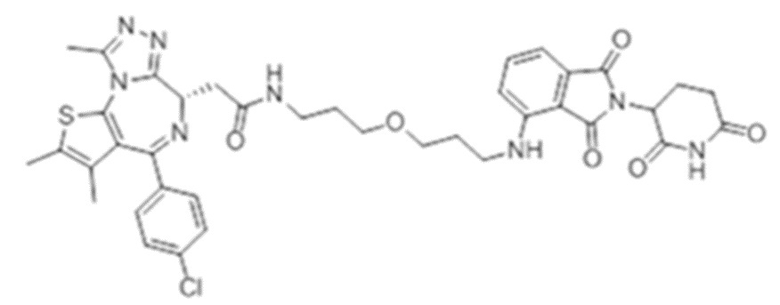

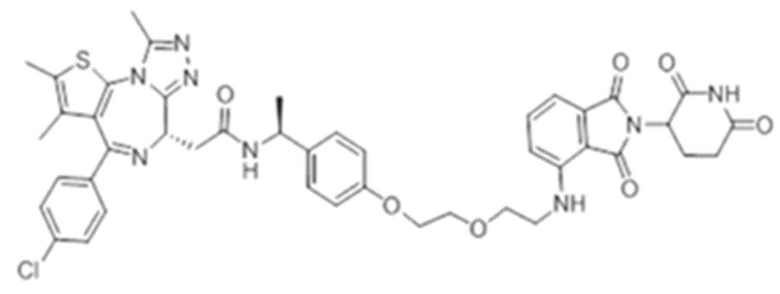
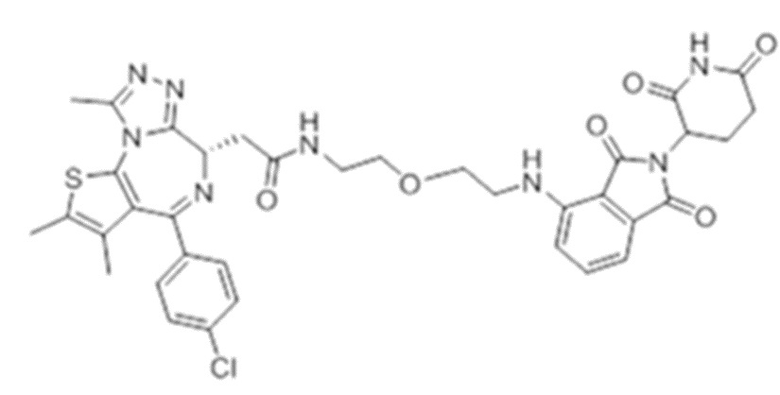
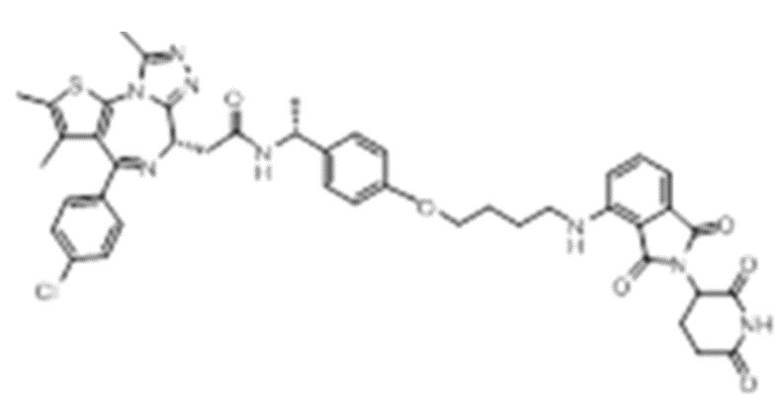
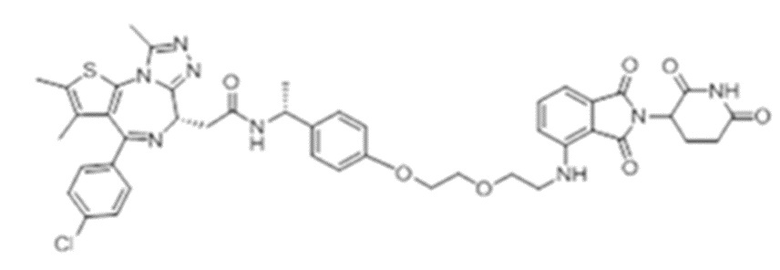
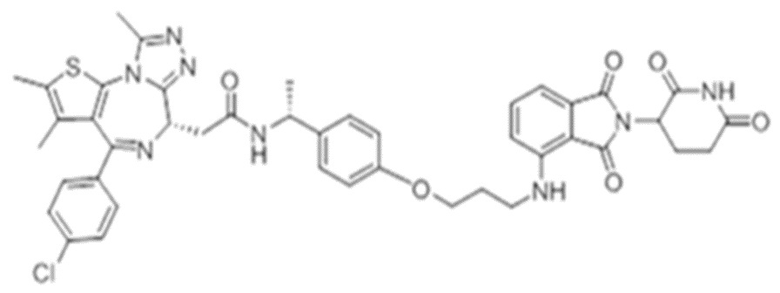

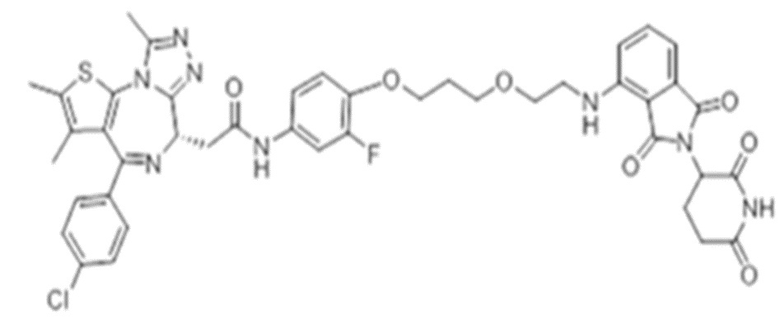
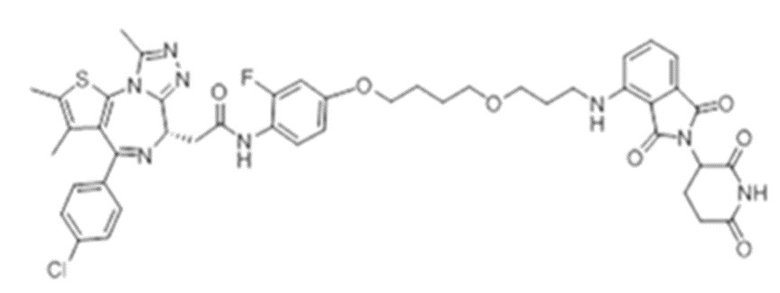
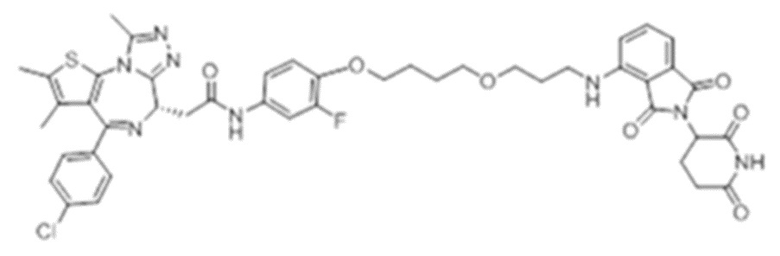
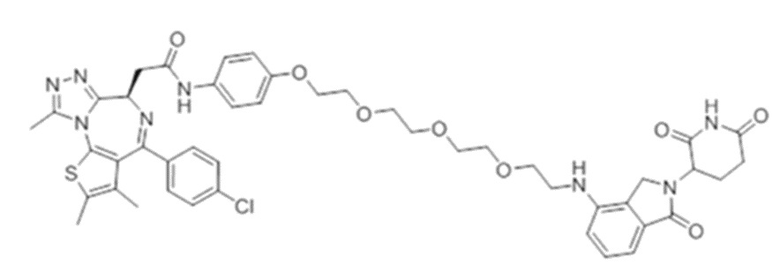
Показатели активности разрушения:
А=10-30% разрушение при 1 мкМ
В=31-50% разрушение при 1 мкМ
С=>50% разрушение при 1 мкМ
D=IC50<50 нМ
Е=IC50 > 50 нМ
Клетки, применявшиеся в биоисследовании:
1 клетки VCaP
2 клетки Panc02.13
3 клетки Namalwa
4 клетки 22RV-1
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Arvinas, Inc.
Crew, Andrew
Crews, Craig
Wang, Jing
Dong, Hanqing
Jin, Meizhong
Qian, Yimin
Chen, Xin
Ferraro, Caterina
Siu, Kam
<120> ИМИДНЫЕ МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 315558(94666)
<150> US 61/979,351
<151> 2014-04-14
<160> 5
<170> PatentIn, версия 3.5
<210> 1
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 1
gtgccgcgtg gctccatggc cggcgaagga gatcagcagg a 41
<210> 2
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 2
gcttcctttc gggcttatta caagcaaagt attactttgt c 41
<210> 3
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 3
tcgggcgcgg ctctcggtcc gaaaaggatg tcgtacaact acgtggtaac 50
<210> 4
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 4
gcttcctttc gggcttattt ttcgaactgc gggtggctcc aatggatccg agttagctcc 60
t 61
<210> 5
<211> 61
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 5
gcttcctttc gggcttactt atcgtcatcg tccttgtagt ccaagcaaag tattactttg 60
t 61
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА НА ОСНОВЕ ИМИДОВ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2704807C2 |
| ЛИГАНДЫ ЦЕРЕБЛОНА И БИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ | 2018 |
|
RU2795146C2 |
| ИЗОИНДОЛИНОВЫЕ СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ РАКА | 2009 |
|
RU2527952C2 |
| PROTAC, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩИЕ НА ТАУ-БЕЛОК, И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2805523C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| СПОСОБЫ И КОМПОЗИЦИИ С ИСПОЛЬЗОВАНИЕМ ИММУНОМОДУЛИРУЮЩИХ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ И ПОДДЕРЖАНИЯ СОСТОЯНИЯ ПРИ РАКЕ И ДРУГИХ ЗАБОЛЕВАНИЯХ | 2004 |
|
RU2348407C2 |
| МОДУЛЯТОРЫ ПРОТЕОЛИЗА И СООТВЕТСТВУЮЩИЕ СПОСОБЫ ПРИМЕНЕНИЯ | 2019 |
|
RU2805511C2 |
| 5-ЗАМЕЩЕННЫЕ ИЗОИНДОЛИНОВЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2448101C2 |
| ПРОИЗВОДНЫЕ АРИЛМЕТОКСИ ИЗОИНДОЛИНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2567753C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОНАФТАЛИНА И ТЕТРАГИДРОИЗОХИНОЛИНА В КАЧЕСТВЕ РАЗРУШИТЕЛЕЙ ЭСТРОГЕНОВОГО РЕЦЕПТОРА | 2017 |
|
RU2797244C2 |
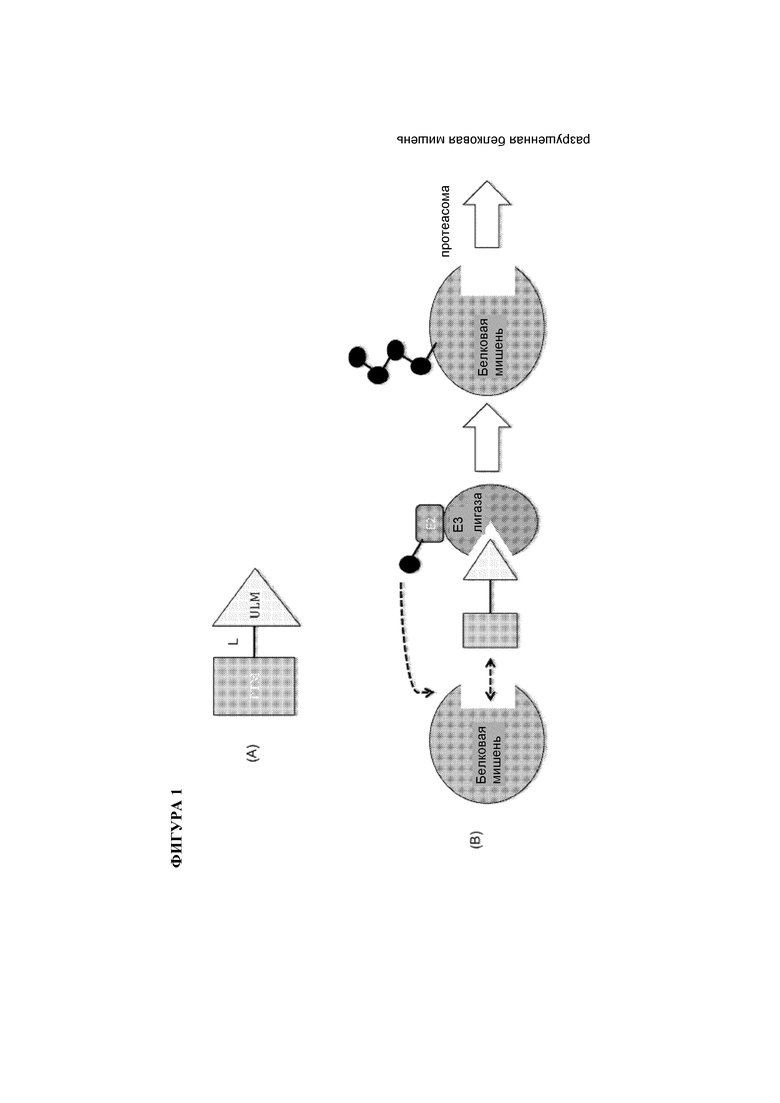
Изобретение относится к соединению, имеющему химическую структуру: PTM-L-CLM, где L ковалентно связана с указанным PTM и указанным CLM и представлена в виде формулы –(A’)q-, PTM представляет собой низкомолекулярный нацеленный на белок фрагмент, который специфически связывается с внутриклеточным целевым белком или внутриклеточным целевым полипептидом в достаточной степени для осуществления убиквитинирования внутриклеточного целевого белка или внутриклеточного целевого полипептида при соединении с CLM; CLM представляет собой фрагмент, связывающий цереблон убиквитин-лигазу Е3, который имеет химическую структуру, представленную формулой:
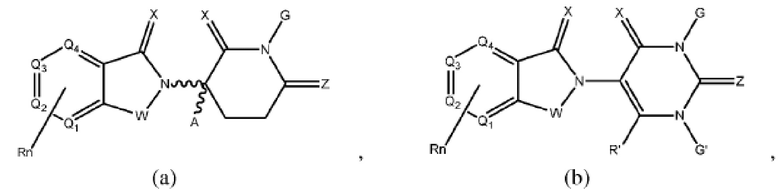

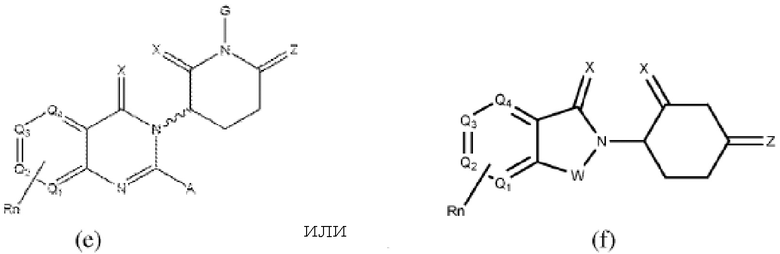
Значения остальных радикалов указаны в формуле изобретения. Изобретение также относится к фармацевтическим композициям, способам индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени, соединениям. Технический результат: получены новые бифункциональные соединения, обеспечивающие рекрутинг белков к убиквитин-лигазе Е3 для их разрушения. 16 н. и 8 з.п. ф-лы, 1 ил., 1 табл.
1. Соединение, имеющее химическую структуру, содержащую:
PTM-L-CLM
или его фармацевтически приемлемую соль, энантиомер или стереоизомер, где L ковалентно связана с указанным PTM и указанным CLM и представлена в виде формулы –(A’)q-,
где
q равен более 2;
–(A’)q- ковалентно связан с PTM и CLM;
каждый A’ независимо выбран из группы, состоящей из связи, CRL1RL2, O, S, SO, SO2, NRL3, SO2NRL3, SONRL3, CONRL3, NRL3CONRL4, NRL3SO2NRL4, CO, CRL1=CRL2, C≡C, SiRL1RL2, P(O)RL1, P(O)ORL1, NRL3C(=NCN)NRL4, NRL3C(=NCN), NRL3C(=CNO2)NRL4, C3-11циклоалкила, необязательно замещенного 0-6 группами RL1 и/или RL2, C3-11гетероциклила, необязательно замещенного 0-6 группами RL1 и/или RL2, арила, необязательно замещенного 0-6 группами RL1 и/или RL2, гетероарила, необязательно замещенного 0-6 группами RL1 и/или RL2;
каждый RL1, RL2, RL3, RL4 и RL5 независимо выбран из группы, состоящей из Н, галогена, С1-8алкила, ОС1-8алкила, SC1-8алкила, NHC1-8алкила, N(С1-8алкил)2, С3-11циклоалкила, арила, гетероарила, С3-11гетероциклила, ОС3-8циклоалкила, SC3-8циклоалкила, NHC3-8циклоалкила, N(C3-8циклоалкил)2, N(С3-8циклоалкил)(С1-8алкила), ОН, NH2, SH, SO2C1-8алкила, Р(О)(ОС1-8алкил)(С1-8алкила), Р(О)(ОС1-8алкил)2, СС-С1-8алкила, ССН, СН=СН(С1-8алкила), С(С1-8алкил)=СН(С1-8алкила), С(С1-8алкил)=С(С1-8алкил)2, Si(OH)3, Si(С1-8алкил)3, Si(OH)(С1-8алкил)2, СОС1-8алкила, СО2Н, галогена, CN, CF3, CHF2, CH2F, NO2, SF5, SO2NHC1-8алкила, SO2N(С1-8алкил)2, SONHC1-8алкила, SON(C1-8алкил)2, CONHC1-8алкила, CON(C1-8алкил)2, N(C1-8алкил)CONH(С1-8алкила), N(C1-8алкил)CON(C1-8алкил)2, NHCONH(С1-8алкила), NHCON(С1-8алкил)2, NHCONH2, N(C1-8алкил)SO2NH(С1-8алкила), N(С1-8алкил)SO2N(С1-8алкил)2, NHSO2NH(C1-8алкила), NHSO2N(С1-8алкил)2 и NHSO2NH2; и
каждый RL1 или RL2 может быть независимо связан с другой группой А с образованием циклоалкильного и/или гетероциклильного фрагмента, который может быть дополнительно замещен 0-4 группами RL5;
PTM представляет собой низкомолекулярный нацеленный на белок фрагмент, который специфически связывается с внутриклеточным целевым белком или внутриклеточным целевым полипептидом в достаточной степени для осуществления убиквитинирования внутриклеточного целевого белка или внутриклеточного целевого полипептида при соединении с CLM, где:
указанный внутриклеточный целевой белок или внутриклеточный целевой полипептид выбран из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, CD23, CD124, тирозинкиназы p56 lck, CD4, CD5, рецептора IL-2, рецептора IL-1, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, CD40/CD40L, нейрокинина, инозинмонофосфатдегидрогеназы, р38 МАР киназы, Ras, Raf, ERK, интерлейкин-1-превращающего фермента, каспазы, протеазы NS3 ВГС, РНК геликазы NS3 ВГС, глицинамидрибонуклеотидформилтрансферазы, протеазы 3С риновируса, протеазы вируса простого герпеса-1 (ВПГ-I), протеазы цитомегаловируса (ЦМВ), поли(АДФ-рибоза)полимеразы, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, SHP2, TANK-связывающей киназы 1, рецептора андрогена, c-Myc, рецептора окситоцина, микросомального транспортного белка, ангиотензина 11, рецептора глицина, рецептора повторного захвата норадреналина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, рецептора эндотелина, нейропептида Y и рецептора, рецепторов аденозина, аденозинкиназы и АМФ-деаминазы, P2Y1, P2Y2, P2Y4, P2Y6, P2X1-7, фарнезилтрансферазы, геранилгеранилтрансферазы, TrkA бета-амилоида, тирозинкиназы Flk-IIKDR, рецептора витронектина, рецептора интегрина, Her-21 neu, теломеразы, цитозольной фосфолипазы А2 и рецепторной тирозинкиназы EGF; или
группа PTM представляет собой ингибитор киназы, группу, включающую соединение, направленно действующее на бромодоменсодержащие белки ВЕТ, ингибитор лизинметилтрансферазы человека, ингибитор рецептора андрогена, ингибитор рецептора эстрогена или ингибитор рецептора, связанного с эстрогеном; и
CLM представляет собой фрагмент, связывающий цереблон убиквитин-лигазу Е3, который имеет химическую структуру, представленную формулой:
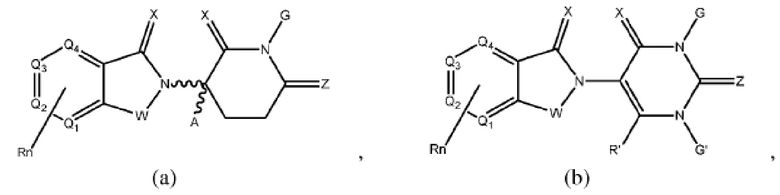
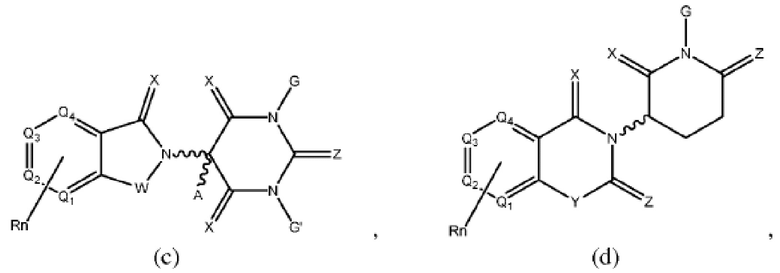
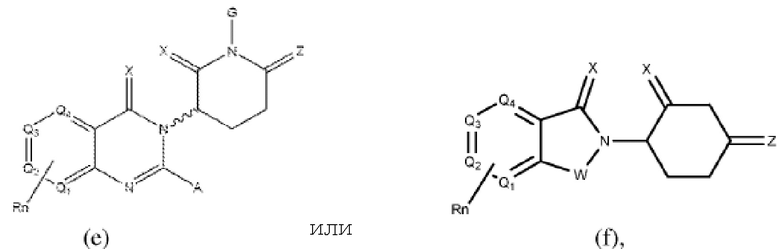
где
W выбран из группы, состоящей из СН2, CHR, C=O, SO2, NH и N-C1-6алкила;
каждый X независимо выбран из группы, состоящей из отсутствия заместителя, О и S;
Y выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-C3-7циклоалкила, N-гетероциклила, О и S;
Z выбран из группы, состоящей из отсутствия заместителя, О и S;
G и G' независимо выбраны из группы, состоящей из Н, С1-8алкила, ОН, СН2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1, Q2, Q3 и Q4 представляют собой атом углерода, замещенный группой, независимо выбранной из H, R, N или N-оксида;
А независимо выбран из группы, состоящей из H, С1-8алкила, С3-7циклоалкила, Cl и F;
R содержит -CONR'Rʺ, -OR', -NR'Rʺ, -SR', -SO2R', -SO2NR'Rʺ, -CR'Rʺ-, -CR'NR'Rʺ-, - арил, -гетероарил, C1-6алкил, C3-7циклоалкил, -гетероциклил, -P(O)(OR')Rʺ, -P(O)R'Rʺ, - OP(O)(OR')Rʺ, -OP(O)R'Rʺ, -Cl, -F, -Br, -I, -CF3, -CN, -NR'SO2NR'Rʺ, -NR'CONR'Rʺ, -CONR'CORʺ, -NR'C(=N-CN)NR'Rʺ, -C(=N-CN)NR'Rʺ, -NR'C(=N-CN)Rʺ, -NR'C(=C-NO2)NR'Rʺ, -SO2NR'CORʺ, -NO2, -CO2R', -C(C=N-OR')Rʺ, -CR'=CR'Rʺ, -CCR', - S(C=O)(C=N-R')Rʺ, -SF5 и -OCF3;
n представляет собой целое число от 1 до 4, где Rn ковалентно присоединён к L;
R' и Rʺ независимо выбраны из группы, состоящей из связи, Н, C1-6алкила, C3-7циклоалкила, арила, гетероарила, гетероциклила; и
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической, где
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической, где
каждый арил представляет собой 6-членный арил или конденсированный бициклический арил;
каждый гетероарил представляет собой 6-членный арил или конденсированный бициклический арил, который включает по меньшей мере один гетероатом, выбранный из О, N и S, и
каждый гетероциклил представляет собой 3-10-членную моно- или полициклическую алкильную группу, которая включает по меньшей мере один гетероатом, выбранный из O, N и S.
2. Соединение по п.1, отличающееся тем, что PTM выбрана из группы, состоящей из:
 ;
;  ,
,  ;
;  ;
; 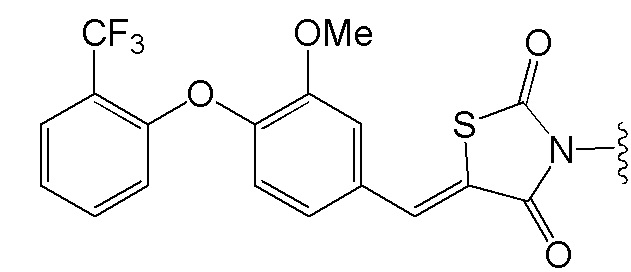 ;
; 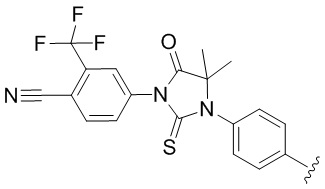 ;
; 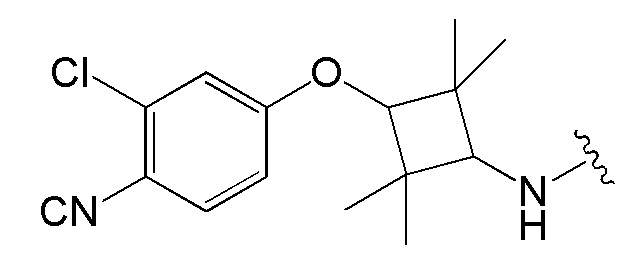 и
и  .
.
3. Соединение по п.1, отличающееся тем, что соединение выбрано из группы, состоящей из:
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3S)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3R)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-[3-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатетрадекан-14-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида;
4-{4,4-диметил-3-[4-({1-[2-(3-метил-2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{4-[(5-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пентил)окси]фенил}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]-этокси}фенил)ацетамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]амино}пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
4-(4-{[(5Z)-3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этил}-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[3-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-пропил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропил)-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{2-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]пиримидин-5-ил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-пропокси]-3-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-2-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-3-фторфенил}ацетамида; и
2-[(9R)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида.
4. Соединение по п.1, отличающееся тем, что указанный внутриклеточный целевой белок или внутриклеточный целевой полипептид выбран из группы, состоящей из TANK-связывающей киназы 1 (TBK1), рецептора эстрогена α (ERα), бромодоменсодержащего белка 4 (BRD4), рецептора андрогена (AR) и c-Myc.
5. Фармацевтическая композиция, содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый носитель, где указанная композиция эффективна для разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени, выбранной из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
6. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.1 в клетку, где:
внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
7. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.3 в клетку, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ и TANK-связывающей киназы 1.
8. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени у пациента, включающий введение эффективного количества соединения по п.1 пациенту, где:
внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
9. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени у пациента, включающий введение эффективного количества соединения по п.3 пациенту, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ и TANK-связывающей киназы 1.
10. Соединение, имеющее химическую структуру, содержащую:
PTM-L-CLM,
или его фармацевтически приемлемую соль, энантиомер или стереоизомер,
где
L ковалентно связана с указанным PTM и указанным CLM и представлена в виде формулы –(A’)q-, где A’ представляет собой химическую группу, и q равен более 2, и –(A’)q- ковалентно связан с PTM и CLM;
PTM представляет собой низкомолекулярный нацеленный на белок фрагмент, который специфически связывается с внутриклеточным целевым белком или внутриклеточным целевым полипептидом в достаточной степени для осуществления убиквитинирования внутриклеточного целевого белка или внутриклеточного целевого полипептида при соединении с CLM, где:
указанный внутриклеточный целевой белок или внутриклеточный целевой полипептид выбран из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, CD23, CD124, тирозинкиназы p56 lck, CD4, CD5, рецептора IL-2, рецептора IL-1, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, CD40/CD40L, нейрокинина, инозинмонофосфатдегидрогеназы, р38 МАР киназы, Ras, Raf, ERK, интерлейкин-1-превращающего фермента, каспазы, протеазы NS3 ВГС, РНК геликазы NS3 ВГС, глицинамидрибонуклеотидформилтрансферазы, протеазы 3С риновируса, протеазы вируса простого герпеса-1 (ВПГ-I), протеазы цитомегаловируса (ЦМВ), поли(АДФ-рибоза)полимеразы, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, SHP2, рецептора андрогена, c-Myc, рецептора окситоцина, микросомального транспортного белка, ангиотензина 11, рецептора глицина, рецептора повторного захвата норадреналина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, рецептора эндотелина, нейропептида Y и рецептора, рецепторов аденозина, аденозинкиназы и АМФ-деаминазы, P2Y1, P2Y2, P2Y4, P2Y6, P2X1-7, фарнезилтрансферазы, геранилгеранилтрансферазы, TrkA бета-амилоида, тирозинкиназы Flk-IIKDR, рецептора витронектина, рецептора интегрина, Her-21 neu, теломеразы, цитозольной фосфолипазы А2 и рецепторной тирозинкиназы EGF; или
группа PTM представляет собой ингибитор киназы, ингибитор тирозинкиназы, группу, включающую соединение, направленно действующее на бромодоменсодержащие белки ВЕТ, ингибитор лизинметилтрансферазы человека, ингибитор BCR-Abl тирозинкиназы, ингибитор HER2/neu, ингибитор Abl, ингибитор BRAF, ингибитор рецептора VEGF, ингибитор рецептора EGF, ингибитор рецептора PDGF, ингибитор c-KIT, ингибитор FLT3, ингибитор рецептора андрогена, ингибитор рецептора эстрогена или ингибитор рецептора, связанного с эстрогеном; и
CLM представляет собой фрагмент, связывающий цереблон убиквитин-лигазу Е3, который имеет химическую структуру, представленную формулой:
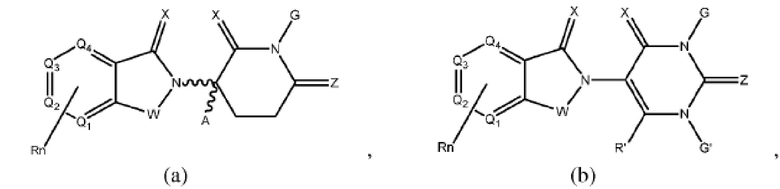
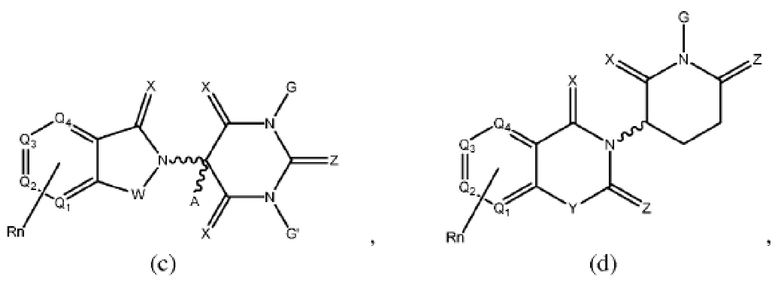

где
W выбран из группы, состоящей из СН2, CHR, C=O, SO2, NH и N-алкила;
каждый X независимо выбран из группы, состоящей из О, S и CH2;
Y выбран из группы, состоящей из NH, N-алкила, N-арила, N-гетероарила, N-циклоалкила, N-гетероциклила, О и S;
Z выбран из группы, состоящей из О, S и CН2;
G и G' независимо выбраны из группы, состоящей из Н, C1-8алкила, ОН, СН2-гетероциклила, необязательно замещенного R', и бензила, необязательно замещенного R';
Q1, Q2, Q3 и Q4 представляют собой атом углерода, замещенный группой, независимо выбранной из R', N или N-оксида;
А независимо выбран из группы, состоящей из H, С1-8алкила, С3-7циклоалкила, Cl и F;
R содержит -CONR'Rʺ, -OR', -NR'Rʺ, -SR', -SO2R', -SO2NR'Rʺ, -CR'Rʺ-, -CR'NR'Rʺ-, -арил, -гетероарил, -алкил, -циклоалкил, -гетероциклил, -P(O)(OR')Rʺ, -P(O)R'Rʺ, - OP(O)(OR')Rʺ, -OP(O)R'Rʺ, -Cl, -F, -Br, -I, -CF3, -CN, -NR'SO2NR'Rʺ, -NR'CONR'Rʺ, -CONR'CORʺ, -NR'C(=N-CN)NR'Rʺ, -C(=N-CN)NR'Rʺ, -NR'C(=N-CN)Rʺ, -NR'C(=C-NO2)NR'Rʺ, -SO2NR'CORʺ, -NO2, -CO2R', -C(C=N-OR')Rʺ, -CR'=CR'Rʺ, -CCR', - S(C=O)(C=N-R')Rʺ, -SF5 и -OCF3;
n представляет собой целое число от 1 до 4, где Rn ковалентно присоединён к L;
R' и Rʺ независимо выбраны из группы, состоящей из связи, Н, С1-8алкила, С3-7циклоалкила, арила, гетероарила, гетероциклила; и
 представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической;
представляет собой связь, которая может быть стереоспецифической ((R)- или (S)-) или нестереоспецифической;
где каждый арил представляет собой 6-членный арил или конденсированный бициклический арил;
каждый гетероарил представляет собой 6-членный арил или конденсированный бициклический арил, который включает по меньшей мере один гетероатом, выбранный из О, N и S, и
каждый гетероциклил представляет собой 3-10-членную моно- или полициклическую алкильную группу, которая включает по меньшей мере один гетероатом, выбранный из O, N и S.
11. Соединение по п.10, отличающееся тем, что PTM выбрана из группы, состоящей из:
12. Соединение по п.10, отличающееся тем, что соединение выбрано из группы, состоящей из:
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3S)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3R)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-[3-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатетрадекан-14-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида;
4-{4,4-диметил-3-[4-({1-[2-(3-метил-2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{4-[(5-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пентил)окси]фенил}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]-этокси}фенил)ацетамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]амино}пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
4-(4-{[(5Z)-3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этил}-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[3-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-пропил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропил)-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{2-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]пиримидин-5-ил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-пропокси]-3-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-2-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-3-фторфенил}ацетамида; и
2-[(9R)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида.
13. Соединение по п.10, отличающееся тем, что
каждый A’ независимо выбран из группы, состоящей из связи, CRL1RL2, O, S, SO, SO2, NRL3, SO2NRL3, SONRL3, CONRL3, NRL3CONRL4, NRL3SO2NRL4, CO, CRL1=CRL2, C≡C, SiRL1RL2, P(O)RL1, P(O)ORL1, NRL3C(=NCN)NRL4, NRL3C(=NCN), NRL3C(=CNO2)NRL4, C3-11 циклоалкила, необязательно замещенного 0-6 группами RL1 и/или RL2, C3-11 гетероциклила, необязательно замещенного 0-6 группами RL1 и/или RL2, арила, необязательно замещенного 0-6 группами RL1 и/или RL2, гетероарила, необязательно замещенного 0-6 группами RL1 и/или RL2; причем
каждый RL1, RL2, RL3, RL4 и RL5 независимо выбран из группы, состоящей из Н, галогена, С1-8алкила, ОС1-8алкила, SC1-8алкила, NHC1-8алкила, N(С1-8алкил)2, С3-11циклоалкила, арила, гетероарила, С3-11гетероциклила, ОС1-8циклоалкила, SC1-8циклоалкила, NHC1-8циклоалкила, N(C1-8циклоалкил)2, N(С1-8циклоалкил)(С1-8алкила), ОН, NH2, SH, SO2C1-8алкила, Р(О)(ОС1-8алкил)(С1-8алкила), Р(О)(ОС1-8алкил)2, СС-С1-8алкила, ССН, СН=СН(С1-8алкила), С(С1-8алкил)=СН(С1-8алкила), С(С1-8алкил)=С(С1-8алкил)2, Si(OH)3, Si(С1-8алкил)3, Si(OH)(С1-8алкил)2, СОС1-8алкила, СО2Н, галогена, CN, CF3, CHF2, CH2F, NO2, SF5, SO2NHC1-8алкила, SO2N(С1-8алкил)2, SONHC1-8алкила, SON(C1-8алкил)2, CONHC1-8алкила, CON(C1-8алкил)2, N(C1-8алкил)CONH(С1-8алкила), N(C1-8алкил)CON(C1-8алкил)2, NHCONH(С1-8алкила), NHCON(С1-8алкил)2, NHCONH2, N(C1-8алкил)SO2NH(С1-8алкила), N(С1-8алкил)SO2N(С1-8алкил)2, NHSO2NH(C1-8алкила), NHSO2N(С1-8алкил)2 и NHSO2NH2; и
где каждый RL1 или RL2 может быть независимо связан с другой группой А с образованием циклоалкильного и/или гетероциклильного фрагмента, который может быть дополнительно замещен 0-4 группами RL5.
14. Соединение по п.10, отличающееся тем, что указанный внутриклеточный целевой белок или внутриклеточный целевой полипептид выбран из группы, состоящей из TANK-связывающей киназы 1 (TBK1), рецептора эстрогена α (ERα), бромодоменсодержащего белка 4 (BRD4), рецептора андрогена (AR) и c-Myc.
15. Фармацевтическая композиция, содержащая эффективное количество соединения по п.10 и фармацевтически приемлемый носитель, где композиция эффективна для разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени, выбранной из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
16. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.10 в клетку, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из бромодоменсодержащего белка ВЕТ, киназы, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
17. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.12 в клетку, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ и TANK-связывающей киназы 1.
18. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.10 пациенту, где:
внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из бромодоменсодержащего белка ВЕТ, тирозинкиназ, тирозинкиназы p56 lck, рецептора ФНО-альфа, ICAM1, VCAM, интегрина VLA-4, р38 МАР киназы, Raf, ERK, циклинзависимых киназ, фактора роста эндотелия сосудов, c-Kit, TGFβ-активированной киназы 1, TANK-связывающей киназы 1, рецептора андрогена, рецептора окситоцина, рецептора эстрогена, рецептора, связанного с эстрогеном, киназы фокальной адгезии, Src, аденозинкиназы, тирозинкиназы Flk-IIKDR и рецепторной тирозинкиназы EGF.
19. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени у пациента, включающий введение эффективного количества соединения по п.12 пациенту, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ и TANK-связывающей киназы 1.
20. Соединение, имеющее химическую структуру, содержащую:
PTM-L–CLM,
где
L представляет собой линкерную группу, выбранную из
-(CH2)3-,
-O-(CH2)3-,
-O-(CH2)4-,
-O-(CH2)5-,
-(CH2)2-O-(CH2)2-,
-(CH2)3-O-(CH2)2-,
-(CH2)3-O-(CH2)3-,
-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)2-O-(CH2)2-,
-O-(CH2)3-O-(CH2)2-,
-O-(CH2)4-O-(CH2)3-,
-O-(CH2)5-O-(CH2)3-,
-O-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)3-O-(CH2)2-O-(CH2)2-,
-O-(CH2)3-O-(CH2)3-O-(CH2)2-,
-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)3-O-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)4-O-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-,
-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-O-(CH2)2-;
CLM представляет собой фрагмент, связывающийся с цереблон убиквитин-лигазой Е3,
выбранный из
причем указанная линкерная группа химически присоединена к указанному CLM;
PTM представляет собой фрагмент, нацеливающий на белок, который связывается с белковой мишенью или целевым полипептидом, выбранный из

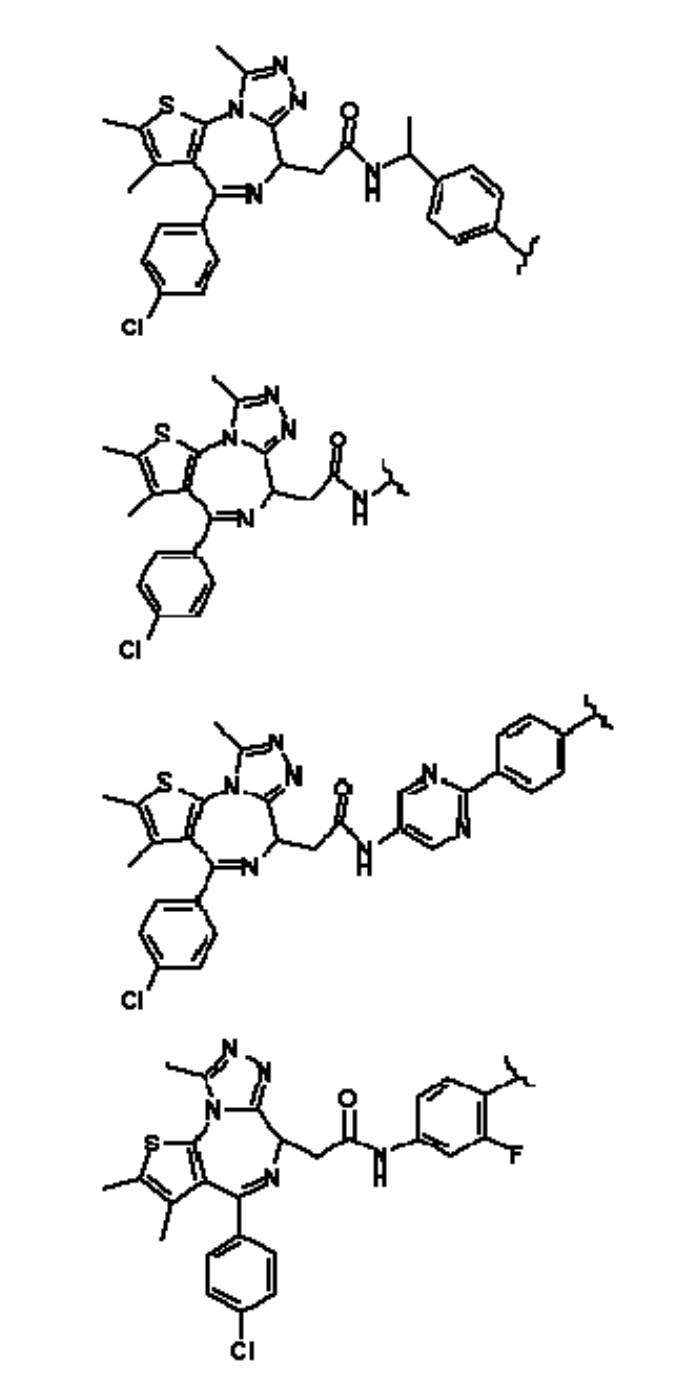
причем PTM химически присоединен к указанному CLM посредством линкерной группы.
21. Соединение по п.20, отличающееся тем, что соединение выбрано из группы, состоящей из:
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3S)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-(3-{4-[(1-{2-[(3R)-2,6-диоксопиперидин-3-ил]-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил}-4,7,10-триокса-1-азадодекан-12-ил)окси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-(3-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]фенил}-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил)-2-(трифторметил)бензонитрила;
4-[3-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-[3-(4-{3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]пропокси}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
4-{3-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатетрадекан-14-ил}окси)фенил]-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-{[5-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)пентил]окси}-N-[транс-3-(3-хлор-4-цианофенокси)-2,2,4,4-тетраметилциклобутил]бензамида;
4-{4,4-диметил-3-[4-({1-[2-(3-метил-2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азатридекан-13-ил}окси)фенил]-5-оксо-2-сульфанилиденимидазолидин-1-ил}-2-(трифторметил)бензонитрила;
4-[3-(4-{4-[(5-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пентил)окси]фенил}фенил)-4,4-диметил-5-оксо-2-сульфанилиденимидазолидин-1-ил]-2-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(4-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]-этокси}фенил)ацетамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]амино}пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13,16-пентаокса-1-азаоктадекан-18-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
N-{3-[(5-бром-2-{[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10,13-тетраокса-1-азапентадекан-15-ил}окси)фенил]амино}-пиримидин-4-ил)амино]пропил}-N-метилциклобутанкарбоксамида;
4-(4-{[(5Z)-3-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)пропил]-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
4-(4-{[(5Z)-3-{2-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этокси]этил}-2,4-диоксо-1,3-тиазолидин-5-илиден]метил}-2-метоксифенокси)-3-(трифторметил)бензонитрила;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[3-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-пропил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропил)-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1S)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)этил]-ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(4-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}бутокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-{4-[2-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-этокси]фенил}этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[(1R)-1-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]этил]ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{2-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-фенил]пиримидин-5-ил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[3-(2-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}этокси)-пропокси]-3-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-2-фторфенил}ацетамида;
2-[(9S)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-{4-[4-(3-{[2-(2,6-диоксопиперидин-3-ил)-1,3-диоксо-2,3-дигидро-1Н-изоиндол-4-ил]амино}пропокси)-бутокси]-3-фторфенил}ацетамида; и
2-[(9R)-7-(4-хлорфенил)-4,5,13-триметил-3-тиа-1,8,11,12-тетраазатрицикло[8.3.0.02,6]тридека-2(6),4,7,10,12-пентаен-9-ил]-N-[4-({1-[2-(2,6-диоксопиперидин-3-ил)-1-оксо-2,3-дигидро-1Н-изоиндол-4-ил]-4,7,10-триокса-1-азадодекан-12-ил}окси)фенил]ацетамида.
22. Фармацевтическая композиция, содержащая эффективное количество соединения по п.20 и фармацевтически приемлемый носитель, где композиция эффективна для разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени, которая выбрана из группы, состоящей из бромодоменсодержащего белка ВЕТ, TANK-связывающей киназы 1, рецептора андрогена, рецептора эстрогена, рецептора, связанного с эстрогеном, и c-Myc.
23. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени в клетке, включающий введение эффективного количества соединения по п.20 в клетку, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ, TANK-связывающей киназы 1 и с-Myc.
24. Способ индуцирования разрушения внутриклеточной белковой мишени или внутриклеточной полипептидной мишени у пациента, включающий введение эффективного количества соединения по п.20 пациенту, где внутриклеточная белковая мишень или внутриклеточная полипептидная мишень выбрана из группы, состоящей из рецептора андрогена, рецептора, связанного с эстрогеном, бромодоменсодержащего белка ВЕТ, TANK-связывающей киназы 1 и с-Myc.
| WO 2013106643 A2, 18.07.2013 | |||
| WO 9803502 A1, 29.01.1998 | |||
| US 20080051432 A1, 28.02.2008 | |||
| RU 2008112221 A, 10.10.2009 | |||
| 5-ЗАМЕЩЕННЫЕ ИЗОИНДОЛИНОВЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2448101C2 |
| RU 2011121567 A, 10.12.2012 | |||
| RU 2012138709 A, 20.03.2014. | |||
Авторы
Даты
2020-12-17—Публикация
2015-04-14—Подача