Настоящее изобретение относится к новым полиморфным кристаллическим формам соединения формулы I и к способам их получения
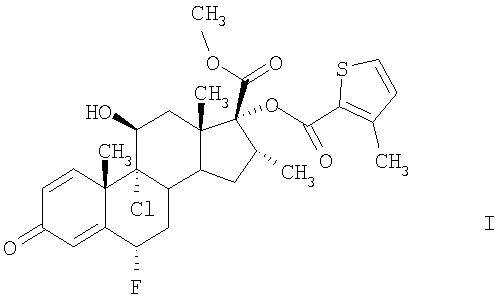
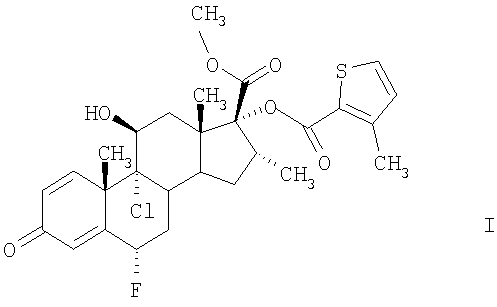
Соединение формулы I, а именно (6S,9R,10S,11S,13S,16R,17R)-9-хлор-6-фтор-11-гидрокси-17-метоксикарбонил-10,13,16-триметил-3-оксо-6,7,8,9,10,11,12,13,14,15,16,17-додекагидро-3Н-циклопента[а]фенантрен-17-иловый эфир 3-метилтиофен-2-карбоновой кислоты, характеризуется высокой противовоспалительной активностью. Эту активность можно определить по ингибированию указанным соединением синтеза альфа-ФНО и высвобождению в клеточной линии макрофагов человека, а также по ингибированию воспалительных состояний, прежде всего дыхательных путей, например, по ингибированию активации эозинофилов на моделях животных, например, на моделях воспалительных состояний дыхательных путей у мышей или у крыс, например, как описано в статьях Szarka и др., J. Immunol. Methods 202:49-57 (1997); Renzi и др., Am. Rev. Respir. Dis. 148:932-939 (1993); Tsuyuki и др., J. Clin. Invest. 96:2924-2931 (1995); Cernadas и др. Am. J. Respir. Cell Mol. Biol. 20:1-8 (1999).
Исследовали возможность использования указанного соединения в качестве фармацевтического препарата. Для выявления форм соединения, наиболее пригодных для указанного назначения, исследовали различные кристаллические полиморфные формы соединения.
В настоящее время выделены новые кристаллические формы соединения формулы I. Некоторые из этих новых кристаллических форм характеризуются достаточно высокой стабильностью, что способствует их использованию для получения фармацевтических лекарственных форм.
В связи с этим один объект настоящего изобретения относится к соединению формулы I
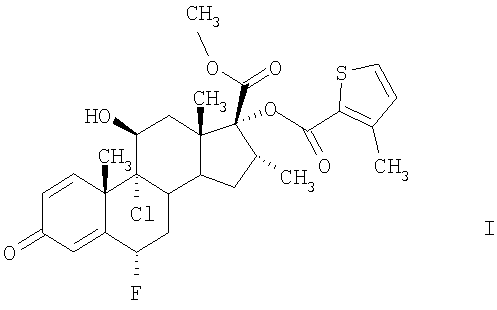
в кристаллической форме А, температура плавления которой по данным дифференциальной сканирующей калориметрии составляет приблизительно 264°С, при одновременном разложении при скорости нагревания 20°С/мин. При рентгеноструктурном анализе наблюдается следующая дифракционная картина с характерными дифракционными полосами (2θ в угловых градусах ±0,2°): 3,6°, 7,3°, 13,4°, 14,6°, 18,3°, 22,0°, 25,8°, 25,9°, 29,5°, или в кристаллической форме В, температура плавления которой по данным дифференциальной сканирующей калориметрии составляет приблизительно 270°С, при самопроизвольном разложении при скорости нагревания 20°С/мин. При рентгеноструктурном анализе наблюдается следующая дифракционная картина с характерными дифракционными полосами (2θ в угловых градусах ±0,2°): 7,2°, 9,3°, 12,0°, 12,8°, 13,1°, 14,5°, 17,4°, 20,4°, 23,2° и 25,8°.
Кристаллическую форму А получают при кристаллизации соединения формулы I из раствора в органическом растворителе, таком как изопропанол, этилацетат, н-бутанол, гексан, гептан, трет-бутилметиловый эфир, толуол или тетрагидрофуран, например, при уравновешивании соединения в указанном растворе при 25°С в течение 24 ч или аналогичным образом, как описано в примере 1. Кристаллизацию индуцируют, например, при охлаждении пересыщенного раствора соединения формулы I в растворителе или при добавлении к раствору соединения формулы I растворителя, в котором соединение формулы I растворимо в меньшей степени. Исходный раствор соединения формулы I можно выдерживать при температуре окружающей среды или при повышенной температуре (вплоть до температуры кипения растворителя).
Кристаллическую форму В получают при кристаллизации соединения формулы I из раствора в полярном органическом растворителе, таком как этанол, метанол или хлористый метилен, например, при уравновешивании соединения в указанном растворе при 25°С в течение 24 ч или аналогичным образом, как описано в примере 2. Кристаллизацию индуцируют, например, при охлаждении пересыщенного раствора соединения формулы I в полярном растворителе или при добавлении к раствору соединения формулы I полярного растворителя, в котором соединение формулы I растворимо в меньшей степени. Исходный раствор соединения формулы I можно выдерживать при температуре окружающей среды или при повышенной температуре (вплоть до температуры кипения растворителя).
Для получения каждой кристаллической формы в основном используют известные методики для выделения кристаллической формы из маточного раствора, например, фильтрованием под давлением или в отсутствие давления и/или в вакууме или в отсутствие вакуума, а также центрифугированием с последующим высушиванием кристаллов.
В присутствии этанола кристаллическая форма А превращается в кристаллическую форму В. В присутствии изопропанола кристаллическая форма В превращается в кристаллическую форму А.
Кристаллические формы различаются, прежде всего, по дифракционной картине на рентгеноструктурной диаграмме, которые получают предпочтительно при использовании дифрактометра с порошковой камерой и излучением Cu-Kα1, используемых для идентификации твердых органических соединений. Порошковые рентгеноструктурные диаграммы, прежде всего, используют для определения кристаллической формы или модификации соединения формулы I. Использование таких диаграмм описано в прилагаемых примерах.
Было установлено, что термодинамическая стабильность кристаллической формы А в твердом состоянии выше по сравнению с кристаллической формой В. Однако стабильность суспензии в растворителе зависит от типа растворителя.
Соединение формулы I можно получить по методике, описанной в примере 26 международной заявки на выдачу патента WO 02/00679.
Благодаря противовоспалительной активности соединение формулы I в кристаллической форме А или В можно использовать для лечения воспалительных состояний, прежде всего воспалительных или обструктивных заболеваний дыхательных путей. Лечение по настоящему изобретению может быть симптоматического или профилактического типа.
Воспалительные или обструктивные заболевания дыхательных путей, которые можно лечить способом по настоящему изобретению, включают астму любого типа или генез, включая наследственную (не аллергическую) бронхиальную астму и приобретенную (аллергическую) бронхиальную астму, легкую форму астмы, умеренную форму астмы, тяжелую форму астмы, астму при бронхите, вызванную нагрузкой астму, профессиональную астму и астму, вызванную бактериальной инфекцией. Следует отметить, что в объем изобретения включено лечение астмы у субъектов, например, в возрасте менее 4 или 5 лет с симптомами затрудненного дыхания и с установленным или предположительным диагнозом «ребенок с затрудненным дыханием», то есть у известной для врачей категории пациентов, которых в настоящее время часто называют пациентами с зарождающейся астмой и с астмой в начальной стадии. (Для удобства такое особое астматическое состояние называют «синдром детей с затрудненным дыханием»).
Профилактическая эффективность лечения астмы проявляется в снижении частоты или тяжести симптоматических приступов, например острого астматического приступа или приступа при бронхостенозе, в улучшении функции легких или улучшении гиперреактивности дыхательных путей. Эффективность лечения, кроме того, проявляется в отсутствии необходимости применения другой симптоматической терапии, то есть для снижения или подавления симпоматического приступа, если он наблюдается, например, противовоспалительной терапии (например, кортикостероиды) или бронхорасширяющей терапии. Профилактическая эффективность лечения астмы прежде всего проявляется также при лечении больных, подверженных «утренним приступам». Так называемые утренние приступы называются астматическим синдромом, который проявляется у определенного процента астматиков и характеризуется приступами астмы, например, в период от приблизительно 4 до 6 ч утра, то есть когда обычно уже не действуют предварительно введенные лекарственные симптоматические средства против астмы.
Другие воспалительные или обструктивные заболевания и состояния дыхательных путей, которые можно лечить способом по настоящему изобретению, включают следующие заболевания: острое повреждение легких (ALI), респираторный дистресс-синдром взрослых (ARDS), хроническое обструктивное заболевание дыхательных путей или легких (COPD, COAD или COLD), включая ассоциированные с указанными заболеваниями хронический бронхит или одышку, эмфизему, а также обострение гиперреактивности дыхательных путей вследствие другой лекарственной терапии, прежде всего при лечении с помощью ингаляции лекарственных средств. Изобретение относится также к лечению бронхита любого типа или генеза, включая, например, острый, арахноидитный, катаральный, фибринозный, хронический или туберкулезный бронхит. Кроме того, изобретение включает лечение воспалительных или обструктивных заболеваний дыхательных путей, таких как пневмокониоз (воспалительное, обычно профессиональное заболевание легких, которое часто сопровождается обструкцией дыхательных путей, хронической или острой, или вызванное частым вдыханием пыли) любого типа или генез, включая, например, алюминоз, антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз.
В связи с противовоспалительной активностью соединений по изобретению, прежде всего в отношении ингибирования активации эозинофилов, соединение формулы I в кристаллической форме А или В можно также использовать для лечения связанных с эозинофилами нарушений, например ацидоцитоза, прежде всего связанного с эозинофилами нарушений дыхательных путей (например, включая патологическую инфильтрацию эозинофилов в легочные ткани), включая гиперацидоцитоз, так как указанные состояния влияют на дыхательные пути и/или легкие, а также, например, связанных с эозинофилами нарушений дыхательных путей, вызванных синдромом Люффлера или сопровождающих его, эозинофильной пневмонии, паразитарной (прежде всего многоклеточные паразиты) инвазии (включая, тропический ацидоцитоз), бронхопульмонального аспергиллеза, нодозного панартериита (включая гранулематозный аллергический ангиит), эозинофильной гранулемы и связанных с эозинофилами нарушений, влияющих на дыхательные пути в связи с реакцией на лекарственные средства.
Соединение формулы I в кристаллической форме А или В можно также использовать для лечения воспалительных состояний кожи, например, таких как псориаз, контактный дерматит, атонический дерматит, гнездная алопеция, экссудативная многоформная эритема, герпетиформный дерматит, склеродерма, витилиго, сверхчувствительный ангиит, крапивница, буллезный пемфигоид, красная волчанка, пемфигус, приобретенный буллезный эпидермолиз и другие воспалительные состояния кожи. Соединение формулы I в кристаллической форме А или В можно также использовать для лечения других заболеваний или состояний, прежде всего заболеваний или состояний, включающих воспалительный компонент, например для лечения глазных заболеваний и состояний, таких как коньюктивит, сухой кератоконьюктивит и весенний коньюктивит, заболевания полости носа, включая аллергический ринит, заболевания суставов, такие как ревматоидный артрит, и заболевания кишечного тракта, такие как язвенный колит и болезнь Крона.
Соединения формулы I в кристаллической форме А или В можно также использовать в качестве дополнительного терапевтического агента для использования в сочетании с другими лекарственными средствами для лечения заболеваний дыхательных путей, прежде всего с бронхорасширяющими или противовоспалительными лекарственными средствами, прежде всего для лечения обструктивных или воспалительных заболеваний дыхательных путей, таких как указанные выше заболевания, например, для усиления терапевтической активности таких лекарственных средств или для снижения требуемых доз или возможного побочного действия таких лекарственных средств. Соединение формулы I в кристаллической форме А или В можно смешивать с другим лекарственным средством в фиксированной фармацевтической композиции или его можно вводить отдельно перед введением другого лекарственного средства, одновременно с ним или после него.
Такие противовоспалительные лекарственные средства включают стероиды, прежде всего глюкокортикостероиды, такие как будезонид, бекламетазона дипропионат, флутиказона пропионат, циклезонида или монометазона фуроат, и соединения, описанные в заявках WO 0200679, WO 0288167, WO 0212266 и WO 02100879; антагонисты LTB4, такие как описанные в патенте US 5451700; антагонисты LTD4, такие как монтелюкаст и зафирлюкаст; агонисты рецептора дофамина, такие как каберголин, бромокриптин, ропинирол и 4-гидрокси-7-[2-[[2-[[3-(2-фенилэтокси)пропил]сульфонил]этил]амино]этил]-2(3Н)-бензотиазолон и их фармацевтически приемлемые соли (например, гидрохлорид Viozan® фирмы AstraZeneca); ингибиторы PDE4, такие как продукт Ariflo® (фирмы GlaxoSmith Kline), рофлюмиласт (фирмы Byk Gulden), продукт V-11294A (фирмы Napp), продукт BAY19-8004 (фирмы Bayer), продукт SCH-351591 (фирмы Schering-Plough), арофиллин (фирмы Almirall Prodesfarma), продукт PD189659 (фирмы Parke-Davis), продукт AWD-12-281 (фирмы Asia Medica), продукт CDC-801 (фирмы Celgene) и продукт KW-4490 (фирмы Kyowa Hakko Kogyo); агонисты А2а, такие как описанные в патентах и заявках ЕР 1052264, ЕР 1241176, WO 0023457, WO 0077018, WO 0123399, WO 0160835, WO 0194368, WO 0200676, WO 0222630, WO 0296462, WO 0127130, WO 0127131, WO 9602543, WO 9602553, WO 9828319, WO 9924449, WO 9924450, WO 9924451, WO 9938877, WO 9941267, WO 9967263, WO 9967264, WO 9967265, WO 9967266, WO 9417090, ЕР 409595А2 и WO 0078774, а также антагонисты А2b, такие как описанные в заявке WO 02/42298.
Такие бронхорасширяющие лекарственные средства включают антихолинергические агенты и мускариновые холиноблокаторы, такие как описанные в патентах и заявках ЕР 424021, US 5171744 (Pfizer) и WO 01/04118 (Almirall Prodesfarma), но прежде всего ипратропий бромид, окситропий бромид и тиотропий бромид, а также агонисты адренорецептора бета-2, такие как сальбутамол, тербуталин, сальметерол и, прежде всего формотерол и их фармацевтически приемлемые соли, и соединения (в свободной форме или в форме соли или сольвата) формулы I, как описано в международной заявке РСТ No. WO 00/75114, включенной в данное описание в качестве ссылки, предпочтительно соединения, описанные в примерах, и прежде всего соединение формулы
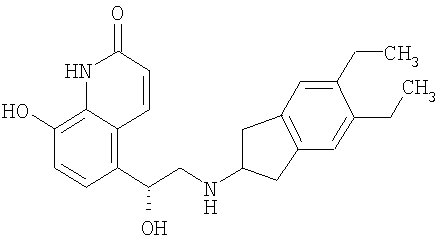
в свободной форме или в форме фармацевтически приемлемой соли или сольвата.
Комбинации соединения формулы I в кристаллической форме А или В и агонистов бета-2, ингибиторов PDE4 или антагонистов LTD4 можно использовать, например, для лечения COPD, предпочтительно астмы.
Комбинации соединения формулы I в кристаллической форме А или В и антихолинергических или мускариновых блокаторов, ингибиторов PDE4, антагонистов LTB4 можно использовать, например, для лечения астмы, или прежде всего COPD.
В связи с вышеизложенным в изобретении предлагается также способ лечения воспалительного состояния, прежде всего воспалительного или обструктивного заболевания дыхательных путей, причем способ включает введение субъекту, прежде всего человеку, нуждающемуся в таком лечении, эффективного количества соединения формулы I в кристаллической форме А или В, описанных выше. Другой объект изобретения относится к применению соединения формулы I в кристаллической форме А или В для получения лекарственного средства, предназначенного для лечения воспалительного состояния, прежде всего воспалительного или обструктивного заболевания дыхательных путей.
Соединение формулы I в кристаллической форме А или В можно вводить любым пригодным способом, например пероральным способом, например, в форме таблетки или капсулы; парентеральным способом, например внутривенно; ингаляцией, например, для лечения воспалительного или обструктивного заболевания дыхательных путей; интраназальным способом, например, при лечении аллергического ринита; местным способом на кожу, например, при лечении атопического дерматита или ректальным способом, например, при лечении воспалительного заболевания кишечника.
Еще один объект настоящего изобретения относится к фармацевтической композиции, включающей в качестве активного ингредиента соединение формулы I в кристаллической форме А или В и необязательно в смеси с фармацевтически приемлемым разбавителем или носителем. Композиция может содержать дополнительный терапевтический агент, такой как бронхорасширяющее или противовоспалительное лекарственное средство, описанное выше. Такую композицию получают с использованием стандартных разбавителей или эксципиентов, а также методов, известных в области получения галеновых форм. Таким образом, пероральная лекарственная форма может включать таблетки и капсулы. Составы для местного применения получают в форме кремов, мазей, гелей и чрескожных систем доставки, например, в форме пластырей. Композиция для ингаляции может включать аэрозоль или другие распыляемые составы или порошкообразные составы.
Если композиция включает аэрозольный состав, то она предпочтительно содержит, например, гидрофторалкан (HFA) в качестве газа-вытеснителя, такой как HFA134a или HFA227 или их смесь, и может содержать один или более известных сорастворителей, таких как этанол (до 20 мас.%), и/или один или более ПАВ, таких как олеиновая кислота или триолеат сорбитана, и/или один или более наполнителей, таких как лактоза. Если композиция включает сухой порошкообразный состав, то она предпочтительно содержит, например, соединение формулы I в кристаллической форме А или В, более предпочтительно - в кристаллической форме А, с размером частиц до 10 мкм, необязательно в смеси с разбавителем или носителем, таким как лактоза, с требуемым распределением частиц по размеру, и соединение, которое обеспечивает защиту от снижения активности продукта при действии влаги. Если композиция включает распыляемый состав, то она предпочтительно содержит, например, соединение формулы I в кристаллической форме А или В, которое растворено или суспендировано в содержащей носитель воде, сорастворитель, такой как этанол или пропиленгликоль, или стабилизатор, который может являться ПАВ.
Изобретение включает (А) соединение формулы I в кристаллической форме А или B в ингаляционной форме, например в виде аэрозольной или распыляемой другим путем композиции или в форме твердых частиц для ингаляции, например, в тонко измельченной форме, (Б) ингаляционное лекарственное средство, включающее соединение формулы I в кристаллической форме А или B в ингаляционной форме, (В) фармацевтический продукт, включающий соединение формулы I в кристаллической форме А или B в ингаляционной форме в составе ингаляционного устройства, и (Г) ингаляционное устройство, содержащее соединение формулы I в кристаллической форме А или B в форме для ингаляции.
Дозировки соединения формулы I в кристаллической форме А или В по настоящему изобретению, используемые на практике, зависят, например, от конкретного состояния, предназначенного для лечения, от требуемого действия и от способа введения. В основном пригодные суточные дозировки для введения ингаляцией составляют от приблизительно 0,005 до 10 мг, а при пероральном способе введения пригодные суточные дозы составляют приблизительно от 0,05 до 100 мг.
Изобретение иллюстрируется следующими примерами.
Пример 1
Получение и характеристика кристаллической формы А
50 мг соединения формулы I уравновешивали в 1 мл изопропанола в течение 24 ч при 25С°. Затем продукт отфильтровывали и высушивали. После высушивания получали соединение формулы I в форме кристаллов белого цвета.
Кристаллы исследовали методом ренгеноструктурного анализа на дифрактометре с порошковой камерой и источником излучения Cu-Kα1. Характеристики полученной дифракционной картины представлены в виде дифракционных линий и интенсивностей наиболее важных линий, как показано ниже на фиг.1 и в таблице 1.
Пример 2
Получение и характеристика кристаллической формы В
87 мг соединения формулы I уравновешивали в 1 мл этанола в течение 24 ч при 25С°. Затем продукт отфильтровывали и высушивали. После высушивания получали соединение формулы I в форме кристаллов белого цвета.
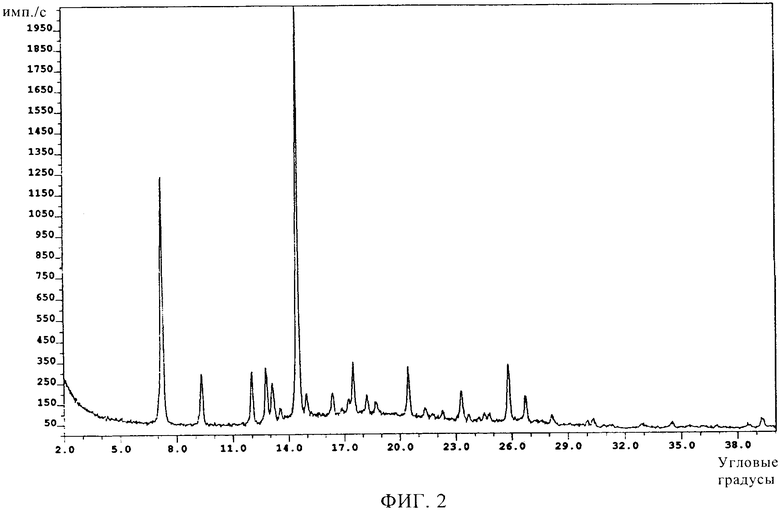
Кристаллы исследовали методом ренгеноструктурного анализа на дифрактометре с порошковой камерой и источником излучения Cu-Kα1. Характеристики полученной дифракционной картины представлены в виде дифракционных линий и интенсивностей наиболее важных линий, как показано ниже на фиг.2 и в таблице 2.
Пример 3
Получение кристаллических форм А и B в различных растворителях
8 мг соединения формулы I уравновешивали в 1,5 мл различных растворителей в течение по крайней мере 24 ч на водяной бане при 25°С±0,1. Растворы отфильтровывали и высушивали в течение 10 мин на воздухе. Для идентификации твердых частиц их исследовали методом рентгеноструктурного анализа с порошковой камерой (РАПК). Результаты показаны ниже в таблице 3.
Методику повторяли при 50°С±0,1 и при 70°С±0,1, полученные результаты показаны в таблице 4 и таблице 5 соответственно.
Полученные результаты свидетельствуют о том, что выбор растворителя определяет тип кристаллической формы, которую образует соединение формулы I.
Пример 4
Стабильность кристаллических форм А и В
Образцы соединения формулы I в кристаллической форме А, соединения формулы I в кристаллической форме В, смесь обоих кристаллических форм и аморфной формы соединения формулы I (полученной при распылительном высушивании) хранили в течение 4 недель при 80°С в различных условиях и анализировали методом РАПК. Результаты представлены ниже в таблице 6.
Полученные результаты свидетельствуют о том, что при хранении в течение 4 недель при 80°С кристаллическая форма B в твердом виде по крайней мере частично превращается в кристаллическую форму А. Аморфная форма может также превращаться в кристаллическую форму А. Такие результаты свидетельствуют о более высокой термодинамической стабильности кристаллической формы А по сравнению с кристаллической формой В.
Пример 5
Теплота исследуемых растворов
Теплоту растворов образцов кристаллических форм А и В соединения формулы I измеряли при 25°С в ацетоне. Результаты представлены ниже в таблице 7.
Полученные результаты свидетельствуют о более высоком значении эндотермической теплоты раствора кристаллической формы А по сравнению с кристаллической формой В. Такие результаты свидетельствуют о более высокой термодинамической стабильности кристаллической формы А по сравнению с кристаллической формой В.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИМОРФИЗМ ДОДЕКАГИДРОЦИКЛОПЕНТА [А] ФЕНАНТРЕНИЛОВОГО ЭФИРА ТИОФЕНКАРБОНОВОЙ КИСЛОТЫ | 2003 |
|
RU2330043C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2005 |
|
RU2387664C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНОНА И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2449991C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2001 |
|
RU2278856C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ А2В | 2005 |
|
RU2374242C2 |
| ПРОИЗВОДНЫЕ 5-ГИДРОКСИБЕНЗОТИАЗОЛА В КАЧЕСТВЕ АГОНИСТОВ β-АДРЕНОРЕЦЕПТОРОВ | 2005 |
|
RU2402540C2 |
| СОЕДИНЕНИЕ, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ СОЕДИНЕНИЯ | 2001 |
|
RU2277100C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛИДИНИЯ В КАЧЕСТВЕ МУСКАРИНОВЫХ РЕЦЕПТОРОВ М3 | 2005 |
|
RU2412183C2 |
| ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ | 2001 |
|
RU2292890C2 |
| ТРИАРИЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ ЛЕЧЕНИЯ И ПРОМЕЖУТОЧНЫЕ ВЕЩЕСТВА | 1997 |
|
RU2194035C2 |
Настоящее изобретение относится к кристаллической форме А соединения формулы I, способу ее получения и использованию в медицине. Форма А может быть получена кристаллизацией соединения формулы I из раствора в изопропаноле, этилацетате, н-бутаноле, гексане, гептане, трет-бутилметиловом эфире, толуоле или тетрагидрофуране и характеризуется температурой плавления 264°С при одновременном разложении при скорости нагревания 20°С/мин, по данным дифференциальной сканирующей калориметрии, и дифракционными полосами (2θ в угловых градусах ±0,2°): 3,6°, 7,3°, 13,4°, 14,6°, 18,3°, 22,0°, 25,8°, 25,9° и 29,5°, по данным рентгеноструктурного анализа
Технический результат - получение стабильной формы соединения формулы I с противовоспалительной активностью. 4 н. и 1 з.п. ф-лы, 7 табл., 2 ил.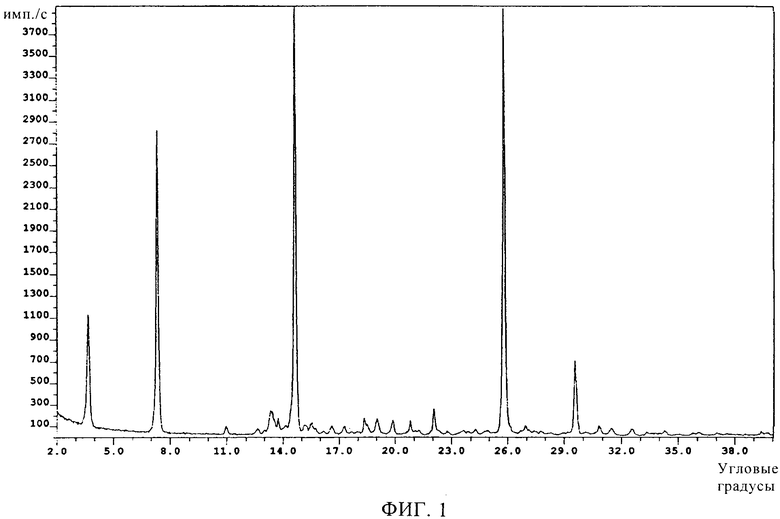
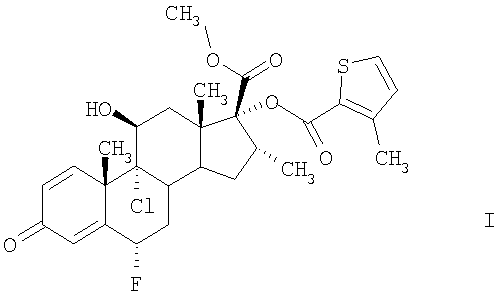
температура плавления которой по данным дифференциальной сканирующей калориметрии составляет приблизительно 264°С при одновременном разложении при скорости нагревания 20°С/мин и которая характеризуется следующей рентгеноструктурной дифракционной картиной с характерными дифракционными полосами (2θ в угловых градусах ±0,2°): 3,6°, 7,3°, 13,4°, 14,6°, 18,3°, 22,0°, 25,8°, 25,9° и 29,5°.
| 1,2,3,4,4А,4В,5,6,10,10А -ДЕКАГИДРО -6- ХЛОРАЦЕТОКСИМЕТИЛ -1,4А-ДИМЕТИЛ -7- (1-МЕТИЛЭТИЛ) -1- ФЕНАНТРЕНКАРБОНОВАЯ КИСЛОТА ИЛИ ЕЕ СОЛИ | 1975 |
|
SU550939A1 |
| Способ контроля разности фаз квазикогерентных сигналов | 1966 |
|
SU200679A1 |
| HALEBLIAN JOHN et all, Journal of pharmaceutical association, 1969, 58, 8, 911-929. | |||
Авторы
Даты
2009-03-10—Публикация
2003-07-28—Подача