Изобретение относится к молекулярной биологии, генетической инженерии, медицине и предназначено для экспресс-диагностики ВИЧ-1 любого типа в биологической пробе. Предлагаемый тест-набор и способ с его использованием позволяет количественно определять непосредственно геном вируса ВИЧ-1 и основан на проведении одноэтапной полимеразной цепной реакции (ПЦР) в реальном времени с использованием олигонуклеотидных праймеров -5'-'GCTTGCCTTGAGTGCTT-3' и 5'-CGCCACTGCTAGAGATTT-3', комплементарных консервативному участку 5'-LTR- области генома ВИЧ-1, детекции полученных ампликонов с использованием меченных гибридизационных зондов - I и II - олигонуклеотидов с последовательностями 5'-6-FAM-AGTACTCTGTCCGCGTCTGTTGTA-BHQ1-3' и 5'-TAMRA-AGTACTCTGTCCGCGTCTGTTGTA-ВHQ2-3', при этом анализ проводят с помощью измерения флуоресценции пробы в реальном времени в формате «закрытая пробирка». Для расчета количества РНК ВИЧ-1 в анализируемом образце используют калибровочные кривые для определения кДНК ВИЧ-1 и определения мутированной кДНК ВИЧ-1, полученные с помощью ДНК плазмиды pVar15-HIV-LTR, несущей клонированный фрагмент генома ВИЧ-1 из консервативного участка 5'-LTR - последовательности, имеющий нуклеотидную последовательность
5'-CGCGGATCCCTCAATAAAGCTTGCCTTGAGTGCTTTAAGTAGTGTGTGCCCGTCTGTTGTATGACTCTGGTAACTAGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTCTAGCAGTGGCGCCCGAATTCCGG-3', далее - SEQ ID NO:1,
и с помощью ДНК плазмиды pBluSK-HIV-LTR mod, использующейся для построения калибровочной кривой для определения количества внутреннего стандарта, несущей клонированный модифицированный фрагмент генома ВИЧ-1 из консервативного участка 5'-LTR-последовательности, имеющий нуклеотидную последовательность
5'-ATGCTCAATAAAGCTTGCCTTGAGTGCTTTAAGTACTCTGTCCGCGTCTCTTGTATGACTCTGGTAACTAGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTCTAGCAGTGGCGCCC-3', далее - SEQ ID NO:2. В качестве внутреннего РНК-стандарта используют РНК-модифицированный фрагмент консервативного участка 5'-LTR-области генома ВИЧ-1, имеющий нуклеотидную последовательность
5'-AUGCUCAAUAAAGCUUGCCUUGAGUGCUUUAAGUACUCUGUCCGCGUCUCUUGUAUGACUCUGGUAACUAGAGAUCCCUCAGACCACUCUAGACGGUGUAAAAAAUCUCUAGCAGUGGCGCCC-3', далее - SEQ ID NO:3.
Использование предложенного набора и способа позволяет осуществить специфическое определение наличия ВИЧ-1 в пробе независимо от типа вируса, сочетания типов и присутствия родственных видов, не прибегая к использованию дополнительных методов постамплификационного анализа, что сокращает время и стоимость тестирования. При этом тестирование проводится в режиме «закрытая пробирка», тем самым значительно снижая риск возможных ложно-положительных результатов анализа.
Наиболее часто применяемая в настоящее время диагностика ВИЧ основана на обнаружении серологического ответа на вирус. Используются различные типы иммуноферментного метода (ELISA) [1, 2], основанные на детекции антител к вирусным белкам с последующим подтверждением диагноза с помощью иммунного блоттинга. Тест ELISA относительно дешев, очень чувствителен и прост в использовании. С его помощью можно сканировать большое число образцов крови. Однако имеются данные о наличии группы инфицированных людей, которые на протяжении 2-36 месяцев остаются серонегативными. Для выявления этой категории больных необходим иной способ детекции вируса. Наиболее рационально определять непосредственно сам геном вируса.
В настоящее время существует несколько методов, позволяющих определять РНК или полученную из нее кДНК ВИЧ-1.
Один из них метод Quantiplex HIV-1 RNA (Chiron Diagnostics, Norwood, MA) использует разветвленную ДНК (bДНК) и позволяет количественно определять содержание РНК ВИЧ-1 в плазме крови за счет амплификации сигнала, а не нуклеиновой кислоты, являющейся мишенью [3]. Метод, основанный на bДНК, не требует очистки вирусной РНК или ее амплификации с помощью ПЦР. Вирусные частицы концентрируют центрифугированием и далее разрушают детергентом и протеиназой К, что приводит к высвобождению вирусной РНК. Полученный лизат далее инкубируют с двумя наборами олигонуклеотидов. Первый набор олигонуклеотидов необходим для иммобилизации вирусной РНК за счет гибридизации с консервативными районами гена pol ВИЧ-1 и с олигонуклеотидами, которые связаны с лунками планшетов для микротитрования. Второй набор олигонуклеотидов обеспечивает амплификацию сигнала. Этот набор состоит из четырех компонентов: (а) олигонуклеотиды, обладающие гомологией с РНК мишени и с "предамплификационными" олигонуклеотидами; (б) предамплификационные олигонуклеотиды; (в) амплификационные олигонуклеотиды; и (г) олигонуклеотидные зонды, связанные с щелочной фосфатазой. Каждый из этих компонентов связывается в результате гибридизации с последующим в нескольких участках. Таким способом сигнал подвергается амплификации без копирования РНК-мишени. Детекция проводится с помощью метода хемилюминесценции с субстратом, специфическим для щелочной фосфатазы. Количество испускаемого света прямо пропорционально количеству связавшейся нуклеиновой кислоты. Абсолютное содержание ВИЧ-1 РНК определяется с помощью стандартной кривой (используется внешний стандарт), которая строится на основании данных, полученных на том же планшете.
Недостатки определения с помощью метода bДНК заключаются в отсутствии внутреннего количественного стандарта для каждого образца и в потребности относительно больших объемов образца (по крайней мере, 1 мл плазмы крови), что может создавать проблемы при ограниченном объеме образца, например, при анализе материала от маленьких детей.
Фирмой Organon Teknika [4] разработан количественный тест, основанный на использовании методики NASBA [5]. Эта технология позволяет осуществить избирательную и прямую амплификацию РНК ВИЧ-1 без применения ПЦР. Прежде всего, с помощью праймеров, один из которых, комплементарен вирусной РНК в районе гена gag и содержит в своем составе промотор РНК-полимеразы фага Т7, согласно способу, из вирусной РНК синтезируется кДНК, затем проводят транскрипцию РНК с полученной кДНК с синтезом 106-109 ее копий. Количество нуклеиновой кислоты определяется ферментативным или хемилюминесцентным методами, которые характеризуется очень высокой чувствительностью и широким динамическим диапазоном. Количественное определение вирусной нагрузки ВИЧ-1 достигается при использовании совместной амплификации трех внутренних количественных стандартов РНК.
Преимущества количественного определения ВИЧ-1 с помощью этого метода заключаются в том, что требуется относительно небольшой объем плазмы (обычно используется 0,1 мл). Динамический диапазон метода является очень большим (80-1000000 копий РНК/мл).
Основным недостатком этого теста является сложная система внутренних количественных стандартов, необходимость использования дорогостоящей приборной базы.
Метод AMPLICOR HIV-1 MONITOR, разработанный Roche Diagnostics Corporation [6, прототип] является пока единственным утвержденный FDA тестом для количественного определения РНК ВИЧ-1 [7]. Он основан на обратной транскрипции РНК ВИЧ-1 (мишени) и амплификации полученной кДНК в присутствии биотинилированных олигонуклеотидных праймеров, специфичных в отношении консервативного района ВИЧ-1 gag. Полученные ампликоны денатурируются и гибридизуются с олигонуклеотидами, иммобилизованными на поверхность лунок планшета для микротитрования. Затем добавляют конъюгат авидина с пероксидазой хрена, который связывается с ампликонами, мечеными биотином. Количество связанных ампликонов определяется путем калометрирования продуктов ферментативной реакции. Тест использует внутренний количественный стандарт с известной концентрацией, который перед экстракцией добавляется к каждому образцу. Количественный стандарт состоит из РНК, транскрибированной in vitro и идентичной по размеру ампликону-мишени.
Несмотря на заявленную чувствительность 96% и специфичность 100%, тестирование показало, что эта система позволяет детектировать 87% изолятов подвида А, 67% изолятов подвида В, 66% изолятов повида Е, 88% изолятов подвида F. Более того, реальный показатель чувствительности метода при тестировании клинических образцов оказался 51%. Это связано с выбором недостаточно консервативного фрагмента генома вируса ВИЧ-1.
Недостатком прототипа является также проведение теста в формате «открытой пробирки». Для выявления генома вируса и его количественной оценки полученные ампликоны переносятся в открытые планшеты. При этом происходит загрязнение помещений и возникновение случаев ложно-положительных результатов анализа.
Технической задачей изобретения является создание набора для одностадийной количественной экспресс-идентификации ВИЧ-1 любого типа в биологической пробе с помощью ПЦР-анализа в реальном времени без проведения постамплификационного анализа в формате "закрытая пробирка", что позволит резко снизить возможность появления ложно-положительных результатов анализа.
Для решения поставленной задачи была использована методология, основанная на использовании 5'-экзонуклеазной активности Taq-полимеразы при наращивании олигонуклеотидной цепи [8]. Гибридизационный зонд содержит флуоресцентую метку в 5'-положении и тушитель флуоресценции в 3'-положении олигонуклеотида. В ходе ПЦР происходит связывание зонда с комплементарной цепью ДНК. При наращивании цепи Taq-полимераза расщепляет зонд, что приводит к увеличению уровня флюоресценции. Это позволяет выявить вирусный материал непосредственно во время амплификации, не прибегая к использованию дополнительных стадий постамплификационного анализа, что значительно упрощает проведение теста и исключает возможность появления ложно-положительных результатов анализа из-за загрязнения помещений ампликонами предыдущих тестов.
Для количественной оценки содержания РНК ВИЧ-1 используется внутренний стандарт, представляющий собой РНК модифицированного участка LTR вируса и предназначенного для контроля проведения реакций обратной транскрипции (ОТ) и ПЦР, а также для расчета точной концентрации вируса в исходном образце.
Для создания тест-набора и способа специфической универсальной ПЦР-детекции ВИЧ-1 в биологической пробе был проведен компьютерный анализ геномов всех известных изолятов ВИЧ-1. В результате был идентифицирован консервативный участок в 5'-LTR области генома протяженностью около 200 нуклеотидов. Использование этого района для диагностики позволяет осуществить специфическое определение в пробе наличия ВИЧ независимо от типа (О или М), сочетания типов и присутствия родственных видов.
Тест-набор для количественной экспресс-идентификации генома ВИЧ-1 любого типа в пробе содержит следующие компоненты:
1. Сконструированный амплификационный праймер к консервативному участку 5'-LTR-области генома ВИЧ-1 (533-549 HIVHXB2, GenBank, образец КО3455) из 17 нуклеотидов
5'-GCTTGCCTTGAGTGCTT-3'.
2. Сконструированный амплификационный праймер к консервативному участку 5'-LTR-области генома ВИЧ-1 (623-640) из 18 нуклеотидов 5'-CGCCACTGCTAGAGATTT-3'.
3. Сконструированный гибридизационный зонд I, комплементарный участку генома ВИЧ-1 (552-575), расположенному между праймерами, и имеющий на 5'-конце флуоресцентную метку в виде флуоресцеина FAM, а на 3'-конце тушитель флюоресценции - неизлучающее соединение BHQ1:
5'-FAM-AGTAGTGTGTGCCCGTCTGTTGTA-BHQ1-3'.
4. Сконструированный гибридизационный зонд II для определения внутреннего стандарта, содержащий на 5'-конце флуоресцентный краситель TAMRA и на 3'-конце - тушитель флуоресценции BHQ2:
5'-TAMRA-AGTACTCTGTCCGCGTCTGTTGTA-BHQ2-3'.
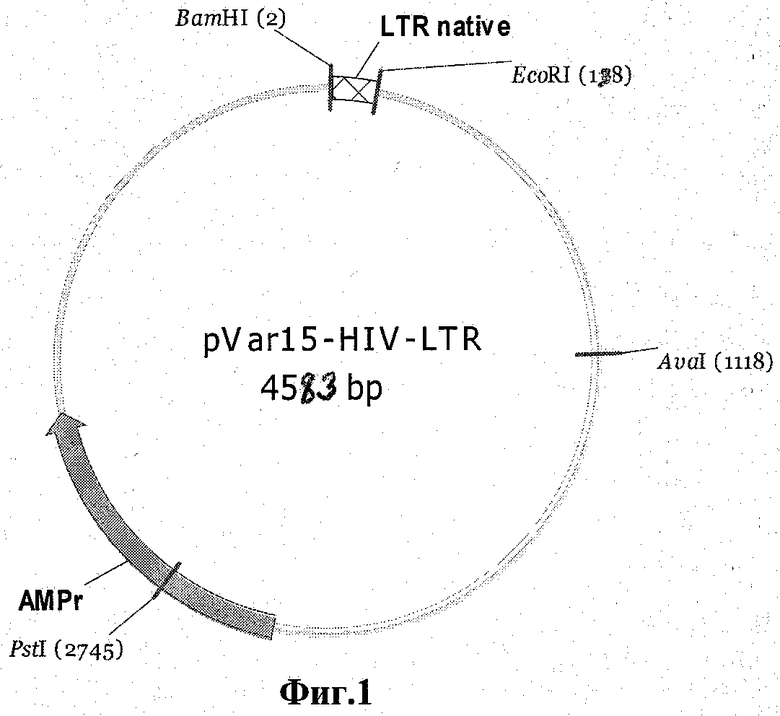
5. Клонированный фрагмент генома вируса ВИЧ-1, содержащий консервативный участок левого 5'-LTR, для определения специфичности гибридизационного зонда I к целевой последовательности генома ВИЧ-1 и построения калибровочной кривой в виде рекомбинантной плазмидной ДНК pVar15-HIV-LTR размером 4583 п.н. и молекулярной массой 3 Мда, содержащей:
- к-ДНК-фрагмент консервативного участка 5'-LTR размером 138 п.н., имеющий нуклеотидную последовательность SEQ ID NO:1, фланкированный сайтами узнавания эндонуклеаз рестрикции BamHI и EcoRI;
- BamHI-EcoRI фрагмент векторной плазмиды pVar15 [9] размером 4445 п.н.,
- генетический маркер: ген β-лактамазы (Ampr), определяющий устойчивость к ампициллину;
- уникальные сайты рестрикции: BamHI (2) и EcoRI (128) (см. фиг.1).
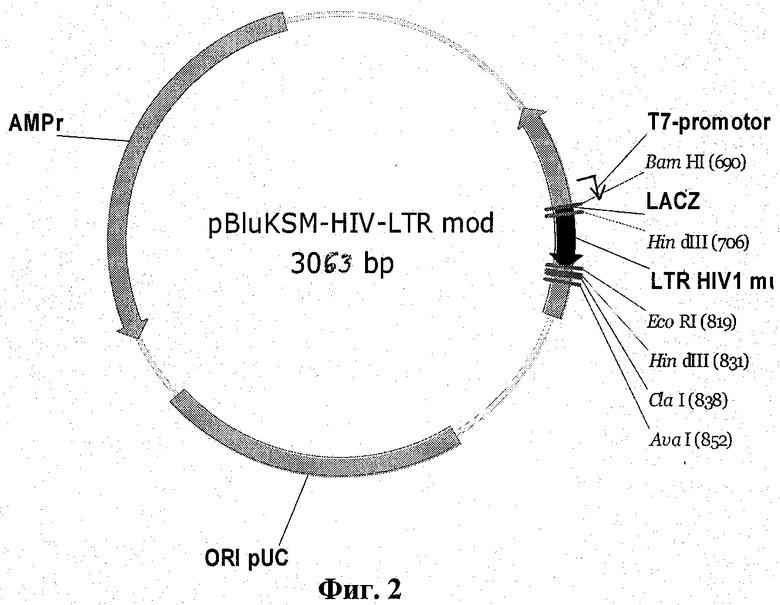
6. Клонированный фрагмент генома вируса ВИЧ-1, содержащий модифицированный консервативный участок 5'-LTR (введен стартовый кодон и пять нуклеотидных замен, предотвращающих преждевременную терминацию РНК-полимеразы), для определения специфичности гибридизационного зонда II к последовательности кДНК РНК-контроля и построения калибровочной кривой в виде рекомбинантной плазмидной ДНК pBluKSM-HIV-LTR mod размером 3063 п.н. и молекулярной массой 2 Мда, содержащей:
- кДНК - модифицированный фрагмент консервативного участка 5'-LTR размером 123 п.н., имеющий транскрибируемую нуклеотидную последовательность SEQ ID NO:2, фланкированную сайтами узнавания эндонуклеаз рестрикции BamHI и EcoRI, и находящуюся под контролем промотора Т7;
- BamHI-EcoRI фрагмент векторной плазмиды pBluKSM (pBluescript KS(-) фирмы Stratagene) размером 2940 п.н., включающий следующие функциональные районы: ген альфа-пептида бета-лактамазы (lacZ') - 460-816; сайт инициации промотора Т7-полимеразы - 643; ген устойчивости к ампициллину (bla) - 1976-2833;
- уникальные сайты рестрикции: BamHI (690) и EcoRI (819), по которым фрагмент может быть извлечен без потерь (см. фиг.2).
7. РНК - модифицированный фрагмент консервативного участка 5'-LTR размером 123 п.н. (внутренний РНК-стандарт), имеющий нуклеотидную последовательность SEQ ID NO:3.
Гибридизационные зонды I и II сконструированы таким образом, что они выявляют только свои целевые последовательности. Гибридизационный зонд I выявляет кДНК вируса ВИЧ-1, но не выявляет кДНК внутреннего стандарта. Гибридизационный зонд II выявляет кДНК внутреннего стандарта вируса ВИЧ-1, но не выявляет кДНК вируса ВИЧ-1. Такие свойства гибридизационных зондов, наряду с известной исходной концентрацией внутреннего РНК-стандарта, позволяют рассчитать концентрацию вируса ВИЧ-1 в тестируемом образце.
Процедура количественного определения содержания РНК ВИЧ-1 в клиническом образце включает:
1. Выделение суммарной РНК.
2. Получение кДНК из РНК ВИЧ-1 с помощью специфических праймеров. Для оценки степени превращения исходной РНК ВИЧ-1 в клинический образец на этой стадии добавляют известное количество (500 копий) мутированной РНК ВИЧ-1 состава 5'-ATGCTCAATAAAGCTTGCCTTGAGTGCTTTAAGTACTCTGTCCGCGTCTCTTGTATGACTCTGGTAACTAGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTCTAGCAGTGGCGCCC-3'.
На этой стадии происходит синтез кДНК как из РНК ВИЧ-1, так и из мутированной РНК ВИЧ-1.
3. Построение калибровочных кривых для определения количества кДНК ВИЧ-1 (калибровочная кривая 1) и определения количества мутированной кДНК ВИЧ-1 (калибровочная кривая 2).
Для построения первой калибровочной кривой используют гибридизационный зонд I и серию последовательных разведений плазмиды pVar15-HIV-LTR.
Для построения второй калибровочной кривой используют гибридизационный зонд II и серию последовательных разведений плазмиды pBluSK-HIV-LTR mod.
4. Расчет содержания в образце кДНК ВИЧ-1 и мутированной кДНК ВИЧ-1 на основании калибровочных кривых.
5. Пересчет содержания РНК ВИЧ-1 в клиническом образце с учетом неколичественного образования кДНК по формуле:
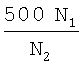
где N1 - рассчитанное из калибровочной кривой 1 количество кДНК ВИЧ-1,
где N2 - рассчитанное из калибровочной кривой 2 количество мутированной кДНК ВИЧ-1.
Основными преимуществами заявляемого метода являются:
- высокая надежность, основанная на анализе высококонсервативного участка генома ВИЧ-1;
- быстрота проведения анализа, поскольку используется формат ПЦР в режиме реального времени, не требующий дополнительных постамплификационных операций анализа;
- проведение анализа в формате «закрытой пробирки», что значительно уменьшает риск контаминации и технологических ошибок.
Изобретение иллюстрируется следующими графическими материалами.
Фиг.1. Схема плазмиды pVar15-HIV-LTR.
Фиг.2. Схема плазмиды pBluKSM-HIV-LTR mod.
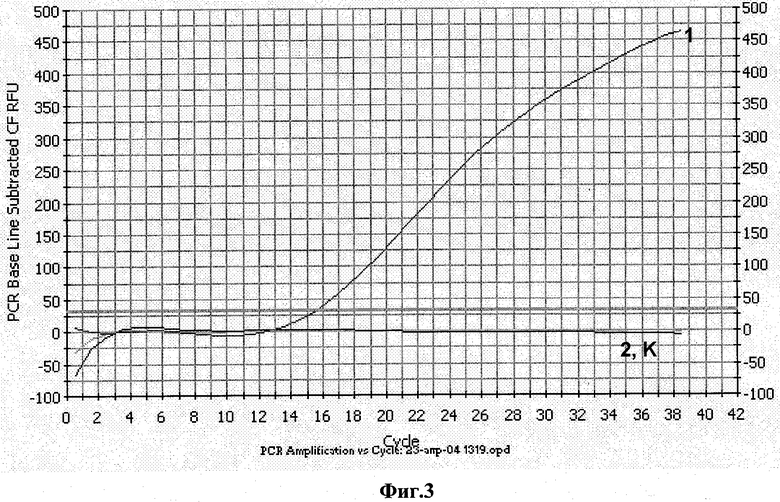
Фиг.3 Определение специфичности гибридизационного зонда I.
1 - плазмида pVar15-HIV-LTR;
2 - Контрольная плазмида pBluSK-HIV-LTR mod с заменами;
К - контроль амплификации без матрицы.
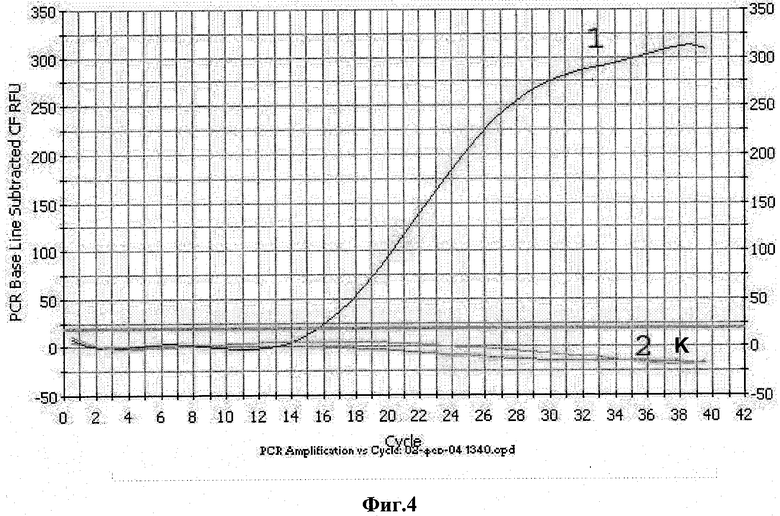
Фиг.4. Определение специфичности гибридизационного зонда II.
1 - Контрольная плазмида pBluSK-HIV-LTR mod;
2 - плазмида pVar15-HIV-LTR;
К - контроль амплификации без матрицы.
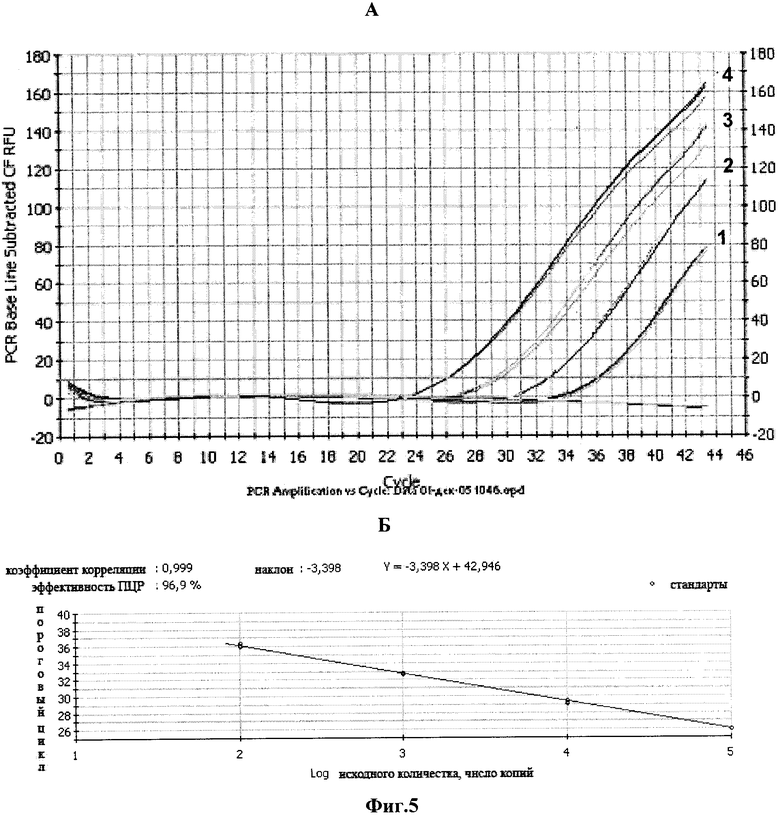
Фиг.5. Построение калибровочной кривой для определения количества вирусной кДНК
А. Амплификация с различным количеством матрицы. Плазмида pVar15-HIV-LTR (копий/реакцию), где: 1 - 102; 2 - 103; 3 - 104; 4 - 105.
Б. Калибровочная кривая зависимости порогового цикла амплификации от количества ДНК pVar15-HIV-LTR.
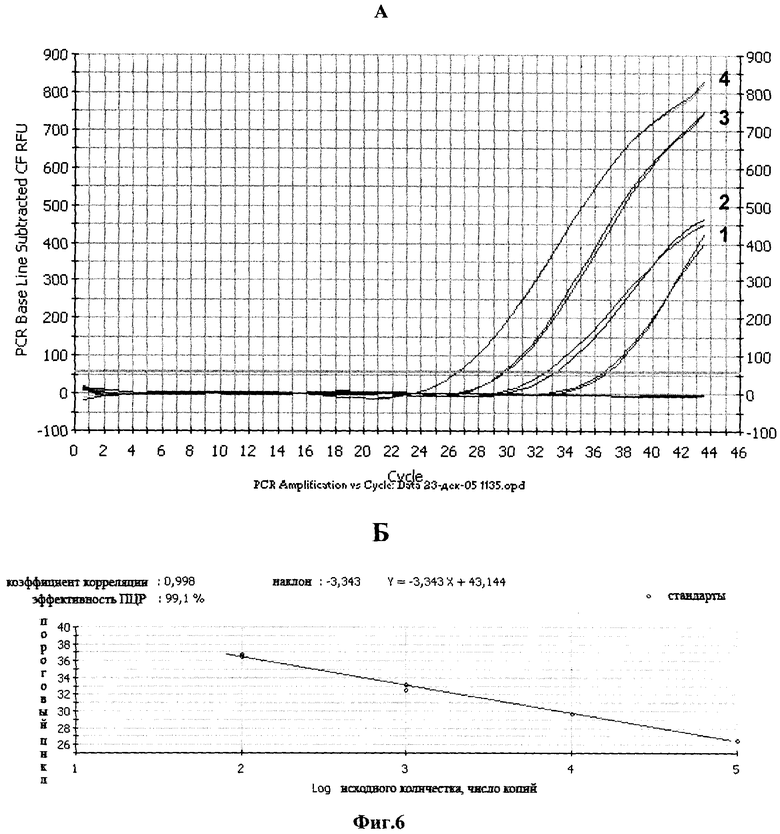
Фиг.6. Построение калибровочной кривой для определения количества мутированной pVar15-HIV-LTR.
А. Амплификация с различным количеством матрицы. Плазмида pBluSK-HIV-LTR mod (копий/реакцию), где: 1 - 102; 2 -103; 3 - 104; 4 - 105.
Б. Калибровочная кривая зависимости порогового цикла амплификации от количества ДНК pBluSK-HIV-LTR mod.
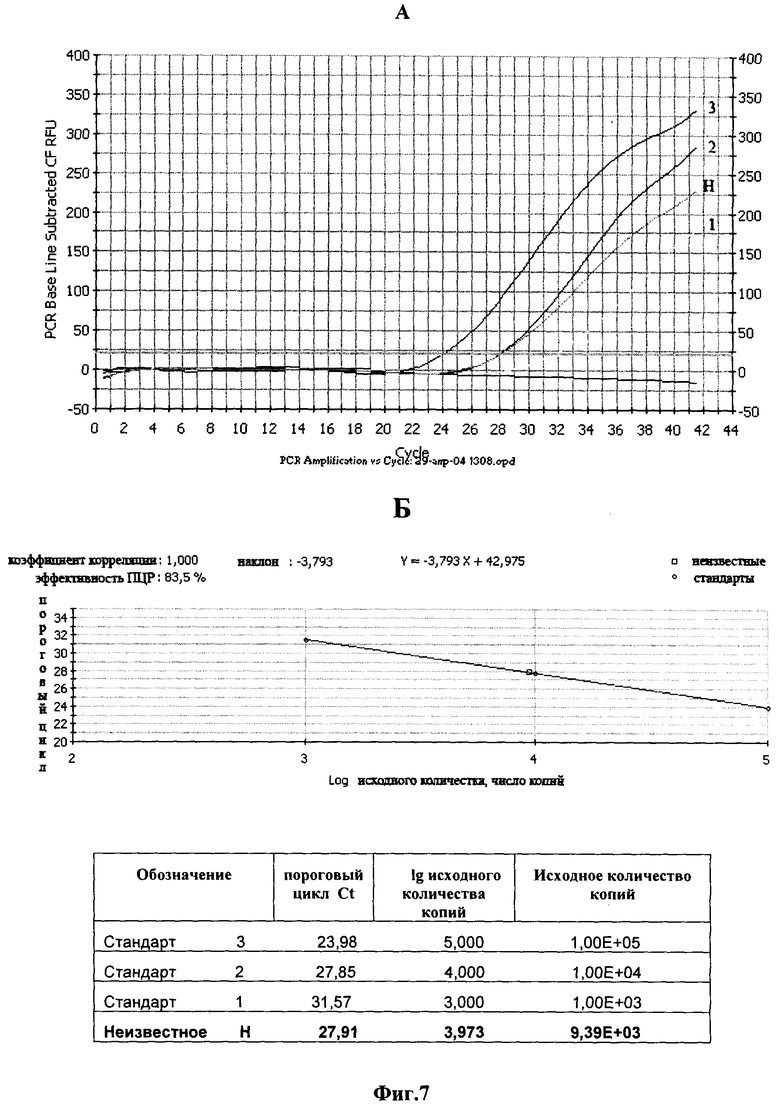
Фиг.7. Определение содержания вирусной кДНК.
А. Амплификация с различным количеством стандарта. Плазмида pBluSK-HIV-LTR mod (копий/реакцию), где: 1 - 103; 2 - 104; 3 - 105; H - кривая амплификации вирусной кДНК анализируемого образца.
Б. Расчет количества содержания вирусной кДНК.
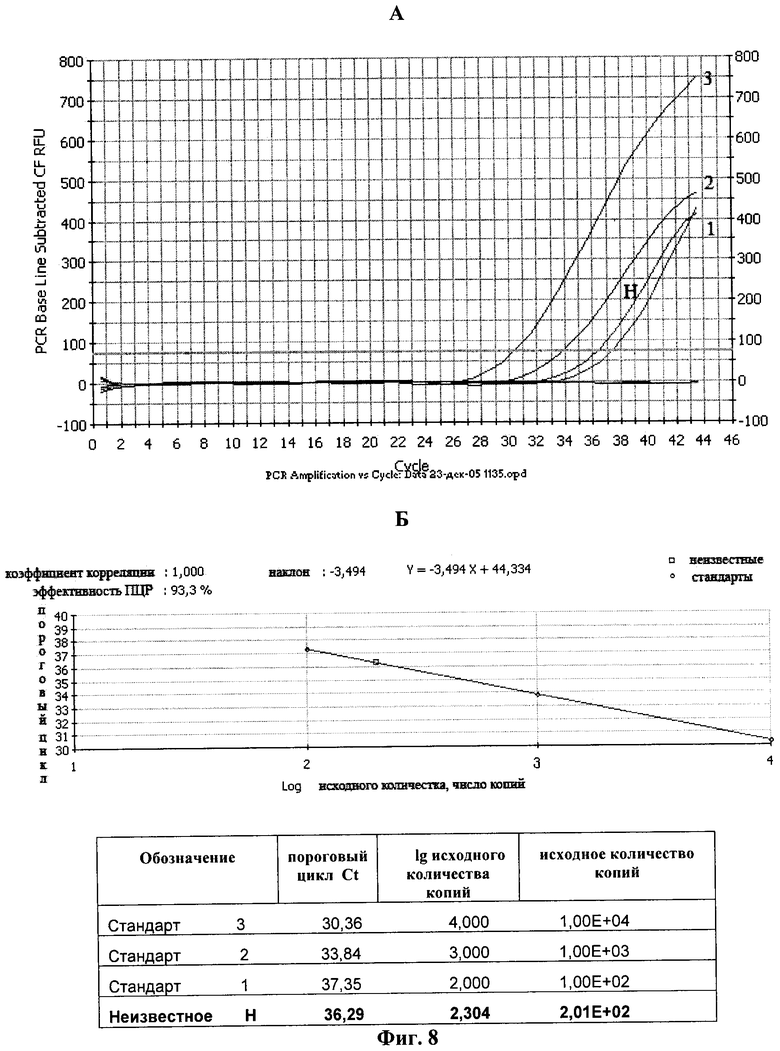
Фиг.8. Определение содержания мутированной вирусной кДНК.
А. Амплификация с различным количеством стандарта. Плазмида pBluSK-HIV-LTR mod (копий/реакцию), где: 1 - 103; 2 - 104; 3 - 105; H - кривая амплификации мутированной вирусной кДНК анализируемого образца.
Б. Расчет количества содержания мутированной вирусной кДНК.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Получение плазмиды pVar15-HIV-LTR.
При конструировании плазмиды pVar15-HIV-LTR для проведения амплификации используют синтетические олигонуклеотиды следующего состава:
5'-CCGGAATTCGGGCGCCACTGCTAGAGATTTTTTACAC-3'
5'-CGCGGATCCCTCAATAAAGCTTGCCTTGAGTGCTTTAAGT-3'
5'-TTGAGTGCTTTAAGTAGTGTGTGCCCGTCTGTTGTATGAC-3'
5'-CGTCTGTTGTATGACTCTGGTAACTAGAGATCCCTCAGAC-3'
5'-AGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTC-3'
5'-CCGGAATTCGGGCGCCACTGCTAGAGATTTTTTACAC-3'
Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, по 40 рМ каждого из олигонуклеотидов, по 1 ед. Taq и Vent ДНК-полимераз, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2.
Условия проведения ПЦР следующие: денатурация - 95°С - 600 сек, отжиг - 58°С - 60 сек, далее 35-39 циклов по схеме: денатурация - 93°С - 45 сек, отжиг 55°С - 60 сек, элонгация при 72°С - 10 сек. Всего проводят 25 циклов амплификации.
После проведения амплификации выделяют полученные ДНК-дуплексы, затем их обрабатывают последовательно Ват HI и Eco RI эндонуклеазами рестрикции, отделяют низкомолекулярные фрагменты и клонируют в плазмиде pVar15 [9] по полученным липким концам. Лигазной смесью трансформируют компетентные клетки E.Coli XL-Blue. Последние высевают на агаризованную среду, селективную по ампициллину. Полученные колонии анализируют с использованием ПЦР и рестриктного анализа с помощью рестриктазы HindIII. ДНК клонов, имеющих теоретические картины рестриктного и ПЦР-анализа, секвенируют. Проведенное секвенирование показало полное соответствие полученного клонированного фрагмента теоретической последовательности левого LTR ВИЧ-1. Схема плазмиды pVar15-HIV-LTR приведена на фиг 1.
Пример 2. Получение плазмиды pBluSK-HIV-LTR mod.
При конструировании плазмиды pBluSK-HIV-LTR mod для проведения амплификации используют синтетические олигонуклеотиды следующего состава:
5'-TTGAGTGCTTTAAGTACTCTGTCCGCGTCTCTTGTATGAC-3'
5'-CGCGGATCCATGCTCAATAAAGCTTGCCTTGAGTGCTTTAAGT-3'
5'-TTGAGTGCTTTAAGTAGTGTGTGCCCGTCTGTTGTATGAC-3'
5'-CGTCTGTTGTATGACTCTGGTAACTAGAGATCCCTCAGAC-3'
5'-AGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTC-3'
5'-CCGGAATTCGGGCGCCACTGCTAGAGATTTTTTACAC-3'
Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, по 40 рМ каждого из олигонуклеотидов, по 1 ед. Taq и Vent ДНК-полимераз, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2.
Условия проведения ПЦР следующие: денатурация - 95°С - 600 сек, отжиг - 58°С - 60 сек, далее 35-39 циклов по схеме: денатурация - 93°С - 45 сек, отжиг 55°С - 60 сек, элонгация при 72°С - 10 сек. Всего проводят 25 циклов амплификации. После проведения амплификации выделяют полученные ДНК-дуплексы, затем их обрабатывают последовательно Bam HI и Eco RI эндонуклеазами рестрикции, отделяют низкомолекулярные фрагменты и клонируют в pBluscriptKSM по полученным липким концам. Лигазной смесью трансформирут компетентные клетки E.coli XL-Blue. Последние высевают на агаризованную среду, селективную по ампициллину. Полученные колонии анализируют с использованием ПЦР и рестриктного анализа с помощью рестриктазы HindIII. ДНК клонов, имеющих теоретические картины рестриктного и ПНР-анализа, секвенировали. Проведенное секвенирование показало полное соответствие полученного клонированного фрагмента конструируемой последовательности левого LTR ВИЧ-1. Схема плазмиды pBluKSM-HIV-LTR mod приведена на фиг 2.
Пример 3. Получение мутированной РНК ВИЧ-1.
10 пкг ДНК pBluSK-HIV-LTR mod гидролизуют с помощью эндонуклеазы рестрикции Eco RI. Полученную линейную форму плазмиды используют для получения мутированной РНК ВИЧ-1 с помощью Т7 РНК-полимеразы.
Транскрипцию проводят в 20 мкл реакционной смеси, содержащей 0,4 mM rNTP, 10 0,4 mM DTT, 3 ед. Т7 РНК-полимеразы в буфере, содержащем 2 mM спермидин, 16 mM MgCl2, 0,2 М трис (рН 8,1) в течение 2 часов при 37°С. Затем полученную РНК очищают фенол-хлороформной экстракцией и осаждают 0,3 М ацетатом натрия при рН 5.2 2,5 объемами абсолютного этанола при -70°С. Дополнительно РНК очищают хроматографией на TSK-геле. Точное количество полученной РНК определяют спектрофотометрически.
Пример 4. Определение специфичности гибридизационного зонда I.
Определение специфичности гибридизационного зонда I к целевой последовательности генома ВИЧ-1 проводят с помощью клонированного фрагмента вируса, содержащего консервативный участок 5'-LTR (ДНК плазмиды pVar15-HIV-LTR), имеющего нуклеотидную последовательность SEQ ID NO:1.
Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, 600 nM, праймеры I и II, 300 nM гибридизационный зонд I, 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2. Содержание матрицы для амплификации варьируется в интервале 0,1-100 пкг.
Условия проведения ПЦР следующие: денатурация - 95°С - 600 сек, отжиг - 58°С - 60 сек, далее 35-39 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят при температуре отжига. Результаты амплификации приведены на фиг.3
В аналогичных условиях проводят амплификацию ДНК pBluSK-HIV-LTR mod, содержащую последовательность ДНК (0,1-100 пкг), соответствующую последовательности РНК-контроля. В условиях ПЦР не происходит амплификация pBluSK-HIV-LTR mod (фиг.3).
Аналогичным образом не происходит накопления флуоресцетного сигнала при проведении ПЦР в отсутствии ДНК.
Таким образом, гибридизационный зонд I является селективным для выявления целевой последовательности консервативного района генома ВИЧ-1.
Пример 5. Определение специфичности гибридизационного зонда II.
Определение специфичности гибридизационного зонда II к последовательности кДНК РНК-контроля проводят с помощью клонированного фрагмента, содержащегося в плазмиде pBluSK-HIV-LTR mod и имеющего состав SEQ ID NO:2.
Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, 600 nM, праймеры I и II, 300 nM гибридизационный зонд II, 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2. Содержание матрицы для амплификации варьируется в интервале 0,1-100 пкг.
Условия проведения ПЦР следующие: денатурация - 95°С - 600 сек, отжиг - 58°С - 60 сек, далее 35-39 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят при температуре отжига. Результаты амплификации приведены на фиг.4
В аналогичных условиях проводят амплификацию ДНК (0,1-100 пкг) pVar15-HIV-LTR, содержащую последовательность клонированного 5'-LTR-фрагмента вируса. В условиях ПЦР не происходит амплификация pVar15-HIV-LTR (фиг.4).
Аналогичным образом не происходит накопления флуоресцетного сигнала при проведении ПЦР в отсутствии ДНК.
Таким образом, гибридизационный зонд II является селективным для выявления кДНК РНК-контроля.
Пример 6. Выделение образца для анализа.
Выделение РНК.
В находящуюся в ледяной бане пробирку вместимостью 1,5 мл вносят 200 мкл раствора гуанидинтиоцианата и 4 мкл РНК-носителя. Затем к раствору добавляют 200 мкл исследуемого материала, встряхивают пробирку на "Вортексе" в течение 10-15 сек и оставляют на холоде 10 мин. Затем вносят 200 мкл смеси фенол-хлороформ (рН 4,3)-изоамиловый спирт (v/v 25:25:1) и встряхивают в течение 1 мин. Для образования плотной интерфазы пробирки замораживают в жидком азоте. После размораживания образец центрифугируют 5 мин при 10-12 тыс. об/мин, отбирают верхнюю водную фазу и добавляют 1/10 часть 2М ацетата натрия (рН 4,5), равный объем изоприлового спирта, перемешивают и оставляют в морозильнике на ночь. РНК осаждают центрифугированием в течение 5 мин при 10-12 тыс. об/мин. Супернатант удаляют пипеткой, к осадку добавляют 600 мкл 75%-ного этилового спирта (предварительно охлажденного в морозильной камере), вновь центрифугируют, супернатант удаляют, осадок РНК высушивают в вакууме и растворяют в 20-30 мкл ДЕПК-обработанной воды. Получение кДНК.
К 15 мкл раствора образца РНК добавляют 0,5 мкг обратного праймера, прогревают 5 мин при 70°С и помещают в ледяную баню, выдерживают 5 мин. Осаждают капли, добавляют компоненты реакционной смеси - 5 мкл 5xM-MLV буфера (250 mM Tris-HCl, 375 mM KCl, 15 mM MgCl2, 50 mM DTT), 1,25 мкл 10 mM dNTP, 25 ед. ингибитора рибонуклеаз, 200 ед. M-MLV RT и воды до объема 25 мкл, выдерживают 90 мин при 42°С.
Для количественного определения содержания РНК ВИЧ-1 в анализируемой пробе на стадии получения кДНК в реакционную смесь добавляют 500 копий мутированной РНК ВИЧ-1 состава
5'-ATGCTCAATAAAGCTTGCCTTGAGTGCTTTAAGTACTCTGTCCGCGTCTCTTGTATGACTCTGGTAACTAGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTCTAGCAGTGGCGCCC-3'.
Пример 7. Построение калибровочной кривой для определения количества кДНК ВИЧ-1.
Для построения калибровочной кривой используют гибридизационный зонд I и серию последовательных разведений плазмиды pVar15-HIV-LTR от 102 до 105 копий. Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, 600 nM праймеры I и II, 300 nM гибридизационный зонд I, 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2, 102-105 копий контрольной плазмиды pVar15-HIV-LTR.
Условия проведения ПЦР: денатурация - 95°С - 10 мин, отжиг - 58°С - 60 сек, далее 40 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят на стадии отжига. Результаты амплификации приведены на фиг.5.
Калибровочная кривая в координатах С(Т) - log P строится автоматически программой прибора iCycler.
СT - значение порогового цикла, определяющее точку, в которой уровень флуоресценции превышает 10-кратное стандартное отклонение, детектируемое на первых циклах амплификации; Р - концентрация ДНК стандарта.
Пример 8. Построение калибровочной кривой для определения количества мутированной кДНК ВИЧ-1.
Для построения калибровочной кривой используют гибридизационный зонд II и серию последовательных разведений плазмиды pBluSK-HIV-LTR mod от 102 до 105 копий.
Амплификацию проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, 600 nM праймеры I и II, 300 nM гибридизационный зонд II, 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2 102-105 копий контрольной плазмиды pBluSK-HIV-LTR mod.
Условия проведения ПЦР: денатурация - 95°С - 10 мин, отжиг - 58°С - 60 сек, далее 40 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят на стадии отжига. Результаты амплификации приведены на фиг.6.
Калибровочная кривая в координатах С(Т) - log P строится автоматически программой прибора iCycler.
СT - значение порогового цикла, определяющее точку, в которой уровень флуоресценции превышает 10-кратное стандартное отклонение, детектируемое на первых циклах амплификации; Р - концентрация ДНК стандарта.
Пример 9. Количественный анализ содержания вирусной кДНК.
Определение количества вирусной кДНК анализируют с помощью флуоресцентных зондов I и II.
При определении количественного содержания вирусной кДНК каждый раз проводится построение калибровочных кривых определения как кДНК ВИЧ-1, так и мутированной кДНК ВИЧ-1. Это позволяет избежать ошибок, связанных с изменением активности ферментов, разным составом примесей из разных образцов крови. Кроме того, добавленное расчетное количество мутированной РНК ВИЧ-1 (500 копий) состава: 5'-ATGCTCAATAAAGCTTGCCTTGAGTGCTTTAAGTACTCTGTCCGCGTCTCTTGTATGACTCTGGTAACTAGAGATCCCTCAGACCACTCTAGACGGTGTAAAAAATCTCTAGCAGTGGCGCCC-3' в анализируемый образец крови на стадии выделения позволяет учесть потери вирусного генома на этих стадиях.
Амплификацию при построении калибровочных кривых проводят в 50 мкл реакционной смеси, содержащей: 200 мкМ dNTP, 600 nM праймеры I и II, 300 nM гибридизационного зонда I, (или 300 nM гибридизационного зонда II), 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2, и от 102 до 105 копий ДНК pVar15-HIV-LTR (или pBluSK-HIV-LTR mod).
Условия проведения ПЦР: денатурация - 95°С - 10 мин, отжиг - 58°С - 60 сек, далее 40 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят на стадии отжига.
При анализе клинического образца, содержащего как вирусную кДНК, так и мутированную вирусную кДНК, полученную на стадии выделения из внесенной мутированной РНК ВИЧ-1 амплификацию проводят в аналогичных условиях. В 50 мкл реакционной смеси содержится: 200 мкМ dNTP, 600 nM праймеры I и II, 300 nM гибридизационного зонда I, 300 nM гибридизационного зонда II, 5 ед. Hot-rescue ДНК-полимеразы, 67 mM tris-HCl, 16,6 mM (NH4)2SO4, 0,01% Tween 20, 3 mM MgCl2, вирусная кДНК и мутированная вирусная кДНК.
Условия проведения ПЦР: денатурация - 95°С - 10 мин, отжиг - 58°С - 60 сек, далее 40 циклов по схеме: денатурация - 95°С - 15 сек, отжиг 58°С - 60 сек. Измерение интенсивности флуоресценции проводят на стадии отжига.
На канале FAM анализируется наличие вирусной кДНК. Количество вирусной кДНК (N1) рассчитывается исходя из калибровочной кривой для определения количества кДНК ВИЧ-1.
На канале TAMRA анализируется количество мутированной кДНК ВИЧ-1. Количество мутированной кДНК ВИЧ-1 (N2) рассчитывается исходя из калибровочной кривой для определения количества мутированной кДНК ВИЧ-1. Истинное количество копий РНК ВИЧ-1, содержащееся в анализируемом образце, рассчитывается по формуле:
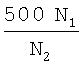
ЛИТЕРАТУРА
1. Международная заявка WO №88/08039, кл. С12Q 1/70, опубл. 20.10.88 г.
2. Патент РФ №2032907, кл. G01N 33/53, опубл. 08.06.92 г.
3. Dewar R.L., Highbarger H.C., Sarmiento M.D., Todd J.A., Vasudevachari M.B., Davey R.T.Jr, Kovacs J.A., Salzman N.P., Lane H.C., Urdea M.S. // Application of branched DNA signal amplification to monitor human immunodeficiency virus type 1 burder in human plasma.// 1994 г.// J. Infect Dis. // v.170 // №5 // p.1172 - 1179.
4. Romano J.W., Van Gemen В., Kievits Т. // NASBA: a novel, isotermal detection technology for qualitative and quantitative HIV-1 RNA measurments. // 1996 г. // Clin Lab Med. // v.16 // №1 // p.89-103.
5. Заявка ЕПВ №329822, кл. С07Н 21/00, опубл. 30.08.89 г.
6. Патент США №5985544, кл. С12Q 1/68, опубл. 16.11.99 г.
7. Mulder J., McKinney N., Christopherson C., Sninsky J., Greenfield L., Kwok S. // Rapid and simple PCR assay for quantitation of human immunodeficiency virus type 1 RNA in plasma: aplication to acute retroviral infection.// 1994 г.// J. Clin. Microbiol. // // v.32 // №2 // p.292-300.
8. Lee L.G., Connell C.R., Bloch W. // 1993 г.// Nucl. Acid Res.// // v.21 // №16 // p.3761-3766.
9. Фодор И.И. и др. // Биотехнология // 1987 г. // т.3 // с.302.
Изобретение относится к молекулярной биологии, генетической инженерии и может быть использовано в медицине. Количественную экспресс-идентификацию генома ВИЧ-1 в пробе детектируют с помощью олигонуклеотидных праймеров, комплементарных консервативному участку 5'-LTR-области генома ВИЧ-1, флуоресцентно меченных зондов и РНК-модифицированного фрагмента консервативного участка 5'-LTR-области генома ВИЧ-1 в качестве внутреннего количественного стандарта. Анализ проводят в реальном времени в формате «закрытая пробирка» с помощью калибровочных кривых, полученных с помощью плазмид pVar15-HIV-LTR и pBluSK-HIV-LTR mod, содержащих нативный и модифицированный кДНК-фрагмент вирусного генома из консервативной 5'-LTR-последовательности соответственно. Плазмида pVarl5-HIV-LTR получена на основе плазмиды pVar15. Плазмида pBluSK-HIV-LTR mod получена на основе плазмиды pBluKSM. Применение изобретения позволяет определить наличие ВИЧ-1 в пробе независимо от типа вируса, сочетания типов и присутствия родственных видов. 4 н.п. ф-лы, 8 ил.
BamHI/EcoRI - фрагмент векторной плазмиды pVar15 размером 4445 п.н.;
BamHI/EcoRI - кДНК - фрагмент консервативного участка 5'-LTR последовательности вируса иммунодефицита человека 1 типа размером 138 п.н., имеющий нуклеотидную последовательность SEQ ID NO:1;
генетический маркер: ген β-лактамазы (Ampr), определяющий устойчивость к ампициллину;
уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: BamHI - 2 и EcoRI - 128.
BamHI/EcoRI - фрагмент векторной плазмиды pBluKSM размером 2940 п.н., содержащий ген альфа-пептида бета-лактамазы (lacZ') - 460-816; сайт инициации промотора Т7-полимеразы - 643; ген устойчивости к ампициллину (bla) - 1976-2833;
BamHI/EcoRI - кДНК - модифицированный фрагмент консервативного участка 5'-LTR-последовательности вируса иммунодефицита человека 1 типа размером 123 п.н., имеющий транскрибируемую нуклеотидную последовательность SEQ ID NO:2;
уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: BamHI - 690 и EcoRI - 819.
амплификационный праймер к консервативному участку 5'-LTR-области генома ВИЧ-1 (533-549) из 17 нуклеотидов
5'-GCTTGCCTTGAGTGCTT-3';
амплификационный праймер к консервативному участку 5'-LTR-области генома ВИЧ-1 (623-640) из 18 нуклеотидов
5'-CGCCACTGCTAGAGATTT-3';
гибридизационный зонд I, комплементарный участку генома ВИЧ-1 (552-575), расположенному между праймерами, и имеющий на 5'-конце флуоресцентную метку, а на 3'-конце - тушитель флюоресценции:
5'-FAM-AGTAGTGTGTGCCCGTCTGTTGTA-BHQ1-3';
гибридизационный зонд II для определения внутреннего стандарта, содержащий на 5'-конце флуоресцентный краситель и на 3'-конце - тушитель флуоресценции:
5'-TAMRA-AGTACTCTOTCCGCGTCTGTTGTA-BHQ2-3';
клонированный фрагмент генома вируса ВИЧ-1 в составе рекомбинантной плазмидной ДНК pVar15-HIV-LTR, охарактеризованной в п.1, для определения специфичности гибридизационного зонда I к целевой последовательности генома ВИЧ-1;
клонированный фрагмент генома вируса ВИЧ-1 в составе рекомбинантной плазмидной ДНК pBluKSM-HIV-LTR mod, охарактеризованной в п.2, для определения специфичности гибридизационного зонда II к последовательности кДНК РНК-контроля и построения калибровочной кривой;
РНК - модифицированный фрагмент консервативного участка 5'-LTR области генома ВИЧ-1 размером 123 п.н. (внутренний РНК-стандарт), имеющий следующую нуклеотидную последовательность SEQ ID NO:3.
| US 5985544, 16.11.1999 | |||
| WO 2005019479, 03.03.2005 | |||
| US 6218186, 17.04.2001 | |||
| Аппарат для вне ротовой репозиции и фиксации отломков нижней челюсти | 1954 |
|
SU104361A1 |
| US 6649749, 18.11.2003 | |||
| US 6897301, 24.05.2005 | |||
| RU 98100921 A, 10.12.1999 | |||
| J Clin Microbiol | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
Авторы
Даты
2009-03-27—Публикация
2006-04-17—Подача