Изобретение относится к медицине, конкретно к разработке корректоров цитостатической полихимиотерапии, обладающих способностью к комплексной защите от гепато-, нефро- и кардиотоксического действия цитостатических препаратов.
Современные методы лечения опухолей, все чаще предусматривающие применение «жесткой» химиотерапии, наталкиваются на ограничения из-за часто возникающих токсических осложнений. Представленные такими явлениями, как гемодепрессия, структурные поражения печени и почек, некротическая энтеропатия, нарушение сердечной деятельности, эти токсические осложнения вынуждают увеличивать интервал между курсами химиотерапии, снижать дозы цитостатиков или полностью их отменять. Это приводит к снижению эффективности химиотерапии, к возврату к легко переносимым, но имеющим меньшие шансы на успех схемам лечения. «Жесткая» полихимиотерапия проходит на неблагоприятном фоне возникающих неспецифических реакций, обусловленных естественным течением опухолевого процесса [1].
Разработка препаратов, снижающих или устраняющих токсические осложнения, активно проводится в последние десятилетия. Но пока не разработаны препараты, обеспечивающие комплексную защиту от токсических осложнений, поражающих жизненно важные органы. Известны селективно действующие протекторы. Так, для снижения гемодепрессии предложены препараты рекомбинантных колониестимулирующих факторов (стимуляторы метаболических процессов) - ά-, β-, ω-эритропоэтины, рекомбинантные миелоцитокины - филграстим, ленограстим и др. [2, с.716]. Эти препараты получаются микробиологическим путем, в России не производятся и являются дорогостоящими.
Поражение печени можно ослабить введением антиоксидантов, например мелатонина [2, с.281]. Однако способность усиления эффекта действия препаратов, угнетающих ЦНС, и ряд побочных эффектов (противопоказания при лейкемии, лимфомах) ограничивают применение мелатонина. Клинически значимая защита тканей сердца от токсического действия цитостатиков обеспечивается препаратом дексразоксон [2, с.754]. Побочное действие этого препарата проявляется в диспепсии, алопеции, лейкопении и тромбоцитопении.
В последнее время все шире применяется препарат амифостин, защищающий клетки, не вовлеченные в опухолевый рост, от токсического действия алкилирующих цитостатиков и препаратов платины. Однако этот препарат не устраняет последствий терапии доссорубицином и может давать осложнения. Как и другие цитопротекторы, амифостин не производится в России и имеет высокую стоимость [2].
Таким образом, можно констатировать отсутствие в клинике злокачественных заболеваний корректоров цитостатиков комплексного действия. Ситуация в России осложняется тем, что отечественные препараты данной лекарственной группы в стране не производятся.
Задачей изобретения является разработка эффективного отечественного препарата - корректора цитостатической полихимиотерапии, способного защищать от токсического воздействия цитостатиков жизненно важные органы и потенцировать действие полихимиотерапии.
Поставленная задача решается химическим соединением формулы (I),
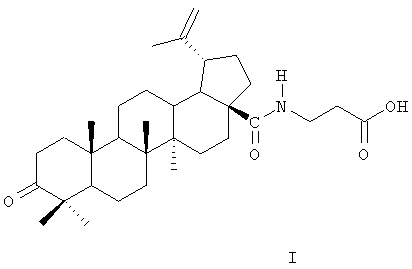
а именно β-аланиламидом бетулоновой кислоты (название по номенклатуре IUPAC: N-[3-оксо-20(29)лупен-28-оил]-3-аминопропионовая кислота), потенцирующим противоопухолевый эффект и антиметастатическую активность полихимиотерапии (ПХТ), проявляющим антиоксидантное и цитопротекторное действие на фоне ПХТ опухолей, а также оказывающим антитоксический эффект при введении комплекса цитостатических препаратов в организм.
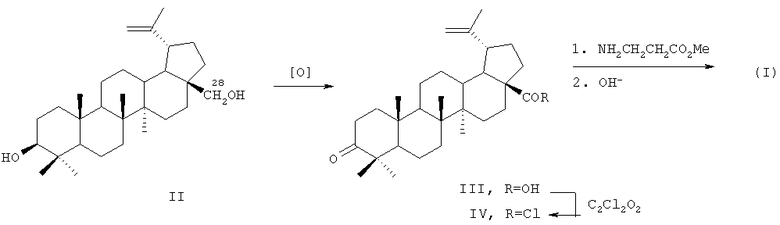
Соединение (I) синтезировано из доступного, извлекаемого из коры березы, тритерпеноида бетулина (II) по схеме 1. Условия синтеза и физико-химические характеристики агента (I) приведены в работе [4]. По нижеприведенной схеме бетулин II, полученный горячей экстракцией коры березы трихлорэтиленом, окисляют реактивом Джонса в ацетоне в бетулоновую кислоту III (температура 0-5°С, 7 ч, выход 85%, чистота 82% по ВЭЖХ). Полученный продукт обрабатывают хлористым оксалилом в хлористом метилене (20°С, 6 ч), получают хлорангидрид (IV). Выделение продукта IV производится трех-четырехкратной отгонкой метилена при контроле температуры, формирования осадка в диэтиловом эфире и его отфильтровывания. Конденсацией хлорангидрида IV с метиловым эфиром β-аланина (безводный хлористый метилен, аргон, 20°С, 20 ч, выход 96%) получают соответствующий амид, содержащий у атома С(28) фрагмент метилового эфира β-аланина. Щелочной гидролиз последнего действием 4 н. раствора гидроокиси натрия в смеси метанола и тетрагидрофурана (2:1, 20°С, 24 ч) приводит к β-аланиламиду бетулоновой кислоты (N-[3-оксо-20(29)лупен-28-оил]-3-аминопропионовой кислоте) (I) (выделяют путем выливания реакционной массы на смесь льда и разбавленной HCl, отфильтровывают образовавшийся осадок, промывают водой, этанолом и высушивают в вакууме при 60°С, выход 97%. Аналитические характеристики образца: т.пл. 214-216°С (из ацетонитрила), 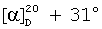 (с 3.04, хлф); брутто-формула С33Н51NO4; Масс-спектр: Найдено [М]+ 525.38371. Вычислено М 525.38178.
(с 3.04, хлф); брутто-формула С33Н51NO4; Масс-спектр: Найдено [М]+ 525.38371. Вычислено М 525.38178.
Схема 1
Известны другие амиды и пептиды бетулоновой кислоты, обладающие противоопухолевой активностью. Так, в работе [5] описан амид бетулоновой кислоты и N-Вос-лизина, обладающий специфической активностью при раке простаты in vitro и in vivo. Амиды бетулоновой кислоты, содержащие фрагменты каприловой, пеларгоновой и ундекановой кислот ингибируют рост опухолевых клеток МТ-4, MOLT-4, СЕМ и Нер G2 [6]. Дипептид бетулоновой кислоты (N'{N-[3-Оксолуп-20(29)-ен-28-оил]-9-аминононаноил}-3-амино-3-фенилпропионовая кислота) запатентован в качестве агента, обладающего противовирусной (антиВИЧ, противогерпесной) и иммуностимулирующей активностью [7]. В работе [8] показано, что это соединение ингибирует рост опухолевых 3 клеток МТ-4, MOLT-4, СЕМ и Нер G2. Дипептид является активным индуктором апоптоза в лейкозных клетках и клетках гепатокарциномы in vitro [8].
Применение производных бетулоновой кислоты в качестве корректоров цитостатиков описано не было.
Исследование активности β-аланиламида бетулоновой кислоты (I) как корректора цитостатических препаратов включало в себя определение его влияния на противоопухолевый и антиметастатический эффекты полихимиотерапии мышей с перевиваемыми опухолями различной степени злокачественности, а также исследование антиоксидантного действия агента в условиях полихимиотерапии и возможности коррекции ее цитотоксического действия на нормальные клетки внутренних органов, не затронутые злокачественным перерождением. Полученные данные обрабатывались статистически с помощью стандартного пакета программ «STATISTICA».
Предварительно методом Кербера определялась острая токсичность β-аланиламида бетулоновой кислоты на белых беспородных мышах массой 22-25 г при однократном внутрижелудочном способе введения. Показано, что β-аланиламид бетулоновой кислоты (I) относится к IV классу токсичности, ЛД50 свыше 5000 мг/кг.
Влияние β-аланиламида бетулоновой кислоты (I) на противоопухолевое действие полихимиотерапии исследовали на мышах с перевитыми опухолями (карцинома легких Льюис и лимфома RLS). Полихимиотерапия проводилась по стандартной схеме АСОР (однократное парентеральное введение циклофосфана, доксорубицина, винкристина и преднизолона в дозах 1/5 от ЛД50). Эффект агента оценивали по отношению к группе мышей, которым назначалась та же схема полихимиотерапии. Агент (I) вводился внутрижелудочно через 6 либо 11 дней после перевивки (в зависимости от штамма опухоли) в виде водно-твинового раствора по 0,2 мл на 10 г массы тела в дозе 50 мг/кг. Введение агента продолжалось в течение 8 дней. Полихимиотерапия АСОР проводилась однократно парентерально за сутки до начала введения агента. Контролем являлась группа мышей с опухолью без терапии. Противоопухолевый эффект оценивали по индексу торможения роста опухоли (отношение разности средних объемов опухолей в контрольной и опытной группах к ее среднему объему в контроле), который определяли в динамике в период введения агента.
Установлено, что введение соединения (I) усиливает противоопухолевый эффект полихимиотерапии АСОР в 1,3-1,5 раз (табл.1, 1а).
Влияние β-аланиламида бетулоновой кислоты (I) на антиметастатический эффект полихимиотерапии исследовали на мышах с перевитыми карциномой легких Льюис и лимфомой RLS. Полихимиотерапия проводилась по вышеописанной схеме. Агент (I) вводился в режиме 8 дней в дозе 50 мг/кг в виде водно-твинового раствора, начиная через сутки после введения цитостатиков. Влияние агента оценивали относительно группы мышей, которым проводилась только полихимиотерапия. Критерием антиметастатического эффекта являлось снижение объемной плотности метастазов (относительного количества метастатических очагов, Vv%), которые определяли путем морфометрического анализа гистологических препаратов тканей животных [9]. Кроме того, интенсивность процесса метастазирования оценивали по частоте метастазирования (отношение числа животных с метастазами к общему количеству животных в группе) и индексу ингибирования метастазирования (ИИМ) [10]. Установлено, что β-аланиламид бетулоновой кислоты (I) повышает индекс ингибирования метастазирования полихимиотерапии АСОР в 1,3-2,5 раз (табл.4).
В этих же экспериментах исследовались антиоксидантные свойства соединения (I) в условиях полихимиотерапии мышей с перевитыми карциномой легких Льюис и лимфомой RLS. Режим и способы введения цитостатических препаратов и изучаемого агента были аналогичны вышеупомянутым. Критерием антиоксидантного действия являлось снижение концентрации маркера перекисного окисления липидов - малонового диальдегида - в сыворотке крови опытных животных по сравнению с группой, которой вводили только цитостатические препараты. Установлено, что β-аланиламид бетулоновой (I) кислоты снижает уровень МДА в 2-4 раза относительно группы сравнения.
Изучение способности β-аланиламида бетулоновой кислоты (I) купировать побочные токсические эффекты цитостатических препаратов на ткани внутренних органов проводилось также на здоровых крысах самках линии Вистар, которым моделировали полихимиотерапию. Схема введения цитостатиков соответствовала АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Агент вводился внутрижелудочно в режиме: 14 дней в дозе 50 мг/кг в виде водно-твинового раствора, начиная через сутки после введения цитостатиков. Методом морфометрии гистологических препаратов тканей животных определяли объемную и поверхностную плотность зон с некротическими и дистрофическими поражениями. Критерием цитопротекторного действия агента являлось снижение морфометрических показателей относительно группы с введением одних цитостатических препаратов. Установлено, что соединение (I) в постцитостатическом периоде оказывает выраженный гепато- и нефропротективный эффекты, в несколько раз снижая степень некробиотического повреждения тканей.
На животных с перевитыми опухолями - карциномой легких Льюис и лимфомой RLS - определялась способность β-аланиламида бетулоновой кислоты (I) снижать цитотоксическое действие полихимиотерапии на здоровые клетки животных опухоленосителей. Установлено, что 8-ми дневное введение агента в дозе 50 мг/кг в постцитостатическом периоде приводит к существенному купированию признаков токсического поражения печени и почек животных. Снижается степень дистрофического поражения гепатоцитов и нефроцитов, уменьшается площадь некрозов и выраженность микроциркуляторных расстройств во внутренних органах. В печени животных с лимфомой отмечено частичное восстановление пластических процессов почек.
Изобретение иллюстрируется следующими примерами.
Пример 1. Изучение влияния β-аланиламида бетулоновой кислоты (I) на противоопухолевый эффект цитостатической полихимиотерапии мышей с перевиваемой карциномой легких Льюис.
Изучение влияния β-аланиламида бетулоновой кислоты (I) на эффективность противоопухолевой полихимиотерапии проводили на мышах самках линии C57BL/6 массой 20-25 г с перевитой карциномой легких Льюис. Опухоль является солидной, метастазирует в легкие.
Животных делили на 3 группы по 10-12 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 5×106 клеток в 0,1 мл физиологического раствора. На 10 день после перевивки двум группам животным вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии вводили внутрижелудочно β-аланиламид бетулоновой кислоты (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора агента (I) опытным мышам продолжали 8 дней. Контроль и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Величину противоопухолевого эффекта определяли по индексу торможения роста опухоли (ТРО), который в период введения агента рассчитывали исходя из объемов первичных узлов опухоли, а в конце опыта - на основе показателей массы этих опухолей (отношение разности средних объемов/массы опухолей в контрольной и опытной группах к ее среднему объему/массе в контроле).
Результаты эксперимента представлены в таблицах 1 и 1а. Установлено, что β-аланиламид бетулоновой кислоты (I), вводимый в дозе 50 мг/кг после полихимиотерапии, усиливает ее противоопухолевый эффект в 1,3-1,5 раза (табл.1).
Индекс торможения роста карциномы легких Льюис (ТРО) в период введения β-аланиламида бетулоновой кислоты (I) на фоне полихимиотерапии АСОР
"Р<0,05 различия с ПХТ АСОР достоверны
Изменение динамики роста карциномы легких Льюис под влиянием введения агента (I) на фоне цитостатической полихимиотерапии АСОР
#Р<0,05 различия с ПХТ АСОР достоверны
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) потенцирует противоопухолевое действие цитостатической полихимиотерапии карциномы легких Льюис.
Пример 2. Изучение влияния β-аланиламида бетулоновой кислоты (I) на противоопухолевые свойства цитостатической полихимиотерапии мышей с перевиваемой лимфомой RLS.
Влияние β-аланиламида бетулоновой кислоты (I) на эффективность противоопухолевой полихимиотерапии лимфомы RLS изучали на мышах самцах линии СВА массой 15-30 г. Данный штамм лимфомы растет в виде солидной опухоли, отличается злокачественностью и относительной резистентностью к циклофосфану.
Животных делили на 3 группы по 10-12 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 5×106 опухолевых клеток в 0,1 мл физиологического раствора. Через 5 дней после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии вводили внутрижелудочно β-аланиламид бетулоновой кислоты в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора β-аланиламида бетулоновой кислоты (I) опытным мышам продолжали 8 дней. Контрольная группа и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Величину противоопухолевого эффекта определяли по индексу торможения роста опухоли (ТРО), который в период введения агента рассчитывали исходя из объемов первичных узлов опухоли, а в конце опыта - на основе показателей массы этих опухолей (отношение разности средних объемов/массы опухолей в контрольной и опытной группах к ее среднему объему/массе в контроле).
Результаты эксперимента представлены в таблицах 2 и 2а. Установлено, что β-аланиламид бетулоновой кислоты (I), вводимый в дозе 50 мг/кг в течение 8 дней после полихимиотерапии, усиливает ее противоопухолевый эффект в 1,3 раза (табл.2).
Индекс торможения роста лимфомы RLS (ТРО) в период введения β-аланиламида бетулоновой кислоты (I) на фоне цитостатической полихимиотерапии АСОР
# Р<0,05 различия с ПХТ АСОР достоверны
Изменение динамики роста лимфомы RLS под влиянием введения β-аланиламида бетулоновой кислоты (I) на фоне цитостатической полихимиотерапии АСОР
# Р<0,05 различия с ПХТ АСОР достоверны
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) потенцирует противоопухолевое действие цитостатической полихимиотерапии лимфомы RLS.
Пример 3. Исследование влияния β-аланиламида бетулоновой кислоты (I) на антиметастатический эффект цитостатической полихимиотерапии мышей с перевиваемой карциномой легких Льюис
Антиметастатические свойства β-аланиламида бетулоновой кислоты (I) изучали на мышах самках линии C57BL/6 массой 20-25 г с солидной карциномой легких Льюис. Клеточную суспензию карциномы легких Льюис перевивали внутримышечно в объеме 5×106 в 0,1 мл физиологического раствора. На 10 день после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии вводили внутрижелудочно β-аланиламид бетулоновой кислоты в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора β-аланиламида бетулоновой кислоты (I) опытным мышам продолжали 8 дней. Контрольная группа и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Через 8 дней введения агента животных умерщвляли, извлекали легкие и после стандартной гистологической обработки исследовали методом световой микроскопии. Антиметастатический эффект определяли путем морфометрического анализа срезов обеих долей легких. Объемную плотность (Vv%) метастазов подсчитывали по-методу Автандилова [9] с использованием окулярной сетки на 289 точек. Интенсивность процесса метастазирования оценивали по частоте метастазирования (ЧМ) (отношение числа животных с метастазами к общему количеству животных в группе) и индексу ингибирования метастазирования (ИИМ) [10]:
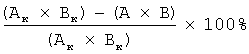 , где
, где
Ак - частота метастазирования в контрольной группе, А - частота метастазирования в опытной группе, Вк - плотность метастазов у животных контрольной группы,
В - плотность метастазов у животных опытной группы.
Данные по изменению объемной плотности метастатических очагов приведены в табл.3. Установлено, что β-аланиламид бетулоновой кислоты (I), вводимый в дозе 50 мг/кг в течение 8 дней после полихимиотерапии, резко усиливает антиметастатическое действие полихимиотерапии АСОР, снижая объемную плотность метастазов в легких в 56 раз. При этом индекс ингибирования метастазирования ПХТ под влиянием агента повышается в 1,3 раза (табл.3).
Изменение показателей метастазирования карциномы легких Льюис в легких мышей под влиянием введения агента (I) на фоне цитостатической полихимиотерапии АСОР
## Р<0,01 различия с ПХТ АСОР достоверны
Vv% - объемная плотность метастазирования; ЧМ - частота метастазирования; ИИМ - индекс ингибирования метастазирования
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) значительно потенцирует антиметастатическое действие цитостатической полихимиотерапии карциномы легких Льюис.
Пример 4. Исследование влияния β-аланиламида бетулоновой кислоты (I) на антиметастатический эффект цитостатической полихимиотерапии мышей с перевиваемой лимфомой RLS
Антиметастатические свойства β-аланиламида бетулоновой кислоты (I) изучали на мышах самцах линии СВА массой 15-30 г с солидной лимфомой RLS. Клеточную суспензию лимфомы RLS перевивали внутримышечно в объеме 5×106 в 0,1 мл физиологического раствора. Через 5 дней после перевивки двум группам животным вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР. Через сутки одной из этих групп начинали введение агента (I) по схеме, указанной выше. Другая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Через 8 дней введения агента животных умерщвляли, извлекали печень и после стандартной гистологической обработки исследовали методом световой микроскопии. Антиметастатический эффект определяли путем морфометрического анализа срезов по методу [9] с использованием окулярной сетки на 289 точек. Интенсивность процесса метастазирования оценивали по объемной плотности (Vv%) метастазов, частоте метастазирования (ЧМ) и индексу ингибирования метастазирования (ИИМ).
Результаты приведены в табл.4. Установлено, что β-аланиламид бетулоновой кислоты (I), вводимый в дозе 50 мг/кг в течение 8 дней после полихимиотерапии, усиливает антиметастатическое действие полихимиотерапии АСОР, снижая плотность метастазов в печени в 1,2 раза. При этом индекс ингибирования метастазирования ПХТ под влиянием агента повышается в 2,5 раза (табл.4).
Изменение показателей метастазирования лимфомы RLS в печени мышей под влиянием введения агента (I) на фоне цитостатической полихимиотерапии АСОР
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) значительно потенцирует антиметастатическое действие цитостатической полихимиотерапии лимфомы RLS.
Пример 5. Исследование антиоксидантного действия β-аланиламида бетулоновой кислоты (I) в условиях цитостатической полихимиотерапии мышей с перевиваемой карциномой легких Льюис
Мышей самок линии C57B L/6 массой 20-25 г делили на 3 группы по 10-12 особей в каждой. Клеточную суспензию карциномы легких Льюис перевивали внутримышечно в объеме 5×106 в 0,1 мл физиологического раствора. На 10 день после перевивки двум группам животным вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии внутрижелудочно вводили агент (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора агента (I) опытным мышам продолжали 8 дней. Контрольные животные и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Животных выводили из опыта декапитацией, получали сыворотку крови и определяли в ней концентрацию малонового диальдегида в реакции с тиобарбитуровой кислотой [11], а также активность трансаминаз (с помощью стандартных наборов реактивов Biocon). Результаты представлены в таблице 5. Установлено, что β-аланиламид бетулоновой кислоты, вводимый в дозе 50 мг/кг в течение восьми дней после полихимиотерапии, в 4 раза снижает в крови концентрацию маркера перекисного окисления липидов МДА. Активность трансаминаз уменьшается в 1,2-1,3 раза по сравнению с животными, получившими только полихимиотерапию (табл.5).
Изменение биохимических показателей в крови мышей с карциномой легких Льюис под влиянием введения β-аланиламида бетулоновой кислоты (I) на фоне цитостатической полихимиотерапии АСОР
# Р<0,05 различия с ПХТ АСОР достоверны
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) оказывает антиоксидантное действие в условиях цитостатической полихимиотерапии карциномы легких Льюис, уменьшая уровень перекисного окисления липидов и цитолиза.
Пример 6. Исследование антиоксидантного действия β-аланиламида бетулоновой кислоты (I) в условиях цитостатической полихимиотерапии мышей с перевиваемой лимфомой RLS
Мышей самцов линии СВА массой 15-30 г делили на 3 группы по 10-12 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 5×106 опухолевых клеток в 0,1 мл физиологического раствора. Через 5 дней после перевивки двум группам животным вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии внутрижелудочно вводили соединение (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора агента (I) опытным мышам продолжали 8 дней. Контрольная группа и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Животных выводили из опыта декапитацией, получали сыворотку крови и определяли в ней концентрацию малонового диальдегида в реакции с тиобарбитуровой кислотой [11]. Результаты представлены в таблице 6. Установлено, что соединение (I) в дозе 50 мг/кг в течение восьми дней после полихимиотерапии, снижает концентрацию МДА в крови в 2 раза по сравнению с животными, получившими только полихимиотерапию (табл.6).
Изменение концентрации МДА в крови мышей с лимфомой RLS под влиянием введения β-аланиламида бетулоновой кислоты (I) на фоне цитостатической полихимиотерапии АСОР
## Р<0,01 различия с ПХТ АСОР достоверны
Таким образом, показано, что β-аланиламид бетулоновой кислоты (I) оказывает антиоксидантное действие в условиях цитостатической полихимиотерапии лимфомы RLS, уменьшая интенсивность перекисного окисления липидов.
Пример 7. Изучение влияния β-аланиламида бетулоновой кислоты (I) на органотоксический эффект комбинации цитостатических препаратов
Самок крыс Вистар массой 180-200 г делили на 3 группы по 10 особей в каждой. Всем группам вводили однократно внутрибрюшинно комбинацию противоопухолевых препаратов: циклофосфан - 21 мг/кг, доксорубицин - 2,1 мг/кг, винкристин - 0,04 мг/кг, преднизолон - 2,1 мг/кг массы тела.
В течение 14 дней после введения цитостатиков крысам вводили внутрижелудочно воду (1 группа), β-аланиламид бетулоновой кислоты (2 группа) и перепарат сравнения - диквертин (дигидрокверцетин, «Бианон», Россия), являющийся антиоксидантом с РР-витаминной активностью (3 группа). Исследуемые тритерпеноиды и референс препарат вводили в водно-твиновом растворе в дозе 50 мг/кг. На 15-е сутки после введения цитостатиков животных забивали мгновенной декапитацией под легким эфирным наркозом извлекали печень, почки и тимус, фиксировали 10% раствором нейтрального формалина и далее подвергали стандартной гистологической обработке на автоматическом комплексе MICROM («Карл Цейс»). Парафиновые срезы толщиной 3-5 мкм окрашивали гематоксилин-эозином и по Ван-Гизону. Морфометрическое исследование площадей срезов и структурных компонентов тканей проводили с помощью окулярной сетки (289 точек) по методу [9]. В печени и почках подсчитывали объемную плотность (Vv) зон с дистрофическими и некротическими изменениями клеток, а также объемную плотность синусоидов печени, численную плотность (Nai) двуядерных гепатоцитов. В тимусе определяли объемную плотность мозгового и коркового вещества, количество телец Гассаля. Статистическую обработку данных проводили методами параметрической статистики с использованием t критерия Стьюдента. Результаты считали достоверными при Р<0.05.
Установлено, что под действием соединения (I) произошло существенное улучшение структуры печени и почек. Показатели объемной плотности гепатоцитов с дистрофическими и некротическими повреждениями снизились соответственно в 4 и 1,5 раза по сравнению с первой группой. Введение агента способствовало восстановлению печеночной микроциркуляции. Объемная плотность нефроцитов проксимальных канальцев в состоянии дистрофии уменьшилась под действием агента (I) в 2,9 раза, объемная плотность зон некрозов - в 2,4 раза. Под действием агента повысился корково-мозговой индекс тимуса и снизилось количество телец Гассаля в его мозговой части. Обнаружено, что органопротекторный эффект β-аланиламида бетулоновой кислоты (I) в условиях цитотоксического поражения не уступает аналогичному эффекту препарата сравнения диквертина.
Изменение объемной плотности структурных элементов тканей внутренних органов крыс под действием β-аланиламида бетулоновой кислоты (I) на фоне введения комбинации цитостатических препаратов
Таким образом, показано, что в условиях комбинированного воздействия цитостатиков введение β-аланиламида бетулоновой кислоты (I) в постцитостатическом периоде оказывает выраженный гепато- и нефропротективный эффекты, в несколько раз снижая степень некробиотического повреждения тканей.
Пример 8. Изучение гепатопротекторных свойств β-аланиламида бетулоновой кислоты (I) в условиях цитостатической полихимиотерапии АСОР мышей с перевиваемой карциномой легких Льюис
Мышей самок линии C57B L/6 массой 20-25 г делили на 3 группы по 10-12 особей в каждой. Клеточную суспензию карциномы легких Льюис перевивали внутримышечно в объеме 5×106 в 0,1 мл физиологического раствора. На 10 день после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии вводили внутрижелудочно соединение (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора соединения (I) опытным животным продолжали 8 дней. Контроль и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. После восьми дней введения агента животных выводили из опыта декапитацией. Для морфологического исследования брали печень и фиксировали в 0,1М фосфатном буфере с pH 7,2-7,8 в течение 4 сут, затем подвергли стандартной гистологической обработке на гистологическом комплексе MIKROM (Карл Цейс). Срезы толщиной 4-5 мкм окрашивали гематоксилином и эозином, а также по методу ШИК - гематоксилин - оранжевый G. Препараты исследовали методом световой микроскопии в проходящем свете. Морфометрический анализ срезов проводили по методу [9] с использованием окулярной сетки на 289 точек. В печени подсчитывали объемную плотность (Vv) зон с дистрофическими и некротическими изменениями клеток. Результаты анализа представлены в табл.8. Установлено, что введение соединения (I) в дозе 50 мг/кг в течение восьми дней после полихимиотерапии, снижает объемную плотность зон с некрозом гепатоцитов в 3 раза и увеличивает объемную плотность синусоидов в 1,4 раза в сравнении с группой ПХТ АСОР. Наблюдаемые изменения свидетельствуют о купировании процессов цитолиза и холестаза в печени, вызванных введением цитостатических препаратов. В результате морфологического исследования выявлено также снижение тяжести дистрофических поражений гепатоцитов под влиянием агента, несмотря на то, что объемная плотность зон с дистрофией не изменилась по сравнению с группой ПХТ. В группе с введением агента отмечено снижение клеток с баллонной и увеличение клеток с гидропической и гиалиново-капельной дистрофией.
Изменение объемной плотности элементов печеночной паренхимы у мышей с карциномой легких Льюис под влиянием введения агента (I) на фоне цитостатической полихимиотерапии АСОР
* Р<0,05 различия с ПХТ АСОР достоверны
Таким образом, β-аланиламид бетулоновой кислоты оказывает гепатопротекторное действие в условиях цитостатической полихимиотерапии карциномы легких Льюис, уменьшая интенсивность цитолиза и холестаза в печеночной паренхиме.
Пример 9. Изучение гепато- и нефропротекторных свойств β-аланиламида бетулоновой кислоты (I) в условиях цитостатической полихимиотерапии АСОР мышей с перевиваемой лимфомой RLS
Мышей самцов линии СВА массой 15-30 г делили на 3 группы по 10-12 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 5×106 опухолевых клеток в 0,1 мл физиологического раствора. Через 5 дней после перевивки двум группам животным вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме АСОР: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии вводили внутрижелудочно соединение (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ АСОР являлась референсной. Контролем являлись животные с опухолью. Введение раствора агента (I) опытным мышам продолжали 8 дней. Контроль и группа с полихимиотерапией АСОР получали в те же сроки эквивалентное количество воды с твином-80. Для морфологического исследования печень фиксировали в 0,1М фосфатном буфере с pH 7,2-7,8 в течение 4 сут, затем подвергли стандартной гистологической обработке, с последующей заливкой в парафиновые блоки на гистологическом комплексе MIKROM (Карл Цейс). Срезы толщиной 4-5 мкм окрашивали гематоксилином и эозином, а также по методу ШИК - гематоксилин - оранжевый G. Препараты исследовали методом световой микроскопии в проходящем свете. Морфометрический анализ срезов проводили с использованием окулярной сетки на 289 точек. В печени подсчитывали объемную плотность(Vv) зон с дистрофическими и некротическими изменениями клеток.
После восьми дней введения агента животных выводили из опыта декапитацией. Для морфологического исследования брали печень и фиксировали в 0,1М фосфатном буфере с pH 7,2-7,8 в течение 4 сут, затем подвергли стандартной гистологической обработке на гистологическом комплексе MIKROM (Карл Цейс). Срезы толщиной 4-5 мкм окрашивали гематоксилином и эозином, а также по методу ШИК - гематоксилин - оранжевый G. Препараты исследовали методом световой микроскопии в проходящем свете. Морфометрический анализ срезов проводили по методу Автандилова [9] с использованием окулярной сетки на 289 точек. В печени подсчитывали объемную плотность (Vv) зон с дистрофическими и некротическими изменениями клеток.
Результаты анализа ткани печени представлены в таблице 9. Установлено, что β-аланиламид бетулоновой кислоты (I), вводимый в дозе 50 мг/кг в течение восьми дней после полихимиотерапии, снижает объемную плотность зон с некрозом гепатоцитов в 2 раза и увеличивает объемную плотность синусоидов в 1,4 раза в сравнении с группой ПХТ АСОР (табл.9). Наблюдаемые изменения свидетельствуют о купировании процессов цитолиза и холестаза в печени, вызванных введением цитостатических препаратов. В этой же группе животных наблюдалось относительное увеличение количества гепатоцитов с дистрофией. При этом тяжесть дистрофии существенно уменьшается, переходя от баллонной к слабо выраженной гидропической и гиалиново-капельной. В гепатоцитах по всему срезу печени отмечено появление гликогена в виде мелкой зернистости, свидетельствующее об усилении синтетической функции печени.
Изменение объемной плотности элементов печеночной паренхимы у мышей с лимфомой RLS под влиянием введения агента (I) на фоне цитостатической полихимиотерапии АСОР
# Р<0,05 различия с ПХТ АСОР достоверны
Результаты анализа ткани почек представлены в таблице 10. Установлено, что под влиянием агента (I) снижается степень структурных повреждений почек за счет уменьшения в 5,8 раз выраженности некротического нефроза, а также уменьшения в 1,8 раза просветов канальцев и отечности интерстициальной ткани в сравнении с группой ПХТ АСОР. В группе животных, которым вводили агент (I), отмечено статистически достоверное увеличение (в 1,5 раза) количества клеток со слабо выраженной гиалиново-капельной дистрофией по сравнению с группой животных, получавших только цитостатическую терапию.
Изменение объемной плотности элементов почечной паренхимы у мышей с лимфомой RLS под влиянием введения агента (Ш) на фоне цитостатической полихимиотерапии АСОР
# Р<0,05; ## Р<0,01 различия с ПХТ АСОР достоверны
Из результатов экспериментов видно, что β-аланиламид бетулоновой кислоты (I) оказывает гепато- и нефропротекторное действие в условиях цитостатической полихимиотерапии лимфомы RLS, уменьшая объем и тяжесть некробиотических поражений печени и почек.
Таким образом, предлагаемое соединение β-аланиламид бетулоновой кислоты (I) как корректор цитостатической полихимиотерапии обладает следующими преимуществами:
- высокой антиоксидантной, гепато- и нефропротекторной активностью на фоне цитостатической полихимиотерапии;
- потенцированием противоопухолевого и антиметастатического эффектов полихимиотерапии;
- получением его из доступного сырья - бетулина из коры березы.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Гершанович М.Л. Осложнения при химио- и гормонотерапии злокачественных опухолей. С-Пб., Сатис, 1999.
2. Машковский М.Д. Лекарственные средства, 15-е изд., «Новая волна», 2006.
3. Гольберг Е.Д., Зуева Е.П. Препараты из растений в комплексной терапии злокачественных заболеваний, Томск, Изд. Томского университета, 2000.
4. Петренко Н.И., Еланцева Н.В., Шульц Э.Э., Шакиров М.М., Толстиков Г.А. Химия природных соединений. 2002. №4. С.276-283.
5. B.B.Saxena, L.Zhu, M.Hao, E.Kisilis, M.Katdare, O.Oktem, A.Bomshteyn, P.Rathnam, Bioorg. Med. Chem. Lett., 2006, V.14. 6349-6358.
6. Покровский А.Г., Шинтяпина А.Б., Н.В.Пронкина, B.C.Кожевников, Плясунова О.А., Шульц Э.Э., Толстиков Г.А. Доклады академии наук. 2006. Т.407. №5. С.698-701.
7. Патент РФ 2211843 от 25.01.2002 г. по заявке 2002102338/04. БИПМ. 2003. №25. ч.3, с.498-499.
8. Шинтяпина А.Б., Шульц Э.Э., Петренко Н.И., Узенкова Н.В., Толстиков Г.А., Пронкина Н.В., Кожевников B.C., Покровский А.Г. Биоорганическая химия. 2007. Т.33. №6. 620-626.
9. Автандилов Г.Г. Медицинская морфометрия. Руководство. M.: Медицина, 1990. 384 с.
10. Архипов С.А., Юнкер В.М. Изменение интенсивности метастазирования в легкие перевиваемых опухолей мышей в зависимости от величины перевивочной дозы опухолевых клеток. - Исследование по индукции и метастазированию опухолей у экспериментальных животных. - Новосибирск, 1984. С.14-32.
11. Камышников B.C. Справочник по клинико-химической лабораторной диагностике, Минск: Беларусь, 2000, Т.2, с.207.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ С ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТЬЮ | 2010 |
|
RU2425680C1 |
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-ПИПЕРИДИН-СРЕДСТВО С ПРОТИВООПУХОЛЕВОЙ, АНТИМЕТАСТАТИЧЕСКОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2466136C1 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-МОРФОЛИН - СРЕДСТВО КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ПОВРЕЖДЕНИЙ ПЕЧЕНИ С ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2461563C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАРАНЕОПЛАСТИЧЕСКИХ ПРОЦЕССОВ И ХИМИОТЕРАПИИ, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2447888C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТЕОМИЕЛИТА | 2015 |
|
RU2604124C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ СРЕДСТВО С АНТИКОАГУЛЯНТНОЙ, ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2412712C1 |
| N,N'-(АЛКАНДИИЛ)БИС[ЛАБДА-7(9),13,14-ТРИЕН-4-КАРБОКСАМИДЫ], ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2654201C1 |
| Средство для лечения хронического атрофического гастрита | 2016 |
|
RU2623866C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТИ ЦИКЛОФОСФАНА В ЭКСПЕРИМЕНТЕ | 2004 |
|
RU2270682C2 |
Изобретение относится к корректорам цитостатической полихимиотерапии. В качестве корректора предлагается использовать β-аланиламид бетулоновой кислоты формулы (I):

который потенцирует противоопухолевый эффект и антиметастатическую активность полихимиотерапии (ПХТ), проявляет антиоксидантное и цитопротекторное действие на фоне ПХТ опухолей, а также оказывает антитоксический эффект при введении комплекса цитостатических препаратов в организм. Соединение (I) синтезируется из растительного тритерпеноида бетулина. 12 табл.
Применение β-аланиламида бетулоновой кислоты формулы (I):
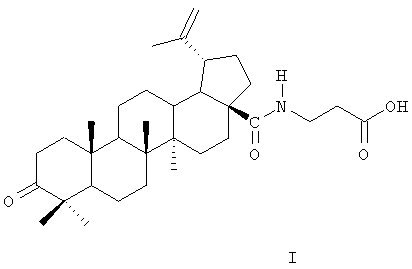
в качестве корректора цитостатической полихимиотерапии.
| ПЕТРЕНКО Н.И | |||
| и др | |||
| Химия природных соединений, 2002, №4, с.276-283 | |||
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
| US 5468888 А, 21.11.1995 | |||
| ПОКРОВСКИЙ А.Г | |||
| ШИНТЯПИНА А.Б | |||
| и др | |||
| Доклады академии наук, 2006, т.407, №5, с.698-701. | |||
Авторы
Даты
2009-04-27—Публикация
2007-09-17—Подача