Изобретение относится к медицине, в частности к фармакологии, и касается конкретно производных бетулоновой кислоты формулы (I):
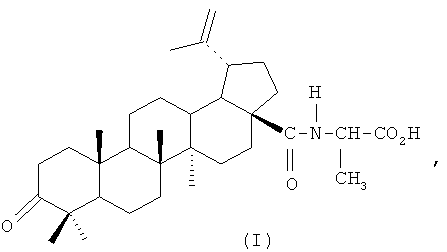
а именно известной М-[3-оксо-20(29)-лупен-28-оил]-2-аминопропионовой кислоты (или α-аланиламиду бетулоновой кислоты), у которой выявлены усиление противоопухолевого эффекта цитостатической полихимиотерапии, снижение ее токсического действия на здоровые клетки печени, отсутствие стимуляции диссеминации и перекисного окисления липидов, а также противовоспалительные свойства и низкая токсичность, что позволит использовать ее в медицине в качестве корректора полихимиотерапии.
Необходимость поиска малотоксичных корректоров цитостатической полихимиотерапии вызвана проблемой повышения ее переносимости и усиления эффективности лечения онкологических больных [Гершанович М.Л., Филов В.А., Акимов М.А., Акимов А.А. Введение в фармакотерапию злокачественных опухолей. - СПб, Сатис, 1999. 152 с.]. Решение данной проблемы возможно путем применения в качестве средств дополнительной терапии препаратов-модификаторов, уменьшающих побочное токсическое действие химиопрепаратов и не ослабляющих их противоопухолевый и антиметастатический эффекты [Трещалина Е.М. Противоопухолевая активность веществ природного происхождения. - М.: Практическая медицина, 2005. - 272 с.; Гольдберг Е.Д., Зуева Е.П. Препараты из растений в комплексной терапии злокачественных новообразований. - Томск: Изд. Томского ун-та, 2000. 42 с.]. Широко применяемые в настоящее время пептидные препараты-модификаторы, такие как Т-активин, тималин, интерфероны, фактор некроза опухоли, различные интерлейкины, бестатин, циклоспорин А, колониестимулирующие факторы и др., нередко вызывают нежелательные иммунологические и токсические реакции (выработка нейтрализующих антител, сенсибилизация) [Трещалина Е.М. Противоопухолевая активность веществ природного происхождения. - М.: Практическая медицина, 2005. - С.37]. Недостатком данных препаратов является также их относительно высокая стоимость.
Среди соединений не пептидной природы в качестве официнальных препаратов-корректоров в схемах лечения чаще всего применяются нативные экстракты различных растений (элеутерококка, родиолы розовой, подорожника, шлемника и др. [Гольдберг Е.Д., Зуева Е.П. Препараты из растений в комплексной терапии злокачественных новообразований. - Томск: Изд. Томского ун-та, 2000. 125 с.]. Поскольку растительные соединения обычно обладают комплексной активностью (гепатопротекторной, антиоксидантной, противовоспалительной и иммуномодулирующей) и лучше переносятся организмом, то они остаются в фокусе внимания при отборе агентов-корректоров химиотерапии.
Одним из перспективных растительных соединений, представляющих интерес в качестве базовой субстанции для разработки потенциальных корректоров химиотерапии, может считаться бетулоновая кислота. Она синтезируется из доступного растительного продукта бетулина и является естественным биорегулятором с разнообразной фармакологической активностью [Толстикова Т.Г., Сорокина И.В., Толстиков Г.А. и др. Терпеноиды ряда лупана как перспективные для медицины биологически активные агенты. Часть 2. Полусинтетические производные лупана // Биоорганическая химия. 2006. №3. С.291-307].
Задачей изобретения является выявление свойств корректора цитостатиков в ряду производных бетулоновой кислоты с целью создания малотоксичного отечественного препарата, обладающего противовоспалительной активностью и способностью потенцировать противоопухолевый эффект полихимиотерапии и оказывать цитопротекторное действие в печени.
Поставленная задача решается известным химическим соединением формулы (I),
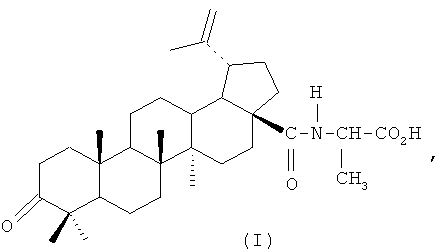
а именно N-[3-оксо-20(29)-лупен-28-оил]-2-аминопропионовой кислотой, у которой было обнаружено в условиях цитостатической полихимиотерапии (ПХТ) потенцирование противоопухолевого и отсутствие снижения антиметастатических эффектов, цитопротекторное действие в печени и противовоспалительная активность.
Прототипом и ближайшим структурным аналогом заявляемого соединения является пентациклический тритерпеноид - бетулоновая кислота (II).

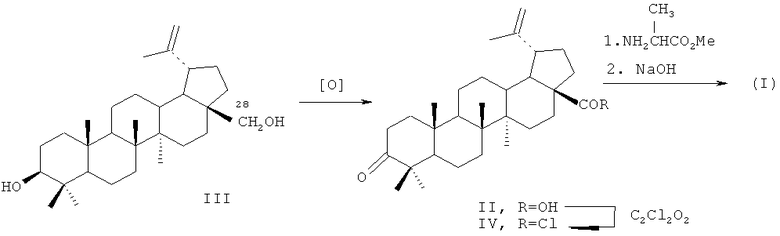
Соединение (I) синтезировано из доступного, извлекаемого из коры березы тритерпеноида бетулина (III). Условия синтеза и физико-химические характеристики агента (I) приведены в работе [Антимонова А.Н., Узенкова Н.В., Петренко Н.И и др. // Химия природных соединений. 2008, №3. С.259-264]. По нижеприведенной схеме бетулин (III), полученный горячей экстракцией коры березы трихлорэтиленом, окисляют реактивом Джонса в ацетоне в бетулоновую кислоту (II) (температура 0-5°C, 7 ч, выход 85%, чистота 82% по ВЭЖХ). Полученный продукт обрабатывают хлористым оксалилом в хлористом метилене (20°C, 6 ч), получают хлорангидрид (IV). Выделение продукта (IV) производится трех-четырехкратной отгонкой метилена при контроле температуры, формированием осадка в диэтиловом эфире и его отфильтровыванием. Конденсацией хлорангидрида (IV) с метиловым эфиром α-аланина (безводный хлористый метилен, аргон, 20°C, 20 ч, выход 96%) получают соответствующий амид, содержащий у атома С(28) фрагмент метилового эфира α-аланина. Щелочной гидролиз последнего действием 4 н. раствора гидроокиси натрия в смеси метанола и тетрагидрофурана (2:1, 20°C, 24 ч) приводит к α-аланиламиду бетулоновой кислоты (N-[3-оксо-20(29)лупен-28-оил]-2-аминопропионовой кислоте) (I) (выделяют путем выливания реакционной массы на смесь льда и разбавленной HCl, отфильтровывают образовавшийся осадок, промывают водой, этанолом и высушивают в вакууме при 60°C, выход 98%. Аналитические характеристики образца: т.пл. 210-218°C (из ацетонитрила), 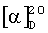 +36° (с 3.72, хлф); брутто-формула C33H51HO4. Масс-спектр: Найдено [М]+ 525.38.163. Вычислено М 525.38178.
+36° (с 3.72, хлф); брутто-формула C33H51HO4. Масс-спектр: Найдено [М]+ 525.38.163. Вычислено М 525.38178.
Схема 1
Ранее было показано, что амиды бетулоновой кислоты, содержащие фрагмент d-l-α-аланина у С-28 (α-аланиламиды бетулоновой кислоты), оказывают противоопухолевое и антиметастатическое действие при введении мышам с трансплантируемой карциномой легких Льюис [И.В.Сорокина, Т.Г.Толстикова, Н.А.Жукова и др. Оценка противоопухолевого и антиметастатического эффектов амидов бетулоновой кислоты на мышах с перевиваемой карциномой Льюис // Бюлл. эксп. биол. и мед., 2006, №1, с.69-72] и проявляют антиоксидантный эффект при моделировании токсического гепатита у мышей [И.В.Сорокина, Т.Г.Толстикова, Е.Б.Бубнова и др. Изучение антиоксидантных свойств производных бетулоновой кислоты на модели острого токсического гепатита // Научный вестник Тюменской медицинской академии. 2003, №1, с.60-61]. Сообщалось, что близкие по структуре амиды бетулоновой кислоты, содержащие фрагмент β-аланина у С-28, оказывают гепато- и нефропротекторное действие при введении животным на фоне цитостатических препаратов, а также обладают умеренной противоопухолевой и антиметастатической активностью [И.В.Сорокина, Т.Г.Толстикова, Н.А.Жукова и др. Бетулоновая кислота и ее производные - новая группа агентов, снижающих побочное действие цитостатиков // Доклады академии наук. 2004. Т.399. №2. С.274-277; Н.А.Жукова, Д.Е.Семенов, И.В.Сорокина и др. Влияние бетулоновой кислоты и [3-оксо-20(29)-лупен-28-оил]-3-аминопропионовой кислоты на морфологию печени мышей с лимфосаркомой RLS после полихимиотерапии // Бюлл. эксп. биол. и мед., 2005, т.14, №9, с.348-351; С.В.Позднякова, О.Р.Грек, А.С.Фунтиков и др. Нефропротективный эффект производных бетулоновой кислоты при экспериментальном цитостатическом повреждении почек у крыс // Бюлл. СО РАМН. 2007. Т.127, №5, с.117-121; И.В.Сорокина, Н.А.Жукова, Т.Г.Толстикова и др. Изучение влияния бетулоновой кислоты и ее амидных производных на рост и метастазирование перевиваемых опухолей у мышей // Вопросы биологической, медицинской и фармацевтической химии. 2006. №1, с.29-31]. Одно из β-аланинамидных производных бетулоновой кислоты - [3-оксо-20(29)-лупен-28-оил]-3-аминопропионовая кислота- запатентована в качестве корректора цитостатической полихимиотерапии [Патент RU №2353623. Т.Г.Толстикова, Г.А.Толстиков, И.В.Сорокина и др. Корректор цитостатической полихимиотерапии. Опубл. 27.04.2009. Бюл. №12].
Литературные данные указывают на высокую вероятность наличия у α-аланиламидов бетулоновой кислоты корректорных свойств при цитостатической химиотерапии. Ранее данные свойства у этих соединений в условиях полихимиотерапии не исследовались.
Токсичность заявленного соединения (I) исследовали в острых опытах на беспородных мышах обоего пола при внутрижелудочном способе введения. В результате проведенных исследований показано, что α-аланиламид бетулоновой кислоты (I) относится к IV классу токсичности, ЛД50 свыше 5000 мг/кг.
Изучение корректорных свойств агента (I) проводили на мышах с перевитой карциномой легких Льюис с использованием модели экспериментальной полихимиотерапии (ПХТ). Исследование включало в себя определение влияния агента на противоопухолевый и антиметастатический эффекты ПХТ, уровень ПОЛ в сыворотке крови и морфологический анализ цитотопротекторного действия на клетки печени, не затронутые злокачественным перерождением. Эффект агента оценивался по отношению к группе мышей, которым назначалась та же схема ПХТ. Полученные данные обрабатывались статистически с помощью стандартного пакета программ «STATISTICA 6».
Влияние заявленного соединения на противоопухолевую эффективность ПХТ определяли на мышах линии C57BL/6 с перевитой внутримышечно карциномой легких Льюис. Цитотоксическое воздействие моделировали у животных на 10-й день после перевивки путем парентерального введения противоопухолевых препаратов по классической схеме CHOP в модификации [Грек О.Р., Мишенина С.В., Пупышев А.Б. // Бюлл. эксп. биол. и мед. 2002. Т.134. №10. С.413-417]: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Агент I вводили внутрижелудочно через сутки после ПХТ в виде водно-твинового раствора по 0,2 мл на 10 г массы тела в дозе 50 мг/кг в течение 8 дней. Контролем являлась группа мышей с опухолью без цитостатической терапии. Группой сравнения являлись животные с изолированным введением ПХТ. Противоопухолевый эффект определяли по величине индекса торможения роста опухоли (отношение разности средних объемов опухолей в контрольной и опытной группах к ее среднему объему в контроле). Измерения проводили в период введения агента. Установлено, что α-аланиламид бетулоновой кислоты I через 5 суток после начала введения усиливает противоопухолевое действие ПХТ в 1,5 раза по сравнению с группой с изолированным введением ПХТ (табл.1, 2).
Влияние агента (I) на антиметастатическую активность ПХТ исследовали в опыте на мышах, который проводили по вышеописанной схеме. Группой сравнения являлись животные с изолированным введением ПХТ. Критерием антиметастатического эффекта являлось снижение объемной плотности метастазов в легких (относительное количество метастатических очагов, Vv%), которые определяли путем морфометрического анализа гистологических препаратов ткани легких [Г.Г.Автандилов. Медицинская морфометрия. Руководство. М.: Медицина, 1990. 384 с.]. Кроме того, интенсивность процесса метастазирования оценивали по частоте метастазирования (отношение числа животных с метастазами к общему количеству животных в группе) и индексу ингибирования метастазирования (ИИМ) [С.А.Архипов, В.М.Юнкер. Изменение интенсивности метастазирования в легкие перевиваемых опухолей мышей в зависимости от величины перевивочной дозы опухолевых клеток. - Исследование по индукции и метастазированию опухолей у экспериментальных животных. Новосибирск, 1984. С.14-32].
Показано, что агент (I), вводимый в дозе 50 мг/кг в течение 8 дней после ПХТ, не вызывает достоверного изменения площади метастатических поражений в легких, Индекс ингибирования метастазирования у мышей с введением соединения (I) существенно не меняется, несмотря на небольшое снижение числа животных без метастазов в данной группе (табл.3). Исследование состояния перекисного окисления липидов в крови этих же животных показало, что введение агента (I) не вызывает достоверных изменений в показателях цитолиза клеток и концентрации вторичных продуктов ПОЛ и, таким образом, свидетельствует о том, что заявленное соединений не усиливает окислительный стресс в условиях ПХТ (табл.4).
Способность α-аланиламида бетулоновой кислоты (I) снижать цитотоксическое действие полихимиотерапии на здоровые клетки печени изучали на мышах с перевитой карциномой легких Льюис. Моделирование ПХТ и режим введения агента проводилось, как указано выше. Установлено, что введение агента в течение 8 дней после ПХТ в дозе 50 мг/кг приводит к снижению выраженности признаков токсического повреждения печени, по сравнению с животными с изолированным введением ПХТ. Под действием агента (I) в постцитостатическом периоде отмечается уменьшение количества некрозов и снижение степени тяжести дистрофических поражений гепатоцитов. Уменьшаются признаки пластической недостаточности, улучшается состояние микроциркуляторного компартмента.
Противовоспалительные свойства заявленного агента изучали на моделях воспаления, индуцированного гистамином и каррагенином. В качестве соединения сравнения брали нестероидный противовоспалительный препарат индометацин (субстанция "Fluka" BioChemika). Флогогены (0,1% раствор гистамина и 1,5% водную взвесь каррагенина с твином) вводили субпланарно в заднюю лапу мышей в объеме 0,05 мл. Агент (I) вводили внутрижелудочно за 1 час до флогогена. Противовоспалительный эффект определяли по величине индекса воспаления, который подсчитывали как процентное отношение разности масс воспаленной и здоровой лап к массе здоровой. Показано, что производное бетулоновой кислоты (I) оказывает достоверное противовоспалительное действие на обеих моделях воспаления. По выраженности эффект превосходит эффект бетулоновой кислоты, но уступает индометацину (табл.5, 6).
Таким образом, заявленное соединение - N-[3-оксо-20(29)-лупен-28-оил]-2-аминопропионовая кислота формулы (I) обладает следующими преимуществами:
- усиливает противоопухолевый эффект ПХТ;
- не снижает антиметастатическую активность ПХТ;
- оказывает цитопротекторное действие на здоровые клетки печени;
- не усиливает интенсивность ПОЛ в условиях ПХТ;
- обладает противовоспалительным действием и низкой токсичностью;
- синтезируется из доступного растительного продукта бетулина.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение N-[3-оксо-20(29)-лупен-28-оил]-2-аминопропионовой кислоты
Условия синтеза и физико-химические характеристики агента (I) приведены в работе [Антимонова А.Н., Узенкова Н.В., Петренко Н.И и др. // Химия природных соединений. 2008. №3. С.259-264]. К раствору 2.12 ммоль (1 г) хлорангидрида бетулоновой кислоты в 60 мл сухого хлористого метилена прибавляли 4.24 ммоль метилового эфира α-аланина и 8.48 ммоля (1.2 мл) перегнанного триэтиламина. Реакционную смесь выдерживали при комнатной температуре в течение 48 ч, периодически перемешивая, затем промывали 10%-ным раствором соляной кислоты и водой, высушивали безводным MgSO4 и упаривали. Полученное вещество хроматографировали на окиси алюминия, используя в качестве элюента хлористый метилен, и высушивали над P2O3. Получили метиловый эфир N-[3-оксо-20(29)-лупен-28-оил-]-D,L-α-аминопропионовой кислоты. ИК-спектр (KBr, ν, см-1): 1644 (C=С), 1663 (CONH), 1704 (C=O), 1744 (COOCH3). Спектр ЯМР 1Н (5, м.д., J/Гц): 0.85 (3Н, с, Me), 0.90 (3Н, с, Me), 0.94 (6Н, с, 2Ме), 0.99 (3Н, с, Me), 1.61 (3Н, с, Ме-30), 3.04 (1Н, тд, J1=11.1, J2=4.0, Н-19), 3.68 (3Н, с, Ме-4'), 4.46 (1Н, м, Н-1'), 4.52 и 4.66 (2Н, оба уш.с, Н-29, 29), 6.06 и 6.12 (1Н, оба д, J1=7.1, CONH). К раствору 0.54 г (1 ммоль) полученного соединения в смеси 10 мл метанола и 5 мл ТГФ в атмосфере аргона при 0°C прибавляли 2 мл (8 ммоль) 4 М раствора NaOH, затем реакционную смесь выдерживали при комнатной температуре в течение суток и выливали на смесь льда с соляной кислотой. Выпавший осадок отфильтровывали, промывали водой и высушивали над P2O5. Получали 0.52 г (98%) соединения (I) в виде порошка, перекристаллизовали из ацетонитрила. Т.пл. 210-218°C. Спектр ЯМР 1H (δ, м.д., J/Гц): 0.89 (3Н, с, Me), 0.93 (3Н, с, Me), 0.94 (6Н, с, 2Ме), 0.99 (3Н, с, Me), 1.65 (3Н, с, Ме-30), 3.06 (1Н, тд, J1=11.11, J2=4.0, H-19), 4.51 (1Н, м, Н-1'), 4.57 и 4.70 (2Н, оба уш. с, Н-29, 29), 6.06 и 6.12 (1Н. оба д, J1=7.0, CONH), 8.84 (1Н, уш.с, COOH) (приведены только характеристичные сигналы).
Пример 2. Определение токсичности
Исследование проводили в острых опытах на беспородных мышах обоего пола массой 18-25 г. Соединение (I) вводили в виде водно-твинового раствора по 0,2 мл на 10 г массы тела в дозах 500, 1000 и 5000 мг/кг. На каждую дозу брали по 6 мышей. Контрольным животным вводили аналогичным образом водно-твиновую взвесь. Наблюдения за состоянием и выживаемостью мышей проводили в течение 14 дней. Установлено, что во всем диапазоне доз соединение (I) не вызывает гибели животных, клинические симптомы интоксикации отсутствуют. Половой чувствительности к агенту не выявлено. Согласно общепринятой классификации соединение (I) признано малотоксичным.
Пример 3. Влияние на противоопухолевый эффект цитостатической полихимиотерапии
Изучение влияния агента (I) на эффективность противоопухолевой полихимиотерапии проводили на мышах самках линии C57BL/6 массой 20-25 г с перевитой карциномой легких Льюис. Данная опухоль является солидной, метастазирует в легкие. Животных делили на 3 группы по 10 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 2×106 клеток в 0,1 мл физиологического раствора. На 10 день после перевивки всем животным, кроме контрольных, вводили однократно парентерально комплекс химиотерапевтических препаратов по классической схеме CHOP, адаптированной для мышей [Грек О.Р., Мишенина С.В., Пупышев А.Б. // Бюлл. эксп. биол. и мед. 2002. Т.134. №10. С.413-417]: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Через сутки после полихимиотерапии (ПХТ) одной группе вводили внутрижелудочно агент I в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ являлась референсной. Контролем являлись животные с опухолью. Введение изучаемого агента продолжали 8 дней. Контроль и группа с полихимиотерапией получали в те же сроки эквивалентное количество воды с твином-80. Величину противоопухолевого эффекта определяли по индексу торможения роста опухоли (ТРО), который рассчитывали исходя из объемов первичных узлов опухоли в период введения агента (отношение разности средних объемов опухолей в контрольной и опытной группах к ее среднему объему в контроле).
Результаты эксперимента представлены в таблице 1 и 2. Установлено, что агент (I), вводимый в дозе 50 мг/кг после полихимиотерапии, усиливает ее цитостатический эффект с сохранением высокой противоопухолевой активности в конце периода введения. На фоне введения агента (I) противоопухолевое действие ПХТ максимально потенцировалось к 6-м суткам введения, при этом размеры опухолевых узлов уменьшались почти в 1,5 раза по сравнению с группой, где вводилась только ПХТ (табл.1).
В табл.2 приведены значения индексов ТРО изучаемого агента, отражающие его вклад в противоопухолевый эффект химиотерапии. Показано, что к концу курсового введения агент (I) повысил индекс ТРО в 6,8 раз относительно группы сравнения.
Таким образом, показано, что амид бетулоновой кислоты (I) потенцирует противоопухолевое действие цитостатической полихимиотерапии у мышей с карциномой легких Льюис.
Пример 4. Влияние на антиметастатический эффект цитостатической полихимиотерапии
Антиметастатические свойства α-аланинамида бетулоновой кислоты изучали на мышах самках линии C57BL/6 массой 20-25 г, которым перевивали солидную карциному легких Льюис, как описано выше. На 10 день после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме CHOP: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии (ПХТ) вводили в течение 8 дней внутрижелудочно агент (I) в дозе 50 мг/кг. Вторая группа с ПХТ являлась референсной. Контролем являлись животные с опухолью. По окончании введения агента животных умерщвляли, извлекали легкие и после стандартной гистологической обработки исследовали методом световой микроскопии. Антиметастатический эффект определяли путем морфометрического анализа срезов обеих долей легких. Объемную плотность (Vv%) метастазов подсчитывали по методу Автандилова [Г.Г.Автандилов. Медицинская морфометрия. Руководство. М.: Медицина, 1990. 384 с.] с использованием окулярной сетки на 289 точек. Интенсивность процесса метастазирования оценивали по частоте метастазирования (ЧМ) (отношение числа животных с метастазами к общему количеству животных в группе) и индексу ингибирования метастазирования (ИИМ) [С.А.Архипов, В.М.Юнкер. Изменение интенсивности метастазирования в легкие перевиваемых опухолей мышей в зависимости от величины перевивочной дозы опухолевых клеток. Исследование по индукции и метастазированию опухолей у экспериментальных животных. Новосибирск, 1984. С.14-32]:
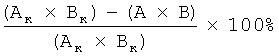 , где
, где
Ак - частота метастазирования в контрольной группе, А - частота метастазирования в опытной группе, Вк - плотность метастазов у животных контрольной группы, В - плотность метастазов у животных опытной группы.
Данные по изменению объемной плотности метастатических очагов в легких приведены в табл.3. Установлено, что агент (I), вводимый в дозе 50 мг/кг в течение 8 дней после полихимиотерапии, поддерживает ее высокий антиметастатический потенциал. Вместе с тем, у отдельных животных в этой группе наблюдалось небольшое увеличение площади метастатических поражений и частоты метастазирования в легких, однако для группы в целом эти изменения не имели статистически достоверной разницы с референсной группой (табл.3). Показано, что в группе с сочетанным введением цитостатиков и изучаемого соединения ИИМ оставался высоким благодаря значительной разнице показателей объемной плотности метастазов с контрольной группой.
Пример 5. Влияние на уровень ПОЛ в условиях ПХТ
Влияние агента (I) на уровень перекисного окисления липидов (ПОЛ) определяли на мышах самках линии C57BL/6 с перевитой карциномой легких Льюис. Эксперимент проводили, как указано выше. На 10 день после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии (ПХТ) вводили в течение 8 дней внутрижелудочно агент (I) в дозе 50 мг/кг. Вторая группа с ПХТ являлась референсной. Контролем являлись животные с опухолью. Мышей выводили из опыта декапитацией, собирали сыворотку крови и определяли в ней концентрацию малонового диальдегида по реакции с тиобарбитуровой кислотой (Камышников B.C. Справочник по клинико-химической лабораторной диагностике. Минск: Беларусь, 2000, Т.2, с.207) и активность трансаминаз (с помощью стандартных наборов реактивов Biocon). Результаты представлены в таблице 4. Установлено, что введение соединения (I) в дозе 50 мг/кг в течение 8 дней после полихимиотерапии не вызывает достоверных изменений в показателях цитолиза клеток и концентрации вторичных продуктов ПОЛ и, таким образом, не приводит к усилению окислительного стресса в условиях ПХТ. В крови наблюдалось небольшое (на 11-12%) снижение активности трансаминаз по сравнению с животными, получившими только полихимиотерапию. Концентрация маркера перекисного окисления липидов МДА уменьшалась незначительно (на 5%) (табл.4).
Таким образом, показано, что агент (I) в условиях цитостатической полихимиотерапии не усиливает процессы перекисного окисления клеточных мембран.
Пример 6. Цитопротекторное действие в печени мышей в условиях цитостатической полихимиотерапии
Животных делили на 3 группы по 10-12 особей в каждой. Всем животным перевивали внутримышечно клеточную суспензию опухоли в объеме 2×106 клеток в 0,1 мл физиологического раствора. На 10 день после перевивки двум группам животных вводили однократно парентерально комплекс химиотерапевтических препаратов по схеме: доксорубицин (4 мг/кг), циклофосфан (50 мг/кг), винкристин (0,1 мг/кг), преднизолон (5 мг/кг). Одной из этих групп через сутки после полихимиотерапии (ПХТ) вводили внутрижелудочно агент (I) в виде водно-твиновой взвеси (твин-80) по 0,2 мл на 10 г массы тела в дозе 50 мг/кг, вторая группа с ПХТ являлась референсной. Контролем являлись животные с опухолью. Введение раствора агента (I) опытным мышам продолжали 8 дней. Контроль и группа с полихимиотерапией получали в те же сроки эквивалентное количество воды с твином-80. После восьми дней введения агента животных выводили из опыта декапитацией. Для морфологического исследования брали печень, фиксировали в 4% параформе и подвергали стандартной обработке на гистологическом комплексе «MICROM» (Карл Цейс). Срезы толщиной 3-4 мкм окрашивали гематоксилином и эозином, ставили ШИК - реакцию с докраской гематоксилином и оранжевым G. Препараты исследовали методом световой микроскопии в проходящем свете. Морфометрический анализ срезов проводили по-методу Автандилова [Автандилов Г.Г. Медицинская морфометрия. Руководство. - М.: Медицина, 1990. 384 с.] с использованием окулярной сетки на 289 точек. В печени подсчитывали объемную плотность (Vv) зон с дистрофическими и некротическими изменениями клеток.
В печени контрольных животных отмечен активный метастатический процесс, а также развитие синдрома регенераторно-пластической недостаточности. Метастазы располагались перипортально в виде множественных мелких очагов, не выходящих за пределы пограничной пластинки. Перифокально отмечались моноцеллюлярные некрозы гепатоцитов. У всех животных в гепатоцитах центролобулярных отделов выявлялась клеточно-инволютивная дистрофия и очаговая мелковезикулярная липидная инфильтрация. При окраске по методу ШИК гликоген определялся в отдельных гепатоцитах в виде пылевидной зернистости. В просвете синусоидов на фоне умеренно выраженного венозного полнокровия выявлялись увеличенные в размере синусоидальные клетки с ШИК - позитивной цитоплазмой, полиморфноядерные лейкоциты, единичные опухолевые клетки.
В морфологической картине печени животных, которым вводили комплекс цитостатиков, превалируют признаки токсического поражения. В гепатоцитах центролобулярных отделов развивается преимущественно мелковезикулярная липидная инфильтация и очаговая гидропическая дистрофия. По сравнению с контрольной группой отмечается увеличение площади некрозов гепатоцитов. Моноцеллюлярные (коагуляционные) некрозы гепатоцитов локализуются по периферии метастатических очагов и в центролобулярных отделах долек. У двух животных отмечаются крупные фокальные некрозы, инфильтрированные полиморфноядерными лейкоцитами. Гликоген в гепатоцитах так же, как и в контроле, выявляется в отдельных клетках в виде пылевидной зернистости. Синусоиды незначительно расширены, инфильтрированы синусоидальными клетками с ШИК - позитивной цитоплазмой и полиморфноядерными лейкоцитами. В портальных и центральных венах выявляется сладж эритроцитов и ШИК - позитивная гомогенная субстанция (фибрин). Перипортально выявляются мелкоочаговые единичные метастазы, не выходящие за пределы пограничной пластинки. Таким образом, после введения комплекса цитостатиков у животных отмечается развитие токсического гепатита.
Введение агента (I) в постцитостатическом периоде приводит к снижению выраженности признаков токсического повреждения печени, по сравнению с животными группы с ПХТ. В гепатоцитах перипоральных зон выявляется клеточно-инволютивная дистрофия и мелковезикулярная липидная инфильтрация. При окраске по методу ШИК гликоген в клетках наблюдается по всему срезу печени в виде крупной зернистости. Визуально отмечается уменьшение количества некрозов гепатоцитов. Просветы синусоидов незначительно расширены, в них выявляются лимфомакрофагальные клетки с ШИК - позитивной цитоплазмой и единичные опухолевые клетки. Просветы отдельных крупных вен заполнены гомогенной ШИК -позитивной субстанцией. Перипортально выявлялись мелкоочаговые единичные метастазы, не выходящие за пределы пограничной пластинки. Таким образом, введение животным агента (I) на фоне полихимиотерапии привело к уменьшению степени токсического повреждения печени.
Пример 7. Исследование противовоспалительных свойств на модели гистаминового воспаления
Эксперименты проводили на беспородных мышах самцах массой 25-30 г, Животных делили на группы по 8 особей. Соединение (I) вводили внутрижелудочно в виде взвеси в дистиллированной воде с добавлением эмульгатора Tween-80 в дозе 100 мг/кг (в объеме 0,2 мл на 10 г массы животного). Отдельной группе мышей аналогично вводили структурный аналог бетулоновую кислоту (II) в дозе 100 мг/кг, а также эталонный противовоспалительный препарат индометацин в эффективной дозе 20 мг/кг. Контрольные животные получали эквивалентное количество водно-твиновой эмульсии. Через 1 час после введения агентов всем мышам субпланарно в заднюю лапу введен 0,5% водный раствор гистамина по 0,05 мл/мышь. Через 5 часов после введения флогогена мышей умерщвляли путем цервикальной дислокации позвоночника, отсекали обе задние лапы, определяли массу каждой. Противовоспалительный эффект оценивали по величине индекса воспаления, который определяли как отношение разности масс воспаленной и здоровой лап к массе здоровой, выраженное в процентах. Результаты обрабатывали статистически с помощью пакета программ «STATISTIKA 6». Различия считали достоверными с вероятностью p<0,05.
Данные эсперимента приведены в табл.5. Показано, что соединение (I), так же как и бетулоновая кислота, снижало в 1,4 раза выраженность отека лапы мышей, тогда как индометацин уменьшал отек в 2,4 раза. Таким образом, в условиях воспаления, вызванного гистамином, заявленное производное бетулоновой кислоты (I) оказывает достоверный противовоспалительный эффект, не уступающий эффекту своего структурного аналога, но меньший по величине, чем у эталонного препарата индометацина.
Пример 8. Исследование противовоспалительных свойств на модели каррагенинового воспаления
Эксперименты проводили на беспородных мышах самцах массой 25-30 г. Животных делили на группы по 8 особей. Соединение (I) вводили внутрижелудочно в виде взвеси в дистиллированной воде с добавлением эмульгатора Tween-80 в дозе 50 мг/кг (в объеме 0,2 мл на 10 г массы животного). Отдельной группе мышей аналогично вводили структурный аналог бетулоновую кислоту в дозе 50 мг/кг, а также эталонный противовоспалительный препарат индометацин в эффективной дозе 20 мг/кг. Контрольные животные получали эквивалентное количество водно-твиновой эмульсии. Через 1 час после введения агентов всем мышам субпланарно в заднюю лапу введен 1,5% водная взвесь каррагенина с твином по 0,05 мл/мышь. Через 5 часов после введения флогогена мышей умерщвляли путем цервикальной дислокации позвоночника, отсекали обе задние лапы, определяли массу каждой. Противовоспалительный эффект оценивали по величине индекса воспаления, который определяли как отношение разности масс воспаленной и здоровой лап к массе здоровой, выраженное в процентах. Результаты обрабатывали статистически с помощью пакета программ «STATISTIKA 6». Различия считали достоверными с вероятностью p<0,05.
Данные эксперимента приведены в табл.6. Показано, что соединение (I) снижало в 1,3 раза выраженность отека лапы мышей, тогда как бетулоновая кислота (II) уменьшала отек в 1,2 раза, а индометацин - в 1,4 раза. Таким образом, в условиях воспаления, вызванного каррагенином, заявляемое производное бетулоновой кислоты
(I) превосходило по противовоспалительной активности свой структурный аналог и незначительно уступало эталонному препарату индометацину.
Таким образом, предлагаемое соединение α-аланиламид бетулоновой кислоты (I) как корректор цитостатической полихимиотерапии обладает следующими преимуществами:
- высокой гепатопротекторной активностью на фоне цитостатической полихимиотерапии;
- потенцированием противоопухолевого эффекта полихимиотерапии;
- выраженной противовоспалительной активностью на моделях каррагенинового и гистаминового отеков у животных;
- низкой токсичностью;
- получением его из доступного сырья - бетулина, выделяемого из коры березы.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОРРЕКТОР ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2007 |
|
RU2353623C1 |
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-ПИПЕРИДИН-СРЕДСТВО С ПРОТИВООПУХОЛЕВОЙ, АНТИМЕТАСТАТИЧЕСКОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2466136C1 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-МОРФОЛИН - СРЕДСТВО КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ПОВРЕЖДЕНИЙ ПЕЧЕНИ С ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2461563C1 |
| СРЕДСТВО ДЛЯ КОРРЕКЦИИ ЦИТОТОКСИЧЕСКИХ ЭФФЕКТОВ ПАРАНЕОПЛАСТИЧЕСКИХ ПРОЦЕССОВ И ХИМИОТЕРАПИИ, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2447888C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТИ ЦИКЛОФОСФАНА В ЭКСПЕРИМЕНТЕ | 2004 |
|
RU2270682C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТЕОМИЕЛИТА | 2015 |
|
RU2604124C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ СРЕДСТВО С АНТИКОАГУЛЯНТНОЙ, ПРОТИВООПУХОЛЕВОЙ И АНТИМЕТАСТАТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2412712C1 |
| Средство для лечения хронического атрофического гастрита | 2016 |
|
RU2623866C1 |
| ПРОТИВООПУХОЛЕВЫЙ АГЕНТ, ОТНОСЯЩИЙСЯ К ГРУППЕ МЕТАЛЛООРГАНИЧЕСКИХ ПРОИЗВОДНЫХ ПОЛИАКРИЛОВОЙ КИСЛОТЫ | 2008 |
|
RU2372091C1 |
Изобретение относится к фармацевтической промышленности, в частности к средству, которое является корректором цитостатической полихимиотерапии. Применение производного бетулоновой кислоты в качестве корректора цитостатической полихимиотерапии, повышающего ее противоопухолевое действие, снижающего ее токсический эффект на печень и обладающего противовоспалительной активностью. Вышеописанное соединение усиливает противоопухолевый эффект цитостатической полихимиотерапии, эффективно снижает ее токсическое действие на здоровые клетки печени, обладает противовоспалительными свойствами и низкой токсичностью. 6 табл.
Применение производного бетулоновой кислоты формулы (I)

в качестве корректора цитостатической полихимиотерапии, повышающего ее противоопухолевое действие, снижающего ее токсический эффект на печень и обладающего противовоспалительной активностью.
| КОРРЕКТОР ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2007 |
|
RU2353623C1 |
| КОРРЕКТОР ПАРАНЕОПЛАСТИЧЕСКИХ ПОВРЕЖДЕНИЙ И ТОКСИЧЕСКИХ ЭФФЕКТОВ ЦИТОСТАТИЧЕСКОЙ ПОЛИХИМИОТЕРАПИИ | 2008 |
|
RU2385324C1 |
| CN 101244067 А, 20.08.2008 | |||
| CN 101342179 А, 14.01.2009. | |||
Авторы
Даты
2011-08-10—Публикация
2010-05-19—Подача