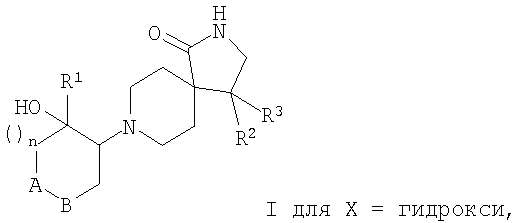
Настоящее изобретение относится к соединениям формулы I
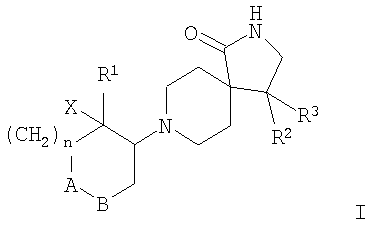
где А-В означает -СН2-СН2-, -СН2-O- или -О-СН2-;
Х означает водород или гидрокси;
R1 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом;
R2 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси;
R3 означает водород или (низш.)алкил;
n означает 0, 1 или 2,
и к их фармацевтически активным солям.
Настоящее изобретение относится к соединениям общей формулы I, содержащей их фармацевтической композиции и их применению в лечении неврологических и невропсихиатрических расстройств.
Неожиданно было найдено, что соединения общей формулы I являются эффективными ингибиторами глицинового переносчика 1 (GlyT-1) и обладают значительной селективностью по отношению к ингибиторам глицинового переносчика 2 (GlyT-2).
Шизофрения является прогрессирующим и разрушительным неврологическим заболеванием, характеризуемым эпизодическими позитивными симптомами, такими, как иллюзии, галлюцинации, нарушения мышления и психоз, и постоянными негативными симптомами, такими, как вялая эмоциональная реакция, нарушенное внимание и социальный уход, и нарушения познавательной способности (D.A.Lewis и J.A.Lieberman, Neuron, 2000, 28: 325-33). В течение десятилетий исследование было сосредоточено на гипотезе "допаминэргической гиперреактивности", которая привела к терапевтическим вмешательствам, включающим блокаду допаминэргической системы (R.J.Vandenberg и K.R.Aubrey, Exp. Opin. Ther. Targets, 2001, 5 (4): 507-518; A.Nakazato и S.Okuyama и др., 2000, Exp. Opin. Ther. Patents, 10 (1): 75-98). Данный фармакологический подход плохо применим к негативным симптомам и симптому нарушенной познавательной способности, которые являются самыми лучшими прогностическими факторами функционального результата (Т.Sharma, Br.J. Psychiatry, 1999, 174 (доп.28): 44-51).
Дополнительная модель шизофрении была предложена в середине шестидесятых годов, основанная на психотомиметическом действии, вызываемом блокадой глутаматной системы соединениями, подобными фенциклидину (РСР) и родственными агентами (кетамин), которые являются неконкурентными антагонистами рецептора N-метил-D-аспартата (NMDA). Что интересно, у здоровых волонтеров психотомиметическое действие, индуцированное РСР, включает позитивные и негативные симптомы, а также дисфункцию познавательной способности, так близко напоминающие шизофрению у пациентов (D.C.Javitt и др., 1999, Biol. Psychiatry, 45: 668-679 и ссылки в контексте). Кроме того, трансгенные мыши, экспрессирующие пониженные уровни субъединицы рецептора NMDAR1, проявляют поведенческие аномалии, подобные тем, которые наблюдались при индуцированных фармакологическим способом моделей шизофрении, поддерживая модель, при которой сниженная рецепторная активность NMDA приводит к подобному шизофрении поведению (A.R.Mohn и др., 1999, Cell, 98: 427-236).
Глутаматная нейротрансмиссия, в особенности рецепторная активность NMDA, играет решающую роль в пластичности синапсов, обучении и запоминании, такие рецепторы, как NMDA, по-видимому, служат в качестве дифференциального переключателя для синхронизации порога синаптической пластичности и формирования памяти (D.O.Hebb, 1949, The organization of behavior, Wiley, NY; T.V.Bliss и G.L.Collingridge, 1993, Nature, 361: 31-39). Трансгенные мыши, сверхэкспрессирующие субъединицу NR2B рецептора NMDA, обладают повышенной синаптической пластичностью и превосходной способностью к обучению и запоминанию (J.P.Tang и др., 1999, Nature, 401 - 63-69).
Так, если дефицит глутамата вовлечен в патофизиологию шизофрении, повышенная передача глутамата, в особенности посредством активации рецептора NMDA, прогнозировала бы получение как антипсихотических эффектов, так и проявлений усиления познавательной способности.
Известно, что аминокислота глицин обладает по меньшей мере двумя важным функциями в ЦНС. Она действует как ингибиторная аминокислота, связывая чувствительные к стрихнину глициновые рецепторы, и также влияет на возбуждающую активность, действуя в качестве незаменимого совместного агониста с глутаматом для рецепторной функции N-метил-D-аспартата (NMDA). В то время как глутамат высвобождается из синаптических окончаний зависимым от активности способом, глицин, по-видимому, присутствует на более постоянном уровне и, видимо, модулирует/контролирует рецептор для его ответа на глутамат.
Одним из наиболее эффективных способов контроля синаптических концентраций нейромедиатора является влияние на их повторное поглощение в синапсах. Нейромедиаторные переносчики путем удаления нейромедиаторов из внеклеточного пространства могут контролировать их внеклеточное время жизни и тем самым модулировать интенсивность синаптической передачи (R.R.Gainetdinov и др., 2002, Trends in Pharm. Sci., 23 (8): 367-373).
Переносчики глицина, которые образуют часть семейства натриевых и хлоридных нейромедиаторных переносчиков, играют важную роль в прекращении глицинэргических действий и поддержании концентрации внеклетчного глицина путем повторного поглощения в пресипаптических нервных окончаниях и проходящих снаружи тонких глиальных процессах.
Два различных гена глицинового переносчика были клонированы (GlyT-1 и GlyT-2) от мозга млекопитающего, которые дают начало двум переносчикам примерно с 50% гомологией аминокислотных последовательностей. Переносчик GlyT-1 представляет собой четыре изоформы (1a, 1b, 1с и 1d), являющиеся результатом альтернативного сплайсинга и альтернативного использования промоторов. Только две из этих изоформ были найдены в мозге грызунов (GlyT-1а и GlyT-1b). Переносчик GlyT-2 также в некоторой степени гетерогенен. В мозге грызунов были идентифицированы две изоформы GlyT-2 (2а и 2b). Известно, что GlyT-1 локализован в ЦНС и в периферических тканях, тогда как GlyT-2 специфичен для ЦНС. GlyT-1 преимущественно распространен в глиальных клетках и найден не только в областях, соответствующих чувствительным к стрихнину глициновым рецепторам, но также и за пределами этих областей, где, как было предположено, включен в модуляцию рецепторной функции NMDA (В.Lopez-Corcuera и др., 2001, Mol. Mem. Biol., 18: 13-20). Таким образом, одна стратегия для усиления рецепторной активности NMDA состоит в увеличении концентрации глицина в локальном микроокружении синаптических рецепторов NMDA путем ингибирования переносчика GlyT-1 (R.Bergereon и др., 1998, Proc. Natl. Acad. Sci. USA, 95: 15730-15734; L. Chen и др., 2003, J. Neurophysiol., 89 (2): 691-703).
Ингибиторы переносчиков глицина пригодны для лечения неврологических и психоневрологических нарушений. Большинство подразумеваемых болезненных состояний составляют психозы, шизофрения (R.E.Armer и D.J.Miller DJ, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572), психотические расстройства настроения, такие, как острая большая депрессия, расстройства настроения, ассоциированные с психотическими расстройствами, такими как острая мания или депрессия, ассоциированная с биполярными расстройствами, и расстройства настроения, ассоциированные с шизофренией (Е.Т.Pralong и др., 2002, Prog. Neurobiol., 67: 173-202), аутистические расстройства (M.L.Carlsson, 1998, J. Neural Transm. 105: 525-535), расстройства познавательной способности, такие, как деменции, включая возрастную деменцию и сенильную деменцию типа болезни Альцгеймера, расстройства памяти у млекопитающих, включая человека, синдром дефицита внимания и боли (R.E.Armer и D.J.Miller, 2001, Exp. Opin. Ther. Patents, 11 (4): 563-572).
Таким образом, усиление активации рецепторов NMDA посредством ингибирования переносчика GlyT-1 может привести к созданию препаратов, которые лечат психоз, шизофрению, деменцию и другие заболевания, при которых нарушены процессы познавательной способности, такие как синдром дефицита внимания или болезнь Альцгеймера.
Объектами по настоящему изобретению являются соединения формулы I как таковые, применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственных средств для лечения заболеваний, связанных с активацией рецепторов NMDA посредством ингибирования переносчика GlyT-1, их приготовление, лекарственные средства, основанные на соединении по изобретению и их получение, а также применение соединений формулы I при контроле и предупреждении болезней, таких как психозы, дисфункция запоминания и обучения, шизофрения, деменция и другие болезни, при которых нарушены процессы познавательной способности, такие как синдром дефицита внимания или болезнь Альцгеймера.
Предпочтительными показаниями для применения соединений по настоящему изобретению являются шизофрения, нарушение познавательной способности и болезнь Альцгеймера.
Более того, изобретение включает все рацемические смеси, все их соответствующие энантиомеры и/или оптические изомеры.
Термин «(низш.)алкил», как он использован в контексте, означает группу с насыщенной линейной или разветвленной цепью, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил, н-бутил, изобутил, 2-бутил, трет-бутил и тому подобное. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода.
Термин «галоид» означает хлор, йод, фтор или бром.
Термин «арил» означает одновалентный циклический ароматический углеводородный радикал, состоящий из одного или нескольких конденсированных колец, из которых по меньшей мере одно кольцо имеет ароматическую природу, например фенил или нафтил.
Термин «гетероарил» означает циклический ароматический углеводородный радикал, содержащий один, два или три гетероатома, выбранных из группы, состоящей из кислорода, серы или азота, например пиридил, пиразинил, пиримидинил, пиридазинил, триазинил, тиазолил, тиенил, фурил, пирролил, имидазолил, пиразолил, оксазолил, изотиазолил или изоксазолил.
Термин «фармацевтически приемлемые кислотно-аддитивные соли» охватывает соли с неорганическими и органическими кислотами, такими, как хлористоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, n-толуолсульфоновая кислота и тому подобное.
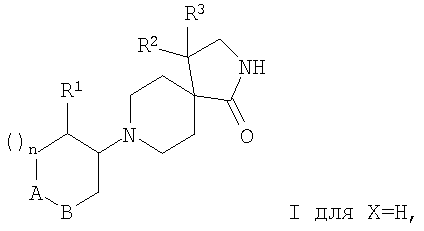
Предпочтительными соединениями формулы I являются соединения формулы

где А-В означает -СН2-СН2- или -СН2-О-;
Х означает водород или гидрокси;
R1 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом;
R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида или (низш.)алкокси;
R3 означает водород;
n означает 1,
и их фармацевтически активные соли.
Наиболее предпочтительными являются соединения, где n означает 1, а А-В означает -СН2-СН2-. Особенно предпочтительными соединениями из этой группы являются те, в которых R1 и R2 означают оба фенил, необязательно замещенный (низш.)алкилом, галоидом или CF3, например, следующие соединения:
цис-рац-4-фенил-8-(2-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-фенил-8-(2-n-толилцикогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-8-[2-(4-фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
8-[2-(4-фторфенил)-2-гидроксициклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(3-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(2-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он,
8-[2-(3-хлорфенил)-2-гидроксициклогексил]-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он или
4-(4-фторфенил)-8-транс-(4-гидрокси-4-фенилтетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он.
Кроме того, предпочтительными являются соединения, в которых Х означает водород.
Изобретение относится также к соединениям, в которых Х означает гидрокси.
Объектами по настоящему изобретению являются, кроме того, соединения, в которых n означает 1, а А-В означает -СН2-О-.
Данные соединения формулы I и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например способами, описанными ниже, которые включают
а) взаимодействие соединения формулы
с соединением формулы
с образованием соединения
где заместители имеют значения, определенные выше, или
б) взаимодействие соединения формулы
с соединением формулы

с образованием соединения формулы
где заместители имеют значения, определенные выше, или
в) при необходимости разделение рацемических форм на соответствующие энантиомеры и
при необходимости превращение полученных соединений в фармацевтически приемлемые кислотно-аддитивные соли.
Соединения формулы I могут быть получены в соответствии с вариантами способа а), б) или в) и со следующими схемами 1, 2 и 3.
Использованы следующие аббревиатуры:
ЛДА - диизопропиламид лития
ТФК - трифторуксусная кислота
ДХМ - дихлорметан
ТГФ - тетрагидрофуран
ПМГС - полиметилгидросилоксан
ДМСО - диметилсульфоксид
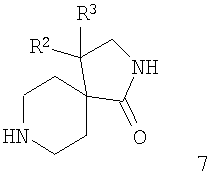
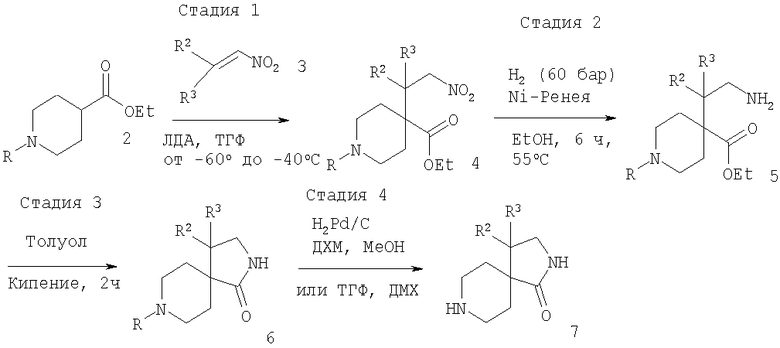
Исходя из соответствующим образом 1-замещенного пиперидин-4-алкилкарбоксилата 2, обработка с походящим основанием, обычно ЛДА, затем обработка с соответствующим образом замещенным нитроалкеном 3 приводит к нитроалкану 4. Восстановление аминогруппы, облегченное применением Ni-Ренея и водорода, обычно при давлении 60 бар и 55°С в этаноле в качестве растворителя, приводит к образованию соединения 5. Последующая циклизация путем нагревания в толуоле при кипении дает амид 6. Удаление защитной группы при стандартных условиях (обработка с ТФК в ДХМ для защитной группы R = трет-бутилоксикарбонил (Boc) или гидрогенолиз с Pd/C в ДХМ и метаноле для защитной группы R = бензил (Bn)) дает диазаспиропиперидины 7 (схема 1).
Схема 1
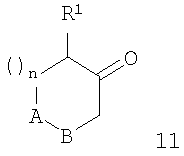
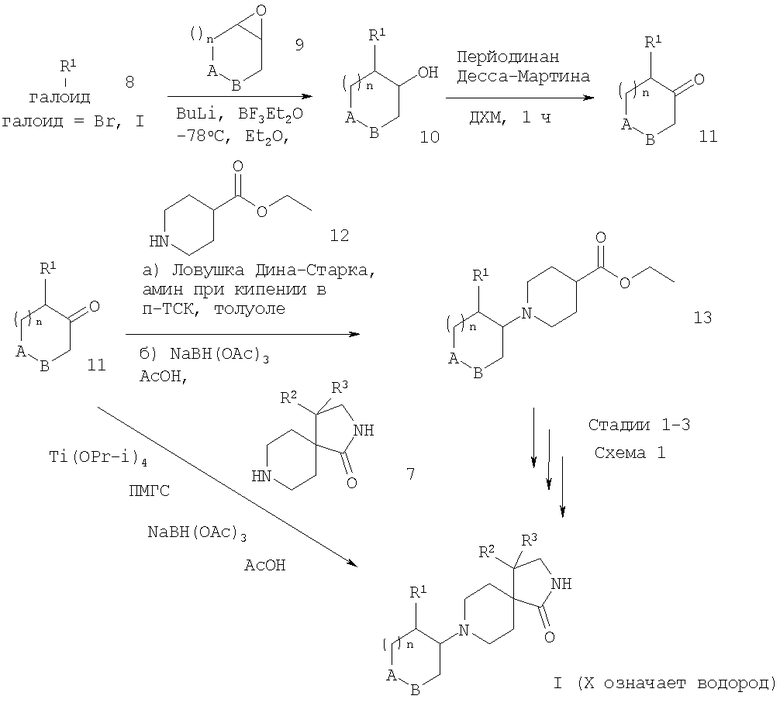
Дальнейшее взаимодействие соединений формулы 7 с соответствующими соединениями формулы 11 (которые могут быть получены реакцией арилгалоидов формулы 8 с бутиллитием и последующей реакцией с эпоксидом формулы 9 для получения спиртов формулы 10, которые окисляют в соответствующие кетоны формулы 11 с перйодинаном Десса-Мартина) в присутствии тетраизопропоксититана и триацетоксиборогидрида натрия дает соединения формулы I (схема 2). Альтернативно реакция соединений формул 7 и 11 в присутствии тетраизопропоксититана и триацетоксиборогидрида натрия (в присутствии или без ПМГС) также дает продукты формулы I. Альтернативная стратегия, при которой полное восстановительное аминирование кетонов формулы 11 с соединениями формулы 12 в приборе с ловушкой Дина-Старка дает промежуточный енамин, который может быть восстановлен in situ в соединение формулы 13. Следующие стадии 1-3, которые описаны на схеме 1, дают соединение формулы I.
Схема 2
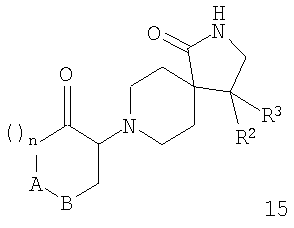
Соединения формулы I при Х=ОН получают взаимодействием соединений формулы 7 с оксидами формулы 9 в кипящем этаноле. Образующийся β-аминоспирт формулы 14 затем может быть окислен в кетон, предпочтительно с комплексом пиридин-SO3 в присутствии триэтиламина в ДМСО, давая соединения формулы 15, которые затем обрабатывают ариллитиевыми реагентами (образованные обменом галоида на металл), чтобы обеспечить подход к требуемым продуктам формулы I (схема 3).
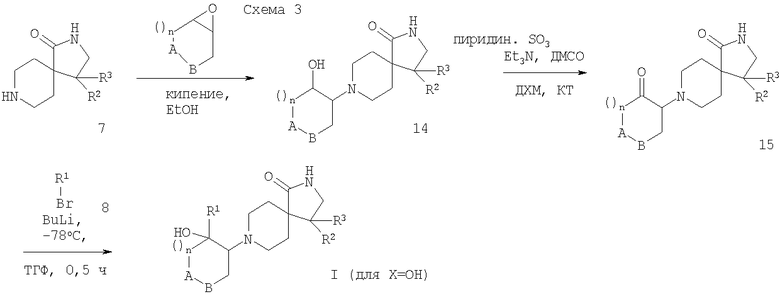
Все соединения формул 1, 4, 5, 6, 7, 11, 10, 13, 14, 15 обычно образуются в ходе последовательных реакций в равной смеси (R,R,S)-, (S,S,R)-, (R,R,R)- и (S,S,S)-энантиомеров (рацемических форм) согласно методикам, описанным ниже. Они могут разделяться на хиральные нерацемические энантиомеры препаративной ВЭЖХ с использованием колонки Chiralpak OD или AD (5×50 см) при комнатной температуре с применением мобильной фазы этанол-гептан и с УФ-детектированием при 220 нм.
Кислотно-аддитивные соли основных соединений формулы I могут быть превращены в соответствующие свободные основания путем обработки по меньшей мере стехиометрическим эквивалентом подходящего основания, такого, как гидроксид натрия или калия, карбонат калия, бикарбонат натрия, аммиак и тому подобное.
Соединения формулы I и их фармацевтически применимые кислотно-аддитивные соли обладают ценными фармакологическими свойствами. Конкретно было найдено, что соединения по настоящему изобретению являются эффективными ингибиторами глицинового переносчика-1 (GlyT-1).
Соединения исследовали в соответствии с тестом, приведенным ниже.
Растворы и материалы
Полная среда DMEM: питательная смесь F-12 (Gibco Life Technologies), 5% эмбриональной бычьей сыворотки (FBS) (Gibco Life Technologies), 1% пенициллина/стрептомицина (Gibco Life Technologies), 0,6 мг/мл гигромицина (Gibco Life Technologies), 1 мМ глутамин (Gibco Life Technologies).
Буфер поглощения (UB): 150 мМ NaCl, 10 мМ Hepes-трис, рН 7,4, 1 мМ CaCl2, 2,5 мМ KCl, 2,5 мМ MgSO4, 10 мМ (+)-D-глюкоза.
Клетки Flp-in™-CHO (по каталогу Invitrogen № R758-07), устойчиво трансфицированные кДНК mGlyT-1b.
Анализ ингибирования поглощения глицина (mGlyT-1b)
В день 1 клетки млекопитающего (Flp-in™-CHO), трансфицированные кДНК mGlyT-1b, помещали при плотности 40000 клеток/лунку в полную среду F-12 без гигромицина в 96-луночные культуральные планшеты. В день 2 среду аспирировали и клетки промывали дважды буфером поглощения (UB). Затем клетки инкубировали в течение 20 мин при 22°С с каждым из следующих вариантов: (i) без потенциального конкурента, (ii) 10 мМ нерадиоактивный глицин, (iii) одна концентрация потенциального ингибитора. Использовали диапазон концентраций потенциального ингибитора, чтобы получить данные для расчета концентрации ингибитора, приводящей к 50% эффекту (например, IC50 - концентрации конкурента, ингибирующего поглощение глицина на 50%). Затем незамедлительно прибавляли раствор, содержащий 60 нМ [3Н]-глицин (11-16 Ки/ммоль) и 25 мкМ нерадиоактивный глицин. Планшеты инкубировали при осторожном встряхивании, реакцию останавливали аспирацией смеси и промыванием (три раза) охлажденным льдом буфером UB. Клетки лизировали со сцинтилляционной жидкостью, встряхивали 1 ч и радиоактивность в клетках считали, используя сцинтилляционный счетчик.
Активность соединения в качестве ингибитора глицинового переносчика 1 (GlyT-1) зависит от его рацемической или энантиомерной формы.
Предпочтительные соединения проявляют IC50 (нМ) в отношении GlyT-1 менее 100.
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут применяться в качестве лекарственных средств, например, в форме фармацевтических композиций. Фармацевтические композиции могут быть введены перорально, например, в форме таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако введение может быть также осуществлено ректально, например, в форме суппозиториев, парентерально, например, в форме инъекционных растворов.
Соединения формулы I могут быть переработаны с фармацевтически инертными неорганическими или органическими носителями для приготовления фармацевтических композиций. Например, лактоза, кукурузный крахмал или их производные, тальк, стеариновые кислоты или их соли и т.д. могут использоваться в качестве таких носителей для таблеток, таблеток с нанесенным покрытием, драже и твердых желатиновых капсул. Соответствующими носителями для мягких желатиновых капсул являются, например, растительные масла, воск, жиры, полутвердые и жидкие полиолы и тому подобное. В зависимости от природы активного вещества никакие носители, однако, не требуются в случае мягких желатиновых капсул. Соответствующими носителями для приготовления растворов и сиропов являются, например, вода, полиолы, глицерин, растительное масло и тому подобное. Соответствующими носителями для суппозиториев являются, например, природные и затвердевшие масла, воск, жиры, полужидкие или жидкие полиолы и тому подобное.
Более того, фармацевтические композиции могут содержать консерванты, солюбилизаторы, стабилизаторы, скользящие агенты, эмульгаторы, подсластители, красители, ароматизаторы, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они могут также содержать и другие терапевтически ценные вещества.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также являются объектом по настоящему изобретению, как и способ для их получения, который включает приведение одного или нескольких соединений формулы I и/или фармацевтически приемлемых их кислотно-аддитивных солей и, если требуется, одного или нескольких терапевтически ценных веществ в галенову форму введения вместе с одним или несколькими терапевтически инертными носителями.
Наиболее предпочтительными показаниями по настоящему изобретению являются те, которые включают нарушения центральной нервной системы, например, лечение или предупреждение шизофрении, повреждение познавательной способности и болезнь Альцгеймера.
Доза может изменяться в широких пределах и, безусловно, должна будет приведена к индивидуальным требованиям в каждом конкретном случае. В случае перорального введения доза для взрослых может меняться от примерно 0,01 мг до 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли. Ежедневная доза может вводиться в виде однократной дозы или в разделенных дозах, и, кроме того, верхний предел может быть также превышен, когда это необходимо по показаниям.
Следующие примеры иллюстрируют настоящее изобретение без его ограничения. Все температуры даны в градусах Цельсия.
Получение структурных элементов 11
рац-2-(4-Фторфенил)циклогексанон
рац-2-(4-Фторфенил)циклогексанол
а) К раствору 1-бром-4-фторбензола (12,5 мл, 114 ммолей) в диэтиловом эфире (250 мл) при -78°С прибавляли бутиллитий (1,6 М, 68 мл, 109 ммолей) в атмосфере аргона. Через 5 мин при данной температуре прибавляли циклогексеноксид (11,0 мл, 109 ммолей), затем диэтилэфират трехфтористого бора (13, 8 мл, 109 ммолей), при этом температура повышалась примерно до -50°С. Через 4 ч при данной температуре реакцию прекращали добавлением хлорида аммония (насыщенного раствора, 200 мл) и разбавляли водой (50 мл). Затем продукт экстрагировали диэтиловым эфиром (3×100 мл) и объединенные органические экстракты сушили над сульфатом натрия. Фильтрация и упаривание дали приведенное в заглавии соединение (11,9 г, 56%) в виде кристаллов белого цвета после растирания в гексане. МС (m/z): 194,1 (М+).
рац-2-(4-Фторфенил)циклогексанон
bi) К раствору рац-2-(4-фторфенил)циклогексанола (3,8 г, 20 ммолей) в ДХМ (320 мл) прибавляли перйодинан Десса-Мартина [1,1,1-трис(ацетилокси)-1,1-дигидро-1,2-бензйодоксол-3(1H)-он] (10 г, 24 ммоля) при комнатной температуре и через 2 ч реакционную смесь промывали раствором бикарбоната натрия (10%, 150 мл). Затем органическую фазу отделяли и промывали раствором тиосульфита натрия (10%, 150 мл), затем сушили над сульфатом натрия, фильтровали и упаривали. Очистка хроматографией на силикагеле, элюирование смесью этилацетат-гексан (1:4) дали упомянутое в заглавии соединение (3,4 г, 89%) в виде кристаллов белого цвета. МС (m/z): 192,1 (М+).
рац-2-(4-Фторфенил)циклогексанон
bii) Альтернативно к раствору рац-2-(4-фторфенил)циклогексанола (7,5 г, 39 ммолей) в безводном ДМСО (67 мл) прибавляли триэтиламин (27 мл, 190 ммолей) в атмосфере аргона, образующуюся смесь охлаждали до 0°С и затем прибавляли по каплям в течение 15 мин раствор комплекса триоксид серы-пиридин (18,4 г, 116 ммолей) в безводном ДМСО. Через 1 ч смесь разбавляли водой (200 мл) и продукт экстрагировали ДХМ (2×100 мл). Затем объединенные органические экстракты сушили над сульфатом натрия, потом фильтровали и упаривали. Очистка фильтрацией через слой силикагеля, элюирование смесью этилацетат-гексан (1:4) дали упомянутое в заглавии соединение (7,1 г, 95%) в виде кристаллов белого цвета. МС (m/z): 192,1 (М+).
рац-2-n-Толилциклогексанон
рац-2-n-Толилциклогексанол
а) К раствору n-толилбромида (17,1 г, 100 ммолей) в безводном ТТФ (100 мл) прибавляли магний (2,43 г, 100 ммолей) и затем образующуюся смесь охлаждали до -20°С, прибавляли комплекс CuBr-диметилсульфид (2,0 г, 10 ммолей) и смесь перемешивали при -20°С в течение 10 мин. Затем прибавляли по каплям раствор циклогексеноксида (10 мл, 100 ммолей) в безводном ТГФ (10 мл) и реакционную смесь нагревали до температуры 0°С, при которой начиналась экзотермическая реакция. При охлаждении баней со льдом температура могла поддерживаться ниже 25°С. Затем реакционную смесь перемешивали при 0-5°С в течение дополнительных 2 ч, после чего «гасили» раствором хлорида аммония (насыщенным, 30 мл) и продукт экстрагировали трет-бутилметиловым эфиром. Затем объединенные органические экстракты промывали водой, сушили над сульфатом натрия, фильтровали и упаривали. Перекристаллизация из гексана дала упомянутое в заглавии соединение (9,9 г, 52%) в виде кристаллов белого цвета. МС (m/z): 190,1 (М+).
рац-2-n-Толилциклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-n-толилциклогексанол (4,86 г, 26 ммолей) превращали в соединение, указанное в заглавии (4,68 г, 97%), которое получали в виде кристаллов белого цвета. МС (m/z): 188,1 (М+).
рац-2-(4-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-бромбензотрифторид (10,0 г, 44 ммоля) превращали в соединение, указанное в заглавии (5,64 г, 52%), которое получали в виде твердого вещества белого цвета. МС (m/z): 244,1 (М+).
рац-2-(4-Трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-трифторметилфенил)циклогексанол (5,5 г, 23 ммоля) превращали в указанное в заглавии соединение (5,26 г, 96%), которое получали в виде твердого вещества белого цвета. МС (m/z): 242,1 (М+).
рац-2-(4-Трифторметоксилфенил)циклогексанон
рац-2-(4-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 1-бром-4-(трифторметокси)бензол (10,3 г, 43 ммоля) превращали в указанное в заглавии соединение (6,7 г, 60%), которое получали в виде твердого вещества белого цвета. МС (m/z): 260,1 (М+).
рац-2-(4-Трифторметоксилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-трифторметоксилфенил)циклогексанол (6,6 г, 25 ммолей) превращали в указанное в заглавии соединение (5,36 г, 82%), которое получали в виде твердого вещества белого цвета. МС (m/z): 258,2 (М+).
рац-2-(3-Фторфенил)циклогексанон
рац-2-(3-Фторфенил)циклогексанол
а) Как описано для структурного элемента 11, стадия а), 1-бром-3-фторбензол (10,0 г, 57 ммолей) превращали в указанное в заглавии соединение (5,1 г, 46%), которое получали в виде твердого вещества белого цвета. МС (m/z): 194,1 (M+).
рац-2-(3-Фторфенил)циклогексанон
Как описано для структурного элемента 11, стадия bi), рац-2-(3-фторфенил)циклогексанол (5,0 г, 26 ммолей) превращали в указанное в заглавии соединение (3,9 г, 80%), которое получали в виде твердого вещества белого цвета. МС (m/z): 192,1 (М+).
рац-2-(3-Трифторметилфенил)циклогексанон
рац-2-(3-Трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 3-бромбензотрифторид (10,0 г, 44 ммоля) превращали в указанное в заглавии соединение (4,87 г, 45%), которое получали в виде твердого вещества белого цвета. МС (m/z): 244,1 (М+).
рац-2-(3-Трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(3-трифторметилфенил)циклогексанол (4,7 г, 19 ммолей) превращали в указанное в заглавии соединение (4,34 г, 93%), которое получали в виде масла светло-желтого цвета. МС (m/z): 242,1 (М+).
рац-2-(3-Фтор-4-метилфенил)циклогексанон
рац-2-(3-Фтор-4-метилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-бром-2-фтортолуол (10,0 г, 53 ммоля) превращали в указанное в заглавии соединение (6,35 г, 58%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,3 (М+).
рац-2-(3-Фтор-4-метилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(3-фтор-4-метилфенил)циклогексанол (6,2 г, 30 ммолей) превращали в указанное в заглавии соединение (5,53 г, 91%), которое получали в виде твердого вещества белого цвета. МС (m/z): 206,1 (М+).
рац-2-(4-Метил-3-трифторметилфенил)циклогексанон
рац-2-(4-Метил-3-трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 4-метил-3-(трифторметил)бромбензол (4,2 г, 18 ммолей) превращали в указанное в заглавии соединение (1,95 г, 43%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,3 (M+).
рац-2-(4-Метил-3-трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-метил-3-трифторметилфенил)циклогексанол (1,91 г, 7 ммолей) превращали в указанное в заглавии соединение (1,8 г, 95%), которое получали в виде твердого вещества белого цвета. МС (m/z): 256,1 (M+).
рац-2-(4-Фтор-3-метилфенил)циклогексанон
рац-2-(4-Фтор-3-метилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 5-бром-2-фтортолуол (10,0 г, 53 ммоля) превращали в указанное в заглавии соединение (5,47 г, 50%), которое получали в виде твердого вещества белого цвета. МС (m/z): 208,2 (М+).
рац-2-(4-Фтор-3-метилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-фтор-3-метилфенил)циклогексанол (5,4 г, 26 ммолей) превращали в указанное в заглавии соединение (14,7 г, 88%), которое получали в виде масла светло-желтого цвета. МС (m/z): 206,1 (М+).
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанон
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанол
a) Как описано для структурного элемента 11, стадия а), 5-бром-2-хлорбензотрифторид (8,32 г, 30 ммолей) превращали в указанное в заглавии соединение (4,4 г, 52%), которое получали в виде твердого вещества белого цвета. МС (m/z): 278,1 (М+).
рац-2-(4-Хлор-3-трифторметилфенил)циклогексанон
b) Как описано для структурного элемента 11, стадия bi), рац-2-(4-хлор-3-трифторметилфенил)циклогексанол (4,3 г, 15 ммолей) превращали в указанное в заглавии соединение (4,13 г, 97%), которое получали в виде твердого вещества белого цвета. МС (m/z): 276,1 (М+).
Получение структурных элементов 7
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты
a) Раствор диизопропиллития (14 ммолей) получали обработкой диизопропиламина (1,37 г, 14 ммолей) бутиллитием (1,6 М, 8,5 мл, 14 ммолей) при -78°С в безводном ТГФ (10 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор охлаждали до -60°С, прибавляли к раствору 1-бензилпиперидин-4-этилкарбоксилата (3,05 г, 12 ммолей) в ТГФ (8 мл) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего по каплям прибавляли раствор транс-β-нитростирола (1,93 г, 13 ммолей) в ТГФ (8 мл). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч, затем прекращали реакцию добавлением раствора хлорида аммония (насыщенного, 40 мл) и продукт экстрагировали этилацетатом (2×40 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Очистка хроматографией на силикагеле при элюировании смесью дихлорметан-метанол (9:1) дала указанное в заглавии соединение (4,1 г, 84%) в виде смолы светло-желтого цвета. МС (m/z): 397,4 (М+Н)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты
b) Раствор этилового эфира рац-1-бензил-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты (3,18 г, 8 ммолей) в безводном этаноле (240 мл) гидрировали в присутствии Ni-Ренея (3 г) при давлении 60 бар и температуре 55°С в течение 3 ч. После охлаждения и снижения давления в реакционном сосуде смесь фильтровали через слой целита и фильтрат упаривали, получая в остатке указанное в заглавии соединение (2,9 г, 99%) в виде прозрачного масла. МС (m/z): 367,4 (М+Н)+.
рац-Бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-он
c) Раствор этилового эфира рац-4-(2-амино-1-фенилэтил)-1-бензилпиперидин-4-карбоновой кислоты (2,9 г, 8 ммолей) в толуоле (30 мл) нагревали при кипении в течение 4 ч. После охлаждения до комнатной температуры и упаривания смесь очищали хроматографией на силикагеле, элюируя смесью дихлорметан-метанол-гидроксид аммония (95:4,5:0,5), чтобы получить указанное в заглавии соединение (1,47 г, 58%) в виде твердого вещества белого цвета. МС (m/z): 321,4 (М+Н)+.
рац-4-Фенил-2,8-диазаспиро[4.5]декан-1-он
d) Суспензию рац-бензил-4-фенил-2,8-диазаспиро[4.5]декан-1-она (28,8 г, 90 ммолей) в смеси метанол-дихлорметан (4:1, 500 мл) гидрировали в присутствии Pd (10% на угле, 14 г, 132 ммоля) при давлении 2 бара в течение 48 ч при комнатной температуре. После фильтрации через слой целита реакционную смесь упаривали и остаток растворяли в растворе гидроксида натрия (2 н., 200 мл). Продукт экстрагировали дихлорметаном (3×150 мл) и объединенные органические экстракты сушили над сульфатом натрия. Фильтрация и упаривание дали указанное в заглавии соединение (13,1 г, 63%) в виде твердого вещества белого цвета после растирания в диэтиловом эфире. МС (m/z): 231,4 (M+H)+.
Схема 1, стадия 1: фторпроизводное из соединения с Вос-защитной группой рац-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он
4-Этиловый эфир 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты
К раствору этилового эфира 4-пиперидинкарбоновой кислоты (20 г, 127 ммолей) в смеси диоксан-вода (1:1, 120 мл) прибавляли триэтиламин (12,87 г, 127 ммолей) при 0°С, затем ди-трет-бутилдикарбонат (35,2 г, 161 ммоль) и полученную смесь выдерживали при данной температуре в течение 2 ч. Продукт затем экстрагировали этилацетатом (3×100 мл) и объединенные органические экстракты промывали хлористоводородной кислотой (1 н., 100 мл), насыщенным солевым раствором (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Очистка перегонкой в высоком вакууме (Кугельрор) дала указанное в заглавии соединение (29,0 г, 89%) в виде бесцветной жидкости, т.кип. 140°С при 0,13 мбар. МС (m/z): 275,2 (M+NH4)+.
4-Этиловый эфир 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин
1,4-дикарбоновой кислоты
b) Раствор диизопропиллития получали обработкой диизопропиламина (6,98 г, 69 ммолей) бутиллитием (1,6 М, 41,3 мл, 66 ммолей) при -78°С в безводном ТГФ (45 мл) в атмосфере аргона и давали нагреться до -20°С. Затем данный раствор охлаждали до -60°С, прибавляли к раствору 4-этилового эфира 1-трет-бутиловото эфира пиперидин-1,4-дикарбоновой кислоты (15,44 г, 60 ммолей) в безводном ТГФ (45 мл) при -60°С и давали нагреться до -40°С в течение 1 ч, после чего прибавляли по каплям раствор 4-фтор-транс-β-нитростирола (10,02 г, 60 ммолей) в безводном ТГФ (40 мл). Реакционной смеси давали нагреться до комнатной температуры в течение 1 ч и затем прекращали реакцию добавлением раствора хлорида аммония (насыщенного, 250 мл), продукт экстрагировали диэтиловым эфиром (3×100 мл). Объединенные органические экстракты затем промывали насыщенным солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в заглавии соединение (26,7 г, 99%) в виде смолы светло-желтого цвета. МС (m/z): 442,4 (M+NH4)+.
Этиловый эфир рац-4-(2-амино-1-фенилэтил)-1-трет-бутилпиперидин-1,4-дикарбоновой кислоты
c) Раствор 4-этилового эфира 1-трет-бутилового эфира рац-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин-1,4-дикарбоновой кислоты (26,6 г, 60 ммолей) в безводном этаноле (600 мл) гидрировали в присутствии Ni-Ренея (25 г) при 50 давлении бар и температуре 50°С в течение 20 ч. После охлаждения и снижения давления в реакционном сосуде смесь фильтровали через слой целита и фильтрат упаривали, оставляя указанное в заголовке соединение (23,4 г, 99%) в виде прозрачного масла, которое использовали непосредственно на следующей стадии.
трет-Бутиловый эфир рац-4-(4-фторфенил)-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты
d) Раствор этилового эфира рац-4-(2-амино-1-фенилэтил)-1-трет-бутилпиперидин-1,4-дикарбоновой кислоты (23,4 г, 60 ммолей) в толуоле (200 мл) нагревали при кипении в течение 18 ч. После охлаждения до комнатной температуры упаривание дало указанное в заглавии соединение (17,17 г, 83%) в виде твердого вещества белого цвета после растирания в горячем пентане. МС (m/z): 349,3 (М+Н)+.
рац-4-(4-Фторфенил)-2,8-диазаспиро[4.5]декан-1-он
e) Раствор трет-бутилового эфира рац-4-(4-фторфенил)-1-оксо-2,8-диазаспиро[4.5]декан-8-карбоновой кислоты (46,0 г, 132 ммоля) в дихлорметане (260 мл), содержащем трифторуксусную кислоту (150 мл, 1,32 моля), энергично перемешивали при 0°С в течение 15 мин. Реакционную смесь затем выливали в раствор гидроксида натрия (3 н., 200 мл) и продукт экстрагировали дихлорметаном (3×100 мл). Затем объединенные органические экстракты промывали водой (100 мл), насыщенным солевым раствором (100 мл) и затем сушили над сульфатом натрия. Фильтрование и упаривание раствора дали указанное в заголовке соединение (22,14 г, 68%) в виде твердого вещества белого цвета после затирания в этилацетате. МС (m/z): 249,2 (М+Н)+.
Пример 1
цис-рац-4-Фенил-8-(2-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-(2-фенилциклогексил)пиперидин-4-карбоновой кислоты
a) Раствор этилового эфира 4-пиперидинкарбоновой кислоты (3,7 г, 24 ммоля), 2-фенилциклогексанона (5,0 г, 29 ммолей) в толуоле, содержащем n-толуолсульфокислоту (446 мг, 2 ммоля), нагревали при кипении в приборе с насадкой Дина-Старка в течение 13 ч. После охлаждения до комнатной температуры смесь упаривали, оставляя приблизительно 15 мл раствора, и затем разбавляли 1,2-дихлорэтаном (120 мл), после чего прибавляли уксусную кислоту (0,95 мл) с последующим прибавлением порциями триацетоксиборогидрида натрия (7,3 г, 33 ммоля). Через 3,5 ч смесь "гасили" раствором гидроксида натрия (3 н., 50 мл), разбавляли водой (50 мл) и органический слой отделяли. Затем органический слой сушили и упаривали, оставляя остаток, который очищали хроматографией на силикагеле, элюируя смесью гептан-этилацетат (9:1) до (4:1) и (3:2), получая указанное в заглавии соединение в виде масла светло-желтого цвета (5,5 г, 75%). МС (m/z): 316,2 (М+Н)+.
Этиловый эфир цис-рац-4-(2-нитро-1-фенилэтил)-1-(2-фенилциклогексил)пиперидин-4-карбоновой кислоты
b) Как описано для структурного элемента 7, стадия а), этиловый эфир 1-(2-фенилциклогексил)пиперидин-4-карбоновой кислоты (1,0 г, 3 ммоля) превращали в указанное в заглавии соединение (1,1 г, 73%), которое получали в виде не совсем белого твердого вещества. МС (m/z): 465,4 (М+Н)+.
цис-рац-4-Фенил-8-(2-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
c) Как описано для структурного элемента 7, стадия b), этиловый эфир 4-(2-нитро-1-фенилциклогексил)пиперидин-4-карбоновой кислоты (1,0 г, 2 ммоля) превращали в аминопроизводное (810 мг, 87%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 435,4 (М+Н)+.
d) Как описано для структурного элемента 7, стадия с), аминопроизводное (810 мг, 2 ммоля) превращали в указанное в заглавии соединение (607 мг, 93%), которое получали в виде твердого вещества белого цвета. МС (m/z): 389,4 (M+H)+.
Пример 2
цис-рац-4-Фенил-8-(2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Смесь рац-2-n-толилциклогексанона (410 мг, 2 ммоля), рац-4-фенил-2,8-диазаспиро[4.5]декан-1-она (502 мг, 2 ммоля) и тетраизопропоксититана (810 мкл, 3 ммоля) перемешивали при комнатной температуре в течение 3 ч. Смесь затем разбавляли тетрагидрофураном (5 мл) и затем прибавляли раствор полиметилгидросилоксана (261 мг, 4 ммоля) в тетрагидрофуране (5 мл), полученный раствор перемешивали в течение ночи. К данному раствору прибавляли цианоборогидрид натрия (245 мг) и полученную смесь перемешивали при комнатной температуре в течение 3 ч. Затем прибавляли раствор гидроксида натрия (3 М, 10 мл) и смесь перемешивали в течение 1 ч. Образовавшийся осадок потом отделяли фильтрованием через слой целита, фильтрат промывали насыщенным солевым раствором, сушили и упаривали, оставляя пену светло-желтого цвета. Очистка хроматографией на силикагеле, элюирование смесью дихлорметан-метанол-водный аммиак (25%) (98:2:0,1 до 95:4,5:0,5) дали указанное в заглавии соединение (250 мг, 29%), которое получали в виде твердого вещества белого цвета. МС (m/z): 403,6 (М+Н)+.
Пример 3
цис-рац-4-(4-Фторфенил)-8-(2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты
а) Как описано для примера 1а, рац-2-n-толилциклогексанон (4,2 г, 22 ммоля) превращали в указанное в заглавии соединение (3,7 г, 48%), которое получали в виде масла светло-желтого цвета. МС (m/z): 330,4 (М+Н)+.
Этиловый эфир цис-рац-4-[1-(4-фторфенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты
b) Как описано для примера 1b, этиловый эфир цис-рац-1-(1-n-толилциклогексил)пиперидин-4-карбоновой кислоты (700 мг, 2 ммоля) превращали в указанное в заглавии соединение (880 мг, 83%), которое получали в виде смолы желтого цвета. МС (m/z): 497,3 (М+Н)+.
цис-рац-4-(4-Фторфенил)-8-(2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
c) Как описано для примера 1с, этиловый эфир цис-рац-4-[1-(4-фторфенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты (880 мг, 2 ммоля) превращали в аминопроизводное (670 мг, 81%), которое получали в виде смолы желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 467,3 (М+Н)+.
d) Как описано для примера 1d, аминопроизводное (665 мг, 1 ммоль) превращали в указанное в заглавии соединение (130 мг, 22%), которое получали в виде твердого вещества светло-желтого цвета. МС (m/z): 421,2 (М+Н)+.
Пример 4
цис-рац-4-(3,4-Дихлорфенил)-8-(2-n-толилциклогексил)-2,8-диазоспиро[4.5]декан-1-он
Этиловый эфир цис-рац-4-[1-(3,4-дихлорфенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты
a) Как описано для примера 1b, этиловый эфир рац-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты (700 мг, 2 ммоля) превращали в указанное в заглавии соединение (772 мг, 66%), которое получали в виде твердого вещества желтого цвета. МС (m/z): 547,2 (М)+.
b) Как описано для примера 1с, этиловый эфир цис-рац-4-[1-(3,4-дихлорфенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты (772 мг, 1 ммоль) превращали в указанное в заглавии соединение (43 мг, 6%), которое получали в виде смолы желтого цвета. МС (m/z): 471,3 (М)+.
Пример 5
цис-рац-4-(4-Метоксифенил)-8-(2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-4-[1-(4-метоксифенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты
a) Как описано для примера 1b, этиловый эфир рац-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты (700 мг, 2 ммоля) превращали в указанное в заглавии соединение (620 мг, 57%), которое получали в виде смолы желтого цвета. МС (m/z): 509,4 (М+Н)+.
цис-рац-4-(4-Метоксифенил)-8-(2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для примера 1с, этиловый эфир цис-рац-4-[1-(4-метоксифенил)-2-нитроэтил]-1-(2-n-толилциклогексил)пиперидин-4-карбоновой кислоты (620 мг, 1 ммоль) превращали в указанное в заглавии соединение (410 мг, 70%), которое получали в виде смолы желтого цвета. МС (m/z): 433,5 (М+Н)+.
Пример 6
цис-рац-8-[2-(4-фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 2, рац-2-(4-фторфенил)циклогексанон (417 мг, 2 ммоля) превращали в указанное в заглавии соединение (150 мг, 17%) (используя 4-фенил-2,8-диазаспиро[4.5]декан-1-он вместо 4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-она), которое получали в виде твердого вещества белого цвета. МС (m/z): 407,5 (М+Н)+.
В качестве альтернативы
цис-рац-8-[2-(4-Фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты
а) Как описано для примера 1b, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты (800 мг, 2,4 ммоля) превращали в указанное в заглавии соединение (677 мг, 59%), которое получали в виде смолы светло-желтого цвета. МС (m/z): 483,3 (М)+.
цис-рац-8-[2-(4-Фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для примера 1с, этиловый эфир 1-[2-(4-фторфенил)циклогексил]-4-(2-нитро-1-фенилэтил)пиперидин-4-карбоновой кислоты (627 мг, 1,3 ммоля) превращали в аминопроизводное (497 мг, 85%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 453,6 (М)+.
c) Как описано для примера 1d, аминопроизводное (497 мг, 1,1 ммоля) превращали в указанное в заглавии соединение (197 мг, 44%), которое получали в виде твердого не совсем белого вещества. МС (m/z): 407,3 (М+Н)+.
Пример 7
цис-рац-4-(4-Фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты
a) Как описано для примера 1а, рац-2-(4-фторфенил)циклогексанон (7,0 г, 36 ммолей) превращали в указанное в заглавии соединение (4,5 г, 38%), которое получали в виде масла светло-желтого цвета. МС (m/z): 334,3 (М+Н)+.
Этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]-4-[1-(4-фторфенил-2-нитроэтил]пиперидин-4-карбоновой кислоты
b) Как описано для примера 1b, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты (1,0 г, 3 ммоля) (используя 4-фтор-транс-β-нитростирол вместо транс-β-нитростирола) превращали в указанное в заглавии соединение (1,2 г, 77%), которое получали в виде твердого вещества белого цвета. МС (m/z): 501,4 (М+Н)+.
цис-рац-4-(4-Фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
c) Как описано для примера 1с, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]-4-[1-(4-фторфенил)-2-нитроэтил]пиперидин-4-карбоновой кислоты (1,1 г, 2 ммоля) превращали в аминопроизводное (1,0 г, 99%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 471,3 (М+Н)+.
d) Как описано для примера 1d, аминопроизводное (1,05 г, 2 ммоля) превращали в указанное в заглавии соединение (670 мг, 71%), которое получали в виде твердого вещества белого цвета. МС (m/z): 425,2 (М+Н)+.
цис-рац-4-(4-Фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
e) Альтернативно смесь рац-2-(4-фторфенил)циклогексанона (775 мг, 3 ммоля), рац-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-она (500 мг, 3 ммоля) и тетраизопропоксититана (887 мкл, 3 ммоля) перемешивали при 60°С в течение ночи. Образующийся раствор затем охлаждали до комнатной температуры, прибавляли цианоборогидрид натрия (245 мг, 4 ммоля) и полученную смесь перемешивали при 50°С в течение 3 ч. Затем прибавляли раствор гидроксида натрия (6 М, 15 мл) и смесь перемешивали в течение 1 ч. Затем полученную смесь фильтровали через слой целита, фильтрат промывали насыщенным солевым раствором, сушили и упаривали, получая в остатке пену светло-желтого цвета. Очистка хроматографией на силикагеле, элюирование смесью дихлорметан-метанол-водный аммиак (25%) (98:2:0,1 до 95:4,5:0,5) дали указанное в заглавии соединение в виде твердого вещества белого цвета. МС (m/z): 425,2 (М+Н)+.
цис-рац-4-(4-Фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
f) Альтернативно, как описано для примера 2, рац-2-(4-фторфенил)циклогексанон (500 мг, 3 ммоля) превращали в указанное в заглавии соединение (219 мг, 20%), которое получали в виде твердого вещества белого цвета. МС (m/z): 425,2 (М+Н)+.
Пример 8
цис-рац-4-(3,4-Дихлорфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-4-[1-(3,4-дихлорфенил)-2-нитроэтил]-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты
а) Как описано для примера 1b, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты (800 мг, 2,4 ммоля) (используя 3,4-дихлор-ω-нитростирол вместо транс-β-нитростирола) превращали в указанное в заглавии соединение (779 мг, 59%), которое получали в виде пены светло-желтого цвета. МС (m/z): 551,3 (М)+.
цис-рац-4-(3,4-Дихлорфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для примера 1с, этиловый эфир цис-рац-4-[1-(3,4-дихлорфенил)-2-нитроэтил]-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты (729 мг, 1,3 ммоля) превращали в аминопроизводное (646 мг, 93%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии.
c) Как описано для примера 1d, аминопроизводное (646 мг, 1,2 ммоля) превращали в указанное в заглавии соединение (270 мг, 46%), которое получали в виде не совсем белого твердого вещества. МС (m/z): 475,2 (М)+.
Пример 9
цис-рац-8-[2-(4-Фторфенил)циклогексил]-4-(4-метоксифенил)-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]-4-[1-(4-метоксифенил)-2-нитроэтил]пиперидин-4-карбоновой кислоты
a) Как описано для примера 1b, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]пиперидин-4-карбоновой кислоты (800 мг, 2,4 ммоля) (используя 4-метокси-β-нитростирол вместо транс-β-нитростирола) превращали в указанное в заглавии соединение (642 мг, 52%), которое получали в виде пены светло-желтого цвета. МС (m/z): 513,4 (М+Н)+.
цис-рац-4-(3,4-Дихлорфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для примера 1с, этиловый эфир цис-рац-1-[2-(4-фторфенил)циклогексил]-4-[1-(4-метоксифенил)-2-нитроэтил] пиперидин-4-карбоновой кислоты (601 мг, 1,2 ммоля) превращали в аминопроизводное (523 мг, 92%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 483,5 (М+Н)+.
c) Как описано для примера 1d, аминопроизводное (523 мг, 1,1 ммоля) превращали в указанное в заглавии соединение (216 мг, 46%), которое получали в виде пены белого цвета. МС (m/z): 437,3 (М+Н)+.
Пример 10
цис-рац-4-(4-Фторфенил)-8-[2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Этиловый эфир цис-рац-1-[2-(4-трифторметилфенил)циклогексил]пиперидин-4-карбоновой кислоты
a) Как описано для примера 1а, рац-2-(4-трифторметилфенил)циклогексанон (5,0 г, 21 ммоль) превращали в указанное в заглавии соединение (2,7 г, 34%), которое получали в виде масла светло-желтого цвета. МС (m/z): 384,2 (М+Н)+.
Этиловый эфир цис-рац-4-[1-(4-фторфенил)-2-нитроэтил]-1-[2-(4-трифторметилфенил)циклогексил]пиперидин-4-карбоновой кислоты
b) Как описано для примера 1b, этиловый эфир 1-[2-(4-трифторметилфенил)циклогексил]пиперидин-4-карбоновой кислоты (1,0 г, 3 ммоля) превращали в указанное в заглавии соединение (610 мг, 43%), которое получали в виде масла светло-желтого цвета. МС (m/z): 551,3 (М+Н)+.
цис-рац-4-(4-Фторфенил)-8-[2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
c) Как описано для примера 1с, этиловый эфир 4-[1-(4-фторфенил)-2-нитроэтил]-1-[2-(4-трифторметилфенил)циклогексил]пиперидин-4-карбоновой кислоты (610 мг, 1 ммоль) превращали в аминопроизводное (345 мг, 60%), которое получали в виде масла светло-желтого цвета и использовали непосредственно на следующей стадии. МС (m/z): 521,4 (М+Н)+.
d) Как описано для примера 1d, аминопроизводное (345 мг, 1 ммоль) превращали в указанное в заглавии соединение (268 мг, 85%), которое получали в виде твердого вещества белого цвета. МС (m/z): 475,4 (М+Н)+.
Получение структурных элементов 15
рац-8-(2-Оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он
рац-8-(2-Гидроксициклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он
а) Суспензию рац-4-фенил-2,8-диазаспиро[4.5]декан-1-она (13,10 г, 56,9 ммоля) и 7-оксабицикло[4.1.0]гептана (5,58 г, 56,9 ммоля) в этаноле (250 мл) нагревали при кипении в течение 3 суток. После охлаждения до комнатной температуры смесь фильтровали и фильтрат упаривали, выделяя указанное в заглавии соединение (18,14 г, 97%), которое получали в виде не совсем белого твердого вещества. МС (m/z): 329,3 (М+Н)+.
рац-8-(2-Оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для структурного элемента 11, стадия bi), 8-(2-гидрксициклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он (18,10 г, 55,0 ммолей) превращали в указанное в заглавии соединение (15,26 г, 76%), которое получали в виде твердого вещества светло-желтого цвета после растирания в горячем диэтиловом эфире. МС (m/z): 327,2 (М+Н)+.
рац-4-(4-Фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он
рац-4-(4-Фторфенил)-8-(2-гидроксициклогексил)-2,8-диазаспиро[4.5]декан-1-он
a) Как описано для структурного элемента 15, стадия а), рац-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он (8,45 г, 34,0 ммоля) превращали в указанное в заглавии соединение (11,63 г, 99%), которое получали в виде не совсем белого твердого вещества МС (m/z): 347,0 (М+Н)+.
рац-4-(4-Фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для структурного элемента 15, стадия b), 4-(4-фторфенил)-8-(2-гидроксициклогексил)-2,8-диазаспиро[4.5]декан-1-он (2,06 г, 6,0 ммолей) превращали в указанное в заглавии соединение (1,26 г, 59%), которое получали в виде твердого вещества светло-желтого цвета после очистки хроматографией на силикагеле при элюировании смесью дихлорметан-метанол (95:5 до 85:15). МС (m/z): 345,2 (М+Н)+.
Пример 11
8-[2-(4-Фторфенил)-2-гидроксициклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
К раствору 1-бром-4-фторбензола (1,4 г, 8 ммолей) в безводном ТГФ (5 мл) в атмосфере аргона при -78°С прибавляли раствор бутиллития (1,6 М в гексане, 5 мл, 8 ммолей) и смесь поддерживали при данной температуре в течение 1 ч. К данному раствору прибавляли раствор 8-(2-оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-она (687 мг, 2 ммоля) в безводном ТГФ (15 мл) и реакционной смеси давали нагреться до -20°С за 2 ч перед прибавлением раствора хлористого аммония (насыщенного, 20 мл). Затем реакционную смесь упаривали, прибавляли воду (20 мл). Продукт экстрагировали этилацетатом (3×15 мл), объединенные органические экстракты промывали насыщенным солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и упаривали, получая в остатке твердое вещество светло-коричневого цвета. Очистка хроматографией на силикагеле при элюировании смесью дихлорметан-метанол-водный аммиак (0,5%) (95:5 до 4:1) дала указанное в заглавии соединение (380 мг, 45%), которое получали в виде твердого вещества белого цвета. МС (m/z): 423,5 (М+Н)+.
Пример 12
8-[2-(3-Фторфенил)-2-гидроксициклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано в примере 11, 8-(2-оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он (500 мг, 1,53 ммоля) превращали в указанное в заглавии соединение (348 мг, 50%) (используя 3-бромфторбензол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 423,5 (М+Н)+.
Пример 13
8-[2-Гидрокси-2-(4-метоксифенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 8-(2-оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он (500 мг, 1,53 ммоля) превращали в указанное в заглавии соединение (88 мг, 15%) (используя 4-броманизол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 435,6 (М+Н)+.
Пример 14
8-[2-Гидрокси-2-(3-метоксифенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 8-(2-оксоциклогексил)-4-фенил-2,8-диазаспиро[4.5]декан-1-он (500 мг, 1,53 ммоля) превращали в указанное в заглавии соединение (411 мг, 69%) (используя 3-броманизол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 435,4 (М+Н)+.
Пример 15
4-(4-Фторфенил)-8-[2-(3-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (195 мг, 76%) (используя 1-бром-3-фторбензол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета.
Пример 16
4-(4-Фторфенил)-8-[2-(2-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (178 мг, 70%) (используя 2-бромфторбензол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z):441,2 (M+H)+.
Пример 17
8-[2-(3-(Хлорфенил)-2-гидроксициклогексил]-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (205 мг, 77%) (используя 1-бром-3-хлорбензол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 457,3 (M)+.
Пример 18
4-{2-[4-(4-Фторфенил)-1-оксо-2,8-диазаспиро[4.5]дец-8-ил]-1-гидроксициклогексил} бензонитрил
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (118 мг, 45%) (используя 4-бромбензонитрил вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 448,2 (М+Н)+.
Пример 19
4-(4-Фторфенил)-8-[2-гидрокси-2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (271 мг, 95%) (используя 4-бромбензотрифторид вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 491,2 (M+H)+.
Пример 20
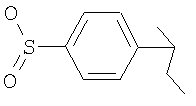
4-(4-Фторфенил)-8-[2-гидрокси-2-(4-метансульфонилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (16 мг, 6%) (используя 4-бромфенилметилсульфон вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 501,5 (М+Н)+.
Пример 21
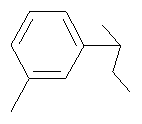
4-(4-Фторфенил)-8-(2-гидрокси-2-n-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (178 мг, 70%) (используя 4-бромтолуол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 437,4 (М+Н)+.
Пример 22
4-(4-Фторфенил)-8-(2-гидрокси-м-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (229 мг, 90%) (используя 3-бромтолуол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 437,3 (M+H)+.
Пример 23
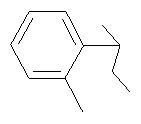
4-(4-Фторфенил)-8-(2-гидрокси-о-толилциклогексил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (158 мг, 62%) (используя 2-бромтолуол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 437,4 (М+Н)+.
Пример 24
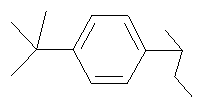
8-[2-(4-трет-Бутилфенил)-2-гидроксициклогексил]-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (192 мг, 69%) (используя 1-бром-4-трет-бутилбензол вместо 1-бром-1-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 479,6 (М+Н)+.
Пример 25
4-(4-Фторфенил)-8-[2-гидрокси-2-(2-трифторметоксифенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (216 мг, 0,63 ммоль) превращали в указанное в заглавии соединение (209 мг, 66%) (используя 1-бром-2-(трифторметокси)бензол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 507,3 (М+Н)+.
Пример 26
4-(4-Фторфенил)-8-[2-гидрокси-2-(4-имидазол-1-илфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (344 мг, 1,0 ммоль) превращали в указанное в заглавии соединение (231 мг, 47%) (используя 1-(4-бромфенил)имидазол вместо 1-бром-1-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 489,3 (М+Н)+.
Пример 27
4-(4-Фторфенил)-8-[2-гидрокси-2-(4-метоксифенил)циклогексил]-2,8-диазаспиро[4.5] декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (517 мг, 1,5 ммоль) превращали в указанное в заглавии соединение (568 мг, 84%) (используя 4-броманизол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 453,3 (М+Н)+.
Пример 28
4-(4-Фторфенил)-8-[2-гидрокси-2-(4-метоксифенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он
Как описано для примера 11, 4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (200 мг, 1 ммоль) превращали в указанное в заглавии соединение (199 мг, 76%) (используя 3-броманизол вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 453,3 (М+Н)+.
Пример 29
4-(4-Фторфенил)-8-транс-(4-гидрокси-4-фенилтетрагидропиран-3-ил)-2,8-диазаспиро[4.5] декан-1-он
4-(4-Фторфенил)-8-транс-(4-гидрокситетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он
a) Как описано для примера 12а, (R)-4-(4-фторфенил)-8-(2-оксоциклогексил)-2,8-диазаспиро[4.5]декан-1-он (100 мг, 0,4 ммоля) превращали в указанное в заглавии соединение (57 мг, 41%) (используя 3,5-эпокситетрагидрофуран вместо оксабицикло[4.1.0]гептана), которое получали в виде твердого вещества белого цвета после очистки хроматографией на силикагеле, элюируя смесью дихлорметан-метанол (9:1). МС (m/z): 349,2 (М+Н)+.
4-(4-Фторфенил)-8-(4-оксотетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он
b) Как описано для структурного элемента 11, стадия bi), 4-(4-фторфенил)-8-транс-(4-гидрокситетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он (128 мг, 0,37 ммоля) превращали в указанное в заглавии соединение (100 мг, 79%), которое получали в виде твердого вещества белого цвета после очистки хроматографией на силикагеле, элюируя смесью дихлорметан-метанол (9:1). МС (m/z): 347,4 (М+Н)+.
4-(4-Фторфенил)-8-транс-(4-гидрокси-4-фенилтетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он
с) Как описано для примера 11, 4-(4-фторфенил)-8-(4-оксотетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он (90 мг, 0,26 ммоля) превращали в указанное в заглавии соединение (65 мг, 59%) (используя фениллитий вместо 1-бром-4-фторбензола), которое получали в виде твердого вещества белого цвета. МС (m/z): 425,4 (М+Н)+.







































Состав таблетки (влажная грануляция)
Методика получения
1. Смешать вещества по пунктам 1, 2, 3 и 4 и гранулировать с очищенной водой.
2. Сушить гранулят при 50°С.
3. Пропустить гранулы через соответствующее измельчающее оборудование.
4. Прибавить вещество по пункту 5 и перемешать в течение трех мин; подвергнуть сжатию на соответствующем прессе.
Состав капсулы
Методика приготовления
1. Смешивать вещества по пунктам 1, 2 и 3 в соответствующем миксере в течение 30 мин.
2. Добавить вещества по пунктам 4 и 5 и перемешивать в течение 3 мин.
3. Загрузить в соответствующую капсулу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАЗАСПИРОПИПЕРИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ГЛИЦИНОВОГО ПЕРЕНОСЧИКА 1 И ГЛИЦИНОВОГО ПЕРЕНОСЧИКА 2 | 2004 |
|
RU2351599C2 |
| СПИРО-КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИПЕРИДИНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛИЕВОГО КАНАЛА НАРУЖНОГО МЕДУЛЛЯРНОГО СЛОЯ | 2013 |
|
RU2642066C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2019 |
|
RU2809257C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ | 2010 |
|
RU2506266C2 |
| 2-АМИНОБЕНЗОТИАЗОЛИЛМОЧЕВИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ АДЕНОЗИНА | 2002 |
|
RU2311905C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНБЕНЗОЛСУЛЬФАМИДА | 2004 |
|
RU2330842C2 |
| СПИРОАЗАЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ АКТИВНОСТИ ИЛИ АКТИВАЦИИ СЕРОТОНИНОВОГО 5-НТ2А РЕЦЕПТОРА, СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНЕННОГО СОСТОЯНИЯ, СВЯЗАННОГО С СЕРОТОНИНОВЫМ 5-НТ2А РЕЦЕПТОРОМ, И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2315051C2 |
| АЗАЦИКЛИЧЕСКИЕ СПИРОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ HSL | 2011 |
|
RU2567395C2 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИДИН-2-ОНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1994 |
|
RU2133743C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ ПРОСТОГО ЭФИРА ИЗОКСАЗОЛИЛА В КАЧЕСТВЕ ПАМ ГАМК A АЛЬФА5 | 2019 |
|
RU2800160C2 |
Настоящее изобретение относится к новым производным диазаспиропиперидина формулы I
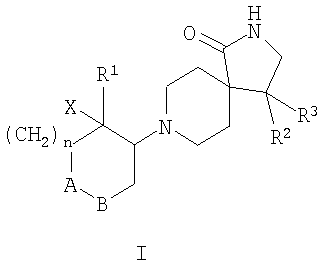
где А-В означает -CH2-СН2-, -СН2-O- или -O-СН2-;
Х означает водород или гидрокси; R1 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом, содержащим два атома азота; R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси; R3 означает водород или (низш.)алкил; n означает 0, 1 или 2, и их фармацевтически активным солям. Изобретение также относится к лекарственному средству на основе соединений формулы I, а также к их применению для получения лекарственного средства для лечения неврологических и нейропсихиатрических заболеваний. 3 н. и 9 з.п. ф-лы., 1 табл.
1. Соединения общей формулы I
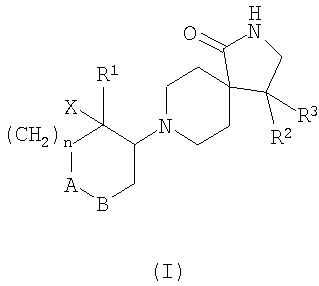
где А-В означает -СН2-CH2-, -СН2-О- или -O-СН2-;
Х означает водород или гидрокси;
R1 означает арил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом, содержащим два атома азота;
R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида, (низш.)алкила, CF3 или (низш.)алкокси;
R3 означает водород или (низш.)алкил;
n означает 0, 1 или 2,
и их фармацевтически активные соли.
2. Соединения формулы I согласно п.1
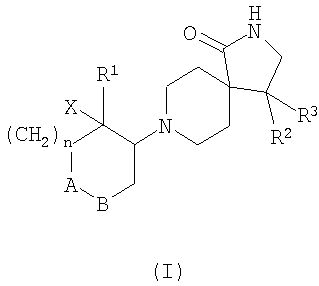
где А-В означает -CH2-СН2- или -СН2-O-;
Х означает водород или гидрокси;
R1 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида (низш.)алкила, циано, CF3, -OCF3, (низш.)алкокси, -SO2-(низш.)алкила, или гетероарилом, содержащим два атома азота;
R2 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, состоящей из галоида или (низш.)алкокси;
R3 означает водород;
n означает 1,
и их фармацевтически активные соли.
3. Соединения формулы I согласно п.2, где А-В означает -СН2-СН2-.
4. Соединения формулы I согласно п.3, где R1 и R2 означают оба фенил, необязательно замещенный (низш.)алкилом, галоидом или CF3.
5. Соединения формулы I согласно п.4, где соединения означают
цис-рац-4-фенил-8-(2-фенилциклогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-фенил-8-(2-n-толилцикогексил)-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-8-[2-(4-фторфенил)циклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-фторфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
цис-рац-4-(4-фторфенил)-8-[2-(4-трифторметилфенил)циклогексил]-2,8-диазаспиро[4.5]декан-1-он,
8-[2-(4-фторфенил)-2-гидроксициклогексил]-4-фенил-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(3-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4.5]декан-1-он,
4-(4-фторфенил)-8-[2-(2-фторфенил)-2-гидроксициклогексил]-2,8-диазаспиро[4,5]декан-1-он,
8-[2-(3-хлорфенил)-2-гидроксициклогексил]-4-(4-фторфенил)-2,8-диазаспиро[4.5]декан-1-он или
4-(4-фторфенил)-8-транс-(4-гидрокси-4-фенилтетрагидропиран-3-ил)-2,8-диазаспиро[4.5]декан-1-он.
6. Соединения формулы I согласно п.1, где Х означает водород.
7. Соединения формулы I согласно п.1, где Х означает гидроксигруппу.
8. Соединения формулы I согласно п.2, где А-В означает -СН2-O-.
9. Лекарственное средство, ингибирующее поглощение глицина, содержащее одно или несколько соединений по п.1, и фармацевтически приемлемые наполнители.
10. Лекарственное средство по п.9 для лечения заболеваний, при которых может быть полезно ингибирование поглощения глицина.
11. Лекарственное средство по пп.9 и 10, где заболеваниями являются психозы, боль, дисфункция запоминания и обучения, шизофрения, деменция и другие заболевания, при которых нарушена познавательная способность, такие, как синдром дефицита внимания или болезнь Альцгеймера.
12. Применение соединения по п.1 для получения лекарственного средства, предназначенного для лечения психозов, боли, нейродегенеративной дисфункции запоминания и обучения, шизофрении, деменции и других заболеваний, при которых нарушена познавательная способность, таких, как синдром дефицита внимания или болезнь Альцгеймера.
| АТЕПГГС- ... -eiie^r^itcj-.g МвйК'котгггА | 0 |
|
SU194346A1 |
| WO 03010138 A2, 06.02.2003 | |||
| WO 03049741 A1, 19.06.2003 | |||
| ПРОИЗВОДНЫЕ СПИРО[ИЗОХИНОЛИН-4(1Н),3-ПИРРОЛИДИН]-1,2',3,5'[2Н]ТЕТРОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ОСЛОЖНЕНИЙ, СВЯЗАННЫХ С САХАРНЫМ ДИАБЕТОМ | 1991 |
|
RU2110518C1 |
Авторы
Даты
2009-05-20—Публикация
2004-12-30—Подача