ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, действующим на моноаминовые рецепторы, включая серотониновые рецепторы. Конкретно, в изобретении предоставлены соединения, проявляющие активность в качестве обратных агонистов, и следовательно, также в качестве антагонистов по отношению к подтипу 5-НТ2А серотониновых рецепторов человека. Кроме того, в изобретении предлагаются способы, применение соединений данного изобретения для модулирования опосредованных 5-НТ2А рецепторами событий, применимых для лечения или облегчения болезненных состояний, при которых изменение активности данных рецепторов является благотворным.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Серотонин или 5-гидрокситриптамин (5-НТ) играет значительную роль в функционировании организма млекопитающего. В центральной нервной системе 5-НТ является важным нейромедиатором и нейромодулятором, который участвует в таких различных процессах и реакциях, как сон, питание, движение, ощущение боли, обучение и память, сексуальное поведение, контролирование температуры тела и давления крови. В позвоночнике серотонин играет важную роль в системах регулирования афферентных периферических болевых рецепторов (Mouligner, Rev. Neurol. 150:3-15, (1994)). Кроме того, 5-НТ приписывают периферические функции в сердечно-сосудистой, гематологической и желудочно-кишечной системах. Было найдено, что при посредстве 5-НТ происходит множество сократительных, секреторных и электрофизиологических эффектов, включая сокращение сосудистых и несосудистых гладких мышц и агрегацию тромбоцитов (Filler, Biology of Serotonin Transmission, 1982; (1973)). 5-НТ2А подтип рецептора (называемый также подклассом) широко, но все же дискретно, экспрессирован в мозге человека, включая многие кортикальные, краевые и переднемозговые области, которые, как постулируется, принимают участие в модулировании более высоких познавательных и эмоциональных функций. Данный подтип рецептора также экспрессирован на зрелых тромбоцитах, где при его посредстве частично происходит агрегация тромбоцитов, одна из начальных стадий в процессе сосудистого тромбоза. Учитывая широкое распределение серотонина в организме, существует огромный интерес к лекарствам, оказывающим воздействие на серотонинергические системы (Gershon, et al., The Peripheral Actions of 5-Hydroxytryptamine, 246 (1989); Saxena, et al., J. Cardiovascular Pharmacol. 15: Supp. 7 (1990)).
Серотониновые рецепторы являются членами большого семейства мембраносвязывающих белков генов человека, функционирующих в качестве преобразователей межклеточного взаимодействия. Они существуют на поверхности клеток различных типов, включая нейроны и тромбоциты, где в результате их активации либо при помощи их эндогенного серотонинового лиганда, либо экзогенно введенных лекарственных средств они изменяют свою конформационную структуру и вслед за этим взаимодействуют с "даунестрим"-медиаторами клеточной передачи сигнала. Многие из этих рецепторов, включая подкласс 5-НТ2А, представляют собой рецепторы, связанные с G-белком (GPCR), подающие сигнал за счет активации гуанин-нуклеотидных связывающих белков (G-белков), приводя к образованию или ингибированию вторичных молекул-мессенджеров, таких как циклический АМР, фосфаты инозитола и диацилглицерин. Эти вторичные мессенджеры затем моделируют функцию множества межклеточных ферментов, включая киназы и ионные каналы, которые, в конечном итоге, влияют на клеточную возбудимость и функцию.
По меньшей мере, 15 генетически различных 5-НТ рецепторов были идентифицировано и отнесено к одному из семи семейств (5-НТ1-7). Каждый подтип проявляет собственное распространение, предпочтение к различным лигандам и функциональную зависимость(зависимости).
Серотонин может являться важным компонентом при патологических состояниях различных типов, таких как психиатрические нарушения (депрессия, агрессивность, приступы паники, обсессивно-компульсивные расстройства, психоз, шизофрения, склонность к суициду), нейродегенеративные нарушения (слабоумие типа Альцгеймера, паркинсонизм, хорея Хантингтона), анорексия, булимия, расстройства, связанные с алкоголизмом, инсульт и мигрень (Meltzer, Neuropsychopharmacology, 21:106S-115S (1999); Barnes & Sharp, Neuropharmacology, 38:1083-1152 (1999); Glennon, Neurosci. Biobehavioral Rev., 14:35 (1990)). Недавние доказательства неопровержимо указывают на участие 5-НТ2 подтипа рецептора в этиологии таких медицинских состояний, как гипертензия, тромбоз, мигрень, вазоспазм, ишемия, депрессия, тревога, психоз, шизофрения, нарушения сна и расстройства аппетита.
Шизофрения представляет собой особенно опустошающее нейропсихиатрическое расстройство, поражающее около 1% человеческого населения. Было приблизительно подсчитано, что общие финансовые затраты на диагностику, лечение и потерю социальной производительности индивидуумов, пораженных этим заболеванием, превышает 2% общего национального продукта (GNP) Соединенных Штатов. Общепринятое лечение включает, прежде всего, фармакотерапию с использованием класса лекарств, известных как антипсихотические средства. Антипсихотические средства эффективны для улучшения позитивных симптомов (например, галлюцинаций и маний), однако они часто не улучшают негативных симптомов (например, аутизма, апатии и бедности речи).
В настоящее время для лечения психотических симптомов прописывают антипсихотические средства девяти основных классов. Однако использование этих соединений ограничено профилями их побочных эффектов. Практически все "типичные", или соединения более ранних поколений, оказывают существенные неблагоприятные воздействия на двигательную функцию человека. Данные "экстрапирамидальные" побочные эффекты, названные так из-за своего влияния на модуляторные двигательные системы человека, могут быть как острыми (например, дистонические реакции, потенциально угрожающий жизни, но редко встречающийся нейролептический злокачественный синдром), так и хроническими (например, акатизия, дрожание и поздняя дискинезия). Поэтому попытки разработки лекарств были направлены на более новые "нетипичные" агенты, не оказывающие подобных неблагоприятных эффектов.
Было показано, что антипсихотические лекарства взаимодействуют с большим количеством центральных моноаминергических нейромедиаторных рецепторов, включая допаминергические, серотонергические, адренергические, мускариновыеигистаминергические рецепторы. По-видимому, терапевтические и неблагоприятные эффекты этих лекарств опосредованы рецепторами различных подтипов. Высокая степень генетической и фармакологической гомологии между рецепторами данных подтипов затрудняла поиск подтип-селективных соединений, а также определение нормальной физиологической или патофизиологической роли рецептора любого конкретного подтипа. Таким образом, существует необходимость в разработке лекарств, селективных по отношению к рецепторам индивидуальных классов и подклассов в ряду моноаминергических нейромедиаторных рецепторов.
Одна из теорий относительно механизма действия антипсихотических лекарств включает антагонизм допаминовых D2 рецепторов. К сожалению, по-видимому, антагонизм допаминовых D2 рецепторов опосредует также экстрапирамидальные побочные эффекты. Антагонизм 5-НТ2А представляет собой альтернативный молекулярный механизм для лекарственных препаратов антипсихотического действия, возможно, при посредстве антагонизма повышенной или увеличенной передачи сигнала через серотонергические системы. Поэтому 5-НТ2А антагонисты являются хорошими кандидатами для лечения психоза без экстрапирамидальных побочных эффектов.
Традиционно считалось, что данные рецепторы существуют в пассивном состоянии до тех пор, пока их не активируют путем связывания с антагонистом (любое лекарственное средство, активирующее рецептор). В настоящее время признают, что многие, если не большинство, GPCR моноаминовых рецепторов, включая серотониновые рецепторы, способны существовать в частично активированном состоянии в отсутствие своих эндогенных антагонистов. Эту повышенную базальную активность (конститутивная активность) можно ингибировать при помощи соединений, называемых обратными агонистами. Как агонисты, так и обратные агонисты обладают собственной активностью по отношению к рецептору, выражающейся в том, что они могут активировать или дезактивировать данные молекулы соответственно. Напротив, классические или нейтральные антагонисты конкурируют с агонистами и обратными агонистами за доступ к рецептору, но не обладают способностью ингибировать повышенные базисные или структурные реакции рецепторов.
Недавно авторами был выяснен важный аспект функционирования рецептора 5-НТ2А с использованием технологии выбора и амплификации рецепторов (R-SAT) (патент США 5707798, 1998, Chem Abstr. 128:111548 (1998) и приведенные там ссылки) для изучения серотониновых рецепторов подкласса 5-НТ2. R-SAT представляет собой фенотипический анализ функции рецептора, который включает гетерологическое экпрессирование рецепторов в фибробласты млекопитающего. Использование данной технологии дало авторам возможность показать, что нативные рецепторы 5-НТ2А обладают значительной конститутивной, или агонист-независимой, рецепторной активностью (Wiener et al. J. Pharmacol. Exp. Ther. 2001, 299 (1), 268-276.). Кроме того, при непосредственном тестировании большого количества центрально действующих терапевтических соединений с известной клинической активностью при нейропсихиатрическом заболевании, авторы обнаружили, что все соединения с антипсихотической эффективностью разделяют общее молекулярное свойство. Было найдено, что практически все эти соединения, которые используются психиатрами для лечения психоза, являются эффективными обратными агонистами 5-НТ2А. Эта уникальная клинико-фармакологическая корреляция по единственному подтипу рецептора является однозначным свидетельством того, что обратный агонизм рецептора 5-НТ2А представляет собой молекулярный механизм антипсихотической эффективности у людей.
Путем подробной фармакологической характеристики большого количества антипсихотических соединений было выявлено, что они обладают широкой активностью по отношению к многочисленным рецепторам родственных подтипов. Большинство этих соединений проявляют агонистическую, конкурентную антагонистическую или обратную агонистическую активность по отношению к многочисленным подтипам моноаминергических рецепторов, включая серотонергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. По-видимому, данная широкая активность ответственна за седативные, гипотензивные и двигательные побочные эффекты этих соединений. Следовательно, было бы очень выгодно получить соединения, являющиеся селективными обратными агонистами по отношению к рецептору 5-НТ2А, но проявляющие невысокую или отсутствие активности по отношению к рецепторам других монаминовых подтипов, в особенности к допаминовым D2 рецепторам. Подобные соединения могут оказаться полезными для лечения заболевания человека (например, в качестве антипсихотических агентов) и могут избежать неблагоприятных побочных эффектов, связанных с неселективными рецепторными взаимодействиями.
В патенте США 4853394 описаны неспироциклические пиперидильные сложные эфиры и амиды, не входящие в объем соединений формулы I.
Smith et al. (J. Med. Chem, 1995, 38, 3772) описывает спиропиперидины, включая оксазолидиноны, гидантоины, имидазолидиноны, пирролидиноны, пиразолидононы и пирролидины, не входящие в объем соединений формулы I.
Maunkel et al. (J. Med. Chem, 1996, 39, 3169) описывает антагонисты псевдопептидного бадикининового В2 рецептора, содержащие 1,3,8-триаза[4.5]декан-4-оновые циклические системы, не входящие в объем соединений формулы I.
Strosberg et al. (J. Med. Chem, 1981, 24, 1320) описывает 1-окса-3,8-диазаспиро[4.5]декан-2-оны, не входящие в объем соединений формулы I.
Strosberg et al. (J. Med. Chem, 1983, 27, 855) описывает 9-замещенные 1-окса-4,9-диазаспиро[5.5]ундекан-3-оны, не входящие в объем соединений формулы I.
Tsukamoto et al. (Chem. Pharm. Bull, 1995, 43(9), 1523) описывает 1-окса-2,8-диазаспиро[4.5]декан-3-оны в качестве М1 мускариновых агонистов. Однако ни одно из соединений Tsukamoto et al. не входит в объем соединений формулы I, и соединения Tsukamoto et al. не относятся к способам данного изобретения.
В WO 97/11940 описаны соединения в качестве ингибиторов фибриноген-зависимой агрегации тромбоцитов, не входящие в объем соединений формулы I.
Wiener et al. (J. Pharmacol. Exp. Ther. 2001, 299(1), 268-276) описывает обратные агонисты 5-НТ2А, не входящие в объем соединений формулы I.
В РСТ/US01/07187 описаны неспироциклические N-(4-пиперидинил)дибензиламиды и мочевины, не входящие в объем соединений формулы I.
В патентах США 6150393, 6140509, 6107324 и ЕР 1071701 описаны неспироциклические соединения, не входящие в объем соединений формулы I.
В WO 99/52927 описаны неспироциклические производные фенилпиразола, не входящие в объем соединений формулы I.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В изобретении предлагаются соединения формулы I, его соли и стереоизомеры
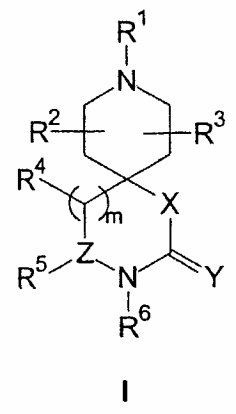
в которой Х выбирают из группы, включающей СН2, СН2СН2, СН2О, ОСН2, О, СН2S, SCH2, S, СН2N(RN), N(RN)СН2 и N(RN); где RN выбирают из водорода и С1-6-алкила;
Y выбирают из группы, включающей О и S;
Z отсутствует или выбирается из группы, включающей СН и N;
R1 выбирают из группы, включающей водород, необязательно замещенный С1-6-алкил, С2-8-алкенил, С2-8-алкинил, необязательно замещенный С3-6-циклоалкил, арил и гетероарил;
m выбирают из группы, включающей 0 и 1;
R4, R5 и R6 независимо выбирают из группы, включающей водород, С1-6-алкил, арил(С1-6-алкил), гетероарил(С1-6-алкил), гетероциклил(С1-6-алкил), гидрокси(С1-6-алкил), амино(С1-6-алкил), галоген(С1-6-алкил), необязательно замещенный С3-6-циклоалкил, арил и гетероарил, где, по меньшей мере, два из R4, R5 и R6 независимо выбирают из группы, включающей арил(С1-6-алкил), гетероарил(С1-6-алкил) и гетероциклил(С1-6-алкил);
R2 и R3 независимо выбирают из группы, включающей водород, галоген, гидрокси и необязательно замещенный С1-6-алкил, или выбирают так, что R2 и R3 совместно образуют циклическую систему, такую, что
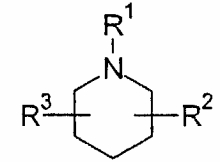
выбирают из группы, включающей
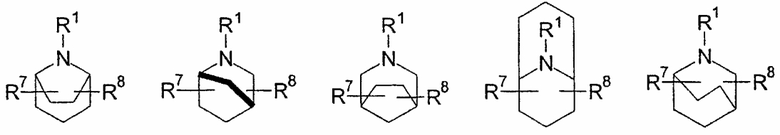
в которых R7 и R8 независимо выбирают из группы, включающей водород, галоген, гидрокси и С1-6-алкил.
В изобретении также предлагаются фармацевтические композиции, содержащие соединения изобретения. В одном из воплощений композиция содержит соединение формулы I, его фармацевтически приемлемую соль или стереоизомер совместно с фармацевтически приемлемым носителем или эксципиентом.
Кроме того, в изобретении предлагаются способы ингибирования активности или активации моноаминового рецептора. В одном из воплощений способ включает контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или более соединений формулы I, для ингибирования активности данного моноаминового рецептора. В следующем воплощении способ включает контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или более соединений формулы I для ингибирования активации данного моноаминового рецептора.
Кроме того, в изобретении предоставлены способы лечения болезненного состояния, связанного с моноаминовым рецептором. В одном из воплощений способ включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений формулы I. В различных аспектах болезненное состояние выбирают из группы, включающей шизофрению, психоз, мигрень, гипертензию, тромбоз, вазоспазм, ишемию, депрессию, тревогу, нарушения сна и расстройства аппетита.
Кроме того, предлагается применение соединения формулы I для получения лекарственного средства для лечения болезненного состояния. В одном из воплощений применение соединения формулы I для получения лекарственного средства предназначено для лечения болезненного состояния, связанного с моноаминовым рецептором. В различных аспектах болезненное состояние выбирают из группы, включающей шизофрению, психоз, мигрень, гипертензию, тромбоз, вазоспазм, ишемию, депрессию, тревогу, нарушения сна и расстройства аппетита.
Кроме того, в изобретении предлагаются способы идентификации генетического полиморфизма, предрасполагающего субъекта к восприимчивости к одному или более соединениям формулы I. В одном из воплощений способ включает:
введение субъекту терапевтически эффективного количества соединения;
определение реакции указанного субъекта на указанное соединение для идентифицирования, таким образом, восприимчивого субъекта с улучшенным болезненным состоянием, связанным с моноаминовым рецептором; и
идентификацию генетического полиморфизма у восприимчивого субъекта, где данный генетический полиморфизм предрасполагает субъекта к восприимчивости к данному соединению.
В дополнительном аспекте в изобретении предлагаются способы идентификации субъекта, подходящего для лечения при помощи одного или более соединений формулы I. В одном из воплощений способ включает определение наличия полиморфизма у субъекта, где данный полиморфизм предрасполагает данного субъекта к восприимчивости к соединению, и где наличие полиморфизма указывает на то, что данный субъект подходит для лечения при помощи одного или более соединений формулы I.
В изобретении предлагаются наборы, включающие одно или более соединений данного изобретения и инструкции для практического применения способа изобретения. В одном из воплощений инструкции предназначены для способов ингибирования активности или активации моноаминового рецептора. В другом воплощении инструкции предназначены для лечения болезненного состояния, связанного с моноаминовым рецептором. В еще одном воплощении инструкции предназначены для введения субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества одного или более соединений формулы I. В различных аспектах субъект страдает от или подвергается риску заболевания шизофренией, психозом, мигренью, гипертензией, тромбозом, вазоспазмом, ишемией, депрессией, тревогой, нарушением сна или расстройством аппетита.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показано влияние 69NLS75 на гиперактивность у мыши, обработанной агонистом NMDA рецептора, МК-801, ((+)-5-метил-10,11-дигидро-5Н-дибензо(a,d)циклогептен-5,10-имин, гидромалеатная соль).
На фиг.2 показано влияние дозы 69NLS75 на спонтанную двигательную активность.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В целях настоящего раскрытия для описания технических терминов будут использованы следующие определения во всей их полноте. Термином "конститутивная активность" определяют повышенную базальную активность рецептора, которая не зависит от присутствия агониста. Конститутивную активность рецептора можно определить при помощи ряда различных способов, включая клеточные (например, мембранные) препараты (смотри, например, Barr & Manning, J. Biol. Chem. 272:32979-87 (1997)), очищенные восстановленные рецепторы, содержащие или не содержащие ассоциированный G-белок в фосфолипидной везикуле (Cerione et al., Biochemistry 23:4519-25 (1984)), и функциональные клеточные анализы (патентная заявка США, серийный № 09/413626).
Термином "агонист" определяют соединение, повышающее активность рецептора при его контакте с данным рецептором.
Термином "антагонист" определяют соединение, конкурирующее с агонистом или обратным агонистом за связывание с рецептором, таким образом, блокируя действие агониста или обратного агониста на рецептор.
Термином "обратный агонист" определяют соединение, снижающее базисную активность рецептора (то есть опосредуемую рецептором передачу сигнала). Такие соединения известны также как отрицательные антагонисты. Обратный агонист представляет собой лиганд для рецептора, приводящий к тому, что рецептор принимает неактивное состояние относительно базисного состояния, имеющего место в отсутствие какого-либо лиганда. Таким образом, хотя антагонист может ингибировать активность агониста, обратный агонист является лигандом, который способен изменять конформацию рецептора в отсутствие агониста. Концепция обратного агониста была изучена Bond et al. в Nature 374:272 (1995). Более конкретно, Bond et al. предположили, что не связанный с лигандом β2-адренорецептор существует в состоянии равновесия между неактивной конформацией и спонтанно активной конформацией. Предполагают, что агонисты стабилизируют рецептор в активной конформации. Напротив, считается, что обратные агонисты стабилизируют неактивную конформацию рецептора. Таким образом, хотя антагонист проявляет свою активность, ингибируя агонист, обратный агонист способен, кроме того, проявлять свою активность в отсутствие агониста, ингибируя спонтанный переход не связанного с лигандом рецептора в активную конформацию.
Термином "5-НТ2А рецептор" определяют рецептор, обладающий активностью, соответствующей активности подтипа серотонинового рецептора человека, охарактеризованный при помощи молекулярного клонирования и фармакологии, что подробно описано у Saltzman et al., Biochem. Biophys. Res. Comm. 181:1469-78; и у Julius et al., Proc. Natl. Acad. Sci. USA 87:928-932.
Термин "субъект" относится к животному, такому как млекопитающее, например к человеку, являющемуся объектом лечения, наблюдения или эксперимента.
Термином "селективный" определяют свойство соединения, благодаря которому количество данного соединения, достаточное для того, чтобы вызвать желательный ответ от рецептора конкретного типа, подтипа, класса или подкласса, вызывает существенно меньшее или отсутствие воздействия на активность рецепторов других типов.
Под термином "селективность", или "селективный" по отношению к обратному агонисту подразумевают свойство соединения, посредством которого количество соединения, которое эффективно оказывает обратный агонистический эффект на 5-НТ2А рецептор и, таким образом, снижает его активность, вызывает небольшую или отсутствие обратной агонистической или антагонистической активности у других, родственных или неродственных рецепторов. В частности, неожиданно было найдено, что соединения настоящего изобретения не взаимодействуют сильно с другими серотониновыми рецепторам (5-НТ 1А, 1B, 1D, 1E, 1F, 2B, 2C, 4A, 6 и 7) при концентрациях, при которых передача сигнала 5-НТ2А рецептора сильно или полностью ингибирована. Соединения настоящего изобретения могут также проявлять селективность по отношению к другим моноаминсвязывающим рецепторам, таким как допаминергические, гистаминергические, адренергические и мускариновые рецепторы. Соединения, проявляющие высокую селективность к 5-НТ2А рецепторам, могут оказать благотворное воздействие при лечении психоза, шизофрении или сходных нейропсихиатрических нарушений, не оказывая, в то же время, неблагоприятных воздействий, связанных с другими лекарствами.
Подразумевается, что ЕС50 для агониста означает концентрацию соединения, необходимую для достижения 50% максимального ответа, наблюдаемого при R-SAT. Для обратных агонистов подразумевается, что ЕС50 означает концентрацию соединения, необходимую для достижения 50% ингибирования ответа при R-SAT по сравнению с базальными уровнями в отсутствие соединения.
Как использовано здесь, термин "совместное введение" относится к доставке двух или более отдельных химических веществ либо in vitro, либо in vivo. Совместное введение относится к одновременной доставке отдельных агентов, к одновременной доставке смеси агентов, а также к доставке одного агента с последующей доставкой второго агента или дополнительных агентов. Во всех случаях подразумевается, что совместно вводимые агенты действуют совместно друг с другом.
В настоящем контексте термин "С1-6-алкил" означает линейную или разветвленную углеводородную цепь, где самая длинная цепь содержит от одного до шести атомов углерода, такую как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил и гексил.
В настоящем контексте термин "С2-8-алкенил" означает линейную или разветвленную углеводородную группу, содержащую от двух до восьми атомов углерода и содержащую одну или более двойных связей. Иллюстративные примеры С2-8-алкенильных групп включают аллил, гомоаллил, винил, кротил, бутенил, пентенил, гексенил, гептенил и октенил. Иллюстративные примеры С2-8-алкенильных групп с более чем одной двойной связью включают бутадиенил, пентадиенил, гексадиенил, гептадиенил, гептатриенил и октатриенил, а также их разветвленные формы. Положение ненасыщенности (двойной связи) может находиться в любом положении углеродной цепи.
В настоящем контексте термин "С2-8-алкинил" означает линейную или разветвленную углеводородную группу, содержащую от двух до восьми атомов углерода и содержащую одну или более тройных связей. Иллюстративные примеры С2-8-алкинильных групп включают этинил, пропинил, бутинил, пентинил, гексинил, гептинил и октинил, а также их разветвленные формы. Положение ненасыщенности (тройной связи) может находиться в любом положении углеродной цепи. Ненасыщенной может быть более чем одна связь, так что "С2-8-алкинил" представляет собой диин или ендиин, как известно специалисту в данной области.
Подразумевается, что термины "галогеналкил", "гидроксиалкил" и "аминоалкил" включают определенные выше С1-6-алкильные группы, содержащие, по меньшей мере, один атом галогена, гидроксигруппу или аминогруппу соответственно.
В настоящем контексте термин "низший алкилен" означает двухвалентное углеводородное связующее звено, содержащее от одного до шести атомов углерода. Кроме того, "низшие алкиленовые" звенья могут необязательно содержать один или более заместителей, выбранных из С1-6-алкила, галогена, гидроксила и амино. Не ограничивающими примерами "низших алкиленовых" групп являются метилен, этилен, пропилен, тетраметилен, гексаметилен.
В настоящем контексте термин "С3-8-циклоалкил" включает трех-, четырех-, пяти-, шести-, семи- и восьмичленные циклы, содержащие только атомы углерода, тогда как термин "гетероциклил" означает трех-, четырех-, пяти-, шести-, семи- и восьмичленные циклы, в которых указанный цикл состоит из атомов углерода наряду с 1-3 гетероатомами. Гетероатомы таких гетероциклильных групп независимо выбирают из кислорода, серы и азота.
Термин "гетероциклильные" группы может также включать одну или более карбонильную или тиокарбонильную функциональные группы так, чтобы данное определение включало оксосистемы и тиосистемы, такие как лактамы, лактоны, циклические имиды, циклические тиоимиды, циклические карбаматы и так далее.
С3-8-циклоалкильные и гетероциклильные кольца могут необязательно содержать одну или более ненасыщенных связей, расположенных, однако, таким образом, чтобы не возникало ароматической π-электронной системы.
Гетероциклильные кольца необязательно могут быть конденсированы с арильными кольцами, так что данное определение включает бициклические структуры. Такие конденсированные гетероциклильные группы могут иметь одну общую связь с бензольным кольцом. Примеры бензоконденсированных гетероциклильных групп включают, но не ограничиваются бензимидазолидиноновыми, тетрагидрохинолиновыми и метилендиоксибензольными циклическими структурами.
Иллюстративные примеры "С3-8-циклоалкила" представляют собой карбоциклы циклопропан, циклобутан, циклопентан, циклопентен, циклопентадиен, циклогексан, циклогексен, 1,3-циклогексадиен, 1,4-циклогексадиен, циклогептан, циклогептен, 1,2-циклогептадиен, 1,3-циклогептадиен, 1,4-циклогептадиен и 1,3,5-циклогептатриен.
Иллюстративные примеры "гетероциклилов" представляют собой гетероциклы тетрагидротиопиран, 4Н-пиран, тетрагидропиран, пиперидин, 1,3-диоксин, 1,3-диоксан, 1,4-диоксин, 1,4-диоксан, пиперазин, 1,3-оксатиан, 1,4-оксатиин, 1,4-оксатиан, тетрагидро-1,4-тиазин, 2Н-1,2-оксазин, малеимид, сукцинимид, барбитуровую кислоту, тиобарбитуровую кислоту, диоксопиперазин, гидантоин, дигидроурацил, морфолин, триоксан, гексагидро-1,3,5-триазин, тетрагидротиофен, тетрагидрофуран, пирролин, пирролидин, пирролидон, пирролидинон, пиразолин, пиразолидин, имидазолин, имидазолидин, 1,3-диоксол, 1,3-диоксолан, 1,3-дитиол, 1,3-дитиолан, изоксазолин, изоксазолидин, оксазолин, оксазолидин, тиазолин, тиазолидин, 1,3-оксатиолан. Связывание с данным гетероциклом может происходить по положению гетероатома, или по атому углерода гетероцикла, или, в случае бензоконденсированных производных, по атому углерода бензоидного цикла.
В настоящем контексте термин "арил" означает карбоциклическое ароматическое кольцо или кольцевую систему. Кроме того, термин "арил" включает конденсированные кольцевые системы, в которых, по меньшей мере, два арильных кольца или, по меньшей мере, одно арильное кольцо и, по меньшей мере, один арил и, по меньшей мере, один С3-8-циклоалкил имеют, по меньшей мере, одну общую химическую связь. Иллюстративные примеры "арильных" колец включают необязательно замещенный фенил, нафталинил, фенантренил, антраценил, тетралинил, флуоренил, инденил и инданил. Другим примером арильной группы является фенил. Термин "арил" относится к ароматическим, например бензоидным, группам, связанным при помощи одного из образующих кольцо атомов углерода и необязательно содержащим один или более заместителей, выбранных из галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, С1-6-алкокси, С1-6-алкила, С1-6-гидроксиалкила, С1-6-аминоалкила, С1-6-алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила или трифторметила. Установлено, что арильные группы могут представлять собой фенил, который включает замещенные фенильные группы, содержащие один или два одинаковых или различных заместителя, перечисленных выше. Конкретным примером типа замещения является пара и/или мета. Представительные примеры арильных групп включают, но не ограничиваются фенилом 3-галогенфенилом, 4-галогенфенилом, 3-гидроксифенилом, 4-гидроксифенилом, 3-аминофенилом, 4-аминофенилом, 3-метилфенилом, 4-метилфенилом, 3-метоксифенилом, 4-метоксифенилом, 3-цианофенилом, 4-цианофенилом, диметилфенилом, нафтилом, гидроксинафтилом, гидроксиметилфенилом, трифторметилфенилом, алкоксифенилом.
В настоящем контексте термин "гетероарил" означает гетероциклическую ароматическую группу, в которой один или более атомов углерода в ароматическом кольце замещен одним или более гетероатомами, выбранными из группы, включающей азот, серу, фосфор и кислород.
Кроме того, в настоящем контексте термин "гетероарил" включает конденсированные кольцевые системы, в которых, по меньшей мере, одно арильное кольцо, или, по меньшей мере, одно гетероарильное кольцо, по меньшей мере, два гетероарильных кольца, по меньшей мере, одно гетероарильное кольцо и, по меньшей мере, одно гетероциклильное кольцо, или, по меньшей мере, одно гетероарильное кольцо и, по меньшей мере, одно С3-8-циклоалкильное кольцо имеют, по меньшей мере, одну общую химическую связь.
Подразумевается, что термин "гетероарил" относится к ароматическим С2-6-циклильным группам, содержащим, кроме того, один О или S атом, или до четырех N атомов, или сочетание одного О или S атома и до двух N атомов, и их замещенным, а также бензо- и пиридоконденсированным производным, обычно присоединенным через один из образующих кольцо атомов углерода. Гетероарильные группы могут содержать один или более заместителей, выбранных из галогена, гидрокси, амино, циано, нитро, алкиламидо, ацила, С1-6-алкокси, С1-6-алкила, С1-6-гидроксиалкила, С1-6-аминоалкила, С1-6-алкиламино, алкилсульфенила, алкилсульфинила, алкилсульфонила, сульфамоила, или трифторметила. Конкретными гетероарильными группами являются пяти- и шестичленные ароматические гетероциклические системы, содержащие 0, 1, или 2 заместителя, выбранных из приведенного выше перечня, которые могут быть одинаковыми или отличаться друг от друга. Представительные примеры гетероарильных групп включают, но не ограничиваются незамещенными и моно- или дизамещенными производными фурана, бензофурана, тиофена, бензотиофена, пиррола, пиридина, индола, оксазола, бензоксазола, изоксазола, бензизоксазола, тиазола, бензотиазола, изотиазола, имидазола, бензимидазола, пиразола, индазола и тетразола, а также фуразана, 1,2,3-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, триазола, бензотриазола, хинолина, изохинолина, пиридазина, пиримидина, пурина, пиразина, птеридина, пиррола, феноксазола, оксазола, изоксазола, оксадиазола, бензопиразола, индазола, хинолизина, циннолина, фталазина, хиназолина и хиноксалина. Наиболее вероятные заместители представляют собой галоген, гидрокси, циано, О-С1-6-алкил, С1-6-алкил, гидрокси-С1-6-алкил, амино-С1-6-алкил.
Термин "арил(С1-6-алкил)" означает арильные группы, связанные, в виде заместителей, через низший алкилен, каждый из которых определен выше. Арильные группы "арил(С1-6-алкила)" могут быть замещенными или незамещенными. Примеры включают замещенный бензил, 2-фенилэтил, 3-фенилпропил и нафтилалкил.
Под термином "гетероарил(С1-6-алкил)" имеют в виду гетарильные группы, связанные, в виде заместителей, через низший алкилен, каждый из которых определен выше. Гетероарильные группы гетероаралкильных групп могут быть замещенными или незамещенными. Примеры включают 2-тиенилметил, 3-тиенилметил, фурилметил, тиенилэтил, пирролилалкил, пиридилалкил, изоксазолилалкил, имидазолилалкил и их замещенные, а также бензоконденсированные аналоги.
Под термином "гетероциклил(С1-6-алкил)" имеют в виду гетероциклильные группы, связанные, в виде заместителей, через низший алкилен, каждый из которых определен выше.
Под термином "циклоалкил(С1-6-алкил)" имеют в виду циклоалкильные группы, связанные, в виде заместителей, через низший алкилен, каждый из которых определен выше.
При использовании здесь термин "О-С1-6-алкил" означает С1-6-алкокси или алкокси, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, неопентилокси и гексилокси. Кроме того, подразумевается, что определение "О-С1-6-алкил" включает циклические алкоксигруппы, содержащие максимум шесть атомов углерода. Иллюстративные неограничивающие примеры циклических алкоксигрупп включают циклобутокси, циклопропилметилокси, циклогексилокси и так далее.
Термин "галоген" включает фтор, хлор, бром и йод.
В настоящем контексте, то есть в связи с терминами "С1-6-алкил", "арил", "гетероарил", "гетероциклил", "гетероарил(С1-6-алкил)", "арил(С1-6-алкил)", "циклоалкил(С1-6-алкил)", "С3-8-циклоалкил", "гетероциклил(С1-6-алкил)", "О-С1-6-алкил", "С2-8-алкенил" и "С2-8-алкинил", термин "необязательно замещенный" означает, что рассматриваемая группа может быть замещена один или несколько раз, например, от 1 до 5 раз, от 1 до 3 раз или от 1 до 2 раз, одной или более группами, выбранными из С1-6-алкила, С1-6-алкокси, оксо (который может быть представлен таутомерной енольной формой), карбоксила, амино, гидрокси (который, при наличии в енольной системе, может быть представлен в таутомерной кетоформе), нитро, алкилсульфонила, алкилсульфенила, алкилсульфинила, С1-6-алкоксикарбонила, С1-6-алкилкарбонила, формила, амино, моно- и ди(С1-6-алкил)амино, карбамоила, моно- и ди(С1-6-алкил)аминокарбонила, амино-С1-6-алкиламинокарбонила, моно- и ди(С1-6-алкил)амино-С1-6-алкиламинокарбонила, С1-6-алкилкарбониламина, циано, гуанидино, карбамидо, С1-6-алканоилокси, С1-6-алкилсульфонилокси, дигалоген-С1-6-алкила, тригалоген-С1-6-алкила и галогена. В целом, можно допустить дальнейшее необязательное замещение приведенных выше заместителей.
Термин "гомохиральный" следует интерпретировать в соответствии с определением в "Principles of Asymmetric Synthesis" (Gawley and Aubé, Pergamon, 1996, ISBN 0 08 0418759).
Термин "соль" означает фармацевтически приемлемые соли присоединения кислоты, которые можно получить при обработке основной формы функциональной группы, такой как амин, соответствующими кислотами, такими как неорганические кислоты, например галогенводородными кислотами, обычно хлористоводородной, бромистоводородной, фтористоводородной или йодистоводородной кислотой, серной кислотой, азотной кислотой, фосфорной кислотой и так далее, или органическими кислотами, например, уксусной, пропионовой, гидроксиуксусной, 2-гидроксипропановой кислотой, 2-оксопропановой кислотой, этандиовой, пропандиовой, бутандиовой, (Z)-2-бутендиовой, (Е)-бутендиовой, 2-гидроксибутандиовой, 2,3-дигидроксибутандиовой, 2-гидрокси-1,2,3-пропантрикарбоновой, метансульфоновой, этансульфоновой, бензолсульфоновой, 4-метилбензолсульфоновой кислотой, циклогексансульфаминовой, 2-гидроксибензойной, 4-амино-2-гидроксибензойной и другими кислотами, которые известны специалисту в данной области.
В изобретении предоставлены соединения, подгруппы которых проявляют относительно высокую селективность по отношению к серотониновым рецепторам, в частности к 5-НТ2А рецепторам, что может оказать благотворное влияние при лечении нейропсихиатрических расстройств.
В предпочтительном варианте воплощения соединения настоящего изобретения определены формулой I и включают их соли и стереоизомеры, а также фармацевтические композиции.

в которой Х выбирают из группы, включающей СН2, СН2СН2, СН2О, ОСН2, О, СН2S, SCH2, S, СН2N(RN), N(RN)СН2 и N(RN); где RN выбирают из водорода и С1-6-алкила;
Y выбирают из группы, включающей О и S;
Z отсутствует или выбран из группы, включающей СН и N;
R1 выбирают из группы, включающей водород, необязательно замещенный С1-6-алкил, С2-8-алкенил, С2-8-алкинил, необязательно замещенный С3-6-циклоалкил, арил и гетероарил;
m выбирают из группы, включающей 0 и 1;
R4, R5 и R6 независимо выбирают из группы, включающей водород, С1-6-алкил, арил(С1-6-алкил), гетероарил(С1-6-алкил), гетероциклил(С1-6-алкил), гидрокси(С1-6-алкил), амино(С1-6-алкил), галоген(С1-6-алкил), необязательно замещенный С3-6-циклоалкил, арил и гетероарил,
где, по меньшей мере, два из R4, R5 и R6 независимо выбирают из группы, включающей арил(С1-6-алкил), гетероарил(С1-6-алкил) и гетероциклил(С1-6-алкил);
R2 и R3 независимо выбирают из группы, включающей водород, галоген, гидрокси и необязательно замещенный С1-6-алкил, или выбирают так, чтобы R2 и R3 совместно образовывал циклическую систему, такую, что
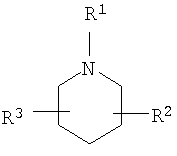
выбирают из группы, включающей
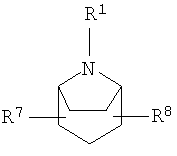
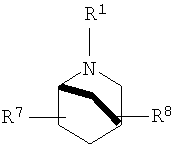
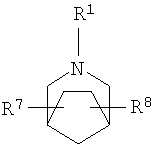
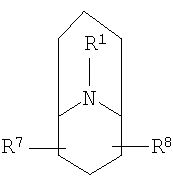
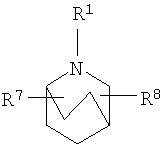
в которых R7 и R8 независимо выбирают из группы, включающей водород, галоген, гидрокси и C1-6-алкил.
Соединения формулы I проявляют активность в отношении моноаминовых рецепторов, в особенности серотониновых рецепторов. Некоторые соединения разделяют общее свойство действия в качестве обратных агонистов на 5-НТ2А рецептор. Таким образом, опыты, проведенные на клетках, временно экспрессируюших указанный рецептор фенотипа человека, показали, что соединения общей формулы I ослабляют передачу сигнала подобных рецепторов в отсутствие дополнительных лигандов, действующих на рецептор. Таким образом, было обнаружено, что данные соединения обладают собственной активностью по отношению к этому рецептору и способны ослаблять базальные, стимулированные не агонистами, конститутивные отклики передачи сигнала, проявляемые рецептором 5-НТ2А. Наблюдение, что соединения общей формулы (I) являются обратными агонистами, указывает также на то, что данные соединения обладают способностью антагонизировать активацию 5-НТ2А рецепторов, опосредуемую эндогенными агонистами или экзогенными синтетическими агонистическими лигандами.
Таким образом, в настоящем изобретении предлагаются соединения формулы I, их соли и стереоизомеры, включая соединения, проявляющие относительно высокую степень селективности по отношению к 5-НТ2А подтипу серотониновых рецепторов по сравнению с другими подтипами семейства серотониновых (5-НТ) рецепторов, а также с другими рецепторами, наиболее конкретно, моноаминергическими G-белок связывающими рецепторами, такими как допаминовые рецепторы. В одном из воплощений соединения изобретения выступают в качестве обратных агонистов по отношению к 5-НТ2А подтипу серотониновых рецепторов.
Следовательно, соединения общей формулы (I) могут быть полезными для лечения или облегчения симптомов болезненных состояний, связанных с ослабленной функцией, в частности повышенными уровнями активности, в особенности, 5-НТ2А рецепторов, где эта ослабленная функция связана с неправильными уровнями стимуляции рецепторов, или фенотипическими аберрациями.
Ранее другими было сделано предположение о том, что некоторые нейрофизиологические заболевания, возможно, вызваны измененными уровнями конститутивной активности моноаминовых рецепторов. Подобную конститутивную активность можно было бы модифицировать, приводя соответствующий рецептор в контакт с синтетическим обратным агонистом. При непосредственном тестировании большого количества центрально действующих используемых в медицине соединений с известной клинической активностью при нейропсихиатрических заболеваниях, все соединения антипсихотического действия обладают общим молекулярным свойством. Было найдено, что почти все эти соединения, используемые психиатрами для лечения психоза, являются эффективными обратными агонистами 5-НТ2А. Данное соответствие является неопровержимым доказательством того, что обратный агонизм по отношению к 5-НТ2А рецепторам представляет собой молекулярный механизм антипсихотической эффективности у людей.
При подробной фармакологической характеризации большого количества антипсихотических соединений в лаборатории авторов было выявлено, что они обладают широкой активностью по отношению к рецепторам множества родственных подтипов. Большинство из этих соединений проявляют либо агонистическую, конкурентную антагонистическую, либо обратную агонистическую активность по отношению к моноаминергическим рецепторам множества подтипов, включая серотонинергические, допаминергические, адренергические, мускариновые и гистаминергические рецепторы. По-видимому, подобная широкая активность является причиной седативного, гипотензивного и двигательного побочных эффектов данных соединений. Следовательно, раскрытые здесь соединения будут обладать эффективностью, например, в качестве новых антипсихотических агентов, но будут оказывать меньшее количество или менее серьезные побочные эффекты, чем существующие соединения.
Настоящее изобретение направлено также на фармацевтические композиции, содержащие соединение общей формулы I.
В данном варианте воплощения, по меньшей мере, два из R4, R5 и R6 могут быть независимо выбраны из группы, включающей 4-монозамещенный арил(С1-6-алкил) и 4-монозамещенный гетероарил(С1-6-алкил).
Обычно, по меньшей мере, два из R4, R5 и R6, независимо выбранных из группы, включающей арил(С1-6-алкил) и гетероарил(С1-6-алкил), выбирают из группы, включающей фторзамещенный арил(С1-6-алкил) и фторзамещенный гетероарил(С1-6-алкил). Кроме того, прочие из, по меньшей мере, двух из R4, R5 и R6, независимо выбранных из группы, включающей арил(С1-6-алкил) и гетероарил(С1-6-алкил), обычно выбирают из группы, включающей (О-С1-6-алкил)замещенный арил(С1-6-алкил) и (О-С1-6-алкил)замещенный гетероарил(С1-6-алкил).
В некоторых вариантах воплощения, по меньшей мере, один из R4, R5 и R6 независимо выбирают из группы, включающей фторзамещенный арил(С1-6-алкил) и фторзамещенный гетероарил(С1-6-алкил).
Обычно, по меньшей мере, каждый из двух R4, R5 и R6, независимо выбранных из группы, включающей арил(С1-6-алкил), гетероарил(С1-6-алкил) и гетероциклил(С1-6-алкил), замещен 1, 2 или 3 раза заместителем, выбранным из группы, включающей галоген и необязательно замещенный О-С1-6-алкил. В одном из аспектов галоген представляет собой фтор. В одном из вариантов воплощения циклическая система одного из, по меньшей мере, двух из R4, R5 и R6, независимо выбранных из группы, включающей арил(С1-6-алкил), гетероарил(С1-6-алкил), гетероциклил(С1-6-алкил), замещена 1-3 раза необязательно замещенным О-С1-6-алкилом, таким как фторированный О-С1-6-алкил.
В еще одном варианте воплощения, по меньшей мере, два из R4, R5 и R6 представляют собой необязательно замещенный арил(С1-6-алкил). В предпочтительном варианте воплощения, по меньшей мере, два из R4, R5 и R6 представляют собой необязательно замещенный бензил.
Установлено, что по меньшей мере, два из R4, R5 и R6 независимо выбирают из группы, включающей арил(С1-6-алкил), гетероарил(С1-6-алкил), гетероциклил(С1-6-алкил). Обычно С1-6-алкил в указанных арил(С1-6-алкиле), гетероарил(С1-6-алкиле), гетероциклил(С1-6-алкиле) представляет собой С1-4-алкил, такой как метилен(С1-алкил), этилен(С2-алкил) или пропилен(С3-алкил) или бутилен(С4-алкил), чаще С1-алкил или С2-алкил, чаще всего С1-алкил. В подходящем варианте воплощения С1-6-алкил в указанных арил(С1-6-алкиле), гетероарил(С1-6-алкиле), гетероциклил(С1-6-алкиле) может быть замещен так, чтобы образовывать разветвленный углеводород.
В комбинации вариантов воплощения, по меньшей мере, два из R4, R5 и R6 представляют собой необязательно замещенный бензил. Один из R4, R5 и R6 может представлять собой 4-галогенбензильную группу, а другой может являться 4-алкоксибензильной группой. Обычно 4-галогенбензильная группа представляет собой 4-фторбензил. 4-алкоксибензильная группа обычно представляет собой С2-5-алкоксибензильную или необязательно фторированную 4-метоксибензильную группу, такую как фторметоксибензильная, дифторметоксибензильная, трифторметоксибензильная группа и 2,2,2-трифторэтоксибензильная.
Установлено, что соединения изобретения можно выбрать из группы, включающей (i) 1-окса-4,9-диазаспиро[5.5]ундекан-3-он, (ii) 1-окса-3,8-диазаспиро[4.5]декан-2-он, (iii) 1,3,8-триазаспиро[4.5]декан-2-он, (iv) 1,2,9-триазаспиро[5.5]ундекан-3-он, (v) 1,2,8-триазаспиро[4.5]декан-3-он, (vi) 1,2,8-триазаспиро[4.5]декан-3-он, (vii) 1,2,4,8-тетраазаспиро[4.5]декан-3-он, (viii) 2,4,9-триазаспиро[5.5]ундекан-3-он, (ix) 2,8-диазаспиро[4.5]декан-3-он, (х) 2-окса-4,9-диазаспиро[5.5]ундекан-3-он, (xi) 1-тиа-3,8-диазаспиро[4.5]декан-2-он и (xii) 1-окса-3,9-диазаспиро[5.5]ундекан-2-он.
Подходящие варианты воплощения соединений изобретения можно выбрать из группы, включающей 4-(4-фторбензил)-3-(4-метоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-этоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-метил-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изопропоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-бутоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-метил-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-метил-3-(4-пентоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-этил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-изопропил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопропилметил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклогексилметил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопентил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-(3-морфолин-4-илпропил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-[3-(2-оксо-2,3-дигидробензимидазол-1-ил)пропил]-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-(2-метилтиазол-4-илметил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-хлорбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-этил-4-(4-хлорбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-хлорбензил)-3-(4-изобутоксибензил)-8-изопропил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопропилметил-4-(4-хлорбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклогексилметил-4-(4-хлорбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-хлорбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-хлорбензил)-3-(4-изобутоксибензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-8-этил-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-изопропил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопропилметил-3-(4-дифторметоксибензил)-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклогексилметил-3-(4-дифторметоксибензил)-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-этил-4-(4-фторбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-изопропил-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопропилметил-4-(4-фторбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклогексилметил-4-(4-фторбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопентил-4-(4-фторбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-этил-4-(4-фторбензил)-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-изопропил-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопропилметил-4-(4-фторбензил)-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклогексилметил-4-(4-фторбензил)-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-циклопентил-4-(4-фторбензил)-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-3-(4-пропоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-8-этил-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-изопропил-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-8-циклопропилметил-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-3-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-{3-[(S)-4-изопропил-2-оксооксазолидин-3-ил]пропил}-1-окса-3,8-диазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-2-(4-метоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-этоксибензил)-1-(4-фторбензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-8-метил-2-(4-пропоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-2-(4-изопропоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-бутоксибензил)-1-(4-фторбензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-циклопропилметоксибензил)-1-(4-фторбензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-8-метил-2-(4-трифторметоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-8-метил-2-(4-пентоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-хлорбензил)-2-(4-этоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-хлорбензил)-8-метил-2-(4-пропоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-хлорбензил)-2-(4-изобутоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-хлорбензил)-2-(4-циклопропилметоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-хлорбензил)-2-(4-дифторметоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-этилбензил)-2-(4-этоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-этилбензил)-2-(4-изопропоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-этилбензил)-2-(4-изобутоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-этилбензил)-2-(4-циклопропилметоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-этилбензил)-8-метил-2-(4-трифторметоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-этил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-изопропил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-циклопропилметил-1,2,8-триазаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-(2-[1,3]диоксолан-2-илэтил)-1,2,8-триазаспиро[4.5]декан-3-он, 8-этил-1-(4-фторбензил)-2-(4-изобутоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-8-изопропил-1,2,8-триазаспиро[4.5]декан-3-он, 8-циклопропилметил-1-(4-фторбензил)-2-(4-изобутоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 8-(2-[1,3]диоксолан-2-илэтил)-1-(4-фторбензил)-2-(4-изобутоксибензил)-1,2,8-триазаспиро[4.5]декан-3-он, 4-(4-этоксибензил)-5-(4-фторбензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-9-метил-4-(4-пропоксибензил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-4-(4-изобутоксибензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-9-метил-4-(4-трифторметоксибензил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-хлорбензил)-4-(4-изобутоксибензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-хлорбензил)-4-(4-циклопропилметоксибензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 9-этил-5-(4-фторбензил)-4-(4-пропоксибензил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-этоксибензил)-9-метил-1,2,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-циклопропилметоксибензил)-9-метил-1,2,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-9-метил-1,2,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-пропоксибензил)-9-метил-1,2,9-триазаспиро[5.5]ундекан-3-он, 1-(4-этилбензил)-2-(4-изобутоксибензил)-9-метил-1,2,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-циклопропилметоксибензил)-9-этил-1,2,9-триазаспиро[5.5]ундекан-3-он, 2-(4-этоксибензил)-1-(4-фторбензил)-8-метил-1,2,4,8-тетразаспиро[4.5]декан-3-он, 1-(4-фторбензил)-1-(4-изобутоксибензил)-8-метил-1,2,4,8-тетразаспиро[4.5]декан-3-он, 2-(4-дифторметоксибензил)-1-(4-фторбензил)-8-метил-2,8-диазаспиро[4.5]декан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-8-метил-2,8-диазаспиро[4.5]декан-3-он, 2-(4-циклопропилметоксибензил)-1-(4-фторбензил)-8-метил-2,8-диазаспиро[4.5]декан-3-он, 8-этил-1-(4-фторбензил)-2-(4-изобутоксибензил)-2,8-диазаспиро[4.5]декан-3-он, 8-(2-[1,3]диоксолан-2-илэтил)-1-(4-фторбензил)-2-(4-изобутоксибензил)-2,8-диазаспиро[4.5]декан-3-он, 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-метил-1,3,8-триазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1,3,8-триазаспиро[4.5]декан-2-он, 3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-метил-1,3,8-триазаспиро[4.5]декан-2-он, 8-этил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1,3,8-триазаспиро[4.5]декан-2-он, 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1,3,8-триазаспиро[4.5]декан-2-он, 1-(4-фторбензил)-2-(4-этоксибензил)-9-метил-2,4,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-циклопропилметоксибензил)-9-метил-2,4,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-9-метил-2,4,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-трифторметоксибензил)-9-метил-2,4,9-триазаспиро[5.5]ундекан-3-он, 1-(4-фторбензил)-2-(4-изобутоксибензил)-9-этил-2,4,9-триазаспиро[5.5]ундекан-3-он, 4-(4-этоксибензил)-5-(4-фторбензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 3-(4-этоксибензил)-5-(4-фторбензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 3-(4-этоксибензил)-4-(4-фторбензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 5-(4-фторбензил)-4-(4-пропоксибензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 5-(4-фторбензил)-3-(4-пропоксибензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 4-(4-фторбензил)-3-(4-пропоксибензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 5-(4-фторбензил)-4-(4-изобутоксибензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-9-метил-1-окса-3,9-диазаспиро[5.5]ундекан-2-он, 4-(4-этоксибензил)-5-(4-фторбензил)-9-метил-2-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-4-(4-метоксибензил)-9-метил-2-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-4-(4-пропоксибензил)-9-метил-2-окса-4,9-диазаспиро[5.5]ундекан-3-он, 5-(4-фторбензил)-4-(4-изобутоксибензил)-9-метил-2-окса-4,9-диазаспиро[5.5]ундекан-3-он, 4-(4-этоксибензил)-5-(4-фторбензил)-9-метил-2-окса-4,9-диазаспиро[5.5]ундекан-3-он, 3-(4-этоксибензил)-4-(4-фторбензил)-8-метил-1-тиа-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-метоксибензил)-8-метил-1-тиа-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-пропоксибензил)-8-метил-1-тиа-3,8-диазаспиро[4.5]декан-2-он, 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-тиа-3,8-диазаспиро[4.5]декан-2-он.
Некоторые воплощения соединений данного изобретения обладают хиральностью или имеют хиральный центр. В изобретении предлагаются соединения изобретения в рацемической форме, энантиомерно-обогащенных формах или энантиомерно чистых формах. Настоящими исследователями были выделены индивидуальные энантиомеры некоторых хиральных воплощений соединений изобретения с высоким энантиомерным избытком и найдена неодинаковая активность данных двух форм по отношению к моноаминовым рецепторам.
Предпочтительный вариант воплощения соединений изобретения включает соединения формулы I, которые гомохиральны по отношению к соединению формулы II.
В примерах показаны подходящие способы получения многих соединений изобретения, при этом указанные способы адаптированы для получения всех соединений изобретения способами, известными специалисту в данной области. В объем данного изобретения также входят фармацевтически приемлемые соли соединений формулы I.
В целом, соединения изобретения можно получить способами, приведенными ниже. Во многих из описанных ниже синтетических подходов необходимо использование защитных групп, включающих группы, описанные у T. W. Green and P. G. M. Wuts, Protective Groups in Organic Chemistry, 3 Ed. John Wiley & Sons, 1999, и их следует выбирать таким образом, чтобы они были устойчивы в используемых условиях реакции и легко снимались на соответствующей стадии с использованием известной в данной области методологии. Типичными защитными группами являются N-Boc, N-Cbz, N-Bn.
В целом, циклизацию соответствующих промежуточных соединений можно осуществить при помощи фосгена или его аналогов, таких как CDI, с хлорацетилхлоридом или его эквивалентами, или при обработке сероуглеродом и последующем окислении.
Введение желательного пиперидинового заместителя (R1) обычно можно осуществить алкилированием или восстановительным аминированием после снятия N-защиты, в случае необходимости.
Соединения изобретения, в которых m=1, Z=CH, а Х=О или ОСН2, можно получить из соответствующим образом защищенного 4-пиперидона, как описано Bassus et al. (Eur. J. Med. Chem.-Chim. Ther. 9:416-423 (1974)). Алкилирование атома азота карбамата и введение желательного пиперидинового N-заместителя приводит к 3,5-дизамещенному спироциклу. 3,4- или 4,5-дизамещенные производные можно получить, как описано у Fisera et al. (Monatsh. Chem. 125:909-919 (1994)), через соответствующим образом защищенный изоксазолин с последующим восстановительным расщеплением. Циклизация полученных γ-аминоспиртов приводит к требуемым спироциклам. Альтернативным образом, 4,5-дизамещенные или 3,4,5-тризамещенные спироциклы можно получить из соответствующего сложного β-кетоэфира реакцией с галогенидом для введения 5-заместителя, восстановительным аминированием (с первичным амином для 3-заместителя), обработкой аллилмагнийбромидом, циклизацией, описанной выше, окислительным расщеплением двойных связей (например, озонолизом) и образованием пиперидинового кольца путем восстановительного аминирования.
Соединения изобретения, в которых m=1, Z=N, а Х=О, или ОСН2, можно получить синтезом Штрекера с использованием соответствующего альдегида и, например, трет-бутилкарбазата. Этот нитрил можно превратить в сложный эфир, который вводят в реакцию с аллилмагнийбромидом с последующим окислительным расщеплением двух олефинов, образованием пиперидина при помощи восстановительного аминирования. Алкилирование, снятие защиты с гидразида и циклизация приводят к желательным спироциклам. В зависимости от требуемых заместителей и их положения данные стадии можно поменять местами, и могут потребоваться дополнительные стадии защиты функциональных групп. Альтернативным образом, данные соединения можно получить из соответствующего β-кетоэфира реакцией с производным бис(2-хлорэтил)амина с образованием пиперидинового цикла. Восстановительное аминировнаие, омыление и перегруппировка Курциуса приводят к циклическому производному мочевины.
Соединения изобретения, в которых m=1, Z=N, а Х=N(R), можно получить, адаптируя способы, описанные Bhatia et al. (J. Med. Chem. 39:3938-3950 (1996)), исходя из соответствующим образом защищенного продукта Штрекера 4-амино-4-цианопиперидина.
Соединения изобретения, в которых m=0, Z=СН, а Х=СН2СН2, можно получить присоединением по Михаэлю нитрильного производного к соответствующим образом защищенному 4-метоксикарбонилметиленпиперидину, восстановлением нитрильной группы до амина с последующим замыканием лактамного цикла, алкилированием полученного амида и введением желательного пиперидинового заместителя.
Соединения изобретения, в которых m=0, Z=СН, а Х=СН2О, можно получить из соответствующего сложного β-кетоэфира реакцией с соответствующим образом защищенным бис(2-хлорэтил)амином. Восстановительное аминирование с последующим восстановлением нитрила до спирта с последующей циклизацией и введением пиперидинового заместителя алкилированием или восстановительным аминированием приводит к требуемому спироциклу.
Соединения изобретения, в которых m=0, Z=СН, а Х=СН2N, можно получить из соответствующего β-кетонитрила реакцией с соответствующим образом защищенным бис(2-хлорэтил)амином. Восстановительное аминирование с последующим восстановлением нитрила до амина с последующей циклизацией и введение пиперидинового заместителя алкилированием или восстановительным аминированием приводит к требуемому спироциклу.
Соединения изобретения, в которых m=0, Z=СН, а Х=ОСН2, можно получить, как описано в примере 1.
Соединения изобретения, в которых m=0, Z=N, а Х=СН2СН2, можно получить из защищенного 8-аза-1-оксаспиро[4.5]декан-2-она (Mullen et al. J. med. Chem. 43:4045 (2000)) реакцией с гидразином, затем с S-этилтрифтортиоацетатом с последующей реакцией Мицунобу согласно Meng et al. (Tetrahedron 47:6251 (1991)). Соответствующие заместители в 1, 2- и 9-положения вводят алкилированием и/или восстановительным аминированием.
Соединения изобретения, в которых m=0, Z=N, а Х=CH2О, можно получить по синтезу Штрекера из соответствующим образом защищенного 4-пиперидона и карбазата (или соответствующего гидразина). Превращение полученного нитрила в спирт, циклизация с использованием описанных выше способов, алкилирование (после основного гидролиза экзоциклической карбазатной функции, при ее наличии) и введение пиперидинового N-заместителя приводит к требуемому соединению.
Соединения изобретения, в которых m=0, Z=N, а Х=CH2N, можно получить с использованием той же стратегии, что и при получении 1,2,9-триаза-4-оксаспиро[5.5]ундекан-3-она, за исключением того, что нитрил восстанавливают до соответствующего амина.
Соединения изобретения, в которых m=0, Z=CH, а Х=CH2, можно получить присоединением по Михаэлю нитропроизводного к соответствующим образом защищенному 4-метоксикарбонилметиленпиперидину, восстановлением нитрогруппы до амина с последующим замыканием лактамного цикла, алкилированием полученного амида и введением желательного пиперидинового заместителя.
Соединения изобретения, в которых m=0, Z=CH, а Х=О, можно получить, как описано в примере 1. Альтернативным образом, для получения желательного промежуточного 1,2-аминоспирта можно использовать нитроальдольную реакцию после восстановления нитрогруппы с последующей циклизацией. Альтернативным образом, данные соединения можно получить эпоксидированием соответствующего олефина, полученного по реакциям Виттига или Хорнера-Водсворта-Эммонса из соответствующим образом защищенного 4-пиперидона. Раскрытие эпоксида аммиаком или первичным амином с последующей циклизацией с использованием эквивалента фосгена, алкилирование карбаматов, при необходимости, и введение желательного пиперидинового заместителя алкилированием или восстановительным аминированием приводит к целевому соединению. Помимо получения энантиомерно чистого соединения, как описано в примере 1, энантиоселективная модификация может включать способ асимметрического эпоксидирования олефина, описанный в литературе, например, Jacobsen или другими. Альтернативным образом, можно использовать способ асимметрического дигидроксилирования Шарплесса с последующим образованием эпоксидного цикла. Альтернативным образом, подходящим образом защищенный 4-метоксикарбонилметиленпиперидин можно восстановить до аллилового спирта, который подвергают асимметрическому эпоксидированию по Шарплессу по литературной методике. Раскрытие эпоксида металлоорганическим реагентом и окисление образующегося первичного спирта приводит к γ-гидроксикарбоновой кислоте, которую переводят в желательный спироциклический энантиомер, как описано в примере 1. Альтернативным образом, подходящим образом защищенный 4-метоксикарбонилметиленпиперидин можно превратить в энантиомерно чистый эпоксид эпоксидированием по Якобсену с последующим раскрытием цикла аммиаком или соответствующим амином, реакцией с металлоорганическим реагентом со сложноэфирной группой, восстановлением, циклизацией, алкилированием, при необходимости, и введением пиперидиновогго заместителя. Альтернативным образом, стереоцентр можно ввести при использовании соответствующего эфира γγ-аминокислоты в качестве хиральной матрицы. Взаимодействие с аллилмагнийбромидом, циклизация, окислительное расщепление аллильных групп, образование пиперидиновго цикла при восстановительном аминировании и конечное алкилирование карбамата приводят к желательному энантиомерно чистому производному.
Соединения изобретения, в которых m=0, Z=CH, а Х=N или NCH2, можно получить при помощи синтеза Штрекера, используя подходящим образом защищенный 4-пиперидон и соответствующий первичный амин. Взаимодействие полученного нитрила с реагентом Гриньяра приводит к кетону, который затем подвергают восстановительному аминированию. Циклизация полученного диамина (после стадии снятия защиты, в случае необходимости) с фосгеном или его эквивалентом приводит к циклической мочевине. Для введения N-пиперидинового заместителя можно использовать стадии алкилирования или восстановительного аминирования. Аналогичным образом можно получить 6-членный аналог (X=NCH2) при использовании для циклизации хлорацетилхлорида или похожего реагента (может потребоваться дополнительное использование защитных групп).
Соединения изобретения, в которых m=0, Z=N, а Х=CH2, можно получить, как описано в примере 1.
Соединения изобретения, в которых m=0, Z=N, а Х=N(R), можно получить литературными способами (Glash et al. Synthesis 803-808 (1990)) при обработке подходящим образом защищенного 4-пиперидона реакцией с производным гидразина и взаимодействием промежуточного гидразона с цианатом калия. Для введения требуемых заместителей после снятия защиты можно использовать алкилирование и/или восстановительное аминировнаие.
Альтернативным образом, соединения изобретения, в которых Х=S или SCH2, или CH2S,можно получить способами, описанными для эквивалентных соединений, содержащих Х=О, ОСН2 или CH2О, при превращении перед циклизацией, соответствующей гидроксильной группы в тиольную при помощи известных в литературе способов (например, обработкой ацетилхлоридом и замещением бензилтиолом и превращением в свободный меркаптан). Аналогичным образом, гидроксильную группу можно превратить в соответствующие амины, что представляет собой альтернативный путь к получению некоторых соединений изобретения, в которых Х=N(R), N(R)CH2, CH2(R).
Соединения изобретения, в которых Y=S, можно получить из соответствующих соединений, в которых Y=О, при обработке, например, реагентом Лоусона, или бис(трициклогексилолово)сульфидом и BCl3, или другими тиилирующими реагентами.
Кроме того, в изобретении предоставлены фармацевтические композиции, содержащие соединения изобретения. В одном из вариантов воплощения композиция включает соединение формулы I, его фармацевтически приемлемую соль или стереоизомер, наряду с фармацевтически приемлемым носителем или эксципиентом.
В некоторых вариантах воплощения соединения изобретения проявляют эффективность при ингибировании активности моноаминового рецептора. Таким образом, в изобретении предлагаются способы ингибирования активности моноаминового рецептора. В одном из вариантов воплощения способ включает контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или более соединений изобретения для ингибирования активности данного моноаминового рецептора. В изобретении также предлагаются способы ингибирования активации моноаминового рецептора. В одном из вариантов воплощения способ включает контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или более соединений изобретения для ингибирования активации данного моноаминового рецептора.
Обычно моноаминовый рецептор представляет собой серотониновый рецептор. Обычно серотониновый рецептор представляет собой 5-НТ2А подкласс. Серотониновый рецептор можно выбрать из центральной нервной системы или перифирической нервной системы. В различных аспектах серотониновый рецептор находится в центральной нервной системе, или в клетках крови, или тромбоцитах. В других аспектах серотониновый рецептор является мутированным или модифицированным.
Обычно активность, ингибируемая по способу изобретения, представляет собой активность передачи сигнала. Кроме того, активность или активация обычно является конститутивной. Активность обычно связана с активацией серотонинового рецептора.
Кроме того, предлагаются способы ингибирования активации моноаминового рецептора. В одном из вариантов воплощения способ включает контактирование моноаминового рецептора или системы, содержащей моноаминовый рецептор, с эффективным количеством одного или более соединений изобретения для ингибирования активации моноаминового рецептора. В одном из аспектов ингибируемая активация представляет собой активацию, относящуюся к действию агонистического агента. Данный агонистический агент может быть экзогенным или эндогенным.
Кроме того, предлагаются способы лечения болезненного состояния, связанного, по меньшей мере, с одним моноаминовым рецептором. В одном из вариантов воплощения способ включает введение субъекту, нуждающемуся в подобном лечении, эффективного количества одного или более соединений изобретения для лечения болезненного состояния, связанного, по меньшей мере, с одним моноаминовым рецептором.
Как описано здесь, данное болезненное состояние может быть связано с дисфункцией, по меньшей мере, одного моноаминового рецептора. Альтернативно, или дополнительно, данное болезненное состояние может быть связано с активацией моноаминового рецептора. Кроме того, болезненное состояние может быть связано с повышенной активностью моноаминового рецептора. Болезненное состояние может быть выбрано из группы, включающей шизофрению, психоз, вызванный лекарствами психоз, вызванный лечением психоз, мигрень, гипертензию, тромбоз, вазоспазм, ишемию, депрессию, тревогу, нарушения сна и расстройства аппетита.
В изобретении также представлено применение соединения формулы I для получения лекарственного средства для лечения болезненного состояния, связанного с моноаминовым рецептором. В конкретных вариантах воплощения применение соединения формулы I для получения лекарственного средства для лечения заболевания выбрано из группы, включающей шизофрению, психоз (включая вызванный лекарствами или лечением психоз, такой как галлюциноз, вызванный лекарствами, применяемыми при лечении болезни Паркинсона), мигрень, гипертензию, тромбоз, вазоспазм, ишемию, депрессию, тревогу (включая общее тревожное расстройство), нарушения сна и расстройства аппетита.
Особенным аспектом изобретения является способ лечения и применение соединения формулы I для получения лекарственного средства для лечения шизофрении. В одном из вариантов воплощения способ включает введение субъекту, нуждающемуся в подобном лечении, терапевтически эффективного количества одного или более соединений изобретения для лечения шизофрении. В другом варианте воплощения применение соединения формулы I заключается в применении для получения лекарственного средства для лечения шизофрении.
Особый аспект изобретения представляет собой способ лечения и применение соединения формулы I для получения лекарственного средства для лечения мигрени. В одном из вариантов воплощения способ включает введение субъекту, нуждающемуся в подобном лечении, терапевтически эффективного количества одного или более соединений изобретения для лечения мигрени. В другом варианте воплощения применение соединения формулы I заключается в применении для получения лекарственного средства для лечения мигрени.
Следующий особый аспект изобретения представляет собой способ лечения и применение соединения формулы I для получения лекарственного средства для лечения вызванного лекарствами или вызванного лечением психоза или галлюциноза. В одном из вариантов воплощения способ включает введение субъекту, нуждающемуся в подобном лечении, терапевтически эффективного количества одного или более соединений изобретения для лечения вызванного лекарствами или лечением галлюциноза или психоза. В другом варианте воплощения использование соединения формулы I заключается в получении лекарственного средства для лечения вызванного лекарствами или лечением галлюциноза или психоза.
Учитывая природу активности серотонинового рецептора, его модулирование может оказать более одного "даунстрим"-эффекта и оказаться благотворным для лечения более чем одного болезненного состояния. Некоторые соединения изобретения могут лучше всего подойти для лечения шизофрении, тогда как другие соединения изобретения могут оказаться наиболее полезными для лечения, например, мигрени, гипертензии, тромбоза, вазоспазма, ишемии, депрессии, тревоги, нарушений сна и расстройств аппетита. Таким образом, в дополнительным аспектах в изобретении предлагаются способы лечения психоза, мигрени, гипертензии, тромбоза, вазоспазма, ишемии, депрессии, тревоги, нарушений сна и расстройств аппетита. В различных вариантах воплощения способ включает введение субъекту, нуждающемуся в подобном лечении, терапевтически эффективного количества одного или более соединений изобретения для лечения психоза, мигрени, гипертензии, тромбоза, вазоспазма, ишемии, депрессии, тревоги, нарушения сна и расстройства аппетита. Предлагается также применение соединения формулы I для получения лекарственного средства для лечения психоза, мигрени, гипертензии, тромбоза, вазоспазма, ишемии, депрессии, тревоги, нарушений сна и расстройств аппетита.
Кроме того, предлагаются способы идентификации генного полиморфизма, предрасполагающего субъекта к восприимчивости к одному или более соединениям формулы I. В одном из вариантов воплощения способ включает:
введение субъекту терапевтически эффективного количества соединения;
определение реакции указанного субъекта на указанное соединение для идентифицирования, таким образом, восприимчивого субъекта с улучшенным состоянием болезни, связанной с моноаминовым рецептором; и
идентификацию генетического полиморфизма в восприимчивом субъекте, где генетический полиморфизм предрасполагает данного субъекта к восприимчивости к данному соединению. Обычно улучшенное состояние болезни связано с 5-НТ классом или 5-НТ2А подклассом моноаминергических рецепторов.
Помимо этого, в изобретении предлагаются способы идентификации субъекта, подходящего для лечения при помощи одного или более соединений формулы I. В одном из вариантов воплощения способ включает детектирование наличия полиморфизма у субъекта, где полиморфизм предрасполагает данного субъекта к восприимчивости к данному соединению и где наличие полиморфизма указывает на то, что данный субъект подходит для лечения при помощи одного или более соединений формулы I.
В примерах приведены подходящие способы получения не ограничивающих вариантов воплощения данного изобретения и показана селективность и активность соединений изобретения по отношению к моноаминовым рецепторам.
ПРИМЕРЫ
Пример 1: синтетическая химия
Общие способы. Спектры 1Н ЯМР регистрировали при 400 МГц, тогда как спектры 13С ЯМР измеряли при 100 МГц с протоновым расщеплением при температуре окружающей среды. Химические сдвиги приведены в величинах δ [м.д.] относительно остаточного пика растворителя хлороформа (CDCl3) при 7,26 и 77,0 и метанола (CD3OD) при 3,31 и 49,2 м.д. Константы спин-спинового взаимодействия, J, приведены в герцах.
Реагенты и растворители были наивысшего качества, доступного от промышленных источников, и использовались без дополнительной очистки. Патроны для анионообменной твердофазной экстракции представляли собой MEGA BE-SCX от Varian.
Общая методика ЖХ-МС: ВЭЖХ/МС анализы проводили с использованием одного из двух способов (способ А или способ В).
Способ А: Agilent HP1100 ВЭЖХ/MCD. Бинарный насос G1312А, автоматический пробоотборник G1313А, ярус колонки G1316А, детектор с диодной матрицей G1315A (190-450 нм), 1946А MSD, электроспреевая ионизация.
Хроматография: подвижная фаза: 8 мМ ацетат аммония в смеси вода/ацетонитрил. Градиент начинают с 70% орг. до 100% орг. в течение 12 мин, уменьшение до 70% орг. в течение 0,5 мин, выдерживание в течение 3,5 мин. Общее время прохода 16 мин. Скорость потока 1 мл/мин.
Колонка: Phenomenex Luna С18(2) 3 мкм, 75×4,6 мм.
МС-параметры: газ-осушитель, 10 л/мин. Давление распылителя 40 фунт/кв. дюйм (изб.), темп. газа 350°С, Об. произв. 4000.
Способ В: Waters/Micromass ВЭЖХ/МС. 600 ЖХ-насос, управление образцами 2700, 996 детектор с диодной матрицей (190-450 нм), ZMD-масс-спектрометр Micromass, электроспреевая ионизация.
Хроматография: подвижная фаза: 10 мМ ацетат аммония в смеси вода/ацетонитрил. Градиент начинают с 30% орг. в течение 0,5 мин до 100% орг. в течение 9,5 мин, выдерживание в течение 2 мин, уменьшение до 30% орг. в течение 0,5 мин, выдерживание в течение 5,5 мин. Общее время прохода 18 мин. Скорость потока 1 мл/мин.
Колонка: Phenomenex Luna C18(2) 3 мкм, 75×4,6 мм.
МС-параметры: десольватирующий газ, 404 л/ч. Капиллярность, 5,3 кВ. Конусность, 36 В. Экстрактор, 3 В. Темп. блока питания, 130°С. Темп. десольватации, 250°С.
Пример 2: Получение 4-[1-карбокси-2-(4-фторфенил)этил]-4-гидрокси-1-метилпиперидина (69NLS42)
К охлажденному раствору N,N-диизопропиламина (4,2 мл, 30 ммоль) в ТГФ (25 мл) при -40°С при перемешивании прибавляли по каплям н-бутиллитий (1,6 М в гексане, 18,8 мл, 30 ммоль) в течение 5 мин. Раствор нагревали до 0°С и прибавляли раствор 3-(4-фторфенил)пропионовой кислоты (2,53 г, 15 ммоль) в ТГФ (20 мл). Смесь перемешивали в течение 30 мин при к.т. (комнатная температура), охлаждали до -78°С и в течение 15 мин прибавляли по каплям N-метилпиперидон (2,2 мл, 18 ммоль). Раствору давали нагреться до к.т. и выливали при перемешивании в смесь диэтилового эфира (100 мл) и воды (60 мл). Органический слой отбрасывали, водный слой экстрагировали следующей порцией диэтилового эфира. Водный слой подкисляли 4 М водн. HCl и один раз экстрагировали хлористым метиленом и н-бутанолом (3×100 мл). Объединенные н-бутанольные экстракты концентрировали в вакууме, получая 69NLS42 в виде светло-желтого масла, которое используют без дальнейшей очистки.
Rf=0,13 (MeOH/CH2Cl2 1:9).
Пример 3: Получение 4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-она (69NLS44)
Сырое производное пиперидина 69NLS42 (прибл. 15 ммоль) растворяли в толуоле (200 мл), добавляли триэтиламин (4,18 мл, 30 ммоль) и дифенилфосфорилазид (3,88 мл, 18 ммоль) и кипятили смесь с обратным холодильником в течение ночи. Растворитель удаляли в вакууме, остаток растворяли в хлористом метилене (200 мл) и экстрагировали 1 М HCl (3×100 мл). Объединенные водные экстракты подщелачивали 20%-ным водн. раствором КОН и экстрагировали хлористым метиленом (3×150 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и упаривали, получая 69NLS44 (2,06 г, 49% после двух стадий) в виде желтого твердого вещества, которое использовали без дальнейшей очистки.
Rf=0,25 (MeOH/CH2Cl2 1:9). ЖХМС m/z 278 [М+Н]+. ВЭЖХ tR=1,9 мин (способ В).
Пример 4: Получение 4-изобутоксибензилбромида (69NLS69)
Алкилирующий реагент получали по литературным методикам из п-крезола синтезом простого эфира по Вильямсону с последующим бронированием по Волю-Циглеру.
Пример 5: Гидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-она (69NLS75)
Оксазолидинон 69NLS44 (сырой, прибл. 7 ммоль) растворяли в смеси ДМФА/ТГФ (1:9, 50 мл), прибавляли гидрид натрия (50% в масле, 0,67 г, 14 ммоль) и перемешивали суспензию при к.т. в течение 30 мин перед прибавлением по каплям бромида 69NLS69 (1,5 г, 7 ммоль). Смесь перемешивали при к.т. в течение 4 ч, а затем распределяли между этилацетатом и водой. Органический слой отделяли, а водный слой дважды экстрагировали этилацетатом. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-6% метанола в хлористом метилене. В результате повторной очистки объединенных фракций на анионообменном SPE патроне получали указанное в заголовке соединение 69NLS75 в виде свободного амина (1,10 г, 34%) в виде бесцветного масла. Данное соединение растворяли в хлористом метилене, обрабатывали избытком 2 М HCl в диэтиловом эфире, осаждали из н-гептана, получая соль гидрохлорида в виде бесцветного масла с количественным выходом.
Rf=0,39 (MeOH/CH2Cl2 1:9). ЖХМС m/z 441 [М+Н]+. 1H ЯМР (CDCl3, свободный амин) δ 0,96 (д, 6Н, J=6,8, CH3), 1,24-1,32 (м, 1Н, пип-Н), 1,50 (м, 1Н, пип-Н), 1,62-1,70 (м, 1Н, пип-Н), 1,83 (м, 1Н, пип-Н), 1,96-2,06 (м, 1Н, CH(CH3)2), 2,17 (с, 3Н, NCH3), 2,26-2,34 (м, 2Н, пип-Н), 2,46 (м, 1Н, пип-Н), 2,60 (м, 1Н, пип-Н), 2,70 (дд, 1Н, J=7,3, 14,2, CH2ArF), 2,85 (дд, 1Н, J=6,6, 14,2, CH2ArF), 3,34 (т, 1Н, J=7,0, H-4), 3,57 (д, 1H, J=15,2, CH2ArOiBu), 3,63 (д, 2H, J=6,6, OCH2CH), 4,69 (д, 1H, J=15,2, CH2ArOiBu). 6,73-6,97 (м, 8Н, Ar-H). 13С ЯМР (CDCl3) δ 19,5, 28,5, 31,3, 34,2, 36,8, 46,1, 46,3, 51,2, 51,3, 63,5, 74,7, 79,6, 114,9, 116,0 (д, JC-F=21,0), 127,7, 129,6, 130,6 (д, JC-F=7,7), 132,9 (д, JC-F=34), 157,3, 159,2, 162,0 (д, JC-F=244,0). ВЭЖХ tR=10,4 мин (способ В).
Пример 6: Гидрохлорид 3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-она (69NLS52)
Указанное в заголовке соединение получали по методике, аналогичной той, которая описана для 69NLS75, из 69NLS44 и соответствующего производного бензилбромида.
Альтернативным образом, 69NLS44 можно сначала алкилировать 4-ацетоксибензилбромидом с последующей обработкой основанием и алкилированием полученной свободной гидроксильной функции циклопропилметилбромидом.
Rf=0,45 (MeOH/CH2Cl2 1:9). ЖХМС m/z 439 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 0,33 и 0,60 (2 м, 4Н, CH(CH2)2), 1,20-1,26 (м, 1H, CH(CH2)2), 1,37-1,45 (м, 1H, пип-Н), 1,58 (м, 1H, пип-Н), 1,79-1,86 (м, 1H, пип-Н), 1,98 (м, 1H, пип-Н), 2,26 (с, 3Н, NCH3), 2,34-2,42 (м, 2H, пип-Н), 2,63 (м, 1H, пип-Н), 2,77 (м, 1H, пип-Н), 2,87 (дд, 1H, J=7,0, 14,2, CH2ArF), 2,98 (дд, 1H, J=7,0, 14,2, CH2ArF), 3,58 (т, 1H, J=7,0, H-4), 3,72 (д, 1H, J=15,2, CH2ArOMecPr), 3,80 (д, 2H, J=6,8, OCH2), 4,61 (д, 1H, J=15,2, CH2ArOMecPr), 6,84-7,21 (м, 8Н, Ar-H). ВЭЖХ tR=6,5 мин (способ А).
Пример 7:
Получение трет-бутилового сложного эфира 4-[1-карбокси-2-(4-фторфенил)этил]4-гидроксипиперидин-1-карбоновой кислоты (69NLS56).
К охлажденному раствору N,N-диизопропиламина (2,0 мл, 14,0 ммоль) в ТГФ (10 мл) при -40°С прибавляли по каплям н-бутиллитий (1,6 М в гексане, 8,8 мл, 14,0 ммоль) при перемешивании в течение 5 мин. Раствор нагревали до 0°С и прибавляли раствор 3-(4-фторфенил)пропионовой кислоты (1,18 г, 7,0 ммоль) в ТГФ (8 мл). Смесь перемешивали в течение 30 мин при к. т, охлаждали до -78°С и в течение 15 мин прибавляли по каплям N-Boc-4-пиперидон (1,68 г, 8,4 ммоль) в ТГФ (7 мл). Раствору давали нагреться до к.т. и выливали при перемешивании в смесь диэтилового эфира (100 мл) и воды (50 мл). Органический слой отбрасывали, водный слой экстрагировали следующей порцией диэтилового эфира. Водный слой подкисляли 2 М водн. HCl до рН 3,5 и экстрагировали хлористым метиленом (3×100 мл). Объединенные экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая 69NLS56 в виде желтого твердого вещества, которое используют без дальнейшей очистки.
Rf=0,42 (MeOH/CH2Cl2 1:19). ЖХМС m/z 268 [М-ВОС+2Н]+. ВЭЖХ tR=3,7 мин (способ В).
Пример 8: Получение трет-бутилового сложного эфира 4-(4-фторбензил)-2-оксо-1-окса-3,8-диазаспиро[4.5]декан-8-карбоновой кислоты (69NLS58)
Сырое производное пиперидина 69NLS56 (прибл. 7 ммоль) растворяли в толуоле (100 мл), добавляли триэтиламин (2,0 мл, 14,0 ммоль) и дифенилфосфорилазид (1,8 мл, 14,0 ммоль) и кипятили смесь с обратным холодильником в течение ночи. Растворитель удаляли в вакууме, остаток растворяли в этилацетате (200 мл) и промывали водой и насыщенным раствором соли. Органический слой сушили над Na2SO4, фильтровали и упаривали, получая 69NLS58. В результате очистки остатка колоночной хроматографией на силикагеле при постепенным элюировании 0-2% метанола в хлористом метилене получали 69NLS58 в виде желтого твердого вещества (1,47 г, общий выход 58%).
Rf=0,63 (MeOH/CH2Cl2 1:19). Rf=0,33 (этилацетат/н-гептан 1:1). ЖХМС m/z 265 [М-ВОС+2Н]+. ВЭЖХ tR=10,3 мин (способ В).
Пример 9: Получение трет-бутилового сложного эфира 4-(4-фторбензил)-3-(4-изобутоксибензил)-2-оксо-1-окса-3,8-диазаспиро[4.5]декан-8-карбоновой кислоты (69NLS77)
Указанное в заголовке соединение получали алкилированием трет-бутилового сложного эфира 4-(4-фторбензил)-2-оксо-1-окса-3,8-диазаспиро[4.5]декан-8-карбоновой кислоты 69NLS58 (7,40 г, 20,3 ммоль) 4-изобутоксибензилбромидом (4,88 г, 20,3 ммоль) по методике, аналогичной той, которая описана для 69NLS75. После очистки сырого продукта колоночной хроматографией на силикагеле с постепенным элюированием 0-60% этилацетата в н-гептане выделенное соединение растворяли в минимальном количестве этилацетата и осаждали н-гептаном, получая после фильтрования 69NLS77 (5,86 г, 55%) в виде бесцветного твердого вещества.
Rf=0,64 (этилацетат/н-гептан 1:1). ЖХМС m/z 544 [M+NH4]+. 1H ЯМР (CDCl3) δ 1,02 (д, 6Н, J=6,6, CH3), 1,36-1,60 (м, 12Н, С(CH3)3, пип-Н), 1,88 (м, 1Н, пип-Н), 2,05-2,11 (м, 1Н, CH(CH3)2), 2,74 (дд, 1Н, J=7,6, 14,2, CH2ArF), 2,95 (дд, 1Н, J=6,6, 14,2, СН2ArF), 3,08 (м, 2Н, пип-Н), 3,39 (т, 1Н, J=7,2, Н-4), 3,66 (д, 1Н, J=15,0, CH2ArOiBu). 3,71 (д, 2Н, J=6, 6, OCH2СН), 3,82 (м, 1Н, пип-Н), 3,92 (м, 1Н, пип-Н), 4,77 (д, 1Н, J=15,0, СН2ArOiBu), 6,82-7,03 (м, 8Н, Ar-H). ВЭЖХ tR=14,8 мин (способ В).
Пример 10: Гидрохлорид 8-(2-[1,3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS79-II)
С 69NLS77 (300 мг, 0,57 ммоль) снимали N-BOC защиту обработкой раствором ТФУ (2 мл) в хлористом метилене (2 мл) при к.т. в течение 1,5 ч. Растворитель удаляли в вакууме, остаток дважды упаривали с ацетонитрилом и повторно растворяли в том же растворителе (10 мл). Добавляли карбонат калия (110 мг, 0,80 ммоль) и 2-(2-бромэтил)-1,3-диоксолан (80 мкл, 0,68 ммоль), затем йодид натрия (102 мг, 0,68 ммоль) и перемешивали смесь в течение 3 дней при 50°С. В результате распределения смеси между водой и хлористым метиленом, двойной экстракции водного слоя хлористым метиленом, сушки объединенных органических слоев над Na2SO4, фильтрования и выпаривания растворителя получали сырой 69NLS79-II. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-4% метанола в хлористом метилене, получая 69NLS79-II (127 мг, 0,24 ммоль) в виде бесцветного масла. Соединение переводили в HCl форму обработкой 2 М HCl в диэтиловом эфире, как описано выше для 69NLS75, получая соль в виде бесцветного порошка.
Rf=0,61 (MeOH/CH2Cl2 1:9). ЖХМС m/z 527 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,00 (д, 6Н, J=6,6, СН3), 1,34-1,42 (м, 1Н, пип-Н), 1,56 (м, 1Н, пип-Н), 1,72-1,81 (м, 3Н, пип-Н, O2CHCH2), 1,92 (м, 1Н, пип-Н), 1,97-2,06 (м, 1Н, CH(СН3)2), 2,27-2,35 (м, 1Н, пип-Н), 2,44 (м, 2Н, NCH2), 2,63 (м, 1Н, пип-Н), 2,76 (м, 1Н, пип-Н), 2,85 (дд, 1Н, J=7,0, 14,2, CH2ArF), 2,95 (дд, 1Н, J=7,0, 14,2, CH2ArF), 3,60 (м, 1Н, Н-4), 3,69 (д, 2Н, J=6,5, OCH2СН), 3,70 (д, 1Н, J=15,2, CH2ArOiBu), 3,76-3,82 и 3,85-3,91 (2 м, 4Н, ОСН2), 4,60 (д, 1Н, J=15,2, CH2ArOiBu), 4,82 (т, 1Н, J=4,7, O2СН), 6,83-7,19 (м, 8Н, Ar-H). ВЭЖХ tR=11,3 мин (способ В).
Пример 11: Дигидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-(3-морфолин-4-илпропил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS83)
С 69NLS77 (300 мг, 0,57 ммоль) снимали N-BOC защиту, как описано при получении 69NLS79-II, и растворяли в ацетонитриле (3 мл) и ДМФА (1 мл). К раствору морфолина (65 мкл, 0,74 ммоль) в ацетонитриле (3 мл) и ДМФА (1 мл) прибавляли по каплям 1-хлор-3-йодпропан (73 мкл, 0,68 ммоль) и карбонат калия (300 мг, 2,17 ммоль). Смесь нагревали при 50°С в течение 3 ч перед прибавлением раствора, содержащего спиропиперидин со снятой защитой, а затем йодид натрия (102 мг, 0,68 ммоль). Смесь перемешивали в течение ночи при 50°С и обрабатывали, как описано выше для 69NLS79-II. В результате очистки остатка колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-6% метанола в хлористом метилене получали требуемое соединение (127 мг, 40%) в виде бесцветного масла. Обработка продукта в хлористом метилене 2 М HCl в диэтиловом эфире, как описано выше для 69NLS75, приводила к соответствующей дигидрохлоридной соли в виде бесцветного порошка.
Rf=0,48 (МеОН/СН2Cl2 1:9). ЖХМС m/z 544 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,01 (д, 6Н, J=6,9, СН3), 1,36-1,43 (м, 1Н, пип-Н), 1,56-1,83 (м, 4Н, пип-Н, NCH2CH2), 1,94-2,06 (м, 2Н, ОСН2СН, пип-Н), 2,30-2,49 (м, 10Н, пип-Н, NCH2CH2O, NCH2CH2CH2N), 2,68 (м, 1Н, пип-Н), 2,79-2,88 (м, 2Н, пип-Н, СН2ArF), 2,97 (дд, 1Н, J=6,8, 14,3, СН2ArF), 3,56-3,74 (м, 8Н, Н-4, OCH2СН, CH2ArOiBu, NCH2CH2O), 4,60 (д, 1Н, J=15,0, СН2ArOiBu), 6,84-7,20 (м, 8Н, Ar-Н). ВЭЖХ tR=10,2 мин (способ В).
Пример 12: Гидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибен-зил)-8-изопропил-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS85)
С 69NLS77 (320 мг, 0,60 ммоль) снимали N-BOC защиту, как описано при получении 69NLS79-II, и растворяли в ДМФА (3 мл). Прибавляли карбонат калия (250 мг, 1,80 ммоль), затем изопропилбромид (68 мкл, 0,73 ммоль) и йодид натрия (110 мг, 0,73 ммоль) и перемешивали смесь в течение ночи при 50°С. Обработку проводили, как в случае 69NLS79-II. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-6% метанола в хлористом метилене с последующей повторной очисткой соединения на анионообменной колонке, получая 69NLS85 (150 мг, 53%) в виде бесцветного масла. Соединение переводили в форму гидрохлорида обработкой 2 М HCl в диэтиловом эфире, как описано выше, получая соль в виде бесцветного порошка.
Rf=0,75 (MeOH/CH2Cl2 1:9). ЖХМС m/z 469 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,00 (д, 6Н, J=6,7, СН3), 1,01 (д, 6Н, J=6,4, СН3), 1,35-1,42 (м, 1Н, пип-Н), 1,56-1,60 (м, 1Н, пип-Н), 1,72-1,79 (м, 1Н, пип-Н), 1,93-2,06 (м, 2Н, ОСН2CH, пип-Н), 2,44-2,51 (м, 2Н, пип-Н), 2,59-2,75 (м, 3Н, пип-Н, NCH(СН3)2), 2,82-2,97 (м, 2Н, СН2ArF), 3,56 (т, 1Н, J=6,8, Н-4), 3,69-3,73 (м, 3Н, OCH2СН, CH2ArOiBu), 4,61 (д, 1Н, J=15,2, CH2ArOiBu), 6,83-7,19 (м, 8Н, Ar-H). ВЭЖХ tR=11,0 мин (способ В).
Пример 13: Гидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4,5]декан-2-она (38РН17-HCl)
Указанное в заголовке соединение получали в виде бесцветного твердого вещества с выходом 29% из 69NLS77 (180 мг, 0,34 ммоль) по той же методике, которая описана для 69NLS85. В качестве алкилирующего реагента использовали 2-(2-оксоимидазолидин-1-ил)этиловый сложный эфир толуол-4-сульфокислоты.
Rf=0,63 (MeOH/CH2Cl2 1:9). ЖХМС m/z 539 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,01 (д, 6Н, J=6,8, СН3), 1,34-1,42 (м, 1Н, пип-Н), 1,56 (м, 1Н, пип-Н), 1,77-1,85 (м, 1Н, пип-Н), 1,94 (м, 1Н, пип-Н), 1,99-2,07 (м, 1Н, CH(СН3)2), 2,33-2,42 (м, 2Н, пип-Н), 2,55 (т, 2Н, J=6,6, NCH2CH2), 2,71 (м, 1Н, пип-Н), 2,83-2,89 (м, 2Н, пип-Н, СН2ArF), 2,97 (дд, 1Н, J=7,0, 14,2, СН2ArF), 3,25 (т, 2Н, J=6,6, NCH2CH2), 2,89-3,36, 3,42-3,46 (2 м, 4Н, CONCH2), 3,56 (т, 1Н, J=7,0, Н-4), 3,71 (д, 2Н, J=6,4, OCH2СН), 3,70 (д, 1Н, J=15,0, CH2ArOiBu), 4,60 (д, 1Н, J=15,0, СН2ArOiBu), 6,84-7,20 (м, 8Н, Ar-H). ВЭЖХ tR=10,0 мин (способ В).
Пример 14: Гидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS81)
С 69NLS77 (300 мг, 0,57 ммоль) снимали N-BOC защиту, как описано при получении 69NLS79-II. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-6% метанола в хлористом метилене и очисткой на анионообменном SPE патроне, получая 69NLS81 (127 мг, 52%) в виде бесцветного масла. Получение гидрохлоридной соли проводили, как описано ранее для 69NLS75, получая указанное в заголовке соединение в виде бесцветного твердого вещества.
Rf=0,29 (MeOH/CH2Cl2 1:9). ЖХМС m/z 427 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,00 (д, 6Н, J=6,8, СН3), 1,25-1,33 (м, 1Н, пип-Н), 1,52 (м, 1Н, пип-Н), 1,65-1,73 (м, 1Н, пип-Н), 1,91 (м, 1Н, пип-Н), 1,98-2,06 (м, 1Н, CH(СН3)2), 2,73-2,97 (м, 6Н, пип-Н, СН2ArF), 3,53 (т, 1Н, J=7,0, Н-4), 3,68-3,71 (м, 3Н, ОСН2СН, CH2ArOiBu), 4,59 (д, 1Н, J=15,2, CH2ArOiBu), 6,83-7,19 (м, 8Н, Ar-Н). ВЭЖХ tR=9,7 мин (способ В).
Пример 15: Гидрохлорид 8-циклопропилметил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-З,8-диазаспиро[4,5]декан-2-она (38РН16-HCl)
Указанное в заголовке соединение получали в виде бесцветного твердого вещества с выходом 10% из 69NLS77 (180 мг, 0,34 ммоль) по той же методике, которая описана для 69NLS85.
Rf=0,64 (MeOH/CH2Cl2 1:9). ЖХМС m/z 481 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 0,25, 0,62 (2 м, 4Н, СН(CH2)2), 0,92-0,99 (м, 1Н, СН(СН2)2), 1,03 (д, 6Н, J=6,6, СН3), 1,52-1,59 (м, 1Н, пип-Н), 1,71 (м, 1Н, пип-Н), 1,89-2,15 (м, 3Н, пип-Н, CH(СН3)2), 2,60 (д, 2Н, J=6,8, NCH2), 2,73-2 80 (м, 2Н, пип-Н), 2,90 (дд, 1Н, J=7,2, 14,4, СН2ArF), 3,03 (дд, 1Н, J=7,0, 14,4, CH2ArF), 3,25-3,13 (м, 2Н, пип-Н), 3,66 (т, 1Н, J=7,2, NCH), 3,73 (д, 1Н, J=6,4, OCH2СН), 3,76 (д, 1Н, J=15,0, CH2ArOiBu), 4,63 (д, 1Н, J=15,0, CH2ArOiBu), 6,85-7,23 (м, 8Н, Ar-H). ВЭЖХ tR=11,4 мин (способ В).
Пример 16: Гидрохлорид 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-этил-1-окса-3,8-диазаспиро[4,5]декан-2-она (38-РН20)
С 69NLS77 (190 мг, 0,45 ммоль) снимали N-BOC защиту, как описано при получении 69NLS79-II, и растворяли в ДМФА (3 мл). Добавляли карбонат калия (250 мг, 1,80 ммоль), затем этилбромид (50 мкл, 0,45 ммоль) и перемешивали смесь в течение ночи при к.т. Обработку продукта осуществляли, как в случае 69NLS79-II. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-6% метанола в хлористом метилене с последующей очисткой на анионообменном SPE патроне, получая 38-РН20 (77 мг, 38%) в виде бесцветного масла. Соединение переводили в гидрохлоридную форму обработкой 2 М HCl в диэтиловом эфире, как описано выше, получая данную соль в виде бесцветного порошка.
Rf=0,52 (MeOH/CH2Cl2 1:9). ЖХМС m/z 455 [М+Н]+. 1H ЯМР (CDCl3, соль) δ 0,96 (д, 6Н, J=6,6, СН3), 1,39-1,55 (м, 6Н, NCH2CH3, пип-Н), 1,98-2,04 (м, 2Н, пип-Н, CH(СН3)2), 2,75-2,86 (м, 2Н, CH2ArF), 2,98 (м, 4Н, NCH2СН3, пип-Н), 3,19 (д, 1Н, J=14,6, CH2ArOiBu), 3,25-3,50 (м, 3Н, пип-Н, Н-4), 3,62 (д, 2Н, J=6,3, OCH2CH), 4,60 (д, 1Н, J=14,6, CH2ArOiBu), 6,70-7,19 (м, 8Н, Ar-H). ВЭЖХ tR=4,7 мин (способ А).
Пример 17: Гидрохлорид 3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (84AF8-30)
Указанное в заголовке соединение получали в виде бесцветного твердого вещества с выходом 25% из 69NLS44 (85 мг, 0,30 ммоль) по той же методике, которая описана для 69NLS75.
Rf=0,44 (MeOH/CH2Cl2 6:94). ЖХМС m/z 434 [М+Н]+. 1H ЯМР (CDCl3, свободный амин) δ 1,42-1,50 (м, 1Н, пип-Н), 1,58-1,63 (м, 1Н, пип-Н), 1,76-1,83 (м, 1Н, пип-Н), 1,90-1,95 (м, 1Н, пип-Н), 2,28 (м, 3Н, NCH3), 2,37-2,45 (м, 2Н, пип-Н), 2,60 (м, 1Н, пип-Н), 2,72 (м, 1Н, пип-Н), 2,80 (дд, 1Н, J=6,8, 14,4, CH2ArF), 2,87 (дд, 1Н, J=7,6, 14,4, СН2ArF), 3,45 (т, 1Н, J=6,8, NCH), 3,73 (д, 1Н, J=15,2, CH2ArOiBu), 4,71 (д, 1Н, J=15,2, СН2ArOiBu), 6,50 (т, 1Н, JC-F=73,6, CF2H), 6,96-7,06 (м, 8Н, Ar-H). ВЭЖХ tR=2,7 мин (способ А).
Пример 18: Получение 4-[1-карбокси-2-(4-метилфенил)этил]-4-гидрокси-1-метилпиперидина (69NLS13)
Указанное в заголовке соединение получали по аналогии с методикой, описанной для 69NLS42, исходя из 3-(4-метилфенил)пропионовой кислотой (0,70 г, 4,26 ммоль).
Rf=0,14 (MeOH/CH2Cl2 1:9).
Пример 19: Получение 4-(4-метилбензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS15)
Указанное в заголовке соединение получали из 69NLS13 по аналогии с методикой, описанной для 69NLS44.
Rf=0,5 (MeOH/CH2Cl2 1:9). ЖХМС m/z 275 [M+H]+. ВЭЖХ tR=3,8 мин (способ В).
Пример 20: Получение гидрохлорида 8-метил-4-(4-метилбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS21)
Указанное в заголовке соединение получали с общим выходом 24% алкилированием 69NLS15 п-трифторметоксибензилбромидом, как описано в методике для 69NLS75. Превращение свободного амина в гидрохлоридную соль проводили, как описано выше, получая указанное в заголовке соединение в виде бесцветного твердого вещества.
Rf=0,26 (MeOH/CH2Cl2 1:9). ЖХМС m/z 449 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,46-1,53 (м, 1Н, пип-Н), 1,64 (м, 1Н, пип-Н), 1,81-1,89 (м, 1Н, пип-Н), 1,97 (м, 1Н, пип-Н), 2,24, 2,30 (2 с, 6Н, Ar-СН3, NCH3), 2,30-2,38 (м, 2Н, пип-Н), 2,63 (м, 1Н, пип-Н), 2,74 (м, 1Н, пип-Н), 2,85 (дд, 1Н, J=6,7, 14,2, СН2ArMe), 2,92 (дд, 1Н, J=7,4, 14,2, СН2ArMe), 3,67 (т, 1Н, J=7,0, H-4), 3,90 (д, 1Н, J=15,2, СН2ArOCF3), 4,59 (д, 1Н, J=15,2, СН2ArOCF3), 7,03-7,21 (м, 8Н, Ar-H). ВЭЖХ tR=10,9 мин (способ В).
Пример 21: Гидрохлорид 3-(4-метоксибензил)-8-метил-4-(4-метилбензил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS35)
Указанное в заголовке соединение получали с выходом 20% по аналогии с методикой, описанной для 69NLS75, алкилированием 69NLS15 п-метоксибензилхлоридом. Однако в данном случае реакцию проводили при кипячении с обратным холодильником в течение 3 ч. Превращение свободного амина в гидрохлоридную соль проводили, как описано выше, получая указанное в заголовке соединение в виде бесцветного твердого вещества.
Rf=0,45 (MeOH/CH2Cl2 1:9). ЖХМС m/z 395 [М+Н]+. 1H ЯМР (CD3OD, свободный амин) δ 1,33-1,41 (м, 1Н, пип-Н), 1,51-1,56 (м, 1Н, пип-Н), 1,77-1,85 (м, 1Н, пип-Н), 1,92-1,97 (м, 1Н, пип-Н), 2,22 и 2,30 (2 с, 6Н, Ar-СН3, NCH3), 2,27-2,36 (м, 2Н, пип-Н), 2,56 (м, 1Н, пип-Н), 2,70(м, 1Н, пип-Н), 2,81 (дд, 1Н, J=7,2, 14,2, СН2ArMe), 2,94 (дд, 1Н, J=7,0, 14,2, СН2ArMe), 3,56 (т, 1Н, J=7,0, Н-4), 3,72 (д, 1Н, J=15,2, СН2ArOMe), 3,76 (с, 3Н, ОСН3), 4,59 (д, 1Н, J=15,2, СН2ArOMe), 6,84-7,13 (м, 8Н, Ar-H). ВЭЖХ tR=6,2 мин (способ А).
Примеры 22 и 23: Гидрохлорид (4R)- и (4S)-4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (78NLS59 и 78NLS62)
Разделение рацемата 64NLS44 проводили при временном введении камфаноильной вспомогательной хиральной группы. Два полученных диастереомера разделяли дробной кристаллизацией, заместитель камфановой кислоты удаляли, а полученные спиропиперидины алкилировали производным соответствующего бензилбромида.
Примеры 24 и 25: Получение 3-[(-)-камфаноил]-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она и разделение двух диастереомеров (78NLS52-крист. и 78NLS52-фильт.)
К охлажденному раствору 69NLS44 (360 мг, 1,29 ммоль) в ТГФ (10 мл) при -78°С прибавляли по каплям н-бутиллитий (2,7 М в гептане, 0,53 мл, 1,42 ммоль) и перемешивали смесь в течение 30 мин. Прибавляли по каплям при -78°С раствор хлорида (-)камфановой кислоты (307 мг, 1,42 ммоль) в ТГФ (2 мл), раствор перемешивали в течение 15 мин при -78°С, а затем 3 ч при к.т. Добавляли насыщенный раствор хлорида аммония (5 мл) и трижды экстрагировали смесь этилацетатом. Объединенные органические экстракты промывали насыщ. раствором NaHCO3 и насыщенным раствором соли, сушили над Na2SO4, фильтровали и упаривали. Остаток кристаллизовали из смеси этилацетат/н-гептан при к.т. Отфильтровывали светло-желтые кристаллы 78NLS52-крист. (155 мг, 26%, de>98%, определенный по 1Н ЯМР), маточный раствор концентрировали и очищали колоночной хроматографией при элюировании с постепенным градиентом 0-2% метанола в хлористом метилене. Второй диастереомер собирался в начальных фракциях, которые упаривали, а остаток кристаллизовали, как раньше. При упаривании маточного раствора получали 78NLS52-фильт. (28 мг, 5%, de 98%, определенный по 1Н ЯМР) в виде бесцветного масла.
78NLS52-крист. (de>98%): Rf=0,40 (МеОН/CH2Cl2 1:9). ЖХМС m/z 459 [M+H]+. 1Н ЯМР (CDCl3) δ 0,87, 1,09 и 1,15 (3с, 3×3H, CH3), 1,45-1,53 (м, 1H, пип-H), 1,70-1,80 (м, 3H, пип-H, камф-H), 1,83-1,92 (м, 1H, камф-H), 1,97-2,02 (м, 1H, пип-H), 2,13-2,20 (м, 1H, камф-H), 2,24 (с, 3H, NCH3), 2,29-2,38 (м, 2H, пип-H), 2,55-2,61 (м, 2H, пип-H, камф-H), 2,66 (м, 1H, пип-H), 2,80 (дд, 1H, J=9,0, 14,2, CH2Ar), 3,06 (дд, 1H, J=4,9, 14,2, CH2Ar), 4,59 (дд, 1H, J=4,9, 9,0, H-4), 6,98-7,25 (м, 4H, Ar-H). ВЭЖХ tR=8,1 мин (способ В).
78NLS52-фильт. (de 98%): Rf=0,40 (МеОН/CH2Cl2 1:9). ЖХМС m/z 459 [M+H]+. 1Н ЯМР (CDCl3) δ 0,98, 1,09 и 1,13 (3с, 3×3H, CH3), 1,59-1,70 (м, 2Н, пип-Н), 1,73-1,80 (м, 1Н, камф-Н), 1,84-1,91 (м, 1Н, камф-Н), 1,97 (м, 2Н, пип-Н), 2,08-2,15 (м, 1Н, камф-Н), 2,25 (с, 3Н, NCH3), 2,24-2,37 (м, 2Н, пип-Н), 2,50-2,60 (м, 2Н, пип-Н), 2,94-3,01 (м, 2Н, СН2Ar, пип-Н), 3,12 (дд, 1Н, J=4,1, 14,2, СН2Ar), 4,32 (дд, 1Н, J=4,1, 9,0, H-4), 6,95-7,24 (м, 4Н, Ar-H). ВЭЖХ tR=8,7 мин (способ В).
Примеры 25 и 26: Получение (4R)- и (4S)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (78NLS57 и 78NLS61)
К раствору 78NLS52-крист. (100 мг, 0,22 ммоль) в смеси ТГФ/вода (4 мл, 3:1) при 0°С прибавляли моногидрат гидроксида лития (20 мг, 0,47 ммоль). После перемешивания в течение 1 ч при 0°С добавляли насыщ. водн. NaHCO3 (3 мл), раствор трижды экстрагировали диэтиловым эфиром, а объединенные органические экстракты сушили над Na2SO4, фильтровали и упаривали. Сырое соединение 78NLS57 (60 мг) использовали без дальнейшей очистки. Аналогичным образом при обработке 78NL352-фильт. (28 мг, 61 мкмоль) гидроксидом лития получали 78NLS61.
Примеры 27 и 28: Получение гидрохлорида (4R)- и (4S)-4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (78NLS59 и 78NLS62)
В результате алкилирования 78NLS57 (прибл. 0,22 ммоль) способом, описанным для 69NLS75, получали энантиомер 78NLS59 (45 мг, 48% после двух стадий). Аналогичным образом при алкилировании второго энантиомера 78NLS61 (прибл. 61 мкмоль) получали 78NLS62 (7 мг, 25% после двух стадий). Спектрохимические данные для обоих соединений были идентичны данным, полученным для 69NLS75. Определенный энантиомерный избыток (ее) составил 98% для 78NLS59 и 93% для 78NLS62 с использованием анализа хиральной ВЭЖХ (колонка Chiracel OD-H, 4,6×250 мм, гексан/изо-PrOH/ДЭА 95:5:0,2; 0,5 мл/мин, tR 20,8 и 23,6 мин для 78NLS59 и 78NLS62 соответственно).
Последующий рентгенодифракционный анализ промежуточного соединения 78NLS52-крист. позволил установить (S)-конфигурацию для элюируемого в начале энантиомера (78NLS59, формула II). При биологической оценке in vivo было показано, что данный (S)-энантиомер представляет собой эвтомер по отношению к 5-НТ2А рецептору (пример 2, таблица 1).
Формула II
78NLS59
Пример 29: Бромид [2-(4-фторфенил)этил]трифенилфосфония (78NLS66)
4-фторфенилэтилбромид (700 мг, 3,44 ммоль) растворяли в толуоле (4 мл), добавляли трифенилфосфин (904 мг, 3,44 ммоль) и нагревали раствор в течение 10 мин в закрытой колбе при 200°С при микроволновом облучении. После охлаждения до к.т.растворитель декантировали и получали указанное в заголовке соединение с количественным выходом в виде остающегося стеклообразного твердого вещества, которое использовали без дальнейшей очистки.
Rf=0,70 (MeOH/CH2Cl2 1:9). 1H ЯМР (CDCl3) δ 2,99-3,06 (м, 2Н, РСН2CH2), 4,16-4,23 (м, 2Н, РСН2), 6,86-7,35 (м, 4Н, ArF-Н), 7,67-7,90 (м, 15Н, PPh3).
Пример 30: Бензиловый сложный эфир 4-[2-(4-фторфенил)этилиден]пиперидин-1-карбоновой кислоты (103NLS05)
К суспензии бромида фосфония 78NLS66 (4,69 г, 10,1 ммоль) в ТГФ (100 мл) при 0°С прибавляли н-бутиллитий (1,6 М в гексане, 6,3 мл, 10,1 ммоль), получая темно-красный раствор. После перемешивания в течение 1 ч при к.т, прибавляли по каплям раствор бензил-4-оксо-1-пиперидинкарбоксилата (2,24 г, 9,6 ммоль) в ТГФ (10 мл) в течение 30 мин. Смесь перемешивали при к.т. в течение 20 ч, затем добавляли воду и трижды экстрагировали смесь диэтиловым эфиром. Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. В результате очистки остатка колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-10% этилацетата в н-гептане получали указанное в заголовке соединение (0,56 г, 17%) в виде бесцветного масла.
Rf=0,63 (этилацетат/н-гептан 2:3). ЖХМС m/z 362 [M+Na]+. 1H ЯМР (CDCl3) δ 2,24 (м, 2Н, пип-Н), 2,35 (м, 2Н, пип-Н), 3,37 (д, 2Н, J=7,2, CH2ArF), 3,55 (м, 4Н, пип-Н), 5,16 (с, 2Н, OCH2), 5,43 (т, 1Н, J=1,2, СН=), 6,96-7,40 (м, 9Н, Ar-H). ВЭЖХ tR=10,7 мин (способ В).
Пример 31: Бензиловый сложный эфир 2-(4-фторбензил)-1-окса-6-азаспиро[2,5]октан-6-карбоновой кислоты (103NLS09)
К раствору олефина 103NLS05 (79 мг, 0,23 ммоль) в хлористом метилене (3 мл) при 0°С прибавляли по каплям раствор м-хлорпербензойной кислоты (70% в Н2O, 69 мг, 0,28 ммоль). Смесь перемешивали при к. т.в течение 24 ч, разбавляли хлористым метиленом и промывали 10%-ным водн. раствором NaHCO3. Органический слой сушили над Na2SO4, фильтровали и упаривали досуха. Указанное в заголовке соединение получали с количественным выходом и использовали без дополнительной очистки.
Rf=0,53 (этилацетат/н-гептан 2:3). ЖХМС m/z 356 [М+Н]+. 1H ЯМР (CDCl3) δ 1,39 (м, 1Н, пип-Н), 1,66 (м, 1Н, пип-Н), 1,83-1,90 (м, 2Н, пип-Н), 2,79-2,92 (м, 2Н, СН2Ar2), 3,03 (м, 1Н, ОСН), 3,39-3,45 (м, 2Н, пип-Н), 3,83-3,89 (м, 2Н, пип-Н), 5,16 (с, 2Н, ОСН2), 6,98-7,36 (м, 9Н, Ar-H). ВЭЖХ tR=9,3 мин (способ В).
Пример 32: Бензиловый сложный эфир 4-[1-амино-2-(4-фторфенил)этил]-4-гидроксипиперидин-1-карбоновой кислоты (103NLS28)
К раствору аммиака в метаноле (7 н., 5 мл) прибавляли сырой эпоксид 103NLS09 (520 мг, 1,40 ммоль) и нагревали раствор в течение 20 ч в закрытой колбе при 100°С. После охлаждения до к.т.растворитель удаляли, а остаток очищали C18 твердофазной экстракцией с обращенной фазой при элюировании с постепенным градиентом 0-80% метанола в хлористом метилене, получая аминоспирт 103NLS28 (459 мг, 88%).
Rf=0,62 (MeOH/CH2Cl2 1:9). ЖХМС m/z 373 [М+Н]+. 1H ЯМР (CDCl3) δ 1,52-1,67 (м, 4Н, пип-Н), 2,37 (дд, 1Н, J=11,3, 13,8, CH2ArF), 2,70 (м, 3Н, NH2, ОН), 2,81 (дд, 1Н, J=2,9, 11,3, CH2ArF), 2,97 (дд, 1Н, J=2,9, 13,8, CHNH2), 3,20-3,26 (м, 2Н, пип-Н), 4,03-4,08 (м, 2Н, пип-Н), 5,15 (с, 2Н, ОСН2), 6,98-7,38 (м, 9Н, Ar-H). ВЭЖХ tR=5,5 мин (способ В).
Пример 33: Бензиловый сложный эфир 5-(4-фторбензил)-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоновой кислоты (103NLS30C)
Указанное в заголовке соединение получали из аминоспирта 103NLS28 (303 мг, 0,81 ммоль) по литературной методике (Clark et al., J. Med. Chem. 26:855-861 (1983)) ацилированием аминофункции хлорацетилхлоридом с последующим обменом галогена при действии NaI и замыканием цикла йод-производного в присутствии трет-бутоксида. В результате очистки сырого продукта колоночной хроматографией на силикагеле при постепенном элюировании 0-100% этилацетата в н-гептане получали указанное в заголовке соединение (64 мг, общий выход 19%) в виде бесцветного твердого вещества.
Rf=0,19 (этилацетат/н-гептан 3:2). ЖХМС m/z 458 [М+Н]+. lH ЯМР (CDCl3) δ 1,52-1,74 (м, 2Н, пип-Н), 1,87-1,98 (м, 2Н, пип-Н), 2,47 (дд, 1Н, J=11,7, 13,3, СН2ArF), 2,81 (дд, 1Н, J=2,7, 13,3, СН2ArF), 3,04-3,22 (м, 2Н, пип-Н), 3,40-3,45 (м, 1Н, Н-5), 4,05-4,20 (м, 4Н, Н-2, пип-Н), 5,15 (с, 2Н, ОСН2Ph), 5,55 (с, 1Н, NH), 6,99-7,37 (м, 9Н, Ar-Н). ВЭЖХ tR=12,4 мин (способ В).
Пример 34: Бензиловый сложный эфир 5-(4-фторбензил)-4-(4-изобутоксибензил)-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоновой кислоты (103NLS33)
Алкилирование спироцикла 103NLS30C (61 мг, 0,148 ммоль) осуществляли, как описано для получения 69NLS75, с использованием 4-изобутоксибензилбромида 69NLS69 в качестве алкилирующего реагента. После очистки остатка колоночной хроматографией на силикагеле при постепенном элюировании 0-70% этилацетата в н-гептане указанное в заголовке соединение 103NLS33 (62 мг, 73%) получали в виде бесцветного масла.
Rf=0,37 (этилацетат/н-гептан 1:1). ЖХМС m/z 575 [М+Н]+. 1H ЯМР (CDCl3) δ 0,79-0,88 (м, 1Н, пип-Н), 1,02 (д, 6Н, J=64, СН3), 1,32-1,37 (м, 1Н, пип-Н), 1,69-1,81 (м, 2Н, пип-Н), 2,03-2,09 (м, 1Н, CH(СН3)2), 2,72 (д, 1Н, J=14,3, CH2ArOiBu), 2,86-2,95 и 3,07-3,15 (2 м, 5Н, Н-5, CH2ArF, пип-Н), 3,70 (д, 2Н, J=6,4, OCH2СН), 3,80-3,85 (м, 2Н, пип-Н), 4,16 (АВ, 2Н, J=17,6, H-2), 5,06 (с, 2Н, OCH2Ph), 5,35 (д, 1Н, J=14,3, CH2ArOiBu), 6,78-7,36 (м, 13Н, Ar-H). ВЭЖХ tR=10,9 мин (способ В).
Пример 35: 5-(4-фторбензил)-4-(4-изобутоксибензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он (103NLS35)
Со спироцикла 103NLS33 (62 мг, 0,107 ммоль) в этаноле (5 мл) снимали защиту N-CBz гидрированием в присутствии Pd/C (10%, 40 мг) под давлением Н2 из баллона. Катализатор отфильтровывали, а фильтрат упаривали при пониженном давлении, получая сырой 5-(4-фторбензил)-4-(4-изобутоксибензил)-1-окса-4,9-диазаспиро[5.5]ундекан-3-он. Остаток растворяли в метаноле (3 мл), добавляли формальдегид (37% в воде, 0,017 мл), после чего прибавляли уксусную кислоту (0,03 мл) и цианоборгидрид натрия (60 мг, 0,95 ммоль). Раствор перемешивали при к.т. в течение 5 ч, затем добавляли воду и подщелачивали смесь 2 н. водн. раствором NaOH. Смесь трижды экстрагировали хлористым метиленом, объединенные органические слои промывали насыщ. раствором хлорида аммония и насыщенным раствором соли, сушили над Na2SO4, фильтровали и упаривали досуха. Остаток очищали колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 0-7% метанола в хлористом метилене, получая 103NLS35B (43 мг, 88% после обеих стадий) в виде бесцветного масла. Соединение переводили в HCl форму обработкой 2 М HCl в диэтиловом эфире, как описано выше для 69NLS75, получая соль в виде бесцветного порошка.
Rf=0,50 (MeOH/CH2Cl2 1:9). ЖХМС m/z 455 [М+Н]+. 1H ЯМР (CDCl3) δ 0,94-1,06 (м, 7Н, пип-Н, СН3), 1,50-1,57 (м, 1Н, пип-Н), 1,69-1,76 (м, 2Н, пип-Н), 2,00-2,09 (м, 2Н, пип-Н, CH(СН3)2), 2,22-2,29 (м, 4Н, NCH3, пип-Н), 2,37-2,40 (м, 1Н, пип-Н), 2,55 (м, 1Н, пип-Н), 2,62 (д, 1Н, J=14,3, CH2ArOiBu), 2,87 (дд, 1Н, J=7,8, 13,5, СН2ArF), 3,06-3,14 (м, 2Н, Н-5, CH2ArF, пип-Н), 3,66 (д, 2Н, J=6,4, OCH2СН), 4,12 (АВ, 2Н, J=17,6, Н-2), 5,29 (д, 1Н, J=14,3, СН2ArOiBu), 6,75-7,18 (м, 8Н, Ar-H). ВЭЖХ tR=7,5 мин (способ В).
Пример 36: Трет-бутиловый сложный эфир 3-оксо-1,2,8-триазаспиро[4,5]декан-8-карбоновой кислоты (84AF15)
Раствор моногидрата гидразина (5,28 мл, 108,8 ммоль) в н-бутаноле (20 мл) прибавляли по каплям к раствору N-BOC-4-метоксикарбонилметиленпиперидина (1,39 г, 5,44 ммоль) в н-бутаноле (120 мл) при к.т. Смесь перемешивали в течение 15 ч при 120°С и давали смеси охладиться до к.т. Растворитель удаляли выпариванием при пониженном давлении, остаток распределяли между этилацетатом и водой, а органический слой сушили над сульфатом натрия, фильтровали и упаривали досуха. В результате очистки остатка колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 3-6% метанола в хлористом метилене получали требуемое соединение (0,88 г, 63%) в виде белого твердого вещества.
Rf=0,34 (MeOH/CH2Cl2 6:94). ЖХМС m/z 200 [M+H-(трет-Bu)]+, 156 [М+Н+ВОС]+. 1H ЯМР (CDCl3) δ 1,45 (с, 9Н, СН3), 1,61-1,74 (м, 4Н, пип-Н), 2,34 (с, 2Н, Н-4), 3,38-3,52 (м, 4Н, пип-Н), 4,01 (с, 1Н, NH), 7,15 (с, 1Н, NH).
Пример 37: Трет-бутиловый сложный эфир 1-(4-фторбензил)-3-оксо-1,2,8-триазаспиро[4,5]декан-8-карбоновой кислоты (84AF84-19)
К раствору 84AF15 (289 мг, 1,13 ммоль) в сухом ДМФА (50 мл) прибавляли по каплям при к.т. 4-фторбензилбромид (0,37 мл, 2,97 ммоль). Смесь перемешивали при к.т. в течение 6 дней в атмосфере аргона. Растворитель удаляли выпариванием при пониженном давлении, остаток распределяли между хлороформом и водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. В результате очистки остатка колоночной хроматографией на силикагеле при элюировании хлористым метиленом получали требуемое соединение (160 мг, 39%).
Rf=0,53 (МеОН/СН2Cl2 6:94). ЖХМС m/z 308 [M+H-BOC]+, 364 [М+Н]+. 1H ЯМР (CDCl3) δ 1,47 (с, 9Н, СН3), 1,71-1,76 (м, 2Н, пип-Н), 1,87-1,93 (м, 2Н, пип-Н), 2,45 (с, 2Н, Н-4), 3,31-3,38 (м, 2Н, пип-Н), 3,64-3,70 (м, 2Н, пип-Н), 3,80 (с, 2Н, CH2ArF), 6,62 (с, 1Н, NH), 7,01-7,30 (м, 4Н, Ar-H).
Пример 38: Трет-бутиловый сложный эфир 1-(4-фторбензил)-2-(4-изобутоксибензил)-3-оксо-1,2,8-триазаспиро[4,5]декан-8-карбоновой кислоты (118AF94-23)
К раствору 84AF84-19 (0,149 г, 0,41 ммоль) в сухом ДМФА (5 мл) медленно прибавляли NaH (24 мг, 0,50 ммоль) и перемешивали смесь при к.т. в течение 30 мин. К смеси прибавляли по каплям раствор 4-изобутоксибензилбромида 69NLS69 (117 мг, 0,48 ммоль) в сухом ДМФА (1 мл). После 1 ч перемешивания смесь распределяли между этилацетатом и водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. В результате очистки остатка колоночной хроматографией на силикагеле при элюировании с постепенным градиентом 3-6% метанола в хлористом метилене с последующей препаративной ВЭЖХ с обращенной фазой (C18) получали требуемое соединение (109 мг, 50%).
Rf=0,51 (MeOH/CH2Cl2 1:99). ЖХМС m/z 526 [М+Н]+, 470 [М+Н-(трет-Bu)]+. 1H ЯМР (CDCl3) δ 1,00 (д, 6Н, J=6,8, СН(СН3)2), 1,35 (м, 4Н, пип-Н), 1,40 (с, 9Н, О(СН3)3), 2,06 (м, 1Н, CH(СН3)2), 2,41 (с, 2Н, Н-4), 3,08-3,15 (м, 2Н, пип-Н), 3,22-3,29 (м, 2Н, пип-Н), 3,67 (д, 2Н, J=6,4, OCH2), 3,92 (м, 4Н, CH2ArF, CH2ArOiBu), 6,77-7,37 (м, 8Н, Ar-H).
Пример 39: 1-(4-фторбензил)-2-(4-изобутоксибензил)-1,2,8-триазаспиро[4,5]декан-3-он (84AF99-24)
С 118AF94-23 (100 мг, 0,21 ммоль) снимали N-BOC-защиту, как описано при получении 69NLS79-II, получая указанное в заголовке соединение, которое использовали без дополнительной очистки.
Rf=0,40 (MeOH/CH2Cl2 1:9). ЖХМС m/z 426 [М+Н]+. 1H ЯМР (CDCl3) δ 0,99 (д, 6Н, J=64, СН(CH3)2), 1,35 (м, 4Н, пип-Н), 1,49 (с, 1Н, NH), 2,00-2,05 (м, 1Н, CH(СН3)2), 2,42 (с, 2Н, Н-4), 2,50 (м, 2Н, пип-Н), 2,76 (м, 2Н, пип-Н), 3,66 (д, 2Н, J=6,4, OCH2), 3,92 (с, 2Н, СН2Ar), 3,95 (с, 2Н, СН2Ar), 6,75-7,34 (м, 8Н, Ar-H).
Пример 40: Гидрохлорид 1-(4-фторбензил)-2-(4-изобутоксибензил)-8-метил-1,2,8-триазаспиро[4,5]декан-3-она (84AF100-25)
Требуемый спироцикл получали из 84AF99-24 (60 мг, 0,14 ммоль) по той же методике, которая описана для получения 103NLS35. Синтез гидрохлоридной соли осуществляли так же, как и для 69NLS75, получая указанное в заголовке соединение (39 мг, 63%) в виде бесцветного твердого вещества.
Rf=0,57 (MeOH/CH2Cl2 1:9). ЖХМС m/z 440 [М+Н]+. 1H ЯМР (CDCl3) δ 0,94 (д, 6Н, J=6,4, СН(СН3)2), 1,38-1,68 (м, 4Н, пип-Н), 1,96-2,02 (м, 1Н, CH(СН3)2), 2,23-2,46 (м, 9Н, пип-Н, NCH3, H-4), 3,61 (д, 2Н, J=6,4, ОСН2), 3,85 (м, 4Н, СН2ArOiBu, СН2ArF), 6,70-7,28 (м, 8Н, Ar-H).
Пример 41: Оксалат 8-(2-[1,3]-диоксан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4,5]декан-2-она (118AF02-74)
С 69NLS77 снимали N-BOC-защиту, как описано при получении 69NLS79-II, а полученное соединение (172 мг, 0,40 ммоль) алкилировали 2-(2-бромэтил)-1,3-диоксаном по методике, аналогичной получению 69NLS85. При переводе данного соединения (139 мг, 64%) в форму оксалата получали указанное в заголовке соединение в виде бесцветного твердого вещества.
Rf=0,33 (MeOH/CH2Cl2 1:24). ЖХМС m/z 541 [М+Н]+. 1H ЯМР (CDCl3) δ 1/00 (д, 6Н, J=6,8, СН(CH3)2), 1,23-1,36 (м, 2Н, пип-Н, диоксан-Н), 1,54-1,66 (м, 1Н, пип-Н), 1,67-1,74 (м, 3Н, CH2СН2N, пип-Н), 1,86-1,90 (м, 1Н, пип-Н), 1,97-2,15 (м, 2Н, диоксан-Н, СН(СН3)2), 2,31-2,43 (м, 4Н, СН2CH2N, пип-Н), 2,55 (м, 1Н, пип-Н), 2,69 (м, 1Н, пип-Н), 2,71-2,89 (м, 2Н, СН2ArF), 3,36 (т, 1Н, J=6,8, H-4), 3,56 (д, 1Н, J=15,2, CH2ArOiBu), 3,67-3,74 (м, 4Н, ОСН2СН(СН3)2, диоксан-Н), 4,03-4,07 (м, 2Н, диоксан-Н), 4,51 (т, 1Н, J=5,2, ОСНО), 4,72 (д, 1Н, J=15,2, CH2ArOiBu), 6,79-7,04 (м, 8Н, Ar-H).
Пример 42: Оксалат 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-{3-[(S)-4-изопропил-2-оксооксазолидин-3-ил]пропил}-1-окса-3,8-диазаспиро[4,5]декан-2-она (118AF04-75)
С 69NLS77 снимали N-BOC-защиту, как описано при получении 69NLS79-II, а полученное соединение (172 мг, 0,40 ммоль) алкилировали (4S)-3-(3-хлорпропил)-4-изопропил-2-оксазолидин-2-оном в ДМФА (3 мл) в присутствии йодида натрия (72 мг, 0,48 ммоль), следуя той же методике, что и при получении 69NLS85. При переводе данного соединения (130 мг, 55%) в форму оксалата получали указанное в заголовке соединение в виде бесцветного твердого вещества.
Rf=0,29 (MeOH/CH2Cl2 1:19). ЖХМС m/z 596 [М+Н]+. 1H ЯМР (CDCl3) δ 0,84-0,88 (м, 6Н, СН3iBu), 1/01 (д, 6Н, J=6,8, СН3iBu), 1,24-1,34 (м, 1Н, пип-Н), 1,55-1,74 (м, 4Н, пип-Н, СН2цепь), 1,87-1,93 (м, 1Н, пип-Н), 1,97-2,13 (м, 2Н, CHOiBu, СНiPr), 2,27-2,40 (м, 4Н, пип-Н, NCH2цепь), 2,56 (м, 1Н, пип-Н), 2,69 (м, 1Н, пип-Н), 2,75-2,80 (м, 1Н, С2ArF), 2,87-2,98 (м, 2Н, СН2ArF, NCH2цепь), 3,37 (т, 1Н, J=6,8, H-4), 3,48-3,55 (м, 1Н, NCH2цепь), 3,58-3,64 (м, 1Н, СН2ArOiBu), 3,65-3,71 (м, 3Н, ОСН2СН(СН3)2, СНизокс), 4,00-4,04 (м, 1Н, ОСНизокс), 4,11-4,16 (м, 1Н, ОСНизокс), 4,75 (д, 1Н, J=15,2, CH2ArOiBu), 6,80-7,03 (м, 8Н, Ar-H).
Пример 43: фармакологические данные
Выбор рецептора и амплификационные (R-SAT) анализы
Для скрининга соединения на предмет эффективности по отношению к 5-НТ2А рецептору использовали функциональный рецепторный анализ, технологию выбора рецептора и амплификации (R-SAT) (с незначительными изменениями по сравнению с ранее описанной в патенте США 5707798). Вкратце, в 96-луночных клеточных культуральных планшетах выращивали NIH3T3 клетки до 70-80% слияния. Клетки трансфицировали в течение 12-16 часов ДНК-плазмидами с использованием superfect (Qiagen Inc.) no протоколам производителя. R-SAT обычно осуществляли с 50 нг/лунку рецептора и 20 нг/лунку бета-галактозидазной плазмиды ДНК. Все использованные конструкции рецепторов и G-белков были в pSI экспрессирующем векторе млекопитающих (Promega Inc), как описано в патента США 5707798. Ген рецептор 5-НТ2А амплифицировали гнездовой PCR из кДНК мозга с использованием олигодезоксинуклеотида на основе опубликованной последовательности (смотри Saltzman et al. Biochem. Biophys. Res. Comm. 181:1469-78 (1991)). При крупномасштабных трансфекциях клетки трансфицировали в течение 12-16 часов, затем трипсинизировали и замораживали в ДМСО. Впоследствии замороженные клетки размораживали, помещали в количестве 10000-40000 клеток на лунку 96-луночного планшета, содержащего лекарственное средство. По обоим способам клетки затем выращивали во влажной атмосфере при 5% СО2 в окружающей среде в течение 5 дней. После этого из планшетов удаляли среды и определяли активность маркерного гена при добавлении бета-галактозидазного субстрата ONPG (в PBS с 5% NP-40). Полученную колориметрическую реакцию определяли в спектрофотометрическом планшет-ридере (Titertek Inc.) при 420 нМ. Все данные анализировали при помощи компьютерной программы XLFit (IDBSm). Эффективность представляет собой процентную максимальную репрессию по сравнению с репрессией под действием контрольного соединения (ритансерин в случае 5-НТ2А). pIC50 является отрицательной величиной от log(IC50), где IC50 представляет собой рассчитанную концентрацию в молях, которая приводит к 50% максимальной репрессии. Результаты, полученные для нескольких соединений данного изобретения, приведены в таблице 1 ниже.
Профиль селективности для 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS75) (соединение Примера 5)
Для изучения селективности 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она использовали R-SAT анализ (описанный выше в примере). Результаты широкого анализа профиля данного соединения по отношению к ряду рецепторов приведены в таблице 2 ниже. HP означает нет реакции, то есть исследованное соединение не оказывает воздействия на изучаемый рецептор.
Таблица 2
Селективность 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она 69NLS75 (Пример5)
Пример 44: Фармакология in vivo 4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-она (69NLS75)
Способы
Животные и аппараты
Самцов нешвейцарских мышей-альбиносов (Harlan Sprague-Dawley) расселяли (4 мыши/клетка) в помещения с контролируемыми температурой и влажностью и со свободным доступом к воде и пище (Harlan Teklad). Мышей выдерживали при 12-часовом цикле свет : темнота. Для экспериментов по двигательной активности пластмассовые клетки (20×20×30 см) для регистрации активности были снабжены матрицами фотоэлементов (AccuScan Instruments).
Методика
Двигательная активность
Для опытов по гиперактивности мышей обрабатывали 0,3 мг/кг дизоцилпином i.p. за 15 мин перед сеансом. Мышей обрабатывали 69NLS75 s.c. за 10 мин перед сеансом или р.о. за 30 мин перед сессией и помещали в клетки для регистрации активности. Для спонтанной активности вводили один 69NLS75. Данные по двигательной активности собирали в течение 15-минутного сеанса без привыкания в освещенном помещении. Комбинацию каждой дозы тестировали в отдельной группе животных (n=8). Пройденное расстояние (см) вычисляли и усредняли по ANOVA и post-hoc сравнениям по t-критерию Даннета.
Результаты
69NLS75 вызывало зависящее от дозы снижение гиперактивности, вызванной агонистом NMDA рецептора, МК-801, ((+)-5-метил-10,11-дигидро-5Н-дибензо(а, d)циклогептен-5,10-имин гидромалеатная соль) у мышей, согласующееся с антипсихотической эффективностью. Статистически значимое снижение по сравнению с контрольным носителем происходило при 3 мг/кг как после s.c., так и р.о. введения, что предполагает прекрасную пероральную биодоступность. Кроме того, ослабление МК-801 гиперактивности происходило при дозах, которые не влияли на спонтанную двигательную активность, что указывает на отсутствие побочных двигательных эффектов при эффективных дозах.
Пример 45: Фармакология in vivo дополнительных соединений
Влияние различных соединений на двигательную активность у мышей, обработанных МК801, наблюдали, как описано выше.
Животные получали 0,1-30 мг/кг указанного соединения путем подкожных инъекций или перорального введения. МЭД означает минимальную эффективную дозу, при которой наблюдается статистически значимое снижение двигательной активности (описанное выше). МЭД = минимальная эффективная доза in vivo.
| название | год | авторы | номер документа |
|---|---|---|---|
| АГОНИСТЫ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2015 |
|
RU2678835C2 |
| N-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИПЕРИДИНА В КАЧЕСТВЕ АГЕНТОВ СЕРОТОНИНОВОГО РЕЦЕПТОРА | 2003 |
|
RU2320646C2 |
| Новые замещенные соединения имидазопиридина в качестве ингибиторов индоламин-2,3-диоксигеназы и/или триптофан-2,3-диоксигеназы | 2017 |
|
RU2741911C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СПИРОСОЕДИНЕНИЯ | 2010 |
|
RU2506266C2 |
| ЗАМЕЩЕННЫЕ ТЕТРАГИДРОПИРАНСПИРОПИРРОЛИДИНОН И ТЕТРАГИДРОПИРАНСПИРОПИПЕРИДИНОН, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРИМЕНЕНИЕ В ЛЕЧЕБНЫХ ЦЕЛЯХ | 2009 |
|
RU2519778C2 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2019 |
|
RU2809257C2 |
| СПИРО-КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ПИПЕРИДИНА ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КАЛИЕВОГО КАНАЛА НАРУЖНОГО МЕДУЛЛЯРНОГО СЛОЯ | 2013 |
|
RU2642066C2 |
| ПРОИЗВОДНЫЕ ИМИДАЗОЛОНА И ИМИДАЗОЛИДИНОНА КАК 11В-HSD1 ИНГИБИТОРЫ ПРИ ДИАБЕТЕ | 2007 |
|
RU2439062C2 |
| Спироконденсированные пирролидиновые производные в качестве ингибиторов деубиквитилирующих ферментов (DUB) | 2017 |
|
RU2730552C2 |
| ОКСАДИАЗОЛЫ В КАЧЕСТВЕ АГОНИСТОВ МУСКАРИНОВОГО РЕЦЕПТОРА M1 И/ИЛИ M4 | 2019 |
|
RU2817018C2 |
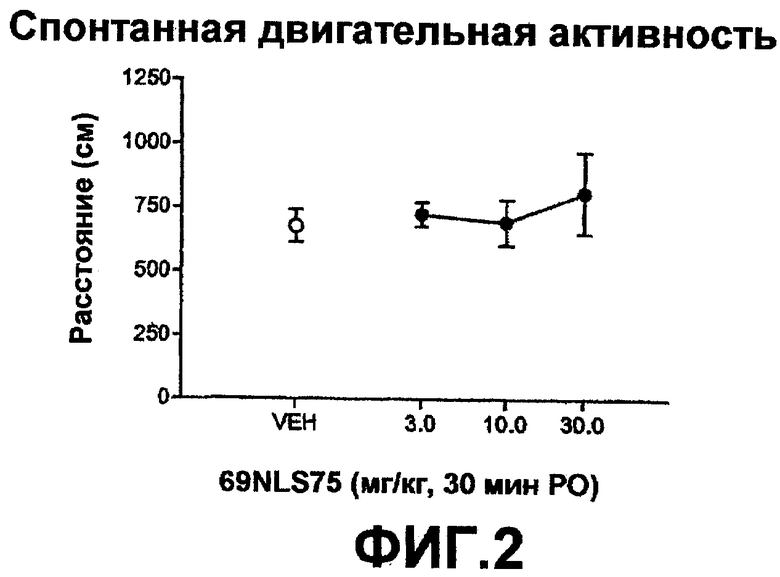
Описываются новые спироазациклические соединения общей формулы I, его соли и стереоизомеры

где Х означает СН2, CH2О, ОСН2 или О; Y представляет О; Z означает СН или N; R1 означает С1-6-алкил, необязательно замещенный морфолинилом, 1,3-диоксанилом, 1,4-диоксанилом, 1,3-диоксоланилом, 2-оксоимидазолидинилом, имидазолидинилом, 2-оксооксазолидинилом, оксазолидинилом или С3-6циклоалкилом, С2-8-алкиловый сложный эфир или бензиловый сложный эфир; m выбирают из группы, включающей 0 и 1; R4 означает водород или бензил, необязательно замещенный галогеном или C1-4-алкилом; R5 означает водород или бензил, необязательно замещенный галогеном, C1-4-алкилом или C1-4-алкокси; R6 означает водород или бензил, необязательно замещенный С1-4-алкокси, циклоалкил(С1-4-алкокси) или галоген(С1-4-алкокси); R2 и R3 означает водород, причем по меньшей мере два радикала из R4, R5 и R6 означают необязательно замещенный бензил, способ ингибирования активности серотонинового 5-НТ2А рецептора, способ лечения состояния, обусловленного серотониновым 5-НТ2А рецептором, и применение спироазациклических соединений. 5 н. и 30 з.п. ф-лы, 3 табл., 2 ил.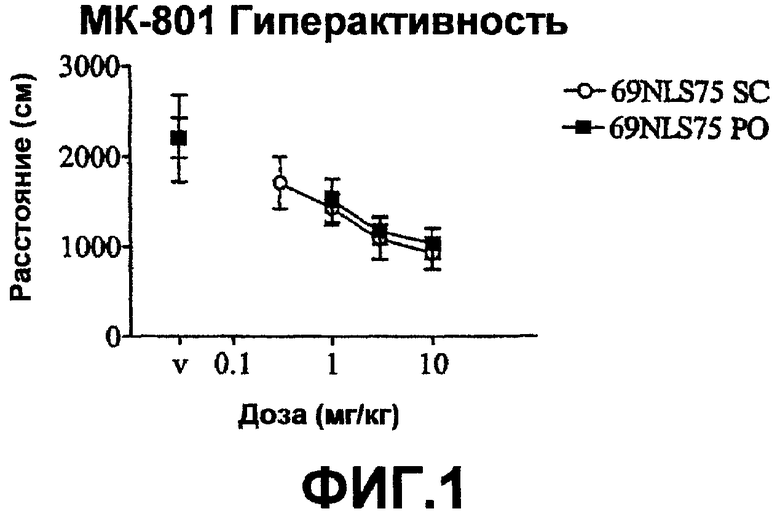
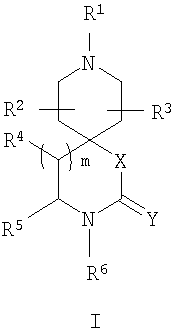
в которой Х выбирают из группы, включающей СН2, СН2О, ОСН2 и О;
Y представляет О;
Z выбирают из группы, включающей СН и N;
R1 выбирают из группы, включающей C1-6-алкил, необязательно замещенный С5-С6 гетероциклилом или С3-8 циклоалкилом, С2-8-алкиловый сложный эфир и бензиловый сложный эфир;
где С5-С6 гетероциклил выбирают из группы, включающей морфолинил, 1,3-диоксанил, 1,3-диоксоланил, 1,4-диоксанил, 2-оксоимидазолидинил, имидазолидинил, 2-оксооксазолидинил и оксазолидинил;
m выбирают из группы, включающей 0 и 1;
R4 отсутствует или выбирают из группы, включающей водород и бензил, необязательно замещенный галогеном или С1-4-алкилом;
R5 выбирают из группы, включающей водород и бензил, необязательно замещенный галогеном, C1-4-алкилом или C1-4-алкокси;
R6 выбирают из группы, включающей водород и бензил, необязательно замещенный С1-4-алкокси, циклоалкил(С1-4-алкокси) или галоген(С1-4-алкокси);
где, по меньшей мере, два из R4, R5 и R6 представляют необязательно замещенный бензил; и
R2 и R3 представляют водород.
3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он;
4-(4-фторбензил)-3-(4-изобутоксибензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он;
3-(4-дифторметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4,5]декан-2-он;
8-этил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4,5]декан-2-он;
4-(4-фторбензил)-3-(4-изобутоксибензил)-8-изопропил-1-окса-3,8-диазаспиро[4.5]декан-2-он;
4-(4-фторбензил)-3-(4-изобутоксибензил)-8-(3-морфолин-4-илпропил)-1-окса-3,8-диазаспиро[4.5]декан-2-он;
8-(2-[1.3]диоксолан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он;
4-(4-фторбензил)-3-(4-изобутоксибензил)-8-[2-(2-оксоимидазолидин-1-ил)этил]-1-окса-3,8-диазаспиро[4.5]декан-2-он;
8-(2-[1.3]диоксан-2-илэтил)-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он;
4-(4-фторбензил)-3-(4-изобутоксибензил)-8-{3-[(S)-4-изопропил-2-оксооксазолидин-3-ил]пропил}-1-окса-3,8-диазаспиро[4.5]декан-2-он;
1-(4-фторбензил)-2-(4-изобутоксибензил)-8-метил-1,2,8-триазаспиро[4.5]декан-3-он;
5-(4-фторбензил)-4-(4-изобутоксибензил)-9-метил-1-окса-4,9-диазаспиро[5.5]ундекан-3-он;
8-метил-4-(4-метилбензил)-3-(4-трифторметоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он; и
3-(4-метоксибензил)-8-метил-4-(4-метилбензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он.
8-циклопропилметил-4-(4-фторбензил)-3-(4-изобутоксибензил)-1-окса-3,8-диазаспиро[4.5]декан-2-он;
бензиловый сложный эфир 5-(4-фторбензил)-4-(4-изобутоксибензил)-3-оксо-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоновой кислоты;
трет-бутиловый сложный эфир 4-(4-фторбензил)-3-(4-изобутоксибензил)-2-оксо-1-окса-3,8-диазаспиро[4.5]декан-8-карбоновой кислоты; и
трет-бутиловый сложный эфир 1-(4-фторбензил)-2-(4-изобутоксибензил)-3-оксо-1,2,8-триазаспиро[4.5]декан-8-карбоновой кислоты.
3-(4-циклопропилметоксибензил)-4-(4-фторбензил)-8-метил-1-окса-3,8-диазаспиро[4.5]декан-2-он.
| US 4255432 А, 10.03.1981 | |||
| US 4353900 А, 12.10.1982 | |||
| Блокировочное устройство к машинам для измерения площади кож | 1940 |
|
SU61322A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-ОКСА-3,8-ДИАЗА-4-ОКСО-СПИРО-[4,5]-ДЕКАНА | 1991 |
|
RU2017743C1 |
| СПИРОСОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ПЯТИЧЛЕННЫЕ КОЛЬЦА, ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ | 1994 |
|
RU2129555C1 |
Авторы
Даты
2008-01-20—Публикация
2002-12-23—Подача