Изобретение относится к новому биологически активному соединению, которое относится к группе лекарственных препаратов, используемых для лечения больных лепрой, аллергодерматозами, герпетиформным дерматитом (диуцифон, димоцифон).
Известные аналоги заявляемого соединения диуцифон (SU 459228) и димоцифон (RU 2200550) обладают противолепрозной активностью (А.с. СССР N 459228), но не проявляют противотуберкулезную активность. Кроме того, перечисленные аналоги характеризуются недостаточно хорошей биодоступностью и требуют применения больших доз для достижения терапевтического эффекта.
Известно также соединение, предложенное авторами патента RU 2136668 и международной заявки PCT/RU98/00314 (№ публикации WO 99/18083), N,N'-(сульфонилди-1,4-фенилен)бис(N",N"-диметилформамидин)1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин-сульфонат-, соответствующее формуле
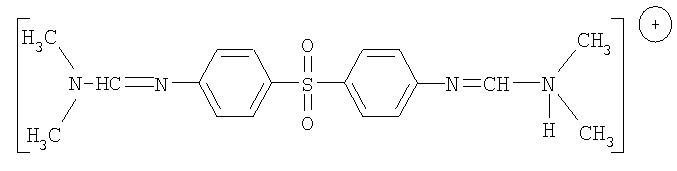
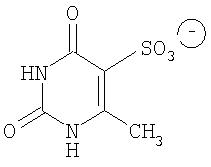
В соответствии с описанием этого изобретения этот препарат обладает преимуществами по сравнению с диуцифоном: он менее токсичен, активен в отношении микобактерий лепры, туберкулеза и условно патогенных атипичных микобактерий, обладает высоким иммунотропным действием на микроорганизмы (индекс стимуляции в 3 раза выше, чем у диуцифона). Кроме того, он принимает участие в обмене клетки, стимулирует ее функцию в 1,5-2 раза лучше, чем диуцифон.
Существенным недостатком соединения, предлагаемого изобретением по патенту РФ 2136668, является зависимость иммунотропной активности и ряда других медико-биологических показателей образцов препарата от трудно регулируемых, и преимущественно не выявленных параметров при проведении синтеза способом, приведенным в описании к патенту RU №2136668 (скорость загрузки компонентов реакционной смеси, интенсивность перемешивания, незначительные колебания температуры в пределах, допускаемых способом по патенту).
Техническим результатом изобретения является получение соединения с более высокой иммунотропной активностью.
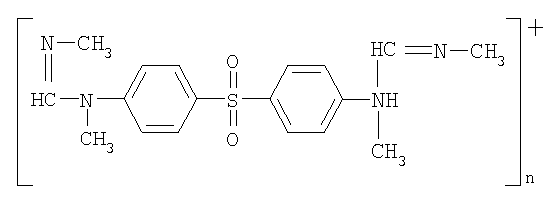
Технический результат достигается соединением N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат,
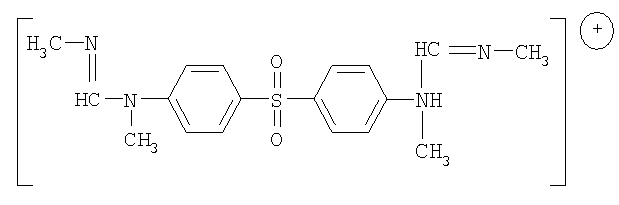

обладающим иммунотропной, антимикобактериальной активностью и стимулирующим клеточный метаболизм.
В соответствии с заявляемым изобретением N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат получают с высокой степенью чистоты за счет использования в процессе синтеза органического основания в качестве акцептора протонов.
N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат исследован на иммунотропную активность в лаборатории лекарственной токсикологии НИИ фармакологии РАМН.
Изучение иммунотропной активности N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната проводили согласно "Методическим указаниям по оценке иммунотоксического действия фармакологических средств" (1) и "Методическим указаниям по оценке иммунотропной активности фармакологических веществ" М., 2005 г.
Препарат N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат, является производным дифенилсульфона. Известно, что действие дифенилсульфона направлено преимущественно на клеточный иммунный ответ. Препарат N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат, избирательно тормозит синтез IgE, при этом уровень IgG, A и М не снижался, а в тех случаях, где были изначально низкие показатели IgG, А и М - отмечался их подъем, т.е. препарат проявлял истинно иммуномодулирующий эффект. Под влиянием N,N'-(сульфонилди-1,4-фенилен) бис [(N”,N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната происходит активация клеток-продуцентов ИЛ-2 и, как следствие, значительное увеличение продукции ими этого цитокина, приводящее к стимуляции Т-хелперов I типа (Th1-ответ). Наблюдается увеличение количества CD25 лимфоцитов, имеющих рецептор к ИЛ-2, а также повышение числа естественных киллеров и усиление антителозависимой клеточной цитотоксичности. В связи с этим, было изучено влияние образца N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната на клеточный иммунный ответ.
Доза N,N'-(сульфонилди-1,4-фенилен) бис [(N",N'"-диметил)метилиминометан] 1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната для человека составляет 0,2 г. После перерасчета с учетом видовой чувствительности, массы и поверхности тела по Freireich E.J величина дозы для мышей составила 26 мг/кг.
В качестве контроля использовали образец N,N'-(сульфонилди-1,4-фенилен)бис(N”,N"-диметилформамидин)1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин сульфоната.
Влияние контрольного и испытуемого образцов препарата на клеточный иммунный ответ изучали по реакции гиперчувствительности замедленного типа в опытах на мышах гибридах F1 (CBAxC57BL/6). Животным первой опытной группы в течение 3-х дней перорально вводили контрольный образец N,N'-(сульфонилди-1,4-фенилен)бис(N",N"-диметилформамидин)1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин сульфоната в дозе 26 мг/кг, мышам второй группы аналогичным образом вводили испытуемый образец N,N'-(сульфонилди-1,4-фенилен) бис [(N”,N”'-диметил)метилиминометан]1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин-сульфоната в дозе 26 мг/кг.
Контрольным животным вводили соответствующий объем 1%-ого раствора крахмала. Перед последним введением препарата мышей контрольной и опытных групп иммунизировали подкожно 1×107 ЭБ в объеме 100 мкл. Разрешающую дозу антигена, 1×10 ЭБ в объеме 20 мкл, вводили на 5 день после сенсибилизации под - апоневротическую - пластинку правой задней конечности, в контралатеральную лапу - соответственно 20 мкл физиологического раствора. Учет интенсивности воспалительной реакции проводили через 24 часа после разрешающей дозы антигена. Мышей забивали, обе лапы отрезали на уровне голеностопного сустава и взвешивали их на торсионных весах. Затем подсчитывали индекс реакции (Ир) по формуле:
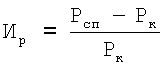
где Роп - масса стопы задней лапы, в подушечку которой вводили ЭБ;
Pк - масса стопы контрольной лапы.
В таблице 1 приведены полученные в результате экспериментов значения индексов реакции.
Полученные значения обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента. Результаты статистической обработки представлены в таблице 2.
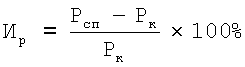
n=10
n=10
n=10
Результаты, представленные в таблице 2, свидетельствуют, что трехкратное пероральное введение исследуемых образцов в дозе 26 мг/кг приводило к выраженной стимуляции клеточного иммунитета. Контрольный образец препарата вызывал стимуляцию клеточного иммунитета на 75,7% (в 1,8 раз) по сравнению с данными контрольной группы. Испытуемый образец стимулировал Т-клеточный иммунный ответ на 106,1% (в 2,1 раза) по сравнению с контролем. Полученные результаты указывают на наличие иммунотропной активности у изученных образцов N,N'-(сульфонилди-1,4-фенилен)бис[(N",N'"-диметил)метилиминометан]-1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин сульфоната.
Таким образом, результаты, полученные при исследовании двух образцов препарата, указывают на увеличение активности испытуемого образца препарата по сравнению с контрольным образцом.
ПРИМЕР
Получение N,N'-(сульфонилди-1,4-фенилен)бис[(N",N'"-диметил)метилиминометан]1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната
К раствору 4.96 г (0.02 моль) 4,4'-диаминодифенилсульфона в 20 мл диметилформамида добавляют 4.05 г (0.04 моль) триэтиламина. Затем при перемешивании маленькими порциями вносят 9.4 г (0.042 моль) 6-метилурацилсульфохлорида, поддерживая температуре не выше 30-35°С. После этого реакционную смесь перемешивали в течение 2 ч при 50°С. Охлажденную реакционную массу выливают в 100 мл хлороформа, перемешивают в течение 1.5 ч. Выпавший осадок отделяют фильтрованием. К полученному продукту добавляют 60 мл этилового спирта, нагревают в течение часа, фильтруют, высушивают при 40°С в вакууме. Получено 9.6 г (80%) вещества желтоватого цвета.
ПМР-спектр (300 MHz, d6 ДМСО):
Снят при 20°С 2.00 (СН3 6-метилурацила), 2.38 с (3 Н, СН3); 3.27 с (6 Н, NCH3); 3.38 с (6 Н, NCH3); 5.32 (Н 6-метилурацила); 7.72 д (4Н, ароматич.); 8.02д (4Н, ароматич.); 8.89 с (2Н, N=CH), 10.63 с и 10.87 с (NH); 11.33 N+ H.
Снят при 80°С: 2.00 (СН3 6-метилурацил), 2.42 с (3 Н, СН3); 3.29 с (6 Н, NCH3); 3.36 с (6 Н, NCH3); 5.32 (Н 6-метилурацил); 7.65 д (4Н, ароматич.); 7.97д (4Н, ароматич.); 8.72 с (2Н, N=CH), 10.67 с и 10.87 с (NH); 11.73 N+ H.
В спектре ПМР, снятом при нагревании (80°С) сигналы метильных протонов при атомах азота не изменяют своего положения. Это подтверждает то, что метальные группы находятся у разных атомов азота в формамидиновой составляющей заявляемого комплекса.
В спектре ПМР контрольного образца (N,N'-(сульфонилди-1,4-фенилен)бис(N",N"-диметилформамидин)1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидин сульфоната), снятого при нагревании сигналы метильных протонов сливаются (3.32 м.д.).
Контрольный образец:
ПМР-спектр (300 MHz, d6 ДМСО):
Снят при 20°С: 2.38 с (3 Н, СН3); 3.25 с (6 Н, NCH3); 3.35 с (6 Н, NCH3); 7.65 д (4Н, ароматич.); 8.01д (4Н, ароматич.); 8.78 с (2Н, N=CH), 10.68 и 10.90 (NH).
Снят при 80°С: 2.42 с (3 Н, СН3); 3.32 с (12 Н, NCH3); 7.65 д (4Н, ароматич.); 7.97 д (4Н, ароматич.); 8.68 с (2Н, N-CH).
Структура заявляемого соединения подтверждена методами УФ-, ИК- и ЯМР-спектроскопии, масс-спектрометрии.
ЯМР-спектры 1Н регистрировали на спектрометрах «Bruker» (300 MHz) в дейтерированном диметилсульфоксиде при 20°С и 80°С.
Масс-спектрометрический анализ проводили на приборе MX-5303, оборудованном электрораспылительным источником ионизации, с ортогональным вводом ионов и времяпролетным масс-анализатором (ESI-o-TOF).
ИК-спектры регистрировались на приборе «Bruker» (FT-IR спектрометр).
УФ-спектры снимали на спектрофотометре СФ-46.
В спектре ПМР заявляемого комплекса N,N'-(сульфонилди-1,4-фенилен)бис[(N",N"'-диметил)метилиминометан]1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфоната, снятом при нагревании (80°С) сигналы метальных протонов при атомах азота не изменяют своего положения. Это подтверждает то, что метальные группы находятся у разных атомов азота в формамидиновой составляющей заявляемого комплекса.
ПМР-спектр (300 MHz, d6 ДМСО):
при 20°С: 2.38 с (3 Н, СН3); 3.27 с (6 Н, NCH3); 3.38 с (6 Н, NCH3); 7.72 д (4Н, ароматич.); 8.02д (4Н, ароматич.); 8.89 с (2Н, N=CH), 10.63 с и 10.87 с (NH); 11.33 N+ H.
при 80°С: 2.42 с (3 Н, СН3); 3.29 с (6 Н, NCH3); 3.36 с (6 Н, NCH3); 7.65 д (4Н, ароматич.); 7.97д (4Н, ароматич.); 8.72 с (2Н, N=CH).
В спектре ПМР контрольного образца (N,N'-(сульфонилди-1,4-фенилен)бис(N”,N”-диметилформамидин)1,2,3,4-тетрагидро-6-метал-2,4-диоксо-5-пиримидин сульфоната) (STANDART), снятого при нагревании сигналы метальных протонов сливаются (3.32 м.д.).
ПМР-спектр (300 MHz, d6 ДМСО):
Снят при 20°С: 2.38 с (3 Н, СН3); 3.25 с (6 Н, NCH3); 3.35 с (6 Н, NCH3); 7.65 д (4Н, ароматич.); 8.01д (4Н, ароматич.); 8.78 с (2Н, N=CH), 10.68 и 10.90 (NH).
Снят при 80°С: 2.42 с (3 Н, СН3); 3.32 с (12 Н, NCH3); 7.65 д (4Н, ароматич.); 7.97 д (4Н, ароматич.); 8.68 с (2Н, N=CH).
Состав комплекса подтвержден методом ВЭЖХ.
Изобретение относится к новому биологически активному соединению -N, N'-(сульфонилди-1,4-фенилен) бис [(N”,N”-диметил)метилиминометан]1,2,3,4-тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат формулы, указанной ниже, которое обладает высокой иммунотропной активностью и может быть использовано при лечении, например, больных лепрой, аллергодерматозами, герпетиформным дерматитом.
1 з.п. ф-лы, 2 табл.
1. N,N'-(Сульфонилди-1,4-фенилен)бис[(N'',N'''-диметил)метилиминометан]1,2,3,4-
тетрагидро-6-метил-2,4-диоксо-5-пиримидинсульфонат формулы


2. Соединение по п.1, обладающее иммунотропной активностью.
| N,N'-(СУЛЬФОНИЛДИ-1,4-ФЕНИЛЕН)БИС(N'',N''- ДИМЕТИЛФОРМАМИДИН)1,2,3,4-ТЕТРАГИДРО-6-МЕТИЛ-2,4- ДИОКСО-5-ПИРИМИДИНСУЛЬФОНАТ, СТИМУЛИРУЮЩИЙ КЛЕТОЧНЫЙ МЕТАБОЛИЗМ И ОБЛАДАЮЩИЙ ИММУНОТРОПНОЙ И АНТИМИКОБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ | 1997 |
|
RU2136668C1 |
| US 3135755 A, 02.06.1964 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2009-06-10—Публикация
2007-11-15—Подача