Объектом настоящего изобретения является применение ингибиторов глюкозидазы для получения лекарственных средств для лечения муковисцидозов.
Муковисцидоз (CF: Cystic Fibrosis) - рецессивное генетическое аутосомное летальное заболевание, наиболее распространенное в европейских и североамериканских популяциях. Ген CF (локус 7q31) кодирует трансмембранный белок, названный CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) (Tsui et al., 1985; Riordan et al., 1989). Мутации гена CF провоцируют аномальный транспорт воды и электролитов через клеточные мембраны различных органов, таких как легкие, потовые железы, кишечник и экзокринная поджелудочная железа. Хотя существует более 1000 мутаций белка CFTR, наиболее частой мутацией (70% пациентов) является делеция фенилаланина в области NBF1 в положении 508 (delF508). Главная причина смертности CF-пациентов связана с этой делецией и ведет к инфекциям или к легочной недостаточности, спровоцированной увеличением вязкости слизи. Эта вязкость приводит к окклюзии дыхательных путей и благоприятствует инфекциям оппортунистическими бактериями. Ухудшение констатируется, кроме того, на уровне пищеварительного тракта, в частности, на уровне поджелудочной железы (пациенты с панкреатической недостаточностью). Белок CFTR представляет собой гликопротеин из 1480 аминокислот, принадлежащий к надсемейству мембранных переносчиков ABC. CFTR является хлоридным каналом, локализованным в апикальной плазматической мембране легочных эпителиальных клеток у здоровых индивидов. CFTR ответственен за трансэпителиальный транспорт воды и электролитов и обеспечивает у здорового индивида увлажнение легочных дыхательных путей. У CF-пациентов этот белок отсутствует в плазматических мембранах вследствие плохой адресации белка, который задерживается в эндоплазматическом ретикулуме (RE). Увлажнения легочных дыхательных путей в этом случае не происходит. Делеция delF508 нарушает скручивание области NBF1 и мешает полному созреванию белка, который, таким образом, распадается очень рано в ходе биосинтеза. Между тем, если белок delF508 достигает мембраны, он функционирует как хлоридный канал. Один из ключевых моментов лечения этого заболевания состоит, таким образом, в переадресации delF508 к мембране клеток. По достижении белком мембраны транспортная активность delF508 может быть стимулирована эндогенными или экзогенными физиологическими агонистами.
Механизм адресации белка CFTR осуществляется следующим образом. После своего неосинтеза белок CFTR оказывается в просвете RE, где он подвергается различным гликозилированиям благодаря гликозил-трансферазам. Белок оказывается, в числе прочих, с N-связанными 3 молекулами глюкозы и 1 молекулой маннозы. Две из молекул глюкозы удаляются глюкозидазами I и II. Кальнексин или кальретикулин, кальций-зависимые шаперонные белки, распознают моноглюкозилированный белок и фиксируются на нем через N-связанную глюкозу. Эти шаперонные белки позволяют избежать агрегации различных белков CFTR, присутствующих в RE, между собой и обеспечивают фиксацию других шаперонных белков, таких как ERp57. Образованный таким образом комплекс CFTR/Кальнексин/ERp57 обеспечивает скручивание CFTR. Затем глюкозидаза II удаляет оставшуюся глюкозу, освобождая, таким образом, CFTR от шаперонных белков. Если скручивание неправильно, глюкозил-трансфераза добавляет глюкозу к CFTR, который может подвергнуться снова одному или нескольким циклам, до достижения правильного скручивания. Если скручивание опять оказывается неправильным, маннозидаза отщепляет N-связанную маннозу, после чего белок транспортируется в цитозоль через комплексный канал транслокона, где он может распадаться (Ellgard & Helenius, 2003). Это явление наблюдается для 80% CFTR-WT и 99% delF508-CFTR. Попавший в цитозоль белок взаимодействует с различными шаперонными белками, такими как Hsp70, Hsp90 или Hdj-2. Эти шаперонные белки позволяют убиквитину фиксироваться на CFTR. Таким образом помеченный, CFTR распознается и разрушается комплексом протеасомы 26S, который является АТФ-зависимым (Gelman et al., 2002). Если скручивание CFTR признается правильным контрольными механизмами ретикулума, белок может достигнуть аппарата Гольджи. Он взаимодействует с «карго»-белком ERGIC-53 (принадлежащим к семейству лектинов), который связывается с CFTR через маннозу. Перенос ERGIC осуществляется при помощи везикул, образованных фактором СОР I (Ellgard & Helenius, 2003). Представляется, что в случае, если белок плохо сложен, он становится уязвимым для эндогликозидаз Н аппарата Гольджи (Cheng et al., 1990) и направляется в этом случае в ретикулум, где разрушается. Напротив, в случае правильного скручивания резистентный к эндогликозидазе Н белок взаимодействует с фактором VIP 36 (гомолог ERGIC-53) и направляется к апикальной мембране (Fiedler & Simsons, 1995).
Несмотря на то, что уже было обнаружено, что ингибитор глюкозидазы, кастаноспермин, оказывает эффект на обновление присутствия delF508 на поверхности клеток легочного эпителия (Wei et al., 1996), никогда не было описано, что это соединение способно не только восстанавливать мембранную адресацию delF508, но также позволяет delF508 функционировать в качестве ионного переносчика. В этом отношении авторы статьи не сформулировали какой-либо гипотезы относительно возможного использования этого соединения в рамках лечения муковисцидоза.
Авторы изучили именно эти ингибиторы глюкозидазы для того, чтобы определить, способны ли они одновременно обеспечить правильную и специфическую адресацию delF508, не затрагивая, тем не менее, ни его активность в качестве ионного переносчика, ни жизнеспособность клеток.
N-Бутил-дезоксинойиримицин (NB-DNJ) представляет собой ингибитор глюкозидаз I и II эндоплазматического ретикулума, который был сначала разработан в качестве противовирусной молекулы для человека. Ингибирование этих ферментов изменяет скручивание гликопротеина оболочки вируса ВИЧ (Human Immunodeficiency Virus), и, следовательно, цикл вируса оказывается заблокированным (Platt et al., 2001). Терапия с использованием NB-DNJ была оценена на пациентах, пораженных синдромом приобретенного иммунодефицита: эта молекула хорошо переносится и не проявляет цитотоксичности в тканях в культуре даже в высокой концентрации (2 мМ). Кроме того, эти клинические анализы обнаружили, что у NB-DNJ был также ингибирующий эффект в отношении глюкозилтрансфераз. Поэтому эта молекула, также названная OGT 918, была изучена при лечении болезни Гоше (Dwek et al., 2000, Сох et al., 2000). Это генетическое заболевание вызвано дефицитом лизосомного фермента β-глюкоцереброзидазы, что влечет за собой накопление глюкоцереброзидов (субстрат фермента). NB-DNJ, ингибитор глюкозилтрансферазы, участвующей в биосинтезе глюкоцереброзидов, препятствует, таким образом, их синтезу и их накоплению (Dwek et al., 2000, Сох et al., 2000). NB-DNJ получил AMM как лекарственное средство для лечения болезни Гоше под названием Zavesca® в 2002.
Настоящее изобретение вытекает из обнаружения авторами того факта, что NB-DNJ и другие ингибиторы глюкозидаз в общем способны восстановить мембранную адресацию delF508, не затрагивая другие хлоридные каналы, и позволяют delF508 функционировать в качестве ионного переносчика.
Объектом настоящего изобретения является применение соединений-ингибиторов глюкозидаз для получения лекарственного средства, предназначенного для лечения муковисцидоза.
Под выражением «ингибитор глюкозидазы» понимают любой ингибитор глюкозидаз I и/или II, причем ингибирование этих глюкозидаз может быть измерено, в частности, согласно методу, описанному в Platt et al., 1994.
Объектом настоящего изобретения является, в частности, указанное применение соединений-ингибиторов глюкозидазы, причем указанные соединения выбирают из соединений, способных восстанавливать мембранную адресацию delF508, не затрагивая другие хлоридные каналы, и позволяют delF508 функционировать в качестве ионного переносчика, в частности в рамках описанных далее испытаний, осуществленных на человеческих клетках CF15 эпителия легких, гомозиготных в отношении делеции delF508.
Объектом настоящего изобретения является указанное применение соединений-ингибиторов глюкозидазы, выбранных среди соединений следующей общей формулы (I):
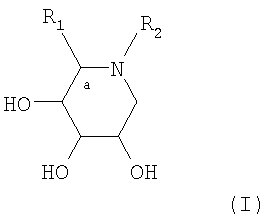
в которой
R1 обозначает группу СН3 или СН2ОН,
R2 обозначает Н или алкил, содержащий от 1 до 5 атомов углерода,
или R1 и R2 образуют вместе с углеродом в положении (а) и азотом в формуле (I) группу формулы:

Изобретение касается особенно указанного применения следующих соединений формулы (I):
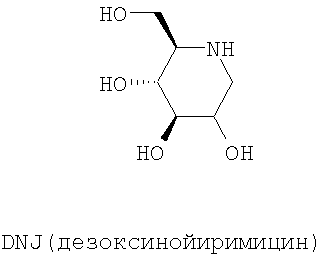




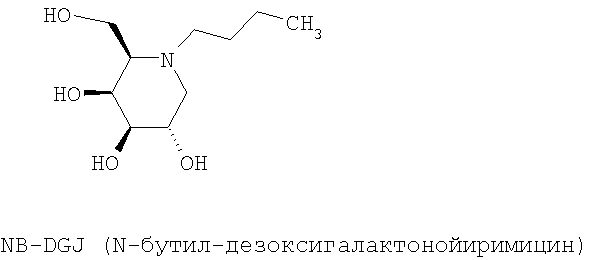
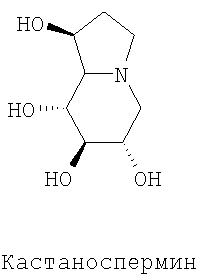
Изобретение касается особенно указанного применения ингибиторов глюкозидазы, выбранных среди соединений следующей общей формулы (II):

в которой R2 обозначает Н или алкил, содержащий от 1 до 5 атомов углерода.
Объектом изобретения является, в частности, указанное применение ингибиторов глюкозидазы, таких как определенные выше, выбранных среди соединений следующий общей формулы (IIbis):

в которой R2 обозначает Н или алкил, содержащий от 1 до 5 атомов углерода.
Объектом изобретения является также указанное применение ингибиторов глюкозидазы по одному из пп.1-4 формулы изобретения, выбранных среди соединений следующих общих формул (II.1) или (II.2):


в которых R2 обозначает Н или алкил, содержащий от 1 до 5 атомов углерода.
Изобретение касается особенно указанного применения следующих соединений формул (II.1) или (II.2), таких как определенные выше, в которой R2 обозначает Н или N-бутил:

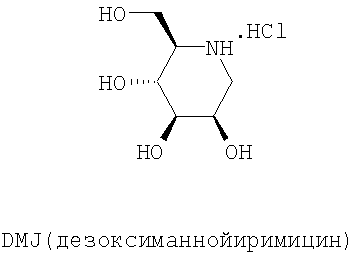

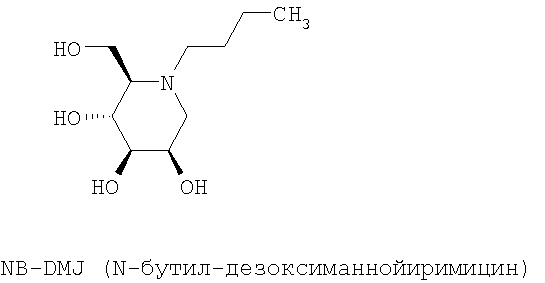
Предпочтительно, соединениями, используемыми в рамках настоящего изобретения, являются NB-DNJ и NB-DMJ.
Также предпочтительно, соединением, используемым в рамках настоящего изобретения, является NB-DNJ.
Объектом изобретения является также указанное применение соединений-ингибиторов глюкозидазы, определенных выше, для получения лекарственного средства, вводимого пероральным (сироп, суспензия, желатиновая капсула, таблетки, порошок или гранулы), ректальным (суппозиторий), назальным (аэрозоль ингаляцией или капли) путями, в частности, из расчета приблизительно от 1 мг до 2 грамм в день активного соединения у взрослого, или от 1 мг до 1 грамма в день у ребенка и младенца, за один или несколько раз.
Изобретение касается также указанного применения соединений-ингибиторов глюкозидазы, определенных выше, в комбинации с соединением-активатором канала CFTR.
В этом отношении объектом изобретения является, в частности, указанное применение соединений-ингибиторов глюкозидазы, определенных выше, в комбинации с соединением-активатором канала CFTR, выбранным из:
генистеина следующей формулы:
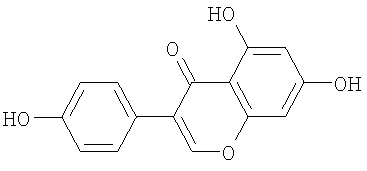
или производных бензо[с]хинолизиниев следующей формулы (II):

в которой:
R1 и R2 обозначают атом водорода или образуют в комбинации с C1 и С2 ароматический цикл с 6 атомами углерода,
R5 обозначает атом водорода, или алкил, прямой или замещенный, содержащий от 1 до 10 атомов углерода, в частности бутил, или сложный эфир формулы COOR', в которой R' обозначает алкил, прямой или замещенный, содержащий от 1 до 10 атомов углерода, в частности этил,
Y обозначает группу -ОН, -SH, -NH2 или -NHCOCH3,
R7, R8, R9 и R10 обозначают атом водорода, или по меньшей мере один из R7, R8, R9 или R10 обозначает атом галогена, в частности атом хлора, брома или фтора,
X обозначает атом галогена в анионной форме, в частности атом брома Br- или хлора Cl-, или группу атомов в анионной форме.
Объектом изобретения является, в частности, указанное применение соединений-ингибиторов глюкозидазы, определенных выше, в комбинации с производными бензо[с]хинолизиниев формулы (II), выбранных из следующих соединений:












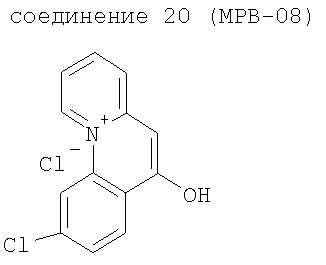

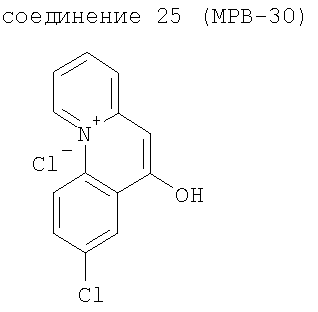







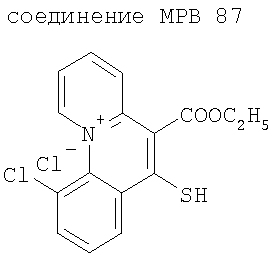



Объектом изобретения являются также продукты, включающие по меньшей мере одно соединение-ингибитор глюкозидазы, в частности соединение формулы (I) или (II), такое как определено выше, и по меньшей мере одно соединение-активатор канала CFTR, такое как определено выше, как продукты комбинации для одновременного, раздельного или разнесенного во времени применения в терапии муковисцидоза.
Изобретение будет более полно проиллюстрировано при помощи подробного описания, которое следует за экспериментальным доказательством правильного и специфического эффекта адресации delF508, обеспечиваемой соединением NB-DNJ, без того чтобы последнее затрагивало его активность как ионного переносчика либо жизнеспособность клеток.
I) МАТЕРИАЛ И МЕТОДЫ
M1. Культура клеток
Клетки CHO-WT: Клетки СНО (Chinese Hamster Ovary) представляют собой фибробласты, которые были трансфицированы геном CFTR дикого типа (CFTR-WT). Эти клетки, таким образом, суперэкспрессируют белок CFTR.
Культуральная среда: среда MEM альфа (GIBCO) + 7% зародышевой телячьей сыворотки + 0,5% пенициллина/стрептомицина + 100 мкМ метотрексата (Аметоптерин, Sigma)
Клетки CF15: клетки CF15 представляют собой человеческие эпителиальные клетки носового происхождения, которые экспрессируют ген ΔF508-CFTR.
Культуральная среда: среда DMEM+НАМ F12 + 10% FCS + 0,6% пенициллина/стрептомицина + факторы роста (инсулин 5 мкг/мл, трансферрин 5 мкг/мл, эпинефрин 5,5 мкМ, аденин 0,18 мМ, EGF 10 нг/мл, Т3 2 нМ, гидрокортизон 1,1 мкМ).
Клетки Calu-3: клетки Calu-3 представляют собой человеческие эпителиальные клетки легочного происхождения, которые экспрессируют ген CFTR дикого типа.
Культуральная среда: среда DMEM/F12 с глутамаксом + 7% зародышевой телячьей сыворотки+1% пенициллина/стрептомицина
М2. Иммуномечение
Иммуномечение позволяет отобразить на экране клеточную локализацию белка CFTR благодаря первичному анти-CFTR антителу (Ас), затем вторичному антителу анти-первичное антитело, меченному флуорофором Cy3. Клетки высевают предварительно на планшеты в соответствующей культуральной среде. Проводили 3 промывания в TBS (NaCl:157 мМ, основной Tris: 20 мкМ, pH 7,4) 5 мин каждое. Клетки затем фиксируют добавлением TBS-параформальдегида (3%) в течение 20 мин. После 3 промываний в TBS (5 мин) клетки инкубируют с TBS-тритон 0,1% (10 мин), который обеспечивает образование отверстий в клеточной мембране, затем опять, после чего клетки инкубируют со смесью TBS-BSA 0,5%-сапонин 0,05% в течение 1 ч. Клетки затем инкубируют с первичным антителом анти-С-конец CFTR (2 мкг/мл) в течение 1 ч. Проводят 3 промывания в TBS-BSA-сапонин по 5 мин каждое, после чего инкубируют с вторичным антителом GAM-Cy3 (1/400) в течение 1 ч. После 2 промываний в TBS по 5 мин ядра метят инкубацией в Topro3 (1/1000) в течение 5 мин. Наконец, после последних 3 промываний в TBS (5 мин) планшеты помещают на пластины. Пластинки наблюдают в конфокальный микроскоп (Bio-Rad) с возбуждением с помощью лазера в соответствующих длинах волн. Для того чтобы различать мечение между Cy3 и Topro3, цвет свечения Topro3 меняют на голубой (цвет ядер).
М3. Эманация радиоактивных индикаторов
Измерения транспорта ионов хлора в клетках осуществляли при помощи техники эманации радиоактивного иодида (Becq et al., 1999; Dormer et al., 2001). Индикатор (125I) вводят во внутриклеточную среду. Затем подсчитывают количество радиоактивного индикатора, которое выходит из клетки после добавления различных фармакологических агентов. В качестве индикатора транспорта ионов хлора используют иодид. Было показано, что оба радиоактивных индикатора 125I и 36Cl могут рассматриваться как эквиваленты для измерения активности хлоридного канала (Venglarick et al., 1990). 125I имеет, кроме того, преимущество, заключающееся в коротком периоде жизни, по сравнению с 35Cl (периоды 1/2 жизни, соответственно: 30 дней и 300000 лет). Клетки культивируют на 24-луночных планшетах в соответствующей среде. 2 промывания в эманационной среде (NaCl: 136,6 мМ, KCl: 5,4 мМ, КН2PO4: 0,3 мМ, NaH2PO4: 0,3 мМ, NaHCO3: 4,2 мМ, CaCl2: 1,3 мМ, MgCl2: 0,5 мм, MgSO4: 0,4 мМ, HEPES: 10 мМ, D-глюкоза: 5,6 мМ) осуществляют для удаления мертвых клеток, которые проявляют беспорядочную радиоактивность. Затем клетки инкубируют с 500 мкл загрузки (1 мкCi/мл 125INa) в течение 30 мин для CHO-WT или 1 ч для CF15 и Calu-3. Иод уравновешивают с одной и с другой стороны клеточной мембраны. Робот (MultiPROBE, Packard) осуществляет следующие стадии: среду загрузки промывают эманационной средой для удаления внеклеточной радиоактивности. Супернатант собирают ежеминутно в гемолизные пробирки и среду заменяют эквивалентным объемом (500 мкл). Пробы, отобранные в течение первых 3 минут, не подвергаются добавлению лекарства, они позволяют получить устойчивую исходную линию, характеризующую пассивный выход ионов I-. 7 следующих проб получают в присутствии тестируемой молекулы. В конце эксперимента клетки лизируют добавлением 500 мкл NaOH (0,1N)/0,1% SDS (30 мин), таким образом, радиоактивность, оставшаяся внутри клетки, может быть определена. Радиоактивность в гемолизных пробирках подсчитывают в импульсах в минуту (cpm) с помощью счетчика гамма (Cobra II, Packard). Результаты в cpm выражены в виде скорости выхода радиоактивного иода (R) согласно следующей формуле: R (мин-1)=[ln(125It1)-ln(125It2)]/(t1-t2), где 125It1: в момент времени t1; 125It2: в момент времени t2. Этот поток иода представлен в виде кривой. Для того чтобы определить количество выхода иода, вызванного введением тестируемой молекулы, рассчитывают следующий относительный поток, который позволяет вывести из расчетов базовый поток: Относительная Скорость (мин-1)=Rpic-Rbasal. Наконец, эти результаты нормализуют, чтобы сравнить эффект различных лекарств между ними. Результаты представлены в виде среднего +/- SEM (среднее стандартное отклонение). Статистический тест Стьюдента используют, чтобы сравнивать эффект лекарственных средств с контролем (величины, соответствующие Р<0,01, рассматривают как статистически значимые).
М4. Тест на цитотоксичность
Тест токсичности с МТТ представляет собой колориметрический тест, который основывается на способности митохондриальных дегидрогеназ метаболизировать МТТ (желтая соль тетразолия) в формазан (пурпур). Поглощение, пропорциональное концентрации превращенного красителя, может быть измерено спектрофотометрией. Клетки инкубируют на 96-луночных планшетах в присутствии тестируемого агента в течение 2 ч. Получают 3 контроля: 100% живые клетки: клетки без агента; 0% живые клетки: клетки, оставленные на открытом воздухе; контроль: среда без клеток. Клетки промывают средой RPMI без фенольного красного, чтобы цвет среды не искажал результатов измерений поглощения. Затем их инкубируют в течение 4 ч со 100 мкл раствора RPMI, дополненного МТТ (0,5 мг/мл). Среду удаляют, добавление 100 мкл ДМСО позволяет солюбилизировать превращенный краситель (формазан). Поглощение измеряют спектрофотометрией при: 570 нм (пурпур); 630 нм (шумовой фон). Для исключения шумового фона осуществляют следующий расчет: DOреальная=DO570нм-DO630нм. Затем результаты нормализуют по отношению к контролю (100% и 0% живых клеток) и представляют в виде среднего +/- SEM.
II) РЕЗУЛЬТАТЫ
R1. Эффект NB-DNJ на адресацию delF508 в клетках CF15
Исследование адресации белка delF508-CFTR осуществляли в лаборатории, с использованием комбинации подходов фармакологии, получения изображений клеток, биохимических и электрофизиологических тестов на человеческих клетках CF15 легочного эпителия, гомозиготных в отношении делеции delF508. Существуют различные молекулы, способные взаимодействовать с некоторыми факторами, участвующими в адресации CFTR. Таков N-бутил-дезоксинойиримицин (NB-DNJ), являющийся ингибитором глюкозидазы I и II и который был протестирован.
Для каждого эксперимента добавление коктейля (Форсколин 10 мкМ, Генистеин 30 мкМ) позволяет активировать CFTR, когда он находится в мембране. Таким образом, если адресация delF508 была восстановлена, можно наблюдать эманацию иода. Результаты, представленные в виде гистограммы, были нормализованы по отношению к контрольной обработке (обработка клеток МРВ-91 250 мкМ в течение 2 ч), в случае которой считается, что наличествует 100% активность CFTR. Здесь показано, что обработка ингибитором глюкозидазы, N-бутилдезоксинойиримицином (NB-DNJ) (структура, представленная ниже), клеток CF15 в течение двух часов при 37°С восстанавливала адресацию белка delF508 и позволяла ему функционировать в качестве ионного переносчика (фиг.1).
В отсутствие обработки клеток белок delF508 не является мембранным и не наблюдается эманации иода, вызванной коктейлем (Форсколин 10 мкМ, Генистеин 30 мкМ). ЕС50 (концентрация молекулы, которая дает 50% максимальной эффективности) NB-DNJ определяли как равную 123 микромоль (фиг.2). С помощью изображения клетки авторы локализовали белок delF508 в плазматических мембранных компартментах после обработки NB-DNJ.
R2. Эффект NB-DNJ в отношении активности CFTR в клетках Calu-3
Для того чтобы показать, что эффект NB-DNJ является специфическим в отношении адресации delF508 и не затрагивает другие хлоридные каналы, NB-DNJ был протестирован в качестве потенциального активатора на клетках Calu-3. Результаты, представленные на фиг.3, были получены для эманации иода на клетках Calu-3. В качестве контролей использовали форсколин (5 мкМ, n=8) и МРВ-91 (250 мкМ, n=8). NB-DNJ (n=8) не является активатором ни CFTR дикого типа, ни другого транспорта анионов в этих клетках, так как не имеется значительной разницы между эффектом в присутствии или в отсутствие NB-DNJ («база»).
R3. Эффект NB-DNJ в отношении адресации CFTR в клетках Calu-3
Для того чтобы показать, что эффект NB-DNJ является специфическим в отношении адресации delF508, NB-DNJ был протестирован в качестве модулятора адресации CFTR дикого типа на клетках Calu-3. Результаты, представленные на фиг.4, были получены для эманации иода на клетках Calu-3, обработанных в течение 2 часов NB-DNJ (500 мкМ). На фиг.4 «база» соответствует не обработанным клеткам и без стимуляции МРВ-91. Эманация иода не стимулирована. Второй контроль соответствует клеткам без обработки, но стимулированным с помощью 250 мкМ МРВ-91. В этом случае CFTR активирован и эманация иода измерена. Третий контроль соответствует клеткам, обработанным МРВ-91 в течение 2 ч при 37°С, затем простимулированным 250 мкМ МРВ-91. Активность CFTR в этом экспериментальном условии не отличается значительно от двух других экспериментальных ситуаций. Наконец, когда клетки Calu-3 были обработаны в течение 2 ч при 37°С с помощью 500 мкМ NB-DNJ и простимулированы 250 мкМ МРВ-91, уровень активности CFTR не изменился. Эти результаты доказывают, что NB-DNJ не затрагивает пути адресации CFTR дикого или других хлоридных каналов, а также не ухудшает активность CFTR в человеческих эпителиальных клетках легких не-CF.
R4. Цитотоксичность различных ингибиторов пути адресации С целью тестировать цитотоксичность NB-DNJ, клетки CHO-WT инкубировали 2 ч с различными концентрациями ингибиторов, после чего подвергали тесту жизнеспособности клеток в МТТ. На фиг.5 представлено обобщение результатов. Результаты показывают, что клетки жизнеспособны для всех концентраций NB-DNJ. Эта молекула не представляет таким образом цитотоксичности для клеток.
R5. Эффект аналогов NB-DNJ на адресацию delF508 в клетках CF15
Сравнивали эффекты различных соединений семейства N-бутил-дезоксинойиримицина (NB-DNJ или nB-DNJ). Эти продукты представлены на фиг.6. Для каждого опыта добавление коктейля (Форсколин 10 мкМ, Генистеин 30 мкМ) позволяет активировать CFTR, когда он находится в мембране. Результаты, представленные на фиг.7, показывают, что обработка клеток CF15 100 мкМ DNJ, nB-DMJ или DMJ в течение двух часов при - 37°С восстанавливала адресацию белка delF508 и позволяла ему функционировать в качестве ионного переносчика (фигура 7). С другой стороны, соединения DGJ, nB-DGJ, DFJ и nB-DFJ не проявляли значительного эффекта на адресацию delF508 (фигура 7). Для каждого соединения (DNJ, DMJ и nB-DMJ) ЕС50 (концентрация молекулы, которая дает 50% максимальной эффективности) была определена при >250 мкМ, 134 мкМ и 113 мкМ соответственно.
III) ВЫВОДЫ
Тесты эманации обнаружили, что NB-DNJ, провоцирующий накопление delF508 в эндоплазматическом ретикулуме, обеспечивает мембранную релокализацию этого белка и представляет собой, таким образом, важное фармакологическое средство переадресации delF508 в человеческой эпителиальной клетке легкого. NB-DNJ обеспечивает специфическую мембранную адресацию delF508, не затрагивая активность этого белка как ионного переносчика и не оказывая эффекта ни на другие хлоридные каналы, ни на жизнеспособность клеток.
СПИСОК ЛИТЕРАТУРЫ
1. BECQ et al. (1999) Journal of Biological Chemistry 274, 27415-27425.
2. CHENG et al. (1990) Cell 63, 827-834.
3. COX et al. (2000) The Lancet 355, 1481-1485.
4. DORMER et al. (2001) Journal of Cell Science 114, 4073-4081.
5. DWEK et al. (2000) Brevet WO 00/62779.
6. ELLGAARD & HELENIUS (2003). Molecular Cell Biology, 4, 181-191.
7. FIEDLER & SIMONS K. (1995) Journal of Cell Science 109, 271-276.
8. GELMAN et al. (2002) The Journal of Biological Chemistry 277, 11709-11714.
9. PLATT et al. (1994) The Journal of Biological Chemistry 2 69, 27108-27114.
10. PLATT et al. (2001) J. Inherit. Metab. Dis. 24, 275-290.
11. RIORDAN et al. (1989) Science 245, 1066-1073.
12. TSUI et al. (1985) Science 230, 1054-1057.
13. WEI et al., (1996) Journal of Cellular Physioly, 168, 373-384.
ОПИСАНИЕ ФИГУР
Фиг.1: Эффект NB-DNJ на адресацию delF508.
Клетки CF15 были предварительно обработаны 2 ч с NB-DNJ (500 мкМ). Эффект МРВ-91 (250 мкМ) рассматривают как составляющий 100% в этом тесте. Активность CFTR измерена через эманацию иода (n=8 для каждого условия) после стимуляции fsk 10 мкМ+Gst 30 мкМ. Ns: незначимая разница. ***: значимая разница Р<0,001.
Фиг.2: Кривая эффекта NB-DNJ на адресацию delF508.
Клетки CF15 были предварительно обработаны 2 ч с NB-DNJ в различных концентрациях. Активность CFTR измерена через эманацию иода (n=4 для каждой концентрации) после стимуляции fsk 10 мкМ+Gst 30 мкМ.
Фиг.3: Эффект NB-DNJ на анионный транспорт клеток Calu-3.
Активность CFTR измерена через эманацию иода (n=8 для каждого условия) после стимуляции форсколином (fsk) 5 мкМ, МРВ-91 250 мкМ, NB-DNJ 500 мкМ. Следует отметить, что fsk и соединение МРВ-91 активируют эманацию иода в этой клетке, но не NB-DNJ, который не проявляет никакого эффекта. Ns: незначимая разница. ***: значимая разница Р<0,001.
Фиг.4: Эффект обработки NB-DNJ клеток Calu-3.
Клетки Calu-3 предварительно инкубируют 2 ч при 37°С с 500 мкМ NB-DNJ, с МРВ-91 250 мкМ. Не обработанные клетки: «без обработки». «База» указывает, что клетки не были ни обработаны, ни стимулированы. Активность CFTR измерена через эманацию иода (n=8 для каждого условия) после стимуляции МРВ-91 250 мкМ. Следует отметить, что обработка NB-DNJ не имеет какого-либо эффекта, так как уровень стимуляции эманации одинаков для всех трех условий. Ns: не значимая разница.
Фиг.5: Эффект NB-DNJ на цитотоксичность клеток СНО.
Следует отметить, что при 5 и 50 мкМ цитотоксичность не определяется. Слабая токсичность появляется при 500 мкМ. 2 ч обработки клеток. Ns: не значимая разница. ***: значимая разница Р<0,001.
Фиг.6: Структуры N-бутил-дезоксинойиримицина (NB-DNJ или nB-DNJ) и различных соединений семейства NB-DNJ.
Фиг.7: Эффект NB-DNJ и аналогов NB-DNJ на адресацию delF508 в клетках CF15.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОБИОТИЧЕСКИЕ ШТАММЫ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ДИАРЕИ | 2013 |
|
RU2642320C2 |
| ПРИМЕНЕНИЕ МОДУЛЯТОРОВ CFTR ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ СОСТОЯНИЙ | 2019 |
|
RU2820288C2 |
| Тимозин альфа-1 для применения в лечении муковисцидоза | 2016 |
|
RU2724932C2 |
| Способ преимплантационного генетического тестирования муковисцидоза | 2021 |
|
RU2777078C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ХЕМОСЕНСИБИЛИЗАЦИИ ОПУХОЛЕЙ, УСТОЙЧИВЫХ К ПРОТИВОРАКОВЫМ СРЕДСТВАМ | 2007 |
|
RU2396974C2 |
| РЕКОМБИНАНТНЫЙ АДЕНОАССОЦИИРОВАННЫЙ ВИРУС, ЯВЛЯЮЩИЙСЯ ГИБРИДОМ СЕРОТИПОВ AAV9 И AAVrh74, С ПОНИЖЕННЫМ ТРОПИЗМОМ К ПЕЧЕНОЧНОЙ ТКАНИ | 2019 |
|
RU2812279C2 |
| ТВЕРДЫЕ ФОРМЫ N-(7-АЗАБИЦИКЛО[2.2.1]ГЕПТАН-7-ИЛ-)-2-(ТРИФТОРМЕТИЛ)ФЕНИЛ)-4-ОКСО-5-(ТРИФТОРМЕТИЛ)-1,4-ДИГИДРОХИНОЛИН-3-КАРБОКСАМИДА | 2009 |
|
RU2518479C2 |
| СПОСОБ ПРЕНАТАЛЬНОЙ И ПОСТНАТАЛЬНОЙ ДНК-ДИАГНОСТИКИ СИНДРОМА ДАУНА, ЭДВАРДСА, ПАТАУ, МУТАЦИИ delF508 В ГЕНЕ МУКОВИСЦИДОЗА И РЕЗУС-ФАКТОРА ПЛОДА | 2014 |
|
RU2539778C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ИНГИБИТОРОВ СУПРЕССИИ СУПРЕССОРА ОПУХОЛЕВОГО РОСТА Pdcd4 В ОПУХОЛЕВЫХ КЛЕТКАХ И ГЕНЕТИЧЕСКАЯ КОНСТРУКЦИЯ pLucPdcd4 ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2016 |
|
RU2640909C1 |
| ТВЕРДЫЕ ФОРМЫ 3-(2, 2-ДИФТОРБЕНЗО[D][1, 3] ДИОКСОЛ-5-ИЛ)ЦИКЛОПРОПАНКАРБОКСАМИДО)-3-МЕТИЛПИРИДИН-2-ИЛ)БЕНЗОЙНОЙ КИСЛОТЫ | 2011 |
|
RU2579370C2 |
Изобретение относится к медицине, а именно, к пульмонологии и может быть использовано для получения лекарственного средства для лечения муковисцидоза. Изобретение заключается в том, что предлагаемое лекарственное средство содержит ингибиторы глюкозидазы (ИГ) общей формулы (IIa). Изобретение обеспечивает повышение эффективности лечения муковисцидоза за счет восстановления мембранной адресации белка delF508 и функционирования его в качестве ионного переносчика при отсутствии цитотоксического эффекта. 5 з.п. ф-лы, 7 ил.
1. Применение ингибитора глюкозидазы для получения лекарственного средства для лечения муковисцидоза, в котором ингибитор глюкозидазы выбирают среди соединений следующей общей формулы (IIа):

в которой R2 обозначает бутил.
2. Применение по п.1 соединения, имеющего одну из следующих общих формул:
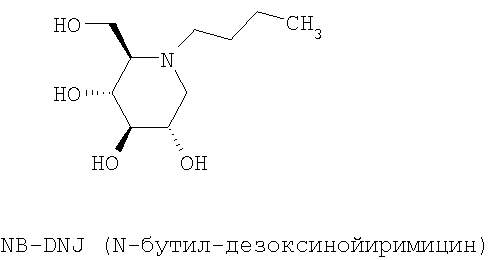

3. Применение по п.2 соединения NB-DNJ.
4. Применение по п.1, в котором лекарственное средство может быть введено пероральным, ректальным или назальным путем.
5. Применение по п.4, в котором лекарственное средство может быть введено в количестве от 1 мг до 2 г активного ингредиента в сутки для взрослого или от 1 мг до 1 г активного ингредиента в сутки для ребенка или младенца, в одной или нескольких дозах.
6. Применение по п.4 или 5, в котором лекарственное средство может быть введено в форме сиропа, суспензии, желатиновой капсулы, таблеток, порошка, гранул, суппозиториев, аэрозоля путем ингаляции или капель.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЗАМЕЩЕННЫЕ АЗЕТИДИНОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 1993 |
|
RU2148056C1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| GALIETTA L.J et al | |||
| Novel CFTR chloride channel activators identified by screening of combinatorial libraries based on flavone and benzoquinolizinium lead compounds | |||
| J | |||
| Biol | |||
| Chem | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Epub | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| реферат, он-лайн [Найдено в Интернет | |||
Авторы
Даты
2009-06-20—Публикация
2004-11-05—Подача