Изобретение относится к медицине, конкретно к биологически активному веществу, производному 1-гидрокси-2-иминоциклогекс-3-ен-1,3-дикарбонитрила, которое может использоваться в качестве ингибитора репродукции вируса иммунодефицита.
Проблема лечения ВИЧ-инфекции остается одной из самых актуальных проблем современной медицины. Для лечения ВИЧ-инфекции на протяжении почти 15 лет в клинической практике широко использовался препарат азидотимидин (АЗТ), являющийся эффективным ингибитором вирусной обратной транскриптазы [Машковский М.Д. «Лекарственные средства», т.2, изд. 14-е, М.: ООО «Новая волна», 2000]. Однако, в последние годы применение этого препарата снижается в связи с быстро развивающейся в организме ВИЧ-инфицированных пациентов резистентностью к нему вируса [Larder В.А, Kemp S.D. «Multiple mutations in HIV-1 reverse transcriptase confer high-level resistance to zidovudine (AZT)». Science, 1989, V.246, p.1155-1158], а также его высокой токсичностью, в том числе митохондриальной [Chiu D.T. & Duesberg Р.Н. «The toxicity of azidothymidine (AZT) on human and animal cells in culture at concentrations used for antiviral therapy». Genetica, 1995, V.95, p.103-109 и Brinkman K, ter Hofstede J.M, Burger D.M. «Adverse effects of reverse transcriptase inhibitors: mitochondrial toxicity as common pathway». AIDS, 1998, V.12, p.1735-1744]. Кроме того, монотерапия азидотимидином не рекомендована Всемирной Организацией Здравоохранения, поскольку приводит к появлению устойчивых к препарату мутантов вируса. В настоящее время азидотимидин применяют в основном в качестве одного из компонентов в так называемых «коктейлях» (в сочетании с 2 - 4 другими препаратами) [Schmit J.-C, Weber В. «Recent advances in antiretroviral therapy and HIV infection monitoring)). Intervirology, 1997, V.40, №5/6, p.304-321 и Кравченко A.B. «Комбинированная антиретровирусная терапия ВИЧ-инфекции». Эпидемиология и инфекционные болезни, 2001, №1, с.59-62]. Несмотря на положительные результаты, достигаемые при использовании некоторых таких «коктейлей», актуальным остается поиск новых анти-ВИЧ препаратов иного структурного типа, достаточно эффективных и недорогих.
Такими доступными и недорогими препаратами являются, например, глицирризиновая кислота и ее производные. Одним из наиболее эффективных производных глицирризиновой кислоты в качестве ингибитора репродукции вируса иммунодефицита человека является пентаникотинат глицирризиновой кислоты, показавший высокую анти-ВИЧ активность по сравнению со многими другими производными названной кислоты [Плясунова О.А., Егоричева И.Н., Федюк Н.В. и др. «Изучение анти-ВИЧ активности р-глицирризиновой кислоты». Вопросы вирусологии, 1992, №5-6, с.235-238]. Однако имеется потребность в ингибиторах, анти-ВИЧ активность которых превышает активность указанного соединения.
Задачей изобретения является расширение ассортимента ингибиторов репродукции вируса иммунодефицита.
Поставленная задача решается применением в качестве ингибитора репродукции вируса иммунодефицита известного 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрила формулы 1:
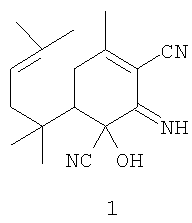
Биологическая активность соединения 1, равно как и других производных 1-гидрокси-2-иминоциклогекс-3-ен-1,3-дикарбонитрила, ранее не исследовалась.
Соединение 1 может быть получено, например, взаимодействием 5,5,8-триметилнона-3,7-диен-2-она 2 с малононитрилом в присутствии основных катализаторов, в том числе гетерогенных, например гидротальцита [Хоменко Т.М., Волчо К.П., Токтарев А.В., Ечевский Г.В., Салахутдинов Н.Ф., Бархаш В.А. ЖОрХ, 2005, Т. 41. Вып.6. С.859-863] или цеолита Csβ [Volcho К.Р., Kurbakova S.Yu., Korchagina D.V., Suslov E.V., Salakhutdinov N.F., Toktarev A.V., Echevskii G.V., Barkhash V.A. J. Mol.Cat. A: Chemical, 2003, Vol.195, N 1-2, pp.263-274], в том числе в условиях ультразвукового воздействия [Волчо К.П., Суслов Е.В., Курбакова С.Ю., Корчагина Д.В., Салахутдинов Н.Ф., Бархаш В.А.ЖОрХ., 2004, Т. 40, Вып.5, 691-700].
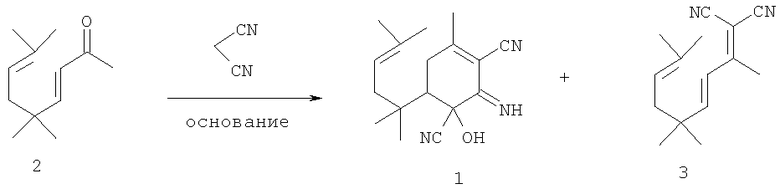
В качестве еще одного продукта в этой реакции образуется 2-(1,4,4,7-тетраметилокта-2,6-диенилиден)-малононитрил 3, который может быть превращен в искомое соединение 1 в присутствии основания в условиях ультразвукового воздействия (УЗ) [Волчо К.П., Суслов Е.В., Курбакова С.Ю., Корчагина Д.В., Салахутдинов Н.Ф., Бархаш В.А. ЖОрХ, 2004, Т.40, Вып.5,691-700].
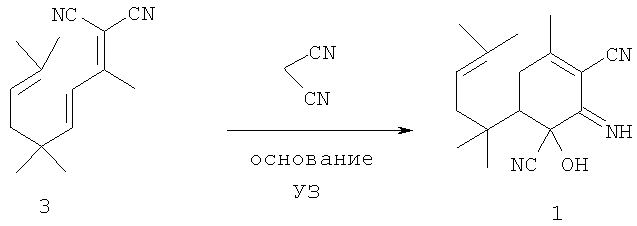
В целях получения оптически активного соединения 1 могут быть использованы существующие способы разделения энантиомеров, а также имеющиеся методы проведения асимметрической реакции Михаэля [Suslov Е.V., Korchagina D.V., Komarova N.I., Volcho К.P., Salakhutdinov N.F. Mendeleev Commun., 2006, N 4, 202-204].
На практике синтез рацемического соединения 1 может быть осуществлен, например, в соответствии с приведенными ниже примерами 1-3.
Оценка цитотоксичности рацемического соединения 1 приведена в примере 4. Обнаружено, что CD50 исследуемого препарата составляет 100 мкг/мл.
Исследования биологической активности рацемического соединения 1, проведенные в отношении вируса иммунодефицита, показали его высокую эффективность как ингибитора репродукции этого вируса. В результате исследований выявлено, что соединение 1 активно влияет на репродукцию ВИЧ, что подтверждается приведенным ниже примером 5.
Исследование ингибирования репродукции ВИЧ включает культивирование первично инфицированных лимфоидных клеток линии МТ-4 в присутствии названных соединений, конечные концентрации которых в культуральной среде составляют 0.0001-100 мкг/мл, на протяжении одного пассажа - в течение 4-х суток.
Об ингибировании репродукции ВИЧ в культуре чувствительных клеток судят по снижению накопления вирусспецифического белка р24 (по данным иммуноферментного анализа), а также по увеличению жизнеспособности клеток в присутствии препарата по сравнению с контролем, определяемому на 4-е сутки культивирования [Schmit J.-C, Weber В. «Recent advances in antiretroviral therapy and HIV infection monitoring)). Intervirology, 1997, V.40, №5/6, p.304-321 и. Кравченко A.B. «Комбинированная антиретровирусная терапия ВИЧ-инфекции». Эпидемиология и инфекционные болезни, 2001, №1, с.59-62] при окрашивании 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромидом (МТТ).
В процессе исследования ингибирования репродукции ВИЧ соединением 1 и эталоном сравнения (пентаникотинатом глицирризиновой кислоты) мы получили следующие результаты:
Соединение 1: ID50 - 5.5 мкг/мл, CD50 - 100 мкг/мл, IS - 18.2.
Пентаникотинат глицирризиновой кислоты: ID50 - 20.4 мкг/мл, CD50 - 1163 мкг/мл, IS - 57.0.
Полученные количественные показатели ингибирования подтверждают высокую степень подавления репликации ВИЧ-1 в культуре клеток МТ-4 соединением 1, превышающую, например, тот же показатель у эталона сравнения - пентаникотината глицирризиновой кислоты - в 3.7 раза.
Таким образом, 1 -гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрил 1 имеет высокую биологическую активность, которая проявляется в том, что он является высокоактивным ингибитором репродукции вируса иммунодефицита и может после проведения соответствующих испытаний использоваться в чистом виде или в качестве основы новых высокоэффективных лекарственных форм для лечения СПИДа.
Пример 1. Получение 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрила 1 в присутствии цеолита Csβ.
К 0.080 цеолита Csβ (приготовление цеолита описано в работе [Volcho К.Р., Kurbakova S.Yu., Korchagina D.V., Suslov E.V., Salakhutdinov N.F., Toktarev A.V., Echevskii G.V., Barkhash V.A. J. Mol.Cat. A: Chemical, 2003, Vol.195, N 1-2, pp.263-274]) добавили раствор 0.30 г малононитрила в 2 мл диэтилового эфира, эфир отогнали и прибавили по каплям 0.200 г 5,5,8-триметилнона-3,7-диен-2-она 2. Реакционную смесь выдержали при комнатной температуре в течение 48 ч, экстрагировали диэтиловым эфиром и ацетоном, растворитель отогнали. Разделение продуктов проводили колоночной хроматографией на силикагеле, элюент - раствор эфира в гексане от 1 до 95%. Выделили 0.054 г непрореагировавшего соединения 2, 0.074 г (40%, в расчете на прореагировавшее соединение 2) 2-(1,4,4,7-тетраметилокта-2,6-диенилиден)-малононитрила 3 и 0.016 г (7%, в расчете на прореагировавшее соединение 2) 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3 -динитрила 1.
Соединение 1: m/е для C17H23N3 (М-16): расч. 269.18919, найдено 269.18927. 1Н ЯМР, δ, J (Гц): 0.76 and 0.86 (s, 6Н, С15Н3, С16Н3), 1.57 (d, J1,49=1.5, 3Н, С14Н3), 1.70
(dt, J11,9=1.5, J11,8=1.5, 3Н, С11Н3), 1.88 (br d, J8,9=7.5, 2H8), 2.23 (d, J17,5'=1.5, 3Н, C17H3), 2.31 (dd, J6,5'=9, J6,5=2.5,1H6), 2.48 (dd, J5,5'=18.5, J=2.5, 1H5) и 2.55 (ddq, J=18.5, J=9, J=1.5,1H5') - AB-system, 4.77 (br s, 2H, OH, NH), 5.09 (tqq, J=7.5, J=1.5, J=1.5, 1H9). ИК (CCl4): δN-H 1580 cm-1, νC=N 1647 cm-1, νC≡N 2188, 2220 cm-1, νo-н, νN-H 3357, 3400, 3480 cm-1.
Пример 2. Получение 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрила 1 в присутствии цеолита Cs-β в условиях ультразвукового воздействия.
К 0.04 г цеолита Cs-β добавили раствор 0.15 г малононитрила в 2 мл диэтилового эфира, эфир отогнали и прибавили 0.15 г соединения 2. Колбу со смесью поместили в ультразвуковую баню (Branson МТН-3510, 42 кГц, 130 Вт), нагретую до 60°С, и выдержали в условиях ультразвукового воздействия в течение 4 ч, реакционную смесь экстрагировали с катализатора этилацетатом. После разделения методом колоночной хроматографии выделили 0.035 мг исходного кетона 2 (конверсия 65%), 0.037 г динитрила 3 (25%, в расчете на прореагировавшее соединение 2) и 0.030 г соединения 1 (16%, в расчете на прореагировавшее соединение 2).
Пример 3. Получение 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрила 1 из 2-(1,4,4,7-тетраметилокта-2,6-диенилиден)-малононитрила 3.
К 0.015 г цеолита Csβ добавили раствор 0.020 г малононитрила в 2 мл диэтилового эфира, эфир отогнали и прибавили 0.018 г соединения 3. Колбу со смесью поместили в ультразвуковую баню (Branson МТН-3510, 42 кГц, 130 Вт), нагретую до 60°С, и выдержали в условиях ультразвукового воздействия в течение 4 ч, реакционную смесь экстрагировали с катализатора этилацетатом. После разделения методом колоночной хроматографии выделили 0.005 г соединения 1 (22%).
Пример 4. Оценка цитотоксичности 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрила 1.
Цитотоксичность соединения 1 оценивают путем добавления его разведений в бессывороточной среде RPMI-1640 к клеточной суспензии МТ-4, помещенной в лунки 96-луночного планшета ("Cel-Cult", England), до конечных концентраций 0.001-100 мкг/мл (по три лунки на каждую дозу) с последующим культивированием при 37°С в течение 4-х суток [Ito М., Sato A., Hirabayashi К., Tanabe F., Shigeta S., Baba M., De Clercq E., Nakasbima H., Yamamoto N. Mechanism of inhibitory effect of glycyrrhizin on replication of human immunodeficiency virus (HIV). Antiviral Res., 1988, V. 10, p.289-298]. Посевная концентрация составляет 0.5x106 клеточных частиц в миллилитре. Контролем служат клетки без добавления препарата, вместо которого вносят такое же количество бессывороточной среды. Жизнеспособность клеток подсчитывают на 4-е сутки культивирования, пользуясь формазановым методом (прижизненным окрашиванием клеток 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолиум бромидом (МТТ). Токсичность различных доз препарата определяют по жизнеспособности клеток относительно контрольных, а по полученным результатам строят дозозависимую кривую и определяют концентрацию, на 50% снижающую жизнеспособность клеток (CD50).
Показатель токсичности исследуемого препарата CD50 - 100 мкг/мл.
Пример 5. Определение влияния 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрил 1 на репродукцию ВИЧ-1 в культуре клеток МТ-4.
Исследование противовирусной активности соединений в отношении ВИЧ-1 проводят на перевиваемой линии чувствительных клеток МТ-4. Для заражения используют супернатант инфицированных клеток, хранящийся в жидком азоте, множественность заражения составляет 0.2-0.5 инфекционных единиц на клетку.
Суспензию клеток МТ-4 с концентрацией 2.0×106 клеточных частиц в миллилитре и жизнеспособностью не менее 90% помещают в лунки 96-луночного планшета ("Orange") непосредственно после внесения вируссодержащего материала и добавляют соединение 1, разведенное в среде RPMI-1640 без сыворотки, до конечных концентраций 0.0001-100 мкг/мл (по три лунки на каждую дозу). Контролями служат инфицированные ВИЧ-1 клетки МТ-4 без добавления препарата (вместо препарата вносят такое же количество среды RPMI-1640 без добавок) и неинфицированные клетки.
Планшет инкубируют в течение часа при 37°С для адсорбции вируса, затем клетки разводят до посевной концентрации (0.5×106 в миллилитре) питательной средой RPMI-1640 с добавлением 10% фетальной сыворотки КРС, предварительно инактивированной прогреванием при 56°С в течение 30 минут, 300 мг/мл L-глютамина и 100 мкг/мл гентамицина. Затем планшет помещают в термостат на 37°С в атмосфере 5% СО2. На 4-е сутки культивирования подсчитывают концентрацию и жизнеспособность клеток формазановым методом. По полученным данным строят графики зависимости прироста жизнеспособности клеток относительно контроля под действием возрастающих доз препаратов, т.е. определяют способность препаратов защищать инфицированные клетки от цитопатогенного действия вируса.
Оценку анти-ВИЧ активности соединений проводят с использованием количественного определения вирусспецифического белка р24 методом прямого иммуноферментного анализа, как описано в работе [Fields А.Р., Bednarik P.P., Hess A., May W.S. «Human immunodeficiency virus induces phosphorylation of its cell surface receptor». Nature (London), 1988, V.333, p.278-280], и строят дозозависимые кривые, по которым рассчитывают концентрации, на 50% подавляющие прирост вирусного антигена (ID50). Терапевтический индекс, или индекс селективности (IS), считают как отношение 50%-ной токсической концентрации соединения к его 50%-ной эффективной дозе.
Полученные результаты: CD50 - 100 мкг/мл, ID50 - 5.5 мкг/мл, IS - 18.2.
Пример 6. Определение влияния пентаникотината глицирризиновой кислоты на репродукцию ВИЧ-1 в культуре клеток МТ-4.
То же, что в примере 5, но в лунки 96-луночного планшета («Orange») непосредственно после внесения вируссодержащего материала добавляют пентаникотинат глицирризиновой кислоты.
Полученные результаты: CD50 - 1163 мкг/мл, ID50 - 20.4 мкг/мл, IS - 57.0
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-НИТРО-6-ТРИФТОРМЕТИЛ-1,2,3-БЕНЗОТРИТИОЛ-1-ОКСИД В КАЧЕСТВЕ ИНГИБИТОРА РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2007 |
|
RU2366419C2 |
| ДИ- И ТРИНИКОТИНАТЫ ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ И ИНГИБИТОР РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2006 |
|
RU2304145C1 |
| ГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С S-БЕНЗИЛ-L-ЦИСТЕИНОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ АКТИВНОСТЬ | 2001 |
|
RU2198177C2 |
| АМИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С 5-АМИНОУРАЦИЛОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ АКТИВНОСТЬ | 2001 |
|
RU2199547C2 |
| ГЛИКОПЕПТИД ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С ГЛИЦИЛ-L-ФЕНИЛАЛАНИНОМ, ПРОЯВЛЯЮЩИЙ АНТИ-ВИЧ-1 АКТИВНОСТЬ | 2006 |
|
RU2315058C1 |
| СОЛИ ДИ- И ТРИНИКОТИНАТОВ ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ И ИНГИБИТОР РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА НА ИХ ОСНОВЕ | 2008 |
|
RU2376312C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНТАНИКОТИНАТА ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ, ЯВЛЯЮЩЕГОСЯ ИНГИБИТОРОМ РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2008 |
|
RU2363703C1 |
| СИНЕРГИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ ВИЧ | 2004 |
|
RU2272631C2 |
| N'-{N-[3-ОКСО-20(29)-ЛУПЕН-28-ОИЛ]-9-АМИНОНОНАНОИЛ}-3-АМИНО-3-ФЕНИЛПРОПИО НОВАЯ КИСЛОТА, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ И ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2002 |
|
RU2211843C1 |
| 2',3'-ДИДЕГИДРО-2',3'-ДИДЕЗОКСИТИМИДИН-5'[(ЭТОКСИКАРБОНИЛ)(ЭТИЛ)ФОСФОНАТ]- ИНГИБИТОР РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2000 |
|
RU2188203C2 |
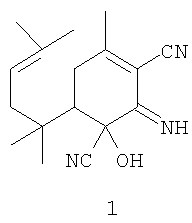
Изобретение относится к медицине, конкретно к биологически активному веществу 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрилу формулы 1:
которое может использоваться в качестве ингибитора репродукции вируса иммунодефицита.
Ингибитор репродукции вируса иммунодефицита, представляющий собой 1-гидрокси-2-имино-4-метил-6-(1,1,4-триметилпент-3-енил)-циклогекс-3-ен-1,3-динитрил формулы 1:
| ХОМЕНКО Т.М | |||
| и др | |||
| Взаимодействие некоторых терпеноидов с малононитрилом в присутствии гидротальцита | |||
| - ЖОрХ, 2005, 41, ВЫП.6, 859-863 | |||
| VOLCHO K.P | |||
| et al | |||
| Competing Michael and Knoevenagel reactions of terpenoids with malononitrile on basic Cs-β zeolite, J | |||
| MOL | |||
| CATAL | |||
| A: CHEM., 2003, 195, 1-2, 263-274 | |||
| ВОЛЧО К.П | |||
| и др | |||
| Взаимодействие |
Авторы
Даты
2009-06-27—Публикация
2007-10-23—Подача