Настоящее изобретение относится к новому ряду производных пиразолопиридина, способу их получения, фармацевтическим композициям, содержащим эти соединения, и их применению в медицине.
Киназы представляют собой белки, участвующие в различных клеточных реакциях на внешние сигналы. В девяностых годах было открыто новое семейство киназ, названное МАРК (протеинкиназы, активируемые митогеном). МАРК активируют свои субстраты путем фосфорилирования в сериновых и треониновых остатках.
МАРК активируются другими киназами в ответ на широкий круг сигналов, включая факторы роста, провоспалительные цитокины, УФ облучение, эндотоксины и осмотические стрессы. После того как МАРК активируются, они активируют путем фосфорилирования другие киназы или белки, такие как факторы транскрипции, которые немедленно вызывают усиление или ослабление экспрессии специфического гена или группы генов.
Семейство МАРК включает киназы, такие как p38, ERK (внеклеточно регулируемая протеинкиназа) и JNK (C-Jun N-концевая киназа).
Киназа p38 играет решающую роль в клеточных реакциях на стресс и в схеме активирования в синтезе многочисленных цитокинов, особенно фактора некроза опухоли (TNF-б), интерлейкина-1 (IL-1), интерлейкина-6 (IL-6) и интерлейкина-8 (IL-8).
IL-1 и TNF-б продуцируются макрофагами и моноцитами и участвуют в опосредствовании процессов иммунорегуляции и других патофизиологических состояний. Например, повышенные уровни TNF-б связаны с воспалительными и аутоиммунными заболеваниями и с процессами, которые запускают разложение соединительных и костных тканей, такими как ревматоидный артрит, остеоартрит, диабет, воспалительные заболевания кишечника и сепсис.
Так, ингибиторы киназы p38 можно использовать для лечения или профилактики заболеваний, опосредованных цитокинами, такими как IL-1 и TNF-б, как было указано ранее. С другой стороны, было обнаружено, что ингибиторы p38 ингибируют другие провоспалительные белки, такие как IL-6, IL-8, интерферон-γ и GM-CSF (фактор, стимулирующий колонии гранулоцит-макрофагов). Кроме того, в процессе последних исследований было обнаружено, что ингибиторы p38 блокируют не только синтез цитокинов, но также каскад сигналов, которые они индуцируют, например индуцирование фермента циклооксигеназы-2 (COX-2).
Один из аспектов настоящего изобретения относится к новым соединениям общей формулы I
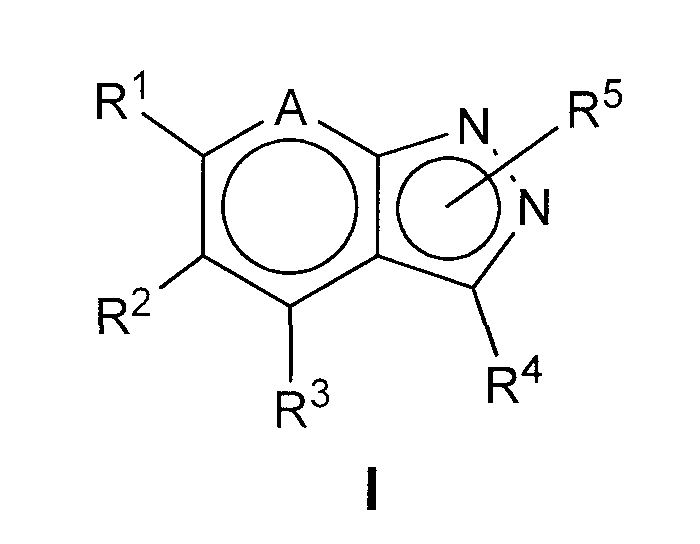
где A представляет N или N+O-;
R1 представляет фенил или Het, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb;
R2 представляет Het, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb;
R3 представляет H, Cy, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb, или R3 представляет С1-6алкил, необязательно замещенный одним или более заместителями, выбранными из Rb и Cy*, где Cy* может быть необязательно замещен одним или более заместителями, выбранными из Rb и Rc;
R4 представляет H, Ra, галоген, -ORа', -OCORa, -OSO2Ra, -OCONRaRa', -NO2, -CN, -CORa', -CO2Ra', -CONRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra', -NRa'CO2Ra, -NRa'SO2Ra, -SRa', -SORa, -SO2Ra или -SO2NRa'Ra';
R5 может быть присоединен к любому из 2 N пиразольного кольца формулы I и представляет H или Rf;
каждый Ra независимо представляет С1-6алкил, C2-6алкенил, C2-6алкинил или Cy, где группы С1-6алкил, C2-6алкенил или C2-6алкинил могут быть необязательно замещены одним или более заместителями, выбранными из Rb и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc;
каждый Ra' независимо представляет H или Ra;
каждый Rb независимо представляет галоген, -ORс', -OCORс, -OSO2Rс, -OCONRсRс', -NO2, -CN, -CORс', -CO2Rс', -CONRс'Rс', -CONRс'NRс'Rс', -NRс'Rс', -NRс'CORс', -NRс'CONRс'Rс', -NRс'CO2Rс, -NRс'SO2Rс, -SRс', -SORс, -SO2Rс, -SO2NRс'Rс', -C(NRс')NRс'Rс', -C(NSO2NRс'Rс')NRс'Rс', -C(NORс')Rс', -C(NNRс'Rс')Rс',
-NRс'C(NRс')NRс'Rс' или -NRс'C(NCN)NRc'Rc';
каждый Rc независимо представляет С1-6алкил, C2-6алкенил, C2-6алкинил или Cy, где все эти группы могут быть необязательно замещены одним или более заместителями Rd;
каждый Rc' независимо представляет H или Rc;
каждый Rd независимо представляет галоген, Re, -ORe', -OCORe, -OSO2Re,
-OCONReRe', -NO2, -CN, -CORe', -CO2Re', -CONRe'Re', -CONRe'NRe'Re', -NRe'Re', -NRe'CORe', -NRe'CONRe'Re', -NRe'CO2Re, -NRe'SO2Re, -SRe', -SORe, -SO2Re, -SO2NRe'Re',
-C(NRe')NRe'Re', -C(NSO2NRe'Re')NRe'Re', -C(NORe')Re', -C(NNRe'Re')Re',
-NRe'C(NRe')NRe'Re', -NRe'C(NCN)NRe'Re' или Cy необязательно замещен одним или более заместителями, выбранными из галогена, Re, -ORe', -OCORe, -OSO2Re,
-OCONReRe', -NO2, -CN, -CORe', -CO2Re', -CONRe'Re', -CONRe'NRe'Re', -NRe'Re', -NRe'CORe', -NRe'CONRe'Re', -NRe'CO2Re, -NRe'SO2Re, -SRe', -SORe, -SO2Re, -SO2NRe'Re',
-C(NRe')NRe'Re', -C(NSO2NRe'Re')NRe'Re', -C(NORe')Re', -C(NNRe'Re')Re',
-NRe'C(NRe')NRe'Re' и -NRe'C(NCN)NRe'Re';
каждый Re независимо представляет С1-6алкил или галоС1-6алкил;
каждый Re' независимо представляет H или Re;
Rf представляет С1-6алкил, C2-6алкенил, C2-6алкинил или Cy, где группы С1-6алкила, C2-6алкенила, C2-6алкинила могут быть необязательно замещены одним или более заместителями, выбранными из Rg и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rg и Ra;
каждый Rg независимо представляет галоген, -ORa', -OCORa, -OSO2Ra, -OCONRaRa', -NO2, -CN, -CORa', -CO2Ra', -CONRa'Ra', -CONRa'NRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra', -NRa'CO2Ra, -NRa'SO2Ra, -SRa', -SORa, -SO2Ra, -SO2NRa'Ra', -C(NRa')NRa'Ra', -C(NSO2NRa'Ra')NRa'Ra', -C(NORa')Ra', -C(NNRa'Ra')Ra',
-NRa'C(NRa')NRa'Ra' или -NRa'C(NCN)NRa'Ra';
Het в приведенных выше определениях представляет пиридин, пиразин, пиримидин, пиридазин, 2(1H)-пиридон, 2(1H)-пиразинон, 2(1H)-пиримидинон или 2(1H)-пиридазинон;
Cy или Cy* в приведенных выше определениях представляет частично ненасыщенное, насыщенное или ароматическое 3-7-членное моноциклическое или 8-12-членное бициклическое карбоциклическое кольцо, которое необязательно содержит от 1 до 4 гетероатомов, выбранных из N, S и O, которое необязательно содержит 1 или 2 оксогруппы, если кольцо является насыщенным или частично ненасыщенным, и где указанное кольцо или кольца могут быть связаны с остальной частью молекулы через атом углерода или азота.
Настоящее изобретение относится также к солям присоединения соединений настоящего изобретения, а также к их сольватам и пролекарственным формам. Пролекарственную форму определяют как любой предшественник соединения формулы I, который может быть превращен in vivo в соединение формулы I.
Некоторые соединения формулы I могут содержать хиральные центры, что приводит к существованию различных стереоизомеров. Настоящее изобретение относится к каждому из этих стереоизомеров, а также к их смесям. Кроме того, некоторые соединения настоящего изобретения могут быть в форме цис/транс- изомеров. Настоящее изобретение относится к каждому из геометрических изомеров и к их смесям.
Соединения формулы I являются селективными ингибиторами p38 киназы.
Так, другой аспект настоящего изобретения относится к фармацевтическим композициям, которые включают эффективное количество соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы и один или более из фармацевтически приемлемых эксципиентов.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для получения лекарства для лечения или профилактики заболеваний, опосредованных p38.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для получения лекарства для лечения или профилактики заболеваний, опосредованных цитокинами.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для получения лекарства для лечения или профилактики заболеваний, опосредованных TNF-б, IL-1, IL-6 и/или IL-8.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для получения лекарства для лечения или профилактики заболеваний, выбранных из иммунных, аутоиммунных и воспалительных заболеваний, сердечно-сосудистых заболеваний, инфекционных заболеваний, нарушений костной ресорбции, нейродегенеративных заболеваний, пролиферативных заболеваний и процессов, связанных с индуцированием циклооксигеназы-2.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для лечения или профилактики заболеваний, опосредованных p38.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для лечения или профилактики заболеваний, опосредованных цитокинами.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для лечения или профилактики заболеваний, опосредованных TNF-б, IL-1, IL-6 и/или IL-8.
Другой аспект настоящего изобретения относится к применению соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы для лечения или профилактики заболеваний, выбранных из иммунных, аутоиммунных и воспалительных заболеваний, сердечно-сосудистых заболеваний, инфекционных заболеваний, нарушений костной ресорбции, нейродегенеративных заболеваний, пролиферативных заболеваний и процессов, связанных с индуцированием циклооксигеназы-2.
Другой аспект настоящего изобретения относится к способу лечения или профилактики заболеваний, опосредованных p38, у нуждающегося в этом субъекта, особенно у человека, который включает введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы.
Другой аспект настоящего изобретения относится к способу лечения или профилактики заболеваний, опосредованных цитокинами, у нуждающегося в этом субъекта, особенно человека, который включает введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы.
Другой аспект настоящего изобретения относится к способу лечения или профилактики заболеваний, опосредованных TNF-б, IL-1, IL-6 и/или IL-8, у нуждающегося в этом субъекта, особенно человека, который включает введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы.
Другой аспект настоящего изобретения относится к способу лечения или профилактики заболеваний, выбранных из иммунных, аутоиммунных и воспалительных заболеваний, сердечно-сосудистых заболеваний, инфекционных заболеваний, нарушений костной ресорбции, нейродегенеративных заболеваний, пролиферативных заболеваний и процессов, связанных с индуцированием циклооксигеназы-2, у нуждающегося в этом субъекта, особенно человека, который включает введение указанному субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, сольвата или пролекарственной формы.
Другой аспект настоящего изобретения относится к способу получения соединения формулы I, который включает
(a) осуществление взаимодействия кетона формулы IV
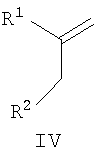
где R1 и R2 имеют указанные выше значения, с аминопиразолом формулы V и альдегидом формулы VI
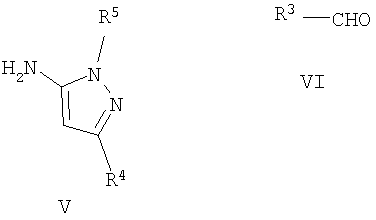
где R3, R4 и R5 имеют указанные выше значения; или
(b) если в соединении формулы I R5 представляет Н и R3 имеет значения, указанные для R1, осуществление взаимодействия кетона формулы IV или енолята формулы VII
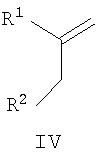
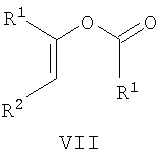
где R1 и R2 имеют указанные выше значения, с аминопиразолом формулы Va
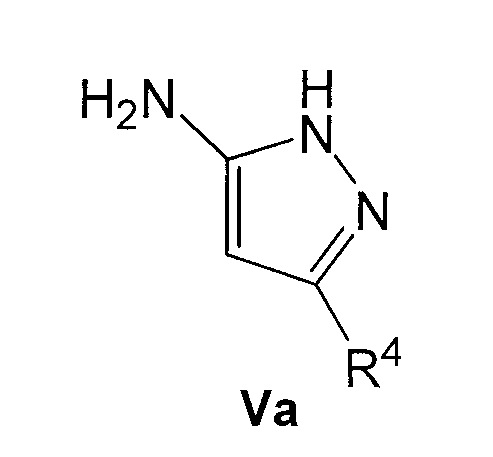
где R4 имеет указанные выше значения; или
(c) если в соединении формулы I R4 представляет NH2, обработку соединения формулы XIX
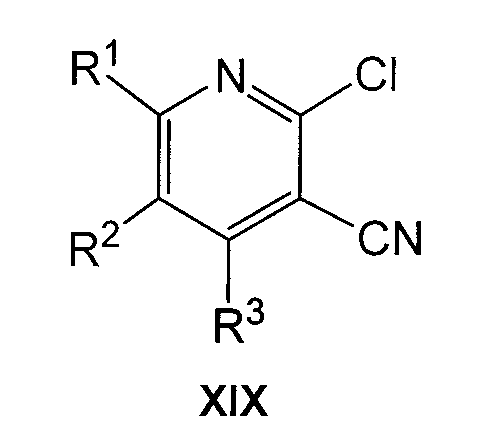
где R1, R2 и R3 имеют указанные выше значения, с гидразином формулы VIIIa
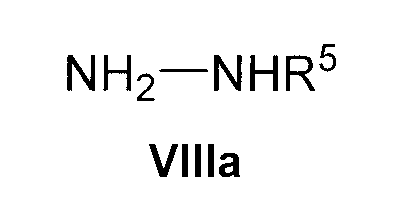
где R5 имеет указанные выше значения; или
(d) превращение, на одной или нескольких стадиях, соединения формулы I в другое соединение формулы I; и
(e) при желании, после предыдущих стадий, осуществление взаимодействия соединения формулы I с основанием или кислотой для получения соответствующей соли.
В предшествующих определениях термин «С1-6алкил» как группа или часть группы означает неразветвленную или разветвленную алкильную цепочку, которая содержит от 1 до 6 атомов углерода. Примеры включают, наряду с другими, группы метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, неопентила и гексила.
Термин «галоС1-6алкильная группа» означает группу, образовавшуюся в результате замены одного или более атомов водорода в С1-6алкильной группе одним или более атомов галогенов (т.е. фтора, хлора, брома или йода), которые могут быть одинаковы или различны. Примеры включают, наряду с другими, трифторметил, фторметил, 1-хлорэтил, 2-хлорэтил, 1-фторэтил, 2-фторэтил, 2-бромэтил, 2-йодоэтил, 2,2,2-трифторэтил, пентафторэтил, 3-фторпропил, 3-хлорпропил, 2,2,3,3-тетрафторпропил, 2,2,3,3,3-пентафторпропил, гептафторпропил, 4-фторбутил, нонафторбутил, 5-фторпентил и 6-фторгексил.
Термин «С2-6алкенил» как группа или часть группы означает неразветвленную или разветвленную алкильную цепочку, которая содержит от 2 до 6 атомов углерода и которая также содержит одну или более двойных связей. Примеры включают, наряду с другими, группы этенила, 1-пропенила, 2-пропенила, изопропенила, 1-бутенила, 2-бутенила, 3-бутенила, 1,3-бутадиенила, 1-пентенила, 2-пентенила, 3-пентенила, 4-пентенила, 1-гексенила, 2-гексенила, 3-гексенила, 4-гексенила и 5-гексенила.
Термин «С2-6алкинил» как группа или часть группы означает неразветвленную или разветвленную алкильную цепочку, которая содержит от 2 до 6 атомов углерода и которая также содержит одну или более тройных связей. Примеры включают группы этинила, 1-пропинила, 2-пропинила, 1-бутинила, 2-бутинила, 3-бутинила, 1,3-бутадиинила, 1-пентинил, 2-пентинила, 3-пентинила, 4-пентинила, 1-гексинил, 2-гексинила, 3-гексинила, 4-гексинила и 5-гексинила.
Термин «оксогруппа» означает карбонильную группу (-CO-).
Галогеновый радикал означает атомы фтора, хлора, брома или йода.
Het в определениях R1 и R2 означает пиридин, пиразин, пиримидин, пиридазин, 2(1H)-пиридон, 2(1Н)-пиразинон, 2(1H)-пиримидинон или 2(1H)-пиридазинон. Как было указано выше, эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, которые могут быть расположены в любом из возможных положений Het группы и могут быть связаны с остальной частью молекулы через любой возможный атом углерода или атом азота.
Термин «Cy» или «Cy*» как группа или часть группы означает 3-7-членную моноциклическую карбоциклическую группу или 8-12-членную бициклическую карбоциклическую группу, которая может быть частично ненасыщенной, насыщенной или ароматической и которая может необязательно содержать от 1 до 4 гетероатомов, выбранных из N, S и O. Если группа Cy или Cy* является насыщенной или частично ненасыщенной, она может необязательно содержать 1 или 2 оксогруппы. Кольцо или кольца Cy или Cy* могут быть замещены, как было указано в определении общей формулы I, причем эти заместители могут быть расположены в любом доступном положении и могут быть связаны с остальной частью молекулы через любой доступный атом углерода или азота. Примеры Cy или Cy* групп включают, наряду с другими, циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, азиридин, оксиран, оксетан, имидазолидин, изотиазолидин, изоксазолидин, оксазолидин, пиразолидин, пирролидин, тиазолидин, диоксан, морфолин, пиперазин, пиперидин, пиран, трагидропиран, азепин, оксазин, оксазолин, пирролин, тиазолин, пиразолин, имидазолин, изоксазолин, изотиазолин, фенил, нафтил, 1,2,4-оксадиазол, 1,2,4-тиадиазол, 1,3,4-оксадиазол, 1,3,4-тиадиазол, фуран, имидазол, изоксазол, изотиазол, оксазол, пиразол, пиррол, тиазол, тиофен, 1,2,3-триазол, 1,2,4-триазол, пиразин, пиридазин, пиридин, пиримидин, бензимидазол, бензофуран, бензотиазол, бензотиофен, имидазопиразин, имидазопиридазин, имидазопиридин, имидазопиримидин, индазол, индол, изоиндол, изохинолин, тетрагидроизохинолин, нафтиридин, пиразолопиразин, пиразолопиридин, пиразолопиримидин, пурин, хиназолин, хинолин, хиноксалин, циклобутанон, циклопентанон, циклогексанон, циклогептанон, пирролидин-2-он, пиперидин-2-он, пиперидин-4-он, 2(1H)-пиридон, 2(1H)-пиразинон, 2(1H)-пиримидинон, 2(1H)-пиридазинон и фталимид.
Термин «гетероарил» как группа или часть группы означает ароматическое 5- или 6-членное моноциклическое или 8-12-членное бициклическое кольцо, которое содержит от 1 до 4 гетероатомов, выбранных из N, S и О, и которое может быть необязательно замещено, как было указано, во всех случаях, когда используют этот термин, где указанные заместители могут быть расположены в любом доступном положении. Гетероарильная группа может быть связана с остальной частью молекулы через любой подходящий атом углерода или азота. Примеры гетероарильных групп включают, наряду с другими, 1,2,4-оксадиазол, 1,2,4-тиадиазол, 1,3,4-оксадиазол, 1,3,4-тиадиазол, фуран, имидазол, изоксазол, изотиазол, оксазол, пиразол, пиррол, тиазол, тиофен, 1,2,3-триазол, 1,2,4-триазол, пиразин, пиридазин, пиридин, пиримидин, бензимидазол, бензофуран, бензотиазол, бензотиофен, имидазопиразин, имидазопиридазин, имидазопиридин, имидазопиримидин, индазол, индол, изоиндол, изохинолин, нафтиридин, пиразолопиразин, пиразолопиридин, пиразолопиримидин, пурин, хиназолин, хинолин и хиноксалин.
В приведенных выше определениях Het, гетероарил, Cy и Cy*, термины предполагают, что радикал получен из соответствующего цикла.
В приведенные выше определения гетероарила, Cy и Cy*, когда специфические примеры относятся к бициклу в общем смысле термина, включены все возможные положения атомов. Например, предполагают, что термин «пиразолопиридин» включает группы, такие как 1H-пиразоло[3,4-b]пиридин, пиразоло[1,5-a]пиридин, 1H-пиразоло[3,4-c]пиридин, 1Н-пиразоло[4,3-c]пиридин и 1H-пиразоло[4,3-b]пиридин; предполагают, что термин «имидазопиразин» включает группы, такие как 1Н-имидазо[4,5-b]пиразин, имидазо[1,2-a]пиразин и имидазо[1,5-a]пиразин, и предполагают, что термин «пиразолопиримидин» включает группы, такие как 1H-пиразоло[3,4-d]пиримидин, 1H-пиразоло[4,3-d]пиримидин, пиразоло[1,5-a]пиримидин и пиразоло[1,5-c]пиримидин.
Выражение "необязательно замещенный одним или более" означает, что группа может быть замещена одним или более, предпочтительно 1, 2, 3 или 4 заместителями, при условии, что в этой группе имеются 1, 2, 3 или 4 положения, в которые может быть введен заместитель.
В приведенных выше определениях, если указано, что R5 могут быть расположены на любом из 2 N пиразольного кольца, это означает, что R5 может находиться у N в положении 1 кольца или у N в положении 2. Так, соединения формулы I включают следующие два типа соединений:
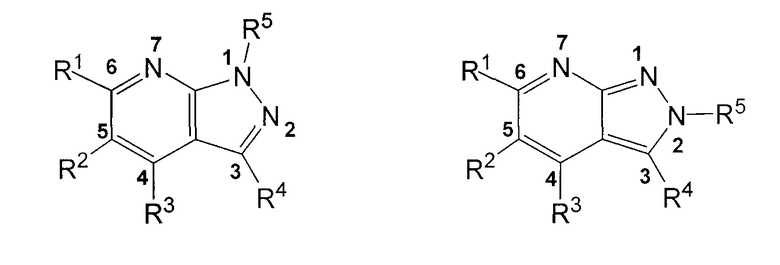
Воплощением настоящего изобретения являются соединения формулы I, как раскрыто выше, где A представляет N.
Другим воплощением настоящего изобретения являются соединения формулы I, где A представляет N и R5 может располагаться у любого из 2 N пиразольного кольца формулы I и представляет H или Ra.
Другим воплощением настоящего изобретения являются соединения формулы I, где если R3 и R5 оба представляют H и R2 представляет Het, необязательно замещенный одним или более заместителями, выбранными из галогена, -CN, -CF3, -OH, -NO2, -OR6, -NR6R6, -OCF3, С1-6алкила, С2-6алкенила, С2-6алкинила и Cy, где Cy может быть необязательно замещен одним или более заместителями, выбранными из Rb и Rc, и где R6 представляет С1-6алкил, тогда R4 не может представлять -NRa'CORa,
-NHCONHRа или -NHCO2Ra.
Другим воплощением настоящего изобретения являются соединения формулы I, где если R3 и R5 оба представляют H, тогда R4 не может представлять -NRa'CORa, -NHCONHRа или -NHCO2Ra.
Другим воплощением настоящего изобретения являются соединения формулы I, где A представляет N; R4 представляет H, Ra, галоген, -ORа', -OCORа, -OSO2Ra, -OCONRaRa', -NO2, -CN, -CORa', -CO2Ra', -CONRa'Ra', -NRa'Ra', -NRa'SO2Ra, -SRa', -SORa, -SO2Ra или -SO2NRa'Ra'; и R5 может располагаться у любого из 2 N пиразольного кольца формулы I и представляет H или Ra.
Другим воплощением настоящего изобретения являются соединения формулы I, где R1 представляет пиридин или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из галогена, -ORс', -NO2, -CN, -CONRс'Rс', -NRc'Rc' и С1-6алкила, необязательно замещенного одним или более заместителями, выбранными из галогена, -ORс', -CORс', -NRс'Rс' и -NRс'CORс'.
Другим воплощением настоящего изобретения являются соединения формулы I, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из галогена и галоС1-6алкила.
Другим воплощением настоящего изобретения являются соединения формулы I, где R2 представляет пиридин или пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R2 представляет 4-пиридин или 4-пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R2 представляет 4-пиридин или 4-пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -ORс', -NRс'Rс', -SRc' и -SO2Rс.
Другим воплощением настоящего изобретения являются соединения формулы I, где R2 представляет 4-пиридин.
Другим воплощением настоящего изобретения являются соединения формулы I, где R2 представляет 4-пиримидин, замещенный -NRс'Rс', где в R2:
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет С1-6алкил, необязательно замещенный одним или более заместителями, выбранными из Cy и -ORe'; и
каждый Re' независимо представляет H или Re.
Другим воплощением настоящего изобретения являются соединения формулы I, где R3 представляет H или Cy, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R3 представляет H, гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R3 представляет гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb.
Другим воплощением настоящего изобретения являются соединения формулы I, где R3 представляет моноциклический гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -NO2, -ORс', С1-6алкила и Cy, где С1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из Rb и Cy*, и любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc.
Другим воплощением настоящего изобретения являются соединения формулы I, где R3 представляет моноциклический гетероарил или фенил, где все эти группы может быть необязательно замещены одним или более заместителями, выбранными из галогена, -NO2, -ORс', С1-6алкила, галоС1-6алкила и Cy; и где в R3:
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет С1-6алкил, необязательно замещенный одним или более заместителями Rd; и
каждый Rd независимо представляет Cy.
Другим воплощением настоящего изобретения являются соединения формулы I, где R4 представляет H, Ra, галоген, -ORa', -CN, -CONRa'Ra, -NRa'Ra' или -NRa'CORa'.
Другим воплощением настоящего изобретения являются соединения формулы I, где R4 представляет H.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 представляет H или R5 представляет Rf и расположен у N в положении 2 пиразольного кольца.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 представляет Rf и расположен у N в положении 2 пиразольного кольца.
Другим воплощением настоящего изобретения являются соединения формулы I, где Rf представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или С2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rg и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rg и Ra.
Другим воплощением настоящего изобретения являются соединения формулы I, где Rf представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или С2-6алкенил могут быть необязательно замещены одним или более заместителями, выбранными из Rg и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из R9 и Ra, где каждый Rg независимо представляет галоген, -ORa', -CORa', -CO2Ra', -CONRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra', -NRa'SO2Ra', -SRa', -SORa' или -SO2Ra'.
Другим воплощением настоящего изобретения являются соединения формулы I, где Rf представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или С2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rg и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rg и Ra, где в Rf:
каждый Rg независимо представляет -ORa', -CORa', -CONRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra', -NRa'SO2Ra', -SORa' или -SO2Ra';
каждый Ra' независимо представляет H или Ra;
каждый Ra независимо представляет Cy или С1-6алкил, где С1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из Rb и Cy*, и любой из группы Cy или Cy* может быть необязательно замещен одним или более заместителями, выбранными из Rb и Rc;
каждый Rb независимо представляет -ORс', -NRс'Rс', -CN, -CORс', -SRс' или -SORc';
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет С1-6алкил или Cy, где все эти группы могут быть необязательно замещены одним или более Rd.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 расположен у N в положении 2 пиразольного кольца и представляет Rf, где Rf представляет С1-6алкил, необязательно замещенный одним или более заместителями, выбранными из -ORa', -CORa', -CONRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra'
-NRa'SO2Ra', и Cy* необязательно замещен одним или более заместителями, выбранными из Ra; где в Rf:
каждый Ra' независимо представляет H или Ra;
каждый Ra независимо представляет Cy или С1-6алкил, где С1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из Rb и Cy*, и
любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc;
каждый Rb независимо представляет -ORс', -NRс'Rс', -CN, -CORс', -SRс' или -SORс';
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет С1-6алкил или Cy, где все эти группы могут быть необязательно замещены одним или более из Rd; и
каждый Rd независимо представляет -ORe'.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 представляет H или R5 представляет Ra и расположен у N в положении 2 пиразольного кольца.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 представляет Ra и расположен у N в положении 2 пиразольного кольца.
Другим воплощением настоящего изобретения являются соединения формулы I, где Ra в R5 представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или
C2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rb и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc.
Другим воплощением настоящего изобретения являются соединения формулы I, где Ra в R5 представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или
C2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rb и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc,
где каждый Rb в R5 независимо представляет галоген, -ORс', -CORс', -CO2Rс', -CONRс'Rс', -NRс'Rс', -NRс'CORс', -NRс'CONRс'Rс', -NRc'SO2Rс', -SRс', -SORс' или -SO2Rс'.
Другим воплощением настоящего изобретения являются соединения формулы I, где Ra в R5 представляет С1-6алкил, С2-6алкенил или Cy, где группы С1-6алкила или
C2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rb и Cy*, и где любая из групп Cy или Cy* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc, где в R5:
каждый Rb независимо представляет -ORс', -CORс', -CONRс'Rс', -NRс'Rс', -NRс'CORс', -NRс'CONRс'Rс', -NRс'SO2Rс', -SORс' или -SO2Rс';
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет Cy или С1-6алкил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Rd;
каждый Rd независимо представляет Re, -ORе', -NRe'Re', -CN, -CORe', -SRe', -SORe' или Cy.
Другим воплощением настоящего изобретения являются соединения формулы I, где R5 расположен у N в положении 2 пиразольного кольца и представляет Ra, где Ra в R5 представляет С1-6алкил, необязательно замещенный одним или более заместителями, выбранными из -ORс', -CORс', -CONRс'Rс', -NRс'Rс', -NRс'CORс', -NRc'CONRc'Rc', -NRc'SO2Rc', и Cy* необязательно замещен одним или более заместителями, выбранными из Rc; где в R5:
каждый Rc' независимо представляет H или Rc;
каждый Rc независимо представляет Cy или С1-6алкил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Rd;
каждый Rd независимо представляет -ORe', -NRe'Re', -CN, -CORe', -SRe', -SORe' или Cy;
каждый Re' независимо представляет H или Re; и
каждый Re независимо представляет С1-6алкил.
Кроме того, все возможные комбинации вышеуказанных вариантов также составляют часть настоящего изобретения.
Соединения настоящего изобретения могут содержать один или более из основных азотов и могут поэтому образовывать соли с органическими или неорганическими кислотами, которые также составляют часть настоящего изобретения. Примеры таких солей включают соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, азотная кислота, перхлорная кислота, серная кислота или фосфорная кислота, и соли органических кислот, таких как метансульфоновая кислота, трифторметансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, фумаровая кислота, щавелевая кислота, уксусная кислота или яблочная кислота, наряду с другими. Соединения настоящего изобретения могут содержать один или более кислотных протонов и поэтому могут также образовывать соли с основаниями, которые также составляют часть настоящего изобретения. Примеры таких солей включают соли неорганических катионов, таких как натрий, калий, кальций, магний, литий, алюминий, цинк и т.д.; и соли, образованные с фармацевтически приемлемыми аминами, такими как аммиак, алкиламины, гидроксилалкиламины, лизин, аргинин, N-метилглюкамин, прокаин и т.п. Не существует ограничений относительно типа солей, которые можно использовать, при условии, что они являются фармацевтически приемлемыми, когда их используют для терапевтических целей. Соли можно получать, обрабатывая соединение формулы I достаточным количеством нужной кислоты или основания, чтобы получить соль обычным способом. Соединения формулы I и их соли отличаются некоторыми физическими свойствами, но для целей настоящего изобретения они эквивалентны.
Некоторые из соединений настоящего изобретения могут существовать в сольватированной форме, включая гидратные формы. Вообще, для целей настоящего изобретения сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобные, эквивалентны несольватированным формам.
Некоторые из соединений настоящего изобретения могут существовать в виде нескольких диастереоизомеров и/или нескольких оптических изомеров. Диастереоизомеры можно разделить обычными способами, такими как разделение с помощью хроматографии или фракционная кристаллизация. Оптические изомеры можно разделить обычными способами оптического разрешения для получения оптически чистых изомеров. Такое разрешение можно осуществить, используя любые хиральные синтетические промежуточные соединения или продукты общей формулы I. Оптически чистые изомеры можно также получить индивидуально, используя энантиоспецифический синтез. Настоящее изобретение включает все изомеры и их смеси (например, рацемические смеси), независимо от того, получены они в результате синтеза или в результате физического смешивания.
Кроме того, некоторые соединения настоящего изобретения могут существовать в виде цис/транс-изомеров. Настоящее изобретение включает каждый из геометрических изомеров и их смеси.
Соединения формулы I можно получить раскрытыми далее способами. Как должно быть очевидно специалистам, конкретные способы, используемые для получения определенного соединения, могут меняться в зависимости от его химического строения. Кроме того, для некоторых раскрытых далее способов может оказаться необходимым или желательным защитить реакционноспособные или лабильные группы с помощью обычных защитных групп. Как природа таких защитных групп, так и способы их введения или удаления хорошо известны и составляют часть известного уровня техники (см. например, Greene T.W. and Wuts P.G.M, "Protective Groups in Organic Synthesis", John Wiley & Sons, 3rd edition, 1999). В качестве примера защитных групп аминофункции можно использовать трет-бутоксикарбонил (Boc) или бензил (Bn). Карбоксильные группы можно защитить, например, в форме С1-6алкиловых сложных эфиров или арилалкиловых сложных эфиров, таких как бензил, тогда как гидроксильные группы можно защитить, например, тетрагидропиранилом (THP). Если только присутствует защитная группа, далее понадобится стадия удаления этой защитной группы, которую можно осуществить в стандартных условиях органического синтеза, таких, которые раскрыты в вышеуказанной ссылке.
Соединения формулы I обычно можно получить, осуществляя взаимодействие соединений формулы IV с аминопиразолом формулы V и альдегидом формулы VI, как представлено на следующей схеме:
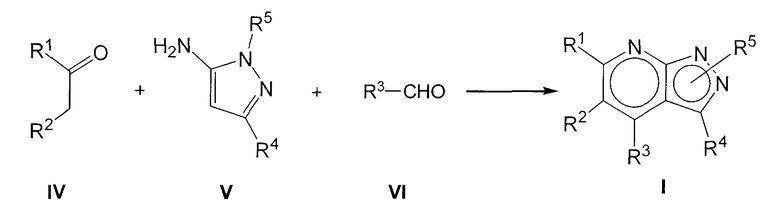
где R1, R2, R3, R4 и R5 имеют значения, указанные для общей формулы I. Эту реакцию осуществляют предпочтительно в присутствии неорганической кислоты, такой как хлористоводородная кислота, в подходящем полярном растворителе, таком как 2-метоксиэтанол или этанол, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Соединения формулы I, где R5 представляет R5* (т.е. соединения формулы Ia и Ib), обычно получают, осуществляя взаимодействие соединений формулы I, где R5 представляет H (т.е. соединения формулы Ic), с алкилирующим агентом формулы R5*-X (II), как представлено на следующей схеме:
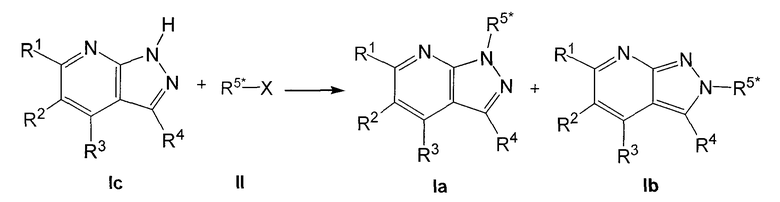
где R5* представляет Ra или Rf, R1, R2, R3, R4, Ra и Rf имеют значения, указанные для общей формулы I, и X представляет уходящую группу, например алкилсульфонат или арилсульфонат, такой как мезилат или тозилат, или галоген, такой как Cl, Br или I. Эту реакцию осуществляют в присутствии основания, такого как КОН, К2СО3 или NaH, в подходящем растворителе, таком как, например, ацетон, толуол, диметилформамид, 1,2-диметоксиэтан или диглим, и при нагревании, предпочтительно при кипячении с обратным холодильником. В случае использования неполярных растворителей, таких как толуол, эту реакцию можно вести в присутствии связывающего катион агента, такого как краун эфир 18-С-6, или агента переноса фазы, такого как соль тетраалкиламмония.
Соединения формулы Ia и Ib, где Ra представляет -СН2OH, можно получить, осуществляя взаимодействие соединений формулы Ic с формальдегидом в подходящем полярном растворителе, таком как вода, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Соединения формулы Ia и Ib, где Ra представляет необязательно замещенный фенил или необязательно замещенный гетероарил, можно получить, осуществляя взаимодействие соединений формулы Ic с бороновой кислотой формулы Ra-B(OH)2 (III), где Ra представляет необязательно замещенный фенил или гетероарил, в присутствии основания, такого как пиридин и/или триэтиламин, и в присутствии катализатора, такого как ацетат меди (II), в подходящем растворителе, таком как апротонный растворитель, такой как дихлорметан.
Соединения формулы II и III коммерчески доступны, подробно описаны в литературе или их можно получить аналогично описанным способам, и при необходимости их можно защитить обычными способами.
Соединения формулы I, где R5 представляет Н и R3 имеет значения, указанные для
R1 (т.е. соединение Id), можно также получить, осуществляя взаимодействие соединений формулы IV с аминопиразолом формулы Va, как представлено на следующей схеме:
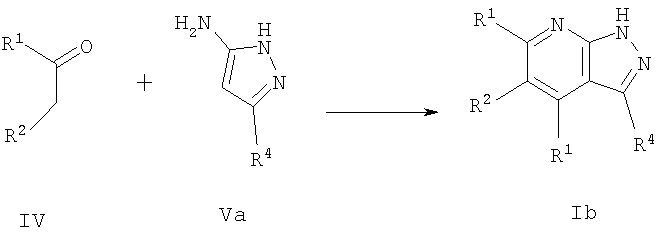
или, в другом варианте, осуществляя взаимодействие соединения формулы VII с соединением формулы Va
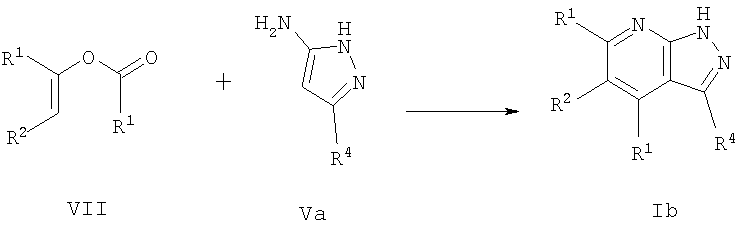
где R1, R2 и R4 имеют значения, указанные для общей формулы I. Эту реакцию осуществляют предпочтительно в присутствии неорганической кислоты, такой как хлористоводородная кислота, в подходящем полярном растворителе, таком как 2-метоксиэтанол или этанол, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Аминопиразолы формулы V и Va и альдегиды формулы VI коммерчески доступны и могут быть защищены обычным способом. В другом варианте соединения формулы Va можно удобно получить, осуществляя взаимодействие соединения формулы VIII с соединением формулы IX, как представлено на следующей схеме:
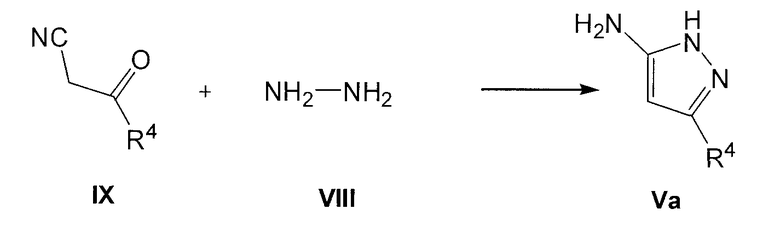
где R4 имеет значения, указанные для общей формулы I. Эту реакцию осуществляют в подходящем полярном растворителе, таком как этанол, и при нагревании, предпочтительно при кипячении с обратным холодильником. Соединения формулы V можно также получить этим способом, исходя из соединения формулы IX и соединения формулы NH2-NHR5 (VIIIa).
Соединения формулы IX коммерчески доступны и могут быть защищены обычным способом, или их удобно получить, осуществляя взаимодействие соединения формулы X
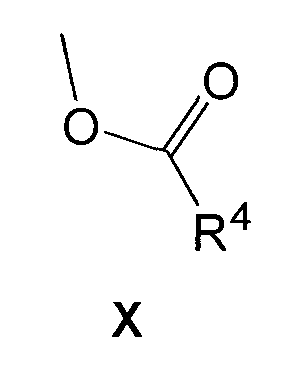
с ацетонитрилом, в присутствии основания, такого как бутиллитий, в подходящем растворителе, таком как тетрагидрофуран, и при соответствующей температуре, предпочтительно при температуре -78°C.
Сложные эфиры формулы X коммерчески доступны, или их можно получить подробно описанными в литературе способами, и их можно защитить обычными способами.
Енольные эфиры формулы VII можно удобно получить, осуществляя взаимодействие кетона формулы IV с соединением формулы R1-COY (XI), где Y представляет галоген, предпочтительно Cl, в присутствии основания, такого как NaH, в подходящем полярном растворителе, таком как диметилформамид.
Соединения формулы XI коммерчески доступны, или их можно получить, используя обычные реакции, из соответствующих карбоновых кислот формулы R1-CO2H (XII).
Соединения формулы XII коммерчески доступны, или их можно получить способами, подробно раскрытыми в литературе, и их можно защитить обычным способом.
Соединения формулы IV можно получить, осуществляя взаимодействие соединения формулы R1-H (XIII) с соединением формулы XIV
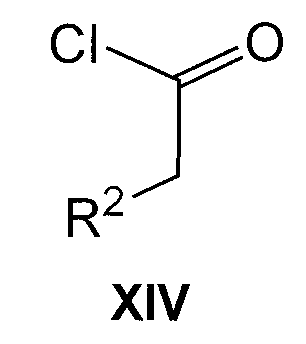
где R1 и R2 имеют значения, указанные для общей формулы I, в присутствии кислоты Льюиса, такой как AlCl3, в подходящем галогенированном растворителе, таком как дихлорметан.
Соединения формулы XIV коммерчески доступны, или их можно легко получить из соответствующей карбоновой кислоты в соответствии с обычными процедурами.
В другом варианте соединения формулы IV можно получить обычным способом, осуществляя взаимодействие соединения формулы R2-CH3 (XV) с соединением формулы R1-CN (XVI), где R1 и R2 имеют значения, указанные для общей формулы I, в присутствии основания, такого как литийдиизопропиламид, образующегося из бутиллития и N,N-диизопропиламина, в апротонном растворителе, таком как тетрагидрофуран, и при охлаждении, предпочтительно до -78°C.
В другом варианте соединения формулы IV можно получить обычным способом, осуществляя взаимодействие соединения формулы R2-CH3 (XV) с соединением формулы R1-CO2R6 (XVII), где R1 и R2 имеют значения, указанные для общей формулы I, и R6 представляет С1-6алкил, в присутствии основания, такого как бис(триметилсилил)амид натрия или гидрид натрия, в апротонном полярном растворителе, таком как тетрагидрофуран или диметилформамид, и при соответствующей температуре, предпочтительно при комнатной температуре.
Соединения XIII, XV, XVI и XVII коммерчески доступны, или их можно получить способами, подробно раскрытыми в литературе.
В другом варианте соединения формулы IV можно получить обычным способом, осуществляя взаимодействие соединения формулы R2-CH3 (XV) с соединением формулы XVIII в условиях, раскрытых выше для реакции соединения формулы XV с соединением формулы XVI.
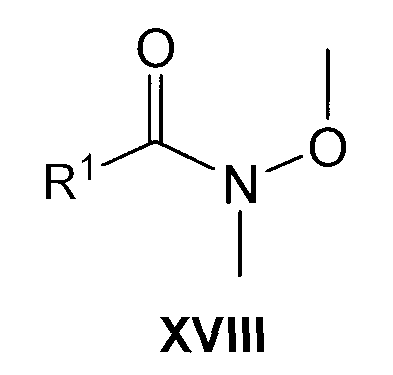
Соединения формулы XVIII можно получить обычным способом, осуществляя взаимодействие соединения формулы XI с N,O-диметилгидроксиламингидрохлоридом в присутствии основания, такого как триэтиламин, в подходящем галогенированном растворителе, таком как дихлорметан, и при охлаждении, предпочтительно до 0°C.
В другом варианте, соединения формулы XVIII можно получить, осуществляя взаимодействие соединения формулы XII с N,O-диметилгидроксиламингидрохлоридом в присутствии подходящего конденсирующего агента, такого, как, например,
N-(3-диметиламинопропил)-N'-этилкарбодиимид или дициклогексилкарбодиимид, необязательно в присутствии 1-гидроксибензотриазола или в присутствии подходящего основания, такого как пиридин, в подходящем растворителе, таком как диметилформамид.
Соединения формулы I можно также получить из соединения формулы XIX, как представлено на схеме далее:
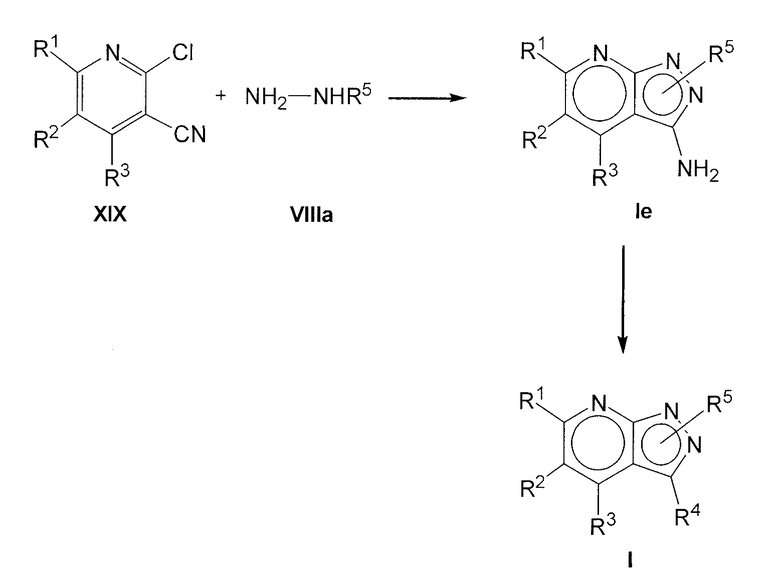
где R1, R2, R3, R4 и R5 имеют значения, указанные для соединений общей формулы I. В результате реакции соединения XIX с соединением формулы VIIIa получают соединение формулы I, где R4 = NH2 (Ie). Эту реакцию осуществляют в подходящем растворителе, таком как этанол, и при нагревании, предпочтительно при кипении с обратным холодильником. Исходя из этих соединений формулы I, где R4=NH2, можно получить соединения формулы I, где R4 отличается от NH2, в результате реакций взаимопревращения, что будет более подробно раскрыто далее. Этот способ пригоден для получения соединений формулы I, где R3 представляет H, необязательно замещенный С1-6алкилом или Cy, отличающимся от R1.
Соединения формулы VIIIa коммерчески доступны, и их можно защитить обычным способом.
Соединения формулы XIX можно получить обычным способом, осуществляя взаимодействие соединения формулы XX
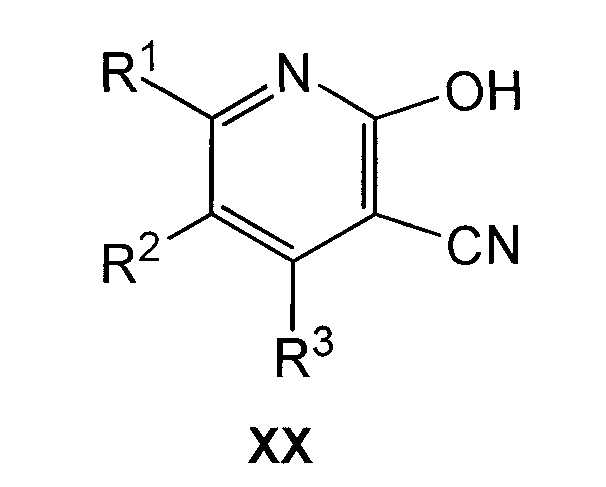
где R1, R2 и R3 имеют значения, указанные для общей формулы I, с хлорирующим агентом, таким как POCl3 или PCl3, без растворителя или в подходящем растворителе, таком как диметилформамид, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Соединения формулы XX обычно получают, осуществляя взаимодействие соединения формулы XXI с 2-цианоацетамидом, как представлено на следующей схеме:
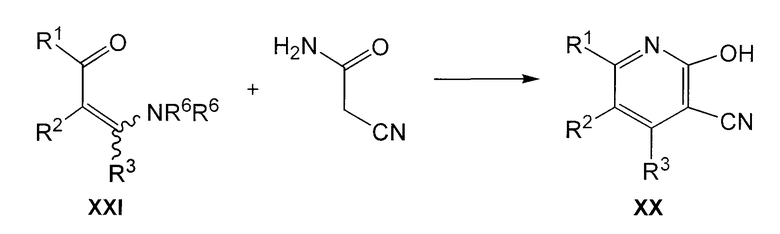
где R1, R2 и R3 имеют значения, указанные для общей формулы I, и каждый R6 независимо представляет С1-6алкил. Эту реакцию осуществляют в присутствии основания, такого как метоксид натрия, в подходящем растворителе, таком как диметилформамид, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Соединения формулы XXI можно получить обычным способом, осуществляя взаимодействие соединения формулы IV с соединением формулы XXII
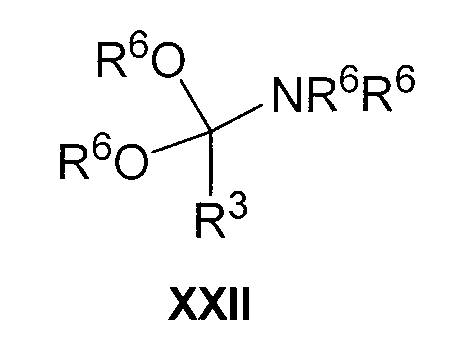
где R3 и R6 имеют указанные выше значения, в подходящем растворителе, таком как тетрагидрофуран.
Соединения формулы XXII коммерчески доступны, или их можно получить раскрытыми в литературе способами, например, осуществляя взаимодействие амида формулы XXIII
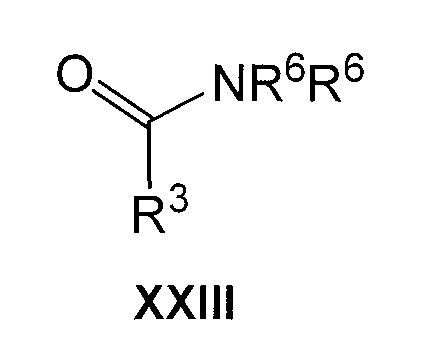
с триэтилоксонийтетрафторборатом в присутствии основания, такого как этоксид натрия, в подходящем растворителе, таком как этанол или смесь этанол-диэтиловый эфир. В другом варианте соединения настоящего изобретения можно также получить в результате взаимопревращения другого соединения в соединение формулы I, в одну или несколько стадий, используя хорошо известные реакции органической химии в указанных стандартных условиях эксперимента.
Так, R4 можно превратить в другой R4, получая новое соединение формулы I. Например, R4 = H можно превратить в R4 = Br, осуществляя взаимодействие с соответствующим бромирующим агентом, таким как Br2, в подходящем растворителе, таком как хлороформ, и при соответствующей температуре в интервале от комнатной температуры до температуры кипения растворителя;
или R4 = H можно превратить в R4 = Cl, осуществляя взаимодействие с соответствующим хлорирующим агентом, таким как N-хлорсукцинимид, в подходящем растворителе, таком как диметилформамид, при соответствующей температуре в интервале от комнатной температуры до температуры кипения растворителя;
или R4 = NH2 можно превратить в R4 = галоген в результате образования диазониевой соли с NaNO2 с последующим осуществлением взаимодействия с галогенидом меди, таким как CuBr или CuCl, в присутствии кислоты, такой как, например, HBr или HCl;
или R4 = NH2 можно превратить в R4 = H, образуя диазониевую соль с NaNO2 с последующим осуществлением взаимодействия с H3PO2, в подходящем растворителе, таком как вода;
или R4 = галоген можно превратить в R4 = CN, осуществляя взаимодействие с цианидной солью, такой как CuCN, в подходящем растворителе, таком как N-метилпирролидон, и при нагревании, предпочтительно при кипячении с обратным холодильником.
Другие превращения R4, которые можно также применить к R5 и также к заместителям R1, R2 и R3 групп для получения других соединений формулы I, включают, например:
превращение CN в CONH2 в результате гидролиза основанием, таким как KOH, в подходящем растворителе, таком как трет-бутанол, и при нагревании, предпочтительно при кипячении с обратным холодильником;
превращение CN в CH2NH2 в результате осуществления взаимодействия с восстанавливающим агентом, таким как LiAlH4, в подходящем растворителе, таком как диэтиловый эфир;
превращение группы карбоновой кислоты в сложный эфир или амид в результате осуществления взаимодействия со спиртом или амином соответственно в присутствии активирующего агента, такого как N,N'-дициклогексилкарбодиимид и
4-диметиламинопиридин, и в подходящем растворителе, таком как диэтиловый эфир;
превращение сложноэфирной группы в карбоксильную группу в результате гидролиза в присутствии основания, такого как KOH, в подходящем растворителе, таком как этанол;
превращение OH, SH или NH2 в OR, SR и NHR или NRR соответственно в результате осуществления взаимодействия алкилирующего агента R-X, где R представляет Ra, Rc, Re или Rf и X представляет галоген, предпочтительно хлор или бром, в присутствии основания, такого как триэтиламин, гидроксид натрия, карбонат натрия, карбонат калия или гидрид натрия, в подходящем растворителе, таком как дихлорметан, хлороформ, диметилформамид, этанол или бутанол, при температуре в интервале от комнатной температуры до температуры кипения растворителя;
в другом варианте NHR можно превратить в NCH3R, где R представляет Ra, Rc, Re или Rf, осуществляя взаимодействие с формальдегидом в кислотной среде, такой как муравьиная кислота, и при нагревании, предпочтительно при кипячении с обратным холодильником;
превращение амина в амид в результате осуществления взаимодействия карбоновой кислоты в присутствии соответствующего конденсирующего агента, такого как N-(3-диметиламинопропил)-N'-этилкарбодиимид или дициклогексилкарбодиимид, необязательно в присутствии 1-гидроксибензотриазола, или в присутствии соответствующего основания, такого как пиридин, в подходящем растворителе, таком как диметилформамид; или в другом варианте амин можно превратить в амид, осуществляя взаимодействие с ацилхлоридом в пиридине или в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, и при охлаждении предпочтительно до 0°C;
превращение амина в мочевину или карбамат в результате двух последовательных стадий, которые включают осуществление взаимодействия амина с активирующим агентом, таким как трифосген, в присутствии основания, такого как диизопропилэтиламин, триэтиламин или N-метилморфолин, в подходящем растворителе, таком как ацетонитрил или галогенированный углеводород, такой как хлороформ или дихлорметан, и затем осуществляя взаимодействие полученного соединения со вторым амином в случае мочевины или со спиртом в случае карбамата в подходящем растворителе, таком как растворитель, используемый на первой стадии; или в другом варианте амин можно превратить в мочевину или карбамат, осуществляя взаимодействие с изоцианатом или хлорформиатом соответственно в подходящем растворителе, таком как диметилформамид, при соответствующей температуре, предпочтительно при комнатной температуре;
превращение амина в сульфонамид в результате осуществления взаимодействия с сульфонилгалогенидом, таким как сульфонилхлорид, необязательно в присутствии основания, такого как 4-диметиламинопиридин, в подходящем растворителе, таком как диоксан, хлороформ, дихлорметан или пиридин;
превращение гидроксильной группы в сложноэфирную группу в результате осуществления взаимодействия с карбоновой кислотой в указанных выше стандартных условиях;
превращение группы сульфанила в сульфинильную или сульфонильную группу в результате осуществления взаимодействия с 1 или 2 эквивалентами соответственно подходящего окисляющего агента, такого как м-хлорпербензойная кислота, в подходящем растворителе, таком как, например, дихлорметан;
превращение первичной или вторичной гидроксильной группы в отщепляемую группу, например в алкилсульфонат или арилсульфонат, такой как мезилат или тозилат, или в галоген, такой как Cl, Br или I, в результате осуществления взаимодействия с сульфонилгалогенидом, таким как метансульфонилхлорид, в присутствии основания, такого как пиридин или триэтиламин, в подходящем растворителе, таком как дихлорметан или хлороформ, или с галогенирующим агентом, таким как SOCl2, в подходящем растворителе, таком как тетрагидрофуран;
замещение указанной отщепляемой группы в результате осуществления взаимодействия со спиртом, амином или тиолом, необязательно в присутствии основания, такого как K2CO3, и в подходящем растворителе, таком как диметилформамид, 1,2-диметоксиэтан или ацетонитрил;
удаление отщепляемой группы, связанной с алкильной группой, для получения алкенильной группы, в результате осуществления взаимодействия с основанием, таким как KOH, в подходящем растворителе, таком как толуол, и при нагревании, предпочтительно при кипячении с обратным холодильником;
превращение первичного амида во вторичный амид в результате осуществления взаимодействия с алкилирующим агентом в присутствии сильного основания, такого как гидрид натрия, в подходящем растворителе и при температуре в интервале от комнатной температуры до температуры кипения растворителя;
превращение CHO в амин в результате осуществления взаимодействия с амином в присутствии восстанавливающего агента, такого как триацетоксиборгидрид натрия, в подходящем растворителе, таком как, например, 1,2-дихлорэтан;
превращение группы ацеталя в альдегид в результате осуществления взаимодействия в кислотной среде, например в HCl, при соответствующей температуре, предпочтительно при кипячении с обратным холодильником;
превращение сложноэфирной группы в спиртовую группу в результате осуществления взаимодействия с восстанавливающим агентом, таким как LiAlH4, в подходящем растворителе, таком как тетрагидрофуран;
превращение сульфонильной группы, связанной с ароматическим кольцом, в аминопроизводное в результате осуществления взаимодействия с соответствующим амином, в подходящем растворителе, таком как тетрагидрофуран, или используя амин в качестве растворителя, при нагревании, предпочтительно до температуры в интервале от комнатной температуры до температуры 100°C, и предпочтительно осуществляя реакцию в закрытом реакторе при атмосферном давлении;
превращение сульфонильной группы, связанной с ароматическим кольцом, путем замещения алкоксидом до получения соответствующего алкоксипроизводного, в подходящем растворителе, таком как тетрагидрофуран, или используя соответствующий спирт в качестве растворителя, при нагревании, предпочтительно до температуры в интервале от комнатной температуры до 100°C, и предпочтительно осуществляя реакцию в закрытом реакторе при атмосферном давлении;
превращение винильного или ароматического галогена в NHR, где R представляет
Ra, Rc, Re или Rf, в результате осуществления взаимодействия с амином формулы H2NR, и предпочтительно при нагревании;
в другом варианте винильный или ароматический галоген можно превратить в NHR, осуществляя взаимодействие с амином формулы H2NR в присутствии основания, такого как Cs2CO3 или трет-бутоксид натрия, в присутствии палладиевого катализатора, такого как ацетат палладия (II), и фосфина, такого как 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, в растворителе, таком как толуол, и предпочтительно при нагревании;
превращение винильного или ароматического галогена в фенильную или гетероарильную группу, обрабатывая фенил- или гетероарилбороновой кислотой в присутствии катализатора, такого как палладиевый катализатор, такой как ацетат палладия (II) или тетракис(трифенилфосфин) палладий (0), и основания, такого как Na2CO3, К2СО3 или CsF, в подходящем полярном растворителе, таком как 1,2-диметоксиэтан, или в смесях толуол-вода, и предпочтительно при нагревании;
превращение ароматического галогена в H в результате галогенолиза, с участием восстанавливающего агента, такого как Zn, в подходящем растворителе, таком как уксусная кислота, и при нагревании, предпочтительно при кипячении с обратным холодильником; и
окисление N в положении 7 пиразоло[3,4-b]пиридинового кольца до получения соответствующего N-оксида в результате осуществления взаимодействия с окисляющим агентом, таким как м-хлорпербензойная кислота, в подходящем растворителе, таком как, например, дихлорметан.
Аналогично, любое из ароматических колец соединений настоящего изобретения может подвергаться электрофильным реакциям ароматического замещения, подробно раскрытым в литературе.
Многие из этих реакций взаимопревращения раскрыты более подробно в разделе «Примеры».
Как должно быть очевидно специалистам, эти реакции взаимопревращения можно также осуществить, используя синтез промежуточных соединений формулы I.
Настоящее изобретение также включает соли соединений формулы I.
Эти соли можно получить обычными способами, обрабатывая соединения формулы I соответствующим количеством кислоты, такой как хлористоводородная кислота, серная кислота, азотная кислота, щавелевая кислота или метансульфоновая кислота. В случае соединений формулы I, которые содержат кислотный протон, соли можно также получить, обрабатывая основанием, таким как гидроксид натрия, гидроксид калия, гидроксид кальция или карбонат кальция. Соли соединений формулы I можно, в свою очередь, превратить в другие соли соединений формулы I с помощью ионообмена, используя ионообменную смолу.
Как было указано выше, соединения настоящего изобретения действуют как ингибиторы киназы p38, индуцируя уменьшение количества провоспалительных цитокинов. Поэтому предполагают, что эти соединения можно использовать для лечения или профилактики заболеваний, в которых важную роль играет киназа p38. Они включает заболевания, вызываемые сверхпродуцированием цитокинов, таких как TNF-б, IL-1, IL-6 или IL-8. Эти заболевания включают, но ими не ограничиваются, иммунные, аутоиммунные и воспалительные заболевания, сердечно-сосудистые заболевания, инфекционные заболевания, нарушения костной ресорбции, нейродегенеративные заболевания, пролиферативные заболевания и процессы, связанные с индуцированием циклооксигеназы-2.
Например, иммунные, аутоиммунные и воспалительные заболевания, которые можно лечить или осуществлять профилактику соединениями настоящего изобретения, включают ревматоидные заболевания (например, ревматоидный артрит, псориатический артрит, инфекционный артрит, прогрессирующий хронический артрит, деформирующий артрит, остеоартрит, травматический артрит, подагрический артрит, синдром Рейтера, полихондрит, острый синовит и спондилит), гломерулонефрит (с нефротическим синдромом или без него), аутоиммунные гематологические нарушения (например, гемолитическую анемию, аплазическую анемию, идиопатическую тромбоцитопению и нейтропению), аутоиммунный гастрит и аутоиммунные заболевания кишечника (например, язвенный колит и болезнь Крона), заболевание “трансплантат против хозяина”, отторжение трансплантата, хронический тироидит, болезнь Грейвса, склеродерму, диабет (первого и второго типа), активный гепатит (острый и хронический), первичный желчный цирроз, тяжелую псевдопаралитическую миастению, рассеянный склероз, системную красную волчанку, псориаз, атопический дерматит, контактный дерматит, экзему, солнечные ожоги кожи, хроническую почечную недостаточность, синдром Stevens-Johnson, идеопатическая спру, саркоидоз, синдром Guillain-Barré, увеит, конъюнктивит, кератоконъюнктивит, воспаление среднего уха, зубные болезни, легочный интерстициальный фиброз, астму, бронхит, ринит, синусит, пневмокониоз, синдром легочной недостаточности, эмфизему легких, фиброз легких, силикоз, хронические воспалительные заболевания легких (например, хроническое обструктивное воспаление легких) и другие воспалительные заболевания дыхательных путей.
Сердечно-сосудистые заболевания, которые можно лечить или осуществлять их профилактику, включают, наряду с другими, инфаркт миокарда, гипертрофию сердца, сердечную недостаточность, ишемические реперфузионные нарушения, тромбозы, агрегацию тромбоцитов, вызываемую тромбином, острые коронарные синдромы, атеросклероз и инсульт.
Инфекционных заболевания, которые можно лечить или осуществлять их профилактику, включают, наряду с другими, сепсис, септический шок, эндотоксический шок, сепсис, вызванный грамотрицательными бактериями, шигеллиоз, менингит, церебральную малярию, пневмонию, туберкулез, вирусный миокардит, вирусные гепатиты (гепатит A, гепатит В и гепатит C), HIV инфекцию, ретинит, вызванный цитомегаловирусом, грипп, герпес, лечение инфекций, вызванных тяжелыми ожогами, миалгию, вызванную инфекциями, кахексию, вторичную по отношению к инфекциям, и ветеринарные вирусные инфекции, такие как лентивирус, вирус козьего артрита, вирус Висна-Маеди, вирус кошачьего иммунодефицита, вирус коровьего иммунодефицита или вирус собачьего иммунодефицита.
Нарушения костной ресорбции, которые можно лечить или осуществить их профилактику, включают, наряду с другими, остеопороз, остеоартрит, травматический артрит, подагрический артрит и костные нарушения, связанные с множественной миеломой.
Нейродегенеративные заболевания, которые можно лечить или осуществлять их профилактику, включают, наряду с другими, болезнь Алцгеймера, болезнь Паркинсона, церебральную ишемию и травматические нейродегенеративные заболевания.
Пролиферативные заболевания, которые можно лечить или осуществлять их профилактику, включают эндометриоз, твердые (солидные) опухоли, острую и хроническую миелоидную лейкемию, саркому Капоши, множественную миелому, метастатическую миелому и ангиогенные нарушения, такие как неоваскуляризация глаза и гемангиома.
Ингибиторы киназы p38 ингибируют также экспрессию провоспалительных белков, таких как циклооксигеназа-2 (COX-2), фермент, ответственный за продуцирование простагландина. Поэтому соединения настоящего изобретения можно также использовать для лечения или профилактики заболеваний, опосредованных COX-2, и особенно для лечения процессов, сопровождающихся воспалениями, лихорадкой и нейромышечной болью, таких как головная боль, боль, вызванная раковым заболеванием, зубная боль и боль при артритах.
В соответствии с активностью раскрытых в настоящем изобретении продуктов настоящее изобретение также относится к композициям, которые содержат соединение настоящего изобретения вместе с эксципиентом или другими вспомогательными агентами при необходимости. Соединения настоящего изобретения можно вводить в форме любых фармацевтических препаратов, природа которых, как это хорошо известно, будет зависеть от природы активного соединения и способа его введения. Можно использовать любой из способов введения, например пероральный, парентеральный, назальный, окулярный, ректальный или способ наружного введения.
В соответствии со способом настоящего изобретения твердые композиции для перорального введения включают таблетки, гранулы и капсулы. В любом случае способ приготовления основан на простом смешивании, сухом гранулировании или влажном гранулировании активного соединения с эксципиентом. Такими эксципиентами могут быть, например, разбавители, такие как лактоза, микрокристаллическая целлюлоза, маннит или гидрофосфат кальция; связующие агенты, такие как, например, крахмал, желатин или повидон; разрыхлители, такие как натрийкарбоксиметилкрахмал или натрийкроскарамеллоза; и смазывающие агенты, такие как, например, стеарат магния, стеариновая кислота или тальк. Таблетки, используя известные способы, можно дополнительно покрыть подходящими эксципиентами с целью задержки их разрушения и абсорбции в желудочно-кишечном тракте, и тем самым обеспечить непрерывное действие в течение более длительного промежутка времени, или просто для того, чтобы улучшить их органолептические характеристики или повысить их стабильность. Активное соединение можно также включить путем нанесения на инертные гранулы, используя природные или синтетические агенты, образующие пленку. Можно также использовать мягкие желатиновые капсулы, в которых активное соединение смешивают с водой или маслянистой средой, например кокосовым маслом, минеральным маслом или оливковым маслом.
Порошки или грануляты для приготовления суспензий для перорального введения путем добавления воды можно получить, смешивая активное соединение с диспергирующими или смачивающими агентами; суспендирующими агентами и консервантами. Можно добавлять и другие эксципиенты, например подсластители, вкусовые агенты и красители.
Жидкие формы для перорального введения включают эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие обычно используемые инертные разбавители, такие как очищенная вода, этанол, сорбит, глицерин, полиэтиленгликоли (макроголи) и пропиленгликоль. Указанные композиции могут также содержать вспомогательные адъюванты, такие как смачивающие, суспендирующие агенты, подсластители, вкусовые агенты, консерванты и буферные агенты.
Препараты для инъекций настоящего изобретения для парентерального введения включают стерильные растворы, суспензии или эмульсии в водном или в неводном растворителе, таком как пропиленгликоль, полиэтиленгликоль или растительные масла. Такие композиции могут также содержать вспомогательные адъюванты, такие как смачивающие, эмульгирующие, диспергирующие агенты и консерванты. Их можно стерилизовать, используя любые известные способы, или приготовить в виде стерильных твердых композиций, которые затем растворяют в воде или в любой другой стерильной среде для инъекций непосредственно перед введением. Возможно также исходить из стерильных материалов, поддерживая их в стерильных условиях на протяжении всего процесса приготовления.
Для ректального введения активное соединение предпочтительно может быть приготовлено в форме суппозитория на маслянистой основе, такой как, например, растительные масла или твердые полусинтетические глицериды, или на гидрофильной основе, такой как полиэтиленгликоли (макроголи).
Соединение можно также приготовить в форме для наружного применения для лечения патологий, расположенных в зонах или органах, доступных для такого способа введения, например, таких как глаза, кожа и кишечный тракт. Композиции включают кремы, лосьоны, гели, порошки, растворы и пластыри, в которых активные соединения диспергированы или растворены в подходящих эксципиентах.
Соединения настоящего изобретения могут также быть приготовлены в твердой форме, растворены или диспергированы в подходящем носителе, для ингаляций в однодозовом или многодозовом контейнере. Препараты, которые должны вводиться в виде аэрозолей (дисперсий твердых или жидких частиц в газе), используют в подходящих устройствах, таких как распылители, ингаляторы под давлением с отмеряемой дозой или ингаляторы с сухими порошками. В зависимости от этого соединения приготавливают с эксципиентами, такими как пропелленты, обеспечивающими создание соответствующего давления в контейнере для того, чтобы содержимое выходило через отверстие клапана, и, чтобы избежать блокировки клапана, в качестве эксципиентов используют растворители, эмульгирующие агенты, снижающие вязкость агенты, консерванты, стабилизаторы и смазывающие агенты.
Дозы и частота введения доз зависят от природы и тяжести подлежащего лечению заболевания, возраста и общего состояния и массы тела пациента, а также от конкретного вводимого соединения, наряду с другими факторами. Представительным примером подходящего интервала доз является интервал от около 0,01 мг/кг до около 100 мг/кг в день, которые можно вводить в виде одной дозы или в виде разделенных доз. Однако выбор вводимых доз обычно оставляют на усмотрение врача.
Активность соединений настоящего изобретения можно оценить, используя следующие тесты.
Тест 1: Ингибирование высвобождения TNF-б, индуцируемого LPS в клетках ретикулоклеточной лимфомы человека, U-937
Поддержание и дифференциация U-937 клеток: U-937 клетки (ATCC N° CRL-159.2) культивируют в RPMI 1640 среде, дополненной 10% инактивированной фетальной телячьей сывороткой (Gibco). Полное количество 0,5×106 клеток инкубируют в присутствии 20 нг/мл PMA (форбол 12-миристат 13-ацетат) в течение 24 часов для достижения полной моноцитной дифференциации. Все процессы инкубирования осуществляют при 37°C в атмосфере с 5% CO2. Клетки центрифугируют (200×g в течение 5 минут) и снова суспендируют в RPMI 1640 среде, дополненной 2% инактивированной фетальной телячьей сывороткой при плотности 2×106 клеток/мл.
Ингибирование высвобождения TNF-б: 100 мкл клеток U-937 (2×106 клеток/мл) инкубируют со 100 мкл тестируемого продукта (конечные концентрации 0,001-10 мкМ) в течение 30 минут в 96-луночных планшетах. Маточные растворы продуктов (10 мМ в ДМСО) разбавляют культуральной средой до достижения конечной концентрации ДМСО, равной или менее чем 0,1%. Полное количество 20 мкл LPS (E. coli 055B5, Sigma) добавляют до конечной концентрации 100 нг/мл и после инкубирования в течение 4 часов количественно определяют количество выделившихся TNF-б в надосадочной жидкости, используя коммерческий набор ELISA (Biosource International).
Тест 2: Ингибирование высвобождения TNF-б, индуцируемого LPS в одноядерных клетках периферической крови человека
Для получения одноядерных клеток: гепаринизированную венозную кровь, полученную от здоровых добровольцев, разбавляют равным объемом физиологического фосфатного буфера без кальция или магния. Аликвоты в 30 мл смеси переносят в 50 мл центрифужные ампулы, содержащие 15 мл Ficoll-Hypaque (1,077 г/мл). Содержимое ампул центрифугируют при 1200×g в течение 20 минут при комнатной температуре без остановок.
Приблизительно две трети слоя тромбоцитов, расположенные над одноядерными клетками, удаляют с помощью пипетки. Одноядерные клетки осторожно переносят в 50 мл ампулы, дважды промывают физиологическим фосфатным буфером, центрифугируют при 300×g в течение 10 минут при комнатной температуре и снова суспендируют в RPMI, дополненной 1% инактивированной фетальной телячьей сывороткой при плотности клеток 2×106 клеток/мл.
Ингибирование высвобождения TNF-б: 100 мкл одноядерных клеток (2×106 клеток/мл) инкубируют в 96-луночных планшетах с 50 мкл тестируемого продукта (конечные концентрации 0,001-10 мкМ) и 50 мкл LPS (E. coli 055B5, Sigma) при конечной концентрации 400 нг/мл в течение 19 часов при 37°C в атмосфере с 5% СО2. Количество выделившихся TNF-б в надосадочной жидкости определяют количественно, используя коммерческой набор ELISA (Biosource International).
Тест 3: Ингибирование p38-б киназы
В конечном объеме 25 мкл инкубируют полное количество 5 мкл тестируемого продукта (конечная концентрация 0,001-10 мкМ), 5-10 мЕд p38-б с 0,33 мг/мл основного белка миелина, ацетат Mg2+ (10 мМ) и [γ33P-ATP] (100 мкМ, удельная активность 500 имп в мин/пмоль) в буфере Tris 25 мМ pH 7,5, EGTA 0,02 мМ. Реакцию инициируют, добавляя Mg2+[γ33P-ATP]. После инкубирования в течение 40 минут при комнатной температуре реакцию гасят, добавляя 5 мкл 3% раствора фосфорной кислоты. Реакционную смесь (10 мкл) пропускают через фильтр (P30) и трижды промывают в течение 5 минут 75 мМ раствором фосфорной кислоты и один раз метанолом, прежде чем сушат, и подсчитывают, используя жидкостный сцинтилляционный счетчик.
В приведенной далее таблице представлены результаты, полученные для представительных соединений настоящего изобретения в тесте 2:
Приводимые далее примеры иллюстрируют, но не ограничивают объем настоящего изобретения.
В разделе примеры использованы следующие сокращения.
AcOH: уксусная кислота
EtOAc: этилацетат
NH4OAc: ацетат аммония
BuLi: бутиллитий
tBuOH: трет-бутанол
conc.: концентрированный
DMAP: 4-(N,N-диметиламино)пиридин
DMF: диметилформамид (ДМФА)
EtOH: этанол
MeOH: метанол
THF: тетрагидрофуран
tR: время удерживания
ЖХ-МС: жидкостная хроматография-масс-спектрометрия
ЖХ-МС спектры получены с использованием следующих условий хроматографической обработки.
Способ 1: Колонка - Column Tracer Excel 120, ODSB 5 мкм (10 мм × 0,21 мм), температура: 30°C, поток: 0,35 мл/мин, элюент: A = ацетонитрил, B = 0,1% HCOOH, градиент: 0 мин 10% A - 10 мин 90% A.
Способ 2: Колонка - Column X-Terra MS C18 5 мкм (150 мм × 2,1 мм), температура: 30°C, поток: 0,40 мл/мин, элюент: A = ацетонитрил, B = 10 мМ NH4OAc (pH = 6,80), градиент: 0 мин 25% A - 6 мин 80% A -7,5 мин 25% A.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1
1-(4-фторфенил)-2-(4-пиридил)этанон
a) 4-фтор-N-метокси-N-метилбензамид
В мерную колбу в атмосфере аргона вводят N,O-диметилгидроксиламингидрохлорид (25,54 г, 261,8 ммоль) и CH2Cl2 (443 мл) при 0°C. Добавляют 4-фторбензоилхлорид (34,59 г, 218,2 ммоль) с последующим медленным добавлением триэтиламина (48,13 г, 475,6 ммоль). Реакционную смесь перемешивают в течение 30 мин при 5°C и оставляют до достижения комнатной температуры. Смесь промывают 5% водной лимонной кислотой (180 мл) и 5% водным NaHCO3 (180 мл). Водную фазу экстрагируют CH2Cl2. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 20,23 г нужного соединения (выход: 88%).
b) Указанное в заголовке соединение
К раствору диизопропиламина (23,4 мл, 165,7 ммоль) в ТГФ (250 мл), охлажденному до -78°C, в атмосфере аргона по каплям добавляют BuLi (103,5 мл 1,6 M раствор в гексане, 165,7 ммоль). Через 5 минут в течение 20 мин добавляют раствор 4-метилпиридина (10,28 г, 110,4 ммоль) в ТГФ (85 мл). Полученную смесь перемешивают при 0°C в течение 15 мин и в течение 30 минут добавляют раствор 4-фтор-N-метокси-N-метилбензамида (полученного в разделе a) в ТГФ (85 мл). Реакционную смесь оставляют до достижения комнатной температуры. Добавляют воду (100 мл) и EtOAc (100 мл) и полученную смесь перемешивают в течение 30 мин. Органическую фазу выделяют, сушат над Na2SO4 и концентрируют досуха, получая 24,32 г нужного соединения (выход: 100%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,29 (с, 2Н), 7,14-7,23 (комплексный сигнал, 4Н), 8,05 (м, 2Н), 8,59 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 2
2-(4-пиридил)-1-[3-(трифторметил)фенил]этанон
a) N-метокси-N-метил-3-(трифторметил)бензамид
По способу, раскрытому в сравнительном примере 1, в разделе a, но используя 3-(трифторметил)бензоилхлорид вместо 4-фторбензоилхлорида, получают нужный продукт (выход: 86%).
b) Указанное в заголовке соединение
По способу, раскрытому в сравнительном примере 1, в разделе b, но используя N-метокси-N-метил-3-(трифторметил)бензамид (полученный в разделе a этого примера) вместо 4-фтор-N-метокси-N-метилбензамида, получают указанное в заголовке соединение (выход: 22%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,31 (с, 2Н), 7,20 (д, J=5,8 Гц, 2Н), 7,63 (т, J=7,8 Гц, 1Н), 7,84 (д, J=7,8 Гц, 1Н), 8,16 (д, J=7,9 Гц, 1Н), 8,24 (с, 1Н), 8,56 (д, J=5,8 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 3
1-фенил-2-(4-пиридил)этанон
Раствор диизопропиламина (22 мл, 15,03 ммоль) в ТГФ (200 мл) в атмосфере аргона охлаждают до -78°C. По каплям добавляют BuLi (96 мл 1,6 M раствор в гексане, 153,0 ммоль). Через 1 час добавляют раствор 4-метилпиридина (15,00 г, 161,1 ммоль) в ТГФ (75 мл) и оставляют нагреваться до 0°C. При этой температуре раствор перемешивают в течение 30 минут. Его охлаждают до -78°C и добавляют бензонитрил (18,27 г, 177,2 ммоль) в ТГФ (75 мл) и перемешивают при -78°C в течение 2 час. Раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду (225 мл), раствор охлаждают на бане со смесью вода-лед и величину рН доводят до 1, используя 48% HBr. Органическую фазу выделяют. Водную фазу кипятят с обратным холодильником в течение 2 час, оставляют остывать и экстрагируют диэтиловым эфиром. Величину рН водной фазы доводят до нейтральной, используя 1 н. NaOH, и экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 28,53 г указанного в заголовке соединения (выход: 90%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,29 (с, 2Н), 7,20 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 7,49 (м, 2Н), 7,58 (м, 1Н), 8,00 (д, J=8,2 Гц, 2Н), 8,56 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 4
1-(4-фторфенил)-2-(4-пиридил)винил 4-фторбензоат
К суспензии NaH (0,81 г, 18,6 ммоль) в ДМФА (30 мл), в атмосфере аргона и охлажденной до 0°C, добавляют раствор 1-(4-фторфенил)-2-(4-пиридил)этанона (2,00 г, 9,3 ммоль, полученный в сравнительном примере 1) в ДМФА (15 мл) и перемешивают до достижения комнатной температуры в течение 30 минут. Затем его охлаждают до 0°C и добавляют раствор 4-фторбензоилхлорида (2,95 г, 1,9 ммоль) в ДМФА (10 мл). Раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду и растворитель выпаривают. Остаток растворяют в смеси CHCl3 и воды и фазы разделяют. Водную фазу экстрагируют CHCl3 (×3). Органическую фазу промывают водой (×2), сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,98 г нужного соединения в виде твердого вещества желтого цвета (выход: 31%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 6,68 (с, 1Н), 7,11 (т, J=8,6 Гц, 2Н), 7,29 (т, J=8,6 Гц, 2Н), 7,39 (д, J=6,0 Гц, 2Н), 7,60 (дд, Jо=5,2 Гц, Jm=8,8 Гц, 2Н), 8,27 (дд, Jо=5,4 Гц, Jm=8,8 Гц, 2Н), 8,58 (д, J=6,0 Гц, 2Н)
СРАВНИТЕЛЬНЫЙ ПРИМЕР 5
1-фенил-2-(4-пиридил)винилбензоат
По способу, раскрытому в сравнительном примере 4, но используя 1-фенил-2-(4-пиридил)этанон (полученный в сравнительном примере 3) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона и бензоилхлорид вместо 4-фторбензоилхлорида, получают указанное в заголовке соединение (выход: 62%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 6,72 (с, 1Н), 7,38-7,42 (комплексный сигнал, 5Н), 7,60-7,63 (комплексный сигнал, 4Н), 7,71 (т, J=7,4 Гц, 1Н), 8,23 (д, J=7,1 Гц, 2Н), 8,51 (дд, Jо=1,5 Гц, Jm=4,6 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 6
2-[2-(метилсульфанил)пиримидин-4-ил]-1-[3-(трифторметил)фенил]этанон
a) 4-метил-2-(метилсульфанил)пиримидин
К раствору NaOH (7,46 г, 186,4 ммоль) в воде (120 мл) добавляют гидрохлорид 4-метилпиримидин-2-тиола (13,78 г, 84,7 ммоль) и затем в атмосфере аргона по каплям добавляют йодометан (13,23 г, 93,2 ммоль). Раствор перемешивают при комнатной температуре в течение 2 часов. Раствор экстрагируют CH2Cl2 (×2). Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 10,26 г нужного соединения (выход: 86%).
b) Указанное в заголовке соединение
По способу, раскрытому в сравнительном примере 1, в разделе b, но используя N-метокси-N-метил-3-(трифторметил)бензамид (полученный в разделе a сравнительного примера 2) вместо 4-фтор-N-метокси-N-метилбензамида и 4-метил-2-(метилсульфанил)пиримидин (полученный в разделе a этого примера) вместо 4-метилпиридина, получают указанное в заголовке соединение в виде неочищенного продукта, который используют непосредственно в следующих реакциях (выход: количественный).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 7
3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-он
К раствору 1-(4-фторфенил)-2-(4-пиридил)этанона (0,30 г, 1,4 ммоль, полученный в сравнительном примере 1) в безводном ТГФ (5 мл), в атмосфере аргона добавляют диметил диметилформамидацеталь (0,27 г, 3,2 ммоль). Полученный раствор перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают, получая 0,39 г указанного в заголовке соединения (выход: количественный).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,79 (с, 6Н), 6,97 (т, J=8,7 Гц, 2Н), 7,05 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,38 (с, 1Н), 7,45 (м, 2Н), 8,48 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 8
3-(диметиламино)-2-[2-(метилсульфанил)пиримидин-4-ил]-1-[3-
(трифторметил)фенил]проп-2-ен-1-он
По способу, раскрытому в сравнительном примере 7, но используя 2-[2-(метилсульфанил)пиримидин-4-ил]-1-[3-(трифторметил)фенил]этанон (полученный в сравнительном примере 6) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона, получают нужное соединение в виде неочищенного продукта, который используют непосредственно в следующих реакциях.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 9
1-(6-хлорпиридин-3-ил)-2-(4-пиридил)этанон
a) гидрохлорид 6-хлорникотиноилхлорида
Раствор 6-хлорникотиновой кислоты (10,00 г, 63,5 ммоль) в SOCl2 (37 мл) нагревают при кипячении с обратным холодильником в течение 2 часов. SOCl2 выпаривают досуха, получая 12,56 г нужного продукта (выход: 93%).
b) 6-хлор-N-метокси-N-метилникотинамид
По способу, раскрытому в сравнительном примере 1, в разделе a, но используя гидрохлорид 6-хлорникотиноилхлорида (полученный в разделе a этого примера) вместо 4-фторбензоилхлорида, получают нужное соединение (выход: 71%).
c) Указанное в заголовке соединение
По способу, раскрытому в сравнительном примере 1, в разделе b, но используя 6-хлор-N-метокси-N-метилникотинамид (полученный в разделе b этого примера) вместо 4-фтор-N-метокси-N-метилбензамида, получают указанное в заголовке соединение (выход: количественный).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,27 (с, 2Н), 7,18 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,45 (дд, Jо=0,6 Гц, Jm=8,4 Гц, 1Н), 8,20 (дд, Jо=2,5 Гц, Jm=8,3 Гц, 2Н с, 1Н), 8,56 (18 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 8,98 (д, J=2,4 Гц, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 10
2-(4-фторфенил)-6-гидрокси-3,4'-бипиридин-5-карбонитрил
К раствору 3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-она (12,77 г, 47,2 ммоль, полученного в сравнительном примере 7) в ДМФА (175 мл), в атмосфере аргона добавляют 2-цианоацетамид (4,41 г, 52,0 ммоль). Затем добавляют метоксид натрия (5,35 г, 99,2 ммоль), и нагревают при кипячении с обратным холодильником в течение 1 часа. Полученную смесь оставляют охлаждаться, концентрируют и разбавляют водой. Величину pH доводят до 4, используя 1 н HCl. Полученный осадок фильтруют и сушат, получая 6,57 г нужного соединения в виде твердого вещества (выход: 48%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,20 (с, OH+NH+CD3OD), 6,96 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н), 7,05 (т, J=8,7 Гц, 2Н), 7,23 (м, 2Н), 7,96 (с, 1Н), 8,39 (дд, Jо=1,4 Гц, Jm=4,6 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 11
2-гидрокси-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]пиридин-3-карбонитрил
По способу, раскрытому в сравнительном примере 10, но используя 3-(диметиламино)-2-[2-(метилсульфанил)пиримидин-4-ил]-1-[3-(трифторметил)фенил]проп-2-ен-1-он (полученный в сравнительном примере 8) вместо 3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-она, получают указанное в заголовке соединение (выход: 20%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 3,28 (с, 3Н), 3,84 (с, OH+CD3OD), 6,38 (д, J=5,4 Гц, 1Н), 7,42 (д, J=7,8 Гц, 1Н), 7,53 (т, J=7,8 Гц, 1Н), 7,61 (с, 1Н), 7,73 (д, J=7,8 Гц, 1Н), 8,18 (д, J=5,1 Гц, 1Н), 8,35 (с, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 12
6-хлор-2-(4-фторфенил)-3,4'-бипиридин-5-карбонитрил
Смесь 2-(4-фторфенил)-6-гидрокси-3,4'-бипиридин-5-карбонитрила (6,57 г, 22,5 ммоль, полученного в сравнительном примере 10), POCl3 (26,3 мл, 287,5 ммоль) и ДМФА (0,37 мл) кипятят с обратным холодильником в атмосфере аргона в течение 2 час. Смесь охлаждают на бане со льдом и подщелачивают, добавляя 30% водный NH3. Полученный осадок фильтруют и промывают водой. Полученный продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 3,86 г нужного продукта в виде твердого вещества желтого цвета (выход: 55%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 7,00 (т, J=8,6 Гц, 2Н), 7,11 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 7,37 (м, 2Н), 7,98 (с, 1Н), 8,62 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 13
1-(6-метилпиридин-3-ил)-2-(4-пиридил) этанон
a) N-метокси-6,N-диметилникотинамид
К раствору 6-метилникотиновой кислоты (5,00 г, 36,5 ммоль) в ДМФА (150 мл), в атмосфере аргона добавляют 1-гидроксибензотриазол (4,92 г, 36,5 ммоль), N-этил-N-(3-диметиламинопропил)карбодиимидгидрохлорид (8,38 г, 45,7 ммоль) и 4-метилморфолин (16,0 мл, 145,8 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 30 минут, после чего добавляют N,O-диметилгидроксиламингидрохлорид (3,55 г, 36,5 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают. Остаток растворяют в смеси CHCl3 и 0,2 н. NaHCO3. Фазы разделяют и водную фазу экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 1,11 г нужного продукта (выход: 29%).
b) Указанное в заголовке соединение
По способу, раскрытому в сравнительном примере 1, в разделе b, но используя N-метокси-6,N-диметилникотинамид (полученный в разделе a этого примера) вместо 4-фтор-N-метокси-N-метилбензамида, получают указанное в заголовке соединение (выход: 87%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,64 (с, 3Н), 4,28 (с, 2Н), 7,20 (дд, Jо=1,4 Гц, Jm=4,6 Гц, 2Н), 7,28 (д, J=8,1 Гц, 1Н), 8,15 (дд, Jо=2,4 Гц, Jm=8,1 Гц, 1Н), 8,57 (дд, Jо= 1,8 Гц, Jm=4,5 Гц, 2Н), 9,10 (д, J=2,4 Гц, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 14
2-хлор-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-
(трифторметил)фенил]пиридин-3-карбонитрил
По способу, раскрытому в сравнительном примере 12, но используя 2-гидрокси-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]пиридин-3-карбонитрил (полученный в сравнительном примере 11) вместо 2-(4-фторфенил)-6-гидрокси-3,4'-бипиридин-5-карбонитрила, получают указанное в заголовке соединение (выход: 44%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,48 (с, 3Н), 6,62 (д, J=5,1 Гц, 1Н), 7,51 (м, 2Н), 7,71 (д, J=7,2 Гц, 1Н), 7,82 (с, 1Н), 8,39 (д, J=5,1 Гц, 1Н), 8,42 (с, 1Н), 8,42 (с, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 15
3-амино-5-(1-бензилпиперидин-4-ил)-2H-пиразол
a) Метил 1-бензилпиперидин-4-карбоксилат
К раствору метил пиперидин-4-карбоксилата (10,00 г, 6,4 ммоль) и триэтиламина (10,32 г, 10,2 ммоль) в CHCl3 (100 мл), в атмосфере аргона добавляют бензилбромид (14,69 г, 8,6 ммоль), охлаждая при этом на бане с водой и льдом. Полученную смесь перемешивают при комнатной температуре в течение ночи. Добавляют CHCl3 и воду и две фазы разделяют. Водную фазу экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 13,80 г нужного соединения в виде твердого вещества оранжевого цвета (выход: 88%).
b) 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрил
К раствору BuLi (12,4 мл, 1,6 M раствор в гексане, 19,8 ммоль) в ТГФ (25 мл), охлажденному до -78°C, по каплям в атмосфере аргона добавляют ацетонитрил (1 мл). После перемешивания полученной суспензии в течение 5 мин при -78°C по каплям добавляют раствор метил 1-бензилпиперидин-4-карбоксилата (2,0 г, 8,1 ммоль, полученного в предыдущем разделе) в ТГФ (5 мл) и перемешивают в течение 30 мин при -78°C. Смесь оставляют до достижения комнатной температуры и перемешивают при этой температуре в течение ночи. Добавляют 1 н. HCl, чтобы довести величину рН до 7, и водную фазу экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 1,92 г нужного соединения в виде твердого вещества оранжевого цвета (выход: 98%).
c) Указанное в заголовке соединение
К раствору 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила (1,85 г, 7,6 ммоль, полученного в предыдущем разделе) в EtOH (77 мл) добавляют моногидрат гидразина (0,74 мл, 15,3 ммоль) в атмосфере аргона. Полученную смесь кипятят с обратным холодильником в течение ночи. Растворитель выпаривают и остаток растворяют в смеси вода-CHCl3. Водную фазу экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности получая 0,46 г нужного соединения (выход: 23%).
1H ЯМР (300 МГц, CD3OD) δ (TMS): 1,72 (м, 2Н), 1,90 (м, 2Н), 2,15 (м, 2Н), 2,56 (м, 1Н), 2,97 (м, 2Н), 3,57 (с, 2Н), 4,89 (ушир.с, NH+NH2+H2O), 5,43 (с, 1Н), 7,27-7,34 (комплексный сигнал, 5Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 16
3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)бут-2-ен-1-он
По способу, раскрытому в сравнительном примере 7, но используя диметилацеталь диметилацетамида вместо диметилацеталя диметилформамида, получают нужное соединение в виде твердого продукта, который используют непосредственно в следующих реакциях.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,15 (с, 3Н), 3,00 (с, 6Н), 6,80 (м, 4Н), 7,45 (м, 2Н), 8,30 (д, J=8,0 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 17
2-(4-фторфенил)-6-гидрокси-4-метил-3,4'-бипиридин-5-карбонитрил
По способу, раскрытому в сравнительном примере 10, но используя 3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)бут-2-ен-1-он (полученный в сравнительном примере 16) вместо 3-диметиламино-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-она, получают указанное в заголовке соединение (выход: 21%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,55 (ушир.с, OH+H2O), 2,30 (с, 3Н), 6,97 (м, 4Н), 7,25 (м, 2Н), 8,52 (м, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 18
6-хлор-2-(4-фторфенил)-4-метил-3,4'-бипиридин-5-карбонитрил
По способу, раскрытому в сравнительном примере 12, но используя 2-(4-фторфенил)-6-гидрокси-4-метил-3,4'-бипиридин-5-карбонитрил (полученный в сравнительном примере 17) вместо 2-(4-фторфенил)-6-гидрокси-3,4'-бипиридин-5-карбонитрила, получают указанное в заголовке соединение (выход: 52%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,41 (с, 3Н), 6,90 (м, 2Н), 7,09 (д, J=9,0 Гц, 2Н), 7,25 (м, 2Н), 8,62 (м, J=4,0 Гц, 2Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 19
1-(4-фторфенил)-2-[2-(метилсульфанил)пиримидин-4-ил]этанон
К раствору 4-метил-2-(метилсульфанил)пиримидина (21,00 г, 150,0 ммоль, полученного в сравнительном примере 6, в разделе a) и этил 4-фторбензоата (25,14 г, 150,0 ммоль) в ТГФ (300 мл) в атмосфере аргона по каплям добавляют раствор натрийбис(триметилсилил)амида (150 мл, 2 M раствор в ТГФ, 300 ммоль) в ТГФ (150 мл), охлаждая при этом на бане со льдом. Раствор перемешивают при комнатной температуре в течение 2 час. Добавляют насыщенный раствор NH4Cl и растворитель выпаривают. Остаток помещают в смесь EtOAc и воды и фазы разделяют. Водную фазу снова экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат над Na2SO4 и концентрируют досуха, получая 36,6 г указанного в заголовке соединения (выход: 93%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,52 (кетон: с, 3Н), 2,61 (енол: с, 3Н), 4,35 (кетон: с, 2Н), 5,92 (енол: с, 1Н), 6,64 (енол: д, J=5,7 Гц, 1Н), 6,95 (кетон: д, J=5,1 Гц, 1Н), 7,08-7,19 (м, 2H), 7,83 (енол: м, 2Н), 8,07 (кетон: м, 2Н), 8,31 (енол: д, J=5,7 Гц, 1Н), 8,56 (кетон: д, J=5,1 Гц, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 20
3-(диметиламино)-1-(4-фторфенил)-2-[2-(метилсульфанил)пиримидин-4-ил]проп-2-ен-1-он
По способу, раскрытому в сравнительном примере 7, но используя 1-(4-фторфенил)-2-[2-(метилсульфанил)пиримидин-4-ил]этанон (полученный в сравнительном примере 19) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона, получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,50 (с, 3Н), 2,96 (с, 6Н), 6,20-8,20 (комплексный сигнал, 7Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 21
6-(4-фторфенил)-2-(гидрокси)-5-(2-метилсульфанилпиримидин-4-ил)пиридин-3-карбонитрил
По способу, раскрытому в сравнительном примере 10, но используя 3-(диметиламино)-1-(4-фторфенил)-2-[2-(метилсульфанил)пиримидин-4-ил]проп-2-ен-1-он (полученный в сравнительном примере 20) вместо 3-(диметиламино)-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-она, получают указанное в заголовке соединение (выход: 91%).
ЖХ-МС (способ 1): tR = 7,09 мин; m/z = 338,9 [M+H]+.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 22
2-хлор-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиридин-3-карбонитрил
Смесь 6-(4-фторфенил)-2-(гидрокси)-5-(2-метилсульфанилпиримидин-4-ил)пиридин-3-карбонитрила (48,84 г, 144,6 ммоль, полученного в сравнительном примере 21), POCl3 (166 мл, 1,8 моль) и ДМФА (2,2 мл) нагревают при 100°C в течение 2 час. Смесь оставляют охлаждаться до комнатной температуры и концентрируют. Смесь охлаждают на бане со смесью ацетон-CO2 и последовательно добавляют EtOAc и лед. Органическую фазу декантируют, промывают насыщенным NaHCO3, сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя смеси гексан-EtOAc возрастающей полярности, получая 31,00 г указанного в заголовке соединения (выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,54 (с, 3Н), 6,60 (д, J=5,1 Гц, 1Н), 7,08 (т, J=8,5 Гц, 2Н), 7,44 (м, 2Н), 8,37 (д, J=5,1 Гц, 1Н), 8,39 (с, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 23
2-(2-хлорпиридин-4-ил)-1-(4-фторфенил)этанон
По способу, раскрытому в сравнительном примере 19, но исходя из 2-хлор-4-метилпиридина и этил 4-фторбензоата, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 7,96 мин; m/z = 250,0, 252,0 [M+H]+.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 24
2-[2-(метилсульфанил)пиримидин-4-ил]-1-фенилэтанон
По способу, раскрытому в сравнительном примере 19, но исходя из 4-метил-2-(метилсульфанил)пиримидина (полученного в сравнительном примере 6, в разделе a) и этилбензоата, получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,52 (кетон: с, 3Н), 2,62 (енол: с, 3Н), 4,39 (кетон: с, 2Н), 5,99 (енол: с, 1Н), 6,65 (енол: д, J=5,7 Гц, 1Н), 6,98 (кетон: д, J=5,1 Гц, 1Н), 7,40-7,51 (м, 3Н), 7,85 (енол: м, 2Н), 8,03 (кетон: м, 2Н), 8,32 (енол: д, J=5,7 Гц, 1Н), 8,46 (кетон: д, J=5,1 Гц, 1Н).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 25
3-(диметиламино)-2-[2-(метилсульфанил)пиримидин-4-ил]-1-фенилпроп-2-ен-1-он
По способу, раскрытому в сравнительном примере 7, но исходя из 2-[2-(метилсульфанил)пиримидин-4-ил]-1-фенилэтанона (полученного в сравнительном примере 24), получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (ТМС): 2,50 (с, 3H), 2,90 (с, 6H), 6,20-8,00 (комплексный сигнал, 8H).
СРАВНИТЕЛЬНЫЙ ПРИМЕР 26
2-гидрокси-5-(2-метилсульфанилпиримидин-4-ил)-6-фенилпиридин-3-карбонитрил
По способу, раскрытому в сравнительном примере 10, но используя 3-(диметиламино)-2-[2-(метилсульфанил)пиримидин-4-ил]-1-фенилпроп-2-ен-1-он (полученный в сравнительном примере 25) вместо 3-диметиламино-1-(4-фторфенил)-2-(4-пиридил)проп-2-ен-1-она, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 6,90 мин; m/z = 320,9 [M+H]+.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 27
1-[6-(4-фторфенил)-2-гидрокси-5-(2-метилсульфанилпиримидин-4-ил)пиридин-3-ил]этанон
По способу, раскрытому в сравнительном примере 10, но исходя из 3-(диметиламино)-1-(4-фторфенил)-2-[2-(метилсульфанил)пиримидин-4-ил]проп-2-ен-1-она (полученного в сравнительном примере 20) и 3-оксобутирамида, получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,43 (с, 3Н), 2,66 (енол: с, 3Н), 6,53 (д, J=5,1 Гц, 1Н), 7,12 (т, J=8,4 Гц, 2Н), 7,42 (м, 2Н), 8,29 (д, J=5,1 Гц, 1Н), 8,63 (с, 1Н).
СРАВНИТЕЛЬНЫЕ ПРИМЕРЫ 28-29
По способу, раскрытому в сравнительном примере 12, но исходя в каждом случае из соответствующих соединений, получают соединения, представленные в следующей таблице:
пр.
соединения
соединения
(мин)
[M+H]+
ил)6-фенилпиридин-3-карбонитрил
393,9
395,9
СРАВНИТЕЛЬНЫЙ ПРИМЕР 30
1-(4-фторфенил)-2-пиримидин-4-илэтанон
К суспензии NaH (2,26 г 50%, 47,7 ммоль) в ДМФА (92 мл), в атмосфере аргона и охлажденной до 0°C, медленно добавляют 4-метилпиримидин (3,00 г, 31,9 ммоль). Затем добавляют этил 4-фторбензоат (6,40 г, 38,2 ммоль) и раствор перемешивают при комнатной температуре в течение ночи. Добавляют воду и растворитель выпаривают. Остаток помещают в смесь EtOAc и солевого раствора. Фазы разделяют и водную фазу снова экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт хроматографически обрабатывают на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 3,30 г нужного соединения (выход: 48%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,11 (кетон: с, 2Н), 5,94 (енол: с, 1Н), 6,94 (енол: д, J=5,4 Гц, 1Н), 7,08-7,16 (м, 2Н), 7,37 (кетон: д, J=5,1 Гц, 1Н), 7,89 (енол: м, 2Н), 8,08 (кетон: м, 2Н), 8,42 (енол: д, J=5,4 Гц, 1Н), 8,69 (кетон: д, J=5,1 Гц, 1Н), 8,81 (енол: с, 1Н), 9,17 (кетон: с, 1Н).
ПРИМЕР 1
4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
СПОСОБ A
В мерную колбу вводят 1-(4-фторфенил)-2-(4-пиридил)этанон (23,56 г, 109,4 ммоль, полученный в сравнительном примере 1) и 2-метоксиэтанол (150 мл). В атмосфере аргона добавляют раствор 3-амино-2H-пиразола (10,00 г, 120,3 ммоль) в 2-метоксиэтаноле (170 мл) и 37% HCl (3,23 г, 32,8 ммоль). Эту смесь нагревают при кипячении с обратным холодильником в течение 3 дней. Смесь оставляют охлаждаться и концентрируют. Полученный твердый продукт растворяют в CHCl3 (400 мл) и MeOH (50 мл) и промывают 0,1 н. HCl (300 мл) и 1 н. NaOH (300 мл). Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 9,93 г нужного продукта в виде твердого вещества кремового цвета (выход: 47%).
СПОСОБ B
К раствору 3-амино-2H-пиразола (60 мг, 71,8 ммоль) в EtOH (2 мл) и 1 капли 37% HCl в атмосфере аргона добавляют 1-(4-фторфенил)-2-(4-пиридил)винил 4-фторбензоат (0,22 г, 65,0 ммоль, полученный в сравнительном примере 4). Раствор нагревают при кипячении с обратным холодильником в течение 3 дней. Полученную смесь разбавляют CHCl3 и MeOH. Смесь промывают насыщенным NaHCO3. Водную фазу экстрагируют CHCl3 (×2). Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 58 мг нужного продукта в виде твердого вещества белого цвета (выход: 23%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,08 (с, NH+CD3OD), 6,80-7,01 (комплексный сигнал, 6Н), 7,21 (м, 2Н), 7,28 (м, 2Н), 7,95 (с, 1Н), 8,27 (дд, Jо=1,4 Гц, Jm=4,6 Гц, 2Н).
ПРИМЕР 2
4,6-дифенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе B, но используя 1-фенил-2-(4-пиридил)винилбензоат (полученный в сравнительном примере 5) вместо 1-(4-фторфенил)-2-(4-пиридил)винил 4-фторбензоата, получают указанное в заголовке соединение в виде твердого вещества белого цвета (выход: 37%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,08 (с, NH+H2O), 6,85 (д, J=6,0 Гц, 2Н), 7,12-7,31 (комплексный сигнал, 10Н), 7,98 (с, 1Н), 8,29 (д, J=5,8 Гц, 2Н).
ПРИМЕР 3
5-(4-пиридил)-4,6-бис[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе A, но используя 2-(4-пиридил)-1-[3-(трифторметил)фенил]этанон (полученный в сравнительном примере 2) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона, получают указанное в заголовке соединение (выход: 10%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (с, NH+H2O), 6,86 (ушир.с, 2Н), 7,30-7,60 (комплексный сигнал, 8Н), 7,99 (с, 1Н), 8,35 (ушир.с, 2Н).
ПРИМЕР 4
4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе B, но используя 3-амино-5-метил-2Н-пиразол вместо 3-амино-2H-пиразола, получают указанное в заголовке соединение в виде твердого вещества белого цвета (выход: 19%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 2,03 (ушир.с, 3Н), 4,08 (с, NH+CD3OD), 6,81 (м, 2Н), 6,96 (м, 2Н), 7,01 (м, 2Н), 7,04 (м, 2Н), 7,29 (м, 2Н), 8,23 (м, 2Н).
ПРИМЕР 5
4,6-дифенил-3-метил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе B, но используя 3-амино-5-метил-2Н-пиразол вместо 3-амино-2H-пиразола и 1-фенил-2-(4-пиридил)винилбензоат (полученный в сравнительном примере 5) вместо 1-(4-фторфенил)-2-(4-пиридил)винил 4-фторбензоата, получают указанное в заголовке соединение в виде твердого вещества белого цвета (выход: 16%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,02 (с, 3Н), 2,02 (с, NH+H2O), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,13 (м, 2Н), 7,23-7,33 (комплексный сигнал, 6Н), 8,25 (83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 6
2-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 7
1-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
Суспензию 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (0,39 г, 0,8 ммоль, полученного в примере 1), KOH (0,05 г, 0,8 ммоль) и краун эфира 18-C-6 (0,01 г, 0,03 ммоль) в толуоле (3 мл) нагревают при 100°C в течение 2 час. Добавляют раствор йодоэтана (0,18 г, 1,2 ммоль) в толуоле (1 мл) и перемешивают при 100°C в течение 2 дней. Раствор оставляют охлаждаться, добавляют воду и EtOAc и фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,20 г 2-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 61%) и 28 мг 1-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 9%).
Пример 6: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,68 (т, J=7,4 Гц, 3Н), 4,51 (c, J=7,2 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm= 4,4 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,30 (м, 2Н), 7,78 (с, 1H), 8,31 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2H).
Пример 7: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (т, J=7,4 Гц, 3Н), 4,67 (c, J=7,2 Гц, 2Н), 6,81 (дд, Jо=1,6 Гц, Jm= 4,4 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 7,86 (с, 1H), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 8
4,6-бис(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 9
4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя йодометан вместо йодоэтана, получают указанные в заголовке соединения.
Пример 8: выход: 52%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,25 (с, 3Н), 6,81 (д, J=5,3 Гц, 2Н), 6,95 (т, J=8,6 Гц, 2Н), 6,98 (т, J=8,5 Гц, 2Н), 7,12 (м, 2Н), 7,28 (м, 2Н), 7,77 (с, 1H), 8,29 (д, J=5,2 Гц, 2Н).
Пример 9: выход: 5%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,20 (с, 3Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,98 (т, J=8,6 Гц, 2Н), 7,12 (м, 2Н), 7,26 (м, 2Н), 7,84 (с, 1H), 8,29 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 10
4,6-бис(4-фторфенил)-2,3-диметил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 11
4,6-бис(4-фторфенил)-1,3-диметил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 4) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина и йодометан вместо йодоэтана, получают указанные в заголовке соединения.
Пример 10: выход: 53%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,03 (с, 3Н), 4,13 (с, 3Н), 6,79 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,88 (т, J=8,8 Гц, 2Н), 6,98-7,11 (комплексный сигнал, 4Н), 7,30 (м, 2Н), 8,26 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 11: выход: 30%; 1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 2,01 (ушир.с, 3Н), 4,15 (ушир.с, 3Н), 6,81 (м, 2Н), 6,93 (м, 2Н), 7,00 (м, 2Н), 7,07 (м, 2Н), 7,30 (м, 2Н), 8,23 (м, 2Н).
ПРИМЕР 12
2-[2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 13
1-[2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
a) 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанол
К раствору 2-(4-пиперидил)этанола (9,63 г, 74,5 ммоль) в ДМФА (100 мл) при 0°C медленно добавляют ди-трет-бутил дикарбонат (16,26 г, 74,5 моль). Полученную смесь перемешивают в течение ночи при комнатной температуре. Растворитель концентрируют и остаток растворяют в смеси EtOAc и воды. Фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 15,09 г нужного продукта (выход: 88%).
b) 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил метансульфонат
К раствору 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанола (7,50 г, 32,7 ммоль, полученного в разделе a) в CHCl3 (180 мл) в атмосфере аргона и при охлаждении до 0°C добавляют триэтиламин (4,6 мл). Затем по каплям добавляют метансульфонилхлорид (2,6 мл, 32,7 ммоль). Полученную смесь перемешивают в течение ночи при комнатной температуре. Добавляют воду и фазы разделяют. Водную фазу экстрагируют CHCl3 (×3). Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 11,18 г нужного соединения (выход: количественный).
c) Указанное в заголовке соединение
Получают указанные в заголовке соединения по способу, раскрытому в примерах 6 и 7, но используя 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил метансульфонат (полученный в разделе b) вместо йодоэтана.
Пример 12: выход: 14%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,00-1,40 (комплексный сигнал, 3Н), 1,45 (с, 9Н), 1,70 (м, 2Н), 2,66 (м, 2Н), 2,05 (м, 2Н), 4,09 (м, 2Н), 4,90 (т, J=7,4 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,77 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 13: выход: 29%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,00-1,40 (комплексный сигнал, 3Н), 1,46 (с, 9Н), 1,82 (м, 2Н), 1,98 (м, 2Н), 2,67 (м, 2Н), 4,08 (м, 2Н), 4,65 (т, J=7,0 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,25 (м, 2Н), 7,28 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 14
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 15
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
a) метансульфонат 1-(трет-бутоксикарбонил)пиперидин-4-ила
По способу, раскрытому в примерах 12 и 13, в разделе b, но используя (1-трет-бутоксикарбонил)пиперидин-4-ол вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанола, получают нужное соединение (выход: 97%).
b) Указанные в заголовке соединения
По способу, раскрытому в примерах 6 и 7, но используя 4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин (полученный в примере 4) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина и метансульфонат 1-(трет-бутоксикарбонил)пиперидин-4-ила (полученный в разделе a) вместо йодоэтана, получают указанные в заголовке соединения.
Пример 14: выход: 13%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,51 (с, 9Н), 1,97 (м, 2Н), 2,06 (с, 3Н), 2,45 (м, 2Н), 2,94 (м, 2Н), 4,35 (м, 3Н), 6,78 (д, J=6,0 Гц, 2Н), 6,87 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,10 (м, 2Н), 7,33 (м, 2H), 8,26 (д, J=6,0 Гц, 2H).
Пример 15: выход: 52%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,54 (с, 9H), 2,00 (с, 3Н), 2,00 (м, 2Н), 2,31 (м, 2Н), 2,99 (м, 2Н), 4,33 (м, 2Н), 5,10 (м, 1Н), 6,78 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,08 (м, 2Н), 7,30 (м, 2Н), 8,27 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 16
2-(3-хлорпропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 17
1-(3-хлорпропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 1-бром-3-хлорпропан вместо йодоэтана, получают указанные в заголовке соединения.
Пример 16: выход: 28%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,54 (м, 2Н), 3,52 (т, J=6,0 Гц, 2Н), 4,61 (т, J=6,0 Гц, 2Н), 6,81 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,86 (т, J=8,8 Гц, 2Н), 6,98 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,28 (м, 2Н), 7,83 (с, 1Н), 8,29 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 17: выход: 19%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,51 (м, 2Н), 3,61 (т, J=6,3 Гц, 2Н), 4,78 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,26 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 18
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол
СПОСОБ A
a) 4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин
Суспензию 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (0,30 г, 0,8 ммоль, полученного в примере 1), KOH (0,05 г, 0,8 ммоль) и краун эфира 18-C-6 (0,01 г, 0,03 ммоль) в толуоле (10 мл) нагревают до 100°C в течение 1 часа. Добавляют 2-(3-бромпропокси)тетрагидропиран (0,17 г, 0,8 ммоль) и перемешивают при 100°C в течение 24 часов. Суспензию оставляют охлаждаться, добавляют воду и EtOAc и фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,22 г нужного соединения (выход: 54%).
ЖХ-МС (способ 1): tR = 7,60 мин; m/z = 527,2 [M+H]+.
b) Указанное в заголовке соединение
Раствор 4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридина (0,22 г, 0,42 ммоль, полученного в разделе a) в смеси 4:2:1 AcOH:ТГФ:H2O (9 мл) нагревают при 55°C в течение 3 часов. Раствор оставляют охлаждаться и концентрируют. К остатку добавляют насыщенный NaHCO3 и 1 н. NaOH и остаток экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 0,15 г указанного в заголовке соединения (выход: 83%).
ЖХ-МС (способ 1): tR = 5,37 мин; m/z = 443,1 [M+H]+.
ПРИМЕР 18
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол
ПРИМЕР 19
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропан-1-ол
СПОСОБ B
По способу, раскрытому в примерах 6 и 7, но используя 3-йодопропанол вместо йодоэтана, получают указанные в заголовке соединения.
Пример 18: выход: 33%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,58 (с, OH+H2O), 2,17 (м, 2Н), 3,71 (м, 2Н), 4,63 (т, J=6,4 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,29 (м, 2Н), 7,82 (с, 1Н), 8,33 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 19: выход: 21%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (с, OH+H2O), 2,17 (м, J=5,9 Гц, 2Н), 3,58 (м, 2Н), 4,78 (т, J=6,0 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,7 Гц, 2Н), 7,02 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,27 (м, 2Н), 7,90 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 20
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 21
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, аналогичному способам, раскрытым в примерах 6 и 7, но используя 1-(трет-бутоксикарбонил)пиперидин-4-ил метансульфонат (полученный в примере 14, в разделе a) вместо йодоэтана, получают указанные в заголовке соединения.
Пример 20: выход: 30%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,48 (с, 9Н), 2,00-2,20 (м, 4Н), 2,87 (м, 2Н), 4,21 (м, 2Н), 4,50 (м, 1Н), 6,73 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,81 (т, J=8,7 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 7,03 (м, 2Н), 7,20 (м, 2Н), 7,73 (с, 1Н), 8,23 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н).
Пример 21: выход: 28%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,46(с, 9Н), 2,10-2,30 (комплексный сигнал, 4Н), 2,96 (м, 2Н), 4,30 (м, 2Н), 4,60 (м, 1Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,31 (м, 2Н), 7,82 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 22
2-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 23
1-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин
К суспензии 4,6-дифенил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (0,10 г, 0,3 ммоль, полученного в примере 2) в ацетоне (1 мл), в атмосфере аргона добавляют KOH (21 мг, 0,4 ммоль). Затем добавляют раствор йодометана (47 мг, 0,3 ммоль) в ацетоне (0,1 мл) и перемешивают в течение ночи при комнатной температуре. Добавляют воду и экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 47 мг 2-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 47%) и 38 мг 1-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-в]пиридина (выход: 38%).
Пример 22: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,24 (с, 3Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,16-7,21 (комплексный сигнал, 4Н), 7,26-7,31 (комплексный сигнал, 6Н), 7,77 (с, 1H), 8,24 (дд, Jо=1,5 Гц, Jm= 4,5 Гц, 2Н).
Пример 23: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,23 (с, 3Н), 6,81 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 7,17 (м, 2Н), 7,22-7,32 (комплексный сигнал, 8Н), 7,89 (с, 1H), 8,26 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 24
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[2-(тетрагидропиран-2-
илокси)этил]пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 2-(2-бромэтокси)тетрагидропиран вместо йодоэтана, получают указанное в заголовке соединение (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,48-1,63 (комплексный сигнал, 6Н), 3,47 (м, 1Н), 3,67 (м, 1Н), 4,02 (м, 1Н), 4,22 (м, 1Н), 4,57 (м, 1Н), 4,65 (м, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,31 (м, 2Н), 7,92 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 25
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]этанол
По способу, раскрытому в примерах 22 и 23, но используя 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 1) вместо 4,6-дифенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина и 2-бромэтанол вместо йодометана, получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,19 (м, 2Н), 4,32 (м, OH), 4,77 (т, J=4,7 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,95 (т, J=8,7 Гц, 2Н), 7,02 (т, J=8,6 Гц, 2Н), 7,15 (м, 2Н), 7,26 (м, 2Н), 7,89 (с, 1Н), 8,34 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 26
4,6-бис(4-фторфенил)-2-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 27
4,6-бис(4-фторфенил)-1-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
a) 1-хлорметил-4-(метилсульфанил)бензол
Раствор тионилхлорида (0,2 мл, 3,2 ммоль) в ТГФ (9 мл) медленно добавляют в атмосфере аргона к
4-(метилсульфанилфенил)метанолу (0,346 г, 2,2 ммоль). Полученную смесь перемешивают при комнатной температуре в течение 2 дней. Добавляют солевой раствор (9 мл) и фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 0,37 г нужного соединения (выход: 95%).
b) Указанные в заголовке соединения
В мерную колбу вводят 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин (0,30 г, 78,0 ммоль, полученный в примере 1) и ДМФА (3,5 мл) в атмосфере аргона. Добавляют KOH (0,06 г, 1,1 ммоль) с последующим добавлением раствора 1-хлорметил-4-(метилсульфанил)бензола (0,15 г, 0,9 ммоль, полученного в разделе a) в ДМФА (0,4 мл). Раствор нагревают при 60°C в течение ночи. Раствор оставляют охлаждаться и концентрируют. Остаток растворяют в смеси воды и EtOAc. Две фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,10 г 4,6-бис(4-фторфенил)-2-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 25%) и 0,19 г 4,6-бис(4-фторфенил)-1-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 47%).
Пример 26: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,50 (с, 3Н), 5,60 (с, 2Н), 6,84 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,92 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,05 (м, 2Н), 7,24-7,37 (комплексный сигнал, 6Н), 7,76 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
Пример 27: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,49 (с, 3Н), 5,77 (с, 2Н), 6,85 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,97 (т, J=8,8 Гц, 2Н), 7,03 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,24-7,33 (комплексный сигнал, 4Н), 7,42 (д, J=8,1 Гц, 2Н), 7,89 (с, 1Н), 8,36 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 28
2-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 29
1-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
a) (4-пиперидил)метанол
К суспензии LiAlH4 (10,10 г, 0,266 моль) в ТГФ (150 мл) при 0°C медленно добавляют раствор этил пиперидин-4-карбоксилата (18,13 г, 0,120 моль) в ТГФ (300 мл). Раствор перемешивают при комнатной температуре в течение ночи. Раствор охлаждают, используя баню со льдом, и медленно добавляют смесь воды (14 мл) и ТГФ (28 мл). После этого добавляют смесь 15% водного NaOH (14 мл) и воды (37 мл) с последующим перемешиванием при комнатной температуре в течение 30 минут. Полученный осадок фильтруют и фильтрат концентрируют, получая 17,88 г нужного соединения (выход: количественный).
b) [1-(трет-бутоксикарбонил)пиперидин-4-ил]метанол
По способу, раскрытому в примере 12, в разделе a, но используя (4-пиперидил)метанол (полученный в разделе a этого примера) вместо 2-(4-пиперидил)этанола, получают указанное в заголовке соединение (выход: 77%).
c) [1-(трет-бутоксикарбонил)пиперидин-4-ил]метил метансульфонат
По способу, раскрытому в примере 12, в разделе b, но используя [1-(трет-бутоксикарбонил)пиперидин-4-ил]метанол (полученный в разделе b этого примера) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанола, получают указанное в заголовке соединение (выход: 71%).
d) Указанные в заголовке соединения
По способу, раскрытому в примерах 26 и 27, но используя [1-(трет-бутоксикарбонил)пиперидин-4-ил]метил метансульфонат (полученный в разделе c) вместо 1-хлорметил-4-метилсульфанил)бензола, получают указанные в заголовке соединения.
Пример 28: выход: 22%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,47 (с, 9Н), 1,63 (м, 2Н), 2,43 (м, 1Н), 2,72 (м, 2Н), 4,15 (м, 2Н), 4,33 (д, J=7,2 Гц, 2Н), 6,86 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,17 (м, 2Н), 7,33 (м, 2Н), 7,77 (с, 1Н), 8,35 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2H).
Пример 29: выход: 71%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,20-1,8 (комплексный сигнал, 5Н), 1,49 (с, 9Н), 2,35 (м, 1Н), 2,74 (м, 2Н), 4,15 (м, 2Н), 4,54 (д, J=7,2 Гц, 2Н), 6,86 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,97 (т, J=8,7 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,18 (м, 2Н), 7,28 (м, 2Н), 7,90 (с, 1Н), 8,36 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 30
4,6-бис(4-фторфенил)-2-[2-(морфолин-4-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 31
4,6-бис(4-фторфенил)-1-[2-(морфолин-4-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 26 и 27, но используя гидрохлорид 4-(2-хлорэтил)морфолина вместо 1-хлорметил-4-(метилсульфанил)бензола и 2 эквивалента KOH, получают указанные в заголовке соединения.
Пример 30: выход: 10%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,55 (м, 4Н), 3,06 (т, J=6,4 Гц, 2Н), 3,70 (м, 4Н), 4,58 (т, J=6,4 Гц, 2Н), 6,86 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,9 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,16 (м, 2Н), 7,31 (м, 2Н), 7,88 (с, 1Н), 8,35 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 31: выход: 24%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,63 (м, 4Н), 3,04 (т, J=6,9 Гц, 2Н), 3,69 (м, 4Н), 4,77 (т, J=6,8 Гц, 2Н), 6,86 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,05 (т, J=8,7 Гц, 2Н), 7,18 (м, 2Н), 7,28 (м, 2Н), 7,90 (с, 1Н), 8,36 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 32
Этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетат
ПРИМЕР 33
Этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]ацетат
По способу, раскрытому в примерах 26 и 27, но используя этил бромацетат вместо 1-хлорметил-4-(метилсульфанил)бензола, получают указанные в заголовке соединения.
Пример 32: выход: 6%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,32 (т, J=7,2 Гц, 3Н), 4,32 (c, J=7,2 Гц, 2Н), 5,27 (с, 2Н), 6,86 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,6 Гц, 2Н), 7,18 (м, 2Н), 7,32 (м, 2Н), 7,93 (с, 1Н), 8,35 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 33: выход: 21%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,32 (т, J=7 Гц, 3Н), 4,31 (c, J=6,9 Гц, 2Н), 5,42 (с, 2Н), 6,84 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н), 6,95 (т, J=8,7 Гц, 2Н), 7,05 (т, J=8,7 Гц, 2Н), 7,19 (м, 2Н), 7,28 (м, 2Н), 7,98 (с, 1Н), 8,36 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 34
Этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионат
ПРИМЕР 35
Этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионат
По способу, раскрытому в примерах 26 и 27, но используя этил 3-бромпропионат вместо 1-хлорметил-4-(метилсульфанил)бензола, получают указанные в заголовке соединения.
Пример 34: выход: 5%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,26 (т, J=7,2 Гц, 3Н), 3,20 (т, J=6,3 Гц, 2Н), 4,31 (c, J=7,2 Гц, 2Н), 4,76 (т, J=6,3 Гц, 2Н), 6,85 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,8 Гц, 2Н), 7,03 (т, J=8,5 Гц, 2Н), 7,16 (м, 2Н), 7,32 (м, 2Н), 7,92 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 35: выход: 3%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,25 (т, J=7,2 Гц, 3Н), 3,10 (т, J=7,2 Гц, 2Н), 4,17 (c, J=7,1 Гц, 2Н), 4,94 (т, J=7,0 Гц, 2Н), 6,85 (дд, Jо=1,6 Гц, Jm=4,6 Гц, 2Н), 6,96 (т, J=8,6 Гц, 2Н), 7,04 (т, J=8,6 Гц, 2Н), 7,18 (м, 2Н), 7,31 (м, 2Н), 7,89 (с, 1Н), 8,36 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 36
4,6-бис(4-фторфенил)-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
К раствору 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,62 г, 1,1 ммоль, полученного в примере 20) в
CH2Cl2 (19 мл), в атмосфере аргона и охлажденному до 0°C, добавляют трифторуксусную кислоту (1,8 мл). Раствор перемешивают при комнатной температуре в течение 2,5 часа. Растворитель выпаривают. Остаток растворяют в CHCl3 и промывают 1 н. NaOH и солевым раствором. Органическую фазу сушат над Na2SO4 и концентрируют досуха, получая 319 мг указанного в заголовке соединения (выход: 62%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,71 (ушир.с, NH+H2O), 2,21 (м, 2Н), 2,34 (м, 2Н), 2,88 (м, 2Н), 3,35 (м, 2Н), 4,54 (м, 1Н), 6,87 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,95 (т, J=8,7 Гц, 2Н), 7,06 (т, J=8,6 Гц, 2Н), 7,18 (м, 2Н), 7,34 (м, 2Н), 7,88 (с, 1Н), 8,36 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 37
4,6-бис(4-фторфенил)-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 21) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 29%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,62 (ушир.с, NH+H2O), 2,13 (м, 2Н), 2,32 (м, 2Н), 2,92 (м, 2Н), 3,33 (м, 2Н), 4,52 (м, 1Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,27 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 38
4,6-бис(4-фторфенил)-2-(4-пиперидилметил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 28) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 13%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,30-1,80 (комплексный сигнал, 4Н), 1,63 (ушир.с, NH+H2O), 2,38 (м, 1Н), 2,64 (м, 2Н), 3,14 (м, 2Н), 4,32 (д, J=7,2Н), 6,86 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,8 Гц, 2Н), 7,04 (т, J=8,6 Гц, 2Н), 7,18 (м, 2Н), 7,33 (м, 2Н), 7,78 (с, 1Н), 8,35 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 39
4,6-бис(4-фторфенил)-1-(4-пиперидилметил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 1-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 29) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 12%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,80-2,10 (комплексный сигнал, 4Н), 2,47 (м, 1Н), 3,0 (м, 3Н), 3,50 (м, 2Н), 4,63 (д, J=6,6 Гц, 2Н), 7,04 (т, J=8,4 Гц, 2Н), 7,12-7,16 (комплексный сигнал, 4Н), 7,22 (м, 2Н), 7,31 (м, 2Н), 7,95 (с, 1Н), 8,58 (д, J=6,6, 2Н).
ПРИМЕР 40
4,6-бис(6-хлорпиридин-3-ил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1 в способе A, но используя 1-(6-хлорпиридин-3-ил)-2-(4-пиридил)этанон (полученный в сравнительном примере 9) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона, получают указанное в заголовке соединение (выход: 17%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 6,90 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,21 (д, J=8,4 Гц, 1Н), 7,30 (д, J=8,4 Гц, 1Н), 7,38 (дд, Jо=2,5 Гц, Jm=8,3 Гц, 1Н), 7,49 (дд, Jо=2,4 Гц, Jm=8,4 Гц, 1Н), 8,00 (с, 1Н), 8,36 (д, J=2,4 Гц, 1Н), 8,46-8,48 (комплексный сигнал, 3Н), 11,34 (ушир.с, 1Н).
ПРИМЕР 41
4,6-бис(4-фторфенил)-3-метил-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 14) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 73%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,55 (ушир.с, NH+H2O), (с, 3Н), 2,35 (м, 2Н), 3,34 (м, 2Н), 3,85 (м, 2Н), 4,73 (м, 2Н), 4,75 (м, 1Н), 6,78 (д, J=6,3 Гц, 2Н), 6,89 (т, J=8,6 Гц, 2Н), 7,03-7,19 (комплексный сигнал, 4Н), 7,29 (м, 2Н), 8,27 (д, J=6,0 Гц, 2H).
ПРИМЕР 42
4,6-бис(4-фторфенил)-3-метил-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 15) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 59%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,55 (ушир.с, NH+H2O), 2,01 (с, 3Н), 2,07 (м, 2Н), 2,29 (м, 2Н), 2,90 (м, 2Н), 3,32 (м, 2Н), 4,75 (м, 1Н), 6,78 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,08 (м, 2Н), 7,30 (м, 2Н), 8,27 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 43
4,6-бис(4-фторфенил)-2-[2-(4-пиперидил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 12) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 88%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,00-1,60 (комплексный сигнал, 3Н), 1,66 (с, NH+H2O), 1,74 (м, 2Н), 2,03 (м, 2Н), 2,60 (м, 2Н), 3,10 (м, 2Н), 4,85 (т, J=7,2 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,30 (м, 2Н), 7,76 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 44
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусная кислота
К раствору этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетата (0,09 г, 0,2 ммоль, полученному в примере 32) в EtOH (4,2 мл) добавляют раствор KOH (0,09 г, 2,5 ммоль) в воде (0,5 мл). Раствор нагревают при кипячении с обратным холодильником в течение 1 часа. Его оставляют охлаждаться и концентрируют. Остаток растворяют в смеси EtOAc и воды. Фазы разделяют. Водную фазу подкисляют и экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха, получая 57 мг указанного в заголовке соединения (выход: 66%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,00 (ушир.с, 1H+CD3OD), 5,28 (ушир.с, 2Н), 6,92-7,05 (комплексный сигнал, 6Н), 7,15-7,30 (комплексный сигнал, 4Н), 8,02 (ушир.с, 1Н), 8,26 (м, 2Н).
ПРИМЕР 45
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]уксусная кислота
По способу, раскрытому в примере 44, но используя этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]ацетат (полученный в примере 33) вместо этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетата, получают указанное в заголовке соединение (выход: 96%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 3,88 (ушир.с, 1H+CD3OD), 5,32 (с, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,88 (т, J=8,7 Гц, 2Н), 6,98 (т, J=8,6 Гц, 2Н), 7,11 (м, 2Н), 7,20 (м, 2Н), 7,90 (с, 1Н), 8,21 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 46
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионовая кислота
По способу, раскрытому в примере 44, но используя этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионат (полученный в примере 34) вместо этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетата, получают указанное в заголовке соединение (выход: 69%)
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 3,08 (т, J=6,3 Гц, 2Н), 4,50 (ушир.с, 1H+CD3OD), 4,72 (т, J=6,3 Гц, 2Н), 6,88 (дд, Jо=1,6 Гц, Jm=4,6 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,23 (м, 2Н), 8,03 (с, 1Н), 8,21 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 47
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионовая кислота
По способу, раскрытому в примере 44, но используя этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионат (полученный в примере 35) вместо этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетата, получают указанное в заголовке соединение (выход: 88%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 3,02 (т, J=7,2 Гц, 2Н), 4,50 (ушир.с, 1H+CD3OD), 4,86 (т, J=7,3 Гц, 2Н), 6,87 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,12 (м, 2Н), 7,24 (м, 2Н), 7,84 (с, 1Н), 8,21 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 48
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-1-(морфолин-4-ил)этанон
К раствору 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты (0,05 г, 0,1 ммоль, полученной в примере 44) в ДМФА (1 мл) добавляют в атмосфере аргона N,N'-дициклогексилкарбодиимид (0,02 г, 0,1 ммоль) и 1-гидроксибензотриазол (0,02 г, 0,1 ммоль). Полученную смесь перемешивают в течение 15 минут и добавляют морфолин (0,01 г, 0,1 ммоль). Смесь перемешивают при комнатной температуре в течение 2 дней. Добавляют EtOAc и полученную смесь фильтруют. Фильтрат промывают насыщенным раствором NaHCO3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 18 мг указанного в заголовке соединения (выход: 35%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,66-3,76 (комплексный сигнал, 8Н), 5,30 (с, 2Н), 6,82 (д, J=5,7 Гц, 2Н), 6,91 (т, J=8,8 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,99 (с, 1Н), 8,32 (д, J=6,0 Гц, 2Н).
ПРИМЕР 49
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]ацетамид
По способу, раскрытому в примере 48, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]уксусную кислоту (полученную в примере 45) вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты и водный NH3 вместо морфолина, получают указанное в заголовке соединение (выход: 36%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,35 (с, 2Н), 5,56 (ушир.с, 1Н), 6,15 (ушир.с, 1Н), 6,85 (д, J=5,4 Гц, 2Н), 6,96 (т, J=8,6 Гц, 2Н), 7,06 (т, J=8,6 Гц, 2Н), 7,17 (м, 2Н), 7,29 (м, 2Н), 8,01 (с, 1Н), 8,38 (д, J=5,4 Гц, 2Н).
ПРИМЕР 50
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-1-(морфолин-4-ил)этанон
По способу, раскрытому в примере 48, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]уксусную кислоту (полученную в примере 45) вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты, получают указанное в заголовке соединение (выход: 60%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,67-3,70 (комплексный сигнал, 4Н), 3,75-3,81 (комплексный сигнал, 4Н), 5,50 (с, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,95 (т, J=8,7 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,17 (м, 2Н), 7,27 (м, 2Н), 7,99 (с, 1Н), 8,35 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 51
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-1-(морфолин-4-ил)пропан-1-он
По способу, раскрытому в примере 48, но используя 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионовую кислоту (полученную в примере 46) вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты, получают указанное в заголовке соединение (выход: 64%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,20 (т, J=6,0 Гц, 2Н), 3,45 (м, 2Н), 3,55-3,63 (комплексный сигнал, 6Н), 4,79 (т, J=6,1 Гц, 2Н), 6,81 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,30 (м, 2Н), 7,94 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н)
ПРИМЕР 52
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-N-пропилпропионамид
По способу, раскрытому в примере 48, но используя 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионовую кислоту (полученную в примере 47) вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты и пропиламин вместо морфолина, получают указанное в заголовке соединение (выход: 76%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 0,84 (т, J=7,3 Гц, 3Н), 1,42 (м, 2Н), 2,98 (т, J=6,7 Гц, 2Н), 3,18 (м, 2Н), 4,95 (т, J=6,7 Гц, 2Н), 6,05 (м, NH), 6,84 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,16 (м, 2Н), 7,32 (м, 2Н), 7,89 (с, 1Н), 8,36 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 53
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-1-(морфолин-4-ил)пропан-1-он
По способу, раскрытому в примере 48, но используя 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионовую кислоту (полученную в примере 47) вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты, получают указанное в заголовке соединение (выход: 72%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,13 (т, J=7,3 Гц, 2Н), 3,49 (м, 2Н), 3,63-3,67 (комплексный сигнал, 6Н), 4,99 (т, J=7,3 Гц, 2Н), 6,84 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,04 (т, J=8,7 Гц, 2Н), 7,16 (м, 2Н), 7,30 (м, 2Н), 7,89 (с, 1Н), 8,36 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н)
ПРИМЕР 54
4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 55
4,6-бис(4-фторфенил)-1-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
В мерную колбу в атмосфере аргона вводят молекулярные сита 4 Å (1 г, предварительно высушенные в течение 3 час при 200°C в вакууме), 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин (0,30 г, 0,8 ммоль, полученный в примере 1), (4-метилсульфанилфенил)бороновую кислоту (0,26 г, 1,6 ммоль), ацетат меди II (0,28 г, 1,6 ммоль), пиридин (0,12 г, 1,6 ммоль), триэтиламин (0,16 г, 1,6 ммоль) и CH2Cl2 (22 мл). Смесь перемешивают при комнатной температуре в течение 2 дней. Смесь фильтруют через целит и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 40 мг 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 10%) и 90 мг 4,6-бис(4-фторфенил)-1-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 23%).
Пример 54: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,46 (с, 3Н), 6,76 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,83 (т, J=8,7 Гц, 2Н), 6,95 (т, J=8,6 Гц, 2Н), 7,11 (м, 2Н), 7,26 (м, 2Н), 7,29 (д, J=8,7 Гц, 2Н), 7,83 (д, J=8,7 Гц, 2Н), 8,16 (с, 1Н), 8,26 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 55: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,46 (с, 3Н), 6,76 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,86 (т, J=8,7 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,08 (м, 2Н), 7,22 (м, 2Н), 7,34 (д, J=9,0 Гц, 2Н), 7,94 (с, 1Н), 8,23 (д, J=8,7 Гц, 2Н), 8,26 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 56
4,6-бис(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 57
4,6-бис(4-фторфенил)-2-(4-метилсульфонилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
К раствору 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,09 г, 0,2 ммоль, полученного в примере 54) в CH2Cl2 (3,5 мл) добавляют в атмосфере аргона 3-хлорпербензойную кислоту (0,04 г, 0,2 ммоль) и перемешивают в течение 2 час при комнатной температуре. Добавляют CHCl3 и промывают насыщенным раствором NaHCO3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 15 мг 4,6-бис(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 16%) и 10 мг 4,6-бис(4-фторфенил)-2-(4-метилсульфонилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 11%).
Пример 56: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,83 (с, 3Н), 6,90 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,96 (т, J=8,7 Гц, 2Н), 7,08 (т, J=8,7 Гц, 2Н), 7,24 (м, 2H), 7,36 (м, 2Н), 7,75 (HA из АВ системы, J=8,9 Гц, 2Н), 8,32 (HB из АВ системы, J=8,9 Гц, 2Н), 8,38 (с, 1Н), 8,39 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
Пример 57: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,16 (с, 3Н), 6,89 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,97 (т, J=8,7 Гц, 2Н), 7,09 (т, J=8,7 Гц, 2Н), 7,24 (м, 2Н), 7,36 (м, 2Н), 8,05 (НА из АВ системы, J=9,0 Гц, 2Н), 8,38 (HB из АВ системы, J=9,0 Гц, 2Н), 8,39 (дд, Jо=1,6 Гц, Jm=4,6 Гц, 2Н), 8,41 (с, 1Н).
ПРИМЕР 58
4,6-бис(4-фторфенил)-1-(4-метилсульфинилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 56, но используя 4,6-бис(4-фторфенил)-1-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 55) вместо 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 70%).
1H ЯМР (300 МГц, CDCl2) δ (TMS): 2,82 (с, 3Н), 6,90 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,09 (т, J=8,6 Гц, 2Н), 7,20 (м, 2Н), 7,35 (м, 2Н), 7,86 (дд, Jо=2,1 Гц, Jm=6,9 Гц, 2Н), 8,10 (с, 1Н), 8,41 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,69 (дд, Jо=1,8 Гц, Jm=6,9 Гц, 2Н).
ПРИМЕР 59
4,6-бис(4-фторфенил)-2-(4-метилсульфинилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 60
4,6-бис(4-фторфенил)-2-(4-метилсульфонилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 56, но используя 4,6-бис(4-фторфенил)-2-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 26) вместо 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанные в заголовке соединения.
Пример 59: выход: 48%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,74 (с, 3Н), 5,70 (с, 2Н), 6,85 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,8 Гц, 2Н), 7,02 (т, J=8,7 Гц, 2Н), 7,16 (м, 2Н), 7,32 (м, 2Н), 7,59 (HA из АВ системы, J=8,2 Гц, 2Н), 7,68 (HB из АВ системы, J=8,2 Гц, 2Н), 7,87 (с, 1Н), 8,39 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
Пример 60: выход: 16%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,07 (с, 3Н), 5,73 (с, 2Н), 6,85 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,8 Гц, 2Н), 7,16 (м, 2Н), 7,32 (м, 2Н), 7,61 (HA из АВ системы, J=8,7 Гц, 2Н), 7,89 (с, 1Н), 7,97 (HB из АВ системы, J=8,7 Гц, 2Н), 8,36 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 61
4,6-бис(4-фторфенил)-1-(4-метилсульфинилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 62
4,6-бис(4-фторфенил)-1-(4-метилсульфонилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 56, но используя 4,6-бис(4-фторфенил)-1-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 27) вместо 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанные в заголовке соединения.
Пример 61: выход: 69%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,71 (с, 3Н), 5,84 (с, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,25 (м, 2Н), 7,61 (HA из АВ системы, J=8,4 Гц, 2Н), 7,92 (HB из АВ системы, J=8,4 Гц, 2Н), 7,91 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
Пример 62: выход: 4%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,03 (с, 3Н), 5,87 (с, 2Н), 6,83 (д, J=6,0 Гц, 2Н), 6,94 (т, J=8,8 Гц, 2Н), 7,02 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,26 (м, 2Н), 7,60 (HA из АВ системы, J=8,2 Гц, 2Н), 7,91 (с, 1H), 7,93 (HB из АВ системы, J=8,2 Гц, 2Н), 8,34 (д, J=6,3 Гц, 2Н).
ПРИМЕР 63
3-хлор-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
К раствору 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (0,20 г, 0,5 ммоль, полученного в примере 1) в ДМФА (5 мл), в атмосфере аргона добавляют N-хлорсукцинимид (0,10 г, 0,8 ммоль) и полученную смесь нагревают до 60°C в течение 5 час. Ее промывают 1 н. NaOH и экстрагируют CHCl3 и EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 171 мг указанного в заголовке соединения (выход: 79%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (ушир.с, NH+H2O), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,98 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 8,35 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 64
3-бром-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
К суспензии 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (1,00 г, 2,6 ммоль, полученного в примере 1) в CHCl3 (10 мл), в атмосфере аргона добавляют раствор Br2 (0,69 г, 4,3 ммоль) в CHCl3 (3 мл). Добавляют ацетонитрил (4 мл) и полученную смесь перемешивают при комнатной температуре в течение 2 дней. Остаток концентрируют, растворяют в CHCl3 и промывают 1 н. NaOH. Образуется осадок, который фильтруют и растворяют в MeOH. Раствор концентрируют и промывают 1 н. NaOH. Раствор экстрагируют EtOAc, сушат над Na2SO4 и концентрируют. Раствор обрабатывают диэтиловым эфиром, растворитель декантируют и полученный продукт сушат, получая 1,16 г указанного в заголовке соединения (выход: 97%).
1H ЯМР (300 МГц, CD3OD) δ (TMS): 4,78 (ушир.с, NH+CD3OD), 6,89 (т, J=8,8 Гц, 2Н), 6,93-6,99 (комплексный сигнал, 4Н), 7,14 (м, 2Н), 7,27 (м, 2Н), 8,12 (дд, Jо =1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 65
4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрил
В мерную колбу в атмосфере аргона вводят 3-бром-4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин (0,20 г, 0,4 ммоль, полученный в примере 64), цианид меди (I) (0,05 г, 0,6 ммоль) и безводный 1-метил-2-пирролидон (1 мл) и нагревают при кипячении с обратным холодильником в течение 2 час. Смесь выливают в 10% водный раствор этилендиамина (4 мл) и экстрагируют CHCl3. В водную фазу добавляют солевой раствор и смесь экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая указанное в заголовке соединение в виде твердого вещества (выход: количественный).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,00 (ушир.с, NH+CD3OD), 6,80-7,40 (комплексный сигнал, 12Н), 8,25 (м, 2Н).
ПРИМЕР 66
3-бром-4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 64, но используя 4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 9) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 15%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,21 (с, 3Н), 6,78 (д, J=6,0 Гц, 2Н), 6,93-7,02 (комплексный сигнал, 4Н), 7,08 (м, 2Н), 7,27 (м, 2Н), 8,29 (д, J=6,0 Гц, 2Н).
ПРИМЕР 67
4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-карбоксамид
Раствор KOH (0,07 г, 1,3 ммоль) в tBuOH (2,5 мл) добавляют в атмосфере аргона к 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-карбонитрилу (0,05 г, 0,1 ммоль, полученному в примере 65) и нагревают при кипячении с обратным холодильником в течение ночи. Добавляют воду и EtOAc и фазы разделяют. Водную фазу экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 15 мг указанного в заголовке соединения в виде твердого вещества (выход: 28%)
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, NH2+H2O), 6,80 (д, J=4,5 Гц, 2Н), 6,90-7,10 (комплексный сигнал, 6Н), 7,30 (м, 2Н), 8,30 (д, J=4,5 Гц, 2Н).
ПРИМЕР 68
3-аминометил-4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин
LiAlH4 (0,06 г, 1,5 ммоль) и безводный диэтиловый эфир (2 мл) вводят в мерную колбу. Полученную смесь охлаждают на бане со льдом и по каплям добавляют раствор 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-карбонитрила (0,15 г, 0,4 ммоль, полученного в примере 65) в диэтиловом эфире (1 мл). Добавляют ТГФ (2 мл) и полученную смесь перемешивают при комнатной температуре в течение ночи. Смесь охлаждают на бане со льдом и последовательно добавляют воду (0,1 мл), ТГФ (0,2 мл), 15% водный NaOH (0,1 мл) и воду (0,3 мл). Полученный осадок фильтруют и промывают ТГФ. Растворитель из фильтрата выпаривают. Полученный остаток очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 71 мг указанного в заголовке соединения в виде твердого вещества (выход: 47%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,10 (ушир.с, NH2+H2O) 3,62 (с, 2Н), 6,80 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,6 Гц, 2Н), 7,11 (м, 2Н), 7,25 (м, 2Н), 8,30 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 69
4,6-бис(4-фтор-3-нитрофенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
К раствору 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (0,20 г, 0,5 ммоль, полученного в примере 1) в концентрированной H2SO4 (3 мл), в атмосфере аргона добавляют 65% HNO3 (0,1 мл, 0,2 ммоль). Смесь нагревают до 90°C в течение 30 мин. Смесь охлаждают на бане со льдом и величину рН доводят до 8, используя 1 н. NaOH. Смесь экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 69 мг указанного в заголовке соединения в виде твердого вещества (выход: 28%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,28 (с, NH+CD3OD), 7,03 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,22 (дд, Jо=2,7 Гц, Jm= 10,5 Гц, 1Н), 7,36 (дд, Jо=2,6 Гц, Jm=10,4 Гц, 1Н), 7,53 (м, 2Н), 7,99-8,01 (комплексный сигнал, 2Н), 8,13 (м, 1Н), 8,41 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 70
3-амино-6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в сравнительном примере 15, в разделе c, но используя 6-хлор-2-(4-фторфенил)-3,4'-бипиридин-5-карбонитрил (полученный в сравнительном примере 12) вместо 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила, получают указанное в заголовке соединение (выход: 41%).
1H ЯМР (300 МГц, CD3OD) δ (TMS): 4,38 (с, NH2+CD3OD), 7,05 (т, J=8,8 Гц, 2Н), 7,26 (дд, Jо=1,6 Гц, Jm=4,6 Гц, 2Н), 7,39 (м, 2Н), 8,27 (с, 1Н), 8,42 (дд, Jо=1,4 Гц, Jm=4,6 Гц, 2H).
ПРИМЕР 71
3-амино-6-(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в сравнительном примере 15, в разделе c, но используя 6-хлор-2-(4-фторфенил)-3,4'-бипиридин-5-карбонитрил (полученный в сравнительном примере 12) вместо 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила и метилгидразин вместо моногидрата гидразина, получают указанное в заголовке соединение (выход: 70%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,00 (с, 3Н), 4,17 (ушир.с, 2Н), 6,98 (т, J=8,7 Гц, 2Н), 7,09 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,37 (м, 2Н), 7,90 (с, 1Н), 8,50 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 72
4-[6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-4-ил]фенол
К раствору 1-(4-фторфенил)-2-(4-пиридил)этанона (0,30 г, 1,4 ммоль, полученного в сравнительном примере 1) в 2-метоксиэтаноле (2 мл), в атмосфере аргона добавляют 3-амино-2H-пиразол (0,13 г, 1,5 ммоль), 4-гидроксибензальдегид (0,17 г, 1,4 ммоль), 2-метоксиэтанол (2 мл) и 37% HCl (0,04 г, 0,4 ммоль). Полученную смесь кипятят с обратным холодильником в течение ночи. Ее оставляют охлаждаться и концентрируют. Полученный твердый продукт растворяют в CHCl3 и нескольких каплях MeOH. Добавляют насыщенный раствор NaHCO3 и водную фазу трижды экстрагируют CHCl3. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,22 г нужного соединения (выход: 41%).
ЖХ-МС (способ 1): tR = 5,56 мин; m/z = 383,0 [M+H]+.
ПРИМЕР 73
2-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 74
1-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
В мерную колбу в атмосфере аргона вводят 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (0,20 г, 0,5 ммоль, полученный в примере 1), KOH (0,03 г, 0,5 ммоль), 2-бром-1,1-диэтоксиэтан (0,10 г, 0,5 ммоль) и 1-метокси-2-(2-метоксиэтокси)этан (2 мл). Полученную смесь нагревают до 100°C и перемешивают при этой температуре в течение ночи. Смесь оставляют охлаждаться и добавляют смесь H2O-EtOAc. Фазы разделяют и водную фазу экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 139 мг 2-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 53%) и 60 мг 1-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (выход: 24%).
Пример 73: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,15 (т, J=7,0 Гц, 6Н), 3,50 (м, 2Н), 3,73 (м, 2Н), 4,49 (д, J=5,4 Гц, 2Н), 5,06 (т, J=5,4 Гц, 1Н), 6,83 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 74: 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,21 (т, J=6,9 Гц, 6Н), 3,58 (м, 2Н), 3,82 (м, 2Н), 4,74 (д, J=5,7 Гц, 2Н), 5,19 (т, J=5,7 Гц, 1Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,25 (м, 2Н), 7,87 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 75
4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-3-карбонитрил
По способу, раскрытому в примере 65, но используя 3-бром-4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 66) вместо 3-бром-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 48%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,32 (с, 3Н), 6,81 (дд, Jо= 1,5 Гц, Jm=4,5 Гц, 2Н), 6,96 (т, J=8,4 Гц, 2Н), 7,05 (т, J=8,4 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 8,35 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 76
3-бром-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-d]пиридин
К раствору 3-амино-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (0,20 г, 0,7 ммоль, полученного в примере 70) в 48% HBr (1 мл) при 0°C по каплям добавляют раствор NaNO2 (0,05 г, 0,7 ммоль) в воде (0,1 мл) в течение 15 минут, поддерживая температуру при 0-5°C. Полученную смесь перемешивают в течение 15 мин при этой температуре. Затем медленно добавляют при 0°C раствор CuBr (0,24 г, 1,7 ммоль) в 48% HBr (1 мл). Полученный раствор перемешивают в течение 3 час при 0°C. Раствор оставляют нагреться до комнатной температуры, нейтрализуют до pH = 7 насыщенным раствором бикарбоната натрия и 30% водным NH3. Раствор фильтруют и твердую часть промывают смесью CH2Cl2 и воды. Органическую фазу промывают 1 н. NaOH и водную фазу экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси CHCl3-MeOH возрастающей полярности, получая 50 мг указанного в заголовке соединения (выход: 21%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,24 (с, NH+CD3OD), 6,92 (м, 2Н), 7,15 (м, 2Н), 7,29 (м, 2Н), 7,95 (с, 1Н), 8,39 (д, J=6,0 Гц, 2Н).
ПРИМЕР 77
6-фторфенил -5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
3-амино-6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (0,20 г, 0,7 ммоль, полученный в примере 70) и раствор H3PO2 (0,2 мл, 2,0 ммоль) в воде (2 мл) смешивают и охлаждают до 5°C. По каплям добавляют раствор NaNO2 (0,10 г, 1,4 ммоль) в воде (0,4 мл). Смесь перемешивают в течение 30 мин при 5°C, оставляют до достижения комнатной температуры и перемешивают при комнатной температуре в течение 4 час. Смесь нейтрализуют 1 н. NaOH и экстрагируют CHCl3. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 63 мг указанного в заголовке соединения (выход: 33%).
1H ЯМР (300 МГц, MeOH+CDCl3) δ (TMS): 3,46 (с, NH+CD3OD), 6,92 (т, J=8,6 Гц, 2Н), 7,07 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 7,26 (м, 2Н), 8,08 (с, 1Н), 8,09 (с, 1Н), 8,37 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 78
N-метил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]амин
К раствору 2-(3-хлорпропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,07 г, 0,1 ммоль, полученного в примере 16) в ацетонитриле (0,3 мл), в атмосфере аргона добавляют метиламин (1,8 мл 33% раствора в EtOH, 14,6 ммоль). Смесь нагревают до 60°C в течение 3 дней, добавляя метиламин (0,9 мл и 3,6 мл 33% раствора в EtOH) через 24 и 48 часов соответственно. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 24 мг указанного в заголовке соединения в виде твердого вещества (выход: 29%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,00 (ушир.с, NH+H2O), 2,53 (м, 2Н), 2,61 (с, 3Н), 2,99 (т, J=6,7 Гц, 2Н), 4,67 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,27 (м, 2Н), 7,90 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 79
[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]метанол
Суспензию 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (0,20 г, 0,5 ммоль, полученного в примере 1) в 30-40% водном растворе формальдегида (0,9 мл) перемешивают при 130°C в атмосфере аргона в течение 4 часов. Растворитель концентрируют и остаток растворяют в смеси CHCl3 и воды и фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 140 мг указанного в заголовке соединения в виде твердого вещества (выход: 65%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,5 (т, 1Н, OH), 6,11 (д, J=7,8 Гц, 2Н), 6,85 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,97 (т, J=8,7 Гц, 1Н), 7,08 (т, J=8,7 Гц, 1Н), 7,16 (м, 2Н), 7,31 (м, 2Н), 7,97 (с, 1Н), 8,37 (дд, Jо=1,6 Гц, Jm=4,3 Гц, 2Н).
ПРИМЕР 80
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-N,N-диметилацетамид
ПРИМЕР 81
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-N,N-диметилацетамид
По способу, раскрытому в примерах 73 и 74, но используя 2-хлор-N,N-диметилацетамид вместо 2-бром-1,1-диэтоксиэтана, получают указанные в заголовке соединения.
Пример 80: выход: 10%.
Пример 81: выход 32%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,01 (с, 3Н), 3,18 (с, 3Н), 5,47 (с, 2Н), 6,79 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,91 (т, J=8,7 Гц, 1Н), 7,01 (т, J=8,6 Гц, 1Н), 7,15 (м, 2Н), 7,23 (м, 2Н), 7,95 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,3Гц, 2H).
ПРИМЕР 82
4,6-бис(4-фторфенил)-2-[2-(2-метоксиэтокси)этил]-5-(4-
пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 83
4,6-бис(4-фторфенил)-1-[2-(2-метоксиэтокси)этил]-5-(4-
пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 1-бром-2-(2-метоксиэтокси)этан вместо йодоэтана, получают указанные в заголовке соединения.
Пример 82: выход: 27%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,28 (с, 3Н), 3,45 (м, 2Н), 3,57 (м, 2Н), 4,05 (т, J=5,1 Гц, 2Н), 4,63 (т, J=5,1 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,93 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н),
Пример 83: выход: 19%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,32 (с, 3Н), 3,50 (м, 2Н), 3,68 (м, 2Н), 4,08 (т, J=6,0 Гц, 2Н), 4,81 (т, J=6,0 Гц, 2Н), 6,81 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,26 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 84
4,6-бис(4-фторфенил)-2-[3-(морфолин-4-ил)пропил]-5-(4-
пиридил)пиразоло[3,4-b]пиридин
a) 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропила метансульфонат
По способу, раскрытому в примере 12, в разделе b, но используя 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол (полученный в примере 18) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанола, получают нужное соединение (выход: количественный).
b) Указанное в заголовке соединение
В мерную колбу в атмосфере аргона вводят 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфонат (0,10 г, 0,2 ммоль, полученный в разделе a), NaI (0,003 г, 0,02 ммоль), морфолин (0,03 г, 0,4 ммоль) и 1,2-диметоксиэтан (2 мл). Полученную смесь нагревают до 90°C и перемешивают при этой температуре в течение ночи. Добавляют смесь воды и EtOAc. Фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 37 мг указанного в заголовке соединения (выход: 36%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,27 (м, 2Н), 2,30-2,43 (комплексный сигнал, 6Н), 3,69 (м, 4Н), 4,53 (т, J=6,6 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,31 (м, 2Н), 7,81 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 85
4,6-бис(6-хлорпиридин-3-ил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 86
4,6-бис(6-хлорпиридин-3-ил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 73 и 74, но используя 4,6-бис(6-хлорпиридин-3-ил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 40) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина и йодометан вместо 2-бром-1,1-диэтоксиэтана, получают указанные в заголовке соединения.
Пример 85: выход: 26%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (с, NH+H2O), 4,32 (с, 3Н), 6,88 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,19 (д, J=8,4 Гц, 1Н), 7,31 (м, 2Н), 7,58 (дд, Jо=2,4 Гц, Jm=8,4 Гц, 1Н), 7,84 (с, 1Н), 8,37 (дд, Jо=2,4 Гц, Jm=6,9 Гц, 2Н), 8,43 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 86: выход: 27%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (с, NH+H2O), 4,26 (с, 3Н), 6,88 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 7,20 (д, J=8,4 Гц, 1Н), 7,29 (д, J=8,1 Гц, 1Н), 7,35 (дд, Jо=2,4 Гц, Jm=8,1 Гц, 1Н), 7,50 (дд, Jо =2,6 Гц, Jm=8,2 Гц, 1Н), 7,91 (с, 1Н), 8,34 (д, J=2,1 Гц, 1Н), 8,43-8,45 (комплексный сигнал, 3Н).
ПРИМЕР 87
4,6-бис(6-хлорпиридин-3-ил)-3-метил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1 в способе A, но используя 1-(6-хлорпиридин-3-ил)-2-(4-пиридил)этанон (полученный в сравнительном примере 9) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона и 3-амино-5-метил-2Н-пиразол вместо 3-амино-2H-пиразола, получают указанное в заголовке соединение (выход: 9%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 2,09 (с, 3Н), 3,51 (с, NH+H2O), 6,92 (м, 2Н), 7,23 (д, J=8,4 Гц, 1Н), 7,32 (м, 1Н), 7,51 (м, 1Н), 7,54 (дд, Jо=2,4 Гц, Jm=8,4 Гц, 1Н), 8,26 (ушир.с, 1Н), 8,35-8,38 (комплексный сигнал, 3Н).
ПРИМЕР 88
4,6-бис(6-метилпиридин-3-ил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе A, но используя 1-(6-метилпиридин-3-ил)-2-(4-пиридил)этанон (полученный в сравнительном примере 13) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона, получают указанное в заголовке соединение (выход: 23%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,59 (с, NH+H2O), 2,59 (с, 6Н), 6,90 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,99 (д, J=8,1 Гц, 1Н), 7,09 (д, J=7,8 Гц, 1Н), 7,33 (м, 2Н), 7,99 (с, 1Н), 8,39 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,47 (д, J=2,1 Гц, 1Н), 8,80 (ушир.с, 1Н).
ПРИМЕР 89
4,6-бис(4-фторфенил)-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя N-(2-бромэтил)фталимид вместо йодометана, получают указанное в заголовке соединение (выход: 29%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,32 (т, J=6,1 Гц, 2Н), 4,76 (т, J=6,0 Гц, 2Н), 6,81 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,88 (т, J=8,7 Гц, 2Н), 6,95 (т, J=8,6 Гц, 2Н), 7,07 (м, 2Н), 7,25 (м, 2Н), 7,50 (м, 2Н), 7,61 (с, 1Н), 7,71 (м, 2Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 90
2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
К раствору 4,6-бис(4-фторфенил)-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,09 г, 0,2 ммоль, полученного в примере 89) в EtOH (2 мл) добавляют моногидрат гидразина (0,02 г, 0,3 ммоль) и полученную смесь кипятят с обратным холодильником в течение 3 час. Добавляют смесь воды и EtOAc. Фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси CHCl3-MeOH возрастающей полярности, получая 57 мг указанного в заголовке соединения (выход: 83%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (с, NH2+H2O), 3,38 (т, J=5,7 Гц, 2Н), 4,49 (т, J=5,5 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,31 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо= 1,6Гц, Jm=4,6 Гц, 2H).
ПРИМЕР 91
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанол
Раствор 4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[2-(тетрагидропиран-2-илокси)этил]пиразоло[3,4-b]пиридина (1,08 г, 2,09 ммоль, полученного в примере 24) в смеси 4:2:1 AcOH:ТГФ:H2O (42 мл) нагревают при 55°C в течение ночи. Полученную смесь оставляют охлаждаться и подщелачивают насыщенным раствором NaHCO3 и экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 0,78 г указанного в заголовке соединения (выход: 87%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (ушир.с, OH+H2O), 4,21 (т, J=4,7 Гц, 2Н), 4,58 (т, J=4,7 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,27 (м, 2Н), 7,87 (с, 1Н), 8,33 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 92
6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 6-фторфенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 77) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина и йодометан вместо йодоэтана, получают указанное в заголовке соединение (выход: 35%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, NH+H2O), 4,31 (с, 3Н), 6,95 (т, J=8,7 Гц, 2Н), 7,11 (д, J=6,0 Гц, 2Н), 7,41 (м, 2Н), 8,01 (с, 1Н), 8,06 (с, 1Н), 8,51 (д, J=6,0 Гц, 2H).
ПРИМЕР 93
4,6-бис(4-фторфенил)-2-(3-фталимидопропил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя N-(3-бромпропил)фталимид вместо йодоэтана, получают указанное в заголовке соединение (выход: 31%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,54 (кв., J=6,4 Гц, 2Н), 3,79 (т, J=6,2 Гц, 2Н), 4,50 (т, J=6,6 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,02 (т, J=8,7 Гц, 2Н), 7,17 (м, 2Н), 7,28 (м, 2Н), 7,71 (м, 2Н), 7,83 (м, 2Н), 7,93 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 94
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетальдегид
В мерную колбу вводят 2-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (0,31 г, 0,6 ммоль, полученный в примере 73) и 1 н. HCl (2,6 мл). Полученную смесь нагревают при 100°C в течение 1 часа. Смесь оставляют охлаждаться, величину рН доводят до 7 и экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 166 мг указанного в заголовке соединения (выход: 65%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,26 (с, 2Н), 6,83 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н), 6,91 (т, J=8,5 Гц, 2Н), 7,00 (т, J=8,8 Гц, 2Н), 7,15 (м, 2Н), 7,30 (м, 2Н), 7,88 (с, 1Н), 8,31 (м, 2Н), 9,85 (с, 1Н).
ПРИМЕР 95
2-(3-аминопропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 90, но используя 4,6-бис(4-фторфенил)-2-(3-фталимидопропил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 93) вместо 4,6-бис(4-фторфенил)-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 49%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,54 (с, NH2+H2O), 2,19 (м, 2Н), 2,76 (т, J=6,7 Гц, 2Н), 4,57 (т, J=6,7 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,30 (м, 2Н), 7,81 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 96
N-[4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-илметил]-1-(трет-бутоксикарбонил)пиперидин-4-карбоксамид
По способу, раскрытому в примере 48, но используя 1-(трет-бутоксикарбонил)пиперидин-4-карбоновую кислоту вместо 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусной кислоты и 3-аминометил-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 68) вместо морфолина, получают указанное в заголовке соединение (выход: 26%).
ПРИМЕР 97
N-[4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-илметил]пиперидин-4-карбоксамид
По способу, раскрытому в примере 36, но используя N-[4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-илметил]-1-(трет-бутоксикарбонил)пиперидин-4-карбоксамид (полученный в примере 96) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 63%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,40-1,90 (комплексный сигнал, 3Н+H2O), 2,18 (м, 2Н), 2,63 (м, 2Н), 3,13 (м, 2Н), 4,15 (д, J=5,1 Гц, 2Н), 5,20 (ушир.с, 1H, NH), 6,20 (ушир.с, 1Н, NH), 6,78 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,7 Гц, 2Н), 7,08-7,14 (комплексный сигнал, 4Н), 8,30 (дд, Jо= 1,6 Гц, Jm=4,4 Гц, 2H).
ПРИМЕР 98
2-(3-бензилоксипропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 99
1-(3-бензилоксипропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 3-бромпропанолбензиловый эфир вместо йодоэтана, получают указанные в заголовке соединения.
Пример 98: выход: 43%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,38 (м, 2Н), 3,48 (т, J=5,6 Гц, 2Н), 4,44 (с, 2Н), 4,57 (т, J=6,7 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,10 (м, 2Н), 7,26-7,32 (комплексный сигнал, 7Н), 7,73 (с, 1Н), 8,32 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2H).
Пример 99: выход: 20%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,19 (м, 2Н), 3,58 (т, J=6,1 Гц, 2Н), 4,48 (с, 2Н), 4,75 (т, J=6,9 Гц, 2Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,12 (м, 2Н), 7,24 -7,33 (комплексный сигнал, 7Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2H).
ПРИМЕР 100
N,N-диэтил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
ПРИМЕР 101
N,N-диэтил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]этил]амин
По способу, раскрытому в примерах 6 и 7, но используя N-(2-хлорэтил)диэтиламингидрохлорид вместо йодоэтана и 2 эквивалента KOH, получают указанные в заголовке соединения.
Пример 100: выход: 5%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 0,99 (т, J=7,2 Гц, 6Н), 2,56 (c, J=7,1 Гц, 4Н), 3,08 (т, J=6,5 Гц, 2Н), 4,48 (т, J=6,5 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 101: выход: 73%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,05 (т, J=7,2 Гц, 6Н), 2,66 (c, J=7,2 Гц, 4Н), 3,09 (т, J=7,2 Гц, 2Н), 4,69 (т, J=7,2 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 6,98 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,26 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 102
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(3-пиридилметил)пиразоло[3,4-b]пиридин
ПРИМЕР 103
4,6-бис(4-фторфенил)-5-(4-пиридил)-1-(3-пиридилметил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 3-хлорметилпиридингидрохлорид вместо йодоэтана, получают указанные в заголовке соединения.
Пример 102: выход: 16%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,63 (с, 2Н), 6,81 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,8 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,10 (м, 2Н), 7,31 (м, 2Н), 7,82 (м, 2Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,61 (дд, Jо=1,5 Гц, Jm=4,8 Гц, 2Н), 8,68 (с, 1Н).
Пример 103: выход: 22%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,80 (с, 2Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,6 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,27 (м, 2Н), 7,79 (м, 1Н), 7,88 (с, 1Н), 8,32 (дд, Jо=1,4 Гц, Jm=4,4 Гц, 2Н), 8,56 (д, J=5,0 Гц, 2Н), 8,75 (с, 1Н).
ПРИМЕР 104
N,N-диметил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]амин
ПРИМЕР 105
N,N-диметил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропил]амин
По способу, раскрытому в примерах 6 и 7, но используя N-(3-хлорпропил)диметиламингидрохлорид вместо йодоэтана, получают указанные в заголовке соединения.
Пример 104: выход: 22%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,21-2,29 (комплексный сигнал, 10Н), 4,51 (т, J=6,6 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,89 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,81 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 105: выход: 19%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,18-2,27 (комплексный сигнал, 8Н), 2,43 (т, J=7,2 Гц, 2Н), 4,65 (т, J=7,1 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,8 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,27 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 106
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ол
В мерную колбу в атмосфере аргона вводят 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетальдегид (0,08 г, 0,2 ммоль, полученный в примере 94), триацетоксиборгидрид натрия (0,08 г, 0,4 ммоль), 4-гидроксипиперидин (0,02 г, 0,2 ммоль) и 1,2-дихлорэтан (3 мл). Полученную смесь перемешивают в течение ночи при комнатной температуре. Смесь концентрируют и добавляют смесь воды и EtOAc. Фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 19 мг указанного в заголовке соединения (выход: 20%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (ушир.с 1Н+OH+H2O), 1,85 (м, 2Н), 2,05 (м, 2Н), 2,30 (м, 2Н), 2,80 (м, 2Н), 3,01 (м, 2Н), 4,54 (м, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,6 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,34 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 107
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-2-гидроксипропан-1-ол
ПРИМЕР 108
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-2-гидроксипропан-1-ол
По способу, раскрытому в примерах 6 и 7, но используя 3-бромпропан-1,2-диол вместо йодоэтана, получают указанные в заголовке соединения.
Пример 107: выход: 17%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,49 (с, 1H, OH), 3,72 (м, 2Н), 4,32 (м, 1Н), 4,60 (м, 2Н), 5,30 (с, 1H, OH), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,88 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 108: выход: 26%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 3,65 (м, 2Н), 4,26 (м, 1Н), 4,78 (м, 2Н), 5,30 (с, 2Н, OH), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,94 (т, J=8,6 Гц, 2Н), 7,03 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,91 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 109
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(4-пиридилметил)пиразоло[3,4-b]пиридин
ПРИМЕР 110
4,6-бис(4-фторфенил)-5-(4-пиридил)-1-(4-пиридилметил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 4-хлорметилпиридингидрохлорид вместо йодоэтана, получают указанные в заголовке соединения.
Пример 109: выход: 29%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,63 (с, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,12 (м, 2Н), 7,23-7,33 (комплексный сигнал, 4Н), 7,84 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,61 (дд, Jо=1,5 Гц, Jm=4,8 Гц, 2Н).
Пример 110: выход: 15%; 5,80 (с, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,20-7,26 (комплексный сигнал, 4Н), 7,93 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,61 (дд, Jо=1,5 Гц, Jm=4,8 Гц, 2Н).
ПРИМЕР 111
N-(трет-бутоксикарбонил)-[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]амин
К раствору 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната (0,15 г, 0,3 ммоль, полученного в примере 84, в разделе a) в ацетонитриле (2 мл) в атмосфере аргона добавляют N-(трет-бутоксикарбонил)-N-(4-пиперидил)амин (0,12 г, 0,6 ммоль) и нагревают при 60°C в течение ночи. Добавляют смесь CHCl3 и насыщенного раствора NaHCO3. Фазы разделяют. Водную фазу экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 40 мг указанного в заголовке соединения (выход: 22%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,44 (ушир.с, 2Н+NH2+H2O), 1,95 (м, 2Н), 2,06 (м, 2Н), 2,25 (м, 2Н), 2,35 (м, 2Н), 3,46 (м, 2Н), 4,40 (м, 1Н), 4,51 (т, 2Н), 6,83 (д, J=6,0 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,80 (с, 1Н), 8,32 (д, J=6,0 Гц, 2Н).
ПРИМЕР 112
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 113
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 6-фторфенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 77) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина и 1-(трет-бутоксикарбонил)пиперидин-4-ил метансульфонат (полученный в примере 14, в разделе a) вместо йодоэтана, получают указанные в заголовке соединения.
Пример 112: выход: 26%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50 (с, 9Н), 2,17-2,32 (комплексный сигнал, 2Н), 2,99 (м, 2Н), 4,33 (м, 2Н), 4,60 (м, 1Н), 6,95 (т, J=8,7 Гц, 2Н), 7,11 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,41 (м, 2Н), 8,06 (с, 1Н), 8,07 (с, 1Н), 8,52 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
Пример 113: выход: 55%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50 (с, 9Н), 2,04 (м, 2Н), 2,30 (м, 2Н), 3,00 (м, 2Н), 4,42 (м, 2Н), 5,10 (м, 1Н), 7,00 (т, J=8,6 Гц, 2Н), 7,10 (дд, Jо=1,6 Гц, Jm=4,5 Гц, 2Н), 7,37 (м, 2Н), 8,07 (с, 1Н), 8,10 (с, 1Н), 8,52 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 114
3-метил-4,6-бис(6-метилпиридин-3-ил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе A, но используя 1-(6-метилпиридин-3-ил)-2-(4-пиридил)этанон (полученный в сравнительном примере 13) вместо 1-(4-фторфенил)-2-(4-пиридил)этанона и 3-амино-5-метил-2H-пиразол вместо 3-амино-2H-пиразола, получают указанное в заголовке соединение (выход: 24%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,07 (с, 3Н), 2,54 (с, 3Н), 2,57 (с, 3Н), 6,85 (м, 2Н), 6,99 (д, J=8,1 Гц, 1Н), 7,08 (д, J=8,1 Гц, 1Н), 7,30 (м, 1Н), 8,10 (дд, Jо=2,4 Гц, Jm=8,1 Гц, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,38 (с, 1Н), 8,57 (с, 1Н), 10,74 (ушир.с, NH).
ПРИМЕР 115
1-[3-[4,6-бис(4-фтофенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-он
В мерную колбу в атмосфере аргона вводят 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфонат (0,15 г, 0,3 ммоль, полученный в примере 84, в разделе a), NaI (0,008 г, 0,06 ммоль), гидрохлорид моногидрата 4-пиперидона (0,04 г, 0,3 ммоль), K2CO3 (0,07 г, 0,5 ммоль) и ДМФА (2 мл). Полученную смесь нагревают до 60°C в течение 24 час. Смесь оставляют охлаждаться и добавляют смесь воды и EtOAc. Фазы разделяют. Водную фазу экстрагируют EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-MeOH возрастающей полярности, получая 16 мг указанного в заголовке соединения (выход: 10%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (ушир.с, 4Н+H2O), 2,30 (м, 2Н), 2,42 (м, 2Н), 2,48 (м, 2Н), 2,73 (т, 2Н), 4,55 (т, 2Н), 6,83 (д, J=6,0 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,18 (м, 2Н), 7,27 (м, 2Н), 7,82 (с, 1Н), 8,32 (д, J=6,0 Гц, 2Н).
ПРИМЕР 116
N-(трет-бутоксикарбонил)-[1-[2-[4,6-бис(4-фторфенил)-5-(4-
пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин
a) 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат
По способу, раскрытому в примере 12, в разделе b, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанол (полученный в примере 91) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этанола, получают нужное соединение (выход: количественный).
b) Указанное в заголовке соединение
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната, получают нужное соединение (выход: 66%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,44 (с, 9Н), 1,57 (ушир.с, 1Н+NH+H2O), 1,90 (м, 2Н), 2,22 (м, 2Н), 2,82 (м, 2Н), 3,01 (т, J=6,6 Гц, 2Н), 3,45 (м, 1Н), 4,40 (м, 1Н), 4,52 (т, J=6,5 Гц, 2Н), 6,82 (д, J=5,7 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,82 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 117
N-метил-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и N-метил-N-(пиперидин-4-ил)амин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (ушир.с, 1Н+NH+H2O), 2,28 (с, 3Н), 2,41 (м, 4Н), 2,57 (м, 4Н), 3,03 (т, J=6,5 Гц, 2Н), 4,55 (т, J=6,5 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 118
[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]амин
По способу, раскрытому в примере 36, но используя N-(трет-бутоксикарбонил)-[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]амин (полученный в примере 111) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 89%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,35 (м, 2Н), 1,62 (ушир.с NH2+H2O), 1,85 (м, 2Н), 2,03 (м, 2Н), 2,25 (м, 2Н), 2,36 (м, 2Н), 2,70 (м, 1Н), 2,82 (м, 2Н), 4,52 (д, J=6,6 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 7,81 (с, 1Н), 8,31 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 119
2-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]этанол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 2-(4-пиперидил)этанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,48-1,53 (комплексный сигнал, 5Н), 2,11 (м, 2Н), 2,88 (м, 2Н), 2,99 (м, 2Н), 3,70 (т, J=6,5 Гц, 2Н), 4,55 (т, J=6,5 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 120
[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин
По способу, раскрытому в примере 36, но используя N-(трет-бутоксикарбонил)-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин (полученный в примере 116) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 77%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,38 (м, 2Н), 1,78 (ушир.с, 2Н+NH2+H2O), 2,18 (м, 2Н), 2,75 (м, 1Н), 2,84 (м, 2Н), 3,02 (т, J=6,3 Гц, 2Н), 4,54 (т, J=6,5 Гц, 2Н), 6,82 (д, J=5,7 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,84 (с, 1Н), 8,31 (д, J=6,0 Гц, 2Н).
ПРИМЕР 121
6-(4-фторфенил)-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 112) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 77%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,89 (м, NH+H2O), 2,25 (м, 2Н), 2,30 (м, 2Н), 2,89 (м, 2Н), 3,34 (м, 2Н), 4,60 (м, 1Н), 6,95 (т, J=8,7 Гц, 2Н), 7,11 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,40 (м, 2Н), 8,07 (с, 1Н), 8,08 (с, 1Н), 8,51 (дд, Jо= 1,6 Гц, Jm=4,4 Гц, 2H).
ПРИМЕР 122
6-(4-фторфенил)-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 113) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: количественный).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,60 (м, NH+H2O), 2,42 (м, 2Н), 2,67 (m 2Н), 3,28 (м, 2Н), 3,72 (м, 2Н), 5,28 (м, 1Н), 7,00 (т, J=8,7 Гц, 2Н), 7,11 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,37 (м, 2Н), 8,10 (с, 1Н), 8,12 (с, 1Н), 8,54 (дд, Jо= 1,6 Гц, Jm=4,4 Гц, 2H).
ПРИМЕР 123
3-амино-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин
По способу, раскрытому в сравнительном примере 15, в разделе c, но используя 2-хлор-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]пиридин-3-карбонитрил (полученный в сравнительном примере 14) вместо 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила, получают указанное в заголовке соединение (выход: 78%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,44 (с, 3Н), 4,32 (ушир.с, NH2), 6,61 (д, J=5,1 Гц, 1Н), 7,44-7,84 (комплексный сигнал, 2Н), 7,65 (д, J=7,2 Гц, 1Н), 7,84 (с, 1Н), 8,30 (д, J=5,1 Гц, 1Н), 8,40 (с, 1Н), 9,55 (ушир.с, NH).
ПРИМЕР 124
4,6-бис(4-фторфенил)-2-[3-[1-(трет-бутоксикарбонил)пиперазин-4-ил]пропил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 84, в разделе b, но используя 1-(трет-бутоксикарбонил)пиперазин вместо морфолина и добавляя триэтиламин (1,5 эквивалента), получают нужное соединение (выход: 14%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,66 (м, 2Н), 2,98 (м, 4Н), 3,10 (м, 2Н), 3,66-3,74 (комплексный сигнал, 4Н), 4,66 (м, 2Н), 6,85 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,98 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 125
4,6-бис(4-фторфенил)-2-[3-(пиперазин-1-ил)пропил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 4,6-бис(4-фторфенил)-2-[3-[1-(трет-бутоксикарбонил)пиперазин-4-ил]пропил]-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 124) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: количественный).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,78 (ушир.с, 2Н+NH+H2O), 2,26 (м, 2Н), 2,40-2,59 (комплексный сигнал, 6Н), 3,04 (м, 2Н), 4,52 (м, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,80 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 126
5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 77, но используя 3-амино-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин (полученный в примере 123) вместо 3-амино-6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 34%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,55 (ушир.с, NH+H2O), 6,70 (д, J=5,1 Гц, 1Н), 7,50 (м, 2Н), 7,72 (м, 1Н), 7,86 (с, 1Н), 8,24 (с, 1Н), 8,35 (д, J=5,1 Гц, 1Н), 8,54 (с, 1Н).
ПРИМЕР 127
5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 56, но используя 5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин (полученный в примере 126) вместо 4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина и 2 эквивалента м-хлорпербензойной кислоты, получают указанное в заголовке соединение (выход: количественный).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, NH+H2O), 3,22 (с, 3Н), 7,21 (д, J=5,1 Гц, 1Н), 7,49 (д, J=4,8 Гц, 2Н), 7,71 (м, 1Н), 7,84 (с, 1Н), 8,30 (с, 1Н), 8,71 (м, 2H).
ПРИМЕР 128
(1S)-N-(1-фенилэтил)-[4-[6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин
Смесь 5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридина (0,55 г, 0,13 ммоль, полученного в примере 127) и (1S)-1-фенилэтиламина (0,16 г, 1,3 ммоль) нагревают при 100°C в течение 1 часа. Смесь оставляют охлаждаться и полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси EtOAc-гексан возрастающей полярности, получая 10 мг указанного в заголовке соединения (выход: 16%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 1,50 (д, 3Н), 3,80 (ушир.с, 2 NH+H2O), 6,30 (д, 1Н), 7,20-7,40 (комплексный сигнал, 6Н), 7,50 (д, 1Н), 7,68 (д, 1Н), 7,76 (д, 1Н), 7,83 (с, 1Н), 8,08 (д, 1Н), 8,15 (с, 1Н), 8,24 (ушир.с, 1Н).
ПРИМЕР 129
1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ол
По способу, раскрытому в примере 111, но используя пиперидин-4-ол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 39%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (м, 2Н), 1,88-2,50 (комплексный сигнал, 5Н+OH+H2O), 2,75 (м, 2Н), 3,44-3,51 (комплексный сигнал, 4Н), 4,52 (т, J=6,6 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,34 (м, 2Н), 7,82 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 130
2-[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]этанол
По способу, раскрытому в примере 111, но используя 2-(4-пиперидил)этанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 44%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,20-2,00 (ушир.с, 8Н+OH+H2O), 2,50 (м, 1Н), 2,85 (м, 1Н), 3,50 (м, 1Н), 3,70 (м, 4Н), 4,59 (м, 2Н), 6,83 (д, J=6,0 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,89 (с, 1Н), 8,32 (д, J=6,0 Гц, 2Н).
ПРИМЕР 131
4,6-бис(4-фторфенил)-3-(4-пиперидил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
a) 3-(1-бензилпиперидин-4-ил)-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 1, в способе A, но используя 3-амино-5-(1-бензилпиперидин-4-ил)-2H-пиразол (полученный в сравнительном примере 15) вместо 3-амино-2H-пиразола, получают указанное в заголовке соединение (выход: 6%).
b) Указанное в заголовке соединение
К раствору 3-(1-бензилпиперидин-4-ил)-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (23 мг, 0,04 ммоль, полученного в предыдущем разделе) в MeOH (1 мл) в атмосфере аргона добавляют Pd/C и раствор HCOONH4 (0,01 г, 0,2 ммоль) в воде (0,06 мл). Полученную смесь нагревают при кипячении с обратным холодильником в течение 5 часов. Смесь фильтруют через целит и концентрируют. Остаток растворяют в CHCl3 и промывают насыщенным раствором NaHCO3, получая 2 мг указанного в заголовке соединения (выход: 10%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,10-1,90 (ушир.с, 7Н), 2,23 (м, 2Н), 2,99 (м, 2Н), 6,80 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,92 (т, J=8,7 Гц, 2Н), 7,02 (т, J=8,7 Гц, 2Н), 7,12 (м, 2Н), 7,28 (м, 2Н), 8,28 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 132
6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрил
По способу, раскрытому в примере 65, но используя 3-бром-6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 76) вместо 3-бром-4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 38%).
ПРИМЕР 133
2-[2-[[1-(трет-бутоксикарбонил)пиперидин-4-ил]амино]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4~фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и [N-(трет-бутоксикарбонил)пиперидин-4-ил]амин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 40%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,20 (м, 2Н), 1,45 (с, 9Н), 1,55 (ушир.с, NH+H2O), 1,83 (м, 2Н), 2,65 (м, 1Н), 2,77 (м, 2Н), 3,31 (т, 2Н), 4,02 (м, 2Н), 4,53 (т, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,28 (м, 2Н), 7,84 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 134
4,6-бис(4-фторфенил)-2-[2-[(4-пиперидил)амино]этил]-5-(4-
пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[2-[[1-(трет-бутоксикарбонил)пиперидин-4-ил]амино]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 133) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 97%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,30 (м, 2Н), 1,70 (ушир.с, 2NH+H2O), 1,85 (м, 2Н), 2,61 (м, 3Н), 3,09 (м, 2Н), 3,31 (т, J=5,7 Гц, 2Н), 4,53 (т, J=5,7 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,90 (т, J=8,8 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н).
ПРИМЕР 135
N-(2-метоксиэтил)-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 2-метоксиэтиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 63%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,57 (ушир.с, NH+H2O), 2,81 (т, J=5,1 Гц, 2Н), 3,30 (т, J=5,8 Гц, 2Н), 3,31 (с, 3Н), 3,45 (т, J=5,1 Гц, 2Н), 4,55 (т, J=5,7 Гц, 2Н), 6,82 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 136
1-[4-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперазин-1-ил]этанон
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 1-(пиперазин-1-ил)этанон вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,07 (с, 3Н), 2,50 (м, 4Н), 3,07 (т, J=6,3 Гц, 2Н), 3,41 (т, J=4,9 Гц, 2Н), 3,57 (т, J=4,9 Гц, 2Н), 4,55 (т, J=6,3 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,82 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 137
3-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол
ПРИМЕР 138
3-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропан-1-ол
По способу, раскрытому в примерах 6 и 7, но используя 4,6-дифенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 2) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина и 3-йодопропанол вместо йодоэтана, получают указанные в заголовке соединения.
Пример 137: выход: 44%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (с, OH+H2O), 2,25 (м, 2Н), 3,70 (м, 2Н), 4,62 (т, J=6,3 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,6 Гц, 2Н), 7,17-7,34 (комплексный сигнал, 10Н), 7,84 (с, 1Н), 8,26 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
Пример 138: выход: 27%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,58 (с, OH+H2O), 2,15 (м, 2Н), 3,59 (м, 2Н), 4,79 (т, J=6,0 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 ГЦ, 2Н), 7,17 (м, 2Н), 7,21-7,33 (комплексный сигнал, 8Н), 7,91 (с, 1Н), 8,27 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 139
2-этил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 140
1-этил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 4,6-дифенил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин (полученный в примере 2) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина, получают указанные в заголовке соединения.
Пример 139: выход: 12%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,67 (т, J=7,3 Гц, 3Н), 4,50 (c, J=7,3 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,15-7,34 (комплексный сигнал, 10Н), 7,80 (с, 1H), 8,25 (дд, Jо=1,5 Гц, Jm= 4,5 Гц, 2Н).
Пример 140: выход: 21%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (т, J=7,2 Гц, 3Н), 4,68 (c, J=7,2 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,17 (м, 2Н), 7,23-7,32 (комплексный сигнал, 8Н), 7,88 (с, 1Н), 8,26 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 141
4,6-дифенил-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя 4,6-дифенил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (полученный в примере 2) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина и N-(2-бромэтил)фталимид вместо йодоэтана, получают указанное в заголовке соединение (выход: 31%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 4,32 (т, J=6,1 Гц, 2Н), 4,75 (т, J=6,1 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,11 (м, 2Н), 7,18-7,32 (комплексный сигнал, 7Н), 7,73 (м, 2Н), 7,80 (с, 1Н), 7,83 (м, 2Н), 8,25 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 142
2-(2-аминоэтил)-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-d]пиридин
По способу, раскрытому в примере 90, но используя 2-(2-фталимидоэтил)-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 141) вместо 4,6-бис(4-фторфенил)-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 51%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50 (с, NH2+H2O), 3,37 (т, J=5,5 Гц, 2Н), 4,48 (т, J=5,4 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,17-7,34 (комплексный сигнал, 10Н), 7,86 (с, 1Н), 8,25 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 143
2-аллил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
ПРИМЕР 144
1-аллил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но используя аллилбромид вместо йодоэтана, получают указанные в заголовке соединения.
Пример 143: выход: 33%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,08 (д, J=6,3 Гц, 2Н), 5,40 (м, 2Н), 6,16 (м, 1Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,30 (м, 2Н), 7,78 (с, 1Н), 8,34 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
Пример 144: выход: 10%; 1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,22-5,34 (комплексный сигнал, 4Н), 6,14 (м, 1Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,93 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,87 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 145
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-он
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и гидрохлорид моногидрата 4-пиперидона вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина и добавляя триэтиламин (3 эквивалента), получают нужный продукт (выход: 18%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,41 (т, J=6,0 Гц, 4Н), 2,84 (т, J=6,0 Гц, 4Н), 3,20 (т, J=6,4 Гц, 2Н), 4,58 (т, J=6,4 Гц, 2Н), 6,83 (д, J=6,0 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,85 (с, 1Н), 8,32 (д, J=6,0 Гц, 2Н).
ПРИМЕР 146
3-аминометил-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 68, но используя 6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрил (полученный в примере 132) вместо 4,6-бис(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрила, получают указанное в заголовке соединение (выход: 22%).
1H ЯМР (300 МГц, CDCl3+CD3OD) δ (TMS): 4,24 (с, 2Н), 4,25 (ушир.с, NH+NH2+CD3OD), 6,95 (м, 2Н), 7,16 (м, 2Н), 7,29 (м, 2Н), 8,25 (ушир.с, 1Н), 8,38 (ушир.с, 2Н).
ПРИМЕР 147
3-амино-6-(4-фторфенил)-4-метил-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в сравнительном примере 15, в разделе c, но используя 6-хлор-2-(4-фторфенил)-4-метил-3,4'-бипиридин-5-карбонитрил (полученный в сравнительном примере 18) вместо 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила, получают указанное в заголовке соединение (выход: 27%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, NH+NH2+H2O), 2,51 (с, 3Н), 6,80-7,20 (комплексный сигнал, 4Н), 7,22 (м, 2Н), 8,55 (д, J=8,0 Гц, 2Н).
ПРИМЕР 148
3-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амино]пропан-1-ол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 3-амино-1-пропанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают указанное в заголовке соединение (выход: 57%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50-1,80 (комплексный сигнал, 2Н+NH+OH+H2O), 2,91 (т, J=5,7 Гц, 2Н), 3,31 (т, J=5,4 Гц, 2Н), 3,77 (т, J=5,4 Гц, 2Н), 4,54 (т, J=5,4 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,15 (м, 2Н), 7,29 (м, 2Н), 7,82 (с, 1Н), 8,31 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 149
N-этил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и этиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 58%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,09 (т, J=7,0 Гц, 3Н), 1,71 (ушир.с, NH+H2O), 2,70 (c, J=7,1 Гц, 2Н), 3,29 (т, J=5,7 Гц, 2Н), 4,56 (т, J=5,7 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,84 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 150
2-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амино]этанол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 2-аминоэтанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 54%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,70 (ушир.с, NH+OH+H2O), 2,82 (т, J=5,3 Гц, 2Н), 3,32 (т, J=5,6 Гц, 2Н), 3,62 (т, J=5,3 Гц, 2Н), 4,55 (т, J=5,6 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,83 (с, 1Н), 8,31 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 151
N-[(2-пиридил)метил]-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и (2-пиридил)метиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 52%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,62 (ушир.с, NH+H2O), 3,33 (т, J=5,7 Гц, 2Н), 3,92 (с, 2Н), 4,58 (т, J=5,7 Гц, 2Н), 6,83 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,6 Гц, 2Н), 7,14 (м, 4Н), 7,29 (м, 2Н), 7,60 (м, 1Н), 7,86 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 8,51 (м, 1Н).
ПРИМЕР 152
N-[(2-тиенил)метил]-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропила и (2-тиенил)метиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 25%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,55 (ушир.с, NH+H2O) 3,32 (т, J=5,6 Гц, 2Н), 4,00 (с, 2Н), 4,54 (т, J=5,6 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,91 (м, 1Н), 7,00 (т, J=8,6 Гц, 2Н), 7,16 (м, 3Н), 7,29 (м, 3Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 153
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-карбоксамид
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116 разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и пиперидин-4-карбоксамид вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61-1,76 (комплексный сигнал, 5Н), 1,84 (м, 2Н), 2,91 (м, 2Н), 3,01 (т, J=6,3 Гц, 2Н), 4,52 (т, J=6,3 Гц, 2Н), 5,27 (ушир.с, NH), 5,41 (ушир.с, NH), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,02 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,83 (с, 1Н), 8,32 (дд, Jо =1,4 Гц, Jm=4,6 Гц, 2H).
ПРИМЕР 154
4,6-бис(4-фторфенил)-2-[2-(пирролидин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и пирролидин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 75%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,77 (м, 4Н), 2,55 (м, 4Н), 3,17 (т, J=6,6 Гц, 2Н), 4,58 (т, J=6,6 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,84 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 155
(3R)-1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пирролидин-3-ол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и (3R)-3-пирролидинол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 52%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,69 (ушир.с, 1H+OH+H2O), 2,14 (м, 1Н), 2,40 (м, 1Н), 2,58 (м, 1Н), 2,69 (м, 1Н), 2,94 (м, 1Н), 3,20 (т, J=6,4 Гц, 2Н), 4,32 (м, 1Н), 4,57 (т, J=6,4 Гц, 2Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,82 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 156
2-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-метиламино]этанол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 2-(метиламино)этанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, OH+H2O), 2,34 (с, 3Н), 2,60 (т, J=5,2 Гц, 2Н), 3,14 (т, J=6,0 Гц, 2Н), 3,53 (т, J=5,2 Гц, 2Н), 4,53 (т, J=6,0 Гц, 2Н), 6,83 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,81 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 157
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[2-(1,2,3,4-тетрагидроизохинолин-2-ил)этил]пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 1,2,3,4-тетрагидроизохинолин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 57%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,78-2,85 (комплексный сигнал, 4Н), 3,20 (т, J=6,3 Гц, 2Н), 3,72 (с, 2Н), 4,63 (т, J=6,3 Гц, 2Н), 6,81 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,86-7,17 (комплексный сигнал, 10Н), 7,30 (м, 2Н), 7,86 (с, 1Н), 8,31 (дд, Jо= 1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 158
4,6-бис(4-фторфенил)-2-[2-(4-фенилпиперазин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 1-фенилпиперазин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 71%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,69 (м, 4Н), 3,10 (т, J=6,4 Гц, 2Н), 3,16 (м, 4Н), 4,59 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н), 6,86-7,02 (комплексный сигнал, 9Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 159
4,6-бис(4-фторфенил)-2-[2-[4-(1-пиперидил)пиперидин-1-ил]этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 4-пиперидинопиперидин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 51%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,40-1,60 (комплексный сигнал, 8Н), 1,78 (м, 2Н), 2,04-2,22 (комплексный сигнал, 3Н), 2,48 (м, 4Н), 2,96 (м, 4Н), 4,52 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 7,85 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕР 160
3-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-метиламино]пропиононитрил
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 3-(метиламино)пропиононитрил вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,35 (комплексный сигнал, 5Н), 2,71 (т, J=6,4 Гц, 4Н), 3,13 (т, J=5,9 Гц, 2Н), 4,50 (т, J=5,9 Гц, 2Н), 6,83 (дд, Jо=1,6 Гц, Jm=4,4 ГЦ, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,17 (м, 2Н), 7,31 (м, 2Н), 7,87 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 161
N-метил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и метиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 51%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,61 (ушир.с, NH+H2O), 3,25 (т, J=5,6 Гц, 2Н), 4,57 (т, J=5,6 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,84 (с, 1Н), 8,31 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 162
2-[2-[4-(трет-бутоксикарбонил)пиперазин-1-ил]этил]-4,6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и N-(трет-бутоксикарбонил)пиперазин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 63%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,45 (с, 9Н), 2,46 (м, 4Н), 3,05 (т, J=6,4 Гц, 2Н), 3,40 (м, 4Н), 4,54 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,15 (м, 2Н), 7,30 (м, 2Н), 7,86 (с, 1Н), 8,33 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 163
4,6-бис(4-фторфенил)-2-[2-(пиперазин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примере 36, но используя 2-[2-[4-(трет-бутоксикарбонил)пиперазин-1-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 162) вместо 2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина, получают указанное в заголовке соединение (выход: 62%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,56 (ушир.с, NH+H2O), 2,45 (м, 4Н), 2,85 (м, 4Н), 3,00 (т, J=6,4 Гц, 2Н), 4,55 (т, J=6,4 Гц, 2Н), 6,82 (дд, Jо=1,6 Гц, Jm=4,4 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 7,03 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,86 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 164
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-винилпиразоло[3,4-b]пиридин
Раствор 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфоната (0,15 г, 0,3 ммоль, полученный в примере 116, в разделе a) и KOH (0,02 г, 0,3 ммоль) в толуоле (4 мл) нагревают до 100°C и кипятят с обратным холодильником в течение ночи. Добавляют воду и EtOAc и фазы разделяют. Водную фазу насыщают NaCl (в твердом виде) и экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 110 мг указанного в заголовке соединения (выход: 90%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 5,27 (дд, Jgem=1,8 Гц, Jvec=8,7 Гц, 1Н), 6,22 (дд,
Jgem=1,4 Гц, Jvec=15,4 Гц, 1Н), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,15 (м, 2Н), 7,17-7,34 (комплексный сигнал, 3Н), 7,90 (с, 1Н), 8,33 (дд,
Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 165
2-[N-[2-[4,6-бис-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-(2-гидроксиэтил)амино]этанол
По способу, раскрытому в примере 111, но используя 2-[4,6-бис-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и 2-(2-гидроксиэтиламино)этанол вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 51%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50 (ушир.с, 2OH+H2O), 2,73 (т, J=5,0 Гц, 4H), 3,21 (т, J=5,6 Гц, 2Н), 3,52 (т, J=5,0 Гц, 4Н), 4,54 (т, J=5,4 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,89 (т, J=8,7 Гц, 2Н), 6,99 (т, J=8,7 Гц, 2Н), 7,13 (м, 2Н), 7,29 (м, 2Н), 7,89 (с, 1Н), 8,32 (дд, Jо=1,8 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 166
N-циклопропил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин
По способу, раскрытому в примере 111, но используя 2-[4,6-бис-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат (полученный в примере 116, в разделе a) вместо 3-[4,6-бис-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил метансульфоната и циклопропиламин вместо N-(трет-бутоксикарбонил)-N-(4-пиперидил)амина, получают нужное соединение (выход: 47%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 0,30 (м, 2Н), 0,45 (м, 2Н), 1,60 (ушир.с, NH+H2O), 2,20 (м, 1Н), 3,36 (т, J=5,7 Гц, 2Н), 4,55 (т, J=5,7 Гц, 2Н), 6,82 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,90 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,30 (м, 2Н), 7,82 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 167
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]ацетамид
По способу, раскрытому в сравнительном примере 1, в разделе a, но используя ацетилхлорид вместо 4-фторбензоилхлорида и 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин (полученный в примере 90) вместо N,O-диметилгидроксиламина, получают нужное соединение (выход: 48%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,98 (с, 3Н), 3,95 (м, 2Н), 4,58 (т, J=5,4 Гц, 2Н), 6,47 (м, NH), 6,83 (д, J=9,0 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,6 Гц, 2Н), 7,14 (м, 2Н), 7,28 (м, 2Н), 7,82 (с, 1Н), 8,33 (д, J=9,0 Гц, 2Н).
ПРИМЕР 168
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N'-изопропилмочевина
К раствору 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,06 г, 0,15 ммоль, полученного в примере 90) в ДМФА (1 мл), в атмосфере аргона добавляют изопропилизоцианат (0,02 г, 0,18 ммоль). Раствор перемешивают при комнатной температуре в течение 2 дней. Растворитель снова концентрируют и к полученному остатку добавляют диэтиловый эфир. Растворитель концентрируют, получая 38 мг указанного в заголовке соединения в виде твердого вещества (выход: 50%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,05 (д, J=6,3 Гц, 6Н), 3,84 (м, 3Н), 4,22 (м, NH), 4,58 (т, J=5,4 Гц, 2Н), 5,30 (м, NH), 6,82 (дд, Jо=1,4 Гц, Jm=4,6 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,00 (т, J=8,6 Гц, 2Н), 7,13 (м, 2Н), 7,28 (м, 2Н), 7,84 (с, 1Н), 8,32 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
ПРИМЕР 169
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]метансульфонамид
К раствору 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (0,06 г, 0,15 ммоль, полученного в примере 90) и DMAP (0,001 г, 0,0058 ммоль) в пиридине (0,6 мл) добавляют в атмосфере аргона метансульфонилхлорид (0,017 мл, 0,22 ммоль) и охлаждают на бане со льдом. Раствор перемешивают в течение ночи при комнатной температуре. Растворитель концентрируют. Остаток растворяют в CHCl3 и добавляют насыщенный NaHCO3. Фазы разделяют. Органическую фазу сушат над Na2SO4 и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве растворителя EtOAc, и получают 70 мг указанного в заголовке соединения (выход: 95%).
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,99 (с, 3Н), 3,86 (м, 2Н), 4,64 (т, J=5,3 Гц, 2Н), 5,33 (м, NH), 6,83 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 6,91 (т, J=8,7 Гц, 2Н), 7,01 (т, J=8,7 Гц, 2Н), 7,14 (м, 2Н), 7,29 (м, 2Н), 7,88 (с, 1Н), 8,33 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2H).
ПРИМЕРЫ 170-178
По способу, раскрытому в примере 72, но исходя из соответствующих соединений в каждом случае, получают соединения, приведенные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
пиперидин-4-карбальдегид
3-амино-2H-пиразол и фуран-2-карбальдегид
3-амино-2H-пиразол и 2H-пиразол-3-карбальдегид
3-амино-2H-пиразол и 5-бромтиофен-2-карбальдегид
3-амино-2Н-пиразол и 4-фторбензальдегид
3-амино-2H-пиразол и 4-фторбензальдегид
3-амино-2H-пиразол и 3-фенилпропион-альдегид
6-хлорпиридин-3-карбальдегид и амино-2H-пиразол
3,4-дихлорбенз-альдегид и 3-амино-2-этилпиразол
ПРИМЕР 179
6-(4-фторфенил)-4-(1-метилпиперидин-4-ил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин
К суспензии 6-(4-фторфенил)-4-(4-пиперидил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (0,24 г, 0,6 ммоль, полученного в примере 170) в муравьиной кислоте (0,64 мл) добавляют 35-40% водный формальдегид (0,96 мл). Смесь нагревают при 70-80°C в течение 24 час. Смесь оставляют охлаждаться и добавляют 1 н. NaOH. Смесь экстрагируют CHCl3 и объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси CHCl3-MeOH-NH3 возрастающей полярности, получая 47 мг нужного соединения (выход: 19%).
ЖХ-МС (способ 1): tR = 3,28 мин; m/z = 388,1 [M+H]+.
ПРИМЕР 180
3-амино-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1H-пиразоло[3,4-b]пиридин
По способу, раскрытому в сравнительном примере 15, в разделе c, но используя 2-хлор-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиридин-3-карбонитрил (полученный в сравнительном примере 22) вместо 3-(1-бензилпиперидин-4-ил)-3-оксопропиононитрила, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 6,70 мин; m/z = 353,0 [M+H]+.
ПРИМЕР 181
6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин
К раствору 3-амино-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридина (10,00 г, 28,4 ммоль, полученного в примере 180) в AcOH (52 мл), воды (22 мл) и концентрированной HCl (5,7 мл), охлажденному до 0°C, по каплям добавляют раствор NaNO2 (2,30 г, 33,4 ммоль) в воде (7,5 мл). Раствор перемешивают в течение 30 мин при 0°C и медленно добавляют H3PO2 (50% водный раствор, 56,8 мл). Раствор перемешивают при 0°C в течение 6 часов. Раствор оставляют охлаждаться до комнатной температуры, подщелачивают при 0°C, медленно добавляя 6 н. NaOH до pH=8 и экстрагируют EtOAc. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 4,00 г указанного в заголовке соединения (выход: 42%)
ЖХ-МС (способ 1): tR = 7,80 мин; m/z = 338,0 [M+H]+.
ПРИМЕРЫ 182-193
По способу, раскрытому в примерах 6 и 7, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные далее в таблице:
ПРИМЕР 194
5-(2-метилсульфанилпиримидин-4-ил)-2-[3-(тетрагидропиран-2-илокси)пропил]-6-(3-трифторметилфенил)пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но исходя из 5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридина (полученного в примере 126) и 2-(3-бромпропокси)тетрагидропирана, получают указанное в заголовке соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 1,50-1,90 (м, 4Н), 2,40 (комплексный сигнал, 5H), 3,37-3,50 (м, 4Н), 3,85 (м, 2Н), 4,53 (м, 1Н), 4,65 (м, 2Н), 6,68 (д, J=5,1 Гц, 1Н), 7,40 (т, J=7,8 Гц, 1Н), 7,52 (д, J=7,6 Гц, 1Н), 7,61 (д, J=7,5 Гц, 1Н), 7,93 (с, 1Н), 8,13 (с, 1Н), 8,32 (д, J= 5,1 Гц, 1H), 8,49 (с, 1Н).
ПРИМЕР 195
6-(4-фторфенил)-2-метил-5-(4-пиридил)-4-[5-(3-пиридил)тиен-2-ил]пиразоло[3,4-b]пиридин
Суспензию 4-(5-бромтиен-2-ил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридина (0,10 г, 0,2 ммоль, полученного в примере 188), 3-пиридилбороновой кислоты (0,04 г, 0,3 ммоль), K2CO3 (0,06 г, 0,4 ммоль), Pd(PPh3)4 (0,017 г 0,01 ммоль), 1,2-диметоксиэтана (1,31 мл) и воды (0,04 мл) нагревают при 80°C в атмосфере аргона в течение ночи. Суспензию оставляют охлаждаться и разбавляют CHCl3 и водой. Объединенные органические фазы сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 35 мг нужного соединения (выход: 50%).
ЖХ-МС (способ 1): tR = 5,42 мин; m/z = 464,0 [M+H]+.
ПРИМЕРЫ 196-202
По способу, раскрытому в примере 91, но используя соответствующие исходные соединения в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
462,2
ПРИМЕРЫ 203-207
По способу, раскрытому в примере 56, но используя соответствующие исходные соединения в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
ПРИМЕР 208
N-циклопропилметил-[4-[6-[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин
Раствор 5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридина (90 мг, 0,2 ммоль, полученного в примере 127) и (циклопропилметил)амина (75 мг, 1,0 ммоль) в ТГФ (2 мл) нагревают в закрытом реакторе при 60°C в течение ночи. Раствор оставляют охлаждаться и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 57 мг нужного соединения (выход: 67%).
ЖХ-МС (способ 1): tR = 8,12 мин; m/z = 411,0 [M+H]+.
По способу, раскрытому в примере 208, но используя соответствующие исходные соединения в каждом случае, получают соединения, представленные в следующей таблице:
ПРИМЕР 214
4-[4-[4,6-бис(4-фторфенил)-2-метилпиразоло[3,4-d]пиридин-5-ил]пиридин-2-иламино]бензолсульфонамид
Смесь 5-(2-хлорпиридин-4-ил)-4,6-бис(4-фторфенил)-2-метилпиразоло[3,4-b]пиридина (100 мг, 0,23 ммоль, полученного в примере 190) и 4-аминобензолсульфонамида (46 мг, 0,27 ммоль) нагревают при 190°C в течение ночи. Смесь оставляют остывать и полученный сырой продукт очищают хроматографически на силикагеле, используя EtOAc в качестве элюента, получая 23 мг нужного соединения (выход: 17%).
ЖХ-МС (способ 1): tR = 6,91 мин; m/z = 569,0 [M+H]+.
ПРИМЕРЫ 215-230
По способу, раскрытому в примере 72, но используя соответствующие исходные соединения в каждом случае, получают соединения, представленные в следующих таблицах:
ПРИМЕР 231
[(2S)-2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пирролидин-2-карбоксамид
a) [(2S)-2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-1-(бензилоксикарбонил)пирролидин-2-карбоксамид
По способу, раскрытому в примере 48, но исходя из 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 90) и (2S)-1-(бензилоксикарбонил)пирролидин-2-карбоновой кислоты, получают нужное соединение.
ЖХ-МС (способ 1): tR = 7,13 мин; m/z = 659,3 [M+H]+.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 269, но исходя из [2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-1-(бензилоксикарбонил)пирролидин-2-карбоксамида (полученного в разделе a), получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 4,35 мин; m/z = 525,2 [M+H]+.
ПРИМЕР 232
2-[2-(4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил)этиламино]этанол
a) 2-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфонат
По способу, раскрытому в примере 12, в разделе b, но исходя из 2-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанола (полученного в примере 196), получают нужное соединение.
1H ЯМР (300 МГц, CDCl3) δ (TMS): 2,94 (с, 3Н), 4,76 (м, 2Н), 4,85 (м, 2Н), 6,88 (д, Jо=1,5 Гц, Jm=4,5 Гц, 2Н), 7,15-7,90 (комплексный сигнал, 10Н), 8,27 (с, 1H), 8,28 (дд, Jо=1,5 Гц, Jm=4,5 Гц, 2Н).
b) Указанное в заголовке соединение
По способу, раскрытому в примере 111, но исходя из 2-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил метансульфоната (полученного в разделе a) и 2-амино-1-этанола, получают нужное соединение.
ЖХ-МС (способ 1): tR = 3,89 мин; m/z = 436,1 [M+H]+.
ПРИМЕР 233
6-(4-фторфенил)-2-метил-4-(3-пиридил)-5-(4-пиридил)пиразоло[3,4-b]пиридин
К раствору 4-(6-хлорпиридин-3-ил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридина (74 мг, 0,2 ммоль, полученного в примере 193) в AcOH (1 мл) в атмосфере аргона добавляют Zn (72 мг, 1,1 ммоль) и полученную смесь кипятят с обратным холодильником в течение ночи. Смесь оставляют охлаждаться и концентрируют. Остаток обрабатывают насыщенным NaHCO3 и экстрагируют CHCl3. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя смеси гексан-EtOAc-MeOH возрастающей полярности, получая 2,4 мг указанного в заголовке соединения (выход: 4%)
ЖХ-МС (способ 1): tR = 4,02 мин; m/z = 382,2 [M+H]+.
ПРИМЕРЫ 234-235
По способу, раскрытому в сравнительном примере 15, в разделе c, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
ПРИМЕРЫ 236-237
По способу, раскрытому в примере 77, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
пиразоло[3,4-b]пиридин
ПРИМЕР 238
5-(2-метоксипиримидин-4-ил)-6-(3-трифторметилфенил)-1H-пиразоло[3,4-b]пиридин
К раствору 5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1H-пиразоло[3,4-b]пиридина (90 мг, 0,2 ммоль, полученного в примере 127) в MeOH (5 мл) в закрытом реакторе добавляют метоксид натрия (11 мг, 0,2 ммоль) и нагревают при 60°C в течение 24 часов. Затем добавляют метоксид натрия (11 мг, 0,2 ммоль) и раствор перемешивают при 60°C еще в течение 2 часов. Раствор оставляют охлаждаться и концентрируют. Добавляют EtOAc и буфер (pH=5,3). Фазы разделяют и органическую фазу промывают водой, сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя смеси гексан-EtOAc при 50%, получая 38 мг указанного в заголовке соединения (выход: 47%)
ЖХ-МС (способ 1): tR = 7,71 мин; m/z = 372,0 [M+H]+.
ПРИМЕРЫ 239-242
По способу, раскрытому в сравнительном примере 1, в разделе a, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
ПРИМЕР 243
N-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]метансульфонамид
По способу, раскрытому в примере 169, но исходя из 2-(3-аминопропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 95), получают нужное соединение.
ЖХ-МС (способ 1): tR = 5,79 мин; m/z = 520,1 [M+H]+.
ПРИМЕР 244
5-(2-аминопиримидин-4-ил)-6-(3-трифторметилфенил)-1H-пиразоло[3,4-b]пиридин
Раствор ТГФ (20 мл), насыщенный NH3 (г) при -20°C, добавляют к 5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридину (90 мг, 0,2 ммоль, полученному в примере 127) в закрытом реакторе. Раствор перемешивают при комнатной температуре в течение 2 дней и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 7 мг указанного в заголовке соединения (выход: 9%)
ЖХ-МС (способ 1): tR = 6,01 мин; m/z = 357,0 [M+H]+.
ПРИМЕР 245
N-[5-(2-метилсульфанилпиримидин-4-ил)-6-(3-трифторметилфенил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамид
Раствор 3-амино-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридина (200 мг, 0,5 ммоль, полученного в примере 123) и ацетилхлорида (39 мг, 0,5 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре в течение 4 часов. Раствор концентрируют и остаток помещают в смесь EtOAc и 1 н NaOH. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc возрастающей полярности, получая 78 мг указанного в заголовке соединения (выход: 37%).
ЖХ-МС (способ 1): tR = 8,55 мин; m/z = 445,0 [M+H]+.
ПРИМЕР 246
N-циклопропилметил-[4-[3-бензилоксикарбониламино-6-(3-трифторметилфенил)-1H-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин
a) N-бензилоксикарбонил-[5-(2-метилсульфанилпиримидин-4-ил)-6-(3-трифторметилфенил)-1H-пиразоло[3,4-d]пиридин-3-ил]амин
По способу, раскрытому в примере 245, но исходя из 3-амино-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридина (полученного в примере 123) и бензилхлорформиата, получают нужное соединение.
ЖХ-МС (способ 1): tR = 10,00 мин; m/z = 537,1 [M+H]+.
b) N-бензилоксикарбонил-[5-(2-метилсульфонилпиримидин-4-ил)-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-3-ил]амин
По способу, раскрытому в примере 56, но исходя из N-бензилоксикарбонил-[5-(2-метилсульфанилпиримидин-4-ил)-6-(3-трифторметилфенил)-1H-пиразоло[3,4-b]пиридин-3-ил]амина (полученного в разделе a), получают нужное соединение.
ЖХ-МС (способ 1): tR = 8,47 мин; m/z = 567,1 [M+H]+.
c) Указанное в заголовке соединение
По способу, раскрытому в примере 208, но исходя из N-бензилоксикарбонил-[5-(2-метилсульфонилпиримидин-4-ил)-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-3-ил]амина (полученного в разделе b) и (циклопропилметил)амина, получают нужное соединение.
ЖХ-МС (способ 1): tR = 9,44 мин; m/z = 560,3 [M+H]+.
ПРИМЕР 247
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-гидроксиацетамид
По способу, раскрытому в примере 48, но исходя из 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 90) и гидроксиуксусной кислоты, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 4,84 мин; m/z = 486,1 [M+H]+.
ПРИМЕР 248
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-карбоксамид
a) N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-1-(трет-бутоксикарбонил)пиперидин-4-карбоксамид
По способу, раскрытому в примере 48, но исходя из 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 90) и 1-(трет-бутоксикарбонил)пиперидин-4-карбоновой кислоты, получают нужное соединение.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 36, но исходя из N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-1-(трет-бутоксикарбонил)пиперидин-4-карбоксамида (полученного в разделе a), получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 4,29 мин; m/z = 539,2 [M+H]+.
ПРИМЕР 249
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-(метиламино)ацетамид
a) N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-хлорацетамид
По способу, раскрытому в сравнительном примере 1, в разделе a, но исходя из 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 90) и хлорацетилхлорида, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 5,72 мин; m/z = 504,1, 506,1 [M+H]+.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 78, но исходя из N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-хлорацетамида (полученного в разделе a) и метиламина, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 4,28 мин; m/z = 499,2 [M+H]+.
ПРИМЕР 250
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-(2-гидроксиэтиламино)ацетамид
По способу, раскрытому в примере 78, но исходя из N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-хлорацетамида (полученного в примере 249, в разделе a) и 2-аминоэтанола, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 4,29 мин; m/z = 529,2 [M+H]+.
ПРИМЕР 251
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]никотинамид
a) Гидрохлорид никотиноилхлорида
Раствор никотиновой кислоты (0,50 г, 4,0 ммоль) и POCl3 (5 мл) нагревают при кипячении с обратным холодильником в течение 1,5 часа и концентрируют. Полученный продукт используют непосредственно в следующей реакции.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 245, но исходя из 2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (полученного в примере 90) и гидрохлорида никотиноилхлорида (полученного в разделе a), получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 5,25 мин; m/z = 533,1 [M+H]+.
ПРИМЕРЫ 252-265
По способу, раскрытому в примерах 6 и 7, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
пиразоло[3,4-b]пиридин
1-бензил-2-хлорметил
пирролидин
451,1
341,2
ПРИМЕР 266
4-[6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]фенол
К раствору 4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридина (112 мг, 0,2 ммоль, полученного в примере 252) в EtOH (13 мл), добавляют 10% Pd/C (20 мг) и смесь гидрируют при атмосферном давлении при комнатной температуре в течение 2 дней. Смесь фильтруют через целит, промывают EtOH и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc-MeOH возрастающей полярности, получая 61 мг указанного в заголовке соединения (выход: 67%)
ЖХ-МС (способ 1): tR = 4,65 мин; m/z = 397,1 [M+H]+.
ПРИМЕР 267
N-[6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1H-пиразоло[3,4-6]пиридин-3-ил]ацетамид
По способу, раскрытому в примере 245, но исходя из 3-амино-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридина (полученного в примере 180) и ацетилхлорида, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 7,01 мин; m/z = 395,1 [M+H]+.
ПРИМЕР 268
N-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид
a) N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамид и N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид 7-оксид
По способу, раскрытому в примере 56, но исходя из N-[6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамида (полученного в примере 267) и используя 2 эквивалента м-хлорпербензойной кислоты, получают указанные в заголовке соединения.
N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид:
ЖХ-МС (способ 1): tR = 5,64 мин; m/z = 427,1 [M+H]+.
N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамид 7-оксид:
ЖХ-МС (способ 1): tR = 4,44 мин; m/z = 443,0 [M+H]+.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 208, но исходя из N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамида (полученного в разделе a) и (циклопропилметил)амина, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 6,19 мин; m/z = 418,1 [M+H]+.
ПРИМЕР 269
3-[6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол
a) 6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин
По способу, раскрытому в примерах 6 и 7, но исходя из 6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридина (полученного в примере 171) и 2-(3-бромпропокси)тетрагидропирана, получают нужное соединение.
ЖХ-МС (способ 1): tR = 7,19 мин; m/z = 499,2 [M+H]+.
b) Указанное в заголовке соединение
По способу, раскрытому в примере 91, но исходя из 6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридина (полученного в разделе a), получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 5,05 мин; m/z = 415,1 [M+H]+.
По способу, раскрытому в примере 269, но исходя из соответствующих соединений в каждом случае, получают представленные в следующей таблице соединения:
соединения
соединения
(мин)
[M+H]+
2-(2-бромэтокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
510,9
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
2-(3-бромпропокси)-
тетрагидропиран
ПРИМЕРЫ 279-285
По способу, раскрытому в примере 268, но исходя из соответствующего соединения и подходящего амина в каждом случае, получают соединения, представленные в следующей таблице:
соединения
(мин)
[M+H]+
пиримидин-2-ил]амин
фенилэтил-
амин
пиримидин-2-ил]амин
метил)амин
пиримидин-2-иламино]пропан-2-ол
пиримидин-2-ил]амин
метил)амин
пиримидин-2-иламино]пропан-1-ол
1-ол
2-иламино]бутан-1-ол
амин
фенил-этиламин
ПРИМЕРЫ 286-290
По способу, раскрытому в примере 208, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
3-метокси-пропиламин
пропан-1-ол
3-аминопропан-1-ол
пропан-1-ол
3-аминопропан-1-ол
ПРИМЕР 291
4-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-4-ил]фенол
a) 4-(4-бензилоксифенил)-6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-2-метилпиразоло[3,4-b]пиридин
По способу, раскрытому в примере 56, но исходя из 4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридина (полученного в примере 255), получают нужное соединение.
ЖХ-МС (способ 1): tR = 8,77 мин; m/z = 566,2 [M+H]+.
b) 4-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-2-метилпиразоло[3,4-b]пиридин-4-ил]фенол
По способу, раскрытому в примере 266, но исходя из 4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(2-метилсульфонилпиримидин-4-ил)пиразоло[3,4-b]пиридина (полученного в разделе a), получают нужное соединение.
ЖХ-МС (способ 1): tR = 6,17 мин; m/z = 476,1 [M+H]+.
c) Указанное в заголовке соединение
По способу, раскрытому в примере 128, но исходя из 4-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-2-метилпиразоло[3,4-b]пиридин-4-ил]фенола (полученного в разделе b) и (циклопропилметил)амина, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 6,62 мин; m/z = 467,2 [M+H]+.
ПРИМЕРЫ 292-295
По способу, раскрытому в примере 266, но исходя из соответствующих соединений в каждом случае, получают соединения, представленные в следующей таблице:
соединения
соединения
(мин)
[M+H]+
ПРИМЕР 296
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(пирролидин-2-илметил)пиразоло[3,4-b]пиридин
К раствору 2-(1-бензилпирролидин-2-илметил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридина (83 мг, 0,1 ммоль, полученного в примере 259) в EtOH (6,9 мл) добавляют 10% Pd/C (8 мг) и муравьиную кислоту (0,34 мл) и нагревают при кипячении с обратным холодильником в течение 2 часов. Смесь оставляют охлаждаться и фильтруют через целит, промывают EtOH и концентрируют. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси гексан-EtOAc-MeOH-NH3 возрастающей полярности, получая 40 мг указанного в заголовке соединения (выход: 57%)
ЖХ-МС (способ 1): tR = 4,98 мин; m/z = 468,1 [M+H]+.
ПРИМЕР 297
4-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиридин-2-иламино]бензолсульфонамид
По способу, раскрытому в примере 214, но исходя из 5-(2-хлорпиридин-4-ил)-6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридина (полученного в примере 263) и 4-аминобензолсульфонамида, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 5,36 мин; m/z = 475,3 [M+H]+.
ПРИМЕР 298
N-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамид 7-оксид
По способу, раскрытому в примере 208, но исходя из N-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид 7-оксида (полученного в примере 268, в разделе a) и (циклопропилметил)амина, получают указанное в заголовке соединение.
ЖХ-МС (способ 1): tR = 5,45 мин; m/z = 434,2 [M+H]+.
ПРИМЕР 299
N-[6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин-3-ил]изоникотинамид
a) Гидрохлорид изоникотиноилхлорида
Раствор изоникотиновой кислоты (0,10 г, 0,8 ммоль) и тионилхлорида (1 мл) нагревают при кипячении с обратным холодильником в течение 2 часов и концентрируют. Полученный продукт используют немедленно на следующей стадии.
b) Указанное в заголовке соединение
В мерную колбу в атмосфере аргона вводят 3-амино-6-(4-фторфенил)-5-(4-пиридил)-1H-пиразоло[3,4-b]пиридин (0,20 г, 0,7 ммоль, полученный в примере 70), гидрохлорид изоникотиноилхлорида (0,12 г, 0,7 ммоль, полученный в разделе a) и пиридин (1 мл). Смесь перемешивают при комнатной температуре в течение 2 дней. Смесь концентрируют и остаток растворяют в смеси CHCl3 и 1 н. HCl. Фазы разделяют и водную фазу экстрагируют CHCl3 (Ч2). Водную фазу подщелачивают, медленно добавляя 1 н. NaOH. Добавляют солевой раствор и экстрагируют CHCl3 и EtOAc. Органическую фазу сушат над Na2SO4 и концентрируют досуха. Полученный сырой продукт очищают хроматографически на силикагеле, используя в качестве элюента смеси CHCl3-MeOH возрастающей полярности, получая 98 мг указанного в заголовке соединения (выход: 68%).
ЖХ-МС (способ 1): tR = 4,21 мин; m/z = 411,1 [M+H]+.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| АНТАГОНИСТЫ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2646762C2 |
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗЫ MKK4 ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ УМЕНЬШЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2019 |
|
RU2788000C2 |
| ПРОИЗВОДНЫЕ ЭТИЛЕНДИАМИНА И СОДЕРЖАЩИЕ ИХ ИНГИБИТОР FXa И АНТИКОАГУЛЯНТ | 2001 |
|
RU2268259C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ | 2005 |
|
RU2390522C2 |
| ПИРАЗОЛО [1, 5-А] ПИРИДИНЫ И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2308457C2 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ 2Н-ПИРАЗОЛА | 2016 |
|
RU2722363C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА | 2004 |
|
RU2332412C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ДИАЗОЛЬНЫЕ ЛАКТАМЫ | 2013 |
|
RU2666730C2 |
Настоящее изобретение относится к соединениям формулы I, которые являются ингибиторами р38 киназы и могут быть использованы в медицине,
где А представляет N или N+O-; R1 представляет собой фенил или гетероциклил; R2 представляет собой гетероциклил; R3 представляет собой Н, карбоциклический радикал, арил или гетероциклил; R4 представляет собой Н, Ra, галоген, -ORa', -CN, -CONRa'Ra', -NRa'Ra', -NRa'CORa' или -NRa'CO2Ra; R5 может быть присоединен к любому из азотов пиразольного кольца соединения формулы I и представляет собой Н, алкил, алкенил, карбоциклический радикал, арил или гетероциклил; Ra независимо представляет собой алкил, карбоциклический радикал, арил или гетероциклил; каждый Ra' независимо представляет собой Н или Ra. Технический результат - получение новых биологически активных соединений. 10 н. и 31 з.п. ф-лы, 16 табл.
1. Соединение общей формулы I
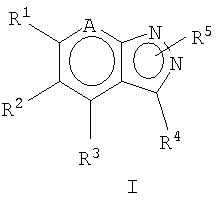
где А представляет N или N+O-;
R1 представляет фенил или Het, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb;
R2 представляет Het, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb;
R3 представляет Н, Cy, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb, или R3 представляет C1-6алкил, необязательно замещенный одним или более заместителями, выбранными из Rb и Су*, где Су* может быть необязательно замещен одним или более заместителями, выбранными из Rb и Rc;
R4 представляет Н, Ra, галоген, -ORa', -CN, -CONRa'Ra',
-NRa'Ra', -NRa'CORa' или -NRa'CO2Ra;
R5 может быть присоединен к любому из 2 N (азотов) пиразольного кольца формулы I и представляет Н или Rf;
каждый Ra независимо представляет С1-6алкил или Су, где группа C1-6алкил может быть необязательно замещена одним или более заместителями, выбранными из Rb и Су*, и где любая из групп Су или Су* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc;
каждый Ra' независимо представляет Н или Ra;
каждый Rb независимо представляет галоген, -ORc', -CORc', -NO2, -CN, -CO2Rc', -NRc'Rc', -NRc'CORc', -NRc'SO2Rc, -SRc', -SORc или -SO2Rc;
каждый Rc независимо представляет C1-6алкил или Су, где все эти группы могут быть необязательно замещены одним или более заместителями Rd;
каждый Rc' независимо представляет Н или Rc;
каждый Rd независимо представляет -ORe', -CO2Re', -SO2NRe'Re', фенил или насыщенный 3-6-членный карбоцикл;
каждый Re независимо представляет C1-6алкил;
каждый Re' независимо представляет Н или Re;
Rf представляет C1-6алкил, С2-6алкенил или Су, где группы C1-6алкила, С2-6алкенила могут быть необязательно замещены одним или более заместителями, выбранными из Rg и Су*, и где любая из групп Су или Су* может быть необязательно замещена одним или более заместителями, выбранными из Rg и Ra;
каждый Rg независимо представляет галоген, -ORa', -OCORa,
-CORa', -CO2Ra', -CONRa'Ra', -NRa'Ra', -NRa'CORa', -NRa'CONRa'Ra', -NRa'CO2Ra,
-NRa'SO2Ra, -SRa', -SORa, -SO2Ra;
Het в приведенных выше определениях представляет пиридин, пиразин, пиримидин, пиридазин, 2(1Н)-пиридон, 2(1Н)-пиразинон, 2(1Н)-пиримидинон или 2(1Н)-пиридазинон;
Су или Су* в приведенных выше определениях представляют насыщенное 3-6-членное карбоциклическое кольцо, фенил, частично ненасыщенное, насыщенное или ароматическое 3-6-членное моноциклическое гетероциклическое кольцо, содержащее 1-2 гетероатома, выбранных из N, S или О, или частично ненасыщенное, насыщенное или ароматическое 8-12-членное бициклическое гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из N, S и О, где каждое гетероциклическое кольцо необязательно содержит 1 или 2 оксогруппы, если кольцо является насыщенным или частично ненасыщенным, и где указанные Су или Су* могут быть связаны с остальной частью молекулы через атом углерода или азота; и его соли или сольваты.
2. Соединение по п.1, где А представляет N.
3. Соединение по п.2, где R5 может быть присоединен к любому из 2 N пиразольного кольца формулы I и представляет Н или Rf, где значения Rf определены в п.1.
4. Соединение по любому из пп.1-3 при условии, что если R3 и R5 оба представляют Н и R2 представляет Het, необязательно замещенный одним или более заместителями, выбранными из галогена, -CN, -CF3, -ОН, -NO2, -OR6, -NR6R6, C1-6алкила или Су, где Су может быть необязательно замещен одним или более заместителями, выбранными из Rb и Rc, и где R6 представляет C1-6алкил, тогда R4 не может представлять -NRa'
CORa или -NHCO2Ra, где значения Het, Су, Rb, Rc, Ra', Ra определены в п.1.
5. Соединение по любому из пп.1-3, где R1 представляет пиридин или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1.
6. Соединение по п.5, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1.
7. Соединение по п.6, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из галогена, -ORc', -NO2, -CN, -NRc'Rc' и C1-6алкила, необязательно замещенного одним или более заместителями, выбранными из галогена, -ORc', -NRc'Rc' и -NRc'CORc', где значения Rc' определены в п.1.
8. Соединение по п.7, где R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из галогена и галоС1-6алкила.
9. Соединение по любому из пп.1-3, где R2 представляет пиридин или пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1.
10. Соединение по п.9, где R2 представляет 4-пиридин или 4-пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1.
11. Соединение по п.10, где R2 представляет 4-пиридин или 4-пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -ORc', -NRc'Rc', -SRc' и -SO2Rc, где значения Rc' и Rc определены в п.1.
12. Соединение по п.11, где R2 представляет 4-пиридин.
13. Соединение по п.11, где R2 представляет 4-пиримидин, замещенный -NRc'Rc', где в R2:
каждый Rc' независимо представляет Н или Rc;
каждый Rc независимо представляет C1-6алкил, необязательно замещенный одним или более заместителями, выбранными из фенила, насыщенного 3-6-членного карбоцикла и -ORe'; и
каждый Re' независимо представляет Н или Re, где значения Re определены в п.1.
14. Соединение по любому из пп.1-3, где R3 представляет Н или Су, необязательно замещенный одним или более заместителями, выбранными из Ra и Rb, где значения Су, Ra и Rb определены в п.1.
15. Соединение по п.14, где R3 представляет Н, гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1, и где гетероарил представляет ароматическое 5- или 6-членное моноциклическое кольцо, которое содержит от 1 до 2 гетероатомов, выбранных из N, S и О, или 8-12-членное бициклическое кольцо, которое содержит от 1 до 4 гетероатомов, выбранных из N, S и О, и которое может быть связано с остальной частью молекулы через атом углерода или атом азота.
16. Соединение по п.15, где R3 представляет гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, где значения Ra и Rb определены в п.1.
17. Соединение по п.16, где R3 представляет моноциклический гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -NO2, -ORc', C1-6алкила и Су, где C1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из
Rb и Су*, и где любая из групп Су или Су* может быть необязательно замещена одним или более заместителями, выбранными из Rb и Rc, где значения Rc', Су, Rb, Су* и Rc определены в п.1.
18. Соединение по п.17, где R3 представляет моноциклический гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -NO2, -ORc', C1-6алкила, галоC1-6алкила, и Су, и где в R3:
каждый Rc' независимо представляет Н или Rc;
каждый Rc независимо представляет С1-6алкил, необязательно замещенный одним или более заместителями Rd; и
каждый Rd независимо представляет фенил или насыщенный 3-6-членный карбоцикл, где значения Су определены в п.1.
19. Соединение по любому из пп.1-3, где R4 представляет Н, Ra, галоген, -ORa', -CN, -CONRa'Ra, -NRa'Ra' или -NRa'CORa', где значения Ra и Ra' определены в п.1.
20. Соединение по п.19, где R4 представляет Н.
21. Соединение по любому из пп.1-3, где R5 представляет Н, или R5 представляет Rf и присоединен к N в положении 2 пиразольного кольца, где значения Rf определены в п.1.
22. Соединение по п.21, где R5 представляет Rf.
23. Соединение по п.21, где Rf в R5 представляет С1-6алкил или Су, где группа С1-6алкила может быть необязательно замещена одним или более заместителями, выбранными из Rg и Су*, и где любая из групп Су или Су* может быть необязательно замещена одним или более заместителями, выбранными из Rg и Ra, где значения Ra, Rg, Су, Су* определены в п.1.
24. Соединение по п.21, где каждый Rg в R5 независимо представляет галоген, -ORa', -CORa', -CO2Ra', -NRa'Ra', -NRa'CORa', -NRa'SO2Ra, -SRa', -SORa или -SO2Ra, где значения
Ra' и Ra определены в п.1.
25. Соединение по п.24, где в R5:
каждый Rg независимо представляет -ORa', -NRa'Ra', -NRa'CORa', -NRa'SO2Ra, -SORa или -SO2Ra;
каждый Ra' независимо представляет Н или Ra,
каждый Ra независимо представляет Су или С1-6алкил, где С1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из Rb и Cy*;
каждый Rb независимо представляет -ORc'; каждый Су* независимо представляет фенил или насыщенный 3-6-членный карбоцикл, где значения Rc' определены в п.1.
26. Соединение по п.22, где Rf в R5 представляет С1-6алкил, необязательно замещенный одним или более заместителями, выбранными из -ORa', -NRa'Ra', -NRa'
CORa', -NRa' SO2Ra и Су*, необязательно замещенного одним или более заместителями, выбранными из Ra; где в R5:
каждый Ra' независимо представляет Н или Ra;
каждый Ra независимо представляет Су или C1-6алкил, где С1-6алкил может быть необязательно замещен одним или более заместителями, выбранными из Rb и Cy*;
каждый Rb независимо представляет -ORc';
каждый Су* независимо представляет фенил или насыщенный 3-6-членный карбоцикл;
каждый Rc' независимо представляет Н или Rc; и каждый Rc независимо представляет C1-6алкил.
27. Соединение по п.1, выбранное из списка, включающего
4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-дифенил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
5-(4-пиридил)-4,6-бис[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-дифенил-3-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
2-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-этил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2,3-диметил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1,3-диметил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-[2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-3-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-(3-хлорпропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-(3-хлорпропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропан-1-ол;
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-метил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[2-(тетрагидропиран-2-илокси)этил]пиразоло[3,4-b]пиридин;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]этанол;
4,6-бис(4-фторфенил)-2-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-метилсульфанилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[1-(трет-бутоксикарбонил)пиперидин-4-илметил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-(морфолин-4-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-[2-(морфолин-4-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетат;
этил 2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]ацетат;
этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионат;
этил 3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионат;
4,6-бис(4-фторфенил)-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(4-пиперидилметил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-пиперидилметил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(6-хлорпиридин-3-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-3-метил-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-3-метил-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-(4-пиперидил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]уксусная кислота;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]уксусная кислота;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропионовая кислота;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропионовая кислота;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-1-(морфолин-4-ил)этанон;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]ацетамид;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-1-(морфолин-4-ил)этанон;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-1-(морфолин-4-ил)пропан-1-он;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-N-пропилпропионамид;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-1-(морфолин-4-ил)пропан-1-он;
4,6-бис(4-фторфенил)-2-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-метилсульфанилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(4-метилсульфинилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(4-метилсульфонилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-метилсульфинилфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(4-метилсульфинилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(4-метилсульфонилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-метилсульфинилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-(4-метилсульфонилбензил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
3-хлор-4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-бром-4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-карбонитрил;
3-бром-4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-карбоксамид;
3-аминометил-4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фтор-3-нитрофенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-амино-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-амино-6-(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-[6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-4-ил]фенол;
2-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-(2,2-диэтоксиэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-3-карбонитрил;
3-бром-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-фторфенил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
N-метил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]амин;
[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]метанол;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-N,N-диметилацетамид;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-N,N-диметилацетамид;
4,6-бис(4-фторфенил)-2-[2-(2-метоксиэтокси)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-1-[2-(2-метоксиэтокси)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[3-(морфолин-4-ил)пропил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(6-хлорпиридин-3-ил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(6-хлорпиридин-3-ил)-1-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(6-хлорпиридин-3-ил)-3-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(6-метилпиридин-3-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-(2-аминоэтил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанол;
6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-(3-фталимидопропил)-5-(4-пиридил)пиразоло[3,4-b] пиридин;
2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]ацетальдегид;
2-(3-аминопропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
N-[4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-илметил]-1-(трет-бутоксикарбонил)пиперидин-4-карбоксамид;
N-[4,6-бис(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-илметил]-1Н-пиперидин-4-карбоксамид;
2-(3-бензилоксипропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-(3-бензилоксипропил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
N,N-диэтил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
N,N-диэтил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]этил]амин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(3-пиридилметил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-1-пиридин-3-илметилпиразоло[3,4-b]пиридин;
N,N-диметил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)-пиразоло[3,4-b]пиридин-2-ил]пропил]амин;
N,N-диметил-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)-пиразоло[3,4-b]пиридин-1 -ил]пропил]амин;
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ол;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]-2-гидроксипропан-1-ол;
3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]-2-гидроксипропан-1-ол;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(4-пиридилметил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-1-(4-пиридилметил)пиразоло[3,4-b]пиридин;
N-(трет-бутоксикарбонил)-[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]амин;
2-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[1-(трет-бутоксикарбонил)пиперидин-4-ил]-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
3-метил-4,6-бис(6-метилпиридин-3-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-он;
N-(трет-бутоксикарбонил)-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин;
N-метил-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]амин;
[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]амин;
2-[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-ил]этанол;
[1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил] пиперидин-4-ил]амин;
6-(4-фторфенил)-2-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-1-(4-пиперидил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
3-амино-5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин;
2-[3-[1-(4-трет-бутоксикарбонил)пиперазин-1-ил]пропил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[3-(1-пиперазин-1-ил)пропил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
5-[2-(метилсульфанил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин;
5-[2-(метилсульфонил)пиримидин-4-ил]-6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин;
(1S)-N-(1-фенилэтил)-[4-[6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ол;
2-[1-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]пиперидин-4-ил]этанол;
4,6-бис(4-фторфенил)-3-(4-пиперидил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-карбонитрил;
2-[2-[[1-(трет-бутоксикарбонил)пиперидин-4-ил]амино]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-[(4-пиперидил)амино]этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
N-(2-метоксиэтил)-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
1-[4-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперазин-1-ил]этанон;
3-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-1-ил]пропан-1-ол;
2-этил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-этил-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-дифенил-2-(2-фталимидоэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-(2-аминоэтил)-4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
2-аллил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-аллил-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-он;
3-аминометил-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-амино-6-(4-фторфенил)-4-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амино]пропан-1-ол;
N-этил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
2-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амино]этанол;
N-[(2-пиридил)метил]-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
N-[(2-тиенил)метил]-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-карбоксамид;
4,6-бис(4-фторфенил)-2-[2-(пирролидин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
(3R)-1-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пирролидин-3-ол;
2-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-метиламино]этанол;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-[2-(1,2,3,4-тетрагидроизохинолин-2-ил)этил]пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-(4-фенилпиперазин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-[4-(1-пиперидил)пиперидин-1-ил]этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
3-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-метиламино]пропиононитрил;
N-метил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
2-[2-[4-(трет-бутоксикарбонил)пиперазин-1-ил]этил]-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-2-[2-(пиперазин-1-ил)этил]-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-винилпиразоло[3,4-b]пиридин;
2-[N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N-(2-гидроксиэтил)амино]этанол;
N-циклопропил-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]амин;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]ацетамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-N'-изопропилмочевина;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]метансульфонамид;
6-(4-фторфенил)-4-(4-пиперидил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(1Н-имидазол-4-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(5-бромтиен-2-ил)-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
5-(2-хлорпиридин-4-ил)-4,6-бис(4-фторфенил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(2-фенилэтил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(6-хлорпиридин-3-ил)-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(3,4-дихлорфенил)-1-этил-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(1-метилпиперидин-4-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-амино-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
4,6-дифенил-5-(4-пиридил)-2-[2-(тетрагидропиран-2-илокси)этил]пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(2-фурил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-4-(1-метил-1Н-имидазол-4-ил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-2-[2-(тетрагидропиран-2-илокси)этил]пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин;
4-(5-бромтиен-2-ил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридин;
5-(2-хлорпиридин-4-ил)-4,6-бис(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(2-фенилэтил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин;
4-(6-хлорпиридин-3-ил)-6-(4-фторфенил)-5-(4-пиридил)-2-[3-(тетрагидропиран-2-илокси)пропил]пиразоло[3,4-b]пиридин;
4-(6-хлорпиридин-3-ил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
5-(2-метилсульфанилпиримидин-4-ил)-2-[3-(тетрагидропиран-2-илокси)пропил]-6-(3-трифторметилфенил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-5-(4-пиридил)-4-[5-(3-пиридил)тиен-2-ил]пиразоло[3,4-b]пиридин;
2-[4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанол;
3-[5-(2-метилсульфанилпиримидин-4-ил)-6-(3-трифторметилфенил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
2-[6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]этанол;
3-[6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4,6-бис(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[6-(4-фторфенил)-4-(2-фенилэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4-(6-хлорпиридин-3-ил)-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
6-(4-фторфенил)-2-метил-5-(2-метилсульфонилпиримидин-4-ил)пиразоло[3,4-b]пиридин;
3-[5-(2-метилсульфонилпиримидин-4-ил)-6-(3-трифторметилфенил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
2-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]этанол;
3-[6-(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4,6-бис(4-фторфенил)-5-(2-метилсульфонилпиримидин-4-ил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
N-циклопропилметил-[4-[6-[3-(трифторметил)фенил]-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
(1S)-3-[5-[2-(1-фенилэтиламино)пиримидин-4-ил]-6-(3-трифторметилфенил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
N-циклопропилметил-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
2-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)пиразоло[3,4-b]пиридин-2-ил]этанол;
3-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-4,6-бис(4-фторфенил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
4-[4-[4,6-бис(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиридин-2-иламино]бензолсульфонамид;
4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-3-ол;
6-(4-фторфенил)-4-(3Н-имидазол-4-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(1Н-пиразол-3-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
3-[6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-4-ил]фенол;
4-циклопропил-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-(5-метилфуран-2-ил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(5-бромфуран-2-ил)-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(4-бензилоксифенил)-6-(4-фторфенил)-5-пиримидин-4-ил-1Н-пиразоло[3,4-b]пиридин;
4-(4-бензилоксифенил)-6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-пропил-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(3-бензилоксифенил)-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
5-(2-хлорпиридин-4-ил)-6-(4-фторфенил)-1Н-пиразоло[3,4-b]пиридин;
4-[6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-4-ил]бутан-1-ол;
4-бензил-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4-(4-бензилоксифенил)-6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин;
4,6-бис(4-фторфенил)-5-пиримидин-4-ил-1Н-пиразоло[3,4-b]пиридин;
[(2S)-2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пирролидин-2-карбоксамид;
2-[2-(4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил)этиламино]этанол;
6-(4-фторфенил)-2-метил-4-(3-пиридил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-3-метил-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
3-амино-5-(2-метилсульфанилпиримидин-4-ил)-6-фенил-1Н-пиразоло [3,4-b]пиридин;
5-(2-метилсульфанилпиримидин-4-ил)-6-фенил-1Н-пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-4-метил-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин;
5-(2-метоксипиримидин-4-ил)-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин;
N-[2-[4,6-(дифенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]ацетамид;
N-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]ацетамид;
N-[2-(4,6-дифенил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил)этил]-N-(2-гидроксиэтил)ацетамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пропионамид;
N-[3-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропил]метансульфонамид;
5-(2-аминопиримидин-4-ил)-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин;
N-[5-(2-метилсульфанилпиримидин-4-ил)-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид;
N-циклопропилметил-[4-[3-бензилоксикарбониламино-6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-гидроксиацетамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]пиперидин-4-карбоксамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-(метиламино)ацетамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]-2-(2-гидроксиэтиламино)ацетамид;
N-[2-[4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этил]никотинамид;
4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-2-метилпиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2,4-диметил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(2-метилсульфанилпиримидин-4-ил)пиразоло[3,4-b]пиридин;
2-(1-бензилпирролидин-2-илметил)-4,6-бис(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-(4-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-пиримидин-4-илпиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-4-(5-метилфуран-2-ил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-(5-бромфуран-2-ил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-4-пропил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-(3-бензилоксифенил)-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
6-(4-фторфенил)-2-метил-4-(2-фенилэтил)-5-(4-пиридил)пиразоло[3,4-b]пиридин;
5-(2-хлорпиридин-4-ил)-6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин;
4-бензил-6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин;
4-[6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]бутан-1-ол;
4-[6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]фенол;
N-[6-(4-фторфенил)-5-(2-метилсульфанилпиримидин-4-ил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид;
N-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-1Н-пиразоло[3,4-b]пиридин-3-ил]ацетамид;
3-[6-(4-фторфенил)-4-(2-фурил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
2-[4-(4-бензилоксифенил)-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]этанол;
3-[4-(4-бензилоксифенил)-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[6-(4-фторфенил)-4-(5-метилфуран-2-ил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4-циклопропил-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4-(5-бромтиен-2-ил)-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[6-(4-фторфенил)-4-пропил-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4,6-бис(4-фторфенил)-5-пиримидин-4-илпиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4-(3-бензилоксифенил)-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
3-[4-бензил-6-(4-фторфенил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-2-ил]пропан-1-ол;
(1S)-N-(1-фенилэтил)-[4-[6-(4-фторфенил)-3-метил-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
N-циклопропилметил-[4-[6-(4-фторфенил)-3-метил-1H-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
1-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиримидин-2-иламино]пропан-2-ол;
N-циклопропилметил-[4-[6-фенил-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
2-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиримидин-2-иламино]пропан-1-ол;
4-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиримидин-2-иламино] бутан-1-ол;
(1S)-N-(1-фенилэтил)-[4-[6-фенил-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
N-(3-метоксипропил)-[4-[6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
3-[4-[6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-иламино]пропан-1-ол;
3-[4-[6-(4-фторфенил)-2-(3-гидроксипропил)пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-иламино]пропан-1-ол;
N-этил-[4-[6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
N-бензил-[4-[6-(3-трифторметилфенил)-1Н-пиразоло[3,4-b]пиридин-5-ил]пиримидин-2-ил]амин;
4-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-4-ил]фенол;
4-[6-(4-фторфенил)-2-(3-гидроксипропил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]фенол;
4-[6-(4-фторфенил)-2-метил-5-пиримидин-4-илпиразоло[3,4-b]пиридин-4-ил]фенол;
3-[6-(4-фторфенил)-2-(3-гидроксипропил)-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]фенол;
3-[6-(4-фторфенил)-2-метил-5-(4-пиридил)пиразоло[3,4-b]пиридин-4-ил]фенол;
4,6-бис(4-фторфенил)-5-(4-пиридил)-2-(пирролидин-2-илметил)пиразоло[3,4-b]пиридин;
4-[4-[6-(4-фторфенил)-2-метилпиразоло[3,4-b]пиридин-5-ил]пиридин-2-иламино]бензолсульфонамид;
N-[5-[2-[(циклопропилметил)амино]пиримидин-4-ил]-6-(4-фторфенил)-1H-пиразоло[3,4-b]пиридин-3-ил]ацетамид 7-оксид; и
N-[6-(4-фторфенил)-5-(4-пиридил)-1Н-пиразоло[3,4-b]пиридин-3-ил]изоникотинамид;
или его соль или сольват.
28. Способ получения соединения формулы I по п.1, который включает осуществление взаимодействия кетона формулы IV
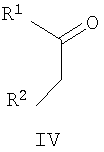
где R1 и R2 имеют указанные в п.1 значения, с аминопиразолом формулы V и альдегидом формулы VI
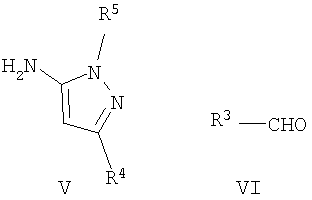
где R3, R4 и R5 имеют указанные в п.1 значения; и, при желании осуществление взаимодействия соединения формулы I с основанием или кислотой для получения соответствующей соли.
29. Способ получения соединения формулы I по п.1, в которой R5 представляет Н и R3 имеют указанные для R1 значения, включает осуществление взаимодействия кетона формулы IV или енолята формулы VII
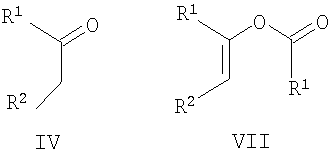
где R1 и R2 имеют указанные в п.1 значения, с аминопиразолом формулы Va
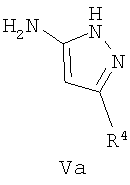
где R4 имеет указанные в п.1 значения; и, при желании, осуществление взаимодействия соединения формулы I с основанием или кислотой для получения соответствующей соли.
30. Способ получения соединения формулы I по п.1, в которой R4 представляет NH2, включает обработку соединения формулы XIX
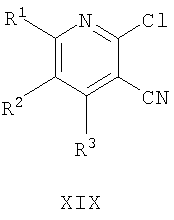
где R1, R2 и R3 имеют указанные в п.1 значения, гидразином формулы VIIIa
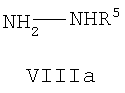
где R5 имеет указанные в п.1 значения; и, при желании, осуществление взаимодействия соединения формулы I с основанием или кислотой для получения соответствующей соли.
31. Способ получения соединения формулы I по п.1, в котором R5 представляет собой Rf, который включает в себя взаимодействие соединения формулы Ic с алкилирующим агентом формулы II
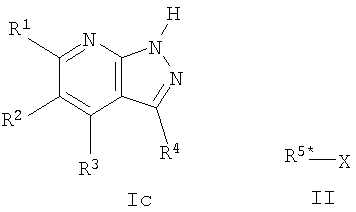
где R5* представляет собой Rf, Х представляет собой уходящую группу, а R1, R2, R3, R4и Rf имеют то же значение, что и в п.1, в присутствии основания и, при желании, осуществление взаимодействия соединения формулы I с основанием или кислотой для получения соответствующей соли.
32. Фармацевтическая композиция, предназначенная для лечения или предотвращения заболевания, опосредованного р38, которая включает эффективное количество соединения формулы I по любому из пп.1-27 и 37-41 или его фармацевтически приемлемой соли или сольвата, и один или более из фармацевтически приемлемых эксципиентов.
33. Применение соединения формулы I по любому из пп.1-27 и 37-41 или его фармацевтически приемлемой соли или сольвата для получения лекарства для лечения или предотвращения заболеваний, опосредованных р38.
34. Применение соединения формулы I по любому из пп.1-27 и 37-41 или его фармацевтически приемлемой соли или сольвата для получения лекарства для лечения или профилактики заболеваний, опосредованных цитокинами.
35. Применение соединения формулы I по любому из пп.1-27 и 37-41 или его фармацевтически приемлемой соли или сольвата для получения лекарства для лечения или профилактики заболеваний, опосредованных TNF-α, IL-1, IL-6 и/или IL-8.
36. Применение соединения формулы I по любому из пп.1-27 и 37-41 или его фармацевтически приемлемой соли или сольвата для получения лекарства для лечения или профилактики заболеваний, выбранных из иммунных, аутоиммунных и воспалительных заболеваний, сердечно-сосудистых заболеваний, инфекционных заболеваний, нарушений костной ресорбции, нейродегенеративных заболеваний, пролиферативных заболеваний и процессов, связанных с индуцированием циклооксигеназы-2.
37. Соединение по п.1, где
А представляет N;
R1 представляет фенил, необязательно замещенный одним или более заместителями, выбранными из галогена, -ORс', -NO2, -CN, -NRc' Rc' и C1-6алкила, необязательно замещенного одним или более заместителями, выбранными из галогена, -ORc', -NRc'Rc' и -NRc'CORc';
R2 представляет 4-пиридин или 4-пиримидин, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из галогена, -ORc', -NRc'Rc', -SRc' и -SO2Rc;
R3 представляет Н, гетероарил или фенил, где все эти группы могут быть необязательно замещены одним или более заместителями, выбранными из Ra и Rb, и где гетероарил представляет ароматическое 5- или 6-членное моноциклическое кольцо, которое содержит от 1 до 2 гетероатомов, выбранных из N, S и О, или 8-12-членное бициклическое кольцо, которое содержит от 1 до 4 гетероатомов, выбранных из N, S и О, и которое может быть связано с остальной частью молекулы через атом углерода или атом азота, где значения Rc', Rc, Ra, Rb определены в п.1.
38. Соединение по п.37, где R4 представляет Н, Ra, галоген, -ORa', -CN, -CONRa'Ra, -NRa'Ra' или -NRa'CORa', где значения Ra' и Ra определены в п.1.
39. Соединение по п.37 или 38, где R5 представляет Н, или R5 представляет Rf и присоединен к N в положении 2 пиразольного кольца, где значения Rf определены в п.1.
40. Соединение по п.39, где R2 представляет 4-пиридин.
41. Соединение по п.39, где R2 представляет 4-пиримидин, замещенный -NRc'Rc', где в R2:
каждый Rc' независимо представляет Н или Rc;
каждый Rc независимо представляет C1-6алкил, необязательно замещенный одним или более заместителями, выбранными из фенила, насыщенного 3-6-членного карбоцикла и -ORe'; и
каждый Re' независимо представляет Н или Re, где значения Re определены в п.1.
| Приспособление к паровозному регулятору для плавного открытия золотника или клапана | 1925 |
|
SU2769A1 |
| СПОСОБ ПРОИЗВОДСТВА ЛИСТОВОГО ПРОКАТА | 1995 |
|
RU2062795C1 |
| 0 |
|
SU153268A1 | |
| WO 9930710, 24.06.1999 | |||
| US 2002013328, 31.01.2002. | |||
Авторы
Даты
2009-06-27—Публикация
2004-02-27—Подача