Изобретение относится к области микробиологии. Может быть использовано при бактериологических исследованиях по внутриродовой идентификации бактерий рода Pseudomonas и таксономических исследованиях.
Известны способы внутриродовой фенотипической идентификации бактерий Pseudomonas на виды, биовары, биогруппы по совокупности многих независимых фенотипических признаков, в том числе по утилизации некоторых аминокислот в качестве единственного источника углерода. Так, в определителе бактерий Берджи (Определитель бактерий Берджи. В 2-х т.Т. 1: Пер. с англ./ Под ред. Дж.Хоулта, Н.Крига, П.Снита, Дж.Стейли, С.Уильямса. - М.: Мир, 1997. - С.97, 157-173) фенотипическая идентификация видов псевдомонад проводится по 45 признакам, в том числе число жгутиков, рост при +4°С и +41°С, образование флуоресцирующих и нефлуоресцирующих пигментов, потребность в органических факторах роста, использование нитрата в качестве источника азота, накопление поли-В-гидрооксибутирата, расщепление катехола и протокатехола; наличие оксидазы, амилазы; утилизация в качестве единственного источника углерода 5 аминокислот (L-валин, L-аланин, L-аргинин, L-серин, L-гистидин) и еще 22 других органических соединений.
В другом определителе бактерий (Мосс У., Уивер Р., Холлис Д., Джордан Дж., Кук Э., Дейншвар М. Определитель нетривиальных патогенных грамотрицательных бактерий(аэробных и факультативно анаэробных) Пер. с англ. - М.: Мир. 1999.- С.509-553, 612-783) для идентификации видов псевдомонад используют 40 фенотипических тестов: морфология, число жгутиков, подвижность; рост при +25°С, +35°С, +42°С; образование флуоресцирующих и нефлуоресцирующих пигментов; рост на средах Макконки, SS-агаре, Симмонса; рост в присутствии 6% NaCl, гемолиз; О/Ф тест на окислительный и ферментативный метаболизм; окисление(глюкозы, ксилозы, маннита, лактозы, сахарозы, мальтозы); наличие оксидазы, каталазы, нитратредуктазы, лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы; образование индола и сероводорода; гидролиз желатина и эскулина; состав клеточных жирных кислот, определяемый методом газово-жидкостной хроматографии. Однако не используется определение субстратного спектра утилизации различных органических соединений, в том числе аминокислот, в качестве единственного источника углерода или азота.
В монографии о бактериях рода Pseudomonas (Смирнов В.В., Киприанова Е.А. Бактерии рода Pseudomonas - Киев: Наукова думка, 1999. - С.153, 189, 221-229) широко представлены сведения о спектрах утилизации псевдомонадами различных химических соединений, в том числе некоторых аминокислот (от 3 до 12) в качестве единственных источников углерода. Для видовой идентификации псевдомонад используют комплекс фенотипических признаков (от 40 до 50): морфология бактерий, число жгутиков, включения поли-β-оксимасляной кислоты, тип метаболизма на среде Хью-Лейфсона с глюкозой; рост при +4°С и +42°С, образование флуоресцирующих и нефлуоресцирующих пигментов; наличие оксидазы, аргининдигидролазы, лизиндекарбоксилазы, леван-сахаразы; гидролиз желатина лецитина, крахмала, эскулина; утилизация в качестве единственного источника углерода различных органических соединений (35), в том числе некоторых аминокислот (L-аргинин, L-лизин, L-пролин, L-аланин, L-лейцин, L-валин, L-аспарагиновая кислота, L-глютаминовая кислота, L-гистидин, L-серин, L-тирозин, L-триптофан). Спектры утилизации бактериями различных органических соединений, в том числе аминокислот, в качестве единственного источника углерода определяют на агаризированной синтетической среде Козера следующего состава (г/л) NaCl 0,5; Mg2SО4 0,2; NH4Н2PО4 1,0; K2HPО4 1,0; источник углерода (в т.ч. L-аминокислота) 1,0; агар 15,0; вода дистиллированная до 1 литра. Исследуемые бактерии - одномиллиардные взвеси суточных агаровых культур в 0,85% растворе хлорида натрия - засевают на среду в чашках Петри репликатором. Контролем служит посев бактерий на ту же среду без источника углерода. Посевы выращивают при +28°С в течение 48 часов. Наличие колоний бактерий на питательной среде с источником углерода при отсутствии роста на контрольной среде указывает на утилизацию данного субстрата. Принадлежность бактерий к известным видам и биоварам псевдомонад определяют по комплексу всех фенотипических признаков, в том числе утилизации некоторых аминокислот, исходя из частоты (в %) исследуемых признаков у определенных видов. Данный способ избран нами прототипом, так как в сравнении с другими аналогами он в большей степени использует для идентификации псевдомонад метод определения спектра утилизации органических субстратов, в том числе аминокислот, что более близко к заявленному нами способу.
Недостатками прототипного способа и других аналогов являются:
- сложность исследования по фенотипической идентификации видов и биоваров псевдомонад, обусловленная необходимость изучения большого комплекса признаков с использованием многочисленных методик и субстратов;
- отсутствие стандартности исследований, обусловленное субъективным выбором исследователями различных фенотипических признаков и методик их изучения.
Целью изобретения является упрощение и повышение стандартности исследования по внутриродовой идентификации бактерий рода Pseudomonas.
В соответствии с изобретением поставленная цель достигается тем, что исследуемые суточные агаровые культуры псевдомонад вносят по одной полной петле диаметром 3 мм в 0,2 мл стерильного 0,85% раствора хлорида натрия в лунке стерильного планшета, тщательно перемешивают и засевают по одной петле одномиллиардной взвеси бактерий радиальным штрихом на сектора минимальных синтетических сред в чашках Петри, содержащих раздельно в каждой среде по одной аминокислоте в качестве единственного источника азота и углерода, из комплекта 20 аминокислот, входящих в состав белков, при следующем содержании ингредиентов в питательной среде (г/л): L-аминокислота 2,0-4,0; NaCl 5,0; Na2SO4 2,0; KH2PO4 1,0; MgSO4∙7H2O 0,1; агар бактериологический 15,0; вода дистиллированная до 1 литра; рН 7,2±0,2; стерилизация при +121°С 15 мин, при этом используются следующие аминокислоты L-α-аланин (Аlа); глицин(Glу); L-аспарагин(Asn); L-аспарагиновая кислота(Аsр); L-глютамин(Gln); L-глютаминовая кислота(Glu), L-лизин(Lуs), L-аргинин гидрохлорид(Аrg), L-гистидин гидрохлорид(Нis), L-метионин(Меt), L-цистеин(Суs), L-треонин(Тhr), L-серин(Ser), L-тирозин(Туr), L-триптофан(Тrу), L-β-фенил-α-аланин(Рhе), L-лейцин(Lеu), L-изолейцин(llе), L-валин(Val), L-пролин(Рrо); контролем служит та же питательная среда без аминокислоты; инкубируют посевы при +28°С в течение 72 часов, после чего учитывают наличие роста бактерий на средах с аминокислотами при отсутствии роста на контрольной среде и идентифицируют виды и биовары исследуемых псевдомонад по профилям утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода, сопоставляя их с прилагаемой базой данных о профилях утилизации 20 белковых амнокислот известных видов и биоваров псевдомонад, изученных ранее по такой же методике (таблица)
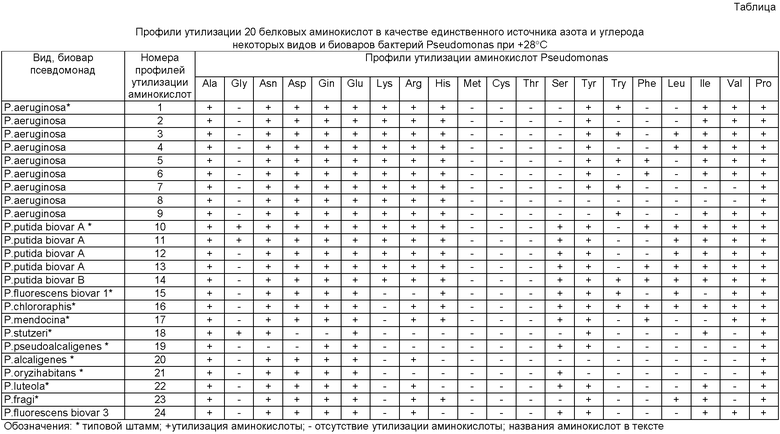
Примечание. Методика приготовления минимальной синтетической питательной среды для изучения утилизации аминокислот в качестве единственного источника азота и углерода.
В колбу, содержащую 300 мл расплавленного водного агара (А), добавляют 100 мл стерильного солевого концентрата (В) и нагревают до полного растворения агара. Затем разливают горячую минимальную солевую среду по 50 мл в стерильные колбы, содержащие раздельно по 0,1 г исследуемых аминокислот
(20 белковых аминокислот, производства фирм "Reanal" Венгрия, "Меrск" США, "ICN" США), добавляют в каждую колбу необходимое количество IN раствора NaOH до рН 7,2; разливают среду из каждой колбы в две стерильные чашки Петри. Контрольная среда - минимальная солевая среда без аминокислоты. Количество I N раствора NaOH до рН 7,2 в средах с различными аминокислотами определяли предварительно для всей серии сред, добавляя в среду индикатор 1,6%-ный водный раствор бромтимолового синего. В среды, используемые для идентификации бактерий, индикатор рН не добавляли. Компоненты среды: "А"(водный агар) - 2% агар бактериологический (агар фирм "Difco" США,"Hi-Media" Индия) на дистиллированной воде по 300 мл в колбах по 500 мл, стерилизованной при +121°С 20 мин, "В" (солевой концентрат) в г/л: NaCl 20,0; Na2SO4 8,0; KH2PO4 4,0; MgSO4∙7H2O 0,4; дистиллированная вода до 1 л; разливают во флаконы 100 мл, стерилизуют при +121°С 20 мин. Срок годности компонентов "А" и "В" 6 месяцев, готовых сред с аминокислотами в чашках Петри 7 суток при хранении от +4°С до +8°С.
Отличительный существенный признак способа - использование комплекта питательных сред, содержащих раздельно 20 аминокислот, входящих в состав белков, по одной аминокислоте в каждой среде в качестве единственного источника азота и углерода и идентификация видов и биоваров псевдомонад по профилям утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода путем сопоставления их с прилагаемой базой данных о профилях утилизации 20 белковых амнокислот известных видов и биоваров псевдомонад, изученных ранее по такой же методике.
Отличительный существенный признак способа не применялся в прототипе, аналогах и не известен из уровня техники. Способность псевдомонад утилизировать некоторые аминокислоты в качестве единственного источника азота и углерода известна ранее (Рубан Е.Л. Физиология и биохимия представителей рода Pseudomonas.- М.: Наука, 1986. - 200 с.) Однако никто не использовал для целей идентификации псевдомонад профили утилизации всех 20 белковых аминокислот в качестве единственного источника азота и углерода. В исследованиях других авторов определялась только частота (%) утилизации некоторых аминокислот различными видами псевдомонад, что не позволяло точно выявить таксономическую значимость этих тестов для идентификации. Отличительный признак способа не следует явным образом из уровня техники. Он установлен нами неожиданно в ходе исследований профилей утилизации 20 белковых аминокислот в качестве единственного единого источника азота и углерода, выполненных на 100 штаммах Р. aeruginosa, 38 штаммах P.putida биовара А, 2 штаммах P.putida биовара В, 10 штаммах P.fluorescens биоваров 1 и 3, 2 штаммах P.luteola, включая типовые штаммы указанных видов, а также на типовых штаммах 7 других видов псевдомонад (Р. chlororaphis, P. mendocina, P. stutzeri, P. fragi, P. alcaligenes, P. pseudoalcaligenes, P. oryzihabitans). У всех изученных видов и биоваров псевдомонад неожиданно обнаружены уникальные профили утилизации 20 белковых аминокислот. При этом внутриродовые варианты профилей у видов Р. aeroginosa, P. putida, P.fluorescens не обнаружены у других видов и биоваров псевдомонад.
Отличительный существенный признак способа непосредственно определяет достижение поставленной цели: исследование упрощается ввиду замены многочисленных методик и тестов (40-50 тестов) одним методом идентификации видов и биоваров псевдомонад по профилям утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода; повышается стандартность исследования вид устранения субъективного выбора различных субстратов и методик при использовании естественного стандартного комплекта из 20 белковых аминокислот по единой методике исследования и оценки профилей их утилизации.
Дополнительным техническим результатом способа, обусловленным его отличительным признаком, является возможность скрининга потенциально новых видов и биоваров псевдомонад, требующих углубленного изучения.
Существенными признаками способа является также возраст культуры бактерий, отсутствие во взвеси бактерий примесей питательной среды, состав минимальных синтетических сред и их рН, температурный и временный режимы. В исследовании нужно использовать суточную культуру псевдомонад, выращенную на питательном агаре. Для получения одномиллиардной взвеси бактерий берут с поверхности среды одну полную петлю бактерий (диаметром 3 мм), не допуская попадания в петлю питательной среды, помещают петлю с бактериями в 0,2 мл стерильного 0,85% раствора хлорида натрия в лунке стерильного планшета для иммунологических реакций, тщательно перемешивают. Контрольное исследование указанной методики получения взвеси бактерий в сравнении с методикой центрифугирования взвеси бактерий (3000 об/мин - 30 мин) с последующим ресуспендированием осадка бактерий в 0,85% растворе хлорида натрия показало совпадающие результаты изучения профилей утилизации аминокислот и предпочтение более простой методики без центрифугирования бактерий. Состав, методика приготовления и контроля рН используемых минимальных синтетических сред указаны выше. Все посевы следует выращивать при +28°С, так как эта температура обеспечивает рост всех видов псевдомонад. Психротрофные виды псевдомонад не способны к росту при +37°С. Кроме того, метаболизм аминокислот у псевдомонад может различаться при +37°С и +28°С. Оптимальный срок инкубации псевдомонад при +28°С 72 часа.
Примеры, подтверждающие возможность осуществления способа.
Пример 1. Исследуемый материал - суточная агаровая культура бактерий рода Pseudomonas, выделенная от больного с сочетанной травмой. Одну полную петлю (диаметром 3 мм), суточной культуры, взятой с поверхности питательного агара, помещают в 0,2 мл стерильного 0,85% раствора хлорида натрия в лунке стерильного планшета, тщательно перемешивают и засевают по одной петле одномиллиардной взвеси бактерий радиальным штрихом на сектора(1/8 часть чашки Петри) комплекта минимальных синтетических питательных сред в чашках Петри (21 среда), содержащих раздельно в каждой среде по одной из 20 белковых аминокислот (по 2 г/л) в качестве единственного источника азота и углерода и контрольную среду без аминокислоты. Методика изготовления питательных сред указана в примечании к описанию заявленного способа. Посевы выращивают при +28°С в течение 72 часов. Положительным результатом утилизации аминокислот в качестве единственного источника азота и углерода считают наличие четко выраженного газона бактерий по ходу посева на средах с аминокислотой при отсутствии роста бактерий на контрольной среде без аминокислоты. Отрицательный результат - отсутствие роста бактерий по ходу посева на средах с аминокислотой. Исследуемый штамм псевдомонад утилизировал 10 белковых аминокислот в качестве единственного источника азота и углерода: (L-аланин(А1а); L-аспарагин(Аsn) L-аспарагиновая кислота(Аsр); L-глютамин(Gln); L-глютаминовая кислота(Glu); L-аргинин гидрохлорид(Аrg); L-cepин(Ser); L-тирозин(Туr); L-изолейцин(lle); L-пролин(Рrо)), что соответствует профилю утилизации аминокислот №22 в прилагаемой базе данных о профилях утилизации 20 белковых аминокислот известных видов и биоваров псевдомонад, изученных ранее по такой же методике (таблица) По указанной базе данных профиль утилизации №22 имеет типовой штамм вида Pseudomonas luteola. Следовательно, исследуемый штамм псевдомонад является видом Р. luteola.
Пример 2. Исследуемый материал - суточная агаровая культура бактерий рода Pseudomonas, выделенная из воды реки Невы. Одну полную петлю (диаметром 3 мм), суточной культуры, взятой с поверхности питательного агара, помещают в 0,2 мл стерильного 0,85% раствора хлорида натрия в лунке стерильного планшета, тщательно перемешивают и засевают по одной петле одномиллиардной взвеси бактерий радиальным штрихом на сектора (1/8 часть чашки Петри) комплекта минимальных синтетических питательных сред в чашках Петри (21 среда), содержащих раздельно в каждой среде по одной из 20 белковых аминокислот (по 4 г/л) в качестве единственного источника азота и углерода и контрольную среду без аминокислоты. Методика изготовления питательных сред указана в примечании к описанию заявленного способа. Посевы выращивают при +28°С в течение 72 часов, после чего учитывают результат. Исследуемый штамм вырос на средах с 16 белковыми аминокислотами: (L-аланин(Аlа); L-аспарагин(Аsn) L-аспарагиновая кислота(Аsр); L-глютамин(Gln); L-глютаминовая кислота(Glu); L-аргинин гидрохлорид(Аrg); L-cepин(Ser); L-тирозин(Туr); L-лейцин(Lеu); L-изолейцин(Llle); L-пролин(Рrо); L-валин(Val); L-лизин(Lуs); L-фенилаланин(Рhе); L-гистамин (Gys); L-триптофан(Тrу), что соответствует профилю утилизации аминокислот №14 в прилагаемой базе данных о профилях утилизации 20 белковых аминокислот известных видов и биоваров псевдомонад, изученных ранее по такой же методике (таблица). По указанной базе данных профиль утилизации аминокислот №14 имеют бактерии Pseudomonas putida biovar В. Следовательно, исследуемый штамм псевдомонад является видом Р. putida biovar В.
Контрольная проверка достоверности идентификации изученных штаммов псевдомонад традиционными методами фенотипических исследований в соответствии с определителем бактерий Берджи (Определитель бактерий Берджи. В 2-х т.Т. 1: Пер. с англ./ Под ред. Дж.Хоулта, Н.Крига, П.Снита, Дж.Стейли, С.Уильямса. - М.: Мир, 1997. - С.97, 157-173) показала полную идентичность идентифицированных заявленным способом псевдомонад видам Pseudomonas luteola и Pseudomonas putida biovar В.
Изобретение относится к биотехнологии. Способ заключается в следующем. Исследуемые суточные агаровые культуры псевдомонад засевают по одной петле одномиллиардной взвеси в 0,85% растворе хлорида натрия радиальным штрихом на сектора (1/8 чашки Петри) минимальных синтетических питательных сред в чашках Петри, содержащих раздельно в каждой среде по одной из 20 белковых аминокислот в качестве единственного источника азота и углерода и контрольную среду без аминокислоты. Состав сред, г/л: L-аминокислота 2,0-4,0; NaCl 5,0; Na2SO4 2,0; КН2РO4 1,0; MgSO4∙7H2O 0,1; агар бактериологический 15,0; вода дистиллированная до 1 л; рН 7,2±0,2; посевы инкубируют при +28°С в течение 72 часов и идентифицируют виды и биовары исследуемых псевдомонад по профилям утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода, сопоставляя их с данными, полученными по такой же методике, о профилях утилизации 20 белковых аминокислот известных видов и биоваров псевдомонад. Изобретение позволяет упростить внутриродовую идентификацию бактерий рода Pseudomonas и повысить стандартность исследования. 1 табл.
Способ внутриродовой идентификации бактерий рода Pseudomonas, состоящий в том, что исследуемые суточные агаровые культуры псевдомонад засевают по одной петле одномиллиардной взвеси в 0,85%-ном растворе хлорида натрия радиальным штрихом на сектора минимальных синтетических сред в чашках Петри, содержащих раздельно различные единственные источники азота и углерода, минеральные соли, агар; инкубируют посевы при 28°С в течение 72 ч, после чего учитывают наличие роста бактерий на средах при отсутствии роста на контрольной среде без источников азота и углерода, отличающийся тем, что используют комплект питательных сред, содержащих раздельно 20 аминокислот, входящих в состав белков, по одной аминокислоте в каждой среде в качестве единственного источника азота и углерода при следующем содержании ингредиентов в питательной среде, г/л: L-аминокислота 2,0-4,0; NaCl 5,0; Na2SO4 2,0; KH2PO4 1,0; MgSO4·7H2O 0,1 агар бактериологический 15,0; вода дистиллированная до 1 л; рН 7,2±0,2; стерилизация при 121°С 20 мин, и идентифицируют виды и биовары исследуемых псевдомонад по профилям утилизации 20 белковых аминокислот в качестве единственного источника азота и углерода, сопоставляя их с данными, полученными по такой же методике, о профилях утилизации 20 белковых аминокислот известных видов и биоваров псевдомонад.
| Способ идентификации микроорганизмов | 1977 |
|
SU731904A3 |
| Приказ об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений | |||
| Микробиологические методы идентификации микробов рода Pseudomonas, 22.04.1985 | |||
| СИВОЛОДСКИЙ Е.П | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
Авторы
Даты
2009-07-20—Публикация
2007-09-17—Подача