Изобретение относится к области биотехнологии. Может быть использовано при бактериологических исследованиях по выделению из внешней среды бактерий для поиска биоремедиаторов загрязнений природной среды нефтепродуктами и синтетическими полимерами, а также при производстве питательных сред для выделения этих бактерий.
Известен способ выделения и идентификации бактерий Pseudomonas putida с использованием элективных сред (Васильев Д.А., Викторов Д.А., Богданов И.И., Шестаков А.Г. Выделение и типирование бактерий Pseudomonas putida. - Вестник Ульяновской государственной сельскохозяйственной академии. - 2009. - №3 (10). - С. 58-60. Электронный адрес: lib.ugsha.ru:8080/bitstream/123456789/518/1/vestnik-2009-3-58-60.pdf). Исследуемый материал (1 мл сточных вод) вносят в 5 мл элективной синтетической среды с сукцинатом натрия следующего состава: сукцинат натрия - 4.0 г, нитрат калия - 0.5 г, фосфат калия двузамещенный - 0,5 г, фосфат калия однозамещенный - 0,1 г, сульфат магния - 0,2 г, хлорид кальция - 0,1 г, вода дистиллированная - 1 л. Посев инкубируют при 30°С в аэробных условиях в течение 48-72 ч, после чего осуществляют посев на чашки Петри с элективной средой с фурадонином следующего состава: фурадонин - 160,0 мг, глюкоза - 10,0 г, пептон - 2,0 г, калий фосфорнокислый двузамещенный - 0,05 г, магний сернокислый - 0,1 г, бромтимоловый синий - 0,03, агар-агар - 15,0, вода дистиллированная - 1 л. Посевы культивируют при 30°С в аэробных условиях в течение 48 ч. Затем отсевают колонии, окисляющие глюкозу, на питательный агар для получения чистой культуры, которую исследуют комплексом тестов: на оксидазу, каталазу, подвижность, рост на питательном агаре с 0,2% хлорида бария, желатиназу, рост при 4°С и 41°С, рост в бульоне с ацетамидом. На основании характерного профиля признаков идентифицируют P. putida. В данной статье автор идентифицировал среди 65 изученных штаммов 33 штамма P. putida. Однако, по представленным в статье сведениям 29 штаммов псевдомонад имели желатиназу, из них 1 рос при 41°С, что указывает на выделение 28 штаммов группы P. fluorescens и 1 штамма Р. aeruginosa.
Этим же способом с использованием тех же питательных сред и схемы исследования были изучены пробы сточных вод, прудовой воды и почвы на наличие Pseudomonas chlororaphis (Гринева Т.А., Викторов Д.А., Васильев Д.А. Схема выделения Pseudomonas chlororaphis из объектов окружающей среды. - Вестник ветеринарии. - 2013. - №1 (64). - С. 18-20. Электронный адрес: www.stogan.ru/science/conference/conference_21.11.12/doklad/24.pdf). Среди 65 выделенных культур были обнаружены 5 штаммов P. chlororaphis. Анализ данных статьи позволяет считать, что 16 выделенных культур не являются псевдомонадами, так как растут на питательном агаре с 0,2% хлорида бария; 37 штаммов являются P. aeruginosa, так как продуцируют пиоцианин, специфический только для синегнойной палочки. Следовательно, селективные среды указанного способа обладают слабой селективностью, так как на них растут кроме искомых бактерий группы P. putida псевдомонады других групп (P. fluorescens, P.aeruginosa, P. chlororaphis), а также бактерии прочих родов.
Известен также способ выделения и идентификации бактерий Pseudomonas putida с использованием питательной среды «Pseudomonas APS» (Сиволодский Е.П. Питательная среда «Pseudomonas APS» для выделения и идентификации бактерий Pseudomonas aeruginosa и Pseudomonas putida. - Лабораторное дело. - 1990. - №8. - С. 65-67). Питательная среда «Pseudomonas APS» имеет следующий состав: сухой питательный агар из рыбного гидролизата (производства Дагестанского НИИ питательных сред) 35,0 г; оксафенамид (пара-оксифенилсалициламид, осалмид) 1,0-1,2 г, растворенный в 10-12 мл диметилсульфоксида, вода дистиллированная до 1 л, рН 7,2±0,2. Приготовление среды: в стерильную колбу вносят 200 мл расплавленного питательного агара из рыбного гидролизата (ГРМ-агар), приготовленного по прописи, добавляют в горячую среду 2,2 мл 10-процентного раствора оксафенамида в диметилсульфоксиде (раствор оксафенамида готовят путем растирания 1 г оксафенамида в ступке с 9 мл диметилсульфоксида), разливают в стерильные чашки Петри; готовая среда прозрачная, светло-серого цвета, пригодна 10 суток при хранении от 4°С до 8°С. Исследуемый материал засевают на поверхность среды петлей или ватным тампоном, инкубируют аэробно 16-24 ч при 42°С и (или) 35°С, затем учитывают результат. Наличие колоний бактерий, выросших при 42°С, указывает на их принадлежность к виду P. aeruginosa. Бактерии, выросшие при 35°С, принадлежат к P. aeruginosa при наличии нитратредуктазы, определяемой микрообъемным методом в течение 3 ч, или принадлежат к виду P. putida при отсутствии нитратредуктазы. Бактерии других видов при 42°С и 35°С на этой среде не растут. Однако, при инкубировании посевов при 28°С в течение 24-48 ч возможен также рост псевдомонад групп P. fluorescens и P. chlororaphis (неопубликованные данные, представленные в данной заявке).
Прототипом заявляемого способа нами избран способ выделения и идентификации бактерий P. putida по статье Васильева Д.А. с соавторами (Васильев Д.А., Викторов Д.А., Богданов И.И., Шестаков А.Г. Выделение и типирование бактерий Pseudomonas putida. - Вестник Ульяновской государственной сельскохозяйственной академии. - 2009. - №3 (10). - С. 58-60), так как он имеет больше совпадающих существенных признаков, чем другой аналог.
Недостатком прототипного способа является слабая селективность используемых питательных сред, на которых растут кроме искомых псевдомонад группы P. putida, псевдомонады прочих групп (P. aeruginosa, P. chlororaphis, P. fluorescens) и других родов бактерий.
Недостатком другого аналога является также недостаточная селективность используемой питательной среды, вследствии чего выделяют совместно с искомыми псевдомонадами бактерии других групп псевдомонад (P. aeruginosa, P. chlororaphis).
Целью изобретения является повышение селективности способа выделения и идентификации бактерий групп P. putida и P. fluorescens. Повышение селективности исследования состоит в достижении роста на селективной среде заявляемого способа только бактерий искомых групп P. putida и P. fluorescens.
В соответствии с изобретением решение указанной технической задачи достигается тем, что исследуемый материал засевают в жидкую питательную среду, содержащую в качестве единственного источника азота и углерода L - серин; осалмид (CAS 526-18-1), растворенный в диметилсульфоксиде, минеральные соли NaCI, Na2SO4, MgSO4, KH2PO4, K2HPO4, дистиллированную воду при следующем содержании ингредиентов: L - серин 2,0-4,0 г; осалмид (CAS 526-18-1) 0,5-0,6 г; диметилсульфоксид 5-6 мл; NaCI 5,0 г; Na2SO4 2,0 г; MgSO4 0,1 г; KH2PO4 0,5 г; K2HPO4 2,0 г; вода дистиллированная 1 л; рН 7,2±0,2; плотная питательная среда этого же состава имеет дополнительно агар 12,0 г; при этом все ингредиенты, кроме суплемента осалмида (5-6 мл 10-процентного раствора осалмида в диметилсульфоксиде), растворяют при нагревании, стерилизуют при 121°С 20 минут, добавляют осалмид, разливают в стерильные флаконы (жидкую среду) и стерильные чашки Петри (плотную среду); посевы в жидкой среде инкубируют при 28°С в аэробных условиях в течение 48 ч, пересевают обогащенный материал из флаконов на плотную среду этого же состава и выращивают посевы при 28°С в аэробных условиях в течение 24-48 ч; затем определяют принадлежность бактерий к группам P. putida и P. fluorescens по наличию выросших колоний или газона бактерий. Примечание: бактериологический контроль качества питательных сред заявляемого способа проводят при изготовлении среды; для положительного контроля используют типовой штамм P. putida АТСС 12633 (или штамм P. putida, выделенный из внешней среды) и штамм Р, fluorescens, выделенный из внешней среды, в посевной дозе 104 КОЕ/мл-1; для отрицательного контроля применяют штамм P. aeruginosa АТСС 27853 и штамм Escherichia coli, выделенный из внешней среды, в посевной дозе 106 КОЕ/мл-1. Исследование проводят по методике заявляемого способа. Питательные среды пригодны к использованию при наличии роста штаммов положительного контроля и отсутствии роста штаммов отрицательного контроля. Срок хранения готовых сред 15 суток при температуре от 4°С до 8°С.
Отличительный существенный признак способа - использование в питательной среде L - серина в качестве единственного источника азота и углерода. Этот признак не применялся в прототипе и аналогах. Он не следует явным образом из уровня техники. Сведения об утилизации L - серина различными видами псевдомонад противоречивы или неизвестны. Для каждого вида бактерий необходимо конкретное экспериментальное обоснование пригодности указанного признака. Из материалов наших исследований, представленных в данной заявке (таблица), следует, что L - серин в концентрации 2 г/л в составе только минимальной солевой основы заявляемой среды (без осалмида) действует как фактор трофической негативной селекции, который полностью блокирует рост всех изученных штаммов P. aeruginosa, Р. fragi, P. stutzeri; неферментирующих бактерий (Acinetobacter baumannii, Burkholderia cepacia, Stenotrophomonas maltophilia, Alcaligenes faecalis), бактерий родов Vibrio, Shewanella, Bacillus, Staphylococcus. При этом не подавляется рост псевдомонад группы P. putida (P. putida, P. fulva, P. monteilii, Р. plecoglosicida), группы P. fluorescens (P. fluorescens biovars I, III), группы Р. chlororaphis (P. chlororaphis), а также наблюдается рост многих видов энтеробактерий (Enterobacter cloacae, Klebsiella pneumoniae subsp.pneumoniae, Salmonella typhimurium, Serratia marcescens).
Второй отличительный существенный признак - использование в составе питательной среды селективного ингибитора бактерий осалмида (CAS 526-18-1) в концентрации 0,5-0,6 г/л. Этот диапазон концентраций осалмида отличается от диапазона его концентраций в аналоге (1,0-1,2 г/л) в составе питательной среды на основе ГРМ-агара. При этом неожиданно выявлено синергидное действие осалмида с L - серином в составе синтетической селективной среды заявляемого способа. При раздельном применении осалмида в концентрации 0,5 г/л в питательном ГРМ-агаре и L - серина 2 г/л в солевой основе синтетической среды нет подавления роста бактерий P. chlororaphis и большинства видов энтеробактерий (таблица). При совместном применении осалмида и L - серина в этих же концентрациях в синтетической питательной среде заявляемого способа полностью подавляется рост всех штаммов P. chlororaphis и энтеробактерий (таблица), допускается рост только псевдомонад групп P. putida и P. fluorescens.
Третий отличительный существенный признак - использование в составе питательной среды комплекса минеральных солей: NaCI 5,0 г; Na2SO4 2,0 г; MgSO4 0,1 г; KH2PO4 0,5 г; K2HPO4 2,0 г на 1 л дистиллированной воды. Эти соли необходимы для обеспечения утилизации L - серина в составе синтетической среды и создания оптимальной рН среды.
Существенными признаками способа являются: температурный режим, аэробные условия культивирования, время инкубирования посевов, наличие этапа обогащения материала в жидкой питательной среде. Оптимальной температурой для культивирования является 28°С, при которой происходит рост всех групп псевдомонад, в том числе психротрофных. На питательной среде заявляемого способа при 28°С растут все исследуемые штаммы группы Р. putida (P. putida, P. fulva, P. monteilii, P. plecoglosicida) и группы Р. fluorescens; при 35°С наблюдается рост большинства штаммов группы Р. putida и редко штаммов P. fluorescens; при 42°С отсутствует рост всех псевдомонад. Аэробные условия культивирования определяются принадлежностью псевдомонад к аэробным бактериям. Время инкубирования посевов в течение 48 ч обусловлено медленным размножением исследуемых видов псевдомонад. Так как заявляемый способ предназначен для выделения искомых псевдомонад из объектов внешней среды, принимается во внимание видовое разнообразие и малые концентрации микроорганизмов во внешней среде. Поэтому применяется этап обогащения материала в жидкой
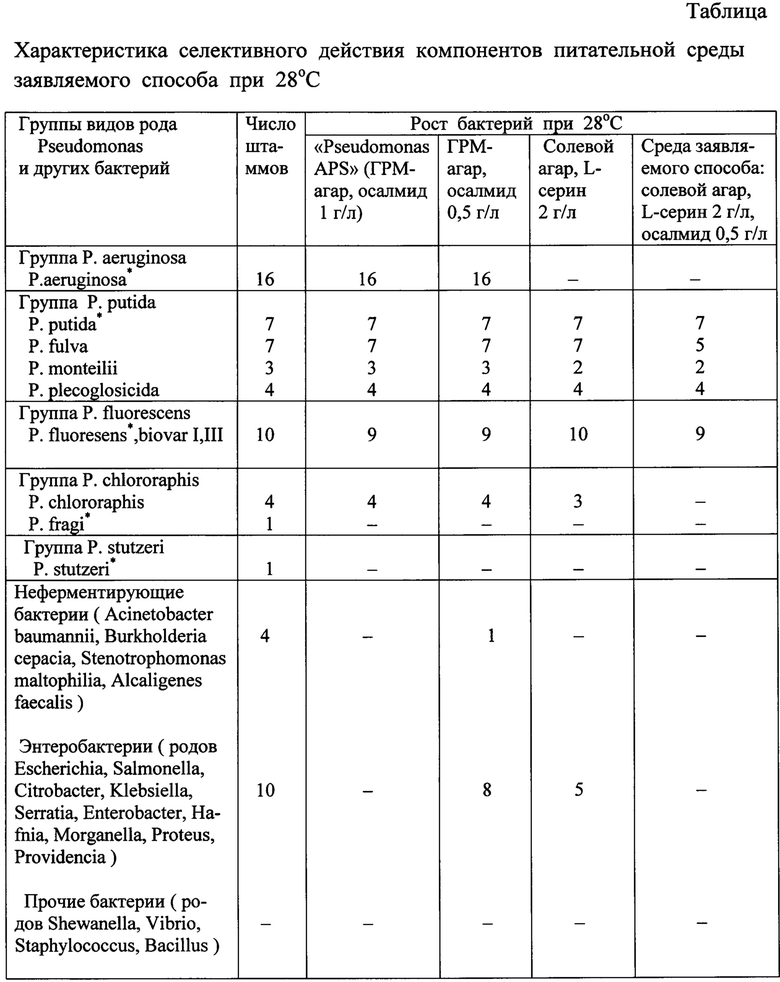
Примечание: - отсутствие роста бактерий; * в том числе типовой штамм бактерий.
питательной среде, позволяющий проводить посев различных объемов исследуемого материала.
Примеры, подтверждающие возможность осуществления способа.
Пример 1. Исследуемый материал - воду реки Невы в объеме 10 мл засевают во флакон с 50 мл жидкой питательной среды заявляемого способа (состав и приготовление питательной среды указаны в примечании к примеру). Посев инкубируют в аэробных условиях при 28°С в течение 48 ч, затем пересевают бактериологической петлей обогащенный материал из флакона на поверхность плотной питательной среды такого же состава. Инкубируют посевы в аэробных условиях при 28°С в течение 24-48 ч, затем учитывают результат. На поверхности питательной среды выросли газон и изолированные колонии бактерий, что указывает на принадлежность их к группам Р. putida, P. fluorescens. Контрольная идентификация выделенных бактерий традиционными культуральными и биохимическими тестами (оксидаза, чувствительность к ионам бария, продуцирование флуоресцеина, нитратредуктаза, желатиназа, рост при 4°С, 26°С, 35°С, 42°С) показали принадлежность их к псевдомонадам групп P. putida, P. fluorescens. Видовая идентификация методом MALDI-TOF масс-спектрометрии установила принадлежность их к видам P. putida, P. plecoglosicida, P. monteilii, P. fluorescens.
Примечание к примеру 1. Методика приготовления питательной среды заявляемого способа. Жидкая питательная среда. В 1 л дистиллированной воды вносят, г/л: L - серин 2,0; NaCI 5,0; Na2SO4 2,0; MgSO4 0,1; KH2PO4 0,5; K2HPO4 2,0; растворяют при нагревании, стерилизуют при 121°С в течение 20 минут, добавляют в горячую среду осалмид (CAS 526-18-1) 0.5 г (5 мл 10-процентного раствора осалмида в диметилсульфоксиде), проверяют рН 7,2±0.2, разливают по 50 мл в стерильные флаконы. Плотная питательная среда содержит в 1 л дистиллированной воды те же компоненты и дополнительно агар 12 г/л. После стерилизации при 121°С в течение 20 минут в горячую среду вносят осалмид 0,5 г (5 мл 10-процентного раствора осалмида в диметилсульфоксиде), проверяют рН 7,2±0,2, разливают в стерильные чашки Петри. Срок хранения готовых сред 15 суток при температуре от 4°С до 8°С. Контроль питательных сред: наличие роста бактерий на средах при посеве по методике заявляемого способа контрольных штаммов P. putida АТСС 12663 (или штамма P. putida, выделенного из внешней среды) и штамма P. fluorescens (выделенного из внешней среды) в посевной дозе 104 КОЕ/мл-1 при отсутствии роста контрольных штаммов P. aeruginosa АТСС 27853 и E. coli (выделенной из внешней среды) при посевной дозе 106 КОЕ/мл-1.
Пример 2. Исследуемый материал - воду реки Невы в объеме 10 мл засевают во флакон с 50 мл жидкой питательной среды заявляемого способа, содержащей на 1 л дистиллированной воды 4,0 г L - серина и 0,6 г осалмида (6 мл 10-процентного раствора осалмида в диметилсульфоксиде) и остальные ингредиенты по примечанию к примеру 1. Посев инкубируют в аэробных условиях при 28°С в течение 48 ч, затем переносят 0,1 мл обогащенного материала из флакона на плотную питательную среду и растирают шпателем. Плотная питательная среда содержит на 1 л дистиллированной воды 4,0 г L - серина и 0,6 г осалмида в 6 мл диметилсульфоксида, остальные ингредиенты по примечанию к примеру 1. Инкубируют посевы в аэробных условиях при 28°С в течение 24-48 ч, затем учитывают результат. На поверхности среды выросли газоном и изолированными колониями бактерии, что указывает на принадлежность их к псевдомонадам групп P. putida и P. fluorescens. Контрольная идентификация выделенных бактерий традиционными культуральными и биохимическими тестами подтвердила принадлежность их к псевдомонадам групп P. putida и P. fluorescens. Видовая идентификация бактерий методом MALDI-TOF масс-спектрометрии установила принадлежность их к видам P. putida, P. monteilii, P. plecoglosicida, P. fluorescens.
Таким образом, при всех предельных концентрациях основных ингредиентов питательной среды заявляемого способа (L - серин 2,0-4,0 г/л; осалмид 0,5-0,6 г/л) получены четкие результаты выделения и идентификации псевдомонад групп P. putida и P. fluorescens в исследуемом материале. Практическая апробация способа путем исследования 20 проб воды реки Невы позволила выделить псевдомонады групп P. putida и P. fluorescens из всех проб воды, что указывает на высокую эффективность заявляемого метода.
Изобретение относится к биотехнологии. Предлагается способ выделения и идентификации бактерий групп Pseudomonas putida и Pseudomonas fluorescens. Способ предусматривает посев исследуемого материала в жидкую селективную синтетическую питательную среду, содержащую L-серин, осалмид (CAS 526-18-1), диметилсульфоксид, NaCl, Na2SO4, MgSO4, КН2РO4, К2НРO4 и дистиллированную воду в заданных соотношениях. Осуществляют инкубирование в аэробных условиях при 28°С в течение 48 ч с последующим пересевом на плотную питательную среду этого же состава, содержащую дополнительно агар, и инкубированием при 28°С в аэробных условиях в течение 24-48 ч. Идентификацию бактерий групп Pseudomonas putida и Pseudomonas fluorescens осуществляют по наличию выросших колоний или газона бактерий. Изобретение позволяет повысить селективность выделения из внешней среды Pseudomonas putida и Pseudomonas fluorescens. 1 табл., 2 пр.
Способ выделения и идентификации бактерий групп Pseudomonas putida и Pseudomonas fluorescens, предусматривающий посев исследуемого материала в жидкую питательную среду, содержащую источники азота и углерода, минеральные соли, ингибиторы микроорганизмов, дистиллированную воду; инкубирование посевов при 28°С в аэробных условиях в течение 48 ч, пересев на плотную питательную среду, инкубирование посевов при 28°С в аэробных условиях в течение 24-48 ч; определение принадлежности бактерий к группам P. putida и P. fluorescens по наличию выросших колоний или газона бактерий, отличающийся тем, что в качестве жидкой и плотной селективных сред используют синтетическую питательную среду одинакового состава, кроме агара, содержащую в качестве единственного источника азота и углерода L-серин, ингибитор осалмид (CAS 526-18-1) 0,5-0,6 г/л, растворенный в диметилсульфоксиде, а также NaCl, Na2SO4, MgSO4, KH2PO4, K2HPO4 при следующем содержании ингредиентов:
рН 7,2±0,2.
| ВАСИЛЬЕВ Д.А., ВИКТОРОВ Д.А., и др | |||
| Выделение и типирование бактерии Pseudomonas putida, Вестник Ульяновской государственной сельскохозяйственной академии, 2009, N 3 (10), с | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ PSEUDOMONAS AERUGINOSA | 2017 |
|
RU2658435C1 |
| СПОСОБ ВНУТРИРОДОВОЙ ИДЕНТИФИКАЦИИ БАКТЕРИЙ РОДА PSEUDOMONAS | 2007 |
|
RU2361923C2 |
| СПОСОБ ВОЗДЕЙСТВИЯ НА ПРИЗАБОЙНУЮ ЗОНУ СКВАЖИНЫ НА СТАДИИ ОСВОЕНИЯ (ВАРИАНТЫ) И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2373387C1 |
Авторы
Даты
2019-07-05—Публикация
2019-01-17—Подача