Изобретение относится к 5-замещенным 1-фенил-1,5-дигидропиридо[3,2-b]индол-2-онам, аналогам 1-фенил-1H-бензо[4,5]фуро[3,2-b]пиридин-2-онов и 1-фенил-1H-бензо[4,5]тиено[3,2-b]пиридин-2-онов, к применению этих соединений как ингибиторов ВИЧ, а также к фармацевтическим композициям, содержащим эти соединения, и к способам получения этих соединений и композиций.
Вирус, вызывающий синдром приобретенного иммунодефицита (СПИД), известен под другими названиями, включая вирус T-лимфоцита III (HTLV-III), лимфоаденопатический вирус (LAV), СПИД-ассоциированный вирус (ARV) или вирус иммунодефицита человека (ВИЧ). До сих пор были идентифицированы два разных класса, например, ВИЧ-1 и ВИЧ-2. В дальнейшем в данной патентной заявке термин ВИЧ будет применяться, чтобы в общем обозначить оба этих класса.
В настоящее время пациентов, инфицированных ВИЧ, лечат ингибиторами ВИЧ протеазы (PI), нуклеозидными ингибиторами обратной транскриптазы (NRTI), ненуклеозидными ингибиторами обратной транскриптазы (NNRTI) и нуклеотидными ингибиторами обратной транскриптазы (NtRTI). Несмотря на тот факт, что эти антиретровирусы очень широко применяются, они имеют общеизвестное ограничение, а именно целевые ферменты в ВИЧ вирусе способны мутировать таким образом, что известные лекарства становятся менее эффективными или даже неэффективными против таких мутированных ВИЧ вирусов. Или, говоря другими словами, ВИЧ вирус создает постоянно увеличивающуюся резистентность к любым доступным лекарствам, и при проведении терапии это является основной причиной неэффективного лечения. Более того, было показано, что резистентный вирус передается вновь инфицированным пациентам, приводя к значительному ограничению в опциях при проведении терапевтических мероприятий для таких не принимавших лекарств пациентов.
Современная терапия ВИЧ заключается в большинстве случаев в назначении коктейля из медицинских препаратов, состоящего из двух или более активных ингредиентов, выбранных из вышеуказанных классов ингибиторов ВИЧ. Но даже при применении комбинированной терапии резистентность к препаратам возрастает, в результате сочетание препаратов становится менее эффективным. Это часто может вынудить лечащего врача повысить уровни плазмы активных препаратов для того, чтобы восстановить эффективность вышеуказанных антиретровирусных препаратов против мутированных ВИЧ вирусов, в результате такого повышения является нежелательное увеличение нагрузки на организм лекарствами. Последнее, в свою очередь, может также привести к повышенному риску несовместимости с прописанной терапией.
Исходя из вышеизложенного, существует постоянная повсеместная необходимость в новых комбинациях ВИЧ ингибиторов, которые содержат новые типы ВИЧ ингибиторов. Следовательно, существует необходимость в новых ВИЧ ингибиторах, которые отличаются от существующих ингибиторов химической структурой, а также типом активности или тем и другим. В частности, существует необходимость в соединениях, которые обладали бы активностью не только против дикого типа ВИЧ вируса, но также против все более и более распространенных резистентных ВИЧ вирусов.
Применяемые в настоящее время ингибиторы ВИЧ обратной транскриптазы принадлежат к трем разным классам. Они включают NRTI, которые внутриклеточно преобразуются до нуклеозидтрифосфатов, которые конкурируют с природными нуклеозидтрифосфатами, с целью включения в удлиненную вирусную ДНК с помощью обратной транскриптаза. Химические модификации, которые отличают такие соединения от природных нуклеозидов, приводят к явлениям обрыва в цепи ДНК. NRTI, которые в настоящее время доступны, включают зидовудин (AZT), диданозин (ddI), зальцитабин (ddC), ставудин (d4T), ламивудин (3TC) и абакавир (ABC). Второй класс содержит NtRTI, такие как тенофовир, который обладает сходным типом действия в качестве NRTI. Возникновение мутаций приводит к тому, что NRTI и NtRTI становятся неэффективными. Третий класс содержит NNRTI, которые взаимодействуют со связывающим участком NNRTI и таким образом блокируют механизм RT (обратной транскриптазы). Доступные в настоящее время NNRTI включают невирапин, делавирдин и эфавиренз, которые, как известно, восприимчивы к относительно быстрому возникновению резистентности, вызванной мутациями у аминокислот, которые окружают связывающий участок NNRTI.
Таким образом, существует медицинская необходимость в новых противоинфекционных соединениях, которые нацелены на обратную транскриптазу ВИЧ, в частности в антиретровирусных соединениях, которые способны задержать появление резистентности и которые противодействуют широкому спектру мутантов ВИЧ вируса.
Патенты WO02/055520 и WO02/059123 раскрывают бензоилалкилиндолпиридиновые соединения в качестве противовирусных препаратов. Рябова с соавторами раскрывают синтез некоторых бензоилалкилиндолпиридиновых соединений (Russian Chem. Bull. 2001, 50(8), 1449-1456; и Chem. Heterocycl. Compd. (Engl. Translat.) 36; 3; 2000; 301-306; Khim. Geterotsikl. Soedin.; RU; 3; 2000; 362-367).
Соединения этого изобретения отличаются от соединений известного уровня техники химической структурой, а также тем, что они взаимодействуют через механизм, который отличается от известных ингибиторов RT. Они не только активны против дикого типа ВИЧ вируса, но также против мутантных ВИЧ вирусов, в частности мутантных ВИЧ вирусов, демонстрирующих резистентность к доступным в настоящее время ингибиторам обратной транскриптазы (RT).
Таким образом, в одном аспекте настоящее изобретение относится к 1-фенил-1,5-дигидропиридо[3,2-b]индол-2-онам и их аналогам, которые можно представить формулой (I):
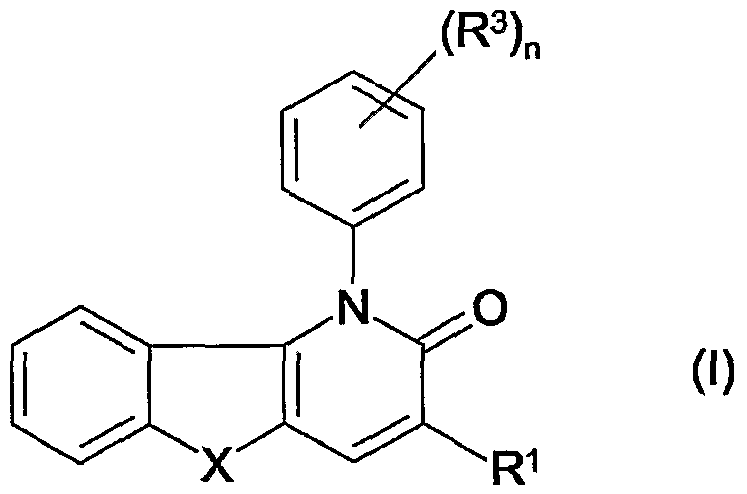
их N-оксидам, солям, четвертичным солям аммония, стереоизометрическим формам, пролекарствам, сложным эфирам и их метаболитам, в которых
X является двухвалентным радикалом NR2, О, S, SO, SO2;
R1 является водородом, циано, галогеном, аминокарбонилом, гидроксикарбонилом, С1-4алкилоксикарбонилом, С1-4алкилкарбонилом, моно- или ди(С1-4алкил)аминокарбонилом, ариламинокарбонилом, N-(арил)-N-(С1-4алкил)аминкарбонилом, метанимидамидилом, N-гидроксиметанимидамидилом, моно- или ди(С1-4алкил)метанимидамидилом, Гет1 или Гет2;
n равен 1, 2 или 3;
R2 является:
i) арилом, замещенным радикалом -COOR4; или R2 является
ii) C1-10алкилом, C2-10алкенилом, С3-7циклоалкилом, каждый из вышеуказанных C1-10алкила, C2-10алкенила, С3-7циклоалкила, каждый индивидуально и независимо замещен арилом, в котором вышеуказанный арил замещен радикалом -COOR4; или R2 является
iii) C1-10алкилом, C2-10алкенилом, С3-7циклоалкилом, каждый индивидуально и независимо, замещен радикалом, выбранным из -NR5a-С(=NR5b)-NR5cR5d, -NR5a-C(=NR5e)-R5f, -О-NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5e)-R5f, -сульфонил-R6, -NR7R8, -NR9R10, радикалов
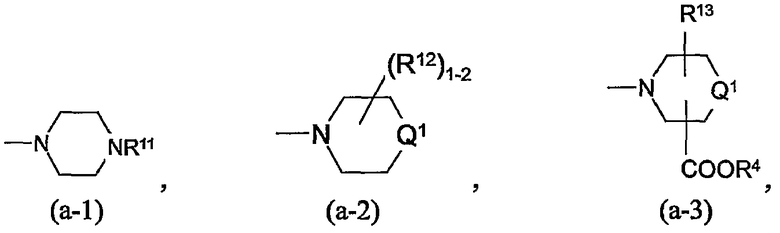
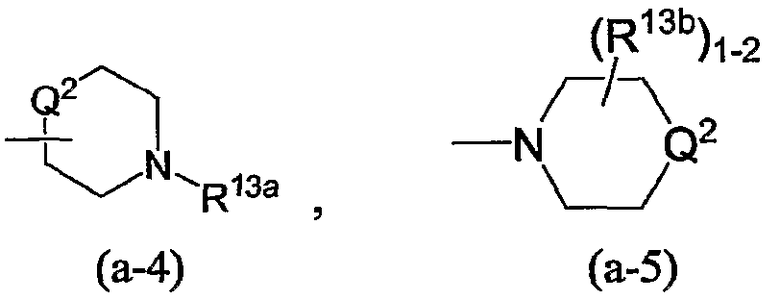
в которых
каждый Q1 независимо является простой связью, -CH2- или -CH2-CH2-;
каждый Q2 независимо является O, S, SO или SO2;
каждый R4 независимо является водородом, С1-4алкилом, арилС1-4 алкилом;
каждый R5a, R5b, R5c, R5d независимо является водородом, С1-4алкилом или арилС1-4алкилом;
каждый R5e, R5f независимо является водородом, С1-4алкилом или арилС1-4алкилом, или R5e и R5f, взятые вместе, могут образовать двухвалентный алкандиильный радикал формулы -CH2-CH2- или -CH2-CH2-CH2-;
R6 является С1-4алкилом, -N(R5aR5b), С1-4алкилокси, пирролидин-1-илом, пиперидин-1-илом, гомопиперидин-1-илом, пиперазин-1-илом, 4-(С1-4алкил)-пиперазин-1-илом, морфолин-4-ил-, тиоморфолин-4-ил-, 1-оксотиоморфолин-4-илом и 1,1-диоксо-тиоморфолин-4-илом;
R7 является водородом, С1-4алкилом, гидроксиС1-4алкилом, С1-4алкоксиС1-4алкилом или С1-4алкилкарбонилоксиС1-4алкилом;
R8 является гидроксиС1-4алкилом, С1-4алкоксиС1-4алкилом, С1-4алкилкарбонилоксиС1-4алкилом, арилом или арилС1-4алкилом;
R9 является водородом или С1-4алкилом;
R10 является Гет1, Гет2 или радикалом
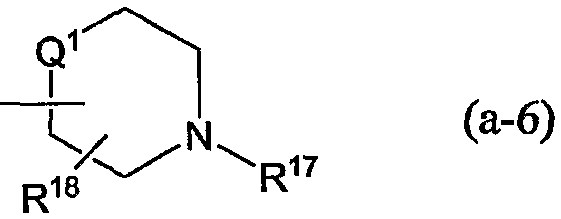
R11 является арилом, арилС1-4алкилом, формилом, С1-4алкилкарбонилом, арилкарбонилом, арилС1-4алкилкарбонилом, С1-4алкилоксикарбонилом, арилС1-4алкилоксикарбонилом, R5aR5bN-карбонилом, гидроксиС1-4алкилом, С1-4алкилоксиС1-4алкилом, арил С1-4алкилоксиС1-4алкилом, арилоксиС1-4алкилом, Гет2;
каждый R12 независимо является гидрокси, С1-4алкилом, арилС1-4алкилом, С1-4алкилокси, арилС1-4алкилокси, оксо, спиро(С2-4алкандиокси), спиро(диС1-4алкилокси), -NR5aR5b;
R13 является водородом, гидрокси, С1-4алкилом, С1-4алкилокси, или арилС1-4алкилокси; или
R13a является С1-4алкилом, арилС1-4алкилом, С1-4алкилоксикарбонилом или арилС1-4алкилоксикарбонилом;
каждый R13b является водородом или С1-4алкилом; или R2 является
iv) радикалом формул:
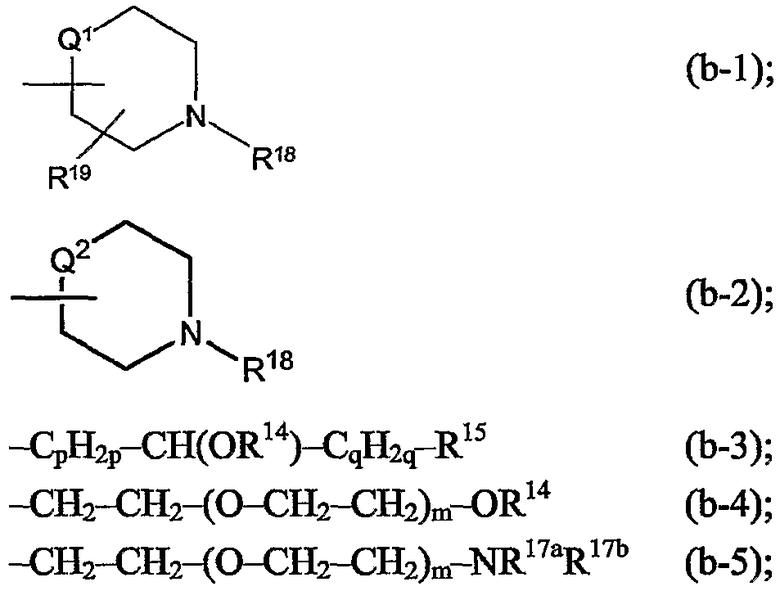
где в радикале (b-3) один из атомов водорода в -СpН2р- и один из атомов водорода в -CH(OR14)-CqH2q-, которые не являются частью R14, могут быть заменены простой связью или С1-4алкандиильной группой;
p равен 1, 2 или 3;
q равен 0, 1, 2 или 3;
каждый m независимо равен 1-10;
каждый R14 независимо является водородом, С1-4алкилом, арилС1-4алкилом, арилом, С1-4алкилкарбонилом, -SO3H, -PO3H2;
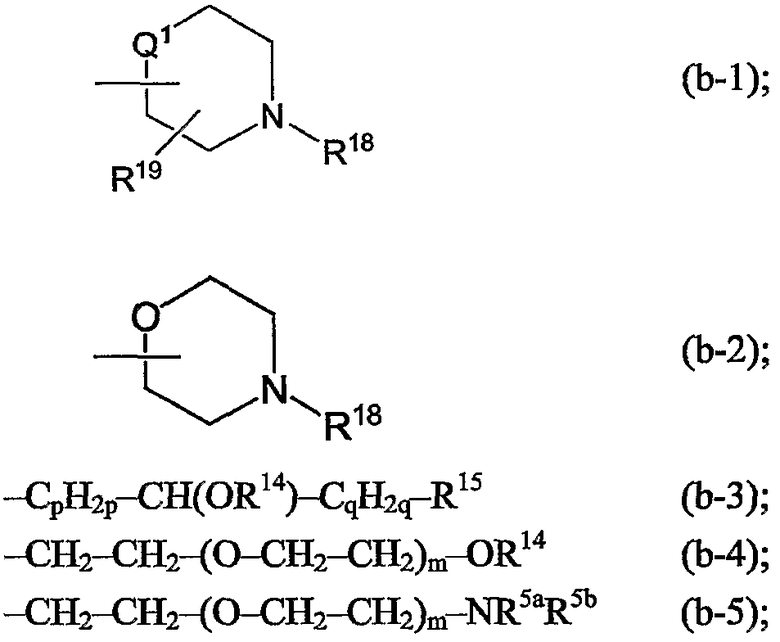
R15 является заместителем, выбранным из группы, состоящей из циано, NR16aR16b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, 4-(С1-4алкилкарбонил)-пиперазинила, 4-(С1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, С1-4алкилкарбонила, N(R16aR16b)карбонила, С1-4алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(С1-4алкил)-пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксо-тиоморфолин-1-илкарбонила; или R15 дополнительно может быть арилом, замещенным радикалом -COOR4; или радикалом, выбранным из -NR5a-C(=NR5b)-NR5сR5d, -NR5a-C(=NR5e)-R5f, -О-NR5a-C(=NR5b)NR5cR5d, -О-NR5a-C(=NR5e)-R5f, -сульфонил-R6, -NR7R8, -NR9R10, радикалом (a-1), (a-2), (a-3), (a-4) или (a-5); в котором R4, R5a, R5b, R5c, R5d, R6, R7, R8, R9, R10 и радикалы (a-1), (a-2), (a-3), (a-4), (a-5) независимо являются такими, как в вышеприведенном определении;
R16a и R16b, независимо друг от друга, являются водородом, С1-6алкилом или С1-6алкилом, замещенным заместителем, выбранным из группы, состоящей из амино, моно- или ди(С1-4алкил)амино, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила и арила;
R17a и R17b, независимо друг от друга, являются водородом, С1-4алкилом или
арилС1-4алкилом; или R17a и R17b вместе с атомом азота, к которому они присоеденены, образуют пирролидинильное, пиперидинильное, гомопиперидинильное, морфолинильное, тиоморфолинильное, 1-оксотиоморфолинильное, 1,1-диоксо-тиоморфолинильное, пиперазинильное, 4-С1-4алкил-пиперазинильное,
4-(С1-4алкилкарбонил)-пиперазинильное, 4-(С1-4алкилоксикарбонил)-пиперазинильное кольцо;
каждый R18 независимо является водородом, С1-4алкилом, арилС1-4алкилом, С1-4алкилкарбонилом или С1-4алкилоксикарбонилом;
R19 является водородом, гидрокси, С1-4алкилом или радикалом -COOR4;
R3 является нитро, циано, амино, галогеном, гидрокси, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, С1-4алкилоксикарбонилом, моно- или
ди(С1-4алкил)аминокарбонилом, С1-4алкилкарбонилом, метанимидамидилом, моно- или
ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом или Гет1; арил является фенилом, необязательно замещенным одним или несколькими заместителями, каждый из которых индивидуально выбран из группы, состоящей из С1-6алкила, С1-4алкокси, галогена, гидрокси, амино, трифторметила, циано, нитро, гидроксиС1-6алкила, цианоС1-6алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила;
Гет1 является 5-членным гетероциклом, в котором один, два, три или четыре члена кольца являются гетероатомами, каждый из которых индивидуально и независимо выбран из группы, состоящей из азота, кислорода и серы, и в котором оставшиеся члены кольца являются атомами углерода; и, где возможно, любой атом азота в гетероцикле необязательно может быть заменен С1-4алкилом; любой атом углерода в кольце, каждый индивидуально и независимо, необязательно может быть замещен заместителем, выбранным из группы, состоящей из С1-4алкила, C2-6алкенила, C3-7циклоалкила, гидрокси, С1-4алкокси, галогена, амино, циано, трифторметила, гидроксиС1-4алкила, цианоС1-4алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила, арил С1-4алкила, аминоС2-6алкенила, моно- или ди(С1-4алкил)аминоС2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и в котором любой из предшествующих фрагментов фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила и триазолила необязательно может быть замещен С1-4алкилом;
Гет2 является пиридилом, пиримидинилом, пиразинилом, пиридазинилом или триазинилом, в котором любой атом углерода каждого из вышеуказанных 6-членных азотсодержащий ароматических колец, необязательно может быть замещен С1-4алкилом.
В определенном аспекте данное изобретение относится к соединениям формулы (I), в которой R1 является циано; X является O или NR2, ге R2 является С1-10алкильным радикалом, замещенным, как указано ранее в патентной заявке, или R2 является линейным радикалом формулы (b-3) или (b-4); n равен 1 и R3 является нитро.
Примененный в данной патентной заявке термин «С1-4алкил», в значении группы или части группы, характеризует прямую или разветвленную цепь, насыщенную углеводородными радикалами, имеющими от 1 до 4 атомов углерода, такими как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил;
«С1-6алкил» охватывает С1-4алкильные радикалы и их высшие гомологи, имеющие 5 или 6 атомов углерода, такие как, например, 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и подобные.
Термин «С1-10алкил», в значении группы или части группы, охватывает С1-6алкильные радикалы и их высшие гомологи, имеющие от 7 до 10 атомов углерода, таких как, например, 1-гептил, 2-гептил, 2-метил-1-гексил, 2-этил-1-гексил, 1-октил, 2-октил, 2-метил-1-гептил, 2-метил-2-гептил, 1-нонил, 2-нонил, 2-метил-1-октил, 2-метил-2-октил, 1-децил, 2-децил, 3-децил, 2-метил-1-децил и подобные.
Термин «С2-6алкенил», в значении группы или части группы, определяет углеводородные радикалы с прямой или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и, по меньшей мере, одну двойную связь, и имеющие от 2 до 6 атомов углерода, такие как, например, пропенил, бутен-1-ил, бутен-2-ил, 2-бутен-1-ил, 3-бутен-1-ил, пентен-1-ил, пентен-2-ил, 2-пентен-2-ил, гексен-1-ил, гексен-2-ил, гексен-3-ил, 2-метилбутен-1-ил, 1-метил-2-пентен-1-ил и подобные. Термин «С2-10алкенил», в значении группы или части группы, определяет С2-6алкенильные группы и их высшие гомологи, имеющие от 7 до 10 атомов углерода и, по меньшей мере, одну двойную связь, такие как, например, гептен-1-ил, 2-гептен-1-ил, 3-гептен-1-ил, октен-1-ил, 2-октен-1-ил, 3-октен-1-ил, нонен-1-ил, 2-нонен-1-ил, 3-нонен-1-ил, 4-нонен-1-ил, децен-1-ил, 2-децен-1-ил, 3-децен-1-ил, 4-децен-1-ил 1-метил-2-гексен-1-ил и подобные. Предпочтительными являются С2-6алкенильные или С2-10алкенильные группы, имеющие одну двойную связь. Всегда, когда есть соединение с гетероатомом, С2-6алкенильные или С2-10алкенильные группы преимущественно присоединяются к гетероатому с помощью насыщенного атома углерода. Предпочтительными группами среди С2-6алкенилов или С2-10алкенилов являются С3-6алкенилы или С3-10алкенилы, которые являются алкенильными группами, как указано в данной патентной заявке, имеющими от 3 до 6 или от 3 до 10 атомов углерода.
Термин «С3-7циклоалкил» является обозначением, характерным для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила.
Термин «С1-4алкандиил» определяет двухвалентную прямую или разветвленную цепь насыщенных углеводородных радикалов, имеющих от 1 до 4 атомов углерода, таких, например, как метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил и подобные, которые относятся к двухвалентным С1-4алкильным радикалам, имеющим от одного до четырех атомов углерода, в частности метилен, 1,2-этандиил, 1,1-этандиил, 1,2-пропандиил, 1,3-пропандиил, 1,2-бутандиил, 1,3-бутандиил, 1,4-бутандиил. Также «С2-4алкандиил» относится к двухвалентным углеводородным атомам, имеющим от 2 до 4 атомов углерода. Отдельный интерес представляют С1-4алкандиильные группы, в которых атомы углерода, несущие связующую связь, являются соседними друг к другу (в соседнем положении), причем на эти группы иногда ссылаются как на этилен, пропилен и бутилен.
«С2-4алкандиокси» относится к прямой и разветвленной цепи насыщенных углеводородных радикалов, имеющих 2-4 атома углерода и две группы окси (-О-), например 1,2-этандиокси (-О-CH2-CH2-O-), 1,3-пропандиокси (-О-CH2CH2CH2-O-), 1,2-пропандиокси (-О-CH2-CH(CH3)-О-), 1,4-бутандиокси (-О-CH2CH2CH2CH2-O-) и подобные.
Термины «спиро(С2-4алкандиокси)» и «спиро(диС1-4алкилокси)» имеют отношение к присоединению С2-4алкандиокси и диС1-4алкилокси к тому же атому углерода, образуя кольцо.
Термин «галоген» является общим для фтора, хлора, брома или йода.
ГидроксиС1-6алкильная группа, когда замещена по атому кислорода или атому азота, предпочтительно является гидроксиС2-6алкильной группой, в которой гидрокси и кислород или азот разделены, по меньшей мере, двумя атомами углерода.
Термин «метанимидамидил» применяется в соответствии со справочником химической номенклатуры (CAS) и относится к радикалу формулы H2N-C(=NH)-, где радикал также может быть отнесен к «амидину». Подобным образом N-гидрокси-метанимидамидил применяется в соответствии с номенклатурой CAS и относится к радикалу формулы H2N-C(=N-OH)- или его таутомеру HN=C(-NH-OH)-, по которой радикал также может быть отнесен к «гидроксиамидину».
Термин «гидроксикарбонил» относится к карбоксильной группе (-COOH).
Арильная группа является фенилом, необязательно замещенным одним или несколькими заместителями, и в частности является фенилом, необязательно замещенным одним, двумя, тремя, четырьмя или пятью заместителями, предпочтительно фенилом, замещенным одним, двумя или тремя заместителями.
Гет1, в частности, является 5-членным кольцом, как указано ранее в данной патентной заявке, где кольцо является ароматическим. В более частном случае Гет1 является 5-членным кольцом, как указано ранее в патентной заявке, в котором кольцо содержит один кислород, серу или азот и необязательно один, два или три дополнительных атомов азота и в котором оставшиеся члены кольца являются атомами углерода. Далее, в частности, Гет1 является ароматическим 5-членным кольцом, как указано ранее в патентной заявке, в котором кольцо содержит один кислород, серу или атом азота и необязательно один, два или три дополнительных атомов азота и в котором оставшиеся члены кольца являются атомами углерода. В каждом из примеров, упомянутых в этом разделе, Гет1 необязательно может быть замещен любым из указанных в данной патентной заявке заместителей, в определениях соединений формулы (I), а также любой из подгрупп соединений формулы (I).
Примерами циклов Гет1 являются фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, изоксазолил, изотиазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, каждый из которых индивидуально и независимо необязательно может быть замещен заместителем, выбранным из группы, состоящей из С1-4алкила, С2-6алкенила, С3-7циклоалкила, гидрокси, С1-4алкокси, галогена, амино, циано, трифторметила, гидроксиС1-4алкила, цианоС1-4алкила, моно- или
ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила, арилС1-4алкила, аминоС2-6алкенила, моно- или ди(С1-4алкил)аминоC2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или
ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и в которой любой из вышеуказанных фрагментов фуранильного, тиенильного, пирролильного, оксазолильного, тиазолильного, имидазолильного, изоксазолильного, изотиазолильного, пиразолильного, оксадиазолильного, тиадиазолильного и триазолильного необязательно может быть замещен С1-4алкилом.
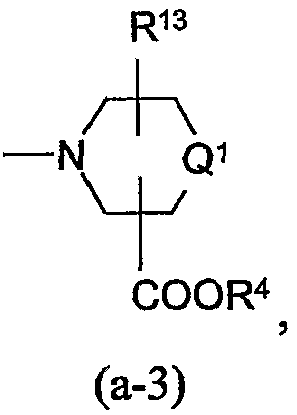
Заместители R12, R13, -COOR4, R13a, R18, R19 по радикалам (a-2), (a-3), (a-5), (a-6) и (b-1) могут быть расположены на любом атоме углерода кольца, включая атомы радикалов Q1. Предпочтительно, заместители R12, R13, R13a, R18 или R19 не находятся в α-положении от атома азота кольца, в частности, где любой из вышеуказанных заместителей является оксо, спиро(С2-4алкандиилдиокси), спиро(диС1-4алкилокси), -NR5aR5b, гидрокси или С1-4алкилокси. Отдельный интерес представляют радикалы (a-2), (a-3), (a-5), (a-6) и (b-1), в которых заместители R12, R13, R13a, R18 или R19 располагаются на атоме углерода Q1 или где Q1 является прямой связью по атому углерода кольца, к которому Q1 присоединен.
Соединяющая связь в радикалах (a-3), (a-4) и (a-6) может располагаться на любом атоме углерода кольца, включая атомы радикалов Q1.
Следует заметить, что разные изомеры разнообразных гетероциклов могут существовать в объеме определений, указанных в описании. Например, оксадиазолил может быть 1,2,4-оксадиазолилом или 1,3,4-оксадиазолилом или 1,2,3-оксадиазолилом; также для тиадиазолила, который может быть 1,2,4-тиадиазолилом или 1,3,4-тиадиазолилом или 1,2,3-тиадиазолилом; пирролил может быть 1H-пирролилом или 2H-пирролилом.
Также следует заметить, что положения радикалов на любом молекулярном фрагменте, примененном в определениях, может находиться в любом положении фрагмента до тех пор, пока оно химически стабильно. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1-пентил, 2-пентил и 3-пентил, морфолинил включает 4-морфолинил, 3-морфолинил и 2-морфолинил.
Когда любые переменные параметры (например, галоген или С1-4алкил) встречаются более одного раза в любом компоненте, каждое определение является независимым.
Термин «пролекарство», как он применяется в данной патентной заявке, означает фармакологически приемлемые производные, такие как сложные эфиры, амиды и фосфаты, такие, что продукт, полученный вследствие in vivo биотрансформации, является активным лекарственным средством согласно вышеприведенному определению в соединениях формулы (I). Ссылка Goodman и Gilman (The Pharmacological Basis of Therapeutics, 8th ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p.13-15), описывающая пролекарства, в целом включена в данную патентную заявку. Предпочтительно пролекарства обладают великолепной растворимостью в воде, повышенной биодоступностью и легко метаболизируются в активные ингибиторы in vivo. Пролекарства соединений настоящего изобретения можно получить путем модификации функциональных групп, присутствующих в соединении таким образом, что модификации расщепляются (гидролизуются), либо манипулированием порядка, либо in vivo, до начального соединения.
Предпочтительными пролекарствами являются фармацевтически приемлемые сложные эфиры, которые являются гидролизуемыми in vivo и получаются из соединений формулы (I), имеющих гидрокси или карбоксильную группу. Гидролизуемый сложный эфир - это сложный эфир, который гидролизуется в организме человека или животного с образованием исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры для карбокси включают
С1-6алкоксиметиловые эфиры, например метоксиметиловый, С1-6алканоилоксиметиловый эфиры, например пивалоилоксиметиловый, фталидиловый эфиры, С3-8циклоалкоксикарбонилоксиС1-6алкиловый эфир, например 1-циклогексилкарбонилоксиэтиловый; 1,3-диоксолен-2-онилметиловые эфиры, например 5-метил-1,3-диоксолен-2-онилметиловый; и С1-6алкоксикарбонилоксиэтиловые эфиры, например 1-метоксикарбонилоксиэтиловый, и могут образовываться на любой карбоксигруппе в соединениях данного изобретения.
Гидролизуемый in vivo сложный эфир соединения формулы (I), содержащий гидрокси, включает неорганические сложные эфиры, такие как фосфатные эфиры, и α-ацилоксиалкильные простые эфиры и родственные соединения, которые, как результат гидролиза in vivo сложного эфира, разрываются, чтобы дать исходную гидроксигруппу. Примеры α-ацилоксиалкильных простых эфиров включают ацетоксиметокси- и 2,2-диметилпропионилокси-метокси-эфир. Выбор гидролизуемого in vivo сложного эфира, образующего группы для гидрокси, включает алканоил, бензоил, фенилацетил и замещенный бензоил и фенилацетил, алкоксикарбонил (для получения сложных эфиров алкилкарбонатов), диалкилкарбомаил и N-(диалкиламиноэтил)-N-алкилкарбамоил (для получения карбаматов), диалкиламиноацетил и карбоксиацетил. Примеры заместителей по бензоилу включают морфолинo и пиперазинo, соединившие атом азота кольца через метиленовую группу с 3- или 4-позицией бензольного кольца.
Для терапевтического применения соли соединений формулы (I) являются такими, в которых противоион является фармацевтически или физиологически приемлемым. Однако солям, имеющим фармацевтически неприемлемый противоион, также можно найти применение, например, в получении или очистке фармацевтически приемлемого соединения формулы (I). Все соли, являются ли они фармацевтически пригодными или нет, включены в объем настоящего изобретения.
Фармацевтически приемлемые или физиологически переносимые формы аддитивной соли, которые способны образовать соединения настоящего изобретения, могут быть легко получены при применении соответствующих кислот, таких как, например, неорганические кислоты, такие как галогеноводородные кислоты, например, хлористоводородная или бромистоводородная кислоту; серная; гемисерная, азотная; фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, аспарагиновая, додецил-серная, гептановая, гексановая, никотиновая, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая кислота, п-аминосалициловая, памовая и подобные кислоты.
И наоборот, вышеупомянутые кислотные формы аддитивных солей можно преобразовывать путем обработки соответствующим основанием в свободную основную форму.
Соединения формулы (I), содержащие кислотный протон, также можно преобразовывать в их нетоксичную металлическую или аминную аддитивную основную форму соли путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие основные формы солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и подобной, соли с органическими основаниями, например соли бензатин, N-метил-D-глюкамин, гидрабамин, и соли с такими аминокислотами, как, например, аргинин, лизин и подобные.
Обратимо вышеупомянутые основные аддитивные формы соли можно преобразовывать путем обработки соответствующей кислотой в свободную кислотную форму.
Термин «соли» также включает гидраты и растворяющие аддитивные формы, которые соединения настоящего изобретения способны образовать. Примерами таких форм являются, например, гидраты, алколяты и подобное.
Термин «четвертичная соль аммония», как применен в данной патентной заявке, определяет четвертичную соль аммония, которую соединения формулы (I) способны образовать с помощью реакции между основным азотом соединения формулы (I) и соответствующим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилйодид или бензилйодид. Другие реагенты с хорошими уходящими группами также могут применяться, например алкилтрифторметан сульфонаты, алкилметан сульфонаты и алкил п-толуолсульфонаты. Четвертичный амин обладает положительно заряженным азотом. Фармацевтически допустимые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион может быть введен с помощью применения ионообменных смол.
Частными четвертичными солями аммония являются те, что получены из групп -NR7R8, -NR9R10, -N(R5aR5b), пирролидин-1-ил, пиперидин-1-ил, гомопиперидин-1-ил,
4-(C1-4алкил)-пиперазин-1-ил, морфолин-4-ил-, NR16aR16b; или NR17aR17b. Эти квартенизированные группы можно представить формулами -(NR7R8R8a)+, -(NR9R10R8a)+, -(NR5aR5bR8a)+, -(NR16aR16bR8a)+; -(NR17aR17bR8a)+, 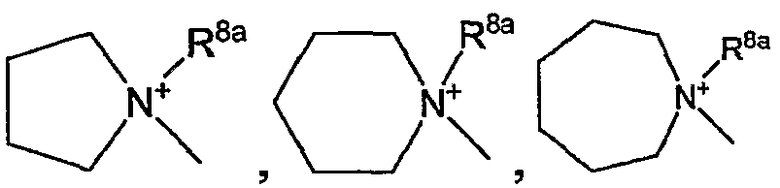
или
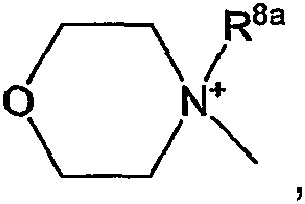
в которых каждый R8a независимо является С1-6алкилом, арилС1-6алкилом или гидроксиС1-6алкилом, в частности каждый R8a независимо является С1-6алкилом или арилС1-6алкилом.
Имеется в виду, что N-оксидные формы данных веществ включают соединения формулы (I), в которых один или несколько атомов азота окисляются до так называемых N-оксидов.
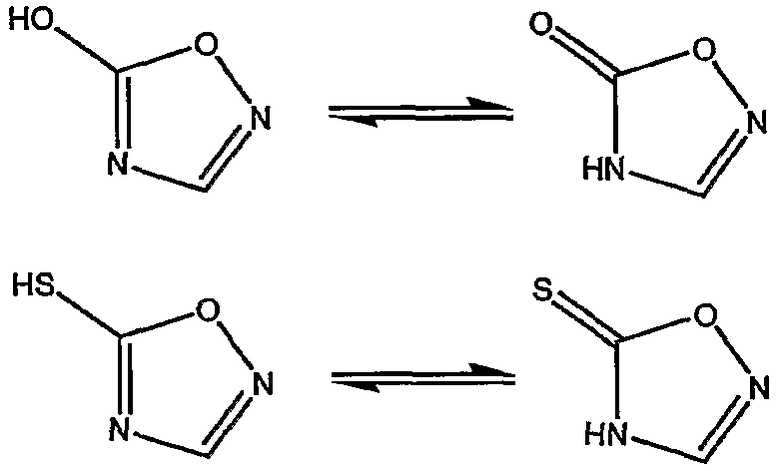
Некоторые соединения данной патентной заявки также могут существовать в таутомерных формах. Такие формы, хотя и неоднозначно определены в вышеуказанной формуле, следует включать в область настоящего изобретения. Например, в рамках определения Гет, 5-членный ароматический гетероцикл, такой как, например, 1,2,4-оксадиазол может быть замещенным гидрокси или тио в 5-положении, таким образом находясь в равновесии с его соответствующей таутомерной формой, как изображено ниже.
Термин стереохимические изомерные формы соединений настоящего изобретения в том значении, какое применяется в данной патентной заявке, определяет все возможные соединения, составленные из тех же самых атомов, связанных той же самой последовательностью связей, но имеющих отличные трехмерные структуры, которые не являются взаимозаменяемыми, которыми могут обладать соединения настоящего изобретения. Если не оговорено или определено особо, химическое обозначение соединения охватывает смесь всех возможных стереохимических изомерных форм, которыми вышеуказанное вещество может обладать. Вышеуказанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры вышеуказанного соединения. Все стереохимические изомерные формы соединений настоящего изобретения как в чистом виде, так и в виде примесей одного в другом, следует охватывать в пределах области настоящего изобретения.
Чистые стереоизомерные формы соединений и промежуточные соединения в значении, упомянутом в данной патентной заявке, определяются как изомеры, по существу свободные от других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры вышеуказанных соединений или промежуточных соединений. В частности, термин «стереоизомерно чистый» касается соединений или промежуточных соединений, имеющих стереоизомерный избыток, по меньшей мере, 80% (то есть минимум 90% одного изомера и максимум 10% других возможных изомеров), вплоть до стереоизомерного избытка 100% (то есть 100% одного изомера и полное отсутствие другого), в более частном случае соединения или промежуточные соединения, имеющие стереоизомерный избыток от 90% до 100%, в еще более частном случае имеющий стереоизомерный избыток от 94% до 100% и совсем в частном случае имеющий стереоизомерный избыток от 97% до 100%. Термины «энантиомерно чистый» и «диастереомерно чистый» следует воспринимать аналогичным образом, но относительно наличия энантиомерного избытка, соответственно диастереомерного избытка смеси, о которой идет речь.
Чистые стереоизомерные формы соединений и промежуточные соединения этого изобретения могут быть получены путем применения известных в данной области процедур. Например, энантиомеры можно отделить друг от друга с помощью селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. Альтернативно, энантиомеры можно разделить с помощью хроматографического оборудования, применяя хиральные неподвижные фазы. Вышеупомянутые стереохимически чистые изомерные формы также можно получить из соответствующих стереохимически чистых изомерных форм соответствующих исходных материалов при условии, что реакция протекает стереоспецифически. Предпочтительно, если нужно получить специфический стереоизомер, вышеуказанное соединение можно синтезировать с помощью стереоспецифических способов получения. Преимущественно в этих способах будут применяться энантиомерно чистые исходные материалы.
Диастереомерические рацематы формулы (I) можно получить отдельно с помощью общеизвестных способов. Соответствующими физическими способами разделения, которые преимущественно можно применять, являются, например, селективная кристаллизация и хроматография, например колоночная хроматография.
Настоящее изобретение также имеет целью включить все изотопы атомов, встречающиеся в соединениях настоящего изобретения. Изотопы включают те атомы, которые имеют тот же самый атомный номер, но другие массовые числа. В качестве основного примера и без ограничения изотопы водорода включают тритий и дейтерий. Изотопы углерода включают C-13 и C-14.
Всякий раз, когда применяют в дальнейшем в этой патентной заявке, термин «соединения формулы (I)» или «настоящие соединения», или сходный термин, подразумевают, что термин включает соединения основной формулы (I), их N-оксиды, соли, стереоизомерные формы, рацемические смеси, пролекарства, сложные эфиры и метаболиты, а также четвертичные азотные аналоги. Один вариант осуществления данного изобретения - это подгруппы, содержащие N-оксиды соединений формулы (I), или любая подгруппа соединений формулы (I), указанных в данной патентной заявке, включая любые соли или их стереоизомерные формы.
Следует понимать, что любые подгруппы соединений формулы (I) также включают любые пролекарства, N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы таких соединений.
Вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(1) n равен 1 или 2; или в которых
(1-a) n равен 1.
Далее вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(2) R1 является водородом, циано, галогеном, аминокарбонилом, С1-4алкиламинокарбонилом, гидроксикарбонилом, С1-4алкилоксикарбонилом, ариламинокарбонилом, N-гидрокси- метанимидамидилом, моно- или ди(С1-4алкил)метанимидамидил, Гет1 или Гет2;
(2-a) R1 является водородом, циано, галогеном, аминокарбонилом, С1-4алкиламинокарбонилом, ариламинокарбонилом, С1-4алкилоксикарбонилом, N-гидрокси-метанимидамидилом, Гет1 или пиридинилом;
(2-b) R1 является водородом, циано, галогеном, аминокарбонилом, C1-4алкиламинокарбонилом, ариламинокарбонилом, C1-4алкилоксикарбонилом, N-гидрокси-метанимидамидилом, пиридинилом, фуранилом, тиенилом, пирролилом, оксазолилом, тиазолилом, имидазолилом, изоксазолилом, изотиазолилом, пиразолилом, оксадиазолилом, тиадиазолилом, триазолилом, тетразолилом, каждый из которых, индивидуально и независимо, необязательно можно заместить заместителем, выбранным из группы, состоящей из С1-4алкила, C2-6алкенила, C3-7циклоалкила, гидрокси, С1-4алкокси, галогена, амино, циано, трифторметила, гидроксиC1-4алкила, цианоС1-4алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(C1-4алкил)аминоC1-4алкила, арилC1-4алкила, аминоC2-6алкенила, моно- или ди(С1-4алкил)аминоС2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила,
С1-4алкилоксикарбонила, моно- или ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и в которой любой из вышеизложенных фрагментов фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила и триазолила, необязательно можно заместить C1-4алкилом;
(2-с) R1 является водородом, циано, галогеном, аминокарбонилом, С1-4алкиламинокарбонилом, ариламинокарбонилом, С1-4алкилoксикарбонилом, N-гидрокси-метанимидамидилом, пиридинилом, фуранилом, тиенилом, оксадиазолилом, тетразолилом, в котором четверо последних необязательно можно заместить С1-4алкилом, С2-6алкенилом, C3-7циклоалкилом, гидрокси, C1-4алкокси, галогеном, амино, циано, трифторметилом, гидроксиС1-4алкилом, цианоС1-4алкилом, моно- или ди(С1-4алкил)амино, аминоС1-4алкилом, моно- или ди(С1-4алкил)аминоС1-4алкилом, арилС1-4алкилом, аминоС2-6алкенилом, моно- или ди(С1-4алкил)аминоС2-6алкенилом, арилом, гидроксикарбонилом, аминокарбонилом, С1-4алкилоксикарбонилом, моно- или ди(C1-4алкил)аминокарбонилом, C1-4алкилкарбонилом, оксо, тио;
(2-d) R1 является водородом, циано, бромом, тетразолилом или оксадиазолилом, необязательно, замещенным заместителем, выбранным из группы, состоящей из C1-4алкила, С2-6алкенила, C3-7циклоалкила, гидрокси, С1-4алкокси, амино, циано, трифторметила, гидроксил-С1-4алкила, цианоС1-4алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила, арилС1-4алкила, аминоC2-6алкенила, моно- или ди(С1-4алкил)аминоC2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или
ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио;
(2-е) R1 является водородом, циано, галогеном, аминокарбонилом, C1-4алкиламинокарбонилом, ариламинокарбонилом, С1-4алкилоксикарбонилом, N-гидрокси-метанимидамидилом, пиридинилом, фуранилом, тетразолилом, оксадиазолилом, в котором последний необязательно можно заместить C1-4алкилом, галогеном, амино, циано, трифторметилом, гидроксиC1-4алкилом, цианоС1-4алкилом, аминоС1-4алкилом, моно- или ди(С1-4алкил)аминоС1-4алкилом, арилС1-4алкилом, аминоC2-6алкенилом, моно- или ди(C1-4алкил)аминоC2-6алкенилом, оксо, тио;
(2-f) R1 является водородом, циано, галогеном, аминокарбонилом, С1-4алкиламинокарбонилом, ариламинокарбонилом, С1-4алкилоксикарбонилом, N-гидрокси-метанимидамидилом, пиридинилом, фуранилом, тетразолилом, оксадиазолилом, в котором последний необязательно можно заместить C1-4алкилом, трифторметилом, аминоC2-6алкенилом, моно- или ди(С1-4алкил)аминоC2-6алкенилом, оксо, тио;
(2-g) R1 является циано, аминокарбонилом, C1-4алкиламинокарбонилом;
(2-h) R1 является циано, метилоксикарбонилом, метиламинокарбонилом, этилоксикарбонилом или этиламинокарбонилом; или
(2-i) R1 является циано и этиламинокарбонилом; или
(2-j) R1 является циано.
Далее вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые соединения формулы (I), указанные в данной патентной заявке, в которых
(3) X является O или S; или
(3-a) X является O.
Далее вариантами осуществления настоящего изобретения являются те соединения формулы (I) или любые соединения формулы (I), указанные в данной патентной заявке, в которых
(4) X является NR2, где R2 является арилом, замещенным радикалом -COOR4; или
R2 является C1-10алкилом, С2-10алкенилом, C3-7циклоалкилом, где вышеуказанные C1-10алкил, С2-10алкенил, C3-7циклоалкил, каждый индивидуально и независимо, замещается арилом, где указанный арил замещается радикалом -COOR4; или
где указанный C1-10алкил, С2-10алкенил, C3-7циклоалкил, каждый индивидуально и независимо, замещен радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -NR5a-C(=NR5e)-R5f, -О-NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5e)-R5f, -сульфонил-R6, -NR7R8,
-NR9R10, радикалов
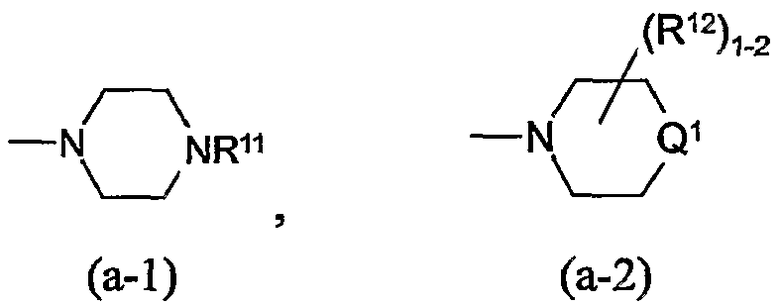
и
в которых
каждый Q1 независимо является простой связью, -CH2- или -CH2-CH2-;
каждый R4 независимо является водородом, С1-4алкилом, арилС1-4алкилом;
каждый из R5a, R5b, R5c, R5d независимо является водородом, C1-4алкилом или
арилС1-4алкилом;
каждый R5e, R5f независимо является водородом, С1-4алкилом или арилС1-4алкилом, или R5e и R5f, взятые вместе могут образовать двухвалентный алкиленовый радикал формулы -CH2-CH2- или -CH2-CH2-CH2-;
R6 является С1-4алкилом, -N(R5aR5b), С1-4алкилокси, пирролидин-1-илом, пиперидин-1-илом, гомопиперидин-1-илом, пиперазин-1-илом, 4-(С1-4алкил)-пиперазин-1-илом, морфолин-4-ил-, тиоморфолин-4-ил-, 1-оксотиоморфолин-4-илом и 1,1-диоксо-тиоморфолин-4-илом;
R7 является водородом или гидроксиC1-4алкилом;
R8 является гидроксиС1-4алкилом;
R9 является водородом или C1-4алкилом;
R10 является Гет1, Гет2 или радикалом 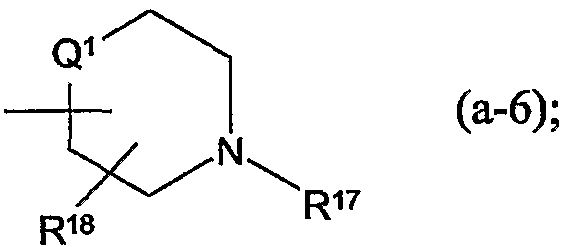
R11 является арилом, арилС1-4алкилом, формилом, C1-4алкилкарбонилом, арилкарбонилом, арилC1-4алкилкарбонилом, C1-4алкилоксикарбонилом, арилС1-4алкилоксикарбонилом, R5aR5bN-карбонилом, гидроксиС1-4алкилом, С1-4алкилоксиС1-4алкилом, арилС1-4алкилоксиС1-4алкилом, арилоксиС1-4алкилом, Гет2;
R12 является гидрокси, С1-4алкилом, арилС1-4алкилом, С1-4алкилокси, арилC1-4алкилокси, оксо, спиро(С2-4алкилендиокси), спиро(диС1-4алкилокси), -NR5aR5b;
R13 является водородом, гидрокси, С1-4алкилом, С1-4алкилокси или арилС1-4алкилокси; или
R2 является радикалом формулы:
в которой в радикале (b-3) один из атомов водорода в -CpH2p- и один из атомов водорода в -CH(OR14)-CqH2q-, который не является частью R14, можно заменить простой связью или C1-4алкандиильной группой;
p равен 1, 2 или 3;
q равен 0, 1, 2 или 3;
m равен 1-10;
каждый R14 независимо является водородом, С1-4алкилом, арилС1-4алкилом, арилом, С1-4алкилкарбонил, -SO3H, -PO3H2;
R15 является заместителем, выбранным из группы, состоящей из циано, NR16aR16b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксотиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, С1-4алкилкарбонила, N(R16aR16b)карбонила, С1-4алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(С1-4алкил)-пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксо-тиоморфолин-1-илкарбонила; и в которой R15 дополнительно может быть арилом, замещенным радикалом -COOR4; или радикалом, выбранным из
-NR5a-C(=NR5b)-NR5cR5d, -NR5a-C(=NR5e)-R5f, -О-NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5e)-R5f, -сульфонил-R6, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3); где R4, R5a, R5b, R5c, R5d, R6, R7, R8, R9, R10 и радикалы (a-1), (a-2), (a-3) независимо являются такими, как определено в настоящей патентной заявке выше;
R16a является водородом, С1-4алкилом или С1-4алкилом, замещенным заместителем, выбранным из группы, состоящей из амино, моно- или ди(С1-4алкил)амино, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
R16b является водородом, С1-4алкилом или С1-4алкилом, замещенным заместителем, выбранным из группы, состоящей из амино, моно- или ди(С1-4алкил)амино, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила и 1,1-диоксотиоморфолинила;
каждый R18 независимо является водородом, С1-4алкилом или арилС1-4алкилом;
R19 является водородом, гидрокси, С1-4алкилом или радикалом -COOR4; или в которых
(4-a) X является NR2, где R2 является С1-10алкилом, С2-10алкенилом, C3-7циклоалкилом, каждый из первых трех радикалов независимо замещаемы арилом, где указанный арил замещен радикалом -COOR4; или
(4-a-1) X является NR2, где R2 является C1-10алкилом, замещаемым арилом, где указанный арил замещен радикалом -COOR4; или
(4-a-2) X является NR2, где R2 является C1-6алкилом, замещенным фенилом, замещенным радикалом -COOR4; или в которых
(4-a-3) X является NR2, где R2 является C1-6алкилом, замещенным фенилом, замещенным в параположении радикалом -COOR4; или в которых
(4-b) X является NR2, где R2 является C1-10алкилом, C2-10алкенилом, C3-7циклоалкилом, каждый из первых трех радикалов независимо замещаемы радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5b)-NR5cR5d, -сульфонил-R6, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3), (a-4) и (a-5);
(4-b-1) X является NR2, где R2 является C1-10алкилом, замещенным радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5b)-NR5cR5d, -сульфонил-R6, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3), (a-4) и (a-5);
(4-b-2) X является NR2, где R2 является C1-10алкилом, замещенным радикалом, выбранным из -NR5a-C(=NR5b)-NR5eR5d, -О-NR5a-C(=NR5b)-NR5cR5d, -сульфонил-R6, -NR7R8, -NR9R10, радикалов (a-1), (a-2) и (a-3);
(4-b-3) X является NR2, где R2 является C1-6алкилом, замещенным радикалами, упомянутыми в (4-b-1)или в (4-b-2);
(4-b-4) X является NR2, где R2 является C1-6алкилом, замещенным радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3), (a-4) и (a-5);
(4-b-5) X является NR2, где R2 является C1-6алкилом, замещенным радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3);
(4-c) X является NR2, где R2 является радикалом (b-1);
(4-c-1) X является NR2, где R2 является радикалом (b-1), в котором R19 является водородом или -COOR4, и где Q1 в радикале (b-1) является простой связью или -CH2-;
(4-d) X является NR2, где R2 является радикалом (b-2);
(4-d-1) X является NR2, где R2 является радикалом (b-2), в котором Q2 является O;
(4-e) X является NR2, где R2 является радикалом (b-3), в котором q равен 1, 2 или 3;
(4-e-1) X является NR2, где R2 является радикалом (b-3), в котором p равен 1 и q равен 1;
(4-e-2) X является NR2, где R2 является радикалом (b-3), в котором R15 является циано, NR16aR16b, пирролидинилом, пиперидинилом, 4-(С1-4алкил)-пиперазинилом, морфолинилом, арилом, имидазолилом, пиридилом, гидроксикарбонилом, N(R16aR16b)карбонилом, С1-4алкилоксикарбонилом, 4-(С1-4алкил)-пиперазин-1-илкарбонилом, -NR7R8, -NR9R10, радикалом (a-1), (a-2), (a-3), (a-4) или (a-5);
(4-e-3) X является NR2, где R2 является радикалом (b-3), в котором R14 является водородом и R15 является циано, NR16aR16b, пирролидинилом, пиперидинилом, 4-(С1-4алкил)-пиперазинилом, морфолинилом, арилом, имидазолилом, пиридилом, гидроксикарбонилом, N(R16aR16b)карбонилом, С1-4алкилоксикарбонилом или 4-(С1-4алкил)-пиперазин-1-илкарбонилом;
(4-e-4) X является NR2, где R2 является радикалом (b-3), в котором p равен 1 и q равен 1, и R15 является циано, NR16aR16b, пирролидинилом, пиперидинилом, 4-морфолинилом, арилом, имидазолилом, пиридилом, гидроксикарбонилом или N(R16аR16b)карбонилом;
(4-e-5) X является NR2, где R2 является радикалом (b-3), в котором R15 является NR16aR16b, пирролидинилом, пиперидинилом, 4-морфолинилом;
(4-e-6) X является NR2, где R2 является радикалом (b-3), в котором R15 является пирролидинилом, пиперидинилом, 4-морфолинилом;
(4-е-7) X является NR2, где R2 является радикалом (b-3), в котором R15 является пирролидинилом;
(4-f) X является NR2, где R2 является радикалом (b-4), в котором m равен 1-6;
(4-f-1) X является NR2, где R2 является радикалом (b-4), в котором R14 является водородом или C1-4алкилом;
(4-f-2) X является NR2, где R2 является радикалом (b-4), в котором m равен 1-5 и R14 является водородом или С1-4алкилом;
(4-g) X является NR2, где R2 является радикалом (b-5);
(4-g-1) X является NR2, где R2 является радикалом (b-5), в котором m равен 1-5.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(5) R3 является водородом, нитро, циано, амино, галогеном, гидрокси, C1-4алкилокси, С1-4алкилом, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)аминокарбонилом, аминотиокарбонилом, С1-4алкилоксикарбонилом, С1-4алкилкарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом или Гет1;
(5-a) R3 является нитро, циано, амино, галогеном, гидрокси, С1-4алкилокси, С1-4алкилом, гидроксикарбонилом, аминокарбонилом, ди(С1-4алкил)аминокарбонилом, С1-4алкилоксикарбонилом, моно- или ди(C1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом или Гет1;
(5-b) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-алкил)метанимидамидилом, N-гидрокси-метанимидамидилом или Гет1;
(5-c) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(C1-алкил)метанимидамидилом, N-гидрокси-метанимидамидилом, фуранилом, тиенилом, пирролилом, оксазолилом, тиазолилом, имидазолилом, изоксазолилом, изотиазолилом, пиразолилом, оксадиазолилом, тиадиазолилом, триазолилом, тетразолилом, где каждый из указанных фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила необязательно можно заместить одним или двумя заместителями, выбранными из группы, состоящей из C1-4алкила, C2-6алкенила, C3-7циклоалкила, гидрокси, С1-4алкокси, амино, циано, трифторметила, гидроксиС1-4алкила, цианоС1-4алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(C1-4алкил)аминоC1-4алкила, арилС1-4алкила, аминоС2-6алкенила, моно- или
ди(С1-4алкил)аминоС2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и где любой из вышеприведенных фрагментов фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила и триазолила необязательно можно заместить С1-4алкилом;
(5-d) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом, оксадиазолилом, тиенилом, тиазолилом, фуранилом, изоксазолилом, где каждый из указанных оксадиазолила, тиенила, тиазолила, фуранила, изоксазолила можно заместить заместителем, выбранным из группы, состоящей из С1-4алкила, С2-6алкенила, С3-7циклоалкила, гидрокси, С1-4алкокси, амино, циано, трифторметила, гидроксиС1-4алкила, цианоС1-4алкила, моно- или
ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила, арилС1-4алкила, аминоC2-6алкенила, моно- или ди(С1-4алкил)аминоC2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или
ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и где любой из вышеприведенных фрагментов фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила и триазолила необязательно можно заместить С1-4алкилом;
(5-e) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом, оксадиазолилом, изоксазолилом, тиенилом, пирролилом, триазолилом, тиазолилом, фуранилом, изоксазолилом, тетразолилом, в которых каждый из указанных оксадиазолила, изоксазолила, тиенила, пирролила, триазолила, тиазолила, фуранила, изоксазолила, тетразолила необязательно можно заместить С1-4алкилом, С2-6алкенилом, C3-7циклоалкилом, гидрокси, С1-4алкилокси, амино, циано, трифторметилом, гидроксиС1-4алкилом, цианоС1-4алкилом, моно- или ди(С1-4алкил)амино, аминоС1-4алкилом, моно- или ди(С1-4алкил)аминоС1-4алкилом, арилС1-4алкилом, аминоС2-6алкенилом, моно- или ди(С1-4алкил)аминоС2-6алкенилом, фуранилом, изоксазолилом, С1-4алкилом, замещенным изоксазолилом, арилом, гидроксикарбонилом, аминокарбонилом, C1-4алкилоксикарбонилом, моно- или
ди(С1-4алкил)аминокарбонилом, С1-4алкилкарбонилом, оксо, тио;
(5-f) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом, оксадиазолилом, изоксазолилом, тиенилом, пирролилом, триазолилом, тиазолилом, фуранилом, изоксазолилом, тетразолилом, в которых каждый из вышеуказанных оксадиазолила, изоксазолила, тиенила, пирролила, триазолила, тиазолила, фуранила, изоксазолила, тетразолила необязательно можно заместить С1-4алкилом, C3-7циклоалкилом, гидрокси, циано, трифторметилом, цианоС1-4алкилом, моно- или ди(C1-4алкил)амино, арилС1-4алкилом, ди(С1-4алкил)аминоС2-6алкенилом, фуранилом, изоксазолилом, C1-4алкилом, замещенным изоксазолилом, арилом, гидроксикарбонилом, аминокарбонилом, С1-4алкилоксикарбонилом, моно- или ди(С1-4алкил)аминокарбонилом, С1-4алкилкарбонилом, оксо, тио;
(5-g) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом, оксадиазолилом, изоксазолилом, тиазолилом, фуранилом, изоксазолилом, тетразолилом, где каждый из указанных оксадиазолила, изоксазолила, тиазолила, фуранила, изоксазолила, тетразолила необязательно можно заместить С1-4алкилом, гидрокси, циано, трифторметилом;
(5-h) R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом;
(5-i) R3 является нитро;
(5-j) группа R3 в фенильном кольце находится в положении напротив атома азота в соединенном пиридиновом фрагменте.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых:
(6) R4 является водородом или С1-4алкилом; или в которых
(6-a) R4 является водородом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(7) каждый R5a, R5b, R5c, R5d, R5e и R5f независимо являются водородом или С1-4алкилом; или R5e и R5f, взятые вместе, могут образовывать двухвалентный алкандиильный радикал формулы -CH2-CH2- или -CH2-CH2-CH2-;
(7-a) каждый R5a, R5b, R5c, R5d, R5e и R5f независимо является водородом или С1-4алкилом;
(7-b) каждый R5a, R5b, R5c, R5d, R5e и R5f независимо является водородом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(8) R6 является С1-4алкилом, -N(R5aR5b), С1-4алкилокси, пирролидин-1-илом, пиперидин-1-илом, гомопиперидин-1-илом, пиперазин-1-илом, 4-(С1-4алкил)-пиперазин-1-илом, морфолин-4-ил-;
(8-a) R6 является С1-4алкилом, -N(R5aR5b), С1-4алкилокси, пирролидин-1-илом, пиперидин-1-илом, морфолин-4-ил-;
(8-b) R6 является С1-4алкилом, -N(R5aR5b), пирролидин-1-илом, пиперидин-1-илом, морфолин-4-ил-; где R5a и R5b независимо являются водородом или С1-4алкилом.
Другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых применяются одно или несколько следующих ограничений:
(9-a) R7 является водородом или гидроксиС1-4алкилом;
(9-b) R8 является гидроксиС1-4алкилом;
(9-c) R9 является водородом.
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(10) R10 является Гет1, пиридилом, пиримидинилом или радикалом (a-6);
(10-a) R10 является имидазолилом, изоксазолилом, пиразолилом, триазолилом, каждый из которых необязательно можно заместить С1-4алкилом; или R10 является пиримидилом или пиримидинилом или радикалом (a-6);
(10-b) R10 является пиримидилом, пиримидинилом или радикалом (a-6);
(10-c) R10 является радикалом (a-6).
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(11) R11 является арилом, арилС1-4алкилом, формилом, С1-4алкилкарбонилом, арилкарбонилом, С1-4алкилоксикарбонилом, арилС1-4алкилоксикарбонилом, моно- и диС1-4алкиламинокарбонилом, С1-4алкилоксиС1-4алкилом, арилС1-4алкилоксиС1-4алкилом, пиридилом или пиримидинилом;
(11-a) R11 является арилом, арилС1-4алкилом, формилом, С1-4алкилкарбонилом, арилкарбонилом, С1-4алкилоксикарбонилом, С1-4алкилоксиС1-4алкилом, арилС1-4алкилоксиС1-4алкилом, пиридилом или пиримидинилом.
(11-b) R11 является арилом, С1-4алкилкарбонилом, С1-4алкилоксикарбонилом, гидроксиС1-4алкилом или пиридилом.
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(12) R12 является гидрокси, С1-4алкилом, С1-4алкилокси, оксо, спиро(C2-4алкандиилдиокси), спиро(диС1-4алкилокси), -NR5аR5b;
(12-a) когда в радикале (a-2) присутствует один радикал R12, R12 является гидрокси, С1-4алкилом, С1-4алкилокси, оксо, -NR5aR5b; или когда в радикале (a-2) присутствуют два радикала R12, оба независимо являются С1-4алкилом, спиро(C2-4алкандиилдиокси) или спиро(диС1-4алкилокси); и
(12-b) R12 является гидрокси или С1-4алкилом.
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых применяется одно или несколько следующих ограничений:
(13-a) Q1 является простой связью или -CH2-; или
(13-b) Q2 является O или S; или (13-b-1) Q2 является O.
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых применяется одно или несколько следующих ограничений:
(14-a) R13 является водородом или гидрокси;
(14-b) R13a является С1-4алкилом;
(14-c) R13b является водородом.
Также другими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых.
(15) R14 является водородом, С1-4алкилом или арилС1-4алкилом;
(15-a) R14 является водородом или С1-4алкилом;
(15-b) R14 является водородом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых.
(16) R15 выбран из группы, состоящей из циано, NR16aR16b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, 4-(C1-4алкилкарбонил)-пиперазинила, 4-(С1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, С1-4алкилкарбонила, N(R16aR16b)карбонила, С1-4алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(С1-4алкил)-пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксо-тиоморфолин-1-илкарбонила; или R15 дополнительно может быть арилом, замещенным радикалом -COOR4; или радикалом, выбранным из -NR5a-C(=NR5b)-NR5cR5d, -NR5a-C(=NR5e)-R5f, -О-NR5a-C(=NR5b)-NR5cR5d, -О-NR5a-C(=NR5e)-R5f, -сульфонил-R6, -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3);
(16-a) R15 выбран из группы, состоящей из циано, NR16aR16b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкила)-пиперазинила, 4-(С1-4алкилкарбонил)-пиперазинила, 4-(С1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила, арила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, пиридила, пиримидинила, пиразинила, пиридазинила, триазинила, гидроксикарбонила, C1-4алкилкарбонила, N(R16aR16b)карбонила, С1-4алкилоксикарбонила, пирролидин-1-илкарбонила, пиперидин-1-илкарбонила, гомопиперидин-1-илкарбонила, пиперазин-1-илкарбонила, 4-(С1-4алкил)-пиперазин-1-илкарбонила, морфолин-1-илкарбонила, тиоморфолин-1-илкарбонила, 1-оксотиоморфолин-1-илкарбонила и 1,1-диоксо-тиоморфолин-1-илкарбонила;
(16-b) R15 выбран из группы, состоящей из циано, NR16aR16b, пирролидинила, пиперидинила, гомопиперидинилаа, пиперазинила, 4-(С1-4алкил)-пиперазинила, 4-(С1-4алкилкарбонил)-пиперазинила, 4-(С1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила, арила, гидрокси-карбонила, С1-4алкилкарбонила, N(R16a R16b)карбонила, С1-4алкилоксикарбонила;
(16-c) R15 выбран из группы, состоящей из NR16aR16b, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, 4-(С1-4алкилкарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила;
(16-d) R15 выбран из группы, состоящей из NR16aR16b, пирролидинила, пиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1,1-диоксо-тиоморфолинила;
(16-e) R15 выбран из группы, состоящей из пирролидинила, пиперидинила.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(17) R16a и R16b, независимо друг от друга, являются водородом, C1-4алкилом или
С1-4алкилом, замещенным заместителем, выбранным из группы, состоящей из амино, моно- или ди(С1-4алкил)амино, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиоморфолинила, 1,1-диоксо-тиоморфолинила и арила;
(17-a) R16a и R16b, независимо друг от друга, являются водородом, С1-4алкилом или С1-4алкилом, замещенным заместителем, выбранным из группы, состоящей из амино, моно- или ди(С1-4алкил)амино, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила, морфолинила, тиоморфолинила, 1-оксотиомрорфолинила, 1,1-диоксо-тиоморфолинила;
(17-b) R16a и R16b, независимо друг от друга, являются водородом или С1-4алкилом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(18) R17a и R17b, независимо друг от друга, являются водородом, С1-4алкилом или арилС1-4алкилом; или R17a и R17b вместе с атомом азота, к которому они присоединены, образуют пирролидинильное, пиперидинильное, гомопиперидинильное, морфолинильное, тиоморфолинильное, 1,1-диоксотиоморфолинильное, пиперазинильное или 4-C1-4алкил-пиперазинильное кольцо;
(18-a) R17a и R17b, независимо друг от друга, являются водородом, C1-4алкилом или арил-С1-4алкилом;
(18-b) R17a и R17b, независимо друг от друга, являются водородом, С1-4алкилом или арил-С1-4алкилом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(19) каждый R18 независимо является водородом, С1-4алкилом или арилC1-4алкилом;
(19-a) каждый R18 независимо является водородом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(20) R19 является водородом, С1-4алкилом или радикалом -COOR4;
(20-a) R19 является водородом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(21) арил является фенилом, необязательно замещенным одним или несколькими заместителями, каждый индивидуально выбран из группы, состоящей из С1-6алкила, С1-4алкокси, циано, нитро;
(21-a) арил является фенилом, необязательно замещенным одним, двумя или тремя заместителями, каждый независимо выбран из группы, состоящей из С1-6алкила, С1-4алкокси, циано и нитро.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(22) Гет1 является ароматическим 5-членным кольцом, в котором один, два, три или четыре члена кольца являются гетероатомами, каждый индивидуально и независимо выбран из группы, состоящей из азота, кислорода и серы, и в котором оставшиеся члены кольца являются атомами углерода; и, где возможно, любой азотный член кольца необязательно можно заместить C1-4алкилом; любой атом углерода кольца, каждый индивидуально и независимо, необязательно можно заместить заместителем, выбранным из группы, состоящей из C1-4алкила, C3-7циклоалкила, галогена, циано, трифторметила, цианоС1-4алкила, моно- или ди(C1-4алкил)амино, моно- или ди(С1-4алкил)аминоC2-6алкенила, изоксазолила, арила, гидроксикарбонила, С1-4алкилоксикарбонила, оксо, тио; и в котором вышеприведенный изоксазолил необязательно можно заместить С1-4алкилом;
(22-a) Гет1 является фуранилом, тиенилом, пирролилом, оксазолилом, тиазолилом, имидазолилом, изоксазолилом, изотиазолилом, пиразолилом, оксадиазолилом, тиадиазолилом, триазолилом, тетразолилом, каждый из которых индивидуально и независимо необязательно можно заместить заместителем, выбранным из группы, состоящей из C1-4алкила, C2-6алкенила, C3-7циклоалкила, гидроксиы, С1-4алкокси, галогена, амино, циано, трифторметила, гидроксиС1-4алкила, цианоС1-4алкила, моно- или ди(С1-4алкил)амино, аминоС1-4алкила, моно- или ди(С1-4алкил)аминоС1-4алкила, арилC1-4алкила, аминоC2-6алкенила, моно- или ди(С1-4алкил)аминоC2-6алкенила, фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила, триазолила, тетразолила, арила, гидроксикарбонила, аминокарбонила, С1-4алкилоксикарбонила, моно- или ди(С1-4алкил)аминокарбонила, С1-4алкилкарбонила, оксо, тио; и где любой из вышеприведенных фрагментов фуранила, тиенила, пирролила, оксазолила, тиазолила, имидазолила, изоксазолила, изотиазолила, пиразолила, оксадиазолила, тиадиазолила и триазолила необязательно можно заместить С1-4алкилом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(23) Гет2 является пиридилом или пиримидинилом, оба необязательно замещенны
С1-4алкилом;
(23-a) Гет2 является пиридилом или пиримидинилом;
(23-b) Гет2 является пиридилом.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(24) p равен 1, 2;
(24-a) p равен 1.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(25) p равен 1, 2, 3;
(25-a) q равен 1, 2;
(25-b) q равен 1.
Дальнейшими вариантами осуществления настоящего изобретения являются соединения формулы (I) или любые подгруппы соединений формулы (I), указанные в данной патентной заявке, в которых
(26) m равен 1-8;
(26-a) m равен 1-6;
(26-b) m равен 1-4;
(26-c) m равен 1-3;
(26-d) m равен 1-2.
Следует понимать, что подгруппы соединений формулы (I) содержат группы соединений формулы (I), в которых применяются одно или несколько вышеупомянутых ограничений в любой комбинации. Если в пределах определения ограничения присутствует одна или несколько переменных величин, то каждая из этих переменных может иметь любые значения, данные в ограничениях, относящихся к этим переменным. Например, если в пределах ограничений для R2 упоминается радикал NR5aR5b, радикалы R5a и R5b могут иметь любые значения, перечисленные в ограничениях, относящихся к R5a и R5b.
Особой группой соединений формулы (I) является группа, в которой R1, R3 и n имеют такие значения, как указано в определении соединений формулы (I), и R2 является таким, как в ограничении (4).
В одном варианте осуществления n равен 1 и группа R3 в фенильном кольце в соединениях формулы (I) или любая подгруппа, указанная в данной патентной заявке, находится в параположении напротив атома азота в соединенном пиридиновом фрагменте так, как отображено ниже в данной патентной заявке, и в дальнейшем именуются как соединения формулы (I-a)

Другой подгруппой соединений формулы (I-a) являются соединения формулы (I-a), в дальнейшем именуемые соединениями формулы (I-a-1), где R3 является нитрогруппой.
Примерами подгрупп соединений являются следующие:
(i) соединения формулы (I-a), в которых R3 является нитрогруппой и R1 является циано, галогеном, аминокарбонилом, N-гидрокси-метанимидамидилом, Гет1; далее подгруппами среди перечисленных соединений являются соединения формулы (I-a), в которых R3 является нитрогруппой, X является O, или X является NR2, в которой R2 является радикалом (b-3), в котором R14 является водородом и R15 является циано, NR16aR16b, пирролидинилом, пиперидинилом, 4-(С1-4алкил)-пиперазинилом, морфолинилом, гидроксикарбонилом; или X является NR2, где R2 является радикалом (b-4), в котором R14 является водородом или С1-4алкилом и R1 имеет такие же значения, как в ограничениях (2-d) - (2-j);
(ii) соединения формулы (I-a), в которых R3 является нитрогруппой и R1 является циано, и X является O. Подходящими соединениями являются соединения формулы (I-a), в которых R1 является циано и R3 является нитро, циано, галогеном, С1-4алкилокси, гидроксикарбонилом, аминокарбонилом, моно- или ди(С1-4алкил)метанимидамидилом, N-гидрокси-метанимидамидилом или Гет1;
(iii) соединения формулы (I-a), в которых R1 является циано; X является O; или X является NR2, где R2 является радикалом формулы (b-3), где p равен 1, q равен 1, R14 является водородом, R15 является циано, NR16aR16b, пирролидинилом, пиперидинилом, 4-(С1-4алкил)-пиперазинилом, морфолинилом, арилом, имидазолилом, пиридилом, гидроксикарбонилом, N(R16aR16b)карбонилом, С1-4алкилоксикарбонилом или 4-(С1-4алкил)-пиперазин-1-илкарбонилом; или X является NR2, где R2 является радикалом формулы (b-4), где m равен 1, 2 или 3, R14 является водородом или С1-4алкилом; и R3 такой же, как в ограничениях (5-d), (5-e), (5-f) или (5-g).
Другая подгруппа соединений включает такие соединения формулы (I), как соль, в которых соль выбрана из трифторацетата, фумарата, хлорацетата, метансульфоната, оксалата, ацетата и цитрата.
Предпочтительными соединениями являются любые соединения, перечисленные в таблицах 1 и 2, более предпочтительными, в частности, являются соединения под номерами 1-9 и 43.
Соединениями, представляющими особый интерес, являются:
1-(4-нитрофенил)-2-оксо-1,2-дигидробензо[4,5]фуро[3,2-b]пиридин-3-карбонитрил,
5-(2-гидрокси-3-пиперидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрил,
5-(3-диэтиламино-2-гидроксипропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрил,
5-[2-(2-метоксиэтокси)этил]-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрил и предпочтительно
5-(2-гидрокси-3-пирролидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрил и предпочтительно
5-(2-гидрокси-3-морфолин-4-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрил.
Другие соединения, представляющие интерес, включают вышеуказанные соединения, представляющие интерес, и соли и их возможные стереоизомеры; или вышеуказанные соединения, представляющие интерес, и N-оксиды, соли и их возможные стереоизомеры.
Соединения настоящего изобретения ингибируют обратную транскриптазу ВИЧ и могут также ингибировать обратные транскриптазы, обладающие сходством с обратной транскриптазой ВИЧ. Такое сходство может определяться при применении известных в этой области техники программ, включая BLAST. В одном варианте осуществления сходство на уровне аминокислоты составляет, по меньшей мере, 25%, предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 75%. В другом варианте осуществления сходство на уровне аминокислоты в связывающем «кармане» для соединений настоящего изобретения составляет, по меньшей мере, 75%, в частности, по меньшей мере, 90%, по сравнению с обратной транскриптазой ВИЧ. Соединения настоящего изобретения можно тестировать дополнительно к ВИЧ-I в других лентивирусах, помимо ВИЧ-I, таких как, например, SIV и ВИЧ-2.
Соединения настоящего изобретения могут обладать хорошей селективностью, как измеренной с помощью соотношения между EC50 и CC50, так и описанной и приведенной в примере антивирусного анализа. Соединения настоящего изобретения также обладают благоприятной специфичностью. Существует высокая диссоциация между активностью на лентивирусах по отношению к другими ретровирусами, такими как МLV, и по отношению к патогенам невирусной природы.
Стандарт «чувствительности» или, альтернативно, «резистентности» фермента обратной транскриптазы ВИЧ к лекарству устанавливается с помощью коммерчески доступных ингибиторов обратной транскриптазы ВИЧ. Существующие коммерческие ингибиторы обратной транскриптазы ВИЧ, включающие эфавиренз, невирапин и делавирдин с течением времени могут терять эффективность против популяции ВИЧ вируса в пациенте. Причина заключается в том, что под давлением присутствия особого ингибитора обратной транскриптазы ВИЧ, существующая популяция ВИЧ вируса, обычно преимущественно дикого типа фермента обратной транскриптазы ВИЧ, мутирует в другие мутанты, которые намного менее чувствительны к тому самому ингибитору обратной транскриптазы ВИЧ. Если такой феномен проявляется, то можно говорить об резистентных мутантах. Если такие мутанты не только резистентны к одному определенному ингибитору обратной транскриптазы ВИЧ, но также ко множеству других коммерчески доступных ингибиторов обратной транскриптазы ВИЧ, то говорится о мультирезистентности обратной транскриптазы ВИЧ. Одним из путей выражения устойчивости мутанта к определенному ингибитору обратной транскриптазы ВИЧ является составление соотношения между EC50 вышеуказанного ингибитора обратной транскриптазы ВИЧ против мутантной обратной транскриптазы ВИЧ через EC50 вышеуказанного ингибитора обратной транскриптазы ВИЧ против дикого типа обратной транскриптазы ВИЧ. Вышеуказанное соотношение также называется кратным изменением в резистентности (FR). Величина EC50 представляет количество соединения, требуемого для защиты 50% клеток от цитопатогенного эффекта вируса.
Многие из мутантов, встречающихся в клинических условиях, обладают кратной резистентностью 100 или больше к коммерчески доступным ингибиторам обратной транскриптазы ВИЧ, таким как невирапин, эфавиренз, делавирдин. Клинически релевантные мутанты фермента обратной транскриптазы ВИЧ можно охарактеризовать с помощью мутации в кодоновом положении 100, 103 и 181. В значении, примененном в данной патентной заявке, кодоновое положение означает положение аминогруппы в последовательности белка. Мутации в положениях 100, 103 и 181 относятся к ненуклеозидным ингибиторам RT (D'Aquila et al. Topics in HIV medicine, 2002, 10, 11-15). Примеры таких клинически релевантных мутантных обратных транскриптаз ВИЧ перечислены в таблице 1А.
Список мутаций, присутствующих в обратной транскриптазе примененных штаммов ВИЧ
Интересной группой соединений являются соединения формулы (I), имеющие кратную резистентность в пределах между 0,01 и 100, против, по меньшей мере, одной мутантной обратной транскриптазы ВИЧ, соответственно пределы находятся между 0,1 и 100, более предпочтительно пределы находятся между 0,1 и 50, а еще более предпочтительно пределами являются пределы между 0,1 и 30. Отдельный интерес представляют соединения формулы (I), демонстрирующие кратную резистентность против, по меньшей мере, одной мутированной обратной транскриптазы ВИЧ, находящейся в пределах между 0,1 и 20, и даже более предпочтительно соединения формулы (I), показывающие кратную резистентность против, по меньшей мере, одной мутированной обратной транскриптазы ВИЧ, находящейся в пределах между 0,1 и 10.
К интересной группе соединений относятся те соединения формулы (I), имеющие кратную резистентность, определенную в соответствии со способами, описанными в данной патентной заявке, в пределах от 0,01 до 100 против видов ВИЧ, имеющих, по меньшей мере, одну мутацию в аминокислотной последовательности обратной транскриптазы ВИЧ, по сравнению с последовательностью дикого типа (genbank accession, например M38432, K03455, gi 327742) в позиции, выбранной из 100, 103 и 181; в частности, по меньшей мере, две мутации, выбранные из позиций 100, 103 и 181. Значительно больший интерес представляют соединения в пределах вышеупомянутой группы соединений, имеющие кратную резистентность в пределах от 0,1 до 100, в частности в пределах от 0,1 до 50, в более частном случае в пределах от 0,1 до 30. Наибольший интерес представляют соединения в пределах вышеуказанной группы соединений, имеющие кратную резистентность в пределах от 0,1 до 20, особенно находящиеся в пределах между 0,1 и 10.
Один вариант осуществления относится к соединениям настоящего изобретения, демонстрирующим кратную резистентность в пределах, упомянутых ранее в данной патентной заявке, против, по меньшей мере, одной клинически обоснованной мутированной обратной транскриптазы ВИЧ.
Отдельной подгруппой соединений являются соединения формулы (I), имеющие IC50 1 мкм или ниже, соответственно IC5O 100 нм или ниже против вируса дикого типа при in vitro скрининге, в соответствии со способами, описанными в данной патентной заявке.
Способность настоящих соединений к ингибированию ВИЧ-1, ВИЧ-2, SIV и ВИЧ вирусов с ферментами обратной транскриптазы (RT), имеющих мутированные под давлением известные в настоящее время ингибиторы RT, вместе с отсутствием кросс-резистентности с известными в настоящее время ингибиторами RT, определяет, что соединения настоящего изобретения связаны с ферментом RT по-другому, чем с известными NNRTI и NRTI. Другими индикаторами иного типа действия являются рибонуклеотидная чувствительность соединений настоящего изобретения, что можно показать с помощью их повышенной активности, при введении в присутствии ATP и с помощью их нуклеозидного конкурирующего поведения. Соединения настоящего изобретения, следовательно, могут классифицироваться как нуклеозидные конкурирующие ингибиторы обратной транскриптазы.
Соединения настоящего изобретения демонстрируют антиретровирусные свойства, в частности, против вируса иммунодефицита человека (ВИЧ), который является этиологическим агентом синдрома приобретенного иммунодефицита человека (СПИД). ВИЧ вирус предпочтительно инфицирует CD4-рецептор, содержащий такие клетки, как T4-клетки человека, и разрушает их или изменяет их нормальную функцию, особенно координацию иммуносистемы. В результате, инфицированный пациент имеет постоянно уменьшающееся число T4-клеток, которые более того ведут себя аномально. Следовательно, система иммунологической защиты не способна бороться с инфекциями и/или новообразованиями и ВИЧ-инфицированный пациент обычно умирает вследствие условно-патогенных инфекций, таких как пневмония, или в результате рака. Другие заболевания, ассоцировнные с инфекцией ВИЧ, включают тромбоцитопению, саркому Капоши и инфекцию центральной нервной системы, характеризующуюся прогрессирующейся демиелинизацией, приводящей к деменции и таким симптомам, как прогрессирующая дизартрия, атаксия и дезориентация. Инфекция ВИЧ далее также ассоциировалась с периферическими заболеваниями нервной системы, прогрессирующей распространенной лимфоаденопатией (PGL) и СПИД-ассоциированным комплексом (ARC). ВИЧ вирус также инфицирует клетки, содержащие CD8-рецептор. Другими клетками, служившими целью для ВИЧ вируса, были микроглия, древовидные клетки, B-клетки и макрофаги.
Обусловленные этими благоприятными фармакологическими свойствами соединения настоящего изобретения или их любая подгруппа могут применяться как лекарственный препарат против вышеупомянутых заболеваний или для их профилактики, или применяться в методе лечения вышеуказанных заболеваний или в их профилактике. Вышеупомянутое применение в качестве лекарственных препаратов или метода лечения включает систематическое назначение ВИЧ-инфицированным субъектам, в частности пациенту (человеку), количества соединения формулы (I) или соединения подгруппы соединений формулы (I), эффективного для профилактических целей или лечения состояний, ассоциированных с инфекцией ВИЧ.
В дополнительном аспекте настоящее изобретение относится к применению соединения формулы (I) или его любой подгруппы при производстве эффективного лекарственного средства для предотвращения, лечения или борьбы с инфекцией или заболеванием, ассоциированными с инфекцией ВИЧ.
В другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его любой подгруппы при производстве эффективного лекарственного средства для ингибирования репликации ВИЧ вируса, в частности ВИЧ вируса, имеющего мутированную обратную транскриптазу ВИЧ, в более частном случае имеющего мультирезистентную мутированную обратную транскриптазу ВИЧ.
Также в другом аспекте настоящее изобретение относится к применению соединения формулы (I) или его любой подгруппы при производстве эффективного лекарственного средства для предотвращения, лечения или борьбы с заболеванием, ассоциированным с вирусной инфекцией ВИЧ, в котором обратная транскриптаза ВИЧ вируса является мутантом, в частности мультирезистентной мутированной обратной транскриптазой ВИЧ.
Соединения формулы (I) или их любая подгруппа также успешно применяются в способе лечения, предотвращения или борьбы с инфекцией или заболеванием, ассоциированным с инфекцией ВИЧ, у млекопитающих, включающем назначение вышеупомянутым млекопитающим эффективного количества соединения формулы (I) или его любой подгруппы.
В другом аспекте соединения формулы (I) или их любая подгруппа успешно применяются в способе лечения, предотвращения или борьбы с инфекцией или заболеванием, ассоциированным с инфекцией млекопитающих мутированным ВИЧ вирусом, включающем назначение вышеупомянутым млекопитающим эффективного количества соединения формулы (I) или его любой подгруппы.
В другом аспекте соединения формулы (I) или их любая подгруппа успешно применяются в способе лечения, предотвращения или борьбы с инфекцией или заболеванием, ассоциированном с инфекцией млекопитающих мультирезистентным ВИЧ вирусом, включающем назначение вышеупомянутым млекопитающим эффективного количества соединения формулы (I) или его любой подгруппы.
В еще одном аспекте соединения формулы (I) или их любая подгруппа успешно применяются в способе ингибирования репликации ВИЧ вируса, в частности ВИЧ вируса, имеющего мутированную обратную транскриптазу ВИЧ, в более частном случае мультирезистентную мутированную обратную транскриптазу ВИЧ, включающем назначение млекопитающим, в случае необходимости, эффективного количества соединения формулы (I) или его любой подгруппы.
Предпочтительно, млекопитающим, упомянутым в способах настоящего изобретения, является человек.
Также можно найти применение соединениям настоящего изобретения при ингибировании ex vivo образцов, содержащих ВИЧ или предположительно подвергшихся воздействию ВИЧ. Следовательно, настоящие соединения могут применяться для ингибирования ВИЧ, присутствующего в образце жидкости организма, который содержит или ожидается, что содержит, или подвергшийся воздействию ВИЧ.
Определенные реакционные процедуры для получения настоящих соединений описываются далее. При получении, описанном далее, продукты реакции могут выделяться из среды и, при необходимости, далее очищаться в соответствии с методиками, общеизвестным в области техники, такими как, например, экстракция, кристаллизация, измельчение в порошок и хроматография.
Соединения формулы (I), в которых X является группой NR2, могут быть представлены формулой (I-b), могут быть получены с помощью N-алкилирующих промежуточных соединений формулы (II), с подходящим N-алкилирующим агентом, как изображено в следующей схеме реакции. Промежуточные соединения формулы (II-а) являются аналогами соединений формулы (I), в которых заместитель R2 является водородом.
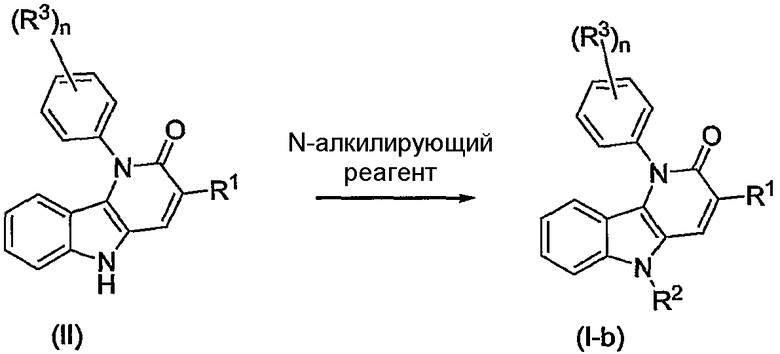
В одном варианте осуществления N-алкилирующий реагент является реагентом, который может быть представлен формулой R2-W (III-a), в которой W является уходящей группой. Удобными уходящими группами являются галогены, в частности хлор, бром и йод, или другие уходящие группы, такие как, например, сульфонаты, например тозилаты, мезилаты и подобные. Этот тип реакции N-алкилирования может быть представлен в соответствующем растворителе в присутствии соответствующего основания, такого как гидрид щелочного металла, например гидрид натрия или калия, или гидроксида щелочного или щелочно-земельного металла, карбоната или гидрокарбоната, например карбонат натрия или калия, гидроксид натрия или калия, гидроксид кальция, бикарбонат натрия или калия и подобные.
Некоторые из соединений формулы (I-b) можно также получить, когда это целесообразно, с помощью восстановительной реакции аминирования, которая заключается во взаимодействии промежуточных соединений (II-а) с промежуточным соединением R2-a=O (III-b), в котором R2-a имеет те же самые значения R2 и при условии, что он содержит атом углерода, который может образовывать альдегид из кетонной функциональной группы. Эта реакция может проводиться в присутствии водорода и соответствующего катализатора, в частности катализатора из благородных металлов, таких как Pd или Pt, обычно в соответствующем растворителе, таком как простой эфир или спирт.
Некоторые из групп R2 можно также ввести, применяя группы R2, полученные из эпоксидного соединения. Этот тип реакции, в частности, подходит для введения групп R2, в которых R2 является радикалом (b-3), (b-4) или (b-5).

Например, соединения формулы (I-b), в которых R2 является радикалом (b-3), в котором p равен 1 и в котором группа -NRaRb является некоторыми радикалами среди R15, такими как -NR16aR16b, пирролидинил, пиперидинил, гомопиперидинил, пиперазинил, 4-(С1-4алкил)-пиперазинил, морфолинил, тиоморфолинил, 1-оксотиоморфолинил, 1,1-диоксо-тиоморфолинил, пирролил, оксазолил, тиазолил, имидазолил, изоксазолил, изотиазолил, пиразолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, радикал (a-1), (a-2), (a-3) или (a-5); в которых любой из вышеприведенных гетероциклов, таких как пирролидинил, пиперидинил, гомопиперидинила и т.д., замещены на фрагмент CqH2q через атом азота; эти соединения можно представить формулой (I-c-1); можно получить при взаимодействии промежуточного соединения формулы (II-а), в котором R2 является водородом, с эпоксидным соединением формулы (III-с). Конечные промежуточные соединения формулы (IV-a) можно преобразовывать в соединения формулы (I-c-1), в которых -NRaRb является таким, как указано ранее, с помощью соответствующего преобразования спирта (C-OH) в амин (C-N). Спиртовая группа может преобразовываться в соответствующую уходящую группу и затем реагировать с амином H-NRaRb. В альтернативном выполнении спиртовую группу можно преобразовать до аминогруппы с помощью реакции Мицонобу-типа, применяя азодикарбоксилат/трифенильный фосфиновый реагент, например диизопропилазодикарбоксилат (DIAD), и последующей реакцией с соответствующим амином. Полученные таким образом соединения формулы (I-c-1) можно O-алкилировать или O-ацилировать, чтобы получить аналоги соединений (I-c-1), в которых R14 является другой группой, отличной от водорода.
В сходном процессе промежуточные соединения (II) взаимодействуют с эпоксидным соединением (III-d), с преобразованием гидроксила в аминогруппу, таким как вышеописанная реакция Мицонобу, чтобы получить эпоксид (IV-b). Последний взаимодействует с амином для получения соединений формулы (I-c-2), как представлено в следующей схеме реакции. Соединения формулы (I-c-2) можно также O-алкилировать или O-ацилировать, как было описано в предыдущем абзаце.
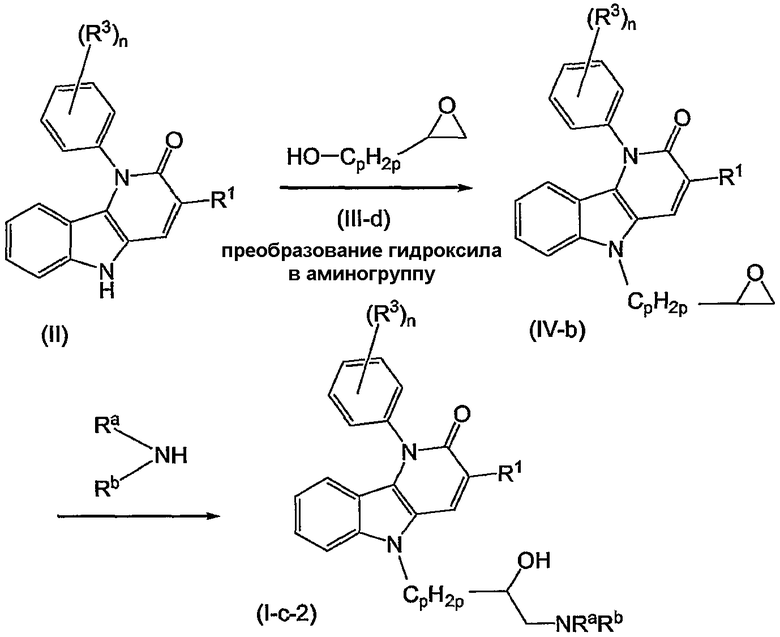
В альтернативной процедуре промежуточное соединение (II-а) может реагировать с эпоксидом, имеющим формулу (III-e)
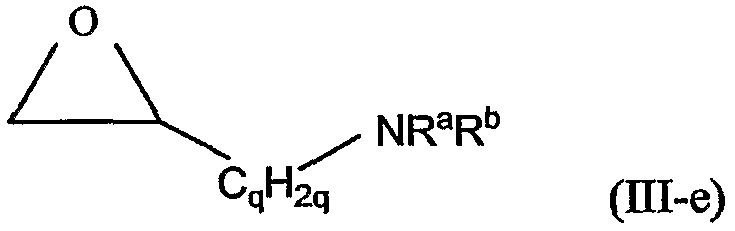
для прямого получения соединений формулы (I), в которых R2 является радикалом (b-3), где R15 является аминозаместителем -NRaRb.
Промежуточные соединения формулы (IV-b) могут также реагировать с алканоламином для получения соединений формулы (I-c-3), которые образуют цикл с образованием соединений (I-c-4), которые являются соединениями формулы (I), в которых R2 является алкилом, замещенным радикалом формулы (a-4). Циклизация может проводиться в присутствии кислоты, такой как соляная кислота с выделением воды или в присутствии соответствующего дегидрирующего агента, например сульфонила амида, такого как арилсульфонил имидазол. Эти реакции представлены в следующей схеме реакции, в которой Ra имеют значения R13a, при условии, что он отличен от водорода. Ra может также быть N-защищающей группой, которая удаляется впоследствии, таким образом давая доступ к соединениям, в которых R13a является водородом.
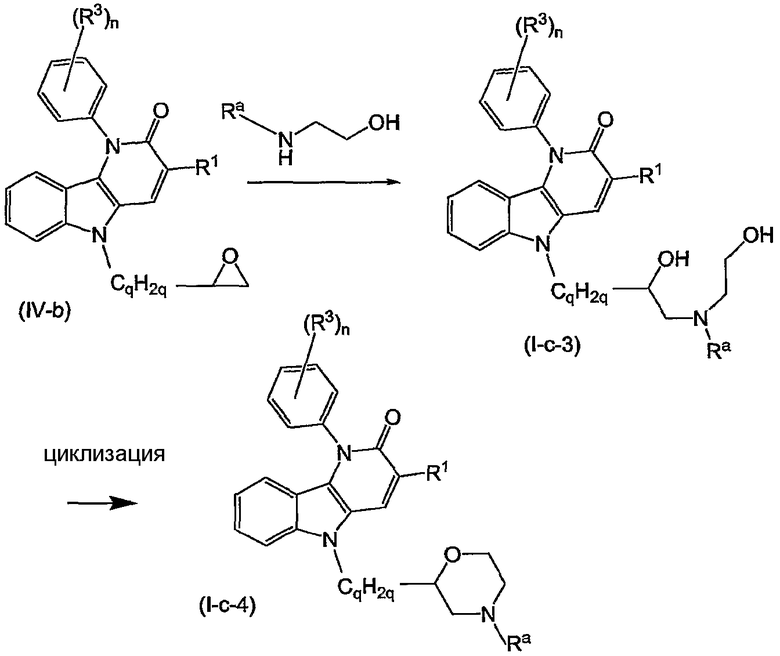
Соединения формулы (I-d), которые являются соединениями формулы (I), в которых R2 является группой (b-4), где R14 является водородом, можно получить, начиная с промежуточных соединений формулы (II), которые реагируют с оксидом этилeна с образованием промежуточных соединений формулы (V), с последующим управляемым добавлением дополнительных фрагментов оксида этилeна, как представлено в следующей схеме реакции.
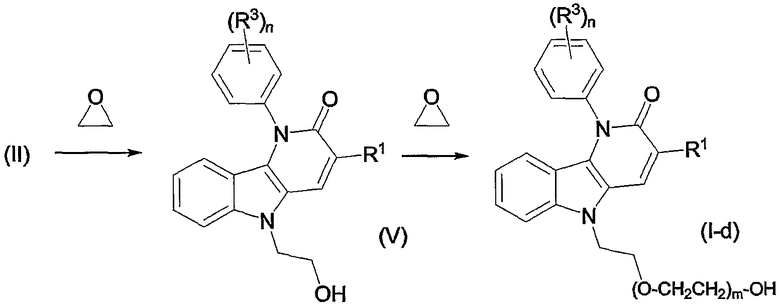
Полученные в результате соединения (I-d) можно алкилировать с образованием соединений формулы (I), имеющих группу (b-4) с радикалом R14, который отличен от водорода. Или соединения (I-d) можно превратить в соответствующие амины (b-5), применяя соответствующий способ преобразования спирта в амин.
Дальнейший аспект настоящего изобретения относится к тому факту, что промежуточные соединения формул (IV-a), (IV-b) и (V) являются новыми соединениями. Было обнаружено, что промежуточные соединения формул (IV-a) и (V) обладают сходными ВИЧ-ингибирующими свойствами, такими как соединения формулы (I). Таким образом, в дальнейшем аспекте изобретение обеспечивает соединениями формулы (IV-a) или (IV-b), или их кислотно-аддитивными солями, или их стереоизомерами, имеющими структурные формулы, изображенные ранее в патентной заявке. Кислотно-аддитивными солями являются такие же, как те, что описаны в отношении соединений формулы (I). Предпочтительными являются фармацевтически допустимые кислотно-аддитивные соли. Промежуточные соединения формул (IV-a) и (V) могут быть составлены в подходящих фармацевтических лекарственных формах, и их можно применять в аналогичных областях применения и способах, как описано для соединений формулы (I).
Соединения формулы (I), в которых R2 является фенильной группой, замещенной группой -COOR4, можно получить с помощью соответствующей реакции N-арилирования. В этой реакционной процедуре промежуточное соединение (II-а) взаимодействует с надлежаще замещенной арильной группой.
Соединения, в которых R2 является группой (b-1), можно получить, начиная с пирролидинового, пиперидинового или гомопиперидинового производного, имеющего соответствующую уходящую группу. Аналогично, соединения, в которых
R2 является группой (b-2), можно получить, начиная с морфолина, имеющего надлежащую уходящую группу. При необходимости, атом азота в пирролидиновой, пиперидиновой, гомопиперидиновой или морфолиновой группах можно защитить с помощью соответствующей N-защищающей группы (например, бензольной, бензолоксикарбонильной, трет-бутилоксикарбонильной и т.д.), которую впоследствии удаляют.
Соединения формулы (I-b), в которых R2 является C1-10алкилом, C2-10алкенилом,
C3-7циклоалкилом, замещенным радикалом, выбранным из -NR7R8, -NR9R10, радикалов (a-1), (a-2), (a-3) или (a-5), как указано ранее, можно получить, начиная с промежуточного соединения (II), с которым взаимодействуют C1-10алкан, C2-10алкенил или С3-7циклоалкан, несущий две уходящие группы, таким управляемым способом, чтобы замещалась только одна уходящая группа. Впоследствии полученное таким образом промежуточное соединение взаимодействует с соответствующим амином, таким образом замещая вторую уходящую группу. Например, соединение формулы (II) может реагировать с С1-10алкандиил дигалидом и затем реагировать с аминами H-NR7R8, H-NR9R10 или другим амином. Могут применяться другие аналогичные варианты процесса, в которых несколько или некоторые функциональные группы защищены и впоследствии защиту снимают.
Соединения формулы (I), в которых X является O, в которых R2 является циано, эти соединения изображаются формулой (I-d), можно получить так, как представлено в следующей схеме реакции.
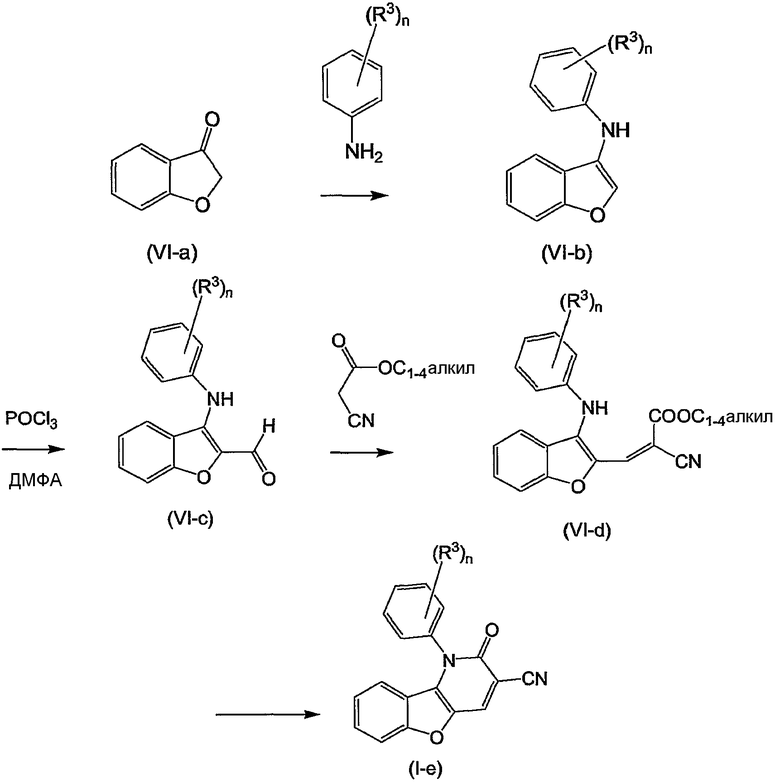
Промежуточное соединение 3-гидроксибензофуран (VI-а) конденсируется с подходящим анилиновым производным, чтобы получить в результате 3-фениламинобензофуран (VI-b) [V. A. Azimov, S. Yu. Ryabova, L. M. Alekseeva и V. G. Granik, Chemistry of heterocyclic compounds 2000, 36, 1272-1275]. Преобразование (VI-а) в (VI-b) обычно проводят в соответствующем растворителе, таком как углеводородный растворитель, например, толуол, обычно в присутствии каталитического количества кислоты, такой как, например, п-толуолсульфоновая кислота. 3-фениламинобензофуран (VI-b) формилируют, например, применением оксихлорида фосфора в ДМФА (диметилформамиде) с последующим гидролизом. Формилированное производное (VI-c) можно преобразовать в соединение (VI-d) с помощью применения цианоацетатного производного, обычно в подходящем растворителе, таком как спирт, например изопропанол, в присутствии основания, предпочтительно основания третичного амина, такого как триэтиламин. Промежуточное соединение (VI-d) впоследствии циклизуется при повышенной температуре с образованием соединения (VI-e). Подходящим растворителем для этой реакции циклизации является гликоль, такой как этиленгликоль.
Такой путь синтеза можно также применять для получения аналогов соединений (I-е), в которых R1 является отличным от циано, в частности соединения (I-е), в которых R1 является С1-4алкилоксикарбонилом, через взаимодействие (VI-c) со сложным эфиром ди(С1-4алкил)малоновой кислоты.
Соединения формулы (I), в которых X является S, можно получить из серных аналогов промежуточного соединения (VI-a), то есть 3-гидроксибензотиена, следуя тем же самым методикам, описанным ранее в данной патентной заявке, выпуская серные аналоги соединений (I-е). Последние можно преобразовывать до соответствующих сульфоксидов (X является SO) или сульфонов (X является SO2), применяя известные в этой области техники методики окисления, например, с помощью обработки надлежащим пероксидом.
Соединения формулы (I) можно перевести в другие соединения формулы (I) с другим замещением, применяя известные в этой области техники методики превращения. Например, соединения формулы (I), в которых R3 является нитро, можно восстановить до R3, являющегося амино; и может затем претерпевать дальнейшие преобразования. Дальнейшие примеры реакций преобразования представлены в экспериментальной части.
Соединения формулы (I), в которых R1 является циано, можно гидролизовать до соответствующих соединений формулы (I), в которых R1 является гидроксикарбонилом, который в свою очередь можно этерифицировать для получения соединений формулы (I), в которых R1 является С1-4алкилоксикарбонилом. Последний или гидроксикарбонильные производные можно преобразовывать до соответствующих амидов, применяя известные в данной области техники реакции превращения карбоксила в амид или сложного алкилэфира в амид.
Соединения формулы (I), содержащие группу -COOR4, в которой R4 является водородом, можно преобразовывать до соответствующих сложных эфиров, применяя известные в данной области техники методики этерификации. И наоборот, сложные эфиры можно преобразовать до свободной кислоты с помощью подходящих методик гидролиза, например с помощью гидролиза в кислой или основной среде.
Соединения формулы (I), применяя тиоморфолинильную группу, можно окислить до соответствующих соединений, содержащих 1-оксотиоморфолинил или 1,1-диоксотиоморфолинил, применяя подходящий органический или неорганический пероксид. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных и щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например, 3-хлор- бензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроперекиси, например гидропероксид трет-бутила. 1-оксотиоморфолиновые аналоги предпочтительно получаются при применении управляемых методик окисления.
Соединения формулы (I) можно также преобразовать до соответствующих N-оксидных форм следующими известными в данной области техники процедурами для превращения тризамещенного азота в его N-оксидную форму. Вышеуказанную реакцию N-окисления можно, главным образом, выполнить путем взаимодействия исходных материалов формулы (I) с подходящими органическими или неорганическими пероксидами. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных и щелочно-земельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогензамещенная бензолкарбопероксикислота, например 3-хлор-бензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидропероксиды, например гидропероксид трет-бутила. Подходящими растворителями являются, например, вода, низшие спирты и подобные, углеводороды, например толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей.
Основный азот, встречающийся в настоящих соединениях, можно кватернизировать с любым агентом, известным специалисту в данной области техники, включая, например, низшие алкилгалогениды, диалкилсульфаты, галогениды с длинной цепью и аралкилгалогениды, в соответствии с методиками, известными в данной области техники.
Ряд промежуточных соединений, примененных для получения соединений формулы (I), является известными соединениями, в то время, как другие являются аналогами известных соединений, которые можно получить следующими модификациями методик, известных в данной области техники, легко доступны для человека, обладающего соответствующими навыками. Ряд получений промежуточных соединений дан в дальнейшем описании патентной заявки в некоторой степени с большими подробностями. В следующих схемах реакции радикалы R1, R2, R3, n имеют значения, указанные в отношении к соединениям формулы (I) или любой из подгрупп соединений формулы (I). W представляет уходящую группу, такую как тозил, мезил, галоген, в частности хлор или бром.
Промежуточные соединения формулы (II) можно получить так, как описано в следующей схеме реакции.
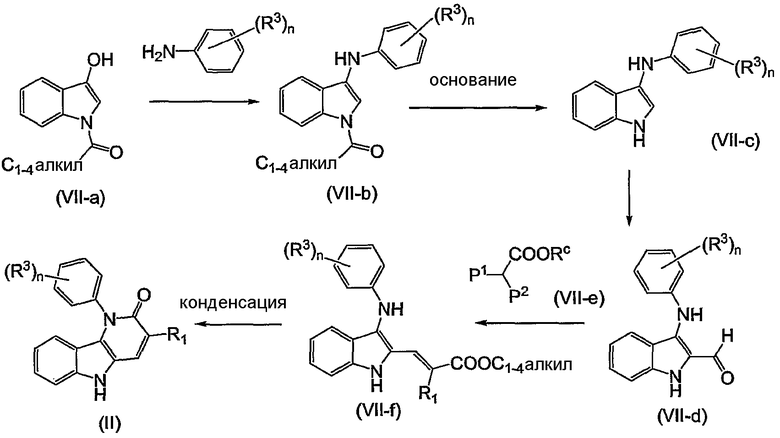
Синтез промежуточных соединений (II) начинается с 1-С1-4алкилкарбонил-3-гидроксииндола (VII-a), который конденсируется замещенным анилином, давая 3-(фениламино)индолы (VII-b). Такую реакцию конденсации можно проводить при повышенных температурах и в кислотной среде, например, при применении кислотного растворителя, такого как уксусная кислота, или применяя растворитель, такой как толуол, бензол, спирт и подобное, в присутствии соответствующего кислотного катализатора, такого как п-толуолсульфоновая кислота. Промежуточное соединение (VII-b) впоследствии деацилируется основанием, таким как, например, триэтиламин, гидроксидом натрия или калия, ацетатом натрия, ацетатом калия карбонатом кальция и подобным, в подходящем растворителе, таком как, например, метанол или этанол, предпочтительно при повышенной температуре, с выходом промежуточных соединений (VII-c). Формилирование промежуточного соединения (VII-c), например, при применении реакции Фильсмайера дает в результате индольные альдегиды (VII-d). Конденсация промежуточных соединений (VII-d) с реагентом (VII-e) приводит к образованию промежуточного соединения (VII-f). Радикалы P1, P2 и Rc в (VII-e) могут иметь разнообразные значения, в зависимости от типа реакции, примененной для получения промежуточных соединений (VII-f). В одном варианте осуществления данного изобретения такую конденсацию можно выполнить в реакции типа Кновенагеля с замещенным сложным эфиром уксусной кислоты формулы R1-CH2-COORc (который является промежуточным соединением (VII-e), в котором P1 является R1, P2 является H и Rc является C1-6алкилом или арилC1-6алкилом), применяя основание, такое как, например, триэтиламин, ацетат натрия, ацетат калия, пиперидин и подобное, при широком выборе растворителей. Альтернативно, выполнения реакции можно достичь с помощью реакции Виттига или реакции Виттига-Норнера. В первом примере применяется реагент Виттиг-типа, такой как трифенил-фосфонийилид. Преобразование Виттига проводится в соответствующем реакционно-инертном растворителе, таком как простой эфир, начиная с трифенилфосфина и сложного эфира галогенуксусной кислоты формулы R1-CH(галоген)-COOR4a. Реакция Виттига-Хорнера выполняется с применением фосфоната, такого как, например, реагент формулы ди(C1-6алкилокси)-P(=O)-CH(R1)-COOR4a, в присутствии основания, предпочтительно сильного основания, в апротонном органическом растворителе. Последующая циклизация промежуточного соединения (VII-f) при повышенной температуре и в растворителе, таком как этиленгликоль, диоксан, N,N-диметилформамид, диметилсульфоксид, глим, диглим и подобных, дает промежуточные соединения (II).
Порядок стадий реакции в способе, установленном в вышеуказанной схеме реакции, может отличаться. Например, формилирование можно выполнить прежде деацилирования.
Такую последовательность синтеза, в частности, удобно применять для получения промежуточных соединений формулы (II), в которой R1 является циано. Также может применяться для получения промежуточных соединений, в которых R1 является аминокарбонилом, С1-4алкилоксикарбонилом, моно- или ди(С1-4алкил)аминокарбонилом, ариламинокарбонилом, N-(арил)-N-(С1-4алкил)аминокарбонилом, Гет1 или Гет2. Промежуточные соединения формулы (II), полученные в результате такого реакционного пути, можно превращать в аналогичные промежуточные соединения формулы (II), в которых R1 обладает другими значениями, с помощью реакции трансформации функциональных групп, таких как гидролиз циано в карбоксильную, превращение карбоксильной группы в амид и т.д.
Более того, эта реакционная последовательность, в частности, применяется для получения промежуточных соединений формулы (II), в которых R3 является нитро или циано. В одном варианте осуществления R3 является пара-нитро и способ начинается с пара-нитроанилина.
Промежуточные соединения формулы (II-a), которые являются промежуточными соединениям формулы (II), в которых R1 является циано, можно альтернативно получить таким образом, как описано в следующей схеме реакции.
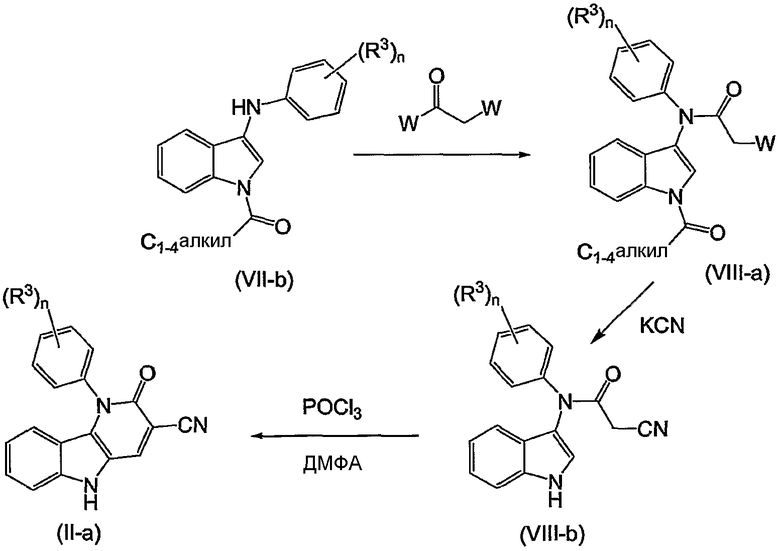
Промежуточное соединение (VII-b), которое получают так, как описано в предыдущей схеме реакции, взаимодействует с хлорацетилхлоридом или его функциональным производным, соответственно при повышенной температуре, чтобы получить промежуточное соединение формулы (VIII-a). Снимается защита с последнего промежуточного соединения формулы (VIII-a), применением соответствующего основания, такого как триэтиламин, ацетат натрия, ацетат калия, гидроксид натрия, гидроксид калия, карбонат калия и подобные, в растворителе, таком как метанол или этанол. Таким образом первое промежуточное соединение (VIII-b) превращается в соответствующее цианопроизводное (VIII-b), при применении цианида калия или цианида тетрабутиламмония. Цианопроизводное (VIII-b) циклизируется в результате двухстадийного синтеза, включающего сначала формилирование Фильсмайера, применяя POCl3 в N,N-диметилформамиде, и последующую циклизацию с образованием промежуточного соединения (II-а).
Промежуточные соединения формулы (II-b), которые являются промежуточными соединениям формулы (II), в которых R1 является водородом, можно получить таким образом, как описано в следующей схеме реакции.
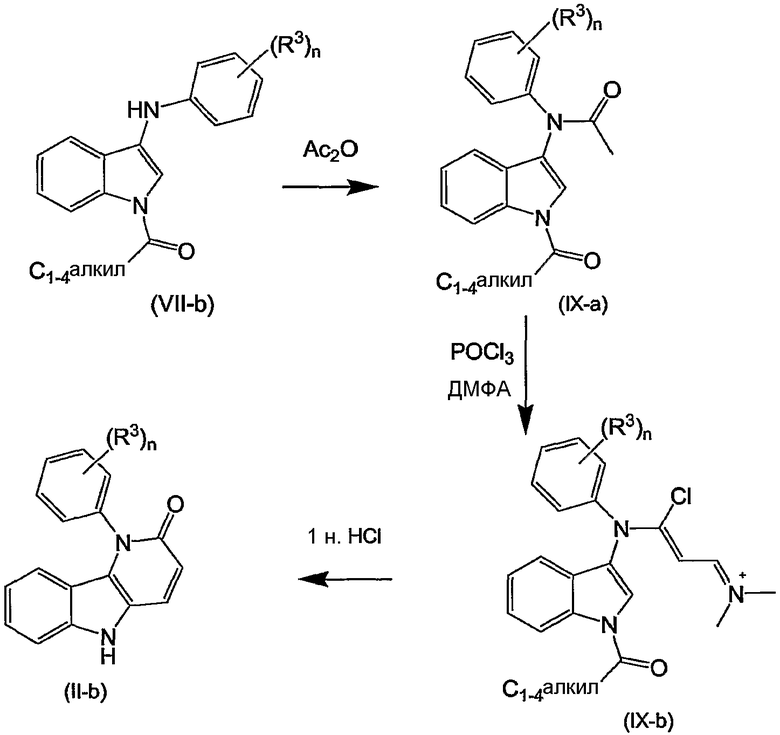
Эта реакционная последовательность, в частности, применяется для получения промежуточных соединений формулы (I), в которых R3 является циано, нитро или C1-6алкилоксикарбонилом.
Промежуточное соединение (VII-b), которое получают, как описано ранее в патентной заявке, взаимодействует с уксусным ангидридом в присутствии катализатора, такого как, например, пиридин или диметиламинопиридин или подобные, соответственно при повышенной температуре, с выходом промежуточного соединения формулы (IX-a). Таким образом, первое промежуточное соединение формулы (IX-a) формилируется при применении реакции Фильсмайера с POCl3 в N,N-диметилформамиде, с образованием промежуточного соединения (IX-b), которое, в свою очередь, можно в дальнейшем циклизировать до промежуточных соединений (II-b), например, в водной кислотной среде, например в водной HCl.
Промежуточные соединения формулы (II-а) или (II-b) можно преобразовывать в другие промежуточные соединения формулы (II), применяя известные в данной области техники реакции функциональных групп. Например, когда R3 является Br, Br можно преобразовывать в гетероциклическое кольцо, применяя гетероциклические бораты и палладий. Или когда R3 является C1-6алкилоксикарбонилом, этот радикал можно преобразовывать до эквивалентной карбоновой кислоты или амида, применяя реакцию гидролиза, или соответственно сложный эфир или карбоновую кислоту до амида. Также R3, являющийся циано, можно преобразовывать до гетероцикла, такого как тетразолил, оксадиазолил, тиазолил и т.д., применяя известные в данной области техники способы циклизации.
Соединения настоящего изобретения можно применять для животных, предпочтительно для млекопитающих, и в частности для человека, в качестве фармацевтических лекарств, в смесях друг с другом или в форме фармацевтических препаратов.
Следовательно, настоящее изобретение касается фармацевтических композиций, содержащих, в качестве активных ингредиентов, эффективной дозы, по меньшей мере, одного из соединений формулы (I), помимо обычных фармацевтически безвредных наполнителей и вспомогательных средств. Фармацевтические препараты могут содержать от 0,1 до 90 мас.% соединения формулы (I). Фармацевтические композиции можно получить способом, суть которого известна специалистам в данной области техники. С этой целью, соединение формулы (I), вместе с одним или несколькими твердыми или жидкими фармацевтическими наполнителями и/или вспомогательными средствами и, необязательно, в комбинации с другими фармацевтически активными соединениями, приводятся к удобной для назначения форме или дозировке, которую можно затем применять как фармацевтический продукт в медицине или ветеринарии.
Фармацевтические композиции, которые содержат соединение, соответствующее настоящему изобретению, можно назначать орально, парентерально, например, внутривенно, ректально, путем ингаляции, или местно, предпочтительный путь введения препарата зависит от индивидуального случая, например определенное течение болезни, нарушения, которое лечится. Введение препарата орально является предпочтительным.
Специалист в данной области техники, хорошо знаком, исходя из своих экспертных знаний, со вспомогательными средствами, которые подходят для желаемой фармацевтической композиции. Помимо растворителей, гелеобразующих агентов, суппозиторных основ, таблеточные вспомогательные средства и другие активные носители соединений, антиоксиданты, дисперсанты, эмульгаторы, пеногасители, ароматические модификаторы лекарственных веществ, консерванты, солюбилизаторы, реагенты для достижения депо-эффекта, буферные вещества или красители также полезны.
Также можно применять комбинацию антиретровирусного соединения и соединения настоящего изобретения. Таким образом, для предотвращения, борьбы или лечения инфекций ВИЧ и заболеваний, ассоциированных с инфекцией ВИЧ, таких как синдром приобретенного иммунодефицита (СПИД) или СПИД-ассоциированный комплекс (ARC), соединения настоящего изобретения можно назначать совместно в комбинации с, например, связывающими ингибиторами, ингибиторами встраивания, связывающими ингибиторами сорецептора; ингибиторами RT; нуклеозидными RTI; нуклеотид RTI; NNRTI; ингибиторами РНКазы Н; ингибиторами TAT; ингибиторами интегразы; ингибиторами протеазы; ингибиторами гликозилирования; ингибиторами проникновения.
Любые из этих комбинаций могут обеспечить синергетический эффект, в силу чего вирусная инфективность и ассоциированные с ней симптомы можно предотвратить, значительно уменьшить или ликвидировать полностью.
Таким образом, в дальнейшем аспекте настоящее изобретение также относится к комбинации, содержащей:
(a) соединение настоящего изобретения, в частности соединение формулы (I), как определено в данной патентной заявке, или соединение формулы (I) любой подгруппы, указанной в данной патентной заявке; N-оксид, соль, стереоизомерная форма, пролекарство, сложный эфир или их метаболит, и
(b) другое антиретровирусное соединение, в частности другой ингибитор ВИЧ.
Дополнительно настоящее изобретение относится к комбинации, содержащей:
(a) соединение настоящего изобретения, в частности соединение формулы (I), как определено в данной патентной заявке, или соединение формулы (I) любой подгруппы, указанной в данной патентной заявке; N-оксид, соль, стереоизомерная форма, пролекарство, сложный эфир или их метаболит, и
(b) любые агенты, выбранные из связывающих ингибиторов, таких как, например, сульфат декстрана, сурамин, полианионы, растворимый CD4, PRO-542, BMS-806; ингибиторы встраивания, такие как, например, T20, T1249, RPR 103611, YK-FH312, IC 9564, 5-спираль, D-пептид ADS-J1; связывающие ингибиторы сорецептора, такие как, например, AMD 3100, AMD-3465, AMD7049, AMD3451 (Bicyclams), ТАК 779, T-22, ALX40-4C; SHC-C (SCH351125), SHC-D, PRO-140, RPR103611; ингибиторы RT, такие как, например, фоскарнет и пролекарства; нуклеозидные RTI, такие как, например, AZT, 3TC, DDC, DDI, D4T, Абакавир, FTC, DAPD (Amdoxovir), dOTC (BCH-10652), фозивудин, DPC 817; нуклеотидные RTI, такие как, например, PMEA, PMPA (тенофовир); NNRTI, такие как, например, невирапин, делавирдин, эфавиренз, 8 и 9-Cl TIBO (тивирапин), ловирид, TMC-125, дапивирин, MKC-442, UC 781, UC 782, каправирин, QM96521, GW420867X, DPC 961, DPC963, DPC082, DPC083, каланолид A, SJ-3366, TSAO, 4"-диаминированный TSAO, MV150, MV026048, PNU-142721; ингибиторы РНКазы Н, такие как, например, SP1093V, PD126338; ингибиторы TAT, такие как, например, RO-5-3335, K12, K37; ингибиторы интегразы, такие как, например, L 708906, L 731988, S-1360; ингибиторы протеазы, такие как, например, ампренавир и фосампренавир, ритонавир, нелфинавир, сакуинавир, индинавир, лопинавир, палинавир, BMS 186316, атазанавир, DPC 681, DPC 684, типранавир, AG1776, мозенавир, DMP-323, GS3333, KNI-413, KNI-272, L754394, L756425, LG-71350, PD161374, PD173606, PD177298, PD178390, PD178392, PNU 140135, TMC-114, маслиновая кислота, U-140690; ингибиторы гликозилирования, такие как, например, кастаноспермин, дезоксиножиримицин; ингибиторы проникновения CGP64222; в будущем относятся к таким агентам, принадлежащим к группе (b).
В одном варианте осуществления предоставляются комбинации, содержащие ингредиенты (a) и (b) такие, как указаны ранее в патентной заявке, в которых соединение настоящего изобретения является соединением (I-a), N-оксидом, солью, стереоизомерной формой, пролекарством, сложным эфиром или их метаболитом.
В другом варианте осуществления предоставляются комбинации, содержащие ингредиенты (a) и (b), такие, как указаны ранее в патентной заявке, в которых соединение настоящего изобретения выбрано из группы, состоящей из
1-(4-нитрофенил)-2-оксо-1,2-дигидробензо[4,5]фуро[3,2-b]пиридин-3-карбонитрила,
5-(2-гидрокси-3-морфолин-4-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрила,
5-(2-гидрокси-3-пиперидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрила,
5-(3-диэтиламино-2-гидроксипропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрила,
5-[2-(2-метоксиэтокси)этил]-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрила, и предпочтительно
5-(2-гидрокси-3-пирролидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-3-карбонитрила,
и их N-оксиды, соли и возможные стереоизомеры, в дальнейшем на вышеуказанную группу будут ссылки как на «группу соединений (I-f)».
Вариантами осуществления настоящего изобретения являются комбинации, содержащие (a) одно или несколько соединений формулы (I), или соединения любой из подгрупп соединений формулы (I), как указано ранее в данной патентной заявке, в частности подгрупп соединений формулы (I-a), или группы соединений (I-f), включая N-оксиды, соли, стереоизомерные формы, пролекарства, сложные эфиры и их метаболиты; и (b) один или несколько ингибиторов ВИЧ, выбранных из
(i) одного или нескольких ингибиторов встраивания, таких как, например, T20, T1249, RPR 103611, YK-FH312, IC 9564, 5-спираль, D-пептид ADS-J1, энфувиртид (ENF), GSK-873140, PRO-542, SCH-417690, TNX-355, маравирок (UK-427857); предпочтительно одного или нескольких ингибиторов встраивания, таких как, например, энфувиртид (ENF), GSK-873140, PRO-542, SCH-417690, TNX-355, маравирок (UK-427857);
(ii) одного или нескольких нуклеозидных RTI, таких как, например, AZT, 3TC, зальцитабин (ddC), ddI, d4T, Абакавир (ABC), FTC, DAPD (Amdoxovir), dOTC (BCH-10652), фозивудин, D-D4FC (DPC 817 или ReversetТМ), аловудин (MIV-310 или FLT), элвуцитабин (ACH-126443); предпочтительно одного или нескольких нуклеозидов RTI, таких как, например, AZT, 3TC, зальцитабин (ddC), ddI, d4T, Абакавир (ABC), FTC, DAPD (Amdoxovir), D-D4FC (DPC 817 или ReversetТМ), аловудин (MIV-310 или FLT), элвуцитабин (ACH-126443);
(iii) нуклеотидных RTI, таких как, например, PMEA, PMPA (TDF или тенофовир) или тенофовир дизопроксил фумарат; предпочтительно тенофовир или тенофовир дизопроксил фумарат;
(iv) одного или нескольких NNRTI, таких как, например, невирапин, делавирдин, эфавиренз, 8 и 9-Cl TIBO (тивирапин), ловирид, TMC125, 4-[[4-[[4-(2-цианоэтенил)-2,6-дифенил]амино]-2-пиримидинил]амино]бензонитрил (TMC278 или R278474), дапивирин (R147681 или TMC120), MKC-442, UC 781, UC 782, Каправирин, QM96521, GW420867X, DPC 961, DPC963, DPC082, DPC083 (или BMS- 561390), каланолид A, SJ-3366, TSAO, 4"-деаминированный TSAO, MV150, MV026048, PNU-14272; или предпочтительно одного или нескольких NNRTI, таких как, например, невирапин, делавирдин, эфавиренз, TMC125, TMC278, TMC120, каправирин, DPC083, каланолид A;
(v) одного или нескольких ингибиторов протеазы, таких как, например, ампренавир и фосампренавир, лопинавир, ритонавир (также как комбинации ритонавир и лопинавир, таких как KaletraТМ), нелфинавир, сакуинавир, индинавир, палинавир, BMS 186316, атазанавир, DPC 681, DPC 684, типранавир, AG1776, мозенавир, DMP-323, GS3333, KNI-413, KNI-272, L754394, L756425, LG-71350, PD161374, PD173606, PD177298, PD178390, PD178392, PNU 140135, TMC-114, маслиновая кислота, U-140690; в частности, одного или несколькихо ингибиторов протеазы, таких как, например, ампренавир и фосампренавир, лопинавир, ритонавир (также как комбинации ритонавир и лопинавир), нелфинавир, сакуинавир, индинавир, атазанавир, типранавир, TMC-114.
В дальнейшем аспекте настоящее изобретение обеспечивает комбинации, включающие, по меньшей мере, одно соединение формулы (I) или соединения любой из подгрупп соединений формулы (I), как указано в данной патентной заявке, в частности подгрупп соединений формулы (I-a), или группы соединений (I-f), включая N-оксиды, соли, стереоизомерные формы, пролекарства, сложные эфиры и их метаболиты, и, по меньшей мере, два различных других антиретровирусных агента.
Одним вариантом осуществления являются комбинации, как указано в предыдущем абзаце, в котором вышеуказанными двумя различными другими антиретровирусными агентами являются
(i) два нуклеозидных ингибитора транскриптазы (NRTI);
(ii) нуклеозидный (NRTI) и нуклеотидный ингибитор обратной транскриптазы (NtRTI);
(iii) NRTI и NNRTI;
(iv) NRTI и ингибитор протеазы (PI);
(v) два NRTI и PI;
(vi) NRTI и ингибитор встраивания.
NRTI, NtRTI, NNRTI, PI и ингибиторы встраивания в комбинациях, упомянутых в предыдущем абзаце, можно выбрать из групп NRTI, NtRTI, NNRTI, PI и ингибиторов встраивания (i), (ii), (iii), (iv) или (v), упомянутых ранее в патентной заявке по отношению к вариантам осуществления, которые являются комбинациями, содержащими ингредиенты (a) и (b).
Отдельный интерес среди комбинаций, упомянутых ранее в патентной заявке, представляют те, что включают соединение настоящего изобретения, имеющее формулу (I) или (I-a), или принадлежащих к группе соединений (I-f), как указано ранее в патентной заявке, и:
(1) ингибитор встраивания, выбранный из энфувиртида (ENF), GSK-873140, PRO-542, SCH-417690, TNX-355, маравирока (UK-427857);
(2) NNRTI, выбранный из невирапина, делавирдина, эфавиренза, TMC125, TMC278, TMC120, каправирина, DPC083, каланолида A;
(3) NRTI, выбранный из AZT, 3TC, зальцитабина (ddC), ddI, d4T, Абакавира (ABC), FTC, DAPD (Amdoxovir), D-D4FC (DPC 817 или ReversetТМ), аловудина (MIV-310 или FLT), элвуцитабина (ACH-126443).
(4) NtRTI, выбранный из тенофовира или тенофовира дисопроксил фумарата;
(5) PI, выбранный из ампренавира и фосампренавира, лопинавира, ритонавира (так же, как комбинации ритонавира и лопинавира), нелфинавира, сакуинавира, индинавира, атазанавира, типранавира, TMC-114;
(6) NRTI, такой как в (3), и PI, такой как в (5);
(7) два разных NRTI, таких как в (3);
(8) NRTI, такой как в (3), и NNRTI, такой как в (2);
(9) два разных NRTI, таких как в (3), и NNRTI, такой как в (2);
(10) два разных NRTI, таких как в (3), и PI, такой как в (5);
(11) NRTI, такой как в (3), и NtRTI, такой как в (4); или
(12) NRTI и ингибитор встраивания, такой как в (1).
Одним типом вариантов осуществления настоящего изобретения являются такие комбинации, которые описаны в данной патентной заявке, которые не содержат 3TC.
Настоящее изобретение также относится к продукту, содержащему (a) соединение настоящего изобретения, в частности соединение формулы (I), такое как определено в данной патентной заявке, или соединение формулы (I) любой из подгрупп, определенной в данной патентной заявке, его N-оксиды, соли, стереоизомерные формы, пролекарства, сложные эфиры и метаболиты, или любое соединение подгруппы, такое, как указано в данной патентной заявке, и (b) другое антиретровирусное соединение, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении ретровирусных инфекций, таких как инфекция ВИЧ, в частности при лечении инфекций мультирезистентных ретровирусов.
Любая из вышеуказанных комбинаций может обеспечить синергетический эффект, посредством чего вирусную инфективность и ассоциированные с ней симптомы можно предотвратить, значительно уменьшить или устранить полностью.
Любые из вышеупомянутых комбинаций или продуктов можно применять для предотвращения, борьбы или лечения инфекций ВИЧ и заболеваний, ассоциированных с инфекциями ВИЧ, такими как синдром приобретенного иммунодефицита (СПИД) или СПИД-ассоциированный комплекс (ARC). Следовательно, в дальнейшем аспекте предоставлены способы лечения млекопитающих, в частности человека, инфицированных ВИЧ или подвергающихся риску быть инфицированными ВИЧ, вышеуказанный способ, заключающийся в назначении вышеуказанным млекопитающим, или, в частности, вышеуказанному человеку, комбинации или продукта, указанного в данной патентной заявке.
Соединения настоящего изобретения можно также назначать в комбинации с иммуномодуляторами (например, бропиримином, нечеловеческим альфа-интерферон антителом, IL-2, метионином энкефалином, интерфероном альфа и налтрексоном) с антибиотиками (например, пентамидин изотиоратом), цитокинами (например, Th2), модуляторами цитокинов, хемокинами или модуляторами хемокинов, рецепторами хемокина (например, CCR5, CXCR4), модуляторами рецепторов хемокина или гормонами (например, гормоном роста) для улучшения, борьбы или устранения инфекции ВИЧ и ее симптомов. Такую комбинированную терапию в разных лекарственных формах можно назначать одновременно, последовательно или независимо друг от друга. Альтернативно, такую комбинацию можно назначить в виде лекарственной формы, принимаемой единовременно, посредством чего активные ингредиенты высвобождаются из лекарственной формы одновременно или отдельно.
Соединения настоящего изобретения можно также назначать в комбинации с модуляторами метаболизма. Эти модуляторы включают соединения, которые препятствуют метаболизму на цитохромах, таких как цитохром P450. Известно, что существуют некоторые изоферменты цитохрома P450, один из которых является цитохромом P450 3A4. Ритонавир является примером модулятора метаболизма через цитохром P450. Такая комбинированная терапия в разных лекарственных формах, может быть назначена одновременно, последовательно или независимо друг от друга. Альтернативно, такую комбинацию можно назначить в виде лекарственной формы, принимаемой единовременно, посредством чего активные ингредиенты высвобождаются из рецептуры одновременно или отдельно. Такой модулятор можно назначить в той же самой или другой пропорции, в виде соединения настоящего изобретения. Предпочтительно, массовое соотношение таких модуляторов к соединению настоящего изобретения (модулятор:соединение настоящего изобретения) составляет 1:1 или ниже, более предпочтительно соотношение 1:3 или ниже, еще более препочтительно соотношение 1:10 или ниже, наиболее предпочтительно соотношение 1:30 или ниже.
Для получения формы, назначаемой перорально, соединения настоящего изобретения смешивают с подходящими добавками, такими как наполнители, стабилизаторы или инертные растворители, и приводятся посредством обычных методов в удобные для назначения формы, такие как таблетки, таблетки в оболочке, твердые капсулы, водные, спиртовые или масляные растворы. Например, удобными инертными носителями являются аравийская камедь, магнезия, карбонат магния, фосфат калия, лактоза, глюкоза или крахмал, в частности кукурузный крахмал. В этом случае препарат можно выполнить как в сухих, так и во влажных гранулах. Удобными масляными наполнителями или растворителями являются растительные и животные масла, такие как подсолнечное масло или масло печени трески. Подходящими растворителями для получения водных или спиртовых растворов являются вода, этанол, растворы сахара или их смеси.
Полиэтиленгликоли и полипропиленгликоли также полезны, как вспомогательные средства для получения лекарственных форм другого назначения.
Для подкожного или внутривенного введения активные соединения, при необходимости, переводятся в раствор, суспензию или эмульсию веществами, обычно применяемыми в таких случаях, такими как солюбилизаторы, эмульгаторы или дальнейшие вспомогательные средства. Соединения формулы (I) также можно лиофилизировать и полученные лиофилизаты применять, например, для получения инъекционных или инфузионных препаратов. Подходящими растворителями являются, например, вода, физиологический солевой раствор или спирты, например этанол, пропанол, глицерин, кроме того, также растворы сахаров, такие как растворы глюкозы или маннита, или, альтернативно, смеси различных упомянутых растворителей.
Удобными фармацевтическими рецептурами для назначения являются препараты в форме аэрозолей и спреев, например растворы, суспензии или эмульсии соединений формулы (I) или их физиологически допустимые соли в фармацевтически допустимом растворителе, таком как этанол или вода, или смеси таких растворителей. При необходимости, рецептура также может дополнительно содержать другие фармацевтические вспомогательные средства, такие как поверхностно-активные вещества, эмульгаторы и стабилизаторы, так же как пропеллент. Такой препарат обычно содержит активное вещество в концентрации приблизительно от 0,1 до 50%, в частности приблизительно от 0,3 до 3 мас.%.
Чтобы повысить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, можно успешно применять α-, β- или γ-циклодекстрины, или их производные. Также сорастворители, такие как спирты, могут улучшить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях. В препаратах водных композиций аддитивные соли предметных соединений являются очевидно более удобными в применении, так как это обусловлено их повышенной растворимостью в воде.
Соответствующими циклодекстринами являются α-, β- или γ-циклодекстрины (CD) или простые эфиры и их смешанные эфиры, в которых один или несколько гидроксигрупп ангидроглюкозных единиц циклодекстрина замещаются C1-6алкилом, в частности метилом, этилом или изопропилом, например беспорядочно метилированным β-CD; гидроксиC1-6алкилом, в частности гидроксиэтилом, гидроксипропилом или гидроксибутилом; карбоксиC1-6алкилом, в частности карбоксиметилом или карбоксиэтилом; C1-6алкилкарбонилом, в частности ацетилом; C1-6алкиоксикарбонилC1-6алкилом или карбоксиC1-6алкилоксиC1-6алкилом, в частности карбоксиметоксипропилом или карбоксиэтоксипропилом; C1-6алкилкарбонилоксиC1-6алкилом, в частности 2-ацетилоксипропилом. Особенно предпочтительными в качестве комплексантов и/или солюбилайзеров являются β-CD, беспорядочно метилированный β-CD, 2,6-диметил-β-CD, 2-гидроксиэтил-β-CD, 2-гидроксиэтил-γ-CD, 2-гидроксипропил-γ-CD и (2-карбоксиметокси)пропил-β-CD и в частности 2-гидроксипропил-β-CD (2-HP-β-CD).
Термин «смешанный простой эфир» обозначает циклодекстриновые производные, в которых, по меньшей мере, две циклодекстриновые гидроксигруппы этерифицируются разными группами, такими как, например, гидроксипропил и гидроксиэтил.
В EP-A-721331 описан интересный путь составления соединений настоящего изобретения в комбинации с циклодекстрином или их производными. Хотя лекарственные формы, описанные в настоящем изобретении, содержат противогрибковые активные ингредиенты, они также интересны для формирования лекарственных форм соединений настоящего изобретения. Лекарственные формы, описанные в данной патентной заявке, в частности, подходят для назначения внутрь и содержат противогрибковое вещество, такое как активный ингредиент, значительное количество циклодекстрина или его производного, в качестве солюбилизатора, водную кислотную среду, такую как основной жидкий носитель и спиртовой сорастворитель, который сильно упрощает получение композиции. Вышеуказанные лекарственные формы можно также воспроизвести с более привлекательным вкусом путем добавления фармацевтически одобренных подсластителей и/или ароматизаторов.
Другие удобные пути повышения растворимости соединений настоящего изобретения в фармацевтических композициях описываются в WO 94/05263, WO 98/42318, EP-A-499299 и WO 97/44014, все включены в данную патентную заявку путем ссылок.
В более частном случае соединения настоящего изобретения можно включить в фармацевтическую композицию, содержащую терапевтически эффективное количество частиц, состоящих из твердой дисперсии, содержащей (a) соединение формулы (I), и (b) один или несколько фармацевтически допустимых водорастворимых полимеров.
Термин «твердая дисперсия» определяет систему в твердом состоянии (в противоположность к жидкому или газообразному состоянию), включающую, по меньшей мере, два компонента, в которых один компонент диспергируется более или менее равномерно через другой компонент или компоненты. Когда вышеуказанная дисперсия компонентов является такой, что система является химически и физически однородной или гомогенной во всех отношениях или состоит из одной фазы, согласно определению в термодинамике, на такую твердую дисперсию ссылаются как на «твердый раствор». Твердые растворы являются предпочтительными физическими системами, поскольку компоненты в них обычно являются легко биодоступными для организмов, которым их назначают.
Термин «твердая дисперсия» также включает дисперсии, которые менее гомогенны во всех отношениях, чем твердые растворы. Такие дисперсии не являются химически и физически однородными во всех отношениях или содержат более одной фазы.
Водорастворимый полимер в частицах является полимером, который обладает видимой вязкостью от 1 до 100 мПa·с, при растворении в 2% водном раствор при температуре раствора 20°C.
Предпочтительными водорастворимыми полимерами являются гидроксипропилметилцеллюлозы или ГПМЦ. ГПМЦ, имеющие степень замещения на метокси от 0,8 до приблизительно 2,5 и молярное замещение на гидроксипропил от 0,05 до приблизительно 3,0, в целом растворимы в воде. Степень замещения на метокси относится к среднему числу присутствующих метилэфирных групп на ангидроглюкозной единице молекулы целлюлозы. Молярное замещение на гидроксипропил относится к среднему числу молей оксида пропилена, которые взаимодействовали с каждой ангидроглюкозной единицей молекулы целлюлозы.
Частицы, согласно вышеизложенному определению в данной патентной заявке, можно получить путем получения сначала твердой дисперсии компонентов, а затем, необязательно, размалывая или измельчая такую дисперсию. Существуют разнообразные способы получения твердых дисперсий, включая экструзию расплавлением, высушивание распылением и выпаривание раствора, предпочтительной является экструзия расплавлением.
В дальнейшем может быть предпочтительно разрабатывать соединения настоящего изобретения в форме наночастиц, которые обладают модификатором поверхности, адсорбированном на их поверхности в количестве значительном для сохранения эффективного среднего размера частиц меньше 1000 нм. Понятно, что полезные модификаторы поверхности включают те, что физически прилипают к поверхности антиретровирусного агента, но химически не связаны с антиретровирусным агентом.
Предпочтительно подходящие поверхностные модификаторы можно выбрать из известных органических и неорганических фармацевтических наполнителей. Такие наполнители включают разнообразные полимеры, олигомеры с низкой молекулярной массой, природные продукты и поверхностно-активные вещества. Предпочтительные поверхностные модификаторы включают неионные и анионные поверхностно-активные вещества.
Еще один интересный путь для получения лекарственных форм соединений настоящего изобретения предусматривает фармацевтическую композицию, в силу чего соединения настоящего изобретения вводят в гидрофильные полимеры, и эту смесь применяют в качестве покрывающей пленки для большого количества маленьких гранул (шариков), таким образом получая композицию с хорошей биодоступностью, которую удобно производить и которая хорошо подходит для получения фармацевтических дозировочных форм для перорального введения.
Вышеуказанные шарики включают (a) центральное, округлое или сферическое ядро, (b) покрывающую пленку из гидрофильного полимера и антиретровирусного агента и (c) запаивающий и одновременно покрывающий полимерный слой.
Материалы, подходящие для применения в качестве ядер в шариках, многообразны, при условии, что вышеуказанные материалы являются фармацевтически приемлемыми и обладают соответствующими размерами и плотностью. Примерами таких материалов являются полимеры, неорганические вещества, органические вещества и сахариды и их производные.
Путь введения лекарства может зависеть от состояния пациента, сопутствующего медикаментозного лечения и подобного.
Другой аспект настоящего изобретения относится к комплекту или контейнеру, содержащему соединение формулы (I) в количестве, эффективном для применения в качестве стандарта или реагента в тесте или испытании для определения способности потенциального фармацевтического препарата ингибировать обратную транскриптазу ВИЧ, рост ВИЧ, или и то и другое. Этот аспект изобретения может найти применение в фармацевтических исследовательских программах.
Соединения настоящего изобретения можно применять в мониторинговых испытаниях фенотипической резистентности, таких как известные рекомбинантные испытания, резистентность развивающихся заболеваний, таких как ВИЧ, в клинических условиях. В частности, полезной мониторинговой системой резистентности является рекомбинантное испытание, известное как Antivirogram®. Antivirogram® является высокоавтоматизированным высокопроизводительным рекомбинантным испытанием второго поколения, которым можно измерить чувствительность, особенно вирусную чувствительность к соединениям настоящего изобретения. (Hertogs K et al. Antimicrob Agents Chemother, 1998; 42(2): 269-276, введенный в данную патентную заявку путем ссылки).
Соединения настоящего изобретения могут содержать химически реактивные фрагменты, способные к образованию ковалентных связей с локализованным сайтам таким образом, что вышеуказанное соединение увеличивает ретенцию ткани и время полувыведения. Термин «химически реакционноспособная группа» так, как применяется в данной патентной заявке, относится к химическим группам, способным к образованию ковалентной связи. Реакционноспособные группы в целом будут стабильными в водной среде и обычно являются карбокси, фосфорильной или удобной ацильной группой, либо в виде сложного эфира, либо смешанного ангидрида, либо имидата, либо малеимидата, при этом способны к образованию ковалентной связи с функциональными группами, такими как аминогруппа, гидрокси или тиольная, на признанном целевым активном центре на, например, компонентах крови, таких как альбумин. Соединения настоящего изобретения могут быть связанными с имидом малеиновой кислоты или их производными с образованием коньюгатов.
Также в дальнейшем аспекте настоящее изобретение предоставляет способ лечения пациентов, которые инфицированы ВИЧ вирусом или подвергаются риску быть инфицированными ВИЧ вирусом, вышеуказанный способ, заключающийся в назначении эффективного количества комбинации соединения формулы (I) или соединения подгруппы соединений формулы (I), как указано в данной патентной заявке, и другого ингибитора ВИЧ, который может быть любым из ингибиторов ВИЧ, упомянутых в данной патентной заявке.
Доза соединений настоящего изобретения или их физиологически допустимой соли (солей), которую назначают, зависит от конкретного случая и, как принято, должна быть адаптирована к условиям конкретного случая для получения оптимального эффекта. Таким образом, это зависит, конечно, от частоты применения и от действенности и продолжительности действия соединений, применяемых в каждом случае для терапии или профилактики, но также от природы и тяжести инфекции и симптомов, и от пола, возраста, веса, сопутствующего медикаментозного лечения и индивидуальной восприимчивости человека или животного, которого лечат, и от того, проводится ли терапия в острой фазе заболевания или профилактически. Обычно дневная доза соединения формулы (I) в случае назначения пациенту с массой приблизительно 75 кг составляет от 1 мг до 3 г, предпочтительно от 3 мг до 1 г, более предпочтительно от 5 мг до 0,5 г. Дозу можно назначать в виде одноразовой дозы, или разделенной на несколько, например, две, три или четыре, индивидуальных доз.
ПРИМЕРЫ
Следующие примеры иллюстрируют получение соединений формулы (I) и их промежуточных соединений, а также их фармакологические свойства. Данные примеры не следует истолковывать как ограничения сути настоящего изобретения.
Пример 1
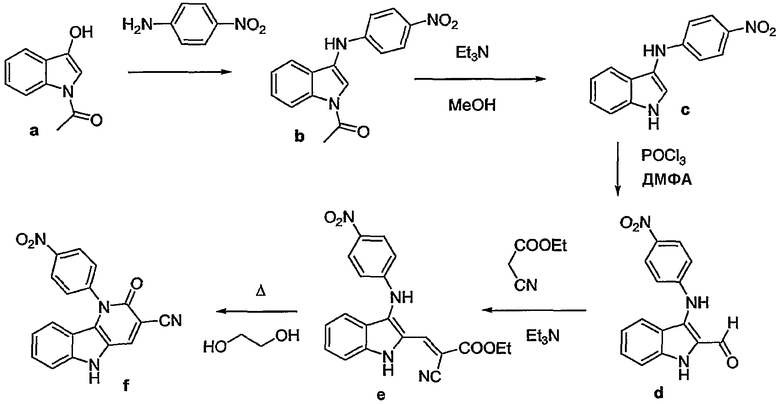
Синтез промежуточного соединения f начинали с коммерчески доступного 1-ацетил-1H-индол-3-ола (a). Конденсация промежуточного соединения с 4-нитроанилином в условиях нагревания с обратным холодильником в уксусной кислоте приодила к образованию 1-ацетил-3-((4-нитрофенил)амино)индола (b) (Valezheva et al; Chem. Heterocycl. Compd. (Engl. Transl); 14; 1978; 757, 759, 760; Khim. Geterotsikl. Soedin.; 14; 1978; 939). Деацилирование промежуточного соединения b с триэтиламином при нагревании с обратным холодильником метанолом и формилирование промежуточного соединения с, с применением оксихлорида фосфора в диметилформамиде, приводили к образованию промежуточного соединения d (Ryabova, S. Yu.; Tugusheva, N. Z.; Alekseeva, L. M.; Granik, V. G.; Pharm. Chem. J. (Engl. Transi.); EN; 30; 7; 1996; 472-477; Khim. Farm. Zh; RU; 30; 7; 1996; 42-46). Конденсация Кновенагеля промежуточного соединения d с этилцианоацетатом в присутствии каталитического количества триэтиламина и последующая внутримолекулярная циклизация промежуточного соединения e при нагревании с обратным холодильником в 1,2-этандиоле приводили к образованию промежуточного соединения f (2,5-дигидро-1-(4-нитрофенил)-2-оксо-1H-пиридо[3,2-b]индол-3-карбонитрил) (Ryabova, S. Yu.; Alekseeva, L. M; Granik, B. G.; Chem. Heterocycl. Compd. (Engl. Translat.) 36; 3; 2000; 301-306; Khim. Geterotsikl. Soedin.; RU; 3; 2000; 362-367).
В более частном случае к смеси 1-ацетил-1H-индол-3-ола (a) (0,114 моль, 20 г) в уксусной кислоте (150 мл), добавляли 4-нитроанилин (1,5 эквив., 0,171 моль, 23,65 г). Смесь нагревали с обратным холодильником в течение 5 часов и охлаждали до комнатной температуры. Оранжевый осадок отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, получая промежуточное соединение b (20,71 г, выход = 62%, чистота (LC) >98%).
Промежуточное соединение b (0,070 моль, 20,71 г) смешивали с метанолом (200 мл) и триэтиламином (3 эквив., 0,210 моль, 21,27 г) и смесь нагревали с обратным холодильником в течение 4 часов, охлаждали до комнатной температуры и выпаривали при пониженном давлении до сухого порошка. Неочищенный продукт с (чистота (LC) >95%) применяли как таковой на следующей стадии.
К охлажденному льдом N,N-диметилформамиду (обозначенный далее в патентной заявке как ДМФА) (50 мл) добавляли по каплям оксихлорид фосфора (3 эквив., 0,210 моль, 32,22 г), выдерживая внутреннюю температуру <10°C, и охлажденную смесь перемешивали в течение 1 часа. Затем по каплям добавляли раствор с в ДМФА (100 мл), выдерживая температуру реакции <10°C в течение добавления. Баню со льдом убирали и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа. Смесь выливали в воду со льдом (1 литр) и затем нагревали в течение ночи при 60°C и охлаждали до комнатной температуры. Осадок отделяли фильтрованием, промывали последовательно водой, изопропанолом и диизопропиловым эфиром, получая промежуточное соединение d (15,93 г, выход = 81%, чистота (LC) >95%).
К смеси d (0,056 моль, 15,93 г) в изопропаноле (150 мл) добавляли триэтиламин (1,5 эквив., 0,085 моль, 8,59 г) и этилцианоацетат (0,068 моль, 7,69 г). Смесь нагревали с обратным холодильником в течение 2 часов, охлаждали до комнатной температуры, отфильтровывали, и осадок последовательно промывали изопропанолом и диизопропиловым эфиром, получая промежуточное соединение e [S. Yu. Ryabova, L.M. Alekseeva, B.G. Granik Chemistry of Heterocyclic Compounds 2000, 36, 301-306] (16,42 г, выход = 78%, чистота (LC) >95%).
Перемешиваемую суспензию e (0,043 моль, 16,42 г) в этиленгликоле (200 мл) нагревали с обратным холодильником в течение 2 часов и охлаждали до комнатной температуры. Осадок отделяли фильтрованием и промывали последовательно изопропанолом и диизопропиловым эфиром. Неочищенное промежуточное соединение f выкристаллизовывали из ДМФА/воды следующим образом: неочищенный осадок растворяли в теплом ДМФА (250 мл). К теплому раствору добавляли воду (100 мл) и раствор охлаждали до комнатной температуры, позволяя промежуточному соединению f выпасть в осадок. Осадок отделяли фильтрованием и последовательно промывали изопропанолом и диизопропиловым эфиром, получая промежуточное соединение f (10,52 г, выход = 73%, чистота (LC) >98%).
1H-ЯМР (δ, ДМСО-D6): 6,11 (1H, д, J≈8 Гц), 6,86 (1H, т, J≈8 Гц), 7,38 (1H, т, J≈8 Гц), 7,54 (1H, д, J≈8 Гц), 7,91 (2H, д, J=8,6 Гц), 8,55 (2H, д, J=8,6 Гц), 8,70 (1H, с), 12,00 (1H, шир. с).
Пример 2
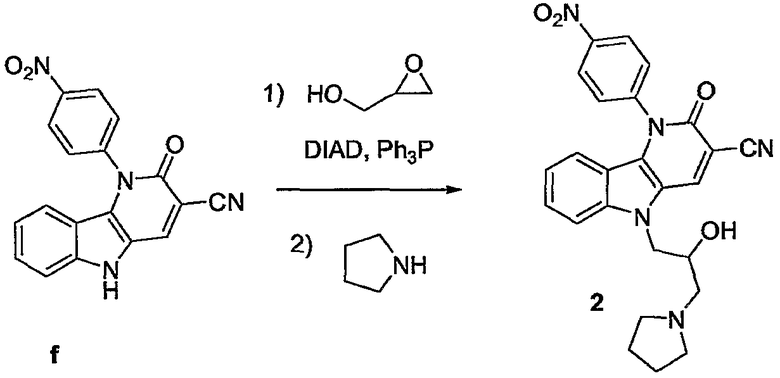
К охлажденному (0°C) раствору промежуточного соединения f (0,845 г, 2,56 ммоль) в ДМФА (10 мл) добавляли глицидол (2 эквив., 5,12 ммоль, 0,379 г), трифенилфосфин (2 эквив., 5,12 ммоль, 1,342 г) и диизопропилазодикарбоксилат (DIAD) (2 эквив., 5,12 ммоль, 1,035 г) и смесь перемешивали в течение ночи при комнатной температуре в атмосфере азота. Затем добавляли пирролидин (20 эквив., 51,16 ммоль, 3,64 г) и смесь нагревали при 70°C в течение 3 часов. Реакционную смесь выпаривали при пониженном давлении и сухой остаток очищали с помощью флэш-хроматографии (силикагель, элюент: 7 н. NH3 в метаноле/дихлорметане 5/95) с получением соединения 2 в виде желтого порошка (1,06 г, выход = 91%, чистота (LC) >98%). 1H-ЯМР (ДМСО-D6): δ 8,9 (1H, с), 8,55 (2H, д, J≈8 Гц), 7,9 (2H, м), 7,65 (1H, д, J≈9 Гц), 7,4 (1H, т, J≈8 Гц), 6,85 (1H, т, J≈8 Гц), 6,1 (1H, д, J≈8 Гц), 5,1 (1H, с), 4,55 (1H, дд, Jab≈15 Гц, Jd≈4 Гц), 4,4 (1H, дд, Jab≈15 Гц, Jd≈6 Гц), 4,0 (1H, с), 2,6-2,3 (6H, м), 1,57 (4H, м).
Пример 3
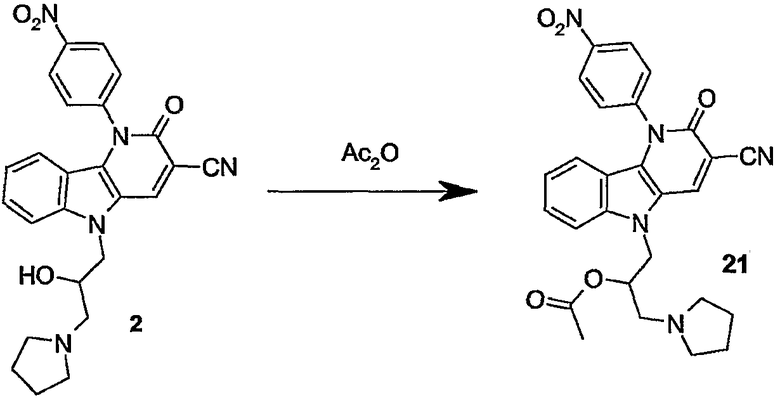
Соединение 2 (0,108 г, 0,236 ммоль) перемешивали с обратным холодильником в течение 2 часов в уксусном ангидриде (3 мл). При охлаждении выпадал осадок. Осадок отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, образуя соединение 21 (0,103 г, выход = 87%, чистота (LC)>95%).
Пример 4
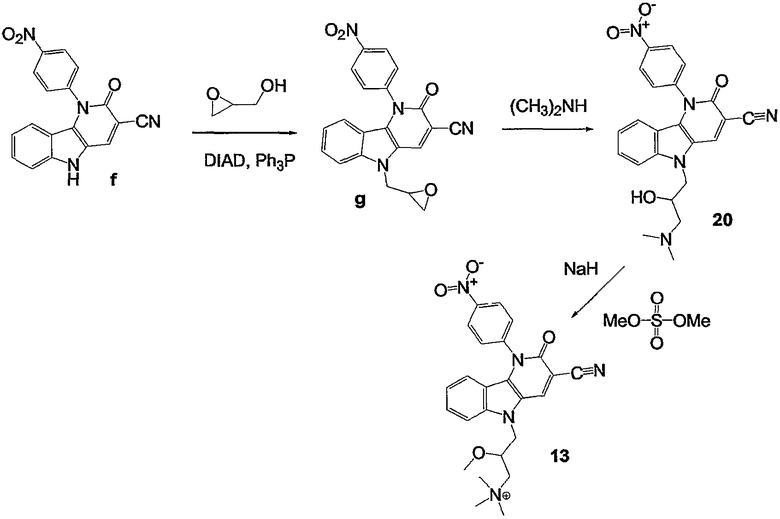
Глицидол (1,5 эквив., 0,673 г, 9,083 ммоль), трифенилфосфин (1,5 эквив., 2,382 г, 9,083 ммоль) и DIAD (1,5 эквив., 1,837 г, 9,083 ммоль) растворяли в ДМФА (20 мл) и перемешивали в течение 1 часа при 0°C в атмосфере азота. Промежуточное соединение f (2,00 г, 6,055 ммоль) добавляли и реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавление воды вызывало выпадение осадка неочищенного промежуточного соединения g. Осадок отделяли фильтрованием, промывали водой и растворяли в этаноле (20 мл). Смесь нагревали при 50°C и охлаждали до комнатной температуры. Осадок отфильтровывали и промывали этанолом и диизопропиловым эфиром для получения эпоксида g (1,867 г, выход = 74,2%, чистота (LC) = 93%).
К перемешенному раствору g (0,200 г, 0,414 ммоль) в ДМФА (3 мл) добавляли раствор диметиламина 40% в воде (10 эквив., 4,14 ммоль, 0,524 мл). Смесь нагревали в течение ночи при 65°C и позволяли охладиться до комнатной температуры, позволяя продукту реакции выпасть в осадок из реакционной смеси. Продукт отфильтровывали, промывали водой, изопропанолом и диизопропиловым эфиром. Перекристаллизация из ДМФА приводила к получению соединения 20 (0,100 г, выход = 56%, чистота (LC) >95%).
К перемешенному раствору соединения 20 (50 мг, 0,120 ммоль) в ДМФА (3 мл) добавляли гидрид натрия (1,2 эквив., 0,144 ммоль, 6 мг суспензии 60% NaH в минеральном масле) и диметилсульфат (10 эквив., 120 ммоль, 0,150 г) и реакционную смесь перемешивали в течение 1 часа при комнатной температуре в атмосфере азота. Добавляли воду и водный слой промывали этилацетатом. Водный слой концентрировали при пониженном давлении и осадок перекристаллизовывали из смеси вода/метанол. Кристаллы отделяли фильтрованием, промывали изопропанолом и диизопропиловым эфиром, получая соединение 13 (0,036 г, выход = 60%, чистота = 89%).
Пример 5
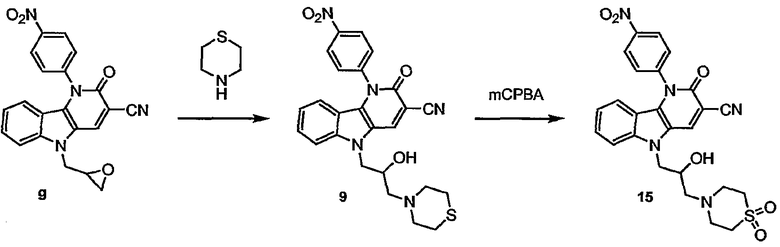
К перемешиваемому раствору соединения g (0,400 г, 1,04 ммоль) в ДМФА (5 мл) добавляли тиоморфолин (5 эквив., 5,18 ммоль, 0,534 г). Смесь нагревали в течение ночи при 65°C и позволяли охладиться при комнатной температуре. Смесь отфильтровывали, промывали водой, изопропанолом и диизопропиловым эфиром. Твердый остаток перекристаллизовывали из ДМФА, отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, получая соединение 9 (0,352 г, выход = 66,7%, чистота (LC) >96%).
К перемешиваемому раствору соединения 9 (0,227 г, 0,464 ммоль) в дихлорметане (4 мл) добавляли 3-хлорпербензойную кислоту (2,2 эквив., 0,176 г, 1,02 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 минут. За этот период времени продукт реакции из раствора выпадал в осадок. Кристаллы отделяли фильтрованием и промывали дихлорметаном и диизопропиловым эфиром, получая соединение 15 (0,208 г, выход = 80%, чистота (LC) = 93%).
Пример 6
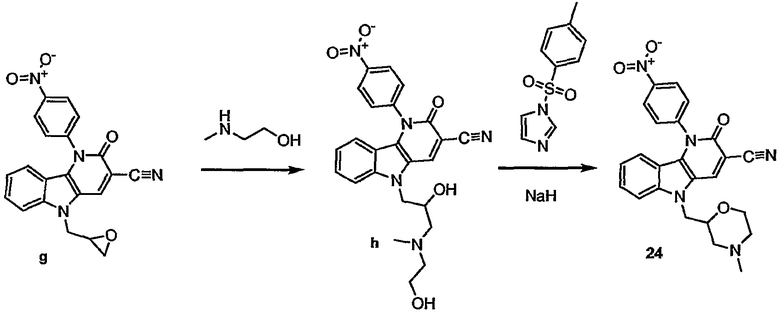
Соединение g (0,300 г, 0,621 ммоль) растворяли в ДМФА (3 мл). 2-метиламиноэтанол (10 эквив., 6,21 ммоль, 0,467 г) добавляли и реакционную смесь нагревали при 65°C в течение ночи. При охлаждении до комнатной температуры, из реакционной смеси выпадал твердый осадок и его отделяли фильтрованием и промывали водой, изопропанолом и диизопропиловым эфиром. Твердый остаток перекристаллизовывали из ДМФА, отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, получая соединение h (0,193 г, выход = 56%, чистота (LC)>83%).
В колбе, снабженной трубкой для сушки CaCl2, соединение h (0,193 г, 0,418 ммоль) растворяли в ТГФ (4 мл) и охлаждали до 0°C. Гидрид натрия (2,5 эквив., 1,05 ммоль, 42 мг суспензии 60% NaH в минеральном масле) добавляли одной порцией и смесь перемешивали при 0°C в течение 20 минут. Добавляли пара-толуолсульфонилимидазол (1,1 эквив., 0,102 г, 0,460 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Выпариванием при пониженном давлении и очисткой неочищенной реакционной смеси с помощью противофазы ВЭЖХ, получали соединение 24 (6 мг, выход = 3%, чистота (LC) >95%).
Пример 7
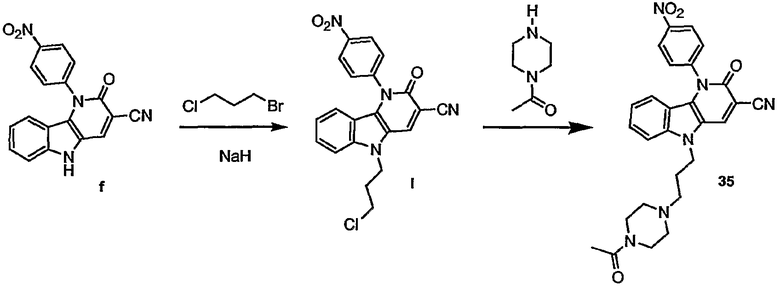
Соединение f (2,0 г, 6,055 ммоль) растворяли в ДМФА (25 мл). Добавляли гидрид натрия (1,2 эквив., 0,290 г суспензии 60% NaH в минеральном масле, 7,266 ммоль) и реакционную смесь нагревали при 100°C в течение 1 часа и позволяли охладиться до комнатной температуры. Добавляли 1-бром-3-хлорпропан (1,5 эквив., 1,430 г, 9,083 ммоль) и смесь перемешивали при комнатной температуре в течение 3 часов. Продукт реакции i выпадал в осадок при добавлении воды. Твердый осадок отделяли фильтрованием и промывали водой, изопропанолом и диизопропиловым эфиром, получая промежуточное соединение i (2,334 г, выход = 95%, чистота = (LC) >95%) в виде темного оранжевого порошка.
Соединение i (0,150 г, 0,369 ммоль) и 1-ацетилпиперазин (3 эквив., 1,11 ммоль, 0,142 г) смешивали в ДМФА (3 мл). Смесь нагревали при 70°C в течение 5 часов. Добавляли вторую порцию 1-ацетилпиперазина (3 эквив., 1,11 ммоль, 0,142 г) и смесь нагревали при 70°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, в воде выпадал осадок, который отфильтровывали и последовательно промывали изопропанолом и диизопропиловым эфиром. Очистка с помощью флэш-хроматографии на силикагеле (элюент дихлорметан/метанол: 9/1) приводила к получению соединения 35 (0,122 г, выход = 63%, чистота (LC) = 94%).
Пример 8
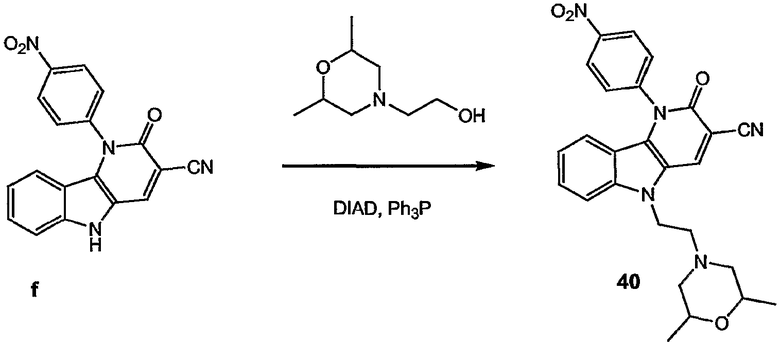
2-(2,6-диметилморфолин-4-ил)этанол (2 эквив., 0,145 г, 0,908 ммоль), трифенилфосфин (2 эквив., 0,238 г, 0,908 ммоль) и DIAD (2 эквив., 0,184 г, 0,908 ммоль) смешивали в ДМФА (4 мл) и перемешивали с помощью мешалки при 0°C в течение 15 минут. Добавляли соединение f (0,150 г, 0,454 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Добавляли воду и осадок отделяли фильтрованием. Осадок смешивали с этанолом и нагревали до 50°C. После охлаждения до комнатной температуры осадок отфильтровывали и промывали этанолом и диизопропиловым эфиром, получая соединение 40 (0,170 г, выход = 79,4%, чистота (LC) >95%).
Пример 9
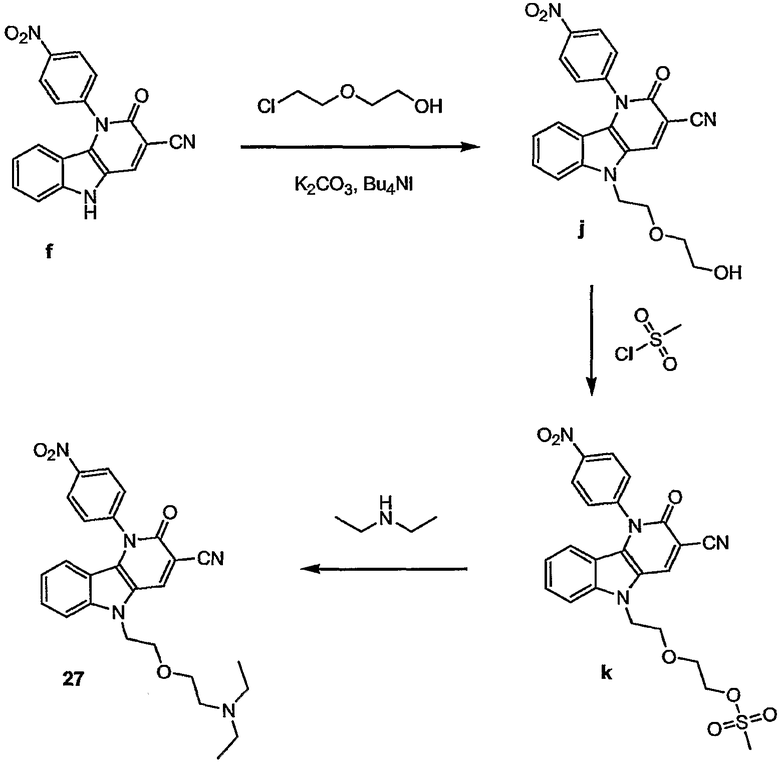
Смесь соединения f (0,500 г, 1,51 ммоль), карбоната калия (1,256 г, 9,06 ммоль, 6 эквив.), 2-(2-хлорэтокси)этанола (1,128 г, 9,06 ммоль, 6 эквив.) и йодида тетрабутиламмония (1,673 г, 3,51 ммоль, 3 эквив.) в ДМФА (20 мл) нагревали в атмосфере азота при 60°C в течение 10 часов. К теплому раствору добавляли воду и осадок отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, получая соединение j (0,460 г, выход = 58,1%, чистота = 83%).
Смесь соединения j (0,460 г, 1,10 ммоль), пиридина (0,434 г, 5,50 ммоль, 5 эквив.) и метансульфонил хлорида (0,377 г, 3,30 ммоль, 3 эквив.) в дихлорметане (10 мл) перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь разбавляли дихлорметаном до получения прозрачного раствора и этот раствор промывали 1 н. раствором соляной кислоты и насыщенным водным раствором
NaHCO3. Органическую фазу выпаривали при пониженном давлении, получая неочищенное промежуточное соединение k (чистота = 83%) и применяя на следующей стадии как таковой.
К раствору неочищенного соединения k (0,181 г, 0,37 ммоль) в ДМФА (15 мл) добавляли диэтиламин (0,266 г, 3,7 ммоль, 10 эквив.) и смесь нагревали в течение 8 часов при 60°C. К смеси добавляли воду, что вызывало выпадение продукта реакции в осадок. Осадок отделяли фильтрованием и промывали изопропанолом и диизопропиловым эфиром. Далее продукт очищали с помощью хроматографии на силикагеле, применяя дихлорметан/метанол (90/10) в качестве элюента, получая соединение 27 (0,030 г, выход = 17% (2 стадии), чистота = 99,5%).
Пример 10
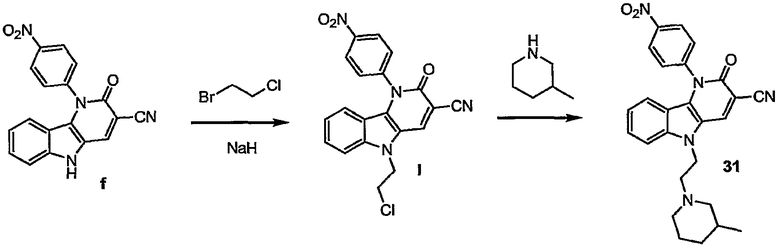
К смеси соединения f (6 ммоль, 2,00 г) в ДМФА (50 мл) добавляли гидрид натрия (2 эквив., 12,1 ммоль, 484 мг 60% NaH в минеральном масле) и смесь нагревали в течение 1 часа до 50°C. Смесь охлаждали до комнатной температуры и добавляли 1-бром-3-хлорэтан (5 эквив., 15 ммоль, 4,343 г). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь, содержащую соединение l (чистота = 85%), применяли на следующей стадии как таковую.
3-метилпиперидин (1,5 эквив., 0,76 ммоль, 0,076 г) добавляли к 5 мл неочищенной реакционной смеси соединения l (0,51 ммоль) и смесь нагревали в течение 5 часов при 70°C. Растворитель удаляли при пониженном давлении, и продукт реакции очищали с помощью препаративной противофазы ВЭЖХ, получая соединение 31 (0,025 г, выход = 9,7%, чистота (LC)>90%).
Пример 11
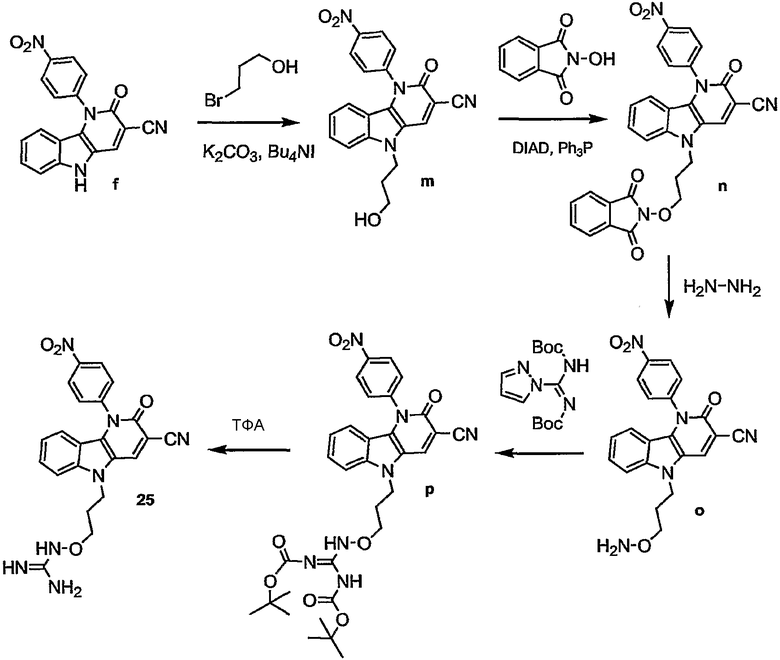
К смеси соединения f (6,06 ммоль, 2,00 г) в сухом ДМФА (20 мл) в атмосфере азота добавляли 3-бром-1-пропанол (2,5 эквив., 15,1 ммоль, 2,10 г), йодид тетрабутиламмония (1 эквив., 6,06 ммоль, 2,24 г) и карбонат калия (2,5 эквив., 15,1 ммоль, 2,09 г). Смесь перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь выпаривали при пониженном давлении до сухого остатка. Остаток смешивали с водой, экстрагировали дихлорметаном и комбинированные органические фракции высушивали (МgSO4) и выпаривали при пониженном давлении до сухого порошка. Порошок промывали этанолом и диизопропиловым эфиром, получая промежуточное соединение m (2,30 г, выход = 97,8%, чистота (LC) = 90,7%).
Смесь промежуточного соединения m (6,0 ммоль, 2,30 г), N-гидроксифталимида (2,00 эквив., 12,1 ммоль, 1,97 г) и трифенилфосфина (2,00 эквив., 12,1 ммоль, 3,17 г) в сухом ДМФА (15 мл) охлаждали до 0°C. При этой температуре по каплям добавляли диизопропилазодикарбоксилат (2,00 эквив., 12,1 ммоль, 2,45 г) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь выпаривали при пониженным давлением до сухого порошка и остаток смешивали с водой. Продукт экстрагировали дихлорметаном и высушивали над МgSO4. После фильтрования и выпаривания при пониженном давлении порошок промывали метанолом и высушивали в вакууме при 50°C, получая соединение n (2,31 г, выход = 71,6%, чистота (LC) = 97%).
К смеси соединения n (0,69 ммоль, 0,37 г) в метаноле (10 мл) добавляли гидразин моногидрат (10 эквив., 6,9 ммоль, 0,345 г). Смесь нагревали с обратным холодильником в течение 3 минут и выпаривали при пониженном давлении до сухого порошка. Добавляли воду, продукт экстрагировали дихлорметаном и высушивали над МgSO4. Фильтрование и выпаривание при пониженном давлении приводило к получению соединения о (270 мг, выход = 97%, чистота (LC) = 91,5%).
К смеси соединения о (0,34 ммоль, 1 мг) в ДМФА (3 мл) в атмосфере азота добавляли трет-бутиловый эфир (трет-бутоксикабонилиминопиразол-1-илметил)карбаминовой кислоты (1,2 эквив., 0,402 ммоль, 125 мг). Смесь перемешивали при комнатной температуре в течение 10 часов. Реакционную смесь смешивали с водой и осадок отфильтровывали. Продукт очищали, применяя колоночную хроматографию (элюент:метанол/дихлорметан 2:98), получая соединение p (147 мг, выход = 68,0%, чистота (LC) = 96%).
К смеси соединения p (0,12 ммоль, 75 мг) в дихлорметане (25 мл) добавляли трифторуксусную кислоту (1 мл). Смесь перемешивали при комнатной температуре в течение 10 часов и растворитель выпаривали при пониженном давлении. Осадок выкристаллизовывали из этанола, получая соединение 25 (13 мг, выход = 25%, чистота (LC) = 93%).
Пример 12
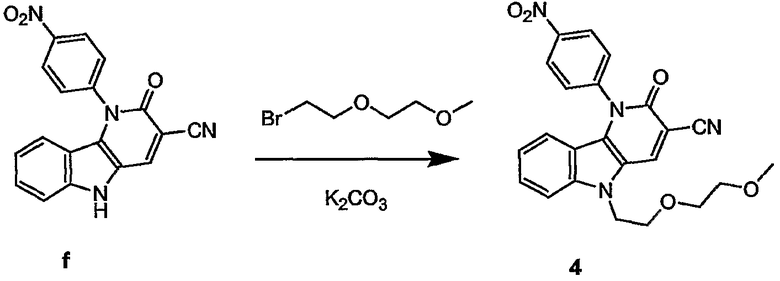
Смесь промежуточного соединения f (105 мг, 0,318 ммоль), 1-бром-2-(2-метоксиэтокси)этана (76 мг, 0,41 ммоль) и K2CO3 (57 мг, 0,41 ммоль) в ДМФА (5 мл) перемешивали при комнатной температуре в течение 48 часов. Реакционную смесь порционно разделяли между водой (20 мл) и этилацетатом (30 мл), высушивали (Na2SO4) и выпаривали. Осадок растирали в порошок в диэтиловом эфире (3 мл) и отфильтровывали. Желтые кристаллы в форме призм промывали диэтиловым эфиром и гексаном, получая целевой продукт 4 (51 мг, выход = 37%).
Пример 13
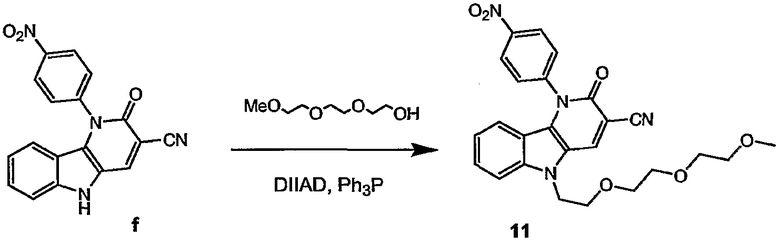
DIAD (0,245 г, 1,21 ммоль) добавляли в атмосфере азота к раствору промежуточного соединения f (200 мг, 0,606 ммоль), трифенилфосфина (318 мг, 1,21 ммоль) и 2-[2-(2-метоксиэтокси)этокси]этанола (240 мкл, 1,21 ммоль) в сухом ДМФА (15 мл). Через 2 часа реакционную смесь порционно разделяли между водой и этилацетатом, высушивали (Na2SO4) и выпаривали. Очистка неочищенного материала с помощью колоночной хроматографии на силикагеле (элюент: 100% ТГФ) приводила к получению целевого продукта 11 (89 мг, выход = 31%) в виде желтого порошка.
Пример 14
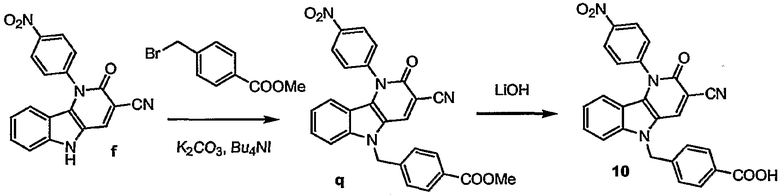
Смесь соединения f (200 мг, 0,606 ммоль), K2CO3 (126 мг, 0,908 ммоль), йодид тетрабутиламмония (300 мг, 0,812 ммоль) и метил-4-(бромметил)бензоата (250 мг, 11,09 ммоль) в ТГФ (15 мл) перемешивали при 65°C в течение 12 часов. Затем растворитель выпаривали и осадок порционно разделяли между этилацетатом и водой, высушивали (Na2SO4) и выпаривали. Осадок растирали в порошок в диэтиловом эфире и отфильтровывали, получая целевой продукт q (260 мг, выход = 89%; чистота (LC) >98%) в виде желтого порошка.
Раствор метил-4-[[3-циано-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1H-пиридо[3,2-b]индол-5-ил]метил]бензоата (q) (260 мг, 0,543 ммоль) и LiOH (170 мг, 7,06 ммоль) в (MeOH/ТГФ/H2О, 5:4:1, 30 мл) перемешивали при комнатной температуре в течение 72 часов. Реакционную смесь порционно разделяли между водой и этилацетатом, уровень pH водного слоя отрегулировали до 2 концентрированной соляной кислотой и экстрагировали этилацетатом, высушивали (Na2SO4) и выпаривали. Очистка с помощью флэш-хроматографии (силикагель, элюент: 100% ТГФ) приводила к получению целевого продукта 10 (20 мг, выход = 7,9%) в виде желтого порошка.
Пример 15
Синтез соединений, в которых X является O

К смеси 3-гидроксибензофурана r (0,0373 моль, 5 г) в толуоле (100 мл) добавляли 4-нитроанилин (1 эквив., 0,0373 моль, 5,149 г) и каталитическое количество п-толуолсульфоновой кислоты. Смесь нагревали с обратным холодильником в течение 2 часов и охлаждали до комнатной температуры. Осадок отфильтровывали и промывали изопропанолом и диизопропиловым эфиром, получая промежуточное соединение s [V. A. Azimov, S. Yu. Ryabova, L. M. Alekseeva и V. G. Granik Chemistry of heterocyclic compounds 2000, 36, 1272-1275] (6,28 г, выход = 66%, чистота (LC) >95%).
К охлажденному льдом ДМФА (20 мл) по каплям добавляли оксихлорид фосфора (3 эквив., 0,074 моль, 11,36 г), поддерживая внутреннюю температуру <10°C. Затем раствор промежуточного соединения s (0,024 моль., 6,10 г) по каплям добавляли в ДМФА (50 мл), поддерживая температуру реакции <10°C. Реакционную смесь перемешивали при 0°C в течение 2 часов. Смесь выливали в воду со льдом (250 мл), нагревали в течение 2 часов при 60°C и затем охлаждали до комнатной температуры. Осадок отделяли фильтрованием, промывали последовательно водой, изопропанолом и диизопропиловым эфиром, получая промежуточное соединение t [V. A. Azimov, S. Yu. Ryabova, L. M Alekseeva и V. G. Granik Chemistry of heterocyclic compounds 2000, 36, 1272-1275] (5,98 г, выход = 86%, чистота (LC) = 95%).
К перемешиваемой смеси промежуточного соединения t (7,036 ммоль, 2,00 г) в изопропаноле (25 мл) добавляли триэтиламин (1,5 эквив., 10,55 ммоль, 1,068 г) и этилцианоацетат (1,2 эквив., 8,44 ммоль, 0,955 г). Смесь нагревали с обратным холодильником в течение 4 часов, охлаждали до комнатной температуры, отфильтровывали и осадок последовательно промывали изопропанолом и диизопропиловым эфиром, получая промежуточное соединение u (2,00 г, выход = 75%, чистота (LC)>95%).
Перемешиваемую суспензию промежуточного соединения u (5,30 ммоль, 2,00 г) в этиленгликоле (30 мл) нагревали с обратным холодильником в течение 1 часа и охлаждали до комнатной температуры. Осадок отделяли фильтрованием и промывали последовательно изопропанолом и диизопропиловым эфиром. Продукт перекристаллизовывали из смеси ДМФА/вода. Осадок отделяли фильтрованием и промывали последовательно изопропанолом и диизопропиловым эфиром, получая соединение 42 (1,065 г, выход = 61%, чистота (LC) >98%). 1H-ЯМР (ДМСО-D6): δ 9,05 (с, 1H), 8,57 (д, J=8,7 Гц, 2H), 7,97 (д, J=8,7 Гц, 2Н), 7,83 (д, J≈8,5 Гц, 1H), 7,62 (т, J≈7,8 Гц, 1H), 7,19 (т, J≈7,7 Гц, 1H), 6,30 (д, J≈8,1 Гц, 1H).
Нижеследующие таблицы представляют список примеров соединений настоящего изобретения, которые получены аналогично соединениям из вышеприведенных схем синтеза.
В нижеследующих таблицах колонка, озаглавленная «rf», представляет список времени удержания, и колонка «(M+H)+» представляет список масс молекулярных ионов.
Время удержания измерили, применяя следующее оборудование: ВЭЖХ-система: Waters Alliance 2790 (насос + автопробоотборник), Waters 996 (фотодиод детектор-преобразователь); колонка: Waters XTerra MS C18 2,5 мкм 50×4,6 мм. Ниже приведены измеренные параметры:
Температура: 30°C
Подвижная фаза: A: 10 мM HCOONH4 + 0,1% HCOOH в H2O
B: 0,1% HCOOH в CH3CN
Градиент: 0 минут: 15% B, 5 минут: 95% B, 7 минут: 95% B
Время выравнивания: 2 минуты
Поток: 1,2 мл/мин
Объем впрыскивания: 3 мкл 1 мг/мл раствора
Молекулярный ион определяли, применяя следующий MS-детектор: Waters LCT; ионизация: электрораспыление в положительном или отрицательном типе.
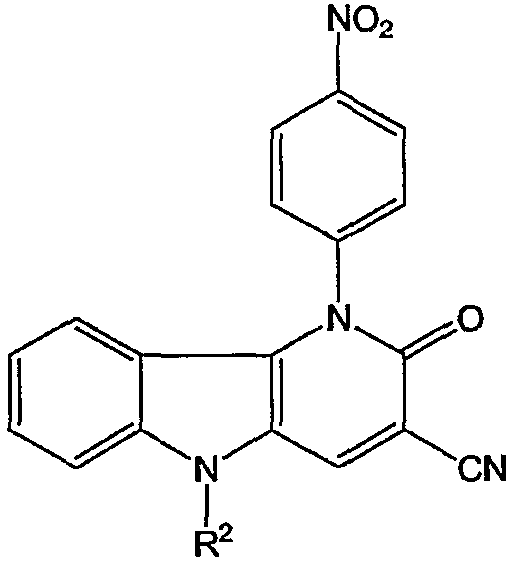

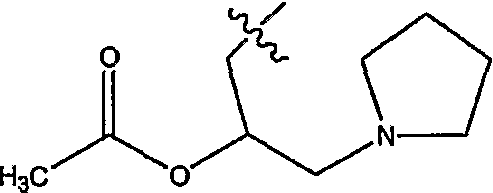
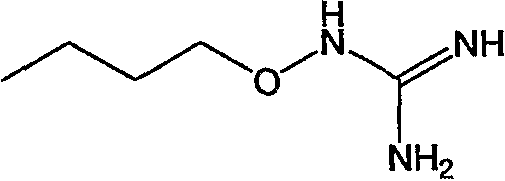
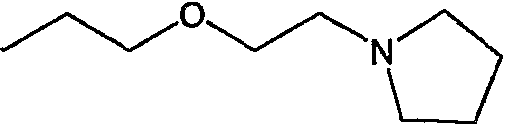
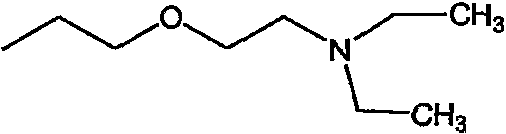
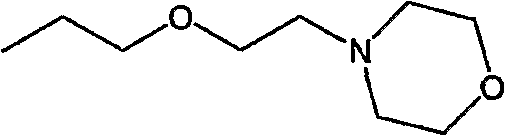
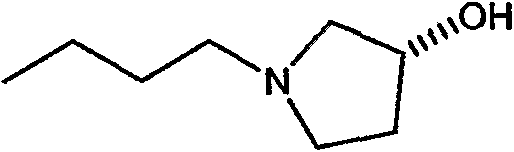
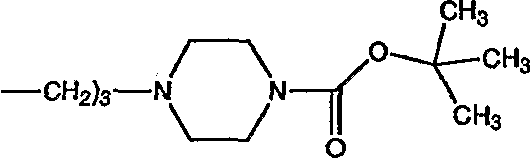
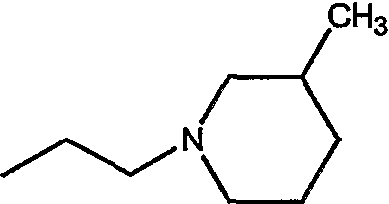
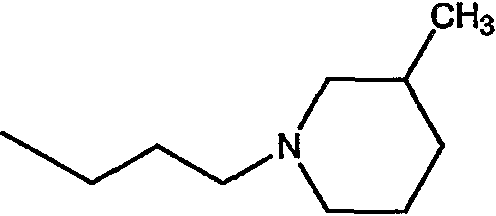

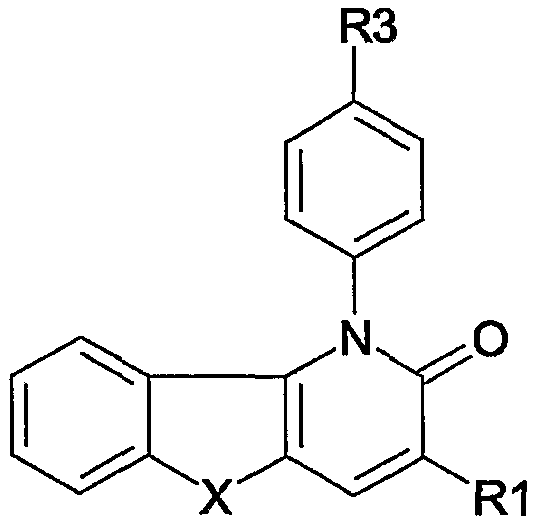
Пример 16: In vitro ингибирование обратной транскриптазы ВИЧ
Испытание производили, применяя набор TRK 1022 (Amersham Life Sciences) в соответствии с инструкциями производителя с небольшими модификациями. Тестируемые соединения разводили постадийно, 1/4 в 100% ДМСО, и затем переводили в среду A (разбавление 1/50; среда A: RPMI 1640 + 10% FetalClone II + Gentamycin 20 мг/л). 25 мкл соединения (в 2% ДМСО в среде A) или 25 мкл 2% ДМСО в среде A разливали по лункам. К каждой лунке добавляли 25,5 мкл матричной смеси (матричная смесь: 5 мкл начальных/шаблонных гранул, 10 мкл буфера, 0,5 мкл меченого вещества (3H-TTP), 5 мкл раствора фермента обратной транскриптазы ВИЧ при конечной активности фермента 15 мЕд на 50 мкл реакции, 5 мкл среды A). Планшет запечатывали, маркировали как радиоактивный и инкубировали в течение 4 часов при 37°C. Затем к каждой ячейке добавляли 100 мкл прерывающего раствора (за исключением R1). Радиоактивность регистрировали на счетчике TopCount.
Соединения 1, 2 и 9 ингибируют обратную транскриптазу ВИЧ in vitro и, следовательно, не требуют преобразования до активного метаболита, чтобы ингибировать обратную транскриптазу.
Пример 17: Цитологический анализ
Соединения настоящего изобретения проверяли на антивирусную активность в цитологическом анализе, который выполняли в соответствии с нижеследующей процедурой.
ВИЧ- или ложно-инфицированные MT4-клетки инкубировали в течение пяти дней в присутствии ингибитора в различных концентрациях. В конце инкубационного периода репликационные силы в контрольных культурах уничтожали все ВИЧ-инфицированные клетки при отсутствии какого-либо ингибитора. Жизнеспособность клетки определяли путем измерения концентрации MTT, желтого, водорастворимого тетразолиевого красителя, который преобразуется в пурпурный, нерастворимый в воде формазан в митохондриях только живых клеток. При растворении изопропанолом полученных в результате кристаллов формазана спектральную поглощательную способность раствора наблюдали при 540 нм. Значения коррелировали непосредственно к числу живых клеток, оставшихся в культуре при завершении пятидневной инкубации. Ингибирующую активность соединения наблюдали на вирус-инфицированных клетках и выражали как EC50 и EC90. Эти значения представляли количество соединения, требуемое для защиты соответственно 50% и 90% клеток от цитопатогенного эффекта вируса. Токсичность соединения измеряли на ложно-инфицированных клетках и выражали как CC50, которое представляет концентрацию соединения, требуемую для ингибирования роста клеток на 50%. Индекс селективности (SI) (соотношение CC50/EC50) является показателем селективности анти-ВИЧ активности ингибитора. Всюду результаты описываются как, например, значения pEC50 или pCC50, результат выражается как отрицательным логарифмом выраженного результата, так и EC50 или CC50 соответственно.
Нижеследующая таблица 3 представляет список значений pEC50, полученных в приведенном тесте для ряда соединений настоящего изобретения.
Пример 18: Лекарственные формы
Капсулы
Активный ингредиент, in casu соединение формулы (I), растворяют в органическом растворителе, таком как этанол, метанол или метиленхлорид, предпочтительно смесь этанола и метиленхлорида. Полимеры, такие как поливинилпирролидон сополимер с винилацетатом (PVP-VA) или гидроксипропилметилцеллюлоза (ГПМЦ), обычно 5 мПа·с, растворяют в органических растворителях, таких как этанол, метанол, метиленхлорид. Предпочтительно растворять полимер в этаноле. Полимер и растворы соединений смешивают и затем высушивали распылением. Соотношение соединение/полимер выбирают из 1/1-1/6. Пределы промежуточного соединения могут быть 1/1,5 и 1/3. Подходящим соотношением может быть 1/6. Затем капсулы заполняют высушенным распылением порошком, твердой дисперсией для назначения. Количество лекарства, загруженного в одну капсулу, находится в интервале от 50 до 100 мг, в зависимости от размера применяемой капсулы.
Таблетки с пленочным покрытием
Получение ядра таблетки
Смесь 100 г соединения формулы (I), 570 г лактозы и 200 г крахмала хорошо перемешивают и после этого увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона в приблизительно 200 мл воды. Влажную порошковую смесь просеивают, высушивают и снова просеивают. Затем добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все хорошо перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая содержит 10 мг активного ингредиента.
Покрытие
К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметане. Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля расплавляют и растворяют в 75 мл дихлорметана. Последний упомянутый раствор добавляют в формовочное устройство и затем добавляют 2,5 г октодеканата магния, 5 г поливинилпирролидона и 30 мл концентрированной придающей цвет суспензии и все гомогенизируют. Ядра таблеток покрываются в глазировочном аппарате полученной таким образом смесью.
| название | год | авторы | номер документа |
|---|---|---|---|
| 6,7,8,9-ЗАМЕЩЕННЫЕ 1-ФЕНИЛ-1,5-ДИГИДРОПИРИДО (3,2-b) ИНДОЛ-2-ОНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ АНТИИНФЕКЦИОННЫХ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2005 |
|
RU2377243C2 |
| 1,5,6-ЗАМЕЩЕННЫЕ 2-ОКСО-3-ЦИАНО-1,6А-ДИАЗАТЕТРАГИДРОФЛУОРАНТЕНЫ | 2006 |
|
RU2389730C2 |
| 5-АМИДО-ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2007 |
|
RU2480464C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА/ПИПЕРАЗИНА | 2008 |
|
RU2478628C2 |
| ВИЧ-ИНГИБИРУЮЩИЕ 5-КАРБО- ИЛИ ГЕТЕРОЦИКЛИЧЕСКИЕ ЗАМЕЩЕННЫЕ ПИРИМИДИНЫ | 2005 |
|
RU2403244C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2403254C2 |
| N-[4-(ГЕТЕРОАРИЛМЕТИЛ)ФЕНИЛ]-ГЕТЕРОАРИЛАМИНЫ | 1997 |
|
RU2190611C2 |
| ПРОИЗВОДНЫЕ 1, 2, 4-ТРИАЗИН-6-ОНА, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2401833C2 |
| 5-ГЕТЕРОЦИКЛИЛПИРИМИДИНЫ, ИНГИБИРУЮЩИЕ ВИЧ | 2005 |
|
RU2405778C2 |
| ПИРИДО [2,3-d] ПИРИМИДИНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ HCV, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2444522C2 |
Изобретение относится к новым соединениям формулы (I).
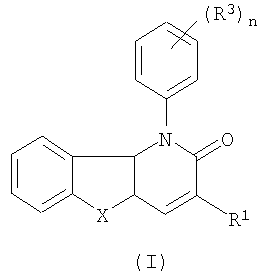
к его солям, в котором Х является двухвалентным радикалом NR2, О; R1 является цианогруппой; n равен 1; R2 является: i) С1-10алкилом, замещенным арилом, где указанный арил замещен радикалом -COOR4; или R2 является ii) С1-10алкилом, замещенным радикалом, выбранным из -O-NR5a-C(=NR5b)-
NR5cR5d, -NR7R8, радикалом
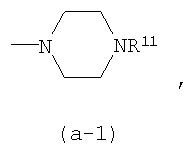
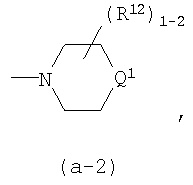
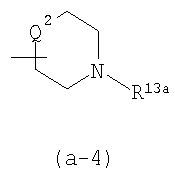
в котором каждый Q1 независимо является простой связью, -СН2-; каждый О2 независимо является О; каждый R4 независимо является водородом; каждый R5a, R5b, R5c, R5d независимо является водородом; R7 является С1-4алкилом; R8 является арилС1-4алкилом; R11 является арилом, С1-4алкилкарбонилом, С1-4алкилоксикарбонилом, гидроксиС1-4алкилом, Гет2; каждый R12 независимо является гидрокси, С1-4алкилом;
R13a является С1-4алкилом; каждый R13b является С1-4алкилом; или R2 является iii) радикалом формулы

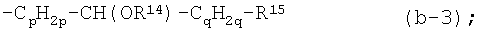
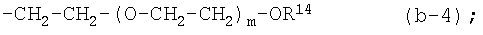
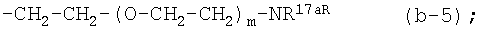
где в радикале (b-3) один из атомов водорода в -СрН2р- и один из атомов водорода в -CH(OR14)-CqH2q-, которые не являются частью R14, могут быть заменены простой связью или С1-4алкандиильной группой; р равен 1, 2 или 3; q равен 0, 1, 2 или 3; каждый m независимо равен 1-10; каждый R14 независимо является водородом, С1-4алкилом, С1-4алкилкарбонилом; R15 является заместителем, выбранным из группы, состоящей из NR16aR16, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(С1-4алкил)-пиперазинила,
4-(С1-4алкилкарбонил)-пиперазинила, 4-(С1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1,1-диоксо-тиоморфолинила; R16a и R16b, независимо друг от друга, являются водородом, C1-6алкилом или C1-6алкилом, замещенным арилом; R17a и R17b, независимо друг от друга, являются водородом, С1-4алкилом; или R17a и R17b, вместе с атомом азота, к которому они присоединены, образуют пирролидинильное, морфолинильное; каждый
R18 независимо является арилС1-4алкилом; R19 является водородом; R3 является нитрогруппой; арил является фенилом; Гет2 является пиридилом. Изобретение также относится к фармацевтической композиции, к способу получения соединения по любому из пп.1-4, а также к соединениям формулы (IV-a), (IV-b), (V). Технический результат - получение новых биологически активных соединений, обладающих способностью к ингибированию ВИЧ. 6 н. и 5 з.п. ф-лы, 4 табл.
1. Соединение формулы (I)
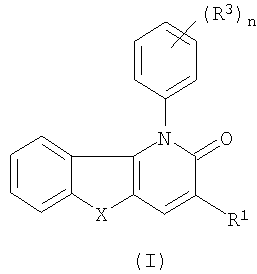
его соль, в котором
Х является двухвалентным радикалом NR2, О;
R1 является цианогруппой;
n равен 1;
R2 является:
i) C1-10алкилом, замещенным арилом, где указанный арил замещен радикалом -COOR4; или
R2 является
ii) C1-10алкилом, замещенным радикалом, выбранным из -O-NR5a-C(=NR5b)-NR5cR5d, -NR7R8, радикалом
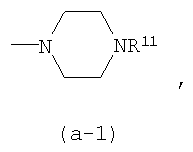
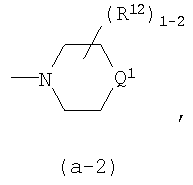
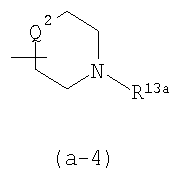
в котором каждый Q1 независимо является простой связью, -СН2-;
каждый Q2 независимо является О;
каждый R4 независимо является водородом;
каждый R5a, R5b, R5c, R5d независимо является водородом;
R7 является С1-4алкилом;
R8 является арилС1-4алкилом;
R11 является арилом, С1-4алкилкарбонилом, С1-4алкилоксикарбонилом, гидроксиС1-4алкилом, Гет2;
каждый R12 независимо является гидрокси, С1-4алкилом;
R13a является С1-4алкилом;
каждый R13b является С1-4алкилом; или
R2 является
iii) радикалом формулы:

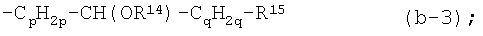
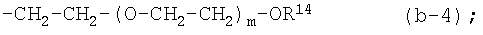
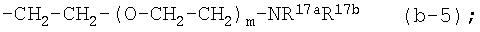
где в радикале (b-3) один из атомов водорода в -СрН2р- и один из атомов водорода в -CH(OR14)-CqH2q-, которые не являются частью R14, могут быть заменены простой связью или С1-4алкандиильной группой;
р равен 1, 2 или 3;
q равен 0, 1, 2 или 3;
каждый m независимо равен 1-10;
каждый R14 независимо является водородом, С1-4алкилом, C1-4алкилкарбонилом;
R15 является заместителем, выбранным из группы, состоящей из NR16aR16, пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, 4-(C1-4алкил)-пиперазинила, 4-(С1-4алкилкарбонил)-пиперазинила, 4-(C1-4алкилоксикарбонил)-пиперазинила, морфолинила, тиоморфолинила, 1,1-диоксо-тиоморфолинила;
R16a и R16b, независимо друг от друга, являются водородом, C1-6алкилом или C1-6алкилом, замещенным арилом;
R17a и R17b, независимо друг от друга, являются водородом, С1-4алкилом;
или R17a и R17b, вместе с атомом азота, к которому они присоединены, образуют пирролидинильное, морфолинильное;
каждый R18 независимо является арилС1-4алкилом;
R19 является водородом;
R3 является нитрогруппой;
арил является фенилом;
Гет2 является пиридилом.
2. Соединение по п.1, в котором (3-а) Х является О;
(4-a-1) X является NR2, в котором R2 является C1-10алкилом, замещенным арилом, где указанный арил замещен радикалом -COOR4;
(4-b-1) X является NR2, в котором R2 является С1-10алкилом, замещенным радикалом, выбранным из -O-NR5a-C(=NR5b)-NR5cR5d, -NR7R8, радикалов (а-1), (а-2) и (а-4);
(4-c-1) Х является NR2, в котором R2 является радикалом (b-1), где R19 является водородом и где Q1 в радикале (b-1) является простой связью или -СН2-;
(4-е) Х является NR2, в котором R2 является радикалом (b-3), где q равен 1, 2 или 3;
(4-f) X является NR2, в котором R2 является радикалом (b-4), где m равен 1-6; или
(4-g-1) X является NR2, в котором R2 является радикалом (b-5), где m равен 1-5.
3. Соединение по пп.1 и 2, в котором
(4-е) Х является NR2, в котором R2 является радикалом (b-3), где q равен 1, 2 или 3.
4. Соединение по пп.1 и 2, в котором
(4-е-5) Х является NR2, в котором R2 является радикалом (b-3), где R15 является NR16aR16b, пирролидинилом, пиперидинилом, 4-морфолинилом.
5. Соединение по п.1, в котором соединение является:
1-(4-нитрофенил)-2-оксо-1,2-дигидробензо[4,5]фуро[3,2-b]пиридин-3-карбонитрилом,
5-(2-гидрокси-3-пиперидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрилом,
5-(3-диэтиламино-2-гидроксипропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрилом,
5-[2-(2-метоксиэтокси)этил]-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрилом, и предпочтительно
5-(2-гидрокси-3-пирролидин-1-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрилом,
и предпочтительно
5-(2-гидрокси-3-морфолин-4-илпропил)-1-(4-нитрофенил)-2-оксо-2,5-дигидро-1Н-пиридо[3,2-b]индол-3-карбонитрилом.
6. Соединение формулы (I), такое как определено в п.1, для применения в качестве лекарственного средства, способного к ингибированию ВИЧ.
7. Фармацевтическая композиция, обладающая способностью к ингибированию ВИЧ, содержащая эффективное количество, по меньшей мере, одного соединения формулы (I), такого как определено в любом из пп.1-5, и фармацевтически приемлемый наполнитель.
8. Способ получения соединения по любому из пп.1-4, отличающийся тем, что промежуточное соединение (II) N-алкилируют, получая соединение формулы (I-b):
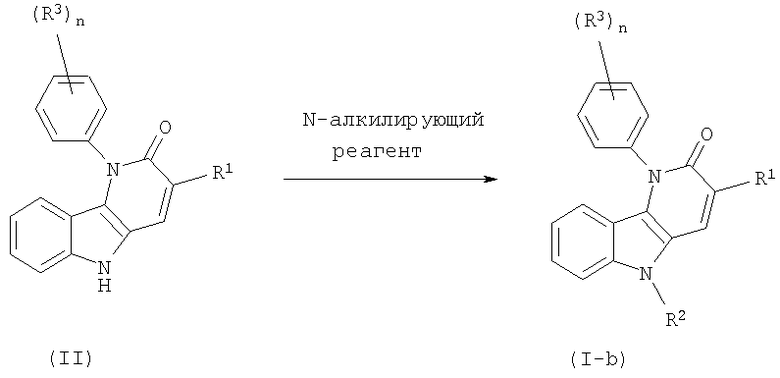
9. Соединение формулы
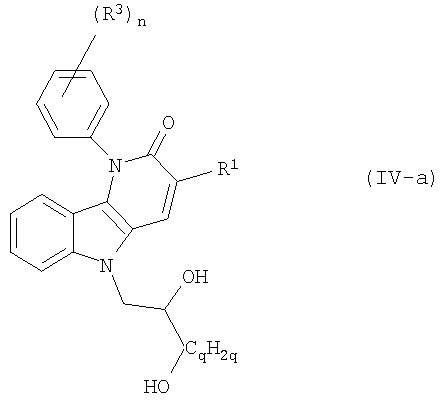
в которой q, R1, R3 и n являются такими, как определено в любом из пп.1-4, или его соль.
10. Соединение формулы
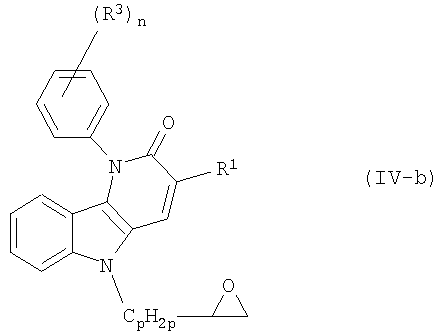
в котором р, R1, R3 и n являются такими, как определено в любом из пп.1-4, или его соль.
11. Соединение формулы
в котором R1, R3 и n являются такими, как определено в любом из пп.1-4, или его соль.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ПРОИЗВОДНЫЕ 1Н-ПИРИДО[3,4-В]ИНДОЛ-4-КАРБОКСАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1997 |
|
RU2180904C2 |
Авторы
Даты
2009-07-27—Публикация
2005-05-17—Подача