Изобретение касается N-[4-гетероарилметил)фенил] гетероариламинов, их N-оксидов и солей присоединения; оно далее касается способов их получения и композиций, содержащих их. Соединения настоящего изобретения являются мощными ингибиторами метаболизма ретиноевой кислоты и, следовательно, также описано их применение в качестве лекарственных средств.
ЕР-А-0260744, опубликованный 23 марта 1988 г., раскрывает (1Н-имидазол-1-илметил)-замещенные бензимидазолы в качестве ингибиторов образования андрогена из C21-стероидов, в качестве ингибиторов биосинтеза тромбоксана A2, которые также обладают способностью увеличивать экскрецию мочевой кислоты. ЕР-А-0371559, опубликованный 6 июня 1990 г., раскрывает указанные бензимидазолы и аналогичные бензотриазолы как мощные супрессоры очищения плазмы от ретиноевой кислоты, вводимой эндогенно или экзогенно.
Ретиноевая кислота (RA) является ключевой молекулой в регуляции роста и дифференциации эпителиальной ткани. Однако RA очень быстро метаболизируется с помощью ряда энзиматических реакций, что приводит к ее дезактивации. Ингибирование метаболизма RA приводит к повышенному уровню RA в плазме и ткани. Поэтому соединения с таким ингибирующим действием, называемым также активностью, имитирующей ретиноиды, имеют терапевтический и/или профилактический потенциал в области дерматологии и онкологии.
Новые соединения настоящего изобретения обладают активностью, имитирующей ретиноиды и, более того, имеют слабое или не имеют эндокринологическое побочное действие.
Настоящее изобретение относится к соединениям формулы (I)
их N-оксидам, фармацевтически приемлемым солям присоединения и стереохимически изомерным формам, в которых
R1 представляет собой водород, гидроксильную группу, C1-6алкил или арил;
R2 представляет собой водород; С1-12алкил; С3-7циклоалкил; С2-8алкенил; арил; пирролидинил, необязательно замещенный С1-4алкилом или С1-4алкилоксикарбонилом, или С1-12алкил, замещенный одним или двумя заместителями, выбранными из С3-7-циклоалкила, гидроксильной группы, С1-4алкилокси, цианогруппы, аминогруппы, моно- и ди(С1-4алкил)аминогруппы, моно- и ди(арил)аминогруппы, арилС1-4алкиламиногруппы, (С1-4алкил)(арилС1-4алкил)аминогруппы, пирролидинила, пиперидинила, пиперазинила, необязательно замещенного С1-4алкилом, морфолинила, пергидроазепинила, карбоксила, C1-4алкоксикарбонила, аминокарбонила, моно- и ди(С1-4алкил) аминокарбонила, арила, арилоксигруппы и арилтиогруппы;
R3 представляет собой водород, C1-6алкил, арил или C1-6алкил, замещенный арилом;
Нet представляет собой ненасыщенный гетероцикл, выбранный из имидазолила, триазолила, тетразолила и пиридинила; каждый из указанных гетероциклов может быть необязательно замещен аминогруппой, меркаптогруппой, C1-6алкилом, C1-6алкилтиогруппой или арилом;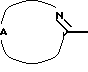 представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из пиридинила, пиридазинила, пиримидинила, пиразинила, хинолинила, изохинолинила, пуринила, фталазинила, циннолинила, хиназолинила и хиноксалинила; каждый из указанных моно- или бициклических гетероциклов может быть необязательно замещен одним, двумя или тремя заместителями, выбранными из гидроксильной группы, галогена, нитрогруппы, аминогруппы, C1-6алкила, гидроксиС1-6алкила, галогенС1-6алкила, C1-6алкилокси, C1-6алкилтиогруппы, формила, карбоксила, моно- и ди(С1-6алкил)аминогруппы, C1-6алкилоксикарбонила или арила, или
представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из пиридинила, пиридазинила, пиримидинила, пиразинила, хинолинила, изохинолинила, пуринила, фталазинила, циннолинила, хиназолинила и хиноксалинила; каждый из указанных моно- или бициклических гетероциклов может быть необязательно замещен одним, двумя или тремя заместителями, выбранными из гидроксильной группы, галогена, нитрогруппы, аминогруппы, C1-6алкила, гидроксиС1-6алкила, галогенС1-6алкила, C1-6алкилокси, C1-6алкилтиогруппы, формила, карбоксила, моно- и ди(С1-6алкил)аминогруппы, C1-6алкилоксикарбонила или арила, или представляет собой радикал формулы
представляет собой радикал формулы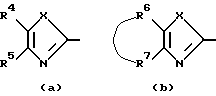
в которой каждый Х независимо представляет собой NR8, О, S, S(=O) или S(=O)2, в котором R8 является водородом, C1-6алкилом, арилом или арилС1-6алкилом;
R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, галоген, цианогруппу, нитрогруппу, аминогруппу, C1-6алкил, гидроксиС1-6алкил, галогенС1-6алкил, C1-6алкилокси, формил, карбоксил, моно- или ди(C1-6алкил)аминогруппу, C1-6алкилоксикарбонил или арил;
-R6-R7 - представляют собой бивалентный радикал формулы
-CR9=CR9-CR9=CR9- (b-1);
-N=CR9-CR9=CR9- (b-2);
-CR9=N-CR9=CR9- (b-3).
-CR9=CR9-N=СR9- (b-4);
-CR9=CR9-CR9=N- (b-5);
-CR9=N-N=CR9- (b-6);
-CR9=N-CR9=N- (b-7);
-CR9=CR9-N=N- (b-8);
-N=N-CR9=CR9- (b-9);
-N=CR9-N=CR9- (b-10);
-N=CR9-CR9=N- (b-11);
-CR9=N-N=N- (b-l2);
-N=CR9-N=N- (b-13);
-N=N-CR9=N- (b-14) или
-N=N-N=CR9- (b-15),
в которой каждый R9 независимо представляет собой водород, гидроксильную группу, галоген, нитрогруппу, аминогруппу, C1-6алкил, гидроксиС1-6алкил, галогенС1-6алкил, C1-6алкилокси, формил, карбоксил, моно- или ди(C1-6алкил)аминогруппу, C1-6-алкилоксикарбонил или арил, и
арил представляет собой фенил или фенил, замещенный одним, двумя или тремя заместителями, выбранными из гидроксильной группы, галогена, цианогруппы, аминогруппы, моно- или ди(C1-6алкил)аминогруппы, C1-6алкила, галогенС1-6алкила, гидроксиС1-6алкила, C1-6алкилокси, формила, карбоксила и C1-6-алкилкарбонила, или два соседних атома углерода указанного фенила могут быть замещены одним бивалентным радикалом, имеющим формулу С1-12алкандиил или галогенС1-12алкандиил.
Как использовано в предшествующих определениях и ниже, галоген является общим обозначением для фтора, хлора, брома и иода; С3-7циклоалкил является общим обозначением для циклопропила, циклобутила, циклопентила, циклогексила и циклогептила; С2-8алкенил определяет углеводородные радикалы с прямой и разветвленной цепью, содержащие одну двойную связь и имеющие от 2 до 8 атомов углерода, такие как, например, этенил, 1-пропенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил, 3-гептенил, 2-октенил и подобные; C1-4алкил определяет насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил, 2,2-диметилэтил и подобные; C1-6алкил включает С1-4алкил и высшие его гомологи, имеющие 5 или 6 атомов углерода, такие как, например, пентил, 2-метилбутил, гексил, 2-метилпентил и подобные; С1-12алкил включает C1-6алкил и высшие его гомологи, имеющие от 7 до 12 атомов углерода, такие как, например, гептил, октил, нонил, децил, ундецил, додецил, 2-метилгексил, 3-этилоктил и подобные; С1-12алкандиил обозначает бивалентные насыщенные углеводородные радикалы с прямой и разветвленной цепью, имеющие от 1 до 12 атомов углерода, такие как, например, 1,1-метандиил, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил, 1,2-пропандиил, 2,3-бутандиил, 1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил, 1,10-декандиил, 1,11-ундекандиил, 1,12-додекандиил, 1,1,4,4-тетраметилбутан-1,4-диил и подобные; галогенС1-6алкил обозначает полигалогензамещенный C1-6алкил, конкретно C1-6алкил, замещенный 1 - 6 атомами галогена, более конкретно дифтор- или трифторметил; галоген-С1-12алкандиил обозначает полигалогензамещенный С1-12алкандиил, конкретно С1-12алкандиил, замещенный 1 - 12 атомами галогена; триазолил включает 1,2,4-триазолил и 1,3,4-триазолил; тетразолил включает 1H-тетразолил и 2Н-тетразолил.
Ненасыщенная гетероарильная группа, обозначенная как Het, может быть присоединена к остальной части молекулы, представленной формулой (I), через любой из углеродов или гетероатомов кольца, как желательно. Так, например, если гетероарильная группа является имидазолилом, она может быть 1-имидазолилом, 2-имидазолилом, 4-имидазолилом и 5-имидазолилом, если она является триазолилом, она может быть 1,2,4-триазол-1-илом, 1,2,4-триазол-3-илом, 1,2,4-триазол-5-илом, 1,3,4-триазол-1-илом и 1,3,4-триазол-2-илом.
Фармацевтически приемлемые соли присоединения, указанные выше, включают терапевтически активные нетоксичные основные и кислотные формы соли присоединения, которые могут образовывать соединение формулы (I). Кислотная форма соли присоединения соединения формулы (I), которое в свободном состоянии является основанием, может быть получена обработкой указанной основной формы соответствующей кислотой, такой как неорганическая кислота, например галогенводородной кислотой, например соляной или бромоводородной, серной, азотной, фосфорной и тому подобными кислотами, или органической кислотой, такой как, например, уксусная, гидроксиуксусная, пропановая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, п-аминосалициловая, памоевая, салициловая и подобными кислотами.
Соединения формулы (I), содержащие кислые протоны, могут быть превращены в их терапевтически активные нетоксичные основания, т.е. металлические или аминные формы соли присоединения, обработкой соответствующими органическими или неорганическими основаниями. Соответствующие основные солевые формы включают, например, аммониевые соли, соли щелочных и щелочноземельных металлов, т.е. соли лития, натрия, калия, магния, кальция и тому подобное, соли с органическими основаниями, например соли с бензатином, N-метил-D-глюкамином, гидрабамином, и с аминокислотами, такими как, например, аргинин, лизин и тому подобные.
Наоборот, указанные солевые формы могут быть превращены в свободные формы обработкой соответствующим основанием или кислотой.
Термин "соли присоединения", как он используется выше, также включает сольваты, которые способны образовывать соединения формулы (I), также как и их соли. Такими сольватами являются, например, гидраты, алкоголяты и тому подобное.
Имеется в виду, что N-оксидные формы соединений формулы (I) включают те соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида.
Термин "стереохимически изомерные формы", как он использован ранее и далее, включает все возможные изомерные формы, в которых могут существовать соединения формулы (I). Если не упомянуто или указано иначе, химическое название соединения обозначает смесь, в частности рацемическую смесь, всех возможных стереохимически изомерных форм, причем указанная смесь содержит все диастереомеры и энантиомеры основной структуры молекулы. Имеется в виду что, стереохимически изомерные формы соединений формулы (I) и смеси таких форм охвачены формулой (I).
В частности, соединения формулы (I) и некоторые из промежуточных соединений имеют, по меньшей мере, один стереогенный центр в своей структуре. Стереогенный центр может быть как R-, так и S-конфигурации, указанные обозначения R и S использованы в соответствии с правилами, описанными в Pure Appl. Chem., 1976, 45, 11-30.
Некоторые из соединений формулы (I) могут также существовать в таутомерных формах. Хотя такие формы ясно не указаны в формуле выше, подразумевается, что они входят в объем настоящего изобретения. В частности, соединения формулы (I), в которых R3 является водородом, могут существовать в соответствующих таутомерных формах.
Где бы далее ни использовался термин "соединение формулы (I)", подразумевается, что он включает также N-оксиды, фармацевтически приемлемые соли присоединения и все стереоизомерные формы.
Отдельная группа соединений включает соединения формулы (I), в которых
R1 представляет собой водород, С1-6алкил или арил;
R2 представляет собой водород, С1-12алкил; С3-7циклоалкил; С2-8алкенил; арил или С1-12алкил, замещенный одним или двумя заместителями, выбранными из С3-7циклоалкила, гидроксильной группы, С1-4алкилокси, цианогруппы, аминогруппы, моно- и ди(С1-4алкил)аминогруппы, моно- и ди(арил)аминогруппы, арил-С1-4алкиламиногруппы, (С1-4алкил)(арилС1-4алкил)аминогруппы, пирролидинила, пиперидинила, пиперазинила, морфолинила, пергидроазепинила, карбоксила, С1-4алкилоксикарбонила, аминокарбонила, моно- и ди(С1-4алкил)аминокарбонила, арила, арилоксигруппы и арилтиогруппы;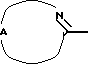 представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из 2-пиридинила, 3-пиридазинила, 2-пиримидинила, 4-пиримидинила, 2-пиразинила, 2-хинолинила, 1-изохинолинила, 3-изохинолинила, 1-фталазинила, 3-циннолинила, 2-хиназолинила, 4-хиназолинила и 2-хиноксалинила, каждый из указанных ненасыщенных моно- или бициклических гетероциклов может быть необязательно замещен одним, двумя или тремя заместителями, выбранными из гидроксильной группы, галогена, нитрогруппы, аминогруппы, C1-6алкила, гидроксиС1-6алкила, галогенС1-6алкила, C1-6алкилокси, формила, карбоксила, моно- или ди(C1-6алкил)аминогруппы, C1-6алкилоксикарбонила или арила, или
представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из 2-пиридинила, 3-пиридазинила, 2-пиримидинила, 4-пиримидинила, 2-пиразинила, 2-хинолинила, 1-изохинолинила, 3-изохинолинила, 1-фталазинила, 3-циннолинила, 2-хиназолинила, 4-хиназолинила и 2-хиноксалинила, каждый из указанных ненасыщенных моно- или бициклических гетероциклов может быть необязательно замещен одним, двумя или тремя заместителями, выбранными из гидроксильной группы, галогена, нитрогруппы, аминогруппы, C1-6алкила, гидроксиС1-6алкила, галогенС1-6алкила, C1-6алкилокси, формила, карбоксила, моно- или ди(C1-6алкил)аминогруппы, C1-6алкилоксикарбонила или арила, или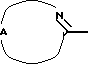 представляет собой радикал формулы (а) или (b), в которой R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, галоген, нитрогруппу, аминогруппу, C1-6алкил, гидроксиС1-6алкил, галогенС1-6алкил, C1-6алкилокси, формил, карбоксил, моно- или ди(C1-6алкил)аминогруппу, C1-6алкилоксикарбонил или арил.
представляет собой радикал формулы (а) или (b), в которой R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, галоген, нитрогруппу, аминогруппу, C1-6алкил, гидроксиС1-6алкил, галогенС1-6алкил, C1-6алкилокси, формил, карбоксил, моно- или ди(C1-6алкил)аминогруппу, C1-6алкилоксикарбонил или арил.
Группа преимущественных соединений включает те соединения формулы (I), в которых
R1 представляет собой водород, гидроксильную группу, C1-6алкил;
R2 представляет собой водород, С1-12алкил, С3-7циклоалкил, пирролидинил, необязательно замещенный С1-4алкилом или С1-4алкилоксикарбонилом, арил или C1-12алкил, замещенный одним или двумя заместителями, выбранными из гидроксильной группы, C1-4алкилокси, моно- и ди(С1-4алкил)аминогруппы, (С1-4алкил)(арилС1-4алкил)аминогруппы, С1-4алкилоксикарбонила, морфолинила, пиперидинила, пиперазинила, необязательно замещенного С1-4алкилом, и арилоксигруппы;
R3 представляет собой водород, C1-6алкил;
Het представляет собой имидазолил, необязательно замещенный C1-6алкилом; пиридинил или триазолил; представляет собой 2-пиридинил, необязательно замещенный гидроксиС1-6алкилом, формилом или C1-6алкилоксикарбонилом; 2-хиноксалинил; 1-изохинолинил; 2-хинолинил; 3-пиридазинил, необязательно замещенный C1-6алкилом; пуринил; 2-пиразинил; 1-фталазинил; 4-хиназолинил, необязательно замещенный арилом; 2-пиримидинил; 4-пиримидинил, необязательно замещенный C1-6алкилтиогруппой, или
представляет собой 2-пиридинил, необязательно замещенный гидроксиС1-6алкилом, формилом или C1-6алкилоксикарбонилом; 2-хиноксалинил; 1-изохинолинил; 2-хинолинил; 3-пиридазинил, необязательно замещенный C1-6алкилом; пуринил; 2-пиразинил; 1-фталазинил; 4-хиназолинил, необязательно замещенный арилом; 2-пиримидинил; 4-пиримидинил, необязательно замещенный C1-6алкилтиогруппой, или представляет собой радикал формулы (а) или (b), в которой
представляет собой радикал формулы (а) или (b), в которой
Х представляет собой NH, О или S;
R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, нитрогруппу, цианогруппу, аминогруппу, C1-6алкил или арил;
-R6-R7- представляют собой бивалентный радикал формулы (b-1), (b-2) или (b-10), в которой каждый R9 независимо представляет собой водород, C1-6алкил, гидроксильную группу, галоген, аминогруппу, галогенС1-6алкил, C1-6алкилоксигруппу.
Особый интерес представляют соединения формулы (I), в которых Het является имидазолилом или триазолилом, необязательно замещенным, в частности 1-имидазолилом, необязательно замещенным C1-6алкилом или арилом, 2-имидазолилом, необязательно замещенным C1-6алкилом, 5-имидазолилом, необязательно замещенным C1-6алкилом, 1,3,4-триазол-1-илом и 1,2,4-триазол-1-илом.
Также особый интерес представляют соединения формулы (I), в которых  представляет собой радикал формулы (b), особенно те, в которых
представляет собой радикал формулы (b), особенно те, в которых
Х представляет собой О или S и
-R6-R7- представляют собой бивалентный радикал формулы (b-1).
Другими соединениями, представляющими особый интерес, являются соединения формулы (I), в которых R2 представляет собой С1-12алкил; С3-7циклоалкил; арил или С1-12алкил, замещенный моно- и ди(С1-4алкил)аминогруппой, С1-4алкилоксикарбонилом или арилоксигруппой.
Заслуживающими особого внимания являются соединения, представляющие особый интерес, в которых Het является 1-имидазолилом, необязательно замещенным C1-6алкилом или арилом; 2-имидазолилом, необязательно замещенным C1-6алкилом; 5-имидазолилом, необязательно замещенным C1-6алкилом; 1,3,4-триазол-1-илом и 1,2,4-триазол-1-илом;
R2 представляет собой С1-12алкил; С3-7циклоалкил; арил или С1-12алкил, замещенный моно- или ди(С1-4алкил)аминогруппой, и представляет собой радикал формулы
представляет собой радикал формулы 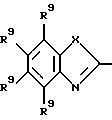
в которой Х представляет собой О или S.
Предпочтительными соединениями являются соединения формулы (I), в которых R1 является водородом и R2 является С3-7-циклоалкилом или C1-6алкилом, необязательно замещенным ди(C1-6алкил)аминогруппой.
Наиболее предпочтительными являются соединения
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил]фенил]-2-бензотиазоламин;
N-[4-[2-этил-1-(1H-1,2,4-триазол-1-ил)бутил]фенил]-2-бензоксазоламин;
N-[4-[2-этил-1-(1Н-1,2,4,-триазол-1-ил)бутил]фенил]-2-бензотиазоламин;
N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)пропил] фенил] -2-бензотиазоламин;
N-[4-[2-(диметиламино)-1-(1Н-1,2,4-триазол-1-ил)пропил] фенил] -2-бензотиазоламин;
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил]фенил]-2-бензоксазоламин;
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил] фенил] -6-метокси-2-бензотиазоламин;
N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)-2-метилпропил] фенил] -2-бензотиазоламин;
N-[4-[2-(диметиламино)-2-метил-1-(1Н-1,2,4-триазол-1-ил)пропил] фенил]-2-бензотиазоламин;
N-[4-[циклогексил(1Н-имидазол-1-ил)метил]фенил]-2-бензотиазоламин;
N-[4-[циклогексил(1Н-1,2,4-триазол-1-ил)метил]фенил]-2-бензотиазоламин;
их N-оксиды, стереохимически изомерные формы и фармацевтически приемлемые соли присоединения.
Где бы далее ни использовались, обозначения R1-R3, Het, арил и  обозначают то же, что в формуле (I), если не указано иначе.
обозначают то же, что в формуле (I), если не указано иначе.
В общем, соединения формулы (I) могут быть получены реакцией промежуточного соединения формулы (II), в которой W1 является соответствующей уходящей группой, такой как, например, галоген, гидроксильная или алкилсульфонилоксигруппа, с промежуточным соединением формулы (III) или его функциональным производным. Например, функциональным производным имидазола может быть 1,1'-карбонилдиимидазол.
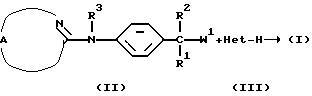
Указанная реакция может быть проведена в инертном по отношению к реакции растворителе, таком как, например, ацетонитрил или тетрагидрофуран, в присутствии подходящего основания, такого как, например, карбонат калия. В случае, когда W1 является гидроксильной группой, может быть удобным проводить указанную выше реакцию в присутствии трифенилфосфина и диэтилазодикарбоксилата или функционального производного любого из указанных реагентов.
В этой и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если необходимо, подвергнуты дальнейшей очистке в соответствии с методиками, широко известными в данной области, такими как, например, экстракция, кристаллизация, перегонка, растирание и хроматография.
Альтернативно соединения формулы (I) могут быть получены N-алкилированием промежуточного соединения формулы (IV) промежуточным соединением формулы (V), в котором W2 является соответствующей уходящей группой, такой как, например, феноксигруппа, в инертном по отношению к реакции растворителе, таком как, например, N,N-диметилформамид.
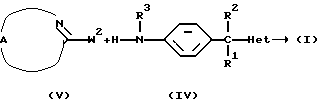
Соединения формулы (I), в которых  является радикалом формулы (а), в котором Х представляет собой S, причем указанные соединения представлены формулой (I-а-1), могут быть получены реакцией промежуточного соединения формулы (VI) с промежуточным соединением формулы (VII), в котором W3 является соответствующей уходящей группой, и в инертном по отношению к реакции растворителе, таком как, например, тетрагидрофуран.
является радикалом формулы (а), в котором Х представляет собой S, причем указанные соединения представлены формулой (I-а-1), могут быть получены реакцией промежуточного соединения формулы (VI) с промежуточным соединением формулы (VII), в котором W3 является соответствующей уходящей группой, и в инертном по отношению к реакции растворителе, таком как, например, тетрагидрофуран.
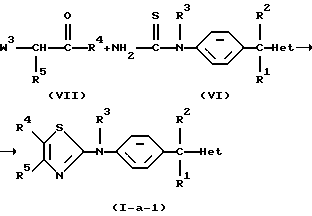
Подходящие промежуточные соединения формулы (VII) могут быть заменены на их функциональное производное, такое как, например, кетальное производное. В случае, когда карбонильная группа в промежуточном соединении формулы (VII) кетализирована, реакцию подходящим образом проводят в присутствии кислоты, такой как, например, соляная кислота.
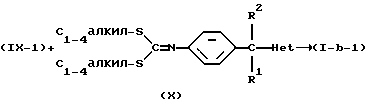
Соединения формулы (I), в которых R3 является водородом и 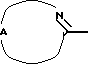 является радикалом формулы (b), в котором Х представляет собой S, причем указанные соединения представлены формулой (I-b-1), могут быть получены реакцией промежуточного соединения формулы (VIII) с промежуточным соединением формулы (IX-1) в инертном по отношению к реакции растворителе, таком как, например, тетрагидрофуран или 1-метил-2-пирролидинон.
является радикалом формулы (b), в котором Х представляет собой S, причем указанные соединения представлены формулой (I-b-1), могут быть получены реакцией промежуточного соединения формулы (VIII) с промежуточным соединением формулы (IX-1) в инертном по отношению к реакции растворителе, таком как, например, тетрагидрофуран или 1-метил-2-пирролидинон.
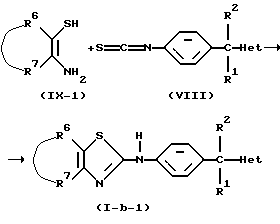
В приведенной выше реакции промежуточное соединение (IX-1) может быть заменено на промежуточное соединение формулы (IХ-2) с образованием таким образом соединения формулы (I-а-1), в котором R3 является водородом и R4 является аминогруппой, причем указанные соединения представлены формулой (I-а-2).
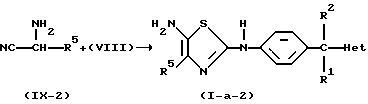
Вместо промежуточного соединения (VIII) в реакции можно также использовать промежуточное соединение формулы (X). Указанную реакцию затем проводят в инертном по отношению к реакции растворителе, таком как, например, диметилсульфоксид, и в присутствии подходящего основания, такого как, например, гидроксид натрия.
Соединения формулы (I), в которых R1 является гидроксильной группой, могут быть получены реакцией промежуточного соединения, соответствующего соединению формулы (I), в котором R1 и R2 вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу с Het-H (III) или его функциональным производным, в присутствии соответствующего реагента, такого как, например, н-бутиллитий, в инертном по отношению к реакции растворителе, таком как тетрагидрофуран, и, необязательно, в присутствии хлортриэтилсилана.
Соединения формулы (I), в которых R2 является C1-4aлкилоксиС1-12алкилом, могут быть получены реакцией промежуточного соединения, соответствующего соединению формулы (I), в котором R2 является L-С1-12алкилом, где L является соответствующей уходящей группой, такой как, например, алкилсульфонилоксигруппа, с С1-4алкилO-М+, где М+ является соответствующим ионом металла, таким как, например, Na+, в соответствующем растворителе, таком как метанол.
Соединения формулы (I), в которых R3 является необязательно замещенным С1-12алкилом, могут быть получены восстановлением промежуточного соединения, соответствующего соединению формулы (I), в котором указанный R2 присоединен к атому углерода, несущему заместитель R2, двойной связью, с помощью соответствующего восстанавливающего агента, такого как, например, борогидрид натрия, в соответствующем растворителе, таком как метанол.
Соединения формулы (I) можно также превращать друг в друга, придерживаясь известных способов превращения функциональных групп.
Например, соединения формулы (I), в которых R3 является водородом, могут быть превращены в соединения формулы (I), в которых R3 отличается от водорода.
Также соединения формулы (I), содержащие C1-6алкилоксикарбонильный заместитель, могут быть превращены в соединения формулы (I), в которых указанный заместитель восстанавливают до гидроксиметила, и, если требуется, указанный гидроксиметильный заместитель может далее быть превращен в формильную группу.
Соединения формулы (I-а-2), в которых R5 является цианогруппой, могут далее быть введены в реакцию с HN=CH-NH2 или его функциональным производным, образуя таким образом соответствующее соединение формулы (I-b-1), в котором -R6-R7-является -N=CH-N=C(NH2)-.
Соединения формулы (I), в которых R1 является гидроксильной группой, могут быть превращены в соединения формулы (I), в которых R1 является водородом, используя соответствующий реагент, такой как хлорид олова.
Соединения формулы (I) можно также превратить в соответствующие N-оксидные формы, следуя известным методикам превращения трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления обычно может быть проведена путем введения в реакцию исходного вещества формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, перекись водорода, пероксиды щелочных металлов или щелочноземельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, бензолперкарбоновая кислота или замещенная галогеном бензолперкарбоновая кислота, например 3-хлорбензолперкарбоновая кислота; пероксиалкановые кислоты, например пероксиуксусная кислота; алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и подобные, углеводороды, например толуол, кетоны, например 2-бутанон, галоидированные углеводороды, например дихлорметан, и смеси таких растворителей.
Некоторые из соединений формулы (I) и некоторые из промежуточных соединений настоящего изобретения могут иметь ассиметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены с помощью известных методик. Например, диастереоизомеры могут быть разделены физическими способами, такими как селективная кристаллизация, или хроматографическими методами, например противоточное разделение, жидкостной хроматографией и подобными способами. Энантиомеры могут быть получены из рацемической смеси путем первоначального превращения указанной рацемической смеси с помощью подходящего разделяющего агента, такого как, например, хиральная кислота, в смесь диастереомерных солей или соединений, затем физического разделения указанной смеси диастереомерных солей или соединений при помощи, например, селективной кристаллизации или хроматографических методов, например жидкостной хроматографии и подобных способов, и, наконец, превращения указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы могут также быть получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ при условии, что промежуточные реакции проходят стереоспецифично.
Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию, в частности жидкостную хроматографию с хиральной неподвижной фазой.
Некоторые из промежуточных соединений и исходных веществ являются известными соединениями и могут быть коммерчески доступны или могут быть получены в соответствии в известными методиками.
В частности, промежуточные соединения формулы (II), в которых R1 и R3 являются водородом, W1 является гидроксильной группой и 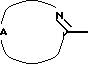 является радикалом формулы (b), причем указанные промежуточные соединения представлены формулой (II-b-1), могут быть получены реакцией промежуточного соединения формулы (IX) с промежуточным соединением формулы (XI-1) или (XI-2) и последующим восстановлением образованного таким образом промежуточного соединения.
является радикалом формулы (b), причем указанные промежуточные соединения представлены формулой (II-b-1), могут быть получены реакцией промежуточного соединения формулы (IX) с промежуточным соединением формулы (XI-1) или (XI-2) и последующим восстановлением образованного таким образом промежуточного соединения.
Первую реакцию проводят по той же методике, что и использованная выше для получения соединения формулы (I-b-1) из промежуточного соединения формулы (IX) и промежуточного соединения формулы (VIII) или (X). Восстановление может быть проведено в присутствии подходящего восстанавливающего агента в соответствующем инертном по отношению к реакции растворителе, такого как, например, боргидрид натрия в метаноле или алюмогидрид лития в тетрагидрофуране и воде.
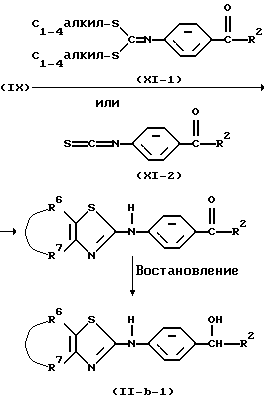
В некоторых случаях может быть удобно заменить гидроксильную группу в промежуточном соединении формулы (II-b-1) на другую уходящую группу, такую как, например, галоген или сульфонильное производное, например п-толуолсульфонилокси-группа или алкилсульфонилоксигруппа, получая, таким образом, промежуточные соединения (II-b-2) и (II-b-3). Указанная реакция может быть проведена в инертном по отношению к реакции растворителе, таком как, например, хлророформ, и в присутствии подходящего реагента, такого как, например, тионилхлорид или метилсульфонилхлорид.
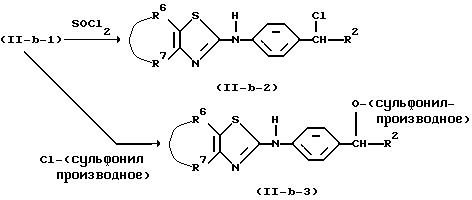
Промежуточные соединения формулы (IV) могут быть получены реакцией промежуточного соединения формулы (XII), в котором Р является защитной группой, такой как, например, С1-4алкилкарбонил, бензоил или С1-4алкилоксикарбонил, с промежуточным соединением формулы (III) и последующей реакцией образованного таким образом амидного производного с кислотой, такой как, например, соляная кислота. Получение промежуточного амидного производного может быть проведено с помощью той же методики, которая была использована для получения соединений формулы (I) из промежуточного соединения формулы (II) и (III).
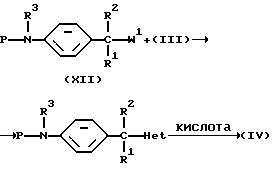
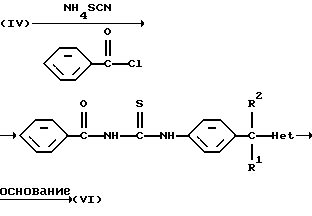
Промежуточные соединения формулы (VI) могут быть получены дальнейшей реакцией промежуточного соединения формулы (IV) с комбинацией из двух подходящих реагентов, таких как, например, NH4SCN в комбинации с бензоилхлоридом или функциональным производным любого из указаных реагентов, в инертном по отношению к реакции растворителе, таком как, например, 2-пропанон. С образованного таким образом промежуточного соединения может быть снята защита с помощью подходящего основания, такого как, например, гидроксид натрия.
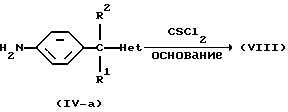
Промежуточные соединения формулы (IV), в которых R3 является водородом, причем указанные промежуточные соединения представлены формулой (IV-a), могут также быть введены в реакцию с соответствующим реагентом, таким как CSCl2 или его функциональное производное, в инертном по отношению к реакции растворителе и в присутствии подходящего основания, такого как, например, гидроксид натрия, давая таким образом промежуточные соединения формулы (VIII).
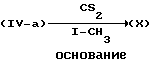
Также промежуточные продукты формулы (IV-a) могут быть далее использованы для получения промежуточных продуктов формулы (X). Указанное получение включает реакцию промежуточного соединения (IV-a) с СS2 и СН3-I или функциональными производными любого из указанных реагентов в инертном по отношению к реакции растворителе и в присутствии основания, такого как, например, гидроксид натрия.
Соединения формулы (I) подавляют уничтожение плазмы ретиноидами, такими как полностью транс-ретиноевая кислота, 13-цис-ретиноевая кислота и их производные, что приводит к более устойчивой концентрации ретиноевой кислоты в плазме и ткани и улучшенному контролю дифференциации и роста различных типов клеток. Это действие соединений данного изобретения также называется активностью, имитирующей ретиноиды, потому что введение соединений формулы (I) вызывает такой же эффект, как при введении ретиноидов. Как таковые соединения настоящего изобретения могут быть использованы для контроля скорости роста и дифференциации нормальных, предопухолевых и опухолевых клеток, являются ли они эпителиальными или мезенхимальными; будут ли они эктодермального, эндодермального или мезодермального происхождения.
Свойство задерживать метаболизм ретиноевой кислоты может быть подтверждено различными опытами in vitro и in vivo. Конкретная методика in vitro описана в примере C.1 и показывает ингибирующее действие соединений формулы (I) на метаболизм ретиноевой кислоты в раковых клетках молочной железы человека. Соединения настоящего изобретения также эффективны в подавлении стимулированного эффекта вагинальной кератинизации у овариэктомизированных крыс, как это описано в примере С.2.
К тому же, соединения формулы (I) демонстрируют слабое или полностью отсутствующее эндокринологическое побочное действие и имеют хорошую доступность при пероральном введении.
В связи с описанными выше фармакологическими свойствами, особенно их активностью, имитирующей ретиноиды, соединения настоящего изобретения полезны для лечения и/или предупреждения болезней, характеризующихся ненормальной пролиферацией и/или ненормальной дифференциацией клеток, особенно клеток, для которых рост и дифференциация чувствительны к действию ретиноидов. Такие болезни относятся к области онкологии, например рак головы и шеи, рак легкого, рак молочной железы, рак шейки матки, рак желудочно-кишечного тракта, рак кожи, рак мочевого пузыря, рак предстательной железы и подобные болезни, а также к области дерматологии, например болезни, связанные с кератинизацией, такие как розовые угри, угри обыкновенные, псориаз, тяжелый псориаз, пластинчатый ихтиоз, плантарные бородавки, омозолелость, акантоз nigricans, красный плоский лишай, моллюск, избыток черного пигмента в коже, роговичная эпителиальная ссадина, ландкартообразный язык, болезнь Fox-Fordyce, кожная метастатическая меланома и келоиды, эпидермолитический гиперкератоз, болезнь Дариера, питириаз rubra pilaris, врожденная ихтиозоформная эритродермия, гиперкератоз palmaris и planaris, избыток черного пигмента в коже, гиперпигментация и подобные болезни.
Далее, соединения формулы (I) пригодны для подавления метаболизма введенного экзогенно или образованного эндогенно 1α, 25-дигидроксивитамина D3 (кальцитриол). Ингибирующее действие соединений формулы (I) на метаболическое разрушение кальцитриола может быть показано при помощи измерения влияния указанных соединений на разрушение кальцитриола в кератиноцитах крайней плоти человека, клетках почки свиньи и клетках гепатомы человека. Вследствие их ингибирующего действия на метаболизм кальцитриола соединения формулы (I) могут применяться в лечении состояния дефицита витамина D. "Классическое" применение соединений витамина D лежит в области метаболических костных заболеваний. Также описано влияние кальцитриола на эффекты и/или продуцирование интерлейкинов. Далее, кальцитриол применяется в лечении болезней, характеризующихся ненормальной пролиферацией и/или дифференциацией клеток, в частности болезней, связанных с кератинизацией, таких как описанные выше (Bouillon et al. Endocrine Reviews, 1995, 16, 200-257).
Из описанных выше применений соединений формулы (I) следует, что настоящее изобретение относится к способу лечения теплокровных животных, страдающих болезнями, которые характеризуются ненормальной пролиферацией и/или ненормальной дифференциацией нормальных, предопухолевых и опухолевых клеток, являются ли они эпителиальными или мезенхимальными; будут ли они эктодермального, эндодермального или мезодермального происхождения. Указанный способ включает системное или местное введение имитирующего ретиноид количества соединения формулы (I), эффективного в лечении описанных выше болезней, особенно болезней, связанных с кератинизацией, таких как псориаз, необязательно в присутствии эффективного количества ретиноевой кислоты, ее производного или ее стереохимически изомерной формы. Настоящее изобретение далее касается способа лечения пациентов, страдающих патологическими состояниями, на которые может благотворно воздействовать введение кальцитриола или его пролекарства, особенно состояниями, связанными с кератинизацией, такими как псориаз, причем указанный способ включает введение пациенту (а) эффективного количества кальцитриола или его пролекарства и (b) эффективного количества соединения формулы (I).
Таким образом, настоящее изобретение также относится к применению соединений формулы (I), определенных выше, в качестве лекарственного средства, в особенности к применению в производстве лекарств для лечения болезней, связанных с кератинизацией, таких как псориаз. Настоящее изобретение далее относится к применению соединений формулы (I), как определено выше, в сочетании с ретиноевой кислотой, ее производным или стереохимически изомерной формой или в сочетании с кальцитриолом или его пролекарством в качестве лекарственного средства.
Для удобства введения соединения изобретения могут быть представлены в различных фармацевтических формах. В качестве соответствующей композиции можно указать все композиции, обычно применяемые для системного или местного введения лекарств. Для получения фармацевтических композиций этого изобретения имитирующее ретиноид эффективное количество конкретного соединения, необязательно в форме соли присоединения, в качестве активного компонента объединяют в однородную смесь с фармацевтически приемлемым наполнителем, который может иметь самые разнообразные формы, в зависимости от формы композиции, желаемой для введения. Желательно, чтобы эти фармацевтические композиции были в виде единичной дозы, подходящей для перорального, ректального, подкожного введения или парентеральной инъекции. Например, для получения композиции в виде дозы для перорального введения может применяться любая обычная фармацевтическая среда, такая как, например, вода, гликоль, масло, спирт и подобные, в случае пероральных жидких препаратов, таких как суспензии, сиропы,
эликсиры и растворы, или твердый носитель, такой как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и подобные в случае порошков, пилюль, капсул и таблеток. Из-за удобства в применении таблетки и капсулы представляют собой наиболее предпочтительную форму единичной пероральной дозы, в этом случае, очевидно, применяются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, большей частью, хотя могут быть включены другие компоненты, например, для облегчения растворимости. Могут быть приготовлены, например, растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. В композиции, подходящей для покожного введения, носитель необязательно включает улучшающий проникновение агент и/или подходящий смачивающий агент, необязательно в сочетании с подходящими добавками любой природы в незначительных количествах, причем эти добавки не оказывают значительного вредного действия на кожу. Указанные добавки могут облегчать введение на кожу и/или могут быть полезны при приготовлении желаемой композиции. Эти композиции могут применяться различными способами, например как чрезкожный пластырь, как наклейка или как мазь. Соли присоединения соединений формулы (I) благодаря повышенной растворимости по сравнению с соответствующими основными формами, очевидно, являются более подходящими для приготовления водных композиций.
В качестве соответствующей композиции для местного введения можно указать все композиции, обычно употребляемые для местно вводимых лекарств, например кремы, гели, повязки, шампуни, настойки, пасты, мази, бальзамы, порошки и тому подобное. Можно применять указанные композиции в виде аэрозоля, например с пропеллентом, таким как азот, углекислый газ, фреон, или без пропеллента, как спрей, капли, лосьоны, или полутвердого вещества, такого как загустевшая композиция, которая может быть нанесена с помощью тампона. В отдельных композициях удобно использовать полутвердые композиции, такие как бальзамы, кремы, гели, мази и подобные.
Особенно полезно составлять вышеупомянутые фармацевтические композиции в форме единичной дозы для удобства введения и единообразия доз. Форма единичной дозы, как это понятие используется здесь в описании и в формуле изобретения, относится к физически дискретным единицам, пригодным в качестве единичной дозы, причем каждая единица содержит заданное количество активного компонента, вычисленное так, чтобы оно произвело желаемый терапевтический эффект вместе с требуемым фармацевтическим носителем. Примером такой формы единичной дозы служат таблетки (включая таблетки с бороздкой или покрытые оболочкой таблетки), капсулы, пилюли, пакеты с порошком, облатки, растворы или суспензии для инъекций, чайные ложечки, столовые ложки и тому подобное, а также те же объединенные дозированные формы.
Другими такими композициями являются препараты косметического типа, такие как туалетная вода, тампоны, лосьоны, молочко для кожи или молочные лосьоны. Указанные препараты содержат, помимо активных компонентов, компоненты обычно применяемые в таких препаратах. Примерами таких компонентов являются масла, жиры, воски, поверхностно-активные вещества, увлажнители, загущающие агенты, антиоксиданты, стабилизаторы вязкости, хелатирующие агенты, буферы, консерванты, ароматизаторы, красители, низшие спирты и подобные. Если требуется, в композицию могут быть включены другие компоненты, например противовоспалительные агенты, антибактериальные, противогрибковые, дезинфицирующие средства, витамины, средства для защиты от загара, антибиотики или другие агенты против угрей.
Настоящее изобретение также относится к определенным фармацевтическим или косметическим композициям, которые включают инертный носитель, эффективное количество соединения формулы (I) и эффективное количество ретиноевой кислоты, ее производного или ее стереохимически изомерной формы. Указанные композиции, содержащие ретиноевую кислоту, особенно полезны для лечения угрей обыкновенных или для замедления эффекта старения кожи и значительно улучшают качество кожи, особенно кожи лица человека. Далее, изобретение также относится к определенным фармацевтическим или косметическим композициям, которые включают инертный носитель, эффективное количество соединения формулы (I) и эффективное количество кальцитриола или его пролекарства. Последние композиции особенно полезны в лечении болезней, связанных с кератинизацией.
Изобретение также относится к продукту, содержащему ретиноевую кислоту или ее производное и соединение формулы (I), как комбинированному препарату для одновременного, раздельного или последовательного использования при дерматологических или онкологических заболеваниях. Изобретение также относится к продукту, содержащему кальцитриол или его пролекарство и соединение формулы (I), как комбинированному препарату для одновременного, раздельного или последовательного использования при заболеваниях, при которых благотворно действует кальцитриол. Такие продукты могут включать, например, набор, содержащий емкость с подходящей композицией, включающей соединение формулы (I), и другую емкость с композицией, включающей кальцитриол или ретиноид. Такой продукт может иметь то преимущество, что врач может выбрать на основании диагноза подвергающегося лечению пациента соответствующие количества каждого компонента и последовательность и время их введения.
Специалисты по лечению описанных выше болезней могут определить эффективное терапевтическое дневное количество из результатов экспериментов, приведенных в экспериментальной части. Эффективное терапевтическое дневное количество составляет от приблизительно 0,1 мг/кг до приблизительно 40 мг/кг веса тела, более предпочтительно от приблизительно 0,1 мг/кг до приблизительно 10 мг/кг веса тела. Может оказаться уместным применять терапевтически эффективную дозу один раз в день или два, три, четыре или более частей дозы через соответствующие интервалы в течение дня. Указанные части дозы могут быть изготовлены в форме единичной дозы, например, содержащей от 0,1 мг до 500 мг активного компонента в единичной дозе.
Точная дозировка и частота введения зависят от конкретного выбранного соединения формулы (I), причем должны быть приняты во внимание конкретное заболевание, серьезность заболевания, возраст, вес и общее физическое состояние данного больного, также как и другое лечение, как это хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное дневное количество может быть уменьшено или увеличено в зависимости от реакции пациента, которого лечат, и/или в зависимости от оценки врача, прописывающего соединения настоящего изобретения. Поэтому упомянутые выше диапазоны эффективного дневного количества являются только руководством.
Следующие примеры предназначены для иллюстрации и не ограничивают объем настоящего изобретения.
Экспериментальная часть.
В некоторых соединениях формулы (I) абсолютная стереохимическая конфигурация стереогенного атома(атомов) углерода не определена экспериментально. В этих случаях стереохимически изомерная форма, которая была выделена первой, обозначена как "А", а вторая - как "В", без дальнейшего указания точной стереохимической конфигурации. Указанные формы "А" и "В" этих соединений формулы (I), в которых присутствуют два стереогенных атома углерода, были разделены на чистые стереохимически изомерные формы, обозначенные как "А1" и "А2", "В1" и "В2", без дальнейшей ссылки на точную стереохимическую конфигурацию.
Ниже "THF" обозначает тетрагидрофуран, "EtOAc" обозначает этилацетат, "DIPE" обозначает диизопропиловый эфир и "RT" обозначает комнатную температуру.
А. Получение промежуточных соединений
Пример А-1.
а) Бензоилхлорид (0,067 моль) добавляют к раствору аминотиоцианата (5,09 г) в 2-пропаноне (150 мл), смесь перемешивают и кипятят с обратным холодильником в течение 20 мин. Добавляют раствор 4-[1-(1Н-имидазол-1-ил)-2-метилпропил] анилина (0,0557 моль) в 2-пропаноне (150 мл) и смесь перемешивают и кипятят с обратным холодильником при 80oС всю ночь. Смесь охлаждают, фильтруют через целит и фильтрат упаривают. Остаток перемещают в CH2Cl2. Органический слой высушивают, отфильтровывают и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NH4ОН 98/2/0,1). Собирают чистые фракции и упаривают растворитель, получая 15,2 г (72%) (±)-N-бензоил-N'-[4-[1-(1Н-имидазол-1-ил)-2-метилпропил]фенил]тиомочевины (промежуточное соединение 1).
b) Раствор промежуточного соединения (1) в NaOH (300 мл; 3 н.) перемешивают и кипятят с обратным холодильником в течение 2 часов. Раствор охлаждают, выливают в лед, нейтрализуют коцентрированной НСl и экстрагируют с помощью СН2Сl2. Органический слой отделяют, высушивают, отфильтровывают и упаривают растворитель, получая 7,91 г (88%) N'-[4-[1-(1H-имидазол-1-ил)-2-метилпропил]фенил]тиомочевины (промежуточное соединение 2).
Пример А-2.
а) втор-Бутиллитий (298 мл; 1,3 М) добавляют по каплям при -60oС в токе N2 к раствору N-(4-бромфенил)ацетамида (0,1892 моль) в THF (400 мл) и смесь перемешивают при -70o С в течение 2 часов. По каплям добавляют раствор 1-циано-1-метил-N,N-диметилэтанамина (0,075 моль) в THF (60 мл), смесь доводят до RT и затем перемешивают при RT в течение 12 часов. Смесь выливают в лед и экстрагируют с помощью EtOAc. Упаривают растворитель, остаток переносят в НСl (3 н. ) и EtOAc, экстрагируют с помощью EtOAc, подщелачивают с помощью К2СО3 (10%) и экстрагируют с помощью CH2Cl2. Органический слой отделяют, высушивают, отфильтровывают и упаривают растворитель. Остаток перекристаллизовывают из (C2H5)2O и DIPE. Осадок отфильтровывают и высушивают, получая 6,8 г (36%) N-[4-[2-(диметиламино)-2-метил-1-оксопропил] фенил] ацетамида (промежуточное соединение 3).
b) Раствор промежуточного соединения (3) (0,026 моль) в НСl (180 мл; 6 н. ) перемешивают и нагревают до 100oС в течение 2 часов. Раствор выливают в лед, промывают EtOAc, подщелачивают NH4OH и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель, получая 5,1 г (94%) 1-(4-аминофенила)-2-(диметиламино)-2-метил-1-пропанона (промежуточное соединение 4).
c) Дихлорангидрид тиоугольной кислоты (2,45 мл) добавляют по каплям при 0oС к раствору промежуточного соединения (4) (0,0247 моль) в NaOH (10,7 мл; 3 н.) и СНСl3 (200 мл) и смесь перемешивают при 0oС в течение 4 часов. Смесь выливают в К2СО3 (10%) и экстрагируют с помощью CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель, получая 6,1 г (99%) 2-(диметиламино)-2-метил-1-(4-изотиоцианатофенил)-1-пропанона (промежуточное соединение 5).
d) Смесь промежуточного соединения (5) (0,0247 моль) и 2-аминотиофенола (0,0298 моль) в THF (60 мл) перемешивают и кипятят с обратным холодильником в течение 2 часов и далее перемешивают при RT в течение 72 часов. Смесь выливают в воду и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток кристаллизуют из (С2Н5)2O и DIPE. Осадок отфильтровывают и высушивают, получая 5,57 г (67%) 1-[4-[2-бензотиазолиламино)фенил] -2-(диметиламино)-2-метил-1-пропанона (промежуточное соединение 6).
е) NaBH4 (3,72 г) добавляют порциями при 10oС к раствору промежуточного соединения (6) (0,0164 моль) в метаноле (60 мл) и смесь перемешивают при RT в течение 24 часов. Смесь выливают в воду и экстрагируют с помощью CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель, получая 5,2 г (93%) 1-[4-(2-бензотиазолиламино)фенил]-2-диметиламино)-2-метил-1-пропанола (промежуточное соединение 7).
Пример А-3.
a) Раствор алюмогидрида лития (0,1107 моль) в THF (100 мл) добавляют по каплям при 0oС в токе N2 к суспензии этил-4-(2-бензотиазолиламино)бензоата (0,1107 моль) в воде. Смесь доводят до RT и перемешивают в течение 30 мин. Смесь гидролизуют, добавляя воду (8 мл) по каплям, и затем добавляют CH2Cl2 (50 мл) и немного СН3ОН. Осадок фильтруют и упаривают растворитель. Остаток кристаллизуют из 2-пропанона и DIPE. Осадок отфильтровывают и высушивают, получая 8 г (86%) 4-(2-бензотиазолиламино)бензолметанола (промежуточное соединение 8).
b) Тионилхлорид (10 мл) добавляют по каплям при 0oС к раствору промежуточного соединения (8) (0,039 моль) в СН2Сl2 (100 мл) и перемешивают смесь при 0oС в течение 2 часов. Упаривают растворитель, получая 10,7 г N-[4-(хлорметил)фенил]-2-бензотиазоламина (промежуточное соединение 9).
Пример А-4.
a) Смесь промежуточного соединения (8) (0,0312 моль) и диоксида магния (0,115 моль) в CH2Cl2 (200 мл ) в N,N-диметилформамиде (10 мл) перемешивают при RT в течение 12 часов. Диоксид магния (0,115 моль) добавляют еще раз и перемешивают смесь при RT в течение 12 часов. Смесь фильтруют через целит, промывают CH2Cl2 и раствор упаривают. Добавляют воду (100 мл), упаривают, фильтруют, кристаллизуют, фильтруют и высушивают, получая 7 г (89%) 4-(2-бензотиазолиламино)бензальдегида (промежуточное соединение 10).
b) Раствор 1-бром-3-фторбензола (0,213 моль) в THF (60 мл) добавляют по каплям при RT в токе N2 к суспензии магния (0,213 моль) в THF (60 мл) и смесь перемешивают в течение 30 мин. Смесь охлаждают до 0oС, раствор промежуточного соединения (10) (0,071 моль) в THF (60 мл) добавляют по каплям и смесь перемешивают в течение 15 мин. Смесь выливают в воду и NH4C1 и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NH4ОН от 100/0/0 до 90/10/0,1). Собирают чистые фракции и упаривают растворитель, получая 22,4 г (90%) (±)-α-[4-(2-бензотиазолиламино)фенил] -3-фторбензолметанола (промежуточное соединение 11).
с) н-Бутиллитий (0,1836 моль; 1,6 М) добавляют по каплям при -70oС в токе N2 к раствору N-(1-метилэтил)-2-пропанамина (0,1836 моль) в THF (60 мл). Смесь перемешивают в течение 20 мин, затем позволяют смеси нагреться до -30oС. Добавляют раствор этилпропионата (0,1836 моль) в THF (100 мл) при -78oС. Позволяют смеси нагреться до -30oС и затем охлаждают до -78oС. Добавляют по каплям раствор промежуточного соединения (10) (0,0875 моль) в THF (60 мл). Смесь перемешивают при -60oС в течение 20 мин, затем выливают в воду и NH4Cl и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 97/3/0,5). Собирают чистые фракции и упаривают растворитель. Остаток кристализуют из 2-пропанона и диэтилового эфира. Осадок фильтруют и высушивают, получая 18 г (±)-этил-4-(2-бензотиазолиламино)-β-гидрокси-α-метилбензолпропаноата (промежуточное соединение 12).
Пример А-5.
а) Раствор 3-бромпентана (0,331 моль) в (C2H5)2O (200 мл) добавляют по каплям к раствору стружки магния (0,331 моль) в (C2H5)2O, смесь перемешивают при RT в течение 2 часов и затем охлаждают до 0oС. Раствор N-(4-формилфенил)ацетамида (0,11 моль) в THF (400 мл) добавляют по каплям и смесь перемешивают в течение 10 мин. Смесь выливают в водный NH4C1 и экстрагируют с помощью EtOAc. Органический слой высушивают, отфильтровывают и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 97/3/0,1). Собирают чистые фракции и упаривают растворитель, получая 13,5 г (52%) (±)-N-[4-(2-этил-1-гидроксибутил)фенил] ацетамида (промежуточное соединение 13).
b) Метансульфонилхлорид (0,114 моль) добавляют по каплям при 0oС под N2 к раствору промежуточного соединения (13) (0,057 моль) и триэтиламина (0,114 моль) в CH2Cl2 (250 мл) и смесь перемешивают при RT в течение 12 часов. Растворитель упаривают, получая 17,86 г (100%) метансульфоната (±)-4-(ацетиламино)-α-(1-этилпропил)бензолметанола (эфир) (промежуточное соединение 14).
c) Cмесь промежуточного соединения (14) (0,187 моль), 1H-1,2,4-триазола (0,516 моль) и карбоната калия (0,561 моль) в метаноле (600 мл) перемешивают и кипятят с обратным холодильником в течение 20 часов. Смесь выливают в воду и экстрагируют с помощью CH2Cl2. Органический слой промывают водой, высушивают, отфильтровывают и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4OН 96/4/0,1). Собирают чистые фракции и упаривают растворитель, получая 22 г (±)-N-[4-[2-этил-1-(1H-1,2,4-триазол-1-ил)бутил] фенил] ацетамида (41%) (промежуточное соединение 15).
d) Смесь промежуточного соединения (15) (0,0073 моль) в НСl (10 мл; 3 н. ) перемешивают при 60o С в течение 12 часов. Смесь выливают в ледяную воду, подщелачивают с помощью концентрированного раствора NaOH и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 98,5/1,5/0,1). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из метилэтилкетона/DIPE. Осадок фильтруют и высушивают, получая 1,8 г (73%) (±)-4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] анилина (промежуточное соединение 16). Продукт разделяют с помощью ЖХВД Chiralpack AS 20 мкм (элюент: гексан/С2Н5ОН 65/35). Чистые фракции собирают, упаривают и высушивают, получая 0,54 г (А)-4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] анилина (промежуточное соединение 17) и (В)-4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] анилина (промежуточное соединение 18).
e) Смесь CS2 (0,0819 моль) в NaOH (3,8 моль; 20 н.) добавляют при RT к раствору промежуточного соединения (16) (0,063 моль) в диметилсульфоксиде (37 мл). Смесь перемешивают в течение 1 часа и охлаждают до 0oС. Добавляют иодметан (4,9 мл). Смесь перемешивают при RT в течение 3 часов и охлаждают до 0oС. Добавляют NaOH (3,8 мл; 20 н.) и иодметан (4,9 мл). Смесь перемешивают при RT всю ночь. Добавляют EtOAc и воду и экстрагируют смесь с помощью EtOAc. Органический слой отделяют, промывают водой, высушивают, фильтруют и упаривают растворитель, получая 25 г (±)-N-[бис(метилтио)метил]-4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]анилина (промежуточное соединение 19а).
f) Дихлорангидрид тиоугольной кислоты (0,216 моль) добавляют по каплям при 0oС к раствору промежуточного соединения (16) (0,1665 моль) в гидроксиде натрия (3 н.; 72,15 мл) и CH2Cl2 (400 мл). Смеси позволяют нагреться до RT за двухчасовой период перемешивания и затем выливают в К2СО3 (10%; 200 мл). Смесь перемешивают 30 мин и затем декантируют. Органический слой высушивают, фильтруют и упаривают растворитель, получая 47,7 г (100%) (±)-1-[2-этил-1-(4-изотиоцианатофенил)бутил] -1Н-1,2,4-триазола (промежуточное соединение 19b).
(±)-1-[1-(4-изотиоцианатофенил)-2-этилбутил] -1H-имидазол (промежуточное соединение 19с) получают так же.
Пример А-6.
а) Смесь 1-(4-аминофенил)-2-метил-1-пропанона (0,0637 моль) и метил-2-хлор-3-пиридинкарбоксилата (0,0637 моль) в 2-метоксиэтаноле (200 мл) перемешивают и кипятят с обратным холодильником в течение 90 часов. Смесь переносят в воду и EtOAc и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель, получая 22,6 г метил-2-[[4-(2-метил-1-оксопропил)фенил]амино]-3-пиридинкарбоксилата (промежуточное соединение 20).
b) Тетрагидроборат натрия (0,0764 моль) добавляют порциями при 0oС к раствору промежуточного соединения (20) (0,0637 моль) в метаноле (200 мл). Раствор перемешивают в течение 2 часов, добавляют воду и упаривают органический растворитель. Концентрат переносят в СН2Сl2, высушивают, фильтруют и упаривают растворитель, получая 18,38 г (±)-метил-2-[[4-(1-гидрокси-2-метилпропил)фенил]амино]-3-пиридинкарбоксилата (промежуточное соединение 21).
Пример А-7.
a) Хлорид алюминия(III) (0,666 моль) добавляют порциями при RT к раствору N-фенил-2-бензотиазолиламина (0,222 моль) и 1,2-дихлор-1-пропанона (0,233 моль) в 1,2-дихлорэтане (500 мл) и смесь перемешивают и нагревают до 80oС в течение 2 часов. Смесь выливают в лед и экстрагируют с помощью СН2Сl2. Органический слой декантируют, высушивают, фильтруют и упаривают растворитель, получая 68 г (±)-1-[4-(2-бензотиазолиламино)фенил] -2-хлор-1-пропанона (95,7%) (промежуточное соединение 22).
b) Смесь промежуточного соединения (22) (0,0423 моль), N-метилэтанамина (0,084 моль) и карбоната калия (0,127 моль) в метаноле (150 мл) перемешивают и кипятят с обратным холодильником 90 мин. Смесь выливают в воду, экстрагируют с помощью CH2Cl2 и декантируют. Органический слой высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/2-пропанон/NН4ОН 95/5/0,1 и 90/10/0,1). Собирают чистые фракции и упаривают растворитель, получая 6,85 г (54%) (±)-1-[4-(2-бензотиазолиламино)фенил] -2-этилметиламино-1-пропанона (промежуточное соединение 23).
Тем же способом получают (±)-1-[4-(2-бензотиазолиламино)фенил] -2-(диметиламино)-1-пропанон (промежуточное соединение 24).
с) Борогидрид натрия (0,0642 моль) добавляют порциями при температуре от 0 до -5oС к раствору промежуточного соединения (24) (0,0584 моль) в метаноле (250 мл) и смесь перемешивают 3 часа. Смесь выливают в воду и экстрагируют с помощью CH2Cl2. Органический слой декантируют, высушивают, фильтруют и упаривают растворитель, получая 45 г (±)-4-(2-бензотиазолиламино)-α-[1-(диметиламино)этил]бензолметанола (промежуточное соединение 25).
Пример А-8.
а) Следующая реакция проводится в атмосфере N2. Раствор N-(4-бромфенил)-2-бензотиазоламина (0,492 моль) в THF (2700 мл) перемешивают при -70oС. Добавляют порциями бутиллитий (0,984 моль; 2,5М в гексане) при -65oС. Смесь перемешивают в течение 1 часа. Раствор 2-этилбутанала (0,492 моль) в THF (300 мл) добавляют порциями при -75oС. Смеси позволяют нагреться до RT в течение ночи. Добавляют 10% водный раствор NH4Cl (3000 мл) и смесь перемешивают в течение 15 мин. Отделенную водную фазу экстрагируют EtOAc (1000 мл). Отделенный органический слой высушивают, фильтруют и упаривают растворитель. Остаток кристаллизуют из метилизобутилкетона. Осадок отфильтровывают и высушивают, получая 109 г (68%) (±)-4-(2-бензотиазолиламино)-α-(1-этилпропил)бензолметанола (промежуточный продукт 28).
b) смесь промежуточного соединения 28 (0,156 моль) и триэтиламина (0,312 моль) в CH2Cl2 (500 мл) перемешивают при 0oС в токе N2. Добавляют порциями раствор метилсульфонилхлорида (0,314 моль) в CH2Cl2 (500 мл). Смесь перемешивают при 0oС в течение 3 часов. Растворитель упаривают, получая метансульфонат (±)-4-(2-бензотиазолиламино)-α-(1-этилпропил)бензолметанола (эфир) (промежуточное соединение 26).
c) Толуол (150 мл) добавляют к промежуточному соединению 28 (0,0582 моль). Гетерогенную смесь перемешивают при RT. Раствор тионилхлорида (0,0644 моль) в толуоле (50 мл) добавляют по каплям. Реакционную смесь перемешивают в течение 2 часов при RT, затем охлаждают до 0oС. Остаток отфильтровывают и высушивают при RT, получая 25 г моногидрохлорид (±)-N-[4-(1-хлор-2-этилбутил)фенил]-2-бензотиазоламина (промежуточное соединение 29).
Пример А-9.
Раствор (±)-α-(1-этилпропил)-4-[2-(метилтио)-4-пиримидиниламино] бензолметанола, полученного способом, описанным в примере А.2е, (0,0227 моль) в метаноле (144 мл) гидрируют при RT в течение 2 дней, используя никель Ренея (7,2 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отфильтровывают через целит, промывают метанолом и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН 95/5). Собирают нужные фракции и упаривают растворитель. Остаток кристаллизуют из диэтилового эфира. Осадок фильтруют и высушивают, получая 1,02 г (17%) (±)-α-(1-этилпропил)-4-[4-пиримидиниламино]бензолметанола (промежуточное соединение 27).
Пример А.10.
a) Соединение 130 (0,009 моль) добавляют при 0oС в тионилхлорид (40 мл). Смесь перемешивают при 0oС в течение 90 мин. Растворитель упаривают, получая 3,5 г N-[4-[2-(диметиламино)-1-(1-метил-1Н-имидазол-5-ил)-1-пропенил]фенил] -2-бензотиазоламин (промежуточное соединение 56).
b) Используя ту же методику, как описанная ниже в примере В-12, получают N-[4-[2-этил-1-(1-метил-1Н-имидазол-2-ил)-1-бутенил]фенил]-2-бензотиазоламин (промежуточное соединение 57).
Все следующие промежуточные соединения (см. таблицу IА), являющиеся рацемическими смесями, кроме промежуточного соединения 55, которое не имеет хиральных атомов углерода, получают в соответствии с одной из методик, описанных выше.
В. Получение целевых соединений.
Пример В-1.
Раствор промежуточного соединения (9) (0,0125 моль), 1H-имидазола (0,0584 моль) и карбоната калия (0,0586 моль) в метаноле (300 мл) перемешивают и кипятят с обратным холодильником в течение 12 часов. Растворитель упаривают и переносят остаток в воду и CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 96,5/3,5/0,2). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из 2-пропанона и DIPE. Осадок отфильтровывают и высушивают, получая 1,65 г (28%) N-[4-(1Н-имидазол-1-илметил)фенил]-2-бензотиазоламина (соединение 24).
Пример В-2.
Трифенилфосфин (4,8 г) и 1Н-1,2,4-триазол (0,018 моль) добавляют в токе N2 при 5oС к раствору промежуточного соединения (7) (0,00732 моль) в THF. Затем добавляют раствор диэтилазодикарбоксилата (2,88 мл) в THF, доводят смесь до RT и затем перемешивают всю ночь. Добавляют воду, упаривают растворитель, подкисляют с помощью НСl (3 н.) и отделяют слои. Водный слой промывают с помощью EtOAc, подщелачивают с помощью NH4OH и экстрагируют с помощью EtOAc.
Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,25). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из (С2Н5)2O. Осадок отфильтровывают и высушивают, получая 1 г (49%) (±)-N-[4-[2-(диметиламино)-2-метил-1-(1Н-1,2,4-триазол-1-ил)пропил]фенил]-2-бензотиазоламина (соединение 38).
Пример В-3.
a) Смесь промежуточного соединения (19b) (0,1665 моль) и 2-аминотиофенола (0,2 моль) в THF (500 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Смесь охлаждают, выливают в воду, экстрагируют с помощью CH2Cl2 и декантируют. Органический слой высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 97,5/2,5/0,1). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из 2-бутанона/диэтилового эфира. Осадок фильтруют и высушивают, получая 31,2 г (49,6%) (±)-N-[4-[2-этил-1-(1H-1,2,4-триазол-1-ил)бутил)фенил]-2-бензотиазоламина (соединение 25).
b) Соединение (25) (0,0265 моль) разделяют и очищают с помощью хиральной колоночной хроматографии на неподвижной фазе Chiralcel OJ (элюент: гексан/этанол 50/50). Собирают две нужные группы фракций и упаривают растворитель. Фракцию 1 кристализуют из 2-пропанола. Осадок отфильтровывают, промывают 2-пропанолом, затем высушивают, получая 2 г (20%) (А) N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]-2-бензотиазоламина (соединение 33).
Фракцию 2 кристализуют из 2-пропанола. Осадок отфильтровывают и высушивают, получая 1,9 г (19%) (В) N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] фенил] -2-бензотиазоламина (соединение 34). Соответствующий фильтрат откристаллизованной фракции 2 упаривают, часть остатка растворяют в 2-пропаноле и превращают в соль (Е)-2-бутендиовой кислоты (2:3). Осадок отфильтровывают и высушивают, получая 3 г (В) N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] фенил]-2-бензотиазоламин-(Е)-2-бутендиоата (2:3) (соединение 35).
с) 2-Метил-2-пропанол, соль калия (0,0127 моль) добавляют порциями при 0oС к раствору соединения (25) (0,0106 моль) в THF (30 мл) и смесь перемешивают при 0oС в течение 10 мин. Медленно добавляют раствор иодметана (0,0127 моль) в THF (10 мл) и перемешивают смесь при RT в течение 12 часов. Смесь выливают в воду и экстрагируют CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 98,5/1,5/0,1). Собирают чистые фракции и упаривают растворитель. Остаток перекристаллизовывают из 2-бутанона и DIPE. Осадок отфильтровывают и высушивают. Остаток перекристаллизовывают из 2-бутанона. Осадок отфильтровывают и высушивают, получая 1,5 г (36%) (±)-N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]-N-метил-2-бензотиазоламина (соединение 32).
Пример В-4.
a) NaOH (6,35 мл; 20 н.) добавляют при RT к раствору 2-аминотиофенола (0,0637 моль) в диметилсульфоксиде (115 мл). Смесь перемшивают при RT в течение 30 мин. Добавляют (±)-β-[4-[[бис(метилтио)метилен]амино]фенил]-N,N, α-триметил-1Н-имидазол-1-этанамин (0,0637 моль), полученный в соответствии со способом получения промежуточного соединения (19а). Смесь перемешивают при 110oС в течение ночи, затем выливают на лед, экстрагируют с помощью EtOAc и промывают с помощью НСl (3 н.). Водный слой подщелачивают концентрированным раствором NH4OH и эктрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток разделяют с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 97/3/0,1 и 90/10/0,1). Две чистые фракции (F1 и F2) собирают и упаривают растворитель. F1 кристаллизуют из 2-пропанона. Осадок отфильтровывают и высушивают. Остаток переносят в К2СО3 (10%), фильтруют и упаривают растворитель, получая 1,12 г (5%) (±)-(A)-N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)пропил] фенил] -2-бензотиазоламина (соединение 1). F2 кристализуют из 2-пропанона. Осадок отфильтровывают и высушивают. Остаток перекристаллизовывают из 2-пропанона. Осадок отфильтровывают и высушивают, получая 0,9 г (4%) (±)-(В)-N-[4-[2-(диметиламино)-1-(1H-имидазол-1-ил)пропил]фенил]-2-бензотиазоламина (соединение 2).
b) Соединение 2 (0,021 моль) разделяют с помощью ЖХВД Chiralpack AS (элюент: гексан/C2Н5ОН от 87/13 до 70/30). Чистые фракции собирают и упаривают растворитель. Фракцию 1 переносят в DIPE. Осадок отфильтровывают и высушивают, получая 2,54 г (В1) N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)пропил] фенил] -2-бензотиазоламина (32%) (соединение 3). Фракцию 2 переносят в диэтиловый эфир. Осадок отфильтровывают и высушивают, получая 2,41 г (В2) N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)пропил]фенил]-2-бензотиазоламина (30,3%) (соединение 4).
Пример В-5.
a) 1,1'-Каробонил-бис-1Н-имидазол (0,122 моль) добавляют при 60oС к смеси промежуточного соединения 21 (0,0612 моль) в THF (250 мл). Смесь перемешивают в течение ночи, выливают в воду и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99,25/0,75/0,1). Собирают чистые фракции и упаривают растворитель. Часть остатка (2 г) кристаллизуют из СН3ОН/2-пропанона/DIРЕ. Осадок отфильтровывают и высушивают, получая 1,6 г (40%) (±)-метил-2-[[4-[1-(1Н-имидазол-1-ил)-2-метилпропил] фенил] амино] -3-пиридинкарбоксилата (соединение 52).
b) Алюмогидрид лития (0,0242 моль) добавляют порциями при 0oС в токе N2 к THF (100 мл). Раствор соединения 52 (0,022 моль) в THF (200 мл) добавляют порциями при 0oС. Смесь перемешивают в течение 7 часов, затем охлаждают до 0oС, гидролизуют с помощью EtOAc и воды и фильтруют через целит. Растворитель упаривают, получая 6,5 г (93%) (±)-2-[[4-[1-(1Н-имидазол-1-ил)-2-метилпропил]фенил]амино]-3-пиридинметанола (соединение 54).
с) Смесь соединения 54 (0,02 моль) и оксида магния (IV) (65 г) в CH2Cl2 (200 мл) перемешивают при RT в течение 16 часов. Смесь фильтруют через целит, растворитель упаривают, получая 5,2 г (81%) (±)-2-[[4-[1-(1Н-имидазол-1-ил)-2-метилпропил]фенил]амино]-3-пиридинкарбоксальдегида (соединение 55).
Пример В-6.
2-Фенокси-1,3-бензоксазол (0,0123 моль) добавляют к раствору промежуточного соединения 16 (0,0123 моль) в N,N-диметилформамиде (20 мл). Смесь перемешивают и кипятят с обратным холодильником при RT в течение 12 часов и затем в течение ночи. Добавляют EtOAc. Органический слой отделяют, промывают водой, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: циклогексан/2-пропанол/NН4ОН 90/10/0,5). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из DIPE. Осадок отфильтровывают и высушивают, получая 2,04 г (49,5%) N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] фенил]-2-бензоксазоламина (соединение 56).
Пример В-7.
Смесь промежуточного соединения 2 (0,0123 моль), 1-хлор-2-пропанона (1,08 мл) и этанола (20 мл) перемешивают и кипятят с обратным холодильником в течение 3 часов. Смесь охлаждают и упаривают растворитель. Остаток переносят в CH2Cl2 и промывают с помощью К2СО3 (10%) и воды. Органический слой высушивают, фильтруют и упаривают. Остаток кристаллизуют из 2-пропанона и (C2H5)2O, получая 3,08 г (80%) (±)-N-[4-[1-(1Н-имидазол-1-ил)-2-метилпропил] фенил]-4-метил-2-тиазоламина (соединение 50).
Пример В-8.
Смесь промежуточного соединения 2 (0,0269 моль), 2-бром-1,1-диэтоксиэтана (0,035 моль) в НСl (11,8 мл; 3 н.) и этанола (200 мл) перемешивают и кипятят с обратным холодильником в течение 3 часов. Смесь охлаждают и упаривают. Остаток переносят в СН2Сl2 и К2СО3 (10%) и экстрагируют с помощью CH2Cl2. Органический слой промывают водой и К2СО3 (10%), высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,2). Собирают чистые фракции и упаривают. Остаток кристаллизуют из 2-пропанона и DIPE, получая 0,9 г (11%) (±)-N-[4-[1-(1Н-имидазол-1-ил)-2-метилпропил]фенил]-2-тиазоламина (соединение 51).
Пример В-9.
Ацетат метанимидамида (0,0309 моль) добавляют к раствору соединения 113 (0,0155 моль) в 1-метил-2-пирролидиноне (35 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 2 часов, затем охлаждают, выливают в воду и экстрагируют с помощью CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток (28,4 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 96/4/0,1). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из СН3ОН. Осадок отфильтровывают, промывают диэтиловым эфиром и высушивают, получая 1,66 г (±)-N2-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] фенил]тиазоло[5,4-d]пиримидин-2,7-диамина (соединение 117).
Пример В-10.
Смесь промежуточного соединения 43 (0,0089 моль) и СН3ОNа 30% в СН3ОН (0,0445 моль) в СН3ОН (81 мл) перемешивают и кипятят с обратным холодильником в течение 15 часов. Смесь охлаждают, выливают в воду, насыщают NaCl и экстрагируют CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток (3,3 г) очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4OН 95/5/0,2; 15-40 мкм). Собирают две чистые фракции и упаривают растворитель. Фракцию 1 кристализуют из 2-бутанона и диэтилового эфира. Осадок отфильтровывают и высушивают, получая 0,6 г (A) N-[4-[1-(1Н-имидазол-1-ил)-3-метокси-2-метилпропил]фенил]-2-бензотиазоламина (соединение 86).
Пример В-11.
NаВН3СN (0,009 моль) добавляют порциями при -4oС в токе N2 к раствору промежуточного соединения 56 (0,009 моль) в метаноле (100 мл). Смесь перемешивают в течение 1 часа, затем выливают в К2СО3 10% и лед и экстагируют с помощью CH2Cl2. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН от 95,5/4,5/0,2 до 93/7/0,3; 15-40 мкм). Собирают две чистые фракции и упаривают растворитель. Остаток кристаллизуют из 2-бутанона. Осадок отфильтровывают, промывают диэтиловым эфиром и высушивают, получая 0,61 г (В) N-[4-[2-(диметиламино)-1-(1-метил-1Н-имидазол-5-ил)пропил]фенил]-2-бензотиазоламина (18%) (соединение 109).
Пример В-12.
SnCl2 (0,156 моль) и НС1 12 н. (0,562 моль) добавляют к смеси соединения 126 (0,039 моль) в уксусной кислоте (159 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи, затем выливают на лед, подщелачивают концентрированным раствором NН4ОН и экстрагируют с помощью CH2Cl2. Органический слой отделяют, фильтруют через целит, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 97,5/2,5/0,2; 15-40 мкм). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из 2-пропанона и диэтилового эфира. Осадок отфильтровывают и высушивают, получая 1,19 г (8%) (±)-N-[4-[2-этил-1-(1-метил-1Н-имидазол-2-ил)бутил]фенил1-2-бензотиазоламина (соединение 110).
Пример В-13.
Соединение 34 (0,0053 моль) растворяют в кипящем этилацетате (15 мл). Н3РO4 (85%; 2,5 мл) добавляют по каплям при перемешивании. В результате образуется маслянистый осадок. Супернатант удаляют декантированием и на оставшееся масло выливают 2-пропанон (20 мл). Смесь энергично перемешивают. Осадок отфильтровывают и высушивают, получая 3,0 г (82%) моногидрата фосфата (1:3) (В)-N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил] фенил] -2-бензотиазоламина (соединение 87).
Пример В-14.
Смесь промежуточного соединения 26 (0,156 моль), 1Н-1,2,4-триазола (0,313 моль) и К2СО3 (0,313 моль) в СН3СN (800 мл) перемешивают и кипятят с обратным холодильником в течение 12 часов. Растворитель упаривают, остаток переносят в СН2Сl2/Н2O. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 98/2/0,1). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из диэтилового эфира. Осадок отфильтровывают и высушивают, получая 16,8 г (±)-N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]-2-бензотиазоламина (26%) (соединение 25).
Пример В-15.
н-Бутиллитий (1,6 М; 0,0607 моль) добавляют по каплям при -70oС в токе N2 к раствору 1-метил-1Н-имидазола (0,0607 моль) в THF (60 мл). Смесь перемешивают при -70oС в течение 30 мин. Смесь промежуточного соединения 24 (0,0243 моль) в THF (60 мл) добавляют по каплям. Смесь перемешивают и выливают в воду и NH4Cl. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4ОН 98/2/0,2). Собирают две чистые фракции и упаривают растворитель. Остаток кристаллизуют из диэтилового эфира и метилэтилкетона. Осадок отфильтровывают и высушивают, получая 2,4 г (24%) (А)-α-[4-(2-бензотиазолиламино)фенил] -α-[1-(диметиламино)этил]-1-метил-1Н-имидазол-2-метанола (соединение 127) и 0,66 г (6%) (В)-α-[4-(2-бензотиазолиламино)фенил] -α-[1-(диметиламино)этил] -1-метил-1Н-имидазол-2-метанола (соединение 128).
Пример В-16.
(А)-α-[4-(2-бензотиазолиламино)фенил] -α-[1-(диметиламино)этил] -1-метил-1Н-имидазол-5-метанол (соединение 130) получают способом, описанным в примере В-15, с тем исключением, что хлор-3-этилсилан (эквимолярное количество с 1-метил-1Н-имидазолом) добавляют в реакционную смесь перед добавлением промежуточного соединения 24.
Пример В-17.
Смесь промежуточного соединения 19b (0,0409 моль) в 1-метил-2-пирролидиноне (40 мл) добавляют по каплям к раствору аминопропандинитрила (0,045 моль) в 1-метил-2-пирролидиноне (100 мл). Смесь перемешивают при RT в течение 15 часов, затем выливают в воду и экстрагируют с помощью EtOAc. Органический слой отделяют, высушивают, фильтруют и упаривают растворитель. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН/NН4OН 97/3/0,1). Собирают чистые фракции и упаривают растворитель. Остаток кристаллизуют из метилэтилкетона и диэтилового эфира. Осадок отфильтровывают и высушивают, получая 0,96 г (±)-5-амино-2-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]амино-4-тиазолкарбонитрила (соединение 113).
Таблицы с 1 по 6 включают список соединений формулы (I), которые получают в соответствии со способами приведенных выше примеров.
В Таблице 7 приведены экспериментальные (столбцы, озаглавленные "эксп") и теоретические (столбцы, озаглавленные "теор") значения элементарного анализа для углерода, водорода и азота соединений, полученных для соединений примеров, описанных выше.
С. Фармакологические примеры.
Пример C.1. Ингибирование метаболизма ретиноевой кислоты (RA).
Раковые клетки молочной железы человека MCF-7 выращены в качестве исходной культуры в соответствии с известными методиками. За один день до начала эксперимента к stock культуре добавляют RA, чтобы стимулировать метаболизм RA. В начале эксперимента суспензию клеток инкубируют в тканевой культуральной среде, содержащей 3H-RA в качестве субстрата. Различные концентрации тестируемых соединений (растворенных в 1% DMSO) добавляют к инкубационной смеси и в конце инкубации неметаболизированную RA отделяют от ее полярных метаболитов. Фракцию, содержащую полярные 3H-меченые метаболиты, собирают и проверяют с помощью сцинтилляционного счетчика. Для каждого эксперимента параллельно проводят контрольную и пустую инкубации. Все те соединения, которые были проверены, т.е. соединения 1-4, 8, 10, 16-18, 24, 25, 27, 29-31, 33, 34, 35, 37, 40, 44-47, 49-51, 53, 56 и 58, имеют значение IC50 ниже 1x10-8 М, где значение IC50 определяется как концентрация, необходимая для снижения количества метаболитов до 50% от контроля.
Пример С. 2. Тест на вагинальную кератинизацию у овариэктомизированных крыс.
Овариэктомизированным крысам подкожно инъецируют раствор кунжутного масла, содержащий 100 мкг ундецилата эстрадиола, в объеме 0,1 мл на 100 г веса тела, а контрольным крысам инъецируют кунжутное масло. На первый, второй и третий день животных раз в день обрабатывали per оs дозой исследуемых веществ, а контрольных животных обрабатывали носителем лекарства (ПЭГ 200). Через день после последней обработки животных убивают и их влагалища подвергают гистологическому анализу в соответствии со способом, описанным в J.Pharmacol. Exp. Ther., 261(2), 773-779 (1992). Доза, при которой у 50% исследуемых животных наблюдается полное подавление стимулированного ундецилатом эстрадиола эффекта кератинизации, определяют как активную дозу. Соединения 2-5, 8, 15-19, 25, 27-29, 31, 32, 34, 42, 46 и 56 имели самую низкую активную дозу (LAD), 2,5 мг/кг или ниже. Другие из протестированных соединений имели LAD выше 2,5 мг/кг.
D. Примеры композиций.
Следующие препаративные формы приведены в качестве примера типичных фармацевтических композиций, пригодных для системного или местного введения животным и человеку, в соответствии с настоящим изобретением.
Термин "активный ингредиент" (A.I.), как он используется в этих примерах, относится к соединениям формулы (I) или их фармацевтически приемлемым солям присоединения кислоты.
Пример D.1. Раствор для перорального введения.
9 г метил-4-гидроксибензоата и 1 г пропил-4-гидроксибензоата растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворяют сначала 10 г 2,3-дигидроксибутандиовой кислоты и затем 20 г A.I. Последний раствор объединяют с оставшейся частью первого раствора и к нему добавляют 12 л 1,2,3-пропантриола и 3 л 70% раствора сорбитола. 40 г сахарина натрия растворяют в 0,5 л воды и добавляют 2 мл малиновой и 2 мл крыжовенной эссенции. Последний раствор объединяют с первым, добавляют воду до объема 20 л, получая раствор для перорального введения, содержащий 5 мг A.I. на чайную ложку (5 мл). Полученный раствор разливают в соответствующие емкости.
Пример D.2. Капли для перорального введения.
500 г A.I. растворяют в 0,5 л 2-гидроксипропановой кислоты и 1,5 л полиэтиленгликоля при 60-80oС. После охлаждения до 30-40oС добавляют 35 л полиэтиленгликоля и смесь хорошо перемешивают. Затем добавляют раствор 1750 г сахарина натрия в 2,5 л очищенной воды и при перемешивании добавляют 2,5 л ароматизатора с запахом какао и полиэтиленгликоль в количестве, необходимом, чтобы довести объем до 50 л, получая капли для перорального введения, содержащие 10 мг/мл A.I. Полученный раствор разливают в соответствующие емкости.
Пример D.3. Капсулы.
20 г A.I., 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидального диоксида кремния и 1,2 г стеарата магния энергично перемешивают вместе. Полученную смесь последовательно разливают в 1000 подходящих твердых желатиновых капсул, причем каждая содержит 20 мг A.I.
Пример D.4. Раствор для инъекций.
0,5 г A.I., 1,50 мг безводной глюкозы и 0,332 мл концентрированной соляной кислоты смешивают с 0,8 мл воды для инъекций. Добавляют гидроксид натрия, пока не будет достигнуто значение рН=3,2±0,1, и добавляют воду до 1 мл. Раствор стерилизуют и разливают в стерильные емкости.
Пример D.5. Таблетки, покрытые пленкой.
Получение сердцевины таблетки.
Смесь 100 г A.I., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют с помощью раствора 5 г додецилсульфата натрия и 10 г поливинилпирролидона (Kollidon-K 90®) в приблизительно 200 мл воды. Влажную порошкообразную смесь просеивают, высушивают и снова просеивают. Добавляют 100 г микрокристаллической целлюлозы (Avicel®) и 15 г гидрогенированного растительного масла (Sterotex®). Все хорошо перемешивают и прессуют в таблетки, получая 10000 таблеток, причем каждая содержит 10 мг активного компонента.
Покрытие оболочкой.
К раствору 10 г метилцеллюлозы (Methocel 60 HG®) в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы (Ethocel 22 cps®) в 150 мл дихлорметана. Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 г полиэтиленгликоля расплавляют и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому и затем добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии (Opaspray K-1-2109®) и все гомогенизируют. Сердцевины таблеток покрывают полученной таким образом смесью в установке для покрытия пленкой.
Пример D.6. 2% крем.
75 мг стеарилового спирта, 2 мг цетилового спирта, 20 мг моностеарата сорбита и 10 мг изопропилмиристата помещают внутрь сосуда с кожухом с двойными стенками и нагревают до тех пор, пока смесь окончательно не расплавится. Смесь добавляют в приготовленную отдельно смесь очищенной воды, 200 мг пропиленгликоля и 15 мг полисорбата 60, имеющую температуру от 70 до 75oС, причем используется гомогенизатор для жидкостей. Полученной эмульсии позволяют остыть до температуры ниже 25oС, непрерывно перемешивая. Затем добавляют к эмульсии раствор 20 мг A.I., 1 мг полисорбата 80 в очищенной воде и раствор 2 мг безводного сульфита натрия в очищенной воде, непрерывно перемешивая. Крем, 1 г A.I., гомогенизируют и помещают в подходящие тюбики.
Пример D.7. 2% гель для местного применения.
К раствору 200 мг гидроксипропил-b-циклодекстрина в очищенной воде добавляют при перемешивании 20 мг A.I., добавляют соляную кислоту до полного растворения и затем добавляют гидроксид натрия до тех пор, пока не будет достигнуто значение рН 6,0. Этот раствор добавляют к дисперсии 10 мг carrageenan PJ в 50 мг пропиленгликоля при перемешивании. Медленно перемешивая, смесь нагревают до 50oС и позволяют остыть до приблизительно 35oС, после чего добавляют 50 мг 95% этилового спирта (об/об). Добавляют остаток очищенной воды до 1 г и смесь перемешивают до гомогенного состояния.
Пример D.8. 2% крем для местного применения.
К раствору 200 мг гидроксипропил-b-циклодекстрина в очищенной воде добавляют при перемешивании 20 мг A.I., добавляют соляную кислоту до полного растворения и затем добавляют гидроксид натрия до тех пор, пока не будет достигнуто значение рН 6,0. При перемешивании добавляют 50 мг глицерина и 35 мг полисорбата 60 и нагревают смесь до 70oС. Полученную смесь добавляют к смеси 100 мг минерального масла, 20 мг стеарилового спирта, 20 мг цетилового спирта, 20 мг моностеарата глицерина и 15 мг сорбата 60, имеющей температуру 70oС, при медленном перемешивании. После охлаждения ниже 25oС добавляют остаток очищенной воды до 1 г и смесь перемешивают до гомогенного состояния.
Пример D.9. 2% липосомный состав.
Смесь 2 г A.I. microfine, 20 г фосфатидилхолина, 5 г холестерола и 10 г этилового спирта перемешивают и нагревают до 55-60oС до полного растворения и добавляют к раствору 0,2 г метилпарабена, 0,02 г пропилпарабена, 0,15 г динатриевой соли эдетовой кислоты и 0,3 г хлорида натрия в очищенной воде, гомогенизируя. Добавляют 0,15 г гидроксипропилметилцеллюлозы в очищенной воде до 100 г, продолжают перемешивать до тех пор, пока не закончится разбухание.
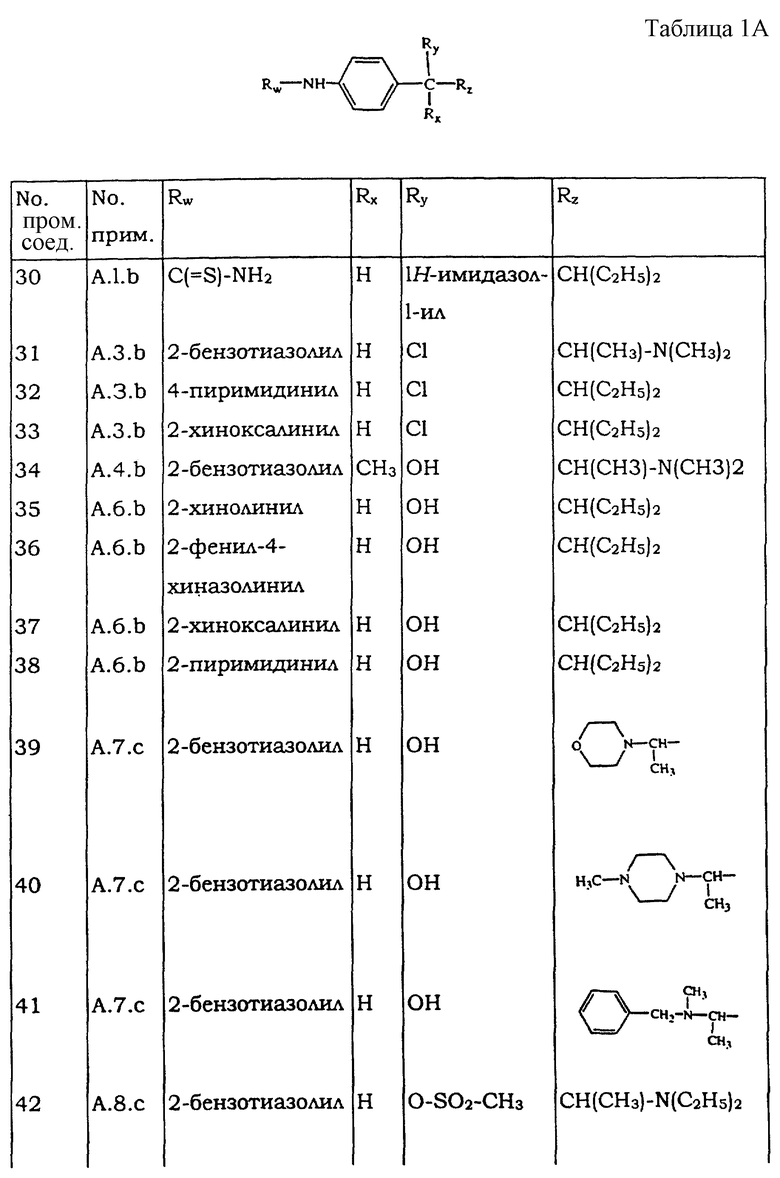
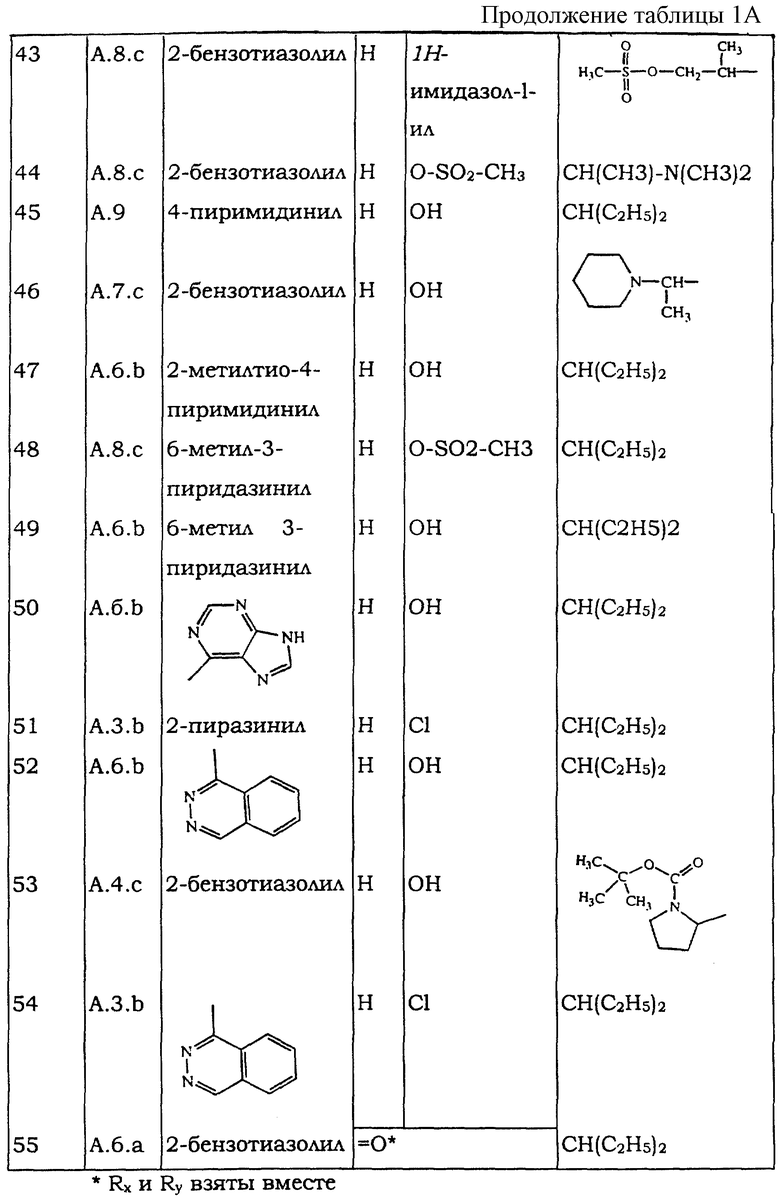
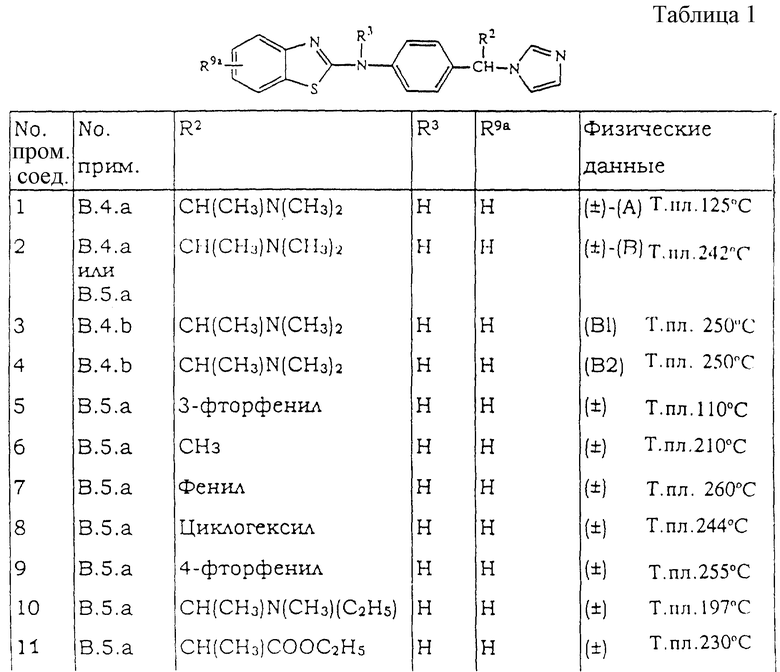
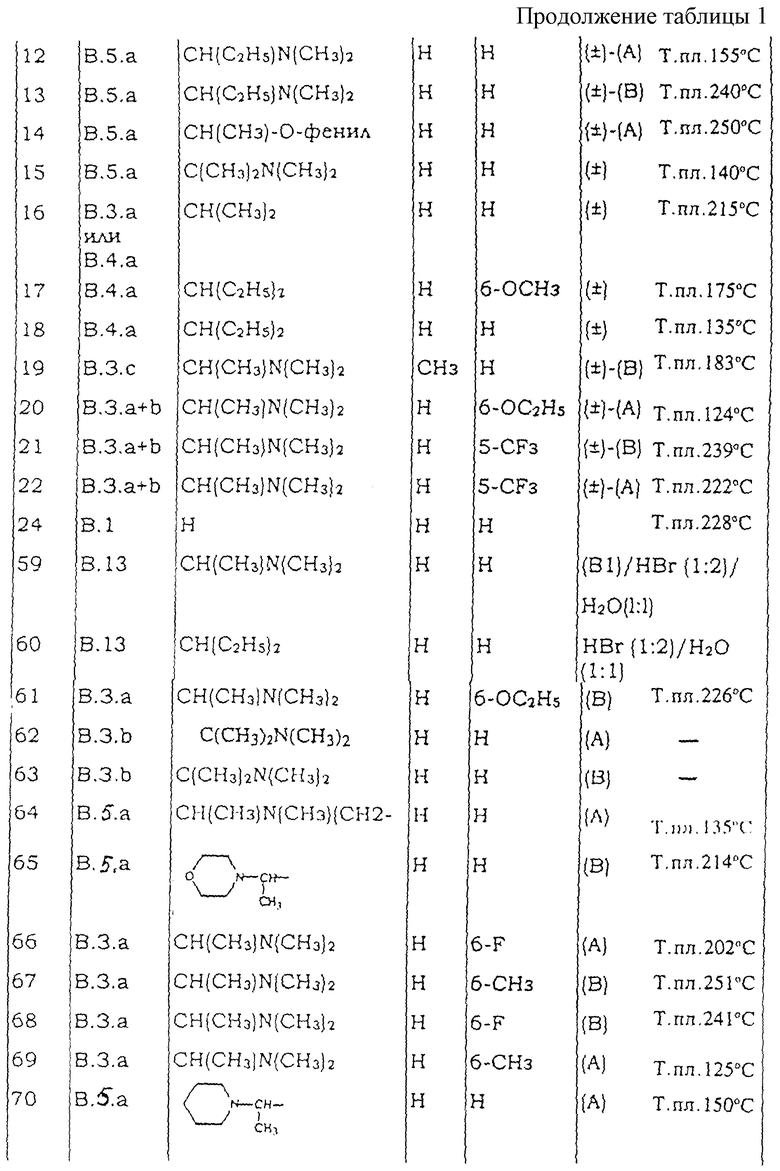
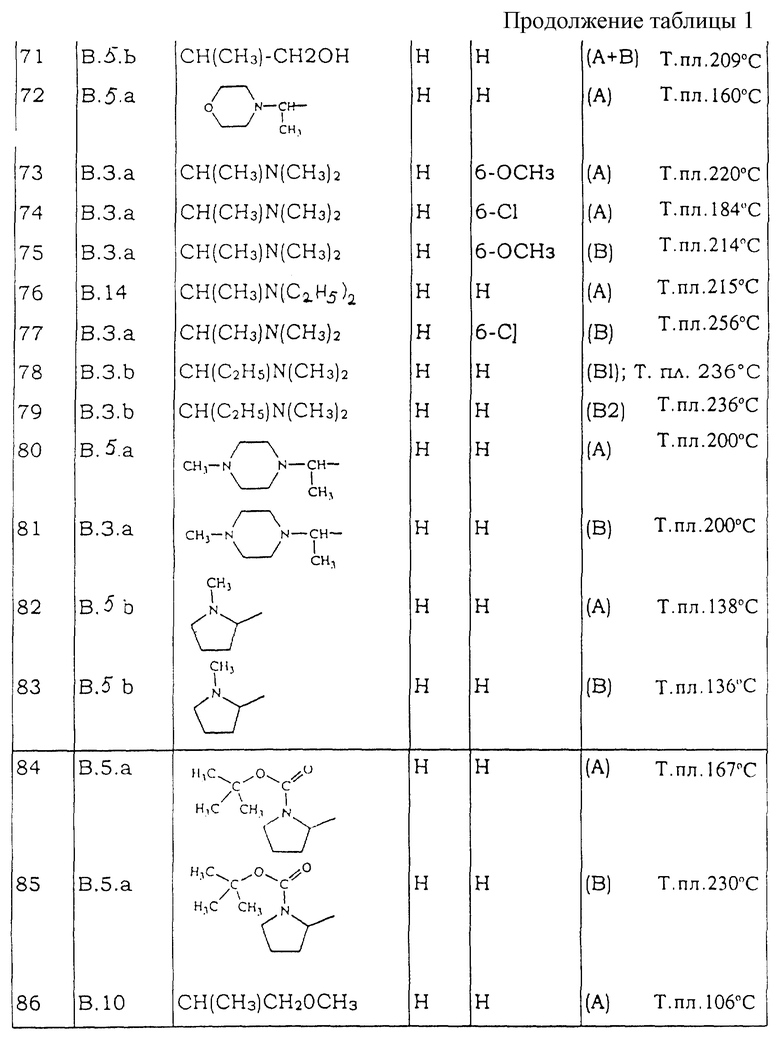
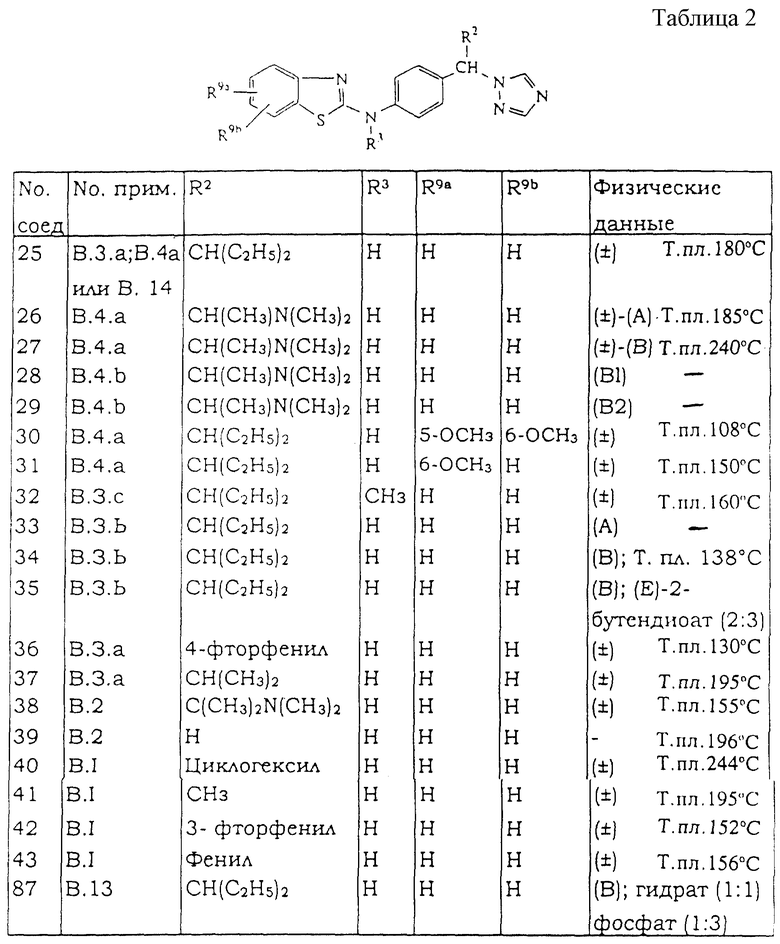
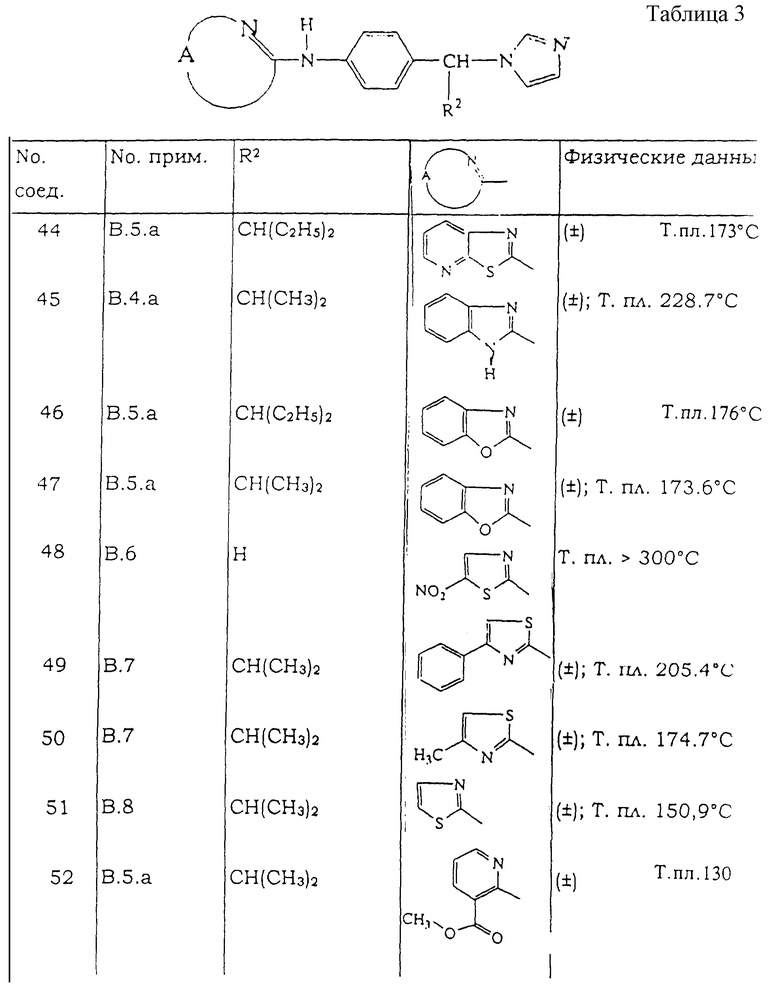
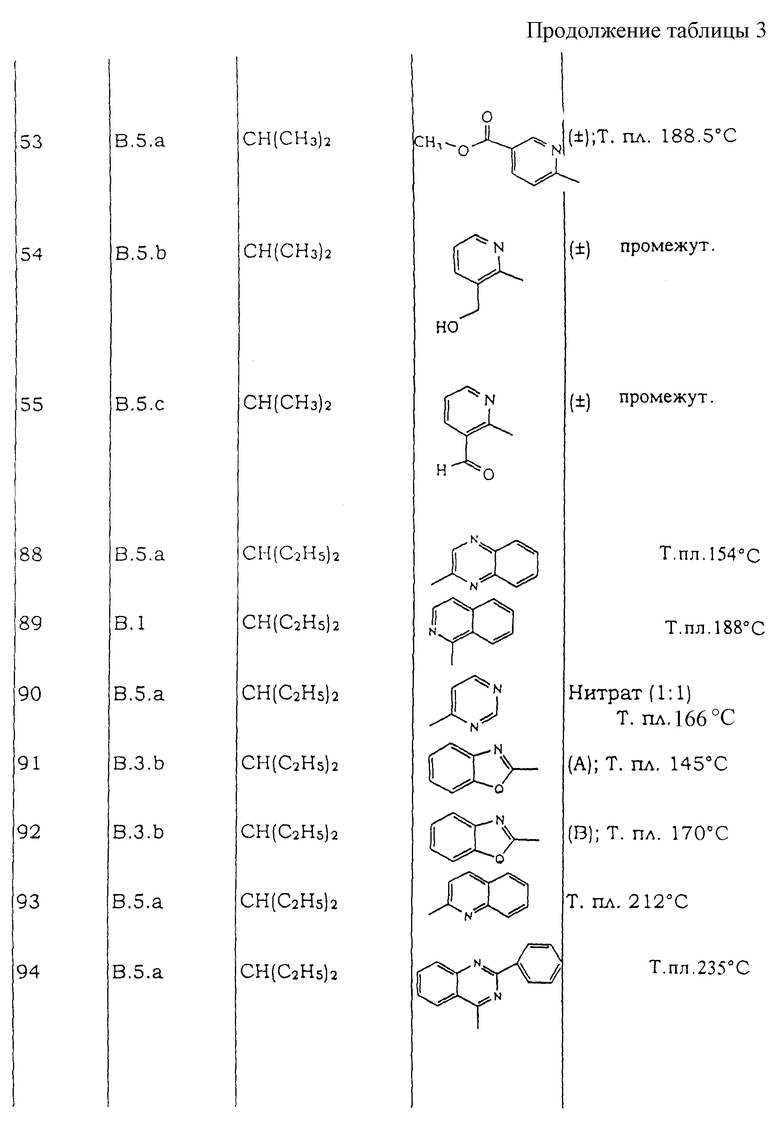
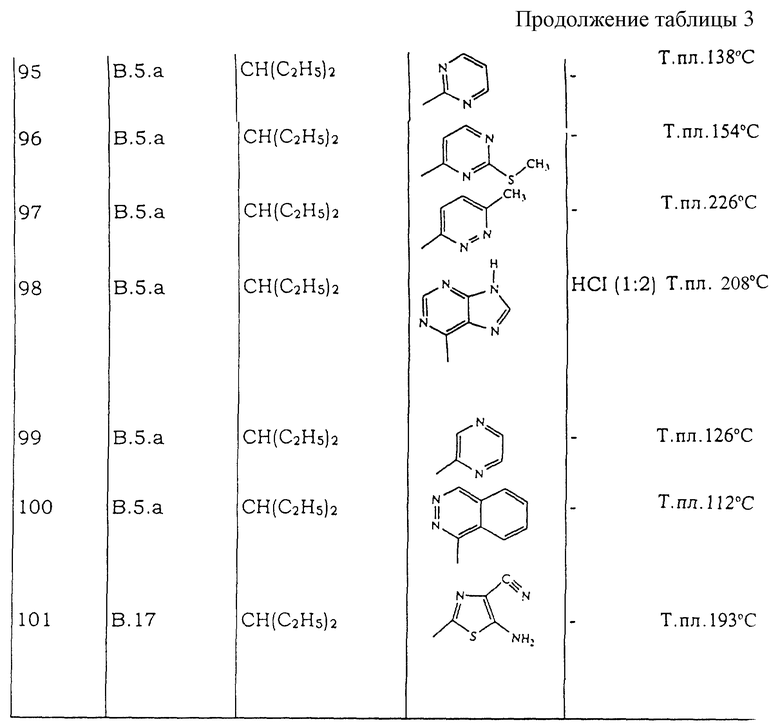
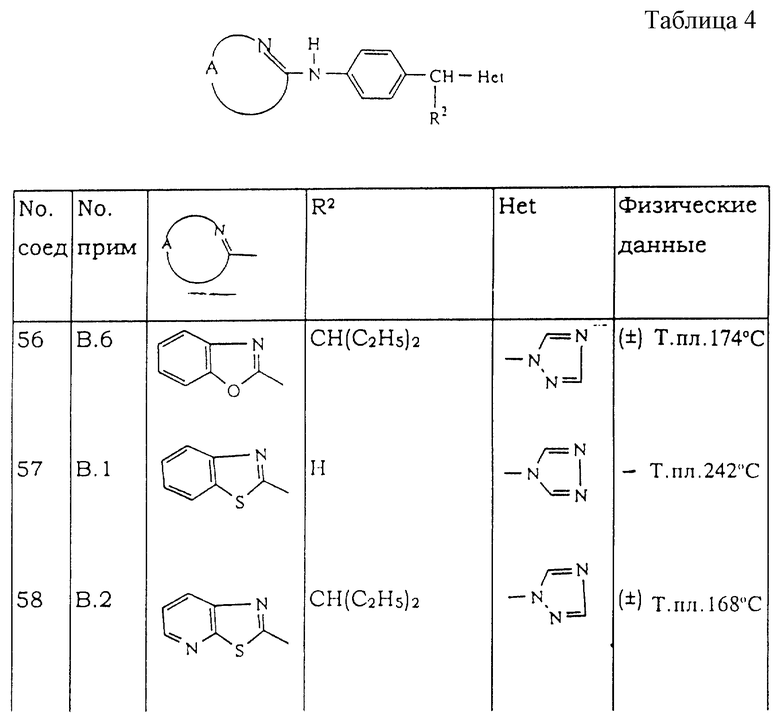
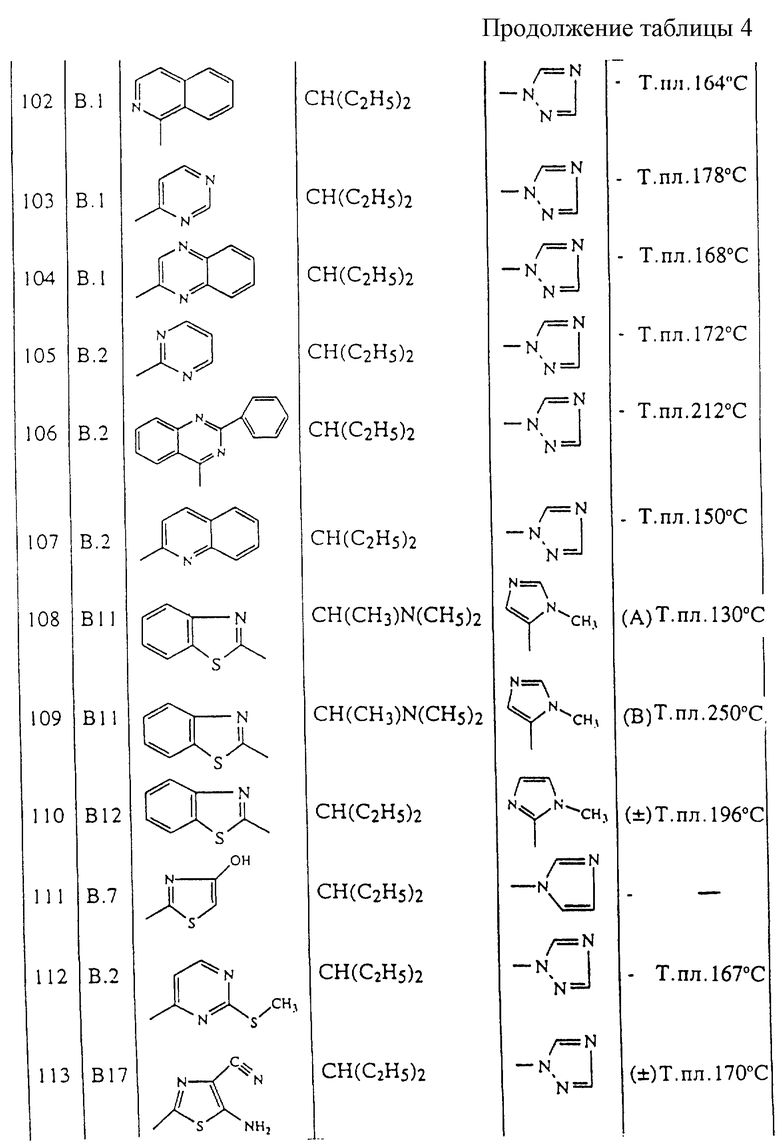
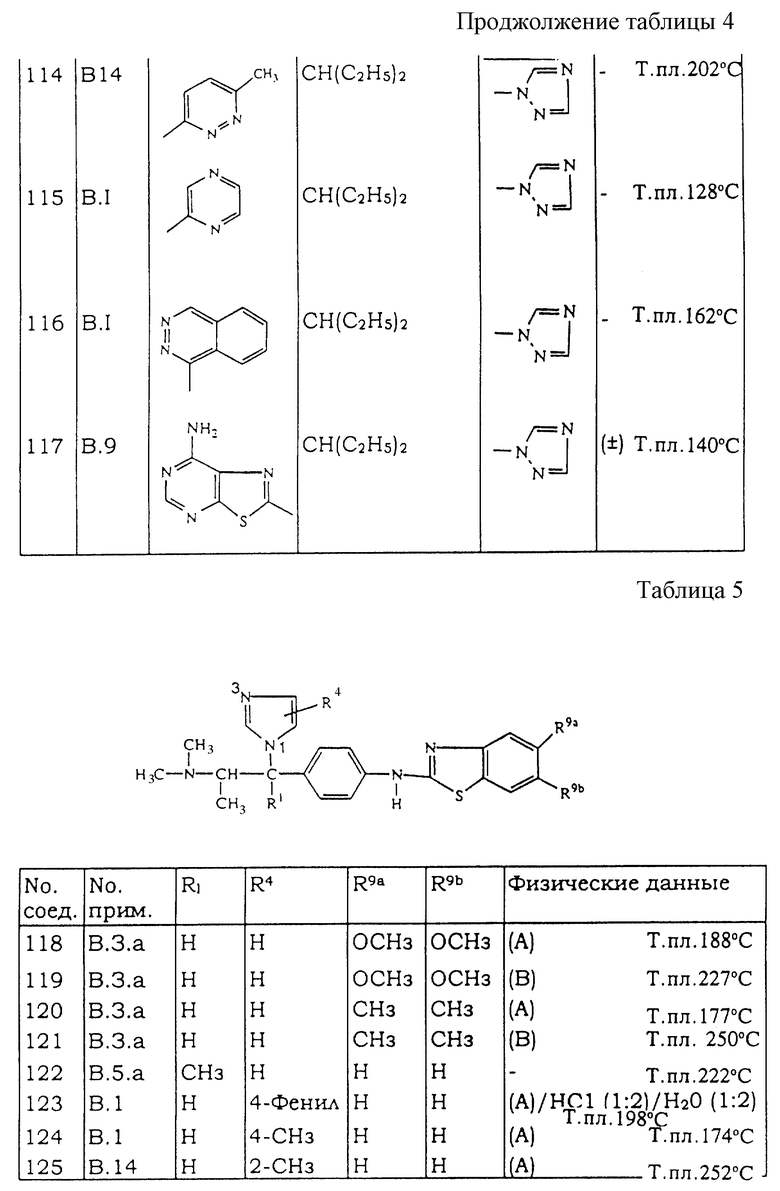
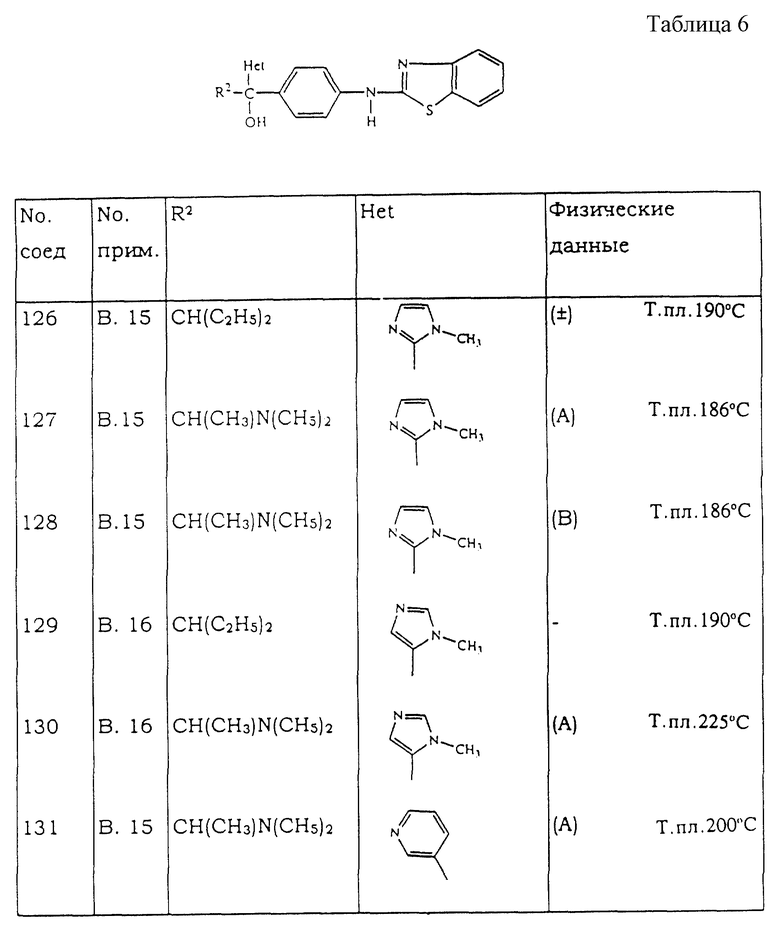
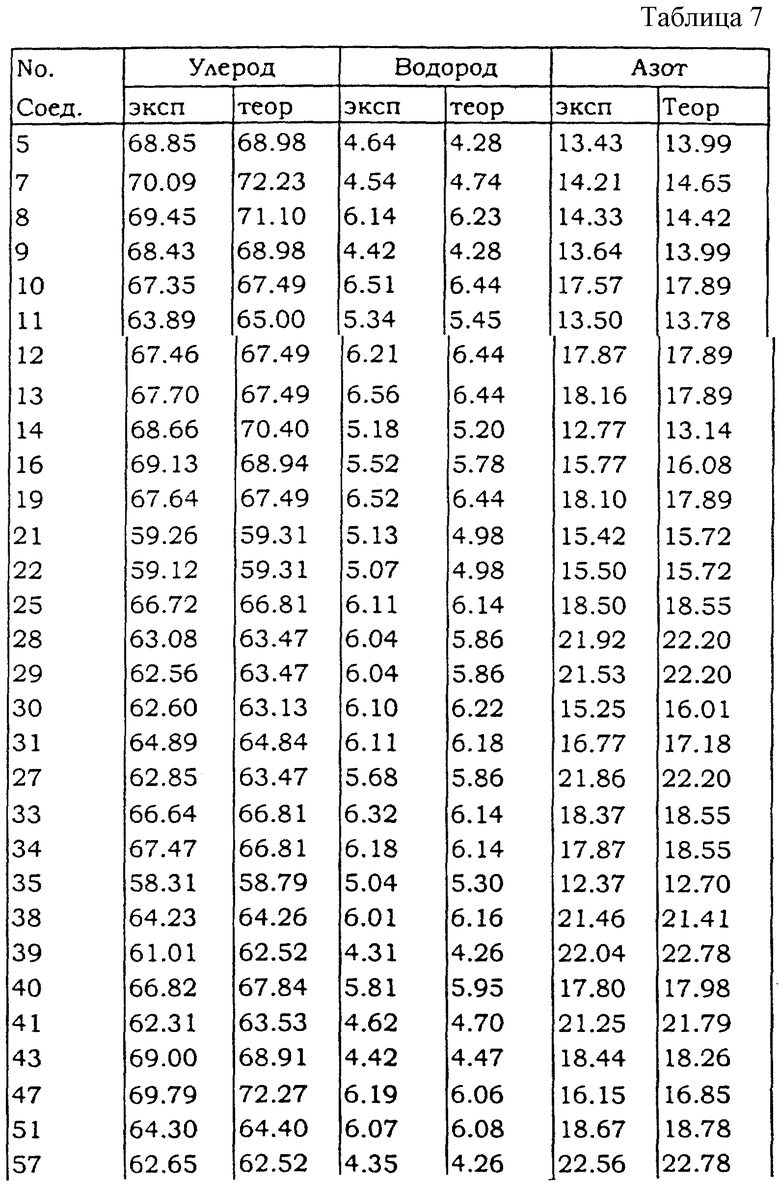
Изобретение раскрывает соединения формулы (I), где R1, R2, R3, Het и 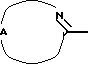 охарактеризованы в описании, а также их N-оксиды, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы. Описывается также получение фармацевтической композиции, обладающей ингибирующей активностью в отношении метаболизма ретиноевой кислоты, включающей терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель. Приводятся способы получения соединения формулы (I). 12 с. и 8 з.п.ф-лы, 8 табл.
охарактеризованы в описании, а также их N-оксиды, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы. Описывается также получение фармацевтической композиции, обладающей ингибирующей активностью в отношении метаболизма ретиноевой кислоты, включающей терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель. Приводятся способы получения соединения формулы (I). 12 с. и 8 з.п.ф-лы, 8 табл.
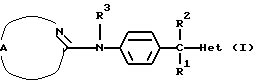
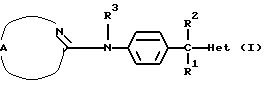
их N-оксиды, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы,
где R1 представляет собой водород, гидроксильную группу или С1-6алкил;
R2 представляет собой водород, С1-12алкил; С3-7циклоалкил; арил; пирролидинил, необязательно замещенный С1-4алкилом или С1-4алкилоксикарбонилом; или С1-12алкил, замещенный С1-4алкилоксигруппой, аминогруппой, моно- и ди(С1-4алкил)аминогруппой, (С1-4алкил)(арилС1-4алкил)аминогруппой, пиперидинилом, пиперазинилом, необязательно замещенным С1-4алкилом, морфолинилом, С1-4алкилоксикарбонилом и арилоксигруппой;
R3 представляет собой водород, С1-6алкил;
Het представляет собой ненасыщенный гетероцикл, выбранный из имидазолила, триазолила и пиридинила; каждый из указанных ненасыщенных гетероциклов может быть необязательно замещен С1-6алкилом;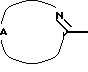
представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из пиридинила, пиридазинила, пиримидинила, пиразинила, хинолинила, изохинолинила, фталазинила, хиназолинила и хиноксалинила; каждый из указанных моно- или бициклических гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из С1-6алкила, гидроксиС1-6алкила, С1-6алкилтиогруппы, формила, С1-6алкилоксикарбонила или арила, или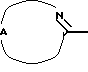
представляет собой радикал формулы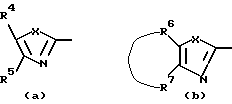
где каждый Х независимо представляет собой NR8, О, S, S(=O) или S=(O)2, где R8 является водородом или C1-6алкилом;
R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, цианогруппу, нитрогруппу, аминогруппу, С1-6алкил или арил;
-R6-R7- представляют собой бивалентный радикал формулы
-CR9=CR9-CR9=CR9- (b-1);
-CR9=CR9-CR9=N - (b-5);
-CR9=N-CR9=N- (b-7) или
-N=CR9-N=CR9- (b-10),
где каждый R9 независимо представляет собой водород, галоген, аминогруппу, С1-6алкил или галогенС1-6алкил, и арил представляет собой фенил или фенил, замещенный галогеном.
представляет собой ненасыщенный моно- или бициклический гетероцикл, выбранный из группы, состоящей из 2-пиридинила, 3-пиридазинила, 2-пиримидинила, 4-пиримидинила, 2-пиразинила, 2-хинолинила, 1-изохинолинила, 3-изохинолинила, 1-фталазинила, 2-хиназолинила, 4-хиназолинила и 2-хиноксалинила; каждый из указанных ненасыщенных моно- или бициклических гетероциклов может быть необязательно замещен одним или двумя заместителями, выбранными из C1-6алкила, гидроксиС1-6алкила, формила, С1-6алкилоксикарбонила или арила, или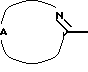
представляет собой радикал формулы (а) или (b), где R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, нитрогруппу, аминогруппу, С1-6алкил или арил.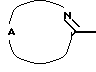
представляет собой 2-пиридинил, необязательно замещенный гидроксиС1-6алкилом, формилом или С1-6арилоксикарбонилом; 2-хиноксалинил; 1-изохинолинил; 2-хинолинил; 3-пиридазинил, необязательно замещенный С1-6алкилом; 2-пиразинил; 1-фталазинил; 4-хиназолинил, необязательно замещенный арилом; 2-пиримидинил; 4-пиримидинил, необязательно замещенный С1-6 алкилтиогруппой, или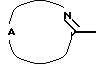
представляет собой радикал формулы (а) или (b), где Х представляет собой NH, О или S; R4 или R5, каждый независимо, представляет собой водород, гидроксильную группу, нитрогруппу, цианогруппу, аминогруппу, С1-6алкил или арил; -R6-R7- представляет собой бивалентный радикал формулы (b-1) или (b-10), где каждый R9 независимо представляет собой водород, С1-6алкил, галоген, аминогруппу, галогенС1-6алкил.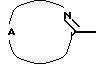
представляет собой радикал формулы (b), где Х представляет собой О или S и -R6-R7- представляет собой бивалентный радикал формулы (b-1).
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил]фенил]-2-бензотиазоламина;
N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]-2-бензотиазоламина;
N-[4-[2-этил-1-(1Н-1,2,4-триазол-1-ил)бутил]фенил]-2-бензотиазоламина;
N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)пропил] фенил] -2-бензотиазоламина;
N-[4-[2-(диметиламино)-1-(1Н-1,2,4-триазол-1-ил)пропил] фенил] -2-бензотиазоламина;
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил]фенил]-2-бензоксазоламина;
N-[4-[2-этил-1-(1Н-имидазол-1-ил)бутил] фенил] -6-метокси-2-бензотиазоламина;
N-[4-[2-(диметиламино)-1-(1Н-имидазол-1-ил)-2-метилпропил] фенил] -2-бензотиазоламина;
N-[4-[2-(диметиламино)-2-метил-1-(1Н-1,2,4-триазол-1-ил)-пропил] фенил] -2-бензотиазоламина;
N-[4-[циклогексил-(1Н-имидазол-1-ил)метил]фенил]-2-бензотиазоламина;
N-[4-[циклогексил-(1Н-1,2,4-триазол-1-ил)метил] фенил] -2-бензотиазоламина,
его N-оксида, стереохимически изомерной формы и фармацевтически приемлемой соли присоединения.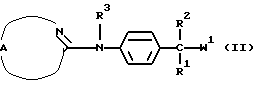
где R1-R3 и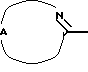
определены в п.1;
W1 является соответствующей уходящей группой,
с Het-H (III) или его функциональным производным, где Het определен в п. 1, в инертном по отношению к реакции растворителе и в присутствии подходящего основания и необязательно в присутствии трифенилфосфина и диэтилазодикарбоксилата или функционального производного любого из указанных реагентов.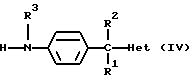
где R1-R3 и Het определены в п.1, промежуточным продуктом формулы (V)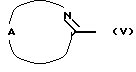
где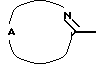
определен в п.1 и W2 является соответствующей уходящей группой,
в инертном по отношению к реакции растворителе.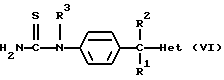
где R1-R3 и Het определены в п.1,
с промежуточным соединением формулы (VII) или его функциональным производным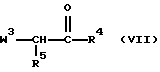
где R4 и R5 определены в п.1 и W3 является соответствующей уходящей группой,
в инертном по отношению к реакции растворителе, необязательно в присутствии кислоты, образуя, таким образом, соединение формулы (I-a-I)
14. Способ получения соединения по п.1,
включающий взаимодействие промежуточного соединения формулы (VIII)
где R1, R2 и Het определены в п.1, с промежуточным соединением формулы (IХ-I)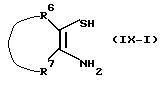
где -R6-R7- определены в п.1,
в инертном по отношению к реакции растворителе, образуя, таким образом, полупродукт формулы (I-b-1)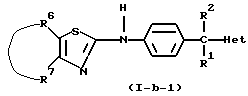
15. Способ получения соединения по п.1, включающий реакцию промежуточного соединения формулы (VIII)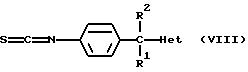
где R1, R2 и Het определены в п.1,
с промежуточным соединением формулы (IX-2)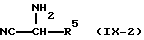
где -R5 определен в п.1,
в инертном по отношению к реакции растворителе, образуя, таким образом, промежуточное соединение формулы (I-а-2)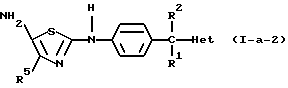
16. Способ получения соединения по п.1, включающий реакцию промежуточного соединения формулы (X)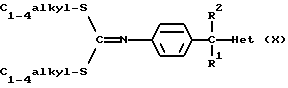
где R1, R2 и Het определены в п.1,
с промежуточным соединением формулы (IX-1) в инертном по отношению к реакции растворителе и в присутствии подходящего основания, образуя, таким образом, промежуточное соединение формулы (I-b-1).
| ЕР 0501552 А1, 02.09.1992 | |||
| RU 2059637 C1, 10.05.1996 | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2002-10-10—Публикация
1997-06-19—Подача