Настоящее изобретение относится к антителам к рецептору интерлейкина-1 (IL-1R), способам их получения, фармацевтическим композициям, содержащим указанные антитела, и их применению.
Пути трансдукции сигнала, активируемые провоспалительным цитокином интерлейкином-1 (IL-1альфа и IL-1бета), являются предметом интенсивного исследования из-за важной роли, которую играет IL-1 в воспалительных заболеваниях, и его участия в воспалительных процессах и разрушении суставов, связанном с ревматоидным артритом.
Описан целый ряд белков, принимающих участие в пострецепторной активации фактора транскрипции ядерного фактора каппаВ (NF-каппаВ) и активируемых стрессом протеинкиназ, таких как активируемая митогеном р38 протеинкиназа (МАРК). Рецептор интерлейкина-1 (IL-1R, Swiss Prot. P14778, CD 121a) является представителем этой сигнальной системы, которая представляет собой имеющую решающее значение детерминанту врожденного иммунного и воспалительного ответа. Подход к лечению ревматоидного артрита в настоящее время претерпел существенное эволюционное изменение как в результате возросшего внимания к серьезности этого состояния, так и в результате весьма значительного прогресса в понимании важной роли цитокинов в иммунопатогенезе этого заболевания. Основное внимание сконцентрировано на понимании важной роли целенаправленного воздействия на TNFα и IL-1. В современных научных публикациях представлены данные о том, что применение некоторых биологических агентов, оказывающих воздействие на TNFα, привело к существенному облегчению симптомов и признаков ревматоидного заболевания, а также что блокада TNFα защищает суставы от структурного повреждения. Анакинра (Anakinra) представляет собой антагонист рецептора интерлейкина-1 (IL-1 rа), который блокирует действия, опосредуемые IL-1.
В US 6511665 заявлено моноклональное антитело, которое специфически связывается с человеческим рецептором IL-1 и блокирует связывание IL-1 с рецептором IL-1.
Объектом настоящего изобретения являются новые антитела к IL-1R, которые являются ценными терапевтическими средствами лечения воспалительных заболеваний типа ревматоидного артрита.
Краткое изложение сущности изобретения
При создании изобретения неожиданно были обнаружены антитела к IL-1R, которые характеризуются значением IC50, составляющим 35 пМ или ниже, в отношении ингибирования опосредуемой IL-1 секреции IL-8 (на человеческих эмбриональных легочных фибробластах, таких как клетки линии MRC-5).
Антитела, предлагаемые в изобретении, обладают специфичностью в отношении эпитопа IL-1R на нативном и денатурированном IL-1R и ингибируют связывание IL-1 с IL-1R и последующую трансдукцию сигнала (активацию ядерного фактора каппаВ (NF-каппаВ)). Антитела связываются с растворимым доменом IL-1R в гликозилированной форме и их аффинность характеризуется значением KD 300 пМ, предпочтительно 200 пМ или менcc.Антитела обладают существенно более низкой аффинностью к связыванию с дегликозилированным IL-1R.
Антитела, предлагаемые в изобретении, ингибируют связывание IL-1 с IL-1R in vitro и in vivo и вследствие этого ингибируют образование комплекса в виде триады (тройного комплекса), состоящего из IL-1, рецептора IL-1 и IL-1Racp (добавочный белок рецептора интерлейкина-1; Q9NPH3).
Изобретение относится к антителу, которое связывается с человеческим IL-1R и ингибирует связывание человеческого IL-1 с IL-1R, отличающемуся тем, что указанное антитело предпочтительно можно получать из клеток гибридомы линии MAK<h-IL-1RI>2D8 (DSM АСС 2601), или оно представляет собой химерный, гуманизированный или с элиминированным Т-клеточным эпитопом вариант антитела или фрагмент указанного антитела, значение IC-50 которого в отношении ингибирования опосредуемой IL-1 секреции IL-8 составляет 35 пМ или менее на клетках человеческих фибробластов линии MRC5 (АТСС CCL 171).
Антитела, предлагаемые в изобретении, предпочтительно не обладают эффекторной функцией (ADCC (антитело-обусловленная клеточнозависимая цитотоксичность) и CDC (комплементзависимая цитотоксичность)) и вследствие этого являются представителями изотипа IgG4. Особенно предпочтительной является мутация, приводящая к замене серина в положении 228 на пролин (Angal S. и др., Mol. Immunol., 30, 1993, cc.105-108). В другом варианте эти антитела относятся к изотипу IgG1 и предпочтительно несут модификацию в шарнирной области, затрагивающую примерно аминокислоты (ак) 220-240 между СН1 и СН2, и/или во второй внутридоменной области, затрагивающую примерно ак 330 между СН2 и СН3 (нумерация дана согласно Кэботу, см., например, Johnson G. и Wu T.T., Nucleic Acids Res., 28, 2000, cc.214-218), в результате чего они не обладают эффекторной функцией. Переключение изотипа в классе IgG можно легко осуществлять путем замены константной области тяжелой и легкой цепей антитела на тяжелую и легкую цепи антитела требуемого класса типа IgG1 или IgG4. Такие методы хорошо известны в данной области.
Антитела, предлагаемые в изобретении, обладают ценными свойствами для пациентов, нуждающихся в противовоспалительной терапии. Антитела, предлагаемые в изобретении, отличаются новыми и обладающими признаками изобретения свойствами, обусловливающими ценность для пациентов, которые страдают указанным заболеванием, прежде всего страдают ревматоидным артритом. Антитела, предлагаемые в изобретении, отличаются вышеуказанными свойствами.
Предпочтительно также, чтобы антитело было получено из организма крысы и включало рамку последовательности крысиного антитела согласно Кэботу. Предпочтительно в последовательностях Кэбота аминокислота 10 (серин) удалена в результате делеции из VL-цепи (DEL10) и/или аминокислота 26 (глицин) в VH -цепи заменена на глутаминовую кислоту (G26E). Предпочтительно антитело представляет собой антитело с элиминированным Т-клеточным эпитопом, которое получают с помощью методов, описанных в WO 98/08097.
Предпочтительно также, чтобы антагонист IL-1R (Arend W.P., J. Clin. Invest., 88, 1991, cc.1445-1451) не ингибировал связывание IL-1R (10 нМ) с иммобилизованным антителом, предлагаемым в изобретении, в концентрации вплоть до 100 мкМ (антагонист IL-1R), т.е. чтобы связывание антитела, предлагаемого в изобретении, с IL-1R не ингибировалось антагонистом IL-1R.
Константная область предпочтительно представляет собой константную область человеческого IgG1 или человеческого IgG4 согласно Кэботу Е. (см. ниже). Предпочтительные константные области представлены на фиг.14, 15 и 16.
Изобретение относится также к нуклеиновым кислотам, кодирующим антитела. Кодируемые полипептиды можно объединять с соответствующей цепью другого антитела, указанной ниже: тяжелой цепью антитела, содержащей в качестве CDR CDR1 (ак 45-54), CDR2 (ак 69-84) и CDR3 (ак 117-123), представленной в SEQ ID NO:1, легкой цепью антитела, содержащей в качестве CDR CDR1 (ак 43-57), CDR2 (ак 73-79) и CDR3 (ак 112-120), представленной в SEQ ID NO:2. Нумерация CDR и определение даны согласно Кэботу Е. (см., например, Johnson G. и Wu T.T., Nucleic Acids Res., 28, 2000, cc.214-218), включая сигнальные последовательности.
Предпочтительно нуклеиновая кислота кодирует полипептид, тяжелая цепь которого содержит вариабельную область (VH), представленную в SEQ ID NO:1, и легкая цепь которого содержит вариабельную область (VL), представленную в SEQ ID NO:2.
Антитело предпочтительно представляет собой моноклональное антитело, а также химерное антитело (с человеческой константной цепью), гуманизированное антитело и прежде всего предпочтительно антитело с элиминированным Т-клеточным эпитопом.
Связывание антитела с человеческим IL-1R является конкурентным к связыванию антител, отличающихся вариабельными цепями, которые представлены в SEQ ID NO:1-2.
Антитело дополнительно отличается тем, что его аффинность характеризуется значением KD 300 пМ, предпочтительно 200 пМ или менее и более предпочтительно примерно 70-200 пМ.
Таким образом, изобретение относится также к полипептиду и кодирующей нуклеиновой кислоте, выбранным из вышеуказанной группы, которая включает CDR1, CDR2, CDR3 тяжелой цепи и CDR1, CDR2, CDR3 легкой цепи антитела к IL-1R, предлагаемого в изобретении.
Изобретение относится также к линиям клеток гибридом, которые продуцируют такие антагонистические моноклональные антитела, предлагаемые в изобретении.
Предпочтительную линию клеток гибридомы, предлагаемую в изобретении, MAK<h-IL-1RI>2D8 депонировали в соответствии с Будапештским договором о международном признании регистрации микроорганизмов для цели патентования в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)), Германия 10 июля 2003 г. под регистрационным номером DSM АСС 2601.
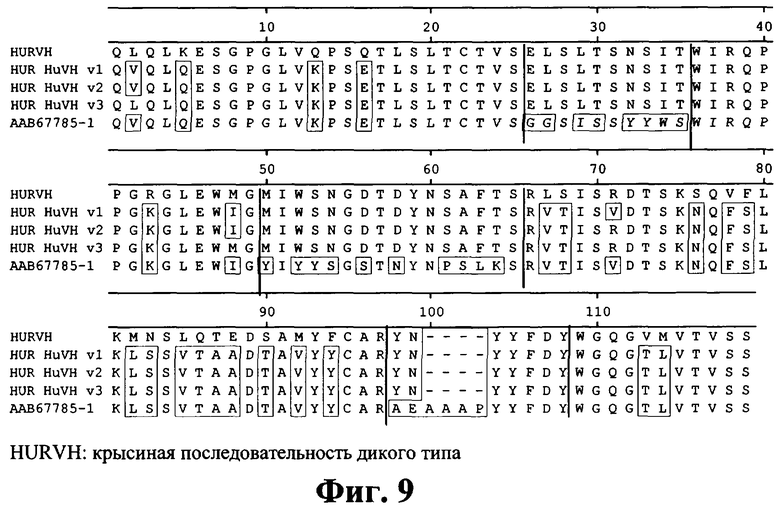
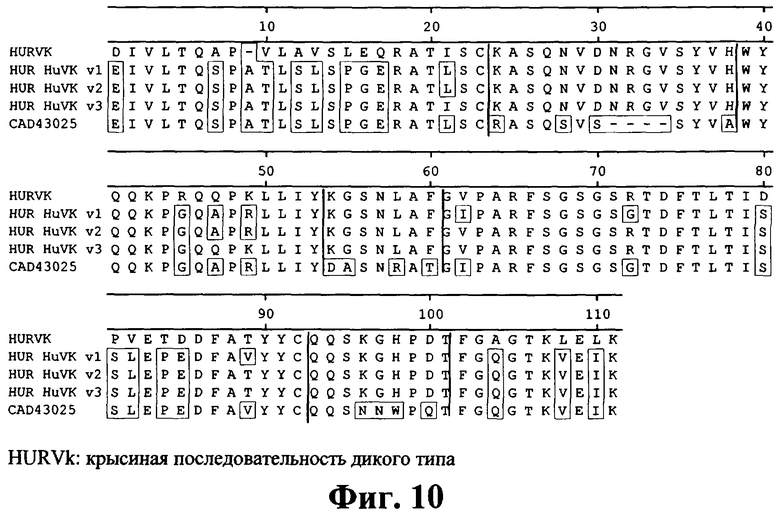
Антитело, которое можно получать с помощью этой линии клеток, представляет собой предпочтительный вариант осуществления изобретения. Предпочтительными являются также все антитела, которые можно образовывать из вариабельных и константных областей, представленных на фиг.7-10 и 14-16, и значение IC-50 которых, характеризующее ингибирование опосредуемой IL-1 секреции IL-8 в клетках человеческих фибробластов линии MRC5 (АТСС CCL 171), составляет 35 пМ или менее. Эти последовательности являются примерами последовательностей, которые получали путем модификации последовательности антитела 2D8 с целью создания улучшенных антител, которые сохраняют очень высокие свойства антитела 2D8, такие как IC-50 и/или характеристики эпитопа. В таких антителах легкие цепи и тяжелые цепи, представленные на фиг.7 и 8 (с элиминированным Т-клеточным эпитопом) или на фиг.9-10 (гуманизированные), объединяют с константной областью, представленной на фиг.14 и фиг.15 или 16. Наиболее предпочтительными являются антитела DEI5/7, DEI4/7, DEI2/4, DEI5/4, DEI4/5, DEI5/5, HUM2/2, HUM2/3, DEI1/8, DEI2/8, DEI2/9, DEI4/9, DEI5/8 и DEI5/9.
В изобретении предложен также способ идентификации и/или получения антитела к IL-1R, предлагаемого в изобретении, с улучшенными свойствами. Способ заключается в том, что полипептидную последовательность антитела 2D8 модифицируют путем мутации, делеции или добавления аминокислот с целью придания антителу меньшей иммуногенности при введении людям. В целом, для снижения иммуногенности модифицируют примерно вплоть до 50 аминокислот в вариабельной области тяжелой цепи и легкой цепи. Эту модификацию осуществляют путем сравнения полипептидной последовательности антитела 2D8 и последовательностей человеческих антител, описанных у Кэбота (loc. cit.), и/или идентификации и элиминации Т-клеточных эпитопов в вариабельных цепях. Примеры указанных модификаций представлены на фиг.7-10. Пригодные антитела можно получать путем одной или нескольких замен аминокислот, которые заключены в рамки на этих фигурах. Предпочтительно модифицируют примерно 20-50 аминокислот вариабельных цепей в областях, которые на фигурах заключены в рамки.
Таким образом, в изобретении предложен способ получения антитела, предлагаемого в изобретении, отличающийся тем, что в последовательностях вариабельных областей антитела 2D8 одну или несколько аминокислот изменяют путем мутации, изымают путем делеции или добавляют к соответствующей(им) заключенной(ым) в рамку аминокислоте(ам), представленной(ым) на фиг.7-10, создают экспрессионный вектор, содержащий нуклеиновую кислоту, которая кодирует вариабельные области модифицированного антитела и дополнительные человеческие константные области, предпочтительно представленные на фиг.14-16, в последовательной рамке считывания, осуществляют экспрессию в клетке-хозяине и полученные рекомбинантным путем легкую и тяжелую цепи антитела объединяют с антителом, предлагаемым в изобретении.
Изобретение относится также к нуклеиновым кислотам, которые кодируют указанные антитела, экспрессионным векторам, содержащим указанные нуклеиновые кислоты, и клеткам-хозяевам, содержащим указанные векторы, для рекомбинантного получения указанных антител.
В изобретении предложен также способ рекомбинантного получения указанных антител.
В изобретении предложены также способы лечения ревматоидного артрита и/или остеоартрита, заключающиеся в том, что пациенту, у которого диагностирован ревматоидный артрит (и который, следовательно, нуждается в таком лечении), вводят эффективное количество антагонистического антитела к IL-1R, предлагаемого в изобретении. Антитело предпочтительно вводят в составе фармацевтической композиции.
Изобретение относится также к применению антитела, предлагаемого в изобретении, для лечения ревматоидного артрита и для приготовления фармацевтической композиции, предлагаемой в изобретении. Кроме того, в изобретении предложен способ приготовления фармацевтической композиции, предлагаемой в изобретении.
Изобретение относится также к фармацевтической композиции, которая содержит антитело, предлагаемое в изобретении, в фармацевтически эффективном количестве, необязательно в сочетании с буфером и/или другими эсципиентами, пригодными для получения препарата антител для фармацевтических целей.
Изобретение относится также к фармацевтическим композициям, содержащим указанные антитела в фармацевтически приемлемом носителе. В одном из вариантов осуществления изобретения фармацевтическая композиция может быть включена в изделие или набор.
Изобретение относится также к вектору, содержащему нуклеиновую кислоту, предлагаемую в изобретении, который может экспрессировать указанную нуклеиновую кислоту в прокариотической или эукариотической клетке-хозяине.
Изобретение относится также к прокариотической или эукариотической клетке-хозяину, которая содержит вектор, предлагаемый в изобретении.
В изобретении предложен также способ получения рекомбинантного человеческого антитела, предлагаемого в изобретении, отличающийся тем, что экспрессируют нуклеиновую кислоту, предлагаемую в изобретении, в прокариотической или эукариотической клетке-хозяине и выделяют антитело из указанной клетки. Изобретение относится также к антителу, которое можно получать с помощью такого метода рекомбинации.
Подробное описание изобретения
Понятие «антитело» относится к различным формам антител, включая (но не ограничиваясь ими) полные антитела, фрагменты антител, гуманизированные антитела, химерные антитела, антитела с элиминированными Т-клеточными эпитопами, а также созданные с помощью генной инженерии антитела, если они сохраняют отличительные признаки, предлагаемые в изобретении.
Понятие «фрагменты антител» относится к части полноразмерного антитела, как правило, по меньшей мере к антигенсвязывающему центру или его вариабельной области. Примерами фрагментов антител являются двойные антитела, молекулы одноцепоченых антител, иммунотоксины и мультиспецифические антитела, образованные из фрагментов антител. Кроме того, фрагменты антител представляют собой одноцепочечные полипептиды, которые имеют характеристики вариабельной области тяжелой цепи (VH-цепь), а именно обладают способностью объединяться с VL-цепью или с VL-цепью, которая связывается с IL-1R, а именно, обладают способностью объединяться с VH-цепью с образованием функционального антигенсвязывающего кармана и в результате обладают способностью ингибировать связывание IL-1 с IL-1R.
Понятия «моноклональное антитело» или «композиция моноклонального антитела» в контексте настоящего описания относятся к препарату, содержащему молекулы антитела, которые имеют одинаковый состав аминокислот. Понятие «химерное антитело» относится к моноклональному антителу, содержащему крысиную вариабельную область, т.е. связывающую область, и по меньшей мере одну часть константной области из другого источника или других видов, как правило, полученному с помощью методов рекомбинантной ДНК. Особенно предпочтительными являются химерные антитела, содержащие крысиную вариабельную область и человеческую константную область. Такие крысиные/человеческие химерные антитела представляют собой продукт экспрессированных генов иммуноглобулина, которые содержат ДНК-сегменты, кодирующие вариабельные области крысиного иммуноглобулина, и ДНК-сегменты, кодирующие константные области человеческого иммуноглобулина. Другие формы «химерных антител», подпадающие под объем настоящего изобретения, представляют собой такие формы, в которых класс или подкласс модифицированы или заменены относительно исходного антитела. Такие «химерные» антитела обозначают также как «антитела переключенного класса». Методы получения химерных антител включают общепринятые методы, основанные на применении рекомбинантной ДНК и генной трансфекции, которые в настоящее время хорошо известны в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad Sci. USA 81, 1984, cc.6851-6855; US 5202238 и 5204244).
Понятие «гуманизированное антитело» относится к антителам, в которых каркасный участок или «гипервариабельные участки» (CDR) модифицированы таким образом, что они содержат CDR иммуноглобулина другой специфичности по сравнению с родительским иммуноглобулином. В предпочтительном варианте осуществления изобретения крысиные CDR трансплантируют в каркасный участок человеческого антитела, получая «гуманизированное антитело» (см., например, Riechmann L. и др., Nature 332, 1988, cc.323-327; и Neuberger M.S. и др. Nature 314, 1985, cc.268-270). Наиболее предпочтительные CDR соответствуют репрезентативным последовательностям, которые распознают антигены, указанные выше для химерных и бифункциональных антител. Примеры гуманизированных антител, предлагаемых в изобретении, представлены на фиг.9 и 10.
Понятие «антитело с элиминированным Т-клеточным эпитопом» относится к антителам, которые были модифицированы с целью устранения или снижения иммуногенности путем удаления человеческих Т-клеточных эпитопов (пептидные последовательности в белках, которые обладают способностью связываться с молекулами класса II ГКГ). С помощью этого метода идентифицируют взаимодействия между боковыми цепями аминокислот пептида и специфических «карманов», которые связываются со связывающими желобками молекул класса II ГКГ. Идентифицированные иммуногенные области подвергают мутациям для элиминации иммуногенности. Такие методы в целом описаны, например, в WO 98/52976. Примеры приемлемых вариабельных областей антител с элиминированными Т-клеточными эпитопами, предлагаемых в изобретении, и которые можно применять согласно изобретению, представлены на фиг.7 и 8.
В контексте настоящего описания понятие «связывание» относится к связыванию антител с IL-1R с аффинностью, характеризующейся значением KD примерно 300 пМ или менее, предпочтительно примерно 200 пМ или менее и наиболее предпочтительно примерно 70-200 пМ.
Понятие «молекула нуклеиновой кислоты» в контексте настоящего описания относится к молекулам ДНК и молекулам РНК. Молекула нуклеиновой кислоты может быть одноцепочечной или двухцепочечной, но предпочтительно представляет собой двухцепочечную ДНК.
Понятие «вариабельная область» (вариабельная область легкой цепи (VL), вариабельная область тяжелой цепи (VH)) в контексте настоящего описания в каждом случае обозначает пару легких и тяжелых цепей, которые непосредственно принимают участие в связывании антитела с антигеном. Домены вариабельных областей легких и тяжелых цепей имеют некоторую общую структуру и каждый домен содержит 4 каркасных участка (FR), последовательности которых являются высококонсервативными, связанных тремя «гипервариабельными участками» (CDR). Каркасные участки принимают β-складчатую конформацию, а CDR-участки могут образовывать петли, связанные с β-складчатой структурой. CDR-участки в каждой цепи поддерживаются в виде трехмерной структуры с помощью каркасных участков и формируют с CDR-участками другой цепи антигенсвязывающий центр. CDR3-участки тяжелой и легкой цепи антитела играют очень важную роль в специфичности связывания/аффинности антител, предлагаемых в изобретении, и вследствие этого являются дополнительным объектом изобретения.
Понятия «гипервариабельный участок» или «антигенсвязывающий центр антитела» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывание с антигеном. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность областей» или «CDR». «Каркасные» или «РР»-участки представляют собой участки вариабельной области, остатки которых отличны от остатков гипервариабельного участка, как они определены в настоящем описании. Таким образом, легкие и тяжелые цепи антитела содержат в направлении от N- к С-концу домены FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR3 тяжелой цепи представляет собой основной участок, который обеспечивает главным образом связывание с антигеном. К CDR- и FR-участкам относятся участки, которые предопределяют согласно стандартному принципу Кэбота и др., «Sequences of Proteins of Immunological Interest», 5-е изд., Public Health Service, National Institutes of Health, Bethesda, MD (1991)), и/или остатки из «гипервариабельной петли».
Понятие «связывание с IL-1R» в контексте настоящего описания обозначает аффинность к связыванию антитела с IL-1R, что определяют in vitro с помощью ELISA, предпочтительно с помощью анализа связывания с использованием биотинилированного человеческого IL-1R и сенсибилизированных стрептавидином титрационных микропланшетов. Аффинность к связыванию с IL-1R можно оценивать также с помощью анализа Biacore (Biacore АВ, Уппсала, Швеция). Аффинность связывания характеризуют с помощью таких параметров, как kon (константа скорости реакции ассоциации антитела из комплекса антитело/антиген), koff (константа диссоциации) и КD (kon/koff). Для антител, предлагаемых в изобретении, установлено, что значение KD составляет 300 пМ или менее, предпочтительно 200 пМ или менее и более предпочтительно 70-200 пМ, и они ингибируют связывание с IL-1R и предпочтительно связываются с IL-1R в том же сайте, что и IL-1.
Понятие «экспрессирующие IL-1R клетки» относится к таким клеткам, которые экспрессируют рецептор IL-1. Примерами таких клеток являются, например, клетки человеческих фибробластов, например, клетки линии MRC5.
Установлено, что антитела, предлагаемые в изобретении, связываются с тем же эпитопом IL-1R, что и антитело 2D8, или ингибируют связывание с IL-1R, создавая стерическую помеху связыванию. Ингибирование связывания можно оценивать с помощью сравнительного анализа с использованием иммобилизованного IL-1R и антитела 2D8. Снижение сигнала на 50% или более свидетельствует о том, что антитело конкурирует с антителом 2D8.
Понятие «эпитоп» означает белковую детерминанту, обладающую способностью специфически связываться с антителом. Эпитопы, как правило, состоят из химически активных поверхностных групп молекул, таких как аминокислоты или боковые цепи сахаров, и, как правило, имеют характеристики специфической трехмерной структуры, а также специфические характеристики зарядов. Конформационные и неконформационные эпитопы различаются тем, что связывание с эпитопами первого, но не второго типа нарушается в присутствии денатурирующих растворителей. Эпитоп IL-1R, с которым специфически связываются антитела, предлагаемые в изобретении, распознается антителом, предлагаемым в изобретении, как на нативном, так и на денатурированном IL-1R. Антитело, предлагаемое в изобретении, связывается с человеческим IL-1R (гликозилированный растворимый внеклеточный домен) примерно по меньшей мере в 50 раз, предпочтительно по меньшей мере в 100 раз сильнее, чем с дегликозилированным IL-1R (после обработки N-гликозидазой F, оценка методом Вестерн-блоттинга). Таким образом, антитело, предлагаемое в изобретении, характеризуется существенно более низкой аффинностью к связыванию с дегликозилированным IL-1R.
К антителам, предлагаемым в изобретении, относятся также антитела, несущие «консервативные модификации последовательностей», модификации нуклеотидных и аминокислотных последовательностей, которые не оказывают воздействия или не изменяют вышеуказанные характеристики антитела, предлагаемого в изобретении. Модификации можно интродуцировать стандартными методами, известными в данной области, такими как сайтнаправленный мутагенез и опосредуемый ПЦР мутагенез. Консервативные аминокислотные замены включают замены, при которых аминокислотный остаток заменяют аминокислотным остатком с такой же боковой цепью. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, известно в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, выбранный остаток заменимой аминокислоты в человеческом антителе к IL-1R предпочтительно можно заменять другим аминокислотным остатком из семейства с такой же боковой цепью.
Аминокислотные замены можно осуществлять путем мутагенеза, основанного на молекулярном моделировании, согласно методу, описанному у Riechmann L. и др., Nature 332, 1988, cc.323-327 и у Queen С.и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.10029-10033.
Антитела, предлагаемые в изобретении, предпочтительно характеризуются временем полужизни в сыворотке, которое составляет примерно по меньшей мере 5 дней in vivo (в организме обезьяны-крабоеда циномолгус (Cynomolgus) или человека), предпочтительно 8-15 дней.
Антитела, предлагаемые в изобретении, предпочтительно получают с помощью методов рекомбинации. Такие методы широко известны в данной области и заключаются в том, что белок экспрессируют в прокариотических и эукариотических клетках с последующим выделением полипептида антитела и, как правило, очисткой до фармацевтически приемлемого уровня. Для экспрессии белков нуклиновые кислоты, кодирующие легкие и тяжелые цепи или их фрагменты, встраивают в экспрессионные векторы стандартными методами. Экспрессию осуществляют в приемлемых прокариотических или эукариотических клетках-хозяевах типа СНО-клеток, NS0-клеток, SР2/0-клеток, НЕК293-клеток, COS-клеток, дрожжей или клеток E.coli, и антитело выделяют из клеток (супернатант или клетки после лизиса).
Рекомбинантное получение антител хорошо известно в данной области и описано, например, в обзорных статьях Makrides S.C., Protein Expr. Purif. 17, 1999, cc.183-202; Geisse S. и др. Protein Expr. Purif. 8, 1996, cc.271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, cc.151-161; Wemer R.G., Drug Res. 48, 1998, cc.870-880.
Антитела могут присутствовать в неповрежденных клетках, в клеточном лизате или находиться в частично очищенной или практически чистой форме. Очистку осуществляют для того, чтобы элиминировать другие клеточные компоненты или другие загрязнители, например другие клеточные нуклеиновые кислоты или белки, с помощью стандартных методов, таких как обработка щелочью/додецилсульфатом натрия (НДС), CsCl-бэндинг, хроматография на колонках, электрофорез в агарозном геле и другие методы, хорошо известные в данной области (см. Current Protocols in Molecular Biology, под ред. Ausubel F. и др., изд-во Greene Publishing and Wiley Interscience, New York, 1987).
Экспрессия в NS0-клетках описана, например, у Barnes L.M. и др., Cytotechnology, 32, 2000, cc.109-123; и Barnes L.M. и др., Biotech. Bioeng., 73, 2001, cc.261-270. Кратковременная экспрессия описана, например, у Durocher Y. и др., Nucl. Acids. Res., 30, 2002, с.Е9. Клонирование вариабельных доменов описано у Oriandi R. и др., Proc. Natl. Acad. Sci. USA 86,1989, cc.3833-3837; Carter P. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc.4285-4289; и у Norderhaug L. и др., J. Immunol. Methods 204, 1997, cc.77-87. Предпочтительная система для кратковременной экспрессии (НЕК 293) описана у Schlaeger E.-J. и Christensen К. в: Cytotechnology 30, 1999, cc.71-83 и у Schlaeger E.-J. в: J. Immunol. Methods 194, 1996, cc.191-199.
Контролирующие последовательности, которые можно применять, например, для прокариот, включают промотор, необязательно последовательность оператора и сайт связывания рибосом. Известно, что для эукариотических клеток применяют промоторы, энхансеры и сигналы полиаденилирования.
Нуклеиновая кислота «функционально связана», когда она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК пре-последовательности или лидерной секреторной последовательности функционально связана с ДНК полипептида, если при ее экспрессии образуется пре-белок, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, что облегчает трансляцию. Как правило, понятие «функционально связан» означает, что последовательности ДНК, будучи связаны, являются смежными, а в случае лидера секреции, смежными и находятся в рамке считывания. Однако энхансеры не должны быть смежными. Связывание осуществляют путем лигирования в соответствующих сайтах рестрикции. Если такие сайты не существуют, то в соответствии с принятой практикой применяют синтетические олигонуклеотидные адаптеры или линкеры.
Моноклональные антитела можно отделять от культуральной среды с помощью общепринятых методов очистки иммуноглобулинов, таких, например, как хроматография на протеин А-сефарозе, гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография. ДНК и РНК, которые кодируют моноклональные антитела, легко выделять и секвенировать с помощью общепринятых методов. Клетки гибридом могут служить источником таких ДНК и РНК. После выделения для осуществления синтеза рекомбинантных моноклональных антител в клетках-хозяевах ДНК можно встраивать в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как НЕК 293-клетки, СНО-клетки или клетки миеломы, которые в любом ином варианте не могут продуцировать белок иммуноглобулина.
Варианты аминокислотных последовательностей антитела к человеческому IL-1R получают путем интродукции соответствующих нуклеотидных замен в ДНК антитела или с помощью пептидного синтеза. Однако такие модификации можно осуществлять только в очень ограниченном диапазоне, например, указанном выше. Например, модификации не должны изменять вышеуказанные характеристики антитела, такие как изотип IgG и связывание с эпитопом, но они могут повышать выход рекомбинантного производства, стабильность белка или облегчать очистку.
Любой остаток цистеина, который не участвует в поддержании правильной конформации антитела к IL-1R, также можно заменять, как правило, серином, для повышения стабильности молекулы при окислении и предупреждения аномального перекрестного связывания. И наоборот, можно вводить в антитело цистеиновую(ые) связь(и) для повышения его стабильности (прежде всего, когда антитело представляет собой фрагмент антитела, такой как Fv-фрагмент).
Другой тип аминокислотного варианта антитела изменяет исходную схему гликозилирования антитела. Под изменением понимают делецию одного или нескольких углеводных остатков, присутствующих в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в антителе. Гликозилированные антитела, как правило, являются N-связанными. Понятие «N-связанный» относится к присоединению углеводного остатка к боковой цепи аспарагинового остатка. Трипептидые последовательности аспарагин-Х-серин и аспарагин-Х-треонин, где Х обозначает любую аминокислоту кроме пролина, представляют собой распознаваемые последовательности для ферментативного присоединения углеводного остатка к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. Введение сайтов гликозилирования в антитело принято осуществлять путем изменения аминокислотной последовательности так, чтобы она содержала одну или несколько из вышеуказанных трипептидных последовательностей (для N-связанных сайтов гликозилирования).
Молекулы нуклеиновых кислот, которые кодируют варианты аминокислотных последовательностей антитела к IL-1R, получают с помощью различных методов, известных в данной области. Эти методы включают (но не ограничиваясь ими) выделение из встречающегося в естественных условиях источника (в случае встречающихся в естественных условиях вариантов аминокислотных последовательностей) или получение с помощью опосредуемого олигонуклеотидами мутагенеза (или сайтнаправленного мутагенеза с использованием олигонуклеотидов), ПЦР-мутагеназа или кассетного мутагенеза ранее полученного варианта или исходной версии гуманизированного антитела к IL-1R или антитела с элиминированным Т-клеточным эпитопом.
Другой тип ковалентной модификации включает химическое или ферментативное сочетание гликозидов с антителом. Указанные методы имеют преимущество, состоящее в том, что при этом не требуется производство антитела в клетке-хозяине, которая обладает способностью к гликозилированию, т.е. N- или O-связанному гликозилированию. В зависимости от применяемого пути сочетания сахар(а) можно присоединять к (а) аргинину и гистидину, (б) свободным карбоксильным группам, (в) свободным сульфгидрильным группам, таким как сульфгидрильные группы цистеина, (г) свободным гидроксильным группам, таким как гидроксильные группы серина, треонина или гидроксипролина, (д) ароматическим остаткам, таким как остатки фенилаланина, тирозина или триптофана, или (е) амидной группе глутамина. Эти методы описаны в WO 87/05330 и у Aplin J.D. и Wriston J.C. Jr., CRC Crit. Rev. Biochem. 4, 1981, cc.259-306.
Удаление любого из углеводных остатков, присутствующих в антителе, можно осуществлять химически или ферментативно. Для химического дегликозилирования требуется обработка антитела таким соединением, как трифторметансульфоновая кислота или эквивалентное соединение. Такая обработка приводит к расщеплению большей части или всех сахаров за исключением связующего сахара (N-ацетилглюкозамин или N-ацетилгалактозамин), при этом антитело остается интактным. Химическое дегликозилирование описано у Sojahr Н.Т. и Bahl О.Р., Arch. Biochem. Biophys. 259, 1987, cc.52-57 и у Edge A.S. и др. Anal. Biochem. 118, 1981. cc.131-137. Ферментативное расщепление углеводных остатков антител можно осуществлять, применяя различные эндо- и экзоглюкозидазы, описанные у Thotakura N.R. и Bahl O.P., Meth. Enzymol. 138, 1987, cc.350-359.
Другой тип ковалентной модификации антитела включает связывание антитела с одним из многочисленных небелковых полимеров, например с полиэтиленгликолем, полипропиленгликолем или полиоксиалкиленами, с помощью методов, описанных в US 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337.
Предпочтительным вариантом осуществления изобретения является фрагмент нуклеиновой кислоты, который кодирует полипептид, связанный с IL-1R, где указанный полипептид ингибирует связывание IL-1 с IL-1R и выбран из группы, включающей тяжелую цепь, которая содержит вариабельную область (VH), представленную в SEQ ID NO:1, и легкую цепь, которая содержит вариабельную область (VL), представленную в SEQ ID NO:2.
Реконструированные вариабельные области тяжелой и легкой цепей объединяют с последовательностями промотора, инициации трансляции, константной области, с 3′-нетранслируемой последовательностью, последовательностями полиаденилирования и терминации транскрипции с получением конструкций экспрессионных векторов. Конструкции для экспрессии тяжелой и легкой цепей можно объединять в одном векторе, их можно применять для котрансфекции, серийной трансфекции или раздельной трансфеции клеток-хозяев, которые затем сливают с получением индивидуальной клетки-хозяина, которая экспрессирует обе цепи.
Таким образом, в изобретении предложен способ получения рекомбинантного человеческого антитела, предлагаемого в изобретении, отличающийся тем, что экспрессируют нуклеиновую кислоту, которая кодирует тяжелую цепь, содержащую вариабельную область (VH), представленную в SEQ ID NO:1, и легкую цепь, которая содержит вариабельную область (VL), представленную в SEQ ID NO:2, и константную область человеческой легкой цепи (CL), в прокриотической или эукариотической клетке-хозяине и выделяют антитело из клетки.
Изобретение относится также к применению антитела, предлагаемого в изобретении, для диагностики IL-1R in vitro, предпочтительно, основанной на определении с помощью иммунологического анализа связывания IL-1R образца и антитела, предлагаемого в изобретении.
Другим объектом настоящего изобретения является композиция, например фармацевтическая композиция, содержащая одно моноклональное антитело, или их комбинацию, или их антигенсвязывающий центр, предлагаемые в настоящем изобретении, в сочетании с фармацевтически приемлемым носителем.
В контексте настоящего описания понятие «фармацевтически приемлемый носитель» включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, придающие изотоничность и замедляющие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Предпочтительно носитель можно применять для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии).
Понятие «фармацевтически приемлемая соль» означает соль, которая сохраняет требуемую биологическую активность антитела и не обладает никакими нежелательными токсикологическими действиями (см., например, Berge S.M. и др., J. Pharm. Sci. 66, 1977, cc.1-19). Такие соли подпадают под объем настоящего изобретения. Примерами таких солей являются кислотно-аддитивные соли и соли присоединения оснований. Кислотно-аддитивные соли включают соли, полученные из нетоксичных неорганических кислот, таких как соли соляной кислоты.
Композицию, предлагаемую в настоящем изобретении, можно вводить различными методами, известными в данной области. Как должно быть очевидно специалисту в данной области, путь и/или механизм введения должен варьироваться в зависимости от требуемых результатов.
Для введения соединения, предлагаемого в изобретении, с помощью конкретных путей введения может оказаться необходимым наносить покрытие на соединение из материала, препятствующего его инактивации, или осуществлять совместное введение соединения с таким материалом. Например, соединение можно вводить пациенту в соответствующем носителе, например липосомах или разбавителе. Фармацевтически приемлемые разбавители включают физиологические и водные буферные растворы.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для приготовления без дополнительной подготовки стерильных инъецируемых растворов или дисперсий. Применение таких сред и агентов для фармацевтически активных субстанций известно в данной области.
Понятия «парентеральное введение» и «введенный парентерально» в контексте настоящего описания означают пути введения, отличные от энтерального и местного применения, как правило, путем инъекции, и включают (но не ограничиваясь ими) внутривенную, внутримышечную, внутриартериальную, подоболочечную, внутрикапсулярную, внутриглазничную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию.
Указанные композиции могут содержать также эксципиенты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Предупреждение присутствия микроорганизмов можно гарантировать как применением процессов стерилизации, так и асептических условий производства, и путем введения различных антибактериальных и противогрибковых агентов, например парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Может также требоваться введение в композицию придающих изотоничность агентов, таких как сахара, хлорид натрия и т.п. Кроме того, для пролонгированной абсорбции инъецируемой фармацевтической формы можно вводить агенты, которые замедляют абсорбцию, такие как моностеарат алюминия и желатин.
Независимо от выбранного пути введения соединения, предлагаемые в настоящем изобретении, которые можно применять в виде пригодной гидратированной формы и/или фармацевтические композиции, предлагаемые в настоящем изобретении, приготавливают в виде фармацевтически приемлемых лекарственных форм с помощью общепринятых методов, известных специалисту в данной области.
Фактические уровни доз действующих веществ в фармацевтических композициях, предлагаемых в настоящем изобретении, могут варьироваться так, чтобы они содержали количество действующего вещества, которое является эффективным для получения требуемого терапевтического ответа у конкретного пациента в зависимости от состава и пути введения, не являясь при этом токсичными для пациента. Выбранный уровень доз должен зависеть от разнообразных фармакокинетических факторов, таких как активность конкретных применяемых композиций, предлагаемых в настоящем изобретении, путь введения, время введения, скорость экскреции конкретного применяемого соединения или его сложного эфира, соли или амида, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, применяемые в сочетании с конкретными композициями, возраст, пол, вес, общее состояние здоровья и предыдущая история болезни пациента, подлежащего лечению, и подобных факторов, которые хорошо известны в медицине.
Композиция должна быть стерильной и жидкой в той степени, чтобы композицию можно было вводить с помощью шприца. Помимо воды носитель может представлять собой изотоничный забуференный физиологический раствор, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их приемлемые смеси.
Требуемую текучесть можно поддерживать, например, нанося покрытие, с использованием, например, лецитина, поддерживая требуемый размер частиц в случае дисперсии, или с использованием поверхностно-активных веществ. Во многих случаях предпочтительным является добавление в композицию придающих изотоничность агентов, например сахаров, полиспиртов, таких как маннит или сорбит, и хлорида натрия. Для достижения продолжительной абсорбции инъецируемых композиций можно, например, включать в состав композиции агент, замедляющий абсорбцию, например моностеарат алюминия или желатин.
Когда действующее вещество соответствующим образом защищено согласно описанному выше методу, то соединение можно вводить орально, например, в сочетании с инертным разбавителем или с усвояемым съедобным носителем.
Антитела, предлагаемые в изобретении, можно применять для лечения пациента, страдающего ревматоидным артритом, который нуждается в такой терапии. Таким образом, в изобретении предложен способ лечения пациента, страдающего ревматоидным артритом.
В изобретении предложен также способ приготовления фармацевтичекой композиции, которая содержит эффективное количество антитела, предлагаемого в изобретении, в сочетании с фармацевтически приемлемым носителем, и применение антитела, предлагаемого в изобретении, в таком способе.
Приведенные ниже примеры, ссылки и перечень последовательностей даны с целью лучшего понимания настоящего изобретения, полный объем которого представлен в прилагаемой формуле изобретения. Следует понимать, что в изложенные процессы можно вносить модификации без отклонения от сущности изобретения.
Описание чертежей
На чертежах показано:
на фиг.1 - данные твердофазного иммуноферментого анализа (ELISA) связывания с антителами 2D8;
на фиг.2 - данные об определении аффинности антител 2D8 к IL-1R;
на фиг.3 - данные о конкуренции антител 2D8 с лигандом IL-1 за связывание с IL-1R;
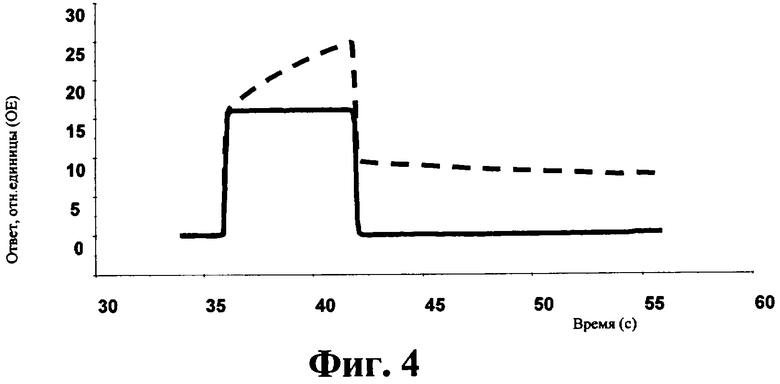
на фиг.4 - данные о ингибировании антителом 2D8 связывания тройного комплекса hIL-1/hIL-1R/hIL-1R AcP
верхняя линия: связывание hIL-1/hIL-1 R с hIL-1 R Аср
нижняя линия: добавление антитела 2D8;
на фиг.5 - данные о ингибировании индуцируемого IL-1 производства IL-8 в клетках линии MRC-5;
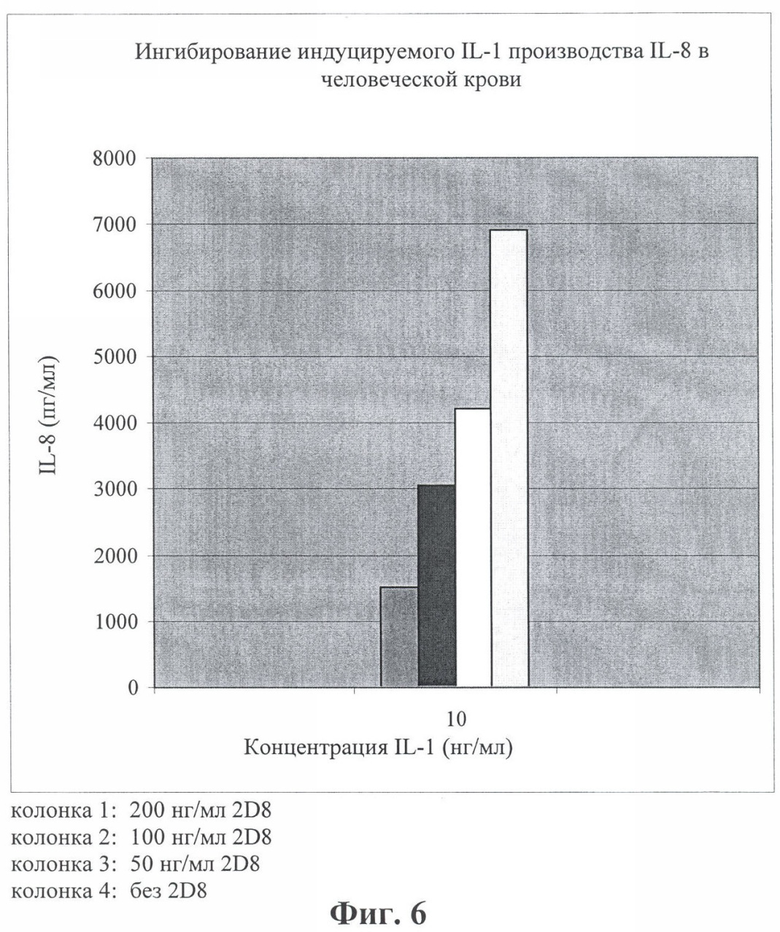
на фиг.6 - данные о ингибировании индуцируемого IL-1 производства IL-8 в человеческой крови;
на фиг.7 - аминокислотная последовательность вариабельных областей тяжелых цепей с элиминированными Т-клеточными эпитопами;
на фиг.8 - аминокислотная последовательность вариабельных областей легких цепей с элиминированными Т-клеточными эпитопами;
на фиг.9 - аминокислотная последовательность вариабельных областей гуманизированных тяжелых цепей;
на фиг 10 - аминокислотная последовательность вариабельных областей гуманизированных легких цепей;
на фиг.11 - аминокислотная последовательность IL-1R
выделенные жирным шрифтом N: потенциальные сайты гликозилирования;
на фиг.12 - полученные с помощью ДСН-ПААГ данные анализа с использованием гликозилированного IL-1R и после обработки гликозидазами;
на фиг.13 - анализ методом Вестерн-блоттинга 2D8 с использованием гликозилированного и дегликозилированного IL-1R;
на фиг.14 - константная область легкой цепи;
на фиг.15 - константная область тяжелой цепи (IgG4);
на фиг.16 - константная область тяжелой цепи (IgG1);
на фиг.17 - последовательности тяжелой и легкой цепей DEI 5/8.
Описание последовательностей
SEQ ID NO:1 вариабельная область тяжелой цепи крысиного 2D8; ак 1-19 - сигнальная последовательность, 20-134 - вариабельная область, 135-139 - крысиный концевой фрагмент,
SEQ ID NO:2 вариабельная область легкой цепи крысиного 2D8; ак 1-20 - сигнальная последовательность, 21-129 - вариабельная область, 130-138 - крысиный концевой фрагмент,
SEQ ID NO:3 аминокислотная последовательность химерной Н-цепи (крысиная/человеческая) 2D8 (IgG1),
SEQ ID NO:4 аминокислотная последовательность химерной Н-цепи (крысиная/человеческая) 2D8 (IgG4),
SEQ ID NO:5 аминокислотная последовательность химерной L-цепи (крысиная/человеческая),
SEQ ID NO:6 аминокислотная последовательность HURVH (фиг.7 и фиг.9),
SEQ ID NO:7 аминокислотная последовательность HURDIVHv1 (фиг.7),
SEQ ID NO:8 аминокислотная последовательность HURDIVHv2 (фиг.7),
SEQ ID NO:9 аминокислотная последовательность HURDIVHv3 (фиг.7),
SEQ ID NO:10 аминокислотная последовательность HURDIVHv4 (фиг.7),
SEQ ID NO:11 аминокислотная последовательность HURDIVHv5 (фиг.7),
SEQ ID NO:12 аминокислотная последовательность HURDIVHv6 (фиг.7),
SEQ ID NO:13 аминокислотная последовательность HURVK (фиг.8 и фиг.10),
SEQ ID NO:14 аминокислотная последовательность HURDIVKv4 (фиг.8),
SEQ ID NO:15 аминокислотная последовательность HURDIVKv5 (фиг.8),
SEQ ID NO:16 аминокислотная последовательность HURDIVKv7 (фиг.8),
SEQ ID NO:17 аминокислотная последовательность HURDIVKv8 (фиг.8),
SEQ ID NO:18 аминокислотная последовательность HURDIVKv9 (фиг.8),
SEQ ID NO:19 аминокислотная последовательность HURDIVKv10 (фиг.8),
SEQ ID NO:20 аминокислотная последовательность HUR HuVHv1 (фиг.9),
SEQ ID NO:21 аминокислотная последовательность HUR HuVHv2 (фиг.9),
SEQ ID NO:22 аминокислотная последовательность HUR HuVHv3 (фиг.9),
SEQ ID NO:23 аминокислотная последовательность ААВ67785-1 (фиг.9),
SEQ ID NO:24 аминокислотная последовательность HUR HuVK v1 (фиг.10),
SEQ ID NO:25 аминокислотная последовательность HUR HuVK v2 (фиг.10),
SEQ ID NO:26 аминокислотная последовательность HUR HuVK v3 (фиг.10),
SEQ ID NO:27 аминокислотная последовательность CAD43025 (фиг.10),
SEQ ID NO:28 аминокислотная последовательность IL-1R (фиг.11),
SEQ ID NO:29 последовательность константной области легкой цепи (фиг.14),
SEQ ID NO:30 последовательность тяжелой цепи IgG4 (фиг.15),
SEQ ID NO:31 последовательность константной области IgGI (фиг.16),
SEQ ID NO:32 последовательность тяжелой цепи DEI 5/8 (фиг.17),
SEQ ID NO:33 последовательность легкой цепи DEI 5/8 (фиг.17).
Примеры
Пример 1
Получение крысиных моноклональных антител к h-IL-1R
Культивирование гибридом
Полученные крысиные моноклональные антитела культивировали в среде RPMI 1640 и в бессывороточной 10%-ной среде Hyclone (фирма BioWhittaker) при 37°С и 5% СO2.
Процедура иммунизации и развитие гибридом
Пять крыс линии Sprague Dawley иммунизировали рекомбинантным человеческим IL-1R, полученным в клетках насекомых SF9. Первую иммунизацию (100 мкг белка) осуществляли внутрибрюшинно в полном адъюванте Фрейнда. Все остальные иммунизации осуществляли в неполных адъювантах Фрейнда. Моноклональные антитела получали путем слияния NSO-клеток с крысиными спленоцитами.
Пример 2
Специфический для IL-1R ELISA
Титры антител к IL-1R в сыворотке иммунизированных мышей или антител в супернатантных культурах определяли с использованием антигенспецифического ELISA. 96-луночные планшеты (предварительно сенсибилизированные стрептавидином) сенсибилизировали растворимым биотинилированным h-IL-1R в концентрации 0,125 мкг/мл в ЗФРБСА (ЗФР/1% БСА) в течение 1 ч при КТ на шейкере. Затем лунки блокировали ЗФРБСА в течение 30 мин при КТ. Сыворотку предварительно разводили ЗФРБСА из расчета 1/100 и готовили серийные разведения вплоть до 1/6400. Супернатанты разбавляли ЗФРБСА из расчета от 1/100 вплоть до 1/10000. Разбавленную сыворотку или супернатант вносили в лунки и инкубировали в шейкере в течение 2 ч при КТ. В качестве отрицательных контролей использовали предварительно отобранную сыворотку или культуральную среду. В качестве положительного контроля использовали 125 нг/мл крысиного антитела к человеческому IL-1R (клон 2D8). Затем планшеты трижды промывали смесью ЗФР/0,05% Твин 20 и инкубировали в течение 1 ч при КТ на шейкере с конъюгированным с пероксидазой из хрена (HRP) кроличьим антикрысиным IgG (фирма Bethyl Laboratories Inc.), разбавленным ЗФРБСА из расчета 1:18750. Лунки четырежды промывали смесью ЗФР/0,05% Твин 20 и осуществляли анализы в течение 15-20 мин при КТ в темноте на шейкере с использованием свежеприготовленного раствора ТМ Blue® (фирма Intergen Company). Абсорбцию оценивали при 370 нм с использованием в качестве эталона данных, полученных при длине волны 492 нм. Необязательно цветовую реакцию прекращали, добавляя в каждую лунку 20 мкл 1М H2SO4; в этом случае оценку осуществляли при длине волны 450 нм с использованием в качестве эталона данных, полученных при длине волны 690 нм. Эти результаты представлены на фиг.1.
Пример 3
Определение способности к связыванию антитела к hIL-1R
Исследование проводили на устройстве типа BIACORE® 3000 с использованием чипа СМ5. Реакцию сочетания осуществляли в виде аминного сочетания. Применяемый буфер представляли собой ЗФРТ (ЗФР + 0,05% Твин), рН 7,4, 25°С.
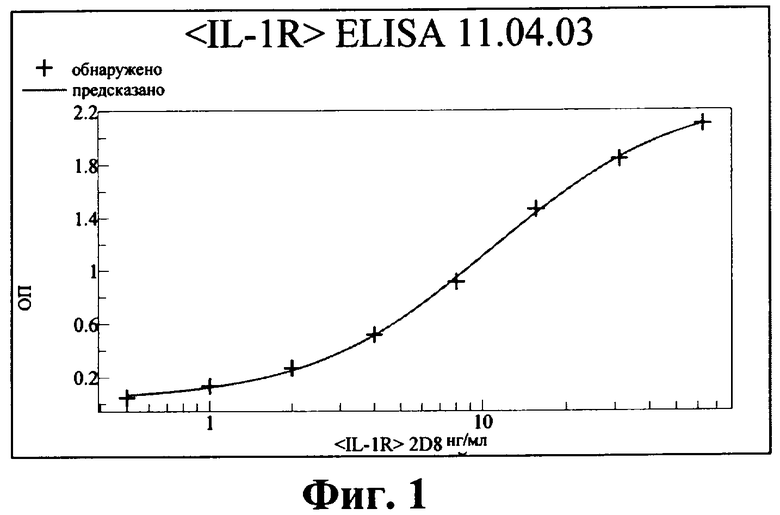
а) Определение аффинности к IL-1R антитела к hIL-1R
Для оценки аффинности антитело к Fcγ (крысиное античеловеческое) сшивали с поверхностью чипа для презентации антитела к IL-1R. Антитело к IL-1R связывали с антителом к Fcγ и в раствор добавляли различные концентрации внеклеточного домена рекомбинантного человеческого IL-1R. Ассоциацию оценивали путем инъекции IL-1R в течение 60 с, диссоциацию оценивали путем отмывки поверхности чипа буфером в течение 3 мин. Установлено, что значение константы аффинности KD (kon/koff) Для антител составляло:
для антитела 2D8 - 100 пМ
для химерного антитела 2D8 (IgG1) - 93 пМ
для химерного антитела 2D8 (IgG4) - 105 пМ
Все полученные значения для всех антител находились в диапазоне 70-120 пМ, отсюда следует, что все три антитела характеризуются близкой аффинностью.
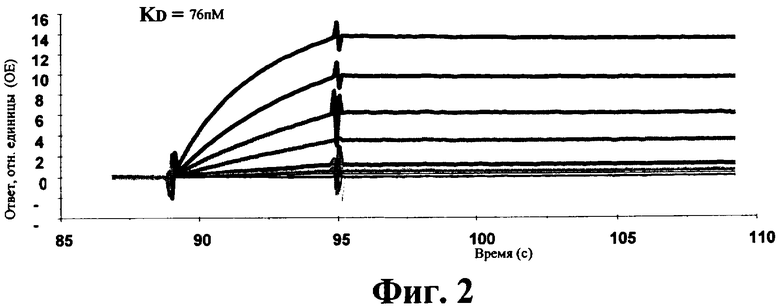
б) Конкуренция антитела к hIL-1R с лигандом IL-1 за связывание с IL-1R
Для этих исследований использовали такой же метод, что и указанный в разделе а). Если hIL-1R связывался с антителом 2D8 к hIL-1R, то не происходило никакого связывания hIL-1 с рецептором. Это антитело блокировало сайт связывания hIL-1 на рецепторе (фиг.3).
в) Ингибирование антителом 2D8 к hIL-1 R образования тройного комплекса hIL-1/hIL-1R/hIL-1RAcP
Для выявления тройного комплекса поликлональное антитело к IgG связывали с поверхностью чипа для презентации слитого белка Fc/hIL-1R AcP (Swiss Prot Q9NPH3; фирма R&D Systems). В растворе выявляли связывание комплекса hIL-1/hIL-1R с иммобилизованным hIL-1R AcP. Антитело 2D8 к hIL-1R ингибировало образование указанного тройного комплекса hIL-1/hIL-1R/hIL-1R AcP при его инкубации с hIL-1R (фиг.4).
Пример 4
а) Ингибирование индуцируемого IL-1 производства IL-8 в клетках линии MRC-5
Ингибирование индуцируемого IL-1 производства IL-8 в человеческих фибробластах оценивали с помощью клеточного биологического анализа. Человеческие эмбриональные легочные фибробласты линии MRC-5 стимулировали с помощью h-IL1β и оценивали производство IL-8 с использованием одностадийного ELISA. Ингибирование стимуляции при добавлении антител к h-IL-1R свидетельствует о блокирующей функциональной активности антител.
Биологические анализы осуществляли следующим образом.
В день 1 MRC-5-клетки высевали с плотностью 2,5×103 клеток на лунку в 100 мкл культуральной среды (10% ФБС) и инкубировали в течение 24 ч в термостате.
В день 2 культуральную среду удаляли и образцы вносили в 50 мкл среды для анализа (1% ФБС) (при тестировании очищенных антител) или среду для гибридом SF (при тестировании супернатантов гибридом). Оптимальное разведение супернатантов гибридом составляло от 1:1000 до 1:1000000. Инкубацию осуществляли в течение 30 мин в термостате. Затем добавляли h-IL-1β, 50 мкл/лунку (2-кратная концентрация) в среду для анализа (1% ФБС или при тестировании супернатантов гибридом 2% ФБС) до конечной концентрации ФБС 1%. Дополнительную инкубацию осуществляли при 37°С в течение 7 ч и супернатанты (80 мкл) переносили в другой 96-луночный планшет.
б) h-IL-8-ELISA
Анализ (Miller M.D и Krangel M.S., Crit. Rev. Immunol. 12, 1992, cc.17-46) осуществляли согласно протоколу производителя (фирма R&D Systems, США) с неразбавленными супернатантами (протокол для образцов крови и спинномозговой жидкости). При максимальной стимуляции (контроли без антитела) получали примерно 750 нг/мл IL-8. Значения IC50, характеризующие ингибирование секреции IL-8 антителами, представлены на фиг.5, и они составляют:
для антитела 2D8 - 7,2 пМ (1,08 нг/мл);
для химерного антитела 2D8 (IgG1) - 4,7 пМ (0,71 нг/мл);
для химерного антитела 2D8 (IgG4) - 5,1 пМ (0,77 нг/мл).
Во всех экспериментах с использованием антител, предлагаемых в изобретении, значения находились в диапазоне 4,0-35,0 пМ.
Результаты, полученные в биологическом анализе на клетках линии MRC-5 при использовании 2D8 в сравнении с результатами, полученными при использовании поступающих в продажу антител к IL-1R, представлены в таблице 1.
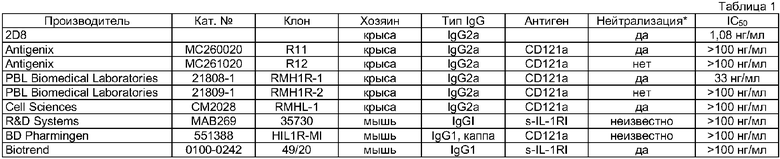
На основе аминокислотных последовательностей, представленных на фиг.7-10, конструировали с помощью мутагенеза панель гуманизированных антител и антител с элиминированными Т-клеточными антигенами и оценивали значения IC50 с помощью h-IL-8-ELISA. Результаты представлены в таблице 2 в сравнении с результатами, полученными при использовании антитела 2D8 (1,0).
Объяснение примененных сокращений
HUM: Комбинация последовательностей, представленных на фиг.9 и 10
DEI: Комбинация последовательностей, представленных на фиг.7 и 8
HUM2/2: Комбинация последовательностей HURHuVHv2 и HURHuVKv2
DEI1/8: Комбинация последовательностей HURDIVHv1 и HURDIVKv8
в) Определение иммунной активности с помощью ELISA
Относительную иммунную активность антител в сравнении с антителом 2D8 определяли с помощью ELISA. Растворимым биотинилированным человеческим IL-1R сенсибилизировали при комнатной температуре в течение 1 ч 96-луночные планшеты (предварительно сенсибилизированные стрептавидином). После блокады с помощью БСА антитело разводили, вносили в лунки и инкубировали при комнатной температуре в течение 2 ч. Планшеты трижды промывали и инкубировали при комнатной температуре в течение 1 ч с конъюгированным с пероксидазой из хрена (POD) кроличьим антикрысиным IgG. После дополнительной промывки определяли количество связанного антитела путем добавления TM-BlueR и оценки абсорбции при 370 нм.
Результаты представлены в таблице 3
Пример 5
Ингибирование индуцируемого IL-1 производства IL-8 в человеческой крови
Для оценки способности антитела 2D8 ингибировать индуцируемое IL-1 производство IL-8 в человеческой крови осуществляли биологический анализ. Человеческую кровь, собранную с добавлением гепарина (19 ед./мл), стимулировали с помощью 10 нг/мл h-IL1β и производство IL-8 определяли с помощью одностадийного ELISA. Ингибирование стимуляции путем добавления антител к h-IL-1R свидетельствует о блокирующей функциональной активности антител в организме человека при анализе ex vivo. Биологический анализ осуществляли согласно методу, описанному в примере 4, за исключением того, что инкубацию с IL-1 в присутствии антитела или без него осуществляли при 37°С в течение 16 ч и разведенные из расчета 1:5 образцы тестировали в отношении присутствия IL-8 согласно протоколу производителя (фирма R&D Systems, США). Индуцируемое IL-1 производство IL-8 в человеческой крови ингибировалось ~ на 50% при концентрации антитела 2D8 100 нг/мл (см. фиг.6).
Пример 6
Рекомбинантное получение антител
Конструировали векторы для экспрессии химерного антитела, которое содержало человеческие константные области, связанные с мышиными вариабельными областями. Создавали два вектора для экспрессии химерных тяжелых цепей, которые содержали крысиные VH антитела к IL-1R, связанные с константными областями человеческого IgG1 и человеческого IgG4, в экспрессионном векторе pSVgpt. Конструировали вектор для экспрессии химерной легкой цепи, который содержал крысиную VK антитела к IL-1R, связанную с человеческой каппа-цепью (С-каппа) в экспрессионном векторе pSVhyg. В химерные экспрессионные векторы интродуцировали 5′-фланкирующую последовательность, включающую лидерный сигнальный пептид, лидерный интрон и промотор мышиного иммуноглобулина, и 3′-фланкирующую последовательность, включающую сайт сплайсинга и интронную последовательность. Векторами для экспрессии тяжелой и легкой цепи совместно трансфектировали с помощью электропорации NS0-клетки (ЕСАСС No 85110503, мышиная миелома, не продуцирующая иммуноглобулин). Трасфектированные клетки подвергали скринингу в отношении производства человеческого антитела с помощью ELISA для человеческого IgG.
Пример 7
Дегликозилирование IL-1R
5 мкг рекомбинантного растворимого человеческого IL-1-рецептора типа 1 (IL-1R, аминокислотная последовательность (см. фиг.11), очищенного из супернатанта трансформированных клеток насекомых линии SF9, инкубировали с 3 мед. нейраминидазы (N) (фирма Roche Diagnostics GmbH, DE; No. 269611), 0,3 ед. N-гликозидазы F (фирма Roche Diagnostics GmbH, DE; No. 1365185) и 0,15 мед. O-гликозидазы (фирма Roche Diagnostics GmbH, DE; No. 1347101) соответственно при 37°С в течение 17 ч. После центрифугирования образцы анализировали с помощью ДСН-ПААГ.
Анализ методом ДСН-ПААГ (фиг.12) продемонстрировал, что молекулярная масса IL-1R (полоса 1) снижалась примерно на 9 кДа при инкубации с N-гликозидазой F (полоса 3), в то время как инкубация с нейраминидазой (полоса 2) и O-гликозидазой (полоса 4) не приводила к каким-либо существенным изменениям молекулярной массы. Совместное применение N-гликозидазы F с нейраминидазой (полоса 5), N-гликозидазы F и O-гликозидазы (полоса 6) или всех трех ферментов (полоса 8) не приводило к какому-либо дополнительному расщеплению боковых цепей углевода. Совместное применение нейраминидазы и O-гликозидазы не приводило к удалению какой-либо из боковых цепей углевода (полоса 7).
Эти данные демонстрируют, что IL-1R является гликозилированным в одном или нескольких из потенциальных сайтов N-гликозилирования и что N-связанное гликозилирование может быть полностью устранено при инкубации с N-гликозидазой F. Не обнаружено никакого O-связанного гликозилирования.
Данные, полученные с помощью анализа методом Вестерн-блоттинга антитела 2D8, представлены на фиг.13 (обозначение полос такое же, как и на фиг.12).
Пример 8
Определение эпитопа
Связывающуюся с антителом область молекулы антигена (эпитоп) определяли с помощью блоттинга и пептидного сканирования (pepscan-анализа).
Для блоттинга образцы нативного или денатурированного растворимого человеческого IL-1R (rshIL-1R) наносили в виде пятен непосредственно на мембрану, инкубировали с антителами к hIL-1R и выявляли с помощью антител к FCγ-POD путем хемилюминисцентного обнаружения. Кроме того, rshIL-1R дегликозилировали с помощью N-гликозидазы F и как гликозилированный, так и дегликозилированный rshIL-1R разделяли в восстанавливающих денатурирующих условиях с помощью ДСН-ПААГ. Белки блоттировали на мембраны из ПВДФ (поливинилиденфторид), инкубировали с антителами к hIL-1R и выявляли с помощью антител к FCγ-POD путем хемилюминисцентного обнаружения.
Анализ методом дот-блоттинга позволил установить, что антитела, предлагаемые в изобретении, специфически связываются с rshIL-1R в нативных и денатурирующих условиях. И наконец, анализ методом Вестерн-блоттинга продемонстрировал, что антитела, предлагаемые в изобретении, распознают только гликозилированный rshIL-1R (нативный или денатурированный). При анализе методом Вестерн-блоттинга не дегликозилированный hIL-1R не мог быть выявлен. Другие гликозилированные белки (например, эритропоэтин, карбоксипептидаза Y) не распознавались антителами, предлагаемыми в изобретении, что свидетельствует о том, что распознавание гликозилированного rshIL-1R является высоко специфическим.
Кроме того, синтезировали биотинилированные пептиды (20 аминокислот), представляющие собой внеклеточный домен rshIL-1R для применения в pepscan-анализе с использованием антител к IL-1R/rshIL-1R. Пептиды имели перекрывающийся участок, состоящий из 10 аминокислот, и они содержали инертный N-концевой биотинилированный спейсер. Биотинилированные пептиды связывали с сенсибилизированными стрептавидином титрационными микропланшетами, инкубировали с антителами к hIL1R и осуществляли обнаружение с помощью антитела к FCγ. Связанные пептиды представляли собой распознаваемую последовательность эпитопа IL-1R.
Пример 9
Связывание 2D8 и DEI5/8 с I1-1 R в присутствии антагониста IL-1R
Взаимодействие типа белок-белок антител к IL-1R с IL-1R анализировали с помощью поверхностного плазмонного резонанса с использованием системы Biacore 3000. Скорости ассоциации определяли путем инъекции в течение 2 мин; скорости диссоциации определяли с использованием трехминутной стадии промывки. Данные, полученные для отрицательного контроля, вычитали из исходных кривых с целью коррекции дрейфа основного уровня, присущего системе, и снижения шумового сигнала. В этом эксперименте применяли два формата с использованием антител и IL-1R, иммобилизованных на поверхности чипа.
а) Антитело 2D8 к IL-1R ковалентно иммобилизовывали на поверхности чипа (СМ5) посредством аминного сочетания. IL-1R инъецировали в концентрации 10 нМ в условиях переноса массы для определения максимального сигнала, который служил в качестве контроля в опытах по оценке ингибирования. Ингибирование связывания IL-1R (10 нМ) оценивали путем предварительной инкубации IL-1R (в HBS-P-буфере в течение по меньшей мере 20 мин при комнатной температуре) в присутствии возрастающих концентраций (0,78-100 нМ) антагониста IL-1R, IL-1beta или DEI5/8. Затем образцы инъецировали в поток клеток и определяли взаимодействие с иммобилизованным антителом 2D8.
б) IL-1beta иммобилизовывали путем ковалентного связывания на поверхности чипа (СМ5) путем аминного сочетания. IL-1R инъецировали в концентрации 10 нМ в условиях переноса массы для определения максимального сигнала, который служил в качестве контрольной величины. Ингибирование связывания rshIL-1R (10 нМ) оценивали путем предварительной инкубации IL-1R с возрастающими концентрациями (0,78-100 нМ) антагониста IL-1R, rhIL-1beta или DEI5/8. Затем образцы инъецировали в поток клеток и определяли взаимодействие с иммобилизованным rhIL-1beta.
В первом опыте установлено, что антагонист IL-1R не ингибировал связывание IL-1R в концентрации 100 мкМ. При использовании IL-1beta ингибирование, составляющее половину от максимального (IC-50), обнаружено при 8 нМ, а при использовании DEI5/8 - при 2 нМ. Во втором опыте установлено, что антагонист IL-1R обладает ингибирующей активностью, значения IC-50 составляло 4нМ, для DEI5/8 - 2 нМ и для 2D8 - 2 нМ.
Поскольку антагонист IL-1R не ингибировал связывание IL-1R с 2D8 в концентрации вплоть до 100 мкМ, можно заключить, что 2D8 и антагонист IL-1R не могут конкурентно связываться с IL-1R. 2D8 при связывании индуцирует быстрое изменение конформации IL-1R. Это изменение конформации IL-1R препятствует связыванию антагониста IL-1R с рецептором. Для 2D8 и DEI5/8 обнаружено аллостерическое ингибирование в отличие от связывания с рецептором антагониста IL-1R. IL-1beta ингибирует связывание IL-1R с 2D8, что свидетельствует о конкурентном связывании IL-1beta и 2D8 с IL-1R.
Перечень ссылок
Angal S. и др., Mol. Immunol. 30, 1993, cc.105-108,
Aplin J.D. и Wriston J.C. Jr., CRC Crit. Rev. Biochem. 4, 1981, cc.259-306,
Arend W.P., J.Clin. Invest. 88, 1991, cc.1445-1451,
Current Protocols in Molecular Biology, под ред. Ausubel F. и др., изд-во Greene Publishing and Wiley Interscience, New York (1987),
Barnes L.M. и др., Biotech. Bioeng. 73, 2001, cc.261-270,
Barnes L.M. и др., Cytotechnology 32, 2000, cc.109-123,
Berge S.M. и др., J.Pharm. Sci. 66, 1977, cc.1-19,
Carter P. и др., Proc. Natl. Acad. Sci. USA 89, 1992, cc.4285-4289,
Durocher Y. и др., Nucl. Acids. Res. 30, 2002, с.Е9,
Edge A.S. и др., Anal. Biochem. 118, 1981, cc.131-137,
Geisse S. и др., Protein Expr. Purif. 8, 1996, cc.271-282.
Johnson G. и Wu T.T., Nucleic Acids Res. 28, 2000, cc.214-218,
Kabat и др., Sequences of Proteins of Immunological Interest, 5-е. изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD (1991),
Kaufman R.J., Mol. Biotechnol. 16, 2000, cc.151-161,
Makrides S.C., Protein Expr. Purif. 17, 1999, cc.183-202,
Miller M.D. и Krangel M.S., Crit. Rev. Immunol. 12, 1992, cc.17-46,
Morrison S.L. и др., Proc. Natl. Acad Sci. USA 81, 1984, cc.6851-6855,
Neuberger M.S. и др., Nature 314, 1985, cc.268-270,
Norderhaug L. и др., J. Immunol. Methods 204, 1997, cc.77-87,
Orlandi R. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.3833-3837,
Queen С. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.10029-10033,
Riechmann L. и др., Nature 332, 1988, cc.323-327,
Schlaeger E.-J. и Christensen К., Cytotechnology 30, 1999, cc.71-83,
Schlaeger E.-J., J. Immunol. Methods 194, 1996, cc.191-199,
Sojahr H.T. и Bahl O.P., Arch. Biochem. Biophys. 259, 1987, cc.52-57,
Thotakura N.R. и Bahl O.P., Meth. Enzymol. 138, 1987, cc.350-359,
US No.4179337,
US No.4496689,
US No.4640835,
US No.4670417,
US No.4791192,
US No.5202238,
US No.5204244,
US No.6511665,
Werner R.G., Drug Res. 48, 1998, cc.870-880,
WO 87/05330,
WO 98/08097,
WO 98/52976.






| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РЕЦЕПТОРУ АЛЬФА 1 IL-13 И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2413736C2 |
| РЕКОМБИНАНТНЫЕ IL4-АНТИТЕЛА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ, СВЯЗАННЫХ С ДЕЙСТВИЕМ IL4 | 1994 |
|
RU2162711C2 |
| ВЫСОКОАФФИННЫЕ АНТИТЕЛА ЧЕЛОВЕКА К РЕЦЕПТОРУ IL-4 ЧЕЛОВЕКА | 2007 |
|
RU2445318C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ IL-1БЕТА | 2001 |
|
RU2286351C2 |
| АНТИТЕЛА ВЫСОКОЙ АФФИННОСТИ К IL-6-РЕЦЕПТОРУ ЧЕЛОВЕКА | 2007 |
|
RU2433138C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА С ВЫСОКОЙ АФФИННОСТЬЮ К РЕЦЕПТОРАМ IL-4 ЧЕЛОВЕКА | 2009 |
|
RU2539774C2 |
| ЧЕЛОВЕЧЕСКИЕ АНТИТЕЛА С ВЫСОКОЙ АФФИННОСТЬЮ К РЕЦЕПТОРАМ IL-4 ЧЕЛОВЕКА | 2014 |
|
RU2663106C2 |
| ИММУНОГЛОБУЛИНЫ | 2005 |
|
RU2404192C2 |
| РЕКОМБИНАНТНОЕ АНТИТЕЛО К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ 1β | 2001 |
|
RU2264413C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ-2 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2745451C1 |








Настоящее изобретение относится к иммунологии и биотехнологии. Описано антитело, которое связывается с человеческим IL-1R и ингибирует связывание человеческого IL-1 с IL-1R. Антитело получают из клеток гибридомы линии DSM АСС 2601 или оно представляет собой химерный, гуманизированный или с элиминированным Т-клеточным эпитопом вариант указанного антитела или его фрагмент. Антитела ингибируют секрецию IL-8 и IL-6 в клетках человеческих фибробластов линии типа MRC5 (АТСС CCL 171), опосредуемую IL-1, с IC50 4-35 пМ. Использование изобретения обеспечивает антитело, которое не обладает значительной функцией ADCC и CDC, что может найти применение для лечения воспалительных заболеваний. 7 з.п. ф-лы, 3 табл., 17 ил.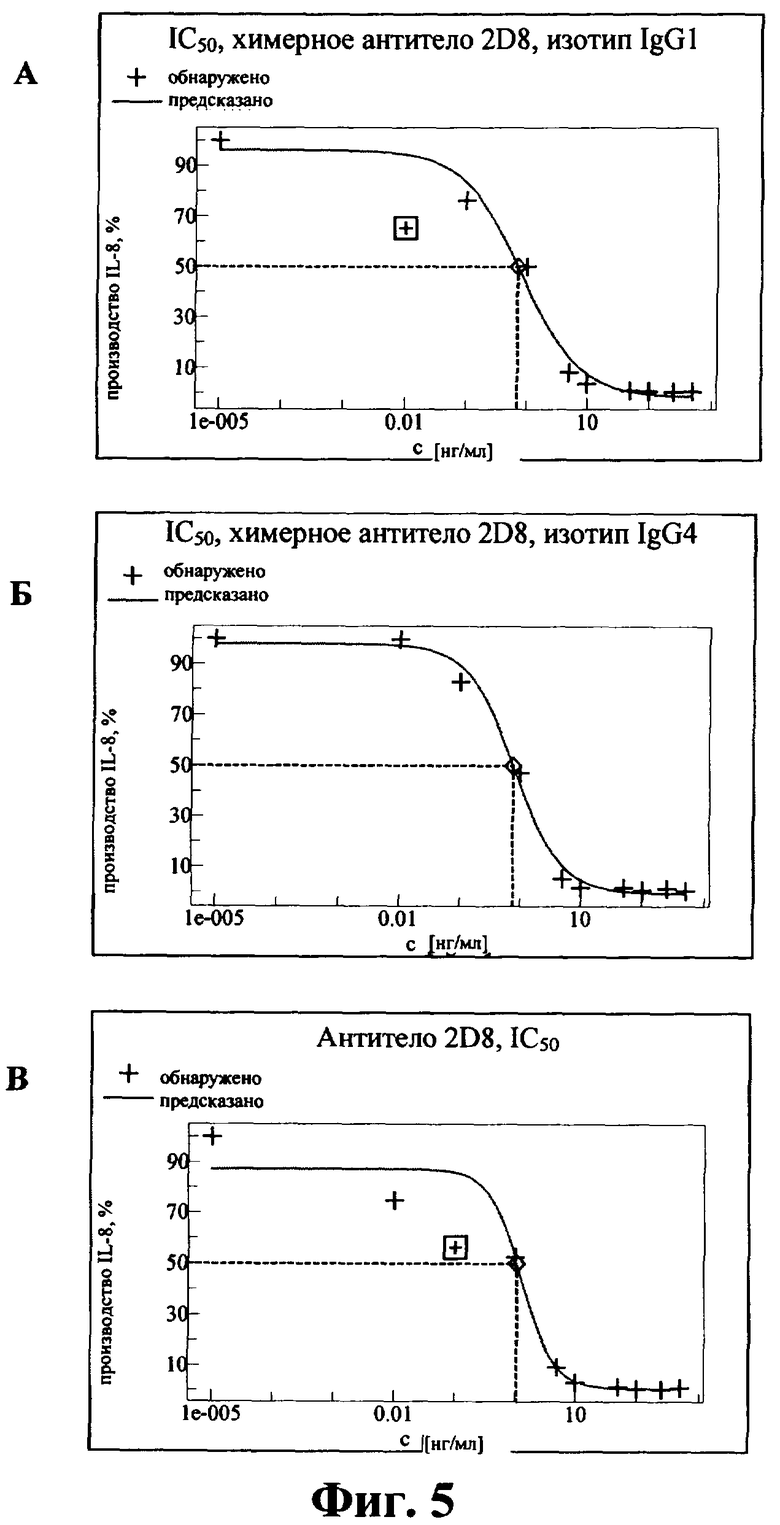
1. Антитело, которое связывается с человеческим IL-1R и ингибирует связывание человеческого IL-1 с IL-1R, отличающееся тем, что антитело получают из клеток гибридомы линии DSM АСС 2601 или оно представляет собой химерный, гуманизированный или с элиминированным Т-клеточным эпитопом вариант антитела или фрагмент указанного антитела, для которых ингибирование опосредуемой IL-1 секреции IL-8 и IL-6 в клетках человеческих фибробластов линии типа MRC5 (АТСС CCL 171) характеризуется значением IC-50 4,0 - 35пМ.
2. Антитело по п.1, отличающееся тем, что антитело получают с помощью клеток гибридомы линии DSM АСС 2601.
3. Антитело по п.1 или 2, отличающееся тем, что антитело представляет собой изотип IgG4 или изотип IgG1, несущий модификацию в шарнирной области, которая затрагивает ак 220-240 между СН1 и СН2, и/или во второй внутридоменной области, которая затрагивает ак 330 между СН2 и СН3 (нумерация согласно Кэботу).
4. Антитело по п.1, отличающееся тем, что антитело имеет вариабельные и константные области, выбранные из представленных на фиг.7-10 и 14-16.
5. Антитело по п.1 или 2, отличающееся тем, что имеет аффинность KD 70-300пМ.
6. Антитело по п.1, отличающееся тем, что оно содержит гипервариабельные участки (CDR), которые имеют следующие последовательности:
а) в тяжелую цепь в качестве CDR входят CDR1 (ак 45-54), CDR2 (ак 69-84) и CDR3 (ак 117-123), представленные в SEQ ID NO:1, и
б) в легкую цепь в качестве CDR входят CDR1 (ак 43-57), CDR2 (ак 73-79) и CDR3 (ак 112-120), представленные в SEQ ID NO:2.
7. Антитело по пп.1, 2 или 6, отличающееся тем, что антитело получено из организма крыс.
8. Антитело по пп.1, 2 или 6, которое получают из клеток гибридомы линии DSM ACC 2601.
Приоритет по пунктам:
10.09.2003 по пп.1-3, 5-8;
23.12.2003 по п.4.
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| ROSS W | |||
| MILNE et al., "Characterization of monoclonal antibodies against human low density lipoprotein", Arteriosclerosis, 3, 1983, стр.23-30 | |||
| MCINTYRE et al., "Inhibition of interleukin 1 (IL-1) binding and bioactivity in vitro and modulation of acute inflammation in vivo by IL-1 receptor antagonist and anti-IL-1 | |||
Авторы
Даты
2009-10-10—Публикация
2004-09-09—Подача