Настоящее изобретение относится к антителам к человеческому интерлейкину I бета (IL-1β) и к применению антител для лечения опосредуемых IL-1 заболеваний и нарушений.
Интерлейкин 1 (IL-1) представляет собой фактор, продуцируемый клетками иммунной системы, который действует в качестве медиатора острой фазы воспалительной реакции. Нарушение производства или избыточное производство IL-1, в частности IL-1β, связано с патологией различных заболеваний и нарушений, таких как септицемия, септический или эндотоксический шок, аллергии, астма, потеря костной ткани, ишемия, "удар", ревматоидный артрит и другие воспалительные заболевания. Антитела к IL-1β предложены для лечения опосредуемых IL-1 заболеваний и нарушений (см., например, WO 95/01997 и обсуждение, приведенное во введении).
При создании изобретения получены улучшенные антитела к человеческому IL-1β, предназначенные для лечения опосредуемых IL-1 заболеваний и нарушений.
Таким образом, изобретение относится к IL-1β-связывающей молекуле, которая содержит антигенсвязывающий центр антитела, включающий по меньшей мере одну вариабельную область тяжелой цепи (VH) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность Val-Tyr-Gly-Met-Asn, CDR2 имеет аминокислотную последовательность Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Arg-Thr-Gly-Pro; и ее непосредственным эквивалентам.
Таким образом, изобретение относится также к IL-1β-связывающей молекуле, содержащей по меньшей мере одну вариабельную область легкой цепи (VL,) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, CDR2' имеет аминокислотную последовательность Ala-Ser-Gln-Ser-Phe-Ser и CDR3' имеет аминокислотную последовательность His-Gln-Ser-Ser-Ser-Leu-Pro, и ее непосредственным эквивалентам.
Первым объектом изобретения является один домен IL-1β-связывающей молекулы, содержащий выделенную тяжелую цепь иммуноглобулина, которая включает указанную выше вариабельную область тяжелой цепи (VH).
Вторым объектом изобретения является также IL-1β-связывающая молекула, которая содержит вариабельные области и тяжелой (VH) и легкой цепи (VL), при этом указанная IL-1β-связывающая молекула содержит по меньшей мере один антигенсвязывающий центр антитела, включающий:
а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность Val-Tyr-Gly-Met-Asn, CDR2 имеет аминокислотную последовательность Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-GIn-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Arg-Thr-Gly-Pro, и
б) вариабельную область легкой цепи (VL) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, CDR2' имеет аминокислотную последовательность Ala-Ser-Gln-Ser-Phe-Ser и CDR3' имеет аминокислотную последовательность His-Gln-Ser-Ser-Ser-Leu-Pro;
и ее непосредственные эквиваленты.
Если не указано иное, любая представленная в описании полипептидная цепь имеет аминокислотную последовательность, которая начинается на N-конце и заканчивается на С-конце. Если антигенсвязывающий центр антитела содержит и VH-, и VL-области, то они могут быть расположены на одной и той же полипептидной молекуле или предпочтительно каждая область может располагаться на разных цепях, VH-область может быть частью тяжелой цепи иммуноглобулина или ее фрагмента, а VL-область - частью легкой цепи иммуноглобулина или ее фрагмента.
Понятие "IL-1β-связывающая молекула" обозначает любую молекулу, которая обладает способностью связываться с антигеном IL-1β либо индивидуально, либо в сочетании с другими молекулами. Реакцию связывания можно идентифицировать с помощью стандартных методов (качественные анализы), которые включают, например, биологический анализ ингибирования связывания IL-1β с его рецептором или анализы связывания любого типа в сравнении с отрицательным контролем, в котором используют антитело неродственной специфичности, но предпочтительно относящееся к тому же изотипу, например антитело к CD25. Для анализа связывания IL-1β-связывающих молекул по изобретению с IL-1β целесообразно применять конкурентный анализ связывания.
Примеры антигенсвязывающих молекул включают антитела, продуцируемые В-клетками или гибридомами, и химерные антитела, антитела со встроенными путем трансплантации гипервариабельными участками (CDR) или человеческие антитела или любые их фрагменты, например F(ab')2- и Fab-фрагменты, а также одну цепь или один домен антитела.
Одноцепочечное антитело состоит из вариабельных областей тяжелых и легких цепей антитела, ковалентно связанных с пептидным линкером, который, как правило, состоит из 10-30 аминокислот, предпочтительно из 15-25 аминокислот. Таким образом, эта структура не включает константную область тяжелых и легких цепей, и можно предположить, что небольшой пептидный спейсер должен обладать менее выраженными антигенными свойствами, чем вся константная область. Понятие "химерное антитело" относится к антителу, в котором константные области тяжелых и легких цепей или и тех, и других цепей получают из антитела человека, а вариабельные области как тяжелых, так и легких цепей получают из антитела организма кроме человека (например, мыши) или из антитела организма человека, но которое представляет собой другое человеческое антитело. Понятие "антитело со встроенным путем трансплантации гипервариабельным участком" обозначает антитело, в котором гипервариабельные участки (CDR) происходят из антитела-донора, такого как антитело организма кроме человека (например, мыши) или другое человеческое антитело, в то время как все или практически все другие части иммуноглобулина, например константные области и высококонсервативные участки вариабельных областей, т.е. каркасные участки, происходят из антитела-акцептора, например человеческого антитела. Однако антитело с встроенным путем трансплантации гипервариабельным участком может включать небольшое количество аминокислот последовательности-донора в каркасных участках, например в частях каркасных участков, примыкающих к гипервариабельным участкам. Понятие "человеческое антитело" обозначает антитело, в котором все константные и вариабельные области как тяжелых, так и легких цепей происходят из антитела человека или практически идентичны последовательностям антитела человека, но необязательно получены из этого же антитела, и включают полученные в организме мыши антитела, в которых мышиные гены вариабельных и константных областей иммуноглобулина заменены их человеческими копиями, например, как описано в целом в ЕР 0546073 В1, патентах US 5545806, 5569825, 5625126, 5633425, 5661016, 5770429, ЕР 0438474 В1 и ЕР 0463151 В1.
Особенно предпочтительные IL-1β-связывающие молекулы по изобретению представляют собой человеческие антитела, прежде всего 5 антитело ACZ885, описанное ниже в примерах.
Так, в предпочтительных химерных антителах вариабельные области как тяжелой, так и легкой цепей получают из антитела человека, например из антитела ACZ885, последовательность которого представлена в Seq. Id. No.1 и Seq. Id. No.2. Участки константных областей также содержат приемлемые участки человеческих константных областей, например, как это описано в "Sequences of Proteins of Immunological Interest", Kabat E.A. и др., US Department of Health и Human Services, Public Health Service, National Institute of Health.
Гипервариабельные участки могут быть получены из каркасных участков любого типа, хотя предпочтительно их получают из антител человека. Приемлемые каркасные участки описаны у Kabat E.A. и др., там же. Предпочтительный каркасный участок тяжелой цепи представляет собой каркасный участок человеческой тяжелой цепи, например антитела ACZ885, последовательность которого представлена в Seq. Id. No.1. Он состоит из расположенных в указанной последовательности FR1-, FR2-, FR3-и FR4-областей. Аналогично этому последовательность, приведенная в Seq. Id. No.2, является предпочтительной в качестве каркасного участка легкой цепи ACZ885 и состоит из расположенных в указанной последовательности FR1'-, FR2'-, FR3'-и FR4'-участков.
Таким образом, изобретение относится также к IL-1β-связывающей молекуле, которая содержит по меньшей мере один антигенсвязывающий центр антитела, включающий либо первый домен, аминокислотная последовательность которого практически идентична последовательности, представленной в Seq. Id. No.1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 118, либо описанный выше первый домен и второй домен, аминокислотная последовательность которого практически идентична последовательности, представленной в Seq. Id. No.2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 107.
Моноклональные антитела, которые вырабатываются против протеина, встречающегося у всех людей, как правило, получают в организме кроме человека, например в мышах, и поэтому они, как правило, представляют собой протеины, не встречающиеся в организме человека. Непосредственным результатом этого является то, что полученное с помощью гибридомы ксеногенное антитело при введении людям вызывает нежелательный иммунный ответ, который главным образом опосредуется константной областью ксеногенного иммуноглобулина. Это существенно ограничивает применение таких антител, поскольку их нельзя вводить в течение длительных периодов времени. Вследствие этого особенно предпочтительно применять одноцепочечные, несущие один домен, химерные антитела, антитела со встроенным путем трансплантации гипервариабельным участком или, прежде всего, человеческие антитела, которые при введении людям, по-видимому, не должны вызывать выраженную аллогенную реакцию.
В свете вышеизложенного более предпочтительную IL-1β-связывающую молекулу по изобретению выбирают из группы, включающей человеческое антитело к IL-1β, которое включает по меньшей мере
а) тяжелую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, состоящую из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, и (II) константную область человеческой тяжелой цепи или ее фрагмент; где CDR1 имеет аминокислотную последовательность Val-Tyr-Gly-Met-Asn, CDR2 имеет аминокислотную последовательность Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-GIn-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Arg-Thr-Gly-Pro, и
б) легкую цепь иммуноглобулина или ее фрагмент, который включает (I) вариабельную область, содержащую расположенные в указанной последовательности гипервариабельные участки и необязательно также гипервариабельные участки CDR1', CDR2' и CDR3', и (II) константную область человеческой легкой цепи или ее фрагмент, где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, CDR2' имеет аминокислотную последовательность Ala-Ser-Gln-Ser-Phe-Ser и CDR3' имеет аминокислотную последовательность His-Gln-Ser-Ser-Ser-Leu-Pro;
и его непосредственные эквиваленты.
В другом варианте IL-1β-связывающую молекулу по изобретению можно выбирать из группы, включающей одноцепочечную связывающую молекулу, которая содержит антигенсвязывающий центр антитела, включающий
а) первый домен, который состоит из расположенных в указанной последовательности гипервариабельных участков CDR1, CDR2 и CDR3, где
гипервариабельные участки имеют аминокислотные последовательности, представленные в Seq. Id. No.1,
б) второй домен, содержащий гипервариабельные участки CDR1', CDR2' и CDR3', где гипервариабельные участки имеют аминокислотные последовательности, представленные в Seq. Id. No.2, и
в) пептидный линкер, который связан либо с N-концом первого домена и с С-концом второго домена или с С-концом первого домена и с N-концом второго домена;
и ее непосредственные эквиваленты.
Как хорошо известно, минорные замены в аминокислотной последовательности, такие как делеция, добавление или замещение одной, небольшого количества или даже нескольких аминокислот, могут приводить к получению аллельной формы исходного протеина, которая обладает практически идентичными свойствами.
Таким образом, понятие "непосредственные эквиваленты" обозначает либо любой один домен IL-1β-связывающей молекулы (молекула X),
(I) в котором гипервариабельные участки CDR1, CDR2 и CDR3 в целом гомологичны по меньшей мере на 80%, предпочтительно гомологичны по меньшей мере на 90%, более предпочтительно гомологичны по меньшей мере на 95% гипервариабельным участкам, последовательность которых представлена в Seq. Id. No.1, и
(II) который обладает способностью ингибировать связывание IL-1β с его рецептором практически в такой же степени, что и молекула, с которой проводится сравнение, несущая каркасные участки, идентичные каркасным участкам молекулы X, и имеющая гипервариабельные участки CDR1, CDR2 и CDR3, идентичные указанным участкам, последовательность которых представлена в Seq. Id. No.1,
либо любую IL-1β-связывающую молекулу, имеющую по меньшей мере два домена в каждом сайте связывания (молекула X'),
(I) в которой гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3' в целом гомологичны по меньшей мере на 80%, предпочтительно гомологичны по меньшей мере на 90%, более предпочтительно гомологичны по меньшей мере на 95% гипервариабельным участкам, последовательность которых представлена в Seq. Id. No.1 и 2, и
(II) которая обладает способностью ингибировать связывание IL-1β с его рецептором практически в такой же степени, что и молекула, с которой проводится сравнение, несущая каркасные участки и константные области, идентичные каркасным участкам и константным областям молекулы X', и имеющая гипервариабельные участки CDR1, CDR2, CDR3, CDR1', CDR2' и CDR3', идентичные указанным участкам, последовательность которых представлена в Seq. Id. No.1 и 2.
В контексте настоящего описания подразумевается, что аминокислотные последовательности по меньшей мере на 80% гомологичны друг другу, если они имеют по меньшей мере 80% идентичных аминокислотных остатков в аналогичном положении, по данным оптимального сравнительного анализа, при котором бреши или вставки в аминокислотных последовательностях рассматриваются как неидентичные остатки.
Ингибирование связывания IL-1β с его рецептором удобно тестировать с помощью различных анализов, включая анализы, которые описаны ниже. Понятие "в такой же степени" обозначает, что молекула, с которой проводится сравнение, и эквивалентная молекула дают практически одинаковые с точки зрения статистики кривые ингибирования связывания IL-1β при исследовании с помощью одного из указанных выше методов. Например, для IL-1β-связывающих молекул по изобретению, как правило, получают значения IC50 для ингибирования связывания IL-1β с его рецептором, которые находятся в пределах +/-x5 (предпочтительно являются практически одинаковым) относительно IC50 соответствующей молекулы, с которой проводится сравнение, при анализе с помощью описанных выше методов.
Например, применяемый анализ может представлять собой анализ конкурентного ингибирования связывания IL-1β с растворимым связывающим IL-1β рецептором и IL-1β-связывающими молекулами по изобретению.
Наиболее предпочтительно человеческое антитело к IL-1β содержит по меньшей мере
а) одну тяжелую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в Seq. Id. No.1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 118, и константную область человеческой тяжелой цепи; и
б) одну легкую цепь, которая несет вариабельную область, аминокислотная последовательность которой практически идентична последовательности, представленной в Seq. Id. No.2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 107, и константную область человеческой легкой цепи.
Константная область человеческой тяжелой цепи может быть γ1-, γ2-, γ3-, γ4-, μ-, α1-, α2-, δ-или ε-типа, предпочтительно γ-типа, более предпочтительно γ1-типа, а константная область человеческой легкой цепи может быть κ- или λ-типа (включая подтипы λ1, λ2 и λ3); но предпочтительно κ-типа. Аминокислотные последовательности всех указанных константных областей приведены у Kabat и др., там же.
IL-1β-связывающую молекулу по изобретению можно получать с помощью методов рекомбинантной ДНК. При этом следует конструировать одну или несколько молекул ДНК, кодирующих связывающую молекулу, помещать под контроль соответствующих последовательностей и трансформировать организм-хозяин, в котором может происходить экспрессия.
Таким образом, в наиболее широком смысле изобретение относится к
(I) молекулам ДНК, кодирующим один домен IL-1β-связывающей молекулы по изобретению, одноцепочечную IL-1β-связывающую молекулу по изобретению, тяжелую или легкую цепь IL-1β-связывающей молекулы по изобретению или их фрагменты, и
(II) применению молекул ДНК по изобретению для получения рекомбинантным путем IL-1β-связывающей молекулы по изобретению.
Существующий уровень техники является таким, что позволяет специалистам в данной области синтезировать молекулы ДНК по изобретению на основе представленной в настоящем описании информации, т.е. аминокислотных последовательностей гипервариабельных участков и кодирующих их последовательностей ДНК. Метод конструирования гена вариабельной области описан, например, в ЕРА 239400, и в целом состоит в следующем: клонируют ген, кодирующий вариабельную область МАт, независимо от его специфичности. Определяют сегменты ДНК, кодирующие каркасный участок и гипервариабельные участки, и сегменты ДНК, кодирующие гипервариабельные участки, удаляют таким образом, чтобы сегменты ДНК, кодирующие каркасные участки, сливать в стыках с приемлемыми сайтами рестрикции. Сайты рестрикции можно создавать в требуемых положениях путем мутагенеза молекулы ДНК с использованием стандартных процедур. Кассеты, несущие двухцепочечные синтетические CDR, получают путем синтеза ДНК на основе данных о последовательностях, представленных в Seq. Id. No.1 или 2. Эти кассеты конструируют так, чтобы они имели "липкие" концы для встраивания путем лигирования в стыки каркаса.
Кроме того, для получения конструкции ДНК, кодирующей IL-1β-связывающие молекулы по изобретению, не требуется использовать мРНК из продуцирующей гибридому линии клеток. Так, в заявке РСТ WO 90/07861 представлены полные инструкции по получению антитела с помощью методов рекомбинантной ДНК на основе только письменной информации, например о нуклеотидной последовательности гена. Метод заключается в синтезе нескольких олигонуклеотидов, их амплификации с помощью ПЦР и их сплайсинге с получением требуемой последовательности ДНК.
Научной общественности известны экспрессионные векторы, содержащие приемлемые промоторы или гены, кодирующие константные области тяжелой и легкой цепи. Так, после получения молекулы ДНК по изобретению ее можно принятым образом переносить в соответствующий экспрессионный вектор. Молекулы ДНК, кодирующие одноцепочечные антитела, можно также получать стандартными методами, например, описанными в WO 88/1649.
В свете вышеизложенного для удовлетворения критериям полноты описания не требуется использовать депонированные гибридомы или линии клеток.
Конкретным вариантом осуществления изобретения являются описанные ниже первая и вторая конструкции ДНК, предназначенные для получения IL-1β-1-связывающей молекулы:
Первая конструкция ДНК кодирует тяжелую цепь или ее фрагмент и включает
а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный и гипервариабельные участки, где
гипервариабельные участки состоят из последовательно расположенных CDR1, DR2 и CDR3, аминокислотные последовательности которых представлены в Seq. Id. No.1; этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области, и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и
б) второй фрагмент, кодирующий константную область тяжелой цепи или ее фрагмент, который начинается с кодона, который кодирует первую аминокислоту константной области тяжелой цепи, и заканчивается кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
Предпочтительно указанный первый фрагмент кодирует вариабельную область, аминокислотная последовательность которой практически идентична аминокислотной последовательности, представленной в SEQ ID No.1, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 118. Более предпочтительно первый фрагмент имеет нуклеотидную последовательность, представленную в SEQ ID No.1, которая начинается с нуклеотида в положении 1 и заканчивается нуклеотидом в положении 354. Предпочтительно также, чтобы второй фрагмент кодировал константную область человеческой тяжелой цепи, более предпочтительно константную область человеческой цепи γ1-типа. Этот второй фрагмент представляет собой фрагмент ДНК геномного происхождения (который содержит интроны) или фрагмент кДНК (без интронов).
Вторая конструкция ДНК кодирует легкую цепь или ее фрагмент и содержит
а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный участок и гипервариабельные участки; где гипервариабельные участки представляют собой CDR1', CDR2' и CDR3', аминокислотные последовательности которых представлены в Seq. Id. No.2; этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и
б) второй фрагмент, кодирующий константную область легкой цепи или ее фрагмент, который начинается с кодона, кодирующего первую аминокислоту константной области легкой цепи, и заканчивающуюся кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
Предпочтительно указанный первый фрагмент кодирует вариабельную область, аминокислотная последовательность которой практически идентична аминокислотной последовательности, представленной в SEQ ID No.2, которая начинается с аминокислоты в положении 1 и заканчивается аминокислотой в положении 107. Более предпочтительно первый фрагмент имеет нуклеотидную последовательность, представленную в SEQ ID No.2, которая начинается с нуклеотида в положении 1 и заканчивается нуклеотидом в положении 321. Предпочтительно также, чтобы второй фрагмент кодировал константную область человеческой легкой цепи, более предпочтительно константную область человеческой цепи κ-типа.
Изобретение относится также к IL-1β-связывающим молекулам, в которых один или более, как правило, лишь небольшое количество остатков CDR1, CDR2, CDR3, CDR1', CDR2' или CDR3' или каркасных участков, как правило, лишь небольшое количество (например, 1-4), заменены по сравнению с остатками последовательностей, представленных в SEQ ID No.1 и SEQ ID No.2; например, в результате мутации, например, сайтнаправленного мутагенеза соответствующих последовательностей ДНК. Изобретение относится к последовательностям ДНК, кодирующим такие измененные IL-1β-связывающие молекулы. Изобретение относится также к IL-1β-связывающим молекулам, в которых один или несколько остатков CDR1 или CDR2' заменены по сравнению с остатками последовательностей, представленных в SEQ ID No.2.
В обеих конструкциях ДНК первый и второй фрагменты могут быть разделены интроном, а также целесообразно, когда в интроне между первым и вторым фрагментом находится энхансер. Наличие энхансера, который является транскрибируемым, но не транслируемым, может повышать эффективность транскрипции. Согласно конкретным вариантам осуществления обе конструкции ДНК содержат энхансер гена тяжелой цепи, предпочтительно человеческого гена.
Каждую конструкцию ДНК помещают под контроль приемлемых контролирующих экспрессию последовательностей, прежде всего, под контроль приемлемого промотора. Можно использовать любой тип промотора при условии, что он адаптирован к организму-хозяину, в который конструкции ДНК должны быть перенесены для экспрессии. Однако, если экспрессия происходит в клетке млекопитающего, то особенно предпочтительно применять промотор гена иммуноглобулина.
Требуемое антитело можно получать в клеточной культуре или в организме трансгенного животного. Соответствующее трансгенное животное можно получать с помощью стандартных методов, которые включают микроинъекцию в яйцеклетки первой и второй конструкций ДНК, помещенных под контроль приемлемых контролирующих последовательностей, перенос полученных таким образом яйцеклеток в соответствующих псевдобеременных самок и отбор потомства, экспрессирующего требуемое антитело.
Когда цепи антитела получают в клеточной культуре, конструкции ДНК должны быть сначала встроены либо в один экспрессионный вектор, либо в два различных, но совместимых экспрессионных вектора, причем последний вариант является предпочтительным.
Таким образом, изобретение относится также к экспрессионному вектору, который может реплицироваться в линии прокариотических или эукариотических клеток и содержит по меньшей мере одну из описанных выше конструкций ДНК.
Каждый экспрессионный вектор, содержащий конструкцию ДНК, затем переносят в приемлемый организм-хозяин. Когда конструкции ДНК встроены индивидуально в два экспрессионных вектора, их можно переносить по отдельности, т.е. по одному типу вектора на клетку, либо посредством котрансформации, указанный последний вариант является предпочтительным. Приемлемый организм-хозяин может представлять собой линию клеток бактерий, дрожжей или млекопитающих, указанный последний вариант является предпочтительным. Более предпочтительно линию клеток млекопитающего получают из лимфомы, например миеломы, гибридомы или здоровых иммортализованных В-клеток, которые предпочтительно не экспрессируют тяжелую или легкую цепи никаких эндогенных антител.
Для экспрессии в клетках млекопитающих кодирующую последовательность IL-1β-связывающей молекулы предпочтительно интегрируют в ДНК клетки-хозяина в локус, в котором может быть обеспечен высокий уровень экспрессии IL-1β-связывающей молекулы или который является предпочтительным для обеспечения высокого уровня экспрессии IL-1β-связывающей молекулы. Клетки, в которых существуют такие локусы, предпочтительные для интеграции кодирующей последовательности IL-1β-связывающей молекулы, можно выявлять и отбирать на основе данных о уровнях экспрессии IL-1β-связывающей молекулы. Для получения клеток-хозяев, содержащих кодирующую последовательность IL-1β-связывающей молекулы, можно применять любой селектируемый маркер; например, можно использовать ген dhfr/метотрексат, или эквивалентную систему отбора. Системы для экспрессии IL-1β-связывающих молекул по изобретению включают системы амплификации/селекции, основанные на применении GS, например, описанные в ЕР 0256055 В, ЕР 0323997 В и ЕР-А 89303964.4.
Еще одним объектом изобретения является способ получения IL-1β-связывающей молекулы, который предусматривает (I) культивирование организма, трансформированного описанным выше экспрессионным вектором, и (II) выделение IL-1β-связывающей молекулы из культуры.
При создании изобретения было установлено, что антитело ACZ885, вероятно, обладает способностью к специфичному связыванию с эпитопом человеческого IL-1β, который включает петлю, несущую остаток Glu 64 зрелого человеческого IL-1β. (Остаток Glu 64 зрелого человеческого IL-1β соответствует остатку 180 предшественника человеческого IL-1β). Этот эпитоп, вероятно, находится вне сайта распознавания рецептора IL-1 и поэтому совершенно неожиданно было установлено, что антитела к этому эпитопу, например антитело ACZ885, обладают способностью ингибировать связывание IL-1β с его рецептором. Антитела, в частности химерные антитела и антитела со встроенными путем трансплантации гипервариабельными участками (CDR) и прежде всего человеческие антитела, обладающие способностью к специфичному связыванию с антигенным эпитопом зрелого человеческого IL-1β, который содержит петлю, несущую остаток Glu 64, и обладающие способностью ингибировать связывание IL-1β с его рецептором; и применение таких антител для лечения опосредуемых IL-1 заболеваний и нарушений, являются новыми и включены в объем настоящего изобретения.
Таким образом, еще одним объектом изобретения является антитело к IL-1β, обладающее способностью к специфическому связыванию с антигенным эпитопом человеческого IL-1β, который содержит петлю, несущую остаток Glu 64 зрелого человеческого IL-1β, и обладающее способностью ингибировать связывание IL-1β с его рецептором.
Объектами изобретения являются также:
I) применение антитела к IL-1β, обладающего способностью к специфическому связыванию с антигенным эпитопом зрелого человеческого IL-1β, содержащему петлю, которая несет остаток Glu 64, и обладающего способностью ингибировать связывание IL-1β с его рецептором, для лечения опосредуемого IL-1 заболевания или нарушения;
II) способ лечения опосредуемого IL-1 заболевания или нарушения у пациента, предусматривающий введение пациенту эффективного количества антитела к IL-1β, обладающего способностью к специфическому связыванию с антигенным эпитопом зрелого человеческого IL-1β, содержащим петлю, которая несет остаток Glu 64, и обладающего способностью ингибировать связывание IL-1β с его рецептором;
III) фармацевтическая композиция, содержащая антитело к IL-1β, обладающее способностью к специфическому связыванию с антигенным эпитопом зрелого человеческого IL-1β, содержащим петлю, которая несет остаток Glu 64, и обладающее способностью ингибировать связывание IL-1β с его рецептором, в сочетании с фармацевтическими приемлемым эксципиентом, разбавителем или носителем; и
IV) применение антитела к IL-1β, обладающего способностью к специфическому связыванию с антигенным эпитопом зрелого человеческого IL-1β, содержащим петлю, которая несет остаток Glu 64, и обладающего способностью ингибировать связывание IL-1β с его рецептором, для приготовления лекарственного средства, предназначенного для лечения опосредуемого IL-1 заболевания или нарушения.
Для целей настоящего описания понятие "антитело, обладающее способностью ингибировать связывание IL-1β" подразумевает, что антитело обладает способностью ингибировать связывание IL-1β с его рецептором практически в такой же степени, что и антитело ACZ885, где понятие " в такой же степени" имеет указанное выше значение.
Аффинность к связыванию с IL-1β антитела ACZ885 выше, чем аффинности ранее описанных антител к IL-1β, например антител к человеческому IL-1β. Так, для ACZ885 значение константы равновесия диссоциации КD, характеризующей связывание с IL-1β, составляет менее примерно 50 пМ, например примерно 35 пМ. Такая высокая аффинность к связыванию делает антитело ACZ наиболее предпочтительным для применения в терапии.
Таким образом, еще одним объектом изобретения является антитело к IL-1β, для которых значение KD, характеризующее связывание с IL-1β, составляет примерно 50 пМ или менее. Этот объект изобретения включает также применение методов и композиций антител, обладающих такой высокой аффинностью, которые описаны для антител к IL-1β, обладающих высокой специфичностью в отношении антигенной детерминанты зрелого человеческого IL-1β, которая содержит петлю, несущую Glu 64.
В контексте описания фраза "опосредуемое IL-1 заболевание" включает все болезни и медицинские состояния, которые связаны с IL-1, при этом прямая или косвенная роль IL-1 включает возникновение, развитие, прогресс, персистенцию или патологию заболевания или медицинского состояния.
В настоящем описании понятия "лечение" или "лечить" относятся как к профилактическому или превентивному лечению, так и к исцеляющему или изменяющему течение болезни лечению, включая лечение пациента, который имеет риск заражения болезнью или для которого существует возможность заражения болезнью, а также пациентов, которые уже больны или у которых диагностировано наличие болезни или медицинского состояния, и включает подавление клинического рецидива.
IL-1β-связывающие молекулы, как они определены выше, в частности IL-1β-связывающие молекулы, описанные в первом и втором объектах изобретения, т.е. антитела, которые обладают способностью к специфическому связыванию с антигенным эпитопом зрелого человеческого IL-1β, который содержит петлю, несущую Glu 64, в частности антитела, которые обладают способностью ингибировать связывание IL-1β с его рецептором; и антитела к IL-1β, значение КD которых в отношении связывания с IL-1β составляет примерно 50 пМ или менее, обозначены в описании как антитела по изобретению.
Предпочтительно антитела по изобретению представляют собой IL-1β-связывающие молекулы, описанные в первом и втором объектах изобретения. Предпочтительно антитела по изобретению представляют собой человеческие антитела, наиболее предпочтительно антитело ACZ 885 или его непосредственный эквивалент.
Антитела по изобретению блокируют действия IL-1β на его клетки-мишени и поэтому их можно применять для лечения опосредуемых IL-1 заболеваний и нарушений. Эти и другие фармакологические активности антител по изобретению можно продемонстрировать с помощью стандартных методов исследования, например, описанных ниже:
Нейтрализация зависимого от IL-1β производства PGE2 и интерлейкина-6 первичными человеческими фибробластами
Производство PGE2 (простагландин Е2) и IL-6 в первичных человеческих фибробластах кожи зависит от IL-1β. Один TNF-α не может эффективно индуцировать производство этих медиаторов воспаления, но при применении совместно с IL-1 обладает повышенной вследствие синергизма активностью. Первичные кожные фибробласты используют в качестве "суррогатной" модели для оценки индуцируемой IL-1 клеточной активации.
Первичные человеческие фибробласты стимулируют рекомбинантным IL-1β или кондиционированной средой, полученной из стимулированных LPS (липополисахарид) человеческих РВМС (мононуклеарные крови периферической крови) в присутствии различных концентраций антитела по изобретению или IL-1RA в диапазоне от 6 до 18000 пМ. Химерное антитело к CD25 Simulect® (базиликсимаб) используют в качестве соответствующего контрольного изотипа. Отбирают супернатант после стимуляции в течение 16 ч и анализируют в отношении присутствия IL-6 с помощью ELISA. Как правило, при оценке описанным выше методом значения IC50 антител по изобретению в отношении ингибирования производства IL-6 составляют примерно 1 нМ или ниже (например, от примерно 0,1 до примерно 1 нМ).
Согласно описанному выше методу антитела по изобретению эффективно блокируют действия IL-1β. Таким образом, антитела по изобретению могут найти следующее применение в фармацевтике:
Антитела по изобретению можно применять для профилактики и лечения опосредуемых IL-1 заболеваний или медицинских состояний, например воспалительных состояний, аллергий и аллергических состояний, гиперчувствительных реакций, аутоиммунных заболеваний, серьезных инфекций и отторжения трансплантата органа или ткани.
Например, антитела по изобретению можно применять для лечения реципиентов после трансплантации сердца, легкого, системы сердце-легкое, печени, почки, поджелудочной железы, кожи или роговицы, включая отторжение аллотрансплантата или отторжение ксенотрансплантата, и для предупреждения реакции "трансплантат против хозяина", например, возникающей после трансплантации костного мозга, а также связанного с артериосклерозом отторжения трансплантата органа.
Антитела по изобретению можно применять для лечения, предупреждения или облегчения аутоиммунного заболевания и воспалительных состояний, в частности воспалительных состояний, этиология которых включает аутоиммунный компонент, таких как артрит (например, ревматоидный артрит, хронический прогрессирующий артрит и деформирующий артрит), и ревматических заболеваний, включая воспалительные состояния и ревматические болезни, связанные с потерей костной ткани, связанную с воспалением боль, гиперчувствительность (включая как гиперчувствительность дыхательный путей, так и кожную гиперчувствительность) и аллергии. Конкретные аутоиммунные заболевания, для лечения которых можно применять антитела по изобретению, включают аутоиммунные гематологические болезни (такие, например, как гемолитическая анемия, апластическая анемия, истинная анемия эритроцитов и идиопатическая тромбоцитопения), системную красную волчанку, полихондрит, склеродему, грануломатоз Вегенера, дерматомиозит, хронический активный гепатит, тяжелую псевдопаралитическую миастению, псориаз, синдром Стивенса-Джонсона, идиопатическую спру, аутоиммунные воспалительные заболевания кишечника (такие, например, как неспецифический язвенный колит, болезнь Крона и синдром раздраженной толстой кишки), эндокринную офтальмопатию, болезнь Грейвса, саркоидоз, рассеянный склероз, первичный билиарный цирроз печени, юношеский диабет (сахарный диабет типа I), увеит (передний и задний), сухой кератоконъюнктивит и весенний кератоконъюнктивит, коллагеноз легкого, псориатический артрит и гломерулонефрит (без нефротического синдрома или с нефротическим синдромом, например, включая идиопатический нефротический синдром или нефропатию с минимальным изменением).
Антитела по изобретению можно применять для лечения, предупреждения или облегчения астмы, бронхита, пневмокониоза, легочной экземы и других обструктивных или воспалительных заболеваний дыхательных путей.
Антитела по изобретению можно применять для лечения нежелательных острых и гиперострых воспалительных реакций, которые опосредуются IL-1 или включают производство IL-1, прежде всего IL-1β, или усиление секреции TNF под действием IL-1, например, острых инфекций, например, септического шока (например, эндотоксического шока и респираторного дистресс-синдрома взрослых), менингита, пневмоний; и серьезных ожогов; и для лечения кахексии или синдрома истощения, связанного с патологической секрецией TNF, что является следствием инфекции, рака или дисфункции органа, прежде всего для лечения связанной со СПИДом кахексии, например, связанной с ВИЧ-инфекцией или являющейся ее следствием.
Антитела по изобретению особенно предпочтительно применять для лечения связанных с метаболизмом заболеваний костной и хрящевой ткани, включая остеоартрит, остеопороз и другие воспалительные артриты, и потерю костной ткани в целом, включая связанную с возрастом потерю костной ткани, и прежде всего заболевание периодонта.
Соответствующая доза, которую можно применять для лечения указанных выше показаний, естественно должна варьироваться в зависимости, например, от конкретного применяемого антитела по изобретению, хозяина, пути введения и природы и серьезности состояния, подлежащего лечению. При этом для профилактики удовлетворительные результаты, как правило, получают при использовании доз от примерно 0,05 до примерно 10 мг на кг веса тела, более предпочтительно от примерно 0,1 до примерно 5 мг на кг веса тела. Частота введения доз при применении в профилактических целях, как правило, составляет от примерно один раз в неделю до примерно один раз каждые 3 месяца, более предпочтительно от примерно один раз каждые 2 недели до примерно 1 раз каждые 10 недель, например, один раз каждые 4 или 8 недель. Антитело по изобретению целесообразно вводить парентерально, внутривенно, например, внутримышечно или подкожно в находящуюся впереди от локтевого сустава или другую периферическую вену. Например, профилактическое лечение включает, как правило, введение антитела по изобретению от одного раза в месяц до одного раза каждые 2-3 месяца или еще реже.
Фармацевтические композиции по изобретению можно приготавливать обычным образом. Композиция по изобретению предпочтительно находится в лиофилизированной форме. Для непосредственного введения лиофилизат растворяют в пригодном водном носителе, например в стерильной воде для инъекций или в стерильном забуференном физиологическом растворе. Если требуется больший объем раствора для введения путем инфузии, например, для быстрого внутривенного введения больших объемов жидкости (болюсная инъекция), целесообразно в физиологический раствор во время приготовления состава добавлять бычий сывороточный альбумин или гепаринизированную собственную кровь пациента. Присутствие избытка такого физиологически инертного протеина препятствует потере антитела в результате адсорбции стенками контейнера и пробирки, которые используются вместе с раствором для инфузии. Если применяют альбумин, то приемлемые концентрации составляют от 0,5 до 4,5% в пересчете на массу физиологического раствора.
Изобретение дополнительно описано с помощью приведенных ниже примеров, представленных только с целью иллюстрации, в которых сделаны ссылки на прилагаемый чертеж, где приведены графики зависимости реакции от дозы для ингибирования связывания IL-1β с растворимыми рецепторами IL-1 типа I и II.
Примеры
Созданную трансгенную линию мышей, у которых происходила экспрессия человеческого спектра IgG/к вместо мышиного спектра иммуноглобулинов (Fishwild и др., Nat. Biotechnol, 14, 845-851, 1996), применяют для получения антител к человеческому IL-1β. В-клетки этих мышей иммортализуют с помощью стандартных методов на основе гибридом и получают клетки мышиной гибридомы, которые секретируют человеческое антитело ACZ885, относящееся к IgGl/κ.
Пример 1: Получение гибридомы и очистка антитела
Полученную с помощью генной инженерии мышь 18077 (фирма Medarex Inc., Аннадал, штат Нью-Джерси, US) иммунизируют путем подкожных инъекций (s.c.) в несколько различных областей рекомбинантного человеческого IL-1β, сшитого с KLH (гемоцианин лимфы улитки, 50 мкг), в адъюванте. Мышь подвергают дополнительным бустерным инъекциям, причем последнюю осуществляют за 3 дня до слияния. В день слияния мышь 18077 умерщвляют путем ингаляции СО2 и клетки селезенки (4,1×107) подвергают слиянию с помощью общепринятого метода, используя ПЭГ 4000, с таким же количеством клеток мышиной миеломы линии PAI-O. Слитые клетки высевают в 624 лунки (1 мл/лунку), содержащие питающий подслой мышиных перитонеальных клеток (мыши линии Balb С), в ГАТ-среде (гипоксантин-аминоптерин-тимидин), дополненной средой RPMI 1640, 10% инактивированной тепловой обработкой фетальной телячьей сыворотки, 5×10-5 M β-меркаптоэтанолом. Супернатанты собирают и подвергают скринингу в отношении IL-1β-реактивных моноклональных антител с помощью ELISA. Выявляют 5 моноклональных антител подкласса IgG/к. Осуществляют клонирование с использованием четырех 96-луночных титрационных микропланшетов, засевая каждую лунку из расчета 0,5 клетки/лунку. Через 2 недели клоны анализируют с помощью инвертированного микроскопа. Супернатанты собирают из лунок, позитивных в отношении роста, и производство моноклональных антител к IL-1β и анализируют с помощью ELISA. Получают 1-2 л кондиционированного супернатанта 4-х субклонов первоначально выявленной гибридомы №657 и антитела очищают аффинной хроматографией на колонке с протеином А.
Чистота антитела и частичные аминокислотные последовательности тяжелой и легкой цепи
Секвенирование аминокислотных последовательностей
Легкую и тяжелую цепи очищенного антитела ACZ 885 разделяют с помощью ДСН-ПААГ и N-концевые аминокислоты определяют с помощью расщепления по Эдману. С помощью секвенирования установлено, что чистота антитела, применяемого в этих экспериментах, составляет ≥90%. Последовательности кДНК, кодирующие вариабельные области тяжелой и легкой цепей, создают с помощью ПЦР-амплификации кДНК, полученной из мРНК клонированных клеток гибридомы и полностью секвенируют. Аминоконцевые последовательности вариабельных областей тяжелой и легкой цепей и соответствующие последовательности ДНК представлены в in Seq. Id No.1 и Seq Id No.2, ниже, где CDR выделены жирным шрифтом.
Вариабельная область тяжелой цепи ACZ885 представлена в Seq. Id. No.1

Вариабельная область легкой цепи ACZ 885 представлена в Seq. Id. No.2

Курсив: Лидерная последовательность (отсутствует в созревшем антителе)
Жирный шрифт: CDR (гипервариабельные участки)
Конструирование экспрессионных векторов тяжелой и легкой цепи
Применяют основанную на GS систему амплификации/отбора, например, описанную в ЕР 0256055 В, ЕР 0323997 В или в заявке на европейский патент 45 89303964.4, в которой в качестве селектируемого маркера используют кодирующую последовательность GS.
Пример 2: Результаты биохимических и биологических анализов
Установлено, что антитело ACZ885 нейтрализует активность интерлейкина-1β in vitro. Моноклональное антитело дополнительно характеризуют на основе данных о его способности связываться с рекомбинантным человеческим IL-1β, полученных с помощью Biacore-анализа. Механизм нейтрализующей активности оценивают с помощью экспериментов по конкурентному связыванию с растворимыми рецепторами IL-1. Биологическую активность антитела ACZ 885 в отношении рекомбинантного и продуцируемого в естественных условиях IL-1β оценивают на культуре первичных человеческих клеток (пример 3), чувствительных к стимуляции IL-1β.
Определение константы равновесия диссоциации
Константы скорости ассоциации и диссоциации для связывания рекомбинантного человеческого IL-1β с ACZ885 оценивают с помощью BIAcore-анализа. ACZ885 иммобилизуют и связывание рекомбинантного IL-1β в диапазоне концентраций 1-4 нМ оценивают с помощью поверхностного плазмонного резонанса. Выбранный формат соответствует одновалентному взаимодействию и поэтому позволяет обеспечивать количество случаев связывании IL-1β с ACZ885, соответствующее стехиометрическому соотношению 1:1. Анализ данных проводят с помощью программного обеспечения BIAevaluation.
Заключение: Связывание ACZ885 с рекомбинантным человеческим IL-1β характеризуется очень высокой аффинностью.
Изучение конкурентного связывания с растворимыми IL-1--*рецепторами типа I и II
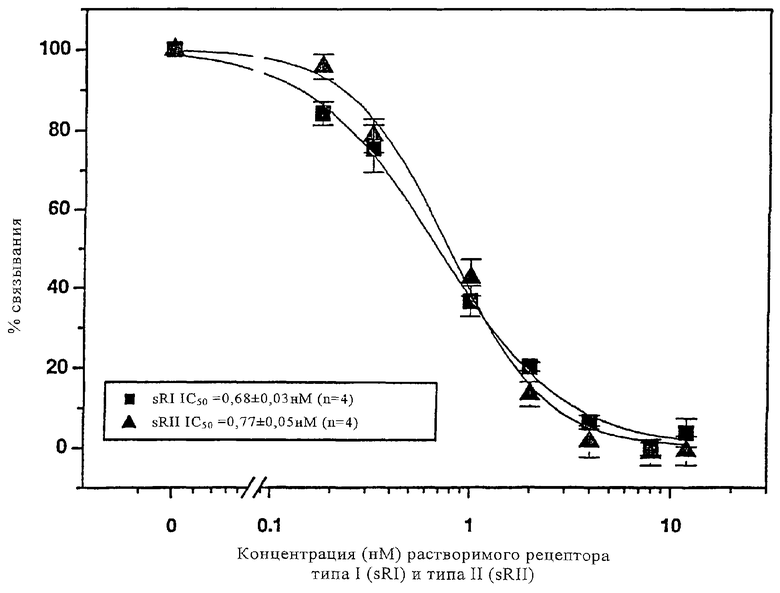
Конкурентное связывание ACZ885 с растворимыми человеческими IL-1-рецепторами типа I и типа II оценивают с помощью Biacore-анализа. ACZ885 иммобилизуют на поверхности чипа биосенсора и вводят путем инъекции человеческий IL-β (1нМ) для оценки связывания с ACZ885 в присутствии возрастающих концентраций рекомбинантного человеческого растворимого рецептора типа I или типа II (0-12 нМ; каждую концентрацию оценивают с помощью 4 независимых повторностей) или без добавления рецепторов. Полученные результаты представлены на чертеже.
Связывание NVP-ACZ885 с человеческим IL-1β оценивают в присутствии рекомбинантных человеческих растворимых IL-1-рецепторов типа I или типа II. Значения, составляющие половину от максимального связывания (IC50), оценивают графически с помощью программного обеспечения Origin 6.0. Результаты представлены в виде средних значений ± СКО (n=4).
Заключение: ACZ885 конкурирует с IL-1β за связывание с IL-1-рецептором как типа I, так и типа II.
Профиль реактивности в отношении человеческого IL-1α, человеческого IL-1RA и IL-1β других видов животных
Профиль реактивности ACZ885 в отношении человеческого IL-1α, человеческого IL-1RA и IL-1β обезьяны (cynomolgous) кролика, мыши и крысы оценивают с помощью Biacore-анализа. ACZ885 иммобилизируют и изучаемые цитокины вносят к концентрации 8 нМ (6 независимых повторностей.)
Перекрестная реактивность NVP-ACZ885 с IL-1β, IL-1α и IL-1RA
Резонансные сигналы регистрируют в течение 1000 с после начала введения; данные, полученные при инъекции буфера, для анализа вычитают из всех сенсограмм и основной уровень после иммобилизации антитела к Fcγ принимают за ноль. Связывание выражают в виде процента накопленных резонансных сигналов для человеческого IL-1β.
Заключение: ACZ885 не обладает выраженной перекрестной реактивностью в отношении человеческого IL-1α, человеческого IL-1RA или IL-1β обезьяны (cynomolgous), кролика, мыши или крысы.
Пример 3: Нейтрализация с помощью ACZ885 высвобождения IL-6 из человеческих кожных фибробластов
Для изучения биологической активность ACZ885 в отношении нейтрализации действия человеческого IL-1β применяют следующий метод:
1. Приготовления содержащей IL-1β кондиционированной среды
Приготовление кондиционированной среды для мононуклеарных клеток периферической крови человека осуществляют следующим образом: мононуклеарные клетки получают из периферической крови обезьян путем разделения в градиенте плотности фикола-гипака согласно методу Hansel [Hansel Т.Т. и др. An improved immunomagnetic procedure for the isolation of highly purified human blood eosinophils. J. Imm. Methods.145: 105-110 (1991)]; их применяют в концентрации 105 клеток/лунку в среде RPMI/10% ФТС. Добавляют IFNβ (100 ед./мл) и LPS (5 мкг/мл) и затем клетки инкубируют в течение 6 ч. Инкубацию прекращают путем центрифугирования при 1200 об/мин в течение 10 мин. Содержание IL-1β в супернатанте оценивают количественно с помощью ELISA.
2. Анализ нейтрализации
Кожные фибробласты крайней плоти человека получают от фирмы Clonetics (CC-2509) и выращивают в среде FBM (фирма Clonetics, CC-3131 ), которая содержит bFGF (1 нг/мл, СС-4065), инсулин (5 βг/мл, СС-4021) и 2% ФТС (СС-4101).
Для индукции IL-6 клетки высевают с плотностью 104 клеток на лунку в 48-луночный кластер для культуры ткани. На следующий день клетки выдерживают в течение 6-7 ч в неполной среде FBM, содержащей 2% ФТС, после чего добавляют цитоцин. Для стимуляции культуральную среду заменяют средой FBM+2% ФТС, содержащей количество кондиционированной среды, необходимое для введения 50 пг/мл IL-1β. В альтернативном варианте используют рекомбинантный человеческий IL-1β в конечной концентрации 50 пг/мл.
Нейтрализующее антитело к IL-1β титруют в разбавленной кондиционированной среде, после чего добавляют клетки. В качестве положительного контроля используют рекомбинантный IL-1Ra (фирма R&D Systems # 280-RA-010).
Через 16-17 ч после стимуляции получают супернатант клеток и количество высвободившегося IL-6 оценивают с помощью сэндвич-ELISA.
3. Анализ IL-6 с помощью ELISA
Титрационные микропланшеты для ELISA сенсибилизируют мышиным МАт к человеческому IL-6 [314-14 (фирма Novartis Pharma; партия EN23,961; 5,5 мг/мл); 100 мкл, 3 мкг/мл] в ЗФР, дополненном 0,02% NaN3, и инкубируют в течение ночи при +4°С. На следующий день титрационные микропланшеты промывают 4 раза смесью ЗФР/0,05% Твин/0,02% NaN3 и блокируют с помощью 300 мкл смеси ЗФР/3% бычьего сывороточного альбумина (БСА)/0,02% NaN3 в течение 3 ч. Планшеты вновь промывают (4 раза) и с дублированием добавляют 100 мкл супернатанта (конечные разбавления 1:20) или рекомбинантного человеческого IL-6 в качестве стандарта [(фирма Novartis Pharma, №91902), титрационная кривая, полученная при использовании концентраций от 1 до 0,0156 нг/мл при двукратном серийном разведении]. После инкубации в течение ночи при комнатной температуре (КТ) планшеты промывают (4 раза) и добавляют различные мышиные МАт к человеческому IL-6 [(110-14, фирма Novartis Pharma; 6,3 мг/мл); 100 мкл, 1 мкг/мл; 3 ч при комнатной температуре]. После еще 4 промывок добавляют меченную с помощью биотина козью антисыворотку к мышиному IgG2b (фирма Southern Biotechnology; №1090-08) в конечном разведении 1/10000 (100 мкл/лунку; 3 ч при комнатной температуре). После инкубации планшеты промывают 4 раза и добавляют сшитую со стрептавидином щелочную фосфататазу (фирма Jackson Immunoresearch, №016-050-084) в конечном разведении 1/3000 (100 мкл/лунку; 30 мин при комнатной температуре). После промывки (4 раза) в течение 30 мин добавляют субстрат (пара-нитрофенилфосфат в диэтаноламинном буфере; 100 мкл). Реакции прекращают, добавляя 50 мкл/лунку 1,5М NaOH. Планшеты анализируют с помощью планшет-ридера для титрационных микропланшетов (фирма Bio-Rad), используя фильтры при длине волн 405 и 490 нм.
Уровни IL-6 в супернатантах культуры рассчитывают в сравнении со стандартными кривыми, используя аппроксимацию кубических кривых.
Статистический анализ и определение значений IC50 осуществляют на основе аппроксимации сигмоидальных кривых.
Результаты:
Ингибирование индуцированной IL-1β секреции IL- 6
Представлены значения IC50 для ингибирования индуцированной IL-1β секреции IL-6 из человеческих кожных фибробластов. Фибробласты стимулируют рекомбинантным человеческим IL-1β или кондиционированной средой, содержащей 50-100 пг/мл IL-1β.
Пример 4: Определение эпитопа для ACZ885
ACZ885 связывается с человеческим IL-1β с высокой аффинностью, но не может распознавать обладающий высокий уровень гомологии IL-1β, полученный из макак резус. Одним из наиболее выраженных различий между аминокислотными последовательностями IL-1β макак резус и человека является аминокислота в положении 64 зрелого IL-1β. В человеческом IL-1β в этом положении находится глутаминовая кислота; а у макак резус - аланин. Мутантный человеческий IL-1β с соответствующей заменой Glu64Ala теряет свою способность связываться с ACZ885 с заметным уровнем аффинности. Отсюда можно сделать заключение, что Glu64 в человеческом IL-1β является важным для распознавания антителом ACZ885. Glu64 локализован в петле IL-1β, которая не является частью поверхности, связывающейся с IL-1β-рецептором типа I, или близко примыкает к ней. Таким образом, антитела к участвующему в связывании эпитопу, который включает Glu64, могут нейтрализовать биологическую активность человеческого IL-1β.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ИЛ-1β | 2012 |
|
RU2571563C2 |
| РЕКОМБИНАНТНОЕ АНТИТЕЛО К ЧЕЛОВЕЧЕСКОМУ ИНТЕРЛЕЙКИНУ 1β | 2001 |
|
RU2264413C2 |
| НОВЫЕ ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ПРИ ЛЕЧЕНИИ АНТИТЕЛАМИ ПРОТИВ IL-1-БЕТА | 2019 |
|
RU2834722C2 |
| НОВЫЕ ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ПРИ ЛЕЧЕНИИ АНТИТЕЛАМИ ПРОТИВ IL-1-БЕТА | 2014 |
|
RU2698208C2 |
| НОВОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ИЛ-1β | 2006 |
|
RU2468817C2 |
| АНТИТЕЛА К ЧЕЛОВЕЧЕСКОМУ МСР-1 | 2001 |
|
RU2314316C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ | 2018 |
|
RU2795240C2 |
| АНТАГОНИСТИЧЕСКИЕ АНТИТЕЛА К IL-17 | 2005 |
|
RU2426741C2 |
| ТЕРАПЕВТИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2002 |
|
RU2328506C2 |
| МОЛЕКУЛЫ АНТИТЕЛ С УЛУЧШЕННЫМИ СВОЙСТВАМИ | 2009 |
|
RU2430111C1 |
Изобретение относится к иммунологии и биотехнологии. Приведены варианты IL-1β связывающей молекулы, которые обладают общими функционально активными участками (CDR участками) и способны связывать IL-1β человека. Указанные молекулы обладают нейтрализующей активностью IC50 около 50 пМ и константой связывания KD около 30 пМ. Аминокислотная последовательность представлена в описании. Раскрыты варианты конструкций ДНК, кодирующих легкую и тяжелую цепи IL-1β связывающей молекулы. Описаны экспрессирующие вектора, несущие по меньшей мере одну из указанных нуклеиновых кислот, а также способ получения IL-1β связывающих молекул с использованием описанных векторов. IL-1β связывающие молекулы являются IL-1β связывающими молекулами человека и направлены против IL-1β человека, обладают высокой нейтрализующей активностью IC50 (около 50 пМ) и константой связывания KD (около 30 пМ). Их использование позволяет преодолевать НАМА ответ. 9 н. и 1 з.п. ф-лы, 1 ил., 3 табл.
(а) вариабельную область тяжелой цепи (VH) иммуноглобулина, которая включает последовательно расположенные гипервариабельные участки CDR1, CDR2 и CDR3, где CDR1 имеет аминокислотную последовательность Val-Tyr-Gly-Met-Asn, CDR2 имеет аминокислотную последовательность Ile-Ile-Trp-Tyr-Asp-Gly-Asp-Asn-Gln-Tyr-Tyr-Ala-Asp-Ser-Val-Lys-Gly и CDR3 имеет аминокислотную последовательность Asp-Leu-Arg-Thr-Gly-Pro; и
(б) вариабельную область легкой цепи (VL) иммуноглобулина, которая состоит из расположенных в указанной последовательности гипервариабельных участков CDR1', CDR2' и CDR3', где CDR1' имеет аминокислотную последовательность Arg-Ala-Ser-Gln-Ser-Ile-Gly-Ser-Ser-Leu-His, CDR2' имеет аминокислотную последовательность Ala-Ser-Gln-Ser-Phe-Ser и CDR3' имеет аминокислотную последовательность His-Gln-Ser-Ser-Ser-Leu-Pro.
а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный и гипервариабельные участки, где гипервариабельные участки состоят из последовательно расположенных CDR1, CDR2 и СDR3, аминокислотные последовательности которых представлены в Seq. Id. No.1; этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области, и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и
б) второй фрагмент, кодирующий константную область тяжелой цепи или ее фрагмент, который начинается с кодона, который кодирует первую аминокислоту константной области тяжелой цепи, и заканчивается кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
а) первый фрагмент, который кодирует вариабельную область, содержащую альтернативные каркасный участок и гипервариабельные участки, где гипервариабельные участки представляют собой CDR1' и CDR3', аминокислотные последовательности которых представлены в Seq. Id. No.2; этот первый фрагмент начинается с кодона, который кодирует первую аминокислоту вариабельной области и заканчивается кодоном, который кодирует последнюю аминокислоту вариабельной области, и
б) второй фрагмент, кодирующий константную область легкой цепи или ее фрагмент, который начинается с кодона, кодирующего первую аминокислоту константной области легкой цепи, и заканчивающуюся кодоном, который кодирует последнюю аминокислоту константной области или ее фрагмента, после которого расположен стоп-кодон.
| WO 9501997 A1, 19.01.1995 | |||
| US 5348858 A, 20.09.1994. |
Авторы
Даты
2006-10-27—Публикация
2001-08-20—Подача