Настоящее изобретение относится к способу получения гликолевого альдегида и к способу получения этиленгликоля из полученного гликолевого альдегида.
Реакция ненасыщенного субстрата с монооксидом углерода и водородом известна как гидроформилирование. Ранее было установлено, что гликолевый альдегид, который может быть использован в качестве промежуточного вещества при производстве этиленгликоля, может быть получен реакцией гидроформилирования формальдегида с использованием родиевого катализатора. Однако получение гликолевого альдегида таким способом затруднено тем, что родиевый катализатор также способствует гидрированию формальдегида до метанола, что снижает выход гликолевого альдегида.
Были предприняты попытки подавить образование метанола и повысить селективность гликольальдегидного продукта, в этой связи установлено, что хороший выход гликолевого альдегида может быть достигнут при использовании родиевых катализаторов, содержащих арилзамещенные фосфиновые лиганды, такие как трифенилфосфины, необязательно в комбинации с протонными кислотами (например, см. Pure and Appl. Chem., Vol. 62, № 4, pp. 661-669, 1990). Однако такие арилзамещенные лиганды имеют недостаток в том, что они нестабильны в реакционных условиях, что понижает их эффективность.
Еще одним ограничением указанного способа получения гликолевого альдегида, в особенности когда он должен использоваться в качестве промежуточного вещества при получении этиленгликоля, является то, что хорошие результаты получают только тогда, когда используют параформальдегид в неводных условиях, и в том, что использование более дешевого водного формальдегида (формалина) дает более низкую конверсию и селективность по гликолевому альдегиду. Как полагают, это обусловлено нестабильностью катализатора в водных условиях. Действительно, проблемы при гидроформилировании водного формальдегида составляют главное препятствие для коммерциализации этого способа с целью получения этиленгликоля.
В европейской патентной заявке ЕР-А-0331512 рассмотрено применение комплекса родий - фосфиновый лиганд, где фосфиновый лиганд представляет собой триорганофосфин, при гидроформилировании водного формальдегида до гликолевого альдегида, который может быть использован для получения этиленгликоля.
В настоящее время разработан способ гидроформилирования формальдегида, который основан на применении родиевого катализатора и определенной формы фосфинового лиганда. Способ имеет эксплуатационные преимущества при сравнении с известными родиевыми катализаторами, содержащими арилзамещенные фосфиновые лиганды. Более того, катализаторы настоящего изобретения более стабильны в водных условиях, чем катализаторы, содержащие арилзамещенные фосфиновые лиганды, и могут быть легко использованы для превращения водного формальдегида в гликолевый альдегид.
Настоящее изобретение предлагает способ получения гликолевого альдегида, который включает взаимодействие формальдегида с водородом и монооксидом углерода в присутствии каталитической композиции, которая основана на
а) источнике родия и
b) лиганде общей формулы

где R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он присоединен, представляет собой необязательно замещенную 2-фосфатрицикло[3.3.1.1{3,7}]децильную группу, где от 1 до 5 атомов углерода замещено гетероатомом и где R2 представляет собой моновалентный радикал, который представляет собой необязательно замещенную углеводородную группу, содержащую от 1 до 40 атомов углерода.
Каталитическая композиция настоящего изобретения нуждается в источнике родия. Обычными источниками родия являются родиевые соли минеральных кислот, такие как соли серной кислоты, азотной кислоты и фосфорной кислоты; соли сульфоновых кислот, таких как метансульфоновая кислота и паратолуолсульфоновая кислота; и соли карбоновых кислот, в особенности соли, содержащие до 6 атомов углерода, такие как уксусная кислота, пропионовая кислота и трифторуксусная кислота. С другой стороны, источник родия может содержать родий в форме с нулевой валентностью, образующий комплекс с лигандами, такими как монооксид углерода, ацетилацетонаты и фосфиновые лиганды. Источник металлического родия содержит смесь анионов и незаряженных лигандов, например, в виде RhCl(CO)2 или Rh(acac)(СO)2.
В лиганде общей формулы (I) R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он присоединен, представляет собой необязательно замещенную 2-фосфатрицикло[3.3.1.1{3,7}]децильную группу, где от 1 до 5 атомов углерода замещено гетероатомом.
Трицикло[3.3.1.1{3,7}]декан является систематическим названием соединения, как правило, известного как адамантан. Следовательно, для простоты в настоящем описании необязательно замещенная 2-фосфатрицикло[3.3.1.1{3,7}]децильная группа или ее производное могут обозначаться как «2-ФА»-группа («2-РА») (как в 2-фосфадамантильной группе).
В лигандах, используемых в настоящем изобретении, от 1 до 5 атомов углерода в «2-ФА»-группе замещено гетероатомом. Примерами гетероатомов, которые обычно могут быть использованы, являются атомы кислорода и серы, причем атомы кислорода предпочтительны. От 1 до 5 атомов углерода, замещенных гетероатомами, предпочтительно расположены в положениях 4, 6, 8, 9 или 10 «2-ФА»-группы. Наиболее предпочтительно 3 атома углерода «2-ФА»-группы замещены гетероатомами, предпочтительно в 6, 9 и 10 положениях.
Предпочтительно «2-ФА»-группа замещена в одном или в нескольких 1, 3, 5 или 7 положениях моновалентным радикалом, содержащим до 20 атомов, предпочтительно радикалом, содержащим от 1 до 10 атомов углерода, и более предпочтительно от 1 до 6 атомов углерода. Примерами подходящих моновалентных радикалов являются метильная, этильная, пропильная, фенильная и 4-додецилфенильная группы, причем метильная и этильная группы особенно предпочтительны. Более предпочтительно «2-ФА»-группа замещена в каждом из 1, 3, 5 и 7 положений. Наиболее предпочтительно заместители на каждом из 1, 3, 5 и 7 положениях являются одинаковыми.
Лиганды, которые дают особенно хорошие результаты в настоящем изобретении, представляют собой лиганды, где бивалентный радикал R1 вместе с атомом фосфора, к которому он присоединен, представляет собой 2-фосфа-1,3,5,7-тетраалкил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]децильную группу (А):
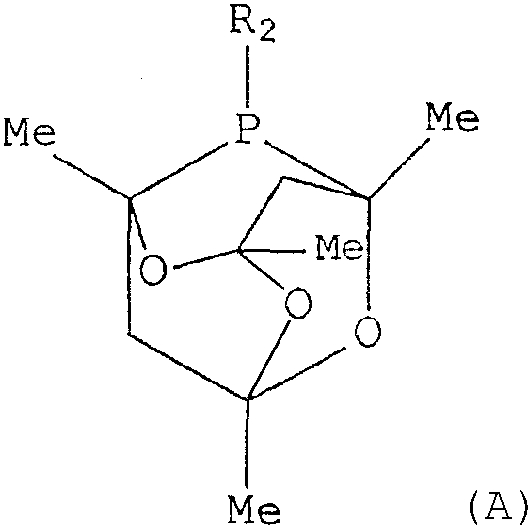
В лиганде общей формулы (I) R2 представляет собой моновалентный радикал, который представляет собой необязательно замещенную углеводородную группу, содержащую от 1 до 40 атомов углерода. Углеводородная группа может представлять собой замещенную или незамещенную, линейную или разветвленную цепь, насыщенную или ненасыщенную; предпочтительно такие углеводородные группы представляют собой алкильные, циклоалкильные, арильные, алкарильные и аралкильные группы. Когда углеводородная группа замещена, заместители, которые углеводородная группа обычно может содержать, могут быть независимо выбраны из одного или нескольких атомов галогена (например, атомов фтора или хлора), алкокси-, алкенилокси-, арилокси-, гидрокси-, диалкиламидо-, диариламидо-, алкилтио-, арилтиогрупп, алкилсульфонильной, алкилсульфинильной, алкоксикарбонильной, диалкиламино- и диариламиногрупп. В данном случае в качестве заместителей предпочтительно алкильный остаток содержит от 1 до 4 атомов углерода, алкенильный остаток содержит от 2 до 4 атомов углерода и арильная группа содержит от 6 до 12 атомов углерода, и в особенности представляет собой фенил. Предпочтительными заместителями являются диалкиламидо- и диариламидогруппы.
В первом предпочтительном варианте в способе настоящего изобретения используют лиганд, где моновалентный радикал R2 представляет собой алкильную группу, содержащую атомы углерода в интервале от 4 до 34. Предпочтительно алкильная группа R2 указанного варианта содержит, по меньшей мере, 6 атомов углерода, наиболее предпочтительно, по меньшей мере, 10, особенно предпочтительно, по меньшей мере, 12 атомов углерода; и предпочтительно до 28 атомов углерода, более предпочтительно до 22 атомов углерода. Алкильная группа может быть линейной или разветвленной, однако предпочтительно она будет линейной. Лиганды указанного варианта изобретения предпочтительны, так как они обеспечивают высокую конверсию до гликолевого альдегида и могут повышать стабильность катализатора. Они особенно хорошо работают при гидроформилировании формальдегида в неводных условиях.
Лиганды, которые могут быть успешно использованы в настоящем изобретении в соответствии с первым вариантом его осуществления, представляют собой 2-фосфа-2-гексил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан, 2-фосфа-2-октил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан, 2-фосфа-2-додецил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан и 2-фосфа-2-икозил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан.
Во втором предпочтительном варианте изобретения в способе настоящего изобретения используется лиганд, где моновалентный радикал R2 имеет общую формулу

где R3 представляет собой алкиленовую группу и R4 и R5 независимо друг от друга представляют собой алкильную, циклоалкильную, арильную или алкарильную группу, или R4 и R5 вместе представляют собой бивалентную мостиковую группу. Таким образом, алкиленовая группа R3 представляет собой метиленовую, этиленовую, пропиленовую или бутиленовую группу, наиболее предпочтительно этиленовую группу. Предпочтительно заместители R4 и R5 независимо друг от друга представляют собой арильную группу, например, фенил; или алкильную группу, предпочтительно алкильную группу, содержащую от 1 до 22 атомов углерода. Примерами алкильных групп, которые могут быть использованы, являются метильная, этильная, пропильная, бутильная и пентильная группы. Лиганды, где заместитель R2 имеет общую формулу (II), являются предпочтительными, так как они обеспечивают прекрасную конверсию до гликолевого альдегида и особенно предпочтительны для реакций гидроформилирования, проводимых с водным формальдегидом.
Лиганды, которые могут быть успешно использованы в настоящем изобретении в соответствии с его вторым вариантом осуществления, представляют собой 2-фосфа-2-(этил-N,N-диэтиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан, 2-фосфа-2-(этил-N,N-дифениламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло-[3.3.1.1{3,7}]декан и 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан.
Лиганды общей формулы (I) могут быть получены сочетанием необязательно замещенного 2-фосфатрицикло[3.3.1.1{3,7}]декана, где от 1 до 5 атомов углерода замещено гетероатомом, с подходящим предшественником группы R2. 2-Фосфатрицикло[3.3.1.1{3,7}]декан просто может быть получен с помощью химического способа, аналогичного способу, описанному в патенте США 3050531, где, например, 2-фосфа-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан получают реакцией 2,4-пентандиона с фосфином в присутствии соляной кислоты. Аналогичный химический процесс также обсуждается в главе 3 публикации «Precious Metal Complexes of Some Novel Functionalised Secondary and Tertiary Phospines» (Ms. Joanne, H. Downing (thesis submitted to the University of Bristol on November 1992).
Примерами предшественников группы R2 являются соединения формулы R2-X, где Х представляет собой галогенид, например, хлорид или бромид, которые могут быть успешно использованы при получении лигандов общей формулы (I), где R2 представляет собой алкильную группу; например, реакцией соединения R2-X с 2-фосфа-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]деканом или его аддуктом с бораном. С другой стороны, когда R2 имеет общую формулу -R3-C(O)NR4R5 (II), предшественник группы R2 успешно может представлять собой N,N-дизамещенный алкениламид. Например, лиганды, в которых R3 представляют собой этиленовую группу и R4 и R5 представляют собой алкильные группы, могут быть получены реакцией диалкилакриламида с «2-ФА»-группой в присутствии кислоты, например, уксусной кислоты. Другие лиганды в соответствии с настоящим изобретением могут быть получены аналогично, что хорошо понимают специалисты в данной области.
Каталитические композиции, используемые в настоящем изобретении, могут необязательно включать источник анионов с) в качестве дополнительного каталитического компонента. Предпочтительными анионами являются анионы протонных кислот, имеющих значение рКа (измеренное при 18°С в воде) менее чем 6, предпочтительно менее чем 4. Анионы, полученные из указанных кислот, не координируют или только слабо координируют с родием, что означает, что между анионом и родием имеет место незначительное ковалентное взаимодействие или такое взаимодействие отсутствует. Катализаторы, содержащие такие анионы, проявляют хорошую активность.
Примерами подходящих анионов являются анионы, полученные из кислот Бренстеда, таких как фосфорная кислота и серная кислота; а также анионы, полученные из сульфоновых кислот, например, метансульфоновой кислоты, трифторметансульфоновой кислоты, п-толуолсульфоновой кислоты и 2,4,6-триметилбензолсульфоновой кислоты; и анионов, полученных из карбоновых кислот, например, 2,4,6-триметилбензойной кислоты, 2,4,6-триизопропилбензойной кислоты, 9-антраценкарбоновой кислоты и галогенированных карбоновых кислот, таких как трифторуксусная кислота, 2,6-дихлорбензойная кислота и 2,6-бис(трифторметил)бензойная кислота. Особенно хорошие результаты получены при использовании в качестве источников анионов алкилзамещенных бензойных кислот, в особенности С1-С4-алкилзамещенных бензойных кислот.
Также подходящими являются комплексные анионы, такие как анионы, полученные путем объединения кислоты Льюиса, такой как BF3, B(C6F5)3, AlCl3, SnF2, Sn(CF3SO3)2, SnCl2 или GeCl2, с протонной кислотой, предпочтительно имеющей рКа менее чем 5, такой как сульфоновая кислота, например, CF3SO3H или CH3SO3H, или галогенводородная кислота, такая как HF или HСl, или путем объединения кислоты Льюиса со спиртом. Примерами таких комплексных анионов являются BF4 -, SnCl3 -, [SnCl2 .CF3SO3]- и PF6 -.
Мольное отношение монооксида углерода к водороду, подаваемому в процесс настоящего изобретения, не является критическим и может меняться в широком интервале, например от 5:95 до 95:5, предпочтительно от 30:70 до 80:20. Однако в целом предпочтительно использование потока газа, в котором мольное отношение СО:Н2 составляет, по меньшей мере, 1:1, так как это сводит до минимума образование метанола. Способ предпочтительно проводят под давлением, обычно в интервале от 5 до 200 бар (от 0,5 до 20 МПа) и предпочтительно в интервале от 10 до 50 бар (от 1 до 5 МПа). Может быть использовано более высокое давление, однако это обычно считается неэкономичным. В потоке газа также могут присутствовать инертные газы, но, так как это приводит к повышению суммарного давления, это считается нежелательным.
Реакцию гидроформилирования настоящего изобретения удобно проводить при умеренных температурах, предпочтительно в интервале от 22 до 180°С, более предпочтительно от 50 до 130°С. Использование как можно более низкой температуры, соизмеримой с желаемой скоростью реакции, предпочтительно, так как при более высоких температурах получаемый гликолевый альдегид чувствителен к побочным реакциям, например, к реакциям альдольной конденсации.
Время реакции процесса настоящего изобретения, конечно, зависит от используемых температур и давления. В целом установлено, что время реакции может находиться в интервале от 1 до 10 ч, предпочтительно от 1 до 6 ч, в особенности от 2 до 5 ч.
Количество, в котором каталитическая система используется в настоящем изобретении, не имеет критического значения и может меняться в пределах широкого интервала. Однако количество атомных молей металлического родия на моль формальдегида будет предпочтительно находиться в интервале от 1:1 до 1:106, более предпочтительно от 1:10 до 1:105 и даже более предпочтительно от 1:100 до 1:104.
Для получения каталитических систем, используемых в настоящем изобретении, количество лиганда общей формулы (I) обычно находится в избытке к количеству родия, что выражается в виде молей лиганда на атомные моли родия. Обычно количество лиганда выбирают так, чтобы на атомный моль родия присутствовало от 1 до 20 молей лиганда. Однако в случае предпочтительной каталитической системы мольное количество лиганда на моль родия предпочтительно находится в интервале от 2 до 10, более предпочтительно в интервале от 2 до 5. При наличии источника аниона с) его количество, хотя и не является критическим, может находиться в интервале от 1 до 500, предпочтительно от 1 до 150 и более предпочтительно от 1 до 20 молей на атомный моль родия.
Способ настоящего изобретения может быть проведен в присутствии растворителя. Примерами растворителей, которые удобно использовать, являются нитрилы, пиридины, замещенные или незамещенные мочевины, например, N,N,N',N'-тетразамещенные мочевины, и замещенные или незамещенные амиды, например, N,N-дизамещенные амиды.
Формальдегид может быть введен в реакционную систему в любой подходящей форме или он может быть получен in situ. Обычным источником формальдегида является параформальдегид. Кроме того, положительным признаком настоящего изобретения является то, что хорошие результаты достигаются, когда в качестве источника формальдегида используют водный формальдегид. Таким образом, в предпочтительном способе в соответствии с настоящим изобретением источником формальдегида является водный формальдегид.
Когда источником формальдегида является водный формальдегид, также предпочтительно, чтобы процесс проводился в реакционной среде, содержащей водную фазу и органическую фазу, где органическая фаза и водная фаза не смешиваются при 22°С. Под определением «не смешиваются», вне всякого сомнения, понимается, что при стоянии при 22°С органическая фаза и водная фаза остаются разделенными на два отдельных слоя. Реакционная среда, содержащая водную фазу и органическую фазу, предпочтительна, так как по окончании реакции катализатор будет оставаться в органической фазе, тогда как гликолевый альдегид будет оставаться в водной фазе, и, следовательно, продукт может быть легко отделен от катализатора путем разделения фаз. Такая методика возможна в настоящем изобретении, так как каталитические композиции более стабильны в водных условиях, чем известные катализаторы на основе арилзамещенных фосфиновых лигандов.
Когда процесс проводят в реакционной среде, содержащей водную фазу и органическую фазу, растворитель органической фазы может представлять собой несмешивающийся с водой амидный растворитель. Примерами несмешивающихся с водой амидных растворителей, которые могут быть использованы в настоящем изобретении, являются растворители, содержащие длинноцепочечные алкильные остатки, и они представляют собой N-алкил-2-пирролидоны, в которых алкильная группа содержит, по меньшей мере, 7 атомов углерода, предпочтительно в интервале от 8 до 20 атомов углерода, N,N-диалкилацетамиды, в которых каждая алкильная группа содержит от 1 до 10 атомов углерода, предпочтительно от 1 до 6 атомов углерода, и N,N-диарилацетамиды, предпочтительно N,N-дифенилацетамид. Примерами несмешивающихся с водой амидных растворителей, которые предпочтительно дают хорошие результаты при использовании в настоящем изобретении, являются N-октилпирролидон и N,N-дибутилацетамид.
Особенно предпочтительным вариантом осуществления настоящего изобретения является процесс, который проводят в реакционной среде, содержащей водную фазу и органическую фазу, содержащую несмешивающийся с водой амидный растворитель, и где в лиганде общей формулы R1P-R2 (I) моновалентный радикал R2 имеет общую формулу -R3-C(O)NR4R5 (II).
Содержащие родий каталитические композиции, описанные выше, специально разработаны для применения в способе настоящего изобретения.
Каталитические композиции данного типа попадают в широкий интервал определений комплексов металл-лиганд, описанных в публикации US-A-2003/0092935 для гидроформилирования олефинов, таких как α-олефины, внутренние олефины и внутренние разветвленные олефины. Предпочтительные каталитические композиции для применения в способе настоящего изобретения отличаются от предпочтительных комплексов металл-лиганд публикации US-A-2003/0092935 и проявляют прекрасную активность при гидроформилировании формальдегида, совсем другого субстрата, как в неводных, так и в водных условиях. Каталитические композиции, в которых моновалентный радикал R2 лиганда (I) имеет общую формулу -R3-C(O)NR4R5 (II), функционируют особенно хорошо в водных условиях, например, когда используют формалин в качестве субстрата, или когда в реакционной среде присутствует вода. Таким образом, настоящее изобретение также предлагает каталитическую композицию, получаемую путем объединения а) источника родия, b) лиганда общей формулы:
 ,
,
где R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он прикреплен, представляет собой необязательно замещенную 2-фосфатрицикло[3.3.1.1{3,7}]децильную группу, где от 1 до 5 атомов углерода замещено гетероатомом и где R2 представляет собой моновалентный радикал, который представляет собой необязательно замещенную алкильную группу, содержащую от 10 до 40 атомов углерода, или предпочтительно имеет общую формулу -R3-C(O)NR4R5, где R3 представляет собой алкиленовую группу и R4 и R5 независимо друг от друга представляют собой алкил, циклоалкил, арил или алкарильную группу, или R4 и R5 вместе представляют собой бивалентную мостиковую группу, и необязательно с с) источником анионов. В рамках такого определения заместителя R2 предпочтительные каталитические композиции, описанные выше в работе относительно способа настоящего изобретения, также являются предпочтительными в качестве каталитической композиции настоящего изобретения.
Важным применением гликолевого альдегида является его превращение в этиленгликоль, и настоящее изобретение также обеспечивает способ получения этиленгликоля путем гидрирования гликолевого альдегида, полученного с помощью процесса гидроформилирования, описанного выше.
Катализаторы гидрирования, используемые при превращении гликолевого альдегида в этиленгликоль, хорошо известны в данной области техники, например, палладиевые, платиновые или никелевые катализаторы, часто в гетерогенной форме. Когда гликолевый альдегид получают в неводных условиях, выбранный катализатор гидрирования может быть добавлен непосредственно в реакционную смесь, полученную при получении гликолевого альдегида без ее обработки, и затем вводят газообразный водород. С другой стороны, реакционная смесь может быть обработана перед гидрированием гликолевого альдегида, например, путем экстракции подходящим растворителем, таким как вода или сам этиленгликоль, и полученный раствор затем гидрируют обычным способом. Такая методика особенно удобна, когда гликолевый альдегид получают из водного формальдегида в реакционной среде, содержащей водную фазу, как это в настоящее время возможно благодаря настоящему изобретению.
Изобретение дополнительно можно понять с помощью следующих иллюстративных примеров.
Синтез лигандов
Следующие примеры, которые проведены в атмосфере очищенного аргона с использованием стандартных методик Шленка, иллюстрируют типичное получение лиганда в соответствии с настоящим изобретением, где (i) R2 представляет собой алкильную группу (2-фосфа-2-икозил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан) и (ii)
R2 имеет общую формулу (II) (2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан).
(i) Синтез 2-фосфа-2-икозил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана
Аддукт борана и 2-фосфа-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана готовят путем добавления ВН3 .ТГФ (70 мл 1 М раствора в ТГФ) к раствору 2-фосфа-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана (60 ммоль) в ТГФ при 0°С. Реакционной смеси дают нагреться до комнатной температуры и перемешивают 2 ч, после чего растворитель удаляют в вакууме, получают борановый аддукт.
К раствору полученного аддукта (16 ммоль в ТГФ) добавляют раствор гексиллития (6,4 мл, 2,5 М в гексане) при температуре -70°С, и реакционной смеси дают нагреться до -20°С в течение 1 ч. После повторного охлаждения до -70°С добавляют раствор 1-бромикозана (16 ммоль в ТГФ). Реакционной смеси затем дают нагреться до комнатной температуры и перемешивают 2 ч, добавляют диэтиламин (3 мл) и реакционную смесь затем кипятят с обратным холодильником 12 ч. По окончании реакции растворитель удаляют в вакууме. Затем продукт выделяют путем экстракции растворителем в дихлорметан-толуол и воду, причем при упаривании толуольных фракций остается твердый остаток, который промывают метанолом, и получают 2-фосфа-2-икозил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло-[3.3.1.1{3,7}]декан (выход 96%).
(ii) Синтез 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана
2-Фосфа-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан (40 ммоль) и N,N-диметилакриламид (100 ммоль) вводят в пробирку Шленка, содержащую смесь толуола и уксусной кислоты, и нагревают до температуры 115°С. Через 18 ч реакционную смесь охлаждают до 80°С, и растворители упаривают в вакууме. Остаток затем растворяют в триэтиламине и смесь нагревают до температуры 100°С в течение 2,5 ч, после чего полученную гомогенную смесь охлаждают до комнатной температуры. Продукт затем выделяют экстракцией растворителем с помощью толуола и воды, толуольные фракции упаривают, получают 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декан (выход 79%).
Гидроформилирование формальдегида
Приведенные ниже примеры проводят в автоклаве объемом 250 мл при перемешивании с помощью магнитной мешалки. В автоклав загружают реагенты и растворитель, после чего из автоклава удаляют воздух и давление в автоклаве повышают с помощью монооксида углерода и водорода, каждого до парциального давления 30 бар (3 МПа). Содержимое автоклава затем нагревают до температуры реакции. По окончании реакции содержимое автоклава охлаждают и определяют конверсию формальдегида и выход гликолевого альдегида с помощью газожидкостной хроматографии при использовании диметилового эфира диэтиленгликоля в качестве внутреннего стандарта. Все лиганды получают с использованием той же химической методики, которая описана выше для лигандов (i) и (ii).
Пример 1
(Лиганд «2-ФА»-С20 в неводных условиях)
В автоклав загружают 0,17 моль формальдегида в форме пара-формальдегида, 62 мл (0,58 моль) N-метилпирролидона, 0,25 ммоль родийдикарбонилацетонилацетона (Rh(аcac)(CO)2), 0,50 ммоль 2-фосфа-2-икозил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 110˚С и выдерживают при этой температуре 2 ч.
Конверсия формальдегида составляет 100% и выход гликолевого альдегида, рассчитанный на поглощенный формальдегид, составляет 7 6%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 595 моль СО/моль Rh.ч.
Пример 2
(Лиганд «2-ФА»-С20 в водных условиях)
В автоклав загружают 0,17 моль формальдегида в форме параформальдегида, 35 мл (0,22 моль) дибутилацетамида, 25 мл деминерализованной воды, 0,25 ммоль Rh(acac)(СО)2, 0,53 ммоль 2-фосфа-2-икозил-1,3,5,7-тетраметил-б,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 110˚С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 64% и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 45%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 115 моль СО/моль Rh.4.
Пример 3
(Лиганд «2-ФА»-СН2СН2С(О)NMe2 в неводных условиях)
В автоклав загружают 0,18 моль формальдегида в форме параформальдегида, 23 мл (0,15 моль) ди-втор.-бутилацетамида, 0,25 ммоль Rh(асас) (СО)2, 0,49 ммоль 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 100°С и выдерживают при этой температуре 3 ч.
Конверсия формальдегида составляет 72%, и выход гликолевого альдегида в однофазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 69%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 275 моль СО/моль Rh.ч.
Пример 4
(Лиганд «2-ФА»-СН2СН2С(О)NMe2 в неводных условиях)
В автоклав загружают 0,25 моль формальдегида в форме параформальдегида, 35 мл (0,26 моль) N,N'-диметилпропилмочевины, 0,10 ммоль Rh(асас)(СО)2, 0,20 ммоль 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 3,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 90°С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 73%, и выход гликолевого альдегида в однофазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 71%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 595 моль СО/моль Rh.ч.
Пример 5
(Лиганд «2-ФА»-CH2CH2C18 в неводных условиях)
В автоклав загружают 0,25 моль формальдегида в форме пара-формальдегида, 35 мл (0,26 моль) N,N'-диметилпропилмочевины, 0,10 ммоль Rh(асас)(СО)2, 0,20 ммоль 2-фосфа-2-октил-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 3,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 90°С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 69%, и выход гликолевого альдегида в однофазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 66%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 518 моль СО/моль Rh.ч.
Пример 6
(Лиганд «2-ФА»-СН2СН2С(О)NMе2 в водных условиях)
В автоклав загружают 0,15 моль формальдегида в форме формалинового раствора (37% формальдегида в воде), 37 мл (0,22 моль) дибутилацетамида, 7,5 мл деминерализованной воды, 0,49 ммоль Rh(асас)(СО)2, 0,96 ммоль 2-фосфа-2-(этил-N,N-диметиламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло [3.3.1.1{3,7}]декана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 90°С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 90%, и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 90%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 170 моль СО/моль Rh.ч.
Пример 7
(Лиганд «2-ФА»-СН2СН2С(О)NPh2 в водных условиях)
В автоклав загружают 0,15 моль формальдегида в форме формалинового раствора (37% формальдегида в воде), 37 мл (0,22 моль) дибутилацетамида, 7,5 мл деминерализованной воды, 0,44 ммоль Rh(асас)(СО)2, 0,89 ммоль 2-фосфа-2-(этил-N,N-дифениламидо)-1,3,5,7-тетраметил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]декана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 110°С и выдерживают при этой температуре 3 ч.
Конверсия формальдегида составляет 100%, и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 52%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 180 моль СО/моль Rh.ч.
Сравнительный пример А
(Лиганд PPh3 в неводных условиях)
В автоклав загружают 0,17 моль формальдегида в форме параформальдегида, 37 мл (0,24 моль) дибутилацетамида, 0,25 ммоль Rh(acac)(СО)2, 0,52 ммоль трифенилфосфина и 9,3 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 90°С и выдерживают при этой температуре 10 ч.
Конверсия формальдегида составляет 61%, и выход гликолевого альдегида в однофазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 40%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 75 моль СО/моль Rh.ч.
Сравнительный пример В
(Лиганд PPh3 в водных условиях)
В автоклав загружают 0,17 моль формальдегида в форме пара-формальдегида, 37 мл (0,22 моль) дибутилацетамида, 12,5 мл деминерализованной воды, 0,25 ммоль Rh(acac)(СО)2, 0,52 ммоль трифенилфосфина и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 90°С и выдерживают при этой температуре 10 ч.
Конверсия формальдегида составляет 54%, и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 25%. Начальную скорость реакции рассчитывают путем измерения падения давления, и она составляет 51 моль СО/моль Rh.ч.
Сравнительный пример С
(Лиганд 9-икозил-9-фосфабицикло[3.3.1]нонан в водных условиях)
В автоклав загружают 0,17 моль формальдегида в форме пара-формальдегида, 37 мл (0,19 моль) N-октилпирролидона, 25 мл деминерализованной воды, 0,25 ммоль Rh(acac)(СО)2, 0,52 ммоль 9-икозил-9-фосфабицикло[3.3.1]нонана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 110°С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 17%, и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 6%.
Сравнительный пример D
(Лиганд 9-СН2СН2С(О)NMe2-9-фосфабицикло [3.3.1]нонан в водных условиях)
В автоклав загружают 0,17 моль формальдегида в форме пара-формальдегида, 37 мл (0,22 моль) дибутилацетамида, 25 мл деминерализованной воды, 0,25 ммоль Rh(асас)(СО)2, 0,50 ммоль 9-фосфа-9-(этил-N,N-диметиламидо)бицикло[3.3.1]нонана и 9,1 ммоль триметилбензойной кислоты. Содержимое автоклава затем нагревают до температуры 110°С и выдерживают при этой температуре 5 ч.
Конверсия формальдегида составляет 3%, и выход гликолевого альдегида в двухфазном реакционном продукте, рассчитанный на поглощенный формальдегид, составляет 0%.
Приведенные выше примеры показывают, что каталитические композиции в соответствии с настоящим изобретением демонстрируют превосходные свойства относительно сравнительных композиций, содержащих трифенилфосфиновый лиганд, как в водных, так и в неводных условиях (например, если сравнить примеры 1 и 3 со сравнительным примером А и примеры 2 и 4 со сравнительным примером В), и относительно катализаторов на основе других форм лиганда, содержащего бициклический фосфин (см. сравнительные примеры С и D). Более того, из примеров 4 и 5 можно увидеть, что каталитические композиции общей формулы (I), где R2 имеет общую формулу -R3-C(О)NR4R5 и сохраняют хороший уровень свойств даже в водных условиях.
Гидрирование этиленгликоля
Чтобы показать простоту, с которой гликолевый альдегид, полученный в соответствии с настоящим изобретением, может быть превращен в этиленгликоль, водную фазу, отделенную от реакционной смеси реакции гидроформилирования, проведенной в условиях, аналогичных условиям примера 2 (лиганд «2-ФА»-С20 в водных условиях), обрабатывают суспензией никеля Ренея. Водную фазу (25 мл, 9,5 мас.% гликолевого альдегида) смешивают с суспензией никеля Ренея (2 мл) и перемешивают 15 ч при температуре 40єС, затем обрабатывают водородом при давлении 50 бар (5 МПа). Конверсия гликолевого альдегида в этиленгликоль составляет 90%.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИТИЧЕСКАЯ СИСТЕМА | 2005 |
|
RU2372989C2 |
| КАТАЛИТИЧЕСКАЯ СИСТЕМА | 2003 |
|
RU2326123C2 |
| АЗААДАМАНТАНОВЫЕ ПРОИЗВОДНЫЕ И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2450002C2 |
| ГИДРОКСИЗАМЕЩЕННЫЕ СТЕРИЧЕСКИ ЗАТРУДНЕННЫЕ N-АЛКОКСИАМИНЫ | 2000 |
|
RU2243216C2 |
| СПОСОБ ГИДРОКСИАЛКИЛИРОВАНИЯ АРОМАТИЧЕСКОГО КАРБОЦИКЛИЧЕСКОГО ПРОСТОГО ЭФИРА, СПОСОБ ОКИСЛЕНИЯ АРОМАТИЧЕСКОГО ГИДРОКСИАЛКИЛИРОВАННОГО ПРОСТОГО ЭФИРА, СПОСОБ ПОЛУЧЕНИЯ ВАНИЛИНА, СПОСОБ ПОЛУЧЕНИЯ ЭТИЛВАНИЛИНА | 1996 |
|
RU2169135C2 |
| ПРОИЗВОДНЫЕ ЭФИРОВ БИСФЕНОЛА, СТАБИЛИЗИРОВАННАЯ КОМПОЗИЦИЯ И СПОСОБ СТАБИЛИЗАЦИИ ПОЛИМЕРА | 1995 |
|
RU2141469C1 |
| СТАБИЛИЗАЦИЯ ОРГАНИЧЕСКОГО МАТЕРИАЛА СОЕДИНЕНИЯМИ МАННИХА НА ОСНОВЕ АМИНОТРИАЗИНА | 2012 |
|
RU2593997C2 |
| СПОСОБ СИНТЕЗА ПРОСТЫХ ЭФИРОВ АМИНОКСИЛОВ ИЗ ВТОРИЧНЫХ АМИНООКСИДОВ | 2001 |
|
RU2273634C2 |
| СПОСОБЫ ХРАНЕНИЯ КАТАЛИЗАТОРОВ НА ОСНОВЕ ФОСФОРОРГАНИЧЕСКИХ ЛИГАНДОВ С ПЕРЕХОДНЫМИ МЕТАЛЛАМИ | 2012 |
|
RU2598386C2 |
| ПОЛИУРЕТАНОВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ГИДРОКСИАЛЬДИМИН | 2009 |
|
RU2546113C2 |
Настоящее изобретение относится к способу получения гликолевого альдегида, включающему взаимодействие формальдегида с водородом и монооксидом углерода в присутствии каталитической композиции, которая основана на а) источнике родия, b) лиганде общей формулы

где R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он присоединен, представляет собой 2-фосфа-1,3,5,7-тетраС1-20алкил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]децильную группу, и где R2 представляет собой моновалентный радикал, который выбирают из алкильной группы, содержащей от 4 до 34 атомов углерода или радикала общей формулы:

где R3 представляет собой метилен, этилен, пропилен или бутилен, и R4 и R5 независимо друг от друга представляют собой алкильную группу, содержащую от 1 до 22 атомов углерода, и с) источнике анионов. Способ позволяет легко превращать формальдегид в присутствии стабильного катализатора в гликолевый альдегид. Изобретение также относится к каталитической композиции, используемой для получения гликолевого альдегида, и к способу получения этиленгликоля из полученного указанным образом гликолевого альдегида. 3 н. и 3 з.п. ф-лы.
1. Способ получения гликолевого альдегида, включающий взаимодействие формальдегида с водородом и монооксидом углерода в присутствии каталитической композиции, которая основана на
a) источнике родия,
b) лиганде общей формулы

где R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он присоединен, представляет собой 2-фосфа-1,3,5,7-тетраС1-20алкил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]децильную группу, и где R2 представляет собой моновалентный радикал, который выбирают из алкильной группы, содержащей от 4 до 34 атомов углерода или радикала общей формулы

где R3 представляет собой метилен, этилен, пропилен или бутилен, и R4 и R5 независимо друг от друга представляют собой алкильную группу, содержащую от 1 до 22 атомов углерода, и с) источнике анионов.
2. Способ по п.1, где источником формальдегида является водный формальдегид и реакцию проводят в реакционной среде, содержащей водную фазу и органическую фазу, где органическая фаза и водная фаза не смешиваются при 22°С.
3. Способ по п.2, где органическая фаза содержит несмешивающийся с водой амидный растворитель.
4. Каталитическая композиция для получения гликолевого альдегида по п.1, получаемая объединением а) источника родия, b) лиганда общей формулы

где R1 представляет собой бивалентный радикал, который вместе с атомом фосфора, к которому он присоединен, представляет собой 2-фосфа-1,3,5,7-тетраС1-20алкил-6,9,10-триоксатрицикло[3.3.1.1{3,7}]децильную группу, и где R2 представляет собой моновалентный радикал, который выбирают из алкильной группы, содержащей от 10 до 34 атомов углерода, или моновалентный радикал R2 представляет собой радикал общей формулы

где R3 представляет собой метилен, этилен, пропилен или бутилен, и R4 и R5 независимо друг от друга представляют собой алкильную группу, содержащую от 1 до 22 атомов углерода, и с) источник анионов.
5. Каталитическая композиция по п.4, где в лиганде b) R2 имеет общую формулу II.
6. Способ получения этиленгликоля, который включает получение гликолевого альдегида способом по любому из пп.1-3, и затем гидрирование указанного гликолевого альдегида.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| СЕСОЮЗНАЯ IПАШТВО-Т?ХН['';?СИАЯ| | 0 |
|
SU331512A1 |
| US 4608444 А, 26.08.1986 | |||
| US 4414421 А, 08.11.1983 | |||
| Способ получения гликолевого альдегида | 1988 |
|
SU1608182A1 |
Авторы
Даты
2009-10-27—Публикация
2004-12-15—Подача