Ссылка на родственные заявки
В данном описании изобретения сделана ссылка на нижеследующие заявки: заявка на патент США № 09/750990, поданная 20 июля 1999 г., и заявка на патент США № 10/409391. Вышеуказанные заявки, все документы, приведенные в данных заявках (“документы, приведенные в заявках”), и все документы, которые приведены или на которые дана ссылка в документах, приведенных в заявках, как в тексте, так и во время ведения дела по заявкам, а также все доводы в поддержку патентоспособности, представленные во время рассмотрения заявок, включены в данное описание изобретения в качестве ссылки. В данном описании изобретения приведены также разные документы (именуемые “документами, на которые имеется ссылка в материалах заявки”). Все документы, на которые имеется ссылка в материалах заявки, и все документы, приведенные в таких документах, включены в данное описание изобретения в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу биоконверсии липидов при помощи липидацилтрансферазы с целью получения сложного эфира углевода, и/или сложного эфира белка, и/или сложного эфира белковой субъединицы, и/или сложного эфира гидроксикислоты.
Настоящее изобретение, кроме того, относится к применению липидацилтрансферазы для биоконверсии липида в один или несколько нижеследующих продуктов: сложный эфир углевода, и/или сложный эфир белка, и/или сложный эфир белковой субъединицы, и/или сложный эфир гидроксикислоты.
Настоящее изобретение, более того, относится к применению вышеуказанной иммобилизованной липидацилтрансферазы для биоконверсии липида в среде с высоким содержанием воды с целью получения одного или нескольких сложных эфиров углеводов, и/или сложных эфиров белков, и/или сложных эфиров белковых субъединиц, и/или сложных эфиров гидроксикислот.
Настоящее изобретение также относится к иммобилизованной липидацилтрансферазе.
Уровень техники
Липазы широко используются для биоконверсии липидов с целью получения ценных продуктов, например сложных эфиров сахаров, предназначенных для применения в разных отраслях промышленности, включая пищевую промышленность и/или промышленность по производству кормов, косметическую и/или парфюмерную промышленность, олеохимическую промышленность и фармацевтическую промышленность.
Если процессы биоконверсии требуют гидролиза липидных субстратов, то можно использовать липолитические ферменты в средах с высоким содержанием воды. Однако когда процессы биоконверсии требуют выполнения реакций переэтерификации, таких как алкоголиз, применение липаз в средах с высоким содержанием воды может быть неприемлемым из-за нежелательных реакций гидролиза, вызывающих образование нежелательных биопродуктов и/или из-за более низкого выхода продукта биоконверсии.
При выполнении процессов биоконверсии, требующих переэтерификации, обычно используют липазы в безводных средах, таких как масляные системы, и/или системы органических растворителей, таких как бутанол, метанол или гексан. Такие системы образуют среду, в которой по крайней мере частично могут быть солюбилизованы как полярная акцепторная молекула, так и донорная молекула липида и липаза обладает достаточной ферментативной активностью. Хотя для обеспечения любой ферментативной активности необходимо небольшое количество воды, ее количество строго контролируется на низком уровне во избежание гидролитической активности фермента.
Сложные эфиры сахаров, сложные эфиры белков или сложные эфиры гидроксикислот получают химическим синтезом с использованием неорганических катализаторов. При выполнении процессов биоконверсии, направленных на получение сложных эфиров сахаров или сложных эфиров гидроксикислот, используют липазы в органических растворителях или сверхкритических жидкостях, в которых присутствует лишь незначительное количество воды (если вообще присутствует).
В публикации Lecointe et al., Biotechnology Letters, Vol. 28, No. 8 (August), стр. 869-874, описано исследование ряда ферментов липазы и их активности в водных средах при получении сложного метилового эфира или сложного бутилового эфира соответственно из метанола и бутанола. В публикации Lecointe et al. указано, что липаза/ацилтрансфераза из Candida parapsilosis при увеличении концентраций метанола или бутанола демонстрирует пониженную гидролизную активность и повышенную способность фермента продуцировать сложный метиловый эфир и сложный бутиловый эфир. Использование липазы/ацилтрансферезы из C. parapsilosis при получении жирной гидроксамовой кислоты рассмотрено в публикации Vaysse et al., J. of Biotechnology 53 (1997) 41-46.
На протяжении некоторого времени известна липаза:холестерол-ацилтрансфераза (см., например, публикацию Buckley, Biochemistry 1983, 22, 5490-5493). В частности, было обнаружено, что глицерофосфолипид: холестерол-ацилтрансферазы (часто именуемые GCAT), которые, как и лецитин:холестерол-ацилтрансферазы (LCAT) растений и/или млекопитающих, катализируют перенос жирных кислот между фосфатидилхолином и холестерином.
В публикациях Upron and Buckley (TIBS 20, May 1995 стр. 178-179) и Brumlik and Buckley (J. of Bacteriology Apr. 1996 стр. 2060-2064) описана липаза/ацилтрансфераза из Aeromonas hydrophila, которая способна осуществлять перенос ацильной группы в спиртовые акцепторы в водных средах.
Сущность изобретения
Первым объектом настоящего изобретения является способ получения одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот, который включает смешивание донора ацильной группы, акцептора ацильной группы и воды с образованием среды с высоким содержанием воды, содержащей 5-98% воды, при этом вышеуказанный донор ацильной группы является липидным субстратом, выбранным из одного или нескольких членов группы, включающей фосфолипид, лизофосфолипид, триацилглицерид, диглицерид, гликолипид или лизогликолипид, и вышеуказанный акцептор ацильной группы выбирают из одного или нескольких членов группы, включающей углевод, белок, белковую субъединицу или гидроксикислоту; и контактирование указанной смеси с липидацилтрансферазой, осуществляемого таким образом, что липидацилтрансфераза катализирует одну или обе нижеследующие реакции: алкоголиз или переэтерификацию.
Другим объектом настоящего изобретения является применение липидацилтрансферазы для получения одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот путем катализа алкоголиза или переэтерификации либо обеих указанных реакций в смеси донора ацильной группы, акцептора ацильной группы и воды, содержащей 5-98% воды в смеси, при этом вышеуказанным донором ацильной группы является липидный субстрат, выбираемый из одного или нескольких членов группы, включающей фосфолипид, лизофосфолипид, триацилглицерид, диглицерид, гликолипид или лизогликолипид, и вышеуказанный акцептор ацильной группы выбирают из одного или нескольких членов группы, включающей углевод, белок, белковую субъединицу или гидроксикислоту.
Другим объектом настоящего изобретения является сложный эфир углевода, сложный эфир белка, сложный эфир белковой субъединицы или сложный эфир гидроксикислоты, полученный способом по настоящему изобретению.
Еще одним объектом настоящего изобретения являются фармацевтический препарат, косметический препарат, пищевой продукт, кормовой продукт и краска, содержащие сложный эфир углевода, сложный эфир белка, сложный эфир белковой субъединицы или сложный эфир гидроксикислоты, полученный способом по настоящему изобретению.
Еще одним объектом настоящего изобретения является иммобилизованный фермент липидацилтрансфераза, описанный в данной заявке.
Подробное описание настоящего изобретения
Термин “липидацилтрансфераза” в используемом здесь значении означает фермент, который кроме того, что обладает липазной активностью (обычно классифицируемой как Е.С. 3.1.1.х в соответствии с рекомендациями по номенклатуре ферментов (1992) Комитета по номенклатуре Международного союза по биохимии и молекулярной биологии), также обладает ацилтрансферазной активностью (обычно классифицируемой как Е.С. 2.3.1.х), благодаря чему фермент способен переносить ацильную группу из липида в один или несколько нижеследующих акцепторных субстратов: углевод, белок, белковая субъединица или гидроксикислота.
“Акцептор ацильной группы” по настоящему изобретению предпочтительно не является водой.
В соответствии с одним объектом изобретения фермент предпочтительно способен переносить ацильную группу из липидного субстрата в углевод.
Углеводным акцетором ацильной группы может быть одно или несколько нижеследующих веществ: моносахарид, дисахарид, олигосахарид или полисахарид. Углеводом предпочтительно является одно или несколько нижеследующих веществ: глюкоза, фруктоза, ангидро-фруктоза, мальтоза, лактоза, сахароза, галактоза, ксилоза, ксилоолигосахариды, арабиноза, мальтоолигосахариды, тагатоза, микротецин, аскопирон Р, аскопирон Т или кортальцерон.
Сложные эфиры углеводов могут быть ценными эмульгаторами, например, в пищевых продуктах.
В соответствии с одним объектом изобретения фермент предпочтительно способен переносить ацильную группу из липидного субстрата в белок и/или белковую субъединицу.
Белковой субъединицей предпочтительно является одно или несколько нижеследующих веществ: аминокислота, гидролизат белка, пептид, дипептид, олигопептид, полипептид.
Приемлемые белки могут представлять собой одно или несколько нижеследующих веществ: белки, присутствующие в пищевых продуктах, например в молочных и/или мясных продуктах. В качестве примера можно привести белки, обнаруживаемые в свернувшемся молоке или сыворотке, такие как лактоглобулин. Другие приемлемые белки включают овальбумин (из яйца), глиадин, глютенин, пуроиндолин, пшеничный белок, липидпереносящие белки из зерна, миозин из мяса или нижеследующие молочные белки: казеины, лактоальбумины и лактоферрины.
Акцептором ацильной группы в белке или белковой субъединице может быть один или несколько нижеследующих компонентов белка или белковой субъединицы: серин, треонин, тирозин или циcтеин.
Когда белковой субъединицей является аминокислота, то такой аминокислотой может быть любая аминокислота. Аминокислотой предпочтительно является, например, серин, треонин, тирозин или цистеин.
В соответствии с одним объектом изобретения фермент способен переносить ацильную группу из липидного субстрата в гидроксикислоту.
Приемлемой гидроксикислотой может быть одна или несколько нижеследующих кислот: лимонная кислота, винная кислота, молочная кислота, аскорбиновая кислота, гликолевая кислота, яблочная кислота, альфа-гидроксиэтановая кислота, альфа-гидроксиоктановая кислота, альфа-гидроксикаприловая кислота, гидроксикаприловая кислота, глюконовая кислота, лактобионовая кислота или мальтобионовая кислота.
Приемлемой гидроксикислотой может быть фруктовая кислота, например одна или несколько кислот, таких как яблочная кислота, молочная кислота, винная кислота, лимонная кислота или гликолевая кислота.
В одном варианте осуществления изобретения предпочтительной гидроксикислотой является одна или несколько нижеследующих кислот: лимонная кислота, молочная кислота, винная кислота или яблочная кислота.
Термин “оксикислота” в используемом здесь значении означает карбоновую кислоту, в которой один или несколько атомов водорода алкильной группы заменены гидроксильной группой.
В соответствии с одним объектом изобретения липидацилтрансфераза помимо способности переносить ацильную группу из липидного субстрата в один или неколько углеводов, белков, белковых субъединиц или гидроксикислот может также переносить ацильную группу из липида в одно или несколько нижеследующих веществ, представляющих собой стерол и/или станол, в частности фитостерол и/или фитостанол.
Когда липидным субстратом является фосфолипид, он может быть лецитином, например фосфатидилхолином. Термин “лецитин” в используемом здесь значении означает фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозитол, фосфатидилсерин и фосфатидилглицерин.
Когда липидным субстратом является лизофосфолипид, он может быть лизолецитином, например лизофосфатидилхолином. Термин “лизофосфатидилхолин” в ипользуемом здесь значении синонимичен термину “лизолецитин”, поэтому указанные термины можно использовать взаимозаменяемо.
Когда липидным субстратом является гликолипид, он может быть, например, дигалактозилдиглицеридом (DGDG).
Липидный субстрат может именоваться в данном описании изобретения как “липидный донор ацильной группы” или “донор ацильной группы”. Указанные термины использованы взаимозаменяемо в данной заявке.
В соответствии с некоторыми объектами изобретения липидным субстратом, в котором действует липидацилтрансфераза, предпочтительно является фосфолипид, такой как лецитин, например фосфатидилхолин.
В соответствии с некоторыми объектами изобретения липидным субстратом предпочтительно является гликолипид, такой как, например, DGDG.
В соответствии с некоторыми объектами изобретения липидным субстратом может быть пищевой липид, то есть липидный компонент пищевого продукта.
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению может быть неспособна или по существу неспособна воздействовать на триглицерид, 1-моноглицерид и/или 2-моноглицерид.
Липидный субстрат или липидный донор ацильной группы может представлять собой один или несколько липидов, присутствующих в одном или нескольких нижеследующих субстратах, таких как жиры, включая лярд, сало и молочный жир; масла, включая масла, экстрагированные или выделенные из пальмового масла, подсолнечного масла, соевого масла, сафлорового масла, хлопкового масла, арахисового масла, кукурузного масла, оливкового масла, кокосового масла и рапсового масла. Лецитин из сои, рапсовых семян или яичного желтка также является приемлемым липидным субстратом. Липидный субстрат может быть липидом овса или другого растения, содержащего галактолипиды.
В соответствии с некоторыми объектами настоящего изобретения липид может быть выбран из липидов, имеющих цепь жирных кислот длиной от 8 до 22 атомов углерода.
В соответствии с некоторыми объектами нестоящего изобретения липид может быть выбран из липидов, имеющих цепь жирных кислот длиной от 16 до 22 атомов углерода, более предпочтительно от 16 до 20 атомов углерода.
В соответствии с некоторыми объектами настоящего изобретения липид может быть выбран из липидов, имеющих цепь жирных кислот длиной не более 14 атомов углерода, в частности из липидов, имеющих цепь жирных кислот длиной от 4 до 14 атомов углерода, в частности от 4 до 10 атомов углерода, в частности от 4 до 8 атомов углерода.
Донор ацильной группы предпочтительно не является свободной жирной кислотой.
Донор ацильной группы предпочтительно не является сложным эфиром углевода (сахара).
Липидацилтрансфераза по настоящему изобретению может обладать одной или несколькими нижеследующими липазными активностями: активностью гликолипазы (Е.С. 3.1.1.26), триацилглицерол-липазы (Е.С. 3.1.1.3), фосфолипазы А2 (Е.С. 3.1.1.4) или фосфолипазы А1 (Е.С. 3.1.1.32). Термин “активность гликолипазы” в используемом здесь значении означает также “активность галактолипазы”.
Липидацилтрансфераза по настоящему изобретению может обладать по крайней мере одной или несколькими нижеследующими активностями: активностью гликолипазы (Е.С. 3.1.1.26), и/или фосфолипазы А1 (Е.С. 3.1.1.32), и/или фосфолипазы А2 (Е.С. 3.1.1.4).
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению может обладать по крайней мере активностью гликолипазы (Е.С. 3.1.1.26).
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению может быть способна переносить ацильную группу из гликолипида и/или фосфолипида в один или несколько нижеследующих акцепторных субстратов: углевод, белок, белковую субъединицу, гидроксикислоту.
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению предпочтительно способна переносить ацильную группу из гликолипида и/или фосфолипида в углевод с образованием по крайней мере сложного эфира углевода.
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению предпочтительно способна переносить ацильную группу из гликолипида и/или фосфолипида в белок или белковую субъединицу с образованием по крайней мере сложного эфира белка (или конденсата жирной кислоты белка) или сложного эфира белковой субъединицы.
Термин “сложный эфир белковой субъединицы” в используемом здесь значении означает сложный эфир, образованный из любой белковой субъединицы, такой как, например, сложный эфир дипептида, сложный эфир олигопептида, сложный эфир полипептида или сложный эфир гидролизата белка.
В соответствии с некоторыми объектами изобретения липидацилтрансфераза по настоящему изобретению предпочтительно не обладает активностью триацилглицерол-липазы (Е.С. 3.1.1.3).
Фермент липидацилтрансферазу по настоящему изобретению предпочтительно можно охарактеризовать на основании нижеследующих критериев:
(i) данный фермент обладает ацилтрансферазной активностью, которую можно определить как активность переноса сложного эфира, в результате которого ацильная часть исходной сложноэфирной связи липидного донора ацильной группы переносится в один или несколько акцепторов ацильной группы, представляющих собой углевод, белок, белковую субъединицу или гидроксикислоту, с образованием нового сложного эфира, то есть сложного эфира углевода, сложного эфира белка, сложного эфира белковой субъединицы и/или сложного эфира гидроксикислоты; и
(ii) данный фермент содержит фрагмент GDSX в аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков: L, A, V, I, F, Y, H, Q, T, N, М или S.
Х в фрагменте GDSX означает L. Таким образом, фермент по настоящему изобретению предпочтительно содержит фрагмент GSDL в аминокислотной последовательности.
Фрагмент GDSX состоит из четырех консервативных аминокислот. Серин в данном фрагменте предпочтительно является каталитическим серином фермента липидацилтрансферазы. Серин фрагмента GDSX может находиться в положении, соответствующем положению Ser-16 в липолитическом ферменте Aeromonas hydrophila, как указано в публикации Brumlik & Buckley (Journal of Bacteriology Apr. 1996, Vоl. 178, No. 7, стр. 2060-2064).
Чтобы определить наличие в белке фрагмента GDSX по настоящему изобретению, последовательность предпочтительно сравнивают со скрытыми профилями модели Маркова (профили НММ) в базе данных Рfam.
Pfam является базой данных семейства доменов белка. База данных Рfam содержит несколько выверенных последовательностей для каждого семейства, а также модели скрытых профилей Маркова (профили НММ) для идентификации указанных доменов в новых последовательностях. С базой данных Рfam можно ознакомиться в публикации Bateman A. et al., (2002) Nucleic Acids Res. 30; 276-280. Модели скрытых профилей Маркова использованы в ряде баз данных, предназначенных для классификации белков, и с ними можно ознакомиться в публикации Bateman A. and Haft D.H. (2002) Brief Bioinform 3; 236-245.
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list _ uids=12230032&dopt=Abstract
http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&list _ uids=11752314&dopt=Abstract
Для детального ознакомления с моделями скрытых профилей Маркова и с их использованием в базе данных Pfam следует обратиться к публикации Durbin R., Eddy S., and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids. Cambridge University Press, ISBN 0-521-62041-4. Пакет программ Хаммера можно приобрести в Вашингтонском университете, Сент-Луис, США.
Альтернативно фрагмент GDSX можно идентифицировать при помощи пакета программ Хаммера, инструкции по использованию которых приведены в публикации Durbin R., Eddy S., and Krogh A. (1998) Biological sequence analysis; probabilistic models of proteins and nucleic acids. Cambridge University Press, ISBN 0-521-62041-4, ссылках, приведенных в указанной публикации, и в профиле HMMER2, рассмотренном в данном описании изобретения.
Доступ к базе данных PFAM можно получить, например, через несколько серверов, которые в настоящее время расположены на следующих Web-сайтах.
http://www.sanger.ac.uc/Software/Pfam/index.shtml
http://pfam.wustl.edu/
http://pfam.jouy.inra.fr/
http://pfam.cgb.ki.se/
Данная база данных предоставляет возможность поиска с получением доступа к белковой последовательности. Используя параметры по умолчанию базы данных, можно произвести анализ белковой последовательности на наличие доменов Pfam. Домен GDSX является устойчивым доменом, поэтому его присутствие будет обнаружено в любой запрашиваемой последовательности. Указанная база данных производит сравнение согласованной последовательности Pfam00657 с запрашиваемой последовательностью.
Сравнительный анализ нескольких последовательностей, включая Aeromonas salmonicida или Aeromonas hydrophila, можно выполнить:
а) вручную
для чего необходимо произвести сравнение представляющего интерес белка с согласованной последовательностью Pfam00657 и сравнение Р10480 с согласованной последовательностью Pfam00657 вышеописанным способом;
или
b) при помощи базы данных
после идентификации согласованной последовательности Pfam00657 база данных предлагает вариант сравнения запрашиваемой последовательности с отобранной согласованной последовательностью Pfam00657. Р10480 является частью сравнения отобранных последовательностей и имеет имя GCAT_AERHY. Запрашиваемая последовательность и Р10480 будут отображены в одном окне.
Эталонная последовательность Aeromonas hydrophila:
остатки липазы GDSX Aeromonas hydrophila пронумерованы в файле Р10480 NCBI, и номера в описании изобретения относятся к номерам, указанным в данном файле, который в настоящем изобретении использован для определения конкретных аминокислотных остатков, присутствующих в предпочтительном варианте осуществления изобретения в ферментах липидацилтрансферазы по данному изобретению.
Сравнение последовательностей было выполнено с использованием базы данных Pfam (фигуры 33 и 34).
Распознаны нижеследующие консервативные остатки, которые могут присутствовать в ферментах, предназначенных для использования в композициях и способах по данному изобретению в соответствии с предпочтительным вариантом его осуществления.

где “hid” означает гидрофобный остаток, выбираемый из Met, Ile, Leu, Val, Ala, Gly, Cys, His, Lys, Trp, Tyr, Phe.
Сравнение фермента липидацилтрансферазы, предназначенного для использования в композициях и способах по данному изобретению, предпочтительно можно произвести с помощью согласованной последовательности Pfam00657.
Положительное соответствие скрытому профилю модели Маркова (профиль НММ) семейства доменов pfam00657 предпочтительно указывает на присутствие домена GDSL или GDSX по настоящему изобретению.
При соответствии согласованной последовательности Pfam00657 липидацилтрансфераза, предназначенная для использования в композициях и способах по данному изобретению, предпочтительно содержит по крайней мере один, предпочтительно более одного, предпочтительно более двух нижеследующих блоков: блок GDSX, блок GANDY, блок НРТ. Липидтрансфераза соответственно может содержать блок GDSX и блок GANDY. Альтернативно фермент может содержать блок GDSX и блок НРТ. Фермент предпочтительно содержит по крайней мере блок GDSX.
При соответствии согласованной последовательности Pfam00657 фермент, предназначенный для использования в композициях и способах по данному изобретению, предпочтительно содержит по крайней мере один, предпочтительно более одного, предпочтительно более двух, предпочтительно более трех, предпочтительно более четырех, предпочтительно более пяти, предпочтительно более шести, предпочтительно более семи, предпочтительно более восьми, предпочтительно более девяти, предпочтительно более десяти, предпочтительно более одиннадцати, предпочтительно более двенадцати, предпочтительно более тринадцати, предпочтительно более четырнадцати нижеследующих аминокислотных остатков при сравнении с эталонной полипептидной последовательностью A. hydrophilia, в частности SEQ ID NO:32: 28hid, 29hid, 30hid, 31hid, 32gly, 33Asp, 34Ser, 35hid, 130hid, 131Gly, 132hid, 133Asn, 134Asp, 135hid, 309His.
Домен GDSX pfam00657 является уникальным идентификатором, позволяющим отличить белки, содержащие указанный домен, от других ферментов.
Согласованная последовательность pfam00657 представлена на фигуре 1 как SEQ ID NO:1. Указанная последовательность получена в результате идентификации семейства pfam 00657, база данных, версия 6, которая может быть также определена в данном описании изобретения как pfam00657.6.
Согласованная последовательность может быть обновлена в последующих выпусках базы данных pfam.
Например, на фигурах 33 и 34 показано сравнение последовательности pfam семейства 00657 из базы данных, версия 11, которая может быть также определена в данном описании изобретения как pfam00657.11.
Блоки GDSX, GANDY и НРТ обнаружены в семействе pfam 00657 в обеих выпусках базы данных. Для идентификации семейства pfam 00657 могут быть использованы последующие выпуски базы данных pfam.
Фермент липидацилтрансферазу по настоящему изобретению можно охарактеризовать на основании нижеследующих критериев:
(i) данный фермент обладает ацилтрансферазной активностью, которая может быть определена как активность переноса сложного эфира, в результате которого ацильная часть исходной сложноэфирной связи липидного донора ацильной группы переносится в один или несколько акцепторов ацильной группы, представляющих собой углевод, белок, белковую субъединицу или гидроксикислоту, с образованием нового сложного эфира, то есть сложного эфира углевода и/или сложного эфира белка и/или сложного эфира белковой субъединицы и/или сложного эфира гидроксикислоты;
(ii) данный фермент содержит фрагмент GDSX аминокислотной последовательности, в котором Х означает один или несколько нижеследующих аминокислотных остатков L, A, V, I, F, Y, H, Q, T, N, M или S;
(iii) данный фермент содержит His-309 или остаток гистидина в положении, соответствующем положению His-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фигуре 2 (SEQ ID NO:2 или SEQ ID NO:32).
Предпочтительным аминокислотным остатком фрагмента GDSX является L.
В SEQ ID NO:2 или SEQ ID NO:32 первые 18 аминокислотных остатков образуют сигнальную последовательность. His-309 непроцессированной последовательности, то есть белка, содержащего сигнальную последовательность, соответствует His-291 зрелой части белка, то есть последовательности без сигнальной последовательности.
Фермент липидацилтрансфераза по настоящему изобретению предпочтительно содержит нижеследующую каталитическую триаду: Ser-34, Asp-134 и His-309 или соответственно остаток серина, остаток аспарагиновой кислоты и остаток гистидина в положениях, соответствующих Ser-34, Asp-134 и His-309 в липолитическом фрагменте Aeromonas hydrophila, показанном на фигуре 2 (SEQ ID NO:2) или фигуре 28 (SEQ ID NO:32). Как было указано выше, в последовательности, показанной в SEQ ID NO:2 или SEQ ID NO:32, первые 18 аминокислотных остатков образуют сигнальную последовательность. Ser-34, Asp-134 и His-309 непроцессированной последовательности, то есть белка, содержащего сигнальную последовательность, соответствуют Ser-16, Asp-116 и His-291 зрелой части белка, то есть последовательности без сигнальной последовательности. В согласованной последовательности pfam00657, показанной на фигуре 1 (SEQ ID NO:1), остатки активного сайта соответствуют Ser-7, Asp-157 и His-348.
Фермент липидацилтрансферазу по настоящему изобретению предпочтительно можно охарактеризовать на основании нижеследующих критериев:
(i) данный фермент обладает ацилтрансферазной активностью, которая может быть определена как активность переноса сложного эфира, в результате которого ацильная часть исходной сложноэфирной связи первого липидного донора ацильной группы переносится в один или несколько акцепторов ацильной группы, представляющих собой углевод, белок, белковую субъединицу или гидроксикислоту, с образованием нового сложного эфира, то есть сложного эфира углевода, сложного эфира белка, сложного эфира белковой субъединицы и/или сложного эфира гидроксикислоты; и
(ii) данный фермент содержит по крайней мере Gly-32, Asp-33, Ser-34, Asp-134 и His-309 или остатки глицина, аспарагиновой кислоты, серина, аспарагиновой кислоты и гистидина в положениях, соответствующих Gly-32, Asp-33, Ser-34, Asp-134 и Gis-309 в липолитическом ферменте Aeromonas hydrophila, показанном на фигуре 2 (SEQ ID NO:2) или фигуре 28 (SEQ ID NO:32).
Фермент липидацилтрансферазу по настоящему изобретению можно получить из организмов, относящихся к одному или нескольким нижеследующим родам: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas и Candida.
Фермент липидацилтрансферазу по настоящему изобретению можно получить из одного или нескольких нижеследующих организмов: Aeromonas hydrophila, Aeromonas salmonicida, Streptomyces coelicolor, Streptomyces rimosus, Мycobacterium, Streprococcus pyogenes, Lactococcus lactis, Streptococcus pyogenes, Streptococcus thermophilus, Lactobacillus helveticus, Desulfitobacterium dehalogenans, Bacillus sp., Campylobacter jejuni, Vibrionaceae, Xylella fastidiosa, Sulfolobus solfataricus, Saccharomyces cerevisiae, Aspergillus terreus, Schizosaccharomyces pombe, Listeria innocua, Listeria monocytogenes, Neisseria meningitidis, Mesorhizobium loti, Ralstoniа solanacearum, Xanthomonas campestris, Xanthomonas axonopodis и Candida parapsilosis.
В соответствии с одним объектом изобретения фермент липидацилтрансферазу по настоящему изобретению предпочтительно получают из одного или нескольких организмов Aeromonas hydrophila или Aeromonas salmonicida.
Фермент липидацилтрансфераза по настоящему изобретению содержит одну или несколько нижеследующих аминокислотных последовательностей:
(i) аминокислотная последовательность, представленная SEQ ID NO:2 (см. фигуру 2);
(ii) аминокислотная последовательность, представленная SEQ ID NO:3 (см. фигуру 3);
(iii) аминокислотная последовательность, представленная SEQ ID NO:4 (см. фигуру 4);
(iv) аминокислотная последовательность, представленная SEQ ID NO:5 (см. фигуру 5);
(v) аминокислотная последовательность, представленная SEQ ID NO:6 (см. фигуру 6);
(vi) аминокислотная последовательность, представленная SEQ ID NO:12 (см. фигуру 14);
(vii) аминокислотная последовательность, представленная SEQ ID NO:20 (см. фигуру 16);
(viii) аминокислотная последовательность, представленная SEQ ID NO:22 (см. фигуру 18);
(ix) аминокислотная последовательность, представленная SEQ ID NO:24 (см. фигуру 20);
(x) аминокислотная последовательность, представленная SEQ ID NO:26 (см. фигуру 22);
(xi) аминокислотная последовательность, представленная SEQ ID NO:28 (см. фигуру 24);
(xii) аминокислотная последовательность, представленная SEQ ID NO:30 (см. фигуру 26);
(xiii) аминокислотная последовательность, представленная SEQ ID NO:32 (см. фигуру 28);
(xiv) аминокислотная последовательность, представленная SEQ ID NO:34 (см. фигуру 30) или
аминокислотная последовательность, которая на 75% или более идентична одной из последовательностей, представленных SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34.
Фермент липидацилтрансфераза по настоящему изобретению содержит аминокислотную последовательность, представленную SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:32 или SEQ ID NO:34, либо аминокислотную последовательность, которая на 75% или более, предпочтительно на 80% или более, предпочтительно на 85% или более, предпочтительно на 90% или более, предпочтительно на 95% или более идентична аминокислотной последовательности, представленной SEQ ID NO:2, аминокислотной последовательности, представленной SEQ ID NO:3, аминокислотной последовательности, представленной SEQ ID NO:32, или аминокислотной последовательности, представленной SEQ ID NO:34.
В соответствии с целями настоящего изобретения степень идентичности основана на количестве одинаковых элементов последовательности. Степень идентичности по настоящему изобретению можно определить при помощи компьютерных программ, известных в данной области, таких как GAP, входящая в пакет программ GCG (Program Manual for the Wisconsin Package, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, US53711) (Needleman & Wunsch (1970), J. of Molecular Biology 48, 443-45), используя нижеследующие установки для сравнения полипептидных последовательностей: штрафные очки за создание пробела равны 3.0 и штрафные очки за удлинение пробела равны 0,1.
Фермент липидацилтрансфераза по настоящему изобретению содержит аминокислотную последовательность, которая на 80% или более, предпочтительно на 85% или более, более предпочтительно на 90% или более, еще предпочтительнее на 95% или более идентична одной из последовательностей, представленных SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34.
Фермент липидацилтрансфераза по настоящему изобретению содержит одну или несколько нижеследующих аминокислотных последовательностей:
(а) аминокислотная последовательность, представленная аминокислотными остатками 1-100 SEQ ID NO:2 или SEQ ID NO:32;
(b) аминокислотная последовательность, представленная аминокислотными остатками 101-200 SEQ ID NO:2 или SEQ ID NO:32;
(с) аминокислотная последовательность, представленная аминокислотными остатками 201-300 SEQ ID NO:2 или SEQ ID NO:32;
(d) аминокислотная последовательность, которая на 75% или более, предпочтительно на 85% или более, более предпочтительно на 90% или более, еще предпочтительнее на 95% или более идентична одной из аминокислотных последовательностей, приведенных выше в пунктах (а)-(с).
Фермент липидацилтрансфераза по настоящему изобретению содержит одну или несколько нижеследующих аминокислотных последовательностей:
(а) аминокислотная последовательность, представленная аминокислотными остатками 28-39 SEQ ID NO:2 или SEQ ID NO:32;
(b) аминокислотная последовательность, представленная аминокислотными остатками 77-88 SEQ ID NO:2 или SEQ ID NO:32;
(с) аминокислотная последовательность, представленная аминокислотными остатками 126-136 SEQ ID NO:2 или SEQ ID NO:32;
(d) аминокислотная последовательность, представленная аминокислотными остатками 163-175 SEQ ID NO:2 или SEQ ID NO:32;
(е) аминокислотная последовательность, представленная аминокислотными остатками 304-311 SEQ ID NO:2 или SEQ ID NO:32;
(f) аминокислотная последовательность, которая на 75% или более, предпочтительно на 85% или более, более предпочтительно на 90% или более, еще предпочтительнее на 95% или более идентична одной из аминокислотных последовательностей, приведенных выше в пунктах (а)-(е).
Фермент липидацилтрансфераза по настоящему изобретению может содержать аминокислотную последовательность, полученную путем экспрессии одной или нескольких нижеследующих нуклеотидных последовательностей:
(а) нуклеотидная последовательность, представленная SEQ ID NO:7 (см. фигуру 9);
(b) нуклеотидная последовательность, представленная SEQ ID NO:8 (см. фигуру 10);
(с) нуклеотидная последовательность, представленная SEQ ID NO:9 (см. фигуру 11);
(d) нуклеотидная последовательность, представленная SEQ ID NO:10 (см. фигуру 12);
(е) нуклеотидная последовательность, представленная SEQ ID NO:11 (см. фигуру 13);
(f) нуклеотидная последовательность, представленная SEQ ID NO:13 (см. фигуру 15);
(g) нуклеотидная последовательность, представленная SEQ ID NO:21 (см. фигуру 17);
(h) нуклеотидная последовательность, представленная SEQ ID NO:23 (см. фигуру 19);
(i) нуклеотидная последовательность, представленная SEQ ID NO:25 (см. фигуру 21);
(j) нуклеотидная последовательность, представленная SEQ ID NO:27 (см. фигуру 23);
(k) нуклеотидная последовательность, представленная SEQ ID NO:29 (см. фигуру 25);
(l) нуклеотидная последовательность, представленная SEQ ID NO:31 (см. фигуру 27);
(m) нуклеотидная последовательность, представленная SEQ ID NO:33 (см. фигуру 29);
(n) нуклеотидная последовательность, представленная SEQ ID NO:35 (см. фигуру 31);
(o) или нуклеотидная последовательность, которая на 75% или более идентична одной из последовательностей, представленных SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
Нуклеотидная последовательность может быть на 80% или более, предпочтительно на 85% или более, предпочтительнее на 90% или более и еще предпочтительнее на 95% или более идентична одной из последовательностей, представленных SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
В соответствии с одним объектом изобретения липидацилтрансфераза по настоящему изобретению может представлять собой лецитин:холестерол-ацилтрансферазы (LCAT) или их варианты (например, вариант, полученный в результате молекулярной эволюции).
Приемлемые LCAT известны в данной области и могут быть получены из одного или нескольких нижеследующих организмов, таких как млекопитающие, крысы, мыши, цыплята, Drosophila melanogaster, растения, включающие Arabidopsis и Oryza sativa, нематоды, грибы и дрожжи.
В одном варианте осуществления изобретения фермент липидацилтрансфераза по настоящему изобретению может представлять собой липидацилтрансферазу, полученную из штаммов TOP 10 E. coli, включающих pPet12aAhydro и pPet12aASalmo, которые были депонированы компанией Даниско A/S, Лангеброгаде 1, DK-1001, Копенгаген К, Дания, согласно Будапештскому соглашению о международном признании депонирования микроорганизмов в соответствии с процедурой выдачи патентов в Национальную коллекцию промышленных, морских и пищевых бактерий (NCIMB) по адресу: 23 St. Machar Street, Aberdeen Scotland, GB, 22 декабря 2003 г. соответственно под номерами доступа NICMB 41204 и NCIMB 41205.
Термин “трансфераза” в используемом здесь значении является взаимозаменяемым с термином “липидацилтрансфераза”.
Липидацилтранcфераза, представленная в данном описании изобретения, катилизирует одну или обе нижеследующие реакции: переэтерификацию и алкоголиз.
Таким образом, в соответствии с настоящим изобретением может быть достигнуто одно или несколько нижеследующих преимуществ: биоконверсия липидов с образованием одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот может происходить в среде с высоким содержанием воды, которая не содержит органического растворителя или содержит меньшее количество органического растворителя по сравнению с известными процессами биоконверсии.
Термин “биоконверсия” в используемом здесь значении означает модификацию одного органического соединения с образованием другого органического соединения и/или синтез органических соединений из других органических соединений путем ферментативного катализа.
Термин “переэтерификация” в используемом здесь значении означает катализируемый ферментом перенос ацильной группы из липидного донора (не являющегося свободной жирной кислотой) в акцептор ацильной группы (не являющийся водой). Во избежание неправильного толкования следует отметить, что термин “переэтерификация” в используемом здесь значении означает перенос ацильной группы из липидного донора в акцептор ацильной группы (не являющийся водой), содержащий приемлемую химическую группу, которая может быть, например, группой -ОН или -SH.
В используемом здесь значении термин “алкоголиз” означает ферментативное расщепление ковалентной связи производного кислоты в результате взаимодействия со спиртовой группой ROH, благодаря чему один продукт связывается с атомом Н спиртовой группы и другой продукт связывается с группой ОR спиртовой группы.
В используемом здесь значении термин “гидролиз” означает катализируемый ферментом перенос ацильной группы из липида в группу ОН молекулы воды. Перенос ацильной группы, происходящий в результате гидролиза, требует отделения молекулы воды.
Термин “взаимная переэтерификация” означает катализируемый ферментом перенос ацильных групп между липидным донором и липидным акцептором, в котором липидный донор не является свободной ацильной группой. Другими словами, “взаимная переэтерификация” означает взаимообмен жирной кислоты между двумя молекулами липида.
В соответствии с одним объектом изобретения липидацилтрансфераза, представленная в данном описании изобретения, катализирует взаимную переэтерификацию.
Способ или применение по настоящему изобретению может далее включает одну или несколько нижеследующих стадий: растворение акцептора ацильной группы в воде; добавление липидного донора ацильной группы к растворенному акцептору ацильной группы с образованием двухфазной системы или эмульсии; перемешивание или обработку ультразвуком реакционной смеси; нагревание реакционной смеси, например, для денатурации фермента; отделение водной фазы от фазы жира/эмульгатора стандартными методами отделения, такими как, например, экстракция растворителем или выпаривание воды; фракционирование жировой фазы при помощи хроматографии с гидрофобным взаимодействием, кристаллизации или перегонки в глубоком вакууме. Одну или несколько стадий нагревания, разделения или фракционирования можно выполнить после уравновешивания реакционной смеси.
В одном варианте осуществления изобретения липаза-ацилтрансфераза, предназначенная для использования в способах по настоящему изобретению, может быть иммобилизована. В случае иммобилизации фермента смесь, содержащую донор ацильной группы, акцептор ацильной группы и воду, пропускают через колонку, заполненную, например, иммобилизованным ферментом. Благодаря иммобилизации фермента можно легко обеспечить его повторное использование.
Иммобилизованный фермент можно использовать в проточном реакторе или реакторе периодического действия, в котором находится реакционная смесь, содержащая акцептор ацильной группы, растворенный в воде, и липидный донор ацильной группы в виде двухфазной системы или эмульсии. Реакционная смесь может быть необязательно перемешана или обработана ультразвуком. После достижения равновесного состояния реакции можно произвести разделение реакционной смеси и иммобилизованного фермента. Продукт реакции может быть фракционирован, например, при помощи хроматографии с гидрофобным взаимодействием, кристаллизации или перегонки в глубоком вакууме.
Иммобилизованную липидацилтрансферазу можно получить методами иммобилизации, известными в данной области. Существует много методов получения иммобилизованных ферментов, которые должны быть известны специалисту в данной области (например, методы, описанные в европейском патенте № 0746608 или в публикациях Balcao V.M., Paiva A.L., Malcata F.X., Enzyme Microb Technol. 1996 May 1; 18(6):392-416; или Retz M.T., Jaeger K.E. Chem Phys Lipids. 1998 Jun; 93(l-2):3-14; Bornscheuer U.T., Bessler C, Srinivas R, Krishna S.H. Trends Biotechnol. 2002 Oct; 20(10):433-7; Plou et al, J. Biotechnology 92 (2002) 55-66; Warmuth et al., 1992. Bio Forum 9,282-283; Ferrer et al., 2000. J. Chem. Technol. Biotechnol. 75, 1-8; или Christensen et al., 1998. Nachwachsende Rohstoff 10, 98-105; Petersen и Christenen, 2000, Applied Biocatalysis. Harwood Academic Publishers, Amsterdam (которые включены в данное описание изобретения в качестве ссылки). Методы, которые могут быть использованы при осуществлении данного изобретения, включают, например, ковалентное связывание с эупергитом С, адсорбцию на полипропилене и грануляцию кремнезема.
Термин “среда с высоким содержанием воды” в используемом здесь значении предпочтительно означает среду с низким содержанием или полным отсутствием органического растворителя, предпочтительно с низким содержанием или полным отсутствием полярного органического растворителя. В определение термина “органический растворитель” в используемом здесь значении предпочтительно не входят пищевые масла, используемые в качестве липидного субстрата, и предпочтительно не входят пищевые масла с высоким содержанием неполярных липидов. Среда с высоким содержанием воды по настоящему изобретению может включать менее 50 об.% органических растворителей, менее 30 об.% органических растворителей, более предпочтительно менее 15 об.% органических растворителей, более предпочтительно менее 5 об.%, более предпочтительно менее 1 об.%, более предпочтительно менее 0,5 об.% органического растворителя, более предпочтительно 0 об.% органических растворителей.
В случае получения сложного эфира углевода по настоящему изобретению сложный эфир углевода предпочтительно является сложным эфиром олигосахарида, сложным эфиром моносахарида или сложным эфиром дисахарида.
Сложный эфир углевода, получаемый по настоящему изобретению, может представлять собой один или несколько нижеследующих сложных эфиров: сложный эфир глюкозы, сложный эфир фруктозы, сложный эфир ангидрофруктозы, сложный эфир мальтозы, сложный эфир лактозы, сложный эфир галактозы, сложный эфир ксилозы, сложный эфир ксилоолигосахарида, сложный эфир арабинозы, сложный эфир мальтоолигосахарида, сложный эфир тагатозы, сложный эфир сахарозы, сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т или сложный эфир кортальцерона.
Сложный эфир углевода, получаемый по настоящему изобретению, предпочтительно представляет собой один или несколько нижеследующих сложных эфиров: сложный моноэфир углевода, сложный моноэфир сахара, сложный моноэфир олигосахарида, сложный моноэфир трисахарида, сложный моноэфир дисахарида, сложный моноэфир моносахарида, сложный моноэфир глюкозы, сложный моноэфир фруктозы, сложный моноэфир ангидрофруктозы, сложный моноэфир мальтозы, сложный моноэфир лактозы, сложный моноэфир галактозы, сложный моноэфир ксилозы, сложный моноэфир ксилоолигосахарида, сложный моноэфир арабинозы, сложный моноэфир мальтоолигосахарида, сложный моноэфир тагатозы, сложный моноэфир сахарозы, сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т или сложный эфир кортальцерона.
В одном варианте осуществления изобретения сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т и/или сложный эфир кортальцерона может быть антимикробным средством. Альтернативно или дополнительно к вышеизложенному сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т и/или сложный эфир кортальцерона может быть антиоксидантом и/или эмульгатором либо тем и другим вместе.
Образование сложного эфира углевода по настоящему изобретению предпочтительно не зависит от UDP-глюкозы.
Пищевой продукт по настоящему изобретению предпочтительно не содержит UDP-глюкозы или содержит UDP-глюкозу в незначительных количествах.
Установлено, что липидацилтрансферазы, используемые в композициях и способах по данному изобретению, обладают уникальными свойствами по сравнению с липолитическими ферментами, выражающимися в том, что они предпочтительно переносят ацильные группы из липидов в акцепторы, не являющиеся водой, даже в присутствии значительного количества воды. По сравнению с ранее известными ферментами липидацилтрансфераза, используемая в данном изобретении, обладает высокой относительной трансферазной активностью в присутствии 6% воды, 54% воды, 73% воды, 89% воды и примерно 95% воды. Исследованные липолитические ферменты фактически не обладают значительной относительной трансферазной активностью в указанных концентрациях воды.
Процентное значение трансферазной активности (то есть трансферазная активность в процентах от общей ферментативной активности) можно определить следующим методом:
Метод определения процентного значения ацилтрансферазной активности
Субстрат, в который добавляют липидацилтрансферазу по настоящему изобретению, можно экстрагировать после выполнения ферментативной реакции с использованием CHCl3:CH3OH (2:1), при этом органическую фазу, содержащую липид, отделяют и анализируют при помощи ГЖХ и ВЭЖХ методом, подробно описанным ниже. В результате выполнения ГЖХ и ВЭЖХ определяют количество свободных жирных кислот и одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц и сложных эфиров гидроксикислот. Аналогичным образом анализируют контрольный субстрат, в который не добавляли фермент по настоящему изобретению.
Вычисления:
На основании результатов анализов ГЖХ и ВЭЖХ можно вычислить увеличение свободных жирных кислот и сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц и/или сложных эфиров гидроксикислот:
Δ % жирной кислоты=% жирной кислоты (фермент) - % жирной кислоты (контрольный образец); Mv жирной кислоты=средняя молекулярная масса жирных кислот;
А=Δ % сложного эфира белка/Mv сложного эфира белка (где Δ % сложного эфира белка=% сложного эфира белка (фермент) - % сложного эфира белка (контрольный образец) и Mv сложного эфира белка=средняя молекулярная масса сложных эфиров белка) - применяется в тех случаях, когда акцептором ацильного группы является белок;
В=Δ % сложного эфира углевода/Mv сложного эфира углевода (где Δ % сложного эфира углевода=% сложного эфира углевода (фермент) - % сложного эфира углевода (контрольный образец) и Mv сложного эфира углевода=средняя молекулярная масса сложного эфира углевода) - применяется, когда акцептором ацильной группы является углевод;
С=Δ % сложного эфира белковой субъединицы/Mv сложного эфира белковой субъединицы (где Δ % сложного эфира белковой субъединицы=% сложного эфира белковой субъединицы (фермент) - % сложного эфира белковой субъединицы (контрольный образец) и Mv сложного эфира белковой субъединицы=средняя молекулярная масса сложного эфира белковой субъединицы) - применяется, когда акцептором ацильной группы является белковая субъединица; и
D=Δ % сложного эфира гидроксикислоты/Mv сложного эфира гидроксикислоты (где Δ % сложного эфира гидроксикислоты=% сложного эфира гидроксикислоты (фермент) - % сложного эфира гидроксикислоты (контрольный образец) и Mv сложного эфира гидроксикислоты=средняя молекулярная масса сложного эфира гидроксикислоты) - применяется, когда акцептором ацильной группы является гидроксикислота.
Трансферазную активность высчитывают в виде процентного значения от общей ферментативной активности:
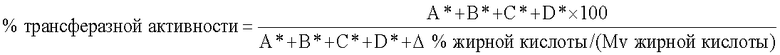
* - удалить при необходимости
Липазную и ацилтрансферазную активность фермента можно высчитать, выполняя нижеследующие анализы. Таким образом можно получить/идентифицировать липидацилтрансферазу, обладающую характеристиками фермента, рассмотренного в данном описании изобретения.
Анализ трансферазы в забуференном субстрате (см. пример 6)
Ферменты, предназначенные для использования в качестве липидацилтрансфераз в композициях и способах по данному изобретению, можно идентифицировать, выполняя анализ, описанный в примере 6. Данный анализ далее определяется как “Анализ трансферазы в забуференном субстрате”. В примере 6 фермент липидацилтрансферазу, выделенный из Aeromonas salmonicida по настоящему изобретению, анализировали и сравнивали с рядом липолитических ферментов, не входящих в объем настоящего изобретения. Было установлено, что только липолитические ферменты LIPOPAN® F (Novozymes, Denmark) обладают трансферазной активностью и лишь на очень низком уровне (1,3%).
Ферменты, пригодные для использования в композициях и способах по данному изобретению, можно идентифицировать, выполняя анализ трансферазы в забуференном субстрате. При выполнении указанного анализа в среде с очень высоким содержанием воды, равным примерно 95%, липидацилтрансферазами по настоящему изобретению являются ферменты, обладающие по крайней мере 2% ацилтрансферазной активностью (относительная трансферазная активность), предпочтительно по крайней мере 5% относительной трансферазной активностью, предпочтительно по крайней мере 10% относительной трансферазной активностью, предпочтительно по крайней мере 15%, 20%, 25%, 26%, 28%, 30%, 40%, 50%, 60% или 75% относительной трансферазной активностью. Липидацилтрансфераза по настоящему изобретению может обладать менее чем 28%, менее чем 30%, предпочтительно менее чем 40%, 50%, 60%, 70%, 80%, 90% или 100% ацилтрансферазной активностью.
Анализ трансферазы в среде с низким содержанием воды
В качестве альтернативы (или дополнительно) “Анализу трансферазы в забуференном субстрате” липидацилтрансферазы, пригодные для использования в настоящем изобретении, можно идентифицировать при помощи “Анализа трансферазы в среде с низким содержанием воды”.
Чтобы определить, является ли фермент липидацилтрансферазой по настоящему изобретению, можно выполнить “Анализ трансферазы в среде с низким содержанием воды”, а именно в масляной среде с 6% воды в соответствии с описанием, приведенным в примере 9. Указанный пример служит для иллюстрации того, что липидацилтрансфераза по данному изобретению обладает высокой относительной трансферазной активностью в масляной среде, содержащей 6% воды, в которой известные липолитические ферменты проявляют гидролитическую активность.
В одном варианте осуществления изобретения липидацилтрансфераза, пригодная для использования в способах и/или применениях по настоящему изобретению, представляет собой фермент, который при исследовании с помощью “Анализа трансферазы в среде с низким содержанием воды”, выполненного через 30, 20 или 120 минут, обладает относительной трансферазной активностью, равной по крайней мере 1%, предпочтительно по крайней мере 2%, предпочтительно по крайней мере 5%, предпочтительно по крайней мере 10%, предпочтительно по крайней мере 20%, предпочтительно по крайней мере 30%, предпочтительно по крайней мере 40%, предпочтительно по крайней мере 50%, предпочтительно по крайней мере 60%, предпочтительно по крайней мере 70%, предпочтительно по крайней мере 75%. Липидацилтрансфераза по настоящему изобретению может обладать менее чем 30%, 40%, 50%, 60%, 70% или 80% активностью при измерении через 10, 20, 30 или 120 минут методом “Анализ трансферазы в среде с низким содержанием воды”.
Как было указано выше, липаза-ацилтрансфераза по данному изобретению может быть идентифицирована методом “Анализ трансферазы в забуференном субстрате” или “Анализ трансферазы в среде с низким содержанием воды” с использованием холестерина в качестве акцептора ацильной группы. Специалисту в данной области должны быть очевидны изменения, которые необходимо внести в аналитические методы “Анализ трансферазы в забуференном субстрате” или “Анализ трансферазы в среде с низким содержанием воды” для определения активности липидацилтрансферазы в отношении любого липидного донора ацильной группы или любой комбинации акцепторов ацильной группы. Квалифицированный специалист при необходимо может просто заменить субстрат донора ацильной группы (например, фосфолипид) альтернативным субстратом донора ацильной группы (например, гликолипидом, триацилглицеридом) и/или заменить акцептор ацильной группы (например, холестерин) альтернативным субстратом акцептора ацильной группы (например, углеводом, белком, белковой субъединицей или гидроксикислотой) (см., например, примеры 10-13).
Термин “среда с высоким содержанием воды” в используемом здесь значении означает любую среду, содержащую 5-98% воды. Указанная среда предпочтительно содержит более 6% воды, предпочтительно более 7%, 8%, 9%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. Среда с высоким содержанием воды может содержать 20-98%, в частности 50-98%, в частности 70-98%, в частности 75-98% воды.
В одном варианте осуществления изобретения в указанной смеси отношение количества добавляемой липидацилтрансферазы к воде составляет по крайней мере 1:700, предпочтительно 1:10000 при измерении в расчете на массу.
Термин “низкое содержание воды” в используемом здесь значении означает любой субстрат или пищевой продукт, содержащий менее 5% воды, предпочтительно менее 4%, 3%, 2%, 1% или 0,5%.
Способ и/или применение по настоящему изобретению предпочтительно можно осуществлять при температуре 15-60°С, предпочтительно при температуре 20-60°С, предпочтительно при 20-50°С, предпочтительно при 20-45°С, предпочтительно при 20-40°С.
Способ или применение по настоящему изобретению включает дальнейшую стадию очистки и/или выделения продукта реакции, а именно одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот. Таким образом, продукт реакции предпочтительно получают в очищенной и/или выделенной форме.
Квалифицированному специалисту известны многие методы очистки сложных эфиров. В качестве примера можно отметить, что сложные эфиры, полученные способами по настоящему изобретению, могут быть очищены хроматографией, такой как хроматография с гидрофобным взаимодействием, фильтрацией, центрифугированием, экстракцией растворителем/перегонкой или кристаллизацией. Приемлемые методы рассмотрены в публикации Ulmann's Encyclopedia of Industrial Chemistry (2002) by Wiley-VCH Verlag GmbH & Co.KgaA.
Липидацилтрансфераза по данному изобретению может быть экспрессирована в любом приемлемом экспрессирующем хозяине. Например, липидацилтрансфераза по данному изобретению может быть экспрессирована в Bacillus subtilis и может быть очищена ультрафильтрацией, осаждением в этаноле и/или центрифугированием и затем может быть подвергнута распылительной сушке с использованием крахмала (мальтодекстрина) в качестве носителя для фермента. Высушенный распылением фермент может быть стандартизирован в соответствии с точно определенной активностью PLU путем добавления дополнительного количества носителя в порошкообразной форме. Применяемые методы хорошо отработаны и представляют собой общепринятую практику в данной области.
В одном варианте осуществления изобретения способ по настоящему изобретению является способом in vitro. Указанный способ может быть соответственно непрерывным или периодическим процессом.
Фермент по настоящему изобретению можно использовать в комбинации с одним или несколькими другими ферментами. Так, в объем настоящего изобретения помимо фермента по данному изобретения входит смесь, контактирующая по крайней мере еще с одним ферментом. Такие дополнительные ферменты включают амилолитические ферменты, в частности эндо- или оксоамилазы, пуллуланазы, деветвящие ферменты, гемицеллюлазы, включающие ксиланазы, целлюлазы, оксидоредуктазы, например глюкозооксидазу или оксидазу углеводов, способную окислять мальтозу, например гексозооксидазу (НОХ), липазы, фосфолипазы и протеазы. Смесь может контактировать с ферментом по данному изобретению и по крайней мере еще с одним дополнительным ферментом одновременно или последовательно.
В одном варианте осуществления изобретения липидацилтрансфераза может быть использована в комбинации с липазой, обладающей одной или несколькими нижеследующими липазными активностями: активностью гликолипазы (Е.С. 3.1.1.26), триацилглицероллипазы (Е.С. 3.1.1.3), фосфолипазы А2 (Е.С. 3.1.1.4) или фосфолипазы А1 (Е.С. 3.1.1.32). Приемлемые ферменты липазы хорошо известны в данной области и включают приведенные в качестве примера нижеследующие липазы: LIPOРAN® F и/или LECITASE® ULTRA (Novozymes A/S, Denmark), фосфолипаза А2 (например, фосфолипаза А2 компании LIPOMOD™, 22L компании Biocatalysts, LIPOMAX™ компании Genecor), LIPOLASE® (Novozymes A/S, Denmark), липазы, описанные в заявке WO 03/97835, европейском патенте № 0977869 или европейском патенте № 1193314.
Применения
Таким образом, в результате осуществления способов по настоящему изобретению можно получить один или несколько сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц, сложных эфиров гидроксикислот. Многие из указанных сложных эфиров являются полезными эмульгаторами. В качестве примера можно отметить, что сложные эфиры аминокислот, сложные эфиры пептидов, сложные эфиры белков, сложные эфиры углеводов и сложные эфиры гидроксикислот (такие как сложные эфиры винной кислоты) являются функционально важными эмульгаторами. Эмульгаторы применяются в целом ряде отраслей промышленности, таких как пищевая промышленность, кормовая промышленность, косметическая промышленность (например, основы для косметических средств), фармацевтическая промышленность (например, синтез и приготовление лекарственных средств) и лакокрасочной промышленности. Эмульгаторы могут быть смачивающими веществами, ингредиентами пищевых продуктов и активными ингредиентами.
Кроме того, конденсаты жирной кислоты белка благодаря присущим им великолепным физиологическим свойствам можно применять, например, в косметике и средствах личной гигиены. Например, сложные эфиры белков можно использовать в средствах для душа и ванны, а также в шампунях и моющих средствах для тела. Конденсаты жирной кислоты белка можно также использовать в фармацевтических композициях, например, в качестве основы.
Конденсаты жирной кислоты белка широко применяются в косметической промышленности. Указанные продукты обычно получают в результате взаимодействия гидролизата белка с хлорангидридом жирной кислоты в условиях реакции Скоттена-Бауманна с использованием воды в качестве растворителя.
(_ e/rawmaterials26 _ e _ .htm#5).
В процессе получения конденсатов жирной кислоты белка можно объединять возобновляемые ресурсы жирных кислот (из растительного масла) и белка, который может быть получен из отходов переработки животного сырья (кожа) и многих растений, для создания структуры поверхностно-активного вещества с гидрофобной (жирная кислота) и гидрофильной (белок) частью. В данном процессе хлор-ангидрид жирной кислоты подвергают взаимодействию с аминогруппой аминокислоты с образованием конденсата жирной кислоты белка (см. фигуру 49). При этом получают продукты, которые характеризуются великолепной совместимостью с кожей и, кроме того, обладают хорошим очищающим действием.
Тот факт, что даже небольшие добавки гидролизата ацилированного белка оказывают синергичное действие на совместимость с кожей других поверхностно-активных веществ, имеет очень важное значение с технической точки зрения получения продукта. Указанное защитное действие можно объяснить амфотерным характером продукта. Между конденсатом жирной кислоты белка и коллагеном кожи происходит взаимодействие. Благодаря такому взаимодействию образуется защитный слой, который уменьшает чрезмерное воздействие поверхностно-активных веществ на верхние слои кожи, ослабляет их сильное обезжиривающее действие и прямое взаимодействие анионогенных поверхностно-активных веществ с кожей.
В косметической промышленности поверхностно-активные вещества на белковой основе используют главным образом в продуктах для душа и ванны, оказывающих мягкое действие, мягких шампунях, очищающих средствах для лица на основе поверхностно-активных веществ, средствах для холодной укладки и фиксации волос или средствах на основе поверхностно-активных веществ для малышей.
Конденсаты жирной кислоты гидролизата белка можно также использовать в качестве основ для фармацевтических препаратов, например для кремов и мазей, содержащих активные ингредиенты для местного нанесения на кожу.
Настоящее изобретение относится к новому способу получения конденсата жирной кислоты белка без использования хлорангидрида жирной кислоты. Реакция по настоящему изобретению показана на фигуре 50. Указанную реакцию можно выполнять в водной или буферной системе при низкой температуре без образования отходов производства.
Термин “конденсат жирной кислоты белка” в используемом здесь значении означает все нижеследующие сложные эфиры белков, сложные эфиры полипептидов, сложные эфиры дипептидов, сложные эфиры олигопептидов, сложные эфиры пептидов и сложные эфиры аминокислот.
Квалифицированному специалисту должно быть известно, что сложные эфиры углеводов (в частности, сложные эфиры сахаров) широко применяются в пищевой промышленности. Другими областями применения указанных продуктов являются косметика, средства для ухода за полостью рта и медицинские препараты. Кроме того, указанные соединения можно использовать в качестве антибиотиков, противоопухолевых средств, фунгицидов и инсектицидов. Липидацилтрансфераза по настоящему изобретению может катализировать образование сложного эфира глюкозы в среде с высоким содержанием воды (фигура 51).
Сложные эфиры по настоящему изобретению находят применение в нижеследующих областях.
Косметика: основные масляные эмульсии (масло в воде, HLB 16-18); парафиновые эмульсии в масле (масло в воде, HLB 10-14); эмульсии стеариновой кислоты; восковые эмульсии (масло в воде, HLB 14-16); ланолиновые эмульсии (масло в воде, HLB 12-14); силиконовые эмульсии; зубные пасты (масло в воде); пены для ванн (масло в воде, HLB 14-18); лосьоны для волос.
Фармацевтические препараты: лекарственные эмульсии; основы для мазей; суппозитории (вода в масле); инкапсулированные препараты; инъекционные препараты.
Сельское хозяйство: препараты для улучшения почвы; в качестве добавки к удобрению; в качестве очищающих средств широкого назначения; очищающих средств для фруктов и овощей; очищающих средств для маслобоек.
Защита урожая: природные инсектициды; хлорированные углеводы и препарат 140; сложные эфиры фосфорной кислоты (эмульсия масла в воде, HLB 10-14); фунгициды (эмульсия масла в воде); гербициды (эмульсия масла в воде).
Пищевая промышленность: хлеб и выпечка; маргарин; шоколад; средство от помутнения жира (эмульсия воды в масле, HLB 5-10); сахарная глазурь (эмульсия масла в воде, HLB 14-16); мягчители для карамели и жевательной резинки (эмульсия воды в масле, HLB 2-4); средства от прилипания (эмульсия воды в масле, HLB 2-4); добавки в мороженое (эмульсия воды в масле, HLB 4-6); смачивающие вещества для сухого молока и пекарного порошка (эмульсия воды в масле, HLB 9-11); заварной крем-концентрат (эмульсия воды в масле, HLB 2-4); фруктовые и овощные напитки; ароматизаторы (эмульсия воды в масле и эмульсия масла в воде, HLB 10-12); приправы к мясу, салату или другие ароматизирующие приправы (эмульсия масла в воде); пищевые красители (эмульсия воды в масле, HLB 2-4; эмульсия масла в воде, HLB 8-18); пеногасители.
Преимущество использования сложных эфиров конденсата жирной кислоты белка, сложных эфиров гидроксикислот и сложных эфиров углеводов по настоящему изобретению в качестве эмульгаторов в пищевой промышленности состоит в том, что указанные вещества являются безвредными совместимыми с пищевыми продуктами компонентами, которые гораздо легче подвергаются биологическому разрушению по сравнению с другими обычно применяемыми эмульгаторами, такими как, например, сложные эфиры этоксилированных жирных кислот. Таким образом, указанные эмульгаторы являются более дружественными для окружающей среды как в пищевой промышленности, так и в непищевой промышленности.
В одном варианте осуществления изобретения сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т и/или сложный эфир кортальцерона можно использовать в качестве антимикробного средства. Альтернативно или дополнительно к вышеуказанному применению сложный эфир микротецина, сложный эфир аскопирона Р, сложный эфир аскопирона Т и/или сложный эфир кортальцерона может представлять собой антиоксидант и/или эмульгатор либо то и другое вместе.
В одном варианте осуществления изобретения способы или применения по настоящему изобретению можно использовать для получения эмульгаторов, предназначенных для приготовления лекарственных средств, в частности для получения препаратов с контролируемым высвобождением активных ингредиентов, в которых активный ингредиент ацилирован липидацилтрансферазой. Такие препараты пролонгированного действия особенно пригодны для фармацевтических композиций для перорального введения благодаря тому, что постепенный гидролиз сложного эфира в пищеварительном тракте обеспечивает постепенную доставку активного ингредиента. Такие ацилированные композиции можно далее использовать для получения препаратов, предназначенных для подкожного или внутривенного введения.
В другом варианте осуществления изобретения способы или применения по настоящему изобретению можно использовать для получения межфазных катализаторов, предназначенных для переноса солей в раствор органических растворителей, например, в процессе органического взаимодействия. Например, перенос ацильной группы в соответствующий катионный акцептор, такой как гидроксикислота (лимонная кислота), или альтернативно в анионный акцептор, такой как гидроксиамины, позволяет получить межфазные катализаторы для переноса солей в раствор органических растворителей.
В другом варианте осуществления изобретения способы по настоящему изобретению можно использовать для получения сложноэфирных пролекарств фармацевтических соединений с низкой биологической доступностью и/или плохой растворимостью, например антивирусных средств, таких как ацикловир и гангацикловир. Указанный способ можно далее использовать для получения других лекарственных соединений со свободной гидроксильной группой, например с первичной, вторичной или третичной гидроксильной группой.
Сложный эфир, полученный по настоящему изобретению, предпочтительно используют в фармацевтическом препарате.
Сложный эфир, полученный по настоящему изобретению, предпочтительно используют в косметических средствах и/или средствах личной гигиены.
Сложный эфир, полученный по настоящему изобретению, предпочтительно используют в пищевых продуктах и/или кормовых продуктах.
Способ по настоящему изобретению может быть одной стадией в процессе получения одного или нескольких фармацевтических препаратов, косметических средств, средств личной гигиены, пищевых или кормовых продуктов.
Преимущества
Одним преимуществом способа по настоящему изобретению является то, что он позволяет получить один или несколько сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот без необходимости использования органических растворителей. Таким образом, настоящее изобретение позволяет сократить или полностью устранить использование органических растворителей. Следствием этого являются многие преимущества, выражающиеся, например, в снижении производственных затрат, уменьшении воздействия органических растворителей на человека и/или окружающую среду, упрощении производственного процесса.
При производстве сложных эфиров для пищевой промышленности особенно эффективным является использование липидов вместо жирных кислот, так как в данном случае не нужно удалять избыточные липиды, поскольку они могут образовывать часть пищевого продукта, в котором использован вышеуказанный продукт реакции. С другой стороны, избыток свободных жирных кислот необходимо удалять, так как они являются вредными для большинства пищевых продуктов.
Выделенный продукт
В соответствии с одним объектом изобретения полипептид или белок, предназначенный для использования в настоящем изобретении, предпочтительно представляет собой выделенный продукт. Термин “выделенный” означает, что последовательность по существу не содержит ни одного другого компонента, с которым данная последовательность естественно связана в природе и встречается в природе.
В соответствии с одним объектом изобретения продукт биоконверсии по настоящему изобретению, например сложный эфир углевода, сложный эфир белка, сложный эфир белковой субъединицы и/или сложный эфир гидроксикислоты, выделен из реакционной смеси. Термин “выделен” означает, что продукт биоконверсии по существу не содержит ни одного другого компонента, с которым данный продукт связан в процессе реакции биоконверсии.
Очищенный продукт
В соответствии с одним объектом изобретения полипептид или белок, предназначенный для использования в настоящем изобретении, предпочтительно представляет собой очищенный продукт. Термин “очищенный” означает, что последовательность находится в относительно чистом состоянии, например является чистой по крайней мере примерно на 51%, по крайней мере примерно на 75%, по крайней мере примерно на 80%, по крайней мере примерно на 90%, по крайней мере примерно на 95% или по крайней мере примерно на 98%.
В соответствии с одним объектом изобретения продукт биоконверсии, полученный по настоящему изобретению, например сложный эфир углевода, сложный эфир белка, сложный эфир белковой субъединицы и/или сложный эфир гидроксикислоты, предпочтительно очищен от реакционной смеси и поэтому является чистым. Термин “очищен” означает, что продукт биоконверсии находится в относительно чистом состоянии, например, является чистым по крайней мере примерно на 51%, по крайней мере примерно на 75%, по крайней мере примерно на 80%, по крайней мере примерно на 90%, по крайней мере примерно на 95% или по крайней мере примерно на 98%.
Фармацевтические композиции
Настоящее изобретение относится также к фармацевтической композиции, содержащей продукт по настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или наполнитель (включая их комбинации).
Фармацевтические композиции могут быть предназначены для введения человеку или животному в медицине или ветеринарии и обычно содержат один или несколько фармацевтических приемлемых разбавителей, носителей или наполнителей. Приемлемые носители или разбавители для терапевтического применения хорошо известны в фармацевтической области и описаны, например, в публикации Remington's Pharmaceutical Sciences, Mack Publishing Co. (A.R. Gennaro edit. 1985). Фармацевтический носитель, наполнитель или разбавитель может быть выбран в зависимости от предполагаемого способа введения и обычной фармацевтической практики. Фармацевтические композиции могут содержать в качестве носителя, наполнителя или разбавителя или дополнительно к ним любые приемлемые связывающие вещества, смазывающие вещества, суспендирующие вещества, покровные вещества, солюбилизирующие вещества.
В фармацевтической композиции могут присутствовать консерванты, стабилизаторы, красители и даже ароматизаторы. Примеры консервантов включают бензоат натрия, сорбиновую кислоту и сложные эфиры п-гидроксиоксибензойной кислоты. Могут быть также использованы антиоксиданты и суспендирующие вещества.
К композиции/препарату могут предъявляться разные требования в зависимости от разных систем доставки. В качестве примера можно отметить, что фармацевтическая композиция по настоящему изобретению может быть предназначена для введения при помощи мини-насоса или через слизистую оболочку, например, в виде распыляемого в нос раствора, аэрозоля для ингаляции, принимаемого внутрь раствора или для парентерального введения, в соответствии с которым композиция представляет собой инъекционный препарат, предназначенный для внутривенной, внутримышечной или подкожной доставки. Альтернативно препарат может быть предназначен для введения несколькими способами.
Лекарственное средство, предназначенное для введения через слизистую оболочку желудочно-кишечного тракта, должно оставаться устойчивым при перемещении по желудочно-кишечному тракту; например оно должно быть устойчиво к протеолитическому разложению, кислотному показателю рН и детергентному действию желчи.
Фармацевтические композиции можно вводить путем ингаляции, в форме анальных или вагинальных суппозиториев, местно в форме лосьона, раствора, крема, мази или тонкого порошка, при помощи кожного пластыря, перорально в форме таблеток, содержащих наполнители, такие как крахмал или лактоза, капсул или шариков отдельно или в смеси с наполнителями, в форме эликсиров, растворов или суспензий, содержащих ароматизаторы или красители, либо в виде парентеральных инъекций, таких как внутривенные, внутримышечные или подкожные инъекции. Композиции для парентерального введения можно использовать в форме стерильного водного раствора, который может содержать другие вещества, например соли или моносахариды, позволяющие сделать раствор изотоническим в отношении крови. Композицию для трансбуккального или подъязычного введения можно вводить в форме таблеток или лепешек, которые могут быть получены известными методами.
Клонирование нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению
Нуклеотидную последовательность, кодирующую полипептид, обладающий специфическими свойствами, представленными в данном описании изобретения, или полипептид, пригодный для модификации, можно выделить из любой клетки или организма, продуцирующего указанный полипептид. В данной области хорошо известны разные методы выделения нуклеотидных последовательностей.
Например, библиотеку геномных ДНК и/или кДНК можно создать, используя хромосомную ДНК или матричную РНК из организма, продуцирующего данный полипептид. Если известна аминокислотная последовательность полипептида, можно синтезировать меченые олигонуклеотидные зонды и использовать их для идентификации полипептидкодирующих клонов из геномной библиотеки, полученной из данного организма. Альтернативно для идентификации полипептидкодирующих клонов можно использовать меченый олигонуклеотидный зонд, содержащий последовательности, гомологичные другому известному гену полипептида. В последнем случае используют менее строгие условия гибридизации и промывки.
Альтернативно полипептидкодирующие клоны можно идентифицировать путем вставки фрагментов геномной ДНК в экспрессирующий вектор, такой как плазмида, трансформирующий ферментотрицательные бактерии при помощи полученной библиотеки геномных ДНК, и последующего культивирования трансформированных бактерий на агаре, содержащем фермент, ингибированный полипептидом, благодаря чему можно идентифицировать клоны, экспрессирующие данный полипептид.
В соответствии с другой альтернативой нуклеотидную последовательность, кодирующую полипептид, можно синтезировать известными стандартными методами, например методом на основе фосфорамидита, описанным в публикации Beucage S.L. et al (1981) Tetrahedron Letters 22, стр. 1859-1869, или методом, описанным в публикации Matthes et al (1984) EMBO J. 3, стр. 801-805. При использовании метода на основе фосфорамидита олигонуклеотиды синтезируют в автоматическом синтезаторе ДНК, очищают, отжигают, лигируют и клонируют в соответствующих векторах.
Нуклеотидная последовательность может иметь смешанное геномное и синтетическое происхождение, смешанное синтетическое и кДНК происхождение или смешанное геномное и кДНК происхождение и может быть получена лигированием фрагментов синтетического, геномного или кДНК происхождения (в соответствии с требованием) стандартными методами. Каждый лигированный фрагмент соответствует разным частям всей нуклеотидной последовательности. Последовательность ДНК можно также получить при помощи полимеразной реакции синтеза цепи (PCR), используя специфические затравки, например, описанные в патенте США № 4683202 или в публикации Saiki R.K. et al. (Science (1988) 239, стр. 487-491).
Нуклеотидные последовательности
Настоящее изобретение относится также к нуклеотидным последовательностям, кодирующим полипептиды, обладающие описанными здесь специфическими свойствами. Термин “нуклеотидная последовательность” в используемом здесь значении означает олигонуклеотидную последовательность или полинуклеотидную последовательность, а также ее варианты, гомологи, фрагменты и их производные (в частности, их части). Нуклеотидная последовательность может быть геномной, синтетической или рекомбинантной, двухцепочечной или одноцепочечной, представляя смысловую или антисмысловую цепь.
Термин “нуклеотидная последовательность” применительно к настоящему изобретению означает геномную ДНК, кДНК, синтетическую ДНК и РНК. Нуклеотидная последовательность предпочтительно означает ДНК, более предпочтительно кДНК для кодирующей последовательности.
В предпочтительном варианте осуществления изобретения в определение нуклеотидной последовательности, per se кодирующей полипептид, обладающий описанными здесь специфическими свойствами, не входит нативная нуклеотидная последовательность в естественном окружении, в котором она естественно связана с другими последовательностями, присутствующими в ее естественном окружении. Для простоты понимания данный предпочтительный вариант будет именоваться “ненативной нуклеотидной последовательностью”. В этой связи термин “нативная нуклеотидная последовательность” означает всю нуклеотидную последовательность, находящуюся в своем естественном окружении, причем в естественное окружение входит весь промотор, с которым функционально связана данная последовательность. Таким образом, полипептид по настоящему изобретению может быть экспрессирован нуклеотидной последовательностью в природном организме, где нуклеотидная последовательность не находится под контролем промотора, с которым она естественно связана в данном организме.
Указанный полипептид предпочтительно не является нативным полипептидом. В этой связи термин “нативный полипептид” означает весь полипептид, находящийся в своем естественном окружении и экспрессированный нативной нуклеотидной последовательностью.
Нуклеотидную последовательность, кодирующую полипептиды, обладающие описанными здесь специфическими свойствами, обычно получают методами рекомбинантных ДНК (то есть с помощью рекомбинантной ДНК). Однако в альтернативном варианте осуществления изобретения нуклеотидная последовательность может быть полностью или частично синтезирована химическими методами, хорошо известными в данной области (см. публикации Caruthers M.H. et al (1980) Nuc Acids Res Symp Ser 215-23 и Horn T. et al (1980) Nuc Acids Res Symp Ser 225-232).
Молекулярная эволюция
После выделения кодирующей фермент нуклеотидной последовательности или идентификации предполагаемой кодирующей фермент нуклеотидной последовательности может быть желательно модифицировать выбранную нуклеотидную последовательность, например может быть желательно мутировать последовательность с целью получения фермента по настоящему изобретению.
Мутации могут быть введены при помощи синтетических олигонуклеотидов. Указанные олигонуклеотиды содержат нуклеотидные последовательности, фланкирующие требуемые сайты мутации.
Приемлемый метод описан в публикации Morinaga et al. (Biotechnology (1984) 2, стр. 646-649). Другой метод введения мутаций в кодирующие фермент нуклеотидные последовательности описан в публикации Nelson and Long (Analytical Biochemistry (1989), 180, стр. 147-151).
Вместо сайтнаправленного мутагенеза, аналогичного описанному выше, можно произвести неспецифическое введение мутаций, используя коммерческий набор, в частности набор для мутагенеза методом PCR GeneMorph компании Stratagene или набор для неспецифического мутагенеза методом PCR Diversify компании Clontech. В европейском патенте № 0583265 описаны методы оптимизации мутагенеза на основе PCR, которые могут быть также объединены с использованием мутагенных аналогов ДНК, подобных описанным в европейском патенте № 0866796. Допускающие возможность ошибки методы на основе PCR пригодны для получения вариантов липидацилтрансфераз с предпочтительными характеристиками. В заявке WO 0206457 рассмотрена молекулярная эволюция липаз.
Третьим методом получения новых последовательностей является фрагментация неидентичных нуклеотидных последовательностей с использованием любого числа рестрикционных ферментов или такого фермента как ДНКаза I, и повторная сборка полных нуклеотидных последовательностей, кодирующих функциональные белки. Альтернативно можно использовать одну или несколько неидентичных нуклеотидных последовательностей и вводить мутации во время повторной сборки полной нуклеотидной последовательности. Методы перестановки ДНК или членов семейств пригодны для получения вариантов липидацилтрансфераз с предпочтительными характеристиками. Приемлемые методы выполнения “перестановки” рассмотрены в европейских патентах №№ 0752008, 1138763, 1103606. Перестановка может быть объединена с другими формами мутагенеза ДНК, описанными в патенте США № 6180406 и заявке WO 01/34835.
Таким образом можно ввести многочисленные сайтнаправленные или неспецифические мутации в нуклеотидную последовательность in vivo или in vitro и затем разными способами произвести скрининг с целью выявления улучшенных функциональных свойств кодированного полипептида. Используя методы силико- и экзоопосредованной рекомбинации (см. заявку WO 00/58517, патент США № 6344328, патент США № 6361974), можно произвести молекулярную эволюцию, в результате которой полученный вариант сохраняет очень слабую гомологию с известными ферментами или белками. Такие варианты могут характеризоваться значительной структурной аналогией с известными ферментами трансферазы и при этом могут обладать очень слабой гомологией с аминокислотной последовательностью.
Кроме того, мутации или естественные варианты полинуклеотидной последовательности могут быть рекомбинированы с последовательностями дикого типа, другими мутациями или естественными вариантами с целью получения новых вариантов. Такие новые варианты также могут быть подвергнуты скринингу для выявления улучшенных функциональных свойств кодированного полипептида.
Применение вышеуказанных и подобных методов молекулярной эволюции позволяет идентифицировать и отобрать варианты ферментов по настоящему изобретению, обладающие предпочтительными характеристиками без какого-либо предварительного знания структуры или функции белка, и получить непрогнозируемые, но полезные мутации или варианты. В данной области существует много примеров применения молекулярной эволюции для оптимизации или изменения активности фермента, которые включают, не ограничиваясь ими, нижеследующие применения: оптимизированная экспрессия и/или активность в клетке-хозяине или in vitro, повышенная ферментативная активность, измененный субстрат и/или специфичность продукта, повышенная или пониженная ферментативная или структурная устойчивость, измененная ферментативная активность/специфичность в предпочтительных окружающих условиях, таких как температура, рН, субстрат.
Как должно быть понятно специалисту в данной области, при помощи средств молекулярной эволюции фермент можно изменить с достижением лучших функциональных свойств данного фермента.
Липидацилтрансфераза по настоящему изобретению может предтавлять собой вариант, то есть может содержать по крайней мере одну замену, делецию или добавление аминокислоты по сравнению с исходным ферментом. Варианты ферментов остаются гомологичными исходному ферменту по крайней мере на 1%, 2%, 3%, 5%, 10%, 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 99%. Приемлемые исходные ферменты могут включать любой фермент, обладающий эстеразной или липазной активностью. Исходный фермент предпочтительно соответствует согласованной последовательности pfam00657.
В предпочтительном варианте осуществления изобретения вариант фермента липидацилтрансферазы сохраняет или включает по крайней мере один или несколько аминокислотных остатков согласованной последовательности pfam00657, встречающихся в блоках GDSX, GANDY и НРТ.
Ферменты, такие как липазы, не обладающие активностью липидацилтрансферазы или обладающие низкой активностью указанного фермента в водной среде, могут быть мутированы методами молекулярной эволюции с целью сообщения или усиления трансферазной активности, что позволяет получить фермент липидацилтрансферазу, обладающий значительной трансферазной активностью, который пригоден для использования в композициях и способах по настоящему изобретению.
Липидацилтрансфераза, предназначенная для использования в данном изобретении, может представлять собой вариант с повышенной ферментативной активностью в отношении полярных липидов, предпочтительно фосфолипидов и/или гликолипидов, по сравнению с исходным ферментом. Такие варианты предпочтительно обладают низкой активностью или вообще не обладают активностью в отношении полярных лизолипидов. Повышенная активность в отношении полярных липидов, фосфолипидов и/или гликолипидов может быть результатом гидролиза и/или трансферазной активности либо их комбинации.
Вариантные липидацилтрансферазы, предназначенные для использования в данном изобретении, могут обладать пониженной активностью в отношении триглицеридов, моноглицеридов и/или диглицеридов по сравнению с исходным ферментом.
Вариантный фермент может не обладать активностью в отношении триглицеридов, моноглицеридов и/или диглицеридов.
Альтернативно вариантный фермент, предназначенный для использования в данном изобретении, может обладать повышенной активностью в отношении триглицеридов и/или может также обладать повышенной активностью в отношении одного или нескольких нижеследующих веществ, таких как полярные липиды, фосфолипиды, лецитин, фосфатидилхолин, гликолипиды, дигалактозилмоноглицерид, моногалактозилмоноглицерид.
Известны варианты липидацилтрансфераз, и один или несколько таких вариантов могут быть пригодны для использования в способах и применениях по данному изобретению. Например, варианты липидацилтрансфераз описаны в нижеследующих ссылках:
Hilton S, Buckley JT. Studies on the reaction mechanism of a microbial lipase/acyltransferase using chemical modification and site-directed mutagenesis J. Biol. Chem. 1991 Jan 15; 266(2):997-1000.
Robertson DL, Hilton S, Wong KR, Koepke A, Buckley JT. Influence of active site and tyrosine modification on the secretion and activity of the Aeromonas hydrophila lipase/acyltransferase. J Biol Chem. 1994 Jan 21; 269(3):2146-50.
Brumlik MJ, Buckley JT.Identification of the catalytic triad of the lipase/acyltransferase from Aeromonas hydrophila. J Bacteriol. 1996 Apr; 178(7):2060-4.
Peelman F, Vinaimont N, Verhee A, Vanloo B, Verschelde JL, Labeur C, Seguret-Mace S, Duverger N, Hutchinson G, Vandekerckhove J, Tavernier J, Rosseneu M. A proposed architecture for lecithin cholesterol acyl transferase (LCAT): identification of the catalytic triad and molecular modeling. Protein Sci. 1998 Mar; 7(3):587-99.
Аминокислотные последовательности
Настоящее изобретение относится также к аминокислотным последовательностям полипептидов, обладающих специфическими свойствами, представленными в данном описании изобретения.
В используемом здесь значении термин “аминокислотная последовательность” синонимичен термину “полипептид” и/или термину “белок”. В некоторых случаях термин “аминокислотная последовательность” синонимичен термину “пептид”.
Аминокислотную последовательность можно получить/выделить из приемлемого источника, синтезировать или получить методами рекомбинантных ДНК.
Аминокислотные последовательности можно получить стандартными методами из выделенных полипептидов, рассмотренных в данном описании изобретения.
Один приемлемый метод определения аминокислотных последовательностей из выделенных полипептидов заключается в следующем.
Очищенный полипептид высушивают вымораживанием и 100 мкг высушенного вымораживанием материала растворяют в 50 мкл смеси 8М мочевины и 0,4М гидрокарбоната аммония, рН 8,4. Растворенный белок денатурируют и восстанавливают в течение 15 минут при 50°С, затем помещают в атмосферу азота и добавляют 5 мкл 45 мМ дитио-треитола. Смесь охлаждают до комнатной температуры и добавляют 5 мкл 100 мМ иодацетамида для замены остатков цистеины в течение 15 минут при комнатной температуре в темноте в атмосфере азота.
К вышеуказанной реакционной смеси добавляют 135 мкл воды и 5 мкг эндопротеиназы Lys-C в 5 мкл воды и гидролизуют смесь при 37°С в атмосфере азота в течение 24 часов.
Полученные пептиды отделяют при помощи ВЭЖХ с обращенной фазой в колонке VYDAC C18 (0,46х15 см; 10 мкм; The Separation Group, California, USA), используя растворитель А: 0,1% ТФУ в воде и растворитель В: 0,1% ТФУ в ацетонитриле. Отобранные пептиды повторно хроматографируют в колонке Develosil C18, используя такую же систему растворителей, и затем секвенируют N-конец. Секвенирование можно произвести в секвенаторе 476А компании Applied Biosystems, используя быстрые циклы импульсно-меченой жидкости в соответствии с инструкциями изготовителя (Applied Biosystems, California, USA).
Идентичность или гомологичность последовательностей
Настоящее изобретение относится также к использованию последовательностей с определенной степенью идентичности или гомологии аминокислотным последовательностям полипептида, обладающего описанными здесь специфическими свойствами, или любой нуклеотидной последовательности, кодирующей такой полипептид (далее именуемая “гомологичная последовательность”). Термин “гомолог” в используемом здесь значении означает структурную единицу, обладающую определенной гомологией с аминокислотными последовательностями и нуклеотидными последовательностями, являющимися объектами данного изобретения. Термин “гомология” может быть аналогичен термину “идентичность”.
Гомологичная аминокислотная последовательность и/или нуклеотидная последовательность должна представлять и/или кодировать полипептид, сохраняющий функциональную активность и/или повышающий активность фермента.
В контексте настоящего изобретения гомологичная последовательность означает аминокислотную последовательность, которая может быть по крайней мере на 75%, 85% или 90% идентична, предпочтительно по крайней мере на 95% или 98% идентична последовательности по настоящему изобретению. Гомологи обычно содержат такие же активные сайты и т.д., что и аминокислотная последовательность по данному изобретению. Хотя гомологию можно также рассматривать с точки зрения сходства (то есть аминокислотных остатков, обладающих подобными химическими свойствами/функциями), в контексте настоящего изобретения гомология предпочтительно выражена в виде идентичности последовательностей.
В контексте настоящего изобретения гомологичная последовательность означает нуклеотидную последовательность, которая может быть по крайней мере на 75%, 85% или 90% идентична, предпочтительно по крайней мере на 95% или 98% идентична нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению (последовательность, являющаяся объектом изобретения). Гомологами обычно являются последовательности, кодирующие такие же активные сайты и т.д., что и последовательность, являющаяся объектом изобретения. Хотя гомологию можно также рассматривать с точки зрения сходства (то есть аминокислотных остатков, обладающих подобными химическими свойствами/функциями), в контексте настоящего изобретения гомология предпочтительно выражена в виде идентичности последовательностей.
Гомологию можно сравнить приблизительно или, как правило, при помощи легко доступных программ сравнения последовательностей. Указанные коммерчески доступные компьютерные программы могут высчитать % гомологии у двух или более последовательностей.
Процентное значение (%) гомологии можно вычислить для смежных последовательностей, при этом одна последовательность сравнивается с другой последовательностью и каждая аминокислота в одной последовательности непосредственно сравнивается остаток за остатком с соответствующей аминокислотой в другой последовательности. Такое сравнение называется сравнением “без пробелов”. Сравнения без пробелов обычно выполняют лишь в отношении относительно небольшого числа остатков.
Хотя данный метод является очень простым и сопоставимым, он не принимает во внимание то, что, например, в идентичной паре последовательностей одна инсерция или делеция может вывести из сравнения указанные аминокислотные остатки, в результате чего происходит значительное уменьшение процентного значения (%) гомологии при выполнении глобального сравнения. Поэтому большинство методов сравнения последовательностей направлены на достижение оптимального сравнения, при котором учитываются все возможные инсерции и делеции без необоснованного начисления штрафных очков при определении общей гомологии. Такой результат достигается путем введения “пробелов” в сравниваемую последовательность для достижения максимальной локальной гомологии.
Однако при выполнении указанных более сложных методов присваиваются “штрафные очки” за каждый пробел, обнаруживаемый при сравнении, в результате чего при наличии одинакового числа идентичных аминокислот последовательность, имеющая как можно меньше пробелов, отражающих более высокое сродство между двумя сравниваемыми последовательностями, получает более высокую оценку, чем последовательность, имеющая много пробелов. Обычно используют “оценки связанных пробелов”, на основании которых присваивают относительно высокие баллы за существование пробела и меньшие штрафные очки за каждый последующий остаток в данном пробеле. Такова наиболее широко используемая система оценки пробелов. Высокие штрафные очки за пробел, несомненно, позволяют получить оптимальные сравнения с меньшим числом пробелов. Большинство программ сравнения позволяют изменять штрафные очки, начисляемые за пробелы. Однако желательно использовать значения по умолчанию, существующие в программах сравнения последовательностей. Например, в пакете программ GCG Wisconsin Bestfit штрафные очки по умолчанию, начисляемые за пробел в аминокислотных последовательностях, составляют -12 за пробел и -4 за каждый последующий остаток.
Поэтому вычисление максимальной % гомологии прежде всего требует выполнения оптимального сравнения с учетом штрафных очков за пробелы. Приемлемой компьютерной программой для выполнения такого сравнения является пакет программ GCG Wisconsin Bestfit (Devereux et al., 1984, Nuc. Acids Research 12, стр. 387). Примеры других программ, которые могут выполнять сравнение последовательностей, включают, не ограничиваясь ими, пакет программ BLAST (см. публикацию Ausubel et al., 1999, Short Protocols in Molecular Biology, 4th Ed - Chapter 18), FASTA (Altschul et al., 1990, J. Mol. Biol. 403-410) и комплект программ сравнения GENEWORKS. Программы BLAST и FASTA предназначены для поиска в автономном и интерактивном режиме (см. публикацию Ausubel et al., 1999, стр. 7-58, 7-60). Однако в некоторых применениях желательно использовать программу GCG Bestfit. Кроме того, существует новая программа, именуемая BLAST 2 Sequences, предназначенная для сравнения белковых и нуклеотидных последовательностей (см. публикацию FEMS Microbiol Lett 1999, 174(2): 247-50; FEMS Microbiol Lett, 1999 177(1): 187-8 и mailto:tatiana@ncbi.nlm.nih.gov).
Хотя конечную % гомологию можно измерить в виде идентичности, процесс сравнения обычно не основывается на сравнении пар оснований по принципу “все или ничего”. Вместо этого обычно используют масштабированную матрицу оценок сходства, в соответствии с которой оценки начисляются за каждое попарное сравнение на основании химического сходства или эволюционного расхождения. Примером обычно используемой матрицы может служить матрица BLOSUM62, которая является матрицей по умолчанию для комплекта программ BLAST. В программах GCG Wisconsin обычно использованы общедоступные значения по умолчанию или таблица сравнения обычных символов, если она имеется (см. руководство пользователя для более подробного ознакомления c программами). В некоторых применениях желательно использовать общедоступные значения по умолчанию для пакета программ GCG или в случае других программ матрицу по умолчанию, такую как BLOSUM62.
Альтернативно процентное значение гомологии можно высчитать, используя функцию множественного сравнения в программе DNASIS™ (Hitachi Software), основанную на алгоритме, аналогичном программе CLUSTAL (Higgins D.G. & Sharp P.M. (1988), Gene 73(1), 237-244).
После выполнения программой оптимального сравнения можно высчитать % гомологии, предпочтительно % идентичности последовательностей. Программы обычно выполняют такие вычисления в виде части сравнения последовательностей и выдает числовой результат.
Последовательности могут также иметь делеции, инсерции или замены аминокислотных остатков, которые вызывают молчащую замену и позволяют получить функционально эквивалентное вещество. Целенаправленные замены аминокислот можно производить на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатического характера остатков при сохранении вторичной активности связывания вещества. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными полярными головными группами, обладающие схожими значениями гидрофильности, включают лейцин, изолейцин, валин, глицин, аланин, аспарагин, глутамин, серин, треонин, фенилаланин и тирозин.
Замены консервативных аминокислот можно производить, например, в соответствии с нижеследующей таблицей. Аминокислоты в одном блоке второго столбца и предпочтительно в одной строке третьего столбца могут заменять друг друга:
Настоящее изобретение относится также к гомологичному замещению (термины “замещение” и “замена” использованы в данном описании изобретения в значении замены существующего аминокислотного остатка альтернативным остатком), которое может иметь место, то есть к замещению подобного остатка подобным, например основного основным, кислотного кислотным, полярного полярным и т.д. Негомологичное замещение также может иметь место, то есть замещение остатка одного класса остатком другого класса или альтернативно введение неприродных аминокислот, таких как орнитин (далее обозначаемый символом Z), орнитин диаминомасляной кислоты (далее обозначаемый символом В), орнитин норлейцина (далее обозначаемый символом О), пириилаланин, тиенилаланин, нафтилаланин и фенил-глицин.
Замены могут также производиться неприродными аминокислотами.
Вариантные аминокислотные последовательности могут содержать приемлемые спейсерные группы, которые могут быть введены между двумя любыми аминокислотными остатками последовательности и включают алкильные группы, такие как метильные, этильные или пропильные группы, дополнительно к аминокислотным спейсерам, таким как остатки глицина или β-аланина. Другой тип изменения, предполагающий наличие одного или нескольких аминокислотных остатков в пептоидной форме, должен быть хорошо известен специалистам в данной области. Во избежание неправильного толкования следует отметить, что термин “пептоидная форма” означает вариантные аминокислотные остатки, в которых α-углеродная замещающая группа находится в положении атома азота остатка, а не α-атома углерода. Методы получения пептидов в пептоидной форме известны в данной области и описаны, например, в публикациях Simon R.J. et al., PNAS (1992) 89(20), 9367-9371 и Horwell D.C., Trends Biotechnol. (1995) 13(4), 132-234.
Нуклеотидные последовательности, предназначенные для использования в настоящем изобретении или кодирующие полипептид, обладающий описанными здесь специфическими свойствами, могут включать синтетические или модифицированные нуклеотиды. В данной области известен ряд разных типов модификации олигонуклеотидов. Указанные модификации включают метилфосфонатные и фосфортиоатные остовы и/или добавление акридиновых или полилизиновых цепей в положении 3'- и/или 5'-концов молекулы. В соответствии с целями настоящего изобретения должно быть понятно, что описанные здесь нуклеотидные последовательности могут быть модифицированы любым методом, существующим в данной области. Такие модификации могут быть выполнены для усиления активности in vivo или увеличения продолжительности жизни нуклеотидных последовательностей.
Настоящее изобретение относится также к использованию нуклеотидных последовательностей, которые являются комплементарными описанным здесь последовательностям, любым их производным, фрагментам или производным фрагментов. Если последовательность является комплементарной фрагменту последовательности, тогда указанную последовательность можно использовать в качестве зонда для идентификации подобных кодирующих последовательностей в других организмах и т.д.
Полинуклеотиды, которые не являются гомологичными последовательностям по настоящему изобретению на 100%, но входят в объем данного изобретения, можно получить рядом методов. Другие варианты описанных здесь последовательностей можно получить зондированием библиотек ДНК, созданных из ряда особей, например особей из разных популяций. Кроме того, можно получить другие вирусные/ бактериальные или клеточные гомологи, в частности клеточные гомологи, обнаруженные в клетках млекопитающих (например, в клетках крыс, мышей, крупного рогатого скота и приматов), и такие гомологи и их фрагменты обычно способны избирательно гибридизировать с последовательностями, представленными в приведенной здесь списке последовательностей. Такие последовательности можно получить, зондируя библиотеки кДНК, созданные из библиотек геномных ДНК других видов животных, зондами, содержащими всю или часть любой последовательности из прилагаемого списка последовательностей, в условиях от средней до высокой строгости. То же самое относится к получению гомологов и аллельных вариантов полипептидных или нуклеотидных последовательностей по данному изобретению.
Варианты и гомологи штамма/вида можно также получить методом PCR вырожденной последовательности с использованием затравок, предназначенных для направленного воздействия на последовательности в указанных вариантах и гомологах, кодирующих консервативные аминокислотные последовательности в последовательностях по настоящему изобретению. Консервативные последовательности можно прогнозировать, например, сравнивая аминокислотные последовательности из нескольких вариантов/гомологов. Сравнение последовательностей можно произвести при помощи компьютерных программ, известных в данной области. Например, широко используется программа GCG Wisconsin PileUp.
Затравки, используемые при выполнении РCR вырожденной последовательности, содержат одно или несколько вырожденных положений и применяются в условиях более низкой строгости по сравнению с условиями, используемыми для клонирования последовательностей при помощи затравок для одной последовательности против известных последовательностей.
Альтернативно такие полинуклеотиды можно получить сайтнаправленным мутагенезом описанных последовательностей. Данный метод можно использовать, например, в тех случаях, когда необходимо изменить последовательность с молчащим кодоном для оптимизации предпочтительности кодона для определенной клетки-хозяина, в которой экспрессированы полинуклеотидные последовательности. Другие изменения последовательности могут быть желательны для введения сайтов узнавания рестрикционного полипептида или для изменения свойства или функции полипептидов, кодированных данными полинуклеотидами.
Полинуклеотиды (нуклеотидные последовательности) по данному изобретению можно использовать для получения затравки, например затравки для PCR, затравки для альтернативной реакции амплификации, зонда, например, меченного опознаваемой меткой обычными методами с использованием радиоактивных или нерадиоактивных меток, либо полинуклеотиды могут быть клонированы в векторах. Такие затравки, зонды и другие фрагменты имеют длину, равную по крайней мере 15, предпочтительно по крайней мере 20, например, по крайней мере 25, 30 или 40 нуклеотидам, и входят в определение термина “полинуклеотиды” по настоящему изобретению.
Полинуклеотиды, такие как полинуклеотиды ДНК и зонды по данному изобретению, можно получить рекомбинантными, синтетическими или любыми другими методами, известными специалистам в данной области. Они могут быть также клонированы стандартными методами.
Затравки обычно получают методами синтеза, включающими поэтапное создание требуемой нуклеотидной последовательности по одному нуклеотиду. Методы синтеза с применением автоматических методов хорошо известны в данной области.
Полинуклеотиды с более длинной цепью обычно получают рекомбинантными методами, например, при помощи методов клонирования с выполнением PCR (полимеразной реакции синтеза цепи). Указанные методы включают создание двух затравок (например, содержащих примерно 15-30 нуклеотидов), фланкирующих область воздействующей на липид последовательности, которую желательно клонировать, введение затравок в соприкосновение с мРНК или кДНК, полученной из клетки животного или человека, выполнение полимеразной реакции синтеза цепи в условиях, вызывающих амплификацию требуемой области, выделение амплифицированного фрагмента (например, путем очистки реакционной смеси на агарозном геле) и получение амплифицированной ДНК. Затравки могут содержать приемлемые сайты узнавания рестрикционных ферментов, благодаря чему амплифицированная ДНК может быть клонирована в приемлемом клонирующем векторе.
Гибридизация
Настоящее изобретение относится также к последовательностям, которые являются комплементарными последовательностям по настоящему изобретению или последовательностям, способным гибридизировать с последовательностями по настоящему изобретению или с комплементарными им последовательностями.
Термин “гибридизация” в используемом здесь значении означает “процесс, в соответствии с которым цепь нуклеиновой кислоты соединяется с комплементарной цепью в результате спаривания оснований”, а также процесс амплификации, выполняемый методами полимеразной реакции синтеза цепи (PCR).
Настоящее изобретение относится также к использованию нуклеотидных последовательностей, способных гибридизировать с последовательностями, которые являются комплементарными последовательностям по настоящему изобретению, их производным, фрагментам или производным фрагментов.
Настоящее изобретение относится также к последовательностям, которые являются комплементарными последовательностям, способным гибридизировать с описанными здесь нуклеотидными последовательностями.
Условия гибридизации включают температуру плавления (Тm) нуклеотидсвязывающего комплекса, как это описано в публикации Berger and Kimmel (1987, Guide to Molecular Cloning Techniques, Methods in Enzymology, Vol. 152, Academic Press, San Diego CA), и определяют установленную “строгость”, рассматриваемую ниже.
Максимальная строгость обычно соответствует температуре, примерно равной Тm-5°С (на 5°С ниже Тm зонда); высокая строгость соответствует температуре, которая примерно на 5-10°С ниже Тm; средняя строгость соответствует температуре, которая примерно на 10-20°С ниже Тm; и низкая строгость соответствует температуре, которая примерно на 20-25°С ниже Тm. Как должно быть понятно специалистам в данной области, гибридизацию в условиях максимальной строгости можно использовать для идентификации или обнаружения идентичных нуклеотидных последовательностей, в то время как гибридизацию в условиях средней (или низкой) строгости можно использовать для идентификации или обнаружения подобных или родственных полинуклеотидных последовательностей.
Настоящее изобретение предпочтительно относится к последовательностям, которые являются комплементарными последовательностям, способным гибридизировать с условиях высокой или средней строгости с нуклеотидными последовательностями, кодирующими полипептиды, обладающие описанными здесь специфическими свойствами.
Более предпочтительно настоящее изобретение относится к последовательностям, которые являются комплементарными последовательностям, способным гибридизировать в условиях высокой строгости (например, 65°С и 0,1хSSC {1xSSC=0,15М NaCl, 0,015М цитрата натрия, рН 7,0}) с нуклеотидными последовательностями, кодирующими полипептиды, обладающие описанными здесь специфическими свойствами.
Настоящее изобретение относится также к нуклеотидным последовательностям, способным гибридизировать с вышеуказанными нуклеотидными последовательностями (включая последовательности, комплементарные рассмотренным последовательностям).
Настоящее изобретение относится также к нуклеотидным последовательностям, которые являются комплементарными последовательностям, способным гибридизировать с описанными здесь нуклеотидными последовательностями (включая последовательности, комплементарные описанными здесь последовательностям).
В объем настоящего изобретения входят также полинуклеотидные последовательности, способные гибридизировать с описанными здесь нуклеотидными последовательностями в условиях от средней до максимальной строгости.
В соответствии с предпочтительным объектом изобретения настоящее изобретения относится к нуклеотидным последовательностям, способным гибридизировать с описанными здесь нуклеотидными последовательностями или с их комплементом в строгих условиях (например, 50°С и 0,2хSSC).
В соответствии с более предпочтительным объектом изобретения настоящее изобретение относится к нуклеотидным последовательностям, способным гибридизировать с описанными здесь нуклеотидными последовательностями или с их комплементом в условиях высокой строгости (например, 65°С и 0,1хSSC).
Экспрессия полипептидов
Нуклеотидная последовательность, предназначенная для использования в настоящем изобретении или для кодирования полипептида, обладающего описанными здесь специфическими свойствами, может быть введена в рекомбинантный реплицируемый вектор. Указанный вектор может быть использован для репликации и экспрессии нуклеотидной последовательности в форме полипептида в совместимой клетке-хозяине. Экспрессия может контролироваться при помощи регулярных последовательностей, которые включают промоторы/энхансеры и другие регулирующие экспрессию сигналы. Можно использовать прокариотические промоторы и промоторы, функционирующие в эукариотических клетках. Можно использовать тканеспецифические или стимулспецифические промоторы. Кроме того, можно использовать химерные промоторы, содержащие элементы последовательности из двух или более разных вышеописанных промоторов.
Полипептид, продуцированный рекомбинантной клеткой-хозяином в результате экспрессии нуклеотидной последовательности, может быть секретирован или может находиться внутри клетки в зависимости от используемой последовательности и/или вектора. Кодирующие последовательности могут содержать сигнальные последовательности, направляющие секрецию кодирующих вещество последовательностей через мембрану определенной прокариотической или эукариотической клетки.
Экспрессирующий вектор
Термин “экспрессирующий вектор” означает конструкцию, которая способна вызывать экспрессию in vivo или in vitro.
Экспрессирующий вектор предпочтительно вводят в геном организма. Термин “вводят” предпочтительно означает устойчивое включение в геном.
Нуклеотидная последовательность по настоящему изобретению или нуклеотидная последовательность, кодирующая полипептид, обладающий описанными здесь специфическими свойствами, может находиться в векторе, где нуклеотидная последовательность функционально связана с регуляторными последовательностями так, что регуляторные последовательности способны обеспечить экспрессию нуклеотидной последовательности приемлемым организмом-хозяином, то есть данный вектор является экспрессирующим вектором.
Векторы по настоящему изобретению могут быть введены в приемлемую клетку-хозяина в соответствии с нижеследующим описанием для экспрессии полипептида, обладающего описанными здесь специфическими свойствами.
Выбор вектора, например, плазмидного, космидного, вирусного или фагового вектора, часто зависит от клетки-хозяина, в которую вводят указанный вектор.
Векторы могут содержать один или несколько селектируемых генов-маркеров, таких как ген, обладающий устойчивостью к антибиотикам, например устойчивостью к ампициллину, канамицину, хлор-амфениколу или тетрациклину. Альтернативно выбор может сопровождаться котрансформацией (как это описано в заявке WO 91/17243).
Векторы могут быть использованы in vitro, например, для продуцирования РНК либо для трансфекции или трансформации клетки-хозяина.
Другой вариант осуществления изобретения относится к способу получения нуклеотидных последовательностей по настоящему изобретению или нуклеотидных последовательностей, кодирующих полипептиды, обладающие описанными здесь специфическими свойствами, путем введения нуклеотидной последовательности в реплицируемый вектор, введения вектора в совместимую клетку-хозяина и выращивания клетки-хозяина в условиях, вызывающих репликацию вектора.
Вектор может далее содержать нуклеотидную последовательность, обеспечивающую репликацию вектора в клетке-хозяине. Примерами таких последовательностей являются ориджины репликации плазмид pUC19, pACYC177, pUB110, pE194, pAMB1 и pIJ702.
Регуляторные последовательности
В некоторых применениях нуклеотидная последовательность, предназначенная для использования в настоящем изобретении, или нуклеотидная последовательность, кодирующая полипептид, обладающий описанными здесь специфическими свойствами, может быть функционально связана с регуляторной последовательностью, способной обеспечить экспрессию нуклеотидной последовательности выбранной клеткой-хозяином. В качестве примера можно отметить, что настоящее изобретение относится к вектору, содержащему нуклеотидную последовательность по настоящему изобретению, функционально связанную с такой регуляторной последовательностью, то есть данный вектор является экспрессирующим вектором.
Термин “функционально связанный” означает смежное положение, обеспечивающее взаимосвязь компонентов, благодаря которой указанные компоненты могут функционировать требуемым образом. Регуляторная последовательность, “функционально связанная” с кодирующей последовательностью, лигирована так, что экспрессия кодирующей последовательности достигается в условиях, совместимых с контрольными последовательностями.
В определение термина “регуляторные последовательности” входят промоторы, энхансеры и другие сигналы, регулирующие экспрессию.
Термин “промотор” имеет значение, обычно употребляемое в данной области, например, сайт связывания РНК-полимеразы.
Усиленная экспрессия нуклеотидной последовательности, кодирующей фермент, обладающий описанными здесь специфическими свойствами, может быть также достигнута в результате выбора гетерологичных регуляторных областей, например промоторных, секретирующих, лидерных и терминирующих областей.
Нуклеотидная последовательность по настоящему изобретению предпочтительно может быть функционально связана по крайней мере с промотором.
Примеры приемлемых промоторов, направляющих транскрипцию нуклеотидной последовательности в бактериальном, грибном или дрожжевом хозяине, хорошо известны в данной области.
Конструкции
Термин “конструкция”, который синонимичен таким терминам, как “конъюгат”, “кластер” и “гибрид”, означает нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами, которая предназначена для использования в настоящем изобретении. Примером непрямого присоединения является приемлемая спейсерная группа, такая как интронная последовательность, в частности Sh1-интрон или ADH-интрон, расположенная между промотором и нуклеотидной последовательностью по настоящему изобретению. Такое же определение относится к термину “слитый” в значении, используемом в настоящем изобретении, которое включает прямое или непрямое присоединение. В некоторых случаях указанные термины не относятся к природной комбинации нуклеотидной последовательности, кодирующей белок, ординарно связанной с промотором гена дикого типа, когда они находятся в своем естественном окружении.
Конструкция может даже содержать или экспрессировать маркер, обеспечивающий выбор генетической конструкции.
В некоторых применениях указанная конструкция предпочтительно содержит по крайней мере одну нуклеотидную последовательность по настоящему изобретению или нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами, который функционально связан с промотором.
Клетки-хозяева
Термин “клетка-хозяин” применительно к настоящему изобретению означает любую клетку, которая содержит нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами, или вышеописанный экспрессирующей вектор и используется для рекомбинантного продуцирования полипептида, обладающего описанными здесь специфическими свойствами.
Таким образом, другой вариант осуществления настоящего изобретения относится к клеткам-хозяевам, трансформированным или трансфецированным нуклеотидной последовательностью по настоящему изобретению, или нуклеотидной последовательностью, экспрессирующей полипептид, обладающий опианными здесь специфическими свойствами. Выбираемые клетки должны быть совместимы с указанным вектором и могут быть, например, прокариотическими (например, бактериальными), грибными, дрожжевыми или растительными клетками. Клетки-хозяева предпочтительно не являются клетками человека.
Примерами приемлемых бактериальных организмов-хозяев являются грамотрицательные или грамположительные бактерии.
В зависимости от характера нуклеотидной последовательности, кодирующей полипептид, обладающий описанными здесь специфическими свойствами, и/или желательности последующего процессинга экспрессированного белка предпочтительными могут быть эукариотические хозяева, такие как дрожжи или другие грибы. Дрожжевые клетки обычно являются более предпочтительными по сравнению с грибными клетками, так как ими легче манипулировать. Однако некоторые белки плохо секретируются из дрожжевой клетки или в некоторых случаях не подвергаются требуемому процессингу (например, гипергликозилирование в дрожжах). В таких случаях следует выбрать другой грибной организм-хозяин.
Использование приемлемых клеток-хозяев, таких как дрожжевые, грибные и растительные клетки-хозяева, позволяет производить пост-трансляционные модификации (миристоилирование, гликозилирование, усечение, лапидирование, фосфорилирование тирозина, серина или треонина), которые могут быть необходимы для сообщения оптимальной биологической активности продуктам рекомбинантной экспрессии по настоящему изобретению.
Клетка-хозяин может относится к штамму с дефицитом протеазы или без протеазы.
Организм
Термин “организм” применительно к настоящему изобретению означает любой организм, который может содержать нуклеотидную последовательность по настоящему изобретению или нуклеотидную последовательность, кодирующую полипептид, обладающий описанным здесь специфическими свойствами, и/или полученные из него продукты.
Приемлемые организмы могут включать прокариоты, грибы, дрожжи или растения.
Термин “трансгенный организм” применительно к настоящему изобретению означает любой организм, который содержит нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами, и/или полученные из него продукты, и/или в котором промотор позволяет экспрессировать нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами. Нуклеотидную последовательность предпочтительно вводят в геном организма.
Термин “трансгенный организм” не относится к нативным нуклеотидным кодирующим последовательностям, находящимся в своем естественном окружении, когда они находятся под контролем нативного промотора, который также находится в своем естественном окружении.
Поэтому термин “трансгенный организм” по настоящему изобретению означает организм, содержащий одну или комбинации нуклеотидных последовательностей, кодирующих полипептид, обладающий описанными здесь специфическими свойствами, вышеуказанные конструкции, векторы, плазмиды, клетки или их продукты. Например, трансгенный организм может также содержать нуклеотидную последовательность, кодирующую полипептид, обладающий описанными здесь специфическими свойствами, которая находится под контролем гетерологичного промотора.
Трансформация клеток-хозяев/организма
Как было указано выше, организм-хозяин может быть прокариотическим или эукариотическим организмом. Примеры приемлемых прокариотических хозяев включают E. coli и Bacillus subtilis.
Трансформация прокариотических хозяев хорошо описана в данной области, например, в публикации Sambrook et al. (Molecular Cloning: A Laboratory Manual, 2nd edition, 1989, Cold Spring Harbor Laboratory Press). При использовании прокариотического хозяина может потребоваться соответствующее изменение нуклеотидной последовательности до трансформации, например, путем удаления интронов.
В другом варианте осуществления изобретения трансгенным организмом могут быть дрожжи.
Клетки нитевидных грибов могут быть трансформированы разными методами, известными в данной области, такими как процесс, включающий образование протопласта и трансформацию протопластов с последующей регенерацией клеточной оболочки известным образом. Применение Aspergillus в качестве организма-хозяина описано в европейском патенте № 0238023.
Другим организмом-хозяином может быть растение. Обзор общих методов, используемых для трансформации растений, можно найти в статьях Potrykus (Annu Rev Plant Physiol Plant Mol Biol [1991] 42:205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27). Трансформация растений далее описана в заявке на европейский патент № 0449375.
В нижеследующих разделах приведены общие сведения о трансформации грибов, дрожжей и растений.
Трансформированные грибы
Организмом-хозяином могут быть грибы, в частности нитевидные грибы. Примеры подобных приемлемых хозяев включают любые организмы, относящиеся к родам Thermomyces, Acremonium, Aspergillus, Penicilliun, Mucor, Neurospora, Triсhoderma и тому подобным.
Трансформация нитевидных грибов описана в заявке на патент США № 5741665, в которой указано, что стандартные методы трансформации нитевидных грибов и культивирования грибов хорошо известны в данной области. Всесторонний обзор методов, применяемых для трансформации N. crassa, представлен в публикации Davis and de Serres, Methods Enzymol (1971) 17A: 79-143.
Трансформация нитевидных грибов далее описана в заявке на патент США № 5674707.
В соответствии с одним объектом изобретения организм-хозяин может относится к роду Aspergillus, такому как Aspergillus niger.
Трансгенный организм-хозяин Aspergillus по настоящему изобретению можно также получить в соответствии с описанием, приведенным, например, в публикации Turner G. 1994 (Vectors for genetic manipulation. In: Martinelli S.D., Kinghorn J.R. (Editors) Aspergillus: 50 years on. Progress in industrial microbiology vol 29. Elsevier Amsterdam 1994, стр. 641-666).
Экспрессия гена в нитевидных грибах описана в публикации Punt et al. (2002) Trends Biotechnol 2002 May; 20(5):200-6, Archer & Peberdy Crit Rev Biotechnol (1997) 17(4):273-306.
Трансформированные дрожжи
В другом варианте осуществления изобретения трансгенным организмом могут быть дрожжи.
Принципы экспрессии гетерологичного гена в дрожжах рассмотрены, например, в публикациях Methods Mol Biol (1995), 49:341-54 и Curr Opin Biotechnol (1997) Oct; 8(5):554-60.
В этой связи дрожжи, в частности виды Saccharomyces cerevisi или Pichia pastoris (см. FEMS Microbiol Rev (2000 24(1):45-66), можно использовать в качестве организма для экспрессии гетерологичного гена.
Принципы экспрессии гетерологичного гена в Saccharomyces cerevisiae и секреции генных продуктов описаны в публикации E. Hinchcliffe E Kenny (1993, “Yeast as a vehicle for the expression of heterologous genes”, Yeasts, Vol 5, Anthony H. Rose and J. Stuart Harrison, eds, 2nd edition, Academic Press Ltd.).
Были разработаны несколько методов трансформации дрожжей. Например, трансгенные дрожжи Saccharomyces по настоящему изобретению можно получить в соответствии с описанием, приведенным в публикациях Hinnen et al., (1978, Proceedings of the National Academy of Sciences of the USA 75, 1929); Beggs, J.D. (1978, Nature, London, 275, 104); и Ito, H. et al. (1983, J. Bacteriology 153, 163-168).
Приемлемый дрожжевой организм-хозяин можно выбрать из пригодных в биотехнологическом отношении видов дрожжей, которые включают, не ограничиваясь ими, виды Pichia sp., Hansenula sp. или Kluyveromyces, Yarrowinia, вид Saccharomyces, включающий Saccharomyces cerevisiae, или вид, относящийся к Schizosaccharomyce, такой как, например, S. pombe.
В качестве организма-хозяина можно использовать штамм метилотрофных дрожжей вида Pichia pastoris.
В одном варианте осуществления изобретения организмом-хозяином является вид Hansenula, такой как Hansenula polymorpha (описанный в заявке WO 01/38544).
Трансформированные дрожжевые клетки можно отобрать при помощи разных селектируемых маркеров, таких как ауксотрофные маркеры, являющиеся главными маркерами устойчивости к антибиотикам.
Трансформированные растения/растительные клетки
Организмом-хозяином, пригодным для использования в настоящем изобретении, может быть растение. С обзором общих методов можно ознакомиться в статьях Potrykus (Annu Rev Plant Physiol Plant Mol Biol [1991] 42:205-225) и Christou (Agro-Food-Industry Hi-Tech March/April 1994 17-27) или в заявке WO 01/16308. Трансгенное растение может продуцировать сложные эфиры фитостерола и сложные эфиры фитостанола в больших количествах.
Поэтому настоящее изобретение относится также к способу получения трансгенного растения с повышенными уровнями продуцирования сложных эфиров фитостерола и сложных эфиров фитостанола, который включает стадии трансформации растительной клетки описанной здесь липидацилтрансферазой (в частности, экспрессирующим вектором или конструкцией, содержащей липидацилтрансферазу), и выращивания растения из трансформированной растительной клетки.
Секреция
Часто желательно секретировать полипептид из экспрессирующего хозяина в культуральную среду, из которой фермент гораздо легче удалить. В соответствии с настоящим изобретением секретирующую лидерную последовательность можно выбрать в зависимости от требуемого экспрессирующего хозяина. В контексте настоящего изобретения можно также использовать гибридные сигнальные последовательности.
Типичными примерами гетерологичных секретирующих лидерных последовательностей являются последовательности, полученные из гена амилоглюкозидазы (AG) грибов (glaA - варианты, содержащие 18 и 24 аминокислоты, выделенные, например, из вида Aspergillus), гена а-фактора (дрожжи, например, Saccharomyces, Kluyveromyces и Hansenula) или гена α-амилазы (Bacillus).
Обнаружение
В данной области имеется ряд методов обнаружения и измерения экспрессии аминокислотной последовательности. Примеры включают твердофазный иммуноферментный анализ (ELISA) радиоиммуноанализ (RIA) и клеточный сортинг с возбуждением флуоресценции (FACS).
Специалистам в данной области должен быть известен целый ряд меток и методов конъюгации, которые могут быть использованы в разных анализах нуклеиных кислот и аминокислот.
Ряд компаний, таких как Pharmacia Biotech (Piscataway, NJ), Promega (Madison, WI) и US Biochemical Corp (Cleveland, OH) поставляют коммерческие наборы и инструкции по осуществлению указанных методов.
Приемлемые репортерные молекулы или метки включают радиоактивные изотопы, ферменты, флуоресцентные, хемилюминесцентные или хромогенные агенты, а также субстраты, кофакторы, ингибиторы, магнитные частицы и тому подобные. Патенты, в которых описано использование таких меток, включают US-A-3817837, US-A-3850752, US-A-3939350, US-A-3996345, US-A-4277437, US-A-4275149 и US-A-4366241.
Кроме того, могут быть получены рекомбинантные иммуноглобулины в соответствии с описанием, приведенным в патенте US-A-4816567.
Слитые белки
Полипептид, обладающий описанными здесь специфическими свойствами, может быть получен в виде слитого белка, например, для облегчения экстракции и очистки указанного полипептида. Примеры партнеров, образующих слитый белок, включают глутатион-S-трансферазу (GST), 6xHis, GAL4 (домены связывания ДНК и/или активации транскрипции) и β-галактозидазу. Кроме того, весьма удобно вводить протеолитический сайт расщепления между партнером слитого белка и представляющей интерес белковой последовательностью, что позволяет удалять последовательности слитого белка. Слитый белок предпочтительно не подавляет активность белковой последовательности.
Системы экспрессии слитого белка гена в E. coli описаны в публикации Curr. Opin. Biotechnol. (1995) 6(5):501-6.
В другом варианте осуществления изобретения аминокислотная последовательность полипептида, обладающего описанными здесь специфическими свойствами, может быть лигирована с гетерологичной последовательностью для кодирования слитого белка. Например, для скрининга пептидных библиотек с целью выявления агентов, способных воздействовать на активность вещества, может быть полезно кодировать химерное вещество, экспрессирующее гетерологичный эпитоп, узнаваемый коммерчески доступным антителом.
Далее настоящее изобретение будет описано на примере его осуществления со ссылкой на нижеследующие фигуры и примеры.
На фигуре 1 показана согласованная последовательность pfam00657 из базы данных, версия 6 (SEQ ID NO:1).
На фигуре 2 показана аминокислотная последовательность (SEQ ID NO:2), полученная из организма Aeromonas hydrophila (P10480; GI:121051).
На фигуре 3 показана аминокислотная последовательность (SEQ ID NO:3), полученная из организма Aeromonas salmonicida (AAG098404; GI:9964017).
На фигуре 4 показана аминокислотная последовательностьи (SEQ ID NO:4), полученная из организма Streptomyces coelicolor A3(2) (номер доступа в банке генов Genbank NP_631558).
На фигуре 5 показана аминокислотная последовательность (SEQ ID NO:5), полученная из организма Streptomyces coelicolor A3(2) (номер доступа в банке генов Genbank CAC42140).
На фигуре 6 показана аминокислотная последовательность (SEQ ID NO:6), полученная из организма Saccharomyces cerevisiae (номер доступа в банке генов Genbank P41734).
На фигуре 7 показано сравнение выбранных последовательностей с согласованной последовательностью pfam00657.
На фигуре 8 показано попарное сравнение SEQ ID NO:3 с SEQ ID NO:2, свидетельствующее о 93% идентичности аминокислотных последовательностей. Сигнальная последовательность подчеркнута. Символ “+” означает различия. Фрагмент GDSX, содержащий активный сайт серина 16 и активные сайты аспарагиновой кислоты 116 и гистидина 291, выделен (см. затемненные области). Числа после аминокислоты означают длину аминокислоты без сигнальной последовательности.
На фигуре 9 показана нуклеотидная последовательность (SEQ ID NO:7), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Aeromonas hydrophila.
На фигуре 10 показана нуклеотидная последовательность (SEQ ID NO:8), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Aeromonas salmonicida.
На фигуре 11 показана нуклеотидная последовательность (SEQ ID NO:9), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Streptomyces coelicolor A3(2) (номер доступа в банке генов Genbank NC_003888.1:8327480..8328367).
На фигуре 12 показана нуклеотидная последовательность (SEQ ID NO:10), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Streptomyces coelicolor A3(2) (номер доступа в банке генов Genbank AL939131.1:265480..266367).
На фигуре 13 показана нуклеотидная последовательность (SEQ ID NO:11), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Saccharomyces cerevisiae (номер доступа в банке генов Genbank Z75034).
На фигуре 14 показана аминокислотная последовательность (SEQ ID NO:12), полученная из организма Ralstonia (номер доступа в банке генов Genbank AL646052).
На фигуре 15 показана нуклеотидная последовательность (SEQ ID NO:13), кодирующая липидацилтрансферазу по настоящему изобретению, полученную из организма Ralstonia.
На фигуре 16 показана SEQ ID NO:20. Белок Scoe1 NCBI c кодом доступа CAB39707.1. GI:4539178 определяет консервативный гипотетический белок [Streptomyces coelicolor A3(2)].
На фигуре 17 показана нуклеотидная последовательность, представленная SEQ ID NO:21, кодирующая белок NCBI с кодом доступа САВ39707.1. GI:4539178 определяет консервативный гипотетический белок [Streptomyces coelicolor A3(2)].
На фигуре 18 показана аминокислотная последовательность, представленная SEQ ID NO:22, кодирущая белок Scoe2 NCBI с кодом доступа CAC01477.1. GI:9716139 определяет консервативный гипотетический белок [Streptomyces coelicolor A3(2)].
На фигуре 19 показана нуклеотидная последовательность, представленная SEQ ID NO:23, кодирующая белок Scoe2 NCBI с кодом доступа САС01477.1. GI:9716139 определяет консервативный гипотетический белок [Streptomyces coelicolor A3(2)].
На фигуре 20 показана аминокислотная последовательность (SEQ ID NO:24). Белок Scoe3 NCBI с кодом доступа САВ88833.1. GI:7635996 определяет предполагаемый секретированный белок [Streptomyces coelicolor A3(2)].
На фигуре 21 показана нуклеотидная последовательность, представленная SEQ ID NO:25, кодирующая белок Scoe3 NCBI с кодом доступа САВ88833.1. GI:7635996 определяет предполагаемый секретированный белок. [Streptomyces coelicolor A3(2)].
На фигуре 22 показана аминокислотная последовательность (SEQ ID NO:26). Белок Scoe4 NCBI с кодом доступа САВ89450.1. GI:7672261 определяет предполагаемый секретированный белок. [Streptomyces coelicolor A3(2)].
На фигуре 23 показана нуклеотидная последовательность, представленная SEQ ID NO:27, кодирующая белок Scoe4 NCBI с кодом доступа САВ89450.1. GI:7672261 определяет предполагаемый секретированный белок [Streptomyces coelicolor A3(2)].
На фигуре 24 показана аминокислотная последовательность (SEQ ID NO:28). Белок Scoe5 NCBI с кодом доступа САВ62724.1. GI:6562793 определяет предполагаемый липопротеин [Streptomyces coelicolor A3(2)].
На фигуре 25 показана нуклеотидная последовательность, представленная SEQ ID NO:29, кодирующая белок Scoe5 NCBI с кодом доступа САВ62724.1. GI:6562793 определяет предполагаемый липопротеин [Streptomyces coelicolor A3(2)].
На фигуре 26 показана аминокислотная последовательность (SEQ ID NO:30. Белок Srim1 NCBI с кодом доступа ААК84028.1. GI:15082088 определяет GDSL-липазу [Streptomyces rimosus].
На фигуре 27 показана нуклеотидная последовательность, представленная SEQ ID NO:31, кодирующая белок Srim1 NCBI с кодом доступа ААК84028.1. GI:15082088 определяет GDSL-липазу [Streptomyces rimosus].
На фигуре 28 показана аминокислотная последовательность (SEQ ID NO:32) липидацилтрансферазы из Aeromonas hydrophila (ATCC № 7965).
На фигуре 29 показана нуклеотидная последовательность (SEQ ID NO:33), кодирующая липидацилтрансферазу из Aeromonas hydrophila (ATCC № 7965).
На фигуре 30 показана аминокислотная последовательность (SEQ ID NO:34) липидацилтрансферазы из Aeromonas salmonicida, подвид Salmonicida (ATCC № 14174).
На фигуре 31 показана нуклеотидная последовательность (SEQ ID NO:35), кодирующая липидацилтрансферазу из Aeromonas salmonicida, подвид Salmonicida (ATCC № 14174).
На фигуре 32 показано, что гомологи генов Aeromonas можно идентифицировать при помощи базовой локальной поисковой службы сравнения в Национальном центре биотехнологической информации, NIH, MD, USA, и баз данных полных геномов. Для поиска в базе данных был использован фрагмент GDSX, при этом был идентифицирован ряд последовательностей/генов, потенциально кодирующих ферменты с липолитической активностью. Были идентифицированы гены из рода Streptomyces, Xanthomonas и Ralstonia. В качестве примера ген Ralstonia solanacearum сравнивали с геном Aeromonas salmonicida (satA). Попарное сравнение показало наличие 23% идентичности. Активный сайт серина находится у аминоконца, при этом можно идентифицировать каталитические остатки гистидина и аспарагиновой кислоты.
На фигуре 33 показана согласованная последовательность Pfam00657.11 [семейство 00657, база данных, вариант 11] (далее именуемая согласованной последовательностью Pfam) и сравнение разных последовательностей с согласованной последовательностью Pfam. Стрелками показаны остатки активного сайта, подчеркнутыми рамками обозначены три области гомологии, описанные в публикации [Upton C. and Buckley J.T. (1995) Trends Biochem Sci 20; 179-179]. Заглавными буквами в согласованной последовательности Pfam обозначены консервативные остатки во многих членах семейства. Символ “-“ означает положение, в котором при помощи модели скрытых профилей Маркова согласованной последовательности Pfam предполагалось обнаружить остаток, который в данном положении отсутствовал, поэтому был введен пробел. Символ “.” означает остаток, не имеющий соответствующего остатка в согласованной последовательности Pfam. Указанные последовательности являются аминокислотными последовательностями, показанными на фигурах 16, 18, 20, 22, 24, 26, 28 и 30.
На фигуре 34 показана согласованная последовательность Pfam00657.11 [семейство 00657, база данных, версия 11] (далее именуемая согласованной последовательностью Pfam) и сравнение разных последовательностей с согласованной последовательностью Pfam. Стрелками показаны остатки активного сайта, подчеркнутыми рамками обозначены три области гомологии, описанные в публикации [Upton C. and Buckley J.T. (1995) Trends Biochem Sci 20; 179-179]. Заглавными буквами в согласованной последовательности Pfam обозначены консервативные остатки во многих членах семейства. Символ “-“ означает положение, в котором при помощи модели скрытых профилей Маркова согласованной последовательности Pfam предполагалось обнаружить остаток, который в данном положении отсутствовал, поэтому был введен пробел. Символ “.” означает остаток, не имеющий соответствующего остатка в согласованной последовательности Pfam. Указанные последовательности являются аминокислотными последовательностями, показанными на фигурах 2, 16, 18, 20, 26, 28 и 30. Было установлено, что все указанные белки являются активными в отношении липидных субстратов.
На фигуре 35 показан экспрессирующий вектор pet12-AsalGCAT=pSM, содержащий С-концевой His-меченный ген липидацилтрансферазы Aeromonas salmonicida.
На фигуре 36 приведены результаты исследования клеточных экстрактов при помощи анализа с использованием набора NEFA, которые свидетельствуют об активности рекомбинантной липидацилтрансферазы A. salmonicida в отношениии лицитина.
В лунках слева направо расположены: положительный контрольный образец, отрицательный контрольный образец (то есть экстракты из пустой плазмиды) и образцы, собранные после культивирования в течение 0, 1, 2 и 3 часов после индукции IPTG.
На фигуре 37 приведены результаты оптимизации роста клеток BL21(DE3)pLysS, содержащих экспрессирующий вектор pet12-AsalGCAT=pSM, которые показывают, что культивирование при 30°С позволяет получить фермент с высокой активностью в отношении лецитина. Клеточные экстракты исследовали на наличие фосфолипазной активности, выполняя анализ с использованием набора NEFA. В лунках слева направо расположены: положительный контрольный образец, отрицательный контрольный образец, 20°С, 30°С.
На фигуре 38 показаны неочищенные клеточные экстракты из клеток BL21(DE3)pLysS, экспрессирующие активную липидацилтрансферазу, инкубируемую с лецитиновым субстратом, при этом реакционную смесь анализировали тонкослойной хроматографией, результаты которой свидетельствовали о наличии продуктов разложения. Ряды: 1. Отсутствие фермента; 2. +А.sal-10мкл, 37°С; 3. +А.sal-20мкл, 37°С; 4. +А.sal-10мкл, 24°С; 5. +А.sal-20мкм, 24°С.
На фигуре 39 приведены результаты частичной очистки ацилтрансферазы Aeromonas salmonicida, свидетельствующие о наличии фосфолипазной активности в отношении очищенного His-меченного белка. SE=экстракты, обработанные ультразвуком, His=очищенный при помощи набора для центрифугирования Ni-NTA компании Qiagen.
На фигуре 40 показан экспрессирующий вектор pet12-A.h. GCAT=pSMa, содержащий С-концевой His-меченный ген глицеролипидацилтрансферазы (GCAT) Aeromonas hydrophila, который был использован для трансформации штамма E.coli BL21(DE3)pLysS.
На фигуре 41 приведены результаты активности неочищенных экстрактов (5 и 10 мкл), содержащих рекомбинантный фермент GCAT Aeromonas hydrophila, которые исследовали в отношении лецитина с использованием набора неэтерифицированных жирных кислот (NEFA) (Roche, Switzerland); полученные результаты свидетельствуют о наличии фермента с активностью в отношении фосфолипида, лецитина.
На фигуре 42 приведены результаты оптимизации роста клеток BL21(DE3)pLysS, содержащих экспрессирующий вектор pet12-AsalGCAT=pSM, которые показывают, что культивирование при 30°С позволяет получить фермент с высокой активностью в отношении лецитина. Клекточные экстракты анализировали в отношении активности фосфолипазы с использованием набора NEFA.
На фигуре 43 приведены результаты частичной очистки ацилтрансфераз Aeromonas hydrophila и A. salmonicida, свидетельствующие о наличии фосфолипазной активности в отношении очищенного His-меченного белка. SE=экстракты, обработанные ультразвуком, His=очищенный при помощи набора для центрифугирования Ni-NTA компании Qiagen.
На фигуре 44 приведены результаты экспрессии генов Aeromonas в Bacillus subtilis 163, свидетельствующие о продуцировании секретированного фермента с активностью в отношении лецитина и DGDG. pUB-AH=конструкция, содержащая ген A. hydrophila, и pUB-AS=конструкция, содержащая ген A. salmonicida. Фильтрат культуры инкубировали с субстратами в течение 60 минут.
На фигуре 45 и фигуре 46 приведены графики, показывающие воздействие жирной кислоты и сложного эфира холестерина в зависимости от времени. Указанные графики отображают результаты, полученные при выполнении анализа методом ГЖХ в процессе измерения ацилтрансферазной активности в пищевом продукте с использованием лецитина и холестерина в буфере, используемом в качестве субстрата.
На фигуре 47 показана аминокислотная последовательность (SEQ ID NO:36) слитой конструкции, используемой для мутагенеза гена липидацилтрансферазы Aeromonas hysrophila в примере 17. Подчеркнутые аминокислоты образуют сигнальный пептид ксиланазы.
На фигуре 48 показана нуклеотидная последовательность (SEQ ID NO:54), кодирующая фермент из Aeromonas hydrophila, включая сигнальный пептид ксиланазы.
На фигуре 49 показана структура конденсатов жирной кислоты белка аминокислот.
На фигуре 50 показана схема взаимодействия жирной кислоты, выделенной из фосфатидилхолина, при переносе в свободную гидроксильную группу аминокислот, содержащих свободную гидроксильную группу, пригодную для этерификации, например тирозин или серин.
На фигуре 51 показана схема взаимодействия DGDG и глюкозы, катализируемого липидацилтрансферазой.
Примеры
Пример 1. Клонирование, секвенирование и гетерологичная экспрессия трансферазы из Aeromonas salmonicida, подвид Salmonicida
Используемые штаммы
Aeromonas salmonicida, подвид Salmonicida (АТСС 14174), полученный из Американской коллекции типовых культур (АТСС), выращивали в течение ночи при 30°С на среде Лурия-Бертани (LB). Клетки центрифугировали и геномную ДНК выделяли методами, применяемыми для выделения геномной ДНК, компании Qiagen Ltd. Буфер для геномной ДНК (№ по каталогу 19060), протеаза К (№ по каталогу 19131) и РНКаза А (№ по каталогу 19101) были приобретены в компании Qiagen Ltd. (Boundary court Gatwick Court, West Sussex, RH10 2AX).
Бактериальный штамм-хозяин BL21(DE3)pLysS (Novagen) использовали для продуцирования рекомбинантных ферментов Aeromonas. Компетентные клетки BL21(DE3)pLysS использовали в качестве хозяина для трансформации экспрессирующим вектором pet12-AsalGCAT=pSM. Трансформанты, содержащие соответствующую плазмиду, выращивали при 37°С на агаровой среде LB, содержащей 100 мкг ампициллина/мл.
Создание экспрессирующего вектора pet12-AsalGCAT-pSM
Геномную ДНК (0,2-1 мкл) использовали в качестве матрицы для амплификации ДНК генов трансферазы из Aeromonas и ДНК-полимеразу pfu (2,5 ед.) использовали с 10 мкл 10-кратного буфера для pfu, 1 мкл каждой затравки (50 пМоль/мкл), 200 мкМ dNTP в общем объеме реакционной смеси, равном 100 мкл. Реакции PCR выполняли в программируемом термоблоке в нижеследующих условиях: при 95°С в течение 30 секунд, 30 циклов при 95°С в течение 30 секунд, при 60°С в течение 1 минуты и при 68°С в течение 2 минут. Производили дополнительное удлинение цепи при 72°С в течение 5 минут.
Ген трансферазы из A. salmonicida амплифицировали методом PCR, выполняя 2 отдельные реакции PCR. Первую реакцию PCR выполняли, используя две затравки, 1USNEW(5'AGCATATGAAAA AATGGTTTGT TTGTTTATTG GGG3' [SEQ ID NO:36] и asls950new (5' GTG ATG GTG GGC GAG GAA CTC GTA CTG3' [SEQ ID NO:37]. Вторую реакцию РCR выполняли для введения С-концевой гистидиновой метки, используя продукт PCR, полученный в результате выполнения первой реакции, и затравки: 1USNEW (5'AGCATATGAAAA AATGGTTTGT TTGTTTATTG GGG 3' [SEQ ID NO:38] и AHLS1001 (5'TTGGATCC GAATTCAT CAATG GTG ATG GTG ATG GTG GGC3' [SEQ ID NO:39]). Продукт PCR, полученный в результате выполнения второй реакции, очищали и расщепляли рестрикционными ферментами Ndel и BamHI. 2 мкг ДНК вектора рЕТ 12а также расщепляли рестрикционными ферментами Ndel и BamHI и обрабатывали фосфатазой. Обработанный рестрикционным ферментом вектор pet12a и продукт РCR, полученный в результате выполнения второй реакции, очищали и лигировали, используя набор для экспресс-лигирования (Roche, Switzerland). Лигированную смесь использовали для трансформации клеток ТОР10 E.coli. Трансформанты культивировали на агаровой среде LB, содержащей 100 мкг/мл ампициллина.
Промоторную затравку Т7 (5'TAATACGACTCACTATAG3' [SEQ ID NO:40]) и терминаторную затравку Т7 (5'CTAGTTATTGCTCAGCGG3' [SEQ ID NO:41]) использовали для проверки последовательностей и ориентации клонированных генов трансферазы в векторе pET12a. ДНК секвенировали при помощи набора для секвенирования ABI Prism® BigDye™ Terminators Cycle, используя 500 нг плазмидной ДНК в качестве матрицы и 3,2 пМоль промоторных и терминаторных затравок Т7.
Конструкцию, показанную на фигуре 35, использовали для трансформации компетентного бактериального штамма-хозяина BL21(DE3)pLysS (Novagen), после чего устойчивые к ампициллину трансформанты собирали и использовали для анализа экспрессии.
Экспрессия рекомбинантной липидацилтрансферазы из Aeromonas salmonicida
Активность фермента в отношении лецитина определяли количественным методом на клеточных экстрактах, используя набор неэтерифицированных жирных кислот (NEFA) (Roche, Switzerland).
Как показано на фигуре 36, клетки BL21(DE3)pLysS, содержащие экспрессирующий вектор pet12-AsalGCAT=pSM, выращивали на среде LB с 100 мкг/мл ампициллина и инкубировали, встряхивая, при 37°С до достижения оптической плотности OD600=0,6-1,0. Затем культуры индуцировали, используя IPTG (0,4 мМ), и продолжали инкубировать в течение следующих 3 часов. Образцы отбирали через 0, 1, 2 и 3 часа после индукции IPTG. Активность фермента исследовали, используя набор NEFA и лецитин в качестве субстрата.
Оптимизация роста для получения более активных ферментов
Клетки BL21(DE3)pLysS, содержащие экспрессирующий вектор pet12-AsalGCAT=pSM, выращивали на среде LB с 100 мкг/мл ампициллина и инкубировали, встряхивая, при разных температурах выращивания (37°С, 30°С и 20°С). Оптимальные условия для продуцирования активного фермента липидацилтрансферазы соответствовали выращиванию культур при 30°С, как показано на фигуре 37.
Частичная очистки рекомбинантной трансферазы из Aeromonas salmonicida
Штамм клеток BL21(DE3)pLysS, содержащих экспрессирующий вектор pet12-AsalGCAT=рSM, выращивали при 37°С и неочищенные клеточные экстракты получали, производя обработку ультразвуком. Рекомбинантный фермент затем очищали от обработанных ультразвуком неочищенных клеточных экстрактов при помощи набора для центрифугирования Ni-NTA компании Qiagen. Активность фосфолипазы определяли, используя набор NЕFA и лецитин в качестве субстрата. Неочищенные клеточные экстракты из клеток BL21(DE3)pLysS, экспрессирующих активную трансферазу, инкубировали с лецитином, используемым в качестве субстрата, и реакционную смесь анализировали тонкослойной хроматографией, результаты которой свидетельствовали о наличии продуктов разложения (см. фигуру 38).
Частичная очистка рекомбинантной трансферазы из Aeromonas salmonicidaе
Штамм клеток BL21(DE3)pLysS, содержащих экспрессирующий вектор pet12-AsalGCAT=pSM, выращивали при 37°С и неочищенные клеточные экстракты получали, производя обработку ультразвуком. Рекомбинантный фермент затем очищали от обработанного ультразвуком неочищенного клеточного экстракта, используя набор для центрифугирования Ni-NTA компании Qiagen. Активность фосфолипазы определяли, используя набор NEFA и лецитин в качестве субстрата (см. фигуру 39).
Пример 2. Клонирование и экспрессия трансферазы из Aeromonas hydrophila в E.coli
Aeromonas hydrophila (АТСС № 7965), полученный из Американской коллекции типовых культур, выращивали в течение ночи при 30°С на среде Лурия-Бертани (LB). Клетки центрифугировали и выделяли геномную ДНК методами выделения геномной ДНК компании Qiagen Ltd. Буфер для геномной ДНК( № по каталогу 19060), протеаза К (№ по каталогу 19131) и РНКаза А (№ по каталогу 19101) были приобретены в компании Quigen Ltd. (Boundary court Gatwick Court, West Sussex, RH10 2AX).
Бактериальный штамм-хозяин BL21(DE3)pLysS (Novagen) использовали для продуцирования рекомбинантных ферментов Aeromonas. Компетентные клетки BL21(DE3)pLysS использовали в качестве хозяина для трансформации экспрессирующим вектором pet12-A.h.GCAT=pSMа. Трансформанты, содержащие соответствующую плазмиду, выращивали при 37°С на агаровой среде LB, содержащей 100 мкг ампициллина/мл.
Создание экспрессирующего вектора pet12a-A.h.GCAT-pSMa
Геномную ДНК (0,2-1 мкл) использовали в качестве матрицы для амплификации ДНК гена трансферазы из Aeromonas и ДНК-полимеразу pfu (2,5 ед.) использовали с 10 мкл 10-кратного буфера для pfu, 1 мкл каждой затравки (50 пМоль/мкл), 200 мкМ dNTP в общем объеме реакционной смеси, равном 100 мкл. Реакции PCR выполняли в программируемом термоблоке в нижеследующих условиях: при 95°С в течение 30 секунд, 30 циклов при 95°С в течение 30 секунд, при 60°С в течение 1 минуты и при 68°С в течение 2 минут. Производили дополнительное удлинение цепи при 72°С в течение 5 минут.
Ген трансферазы из A. hydrophila (АТСС № 7965) амплифицировали методом PCR, выполняя две отдельные реакции PCR.
Первую реакцию PCR выполняли, используя две затравки, AHUS1 (5'GTCATATGAAAAAATGGTTTGTGTGTTTATTGGGATTGGTC 3', SEQ ID NO:42) и ahls950 (5'ATGGTGATGGTGGGCGAGGAACTCGTACTG 3', SEQ ID NO:43).
Вторую реакцию PCR выполняли для введения С-концевой гистидиновой метки, используя продукт PCR, полученный в результате выполнения первой реакции, и две затравки:
AHUS1(5'GTCATATGAAAAAATGGTTTGTGTGTTTATTGGGATTGGTC3', SEQ ID NO:44) и AHLS1001 (5'TTGGATCCGAATTCATCAATGGTGATGGTGATGGTGGGC3', SEQ ID NO:45).
Продукт PCR, полученный в результате выполнения второй реакции, очищали и расщепляли рестрикционными ферментами Ndel и BamHI. 2 мкг ДНК вектора рЕТ12а также расщепляли рестрикционными ферментами Ndel и BamHI и обрабатывали фосфатазой. Обработанный рестрикционным ферментом вектор pet12a и продукт РCR, полученный в результате выполнения второй реакции, очищали и лигировали, используя набор для экспресс-лигирования (Roche, Switzerland). Лигированную смесь использовали для трансформации клеток ТОР10 E.coli. Трансформанты культивировали на агаровой среде LB, содержащей 100 мкг/мл ампициллина.
Промоторную затравку Т7 (5'TAATACGACTCACTATAG3') и терминаторную затравку Т7 (5'CTAGTTATTGCTCAGCGG3') использовали для проверки последовательностей и ориентации клонированных генов GCAT в векторе pET12a. ДНК секвенировали при помощи набора для секвенирования ABI Prism® BigDye™ Terminators Cycle, используя 500 нг плазмидной ДНК в качестве матрицы и 3,2 пМоль промоторных и терминаторных затравок Т7.
Конструкцию, показанную на фигуре 40, использовали для трансформации компетентного бактериального штамма-хозяина BL21(DE3)pLysS (Novagen), после чего устойчивые к ампициллину трансформанты собирали и использовали для анализа экспрессии.
Экспрессия трансферазы из Aeromonas hydrophila в клетках BL21(DE3)pLysS
Штамм клеток BL21(DE3)pLysS E.coli, содержащих экспрессирующий вектор pet12а-A.h.GCAT=pSMа, выращивали на среде LB с 100 мкг/мл ампициллина и инкубировали, встряхивая, при 37°С до достижения оптической плотности OD600=0,6-1,0. Затем культуры индуцировали, используя IPTG (0,4 мМ), и продолжали инкубировать в течение следующих 3 часов. Образцы отбирали через 0, 1, 2 и 3 часа после индукции IPTG. Активность фермента исследовали, используя набор NEFA и лецитин в качестве субстрата (фигура 41).
Оптимизация роста для получения более активных ферментов
Клетки BL21(DE3)pLysS, содержащие экспрессирующий вектор pet12а-A.h.GCAT=pSMа, выращивали на среде LB с 100 мкг/мл ампициллина и инкубировали, встряхивая, при разных температурах выращивания (37°С, 30°С и 20°С). Оптимальные условия для продуцирования активного фермента GCAT соответствовали выращиванию культур при 30°С, как показано на фигуре 42.
Частичная очистки рекомбинантной трансферазы из A.hydrophila (GCAT)
Штамм клеток BL21(DE3)pLysS, содержащих экспрессирующий вектор pet12а-A.h.GCAT=рSMа, выращивали при 37°С и неочищенные клеточные экстракты получали, производя обработку ультразвуком. Рекомбинантный фермент затем очищали от обработанных ультразвуком неочищенных клеточных экстрактов при помощи набора для центрифугирования Ni-NTA компании Qiagen. Активность фосфолипазы анализировали, используя набор NEFA и лецитин в качестве субстрата. (фигура 43).
Пример 3. Экспрессия трансфераз из Aeromonas в Bacillus subtilis 163
Создание плазмиды
Для гетерологичной экспрессии генов Aeromonas в Bacillus subtilis использовали два разных экспрессирующих вектора Bacillus subtilis (pUB110 и рВЕ5). Вектор pUB110 содержит альфа-амилазный промотор, в то время как вектор рВЕ содержит промотор Р32 в виде регуляторной области для экспрессии слитых генов Aeromonas. В векторе pUB110 первая аминокислота зрелых генов GCAT Aeromonas была слита в рамке считывания с последней аминокислотой последовательности сигнального пептида ксиланазы из Bacillus subtilis на сайте рестрикции Nhe1, создавая две дополнительные аминокислоты впереди зрелых белков. Вектор РВЕ5 содержит сигнальную последовательность cgtase, слитую на сайте Ncol для секреции рекомбинантных белков в фильтрат культуры.
Реакции РCR выполняли для слияния генов Aeromonas в рамке считывания с сигнальными последовательностями векторов pUB110 и рВЕ5. Реакции PCR выполняли, используя две нижеследующие затравки для гена A. hydrophila.
Первая реакция PCR: usAHncol (5'ATGCCATGGCCGACAGCCGTCCCGCC3', SEQ ID NO:46) и 1sAH (5'TTGGATCCGAATTCATCAATGGTGATG3', SEQ ID NO:47).
Вторая реакция PCR: US-AhnheI (5'TTGCTAGCGCCGACAGCCGTCCCGCC3', SEQ ID NO:48) и lsAH (5'TTGGATCCGAATTCATCAATGGTGATG3', SEQ ID NO:49).
Реакции PCR выполняли, используя две нижеследующие затравки для гена A. salmonicida.
Третья реакция PCR: US-Asncol (5'TTGCCATGGCCGACACTCGCCCCGCC3', SEQ ID NO:50) и lsAH (5'TTGGATCCGAATTCATCAATGGTGATG3', SEQ ID NO:51).
Четвертая реакция PCR: US-ASnhel (5'TTGCTAGCGCCGACACTCGCCCCGCC3', SEQ ID NO:52) и lsAH (5'TTGGATCCGAATTCATCAATGGTGATG3', SEQ ID NO:53).
Все продукты PCR клонировали по тупому концу II PCR (вектор ТОРО) и секвенировали с использованием нижней и верхней затравок для секвенирования.
Клоны, полученные в результате выполнения реакций PCR 1 и 3, разрезали Ncol и BamHI и использовали в качестве вставок для лигирования с вектором рВЕ5, разрезанным Ncol/BamHI/фосфатазой. Клоны, полученные в результате выполнения реакций РCR 2 и 4, разрезали Nhel и BamHI и использовали в качестве вставок для лигирования с вектором pUB, разрезанным Nhel/BamHl/фосфатазой.
Экспрессия генов трансферазы из Aeromonas в Bacillus subtilis и исследование ферментативной активности
Ацилтрансферазы, полученные из двух видов Aeromonas, были успешно экспрессированы в E.coli (результаты приведены выше). Слитые конструкции генов в векторах pUB110 и рВЕ5 Bacillus использовали для трансформации Bacillus subtilis и трансформанты отбирали, культивируя клетки на планшетах с канамицином. Устойчивые к канамицину трансформанты, выделенные и выращенные в 2-кратном объеме YT, способны гетерологично экспрессировать гены Aeromonas в Bacillus. Фильтраты культуры обладают галактолипазной активностью дигалактозилдиацилглицерина (DGDG) помимо ацилтрансферазной и фосфолипазной активностей. Активность в отношении дигалактозилдиацил-глицерина (DGDG) и активность в отношении лецитина измеряли после инкубации супернатанта культуры с субстратом DGDG из пшеничной муки (приобретенной в компании Sigma) в течение 60 минут, как показано на фигуре 44. Bacillus продуцировал фермент в виде секретированного белка при культивировании в культуральной среде в течение периода от 20-24 часов до 48 часов. В некоторых случаях было установлено, что экспрессия генов Aeromonas влияет на жизнеспособность и рост клеток в Вacillus и E.coli, поэтому необходимо тщательно отбирать экспрессирующие штаммы и оптимизировать условия роста для гарантии экспрессии. Например, несколько штаммов-хозяев Bacillus (B.s 163, DB104 и OS21) трансформировали экспрессирующими векторами для сравнения роста. Штамм B.s163 трансформируется двумя генами Aeromonas и способен экспрессировать активный белок. Штамм DB104 трансформируется всеми конструкциями, но способен экспрессировать только трансферазу из A. salmonicida.
Пример 4. Ферментация и очистка липидацилтрансфераз из Aeromonas, продуцированных в E.coli
Ферментация E.coli
Микроорганизмы
В данном исследовании были использованы два штамма Eschericia coli, один из которых содержал липидацилтрансферазу из Aeromonas hydrophila (пример 2) и второй содержал липидацилтрансферазы из Aeromonas salmonicida (пример 1).
Штамм E.coli, содержавший ген A. hydrophila, получил название DIDK0124, и штамм E.coli, содержавший ген A. salmonicida, получил название DIDK0125. Ферментация DIDK0124 получила название HYDRO0303, и ферментация DIDK0125 получила название SAL0302. Очищенный белок, полученный в результате HYDRO025, был назван REF#138. Очищенный белок, полученный в результате HYDRO0303, был назван REF#135.
Питательные среды и условия культивирования
Агаровая среда LB
Планшеты с агаровой средой LB, используемые для культивирования штаммов, содержали: 10 г/л триптона, 5 г/л дрожжевого экстракта, 5 г/л NaCl, 15 г/л агара, 100 мг/л ампициллина и 35 мг/л хлорамфеникола. Планшеты с агаровой средой инкубировали при 30°С.
Встряхиваемая колба со средой LB
Среда LB (50 мл в одной встряхиваемой колбе), используемая для продуцирования инокулята для культивирования в биореакторе, содержала: 10 г/л триптона, 5 г/л дрожжевого экстракта, 5 г/л NaCl, 100 мг/л ампициллина и 35 мг/л хлорамфеникола. Встряхиваемые колбы инокулировали культурой с планшетов с агаровой средой LB и инкубировали при 30°С и скорости вращения 200 оборотов/мин.
Культивирование в биореакторе
Для культивирования в биореакторе использовали биореакторы емкостью 6 л, созданные в собственной лаборатории, которые наполняли 4 л среды, содержащей: 10 г/л триптона, 5 г/л дрожжевого экстракта, 5 г/л NaCl, 8 г/л КН2РО4, 0,9 г/л MgSO4·7Н2О, 40 г/л моногидрата глюкозы, 0,4 мл/л ADD APT® Foamstop Sin 260 (ADD APT Chemicals AG, Helmond, The Netherlands), 10 мг/л (NH4)2Fe(SO4)2·6H2O, 0,7 мг/л CuSO4·5H2O, 3 мг/л ZnSO4·7H2O, 3 мг/л MnSO4·H2O, 10мг/л EDTA, 0,1 мг/л NiSO4·6H2O, 0,1 мг/л СоCl2, 0,1 мг/л Н3ВО4, 0,1 мг/л KI, 0,1 мг/л Na2MoO4·2H2O, 1 г/л ампициллина и 35 мг/л хлорамфеникола.
Биореакторы инокулировали культурой LB в количестве, гарантирующем окончание роста после культивирования в течение примерно через 20 часов (высчитано с учетом максимальной удельной скорости роста 0,6 час-1, OD600 в стряхиваемой колбе со средой LB и конечного значения OD600 в биореакторе примерно через 20 часов).
Ферментер SAL0302 инокулировали 10 мл культуры LB и ферментер HYDRO0303 инокулировали 4 мл культуры LB.
Биореакторы действовали в следующих условиях: температура 30°С, перемешивание со скоростью 800-1000 оборотов/мин (в зависимости от эксперимента), аэрация со скоростью 5 л/мин, рН 6,9, контрольное значение рН 8,75% (мас./об.) при добавлении смеси NH3-вода и 2М раствора H2SO4. Индукция достигалась путем добавления изопропил-β-D-тиогалактозида до конечной концентрации 0,6 мМ, при которой было продуцировано соответственно 0,4 моля (HUDRO0303) и 0,7 моль СО2.
Сбор биомассы
Сбор и гомогенизацию биомассы выполняли нижеследующим способом.
1) Ферментационный бульон, полученный в результате ферментаций, центрифугировали с ускорением 5000g при 4°С в течение 10 минут и удаляли супернатант. Биомассу хранили при -20°С до использования. Затем биомассу оттаивали и вторично суспендировали в 500 мл 20 мМ NaH2PO4, рН 7,4, 500 мМ NaCl, 10 мМ имидазола и полного ингибитора протеазы (без EDTA) (Roche, Germany).
2) Суспендированную биомассу гомогенизировали под давлением 2 кбар и 4°С в клеточном дезинтеграторе компании Constant Systems Ltd (Warwick, UK).
3) Клеточный дебрис удаляли центрифугированием с ускорением 10000g при 4°С в течение 30 минут, после чего собирали супернатант.
4) Супернатант очищали центрифугированием с ускорением 13700g при 4°С в течение 60 минут, после чего супернатант собирали.
5) Супернатант фильтровали через 0,2 мкм фильтры с вакуумной крышкой (Pall Life Science, UK) и фильтрат собирали для немедленного выполнения хроматографической очистки.
Хроматографическая очистка трансфераз
Колонку (2,5×10 см) заполняли 50 мл геля, представляющего собой хелатирующую сефарозу (Sapharose ff.), и вводили сульфат никеля (методом, описанным изготовителем, Amersham Biosciences). Колонку уравновешивали 200 мл 20 мМ
NaH2PO4, pH 7,4, 500 мМ NaCl, 10 мМ имидазола. В колонку вводили 400 мл неочищенной трансферазы со скоростью потока 5 мл/мин. Затем колонку промывали 20 мМ NaH2PO4, рН 7,4, 500 мМ NaCl, 10 мМ имидазола до тех пор, пока значение UV280 не достигало базового уровня. GCAT затем элюировали 40 мл 20 мМ NaH2PO4, рН 7,4, 500 мМ NaCl и 500 мМ имидазола.
Пример 5. Ферментация и очистка липидацилтрансфераз из Aeromonas, продуцированных в Bacillus subtilis
Ферментации
ВАС0318-19, ВАС0323-24
Микроорганизм
Микроорганизмы, использованные в данном исследовании, были получены в результаты трансформации штамма-хозяина Bacillus subtilis № 163 плазмидой, содержащей ген, кодирующий трансферазу Aeromonas salmonicida, который был введен в вектор pUB1210OIS. Экспрессия данного гена контролировалась альфа-амилазным промотором, и секреция трансферазы была опосредована сигнальной последовательностью ксиланазы B. subtilis (пример 3). Указанные штаммы получили названия DIDK0138 (ферментация ВАС0318-10) и DIDK0153 (ферментация ВАС0323-24).
Питательные среды и условия культивирования
Предкультуральная среда
Во встряхиваемую колбу (общий объем 500 мл с перегородками) добавляли 100 мл среды, содержащей:
Показатель рН доводили до 7,0 до обработки в автоклаве.
После обработки в автоклаве в каждую колбу добавляли 6 мл 50% (мас./мас.) нутриозы. Канамицин добавляли в концентрации 50 мг/л после обработки в автоклаве.
Инокуляция
Встряхиваемую колбу с предкультуральной средой инокулировали замороженной культурой непосредственно из 25% (мас./об.) исходного раствора в глицерине. Встряхиваемую колбу инкубировали при 33°С со скоростью вращения 175 оборотов/мин в течение примерно 16 часов, после чего 50 мл использовали для инокуляции ферментера.
Ферментации
Ферментации выполняли в ферментерах емкостью 6 л, изготовленных в собственной лаборатории.
Порция среды (3 л) содержала:
Подаваемая смесь содержала:
Подачу в процессе ферментации ВАС0318 и ВАС0323 начинали с учетом аккумулированного СО2, вычисляемого из нижеследующих уравнений:
Подача-поток [г/час]=0, АсСО2<0,15
Подача-поток [г/час]=2,85+t·1,54, АсСО2≥0,15 и t<12
Подача-поток [г/час]=21,3, t>12
t: время (часы) с момента достижения аккумулированным СО2 (АсСО2) 0,15 моль.
Подачу в процессе ферментации ВАС0319 и ВАС0324 начинали с учетом аккумулированного СО2, вычисляемого из нижеследующих уравнений:
Подача-поток [г/час]=0, АсСО2<0,15
Подача-поток [г/час]=2,0+t·1,08, АсСО2≥0,15 и t<12
Подача-поток [г/час]=15, t>12
t: время (часы) с момента достижения аккумулированным СО2 (АсСО2) 0,15 моль.
Показатель рН доводили до 7,0, добавляя 12,5% (мас./об.) смеси NH3-вода или 2М раствор фосфорной кислоты.
Аэрацию производили со скоростью 3 л/мин, соответствующей 1 vvm.
Температура была равна 33°С.
Ферментер был оснащен двумя импеллерами Rushton диаметром 8 см, расположенными на расстоянии 10 см.
Сбор биомассы
Биомассу удаляли центрифугированием с ускорением 16000g в течение 10 минут при комнатной температуре. Супернатант стерилизовали фильтрацией и фильтрат использовали для очистки и исследований возможностей применения.
Пример 6. “Анализ трансферазы в забуференном субстрате” с целью измерения ацилтрансферазной активности фермента
Липидацилтрансферазу выделяли из Aeromonas salmonicida и экспрессировали в Bacillus subtilis. Данный фермент очень эффективно переносит жирную кислоту из лецитина в холестерин в процессе образования сложных эфиров холестерина. Кроме того, было установлено, что данный фермент обладает некоторой гидролитической активностью, которая проявляется в образовании свободной жирной кислоты. Традиционные фосфолипазы (ЕС3.1.1.4 и ЕС3.1.1.32) обладают способностью гидролизовать лецитин в процессе образования свободных жирных кислот и лизолецитина, при этом не сообщалось о трансферазной реакции указанных ферментов.
В данном описании изобретения подробно рассмотрен анализ, позволяющий измерить трансферазную и гидролитическую активность ферментов и таким образом идентифицировать липидацилтрансферазы по настоящему изобретению; при выполнении данного анализа используют субстрат, содержащий лецитин и холестерин. В данной работе был использован субстрат на основе фосфатидилхолина и холестерина, диспергированный в буфере. Количественное определение продуктов реакции производили путем экстракции липидов из субстрата и последующего анализа липидных компонентов методом ГЖХ.
Способ измерения
Вещества
L-альфа-фосфатидилхолин 95% (растительный) Avanti № 441601
Холестерин: Sigma, № по каталогу С 8503
Холестерилпальмитат, Sigma C6072
Холестерилстеарат, Sigma C 3549
Буфер HEPES, Sigma, № по каталогу Н 3375
Хлороформ, аналитическая чистота
Ферменты
Очищенная GCAT из A. salmonicida № 178-9
Анализ методом ТСХ
Пластинки для тонкослойной хроматографии (ТСХ) активировали в термостате (110°С) в течение 1/2 часа.
В хроматографическую камеру с крышкой выливали 100 мл рабочего буфера. Стенки камеры покрывали фильтровальной бумагой (Whatman 2) для насыщения камеры парами растворителя.
Пластинки для ТСХ помещали в рамку и на пластинку для ТСХ наносили образец на расстоянии 2 см от основания. Затем пластинку для ТСХ помещали в камеру для ТСХ с рабочим буфером. Когда рабочий буфер достигал 14 см от основания пластинки, пластинку для ТСХ удаляли, сушили в вытяжном шкафу и затем помещали в термостат при 110°С на 10 минут.
Затем пластинку для ТСХ погружали в проявляющий реагент и сушили в термостате при 110°С в течение 15 минут.
Рабочий буфер
№ IV: хлороформ:метанол:Н2О (65:25:4)
№ I: петролейный эфир:МТВЕ:уксусная кислота (60:40:1)
Проявляющий буфер (ванадатный буфер)
32 г Na2CO3 и 300 мл Н2О (1М)
Добавляют 18,2 пентоксида ванадия (V2O5) и растворяют при осторожном нагревании.
Раствор охлаждают до комнатной температуры.
Осторожно добавляют 460 мл 2,5М раствора H2SO4 (460 мл Н2О + 61 мл H2SO4).
Воду добавляют до 1000 мл.
Анализ методом ГЖХ
Капиллярный газовый хроматограф Autosystem 9000 компании Perkin Elmer, оснащенный колонкой с кварцевым стеклом WCOT 12,5 м × внутренний диаметр 0,25 мм × толщина пленки 5% фенилметилсиликона 0,1 мкм (СР Sil 8 CB компании Chrompack).
Газ-носитель: гелий.
Инжектор: раздельное впрыскивание в холодном состоянии PSSI (начальная температура 50°С, повышаемая до 385°С), объем 1,0 мкл
Детектор FID: 395°С
Получение образца: 30 мг образца растворяли в 9 мл смеси гептан:пиридин (2:1), содержащей гептадекан (0,5 мг/мл), соответствующий внутреннему стандарту. 300 мкл раствора образца переносили в изогнутую пробирку, добавляли 300 мкл MSTFA (N-метил-N-триметилсилилтрифторацетамида) и осуществляли взаимодействие в течение 20 минут при 60°С.
Вычисление: коэффициенты реакции для монодитриглицеридов и свободной жирной кислоты определяли с использованием эталона 2 (монодитриглицерида). Коэффициенты реакции для холестерина, холестерилпальмитата и холестерилстеарата определяли с использованием чистых эталонных веществ.
Результаты: анализ трансферазы с использованием фосфатидилхолина и холестерина в качестве субстрата.
Трансферазную активность трансферазы испытывали в субстрате на основе фосфатидилхолина и холестерина нижеследующим методом.
450 мг фосфатидилхолина (>95% PC Avanti, № 441601) и 50 мг холестерина растворяли в хлороформе и упаривали досуха в вакууме. 300 мг смеси холестерин/фосфатидилхолин переносили в стакан Витона и добавляли 15 мл 50 мМ буфера HEPES, рН 7. Липид диспергировали в буфере при перемешивании.
Субстрат нагревали до 35°С, перемешивая магнитной мешалкой, и добавляли 0,25 мл раствора фермента. Данный субстрат представляет собой среду с очень высоким содержанием воды, равным примерно 95%.
Образцы, равные 2 мл, отбирали по истечении 0, 5, 10, 15, 25, 40 и 60 минут времени реакции. Сразу же добавляли 25 мкл 4М раствора HCl для подкисления свободной жирной кислоты и прекращали ферментативную реакцию. Добавляли 3,00 мл хлороформа и интенсивно встряхивали образец в вихревом шейкере в течение 30 секунд. Образец центрифугировали, отделяли 2 мл фазы хлороформа и фильтровали через 0,45 мкм фильтры в 10 мл градуированный стакан Драма. Хлороформ выпаривали в потоке азота при 60°С и образцы снова измеряли. Экстрагированный липид анализировали методом ГЖХ.
Результаты анализа методом ГЖХ приведены в таблице 1. Результаты выражены в %, высчитанных в расчете на экстрагированный липид. Количество жирной кислоты и сложного эфира холестерина, образованное в зависимости от времени, показано на фигуре 45. Исходя из фигуры 45 можно сделать вывод о том, ферментативная реакция не являются линейной в зависимости от времени, так как в начале реакции наблюдается сильная гидролитическая активность и трансферазная активность. Примерно через 10 минут и до истечения примерно 60 минут наблюдалась почти линейная реакция образования жирной кислоты и сложного эфира холестерина в зависимости от времени. Поэтому было решено проанализировать ферментативную реакцию в указанный временной период.
Зная количество липида в реакционной смеси и количество добавленного фермента, можно высчитать количество образованной жирной кислоты и сложного эфира холестерина, выраженное в мкмоль/мл фермента (таблица 2 и фигура 46).
На основании результатов, приведенных в таблице 2, и наклона кривых, показанных на фигуре 46, можно высчитать количество жирной кислоты и сложного эфира холестерина в зависимости от времени, выраженное в мкмоль/мин на мл фермента.
Вычисление гидрофильной и трансферазной активности представлено в таблице 3. Относительную трансферазную активность определяли методом измерения % ацилтрансферазной активности в соответствии с приведенным выше описанием.
Скрининг других ферментов в отношении трансферазной активности
Вышеуказанный метод использовали для скрининга разных липолитических ферментов в отношении трансферазной и гидролитической активности. Ферменты испытывали в соответствии с таблицей 4.
Субстрат, содержащий 300 мг смеси фосфатидилхолин/холестерин, диспергированной в 50 мМ буфера HEPES, рН 7,0, нагревали до 35°С при перемешивании. Добавляли раствор фермента и образец выдерживали, перемешивая, при 35°С. Образцы отбирали через определенные интервалы времени и экстрагировали хлороформом. Выделенные липиды анализировали методом ГЖХ, результаты которой приведены в таблице 5.
Результаты анализа методом ГЖХ показывают, что только липидацилтрансфераза (178-9) продуцировала значительное количество сложного эфира холестерина и жирных кислот. Фосфолипаза из Fusarium oxysporum также характеризовалась устойчивым увеличением свободной жирной кислоты, но сложный эфир холестерина образовался в небольшом количестве лишь на начальной стадии реакции, и при этом не наблюдалось увеличения выхода сложного эфира холестерина в зависимости от времени.
Зная количество липидного субстрата и результаты анализов ГЖХ, можно высчитать относительную трансферазную активность и относительную гидролитическую активность на основании результатов, полученных за время реакции с 10 до 60 минут. Результаты, полученные для трансферазы 178-9 и липазы Fusariun oxysporum, приведены в таблице 6. Другие испытанные ферменты не проявляли активности.
Результаты, приведенные в таблице 6, подтверждают значительную трансферазную активность липидацилтрансферазы (образец 178-9). Кроме того, установлено, что относительная трансферазная активность хорошо согласуется с результатами эксперимента, приведенными в таблице 3.
При этом была обнаружена очень низкая трансферазная активность фосфолипазы Fusarium oxysporum. Указанный уровень трансферазной активности является таким низким, что он попадает в категорию неопределенного результата анализа. Как ожидалось, фосфолипаза Fusarium oxysporum обладает значительной гидролитической активностью.
Заключение
Искусственный субстрат на основе очищенного фосфатидилхолина и холестерина использовали в качестве субстрата для измерения активности трансферазы из Aeromonas salmonicida. Между 10 и 60 минутами времени реакции результаты анализа свидетельствовали о почти линейном образовании свободных жирных кислот и сложного эфира холестерина в зависимости от времени. С учетом активности между 10 и 60 минутами времени реакции были высчитаны значения гидролитической и трансферазной активности.
На основании результатов анализа липидацилтрансферазы (в данном случае GCAT) из Aeromonas salmonicida в искусственном субстрате, представляющем собой смесь фосфатидилхолин/холестерин в буфере, сделан вывод о том, что данный фермент обладает также очень хорошей трансферазной активностью в системе с очень высоким содержанием воды.
Анализ с использованием субстрата на основе смеси фосфатидилхолин/холестерин в буфере можно применять для измерения трансферазной и гидролитической активности фермента. Результаты анализа с использованием субстрата на основе смеси фосфатидилхолин/ холестерин в буфере являются линейными только в определенном временном интервале.
Пример 7. Иммобилизация липидацилтрансферазы из Aeromonas salmonicida
Липидацилтрансферазу (в данном случае GCAT) из A.salmonicida иммобилизовали на целите 535 535 (компании Fluka) путем осаждения ацетоном. 10 мл раствора фермента в 20 мМ буфера ТЕА, рН 7, медленно перемешивали с 0,1 г целита 535 535 (компании Fluka) в течение 2 часов при комнатной температуре.
При непрерывном перемешивании добавляли 50 мл холодного ацетона.
Осадок отделяли центрифугированием с ускорением 5000g в течение 1 минуты.
Осадок дважды промывали 20 мл холодного ацетона.
Целит проверяли при комнатной температуре в течение примерно 1 часа.
Кроме того, было установлено, что данный фермент обладает высокой активностью в средах с высоким содержанием воды (6-89%), поэтому данную трансферазу и другие трансферазы можно использовать в применениях с иммобилизованным ферментом по данному изобретению с достаточно высоким содержанием воды. Это позволяет заменить растворители, используемые с применяемыми в настоящее время иммобилизованными липазами в процессе биоконверсии липидов с использованием трансфераз.
Пример 8. Варианты липидацилтрансферазы из Aeromonas hydrophila (Ahyd2) (SEQ ID NO:36 (см. фигуру 47))
Мутации вводили при помощи набора для мультисайтнаправленного мутагенеза QuikChange® компании Stratagene, La Jolla, CA 92037, USA, в соответствии с инструкциями, предоставленными компанием Stratagene.
Варианты в положении Tyr256 характеризовались повышенной активностью в отношении фосфолипидов.
Варианты в положении Tyr256 и Tyr260 характеризовались повышенной активностью в отношении галактолипидов.
Варианты в положении Tyr265 характеризовались повышенной трансферазной активностью с использованием галактолипидов в качестве донора ацильной группы.
Числами указаны положения в нижеследующей последовательности: фермент из Aeromonas hydrophila, аминокислотная последовательность которого представлена SEQ ID NO:36 на фигуре 47 (подчеркнутые аминокислоты образуют сигнальный пептид ксиланазы). Нуклеотидная последовательность соответствует SEQ ID NO:54 на фигуре 48.
Пример 9. “Анализ в среде с низким содержанием воды”
Трансферазные реакции липолитических ферментов в среде с низким содержанием воды.
Способ выполнения
Вещества
Холестерин, Sigma, № по каталогу С 8503
L-альфа-фосфатидилхолин 95% (растительный) Avanti № 441601
Соевое масло, Aarhus United, DK
Хлороформ, аналитическая чистота
Ферменты
№ 179, GCAT из A. salmonicida
№ 2427, фосфолипаза А1 из Fusarium oxysporum. LIPOPAN® F компании Novozymes, Дания
№ 1991, фосфолипаза А2 из поджелудочной железы, LIPOMOD 22L компании Biocatalysts, UK
№ 2373, липаза из Candida Antarctica, новозим 525 L компании Novozymes, Дания
Ферментативный анализ
13,1% лецитина и 6,6% холестерина растворяли в соевом масле, нагревая до 60°С при перемешивании.
Субстрат помещали в 20 мл стакан Витона и нагревали до 46°С.
Добавляли воду и раствор фермента и включали секундомер с остановом.
Через определенные промежутки времени 50 мг образцы переносили в 10 мл стакан Драма и замораживали.
Выделенные липиды анализировали методом ГЖХ.
Анализ методом ГЖХ
Для ознакомления с описанием анализа методом ГЖХ см. пример 6.
Результаты
Результаты эксперимента приведены в таблице 8.
Субстрат на основе соевого масла, содержащий 13,1% лецитина и 6,6% холестерина, нагревали до 46°С. Добавляли раствор фермента и включали секундомер с остановом. По истечении 30, 60 и 120 минут времени реакции отбирали образцы для анализа методом ГЖХ.
Результаты анализа методом ГЖХ приведены в таблице 9. Результаты выражены в процентах от общего состава образца. На основании результатов ГЖХ можно высчитать количество жирной кислоты и сложного эфира холестерина, продуцированное в результате ферментативной реакции, по сравнению с контрольным образцом без добавления фермента. В указанных экспериментальных условиях общую ферментативную активность определяли в виде гидролитической активности, измеренной с учетом образования свободной жирной кислоты, и трансферазную активность определяли с учетом образования сложного эфира холестерина. На основании указанных результатов и информации о молекулярной массе жирной кислоты и сложного эфира холестерина можно высчитать относительную молярную гидролитическую активность и относительную молярную трансферазную активность, значения которых приведены в таблице 10.
Заключение
При выполнении вышеуказанных экспериментов было установлено, что все испытанные ферменты обладали гидролитической активностью, о чем свидетельствовало увеличение количества жирной кислоты. При этом единственным ферментом, проявляющим трансферазную активность, был GCAT из A.salmonicida. Поэтому был сделан вывод о том, что в масляной системе с лецитином и холестерином, содержащей 6% воды, только фосфолипаза А1 из Fusarium oxysporum, фосфолипаза А2 из поджелудочной железы и липаза из Candida antarctica проявляют гидролитическую активность.
Пример 10. Получение сложного эфира углевода с использованием иммобилизованной липидацилтрансферазы по настоящему изобретению
Сложные эфиры углеводов жирных кислот, такие как сложные эфиры сахарозы и сложные эфиры глюкозы, обычно получают, осуществляя взаимодействие жирной кислоты или мыла жирной кислоты с углеводом при высокой температуре (Journal of the American Oil Chemists' Society (1978) 55; 4; 398-401). Однако недостатком данного метода являются побочные реакции и образование окрашенных побочных продуктов.
В соответствии с настоящим изобретением сложные эфиры углеводов жирных кислот получают в результате выполнения трансферазной реакции с использованием лецитина в качестве донора жирной кислоты и углевода, такого как глюкоза, в качестве акцепторной молекулы.
Указанную реакцию выполняют в проточном реакторе, в котором липидацилтрансфераза иммобилизована на твердом носителе.
Способ выполнения
100 г глюкозы растворяют в 1000 мл воды при перемешивании, затем 200 г фосфатидилхолина диспергируют в водной фазе при перемешивании и нагревают до 40°С.
Показатель рН доводят до рН 6,5.
В проточный реактор вводят 100 г липидацилтрансферазы из A. salmonicidа, иммобилизованной на твердом носителе.
Проточный реактор устанавливают в термокамеру при 40°С.
Реакционную смесь подают насосом в колонку со скоростью 2 мл/мин.
Продукт реакции собирают.
Из продукта реакции удаляют воду в тонкопленочном вакуумном выпарном аппарате и выделяют липиды.
Сложный эфир глюкозы отделяют от других липидов сольвентным фракционированием.
Сложные эфиры углеводов можно использовать во многих применениях, таких как эффективные эмульгаторы в пищевой и непищевой промышленности.
Пример 11. Получение сложного эфира белка с использованием липидацилтрансферазы по настоящему изобретению
В соответствии с настоящим изобретением конденсаты жирных кислот аминокислот, пептидов или белков получают в результате выполнения трансферазной реакции. При выполнении данной реакции фосфатидилхолин используют в качестве донора для переноса жирной кислоты в свободную гидроксильную группу аминокислот (таких как тирозин, верин или треонин), имеющих свободную гидроксильную группу, пригодную для этерификации.
Способ выполнения 1
50 г 1-тирозина (серина или треонина) растворяют в 1000 мл воды при перемешивании, затем 200 г фосфатидилхолина диспергируют в водной фазе при перемешивании и нагревают до 40°С.
Показатель рН доводят до рН 7 и сохраняют данное значение рН при помощи NaOH или HCl.
Добавляют 50 мл фермента липидацилтрансферазы из A.salmonicida и продолжают взаимодействие при перемешивании при 40°С.
Образцы отбирают через определенные периоды времени и анализируют методами ТСХ и ВЭЖХ.
По истечении 20 часов времени реакции реакционная смесь достигает равновесия, после чего реакцию прекращают.
Конденсат жирной кислоты тирозина, лецитин и лизолецитин выделяют из реакционной среды центрифугированием стандартными методами (см., например, публикацию “Centrifuges, Filtering” in Ullmann's Encyclopedia of Industrial Chemistry (2002) by Wiley-VCH Verlag GmbH & Co. KgaA).
Конденсат жирной кислоты тирозина подвергают дальнейшей очистке хроматографией на колонке с гидрофобным взаимодействием, отделяют фракцию, содержащую конденсат жирной кислоты тирозина, и удаляют растворитель выпариванием. (См. публикацию “Basic Principles of Chromatography” in Ullmann's Encyclopedia of Industrial Chemistry (2002) by Wiley-VCH Verlag GmbH & Co. KGaA).
Способ выполнения 2
Трансферазную активность липидацилтрансферазы испытывают в субстрате на основе фосфатидилхолина и 1-тирозина в соответствии с нижеследующим способом.
450 мг фосфатидилхолина (>95% PC Avanti, № 441601) и 50 мг 1-тирозина вводят в стакан Витона и добавляют 15 мл 50 мМ буфера HEPES, рН 7. Липид диспергируют в указанном буфере при перемешивании.
Субстрат нагревают до 35°С, перемешивая магнитной мешалкой, и добавляют 0,25 мл трансферазы в количестве 10 PLU/мл.
Образцы, равные 2 мл, отбирают по истечении 0, 5, 10, 15, 25, 40 и 60 минут времени реакции.
Сразу же добавляют 25 мкл 4М раствора HCl для подкисления свободной жирной кислоты и прекращения ферментативной реакции. Добавляют 3,00 мл хлороформа и образец интенсивно встряхивают в вихревом шейкере в течение 30 секунд. Образец центрифугируют, отделяют 2 мл фазы хлороформа и фильтруют через 0,45 мкм фильтры в 10 мл градуированный стакан Драма.
Хлороформ выпаривают в потоке азота при 60°С и образец снова измеряют. Экстрагированный липид анализируют методом ТСХ.
Пример 12. Получение сложного эфира гидроксикислоты (в частности, сложного эфира молочной кислоты) с использованием липидацилтрансферазы по настоящему изобретению
Сложные эфиры гидроксикислоты жирных кислот обычно получают, осуществляя взаимодействие жирной кислоты и гидроксикислоты при высокой температуре с использованием неорганических солей или ионов металла в качестве катализаторов (см., например, публикацию Bailey's Industrial Oil and Fat Products, Fifth edition, Volume 3. Edible Oil and Fat Products: Products and Application Technology, page 502-511). Однако недостатком данного способа являются побочные реакции и образование окрашенных побочных продуктов.
В соответствии с настоящим изобретением сложные эфиры гидроксикислоты жирных кислот получают в результате выполнения трансферазной реакции с использованием лецитина в качестве донора жирной кислоты и гидроксикислоты (в частности, молочной кислоты) в качестве акцепторной молекулы.
Способ выполнения
50 г молочной кислоты растворяют в 1000 мл воды при перемешивании, затем 200 г фосфатидилхолина диспергируют в водной фазе при перемешивании и нагревают до 40°С.
Показатель рН доводят до рН 6,5 и сохраняют данное значение рН при помощи NaOH или HCl.
Добавляют 50 мл фермента липидацилтрансферазы из A.salmonicida и продолжают взаимодействие при перемешивании при 40°С.
Образцы отбирают через определенные периоды времени и анализируют методами ТСХ и ГЖХ.
По истечении 20 часов времени реакции реакционная смесь достигает равновесия, после чего реакцию прекращают.
Сложный эфир молочной кислоты, лецитин и лизолецитин выделяют из реакционной среды центрифугированием стандартными методами (см., например, публикацию “Centrifuges, Filtering” in Ullmann's Encyclopedia of Industrial Chemistry (2002) by Wiley-VCH Verlag GmbH & Co. KgaA).
Сложный эфир молочной кислоты подвергают дальнейшей очистке методом молекулярной перегонки, получая при этом сложный эфир молочной кислоты жирной кислоты с высокой степенью чистоты.
Пример 13. Получение сложного эфира лимонной кислоты с использованием липидацилтрансферазы по настоящему изобретению
Анализ трансферазы в субстрате на основе фосфатидилхолина и лимонной кислоты
Трансферазную активность липидацилтрансферазы из A.salmonicida испытывали в субстрате на основе фосфатидилхолина и лимонной кислоты в соответствии с нижеследующим способом.
450 мг фосфатидилхолина (>95% PC Avanti, № 441601) и 50 мг лимонной кислоты вводят в стакан Витона и добавляют 15 мл 50 мМ буфера HEPES, рН 7. Липид диспергируют в буфере при перемешивании.
Субстрат нагревают до 35°С, перемешивая магнитной мешалкой, и добавляют 0,25 мл липидацилтрансферазы из A. salmonicida в количестве 10 PLU/мл.
Образцы, равные 2 мл, отбирают по истечении 0, 5, 10, 15, 25, 40 и 60 минут времени реакции.
Сразу же добавляют 25 мкл 4М раствора HCl для подкисления свободной жирной кислоты и прекращения ферментативной реакции. Добавляют 3,00 мл хлороформа и образец интенсивно встряхивают в вихревом шейкере в течение 30 секунд. Образец центрифугируют, отделяют 2 мл фазы хлороформа и фильтруют через 0,45 мкм фильтры в 10 мл градуированный стакан Драма.
Хлороформ выпаривают в потоке азота при 60°С и образец снова измеряют. Экстрагированный липид анализируют методом ТСХ.
Все публикации, указанные в приведенном выше описании изобретения, включены в данную заявку в качестве ссылки. Специалистам в данной области должны быть очевидны разные модификации и изменения описанных способов и систем по настоящему изобретению, не выходящие за пределы объема настоящего изобретения. Несмотря на то что настоящее изобретение было описано на примере конкретных предпочтительных вариантов его осуществления, должно быть понятно, что заявленное изобретение не может быть необоснованно ограничено конкретными вариантами осуществления. Предполагается, что все возможные модификации описанных вариантов осуществления изобретения, очевидные специалистам в области биохимии, биотехнологии или родственных областях, входят в объем нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ | 2004 |
|
RU2518345C2 |
| ВАРИАНТЫ ГЛИКОЛИПИДАЦИЛТРАНСФЕРАЗЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2004 |
|
RU2377300C2 |
| СПОСОБ | 2004 |
|
RU2376868C2 |
| ФЕРМЕНТАТИВНАЯ ОБРАБОТКА МАСЕЛ | 2004 |
|
RU2377307C2 |
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ, ИХ ПРИМЕНЕНИЕ ПРИ ИСПОЛЬЗОВАНИИ ПИЩЕВЫХ ПРОДУКТОВ | 2010 |
|
RU2538144C2 |
| ПОЛУЧЕНИЕ ЛИЗОГЛИКОЛИПИДА И БИОКОНВЕРСИЯ ГЛИКОЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА | 2005 |
|
RU2548805C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| БЕЛОК | 2005 |
|
RU2380414C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ПОЛУЧЕНИЯ ДУШИСТОГО СЛОЖНОГО ЭФИРА | 2008 |
|
RU2511409C2 |
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ОЧИСТКИ ТКАНИ ИЛИ ПОВЕРХНОСТИ ОТ ЗАГРЯЗНЯЮЩЕГО ВЕЩЕСТВА, СОДЕРЖАЩЕГО ТРИГЛИЦЕРИД (ВАРИАНТЫ) | 2008 |
|
RU2479628C2 |








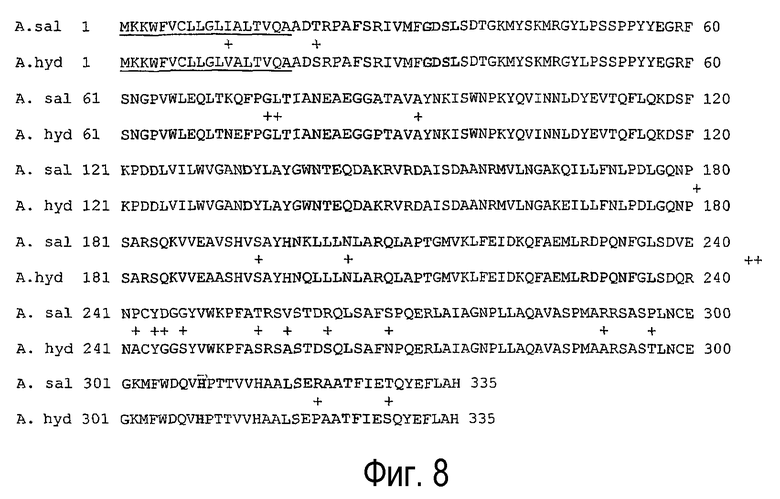
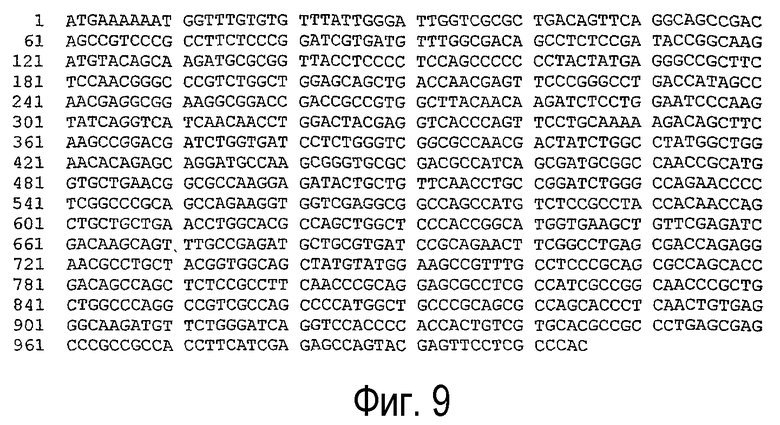
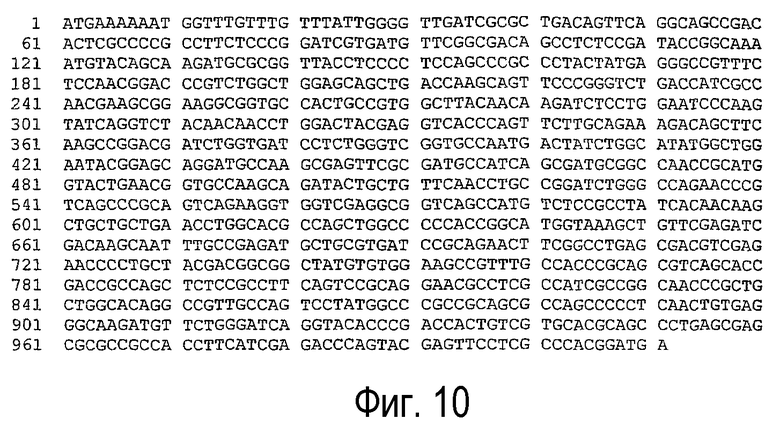
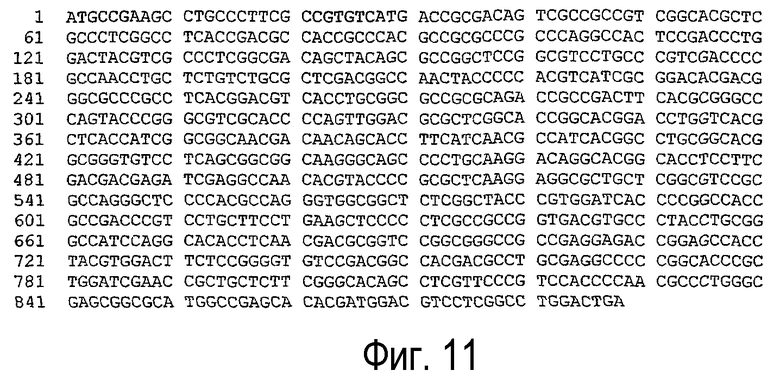
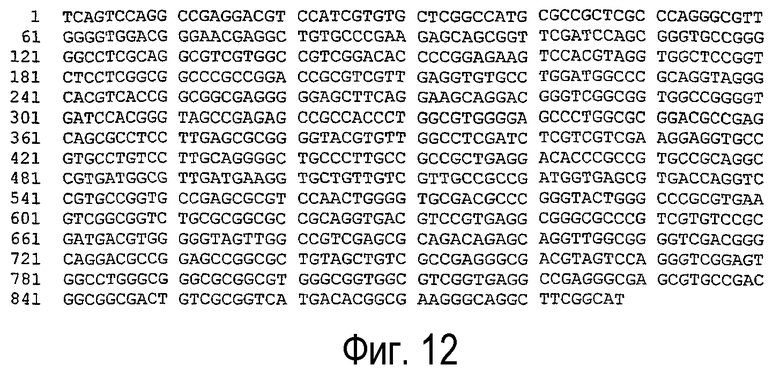


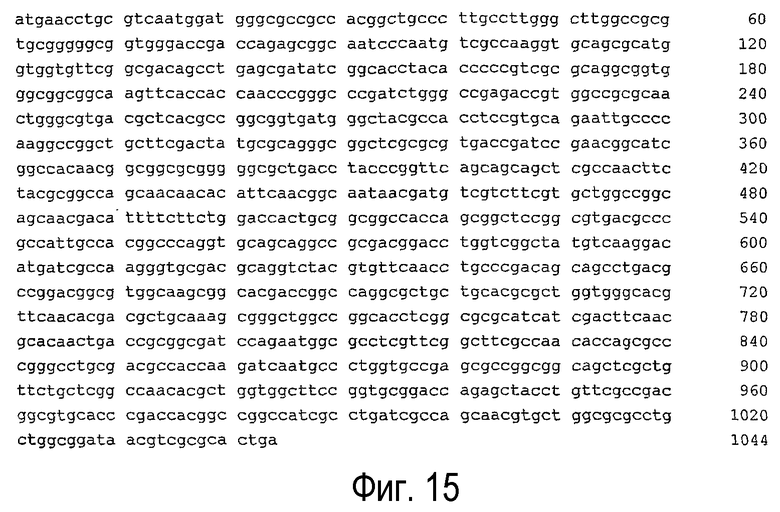







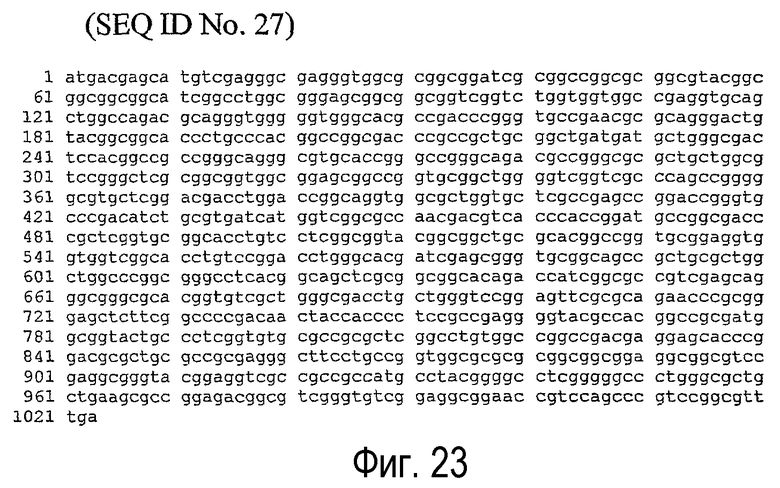











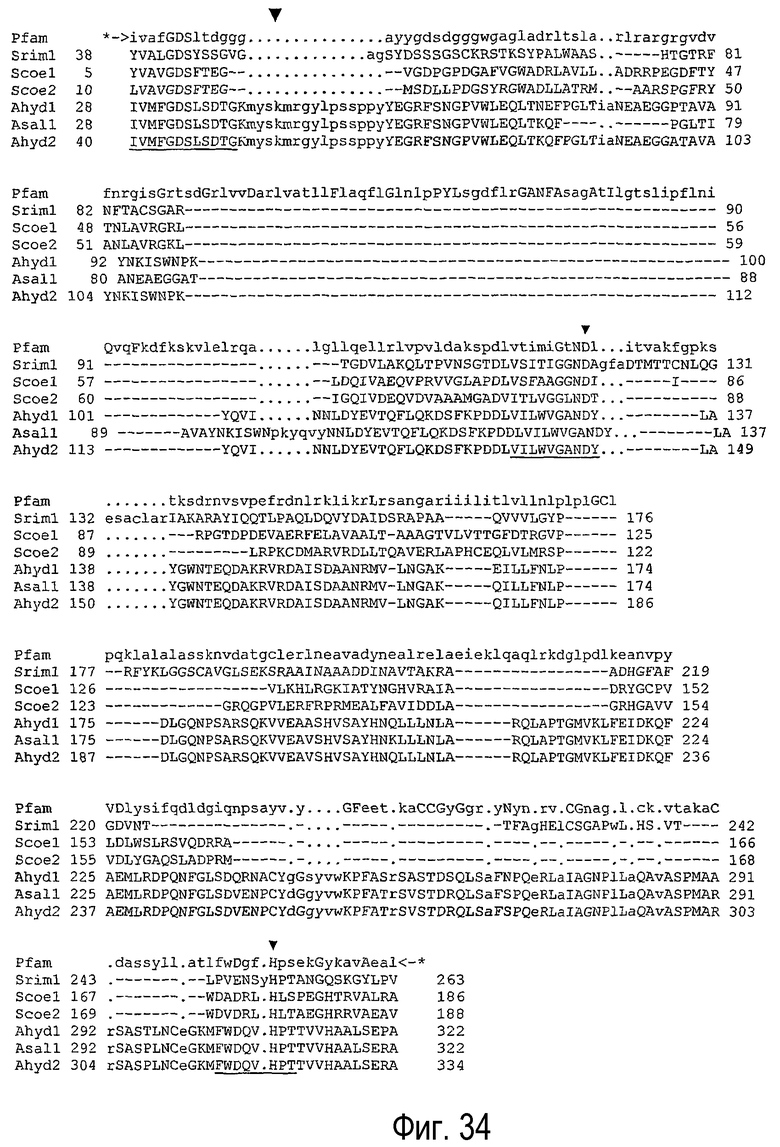
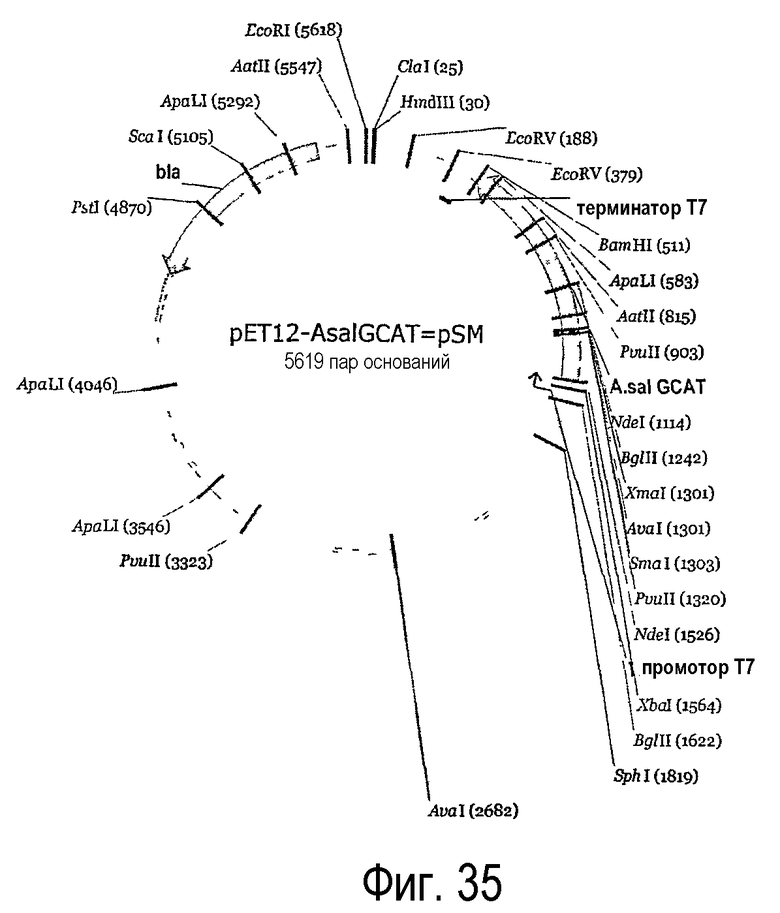

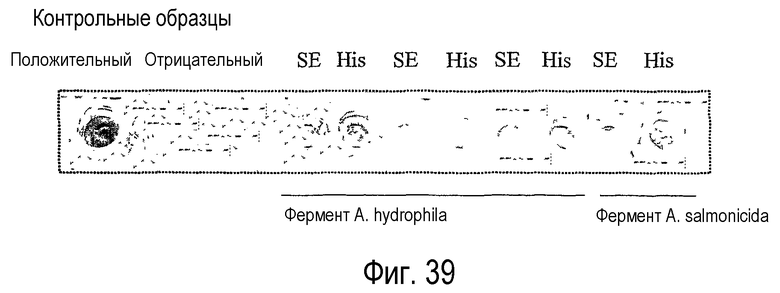
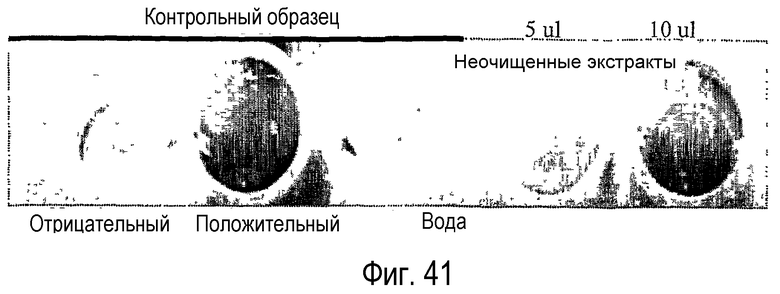

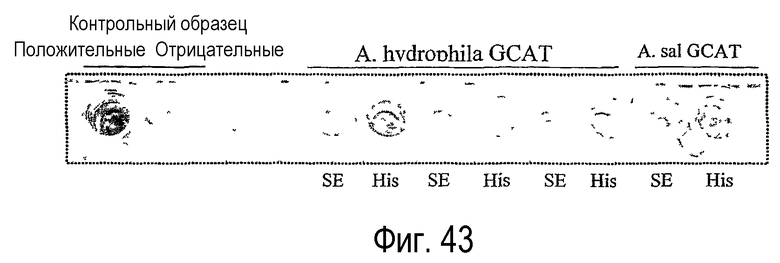
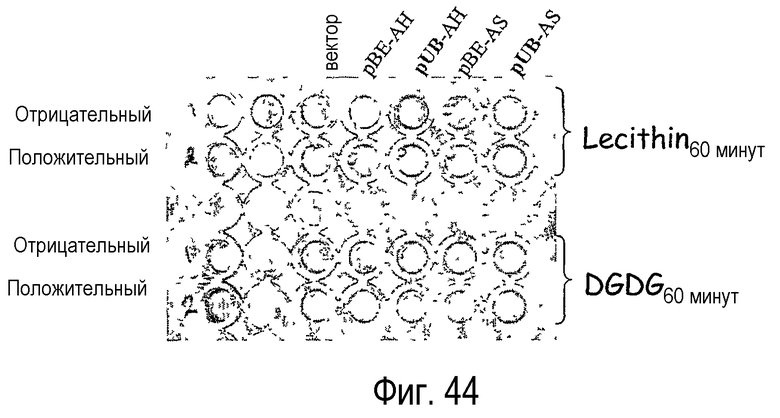
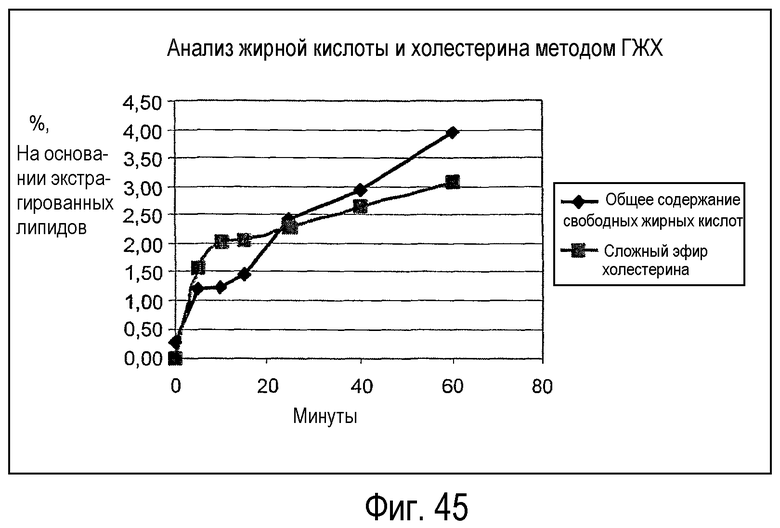
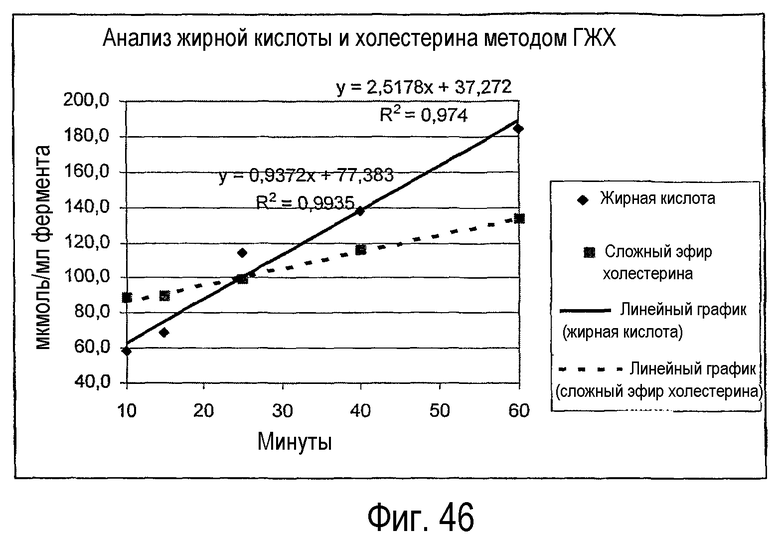


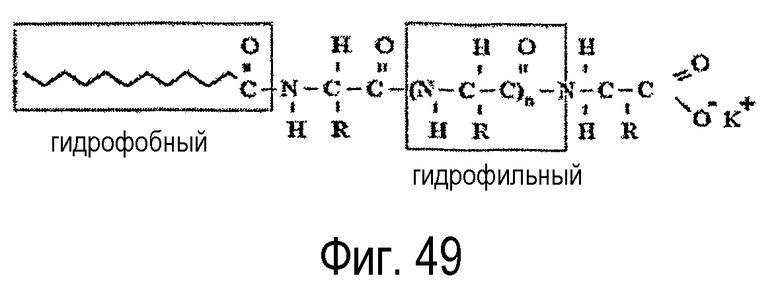
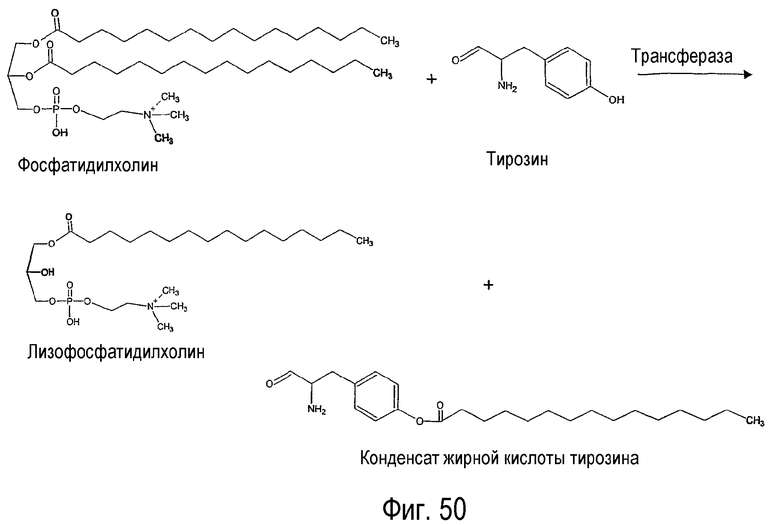
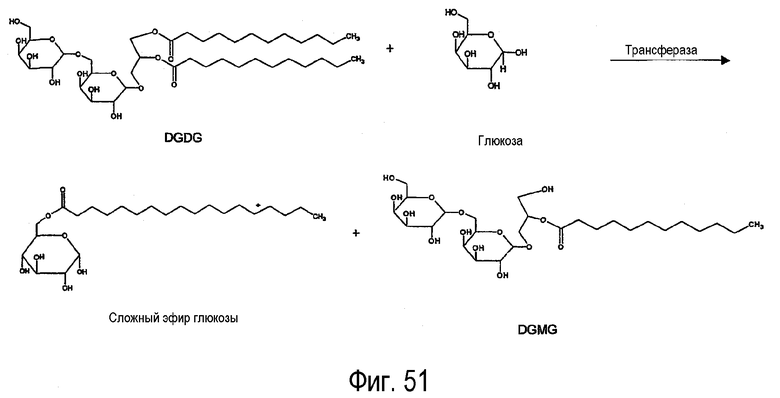
Изобретение относится к области биотехнологии и может быть использовано для получения сложных эфиров таких соединений, как углеводы, белки, белковые субъединицы и гидроксикислот. Способ предусматривает смешивание донора ацильной группы, акцептора ацильной группы и воды с образованием среды с высоким содержанием воды, содержащей 5-98% воды. В качестве донора ацильной группы используют липидный субстрат, выбранный из фосфолипида, лизофосфолипида, триацилглицерида, диглицерида, гликолипида или лизогликолипида, а в качестве акцептора ацильной группы используют углевод, белок, белковую субъединицу или гидроксикислоту. Затем производят контактирование смеси с липидацилтрансферазой, которая катализирует алкоголиз и/или переэтерификацию и является ферментом, обладающим ацилтрансферазной активностью, содержащим фрагмент GDSX аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S. Изобретение позволяет получить один или несколько сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот при использовании липидацилтрансферазы. 2 н. и 16 з.п. ф-лы, 51 ил., 10 табл.
1. Способ получения одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц, сложных эфиров гидроксикислот, который включает смешивание донора ацильной группы, акцептора ацильной группы и воды с образованием среды с высоким содержанием воды, содержащей 5-98% воды, при этом указанный донор ацильной группы является липидным субстратом, выбранным из одного или нескольких представителей группы, состоящей из фосфолипида, лизофосфолипида, триацилглицерида, диглицерида, гликолипида или лизогликолипида, и указанный акцептор ацильной группы выбран из одного или нескольких представителей группы, состоящей из углевода, белка, белковой субъединицы или гидроксикислоты; и контактирование смеси с липидацилтрансферазой, при котором указанная липидацилтрансфераза катализирует одну или обе нижеследующие реакции: алкоголиз или переэтерификацию, причем липидацилтрансфераза является ферментом, обладающим ацилтрансферазной активностью и содержащим фрагмент GDSX аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S.
2. Способ по п.1, где липидацилтрансфераза является иммобилизованной.
3. Способ по п.1, который включает очистку сложного эфира углевода, сложного эфира белка, сложного эфира белковой субъединицы, сложного эфира гидроксикислоты.
4. Способ по любому из предшествующих пунктов, в котором
фермент липидацилтрансфераза содержит Н-309 или остаток гистидина в положении, соответствующем положению His-309 в аминокислотной последовательности липолитического фермента Aeromonas hydrophila, представленной как SEQ ID NO:2 или SEQ ID NO:32.
5. Способ по п.1, в котором липидацилтрансферазу получают из организма, относящегося к одному или нескольким нижеследующим родам: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas и Candida.
6. Способ по п.1, в котором липидацилтрансфераза содержит одну из нижеследующих аминокислотных последовательностей:
(i) аминокислотную последовательность SEQ ID NO:2;
(ii) аминокислотную последовательность SEQ ID NO:3;
(iii) аминокислотную последовательность SEQ ID NO:4;
(iv) аминокислотную последовательность SEQ ID NO:5;
(v) аминокислотную последовательность SEQ ID NO:6;
(vi) аминокислотную последовательность SEQ ID NO:12;
(vii) аминокислотную последовательность SEQ ID NO:20;
(viii) аминокислотную последовательность SEQ ID NO:22;
(ix) аминокислотную последовательность SEQ ID NO:24;
(x) аминокислотную последовательность SEQ ID NO:26;
(xi) аминокислотную последовательность SEQ ID NO:28;
(xii) аминокислотную последовательность SEQ ID NO:30;
(xiii) аминокислотную последовательность SEQ ID NO:32;
(xiv) аминокислотную последовательность SEQ ID NO:34, или
аминокислотную последовательность, которая на 75% или более идентична одной из последовательностей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34.
7. Способ по п.1, где фермент липидацилтрансфераза содержит аминокислотную последовательность, полученную путем экспрессии одной из нижеследующих нуклеотидных последовательностей:
(a) нуклеотидной последовательности SEQ ID NO:7 (см. фигуру 9);
(b) нуклеотидной последовательности SEQ ID NO:8 (см. фигуру 10);
(c) нуклеотидной последовательности SEQ ID NO:9 (см. фигуру 11);
(d) нуклеотидной последовательности SEQ ID No:10 (см. фигуру 12);
(e) нуклеотидной последовательности SEQ ID NO:11 (см. фигуру 13);
(f) нуклеотидной последовательности SEQ ID NO:13 (см. фигуру 15);
(g) нуклеотидной последовательности SEQ ID NO:21 (см. фигуру 17);
(h) нуклеотидной последовательности SEQ ID NO:23 (см. фигуру 19);
(i) нуклеотидной последовательности SEQ ID NO:25 (см. фигуру 21);
(j) нуклеотидной последовательности SEQ ID NO:27 (см. фигуру 23);
(k) нуклеотидной последовательности SEQ ID NO:29 (см. фигуру 25);
(l) нуклеотидной последовательности SEQ ID NO:31 (см. фигуру 27);
(m) нуклеотидной последовательности SEQ ID NO:33 (см. фигуру 29);
(n) нуклеотидной последовательности SEQ ID NO:35 (см. фигуру 31);
(о) или нуклеотидной последовательности, которая на 75% или более идентична одной из последовательностей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
8. Способ по п.1, в котором липидацилтрансфераза является иммобилизованной липидацилтрансферазой, обладающей ацилтрансферазной активностью и содержащей фрагмент GDSX аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S, которая содержит Н-309 или остаток гистидина в положении, соответствующем положению His-309 в аминокислотной последовательности липолитического фермента Aeromonas hydrophila, представленной SEQ ID NO:2 или SEQ ID NO:32, и где фермент липидацилтрансфераза содержит одну из следующих последовательностей:
(i) аминокислотную последовательность SEQ ID NO:2;
(ii) аминокислотную последовательность SEQ ID NO:3;
(iii) аминокислотную последовательность SEQ ID NO:4;
(iv) аминокислотную последовательность SEQ ID NO:5;
(v) аминокислотную последовательность SEQ ID NO:6;
(vi) аминокислотную последовательность SEQ ID NO:12;
(vii) аминокислотную последовательность SEQ ID NO:20;
(viii) аминокислотную последовательность SEQ ID NO:22;
(ix) аминокислотную последовательность SEQ ID NO:24;
(x) аминокислотную последовательность SEQ ID NO:26;
(xi) аминокислотную последовательность SEQ ID NO:28;
(xii) аминокислотную последовательность SEQ ID NO:30;
(xiii) аминокислотную последовательность SEQ ID NO:32;
(xiv) аминокислотную последовательность SEQ ID NO:34 или аминокислотную последовательность, которая на 75% или более идентична одной из последовательностей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34,
или содержит аминокислотную последовательность, полученную путем экспрессии одной из нижеследующих нуклеотидных последовательностей:
(a) нуклеотидной последовательности SEQ ID NO:7 (см. фигуру 9);
(b) нуклеотидной последовательности SEQ ID NO:8 (см. фигуру 10);
(c) нуклеотидной последовательности SEQ ID NO:9 (см. фигуру 11);
(d) нуклеотидной последовательности SEQ ID NO:10 (см. фигуру 12);
(e) нуклеотидной последовательности SEQ ID NO:11 (см. фигуру 13);
(f) нуклеотидной последовательности SEQ ID NO:13 (см. фигуру 15);
(g) нуклеотидной последовательности SEQ ID NO:21 (см. фигуру 17);
(h) нуклеотидной последовательности SEQ ID NO:23 (см. фигуру 19);
(i) нуклеотидной последовательности SEQ ID NO:25 (см. фигуру 21);
(j) нуклеотидной последовательности SEQ ID NO:27 (см. фигуру 23);
(k) нуклеотидной последовательности SEQ ID NO:29 (см. фигуру 25);
(1) нуклеотидной последовательности SEQ ID NO:31 (см. фигуру 27);
(m) нуклеотидной последовательности SEQ ID NO:33 (см. фигуру 29);
(n) нуклеотидной последовательности SEQ ID NO:35 (см. фигуру 31); или
(о) нуклеотидной последовательности, которая на 75% или более идентична одной из последовательностей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
9. Способ по п.8, где иммобилизованную липидацилтрансферазу получают из организма, относящегося к одному или нескольким нижеследующим родам: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas и Candida.
10. Применение липидацилтрансферазы для получения одного или нескольких сложных эфиров углеводов, сложных эфиров белков, сложных эфиров белковых субъединиц или сложных эфиров гидроксикислот путем катализа алкоголиза или переэтерификации либо обеих указанных реакций в смеси донора ацильной группы, акцептора ацильной группы и воды, содержащей 5-98% воды, при этом указанный донор ацильной группы является липидным субстратом, выбранным из одного или нескольких представителей группы, состоящей из фосфолипида, лизофосфолипида, триацилглицерида, диглицерида, гликолипида или лизогликолипида, указанный акцептор ацильной группы выбран из одного или нескольких представителей группы, состоящей из углевода, белка, белковой субъединицы или гидроксикислоты, и липидацилтрансфераза является ферментом, обладающим ацилтрансферазной активностью и содержащим фрагмент GDSX аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S.
11. Применение по п.10, при котором липидацилтрансфераза является иммобилизованной.
12. Применение по п.10, при котором сложный эфир углевода, сложный эфир белка, сложный эфир белковой субъединицы или сложный эфир гидроксикислоты является очищенным.
13. Применение по п.10, при котором фермент липидацилтрансфераза содержит Н-309 или остаток гистидина в положении, соответствующем положению His-309 в аминокислотной последовательности липолитического фермента Aeromonas hydrophila, представленной SEQ ID NO:2 или SEQ ID NO:32.
14. Применение по п.10, где липидацилтрансферазу получают из организма, относящегося к одному или нескольким нижеследующим родам: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas и Candida.
15. Применение по п.10, при котором липидацилтрансфераза содержит одну из нижеследующих аминокислотных последовательностей:
(i) аминокислотную последовательность SEQ ID NO:2;
(ii) аминокислотную последовательность SEQ ID NO:3;
(iii) аминокислотную последовательность SEQ ID NO:4;
(iv) аминокислотную последовательность SEQ ID NO:5;
(v) аминокислотную последовательность SEQ ID NO:6;
(vi) аминокислотную последовательность SEQ ID NO:12;
(vii) аминокислотную последовательность SEQ ID NO:20;
(viii) аминокислотную последовательность SEQ ID NO:22;
(ix) аминокислотную последовательность SEQ ID NO:24;
(x) аминокислотную последовательность SEQ ID NO:26;
(xi) аминокислотную последовательность SEQ ID NO:28;
(xii) аминокислотную последовательность SEQ ID NO:30;
(xiii) аминокислотную последовательность SEQ ID NO:32;
(xiv) аминокислотную последовательность SEQ ID NO:34, или аминокислотную последовательность, которая на 75% или более идентична одной из последовательностей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34.
16. Применение по п.10, где фермент липидацилтрансфераза содержит аминокислотную последовательность, полученную путем экспрессии одной из нижеследующих нуклеотидных последовательностей:
(a) нуклеотидной последовательности SEQ ID NO:7 (см. фигуру 9);
(b) нуклеотидной последовательности SEQ ID NO:8 (см. фигуру 10);
(c) нуклеотидной последовательности SEQ ID NO:9 (см. фигуру 11);
(d) нуклеотидной последовательности SEQ ID NO:10 (см. фигуру 12);
(e) нуклеотидной последовательности SEQ ID NO:11 (см. фигуру 13);
(f) нуклеотидной последовательности SEQ ID NO:13 (см. фигуру 15);
(g) нуклеотидной последовательности SEQ ID NO:21 (см. фигуру 17);
(h) нуклеотидной последовательности SEQ ID NO:23 (см. фигуру 19);
(i) нуклеотидной последовательности SEQ ID NO:25 (см. фигуру 21);
(j) нуклеотидной последовательности SEQ ID NO:27 (см. фигуру 23);
(k) нуклеотидной последовательности SEQ ID NO:29 (см. фигуру 25);
(l) нуклеотидной последовательности SEQ ID NO:31 (см. фигуру 27);
(m) нуклеотидной последовательности SEQ ID NO:33 (см. фигуру 29);
(n) нуклеотидной последовательности SEQ ID NO:35 (см. фигуру 31); или
(о) нуклеотидной последовательности, которая на 75% или более идентична одной из последовательностей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
17. Применение по п.10, где липидацилтрансфераза является иммобилизованной липидацилтрансферазой, обладающей ацилтрансферазной активностью и содержащей фрагмент GDSX аминокислотной последовательности, где Х означает один или несколько нижеследующих аминокислотных остатков L, А, V, I, F, Y, H, Q, Т, N, М или S, которая содержит Н-309 или остаток гистидина в положении, соответствующем положению His-309 в аминокислотной последовательности липолитического фермента Aeromonas hydrophila, представленной как SEQ ID NO:2 или SEQ ID NO:32, и где фермент липидацилтрансфераза содержит одну из следующих последовательностей:
(i) аминокислотную последовательность SEQ ID NO:2;
(ii) аминокислотную последовательность SEQ ID NO:3;
(iii) аминокислотную последовательность SEQ ID NO:4;
(iv) аминокислотную последовательность SEQ ID NO:5;
(v) аминокислотную последовательность SEQ ID NO:6;
(vi) аминокислотную последовательность SEQ ID NO:12;
(vii) аминокислотную последовательность SEQ ID NO:20;
(viii) аминокислотную последовательность SEQ ID NO:22;
(ix) аминокислотную последовательность SEQ ID NO:24;
(x) аминокислотную последовательность SEQ ID NO:26;
(xi) аминокислотную последовательность SEQ ID NO:28;
(xii) аминокислотную последовательность SEQ ID NO:30;
(xiii) аминокислотную последовательность SEQ ID NO:32;
(xiv) аминокислотную последовательность SEQ ID NO:34, или аминокислотную последовательность, которая на 75% или более идентична одной из последовательностей SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:12, SEQ ID NO:20, SEQ ID NO:22, SEQ ID NO:24, SEQ ID NO:26, SEQ ID NO:28, SEQ ID NO:30, SEQ ID NO:32 или SEQ ID NO:34,
или содержащую аминокислотную последовательность, полученную путем экспрессии одной из нижеследующих нуклеотидных последовательностей:
(a) нуклеотидной последовательности SEQ ID NO:7 (см. фигуру 9);
(b) нуклеотидной последовательности SEQ ID NO:8 (см. фигуру 10);
(c) нуклеотидной последовательности SEQ ID NO:9 (см. фигуру 11);
(d) нуклеотидной последовательности SEQ ID NO:10 (см. фигуру 12);
(e) нуклеотидной последовательности SEQ ID NO:11 (см. фигуру 13);
(f) нуклеотидной последовательности SEQ ID NO:13 (см. фигуру 15);
(g) нуклеотидной последовательности SEQ ID NO:21 (см. фигуру 17);
(h) нуклеотидной последовательности SEQ ID NO:23 (см. фигуру 19);
(i) нуклеотидной последовательности SEQ ID NO:25 (см. фигуру 21);
(j) нуклеотидной последовательности SEQ ID NO:27 (см. фигуру 23);
(k) нуклеотидной последовательности SEQ ID NO:29 (см. фигуру 25);
(l) нуклеотидной последовательности SEQ ID NO:31 (см. фигуру 27);
(m) нуклеотидной последовательности SEQ ID NO:33 (см. фигуру 29);
(n) нуклеотидной последовательности SEQ ID NO:35 (см. фигуру 31); или (о) нуклеотидной последовательности, которая на 75% или более идентична одной из последовательностей SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:13, SEQ ID NO:21, SEQ ID NO:23, SEQ ID NO:25, SEQ ID NO:27, SEQ ID NO:29, SEQ ID NO:31, SEQ ID NO:33 или SEQ ID NO:35.
18. Применение по п.17, где липидацилтрансферазу получают из организма, относящегося к одному или нескольким нижеследующим родам: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas и Candida.
| HILTON C | |||
| et al | |||
| Purification and spectral study of a microbial fatty acyltransferase activation by limited proteolysis | |||
| Biochemistry, 1990, vol.29, №38, p.9073 | |||
| Преобразователь частоты | 1984 |
|
SU1275711A1 |
| Способ разделения рацемической смеси (его варианты) и способ отделения хирального продукта от ахирального предшественника | 1989 |
|
SU1825378A3 |
Авторы
Даты
2009-10-27—Публикация
2004-01-15—Подача