Предпосылки изобретения
Настоящее изобретение относится к обеспечению последовательности ДНК основных аллергенов группы 4 из зерновых культур (Triticeae). Изобретение также охватывает фрагменты, новые комбинации частичных последовательностей и точечные мутанты, которые обладают гипоаллергенным действием. Молекулы рекомбинантной ДНК и полипептиды, полученные из них, фрагменты, новые комбинации частичных последовательностей и варианты также могут использоваться для терапии заболеваний, связанных с аллергией на пыльцу. Белки, полученные с помощью рекомбинантных способов, могут использоваться для in vitro и in vivo диагностики аллергий на пыльцу.
Аллергии типа 1 представляют собой важную проблему во всем мире. Вплоть до 20% популяции населения индустриально развитых стран страдают от осложнений, таких как аллергический ринит, конъюнктивит или бронхиальная астма. Эти аллергии вызываются аллергенами, присутствующими в воздухе (аэроаллергенами), которые высвобождаются из источников различного происхождения, таких как растительная пыльца, клещи, коты или собаки. Вплоть до 40% этих пациентов, страдающих от аллергии типа 1, в свою очередь, демонстрируют IgE реактивность с аллергенами пыльцы трав (Freidhoff и др., 1986, J. Allergy Clin. Immunol. 78, 1190-2001). Среди аллергенов пыльцы зерновых культур аллергены ржи имеют особую важность.
Вещества, которые запускают аллергию типа 1, представляют собой белки, гликопротеины или полипептиды. После попадания через слизистые оболочки эти аллергены реагируют с молекулами IgE, связанными с поверхностью тучных клеток у сенсибилизированных индивидуумов. Если две молекулы IgE поперечно связываются друг с другом, то это приводит к высвобождению медиаторов (например, гистамина, простагландинов) и цитокинов эффекторными клетками и, таким образом, к соответствующим клиническим симптомам.
Различие делается между основными и второстепенными аллергенами в зависимости от относительной частоты, с которой молекулы индивидуального аллергена реагируют с IgE антителами пациентов, страдающих от аллергии.
Аллергены пыльцы различных видов из семейства трав (Роасеае) разделяются на группы, которые являются гомологичными друг другу. В частности, молекулы основного аллергена группы 4 обладают высокой иммунологической перекрестной реактивностью относительно друг с друга как с моноклональными мышиными антителами, так и человеческими IgE антителами (Fahlbusch и др., 1993 Clin. Exp. Allergy 23: 51-60; Leduc-Brodard и др., 1996, J. Allergy Clin. Immunol. 98: 1065-1072; Su и др., 1996, J. Allergy Clin. Immunol. 97: 210; Fahlbusch и др., 1998, Clin. Exp.Allergy 28: 799-807; Gavrovic-Jankulovic и др., 2000, Invest. Allergol. Clin. Immunol. 10 (6): 361-367; Stumvoll и др., 2002, Biol. Chem. 383: 1383-1396; Grote и др., 2002, Biol. Chem. 383: 1441-1445; Andersson и Lidholm, 2003, Int. Arch. Allergy Immunol. 130: 87-107; Man, 2003, Clin. Exp. Allergy, 33 (I): 43-51).
Полная последовательность ДНК до настоящего времени не известна ни для одного из основных аллергенов группы 4.
Из группы аллергенов 4 до настоящего момента времени было возможным только для аллергена из Dactylus glomerata получить пептиды с помощью ферментативного расщепления, а также секвенировать их:
DIYNYMEPYVSK (SEQ ID NO 13),
VDPTDYFGNEQ (SEQ ID NO 14),
ARTAWVDSGAQLGELSY (SEQ ID NO 15)
и GVLFNIQYVNYWFAP (SEQ ID NO 16, Leduc-Brodard и др., 1996, J. Allergy Clin. Immunol. 98: 1065-1072).
Путем протеолиза и секвенирования были также получены пептиды из группы аллергенов 4 для субтропической бермудской травы (Cynodon dactylon):
KTVKPLYIITP (SEQ ID NO 17),
KQVERDFLTSLTKDIPQLYLKS (SEQ ID NO 18),
TVKPLYIITPITAAMI (SEQ ID NO 19),
LRKYGTAADNVIDAKWDAQGRLL (SEQ ID NO 20),
KWQTVAPALPDPNM (SEQ ID NO 21),
VTWIESVPYIPMGDK (SEQ ID NO 22),
GTVRDLLXRTSNIKAFGKY (SEQ ID NO 23),
TSNIKAFGKYKSDYVLEPIPKKS (SEQ ID NO 24),
YRDLDLGVNQWG (SEQ ID NO 25),
SATPPTHRSGVLFNI (SEQ ID NO 26)
и AAAALPTQVTRDIYAFMTPYVSKNPRQAYVNYRDLD (SEQ ID NO 27, Liaw и др., 2001, Biochem. Biophys. Research Communication 280: 738-743).
Для Lolium perenne были описаны пептидные фрагменты для основных аллергенов группы 4, содержащие следующие последовательности: FLEPVLGLIFPAGV (SEQ ID NO 28) и GLIEFPAGV (SEQ ID NO 29, Jaggi и др., 1989, Int. Arch. Allergy Appl. Immunol. 89: 342-348).
В качестве первой последовательности аллергенов группы 4 авторами настоящей заявки была раскрыта все еще не опубликованная последовательность Ph1 p 4 из Phleum pratense (SEQ ID NO 11), которая описана в международной заявке WO 04/000881.
До настоящего времени ничего неизвестно о последовательностях основных аллергенов группы 4 из зерновых культур (Triticeae).
Задача, на которой основывается настоящее изобретение, таким образом, состоит в обеспечении последовательности ДНК основных аллергенов группы 4 из зерновых культур, в частности аллергена Sec с 4 из ржи (Secale cerale) (SEQ ID NO 1, 3), Hor v 4 из ячменя (Hordeum vulgare) (SEQ ID NO 5) и Tri a 4 из пшеницы (Triticum aestivum) (SEQ ID NO 7, 9), а также соответствующих рекомбинантных молекул ДНК, на основе которых могут быть экспрессированы в виде белка и получены в распоряжение аллергены как таковые или в модифицированной форме, для фармакологически значимого применения. Последовательность Ph1 p 4 (SEQ ID NO 11) была исходной точкой для настоящего изобретения.
Перечень последовательностей в соответствии с изобретением
Последовательности ДНК и белка зрелых аллергенов в соответствии с SEQ ID NO 1-10 предваряются сигнальной последовательностью. Кодирующий участок в последовательностях ДНК завершается стоп-кодонами TGA или TAG.
- Последовательность ДНК Sec с 4. (а) Изоформа Sec с 4.01 (SEQ ID NO 1), (b) изоформа Sec с 4.02 (SEQ ID NO 3).
- Белковые последовательности (SEQ ID NO 2, 4), полученные из последовательностей ДНК в соответствии с SEQ ID NO 1 и 3.
- Последовательность ДНК Hor v 4 (SEQ ID NO 5).
- Белковая последовательность (SEQ ID NO 6), полученная из последовательности ДНК в соответствии с SEQ ID NO 5.
- Последовательность ДНК Tri a 4. (а) Изоформа Tri a 4.01 (SEQ ID NO 7), (b) изоформа Tri а 4.02 (SEQ ID NO 9).
- Белковые последовательности (SEQ ID NO 8, 10), полученные из последовательностей ДНК в соответствии с SEQ ID NO 7 и 9.
- Последовательность ДНК Phi p 4 (SEQ ID NO 11) в соответствии с SEQ ID NO 5 из WO 04/000881.
- Белковая последовательность Phi p 4 (SEQ ID NO 12) в соответствии с SEQ ID NO 6 из WO 04/000881.
Описание изобретения
Настоящее изобретение прежде всего обеспечивает последовательности ДНК основных аллергенов пыльцы злаковых Sec с 4, Hor v 4 и Tri a 4 в соответствии с последовательностями SEQ ID NO 1, 3, 5, 7 и 9.
Настоящее изобретение, таким образом, относится к молекулам ДНК, выбранным из нуклеотидных последовательностей в соответствии с SEQ ID NO 1, 3, 5, 7 и 9.
Изобретение также относится к последовательностям, гомологичным последовательностям ДНК в соответствии с изобретением, и к соответствующим молекулам ДНК аллергенов группы 4 из других Роасеае, таких как, например, Lolium perenne, Dactylis glomerata, Poa pratensis, Cynodon dactylon and Holcus lanatus, которые благодаря существующей гомологии последовательностей гибридизуются с последовательностями ДНК в соответствии с изобретением в жестких условиях или обладают иммунологической перекрестной реактивностью по отношению к аллергенам в соответствии с изобретением.
Изобретение также охватывает новые комбинации частичных последовательностей и точечные мутанты, обладающие гипоаллергенной активностью.
Изобретение, таким образом, также относится к соответствующим частичным последовательностям, комбинации частичных последовательностей или к мутантам, полученным в результате замены, удаления или добавления, которые кодируют иммуномодуляторный фрагмент, реактивный по отношению к Т-клеткам, группы 4 аллергенов из Роасеае.
При знании последовательности ДНК существующих в природе аллергенов в настоящее время является возможным получить эти аллергены в виде рекомбинантных белков, которые могут использоваться в диагностике и терапии аллергических заболеваний (Schemer и Kraft, 1995, Allergy 50: 384-391).
Классический подход для эффективного лечения аллергий представляет собой специфическую иммунотерапию или гипосенсибилизацию (Fiebig, 1995, Allergo J. 4 (6); 336-339, Bousquet и др., 1998, J. Allergy Clin. Immunol. 102 (4): 558-562). В этом способе пациента подкожно инъецируют с помощью экстрактов природного аллергена в увеличивающихся дозах. Однако при этом существует риск возникновения аллергических реакций или даже анафилактического шока. Для того чтобы минимизировать этот риск, используются усовершенствованные препараты в форме аллергоидов. Последние представляют собой экстракты химически модифицированных аллергенов, которые обладают значительно сниженной IgE реактивностью, но идентичной Т-клеточной реактивностью по сравнению с необработанным экстрактом (Fiebig, 1995, Allergo J. 4 (7): 377-382).
Еще более существенная оптимизация терапии будет возможной с аллергенами, полученными с помощью рекомбинантных способов. Определенные смеси высокоочищенных аллергенов, полученные при использовании рекомбинантных способов, необязательно подобранными в соответствии с индивидуальными моделями сенсибилизации пациентов, могут быть заменены экстрактами из природных источников аллергенов, поскольку такие, в дополнение к различным аллергенам, содержат относительно высокое количество иммуногенных, но не аллергенных вторичных белков.
Реалистические перспективы, которые могут приводить к надежной гипосенсибилизации с помощью экспрессионных продуктов, предлагаются при использовании специфически мутированных рекомбинантных аллергенов, в которых эпитопы IgE являются, в частности, делетированным без повреждения эпитопов Т-клеток, которые являются существенными для терапии (Schramm и др., 1999, J.Immunol. 162: 2406-2414).
Дополнительная возможность для терапевтического влияния на нарушенное равновесие ТН клеток у пациентов, страдающих от аллергии, представляет собой ДНК-вакцинацию, которая вовлекает лечение с помощью способной к экспрессии ДНК, кодирующей соответствующие аллергены. Исходное экспериментальное доказательство специфического для аллергена влияния на иммунный ответ было выполнено на грызунах при использовании инъекции ДНК, кодирующей аллерген (Hsu и др., 1996, Nature Medicine 2 (5): 540-544).
Настоящее изобретение, таким образом, также относится к молекуле ДНК, описанной выше или ниже, в качестве лекарственного средства, а также к соответствующему рекомбинантному экспрессионному вектору в качестве лекарственного средства.
Соответствующие белки, полученные с помощью рекомбинантных способов, могут использоваться для терапии и для in vitro и in vivo диагностики аллергий на пыльцу трав.
Для получения рекомбинантного аллергена клонированную нуклеиновую кислоту лигируют в экспрессионный вектор и эту конструкцию экспрессируют в организме приемлемого хозяина. После биохимической очистки этот рекомбинантный аллерген является пригодным для определения IgE антител с помощью известных способов.
Настоящее изобретение, таким образом, также относится к рекомбинантному экспрессионному вектору, включающему молекулу ДНК, описанную выше и ниже, функционально связанную с последовательностью контроля экспрессии, и к хозяйскому организму, трансформированному с помощью указанной молекулы ДНК или указанного вектора экспрессии.
Изобретение также относится к применению, по крайней мере, одной молекулы ДНК, описанной выше, или, по крайней мере, к одного экспрессионного вектора, описанного выше, для получения лекарственного средства для иммунотерапевтической ДНК-вакцинации пациентов с аллергиями, в запуск которых вовлечены аллергены группы 4 из Роасеае, предпочтительно Triticeae, в частности Sec с 4, Hor v 4, Tri a 4, и/или для предотвращения таких аллергий.
Как уже было указано, изобретение может быть использовано в качестве основного компонента в рекомбинантном препарате, содержащем аллерген или нуклеиновую кислоту, для специфической иммунотерапии. Из этого факта вытекает ряд возможностей. С одной стороны, белок с неизмененной первичной структурой может быть ингредиентом препарата. С другой стороны, гипоаллергенная (аллергоидная) форма может быть использована в соответствии с изобретением для терапии с целью устранения нежелательных побочных эффектов путем специфической делеции IgE эпитопов молекулы целиком или с помощью получения индивидуальных фрагментов, которые кодируют эпитопы Т-клеток. В завершение, нуклеиновая кислота сама по себе в случае, если ее лигируют с эукариотическим экспрессионным вектором, обеспечивает получение препарата, который при непосредственном использовании модифицирует аллергический иммунный статус в терапевтическом смысле.
Настоящее изобретение также относится к полипептидам, которые кодируются одной или более молекулами ДНК, описанными выше, предпочтительно в качестве лекарственного средства.
Таковые представляют собой белки, соответствующие аминокислотной последовательности в соответствии с SEQ ID NO 2, 4, 6, 8 или 10. В частности, таковые представляют собой зрелые белки (без компонента сигнальной последовательности), начинающиеся с аминокислоты 23 (SEQ ID NO 2, 4 и 6) и с аминокислоты 22 (SEQ ID NO 8, 10). Изобретение также относится к белкам, которые содержат эти аминокислотные последовательности или части этих последовательностей.
В соответствии с этим изобретение также относится к способу получения препарата таких полипептидов путем культивирования хозяйского организма и изоляции соответствующего полипептида из культуры.
Изобретение также относится к применению, по крайней мере, одного полипептида или белка, описанного выше, для получения лекарственного средства для диагностики и/или лечения аллергий, в запуск которых вовлечена группа 4 аллергенов из Роасеае, предпочтительно Triticeae, в частности Sec с 4, Hor v 4, Tri a 4, а также для предотвращения таких аллергий.
При определении белка и последовательностей ДНК в соответствии с изобретением используют следующую процедуру.
Sec с 4 из ржи
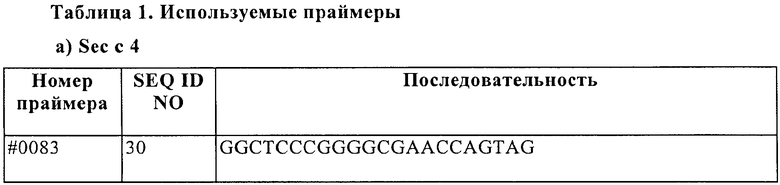
1. Исходя из последовательности ДНК Phi p 4 (SEQ ID NO 12, WO 04/000881), получали специфические праймеры (Таблица 1), имеющие происхождение от последовательности Phi p 4. Получали пять клонов из ДНК пыльцы ржи с помощью ПЦР с праймерами #87 и #83. Амплифицированный фрагмент 1 гена Sec с 4, соответствующий этим клонам, кодирует полипептид, соответствующий аминокислотам 68-401 Phi p 4 (SEQ ID NO 12).
2. Осуществляли поиск на основе базы данных EST с помощью частичной последовательности Sec с 4. Однако никаких гомологичных последовательностей, специфических для ржи, не было обнаружено в базе данных EST. Вместо этого были обнаружены индивидуальные, гомологичные неперекрывающиеся EST фрагменты в базе данных EST, специфические для ячменя и пшеницы. Индивидуальные фрагменты EST находились на участке 5'-UTR, а другие - на участке 3'-UTR (UTR = нетранслируемый участок) соответствующих генов.
3. Однако полный ген группы 4 для пшеницы или ячменя не может быть сконструирован из последовательностей EST, обнаруженных в базе данных, поскольку эти последовательности не перекрывались и гомологичный ген группы 4 не являлся известным. Однако было возможным определить эти последовательности EST со ссылкой на последовательность Phi p 4 (SEQ ID NO 11), при этом фрагмент Sec с 4, полученный на этапе 1, и эти последовательности служили в качестве матрицы для получения праймеров ПЦР.
4. С помощью праймеров #195 и #189, полученных таким образом, при использовании ПЦР были получены три клона. Праймер #195 был получен из EST последовательности ячменя, праймер #189 представлял собой специфический для Phi p 4 праймер и перекрывал стоп-кодон Phi p 4 и кодоны 10 С-терминальных аминокислот Phi p 4. Фрагмент 2 гена Sec с 4, амплифицированный таким образом, кодирует полипептид, начинающийся с сигнальной последовательности и заканчивающийся положением, соответствующим положению 490 Phl p 4. Этот полипептид перекрывал N-терминальную часть Sec с 4.
5а. Три дополнительных клона получали с помощью ПЦР при использовании праймеров #195 и #202. Оба праймера имели происхождение от EST последовательностей ячменя. Амплифицированный ген 3 Sec с 4 кодирует соответствующие аминокислоты, начинающиеся с сигнальной последовательности и заканчивающиеся на С-терминальном конце Sec с 4. Таким образом, полная последовательность зрелого Sec с 4 присутствовала в определенной таким образом последовательности.
Следующие два этапа 5b и 5 с служили для двойной проверки результата, полученного на этапе 5а.
5b. Дополнительный клон получали с помощью ПЦР при использовании праймеров #195 и #203. Праймер #195 имел происхождение от EST последовательности ячменя, праймер #203 - от EST последовательности пшеницы. Амплифицированный ген Sec с 4 кодирует соответствующие аминокислоты, начинающиеся с сигнальной последовательности и заканчивающиеся на С-терминальном конце Sec с 4. Таким образом, полная последовательность зрелого Sec с 4 присутствовала в определенной таким образом последовательности.
5с. Дополнительный клон получали с помощью ПЦР при использовании праймеров #195 и #198. Амплифицированный ген Sec с 4 кодирует соответствующие аминокислоты, начинающиеся с сигнальной последовательности и заканчивающиеся на С-терминальном конце Sec с 4. Таким образом, полная последовательность зрелого Sec с 4 присутствовала в определенной таким образом тпоследовательности.
Были обнаружены две изоформы Sec с 4.01 и 4.02. Зрелые аллергены начинались с аминокислоты 23 последовательностей в соответствии с SEQ ID NO 2, 4 и 6.
Hor v 4 из ячменя
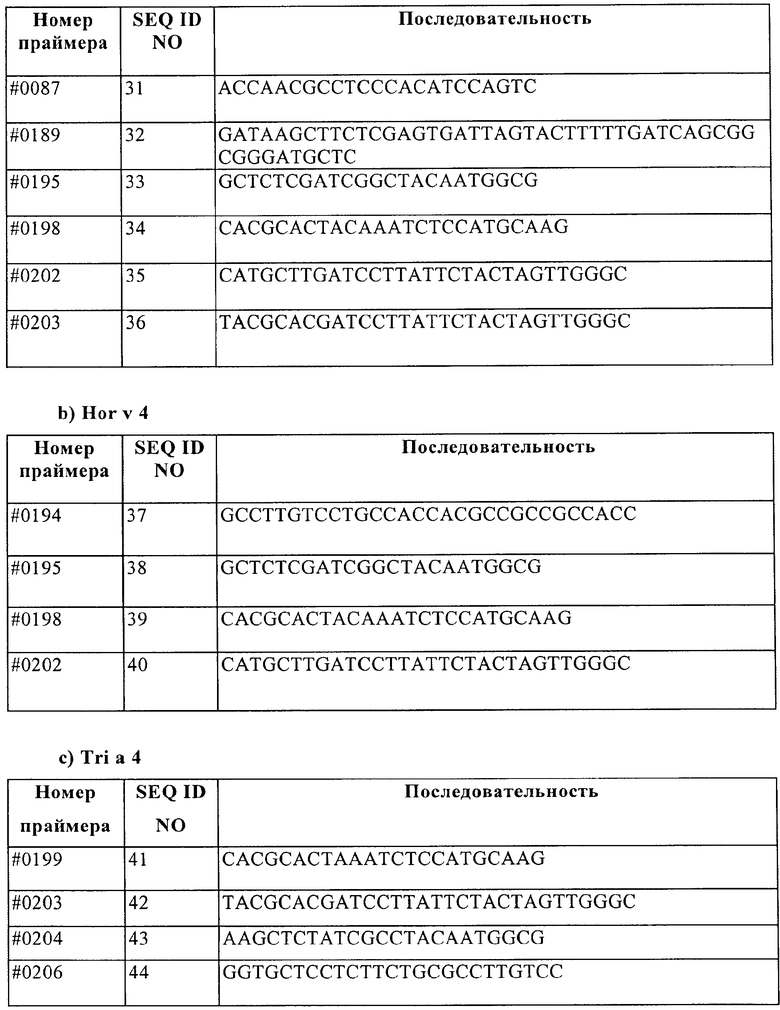
С помощью последовательностей Sec с 4, полученных так, как описано выше, были обнаружены гомологичные фрагменты EST в базе данных EST Hordeum vulgare. Эти последовательности перекрывались, но не давали полного гена. Однако со ссылкой на обнаруженные последовательности EST было возможным получить специфические для Hor v 4 праймеры, которые использовали для амплификации гена Hor v 4 из геномной ДНК.
В общей сложности было проанализировано 15 клонов.
4 клона были получены с помощью ПЦР при использовании праймеров #195 и#198.
4 клона были получены с помощью ПЦР при использовании праймеров #195 и#202.
3 клона были получены с помощью ПЦР при использовании праймеров #194 и #198.
4 клона были получены с помощью ПЦР при использовании праймеров #194 и#202.
Полученная белковая последовательность начиналась в пределах сигнальной последовательности Hor v 4 и простиралась до С-терминального конца белка (от аминокислоты 23 SEQ ID NO 6).
Tri a 4 из пшеницы
С помощью последовательностей Sec с 4, полученных так, как описано выше, были обнаружены гомологичные фрагменты EST в базе данных EST Triticum aestivum. Эти последовательности перекрывались, но не давали полного гена. Однако со ссылкой на обнаруженные последовательности EST было возможным получить специфические для Tri a 4 праймеры #199, #203, #204 и #206, которые использовали для амплификации гена Tri a 4 из геномной ДНК.
В общей сложности было проанализировано 13 клонов.
4 клона были получены с помощью ПЦР при использовании праймеров #204 и #203.
4 клона были получены с помощью ПЦР при использовании праймеров #204 и #199.
3 клона были получены с помощью ПЦР при использовании праймеров #206 и #203.
4 клона были получены с помощью ПЦР при использовании праймеров #206 и #199.
Полученная белковая последовательность начиналась в пределах сигнальной последовательности Tri a 4 и простиралась до С-терминального конца белка. Было обнаружено два варианта Tri а 4.01 (от аминокислоты 22 SEQ ID NO 8) и Tri a 4.02 (от аминокислоты 22 SEQ ID NO 10).
С целью получения рекомбинантных аллергенов в соответствии с изобретением последовательности ДНК в соответствии с SEQ ID NO 1, 3, 5, 7 и 9 были введены в экспрессионные векторы (например, pProEx, pSE 380). Для N-терминальных аминокислот, известных из секвенирования белка, использовали оптимизированные для E.coli кодоны.
После трансформации в Е.coli осуществляли экспрессию и очистку рекомбинантных аллергенов в соответствии с изобретением с помощью различных способов разделения, а полученные белки подвергали процессу повторной сборки.
Оба аллергена могут быть использованы для высокоспецифической диагностики аллергий на пыльцу трав. Такая диагностика может быть осуществлена in vitro путем определения специфических антител (IgE, IgG1-4, IgA) и реакции с эффекторными клетками, нагруженными IgE (например, базофилами крови), а также in vivo с помощью пробных кожных реакций и провокации реакции в органе.
Реакция аллергенов в соответствии с изобретением с Т-лимфоцитами пациентов, страдающих от аллергии на пыльцу трав, может быть определена с помощью специфической для аллергена стимуляции Т-лимфоцитов к пролиферации и синтезу цитокинов как при использовании Т-клеток в свежеполученных образцах лимфоцитов крови, так и на известных nSec с 4, nHor v 4 или nTri a 4 реактивных линиях и клонах Т-клеток.
Триплеты, кодирующие цистеины, были модифицированы с помощью сайт-специфического мутагенеза таким образом, что они кодировали другие аминокислоты, предпочтительно серин. Были получены как варианты, в которых индивидуальные цистеины были заменены, так и те, в которых различные комбинации двух остатков цистеина или все цистеины были модифицированы. Экспрессированные белки этих цистеиновых точечных мутантов обладают в значительной степени сниженной или нулевой реактивностью по отношению к IgE антителам, полученным от пациентов, страдающих аллергией, но реагируют с Т-лимфоцитами этих пациентов.
Настоящее изобретение, таким образом, также относится к молекуле ДНК, описанной выше или ниже, в которой множество или все остатки цистеина соответствующего полипептида были заменены другой аминокислотой с помощью сайт-специфического мутагенеза.
Иммуномодуляторная активность гипоаллергенных фрагментов, которые соответствуют полипептидам, содержащим эпитопы Т-клеток, и таких, которые представляют собой гипоаллергенные точечные мутанты (например, замены цистеинов), могут быть определены с помощью их реакции с Т-клетками, полученными от пациентов, страдающих аллергией на пыльцу трав.
Такие гипоаллергенные варианты или точечные мутанты цистеинов могут быть использованы в качестве препаратов для гипосенсибилизации пациентов, страдающих от аллергии, поскольку они реагируют с Т-клетками с равной эффективностью, но приводят к сниженным побочным эффектам, опосредованным IgE, благодаря сниженной или полностью отсутствующей IgE реактивности.
Если нуклеиновые кислоты, кодирующие гипоаллергенные варианты в соответствии с изобретением, или немодифицированные молекулы ДНК в соответствии с изобретением являются лигированными с экспрессионным вектором человека, то эти конструкции могут также использоваться в качестве препаратов для иммунотерапии (ДНК-вакцинации).
В завершение, настоящее изобретение относится к фармацевтическим композициям, которые включают, по крайней мере, одну молекулу ДНК, описанную выше, или, по крайней мере, один экспрессионный вектор, описанный выше, и необязательно дополнительные активные ингредиенты и/или вспомогательные вещества для иммунотерапевтической ДНК-вакцинации пациентов с аллергиями, в запуск которых вовлечены аллергены группы 4 из Роасеае, в частности nSec с 4, nHor v 4, nTri a 4, и/или для предотвращения таких аллергий.
Дополнительная группа фармацевтических композиций в соответствии с изобретением включает вместо ДНК, по крайней мере, один полипептид, описанный выше, и является приемлемой для диагностики и/или лечения указанных аллергий.
Фармацевтические композиции в контексте настоящего изобретения включают в качестве активных ингредиентов полипептид в соответствии с изобретением или экспрессионный вектор и/или его соответствующие фармацевтически приемлемые производные, в том числе их смеси во всех соотношениях. Активные ингредиенты в соответствии с изобретением могут быть внесены в приемлемую дозированную форму вместе, по крайней мере, с одним твердым, жидким и/или полужидким наполнителем или вспомогательным веществом и необязательно в сочетании с одним или более дополнительными активными ингредиентами.
Особенно приемлемыми вспомогательными веществами являются иммуностимуляторная ДНК или олигонуклеотиды, содержащие фрагменты CpG.
Эти композиции могут использоваться в качестве терапевтических агентов или диагностических агентов в медицине или ветеринарии. Приемлемые наполнители представляют собой органические или неорганические вещества, которые являются приемлемыми для парентерального введения и не оказывают вредного влияния на действие активного ингредиента в соответствии с изобретением. Приемлемыми для парентерального использования являются, в частности, растворы, предпочтительно на основе масел или водные растворы, а также суспензии, эмульсии или имплантаты. Активный ингредиент в соответствии с изобретением может также быть лиофилизированным, а полученные лиофилизаты используются, например, для получения инъекционных препаратов. Указанные композиции могут быть стерилизованными и/или включать вспомогательные вещества, такие как консерванты, стабилизаторы и/или смачивающие агенты, эмульгаторы, соли для модификации осмотического давления, буферные вещества и/или множество дополнительных активных ингредиентов.
Кроме того, препараты отсроченного высвобождения могут быть получены при использовании соответствующей композиции активного ингредиента в соответствии с изобретением, например, с помощью адсорбции на гидроокиси алюминия.
Изобретение, таким образом, служит для улучшения in vitro диагностики как части идентификации аллергенного компонента запуска в пределах специфического для пациента спектра чувствительности. Изобретение также служит для получения значительно усовершенствованных препаратов для специфической иммунотерапии аллергий на пыльцу трав.




































| название | год | авторы | номер документа |
|---|---|---|---|
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК И ПОЛУЧЕНИЕ АЛЛЕРГЕНА ПЫЛЬЦЫ ТРАВ Phl p 4 С ПОМОЩЬЮ РЕКОМБИНАНТНЫХ СПОСОБОВ | 2003 |
|
RU2327739C2 |
| ПРОИЗВОДНЫЕ PhI p 5а, ОБЛАДАЮЩИЕ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ | 2004 |
|
RU2368620C2 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2658767C1 |
| ВАРИАНТЫ ГРУППЫ 5 АЛЛЕРГЕНОВ ЗЛАКОВЫХ СО СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ ВСЛЕДСТВИЕ МУТАГЕНЕЗА ОСТАТКОВ ПРОЛИНА | 2010 |
|
RU2575606C2 |
| ВАРИАНТ АЛЛЕРГЕНА ГРУППЫ I ИЗ Роасеае, ХАРАКТЕРИЗУЮЩИЙСЯ СНИЖЕННОЙ АЛЛЕРГЕННОСТЬЮ И СОХРАНЕННОЙ Т-КЛЕТОЧНОЙ РЕАКТИВНОСТЬЮ (ВАРИАНТЫ), КОДИРУЮЩАЯ ЕГО МОЛЕКУЛА ДНК И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2409589C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК И ПОЛУЧЕНИЕ АЛЛЕРГЕНА ЗЛАКОВЫХ РЕКОМБИНАНТНЫМ СПОСОБОМ | 2000 |
|
RU2238321C2 |
| МОДИФИКАЦИИ АЛЛЕРГЕНОВ ГРУППЫ 6 POACEAE (МЯТЛИКОВЫХ), ИМЕЮЩИХ ПОНИЖЕННУЮ АЛЛЕРГЕННОСТЬ БЛАГОДАРЯ МУТАГЕНЕЗУ ПРОЛИНОВЫХ ОСТАТКОВ | 2010 |
|
RU2607373C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ АЛЛЕРГЕННЫХ БЕЛКОВ И ПЕПТИДОВ | 2009 |
|
RU2519674C2 |
| НОВЫЕ АЛЛЕРГЕНЫ ПШЕНИЦЫ | 2008 |
|
RU2502742C2 |
| ГИПОАЛЛЕРГИЧЕСКИЕ ВАРИАНТЫ Mal d 1, ГЛАВНОГО АЛЛЕРГЕНА Malus domectica | 2012 |
|
RU2624030C2 |
Настоящее изобретение относится к биотехнологии. Описана молекула ДНК, кодирующая основной аллерген пыльцы злаковых, имеющая нуклеотидную последовательность, выбранную из последовательностей, представленных в описании. Предложена молекула ДНК, которая гибридизуется с описанной молекулой ДНК в жестких условиях и имеет происхождение от последовательностей ДНК из видов Роасеае. Представлены молекула ДНК, кодирующая иммуномодуляторный, реактивный по отношению к Т-клеткам фрагмент основного аллергена пыльцы злаковых, и соответствующая ей модифицированная молекула. Описан рекомбинантный ДНК экспрессионный вектор, включающий описанную молекулу ДНК. Раскрыт способ получения полипептида, который кодируется последовательностью ДНК описанной молекулы. Раскрыты основные аллергены пыльцы злаковых, имеющие последовательности, раскрытые в описании. Предложена фармацевтическая композиция, включающая по крайней мере один из раскрытых основных аллергенов пыльцы злаковых, вспомогательные вещества и необязательно дополнительные активные ингредиенты, для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых. Изобретение может быть использовано для получения белков, используемых для in vitro и in vivo диагностики аллергий на пыльцу. 13 н. и 4 з.п. ф-лы, 1 табл.
1. Молекула ДНК, кодирующая основной аллерген пыльцы злаковых, имеющая нуклеотидную последовательность, выбранную из последовательностей в соответствии с SEQ ID NO 1, 3, 7 и 9.
2. Молекула ДНК, которая гибридизуется с молекулой ДНК по п.1 в жестких условиях и имеет происхождение от последовательностей ДНК из видов Роасеае.
3. Молекула ДНК, кодирующая иммуномодуляторный, реактивный по отношению к Т-клеткам фрагмент основного аллергена пыльцы злаковых и соответствующая частичной последовательности или комбинации частичных последовательностей, выбранных из последовательностей в соответствии с SEQ ID NO 1, 3, 7 и 9.
4. Молекула ДНК, кодирующая иммуномодуляторный, реактивный по отношению к Т-клеткам фрагмент основного аллергена пыльцы злаковых, имеющая нуклеотидную последовательность последовательностей ДНК молекул по любому из пп.1, 2 и 3, где указанная нуклеотидная последовательность является модифицированной с помощью мутации индивидуальных кодонов, удаления или добавления.
5. Молекула ДНК по п.4, где указанная мутация приводит к замене одного, множества или всех цистеинов соответствующего полипептида другой аминокислотой.
6. Рекомбинантный ДНК экспрессионный вектор, включающий молекулу ДНК в соответствии с одним или более пп.1-5, функционально связанную с последовательностью, которая контролирует экспрессию.
7. Способ получения полипептида, который кодируется последовательностью ДНК в соответствии с одним или более пп.1-5, путем культивирования организма хозяина, трансформированного ДНК молекулой в соответствии с одним или более пп.1-5 или вектором экспрессии по п.6 и изоляции соответствующего полипептида из культуры.
8. Основной аллерген пыльцы злаковых, имеющий аминокислотную последовательность, выбранную из SEQ ID NO 2, 4, 8 и 10.
9. Основной аллерген пыльцы злаковых по п.8, имеющий аминокислотную последовательность, выбранную из группы
в соответствии с SEQ ID NO 2 или 4, которая начинается с аминокислоты 23,
в соответствии с SEQ ID NO 8 или 10, которая начинается с аминокислоты 22.
10. Основной аллерген пыльцы злаковых по п.8 или 9 в качестве лекарственного средства для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых.
11. Фармацевтическая композиция, включающая по крайней мере один основной аллерген пыльцы злаковых по п.10, вспомогательные вещества и необязательно дополнительные активные ингредиенты, для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых.
12. Применение по крайней мере одного основного аллергена пыльцы злаковых по п.10 для получения лекарственного средства для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых, и/или для предотвращения таких аллергий.
13. Применение по крайней мере одного основного аллергена пыльцы злаковых по п.10 для получения лекарственного средства для диагностики аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых.
14. Молекула ДНК в соответствии с одним или более пп.1-5 в качестве лекарственного средства для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых.
15. Рекомбинантный экспрессионный вектор по п.6 в качестве лекарственного средства для лечения аллергий, в запуск которых вовлечены основные аллергены пыльцы злаковых.
16. Фармацевтическая композиция, включающая по крайней мере одну молекулу ДНК по п.14 или по крайней мере один экспрессионный вектор по п.15, вспомогательные вещества и необязательно дополнительные активные ингредиенты для иммунотерапевтической ДНК вакцинации пациентов с аллергиями, в запуск которых вовлечены основные аллергены пыльцы злаковых и/или для предотвращения таких аллергий.
17. Применение по крайней мере одной молекулы ДНК по п.14 или по крайней мере одного экспрессионного вектора по п.15 для получения лекарственного средства для иммунотерапевтической ДНК вакцинации пациентов с аллергиями, в запуск которых вовлечены основные аллергены пыльцы злаковых, и/или для предотвращения таких аллергий.
| DATA BASE, GenBank, BU 996834, 23.10.2002 | |||
| RU 2001130165 A, 20.07.2003. |
Авторы
Даты
2009-11-20—Публикация
2004-12-01—Подача