Область техники
Настоящее изобретение относится к новым производным пирроло[3,2-c]пиридина или их фармацевтически приемлемым солям, которые обладают превосходной ингибирующей активностью в отношении секреции желудочной кислоты, к способам их получения и фармацевтическим композициям, включающим их.
Уровень техники
Заболевание пептическая язва желудка возникает при усилении агрессивных факторов, вызывающих секрецию желудочной кислоты, или ослаблении защитных факторов слизистой желудка. Для лечения пептической язвенной болезни использовались разнообразные лекарственные средства, такие как антациды, антихолинергические агенты, антагонисты Н2-рецептора и ингибиторы протонного насоса. Появление омепразола как ингибитора протонного насоса вновь возбудило исследовательскую деятельность в данной области.
Однако отмечено, что ингибирование протонного насоса с помощью омепразола является необратимым, что влечет за собой длительное ингибирование секреции желудочной кислоты, что может вызывать побочные эффекты. Соответственно делаются различные попытки разработать обратимый ингибитор протонного насоса. Например, в WO 98/37080 (AstraZeneca AB), WO 00/17200 (Byk Gulden Lomberg Chem.) и патенте США № 4450164 (Schering Corporation) раскрываются производные имидазопиридина в качестве обратимых ингибиторов протонного насоса. Далее, в европейском патенте № 775120 (Yuhan Corp.) раскрываются производные пиримидина.
Раскрытие изобретения
Техническая задача
Настоящее изобретение предоставляет новые производные пирроло[3,2-c]пиридина или их фармацевтически приемлемые соли, которые оказывают превосходное ингибирующее действие на протонный насос и обладают способностью обеспечивать обратимое ингибирование протонного насоса.
Техническое решение
Согласно одному из аспектов настоящего изобретения предоставляются производные пирроло[3,2-c]пиридина или их фармацевтически приемлемые соли.
Далее, согласно еще одному аспекту настоящего изобретения, предоставляется способ получения производных пирроло[3,2-c]пиридина или их фармацевтически приемлемых солей.
Далее, согласно еще одному аспекту настоящего изобретения, предоставляется фармацевтическая композиция, включающая производное пирроло[3,2-c]пиридина или его фармацевтически приемлемую соль в качестве активного ингредиента и фармацевтически приемлемый носитель.
Наилучший способ осуществления изобретения
В соответствии с одним из аспектов настоящего изобретения предоставляется соединение формулы (I) или его фармацевтически приемлемая соль:
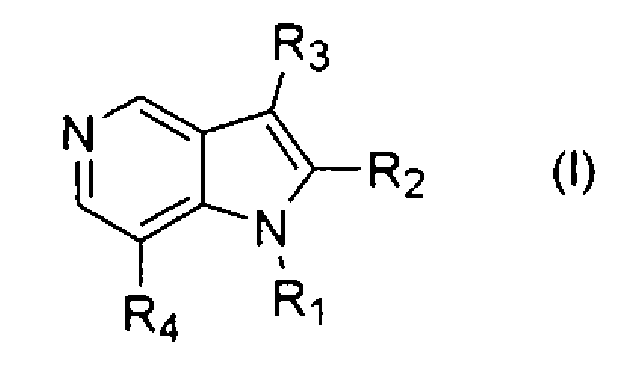
в которой
R1 представляет водород; линейную или разветвленную С1-С6алкильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из С1-С5алкокси, С3-С7циклоалкила, 1,3-диоксоланила, циано, нафтила,
С2-С5алкенилокси, и 2,3-дигидробензо[1,4]диоксинила; С2-С6алкенильную группу; С2-С6алкинильную группу; или бензильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, С1-С3алкила, С1-С3алкокси, циано, С1-С3алкоксикарбонила и трифтор-С1-С3алкила,
R2 представляет линейную или разветвленную С1-С6алкильную группу,
R3 представляет водород; линейную или разветвленную С1-С6алкильную группу, необязательно замещенную гидроксилом или циано, и
R4 представляет 1,2,3,4-тетрагидроизохинолинильную группу, необязательно замещенную одним или более галогенами или С1-С5алкилами; бензилоксигруппу, необязательно замещенную одним или более галогенами или С1-С5алкилами; или бензиламиногруппу, необязательно замещенную галогеном.
Среди соединений формулы (I) или их фармацевтически приемлемых солей настоящего изобретения предпочтительными являются соединения, в которых
R1 представляет водород; линейную или разветвленную С1-С6алкильную группу; С1-С3алкильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из метокси, циклопропила, циклобутила, 1,3-диоксоланила, циано, нафтила, С2-С5алкенилокси и 2,3-дигидробензо[1,4]диоксинила; С2-С6алкенильную группу; С2-С6алкинильную группу; или бензильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, метила, метокси, циано, метоксикарбонила и трифторметила,
R2 представляет метильную группу,
R3 представляет водород; метильную группу; гидроксиметильную группу; цианометильную группу, и
R4 представляет 1,2,3,4-тетрагидроизохинолинил; 1-метил-6-фтор-1,2,3,4-тетрагидроизохинолинил; бензилоксигруппу, необязательно замещенную одним или более галогенами или метилами; или бензиламиногруппу, необязательно замещенную одним или более галогенами.
Более предпочтительными соединениями формулы (I) или их фармацевтически приемлемыми солями настоящего изобретения являются:
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-этил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-аллил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-(3-метоксибензил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(4-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-трифторметилбензил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-изобутил-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2,5-диметилбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-хлорбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(2,4-дихлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-бензилокси-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(2-метилбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-бензиламино-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-6-фтор-1-метил-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-[1-(4-фторбензил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 1-(4-метоксикарбонилбензил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-[1-(2,3-дигидробензо[1,4]диоксин-6-илметил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 1-(2-метоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-нафтилметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-винилоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(1,3-диоксолан-2-илметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-изобутил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-циклобутилметил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-(2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-(1-циклопропилметил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-(1-этил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 3-[7-(3,4-дигидро-1H-изохинолин-2-ил)-2,3-диметилпирроло[3,2-c]пиридин-1-илметил]бензонитрила;
гидрохлорид [7-(3,4-дигидро-1H-изохинолин-2-ил)-2,3-диметилпирроло[3,2-c]пиридин-1-ил]ацетонитрила;
гидрохлорид 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-3-гидроксиметил-2-метил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-(1-бензил-2-метил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 1-бензил-7-(3,4-дигидро-1H-изохинолин-2-ил)-2-метил-1H-пирроло[3,2-c]пиридин-3-карбонитрила.
Среди них особенно предпочтительными соединениями формулы (I) или их фармацевтически приемлемыми солями являются
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-этил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-аллил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-(3-метоксибензил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(4-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-трифторметилбензил)-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-изобутил-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2,5-диметилбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-хлорбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-[1-(4-фторбензил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 1-(4-метоксикарбонилбензил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-[1-(2,3-дигидробензо[1,4]диоксин-6-илметил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 1-(2-метоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-нафтилметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(2-винилоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-(1,3-диоксолан-2-илметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-изобутил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 1-циклобутилметил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина;
гидрохлорид 2-(2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-(1-циклопропилметил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 2-(1-этил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорид 3-[7-(3,4-дигидро-1H-изохинолин-2-ил)-2,3-диметилпирроло[3,2-c]пиридин-1-илметил]бензонитрила.
Соединения настоящего изобретения могут быть в форме фармацевтически приемлемых нетоксичных солей. Нетоксичные соли могут включать в себя общепринятые кислотно-аддитивные соли, используемые в области противоязвенных агентов, например соли, получаемые из неорганической кислоты, такой как соляная кислота, бромистоводородная кислота, серная кислота, сульфаминовая кислота, фосфорная кислота или азотная кислота, и органической кислоты, такой как уксусная, пропионовая, янтарная, гликолевая, стеариновая, лимонная, малеиновая, малоновая, метансульфоновая, винная, яблочная, фенилуксусная, глутаминовая, бензойная, салициловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, щавелевая или трифторуксусная кислота. Такие кислотно-аддитивные соли могут быть получены в соответствии с любым из общепринятых способов.
Настоящее изобретение охватывает способ получения соединения формулы (I) или его фармацевтически приемлемой соли в соответствии со следующей схемой 1:
Схема 1
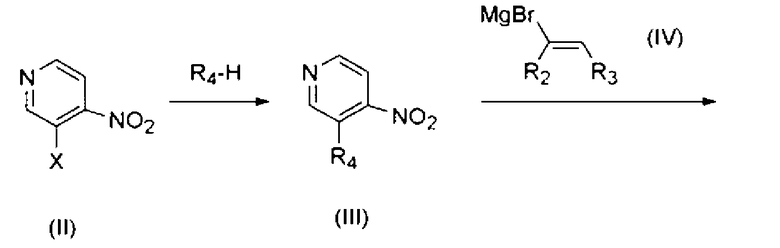
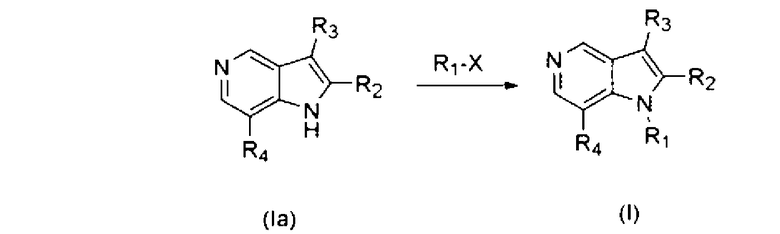
в которой R1, R2, R3 и R4 имеют значения, определенные выше, и Х представляет галоген.
В частности, соединение формулы (I) или его фармацевтически приемлемая соль могут быть получены с использованием процесса, который включает в себя взаимодействие соединения формулы (II) с R4-Н, с получением соединения формулы (III), взаимодействие соединения формулы (III) с соединением формулы (IV), с получением соединения формулы (Ia), и взаимодействие соединения формулы (Ia) с R1-X, с получением соединения формулы (I).
В процессах схемы 1 соединения формулы (II) и (IV) являются коммерчески доступными. Взаимодействие соединения формулы (II) и R4-Н может проводиться в присутствии основания, такого как гидрид натрия, трет-бутоксид калия, карбонат натрия или гидроксид калия. Далее, взаимодействие может осуществляться в органическом растворителе, таком как безводный тетрагидрофуран и N,N-диметилформамид, и при комнатной температуре или при нагревании, например, при температуре 40°С~140°С.
Реакция циклизации соединения формулы (III) и соединения формулы (IV) может проводиться в органическом растворителе, например безводном тетрагидрофуране. Далее реакция может осуществляться при температуре -78°С~-20°С или при комнатной температуре.
Соединение формулы (Ia) подвергается взаимодействию с R1-Х, с получением соединения формулы (I). Взаимодействие соединения формулы (Ia) и R1-Х может проводиться в присутствии основания, такого как гидрид натрия или трет-бутоксид калия. Далее, взаимодействие может осуществляться в органическом растворителе, таком как тетрагидрофуран или N,N-диметилформамид, и при комнатной температуре или при температуре 40°С~100°С. Для того чтобы увеличить скорость реакции и/или реакционный выход, можно использовать каталитическое количество 18-краун-6.
В соответствии с еще одним аспектом настоящего изобретения, соединение формулы (Iс) или его фармацевтически приемлемая соль может получаться в соответствии со следующей схемой 2:
Схема 2
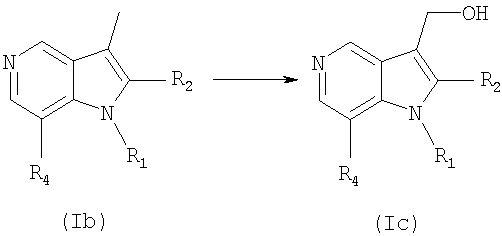
в которой R1, R2 и R4 имеют значения, определенные выше.
В частности, соединение формулы (Iс) или его фармацевтически приемлемая соль могут быть получены с использованием процесса, который включает в себя гидролиз соединения формулы (Ib) в присутствии аммониевого нитрата церия (IV) и уксусной кислоты.
В соответствии с еще одним аспектом настоящего изобретения соединение формулы (Iе) или его фармацевтически приемлемая соль могут получаться с использованием процесса, который включает проведение реакции Манниха соединения формулы (Id), с последующей реакцией получающегося продукта с цианидом натрия или цианидом калия, с получением соединения формулы (Iе) в соответствии со следующей схемой 3:
Схема 3
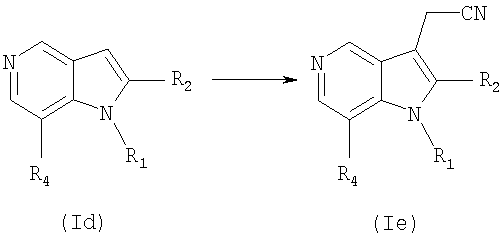
в которой R1, R2 и R4 имеют значения, определенные выше.
Настоящее изобретение далее включает фармацевтическую композицию, включающую терапевтически эффективное количество любого из соединений формулы (I), определенной выше, или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Соединение формулы (I) или его фармацевтически приемлемая соль могут использоваться для предотвращения и лечения желудочно-кишечных воспалительных заболеваний и связанных с желудочной кислотой заболеваний млекопитающих, включая людей, таких как гастрит, язва желудка, язва двенадцатиперстной кишки, рефлюкс-эзофагит и синдром Золлингера-Эллисона. Кроме того, соединения настоящего изобретения или их соли могут использоваться для лечения других желудочно-кишечных расстройств, при которых желателен желудочный антисекреторный эффект, например, у пациентов с гастриномами и у пациентов с острым верхним желудочно-кишечным кровотечением. Соединения настоящего изобретения или их соли могут также использоваться для пациентов в ситуациях интенсивного ухода за ними, и до- и послеоперативно для предотвращения кислотной аспирации и стрессового изъязвления.
Композиция настоящего изобретения может включать в свой состав добавки, такие как лактоза или кукурузный крахмал, смазывающие агенты, такие как стеарат магния, эмульгаторы, суспендирующие агенты, стабилизаторы и изотонические агенты. Если необходимо, могут добавляться подслащивающие агенты и/или вкусовые или ароматизирующие агенты.
Композиция настоящего изобретения может вводиться перорально или парентерально, включая внутривенный, интраперитональный, подкожный, ректальный и местный способы введения. Поэтому композиция настоящего изобретения может формулироваться в разнообразных формах, таких как таблетки, капсулы, водные растворы или суспензии. В случае таблеток для перорального использования обычно добавляются носители, такие как лактоза, кукурузный крахмал и смазочные агенты, например стеарат магния. В случае капсул для перорального введения в качестве разбавителя может использоваться лактоза и/или высушенный кукурузный крахмал. Когда для перорального использования требуется водная суспензия, активный ингредиент может комбинироваться с эмульгирующим и/или суспендирующим агентами. При желании могут добавляться некоторые подслащивающие и/или вкусовые или ароматизирующие агенты. Для внутримышечного, интраперитонеального, подкожного и внутривенного использования обычно приготавливаются стерильные растворы активного ингредиента, и следует подходящим образом устанавливать и буферировать рН растворов. Для внутривенного использования следует регулировать общую концентрацию растворенных веществ, чтобы сделать препарат изотоническим. Композиция настоящего изобретения может быть в форме водного раствора, содержащего фармацевтически приемлемые носители, например солевой раствор, при уровне рН 7,4. Растворы могут вводиться во внутримышечный ток крови пациента с помощью локальной инъекции болюсов.
Соединения настоящего изобретения могут вводиться пациенту в эффективном количестве в интервале примерно от 0,1 мг/кг до примерно 500 мг/кг в день. Конечно, дозировка может меняться в зависимости от возраста пациента, веса, восприимчивости или симптомов.
Следующие примеры предоставляются лишь для целей иллюстрации, и не предназначаются для ограничения объема изобретения.
Получение 1. 3-(4-Фторбензилокси)-4-нитропиридин
Стадия 1: 3-Бромпиридин-N-оксид
30% перекись водорода (41 мл) добавляли к раствору 3-бромпиридина (32 г, 0,202 моль) в уксусной кислоте (120 мл). Реакционную смесь перемешивали при 70°С~80°С в течение 9 часов, концентрировали при пониженном давлении, подщелачивали избытком карбоната натрия, а затем разбавляли метиленхлоридом (100 мл). Реакционную смесь фильтровали для удаления нерастворенных неорганических веществ. Получающийся органический слой сушили безводным сульфатом магния и затем концентрировали при пониженном давлении. Получающийся остаток использовали на последующей стадии без дополнительной очистки.
Стадия 2: 3-Бром-4-нитропиридин-N-оксид
Концентрированную азотную кислоту (128 мл) и концентрированную серную кислоту (77 мл) добавляли медленно к раствору 3-бромпиридин-N-оксида (31,9 г, 181,0 ммоль), полученного на стадии 1, в концентрированной серной кислоте (77 мл) при поддержании температуры при 0°С~5°С. Реакционную смесь перемешивали при 90°С в течение 2 часов, а затем охлаждали до комнатной температуры. Реакционную смесь добавляли к 1000 мл ледяной воды, а затем доводили до рН 8 50% раствором гидроксида натрия. Получающийся осадок отфильтровывали и сушили, с получением указанного в заголовке соединения в виде желтого твердого вещества (29,3 г, 72,0%).
ТСХ; н-гексан/этилацетат = 1/1 (об./об.); Rf=0,3
1H-ЯМР (CDCl3) δ 8,6 (с, 1H), 8,4-7,9 (м, 2H).
Стадия 3: 3-(4-Фторбензилокси)-4-нитропиридин-N-оксид
3-Бром-4-нитропиридин-N-оксид (2,0 г, 9,05 ммоль), полученный на стадии 2, 4-фторбензиловый спирт (1,48 мл, 13,57 ммоль), карбонат калия (1,25 г, 9,05 ммоль) и гидроксид калия (2,03 г, 36,2 ммоль) добавляли к 500 мл безводного толуола. К реакционной смеси добавляли трис[2-(2-метоксиэтокси)этил]амин (0,29 мл, 0,90 ммоль), и смесь затем перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь фильтровали и концентрировали. Получающийся в результате осадок очищали с помощью колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/1 (об./об.) с получением указанного в заголовке соединения в виде белого твердого вещества (500 мг, 14,6%).
ТСХ; н-гексан/этилацетат = 1/1 (об./об.); Rf=0,2
1H-ЯМР (CDCl3) δ 8,5 (с, 1H), 8,33 (д, 1H), 8,20 (м, 2H), 8,17 (д, 1H), 8,15 (м, 2H), 5,21 (с, 2H).
Стадия 4: 3-(4-Фторбензилокси)-4-нитропиридин
Трихлорид фосфора (3,65 мл, 41,80 ммоль) медленно добавляли при 0°С к раствору 3-(4-фторбензилокси)-4-нитропиридин-N-оксида (7,72 г, 27,87 ммоль), полученного на стадии 3, в 500 мл этилацетата. Реакционную смесь перемешивали в течение 1 часа при комнатной температуре, а затем подщелачивали 2 н. раствором гидроксида натрия. Отделенный органический слой сушили безводным сульфатом магния и затем концентрировали при пониженном давлении. Получающийся в результате остаток использовали на последующей стадии без дополнительной очистки.
Получение 2. 2-(4-Нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолин
Стадия 1: 2-(4-Нитро-1-оксипиридин-3-ил)-1,2,3,4-тетрагидроизохинолин
3-Бром-4-нитропиридин-N-оксид (1,0 г, 4,53 ммоль), полученный на стадии 2 получения 1, добавляли к смеси трет-бутанола (30 мл), трет-бутоксида калия (507 мг, 4,53 ммоль) и 1,2,3,4-тетрагидроизохинолина (0,79 мл, 6,34 ммоль). Реакционную смесь перемешивали в течение 12 часов при комнатной температуре. К реакционной смеси добавляли воду (10 мл), и смесь затем экстрагировали этилацетатом (100 мл). Отделенный органический слой сушили безводным сульфатом магния и затем концентрировали при пониженном давлении. Получающийся в результате осадок очищали с помощью колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/1 (об./об.), с получением указанного в заголовке соединения в виде желтого твердого вещества (600 мг).
ТСХ; н-гексан/этилацетат = 1/1 (об./об.); Rf=0,2
1H-ЯМР (CDCl3) δ 8,13 (с, 1H), 7,83 (д, 1H), 7,71 (д, 1H), 7,24 (м, 3H), 7,09 (м, 1H), 4,32 (с, 2H), 3,46 (т, 2H), 3,06 (т, 2H).
Стадия 2: 2-(4-Нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолин
Трихлорид фосфора (3,81 мл, 28,9 ммоль) медленно добавляли при 0°С к раствору 2-(4-нитро-1-оксипиридин-3-ил)-1,2,3,4-тетрагидроизохинолина (8,5 г, 25,3 ммоль), полученного на стадии 1, в 100 мл этилацетата. Реакционную смесь перемешивали в течение 1 часа при комнатной температуре, а затем подщелачивали 2 н. раствором гидроксида натрия. Отделенный органический слой сушили безводным сульфатом магния и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде желтого твердого вещества (5,26 г, 65,3%). Продукт использовали на последующей стадии без дополнительной очистки.
Пример 1. Гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
3-(4-Фторбензилокси)-4-нитропиридин (6,6 г, 26,59 ммоль), полученный в получении 1, растворяли в безводном тетрагидрофуране (300 мл) в атмосфере азота. При -78°С 1-метил-1-пропенилмагнийбромид (0,5М в растворе тетрагидрофурана, 80 мл) добавляли к раствору, который затем перемешивали в течение 5 часов при -20°С. К реакционной смеси добавляли 20 мл 20% раствора хлорида аммония, и смесь затем экстрагировали дважды этилацетатом (200 мл). Отделенный органический слой сушили безводным сульфатом магния и затем концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол = 10/1 (об./об.), и затем концентрировали для удаления растворителя. Получающийся осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (910 мг, 13,5%).
ТСХ; этилацетат/метанол = 10/1 (об./об.); Rf=0,2
1H-ЯМР (CDCl3) δ 8,46 (с, 1H), 8,20 (с, 1H), 7,94 (с, 1H), 7,43 (м, 2H), 7,09 (м, 2H), 5,18 (с, 2H), 2,36 (с, 3H), 2,25 (с, 3H).
Пример 2. Гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1H-пирроло[3,2-c]пиридина
Соединение (25,0 мг, 0,072 ммоль), полученное в примере 1, обрабатывали насыщенным раствором бикарбоната натрия с получением 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина (20,0 мг, 0,073 ммоль). В безводном тетрагидрофуране (2 мл) растворяли 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридин (20,0 мг, 0,073 ммоль), трет-бутоксид калия (11,0 мг, 0,109 ммоль) и каталитическое количество 18-краун-6. К раствору добавляли пропаргилбромид (0,08 мл, 0,109 ммоль). Реакционную смесь перемешивали в течение 12 часов при комнатной температуре, а затем концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол = 10/1 (об./об.), и затем концентрировали для удаления растворителя. Получающийся в результате осадок растворяли в 1 мл этилацетата и насыщали газообразным хлороводородом. Получающийся осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (8,5 мг, 40,1%).
ТСХ; этилацетат/метиленхлорид/метанол = 10/1/1 (об./об.); Rf=0,4
1H-ЯМР (CDCl3) δ 8,55 (с, 1H), 7,94 (с, 1H), 7,49 (д, 2H), 7,14 (д, 2H), 5,30 (с, 2H), 5,21 (с, 2H), 2,50 (с, 3H), 2,42 (с, 1H), 2,32 (с, 3H).
Примеры с 3 по 17
Соединения, указанные в заголовках примеров 3-17, получали с помощью тех же процедур, что в примере 2, с использованием 7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина, полученного обработкой соединения примера 1 насыщенным раствором бикарбоната натрия; и иодэтана, (бромметил)циклопропана, аллилбромида, 3-фторбензилхлорида, 3-метоксибензилхлорида, 4-метилбензилхлорида, 4-фторбензилбромида, 4-(трифторметил)бензилбромида, 1-иод-2-метилпропана, бензилбромида, 2,5-диметилбензилхлорида, 2-хлорбензилхлорида, 2-фторбензилхлорида, 1-иодпропана или 2-бромэтилметилового эфира.
Пример 3. Гидрохлорид 1-этил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,55 (д, 1H), 7,90 (д, 1H), 7,44 (т, 2H), 7,14 (т, 2H), 5,21 (с, 2H), 4,40 (м, 2H), 2,41 (с, 3H), 2,30 (с, 3H), 1,32 (т, 3H); (выход: 56,5%).
Пример 4. Гидрохлорид 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,55 (с, 1H), 7,95 (с, 1H), 7,46 (д, 2H), 7,17 (д, 2H), 5,28 (с, 2H), 4,29 (д, 2H), 2,44 (с, 3H), 2,32 (с, 3H), 1,21 (м, 1H), 0,48 (д, 2H), 0,22 (д, 2H); (выход: 58,4%).
Пример 5. Гидрохлорид 1-аллил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,89 (c, 1H), 8,51 (c, 1H), 7,55 (м, 2H), 7,08 (м, 2H), 5,89 (м, 1H), 5,60 (c, 2H), 5,56 (c, 2H), 5,49 (д, 1H), 5,18 (д, 1H), 2,37 (c, 3H), 2,35 (c, 3H); (выход: 69,7%).
Пример 6. Гидрохлорид 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,62 (c, 1H), 8,01 (м, 2H), 7,61 (м, 2H), 6,79 (м, 4H), 6,49 (м, 1H), 5,62 (c, 2H), 5,01 (c, 2H), 2,25 (c, 6H); (выход: 85,4%).
Пример 7. Гидрохлорид 7-(4-фторбензилокси)-1-(3-метоксибензил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,60 (c, 1H), 7,89 (м, 1H), 7,48 (м, 1H), 6,96 (м, 5H), 6,27 (c, 2H), 5,62 (c, 2H), 5,11 (c, 2H), 3,73 (c, 3H), 2,34 (c, 6H); (выход: 45,8%).
Пример 8. Гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,61 (c, 1H), 7,51 (c, 1H), 7,10 (c, 4H), 6,98 (c, 2H), 6,65 (c, 2H), 5,62 (c, 2H), 5,30 (c, 2H), 2,34 (c, 6H); (выход: 35,7%).
Пример 9. Гидрохлорид 1-(4-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,60 (д, 1H), 7,91 (c, 1H), 7,10 (м, 2H), 7,00 (м, 4H), 6,71 (м, 2H), 5,60 (c, 2H), 5,09 (c, 2H), 2,34 (c, 3H), 2,33 (c, 3H); (выход: 66,2%).
Пример 10. Гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-(4-трифторметилбензил)-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,63 (д, 1H), 7,92 (д, 1H), 7,55 (д, 2H), 7,02 (м, 4H), 6,82 (д, 2H), 5,67 (c, 2H), 5,06 (c, 2H), 2,36 (c, 3H), 2,33 (c, 3H); (выход: 33,2%).
Пример 11. Гидрохлорид 7-(4-фторбензилокси)-1-изобутил-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,53 (д, 1H), 7,91 (д, 1H), 7,44 (т, 2H), 7,15 (т, 2H), 5,16 (c, 2H), 4,11 (д, 2H), 2,38 (c, 3H), 2,30 (c, 3H), 2,04 (м, 1H), 0,72 (c, 3H), 0,70 (c, 3H); (выход: 34,1%).
Пример 12. Гидрохлорид 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,34 (c, 1H), 7,52 (c, 1H), 7,37 (м, 2H), 7,09 (м, 2H), 7,04 (м, 3H), 6,97 (м, 2H), 5,66 (c, 2H), 5,26 (c, 2H), 2,36 (c, 3H), 2,34 (c, 3H); (выход: 45,8%).
Пример 13. Гидрохлорид 1-(2,5-диметилбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,62 (д, 1H), 7,85 (д, 1H), 7,45 (м, 1H), 7,07 (м, 2H), 6,92 (м, 4H), 5,46 (c, 2H), 4,98 (c, 2H), 2,48 (c, 3H), 2,31 (c, 3H), 2,12 (c, 3H), 2,02 (c, 3H); (выход: 49,8%).
Пример 14. Гидрохлорид 1-(2-хлорбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,62 (c, 1H), 7,89 (c, 1H), 7,41 (д, 2H), 7,14 (т, 2H), 6,95 (д, 4H), 6,07 (c, 1H), 5,66 (c, 2H), 5,03 (c, 2H), 2,37 (c, 3H), 2,31 (c, 3H); (выход: 58,9%).
Пример 15. Гидрохлорид 1-(2-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,62 (c, 1H), 7,92 (c, 1H), 7,31 (м, 1H), 7,05 (м, 6H), 6,31 (c, 1H), 5,69 (c, 2H), 5,10 (c, 2H), 2,36 (c, 3H), 2,34 (c, 3H); (выход: 49,8%).
Пример 16. Гидрохлорид 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,34 (c, 1H), 8,11 (c, 1H), 7,61 (м, 2H), 7,17 (м, 2H), 5,32 (c, 2H), 4,39 (c, 2H), 2,53 (c, 3H), 2,33 (c, 3H), 1,81 (м, 2H), 0,79 (д, 3H); (выход: 61,1%).
Пример 17. Гидрохлорид 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,54 (c, 1H), 7,91 (c, 1H), 7,44 (д, 2H), 7,15 (д, 2H), 5,30 (c, 2H), 5,21 (т, 2H), 3,57 (д, 2H), 3,21 (c, 3H), 2,46 (c, 3H), 2,05 (c, 3H); (выход: 54,3%).
Пример 18. Гидрохлорид 7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
Стадия 1: 3-(4-Хлорбензилокси)-4-нитропиридин
В соответствии с теми же процедурами, что на стадиях 3 и 4 получения 1, за исключением использования 3-бром-4-нитропиридин-N-оксида, полученного на стадии 2 получения 1, и 4-хлорбензилового спирта получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 25,3%)
1H-ЯМР (CDCl3) δ 8,40 (c, 1H), 8,31 (д, 1H), 8,25 (м, 2H), 8,19 (д, 1H), 8,13 (м, 2H), 5,20 (c, 2H).
Стадия 2: Гидрохлорид 7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
В соответствии с теми же процедурами, что в примере 1, за исключением использования 3-(4-хлорбензилокси)-4-нитропиридина, полученного на стадии 1, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 13,4%).
1H-ЯМР (CDCl3) δ 8,43 (c, 1H), 8,19 (c, 1H), 7,93 (c, 1H), 7,44 (м, 2H), 7,10 (м, 2H), 5,15 (c, 2H), 2,37 (c, 3H), 2,24 (c, 3H).
Пример 19. Гидрохлорид 1-бензил-7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
В соответствии с теми же процедурами, что в примере 2, за исключением использования 7-(4-хлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина, полученного обработкой соединения примера 18 насыщенным раствором бикарбоната натрия и бензилбромидом, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 38,8%).
1H-ЯМР (CDCl3) δ 8,33 (c, 1H), 7,50 (c, 1H), 7,35 (м, 2H), 7,08 (м, 2H), 7,01 (м, 3H), 6,89 (м, 2H), 5,63 (c, 2H), 5,21 (c, 2H), 2,34 (c, 3H), 2,32 (c, 3H).
Пример 20. Гидрохлорид 7-(2,4-дихлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
Стадия 1: 3-(2,4-Дихлорбензилокси)-4-нитропиридин
В соответствии с теми же процедурами, что на стадиях 3 и 4 получения 1, за исключением использования 3-бром-4-нитропиридин-N-оксида, полученного на стадии 2 получения 1, и 2,4-дихлорбензилового спирта получали указанное в заголовке соединение (Выход: 68,2%).
1H-ЯМР (CDCl3) δ 8,40 (c, 1H), 8,38 (c, 1H), 8,31 (д, 1H), 8,25 (м, 1H), 8,22 (м, 1H), 8,19 (д, 1H), 5,20 (c, 2H).
Стадия 2: Гидрохлорид 7-(2,4-дихлорбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
В соответствии с теми же процедурами, что в примере 1, за исключением использования 3-(2,4-дихлорбензилокси)-4-нитропиридина, полученного на стадии 1, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 11,3%).
1H-ЯМР (CDCl3) δ 8,43 (c, 1H), 8,32 (c, 1H), 8,19 (c, 1H), 7,93 (c, 1H), 7,10 (м, 2H), 5,15 (c, 2H), 2,37 (c, 3H), 2,24 (c, 3H).
Примеры 21 и 22
Соединения, указанные в заголовках примеров 21 и 22, получали с помощью тех же процедур, что в примере 20, с использованием 3-бром-4-нитропиридин-N-оксида, полученного на стадии 2 получения 1, и бензилового спирта или 2-метилбензилового спирта.
Пример 21. Гидрохлорид 7-бензилокси-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,42 (c, 1H), 8,15 (c, 1H), 8,00 (c, 1H), 7,44 (м, 3H), 7,10 (м, 2H), 5,13 (c, 2H), 2,35 (c, 3H), 2,25 (c, 3H); (выход: 15,3%).
Пример 22. Гидрохлорид 7-(2-метилбензилокси)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,45 (c, 1H), 8,13 (c, 1H), 7,98 (c, 1H), 7,44 (м, 4H), 5,13 (c, 2H), 2,35 (c, 3H), 2,25 (c, 3H), 1,58 (c, 3H); (выход: 14,7%).
Пример 23. Гидрохлорид 7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина
Стадия 1: 3-(4-фторбензиламино)-4-нитропиридин
В соответствии с теми же процедурами, что в получении 2, за исключением использования 3-бром-4-нитропиридин-N-оксида, полученного на стадии 2 получения 1, и 4-фторбензиламина получали указанное в заголовке соединение в виде желтого твердого вещества (Выход: 35,8%).
1H-ЯМР (CDCl3) δ 8,43 (c, 1H), 8,29 (д, 1H), 8,21 (м, 2H), 8,11 (д, 1H), 8,19 (м, 2H), 5,84 (д, 2H).
Стадия 2: Трет-бутиловый эфир (4-фторбензил)-(4-нитропиридин-3-ил)карбаминовой кислоты
Ди-трет-бутилдикарбонат (4,06 г, 18,62 ммоль) и N,N-диметиламинопиридин (1,14 г, 9,31 ммоль) добавляли к раствору 3-(4-фторбензиламино)-4-нитропиридина (1,53 г, 6,21 ммоль), полученного на стадии 1, в 60 мл тетрагидрофурана. Реакционную смесь перемешивали в течение 24 часов, а затем концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/н-гексан = 1/1 (об./об.), с получением указанного в заголовке соединения в виде желтого масла (1,5 г, 75,8%).
1H-ЯМР (CDCl3) δ 8,61 (c, 1H), 7,31 (м, 3H), 7,17 (м, 2H), 6,72 (д, 1H), 5,11 (c, 2H), 1,2 (c, 9H).
Стадия 3: Гидрохлорид 7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина
Трет-бутиловый эфир (4-фторбензил)-(4-нитропиридин-3-ил)карбаминовой кислоты (5,1 г), полученный на стадии 2, растворяли в безводном тетрагидрофуране (100 мл) в атмосфере азота. К раствору при -78°С добавляли 1-метил-1-пропенилмагнийбромид (0,5М в растворе тетрагидрофурана, 55,0 мл, 65,2 ммоль), и раствор затем перемешивали в течение 5 часов при -20°С. К реакционной смеси добавляли 20 мл 20% раствора аммонийхлорида, и смесь затем дважды экстрагировали этилацетатом (200 мл). Отделенный органический слой сушили безводным сульфатом магния и концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат/метанол = 10/1 (об./об.), растворяли в 1 мл этилацетата, а затем насыщали газообразным хлороводородом. Получающийся осадок отфильтровывали с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (2,1 г, 35,0%).
1H-ЯМР (CDCl3) δ 8,41 (уш.с, 1H), 8,13 (c, 1H), 7,48 (c, 1H), 7,15 (д, 2H), 7,01 (д, 2H), 5,14 (c, 2H), 2,51 (c, 3H), 2,48 (c, 3H).
Пример 24. Гидрохлорид 1-бензил-7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина
В соответствии с теми же процедурами, что в примере 2, за исключением использования 7-(4-фторбензиламино)-2,3-диметил-1H-пирроло[3,2-c]пиридина, полученного обработкой соединения примера 23 насыщенным раствором бикарбоната натрия и бензилбромидом, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 15,8%).
1H-ЯМР (CDCl3) δ 8,31 (c, 1H), 7,52 (c, 1H), 7,28 (м, 2H), 7,07 (м, 2H), 7,00 (м, 3H), 6,87 (м, 2H), 5,60 (c, 2H), 5,20 (c, 2H), 2,33 (c, 3H), 2,30 (c, 3H).
Пример 25. Гидрохлорид 7-бензиламино-2,3-диметил-1H-пирроло[3,2-c]пиридина
В соответствии с теми же процедурами, что в примере 23, за исключением использования 3-бром-4-нитропиридин-N-оксида, полученного на стадии 2 получения 1, и бензиламина, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 11,3%).
1H-ЯМР (CDCl3) δ 8,43 (уш.с, 1H), 8,12 (c, 1H), 7,85 (c, 1H), 7,13 (м, 3H), 7,02 (м, 2H), 5,56 (c, 2H), 2,53 (c, 3H), 2,47 (c, 3H).
Пример 26. Гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-6-фтор-1-метил-1,2,3,4-тетрагидроизохинолина
Стадия 1: 6-Фтор-1-метил-2-(4-нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолин
В соответствии с теми же процедурами, что в получении 2, за исключением использования 6-фтор-1-метил-1,2,3,4-тетрагидроизохинолина, полученного в соответствии с методами, описанными в WO 94/14795, получали указанное в заголовке соединение в виде бледно-желтого твердого вещества (Выход: 59,8%). Продукт использовали на последующей стадии без дополнительной очистки.
Стадия 2: Гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-6-фтор-1-метил-1,2,3,4-тетрагидроизохинолина
В соответствии с теми же процедурами, что в примере 1, за исключением использования 6-фтор-1-метил-2-(4-нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолина, полученного на стадии 1, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 14,8%).
1H-ЯМР (CDCl3) δ 10,21 (c, 1H), 8,50 (c, 1H), 7,88 (c, 1H), 7,21 (м, 2H), 7,07 (c, 1H), 4,35 (c, 2H), 3,49 (т, 1H), 3,15 (т, 2H), 2,38 (д, 3H), 2,54 (c, 3H), 2,27 (c, 3H).
Пример 27. Гидрохлорид 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
2-(4-Нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолин (2,0 г, 7,835 ммоль), полученный в получении 2, растворяли в безводном тетрагидрофуране (100 мл) в атмосфере азота. К раствору при -78°С добавляли 1-метил-1-пропенилмагнийбромид (0,5М в растворе тетрагидрофурана, 9,4 мл), и раствор затем перемешивали в течение 20 минут при той же температуре. К реакционной смеси добавляли 10 мл 20% раствора аммонийхлорида, и смесь затем дважды экстрагировали этилацетатом (100 мл). Отделенный органический слой сушили безводным сульфатом магния и концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле (метиленхлорид/метанол = 10/1 (об./об.), растворяли в 5 мл этилацетата, а затем насыщали газообразным хлороводородом. Получающийся осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (850 мг, 19,5%).
1H-ЯМР (CDCl3) δ 10,21 (c, 1H), 8,50 (c, 1H), 7,88 (c, 1H), 7,21 (м, 3H), 7,07 (д, 1H), 4,35 (c, 2H), 3,49 (т, 2H), 3,15 (т, 2H), 2,54 (c, 3H), 2,27 (c, 3H).
Примеры с 28 по 42
Соединения, указанные в заголовках примеров 28-42, получали в соответствии с теми же процедурами, что в примере 2, с использованием 2-(2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина, полученного с помощью обработки соединения примера 27 насыщенным раствором бикарбоната натрия; и 4-фторбензилхлорида, метил-4-(бромметил)бензоата, 6-хлорметил-2,3-дигидробензо[1,4]диоксина, 2-бромэтилметилового эфира, 2-бромметилнафталина, 2-хлорэтилвинилового эфира, 2-бромметил-1,3-диоксолана, бензилбромида, 1-иод-2-метилпропана, (бромметил)циклобутана, 1-иодпропана, (бромметил)циклопропана, иодэтана, 3-бромметилбензонитрила или бромацетонитрила.
Пример 28. Гидрохлорид 2-[1-(4-фторбензил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина
1H-ЯМР (CDCl3) δ 8,50 (c, 1H), 7,88 (c, 1H), 7,21 (м, 3H), 7,10 (м, 2H), 7,07 (д, 1H), 6,98 (м, 2H), 5,65 (c, 2H), 4,35 (c, 2H), 3,49 (т, 2H), 3,15 (т, 2H), 2,54 (c, 3H), 2,27 (c, 3H); (выход: 25,8%).
Пример 29. Гидрохлорид 1-(4-метоксикарбонилбензил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,74 (c, 1H), 8,16 (c, 1H), 7,91 (м, 2H), 7,22 (м, 2H), 7,19 (м, 2H), 6,74 (м, 2H), 5,91 (м, 2H), 4,04 (c, 2H), 3,96 (c, 3H), 3,31 (м, 2H), 2,79 (м, 2H), 2,38 (c, 3H), 2,29 (c, H); (выход: 38,8%).
Пример 30. Гидрохлорид 2-[1-(2,3-дигидробензо[1,4]диоксин-6-илметил)-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина
1H-ЯМР (CDCl3) δ 8,36 (c, 1H), 7,58 (м, 4H), 7,15 (c, 1H), 7,10 (м, 3H), 5,16 (c, 2H), 4,69 (c, 2H), 4,33 (м, 2H), 3,57 (м, 2H), 3,01 (м, 2H), 2,57 (c, 3H), 2,47 (c, 3H); (выход: 35,3%).
Пример 31. Гидрохлорид 1-(2-метоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,69 (c, 1H), 8,14 (c, 1H), 7,22 (м, 3H), 7,06 (м, 1H), 4,64 (м, 2H), 4,19 (м, 2H), 3,50 (м, 2H), 3,34 (м, 2H), 3,23 (м, 2H), 3,13 (c, 3H), 2,49 (c, 3H), 2,36 (c, 3H); (выход: 58,9%).
Пример 32. Гидрохлорид 1-(2-нафтилметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,35 (c, 1H), 8,20 (м, 1H), 7,73 (м, 6H), 7,18 (м, 5H), 5,89 (c, 2H), 4,06 (c, 2H), 3,27 (м, 2H), 2,87 (м, 2H), 2,38 (c, 3H), 2,32 (c, 3H); (выход: 63,2%).
Пример 33. Гидрохлорид 1-(2-винилоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,63 (c, 1H), 8,13 (c, 1H), 7,25 (м, 3H), 7,12 (м, 1H), 4,58 (м, 2H), 4,20 (м, 2H), 3,81 (м, 2H), 3,52 (м, 3H), 3,39 (м, 1H), 3,18 (м, 1H), 2,96 (м, 1H), 2,49 (c, 3H), 2,34 (c, 3H); (выход: 66,3%).
Пример 34. Гидрохлорид 1-(1,3-диоксолан-2-илметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,35 (c, 1H), 8,10 (c, 1H), 7,85 (м, 2H), 7,23 (м, 3H), 5,91 (д, 2H), 4,35 (c, 2H), 4,04 (м, 4H), 3,96 (c, 2H), 2,79 (м, 2H), 2,38 (c, 3H), 2,29 (c, H); (выход: 55,8%).
Пример 35. Гидрохлорид 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,76 (c, 1H), 8,14 (c, 1H), 7,11 (м, 4H), 6,74 (м, 4H), 5,83 (м, 2H), 4,16 (м, 2H), 3,26 (м, 2H), 2,90 (м, 2H), 2,46 (c, 3H), 2,38 (c, 3H); (выход: 59,1%).
Пример 36. Гидрохлорид 1-изобутил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,75 (c, 1H), 8,17 (c, 1H), 7,33 (м, 2H), 7,08 (м, 2H), 4,25 (м, 4H), 3,47 (м, 2H), 3,25 (м, 2H), 2,54 (c, 3H), 2,37 (c, 3H), 1,97 (м, 1H), 1,60 (д, 6H); (выход: 65,3%).
Пример 37. Гидрохлорид 1-циклобутилметил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина
1H-ЯМР (CDCl3) δ 8,70 (c, 1H), 8,03 (c, 1H), 7,23 (м, 2H), 7,08 (м, 2H), 4,52 (д, 2H), 4,30 (м, 2H), 3,43 (м, 2H), 3,10 (м, 2H), 2,43 (c, 3H), 2,33 (c, 3H), 1,74 (м, 4H), 1,67 (м, 1H), 1,57 (м, 2H); (выход: 55,4%).
Пример 38. Гидрохлорид 2-(2,3-диметил-1-пропил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
1H-ЯМР (CDCl3) δ 8,66 (c, 1H), 8,15 (c, 1H), 7,22 (м, 3H), 7,08 (м, 1H), 4,37 (м, 4H), 3,49 (м, 2H), 3,30 (м, 1H), 3,01 (м, 1H), 2,48 (c, 3H), 2,34 (c, 3H), 1,56 (м, 2H), 0,68 (т, 3H); (выход: 59,9%).
Пример 39. Гидрохлорид 2-(1-циклопропилметил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
1H-ЯМР (CDCl3) δ 8,15 (c, 1H), 7,57 (c, 1H), 7,32 (м, 3H), 7,09 (м, H), 4,43 (м, 4H), 3,49 (м, 4H), 2,58 (c, 3H), 2,39 (c, 3H), 1,21 (м, 1H), 0,39 (м, 2H), 0,14 (м, 2H); (выход: 65,8%).
Пример 40. Гидрохлорид 2-(1-этил-2,3-диметил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
1H-ЯМР (CDCl3) δ 8,65 (c, 1H), 8,13 (c, 1H), 7,23 (м, 3H), 7,08 (м, 1H), 4,59 (м, 2H), 4,23 (м, 2H), 3,51 (м, 2H), 3,23 (м, 2H), 2,45 (c, 3H), 2,34 (c, 3H), 1,25 (д, 3H); (выход: 65,8%).
Пример 41. Гидрохлорид 3-[7-(3,4-дигидро-1H-изохинолин-2-ил)-2,3-диметилпирроло[3,2-c]пиридин-1-илметил]бензонитрила
1H-ЯМР (CDCl3) δ 8,36 (c, 1H), 7,58 (м, 4H), 7,10 (c, 1H), 7,08 (м, 3H), 6,98 (c, 1H), 5,68 (c, 2H), 4,39 (c, 2H), 3,68 (м, 2H), 2,98 (м, 2H), 2,56 (c, 3H), 2,50 (c, 3H); (выход: 55,7%).
Пример 42. Гидрохлорид [7-(3,4-дигидро-1H-изохинолин-2-ил)-2,3-диметилпирроло[3,2-c]пиридин-1-ил]ацетонитрила
1H-ЯМР (CDCl3) δ 8,35 (c, 1H), 7,58 (м, 4H), 7,10 (c, 1H), 4,38 (c, 2H), 4,35 (c, 2H), 3,61 (м, 2H), 2,89 (м, 2H), 2,58 (c, 3H), 2,54 (c, 3H); (выход: 65,3%).
Пример 43. Гидрохлорид 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-3-гидроксиметил-2-метил-1H-пирроло[3,2-c]пиридина
Соединение, полученное в примере 35 (250,4 мг, 0,62 ммоль), обрабатывали насыщенным раствором бикарбоната натрия, с получением 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина (216,8 мг, 0,59 ммоль). Аммониевый нитрат церия (IV) (973 мг, 1,77 ммоль) добавляли при комнатной температуре к раствору 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1H-пирроло[3,2-c]пиридина (216,8 мг, 0,59 ммоль) в уксусной кислоте (3 мл), а затем перемешивали в течение 4 часов при 55°С. Реакционную смесь охлаждали до комнатной температуры, добавляли к воде и затем экстрагировали этилацетатом. Отделенный органический слой промывали насыщенным раствором хлорида натрия, сушили безводным сульфатом магния и затем концентрировали при пониженном давлении. Получающийся в результате остаток растворяли в метаноле (10 мл). К реакционной смеси добавляли 2 н. гидроксид лития (2,5 мл), и смесь затем перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь нейтрализовали 1 н. гидрохлоридом, концентрировали при пониженном давлении, а затем экстрагировали этилацетатом. Отделенный органический слой сушили безводным сульфатом магния, отфильтровывали и затем концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле, с получением 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-3-гидроксиметил-2-метил-1H-пирроло[3,2-c]пиридин, который затем растворяли в 10 мл этилацетата и насыщали газообразным хлороводородом. Получающийся осадок отфильтровывали с получением указанного в заголовке соединения в виде белого твердого вещества (200 мг, 76,8%).
1H-ЯМР (CDCl3) δ 8,77 (c, 1H), 8,18 (c, 1H), 7,12 (м, 4H), 6,75 (м, 5H), 5,82 (c, 2H), 4,15 (м, 2H), 4,09 (c, 2H), 3,25 (м, 2H), 2,89 (м, 2H), 2,38 (c, 3H).
Пример 44. Гидрохлорид 2-(1-бензил-2-метил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
Стадия 1: Гидрохлорид 2-(2-метил-1H-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
В соответствии с теми же процедурами, что в примере 27, за исключением использования 2-(4-нитропиридин-3-ил)-1,2,3,4-тетрагидроизохинолина, полученного в получении 2, и изопропенилмагнийбромида, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 18,4%). Продукт использовали на последующей стадии без дополнительной очистки.
Стадия 2: Гидрохлорид 2-(1-бензил-2-метил-1H-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина
В соответствии с теми же процедурами, что в примере 2, за исключением использования 2-(2-метил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина, полученного обработкой соединения стадии 1 насыщенным раствором бикарбоната натрия и бензилбромидом, получали указанное в заголовке соединение в виде белого твердого вещества (Выход: 25,3%).
1H-ЯМР (CDCl3) δ 8,36 (c, 1H), 7,54 (м, 4H), 7,24 (м, 5H), 7,18 (д, 1H), 7,10 (д, 1H), 6,15 (c, 1H), 5,24 (c, 2H), 4,36 (c, 2H), 3,65 (м, 2H), 2,69 (м, 2H), 2,34 (c, 3H).
Пример 45. Гидрохлорид 1-бензил-7-(3,4-дигидро-1H-изохинолин-2-ил)-2-метил-1H-пирроло[3,2-c]пиридин-3-карбонитрила
Диметиламин (1,05 мл, 2,1 ммоль), уксусная кислота (0,81 мл) и формальдегид (0,042 мл) добавляли к раствору гидрохлорида 2-(1-бензил-2-метил-1H-пирроло[3,2-c]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина (600 мг, 1,71 ммоль), полученного в примере 44, в этаноле (5 мл). Получающуюся смесь нагревали с обратным холодильником при перемешивании на протяжении ночи и концентрировали при пониженном давлении. Получающийся остаток очищали с помощью колоночной хроматографии на силикагеле. Получающееся в результате соединение (300 мг, 0,73 ммоль) растворяли в этаноле (2 мл). К раствору добавляли иодметан (0,091 мл, 0,46 ммоль), и раствор перемешивали на протяжении ночи при комнатной температуре. Получающийся в результате белый продукт (100 мг, 0,18 ммоль) растворяли в N,N-диметилформамиде (3 мл). К раствору добавляли цианид натрия (34 мг, 0,72 ммоль), и раствор затем перемешивали в течение 5 часов при 100°С. К реакционной смеси добавляли воду, и смесь затем экстрагировали этилацетатом. Отделенный органический слой сушили безводным сульфатом магния и концентрировали при пониженном давлении. Получающийся в результате остаток очищали с помощью колоночной хроматографии на силикагеле, растворяли в эфире, и затем насыщали газообразным хлороводородом с получением указанного в заголовке соединения в виде белого твердого вещества (25 мг, 34,0%).
1H-ЯМР (CDCl3) δ 8,23 (д, 1H), 7,54 (м, 4H), 7,24 (м, 5H), 7,18 (д, 1H), 5,81 (c, 2H), 5,23 (c, 2H), 4,34 (c, 2H), 3,66 (м, 2H), 2,70 (м, 2H), 2,33 (c, 3H).
Пример испытания 1. Ингибирующее действие на активность протонного насоса (Н + /К + -АТФазы)
1-1. Приготовление везикул желудочного протонного насоса
Фундальные области свиньи, содержащие париетальные и пептические клетки, соскабливали с помощью стекла. Собранные клетки суспендировали в 10 мл 0,25М сахарозного буфера и гомогенизировали с использованием плотно устанавливающегося тефлонового стеклянного гомогенизатора. Гомогенат центрифугировали в течение 35 мин при 8000 об/мин и осадок отбрасывали. Супернатант дополнительно центрифугировали в течение 75 мин при 25000 об/мин. Получающийся в результате осадок повторно суспендировали в сахарозном буфере (10 мл), а затем суспензию помещали на прерывистые градиенты плотности, состоящие из 0,25М сахарозного буфера и изоляционной среды, содержащей 9% Ficoll (мас./мас.). После центрифугирования в течение 3 час и 15 мин при 100000g, вещество на поверхности раздела сахарозного буфера и раствора Ficoll собирали и затем центрифугировали в течение 40 мин. при 100000g. Получающийся в результате осадок повторно суспендировали в 1 мл 5 мМ Hepes/Трис буфера (рН 6,1). Вещество лиофилизировали и хранили при -70°С и использовали в качестве ферментного источника в in vitro ферментном реакционном анализе протонного насоса.
1-2. Измерение ингибирующего действия на активность (Н+/К+-АТФазы) протонного насоса
Ингибирующее действие соединений настоящего изобретения на активность протонного насоса оценивали в 96-луночном планшете. В данном анализе К+ специфическую Н+/К+-АТФазную активность вычисляли на основе разницы между активностью Н+/К+-АТФазы с К+ и без К+ ионов. На 96-луночном планшете 1% диметилсульфоксид (ДМСО) в буфере добавляли к отрицательной и положительной контрольным группам, и разбавленные соединения настоящего изобретения в буфере добавляли к испытуемой группе. Все анализы проводили в 100 мкл реакционном объеме при комнатной температуре, а желудочные везикулы свиньи перед использованием хранили во льду. В начале реакции к отрицательной и положительной контрольным группам и к каждой концентрации соединений в испытуемой группе добавляли 10 мкл реакционного буфера, содержащего 1% ДМСО. Затем лиофилизованные везикулы в 5 мМ Pipes/Трис буфера (рН 6,1) предварительно инкубировали в присутствии различных концентраций испытуемых соединений. После 5-минутного инкубирования отрицательный и положительный буферы добавляли соответственно к предыдущей реакционной смеси. В качестве субстрата к реакционному буферу добавляли АТФ и инкубировали в течение 30 мин при 37°С. Ферментативную активность останавливали добавлением колориметрического реагента (2Х малахитовый зеленый, 1Х молибдат аммония, 1Х поливиниловый спирт, 2Х Н2О), и измеряли количество монофосфата (Рi) в реакционной смеси при 620 нм с использованием микропланшетного счетчика (Genios Pro, TECAN). Разницу между получением Pi с K+ и без K+ принимали за стимулируемую K+ H+/K+-АТФазную активность. Величину IC50 испытуемых соединений вычисляли исходя из каждой ингибирующей величины соединений с использованием метода Litchfield-Wilcoxon (J. Pharmacol. Exp. Ther. (1949) 96, 99). Результаты показаны в таблице 1.
Как показано в таблице 1, соединения настоящего изобретения оказывают превосходное ингибирующее действие на H+/K+-АТФазу желудка.
Пример испытания 2. Ингибирующее действие на базальную секрецию желудочной кислоты на крысах с перевязанным пилорусом (привратником)
Испытание ингибирующего действия соединений настоящего изобретения на базальную секрецию желудочной кислоты проводили на модели крыс согласно методике Shay (Shay, Y., et al., 1945, Gastroenterology, 5, 43-61). Самцов крыс Sprague Dawley (SD) (вес тела 200±10 г) подразделяли на 3 группы (n=5) и подвергали голоданию в течение 24 часов при свободном доступе к воде. Контрольной группе вводили перорально только 0,5% метилцеллюлозу, а другим группам вводили перорально испытуемые соединения, суспендированные в 0,5% растворе метилцеллюлозы в дозах 1, 3 и 10 мг/кг/5 мл за один час до перевязки пилоруса.
Под эфирной анестезией брюшные полости крыс разрезали с помощью ножа и затем пилорусы перевязывали. Через 5 часов после перевязки животных умерщвляли и собирали содержимое желудка. Собранное содержимое центрифугировали при 1000g в течение 10 мин для получения желудочного сока. Измеряли общий выход кислоты 0,01 н. NaOH объемом (мкэкв./мл) для автоматического титрования желудочного сока до рН 7,0 и вычисляли показатели ED50 испытуемых соединений с использованием метода Litchfield-Wilcoxon. % ингибирующей активности вычисляли с использованием следующего уравнения, и результаты приведены в таблице 2.
% ингибирующей активности испытуемого соединения = (общий выход кислоты в контрольной группе - общий выход кислоты в группе, обработанной испытуемыми соединениями)/общий выход кислоты в контрольной группе ×100
Как видно из таблицы 2, соединения настоящего изобретения проявляют сильную ингибирующую активность на базальную секрецию желудочной кислоты у крыс с перевязанным пилорусом.
Пример испытания 3. Обратимое ингибирование H + /K + -АТФазы желудка свиньи
3-1. Приготовление желудочных везикул
Желудочные везикулы приготавливали из фундальной слизистой свиньи с использованием метода Saccomani et al. (Saccomani G, Stewart HB, Shqw D, Lewin M and Sachs G, Характеристика желудочных мукозных мембран. IX. Фракционирование и очистка К-АТФаза-содержащих везикул с помощью приема зонального центрифугирования и свободно-поточного электрофореза. Biochem. Biophy. Acta (BBA) - Biomembranes 465, 311-330, 1977). Данный материал лиофилизировали и хранили при -70°С. Содержание белка желудочных везикул определяли по методу Брэдфорда с использованием бычьего сывороточного альбумина в качестве стандарта (Bradford MM, Быстрый и чувствительный метод количественного определения микрограммовых количеств белка с использованием принципа связывания белок-краситель. Anal Biochem. 72, 248-254, 1976).
3-2. Определение обратимого ингибирования H + /K + -АТФазы желудка свиньи
Активность H+/K+-АТФазы в микросомах свиньи (лиофилизованные везикулы) измеряли с помощью неорганического фосфата, высвобождаемого из АТФ с использованием одностадийного метода колориметрической детекции при концентрации, при которой испытуемые соединения оказывали 50% ингибирование протонного насоса (Chan KM, Delfert D, and Junger KD, Прямой колориметрический анализ активности Са2+-стимулируемой АТФазы. Anal Biochem, 157, 375-380, 1986). Способ действия испытуемых соединений на H+/K+-АТФазу исследовали по методу Washout (Beil W, Staar U, and Sewing KF, Замещенные тиено[3,4-d]имидазолы, новая группа H+/K+-АТФазных ингибиторов. Дифференцирование их ингибирующих характеристик от характеристик омепразола. Eur. J. Pharmacol., 187, 455-67, 1990).
Лиофилизованные везикулы в растворе 5 мМ Pipes/Трис буфера предварительно инкубировали в присутствии испытуемого соединения (соединение примера 38) в концентрации, при которой оно оказывает 50% ингибирование протонного насоса. К предыдущему реакционному буферу добавляли 2 мМ MgCl2, 50 мМ КСl, 5 мкМ валиномицина и 0,5 мМ АТФ, а затем инкубировали в течение 30 мин при 37°С. H+/K+-АТФазную активность измеряли с использованием метода колориметрической детекции, а затем опытный образец центрифугировали при 100000g в течение 1 часа. Везикулы в опытном образце присутствовали в виде гранул. Их супернатант заменяли тем же буфером, не содержащим испытуемое соединение. Опытный образец предварительно инкубировали в течение 5 мин при комнатной температуре, а затем инкубировали дополнительно в течение 30 мин при 37°С. H+/K+-АТФазную активность измеряли также с использованием метода колориметрической детекции. Анализировали H+/K+-АТФазную активность в опытном образце до промывки и после промывки в сравнении с активностью в необработанной группе.
В результате соединение примера 38 ингибировало H+/K+-АТФазную активность на 50% до промывки, и не ингибировало H+/K+-АТФазную активность после промывки; желудочную H+/K+-АТФазную активность под действием соединения примера 38 полностью регенерировали до уровня необработанной группы после промывки. Данные результаты подтверждают, что соединения формулы (I) проявляют обратимое ингибирование желудочной H+/K+-АТФазы.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-b]ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2397170C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-c]ПИРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2378275C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[2,3-c] ПИРИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2005 |
|
RU2385320C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
| НОВЫЕ ПИРРОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2014 |
|
RU2607788C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1995 |
|
RU2129549C1 |
| ПРОИЗВОДНОЕ ТЕТРАГИДРОКАРБОЛИНА | 2011 |
|
RU2572818C2 |
| ЗАМЕЩЕННЫЕ ГИДРИРОВАННЫЕ ТИЕНО-ПИРРОЛО [3,2-c] ПИРИДИНЫ, ЛИГАНДЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2451686C1 |
| АГОНИСТ РЕЦЕПТОРА GPR40, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2013 |
|
RU2650506C2 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
Изобретение относится к новым производным пирроло[3,2-с]пиридина общей формулы (I)
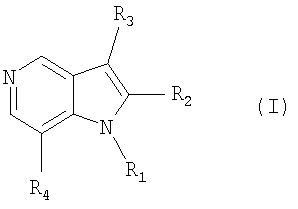
где, R1 представляет водород; линейную или разветвленную C1-С6алкильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из С1-С5алкокси, С3-С7циклоалкила, 1,3-диоксоланила, циано, нафтила, С2-С5алкенилокси и 2,3-дигидробензо[1,4]диоксинила; С2-С6алкенильную группу; С2-С6алкинильную группу; или бензильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, C1-С3алкила, C1-С3алкокси, циано, C1-С3алкоксикарбонила и трифтор-С1-С3алкила, R2 представляет линейную или разветвленную C1-С6алкильную группу, R3 представляет водород; линейную или разветвленную C1-С6алкильную группу, необязательно замещенную гидроксилом или циано, и R4 представляет 1,2,3,4-тетрагидроизохинолинильную группу, необязательно замещенную одним или более галогенами или С1-С5алкилами; бензилокси-группу, необязательно замещенную одним или более галогенами или С1-С5алкилами; или бензиламиногруппу, необязательно замещенную галогеном, а также к способу их получения и фармацевтической композиции, обладающей способностью ингибировать протонный насос. Технический результат: получены и описаны новые соединения, которые оказывают ингибирующее действие на протонный насос и обладают способностью обеспечивать обратимый ингибиторный эффект протонного насоса. 3 н. и 4 з.п. ф-лы, 2 табл.
1. Соединение формулы (I) или его фармацевтически приемлемая соль:
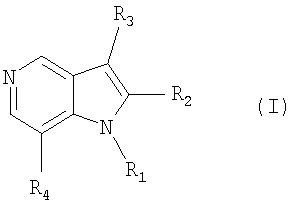
в которой
R1 представляет водород; линейную или разветвленную C1-С6алкильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из С1-С5алкокси, С3-С7циклоалкила, 1,3-диоксоланила, циано, нафтила,
С2-С5алкенилокси и 2,3-дигидробензо[1,4]диоксинила; С2-С6алкенильную группу; C2-С6алкинильную группу; или бензильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, C1-С3алкила, C1-С3алкокси, циано, C1-С3алкоксикарбонила и трифтор-С1-С3алкила,
R2 представляет линейную или разветвленную C1-С6алкильную группу,
R3 представляет водород; линейную или разветвленную C1-С6алкильную группу, необязательно замещенную гидроксилом или циано, и
R4 представляет 1,2,3,4-тетрагидроизохинолинильную группу, необязательно замещенную одним или более галогенами или C1-С5алкилами; бензилоксигруппу, необязательно замещенную одним или более галогенами или С1-С5алкилами; или бензиламиногруппу, необязательно замещенную галогеном.
2. Соединение или его фармацевтически приемлемая соль по п.1, в которых R1 представляет водород; линейную или разветвленную С1-С6алкильную группу; C1-С3алкильную группу, замещенную одним или более заместителями, выбранными из группы, состоящей из метокси, циклопропила, циклобутила, 1,3-диоксоланила, циано, нафтила, C2-С5алкенилокси и 2,3-дигидробензо[1,4]диоксинила; С2-С6алкенильную группу; С2-С6алкинильную группу; или бензильную группу, необязательно замещенную одним или более заместителями, выбранными из группы, состоящей из галогена, метила, метокси, циано, метоксикарбонила и трифторметила,
R2 представляет метильную группу,
R3 представляет водород; метильную группу; гидроксиметильную группу; цианометильную группу, и
R4 представляет 1,2,3,4-тетрагидроизохинолинил; 1-метил-6-фтор-1,2,3,4-тетрагидроизохинолинил; бензилоксигруппу, необязательно замещенную одним или более галогенами или метилами; или бензиламиногруппу, необязательно замещенную одним или более галогенами.
3. Соединение или его фармацевтически приемлемая соль по п.1, которое выбрано из группы, состоящей из
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида1-этил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-аллил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло [3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-(3-метоксибензил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(4-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(4-трифторметилбензил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-изобутил-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло [3,2-с]пиридина;
гидрохлорида 1-(2,5-диметилбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-хлорбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-хлорбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(4-хлорбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(2,4-дихлорбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-бензилокси-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(2-метилбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензиламино)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(4-фторбензиламино)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-бензиламино-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-(2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-6-фтор-1-метил-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-(2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-[1-(4-фторбензил)-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 1-(4-метоксикарбонилбензил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]-пиридина;
гидрохлорида 2-[1-(2,3-дигидробензо[1,4]диоксин-6-илметил)-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 1-(2-метоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с] пиридина;
гидрохлорида 1-(2-нафтилметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-винилоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(1,3-диоксолан-2-илметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-изобутил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-циклобутилметил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-(2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-(1-циклопропилметил-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-(1-этил-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 3-[7-(3,4-дигидро-1Н-изохинолин-2-ил)-2,3-диметилпирроло[3,2-с]пиридин-1-илметил]бензонитрила;
гидрохлорида [7-(3,4-дигидро-1Н-изохинолин-2-ил)-2,3-диметилпирроло[3,2-с]пиридин-1-ил]ацетонитрила;
гидрохлорида 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-3-гидроксиметил-2-метил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-(1-бензил-2-метил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина; и
гидрохлорида 1-бензил-7-(3,4-дигидро-1Н-изохинолин-2-ил)-2-метил-1Н-пирроло[3,2-с]пиридин-3-карбонитрила.
4. Соединение или его фармацевтически приемлемая соль по п.3, которое выбрано из группы, состоящей из
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-этил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-аллил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-c]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-(3-метоксибензил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1Н-пирроло [3,2-с]пиридина;
гидрохлорида 1-(4-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(4-трифторметилбензил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-изобутил-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2,5-диметилбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-хлорбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-(2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-[1-(4-фторбензил)-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 1-(4-метоксикарбонилбензил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-[1-(2,3-дигидробензо[1,4]диоксин-6-илметил)-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 1-(2-метоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-нафтилметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(2-винилоксиэтил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(1,3-диоксолан-2-илметил)-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-изобутил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-циклобутилметил-7-(1,2,3,4-тетрагидроизохинолин-2-ил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 2-(2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-(1-циклопропилметил-2,3-диметил-1Н-пирроло [3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина;
гидрохлорида 2-(1-этил-2,3-диметил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина; и
гидрохлорида 3-[7-(3,4-дигидро-1 Н-изохинолин-2-ил)-2,3-диметилпирроло[3,2-с]пиридин-1-илметил]-бензонитрила.
5. Соединение или его фармацевтически приемлемая соль по п.4, которое выбрано из группы, состоящей из
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(проп-2-инил)-1Н-пирроло[3,2-с] пиридина;
гидрохлорида 1-циклопропилметил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-(3-фторбензил)-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-(4-метилбензил)-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 1-бензил-7-(4-фторбензилокси)-2,3-диметил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридина;
гидрохлорида 7-(4-фторбензилокси)-1-(2-метоксиэтил)-2,3-диметил-1Н-пирроло[3,2-с]пиридина; и
гидрохлорида 2-(2,3-диметил-1-пропил-1Н-пирроло[3,2-с]пиридин-7-ил)-1,2,3,4-тетрагидроизохинолина.
6. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, включающий
взаимодействие соединения формулы (II) с R4-H с получением соединения формулы (III),
взаимодействие соединения формулы (III) с соединением формулы (IV), с получением соединения формулы (Ia), и
взаимодействие соединения формулы (Ia) с R1-x, с получением соединения формулы (I):

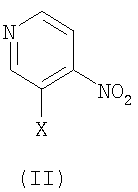
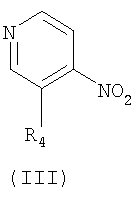
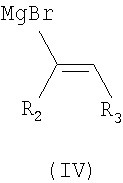
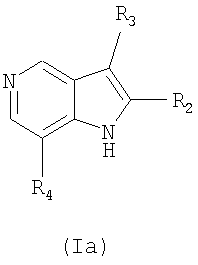
в которых R1, R2, R3 и R4 имеют значения, определенные в п.1; и Х представляет галоген.
7. Фармацевтическая композиция, обладающая способностью ингибировать протонный насос, включающая терапевтически эффективное количество любого из соединений формулы (I) или его фармацевтически приемлемой соли по п.1, и фармацевтически приемлемый носитель.
| US 20040110785 A1, 10.06.2004 | |||
| WO 03053970 A1, 03.07.2003 | |||
| WO 03044015 A2, 30.05.2003 | |||
| РЫЧАЖНЫЙ МЕХАНИЗМ ПЕРЕКЛЮЧЕНИЯ | 1991 |
|
RU2076963C1 |
| ПИРРОЛОПИРИДИНЫ ИЛИ ИХ СЕЛЬСКОХОЗЯЙСТВЕННО-ПРИЕМЛЕМЫЕ СОЛИ, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ ПОДАВЛЕНИЯ НЕЖЕЛАТЕЛЬНОЙ РАСТИТЕЛЬНОСТИ | 1994 |
|
RU2135497C1 |
Авторы
Даты
2009-12-10—Публикация
2005-09-03—Подача