Изобретение относится к способу пролиферации кардиомиоцитов млекопитающих.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Вследствие потери зрелыми кардиомиоцитами способности к пролиферации путем деления клеток, повреждения сердца, вызванные различными стрессами, такие как ишемия и воспаление, ведут к некрозу или потере кардиомиоцитов без последующего восстановления. Впоследствии оставшиеся кардиомиоциты компенсаторно гипертрофируются для поддержания функций сердца. Однако когда количество кардиомиоцитов снижается ниже допустимого уровня, они подвергаются дальнейшему повреждению и погибают. В конечном итоге такое состояние приводит к нарушению функций сердечной мышцы, а именно к сердечной недостаточности.
Заболевания сердца, в основном связанные с сердечной недостаточностью, занимают второе место по количеству смертности в Японии. Кроме того, прогноз больных с заболеваниями сердца настолько неблагоприятен, что пятилетняя выживаемость наблюдается примерно у 50% больных. Таким образом, очевидно, что разработка эффективных способов лечения сердечной недостаточности является в настоящее время очень важной с точки зрения медицинской помощи и экономики здравоохранения. Используемые в настоящее время лекарственные средства для лечения сердечной недостаточности включают препараты дигиталиса, которые увеличивают силу сокращения миокарда, препараты ксантина и другие сердечные стимуляторы, однако известно, что длительное применение этих лекарств ведет к ухудшению состояния. В последние годы основным направлением лечения с применением фармацевтических средств является назначение β-блокаторов и ингибиторов АПФ для уменьшения повреждений сердца посредством активации симпатической нервной системы и ренин-ангиотензиновой системы. Однако эти способы лечения являются лишь симптоматическими и не могут восстановить поврежденные сердечные ткани. С другой стороны, оптимальным способом лечения серьезных форм сердечной недостаточности является пересадка сердца. В связи с проблемами, вызванными небольшим количеством доноров органов, проблемами медицинской этики, травматичностью для организма, а также высокой стоимостью лечения для пациента, пересадка сердца не может применяться как основной способ лечения.
Недавно был описан способ поддерживающего введения кардиомиоцитов в поврежденную ткань сердца. Известно, что в ряде экспериментов на животных, когда кардиомиоциты зародыша вводили в зрелую сердечную ткань, введенные клетки могли эффективно функционировать как кардиомиоциты (например, см. непатентную ссылку 1). Продолжаются исследования получения кардиомиоцитов из полипотентных клеток, способных дифференцироваться в различные клетки, включая кардиомиоциты, так называемых зародышевых стволовых клеток (ES-клетки), для использования в качестве вводимых клеток. Однако эти способы связаны со значительными трудностями применения в клинической медицине в связи с этическими трудностями. Недавно были предприняты новые попытки введения стволовых клеток костного мозга в ткани сердца и обеспечения их дифференциации в кардиомиоциты. Однако степень дифференциации была очень низкой. Таким образом, этот способ не имеет практического значения для регенерации и восстановления кардиомиоцитов (см., например, непатентные ссылки 2, 3 и 4, в качестве обзора).
Авторы данного изобретения исследовали регуляторный механизм клеточного цикла кардиомиоцитов, в частности роль системы циклин-циклин-зависимой киназы (CDK). В то же время авторы обнаружили, что хотя экспрессию циклина типа 4 и CDK4 индуцирует стимуляция, например, сывороточных или ростовых факторов в кардиомиоцитах, эти белковые молекулы локализованы в цитоплазме и не переносятся в ядро, поэтому не происходит фосфорилирования RB-протеина, то есть ядерной молекулярной мишени циклина D-CDK4, или активации циклина E-CDK2. После этого авторами изобретения был получен аденовирусный вектор способности, в который интегрировали ген циклина D1, меченного сигналом локализации в ядре (NLS) (называемым здесь D1NLS) и ген, кодирующий CDK4, и им инфицировали культуры кардиомиоцитов, в ядрах экспрессировались белки циклин D1 и CDK4, вызывая деление и размножение кардиомиоцитов путем RB-фосфорилирования. Затем авторы успешно стимулировали пролиферацию кардиомиоцитов, практически неспособных к делению в обычных условиях культивирования. Кроме того, авторы вводили гены D1NLS и CDK4 в ткань сердечной мышцы взрослых животных для их экспрессии, таким образом успешно продлевая клеточный цикл кардиомиоцитов взрослых животных (см., например, патентную ссылку 1 и непатентную ссылку 5). Способ пролиферации кардиомиоцитов по изобретению обозначен как способ DNLS/CDK. Содержание патента 1, непатентной ссылки 5 и других ссылок, приведенных здесь, полностью включено в описание настоящего изобретения.
С целью индукции деления клеток было предпринято большое количество других попыток продления клеточного цикла кардиомиоцитов (см., например, непатентную ссылку 6, в качестве обзора о продлении клеточного цикла кардиомиоцитов). Например, сообщалось, что когда в культуре кардиомиоцитов, выделенных из новорожденных крыс, экспрессируются аденовирусный ген Е1А/Е1В (см. непатентную ссылку 7) или ген Е2F (см. непатентную ссылку 8), то происходит индукция синтеза ДНК в кардиомиоцитах. У трансгенных мышей, избыточно экспрессирующих интактный ген циклина D1, без каких-либо сигналов локализации в ядре, в кардиомиоцитах наблюдалось повышение экспрессии гена CDK4 наряду с усилением синтеза ДНК (см., например, непатентную ссылку 9). Совсем недавно было показано, что у мышей, дефицитных по гену jumonji, ингибирующего экспрессию гена циклина D1, наблюдается увеличение длительности клеточной пролиферации зародышевых кардиомиоцитов (см., например, непатентную ссылку 10). Как описано выше, было показано, что усиление синтеза ДНК и удлинение клеточного цикла возможно даже в кардиомиоцитах. В экспериментальных примерах, однако, в кардиомиоцитах часто наблюдается усиление апоптоза и появление патологических многоядерных клеток. Никакой другой способ, кроме DNLS/CDK, не вызывает в послезародышевом периоде деление кардиомиоцитов с реальным увеличением количества клеток.
Как описано выше, способ DNLS/CDK является инновационным способом, увеличивающим количество кардиомиоцитов, которые «практически не делятся» в обычных условиях. Таким образом, данный способ имеет широкое промышленное применение.
Известно, что множество стимулирующих и ингибирующих факторов регулируют продолжительность клеточного цикла эукариотических клеток. Стимулирующие факторы включают отдельные типы циклина и CDK, тогда как ингибирующие факторы включают ряд белковых групп, называемых CDK-ингибиторами. Идентифицированы два семейства CDK-ингибиторов, различающихся по механизму действия (см., например, непатентную ссылку 11, в качестве обзора). Первая группа названа белками семейства Ink4 и включает р6 (также называемый Ink4A, Mts1, Cdkn2 и Cdkn4i), p15 (также называемый Ink4B и Mts2), p18 (также называемый Ink4C и Ink6A), и p19 (также называемый p20, Ink4D и Ink6B). Первая группа избирательно связывается с CDK4 или CDK6 и ингибирует действие комплекса циклин D-CDK4 (или CDK6) (см., например, непатентные ссылки 12, 13 и 14). Вторая группа CDK-ингибирующих белков называется белками семейства Cip/Kip и включает р21 (также называемый Cip1, Pic1, Sdi1, mda6 и Waf1; здесь называемый - p21Cip1 ), p27 (также называемый Ick, Kip1 и Pic2, здесь называемый - p27Kip1), и р57 (также называемый Kip2, здесь называемый - p57Kip2). Показано, что, в отличие от семейства Ink4, второе семейство ингибирует продолжительность клеточного цикла путем ингибирования функций различных циклин-CDK-комплексов (см., например, непатентные ссылки 15, 16, 17 и 18).
Что касается того, каким образом CDK-ингибирующие белки участвуют в ингибировании пролиферации кардиомиоцитов, то было сделано несколько сообщений о роли молекул семейства Cip/Kip. В частности, известно, что уровень экспрессии белков p21Cip1 и p27Kip1 повышается вслед за снижением способности кардиомиоцитов к пролиферации в течение периода от поздней зародышевой до послеродовой стадии, при этом активность CDK2 и CDK4, в качестве молекул-мишеней, снижается (см., например, непатентную ссылку 19). При добавлении IGF-1 (инсулин-подобный фактор роста-1) к кардиомиоцитам с повышенной экспрессией гена E2F-1 тереина, уровень экспрессии белков p21Cip1 и
p27Kip1 снижается, при этом повышается доля кардиомиоцитов в фазе синтеза ДНК (S-фаза) (см., например, непатентную ссылку 20). Также сообщалось, что у мышей, дефицитных по гену p27Kip1, время пролиферации кардиомиоцитов короче, чем у нормальных мышей, и количество кардиомиоцитов у ген-дефицитных мышей повышено (см., например, непатентную ссылку 21). Как описано выше, было сделано предположение, что белки семейства Cip/Kip, в частности белок p27Kip1, может участвовать в ингибировании пролиферации кардиомиоцитов. Кроме делеции гена, не известно других примеров, при которых наблюдается ингибирование экспрессии и функции белков семейства Cip/Kip, и, таким образом, усиления деления и пролиферации кардиомиоцитов.
Известно, что уровень внутриклеточной экспрессии белков семейства Cip/Kip в основном регулируется системой разрушения через убиквитиновый путь (см., например, непатентные ссылки 22, 23 и 24). Убиквитин является полипептидом, состоящим из 76 высококонсервативных аминокислот и встречающимся во всех зрелых эукариотических клетках. Убиквитиновый путь заключается в том, что полиубиквитиновая цепь ковалентно связывается с субстратом-мишенью и затем разрушается многофункциональным протеасомным комплексом. Белковые молекулы, разрушающиеся такой убиквитин-протеасомной системой, включают, кроме белков семейства Cip/Kip, широкий спектр молекул, таких как циклин, р53, р300, Е2F, STAT-1, c-Myc, c-Jun, EGF-рецептор, IkBα, NFkB и β-катенин. В настоящее время ведутся интенсивные исследования по изучению механизма убиквитинилирования белковых молекул. В целом, белковые молекулы убиквитинилируются несколькими группами ферментов, а именно убиквитинактивирующим ферментом (Е1), убиквитинкомплексообразующим ферментом (Е2) и убиквитинлигазой (Е3), и, в конечном итоге, разрушаются 26S-протеасомами (см., например, непатентные ссылки 25, 26, 27 и 28, в качестве обзоров).
Вероятно убиквитинлигаза (Е3) отвечает за специфичность убиквитинилирования специфичных белков-мишеней. Известно большое количество примеров, таких как комплекс, способствующий анафазе/циклосома (АРС/С), VHL (комплекс белка von Hipple-Lindau - элонгин В/С (VBC)), Nedd4, Ufd4, Rad4, Rad18 и Parkin. Недавно в ходе исследований с использованием низших биологических организмов, таких как дрожжи, был идентифицирован новый тип убиквитинлигазного комплекса, названный SCF. Убиквитинлигаза комплекса типа SCF (иногда называемая здесь убиквитинлигазным SCF-комплексом) является белковым модулем, состоящим из трех субъединиц, называемых Skp1, Cul1 (другое название Cdc53) и белка F-бокса. Название лигазы SCF является аббревиатурой названий отдельных субъединиц (см., например, непатентные ссылки 29 и 30, в качестве обзоров).
Белок F-бокса, как один из компонентов комплекса SCF, содержит мотив F-бокса, впервые идентифицированный в циклине F. Область мотива необходима для взаимодействия с Skp1. Кроме того, белок F-бокса содержит область повтора мотива примерно из 40 аминокислот, называемую повтором WD-40, или область мотива, обогащенную лейцином, называемую лейцин-богатым повтором. В комплексе SCF субъединицы Skp1 и Cull/Cdc53 никогда не изменяются в зависимости от субстрата-мишени, тогда как молекулярная специфичность белка F-бокса меняется в зависимости от субстрата-мишени убиквитинилирования. Распознавая и связывая субстратную мишень повтором WD-40 или повтором, богатым лейцином, белок F-бокса определяет субстратную специфичность комплекса SCF (см., например, непатентные ссылки 31, 32 и 33, в качестве обзоров). Как описано выше, комплекс SCF включает различные типы SCFβTrCP, SCFCdc4, SCFMet30 и SCFCrr1, в зависимости от различий белка F-бокса, содержащегося как компонент (см., например, непатентные ссылки 29 и 30).
В случае белкового семейства Cip/Kip в убиквитин-протеасомную деградацию вовлечен комплекс SCF, содержащий в качестве белка F-бокса Skp2 (SCFSkp2). Skp2 был идентифицирован как фактор, связанный с циклиновым A-CDK2 комплексом. Поскольку накопление Skp2 происходит в течение периода, начиная с поздней G1 фазы клеточного цикла, и уровень эспрессии достигает максимума в период от S фазы до G2 фазы, Skp2 называют киназа-связанным белком S-фазы (см., например, непатентную ссылку 38). Имеются данные, что, помимо белков семейства Cip/Kip, Skp2 распознает такие белковые молекулы, как E2F-1 (см. непатентную ссылку 39), циклин Е (см. непатентную ссылку 40), CDK9 (см. непатентную ссылку 41) и c-Myc (см. непатентную ссылки 42 и 43) в качестве субстратных мишеней, и Skp2 вовлечен в их деградацию.
Как описано выше, известно, что ингибиторы CDK, включая белок семейства Cip/Kip, участвуют в ингибировании пролиферации основных пролиферирующих клеток, таким образом, убиквитин-протеасомная система посредством комплекса SCFSkp2 отвечает за регуляцию уровня внутриклеточной экспрессии. Однако почти ничего не известно о том, каким образом убиквитин-протеасомная система участвует в механизмах регуляции пролиферации кардиомиоцитов.
Метод DNLS/CDK является единственным известным в настоящее время методом пролиферации кардиомиоцитов. Метод очень эффективен и имеет огромное промышленное применение. Для внедрения лечебного метода регенерации сердечной мышцы в практику и его промышленного применения желательно повысить эффективность пролиферирующих кардиомиоцитов и их активность.
Патентная ссылка 1: Pamphlet of International Publication WO 02/095026
Непатентная ссылка 1: Soonpaa, et al., Science 264:98, (1994).
Непатентная ссылка 2: Murry, et al., Cold Spring Harb. Symp. Quant. Biol. 67:519, (2002).
Непатентная ссылка 3: Menasche, Ann. Thorac. Surg. 75:S20, (2003).
Непатентная ссылка 4: Nir, et al., Cardiovasc. Res. 58:313, (2003).
Непатентная ссылка 5: Tamamori-Adachi, et al., Circ. Res. 92:e12, (2003).
Непатентная ссылка 6: Kishore, et al., Circ. Res. 90:1044, (2002).
Непатентная ссылка 7: Kirshenbaum, et al., J. Biol. Chem. 270: 7791, (1995).
Непатентная ссылка 8: Kirshenbaum, et al., Dev. Biol. 179:402, (1996).
Непатентная ссылка 9: Soonpaa, et al., Clin. Invest. 99: 2644, (1997).
Непатентная ссылка 10: Toyoda, et al., Dev. Cell 5: 85, (2003).
Непатентная ссылка 11: Sherr & Roberts, Genes Dev. 9:1149, (1995).
Непатентная ссылка 12: Hannon& Beach, Nature 371: 257, (1993).
Непатентная ссылка 13: Serrano, et al., Nature 366: 704, (1993).
Непатентная ссылка 14: Hirai, et al., Mol. Cell. Biol. 15:2672, (1995).
Непатентная ссылка 15: Harper, et al., Cell 75:805, (1993).
Непатентная ссылка 16: Polyyak, et al., Cell 78:59, (1994).
Непатентная ссылка 17: Toyoshima & Hunter Cell 78:67, (1994).
Непатентная ссылка 18: Matsuoka, et al., Genes Dev. 9:650, (1995).
Непатентная ссылка 19: Flink, et al., J. Mol. Cell. Cardiol. 30:563, (1998).
Непатентная ссылка 20: von Harsdorf, et al., Circ. Res. 85:128, (1999).
Непатентная ссылка 21: Poolman, et al., Circ. Res. 85:117, (1999).
Непатентная ссылка 22: Pagano, et al., Science 269: 682 (1995).
Непатентная ссылка 23: Maki& Howley, Mol. Cell Biol. 17:355, (1997).
Непатентная ссылка 24: Urano, et al., J. Biol. Chem. 274:12197, (1999).
Непатентная ссылка 25: Coux, et al., Annu. Rev. Biochem. 65:801, (1996).
Непатентная ссылка 26: Hochstrasser, Annu. Rev. Genet. 30:405, (1996).
Непатентная ссылка 27: Pagano, FASEV J. 11:1067, (1997).
Непатентная ссылка 28: Hershko, et al., Annu. Rev. Biochem. 67:425, (1998).
Непатентная ссылка 29: Patton, et al., Trends Genet. 14:236, (1998).
Непатентная ссылка 30: Jackson & Eldridge, Mol. Cell 9:923,(2002).
Непатентная ссылка 31: Bai, et al., Cell 86:263, (1996).
Непатентная ссылка 32: Slowrya, et al., Cell 91:209, (1997).
Непатентная ссылка 33: Kobe, et al., Curr. Opin. Struct. Biol. 11725, (2001).
Непатентная ссылка 34: Carrano, et al., Nature Cell Biol. 1:193, (1999).
Непатентная ссылка 35: Tsverkov, et al., Curr. Biol. 9:661, (1999).
Непатентная ссылка 36: Bornstein, et al., J. Biol. Chem. 278:26752, (2003).
Непатентная ссылка 37: Kamura, et al., Proc. Natl. Acad. Sci. USA 100:10231, (2003).
Непатентная ссылка 38: Zhang, et al., Cell 82:915, (1995).
Непатентная ссылка 39: Marti, et al., Nat. Cell Biol. 1:14, (1999).
Непатентная ссылка 40: Nakayama, et al., EMBO J. 19:2069, (2000).
Непатентная ссылка 41: Kiernan, et al., Mol. Cell. Biol. 21:7956, (2001).
Непатентная ссылка 42: Kim, et al., Mol. Cell 11:1177, (2003).
Непатентная ссылка 43: von der Lehr, et al., Mol. Cell 11:1189, (2003).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В отношении способа пролиферации кардиомиоцитов объектом настоящего изобретения является создание способа усиления пролиферативной активности кардиомиоцитов и создание рекомбинатного вектора и тому подобного для применения в этом способе.
СРЕДСТВА РЕШЕНИЯ УКАЗАННЫХ ЗАДАЧ
Для решения этих задач авторы изобретения проанализировали механизм регуляции клеточного цикла кардиомиоцитов. Конкретно, авторы изучили этот механизм, обращая особое внимание на роль отдельных факторов регуляции клеточного цикла кардиомиоцитов, повышенной экспрессией генов циклина и CDK, в частности ингибиторов CDK. Кроме того, авторы обнаружили, что белок, называемый р27Kip1, относящийся к семейству белков Cip/Kip и являющийся ингибитором CDK, неожиданно избыточно накапливается в ядрах кардиомиоцитов при стимуляции циклином и CDK.
Известно, что белок семейства Cip/Kip, в основном р27Kip1, убиквитинилируется с помощью убиквитинлигазы в большинстве пролиферирующих клеток, и, таким образом, белок семейства Cip/Kip разрушается протеасомами. Следовательно, одновременно с генами циклина и CDK, в кардиомиоцитах экспрессировался ген, кодирующий компонент убиквитинлигазы. Затем было обнаружено, что уровень белка р27Kip1 значительно снижается в ядрах кардиомиоцитов. Кроме того, было обнаружено значительное повышение способности кардиомиоцитов к пролиферации, и на основании этих обнаружений было сделано настоящее изобретение.
В частности, данное изобретение относится к способу повышения пролиферативной активности кардиомиоцитов путем ингибирования продукции, функционирования и активности (эффективности) белка семейства Cip/Kip, экспрессируемого в кардиомиоцитах при стимуляции циклином и CDK. Белки семейства Cip/Kip, активность которых подлежит ингибированию, не ограничены, но белок р27Kip1 является предпочтительным.
В рамках данного изобретения термин «кардиомиоциты» означает любые клетки сердечной мышцы, экспрессирующие многочисленные специфичные для кардиомиоцитов маркеры, которые распознаются как морфологические, физиологические и/или иммунологические особенности интактных кардиомиоцитов. Термин включает не только кардиомиоциты, полученные непосредственно из тканей сердца млекопитающих и их первичной клеточной культуры, но также кардиомиоциты, происходящие и дифференцирующиеся из стволовых клеток, таких как зародышевые стволовые клетки, стволовые клетки костного мозга и CMG клетки.
Любой способ ингибирования ингибирования, функционирования и активности белка семейства Cip/Kip может считаться приемлемым и не имеет особых ограничений. Способ направлен на ингибирование экспрессии гена, кодирующего белок, ингибирование продукции белка, ингибирование активности белка или увеличение разрушения белка.
В частности, способом активации разрушения белка, предпочтительно, является способ активации убиквитинилирования белка. Убиквитинилирование может быть достигнуто введением в клетку-мишень, например, лекарственных средств, белков, пептидов, низкомолекулярных соединений и генов.
Кроме того, геном, активирующим убиквитинилирование белка семейства Cip/Kip, предпочтительно, является ген, кодирующий компонент убиквитинлигазы, еще более предпочтительно, ген, кодирующий фактор F-бокса, способный связываться с белком семейства Cip/Kip, включая, например, ген Skp2.
При осуществлении изобретения, кроме того, может быть использован способ ингибирования экспрессии гена (транскрипции мРНК) гена, кодирующего белок семейства Cip/Kip или ингибирования трансляции и продукции гена. Например, может применяться siРНК, специфичная гену, кодирующему белок семейства Cip/Kip.
При осуществлении изобретения, кроме того, нуклеотидную последовательность, кодирующую сигнал ядерной локализации, присоединяют, предпочтительно, по меньшей мере к одному из генов циклина или CDK, для введения полученного в результате гена в клетки-мишени. Циклин способен активировать CDK4 или CDK6 и, предпочтительно, включает, например, циклин D1, D2 и D3 млекопитающих. Кроме того, CDK активируется циклином типа D и, предпочтительно, включает, например, CDK4 и CDK6 млекопитающих.
В еще одном варианте осуществления изобретение относится к вектору, несущему ген циклина, ген CDK и ген фактора ингибирования активности белка семейства Cip/Kip. В случае, когда предполагают введение гена в кардиомиоциты, предпочтительно, введение производят с использованием вирусного вектора, или липосом, или тому подобное. В качестве вирусного вектора, например, может применяться аденовирус.
В дополнительном варианте осуществления изобретения изобретение относится к фармакологической композиции, содержащей вектор, несущий ген циклина, ген CDK и ген фактора ингибирования активности белка семейства Cip/Kip.
В еще одном дополнительном варианте осуществления изобретения изобретение относится к кардиомиоцитам, полученным способом пролиферации кардиомиоцитов.
В другом варианте осуществления изобретения, изобретение относится к способу скрининга с использованием клеток, полученных способом пролиферации кардиомиоцитов, для выявления новых факторов, поддерживающих и стимулирующих жизнеспособность и функционирование кардиомиоцитов и тому подобное, или для выявления химиотерапевтических средств и их возможностей.
В дополнительном варианте осуществления изобретения изобретение относится к способу лечения заболеваний сердца, предусматривающему введение (трансплантацию) больным фармакологической композиции или кардиомиоцитов в область с ослабленными кардиомиоцитами, у которых ослаблена функция или они уничтожены, для восстановления и пролиферации клеток.
Соответственно, настоящее изобретение в целом относится к следующим объектам.
(1) Способ пролиферации кардиомиоцитов, предусматривающий стадию введения (a) циклина, (b) циклин-зависимой киназы, и (c) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, ингибирующую продукцию белка семейства Cip/Kip, в кардиомиоциты, и стадию последующего культивирования или поддержания указанных клеток.
(2) Способ пролиферации кардиомиоцитов, предусматривающий стадию введения (a) циклина, (b) циклин-зависимой киназы, и (с) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, которая ингибирует продукцию белка семейства Cip/Kip, в кардиомиоциты in vitro, и стадию последующего культивирования указанных клеток.
(3) Способ пролиферации кардиомиоцитов, предусматривающий стадию введения (a) циклина, (b) циклин-зависимой киназы, и (с) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, которая ингибирует продукцию белка семейства Cip/Kip, в кардиомиоциты in vivo, и стадию последующего поддержания клеток.
(4) Способ, описанный выше в (1)-(3), в котором указанный циклин представляет собой циклин, способный активировать CDK4 или CDK6 млекопитающих.
(5) Способ, описанный выше в (4), в котором указанный циклин представляет собой циклин D млекопитающих.
(6) Способ, описанный выше в (1)-(5), в котором указанная циклин-зависимая киназа представляет собой циклин-зависимую киназу, активируемую циклином D.
(7) Способ, описанный выше в (6), в котором указанная циклин-зависимая киназа представляет собой CDK4 или CDK6.
(8) Способ, описанный выше в (1)-(7), в котором белок семейства Cip/Kip представляет собой p27Kip1.
(9) Способ, описанный выше в (1)-(8), в котором фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, представляет собой фактор с активностью, стимулирующей деградацию белка семейства Cip/Kip.
(10) Способ, описанный выше в (9), в котором фактор с активностью, стимулирующей деградацию белка семейства Cip/Kip, представляет собой компонент убиквитинлигазы.
(11) Способ, описанный выше в (10), в котором компонент убиквитинлигазы представляет собой фактор F-бокса, способный связываться с белком семейства Cip/Kip.
(12) Способ, описанный выше в (11), в котором фактор F-бокса, способный связываться с белком семейства Cip/Kip представляет собой Skp2.
(13) Способ, описанный выше в (1)-(12), в котором нуклеиновая кислота, которая ингибирует продукцию белка семейства Cip/Kip, представляет собой siРНК, специфичную в отношении гена, кодирующего белок семейства Cip/Kip.
(14) Способ, описанный выше в (13), в котором нуклеиновая кислота, ингибирующая продукцию белка семейства Cip/Kip, представляет собой siРНК, специфичную в отношении гена p27Kip1.
(15) Способ, описанный выше в (1)-(14), включающий в себя введение генов в кардиомиоциты с использованием вирусного вектора или липосомы.
(16) Способ, описанный выше в (1)-(15), в котором по меньшей мере один из генов циклина и циклин-зависимой киназы метят нуклеотидной последовательностью, кодирующей сигнал ядерной локализации.
(17) Вектор, содержащий (a) ген циклина, (b) ген циклин-зависимой киназы, и (с) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, и последовательность нуклеиновой кислоты, ингибирующей продукцию белка семейства Cip/Kip.
(18) Вектор, описанный выше в (17), в котором циклин представляет собой циклин, способный активировать CDK4 или CDK6 млекопитающих.
(19) Вектор, описанный выше в (18), в котором циклин представляет собой циклин D млекопитающих.
(20) Вектор, описанный выше в (17)-(19), в котором циклин-зависимая киназа представляет собой циклин-зависимую киназу, активируемую циклином D.
(21) Вектор, описанный выше в (20), в котором циклин-зависимая киназа представляет собой CDK4 или CDK6.
(22) Вектор, описанный выше в (17)-(21), в котором фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip представляет собой фактор с активностью, стимулирующей деградацию белка семейства Cip/Kip.
(23) Вектор, описанный выше в (22), в котором фактор с активностью, стимулирующей деградацию белка семейства Cip/Kip, представляет собой компонент убиквитинлигазы.
(24) Вектор, описанный выше в (23), в котором компонент убиквитинлигазы представляет собой фактор F-бокса, способный связываться с белком семейства Cip/Kip.
(25) Вектор, описанный выше в (24), в котором фактор F-бокса, способный связываться с белком семейства Cip/Kip, представляет собой Skp2.
(26) Вектор, описанный выше в любом из вышеперечисленных (17)-(25), в котором нуклеиновая кислота, ингибирующая продукцию белка семейства Cip/Kip представляет собой siРНК, специфичную в отношении гена, кодирующего белок семейства Cip/Kip.
(27) Вектор, описанный выше в (26), в котором нуклеиновая кислота, ингибирующая продукцию белка семейства Cip/Kip, представляет собой siРНК, специфичную в отношении гена р27Kip1.
(28) Вектор, описанный выше в любом из вышеперечисленных (17)-(27), в котором по меньшей мере один из генов циклина или циклин-зависимой киназы помечен нуклеотидной последовательностью, кодирующей сигнал ядерной локализации.
(29) Фармацевтическая композиция, которую используют при лечении сердечного заболевания, содержащая вектор, описанный в любом из вышеуказанных (17)-(28).
(30) Фармацевтическая композиция, описанная выше в (29), где сердечным заболеванием является инфаркт миокарда, ишемическая болезнь сердца, дилатационная кардиомиопатия, миокардит или хроническая сердечная недостаточность.
(31) Кардиомиоциты, полученные способом, описанным в любом из указанных выше (1)-(16).
(32) Способ лечения сердечного заболевания, представляющий инъекцию фармацевтической композиции, как описано выше в (29), или пересадку кардиомиоцитов, как описано в (31), в область с нарушением пациенту, страдающему сердечным заболеванием, и поддержание и пролиферацию кардиомиоцитов в этой области.
(33) Способ, описанный выше в (32), в котором сердечным заболеванием является инфаркт миокарда, ишемическая болезнь сердца, дилатационная кардиомиопатия, миокардит или хроническая сердечная недостаточность.
Преимущества изобретения
Применение способа по изобретению позволяет ингибировать активность белка семейства Cip/Kip в ядрах кардиомиоцитов и стимулировать, таким образом, пролиферацию кардиомиоцитов. Кроме того, преимущества и характерные особенности изобретения достаточно подробно описаны ниже в разделе «подробное описание предпочтительных способов осуществления изобретения».
Краткое описание рисунков
Фиг. 1
Экспрессия белка р27Kip1 в кардиомиоцитах, трансфицированных генами D1NLS и CDK4. При выделении ядерного белка экспрессию белка р27Kip1 оценивали с помощью вестерн-блоттинга. CM: кардиомиоциты крысы; REF: клеточная линия фибробластов крысы (клетки REF52).
Фиг. 2
Локализация белка р27Kip1 в кардиомиоцитах, трансфицированных генами D1NLS и CDK4. При инфицировании кардиомиоцитов рекомбинантным аденовирусом, несущим ген LacZ (верхняя колонка, контроль), или ген D1NLS и ген CDK4 (нижняя колонка), внутриклеточную экспрессию белка р27Kip1 оценивали способом иммунофлюоресцентного окрашивания. На рисунке зеленым цветом показан р27Kip1, красным цветом показан саркомерный актин. Кроме того, клеточные ядра окрашивали DAPI.
Фиг.3
Регуляция экспрессии белка р27Kip1 в кардиомиоцитах. Кардиомиоциты, стимулированные FBS или стимулированные D1NLS+CDK4 были обработаны протеасомным ингибитором лактостатином (LC) для сравнения посредством экспрессии белка р27Kip1.
Фиг.4
Убиквитинилирование белка р27Kip1 в кардиомиоцитах. Клетки, выделенные из кардиомиоцитов (СМ) или фибробластов (REF) при стимуляции FBS или стимуляции D1NLS+CDK4, использовали для убиквитинилирования in vitro для последующего определения белка р27Kip1 с помощью вестерн-блоттинга. На фиг.IB обозначает антитела, которые использовали в анализе вестерн-блоттинг. Полоса, наблюдаемая в положении с более высокой молекулярной массой, является убиквитинилированным белком р27Kip1 (p27-GST-Ub).
Фиг. 5
Экспрессия белка Skp2 в кардиомиоцитах. Кардиомиоциты, стимулированные FBS или стимулированные D1NLS+CDK4, были обработаны протеасомным ингибитором лактостатином (LC) для сравнения посредством экспрессии белка Skp2.
Фиг.6
Снижение белка р27Kip1 за счет совместной экспрессии гена Skp2. Изучали экспрессию белка р27Kip1 в кардиомиоцитах, трансфицированных генами D1NLS, CDK4 и Skp2.
Фиг. 7
Локализация белка р27Kip1 в кардиомиоцитах с коэкспрессированными в них генами D1NLS, CDK4 и Skp2. При инфицировании кардиомиоцитов рекомбинантным аденовирусом, несущим гены D1NLS+CDK4 (верхняя колонка, контроль), или несущим гены D1NLS+CDK+Skp2 (средняя и нижняя колонки), и при обработке части кардиомиоцитов протеасомным ингибитором лактостатином (LC) (нижняя колонка), внутриклеточную экспрессию белка р27Kip1 оценивали способом иммунофлюоресцентного окрашивания. На рисунке зеленым цветом показан р27Kip1, красным цветом показан саркомерный актин. Кроме того, клеточные ядра были окрашены DAPI.
Фиг. 8
Эффект усиленной экспрессии гена Skp2 на стимуляцию пролиферации кардиомиоцитов. При инфицировании кардиомиоцитов рекомбинантным вирусом, несущим ген LacZ (контроль), гены D1NLS+CDK4, гены D1NLS+CDK4+Skp2 или только ген Skp2, в указанные дни подсчитывали число кардиомиоцитов.
Фиг. 9
Снижение белка р27Kip1 за счет совместной экспрессии siРНК, специфичной гену
р27Kip1. В кардиомиоцитах, трансфицированных генами D1NLS, CDK4 и siРНК, специфичной гену р27Kip1, оценивали экспрессию белка р27Kip1.
Фиг. 10
Эффект усиленной экспрессии siРНК, специфичной гену р27Kip1, на стимуляцию пролиферации кардиомиоцитов. При инфицировании кардиомиоцитов рекомбинантным вирусом, несущим ген LacZ (контроль), гены D1NLS+CDK4, гены D1NLS+CDK4+siРНК, специфичную гену р27Kip1 (р27 siРНК), или несущим только siРНК, специфичную гену р27Kip1, в указанные дни подсчитывали число кардиомиоцитов.
Фиг. 11
Изучение эффекта усиленной экспрессии гена Skp2 на снижение массы легких. Измеряли массу легких у крыс через 6 недель после ишемии сердца и реперфузии для подсчета отношения к массе тела. *: р<0,05 по сравнению с опытной группой. #: р<0,05 по сравнению с контрольной группой.
Фиг. 12
Изменение кривой пассивного объема левого желудочка при усиленной экспрессии гена Skp2. Оценивали кривую пассивного объема левого желудочка, используя сердце крыс через 6 недель после ишемии сердца и реперфузии. *: р<0,05 по сравнению с опытной группой. #: р<0,05 по сравнению с контрольной группой. †: р<0,05 по сравнению с группой D1NLS.
Фиг. 13
Изучение эффекта усиленной экспрессии гена Skp2 на уменьшение области инфаркта миокарда. Измеряли область инфаркта миокарда у крыс через 6 недель после ишемии сердца и реперфузии для подсчета отношения к площади левого желудочка. #: р<0,05 по сравнению с контрольной группой.
+: Обозначает добавление FBS и фармацевтических агентов или инфицирование различными типами аденовирусов.
-: Обозначает отсутствие добавления FBS и фармацевтических агентов или инфицирования различными типами аденовирусов.
р27: Обозначает белок р27.
Лучший способ осуществления изобретения
При осуществлении изобретения и с целью внедрения изобретения в практику, специалисты могут обратиться к обычным ссылочным руководствам в области молекулярной биологии, микробиологии, клеточной биологии и основным методам, таким как технология рекомбинантной ДНК и подобным технологиям, если не указано иного. Эти источники включают, например, Molecular Cloning: A Laboratory Manual, the 3rd edition (Sambrook & Russel, Cold Spring Harbor Laboratory Press, 2001); Current Protocols in Molecular biology (edited by Ausubel, et al., John Wiley & Sons, 1987); Methods in Enzymology in series (Academic Press); PCR Protocols: Methods in Molecular Biology (edited by Barlett & Striling, Humana Press, 2003); Animal Cell Culture: A Practical Approach, the 3rd edition (edited by Masters, Oxford University Press, 2000); Antibodies: A Laboratory Manual (edited by Harlow, et al. & Lane, Cold Spring Harbor Laboratory Press, 1987). Реактивы и наборы для культуры клеток и экспериментов в области клеточной биологии, которые упоминаются в настоящем описании, могут быть коммерчески доступны у производителей, таких как Sigma, Aldrich, Invitrogen/GIBCO, Clontech и Stratagene.
Получение кардиомиоцитов
Кардиомиоциты как мишень для пролиферации с использованием способа по изобретению включают все клетки на стадии развития, такие как кардиомиоциты зародышевого типа, послеродового типа и зрелого типа, и определяются как клетки с по меньшей мере одним, предпочтительно, несколькими, маркерами или стандартами, подтвержденными по меньшей мере одним, предпочтительно, несколькими, методами, описанными ниже.
Экспрессия различных маркеров, специфичных для кардиомиоцитов, может быть определена общепринятыми биохимическими или иммунохимическими способами. Эти способы не ограничены. Предпочтительно, используются иммунохимические способы, такие как иммуноцитохимическое окрашивание и иммуноэлектрофорез. При этом могут быть использованы маркер-специфичные поликлональные антитела или моноклональные антитела, реагирующие с клетками-предшественниками кардиомиоцитов или с кардиомиоцитами. Антитела против индивидуальных специфичных маркеров, коммерчески доступны и могут легко использоваться. Маркеры, специфичные для клеток-предшественников кардиомиоцитов или для кардиомиоцитов, включают, например, тяжелую цепь/легкую цепь миозина, α-актинин, тропонин I, ANP, GATA-4, Nkx2,5 и MEF-2с.
С другой стороны, экспрессия маркеров, специфичных для клеток-предшественников кардиомиоцитов или для кардиомиоцитов, может быть подтверждена способами молекулярной биологии, широко используемыми в соответствующих областях для амплификации, определения и анализа мРНК, кодирующей соответствующие белковые маркеры, включая, например, полимеразную цепную реакцию с обратной транскриптазой (RT-PCR) и анализа гибридизации. Последовательности нуклеиновых кислот, кодирующие белковые маркеры (например, тяжелая цепь/легкая цепь миозина, α-актинин, тропонин I, ANP, GATA-4, Nkx2,5 и MEF-2с), специфичные для клеток-предшественников кардиомиоцитов или для кардиомиоцитов, известны и могут быть получены из общедоступных баз данных, таких как GenBank в National Center for Biotechnology. Маркер-специфичные последовательности, необходимые для использования в качестве праймеров или зондов, могут быть легко определены.
Кроме того, могут быть использованы физиологические признаки. В частности, могут быть применены такие признаки, как автономная пульсация кардиомиоцитов и экспрессия различных ионных каналов в кардиомиоцитах, таким образом, чтобы кардиомиоциты могли реагировать на электрофизиологические стимулы.
В соответствии со способами по изобретению, в качестве объекта могут быть непосредственно использованы кардиомиоциты, присутствующие в тканях сердца млекопитающих. Кроме того, также могут быть использованы кардиомиоциты, выделенные из свежих тканей сердца различными методами, такими как ферментные процессы или первичная культура клеток, полученная культивированием кардиомиоцитов в соответствующих условиях в течение от одного до 5 дней. Специфические способы культивирования кардиомиоцитов описаны в ряде руководств. Эти способы включают способ Chien'а и модифицированный способ Chien'а (Chien, et al., J. Clin. Invest. 75: 1770, 1985; Meidell, et al., Am. J. Physiol. 251: H1076, 1986; Tamamori, et al., Am. J. Physiol. 275: H2036, 1998).
Кроме того, культивируемые кардиомиоциты включают в себя кардиомиоциты, полученные путем индукции дифференцирования стволовых клеток, не ограничиваясь методами, описанными здесь. Стволовые клетки для применения по изобретению означают клетки со способностью возможного дифференцирования в клетки с кардиомиоцитоподобными фенотипами, при культивировании in vitro. В частности, стволовые клетки включают, например, эмбриональные стволовые клетки (ES клетки) и зародышевые стволовые клетки (EG клетки), получаемые от млекопитающих, таких как мыши, обезьяны и люди, для широкого использования в культурах клеток, и мультипотентные стволовые клетки, такие как мультипотентные взрослые клетки-предшественники (МАРС). Созданы стандартные протоколы для осуществления способов получения, культивирования и хранения этих клеток. Эти мультипотентные стволовые клетки могут быть легко использованы в соответствии с описаниями многих руководств, таких как, например, Manipulating the Mouse Embryo: A laboratory manual (edited by Hogan, et al., Cold Spring Harbor Laboratory Press, 1994), Embryonic Stem Cells (edited by Turkesen, Humana Press, 2002) и в ряде статей (Matsui, et al., Cell 70:841, 1992; Shamblott, et al., Proc. Natl. Acad. Sci. USA 95:13726, 1998; в патенте США № 6090622; Jiang, et al., Nature 418:41, 2002; в международной публикации № 01/11011).
Стволовые клетки, которые можно использовать в соответствии с изобретением, не ограничиваются тремя типами, описанными выше. Любые стволовые клетки, схожие по своим свойствам с клетками ES, могут быть использованы. В этой связи свойства, схожие со свойствами клеток ES, могут быть определены как клеточные биологические свойства, специфичные для клеток ES, такие как наличие поверхностного маркера (антигена), специфичного для клеток ES, экспрессия гена, специфичного для клеток ES, способность формировать тератому и способность формировать химерных мышей. Конкретные примеры включают стволовые клетки, схожие по своим свойствам с клетками ES, такие как стволовые клетки, полученные путем обработки клеток волосяного фолликула и клеток эпидермиса химическими агентами, такими как 5-азацитидин (Sharda & Zahner, Международная публикация № 02/051980), стволовые клетки, полученные путем обработки мононуклеарных клеток антителом CR3/43 (Abuljadayel, Curr. Med. Res. Opinion 19:355. 2003), и стволовые клетки, полученные из зрелых клеток внутреннего уха (Li, et al., Nature Med., предварительная on-line публикация).
Способ по изобретению может быть применен к любым клеткам без свойств, схожих со свойствами клеток ES или любым немультипотентным клеткам, если только клетка обладает по меньшей мере способностью дифференцироваться в клетки с фенотипом, схожим с фенотипом кардиомиоцитов, по меньшей мере при культивировании in vitro. Примеры таких клеток включают мезенхимальные стволовые клетки, происходящие из клеток костного мозга (Bruder, et al., патент США 5736396; Pittenger, et al., Science 284:143, 1999: Международная публикация № WO 03/035382).
В качестве способа культивирования для получения кардиомиоцитов из стволовых клеток по изобретению, любой способ, приемлемый для индукции дифференциации кардиомиоцитов, может быть использован. В случае использования, например, клеток ES, способ культивирования включает, например, суспензионный способ культивирования, способ культивирования в висящей капле, способ совместного культивирования с поддерживающими клетками, ротационный способ культивирования, способ культивирования в мягком агаре и способ культивирования на микроносителях. Создано множество способов для индукции дифференциации. Желающие применить изобретение на практике могут ознакомиться с руководствами, такими как Embryonic Stem Cells (edited by Turkesen, Humana Press, 2002) и рядом ссылочных руководств (Klug, et al., J. Clin. Invest. 98:216, 1996; Wobus, et al., J. Mol. Cell. Cardiol. 29:1525, 1997; Kehat, et al., J. Clin. Invest. 108:407, 2001; Xu, et al., Circ. Res. 91:501, 2002; Takahashi, et al., Circulation 107:1912, 2003; Field, et al., патент США 6015671; Xu, et al., Международная публикация № WO 03/06950).
Метод пролиферации кардиомиоцитов
Одним из способов осуществления изобретения является способ пролиферации кардиомиоцитов, предусматривающий стадию введения и экспрессии циклина и CDK в кардиомиоциты и стадию ингибирования экспрессии, функционирования и активности белка Cip/Kip. Как и кардиомиоциты, клетки выделяли из живых тканей сердца различными способами, такими как ферментативная обработка, первичная культура клеток, полученных культивированием вышеупомянутых кардиомиоцитов при определенных условиях в течение от одного до 5 дней, а также могут быть использованы кардиомиоциты, дифференцированные из различных стволовых клеток, как описано выше. Кардиомиоциты, присутствующие в ткани сердца млекопитающих, могут пролиферировать при непосредственной обработке кардиомиоцитов различными способами, описанными ниже, и поддержании клеток in vivo. Термин «поддержание» здесь означает предоставление клеткам возможности существовать без каких-либо изменений физиологических функций, в физиологическом окружении в биологическом организме, например, при приемлемой температуре тела и кровоснабжении в объеме, необходимом для поддержания клеток.
Одним из наиболее предпочтительных способов для введения и/или экспрессии циклина и CDK в кардиомиоциты является способ DNLS/CDK, ранее описанный авторами изобретения (см. патентную ссылку 1 и непатентную ссылку 5). В частности, вначале получают два типа аденовирусных векторов с геном D1NLS (циклин D1, меченный NLS) или с геном CDK4, введенными в векторы; затем два типа вирусов вводят в кардиомиоциты для локализации в ядре белка циклина D1 и белка CDK4 так, чтобы не вызвать значительного усиления деления и пролиферации кардиомиоцитов. Содержание патента также включено в настоящее описание.
При осуществлении изобретения способ введения и/или экспрессии циклина и CDK в кардиомиоциты может быть любым, без специальных ограничений, способом, если он может вызывать тот же эффект, что и способ DNLS/CDK. Например, циклином, вводимым и экспрессируемым в кардиомиоцитах, может быть любой циклин, способный активировать CDK4 или CDK6. Помимо циклина D1 могут быть использованы гены циклина D2 или D3.
При этом CDK может удовлетворительно быть активирована циклином типа D. В качестве такой CDK может быть использована не только CDK4, но и CDK6. Такие гены циклина и CDK были выделены и идентифицированы из разных организмов, включая человека. Кроме того, могут быть использованы нуклеотидные последовательности из общедоступных баз данных ДНК, таких как GenBank. Таким образом, специалист в данной области может легко получить нужные гены путем конструирования специфичных праймеров или зондов, и затем используя основные подходы молекулярной биологии.
В качестве способа введения циклина и CDK в кардиомиоциты могут быть применены физические способы, такие как микроскопическая инъекция. С точки зрения эффективности введения предпочтительно применять способ трансфицирования гена. Кроме того, белковые молекулы, продуцируемые в цитоплазму кардиомиоцитов при экспрессии трансфицированного гена, преимущественно, перемещаются в ядро. В связи с этим может применяться любой способ, без специальных ограничений. Способ включает, например, способ присоединения к каждому из генов нуклеотидной последовательности, кодирующей NLS. Два типа белков, производимых этими генами, а именно циклин и CDK, образуют в цитоплазме комплексы. Если любой из этих белков, предпочтительно, циклин, имеет последовательность NLS, то, соответственно, образующийся комплекс может быть перемещен в ядро. В настоящее время известны три типа последовательностей NLS. В частности, первым примером является тип с почти отсутствующими основными аминокислотами, такими как лизин и аргинин, и им, например, является NLS в нуклеопротеине вируса гриппа (Davy, et al., Cell 40:667, 1985). Примером второго типа является тип с более высоким содержанием основных аминокислот, и им, например, является последовательность NLS (N-Pro-Lys-Lys-Lys-Arg-Lys-Val-C; SEQ ID NO.1) антигена SV40 Т (Kalderon, et al., Nature 311:33, 1984). Третьим примером является тип, где основные аминокислоты образуют кластер с интервалом в, примерно, 10 аминокислот, и она называется NLS двойного типа (Robbin, et al., Cell 64:615, 1991). При осуществлении изобретения может быть использована NLS любого из трех типов. Также может быть использована NLS, не относящаяся к этим трем типам. С учетом длины последовательности NLS, способности перемещать желаемую белковую молекулу в ядро и легкодоступности гена последовательности NLS, предпочтительно, может быть использована последовательность NLS антигена SV40 Т. Например, плазмида, содержащая последовательность NLS антигена SV40 Т, а именно pEF/myc/nus, коммерчески доступна от фирмы Invitrogen.
По изобретению белок семейства Cip/Kip является серией белковых групп, составляющих одно семейство ингибиторов CDK, отрицательно регулирующих продолжительность клеточного цикла и включающих три молекулы: p21Cip1, p27Kip1 и p57Kip2. Известно, что белок семейства Cip/Kip подавляет функцию различных комплексов циклин-CDK, например циклин D-CDK4/CDK6 и циклин A/E-CDK2 (см. обзор Sherr & Roberts, Genes Dev. 9:1149, 1995).
Среди белков семейства Cip/Kip, в настоящее время изучаются, в частности функция и характерные особенности белка p27Kip1. p27Kip1 был впервые идентифицирован как фактор связывания с комплексом циклин E-CDK2 в клетках с клеточным циклом, остановленным стимулом TGF-β (Koff, et al., Cell 66:1217, 1991). Известно, что p27Kip1 является отрицательным регулятором клеточного цикла, ответственным за остановление фазы G1. Например, избыточная экспрессия белка p27Kip1 в клетках млекопитающих вызывает остановку клеточного цикла в фазе G1 (Polyak, et al., Cell 79:59, 1994; Toyoshima & Hunter Cell 78:67, 1994). Предполагается, что p27Kip1 играет значительную роль в задержке фазы G0 в статичной фазе, так как p27Kip1 активно экспрессируется в этой стадии клеток (Nourse, et al., Nature 372:570, 1994). Приведенные ниже исследования показывают, что p21Cip1 и p57Kip2 имеют структурные, функциональные и отличительные особенности, весьма сходные с таковыми p27Kip1 (Mainprize, et al., J. Neurooncol. 51:205, 2001; Conqueret, Trends. Cell Biol. 13:65, 2003). Поэтому если не указано иного, в настоящем описании термин белок (семейства) Cip/Kip обозначает три типа белков, p21Cip1, p27Kip1 и p57Kip2, преимущественно, p27Kip1.
При осуществлении изобретения способ ингибирования функций и активности белка семейства Cip/Kip конкретно не ограничен. Примером такого способа является способ ингибирования активности белка семейства Cip/Kip, предусматривающий введение в клетки нейтрализующих антител, ингибирующих функцию и активность белка, или низкомолекулярных соединений, или подобных соединений в клетках. Кроме того, способ, который стимулирует разрушение белка семейства Cip/Kip, также конкретно не ограничен. Однако, предпочтительно, им является способ стимуляции убиквитинилирования белка.
Убиквитин является полипептидом, в большом количестве представленном во всех эукариотических клетках. Уровень экспрессии белка семейства Cip/Kip в клетках в основном регулируется системой разрушения посредством убиквитинового пути (Pagono, et al., Science 269:682, 1995; Maki & Howley, Mol. Cell Biol. 17:355, 1997; Urano, et al., J. Biol. Chem. 274:12197, 1999). В частности, полиубиквитиновая цепь ковалентно связывается с белком Cip/Kip (убиквитинилирует) посредством функции и активности убиквитинактивирующего фермента (Е1), убиквитинкомплексообразующего фермента (Е2) и убиквитинлигазы (Е3). В дальнейшем убиквитинилированный белок Cip/Kip окончательно разрушается протеасомой 26S. Поэтому способ введения в кардиомиоцит молекулы, вызывающей убиквитинилирование белка Cip/Kip, является предпочтительным при осуществлении изобретения. Любое вещество с действием, вызывающим убиквитинилирование белка Cip/Kip, является приемлемым веществом для введения в кардиомиоциты. В частности, вещество, включающее, например, фармацевтические агенты, белки, пептиды и низкомолекулярные соединения. Предпочтительно, используется нуклеиновая кислота, а именно ген. Такой ген включает в себя гены, кодирующие белки, составляющие убиквитинактивирующий фермент, убиквитинкомплексообразующий фермент и убиквитинлигазу. Принимая во внимание, что именно убиквитинлигаза ответственна за специфичность убиквитинилирования белка-мишени, предпочтительно, использовать ген, кодирующий белки, составляющие убиквитинлигазу.
В настоящее время известно множество молекул, как убиквитинлигаза, включая комплекс АРС/С, комплекс VBC, комплекс SCF, Nedd4, Ufd4, Rad5, Rad18 и Parkin. Кроме того, существует несколько типов комплекса SCF, в зависимости от различий в белках F-бокса, содержащихся в них в качестве компонентов, например SCFβTrCP, SCFCdc4, SCFMet3 и SCFGrr1 (Patton, et al., Trends Genet. 14:236, 1998; Jackson & Eldridge, Mol. Cell 9:923, 2002). Как убиквитинлигаза (комплекс), вовлеченная в убиквитинилирование белка Cip/Kip, убиквитинлигазу называют SCFSkp2. Предпочтительно используют ген, кодирующий компонент комплекса, но он конкретно не ограничен. Ген, кодирующий компонент убиквитинлигазы с действием, вызывающим убиквитинилирование белка Cip/Kip, также может быть использован. Известно, что в молекулах, составляющих SCFSkp2, белок F-бокса, называемый Skp2, в частности, распознает белок Cip/Kip и связывается с ним, а также присоединяется к белку полиубиквитиновой цепи (Carrano, et al., Nature Cell Biol. 1:193, 1999; Tsvetkov, et al., Curr. Biol. 9:661, 1999; Bornstein, et al., J. Biol. Chem. 278:26752, 2003; Kamura, et al., Proc. Natl. Acad. Sci. USA 100:10231, 2003). Поэтому при осуществлении изобретения ген, кодирующий белок Skp2 (иногда в настоящем описании называемый геном Skp2), является предпочтительным для использования в качестве гена, вводимого в кардиомиоциты.
Ген Skp2 был выделен и идентифицирован у человека (Zhang, et al., Cell. 82:915, 1995) и животных, таких как мыши (Nakayama, et al., EMBO J. 19:2069, 2000; Nakayama, et al., JP-A-2001-224380) и крысы. Также известна нуклеотидная последовательность. Кроме того, могут быть использованы нуклеотидные последовательности из общедоступных баз данных ДНК, таких как GenBank (Skp2 человека: U33761, AY029177; Skp2 мыши: AF:083215, BC003468). Таким образом, специалист в данной области может легко получить и использовать ген Skp2, конструируя специфичные праймеры или зонды, специфичные для гена Skp2, и применяя затем основные подходы молекулярной биологии. Гены Skp2, полученные от млекопитающих, таких как человек, мыши или крысы, могут привести к подобным результатам, что и ген Skp2, при использованнии для осуществления изобретения.
При осуществлении изобретения, кроме того, не только ген Skp2, но также и гены, кодирующие факторы, вызывающие убиквитинилирование и/или разрушение белка Cip/Kip (называемые здесь генами, вызывающими разрушение белка Cip/Kip), как и ген Skp2, могут быть использованы в качестве генов для введения в кардиомиоциты. Например, могут быть использованы гены, кодирующие белок F-бокса, распознающий и связывающий белок Cip/Kip, белок F-бокса, который на 80% или более гомологичен, предпочтительнее, на 90% или более гомологичен аминокислотной последовательности области мотива, называемой WD-40 повтором или повтором, богатым лейцином, рассматриваемой как место распознавания/связывания субстрата Skp2, и компоненты убиквитинлигазы, способные вызывать убиквитинилирование белка Cip/Kip.
Гены, кодирующие белки любых факторов, и обладающие специфичным связыванием и/или взаимодействием с белком p27Kip1, вызывая его разрушение без прямого вовлечения в убиквитинилирование белка Cip/Kip, также могут быть использованы в способе по изобретению. Сообщалось, например, о нуклеопорине 50, белке, который связывается с порами ядерной мембраны (также называемом Nup50, NPAP60 и p163) (Buergin, et al., EP № 926236; Mueller, et al., EMBO J. 19:2168, 2000; Smitherman, et al., Mol. Cell. Biol. 20:5631, 2000; Buergin, et al., патент США № 6265562), и о Jab1/CSN5, сигналосоме Cop9 (Tomoda, et al., J. Biol. Chem. 277:2302), а также генах. Известно, что когда остаток серина в положении 10 в p27Kip1 фосфорилирован, p27Kip1 связывается с белком CRM1, являющимся внеядерно-локализованным переносчиком, так что p27Kip1 выводится из ядра и затем разрушается (Ishida, et al., J. Biol. Chem. 277:14355, 2002; Connor et al., Mol. Biol. Cell 14:201, 2003). Был идентифицирован KIS (взаимодействующий с киназой статмин), который представляет собой специфичную фосфорилазу остатка серина в положении 10 белка (Boehm, et al., EMBO J. 21:3390, 2002). Способ, в котором используется ген, кодирующий KIS, также входит в рамки настоящего изобретения. В соответствии с изобретением факторы или гены, связанные с факторами, могут быть использованы отдельно или в сочетании с некоторыми другими факторами или генами для стимуляции разрушения белка семейства Cip/Kip.
Как описано выше, типичный пример предпочтительного способа осуществления изобретения включает стадию введения гена, кодирующего циклин и CDK, по меньшей мере один из которых помечен NLS, и гена, вызывающего разрушение белка Cip/Kip, в кардиомиоциты, и экспрессию этих генов в них. Предпочтительно, эти гены присоединены к последовательности нуклеиновых кислот, что делает возможным транскрипцию и экспрессию генов в клетках млекопитающих, прежде всего кардиомиоцитах, так называемой промоторной последовательности, таким образом, чтобы эта транскрипция и экспрессия происходили под контролем промотора. Кроме того, транскрибируемый и экспрессируемый ген должен, предпочтительно, быть связан с сигналом polyAденилирования (polyA). Предпочтительно, промотор включает, например, промоторы, происходящие из вирусов, таких как SV (обезьяний вирус) 40 вирус, цитомегаловирус (CMV) и вирус саркомы Роуза; и β-актин промотор и EF (фактор элонгации) 1α промотор. Более того, приемлемым является GAG промотор (Niwa, et al., Gene 108:193, 1991), являющийся гибридным промотором, полученным введением гена-усилителя CMV и последовательности сигнала polyA β-глобина кролика в промотор куриного β-актина.
В другом способе осуществления изобретения промотор, применяемый при транскрипции и экспрессии гена, является промотором, специфичным для кардиомиоцитов. Даже в этом случае транскрибируемый и экспрессируемый ген должен, предпочтительно, быть связан с сигналом polyА. Промотор, специфичный для кардиомиоцитов включает, например, промотор легкой цепи миозина, специфичный для кардиомиоцитов (Lee, et al., J. Biol. Chem. 267:15876, 1992), промотор тяжелой цепи миозина, специфичный для кардиомиоцитов, и промотор сердечного белка с анкириновым повтором (CARP), специфичным для кардиомиоцитов (Cuo, et al., Development 126:4223, 1999; International Publication No. WO 00/15821). Нуклеотидные последовательности этих промоторов могут быть получены из общедоступных баз данных ДНК, таких как GenBank. С использованием основных подходов молекулярной биологии могут быть получены генные векторы, содержащие желаемые генные последовательности.
В соответствии с изобретением способ ингибирования экспрессии гена, кодирующего белок (транскрипция мРНК), или способ ингибирования трансляции и продукции генного продукта также может быть использован вместо способа стимуляции разрушения белка семейства Cip/Kip. В частности, олигонуклеиновая кислота или ее производные или подобные соединения, ингибирующие или останавливающие ген, кодирующий белок семейства Cip/Kip, или ген, кодирующий фактор, способный вызывать экспрессию белка, могут быть введены внутриклеточно. В соответствии с изобретением термин «производное олигонуклеиновой кислоты» означает соединение, полученное путем химической модификации, добавления или замещения в определенном месте нуклеиновой кислоты в целях повышения внутриклеточной стабильности и эффективности внедрения нуклеиновой кислоты. Производное включает, например, модифицированную фосфоротиоатной группой олигонуклеиновую кислоту или олигонуклеиновую кислоту, полученную замещением уридина или цитидина 2'-флюороуридином или 2'-флюороцитидином.
Доступны олигонуклеиновые кислоты, которые могут применяться, например, для получения антисмысловых ДНК, ДНК, кодирующих РНК с рибозимной активностью, и ложных ДНК. Недавно предложен способ интерференции РНК (называемый РНКi), в котором используется двухцепочечная РНК. РНКi является феноменом специфического разрушения эндогенной мРНК в гене-мишени, когда двухцепочечная РНК с такой же последовательностью, как и в гене-мишени, или со сходной с геном-мишенью последовательностью вводится внутриклеточно. На начальных стадиях предполагалось, что применение РНКi как способа специфичного ингибирования генов у млекопитающих животных связано с большими трудностями. Было показано, что в случае использования короткой двухцепочечной РНК, как промежуточного продукта РНКi (называемой короткой/малой интерферирующей РНК; siРНК), РНКi применим к клеткам млекопитающих (Hammond, et al., Nat. Rev. Genet. 2:110, 2001; Elbashir, et al., Nature 411-494, 2002). В качестве обзоров по siРНК, способах получения и способах использования, см., например, различные учебники, например, RNA Interference (РНКi): The Nuts & Bolts of siRNA Technology (edited by Engelke, DNA Press, 2004) и RNA Interference, Editing, and Modification; Methods and Protocols (edited by Gott, Humana Press, 2004).
siРНК легко может быть получена обычным способом полимеразной цепной реакцией (ПЦР) или химическим синтезом. Известно, что эффект siРНК зависит от особенности последовательности. siРНК, специфичная для гена белка Cip/Kip, может быть получена на основе генной последовательности гена, предпочтительно, последовательности 300-bp, начиная с инициирующего кодона. Ген, используемый в siРНК, не обязательно, должен быть абсолютно таким же, как ген-мишень. Ген, используемый в siРНК, должен быть гомологичен гену-мишени по меньшей мере на 70%, или более предпочтительно, на 80% или более, еще более предпочтительно, на 90% или более, наиболее предпочтительно, на 95% или более. Нуклеотидные последовательности гена могут быть получены из общедоступных баз данных ДНК, таких как GenBank. Белки p27Kip1 человека, мыши и крысы зарегистрированы под номерами доступа U10906, U10440 и D83792, соответственно. Сообщалось о различных способах и программах для конструирования более эффективной siРНК (Chalk, et al., Nucl. Acids Res. 32:936, 2004; Reynolds, et al., Nat Biotechnol. 22:326, 2004). Специалист в данной области может получить и использовать siРНК, специфичную для гена белка Cip/Kip, также, как и для p27Kip1.
siРНК, полученная этим способом, может быть использована в форме олигонуклеиновой кислоты или ее производного. С целью, например, повышения эффективности и продолжительности действия siРНК предпочтительно использовать в форме, введенной в вектор, экспрессирующий РНК. Вектор, экспрессирующий РНК, включает, например, любой экспрессирующий вектор с промотором, допускающим экспрессию siРНК, без конкретных ограничений. Предпочтительно использовать промоторы Pol. III, подходящие для экспрессии короткой РНК, в частности промоторы U6 и Н1. Кроме того, предпочтительно использовать промотор тРНК, обеспечивающий локализацию продукта транскрипции в цитоплазме. siРНК экспрессирующий вектор, в котором можно использовать эти промоторы, коммерчески доступен от фирм Ambion, Invitrogen, TAKARA и iGene.
В качестве способов введения гена или генного вектора могут быть использованы известные способы. Способ включает, например, способы трансфекции с использованием фосфата кальция и электрического импульса, способ, предусматривающий внедрение нужного гена в липосомы и затем трансфицирование гена в клетку, и способ, предусматривающий присоединение нужного гена к генным векторам, таким как ретровирус и аденовирус, и инфицирование образующихся рекомбинантных вирусов в клетку. В этом случае термин вирусный вектор означает конструкцию, в которой нужный ген введен в последовательность нуклеиновой кислоты с недостатком или изменением полной длины или части вирусной ДНК или РНК, для обеспечения экспрессии.
Вирусный вектор включает векторы, производные от, например, аденовируса, аденоассоциированного вируса (AAV), ретровируса, вируса гемагглютинации Nippon (HVJ; другое название вирус Sendai), лентивируса, вируса осповакцины, вируса куриной оспы и паповавируса, включая SV40. Используя вектор аденовируса, вектор AAV, вектор HVJ или вектор лентивируса, предпочтительно, может быть достигнут эффективный перенос гена и высокий уровень экспрессии трансгена. Перемещение гена с помощью этих вирусных векторов является наиболее перспективным способом введения генов в клетки млекопитающих. В частности, способ применим для введения генов во все типы клеток человека и большого количества нечеловеческих клеток. Так как инфицирование этими вирусами не зависит от клеточного цикла, то гены могут экспрессироваться в различных сериях первичных клеточных культур и сериях трансформированных клеток. Гены могут вводиться с высокой эффективностью даже в клетки без наличия синтеза ДНК или деления клеток, такие как кардиомиоциты. Так как большое число клеток получают различные копии рекомбинантной ДНК (РНК) после инфицирования, введенный ген временно экспрессируется на высоком уровне. В случае аденовирусного вектора и вектора HVJ, например, ДНК/РНК в основном остаются в цитоплазме и плохо проникают в ядро. Поэтому при использовании этих вирусных векторов, почти не происходит случайных мутагенных ошибок, когда четко проявляется чужеродный ген, встроившийся в геном клетки-хозяина.
Аденовирусный вектор, как один из предпочтительных вариантов использования в соответствии с изобретением, может быть получен способом с использованием гомологичной рекомбинации в клетках-хозяевах, таких как зародышевые человеческие клетки почек 293 или Esherichia coli (Miyake, et al., Proc. Natl. Acad. Sci. USA 93:1320, 1996), и простого способа лигирования in vitro (Mizuguchi, et al., Hum. Gene Ther. 9:2577, 1998). Аденовирусный вектор является одним из ДНК-вирусов с двухцепочечным ДНК геномом. Аденовирусы типа 5 и типа 2 человека изучались наиболее интенсивно. Путем удаления большинства из Е1 и Е3 генов из дикого штамма этих аденовирусов может быть получен вирусный вектор, не способный к репликации, так что чужеродная ДНК размером несколько т.п.о. может быть введена без побочных эффектов на формирование вирусных частиц. Рекомбинантный аденовирус не содержит гена Е1, являющегося фактором регуляции транскрипции. Однако аденовирусный вектор может экспрессировать нужный ген, введенный одиночно посредством транскрипционной единицы, специфичной для введенного гена, вне зависимости от пролиферации клетки-мишени или присутствия или отсутствия другого вирусного гена.
Желающие применить изобретение на практике могут обратиться к различным руководствам, содержащим обзоры по аденовирусному вектору и другим вирусным векторам, и способы получения и использования таких способов. Эти руководства включают, например, Gene Therapy Protocols: Methods in Molecular Medicine (edited by Robbins, Humana Press, 1997), Gene Transfer in Cardiovascular System: Experimental Approaches & Therapeutic Implications (edited by March, Kluwer Academic Publishers, 1997), Adenoviral Vectors for Gene Therapy (edited by Curiel & Douglas, Academic Press, 2002). Наборы для получения аденовирусного вектора коммерчески доступны. Например, Adenovirus Expression Vector Kit (№6170), коммерчески доступный от фирмы Takara Bio, подходит для осуществления изобретения. Авторы изобретения недавно сообщали об успешном примере такого применения (см. Nakayama, et al., EMBO J. 19:2069, 2000; патентная ссылка 1 и непатентная ссылка 5, описанные ниже).
В случае необходимости экспрессии нескольких генов, например сочетания гена циклина и гена CDK, и сочетания с другим геном, вызывающим разрушение белка Cip/Kip, в соответствии с изобретением эти два типа или три типа генов могут быть введены в один вирусный вектор для инфицирования, или могут быть инфицированы в форме отдельных рекомбинантных векторов. В случае конкурентного инфицирования различными рекомбинантными вирусами, инфицирование может проводиться одновременно или быть разделено определенным интервалом времени. В качестве меры инфицируемых вирусов, в соответствии с изобретением, используется маточный раствор вируса, например, от 107 до 1013 бляшкообразующих единиц/мл, более предпочтительно, от 109 до 1012 бляшкообразующих единиц/мл. Для клеточной культуры маточный раствор вируса, предпочтительно, должен составлять около 100 вирусов на клетку (moi=100) для инфицирования. Вирусный титр может легко быть получен путем анализа бляшек.
В другом варианте осуществления изобретения вместо (1) гена циклина, (2) гена CDK и (3) одного или нескольких генов, вызывающих деградацию белка семейства Cip/Kip или нуклеиновых кислот, ингибирующих продукцию белка семейства Cip/Kip, может применяться низкомолекулярное соединение с эффектом экспрессии гена и тем же действием, что у данного гена, конкретно включающее в себя, например, соединение с действием, сходным с таковым белка циклина, соединение с действием, сходным с таковым белка CDK, соединение с действием, способствующим деградации белка Cip/Kip, или соединение с действием, ингибирующим продукцию белка Cip/Kip. В данном случае способ введения соединения в кардиомиоциты не имеет конкретных ограничений. В общем, соединения растворяют в фармацевтически приемлемых носителях, таких как буферный физиологический солевой раствор, и растворах разбавителях для получения дозированных форм, таких как формы для перорального введения, внутривенных инъекций, внутрибрюшинных инъекций, чрескожного введения, подкожных инъекций и прямых инъекций в сердечную ткань. В случае, когда кардиомиоциты находятся в культуре, соединение может также добавляться непосредственно в их культуральную среду.
(Применение в качестве генотерапевтического способа)
В другом варианте осуществления изобретения может быть получена фармацевтическая композиция для генной терапии, причем композиция содержит генный вектор для использования в практике изобретения, предпочтительно, вирусный вектор, более предпочтительно, аденовирусный вектор или HVJ вектор, AAV вектор или лентивирусный вектор. Каждая фармацевтическая композиция для генной терапии может быть использована в качестве фармацевтического средства для регенерации кардиомиоцитов или в качестве терапевтического средства при заболеваниях сердца. Такое применение может быть эффективно при любом заболевании сердца, если при заболевании сердца произошло повреждение, функциональное нарушение или гибель кардиомиоцитов. Конкретные примеры таких заболеваний включают инфаркт миокарда, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертрофическую кардиомиопатию, дилатационную кардиомиопатию, миокардиты и хроническую сердечную недостаточность.
Приемлемой является любая форма фармацевтической композиции. Фармацевтическая композиция может быть получена обычными способами. Например, фармацевтическая композиция может быть в виде впрыскиваемой формы, содержащей вектор генной экспрессии изобретения в фармацевтически приемлемых носителях, таких как стерильная вода и буферный физиологический раствор, и разжижающий раствор. Фармацевтические приемлемые носители дополнительно могут содержать соответствующие стабилизаторы (например, ингибиторы нуклеаз), хелатные агенты (например, EDTA) и/или другие вспомогательные агенты. Фармацевтическую композицию, содержащую компоненты, можно стерилизовать фильтрацией и подобным способом, если необходимо, и затем помещать в асептическую ампулу. С использованием, например, осмотического насоса или осмотической трубки препарат может затем быть доставлен к месту повреждения. Здесь дозу фармацевтической композиции по изобретению увеличивают или уменьшают в зависимости от необходимости, соответственно, в зависимости от условий, таких как возраст, пол, масса тела и симптомы пациента и путь введения дозы. Специалист в данной области может соответственно определить нужную дозу. Как правило, единичная доза взрослых находится в пределах от 1,0 мкг/кг до 1,0 г/кг, предпочтительно, в пределах от 10 мкг/кг до 100 мг/кг. В случае использования вирусных векторов, таких как аденовирусный вектор, дополнительно, конечный титр вируса, предпочтительно, 107 до 1013 бляшкообразующих единиц/мл, более предпочтительно, 109 до 1012 бляшкообразующих единиц/мл.
В случае, когда вектор генной экспрессии является невирусным вектором, в частности, фармацевтическая композиция изобретения может быть доставлена в комплекс липосомой. Посредством каждой формы фармацевтическая композиция может реализовывать высокую эффективность трансфекции, в частности, в кардиомиоцитах. Как специфические примеры липосом было разработано большое число липидных препаратов, включающих например N-[2,3-(диолеилокси)пропил]-N,N,N-триметиламмонийхлорид (ДОТМА) и диолеоилфосфатидилэтаноламин (ДОФЭ). Были проведены эксперименты с трансфекцией, с применением различных клеточных систем. (Banerjee, J. Biomater. Appl. 16:3, 2001; Maurer, et al., Expert Opin. Biol. Ther. 1:923, 2001). Кроме того, также эффективен способ, использующий синтезированную вирусную липосому с синтезированной оболочкой, полученной из HVJ, названный HVJ-липосомный способ (Yonemitsu, et al., Int.J. Oncol. 12:1277, 1998; Kaneda, et al., Mol. Med. Today 5:298, 1999).
Вектор генной экспрессии или фармацевтическая композиция, содержащая вектор, могут быть успешно введены в целое сердце пациента с заболеваниями сердца. Тем не менее предпочтительно, чтобы вектор генной экспрессии или фармацевтическая композиция могли быть введены только в место повреждения. По изобретению участки повреждения означают участки с повреждением, функциональным нарушением или гибелью кардиомиоцитов, функциональной задержкой или смертью, или подобного у индивидуума (людей или животных: то же справедливо и здесь) или место, где ожидается усиление нарушения или функционального повреждения или гибели кардиомиоцитов. В этом случае способ введения вектора генной экспрессии или фармацевтической композиции, содержащей вектор генной экспрессии, в место повреждения включает способ прямой инъекции вектора генной экспрессии или фармацевтической композиции, содержащей его, в сердце после торакотомии, с использованием шприца для инъекций, и способа инъекции вектора или фармацевтической композиции через катетер под рентгеновским диафаноскопом. Предпочтителен способ введения через катетер, так как введение гена может быть локализовано точно в сердце. В этом случае вектор генной экспрессии или фармацевтическая композиция, содержащая вектор, может быть инъецирован в катетер для высвобождения вектора или композиции через кровяное русло в кардиомиоциты. Вектор или фармацевтическая композиция также могут быть напрямую инъецированы в слой сердечной мышцы, контактирующий с кардиомиоцитами. Такой хирургический подход, использующий катетер и подобное, известен в данной области. Справочная литература включает, например, Gene Transfer in Cardiovascular System: Experimental Approaches & Therapeutic Implications (edited by March, Kluwer Academic Publishers, 1997), Vascular Surgery, the 5th edition (Rutherford, W.B.Saunders, 2000) and Textbook of Interventional Cardiology, the 4th edition (edited by Topol, W.B.Saunders, 2002).
Катетер, использованный в данном изобретении, коммерчески доступен от Boston Scientific, Edwards Life Sciences Corporation и подобных компаний.
(Использование кардиомиоцитов, пролиферирующих с помощью способа изобретения)
Из кардиомиоцитов, пролиферирующих с помощью метода изобретения, могут быть эффективно получены высокоочищенные кардиомиоциты в большом масштабе, с последовательным применением выделения клеток, разделения и очистки согласно известным традиционным способам. Кардиомиоциты, полученные подобным образом, здесь называются кардиомиоцитами, полученными по изобретению.
Может быть использован любой способ очистки кардиомиоцитов из известных способов разделения и очистки клеток. Специфические примеры таких способов включают способы реакций антиген-антитело, например способы с проточной цитометрией и магнитными шариками и способ промывки, и способы клеточного фракционирования центрифугированием в градиенте плотности, с использованием таких носителей, как сахароза и Перколл. Другим способом скрининга кардиомиоцитов является способ селективного получения кардиомиоцитов с помощью предварительного получения такой искусственной модификации, которая сохранит химическую толерантность и потенциал экспрессии эктопического белка к гену животного или стволовую клетку, такую как ES-клетка как источник кардиомиоцитов, и затем использование полученных модификаций как индикатор для скрининга. Например, Field с соавторами сконструировали систему, полученную введением генной кассеты, способной экспрессировать неомицин-(G418)-резистентный ген в мышиную ES-клетку под контролем промотора тяжелой α-цепи миозина для дифференцировки ES-клеток в кардиомиоцитах для предоставления возможности экспрессии гена тяжелой α-цепи миозина с последующей дифференциацией, точно когда полученная клетка сможет выжить в культуре с G418. Исследователи сообщают, что клетка, выявленная при скрининге как G418-резистентная, является кардиомиоцитом с вероятностью 99% или более (патент США 6015671; J. Clin. Invest. 98:216, 1996).
В дополнительном варианте осуществления изобретения кардиомиоциты, полученные в соответствии с изобретением, использовались для фармакологической оценки и оценки активности различных физиологически активных субстанций (например, лекарств) и функционально неидентифицированных новых генных продуктов. Например, кардиомиоциты могут быть использованы для скрининга вещества или фармацевтического агента, ассоциированных с функциональной регуляцией кардиомиоцитов, и вещества и фармацевтического агента с токсичностью и повреждающими свойствами к кардиомиоцитам. В еще одном дополнительном осуществлении оценочный набор, содержащий кардиомиоциты, полученные по изобретению, использовали для скрининга.
Может быть успешно применен любой тип тестируемого вещества для использования в скрининге, так, тестируемое вещество может быть добавлено в культуру и включает, например, низкомолекулярные компоненты, высокомолекулярные компоненты, органические компоненты, неорганические компоненты, белок, пептид, ген, вирус, клетку, жидкую культуру клеток и жидкую микробную культуру. Способ эффективного введения гена в культуру включает способ добавления вирусного вектора, такого как ретровирус и аденовирус, в культуру или способ упаковки такого вирусного вектора в липосому и подобное с добавлением векторов в культуру.
Оценка тестируемых веществ может быть сделана с помощью исследования количественного и качественного изменения функций кардиомиоцитов. Один пример исследования жизнеспособности кардиомиоцитов следующий. Кардиомиоциты, полученные согласно изобретению, инокулировали на чашку с культурой до соответствующей клеточной плотности для индуцирования клеточной гибели (апоптоза), когда выращивали на среде без сыворотки или для изучения жизнеспособности или гибели кардиомиоцитов в среде с соответствующим количеством тестируемого вещества, добавленного туда. Способ изучения жизнеспособности или гибели кардиомиоцитов осуществляется под визуальным наблюдением или с использованием введения красителя, такого как трипановый синий в качестве индикатора. Также может быть использован другой способ, такой как использование дегидрогеназной активности (редуцирующая активность) как индикатора или способ, использующий активность каспазы, специфичной в отношении апоптозной клетки, или экспрессию аннексина V как индикатор. Наборы, использующие этот механизм, коммерчески доступны от большого числа компаний, таких как Sigma, Clontech и Promega.
Поскольку вещества и фармацевтические агенты, полученные способом скрининга, имеют способность индуцировать дифференциацию кардиомиоцитов и способность регулировать функции, причем эти вещества и фармацевтические средства могут быть использованы как профилактические средства для заболеваний сердца, таких как инфаркт миокарда, ишемическая болезнь сердца, застойная сердечная недостаточность, гипертрофическая кардиомиопатия, дилатационная кардиомиопатия, миокардит и хроническая сердечная недостаточность. Эти компоненты могут быть новыми или известными компонентами.
Кроме того, кардиомиоциты, полученные по изобретению, также могут быть использованы как трансплантируемые клетки для регенерации сердечной мышцы или для терапевтического лечения заболеваний сердца. Заболевания сердца включают, например, инфаркт миокарда, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертрофическую кардиомиопатия, дилатационную кардиомиопатию, миокардит и хроническую сердечную недостаточность. В качестве трансплантируемых клеток клетки, содержащие высокоочищенные кардиомиоциты, полученные по изобретению, могут быть использованы в любой форме, такой как клетки, суспендированные в водном носителе, таком как культуральная среда, клетки, вводимые в твердые носители, такие как биодеградируемые вещества, или клетки, вводимые в единичные или множественные пласты кардиомиоцитов (Shimizu, et al., Circ. Res. 90: e40, 2002).
Способ введения кардиомиоцитов в качестве трансплантируемых кардиомиоцитов в поврежденный участок включает способ прямой инъекции трансплантируемых кардиомиоцитов в сердце после торакотомии, с использованием шприца для инъекций, способа хирургического надреза части сердца для введения кардиомиоцитов и способа инъекции кардиомиоцитов через кровяную трубку с применением катетера (Murry, et al., Cold Spring Harb. Symp. Quant. Biol. 67:519, 2002; Menasche, Ann. Thorac. Surg. 75:S20, 2003; Dowell, et al., Cardiovasc. Res. 58:336, 2003). Однако способ не ограничивается описанным выше. Когда кардиомиоциты, полученные из сердца эмбриона, ввели в сердце животного с сердечной патологией, то получили великолепный терапевтический эффект, как сообщают (Menasche, Ann. Thorac. Surg. 75:S20, 2003; Reffelmann, et al., Heart Fail. Rev. 8:201, 2003). Кардиомиоциты, полученные из ES клеток, фенотипически очень похожи на кардиомиоциты, полученные из сердца эмбриона (Maltsev, et al., Mech. Dev. 44:41, 1993; Circ. Res. 75:233, 1994). В экспериментальном примере на животных, где кардиомиоциты, полученные из ES клеток, были действительно трансплантированы в сердце взрослого, доказано, что получена очень высокая биосовместимость. (Klug, et al., J. Clin. Invest. 98:216, 1996). Пересадка кардиомиоцитов, полученных способом по изобретению, в нарушенную сердечную ткань при заболеваниях сердца вследствие нарушения и диссоциации кардиомиоцитов по компенсаторному типу, как и следовало ожидать, может способствовать улучшению сердечной деятельности.
ПРИМЕРЫ
Теперь изобретение будет конкретно описано следующими примерами. Однако примеры, изложенные ниже, просто иллюстрируют изобретение, но не ограничивают его объем.
[Пример 1: получение рекомбинантного аденовируса]
Аденовирусные векторы, каждый из которых несет CDK4 ген, циклин D1 ген с нуклеотидной последовательностью, кодирующей ядерную локализацию сигнала (NLS), соединяли (D1NLS) или Skp2 ген получали с использованием набора для получения рекомбинантного аденовируса (Adenovirus Expression Vector Kit; TaKaRa Bio).
В случае аденовирусного вектора, несущего CDK4 ген, именуемого Ad-CDK4, плазмида pCMV-CDK4 (поставляемая Dr. Sander van den Heuvel [Massachusetts General Hospital Cancer Center; USA]; van den Heuvel, et al., Science 262: 2050, 1993) была порезана BamHI для получения мышиного CDK4 кДНК фрагмента, у которого оба конца были затуплены, с использованием Т4 ДНК-полимеразы. Следующий протокол связан с набором вектора аденовирусной экспрессии, где затупленный фрагмент был вставлен в SwaI сайт космиды pAxCAwt для получения космиды pAd-CDK4. Впоследствии трансфекция космиды вместе с обработанным рестриктазой ДНК-ТРС (терминальный пептидный комплекс), полученным из геномной ДНК человеческого аденовируса типа 5, в 293 клетки, полученные из человеческих эмбриональных клеток почки, позволила получить рекомбинантный аденовирус Ad-CDK4.
Плазмида, несущая D1NLS ген, была сконструирована конъюгацией мышиного циклин D1 кДНК фрагмента, полученного из pRSV-циклин D1 (Matsushime, et al., Cell 65:701, 1991) c pEF/myc/nus (Invitrogen), происходящим из NLS. Точнее, плазмиду pEF/myc/nus расщепляли рестриктазами NcoI и XhoI для получения первого ДНК-фрагмента, содержащего последовательность NLS. Затем плазмида pRSV-циклин D1 расщеплялась рестриктазой NcoI для получения второго ДНК-фрагмента, содержащего циклин D1 последовательность. Затем проводили ПЦР, с использованием плазмиды pRSV-циклин D1 в качестве матрицы и также с использованием следующих двух типов праймеров для получения третьего ДНК-фрагмента, кодирующего С-конец кДНК циклин D1.
5′-праймер: 5′-ACCCTCCATGGTAGCTGCTGGGA3′ (SEQ ID NO: 2)
3′-праймер: 5′-TGATCTCGAGGTCGATGTCCACATCTCGCACGT-3′ (SEQ ID NO: 3)
С использованием Т4 ДНК-лигазы эти три типа ДНК-фрагментов сшивали вместе для конструирования плазмиды, несущей нуклеотидную последовательность, кодирующую SV40, происходящую из T-антигена NLS в трех параллелях на стороне С-конца кДНК мышиного циклина D1. ДНК-фрагмент, удаленный из плазмиды рестриктазами PmaCI и SmaI, вставили в SwaI сайт космиды pAxCAwt. Полученную космиду (pAd-D1NLS) ДНК ТРС, обработанную рестриктазой, трансфицировали в клетки 293 для получения рекомбинантного аденовируса Ad-D1NLS.
Аденовирусный вектор Ad-Skp2, несущий Skp2, получали на основе мышиной Skp2 кДНК. Мышиная Skp2 кДНК получена из библиотеки кДНК мышиного тимуса (Stratagene) с использованием мышиного клона EST (expressed sequence tag) (инвентарный номер AA511897), зарегистрированного в GenBank как зонд (Nakayama, et al., спецификация JP-A-2001-224380). Точнее, 32Р-меченный зонд получили из EST клона согласно основным способам. Затем зонд гибридизовали с копией фильтра, полученной на основе библиотеки кДНК, в буфере при 68°С 24 часа. Полученный гибрид отмыли в буфере, содержащем 0,1% SDS при 68°С. Полученный позитивный клон субклонировали в плазмиду pBluescript SK (Stratagene) для нуклеотидного секвенирования. Нуклеотидную последовательность мышиной Skp2 кДНК, как определено в каждом способе, регистрировали в GenBank (инвентарный номер AF083215) (Nakayama, et al., EMBO J. 19:2069, 2000; Nakayama, et al., спецификация JP-A-2001-224380). Используя мышиную Skp2 кДНК как матрицу и следующие два типа праймеров, проводили ПЦР для получения фрагмента мышиной кДНК Skp2 с последовательностью метки Flag (N-Asp-Tyr-Lys-Arp-Asp-Asp-Asp-Lys-C; SEQ ID NО:4) на N-конце, которую затем вставляли в XhoI участок вектора пкДНК-3 (Invitrogen) для получения вектора pcDNA3-Flag-Skp2.
5′-праймер: 5′-ATACTCGAGGCCACCATGGACTACAAGGACGACGATGACAAGCATAGGAAGCACCTTCAGGAGATT-3′ (SEQ ID NО:5)
3′-праймер: 5′-ATACTCGAGTCATAGACAACTGGGCTTTTGCAG-3′ (SEQ ID NО: 6)
Фрагмент, содержащий Skp2 кДНК, полученный расщеплением вектора pcDNA3-Flag-Skp2 с помощью XhoI, вставили в SwaI участок космиды pAxCAwt. Полученную космиду и ДНК-ТРС (конечный пептидный комплекс), полученный из геномной ДНК человеческого аденовируса 5 типа, трансфицировали в 293 клетки для получения рекомбинантного аденовируса Ad-Skp2.
Три типа рекомбинантных аденовирусов, полученных способом, описанным выше (Ad-CDK4, Ad-D1NLS и Ad-Skp2), конструировали в каждом способе так, чтобы отдельный встроенный ген мог бы экспрессироваться под контролем CAG промотеров (CMV энхансер, промотер β-актина цыпленка и polyA последовательность гена крысиного β-глобина). Поэтому включенные гены могут быть высокоэкспрессированы в клетках млекопитающих.
Впоследствии, намеревались получить вирусные растворы индивидуальных рекомбинантных вирусов в высоком титре. 4 мкг каждого из трех типов космид (pAd-CDK4, pAd-D1NLS и pAd-Skp2) смешали с 2,5 мкл ДНК-ТРС, обработанной рестриктазой, прикрепленной к набору для получения рекомбинантного аденовируса. Смеси были по отдельности трансфицированы в 293 клетки, культивированные в культуральной чашке (диаметр 60 мм) способом lipofection, с использованием
FuGENETM 6 Transfection Reagent (Roche). На следующий день клетки разъединяли, и полученные клеточные суспензии снова по отдельности инокулировали на культуральной плашке (96 лунок), покрытой коллагеном. Через 7-15 дней вирус вырастал, и клетки убивали в различных лунках. Из каждой лунки, в которой клетки целиком умирали, культуральная среда была асептически собрана в стерильную пробирку, замораживание и оттаивание повторяли 6 раз, и центрифугировали при 500 оборотах в минуту 5 минут. Супернатанты сохраняли как первичный маточный раствор вируса при -80°С. 10 мкл исходного раствора вируса инфицировали в 293 клетки, культивированные на культуральной плашке (24 лунки), покрытой коллагеном. Культуральную среду в лунке, содержащую убитые клетки, через 3-4 дня асептически переносили в стерильную пробирку, замораживание и оттаивание повторяли 6 раз и центрифугировали при 5000 оборотах в минуту 5 минут для получения результирующего супернатанта и сохраняли как вторичный вирусный маточный раствор при -80°С. 15 мкл вторичного вирусного маточного раствора инфицировали в 293 клетки, культивированные в культуральном флаконе (25 см2), покрытом коллагеном. Культуральную среду через 3-4 дня асептически переносили в стерильную пробирку, и вирус выходил из клеток с помощью замораживания и оттаивания или гомогенизацией клеток с помощью герметичной обработки ультразвуком. Супернатант, полученный после центрифугирования (3000 об/мин, 10 минут, 4°С), сохраняли как третичный вирусный маточный раствор при -80°С. 50 мкл третичного вирусного маточного раствора инфицировали в 293 клетки, выращенные в культуральном флаконе (75 см2), покрытом коллагеном. Культуральную среду асептически перенесли в стерильную пробирку, и вирус был высвобожден из клеток замораживанием-оттаиванием или гомогенизацией клеток с помощью герметичной обработки ультразвуком. Супернатант, полученный после центрифугирования (3000 об/мин, 10 минут, 4°С), сохраняли как четвертый вирусный маточный раствор при -80°С. Титр четвертого вирусного раствора определяли анализом бляшек с использованием клеток 293. Титр постоянно находился в пределах от 109 до 1011 бляшкообразующих единиц/мл без исключения. В этом изобретении свежее число вирусных единиц, введенных на 1 клетку, выражается как множественность инфекции (moi) здесь далее. Иными словами, одна вирусная частица, трансфицированная в одну клетку, выражается как moi=1.
[Пример 2: Накопление белка p27Kip1 в кардиомиоцитах, обработанных DNLS/CDK]
Кардиомиоциты выделяли из крысы (Sprague-Dawley) на 2-4 день после рождения, фракцию кардиомиоцитов получали центрифугированием в градиенте концентрации Перколл (Tamamori, et al., Am. J. Physiol. 275:H2036, 1998). Доказано с помощью иммунологического окрашивания, с использованием антител против актина саркомеров, что 95% или более полученных клеток являлись кардиомиоцитами. Кардиомиоциты новорожденных крыс суспендировали в минимально чувствительной культуральной среде Игла (Flow Laboratories) с добавлением 5% бычьей эмбриональной сыворотки (FBS; Flow Laboratories) и затем инокулировали на культуральную чашку для роста в инкубаторе с диоксидом углерода в течение 24 часов. На следующий день культуральную среду сменили на бессывороточную минимально чувствительную культуральную среду Игла для другого 24-часового роста. Потом рекомбинантный вирус Ad-D1NLS (moi=от 10 до 100) и Ad-CDK4 (moi=100), полученный в примере 1, добавили в культуральную среду на 48 часов роста. Процедура инфицирования и трансфекции кардиомиоцитов рекомбинантными вирусами Ad-D1NLS и Ad-CDK4 для экспрессии циклин D1 белка и CDK4 белка в ядре кардиомиоцитов здесь и далее рассматривается как стимуляция D1NLS+CDK4 или лечение D1NLS+CDK4. В качестве контроля был сделан похожий эксперимент с использованием REF52 клеток в качестве клеточной линии фибробластов.
Экспрессия белка p27Kip1 в кардиомиоцитах, трансфицированных генами D1NLS и CDK4, была оценена с помощью вестерн-блота. Клетки, трансфицированные вирусами Ad-D1NLS и Ad-CDK4, отмыли фосфатно-солевым буфером (PBS) на льду и затем соскребали клеточным скребком и центрифугировали с удалением полученного супернатанта. Полученный преципитат снова один раз промыли в малом объеме PBS и затем перенесли в 1,5-мл пробирки типа Eppendorf, куда был добавлен на льду Буфер А (10 мМ HEPES, pH 7,9, 1,5 мM MgCl2, 10 мM KCl, 0,5 мM DTT). Затем полученную смесь встряхнули и оставили на льду на 10 минут. Потом к смеси добавили NONIDET P-40 до конечной концентрации 0,2% , встряхнули и потом оставили смесь на льду на 5 минут. К преципитату, полученному другим центрифугированием (5000 об/мин, 5 минут), добавили равный объем Буфера С (20 мM HEPES, pH 7,9, 25% глицерин, 0,42 М NaCl, 1,5 мM MgCl2, 0,2 мM EDTA) для встряхивания. Полученную смесь оставили на льду на 30 минут, центрифугировали (15000 об/мин, 10 минут) для получения супернатанта, который использовали как ядерную белковую фракцию. Непосредственно перед использованием, кроме того, 1 мM DTT, 1 мM PMSF, 1 мкг/мл aпротинина, 1 мкг/мл лейпептина, и 1 мкг/мл пепстатина (все от Sigma) добавили к Буферу А и Буферу С, описанным выше.
Ядерные белки, полученные в каждом способе, подогнали под объем, содержащий 1×106 клеток на один образец, провели электрофорез в SDS-PAGE геле, перенесли на нитроцеллюлозную мембрану и анализировали с помощью вестерн-блота. Точнее, ядерные белки взаимодействовали с анти-циклин D1 антителами (Oncogene Science: Ab-3) или анти- p27Kip1 антителами (Santa Cruz; sc-528) как основными антителами и потом взаимодействовали с анти-мышиными Ig антителами, мечеными пероксидазой хрена (Amersham Life Science; NA931) или антителами против крысиных Ig (Amersham Life Science; NA934) в качестве вторичных антител для детекции наличия связывания антиген-антитело, с использованием хемилюминесцентного набора (Amersham Life Science; RPN2109).
Результаты показаны на фиг.1. Подобно предыдущим сообщениям (Nakayama, et al., EMBO J. 19: 2069, 2000; патентная ссылка 1 и непатентная ссылка 5), доказано, что трансфекция кардиомиоцитов генами D1NLS и CDK увеличивала уровни экспрессии белка циклина D1 и белка CDK4 в ядрах кардиомиоцитов. Затем экспрессия белка
p27Kip1 сильнее стимулировалась, чем возрастал уровень экспрессии белка циклина D1. В фибробластах (REF52 клетки), между тем, увеличение экспрессии белка циклина D1 сильнее уменьшало уровень экспрессии белка p27Kip1. Отличия в производительности белка p27Kip1 при стимуляции D1NLS+CDK4 наблюдались в двух типах клеток.
Впоследствии экспрессию и локализацию белка p27Kip1 в кардиомиоцитах оценивали способом иммуноцитохимического окрашивания. Подобно способу, описанному выше, кардиомиоциты, трансфицированные вирусами Ad-D1NLS и Ad-CDK4 (moi=100), были зафиксированы 70% этанолом 48 часов после инфицирования вирусом. Затем анти-p27Kip1 антитела (те же, что описаны выше) (разведенные 1:1000) и анти-sarcomeric актиновые антитела (DAKO; M0874) (разведенные 1:100) взаимодействовали с полученными кардиомиоцитами, для окрашивания кардиомиоцитов использовали меченные Alexa FluorТМ антитела (Alexa-488 и Alexa-568; Molecular Probes) (оба в разведении 1:200). Затем клеточные ядра окрашивали раствором 4',6-диамидино-2-фенилиндола (DAPI) (1 мкг/мл). Изображения, окрашенные этими антителами, и краситель наблюдали во флуоресцентном микроскопе (laser scanning co-focus image system; Zeiss LSM510).
Результаты показаны на фиг.2. Экспрессию p27Kip1 наблюдали в ядрах интактных кардиомиоцитов (клетки, положительные с саркомерным актином на рисунке), но не так сильно. Большую экспрессию и ядерную аккумуляцию p27Kip1 наблюдали в кардиомиоцитах, трансфицированных генами D1NLS и CDK4 для экспрессии. Результаты на фиг. 1 и 2 свидетельствуют, что усиленная экспрессия генов D1NLS и CDK4 в кардиомиоцитах позволяла аккумуляции белка p27Kip1 подавлять прогресс клеточного цикла в ядрах кардиомиоцитов, так что возможность деления и пролиферации кардиомиоцитов, индуцированная стимуляцией D1NLS+CDK4, могла, вероятно, быть ингибирована.
С тем, чтобы оценить, регулируется ли увеличение экспрессии p27Kip1 за счет стимуляции D1NLS+CDK4, на уровне транскрипции, проводили нозерн-блот-анализ. Однако в любых кардиомиоцитах и фибробластах усиленная экспрессия генов D1NLS и CDK4 не влияла на уровень экспрессии мРНК p27Kip1. Известно, что уровень экспрессии белка p27Kip1 в пролиферирующих клетках супрессируется деградирующей системой убиквитин-протеасомы (Carrano, et al., Nature Cell Biol. 1:193, 1999; Tsvetkov, et al., Curr. Biol. 9:661, 1999). Таким образом оценили, регулируется ли уровень экспрессии белка p27Kip1 даже в кардиомиоцитах с протеасомной деградирующей системой. После того, как кардиомиоциты, полученные данным способом, 24 часа культивировали в условиях недостатка сыворотки, в культуральную среду добавили Ad-D1NLS и Ad-CDK4 (moi=100) на 48 часов роста. В различных группах кардиомиоциты выращивали в условиях сывороточного голода 48 часов. Затем в культуральную среду добавили FBS в объеме до 10% на 24 часа. Затем к одной из групп одновременно добавили лактастатин (20 мкМ) (Santa Cruz) как ингибитор протеасом, в другие группы ингибитор не добавляли. Уровень экспрессии белка p27Kip1 в каждой группе определяли вестерн-блоттингом.
Впоследствии отдельное повышение уровня экспрессии белка p27Kip1 подтверждали (фиг.3) как для фиг.1. Альтернативно, уровень экспрессии белка p27Kip1 уменьшался при стимуляции FBS. Авторы изобретения показали в предыдущих работах, что белок циклин D1 и белок CDK4 были слабо локализованы в ядрах кардиомиоцитов, хотя эти молекулы сильнее экспрессировались при стимуляции FBS, так что клеточный цикл не активировался (см. патентную ссылку 1 и непатентную ссылку 5). Это наводит на мысль, что увеличение количества белка p27Kip1 в кардиомиоцитах было специфично для стимуляции ядерного переноса циклин D1 белка и/или CDK4 белка. В случае, когда функционирование и активность протеасомы уменьшались при обработке лактастатином, альтернативно, было показано отсутствие различий в уровне экспрессии белка p27Kip1 между группой, к которой ничего не добавляли, группой, обработанной FBS, и группой, обработанной D1NLS+CDK4. Данные результаты означают, что функционирование и активность белка
p27Kip1 ингибируется в группе, обработанной D1NLS+CDK4, хотя белок p27Kip1 постоянно деградировал в группе, куда ничего не добавляли, или в группе, обработанной FBS.
Для оценки потенциала убиквитинилирования белка p27Kip1 в кардиомиоцитах впоследствии проводили исследование убиквитинилирования in vitro. Подробности экспериментального способа согласуются со способом, описанным в сообщениях авторов изобретения (Nakayama, et al., EMBO J. 19: 2069, 2000; Nakayama, et al., JP-A-2001-224380; Hara, et al., J. Biol. Chem. 276:48937, 2001; Ishida, et al., J. Biol. Chem. 277:14355, 2002). Кардиомиоциты, полученные вышеизложенным способом, культивировали в условиях сывороточного голодания 24 часа, после чего 48 часов в культуральной среде с добавлением Ad-D1NLS и Ad-CDK4 (moi=100). В другой группе кардиомиоциты культивировали в условиях недостатка сыворотки 48 часов, после чего выращивали 24 часа в культуральной среде с FBS в концентрации 10%. В качестве контроля использовали REF52 клетки, выращенные в культуральной среде с добавлением 10% FBS. После этого клетки отмывали PBS на льду, клетки соскребали клеточным скребком и затем центрифугировали для удаления супернатанта. К полученному преципитату добавили 2-кратный объем Буфера С (описан выше) с добавлением 0,5% NONIDET P-40. Затем полученную смесь взболтали и оставили на льду на 30 минут для ультразвукового разрушения. Потом полученную смесь центрифугировали (15000 об/мин, 20 минут) для получения супернатанта, который был использован как клеточный экстракт.
С помощью транслирующей системы, использующей лизат крысиных ретикулоцитов, in vitro был получен рекомбинантный белок p27Kip1 для использования как субстрат для убиквитинилирования. Точнее, проводили транскрипцию и трансляцию in vitro, с использованием коммерческого набора транскрипции и трансляции in vitro (TnT coupled Reticulocyte Lysate System; Promega) и с использованием мышиной кДНК p27Kip1 с последовательностью метки FLAG, меченной там, как матрицу согласно с приложенным протоколом. Таким образом полученный рекомбинантный белок p27Kip1 и каждый образец ретикулоцитарного лизата (от 20 до 40 мкг количества белка) получали вместе с мышиным белком Е1 (50 мкг/мл), мышиным белком Е2/Ubs5 (100 мкг/мл) и белком GST-Ub (4 мг/мл) (все из Calbiochem) в реакционном растворе конечного объема 10 мкл (4 мМ Tris-HCl (pH 7,5), 6 мМ NaCl, 5 мМ MgCl2, 0,1 мМ DTT, 0,1 мг/мл креатинфосфокиназы, 10 мМ фосфокреатина, 1,5 мМ АТР) для взаимодействия их вместе при 26°С в течение 30 минут. Затем проводили электрофорез образца в геле SDS-PAGE и переносили на нитроцеллюлозную мембрану для вестерн-блоттинга. Более конкретно, реакция с первым антителом анти-Flag антителом (Sigma; F-3165) или анти-GST антителом (Santa Crus; sc-138) (оба в разведении 1:1000) и реакция со вторым антителом антимышиным Ig, меченным пероксидазой хрена (как приведено выше) (в разведении 1:1000) дала возможность определить наличие связи антигена с каждым антителом, с использованием хемилюминесцентного набора (как описано выше).
Результаты показаны на фиг.4. В белке p27Kip1, убиквитинилированном in vitro с использованием клеточного экстракта фибробластов во время пролиферации (стимуляция FBS) (REF на рисунке) в качестве положительного контроля, наличие in vitro убиквитинилированного белка p27Kip1 можно было четко детектировать с использованием узнавания антителами пептида Flag, прикрепленного к рекомбинантному белку p27Kip1 (IB: Flag на рисунке) и специфического антитела (IB: GST на рисунке), узнающего белок GST, добавленного к рекомбинантному белку убиквитину. Однако когда использовали клеточный экстракт, полученный из кардиомиоцитов, стимулированных FBS, наблюдали только слабый убиквитинилированный белок p27Kip1, и только очень неясное связывание убиквитинилированного белка p27Kip1 определялось в кардиомиоцитах, трансфицированных генами D1NLS и CDK4. Результаты, показанные на фиг.3 и 4, отчетливо указывают на то, что убиквитинилирование белка p27Kip1 значительно уменьшалось в кардиомиоцитах при стимуляции D1NLS+CDK4, так что протеасомная деградация едва происходила, с последующим накоплением белка p27Kip1 в ядре.
[Пример 3: Уменьшение белка p27Kip1, накопленного в кардиомиоцитах, за счет усиленной экспрессии Skp2]
Известно, что белок p27Kip1 убиквитинилирован в основных пролиферирующих клетках убиквитинлигазой, содержащей Skp2 в качестве белка F-бокса, а именно
SCFSkp2-комплекс, так что белок p27Kip1 разрушается протеасомой (Carrano, et al., Nature Cell Biol. 1:193, 1999; Tsverkiv, et al., Curr. Biol. 9:661, 1999). Поэтому экспрессию белка Skp2 в кардиомиоцитах определяли вестерн-блотом. Способы получения кардиомиоцитов, трансфекции Ad-D1NLS и Ad-CDK4, получения ядерного белка, вестерн-блоттинг и подобные были такими же, как описанные выше. Так, для детекции белка Skp2 использовали антитела против Skp2.
Результаты показаны на фиг.5. Экспрессия белка Skp2 в фибробластах (REF52 клетки), использованных как клетки контроля, значительно активировалась при стимуляции FBS и стимуляции D1NLS и CDK4, контролирующих пролиферацию. Однако хотя в кардиомиоцитах наблюдали отсутствие индукции экспрессии белка Skp2, в то время как в кардиомиоцитах, транфицированных генами D1NLS и CDK4, можно было детектировать только незначительное количество белка Skp2. Результаты указывают на возможность ингибирования разрушения белка p27Kip1, аккумулированного при стимуляции D1NLS+CDK4, так как не было случая индукции экспрессии Skp2 в кардиомиоцитах.
Соответственно проводили оценку влияния гена Skp2 на экспрессию белка p27Kip1 через ко-экспрессию гена Skp2 в кардиомиоцитах, трансфицированных генами D1NLS и CDK4. Кардиомиоциты заражали Ad-D1NLS (moi=100), Ad-CDK4 (moi=100) и Ad-Skp2 (moi=50, 100), полученными в Примере 1, за 48 часов культивирования для анализа экспрессии циклина D1, Skp2 и p27Kip1 вестерн-блоттингом. Способы получения кардиомиоцитов, ядерого белка, вестерн-блот и подобные были такими же, как способы, описанные выше.
Три гена D1NLS, CDK4 и Skp2 конкурентно экспрессировали в кардиомиоцитах. Результаты показаны на фиг.6. Когда гены D1NLS и CDK4 трансфицировали в кардиомиоциты, экспрессия белка p27Kip1 сильно индуцировалась как в предыдущих экспериментах (фиг.1 и 3). В этом случае трансфекция Ad-Skp2 в кардиомиоциты для предоставления возможности конкурентной экспрессии гена Skp2 потом значительно уменьшала уровень экспрессии белка p27Kip1. В кардиомиоцитах, инфицированных Ad-Skp2 в высокой концентрации (moi=100), наблюдали почти полное отсутствие экспрессии белка p27Kip1.
В дальнейшем подтвердили, с использованием способа иммуноцитохимического окрашивания, как показано на фиг. 7, что накопление белка p27Kip1 в кардиомиоцитах, трансфицированных генами D1NLS и CDK4, уменьшалось благодаря совместной экспрессии гена Skp2. Способ иммуноцитохимического окрашивания был таким же, как в эксперименте, описанном выше (фиг.2). Как показано на фиг.2, значительная экспрессия p27Kip1 и ядерная аккумуляция его наблюдались в кардиомиоцитах, трансфициованных генами D1NLS и CDK4. Когда ко-экспрессировали ген Skp2, альтернативно, наблюдали значительное уменьшение белка p27Kip1 в ядрах клеток. Когда кардиомиоциты с генами D1NLS, CDK4 и Skp2, конкурентно экспрессированными там, обрабатывали лактастатином, уровень экспрессии белка
p27Kip1 восстанавливался почти до уровня во время стимуляции D1NLS и CDK4. Таким образом, подтвердили, что уменьшение белка p27Kip1 за счет усиленной экспрессией белка Skp2 было опосредовано деградирующей системой убиквитин-протеасома.
[Пример 4: Влияние усиленной экспрессии Skp2 на стимуляцию пролиферации кардиомиоцитов]
Делая расчет Ad-D1NLS, Ad-CDK4 и Ad-Skp2 (у каждого moi=100) для трансфекции кардиомиоцитов и потом периодического подсчета числа клеток, оценивали влияние введения гена Skp2 на потенциал пролиферации кардиомиоцитов. Подобно результатам предыдущих сообщений (см. патентную ссылку 1 и непатентную ссылку 5) число клеток кардиомиоцитов с генами D1NLS и CDK4, экспрессированными здесь, увеличивалось примерно в 3 раза на 7 день после культивирования (фиг.8). Альтернативно подтвердили, что число клеток кардиомиоцитов с тремя генами, называемыми генами D1NLS, CDK4 и Skp2, экспрессированными там, увеличивалось в 5 или более раз. Показано, что число клеток кардиомиоцитов, инфицированных контрольным вектором, и кардиомиоцитов, инфицированных одним Ad-Skp2 как отрицательным контролем, почти не увеличивалось. Вышеупомянутые результаты несомненно показывают, что Skp2 может более значительно стимулировать потенциал пролиферации кардиомиоцитов, чем стимуляция D1NLS+CDK4.
[Пример 5: Влияние обработки siРНК p27 на стимуляцию пролиферации кардиомиоцитов]
С тем, чтобы более четко продемонстрировать влияние белка p27Kip1 на кардиомиоцитах, обработанных D1NLS и CDK4, siРНК, специфичную к гену p27Kip1 (здесь далее обозначаемая как «siРНК p27») экспрессировали в кардиомиоцитах.
С тем, чтобы создать вектор для экспрессии siРНК p27, последовательности-мишени определяли на основе информации о нуклеотидной последовательности крысиной кДНК p27Kip1 (инвентарный номер D83792 в GenBank), при этом сконструировали и получили олиго-ДНК для использования в конструировании вектора экспрессии siРНК соответствующей последовательности. В качестве последовательности-мишени из крысиной p27Kip1 кДНК отбирали следующие три типа:
номера нуклеотидов: 830-847 (5′-GGCAGAAGATTCTTCTTC-3′: SEQ ID NO: 7);
номера нуклеотидов: 532-550 (5′-AGCGCAAGTGGAATTTCGA-3′: SEQ ID NO: 8); и
номера нуклеотидов: 372-390 (5′-GTGAGAGTGTCTAACGGGA -3′: SEQ ID NO: 9). siРНК, основанные на SEQ ID NO: 7-9, указываются здесь ниже как siРНК #1, #4 и #6 соответственно. Встроенные последовательности олиго-ДНК, использованные в конструировании векторов, экспрессирующих siРНК #1, #4 и #6 являются следующими.
SiРНК #1: 5′-CACCGGTAGGAGGTTCTTCTTCAACGTGTGCTGTCCGTTGAAGAAGAATC TTCTGCCTTT TT -3′ (SEQ ID NO: 10) и 5′-GCATAAAAAG GCAGAAGATT CTTCTTCAAC GGACAGCACA CGTTGAAGAA GAACCTCCTACC-3′ (SEQ ID NO: 11).
siРНК #4: 5′-CACCAGTGTA AGTGGAGTTT CGAACGTGTG CTGTCCGTTC GAAATTCCAC TTGCGCTTTT TT-3′ (SEQ ID NO: 12) и 5′-GCATAAAAAAGCGCAAGTGG AATTTCGAAC GGACAGCACA CGTTCGAAAC TCCACTTACA CT-3′ (SEQ ID NO: 13).
siРНК #6: 5′-CACCGTGGGA GTGTTTAATG GGAACGTGTG CTGTCCGTTC CCGTTAGACA CTCTCACTTT TT-3′ (SEQ ID NO: 14) и 5′-GCATAAAAAG TGAGAGTGTC TAACGGGAAC GGACAGCACA CGTTCCCATT AAACACTCCC AC-3′ (SEQ ID NO: 15).
Провели отжиг трех групп олиго-ДНК, каждая из которых содержала последовательность-мишень siРНК, и затем встроили их в участок BsmMI сайт экспрессирующего РНК-вектора (pcPURU6 β icassette, iGENE). Вектор находился в конструкции, так что транскрипция РНК, отвечающая за включенные гены, может начинаться под контролем человеческого U6-промотора для высокого уровня экспрессии,обозначенной РНК в клетках млекопитающих. Затем вектор расщепляли EcoRI и HindIII для очистки полученного фрагмента, содержащего U6-промотер и включенные последовательности генов. Затем концы затупили, с использованием Т4 ДНК-полимеразы, фрагмент встроили в SwaI-сайт космиды pAxcwit (TAKARA BIO). Последующая трансфекция 293 клеток с космидой и ДНК-ТРС, обработанной рестриктазой, полученных из геномной ДНК человеческого аденовируса 5 типа, дала возможность получить рекомбинантные аденовирусы, экспрессирующие p27Kip1 siРНК (Ad-p27 siРНК-#1, #4, #6). Впоследствии вирусный раствор с высоким титром вновь получили из вирусного вектора тем же способом, как в примере 1.
Во-первых, p27 siРНК ко-экспрессировали в кардиомиоцитах, трансфицированных генами D1NLS и CDK4, для оценки влияния экспрессии белка p27Kip1 с помощью вестерн-блота. Точнее, Ad-D1NLS, Ad-CDK4 и Ad-p27 siРНК (moi каждого=100) трансфицировали в кардиомиоциты за 48 часов культивирования для анализа экспрессии белка p27Kip1 вестерн-блоттингом. Способы получения кардиомиоцитов, получения ядерного белка, вестерн-блот и подобные такие же, как способы, описанные выше (Примеры 1 и 3).
Результаты показаны на фиг.9. Когда D1NLS и CDK4 гены трансфицировали в кардиомиоциты, экспрессия белка p27Kip1 сильно индуцировалась как в экспериментах, описанных выше (фиг. 1, 3 и 7). Экспрессией р27 siРНК (#1, #4, #6) в кардиомиоцитах продукция белка p27Kip1 значительно уменьшалась. В частности было показано почти полное отсутствие экспрессии белка p27Kip1 с р27 siРНК-#6. Экспрессия р27 siРНК приводит в действие супрессивный эффект специфичного белка p27Kip1, но никогда не влияет на внутриклеточную фракцию белка р21Cip1, белок циклин D1 или саркомерный актин. Даже в результате иммуноцитохимического окрашивания было показано почти полное отсутствие аккумуляции белка p27Kip1 в ядрах кардиомиоцитов на протяжении экспрессии р27 siРНК.
Впоследствии Ad-D1NLS, Ad-CDK4 и Ad-p27 siРНК-#6 (moi каждого=100) трансфицировали в кардиомиоциты для того, чтобы потом периодически подсчитывать число клеток. Подобно результатам в примере 4 число клеток кардиомиоцитов с генами D1NLS и CDK4, экспрессированными там, увеличилось в 3 раза на 7 день после культивирования (фиг. 10). Между тем верифицировали, что число клеток кардиомиоцитов с тремя генами, называемыми D1NLS, CDK4 и p27 siРНК, экспрессированными там, значительно увеличилось. Было показано, что число клеток кардиомиоцитов, инфицированных LacZ экспрессирующим вирусом, и кардиомиоцитов, инфицированных одной siРНК Ad-p27 в качестве отрицательного контроля, почти не увеличилось. Указанные выше результаты очевидно показывают, что экспрессия р27 siРНК более значительно может стимулировать потенциал пролиферации кардиомиоцитов, чем стимуляция D1NLS+CDK4.
[Пример 6: влияние усиленной экспрессии гена Skp2 на лечение сердца]
Для того, чтобы подтвердить, что влияние усиленной экспрессии генов D1NLS+CDK4+ Skp2 на пролиферацию кардиомиоцитов имело терапевтический эффект на поврежденные кардиомиоциты, провели оценку, с использованием модели ишемии и реперфузии миокарда на крысах. Модель получали согласно способу Dairaku, et al. (Circ. J. 66:411, 2002). Cамцу крысы Wistar (возраст 8 недель) проводили анестезию пентобарбиталом натрия под интраперитонеальным контролем (нембутал: Dainippon Pharmaceutical Co., Ltd.) (55 мг/кг). Потом крысе проводили торакотомию при искусственной вентиляции легких для открытия сердца. Впоследствии, левую коронарную артерию лигировали наложением шва иглой №5-0. Затем крысу оставляли на 30 минут. Лигатура освобождалась, давая возможность кровяной струе реперфузировать (реперфузия). В качестве контроля использовали животных только со швом коронарной артерии в качестве мнимой операционной группы (здесь далее обозначенная как «Sham-группа»).
Аденовирусный вектор ввели в сердце в период от 25 до 30 минут после ишемии. Аденовирусный раствор высокого титра (1×109 бляшкообразующих единиц/мл) той же серии, что и полученный и использованный в описанном выше примере, непосредственно ввели в пласт сердечной мышцы в центр ишемии и на периферию по 50 мкл на один участок, всего в 5 участков (общий объем 250 мкл) с использованием инъекционной иглы 30G.
Для оценки влияния обработки D1NLS+CDK4, группу животных инъецировали раствором смеси трех типов аденовирусов, называемых Ad-D1NLS (1×109 бляшкообразующих единиц), Ad-CDK4 (1×108 бляшкообразующих единиц) и Ad-LAcZ (1×109 бляшкообразующих единиц), и она упоминается здесь и далее как «D1NLS-группа». Для оценки влияния обработки D1NLS+LCDK4+Skp2 группа животных, инъецированная раствором смеси трех типов аденовирусов, называемых Ad-D1NLS (1×109 бляшкообразующих единиц), Ad-CDK4 (1×108 бляшкообразующих единиц) и Ad-Skp2 (1×109 бляшкообразующих единиц), упоминается здесь далее как «Skp2-группа». В качестве отрицательной контрольной группы получали группу животных, инъецированных Ad-LAcZ (2×109 бляшкообразующих единиц) (здесь называемая как «Cont-группа»). В Sham-группе не проводилось инъекции аденовирусного раствора. После закрытия грудной клетки крысе давали возможность отойти от анестезии и затем кормили 6 недель в условиях общего кормления.
В качестве индикатора некроза сердечной мышцы, приводящего к ишемии и нарушенной реперфузии, исследовали значение в плазме тропонина Т сердечной мышцы (сТnТ) (O′brien, et al., Lab. Anim. Sci. 47: 486, 1997; Morimoto, et al., J. Pharmacol. Sci. 91: 151 [Suppl. 1], 2003). Через 2 часа после реперфузии кровь отобрали из нижней внутренней части сердца и центрифугировали для получения плазмы. Значение cTnT исследовали с использованием кардиоридера (Roche Diagnostics). В результате показано, что значение cTnT после ишемии и реперфузии сильно увеличивалось в Cont-группе, D1NLS-группе и Skp2-группе по сравнению с Sham-группой (Sham-группа: 0,2±0,0 нг/мл, Cont-группа: 8,8±0,5 нг/мл, D1NLS-группа: 9,1±0,7 нг/мл, Skp2-группа: 9,9±1,3 нг/мл). Было показано отсутствие различия в значении cTnT между тремя группами, исключая Sham-группу, что указывало на индукцию сходного уровня некроза сердечной мышцы.
Через 6 недель после реперфузии сердечные функции измерили путем томографии (способ B mode) и способа M mode, отражающих томограмму во времени, с использованием аппаратуры для ультразвукового исследования (power Vision 8000: Toshiba Medical). Для анестезии крысе интраперитонеально вводили кетамин (Ketaral: Sankyo) и ксилазин (Sigma). С использованием линейного зонда с частотой 15 МГц измерили левожелудочковую короткоосную сосочковую мышцу способом M mode для измерения левожелудочкового конечнодиастолического размера и левожелудочкового конечно-систолического размера для расчета фракционального сокращения левожелудочкового внутренного диаметра (FS).
Фракциональное сокращение левожелудочкового внутренного диаметра (FS)=(конечно-диастолический размер - конечно-систолический размер)/конечно-диастолический размер × 100 (%)
Для измерения левожелудочковой продольной оси B mode способом измерили левожелудочковую конечно-диастолическую зону и конечно-систолическую зону для расчета фракциональной зоны изменения левого желудочка (FAC), которая использовалась как индикатор систолической функции.
Фракциональная зона изменения левого желудочка (FAC)=(конечно-диастолическая зона - конечно-систолическая зона)/конечно-диастолическая зона × 100 (%)
С дополнительным использованием секторного зонда 10 МГц измерили втекание крови в левый желудочек в раннюю диастолическую фазу (Е) и в предсердие в систолическую фазу (А) доплеровским способом для расчета значения Е/А, которое использовали как индикатор диастолической функции. Вышеперечисленные измерения проводили слепым способом, так что тестирующий человек не мог видеть содержания лечения каждого животного.
Через 6 недель после ишемии миокарда и реперфузии функции сердца измеряли способами, описанными выше. В Cont-группе по сравнению с Sham-группой фракциональное сокращение (FS) и фракциональное изменение зоны (FAC) имели очень маленькие значения, в то время как отношение втекания крови в левый желудочек в раннюю диастолическую фазу и систолическую предсердную фазу (Е/А) имело большое значение. Таким образом показано, что систолическая и диастолическая функции несомненно ухудшались. В D1NLS-группе или Skp2-группе, наоборот, FS и FAC имели наибольшие значения по сравнению с Cont-группой. Наиболее вероятный эффект улучшения был показан в плане значения E/A. По сравнению с Cont-группой значение E/A в Skp2-группе было значительно меньше. E/A значение в D1NLS-группе было меньше, чем в Cont-группе, но статистически значимого отличия между ними не показано (Sham-группа: 2,30±0,25, Cont-группа: 5,49±0,86, D1NLS-группа: 3,69±0,68, Skp2-группа: 3,44±0,57: n=от 9 до 12).
Впоследствии гемодинамика сердца изучалась на следующий день после ультрасонографии сердца. После введения крысе пентобарбитала натрия интраперитонеально для анестезии вводили катетер с микрочипом давления, оснащенным трансдуктором (SPC-320: Millar Instruments) в левый желудочек из правой сонной артерии для измерения максимума дифференциального отношения (dP/dt max) левожелудочкового давления (LVP) как индикатора левожелудочкового систолического потенциала и измерения dp/dt/P max, полученного делением dP/dt max с LVP, одновременно измеренного как индикатор левожелудочкового диастолического потенциала. Кроме того, измерили минимум дифференциального отношения (dP/dt min) LVP как индикатора левожелудочкового диастолического потенциала и левожелудочкового конечно-диастолического давления (LVEDP). Вышеперечисленные измерения были сделаны в слепом тесте, так что тестирующий человек не мог идентифицировать содержание лечения каждого животного.
Результаты показаны в таблице 1.
(мм.рт.ст/с)
(мм.рт.ст./с)
max (1/с)
#: p<0,05 по сравнению с Cont-группой
По сравнению с Sham-группой левожелудочковое конечно-диастолическое давление (LVEDP) в Cont-группе находилось на значительно более высоком уровне. Кроме того, максимум дифференциального отношения (dP/dt max), минимум дифференциального отношения (dP/dt min) или dP/dt/P max левожелудочкового давления (LVP) находились на значительно меньшем уровне. Результаты показывают, что левожелудочковая систолическая функция и диастолическая функция у животных ухудшались. В D1NLS-группе три индикатора dP/dt max, dP/dt min и dP/dt/P max имели большие значения, чем в Cont-группе. Все индивидуальные индикаторы в Skp2-группе имели большие значения, чем в D1NLS-группе, тогда как dP/dt min и dP/dt/P max имели значительно большие значения, чем в Cont-группе.
После рассчета сердечной гемодинамики произвели резекцию легкого для взвешивания влажного веса (фиг. 11). По сравнению с Sham-группой вес легкого в Cont-группе был значительно больше. Это наводит на мысль о возможном распространении легочной гиперемии. По сравнению с Cont-группой вес легкого был меньше в D1NLS-группе, в то время как вес легкого в Skp2-группе имел значительно меньшее значение, что говорит об уменьшении легочной гиперемии.
С использованием удаленного путем резекции сердца после измерения сердечных функций построили график пассивное (левожелудочковое) давление-объем. Основной способ соответствовал сообщению Pfeffer, et al. (Circ. Res. 57:84, 1985). Более конкретно, гепарин (Novo-heparin: Aventis Pharma) и насыщенный хлорид калия вводили в хвостовую вену крысы для стимулирования остановки сердца в диастолическую фазу. Сразу после этого сердце подвергали резекции. Через аорту в левый желудочек вводили двойной катетер для просвета (DP-8: Natsume Seisakusho). Соединив одну из трубочек трансдуктора давления для измерения левожелудочкового давления, крысе вводили физиологический раствор со скоростью 0,72 мл/мин из другой трубки для регистрации кривой давление-объем на графике. Одно удаленное сердце тестировали три раза для расчета средней величины. Основываясь на кривой давление-объем конкретного животного, рассчитывали объем, отвечающий за левожелудочковое конечно-диастолическое давление, измеренное катетером с микрочипом, оснащенным трансдуктором давления, и затем корректировали, основываясь на весе тела, для вычисления индекса левожелудочкового конечно-диастолического объема (LVEDVI).
Результаты показаны на фиг.12. Как показано, по сравнению с Sham-группой кривая пассивного давления-объема в Cont-группе была значительно сдвинута в правую сторону. Результаты показывают возможность прогресса в левожелудочковой реконструкции, такого как увеличение левожелудочкового объема и истончение зоны инфаркта после сердечной ишемии и реперфузии. По сравнению с Cont-группой правосторонний сдвиг кривой пассивное давление-объем уменьшался в D1NLS-группе. По сравнению не только с Cont-группой, но также с D1NLS-группой правосторонний сдвиг кривой давление - объем в Skp2-группе значительно уменьшался. В то время как индекс левожелудочкового конечно-диастолического объема (LVEDVI) был большим в Cont-группе, в D1NLS-группе этот индекс был меньше. Кроме того, в Skp2-группе индекс был меньше, чем в D1NLS-группе и значительно меньше, чем в Cont-группе (Sham-группа: 0,80±0,12 мл/кг, LacZ-группа: 2,18±0,16 мл/кг, D1NLS/CDK4-группа: 1,72±0,19 мл/кг, Skp2-группа: 1,54±0,17 мл/кг; n=от 9 до 12).
В заключение оценивали уровень инфаркта в сердце через 6 недель после ишемии и реперфузии. Удаленное сердце зафиксировали в 10% рН-нейтральном растворе формалина, проводили в парафин, получали 6 секциях с интервалом 2 мм на каждый образец вдоль поперечного направления, и покрасили Masson Trichrome для визуализации зоны сердечного инфаркта. Затем зону инфаркта измерили с использованием компьютерного анализа изображения (Lumina vision: Mitsuya Shoji). Соответственно сообщению Jain, et al. (Circulation 103:1920, 2001) зону инфаркта измерили измерением всей периферической длины внутренней мембраны левого желудочка, всей периферической длины внешней мембраны его же, периферической длины рубца на стороне внутренней мембраны левого желудочка и периферической длины рубца на стороне его внешней мембраны для расчета зоны инфаркта согласно следующей формуле.
Зона инфаркта=[(периферическая длина рубца на стороне внутренней мембраны левого желудочка + периферическая длина рубца на стороне его внешней мембраны)/(целая периферическая длина внутренней мембраны + целая периферическая длина внешней мембраны)] × 100%
Результаты показаны на фиг.13. По сравнению с Cont-группой зона инфаркта в D1NLS-группе значительно уменьшилась. Показано большее уменьшение зоны инфаркта в Skp2-группе, чем в D1NLS-группе. По сравнению с Cont-группой зона инфаркта была меньше в Skp2-группе.
Основываясь на этих результатах, подтверждено, что введение генов D1NLS+CDK4+Skp2 приводило к облегчению недостаточности сердечных функций после приступа инфаркта миокарда и усилению гемодинамики с ингибированием застоя в легких и левожелудочковой реконструкции и, кроме того, к получению эффекта уменьшения зоны инфаркта миокарда.
ВОЗМОЖНОСТЬ ПРОМЫШЛЕННОГО ПРИМЕНЕНИЯ
В соответствие со способом по изобретению клеточное деление кардиомиоцитов может быть более эффективно индуцировано по сравнению с известными в данной области способами для стимуляции пролиферации клеток. Кардиомиоциты, полученные таким способом, могут быть использованы в качестве клеток для скрининга различных фармацевтических средств и для трансплантологии. Кроме того, применение способа по изобретению в генной терапии может ожидаемо приводить к применению регенеративной медицинской терапии сердечных заболеваний с известной этиологией, такой как дефицит кардиомиоцитов.








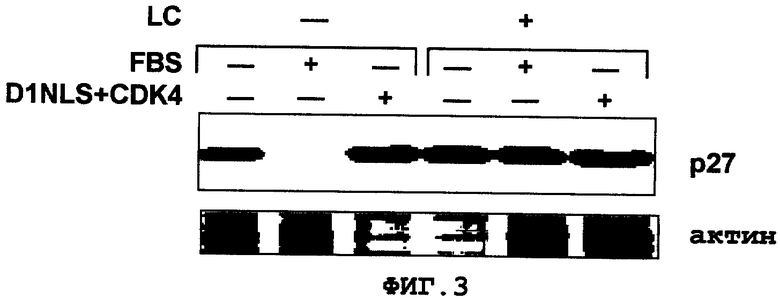
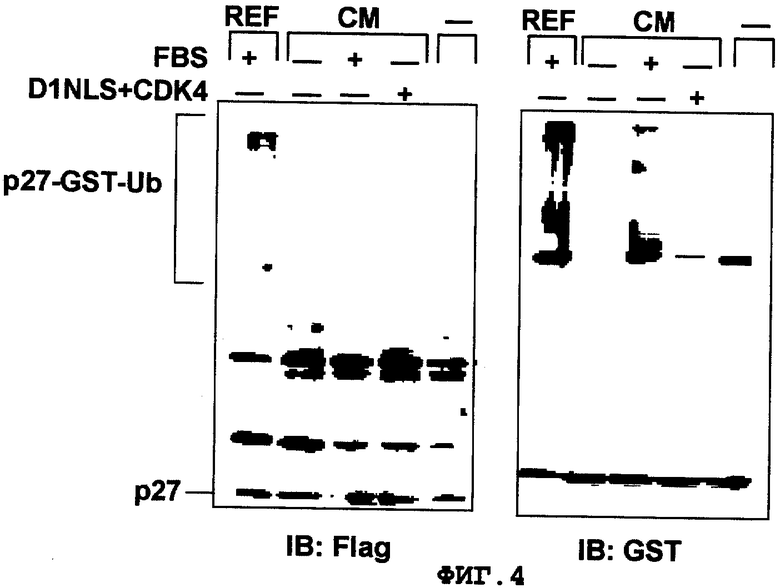


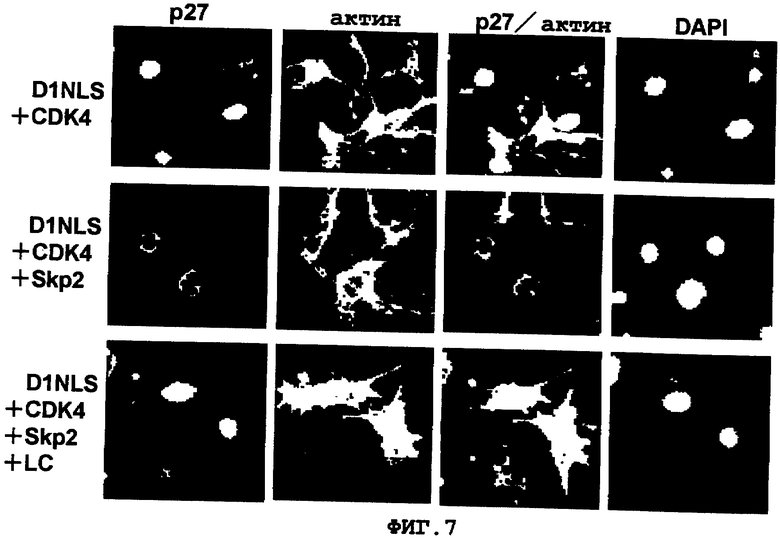

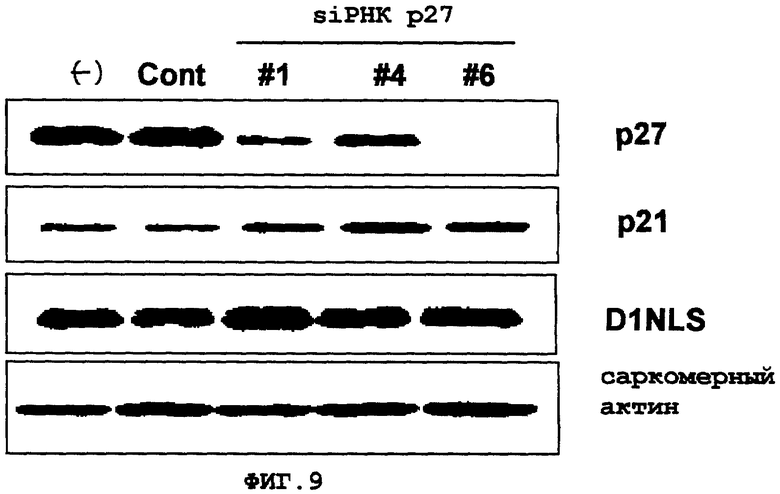




Изобретение относится к биотехнологии. Проводят пролиферацию кардиомиоцитов, индуцируя экспрессию циклина и CDK в кардиомиоцитах и ингибируя функцию или активность белка семейства Cip/Kip или ингибируя продукцию белка семейства Cip/Kip. Описан вектор экспрессии, который содержит ген циклина, ген циклин-зависимой киназы и один или несколько агентов, выбранных из группы, включающей ген, кодирующий фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, и последовательность нуклеиновой кислоты, которая ингибирует продукцию белка семейства Cip/Kip. Раскрыта фармацевтическая композиция, содержащая описанный вектор и применяемая для лечения заболеваний сердца. Предложен кардиомиоцит, полученный заявленным способом. Представлен способ лечения заболевания сердца, предусматривающий инъекцию раскрытой фармацевтической композиции. Изобретение позволяет осуществлять регенерацию и восстановление кардиомиоцитов. 7 н. и 24 з.п. ф-лы, 13 ил., 1 табл.
1. Способ пролиферации кардиомиоцитов, предусматривающий стадию введения
(a) циклина D,
(b) циклинзависимой киназы, активируемой циклином D, и
(c) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, которая ингибирует продукцию белка семейства Cip/Kip в кардиомиоциты, и стадию последующего культивирования или поддержания указанных клеток.
2. Способ пролиферации кардиомиоцитов, предусматривающий стадию введения
(a) циклина D,
(b) циклинзависимой киназы, активируемой циклином D, и
(c) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, которая ингибирует продукцию белка семейства Cip/Kip в кардиомиоциты in vitro, и
стадию последующего культивирования указанных клеток.
3. Способ пролиферации кардиомиоцитов, предусматривающий стадию введения
(а) циклина D,
(b) циклинзависимой киназы, активируемой циклином D, и
(c) одного или нескольких компонентов, выбранных из группы, включающей ген, кодирующий фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, и нуклеиновую кислоту, которая ингибирует продукцию белка семейства Cip/Kip в кардиомиоциты in vivo, и стадию последующего поддержания клеток.
4. Способ по любому из пп.1-3, в котором указанный циклин представляет собой циклин, способный активировать CDK4 или CDK6 млекопитающих.
5. Способ по пп.1-3, в котором указанная циклинзависимая киназа представляет собой CDK4 или CDK6.
6. Способ по любому из пп.1-3, в котором белок семейства Cip/Kip представляет собой р27kipl.
7. Способ по любому из пп.1-3, в котором фактор, ингибирующий продукцию, функцию или активность белка семейства Cip/Kip, представляет собой фактор с активностью, вызывающей деградацию белка семейства Cip/Kip.
8. Способ по п.7, в котором фактор с активностью, вызывающей деградацию белка семейства Cip/Kip, представляет собой компонент убиквитинлигазы.
9. Способ по п.8, в котором компонент убиквитинлигазы представляет собой фактор F-бокса, способный связываться с белком семейства Cip/Kip.
10. Способ по п.9, в котором фактор F-бокса, способный связываться с белком семейства Cip/Kip, представляет собой Skp2.
11. Способ по любому из пп.1-3, в котором нуклеиновая кислота, которая ингибирует продукцию белка семейства Cip/Kip, представляет собой siPHK, специфичную в отношении гена, кодирующего белок семейства Cip/Kip.
12. Способ по п.11, в котором нуклеиновая кислота, которая ингибирует продукцию белка семейства Cip/Kip, представляет собой siPHK, специфичную в отношении гена р27kipl.
13. Способ по любому из пп.1-3, предусматривающий введение генов в кардиомиоциты с помощью вирусного вектора или липосомы.
14. Способ по любому из пп.1-3, в котором по меньшей мере один ген циклина и ген циклинзависимой киназы метят нуклеиновой кислотой, кодирующей сигнал ядерной локализации.
15. Вектор экспрессии, содержащий
(a) ген циклина,
(b) ген циклинзависимой киназы и
(c) одного или нескольких агентов, выбранных из группы, включающей ген, кодирующий фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, и последовательность нуклеиновой кислоты, которая ингибирует продукцию белка семейства Cip/Kip.
16. Вектор по п.15, в котором циклин представляет собой циклин, способный активировать CDK4 или CDK6 млекопитающих.
17. Вектор по п.16, в котором циклин представляет собой циклин D млекопитающих.
18. Вектор по п.15, в котором циклинзависимая киназа представляет собой циклинзависимую киназу, активируемую циклином D.
19. Вектор по п.18, в котором циклинзависимая киназа представляет собой CDK4 или CDK6.
20. Вектор по п.15, в котором фактор, который ингибирует продукцию, функцию или активность белка семейства Cip/Kip, представляет собой фактор с активностью, вызывающей деградацию белка семейства Cip/Kip.
21. Вектор по п.20, в котором фактор с активностью, вызывающей деградацию белка семейства Cip/Kip, представляет собой компонент убиквитинлигазы.
22. Вектор по п.21, в котором компонент убиквитинлигазы представляет собой фактор F-бокса, способный связываться с белком семейства Cip/Kip.
23. Вектор по п.22, в котором фактор F-бокса, способный связываться с белком семейства Cip/Kip, представляет собой Skp2.
24. Вектор по п.15, в котором нуклеиновая кислота, которая ингибирует продукцию белка семейства Cip/Kip, представляет собой siPHK, специфичную в отношении гена, кодирующего белок семейства Cip/Kip.
25. Вектор по п.24, в котором нуклеиновая кислота, которая ингибирует продукцию белка семейства Cip/Kip, представляет собой siPHK, специфичную в отношении гена
р27kipl.
26. Вектор по п.15, в котором по меньшей мере один ген циклина и ген циклинзависимой киназы помечен нуклеиновой кислотой, кодирующей сигнал ядерной локализации.
27. Фармацевтическая композиция, которую применяют для лечения заболеваний сердца, содержащая эффективное количество вектора по любому из пп.15-26 и фармацевтически приемлемый носитель.
28. Фармацевтическая композиция по п.27, где заболевание сердца представляет собой инфаркт миокарда, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертрофическую кардиомиопатию, дилатационную кардиомиопатию, миокардит или хроническую сердечную недостаточность.
29. Кардиомиоцит, полученный способом по любому из пп.1-14.
30. Способ лечения заболевания сердца, предусматривающий инъекцию фармацевтической композиции по п.27 или трансплантацию кардиомиоцитов по п.29 в участок нарушения у индивидуума, страдающего сердечным заболеванием, и поддержание и пролиферацию кардиомиоцитов в указанном участке.
31. Способ по п.30, в котором заболевание сердца представляет собой инфаркт миокарда, ишемическую болезнь сердца, застойную сердечную недостаточность, гипертрофическую кардиомиопатию, дилатационную кардиомиопатию, миокардит или хроническую сердечную недостаточность.
| TAMAMORI-ADACHI M | |||
| et al | |||
| "Critical role of cyclin Dl nuclear import in cardiomyocyte proliferation", Circ Res., 2003 Jan 10; 92(1):e12-9 | |||
| POOLMAN RA | |||
| et al | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| KIM MH | |||
| et al | |||
| "Successful | |||
Авторы
Даты
2010-01-10—Публикация
2004-11-19—Подача