Область применения
Изобретение относится к биотехнологии и может быть применено для направленного изменения свойств растений. Предлагается способ создания трансгенных растений, обладающих улучшенными хозяйственно-ценными свойствами, в результате экспрессии в их клетках гена мембранной пирофосфатазы бактерии Rhodospirillum rubrum.
Одной из основных причин снижения урожайности сельскохозяйственных культур является воздействие различных стрессовых факторов, таких как низкие и высокие температуры, засоленность, недостаток влаги в почве и т.д. О силе стрессового воздействия на растения можно судить по интенсивности их роста в условиях стресса, приросту биомассы, биологической продуктивности, причем эти показатели находятся в обратно пропорциональной зависимости от силы воздействия. Практически во всех случаях сильно ингибируются ростовые функции растений, изменяется их морфология, что связано со значительными нарушениями биохимических, физиологических и генетических механизмов.
Большинство сельскохозяйственных растений чрезвычайно чувствительны к засолению, что вызывает существенные потери урожая вследствие действия этого фактора. По данным программы ООН «По защите окружающей среды» приблизительно 70% земель сельскохозяйственного назначения в мире подвержены засолению. На территории Российской Федерации засоленные почвы составляют 27,7 млн. гектаров (14,8%) сельскохозяйственных угодий, в том числе 12,4 млн. гектаров (11%) пахотных земель. В отдельные годы из-за засоления почв и неравномерного распределения осадков, особенно в период формирования генеративных органов, урожайность сельскохозяйственных культур снижается до 30-60%. В связи с этим создание сортов культурных растений с улучшенными хозяйственно-ценными признаками и устойчивых к засолению почвы методами генетической инженерии является одной из актуальных задач современной биотехнологии.
Решение этой проблемы предусматривает как изучение механизмов приспособления определенных растений к таким факторам, так и выявление генов, продукты которых играют ключевую роль в формировании устойчивости. Перенося такие гены методами генетической инженерии в другие растения, можно создавать новые высоко устойчивые к стрессовым воздействиям сорта важных сельскохозяйственных культур.
Уровень техники
Одним из главных эндогенных факторов, влияющих на рост, морфологию, регенерацию и развитие растений, являются фитогормоны, которые находят все более широкое применение в современном растениеводстве. Одним из таких регуляторов роста является индолилуксусная кислота (ИУК) - фитогормон ауксин, продуцируемый растущими верхушками (апексами) стеблей, корней и перемещающийся в зону растяжения клеток, усиливая рост стеблей, листьев и корней. Современное представление о механизме действия ИУК основывается на индуцировании увеличения степени растяжимости клеточных стенок, усиления дыхания, синтеза белка и нуклеиновых кислот. Важное значение имеет явление апикального доминирования ИУК в побегах и ее роль в механизмах, обеспечивающих координированное влияние на целостность всего растения. От функциональной активности верхушки побега зависят многие физиологические и морфологические процессы, протекающие как в надземных органах, так и в корневой системе [1].
Механизм полярного транспорта ауксина заключается в том, что ИУК проникает пассивно вместе с ионами Н+ в апикальный конец клетки, а в базальном конце активно секретируется через клеточную мембрану. Установлено, что в плазмалемме ауксин индуцирует работу Н+-помпы, в результате чего матрикс клеточных стенок закисляется. Это приводит к усилению активности кислых гидролаз и размягчению клеточных стенок, что является необходимым условием для роста клеток растяжением.
Повышение концентрации Н+ в апопласте повышает скорость реакции протонирования ИУК, что приводит к усилению транспорта ауксина через растительную клетку, обуславливая эффект удлинения органов растения. В этом случае наблюдается прямая зависимость между ростом осевых органов путем растяжения и генерированием разности электрического потенциала на клеточной мембране.
Недавно в ряде работ была предложена схема влияние протонных насосов на транспорт индолилуксусной кислоты (ИУК) - фитогормона (ауксина), в частности, было показано, что при суперэкспрессии гена AVP1, кодирующего вакуолярную Н+пирофосфатазу A. thaliana, повышалась активность Н+-АТФазы, белков-переносчиков ИУК и, соответственно, усиливался транспорт ИУК через растительную клетку [2]. С этой точки зрения представляется закономерным, что трансгенные растения A.thaliana с суперэкспрессией гена AVP1 имели более развитую корневую систему, более розеточные листья и большую листовую поверхность по сравнению с родительскими немодифицированными формами.
В настоящее время также установлено, что повышенная экспрессия различных протонных насосов (АТФаз Р-типа, вакуолярных Н+-АТФаз и H+-пирофосфатаз) увеличивает доступность протонов для Н+/Nа+-антипортера и усиливает процесс активного выведения ионов Na+ из цитоплазмы, что повышает уровень солеустойчивости растений [3, 4, 5]. Так, например, экспрессия гена AVP1, кодирующего вакуолярную Н+-пирофосфатазу Arabidopsis thaliana, в дрожжах, которые не содержат собственной мембранной пирофосфатазы, повышает солеустойчивость чувствительного к соли мутанта дрожжей [6], а введение того же гена в A. thaliana приводит к получению засухо- и солеустойчивых растений [5].
Следует, однако, отметить, что исследования, проводимые в этом направлении, сосредоточены, главным образом, на изменении свойств растений за счет повышения экспрессии либо их собственного гена пирофосфатазы, либо гомологичного гена другого растения.
Основным недостатком такого подхода является возможность активации посттранскрипционного ген-сайленсинга, направленного против экспрессируемого гена. Во многих случаях это явление приводит к тому, что полученные трансгенные растения синтезируют не большее, а меньшее количество целевого белка, чем немодифицированные (примеры приведены в работах [7, 8, 9, 10, 11]), причем активация посттранскрипционного ген-сайленсинга происходит на различных стадиях развития растения непредсказуемым образом. Соответственно, растения, модифицированные введением гена растительной пирофосфатазы, в случае развития посттранскрипционного ген-сайленсинга будут обладать не повышенной, а пониженной солеустойчивостью.
По мнению создателей настоящего изобретения, перспективным в плане преодоления указанного недостатка и, соответственно, разработки более надежных и эффективных способов получения трансгенных растений с повышенной устойчивостью к засолению и сопутствующим улучшением других полезных свойств (см. выше), является подход, заключающийся в использовании функциональных аналогов вакуолярной Н+-пирофосфатазы растений, имеющих бактериальное происхождение. О существовании таких аналогов сообщается, например, в работе [12]. Во-первых, есть все основания полагать, что использование бактериальных генов для получения трансгенных растений должно существенно снизить вероятность активации посттранскрипционного ген-сайленсинга и других нарушений развития растения, обусловленных отклонением уровня экспрессии его собственных генов от естественного. Во-вторых, использование генов бактериальных мембранных пирофосфатаз позволяет рассчитывать на дополнительное повышение эффективности пирофосфат-зависимого транспорта H+, благодаря возможности встраивания экспрессированного фермента не только в мембрану вакуолей, но и во внешнюю клеточную мембрану, результатом чего должно быть выведение ионов натрия из клетки наружу, во внеклеточное пространство. Кроме того, использование бактериальных источников для получения (клонирования?) генов предпочтительно в технологическом отношении.
До настоящего времени предлагаемый авторами настоящего изобретения подход к решению задачи получения трансгенных растений с улучшенными хозяйственно-ценными свойствами не применялся.
Раскрытие изобретения
При создании настоящего изобретения ставилась задача разработки надежного и эффективного способа улучшения хозяйственно-ценных признаков растений и/или повышения солеустойчивости. Этот способ состоит во включении в геном растения гена мембранной H+-пирофосфатазы прокариотического происхождения, в частности, из бактерии Rhodospirillum rubrum.
Результатом реализации изобретения является получение трансгенных растений (в одном из конкретных воплощений - растений табака), экспрессирующих ген мембранной H+-пирофосфатазы Rhodospirillum rubrum, которые обладают ускоренным ростом растений. При этом у полученных трансгенных растений наблюдается повышение уровня солеустойчивости и другие, известные для случаев применения растительных пирофосфатаз, позитивные изменения хозяйственно-ценных признаков, а именно повышенная биологическая продуктивность, увеличение длины и массы корневой системы, а также массы листьев.
Однако в отличие от описанных ранее способов ускорения роста, повышения биологической продуктивности, увеличения длины и массы корневой системы, а также массы листьев, повышения солеустойчивости растений, основанных на экспрессии генов вакуолярных пирофосфатаз растений, способ по изобретению позволяет не просто обратимо локализовать ионы натрия в вакуолях, но понизить общее содержания натрия в растении за счет его выведения из клетки (см. пример 10), что имеет следствием получение более выраженного и стабильного эффекта. Кроме того, при осуществлении настоящего изобретения не было отмечено случаев получения аномальных результатов (торможение ростовых процессов, снижение биопродуктивности и солеустойчивости на фоне экспрессии включившегося гена) вследствие активации посттрансляционного ген-сайленсинга, что также свидетельствует в пользу более высокой надежности и эффективности предложенного способа в сравнении с известными аналогами. Очевидно, что указанные преимущества достигаются за счет использования гена мембранной пирофосфатазы бактериального, а не растительного происхождения.
Предлагаемый способ улучшения хозяйственно-полезных свойств и повышения солеустойчивости, основанный на использовании гена мембранной Н+-пирофосфатазы Rhodospirillum rubrum, включает следующие стадии: а) конструирование вектора, обеспечивающего экспрессию целевого гена, б) трансформацию указанным вектором растительного материала и выращивание растений, в) молекулярно-биологический анализ растений на наличие введенного гена и уровень экспрессии кодируемого фермента и г) анализ фенотипических признаков трансгенных растений (роста и развития побегов и корневой системы, биопродуктивности, уровня солеустойчивости).
В качестве исходных форм в способе по изобретению для трансформации могут использоваться различные виды растений. В конкретном воплощении, результаты которого приведены в экспериментальной части описания, использовали растения табака (Nicotiana tabacum).
Ген мембранной пирофосфатазы Rhodospirillum rubrum (SEQ ID № AF 044912) может быть выделен из генома этой бактерии, в частности получен путем ПЦР с использованием праймеров PR1 (5'-ATGGCTGGCATCTATCTTTTCG) и PR2 (5'-TTAGTGGGCCAGCACCGCCA). Векторные конструкции для переноса гена мембранной Н+-пирофосфатазы Rhodospirillum rubrum в растительные клетки подбирают в зависимости от выбранной формы растения и метода его генетической трансформации. Примеры некоторых плазмидных конструкций, которые могут быть использованы в способе по изобретению, приведены в табл.2.
Для введения гена в клетки растений в предлагаемом способе применимы по существу любые известные методы: агробактериальная трансформация; бомбардировка микрочастицами; использование векторов на основе вирусов; прямое введение генов в протопласты растений; микроинъекции; электропорация. В предлагаемом варианте получения трансгенных растений табака наилучшие результаты были получены при использовании агробактериальной трансформации, проводившейся, как и последующее выращивание растений, по стандартной методике (см. пример 2). При этом из трех выращенных в условиях in vivo и взятых для трансформации растений было получено 120 первичных трансформантов, из которых, по данным молекулярно-биологического анализа, 25 содержали ген бактериальной пирофосфатазы, уровень экспрессии которого варьировал.
При этом результаты исследования роста и развития побегов и корневой системы, биопродуктивности, а также солеустойчивости трансгенных растений показали, что лучшие показатели изменения названных свойств демонстрируют растения с наиболее высоким уровнем экспрессии гена H+-пирофосфатазы Rhodospirillum rubrum.
Таким образом, предлагаемое изобретение относится к а) способу получения трансгенного растения с улучшенными хозяйственно-ценными свойствами (в частности, ускоренным ростом, увеличенной длиной и массой корневой системы и большей массой листьев, повышенной устойчивостью к засолению), осуществляемому путем введения в геном растения экзогенного гена пирофосфатазы, отличающегося тем, что в качестве транформирующего агента используют ген мембранной пирофосфатазы бактерии Rhodospirillum rubrum, б) полученному этим способом трансгенному растению, обладающему улучшенными хозяйственно-ценными свойствами (ускоренным ростом, и/или увеличенной длиной и массой корневой системы, и/или большей массой листьев, и/или повышенной биологической продуктивностью, и/или повышенной устойчивостью к засолению); в) клетке трансгенного растения, которая содержит ген мембранной пирофосфатазы бактерии Rhodospirillum rubrum и продуцирует кодируемый названным геном фермент, и г) потомству полученного трансгенного растения, сохранившему в ряду поколений ген мембранной пирофосфатазы бактерии Rhodospirillum rubrum и определяемые названным геном фенотипические признаки.
Краткое описание чертежей
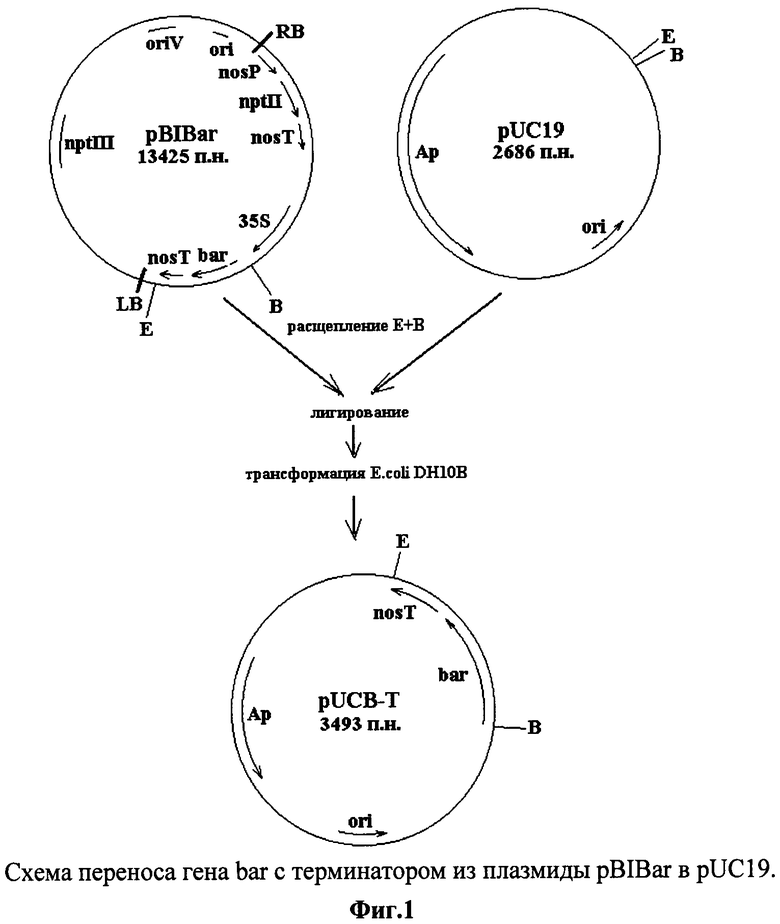
Фиг.1 - схема переноса гена bar с терминатором из плазмиды pBIBar в pUC19.
Фиг.2 - ПЦР - амплификация Pnos промотера и создание в векторе pUC19 кассеты экспрессии nosP-bar-nosT.
Фиг.3 - схема замены кассеты nosP-nptII-nosT на nosP-bar-nosT в векторе pBIBar.
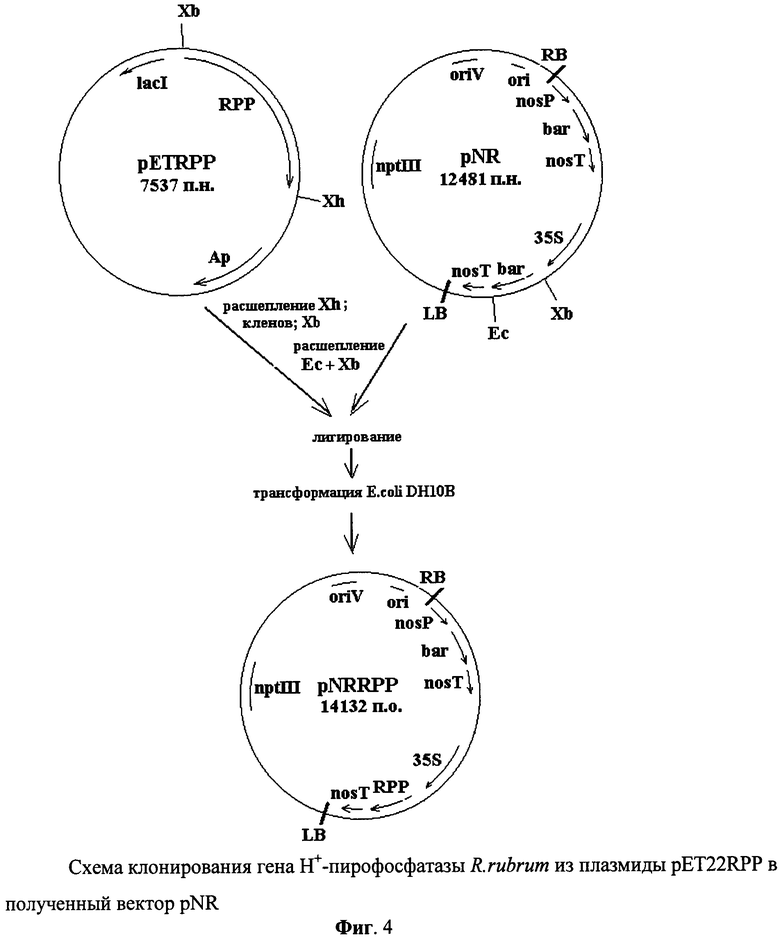
Фиг.4 - схема клонирования гена H+-пирофосфатазы R.rubrum из плазмиды pET22RPP в полученный вектор pNR.
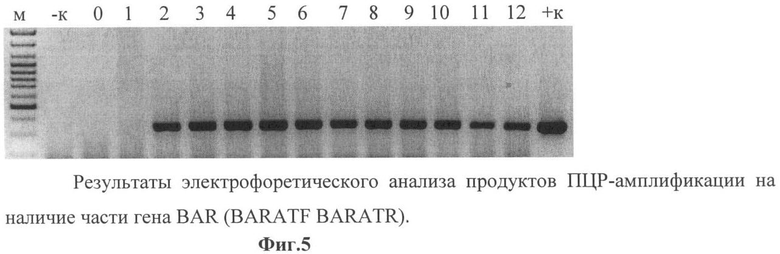
Фиг.5 - результаты электрофоретического анализа продуктов ПЦР-амплификации на наличие части гена BAR (праймеры BARATF и BARATR) размером 350 п.о.
М - маркер; -к - ПЦР на ДНК исходного сорта; +к - ПЦР на плазмидной ДНК Samsun NN; 0 - проба без матрицы; 1-12 - ПЦР на ДНК первичных трансформантов.
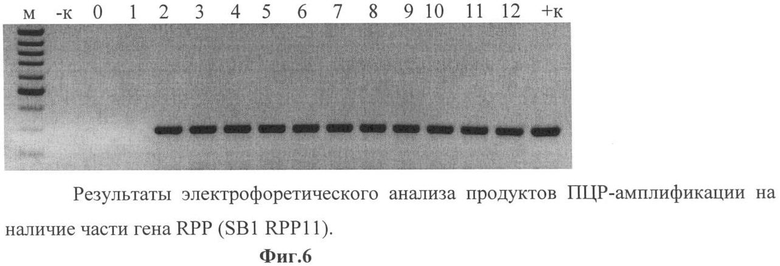
Фиг.6 - результаты электрофоретического анализа продуктов ПЦР-амплификации на наличие части гена RPP (SB1 RPP11) размером 300 п.о.
М - маркер; - к - ПЦР на ДНК исходного сорта; +к - ПЦР на плазмидной ДНК Samsun NN; 0 - проба без матрицы; 1-12 - ПЦР на ДНК первичных трансформантов.
Фиг.7 - результаты электрофоретического анализа продуктов ПЦР-амплификации на наличие части гена RPP (NOSR-RPP12) размером 490 п.о.
М - маркер; -к - ПЦР на ДНК исходного сорта; +к - ПЦР на плазмидной ДНК Samsun NN; 0 - проба без матрицы; 1-12 - ПЦР на ДНК первичных трансформантов.
Фиг.8 - результаты Вестерн-блот анализа контрольных и трансгенных растений табака.
1, 2 - растения исходного сорта Samsun NN; 3-6 - трансгенные растения табака (линии RPP08, RPP12, RPP04 и RPP06 соответственно).
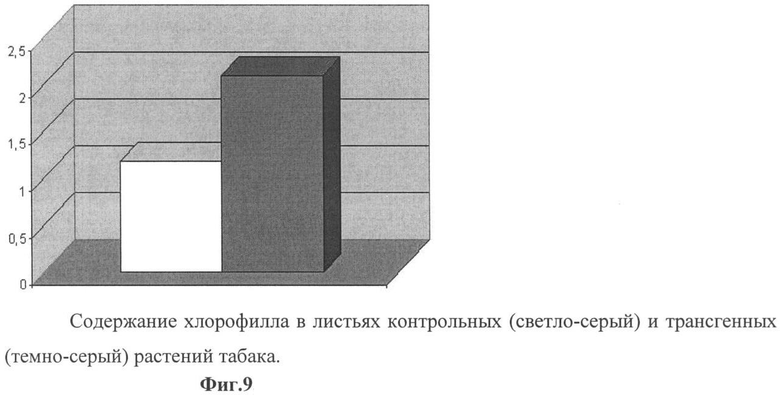
Фиг.9 - содержание хлорофилла в листьях контрольных (светло-серый) и трансгенных (темно-серый) растений табака.
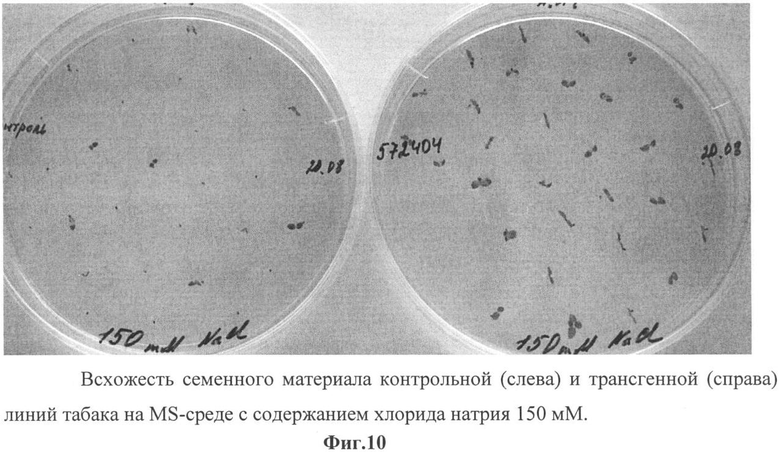
Фиг.10 - всхожесть семенного материала контрольной (слева) и трансгенной (справа) линий табака на MS-среде с содержанием хлорида натрия 150 мм.
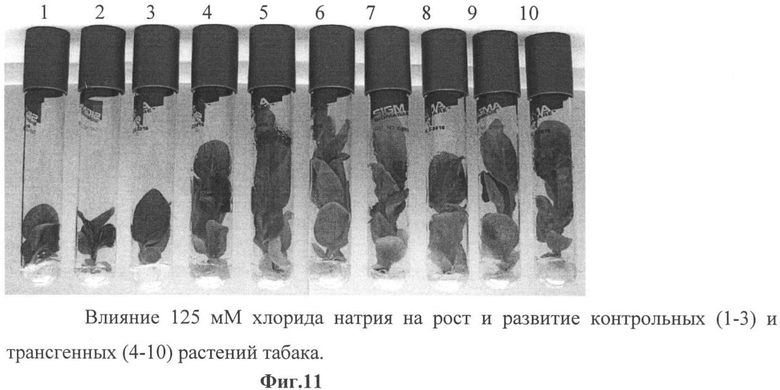
Фиг.11 - влияние 125 мМ хлорида натрия на рост и развитие контрольных (1-3) и трансгенных (4-10) растений табака.
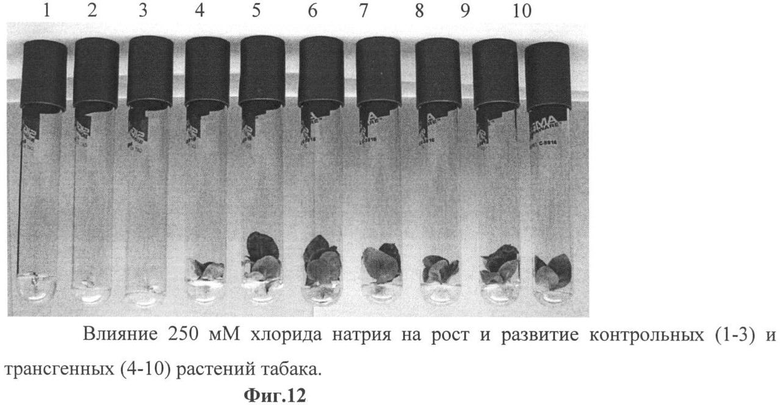
Фиг.12 - влияние 250 мМ хлорида натрия на рост и развитие контрольных (1-3) и трансгенных (4-10) растений табака.
Фиг.13 - уровень накопления натрия в тканях контрольных (светло-серый) и трансгенной (темно-серый) линий табака, выращенных на MS-среде с различным содержанием хлорида натрия.
Осуществление изобретения
Далее приводятся конкретные примеры осуществления изобретения, которые не могут рассматриваться как ограничивающие его объем.
Пример 1. Конструирование вектора, обеспечивающего экспрессию целевого гена.
Для получения рекомбинантного бинарного вектора была использована плазмида pBIBar. Данная плазмида содержит две кассеты экспрессии: первая несет ген bar, кодирующий синтез фосфинотрицинацетилтрансферазы, определяющий устойчивость к гербициду биалофосу, находящийся под контролем 358-промотера вируса мозаики цветной капусты и nosT терминатора гена нопалинсинтетазы. Вторая содержит ген устойчивости к канамицину nptII, кодирующего синтез аминогликозид-3'-фосфотрансферазы под контролем nosP промотера и nosT терминатора.
На первом этапе ген BAR с терминатором из плазмиды pBIBar был перенесен в вектор pUC19. Плазмиды pUC19 и pBIBar расщепляли с помощью рестриктаз BamHI и EcoRI. После выделения необходимых фрагментов ДНК из агарозного геля, лигирования и трансформации штамма Е. coli DH10B с отбором трансформантов по устойчивости к ампициллину получена плазмида pUC19B-T, содержащая вставку bar-позТ (фиг.1).
В составе плазмиды pUC19 сконструирована кассета nosP-bar-nosT. Проведена ПЦР - амплификации nosP промотора. Затем необходимый фрагмент ДНК, содержащий nosP (размером 361 п.н.), выделяли из агарозного геля, обрабатывали эндонуклеазами HindIII и BglII и лигировали с вектором pUC19, расщепленным ферментами HindIII и BamHI. Полученной дотированной смесью трансформировали штамм DH10B с отбором трансформантов по устойчивости к ампициллину. В результате отобрана плазмида pUCP-B-T, содержащая кассету экспрессии nosP-bar-nosT (фиг.2). Корректность процедур амплификации и клонирования подтверждена с помощью секвенирования nosP - промотера.
Кассета nosP-bar-nosT клонирована в составе вектора pBIBar. Плазмиду pUCP-B-T обрабатывали эндонуклеазами PmeI и NdeI. После выделения из агарозного геля необходимый фрагмент ДНК лигировали с плазмидой pBIBar, обработанной PmeI и VspI. Полученным продуктом трансформировали штамм E.coli DH10B с отбором трансформантов по устойчивости к канамицину. В результате рестрикционного анализа плазмидной ДНК, выделенной из клонов трансформантов, отобрана плазмида pNR (фиг.3).
На заключительном этапе клонировали ген Н+пирофосфотазы R.rubrum из плазмиды pET22RPP в полученный вектор pNR. ДНК pET-RPP обрабатывали с помощью эндонуклеазы XhoI и застраивали липкие концы с помощью фрагмента Кленова. Полученный препарат обрабатывали рестриктазой XbaI. Фрагмент ДНК, несущий ген Н+-пирофосфатазы выделяли из агарозного геля и лигировали с вектором pBI-NR, обработанным эндонуклеазами Ес1136II и XbaI. Полученной лигазной смесью трансформировали штамм E.coli DH10B с отбором трансформантов по устойчивости к ампициллину. В результате рестрикционного анализа плазмидной ДНК, выделенной из клонов трансформантов, отобрана плазмида pNR-RPP, содержащая ген Н+-пирофосфатазы Rhodospirillum rubrum. (фиг.4). Корректность процедуры клонирования пирофосфатазы Rhodospirillum rubrum в составе вектора pBI-NR подтверждена с помощью секвенирования вставки.
Плазмиду pNRRPP перенесли в штамм Agrobacterium tumefaciens GV3101 методом трехродительской конъюгации [13].
Бактериальные штаммы, использованные в работе
Плазмиды, использованные в работе
Для проведения ПЦР-амплификации nosP промотера использовали синтетические олигонуклеотиды, Pnos1 (CCCAAGCTTGTTTAAACTGAAGCCGGGA) и Pnos2 (GAAGATCTCGATCCAGATCCGGTGCA).
Все манипуляции с ДНК - субклонирование в плазмидные вектора, ПЦР-амплификацию, секвенирование, лигирование и т.п. проводили согласно общепринятым методикам [18].
Пример 2. Создание трансгенных растений табака.
Для создания трансгенных растений табака, экспрессирующих ген Н+пирофосфатазы, использовали метод агробактериальной трансформации. Растения Nicotiana tabacum сорт Samsun NN, выращенные в условиях in vitro трансформировали по стандартной методике [19]. В ходе трансформационных экспериментов получили 120 первичных трансформантов, прошедших отбор на среде, содержащей селективный агент фосфинотрицин - 5 мг/л.
Пример 3. Молекулярно-биологический анализ полученных первичных трансформантов.
Молекулярно-биологический анализ включал в себя ПЦР-анализ на наличие части гена BAR и частей гена RPP, а также определение уровня экспрессии методом Вестерн-блот.
ПЦР-анализ
Для ПЦР-анализа генома растений на наличие части гена BAR были использованы праймеры:
BarAtF: 5' ggc gga cat gcc ggc ggt ctg cac с
BarAtR: 5' cag ccc gat gac agc gac cac gct с
Условия проведения ПЦР: горячий старт: 1 цикл - 95°С - 1 мин; 40 циклов: 95°С - 30 сек, 65°С - 30 сек, 72°С - 30 сек.
Данные электрофоретического анализа продуктов ПЦР-амплификации показали наличие части гена BAR размером 350 п.о. у 32 трансформантов (фиг.5). Данные трансформанты отобрали для дальнейшей работы.
Для ПЦР-анализа генома этих растений на наличие частей гена RPP подобрали и использовали две пары праймеров:
Sb1: cca cta tcc tcc gca aga ccc ttc с
RPP11: gac ggc gat gtt ctt gta ctg acg a
Условия проведения ПЦР:
40 циклов (95°С - 30 сек; 68°С - 30 сек; 72°С - 30 сек) и окончательная полимеризация - 7 минут.
RPP12: саа gaa gta cat cga aga cg
NOS-R: tta tcc tag ttt gcg cgc ta
Условия проведения ПЦР:
40 циклов (95°С - 30 сек; 55°С - 30 сек; 72°С - 30 сек) и окончательная полимеризация - 7 минут.
Данные электрофоретического анализа продуктов ПЦР-амплификации показали наличие частей гена RPP размером: Sb1-RPP11 - 300 п.о. (фиг.6) и NOSR-RPP12 - 490 п.о. у 25 трансформантов (фиг.7).
Проведение ПЦР-анализа осуществляли с использованием ДНК-амплификатора («Techne Genius»).
Состав реакционной смеси для ПЦР:
- Праймеры - по 2 мкл каждого;
- 10Х буфер-2 мкл;
- 10Х dNТР-2 мкл;
- Taq полимераза - 1 единица;
- ДНК-матрица - 1 мкл;
- Н2O - 11 мкл.
В качестве матрицы использовали выделенные образцы геномной ДНК.
Выделение ДНК осуществляли следующим способом. 20-100 мг растительной ткани (фрагменты листовых пластинок) растирали в гомогенизаторе в 120 мкл буфера I (50 mM Tris HCl, рН8.0; 10 mМ EDTA; 50 мкг/мл панкреатической РНКазы, предварительно подогретой 30 минут на кипящей водяной бане) до получения гомогенной суспензии. Затем к гомогенату добавляли 125 мкл лизирующего буфера II (0.2 М NaOH; 1% додецил сульфата Na). Полученную смесь обрабатывали в шейкере 2 минуты при комнатной температуре, перенесли в пробирки, которые помещали в термостат и инкубировали при 65°С в течение 45 минут. По окончании инкубации лизат охлаждали до температуры 20-25°С и добавляли в каждую пробирку по 125 мкл нейтрализующего раствора III (2.5 mM ацетата К, рН 4.5). Содержимое пробирок тщательно перемешивали на шейкере и центрифугировали при 14000 об/мин в течение 10 минут. Надосадочную жидкость перенесли в новые микроцентрифужные пробирки, содержащие 500 мкл смолы Wizard MaxiPreps и далее выделяли ДНК согласно рекомендациям фирмы Promega для набора Wizard Preps.
Для центрифугирования использовали настольную микроцентрифугу (Eppendorf 5415С) с максимальной скоростью вращения ротора 14000 об/мин. Термостатирование образцов осуществляли в сухом термостате («Термо 28-23»). Анализ продуктов ПЦР осуществляли методом электрофореза в агарозном геле при напряженности электрического поля 6 В/см с последующим окрашиванием гелей бромистым этидием (концентрация красящего раствора 1 мкг/мл в воде, время окрашивания - 20 минут при комнатной температуре) и фотографировали полученную картину в ультрафиолете (длина волны - 260-280 нм) цифровым фотоаппаратом. Обработку оцифрованной информации проводили при помощи пакета Adobe Photoshop 7.0.
Заключение о встраивании в геном растения чужеродного гена делали на основании появления продукта ПЦР с ожидаемым (в зависимости от использованных специфических праймеров) размером.
Вестерн-блот анализ
Уровень экспрессии гена H+-пирофосфатазы Rhodospirillum rubrum в трансгенных растениях табака поколения ТО определяли с помощью Вестерн-блотт анализа.
Для выделения белковых препаратов листья трансгенных растений табака гомогенизировали в буфере (0.4 М сахароза, 50 мМ Трис рН 8.0, 10 мМ КСl, 5 мМ MgCl2, 10% глицерин, 10 мМ меркаптоэтанола). Полученный раствор центрифугировали 5000 g - 10 мин, осадок отбрасывали. Концентрацию белка в супернатанте определяли по Брэдфорду.
При проведении электрофоретического анализа в полиакриламидном геле на каждую дорожку наносили по 100 мкрг общего белка выделенного из 25 трансгенных растений и контрольного нетрансгенного растения табака.
В результате проведенного анализа выявлено различие в уровне экспрессии гена Н+-пирофосфатазы у проанализированных трансформантов (фиг.8).
Вестерн-блот анализ и связанные процедуры проводили, следуя указаниям производителей мембран и системы детекции (Amersham).
Пример 4. Получение семенного материала трансгенных растений табака - поколение Т1.
Трансгенные растения табака с различным уровнем экспрессии гена Н+-пирофосфатазы Rhodospirillum rubrum (T0), отобранные по результатам Вестерн-блот анализа, адаптировали к условиям in vivo и культивировали до получения семенного материала. Растения формировали соцветия на 45-50 день. Так как табак является самоопыляющейся культурой, скрещивание между различными линиями трансгенных растений табака Т0 было исключено. С каждого растения получили семенной материал - поколение Т1.
Пример 5. Изучение влияния экспрессии гена мембранной Н+-пирофосфатазы Rhodospirillum rubrum на рост и развитие побегов и корневой системы растений.
Для изучения влияния экспрессии гена мембранной H+-пирофосфатазы Rhodospirillum rubrum на рост и развитие побегов и корневой системы контрольные и трансгенные растения табака выращивали в условиях in vivo.
Часть растений в возрасте 6-7 настоящих листьев оценивали по следующим параметрам: длина корня, масса корня, масса листьев, соотношение массы корневой системы к массе листьев.
Сравнение контрольных и трансгенных растений табака, экспрессирующих ген мембранной H+-пирофосфатазы R.rubrum, показало, что трансгенные растения превышают контрольные по длине корневой системы в 2 раза, по массе корневой системы в 2,9 раза, по массе листьев в 2 раза (табл.3).
Сравнение роста и развития побегов и корневой системы контрольных и трансгенных растений
Оставшиеся растения выращивали в условиях in vivo до получения семенного материала - поколение Т2. Наблюдение за растениями показало, что количество листьев у трансгенных растений в 1,3 раза больше, чем у контрольных. Расстояние между междоузлиями у трансгенных растений уменьшается ближе к соцветию по сравнению с контрольными. Также отмечено, что начало фазы цветения у трансгенных растений наступает на 7-8 дней раньше, чем у контрольных растений.
Полученные данные свидетельствуют, что экспрессия гена Н+-пирофосфатазы Rhodospirillum rubrum стимулирует рост побегов и развитие корневой системы у трансгенных растений.
Пример 6. Изучение влияния экспрессии гена мембранной Н+-пирофосфатазы Rhodospirillum rubrum на биологическую продуктивность растений.
Сравнение полученного семенного материала - поколение Т2 (см. пример 5) показало, что количество семенных коробочек на трансгенных растениях больше в 1,9 раз по сравнению с контрольными, масса и количество семенного материла, собранного с трансгенных растений, больше в 1,5 раза соответственно (табл.4).
Сравнение массы и количества семенного материала, полученного с контрольных и трансгенных растений
В таблице приведены средние значения показателей для контрольных и трансгенных растений.
Полученные данные могут свидетельствовать о том, что экспрессия гена Н+пирофосфатазы оказывает стимулирующее влияние на биологическую продуктивность растения.
Пример 7. Определение содержания хлорофилла в листьях трансгенных растений, экспрессирующих ген мембранной Н+-пирофосфатазы Rhodospirillum rubrum.
Содержание хлорофилла в листьях контрольных и трансгенных растений определяли по стандартной методике [20].
Содержание хлорофилла определяли на стадии начала цветения, когда его уровень достигает своего максимального значения. С каждого растения были взяты по 10 проб. Пробы отбирались с 9 по 18 лист (снизу вверх), тем самым мы исключили из выборки самые нижние старые листья - с очень низким уровнем хлорофилла и самые верхние молодые листья - уровень хлорофилла которых очень высок. Опыт показал, что листья трансгенных растений содержат в 1,8 раз больше хлорофилла, чем контрольные растения (табл.5, фиг.9).
Сравнение содержания хлорофилла в листьях контрольных и трансгенных растений
В таблице приведены средние значения показателей для контрольных и трансгенных растений.
Пример 8. Определение влияния различных концентраций хлорида натрия на рост и развитие контрольных и трансгенных растений, экспрессирующих ген Н+-пирофосфатазы Rhodospirillum rubrum.
Для определения влияния действия хлорида натрия на рост и развитие растений провели тестирование контрольных и трансгенных растений, предварительно выращенных на MS-среде без добавления соли до получения 3-4 настоящих листьев, а затем пересаженных в пробирки с питательной средой, содержащей различные концентрации хлорида натрия в диапазоне от 0 до 250 мМ (шаг 25 мМ). Оценку проводили по морфологическим признакам (рост, развитие побегов и корневой системы, интенсивность окраски листьев, появление некрозов и т.д.).
Опыт показал, что различия по морфологическим признакам между контрольными и трансгенными растениями слабо проявлялись на концентрациях от 25 мМ до 100 мМ NaCl. Значительное различие в росте и развитии трансгенных и контрольных растений наблюдалось на концентрации 125 мМ и выше (фиг.10), а на концентрации 250 mM NaCl наблюдали полную гибель контрольных растений (фиг.11).
Пример 9. Определения уровня накопления натрия в тканях контрольных и трансгенных растений табака, экспрессирующих ген H+-пирофосфатазы Rhodospirillum rubrum.
Содержание натрия в растительных тканях определяли с помощью плазменного фотометра. Для анализа использовали образцы тканей листьев контрольных и трансгенных растений, выращенных на питательной среде с различной концентрацией хлорида натрия в диапазоне от 0 до 250 мМ (шаг 25 мМ).
Для получения проб надземную часть контрольных и трансгенных растений высушивали в течение 72 часов при температуре 65°С до постоянной массы. После гомогенизации сухих листьев экстракцию осуществляли 1М раствором НСl в течение 1 часа (из расчета: на 50 мг свежих листьев - 1 мл 1М НСl). После центрифугирования собранный супернатант использовали для анализа.
Анализ образцов показал, что содержание натрия в листьях трансгенных и контрольных растений существенно не отличается при выращивании растений на средах с концентрацией NaCl от 0 до 175 мМ (табл.6).
Количество натрия в мг на 1 г сухого вещества
Однако при концентрации NaCl 200 мМ, когда наблюдалось практически полное угнетение роста контрольных растений, концентрация натрия в листьях контрольных растений по сравнению с трансгенными возрастает в 1,7 раза (фиг.12).
Библиографические данные
1. Полевой В.В. // Фитогормоны. Л.: Изд-во Ленинградского ун-та, 1982.
2. Jisheng Li, Haibing Yang, Wendy Ann Peer, Gregory Richter, Joshua Blakeslee, 3 Anindita Bandyopadhyay, Boosaree Titapiwantakun, Soledad Undurraga, Mariya Khodakovskaya, Elizabeth L. Richards, Beth Krizek, Angus S. Murphy, Simon Gilroy, Roberto Gaxiola. // Arabidopsis H-PPase AVP1 Regulates Auxin-Mediated Organ Development, Science, 2005, v.310. p.121.
3. Zhang H-X., Blumwald E. // Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit. Nature Biotechnology, 2001, vol.19, p.765-768.
4. Apse M.P., Aharon G.S., Sneddon W.A., Blumwald E. // Salt tolerance conferred by overexpression of avacuolar Na+/H+ antiport in Arabidopsis. Science, 1999, vol.285, p.1256-1258.
5. Gaxiola R, Li J, Undurraga S, Dang LM, Alien GJ, Alper SL, Fink GR. // Drought-and salt-tolerant plants result from overexpression of the AVP1 H+ pump. Proceedings of the National Academy of Sciences of the USA 98, 2001, 11444±11449.
6. R.A.Gaxiola, R.Rao, A.Sherman, P.Grisafi, S.L.Alper, G.R.Fink, The Arabidopsis thaliana proton transporters, AtNhxl and Avpl, can function in cation detoxification in yeast. // Proc. Natl. Acad. Sci. USA 96, 1999, 1480-1485.
7. Matzke, M., Matzke, A.J., and Kooter, J.M. // RNA: Guiding gene silencing. Science 293, 2001, 1080-1083.
8. Vance, V., and Vaucheret, H. // RNA silencing in plants-Defense and counterdefense. Science 292, 2001, 2277-2280.
9. Voinnet, O. // RNA silencing as a plant immune system against viruses. Trends Genet. 17, 2001, 449-459.
10. Waterhouse, P.M., Wang, M.B., and Lough, T.// Gene silencing as an adaptive defence against viruses. Nature 411, 2001, 834-842.
11. Baulcombe, D. // RNA silencing. Curr. Biol. 12, 2002, R82-R84.
12. Drozdowicz Y.M., Rea P.A. // Vacuolar H+ pyrophosphatases: from the evolutionary backwaters into the mainstream. // Trends of Plant Science, 2001, vol.6, p.1360-1385.
13. Van Haute E., et al., // EMBO J., 1983, V.2, P.411-418.
14. Grant SGN., Jessee J., Bloom FR., and Hanahan D. // PNAS 87, 1990, 4645-4649.
15. Yanisch-perron, С., Vieira, J., and Messing, J. // Gene 33, 1985, 103-119.
16. Падегимас, Л. // Автореферат диссертации на соискание ученой степени кандидата химических наук. Москва, 1993.
17. Baltscheffsky M, Nadanaciva S, Schultz A. // Biochim Biophys Acta. May 27; 1364(3): 301-6, 1998.
18. Sambrook, J., Fritsch E.F., and Maniatis, T. // Molecular cloning: a laboratory manual, 2nd ed. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y, 1989.
19. Дрейпер Дж., Скотт Р., Уолден Р. // В сб.: Генетическая инженерия растений. Москва: Мир, 1991, 119-130.
20. Amon D.I.// Plant Physiology, 1949, V.24, 1-6.
Список сокращений
AVP1 - ген вакуолярной Н+-пирофосфатазы Arabidopsis thaliana
RPP - ген мембранной H+-пирофосфатазы Rhodospirillum rubrum
Bar - ген, кодирующий фосфинотрицинацетилтрансферазу и
обеспечивающий устойчивость к гербицидам на основе L-фосфинотрицина
H+-АТФаза - аденозинтрифосфат-зависимая протонная помпа
ИУК (IAA) - индолил-3-уксусная кислота
NaCl - хлорид натрия
Na+ - ион натрия
Н+ - протон
ПЦР - полимеразная цепная реакция
MS-среда - питательная среда Muraashige and Scoog
мкг - микрограмм
мг - миллиграмм
мкл - микролитр
об/мин - обороты в минуту
В/см - вольт на сантиметр
t - температура
л - литр
мл - миллилитр
°С - градусы по Цельсию
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРАНСГЕННОЕ РАСТЕНИЕ БЕРЕЗЫ С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ | 2013 |
|
RU2587623C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pBM И СПОСОБ ПОЛУЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ БЕЗМАРКЕРНЫХ ТРАНСГЕННЫХ РАСТЕНИЙ, СИНТЕЗИРУЮЩИХ ЦЕЛЕВЫЕ ПРОДУКТЫ | 2009 |
|
RU2410433C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pART27INT6 И СПОСОБ ПОЛУЧЕНИЯ НА ЕЕ ОСНОВЕ ИНБРЕДНОЙ ЛИНИИ РАСТЕНИЙ ТАБАКА, СИНТЕЗИРУЮЩЕГО ВНУТРИКЛЕТОЧНЫЙ ГАММА-ИНТЕРФЕРОН БЫКА | 2014 |
|
RU2564115C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ КАРТОФЕЛЯ СОРТА НЕВСКИЙ С ПОМОЩЬЮ AGROBACTERIUM TUMEFACIENS | 2002 |
|
RU2231549C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ КАРТОФЕЛЯ СОРТА ЛУГОВСКОЙ С ПОМОЩЬЮ AGROBACTERIUM TUMEFACIENS | 2002 |
|
RU2231550C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА PGBP450F ДЛЯ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ И СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННОЙ ПРОДУКТИВНОСТЬЮ И УСТОЙЧИВОСТЬЮ К ГРИБНЫМ ФИТОПАТОГЕНАМ | 2002 |
|
RU2237717C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОБРАЗОВАНИЯ ПОБЕГОВ (ВАРИАНТЫ), ДНК-КОНСТРУКЦИЯ ( ВАРИАНТЫ) И СПОСОБ СКРИНИНГА БИБЛИОТЕК НУКЛЕИНОВЫХ КИСЛОТ | 1998 |
|
RU2233332C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324736C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324737C1 |
| С4-ЦИКЛ ФКК-ТИПА | 1998 |
|
RU2159813C2 |





Настоящее изобретение решает задачу создания растений с улучшенными хозяйственно-ценными признаками, такими как ускоренный рост, повышенная длина и масса корней, увеличенная масса листьев, повышенная биологическая продуктивность и устойчивость растений к засолению. В геном растения вводят ген мембранной пирофосфатазы фотосинтезирующей бактерии Rhodospirillum rubrum, что обеспечивает синтез соответствующего белка в растительных клетках. В частности, сконструированы трансгенные растения табака, экспрессирующие ген мембранной Н+-пирофосфатазы из бактерии Rhodospirillum rubrum. В результате трансформации при выращивании в условиях in vivo трансгенные растения превышают контрольные по длине корневой системы и по массе листьев. Среднее количество семенных коробочек на трансгенных растениях больше, чем у контрольных, среднее количество и масса семенного материала трансгенных растений также больше. Содержание хлорофилла в листьях трансгенных растений больше, чем в листьях контрольных растений. Трансгенные растения значительно обгоняют в росте контрольные растения. 3 н. и 4 з.п. ф-лы, 13 ил., 6 табл.
1. Способ получения трансгенного растения с ускоренным ростом, и/или увеличенными длиной и массой корневой системы, и/или большей массой листьев, и/или повышенным содержанием хлорофилла, и/или пониженным содержанием ионов натрия в тканях, состоящий во введении в геном растения гена мембранной Н+-транспортирующей пирофосфатазы бактерии Rhodospirillum rubrum.
2. Способ по п.1, отличающийся тем, что введение гена осуществляется методом агробактериальной трансформации.
3. Способ по п.1 или 2, отличающийся тем, что он используется для получения растения с ускоренным по сравнению с соответствующим немодифицированным растением ростом.
4. Способ по п.1 или 2, отличающийся тем, что он используется для получения растения с увеличенными по сравнению с соответствующим немодифицированным растением длиной и массой корневой системы.
5. Способ по п.1 или 2, отличающийся тем, что он используется для получения растения с большей по сравнению с соответствующим немодифицированным растением массой листьев и повышенным содержанием хлорофилла.
6. Трансгенное растение, полученное способом по п.1, которое обладает улучшенными хозяйственно-ценными свойствами.
7. Клетка растения по п.6, которая содержит ген мембранной пирофосфатазы бактерии Rhodospirillum rubrum и продуцирует кодируемый названным геном фермент.
| PROC NATL ACAD USA, 2001, 98(20), 11444-9 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ РАСТЕНИЙ КАПУСТЫ БЕЛОКОЧАННОЙ | 2005 |
|
RU2286669C1 |
| БИОКАТАЛИЗАТОР НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ КЛЕТОК ФОТОТРОФНЫХ БАКТЕРИЙ ДЛЯ ПОЛУЧЕНИЯ ВОДОРОДА | 2006 |
|
RU2323975C1 |
Авторы
Даты
2010-01-10—Публикация
2008-10-07—Подача