Область изобретения
Настоящее изобретение относится к применению новых дифторпроизводных для лечения заболеваний, ассоциированных с цистеинпротеазой, в частности заболеваний, ассоциированных с активностью катепсина S, K и B. Настоящее изобретение относится также к способам получения таких соединений.
Предпосылки создания изобретения
Цистеинпротеазы представляют собой класс пептидаз, характеризующихся наличием цистеинового остатка в каталитическом центре фермента. Цистеинпротеазы ассоциируются с нормальным разложением и процессингом белков. Однако нарушение активности цистеинпротеаз, например, в результате повышенной экспрессии или усиленной активации может иметь патологические последствия. В этом отношении некоторые цистеинпротеазы ассоциируются с рядом патологических состояний, в число которых входят артрит, атеросклероз, эмфизема, остеопороз, мышечная дистрофия, воспаление, инвазия опухоли, гломерулонефрит, периодонтоз, метахроматическая лейкодистрофия и т.п.
Повышение активности катепсина, например катепсина S, способствует развитию патологии и/или симптоматологии ряда заболеваний, таких как, например, аутоиммунные нарушения, включая, но не ограничиваясь ими, ювенильный диабет, рассеянный склероз, обыкновенную пузырчатку, болезнь Грейвса, злокачественную миастению, системную красную волчанку, синдром раздраженного кишечника, ревматоидный артрит и тиреоидит Хашимото, аллергические заболевания, включая, но не ограничиваясь ими, астму и аллогенные иммунные реакции, включая, но не ограничиваясь ими, реакции при трансплантации органов или тканей. Катепсин S также ассоциируется с нарушениями, включающими избыточный эластолиз, например хроническое обструктивное заболевание легких (например, эмфизему), бронхиолит, избыточный эластолиз дыхательных путей при астме и бронхите, пневмониты и сердечно-сосудистые заболевания, такие как разрушение бляшек и атерома. Катепсин S участвует в образовании фибрилл, поэтому ингибиторы катепсина S могут быть использованы в лечении системного амилоидоза.
Активность, например, катепсина B в синовиальной жидкости значительно повышалась в моделях остеоартрита (F. Mehraban Ann. Rheum. Dis. 1997; 56, 108-115). Аналогичным образом, катепсин K представляет собой протеазу, играющую важную роль в распаде коллагенов, опосредуемом синовиальными фибробластами (W.-S. Hou (et al.) Am. J. Pathol. 2001, 159, 2167-2177). Таким образом, ингибирование катепсина B и K является, например, эффективным методом лечения дегенеративных поражений суставов, например, остеоартрита. Ингибирование катепсина K, например, приводит к ингибированию резорбции кости (G. B. Stroup (et al.) J. Bone Mineral Res. 2001, 16, 1739-1746). Поэтому ингибиторы катепсина K могут быть использованы для лечения остеопороза.
Известно, что катепсины играют важную роль в разрушении соединительных тканей, продуцировании биологически активных белков и процессировании антигенов. Они участвуют в патогенезе остеопороза, мышечной дистрофии, бронхита, эмфиземы, вирусной инфекции, раковых метастазов и нейродегенеративных заболеваний, таких как болезнь Альцгеймера и болезнь Гентингтона. В последнее время возросший интерес к ингибиторам катепсинов был связан с появлением потенциальных терапевтических мишеней, таких как катепсин K или катепсин L, в случае остеопороза, и катепсин S, в случае модуляции иммунного ответа (W. Kim., K. Kang. Expert Opin. Ther. Pat. 2002, 12, 419-432). Повышение активности катепсина K или B приводит к патологии и/или симптоматологии ряда заболеваний. В соответствии с этим молекулы, ингибирующие активность катепсинпротеазы, могут быть использованы в качестве терапевтических средств при лечении таких заболеваний.
Краткое описание изобретения
В одном из аспектов настоящего изобретения описаны соединения, ингибирующие ферментативную активность катепсина S, B и K и имеющие структуру формулы (I):
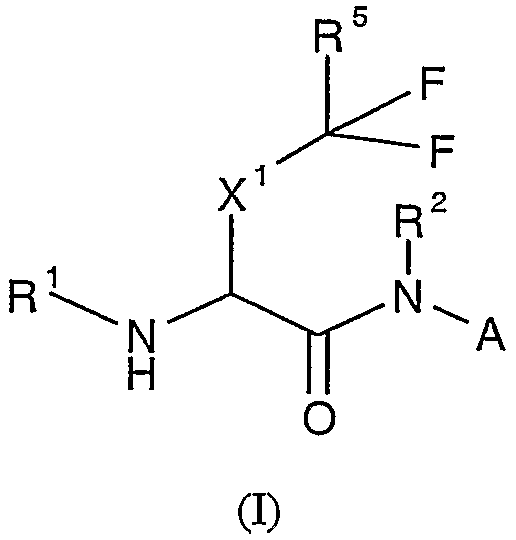
где
A представляет собой
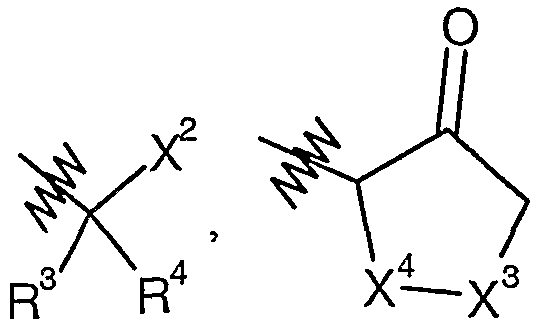 или
или 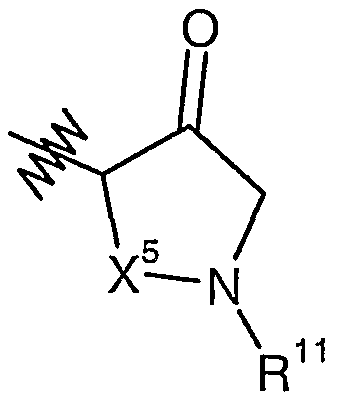 ;
;
X1 представляет собой метилен, этилен или связь;
X2 представляет собой CN, CHO, C(O)R6, C(O)C(O)NR7R7, C(O)C(O)NR7R8, C(O)C(O)R13, C(O)C(O)OR13, C(O)CH2X3R13;
X3 выбран из группы, состоящей из O, S(O)n, CO, CONH, NHCO, NHSO2 и SO2NH;
X4 представляет собой CH(R12) или CH(R12)-CH2;
X5 представляет собой метилен, этилен, пропилен или связь;
X6 представляет собой связь или (C1-2)алкилен;
R1 представляет собой H, R13C(O)-, R13S(O)2-, R13OC(O)-, R8R7NC(O)-, R8R7NS(O)2-; R13S(O)2NC(O)- или R13C(O)NS(O)2-; или R1 выбран из группы, состоящей из (C1-9)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C5-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила и гетеро(C5-13)арил(C0-6)алкила, каждый из которых может быть замещен 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-4)алкила, цианогруппы, галогена, галогензамещенного (C1-4)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, -X6S(O)2R10 и -X6C(O)R10;
R2 выбран из группы, состоящей из водорода, (C1-6)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C5-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила или гетеро(C5-12)арил(C0-6)алкила;
R3 выбран из группы, состоящей из H, (C1-6)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C5-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила или гетеро(C5-13)арил(C0-6)алкила, необязательно замещенных 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-4)алкила, цианогруппы, галогена, галогензамещенного (C1-4)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, -X6S(O)2R10 и -X6C(O)R10;
R4 представляет собой H или (C1-6)алкил; или R3 и R4 вместе с атомом углерода, к которому присоединены R3 и R4, образуют (C3-8)циклоалкилен или (C3-8)гетероциклоалкилен;
R5 представляет собой H, F, или R5 представляет собой (C1-9)алкил, (C3-12)циклоалкил(C0-6)алкил, гетеро(C3-12)циклоалкил(C0-6)алкил, (C6-12)арил(C0-6)алкил, гетеро(C5-13)арил(C0-6)алкил, каждый из которых может быть замещен 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-4)алкила, цианогруппы, галогена, галогензамещенного (C1-4)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, -X6S(O)2R10 и -X6C(O)R10;
R6 представляет собой (C6-12)арил, гетеро(C5-13)арил и галогензамещенный (C1-6)алкил; где R6 может быть замещен 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-9)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C5-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила, гетеро(C5-13)арил(C0-6)алкила, цианогруппы, галогена, галогензамещенного (C1-6)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, -X6S(O)2R10 и -X6C(O)R10;
R7 представляет собой H, (C1-6)алкил, (C3-12)циклоалкил(C0-6)алкил, гетеро(C3-12)циклоалкил(C0-6)алкил, (C6-12)арил(C0-6)алкил, гетеро(C5-13)арил(C0-6)алкил и галогензамещенный (C1-6)алкил; где R7 может быть замещен 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-4)алкила, цианогруппы, галогена, галогензамещенного (C1-4)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, -X6S(O)2R10 и -X6C(O)R10;
R8 выбран из группы, состоящей из H, (C1-6)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C3-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила и гетеро(C5-13)арил(C0-6)алкила; или R7 и R8 вместе с присоединенным атомом, образуют (C3-8)циклоалкилен или (C3-8)гетероциклоалкилен;
R9 независимо в каждом случае представляет собой водород, (C1-6)алкил или галогензамещенный (C1-6)алкил;
R10 представляет собой (C1-6)алкил или галогензамещенный (C1-6)алкил;
R11 выбран из группы, состоящей из водорода, (C1-9)алкила, (C3-12)циклоалкил(C0-6)алкила, гетеро(C5-12)циклоалкил(C0-6)алкила, (C6-12)арил(C0-6)алкила, гетеро(C5-13)арил(C0-6)алкила, (C9-12)бициклоарил(C0-3)алкила, гетеро(C8-12)бициклоарил(C0-3)алкила, -C(O)R13, -C(S)R13, -S(O)2R13, -C(O)OR13, -C(O)N(R7)R8, -C(S)N(R7)R8 и -S(O)2N(R7)R8;
R12 представляет собой H или (C1-6)алкил, необязательно замещенный амидом, (C6-12)арилом, гетеро(C5-12)арилом, гетеро(C5-12)циклоалкилом или гидрокси;
R13 представляет собой (C1-6)алкил, (C3-12)циклоалкил(C0-6)алкил, гетеро(C3-12)циклоалкил(C0-6)алкил, (C6-12)арил(C0-6)алкил, гетеро(C5-13)арил(C0-6)алкил и галогензамещенный (C1-6)алкил; где R13 необязательно может быть замещен 1-5 радикалами, независимо выбранными из группы, состоящей из (C1-4)алкила, цианогруппы, галогена, галогензамещенного (C1-4)алкила, -X6NR9R9, -X6OR9, -X6SR9, -X6C(O)NR9R9, -X6OC(O)NR9R9, -X6C(O)OR9, -X6NC(O)OR9, -X6S(O)R10, X6S(O)2R10 или -X6C(O)R10; и
n равно нулю или целому числу 1 или 2;
и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также их фармацевтически приемлемые соли и сольваты (например, гидраты) таких соединений формулы (Ia) и N-оксиды и пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
В другом своем аспекте настоящее изобретение относится к каркасным структурам формул II, III, IV или V, где sub1-sub8 обозначают общие заместители. Предпочтительные заместители sub1-sub8 не являются частью данного аспекта изобретения и могут представлять собой любые химические группы или радикалы, которые могут быть замещены в этих положениях (далее называемые «общими заместителями»), включая замещения, которые могут быть сделаны любыми общепринятыми методами или с применением каких-либо новых технологий, которые будут разработаны в будущем. Таким образом, для целей настоящей заявки «общие заместители» не входят в формулу изобретения или не ограничивают притязаний данной заявки; и они сами по себе могут быть новыми и неочевидными, или неизвестными на момент создания настоящего изобретения.

В еще одном аспекте настоящее изобретение относится к основной структуре формул II, III, IV или V вместе с обычными заместителями в положениях sub1-sub8. В описании настоящей заявки под «обычным заместителем» следует понимать любую химическую группу или радикал, которые, на момент создания изобретения, по мнению специалистов в данной области могут быть введены в положения sub1-sub8 методами введения предпочтительных заместителей, список которых приводится ниже в качестве руководства, без ненужных экспериментов по реализации настоящего изобретения.
В еще одном своем аспекте настоящее изобретение включает основные структуры формул II, III, IV или V и упоминаемые ниже предпочтительные заместители в положениях sub1-sub8. Предпочтительные заместители, описанные в настоящей заявке, далее будут называться «особыми заместителями». Для целей данной заявки особый заместитель, если он упомянут в формуле изобретения, служит ограничением притязаний и может сообщать патентоспособность сам по себе или в сочетании с основной структурой и присутствующими в ней заместителями.
Определения
Если это не указано особо, то приведенные ниже термины, используемые в описании изобретения и в формуле изобретения, в контексте настоящей заявки имеют следующие значения.
«Химической структурной единицей, относящейся к соединению» называется N-оксидное производное, производное пролекарства, защищенное производное, отдельный изомер, смесь изомеров или фармацевтически приемлемая соль или сольват упомянутого соединения, которые могут быть получены специалистами в данной области без излишнего экспериментирования.
«Ацил» означает H-CO- или алкил-CO-группу, где алкильная группа определена в настоящем описании.
«Ациламино» представляет собой ацил-NH-группу, где ацил определен в настоящем описании.
«Алкокси» означает алкил-O-группу, где алкильная группа определена в настоящем описании. Примерами алкоксигрупп являются аллилокси, дифторметокси, метокси, трифторметокси, этокси, н-пропокси, изопропокси, н-бутокси и гептокси.
«Алкоксикарбонил» означает алкил-O-CO-группу, где алкильная группа определена в настоящем описании. Примерами алкоксикарбонильных групп являются метокси и этоксикарбонил.
«Алкил» сам по себе означает линейный или разветвленный, насыщенный или ненасыщенный алифатический радикал с указанным числом атомов углерода (например, к (C1-6)алкилам относятся метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил, винил, аллил, 1-пропенил, изопропенил, 1-бутенил, 2-бутенил, 3-бутенил, 2-метилаллил, этинил, 1-пропинил, 2-пропинил и т.п.). Алкил вместе с другим радикалом (например, таким как арилалкил) означает линейный или разветвленный, насыщенный или ненасыщенный алифатический двухвалентный радикал с указанным количеством атомов углерода, или если количество атомов не указано, то это означает прямую связь (например, к (C6-12)арил(C0-6)алкилам относятся фенил, бензил, фенетил, 1-фенилэтил, 3-фенилпропил и т.п.). Специалистам в данной области известно, что если алкил представляет собой ненасыщенный алифатический радикал, то такие радикалы не могут присоединяться непосредственно к атому кислорода, азота или серы через кратную углерод-углеродную связь указанного ненасыщенного алифатического радикала.
«Алкилен», если это не оговорено особо, означает линейный или разветвленный, насыщенный или ненасыщенный алифатический двухвалентный радикал с указанным количеством атомов углерода; причем к числу (C1-2)алкиленов относятся метилен (-CH2-) и этилен (-CH2CH2-). Специалистам в данной области известно, что если алкилен представляет собой ненасыщенный алифатический двухвалентный радикал, то такой радикал не может быть присоединен непосредственно к атому кислорода, азота или серы через кратную углерод-углеродную связь указанного ненасыщенного алифатического двухвалентного радикала.
«Алкилендиокси» означает -O-алкилен-O-группу, в которой алкилен определен выше. Примерами алкилендиоксигрупп являются метилендиокси и этилендиокси.
«Алкилсульфинил» означает алкил-SO-группу, в которой алкильная группа определена выше. Предпочтительными алкилсульфинильными группами являются группы, в которых алкильная группа представляет собой (C1-4)алкил.
«Алкилсульфонил» означает алкил-SO2-группу, в которой алкильная группа определена выше. Предпочтительными алкилсульфонильными группами являются группы, в которых алкильная группа представляет собой (C1-4)алкил.
«Алкилтио» означает алкил-S-группу, в которой алкильная группа определена выше. Примерами алкилтиогрупп являются метилтио, этилтио, изопропилтио и гептилтио.
«Ароматическим» называется любое соединение, атомы которого образуют ненасыщенную кольцевую систему, все атомы которой sp2-гибридизированы, и в которой полное количество пи-электронов равно 4n+2.
«Ароил» означает арил-CO-группу, в которой арильная группа определена выше. Примерами ароильных групп являются бензоил и 1- и 2-нафтоил.
«Ароиламино» представляет собой ароил-NH-группу, в которой ароил определен выше.
«Арил» как группа или часть группы означает: (i) необязательно замещенную моноциклическую или полициклическую ароматическую карбоциклическую группу, имеющую от 6 до 12 атомов углерода, такую как фенил или нафтил; или (ii) необязательно замещенную частично насыщенную полициклическую ароматическую карбоциклическую группу, в которой арильная и циклоалкильная или циклоалкенильная группы являются конденсированными и образуют циклическую структуру, такую как тетрагидронафтильное, инденильное или инданильное кольцо. Если это не оговорено особо, арильные группы могут иметь заместители в виде одной или нескольких одинаковых или различных арильных групп, где «заместителем в виде арильной группы» является, например, ацил, ациламино, алкокси, алкоксикарбонил, алкилендиокси, алкилсульфинил, алкилсульфонил, алкилтио, ароил, ароиламино, арил, арилалкилокси, арилалкилоксикарбонил, арилалкилтио, арилокси, арилоксикарбонил, арилсульфинил, арилсульфонил, арилтио, карбокси (или кислый биоизостер), циано, циклоалкил, галоген, гетероароил, гетероарил, гетероарилалкилокси, гетероароиламино, гетероарилокси, гетероциклоалкил, гидрокси, нитро, трифторметил, -NY3Y4, -CONY3Y4, -SO2NY3Y4, -NY3-C(=O)алкил, -NY3SO2алкил или алкил, необязательно замещенный арилом, гетероарилом, гидрокси или -NY3Y4 (где Y3 и Y4 независимо представляют собой водород, алкил, арил, арилалкил, циклоалкил, гетероарил или гетероарилалкил; или группа -NY3Y4 может образовывать циклический амин). Примерами необязательно замещенных (C6-12)арилов являются, но не ограничивается ими, бифенил, бромфенил, хлорфенил, дихлорфенил, дифторметоксифенил, диметилфенил, этоксикарбонилфенил, фторфенил, изопропилфенил, метоксифенил, метилфенил, метилсульфонилфенил, нафтил, пентафторфенил, фенил, трифторметоксифенил, трифторметилфенил и т.п. Необязательно замещенный (C6-12)арил, используемый в данном описании для обозначения радикального заместителя, присоединенного к группе R6, представляет собой трифторметоксифенил, дифторметоксифенил, 4-фторфенил и т.п.
«Арилалкилокси» означает арилалкил-O-группу, в которой арилалкильные группы определены выше. Примерами арилалкилоксигрупп являются бензилокси и 1- или 2-нафталинметокси.
«Арилалкилоксикарбонил» означает арилалкил-O-CO-группу, в которой арилалкильные группы определены выше. Примером арилалкилоксикарбонильной группы является бензилоксикарбонил.
«Арилалкилтио» означает арилалкил-S-группу, в которой арилалкильная группа определена выше. Примером арилалкилтиогруппы является бензилтио.
«Арилокси» означает арил-O-группу, в которой арильная группа определена выше. Примерами арилоксигрупп являются фенокси и нафтокси, каждая из которых может иметь заместители.
«Арилоксикарбонил» означает арил-O-C(=O)-группу, в которой арильная группа определена выше. Примерами арилоксикарбонильных групп являются феноксикарбонил и нафтоксикарбонил.
«Арилсульфинил» означает арил-SO-группу, в которой арильная группа определена выше.
«Арилсульфонил» означает арил-SO2-группу, в которой арильная группа определена выше.
«Арилтио» означает арил-S-группу, в которой арильная группа определена выше. Примерами арилтиогрупп являются фенилтио и нафтилтио.
«Циклоалкил» означает насыщенную или частично ненасыщенную моноциклическую конденсированную бициклическую или связанную мостиковой связью полициклическую систему с указанным числом атомов углерода в кольце и любое ее карбоциклическое кето-, тиокето- или иминокетопроизводное (например, (C3-12)циклоалкил означает циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, 2,5-циклогексадиенил, бицикло[2.2.2]октил, адамантан-1-ил, декагидронафтил, оксоциклогексил, диоксоциклогексил, тиоциклогексил, 2-оксобицикло[2.2.1]гепт-1-ил и т.п.). Специалистам в данной области известно, что если циклоалкил представляет собой ненасыщенную систему колец, то такая система не может быть присоединена непосредственно через кратную углерод-углеродную связь к атому кислорода, азота или серы.
«Циклоалкилен» означает двухвалентную насыщенную или частично ненасыщенную моноциклическую или связанную мостиковой связью полициклическую систему, содержащую указанное число атомов углерода в кольце и любое ее карбоциклическое кето-, тиокето- или иминокетопроизводное.
«Гетероароил» означает гетероарил-C(=O)-группу, в которой гетероарильная группа определена выше. Примером гетероарильной группы является пиридилкарбонил.
«Гетероариламино» означает гетероароил-NH-группу, в которой гетероарильная группа определена выше.
«Гетероарил» как группа или часть группы означает: (i) ароматическую необязательно замещенную моноциклическую или полициклическую органическую функциональную группу, содержащую от приблизительно 5 до приблизительно 13 кольцевых членов, в которых один или несколько атомов не являются углеродом, например, являются азотом, кислородом или серой (примерами таких групп являются бензимидазолильная, бензоксазолильная, бензотиазолильная, фурильная, имидазолильная, индолильная, индолизинильная, изоксазолильная, изохинолинильная, изотиазолильная, оксадиазолильная, оксазолильная, пиразинильная, пиридазинильная, пиразолильная, пиридильная, пиримидинильная, пирролильная, хиназолинильная, хинолинильная, 1,3,4-тиадиазолильная, тиазолильная, тиенильная и триазолильная, необязательно замещенные одной или несколькими арильными группами, определенными выше, если не оговорено особо); (ii) необязательно замещенную частично насыщенную полициклическую гетерокарбоциклическую группу, в которой гетероарильная и циклоалкильная или циклоалкенильная группы сконденсированы и образуют циклическую структуру (примерами таких групп являются пиринданильные группы, необязательно замещенные одним или несколькими «заместителями в виде арильной группы», определенными выше, если не оговорено особо). Возможными заместителями являются один или несколько «заместителей в виде арильной группы», определенных выше, если это не оговорено особо. Необязательно замещенный гетеро(C5-13)арил, который в данной заявке обозначен R6, включает бензоксазол-2-ил, 5-трет-бутил[1,2,4]оксадиазол-3-ил, 3-циклопропил-1,2,4-оксадиазол-5-ил, 5-циклопропил-1,2,4-оксадиазол-5-ил, 5-циклопропил-1,3,4-оксадиазол-2-ил, 5-этил[1,3,4]оксадиазол-2-ил, 5-(4-фторфенил)-1,2,4-оксадиазол-3-ил, 5-изопропилизоксазол-3-ил, 5-(5-метилизоксазол-3-ил)оксазол-2-ил, оксазол-2-ил, 3-фенил-1,2,4-оксадиазол-5-ил, 5-фенил-1,2,4-оксадиазол-3-ил, 3-(тетрагидропиран-4-ил)-1,2,4-оксадиазол-5-ил, 5-тиофен-2-илоксазол-2-ил, 5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил и т.п.
«Гетероарилалкилокси» означает гетероарилалкил-O-группу, в которой гетероарилалкильная группа определена выше. Примером гетероарилоксигруппы является необязательно замещенная пиридилметокси.
«Гетероарилокси» означает гетероарил-O-группу, в которой гетероарильная группа определена выше. Примером гетероарилоксигруппы является необязательно замещенная пиридилокси.
«Гетероциклоалкил» означает циклоалкил, определенный в настоящей заявке, при условии, что один или несколько указанных атомов углерода в кольце заменены гетероатомом группы, выбранной из -N=, -NR-, -O- или -S-, где R представляет собой водород, (C1-6)алкил, защитную группу или свободную валентность, которая служит местом присоединения к атому азота в кольце, и любое его карбоциклическое кето-, тиокето- или иминокетопроизводное (например, термин «гетеро(C5-12)циклоалкил» включает имидазолидинил, морфолинил, пиперазинил, пиперидил, пирролидинил, пирролинил, хинуклидинил и т.п.). Подходящими защитными группами являются трет-бутоксикарбонил, бензилоксикарбонил, бензил, 4-метоксибензил, 2-нитробензил и т.п. В объем настоящего изобретения входят как незащищенные, так и защищенные производные.
«Гетероциклоалкилен» означает циклоалкилен, определенный в данном описании, при условии, что один или несколько указанных атомов углерода в кольце заменены гетероатомом группы, выбранной из -N=, -NR-, -O-, -S- и -S(O)2-, где R представляет собой водород, (C1-6)алкил или защитную группу.
Используемый в настоящем описании термин «изомеры» означает соединения согласно изобретению, имеющие одинаковые молекулярные формулы, но отличающиеся по своей природе или по последовательности связей между атомами, или по расположению атомов в пространстве. Изомеры, имеющие различное расположение атомов в пространстве, называются «стереоизомерами». Стереоизомеры, не являющиеся зеркальными отображениями друг друга, называются «диастереомерами», а стереоизомеры, не являющиеся совмещаемыми зеркальными отображениями друг друга, называются «энантиомерами» или, иногда, «оптическими изомерами». Атом углерода с четырьмя неидентичными заместителями называется «хиральным центром». Соединение, которое имеет один хиральный центр, имеет две энантиомерных формы противоположной хиральности. «Рацемическая смесь» содержит оба энантиомера в соотношении 1:1. Однако, в данном описании, термин «рацемическая смесь» используется в том случае, если присутствуют оба энантиомера независимо от их соотношения. Соединение, которое содержит более одного хирального центра, имеет 2n-1 энантиомерных пар, где n - количество хиральных центров. Соединения с более чем одним хиральным центром могут существовать как в виде отдельного диастереомера, так и в виде смеси диастереомеров, называемой «диастереомерной смесью». Если имеется один хиральный центр, то стереоизомер может быть охарактеризован по абсолютной конфигурации этого хирального центра. Под абсолютной конфигурацией понимают пространственное расположение заместителей, присоединенных к данному хиральному центру. Энантиомеры характеризуются абсолютной конфигурацией их хиральных центров и описываются правилами R- и S-номенклатуры Кана, Ингольда и Прелога. Правила стереохимической номенклатуры, методы определения стереохимической структуры и методы разделения изомеров хорошо известны специалистам в данной области (например, смотрите "Advanced Organic Chemistry", 4th edition, March, Jerry, John Wiley & Sons, New York, 1992). Следует отметить, что названия и примеры, используемые в настоящей заявке для описания соединений настоящего изобретения, должны охватывать все возможные стереоизомеры. Так, например, название {1-[1-(3-циклопропил[1,2,4]оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты должно включать {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты и {(R)-1-[(R)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты, а также любую их смесь, в том числе и рацемическую или т.п.
«N-оксидные производные» означают производные соединений согласно изобретению, в которых атомы азота находятся в окисленном состоянии (т.е. N-O), и которые обладают желаемой фармакологической активностью.
Термин «фармацевтически приемлемый» относится к соединению, которое может быть использовано для получения фармацевтической композиции, являющейся, по существу, безопасной, нетоксичной и не обладающей нежелательными биологическим или другими свойствами, и которое может быть использовано в ветеринарии, а также в медицине.
«Фармацевтически приемлемыми солями» называются соли соединений согласно изобретению, которые являются фармацевтически приемлемыми, как определено выше, и которые обладают желаемой фармакологической активностью. Такими солями являются кислотно-аддитивные соли, образованные неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, гептановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, o-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метилсульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, п-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло[2.2.2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.
Фармацевтически приемлемыми солями также являются основно-аддитивные соли, которые могут образовываться в том случае, если имеющиеся кислотные протоны могут вступать в реакцию с неорганическими или органическими основаниями. Приемлемыми неорганическими основаниями являются гидроксид натрия, карбонат натрия, гидроксид калия, гидроксид алюминия и гидроксид кальция. Приемлемыми органическими основаниями являются этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п.
«Пролекарство» означает соединение, которое в процессе метаболизма in vivo может превращаться в соединение согласно изобретению. Например, сложный эфир соединения согласно изобретению, содержащий гидроксигруппу, может посредством гидролиза превращаться in vivo в исходную молекулу. Альтернативно, сложный эфир соединения согласно изобретению, содержащий карбоксигруппу, может посредством гидролиза превращаться in vivo в исходную молекулу. Подходящими сложными эфирами соединений согласно изобретению, содержащих гидроксигруппу, являются, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты, пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-b-гидроксинафтоаты, гентизаты, изетионаты, ди-п-толуоилтартраты, метилсульфонаты, этансульфонаты, бензолсульфонаты, п-толуолсульфонаты, циклогексилсульфаматы и хинаты. Подходящими сложными эфирами соединений согласно изобретению, содержащими карбоксильную группу, являются, например, описанные в работе F.J. Leinweber, Drug Metab. Res., 1987, 18, стр.379. Особенно подходящий класс сложных эфиров соединений согласно изобретению, содержащих гидроксильную группу, может быть образован из кислотных групп, выбранных из описанных в работе Bundgaard et al., J. Med. Chem., 1989, 32, стр.2503-2507, и может включать в себя замещенные (аминометил)бензоаты, например диалкиламинометилбензоаты, в которых две алкильные группы могут быть или соединены вместе, или разделены атомом кислорода или необязательно замещенным атомом азота, например алкилированным атомом азота, а именно (морфолинометил)бензоаты, например 3- или 4-(морфолинометил)бензоаты и (4-алкилпиперазин-1-ил)бензоаты, например 3- или 4-(4-алкилпиперазин-1-ил)бензоаты.
«Защищенными производными» называются производные соединений согласно изобретению, в которых реакционный центр или центры блокированы защитными группами. Защищенные производные соединений согласно изобретению могут быть использованы для получения соединений согласно изобретению, или они сами могут быть активными ингибиторами катепсина S. Полный список подходящих защитных групп можно найти в работе T.W. Greene, Protecting Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, Inc., 1999.
«Терапевтически эффективным количеством» называется количество, которое при введении его животному в целях лечения заболевания является достаточным для лечения этого заболевания.
«Лечение» или «лечебный процесс» означает введение соединения согласно изобретению и включает:
(1) профилактику заболевания у животного, которое может иметь предрасположенность к этому заболеванию, но у которого пока не имеется или не проявляется патология или симптоматология данного заболевания;
(2) подавление заболевания у животного, у которого имеется или проявляется патология или симптоматология данного заболевания (то есть предотвращение дальнейшего развития патологии и/или симптоматологии), или
(3) достижение более благоприятного течения заболевания у животного, у которого имеется или проявляется патология или симптоматология данного заболевания (т.е. ослабление патологии и/или симптомов).
Номенклатура
Соединения согласно изобретению или промежуточные соединения и исходные вещества, используемые для их получения, именуются в соответствии с правилами номенклатуры ИЮПАК, где характеристические группы, перечисленные ниже, имеют следующий приоритет по убыванию важности: кислоты, сложные эфиры, амиды и т.д. Альтернативно, названия этим соединениям присваивают с помощью программы AutoNom 4.0 (Beilstein Information Systems, Inc.). Например, соединение формулы (I), в котором R1 представляет собой морфолин-4-карбонил, X1 представляет собой метилен, R5 представляет собой метил, R2 представляет собой H, и A представляет собой 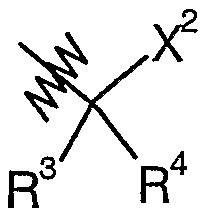 , где R3 представляет собой этил, R4 представляет собой H, и X2 представляет собой C(O)R6, где R6 представляет собой 3-циклопропил-1,2,4-оксадиазол-5-ил; то есть соединение следующей структуры:
, где R3 представляет собой этил, R4 представляет собой H, и X2 представляет собой C(O)R6, где R6 представляет собой 3-циклопропил-1,2,4-оксадиазол-5-ил; то есть соединение следующей структуры:
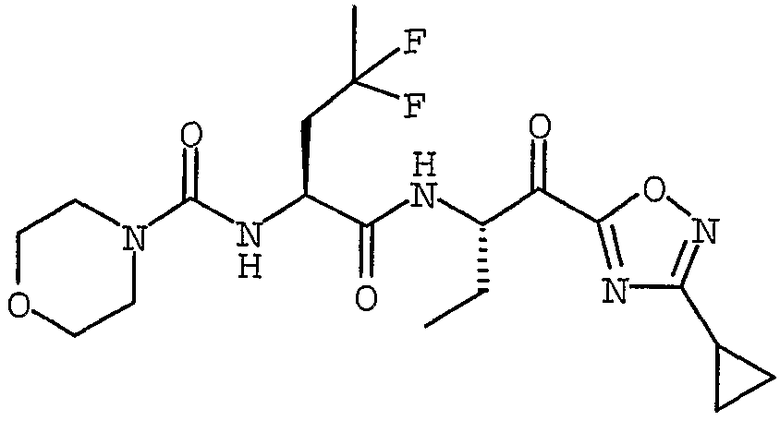
называется {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амидом морфолин-4-карбоновой кислоты.
Однако при этом следует отметить, что если для какого-либо предпочтительного соединения, представленного как структурной формулой, так и номенклатурным названием, имеется несоответствие между структурной формулой и номенклатурным названием, то предпочтение следует отдать структурной формуле.
Различные признаки настоящего изобретения, представляющие новизну, подробно описаны в прилагаемой формуле изобретения и являются частью описания настоящего изобретения. Для лучшего понимания изобретения, преимуществ его использования и предпочтительных целей осуществления ниже приводится описание, в котором проиллюстрированы и описаны предпочтительные варианты осуществления настоящего изобретения.
Подробное описание предпочтительных вариантов осуществления изобретения
В приведенной выше формуле (I) используются следующие предпочтительные группы:
X1 может представлять собой, в частности, метилен.
A может представлять собой, в частности, 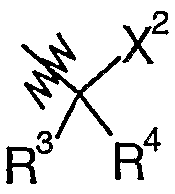 , где: R3 представляет собой H, (C6-12)арил(C2-6)алкил или (C1-6)алкил, который необязательно замещен -X6OR9 [в котором X6 представляет собой связь, а R9 представляет собой (C1-6)алкил]; R4 представляет собой H или (C1-6)алкил; и X2 представляет собой CHO, CN или C(O)R6 [в котором R6 представляет собой гетеро(C5-13)арил, необязательно замещенный (C1-9)алкилом, (C3-12)циклоалкилом, (C6-12)арилом или гетеро(C5-13)арилом].
, где: R3 представляет собой H, (C6-12)арил(C2-6)алкил или (C1-6)алкил, который необязательно замещен -X6OR9 [в котором X6 представляет собой связь, а R9 представляет собой (C1-6)алкил]; R4 представляет собой H или (C1-6)алкил; и X2 представляет собой CHO, CN или C(O)R6 [в котором R6 представляет собой гетеро(C5-13)арил, необязательно замещенный (C1-9)алкилом, (C3-12)циклоалкилом, (C6-12)арилом или гетеро(C5-13)арилом].
A также может также представлять собой 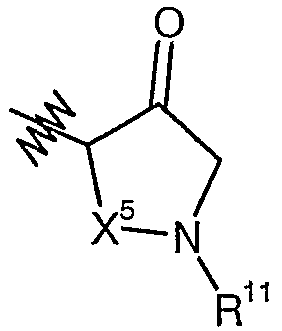 , где X5 представляет собой пропилен, а R11 представляет собой -C(O)OR13 или -S(O)2R13, где R13 представляет собой алкил или (C6-12)арил.
, где X5 представляет собой пропилен, а R11 представляет собой -C(O)OR13 или -S(O)2R13, где R13 представляет собой алкил или (C6-12)арил.
R1 может, в частности, представлять собой R13C(O)-, где R13 представляет собой гетеро(C5-12)циклоалкил.
R1 также может, в частности, представлять собой R13OC(O)-, где R13 представляет собой (C6-12)арил(C1-6)алкил.
R1 также может, в частности, представлять собой (C1-9)алкил.
R1 также может, в частности, представлять собой гетеро(C5-12)циклоалкил.
R2 может, в частности, представлять собой H.
R5 может, в частности, представлять собой (C1-9)алкил.
R5 также может, в частности, представлять собой (C6-12)арил(C1-6)алкил.
Предпочтительные виды соединений
Одной из предпочтительных групп соединений согласно изобретению являются соединения формулы (Ia):
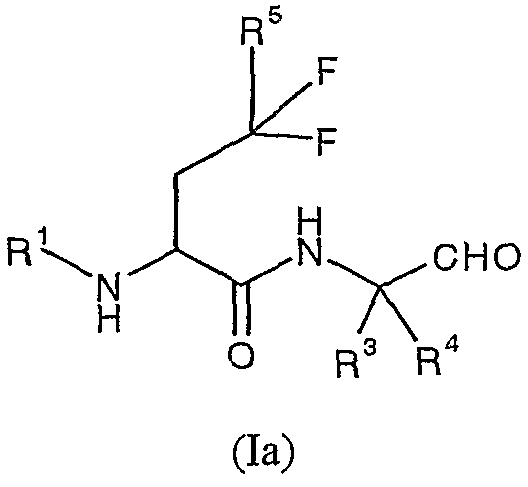
где R1, R3, R4 и R5 описаны выше, и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также фармацевтически приемлемые соли и сольваты (например, гидраты) таких соединений формулы (Ia) и их N-оксиды и пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
Примерами могут служить соединения формулы (Ia), в которых R1 представляет собой R13C(O)-, и R13 представляет собой гетеро(C5-12)циклоалкил. В частности, примерами могут служить соединения формулы (Ia), в которых R1 представляет собой  .
.
Примерами могут служить соединения формулы (Ia), в которых R3 представляет собой H, (C6-12)арил(C1-6)алкил или (C1-6)алкил. В частности, примерами могут служить соединения формулы (Ia), в которых R3 представляет собой H, 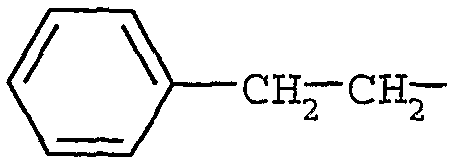 или СН3-СН2-СН2-.
или СН3-СН2-СН2-.
Примерами могут служить соединения формулы (Ia), в которых R4 представляет собой H или метил.
Примерами могут служить соединения формулы (Ia), в которых R5 представляет собой (C6-12)арил(C1-6)алкил.
В частности, примерами могут служить соединения формулы (Ia), в которых R5 представляет собой 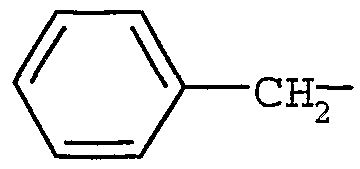 .
.
Одной предпочтительной группой соединений согласно изобретению являются соединения формулы (Ia), в которых: R1 представляет собой R13C(O)- (в частности, 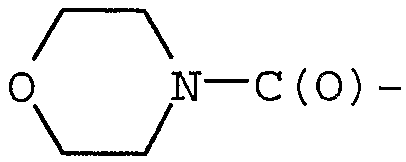 ); R3 представляет собой H, (C6-12)арил(C1-6)алкил (в частности,
); R3 представляет собой H, (C6-12)арил(C1-6)алкил (в частности, 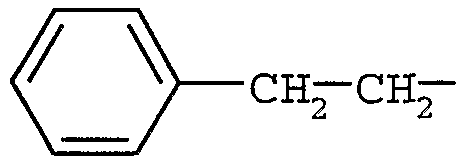 ) или (C1-6)алкил (в частности, СН3-СН2-СН2-);
) или (C1-6)алкил (в частности, СН3-СН2-СН2-);
R4 представляет собой H или метил, и R5 представляет собой (C6-12)арил(C1-6)алкил (в частности, 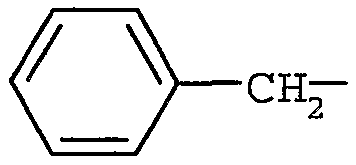 ).
).
Другой предпочтительной группой соединений согласно изобретению являются соединения формулы (Ib):

где R1, R3, R4 и R5 определены выше, и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также фармацевтически приемлемые соли и сольваты (например, гидраты) таких соединений формулы (Ib) и их N-оксиды и пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
Примерами могут служить соединения формулы (Ib), в которых R1 представляет собой R13C(O)-, а R13 представляет собой гетеро(C5-12)циклоалкил. В частности, примерами могут служить соединения формулы (Ib), в которых R1 представляет собой 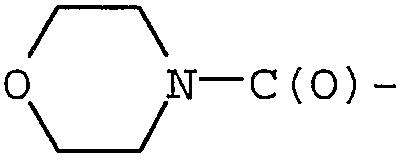 .
.
Примерами могут служить соединения формулы (Ib), в которых R3 представляет собой H, (C6-12)арил(C1-6)алкил или (C1-6)алкил. В частности, примерами могут служить соединения формулы (Ib), в которых R3 представляет собой H,  или СН3-СН2-СН2-.
или СН3-СН2-СН2-.
Примерами могут служить соединения формулы (Ib), в которых R4 представляет собой H или метил.
Примерами могут служить соединения формулы (Ib), в которых R5 представляет собой (C6-12)арил(C1-6)алкил. В частности, примерами могут служить соединения формулы (Ib), в которых R5 представляет собой  .
.
Предпочтительной группой соединений согласно изобретению являются соединения формулы (Ib), в которых: R1 представляет собой R13C(O)- (в частности,  ); R3 представляет собой H, (C6-12)арил(C1-6)алкил (в частности,
); R3 представляет собой H, (C6-12)арил(C1-6)алкил (в частности, 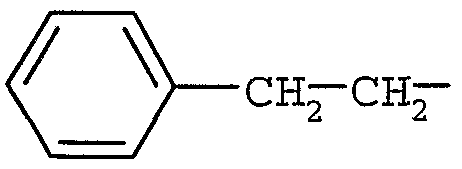 ) или (C1-6)алкил (в частности, СН3-СН2-);
) или (C1-6)алкил (в частности, СН3-СН2-);
R4 представляет собой H или метил, и R5 представляет собой (C6-12)арил(C1-6)алкил (в частности, 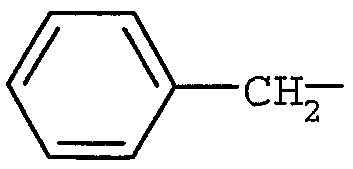 ).
).
Еще одной предпочтительной группой соединений согласно изобретению являются соединения формулы (Ic):
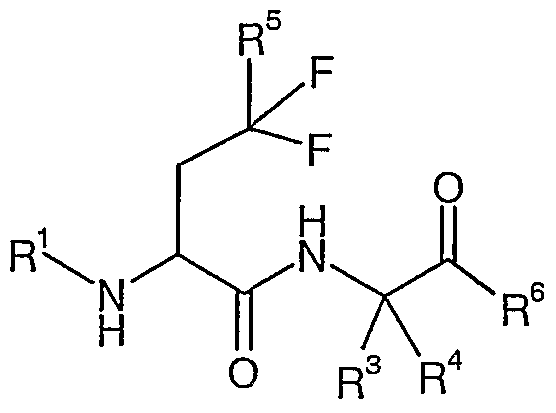

где R1, R3, R4, R5 и R6 определены выше, и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также фармацевтически приемлемые соли и сольваты (например, гидраты) соединений формулы (Ic) и их N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
Примерами могут служить соединения формулы (Ic), в которых R1 представляет собой R13C(O)-, а R13 представляет собой гетеро(C5-12)циклоалкил. В частности, примерами могут служить соединения формулы (Ic), в которых R1 представляет собой 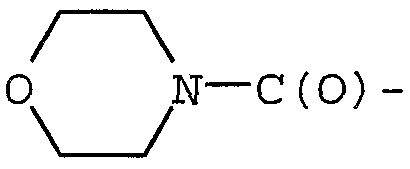 .
.
Примерами могут служить соединения формулы (Ic), в которых R3 представляет собой (C1-6)алкил, который необязательно замещен -X6OR9 [где X6 представляет собой связь, а R9 представляет собой (C1-6)алкил]. В частности, примерами могут служить соединения формулы (Ic), в которых R3 представляет собой СН3-СН2-, СН3-СН2-СН2- или СН3-О-СН2-.
Примерами могут служить соединения формулы (Ic), в которых R4 представляет собой H или метил. Примерами могут служить соединения формулы (Ic), в которых R4 представляет собой H.
Примерами могут служить соединения формулы (Ic), в которых R5 представляет собой (C1-9)алкил или (C6-12)арил(C1-6)алкил. В частности, примерами могут служить соединения формулы (Ic), в которых R5 представляет собой CH3CH2CH2, CH3CH2, CH3 или  . Примерами могут служить соединения формулы (Ic), в которых R5 представляет собой
. Примерами могут служить соединения формулы (Ic), в которых R5 представляет собой  .
.
Примерами могут служить соединения формулы (Ic), в которых R6 представляет собой гетеро(C5-13)арил, необязательно замещенный (C1-9)алкилом, (C3-12)циклоалкилом, (C6-12)арилом или гетеро(C5-13)арилом. Примерами необязательно замещенных гетеро(C5-13)арильных групп являются необязательно замещенные бензоксазолил, оксадиазолил, изоксазолил или оксазолил. В качестве примеров могут служить соединения формулы (Ic), в которых R6 представляет собой бензоксазол-2-ил, 5-трет-бутил[1,2,4]оксадиазол-3-ил, 3-циклопропил-1,2,4-оксадиазол-5-ил, 5-циклопропил-1,2,4-оксадиазол-2-ил, 5-циклопропил-1,3,4-оксадиазол-2-ил, 5-этил-1,3,4-оксадиазол-2-ил, 5-(4-фторфенил)-1,2,4-оксадиазол-3-ил, 5-изопропилизоксазол-3-ил, 5-(5-метилизоксазол-3-ил)оксазол-2-ил, 5-(5-метилтиен-2-ил)оксазол-2-ил, оксазол-2-ил, 3-фенил-1,2,4-оксадиазол-5-ил, 5-фенил-1,2,4-оксадиазол-3-ил, 5-тиофен-2-илоксазол-2-ил, 5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил и т.п. В частности, примерами могут служить соединения формулы (Ic), в которых R6 представляет собой бензоксазол-2-ил, 3-циклопропил-1,2,4-оксадиазол-5-ил, оксазол-2-ил.
Одной из предпочтительных групп соединений согласно изобретению являются соединения формулы (Ic), в которых: R1 представляет собой R13C(O)- (в частности,  );
);
R3 представляет собой (C1-6)алкил, который необязательно замещен -X6OR9 (в частности, СН3-СН2-, СН3-СН2-СН2- или СН3-О-СН2-); R4 представляет собой H, и R5 представляет собой (C1-9)алкил или (C6-12)арил(C1-6)алкил (в частности,  ); R6 представляет собой гетеро(C5-13)арил, необязательно замещенный (C1-9)алкилом, (C3-12)циклоалкилом, гетеро(C5-12)циклоалкилом, (C6-12)арилом или гетеро(C5-13)арилом (в частности, бензоксазол-2-илом, 3-циклопропил-1,2,4-оксадиазол-5-илом, оксазол-2-илом и 5-(5-метилизоксазол-3-ил)оксазол-2-илом).
); R6 представляет собой гетеро(C5-13)арил, необязательно замещенный (C1-9)алкилом, (C3-12)циклоалкилом, гетеро(C5-12)циклоалкилом, (C6-12)арилом или гетеро(C5-13)арилом (в частности, бензоксазол-2-илом, 3-циклопропил-1,2,4-оксадиазол-5-илом, оксазол-2-илом и 5-(5-метилизоксазол-3-ил)оксазол-2-илом).
Другой предпочтительной группой соединений согласно изобретению являются соединения формулы (Id):
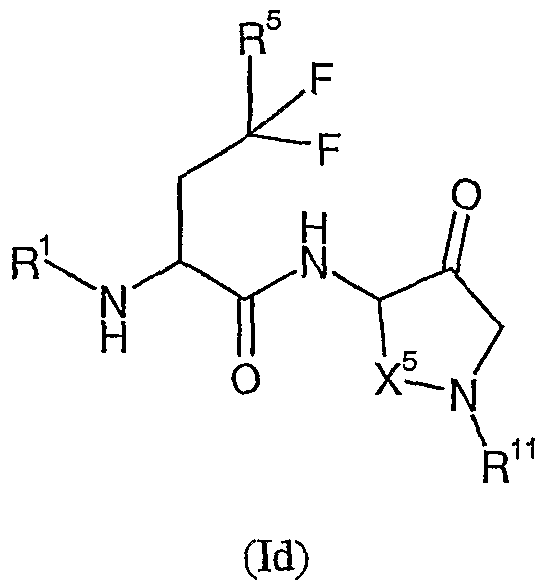
где R1, R5, R11 и X5 определены выше, и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также фармацевтически приемлемые соли и сольваты (например, гидраты) соединений формулы (Id) и их N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
Примерами могут служить соединения формулы (Id), в которых R1 представляет собой R13C(O)-, и R13 представляет собой гетеро(C5-12)циклоалкил. В частности, примерами могут служить соединения формулы (Id), в которых R1 представляет собой 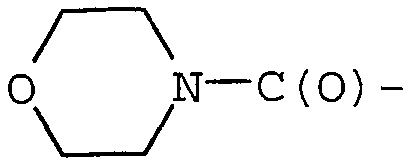 .
.
Примерами могут служить соединения формулы (Id), в которых R5 представляет собой (C6-12)арил(C1-6)алкил. В частности, примерами могут служить соединения формулы (Id), в которых R5 представляет собой 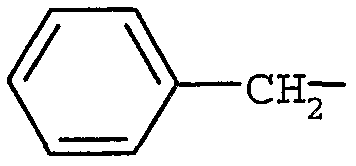 .
.
Примерами могут служить соединения формулы (Id), в которых R11 представляет собой -C(O)OR13 или -S(O)2R13, где R13 представляет собой алкил или (C6-12)арил. В частности, примерами могут служить соединения формулы (Id), в которых R11 представляет собой -C(O)OC(CH3)3 или 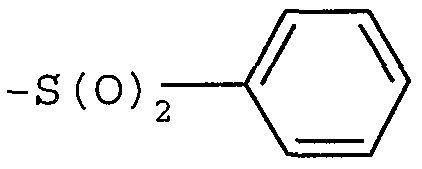 .
.
Примерами могут служить соединения формулы (Id), в которых X1 представляет собой пропилен.
Одной из предпочтительных групп соединений согласно изобретению являются соединения формулы (Id), в которых: R1 представляет собой R13C(O)- (в частности,  ); R5 представляет собой (C6-12)арил(C1-6)алкил (в частности,
); R5 представляет собой (C6-12)арил(C1-6)алкил (в частности,  );
);
R11 представляет собой -C(O)OR13 [в частности, -C(O)OC(CH3)3] или -S(O)2R13 (в частности,  ), и X1 представляет собой пропилен.
), и X1 представляет собой пропилен.
Предпочтительными соединениями согласно изобретению являются
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{1-[1-(3-циклопропил[1,2,4]оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-5-метилгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(3-фенил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(5-фенил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{1-[1-(5-циклопропил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{3,3-дифтор-1-[1-(5-изопропилизоксазол-3-карбонил)пропилкарбамоил]гексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{1-[5-(5-метилизоксазол-3-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(оксазол-2-карбонил)пропилкарбамоил]-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-тиофен-2-илоксазол-2-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)бутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
[1-(2-бензоксазол-2-ил-1-метоксиметил-2-оксоэтилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)-1-метилбутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
[(S)-1-((S)-1-циано-3-фенилпропилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
[(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
[(S)-3,3-дифтор-1-((S)-1-формил-1-метилбутилкарбамоил)-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-этил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-фенил[1,2,4]оксадиазол-3-ил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
сложный бензиловый эфир [(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]карбаминовой кислоты,
цианометиламид (S)-4,4-дифтор-5-фенил-2-(тетрагидропиран-4-иламино)пентановой кислоты,
цианометиламид (S)-4,4-дифтор-2-изобутиламино-5-фенилпентановой кислоты,
[(S)-1-((S)-1-бензолсульфонил-3-оксоазепан-4-илкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
сложный трет-бутиловый эфир (S)-4-{(S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентаноиламино}-3-оксоазепан-1-карбоновой кислоты,
((S)-1-{(S)-1-[(5-этил-1,3,4-оксадиазол-2-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(R)-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
[(S)-1-(цианометилкарбамоил)-3,3-дифторгексил]амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(R)-1-[5-(5-метилтиофен-2-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(5-метилтиофен-2-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
и их соответствующие N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров, а также фармацевтически приемлемые соли и сольваты (например, гидраты) соединений формулы (Ia), их N-оксиды, пролекарства, защищенные производные, отдельные изомеры и смеси этих изомеров.
Фармакология и применение
Соединения согласно изобретению являются ингибиторами катепсина S и, как таковые, могут быть использованы для лечения заболеваний, при которых активность катепсина S участвует в патогенезе и/или в индуцировании симптомов заболевания. Например, соединения согласно изобретению могут быть использованы для лечения аутоиммунных заболеваний, включая, но не ограничиваясь ими: ювенильный диабет, рассеянный склероз, вульгарную пузырчатку, болезнь Грейвса, злокачественную миастению, системную красную волчанку, синдром раздраженной толстой кишки, ревматоидный артрит и аутоиммунный тиреоидит; аллергические нарушения, включая, но не ограничиваясь ими, астму и аллогенные иммунные реакции, включая, но не ограничиваясь ими, реакции при трансплантации органов или тканей.
Катепсин S также ассоциирован с расстройствами, включающими избыточный эластолиз, например, хроническую обструктивную болезнь легких (например, эмфизему), бронхиолит, избыточный эластолиз дыхательных путей при астме и бронхите, пневмонит и сердечно-сосудистые заболевания, такие как разрушение бляшек и атерома. Катепсин S участвует в образовании фибрилл, и, следовательно, ингибиторы катепсина S могут быть использованы для лечения системного амилоидоза.
Активность ингибирования цистеинпротеаз соединениями согласно изобретению может быть определена методами, известными специалистам в данной области. Известны соответствующие анализы in vitro, позволяющие измерять активность протеазы и ее ингибирование тестируемыми соединениями. Как правило, при таком анализе определяют степень индуцированного протеазой гидролиза пептидного субстрата. Подробная информация об анализах для измерения активности ингибирования протеазы приводится ниже в примерах 31, 32, 33, 34.
Соединения согласно изобретению также являются ингибиторами катепсина K и B и, как таковые, могут быть использованы для лечения заболеваний, при которых активность катепсина K и B участвует в патогенезе и/или симптоматологии заболевания. Например, соединения согласно изобретению могут быть использованы для лечения остеоартрита, остеопороза или раковых заболеваний, таких как рак легких, лейкоз (B- и T-клеточный острый лейкоз), рак яичника, саркомы, саркома Капоши, рак кишечника, рак лимфоузлов, опухоль головного мозга, рак молочной железы, рак поджелудочной железы, рак предстательной железы или рак кожи.
Введение и фармацевтические композиции
В общем, соединения согласно изобретению могут быть введены в терапевтически эффективных количествах любыми традиционными и приемлемыми методами, известными специалистам в данной области, или отдельно, или в сочетании с одним или несколькими терапевтическими средствами. Терапевтически эффективное количество может варьироваться в широких пределах в зависимости от тяжести заболевания, возраста и общего состояния здоровья пациента, эффективности используемого соединения и других факторов. Например, терапевтически эффективное количество соединения согласно изобретению может составлять в пределах от примерно 1 микрограмма на килограмм массы тела (мкг/кг) в день до примерно 60 миллиграмм на килограмм массы тела (мг/кг) в день, обычно от примерно 1 мкг/кг/день до примерно 20 мг/кг/день. Следовательно, терапевтически эффективное количество для человека весом 80 кг может составлять от примерно 80 мкг/день до примерно 4,8 г/день, обычно от примерно 80 мкг/день до примерно 1,6 г/день. В общих чертах, специалист в данной области, на основе своих знаний и информации, приведенной в настоящем описании, может самостоятельно определить терапевтически эффективное количество соединения согласно изобретению для лечения данного заболевания.
Соединения согласно изобретению могут быть введены в виде фармацевтических композиций одним из следующих способов: пероральным, системным (например, трансдермальным, интраназальным или с помощью суппозиториев) или парентеральным (например, внутримышечным, внутривенным или подкожным). Композиции могут иметь форму таблеток, драже, капсул, полутвердых веществ, порошков, препаратов пролонгированного высвобождения, растворов, суспензий, эликсиров, аэрозолей или любых других подходящих препаратов, и могут состоять, по существу, из соединения согласно изобретению в комбинации, по меньшей мере, с одним фармацевтически приемлемым наполнителем. Приемлемые наполнители являются нетоксичными, облегчают введение лекарственного средства и не оказывают негативного воздействия на терапевтическую эффективность активного ингредиента. Таким наполнителем может быть любой твердый, жидкий, полутвердый или, в случае аэрозольной композиции, газообразный наполнитель, имеющийся в распоряжении специалистов в данной области.
Твердыми фармацевтическими наполнителями являются крахмал, целлюлоза, тальк, глюкоза, лактоза, сахароза, желатин, солод, рис, мука, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, сухое сепарированное молоко и т.п. Жидкие и полутвердые наполнители могут быть выбраны из воды, этанола, глицерина, пропиленгликоля и различных масел, включая вазелиновое масло, масло животного или растительного происхождения или синтетическое масло (например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п.). Предпочтительными жидкими носителями, в частности, носителями для инъекционных растворов, являются вода, физиологический раствор, водная декстроза и гликоли.
Количество соединения согласно изобретению в данной композиции может широко варьироваться в зависимости от типа композиции, размера унифицированной дозы, типа наполнителя и других факторов, известных специалистам в области фармакологии. В общих чертах, композиция, содержащая соединение согласно изобретению и предназначенная для лечения данного заболевания, может содержать активный ингредиент в пределах от 0,01 мас.% до 10 мас.%, предпочтительно от 0,3 мас.% до 1 мас.%, и остальное будет составлять один или несколько наполнителей. Фармацевтическую композицию предпочтительно вводят в виде одной унифицированной дозы для продолжительного лечения или в виде одной унифицированной дозы, вводимой по желанию, для облегчения конкретных симптомов. Репрезентативные фармацевтические композиции, содержащие соединение согласно изобретению, описаны в примере 35.
Химия
Способы получения соединений согласно изобретению
Соединения согласно изобретению могут быть получены путем применения или адаптации способов, описанных ранее или известных из литературы, например, описанных в работе R.C. Larock in Comprehensive Organic Transformations, VCH publishers, 1989.
В описанных ниже реакциях может возникнуть необходимость в защите реакционных функциональных групп, например, гидрокси-, амино-, имино-, тио- или карбоксигрупп, во избежание их нежелательного участия в реакциях в случаях, когда желательно их присутствие в конечном продукте. Для этого могут быть использованы стандартные защитные группы в соответствии с общепринятой практикой, например, смотрите T.W. Greene and P. G. M. Wuts in "Protective Groups in Organic Chemistry" John Wiley and Sons, 1991.
Соединения согласно изобретению могут быть получены в соответствии с реакционной схемой 1:
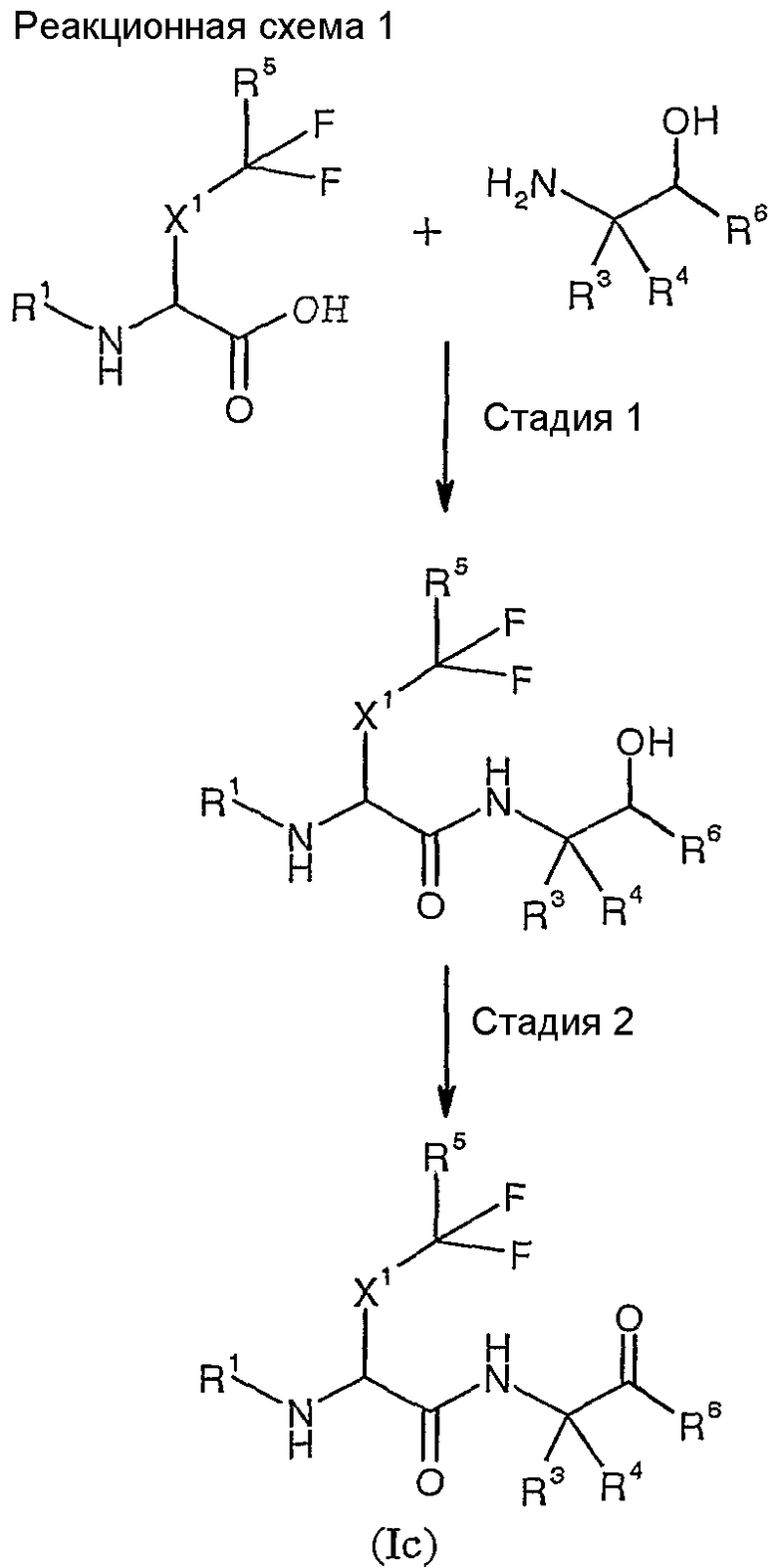
где каждый из X1, R1, R3, R4, R5 и R6 определен в кратком описании изобретения. Так, например, на стадии 1 кислота может быть сконденсирована с аминосоединением указанной формулы с образованием β-гидроксиамида. Реакция конденсации может проводиться в присутствии соответствующего связущего реагента сочетания (например, гексафторфосфата бензотриазол-1-илокситриспирролидинофосфония (PyBOP®), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI), гексафторфосфата O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (HBTU), 1,3-дициклогексилкарбодиимида (DCC) или т.п.), с добавлением, но необязательно, соответствующего катализатора (например, 1-гидроксибензотриазола (HOBt), 1-гидрокси-7-азабензотриазола (HOAt), гексафторфосфата O-(7-азабензотризол-1-ил)-1,1,3,3- тетраметилурония (HATU) или т.п.) и ненуклеофильного основания (например, триэтиламина, N-метилморфолина и т.п., или любой подходящей их комбинации) при температуре окружающей среды; при этом для полного завершения реакции требуется от 2 до 10 часов. Затем β-гидроксиамид может быть окислен на стадии 2 с получением соединения формулы (Ic). Реакцию окисления обычно проводят с использованием периодинана Десс-Мартина в инертном растворителе, таком как дихлорметан, при температуре от примерно 0°C до примерно комнатной температуры.
Кроме того, соединения согласно изобретению могут быть получены в соответствии с реакционной схемой 2:
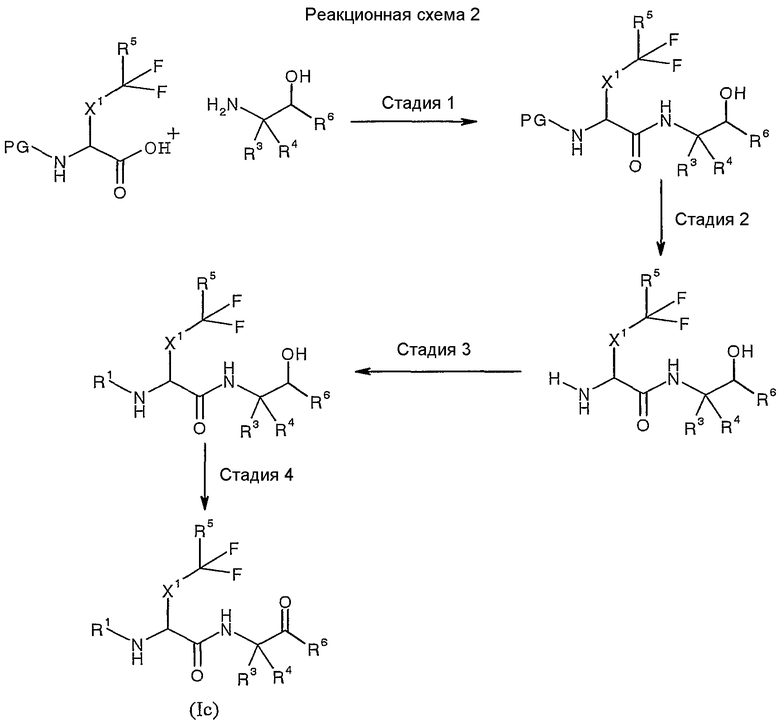
где каждый из X1, R1, R3, R4, R5 и R6 определен в кратком описании изобретения, а PG обозначает подходящую защитную группу. Так, например, на стадии 1 кислота может быть сконденсирована с аминосоединением указанной формулы с образованием β-гидроксиамида. После удаления защитной группы (стадия 2) с последующим введением группы R1 (стадия 3) и окислением (стадия 4) получают соединение формулы (Ic).
Примеры
Настоящее изобретение, кроме того, проиллюстрировано, но не ограничено, следующими примерами, в которых описано получение соединений формулы (I) (примеры) и промежуточных соединений (ссылочные примеры) согласно изобретению.
Спектры ядерного магнитного резонанса 1H (ЯМР) были зарегистрированы на приборах Varian Mercury-300, Unity-400, UnityPlus-500 или Inova-500. В спектрах ядерного магнитного резонанса (ЯМР) величины химического сдвига (δ) выражены в м.д. относительно тетраметилсилана. Сокращения имеют следующие значения: с = синглет; д = дублет; т = триплет; м = мультиплет; кв = квартет; дд = дублет дублетов; ддд = дублет двойных дублетов.
Жидкостную хроматографию высокого давления (ЖХВД) проводили на колонке Kromasil 10 микрон, 100A силикагель, 4,6 мм внутр. диам. ×250 мм со смесью гептан/ТГФ/1,2-дихлорэтан в качестве подвижной фазы. Масс-спектры регистрировали на приборе Agilent 1100 series или MICROMASS LCT-TOF MS. В тонкослойной хроматографии (ТСХ), время удерживания RF определяли на планшетах с двуокисью кремния компании Merck.
Сокращения
CBZ - бензилоксикарбонил
DAST - трифторид (диэтиламино)серы
DCM (ДХМ) - дихлорметан
DMF (ДМФА) - диметилформамид
DMSO (ДМСО) - диметилсульфоксид
DTT (ДТТ) - дитиотреитол
EDCI - гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида
EDTA (ЭДТА) - этилендиаминтетрауксусная кислота
EtOAc - этилацетат
HOBT - гидрат 1-гидроксибензотриазола
MeOH - метанол
MES - 2-морфолиноэтансульфоновая кислота
PyBOP - гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония
THF (ТГФ) - тетрагидрофуран
ССЫЛОЧНЫЙ ПРИМЕР 1
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксо-5-фенилпентановой кислоты
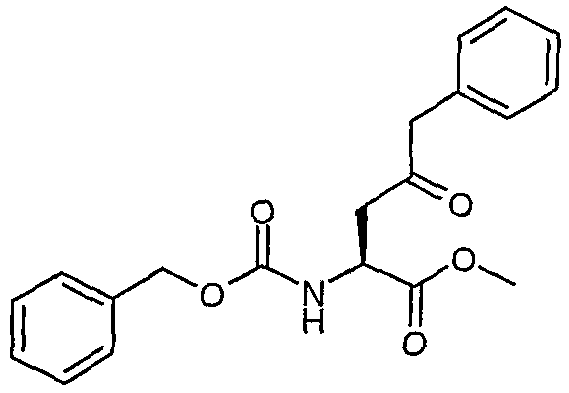
К суспензии бромида меди(I) (4,26 ммоль, 611,1 мг) в 3 мл сухого ТГФ в атмосфере N2 добавляли раствор бромида лития (8,52 ммоль, 740 мг) в 5 мл сухого ТГФ. Полученную смесь перемешивали при комнатной температуре в течение 20 минут, а затем охлаждали до -78°C. После этого добавляли раствор хлорида бензилмагния (20 мас.% в ТГФ, 4,26 ммоль, 3,25 мл), а затем раствор сложного метилового эфира (S)-2-бензилоксикарбониламино-3-хлоркарбонилпропионовой кислоты [смотрите Synth. Comm. 1993, 23(18), 2511-2526] (3,59 ммоль) в 7 мл сухого ТГФ. Полученную смесь перемешивали при -78°C в течение 30 минут, а затем реакцию гасили насыщенным NH4Cl (50 мл). Смесь два раза экстрагировали этилацетатом (30 мл). Органические слои сушили над сульфатом магния, а затем концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью EtOAc:гептан (1:1), и получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксо-5-фенилпентановой кислоты (1,07 г, 84%).
1H-ЯМР (CDCl3): δ 7,4-7,17 (м, 10H), 5,73 (д, J=8,2 Гц, 1H), 5,11 (с, 2H), 4,57 (м, 1H), 3,7 (2×с, 5H), 3,24 (дд, J=18,5, 4,4 Гц, 1H), 3,0 (дд, J=18,2, 4,1 Гц, 1H).
ЖХ/МС: 100% 378 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 2
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксогептановой кислоты
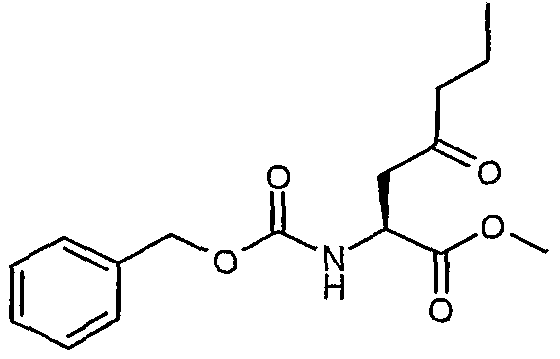
Способом, аналогичным описанному выше в ссылочном примере 1, но с использованием пропилхлорида магния вместо бензилхлорида магния получали сложный метиловый эфир (S)-2-бензоксикарбониламино-4-оксогептановой кислоты.
1H-ЯМР (CDCl3): δ 7,35 (м, 5H), 5,78 (д, J=8,5 Гц, 1H), 5,13 (с, 2H), 4,58 (м, 1H), 3,75 (с, 3H), 3,2 (дд, J=18,3, 4,2 Гц, 1H), 2,96 (дд, J=18,3, 4,1 Гц, 1H), 2,4 (м, 2H), 1,6 (м, 2H), 0,92 (т, J=7,4 Гц, 3H).
ЖХ/МС: 330 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 3
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифтор-5-фенилпентановой кислоты
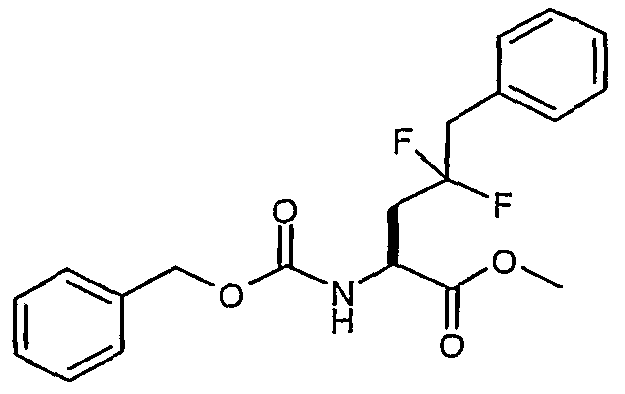
Смесь сложного метилового эфира 2-бензилоксикарбониламино-4-оксо-5-фенилпентановой кислоты (3,310 г, 9,31 ммоль) и DAST (7 мл) перемешивали при комнатной температуре в течение 3 дней. Полученную смесь разбавляли дихлорметаном (100 мл) и осторожно добавляли к раствору 0,5 н. NaOH (150 мл). Водный слой экстрагировали дихлорметаном (50 мл). Органические фазы сушили над сульфатом магния, а затем концентрировали в вакууме. Остаток очищали над 110 г силикагеля, элюируя смесью EtOAc:гептан (1:4, затем 1:3), и получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифтор-5-фенилпентановой кислоты (1,797 г, 51,1%).
1H-ЯМР (CDCl3): δ 7,3 (м, 10H), 5,43 (д, J=7,6 Гц, 1H), 5,14 (с, 2H), 4,65 (м, 1H), 3,74 (с, 3H), 3,2 (т, J=16,5 Гц, 2H), 2,4 (м, 2H).
ЖХ/МС: 97% 400 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 4
Гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифтор-5-фенилпентановой кислоты
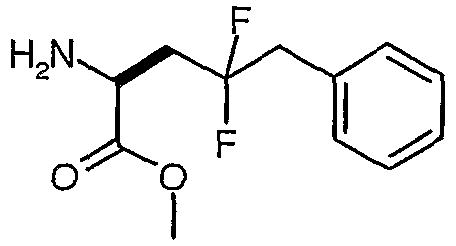
Раствор сложного метилового эфира (S)-2-бензилоксикарбониламино-4,4-дифтор-5-фенилпентановой кислоты (7,806 г, 20,68 ммоль) в 120 мл метанола и 4 M HCl в диоксане (41,4 ммоль, 10,3 мл) гидрировали над 10% Pd/C (1,0 г) при давлении 50 фунтов на кв. дюйм. Через 8 часов добавляли еще одну порцию 10% Pd/C (1,0 г). Через 24 часа катализатор удаляли фильтрацией через целит, и фильтрат концентрировали в вакууме. Полученное светло-желтое твердое вещество растворяли в минимальном количестве метанола и медленно добавляли к эфиру (150 мл). Полученную взвесь выдерживали в течение 30 минут, а затем фильтровали. Полученное белое твердое вещество сушили в вакууме и получали гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифтор-5-фенилпентановой кислоты (4,950 г, 85,5%).
1H-ЯМР (ДМСО-d6): δ 8,6 (шир., 3H), 7,3 (м, 5H), 4,26 (т, J=6 Гц, 1H), 3,73 (с, 3H), 3,3 (т, J=17,5 Гц, 2H), 2,55 (м, 2H).
ЖХ/МС: 100% 244 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 5
Сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты

К смеси гидрохлорида сложного метилового эфира (S)-2-амино-4,4-дифтор-5-фенилпентановой кислоты (2,50 г, 8,94 ммоль) и диизопропиламина (22,3 ммоль, 2,89 г) в сухом дихлорметане (40 мл) в атмосфере N2 по каплям добавляли морфолинкарбонилхлорид (13,4 ммоль, 2,0 г). Полученную смесь перемешивали при комнатной температуре в течение 15 часов, а затем разбавляли водой (50 мл). Водный слой экстрагировали дихлорметаном (30 мл). Органические слои сушили над сульфатом магния, а затем концентрировали в вакууме. После очистки над 110 г силикагеля с элюированием смесью EtOAc:гептан (1:1, затем 2:1) получали сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты (2,82 г, 88,5%).
1H-ЯМР (CDCl3): δ 7,3 (м, 5H), 5,16 (д, J=7,5 Гц, 1H), 4,75 (дд, J=13, 6 Гц, 1H), 3,73 (с, 3H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,7 Гц, 2H), 2,4 (м, 2H).
ЖХ/МС: 100% 357 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 6
(S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановая кислота
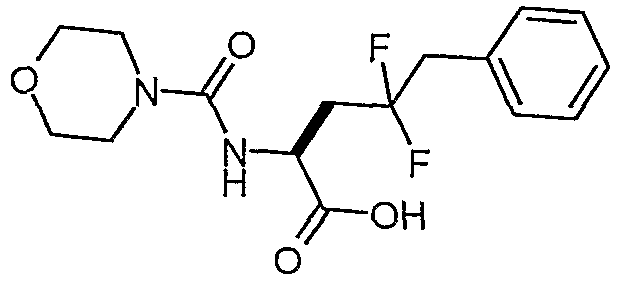
К раствору сложного метилового эфира (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты (2,81 г, 7,88 ммоль) в MeOH:H2O (2:1 об., 40 мл) добавляли моногидрат LiOH (662 мг, 15,76 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2,5 часа, а затем разбавляли водой (30 мл). Метанол удаляли в вакууме. pH корректировали до 1 добавлением 6 н. HCl, и водный слой экстрагировали дихлорметаном (2×30 мл). Органические слои сушили над сульфатом магния и концентрировали в вакууме с получением (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты (2,509 г, 93%).
1H-ЯМР (CDCl3): δ 8,2 (шир., 1H), 7,3 (м, 5H), 5,3 (м, 1H), 4,6 (м, 1H), 3,65 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,5 Гц, 2H), 2,4 (м, 2H).
ЖХ/МС: 94% 343 (MH+)
ССЫЛОЧНЫЙ ПРИМЕР 7
Сложный 1-трет-бутил-6-метиловый эфир (S)-5-бензилоксикарбониламино-2-изопропил-3-оксогександионовой кислоты
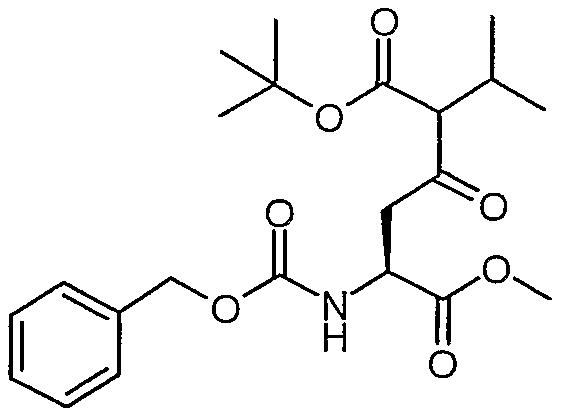
К охлажденному до -78°C раствору диизопропиламина (3,53 г, 34,88 ммоль) в сухом ТГФ (20 мл) в атмосфере N2 по каплям добавляли раствор н-бутиллития (2,5 M в гексане, 34,88 ммоль, 13,95 мл). Полученную смесь перемешивали при -78°C в течение 30 минут, а затем добавляли раствор сложного трет-бутилового эфира 3-метилмасляной кислоты (34,88 ммоль, 5,52 г) в ТГФ (40 мл). Полученную смесь перемешивали при -78°C в течение 30 минут, а затем добавляли по каплям раствор метила (S)-2-бензилоксикарбониламино-3-хлоркарбонилпропионовой кислоты (смотрите Synth. Comm 1993, 23(18), 2511-2526] (16,6 ммоль) в 30 мл сухого ТГФ. После перемешивания в течение еще 2 часов при -78°C реакцию гасили 50 мл 1 н. HCl и нагревали до комнатной температуры. pH корректировали до 3 добавлением 1 н. NaOH, и удаляли ТГФ в вакууме. Органический слой экстрагировали EtOAc (2Ч60 мл). Органические фазы сушили над сульфатом магния, а затем концентрировали в вакууме. Остаток очищали над 90 г силикагеля, элюируя смесью EtOAc:гептан (1:3, затем 1:2), и получали сложный 1-трет-бутил-6-метиловый эфир (S)-5-бензилоксикарбониламино-2-изопропил-3-оксогександионовой кислоты (2,417 г, 34,5%).
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,73 (д, J=8,4 Гц, 1H), 5,12 (с, 2H), 4,6 (м, 1H), 3,74 (с, 3H), 3,39-3,06 (м, 3H), 2,4 (м, 1H), 1,45 (2с, 9H), 0,98 (д, J=6,6 Гц, 3H), 0,88 (д, J=6,7 Гц, 3H).
ЖХ/МС: 100% 422 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 8
Сложный 6-трет-бутил-1-метиловый эфир (S)-2-бензилоксикарбониламино-4-оксогександионовой кислоты
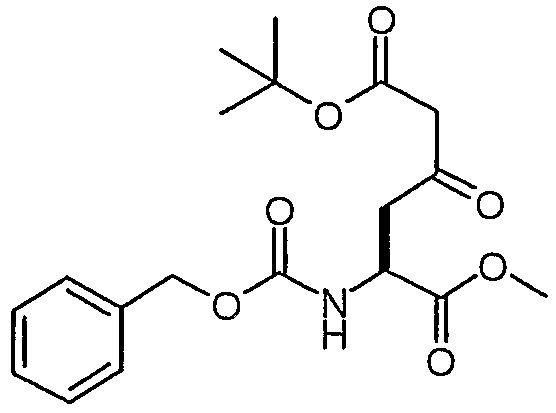
К раствору сложного 1-метилового эфира N-CBZ-L-аспарагиновой кислоты (1,00 г, 3,55 ммоль) в сухом тетрагидрофуране (17 мл) добавляли карбонилдиимидазол (634,1 мг, 3,91 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 6 часов, а затем добавляли магниевую соль моно-трет-бутилмалоната (1,339 г, 3,91 ммоль) (полученную как описано Angew. Chem. Int. Ed. Engl. 1979, 18(1), 72-74). Смесь перемешивали при комнатной температуре в течение еще 20 часов, а затем концентрировали в вакууме. Остаток разделяли между эфиром (60 мл) и 0,5 н. HCl (60 мл). Органический слой промывали насыщенным раствором NaHCO3 (50 мл), а затем сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью EtOAc:гептан (1:1), и получали сложный 6-трет-бутил-1-метиловый эфир (S)-2-бензилоксикарбониламино-4-оксогександионовой кислоты (1,17 г, 87%).
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,73 (д, J=8,3 Гц, 1H), 5,1 (с, 2H), 4,6 (м, 1H), 3,75 (с, 3H), 3,37 (с, 2H), 3,32 (дд, J=18,7, 4,3 Гц, 1H), 3,13 (дд, J=18,5, 4,1 Гц, 1H), 1,47 (с, 9H).
ЖХ/МС: 93% 402 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 9
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-6-метил-4-оксогептановой кислоты
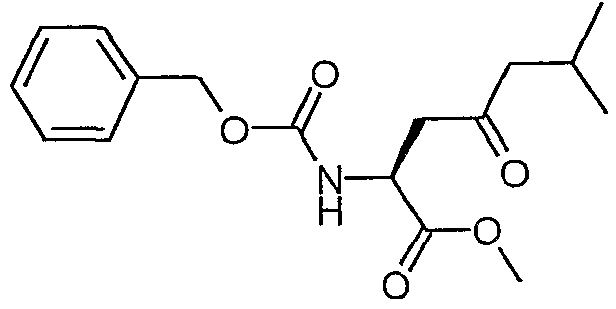
Раствор сложного 1-трет-бутил-6-метилового эфира 5-бензилоксикарбониламино-2-изопропил-3-оксогександионовой кислоты (1,06 г, 2,51 ммоль) и моногидрата п-толуолсульфоновой кислоты (35,8 мг, 0,19 ммоль) в толуоле (20 мл) кипятили с обратным холодильником в атмосфере N2 в течение 6,5 часа. Полученную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью EtOAc:гептан (1:4), и получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-6-метил-4-оксогептановой кислоты (727 мг, 90%).
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,78 (д, J=9,1 Гц, 1H), 5,13 (с, 2H), 4,6 (м, 1H), 3,74 (с, 3H), 3,2 (дд, J=18,3, 4,4 Гц, 1H), 2,95 (дд, J=18,2, 4,0 Гц, 1H), 2,3 (м, 2H), 2,1 (м, 1H), 0,92 (д, J=6,7 Гц, 6H).
ЖХ/МС 77% 322 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 10
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксопентановой кислоты
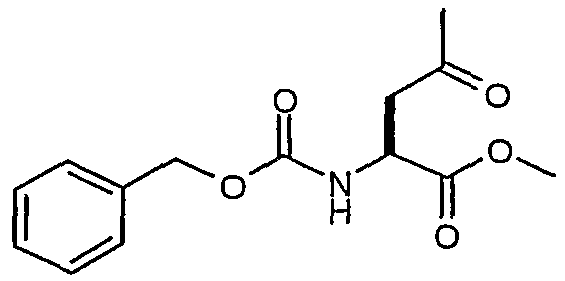
Способом, аналогичным описанному выше в ссылочном примере 9, но с использованием сложного 6-трет-бутил-1-метилового эфира 2-бензилоксикарбониламино-4-оксогександионовой кислоты, получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксопентановой кислоты.
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,76 (д, J=8,1 Гц, 1H), 5,14 (с, 2H), 4,57 (м, 1H), 3,75 (с, 3H), 3,23 (дд, J=18,4, 4,3 Гц, 1H), 3,0 (дд, J=18,4, 4,3 Гц, 1H), 2,18 (с, 3H).
ЖХ/МС >85% 280 (MH+).
Альтернативный способ
К охлажденной до 0°C суспензии иодида меди(I) в эфире (20 мл) в атмосфере N2 медленно добавляли метиллитий (раствор 1,6 M в эфире, 21,3 ммоль, 13,3 мл). Полученную смесь перемешивали при 0°C в течение 10 минут, а затем охлаждали до -78°C. После этого по каплям добавляли раствор 3,55 ммоль сложного метилового эфира (S)-2-бензилоксикарбониламино-3-хлоркарбонилпропионовой кислоты (смотрите Synth. Comm 1993, 23(18), 2511-2526) в 12 мл сухого ТГФ. Полученную смесь перемешивали при -78°C в течение 30 минут, а затем реакцию гасили добавлением метанола (2 мл). Смесь выливали в насыщенный NH4Cl (80 мл) и экстрагировали эфиром (2×40 мл). Органические слои сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью EtOAc:гептан (1:1), и получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4-оксопентановой кислоты (261 мг, 26%).
ССЫЛОЧНЫЙ ПРИМЕР 11
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифтор-6-метилгептановой кислоты
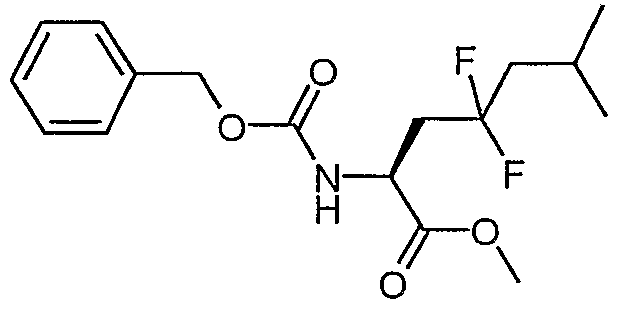
Смесь сложного метилового эфира (S)-2-бензилоксикарбониламино-6-метил-4-оксогептановой кислоты (915 мг, 2,85 ммоль) и DAST (3 мл, избыток) перемешивали при 35°C в течение 47 часов. Смесь разбавляли дихлорметаном (50 мл) и осторожно добавляли к насыщенному раствору NaHCO3 (150 мл). Водный слой экстрагировали дихлорметаном (30 мл). Органические слои сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью EtOAc:гептан (1:4), и получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифтор-6-метилгептановой кислоты (156 мг, 16%).
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,48 (д, J=7,9 Гц, 1H), 5,15 (с, 2H), 4,61 (кв, J=5,9 Гц, 1H), 3,78 (с, 3H), 2,4 (м, 2H), 1,95 (м, 1H), 1,8 (м, 2H), 0,98 (д, J=6,6 Гц, 6H).
ЖХ/МС 98% 366 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 12
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифторпентановой кислоты
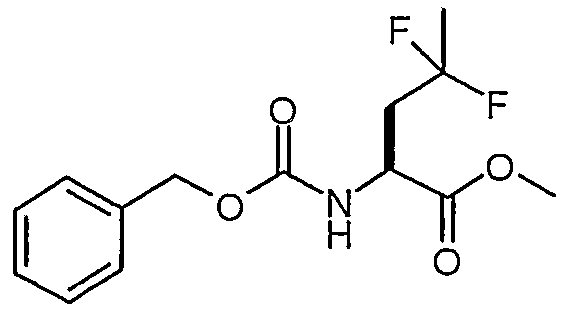
Способом, аналогичным описанному выше в ссылочном примере 11, но с использованием сложного метилового эфира (S)-2-бензоксикарбониламино-4-оксопентановой кислоты получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифторпентановой кислоты.
1H-ЯМР (CDCl3): δ 7,4 (м, 5H), 5,46 (д, J=7,1 Гц, 1H), 5,15 (с, 2H), 4,61 (кв, J=7,3 Гц, 1H), 3,78 (с, 3H), 2,45 (м, 2H), 1,67 (т, J=18,8 Гц, 3H).
ЖХ/МС: 94% 324 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 13
Сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифторгептановой кислоты
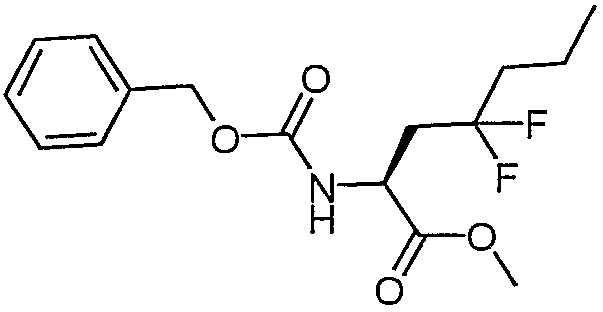
Способом, аналогичным описанному выше в ссылочном примере 11, но с использованием сложного метилового эфира (S)-2-бензилоксикарбониламино-4-оксогептановой кислоты получали сложный метиловый эфир (S)-2-бензилоксикарбониламино-4,4-дифторгептановой кислоты.
ЖХ/МС: 96% 330 (MH+), 352 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 14
Гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифтор-6-метилгептановой кислоты
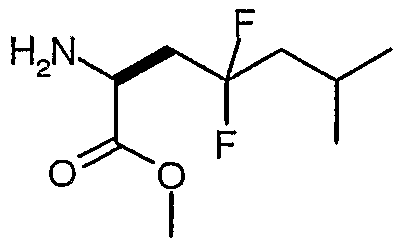
Раствор сложного метилового эфира (S)-2-бензилоксикарбониламино-4,4-дифтор-6-метилгептановой кислоты (333 мг, 0,97 ммоль) в метаноле (10 мл) и 4 M HCl в диоксане (4 ммоль, 1 мл) гидрировали над 10% Pd/C (150 мг) под давлением 55 фунтов на кв. дюйм. Через 7 часов добавили еще одну порцию 10% Pd/C (200 мг), и продолжали гидрирование. Через 5,5 часа реакция прекращалась. Катализатор фильтровали, и фильтрат концентрировали в вакууме и помещали в условия гидрирования. Через 6,5 часа катализатор удаляли фильтрованием через целит, и фильтрат концентрировали в вакууме, и получали гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифтор-6-метилгептановой кислоты в виде желтого клейкого твердого вещества (240 мг, колич.).
1H-ЯМР (CDCl3): δ 4,8 (шир., 3H), 4,35 (шир., 1H), 3,84 (с, 3H), 2,6 (м, 2H), 1,9 (м, 3H), 0,99 (д, J=6,2 Гц, 6H).
ЖХ/МС: 90% 210 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 15
Гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифторпентановой кислоты

Способом, аналогичным описанному выше в ссылочном примере 14, но с использованием сложного метилового эфира (S)-2-бензилоксикарбониламино-4,4-дифторпентановой кислоты получали гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифторпентановой кислоты.
1H-ЯМР (CDCl3): δ 4,8 (с, 3H), 4,37 (м, 1H), 3,86 (с, 3H), 2,4-2,8 (м, 2H), 1,73 (т, J=18,9 Гц, 3H).
ЖХ/МС: 100% 168 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 16
Гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифторгептановой кислоты
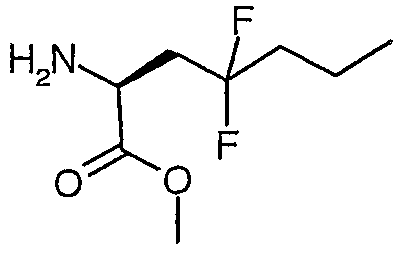
Способом, аналогичным выше описанному в ссылочном примере 14, но с использованием сложного метилового эфира (S)-2-бензилоксикарбониламино-4,4-дифторгептановой кислоты получали гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифторгептановой кислоты.
ЖХ/МС: 100% 196 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 17
Сложный метиловый эфир (S)-4,4-дифтор-6-метил-2-[(морфолин-4-карбонил)амино]гептановой кислоты

К смеси гидрохлорида сложного метилового эфира (S)-2-амино-4,4-дифтор-6-метилгептановой кислоты (238 мг, 0,97 ммоль) и диизопропиламина (2,42 ммоль, 313 мг) в сухом дихлорметане (5 мл) в атмосфере N2 добавляли по каплям морфолинкарбонилхлорид (1,45 ммоль, 218 мг). Полученную смесь перемешивали при комнатной температуре в течение 23 часов, а затем разбавляли дихлорметаном (25 мл) и промывали разбавленной HCl (30 мл) и насыщенным NaHCO3 (30 мл). Органические фазы сушили над сульфатом магния и концентрировали в вакууме. После очистки над 12 г силикагеля с элюированием смесью EtOAc:гептан (1:1, затем 2:1) получали сложный метиловый эфир (S)-4,4-дифтор-6-метил-2-[(морфолин-4-карбонил)амино]гептановой кислоты (206 мг, 66%).
1H-ЯМР (CDCl3): δ 5,2 (д, J=7,4 Гц, 1H), 4,72 (дд, J=13,6 Гц, 1H), 3,78 (с, 3H), 3,7 (м, 4H), 3,4 (м, 4H), 2,4 (м, 2H), 1,95 (м, 1H), 1,8 (м, 2H), 0,99 (д, J=6,4 Гц, 6H).
ЖХ/МС: 90% 345 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 18
Сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты
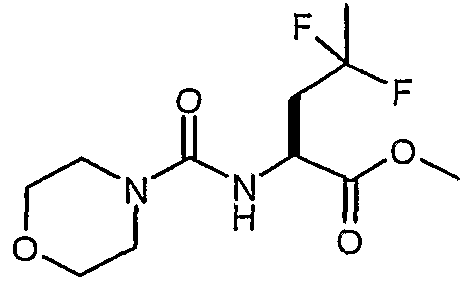
Способом, аналогичным описанному выше в ссылочном примере 17, но с использованием гидрохлорида сложного метилового эфира (S)-2-амино-4,4-дифторпентановой кислоты получали сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты.
1H-ЯМР (CDCl3): δ 5,18 (д, J=7,5 Гц, 1H), 4,71 (кв, J=7 Гц, 1H), 3,78 (с, 3H), 3,71 (м, 4H), 3,4 (м, 4H), 2,37-2,55 (м, 2H), 1,67 (т, J=18,7 Гц, 3H).
ЖХ/МС: 100% 303 (M+Na).
ССЫЛОЧНЫЙ ПРИМЕР 19
Сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты
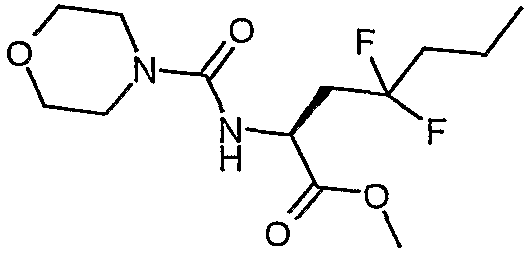
Способом, аналогичным описанному выше в ссылочном примере 17, но с использованием гидрохлорида сложного метилового эфира (S)-2-амино-4,4-дифторгептановой кислоты получали сложный метиловый эфир (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты.
ЖХ/МС: 100% 309 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 20
(S)-4,4-дифтор-6-метил-2-[(морфолин-4-карбонил)амино]гептановая кислота
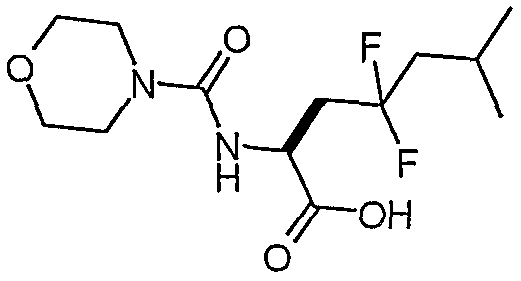
К раствору сложного метилового эфира (205 мг, 0,63 ммоль) в MeOH:H2O (2:1 об., 4 мл) добавляли моногидрат LiOH (80 мг, 1,9 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 21 часа, а затем разбавляли водой (15 мл) и экстрагировали эфиром (20 мл). pH водной фазы корректировали до 1 добавлением 1 н. HCl, и экстрагировали дихлорметаном (2×20 мл). Органические слои сушили над сульфатом магния и концентрировали в вакууме, и получали (S)-4,4-дифтор-6-метил-2-[(морфолин-4-карбонил)амино]гептановую кислоту (168 мг, 86%).
1H-ЯМР (CDCl3): δ 6,4 (шир., 1H), 5,3 (д, J=6,2 Гц, 1H), 4,6 (м, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,5 (м, 2H), 2,0 (м, 1H), 1,8 (м, 2H), 1,0 (д, J=6,6 Гц, 6H).
ЖХ/МС: 90% 309 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 21
(S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановая кислота
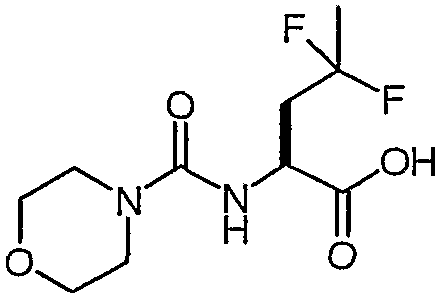
Способом, аналогичным описанному выше в ссылочном примере 20, но с использованием сложного метилового эфира (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты получали (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановую кислоту.
1H-ЯМР (CDCl3): δ 5,9 (шир., 1H), 5,29 (д, J=6,3 Гц, 1H), 4,6 (м, 1H), 3,71 (м, 4H), 3,4 (м, 4H), 2,38-2,65 (м, 2H), 1,70 (т, J=18,9 Гц, 3H).
ЖХ/МС: 100% 267 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 22
(S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановая кислота

Способом, аналогичным описанному выше в ссылочном примере 20, но с использованием сложного метилового эфира (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты получали (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановую кислоту.
1H-ЯМР (CDCl3): δ 5,3 (шир., 1H), 5,25 (д, J=5,4 Гц, 1H), 4,6 (м, 1H), 3,71 (м, 4H), 3,4 (м, 4H), 2,6-2,3 (м, 2H), 1,9 (м, 2H), 1,55 (м, 2H), 1,0 (т, J=7,3 Гц, 3H).
ЖХ/МС: 83% 295 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 23
5-тиофен-2-илоксазол
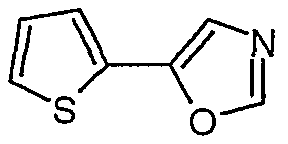
К раствору п-толуолсульфонилметилизоцианида (3,0 г, 15,36 ммоль) и тиофен-2-карбоксальдегида (1,72 г, 15,36 ммоль) в метаноле (45 мл) в атмосфере N2 добавляли карбонат калия (2,12 г, 15,36 ммоль). Полученную смесь кипятили с обратным холодильником в течение 5 часов, а затем охлаждали и концентрировали в вакууме (холодная водяная баня). Остаток распределяли между эфиром (100 мл) и водой (100 мл). Органический слой промывали водой (100 мл), сушили над сульфатом магния, а затем концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью этилацетат:гептан (1:5), и получали 5-тиофен-2-илоксазол (0,852 г, 37%).
1H-ЯМР (CDCl3): δ 7,9 (с, 1H), 7,3 (м, 2H), 7,2 (с, 1H), 7,1 (дд, J=5, 3,8 Гц, 1H).
ЖХ/МС: 100% 152 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 24
Сложный трет-бутиловый эфир {(S)-1-[гидрокси-(5-тиофен-2-ил-оксазол-2-ил)метил]пропил}карбаминовой кислоты

К раствору 5-тиофен-2-илоксазола (0,85 г, 5,62 ммоль) в сухом ТГФ (4 мл) добавляли триэтилборан (1,0 M в ТГФ, 5,62 ммоль, 5,62 мл). Полученную смесь перемешивали при комнатной температуре в течение 45 минут, а затем охлаждали до -78°C и к ней по каплям добавляли н-бутиллитий (1,6 M в гексане, 5,62 ммоль, 3,51 мл). Смесь перемешивали при -78°C в течение 45 минут, а затем к ней медленно добавляли раствор сложного трет-бутилового эфира (1-формилпропил)карбаминовой кислоты (2,81 ммоль, 0,526 г) в сухом ТГФ (3 мл). Полученную смесь перемешивали при -78°C в течение 4 часов, а затем нагревали до 0°C и гасили добавлением 30 мл 10% (об.) раствора HOAc в этаноле. Смесь перемешивали при комнатной температуре в течение 18 часов, а затем концентрировали в вакууме. Остаток очищали над 90 г силикагеля с элюированием смесью этилацетат:гептан (1:2, затем 1:1) и получали сложный трет-бутиловый эфир {(S)-1-[гидрокси-(5-тиофен-2-ил-оксазол-2-ил)метил]пропил}карбаминовой кислоты (363 мг, 38%) в виде желтого масла.
1H-ЯМР (CDCl3): δ (смесь изомеров) 7,35 (м, 2H), 7,1 (м, 2H), 4,9 (м, 2H), 4,0 (шир., 1H), 3,6 (м, 1H), 1,8-1,55 (м, 2H), 1,4 и 1,3 (2с, 9H), 1,0 и 0,9 (2т, J=7,4 Гц, 3H).
ЖХ/МС: 100% 339 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 25
Гидрохлорид (S)-2-амино-1-(5-тиофен-2-илоксазол-2-ил)бутан-1-ола
К раствору сложного трет-бутилового эфира {(S)-1-[гидрокси-(5-тиофен-2-ил-оксазол-2-ил)метил]пропил}карбаминовой кислоты (361 мг, 1,07 ммоль) в сухом дихлорметане (3 мл) добавляли 4 н. HCl в диоксане (3,0 мл, изб.). Полученную смесь перемешивали при комнатной температуре в течение 16 часов, а затем концентрировали в вакууме, и получали гидрохлорид (S)-2-амино-1-(5-тиофен-2-илоксазол-2-ил)бутан-1-ола в виде желто-коричневого твердого вещества (колич.).
1H-ЯМР (CDCl3): δ 7,5 (дд, J=5,2, 1,2 Гц, 1H), 7,4 (дд, J=3,6, 1,1 Гц, 1H), 7,3 (с, 1H), 7,1 (дд, J=5, 3,6 Гц, 1H), 4,8 (м, 3H), 3,6 (м, 2H), 3,3 (шир., 1H), 1,75 (м, 2H), 1,0 (т, J=7,5 Гц, 3H).
ЖХ/МС: 100% 239 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 26
Сложный трет-бутиловый эфир (1-этил-2-гидрокси-3-нитропропил)карбаминовой кислоты
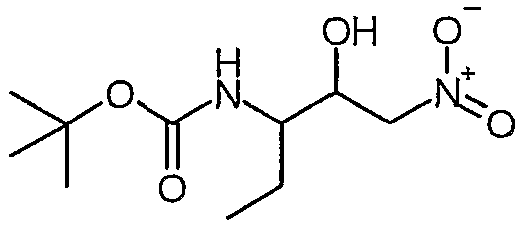
К раствору сложного трет-бутилового эфира (1-формилпропил)карбаминовой кислоты (1,0 г, 5,34 ммоль) в сухом ТГФ (10 мл) и этаноле добавляли нитрометан (3,91 г, 64,09 ммоль), а затем триэтиламин (2,70 г, 26,7 ммоль). Смесь перемешивали при комнатной температуре в течение 22 часов, а затем концентрировали в вакууме. Остаток разбавляли эфиром (50 мл) и промывали концентрированным NH4Cl (60 мл). Эфирный слой сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали над 35 г силикагеля, элюируя смесью этилацетат:гептан (1:3), и получали нужный спирт (1,09 г, 82%) в виде светло-желтого маслянистого твердого вещества.
1H-ЯМР (CDCl3): δ 4,2-4,8 (м, 4H), 3,15-3,8 (м, 2H), 1,69-1,6 (м, 2H), 1,47 (2×с, 9H), 1,02 и 1,0 (2×т, J=7,1 Гц, 3H).
ЖХ/МС: 2 изомера, всего 100% 149 (M-BOC+1).
ССЫЛОЧНЫЙ ПРИМЕР 27
Сложный трет-бутиловый эфир (1-этил-3-нитро-2-триметилсиланилоксипропил)карбаминовой кислоты
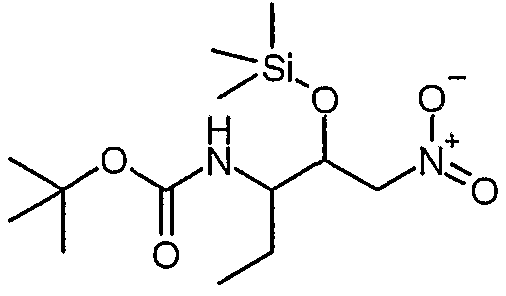
К смеси сложного трет-бутилового эфира (1-этил-2-гидрокси-3-нитропропил)карбаминовой кислоты (1,83 г, 7,37 ммоль) и триэтиламина (1,49 г, 14,75 ммоль) в сухом дихлорметане (25 мл) в атмосфере N2 добавляли триметилсилилхлорид (1,20 г, 11,05 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов, а затем разбавляли 40 мл дихлорметана и промывали водой (40 мл). Органический слой сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали над 110 г силикагеля, элюируя смесью этилацетат:гептан (1:4) и получали сложный трет-бутиловый эфир (1-этил-3-нитро-2-триметилсиланилоксипропил)карбаминовой кислоты (1,505 г, 86%) в виде бесцветного масла.
1H-ЯМР (CDCl3): δ 4,4-4,65 (м, 4H), 3,55 (м, 1H), 1,2-1,7 (м, 11H), 0,98 (2×т, J=7,4 Гц, 3H), 0,13 (2с, 9H).
ЖХ/МС: 2 изомера, всего 100% 221 (M-BOC+1).
ССЫЛОЧНЫЙ ПРИМЕР 28
Сложный трет-бутиловый эфир {1-[(5-изопропилизоксазол-3-ил)-триметилсиланилоксиметил]пропил}карбаминовой кислоты

К раствору сложного трет-бутилового эфира (1-этил-3-нитро-2-триметилсиланилоксипропил)карбаминовой кислоты (918 мг, 2,86 ммоль), 1,4-фенилендиизоцианата (1,38 г, 8,5 ммоль) и 3-метил-1-бутина (586 мг, 8,5 ммоль) в сухом толуоле (15 мл) в атмосфере N2 добавляли триэтиламин (10 капель). Смесь нагревали до 50°C в герметичной колбе в течение 28 часов, а затем охлаждали до комнатной температуры. После этого добавляли воду (1 мл) и смесь перемешивали еще 2 часа, а затем фильтровали. Фильтрат концентрировали в вакууме и остаток очищали над 35 г силикагеля и элюировали смесью этилацетат:гептан (1:5), в результате чего получали сложный трет-бутиловый эфир {1-[(5-изопропилизоксазол-3-ил)триметилсиланилоксиметил]пропил}карбаминовой кислоты (764 г, 72%) в виде бесцветного масла.
1H-ЯМР (CDCl3): δ 6,0 (2с, 1H), 4,4-4,9 (м, 2H), 3,7 (м, 1H), 3,0 (м, 1H), 1,2-1,6 (м, 17H), 1,0 (м, 3H), 0,11 и 0,1 (2×с, 9H).
ЖХ/МС: 2 изомера, всего 67% 271 (M-BOC+1).
ССЫЛОЧНЫЙ ПРИМЕР 29
Гидрохлорид 2-амино-1-(5-изопропилизоксазол-3-ил)бутан-1-ола
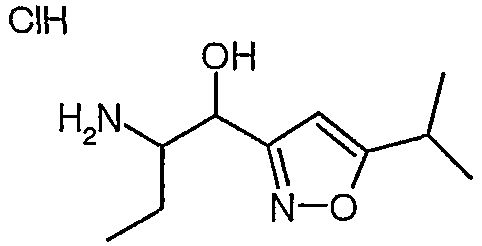
К раствору сложного трет-бутилового эфира {1-[(5-изопропилизоксазол-3-ил)триметилсиланилоксиметил]пропил}карбаминовой кислоты в сухом дихлорметане (5 мл) в атмосфере N2 добавляли раствор 4 M HCl в диоксане (5,0 мл, изб.). Смесь перемешивали при комнатной температуре в течение 22 часов, а затем концентрировали в вакууме с получением аминовой соли (475 мг, 99%) в виде желтовато-коричневого твердого вещества.
1H-ЯМР (CDCl3): δ 6,25 (2×с, 1H), 5,0 (д, J=3,9 Гц, 1H), 4,8 (д, J=6,8 Гц, 1H), 3,4 (м, 1H), 3,1 (м, 1H), 1,5-1,7 (м, 2H), 1,3 (д, J=6,8 Гц, 6H); 1,0 (т, J=6,7 Гц, 3H).
ЖХ/МС: 100% 199 (M+1).
ССЫЛОЧНЫЙ ПРИМЕР 30
5-метил-3-оксазол-5-ил-изоксазол
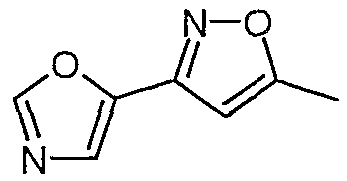
Гидрид диизобутилалюминия (1,0 M в ДХМ, 25,5 мл, 25,5 ммоль) добавляли по каплям в течение 20 минут к раствору метил-5-метилизоксазол-3-карбоксилата (3,0 г, 21,3 ммоль) в 35 мл сухого метиленхлорида с перемешиванием при -78°C, и реакционную смесь перемешивали при -78°C в течение 5,5 часа. Реакционную смесь нагревали до -40°C и реакцию гасили льдом (60 г). После нагревания полученной двухфазной смеси до комнатной температуры добавляли тетрагидрат тартрата калия-натрия (100 мл насыщенного водного раствора). Двойной слой разделяли и водный слой экстрагировали метиленхлоридом. Органические экстракты сушили над сульфатом натрия и концентрировали при пониженном давлении с получением 5-метилизоксазол-3-карбальдегида в виде белого твердого вещества (1,3 г).
П-толуолсульфонилметилизоцианид (1,75 г, 8,97 ммоль) и карбонат калия (1,24 г, 8,97 ммоль) добавляли к раствору 5-метилизоксазол-3-карбальдегида (1,0 г, 8,97 ммоль) в 35 мл сухого метанола, и реакционную смесь кипятили с обратным холодильником (90°C) в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток распределяли в диэтиловом эфире (100 мл) и воде (200 мл). Органический слой отделяли и водный слой экстрагировали диэтиловым эфиром. Органические экстракты промывали солевым раствором и водой, сушили над сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде желтоватого твердого вещества (1,25 г).
ЖХ/МС: 87%, 238 (M+1)
ССЫЛОЧНЫЙ ПРИМЕР 31
Сложный трет-бутиловый эфир ((S)-1-{гидрокси-[5-(5-метилизоксазол-3-ил)оксазол-2-ил]метил}пропил)карбаминовой кислоты
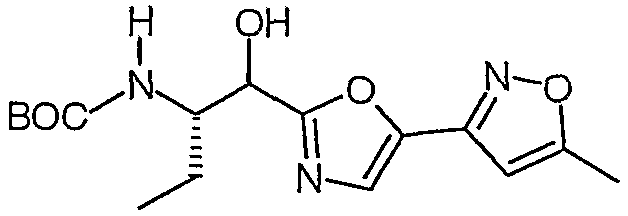
Триэтилборан (1 M в ТГФ, 12 мл, 12 ммоль) добавляли к раствору 5-метил-3-оксазол-5-илизоксазола (1,8 г, 12 ммоль) в 40 мл сухого тетрагидрофурана, и полученную смесь перемешивали при комнатной температуре в течение 15 минут. Смесь охлаждали до -78°C, добавляли по каплям н-BuLi (2,5 M в гексане, 4,8 мл, 12 ммоль), и смесь перемешивали при -78°C в течение 15 минут. Затем по каплям добавляли раствор сложного трет-бутилового эфира (S)-1-формилпропил)карбаминовой кислоты (898,7 мг, 4,8 ммоль) в 15 мл сухого тетрагидрофурана и реакционную смесь перемешивали при -78°C в течение 3 часов, а затем нагревали до -30°C, и реакцию гасили уксусной кислотой в этаноле (4%, 250 мл), после чего перемешивание продолжали еще 2 часа при нагревании смеси до комнатной температуры. Реакционную смесь концентрировали при пониженном давлении, остаток растворяли в диэтиловом эфире (250 мл) и перемешивали в течение 1,5 часа при комнатной температуре. Осадок фильтровали, и фильтрат концентрировали при пониженном давлении. После хроматографии на колонке с двуокисью кремния с элюированием смесью метиленхлорида и этилацетата получали указанное в заголовке соединение в виде бледно-желтого твердого вещества (830 мг).
ЖХ/МС 100%, 338 (M+1)
ССЫЛОЧНЫЙ ПРИМЕР 32
Гидрохлорид (S)-2-амино-1-[5-(5-метилизоксазол-3-ил)оксазол-2-ил]бутан-1-ола
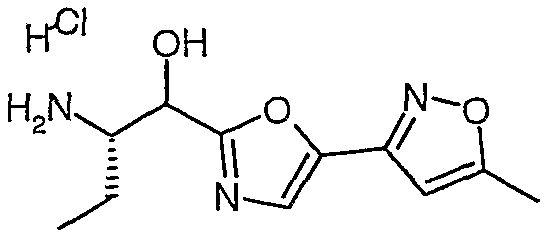
Хлористый водород (4 M в 1,4-диоксане, 3,3 мл) добавляли по каплям к раствору сложного трет-бутилового эфира ((S)-1-{гидрокси-[5-(5-метилизоксазол-3-ил)оксазол-2-ил]метил}пропил)карбаминовой кислоты (0,75 г, 2,22 ммоль) в 10 мл метиленхлорида и реакционную смесь перемешивали при комнатной температуре в течение 2,5 часа. Реакционную смесь разбавляли диэтиловым эфиром (50 мл) и перемешивали еще в течение часа при комнатной температуре, а затем концентрировали при пониженном давлении, в результате чего получали указанное в заголовке соединение в виде желтоватого твердого вещества (0,75 г).
1H-ЯМР [(CD)3SO]: δ 8,18 (м, 3H), 7,84 (с, 1H), 6,70 (с, 1H), 4,90 (м, 1H), 3,58 (м, 2H), 2,50 (с, 3H), 1,60 (м, 2H), 0,90 (т, 3H).
ЖХ/МС 100%, 238 (M+1)
ССЫЛОЧНЫЙ ПРИМЕР 33
(S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ол

Раствор (S)-3-трет-бутоксикарбониламино-2-гидроксипентановой кислоты (2,00 г, 8,57 ммоль) и N-гидроксициклопропанкарбоксамидина (1,03 г, 10,29 ммоль) в дихлорметане (20 мл) перемешивали при 0°С, и порциями добавляли 1,25 эквивалента N-циклогексилкарбодиимида-N'-метилполистирола (1,70 ммоль/г, 6,30 г, 10,72 ммоль). Реакционную смесь перемешивали в атмосфере азота в течение трех часов при нагревании до 15°С. Затем реакционную смесь фильтровали, смолу промывали дихлорметаном, а фильтрат упаривали в вакууме досуха [ЖХ/МС m/z=338 (M+H+Na)].
Остаток растворяли в тетрагидрофуране (20 мл) и нагревали в микроволновом реакторе (Smith Creator) при 160°C в течение трех минут, а затем охлаждали до комнатной температуры и упаривали в вакууме досуха [ЖХ/МС m/z=320 (M+H+Na)]. Остаток растворяли в дихлорметане (50 мл) и перемешивали при комнатной температуре с добавлением по каплям 50 мл раствора 50% трифторуксусной кислоты в дихлорметане. Через три часа реакционную смесь упаривали в вакууме досуха и снова растворяли в 50 мл дихлорметана. Затем добавляли три эквивалента силикагеля Silicycle triamine-3, и смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и промывали дихлорметаном. После выпаривания в вакууме получали 1,04 г (всего 61%).
[ЖХ/МС m/z=198 (M+H)].
Альтернативно, удаление защитной группы BOC осуществляли добавлением HCl в диоксане, в результате чего получали гидрохлорид (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола.
ССЫЛОЧНЫЙ ПРИМЕР 34
(S)-2-амино-1-(3-фенил-1,2,4-оксадиазол-5-ил)бутан-1-ол
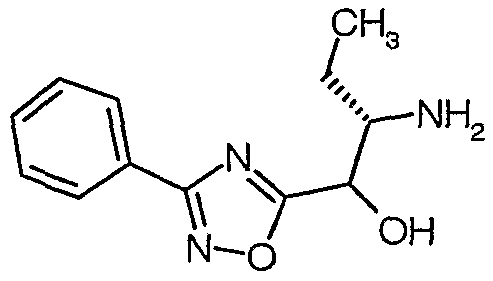
Раствор (S)-3-трет-бутоксикарониламино-2-гидроксипентановой кислоты (2,00 г, 8,57 ммоль) и N-гидроксибензамидина (1,3 г, 9,5 ммоль) в дихлорметане (40 мл) перемешивали при 0°C. Затем порциями добавляли N-циклогексилкарбодиимид-N'-метилполистирол (1,90 ммоль/г, 6 г, 11,4 ммоль). Реакционную смесь перемешивали в атмосфере азота в течение одного часа. Затем реакционную смесь фильтровали, смолу промывали дихлорметаном, и фильтрат упаривали в вакууме досуха [ЖХ/МС m/z=352 (M+H+), 296 (M+H+-изобутен)]. Остаток растворяли в тетрагидрофуране (20 мл) и нагревали в микроволновом реакторе (Smith Creator) при 180°C в течение трех минут, охлаждали до комнатной температуры и упаривали в вакууме досуха. Остаток очищали флеш-хроматографией (с градиентным элюированием смесью от 5% до 65% этилацетата в гептане) и получали продукт в виде белого твердого вещества [ЖХ/МС m/z=356 (M+Na+), 234 (M+H+-Boc)].
Продукт растворяли в дихлорметане (45 мл) и добавляли трифторуксусную кислоту (5 мл). Через два часа реакционную смесь упаривали в вакууме досуха. Остаток снова растворяли в 50 мл дихлорметана. Затем добавляли силикагель Silicycle triamine-3 (9,9 г, 39 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и промывали дихлорметаном. Фильтрат концентрировали в вакууме с получением (S)-2-амино-1-(3-фенил-1,2,4-оксадиазол-5-ил)бутан-1-ола (775 мг, 38%) в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ 8,12-8,06 (м, 2H), 7,54-7,45 (м, 3H), 4,93 и 4,75 (2×д, J=5 Гц и 3,5 Гц, 1H), 3,25 и 3,11 (2×м, 1H), 1,78-1,42 (2×м, 2H), 1,04 и 1,01 (2×т, J=7,5 Гц, 3H).
[ЖХ/МС m/z=234 (M+H)].
ССЫЛОЧНЫЙ ПРИМЕР 35
(S)-2-амино-1-(5-фенил[1,2,4]оксадиазол-3-ил)бутан-1-ол

Это соединение синтезировали, как описано в нижеследующей реакционной схеме:
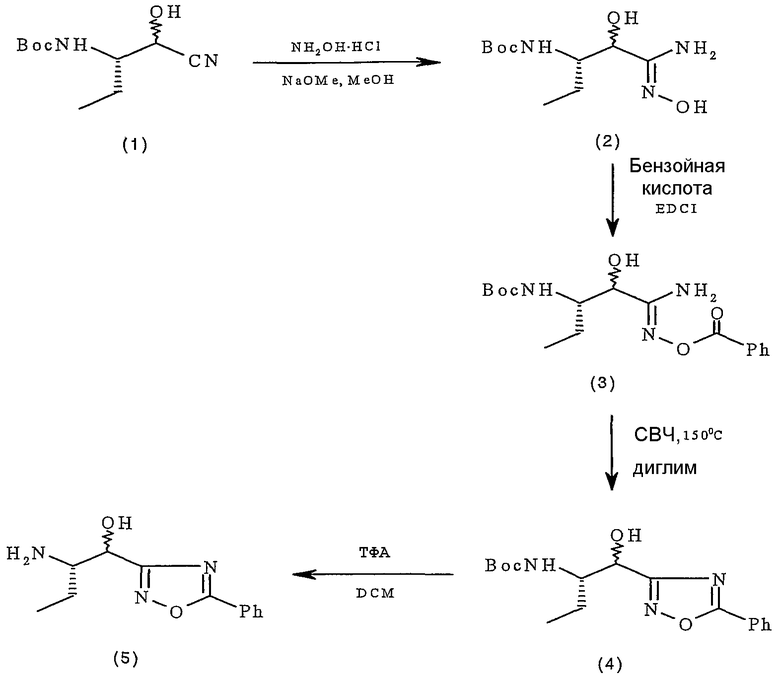
Сложный трет-бутиловый эфир {(S)-1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (2)
Раствор сложного трет-бутилового эфира (2-циано-1-этил-2-гидроксиэтил)карбаминовой кислоты (9,53 г, 44 ммоль) в метаноле (80 мл) охлаждали до 0°C и последовательно обрабатывали гидрохлоридом гидроксиламина (3,05 г, 44 ммоль) в метаноле (80 мл) и 25% раствором метоксида натрия в метаноле (10,2 мл). После перемешивания при 0°C в течение 5 минут реакционную смесь перемешивали при комнатной температуре в течение 5 часов, а затем упаривали. Остаток распределяли между этилацетатом и водой. Органический слой отделяли, сушили над сульфатом магния, а затем упаривали при пониженном давлении. Остаточное желтое масло подвергали жидкостной хроматографии среднего давления с элюированием смесью этилацетата и гептана, в результате чего получали сложный трет-бутиловый эфир {(S)-1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (3,5 г) в виде белого твердого вещества.
МС: MH+ 248.
Сложный трет-бутиловый эфир {1-[гидрокси-(N-бензилоксикарбамимидоил)метил]пропил}карбаминовой кислоты (3)
Раствор сложного трет-бутилового эфира {1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (2) (2,5 г, 10 ммоль) в дихлорметане (125 мл) обрабатывали бензойной кислотой (1,36 г, 11 ммоль), EDCI (2,14 г, 11 ммоль), HOBT (1,37 г, 10 ммоль) и триэтиламином (1,35 мл, 11 ммоль) и перемешивали при комнатной температуре в течение ночи. Реакционную смесь промывали насыщенным раствором бикарбоната натрия, а затем водой, после чего сушили над Na2SO4 и упаривали при пониженном давлении. Остаток хроматографировали жидкостной хроматографией среднего давления с элюированием 1% триэтиламина в смеси 2:3 об/об этилацетата и гептана и получали сложный трет-бутиловый эфир {1-[гидрокси-(N-бензилоксикарбамимидоил)метил]пропил}карбаминовой кислоты (850 г) в виде желтого твердого вещества.
МС: MH+ 352.
2-амино-1-(5-фенил[1,2,4]оксадиазол-3-ил)бутан-1-ол (5)
Раствор (3) (1,5 г, 4,3 ммоль) в диглиме нагревали при 150°C в микроволновом реакторе (Smith Creator, S00219) в течение 40 минут. Растворитель упаривали в вакууме в испарителе Genevac при 80°C в течение 3 часов с получением коричневого твердого вещества. Полученное вещество растворяли в дихлорметане (40 мл) и обрабатывали трифторуксусной кислотой при комнатной температуре в течение 2 часов. Растворитель упаривали досуха при пониженном давлении, необработанный продукт растворяли в воде, промывали ДХМ, водный слой подщелачивали раствором 1 M NaOH и экстрагировали дихлорметаном. Органический слой сушили над Na2SO4 и упаривали при пониженном давлении с получением 2-амино-1-(5-фенил[1,2,4]оксадиазол-3-ил)бутан-1-ола (300 мг) в виде бледно-коричневого твердого вещества.
1H-ЯМР (CDCl3): δ 8,14-8,10 (м, 2H), 7,59-7,47 (м, 3H), 4,83 и 4,65 (д, J=5 Гц, 1H), 3,18-3,05 (2м, 1H), 1,71-1,20 (м, 2H), 1,05-0,97 (2×т, J=7,2 Гц, 3H).
ССЫЛОЧНЫЙ ПРИМЕР 36
(S)-2-ацетокси-3-трет-бутоксикарбониламинопентановая кислота
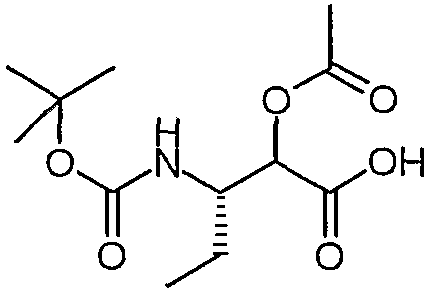
Пиридин (5 мл), 4-(диметиламино)пиридин (0,01 г) и уксусный ангидрид (11 ммоль, 1,12 г) растворяли в дихлорметане (150 мл), и полученный раствор охлаждали до 0°C. После этого сразу добавляли (S)-3-трет-бутоксикарбониламино-2-гидроксипентановую кислоту (10 ммоль, 2,33 г, A) и полученную реакционную смесь перемешивали в течение 5 часов. Затем добавляли 1 M соляную кислоту (250 мл) и смесь переносили в делительную воронку. Фазы разделяли и водную фазу три раза экстрагировали этилацетатом (200 мл). Объединенные органические фазы два раза промывали водой (200 мл) и насыщенным раствором соли (100 мл). Органическую фазу сушили сульфатом магния и растворители упаривали при пониженном давлении с получением (S)-2-ацетокси-3-трет-бутоксикарбониламинопентановой кислоты (2,535 г, 92%).
МС: m/z=298 (M+Na+), 276 (M+H+)
ССЫЛОЧНЫЙ ПРИМЕР 37
Сложный (S)-2-трет-бутоксикарбониламино-1-[N'-(4-трифторметоксибензоил)гидразинокарбонил]бутиловый эфир уксусной кислоты

(S)-2-ацетокси-3-трет-бутоксикарбониламинопентановую кислоту (1,82 ммоль, 0,5 г, A) растворяли в 30 мл дихлорметана. Затем добавляли N-циклогексилкарбодиимид-N'-метилполистирол (3,64 ммоль, 1,92 г, B), и полученную реакционную смесь перемешивали в течение 2 минут. После этого добавляли гидразид 4-(трифторметокси)бензойной кислоты (1,65 ммоль, 0,363 г, C), и реакционную смесь перемешивали в течение ночи. Через 16 часов анализ методом ЖХ/МС все еще указывал на присутствие гидразида. Затем добавляли полистиролметилизоцианат (1,65 ммоль, 1,15 г) и перемешивание продолжали еще восемь часов. Реакционную смесь фильтровали в вакууме и фильтрат концентрировали при пониженном давлении. В результате получали сложный (S)-2-трет-бутоксикарбониламино-1-[N'-(4-трифторметоксибензоил)гидразинокарбонил]бутиловый эфир уксусной кислоты в виде желтой пены (0,5 г, 64%). По данным анализа методом ЖХ/МС сохранялись остатки гидразида.
МС: m/z=500 (M+Na+), 478 (M+H+)
ССЫЛОЧНЫЙ ПРИМЕР 38
Сложный (S)-2-трет-бутоксикарбониламино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутиловый эфир уксусной кислоты
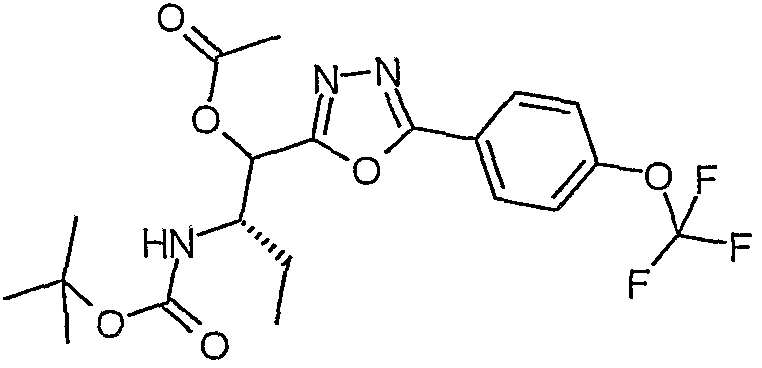
Сложный (S)-2-трет-бутоксикарбониламино-1-[N'-(4-трифторметоксибензоил)гидразинокарбонил]бутиловый эфир уксусной кислоты, полученный как описано выше, разделяли на 5 порций, которые были отдельно использованы в следующих реакциях:
Сложный (S)-2-трет-бутоксикарбониламино-1-[N'-(4-трифторметоксибензоил)гидразинокарбонил]бутиловый эфир уксусной кислоты (0,21 ммоль, 0,1 г) растворяли в ТГФ (5 мл) и полученный раствор помещали в микроволновый реактор для синтеза Smith Microwave. Затем добавляли 2-трет-бутиламино-2-диэтиламино-1,3-диметилпергидро-1,2,3-диазафосфорин на полистироле (1,05 ммоль, 0,456 г, 2,3 ммоль/г загрузки), п-толуолсульфохлорид (0,25 ммоль, 0,048 г) и реакционную смесь нагревали при 150°C в течение 10 минут (фиксированное время пребывания) в микроволновом синтезаторе.
Объединенные реакционные смеси фильтровали в вакууме, и смолу промывали 300 мл этилацетата. Объединенные фильтраты концентрировали при пониженном давлении. Неочищенный продукт очищали флеш-хроматографией (на колонке Biotage Horizon, 25 M, неочищенный продукт наносили на небольшую колонку, скорость потока - 17 мл/мин, 12 мл на фракцию, 120 мл с градиентом от 0% этилацетата в гептане до 30% этилацетата в гептане, 240 мл 30% этилацетата в гептане, 60 мл с градиентом 30-50% этилацетата в гептане, 300 мл 50% этилацетата в гептане) и получали сложный (S)-2-трет-бутоксикарбониламино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутиловый эфир уксусной кислоты (0,28 г, 58%).
МС: m/z=460 (M+H+)
ССЫЛОЧНЫЙ ПРИМЕР 39
Сложный трет-бутиловый эфир ((S)-1-{гидрокси-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]метил}пропил)карбаминовой кислоты
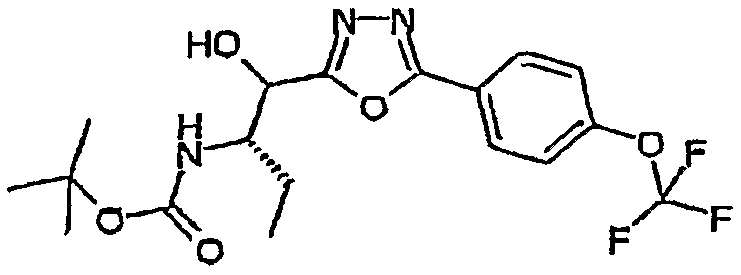
Сложный (S)-2-трет-бутоксикарбониламино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутиловый эфир уксусной кислоты (0,61 ммоль, 0,28 г) растворяли в смеси ТГФ (10 мл) и воды (10 мл). Затем добавляли гидрат гидроксида лития (1,22 ммоль, 0,051 г) и реакционную смесь перемешивали в течение 2 часов. Растворители выпаривали при пониженном давлении и остаток переносили в делительную колонку с 300 мл этилацетата и 50 мл воды. Фазы разделяли и органическую фазу промывали насыщенным раствором соли (100 мл). Затем органическую фазу сушили над сульфатом магния. Растворитель выпаривали при пониженном давлении, сушили в условиях высокого вакуума и получали сложный трет-бутиловый эфир ((S)-1-{гидрокси-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]метил}пропил)карбаминовой кислоты в виде желтого масла (0,225 г, 89%).
МС: m/z=440 (M+Na+), 418 (M+H+)
ССЫЛОЧНЫЙ ПРИМЕР 40
(S)-2-амино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутан-1-ол
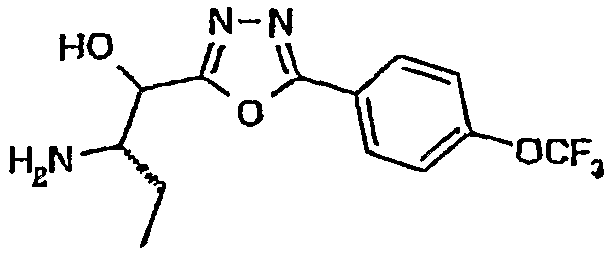
Сложный трет-бутиловый эфир ((S)-1-{гидрокси-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]метил}пропил)карбаминовой кислоты (0,54 ммоль, 0,225 г) растворяли в дихлорметане (9 мл) и обрабатывали трифторуксусной кислотой (1 мл). Реакционную смесь перемешивали в течение четырех часов. Растворители упаривали при пониженном давлении. Остаток снова растворяли в дихлорметане (20 мл) и добавляли силикагель Silicycle Triamine (5,4 ммоль, 1,47 г). Реакционную смесь перемешивали в течение 60 часов (в течение выходных). Реакционную смесь фильтровали в вакууме, и растворители выпаривали, и получали (S)-2-амино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутан-1-ол (0,164 г, 96%).
МС: m/z=318 (M+H+)
ССЫЛОЧНЫЙ ПРИМЕР 41
2-циклопропил[1,3,4]оксадиазол

Смесь сложного метилового эфира циклопропанкарбоновой кислоты (10 г, 0,1 моль) и гидрата гидразина (7,3 мл, 0,15 моль) кипятили с обратным холодильником в течение 28 часов, а затем охлаждали до комнатной температуры. Смесь упаривали при пониженном давлении, а затем сушили путем азеотропного удаления растворителя с толуолом. Остаток растворяли в дихлорметане и промывали насыщенным NaCl. Органическую фазу сушили над безводным MgSO4 и растворитель выпаривали при пониженном давлении с получением гидразида циклопропанкарбоновой кислоты (4,36 г, 44%).
Смесь гидразида циклопропанкарбоновой кислоты (31,35 г, 0,31 моль), триметилортоформиата (300 мл) и моногидрата п-толуолсульфоновой кислоты (200 мг) кипятили с обратным холодильником в течение ночи. Избыток триметилортоформиата и метанола удаляли путем перегонки. После вакуумной перегонки остатка получали 2-циклопропил[1,3,4]оксадиазол (22 г, 64%).
1H-ЯМР (CDCl3): δ 8,24 (с, 1H), 2,2 (м, 1H), 1,15 (м, 4H).
ЖХ/МС: 100%, 111 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 42
Сложный трет-бутиловый эфир {1-[(5-циклопропил[1,3,4]оксадиазол-2-ил)-гидроксиметил]пропил}карбаминовой кислоты

Раствор 2-циклопропил[1,3,4]оксадиазола (2,16 г, 19,6 ммоль) в сухом ТГФ (100 мл) охлаждали до -78°C. Затем по каплям добавляли н-BuLi (1,6 М в гексане, 12,3 мл, 19,6 ммоль). Реакционную смесь перемешивали при -78°C в течение 40 минут. Затем добавляли MgBr2·OEt2 (5,0692 г, 19,6 ммоль). Реакционную смесь оставляли для нагревания до -45°C, а затем перемешивали при этой температуре в течение 1,5 часа. После этого добавляли раствор сложного трет-бутилового эфира (1-формилпропил)карбаминовой кислоты (3,7 г, 19,6 ммоль) в ТГФ (40 мл). Реакционную смесь нагревали до -20°C и перемешивали при этой температуре в течение 3,5 часа. Реакцию гасили насыщенным раствором NH4Cl и смесь экстрагировали этилацетатом. Объединенные органические экстраты промывали насыщенным раствором NaCl и сушили над MgSO4. Растворитель выпаривали при пониженном давлении и неочищенный продукт очищали колоночной хроматографией, элюируя смесью этилацетата и гептана, в результате чего получали сложный трет-бутиловый эфир {1-[(5-циклопропил[1,3,4]оксадиазол-2-ил)гидроксиметил]пропил}карбаминовой кислоты (2,83 г, 49%).
ЖХ/МС: 298 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 43
(S)-2-амино-1-(5-циклопропил-1,3,4-оксадиазол-2-ил)бутан-1-ол; соединение с трифторуксусной кислотой
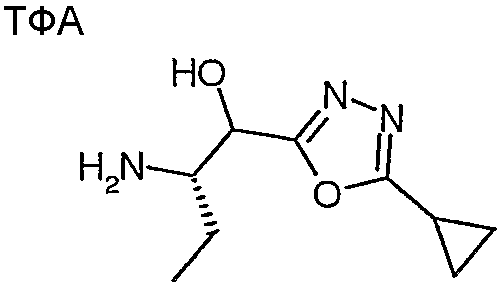
Смесь сложного трет-бутилового эфира {1-[(5-циклопропил[1,3,4]оксадиазол-2-ил)гидроксиметил]пропил}карбаминовой кислоты (2,83 г, 9,95 ммоль) и трифторуксусной кислоты (5 мл) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 2 часов и концентрировали досуха при пониженном давлении, и получали (S)-2-амино-1-(5-циклопропил-1,3,4-оксадиазол-2-ил)бутан-1-ол; соединение с трифторуксусной кислотой.
ЖХ/МС: 100% 198 (MH+).
ССЫЛОЧНЫЙ ПРИМЕР 44
Сложный метиловый эфир (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановой кислоты
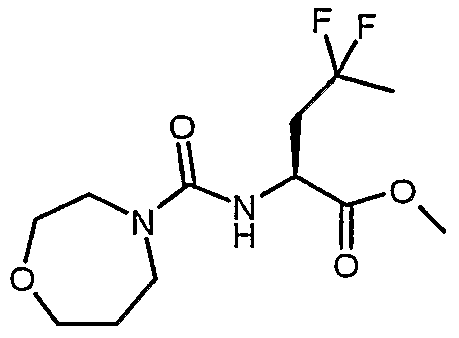
Трифосген растворяли в дихлорметане (10 мл) и в полученный раствор через шприцевой насос в течение 1 часа добавляли смесь гидрохлорида S-2-амино-4,4-дифторпентановой кислоты (1,00 г, 4,90 ммоль) (смотрите ссылочный пример 15) и диизопропилэтиламина (1,88 мл, 10,80 ммоль), растворенного в дихлорметане (10 мл). После перемешивания еще в течение 15 минут, к этому раствору добавляли раствор гидрохлорида гомоморфолина (0,67 г, 4,90 ммоль) и диизопропилэтиламина (1,90 мл, 10,90 ммоль) в дихлорметане (10 мл). Полученный раствор перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали, и остаток разбавляли этилацетатом (100 мл), а затем промывали 1 M KHSO3 (2×10 мл), насыщенным NaHCO3 и насыщенным раствором соли. Органические фазы сушили (Na2SO4), фильтровали и концентрировали с получением светло-желтого масла. Неочищенный продукт очищали на 20 г силикагеля, элюируя смесью этилацетат:гептан в градиенте 50-100%. В результате получали сложный метиловый эфир (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановой кислоты в виде белого твердого вещества (0,40 г, 28%).
1H-ЯМР (CDCl3): δ 5,12 (д, J=7,5 Гц, 1H), 4,72 (дд, J=12,0, 7,2 Гц, 1H), 3,75 (м, 7H), 3,55 (м, 4H), 2,45 (м, 2H), 1,98 (м, 2H), 1,66 (т, J=18,7 Гц, 3H).
ЖХ/МС: 295, 100%, (M+H), 317 (M+Na)
ССЫЛОЧНЫЙ ПРИМЕР 45
(S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановая кислота

Сложный метиловый эфир (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановой кислоты (0,38 г, 1,29 ммоль) растворяли в смеси тетрагидрофуран/метанол (15 мл/10 мл) и добавляли гидроксид лития (35 мг, 1,40 ммоль), растворенный в воде (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, а затем смесь метанол/тетрагидрофуран удаляли в вакууме. Остаток подкисляли 6 M хлористоводородной кислотой (0,25 мл) и экстрагировали дихлорметаном (3×20 мл), сушили (Na2SO4) и концентрировали, и получали (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановую кислоту в виде белого твердого вещества (0,36 г, 99%).
1H-ЯМР (ДМСО-d6): δ 12,6 (шир.с, 1H), 6,60 (д, J=8,3 Гц, 1H), 4,30 (дд, J=14,5, 7,0 Гц, 1H), 3,57 (м, 4H), 3,43 (м, 4H), 2,38 (м, 2H), 1,77 (м, 2H), 1,61 (т, J=19,2 Гц, 3H).
ЖХ/МС: 100% 281 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 46
Сложный метиловый эфир (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты
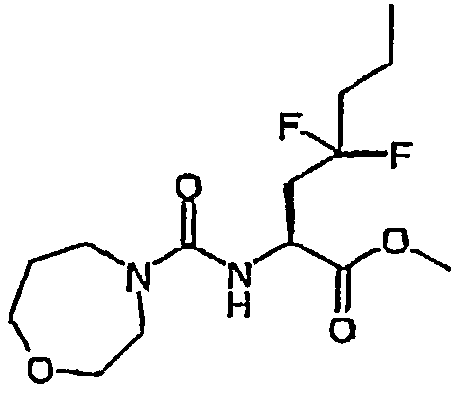
К смеси бикарбоната натрия (5,25 г), п-нитрохлорформиата (5,03 г, 25 ммоль) в ацетонитриле (130 мл) в атмосфере азота добавляли гидрохлорид сложного метилового эфира (S)-2-амино-4,4-дифторгептановой кислоты (5,79 г, 0,025 моль) и смесь перемешивали при комнатной температуре в течение 5 часов. Затем добавляли гидрохлорид гомоморфолина (3,61 г, 26,25 ммоль) и триэтиламин (12,5 мл) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель выпаривали при пониженном давлении и неочищенный продукт распределяли между водой (150 мл) и этилацетатом (200 мл). Органический слой отделяли, промывали раствором K2CO3 (150 мл), HCl (150 мл) и насыщенным раствором соли (150 мл). Органический слой отделяли, сушили (MgSO4) и выпаривали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией, элюируя смесью от 1:1 до 8:2 об/об этилацетата и гептана, а затем этилацетатом, и получали сложный метиловый эфир (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты (4,8 г) в виде бледно-желтого масла.
ЖХ/МС: 323 (M+H)
ССЫЛОЧНЫЙ ПРИМЕР 47
(S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановая кислота

Способом, аналогичным описанному выше в ссылочном примере 45, но с использованием сложного метилового эфира (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты получали (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановую кислоту.
ЖХ/МС: 309 (M+H)
ССЫЛОЧНЫЙ ПРИМЕР 48
(S)-2-амино-1-(3-изопропил[1,2,4]оксадиазол-5-ил)бутан-1-ол
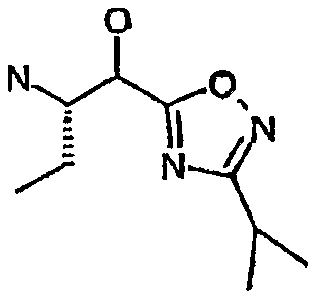
Это соединение получали способом, аналогичным описанному в ссылочном примере 33.
ЖХ/МС: 200 (M+H)
ССЫЛОЧНЫЙ ПРИМЕР 49
Сложный трет-бутиловый эфир {(S)-1-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты
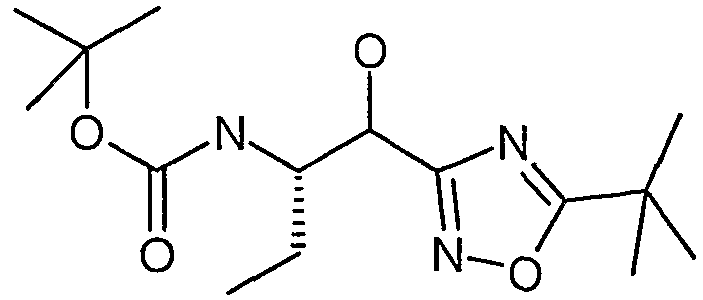
Сложный трет-бутиловый эфир {(S)-1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (235 мг, 0,95 ммоль) в диглиме (2 мл) обрабатывали триметилуксусным ангидридом (0,212 мл, 1,04 ммоль), и реакционную смесь нагревали при 170°C в течение 5 минут в микроволновом реакторе Emrys Optimizer компании Personal Chemistry. Растворитель выпаривали в условиях высокого вакуума. Полученный неочищенный продукт очищали флеш-хроматографией, элюируя смесью этилацетата и гептана (1:4) и получали сложный трет-бутиловый эфир {(S)-1-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты в виде коричневого масла (100 мг) (смесь диастереоизомеров).
1H-ЯМР (CDCl3): δ 4,92-4,69 (м, 2H), 4,05-3,85 (м, 1H), 3,57-3,41 и 3,32-3,15 (2×шир.с, 1H), 1,73-1,48 (м, 2H), 1,45 и 1,44 (2×с, 9H), 1,43 и 1,39 (2×с, 9H), 0,99 и 0,96 (2×т, J=7,5 Гц, 3H).
МС: 314 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 50
(S)-2-амино-1-(5-трет-бутил-1,2,4-оксадиазол-3-ил)бутан-1-ол
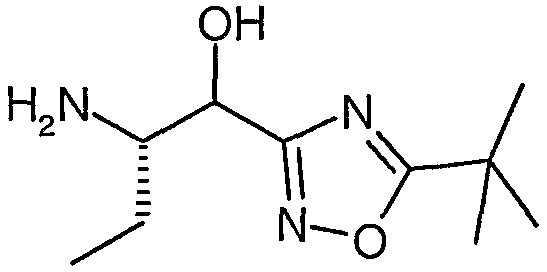
Раствор сложного трет-бутилового эфира {(S)-1-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты (2,11 г, 6,72 ммоль) в метиленхлориде (20 мл) обрабатывали трифторуксусной кислотой (5,18 мл, 67,25 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Растворитель выпаривали при пониженном давлении. Остаток растворяли в метиленхлориде (100 мл) и обрабатывали тризамином на полимерной подложке (Argonaut Technologies) (загрузка 5,38 г, 20,18 ммоль, 3,75 ммоль/г), после чего реакционную смесь перемешивали при комнатной температуре в течение 4 часов, фильтровали, и фильтрат упаривали и получали (S)-2-амино-1-(5-трет-бутил-1,2,4-оксадиазол-3-ил)бутан-1-ол в виде оранжевого масла (975 мг) (смесь диастереоизомеров).
1H-ЯМР (CDCl3): δ 4,73 и 4,58 (2×д, J=5 Гц, 1H), 3,12-3,00 (м, 1H), 2,64-2,31 (шир.с, 3H), 1,69-1,44 (м, 2H), 1,43 (с, 9H), 0,99 и 0,97 (2×т, J=7,5 Гц, 3H).
МС: 214 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 51
Сложный трет-бутиловый эфир (S)-1-{[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]гидроксиметил}пропил)карбаминовой кислоты
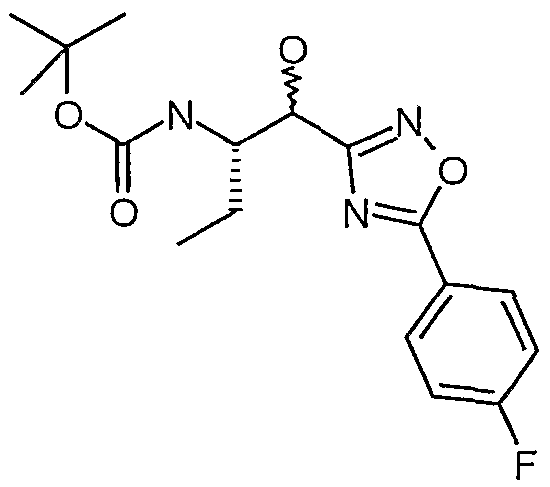
Суспензию 4-фторбензойной кислоты (1,70 г, 0,012 моль) и гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (2,12 г, 0,011 моль) в метиленхлориде (80 мл) обрабатывали сложным трет-бутиловым эфиром (S)-1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (3 г, 0,012 моль) и триэтиламином (1,54 мл, 0,011 моль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем ее разбавляли 40 мл метиленхлорида, промывали насыщенным водным раствором бикарбоната (30 мл), водой (30 мл) и насыщенным раствором соли (30 мл), сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали флеш-хроматографией, элюируя смесью этилацетата и гептана (2:1), и получали не совсем белое твердое вещество (2,20 г).
1H-ЯМР (CDCl3): δ 8,10-7,95 (м, 2H), 7,16-7,00 (м, 2H), 5,43-5,24 (м, 2H), 5,22-5,05 (м, 1H), 5,01-4,85 (м, 1H), 4,50-4,39 (м, 1H), 3,80-3,60 (м, 1H), 1,90-1,78 (м, 2H), 1,40 (с, 9H), 0,98 (т, J=7,5 Гц, 3H).
МС: 370 (M+H).
240 мг твердого вещества (0,65 ммоль), полученного, как описано выше, растворяли в диглиме (5 мл) и кипятили при 160°C в микроволновом реакторе (Smith Creator, S00219) в течение 18 минут. Растворитель выпаривали в высоком вакууме. Полученный неочищенный продукт очищали флеш-хроматографией, элюируя смесью этилацетата и гептана (1:4), и получали сложный трет-бутиловый эфир (S)-1-{[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]гидроксиметил}пропил)карбаминовой кислоты в виде белого твердого вещества (148 мг).
1H-ЯМР (CDCl3): δ 8,16-8,09 (м, 2H), 7,25-7,12 (м, 2H), 4,98-4,73 (м, 2H), 4,13-3,87 (м, 1H), 3,82-3,35 (м, 1H), 1,80-1,52 (м, 2H), 1,46 и 1,34 (2×с, 9H), 1,02 и 0,99 (2×т, J=7,5 Гц, 3H).
МС: 352 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 52
(S)-2-амино-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]бутан-1-ол
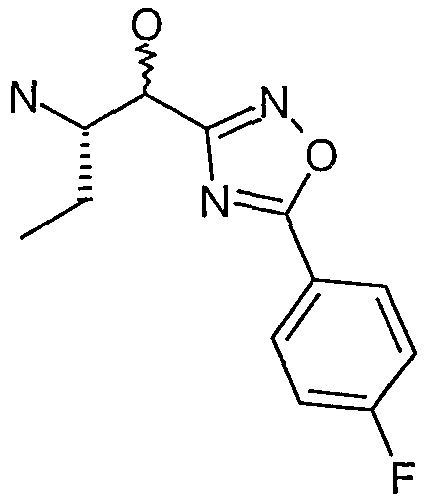
Соединение получали способом, аналогичным описанному выше в ссылочном примере 50, но с использованием сложного трет-бутилового эфира (S)-1-{[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]гидроксиметил}пропил)карбаминовой кислоты.
1H-ЯМР (CDCl3): δ 8,18-8,05 (м, 2H), 7,26-7,12 (м, 2H), 4,92 и 4,73 (2×д, J=5 Гц, 1H), 3,27-3,05 (м, 1H), 1,75-1,62 (м, 1H), 1,59-1,41 (м, 1H), 1,02 и 1,00 (2×т, J=7,5 Гц, 3H).
МС: 252 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 53
Сложный трет-бутиловый эфир {(S)-1-[(5-циклопропил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты
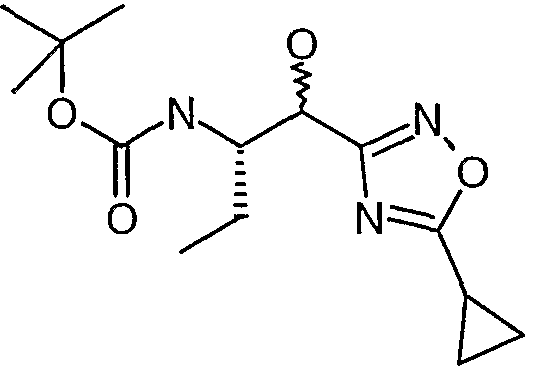
Суспензию сложного трет-бутилового эфира (S)-1-[гидрокси-(N-гидроксикарбамимидоил)метил]пропил}карбаминовой кислоты (6,12 г, 24,78 ммоль) в метиленхлориде (150 мл) обрабатывали триэтиламином (3,46 мл, 24,82 ммоль), а затем охлаждали до 0°C. После этого по каплям добавляли циклопропилкарбонилхлорид (2,25 мл, 24,79 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа 45 минут и разбавляли 150 мл метиленхлорида, промывали водой (40 мл), насыщенным водным бикарбонатом (20 мл), водой (20 мл), сушили над Na2SO4 и растворитель выпаривали при пониженном давлении с получением белого твердого вещества (7,16 г).
МС: 338 (M+Na).
Раствор соединения, полученного, как описано выше, (7,45 г, 0,024 моль) в диоксане (150 мл) кипятили с обратным холодильником в течение 15 часов. Растворитель выпаривали при пониженном давлении и остаток очищали флеш-хроматографией, элюируя смесью этилацетата и гептана, и получали сложный трет-бутиловый эфир (S)-1-[(5-циклопропил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты в виде бледно-желтого твердого вещества (5 г).
1H-ЯМР (CDCl3): δ 4,94-4,74 (м, 2H), 3,97 и 3,85 (2×м, 1H), 3,62 и 3,48 (2×шир.с, 1H), 2,19 (м, 1H), 1,72-1,42 (м, 2H), 1,44 и 1,39 (2×с, 9H), 1,26-1,18 (м, 4H), 0,98 и 0,95 (2×т, J=7,4 Гц, 3H).
МС: 298 (M+H).
ССЫЛОЧНЫЙ ПРИМЕР 54
HCl-соль (S)-2-амино-1-(5-циклопропил-1,2,4-оксадиазол-3-ил)бутан-1-ола

Раствор сложного трет-бутилового эфира {(S)-1-[(5-циклопропил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропил}карбаминовой кислоты (3,41 г, 0,011 ммоль) в 4 н. HCl в диоксане (43 мл, 0,172 ммоль) перемешивали при комнатной температуре в течение 2 часов. Растворитель выпаривали при пониженном давлении. Остаток растирали со смесью этилацетата и эфира. Затем его фильтровали и получали HCl-соль (S)-2-амино-1-(5-циклопропил-1,2,4-оксадиазол-3-ил)бутан-1-ола в виде коричневого твердого вещества (2,47 г).
1H-ЯМР (CDCl3): δ 8,21 (шир.с, 2H), 5,37 и 5,14 (2×д, 1H), 3,88 и 3,73 (2×м, 1H), 2,21 (м, 1H), 1,92-1,50 (м, 2H), 1,24 (м, 4H), 1,08 и 1,06 (2×т, J=7,4 Гц, 3H).
МС: 198 (M+H).
ПРИМЕР 1
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты
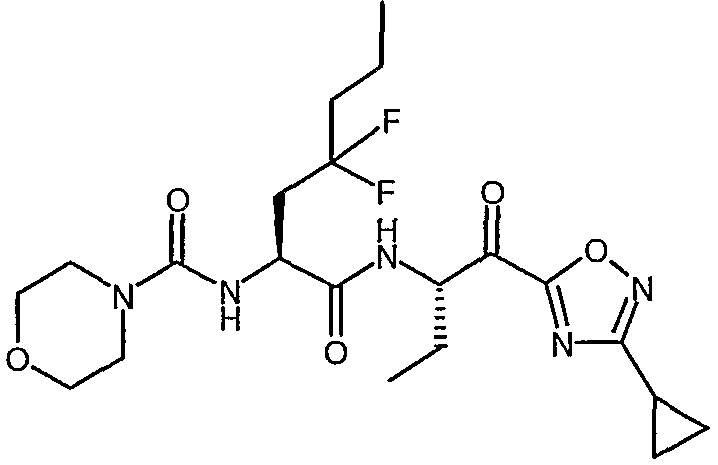
К смеси (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты (104 мг, 0,35 ммоль), гидрохлорида (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола (86,7 мг, 0,37 ммоль) и диизопропиламина (219 мг, 0,42 ммоль) в сухом дихлорметане (5 мл) добавляли PyBOP (113 мг, 0,87 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 16 часов и упаривали в вакууме. Остаток разбавляли этилацетатом (25 мл), промывали насыщенным NaHCO3 (30 мл), а затем разбавленной HCl (30 мл) и насыщенным NaHCO3 (30 мл). Органический слой сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали на 12 г силикагеля, элюируя смесью этилацетат:гептан (2:1, затем 1:0), и получали (1-{1-[(3-циклопропил[1,2,4]оксадиазол-5-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил)амид морфолин-4-карбоновой кислоты (146 мг, 88%) в виде белого твердого вещества. Анализ методом ЖХ/МС выявил 2 изомера, всего 100% M+1 474.
К раствору (1-{1-[(3-циклопропил[1,2,4]оксадиазол-5-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил)амида морфолин-4-карбоновой кислоты (145 мг, 0,31 ммоль) в сухом дихлорметане (3 мл) в атмосфере N2 добавляли периодинан Десс-Мартина (15 мас.% раствора в дихлорметане, 1,73 г, 0,061 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, а затем реакцию гасили раствором Na2S2O3 (193 мг, 1,22 ммоль) в насыщенном NaHCO3 (30 мл). Водный слой экстрагировали дихлорметаном (2×30 мл). Органические слои сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали на 12 г силикагеля, элюируя смесью этилацетат:гептан (1:1, затем 2:1), с получением целевого кетона (119 мг, 81%) в виде желтовато-коричневого твердого вещества.
1H-ЯМР (CDCl3): δ 7,4 (д, J=7,0 Гц, 1H), 5,27 (м, 1H), 5,13 (д, J=6,9 Гц, 1H), 4,65 (дд, J=13,1, 6,9 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,4 (м, 2H), 2,2 (м, 1H), 2,05 (м, 1H), 1,8 (м, 3H), 1,55 (м, 2H), 1,15 (м, 4H), 0,98 (т, J=7,4 Гц, 6H).
ЖХ/МС: 28% 512 (M+H2O+Na) и 68% 494 (M+Na).
ПРИМЕР 2
{(S)-1-[(S)-1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты
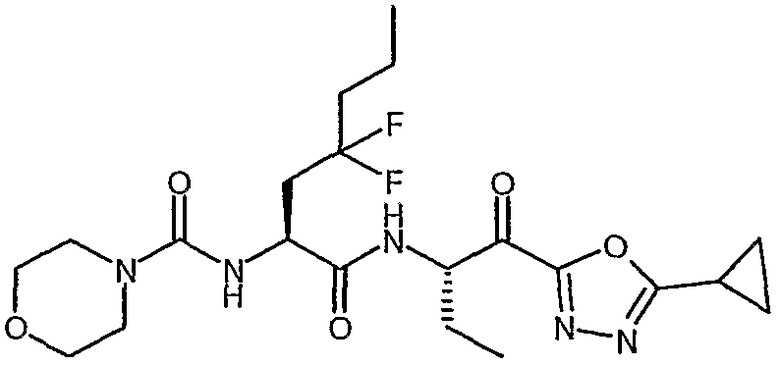
PyBOP (171,73 мг, 0,33 ммоль), диизопропилэтиламин (0,0575 мл, 0,33 ммоль) и (S)-2-амино-1-(5-циклопропил-1,3,4-оксадиазол-2-ил)бутан-1-ол, соединение с трифторуксусной кислотой (0,30 ммоль), добавляли к раствору (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты (88,29 мг, 0,30 ммоль) в сухом метиленхлориде (4 мл), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакцию гасили водным бикарбонатом натрия, два раза экстрагировали метиленхлоридом, и органические экстракты сушили над сульфатом натрия и упаривали при пониженном давлении. После колоночной хроматографии на силикагеле с элюированием смесью метиленхлорида и этилацетата получали ((S)-1-{(S)-1-[(5-циклопропил-1,3,4-оксадиазол-2-ил)гидроксиметил]пропилкарбамоил}-3,3-фторгексил)амид морфолин-4-карбоновой кислоты в виде белого твердого вещества (87 мг).
ЖХ/МС 97%, 474 (M+1).
Периодинан Десс-Мартина (15 мас.% в ДХМ, 0,79 г, 0,28 ммоль) добавляли в раствор ((S)-1-{(S)-1-[(5-циклопропил-1,3,4-оксадиазол-2-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил)амида морфолин-4-карбоновой кислоты (67 мг, 0,14 ммоль) в сухом метиленхлориде (10 мл), и смесь перемешивали при комнатной температуре в течение 2,5 часа. Реакцию гасили раствором Na2S2O3 (110,68 мг, 0,70 ммоль) в водном NaHCO3. Органический слой отделяли, и водный слой экстрагировали дихлорметаном. Органические экстракты сушили над сульфатом натрия и концентрировали при пониженном давлении. После колоночной хроматографии на двуокиси кремния с элюированием смесью метиленхлорида и этилацетата получали {(S)-1-[(S)-1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты в виде белого порошка (48 мг).
1H-ЯМР (CDCl3): δ 7,52 (д, J=7,5 Гц, 1H), 5,34 (м, 1H), 5,18 (д, J=7,5 Гц, 1H), 4,65 (м, 1H), 3,72 (м, 4H), 3,40 (м, 4H), 2,50-2,22 (м, 3H), 2,18-2,08 (м, 1H), 1,96-1,78 (м, 3H), 1,60-1,45 (м, 2H), 1,30 (м, 4H), 0,98 (т+т, 6H).
ЖХ/МС 95%, 472 (M+1).
ПРИМЕР 3
((S)-3,3-дифтор-1-{(S)-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты
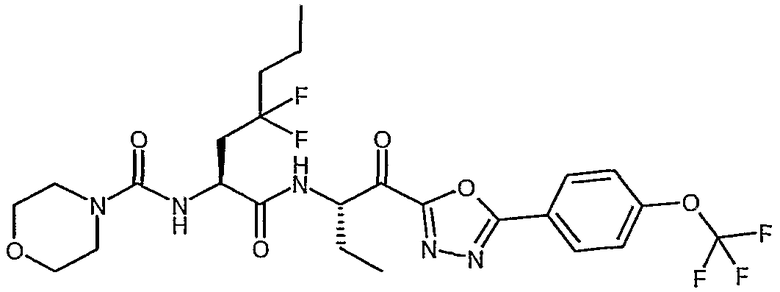
PyBOP (68,69 мг, 0,13 ммоль), диизопропилэтиламин (0,023 мл, 0,13 ммоль) и (S)-2-амино-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]бутан-1-ол (38,0 мг, 0,12 ммоль) добавляли к раствору (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты (34 мг, 0,12 ммоль) в сухом метиленхлориде (4 мл), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакцию гасили водным раствором NaHCO3, смесь два раза экстрагировали метиленхлоридом и органические экстракты сушили над Na2SO4 и выпаривали при пониженном давлении. После колоночной хроматографии на силикагеле с элюированием смесью метиленхлорида и этилацетата получали [(S)-3,3-дифтор-1-((S)-1-{гидрокси-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]метил}пропилкарбамоил)гексил]амид морфолин-4-карбоновой кислоты в виде белого твердого вещества (61 мг).
ЖХ/МС 71%, M+1=594.
Периодинан Десс-Мартина (15 мас.% в ДХМ, 0,58 г, 0,21 ммоль) добавляли к раствору [(S)-3,3-дифтор-1-((S)-1-{гидрокси-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-ил]метил}пропилкарбамоил)гексил]амида морфолин-4-карбоновой кислоты (61 мг, 0,10 ммоль) в сухом метиленхлориде (8 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакцию гасили раствором Na2S2O3 (81,43 мг, 0,50 ммоль) в водном NaHCO3. Органический слой отделяли и водный слой экстрагировали дихлорметаном. Органические экстракты сушили над сульфатом натрия и концентрировали при пониженном давлении. После хроматографии на колонке с двуокисью кремния с элюированием смесью метиленхлорида и этилацетата получали ((S)-3,3-дифтор-1-{(S)-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты в виде белого порошка (39 мг).
1H-ЯМР (CDCl3): δ 8,25 (д, J=7,5 Гц, 2H), 7,60 (д, J=7,5 Гц, 1H), 7,42 (д, J=7,5 Гц, 2H), 5,36 (м, 1H), 5,16 (д, J=7,5 Гц, 1H), 4,70 (м, 1H), 3,74 (м, 4H), 3,42 (м, 4H), 2,54-2,32 (м, 2H), 2,28-2,14 (м, 1H), 2,02-1,80 (м, 3H), 1,60-1,45 (м, 2H), 1,06 (т, J=7 Гц, 3H), 0,96 (т, J=7 Гц, 3H).
ЖХ/МС: 96%, 592 (M+1).
ПРИМЕР 4
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,3 (м, 6H), 5,25 (м, 1H), 5,08 (д, J=6,9 Гц, 1H), 4,7 (дд, J=12,8, 7,4 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,8 Гц, 2H), 2,4-2,1 (м, 3H), 2,05 (м, 1H), 1,8 (м, 1H), 1,1 (м, 4H), 0,95 (т, J=7,5 Гц, 3H).
ЖХ/МС: 35% 560 (M+H2O+Na) и 65% 542 (M+Na).
ПРИМЕР 5
{1-[1-(3-циклопропил[1,2,4]оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-5-метилгексил}амид морфолин-4-карбоновой кислоты
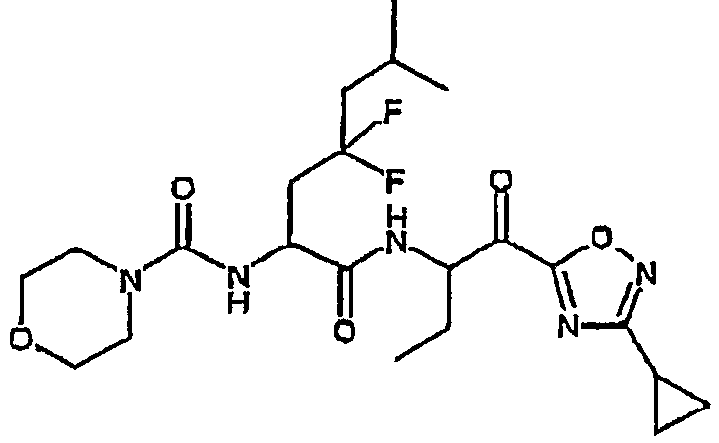
Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-6-метил-2-[(морфолин-4-карбонил)амино]гептановой кислоты и (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {1-[1-(3-циклопропил[1,2,4]оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-5-метилгексил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,6 (д, J=6,8 Гц, 1H), 5,2 (м, 2H), 4,66 (дд, J=13, 7,2 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,3 (м, 2H), 2,2 (м, 1H), 2,05 (м, 1H), 1,95 (м, 1H), 1,8 (м, 3H), 1,1 (м, 4H), 0,97 (д, J=6,6 Гц, 6H), 0,96 (т, J=7,4 Гц, 3H).
ЖХ/МС: 26%, 526 (M+H2O+Na) и 74%, 508 (M+Na).
ПРИМЕР 6
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты
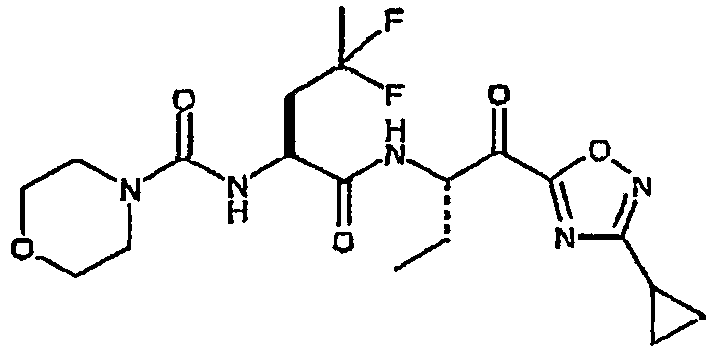
Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты и (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,47 (д, J=6,8 Гц, 1H), 5,3 (м, 1H), 5,16 (д, J=6,9 Гц, 1H), 4,65 (дд, J=13, 7,4 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,4 (м, 2H), 2,2 (м, 1H), 2,05 (м, 1H), 1,8 (м, 1H), 1,67 (т, J=18,7 Гц, 3H), 1,1 (м, 4H), 0,97 (т, J=7,5 Гц, 3H).
ЖХ/МС: 37% 484 (M+H2O+Na) и 63% 484 (M+CH3CN).
ПРИМЕР 7
{(S)-3,3-дифтор-1-[(S)-1-(3-фенил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты и (S)-2-амино-1-(3-фенил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {(S)-3,3-дифтор-1-[(S)-1-(3-фенил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты в виде светло-коричневого твердого вещества.
1H-ЯМР (CDCl3): δ 8,15 (дд, J=7,7, 1,5 Гц, 2H), 7,61 (д, J=6,4 Гц, 1H), 7,5 (м, 3H), 5,35 (м, 1H), 5,2 (д, J=6,9 Гц, 1H), 4,68 (дд, J=13,2, 7,8 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,4 (м, 2H), 2,2 (м, 1H), 1,95 (м, 1H), 1,66 (т, J=18,7 Гц, 3H), 1,03 (т, J=7,5 Гц, 3H).
ЖХ/МС: 37% 520 (M+H2O+Na) и 63% 502 (M+Na).
ПРИМЕР 8
{(S)-3,3-дифтор-1-[(S)-1-(5-фенил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты и (S)-2-амино-1-(5-фенил[1,2,4]оксадиазол-3-ил)бутан-1-ола получали {(S)-3,3-дифтор-1-[(S)-1-(5-фенил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты
1H-ЯМР (CDCl3): δ 8,2 (д, J=7,1 Гц, 2H), 7,65 (д, J=7,4 Гц, 1H), 7,55 (м, 3H), 5,4 (дд, J=12,2, 7 Гц, 1H), 5,3 (д, J=7,4 Гц, 1H), 4,7 (дд, J=13, 7,3 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 2,4 (м, 2H), 2,1 (м, 1H), 1,9 (м, 1H), 1,67 (т, J=18,7 Гц, 3H), 1,0 (т, J=7,4 Гц, 3H).
ЖХ/МС: 6% 520 (M+H2O+Na) и 94% 502 (M+Na).
ПРИМЕР 9
{1-[1-(5-циклопропил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты
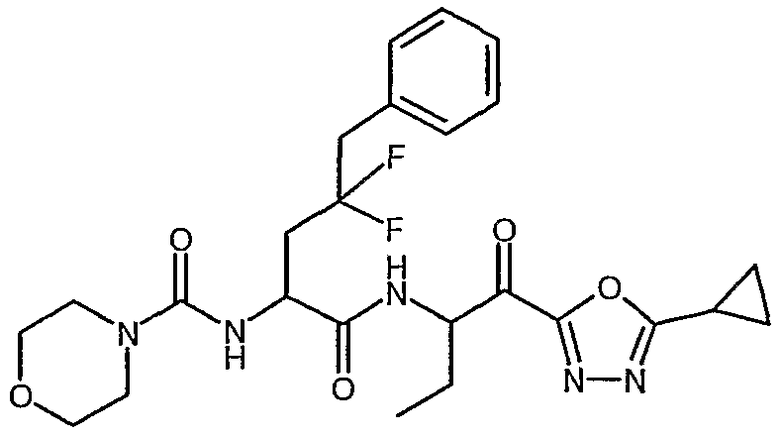
Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и соли трифторуксусной кислоты (S)-2-амино-1-(5-циклопропил-1,3,4-оксадиазол-2-ил)бутан-1-ола получали {1-[1-(5-циклопропил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,3 (м, 6H), 5,27 (м, 1H), 5,0 (д, J=7,0 Гц, 1H основной), 4,95 (д, J=7,3 Гц, 1H малый), 4,7 (м, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,3 Гц, 2H), 2,4-2,2 (м, 3H), 2,05 (м, 1H), 1,8 (м, 1H), 1,2 (м, 4H), 0,95 (т, J=7,5 Гц, 3H).
ЖХ/МС: 12% 560 (M+H2O+Na) и 83% 542 (M+Na).
ПРИМЕР 10
{3,3-дифтор-1-[1-(5-изопропилизоксазол-3-карбонил)пропилкарбамоил]гексил}амид морфолин-4-карбоновой кислоты
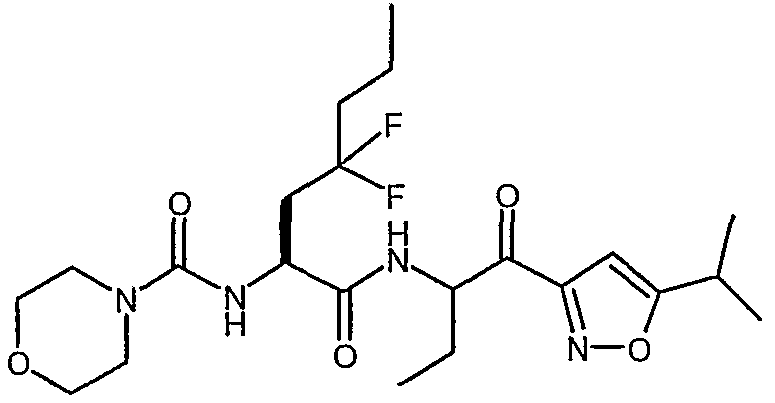
Способом, аналогичным описанному выше в примере 1, но с использованием гидрохлорида 2-амино-1-(5-изопропилизоксазол-3-ил)бутан-1-ола вместо гидрохлорида (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {3,3-дифтор-1-[1-(5-изопропил-изоксазол-3-карбонил)пропилкарбоил]гексил}амид морфолин-4-карбоновой кислоты в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ смесь изомеров примерно 2:1 7,4 (шир., 1H), 6,37 (с, 1H), 5,4 (м, 1H), 5,26 (д, J=6,9 Гц, 1H основной), 5,2 (д, J=7,2 Гц, 1H малый), 4,7 (м, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,15 (м, 1H), 2,4 (м, 2H), 2,1 (м, 1H), 1,8 (м, 4H), 1,5 (м, 1H), 1,35 (д, J=7,0 Гц, 6H), 0,95 (м, 6H).
ЖХ/МС: 100% 473 (M+1).
ПРИМЕР 11
((S)-3,3-дифтор-1-{1-[5-(5-метилизоксазол-3-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты
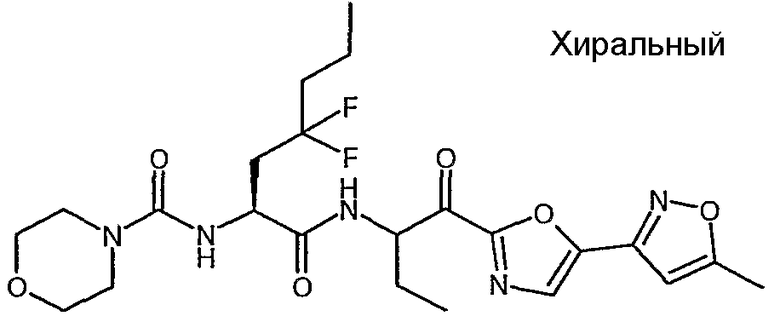
Способом, аналогичным описанному выше в примере 3, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты и гидрохлорида (S)-2-амино-1-[5-(5-метилизоксазол-3-ил)оксазол-2-ил]бутан-1-ола получали ((S)-3,3-дифтор-1-{1-[5-(5-метилизоксазол-3-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ 7,78 (с, 1H), 7,40 (м, 1H), 6,44 (с, 1H), 5,48 (м, 1H), 5,22-5,10 (м, 1H), 4,68 (м, 1H), 3,72 (м, 4H), 3,40 (м, 4H), 2,54 (с, 3H), 2,50-2,30 (м, 2H), 2,22-2,08 (м, 1H), 1,94-1,78 (м, 3H), 1,60-1,46 (м, 2H), 1,08-0,94 (2×т, 6H).
ЖХ/МС: 99%, 512 (M+1).
ПРИМЕР 12
{(S)-3,3-дифтор-1-[(S)-1-(оксазол-2-карбонил)пропилкарбамоил]-4-фенилбутил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 2, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и гидрохлорида (S)-2-амино-1-оксазол-2-илбутан-1-ола получали {(S)-3,3-дифтор-1-[(S)-1-(оксазол-2-карбонил)пропилкарбамоил]-4-фенилбутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,86 (с, 1H), 7,37 (с, 1H), 7,30 (м, 5H), 7,24 (м, 1H), 5,45 (м, 1H), 5,08 (д, J=9 Гц, 1H), 4,70 (м, 1H), 3,72 (м, 4H), 3,38 (м, 4H), 3,22 (т, J=17 Гц, 2H), 2,35 (м, 2H), 2,12 (м, 1H), 1,85 (м, 1H), 0,95 (т, J=9 Гц, 3H).
ЖХ/МС: 97%, 479 (M+1).
ПРИМЕР 13
{(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-тиофен-2-илоксазол-2-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты
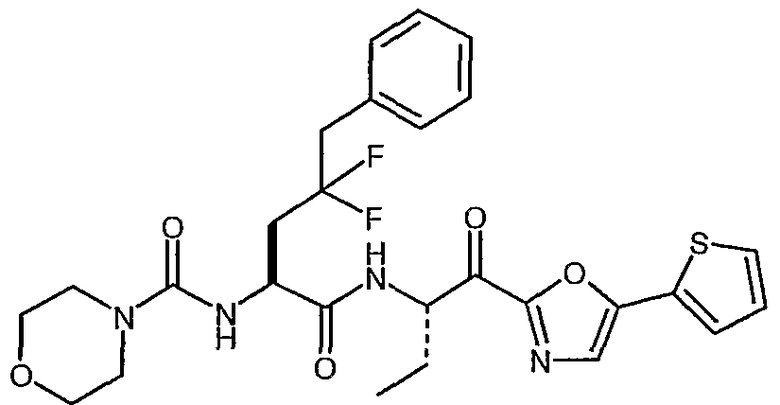
Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и гидрохлорида (S)-2-амино-1-(5-тиофен-2-илоксазол-2-ил)бутан-1-ола получали {(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-тиофен-2-илоксазол-2-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,53 (дд, J=3,6, 1 Гц, 1H), 7,48 (дд, J=5, 1 Гц, 1H), 7,4 (с, 1H), 7,3 (м, 6H), 7,15 (дд, J=5, 3,6 Гц, 1H), 5,4 (м, 1H), 5,15 (д, J=7,1 Гц, 1H), 4,7 (дд, J=13, 7,4 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,7 Гц, 2H), 2,4 (м, 2H), 2,1 (м, 1H), 1,8 (м, 1H), 0,96 (т, J=7,5 Гц, 3H).
ЖХ/МС: 100% 561 (M+1).
ПРИМЕР 14
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)бутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и (S)-2-амино-1-бензоксазол-2-илпентан-1-ола получали {(S)-1-[(S)-1-(бензоксазол-2-карбонил)бутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,9 (д, J=8,0 Гц, 1H), 7,66 (д, J=8 Гц, 1H), 7,56 (т, J=7,2 Гц, 1H), 7,47 (т, J=8 Гц, 1H), 7,2 (м, 6H), 5,6 (м, 1H), 5,05 (д, J=7 Гц, 1H), 4,71 (дд, J=12,8, 7,4 Гц, 1H), 3,7 (м, 4H), 3,35 (м, 4H), 3,18 (т, J=16,8 Гц, 2H), 2,3 (м, 2H), 2,1 (м, 1H), 1,8 (м, 1H), 1,4 (м, 2H), 0,94 (т, J=7,3 Гц, 3H).
ЖХ/МС: 100% 543 (M+1).
ПРИМЕР 15
[1-(2-бензоксазол-2-ил-1-метоксиметил-2-оксоэтилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты
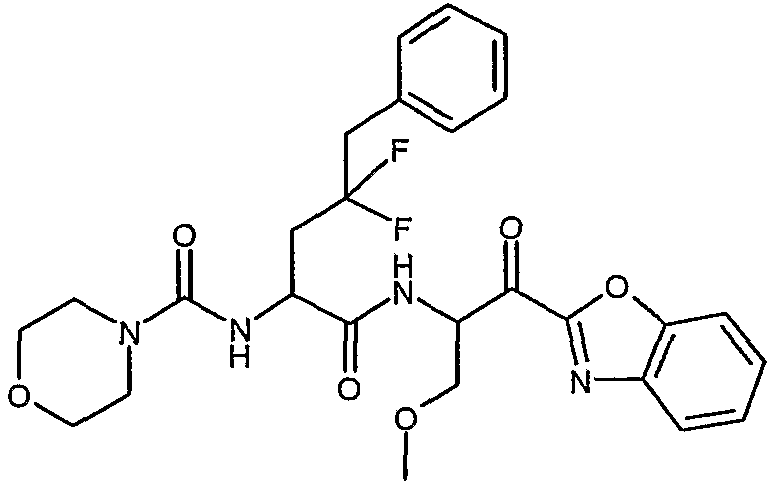
Способом, аналогичным описанному выше в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и (S)-2-амино-1-бензоксазол-2-ил-3-метоксипропан-1-ола получали [1-(2-бензоксазол-2-ил-1-метоксиметил-2-оксоэтилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,9 (д, J=7,7 Гц, 1H), 7,67 (д, J=8 Гц, 1H), 7,56 (т, J=8 Гц, 1H), 7,48 (т, J=8 Гц, 1H), 7,2 (м, 6H), 5,7 (м, 1H), 5,1 (д, J=7 Гц, 1H основной), 5,05 (д, J=7,3 Гц, 1H малый), 4,8 (м, 1H), 4,26 (дд, J=9,7, 3,5 Гц, 1H), 3,8 (м, 1H), 3,7 (м, 4H), 3,35 (м, 4H), 3,27 (с, 3H), 3,22 (т, J=16,2 Гц, 2H), 2,4 (м, 2H).
ЖХ/МС: 94% 545 (M+1).
ПРИМЕР 16
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)-1-метилбутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты
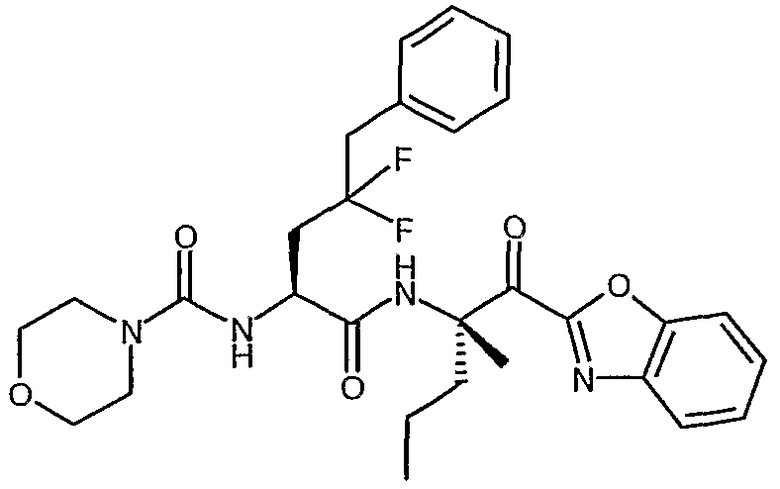
Смесь гидрохлорида (S)-2-амино-1-бензоксазол-2-ил-2-метилпентан-1-она (80,6 мг, 0,3 ммоль), (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты (0,102 мг, 0,3 ммоль), EDCI (69 мг, 0,36 ммоль), HOBT (48,6 мг, 0,36 ммоль) и диизопропилэтиламина (0,2 мл) в ДМФА перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли этилацетатом, промывали холодной 1 н. HCl, насыщенным NaHCO3, а затем насыщенным раствором NaCl. Органическую фазу сушили над сульфатом магния, и растворитель выпаривали при пониженном давлении с получением неочищенного продукта. После очистки колоночной хроматографией на силикагеле с элюированием смесью этилацетата и гептана получали {(S)-1-[(S)-1-(бензоксазол-2-карбонил)-1-метилбутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты (82%).
1H-ЯМР (CDCl3): δ 7,8 (д, J=7, 8,0 Гц, 1H), 7,64 (д, J=7,8 Гц, 1H), 7,53 (дт, J=7,2, 1,2 Гц, 1H), 7,43 (дт, J=8, 1,2 Гц, 1H), 7,2 (м, 6H), 4,9 (д, J=7,3 Гц, 1H), 4,65 (м, 1H), 3,7 (м, 4H), 3,3 (м, 4H), 3,1 (т, J=16,8 Гц, 2H), 2,2 (м, 3H), 2,1 (м, 1H), 1,74 (с, 3H), 1,25 (м, 2H), 0,9 (т, J=7,3 Гц, 3H).
ЖХ/МС: 100% 557 (M+1).
ПРИМЕР 17
[(S)-1-((S)-1-циано-3-фенилпропилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты
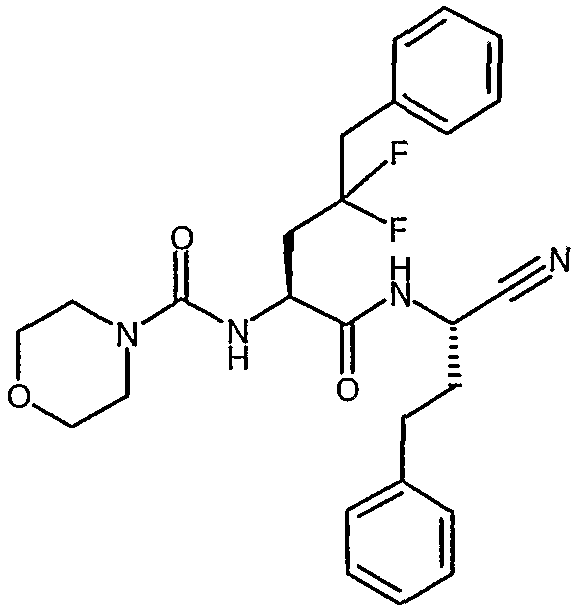
В соответствии с методом, аналогичным методу сочетания PyBOP, описанному в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и гидрохлорида (S)-2-амино-4-фенилбутиронитрила получали [(S)-1-((S)-1-циано-3-фенилпропилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,9 (д, J=7,6 Гц, 1H), 7,2 (м, 10H), 5,1 (д, J=7,3 Гц, 1H), 4,6 (м, 2H), 3,6 (м, 4H), 3,3 (м, 4H), 3,2 (т, J=16,5 Гц, 2H), 2,74 (т, J=7,2 Гц, 2H), 2,3 (м, 2H), 2,1 (м, 2H).
ЖХ/МС: 100% 485 (M+1).
ПРИМЕР 18
[(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты
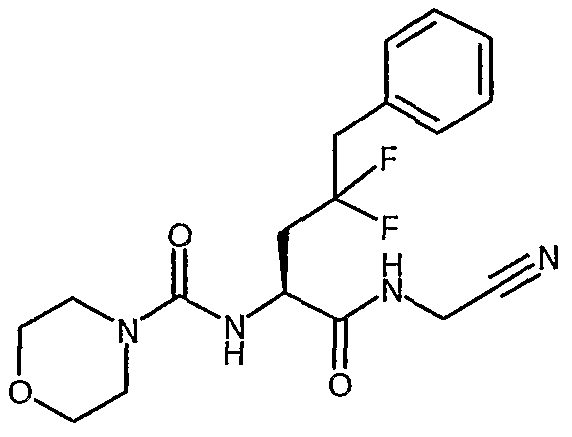
В соответствии с методом, аналогичным методу сочетания PyBOP, описанному в примере 1, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и гидрохлорида аминоацетонитрила получали [(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты.
1H-ЯМР (CDCl3): δ 7,95 (шир., 1H), 7,3 (м, 5H), 5,25 (д, J=7,0 Гц, 1H), 4,7 (дд, J=12,7, 7,2 Гц, 1H), 4,1 (м, 2H), 3,7 (м, 4H), 3,35 (м, 4H), 3,2 (т, J=16,3 Гц, 2H), 2,4 (м, 2H).
ЖХ/МС: 83% 403 (M+Na).
ПРИМЕР 19
[(S)-3,3-дифтор-1-((S)-1-формил-1-метилбутилкарбамоил)-4-фенилбутил]амид морфолин-4-карбоновой кислоты
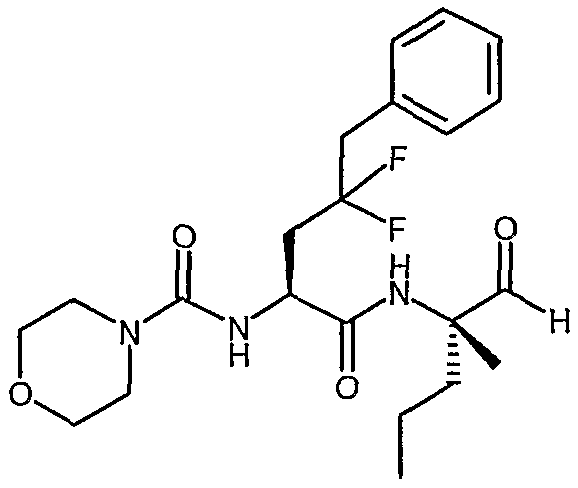
Смесь гидрохлорида (S)-2-амино-2-метилпентан-1-ола (104,4 мг, 0,67 ммоль), (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты (231 мг, 0,67 ммоль), EDCI (154 мг, 0,8 ммоль), HOBT (108 мг, 0,8 ммоль) и диизопропилэтиламина (0,23 мл) в ДМФА (2 мл) перемешивали при комнатной температуре в течение ночи. Смесь разбавляли этилацетатом, промывали холодной 1 н. HCl, насыщенным NaHCO3, а затем насыщенным раствором NaCl. Органическую фазу сушили над MgSO4 и растворитель выпаривали при пониженном давлении с получением неочищенного продукта. После очистки на хроматографической колонке с силикагелем и элюированием смесью этилацетата и гептана получали [(S)-3,3-дифтор-1-((S)-1-гидроксиметил-1-метилбутилкарбамоил)-4-фенилбутил]амид морфолин-4-карбоновой кислоты (223 мг, 75%).
Смесь [(S)-3,3-дифтор-1-((S)-1-гидроксиметил-1-метилбутилкарбамоил)-4-фенилбутил]амида морфолин-4-карбоновой кислоты (217 мг) и периодинана Десс-Мартина (15% в ДХМ, 2 экв.) в ДХМ (5 мл) перемешивали при комнатной температуре в течение 3 часов, и реакцию гасили раствором тиосульфата натрия в насыщенном NaHCO3. Продукт экстрагировали этилацетатом и промывали насыщенным раствором NaCl. Органическую фазу сушили над безводным MgSO4, растворитель выпаривали при пониженном давлении. После очистки на хроматографической колонке с силикагелем и элюированием смесью этилацетата и гептана получали [(S)-3,3-дифтор-1-((S)-1-формил-1-метилбутилкарбамоил)-4-фенилбутил]амид морфолин-4-карбоновой кислоты (83 мг, 38%).
1H-ЯМР (CDCl3): δ 9,3 (с, 1H), 7,2 (м, 5H), 7,0 (с, 1H), 5,0 (д, J=7 Гц, 1H), 4,64 (дд, J=13, 7,3 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (т, J=16,5 Гц, 2H), 2,3 (м, 2H), 1,9 (м, 1H), 1,65 (м, 1H), 1,35 (с, 3H), 1,2 (м, 2H), 0,9 (т, J=7,3 Гц, 3H).
ЖХ/МС: 100% 440 (M+1)
ПРИМЕР 20
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты
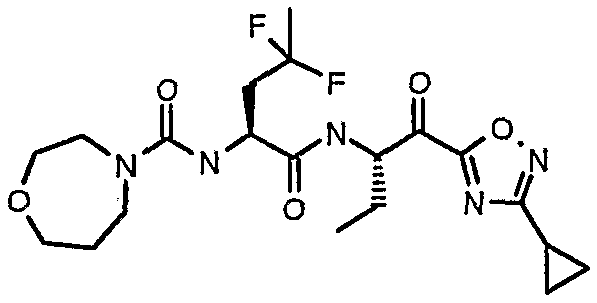
К смеси (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]пентановой кислоты (97 мг, 0,35 ммоль), гидрохлорида (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола (83 мг, 0,36 ммоль) и диизопропилэтиламина (121 мкл, 0,70 ммоль) в сухом дихлорметане (12 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (66 мг, 0,35 ммоль) и гидрат 1-гидроксибензотриазола (47 мг, 0,35 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов, затем разбавляли дихлорметаном (20 мл) и промывали разбавленной HCl (30 мл), а затем насыщенным NaHCO3 (30 мл). Органический слой сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали на 12 г силикагеля, элюируя смесью этилацетат:гептан (градиент 50-100%), и получали ((S)-1-{(S)-1-[(3-циклопропил-1,2,4-оксадиазол-5-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторбутил)амид пергидро-1,4-оксазепин-4-карбоновой кислоты (120 мг, 75%) в виде бесцветного стекловидного твердого вещества.
ЖХ/МС 100% 460 (M+H).
К раствору ((S)-1-{(S)-1-[(3-циклопропил-1,2,4-оксадиазол-5-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторбутил)амида пергидро-1,4-оксазепин-4-карбоновой кислоты (110 мг, 0,24 ммоль) в сухом дихлорметане (20 мл) в атмосфере N2 добавляли периодинан Десс-Мартина (143 мг, 0,34 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, а затем добавляли дихлорметан (20 мл). Реакцию гасили раствором Na2S2O3 (0,26 M, 2 мл) и реакционную смесь промывали насыщенным NaHCO3 (20 мл). Водный слой экстрагировали дихлорметаном (2×30 мл). Органические слои сушили (Na2SO4) и концентрировали в вакууме. Остаток очищали на 12 г силикагеля, элюируя смесью этилацетат:гептан (градиент 50-100%) и получали {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты (82 мг, 75%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ 7,52 (д, 6,2H), 5,28 (м, 1H), 5,05 (д, J=7 Гц, 1H), 4,66 (м, 1H), 3,78 (м, 4H), 3,59 (м, 4H), 2,42 (м, 2H), 2,23 (м, 1H), 2,07 (м, 1H), 1,98 (м, 1H), 1,85 (м, 1H), 1,69 (т, J=18,8 Гц, 3H), 1,15 (м, 4H), 0,98 (т, J=7,5 Гц, 3H).
ЖХ/МС: 97% 458 (M+H).
ПРИМЕР 21
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 20, но с использованием (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты и гидрохлорида (S)-2-амино-1-(3-циклопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты (98 мг, 65%) в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ 7,6 (д, J=7,5 Гц, 1H), 5,25 (м, 1H), 5,10 (д, J=7,5 Гц, 1H), 4,65 (дд, J=14, J=7,5 Гц, 1H), 3,75 (м, 6H), 3,55 (м, 4H), 2,4 (м, 2H), 2,2 (м, 2H), 1,95 (м, 1H), 1,8 (м, 3H), 1,55 (м, 2H), 1,10 (м, 4H), 0,95 (т, J=7,5 Гц, 6H).
ЖХ/МС: 70% 486 (M+1) и 30% 504 (M+1+H2O).
ПРИМЕР 22
{(S)-1-[(S)-1-(3-изопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты

Способом, аналогичным описанному выше в примере 20, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты и (S)-2-амино-1-(3-изопропил-1,2,4-оксадиазол-5-ил)бутан-1-ола получали {(S)-1-[(S)-1-(3-изопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты (122 мг, 71%) в виде белого твердого вещества.
1H-ЯМР (CDCl3): δ 7,5 (д, J=7,0 Гц, 1H), 5,3 (м, 1H), 5,25 (д, J=7,0 Гц, 1H), 4,65 (дд, J=13, 7,0 Гц, 1H), 3,7 (м, 4H), 3,4 (м, 4H), 3,2 (м, 1H), 2,35 (м, 2H), 2,1 (м, 1H), 1,8 (м, 3H), 1,55 (м, 2H), 1,40 (д, J=7 Гц, 6H), 0,9 (т, J=7,0 Гц, 6H).
ЖХ/МС: 72% 474 (M+1) и 28% 492 (M+1+H2O).
ПРИМЕР 23
{(S)-1-[(S)-1-(5-трет-бутил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты
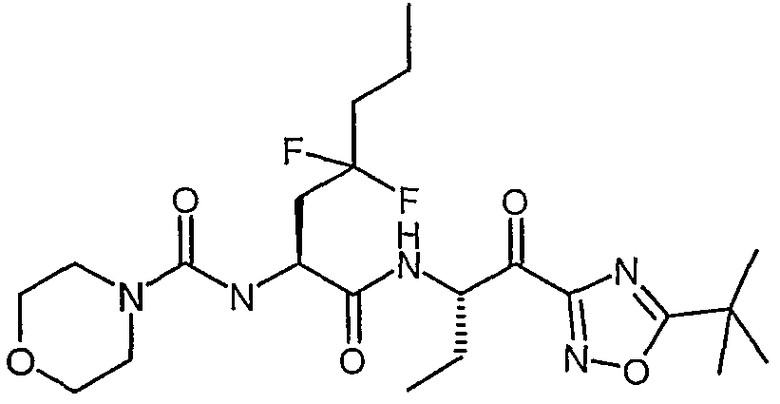
Раствор (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты (175 мг, 0,60 ммоль) в диметилформамиде (6 мл) последовательно обрабатывали (S)-2-амино-1-(5-трет-бутил-1,2,4-оксадиазол-3-ил)бутан-1-олом (240 мг, 1,13 ммоль), гексафторфосфатом O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (226 мг, 0,59 ммоль) и диизопропилэтиламином (0,104 мл, 0,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали в условиях высокого вакуума. Остаток растворяли в этилацетате и промывали 1 н. хлористоводородной кислотой, насыщенным водным раствором бикарбоната и водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали флеш-хроматографией на двуокиси кремния (на колонке, 10 г), элюируя смесью этилацетата и гептана (2:1), и получали ((S)-1-{(S)-1-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил)амид морфолин-4-карбоновой кислоты в виде коричневого масла (60 мг).
МС: 490 (M+H).
Раствор ((S)-1-{(S)-1-[(5-трет-бутил-1,2,4-оксадиазол-3-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил)амида морфолин-4-карбоновой кислоты (57 мг, 0,117 ммоль) в метиленхлориде (3 мл) обрабатывали периодинаном Десс-Мартина (59 мг, 0,139 ммоль) и перемешивали при комнатной температуре в течение 90 минут. Реакционную смесь промывали раствором Na2S2O3 в воде (0,26 M), насыщенным водным раствором бикарбоната и водой, сушили над Na2SO4 и растворитель выпаривали при пониженном давлении. Остаток очищали флеш-хроматографией, элюируя смесью этилацетата и гептана (1:1), и получали {(S)-1-[(S)-1-(5-трет-бутил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты в виде не совсем белого твердого вещества (41 мг).
МС: 488 (M+H).
ПРИМЕР 24
{(S)-1-[1-(5-трет-бутил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты
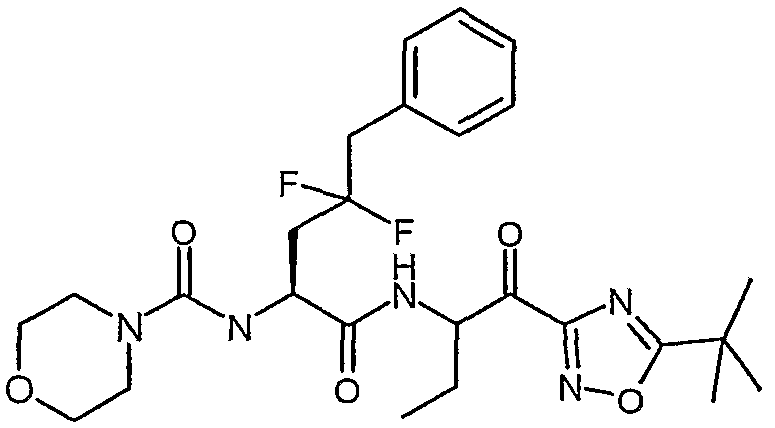
Способом, аналогичным описанному выше в примере 23, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и (S)-2-амино-1-(5-трет-бутил-1,2,4-оксадиазол-3-ил)бутан-1-ола получали {(S)-1-[1-(5-трет-бутил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты в виде смеси 7:3 диастереоизомеров.
1H-ЯМР (CDCl3): δ 7,36-7,19 (м, 5H), 7,15 (д, J=7,1 Гц, 1H), 5,31 (м, 1H), 5,03 и 4,96 (2×д, J=7 Гц, 1H), 4,68 (м, 1H), 3,76-3,59 (м, 4H), 3,45-3,26 (м, 4H), 3,18 (т, J=16,8 Гц, 2H), 2,52-2,18 (м, 2H), 2,17-1,94 (м, 1H), 1,88-1,70 (м, 1H), 1,47 (с, 9H), 0,93 (т, J=7,4 Гц, 3H).
МС: 536 (M+H).
ПРИМЕР 25
((S)-3,3-дифтор-1-{(S)-1-[5-(4-фтофенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты
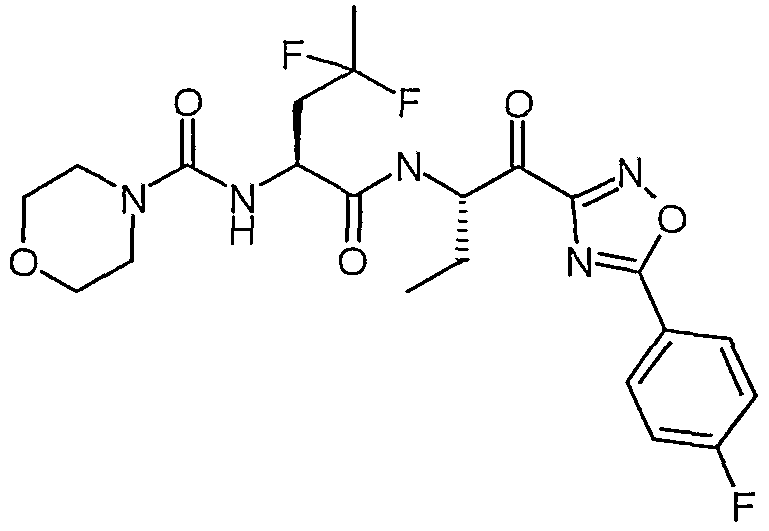
Способом, аналогичным описанному выше в примере 23, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]пентановой кислоты и (S)-2-амино-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-ил]бутан-1-ола получали ((S)-3,3-дифтор-1-{(S)-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты
1H-ЯМР (CDCl3): δ 8,21 (м, 2H), 7,31 (д, J=6,8 Гц, 1H), 7,30-7,20 (м, 2H), 5,38 (м, 1H), 5,07 (д, J=6,8 Гц, 1H), 4,63 (м, 1H), 3,75-3,64 (м, 4H), 3,44-3,33 (м, 4H), 2,58-2,28 (м, 2H), 2,22-2,04 (м, 1H), 1,96-1,79 (м, 1H), 1,66 (т, J=18,8 Гц, 3H), 0,97 (т, J=7,4 Гц, 3H).
МС: 498 (M+H).
ПРИМЕР 26
{(S)-1-[1-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты
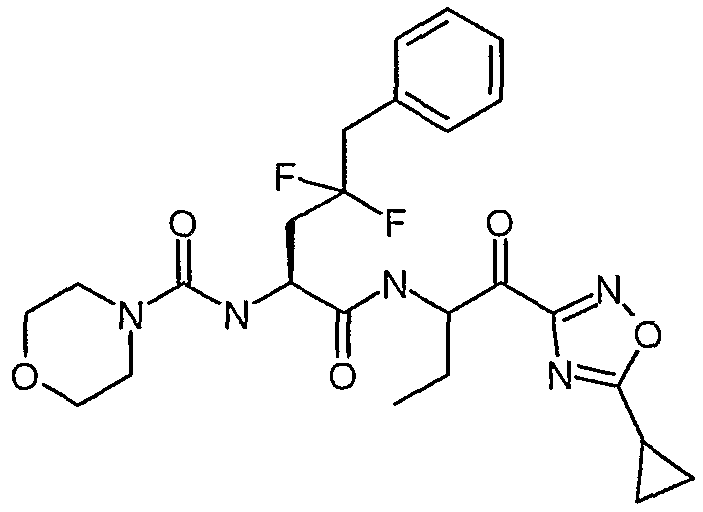
Способом, аналогичным описанному выше в примере 23, но с использованием (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентановой кислоты и (S)-2-амино-1-(5-циклопропил-1,2,4-оксадиазол-3-ил)бутан-1-ола получали {(S)-1-[1-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты в виде смеси диастереоизомеров 3:1.
1H-ЯМР (CDCl3): δ 7,36-7,20 (м, 5H), 7,14 (д, J=7,1 Гц, 1H), 5,26 (м, 1H), 5,02 и 4,96 (2×д, J=7 Гц, 1H), 4,70 (м, 1H), 3,73-3,61 (м, 4H), 3,43-3,28 (м, 4H), 3,18 (т, J=16,5 Гц, 2H), 2,48-2,21 (м, 3H), 2,14-1,98 (м, 1H), 1,85-1,70 (м, 1H), 1,38-1,21 (м, 4H), 0,91 (т, J=7,5 Гц, 3H).
МС: 520 (M+H).
ПРИМЕР 27
{(S)-1-[1-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты
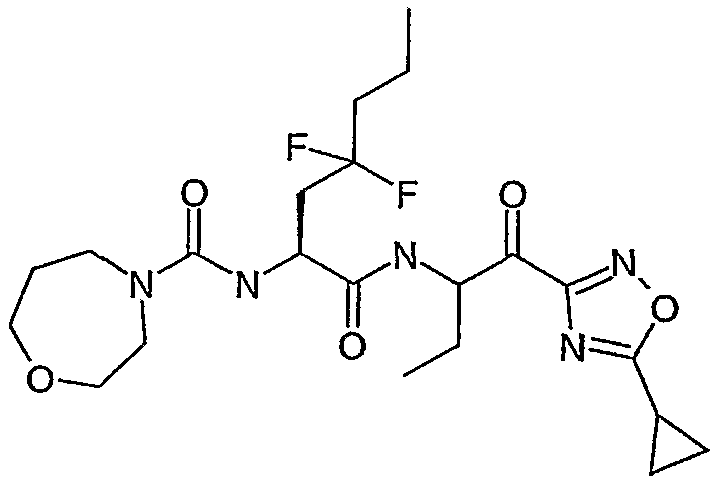
Способом, аналогичным описанному выше в примере 23, но с использованием (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты и (S)-2-амино-1-(5-циклопропил-1,2,4-оксадиазол-3-ил)бутан-1-ола получали {(S)-1-[1-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид пергидро-1,4-оксазепин-4-карбоновой кислоты в виде смеси диастереомеров 5:1.
1H-ЯМР (CDCl3): δ 7,44 и 7,39 (2×д, J=7,3 Гц, 1H), 5,30 (м, 1H), 5,05 и 4,98 (2×д, J=6,5 Гц, 1H), 4,63 (м, 1H), 3,79-3,73 (м, 4H), 3,59-3,53 (м, 4H), 2,47-2,23 (м, 3H), 2,15-1,76 (м, 6H), 1,57-1,43 (м, 2H), 1,38-1,26 (м, 4H), 0,95 (т, J=7,3 Гц, 3H), 0,93 (т, J=7,2 Гц, 3H).
МС: 486 (M+H).
ПРИМЕР 28
[(S)-1-(цианометилкарбамоил)-3,3-дифторгексил]амид пергидро-1,4-оксазепин-4-карбоновой кислоты
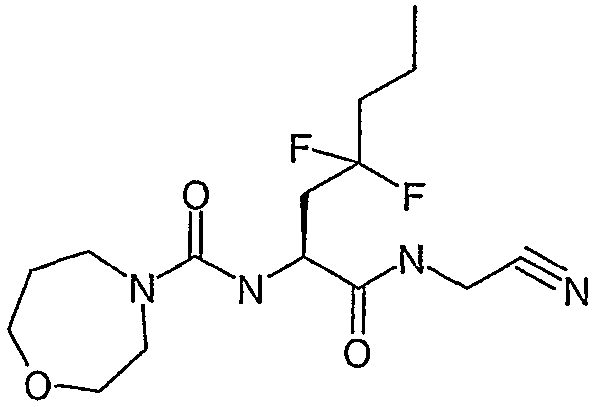
Суспензию связанного с полистиролом карбодиимида (570 мг, 0,73 ммоль) и (S)-4,4-дифтор-2-[(пергидро-1,4-оксазепин-4-карбонил)амино]гептановой кислоты (135 мг) в ДХМ (10 мл) перемешивали в течение 10 минут. Затем добавляли HOBT (60 мг), и смесь перемешивали еще 10 минут. После этого добавляли суспензию гидрохлорида аминоацетонитрила (34 мг) и триэтиламина (52 мкл) в ДХМ (5 мл), и смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли тризамин на полистироле (493 мг), и смесь перемешивали при комнатной температуре в течение 2 часов 30 минут. После фильтрации фильтрат разбавляли ДХМ, промывали водой, упаривали при пониженном давлении и очищали колоночной хроматографией, элюируя смесью этилацетата и гептана, в результате чего получали [(S)-1-(цианометилкарбамоил)-3,3-дифторгексил]амид пергидро-1,4-оксазепин-4-карбоновой кислоты в виде белого твердого вещества.
ЖХ/МС: 100% 347 (M+H)
ПРИМЕР 29
[(S)-1-((S)-1-цианопропилкарбамоил)-3,3-дифторгексил]амид пергидро-1,4-оксазепин-4-карбоновой кислоты
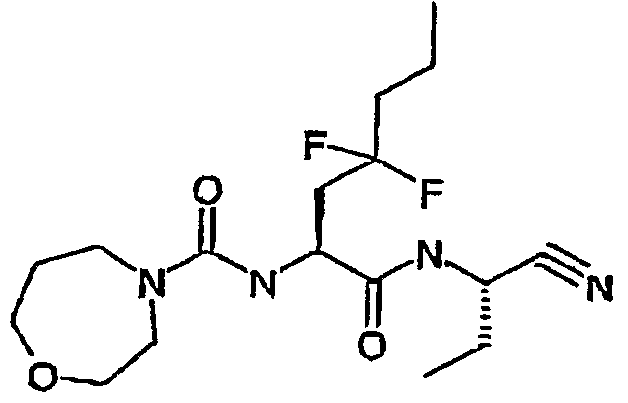
Способом, аналогичным описанному выше в примере 28, но с использованием 4,4-дифтор-2-[([1,4]оксазепан-4-карбонил)амино]гептановой кислоты и гидрохлорида (S)-2-аминобутиронитрила получали [(S)-1-((S)-1-цианопропилкарбамоил)-3,3-дифторгексил]амид пергидро-1,4-оксазепин-4-карбоновой кислоты.
ЖХ/МС: 100% 375 (M+H).
ПРИМЕР 30
[(S)-1-(1-цианоциклопропилкарбамоил)-3,3-дифторгексил]амид морфолин-4-карбоновой кислоты
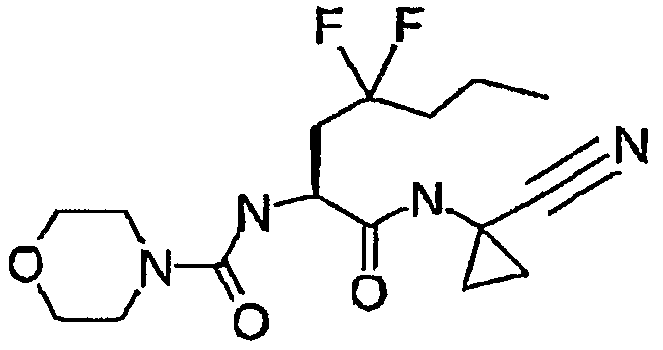
Указанное соединение получали в результате реакции (S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]гептановой кислоты и гидрохлорида 1-аминоциклопропанкарбонитрила с использованием TOTU в качестве реагента сочетания и диизопропилэтиламина в качестве основания.
ЖХ/МС: 359 (M+H)
ПРИМЕР 31
Анализ катепсина S
Растворы тестируемых соединений в различных концентрациях получали в 10 мкл диметилсульфоксида (ДМСО), а затем разводили аналитическим буфером (40 мкл, содержащем: MES, 50 мМ (pH 6,5); ЭДТА, 2,5 мМ; и NaCl, 100 мМ, 0,5 мМ ДТТ, 0,01% тритон X-100).
К разведенным растворам добавляли человеческий катепсин S (конечная концентрация в лунке 1,74 нМ). Растворы для анализа перемешивали в течение 5-10 секунд на планшетном шейкере, закрывали и инкубировали в течение 30 минут при комнатной температуре. К аналитическим растворам добавляли Z-Val-Val-Arg-AMC (конечная концентрация в лунке 0,08 мМ) и за гидролизом следили с помощью спектрофотометрии (при λ 460 нм) в течение 5 минут. Кажущиеся константы ингибирования (Ki) рассчитывали, исходя из кривых изменения концентрации фермента, построенных с использованием стандартных математических моделей.
ПРИМЕР 32
Анализ катепсина B
Растворы тестируемых соединений в различных концентрациях получали в 10 мкл диметилсульфоксида (ДМСО), а затем разводили аналитическим буфером (содержащем: MES 50 мМ (pH 6); 2,5 мМ ЭДТА, 2% ДМСО и дитиотреитол (ДТТ), 2,5 мМ).
К разбавленным растворам добавляли человеческий катепсин B (конечная концентрация 0,3 нг/мкл). Аналитические растворы перемешивали 5-10 секунд на планшетном шейкере, закрывали и инкубировали в течение 30 минут при комнатной температуре. К аналитическим растворам добавляли Z-FR-pNa (конечная концентрация 100 мкМ) и за гидролизом следили с помощью спектрофотометрии (при λ 405 нм) в течение 60 минут. Кажущиеся константы ингибирования (Ki) рассчитывали исходя из кривых изменения концентрации фермента, построенных с использованием стандартных математических моделей.
ПРИМЕР 33
Анализ катепсина К
Растворы тестируемых соединений в различных концентрациях получали в 10 мкл диметилсульфоксида (ДМСО), а затем разводили аналитическим буфером (40 мкл, содержащем: MES, 50 мМ (pH 5,5); ЭДТА, 2,5 мМ; и ДТТ, 0,5 мМ).
К разведенным растворам добавляли человеческий катепсин K (0,0906 пмоль в 25 мкл аналитического буфера). Аналитические растворы перемешивали 5-10 секунд на планшетном шейкере, закрывали и инкубировали в течение 30 минут при комнатной температуре. К аналитическим растворам добавляли Z-Phe-Arg-AMC (4 нмоль в 25 мкл аналитического буфера) и за гидролизом следили с помощью спектрофотометрии (при λ 460 нм) в течение 5 минут. Кажущиеся константы ингибирования (Ki) рассчитывали из кривых изменения концентрации фермента с использованием стандартных математических моделей.
ПРИМЕР 34
Анализ катепсина L
Растворы тестируемых соединений в различных концентрациях получали в 10 мкл диметилсульфоксида (ДМСО), а затем разводили аналитическим буфером (40 мкл, содержащем: MES, 50 мМ (pH 6,0); ЭДТА, 2,5 мМ; и ДТТ, 2,5 мМ).
К разведенным растворам добавляли человеческий катепсин L (10 мкл 0,2 нг/мкл, конечная концентрация 0,02 нг/мкл). Аналитические растворы перемешивали 5-10 секунд на планшетном шейкере, закрывали и инкубировали в течение 30 минут при комнатной температуре. К аналитическим растворам добавляли Z-Phe-Arg-AMC (10 мкл 0,1 мМ, конечная концентрация 10 мкМ) и за гидролизом следили с помощью спектрофотометрии (при λ 460 нм) в течение 30 минут. Кажущиеся константы ингибирования (Ki) рассчитывали из кривых изменения концентрации фермента с использованием стандартных математических моделей.
Соединения согласно изобретению тестировали в соответствии с вышеописанными анализами на ингибирование протеазы, и эти анализы указывали на селективное ингибирование катепсина S. Кажущиеся константы ингибирования (Ki) для соединений согласно изобретению, ингибирующих катепсин S, составляли в пределах примерно от 10-10 M до 10-7 M.
ПРИМЕР 35
Репрезентативные фармацевтические композиции, содержащие соединение формулы (I):
Хотя в настоящей заявке описаны и продемонстрированы новые фундаментальные отличительные признаки изобретения, применяемые в предпочтительных вариантах осуществления изобретения, однако следует отметить, что в настоящее изобретение могут быть внесены различные сокращения, замены и изменения, относящиеся к форме, к конкретному составу композиций и к способам, не выходящим за рамки существа изобретения. Так, например, совершенно очевидно, что допускается замена химических радикалов и/или замена стадий методов, в которых осуществляются, по существу, одинаковые процедуры, проводимые, по существу, одним и тем же способом с достижением одинаковых результатов, и такие изменения также входят в объем настоящего изобретения.
Настоящее изобретение не ограничивается вышеописанными вариантами его осуществления, которые приводятся здесь лишь в качестве примеров и которые могут быть модифицированы различными способами, не выходящими за пределы объема изобретения, защищенного прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПИРОЦИКЛИЧЕСКИЕ НИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕАЗЫ | 2012 |
|
RU2621695C2 |
| СПИРОЦИКЛИЧЕСКИЕ НИТРИЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕАЗЫ | 2007 |
|
RU2478620C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ТКБ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2742122C2 |
| ПРОИЗВОДНЫЕ 5-ЧЛЕННЫХ ГЕТЕРОЦИКЛОВ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ p38 | 2004 |
|
RU2381219C2 |
| ТРИАЗОЛОПИРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ ДЛЯ ЛЕЧЕНИЯ КОЖНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2544011C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ БЕНЗИМИДАЗОЛА ДЛЯ МОДУЛЯЦИИ IkB-КИНАЗЫ | 2003 |
|
RU2318820C2 |
| ЗАМЕЩЕННЫЕ ХРОМАНЫ | 2015 |
|
RU2718060C2 |
| ПИРРОЛОПИРАЗИНОВЫЕ ИНГИБИТОРЫ КИНАЗЫ | 2012 |
|
RU2673064C2 |
Изобретение относится к новым соединениям формулы (I), их изомерам и фармацевтически приемлемым солям. Соединения настоящего изобретения свойствами ингибитора катепсина. В общей формуле (I)
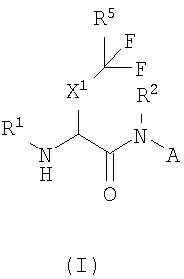
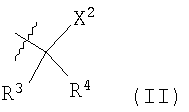
А представляет собой (II); X1 представляет собой метилен; X2 представляет собой CN, СНО, C(O)R6; X6 представляет собой связь; R1 представляет собой R13C(O)-; R2 представляет собой водород; R выбран из группы, состоящей из Н, фенил-(С0-6)алкила, (С1-6)алкила, необязательно замещенного группой -X6OR9; R4 представляет собой Н или (С1-6)алкил; или R3 и R4 вместе с атомом углерода, с которым связаны R3 и R4, образуют (С3-8)циклоалкилен; R5 представляет собой (С1-9)алкил, бензил. Изобретение также относится к соединениям формул (Ia), (Ib), (Ic), и к фармацевтической композиции на основе соединений изобретения. 5 н. и 17 з.п. ф-лы.
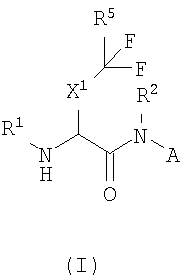
где А представляет собой 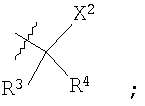
X1 представляет собой метилен;
X2 представляет собой CN, CHO, C(O)R6;
X6 представляет собой связь;
R1 представляет собой R13C(O)-;
R2 представляет собой водород;
R3 выбран из группы, состоящей из Н, фенил-(С0-6)алкила, (С1-6)алкила, необязательно замещенного группой -X6OR9;
R4 представляет собой Н или (С1-6)алкил; или R3 и R4 вместе с атомом углерода, с которым связаны R3 и R4, образуют (С3-8)циклоалкилен;
R5 представляет собой (С1-9)алкил, бензил;
R6 представляет собой 5-ти членный гетероарил с 2 или 3 гетероатомами, представляющими собой N, О, где R6 может быть необязательно замещен радикалом, независимо выбранными из группы, состоящей из (С1-9)алкила, (С3-7)циклоалкила, фенила, необязательно замещенного галогензамещенным (С1-6)алкоксилом или галогеном, 5-членного гетероарила с 1 или 2 гетероатомами, выбранными из N, О, S, необязательно замещенного (С1-6)алкилом; или бициклический 9-членный гетероарил с 2 гетероатомами, представляющими собой N, О;
R9 представляет собой (С1-6)алкил;
R13 представляет собой 6-7 членный гетероциклил с 2 гетероатомами, представляющими собой N, O,
и его соответствующие изомеры и смеси изомеров; а также фармацевтически приемлемые соли.
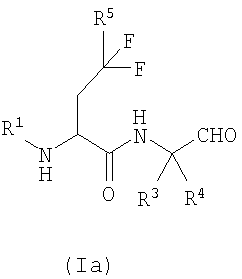
где R1, R3, R4 и R5 определены выше,
и его соответствующие изомеры и смеси изомеров; а также фармацевтически приемлемые соли.

где R1, R3, R4 и R5 определены выше,
и его соответствующие изомеры и смеси изомеров; а также фармацевтически приемлемые соли.
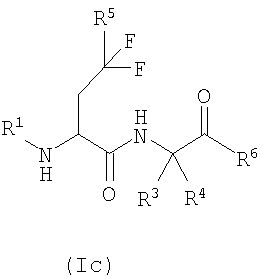
где R1, R3, R4, R5 и R6 определены выше,
и его соответствующие изомеры и смеси изомеров; а также фармацевтически приемлемые соли.
 .
. или СН3СН2СН2-.
или СН3СН2СН2-.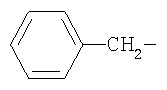 .
.{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(4-трифторметоксифенил)-1,3,4-оксадиазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{1-[1-(3-циклопропил[1,2,4]оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифтор-5-метилгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(3-циклопропил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(3-фенил-1,2,4-оксадиазол-5-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(5-фенил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{1-[1-(5-циклопропил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{3,3-дифтор-1-[1-(5-изопропилизоксазол-3-карбонил)пропилкарбамоил]гексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{1-[5-(5-метилизоксазол-3-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-1-[(S)-1-(оксазол-2-карбонил)пропилкарбамоил]-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-тиофен-2-илоксазол-2-карбонил)пропилкарбамоил]бутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)бутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
[1-(2-бензоксазол-2-ил-1-метоксиметил-2-оксоэтилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)-1-метилбутилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
[(S)-1-((S)-1-циано-3-фенилпропилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
[(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
[(S)-3,3-дифтор-1-((S)-1-формил-1-метилбутилкарбамоил)-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-этил[1,3,4]оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифтор-4-фенилбутил}амид морфолин-4-карбоновой кислоты,
{(S)-3,3-дифтор-4-фенил-1-[(S)-1-(5-фенил[1,2,4]оксадиазол-3-ил)пропилкарбамоил]бутил} амид морфолин-4-карбоновой кислоты,
сложный бензиловый эфир [(S)-1-(цианометилкарбамоил)-3,3-дифтор-4-фенилбутил]карбаминовой кислоты,
цианометиламид (S)-4,4-дифтор-5-фенил-2-(тетрагидропиран-4-иламино)пентановой кислоты,
цианометиламид (S)-4,4-дифтор-2-изобутиламино-5-фенилпентановой кислоты,
[(S)-1-((S)-1-бензолсульфонил-3-оксоазепан-4-илкарбамоил)-3,3-дифтор-4-фенилбутил]амид морфолин-4-карбоновой кислоты,
сложный трет-бутиловый эфир (S)-4-{(S)-4,4-дифтор-2-[(морфолин-4-карбонил)амино]-5-фенилпентаноиламино}-3-оксоазепан-1-карбоновой кислоты,
((S)-1-{(S)-1-[(5-этил-1,3,4-оксадиазол-2-ил)гидроксиметил]пропилкарбамоил}-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[1-(5-циклопропил-1,3,4-оксадиазол-2-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
{(S)-1-[l-(5-циклопропил-1,2,4-оксадиазол-3-карбонил)пропилкарбамоил]-3,3-дифторгексил}амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(R)-1-[5-(4-фторфенил)-1,2,4-оксадиазол-3-карбонил]пропилкарбамоил}бутил)амид морфолин-4-карбоновой кислоты,
{(S)-1-[(S)-1-(бензоксазол-2-карбонил)пропилкарбамоил]-3,3-дифторбутил}амид морфолин-4-карбоновой кислоты,
[(S)-1-(цианометилкарбамоил)-3,3-дифторгексил]амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(R)-1-[5-(5-метилтиофен-2-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты,
((S)-3,3-дифтор-1-{(S)-1-[5-(5-метилтиофен-2-ил)оксазол-2-карбонил]пропилкарбамоил}гексил)амид морфолин-4-карбоновой кислоты, и его соответствующие изомеры и смеси изомеров, а также фармацевтически приемлемые соли.
| ПРОИЗВОДНЫЕ ПИПЕРИДИН-КЕТОКАРБОНОВОЙ КИСЛОТЫ | 1997 |
|
RU2189974C2 |
| СПОСОБ ВОЗДЕЙСТВИЯ НА ВУЛКАНИЧЕСКУЮ СИСТЕМУ | 1996 |
|
RU2098850C1 |
| СПОСОБ КОНТРОЛЯ ГАЗОВОЙ НЕГЕРМЕТИЧНОСТИ ТВЭЛОВ ЯДЕРНОГО РЕАКТОРА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1990 |
|
RU2069901C1 |
| Устройство для преобразования постоянного тока в переменный | 1938 |
|
SU55125A1 |
| WO 03075836 А2, 18.09.2003. | |||
Авторы
Даты
2009-02-20—Публикация
2004-10-22—Подача