ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка испрашивает приоритет предварительной заявки на патент США № 62/345315, поданной 3 июня 2016 года, которая включена в данный документ во всей своей полноте для всех целей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится к замещенным пиридиновым соединениям, которые являются модуляторами белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), пригодными при лечении заболеваний и состояний, опосредованных и модулируемых CFTR. Настоящее изобретение также относится к композициям, содержащим соединения по настоящему изобретению, к способам их получения и способам лечения с их применением.
Описание известного уровня техники
[0003] Транспортеры ABC представляют собой семейство гомологичных мембранных белков-транспортеров, регулирующих транспорт широкого спектра фармакологических средств (например, лекарственных средств, ксенобиотиков, анионов и пр.), которые связывают и используют клеточный аденозинтрифосфат (ATP) для своих определенных видов активности. Некоторые из этих транспортеров, как было обнаружено, защищают злокачественные раковые клетки от химиотерапевтических средств, выступая в качестве белков множественной лекарственной устойчивости (подобно гликопротеину MDR1-P или белку множественной лекарственной устойчивости MRP 1). На данный момент идентифицированы 48 транспортеров ABC, сгруппированных в 7 семейств на основании их идентичности последовательностей и функции.
[0004] Транспортеры ABC обеспечивают защиту от вредоносных соединений из окружающей среды путем регуляции различных важных физиологических ролей в организме и, таким образом, представляют важные потенциальные мишени для лекарственных средств для лечения заболеваний, связанных с нарушениями в отношении транспортеров, транспортом лекарственных средств за пределы клетки, и других заболеваний, при которых может быть благоприятной модуляция активности транспортера ABC.
[0005] Опосредованный cAMP/ATP анионный канал, CFTR, является представителем семейства транспортеров ABC, обычно связанных с заболеваниями, который экспрессируется во множестве типов клеток, в том числе в абсорбирующих и секреторных клетках эпителия, где он регулирует поток анионов через мембрану, а также активность других ионных каналов и белков. Активность CFTR в клетках эпителия является крайне важной для поддержания транспорта электролитов во всем организме, в том числе в легочной и кишечной тканях (Quinton, P.M., 1990. Cystic fibrosis: a disease in electrolyte transport. FASEB J. 4, 2709-2717).
[0006] Ген, кодирующий CFTR, идентифицировали и секвенировали (Kerem, B., Rommens, J.M., Buchanan, J.A., Markiewicz, D., Cox, T.K., Chakravarti, A., Buchwald, M., Tsui, L.C., 1989. Identification of the cystic fibrosis gene: genetic analysis. Science 245, 1073-1080). CFTR содержит приблизительно 1480 аминокислот, которые кодируют белок, имеющий в составе тандемный повтор трансмембранных доменов, причем каждый содержит шесть трансмембранных спиралей и нуклеотидсвязывающий домен. Пара трансмембранных доменов связана большим полярным регуляторным (R)-доменом со множеством сайтов фосфорилирования, которые регулируют активность каналов и клеточный транспорт.
[0007] Муковисцидоз (CF) вызывается нарушением в этом гене, что индуцирует мутации в CFTR. Муковисцидоз является наиболее распространенным генетическим заболеванием со смертельным исходом у человека и поражает ~0,04% индивидуумов с белой кожей (Bobadilla, J.L., Macek, M., Jr, Fine, J.P., Farrell, P.M., 2002. Cystic fibrosis: a worldwide analysis of CFTR mutations--correlation with incidence data and application to screening. Hum. Mutat. 19, 575-606. doi:10.1002/humu.10041), например, в Соединенных Штатах поражен приблизительно один ребенок из 2500 детей, и у вплоть до 10 миллионов людей присутствует уникальная копия дефектного гена без видимых неблагоприятных последствий; кроме того, субъекты, носящие уникальную копию гена, имеют повышенную устойчивость к холере и к обезвоживанию из-за диареи. Этим эффектом можно объяснить относительно высокую частоту встречаемости CF-гена в популяции.
[0008] Напротив, индивидуумы с двумя копиями ассоциированного с CF гена страдают от истощающего и смертельного действия CF, в том числе от хронических легочных инфекций.
[0009] У пациентов с муковисцидозом мутации CFTR эндогенного дыхательного эпителия приводят к тому, что он не обеспечивает проницаемость для хлоридов и бикарбонатов в эпителиальные клетки легких и других тканей, что, таким образом, приводит к снижению апикальной секреции анионов и нарушениям ионного и флюидного транспорта. Такое сокращение анионного транспорта приводит к увеличенному накоплению слизи и патогенных агентов в легких, вызывая микробные инфекции, которые в конечном итоге приводят к смерти пациентов с CF.
[0010] Помимо респираторного заболевания пациенты с CF также страдают от проблем с желудочно-кишечным трактом и недостаточности поджелудочной железы, что при отсутствии лечения приводит к смерти. Кроме того, субъекты-женщины с муковисцидозом страдают от пониженной фертильности, тогда как мужчины с муковисцидозом - бесплодны.
[0011] При анализе последовательностей гена CFTR хромосом при CF был идентифицирован ряд вызывающих заболевание мутаций (Kerem, B., Rommens, J.M., Buchanan, J.A., Markiewicz, D., Cox, T.K., Chakravarti, A., Buchwald, M., Tsui, L.C., 1989. Identification of the cystic fibrosis gene: genetic analysis. Science 245, 1073-1080). ΔF508-CFTR, наиболее часто встречающаяся мутация при CF (присутствует по меньшей мере в 1 аллели у ~90% пациентов с CF) и проявляющаяся в примерно 70% случаев муковисцидоза, предусматривает одну делецию аминокислоты - фенилаланина 508. Эта делеция препятствует правильному сворачиванию образующегося белка, при этом белок, в свою очередь, не может выходить из эндоплазматического ретикулума (ER) и перемещаться в плазматическую мембрану, поэтому быстро разрушается. В результате количество каналов, присутствующих в мембране, намного меньше, чем в клетках, экспрессирующих CFTR дикого типа. Помимо ухудшенного транспорта, мутация приводит к нарушенному воротному механизму ионных каналов. Конечно, даже если ΔF508-CFTR может достичь цитоплазматической мембраны при низкотемпературном (27°C) высвобождении, где он может работать как активируемый cAMP хлоридный канал, его активность значительно снижается по сравнению с WT-CFTR (Pasyk, E.A., Foskett, J.K., 1995. Mutant (ΔF508) Cystic Fibrosis Transmembrane Conductance Regulator Cl- Channel Is Functional When Retained in Endoplasmic Reticulum of Mammalian Cells. J. Biol. Chem. 270, 12347-12350).
[0012] Также были идентифицированы другие мутации с меньшей частотой возникновения, которые изменяют регуляцию каналов или проводимость каналов. В случае мутантов регуляции каналов мутировавший белок должным образом транспортируется и локализуется в плазматической мембране, но при этом либо не может активироваться, либо не может функционировать в качестве хлоридного канала (например, в результате миссенс-мутаций, находящихся в нуклеотидсвязывающих доменах); примеры таких мутаций представляют собой G551D, G178R и G1349D. Белок CFTR, имеющий мутации, воздействующие на проводимость хлоридов, надлежащим образом переносится в клеточную мембрану, но при этом генерирует уменьшенный поток хлоридов (например, в результате миссенс-мутаций, находящихся в трансмембранном домене); примеры таких мутаций представляют собой R117H и R334W.
[0013] Помимо муковисцидоза, модуляция активности CFTR может быть благоприятной при других заболеваниях, не вызываемых непосредственно мутациями в CFTR, таких как, например, хроническое обструктивное заболевание легких (COPD), заболевание "сухого глаза" и синдром Шегрена.
[0014] COPD характеризуется прогрессирующим и необратимым снижением поступления воздуха, что происходит в результате повышенной секреции слизи, бронхиолита и эмфиземы. Возможное лечение повышенной секреции слизи и ослабленного мукоцилиарного клиренса, который часто встречается при COPD, может состоять в применении активаторов мутантного CFTR или CFTR дикого типа. В частности, увеличение секреции анионов через CFTR может облегчать флюидный транспорт в жидкость поверхности дыхательных путей для увлажнения слизи и оптимизации вязкости перицилиарной жидкости. Полученный повышенный мукоцилиарный клиренс будет способствовать ослаблению симптомов, связанных с COPD.
[0015] Заболевание "сухого глаза" характеризуется уменьшением слезоотделения и аномальными профилями липидов, белков и муцинов слезной пленки. Заболевание "сухого глаза" может быть вызвано множеством факторов, некоторые из которых включают возраст, артрит, хирургию глаз по технологии LASIK, химические/термические ожоги, лекарственные препараты, виды аллергии и заболевания, такие как муковисцидоз и синдром Шегрена. Увеличение секреции анионов посредством CFTR может повышать флюидный транспорт из эпителиальных клеток роговицы и секреторных желез, окружающих глаз, и в конечном счете улучшать увлажнение роговицы, таким образом способствуя ослаблению связанных с заболеванием "сухого глаза" симптомов. Синдром Шегрена представляет собой аутоиммунное заболевание, при котором иммунная система поражает влагопродуцирующие железы во всем организме, в том числе глаза, рот, кожу, легочную ткань, печень, влагалище и кишечник. Последующие симптомы включают сухость глаз, полости рта и влагалища, а также заболевание легких. Синдром Шегрена также связан с ревматоидным артритом, системной волчанкой, склеродермией и полимиозитом/дерматомиозитом. Причина заболевания, как считается, заключается в нарушенном транспорте белков, варианты лечения которого ограничены. Следовательно, модуляция активности CFTR может способствовать увлажнению различных органов и способствовать ослаблению связанных симптомов.
[0016] Помимо CF, нарушенный транспорт белков, индуцируемый ΔF508-CFTR, как было показано, является причиной широкого ряда других заболеваний, в частности заболеваний, где нарушенное функционирование эндоплазматического ретикулума (ER) может или препятствовать выходу белка CFTR из EP, и/или вызывать разрушение неправильно свернутого белка (Morello, J.-P., Bouvier, M., Petäjä-Repo, U.E., Bichet, D.G., 2000. Pharmacological chaperones: a new twist on receptor folding. Trends Pharmacol. Sci. 21, 466-469. doi:10.1016/S0165-6147(00)01575-3; Shastry, B.S., 2003. Neurodegenerative disorders of protein aggregation. Neurochem. Int. 43, 1-7. doi:10.1016/S0197-0186(02)00196-1; Zhang, W., Fujii, N., Naren, A.P., 2012. Recent advances and new perspectives in targeting CFTR for therapy of cystic fibrosis and enterotoxin-induced secretory diarrheas. Future Med. Chem. 4, 329-345. doi:10.4155/fmc.12.1).
[0017] Ряд генетических заболеваний связан с нарушенным процессингом в ER, что эквивалентно дефекту, наблюдаемому в CFTR при CF, такому как гликаноз CDG 1 типа, наследственная эмфизема (α-l-антитрипсин (вариант PiZ)), врожденный гипертиреоз, несовершенный остеогенез (проколлаген I, II или IV типа), наследственная гипофибриногенемия (фибриноген), недостаточность ACT (α-l-антихимотрипсин), несахарный диабет (DI), нейрогипофизарный DI (N2-рецептор гормона вазопрессина), нефрогенный DI (аквапорин II), синдром Шарко-Мари-Тута (периферический миелиновый белок 22), болезнь Пелицеуса-Мерцбахера, нейродегенеративные заболевания, такие как болезнь Альцгеймера (APP и пресенилины), болезнь Паркинсона, боковой амиотрофический склероз, прогрессирующий надъядерный паралич, болезнь Пика, некоторые полиглутаминовые неврологические нарушения, такие как болезнь Хантингтона, спиноцеребеллярная атаксия I типа, спинально-бульбарная мышечная атрофия, дентато-рубро-паллидо-льюисова атрофия и миотоническая дистрофия, а также виды губчатой энцефалопатии, такие как наследственная болезнь Крейтцфельда-Якоба (дефект процессинга прионного белка), болезнь Фабри (лизосомальная α-галактозидаза A), синдром Штраусслера-Шейнкера, хроническое обструктивное заболевание легких (COPD), заболевание "сухого глаза" и синдром Шегрена.
[0018] Помимо усиления активности CFTR, снижение секреции анионов модуляторами CFTR может быть благоприятным для лечения тех видов секреторной диареи, при которых транспорт воды в эпителии сильно повышается в результате активации транспорта хлоридов повышающим секрецию средством. Механизм предусматривает повышение уровня cAMP и стимуляцию CFTR.
[0019] Вне зависимости от причины чрезмерный транспорт хлоридов присутствует при всех видах диареи и приводит к обезвоживанию, ацидозу, ослабленному росту и смерти. Острые и хронические виды диареи остаются острой медицинской проблемой по всему миру и являются существенным фактором нарушения питания, приводя к смерти среди детей младше пяти лет (5000000 смертей/год). Кроме того, для пациентов с хроническими воспалительными заболеваниями кишечника (IBD) и/или синдромом приобретенного иммунодефицита (СПИД) диарея является опасным состоянием.
[0020] Следовательно, существует необходимость в новых соединениях, способных модулировать CFTR. В частности, в настоящем изобретении раскрываются соединения, которые могут выступать в качестве модуляторов CFTR для лечения муковисцидоза. В настоящем изобретении также предусматриваются способы получения таких соединений, фармацевтические композиции, содержащие такие соединения, и способы лечения муковисцидоза путем введения соединений по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0021] В одном аспекте в настоящем изобретении предусмотрены соединения формулы I и их фармацевтически приемлемые соли,
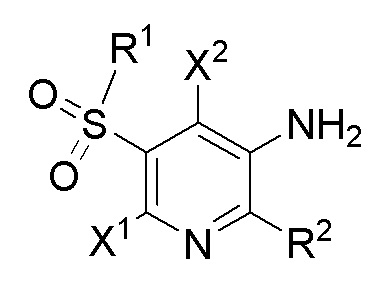
I
где
X1 и X2 независимо выбраны из
H;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
NR8AR8B;
-NR9AR9B;
циклопропила, необязательно замещенного одним или несколькими независимо выбранными группами R5;
фенокси, необязательно замещенного одной или несколькими независимо выбранными группами R5; или
фенила, необязательно замещенного одной или несколькими независимо выбранными группами R5;
R1 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, конденсированный с фенилом, при этом моноциклический гетероцикл и фенил необязательно замещены одной или несколькими независимо выбранными группами R5;
C3-7циклоалкил, необязательно замещенный одной или несколькими независимо выбранными группами R5; или
-NR6R7;
R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
каждая R4 независимо выбрана из группы, состоящей из:
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
каждая R5 независимо выбрана из группы, состоящей из:
OH;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C1-4алкокси, галогена или OH; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
R6 представляет собой H, C1-4алкил или C3-7циклоалкил, где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами R5;
R7 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
галогена;
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
каждая из R8a и R8b независимо выбрана из группы, состоящей из
H и
C1-4алкила;
R9a и R9b независимо выбраны из группы, состоящей из
H;
C1-4алкила и
C3-7циклоалкила; и
каждая R10 независимо выбрана из группы, состоящей из
C1-6алкила и
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
каждая R11 независимо выбрана из группы, состоящей из
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA; и
каждая RA независимо выбрана из группы, состоящей из
CN,
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена.
[0022] Другой аспект настоящего изобретения относится к фармацевтическим композициям, содержащим соединение по настоящему изобретению и фармацевтический носитель. Такие композиции можно вводить в соответствии со способом по настоящему изобретению, обычно как часть схемы лечения для лечения или предупреждения состояний и нарушений, связанных с активностью регулятора трансмембранной проводимости при муковисцидозе. В конкретном аспекте фармацевтические композиции могут также содержать дополнительные терапевтически активные ингредиенты, подходящие для применения в комбинации с соединениями по настоящему изобретению. В более конкретном аспекте дополнительный терапевтически активный ингредиент представляет собой средство для лечения муковисцидоза.
[0023] Кроме того, соединения по настоящему изобретению, пригодные в фармацевтических композициях и способах лечения, раскрытых в данном документе, являются фармацевтически приемлемыми в том виде, в каком они получены и применяются.
[0024] Еще один аспект настоящего изобретения относится к способу лечения или предупреждения состояний и нарушений, связанных с активностью регулятора трансмембранной проводимости при муковисцидозе у млекопитающих. Более конкретно, способ пригоден для лечения или предупреждения состояний и нарушений, связанных с муковисцидозом, синдромом Шегрена, недостаточностью поджелудочной железы, хроническим обструктивным заболеванием легких или хронической непроходимостью дыхательных путей. Следовательно, соединения и композиции по настоящему изобретению пригодны в качестве лекарственного препарата для лечения или предупреждения заболевания, модулируемого регулятором трансмембранной проводимости при муковисцидозе.
[0025] Соединения, композиции, содержащие такие соединения, способы получения соединений и способы лечения или предупреждения состояний и нарушений путем введения соединений также описаны в данном документе.
[0026] В конкретном аспекте предусмотрены соединения по настоящему изобретению для применения в лечении муковисцидоза. В конкретном аспекте предусмотрены соединения по настоящему изобретению для применения в лечении муковисцидоза, вызванного мутациями I, II, III, IV, V и/или VI классов.
[0027] В настоящем изобретении также предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению и подходящий фармацевтический носитель для применения в медицине. В конкретном аспекте фармацевтическая композиция предназначена для применения в лечении муковисцидоза.
[0028] Эти и другие цели настоящего изобретения описаны в следующих разделах. Эти цели не должны рассматриваться как сужающие объем настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0029] В данном документе описаны соединения формулы I,
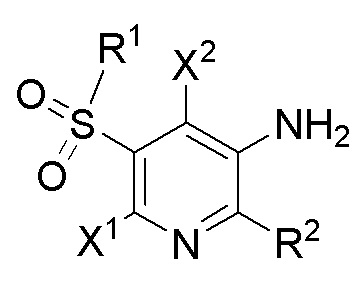
I
где X1, X2, R1 и R2 определены выше в кратком описании и ниже в подробном описании. Кроме того, также включены композиции, содержащие такие соединения, и способы лечения состояний и нарушений с применением таких соединений и композиций.
[0030] Соединения, включенные в данный документ, могут содержать одну или несколько переменных, которые встречаются больше одного раза в любом заместителе или в формулах в данном документе. Определение переменной в каждом случае не зависит от ее определения в другом случае. Кроме того, комбинации заместителей допустимы, только если такие комбинации приводят к стабильным соединениям. Стабильные соединения представляют собой соединения, которые можно выделить из реакционной смеси.
Определения
[0031] Следует отметить, что используемая в данном описании и прилагаемой формуле изобретения форма единственного числа включает ссылки на множественное число, если в контексте явно не указывается иное. Таким образом, например, ссылка на "соединение" включает одно соединение, а также одно или несколько одинаковых или различных соединений, ссылка на "фармацевтически приемлемый носитель" означает один фармацевтически приемлемый носитель, а также один или несколько фармацевтически приемлемых носителей и так далее.
[0032] При использовании в данном описании и прилагаемой формуле изобретения, если не указано иное, следующие термины имеют значение, представленное после них.
[0033] Термин "алкокси", используемый в данном документе, означает алкильную группу, определенную в данном документе, присоединенную к исходному фрагменту молекулы посредством атома кислорода. Типичные примеры алкокси включают без ограничения метокси, этокси, пропокси, 2-пропокси, бутокси, трет-бутокси, пентилокси и гексилокси. В некоторых случаях количество атомов углерода в алкоксифрагменте указано с помощью индекса "Cx-y", где x - минимальное, а y - максимальное количество атомов углерода в заместителе. Таким образом, например, "C1-6алкокси" означает алкоксизаместитель, содержащий 1-6 атомов углерода, и "C1-4алкокси" означает алкоксизаместитель, содержащий 1-4 атома углерода.
[0034] Термин "алкил", используемый в данном документе, означает насыщенный углеводородный радикал с прямой или разветвленной цепью. В некоторых случаях количество атомов углерода в алкильном фрагменте указано с помощью индекса "Cx-y", где x - минимальное, а y - максимальное количество атомов углерода в заместителе. Таким образом, например, "C1-6алкил" означает алкильный заместитель, содержащий от 1 до 6 атомов углерода, и "C1-4алкил" означает алкильный заместитель, содержащий от 1 до 4 атомов углерода. Примеры алкила включают без ограничения метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 3,3-диметилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-метилпропил, 2-метилпропил, 1-этилпропил и 1,2,2-триметилпропил.
[0035] Термин "C3-7циклоалкил", используемый в данном документе, означает циклопропил, циклобутил, циклопентил, циклогексил и циклогептил, при этом каждый из них необязательно замещен, если не указано иное.
[0036] Термин "C3-6циклоалкил", используемый в данном документе, означает циклопропил, циклобутил, циклопентил и циклогексил, при этом каждый из них необязательно замещен, если не указано иное.
[0037] Термин "C4-6циклоалкил", используемый в данном документе, означает циклобутил, циклопентил и циклогексил, при этом каждый из них необязательно замещен, если не указано иное.
[0038] Термин "галогено" или "галоген", используемый в данном документе, означает хлор (Cl), бром (Br), йод (I) и фтор (F).
[0039] Термин "моноциклический гетероцикл" или "моноциклический гетероциклический", используемый в данном документе, означает трех-, четырех-, пяти-, шести-, семи- или восьмичленное полностью насыщенное моноциклическое карбоциклическое кольцо, где один или несколько атомов углерода в кольце замещены гетероатомом, независимо выбранным из группы, состоящей из O, N и S. 3 и 4членные моноциклические гетероциклы содержат один атом углерода в кольце, который замещен гетероатомом, выбранным из группы, состоящей из O, N и S. 5, 6, 7 и 8членные моноциклические гетероциклы могут содержать один, два или три атома углерода в кольце, которые замещены гетероатомами, выбранными из группы, состоящей из O, N и S. Примеры пятичленных моноциклических гетероциклов включают гетероциклы, содержащие в кольце: 1 O; 1 S; 1 N; 2 N; 3 N; 1 S и 1 N; 1 S и 2 N; 1 O и 1 N; или 1 O и 2 N. Неограничивающие примеры 5-членных моноциклических гетероциклических групп включают 1,3-диоксоланил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, дигидротиенил, имидазолидинил, оксазолидинил, имидазолинил, изоксазолидинил, пиразолидинил, пиразолинил, пирролидинил, 2-пирролинил, 3-пирролинил, тиазолинил и тиазолидинил. Примеры шестичленного моноциклического гетероцикла включают гетероциклы, которые содержат в кольце: 1 O; 2 O; 1 S; 2 S; 1 N; 2 N; 3 N; 1 S, 1 O и 1 N; 1 S и 1 N; 1 S и 2 N; 1 S и 1 O; 1 S и 2 O; 1 O и 1 N; и 1 O и 2 N. Примеры 6-членных моноциклических гетероциклических групп включают тетрагидропиранил, дигидропиранил, 1,4-диоксанил, 1,4-дитианил, гексагидропиримидин, морфолинил, пиперазинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, тетрагидротиопиранил, тиоморфолинил, тиоксанил и тритианил. Типичные примеры моноциклических гетероциклов включают без ограничения азетидинил, азепанил, азиридинил, диазепанил, 1,4-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, оксетанил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидропиридинил, тетрагидропиранил, тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, тиопиранил и тритианил.
[0040] Термин "4-6-членный моноциклический гетероцикл" или "4-6-членный моноциклический гетероциклический", используемый в данном документе, означает 4-, 5- или 6-членный моноциклический гетероцикл, определенный в данном документе выше. Неограничивающие примеры 4-6-членного моноциклического гетероцикла включают азетидинил, оксетанил, 1,3-диоксоланил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, 1,4-диоксанил, пиперазинил, пиперидинил, тиоморфолинил и морфолинил.
[0041] Термин "3-6-членный моноциклический гетероцикл" или "3-6-членный моноциклический гетероциклический", используемый в данном документе, означает 3-, 4-, 5- или 6-членный моноциклический гетероцикл, определенный в данном документе выше. Неограничивающие примеры 3-6-членного моноциклического гетероцикла включают азиридинил, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, пиперазинил, пиперидинил, тиоморфолинил и морфолинил.
[0042] Термин "5-11-членный спирогетероцикл", используемый в данном документе, означает 3-6-членный моноциклический гетероцикл, где два заместителя при одном и том же атоме углерода 3-6-членного моноциклического гетероциклического кольца вместе с указанным атомом углерода образуют вторую кольцевую систему; причем вторая кольцевая система представляет собой C3-6циклоалкил или 3-6-членный моноциклический гетероцикл. Примеры 5-11-членного спирогетероцикла включают без ограничения 1-оксаспиро[4.4]нон-3-ил и 1-оксаспиро[4.5]декан-3-ил.
[0043] Термин "7-11-членный спирогетероцикл", используемый в данном документе, означает 4-6-членный моноциклический гетероцикл, где два заместителя при одном и том же атоме углерода 4-6-членного моноциклического гетероциклического кольца вместе с указанным атомом углерода образуют вторую кольцевую систему; причем вторая кольцевая система представляет собой C4-6циклоалкил или 4-6-членный моноциклический гетероцикл. Конкретные примеры 7-11-членных спирогетероциклов представляют собой 6-окса-2-азаспиро[3.5]нонил, 6-окса-2-азаспиро[3.4]октил и 2-окса-6-азаспиро[3.3]гептил.
[0044] Моноциклические гетероциклы и спирогетероциклы, в том числе типичные кольца, необязательно замещены и соединены с исходным фрагментом молекулы посредством любого атома углерода или любого атома азота, содержащегося в кольцевых системах, если не указано иное. Атомы азота в гетероциклических кольцах могут быть необязательно окислены или могут быть необязательно кватернизированы.
[0045] Термин "5-6 членный моноциклический гетероарил", используемый в данном документе, означает пяти- или шестичленную моноциклическую ароматическую кольцевую структуру, где один или несколько атомов углерода в кольце заменены гетероатомом(гетероатомами), независимо выбранным(выбранными) из группы, состоящей из O, N и S. Пятичленное кольцо содержит две двойные связи. 5-членное кольцо может также содержать один гетероатом, выбранный из группы, состоящей из O и S; или может содержать один, два, три или четыре атома азота и необязательно один атом кислорода или один атом серы. 6-членное кольцо содержит три двойные связи и один, два, три или четыре атома азота. Типичные примеры 5-6-членного моноциклического гетероарила включают, не ограничиваясь ими, фуранил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, 1,3-оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, 1,3-тиазолил, тиенил, триазолил и триазинил. 5-6-членные моноциклические гетероарилы, в том числе типичные кольца, необязательно замещены, если не указано иное, и соединены с исходным фрагментом молекулы посредством любого замещаемого атома углерода или любого замещаемого атома азота, содержащегося в кольцевых системах. Атом азота в гетероарильных кольцах может быть необязательно окислен и может быть необязательно кватернизован.
[0046] Термин "фенокси", используемый в данном документе, означает фенил, присоединенный к исходному фрагменту молекулы посредством атома кислорода.
[0047] Термин "гетероатом", используемый в данном документе, означает азот (N), кислород (O) или серу (S).
[0048] Термин "радиоактивно меченый" относится к соединению по настоящему изобретению, в котором по меньшей мере один из атомов является радиоактивным атомом или радиоактивным изотопом, при этом радиоактивный атом или изотоп самопроизвольно излучает гамма-лучи или энергетические частицы, например, альфа-частицы, или бета-частицы, или позитроны. Примеры таких радиоактивных атомов включают без ограничения 3H (тритий), 14C, 11C, 15O, 18F, 35S, 123I и 125I.
[0049] Если фрагмент описан как "замещенный", радикал, не являющийся водородом, находится на месте водородного радикала любого замещаемого атома данного фрагмента. Таким образом, например, замещенный гетероциклический фрагмент представляет собой гетероциклический фрагмент, в котором по меньшей мере один радикал, не являющийся водородом, находится на месте водородного радикала в гетероцикле. Следует отметить, что, если есть больше одного замещения при фрагменте, то каждый радикал, не являющийся водородом, может быть одинаковым или отличным (если не указано иное).
[0050] Если фрагмент описан как "необязательно замещенный", то фрагмент может являться либо (1) незамещенным, либо (2) замещенным. Если фрагмент описан как необязательно замещенный не более чем определенным количеством радикалов, не являющихся водородом, то этот фрагмент может быть либо (1) незамещенным, либо (2) замещенным не более чем таким определенным количеством радикалов, не являющихся водородом, или же максимальным количеством замещаемых положений при фрагменте, в зависимости от того, какое из них меньше. Таким образом, например, если фрагмент описан как гетероарил, необязательно замещенный не более чем 3 радикалами, не являющимися водородом, то любой гетероарил с менее чем 3 замещаемыми положениями будет необязательно замещен радикалами, не являющимися водородом, в количестве, не превышающем максимальное количество замещаемых положений, которые имеет гетероарил. В качестве примера тетразолил (который имеет только одно замещаемое положение) будет необязательно замещен не более чем одним радикалом, не являющимся водородом. В качестве дополнительного примера, если азот аминогруппы описан как необязательно замещенный не более чем 2 радикалами, не являющимися водородом, то азот первичной аминогруппы будет необязательно замещен не более чем 2 радикалами, не являющимися водородом, тогда как азот вторичной аминогруппы будет необязательно замещен всего лишь не более чем 1 радикалом, не являющимся водородом.
[0051] Термин "замещенный одним или несколькими" относится к одному-четырем заместителям. В одном варианте осуществления он относится к одному-трем заместителям. В дополнительных вариантах осуществления он относится к одному или двум заместителям. В еще одном варианте осуществления он относится к одному заместителю.
[0052] Термины "лечить", "осуществление лечения" и "лечение" относятся к способу облегчения или устранения заболевания и/или его сопутствующих симптомов. В определенных вариантах осуществления "лечить", "осуществление лечения" и "лечение" относятся к облегчению по меньшей мере одного физического параметра, который может не быть явным для субъекта. В еще одном варианте осуществления "лечить", "осуществление лечения" и "лечение" относятся к модуляции заболевания или нарушения, при этом либо физически (например, стабилизация явного симптома), либо физиологически (например, стабилизация физического параметра), либо обоими способами. В дополнительном варианте осуществления "лечить", "осуществление лечения" и "лечение" относятся к замедлению прогрессирования заболевания или нарушения.
[0053] Термины "предупреждать", "осуществление предупреждающих мер" и "предупреждение" относятся к способу осуществления предупреждающих мер в отношении возникновения заболевания и/или его сопутствующих симптомов или исключения возможности приобретения заболевания субъектом. Используемые в данном документе термины "предупреждать", "осуществление предупреждающих мер" и "предупреждение" также включают отсрочку возникновения заболевания и/или его сопутствующих симптомов и снижение для субъекта риска приобретения или развития заболевания или нарушения.
[0054] Фраза "терапевтически эффективное количество" означает количество соединения или его фармацевтически приемлемой соли, достаточное для предупреждения развития или для облегчения в некоторой степени одного или нескольких симптомов состояния или нарушения, лечение которых осуществляют, при введении отдельно или совместно с другим терапевтическим средством для лечения конкретного субъекта или группы субъектов. "Терапевтически эффективное количество" может изменяться в зависимости от соединения, заболевания и его тяжести, а также возраста, веса, состояния здоровья и т. д. субъекта, подлежащего лечению. Например, для людей или других млекопитающих терапевтически эффективное количество можно определять экспериментально в лабораторных или клинических условиях, или же оно может представлять собой количество, предусмотренное в указаниях Управления по контролю за продуктами и лекарствами США или эквивалентного иностранного учреждения в отношении конкретного заболевания и субъекта, лечение которого осуществляют.
[0055] Термин "субъект" определен в данном документе в отношении животных, таких как млекопитающие, в том числе без ограничения приматы (например, люди), коровы, овцы, козы, свиньи, лошади, собаки, кошки, кролики, крысы, мыши и т. д. В предпочтительных вариантах осуществления субъектом является человек. Термины "человек", "пациент" и "субъект" используются в данном документе взаимозаменяемо.
[0056] Используемый в данном документе термин "мутация(мутации) I класса" относится к мутациям, которые препятствуют синтезу белков. Они приводят к возникновению преждевременного сигнала терминации трансляции (стоп-кодон) в mRNA. Усеченные белки CFTR являются нестабильными и быстро разрушаются, поэтому совокупный эффект состоит в том, что белок отсутствует в апикальной мембране. В частности, мутация(мутации) I класса относится(относятся) к мутации p.Gly542X (G542X), W1282X, c.489+1G>T (621+1G>T) или c.579+1G>T (711+1G>T). Более конкретно мутация(мутации) I класса относится(относятся) к мутациям G542X или W1282X.
[0057] Используемый в данном документе термин "мутация(мутации) II класса" относится к мутациям, которые влияют на созревание белков. Они приводят к продуцированию белка CFTR, который не может правильно сворачиваться и/или транспортироваться в область его действия на апикальной мембране. В частности, мутация(мутации) II класса относится(относятся) к мутациям p.Phe508del (F508del), p.Ile507del или p.Asn1303Lys (N1303K). Более конкретно мутация(мутации) II класса относится(относятся) к мутациям F508del или N1303K.
[0058] Используемый в данном документе термин "мутация(мутации) III класса" относится к мутациям, которые изменяют регуляцию канала CFTR. Мутировавший белок CFTR надлежащим образом транспортируется и локализуется в плазматической мембране, но не может быть активирован или не может функционировать в качестве хлоридного канала. В частности, термин "мутация(мутации) III класса" относится к мутациям p.Gly551Asp (G551D), G551S, R553G; G1349D; S1251N, G178R, S549N. Более конкретно, мутация(мутации) III класса относится(относятся) к мутациям G551D, R553G, G1349D, S1251N, G178R или S549N.
[0059] Используемый в данном документе термин "мутация(мутации) IV класса" относится к мутациям, которые влияют на проводимость хлоридов. Белок CFTR надлежащим образом транспортируется в клеточную мембрану, но генерирует уменьшенный поток хлоридов или "нарушение воротного механизма" (большинство являются миссенс-мутациями, расположенными в трансмембранном домене). В частности, мутация(мутации) IV класса относится(относятся) к мутациям p.Arg117His (R117H), R347P или p.Arg334Trp (R334W).
[0060] Используемый в данном документе термин "мутация(мутации) V класса" относится к мутациям, которые снижают уровень нормально функционирующего CFTR в апикальной мембране или приводят к "нарушению проводимости" (например, частично аберрантные мутации при сплайсинге или миссенс-мутации, приводящие к неэффективному транспорту). В частности, мутация(мутации) V класса относится(относятся) к мутациям c.1210-12T[5] (5T аллель), c.S3140-26A>G (3272-26A>G), c.3850-2477C>T (3849+10kbC>T).
[0061] Используемый в данном документе термин "мутация(мутации) VI класса" относится к мутациям, которые снижают стабильность имеющегося CFTR, или которые влияют на регуляцию других каналов, приводя к присущей нестабильности белка CFTR. По сути, будучи все еще функциональным, белок CFTR является нестабильным на поверхности клеток и он быстро удаляется и разрушается клеточными механизмами. В частности, мутация(мутации) VI класса относится(относятся) к мутациям Rescued F508del, 120del23, N287Y, 4326dellTC или 4279insA. Более конкретно мутация(мутации) VI класса относится(относятся) к мутациям Rescued F508del.
Соединения
[0062] Соединения по настоящему изобретению характеризуются общей формулой I, описанной выше.
[0063] Конкретные значения переменных групп приведены ниже. Такие значения можно использовать при необходимости в отношении любого из других значений, определений, пунктов формулы изобретения или вариантов осуществления, определенных выше или ниже по тексту.
[0064] Определенные варианты осуществления относятся к соединениям формулы I,
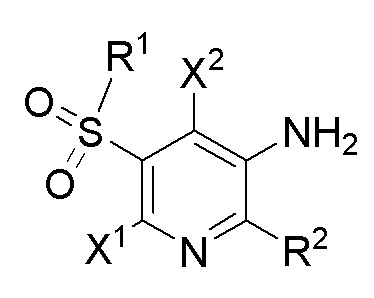
I
где
X1 и X2 независимо выбраны из
H;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
NR8AR8B;
-NR9AR9B;
циклопропила, необязательно замещенного одним или несколькими независимо выбранными группами R5;
фенокси, необязательно замещенного одной или несколькими независимо выбранными группами R5; или
фенила, необязательно замещенного одной или несколькими независимо выбранными группами R5;
R1 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, конденсированный с фенилом, при этом моноциклический гетероцикл и фенил необязательно замещены одной или несколькими независимо выбранными группами R5;
C3-7циклоалкил, необязательно замещенный одной или несколькими независимо выбранными группами R5; или
-NR6R7;
R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
каждая R4 независимо выбрана из группы, состоящей из:
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
каждая R5 независимо выбрана из группы, состоящей из:
OH;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C1-4алкокси, галогена или OH; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
R6 представляет собой H, C1-4алкил или C3-7циклоалкил, где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами R5;
R7 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
галогена;
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
каждая из R8a и R8b независимо выбрана из группы, состоящей из
H и
C1-4алкила;
R9a и R9b независимо выбраны из группы, состоящей из
H;
C1-4алкила и
C3-7циклоалкила; и
каждая R10 независимо выбрана из группы, состоящей из
C1-6алкила и
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
каждая R11 независимо выбрана из группы, состоящей из
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA; и
каждая RA независимо выбрана из группы, состоящей из
CN,
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена.
[0065] Определенные варианты осуществления относятся к соединениям формулы I,
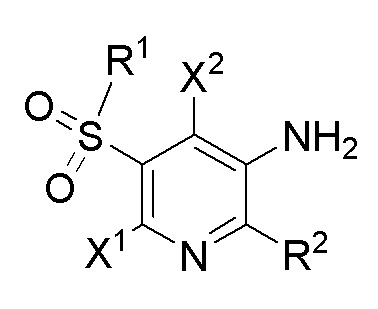
I
где
X1 и X2 независимо выбраны из
H;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
NR8AR8B;
-NR9AR9B;
циклопропила, необязательно замещенного одним или несколькими независимо выбранными группами R5;
фенокси, необязательно замещенного одной или несколькими независимо выбранными группами R5; или
фенила, необязательно замещенного одной или несколькими независимо выбранными группами R5;
R1 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, конденсированный с фенилом, при этом моноциклический гетероцикл и фенил необязательно замещены одной или несколькими независимо выбранными группами R5;
C3-7циклоалкил, необязательно замещенный одной или несколькими независимо выбранными группами R5; или
-NR6R7;
R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
циклопропила;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенила;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из циклопропила, галогена или OCH3;
OR11;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
C3-7циклоалкила; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
каждая R4 независимо выбрана из группы, состоящей из:
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
каждая R5 независимо выбрана из группы, состоящей из:
OH;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C1-4алкокси, галогена или OH; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
R6 представляет собой H, C1-4алкил или C3-7циклоалкил, где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами R5;
R7 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
галогена;
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
каждая из R8a и R8b независимо выбрана из группы, состоящей из
H и
C1-4алкила;
R9a и R9b независимо выбраны из группы, состоящей из
H;
C1-4алкила и
C3-7циклоалкила; и
каждая R10 независимо выбрана из группы, состоящей из
C1-6алкила и
фенила; и
каждая R11 независимо выбрана из группы, состоящей из
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
C3-7циклоалкила; и
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
галогена.
[0066] В определенных вариантах осуществления формулы I R1 представляет собой фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4.
[0067] В определенных вариантах осуществления формулы I R1 представляет собой фенил, необязательно замещенный одной, двумя или тремя независимо выбранными группами R4.
[0068] В определенных вариантах осуществления формулы I R1 представляет собой фенил, который является незамещенным.
[0069] В определенных вариантах осуществления формулы I R1 представляет собой фенил, замещенный одной или двумя независимо выбранными группами R4.
[0070] В определенных вариантах осуществления формулы I R1 представляет собой фенил, замещенный одной независимо выбранной группой R4.
[0071] В определенных вариантах осуществления формулы I каждая R4 независимо выбрана из группы, состоящей из фтора; C1-4алкила, необязательно замещенного 1, 2 или 3 атомами фтора; и C1-4алкокси, необязательно замещенного 1, 2 или 3 атомами фтора.
[0072] В определенных вариантах осуществления формулы I каждая R4 независимо выбрана из группы, состоящей из C1-4алкила, необязательно замещенного 1, 2 или 3 атомами фтора; и C1-4алкокси, необязательно замещенного 1, 2 или 3 атомами фтора.
[0073] В определенных вариантах осуществления формулы I каждая R4 выбрана из группы, состоящей из F, -CH3, CH(CH3)2, t-Bu, -CF3, -OCH3, OCH(CH3)2 и -OCF3. В некоторых вариантах осуществления формулы I R4 выбран из группы, состоящей из F, -CF3 и -OCF3. В некоторых вариантах осуществления формулы I R4 представляет собой CH(CH3)2. В некоторых вариантах осуществления формулы I R4 представляет собой F. В некоторых вариантах осуществления формулы I R4 представляет собой CF3. В некоторых вариантах осуществления формулы I R4 представляет собой -OCF3.
[0074] В определенных вариантах осуществления формулы I R1 представляет собой фенил, замещенный одним -OCF3.
[0075] В определенных вариантах осуществления формулы I R1 представляет собой N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, при этом моноциклический гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами R5.
[0076] В определенных вариантах осуществления формулы I R1 представляет собой N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1 или 2 гетероатома, независимо выбранных из группы, состоящей из N и O, при этом моноциклический гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I каждая R5 независимо выбрана из группы, состоящей из F, CH3, -CH(CH3)2, t-Bu, -CF3, -OCH3 и -OCF3. В некоторых данных вариантах осуществления формулы I каждая R5 независимо выбрана из группы, состоящей из F, -CH3, t-Bu, -CF3, -OCH3, CH2OH и -OCF3.
[0077] В определенных вариантах осуществления формулы I R1 представляет собой азетидинил, пирролидинил, морфолинил или пиперидинил, при этом каждый из них необязательно замещен 1 или 2 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I каждая R5 независимо выбрана из группы, состоящей из F, -CH3, CH(CH3)2, t-Bu, CF3, OCH3 и -OCF3.
[0078] В определенных вариантах осуществления формулы I R1 представляет собой пиперидинил, который необязательно замещен 1 или 2 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I каждая R5 независимо выбрана из группы, состоящей из F, CH3, t-Bu, CF3, OCH3 и -OCF3. В некоторых данных вариантах осуществления R1 представляет собой пиперидинил, замещенный двумя группами, представляющими собой фтор. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной группой, представляющей собой фтор. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной метильной группой. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный двумя метильными группами. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной группой CF3. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной группой OCH3. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной группой OCF3. В некоторых данных вариантах осуществления формулы I R1 представляет собой пиперидинил, замещенный одной группой tBu.
[0079] В определенных вариантах осуществления формулы I R1 представляет собой N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, конденсированный с фенилом, при этом моноциклический гетероцикл и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I R1 представляет собой 3,4-дигидро-2H-бензо[b][1,4]оксазинил, необязательно замещенный 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I R1 представляет собой незамещенный 3,4-дигидро-2H-бензо[b][1,4]оксазинил.
[0080] В определенных вариантах осуществления формулы I R1 представляет собой C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или 4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N. В некоторых данных вариантах осуществления формулы I R1 представляет собой C1-4алкил, который является незамещенным. В некоторых данных вариантах осуществления формулы I R1 представляет собой C1-4алкил, который замещен OH. В некоторых данных вариантах осуществления формулы I R1 представляет собой C1-4алкил, который замещен C1-4алкокси. В некоторых данных вариантах осуществления формулы I R1 представляет собой C1-4алкил, который замещен 4-6-членным моноциклическим гетероциклом, содержащим 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N. В некоторых данных вариантах осуществления формулы I R1 представляет собой CH2CH3. В некоторых данных вариантах осуществления формулы I R1 представляет собой CH2CH2OH. В некоторых данных вариантах осуществления формулы I R1 представляет собой CH(CH3)2. В некоторых данных вариантах осуществления R1 представляет собой CH2CH2OCH3. В некоторых данных вариантах осуществления формулы I R1 представляет собой C1алкил, замещенный тетрагидрофураном.
[0081] В определенных вариантах осуществления формулы I R1 представляет собой C3-7циклоалкил, необязательно замещенный одной или несколькими независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил. В некоторых данных вариантах осуществления формулы I R1 представляет собой циклопентил.
[0082] В определенных вариантах осуществления формулы I R1 представляет собой -NR6R7.
[0083] В определенных вариантах осуществления формулы I R1 представляет собой -NR6R7; где
R6 представляет собой H, CH3 или циклопропил; где циклопропил необязательно замещен 1 или 2 независимо выбранными группами R5; и
R7 представляет собой
C1-4алкил;
C1-4алкил, замещенный 1, 2 или 3 атомами фтора;
C1-4алкил, замещенный одним фенилом, где фенил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из
фтора;
C1-4алкила, необязательно замещенного 1, 2 или 3 атомами фтора; или
C1-4алкокси, необязательно замещенного 1, 2 или 3 атомами фтора;
C2-4алкил, замещенный одним C1-4алкокси; или
C1-4алкил, замещенный одним 4-6-членным моноциклическим гетероциклом, содержащим 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; причем моноциклический гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами R5.
[0084] В определенных вариантах осуществления формулы I R1 представляет собой -NR6R7; где
R6 представляет собой H, CH3, циклобутил или циклопропил; где циклобутил и циклопропил необязательно замещены 1 или 2 независимо выбранными группами R5; и
R7 представляет собой
C1-4алкил;
C1-4алкил, замещенный 1, 2 или 3 атомами фтора;
C1-4алкил, замещенный одним фенилом, где фенил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из
фтора;
C1-4алкила, необязательно замещенного 1, 2 или 3 атомами фтора; или
C1-4алкокси, необязательно замещенного 1, 2 или 3 атомами фтора;
C2-4алкил, замещенный одним C1-4алкокси; или
C1-4алкил, замещенный одним 4-6-членным моноциклическим гетероциклом, содержащим 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; причем моноциклический гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами R5.
[0085] В определенных вариантах осуществления формулы I R7 представляет собой C1-4алкил, замещенный одним фенилом, где фенил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из CF3, фтора или C1-4алкокси. В некоторых данных вариантах осуществления R7 представляет собой C1-4алкил, замещенный одним фенилом, где фенил является незамещенным.
[0086] В определенных вариантах осуществления формулы I X1 представляет собой H; галоген; C1-4алкил, необязательно замещенный одним или несколькими независимо выбранными атомами галогена; C1-4алкокси, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или NR11AR11B; NR12AR12B; необязательно замещенный циклопропил; необязательно замещенный фенокси или необязательно замещенный фенил.
[0087] В определенных вариантах осуществления формулы I R1 представляет собой -NR6R7; где
R6 представляет собой CH3; и
R7 представляет собой
C1-4алкил, замещенный одним фенилом, где фенил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из
фтора;
C1-4алкила, необязательно замещенного 1, 2 или 3 атомами фтора; или
C1-4алкокси, необязательно замещенного 1, 2 или 3 атомами фтора;
C2-4алкил, замещенный одним C1-4алкокси; или
C1-4алкил, замещенный одним 4-6-членным моноциклическим гетероциклом, содержащим 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; причем моноциклический гетероцикл необязательно замещен 1, 2 или 3 независимо выбранными группами R5.
[0088] В определенных вариантах осуществления формулы I R1 представляет собой -NR6R7; где
R6 представляет собой CH3; и
R7 представляет собой C1-4алкил, замещенный одним фенилом. В некоторых данных вариантах осуществления R1 представляет собой -NR6R7; где R6 представляет собой CH3; и R7 представляет собой C1-4алкил, замещенный одним фенилом.
[0089] В определенных вариантах осуществления формулы I X1 и X2 независимо выбраны из H, галогена, необязательно замещенного циклопропила или необязательно замещенного фенила.
[0090] В определенных вариантах осуществления формулы I X1 и X2 независимо выбраны из H, галогена или незамещенного циклопропила.
[0091] В определенных вариантах осуществления формулы I каждый из X1 и X2 представляет собой H.
[0092] В определенных вариантах осуществления формулы I X1 представляет собой H; и X2 представляет собой Cl. В определенных вариантах осуществления формулы I X1 представляет собой H; и X2 представляет собой Br.
[0093] В определенных вариантах осуществления формулы I X1 представляет собой Cl; и X2 представляет собой H. В определенных вариантах осуществления формулы I X1 представляет собой Br; и X2 представляет собой H.
[0094] В определенных вариантах осуществления формулы I каждый из X1 и X2 независимо выбран из H, брома, NR12AR12B, C1-4алкокси, циклопропила, фенокси или фенила; при этом циклопропил, фенокси и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5, и при этом C1-4алкокси необязательно замещен одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или NR11AR11B. В некоторых данных вариантах осуществления формулы I циклопропил является незамещенным. В некоторых данных вариантах осуществления формулы I фенил и фенокси замещены F.
[0095] В определенных вариантах осуществления формулы I каждый из X1 и X2 представляет собой H, бром, циклопропил или фенил; при этом циклопропил и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I циклопропил является незамещенным.
[0096] В определенных вариантах осуществления формулы I X1 представляет собой бром.
[0097] В определенных вариантах осуществления формулы I X2 представляет собой бром.
[0098] В определенных вариантах осуществления формулы I X1 представляет собой циклопропил или фенил; при этом циклопропил и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5, и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I циклопропил является незамещенным.
[0099] В определенных вариантах осуществления формулы I X1 представляет собой циклопропил, фенокси или фенил; при этом циклопропил, фенокси и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5, и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I циклопропил является незамещенным.
[00100] В определенных вариантах осуществления формулы I X1 представляет собой незамещенный циклопропил или фенил, замещенный одним атомом фтора; и X2 представляет собой H.
[00101] В определенных вариантах осуществления формулы I X1 представляет собой незамещенный циклопропил, фенил, замещенный одним атомом фтора, или фенокси, замещенный одним атомом фтора; и X2 представляет собой H.
[00102] В определенных вариантах осуществления формулы I X1 представляет собой незамещенный циклопропил; и X2 представляет собой H.
[00103] В определенных вариантах осуществления формулы I X1 представляет собой фенил, замещенный одним атомом фтора; и X2 представляет собой H.
[00104] В определенных вариантах осуществления формулы I X1 представляет собой фенокси, замещенный одним атомом фтора; и X2 представляет собой H.
[00105] В определенных вариантах осуществления формулы I X1 представляет собой C1-4алкокси, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или NR11AR11B; и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I R11A и R11B представляют собой H или C1-4алкил. В некоторых данных вариантах осуществления формулы I как R11A, так и R11B представляет собой CH3.
[00106] В определенных вариантах осуществления формулы I X1 представляет собой C1-4алкокси, который является незамещенным; и X2 представляет собой H. В некоторых данных вариантах осуществления X1 представляет собой OCH3.
[00107] В определенных вариантах осуществления формулы I X1 представляет собой C1-4алкокси, который замещен C1-4алкокси; и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I X1 представляет собой OCH2CH2OCH3.
[00108] В определенных вариантах осуществления формулы I X1 представляет собой C1-4алкокси, который замещен NR11AR11B; и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I R11A и R11B представляют собой H или C1-4алкил. В некоторых данных вариантах осуществления формулы I как R11A, так и R11B представляет собой CH3.
[00109] В определенных вариантах осуществления формулы I X1 представляет собой -NR12AR12B; и X2 представляет собой H. В некоторых данных вариантах осуществления формулы I R12A и R12B представляют собой H, C1-4алкил или C3-7циклоалкил. В некоторых данных вариантах осуществления формулы I как R12A, так и R12B представляет собой CH3. В некоторых данных вариантах осуществления формулы I R12A представляет собой H, и R12B представляет собой циклопропил.
[00110] В определенных вариантах осуществления формулы I R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA.
[00111] В определенных вариантах осуществления формулы I R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I моноциклический гетероарил является незамещенным. В некоторых данных вариантах осуществления формулы I моноциклический гетероарил необязательно замещен одной независимо выбранной R3. В некоторых данных вариантах осуществления формулы I моноциклический гетероарил замещен одной независимо выбранной R3.
[00112] В определенных вариантах осуществления формулы I R2 представляет собой 5-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I R2 представляет собой имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиразолил, тиадиазолил или тиазолил; при этом имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиразолил, тиадиазолил и тиазолил необязательно замещены одной или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиразолил, тиадиазолил и тиазолил являются незамещенными. В некоторых данных вариантах осуществления формулы I имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиразолил, тиадиазолил и тиазолил необязательно замещены одним или двумя независимо выбранными R3. В некоторых данных вариантах осуществления формулы I имидазолил, изоксазолил, изотиазолил, оксадиазолил, оксазолил, пиразолил, тиадиазолил и тиазолил замещены одним или двумя независимо выбранными R3. В некоторых данных вариантах осуществления формулы I R2 представляет собой оксадиазолил или тиазолил; при этом оксадиазолил или тиазолил замещены одной независимо выбранной R3. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный оксадиазолил. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный тиазолил. В некоторых данных вариантах осуществления формулы I R2 представляет собой 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-тиадиазолил или тиазолил; при этом 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-тиадиазолил и тиазолил необязательно замещены одним или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I R2 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-тиадиазолил и тиазолил необязательно замещены одним или двумя независимо выбранными R3. В некоторых данных вариантах осуществления формулы I R2 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-тиадиазолил и тиазолил замещены одним или двумя независимо выбранными R3. В некоторых данных вариантах осуществления формулы I R2 1,3,4-оксадиазолил, 1,2,4-оксадиазолил, 1,3,4-тиадиазолил и тиазолил замещены одной независимо выбранной R3. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный 1,3,4-оксадиазолил. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный 1,2,4-оксадиазолил. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный 1,3,4-тиадиазолил. В некоторых данных вариантах осуществления формулы I R2 представляет собой замещенный тиазолил.
[00113] В определенных вариантах осуществления формулы I R2 представляет собой 6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I R2 представляет собой пиридинил, пиримидинил, пиридазинил или пиразинил; при этом пиридинил, пиримидинил, пиридазинил и пиразинил необязательно замещены одним или несколькими независимо выбранными группами R3. В некоторых данных вариантах осуществления формулы I пиридинил, пиримидинил, пиридазинил и пиразинил являются незамещенными. В некоторых данных вариантах осуществления формулы I пиридинил, пиримидинил, пиридазинил и пиразинил необязательно замещены одним или двумя независимо выбранными R3. В некоторых данных вариантах осуществления формулы I пиридинил, пиримидинил, пиридазинил и пиразинил замещены одним или двумя независимо выбранными R3.
[00114] В определенных вариантах осуществления формулы I каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA;
5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами RA;
C3-7циклоалкила; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA.
[00115] В определенных вариантах осуществления формулы I каждая R3 независимо выбрана из группы, состоящей из:
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенила;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
NHC(=S)R11 или
OP(O)(OH)(OH);
C(O)NH2;
C3-7циклоалкила; и
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N.
[00116] В определенных вариантах осуществления формулы I каждая R3 независимо представляет собой C(O)NH2.
[00117] В некоторых вариантах осуществления формулы I каждая R3 независимо представляет собой C3-7циклоалкил. В некоторых вариантах осуществления формулы I каждая R3 независимо представляет собой C6циклоалкил.
[00118] В определенных вариантах осуществления формулы I R3 независимо представляет собой 4-6-членный моноциклический гетероцикл, содержащий 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой тетрагидрофуранил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой тетрагидропиранил.
[00119] В определенных вариантах осуществления формулы I каждая R3 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
C3-7циклоалкила;
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенила;
C1-4алкокси, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3;
OR11;
OH;
галогена;
NHC(=S)R11 или
OP(O)(OH)(OH).
[00120] В определенных вариантах осуществления формулы I каждая R3 независимо представляет собой C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, галогена или OP(O)(OH)(OH). В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, который является незамещенным. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C(CH3)3. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OH. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH2OH.. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH2CH2OH. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH(OH)CH3. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C(OH)(CH3)2. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH(OH)CF3. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OP(O)(OH)(OH). В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1алкил, замещенный одним OP(O)(OH)(OH). В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OH и тремя F. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C2алкил, замещенный одним OH и тремя F. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C3алкил, замещенный одним OH и тремя F.
[00121] В определенных вариантах осуществления формулы I каждая R3 независимо представляет собой необязательно замещенный C1-4алкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним C1-4алкокси и одним фенилом. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH(OCH3)фенил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним C1-4алкокси, где C1-4алкокси необязательно замещен одним или несколькими заместителями, независимо выбранными из C3-7циклоалкила, галогена или OCH3. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH(OCH3)CH3. В некоторых данных вариантах осуществления R3 независимо представляет собой C(OCH3)(CH3)2. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2OCH3. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2CH2OCH3. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2OCH2CH3. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2OCF3. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2OCHF2. В некоторых данных вариантах осуществления формулы I R3 представляет собой CH2OCH2CH2OCH3. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним C1-4алкокси; где C1-4алкокси необязательно замещен одним или несколькими независимо выбранными C3-7циклоалкилами. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой 
[00122] В определенных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11; и каждая R11 независимо выбрана из группы, состоящей из 4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; 5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N; C3-7циклоалкила и фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11; и R11 независимо представляет собой фенил; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой  . В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой
. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой  . В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11, и R11 независимо представляет собой C3-7циклоалкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH2O-C5циклоалкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11, и R11 независимо представляет собой 4-6-членный моноциклический гетероцикл, содержащий 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой
. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11, и R11 независимо представляет собой C3-7циклоалкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой CH2O-C5циклоалкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним OR11, и R11 независимо представляет собой 4-6-членный моноциклический гетероцикл, содержащий 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой  .
.
[00123] В определенных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним C3-7циклоалкилом; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним C3-7циклоалкилом; где C3-7циклоалкил является незамещенным. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1алкил, замещенный одним C3циклоалкилом; где C3циклоалкил является незамещенным.
[00124] В определенных вариантах осуществления формулы I R3 независимо представляет собой C3-7циклоалкил; где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C3-7циклоалкил; где C3-7циклоалкил является незамещенным. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой циклопропил.
[00125] В определенных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним NHC(=S)R11; и каждая R11 независимо выбрана из группы, состоящей из 4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; 5-6-членного моноциклического гетероарила, содержащего 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N; C3-7циклоалкила и фенила; где фенил необязательно замещен одной или несколькими независимо выбранными группами RA; и каждая RA представляет собой независимо выбранный галоген. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним NHC(=S)R11; и каждая R11 независимо представляет собой C3-7циклоалкил. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1алкил, замещенный одним NHC(=S)R11; и каждая R11 независимо представляет собой циклопропил.
[00126] В определенных вариантах осуществления формулы I R3 независимо представляет собой C1-4алкил, замещенный одним 4-6-членным моноциклическим гетероциклом, содержащим 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами RA. В некоторых данных вариантах осуществления формулы I R3 независимо представляет собой C1алкил, замещенный тетрагидрофуранилом.
[00127] В определенных вариантах осуществления формулы I R2 представляет собой 5-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной независимо выбранной R3; где R3 независимо представляет собой C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, галогена или OP(O)(OH)(OH). В некоторых данных вариантах осуществления формулы I R2 представляет собой оксадиазолил или тиазолил, при этом оксадиазолил или тиазолил замещены одной независимо выбранной R3; где R3 независимо представляет собой C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, галогена или OP(O)(OH)(OH).
[00128] В данный документ включены соединения формулы I-a или их фармацевтически приемлемые соли,
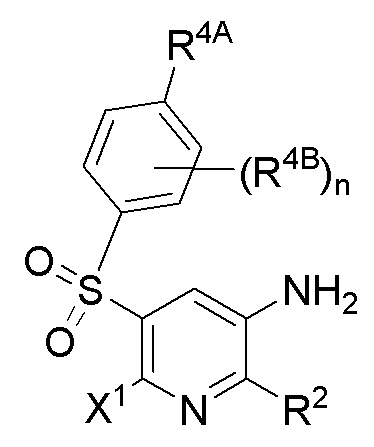
I-a
где n равняется 0, 1 или 2, R4A представляет собой H, F, CH3, -CH(CH3)2, t-Bu, CF3, -OCH3, -O-CH(CH3)2 или -OCF3, каждая R4B независимо представляет собой F или -OCF3, и X1 и R2 определены в данном документе в кратком описании и вариантах осуществления для формул I и I-b.
[00129] В определенных вариантах осуществления формулы I-a X1 представляет собой H.
[00130] В определенных вариантах осуществления формулы I-a n равняется 0 или 1. В определенных вариантах осуществления формулы I-a n равняется 0. В определенных вариантах осуществления формулы I-a n равняется 1.
[00131] В определенных вариантах осуществления формулы I-a R4A представляет собой H, -CH(CH3)2, -O-CH(CH3)2, t-Bu, CH3, -OCH3, F, CF3 или -OCF3.
[00132] В определенных вариантах осуществления формулы I-a R4A представляет собой H, F, CF3 или -OCF3.
[00133] В определенных вариантах осуществления формулы I-a R4A представляет собой F, CF3 или -OCF3.
[00134] В определенных вариантах осуществления формулы I-a n равняется 0 или 1, R4A представляет собой F, CF3 или -OCF3, и R4B представляет собой F.
[00135] В определенных вариантах осуществления формулы I-a R4A представляет собой F.
[00136] В определенных вариантах осуществления формулы I-a n равняется 0, и R4A представляет собой F.
[00137] В определенных вариантах осуществления формулы I-a n равняется 0, и R4A представляет собой -OCF3.
[00138] В определенных вариантах осуществления формулы I-a n равняется 0, и R4A представляет собой H.
[00139] В определенных вариантах осуществления формулы I-a X1 представляет собой H; n равняется 0; R4A представляет собой OCF3; R2 представляет собой 1,3,4-оксадиазолил или тиазолил, замещенные одной R3; и R3 представляет собой C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH; галогена или OP(O)(OH)(OH).
[00140] В данный документ включены соединения формулы I-b или их фармацевтически приемлемые соли,

I-b
где X1, R1 и R2 определены в данном документе ниже и в кратком описании и вариантах осуществления для формулы I.
[00141] Определенные варианты осуществления относятся к соединениям формулы I-b,
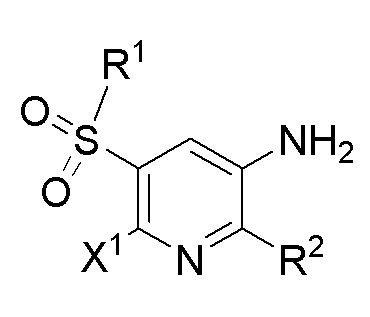
I-b
где
X1 представляет собой
H;
галоген;
C1-4алкил, необязательно замещенный одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
NR8AR8B;
NR9AR9B;
циклопропил, необязательно замещенный одной или несколькими независимо выбранными группами R5;
фенокси, необязательно замещенный одной или несколькими независимо выбранными группами R5; или
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R5;
R1 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
C1-4алкокси или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N;
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
N-связанный 4-6-членный моноциклический гетероцикл, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из N, O и S, конденсированный с фенилом, при этом моноциклический гетероцикл и фенил необязательно замещены одной или несколькими независимо выбранными группами R5;
C3-7циклоалкил, необязательно замещенный одной или несколькими независимо выбранными группами R5; или
NR6R7;
R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
OH;
галогена;
CN;
OC(O)R10;
OS(O)2OH или
OP(O)(OH)(OH);
каждая R4 независимо выбрана из группы, состоящей из:
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
каждая R5 независимо выбрана из группы, состоящей из:
OH;
галогена;
C1-4алкила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из C1-4алкокси, галогена или -OH; и
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
R6 представляет собой H, C1-4алкил или C3-7циклоалкил, где C3-7циклоалкил необязательно замещен одной или несколькими независимо выбранными группами R5;
R7 представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
галогена;
фенила, необязательно замещенного одним или несколькими заместителями, независимо выбранными из
галогена;
C1-4алкила, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена;
C1-4алкокси, необязательно замещенного одним или несколькими независимо выбранными атомами галогена; или
4-6-членного моноциклического гетероцикла, содержащего 1 или 2 гетероатома, независимо выбранных из группы, состоящей из O, S и N; при этом моноциклический гетероцикл необязательно замещен одной или несколькими независимо выбранными группами R5;
каждая из R8a и R8b независимо выбрана из группы, состоящей из
H и
C1-4алкила;
R9a и R9b независимо выбраны из группы, состоящей из
H;
C1-4алкила и
C3-7циклоалкила; и
каждая R10 независимо выбрана из группы, состоящей из
C1-6алкила и
фенила.
[00142] В определенных вариантах осуществления формулы I-b X1 представляет собой H, галоген, необязательно замещенный циклопропил или необязательно замещенный фенил.
[00143] В определенных вариантах осуществления формулы I-b X1 представляет собой H, галоген или незамещенный циклопропил.
[00144] В определенных вариантах осуществления формулы I-b X1 представляет собой H.
[00145] В определенных вариантах осуществления формулы I-b X1 представляет собой бром, NR12AR12B, алкокси, циклопропил, фенокси или фенил; при этом циклопропил, фенокси и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5, и при этом C1-4алкокси необязательно замещен одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или NR11AR11B. В некоторых данных вариантах осуществления формулы I-b циклопропил является незамещенным. В некоторых данных вариантах осуществления формулы I-b фенил и фенокси замещены F.
[00146] В определенных вариантах осуществления формулы I-b X1 представляет собой бром, циклопропил или фенил; при этом циклопропил и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I-b циклопропил является незамещенным.
[00147] В определенных вариантах осуществления формулы I-b X1 представляет собой бром.
[00148] В определенных вариантах осуществления формулы I-b X1 представляет собой циклопропил или фенил; при этом циклопропил и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I-b циклопропил является незамещенным.
[00149] В определенных вариантах осуществления формулы I-b X1 представляет собой циклопропил, фенокси или фенил; при этом циклопропил, фенокси и фенил необязательно замещены 1, 2 или 3 независимо выбранными группами R5. В некоторых данных вариантах осуществления формулы I-b циклопропил является незамещенным.
[00150] В определенных вариантах осуществления формулы I-b X1 представляет собой незамещенный циклопропил или фенил, замещенный одним атомом фтора.
[00151] В определенных вариантах осуществления формулы I-b X1 представляет собой незамещенный циклопропил или фенил, замещенный одним атомом фтора, или фенокси, замещенный одним атомом фтора.
[00152] В определенных вариантах осуществления формулы I-b X1 представляет собой незамещенный циклопропил.
[00153] В определенных вариантах осуществления формулы I-b X1 представляет собой фенил, замещенный одним атомом фтора.
[00154] В определенных вариантах осуществления формулы I-b X1 представляет собой фенокси, замещенный одним атомом фтора.
[00155] В определенных вариантах осуществления формулы I-b X1 представляет собой C1-4алкокси, необязательно замещенный одним или несколькими заместителями, независимо выбранными из OH, C1-4алкокси или NR11AR11B. В некоторых данных вариантах осуществления формулы I-b R11A и R11B представляют собой H или C1-4алкил. В некоторых данных вариантах осуществления формулы I-b как R11A, так и R11B представляет собой CH3.
[00156] В определенных вариантах осуществления формулы I-b X1 представляет собой C1-4алкокси, который является незамещенным. В некоторых данных вариантах осуществления формулы I-b X1 представляет собой OCH3.
[00157] В определенных вариантах осуществления формулы I-b X1 представляет собой C1-4алкокси, который замещен C1-4алкокси. В некоторых данных вариантах осуществления формулы I-b X1 представляет собой OCH2CH2OCH3.
[00158] В определенных вариантах осуществления формулы I-b X1 представляет собой C1-4алкокси, который замещен NR11AR11B. В некоторых данных вариантах осуществления формулы I-b R11A и R11B представляют собой H или C1-4алкил. В некоторых данных вариантах осуществления формулы I-b как R11A, так и R11B представляет собой CH3.
[00159] В определенных вариантах осуществления формулы I-b X1 представляет собой NR12AR12B. В некоторых данных вариантах осуществления формулы I-b R12A и R12B представляют собой H, C1-4алкил или C3-7циклоалкил. В некоторых данных вариантах осуществления формулы I-b как R12A, так и R12B представляет собой CH3. В некоторых данных вариантах осуществления формулы I-b R12A представляет собой H, и R12B представляет собой циклопропил.
[00160] В одном варианте осуществления настоящее изобретение относится к соединениям формулы I-b, где
X1 представляет собой
H;
R1 представляет собой
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
R2 представляет собой 5-6-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
галогена или
OP(O)(OH)(OH); и
каждая R4 независимо представляет собой
C1-4алкокси, необязательно замещенный одним или несколькими независимо выбранными атомами галогена.
[00161] В одном варианте осуществления настоящее изобретение относится к соединениям формулы I-b, где
X1 представляет собой
H;
R1 представляет собой
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
R2 представляет собой 5-членный моноциклический гетероарил, содержащий 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом моноциклический гетероарил необязательно замещен одной или несколькими независимо выбранными группами R3;
каждая R3 независимо представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
галогена или
OP(O)(OH)(OH); и
каждая R4 независимо представляет собой
C1-4алкокси, необязательно замещенный одним или несколькими независимо выбранными атомами галогена.
[00162] В одном варианте осуществления настоящее изобретение относится к соединениям формулы I-b, где
X1 представляет собой
H;
R1 представляет собой
фенил, необязательно замещенный одной или несколькими независимо выбранными группами R4;
R2 представляет собой оксадиазолил или тиазолил, содержащие 1, 2 или 3 гетероатома, независимо выбранных из группы, состоящей из O, S и N, при этом оксадиазолил и тиазолил необязательно замещены одной или несколькими независимо выбранными группами R3;
каждая R3 независимо представляет собой
C1-4алкил, необязательно замещенный одним или несколькими заместителями, независимо выбранными из
OH;
галогена или
OP(O)(OH)(OH); и
каждая R4 независимо представляет собой
C1-4алкокси, необязательно замещенный одним или несколькими независимо выбранными атомами галогена.
[00163] Различные варианты осуществления заместителей X1, X2, R1 и R2 были рассмотрены выше. Такие варианты осуществления заместителей можно объединять с получением различных вариантов осуществления настоящего изобретения. Все варианты осуществления соединений по настоящему изобретению, полученных путем объединения вариантов осуществления заместителей, рассматриваемых выше, находятся в пределах объема изобретения, принадлежащего заявителю.
[00164] Типичные соединения формулы I включают без ограничения:
(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метилдигидрофосфат;
2-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-1,1,1-трифторпропан-2-ол;
1-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-2,2,2-трифторэтан-1-ол;
(2-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3-тиазол-5-ил)метанол;
2-(1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
(5-{3-амино-5-[4-(трифторметил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-карбоксамид;
{5-[3-амино-5-(4-фторбензол-1-сульфонил)пиридин-2-ил]-1,3,4-оксадиазол-2-ил}метанол;
2-(5-циклогексил-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(S)-метокси(фенил)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(циклопропилметокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(феноксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(циклопентилокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
5-[4-(трифторметокси)бензол-1-сульфонил]-2-{5-[(трифторметокси)метил]-1,3,4-оксадиазол-2-ил}пиридин-3-амин;
2-(5-{[(оксолан-3-ил)окси]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(2-метоксиэтокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
N-[(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)метил]циклопропанкарботиоамид;
2-{5-[(S)-метокси(фенил)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
(2S)-2-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)-1,1,1-трифторпропан-2-ол;
2-{5-[(1R)-1-метоксиэтил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(1-метоксиэтил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(1S)-1-метоксиэтил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(циклопропилметокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(этоксиметил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(метоксиметил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(пиридин-3-ил)окси]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
5-[4-(трифторметокси)бензол-1-сульфонил]-2-{5-[(трифторметокси)метил]-1,3,4-тиадиазол-2-ил}пиридин-3-амин;
2-(5-{[(оксолан-3-ил)окси]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(дифторметокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(2S)-оксолан-2-ил]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(2R)-оксолан-2-ил]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(2-метоксиэтокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(1R)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(1S)-1-метоксиэтил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(этоксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[5-(метоксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(пиридин-3-ил)окси]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{5-[(дифторметокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(2S)-оксолан-2-ил]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(5-{[(2R)-оксолан-2-ил]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
1-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)этан-1-ол;
2-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)пропан-2-ол;
(1S)-1-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-2-фенилэтан-1-ол;
(S)-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)(фенил)метанол;
2-[3-(2-метоксипропан-2-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(1-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(оксан-4-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{3-[(4-фторфенокси)метил]-1,2,4-оксадиазол-5-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(циклопропилметил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-{3-[(оксолан-2-ил)метил]-1,2,4-оксадиазол-5-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(3-циклопропил-1,2,4-оксадиазол-5-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(оксолан-3-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-(3-трет-бутил-1,2,4-оксадиазол-5-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(2-метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
2-[3-(метоксиметил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин;
(5-{3-амино-4-хлор-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-5-[3-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-5-[2-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
5-амино-N-бензил-6-[5-(гидроксиметил)-1,3,4-оксадиазол-2-ил]-N-метилпиридин-3-сульфонамид;
{5-[3-амино-5-(бензолсульфонил)пиридин-2-ил]-1,3,4-оксадиазол-2-ил}метанол;
(5-{3-амино-5-[4-(трифторметил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)метанол;
(5-{3-амино-6-бром-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-6-хлор-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-5-[2-(пропан-2-ил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
(5-{3-амино-4-бром-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол;
2-(5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,2,4-оксадиазол-3-ил)этан-1-ол и их фармацевтически приемлемые соли.
[00165] Соединения по настоящему изобретению названы с применением алгоритма определения названий Name 2015 от Advanced Chemical Development или алгоритма определения названий Struct=Name, который является частью CHEMDRAW® Professional версии 15.0.0.106.
[00166] Соединения по настоящему изобретению могут существовать в виде стереоизомеров, где присутствуют центры асимметрии или хиральные центры. Эти стереоизомеры представляют собой "R" или "S" в зависимости от конфигурации заместителей около хирального атома углерода. Термины "R" и "S", используемые в данном документе, представляют собой конфигурации, определенные в рекомендациях IUPAC 1974 г. для Раздела E, Fundamental Stereochemistry (Фундаментальная стереохимия), в Pure Appl. Chem., 1976, 45: 13-30. В настоящем изобретении рассматриваются различные стереоизомеры и их смеси; конкретно они включены в объем настоящего изобретения. Стереоизомеры включают энантиомеры и диастереомеры, а также смеси энантиомеров или диастереомеров. Отдельные стереоизомеры соединений по настоящему изобретению можно получать синтетически из коммерчески доступных исходных веществ, которые содержат центры асимметрии или хиральные центры, или путем получения рацемических смесей с последующим применением способов разделения, хорошо известных специалистам в данной области техники. Примерами таких способов разделения являются (1) присоединение смеси энантиомеров к хиральному вспомогательному средству, разделение полученной смеси диастереомеров посредством перекристаллизации или хроматографии и необязательно выделение оптически чистого продукта из вспомогательного средства, как описано в Furnis, Hannaford, Smith, и Tatchell, "Vogel's Textbook of Practical Organic Chemistry", 5th edition (1989), Longman Scientific & Technical, Essex CM20 2JE, England или (2) непосредственное разделение смеси оптических энантиомеров на хиральных хроматографических колонках или (3) способы фракционной перекристаллизации.
[00167] Соединения по настоящему изобретению могут существовать в виде цис- или транс-изомеров, причем заместители при кольце могут быть присоединены таким образом, что они находятся на одной и той же стороне кольца (цис) относительно друг друга или на противоположных сторонах кольца относительно друг друга (транс). Например, циклобутан может находиться в цис- или транс-конфигурации и может присутствовать в виде одного изомера или смеси цис- и транс-изомеров. Отдельные цис- или транс-изомеры соединений по настоящему изобретению можно получать синтетически из коммерчески доступных исходных материалов с применением селективных органических превращений или получать в форме одного изомера посредством очистки смесей цис- и транс-изомеров. Такие способы хорошо известны специалистам в данной области техники и могут включать разделение изомеров посредством перекристаллизации или хроматографии.
[00168] Следует понимать, что соединения по настоящему изобретению могут характеризоваться таутомерными формами, а также геометрическими изомерами, и что они также составляют аспект настоящего изобретения.
[00169] Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения формулы I и I-a, где один или несколько атомов заменены атомами с таким же атомным числом, но с атомной массой или массовым числом, отличными от атомной массы или массового числа, которые преобладают в природе. Примеры изотопов, подходящих для включения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32P, и серы, такие как 35S. Определенные меченные изотопами соединения формул I, I-a и I-b, например, содержащие радиоактивный изотоп, пригодны в исследованиях распределения в тканях лекарственных средств и/или субстратов. Радиоактивные изотопы тритий, т. e. 3H, и углерод-14, т. e. 14C, особенно пригодны для этой цели ввиду простоты их включения и простоты обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, т. e. 2H, может обеспечивать определенные терапевтические преимущества, обусловленные большей метаболической стабильностью, например, увеличение периода полураспада in vivo или уменьшение необходимой дозы, и поэтому может быть предпочтительно в некоторых случаях. Замещение позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, может быть пригодно в исследованиях с помощью позитронно-эмиссионной томографии (PET) для определения степени занятости рецептора субстратом. Меченные изотопами соединения формул I, I-a и I-b можно в общем получать посредством традиционных методик, известных специалистам в данной области техники, или посредством способов, аналогичных описанным в прилагаемых примерах с применением подходящих меченных изотопами реагентов вместо немеченных реагентов, применяемых ранее.
[00170] Таким образом, изображения формул в данном описании могут представлять только одну из возможных таутомерных, геометрических или стереоизомерных форм. Следует понимать, что настоящее изобретение охватывает любую таутомерную, геометрическую или стереоизомерную форму и их смеси и не ограничено только одной таутомерной, геометрической или стереоизомерной формой, используемой на изображениях формул.
[00171] Соединения формул I, I-a и I-b можно применять в форме фармацевтически приемлемых солей. Фраза "фармацевтически приемлемая соль" означает такие соли, которые в рамках тщательного медицинского обследования подходят для применения в контакте с тканями человека и низших животных без нежелательной токсичности, раздражения, аллергических реакций и подобного и соответствуют разумному соотношению пользы/риска.
[00172] Фармацевтически приемлемые соли описаны в S. M. Berge et al. J. Pharmaceutical Sciences, 1977, 66: 1-19.
[00173] Соединения формул I, I-a и I-b могут содержать либо основные, либо кислотные функциональные группы, либо и те и другие, и могут быть превращены в фармацевтически приемлемую соль, при необходимости, с применением подходящих кислоты или основания. Соли можно получать in situ во время конечного выделения и очистки соединений по настоящему изобретению.
[00174] Примеры солей присоединения кислоты включают без ограничения ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат (изотионат), лактат, малат, малеат, метансульфонат, никотинат, 2-нафталинсульфонат, оксалат, пальмитат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат, тартрат, тиоцианат, фосфат, глутамат, бикарбонат, п-толуолсульфонат и ундеканоат. Также основные азотсодержащие группы могут быть кватернизованы такими средствами, как низшие алкилгалогениды, как, например, без ограничения метил-, этил-, пропил- и бутилхлориды, бромиды и йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты; длинноцепочечные галогениды, как, например, без ограничения децил-, лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; галогениды арилалкилов, такие как бензил- и фенэтилбромиды, и т. д. При этом получают растворимые или диспергируемые в воде или масле продукты. Примеры кислот, которые можно использовать для образования фармацевтически приемлемых солей присоединения кислоты, включают неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, серная кислота и фосфорная кислота, и органические кислоты, такие как уксусная кислота, фумаровая кислота, малеиновая кислота, 4-метилбензолсульфоновая кислота, янтарная кислота и лимонная кислота.
[00175] Соли присоединения основания можно получать in situ во время конечного выделения и очистки соединений по настоящему изобретению путем осуществления реакции содержащего карбоновую кислоту фрагмента с подходящим основанием, таким как без ограничения гидроксид, карбонат или бикарбонат катиона фармацевтически приемлемого металла, или с аммиаком или органическим первичным, вторичным или третичным амином. Фармацевтически приемлемые соли включают без ограничения катионы на основе щелочных металлов или щелочноземельных металлов, такие как без ограничения соли лития, натрия, калия, кальция, магния и алюминия и т. п., и нетоксичные катионы четвертичного аммония и амина, в том числе аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин и т. п. Другие примеры органических аминов, пригодных для образования солей присоединения основания, включают этилендиамин, этаноламин, диэтаноламин, пиперидин, пиперазин и т. п.
[00176] Соединения, описанные в данном документе, могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы, такие как полугидраты. В общем сольватированные формы с фармацевтически приемлемыми растворителями, такими как вода и этанол, помимо прочего, эквивалентны несольватированным формам для целей настоящего изобретения.
Фармацевтические композиции
[00177] При использовании соединения по настоящему изобретению в качестве фармацевтического средства его обычно вводят в виде фармацевтической композиции. В одном варианте осуществления такие композиции можно получать хорошо известным в фармацевтической области способом, и они содержат терапевтически эффективное количество соединения формул I, I-a, I-b или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым носителем. Фраза "фармацевтическая композиция" относится к композиции, подходящей для введения при медицинском или ветеринарном применении.
[00178] Фармацевтические композиции, которые содержат соединение формул I, I-a или I-b отдельно или в комбинации с дополнительным терапевтически активным ингредиентом, можно вводить субъектам перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально или в виде перорального или назального спрея. Термин "парентерально", используемый в данном документе, относится к способам введения, которые включают внутривенную, внутримышечную, внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекции и инфузии.
[00179] Термин "фармацевтически приемлемый носитель", используемый в данном документе, означает нетоксичные инертные твердые, полутвердые или жидкие наполнитель, разбавитель, инкапсулирующее вещество или вспомогательное средство для состава любого типа. Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, представляют собой сахара, такие как без ограничения лактоза, глюкоза и сахароза; крахмалы, такие как без ограничения кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как без ограничения натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; вспомогательные средства, такие как без ограничения масло какао и виды воска для суппозиториев; масла, такие как без ограничения арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как без ограничения этилолеат и этиллаурат; агар; буферные средства, такие как без ограничения гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как без ограничения лаурилсульфат натрия и стеарат магния, и кроме того, красители, разделительные средства, покрывающие средства, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции, в зависимости от решения составителя.
[00180] Фармацевтические композиции для парентеральной инъекции содержат фармацевтически приемлемые стерильные водные или неводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для растворения в стерильных инъекционных растворах или дисперсиях непосредственно перед применением. Примеры подходящих водных и неводных разбавителей, растворителей или сред включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т. п.), растительные масла (такие как оливковое масло), инъекционные органические сложные эфиры (такие как этилолеат) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, посредством применения покрывающих веществ, таких как лецитин, посредством поддержания необходимого размера частиц в случае дисперсий и посредством применения поверхностно-активных веществ.
[00181] Эти композиции могут также содержать вспомогательные вещества, такие как консерванты, смачивающие средства, эмульгаторы и диспергирующие средства. Предупреждение воздействия микроорганизмов можно обеспечивать путем включения различных антибактериальных и противогрибковых средств, например, парабена, хлорбутанола, фенолсорбиновой кислоты и т. п. Также может быть желательным включение изотонических средств, таких как сахара, хлорид натрия и т. п. Продолжительной абсорбции инъекционной фармацевтической формы можно достигнуть путем включения средств, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
[00182] В некоторых случаях для продления действия лекарственного средства может быть желательным замедление абсорбции лекарственного средства при подкожной или внутримышечной инъекции. Этого можно достигнуть посредством применения жидкой суспензии кристаллического или аморфного вещества, характеризующегося плохой растворимостью в воде. В таком случае скорость абсорбции лекарственного средства зависит от его скорости растворения, что, в свою очередь, может зависеть от размера кристалла и кристаллической формы. В качестве альтернативы замедленную абсорбцию парентерально-вводимой лекарственной формы можно обеспечивать путем растворения или суспендирования лекарственного средства в масляной среде-носителе.
[00183] Инъекционные формы депо создают путем получения микроинкапсулированных матриц лекарственного средства в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения лекарственного средства и полимера, а также природы конкретного используемого полимера можно регулировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Инъекционные составы-депо также получают путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма.
[00184] Инъекционные составы можно стерилизовать, например, путем фильтрации через удерживающий бактерии фильтр или путем введения стерилизующих средств в виде стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или другой стерильной инъекционной среде непосредственно перед применением.
[00185] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В определенных вариантах осуществления твердые лекарственные формы могут содержать от 1% до 95% (вес/вес) соединения формул I, I-a или I-b. В определенных вариантах осуществления соединение формул I, I-a или I-b или его фармацевтически приемлемые соли могут содержаться в твердой лекарственной форме в диапазоне от 5% до 70% (вес/вес). В таких твердых лекарственных формах активное соединение может быть смешано по с меньшей мере одним инертным фармацевтически приемлемым носителем, таким как цитрат натрия или фосфат дикальция, и/или a) наполнителями или сухими разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; b) связующими средствами, такими как карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик; c) увлажнителями, такими как глицерин; d) средствами для улучшения распадаемости таблеток, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия; e) замедлителями растворения, такими как парафин; f) ускорителями абсорбции, такими как соединения четвертичного аммония; g) смачивающими средствами, такими как цетиловый спирт и глицеринмоностеарат; h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственная форма может также содержать буферные вещества.
[00186] Фармацевтическая композиция может быть единичной лекарственной формой. В такой форме препарат разделяют на разовые дозы, содержащие соответствующие количества активного компонента. Единичная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препарата, к примеру упакованные таблетки, капсулы и порошки во флаконах или ампулах. Также единичная лекарственная форма может представлять собой собственно капсулу, таблетку, саше или пастилку, или же она может быть представлена соответствующим числом любых из них в упакованной форме. Количество активного компонента в единичной дозе препарата может изменяться или регулироваться от 0,1 мг до 1000 мг, от 1 мг до 100 мг или от 1% до 95% (вес/вес) единичной дозы согласно конкретному применению и силе активного компонента. Композиция может при необходимости также содержать другие совместимые терапевтические средства.
[00187] Дозу, подлежащую введению субъекту, можно определить, исходя из эффективности конкретного используемого соединения и состояния субъекта, а также массы тела или площади поверхности субъекта, подлежащего лечению. Величина дозы также будет определяться наличием, природой и степенью любых побочных эффектов, которые сопутствуют введению конкретного соединения конкретному субъекту. При определении эффективного количества соединения, подлежащего введению, при лечении или профилактике нарушения, лечение которого осуществляют, врач может оценить такие факторы, как уровни циркуляции соединения в плазме, токсичность соединения и/или развитие заболевания и т. д.
[00188] Что касается введения, то соединения можно вводить при норме, определяемой факторами, которые могут включать без ограничения LD50 соединения, фармакокинетический профиль соединения, противопоказания для лекарственных средств и побочные эффекты соединения при различных концентрациях, применительно к массе тела и общему состоянию здоровья субъекта. Введение можно выполнять посредством однократной или разделенной дозы.
[00189] Твердые композиции аналогичного типа можно также использовать в качестве наполнителей в мягких и твердых желатиновых капсулах с применением таких носителей, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и т.п.
[00190] Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области составления фармацевтических препаратов. Они могут необязательно содержать замутняющие средства, а также могут представлять собой такую композицию, что они высвобождают лишь активный(активные) ингредиент(ингредиенты), или предпочтительно высвобождают его(их) в конкретном отделе кишечника, необязательно замедленным образом. Примеры вводимых композиций, которые можно применять, включают полимерные вещества и воски.
[00191] Активные соединения могут также находиться в микроинкапсулированной форме, при необходимости, с одним или несколькими вышеуказанными носителями.
[00192] Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и настойки. Помимо активных соединений жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие средства и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масло, масло из зародышей кукурузы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, сложные эфиры жирных кислот и сорбитана и их смеси.
[00193] Помимо инертных разбавителей, композиции для перорального применения могут также содержать вспомогательные вещества, такие как смачивающие средства, эмульгаторы и суспендирующие средства, подсластители, ароматизаторы и отдушки.
[00194] Суспензии, помимо активных соединений, могут содержать суспендирующие средства, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар, трагакант и их смеси.
[00195] Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получать смешиванием соединений с подходящими нераздражающими носителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при комнатной температуре, но жидкими при температуре тела, и поэтому плавятся в прямой кишке или вагинальной полости и высвобождают активное соединение.
[00196] Соединения можно также вводить в виде липосом. Липосомы в большинстве случаев можно получать из фосфолипидов или других липидных веществ. Липосомы образуются моно- или многослойными гидратированными жидкими кристаллами, которые диспергируются в водной среде. Можно применять любой нетоксичный, физиологически приемлемый и метаболизируемый липид, способный образовывать липосомы. Композиции по настоящему изобретению в виде липосом могут содержать, помимо соединения по настоящему изобретению, стабилизаторы, консерванты, вспомогательные средства и т. п. Примеры липидов включают без ограничения природные и синтетические фосфолипиды и фосфатидилхолины (лецитины), применяемые отдельно или вместе.
[00197] Способы получения липосом были описаны, например, в Prescott, Ed., Methods in Cell Biology, Volume XIV, Academic Press, New York, N.Y. (1976), p. 33 et seq.
[00198] Лекарственные формы для местного применения соединения, описанного в данном документе, включают порошки, спреи, мази и лекарственные формы для ингаляции. Активное соединение можно смешивать в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами, буферами или газами-вытеснителями, которые могут быть необходимы. Офтальмологические составы, глазные мази, порошки и растворы также рассматриваются как находящиеся в пределах объема настоящего изобретения.
[00199] Соединение по настоящему изобретению можно также вводить в формах с замедленным высвобождением или из систем доставки лекарственных средств с замедленным высвобождением.
Способы применения
[00200] Соединения и композиции с использованием любого количества и любого способа введения можно применять в отношении субъекта для лечения или предупреждения муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронического обструктивного заболевания легких (COLD) или хронической непроходимости дыхательных путей (COAD).
[00201] Термин "введение" относится к способу приведения в контакт соединения с субъектом. Таким образом, соединения можно вводить посредством инъекции, а именно, внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально, парентерально или внутрибрюшинно. Также соединения, описанные в данном документе, можно вводить посредством ингаляции, например, интраназально. Кроме того, соединения можно вводить трансдермально, местно, посредством имплантации, трансдермально, местно и посредством имплантации. В определенных вариантах осуществления соединения и композиции на их основе можно доставлять перорально. Соединения можно также доставлять ректально, буккально, интравагинально, через глаза или посредством инсуффляции. Модулируемые CFTR нарушения и состояния можно подвергать лечению с профилактической целью, а также при остром и хроническом их течении с применением соединений и композиций на их основе в зависимости от природы нарушения или состояния. Обычно хозяином или субъектом в каждом из этих способов является человек, хотя другие млекопитающие также могут получать положительный результат при введении соединений и композиций на их основе, указанных выше.
[00202] Соединения по настоящему изобретению пригодны в качестве модуляторов CFTR. Таким образом, соединения и композиции являются особенно пригодными для лечения или уменьшения тяжести или развития заболевания, нарушения или состояния, связанного с повышенной активностью или отсутствием активности CFTR. Следовательно, в настоящем изобретении предусмотрен способ лечения муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронического обструктивного заболевания легких (COLD) или хронической непроходимости дыхательных путей (COAD) у субъекта, причем способ включает стадию введения указанному субъекту терапевтически эффективного количества соединения формул I, I-a или I-b или его предпочтительного варианта осуществления, указанного выше, с фармацевтически приемлемым носителем или без него. В частности, способ предназначен для лечения или предупреждения муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызван мутацией I, II, III, IV, V и/или VI класса.
[00203] В другом варианте осуществления в настоящем изобретении предусмотрены соединения по настоящему изобретению или фармацевтические композиции, содержащие соединение по настоящему изобретению, для применения в медицине. В конкретном варианте осуществления в настоящем изобретении предусмотрены соединения по настоящему изобретению или их фармацевтически приемлемая соль, либо фармацевтическая композиция, содержащая соединение по настоящему изобретению, для применения в медицине. В конкретном варианте осуществления в настоящем изобретении предусмотрены соединения по настоящему изобретению или фармацевтические композиции, содержащие соединение по настоящему изобретению, для применения в лечении муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронического обструктивного заболевания легких (COLD) или хронической непроходимости дыхательных путей (COAD). В более конкретном варианте осуществления в настоящем изобретении предусмотрены соединения по настоящему изобретению или фармацевтические композиции, содержащие соединение по настоящему изобретению, для применения в лечении муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызван мутацией I, II, III, IV, V и/или VI класса.
[00204] Один вариант осуществления относится к применению соединения формул I, I-a или I-b или его фармацевтически приемлемой соли в получении лекарственного препарата. Лекарственный препарат необязательно может содержать одно или несколько дополнительных терапевтических средств. В некоторых вариантах осуществления лекарственный препарат предназначен для применения в лечении муковисцидоза, недостаточности поджелудочной железы, синдрома Шегрена (SS), хронического обструктивного заболевания легких (COLD) или хронической непроходимости дыхательных путей (COAD). В конкретном варианте осуществления лекарственный препарат предназначен для применения в лечении муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызван мутацией I, II, III, IV, V и/или VI класса.
[00205] Настоящее изобретение также относится к применению соединения формул I, I-a или I-b или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения муковисцидоза, синдрома Шегрена, недостаточности поджелудочной железы, хронического обструктивного заболевания легких или хронической непроходимости дыхательных путей. Лекарственный препарат необязательно может содержать одно или несколько дополнительных терапевтических средств. В конкретном варианте осуществления настоящее изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли в изготовлении лекарственного препарата для лечения муковисцидоза. В более конкретном варианте осуществления муковисцидоз вызван мутацией I, II, III, IV, V и/или VI класса.
[00206] В одном варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль и одно или несколько дополнительных терапевтических средств. В другом варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль и одно или несколько дополнительных терапевтических средств, причем дополнительные терапевтические средства выбраны из группы, состоящей из модуляторов CFTR и усилителей активности CFTR. В другом варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль и одно или несколько дополнительных терапевтических средств, причем дополнительные терапевтические средства представляют собой модуляторы CFTR.
[00207] В одном варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль и одно или несколько дополнительных терапевтических средств. В одном варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению или его фармацевтически приемлемую соль и один или несколько корректоров. В одном варианте осуществления в настоящем изобретении предусмотрены фармацевтические композиции, содержащие соединение по настоящему изобретению и другое терапевтическое средство. В конкретном варианте осуществления другое терапевтическое средство представляет собой средство для лечения муковисцидоза. В одном варианте осуществления в настоящем изобретении предусмотрен способ лечения муковисцидоза у субъекта, который включает введение терапевтически эффективного количества соединения по настоящему изобретению или его фармацевтически приемлемой соли. В одном варианте осуществления в настоящем изобретении предусмотрен способ лечения муковисцидоза у субъекта, который включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли и одного или нескольких дополнительных терапевтических средств. В другом варианте осуществления в настоящем изобретении предусмотрен способ лечения муковисцидоза у субъекта, который включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли и одного или нескольких дополнительных терапевтических средств, причем дополнительные терапевтические средства выбраны из группы, состоящей из модуляторов CFTR и усилителей активности CFTR. В одном варианте осуществления в настоящем изобретении предусмотрен способ лечения муковисцидоза у субъекта, который включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли и одного или нескольких дополнительных терапевтических средств, причем дополнительные терапевтические средства представляют собой модуляторы CFTR. В одном варианте осуществления в настоящем изобретении предусмотрен способ лечения муковисцидоза у субъекта, который включает введение соединения по настоящему изобретению или его фармацевтически приемлемой соли и другого терапевтического средства. В конкретном варианте осуществления другое терапевтическое средство представляет собой средство для лечения муковисцидоза. В конкретном варианте осуществления дополнительное(дополнительные) терапевтическое(терапевтические) средство(средства) выбран(выбраны) из группы, состоящей из модуляторов CFTR и усилителей активности CFTR. В конкретном варианте осуществления дополнительное(дополнительные) терапевтическое(терапевтические) средство(средства) представляет(представляют) собой один или несколько корректоров. В другом варианте осуществления другое терапевтическое(терапевтические) средство(средства) представляет(представляют) собой модулятор CFTR. В более конкретном варианте осуществления муковисцидоз вызван мутацией I, II, III, IV, V и/или VI класса.
[00208] Соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить в виде одного активного средства или их можно вводить совместно с другими терапевтическими средствами, в том числе с другими соединениями или их фармацевтически приемлемыми солями, которые показывают такую же или аналогичную терапевтическую активность, и для которых установлено, что они являются безопасными и эффективными для такого совместного введения. Соединения по настоящему изобретению можно совместно вводить субъекту. Термин "совместное введение" означает введение двух или более различных терапевтических средств субъекту в одной фармацевтической композиции или в разных фармацевтических композициях. Таким образом, совместное введение подразумевает наряду с этим введение одной фармацевтической композиции, содержащей два или более терапевтических средств, или введение двух или более разных композиций одному субъекту одновременно или в разное время.
[00209] Соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с терапевтически эффективным количеством одного или нескольких дополнительных терапевтических средств для лечения опосредованного CFTR заболевания, при этом примеры терапевтических средств включают без ограничения антибиотики (например, аминогликозиды, колистин, азтреонам, ципрофлоксацин и азитромицин), отхаркивающие средства (например, гипертонический солевой раствор, ацетилцистеин, дорназа альфа и денуфосол), ферментные добавки для поджелудочной железы (например, панкреатин и панкрелипаза), ингибиторы блокатора эпителиальных натриевых каналов (ENaC), модуляторы CFTR (например, потенцирующие средства для CFTR, корректоры CFTR) и усилители активности CFTR. В одном варианте осуществления опосредованное CFTR заболевание представляет собой муковисцидоз, хроническое обструктивное заболевание легких (COPD), заболевание "сухого глаза", недостаточность поджелудочной железы или синдром Шегрена. В одном варианте осуществления опосредованное CFTR заболевание представляет собой муковисцидоз.
[00210] В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или двумя модуляторами CFTR и одним усилителем активности CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенцирующим средством, одним или несколькими корректорами и одним усилителем активности CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним модулятором CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с тремя модуляторами CFTR. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенцирующим средством и одним или несколькими корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенцирующим средством и двумя корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним потенцирующим средством. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним корректором. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя корректорами. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним или несколькими корректорами и одним усилителем активности. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним корректором и одним усилителем активности. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя корректорами и одним усилителем активности. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с одним корректором. В одном варианте осуществления соединения по настоящему изобретению или их фармацевтически приемлемые соли можно вводить совместно с двумя корректорами.
[00211] Примеры потенцирующих средств для CFTR включают без ограничения Ivacaftor (VX-770), CTP-656, NVS-QBW251, FD1860293, PTI-808, N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-5-карбоксамид и 3-амино-N-[(2S)-2-гидроксипропил]-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамид. Примеры потенцирующих средств также раскрыты в публикациях: WO2005120497, WO2008147952, WO2009076593, WO2010048573, WO2006002421, WO2008147952, WO2011072241, WO2011113894, WO2013038373, WO2013038378, WO2013038381, WO2013038386 и WO2013038390 и в заявках на патент США 14/271080, 14/451619 и 15/164317.
[00212] В одном варианте осуществления потенцирующее средство можно выбрать из группы, состоящей из
Ivacaftor (VX-770, N-(2,4-ди-трет-бутил-5-гидроксифенил)-4-оксо-1,4-дигидрохинолин-3-карбоксамида);
CTP-656;
NVS-QBW251;
FD1860293;
PTI-808;
2-(2-фторбензамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-5-карбоксамида;
2-(2-гидроксибензамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(1-гидроксициклопропанкарбоксамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
5,5,7,7-тетраметил-2-(2-(трифторметил)бензамидо)-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(2-гидрокси-2-метилпропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(1-(гидроксиметил)циклопропанкарбоксамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-(3-гидрокси-2,2-диметилпропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-метил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-циклопропил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-изопропил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-(трифторметил)-1H-пиразол-3-карбоксамида;
5-трет-бутил-N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-5-этил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-3-этил-4-метил-1H-пиразол-5-карбоксамида;
2-(2-гидроксипропанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-хлор-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1,4,6,7-тетрагидропирано[4,3-c]пиразол-3-карбоксамида;
4-бром-N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-хлор-5-метил-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-2-ил)-4-метил-1H-пиразол-3-карбоксамида;
2-(2-гидрокси-3,3-диметилбутанамидо)-5,5,7,7-тетраметил-5,7-дигидро-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[(2-гидрокси-4-метилпентанoил)амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
5-(2-метоксиэтокси)-1H-пиразол-3-карбоновой кислоты (3-карбамоил-5,5,7,7-тетраметил-4,7-дигидро-5H-тиено[2,3-c]пиран-2-ил)-амида;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(3-метоксипропил)-1H-пиразол-3-карбоксамида;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(2-этоксиэтил)-1H-пиразол-3-карбоксамида;
2-[[(2S)-2-гидрокси-3,3-диметилбутаноил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[[(2R)-2-гидрокси-3,3-диметилбутаноил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[(2-гидрокси-2,3,3-триметилбутаноил)амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
[5-[(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)карбамоил]пиразол-1-ил]метилдигидрофосфата;
[3-[(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)карбамоил]пиразол-1-ил]метилдигидрофосфата;
N-(3-карбамоил-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-2-ил)-4-(1,4-диоксан-2-ил)-1H-пиразол-3-карбоксамида;
5,5,7,7-тетраметил-2-[[(2S)-3,3,3-трифтор-2-гидрокси-2-метилпропаноил]амино]-4H-тиено[2,3-c]пиран-3-карбоксамида;
2-[[(2S)-2-гидроксипропанoил]амино]-5,5,7,7-тетраметил-4H-тиено[2,3-c]пиран-3-карбоксамида;
3-амино-N-(2-гидрокси-2-метилпропил)-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-N-[(4-гидрокси-1-метилпиперидин-4-ил)метил]-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-N-(3-гидрокси-2,2-диметилпропил)-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-5-[(4-фторфенил)сульфонил]-N-[(1-гидроксициклопропил)метил]пиридин-2-карбоксамида;
3-амино-5-[(4-фторфенил)сульфонил]-N-[(2R)-3,3,3-трифтор-2-гидроксипропил]пиридин-2-карбоксамида;
3-амино-5-[(3-фторфенил)сульфонил]-N-(2-гидрокси-2-метилпропил)пиридин-2-карбоксамида;
3-амино-N-[2-(циклопропиламино)-2-оксоэтил]-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
(3-амино-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-ил)(азетидин-1-ил)метанона;
(3-амино-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-ил)[3-(гидроксиметил)азетидин-1-ил]метанона;
(3-амино-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-ил)(3-фторазетидин-1-ил)метанона;
3-амино-N-[(2R)-2-гидрокси-3-метоксипропил]-5-{[4-(трифторметил)фенил]сульфонил}пиридин-2-карбоксамида;
(3-амино-5-{[2-фтор-4-(трифторметокси)фенил]сульфонил}пиридин-2-ил)(3-гидроксиазетидин-1-ил)метанона;
(3-амино-5-{[2-(трифторметокси)фенил]сульфонил}пиридин-2-ил)(3,3-дифторазетидин-1-ил)метанона;
rac-3-амино-N-[(3R,4S)-4-гидрокситетрагидро-2H-пиран-3-ил]-5-{[2-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-5-[(4,4-дифторпиперидин-1-ил)сульфонил]-N-(3,3,3-трифтор-2-гидроксипропил)пиридин-2-карбоксамида;
(3-амино-5-{[2-(трифторметокси)фенил]сульфонил}пиридин-2-ил)[3-гидрокси-3-(трифторметил)азетидин-1-ил]метанона;
3-амино-N-(2-гидрокси-4-метилпентил)-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
(3-амино-5-{[4-(трифторметил)фенил]сульфонил}пиридин-2-ил)(3-гидрокси-3-метилазетидин-1-ил)метанона;
3-амино-N-(3,3,3-трифтор-2-гидроксипропил)-5-{[4-(трифторметил)пиперидин-1-ил]сульфонил}пиридин-2-карбоксамида;
3-амино-N-[2-гидрокси-1-(4-метоксифенил)этил]-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-5-[(3,3-дифторазетидин-1-ил)сульфонил]-N-(3,3,3-трифтор-2-гидроксипропил)пиридин-2-карбоксамида;
3-амино-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}-N-[(2S)-2-гидроксипропил]пиридин-2-карбоксамида;
3-амино-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}-N-[(2R)-2-гидрокси-3-метоксипропил]пиридин-2-карбоксамида;
3-амино-N-[2-оксо-2-(пропан-2-иламино)этил]-5-{[4-(трифторметил)фенил]сульфонил}пиридин-2-карбоксамида;
(3-амино-5-{[4-(трифторметил)фенил]сульфонил}пиридин-2-ил)[3-гидрокси-3-(трифторметил)азетидин-1-ил]метанона;
3-амино-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}-N-[(3R)-тетрагидрофуран-3-илметил]пиридин-2-карбоксамида;
(3-амино-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}пиридин-2-ил)[3-гидрокси-3-(трифторметил)азетидин-1-ил]метанона;
3-амино-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}-N-[(3S)-тетрагидрофуран-3-илметил]пиридин-2-карбоксамида;
3-амино-5-{[2-фтор-4-(трифторметокси)фенил]сульфонил}-N-[(3S)-тетрагидрофуран-3-илметил]пиридин-2-карбоксамида;
3-амино-N-[2-гидрокси-3-(2,2,2-трифторэтокси)пропил]-5-{[4-(трифторметил)фенил]сульфонил}пиридин-2-карбоксамида;
3-амино-N-(3-трет-бутокси-2-гидроксипропил)-5-{[2-фтор-4-(трифторметил)фенил]сульфонил}пиридин-2-карбоксамида;
[3-амино-5-(фенилсульфонил)пиридин-2-ил][3-гидрокси-3-(трифторметил)азетидин-1-ил]метанона;
{3-амино-5-[(3-фторфенил)сульфонил]пиридин-2-ил}[3-гидрокси-3-(трифторметил)азетидин-1-ил]метанона и
3-амино-N-[(2S)-2-гидроксипропил]-5-{[4-(трифторметокси)фенил]сульфонил}пиридин-2-карбоксамида.
[00213] Неограничивающие примеры корректоров включают Lumacaftor (VX-809), 1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1-[(2R)-2,3-дигидроксипропил]-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил}циклопропанкарбоксамид (VX-661), VX-983, GLPG2222, GLPG2665, GLPG2737, GLPG2851, GLPG3221, PTI-801, VX-152, VX-440, VX-659, VX-445, FDL169, FDL304, FD2052160 и FD2035659. Примеры корректоров также раскрыты в заявках на патент США 14/925649, 14/926727, 15/205512, 15/496094, 15/287922 и 15/287911.
[00214] В одном варианте осуществления корректор(корректоры) можно выбрать из группы, состоящей из
Lumacaftor (VX-809);
1-(2,2-дифтор-1,3-бензодиоксол-5-ил)-N-{1-[(2R)-2,3-дигидроксипропил]-6-фтор-2-(1-гидрокси-2-метилпропан-2-ил)-1H-индол-5-ил}циклопропанкарбоксамида (VX-661);
VX-983;
GLPG2665;
GLPG2737;
GLPG3221;
PTI-801;
VX-152;
VX-440;
VX-659;
VX-445
FDL169
FDL304;
FD2052160;
FD2035659;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метил-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-метокси-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновой кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновой кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-фтор-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-({3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]бензоил}амино)-1-метилциклопентанкарбоновой кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метил-3,4-дигидро-2H-хромен-2-ил]-N-[(2R)-2,3-дигидроксипропил]бензамида;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-метоксиэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-7-(бензилокси)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(2-фторэтокси)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(трифторметил)-3,4-дигидро-2H-хромен-2-ил]циклогексанкарбоновой кислоты;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-метокси-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
3-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-8-фтор-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
4-[(2R,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-7-(дифторметокси)-3,4-дигидро-2H-хромен-2-ил]бензойной кислоты;
rac-3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2H-пиран-2-ил]бензойной кислоты;
rac-4-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2H-пиран-2-ил]бензойной кислоты;
3-[(2S,4R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2H-пиран-2-ил]бензойной кислоты;
3-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2H-пиран-2-ил]бензойной кислоты;
rac-3-[(2R,4S,6S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2H-пиран-2-ил]бензойной кислоты;
3-[(2S,4R,6R)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2H-пиран-2-ил]бензойной кислоты;
3-[(2R,4S,6S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)-6-фенилтетрагидро-2H-пиран-2-ил]бензойной кислоты;
4-[(2R,4S)-4-({[1-(2,2-дифтор-1,3-бензодиоксол-5-ил)циклопропил]карбонил}амино)тетрагидро-2H-пиран-2-ил]бензойной кислоты;
4-[6-(4-цианопиперидин-1-ил)пиридин-3-ил]-3-циклобутил-N-(метансульфонил)-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(метансульфонил)-4-[4-(метоксиметил)пиперидин-1-ил]-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
4-[6-(4-цианопиперидин-1-ил)пиридин-3-ил]-3-циклобутил-N-(метансульфонил)-1-[2-(морфолин-4-ил)пиридин-4-ил]-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
N-(метансульфонил)-4-[4-(метоксиметил)пиперидин-1-ил]-1-[2-(морфолин-4-ил)пиридин-4-ил]-3-(пропан-2-ил)-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-4-[4-(метоксиметил)пиперидин-1-ил]-N-[2-(морфолин-4-ил)этансульфонил]-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-[2-(диметиламино)этансульфонил]-4-[4-(метоксиметил)пиперидин-1-ил]-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
1-(4-фторфенил)-N-(метансульфонил)-4-(1'-метил[4,4'-бипиперидин]-1-ил)-3-(пропан-2-ил)-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(метансульфонил)-4-{4-[2-(морфолин-4-ил)этил]пиперидин-1-ил}-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-4-[4-(метоксиметил)пиперидин-1-ил]-N-(оксолан-3-сульфонил)-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(диметилсульфамоил)-1-(4-фторфенил)-4-(4-метокси[1,4'-бипиперидин]-1'-ил)-1H-пиразоло[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(морфолин-4-сульфонил)-4-[4-(морфолин-4-ил)пиперидин-1-ил]-1-фенил-1H-пиразоло[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(морфолин-4-сульфонил)-1-фенил-4-{4-[(пирролидин-1-ил)метил]пиперидин-1-ил}-1H-пиразоло[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-N-(метансульфонил)-4-[4-(морфолин-4-ил)пиперидин-1-ил]-1-фенил-1H-пиразолo[3,4-b]пиридин-6-карбоксамида;
3-циклобутил-4-[4-(морфолин-4-ил)пиперидин-1-ил]-1-фенил-1H-пиразоло[3,4-b]пиридин-6-карбоновой кислоты;
3-циклобутил-1-фенил-4-{4-[(пирролидин-1-ил)метил]пиперидин-1-ил}-1H-пиразоло[3,4-b]пиридин-6-карбоновой кислоты;
5-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]пиразин-2-карбоновой кислоты;
6-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]пиридин-3-карбоновой кислоты;
транс-4-[(2S,4S)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
6-[(2R,4R)-7-(дифторметокси)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-3,4-дигидро-2H-1-бензопиран-2-ил]пиридин-3-карбоновой кислоты;
транс-4-[(2S,4S)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
этил-транс-4-[(2S,4S)-7-(дифторметокси)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоксилата;
цис-4-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2S,4S)-7-(дифторметокси)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
1-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклопропан-1-карбоновой кислоты;
транс-4-[(2R,4R)-4-{[(5S)-2,2-дифтор-5-метил-6,7-дигидро-2H,5H-индено[5,6-d][1,3]диоксол-5-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2R,4R)-4-{[(5S)-2,2-дифтор-5-метил-6,7-дигидро-2H,5H-индено[5,6-d][1,3]диоксол-5-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2R,4R)-7-(дифторметокси)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2R,4R)-4-{[(7R)-2,2-дифтор-7-метил-6,7-дигидро-2H-фуро[2,3-f][1,3]бензодиоксол-7-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
4-{(2R,4R)-4-[2-(2,2-дифтор-2H-1,3-бензодиоксол-5-ил)-2-метилпропанамидо]-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил}бензойной кислоты;
4-[(2R,4R)-4-{[1-(3,4-дихлорфенил)циклопропан-1-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
4-[(2R,4R)-4-{[1-(4-бромфенил)циклопропан-1-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
4-[(2R,4R)-7-метокси-4-({1-[4-(трифторметил)фенил]циклопропан-1-карбонил}амино)-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
4-[(2R,4R)-7-метокси-4-{[1-(4-метилфенил)циклопропан-1-карбонил]амино}-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
4-{(2R,4R)-4-[(1,5-диметил-2,3-дигидро-1H-инден-1-карбонил)амино]-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил}бензойной кислоты;
3-[(2R,4R)-4-{[(1S)-1,5-диметил-2,3-дигидро-1H-инден-1-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
4-[(2R,4R)-4-{[(1S)-1,5-диметил-2,3-дигидро-1H-инден-1-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]бензойной кислоты;
транс-4-[(2R,4R)-4-{[1-(2,2-дифтор-2H-1,3-бензодиоксол-5-ил)циклопропан-1-карбонил]амино}-7-метокси-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты;
транс-4-[(2R,4R)-4-{[1-(2,2-дифтор-2H-1,3-бензодиоксол-5-ил)циклопропан-1-карбонил]амино}-7-(трифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты и
4-[(2R,4R)-4-{[1-(2,2-дифтор-2H-1,3-бензодиоксол-5-ил)циклопропан-1-карбонил]амино}-7-(дифторметокси)-3,4-дигидро-2H-1-бензопиран-2-ил]циклогексан-1-карбоновой кислоты.
[00215] В одном варианте осуществления дополнительное терапевтическое средство представляет собой усилитель активности CFTR. Усилители активности CFTR повышают эффект известных модуляторов CFTR, таких как потенцирующие средства и корректоры. Примеры усилителей активности CFTR включают PTI130 и PTI-428. Примеры усилителей активности также раскрыты в публикациях международных заявок на патент №№: WO2015138909 и WO2015138934.
[00216] В одном варианте осуществления дополнительное терапевтическое средство представляет собой стабилизатор CFTR. Стабилизаторы CFTR повышают стабильность скорректированного CFTR, который был обработан корректором, корректором/потенцирующим средством или другой(другими) комбинацией(комбинациями) модуляторов CFTR. Примером стабилизатора CFTR является кавосонстат (N91115). Примеры стабилизаторов также раскрыты в публикации международной заявки на патент №: WO2012048181.
[00217] В одном варианте осуществления дополнительное терапевтическое средство представляет собой средство, которое снижает активность блокатора эпителиальных натриевых каналов (ENaC) либо непосредственно путем блокирования канала, либо опосредованно путем модуляции протеаз, которые влияют на повышение активности ENaC (например, сериновых протеаз, канал-активирующих протеаз). Примеры таких средств включают камостат (ингибитор трипсиноподобных протеаз), QAU145, 552-02, GS-9411, INO-4995, Aerolytic, амилорид и VX-371. Информацию о дополнительных средствах, которые снижают активность блокатора эпителиальных натриевых каналов (ENaC), можно найти, например, в публикациях международных заявок на патент №№: WO2009074575 и WO2013043720 и в патенте США № US8999976.
[00218] В одном варианте осуществления ингибитор ENaC представляет собой VX-371.
[00219] В одном варианте осуществления ингибитор ENaC представляет собой SPX-101 (S18).
[00220] Настоящее изобретение также относится к наборам, которые содержат одно или несколько соединений и/или солей по настоящему изобретению и необязательно одно или несколько дополнительных терапевтических средств.
[00221] Настоящее изобретение также относится к способам применения соединений, солей, композиций и/или наборов по настоящему изобретению, например, для модулирования белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR) и для лечения заболевания, поддающегося лечению с помощью модуляции белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR) (в том числе муковисцидоза, синдрома Шегрена, недостаточности поджелудочной железы, хронического обструктивного заболевания легких и хронической непроходимости дыхательных путей).
Общий синтез
[00222] Соединения по настоящему изобретению можно лучше понять в сочетании со следующими схемами синтеза и способами, которые иллюстрируют средства, с помощью которых можно получить данные соединения.
[00223] Соединения по настоящему изобретению можно получать с помощью различных процедур синтеза. Типичные процедуры показаны без ограничения на схемах 1-3. На схемах 1-3 переменные X1, X2, R1 и R3 являются такими, как описано в кратком описании, или они представляют собой фрагмент, который может быть превращен в одну из указанных групп с применением химических преобразований, известных специалисту в данной области техники.
Схема 1

[00224] Как показано на схеме 1, соединения формулы (1-6) можно получать из соединений формулы (1-1). Соединения формулы (1-1), где Hal представляет собой галоген, сначала можно вводить в реакцию с тиолами (R1-SH) в присутствии основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен или карбонат калия, в растворителе, таком как без ограничения N,N-диметилацетамид, с нагреванием либо обычным способом, либо с помощью микроволнового излучения с получением промежуточных тиоэфиров. На второй стадии промежуточные тиоэфиры можно окислять пероксидом водорода в растворителе, таком как охлажденная трифторуксусная кислота, с получением соединений формулы (1-2). Карбоновые кислоты формулы (1-2) можно вводить в реакцию сочетания с ацилгидразинами формулы (1-4) с получением соединений формулы (1-5). Примеры условий, известных как обеспечивающие образование соединений формулы (1-5) из смеси карбоновой кислоты и ацилгидразина, включают без ограничения добавление реагента для реакции сочетания, такого как без ограничения N-(3-диметиламинопропил)-N'-этилкарбодиимид, или 1-(3-диметиламинопропил)-3-этилкарбодиимид (EDC, EDAC или EDCI), или соответствующая хлористоводородная соль, 1,3-дициклогексилкарбодиимид (DCC), бис(2-оксо-3-оксазолидинил)фосфинхлорид (BOPCl), гексафторфосфат N-[(диметиламино)-1H-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия N-оксида или гексафторфосфат 2-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония или гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU), тетрафторборат O-(бензотриазол-1-ил)-N,N,N′,N′-тетраметилурония (TBTU), гексафторфосфат(V) 2-(1H-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоурония (HBTU) и 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинан-2,4,6-триоксид (T3P®). Реагенты для реакции сочетания можно добавлять в виде твердого вещества, раствора или в виде реагента, связанного с твердой полимерной подложкой. Помимо реагентов для реакции сочетания, облегчить осуществление реакции сочетания могут вспомогательные реагенты для реакции сочетания. Вспомогательные реагенты для реакции сочетания, которые часто применяют в реакциях сочетания, включают без ограничения 4-(диметиламино)пиридин (DMAP), 1-гидрокси-7-азабензотриазол (HOAT) и 1-гидроксибензотриазол (HOBT). Реакцию можно необязательно осуществлять в присутствии основания, такого как без ограничения триэтиламин, N,N-диизопропилэтиламин или пиридин. Реакцию сочетания можно осуществлять в растворителях, таких как без ограничения тетрагидрофуран, N,N-диметилформамид, N,N-диметилацетамид, диметилсульфоксид, дихлорметан и этилацетат. Реакции можно осуществлять при температуре окружающей среды или при нагревании. Нагревания можно достигать либо обычным способом, либо с помощью микроволнового излучения. Ацилгидразины формулы (1-4) являются либо коммерчески доступными, либо их получают из сложных эфиров формулы (1-3). Сложные эфиры формулы (1-3) можно обрабатывать гидратом гидразина в растворителе, таком как без ограничения нагретый тетрагидрофуран. Соединения формулы (1-5) можно подвергать дегидратации путем обработки п-толуолсульфонилхлоридом и основанием, таким как триэтиламин, в растворителе, таком как без ограничения дихлорметан, с получением соединений формулы (1-6). Заместитель, представляющий собой R3, можно подвергать дополнительным манипуляциям в условиях реакции, известных специалисту в данной области техники, с получением заместителей, представляющих собой R3, описанных в кратком описании. Соединения формулы (1-6) представляют собой типичные примеры соединений формулы (I).
Схема 2
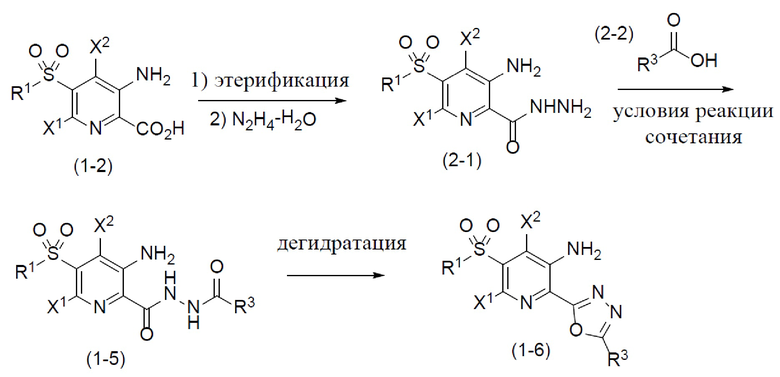
[00225] Как показано на схеме 2, соединения формулы (1-6) можно получать из соединений формулы (1-2) с помощью способа, альтернативного показанной на схеме 1 последовательности. Соединения формулы (1-2) можно превращать в соединения формулы (2-1) посредством двухстадийного способа. На первой стадии соединения формулы (1-2) можно подвергать эстерификации путем объединения соединений формулы (1-2) с метанолом или этанолом в присутствии кислотного катализатора, такого как без ограничения серная кислота. Нагревание смеси обеспечивает образование промежуточных сложных эфиров. Указанные промежуточные сложные эфиры можно обрабатывать на второй стадии гидратом гидразина в нагретом растворителе, таком как тетрагидрофуран, с получением соединений формулы (2-1). Соединения формулы (2-1) можно подвергать реакции сочетания с соединениями формулы (2-2) с применением условий, описанных на схеме 1, с сочетанием карбоновой кислоты и ацилгидразина с получением соединений формулы (1-5). Соединения формулы (1-5) можно подвергать дегидратации, как описано на схеме 1, с получением соединений формулы (1-6). Соединения формулы (1-6) представляют собой типичные примеры соединений формулы (I).
Схема 3
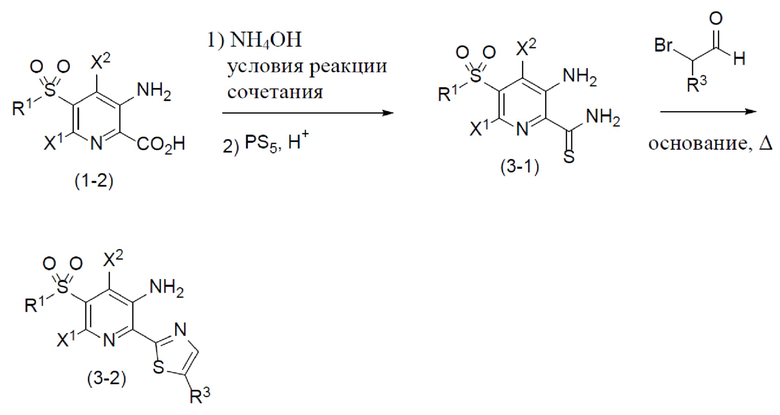
[00226] Как показано на схеме 3, соединения формулы (3-3) можно получать из соединений формулы (1-2). Соединения формулы (1-2) можно превращать в соединения формулы (3-1) посредством двухстадийного способа. Соединения формулы (1-2) также можно подвергать реакции сочетания с аммиаком с применением условий сочетания, описанных на схеме 1, с сочетанием карбоновой кислоты и ацилгидразина с получением промежуточных первичных амидов. Указанные первичные амиды можно вводить в реакцию с пентасульфидом фосфора в присутствии кислоты, такой как 1 M хлористоводородная кислота, в нагретой смеси растворителей, таких как без ограничения тетрагидрофуран и толуол, с получением тиоамидов формулы (3-1). Тиоамиды формулы (3-1) можно вводить в реакцию с ɑ-бромальдегидами формулы (3-2) в присутствии основания, такого как без ограничения пиридин, в нагретом растворителе, таком как без ограничения 2-метилтетрагидрофуран, с получением соединений формулы (3-3). Соединения формулы (3-3) представляют собой типичные примеры соединений формулы (I).
Схема 4
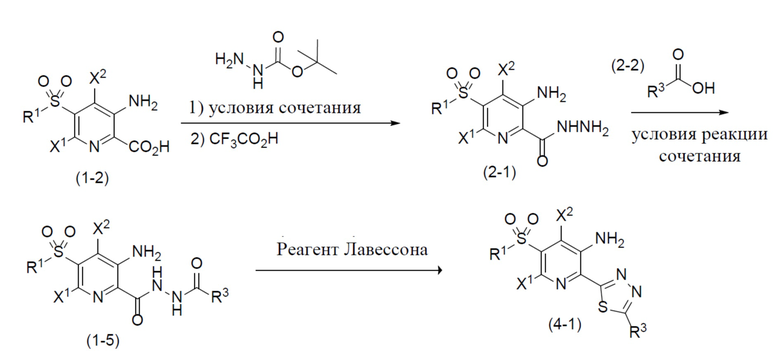
[00227] Как показано на схеме 4, соединения формулы (4-1) можно получать из соединений формулы (1-2) посредством последовательности, подобной показанной на схеме 2. Соединения формулы (1-2) можно превращать в соединения формулы (2-1) посредством двухстадийного способа. На первой стадии соединения формулы (1-2) подвергают реакции сочетания с трет-бутилгидразинкарбоксилатом с применением стандартных условий образования пептидной связи, известных специалистам в данной области техники и широко доступных в литературе. Boc-защищенный субстрат можно обрабатывать кислотой, такой как без ограничения TFA (трифторуксусная кислота), с получением соединений формулы (2-1). Соединения формулы (2-1) можно подвергать реакции сочетания с соединениями формулы (2-2) с применением условий, описанных на схеме 1, с сочетанием карбоновой кислоты и ацилгидразина с получением соединений формулы (1-5). Соединения формулы (1-5) можно обрабатывать реагентом Лавессона с получением соединений формулы (4-1). Обычно реакцию осуществляют при повышенной температуре в растворителе, таком как без ограничения толуол. Соединения формулы (4-1) представляют собой типичные примеры соединений формулы (I).
Схема 5
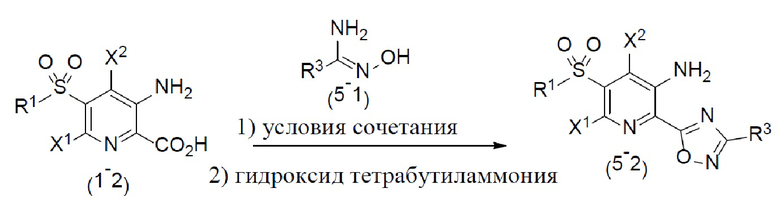
[00228] Как показано на схеме 5, соединения формулы (5-2) можно получать из соединений формулы (1-2). Соединения формулы (1-2) можно вводить в реакцию с соединениями формулы (5-1), где R3 описан в данном документе, с применением условий сочетания, таких как присутствие гексафторфосфата(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония и N-этил-N-изопропилпропан-2-амина. Обычно реакцию осуществляют в растворителе, таком как без ограничения N,N-диметилацетамид. Полученное путем реакции сочетания промежуточное соединение затем можно обрабатывать гидроксидом тетрабутиламмония с получением соединений формулы (5-2). Обычно реакцию осуществляют при температуре окружающей среды в растворителе, таком как без ограничения тетрагидрофуран. Соединения формулы (5-2) представляют собой типичные примеры соединений формулы (I).
Процедуры химического синтеза
[00229] Список сокращений, применяемых в разделе примеров: мин. означает минуту; DBU означает 1,8-диазабицикло[5.4.0]ундец-7-ен; DCI означает химическую ионизацию посредством десорбции; DMSO означает диметилсульфоксид; EDCI означает гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида; ESI означает ионизацию электрораспылением; HATU означает гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида; HPLC означает высокоэффективную жидкостную хроматографию; MS означает масс-спектрометрию; ЯМР означает ядерный магнитный резонанс; вес. означает весовой, и UPLC означает сверхвысокоэффективную жидкостную хроматографию.
[00230] Соединения по настоящему изобретению можно получать из легко доступных исходных веществ с применением следующих общих способов и процедур. Следует понимать, что если приведены типичные или предпочтительные условия способа (т. е. значения температуры реакции, времени реакции, мольные соотношения реагентов, растворители, значения давления и т. д.), то также можно использовать другие условия способа, если не указано иное. Оптимальные условия реакции могут изменяться в зависимости от конкретных применяемых реагентов или растворителя, но такие условия может определять специалист в данной области техники посредством обычных процедур оптимизации.
[00231] Кроме того, как будет очевидно специалистам в данной области техники, могут быть необходимы типичные защитные группы для предотвращения протекания нежелательных реакций с участием определенных функциональных групп. Выбор подходящей защитной группы для конкретной функциональной группы, а также подходящие условия для защиты и снятия защиты, хорошо известны из уровня техники (Protective Groups in Organic Synthesis Third Edition; Greene, T W и Wuts, P G M, Eds.; Wiley-Interscience: New York, 1991).
[00232] Следующие способы представлены подробно для получения соединения по настоящему изобретению, определенного выше в данном документе и в сравнительных примерах. Соединение по настоящему изобретению может быть получено специалистом в области органического синтеза из известных или коммерчески доступных исходных веществ и реагентов.
[00233] Все реагенты были торгового качества, и их применяли как есть без дополнительной очистки, если не указано иное. Коммерчески доступные безводные растворители применяли для реакций, проводимых в инертной атмосфере. Химически чистые растворители применяли во всех других случаях, если не указано иное. Колоночную хроматографию проводили на силикагеле 60 (35-70 мкм). Тонкослойную хроматографию проводили с помощью предварительно покрытых силикагелем F-254 пластин (толщина 0,25 мм). Спектры 1H ЯМР записывали на спектрометре для ЯМР Bruker Advance 300 (300 МГц), спектрометре для ЯМР Agilent при 400 МГц или при 500 МГц. Химические сдвиги (δ) для спектров 1H ЯМР записывали в частях на миллион (ppm) относительно тетраметилсилана (δ 0,00) или соответствующего пика остаточного растворителя, т. е. CHCl3 (δ 7,27), в качестве внутреннего стандарта. Мультиплетности приведены в виде синглета (s), дублета (d), дублета квартетов (dq), триплета (t), квартета (q), квинтуплета (quin), мультиплета (m) и широкого (br) сигнала. Спектры MS с электрораспылением получали на спектрометре LC/MS Waters platform или с помощью Waters Acquity H-Class UPLC, соединенного со спектрометром Waters с масс-детектором 3100. Используемые колонки: Waters Acquity UPLC BEH C18 1,7 мкм, внутренний диаметр 2,1 мм x длина 50 мм, Waters Acquity UPLC BEH C18 1,7 мкм, внутренний диаметр 2,1 мм x длина 30 мм, или Waters Xterra® MS 5 мкм C18, 100×4,6 мм. В способах применяли либо градиенты CH3CN/H2O (H2O содержит либо 0,1% CF3CO2H, либо 0,1% NH3), либо градиенты CH3OH/H2O (H2O содержит 0,05% CF3CO2H). Нагревание с использованием микроволнового излучения проводили с помощью Biotage® Initiator.
Способы очистки с применением обратной фазы
Способ с применением трифторуксусной кислоты
[00234] Образцы очищали с помощью препаративной HPLC на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (30 мм × 75 мм). Применяли градиент ацетонитрила (A) и 0,1% трифторуксусной кислоты в воде (B) при скорости потока 50 мл/мин. (0-1,0 мин. 5% A, 1,0-8,5 мин. линейный градиент 5-100% A, 8,5-11,5 мин. 100% A, 11,5-12,0 мин. линейный градиент 95-5% A).
Препаративная LC/MS, способ TFA6
[00235] Образцы очищали с помощью препаративной HPLC с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (50 мм × 21,2 мм). Применяли градиент ацетонитрила (A) и 0,1% трифторуксусной кислоты в воде (B) при скорости потока 40 мл/мин. (0-0,5 мин. 15% A, 0,5-8,0 мин. линейный градиент 15-100% A, 8,0-9,0 мин. 100% A, 7,0-8,9 мин. 100% A, 9,0-9,1 мин. линейный градиент 100-15% A, 9,1-10 мин. 15% A). Применяли специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор в УФ и видимой областях спектра Gilson 155; блок интерфейса Gilson 506C; коллектор фракций Gilson FC204; активный делитель потока Agilent G1968D и масс-спектрометр Thermo MSQ Plus. Систему контролировали посредством комбинации программного обеспечения Thermo Xcalibur 2.0.7 и специального приложения собственной разработки с применением Microsoft Visual Basic 6.0.
Препаративная LC/MS, способ TFA8
[00236] Образцы очищали с помощью препаративной HPLC с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (50 мм × 21,2 мм). Применяли градиент ацетонитрила (A) и 0,1% трифторуксусной кислоты в воде (B) при скорости потока 40 мл/мин. (0-0,5 мин. 35% A, 0,5-8,0 мин. линейный градиент 35-100% A, 8,0-9,0 мин. 100% A, 7,0-8,9 мин. 100% A, 9,0-9,1 мин. линейный градиент 100-35% A, 9,1-10 мин. 35% A). Применяли специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор в УФ и видимой областях спектра Gilson 155; блок интерфейса Gilson 506C; коллектор фракций Gilson FC204; активный делитель потока Agilent G1968D и масс-спектрометр Thermo MSQ Plus. Систему контролировали посредством комбинации программного обеспечения Thermo Xcalibur 2.0.7 и специального приложения собственной разработки с применением Microsoft Visual Basic 6.0.
Препаративная LC/MS, способ TFA10
[00237] Образцы очищали с помощью препаративной HPLC с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (50 мм × 21,2 мм). Применяли градиент ацетонитрила (A) и 0,1% трифторуксусной кислоты в воде (B) при скорости потока 30 мл/мин. (0-0,2 мин. 5% A, 0,2-3,0 мин. линейный градиент 5-100% A, 4,1-4,5 мин. 100-5% A, 4,5-5,0 мин. 5% A). Применяли специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор в УФ и видимой областях спектра Gilson 155; блок интерфейса Gilson 506C; коллектор фракций Gilson FC204; активный делитель потока Agilent G1968D и масс-спектрометр Thermo MSQ Plus. Систему контролировали посредством комбинации программного обеспечения Thermo Xcalibur 2.0.7 и специального приложения собственной разработки с применением Microsoft Visual Basic 6.0.
Препаративная LC/MS, способ AA6
[00238] Образцы очищали с помощью препаративной HPLC с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (50 мм × 21,2 мм). Применяли градиент ацетонитрила (A) и 0,1% ацетата аммония в воде (B) при скорости потока 40 мл/мин. (0-0,5 мин. 15% A, 0,5-8,0 мин. линейный градиент 15-100% A, 8,0-9,0 мин. 100% A, 7,0-8,9 мин. 100% A, 9,0-9,1 мин. линейный градиент 100-15% A, 9,1-10 мин. 15% A). Применяли специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор в УФ и видимой областях спектра Gilson 155; блок интерфейса Gilson 506C; коллектор фракций Gilson FC204; активный делитель потока Agilent G1968D и масс-спектрометр Thermo MSQ Plus. Систему контролировали посредством комбинации программного обеспечения Thermo Xcalibur 2.0.7 и специального приложения собственной разработки с применением Microsoft Visual Basic 6.0.
Препаративная LC/MS, способ AA7
[00239] Образцы очищали с помощью препаративной HPLC с обращенной фазой на колонке Phenomenex® Luna® C8(2) 5 мкм, 100Å AXIA (50 мм × 21,2 мм). Применяли градиент ацетонитрила (A) и 0,1% ацетата аммония в воде (B) при скорости потока 40 мл/мин. (0-0,5 мин. 25% A, 0,5-8,0 мин. линейный градиент 25-100% A, 8,0-9,0 мин. 100% A, 7,0-8,9 мин. 100% A, 9,0-9,1 мин. линейный градиент 100-25% A, 9,1-10 мин. 25% A). Применяли специальную систему очистки, состоящую из следующих модулей: насосы Gilson 305 и 306; манометрический модуль Gilson 806; детектор в УФ и видимой областях спектра Gilson 155; блок интерфейса Gilson 506C; коллектор фракций Gilson FC204; активный делитель потока Agilent G1968D и масс-спектрометр Thermo MSQ Plus. Систему контролировали посредством комбинации программного обеспечения Thermo Xcalibur 2.0.7 и специального приложения собственной разработки с применением Microsoft Visual Basic 6.0.
Пример 1
(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
Стадия 1. 3-Амино-5-(4-трифторметоксифенилсульфанил)пиридин-2-карбоновая кислота
[00240] Раствор 3-амино-5-бромпиридин-2-карбоновой кислоты (CAS: 870997-85-6, 3,26 г, 15 ммоль), 4-(трифторметокси)бензол-1-тиола (CAS: 169685-29-4, 3,5 г, 18 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU, 2,22 мл, 15 ммоль) получали в N,N-диметилацетамиде (15 мл). Эту смесь нагревали при 140°C в течение 45 минут в реакторе для микроволновой обработки. Затем смесь разбавляли с помощью смеси 1% уксусной кислоты в воде. Получали суспензию, которую затем фильтровали. Данное собранное твердое вещество промывали с помощью смеси 1% уксусная кислота/вода с последующим промыванием с помощью петролейного эфира. После высушивания в вакуумной печи получали указанное в заголовке соединение. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 7,68 (d, J=2,0 Гц, 1H), 7,64-7,60 (m, 2H), 7,48-7,44 (m, 2H), 6,99 (d, J=2,0 Гц, 1H).
Стадия 2. 3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-карбоновая кислота
[00241] 3-Амино-5-(4-трифторметоксифенилсульфанил)пиридин-2-карбоновую кислоту (12,5 г, 40 ммоль, стадия 1) растворяли в трифторуксусной кислоте (80 мл) и полученную смесь охлаждали до 0°C на ледяной бане. Затем добавляли H2O2 (14 мл, 160 ммоль) и смесь перемешивали при 0°C до завершения реакции. Для обработки смесь разбавляли с помощью смеси 1% уксусной кислоты в воде. Получали суспензию, которую затем фильтровали. Собранное твердое вещество промывали с помощью смеси 1% уксусная кислота/вода с последующим промыванием с помощью петролейного эфира. После высушивания в вакуумной печи получали указанное в заголовке соединение. MS (ESI+) масса/заряд 363 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,26 (d, J=1,9 Гц, 1H), 8,14 (d, J=8,8 Гц, 2H), 7,79 (d, J=1,9 Гц, 1H), 7,65 (d, J=8,4 Гц, 2H).
Стадия 3. 3-Амино-N'-(гидроксиацетил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбогидразид (A-1654077.0)
[00242] Во флакон объемом 40 мл добавляли 3-амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-карбоновую кислоту (0,50 г, 1,311 ммоль, стадия 2) и N,N-диметилформамид (3 мл). Затем добавляли гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (HATU, 0,548 г, 1,442 ммоль) и полученный раствор перемешивали в течение 30 минут при комнатной температуре. Данный раствор затем переносили с помощью канюли в другой флакон объемом 20 мл, который содержал 2-гидроксиацетогидразид (0,154 г, 1,704 ммоль) в N,N-диметилформамиде (3 мл). N,N-Диметилформамид (1 мл) добавляли в качестве раствора для промывания. Затем по каплям добавляли основание Хунига (0,458 мл, 2,62 ммоль) и смесь перемешивали в течение 30 минут при комнатной температуре. Добавляли этилацетат (20 мл) и 5% NaHCO3 (20 мл), полученную двухфазную смесь перемешивали в течение 5 минут и слои разделяли. Водный слой экстрагировали с помощью этилацетата (20 мл). Объединенные органические экстракты промывали с помощью воды (2 × 20 мл) и солевого раствора (20 мл), высушивали над Na2SO4, фильтровали и затем концентрировали под вакуумом с получением указанного в заголовке соединения, которое применяли без дополнительной очистки (470 мг). 1H ЯМР (501 МГц, DMSO-d6) δ ppm 3,93 (d, J=5,9 Гц, 2H), 5,48 (t, J=6,0 Гц, 1H), 7,12-7,24 (m, 2H), 7,64 (dq, J=7,8, 1,1 Гц, 2H), 7,75 (d, J=2,0 Гц, 1H), 8,09-8,16 (m, 2H), 8,21 (d, J=2,1 Гц, 1H), 9,70 (s, 1H), 10,23 (s, 1H); MS (ESI-) масса/заряд 433,1 [M-H]-.
Стадия 4. 3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-({[три(пропан-2-ил)силил]окси}ацетил)пиридин-2-карбогидразид
[00243] 3-Амино-N'-(гидроксиацетил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбогидразид (0,5315 г, 1,224 ммоль, стадия 3) суспендировали в 10 мл дихлорметана в 50-мл круглодонной колбе и колбу охлаждали до 0°C на ледяной бане. Добавляли триэтиламин (0,341 мл, 2,447 ммоль) с последующим добавлением по каплям триизопропилсилилтрифторметансульфоната (0,660 мл, 2,447 ммоль). Реакционную смесь перемешивали при 0°C в течение 15 минут, после чего колбу нагревали до комнатной температуры и перемешивали в течение дополнительных 2,5 часа. Реакционную смесь гасили посредством добавления воды. Органический слой отделяли, высушивали над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали посредством флэш-хроматографии, элюировали с помощью градиента 0-2,5% CH3OH в CH2Cl2 на колонке с 40 г силикагеля с получением 720 мг указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 1,01 (d, J=7,1 Гц, 18H), 1,08-1,19 (m, 3H), 5,03 (s, 2H), 7,26 (s, 2H), 7,60-7,68 (m, 2H), 7,90 (d, J=2,0 Гц, 1H), 8,11-8,20 (m, 2H), 8,41 (d, J=2,0 Гц, 1H); MS (ESI+) масса/заряд 591,1 [M+H]+.
Стадия 5. 5-[4-(Трифторметокси)бензол-1-сульфонил]-2-[5-({[три(пропан-2-ил)силил]окси}метил)-1,3,4-оксадиазол-2-ил]пиридин-3-амин
[00244] К раствору 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-({[три(пропан-2-ил)силил]окси}ацетил)пиридин-2-карбогидразида (0,4638 г, 0,785 ммоль, стадия 4) и триэтиламина (0,219 мл, 1,570 ммоль) в дихлорметане (1,8 мл) добавляли п-толуолсульфонилхлорид (0,299 г, 1,570 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Затем реакционную смесь промывали с помощью насыщенного водного раствора NaHCO3. Органический слой отделяли, высушивали над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток очищали посредством осаждения из 3 мл диметилсульфоксида и 3 мл метанола с получением 268 мг указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 1,01 (d, J=7,1 Гц, 18H), 1,08-1,19 (m, 3H), 5,03 (s, 2H), 7,26 (s, 2H), 7,60-7,68 (m, 2H), 7,90 (d, J=2,0 Гц, 1H), 8,11-8,20 (m, 2H), 8,41 (d, J=2,0 Гц, 1H); MS (ESI+) масса/заряд 573,1 [M+H]+.
Стадия 6. (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00245] К раствору 5-[4-(трифторметокси)бензол-1-сульфонил]-2-[5-({[три(пропан-2-ил)силил]окси}метил)-1,3,4-оксадиазол-2-ил]пиридин-3-амина (0,2664 г, 0,465 ммоль, стадия 5) в тетрагидрофуране (3 мл) по каплям добавляли раствор фторида тетрабутиламмония (1 M в тетрагидрофуране, 0,465 мл, 0,465 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1,5 часа. Затем реакционную смесь разделяли между этилацетатом и водой. Объединенные органические экстракты высушивали над сульфатом натрия, фильтровали и концентрировали in vacuo. Затем остаток подвергали воздействию ультразвука в дихлорметане с получением белого твердого вещества, которое выделяли посредством фильтрации и высушивали до постоянного веса с получением 168 мг указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 4,71 (s, 2H), 5,98 (s, 1H), 7,23 (s, 2H), 7,63 (dq, J=8,9, 1,1 Гц, 2H), 7,87 (d, J=2,0 Гц, 1H), 8,07-8,20 (m, 2H), 8,39 (d, J=2,0 Гц, 1H); MS (ESI-) масса/заряд 414,9 [MH]-.
Альтернативный способ получения 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-({[три(пропан-2-ил)силил]окси}ацетил)пиридин-2-карбогидразида
Стадия 1. Метил-{[три(пропан-2-ил)силил]окси}ацетат
[00246] Метил-2-гидроксиацетат (CAS: 96-35-5, 80 г, 888,9 ммоль) смешивали с имидазолом (CAS: 288-32-4, 182 г, 2,7 моль) в сухом N,N-диметилформамиде (1 л). К данному раствору добавляли триизопропилсилилхлорид (CAS: 13154-24-0, 228 мл, 1,1 моль). Полученную смесь перемешивали при температуре окружающей среды в атмосфере азота. После перемешивания в течение ночи смесь гасили с помощью насыщенного NaHCO3 (1,5 л) и последовательно экстрагировали с помощью диэтилового эфира. Объединенные органические фракции промывали с помощью 2 M HCl (1,4 л, 2,8 моль), воды (0,5 л) и солевого раствора (1 л). Затем органический слой высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 199 г указанного в заголовке соединения, которое применяли без очистки.
Стадия 2. 2-{[Три(пропан-2-ил)силил]окси}ацетогидразид
[00247] Метил{[три(пропан-2-ил)силил]окси}ацетат (199 г, 808,4 ммоль) растворяли в тетрагидрофуране (1 л). Добавляли водный раствор гидразина (35% вес/вес, 200 мл, 2,2 моль) и смесь нагревали с обратным холодильником в течение ночи. Затем смесь гасили с помощью NaHCO3 (1,5 л) с последующей экстракцией с помощью эфира (4 × 500 мл). Объединенные органические фракции высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 191 г неочищенного материала. Неочищенный материал осаждали в течение ночи из этилацетата/гептана (500 мл, 5/95) с получением 122 г указанного в заголовке соединения.
Стадия 3. 3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-({[три(пропан-2-ил)силил]окси}ацетил)пиридин-2-карбогидразид
[00248] 3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-карбоновую кислоту (107,3 г, 296,4 ммоль) смешивали с 2-{[три(пропан-2-ил)силил]окси}ацетогидразидом (87,5 г, 355,7 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлоридом (EDCI, CAS: 1892-57-5, 68,3 г, 355,7 ммоль) и 4-диметиламинопиридином (CAS: 1122-58-3, 43,4 г, 355,7 ммоль) в дихлорметане (2 л). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Затем реакцию гасили с помощью 1 н. раствора HCl (1 л, 1 моль) и экстрагировали с помощью дихлорметана. Органический слой промывали с помощью солевого раствора и H2O, высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 186,5 г указанного в заголовке соединения, которое применяли без очистки.
Пример 2
(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метилдигидрофосфат
Стадия 1. (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метилди-трет-бутилфосфат
[00249] 1H-Тетразол (0,45 M в CH3CN, 42,7 мл, 19,22 ммоль) разбавляли с помощью N,N-диметилацетамида (19,22 мл) и CH3CN удаляли in vacuo при температуре бани, составляющей 60°C. После охлаждения колбы до комнатной температуры (5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол (4 г, 9,61 ммоль, пример 1) добавляли одной порцией в виде чистого твердого вещества с последующим добавлением по каплям ди-трет-бутил-N,N-диэтилфосфорамидита (4,01 мл, 14,41 ммоль). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре, после чего реакционный сосуд помещали в баню с водой комнатной температуры и по каплям добавляли пероксид водорода (30% водный, 2,94 мл, 96 ммоль). Отмечали замедленный экзотермический эффект до температуры 40°C. После охлаждения колбы до комнатной температуры реакционную смесь перемешивали в течение 15 минут, и продукт начинал выпадать в осадок из раствора. Реакционную смесь разбавляли с помощью этилацетата, промывали с помощью воды и солевого раствора, затем высушивали над сульфатом натрия, фильтровали и концентрировали in vacuo. Твердый остаток осаждали из этилацетата/гептанов с получением 5,255 г указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) δ ppm 8,49 (d, J=1,9 Гц, 1H), 8,05 (d, J=8,8 Гц, 2H), 7,75 (d, J=2,0 Гц, 1H), 7,45-7,33 (m, 2H), 6,39 (s, 2H), 5,27 (d, J=8,8 Гц, 2H), 7,75 (d, масса/заряд 607,0 [M-H]-.
Стадия 2. (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метилдигидрофосфат
[00250] (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метилди-трет-бутилфосфат (5,0 г, 8,22 ммоль, стадия 1) растворяли в уксусной кислоте (20,0 мл). HCl (1 M в уксусной кислоте, 41,1 мл, 41,1 ммоль) добавляли с помощью шприца и полученный раствор тщательно перемешивали при комнатной температуре. После примерно 1 минуты твердое вещество начинало выпадать в осадок из раствора. Полученную суспензию перемешивали в течение 30 минут при комнатной температуре, после чего твердые вещества собирали с помощью фриттованной воронки. Осадок на фильтре промывали с помощью 5 мл уксусной кислоты и 2 × 10 мл гептанов и затем высушивали до постоянного веса в вакуумной печи в течение 16 часов при 35°C с получением указанного в заголовке соединения в виде твердого вещества (3,7 г). 1H ЯМР (400 МГц, метанол-d4) δ ppm 8,37 (d, J=2,0 Гц, 1H), 8,14 (d, J=8,9 Гц, 2H), 7,88 (d, J=2,0 Гц, 1H), 8,14 (d, J=9,1 Гц, 2H); MS (ESI-) масса/заряд 495,0 [M-H]-.
Пример 3
2-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-1,1,1-трифторпропан-2-ол
Стадия 1. Метил-3-амино-5-[4-(трифторметокси)фенил]сульфонилпиридин-2-карбоксилат
[00251] К суспензии 3-амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-карбоновой кислоты (1,08 г, 3 ммоль, пример 1 - стадия 2) в CH3OH (20 мл) добавляли несколько капель H2SO4. Полученную смесь перемешивали при 70°C в закрытом флаконе в течение 72 часов. Затем смесь добавляли к воде, которую доводили до значения pH=7 с применением 1 M раствора NaOH. Полученный осадок собирали посредством фильтрации. Твердое вещество промывали с помощью воды и высушивали в вакуумной печи (50°C) с получением указанного в заголовке соединения (0,93 г), которое применяли без дополнительной очистки. MS (ESI+) масса/заряд 377 [M+H]+.
Стадия 2. 3-Амино-5-[4-(трифторметокси)фенил]сульфонилпиридин-2-карбогидразид
[00252] Гидрат гидразина (CAS: 7803-57-8, 80% в воде, 4 мл) добавляли к раствору метил-3-амино-5-[4-(трифторметокси)фенил]сульфонилпиридин-2-карбоксилата (0,92 г, 2,44 ммоль, стадия 1) в тетрагидрофуране (15 мл). Раствор нагревали при 55°C в закрытом флаконе. После перемешивания в течение ночи смесь разбавляли в воде и полученную суспензию фильтровали с получением твердого вещества, которое промывали с помощью воды. С помощью последующего высушивания в вакуумной печи (50°C) получали указанное в заголовке соединение (0,7 г), которое применяли без дополнительной очистки. MS (ESI+) масса/заряд 377 [M+H]+.
Стадия 3. 3-Амино-N'-(3,3,3-трифтор-2-гидрокси-2-метилпропанoил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбогидразид
[00253] К раствору 1-метил-2-пирролидинoна (4 мл), содержащему 3-амино-5-[4-(трифторметокси)фенил]сульфонилпиридин-2-карбогидразид (188 мг, 0,5 ммоль, 1 экв., стадия 2), гексафторфосфат 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (190 мг, 0,5 ммоль, HATU, 1 экв.) и триэтиламин (139 мкл, 1 ммоль, 2 экв.) добавляли 3,3,3-трифтор-2-гидрокси-2-метилпропанoвую кислоту (72 мг, 0,5 ммоль, [CAS № 114715-77-4], 1 экв.). Полученную смесь перемешивали при комнатной температуре до завершения реакции. Указанное в заголовке соединение получали после экстракции с помощью этилацетата и концентрирования объединенных органических фракций. MS (ESI+) масса/заряд 517 [M+H]+.
Стадия 4. 3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-(3,3,3-трифтор-2-метил-2-{[три(пропан-2-ил)силил]окси}пропаноил)пиридин-2-карбогидразид
[00254] К суспензии 3-амино-N'-(3,3,3-трифтор-2-гидрокси-2-метилпропанoил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбогидразида (258 мг, 0,5 ммоль, 1 экв., стадия 3) и триэтиламина (28 мкл, 1 ммоль, 2 экв.) в дихлорметане (15 мл) при 0°C по каплям добавляли триизопропилсилилтрифторметансульфонат (108 мкл, 1 ммоль CAS: 80522-42-5, 2 экв.). Полученную смесь перемешивали при 0°C в течение 15 минут, после чего обеспечивали достижение смесью комнатной температуры. После завершения реакции смесь добавляли к воде и экстрагировали с помощью этилацетата. Объединенные органические фракции высушивали с помощью Na2SO4 и концентрировали с получением указанного в заголовке соединения, которое применяли без дополнительной очистки. MS (ESI+) масса/заряд 629 [M-C3H7]+.
Стадия 5. 5-[4-(Трифторметокси)бензол-1-сульфонил]-2-[5-(1,1,1-трифтор-2-{[три(пропан-2-ил)силил]окси}пропан-2-ил)-1,3,4-оксадиазол-2-ил]пиридин-3-амин
[00255] К раствору 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-(3,3,3-трифтор-2-метил-2-{[три(пропан-2-ил)силил]окси}пропаноил)пиридин-2-карбогидразида (336 мг, 0,5 ммоль, 1 экв., стадия 4) и триэтиламина (209 мкл, 1,5 ммоль, 3 экв.) в сухом дихлорметане (10 мл) добавляли п-толуолсульфонилхлорид (286 мг, 1,5 ммоль, CAS: 98-59-9, 3 экв.). Смесь перемешивали при температуре окружающей среды до завершения. Затем смесь разбавляли с помощью воды и экстрагировали с помощью этилацетата. Объединенную органическую фракцию промывали с помощью водного NaHCO3, высушивали с помощью Na2SO4 и концентрировали. Остаток очищали посредством колоночной хроматографии с применением петролейного эфира/этилацетата (9/1) в качестве элюента с получением указанного в заголовке соединения. MS (ESI+) масса/заряд 655 [M+H]+.
Стадия 6. 2-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-1,1,1-трифторпропан-2-ол
[00256] К раствору 5-[4-(трифторметокси)бензол-1-сульфонил]-2-[5-(1,1,1-трифтор-2-{[три(пропан-2-ил)силил]окси}пропан-2-ил)-1,3,4-оксадиазол-2-ил]пиридин-3-амина (98 мг, 0,15 ммоль, 1 экв., стадия 5) в тетрагидрофуране (5 мл) добавляли 1 M раствор фторида тетрабутиламмония в тетрагидрофуране (0,15 мл, 0,15 ммоль, 1 экв.). Смесь перемешивали при температуре окружающей среды до завершения. Затем смесь разбавляли с помощью воды и экстрагировали с помощью этилацетата. Объединенные органические фракции высушивали и концентрировали. Остаток очищали посредством препаративной хроматографии (защитная колонка XSelect™ CSH Prep, C18, 19 × 10 мм, 5 мкм (Waters) с колонкой XSelect™ CSH Prep OBD, C18, 19 × 100 мм, 5 мкм (Waters) и применяли градиент 0,1% муравьиной кислоты в воде (A) и ацетонитрила (B) со скоростью потока 20 мл/минута. В качестве альтернативы применяли защитную колонку XBridge™ Prep, C18, 19 × 10 мм, 5 мкм (Waters) с колонкой XBridge™ Prep OBD, C18, 19 × 100 мм, 5 мкм (Waters) и градиент 0,5% NH3 в воде (A) и ацетонитрила (B) со скоростью потока 20 мл/минута). После элюирования растворитель удаляли под вакуумом с получением указанного в заголовке соединения. MS (ESI+) масса/заряд 499 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,46 (d, J=2 Гц, 1H), 8,16 (m, 2H), 7,93 (d, J=2 Гц, 1H), 7,67 (m, 1H), 7,67 (m, 2H), 7,27 (br. s, 2H), 1,84 (s, 3H).
Пример 4
1-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-2,2,2-трифторэтан-1-ол
[00257] Указанное в заголовке соединение получали с применением процедур, описанных в синтезе примера 3, и заменой 3,3,3-трифтор-2-гидроксипропанoвой кислоты на 3,3,3-трифтор-2-гидрокси-2-метилпропанoвую кислоту на стадии 3, и получением следующей последовательности промежуточных соединений: 3-амино-N'-(3,3,3-трифтор-2-гидроксипропанoил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбогидразид (MS (ESI+) масса/заряд 503 [M+H]+), 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]-N'-(3,3,3-трифтор-2-{[три(пропан-2-ил)силил]окси}пропаноил)пиридин-2-карбогидразид (MS (ESI+) масса/заряд 615 [M-C3H7]+, 643 [M-CH3]+), 5-[4-(трифторметокси)бензол-1-сульфонил]-2-[5-(2,2,2-трифтор-1-{[три(пропан-2-ил)силил]окси}этил)-1,3,4-оксадиазол-2-ил]пиридин-3-амин (MS (ESI+) масса/заряд 641 [M+H]+). MS (ESI+) масса/заряд 485 [M+H]+; 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,43 (d, J=2 Гц, 1H), 8,15 (m, 2H), 7,90 (d, J=2 Гц, 1H), 7,67 (m, 2H), 7,29 (br s, 2H), 6,04 (t, J=6 Гц, 1H), 4,74 (d, J =6 Гц, 2H).
Пример 5
(2-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3-тиазол-5-ил)метанол
Стадия 1. 3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбоксамид
[00258] Раствор 3-амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-карбоновой кислоты (140 мг, 0,386 ммоль, пример 1 - стадия 2) и гексафторфосфата 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида (294 мг, 0,773 ммоль, HATU) в N,N-диметилформамиде (1,4 мл) обрабатывали с помощью триэтиламина (108 мкл, 0,773 ммоль), перемешивали при комнатной температуре в течение 20 минут, обрабатывали с помощью избытка 37% водного раствора гидроксида аммония (407 мкл, 3,86 ммоль) и перемешивали в течение ночи. Смесь разбавляли водой (20 мл) и перемешивали в течение 15 минут. Твердое вещество, которое образовывалось, собирали посредством фильтрации, промывали с помощью воды и высушивали под вакуумом с получением указанного в заголовке соединения (129 мг, 0,357 ммоль, выход 92%). MS (DCI+) масса/заряд 362 [M+H]+, 379 [M+NH4]+; 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,17 (d, J=2,1 Гц, 1H), 8,13-8,09 (m, 2H), 8,02 (br s, 1H), 7,69 (d, J=2,1 Гц, 1H), 8,13-8,09 (m, 2H), 8,02 (br s, 1H), 7,69 (d, J=8,1 Гц, 2H), 7,58 (br s, 1H), 7,25 (bs, 2H).
Стадия 2. 3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карботиоамид
[00259] Смесь 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карбоксамида (80 мг, 0,221 ммоль, стадия 1) и пентасульфида фосфора (49,2 мг, 0,221 ммоль) в тетрагидрофуране (2 мл) перемешивали при 55°C в течение 45 минут. Смесь обрабатывали с помощью 1 M HCl (~10 мл) и толуола (20 мл). Смесь тщательно перемешивали и нагревали до 95°C в течение 2 часов, а затем охлаждали до комнатной температуры. Смесь экстрагировали с помощью этилацетата. Этилацетатный слой промывали с помощью солевого раствора, высушивали (MgSO4), фильтровали, концентрировали, повторно растворяли в этилацетате/CH2Cl2, обрабатывали с помощью силикагеля (~ 3 г) и концентрировали до сухого состояния. Суспензию, содержащую силикагель, переносили на поверхность картриджа DASi™-12, на предварительно уравновешенную колонку с 25 г силикагеля. При помощи хроматографии посредством элюирования с использованием градиента от 20% до 50% этилацетата в гептанах получали указанное в заголовке соединение (36 мг, 0,095 ммоль, выход 43,1%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 9,93 (br s, 1H), 9,73 (br s, 1H), 8,20 (d, J=2,1 Гц, 1H), 8,16-8,11 (m, 2H), 7,81 (d, J=2,1 Гц, 1H), 8,16-8,11 (m, 2H), 7,81 (d, J=8,1 Гц, 2H).
Стадия 3. 2-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3-тиазол-5-карбальдегид
[00260] Смесь 3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-карботиоамида (30 мг, 0,079 ммоль, стадия 2) и 2-броммалональдегида (48,0 мг, 0,318 ммоль) в 2-метилтетрагидрофуране обрабатывали с помощью пиридина (12,86 мкл, 0,159 ммоль) и смесь нагревали до 70°C в течение 90 минут. Смесь охлаждали и разделяли между этилацетатом (50 мл) и 0,1 M водным HCl (15 мл). Этилацетатный слой промывали с помощью солевого раствора, высушивали (MgSO4), фильтровали, концентрировали, повторно растворяли в CH2Cl2/этилацетате, обрабатывали с помощью силикагеля (~1,5 г) и концентрировали до сухого состояния. Суспензию, содержащую силикагель, переносили на поверхность картриджа DASi™-12, на предварительно уравновешенную колонку с 12 г силикагеля. При помощи элюирования с использованием градиента от 15% до 50% этилацетата в гептанах получали указанное в заголовке соединение (7 мг, 0,016 ммоль, выход 20,51%). MS (ESI+) масса/заряд 462 (M+CH3OH+H)+; MS (ESI-) масса/заряд 428 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ ppm 10,07 (s, 1H), 8,44 (s, 1H), 8,40 (d, J=1,9 Гц, 1H), 8,06-8,01 (m, 2H), 7,62 (d, J=1,9 Гц, 1H), 7,37 (d, J=8,1 Гц, 2H).
Стадия 4. (2-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3-тиазол-5-ил)метанол
[00261] Раствор 2-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3-тиазол-5-карбальдегида (7 мг, 0,016 ммоль, стадия 3) в метаноле (1 мл) обрабатывали с помощью избытка NaBH4 (5 мг), перемешивали при комнатной температуре в течение 15 минут, обрабатывали с помощью 1 M водного HCl (5 мл) и экстрагировали с помощью этилацетата (30 мл). Этилацетатный слой промывали с помощью солевого раствора, высушивали (MgSO4), фильтровали и концентрировали до сухого состояния. Остаток растворяли в смеси CH2Cl2 и этилацетата, обрабатывали с помощью силикагеля (~1,5 г) и концентрировали до сухого состояния. Суспензию, содержащую силикагель, переносили на поверхность картриджа DASi™-12, на предварительно уравновешенную колонку с 4 г силикагеля. При помощи хроматографии посредством элюирования с использованием градиента от 50% до 100% этилацетата в гептанах получали указанное в заголовке соединение (3 мг, 6,95 мкмоль, выход 42,7%). MS (ESI-) масса/заряд 430 [M-H]-; 1H ЯМР (400 МГц, CDCl3) δ ppm 8,38 (d, J=1,7 Гц, 1H), 8,04-8,00 (m, 2H), 7,77 (s, 1H), 7,54 (d, J=1,7 Гц, 1H), 8,04-8,00 (m, 2H), 7,77 (s, 1H), 7,54 (d, J=8,0 Гц, 2H), 6,43 (s, 2H), 4,93 (d, J=5,9 Гц, 2H), 1,90 (d, J=5,9 Гц, 1H).
Пример 6
2-(1,3,4-Оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00262] Раствор йодбензола (696 мг, 2,162 ммоль), (2,2,6,6-тетраметилпиперидин-1-ил)оксила (TEMPO, 45,0 мг, 0,288 ммоль) и (5-(3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)метанола (300 мг, 0,721 ммоль, пример 1) в 1,4-диоксане (20 мл) и воде (6,00 мл) перемешивали при температуре окружающей среды в течение 30 минут. LC/MS анализ показал главным образом необходимый продукт. Смесь экстрагировали с помощью 60 мл этилацетата и 20 мл воды. Органический слой разделяли и растворитель удаляли in vacuo. Неочищенный материал перемешивали в 20 мл этилацетата и фильтровали с получением указанного в заголовке соединения (177 мг, 0,458 ммоль, выход 63,6%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 9,44 (s, 1H), 8,44 (d, J=2,0 Гц, 1H), 8,21-8,12 (m, 2H), 7,93 (d, J=2,1 Гц, 1H), 7,67 (dd, J=9,0, 1,2 Гц, 2H), 7,30 (s, 2H); MS (ESI+) масса/заряд 387 (M+H+).
Пример 7
(5-{3-Амино-5-[4-(трифторметил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
Стадия 1. 3-Амино-5-((4-(трифторметил)фенил)тио)пиколиновая кислота
[00263] Раствор 3-амино-5-бромпиколиновой кислоты (15,00 г, 69,1 ммоль) в N,N-диметилформамиде (150 мл) и 4-(трифторметил)бензолтиоле (11,37 мл, 83 ммоль) барботировали с помощью N2 в течение 20 минут. К реакционной смеси добавляли N-этил-N-изопропилпропан-2-амин (24,14 мл, 138 ммоль). Реакционную смесь нагревали до 100°C в атмосфере N2 в течение 4 часов. Реакционную смесь медленно выливали в смесь 150 мл воды и 20 мл 1 M водного раствора HCl, который охлаждали до 0°C. Образовавшееся твердое вещество промывали в колбе, содержащей реакционную смесь, с помощью воды (100 мл) и петролейного эфира (30 мл x 3) и затем высушивали при пониженном давлении с получением указанного в заголовке соединения (19,5 г, 61,4 ммоль, выход 89%). MS (ESI+) масса/заряд 315,1 (M+H)+.
Стадия 2. 3-Амино-5-((4-(трифторметил)фенил)сульфонил)пиколиновая кислота
[00264] 3-Амино-5-((4-(трифторметил)фенил)тио)пиколиновую кислоту (2,000 г, 6,36 ммоль) растворяли в трифторуксусной кислоте (TFA, 15 мл) и полученную смесь охлаждали до 0°C на ледяной бане. Затем H2O2 (2,60 мл, 25,5 ммоль, 30% в воде) добавляли при 0°C и смесь перемешивали при 0°C в течение 1 часа. Обеспечивали нагревание смеси до 20°C и перемешивали в течение 2 часов. Взвесь разбавляли с помощью смеси 1% уксусной кислоты в воде. Получали суспензию и смесь последовательно фильтровали. Собранное твердое вещество промывали с помощью смеси 1% уксусная кислота/вода и затем с помощью смеси дихлорметан/метанол (10/1, 20 мл). Твердое вещество высушивали при пониженном давлении с получением указанного в заголовке соединения (1,96 г, 5,66 ммоль, выход 89%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,28 (d, J=2,0 Гц, 1H), 8,22 (d, J=8,3 Гц, 2H), 8,06 (d, J=8,4 Гц, 2H), 7,82 (d, J=2,0 Гц, 1H), 7,12 (brs, 2H); MS (ESI+) масса/заряд 347 (M+H)+.
Стадия 3. 3-Амино-N'-(2-гидроксиацетил)-5-((4-(трифторметил)фенил)сульфонил)пиколинoгидразид
[00265] 3-Амино-5-((4-(трифторметил)фенил)сульфонил)пиколиновую кислоту (3,00 г, 8,66 ммоль), 3H-[1,2,3]триазоло[4,5-b]пиридин-3-ол (0,059 г, 0,433 ммоль) и 2-гидроксиацетогидразид (0,858 г, 9,53 ммоль) добавляли к N,N-диметилформамиду (20 мл). Смесь перемешивали при 25°C в течение 10 минут. 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (2,491 г, 13,00 ммоль) добавляли за один раз. Смесь перемешивали при 45°C в течение 2 часов. Добавляли воду (20 мл). Смесь фильтровали, промывали с помощью этилацетата (3 x10 мл) и высушивали при пониженном давлении с получением указанного в заголовке соединения (3,4 г, 7,96 ммоль, выход 92%); MS (ESI+) масса/заряд 419,7 (M+H)+.
Стадия 4. 3-Амино-5-((4-(трифторметил)фенил)сульфонил)-N'-(2-((триизопропилсилил)окси)ацетил)пиколинoгидразид
[00266] К смеси 3-амино-N'-(2-гидроксиацетил)-5-((4-(трифторметил)фенил)сульфонил)пиколинoгидразида (6,00 г, 14,34 ммоль) в N,N-диметилформамиде (50 мл) добавляли триэтиламин (5,00 мл, 35,9 ммоль). Смесь охлаждали до 0°C и добавляли трифторметилтриизопропилсилансульфонат (5,03 мл, 18,64 ммоль). Реакционную смесь перемешивали при 20°C в течение 3 часов. Добавляли воду (100 мл). Твердое вещество фильтровали, промывали с помощью воды (50 мл x 2), промывали с помощью этилацетата (2×15 мл) и высушивали при пониженном давлении с получением указанного в заголовке соединения (7,2 г, 12,53 ммоль, выход 87%). MS (ESI+) масса/заряд 575,7 (M+H)+.
Стадия 5. 5-((4-(Трифторметил)фенил)сульфонил)-2-(5-(((триизопропилсилил)окси)метил)-1,3,4-оксадиазол-2-ил)пиридин-3-амин
[00267] В трехгорлую круглодонную колбу объемом 250 мл, оснащенную магнитом для перемешивания, загружали 3-амино-5-((4-(трифторметил)фенил)сульфонил)-N'-(2-((триизопропилсилил)окси)ацетил)пиколинoгидразид (3,50 г, 6,09 ммоль) и помещали в атмосферу N2. Добавляли N,N-диметилпиридин-4-амин (0,074 г, 0,609 ммоль), 4-метилбензол-1-сульфонилхлорид (1,742 г, 9,14 ммоль) и ацетонитрил (35 мл), что приводило к получению взвеси. Реакционную смесь нагревали до 50°C. N-Этил-N-изопропилпропан-2-амин (3,72 мл, 21,32 ммоль) медленно добавляли с помощью шприца (внутреннюю температуру увеличивали до 50°C во время добавления), что приводило к тому, что реакционная смесь становилась однородной. Реакционную смесь перемешивали при 50°C в течение 1 часа. Смесь концентрировали и добавляли воду (15 мл). Смесь фильтровали и твердое вещество промывали с помощью воды (15 мл x 2) и метанола (2×10 мл). Твердое вещество высушивали при пониженном давлении с получением указанного в заголовке соединения (3,2 г, 5,12 ммоль, выход 84%). MS (ESI+) масса/заряд 557,2 (M+H)+.
Стадия 6. (5-{3-Амино-5-[4-(трифторметил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00268] Раствор 5-((4-(трифторметил)фенил)сульфонил)-2-(5-(((триизопропилсилил)окси)метил)-1,3,4-оксадиазол-2-ил)пиридин-3-амина (5,80 г, 10,42 ммоль) в ацетонитриле (50 мл) смешивали при комнатной температуре в течение 5 минут. Добавляли тетра-N-бутиламмонийфторид (1,0 M TBAF, 10,94 мл, 10,94 ммоль) в тетрагидрофуране. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. После завершения реакционную смесь концентрировали до приблизительно 10 мл. Добавляли воду (30 мл). Твердое вещество фильтровали и промывали с помощью воды (2×30 мл) и метанола (15 мл x 3). Твердое вещество высушивали под вакуумом с получением указанного в заголовке соединения (3,57 г, 8,92 ммоль, выход 86%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,46 (d, J=1,8 Гц, 1H), 8,25 (d, J=8,2 Гц, 2H), 8,07 (d, J=8,3 Гц, 2H), 7,94 (d, J=1,8 Гц, 1H), 7,30 (s, 2H), 6,04 (s, 1H), 4,76 (d, J=6,3 Гц, 2H); MS (ESI+) масса/заряд 401,0 (M+H)+.
Пример 8
5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-карбоксамид
Стадия 1. 2-(2-(3-Амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoил)гидразинил)-2-оксоацетамид
[00269] Флакон объемом 20 мл загружали 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколиновой кислотой (0,5 г, 1,380 ммоль, стадия 2, пример 1), 2-гидразинил-2-оксоацетамидом (0,213 г, 2,070 ммоль), 3H-[1,2,3]триазоло[4,5-b]пиридин-3-олом (9,39 мг, 0,069 ммоль) и N,N-диметилформамидом (3 мл). Смесь перемешивали при комнатной температуре в течение 15 минут. 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (0,397 г, 2,070 ммоль) добавляли за один раз и смесь нагревали при 45°C в течение часа. Добавляли воду (8 мл). Смесь перемешивали в течение 30 минут при комнатной температуре и фильтровали с получением указанного в заголовке соединения (0,431 г, 0,963 ммоль, выход 69,8%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 10,53 (s, 1H), 10,46 (s, 1H), 8,23 (d, J=2,0 Гц, 1H), 8,18-8,13 (m, 3H), 7,87 (s, 1H), 7,78 (d, J=2,1 Гц, 1H), 7,66 (d, J=7,9 Гц, 1H), 7,21 (s, 2H); MS (APCI+) масса/заряд 448 (M+H)+.
Стадия 2. 5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-карбоксамид
[00270] Флакон объемом 20 мл загружали 2-(2-(3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoил)гидразинил)-2-оксоацетамидом (390 мг, 0,872 ммоль, стадия 1), 4-диметиламинопиридином (10,65 мг, 0,087 ммоль), п-толуолсульфонилхлоридом (316 мг, 1,656 ммоль) и ацетонитрилом (5,1 мл). Полученную взвесь нагревали при 45°C. Медленно добавляли по каплям основание Хунига (N,N-диизопропилэтиламин, 0,533 мл, 3,05 ммоль) и нагревание продолжали при 45°C в течение двух часов. Добавляли воду (8 мл) и взвесь перемешивали в течение 30 минут при комнатной температуре. Твердое вещество фильтровали через бумажный фильтр с помощью силы тяготения. Твердое вещество растворяли в 5 мл DMSO с нагреванием при 60°C, охлаждали и фильтровали. Полученное твердое вещество высушивали под вакуумом в течение 16 часов с получением чистого указанного в заголовке соединения (180 мг, 0,420 ммоль, выход 48,1%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,68 (s, 1H), 8,46 (d, J=2,1 Гц, 1H), 8,29 (s, 1H), 8,22-8,13 (m, 2H), 7,95 (d, J=2,1 Гц, 1H), 7,67 (dt, J=7,9, 1,1 Гц, 2H), 7,32 (s, 2H); MS (APCI+) масса/заряд 430 (M+H)+.
Пример 9
{5-[3-Амино-5-(4-фторбензол-1-сульфонил)пиридин-2-ил]-1,3,4-оксадиазол-2-ил}метанол
Стадия 1. 3-Амино-5-((4-фторфенил)тио)пиколиновая кислота
[00271] 3-Амино-5-бромпиколиновую кислоту (5 г, 23,04 ммоль) перемешивали в N,N-диметилформамиде (50 мл). Добавляли 4-фторбензолтиол (3,54 г, 27,6 ммоль) и N,N-диизопропилэтиламин (8,05 мл, 46,1 ммоль). Реакционную смесь нагревали при 100°C в течение 5 часов. Смесь охлаждали до комнатной температуры. Реакционную смесь медленно выливали в ледяную воду и pH регулировали до 5 с помощью 1 н. водного раствора HCl. Твердое вещество фильтровали и промывали с помощью холодной воды с последующей промывкой петролейным эфиром с получением указанного в заголовке соединения (5,6 г, 20,77 ммоль, выход 90%); MS (ESI+) масса/заряд 265,7 (M+H)+.
Стадия 2. 3-Амино-5-((4-фторфенил)сульфонил)пиколиновая кислота
[00272] 3-Амино-5-((4-фторфенил)тио)пиколиновую кислоту (3 г, 11,35 ммоль) растворяли в трифторуксусной кислоте (21 мл) и полученную смесь охлаждали до 0°C на ледяной бане. Пероксид водорода (4,64 мл, 45,4 ммоль, 30% в воде) добавляли при 0°C и смесь перемешивали при 0°C в течение 1 часа. Обеспечивали нагревание смеси до 20°C и перемешивали в течение 1 часа. Реакционную смесь разбавляли с помощью смеси 1% уксусной кислоты в воде (150 мл). Получали суспензию, которую затем фильтровали. Собранное твердое вещество промывали с помощью ледяной воды (200 мл) и высушивали при пониженном давлении с получением указанного в заголовке соединения (3,0 г, 10,02 ммоль, выход 88%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,25 (s, 1H), 8,11-8,07 (m, 2H), 8,06 (d, J=8,4 Гц, 2H), 7,78 (s, 1H), 7,53 (t, J=8,8 Гц, 2H), 7,12 (brs, 2H); MS (ESI+) масса/заряд 297,7 (M+H)+.
Стадия 3. 3-Амино-5-((4-фторфенил)сульфонил)-N'-(2-гидроксиацетил)пиколинoгидразид
[00273] 3-Амино-5-((4-фторфенил)сульфонил)пиколиновую кислоту (5 г, 16,88 ммоль), 1-гидрокси-7-азабензотриазол (0,115 г, 0,844 ммоль) и 2-гидроксиацетогидразид (1,672 г, 18,56 ммоль) в диметилформамиде (30 мл) перемешивали при 25°C в течение 10 минут. 1-(3-Диметиламинопропил)-3-этилкарбодиимидгидрохлорид (4,85 г, 25,3 ммоль) добавляли за один раз при внутренней температуре, составляющей 25°C. Раствор перемешивали при 25°C в течение 10 минут и нагревали до 45°C в течение 1 часа. Реакционную смесь добавляли в ледяную воду и перемешивали в течение 3 часов. Твердое вещество собирали посредством фильтрации и промывали с помощью ледяной воды с получением указанного в заголовке соединения (5,7 г, 14,70 ммоль, выход 87%). MS (ESI+) масса/заряд 369,7 (M+H)+.
Стадия 4. 3-Амино-5-((4-фторфенил)сульфонил)-N'-(2((триизопропилсилил)окси)ацетил)пиколинoгидразид
[00274] Раствор 3-амино-5-((4-фторфенил)сульфонил)-N'-(2-гидроксиацетил)пиколинoгидразида (6,2 г, 16,83 ммоль) перемешивали в N,N-диметилформамиде (45 мл) при 0oC. Добавляли триэтиламин (7,04 мл, 50,5 ммоль) и медленно добавляли триизопропилсилилтрифторметансульфонат (8,77 г, 28,6 ммоль). Реакционную смесь перемешивали при 20°C в течение 16 часов. Реакционную смесь добавляли в ледяную воду и перемешивали в течение 2 часов. Твердое вещество собирали посредством фильтрации и промывали с помощью ледяной воды с получением указанного в заголовке соединения (8,5 г, 15,39 ммоль, выход 91%). MS (ESI+) масса/заряд 525,7 (M+H)+.
Стадия 5. 5-((4-Фторфенил)сульфонил)-2-(5-(((триизопропилсилил)окси)метил)-1,3,4-оксадиазол-2-ил)пиридин-3-амин
[00275] Раствор 3-амино-5-((4-фторфенил)сульфонил)-N'-(2-((триизопропилсилил)окси)ацетил)пиколинoгидразида (4 г, 7,62 ммоль), N,N-диметилпиридин-4-амина (0,931 г 7,62 ммоль) и 4-метилбензол-1-сульфонилхлорида (1,453 г, 7,62 ммоль) перемешивали в ацетонитриле (40 мл). Реакционную смесь нагревали до 45°C. Медленно добавляли N-этил-N-изопропилпропан-2-амин (0,985 г, 7,62 ммоль). Реакционную смесь нагревали при 45°C в течение 2 часов и затем охлаждали до комнатной температуры. Добавляли воду и смесь перемешивали в течение 1 часа. Смесь фильтровали и твердое вещество промывали с помощью воды с получением указанного в заголовке соединения (3,8 г, 7,13 ммоль, выход 93%). MS (ESI+) масса/заряд 507,7 (M+H)+.
Стадия 6. (5-(3-Амино-5-((4-фторфенил)сульфонил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)метанол
[00276] Смесь 5-((4-фторфенил)сульфонил)-2-(5-(((триизопропилсилил)окси)метил)-1,3,4-оксадиазол-2-ил)пиридин-3-амина (8 г, 15,79 ммоль) перемешивали в течение 5 минут в ацетонитриле (120 мл). Добавляли тетра-N-бутиламмонийфторид) (18,95 мл, 18,95 ммоль). Реакционную смесь перемешивали при 20°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры. Раствор 0,53 мл 85% H3PO4 в 75 мл воды медленно добавляли к реакционной смеси. Полученную взвесь перемешивали при 20°C в течение 3 часов. Твердое вещество фильтровали и промывали с помощью 35 мл раствора 1:5 (об./об.) CH3CN/вода, промывали с помощью 15 мл воды и высушивали под вакуумом с получением указанного в заголовке соединения (5,06 г, 14,15 ммоль, выход 90%). 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,42 (d, J=2,0 Гц, 1H), 8,13-8,08 (m, 2H), 7,90 (d, J=2,0 Гц, 1H), 7,53 (t, J=10,4 Гц, 2H), 7,27 (s, 2H), 6, (t, J=6,2 Гц, 1H), 4,75 (d, J=6,4 Гц, 2H); MS (ESI+) масса/заряд 351,7 (M+H)+.
Пример 10
2-(5-Циклогексил-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
Трет-бутил-2-(3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoил)гидразинкарбоксилатТрет-бутил-2-(3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoил)гидразинкарбоксилат
[00277] Во флакон объемом 20 мл добавляли 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколиновую кислоту (100 мг, 0,276 ммоль) в N,N-диметилацетамиде (4 мл). Добавляли гексафторфосфат(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (115 мг, 0,304 ммоль) и N-этил-N-изопропилпропан-2-амин (0,145 мл, 0,828 ммоль) с последующим добавлением трет-бутилгидразинкарбоксилата (43,8 мг, 0,331 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли в потоке азота. Остаток разбавляли с помощью 4 мл этилацетата и промывали с помощью воды (1×5 мл). Органический слой концентрировали и очищали с применением хроматографии на силикагеле (с применением этилацетата в гептанах в качестве градиента, 5-100%, колонка с 4 г) с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 10,16 (s, 1H), 8,82 (s, 1H), 8,18 (d, J=2,1 Гц, 1H), 8,17-8,04 (m, 2H), 7,74 (d, J=2,1 Гц, 1H), 8,17-8,04 (m, 2H), 7,74 (d,
Стадия 2. 3-Амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид
[00278] Трифторуксусную кислоту (1 мл, 12,98 ммоль) добавляли к трет-бутил-2-(3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoил)гидразинкарбоксилату и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Растворитель удаляли в потоке азота. Неочищенный материал суспендировали в 1 мл гептанов и перемешивали в течение ночи. Полученное твердое вещество собирали посредством фильтрации с получением указанного в заголовке соединения. 1H ЯМР (501 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,25 (d, J=2,1 Гц, 1H), 8,17-8,10 (m, 2H), 7,82 (d, J=2,0 Гц, 1H), 7,65 (dq, J=7,9, 1,1 Гц, 2H).
Стадия 3. 3-Амино-N'-(циклогексанкарбонил)-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид
[00279] Во флакон объемом 4 мл добавляли циклогексанкарбоновую кислоту (25,7 мг, 0,201 ммоль), гексафторфосфат(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (70,0 мг, 0,184 ммоль) и N-этил-N-изопропилпропан-2-амин (0,088 мл, 0,502 ммоль) в N,N-диметилацетамиде (1 мл). Добавляли 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид (63 мг, 0,167 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с применением процедуры очистки TFA6 с обращенной фазой с получением указанного в заголовке соединения (20 мг, выход 24,6%). 1H ЯМР (501 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,24 (d, J=2,0 Гц, 1H), 8,20-8,12 (m, 2H), 7,76 (d, J=2,0 Гц, 1H), 8,20-8,12 (m, 2H), 7,76 (d, J=12,6 Гц, 1H), 1,43-1,12 (m, 6H).
Стадия 4. 2-(5-Циклогексил-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00280] In a 4 mL vial, 3-amino-N'-(cyclohexanecarbonyl)-5-((4-(trifluoromethoxy)phenyl)sulfonyl)picolinohydrazide (20 mg, 0.041 mmol) was added to acetonitrile (1 mL). Добавляли п-толуолсульфонилхлорид (15,68 мг, 0,082 ммоль) и N-этил-N-изопропилпропан-2-амин (0,022 мл, 0,123 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционная смесь прореагировала только на 50%, что определяли с помощью HPLC, поэтому реакционную смесь нагревали до 65°C в течение выходных. Смесь непосредственно очищали с применением способа TFA6 препаративной HPLC/MS с получением указанного в заголовке соединения (5,2 мг, выход 27%). 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,0 Гц, 1H), 8,17 (d, J=8,9 Гц, 2H), 7,89 (d, J=2,1 Гц, 1H), 7,66 (dd, J=8,8, 1,2 Гц, 2H), 3,17-2,99 (m, 1H), 2,05 (d, J=12,0 Гц, 2H), 1,83-1,20 (m, 8H); MS (APCI+) масса/заряд 469,0 (M+H)+.
Пример 11
2-{5-[(S)-Метокси(фенил)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00281] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя (S)-2-метокси-2-фенилуксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,42 (d, J=2,0 Гц, 1H), 8,16 (d, J=8,9 Гц, 2H), 7,90 (d, J=2,1 Гц, 1H), 7,70-7,61 (m, 2H), 7,52-7,36 (m, 5H), 5,89 (s, 1H), 3,41 (s, 3H); MS (APCI+) масса/заряд 506,9 (M+H)+.
Пример 12
2-{5-[(Циклопропилметокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00282] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-(циклопропилметокси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,1 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,70-7,64 (m, 2H), 4,82 (s, 2H), 3,39 (d, J=7,0 Гц, 2H), 1,09-0,94 (m, 1H), 0,56-0,40 (m, 2H), 0,24-0,15 (m, 2H); MS (APCI+) масса/заряд 471,0 (M+H)+.
Пример 13
2-[5-(Феноксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00283] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-феноксиуксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,0 Гц, 1H), 8,18 (d, J=9,0 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,66 (d, J=8,4 Гц, 2H), 7,34 (dd, J=8,8, 7,3 Гц, 2H), 7,09 (d, J=1,1 Гц, 2H), 7,03 (t, J=7,4 Гц, 1H), 5,51 (s, 2H); MS (APCI+) масса/заряд 492,9 (M+H)+.
Пример 14
2-{5-[(Циклопентилокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00284] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-(циклопентилокси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 8,18 (d, MS (APCI+) масса/заряд 485,0 (M+H)+.
Пример 15
5-[4-(Трифторметокси)бензол-1-сульфонил]-2-{5-[(трифторметокси)метил]-1,3,4-оксадиазол-2-ил}пиридин-3-амин
[00285] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-(трифторметокси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,46 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,94 (d, J=2,0 Гц, 1H), 7,77-7,62 (m, 2H), 5,62 (s, 2H); MS (APCI+) масса/заряд 484,9 (M+H)+.
Пример 16
2-(5-{[(Оксолан-3-ил)окси]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00286] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-((тетрагидрофуран-3-ил)окси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,1 Гц, 1H), 8,19 (d, J=9,0 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,72-7,56 (m, 2H), 4,83 (s, 2H), 4,39-4,30 (m, 1H), 3,79-3,59 (m, 4H), 2,14-1,76 (m, 2H); MS (APCI+) масса/заряд 486,9 (M+H)+.
Пример 17
2-{5-[(2-Метоксиэтокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
Стадия 1. 3-Амино-N'-(2-(2-метоксиэтокси)ацетил)-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид
[00287] Во флакон объемом 4 мл добавляли 2-(2-метоксиэтокси)уксусную кислоту (0,4 M в N,N-диметилацетамиде, 199 мкл, 0,08 ммоль, 1,5 экв.) и гексафторфосфат(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (0,12 M в N,N-диметилацетамиде, 500 мкл, 0,063 ммоль, 1,2 экв.). Добавляли 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид со стадии 2 в примере 10 (0,10 M в N,N-диметилацетамиде, 500 мкл, 0,053 ммоль, 1,0 экв.) с последующим добавлением N-этил-N-изопропилпропан-2-амина (27 мкл, 0,16 ммоль, 3,0 экв.) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с применением процедуры TFA6 с обращенной фазой с получением указанного в заголовке соединения.
Стадия 2. 2-{5-[(2-Метоксиэтокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00288] Соединение со стадии 1 переносили во флакон объемом 4 мл и добавляли толуол (500 мкл). Во флакон добавляли чистый реагент Лавессона (32 мг, 0,08 ммоль, 1,5 экв.) и реакционную смесь нагревали до 110°C в течение 1 часа. Растворитель удаляли в потоке азота. Добавляли воду и дихлорметан и смесь перемешивали вихревым способом. Органическую фазу удаляли, высушивали в потоке азота и восстанавливали в DMSO/CH3OH. Неочищенный материал очищали с применением способа AA7 HPLC/MS с обращенной фазой с получением указанного в заголовке соединения (6,4 мг, выход 25%). 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,91 (d, J=2,0 Гц, 1H), 8,19 (d, MS (APCI+) масса/заряд 490,9 (M+H)+.
Пример 18
N-[(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)метил]циклопропанкарботиоамид
[00289] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-(циклопропанкарбоксамидо)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,38 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,89 (d, J=2,0 Гц, 1H), 8,18 (d, MS (APCI+) масса/заряд 515,8 (M+H)+.
Пример 19
2-{5-[(S)-Метокси(фенил)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00290] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (S)-метоксифенилуксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,38 (d, J=2,0 Гц, 1H), 8,17 (d, J=8,9 Гц, 2H), 7,88 (d, J=2,0 Гц, 1H), 8,17 (d, MS (APCI+) масса/заряд 522,8 (M+H)+.
Пример 20
(2S)-2-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)-1,1,1-трифторпропан-2-ол
[00291] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (R)-3,3,3-трифтор-2-гидрокси-2-метилпропановую кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,70-7,64 (m, 3H), 1,86 (s, 3H); MS (APCI+) масса/заряд 514,7 (M+H)+.
Пример 21
2-{5-[(1R)-1-Метоксиэтил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00292] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (R)-2-метоксипропановую кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,26-8,14 (m, 2H), 7,90 (d, J=2,0 Гц, 1H), 8,26-8,14 (m, 2H), 7,90 (d, J=6,5 Гц, 1H), 3,35 (s, 3H), 1,55 (d, J=6,5 Гц, 3H); MS (APCI+) масса/заряд 460,9 (M+H)+.
Пример 22
2-[5-(1-Метоксиэтил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00293] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-метоксипропанoвую кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,90 (d, J=2,0 Гц, 1H), 7,75-7,62 (m, 2H), 4,88 (q, J=6,5 Гц, 1H), 3,35 (s, 3H), 1,56 (d, J=6,5 Гц, 3H); MS (APCI+) масса/заряд 460,9 (M+H)+.
Пример 23
2-{5-[(1S)-1-Метоксиэтил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00294] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (S)-2-метоксипропанoвую кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,90 (d, J=2,0 Гц, 1H), 7,75-7,62 (m, 2H), 4,88 (q, J=6,5 Гц, 1H), 3,35 (s, 3H), 1,56 (d, J=6,5 Гц, 3H); MS (APCI+) масса/заряд 460,9 (M+H)+.
Пример 24
2-{5-[(Циклопропилметокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00295] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-(циклопропилметокси)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,90 (d, J=2,0 Гц, 1H), 8,18 (d, J=6,9 Гц, 2H), 1,13-0,86 (m, 1H), 0,58-0,43 (m, 2H), 0,29-0,11 (m, 2H); MS (APCI+) масса/заряд 486,9 (M+H)+.
Пример 25
2-[5-(Этоксиметил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00296] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-этоксиуксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,90 (d, J=2,0 Гц, 1H), 7,71-7,63 (m, 2H), 4,92 (s, 2H), 3,62 (q, J=7,0 Гц, 2H), 1,18 (t, J=7,0 Гц, 3H); MS (APCI+) масса/заряд 460,9 (M+H)+.
Пример 26
2-[5-(Метоксиметил)-1,3,4-тиадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00297] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-метоксиуксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,91 (d, J=2,0 Гц, 1H), 8,19 (d, MS (APCI+) масса/заряд 446,8(M+H)+.
Пример 27
2-(5-{[(Пиридин-3-ил)окси]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00298] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя гидрохлорид 2-(пиридин-3-илокси)уксусной кислоты на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,61-8,54 (m, 1H), 8,40 (d, J=2,0 Гц, 1H), 8,37 (d, J=5,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,87 (dd, J=8,6, 2,9 Гц, 1H), 7,72-7,56 (m, 3H), 5,79 (s, 2H); MS (APCI+) масса/заряд 509,8 (M+H)+.
Пример 28
5-[4-(Трифторметокси)бензол-1-сульфонил]-2-{5-[(трифторметокси)метил]-1,3,4-тиадиазол-2-ил}пиридин-3-амин
[00299] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-(трифторметокси)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,41 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,93 (d, J=2,0 Гц, 1H), 7,73-7,61 (m, 2H), 5,70 (s, 2H); MS (APCI+) масса/заряд 500,8 (M+H)+.
Пример 29
2-(5-{[(Оксолан-3-ил)окси]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00300] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-((тетрагидрофуран-3-ил)окси)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,23-8,13 (m, 2H), 7,90 (d, J=2,0 Гц, 1H), 8,23-8,13 (m, 2H), 7,90 (d, MS (APCI+) масса/заряд 502,9 (M+H)+.
Пример 30
2-{5-[(Дифторметокси)метил]-1,3,4-тиадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00301] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя 2-(дифторметокси)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,41 (d, J=2,0 Гц, 1H), 8,19 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,67 (dd, J=8,9, 1,1 Гц, 2H), 6,88 (t, J=74,2 Гц, 1H), 5,43 (s, 2H); MS (APCI+) масса/заряд 482,8 (M+H)+.
Пример 31
2-(5-{[(2S)-Оксолан-2-ил]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00302] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (S)-2-(тетрагидрофуран-2-ил)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,39 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,88 (d, J=2,1 Гц, 1H), 7,71-7,62 (m, 2H), 4,21-4,13 (m, 1H), 3,86-3,61 (m, 2H), 3,44-3,18 (m, 2H), 2,03 (dd, J=12,7, 6,3 Гц, 1H), 1,89-1,78 (m, 2H), 1,54 (dd, J=12,2, 7,6 Гц, 1H); MS (APCI+) масса/заряд 486,9 (M+H)+.
Пример 32
2-(5-{[(2R)-Оксолан-2-ил]метил}-1,3,4-тиадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00303] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 17, заменяя (R)-2-(тетрагидрофуран-2-ил)уксусную кислоту на 2-(2-метоксиэтокси)уксусную кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,39 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,88 (d, J=2,0 Гц, 1H), 8,18 (d, J=13,1, 6,8 Гц, 1H), 1,90-1,75 (m, 2H), 1,62-1,45 (m, 1H); MS (APCI+) масса/заряд 486,9 (M+H)+.
Пример 33
2-{5-[(2-Метоксиэтокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00304] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-(2-метоксиэтокси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,1 Гц, 1H), 7,70-7,62 (m, 2H), 4,84 (s, 2H), 3,70-3,66 (m, 2H), 3,50-3,47 (m, 2H), 3,23 (s, 3H); MS (APCI+) масса/заряд 474,8 (M+H)+.
Пример 34
2-{5-[(1R)-1-Метоксиэтил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00305] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя (R)-2-метоксипропанoвую кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,0 Гц, 1H), 8,18 (d, J=9,0 Гц, 2H), 7,91 (d, J=2,0 Гц, 1H), 7,72-7,60 (m, 2H), 4,82 (q, J=6,6 Гц, 1H), 3,31 (s, 3H), 1,55 (d, J=6,6 Гц, 3H); MS (APCI+) масса/заряд 444,8 (M+H)+.
Пример 35
2-{5-[(1S)-1-Метоксиэтил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00306] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя (S)-2-метоксипропанoвую кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,91 (d, J=2,1 Гц, 1H), 7,67 (d, J=8,4 Гц, 3H), 4,81 (q, J=6,7 Гц, 1H), 3,31 (s, 3H), 1,55 (d, J=6,6 Гц, 3H); MS (APCI+) масса/заряд 444,8 (M+H)+.
Пример 36
2-[5-(Этоксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00307] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-этоксиуксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,0 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,1 Гц, 1H), 7,75-7,62 (m, 2H), 4,79 (s, 2H), 3,59 (q, J=7,0 Гц, 2H), 1,15 (t, J=7,0 Гц, 3H); MS (APCI+) масса/заряд 444,9 (M+H)+.
Пример 37
2-[5-(Метоксиметил)-1,3,4-оксадиазол-2-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00308] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-метоксиуксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,1 Гц, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,1 Гц, 1H), 8,18 (d, MS (APCI+) масса/заряд 430,9 (M+H)+.
Пример 38
2-(5-{[(Пиридин-3-ил)окси]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00309] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя гидрохлорид 2-(пиридин-3-илокси)уксусной кислоты на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,52-8,38 (m, 3H), 8,31-8,24 (m, 1H), 8,18 (d, J=8,9 Гц, 2H), 7,92 (d, J=2,0 Гц, 1H), 7,72-7,57 (m, 3H), 7,46 (dd, J=8,5, 4,7 Гц, 2H), 5,64 (s, 2H); MS (APCI+) масса/заряд 493,8(M+H)+.
Пример 39
2-{5-[(Дифторметокси)метил]-1,3,4-оксадиазол-2-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00310] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя 2-(дифторметокси)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,0 Гц, 1H), 8,25-8,13 (m, 2H), 7,93 (d, J=2,0 Гц, 1H), 8,25-8,13 (m, 2H), 7,93 (d, J=73,9 Гц, 1H), 5,31 (s, 2H); MS (APCI+) масса/заряд 466,9 (M+H)+.
Пример 40
2-(5-{[(2S)-Оксолан-2-ил]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00311] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя (S)-2-(тетрагидрофуран-2-ил)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,0 Гц, 1H), 8,25-8,11 (m, 2H), 7,90 (d, J=2,1 Гц, 1H), 7,70-7,60 (m, 2H), 4,31-4,20 (m, 1H), 3,65-3,57 (m, 2H), 3,28-3,02 (m, 2H), 2,13-1,99 (m, 1H), 1,93-1,76 (m, 2H), 1,74-1,57 (m, 1H); MS (APCI+) масса/заряд 470,9 (M+H)+.
Пример 41
2-(5-{[(2R)-Оксолан-2-ил]метил}-1,3,4-оксадиазол-2-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00312] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 10, заменяя (R)-2-(тетрагидрофуран-2-ил)уксусную кислоту на циклогексанкарбоновую кислоту. 1H ЯМР (500 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,1 Гц, 1H), 8,21-8,14 (m, 2H), 7,90 (d, J=2,1 Гц, 1H), 8,21-8,14 (m, 2H), 7,90 (d, MS (APCI+) масса/заряд 470,9 (M+H)+.
Пример 42
1-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)этан-1-ол
Стадия 1. (S)-3-Амино-N'-(2-гидроксипропанoил)-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид
[00313] Во флакон объемом 4 мл добавляли (S)-2-гидроксипропанoвую кислоту (10,8 мг, 0,12 ммоль, 1,5 экв.) и гексафторфосфат(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (36,4 мг, 0,10 ммоль, 1,2 экв.) в N,N-диметилацетамиде (1,0 мл). Добавляли 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколинoгидразид из примера 10 стадии 2 (30,0 мг, 0,08 ммоль, 1,0 экв.) с последующим добавлением N-этил-N-изопропилпропан-2-амина (42 мкл, 0,24 ммоль, 3,0 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь очищали с применением способа TFA10 с обращенной фазой с получением указанного в заголовке соединения.
Стадия 2. (S)-3-Амино-5-((4-(трифторметокси)фенил)сульфонил)-N'-(2-((триизопропилсилил)окси)пропаноил)пиколинoгидразид
[00314] Очищенный материал со стадии 1 суспендировали в 500 мкл дихлорметана. Добавляли триэтиламин (30 мкл, 0,21 ммоль, 2,5 экв.) с последующим добавлением TIPS трифлата (триизопропилсилилтрифторметансульфоната, 50 мкл, 0,21 ммоль, 2,5 экв.). Реакционную смесь перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь дважды промывали с помощью воды. Органический слой разделяли, высушивали с помощью Na2SO4 и фильтровали. Фильтрат концентрировали с получением указанного в заголовке соединения.
Стадия 3. (S)-5-((4-(Трифторметокси)фенил)сульфонил)-2-(5-(1-((триизопропилсилил)окси)этил)-1,3,4-оксадиазол-2-ил)пиридин-3-амин
[00315] Остаток со стадии 2 растворяли в 500 мкл CH3CN. Добавляли исходные растворы 4-(диметиламино)пиридина (0,007 M, 1 мл, 0,007 ммоль, 0,1 экв.) и п-толуолсульфонилхлорида (0,14 M, 1 мл, 0,14 ммоль, 1,9 экв.) с последующим добавлением диизопропилэтиламина (50 мкл, 0,29 ммоль, 4,0 экв.). Реакционную смесь нагревали при 45°C в течение 1 часа и затем непосредственно очищали с помощью способа TFA8 с обращенной фазой.
Стадия 4. 1-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)этан-1-ол
[00316] Соединение со стадии 3 растворяли в тетрагидрофуране (500 мкл). Фторид тетрабутиламмония (1 M в тетрагидрофуране, 70 мкл, 0,07 ммоль, 1,0 экв.) добавляли при комнатной температуре и реакционную смесь перемешивали до завершения, что определяли посредством LC. Реакционную смесь очищали посредством способа TFA8 препаративной HPLC/MS с обращенной фазой. После очистки образец все еще содержал следовые количества солей тетрабутиламмония и его повторно очищали с применением такого же способа с получением указанного в заголовке соединения. 1H ЯМР (501 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,1 Гц, 1H), 8,21-8,14 (m, 2H), 7,91 (d, J=2,1 Гц, 1H), 7,70-7,64 (m, 2H), 5,05 (q, J=6,6 Гц, 1H), 1,54 (d, J=6,7 Гц, 3H); MS (APCI+) масса/заряд 430,9 (M+H)+.
Пример 43
2-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)пропан-2-ол
[00317] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 42, заменяя 2-гидрокси-2-метилпропанoвую кислоту на (S)-2-гидроксипропанoвую кислоту. 1H ЯМР (501 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,45 (d, J=2,0 Гц, 1H), 8,21-8,14 (m, 2H), 7,91 (d, J=2,0 Гц, 1H), 8,21-8,14 (m, 2H), 7,91 (d, MS (APCI+) масса/заряд 444,9 (M+H)+.
Пример 44
(1S)-1-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)-2-фенилэтан-1-ол
[00318] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 42, заменяя (S)-2-гидрокси-3-фенилпропанoвую кислоту на (S)-2-гидроксипропанoвую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,46 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,91 (d, J=2,0 Гц, 1H), 7,68 (d, J=8,4 Гц, 2H), 7,31-7,17 (m, 5H), 5,12 (t, J=7,2 Гц, 1H), 3,20 (dd, J=7,1, 4,7 Гц, 2H); MS (APCI+) масса/заряд 506,9 (M+H)+.
Пример 45
(S)-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)(фенил)метанол
[00319] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 42, заменяя (S)-2-гидрокси-2-фенилуксусную кислоту на (S)-2-гидроксипропанoвую кислоту. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,40 (d, J=2,0 Гц, 1H), 8,19-8,10 (m, 2H), 7,88 (d, J=2,0 Гц, 1H), 8,19-8,10 (m, 2H), 7,88 (d, MS (APCI+) масса/заряд 492,9 (M+H)+.
Пример 46
2-[3-(2-Метоксипропан-2-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00320] Во флакон объемом 4 мл добавляли 3-амино-5-((4-(трифторметокси)фенил)сульфонил)пиколиновую кислоту (60,4 мг, 0,167 ммоль, 1,0 экв.) в N,N-диметилацетамиде (1 мл). Добавляли гексафторфосфат(V) 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония (69,7 мг, 0,183 ммоль, 1,1 экв.) и N-этил-N-изопропилпропан-2-амин (0,087 мл, 0,500 ммоль, 3,0 экв.) с последующим добавлением (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамида (26,4 мг,,2 ммоль, 1,2 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, после чего завершение реакции подтверждали с помощью LC/MS. Растворитель удаляли в потоке азота. Остаток разбавляли с помощью 2 мл дихлорметана и промывали с помощью воды (1×5 мл). Остаток из первой стадии разбавляли с помощью 1 мл тетрагидрофурана. Добавляли гидроксид тетрабутиламмония (40% вес. в воде, 108 мг, 0,167 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 3 часов. Растворитель удаляли в потоке азота. Остаток растворяли в 0,5 мл CH3CN и добавляли к 4 мл перемешиваемой воды в течение 30 минут. Воду удаляли с помощью пипетки и твердое вещество растворяли в DMSO и очищали с помощью HPLC/MS с обращенной фазой с применением способа TFA8. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,47 (d, J=2,1 Гц, 1H), 8,26-8,15 (m, 2H), 7,99 (d, J=2,1 Гц, 1H), 8,26-8,15 (m, 2H), 7,99 (d, MS (APCI+) масса/заряд 458,8 (M+H)+.
Пример 47
2-[3-(1-Метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00321] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокси-2-метоксипропанамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,96 (d, J=2,1 Гц, 1H), 7,72-7,63 (m, 2H), 4,69 (q, J=6,6 Гц, 1H), 3,28 (s, 3H), 1,53 (d, J=6,6 Гц, 3H); MS (APCI+) масса/заряд 444,9 (M+H)+.
Пример 48
2-[3-(Оксан-4-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00322] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокситетрагидропиран-4-карбоксамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=2,1 Гц, 1H), 7,71-7,63 (m, 2H), 3,96-3,88 (m, 2H), 3,50 (td, J=11,5, 2,3 Гц, 2H), 3,27-3,14 (m, 1H), 2,01-1,93 (m, 2H), 1,87-1,72 (m, 2H); MS (APCI+) масса/заряд 470,8 (M+H)+.
Пример 49
2-{3-[(4-Фторфенокси)метил]-1,2,4-оксадиазол-5-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00323] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя 2-(4-фторфенокси)-N'-гидроксиацетамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,44 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, MS (APCI+) масса/заряд 510,8 (M+H)+.
Пример 50
2-[3-(Циклопропилметил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00324] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя 2-циклопропил-N'-гидроксиацетамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=7,0 Гц, 2H), 1,19-1,14 (m, 1H), 0,58-0,49 (m, 2H), 0,32-0,24 (m, 2H); MS (APCI+) масса/заряд 440,9 (M+H)+.
Пример 51
2-{3-[(Оксолан-2-ил)метил]-1,2,4-оксадиазол-5-ил}-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00325] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокси-2-тетрагидрофуран-2-илацетамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=2,0 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=6,6 Гц, 1H), 3,80-3,74 (m, 1H), 3,65-3,56 (m, 1H), 3,00 (d, J=6,5 Гц, 2H), 2,11-1,98 (m, 1H), 1,94-1,77 (m, 2H), 1,71-1,57 (m, 1H); MS (APCI+) масса/заряд 470,8 (M+H)+.
Пример 52
2-(3-Циклопропил-1,2,4-оксадиазол-5-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00326] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидроксициклопропанкарбоксамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,41 (d, J=2,1 Гц, 1H), 8,22-8,13 (m, 2H), 7,93 (d, J=2,0 Гц, 1H), 7,71-7,63 (m, 2H), 2,28-2,17 (m, 1H), 1,19-1,09 (m, 2H), 1,10-1,01 (m, 2H); MS (APCI+) масса/заряд 426,9 (M+H)+.
Пример 53
2-[3-(Оксолан-3-ил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00327] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокситетрагидрофуран-3-карбоксамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,1 Гц, 1H), 8,23-8,14 (m, 2H), 7,94 (d, J=2,1 Гц, 1H), 7,71-7,63 (m, 2H), 4,07 (dd, J=8,5, 7,6 Гц, 1H), 3,94-3,81 (m, 4H), 2,42-2,15 (m, 2H); MS (APCI+) масса/заряд 456,9 (M+H)+.
Пример 54
2-(3-Трет-бутил-1,2,4-оксадиазол-5-ил)-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00328] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокси-2,2-диметилпропанамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,42 (d, J=2,1 Гц, 1H), 8,22-8,14 (m, 2H), 7,95 (d, J=2,0 Гц, 1H), 7,71-7,63 (m, 2H), 1,39 (s, 9H); MS (APCI+) масса/заряд 442,9 (M+H)+.
Пример 55
2-[3-(2-Метоксиэтил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00329] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокси-3-метоксипропанамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,43 (d, J=2,1 Гц, 1H), 8,22-8,14 (m, 2H), 7,94 (d, J=2,0 Гц, 1H), 7,71-7,63 (m, 2H), 3,78 (t, J=6,2 Гц, 2H), 3,25 (s, 3H), 3,06 (t, J=6,3 Гц, 2H); MS (APCI+) масса/заряд 444,9 (M+H)+.
Пример 56
2-[3-(Метоксиметил)-1,2,4-оксадиазол-5-ил]-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-3-амин
[00330] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N'-гидрокси-3-метоксиацетамидин на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6:D2O=9:1 (об./об.)) δ ppm 8,47 (d, J=2,0 Гц, 1H), 8,27-8,18 (m, 2H), 7,98 (d, J=2,1 Гц, 1H), 7,74-7,66 (m, 2H), 7,41-7,35 (m, 2H), 4,70 (s, 2H), 3,42 (s, 3H); MS (APCI+) масса/заряд 430,9 (M+H)+.
Пример 57
(5-{3-Амино-4-хлор-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00331] {5-[3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-ил]-[1,3,4]оксадиазол-2-ил}метанол (200 мг, 0,48 ммоль) растворяли в уксусной кислоте (5 мл). Добавляли N-хлорсукцинимид (CAS: 128-09-6, 640 мг, 4,8 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали, добавляли воду и полученную суспензию фильтровали с получением 250 мг неочищенного материала. Неочищенный материал очищали с помощью препаративной HPLC с обращенной фазой (97% 10 мМ NH4HCO3/pH 10, 3% CH3CN) с получением двух региоизомеров, Пример 57 и Пример 64. Пример 57: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,34 (s, 1H), 8,09-8,14 (m, 2H), 7,64-7,68 (m, 2H), 7,45 (br. s., 2H), 6,03 (t, J=6,4 Гц, 1H), 4,74 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 451 [M+H]+. Пример 64: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,68 (s, 1H), 8,16-8,20 (m, 2H), 7,65 (m, 2H), 7,40 (s, 2H), 6,07 (t, J=6,3 Гц, 1H), 4,78 (d, J=6,2 Гц, 2H), MS (ESI+) масса/заряд 451 [M+H]+.
Пример 58
(5-{3-Амино-5-[3-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
Стадия 1. Метил-2-триизопропилсилилоксиацетат
[00332] Триизопропилхлорид (CAS: 13154-24-0, 228 мл, 1067 ммоль) добавляли к раствору метил-гликолята (CAS: 96-35-5, 80 г, 889 ммоль) и имидазола (CAS: 288-32-4, 182 г, 1067 ммоль) в сухом N,N-диметилформамиде (1 л) в атмосфере N2. Полученный раствор перемешивали при комнатной температуре. После перемешивания в течение ночи посредством тонкослойной хроматографии (этилацетат/петролейный эфир, 35:65) показывали полное потребление исходного вещества. Реакционную смесь гасили с помощью 1,5 л насыщенного водного раствора NaHCO3. Полученную смесь экстрагировали с помощью диэтилового эфира. Органический слой последовательно промывали с помощью 1,4 л 2 н. водного HCl (2,8 моль), 0,5 л H2O и 1 л солевого раствора. Органический слой высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением неочищенного указанного в заголовке соединения, которое применяли без очистки в следующей стадии.
Стадия 2. 2-Триизопропилсилилоксиацетогидразид
[00333] Метил-2-триизопропилсилилоксиацетат (199 г, 889 ммоль) растворяли в тетрагидрофуране (1 л). Добавляли моногидрат гидразина (CAS: 7803-57-8, 35% вес/вес, 203 мл, 2,222 моль) и смесь нагревали с обратным холодильником. После перемешивания в течение ночи с обратным холодильником посредством тонкослойной хроматографии (этилацетат/петролейный эфир, 5:95) показывали полное потребление исходного вещества. Реакционную смесь охлаждали и гасили с помощью насыщенного водного раствора NaHCO3 (1,5 л). Полученный раствор экстрагировали с помощью диэтилового эфира (4×500 мл). Органический слой высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 191 г неочищенного материала в виде воскообразного твердого вещества. С помощью осаждения из этилацетата/гептана (5%, 500 мл) получали 122 г указанного в заголовке соединения. 1H ЯМР (400 МГц, CDCl3) δ ppm 7,76 (s, 1H), 7,26 (s, 1H), 4,28 (s, 2H), 3,87 (d, J=4,3 Гц, 2H), 1,19-1,05 (m, 21H).
Стадия 3. 3-Амино-5-(3-трифторметоксифенилсульфанил)пиридин-2-карбоновая кислота
[00334] Раствор 3-амино-5-бромпиридин-2-карбоновой кислоты (CAS: 870997-85-6, 500 мг, 2,3 ммоль), 3-(трифторметокси)бензолтиола (CAS: 220239-66-7, 534 мг, 2,76 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0,344 мл, 2,3 ммоль) получали в N,N-диметилацетамиде (2 мл). Смесь нагревали при 150°C в течение 45 минут в реакторе для микроволновой обработки (Biotage, SW версия 2.2). Добавляли воду и смесь экстрагировали с помощью этилацетата. Органический слой промывали с помощью насыщенного водного NaHCO3, высушивали (Na2SO4), фильтровали и концентрировали с получением 783 мг указанного в заголовке соединения.
Стадия 4. 3-Амино-5-(3-трифторметоксибензолсульфонил)пиридин-2-карбоновая кислота
[00335] 3-Амино-5-(3-трифторметоксифенилсульфанил)пиридин-2-карбоновую кислоту (783 мг, 2,37 ммоль) растворяли в трифторуксусной кислоте (5 мл) и полученную смесь охлаждали до 0°C на ледяной бане. Затем добавляли H2O2 (30% в воде, 0,968 мл, 9,48 ммоль) и смесь перемешивали при комнатной температуре в течение 2 часов. Смесь разбавляли с помощью 1% уксусной кислоты в воде (10 мл). Получали суспензию, которую затем фильтровали. Собранное твердое вещество промывали с помощью 1% уксусной кислоты с последующей промывкой петролейным эфиром с получением 652 мг указанного в заголовке соединения.
Стадия 5. 3-Амино-5-(3-трифторметоксибензолсульфонил)пиридин-2-карбоновой кислоты N'-(2-триизопропилсиланилоксиацетил)гидразид
[00336] К раствору дихлорметана (10 мл), содержащему 3-амино-5-(3-трифторметоксибензолсульфонил)пиридин-2-карбоновую кислоту (336 мг, 0,93 ммоль), добавляли диизопропилэтиламин (0,323 мл, 1,86 ммоль), гексафторфосфата N-[(диметиламино)-1H-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия N-оксида (354 мг, 0,93 ммоль) и 2-триизопропилсилилоксиацетогидразид (231 мг, 0,93 ммоль). Полученную смесь перемешивали при комнатной температуре до завершения реакции. Смесь разбавляли с помощью воды и экстрагировали с помощью дихлорметана. Органический слой промывали с помощью NaHCO3, высушивали (Na2SO4), фильтровали и концентрировали с получением 540 мг указанного в заголовке соединения.
Стадия 6. 5-(3-Трифторметоксибензолсульфонил)-2-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)пиридин-3-иламин
[00337] 3-Амино-5-(3-трифторметоксибензолсульфонил)пиридин-2-карбоновой кислоты N'-(2 -триизопропилсиланилоксиацетил)гидразид (540 мг, 0,91 ммоль) смешивали с тозилхлоридом (522 мг, 2,74 ммоль) и триэтиламином (381 мкл, 2,74 ммоль) в дихлорметане в атмосфере аргона. Реакционную смесь перемешивали при температуре окружающей среды в течение 18 часов. Реакционную смесь гасили с помощью 1 н. водного NaOH и последовательно экстрагировали с помощью дихлорметана. Органический слой промывали с помощью воды, высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 670 мг неочищенного материала. Неочищенный материал очищали посредством колоночной хроматографии (с применением дихлорметана в качестве элюента) с получением 68 мг указанного в заголовке соединения.
Стадия 7. {5-[3-Амино-5-(3-трифторметоксибензолсульфонил)пиридин-2-ил]-[1,3,4]оксадиазол-2-ил}метанол
[00338] 5-(3-Трифторметоксибензолсульфонил)-2-(5-триизопропилсиланоксиметил[1,3,4]оксадиазол-2-ил)пиридин-3-иламин (68 мг, 0,12 ммоль) растворяли в тетрагидрофуране (2 мл). Добавляли раствор фторида тетрабутиламмония (CAS: 429-41-4, 1 M в тетрагидрофуране, 0,12 мл, 0,12 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Смесь концентрировали. Неочищенный материал гасили с помощью H2O, экстрагировали с помощью этилацетата, высушивали (Na2SO4), фильтровали и концентрировали с получением 56 мг неочищенного материала. После растирания в дихлорметане получали 14 мг указанного в заголовке соединения. 1H ЯМР (500 МГц, DMSO-d6) δ ppm 8,47 (d, J =2,1 Гц, 1H), 8,06 (m, 1H), 8,00 (s, 1H), 7,93 (d, J=1,8 Гц, 1H), 7,82-7,87 (m, 1H), 7,78-7,82 (m, 1H), 7,27 (s, 2H), 6,02 (t, J=6,4 Гц, 1H), 4,75 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 417 [M+H]+.
Пример 59
(5-{3-Амино-5-[2-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00339] Указанное в заголовке соединение получали как описано в примере 58, заменяя 2-(трифторметокси)бензолтиол (CAS: 175278-01-0) на 3-(трифторметокси)бензолтиол). 1H ЯМР (500 МГц, DMSO-d6) δ ppm 8,31 (d, J=2,1 Гц, 1H), 8,27 (m, 1H), 7,90-7,95 (m, 1H), 7,87 (d, J=1,8 Гц, 1H), 7,73 (m, 1H), 7,61 (d, J=8,2 Гц, 1H), 7,32 (s, 2H), 6,02 (t, J=6,4 Гц, 1 H), 4,75 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 417 [M+H]+.
Пример 60
5-Амино-N-бензил-6-[5-(гидроксиметил)-1,3,4-оксадиазол-2-ил]-N-метилпиридин-3-сульфонамид
Стадия 1. 3-Амино-5-бромпиридин-2-карбоновой кислоты N'-(2-триизопропилсиланилоксиацетил)гидразид
[00340] К раствору дихлорметана (200 мл), содержащему 3-амино-5-бромпиридин-2-карбоновую кислоту (CAS: 870997-85-6, 10 г, 46 ммоль), добавляли диизопропилэтиламин (16 мл, 92 ммоль), гексафторфосфата N-[(диметиламино)-1H-1,2,3-триазоло-[4,5-b]пиридин-1-илметилен]-N-метилметанаминия N-оксида (17,49 г, 46 ммоль) и 2-триизопропилсилилоксиацетогидразид (11,35 г, 46 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 18 часов. Смесь разбавляли с помощью воды и экстрагировали с помощью дихлорметана. Органический слой промывали с помощью насыщенного водного NaHCO3, высушивали с помощью Na2SO4, фильтровали и концентрировали с получением 25,37 г указанного в заголовке соединения.
Стадия 2. 3-Амино-5-(4-метоксибензилсульфанил)пиридин-2-карбоновой кислоты N'-(2-триизопропилсиланилоксиацетил)гидразид
[00341] Сосуд, наполненный смесью 3-амино-5-бромпиридин-2-карбоновой кислоты N'-(2-триизопропилсиланилоксиацетил)гидразида (1 г, 2,2 ммоль), диизопропилэтиламина (0,768 мл, 4,4 ммоль) и толуола (10 мл) вакуумировали и реакционный сосуд наполняли аргоном. Затем добавляли аддукт трис(дибензилиденацетон)дипалладий(0)-хлороформа (68 мг, 0,07 ммоль), Xantphos (4,5-бис(дифенилфосфино)-9,9-диметилксантен, 76 мг, 0,13 ммоль) и (4-метоксифенил)метантиол (432 мг, 2,8 ммоль)). Реакционный сосуд еще раз наполняли аргоном и реакционную смесь перемешивали при 110°C в течение 18 часов. Реакционную смесь фильтровали через цилиндр из оксида кремния (с применением этилацетата в качестве элюента) и концентрировали с получением 759 мг указанного в заголовке соединения.
Стадия 3. 5-(4-Метоксибензилсульфанил)-2-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)пиридин-3-иламин
[00342] 3-Амино-5-(4-метоксибензилсульфанил)пиридин-2-карбоновой кислоты N'-(2-триизопропилсиланилоксиацетил)гидразид (160 мг, 0,29 ммоль) смешивали с тозилхлоридом (166 мг, 0,87 ммоль) и триэтиламином (0,121 мл, 0,87 ммоль) в дихлорметане (10 мл) в атмосфере аргона. Реакционную смесь перемешивали при температуре окружающей среды в течение 2 дней. Смесь гасили с помощью 1 н. водного NaOH и последовательно экстрагировали с помощью дихлорметана. Органический слой промывали с помощью воды, высушивали над Na2SO4, фильтровали и концентрировали до сухого состояния с получением 360 мг неочищенного материала. Неочищенный материал дополнительно очищали посредством флэш-хроматографии (SiO2, колонка с 5 г, элюировали с помощью дихлорметана) с получением 69 мг указанного в заголовке соединения.
Стадия 4. 5-Амино-6-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)-пиридин-3-сульфонилхлорид
[00343] Смесь 5-(4-метоксибензилсульфанил)-2-(5-триизопропилсиланилоксиметил[1,3,4]оксадиазол-2-ил)пиридин-3-иламина (69 мг, 0,14 ммоль) в 2 мл смеси CH3CN/уксусная кислота/H2O=7: 0,37: 0,18 охлаждали в ледяной бане и обрабатывали порциями с помощью 1,3-дихлор-5,5-диметилгидантоина (CAS: 118-52-5, 54 мг, 0,28 ммоль). После завершения добавления полученную суспензию перемешивали при 0°C в течение 90 минут и затем при комнатной температуре в течение 6 часов. Смесь разбавляли с помощью этилацетата и промывали с помощью воды. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали с получением 98 мг указанного в заголовке соединения.
Стадия 5. Бензилметиламид 5-амино-6-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)пиридин-3-сульфоновой кислоты
[00344] Суспензию 5-амино-6-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)пиридин-3-сульфонилхлорида (98 мг, 0,21 ммоль) в дихлорметане (2 мл) обрабатывали с помощью пиридина (0,051 мл, 0,63 ммоль) и N-метилбензиламина (CAS: 103-67-3, 0,037 мл, 0,28 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь очищали посредством колоночной хроматографии (SiO2, колонка с 2 г, дихлорметан в качестве элюента) с получением 36 мг указанного в заголовке соединения.
Стадия 6. 5-Амино-N-бензил-6-[5-(гидроксиметил)-1,3,4-оксадиазол-2-ил]-N-метилпиридин-3-сульфонамид
[00345] Бензилметиламид 5-амино-6-(5-триизопропилсиланилоксиметил-[1,3,4]оксадиазол-2-ил)пиридин-3-сульфоновой кислоты (36 мг, 0,07 ммоль) растворяли в тетрагидрофуране (1 мл). Добавляли раствор фторида тетрабутиламмония (TBAF, CAS: 429-41-4, 1 M в тетрагидрофуране, 0,02 мл, 0,02 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Смесь концентрировали для удаления большей части тетрагидрофурана. Реакционную смесь гасили с помощью H2O, экстрагировали с помощью этилацетата, высушивали (с помощью Na2SO4), фильтровали и концентрировали с получением 18 мг неочищенного продукта. Полученный неочищенный материал растирали с дихлорметаном с получением 3 мг указанного в заголовке соединения. 1H ЯМР (500 МГц, DMSO-d6) δ 8,31 (d, J=1,8 Гц, 1H), ), 7,82 (d, J=1,8 Гц, 1H), 7,36-7,42 (m,3H), 7,33 (d, J=7,3 Гц, 2H), 7,23 (s, 2H), 6,04 (t, J=6,1 Гц, 1H), 4,77 (d, J=5,5 Гц, 2H), 4,23 (s, 2H), 2,63 (s, 3H), MS (ESI+) масса/заряд 376 [M+H]+.
Пример 61
{5-[3-Амино-5-(бензолсульфонил)пиридин-2-ил]-1,3,4-оксадиазол-2-ил}метанол
[00346] Указанное в заголовке соединение получали как описано в примере 58, заменяя 3-бензолтиол (CAS: 108-98-5) на 3-(трифторметокси)бензолтиол. 1H ЯМР (500 МГц, DMSO-d6) δ ppm 8,40 (d, J=1,8 Гц, 1H), 7,97-8,04 (m, 2H), 7,90 (d, J=2,1 Гц, 1H), 7,74-7,80 (m, 1H), 7,66-7,71 (m, 2H), 7,26 (br. s, 2H), 6,01 (t, J=6,4 Гц, 1H), 4,74 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 333 [M+H]+.
Пример 62
(5-{3-Амино-5-[4-(трифторметил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-тиадиазол-2-ил)метанол
Стадия 1. 5-[4-(Трифторметил)фенил]сульфонил-2-[5-(триизопропилсилилоксиметил)-1,3,4-тиадиазол-2-ил]пиридин-3-амин
[00347] К суспензии 3-амино-5-[4-(трифторметокси)фенил]сульфонил-N'-(2-триизопропилсилилоксиацетил)пиридин-2-карбогидразида (200 мг, 0,35 ммоль) в сухом толуоле (8 мл) добавляли реагент Лавессона (номер по CAS 19172-47-5, 155 мг, 0,38 ммоль) и раствор нагревали с обратным холодильником в течение 1 часа. Добавляли воду и смесь экстрагировали с помощью этилацетата, высушивали (с помощью Na2SO4), фильтровали и концентрировали с получением 178 мг неочищенного материала. Неочищенный материал очищали посредством колоночной хроматографии (SiO2, колонка с 2 г, в качестве элюента применяли дихлорметан) с получением 107 мг указанного в заголовке соединения.
Стадия 2. [5-[3-Амино-5-[4-(трифторметил)фенил]сульфонил-2-пиридил]-1,3,4-тиадиазол-2-ил]метанол
[00348] 5-[4-(Трифторметил)фенил]сульфонил-2-[5-(триизопропилсилилоксиметил)-1,3,4-тиадиазол-2-ил]пиридин-3-амин (107 мг, 0,18 ммоль) растворяли в тетрагидрофуране (3 мл). Добавляли раствор фторида тетрабутиламмония (TBAF, CAS: 429-41-4, 1 M в тетрагидрофуране, 0,18 мл, 0,18 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 10 минут. Смесь концентрировали для удаления большей части тетрагидрофурана. Реакционную смесь гасили с помощью H2O, экстрагировали с помощью этилацетата, высушивали (с помощью Na2SO4), фильтровали и концентрировали с получением 140 мг неочищенного материала. После растирания с дихлорметаном получали 36 мг указанного в заголовке соединения. 1H ЯМР (500 МГц, DMSO-d6) δ ppm 8,42 (d, J=1,8 Гц, 1H), 8,24 (d, J=8,2 Гц, 2H), 8,05 (d, J=8,2 Гц, 2H), 7,91 (d, J=1,8 Гц, 1H), 7,49 (s, 2H), 6,29 (br. s., 1H), 4,89 (br. s., 2H), MS (ESI+) масса/заряд 417 [M+H]+, MS (ESI+) масса/заряд 417 [M+H]+.
Пример 63
(5-{3-Амино-6-бром-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00349] 5-[3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-ил]-[1,3,4]оксадиазол-2-ил}метанол (200 мг, 0,48 ммоль) растворяли в уксусной кислоте (5 мл). Добавляли N-бромсукцинимид (NBS, 85 мг, 0,48 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли дополнительное количество NBS (170 мг, 0,41 ммоль) и смесь перемешивали при комнатной температуре в течение еще 24 часов. Снова добавляли дополнительное количество NBS (340 мг, 0,82 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали, добавляли воду и реакционную смесь экстрагировали с помощью этилацетата и промывали с помощью насыщенного водного NaHCO3. Органические фазы объединяли, высушивали (с помощью Na2SO4), фильтровали и концентрировали с получением 380 мг неочищенного материала. Неочищенный материал очищали с помощью препаративной HPLC с обращенной фазой (с применением смеси элюентов, 97% 10 мМ NH4HCO3/pH 10 3% CH3CN) с получением указанного в заголовке соединения (пример 63) и пример 66. Пример 63: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,34 (s, 1H), 8,09-8,14 (m, 2H), 7,64-7,68 (m, 2H), 7,45 (br. s., 2H), 6,03 (t, J=6,4 Гц, 1H), 4,74 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 496 [M+H]+. Пример 66: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,68 (s, 1H), 8,16 (d, 2H), 7,64 (m, 2H), 6,07 (t, J=6,4 Гц, 1H), 7,36 (br. s., 2H), 4,78 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 496 [M+H]+.
Пример 64
(5-{3-Амино-6-хлор-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00350] {5-[3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-ил]-[1,3,4]оксадиазол-2-ил}метанол (200 мг, 0,48 ммоль) растворяли в уксусной кислоте (5 мл). Добавляли N-хлорсукцинимид (CAS: 128-09-6, 640 мг, 4,8 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали, добавляли воду и полученную суспензию фильтровали с получением 250 мг неочищенного продукта. Неочищенный материал очищали с помощью препаративной HPLC с обращенной фазой (с применением смеси элюентов 97% 10 мМ NH4HCO3/pH 10 3% CH3CN) с получением обоих региoизомеров, примера 57 и указанного в заголовке соединения. Пример 64: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,68 (s, 1H), 8,16-8,20 (m, 2H), 7,65 (m, 2H), 7,40 (s, 2H), 6,07 (t, J=6,3 Гц, 1H), 4,78 (d, J=6,2 Гц, 2H), MS (ESI+) масса/заряд 451 [M+H]+.
Пример 65
(5-{3-Амино-5-[2-(пропан-2-ил)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00351] Указанное в заголовке соединение получали как описано в примере 58, заменяя 2-изопропилбензолтиол (CAS: 6262-87-9) на 3-(трифторметокси)бензолтиол. 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,24 (d, J=2,1 Гц, 1H), 8,12 (m, 1H), 7,81 (d, J=2,1 Гц, 1H), 7,76 (m, 1H), 7,66 (m, 1H), 7,55 (m, 1H), 7,27 (s, 2H), 6,01 (t, J=6,4 Гц, 1H), 4,75 (d, J=6,1 Гц, 2H), 3,64 (m, 1H), 1,01 (d, J=6,7 Гц, 6H), MS (ESI+) масса/заряд 375 [M+H]+.
Пример 66
(5-{3-Амино-4-бром-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол
[00352] 5-[3-Амино-5-(4-трифторметоксибензолсульфонил)пиридин-2-ил]-[1,3,4]оксадиазол-2-ил}метанол (200 мг, 0,48 ммоль) растворяли в уксусной кислоте (5 мл). Добавляли N-бромсукцинимид (NBS, 85 мг, 0,48 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 18 часов. Добавляли дополнительное количество NBS (170 мг, 0,41 ммоль) и смесь перемешивали при комнатной температуре в течение еще 24 часов. Добавляли дополнительное количество NBS (340 мг, 0,82 ммоль) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь концентрировали, добавляли воду и реакционную смесь экстрагировали с помощью этилацетата и промывали с помощью насыщенного водного NaHCO3. Органические фазы объединяли, высушивали (с помощью Na2SO4), фильтровали и концентрировали с получением 380 мг неочищенного материала. Неочищенный материал очищали с помощью препаративной HPLC с обращенной фазой (с применением элюентов, 97% 10 мМ NH4HCO3/pH 10 3% CH3CN) с получением указанного в заголовке соединения и примера 63. Пример 63: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,34 (s, 1H), 8,09-8,14 (m, 2H), 7,64-7,68 (m, 2H), 7,45 (br. s., 2H), 6,03 (t, J=6,4 Гц, 1H), 4,74 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 496 [M+H]+. Пример 66: 1H ЯМР (600 МГц, DMSO-d6) δ ppm 8,68 (s, 1H, ), 8,16 (d, 2H,), 7,64 (m, 2H), 6,07 (t, J=6,4 Гц, 1H), 7,36 (br. s., 2H), 4,78 (d, J=6,4 Гц, 2H), MS (ESI+) масса/заряд 496 [M+H]+.
Пример 67
2-(5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,2,4-оксадиазол-3-ил)этан-1-ол
[00353] Указанное в заголовке соединение получали в соответствии с процедурой, описанной в примере 46, заменяя N',3-дигидроксипропанимидамид на (Z)-N'-гидрокси-2-метокси-2-метилпропанимидамид и посредством очистки образца после обеих, первой и второй, стадий. 1H ЯМР (400 МГц, DMSO-d6) δ ppm 8,44 (d, J=2,1 Гц, 1H), 8,20-8,14 (m, 2H), 7,94 (d, J=2,1 Гц, 1H), 7,74-7,60 (m, 2H), 7,37 (s, 2H), 4,83 (t, J=5,5 Гц, 1H), 3,84 (q, J=6,2 Гц, 2H), 2,95 (t, J=6,4 Гц, 2H). MS (APCI+) масса/заряд 431,0 (M+H)+.
Биологические примеры
[00354] Перечень сокращений применяемых в разделе биологических примеров: cAMP для циклического аденозинмонофосфата; DMSO для диметилсульфоксида; D-PBS для фосфатно-солевого буферного раствора Дульбекко; и PBS для фосфатно-солевого буферного раствора.
Анализы in vitro
Анализ всасывания YFP-галогенида в отношении мутации CFTR- ΔF508
[00355] С помощью анализа всасывания YFP-галогенида измеряли функциональность каналов регулятора трансмембранной проводимости при муковисцидозе (CFTR) в клеточной линии CFBE41o- бронхиального эпителия при муковисцидозе. Анализ применяли для оценки способности соединений повышать вероятность открытия существующих каналов CFTR в мембране. При его проведении основывались на наблюдении, что флуоресценция варианта желтого флуоресцентного белка (YFP) YFP H148Q, I152L, F47L существенно гасится ионами галогенидов, такими как Cl- и I- (Galietta, L.J.V., Haggie, P.M., Verkman, A.S., 2001. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499, 220-224. doi:10.1016/S0014-5793(01)02561-3; Nagai, T., Ibata, K., Park, E.S., Kubota, M., Mikoshiba, K., Miyawaki, A., 2002. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat. Biotechnol. 20, 87-90. doi:10.1038/nbt0102-87).
[00356] Для этой цели клетки CFBE41o- высевали в 384-луночные планшеты (3000 клеток CFBE/лунка). Через день после высевания клетки CFBE подвергали трансдукции аденовирусными векторами, направляющими экспрессию мутанта CFTR ΔF508 и репортера YFP. Клетки инкубировали при 27°C, 5% CO2 в течение 24 часов, чтобы обеспечить надлежащее сворачивание и миграцию к мембране канала CFTR, или обрабатывали модулятором CFTR в течение 24 часов при 37°C.
[00357] На следующий день каналы CFTR активировали посредством обработки с помощью cAMP-индуцирующего фактора форсколина (10,67 мкМ) и тестового соединения в 1xD-PBS с общим объемом 30 мкл (от Gibco, номер по каталогу 14090-041) в течение 10 минут, после чего добавляли 30 мкл следующего йодного раствора (375 мМ NaI, 7,5 мМ KI, 1,76 мМ KH2PO4, 10,1 мМ Na2HPO4, 13,75 мМ глюкозы). Индуцированное йодом гашение флуоресценции регистрировали сразу после введения йодида в течение 2 минут на FDSS/μCell (Hamamatsu). Способность соединения увеличивать отверстие канала непосредственно соотносилась со снижением флуоресценции, и ее выражали как (1-(флуоресценция через 36 секунд (F)/флуоресценция до введения (F0))) и значение EC50 получали из (1-F/F0) относительно графика концентрации соединения.
Таблица I. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR- ΔF508, соединений по настоящему изобретению.
Анализ всасывания YFP-галогенида в отношении мутации CFTR-G551D
[00358] С помощью анализа всасывания YFP-галогенида измеряли функциональность каналов регулятора трансмембранной проводимости при муковисцидозе (CFTR). Анализ применяли для оценки способности соединений увеличивать отверстие канала существующих каналов мутантных CFTR в мембране. При его проведении основывались на наблюдении, что флуоресценция варианта желтого флуоресцентного белка (YFP) YFP H148Q, I152L, F47L существенно гасится ионами галогенидов, такими как Cl- и I- (Galietta, L.J.V., Haggie, P.M., Verkman, A.S., 2001. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499, 220-224. doi:10.1016/S0014-5793(01)02561-3).
[00359] Для этой цели клетки HEK293 высевали в 96-луночные планшеты. При высевании клетки подвергали обратной трансфекции плазмидными векторами, направляющими экспрессию мутанта CFTR G551D и репортера YFP. Клетки инкубировали при 37°C, 5% CO2 в течение 24 часов, чтобы обеспечить достаточную экспрессию белка CFTR.
[00360] На следующий день каналы CFTR активировали посредством обработки с помощью cAMP-индуцирующего фактора форсколина (10,67 мкМ) и тестового соединения в D-PBS (Gibco) в течение 10 минут перед добавлением раствора I- (137 мМ NaI, 2,7 мМ KI, 1,76 мМ KH2PO4, 10,1 мМ Na2HPO4, 5 мМ глюкозы). Индуцированное I- гашение флуоресценции регистрировали сразу после введения I- в течение 7 секунд. Способность соединения увеличивать отверстие канала непосредственно соотносилась со снижением флуоресценции, и ее выражали как (1-(флуоресценция через 7 секунд (F)/флуоресценция до введения (F0))) и значение EC50 получали из (1-F/F0) относительно графика концентрации соединения.
[00361] Аналогичные анализы YHA проводили в отношении других мутантов CFTR с дефектным воротным механизмом ионных каналов или с дефектами проводимости каналов для определения эффекта соединения на активность канала. Примеры мутантов представляют собой G178R, G1349D, S549N, R117H, R334W. Этот анализ также применяли для дополнительных мутантов CFTR I класса, включая G542X, W1282X; мутантов II класса, включая N1303K, и для мутантов III класса, включая S1251N; или CFTR дикого типа.
Таблица II. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR-G551D, соединений по настоящему изобретению.
Таблица III. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR-G178R, соединений по настоящему изобретению.
Таблица IV. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR-G1349D, соединений по настоящему изобретению.
Таблица V. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR-S549N, соединений по настоящему изобретению.
Таблица VI. Иллюстративные значения EC50, измеренные посредством анализа всасывания YFP-галогенида в отношении CFTR-R117H, соединений по настоящему изобретению.
Клеточные анализы
[00362] Электрофизиологические измерения на первичных клеточных культурах бронхиального эпителия человека являются пригодным доклиническим заменителем для определения клинической эффективности (Rowe, S.M., Verkman, A.S., 2013. Cystic Fibrosis Transmembrane Regulator Correctors and Potentiators. Cold Spring Harb. Perspect. Med. 3, a009761. doi:10.1101/cshperspect.a009761), таким образом, соединения оценивают в камере Уссинга и/или при анализе TECC, которые являются электрофизиологическими измерительными анализами.
Анализ в камере Уссинга
Протокол
[00363] С помощью анализа в камере Уссинга измеряют функциональность регулятора трансмембранной проводимости при муковисцидозе (CFTR) путем измерения тока короткого замыкания (Isc), создаваемого на базолатеральной и апикальной мембранах клеток эпителия легкого.
[00364] Для измерения Isc эпителий закорачивают путем подачи тока, который регулируют посредством усилителя обратной связи для поддержания трансэпителиального потенциала (Vt) на уровне 0 мВ. Величина требуемого тока регулируется контуром обратной связи и непрерывно измеряется. Периодически напряжение фиксируют на значениях, отличных от 0 мВ, таким образом позволяя оценить трансэпителиальное сопротивление (Rt).
[00365] С этой целью клетки бронхиального эпителия, выделенные у пациентов с CF, гомозиготных по мутации CFTR ΔF508 (hAEC-CF, Epithelix) или гетерозиготных по мутациям CFTR G551D и ΔF508 (Университет Северной Каролины, Чапел-Хилл), помещают на покрытые коллагеном IV типа подложки SnapwellTM (Corning-Costar). Эпителий дыхательных путей человека получают путем обеспечения поверхности контакта воздух-жидкость в течение 21 дня для образования хорошо дифференцированных поляризованных культур, которые похожи на in vivo псевдорасслоенный реснитчатый эпителий (Fulcher, M.L., Gabriel, S., Burns, K.A., Yankaskas, J.R., Randell, S.H., 2005. Well-differentiated human airway epithelial cell cultures. Methods Mol. Med. 107, 183-206). В случае гомозиготных по ΔF508 CFTR образцов дифференцированные клетки обрабатывают 3 мкМ VX809 (2626 South Loop West, Suite 225, Хьюстон, Техас 77054, США, номер по каталогу S1565) для обеспечения достаточной экспрессии надлежащим образом свернутого белка CFTR на мембране (48 часов обработки базолатеральной мембраны и 24 часа обработки апикальной мембраны), после чего регистрируют электрофизиологические показатели. Для гетерозиготных G551D/ΔF508 дифференцированные клетки применяют для записи как есть.
[00366] Для записи электрофизиологических показателей эпителий дыхательных путей человека устанавливают в камерах Уссинга для измерения тока короткого замыкания (Isc). Эпителий погружают в NaCl-раствор Рингера (120 мМ NaCl, 25 мМ NaHCO3, 1,2 мМ CaCl2, 1,2 мМ MgCl2, 0,8 мМ KH2PO4, 0,8 мМ K2HPO4, pH 7,4, 5 мМ глюкозы) на базолатеральной стороне и глутамат-раствор Рингера (120 мМ глутамата натрия, 25 мМ NaHCO3, 1,2 мМ CaCl2, 1,2 мМ MgCl2, 0,8 мМ KH2PO4, 0,8 мМ K2HPO4, pH 7,4, 5 мМ глюкозы) на апикальной стороне для создания градиента Cl-. В обе камеры подают газ, содержащий 95% O2, 5% CO2 и поддерживают при 27°C. Амилорид применяют на апикальной стороне для ингибирования токов эндогенных ENaC, тогда как форсколин применяют как на апикальной, так и базолатеральной стороне для стимуляции CFTR. После подачи форсколина соединения добавляют на обеих сторонах для тестирования их эффективности повышения отпирания CFTR. Увеличение Isc используют как меру увеличения активности CFTR, значения EC50 можно получать путем измерения влияния различных концентраций соединения на ток короткого замыкания в первичных клетках, для этой цели применяли тот же SnapwellTM для добавления повышенных количеств соединения, и увеличение сигнала Isc на каждой стадии затем превращали в кривую зависимости дозы от эффекта. Inh-172, специфичный для CFTR ингибитор, применяют для тестирования специфичности тестируемых соединений.
Анализ TECC
Протокол для первичных клеток бронхиального эпителия
[00367] В анализе TECC (трансэпителиальная фиксирующая схема, EP-модель) измеряют функциональность регулятора трансмембранной проводимости при муковисцидозе (CFTR) путем измерения тока короткого замыкания (Isc) создаваемого на базолатеральной и апикальной мембранах клеток эпителия легкого. В TECC трансэпителиальный потенциал PD и трансэпителиальное сопротивление (Rt) измеряют в открытом контуре и преобразуют в Isc, используя закон Ома. 24 лунки можно измерять одновременно, обеспечивая высокую производительность по сравнению с камерами Уссинга.
[00368] С этой целью клетки бронхиального эпителия, выделенные у пациентов с CF, гомозиготных по мутации CFTR ΔF508 (hAEC-CF, McGill, UNC), помещают на покрытые коллагеном IV типа подложки Transwell® (Costar). Эпителий дыхательных путей человека получают путем обеспечения поверхности контакта воздух-жидкость в течение 21 дня для образования хорошо дифференцированных поляризованных культур, которые похожи на in vivo псевдорасслоенный реснитчатый эпителий (Fulcher, M.L., Gabriel, S., Burns, K.A., Yankaskas, J.R., Randell, S.H., 2005. Well-differentiated human airway epithelial cell cultures. Methods Mol. Med. 107, 183-206). В случае гомозиготных по ΔF508 CFTR образцов дифференцированные клетки обрабатывают 3 мкм VX809 (2626 South Loop West, Suite 225, Хьюстон, Техас 77054, США, номер по каталогу S1565) или 0,15 мкМ GLPG2222 для обеспечения достаточной экспрессии надлежащим образом свернутого белка CFTR на мембране (48 часов обработки базолатеральной мембраны и 24 часа обработки апикальной мембраны), после чего регистрируют электрофизиологические показатели.
[00369] Информацию о соединениях можно получать из гомозиготных по ΔF508 CFTR образцов, рассматривая повышенную активность CFTR, когда соединения добавляют в остром режиме или в постоянном режиме.
[00370] Для острого режима для регистрирования электрофизиологических показателей эпителий дыхательных путей человека устанавливают в термоплиту TECC для измерения электрофизиологических показателей и поддерживают при 37°C. Эпителий погружают в NaCl-раствор Рингера (120 мМ NaCl, 25 мМ NaHCO3, 1,2 мМ CaCl2, 1,2 мМ MgCl2, 0,8 мМ KH2PO4, 0,8 мМ K2HPO4, pH 7,4, 5 мМ глюкозы) как на базолатеральной, так и апикальной стороне. Амилорид применяют на апикальной стороне для ингибирования токов эндогенных ENaC, тогда как форсколин применяют как на апикальной, так и базолатеральной стороне для стимуляции CFTR. После подачи форсколина соединения добавляют на обеих сторонах для тестирования их эффективности повышения отпирания CFTR. Измерения проводят в течение 20 минут с записями каждые 2 минуты. Повышение Isc используют как меру увеличения активности CFTR, значения EC50 можно получать путем измерения влияния различных концентраций соединения на Isc в первичных клетках, для этой цели каждый трансвел обрабатывают различной концентрацией соединения. Inh-172, специфичный для CFTR ингибитор, применяют для тестирования специфичности тестируемых соединений.
[00371] Аналогичные записи TECC проводят с применением первичных клеток для других мутантов CFTR с дефектным воротным механизмом ионных каналов или с дефектами проводимости каналов для определения эффекта соединения на активность канала. Примеры мутантов включают R117H, G178R. Аналогичные первичные клетки, содержащие мутанты CFTR I класса, включая G542X, W1282X; и дополнительные мутанты II класса, включая N1303K, можно применять для регистрации электрофизиологических показателей.
Результаты
[00372] Следуя данному протоколу, получали следующие значения. Разница между ΔIsc, измеренным как DMSO (исходный уровень), и ΔIsc, измеренным с тестируемым соединением.
Измерения EC50 в анализе TECC в отношении CFTR ΔF508
Таблица VII. Значения EC50 в анализе TECC в отношении CFTR ΔF508 для иллюстративных соединений по настоящему изобретению.
[00373] Данные, представленные в настоящей заявке, показывают, что соединения по настоящему изобретению проявляют активность in vitro и могут быть пригодны in vivo при лечении муковисцидоза.
[00374] Дополнительные преимущества настоящего изобретения заявителя будут очевидны для специалиста в данной области в ходе ознакомления с данной патентной заявкой.
[00375] Понятно, что вышеуказанное подробное описание и приложенные примеры являются только иллюстративными и не должны рассматриваться как ограничения объема настоящего изобретения, который определен исключительно приложенной формулой изобретения и эквивалентами пунктов формулы изобретения. Различные изменения и модификации вариантов осуществления будут очевидны специалистам в данной области. Такие изменения и модификации, в том числе без ограничения относящиеся к химическим структурам, заместителям, производным, промежуточным соединениям, способам синтеза, составам или способам, или любую комбинацию таких изменений и модификаций применения настоящего изобретения можно осуществлять без отклонения от его сути и объема.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗИНА, ИСПОЛЬЗУЕМЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ ATR | 2009 |
|
RU2604066C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2616612C2 |
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПОВЫШЕНИЯ АКТИВНОСТИ CFTR | 2015 |
|
RU2767460C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ ДИГИДРОНАФТИРИДИНОНА, И СПОСОБ ЕГО ПОЛУЧЕНИЯ, И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2021 |
|
RU2809869C1 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ЗАМЕЩЕННЫЕ ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБ ПРИМЕНЕНИЯ | 2016 |
|
RU2744766C2 |
| ПИРАЗОЛОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ АДЕНОЗИНОВОГО РЕЦЕПТОРА | 2019 |
|
RU2806758C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ NAMPT | 2011 |
|
RU2617988C2 |
| МОДУЛЯТОРЫ ТРАНСПОРТЕРОВ АТФ-СВЯЗЫВАЮЩЕЙ КАССЕТЫ | 2005 |
|
RU2528046C2 |
| ИНГИБИТОРЫ ФЕРМЕНТА ДИАЦИЛГЛИЦЕРИН О-АЦИЛТРАНСФЕРАЗА ТИПА 1 | 2007 |
|
RU2474576C2 |
Настоящее изобретение относится к замещенным пиридиновым соединениям, которые являются модуляторами белка-регулятора трансмембранной проводимости при муковисцидозе (CFTR), пригодными при лечении заболеваний и состояний, опосредованных и модулируемых CFTR. Конкретно описывается соединение (5-{3-амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол или его фармацевтически приемлемая соль, а также фармацевтическая композиция для лечения муковисцидоза, содержащая терапевтически эффективное количество соединения или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем. 4 н.п. ф-лы, 7 табл., 67 пр.
1. (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол.
2. (5-{3-Амино-5-[4-(трифторметокси)бензол-1-сульфонил]пиридин-2-ил}-1,3,4-оксадиазол-2-ил)метанол или его фармацевтически приемлемая соль.
3. Фармацевтическая композиция для лечения муковисцидоза, содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем.
4. Фармацевтическая композиция для лечения муковисцидоза, содержащая терапевтически эффективное количество соединения по п.2 или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем.
| WO 2013038386 A1, 21.03.2013 | |||
| WO 2016193812 A1, 08.12.2016 | |||
| WO 2009076593 A1, 18.06.2009 | |||
| Предохранительная трубка для сосудов с огнеопасными жидкостями | 1927 |
|
SU11074A1 |
Авторы
Даты
2021-10-05—Публикация
2017-05-24—Подача