Родственные заявки
В данной заявке заявлен приоритет к предварительной заявке на патент США 62/060,249, поданной 6 октября 2014, содержание которой включено сюда в качестве ссылки полностью.
Область техники данного изобретения
Данное изобретение относится к соединениям имидазопиридина, которые применяют в качестве ингибиторов тирозинкиназы Брутона (ТКБ). В данном изобретении также представлены фармацевтически приемлемые композиции, содержащие соединения в соответствии с данным изобретением и способы применения таких композиций в лечении различных расстройств.
Уровень изобретения
Протеинкиназы составляют одно из самых больших семейств ферментов человека и регулируют множество различных сигнальных процессов через добавление фосфатных групп к белкам (T. Hunter, Cell 1987 50:823-829). Более конкретно, тирозинкиназы фосфорилируют белки на фенольной части тирозиновых остатков. Семейство тирозинкиназ включает члены, которые контролируют рост, миграцию и дифференциацию клетки. Аномальная киназная активность вовлечена во множество человеческих заболеваний, включая рак, аутоиммунные и воспалительные заболевания. Так как протеинкиназы являются одними из ключевых регуляторов клеточных сигналов, они являются целью для модулирования клеточной функции низкомолекулярными ингибиторами киназы и, следовательно, представляют собой хорошие цели для лекарственных средств. Кроме лечения медиированных киназой болезненных процессов, селективные и эффективные ингибиторы киназной активности также применяют для исследования процессов клеточной сигнализации и идентификации других клеточных целей, представляющих терапевтический интерес.
Существует хорошее доказательство того, что B-клетки играют ключевую роль в патогенезе аутоиммунного и/или воспалительного заболевания. Лекарственные средства на основе белков, которые обедняют B-клетки, такие как Ритуксан, являются эффективными против запускаемых аутоантителом (Rastetter et al. Annu Rev Med 2004 55:477). Поэтому ингибиторы протеинкиназ, которые играют роль в активации B-клеток, должны быть полезными лекарственными средствами для медиированных B-клетками болезненных патологий, таких как образование аутоантител.
Подача сигнала через рецептор B-клетки (BCR) контролирует множество реакций B-клетки, включая пролиферацию и дифференциацию в зрелые клетки, образующие антитело. BCR является ключевой регулирующей точкой в B-клеточной активности и аберрантной сигнализации, которая может вызвать дерегулированную пролиферацию B-клетки и образование патогенных антител, что приводит к множеству аутоиммунных и/или воспалительных заболеваний. Тирозинкиназа Брутона (ТКБ) является не связанной с BCR киназой, которая находится рядом с мембраной и сразу же после BCR. Было показано, что отсутствие ТКБ блокирует BCR сигнализацию и поэтому ингибирование ТКБ может быть полезным терапевтическим подходом для блокирования медиированных B-клеткой болезненных процессов. Также было показано, что ТКБ играет роль в апоптозе (Islam and Smith Immunol. Rev. 2000 178:49,) и, следовательно, ингибиторы ТКБ могут быть полезными для лечения определенных B-клеточных лимфом и лейкозов (Feldhahn et al. J. Exp. Med. 2005 201:1837).
ТКБ является членом семейства Tec тирозинкиназ, и было показано, что он является критическим регулятором раннего развития B-клетки и активации и выживания зрелой B-клетки (Khan et al. Immunity 1995 3:283; Ellmeier et al. J. Exp. Med. 2000 192:1611). Мутация ТКБ у человека приводит к агаммаглобулинемии, сцепленной с Х-хромосомой (XLA) (обзор дан в Rosen et al. New Eng. J. Med. 1995 333:431 и Lindvall et al. Immunol. Rev. 2005 203:200). Такие пациенты имеют ослабленный иммунитет и показывают ухудшенное созревание B-клеток, пониженный иммуноглобулин и периферийные уровни B-клетки, ослабленные иммунные реакции T-клетки, а также ослабленную мобилизацию кальция после стимулирования BCR.
Доказательства роли ТКБ в аутоиммунных и воспалительных заболеваниях также были представлены на моделях мышей с дефицитом ТКБ. В предклинических мышиных моделях системной красной волчанки (СКВ), мыши с дефицитом ТКБ показали значительное облегчение развития заболевания. Кроме того, мыши с дефицитом ТКБ оказались резистентными к вызванному коллагеном артриту (Jansson and Holmdahl Clin. Exp. Immunol. 1993 94:459). Селективный ингибитор ТКБ показан дозозависимую эффективность в модели артрита у мышей (Z. Pan et al., Chem. Med Chem. 2007 2:58-61).
ТКБ также экспрессируется в клетках, отличных от B-клеток, которые могут быть вовлечены в болезненные процессы. ТКБ является ключевым компонентом Fc-гамма сигнализации в миелоидных клетках. Например, ТКБ экспрессируемая мастоцитами ТКБ-дефицитным костным мозгом, вырабатывающим мастоциты, демонстрирует ухудшенное вызванное антигеном дегранулирование (Iwaki et al. J. Biol. Chem. 2005 280:40261). Это показывает, что ТКБ может быть полезна для лечения патологических реакций мастоцитов, таких как аллергия и астма. Также моноциты пациентов с XLA, у которых отсутствует активность ТКБ, показали пониженное вырабатывание ФНО альфа после стимулирования (Horwood et al. J Exp Med 197:1603, 2003). Поэтому медиированное ФНО альфа воспаление может быть модулировано низкомолекулярными ингибиторами ТКБ.
Сущность изобретения
В настоящее время было обнаружено, что соединения в соответствии с данным изобретением и их фармацевтически приемлемые композиции являются эффективными ингибиторами ТКБ. Такие соединения имеют общую формулу I:
I
или его таутомер или фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, кольца A, кольца Z, n и p такой, как определен и описан в представленных здесь вариантах.
Соединения в соответствии с данным изобретением и их фармацевтически приемлемые композиции применяют для лечения множества заболеваний, расстройств или состояний, связанных с ТКБ. Такие заболевания, расстройства или состояния включают такие, которые описаны здесь.
Подробное описание некоторых вариантов
1. Общее описание соединений в соответствии с данным изобретением
В определенных аспектах, в данном изобретении представлены ингибиторы ТКБ. В некоторых вариантах, такие соединения включают соединения формул, описанных здесь, или их фармацевтически приемлемую соль, где каждая переменная такая, как определена и описана здесь.
2. Соединения и определения
Соединения в соответствии с данным изобретением включают такие, которые описаны в общем выше, и иллюстрированы далее классами, подклассами и видами, описанными здесь. В данном описании должны применяться представленные ниже определения, если не указано иначе. Для целей данного изобретения химические элементы идентифицированы в соответствии с Периодической таблицей элементов, версия CAS, Handbook of Chemistry and Physics, 75th Ed. Дополнительно, общие принципы органической химии описаны в ʺOrganic Chemistryʺ, Thomas Sorrell, University Science Books, Sausalito: 1999 и ʺMarch's Advanced Organic Chemistryʺ, 5th Ed., Ed.: Smith, M.B. and March, J., John Wiley & Sons, New York: 2001, полное содержание которых включено сюда в качестве ссылки.
Термин ʺалифатическийʺ или ʺалифатическая группаʺ в данном описании означает прямую цепь (т.е., не разветвленную) или разветвленную, замещенную или не замещенную углеводородную цепь, которая полностью насыщена или которая содержит одну или более единиц ненасыщенности, или моноциклический углеводород или бициклический углеводород, который полностью насыщен или который содержит одну или более единиц ненасыщенности, но который не является ароматическим (также называемый здесь ʺкарбоциклʺ ʺциклоалифатическийʺ или ʺциклоалкилʺ), который имеет одну точку присоединения к остальной молекуле. Если не определено иначе, алифатические группы содержат 1-6 алифатических атомов углерода. В некоторых вариантах, алифатические группы содержат 1-5 алифатических атомов углерода. В других вариантах, алифатическая группа содержит 1-4 алифатических атома углерода. В других вариантах, алифатическая группа содержит 1-3 алифатических атомов углерода, и в еще других вариантах, алифатические группы содержат 1-2 алифатических атомов углерода. В некоторых вариантах, ʺциклоалифатическийʺ (или ʺкарбоциклʺ или ʺциклоалкилʺ) относится к моноциклическому C3-C6 углеводороду, который полностью насыщен или содержит одну или более единиц ненасыщенности, но который не является ароматическим, который имеет одну точку присоединения к оставшейся молекуле. Типовые алифатические группы являются линейными или разветвленными, замещенными или не замещенными C1-C8 алкильными, C2-C8 алкенильными, C2-C8 алкинильными группами и их гибридами, такими как (циклоалкил)алкил, (циклоалкенил)алкил или (циклоалкил)алкенил.
Термин ʺнизший алкилʺ относится к C1-4 прямой или разветвленной алкильной группе. Типовые низшие алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил.
Термин ʺнизший галоалкилʺ относится к C1-4 прямой или разветвленной алкильной группе, которая замещена одном или более атомами галогена.
Термин ʺгетероатомʺ означает один или более из кислорода, серы, азота или фосфора (включая любые окисленные формы азота, серы или фосфора; кватернизированную форму любого основного азота или; замещаемый азот гетероциклического кольца, например N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин ʺненасыщеннаяʺ в данном описании означает, что часть имеет одну или более единиц ненасыщенности.
В данном описании, термин ʺдвухвалентная C1-8 (или C1-6) насыщенная или ненасыщенная, прямая или разветвленная углеводородная цепьʺ относится к двухвалентной алкиленовой, алкениленовой и алкиниленовой цепям, которые являются прямыми или разветвленными, как определено здесь.
Термин ʺалкиленʺ относится к двухвалентной алкильной группе. ʺАлкиленовой цепьюʺ является полиметиленовая группа, т.е. -(CH2)n-, где n является положительным целым числом, предпочтительно, от 1 до 6, от 1 до 4, от 1 до 3, от 1 до 2 или от 2 до 3. Замещенной алкиленовой цепью является полиметиленовая группа, в которой один или более атомов водорода метилена замещены заместителем. Подходящие заместители включают описанные ниже для замещенной алифатической группы.
Термин ʺалкениленʺ относится к двухвалентной алкенильной группе. Замещенной алкениленовой цепью является полиметиленовая группа, содержащая, по крайней мере, одну двойную связь, в которой один или более атомов водорода замещены заместителем. Подходящие заместители включают описанные ниже для замещенной алифатической группы.
Термин ʺгалогенʺ означает F, Cl, Br или I.
Термин ʺарилʺ, применяемый отдельно или как часть большей части, такой как ʺаралкилʺ, ʺаралкоксиʺ или ʺарилоксиалкилʺ, относится к моноциклической и бициклической кольцевым системам, имеющим всего от пяти до четырнадцати членов в кольце, где, по крайней мере, одно кольцо в системе является ароматическим, и где каждое кольцо в системе содержит от трех до семи членов в кольце. Термин ʺарилʺ применяется взаимозаменяемо с термином ʺарильное кольцоʺ. В определенных вариантов в соответствии с данным изобретением, ʺарилʺ относится к ароматической кольцевой системе. Типовыми арильными группами являются фенил, бифенил, нафтил, антрацил и подобные, которые необязательно включают один или более заместителей. Также в объем термина ʺарилʺ, такой, как он применяется здесь, включена группа, в которой ароматическое кольцо конденсировано с одним или более не ароматическими кольцами, такая как инданил, фталимидил, нафтимидил, фенантирдинил или тетрагидронафтил и подобные.
Термины ʺгетероарилʺ и ʺгетероар-ʺ, применяемые отдельно или как часть больше части, например, ʺгетероаралкилаʺ или ʺгетероаралкоксиʺ, относятся к группам, содержащим от 5 до 10 атомов в кольце, предпочтительно, 5, 6 или 9 атомов в кольце; содержащим 6, 10 или 14 π электронов, разделенных в циклической структуре; и содержащим, в дополнение к атомам углерода, от одного до пяти гетероатомов. Термин ʺгетероатомʺ относится к азоту, кислороду или сере и включает любую окисленную форму азота или серы и любую кватернизированную форму основного азота. Гетероарильные группы включают, без ограничений, тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил и птеридинил. Термины ʺгетероарилʺ и ʺгетероар-ʺ в данном описании также включают группы, в которых гетероароматическое кольцо конденсировано с одним или более арильным, циклоалифатическим или гетероциклильным кольцами, где радикал или точка присоединения находится на гетероароматическом кольце. Не ограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензтиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4Н-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил и пиридо[2,3-b]-1,4-оксазин-3(4Н)-он. Гетероарильная группа необязательно является моно- или бициклической. Термин ʺгетероарилʺ применяют взаимозаменяемо с терминами ʺгетероарильное кольцоʺ, ʺгетероарильная группаʺ или ʺгетероароматическийʺ, где любой из этих терминов включает кольца, которые необязательно замещены. Термин ʺгетероаралкилʺ относится к алкильной группе, замещенной гетероарилом, где алкильная и гетероарильная части независимо необязательно замещены.
В данном описании термины ʺгетероциклʺ, ʺгетероциклилʺ, ʺгетероциклический радикалʺ и ʺгетероциклическое кольцоʺ применяют взаимозаменяемо, и они означают стабильную 5-7-членную моноциклическую или 7-10-членную бициклическую гетероциклическую часть, которая или насыщена, или частично ненасыщена и имеет, в дополнение к атомам углерода, один или более, предпочтительно, от одного до четырех, гетероатомов, как определено выше. При применении в отношении атома кольца гетероцикла, термин ʺазотʺ включает замещенный азот. Например, в насыщенном или частично ненасыщенном кольце, имеющем 0-3 гетероатома, выбранные из кислорода, серы или азота, азотом является N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или +NR (как в N-замещенном пирролидиниле).
Гетероциклическое кольцо может быть присоединено к группе боковой цепи любого гетероатома или атома углерода, которые дают стабильную структуру, и любые атомы кольца могут быть необязательно замещены. Примеры таких насыщенных или частично ненасыщенных гетероциклических радикалов включают, без ограничений, тетрагидрофуранил, тетрагидротиофенил, пирролидинил, пиперидинил, пирролинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, оксазолидинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил, морфолинил и хинуклидинил. Термины ʺгетероциклʺ, ʺгетероциклилʺ, ʺгетероциклильное кольцоʺ, ʺгетероциклическая группаʺ, ʺгетероциклическая частьʺ и ʺгетероциклический радикалʺ применяют взаимозаменяемо, и они также включают группы, в которых гетероциклильное кольцо конденсировано с одним или более арильным, гетероарильным или циклоалифатическим кольцами, например, индолинилом, 3H-индолилом, хроманилом, фенантридинилом или тетрагидрохинолинилом, где радикал или точка присоединения находится на гетероциклильном кольце. Гетероциклильная группа необязательно является моно- или бициклической. Термин ʺгетероциклилалкилʺ относится к алкильной группе, замещенной гетероциклилом, где алкильная и гетероциклильная части независимо необязательно замещены.
В данном описании термин ʺчастично ненасыщенныйʺ относится к кольцевой части, которая включает, по крайней мере, одну двойную или тройную связь. Термин ʺчастично ненасыщенноеʺ охватывает кольца, имеющие множество мест ненасыщенности, но не включает арильную или гетероарильную части, как определено здесь.
Как описано здесь, определенные соединения в соответствии с данным изобретением содержат ʺнеобязательно замещенныеʺ части. В общем, термин ʺзамещенныйʺ, независимо от того, стоит перед ним термин ʺнеобязательноʺ или нет, означает, что один или более атомов водорода указанной части замещен подходящим заместителем. ʺЗамещенныйʺ применяется к одному или более атомом водорода, которые явно или не явно подразумеваются в структуре (например,  относится к, по крайней мере,
относится к, по крайней мере,  ; и
; и  относится к, по крайней мере,
относится к, по крайней мере,  ,
,  ,
,  или
или  . Если не указано иначе, ʺнеобязательно замещеннаяʺ групп имеет подходящий заместитель в каждом замещаемом положении группы, и если более одного положения в любой данной структуре замещены более чем одним заместителем, выбранным из определенной группы, заместители являются одинаковыми или разными в каждом положении. Сочетания заместителей, предусмотренные в данном изобретении, предпочтительно, включают такие, которые дают стабильные или химически возможные соединения. Термин ʺстабильноеʺ в данном описании относится к соединениям, которые практически не изменяются в условиях их получения, определения и, в определенных вариантах, их восстановления, очистки и применения для одной или более целей, описанных здесь.
. Если не указано иначе, ʺнеобязательно замещеннаяʺ групп имеет подходящий заместитель в каждом замещаемом положении группы, и если более одного положения в любой данной структуре замещены более чем одним заместителем, выбранным из определенной группы, заместители являются одинаковыми или разными в каждом положении. Сочетания заместителей, предусмотренные в данном изобретении, предпочтительно, включают такие, которые дают стабильные или химически возможные соединения. Термин ʺстабильноеʺ в данном описании относится к соединениям, которые практически не изменяются в условиях их получения, определения и, в определенных вариантах, их восстановления, очистки и применения для одной или более целей, описанных здесь.
Подходящие одновалентные заместители на замещаемом атоме углерода ʺнеобязательно замещеннойʺ группы независимо включают дейтерий; галоген; -(CH2)0-4R°; -(CH2)0-4OR°; -O(CH2)0-4Ro, -O- (CH2)0-4C(O)OR°; -(CH2)0-4CH(OR°)2; -(CH2)0-4SR°; -(CH2)0-4Ph, который необязательно замещен R°; -(CH2)0-4O(CH2)0-1Ph, который необязательно замещен R°; -CH=CHPh, который необязательно замещен R°; -(CH2)0-4O(CH2)0-1-пиридил, который необязательно замещен R°; -NO2; -CN; -N3; -(CH2)0-4N(R°)2; -(CH2)0-4N(R°)C(O)R°; -N(R°)C(S)R°; -(CH2)0-4N(R°)C(O)NR°2; -N(R°)C(S)NR°2; -(CH2)0-4N(R°)C(O)OR°; -N(R°)N(R°)C(O)R°; -N(R°)N(R°)C(O)NR°2; -N(R°)N(R°)C(O)OR°; -(CH2)0-4C(O)R°; -C(S)R°; -(CH2)0-4C(O)OR°; -(CH2)0-4C(O)SR°; -(CH2)0-4C(O)OSiR°3; -(CH2)0-4OC(O)R°; -OC(O)(CH2)0-4SR°, SC(S)SR°; -(CH2)0-4SC(O)R°; -(CH2)0-4C(O)NR°2; -C(S)NR°2; -C(S)SR°; -SC(S)SR°, -(CH2)0-4OC(O)NR°2; -C(O)N(OR°)R°; -C(O)C(O)R°; -C(O)CH2C(O)R°; -C(NOR°)R°; -(CH2)0-4SSR°; -(CH2)0-4S(O)2R°; -(CH2)0-4S(O)2OR°; -(CH2)0-4OS(O)2R°; -S(O)2NR°2; -(CH2)0-4S(O)R°; -N(R°)S(O)2NR°2; -N(R°)S(O)2R°; -N(OR°)R°; -C(NH)NR°2; -P(O)2R°; -P(O)R°2; -OP(O)R°2; -OP(O)(OR°)2; SiR°3; -(C1-4 прямой или разветвленный алкилен)O-N(R°)2; или -(C1-4 прямой или разветвленный алкилен)C(O)O-N(R°)2, где каждый R° необязательно замещен, как определено ниже, и независимо является водородом, C1-6 алифатическим, -CH2Ph, -O(CH2)0-1Ph, -CH2-(5-6-членным гетероарильным кольцом) или 5-6-членным насыщенным, частично ненасыщенным или арильным кольцом, имеющим 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, несмотря на данное выше определение, два независимых случая R°, взятые вместе с их промежуточными атомами, образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранные из азота, кислорода или серы, которые необязательно замещены как определено ниже.
Подходящие одновалентные заместители R° (или кольца, образованного двумя независимыми вариантами R° вместе с промежуточными атомами) независимо включают дейтерий, галоген, -(CH2)0-2Rλ, -(галоRλ), -(CH2)0-2OH, -(CH2)0-2ORλ, -(CH2)0-2CH(ORλ)2; -O(галоRλ), -CN, -N3, -(CH2)0-2C(O)Rλ, -(CH2)0-2C(O)OH, -(CH2)0-2C(O)ORλ, -(CH2)0-2SRλ, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHRλ, -(CH2)0-2NRλ2, -NO2, -SiRλ3, -OSiRλ3, -C(O)SRλ, -(C1-4 прямой или разветвленный алкилен)C(O)ORλ или -SSRλ, где каждый Rλ не замещен или, если имеет приставку ʺгалоʺ, замещен только одним или более атомами галогена, и его независимо выбирают из C1-4 алифатического, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители на насыщенном атоме углерода R° включают =O и =S.
Подходящие двухвалентные заместители на насыщенном атоме углерода ʺнеобязательно замещеннойʺ группы включают следующие: =O, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(C(R*2))2-3O- или -S(C(R*2))2-3S-, где каждый независимый случай R* выбирают из водорода, C1-6 алифатического, который замещен как описано ниже, или не замещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, имеющего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы. Подходящие двухвалентные заместители, которые связаны с соседними замещаемыми атомами углерода ʺнеобязательно замещеннойʺ группы, включают: -O(CR*2)2-3O-, где каждый независимый случай R* выбирают из водорода, C1-6 алифатического, который необязательно замещен, как определено ниже, или не замещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца, имеющего 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R* включают галоген, -Rλ, -(галоRλ), -OH, -ORλ, -O(галоRλ), -CN, -C(O)OH, -C(O)ORλ, -NH2, -NHRλ, -NRλ2 или -NO2, где каждый Rλ не замещен, или, если имеет приставку ʺгалоʺ, замещен только одним или более атомами галогена, и независимо является C1-4 алифатическим, -CH2Ph, -O(CH2)0-1Ph или 5-6-членным насыщенным, частично ненасыщенным или арильным кольцом, имеющим 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на замещаемом атоме азота ʺнеобязательно замещеннойʺ группы включают -R†, -NR†2, -C(O)R†, -C(O)OR†, -C(O)C(O)R†, -C(O)CH2C(O)R†, -S(O)2R†, -S(O)2NR†2, -C(S)NR†2, -C(NH)NR†2 или -N(R†)S(O)2R†; где каждый R† независимо является водородом, C1-6 алифатическим, который необязательно замещен, как определено ниже, не замещенным -OPh или не замещенным 5-6-членным насыщенным, частично ненасыщенным или арильным кольцом, имеющим 0-4 гетероатома, независимо выбранных из азота, кислорода или серы, или, несмотря на данное выше определение, два независимых случая R†, взятые вместе с промежуточными атомами, образуют не замещенное 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо, имеющее 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
Подходящие заместители на алифатической группе R† независимо являются галогеном, -Rλ, -(галоRλ), -OH, -ORλ, -O(галоRλ), -CN, -C(O)OH, -C(O)ORλ, -NH2, -NHRλ, -NRλ2 или -NO2, где каждый Rλ не замещен, или если имеет приставку ʺгалоʺ, замещен только одним или более атомами галогена, и независимо является C1-4 алифатическим, -CH2Ph, -O(CH2)0-1Ph или 5-6-членным насыщенным, частично ненасыщенным или арильным кольцом, имеющим 0-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, термины ʺнеобязательно замещенныйʺ, ʺнеобязательно замещенный алкил,ʺ ʺнеобязательно замещенный ʺнеобязательно замещенный алкенил,ʺ ʺнеобязательно замещенный алкинилʺ, ʺнеобязательно замещенный карбоциклическийʺ, ʺнеобязательно замещенный арилʺ, "необязательно замещенный гетероарил", ʺнеобязательно замещенный гетероциклическийʺ и любая другая необязательно замещенная группа в данном описании относится к группам, которые замещены или не замещены независимым замещением одного, двух или трех атомов водорода на них, где типовые заместители включают, но не ограничены ими:
-F, -Cl, -Br, -I, дейтерий,
-OH, защищенный гидрокси, алкокси, оксо, тиооксо,
-NO2, -CN, CF3, N3,
-NH2, защищенный амино, -NH-алкил, -NH-алкенил, -NH-алкинил, -NH-циклоалкил, -NH-арил, -NH-гетероарил, -NH-гетероциклический, -диалкиламино, -диариламино, -дигетероариламино,
-O-алкил, -O-алкенил, -O-алкинил, -O-циклоалкил, -O-арил, -O-гетероарил, -O-гетероциклический,
-C(O)-алкил, -C(O)-алкенил, -C(O)-алкинил, -C(O)-карбоциклил, -C(O)-арил, -C(O)-гетероарил, -C(O)-гетероциклил,
-CONH2, -CONH-алкил, -CONH-алкенил, -CONH-алкинил, -CONH-карбоциклил, -CONH-арил, -CONH-гетероарил, -CONH-гетероциклил,
-OCO2-алкил, -OCO2-алкенил, -OCO2-алкинил, -OCO2-карбоциклил, -OCO2-арил, -OCO2-гетероарил, -OCO2-гетероциклил, -OCONH2, -OCONH-алкил, -OCONH-алкенил, -OCONH-алкинил, -OCONH-карбоциклил, -OCONH-арил, -OCONH-гетероарил, -OCONH-гетероциклил,
-NHC(O)-алкил, -NHC(O)-алкенил, -NHC(O)-алкинил, -NHC(O)-карбоциклил, -NHC(O)-арил, -NHC(O)-гетероарил, -NHC(O)-гетероциклил, -NHCO2-алкил, -NHCO2-алкенил, -NHCO2-алкинил, -NHCO2-карбоциклил, -NHCO2-арил, -NHCO2-гетероарил, -NHCO2-гетероциклил, -NHC(O)NH2, -NHC(O)NH-алкил, -NHC(O)NH-алкенил, -NHC(O)NH-алкенил, -NHC(O)NH-карбоциклил, -NHC(O)NH-арил, -NHC(O)NH-гетероарил, -NHC(O)NH-гетероциклил, NHC(S)NH2, -NHC(S)NH-алкил, -NHC(S)NH-алкенил, -NHC(S)NH-алкинил, -NHC(S)NH-карбоциклил, -NHC(S)NH-арил, -NHC(S)NH-гетероарил, -NHC(S)NH-гетероциклил, -NHC(NH)NH2, -NHC(NH)NH-алкил, -NHC(NH)NH-алкенил, -NHC(NH)NH-алкенил, -NHC(NH)NH-карбоциклил, -NHC(NH)NH-арил, -NHC(NH)NH-гетероарил, -NHC(NH)NH-гетероциклил, -NHC(NH)-алкил, -NHC(NH)-алкенил, -NHC(NH)-алкенил, -NHC(NH)-карбоциклил, -NHC(NH)-арил, -NHC(NH)-гетероарил, -NHC(NH)-гетероциклил,
-C(NH)NH-алкил, -C(NH)NH-алкенил, -C(NH)NH-алкинил, -C(NH)NH-карбоциклил, -C(NH)NH-арил, -C(NH)NH-гетероарил, -C(NH)NH-гетероциклил,
-S(O)-алкил, -S(O)-алкенил, -S(O)-алкинил, -S(O)-карбоциклил, -S(O)-арил, -S(O)-гетероарил, -S(O)-гетероциклил, -SO2NH2, -SO2NH-алкил, -SO2NH-алкенил, -SO2NH-алкинил, -SO2NH-карбоциклил, -SO2NH-арил, -SO2NH-гетероарил, -SO2NH-гетероциклил,
-NHSO2-алкил, -NHSO2-алкенил, -NHSO2-алкинил, -NHSO2-карбоциклил, -NHSO2-арил, -NHSO2-гетероарил, -NHSO2-гетероциклил,
-CH2NH2, -CH2SO2CH3,
-моно-, ди- или триалкилсилил,
-алкил, -алкенил, -алкинил, -арил, -арилалкил, -гетероарил, -гетероарилалкил, -гетероциклоалкил, -циклоалкил, -карбоциклический, -гетероциклический, полиалкоксиалкил, полиалкокси, -метоксиметокси, -метоксиэтокси, -SH, -S-алкил, -S-алкенил, -S-алкинил, -S-карбоциклил, -S-арил, -S-гетероарил, -S-гетероциклил или метилтиометил.
В данном описании термин ʺфармацевтически приемлемая сольʺ относится к таким солям, которые, в пределах медицинских показаний, подходят для применения в контакте с тканями человека и низших животных, не вызывая токсичности, раздражения, аллергической реакции, и подобных реакций, и соразмерны с разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. M. Berge et al., подробно описывает фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенном сюда в качестве ссылки. Фармацевтически приемлемые соли соединений в соответствии с данным изобретением включают соли, полученные из подходящих неорганических и органических кислот и оснований. Примеры фармацевтически приемлемых не токсичных кислотно-аддитивных солей включают соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с применением других методов, применяемых в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и тому подобное.
Соли, полученные из подходящих оснований, включают соли щелочного металла, щелочноземельного металла, аммония и N+(C1-4алкила)4. Типовые соли щелочного или щелочноземельного металла включают натрий, литий, калий, кальций, магний и подобные. Другие фармацевтически приемлемые соли включают, если применимо, не токсичные катионы аммония, четвертичного аммония и амина, полученные с применением противоионов, таких как галогенид, гидроксид, сульфат, фосфат, нитрит, низший алкилсульфонат и арилсульфонат.
Если не указано иначе, изображенные здесь структуры также включают все изомерные (например, энантиомерные, диастереомерные и геометрические (или конформационные)) формы структуры; например, R и S конфигурации для каждого асимметрического центра, изомеры Z и E двойной связи и Z и E конформационные изомеры. Поэтому отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений в соответствии с данным изобретением включены в объем данного изобретения. Если не указано иначе, все таутомерные формы соединений в соответствии с данным изобретением включены в объем данного изобретения.
В данном описании термин ʺтаутомерʺ означает каждый из двух или более изомеров соединения, которые существуют вместе в равновесии и легко меняются местами в результате миграции атома или группы в молекуле. Таутомеры являются конституционными изомерами органических соединений, которые легко взаимопревращаются химической реакцией, называемой таутомеризация. Эта реакция обычно дает формальную миграцию атома водорода или протона, сопровождаемую переключением одинарной связи и соседней двойной связи. Например, см.
Дополнительно, если не указано иначе, изображенные здесь структуры также включают соединения, которые отличаются только присутствием одного или более изотопно обогащенных атомов. Например, соединения, имеющие структуру в соответствии с данным изобретением, включая замещение атома углерода 13C- или 14C-обогащенным углеродом, включены в объем данного изобретения. В некоторых вариантах, группа содержит один или более атомов дейтерия.
Также подразумевается, что соединение формулы I включает его изотопно-меченые формы. Изотопно-меченая форма соединения формулы I идентична этому соединению за исключением того, что один или более атомов соединения замещены атомом или атомами, имеющими атомную массу или массовое число, которые отличаются от атомной массы или массового числа атома, которые обычно имеются в природе. Примеры изотопов, которые легко доступны коммерчески, и которые могут быть включены в соединение формулы I хорошо известными способами, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36CI, соответственно. Соединение формулы I, его пролекарство или его фармацевтически приемлемая соль, которая содержит один или более из указанных выше изотопов и/или других изотопов других атомов, являются частью данного изобретения. Изотопно-меченое соединение формулы I может применяться различными полезными путями. Например, изотопно-меченное соединение формулы I, в которое введен, например, радиоизотоп, такой как 3H или 14C, подходит для лекарственного средства и/или анализа распределения субстрата в тканях. Эти радиоизотопы, т.е. тритий (3H) и углерод-14 (14C), являются особенно предпочтительными благодаря простоте получения и превосходной определяемости. Введение более тяжелых изотопов, например, дейтерия (2H), в соединение формулы I имеет терапевтические преимущества благодаря более высокой метаболической стабильности такого изотопно-меченного соединения. Более высокая метаболическая стабильность транслируется непосредственно в повышенный период полувыведения in vivo или пониженную дозу, которые, при определенных обстоятельствах, представляют предпочтительный вариант данного изобретения. Изотопно-меченное соединение формулы I обычно может быть получено методами, описанными на схемах синтеза и в описании, в разделах, посвященных примерам и получению в данном тексте, заменяя не изотопно-меченный реагент легко доступным изотопно-меченным реагентом.
Дейтерий (2H) также может быть введен в соединение формулы I для целей управления окислительным метаболизмом соединения через первичный кинетический изотопный эффект. Первичный кинетический изотопный эффект представляет собой изменение скорости химической реакции, которая возникает при изменении изотопного ядра, которое, в свою очередь, вызвано изменением энергий основного состояния, необходимым для образования ковалентной связи после такого изотопного обмена. Изменение более тяжелого изотопа обычно вызывает снижение энергии основного состояния для химической связи и, следовательно, вызывает снижение скорости ограничивающего скорость разрыва связи. Если разрыв связи возникает в или рядом с областью седловой точки вдоль координаты мультипродуктной реакции, соотношения распределения продуктов могут быть значительно изменены. Для объяснения: если дейтерий связан с атомом углерода в не заменяемом положении, разность скоростей kM/kD=2-7 является обычной. Если эта разность скоростей успешно применяется к соединению формулы I, которое подвержено окислению, профиль этого соединения in vivo может быть значительно модифицирован и дает улучшенные фармакокинетические свойства.
При поиске и разработке терапевтических агентов, специалист в данной области техники может оптимизировать фармакокинетические параметры при сохранении желаемых in vitro свойств. Разумно предположить, что множество соединений с плохим фармакокинетическим профилем подвержено окислительному метаболизму. In vitro анализ микросом печени, доступный в настоящее время, дает ценную информацию о течении окислительного метаболизма такого типа, которая, в свою очередь, позволяет рационально разработать дейтерированные соединения формулы I с улучшенной стабильностью через резистентность к такому окислительному метаболизму. Таким образом достигаются значительные улучшения в фармакокинетических профилях соединений формулы I, и они могут быть выражены количественно в том, что касается повышения периода полувыведения in vivo (t/2), концентрации при максимальном терапевтическом эффекте (Cmax), площади под дозозависимой кривой (ППК) и F; и в том, что касается пониженного клиренса, дозы и затрат на материалы.
Далее представлена иллюстрация описанного выше: соединение формулы I, которое имеет множество потенциальных мест наступления окислительного метаболизма, например, бензильных атомов водорода и атомов водорода, связанных с атомом азота, получают в виде серии аналогов, в которых различные сочетания атомов водорода замещены атомами дейтерия так, чтобы некоторые, большинство или все такие атомы водорода были замещены атомами дейтерия. Определение периода полувыведения позволяет удобно и точно определить степень, до которой улучшается улучшение резистентности к окислительному метаболизму. Таким образом определяют, что период полувыведения исходного соединения может быть увеличен вплоть до 100% в результате обмена дейтерий-водород подобного типа.
Обмен дейтерий-водород в соединении формулы I также может применяться для достижения благоприятной модификации спектра метаболита исходного соединения для уменьшения или исключения нежелательных токсичных метаболитов. Например, если токсичный метаболит возникает при окислительном расщеплении связи углерод-водород (C-H), разумно предположить, что дейтерированный аналог будет в большей степени снижать или исключать образование нежелательного метаболита, даже если конкретное окисление не является определяющей скорость стадией. Дополнительная информация известного уровня техники, относящаяся к обмену дейтерий-водород, может быть найдена, например, в Hanzlik et al., J. Org. Chem. 55, 3992-3997, 1990, Reider et al., J. Org. Chem. 52, 3326-3334, 1987, Foster, Adv. Drug Res. 14, 1-40, 1985, Gillette et al, Biochemistry 33(10) 2927-2937, 1994 и Jarman et al. Carcinogenesis 16(4), 683-688, 1993.
В данном описании, термин ʺмодуляторʺ определен как соединение, которое связывается с и/или ингибирует цель с измеримым сродством. В определенных вариантах, модулятор имеет IC50 и/или константу связывания менее около 50 мкМ, менее около 5 мкМ, менее около 1 мкМ, менее около 500 нМ, менее около 100 нМ или менее около 10 нМ.
Термины ʺизмеримое сродствоʺ и ʺизмеримо ингибируетʺ в данном описании означает измеримое изменение активности ТКБ между образцом, содержащим соединение в соответствии с данным изобретением, или его композицию, и ТКБ и эквивалентным образцом, содержащим ТКБ, при отсутствии указанного соединения или его композиции.
Сочетания заместителей и переменных, указанные в данном изобретении, могут быть только такими, которые дают образование стабильных соединений. Термин ʺстабильноеʺ в данном описании относится к соединениям, которые обладают стабильностью, достаточной для того, чтобы позволить производство, и которые сохраняют целостность соединения в течение достаточного периода времени для применения для описанных здесь целей (например, терапевтического или профилактического введения пациенту).
Цитирование или перечисление химических групп в любом определении переменной в данном описании включает определение этой переменной как любой отдельной группы или сочетания перечисленных групп. Описание варианта для переменной здесь включает этот вариант в виде любого отдельного варианта или в сочетании с любыми другими вариантами или их частями.
3. Описание типовых соединений
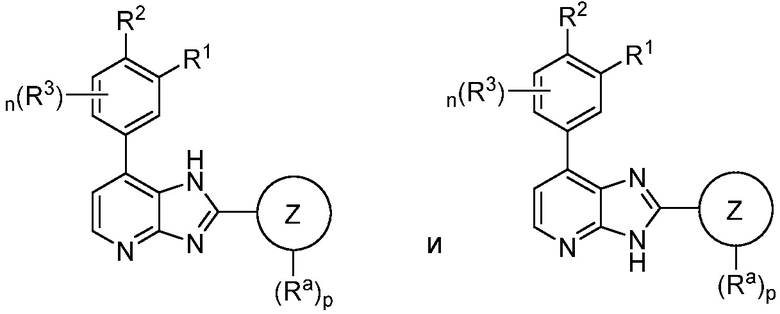
Согласно одному аспекту, в данном изобретении представлено соединение формулы I

I
или его таутомер или фармацевтически приемлемая соль, где:
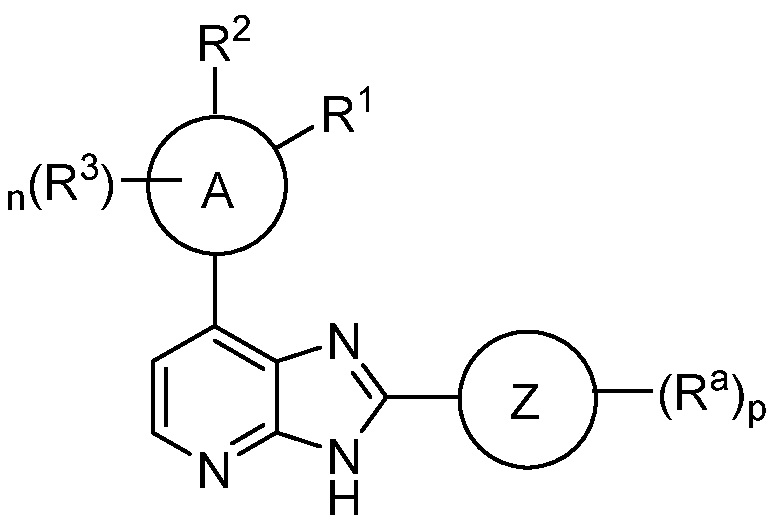
Кольцом A является 5-6-членный арил или гетероарил;
R1 является H, галоген, (C(R5)(R5))mNR2, N(R4)C(O)R, N(R4)C(O)NR2, N(R4)CO2R, N(R4)S(O)2R, N(R4)S(O)R, N(R4)(R4), необязательно замещенное 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или необязательно замещенное 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; или R1 отсутствует;
R2 является H, (C(R5)(R5))mOR4, (C(R5)(R5))mN(R4)COR, (C(R5)(R5))mN(R4)C(O)C(O)NR2, (C(R5)(R5))mN(R4)( R4), необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; или R2 отсутствует;
или R1 и R2 вместе с атомами, к которым они присоединены, образуют конденсированное 3-7-членное кольцо, которое необязательно замещено;
где R1 и R2 оба не являются H; и где R1 и R2 оба отсутствуют;
каждый R3 независимо является галогеном, C1-6 алифатическим, C5-10 арилом, 3-8-членным насыщенным или частично ненасыщенным карбоциклическим кольцом, 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членным моноциклическим гетероарильным кольцом, имеющим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен;
каждый R4 независимо является -R, -SO2R, -SOR, -C(O)R, -CO2R или -C(O)N(R)2;
каждый R5 независимо является -R, галогеном, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
каждый R независимо является водородом, C1-6 алифатическим, C5-10 арилом, 3-8-членным насыщенным или частично ненасыщенным карбоциклическим кольцом, 3-7-членным гетероциклическим кольцом, имеющим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждый из которых необязательно замещен; или
две R группы на одном и том же атоме берут вместе с атомом, к которому они присоединены с получением C5-10 арила, 3-8-членного насыщенного или частично ненасыщенного карбоциклического кольца, 3-7-членного гетероциклического кольца, содержащего 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 5-6-членного моноциклического гетероарильного кольца, содержащего 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; 10-15-членного конденсированного арильного кольца; 6-15-членного насыщенного или частично ненасыщенного конденсированного карбоциклического кольца; 10-15-членного конденсированного гетероарильного кольца; или 6-15-членного насыщенного или частично ненасыщенного конденсированного гетероциклического кольца; каждое из которых необязательно замещено;
кольцом Z является C5-10 арил, 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы; каждое из которых необязательно замещено; или кольцо Z отсутствует;
каждый Ra независимо является -R, галогеном, -OR, -SR, -CN, -NO2, -SO2R, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2;
m равно 1, 2 или 3;
n равно 0, 1 или 2; и
p равно 0, 1, 2 или 3.
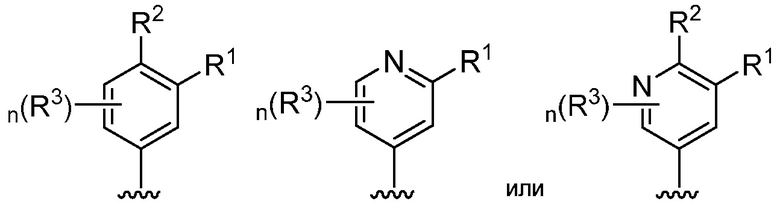
В определенных вариантах, кольцом A является фенил, пиридин, пиразин, пиримидин, пиридазин или триазин.
В определенных вариантах, кольцом A является фенил. В определенных вариантах, кольцом A является пиридин.
В определенных вариантах, кольцом A является
 .
.
В определенных вариантах, R1 является H. В определенных вариантах, R1 является F, Cl, Br или I. В определенных вариантах, R1 является F.
В определенных вариантах, R1 является (C(R5)(R5))mNR2, N(R4)C(O)R, N(R4)C(O)NR2, N(R4)CO2R, N(R4)S(O)2R, N(R4)S(O)R, N(R4)(R4), необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, R1 является (C(R5)(R5))mNR2, N(R4)C(O)R, N(R4)C(O)NR2, N(R4)(R4), необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, R1 является (C(R5)(R5))mNR2. В определенных вариантах, R1 является N(R4)C(O)R. В определенных вариантах, R1 является N(R4)C(O)NR2. В определенных вариантах, R1 является N(R4)(R4). В определенных вариантах, R1 является необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В определенных вариантах, R1 является необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, R1 является необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, где гетероциклическое кольцо дополнительно замещено конденсированным кольцом.
В определенных вариантах, R1 является необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, где гетероарильное кольцо дополнительно замещено конденсированным кольцом.
В определенных вариантах, R1 отсутствует.
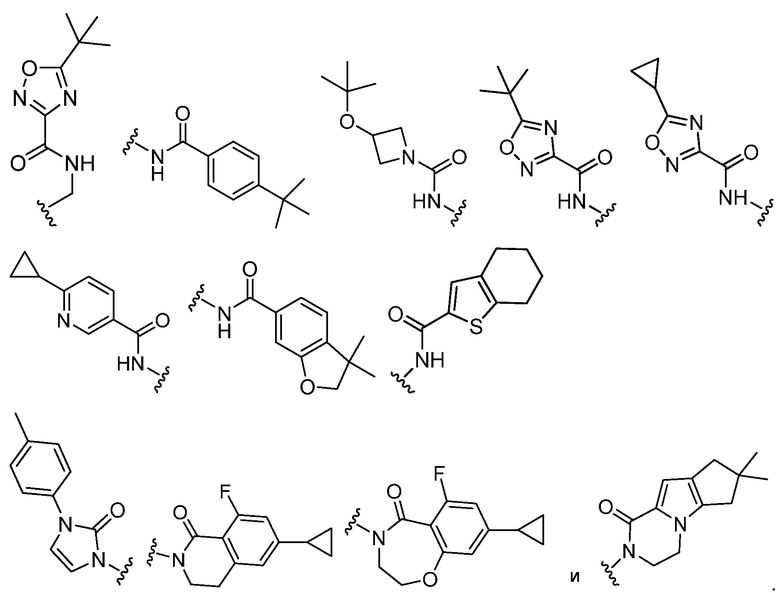
В определенных вариантах, R1 выбирают из:
В определенных вариантах, R2 является водородом.
В определенных вариантах, R2 является (C(R5)(R5))mOR4, (C(R5)(R5))mN(R4)COR, (C(R5)(R5))mN(R4)C(O)C(O)NR2, (C(R5)(R5))mN(R4)(R4), необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, или необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, R2 является (C(R5)(R5))mN(R4)(R4). В определенных вариантах, R2 является (C(R5)(R5))mOR4. В определенных вариантах, R2 является (C(R5)(R5))mN(R4)COR. В определенных вариантах, R2 является (C(R5)(R5))mN(R4)C(O)C(O)NR2. В определенных вариантах, R2 является необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В определенных вариантах, R2 является необязательно замещенным 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, R2 является (CH2)mN(R4)(R4). В определенных вариантах, R2 является (CH2)mOR4. В определенных вариантах, R2 является (CH2)mN(R4)COR. В определенных вариантах, R2 является (CH2)mN(R4)C(O)C(O)NR2.
В определенных вариантах, R2 является -CH2OH, -CH2NH2,
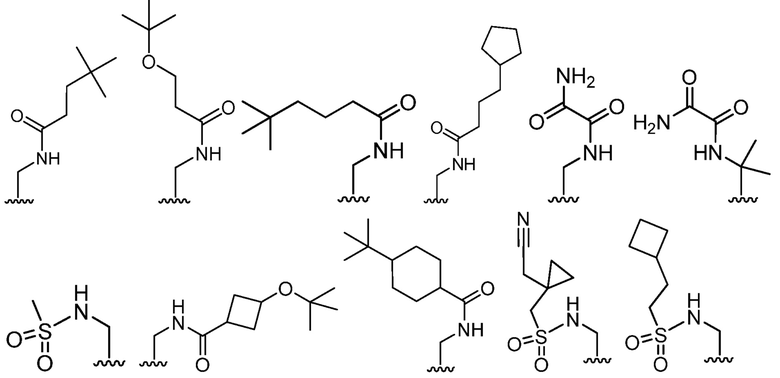
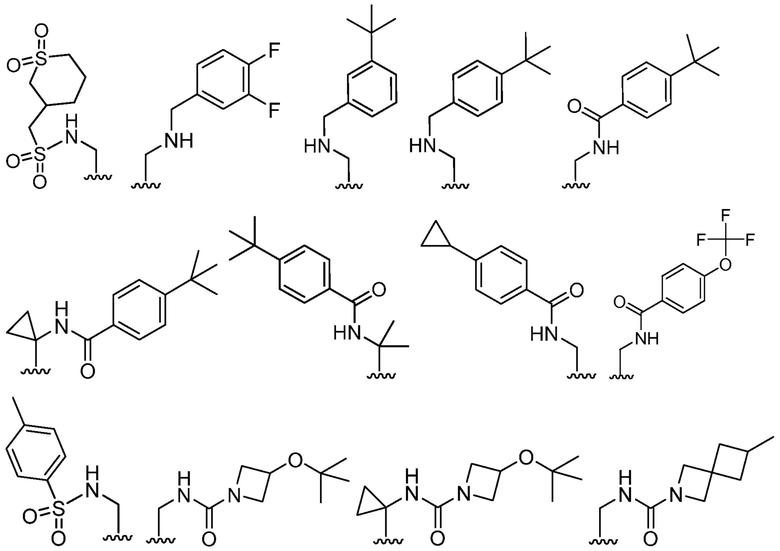
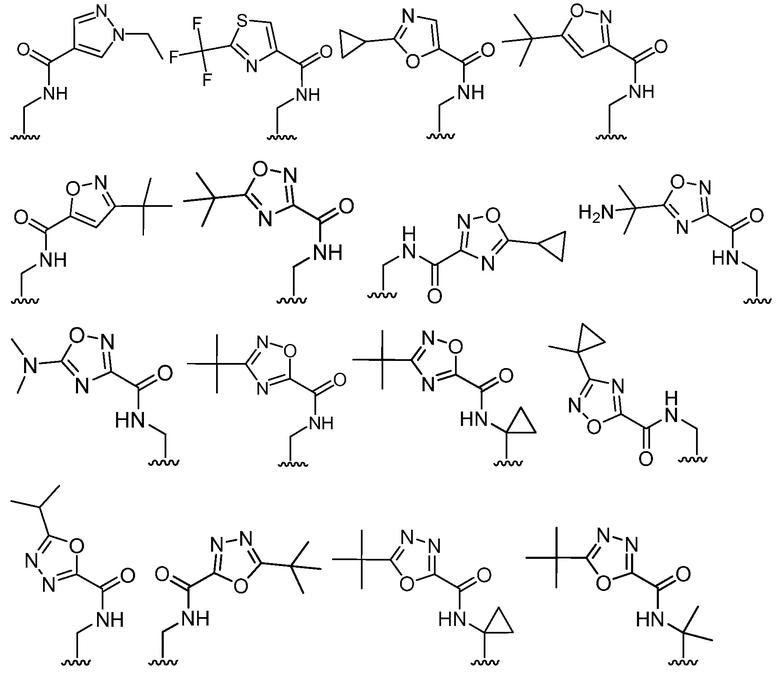
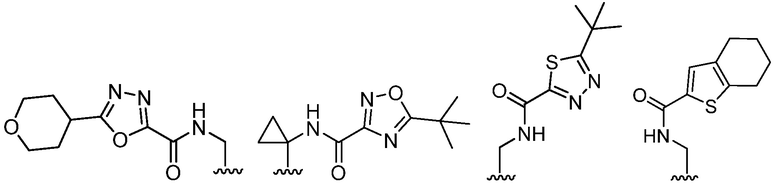
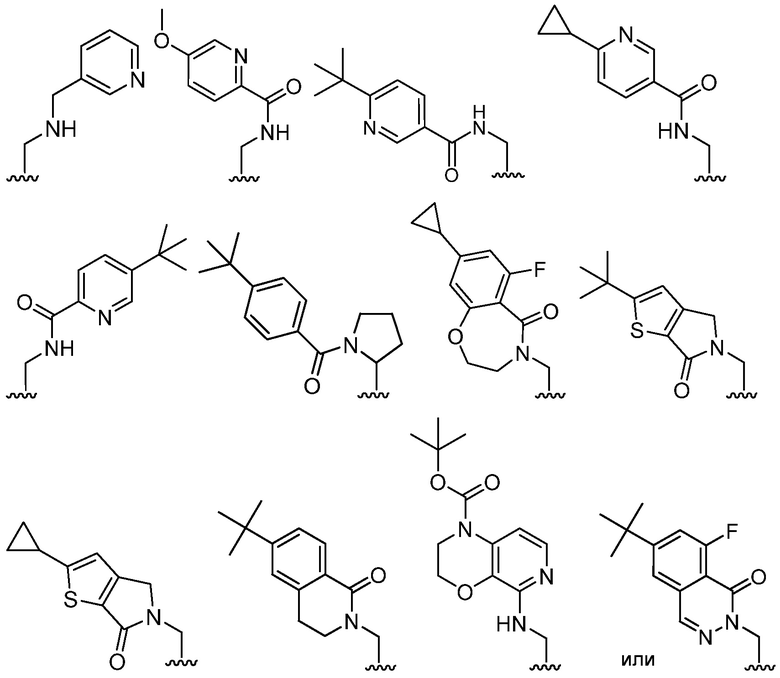 .
.
В определенных вариантах, R1 и R2 вместе образуют
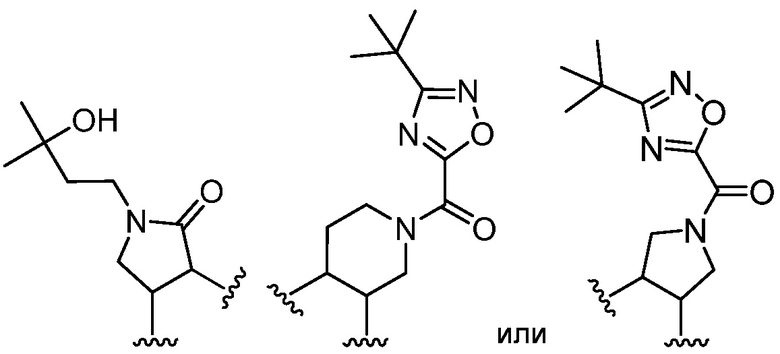 .
.
В определенных вариантах, каждый R3 независимо является галогеном. В определенных вариантах, каждый R3 независимо является необязательно замещенным C1-6 алифатическим. В определенных вариантах, каждый R3 независимо является необязательно замещенным C5-10 арилом. В определенных вариантах, каждый R3 независимо является необязательно замещенным 3-8-членным насыщенным или частично ненасыщенным карбоциклическим кольцом. В определенных вариантах, каждый R3 независимо является необязательно замещенным 3-7-членным гетероциклическим кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В определенных вариантах, каждый R3 независимо является необязательно замещенным или 5-6-членным моноциклическим гетероарильным кольцом, содержащим 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
В определенных вариантах, каждый R3 независимо является галогеном или необязательно замещенным C1-6 алифатическим.
В определенных вариантах, каждый R3 независимо является F, Cl, Br, I, метилом, этилом, этилом, пропилом, и-пропилом, бутилом, в-бутилом, т-бутилом, прямым или разветвленным пентилом или прямым или разветвленным гексилом; каждый из которых необязательно замещен.
В определенных вариантах, каждый R3 независимо является F, метилом, -CF3 или -CH2OH.
В определенных вариантах, кольцом Z является необязательно замещенный C5-10 арил. В определенных вариантах, кольцом Z является необязательно замещенное 3-8-членное насыщенное или частично ненасыщенное карбоциклическое кольцо. В определенных вариантах, кольцом Z является необязательно замещенное 3-7-членное гетероциклическое кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В определенных вариантах, кольцом Z является необязательно замещенное или 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы.
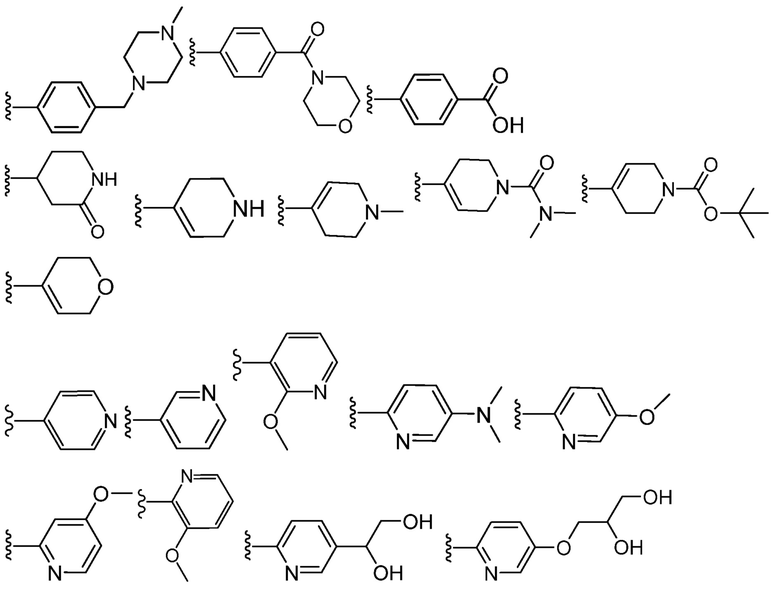
В определенных вариантах, кольцом Z является фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, адамантил, циклооктил, [3.3.0]бициклооктанил, [4.3.0]бициклононанил, [4.4.0]бициклодеканил, [2.2.2]бициклооктанил, флуоренил, инданил, тетрагидронафтил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбазолил, NH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидин-он, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизоквинолинил, тетрагидроквинолинил, тетрагидропиридин, тетрагидропиран, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, оксетанил, азетидинил или ксантенил; каждый из которых необязательно замещен.
В определенных вариантах, кольцом Z является циклопропил, фенил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3H-индолил, изоиндолинил, изоиндоленил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, оксазолидинил, оксазолил, оксазолидинил, пиперидин-он, пиримидинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2H-пирролил, пирролил, тетрагидропиридин, тетрагидропиран, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил или 1,3,4-триазолил; каждый из которых необязательно замещен.
В определенных вариантах, кольцом Z является циклопропил, пиперидин-он, фенил, пирахолил, пиридинил, тетрагидропиридин или тетрагидропиран; каждый из которых необязательно замещен.
В определенных вариантах, кольцом Z является
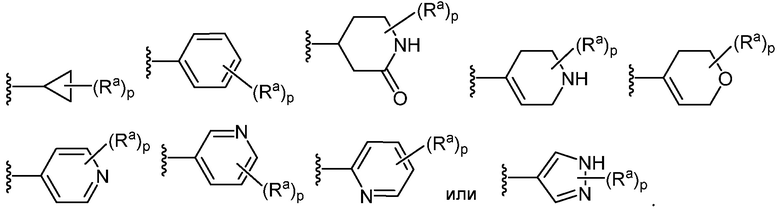
В определенных вариантах, кольцом Z является
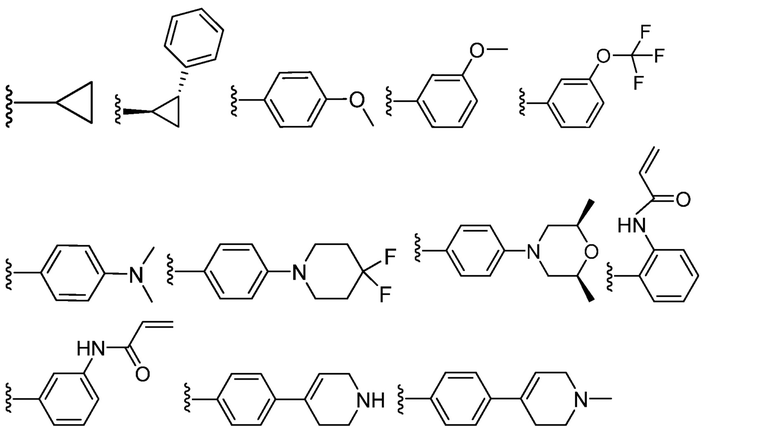
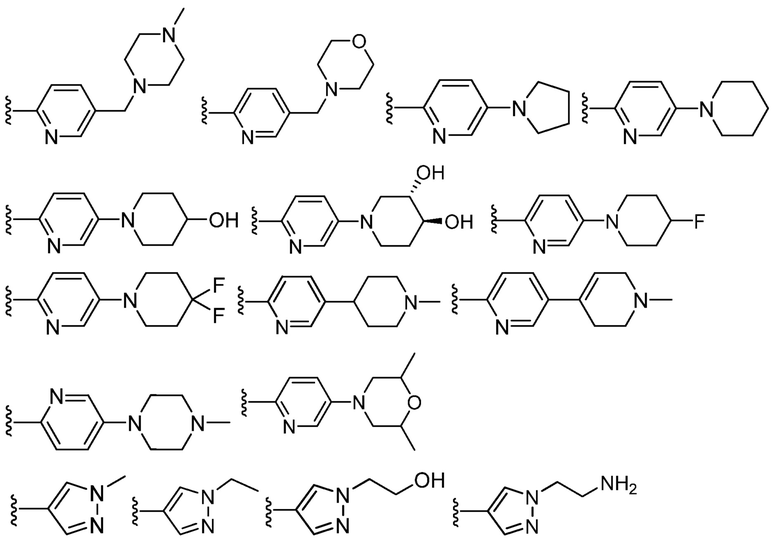
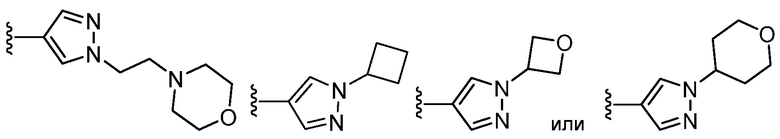 .
.
В определенных вариантах, кольцо Z отсутствует и Ra является -CF3, и-Pr или и-Bu.
В определенных вариантах, каждый из R1, R2, R3, кольца Z и n такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II
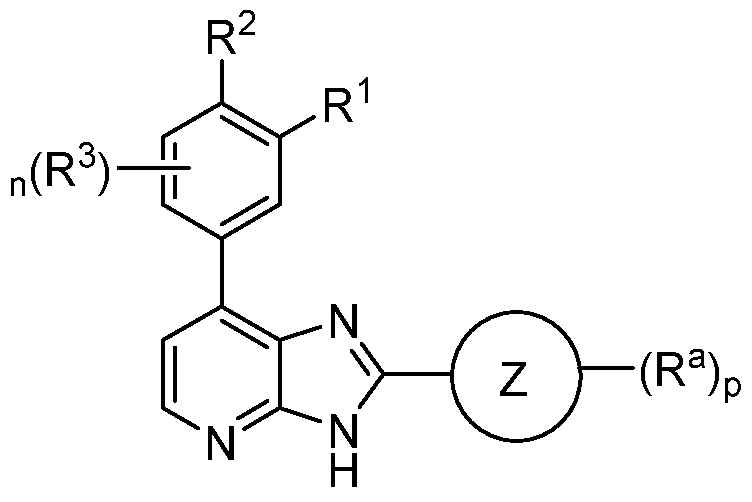
II;
или его фармацевтически приемлемая соль, где каждый из кольца Z, R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-a
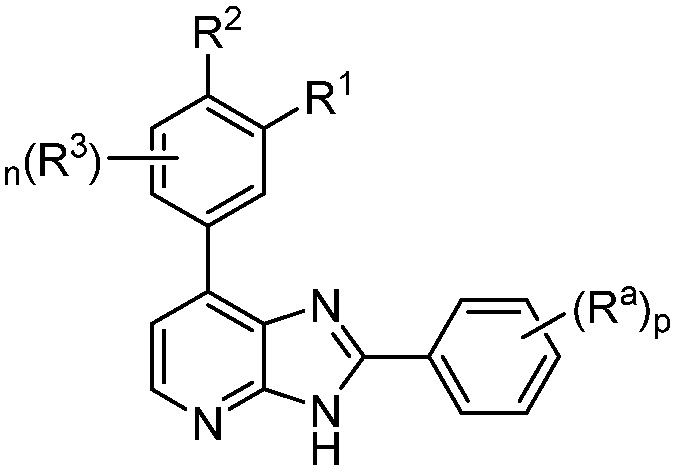
II-a;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-b
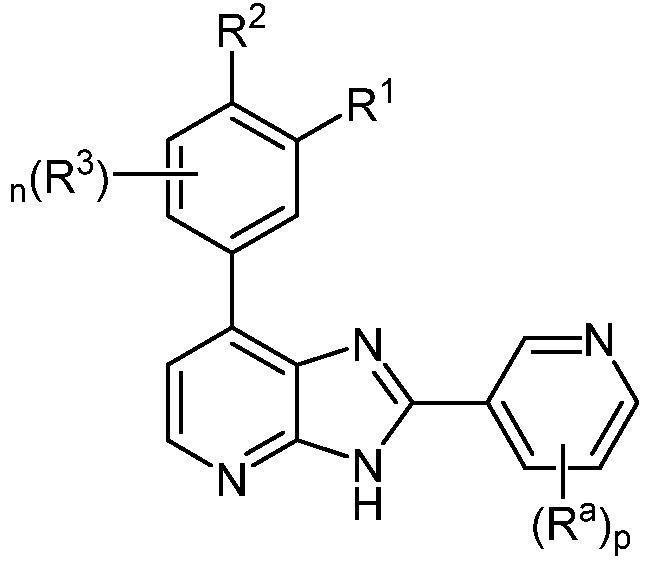
II-b;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-c
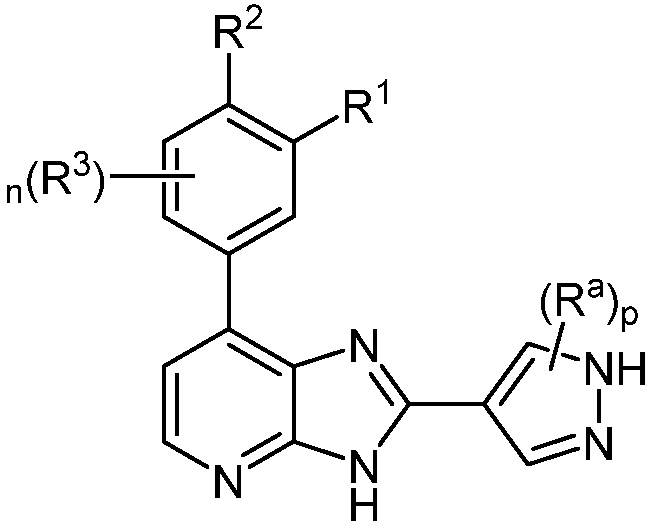
II-c;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-d
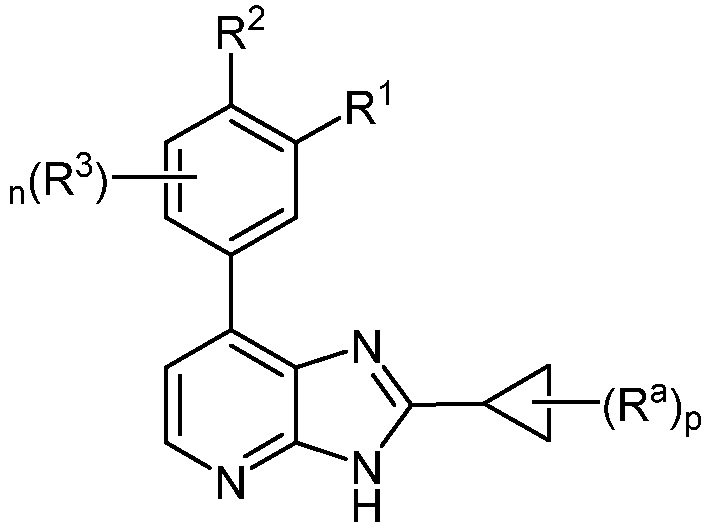
II-d;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-e
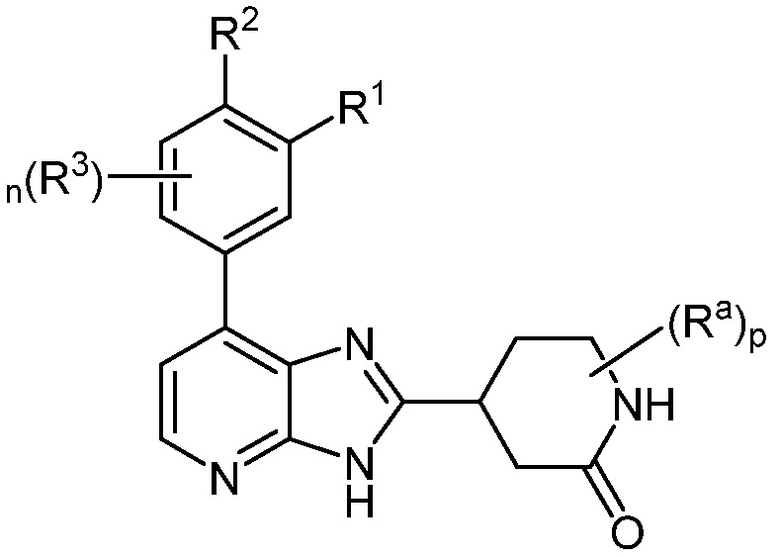
II-e;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-f
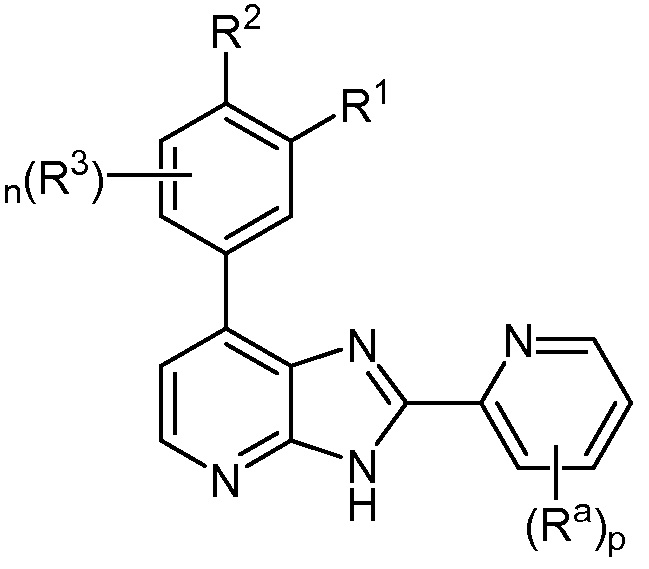
II-f;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-g
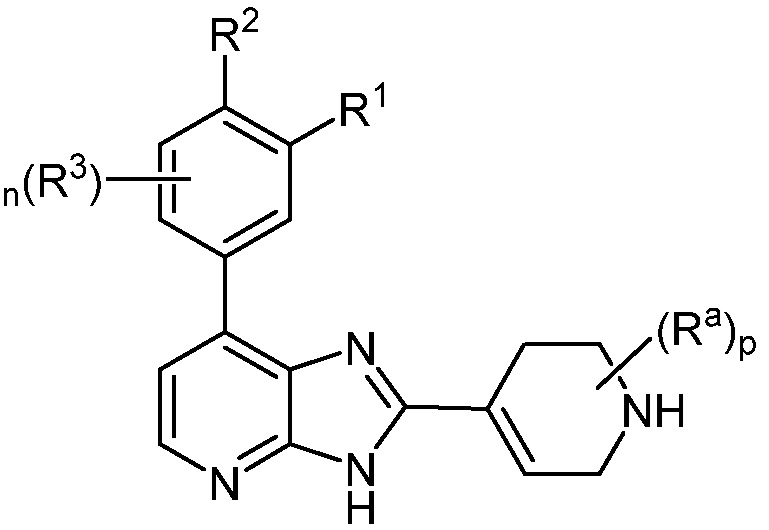
II-g;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-h
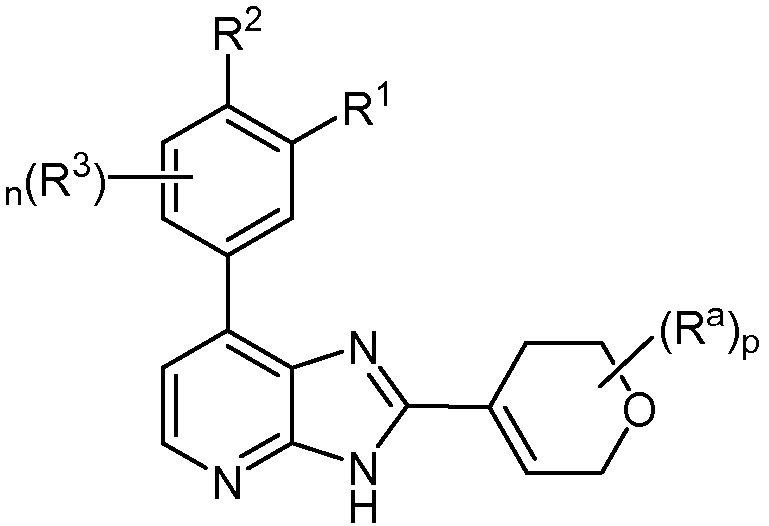
II-h;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы II-i
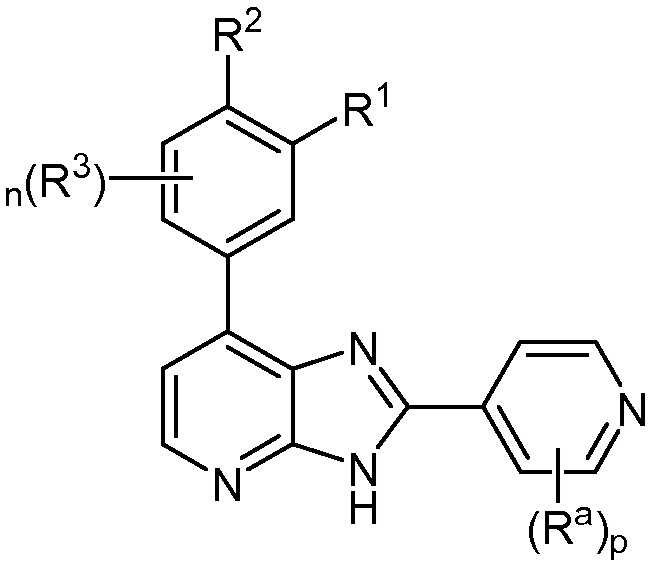
II-i;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
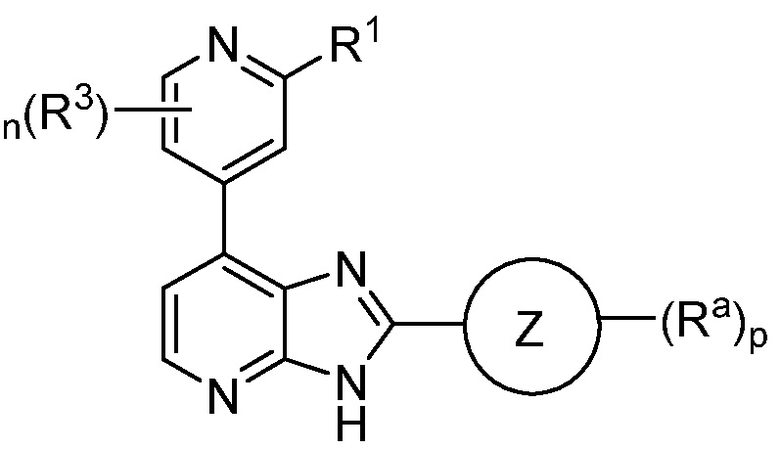
В определенных вариантах, в данном изобретении представлено соединение формулы III
III;
или его фармацевтически приемлемая соль, где каждый из кольца Z, R1, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы III-a
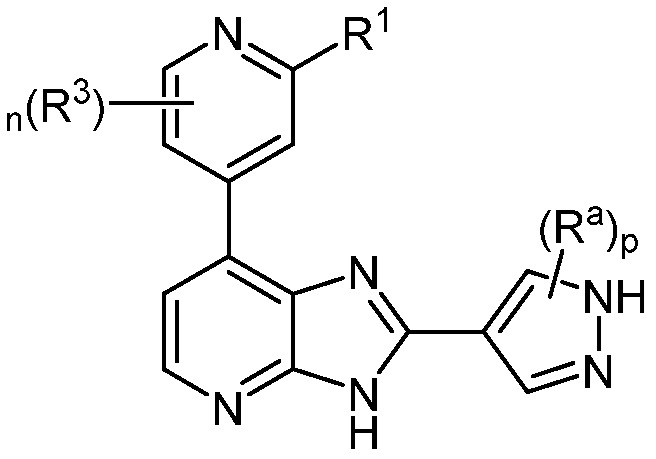
III-a;
или его фармацевтически приемлемая соль, где каждый из R1, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы III
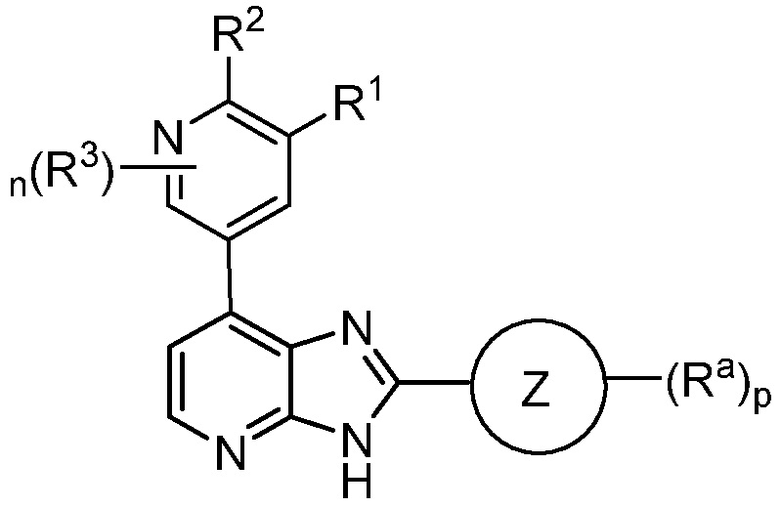
III;
или его фармацевтически приемлемая соль, где каждый из кольца Z, R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение формулы III-a
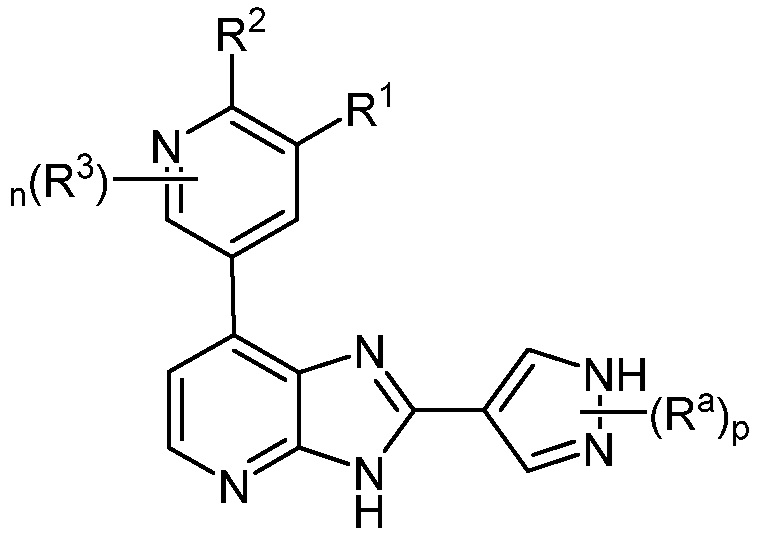
III-a;
или его фармацевтически приемлемая соль, где каждый из R1, R2, R3, Ra, n и p такие, как определены выше и описаны в вариантах, классах и подклассах выше и здесь, отдельно или в сочетании.
В определенных вариантах, в данном изобретении представлено соединение, выбранное из таблицы 1:
Таблица 1
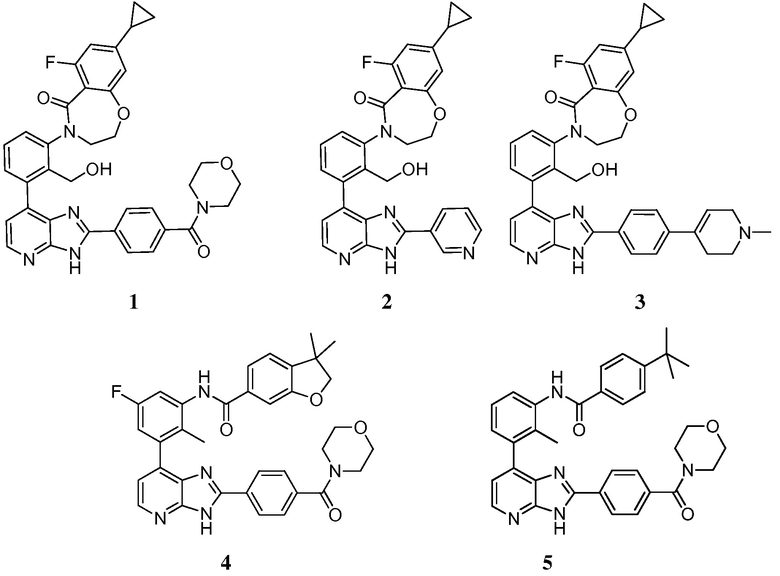
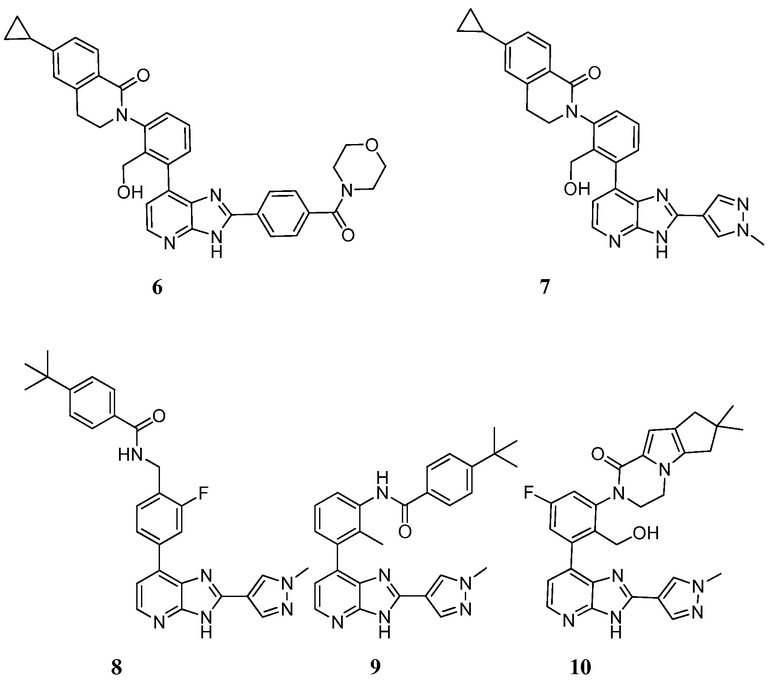
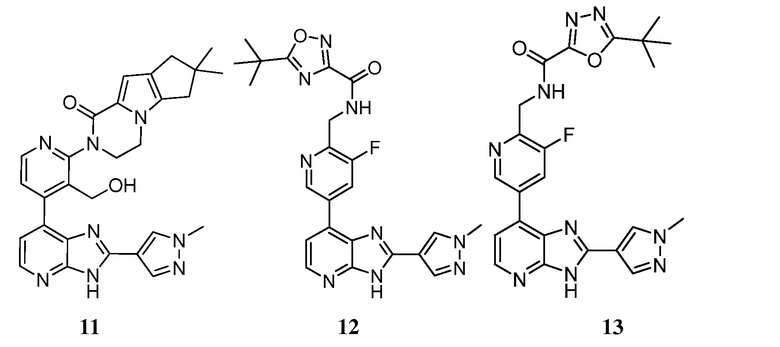
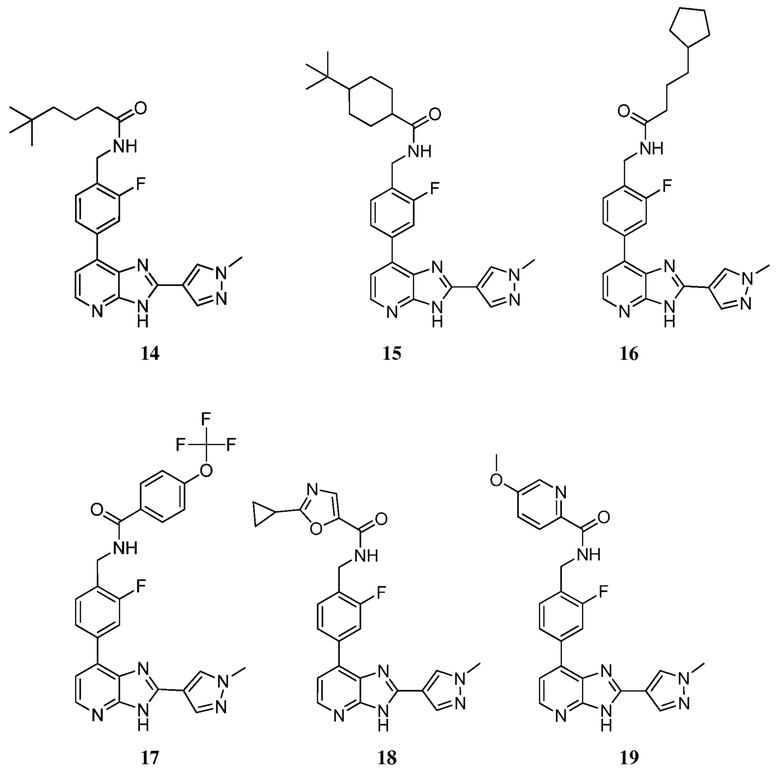
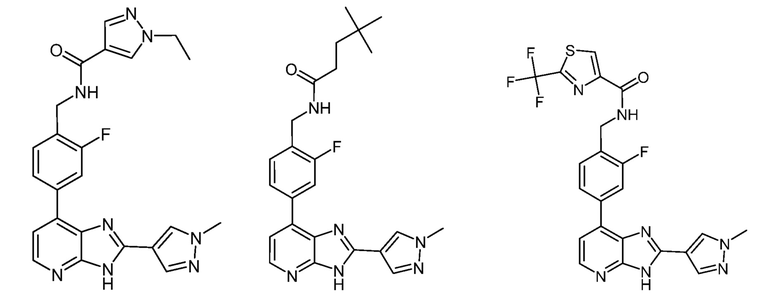
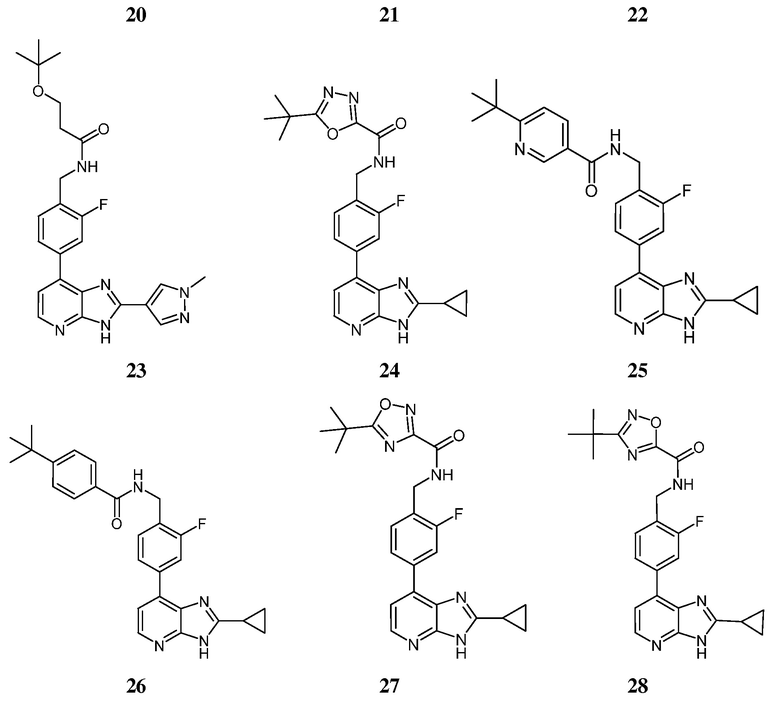
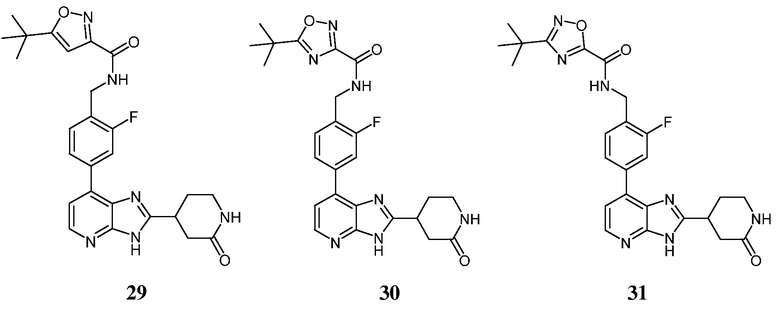
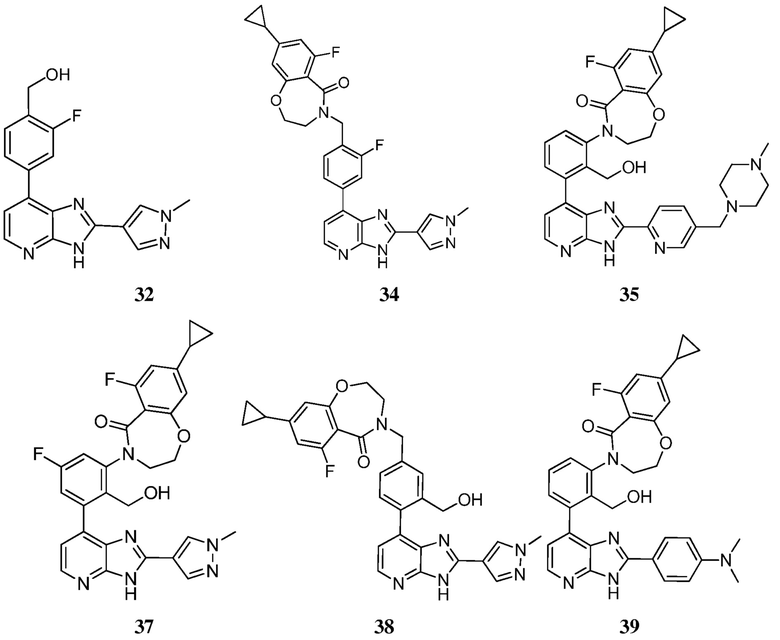
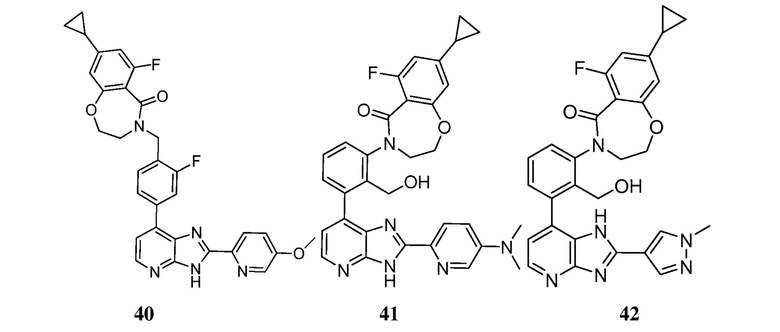
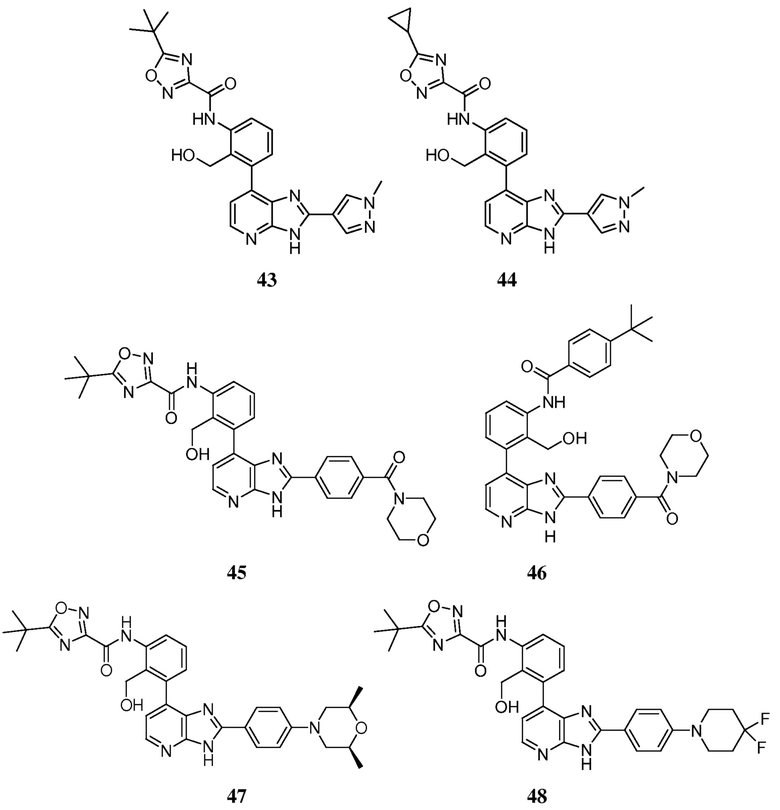
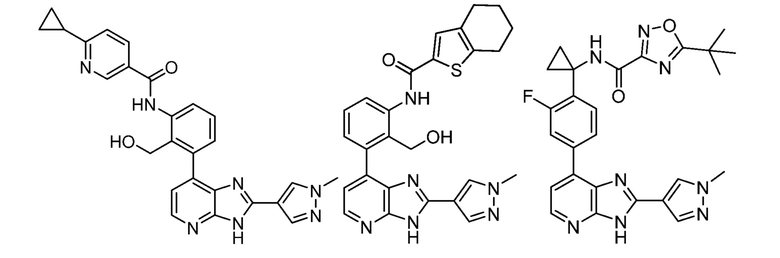
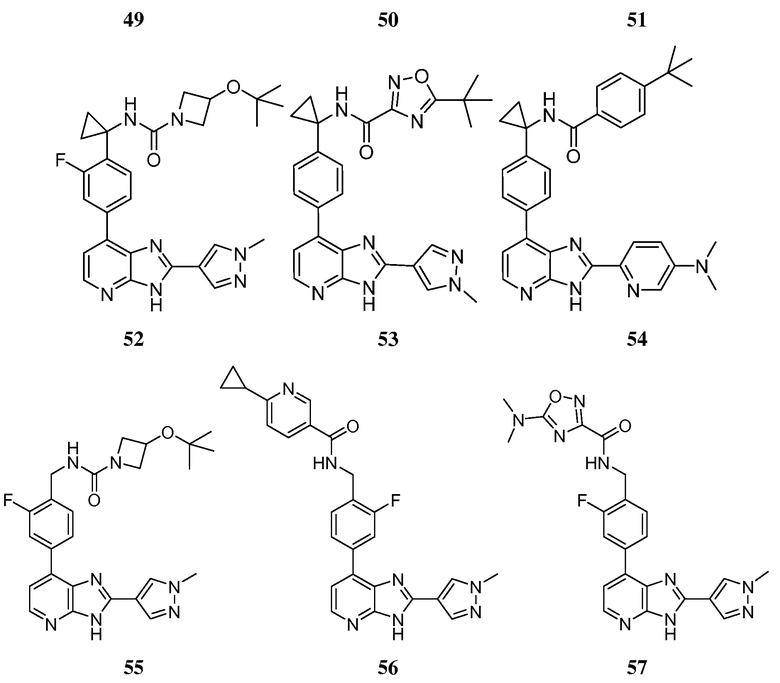
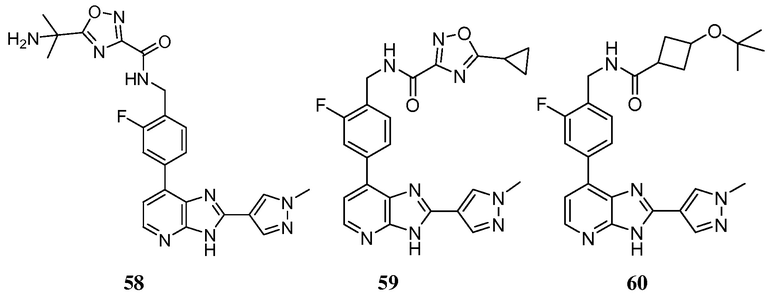
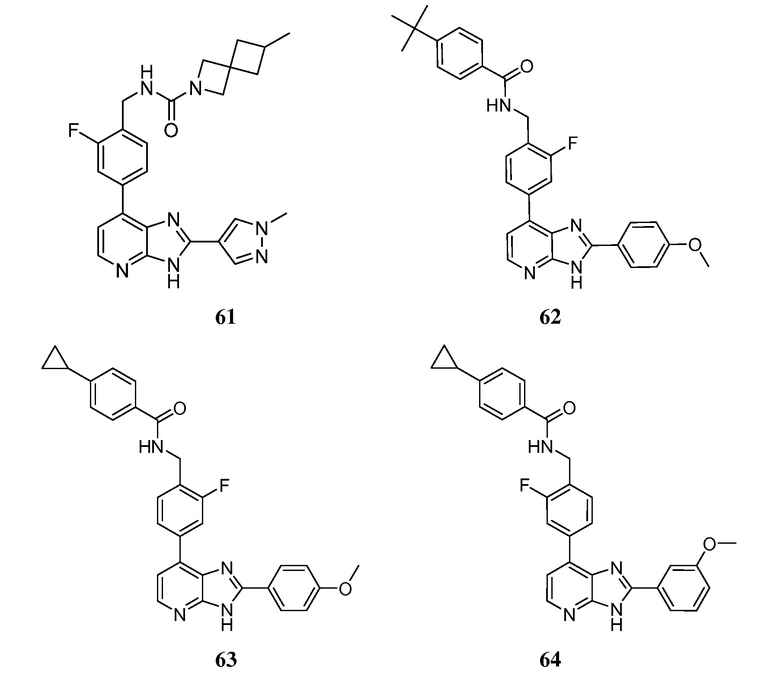
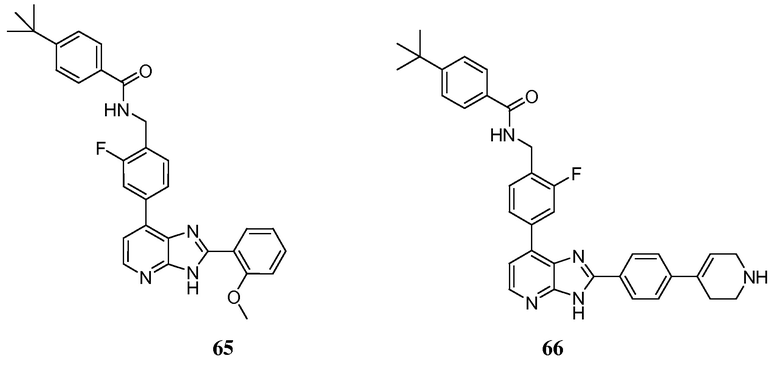
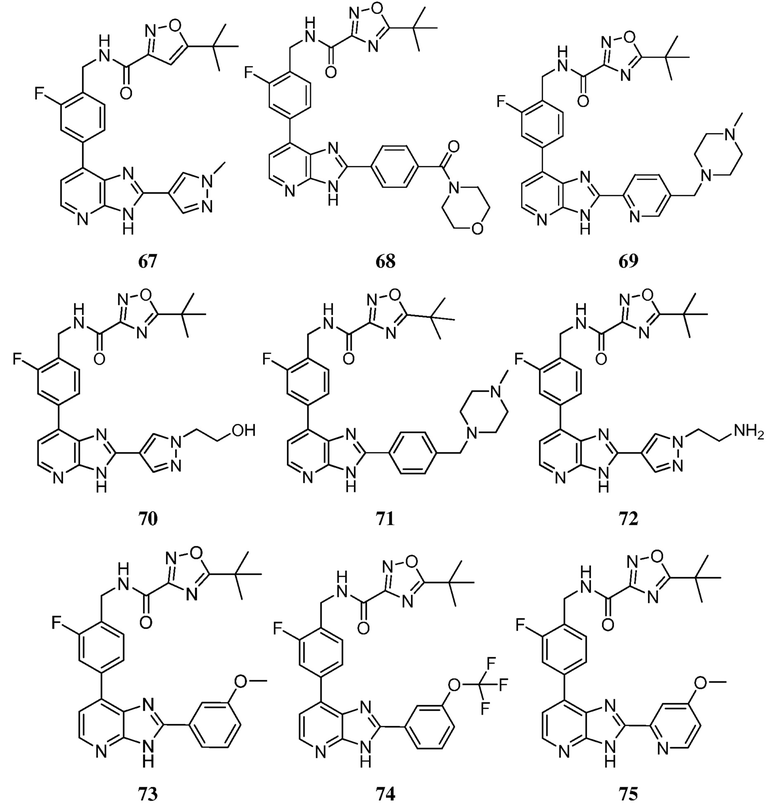
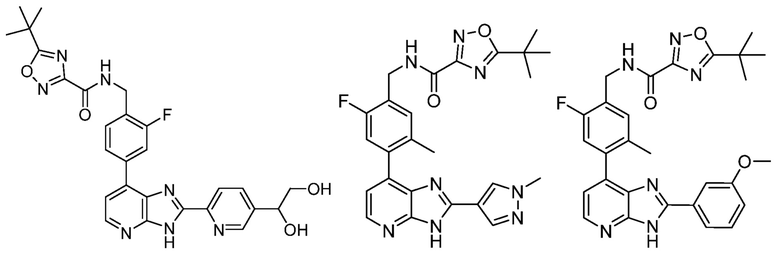
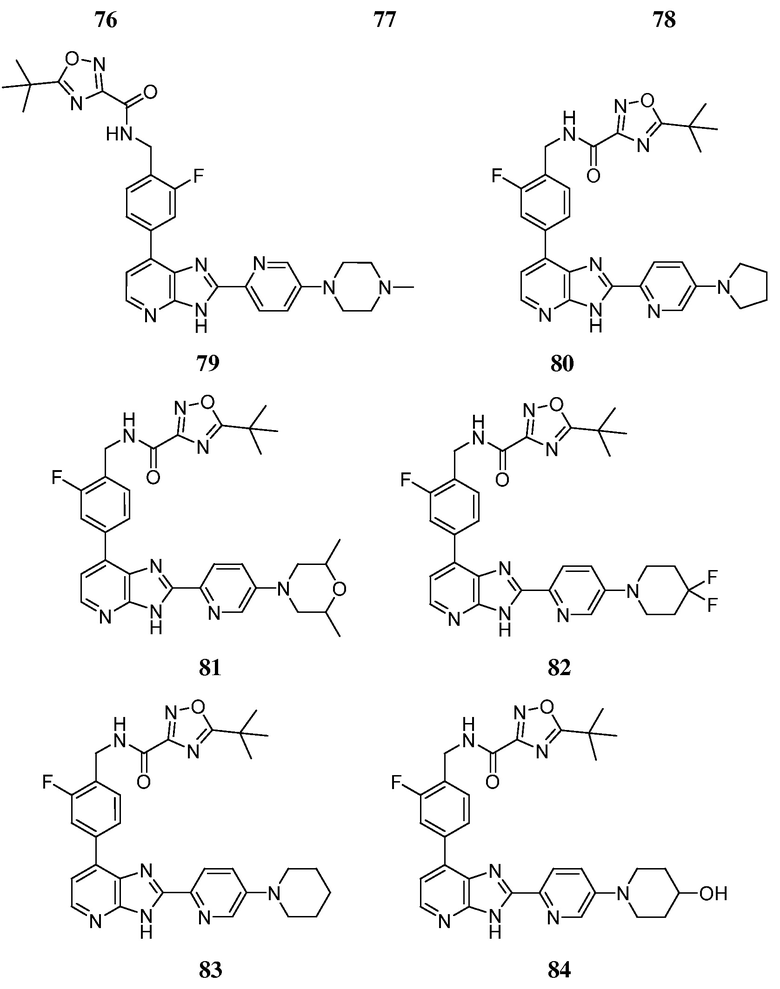
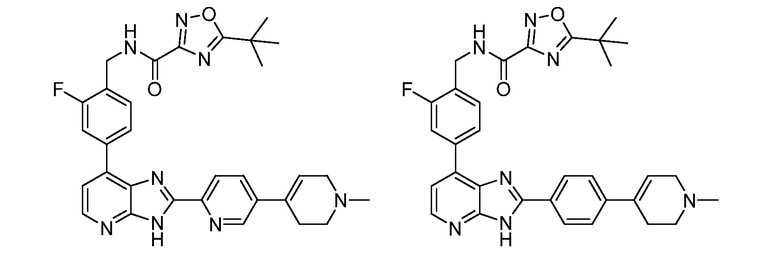
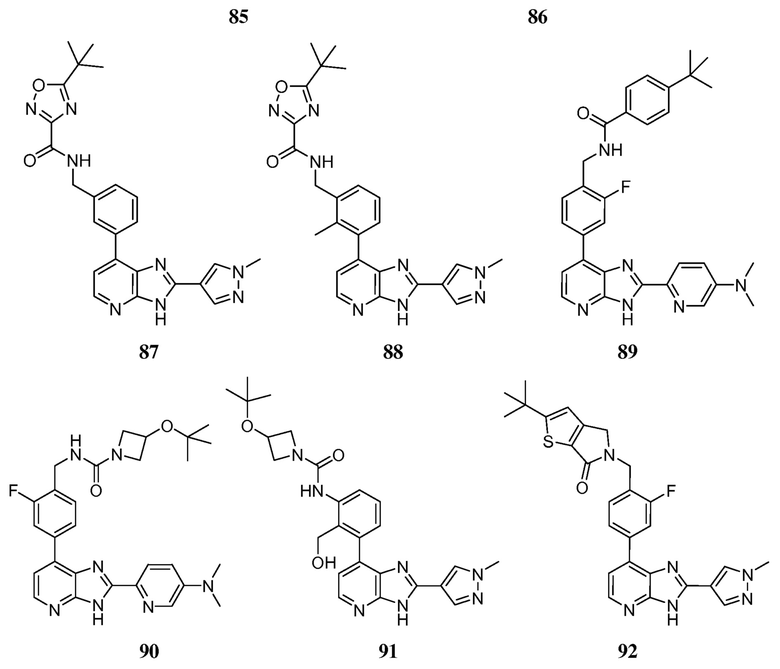
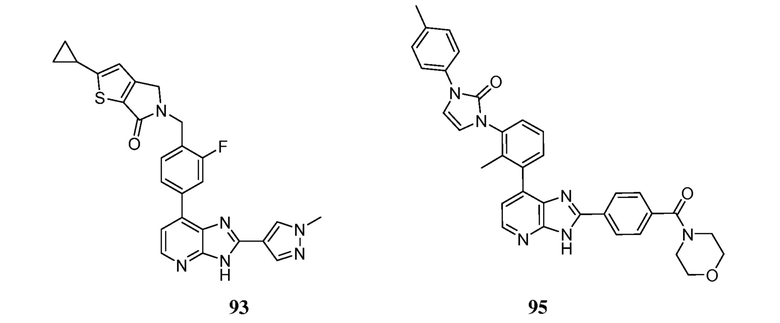
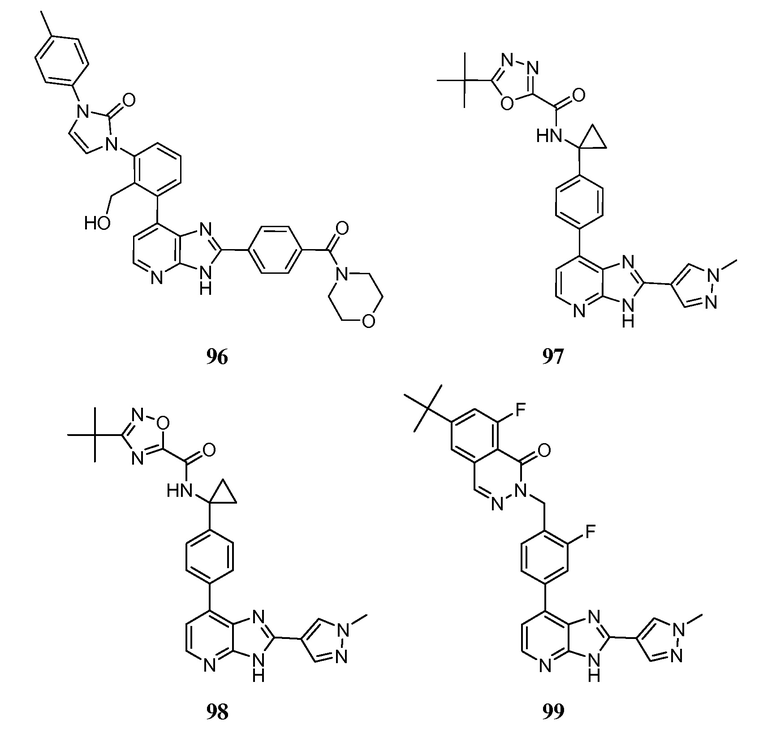
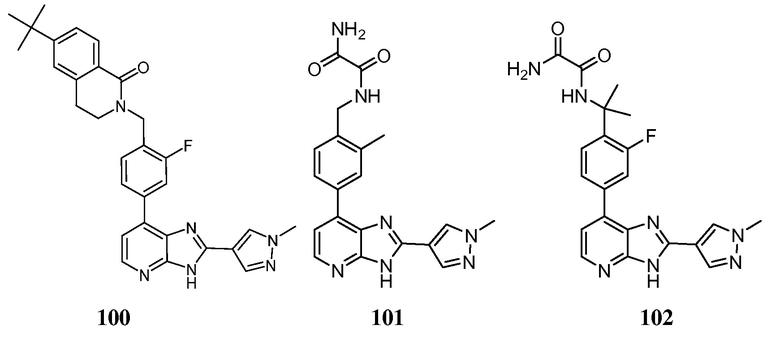
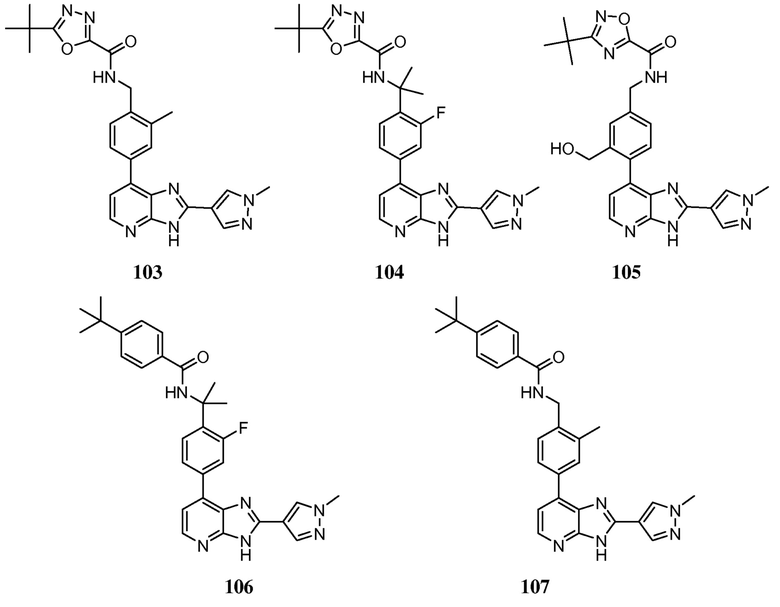
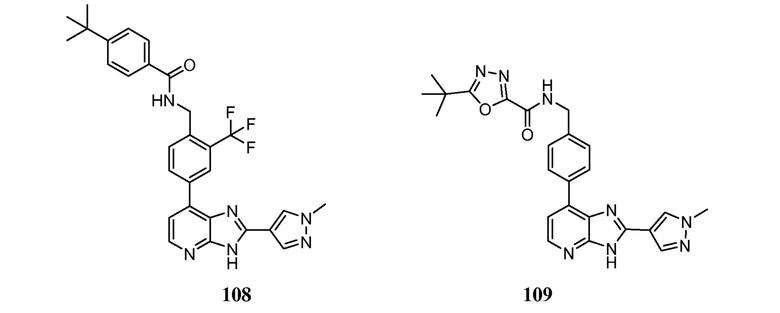
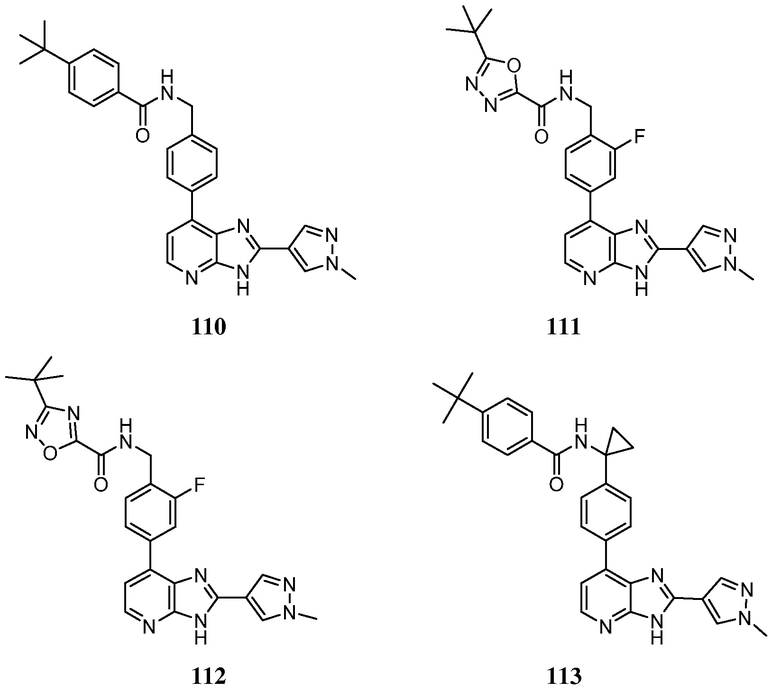
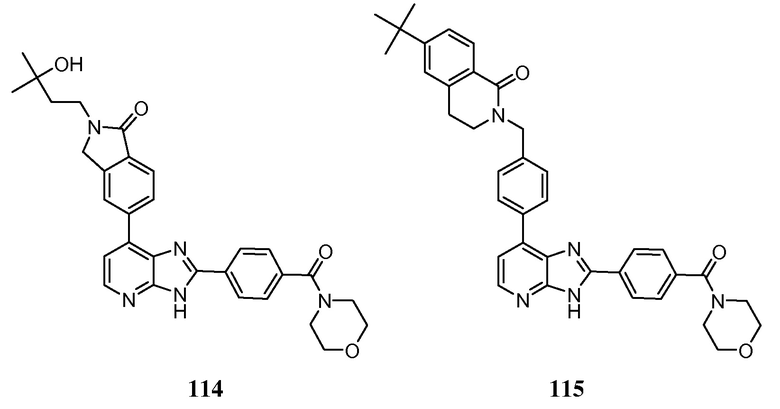
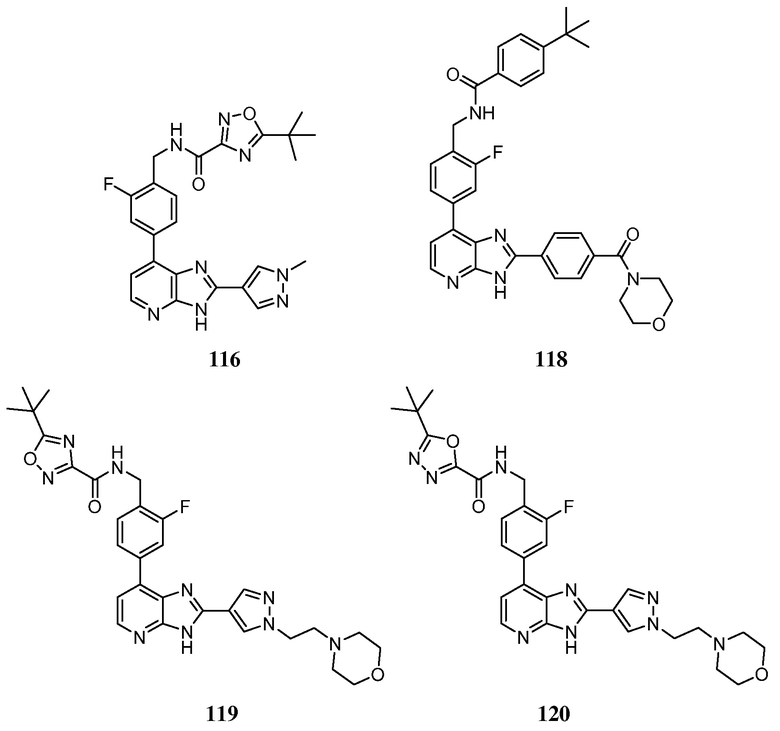
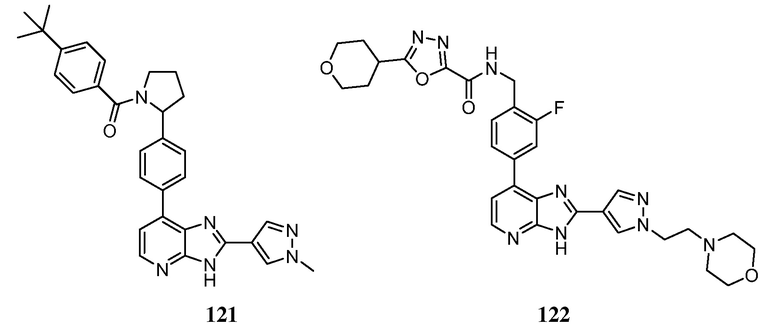
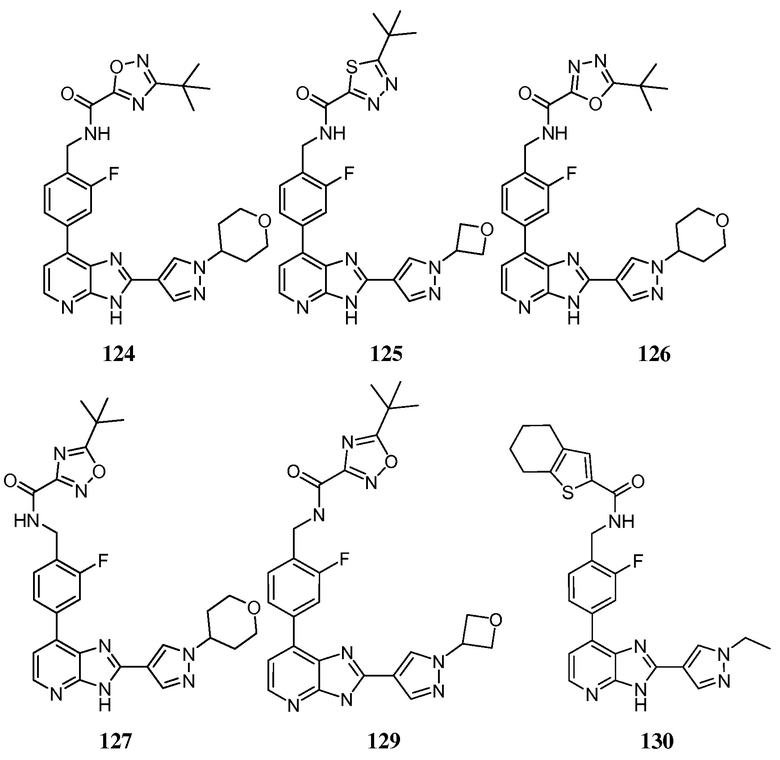
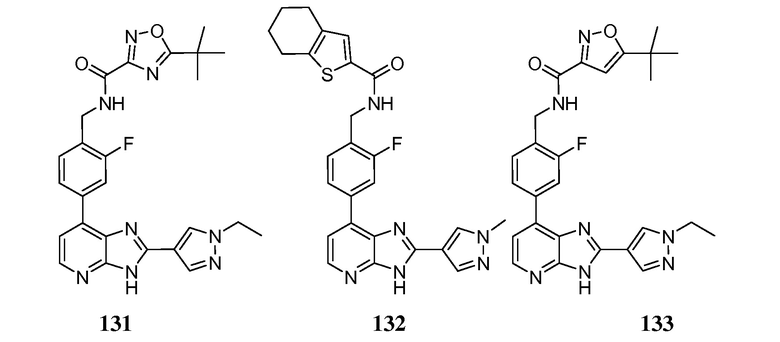
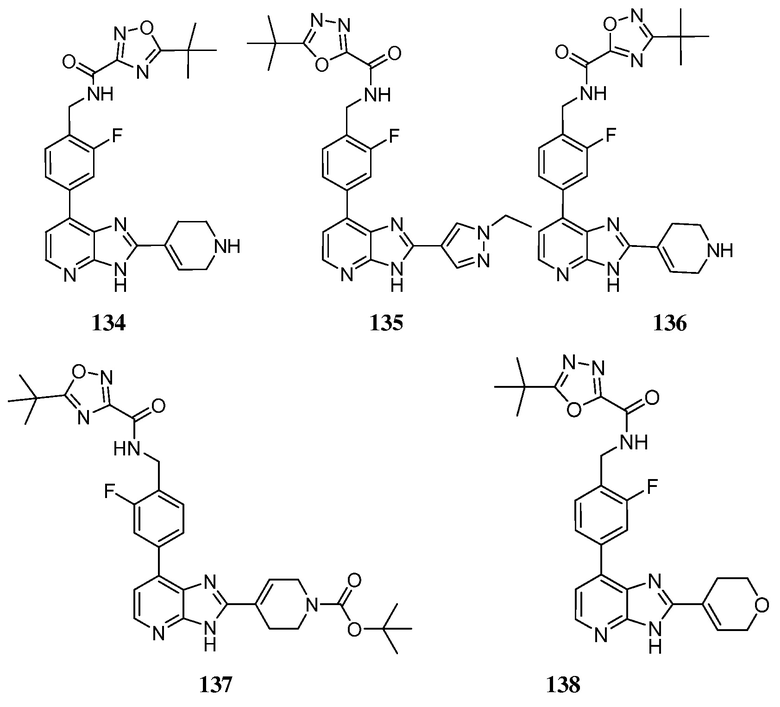
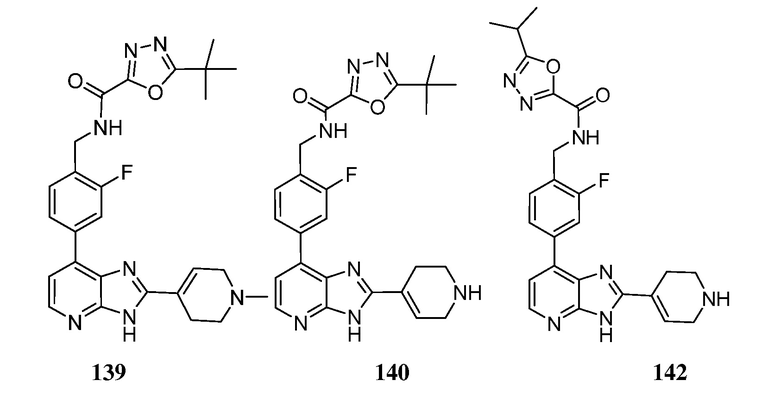

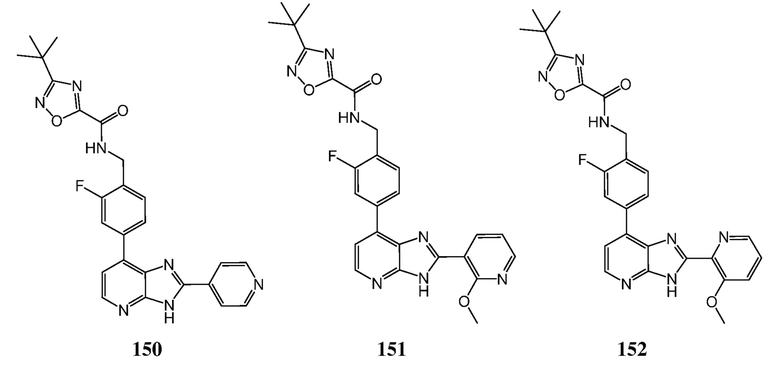
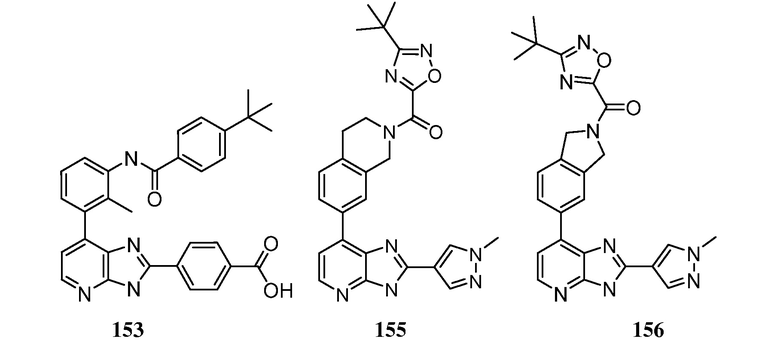
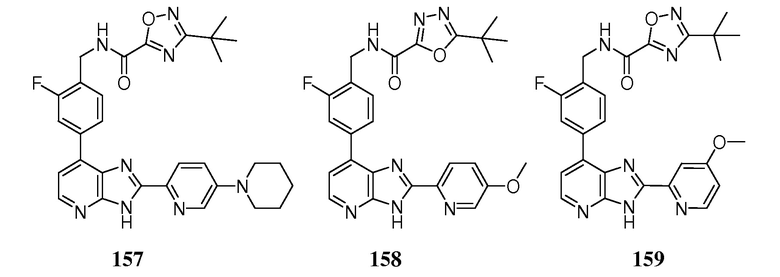
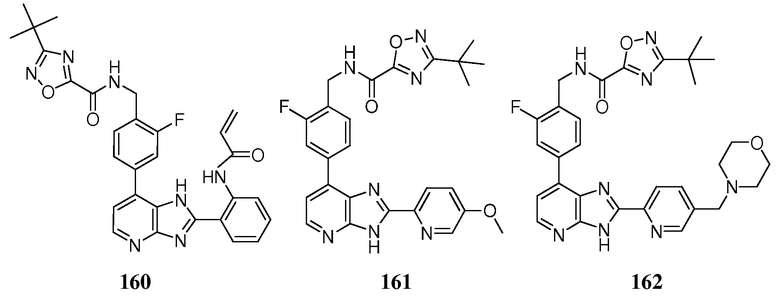
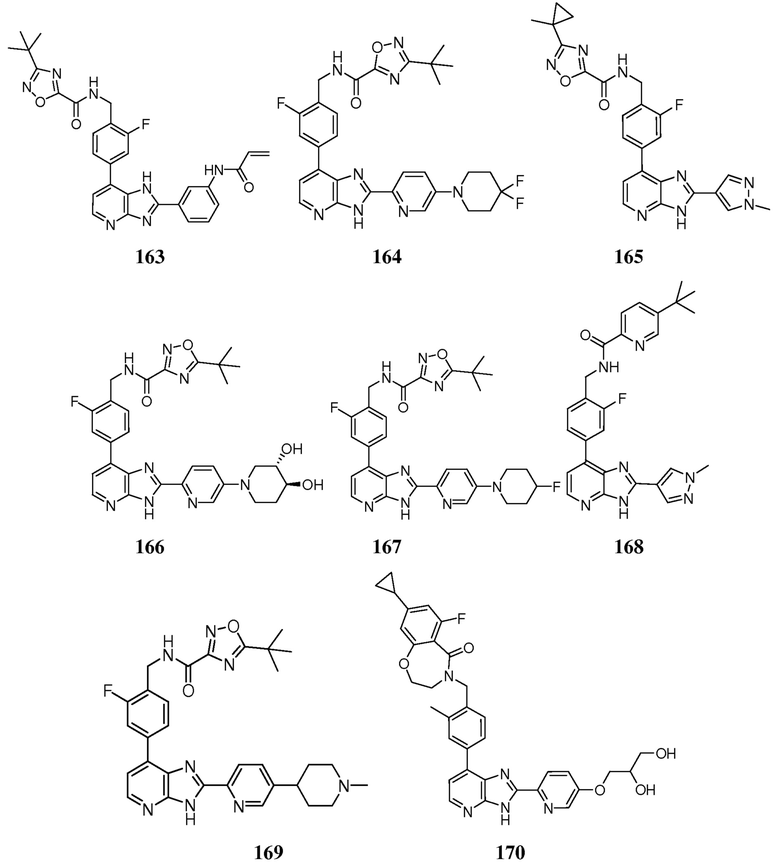
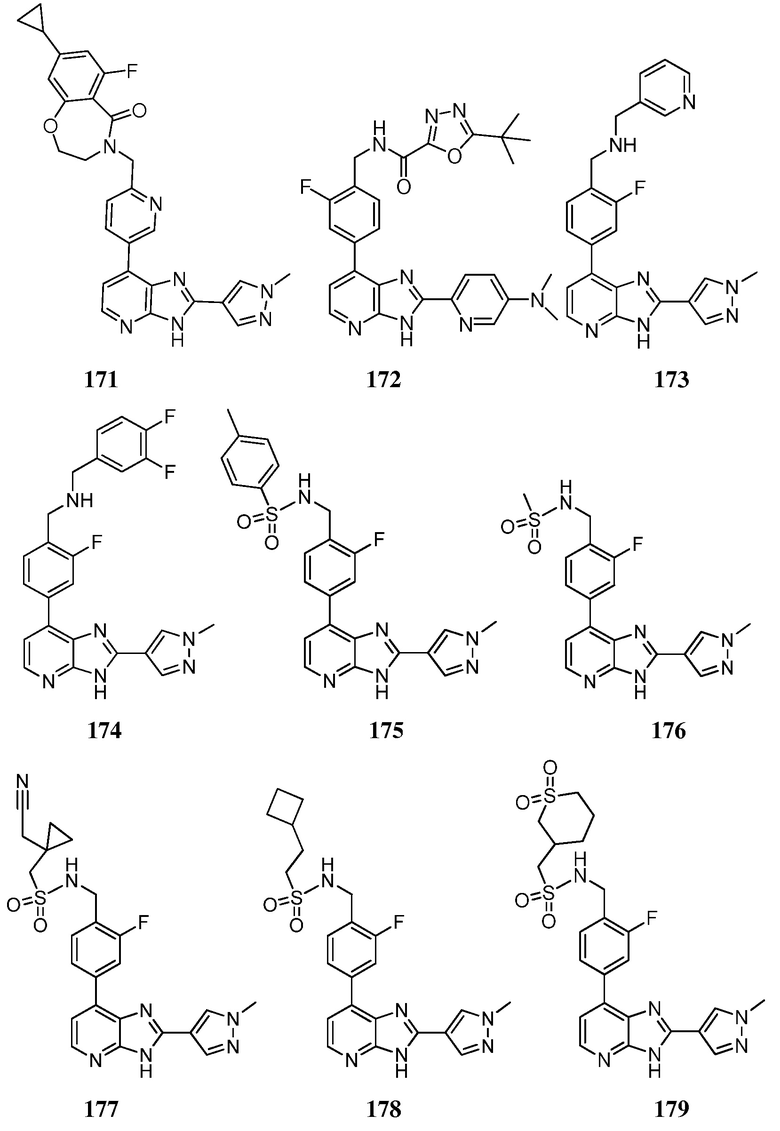
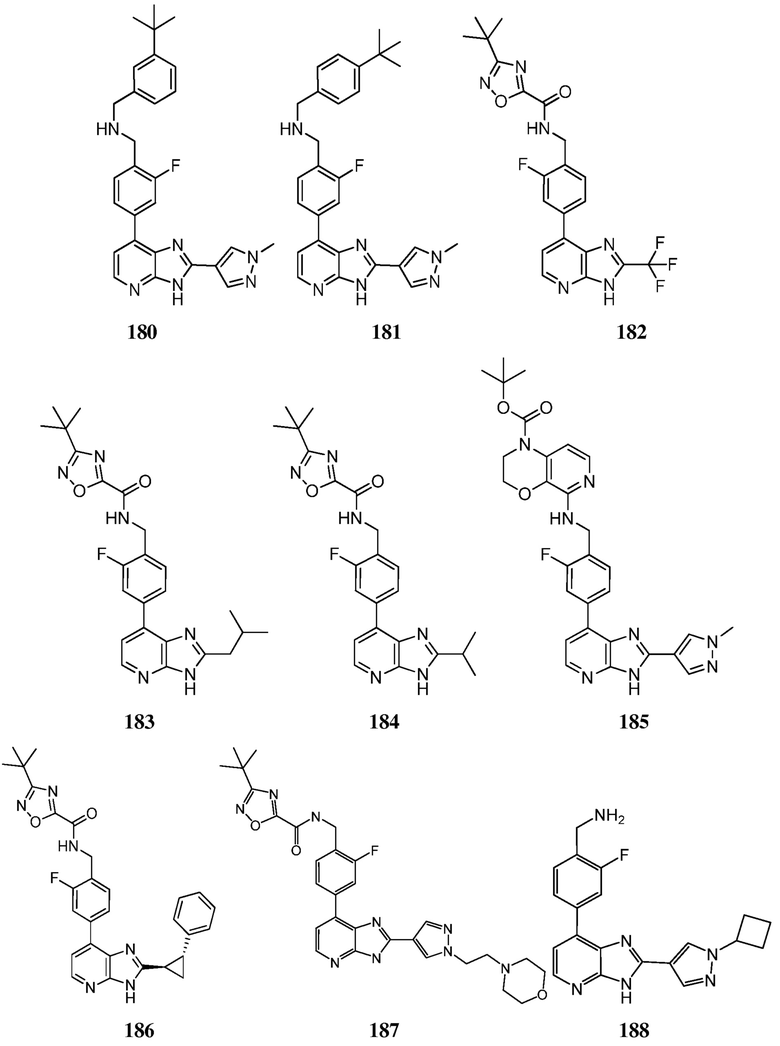
В некоторых вариантах, в данном изобретении представлено соединение, выбранное из изображенных выше, или его фармацевтически приемлемая соль.
Различные структурные изображения могут показывать гетероатом без присоединенной группы, радикала, заряда или противоиона. Специалист в данной области техники сознает, что такие изображения указывают на то, что гетероатом присоединен к водороду (например,  понимается как
понимается как  ).
).
В определенных вариантах, соединения в соответствии с данным изобретением синтезируют в соответствии со схемами, представленными в примерах ниже.
4. Применение, составление и введение
Фармацевтически приемлемые композиции
Согласно другому варианту, в данном изобретении представлена композиция, содержащая соединение в соответствии с данным изобретением или его фармацевтически приемлемое производное и фармацевтически приемлемый носитель, адъювант или наполнитель. Количество соединения в композициях в соответствии с данным изобретением таково, чтобы быть эффективным для измеримого ингибирования ТКБ или ее мутанта, в биологическом образце или у пациента. В определенных вариантах, количество соединения в композициях в соответствии с данным изобретением таково, чтобы быть эффективным для измеримого ингибирования ТКБ или ее мутанта, в биологическом образце или у пациента. В определенных вариантах, композиция в соответствии с данным изобретением составлена для введения пациенту, нуждающемуся в такой композиции.
Термин ʺпациентʺ или ʺсубъектʺ в данном описании означает животное, предпочтительно, млекопитающее, и наиболее предпочтительно, человека.
Термин ʺфармацевтически приемлемый носитель, адъювант или наполнительʺ относится к не токсичному носителю, адъюванту или наполнителю, который не разрушает фармакологическую активность соединения, с которым он смешан. Фармацевтически приемлемые носители, адъюванты или наполнители, которые применяют в композициях в соответствии с данным изобретением, включают, но не ограничены ими, ионообменные вещества, окись алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий альбумин сыворотки, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как сульфат протамина, двузамещенный фосфорнокислый натрий, хлорид натрия, соли цинка, коллоидная двуокись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлоза натрия, полиакрилаты, воски, блоксополимеры полиэтилена-полиоксипропилена, полиэтиленгликоль и ланолин.
ʺФармацевтически приемлемое производноеʺ означает любую не токсичную соль, сложный эфир, соль сложного эфира или другое производное соединения в соответствии с данным изобретением, которое, при введении получателю, способно давать, прямо или косвенно, соединение в соответствии с данным изобретением или его метаболит или остаток, обладающий ингибирующим действием.
Композиции в соответствии с данным изобретением вводят перорально, парентерально, ингаляцией, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин "парентерально" в данном описании включает подкожное, внутривенное, внутримышечное, внутрисуставное, внутрисиновиальное, внутригрудинное, интратекальное, внутрипеченочное, внутриочаговое и внутричерепное введение инъекцией или инфузией. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно. Стерильные формы для инъекций композиций в соответствии с данным изобретением включают водные или масляные суспензии. Эти суспензии составлены по методикам, известным в данной области техники, с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильными препаратами для инъекций также могут быть стерильные впрыскиваемые растворы или суспензии в не токсичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Применяемые носители и растворители включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды.
Для этой цели любое применяемое мягкое нелетучее масло включает синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, применяют для получения препаратов для инъекций в качестве природных фармацевтически приемлемых масел, таких как оливковое масло или касторовое масло, особенно в полиоксиэтилированных вариантах. Такие масляные растворы или суспензии также содержат длинноцепный спиртовой разбавитель или диспергирующий агент, такой как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно применяют для составления фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Другие обычно применяемые поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгирующие агенты или усилители биодоступности, которые обычно применяют в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, также применяются для целей получения композиции.
Фармацевтически приемлемые композиции в соответствии с данным изобретением вводят перорально в любой перорально приемлемой форме. Типовые пероральные лекарственные формы включают капсулы, таблетки, водные суспензии или растворы. Для пероральных таблеток применяемые обычно носители включают лактозу и кукурузный крахмал. Также обычно применяют смазывающие агенты, такие как стеарат магния. Для перорального применения в форме капсул полезные разбавители включают лактозу и высушенный кукурузный крахмал. Если для перорального применения используют водные суспензии, активный ингредиент объединяют с эмульгирующими и суспендирующими агентами. При желании, также необязательно добавляют определенные подсластители, вкусовые или красящие агенты.
Альтернативно, фармацевтически приемлемые композиции в соответствии с данным изобретением вводят в форме суппозиториев для ректального введения. Они могут быть получены смешиванием агента с подходящим не раздражающим наполнителем, который является твердым при комнатной температуре, но становится жидким при температуре в прямой кишке и, следовательно, плавится в прямой кишке с выделением лекарственного средства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтически приемлемые композиции в соответствии с данным изобретением также вводит местно, особенно если цель лечения включает области или органы, легко доступные для местного введения, включая заболевания глаз, кожи или нижнего кишечного тракта. Подходящие местные композиции легко получают для каждого из этих областей или органов.
Местное введение для нижнего кишечного тракта может осуществляться в виде ректального суппозитория (см. выше) или в виде подходящей клизмы. Также применяют местные чрезкожные пластыри.
Для местного введения представленные фармацевтически приемлемые композиции составляют в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Типовые носители для местного введения соединений включают минеральное масло, вазелиновое масло, медицинский вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. Альтернативно, представленные фармацевтически приемлемые композиции могут быть составлены в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителей. Подходящие носители включают, но не ограничены ими, минеральное масло, сорбитанмоностеарат, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Фармацевтически приемлемые композиции в соответствии с данным изобретением необязательно вводят в виде назального аэрозоля или ингаляции. Такие композиции получают методами, хорошо известными в области фармацевтических композиций, и получают в виде растворов в солевом растворе, с применением бензилового спирта или других подходящих консервантов, промоторов абсорбции для улучшения биодоступности, фтороуглеводородов и/или других обычных солюбилизирующих или диспергирующих агентов.
Наиболее предпочтительно, фармацевтически приемлемые композиции в соответствии с данным изобретением составляют для перорального введения. Такие композиции могут вводиться с или без пищи. В некоторых вариантах, фармацевтически приемлемые композиции в соответствии с данным изобретением вводят без пищи. В других вариантах, фармацевтически приемлемые композиции в соответствии с данным изобретением вводят с пищей.
Количество соединения в соответствии с данным изобретением, которое необязательно объединено с носителями для получения композиции в виде стандартной лекарственной формы, изменяется в зависимости от лечимого хозяина, конкретного способа введения. Предпочтительно, представленные композиции должны быть составлены так, чтобы доза составляла около 0,01-100 мг/кг массы тела/сутки соединения, которое может вводиться пациенту, принимающему такие композиции.
Также должно быть понятно, что определенная дозировка и режим приема для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания, время введения, скорость выведения, сочетание лекарственных средств и мнение лечащего врача и тяжесть конкретного лечимого заболевания. Количество соединения в соответствии с данным изобретением в композиции также зависит от конкретного соединения композиции.
Применение соединений и фармацевтически приемлемых композиций
В определенных вариантах, в данном изобретении представлен способ ингибирования ТКБ или ее мутанта у пациента или в биологическом образце, включающий стадию введения указанному пациенту или контакт указанного биологического образца с соединением в соответствии с данным изобретением.
В определенных вариантах, данное изобретение относится к применению соединений в соответствии с данным изобретением и/или их физиологически приемлемых солей для модулирования или ингибирования ТКБ фермента. Термин ʺмодулированиеʺ означает любое изменение медиированной ТКБ трансдукции сигнала, которое основано на действии определенных соединений в соответствии с данным изобретением, способных взаимодействовать с целевой ТКБ так, чтобы сделать возможным распознавание, связывание и активацию. Соединения характеризуют таким высоким сродством с ТКБ, которое обеспечивает надежное связывание ТКБ. В определенных вариантах, вещества являются высоко селективными для ТКБ по сравнению с большинством других киназ для того, чтобы гарантировать исключительное и направленное распознавание с единственной целевой ТКБ. В контексте данного изобретения, термин ʺраспознаваниеʺ - не ограничиваясь ими - относится к любому типу взаимодействия между определенными соединениями и целью, в частности, ковалентному или не ковалентному связыванию или ассоциации, такой как ковалентная связь, гидрофобные/гидрофильные взаимодействия, ванн-дер-ваальсовы силы, r ионные пары, водородные связи, взаимодействия лиганд-рецептор (фермент-ингибитор) и подобные. Такая ассоциация также может охватывать присутствие других молекул, таких как пептиды, белки или нуклеотидные последовательности. Указанное взаимодействие белок/лиганд (фермент-ингибитор) характеризуется высоким сродством, высокой селективностью и минимальное или даже отсутствием перекрестной специфичности к другим целевым молекулам для исключения вредных для здоровья и опасных воздействий на лечимого пациента.
В определенных вариантах, данное изобретение относится к способу ингибирования ТКБ фермента с, по крайней мере, одним соединением формулы (I) в соответствии с данным изобретением и/или его физиологически приемлемых солей, в таких условиях, что указанная ТКБ ингибирована. В определенных вариантах, системой является клеточная система. В других вариантах, системой является in-vitro трансляция, которая основана на синтезе белка без живых клеток. Клеточная система определена как любой субъект, при условии, что субъект содержит клетки. Следовательно, клеточная система может быть выбрана из группы отдельных клеток, клеточных культур, тканей, органов и животных. В определенных вариантах, способ модулирования ТКБ фермента проводят in-vitro. Представленные выше постулаты данного описания, касающиеся соединений формулы (I), включая любые их варианты, действуют и применяются без ограничений к соединениям формулы (I) и их солям, применяемым в способе ингибирования ТКБ. Представленные выше постулаты данного описания, касающиеся соединений формулы (I), включая любые их варианты, действуют и применяются без ограничений к соединениям формулы (I) и их солям, применяемым в способе ингибирования ТКБ.
Пациенты с мутациями в ТКБ имеют основательный блок в развитии B-клетки, что вызывает практически полное отсутствие зрелых B лимфоцитов и клеток плазмы, сильное снижение уровней Ig и основательное ингибирование гуморального ответа для вторичного иммунного ответа антигенов (обзор в Vihinen et al Frontiers in Bioscience 5: d917-928). Мыши с дефицитом ТКБ также имеют пониженное количество периферийных B-клеток и значительно пониженные сывороточные уровни IgM и IgG3. Делеция ТКБ у мышей оказывает сильное действие на пролиферацию B-клетки, вызванное анти-IgM и ингибирует иммунные реакции на тимус-независимые антигены II типа (Ellmeier et al, J Exp Med 192: 1611-1623 (2000)). ТКБ также играет критическую роль в активации мастоцитов через IgE рецептор с высоким сродством (Fc эпсилон RI). ТКБ дефицитные мышиные мастоциты отличаются пониженной дегрануляцией и пониженным производством провоспалительных цитокинов после поперечного сшивания Fc эпсилон RI (Kawakami et al. Journal of Leukocyte Biology 65: 286-290).
Представленные соединения являются ингибиторами ТКБ, следовательно, применяются для лечения одного или более расстройств, связанных с ТКБ. Таким образом, в некоторых вариантах, в данном изобретении представлен способ лечения медиированного ТКБ расстройства, включающий стадию введения пациенту, нуждающемуся в таковом, соединения в соответствии с данным изобретением или его фармацевтически приемлемой композиции.
В данном описании, термин "медиированные ТКБ" расстройства или состояния, в данном описании, означает любое заболевание или другое вредное состояние, в котором, как известно, ТКБ или ее мутант играет роль. Следовательно, в другом варианте данное изобретение относится к лечению или облегчению тяжести одного или более заболеваний, в которых, как известно, ТКБ или ее мутант играет роль. Более конкретно, данное изобретение относится к способу лечения или облегчения тяжести заболевания или состояния, выбранного из пролиферативного расстройства или аутоиммунного расстройства, где указанный способ включает введение пациенту, нуждающемуся в таковом, соединения или композиции в соответствии с данным изобретением.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ. В некоторых вариантах, заболеванием или состоянием является аутоиммунное заболевание, например, воспалительная болезнь толстой кишки, артрит, системная красная волчанка (СКВ или волчанка), волчаночный нефрит, васкулит, идиопатическая тромбоцитопеническая пурпура (ИТП), ревматоидный артрит (РА), псориазный артрит, остеоартрит, болезнь Стилла, ювенильный артрит, диабет, тяжелая псевдопаралитическая миастения, аутоиммунный тиреоидит, атрофическая форма аутоиммунного тиреоидита, диффузный тиреотоксический зоб, аутоиммунный тиреоидит, сухой кератоконъюнктивит, рассеянный склероз (РС), системный склероз, нейроборрелиоз Лайма, острый первичный идиопатический полирадикулоневрит, острый рассеянный энцефаломиелит, хронический гипокортикоидизм, опсо-миоклональный синдром, анкилозирующий спондилез, антифосфолипидный синдром, апластическая анемия, аутоиммунный гепатит, аутоиммунный гастрит, пернициозная анемия, целиакия, синдром Гудпасчера, идиопатическая тромбоцитопеническая пурпура, неврит зрительного нерва, склеродермия, первичный билиарный цирроз печени, синдром Рейтера, неспецифический аортоартериит, височный артериит, теплая аутоиммунная гемолитическая анемия, некротический неинфекционный гранулематоз, псориаз, общая алопеция, болезнь Бехчета, хроническая усталость, вегетативная дистония, оболочечная гломерулонефропатия, эндометриоз, интерстициальный цистит, пузырчатка обыкновенная, буллезный пемфигоид, нейромиотония, склеродермия или вульводиния. В определенных вариантах, заболеванием или состоянием является системная красная волчанка (СКВ или волчанка) или волчаночный нефрит. В определенных вариантах, заболеванием или состоянием является РА. В определенных вариантах, заболеванием или состоянием является РС.
В некоторых вариантах, заболеванием или состоянием является гиперпролиферативное заболевание или иммунологически медиированные заболевания, включая отторжение трансплантированных органов или тканей и синдром приобретенного иммунодефицита (СПИД, также известный как ВИЧ).
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, где заболевание или состояние выбирают из гетероиммунных состояний или заболеваний, которые включают, но не ограничены ими, болезнь «трансплантат против хозяина», трансплантацию, трансфузию, анафилактический шок, аллергии (например, аллергии на пыльцу растений, латекс, лекарственные средства, пищу, яды насекомых, шерсть животных, перхоть животных, пылевых клещей или чашечки тараканов), гиперчувствительность I типа, аллергический конъюнктивит, аллергический ринит и атопический дерматит.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, где заболевание или состояние выбирают из воспалительного заболевания, например, астмы, аппендицита, атопического дерматита, астмы, аллергии, блефарита, бронхиолита, бронхита, бурсита, цервицита, холангита, холецистита, хронического отторжения трансплантата, колита, конъюнктивита, болезни Крона, цистита, дакриоаденита, дерматита, дерматомиозита, энцефалита, эндокардита, эндометрита, энтерита, энтероколита, эпикондилита, эпидидимита, фасцита, фиброза, гастрита, гастроэнтерита, пурпура Шенлейна-Геноха, гепатита, гнойного гидраденита, IgА нефропатии, интерстициальной легочной болезни, ларингита, мастита, менингита, миелита, миокардита, нефрита, оофорита, орхита, остита, отита, панкреатита, паротита, перикардита, перитонита, фарингита, плеврита, флебита, пневмонита, пневмонии, полимиозита, проктита, простатита, пиелонефрита, ринита, сальпингита, синусита, стоматита, синовиита, тендинита, тонзиллита, язвенного колита, увеита, вагинита, васкулита или вульвита.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, где заболеванием или состоянием является рак. В одном варианте, раком является пролиферативное расстройство B-клетки, например, диффузная В-крупноклеточная лимфома, фолликулярная лимфома, хроническая лимфоцитарная лимфома, хронический лимфоцитарный лейкоз, острый лимфоцитарный лейкоз, В-клеточный пролимфоцитарный лейкоз, лимфоплазматическая лимфома/макроглобулинемия Вальденстрема, лимфома маргинальной зоны селезенки, множественная миелома (также известная как миелома клеток плазмы), неходжкинская лимфома, лимфома Ходжкина, плазмоцитома, экстранодальная В-клеточная лимфома из клеток маргинальной зоны, узловая В-клеточная лимфома из клеток маргинальной зоны, мантийноклеточная лимфома, медиастинальная (тимусная) В-крупноклеточная лимфома, внутрисосудистая В-крупноклеточная лимфома, первичная эффузионная лимфома, лимфома Беркитта/лейкоз или лимфоматоидный гранулематоз. В некоторых вариантах, раком является рак молочной железы, рак предстательной железы или рак мастоцитов (например, мастоцитома, тучноклеточный лейкоз, тучноклеточная саркома, системный мастоцитоз). В одном варианте, раком является рак кости. В другом варианте, раком имеет другое первичное происхождение и дает метастазы в кость. В определенных вариантах, раком является рак прямой и ободочной кишки или рак поджелудочной железы.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, включая заболевания костей и суставов, включая, без ограничений, ревматоидный артрит, серонегативные спондилоартропатии (включая анкилозирующий спондилит, псориазный артрит и синдром Рейтера), синдром Бехчета, сухой кератоконъюнктивит, системный склероз, остеопороз, рак кости и метастазы в кости.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, где болезнь или состояние выбирают из тромбоэмболического расстройства или сердечнососудистого расстройства, например, инфаркта миокарда, стенокардии, реокклюзии после ангиопластики, рестеноза после ангиопластики, реокклюзии после аортокоронарного шунтирования, рестеноза после аортокоронарного шунтирования, удара, преходящей ишемии, окклюзионного расстройства артериальной периферии, легочной эмболии или тромбоза глубоких вен. В определенных вариантах, в данном изобретении представлен антиромботический агент, так как Btk также вовлечена в активацию тромбоцитов.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, включая инфекционные и не инфекционные воспалительные события и аутоиммунные и другие воспалительные заболевания. Такие аутоиммунные и воспалительные заболевания, расстройства и синдромы включают воспаление таза, уретрит, солнечный ожог кожи, синусит, пневмонию, энцефалит, менингит, миокардит, нефрит, остеомиелит, миозит, гепатит, гастрит, энтерит, дерматит, гингивит, аппендицит, панкреатит, холецистит, агаммаглобулинемию, псориаз, аллергию, болезнь Крона, синдром раздраженной толстой кишки, неспецифический язвенный колит, синдром Сегрена, отторжение тканевых трансплантатов, чрезмерное отторжение трансплантированных органов, астму, аллергический ринит, хроническую обструктивную болезнь легких (ХОБЛ), аутоиммунную полигландулярную болезнь (также известную как аутоиммунный полигландулярный синдром), аутоиммунную алопецию, пернициозную анемию, гломерулонефрит, дерматомиозит, рассеянный склероз, склеродермию, васкулит, аутоиммунные гемолитические и тромбоцитопенические состояния, синдром Гудпасчера, атеросклероз, болезнь Аддисона, болезнь Паркинсона, болезнь Альцгеймера, диабет, септический шок, системную красную волчанку (СКВ), ревматоидный артрит, псориатический артрит, артрит, ювенильный артрит, остеоартрит, хроническую идиопатическую тромбоцитопеническую пурпуру, макроглобулинемию Вальденстрема, миастению, тиреоидит Хашимото, атопический дерматит, дегенеративное заболевание суставов, витилиго, аутоиммунный гипопитуитаризм, синдром Гийена-Барре, болезнь Бехчета, склеродермию, грибковые микозы, острые воспалительные реакции (такие как острый респираторный дистресс-синдром и ишемическое/реперфузионное повреждение) и болезнь Грейвса. В определенных вариантах диабетом является диабет I типа.
В некоторых вариантах, в данном изобретении представлен способ лечения или облегчения тяжести одного или более заболеваний и состояний, связанных с ТКБ, выбранных из ревматоидного артрита, рассеянного склероза, B-клеточного хронического лимфоцитарного лейкоза, острого лимфоцитарного лейкоза, лейкоза ворсистых клеток, неходжкинской лимфомы, лимфомы Ходжкина, множественной миеломы, рака кости, метастазов в кость, остеопороза, диабета (например, диабета I типа), синдрома раздраженной толстой кишки, болезни Крона, волчанки и трансплантата почки.
Другим объектом данного изобретения является получение способа лечения заболеваний, которые вызваны, медиированы и/или репродуцированы активностью ТКБ, где, по крайней мере, одно соединение формулы (I) в соответствии с данным изобретением и/или его физиологически приемлемые соли вводят млекопитающему, нуждающемуся в таком лечении. В определенных вариантах, в изобретении представлен способ лечения волчанки, где, по крайней мере, одно соединение формулы (I) в соответствии с данным изобретением и/или его физиологически приемлемые соли вводят млекопитающему, нуждающемуся в таком лечении. В определенных вариантах, соединение вводят в эффективном количестве, как определено выше. В определенных вариантах, лечением является пероральное введение.
Способ в соответствии с данным изобретением может проводиться in-vitro или in-vivo. Подверженность конкретной клетки лечению соединениями в соответствии с данным изобретением может быть в частности определена in-vitro тестами, в курсе исследования или при клиническом применении. Обычно культуру клетки объединяют с соединением в соответствии с данным изобретением в различных концентрациях в течение определенного периода времени, которое достаточно для того, чтобы позволить активным агентам ингибировать активность ТКБ, обычно от около одного часа до одной недели. In-vitro обработка может проводиться с применением культивированных клеток из образца, взятого биопсией, или колонии клеток.
Хозяин или пациент может принадлежать к любому виду млекопитающих, например, к приматам, в частности, человеку; грызунам, включая мышей, крыс и хомяков; кроликам; лошадям, коровам, собакам, кошкам и т.д. Животные модели представляют интерес для экспериментальных исследований, давая модель для лечения человеческих заболеваний.
Для идентификации пути трансдукции сигнала и для определения взаимодействий между различными путями трансдукции сигнала различные ученые разработали подходящие модели или модельные системы, например, модели культуры клеток и модели трансгенных животных. Для определения определенных стадий в каскаде трансдукции сигнала, взаимодействующие соединения могут применяться для модулирования сигнала. Соединения в соответствии с данным изобретением также могут применяться в качестве реагентов для тестирования ТКБ-зависимых путей трансдукции сигнала у животных и/или в моделях клеточной культуры или в клинических заболеваниях, указанных в данной заявке.
Более того, представленные ниже постулаты данного описания, касающиеся применения соединений формулы (I) и ее производных для производства лекарственного средства для профилактического или терапевтического лечения и/или отслеживания, считаются действующими и применимыми без ограничений для применения соединения для ингибирования активности ТКБ, если это полезно.
Изобретение также относится к применению соединений формулы (I) и/или их физиологически приемлемых солей для профилактического или терапевтического лечения и/или отслеживания заболеваний, которые вызываются, медиируются и/или репродуцируются активностью ТКБ. Более того, изобретение относится к применению соединений формулы (I) и/или их физиологически приемлемых солей для производства лекарственного средства для профилактического или терапевтического лечения и/или отслеживания заболеваний, которые вызываются, медиируются и/или репродуцируются активностью ТКБ. В определенных вариантах, в изобретении представлено применение соединения формулы I или его физиологически приемлемой соли для производства лекарственного средства для профилактического или терапевтического лечения медиированных ТКБ расстройств.
Соединения формулы (I) и/или их физиологические приемлемая соль может применяться в качестве промежуточного соединения для получения других лекарственных активных ингредиентов. Лекарственное средство, предпочтительно, получают не химическим способом, например, объединением активного ингредиента с, по крайней мере, одним твердым, жидким и/или полужидким носителем или наполнителем и, необязательно, в сочетании с одним или более другими активными веществами в подходящей лекарственной форме.
Другим объектом данного изобретения являются соединения формулы (I) в соответствии с данным изобретением и/или их физиологически приемлемые соли для применения в профилактическом или терапевтическом лечении и/или отслеживании заболеваний, которые вызываются, медиируются и/или репродуцируются активностью ТКБ. Другим предпочтительным объектом изобретения являются соединения формулы (I) в соответствии с данным изобретением и/или их физиологически приемлемые соли для применения в профилактическом или терапевтическом лечении и/или отслеживании волчанки. Представленные выше постулаты данного описания, относящиеся к соединениям формулы (I), включая любые ее предпочтительные варианты, действительны и применимы без ограничений к соединениям формулы (I) и их солям для применения в профилактическом или терапевтическом лечении и/или отслеживании волчанки.
Соединения формулы (I) в соответствии с данным изобретением могут вводиться до или после наступления заболевания, один или несколько раз, действуя в качестве терапии. Указанные выше соединения и медицинские продукты, применяемые в соответствии с данным изобретением, особенно полезны для терапевтического лечения. Терапевтически релевантное действие облегчает до некоторой степени один или более симптомов расстройства, или возвращает к нормальному состоянию, частично или полностью, один или более физиологических или биохимических параметров, связанных с, или являющихся причиной заболевания или патологического состояния. Отслеживание является вариантом лечения при условии, что соединения вводят через определенные интервалы времени, например, для усиления реакции и уничтожения патогенов и/или симптомов заболевания полностью. Могут применяться одинаковые соединения или разные соединения. Способы в соответствии с данным изобретением также могут применяться для снижения вероятности развития расстройства или даже предотвращения инициации расстройств, связанных с активностью ТКБ заранее, или для лечения появляющихся и продолжающихся симптомов.
В данном изобретении профилактическое лечение желательно, если пациент обладает любыми предварительными условиями для указанных выше физиологических или патологических состояний, такими как наследственная предрасположенность, генетический дефект или недолеченное ранее заболевание.
Данное изобретение также относится к лекарственному средству, содержащему, по крайней мере, одно соединение в соответствии с данным изобретением и/или его фармацевтически применимые производные, соли, сольваты и стереоизомеры, включая их смеси во всех пропорциях. В определенных вариантах, изобретение относится к лекарственному средству, содержащему, по крайней мере, одно соединение в соответствии с данным изобретением и/или его физиологически приемлемую соль.
ʺЛекарственным средствомʺ в данном изобретении является любой агент в области медицины, который содержит одно или более соединений формулы (I) или их препаратов (например, фармацевтическую композицию или фармацевтический состав), и может применяться для профилактики, терапии, последующего врачебного наблюдения или реабилитации пациентов, которые страдают от заболеваний, которые связаны с активностью ТКБ, так, чтобы патогенная модификация их общего состояния или состояния определенных областей организма могла быть установлена, по крайней мере, временно.
В различных вариантах, активный ингредиент может вводиться отдельно или в сочетании с другими способами лечения. Синергетический эффект может быть достигнут применением более одного соединения в фармацевтической композиции, т.е. соединение формулы (I) объединяют с, по крайней мере, другим агентом в качестве активного ингредиента, который является либо другим соединения формулы (I), либо соединением с другой структурной матрицей. Активные ингредиенты могут применяться одновременно или последовательно.
В данную заявку включены способы лечения, в которых, по крайней мере, одно химическое соединение, представленное здесь, вводят в сочетании с противовоспалительным агентом. Противовоспалительные агенты включают, но не ограничены ими, НПВП, не специфические и COX-2 специфические ингибиторы фермента циклооксигеназы, соединения золота, кортикостероиды, метотрексат, антагонисты фактора некроза опухоли (ФНО), иммунодепрессанты и метотрексат.
Примеры НПВП включают, но не ограничены ими, ибупрофен, флурбипрофен, напроксен и напроксен натрий, диклофенак, сочетания диклофенака натрия и мизопростола, сулиндак, оксапрозин, дифлунизал, пироксикам, индометацин, этодолак, фенопрофен кальций, кетопрофен, набуметон натрия, сульфасалазин, толметин натрий и гидроксихлорохин. Примеры НПВП также включают специфические ингибиторы СОХ-2, такие как целекоксиб, валдекоксиб, люмиракоксиб и/или эторикоксиб.
В некоторых вариантах, противовоспалительным агентом является салицилат. Салицилаты включают, но не ограничены ими, ацетилсалициловую кислоту или аспирин, салицилат натрия и холин и салицилаты магния.
Противовоспалительным агентом также может быть кортикостероид. Например, кортикостероидом может быть кортизон, дексаметазон, метилпреднизолон, преднизолон, фосфат натрия преднизолона или преднизон.
В дополнительных вариантах противовоспалительным агентом является соединение золота, такое как тиомалат натрия золота или ауранофин.
Изобретение также включает варианты, в которых противовоспалительным агентом является метаболический ингибитор, такой как ингибитор дигидрофолатредуктазы, такой как метотрексат, или ингибитор дигидрооротатдегидрогеназы, такой как лефлуномид.
Другие варианты данного изобретения относятся к сочетаниям, в которых, по крайней мере, одним противовоспалительным соединением является анти-моноклональное антитело (такое как экулизумаб или пекселизумаб), антагонист ФНО, такой как энтанерцепт или инфликсимаб, который является анти-ФНО альфа моноклональным антителом.
Другие варианты данного изобретения относятся к сочетаниям, в которых, по крайней мере, одним активным агентом является иммунодепрессант, выбранный из метотрексата, лефлуномида, циклоспорина, такролимуса, азатиоприна и микофенолат мофетила.
B-клетки и предшественники B-клеток, экспрессирующие ТКБ, вовлечены в патологию злокачественных образований B-клетки, включая, но не ограничиваясь ими, B-клеточную лимфому, лимфому (включая ходжкинскую и не ходжкинскую лимфому), лимфому волосистых клеток, множественную миелому, хронический и острый миелогенный лейкоз и хронический и острый лимфоцитарный лейкоз.
Было показано, что ТКБ является ингибитором смерти Fas/APO-1 (CD-95), включая сигнальный комплекс (DISC) в B-клеточных лимфоидных клетках. Судьба клеток лейкоза/лимфомы может заключаться в балансе между противодействующими проапоптозным действием каспаз, активированных DISC, и восходящим анти-апоптозным регулирующим механизмом, вовлекающим ТКБ и/или ее субстраты (Vassilev et al., J. Biol. Chem. 1998, 274, 1646-1656).
Также было обнаружено, что ингибиторы ТКБ применяются в качестве хемосенсибилизирующих агентов и, таким образом, применяются в сочетании с другими химиотерапевтическими лекарственными средствами, в частности, лекарственными средствами, которые вызывают апопотоз. Примеры других химиотерапевтических лекарственных средств, которые могут применяться в сочетании с хемосенсибилизирующими ингибиторами ТКБ, включают ингибиторы топоизомеразы I (камптотецин или топотекан), ингибиторы топоизомеразы II (например, дауномицин и этопозид), алкилирующие агенты (например, циклофосфамид, мелфалан и BCNU), агенты, направленные на тубулин (например, таксол и винбластин) и биологические агенты (например, антитела, такие как анти CD20 антитело, IDEC 8, иммунотоксины и цитокины).
Описанные соединения формулы I могут вводиться в сочетании с другими известными терапевтическими агентами, включая противораковые агенты. В данном описании, термин "противораковый агент" относится к любому агенту, который вводят пациенту, страдающему раком, для целей лечения рака.
Определенное выше противораковое лечение может применяться в виде монотерапии или может включать, в дополнение к описанным здесь соединениям формулы I, обычную хирургию или радиотерапию или медицинскую терапию. Такая медицинская терапия, например, химиотерапия или целевая терапия, может включать один или более, но, предпочтительно, один из следующих противораковых агентов:
Алкилирующие агенты: такие как альтретамин, бендамустин, бусульфан, кармустин, хлорамбуцил, хлорметин, циклофосфамид, дакарбазин, ифосфамид, импросульфан, тозилат, ломустин, мелфалан, митобронит, митолактол, нимустин, ранимустин, темозоломид, тиотепа, треосульфан, мехлорэтамин, карбоквон; апазиккон, фотемустин, глуфосфамид, палифосфамид, пипроброман, трофосфамид, урамустин, TH-3024, VAL-0834;
Соединения платины: такие как карбоплатин, цисплатин, эптаплатин, гидрат мирилаплатина, оксалиплатин, лобаплатин, недестатин, пикоклатин, сатраплатин; лобаплатин, недаплатин, пикоклатин, сатраплатин;
Агенты, изменяющие ДНК: такие как амрубицин, бисантрен, децитабин, митоксантрон, прокарбазин, трабектин, клофарабин; амсакрин, бросталлицин, пиксантрон, ларомустин1,3;
Ингибиторы топоизомеразы: такие как этопозид, иринотекан, разоксан, собузоксан, тенипозид, топотекан; амонафид, белотекан, ацетат эллиптина, ворелоксин;
Модификаторы микротрубочек: такие как кабазитаксел, доцетаксел, эрибулин, иксабепилон, паклитаксел, винбластин, винкристин, винорелбин, виндезин, винфлунин; фосбретабулин, тезетаксел;
Антиметаболиты: такие как аспарагиназа3, азацитидин, левофолинат кальция, капецитабин, кладрибин, цитарабин, эноцитабин, флоксуридин, флударабин, фторурацил, гемцитабин, меркаптопурин, метотрексат, неларабин, пеметрексед, пралатрексат, азатиоприн, тиогуанин, кармофур; доксифлуридин, элацитарабин, ралтитрексед, сапацитабин, тегафур2,3, триметрексат;
Противораковые антибиотики: такие как блеомицин, дактиномицин, доксорубицин, эпирубицин, идарубицин, левамизол, милтефозин, митомицин С, ромидепсин, стрептозоцин, валрубицин, зиностатин, зорубицин, даунуробицин, пликамицин; акларубицин, пепломицин, пирарубицин;
Гормоны/антагонисты: такие как абареликс, абиратерон, бикалутамид, бусерелин, калустерон, хлортрианизен, дегареликс, дексаметазон, эстрадиол, флуоркортолон, флуоксиместерон, флутамид, фульвестрант, гозерелин, гистрелин, лейпрорелин, мегестрол, митотан, нафарелин, нандролон, нилутамид, октреотид, преднизолон, ралоксифен, тамоксифен, тиротропин альфа, торемифен, трилостан, трипторелин, диэтилстилбестрол; аколбифен, даназол, дезорелин, эпитиостанол, ортеронел, энзалутамид1,3;
Ангибиторы ароматазы: такие как аминоглютетимид, анастрозол, экземестан, фадрозол, летрозол, тестолактон; форместан;
Ингибиторы низкомолекулярной киназы: такие как кризотиниб, дазатиниб, эрлотиниб, иматиниб, лапатиниб, нилотиниб, пазопаниб, регорафениб, руксолитиниб, сорафениб, сунитиниб, вандетаниб, вемурафениб, бозутиниб, гефитиниб, акситиниб; афатиниб, алицертиб, дабрафениб, дакомитиниб, динациклиб, довитиниб, энзастаурин, нинтеданиб, ленватиниб, линифаниб, линзитиниб, мазитиниб, мидостаурин, мотосаниб, нератиниб, орантиниб, перифозин, понатиниб, радотиниб, ригосертиб, типифарниб, тивантиниб, тивозаниб, траметиниб, пимасертиб, бриваниниб анианинат, седираниб, апатиниб4, карбозатиниб S-малат1,3, ибрутинипб1,3, икотиниб4, бупарлизиб2, ципатиниб4, кобиметиниб1,3, иделализиб1,3, федратиниб1, XL-6474;
Фотосенсибилизаторы: такие как метокссален3; порфимер натрий, талапорфин, темопорфин;
Антитела: такие как алемтузумаб, бесилезомаб, брентуксимаб ведотин, цетуксимаб, деноксумаб, ипилимумаб, офатумумаб, панитумумаб, ритуксимаб, тозитумомаб, трастузумаб, бевацизумаб, пертузумаб2,3; катумаксомаб, элотузумаб, эпратузумаб, фарлетузумаб, могамулизумаб, нецитумумаб, нимотузумаб, обинутузумаб, окаратузумаб, ореговомаб, рамуцирумаб, рилотумумаб, силтуксимаб, тоцилизумаб, залутумумаб, занолимумаб, матузумаб, далтузумаб1,2,3, онартузумаб1,3, ракотумомаб1, табалумаб1,3, EMD-5257974, ниволумаб1,3;
Цитокины: такие как альдезлейкин, интерферон альфа2, интерферон альфа2a3, интерферон альфа2b2,3; целмолейкин, тазонермин, тецелейкин, опрелвекин1,3, рекомбинантный интерферон бета-1a4;
Конъюгаты лекарственных средств: такие как денилейкин дифтитокс, ибритумомаб тиуксетан, иобенгуан I123, преднимустин, трастузумаб эмтансин, эстрамустин, гемтузумаб, озогамицин, афлиберцепт; цинтредекин безудотокс, эдотреотид, энотузумаб озогамицин, наптумомаб, эстафенатокс, опортузумаб монатокс, технеций (99mTc) арцитумомаб1,3, винтафолид1,3;
Вакцины: такие как сипулейцел3; витеспен3, эмепепимут-S3, окноВакс4, риндопепимут3, троВакс4, MGN-16014, MGN-17034; и
Разное: алитретиноин, бексаротен, бортезомиб, эверолимус, ибандроновая кислота, имиквимод, леналидомид, лентинан, метирозин, мифамуртид, памидроновая кислота, пегаспаргаза, пентостатин, сипулейцел3, сизофиран, тамибаротен, темсиролимус, талидомид, третиноин, висмодегиб, золедроновая кислота, вориностат; целекоксиб, циленгитид, энтиностат, этанидазол, ганетеспиб, идроноксил, инипариб, иксазомиб, лонидамин, ниморазол, панобиностат, перетиноин, плитидепсин, помалидомид, прокодазол, ридафоролимус, таскинимод, телотристат, тималфазин, тирапазамин, тозедостат, трабедерсен, убенимекс, валсподар, гендицин4, пицибанил4, реолизин4, гидрохлорид ретаспимицина1,3, требананиб2,3, вирулизин4, карфилзомиб1,3, эндостатин4, иммукотел4, белиностат3, MGN-17034.
(1 предл. МНН (предложенное международное непатентованное название); 2 рек. МНН (рекомендованные международные непатентованные названия); 3 USAN (наименование лекарства, официально присвоенное Американской медицинской ассоциацией); 4 без МНН).
В другом аспекте, в данном изобретении представлен набор, включающий отдельные упаковки эффективного количества соединения в соответствии с данным изобретением и/или его фармацевтически приемлемых солей, производных, сольватов и стереоизомеров, включая их смеси во всех пропорциях, и, необязательно, эффективного количества другого активного ингредиента. Набор содержит подходящие контейнеры, такие как коробки, отдельные бутылки, пакеты или ампулы. Набор может, например, содержать отдельные ампулы, каждая из которых содержит эффективное количество соединения в соответствии с данным изобретением и/или его фармацевтически приемлемых солей, производных, сольватов и стереоизомеров, включая их смеси во всех пропорциях, и, необязательно, эффективного количества другого активного ингредиента в растворенной или лиофилизированной форме.
В данном описании термины ʺлечениеʺ, ʺлечитьʺ и ʺлечениеʺ относятся к обращению, облегчению, задержке наступления или ингибированию развития заболевания или расстройства или одного или более их симптомов, как описано здесь. В некоторых вариантах, лечение вводят после развития одного или более симптомов. В других вариантах, лечение вводят при отсутствии симптомов. Например, лечение вводят индивидууму с предрасположенностью до проявления симптомов (например, в свете истории симптомов и/или в свете генетических или других факторов предрасположенности). Лечение также продолжают после устранения симптомов, например, для предотвращения или задержки их повторного наступления.
Соединения и композиции в соответствии со способом данного изобретения вводят с применением любого количества и любого пути введения, эффективных для лечения или облегчения тяжести расстройства, представленного выше. Точное требуемое количество может варьироваться от пациента к пациенту, в зависимости от вида, возраста и общего состояния пациента, тяжести инфекции, конкретного агента, его способа введения и подобных. Соединения в соответствии с данным изобретением, предпочтительно, составляют в виде стандартной лекарственной формы для простоты введения и однородности дозирования. Выражение "стандартная лекарственная форма" в данном описании относится к физически отдельной единицу агента, подходящей для лечимого пациента. Должно быть понятно, однако, что общая суточная доза соединений и композиций в соответствии с данным изобретением будет назначаться лечащим врачом в рамках обоснованного медицинского заключения. Конкретная эффективная доза для каждого конкретного пациента или организма будет зависеть от множества факторов, включая лечимое расстройство и тяжесть расстройства; активность конкретного применяемого соединения; конкретной применяемой композиции; возраста, массы тела, общего состояния здоровья, пола и режима питания пациента; времени введения, способа введения и скорости выведения конкретного применяемого соединения; длительности лечения; лекарственных средств, применяемых в сочетании или одновременно с конкретным применяемым соединением, и подобных факторов, хорошо известных в области медицины.
Фармацевтически приемлемые композиции в соответствии с данным изобретением могут вводиться человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально, в виде перорального или назального спрея, или подобными способами, в зависимости от тяжести лечимой инфекции. В определенных вариантах, соединения в соответствии с данным изобретением вводят перорально или парентерально в дозе от около 0,01 мг/кг до около 100 мг/кг и, предпочтительно, от около 1 мг/кг до около 50 мг/кг массы тела пациента в сутки, один или более раз в сутки, с получением желаемого терапевтического эффекта.
Жидкие лекарственные формы для перорального введения включают, но не ограничены ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы необязательно содержат инертные разбавители, применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензоат бензила, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и конопляное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирной кислоты сорбитана и его смесей. Кроме инертных разбавителей, пероральные композиции также могут включать адъюванты, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты, подсластители, вкусовые и ароматизирующие агенты.
Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций, составляют в соответствии с известным уровнем техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильные препараты для инъекций также включают стерильные растворы, суспензии или эмульсии для инъекций в не токсичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Приемлемые носители и растворители, которые могут применяться, включают воду, раствор Рингера, U.S.P., и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. Для этой цели может применяться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяют для получения препаратов для инъекций.
Композиции для инъекций могут быть стерилизованы, например, фильтрацией через фильтр, улавливающий бактерии, или введением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций перед применением.
Для продления действия соединения в соответствии с данным изобретением, часто желательно замедлять абсорбцию соединения при подкожной или внутримышечной инъекции. Это достигается применением жидкой суспензии кристаллического или аморфного продукта с плохой растворимостью в воде. Скорость абсорбции соединения в этом случае зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленная абсорбция вводимой парентерально форма соединения достигается растворением или суспендированием соединения в масляном носителе. Формы депо для инъекций получают образованием микроинкапсулирующих матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения соединения к полимеру и природы конкретного применяемого полимера, скорость выделения соединения может контролироваться. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Композиции депо для инъекций также получают заключением соединения в липосомы или микроэмульсии, которые совместимы с тканями тела.
Композиции для ректального или вагинального введения включают, предпочтительно, суппозитории, которые могут быть получены смешиванием соединений в соответствии с данным изобретением с подходящими не раздражающими наполнителями или носителями, такими как масло какао, полэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но становятся жидкими при температуре тела и, следовательно, плавятся в прямой кишке или влагалище и выделяет активный ингредиент.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают с, по крайней мере, одним инертным, фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или вторичный кислый фосфат кальция и/или a) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза, манит и кремниевая кислота, b) связующими агентами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, c) смачивателями, такими как глицерин, d) разрыхляющими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) замедлителем схватывания раствора, такими как парафин, f) усилителями абсорбции, такими как соединения четвертичного аммония, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль, лекарственные формы также необязательно содержат буферные агенты.
Твердые композиции подобного типа также применяют в качестве наполнителей для мягких и твердых желатиновых капсул с применением таких наполнителей, как лактоза или молочный сахар, а также полиэтилегликолей с высокой молекулярной массой и подобных. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области получения фармацевтических составов. Они необязательно содержат опалесцирующие агенты, а также могут представлять собой композиции, которые выделяют активный ингредиент(ы) только, или предпочтительно, в определенной части кишечного тракта, необязательно, в отсроченном порядке. Примеры заливочных композиций, которые могут применяться, включают полимерные вещества и воски. Твердые композиции подобного типа также применяют в качестве наполнителей для мягких и твердых желатиновых капсул с применением таких наполнителей, как лактоза или молочный сахар, а также полиэтиленгликолей с высокой молекулярной массой и подобных.
Активные соединения также могут быть в микроинкапсулированной форме с одним или более наполнителей, как указано выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия, контролирующие выделения и другие покрытия, хорошо известные в области получения фармацевтических составов. В таких твердых лекарственных формах активное соединение может быть смешано с, по крайней мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также включают, в качестве нормальной практики, дополнительные вещества, отличные от инертных разбавителей, например, таблетирующие смазывающие агенты и другие таблетирующие добавки, такие как стеарат магния и микрокристаллическая целлюлоза. Для капсул, таблеток и пилюль, лекарственные формы также необязательно содержат буферные агенты. Они необязательно содержат опалесцирующие агенты, также они могут представлять собой композиции, которые выделяют активный ингредиент(ы) только, или преимущественно, в определенной части кишечного тракта, необязательно, в отсроченном порядке. Примеры заливочных композиций, которые могут применяться, включают полимерные вещества и воски.
Лекарственные формы для местного или чрезкожного введения соединения в соответствии с данным изобретением включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалируемые композиции или пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, при необходимости. Офтальмологические композиции, ушные капли и глазные капли также включены в объем данного изобретения. Дополнительно, данное изобретение включает применение чрезкожных пластырей, которые обладают дополнительным преимуществом, заключающимся в контролируемой доставке соединения в тело. Такие лекарственные формы могут быть получены растворением или распределением соединения в подходящей среде. Усилители абсорбции также могут применяться для повышения потока соединения через кожу. Скорость может контролироваться либо с помощью контролирующей скорость мембраны, либо диспергированием соединения в полимерной матрице или геле.
Согласно одному варианту, изобретение относится к способу ингибирования активности ТКБ в биологическом образце, включающему стадию контакта такого биологического образца с соединением в соответствии с данным изобретением или композицией, содержащей такое соединение.
Согласно другому варианту, изобретение относится к способу ингибирования активности ТКБ или ее мутанта в биологическом образце положительным образом, включающему стадию контакта такого биологического образца с соединением в соответствии с данным изобретением или композицией, содержащей такое соединение.
Соединения в соответствии с данным изобретением применяют in-vitro в качестве уникальных инструментов для понимания биологической роли ТКБ, включая оценку многих факторов, которые, как считается, влияют на, и подвержены влиянию производства ТКБ и взаимодействия ТКБ. Данные соединения также применяют для разработки других соединений, которые взаимодействуют с ТКБ, так как данные соединения дают информацию относительно важной связи структура-активность (ССА), которая способствует этой разработке. Соединения в соответствии с данным изобретением, которые связываются с ТКБ, могут применяться в качестве реагентов для определения ТКБ в живых клетках, связанных клетках, в биологических жидкостях, в гомогенатах тканей, в очищенных природных биологических материалах, и т.д. Например, при мечении таких соединений можно идентифицировать клетки, экспрессирующие ТКБ. Кроме того, благодаря их способности связывать ТКБ, соединения в соответствии с данным изобретением могут применяться при in-situ окрашивании, СКВФ (сортировке клеток с возбуждением флуоресценции), электрофорезе в полиакриламидном геле с додецилсульфатом натрия (ДСН-ПААГ-электрофорезе), ELISA (фермент-связанном иммуносорбентном исследовании), и т.д., ферментной очистке, или при очистке клеток, экспрессирующих ТКБ, внутри пермеабилизированных клеток. Соединения в соответствии с данным изобретением также могут применяться в качестве реагентов для коммерческих исследований для различных медицинских исследований и диагностики. Такое применение включает, но не ограничено ими: применение в качестве калибровочного стандарта для количественной оценки активности предполагаемых ТКБ ингибиторов во множестве функциональных исследований; применение в качестве блокирующих реагентов в произвольном скрининге соединений, т.е. при поиске новых семейств ТКБ лигандов, где соединения могут применяться для блокирования выделения заявляемых ТКБ соединений; применение в со-кристаллизации с ТКБ ферментом, т.е. соединения в соответствии с данным изобретением позволяют получить кристаллы соединения, связанные с ТКБ, что позволяет определить структуру фермент/соединение рентгеновской кристаллографией; другие области применения для исследований и диагностики, где ТКБ, предпочтительно, является активированным, или такая активация удобным образом калибруется в отношении известного количества ингибитора ТКБ, и т.д.; применение в исследованиях в качестве проб для определения экспрессии ТКБ в клетках; и проявляющих исследованиях для определения соединений, которые связываются с тем же местом, как и ТКБ связывающие лиганды.
Соединения в соответствии с данным изобретением могут применяться сами по себе и/или в сочетании с физическими измерениями для диагностики эффективности лечения. Фармацевтические композиции, содержащие указанные соединения, и применение указанных соединений для лечения медиированных ТКБ состояний является многообещающим новым подходом для широкого спектра терапий, вызывающим прямое и немедленное улучшение состояния здоровья человека или животного. Перорально биодоступные и активные новые химические вещества в соответствии с данным изобретением улучшают удобство для пациентов и соблюдение режима терапии для терапевтов.
Соединения формулы (I), их соли, изомеры, таутомеры, энантиомерные формы, диастереомеры, рацематы, производные, пролекарства и/или метаболиты характеризуются высокой специфичностью и стабильностью, низкими производственными затратами и удобством в обработке. Эти характеристики являются основанием для повторяемого действия, где вызывается потеря перекрестной реактивности и для надежного и безопасного взаимодействия с целевой структурой.
Термин ʺбиологический образецʺ в данном описании включает, без ограничений, клеточные культуры или их экстракты; взятые биопсией материалы, полученные у млекопитающих, или их экстракты; и кровь, слюну, мочу, фекалии, семенную жидкость, слезы или другие жидкости тела или их экстракты.
Модулирование активности ТКБ или ее мутанта в биологическом образце применяют для множества целей, которые известны специалистам в данной области техники. Примеры таких целей включают, но не ограничены ими, переливание крови, трансплантацию органов, хранение биологических образцов и биологические исследования.
Иллюстративные примеры
Как изображено в представленных ниже примерах, в определенных типовых вариантах соединения получают согласно представленным ниже общим методам. Должно быть понятно, что хотя в общих способах изображен синтез определенных соединений в соответствии с данным изобретением, представленные ниже общие способы и другие способы, известные специалисту в данной области техники, могут применяться ко всем соединениям и подклассам и видам каждого из этих соединений, как описано здесь.
Символы и условные обозначения, применяемые в представленных ниже описаниях способов, схем и примеров, согласуются с теми, которые применяют в современной научной литературе, например, в Журнале Химического общества США или Журнале биологической химии.
Номера соединений, применяемые в примерах ниже, соответствуют номерам соединений, указанных выше.
Общие условия и аналитические способы
Все применяемые растворители коммерчески доступны и применяются без дальнейшей очистки. Реакции обычно проводят с применением безводных растворителей в инертной атмосфере азота, если не указано иначе.
ЯМР эксперименты записывают на ЯМР спектрометре Bruker Mercury Plus 400, оборудованном BBFO пробой Bruker 400 или Bruker Avance III 400 МГц. Дейтерированные растворители обычно содержат от 0,03% до 0,05% об./об. тетраметилсилана, который используют в качестве ссылочного сигнала (установленного на δ 0,00 для 1H и 13C). Химические сдвиги (δ) записаны в ч./млн. Константы сочетания представлены в единицах Герца (Гц). Шаблоны расщепления описывают видимые мультиплетности и обозначены как с (синглет), д (дублет), т (триплет), кв (квартет), м (мультиплет) или ш (широкий).
Для примеров 1-4 и примеров 33-96, анализы ЖХ-МС проводят на ЖХ-МС аппарате SHIMADZU, включающем ССЖХ систему 20-AD и ЖХ-МС определитель 2020. Применяемой колонкой является Shim-pack XR-ODS, 2,2 мкм, 3,0×50 мм. Применяют линейный градиент, начиная с 95% A (A: 0,05% ТФК в воде) и заканчивая 100% B (B: 0,05% ТФК в АЦН) в течение более 2,2 мин при общем времени прогона 3,6 мин. Температура колонки составляет 40οC при скорости потока 1,0 мл/мин. Диодно-матричный детектор сканируют на 200-400 нм. Масс-спектрометр оборудован источником для электрораспыления иона (ЭР), работающим в положительном и отрицательном режиме. Масс-спектрометр сканируют при m/z 90-900 при времени сканирования 0,6 с.
Для примера 5, анализы ЖХ-МС проводят с применением XBridge C8 (50×4,6 мм, 3,5 мкм) в положительном режиме. Применяют градиент с использованием буфера A (0,1% ТФК в H2O) и буфера B (0,1% ТФК в ацетонитриле) со скоростью потока 2,0 мл/мин. ЖХВД проводят в тех же условиях.
Для всех других примеров ЖХ-МС спектр получают на масс-спектрометрах серии Agilent 1200 от Agilent technologies, с применением или химической ионизации при атмосферном давлении (ХИАД), или ионизации электрораспылением (ИЭР). Колонка: XBridge C8, 3,5 мкм, 4,6×50 мм; растворитель A: вода+0,1% ТФК; растворитель B: АЦН; поток: 2 мл/мин; градиент: 0 мин: 5% B, 8 мин: 100% B, 8,1 мин: 100% B, 8,5 мин: 5% B, 10 мин 5% B. Данные ЖХВД получают с применением ЖХВД серии Agilent 1100 от Agilent technologies с применением колонки XBridge (C8, 3,5 мкм, 4,6×50 мм). Подвижная фаза A: вода+0,1% ТФК; подвижная фаза B: АЦН; поток: 2 мл/мин; градиент: 0 мин: 5% подвижная фаза B, 8 мин: 100% подвижная фаза B, 8,1 мин: 100% подвижная фаза B, 8,5 мин: 5% подвижная фаза B, 10 мин 5% подвижная фаза B.
Микроволновые реакции проводят с применением Biotage Initiator Microwave Synthesizer с применением стандартных протоколов, известных в данной области техники.
Схема 1:
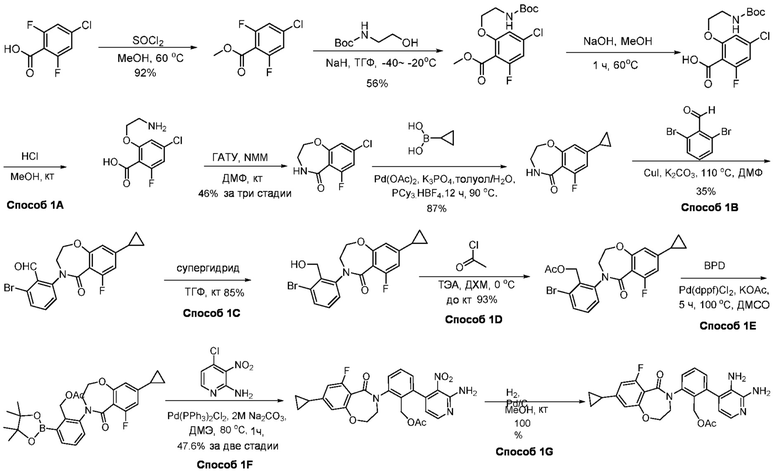

Пример 1,8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (1)
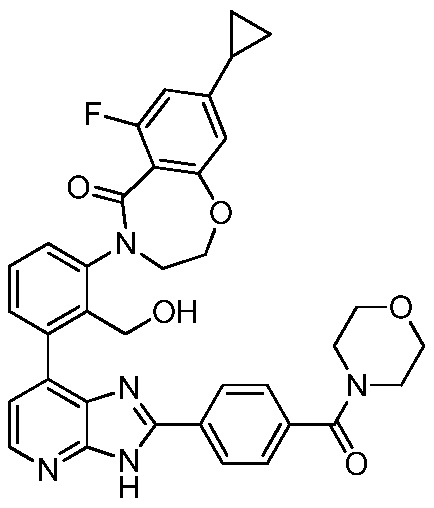
Метил 4-хлор-2,6-дифторбензоат
В 500-мл круглодонной колбе с магнитной мешалкой, 4-хлор-2,6-дифторбензойную кислоту (5,0 г, 25,97 ммоль, 1,0 эквив.) растворяют в тионилхлориде (15,45 г, 129,84 ммоль, 5,00 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 1 ч. при 60°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением промежуточного хлорангидрида, который затем растворяют в ДХМ (10 мл). Полученный раствор хлорангидрида затем по каплям добавляют к метанолу (100 мл) при 0°C. Полученный раствор перемешивают в течение еще 30 мин при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением метил 4-хлор-2,6-дифторбензоата (5 г, 92%) в виде желтого масла.
Метил 2-(2-[[(трет-бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензоат
В 100-мл круглодонной колбе с магнитной мешалкой, трет-бутил N-(2-гидроксиэтил)карбамат (4,68 г, 29,04 ммоль, 1,20 эквив.) растворяют в тетрагидрофуране (50 мл), туда добавляют гидрид натрия (1,26 г, 31,46 ммоль, 60%, 1,30 эквив.) порциями при -40°C. Полученную суспензию перемешивают в течение 10 мин и добавляют метил 4-хлор-2,6-дифторбензоат (5,0 г, 24,2 ммоль, 1,0 эквив.) при -40°C. Реакционную смесь перемешивают в течение 30 мин при -40°C, затем медленно нагревают вплоть до -20°C в течение более 1 ч при перемешивании. После завершения реакции, ее гасят добавлением 100 мл насыщ. раствора NH4Cl, и смесь экстрагируют этилацетатом (3×150 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 10% градиент) с получением метил 2-(2-[[(трет-бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензоата (5 г, 56%) в виде желтого масла. МС: m/z=248,0 [M+H-100]+.
2-(2-[[(трет-Бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензойная кислота
В 250-мл круглодонной колбе с магнитной мешалкой, метил 2-(2-[[(трет-бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензоат (5,00 г, 14,38 ммоль, 1,00 эквив.) растворяют в смеси метанола (50 мл) и воды (30 мл) при комнатной температуре. Затем медленно добавляют гидроксид натрия (2,88 г, 72,00 ммоль, 5,01 эквив.). Полученный раствор перемешивают в течение 1 ч. при 60°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Значение рН оставшегося раствора доводят до 4 с применением раствора лимонной кислоты (10% об./об.) и смесь экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 2-(2-[[(трет-бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензойной кислоты (4,3 г, неочищенная) в виде желтого масла.
Способ 1A: 8-Бром-4-хлор-7-метилхинолин-3-карбоксамид
В 100-мл круглодонной колбе с магнитной мешалкой, 2-(2-[[(трет-бутокси)карбонил]амино]этокси)-4-хлор-6-фторбензойную кислоту (2 г, 5,99 ммоль, 1,00 эквив.) растворяют в растворе HCl в метаноле (4N, 30 мл) при комнатной температуре. Полученную смесь перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением 2-(2-аминоэтокси)-4-хлор-6-фторбензойной кислоты (1,6 г, неочищенная) в виде белого твердого вещества.
8-Хлор-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 100-мл круглодонной колбе с магнитной мешалкой, ГАТУ (7,81 г, 20,55 ммоль, 1,50 эквив.) и NMM (3,88 г, 38,35 ммоль, 2,80 эквив.) добавляют к раствору 2-(2-аминоэтокси)-4-хлор-6-фторбензойной кислоты (3,20 г, 13.70 ммоль, 1,00 эквив.) в N,N-диметилформамиде (50 мл) при комнатной температуре. Полученный раствор перемешивают в течение 3 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением 8-хлор-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (2,3 г, 46% за три стадии) в виде беловатого твердого вещества. МС: m/z=216,0 [M+H]+.
8-Циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 100-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 8-хлор-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (3,4 г, 15,77 ммоль, 1,00 эквив.), циклопропилбороновую кислоту (4,06 г, 47,31 ммоль, 3,00 эквив.), PCy3.HBF4 (2,32 г, 6,31 ммоль, 0,40 эквив.), Pd(OAc)2 (708 мг, 3,15 ммоль, 0,20 эквив.) и K3PO4 (10,04 г, 47,31 ммоль, 3,00 эквив.) смешивают в смеси толуола и воды (10:1, 55 мл) при комнатной температуре. Полученную смесь перемешивают в течение 12 ч. при 90°C. После завершения реакции, реакционную смесь разбавляют водой (50 мл) и экстрагируют этилацетатом (3×150 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (3,2 г, 87%) в виде желтого твердого вещества. МС: m/z=222,0 [M+H]+.
Способ 1B: 2-Бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)бензальдегид
В 100-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (3,1 г, 14,01 ммоль, 1,00 эквив.), 2,6-дибромбензальдегид (11,11 г, 42,10 ммоль, 3,00 эквив.), CuI (533,2 мг, 2,80 ммоль, 0,20 эквив.), карбонат калия (3,85 г, 27,86 ммоль, 1,99 эквив.) смешивают в N,N-диметилформамиде (30 мл) при комнатной температуре. Полученную смесь перемешивают в течение 12 ч, при 110°C. После охлаждения до КТ, реакционную смесь разбавляют 100 мл H2O и экстрагируют этилацетатом (3×200 мл). Органические слои объединяют и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 60% градиент) с получением 2-бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)бензальдегида (2 г, 35%) в виде желтого твердого вещества. МС: m/z=404,0 [M+H]+.
Способ 1C: 4-[3-Бром-2-(гидроксиметил)фенил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 100-мл круглодонной колбе с магнитной мешалкой, к раствору 2-бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)бензальдегида (2 г, 4,95 ммоль, 1,00 эквив.) в тетрагидрофуране (30 мл) добавляют триэтилборгидрид лития (1,58 г, 14,91 ммоль, 3,01 эквив.) порциями, при комнатной температуре. Полученный раствор перемешивают в течение 40 мин при комнатной температуре. После завершения реакции, ее гасят 20 мл H2O и смесь экстрагируют этилацетатом (3×50 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 60% градиент) с получением 4-[3-бром-2-(гидроксиметил)фенил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (1,7 г, 85%) в виде желтого твердого вещества. МС: m/z=406,0 [M+H]+.
Способ 1D: [2-Бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетат
В 100-мл круглодонной колбе с магнитной мешалкой, 4-[3-бром-2-(гидроксиметил)фенил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (1,7 г, 4,01 ммоль, 1,00 эквив.) и ТЭА (1,27 г, 12,54 ммоль, 3,00 эквив.) растворяют в дихлорметане (20 мл) при комнатной температуре. Смесь охлаждают до 0°C и добавляют ацетилхлорид (986 мг, 12,56 ммоль, 3,00 эквив.) по каплям. Полученный раствор затем перемешивают в течение 3 ч. при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 20 мл H2O и экстрагируют этилацетатом (3×50 мл). Органические слои объединяют и концентрируют при пониженном давлении с получением [2-бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетата (1,67 г, 93%) в виде желтого твердого вещества. МС: m/z=447,9 [M+H]+.
Способ 1E: [2-(8-Циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетат
В 30-мл герметично закрытой пробирке, продутой и имеющей инертную атмосферу азота, [2-бром-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетат (1,67 г, 3,57 ммоль, 1,00 эквив.), KOAc (733 мг, 7,47 ммоль, 2,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (1,14 г, 4,49 ммоль, 1,21 эквив.), Pd(dppf)Cl2.CH2Cl2 (305,6 мг, 0,37 ммоль, 0,10 эквив.) смешивают в ДМСО (10 мл) при комнатной температуре. Полученную смесь перемешивают в течение 5 ч. при 100°C. После завершения реакции, реакционную смесь разбавляют 30 мл воды и экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 6% градиент) с получением [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетата (2 г, неочищенный) в виде желтого твердого вещества.
Способ 1F: [2-(2-Амино-3-нитропиридин-4-ил)-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетат
В 100-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетат (2 г, 2,58 ммоль, 1,00 эквив.) 4-хлор-3-нитропиридин-2-амин (773,3 мг, 4,46 ммоль, 1,72 эквив.), Pd(PPh3)2Cl2 (283,6 мг, 0,40 ммоль, 0,16 эквив.) и карбонат натрия (856,5 мг, 8,08 ммоль, 3,13 эквив.) смешивают в смеси диметилового эфира этиленгликоля и воды (5:1, 25 мл) при комнатной температуре. Полученный раствор перемешивают в течение 1 ч. при 80°C. После завершения реакции, реакционную смесь разбавляют 30 мл воды и экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 6% градиент) с получением [2-(2-амино-3-нитропиридин-4-ил)-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетата (900 мг, 47,6% за две стадии) в виде желтого твердого вещества. МС: m/z=529,4 [M+Na]+.
Способ 1G: [2-(8-Циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетат
В 100-мл круглодонной колбе, [2-(2-амино-3-нитропиридин-4-ил)-6-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)фенил]метилацетат (500 мг, 0,98 ммоль, 1,00 эквив.) растворяют в метаноле (50 мл) при комнатной температуре. Затем добавляют палладий на угле (10%, 100 мг, 0,0089 ммоль, 0,1 эквив.) в атмосфере азота. Реакционную колбу вакуумируют и ополаскивают водородом, и смесь гидрируют при комнатной температуре в течение 3 часов в атмосфере водорода с применением водородного баллона. После завершения реакции, реакционную смесь фильтруют через слой целлита, и фильтрат концентрируют при пониженном давлении с получением [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата (470 мг, 100%) в виде желтого твердого вещества. МС: m/z=477,1 [M+H]+.
4-[(Морфолин-4-ил)карбонил]бензальдегид
В 250-мл круглодонной колбе, 4-формилбензойную кислоту (1,50 г, 9,99 ммоль, 1,00 эквив.), 3H-[1,2,3]триазоло[4,5-b]пиридин-3-ол (1,49 г, 10,99 ммоль, 1,10 эквив.) и ГАТУ (4,56 г, 11,99 ммоль, 1,20 эквив.) смешивают в дихлорметане (140 мл), затем туда добавляют ДИЭА (3,87 г, 29,9 ммоль, 3,00 эквив.) и морфолин (1,09 г, 12,5 ммоль, 1,25 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 16 ч. при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 3% градиент) с получением 4-[(морфолин-4-ил)карбонил]бензальдегида (1,5 г, 68%) в виде бесцветного масла. МС: m/z=477,1 [M+H]+.
Способ 1H: [2-(8-Циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метилацетат :
IВ 8-мл пробирке, продутой и имеющей инертную атмосферу азота, [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетат (200 мг, 0,42 ммоль, 1,00 эквив.) растворяют в 5 мл N,N-диметилформамида, затем туда добавляют 4-[(морфолин-4-ил)карбонил]бензальдегид (110,4 мг, 0,50 ммоль, 1,20 эквив.) и pТСК (93,9 мг, 0,55 ммоль, 1,30 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 4 ч. при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой в следующих условиях: колонка, C18 силикагель; подвижная фаза, MeOH в воде, от 10% до 50% градиент за 10 мин; определитель, УФ 254 нм. [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метилацетат (120 мг, 40%) получают в виде желтого твердого вещества.
Способ 1I
8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (1)
В 50 мл круглодонной колбе, [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метилацетат (100 мг, 0,15 ммоль, 1,00 эквив.) растворяют в смеси метанола и воды (3:1, 4 мл), туда добавляют LiOH (17,7 мг, 0,74 ммоль, 4,99 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 1 ч. при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Значение рН оставшегося раствора доводят до 7 с применением раствора HCl (1M), и полученный раствор экстрагируют этилацетатом (3×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка, SunFire Prep C18 OBD Column, 19*150 мм 5мкм 10 нм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 43% до 50% градиент за 9 мин; определитель, УФ 254 нм. 8-циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (10 мг, 11%) получают в виде белого твердого вещества. ЖХВД: 99,3% чистота. МС: m/z =634,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,50 (с, 1H), 8,26 (шс, 2H), 7,77-7,54 (м, 5H), 7,39 (д, J=5,1 Гц, 1H), 6,85-6,75 (м, 2H), 4,66-4,49 (м, 3H), 4,41-4,40 (м, 1H), 4,08-4,03 (м, 2H), 3,81-3,58 (м, 6H), 3,50-3,48 (м, 2H), 2,07-1,95 (м, 1H), 1,16-1,05 (м, 2H), 0,88-0,82 (м, 2H).
Пример 2. 8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (2)
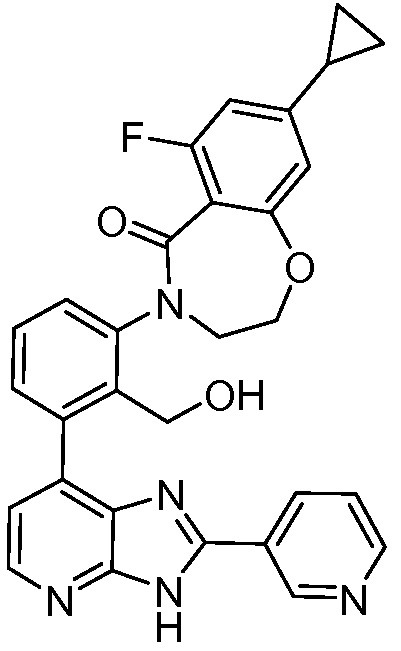
8-циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 4,9 мг (8%) получают из [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата, пиридин-3-карбальдегида, LiOH с применением способа 1H и 1I из примера 1. ЖХВД: 98,5% чистота. МС: m/z=522,1 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,32 (с, 1H), 8,69-8,68 (м, 1H), 8,49-8,43 (м, 2H), 7,61-7,53 (м, 3H), 7,46 (д, J=8 Гц, 1H), 7,34 (д, J=4 Гц, 1H), 6,84-6,77 (м, 2H), 4,51-4,45 (м, 3H), 4,40-4,38 (м, 1H), 4,26-4,23 (м, 1H), 3,97-3,93 (м, 2H), 2,01-1,99 (м, 1H), 1,04-1,02 (м, 2H), 0,80-0,77 (м, 2H).
Схема 2
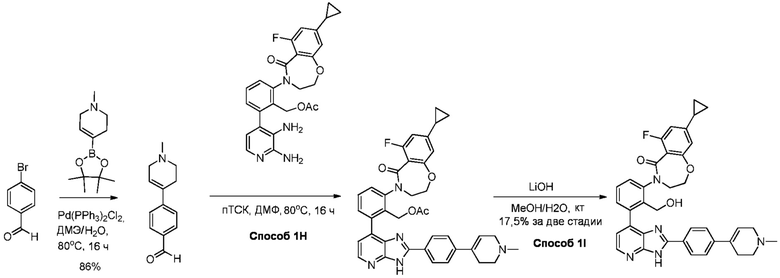
Пример 3. 8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-[4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (3)
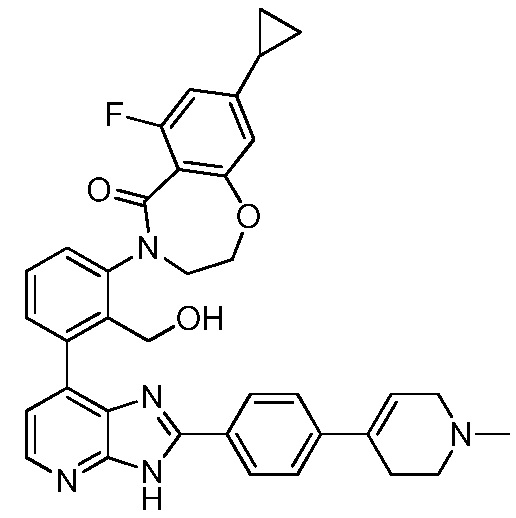
4-(1-Метил-1,2,3,6-тетрагидропиридин-4-ил)бензальдегид
В 30 мл герметично закрытой пробирке, продутой и имеющей инертную атмосферу азота, 4-бромбензальдегид (500 мг, 2,70 ммоль, 1,00 эквив.), 1-метил-4-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридин (723,6 мг, 3,24 ммоль, 1,20 эквив.), Pd(PPh3)2Cl2 (189,7 мг, 0,27 ммоль, 0,10 эквив.) и раствор карбоната натрия (572,8 мг, 5,40 ммоль, 2,00 эквив.) смешивают в смеси этиленгликольдиметилового эфира/воды (10:3, 13 мл) при комнатной температуре. Полученную смесь перемешивают в течение 16 ч. при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в (от 10% до 30% градиент) петролейным эфиром с получением 4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)бензальдегида (490 мг, 86%) в виде желтого твердого вещества.
8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-[4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
8-циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-[4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 25 мг (17,5% за две стадии) получают из [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата и 4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)бензальдегида с применением способа 1H и 1I. ЖХВД: 99,7% чистота. МС: m/z=616,1 [M+H]+, 1H ЯМР (400 МГц, ДМСО-d6): δ 8,46 (д, J=5,6 Гц, 1H), 8,15-8,05 (м, 2H), 7,71-7,53 (м, 5H), 7,35 (д, J=4,8 Гц, 1H), 6,83-6,73 (м, 2H), 6,32 (с, 1H), 4,65-4,32 (м, 4H), 4,05-3,85 (м, 2H), 3,26-3,20 (м, 2H), 2,81-2,75 (м, 2H), 2,66-2,60 (м, 2H), 2,42 (с, 3H), 2,01-1,92 (м, 1H), 1,10-1,05 (м, 2H), 0,84-0,80 (м, 2H).
Схема 3

Пример 4. N-[5-Фтор-2-метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамид (4)
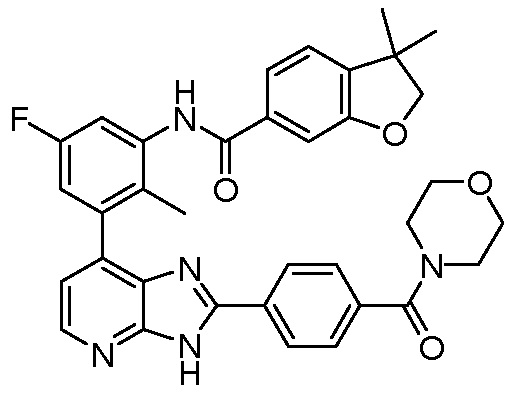
Метил 4-бром-3-[(2-метилпроп-2-ен-1-ил)окси]бензоат
В 250-мл круглодонной колбе, метил 4-бром-3-гидроксибензоат (5,0 г, 21,64 ммоль, 1,00 эквив.) и 3-бром-2-метилпроп-1-ен (2,92 г, 21,63 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (100 мл), туда добавляют карбонат калия (4,49 г, 32,49 ммоль, 1,50 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 18 ч при комнатной температуре. После завершения реакции, реакционную смесь разбавляют смесью этилацетата (20 мл) и гексан (80 мл). Нерастворимые твердые вещества в смеси отфильтровывают, и фильтрат концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 10% градиент) с получением метил 4-бром-3-[(2-метилпроп-2-ен-1-ил)окси]бензоата (5,1 г, 79%) в виде бесцветного масла. МС: m/z=284,9 [M+H]+.
Метил 3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксилат
В 250-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 4-бром-3-[(2-метилпроп-2-ен-1-ил)окси]бензоат (6,900 г, 24,20 ммоль, 1,00 эквив.), ацетат натрия (4,963 г, 60,50 ммоль, 2,50 эквив.), формиат натрия (1,975 г, 29,04 ммоль, 1,20 эквив.), гидрат хлорида тетраэтилазания (5,335 г, 29,04 ммоль, 1,20 эквив.) и Pd(OAc)2 (543 мг, 2,42 ммоль, 0,10 эквив.) смешивают в N,N-диметилформамиде (150 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 3 ч. при 90°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 600 мл этилацетатом и промывают насыщенным раствором соли (5×150 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением метил 3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксилата (4,5 г, 86%) в виде желтого масла. МС: m/z=206,9 [M+H]+.
3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоновая кислота
3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоновую кислоту 399 мг (77%) получают из метил 3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксилата с применением способа 1I. МС: m/z=192,9 [M+H]+.
N-(3-Бром-5-фтор-2-метилфенил)-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамид
В 50-мл круглодонной колбе, продутой и содержащей инертную атмосферу азота, 3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоновую кислоту (500 мг, 2,45 ммоль, 1,00 эквив.) растворяют в тионилхлориде (5 мл) при комнатной температуре. Полученный раствор перемешивают в течение 1 ч. при 60°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением промежуточного хлорангидрида (600 мг), который применяют на следующей стадии без дальнейшей очистки. В 50-мл круглодонной колбе, хлорангидрид (600 мг), полученный выше, was медленно добавляют к раствору 3-бром-5-фтор-2-метиланилина (637 мг, 3,31 ммоль, 1,35 эквив.) в пиридине (5 мл) при 0°C. Затем смесь перемешивают 2 ч. при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 20% градиент) с получением N-(3-бром-5-фтор-2-метилфенил)-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамида (430 мг, 45%) в виде белого твердого вещества. МС: m/z=379,8 [M+H]+.
N-[5-Фтор-2-метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамид
N-[5-фтор-2-метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамид 20 мг (3,5% за 4 стадии) получают из N-(3-бром-5-фтор-2-метилфенил)-3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксамида, 4-хлор-3-нитропиридин-2-амина, 4-[(морфолин-4-ил)карбонил]бензальдегида с применением способа 1E, 1F, 1G и 1H. ЖХВД: 97,8% чистота. МС: m/z=606,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,82 (шс, 1H), 9,96 (с, 1H), 8,51 (с, 1H), 8,30-8,29 (м, 2H), 7,57-7,55 (м, 3H), 7,38-7,35 (м, 3H), 7,15-7,13 (м, 2H), 4,28 (с, 2H), 3,55-3,45 (м, 6H), 3,31-3,30 (м, 2H), 2,06 (с, 3H), 1,32 (с, 6H).
Пример 5. 4-(трет-бутил)-N-(2-метил-3-(2-(4-(морфолин-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)бензамид (5)
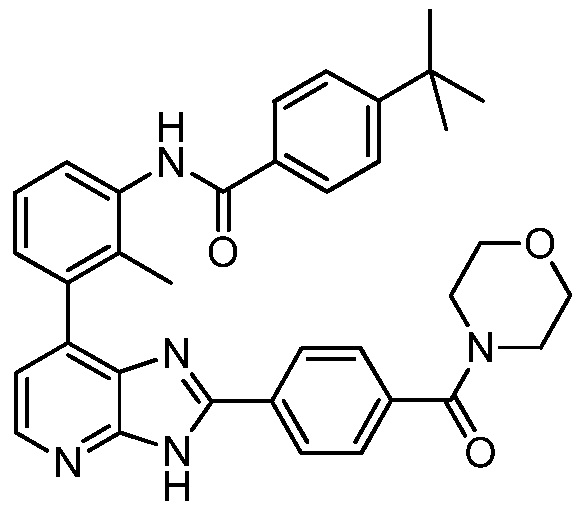
4-хлор-3-нитропиридин-2-амин
Нитрирующую смесь (HNO3:H2SO4, 5 мл) добавляют к 4-хлорпиридин-2-амину (2,56 г, 20 ммоль) при 0°C и перемешивают в течение 16 ч. После завершения реакции, смесь разбавляют водой и этилацетатом, экстрагируют этилацетатом, промывают водой, насыщенным раствором соли, сушат над безводным Na2SO4 и затем концентрируют при пониженном давлении. Полученный неочищенный продукт очищают флэш-хроматографией с получением 4-хлор-3-нитропиридин-2-амина в виде желтого твердого вещества (1,211 г, 35% выход). ЖХВД: 97,2% чистота. МС: 74,0 [M+H]+. 1H ЯМР: 400 МГц, ДМСО-d6: δ 8,11 (д, J=5,24 Гц, 1H), 7,23 (с, 2H), 6,85 (д, J=5,24 Гц, 1H).
N-(3-(2-амино-3-нитропиридин-4-ил)-2-метилфенил)-4-(трет-бутил)бензамид
В пробирку под давлением загружают 4-хлор-3-нитропиридин-2-амин (300 мг, 1,73 ммоль), 4-(трет-бутил)-N-(2-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)бензамид (744, 1,89 ммоль), ДМЭ (10 мл) и Na2CO3 (294 мг, 3,4 ммоль) и затем дегазируют в течение 10 мин. Затем добавляют Pd2Cl2(PPh3)2 (120 мг, 0,171 ммоль), и реакционную смесь нагревают до 80°C в течение 1 ч. После завершения реакции, реакцию гасят добавлением воды, экстрагируют этилацетатом, промывают водой и насыщенным раствором соли и затем сушат над безводным Na2SO4. Растворитель выпаривают при пониженном давлении с получением неочищенного соединения, которое очищают флэш-хроматографией с получением N-(3-(2-амино-3-нитропиридин-4-ил)-2-метилфенил)-4-(трет-бутил)бензамида (0,400 г, 57% выход). ЖХВД: 86,8% чистота. МС: 405,2 [M+H]+.
4-( трет- бутил)-N-(3-(2,3-диаминопиридин-4-ил)-2-метилфенил)бензамид
Раствор 4-(трет-бутил)-N-(3-(2,3-диаминопиридин-4-ил)-2-метилфенил)бензамида (50 мг, 0,124 ммоль) в MeOH (10 мл) восстанавливают с применением Н-куба при 30°C (скорость потока=0,9 мл/мин) и 10% Pd/C картриджа. После завершения реакции, растворитель выпаривают при пониженном давлении с получением 4-(трет-бутил)-N-(3-(2,3-диаминопиридин-4-ил)-2-метилфенил)бензамида в виде бледно-желтой жидкости (0,043 г, 93%). ЖХВД: 97,5% чистота. МС: 375,3 [M+H]+. 1H ЯМР: 400 МГц, ДМСО-d6: δ 9,84 (с, 1H), 7,91-7,95 (м, 2H), 7,54 (дд, J=1,92, 6,64 Гц, 2H), 7,42 (д, J=7,04 Гц, 1H), 7,36 (д, J=5,16 Гц, 1H), 7,31 (т, J=7,76 Гц, 1H), 7,03 (дд, J=1,16, 7,46 Гц, 1H), 5,70 (с, 2H), 2,00 (с, 3H), 1,31 (с, 9H).
4-( трет- бутил)-N-(2-метил-3-(2-(4-(морфолин-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)бензамид
К раствору 4-(трет-бутил)-N-(3-(2,3-диаминопиридин-4-ил)-2-метилфенил)бензамида и 4-(морфолин-4-карбонил)бензальдегида (85 мг, 0,227 ммоль) в ДМФ (3 мл) добавляют pТСК (43 мг, 0,25 ммоль) и нагревают до 85°C в течение 12 ч. После завершения реакции, реакцию гасят добавлением воды, экстрагируют этилацетатом, промывают водой, насыщенным раствором соли и затем сушат над безводным Na2SO4. Растворитель выпаривают при пониженном давлении. Полученное неочищенное соединение затем очищают флэш-хроматографией с получением 4-(трет-бутил)-N-(2-метил-3-(2-(4-(морфолин-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)бензамида в виде беловатого твердого вещества (17 мг, 13% выход). ЖХВД: 96,2% чистота. МС: 574,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 9,95 (с, 1H), 8,35-8,46 (м, 1H), 8,25 (д, J=7,48 Гц, 2H), 7,96 (д, J=7,88 Гц, 2H), 7,47-7,61 (м, 6H), 7,28-7,39 (м, 2H), 7,17 (д, J=4,84 Гц, 1H), 3,61-0,00 (м, 6H), 3,32-0,00 (м, 2H), 2,11 (с, 3H), 1,32 (с, 9H).
Пример 6. 6-Циклопропил-2-(2-гидроксиметил-3-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}фенил)-3,4-дигидро-2H-изохинолин-1-он (6)
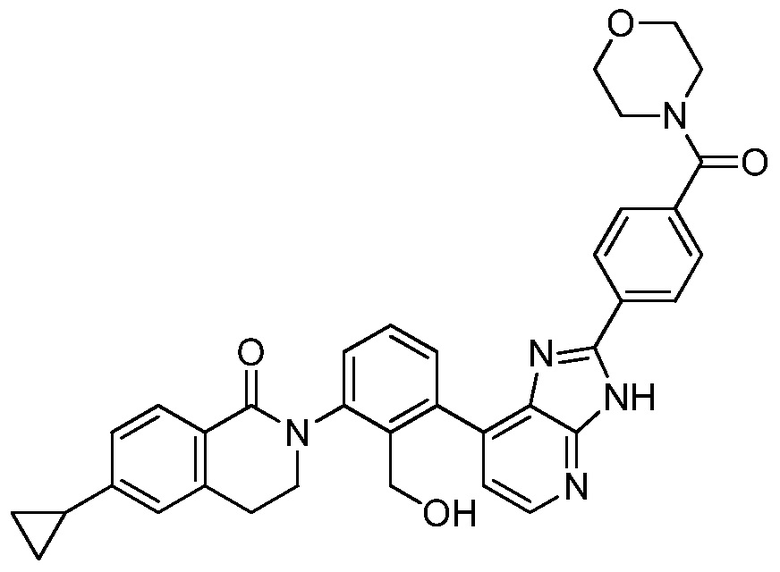
2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензилацетат
В 20 мл реакционную пробирку с мешалкой добавляют 2-бром-6-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)бензилацетат (500,00 мг; 1,21 ммоль; 1,00 экв.), бис(пинаколато)диборон (612,95 мг; 2,41 ммоль; 2,00 экв.), продукт присоединения трис(дибензилиденацетон)дипалладий-хлороформ (124,92 мг; 0,12 ммоль; 0,10 экв.), дициклогексил-(2',4',6'-триизопропилбифенил-2-ил)фосфан (115,07 мг; 0,24 ммоль; 0,20 экв.) и ацетат калия (355,34 мг; 3,62 ммоль; 3,00 экв.). Пробирку герметично закрывают и ополаскивают аргоном. Реакционную смесь затем обрабатывают диоксаном (10,00 мл; 117,36 ммоль; 97,24 экв.) через шприц, дегазируют аргоном и нагревают до 65°C в течение ночи при перемешивании. После завершения реакции (отслеживается ЖХ-МС), реакционную смесь охлаждают до КТ и фильтруют. Фильтрат концентрируют при пониженном давлении, затем загружают в 25 г картридж для образца KP-sil и очищают флэш-хроматографией с применением системы Biotage (колонка KP-двуокись кремния; подвижная фаза 5%-50% EtOAc/гексан 15 объемов колонки). Фракции продукта концентрируют при пониженном давлении с получением 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензилацетата в виде коричневого воскообразного твердого вещества (729 мг, 131%). ЖХ-МС анализ показал присутствие исходного дез-бром в виде примеси. МС: [M+H]+ 462.
2-(2-амино-3-нитропиридин-4-ил)-6-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)бензилацетат
В 30 мл реакционную пробирку с мешалкой добавляют 2-амино-4-хлор-3-нитропиридин (250,00 мг; 1,44 ммоль; 1,00 экв.), 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензилацетат (731,02 мг; 1,58 ммоль; 1,10 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорид палладия(II) с дихлорметаном (117,63 мг; 0,14 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси затем добавляют водный гидроортофосфат калия (1M; 2,88 мл; 2,88 ммоль; 2,00 экв.), водный ацетат натрия (2,88 мл; 2,88 ммоль; 2,00 экв.) и АЦН (7,50 мл; 143,59 ммоль; 99,69 экв.) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 110°C в течение 2 ч. После завершения реакции (отслеживается ЖХ-МС), реакцию гасят добавлением воды (10 мл), выливают в делительную воронку и затем экстрагируют EtOAc (3×10 мл). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток загружают в 25 г образец и подвергают флэш-хроматографии на системе Biotage (KP-NH колонка; подвижная фаза 20-100% EtOAc/гексан; 15 объемов колонки). Фракции продукта концентрируют при пониженном давлении с получением 2-(2-амино-3-нитропиридин-4-ил)-6-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)бензилацетата в виде желтого твердого вещества (353 мг, 52%). ЖХВД: 97% чистота. МС: 473 [M+H]+.
2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2,3-диаминопиридин-4-ил)бензилацетат
2-(2-амино-3-нитропиридин-4-ил)-6-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)бензилацетат (350,00 мг; 0,74 ммоль; 1,00 экв.) растворяют в метаноле (30,00 мл; 740,59 ммоль; 999,78 экв.) и подвергают гидрированию на системе Н-Куб (1 мл/мин, 30°C, полное давление водорода) над 10% Pd/C картридже. После завершения реакции (отслеживается ЖХ-МС), раствор концентрируют при пониженном давлении с получением 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2,3-диаминопиридин-4-ил)бензилацетата в виде коричневого воскообразного твердого вещества (308 мг, 94%). Неочищенный продукт применяют в следующих реакциях без дальнейшей очистки.
2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(4-(морфолинe-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетат
В 10 мл реакционную пробирку с мешалкой добавляют раствор 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2,3-диаминопиридин-4-ил)бензилацетата (75,00 мг; 0,17 ммоль; 1,00 экв.) и 4-(морфолин-4-карбонил)бензальдегида (40,87 мг; 0,19 ммоль; 1,10 экв.) в ДМФ (2,00 мл; 25,94 ммоль; 153,04 экв.). К этой смеси затем добавляют моногидрат п-толуолсульфоновой кислоты (3,22 мг; 0,02 ммоль; 0,10 экв.). Реакционную смесь нагревают до 85°C в течение 12 ч. После завершения реакции (отслеживается ЖХ-МС), реакцию гасят добавлением воды (5 мл) и экстрагируют этилацетатом (3×10 мл). Органические фазы объединяют, промывают насыщ. водн. NaHCO3 и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Остаток растворяют и подвергают препаративной ЖХВД (система Interchim; C-18 (10 мкм) колонка, 30×150 мм) с применением подвижной фазы A (0,1% NH4OH в воде) и подвижной фазы B ((0,1% NH4OH в ацетонитриле). В способе применяют 35% подвижной фазы B в течение 1 мин, затем градиент от 35% до 95% подвижной фазы B в течение более 10 мин со скоростью потока 60 мл/мин. Продукт элюируют 59% подвижной фазой B. Фракции продукта объединяют и концентрируют с получением 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(4-(морфолин-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетата в виде белого твердого вещества (37 мг, 34% выход).
6-Циклопропил-2-(2-гидроксиметил-3-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}фенил)-3,4-дигидро-2H-изохинолин-1-он
В 10 мл реакционную пробирку с мешалкой добавляют 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(4-(морфолин-4-карбонил)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетат (37,00 мг; 0,06 ммоль; 1,00 экв.), моногидрат гидроксида лития (120,98 мг; 2,88 ммоль; 50,00 экв.), изопропанол (1,00 мл; 13,06 ммоль; 226,55 экв.), ТГФ (1,00 мл; 12,34 ммоль; 214,07 экв.) и воду (0,50 мл; 27,75 ммоль; 481,37 экв.). Реакционную смесь нагревают до 30°C при перемешивании в течение 2 ч. После завершения реакции (отслеживается ЖХ-МС), реакционную смесь разделяют между EtOAc и водой и затем экстрагируют EtOAc (3×10 мл). Органические фазы объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток загружают в 10 г образец и очищают флэш-хроматографией с применением системы Biotage (KP-Двуокись кремния колонка; подвижная фаза 2-20% MeOH/ДХМ). Фракции продукта объединяют и концентрируют досуха с получением 6-циклопропил-2-(2-гидроксиметил-3-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}фенил)-3,4-дигидро-2H-изохинолин-1-она в виде беловатого твердого вещества (27 мг, 78% выход). ЖХВД: 96% чистота. МС: 600 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,96 (с, 1H), 8,45 (д, J=5,0 Гц, 1H), 8,22 (д, J=7,9 Гц, 2H), 7,79 (д, J=8,0 Гц, 1H), 7,60 (д, J=7,9 Гц, 2H), 7,57 (д, J=7,5 Гц, 1H), 7,52 (д, J=7,6 Гц, 1H), 7,49 (д, J=7,7 Гц, 1H), 7,39 (д, J=5,0 Гц, 1H), 7,09 (д, J=8,0 Гц, 1H), 7,08 (с, 1H), 5,53 (с, 1H), 4,42-4,28 (м, 1H), 4,23 (д, J=11,4 Гц, 1H), 4,08-3,88 (м, 2H), 3,64 (с, 6H), 3,36 (с, 2H), 3,30-3,19 (м, 1H), 3,06 (дт, J=16,0, 5,1 Гц, 1H), 2,00 (тт, J=8,7, 4,9 Гц, 1H), 1,09-0,97 (м, 2H), 0,77 (кв, J=5,4 Гц, 2H).
Пример 7. 6-циклопропил-2-(2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-3,4-дигидроизохинолин-1(2H)-он (7)
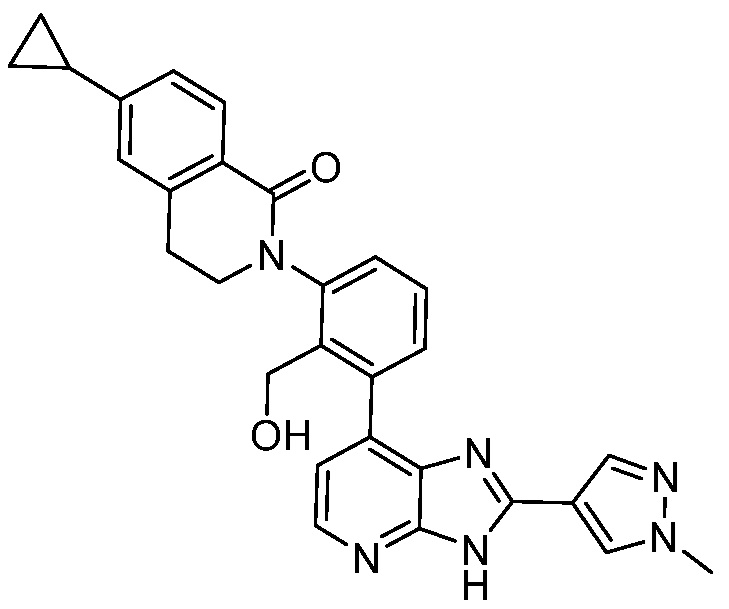
2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетат
В 10 мл реакционную пробирку с мешалкой добавляют раствор 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2,3-диаминопиридин-4-ил)бензилацетата (75,00 мг; 0,17 ммоль; 1,00 экв.) и 1-метил-1H-пиразол-4-карбальдегида (18,66 мкл; 0,19 ммоль; 1,10 экв.) в ДМФ (2,00 мл; 25,94 ммоль; 153,04 экв.). Реакционную смесь затем обрабатывают моногидратом п-толуолсульфоновой кислоты (3,22 мг; 0,02 ммоль; 0,10 экв.) и нагревают до 85°C в течение 12 ч. Реакционную смесь гасят добавлением воды (5 мл) и экстрагируют этилацетатом (3×10 мл). Органические фазы объединяют, промывают насыщенным водн. NaHCO3 и насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный продукт растворяют в ДМСО и подвергают препаративной ЖХВД (система Interchim; C-18 колонка (10 мкм), 30×150 мм; подвижная фаза A: 0,1% NH4OH в воде; подвижная фаза B: 0,1% NH4OH в ацетонитриле) с применением 35% подвижной фазы B в течение 1 мин и затем градиентом от 35% до 95% подвижной фазой B в течение более 10 мин со скоростью потока 60 мл/мин. Продукт элюируют 60% подвижной фазой B. Фракции продукта объединяют и концентрируют с получением 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетата в виде беловатого твердого вещества (30 мг, 33% выход).
6-циклопропил-2-(2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-3,4-дигидроизохинолин-1(2H)-он
В 10 мл реакционную пробирку с мешалкой добавляют 2-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетат (30,00 мг; 0,06 ммоль; 1,00 экв.), моногидрат гидроксида лития (118,19 мг; 2,82 ммоль; 50,00 экв.), изопропанол (1,00 мл; 13,06 ммоль; 231,90 экв.), ТГФ (1,00 мл; 12,34 ммоль; 219,13 экв.) и воду (0,50 мл; 27,75 ммоль; 492,73 экв.). Реакционную смесь нагревают до 30°C при перемешивании в течение 2 ч. Реакционную смесь разделяют между EtOAc и водой и экстрагируют EtOAc (3×10 мл). Органические фазы объединяют, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток загружают в 10 г образец и подвергают флэш-хроматографии на системе Biotage (KP-Двуокись кремния колонка; 2-20% MeOH/ДХМ элюент). Фракции продукта концентрируют при пониженном давлении с получением 6-циклопропил-2-(2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-3,4-дигидроизохинолин-1(2H)-она в виде беловатого твердого вещества (21 мг, 76% выход). ЖХВД: 94% чистота. МС: 491 [M+H]+, 1H ЯМР (500 МГц, ДМСО-d6) δ 13,53 (с, 1H), 8,36 (с, 1H), 8,33 (д, J=5,0 Гц, 1H), 8,06 (с, 1H), 7,78 (д, J=7,9 Гц, 1H), 7,55 (т, J=7,7 Гц, 1H), 7,45 (д, J=7,4 Гц, 2H), 7,27 (д, J=5,2 Гц, 1H), 7,11-7,05 (м, 2H), 5,71 (с, 1H), 4,29 (т, J=9,5 Гц, 1H), 4,15 (д, J=11,6 Гц, 1H), 4,05-3,85 (м, 5H), 3,29-3,21 (м, 1H), 3,05 (дт, J=16,1, 5,1 Гц, 1H), 1,99 (ддд, J=13,4, 8,6, 4,9 Гц, 1H), 1,02 (дт, J=9,1, 3,1 Гц, 2H), 0,77 (тд, J=5,9, 3,9 Гц, 2H).
Схема 4
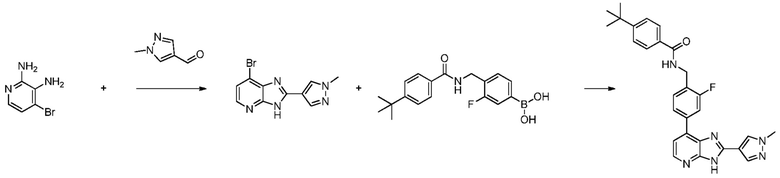
Пример 8. 4-трет-Бутил-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид (8)
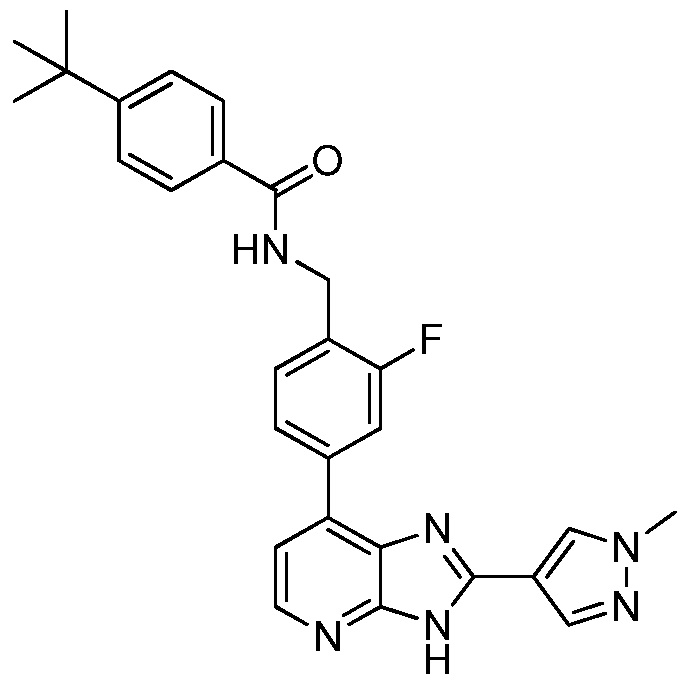
7-Бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
В 10 мл реакционную пробирку с мешалкой добавляют раствор 2,3-диамино-4-бромпиридина (75,00 мг; 0,40 ммоль; 1,00 экв.) и 1-метил-1h-пиразол-4-карбальдегида (41,93 мкл; 0,42 ммоль; 1,05 экв.) в ДМФ (2,00 мл; 25,94 ммоль; 65,03 экв.). Реакционную смесь затем обрабатывают моногидратом п-толуолсульфоновой кислоты (7,59 мг; 0,04 ммоль; 0,10 экв.) и нагревают до 85°C в течение 12 ч. После завершения реакции, смесь выливают в насыщенный водн. NaHCO3 (20 мл) и переносят в делительную воронку. Продукт экстрагируют этилацетатом (3×10 мл), промывают насыщенным водн. NaHCO3 и насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Неочищенный продукт загружают в 10 г KP-NH образец и очищают на системе Biotage флэш-хроматографией (KP-NH колонка; 2-10% MeOH/CH2Cl2 над 15 объемами колонки). Фракции продукта концентрируют с получением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина в виде бежевого твердого вещества (68% выход). ЖХВД: 99% чистота. МС: 279 [M+H]+.
[4-[[(4-трет-бутилбензоил)амино]метил]-3-фторфенил]бороновая кислота
В 20 мл реакционную пробирку добавляют 4-(аминометил)-3-фторфенилбороновую кислоту, HCl (500,00 мг; 2,43 ммоль; 1,00 экв.) и бикарбонат натрия (511,18 мг; 6,09 ммоль; 2,50 экв.). Смесь суспендируют в воде (0,80 мл; 44,41 ммоль; 18,24 экв.) и ТГФ (8,00 мл; 98,74 ммоль; 40,57 экв.) и затем охлаждают до 0°C. Реакционную смесь затем обрабатывают хлоридом 4-трет-бутилбензоила (0,49 мл; 2,68 ммоль; 1,10 экв.) и медленно нагревают до температуры окружающей среды при перемешивании в течение ночи. После завершения реакции (отслеживается ЖХ-МС), смесь концентрируют при пониженном давлении, загружают в 50 г Biotage образец и подвергают флэш-хроматографии на колонке Biotage (50 г колонка, элюируют 20-70% EtOAc/гексаном). Фракции продукта собирают, концентрируют и сушат с получением [4-[[(4-трет-бутилбензоил)амино]метил]-3-фторфенил]бороновой кислоты в виде белого твердого вещества (650 мг, 81% выход). ЖХВД: 99% чистота. МС: 330 [M+H]+.
4- трет- Бутил-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид (8)
В 5 мл реакционную пробирку с мешалкой добавляют 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (35,00 мг; 0,13 ммоль; 1,00 экв.), [4-[[(4-трет-бутилбензоил)амино]метил]-3-фторфенил]бороновую кислоту (53,85 мг; 0,16 ммоль; 1,30 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорид палладия(II) с дихлорметаном (10,28 мг; 0,01 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют раствор гидроортофосфата калия (0,25 мл; 1M; 2,00 экв.), раствор ацетата натрия (0,25 мл; 0,25 ммоль; 2,00 экв.) и АЦН (1,50 мл; 28,72 ммоль; 228,20 экв.) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 110°C в течение 2 ч. После завершения реакции (отслеживается ЖХ-МС) смесь загружают в 25 г KP-Sil образец and подвергают флэш-хроматографии с получением 4-трет-бутил-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамида в виде коричневого твердого вещества (44 мг, 72% выход). ЖХВД: 99% чистота. МС: 483 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,38 (с, 1H), 9,04 (т, J=5,8 Гц, 1H), 8,44 (с, 1H), 8,29-8,23 (м, 2H), 8,14 (д, J=10,4 Гц, 2H), 7,87 (д, J=8,2 Гц, 2H), 7,53-7,46 (м, 4H), 4,59 (д, J=5,8 Гц, 2H), 3,93 (с, 3H), 1,30 (с, 9H).
Пример 9. 4-трет-Бутил-N-{2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}бензамид (9)
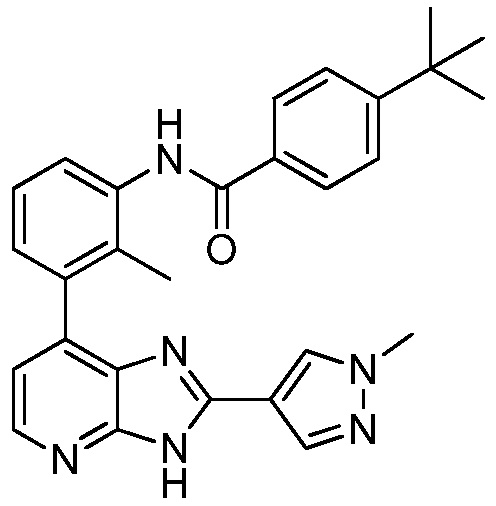
4-трет-Бутил-N-[2-метил-3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бензамид
В 20 мл реакционную пробирку добавляют 2-метил-3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фениламин (300,00 мг; 1,29 ммоль; 1,00 экв.) и бикарбонат натрия (162,16 мг; 1,93 ммоль; 1,50 экв.). Смесь суспендируют в воде (0,50 мл; 27,75 ммоль; 21,57 экв.) и ТГФ (5,00 мл; 61,71 ммоль; 47,96 экв.) и затем охлаждают до 0°C. Смесь затем обрабатывают хлоридом 4-трет-бутилбензоила (0,28 мл; 1,54 ммоль; 1,20 экв.) Реакционную смесь нагревают до температуры окружающей среды при перемешивании в течение ночи. После завершения реакции (отслеживается ЖХ-МС), неочищенный продукт подвергают флэш-хроматографии на системе Biotage (25 г колонка, с применением 10-60% EtOAc/гексан). Фракции продукта собирают и концентрируют с получением 4-трет-бутил-N-[2-метил-3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бензамида в виде белого твердого вещества (300 мг, 59% выход). ЖХВД: 99% чистота. МС: 394 [M+H]+.
4-трет-Бутил-N-{2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}бензамид (9)
В 5 мл реакционную пробирку с мешалкой добавляют 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (35,00 мг; 0,13 ммоль; 1,00 экв.), 4-трет-бутил-N-[2-метил-3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бензамид (64,35 мг; 0,16 ммоль; 1,30 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорид палладия(II) с дихлорметаном (10,28 мг; 0,01 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют гидроортофосфат калия (1M раствор, 2,00 экв.), ацетат натрия (0,25 мл; 0,25 ммоль; 2,00 экв.) и АЦН (1,50 мл; 28,72 ммоль; 228,20 экв.) через шприц. Реакционную пробирку дегазируют аргоном и затем нагревают до 110°C в течение 2 ч. После завершения реакции (отслеживается ЖХ-МС), реакционную смесь загружают в 25 г KP-Sil образец и затем подвергают флэш-хроматографии с получением 4-трет-бутил-N-{2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}бензамида в виде беловатого твердого вещества (30 мг, 51% выход). ЖХВД: 99% чистота. МС: 465 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,31 (с, 1H), 9,92 (с, 1H), 8,37 (с, 1H), 8,27 (д, J=5,0 Гц, 1H), 8,06 (с, 1H), 7,94 (д, J=8,2 Гц, 2H), 7,54 (д, J=8,2 Гц, 2H), 7,45 (д, J=7,8 Гц, 1H), 7,34 (т, J=7,8 Гц, 1H), 7,25 (д, J=7,5 Гц, 1H), 7,05 (д, J=5,0 Гц, 1H), 3,89 (с, 3H), 2,07 (с, 3H), 1,32 (с, 9H).
Пример 10. 2-(5-фтор-2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-7,7-диметил-2,3,4,6,7,8- гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-он (10)
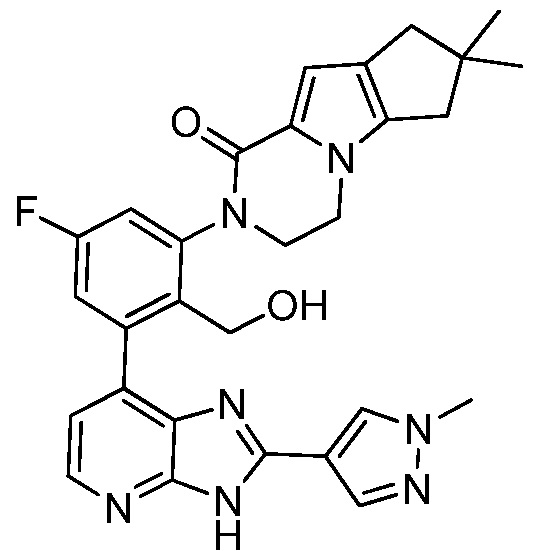
7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
К раствору 4-хлорпиридин-2,3-диамина (1,80 г, 12,5 ммоль) в ДМФ (20 мл) добавляют TPSA (410 мг, 2,38 ммоль) и 1-метил-1H-пиразол-4-карбальдегид (1,38 г, 12,5 ммоль). Смесь перемешивают при 80°C в течение 10 ч. После того, как ЖХ-МС покажет завершение реакции, реакционную смесь концентрируют при пониженном давлении с получением остатка, который очищают препаративной ЖХВД (нейтральные условия) с получением 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (1,58 г, 53,9% выход) в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6) δ: 8,49 (с, 1H), 8,22 (д, J=5,2 Гц, 1H), 8,17 (с, 1H), 7,36 (д, J=5,6 Гц, 1H), 3,95 (с, 3H).
2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-фтор-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетат
Смесь 2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-фтор-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензилацетата (600 мг, 1,21 ммоль), 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (282 мг, 1,21 ммоль), Pd(dppf)Cl2 (106 мг, 120 мкмоль), NaOAc (297 мг, 3,63 ммоль) и K3PO4 (768 мг, 3,63 ммоль) в АЦН (10 мл) и H2O (5 мл) дегазируют и продувают N2 3 раза, и затем смесь перемешивают при 110°C в течение 3 ч в атмосфере N2. После того, как ЖХ-МС покажет завершение реакции, реакционную смесь фильтруют, и растворитель концентрируют при пониженном давлении с получением 2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-фтор-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетата (300 мг, 43,6% выход), который применяют на следующей стадии без дальнейшей очистки.
2-(5-фтор-2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-7,7-диметил-2,3,4,6,7,8-гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-он
К раствору 2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-фтор-6-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензилацетата (300 мг, 528 мкмоль) в ТГФ (10 мл) добавляют раствор NaOH (21,1 мг, 528 мкмоль) в H2O (3 мл). Смесь перемешивают при 70°C в течение 1 часа. After того, как ЖХ-МС покажет завершение реакции, реакционную смесь концентрируют при пониженном давлении с получением остатка, который очищают препаративной ЖХВД (нейтральные условия) с получением 2-(5-фтор-2-(гидроксиметил)-3-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-7,7-диметил-2,3,4,6,7,8-гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-она (36 мг, 12,9% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ: 8,38 (с, 1H), 8,34 (д, J=4,8 Гц, 1H), 8,07 (с, 1H), 7,45 (д, J=7,6 Гц, 1H), 7,32-7,35 (м, 2H), 6,50 (с, 1H), 4,01-4,27 (м, 6H), 3,92 (с, 3H), 2,56 (с, 2H), 2,41 (с, 2H), 1,21 (с, 6H).
Пример 11. 2-(3-(гидроксиметил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-2-ил)-7,7-диметил-2,3,4,6,7,8-гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-он (11)
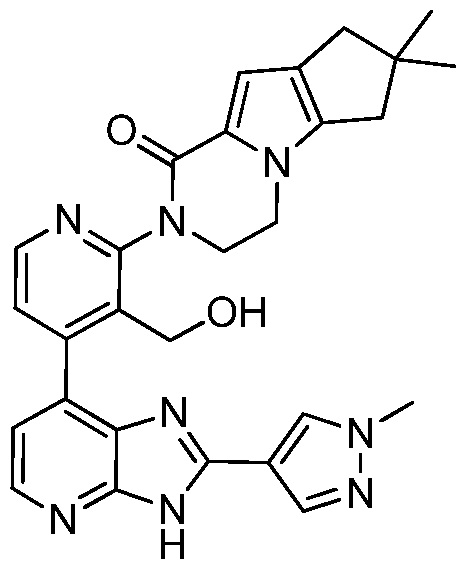
(2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-3-ил)метилацетат
Смесь (2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-3-ил)метилацетата (900,0 мг, 1,88 ммоль, 1,00 экв.), 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (438 мг, 1,88 ммоль), Pd(dppf)Cl2 (1,10 г, 1,88 ммоль), NaOAc (308 мг, 3,75 ммоль) и K3PO4 (796 мг, 3,75 ммоль) в диоксане (50 мл) дегазируют и продувают N2 3 раза и затем смесь перемешивают при 110°C в течение 2,5 ч. в атмосфере N2. После того, как ЖХ-МС покажет завершение реакции, реакционную смесь фильтруют, и растворитель концентрируют при пониженном давлении с получением (2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-3-ил)метилацетата (900 мг, 86,9% выход) в виде красного твердого вещества, который применяют на следующей стадии без дальнейшей очистки.
2-(3-(гидроксиметил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-2-ил)-7,7-диметил-2,3,4,6,7,8-гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-он
К раствору (2-(7,7-диметил-1-оксо-3,4,7,8-тетрагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-2(6H)-ил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-3-ил)метилацетата (900 мг, 1,63 ммоль) в ТГФ (10 мл) добавляют раствор NaOH (65,2 мг, 1,63 ммоль) в H2O (3 мл). Смесь перемешивают при 70°C в течение 2 ч. После того как ЖХ-МС покажет завершение реакции, реакционную смесь концентрируют при пониженном давлении с получением остатка, который очищают препаративной ЖХВД (нейтральные условия) с получением 2-(3-(гидроксиметил)-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)пиридин-2-ил)-7,7-диметил-2,3,4,6,7,8-гексагидро-1H-циклопента[4,5]пирроло[1,2-a]пиразин-1-она (37,0 мг, 4,46% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6): δ 8,58 (д, J=5,2 Гц, 1H), 8,32-8,36 (м, 2H), 8,06 (с, 1H), 7,49 (д, J=4,8 Гц, 1H), 7,28 (д, J=5,2 Гц, 1H), 6,55 (с, 1H), 4,15-4,38 (м, 5H), 3,85-3,92 (м, 4H), 2,58 (д, J=6,0 Гц, 2H), 2,43 (с, 2H), 1,22 (с, 6H).
Схема 5:
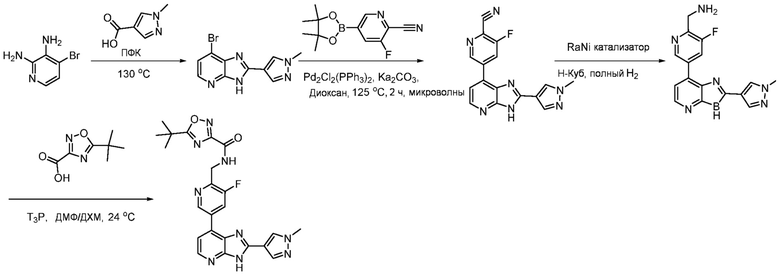 Пример 12. {3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил-[1,2,4]оксадиазол-3-карбоновой кислоты (12)
Пример 12. {3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил-[1,2,4]оксадиазол-3-карбоновой кислоты (12)
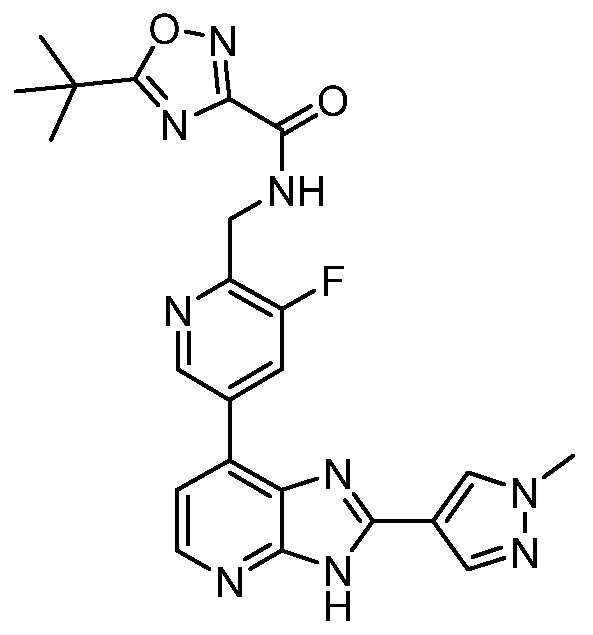
Способ C:
7-Бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
Смесь 2,3-диамино-4-бромпиридина (1000,00 мг; 5,32 ммоль; 1,00 экв.), 1-метил-1h-пиразол-4-карбоновой кислоты (737,80 мг; 5,85 ммоль; 1,10 экв.) и полифосфорной кислоты (20,00 г) нагревают при 130°C в течение ночи. ЖХ-МС анализ показывает завершение реакции. Реакционную смесь растворяют в воде/льде (25 мл) и pH доводят хлоридом аммония (1000,00 мг; 18,69 ммоль; 3,52 экв.), затем NaOH (11000,00 мг; 200,02 ммоль; 37,61 экв.) (гранулы, добавление порциями, экзотермическая реакция) до pH=7, когда продукт выпадает в осадок. Суспензию охлаждают при 5°C на льду в течение 30 мин, затем фильтруют через пластиковый фильтр. Осадок сушат в высоком вакууме с получением желаемого продукта 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (1293,00 мг; 4,65 ммоль) в виде бежевого аморфного вещества. МС: m/z=278,1 [M+H]+.
Способ D: 3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-пиридин-2-карбoнитрил
В микроволновой пробирке, содержащей 3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиколинонитрил (256,44 мг; 1,03 ммоль; 1,15 экв.), 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (250,00 мг; 0,90 ммоль; 1,00 экв.), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (36,71 мг; 0,04 ммоль; 0,05 экв.) и дикарбонат калия (496,95 мг; 3,60 ммоль; 4,00 экв.) добавляют диоксан (10,00 мл; 117,36 ммоль; 130,56 экв.) и воду (0,75 мл; 41,63 ммоль; 46,31 экв.). Раствор вакуумируют и повторно заполняют азотом два раза, затем перемешивают при 125°C в течение 2 часов в микроволновом реакторе (Biotage). ЖХ-МС-5 анализ показывает завершение реакции. Реакционную смесь фильтруют, и остаток очищают хроматографией с обращенной фазой при умеренном давлении на аппарате ARMEN-1 (основной буфер) с получением желаемого продукта 3-фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-пиридин-2-карбoнитрила в виде бежевого аморфного вещества. МС: m/z=320,2 [M+H]+.
C-{3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил}метиламин
3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-пиридин-2-карбoнитрил (287,02 мг; 0,90 ммоль; 1,00 экв.) растворяют в метаноле (100 мл) и пропускают через картридж с RaNi катализатором на Н-Кубе от ThalesNano (полный водород, температура: 35°C; поток: 1 мл/мин) с получением желаемого продукта C-{3-фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил}метиламина (90,00 мг; 0,28 ммоль), применяемого на следующей стадии синтеза как есть. МС: m/z=324,3 [M+H]+.
Способ E: {3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты
В сцинтилляционной пробирке, содержащей C-{3-фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил}метиламин (20,00 мг; 0,06 ммоль; 1,00 экв.), 5-трет-бутил-1,2,4-оксадиазол-3-карбоновую кислоту (13,16 мг; 0,08 ммоль; 1,25 экв.), ДИПЭА (0,03 мл; 0,19 ммоль; 3,00 экв.), ДХМ (10,00 мл) и ДМФ (1,00 мл) добавляют 2,4,6-триоксид 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан (0,05 мл; 0,08 ммоль; 1,25 экв.). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. ЖХ-МС-5 анализ показывает завершение реакции. Растворитель выпаривают, и остаток растворяют в метаноле/воде. Очистка хроматографией с обращенной фазой при умеренном давлении на аппарате ARMEN-1 (основной буфер; Interchim 15 мкм размер частиц 55 г C18 пластиковая колонка с обращенной фазой; поток: 30 мл/мин; градиент: 20-80% вода/ацетонитрил за 20 мин) дает желаемый продукт {3-фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (3,10 мг; 0,01 ммоль) в виде белого аморфного вещества. МС: m/z=476,2 [M+H]+.
Пример 13. {3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (13)
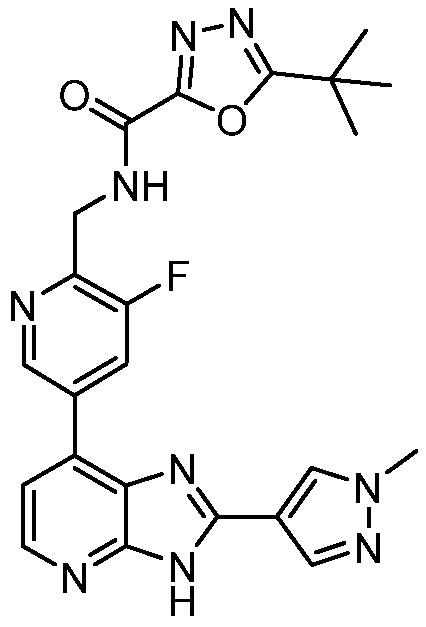
{3-Фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-илметил}амид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (2,50 мг; 0,01 ммоль) получают из C-{3-фтор-5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил}метиламина (20,00 мг; 0,06 ммоль; 1,00 экв.) и 5-трет-бутил-1,3,4-оксадиазол-2-карбоновой кислоты (10,53 мг; 0,06 ммоль; 1,00 экв.) с применением способа E из примера 12. ЖХВД: 91,5% чистота. МС: m/z=476,2 [M+H]+
Схема 6:
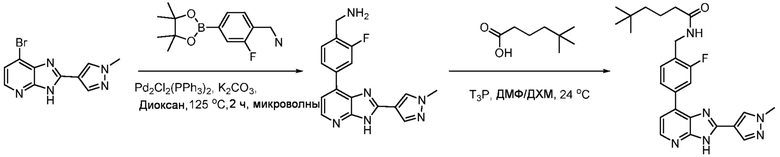
Пример 14. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5,5-диметилгексановой кислоты (14)
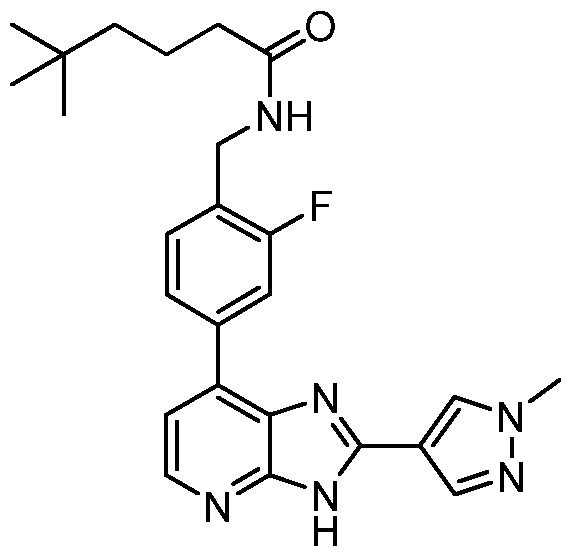
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин
В микроволновой пробирке, содержащей 4-(аминометил)-3-фторфенилбороновую кислоту, соль HCl (221,59 мг; 1,08 ммоль; 1,20 экв.), 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (250,00 мг; 0,90 ммоль; 1,00 экв.), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (36,71 мг; 0,04 ммоль; 0,05 экв.) и дикарбонат калия (496,95 мг; 3,60 ммоль; 4,00 экв.) добавляют диоксан (7,00 мл; 117,36 ммоль; 130,55 экв.) и воду (0,75 мл; 41,63 ммоль; 46,31 экв.). Раствор вакуумируют и повторно заполняют азотом два раза, затем перемешивают при 125°C в течение 2 ч в микроволновом реакторе (Biotage). Реакционную смесь очищают хроматографией с обращенной фазой при умеренном давлении с получением желаемого продукта 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (256,00 мг; 0,79 ммоль) в виде темно-коричневого твердого вещества. ЖХВД: 95,0% чистота. МС: m/z=323,2 [M+H]+
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5,5-диметилгексановой кислоты
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5,5-диметилгексановой кислоты (27,70 мг; 0,06 ммоль) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,00 мг; 0,08 ммоль; 1,00 экв.) и 5,5-диметилгексановой кислоты (12,30 мг; 0,09 ммоль; 1,10 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=449,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,44 (с, 1H), 8,37 (т, J=5,8 Гц, 1H), 8,33-8,00 (м, 4H), 7,48 (м, 2H), 4,38 (д, J=5,8 Гц, 2H), 3,96 (с, 3H), 2,15 (т, J=7,4 Гц, 2H), 1,62-1,41 (м, 2H), 1,26-1,07 (м, 2H), 0,87 (с, 9H).
Пример 15. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 4-трет-бутилциклогексанкарбоновой кислоты (15)
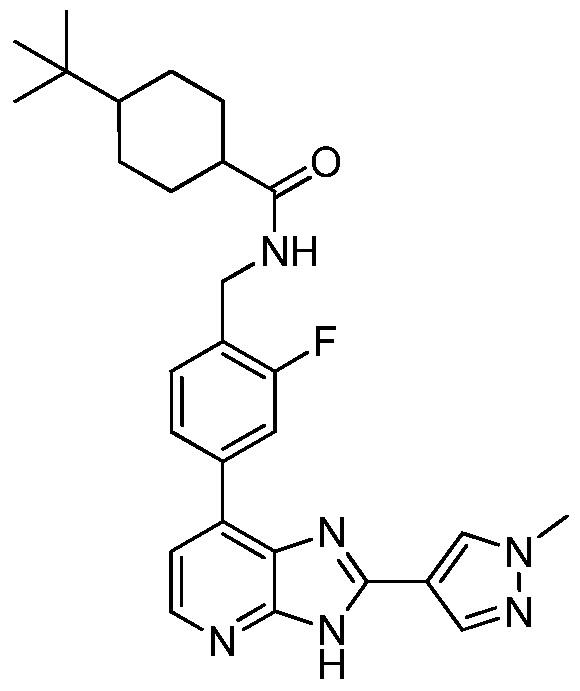
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид (15,60 мг; 0,03 ммоль, 41,2% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,00 мг; 0,08 ммоль; 1,00 экв.) и 4-трет-бутилциклогексанкарбоновой кислоты (17,86 мг; 0,10 ммоль; 1,25 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=489,5 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,37-8,06 (м, 4H), 7,70-7,30 (м, 3H), 4,39 (дд, J=11,4, 5,7 Гц, 2H), 3,96 (с, 4H), 2,27-2,01 (м, 1H), 1,94-1,70 (м, 4H), 1,59-1,21 (м, 3H), 1,10-0,90 (м, 4H), 0,90-0,74 (м, 11H).
Пример 16. 4-Циклопентил-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бутирамид (16)
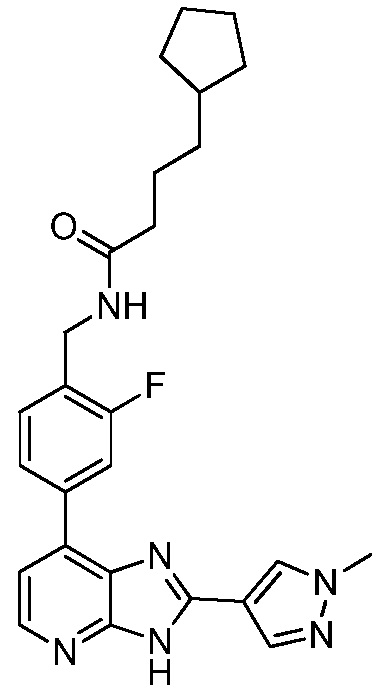
4-Циклопентил-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бутирамид (26,00 мг; 0,06 ммоль, 72,8% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,00 мг; 0,08 ммоль; 1,00 экв.) и 4-циклопентилмасляной кислоты (13,3 мг; 0,09 ммоль; 1,1 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=461,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,45 (с, 1H), 8,37 (т, J=5,8 Гц, 1H), 8,27 (дд, J=17,3, 8,1 Гц, 2H), 8,15 (с, 1H), 7,65-7,33 (м, 2H), 4,38 (д, J=5,8 Гц, 2H), 3,96 (с, 3H), 2,17 (т, J=7,4 Гц, 2H), 1,86-1,64 (м, 3H), 1,64-1,34 (м, 5H), 1,34-1,15 (м, 2H), 1,05 (м, 2H).
Пример 17. N-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-4-трифторметоксибензамид (17)
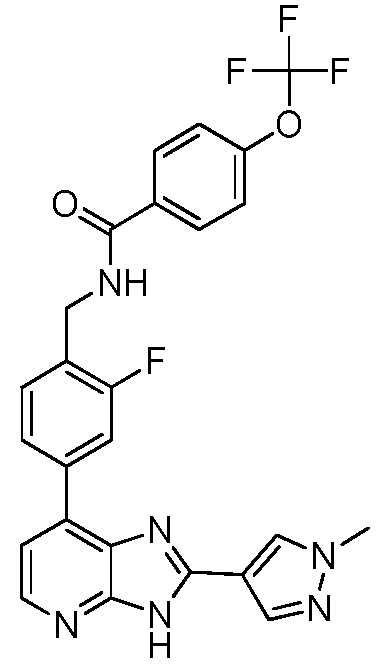
N-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-4-трифторметоксибензамид (21,5 мг, 0,05 нмоль, 81,1% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,00 мг; 0,08 ммоль; 1,00 экв.) и хлорида 4-(трифторметокси)бензоила (20,9 мг; 0,09 ммоль; 1,2 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=511,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 10,20 (с, 0H), 9,26 (т, J=5,7 Гц, 1H), 8,46 (с, 1H), 8,41-8,24 (м, 2H), 8,16 (д, J=7,4 Гц, 2H), 8,13-7,99 (м, 2H), 7,71-7,37 (м, 4H), 4,62 (д, J=5,7 Гц, 2H), 3,95 (с, 3H).
Пример 18. N-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-4-трифторметоксибензамид (18)
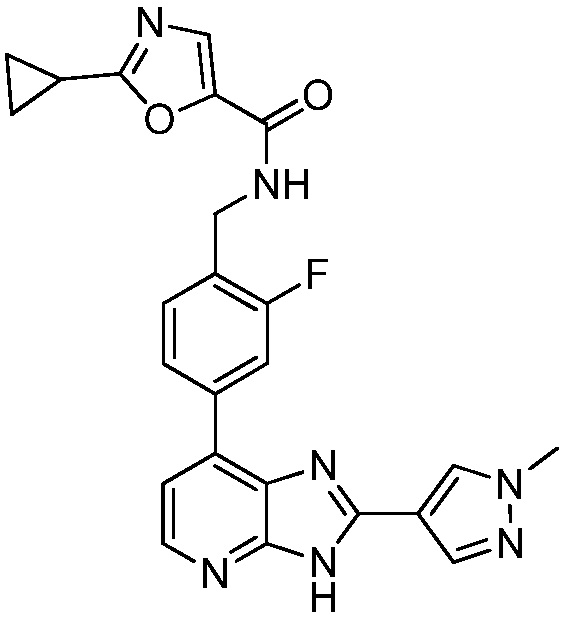
N-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-4-трифторметоксибензамид (21,0 мг, 0,05 ммоль, 59,2% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,00 мг; 0,08 ммоль; 1,00 экв.) и 2-циклопропилоксазол-5-карбоновой кислоты (14,3 мг; 0,09 ммоль; 1,2 экв.) с применением способа E из примера 12. ЖХВД: 98,0% чистота. МС: m/z=458,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,38 (с, 1H), 8,24 (д, J=5,1 Гц, 1H), 8,21-8,09 (м, 2H), 8,09-7,98 (м, 1H), 7,62 (с, 1H), 7,50 (т, J=8,1 Гц, 1H), 7,41 (д, J=5,2 Гц, 1H), 4,55 (с, 2H), 3,93 (с, 3H), 2,25-2,02 (м, 1H), 1,07 (ддт, J=13,6, 7,2, 2,4 Гц, 4H).
Пример 19. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-метоксипиридин-2-карбоновой кислоты (19)
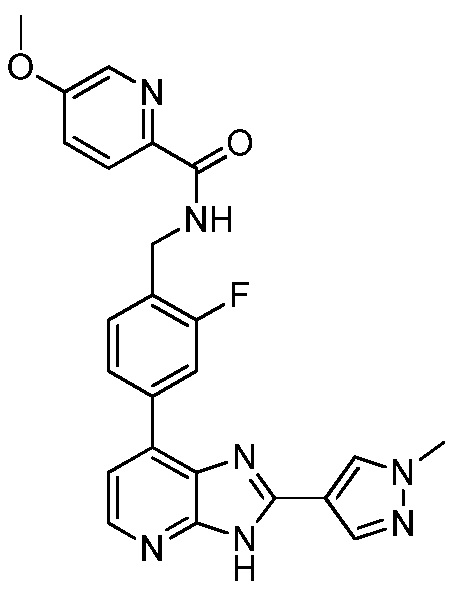
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-метоксипиридин-2-карбоновой кислоты (15,1 мг, 0,03 ммоль, 56,0% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (19,0 мг; 0,06 ммоль; 1,00 экв.) и 5-метоксипиридин-2-карбоновой кислоты (10,8 мг; 0,07 ммоль; 1,2 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=458,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,20 (т, J=6,3 Гц, 1H), 8,45 (с, 1H), 8,36 (д, J=2,9 Гц, 1H), 8,29 (д, J=5,2 Гц, 1H), 8,18-7,94 (м, 2H), 7,58 (дд, J=8,8, 2,9 Гц, 1H), 7,50 (т, J=8,0 Гц, 2H), 4,63 (д, J=6,3 Гц, 2H), 3,95 (с, 3H), 3,93 (с, 3H).
Пример 20. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 1-этил-1H-пиразол-4-карбоновой кислоты (20)
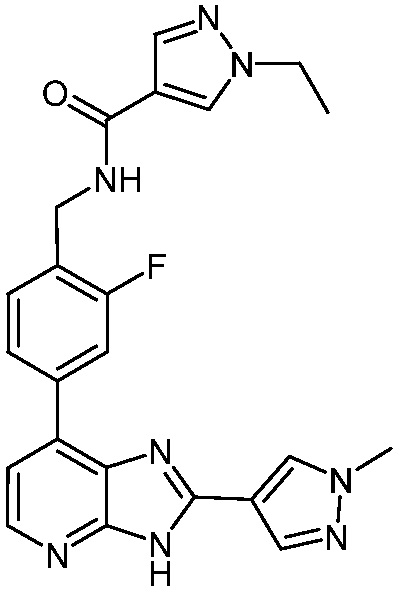
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 1-этил-1H-пиразол-4-карбоновой кислоты (21,6 мг, 0,05 ммоль, 62,7% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,0 мг; 0,08 ммоль; 1,00 экв.) и 1-этил-1h-пиразол-4-карбоновой кислоты (11,9 мг; 0,09 ммоль; 1,1 экв.) с применением способа E из примера 12. ЖХВД: 98,0% чистота. МС: m/z=445,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,65 (т, J=5,8 Гц, 1H), 8,44 (с, 1H), 8,37-8,19 (м, 2H), 8,14 (с, 2H), 7,92 (с, 1H), 7,64-7,37 (м, 2H), 4,54 (д, J=5,8 Гц, 2H), 4,17 (кв, J=7,3 Гц, 2H), 3,95 (с, 3H), 1,39 (т, J=7,3 Гц, 3H).
Пример 21. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 4,4-диметилпентановой кислоты (21)
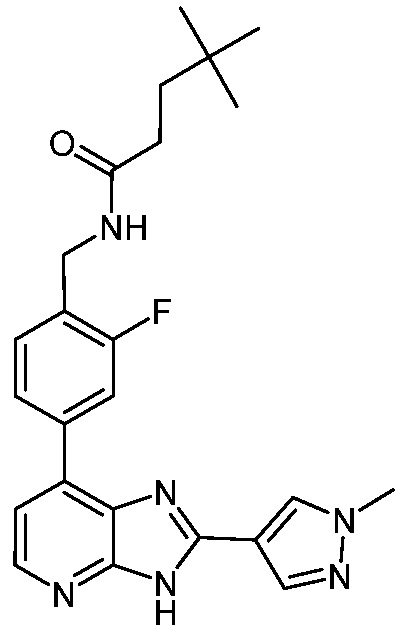
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 4,4-диметилпентановой кислоты (25,8 мг, 0,06 ммоль, 76,6% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,0 мг; 0,08 ммоль; 1,00 экв.) и 4,4-диметилпентановой кислоты (11,1 мг; 0,09 ммоль; 1,1 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=435,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,45 (с, 1H), 8,39 (т, J=5,6 Гц, 1H), 8,34-8,21 (м, 2H), 8,14 (д, J=7,9 Гц, 2H), 7,70-7,29 (м, 2H), 4,37 (д, J=5,7 Гц, 2H), 2,26-2,03 (м, 2H), 1,58-1,33 (м, 2H), 0,88 (с, 9H).
Пример 22. 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 2-трифторметилтиазол-4-карбоновой кислоты (22)
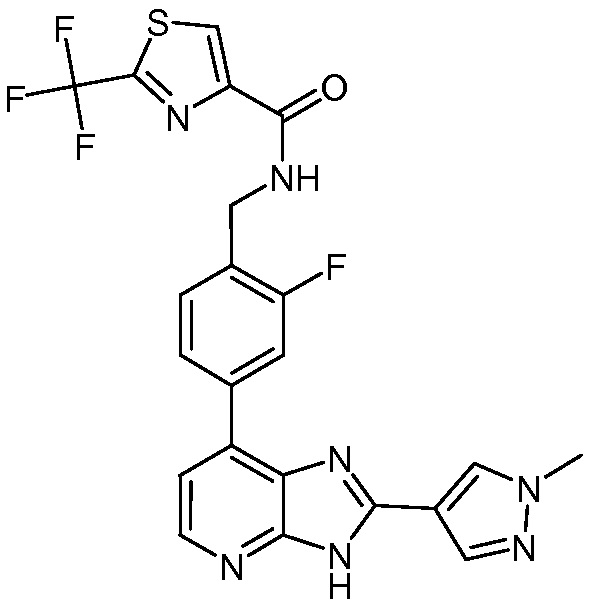
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 2-трифторметилтиазол-4-карбоновой кислоты (11,5 мг, 0,02 ммоль, 29,6% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,0 мг; 0,08 ммоль; 1,00 экв.) и 2-(трифторметил)-1,3-тиазол-4-карбоновой кислоты (18,4 мг; 0,09 ммоль; 1,2 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=435,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,29 (т, J=6,1 Гц, 1H), 8,75 (с, 1H), 8,46 (с, 1H), 8,27 (дд, J=17,1, 5,9 Гц, 1H), 8,15 (с, 1H), 7,53 (т, J=7,9 Гц, 2H), 4,62 (д, J=6,1 Гц, 2H), 3,95 (с, 3H).
Пример 23. 3-трет-Бутокси-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}пропионамид (23)
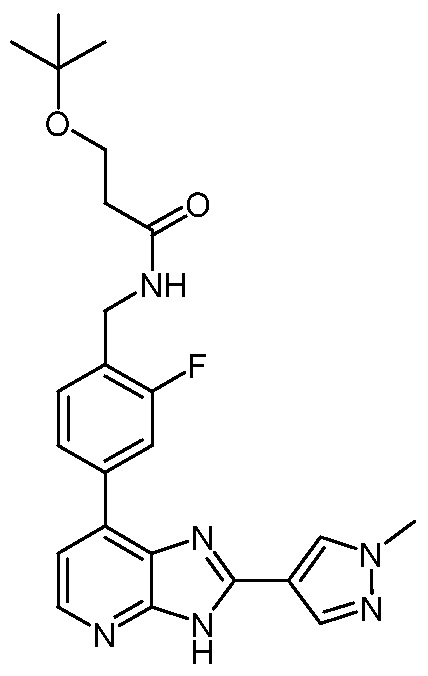
3-трет-Бутокси-N-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}пропионамид (21,2 мг, 0,05 ммоль, 60,7% выход) получают из 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (25,0 мг; 0,08 ммоль; 1,00 экв.) и 2-(трифторметил)-1,3-тиазол-4-карбоновой кислоты (18,4 мг; 0,09 ммоль; 1,2 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=451,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,40 (т, J=5,9 Гц, 1H), 8,29 (д, J=5,2 Гц, 1H), 8,14 (д, J=0,7 Гц, 1H), 7,52 (т, J=8,1 Гц, 2H), 4,40 (д, J=5,8 Гц, 2H), 3,96 (с, 3H), 3,58 (т, J=6,3 Гц, 2H), 2,36 (т, J=6,3 Гц, 2H), 1,16 (с, 9H).
Пример 24. 4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (24)
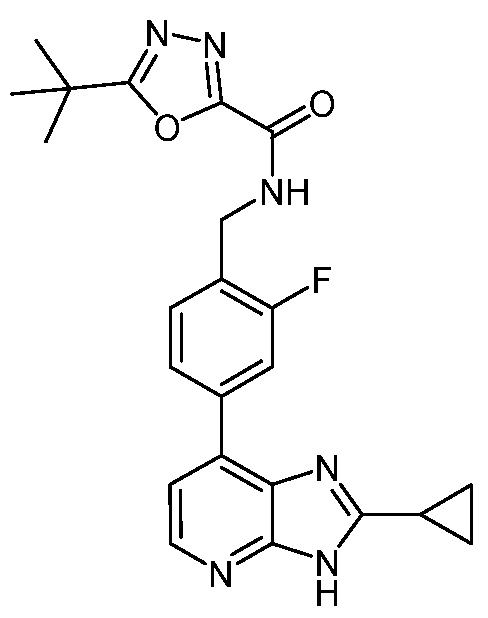
7-Хлор-2-циклопропил-3H-имидазо[4,5-b]пиридин
7-Хлор-2-циклопропил-3H-имидазо[4,5-b]пиридин (255,0 мг, 1,32 ммоль, 63,0% выход) получают из 4-хлорпиридин-2,3-диамина (300,0 мг, 2,1 ммоль, 1 экв.) и циклопропанкарбоновой кислоты (269,83 мг, 3,13 ммоль, 1,5 экв.) с применением способа C из примера 12. ЖХВД: 94,0% чистота. МС: m/z=194,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,12 (с, 1H, обм.), 8,14 (д, J=5,3 Гц, 1H), 7,27 (д, J=5,3 Гц, 1H), 2,16 (тт, J=7,7, 5,3 Гц, 1H), 1,13 (дтд, J=7,5, 4,2, 2,0 Гц, 4H).
4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фтор-бензиламин
4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фтор-бензиламин (168,4 мг, 0,6 ммоль, 66,0% выход) получают из 7-хлор-2-циклопропил-3H-имидазо[4,5-b]пиридина (175,0 мг, 0,9 ммоль, 1 экв.) и 4-(аминометил)-3-фторфенилбороновой кислоты, соли HCl (222,8 мг, 1,1 ммоль, 1,2 экв.) с применением способа D из примера 12. ЖХВД: 91,0% чистота. МС: m/z=283,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,40-7,87 (м, 2H), 7,64 (т, J=8,1 Гц, 1H), 7,48 (с, 1H), 3,85 (с, 2H), 2,28-2,09 (м, 1H), 1,13 (д, J=6,7 Гц, 4H).
4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (17,5 мг, 0,04 ммоль, 45,4% выход) получают из 4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламина (25,0 мг, 0,09 ммоль, 1,0 экв.) и 5-трет-бутил-1,3,4-оксадиазол-2-карбоновой кислоты (18,1 мг, 0,1 ммоль, 1,2 экв.) с применением способа E из примера 12. ЖХВД: 92,0% чистота. МС: m/z=435,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,84 (с, 1H), 8,50-8,15 (м, 2H), 8,09 (д, J=8,1 Гц, 1H), 7,77-7,40 (м, 2H), 4,58 (д, J=5,7 Гц, 2H), 2,19 (тд, J=9,0, 7,8, 4,5 Гц, 1H), 1,41 (с, 9H), 1,13 (м, 4H).
Пример 25. 6-трет-Бутил-N-[4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил]никотинамид (25)

6-трет-Бутил-N-[4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил]никотинамид (23,4 мг, 0,05 ммоль, 49,7% выход) получают с применением 4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламина (30 мг, 0,1 ммоль, 1 экв.) и 6-трет-бутилникотиновой кислоты (23,8 мг, 0,13 ммоль, 1,25 экв.) с применением способа E из примера 12. ЖХВД: 95,5% чистота. МС: m/z=444,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,21 (т, J=5,8 Гц, 1H), 9,01 (дд, J=2,5, 0,9 Гц, 1H), 8,36-7,92 (м, 4H), 7,66-7,31 (м, 3H), 4,61 (д, J=5,7 Гц, 2H), 2,19 (тт, J=7,6, 6,1 Гц, 1H), 1,35 (с, 9H), 1,18-1,03 (м, 4H).
Пример 26. 4-трет-Бутил-N-[4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил]бензамид (26)
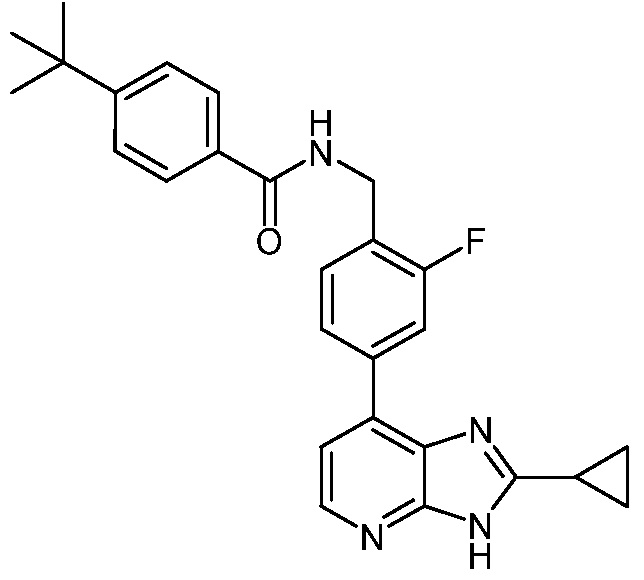
4-трет-Бутил-N-[4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил]бензамид получают с применением 4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламина (20 мг, 0,07 ммоль, 1 экв.) и хлорида 4-трет-бутилбензоила (17,42 мг, 0,09 ммоль, 1,25 экв.) с применением способа E из примера 12. ЖХВД: 93,7% чистота. МС: m/z=443,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,02 (с, 1H), 8,36-8,16 (м, 1H), 8,07 (д, J=8,0 Гц, 1H), 7,97-7,82 (м, 2H), 7,68-7,35 (м, 3H), 4,59 (д, J=5,7 Гц, 2H), 2,19 (п, J=6,7 Гц, 1H), 1,32 (с, 9H), 1,17-1,02 (м, 4H).
Пример 27. 4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (27)
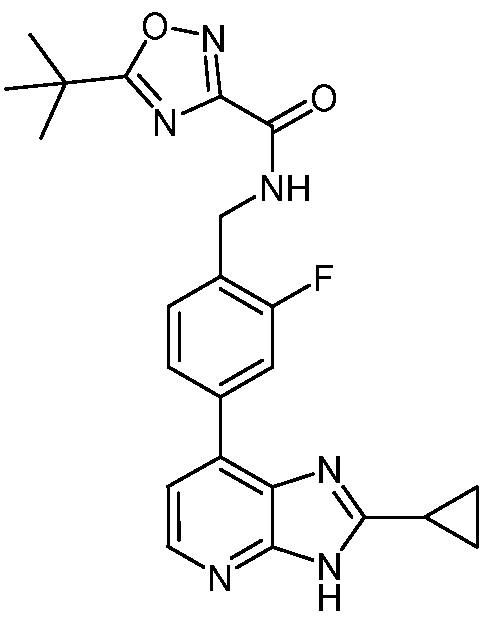
4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты получают с применением 4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламина (25,0 мг, 0,09 ммоль, 1 экв.) и 5-трет-бутил-1,2,4-оксадиазол-3-карбоновой кислоты (18,84 мг, 0,11 ммоль, 1,25 экв.) с применением способа E из примера 12. ЖХВД: 95,4% чистота. МС: m/z=435,4 [M+H]+.
Пример 28. 4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (28)

4-(2-Циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (13,0 мг, 0,03 ммоль, 33,8% выход) получают с применением 4-(2-циклопропил-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензиламина (25,0 мг, 0,09 ммоль, 1 экв.) и 3-трет-бутил-1,2,4-оксадиазол-5-карбоновой кислоты (18,1 мг, 0,11 ммоль, 1,2 экв.) с применением способа E из примера 12. ЖХВД: 96,0% чистота. МС: m/z=435,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,91 (с, 1H), 8,38-7,91 (м, 2H), 7,80-7,24 (м, 2H), 4,59 (с, 2H), 2,24-2,11 (м, 1H), 1,37 (с, 9H), 1,13 (м, 4H).
Пример 29. 2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутилизоксазол-3-карбоновой кислоты (29)
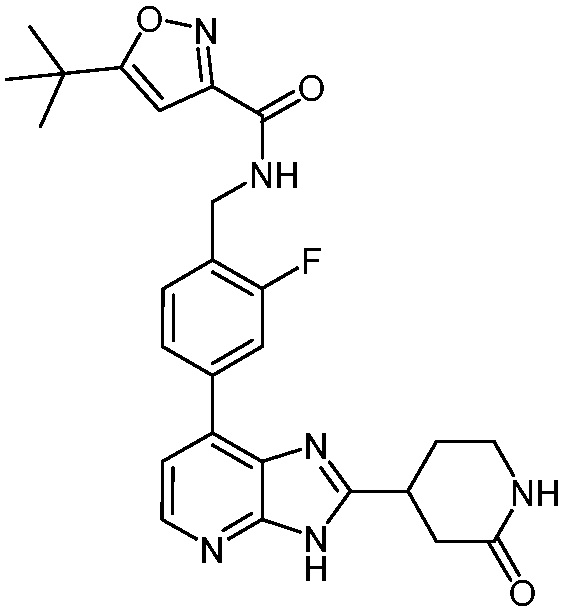
4-(7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил)пиперидин-2-он
4-(7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил)пиперидин-2-он (519 мг, 2,1 ммоль, 99,1% выход) получают из 4-хлорпиридин-2,3-диамина (300,0 мг, 2,1 ммоль, 1 экв.) и 2-оксопиперидин-4-карбоновой кислоты (358,9 мг, 2,5 ммоль, 1,2 экв.) с применением способа C из примера 12. ЖХВД: 94,0% чистота. МС: m/z=251,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,23 (д, J=5,3 Гц, 1H), 7,60 (с, 1H), 7,34 (д, J=5,3 Гц, 1H), 3,63-3,04 (м, 3H), 2,62 (д, J=7,8 Гц, 2H), 2,21 (м, 1H), 2,09-1,82 (м, 1H).
4-[7-(4-Аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиперидин-2-он
4-[7-(4-Аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиперидин-2-он (128,2 мг, 0,38 ммоль, 54,1% выход) получают из 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)пиперидин-2-она (175,0 мг, 0,7 ммоль, 1 экв.) и 4-(аминометил)-3-фторфенилбороновой кислоты, соли HCl (172,1 мг, 1,2 ммоль, 1,2 экв.) с применением способа D из примера 12. ЖХВД: 99,0% чистота. МС: m/z=340,1 [M+H]+.
2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутилизоксазол-3-карбоновой кислоты
2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-бензиламид 5-трет-бутилизоксазол-3-карбоновой кислоты (23,0 мг, 0,05 ммоль, 53,0% выход) получают с применением 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиперидин-2-она (30,0 мг, 0,09 ммоль, 1,0 экв.) и 5-трет-бутилизоксазол-3-карбоновой кислоты (15,0 мг, 0,09 ммоль, 1,0 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=491,5 [M+H]+.
Пример 30. 2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (30)
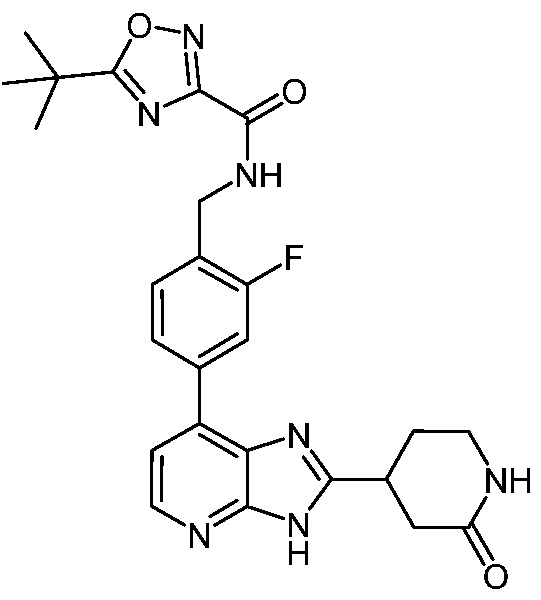
2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (7,0 мг, 0,01 ммоль, 16,1% выход) получают с применением 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиперидин-2-она (30,0 мг, 0,09 ммоль, 1,0 экв.) и 5-трет-бутил-1,2,4-оксадиазол-3-карбоновой кислоты (13,5 мг, 0,08 ммоль, 0,9 экв.) с применением способа E из примера 12. ЖХВД: 99,0% чистота. МС: m/z=492,5 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,52 (т, J=6,0 Гц, 1H), 8,46-7,91 (м, 3H), 7,79-7,40 (м, 3H), 4,59 (д, J=5,8 Гц, 2H), 3,33 (м, 3H), 2,72-2,55 (м, 1H), 2,32-1,87 (м, 2H), 1,44 (с, 9H).
Пример 31. 2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (31)
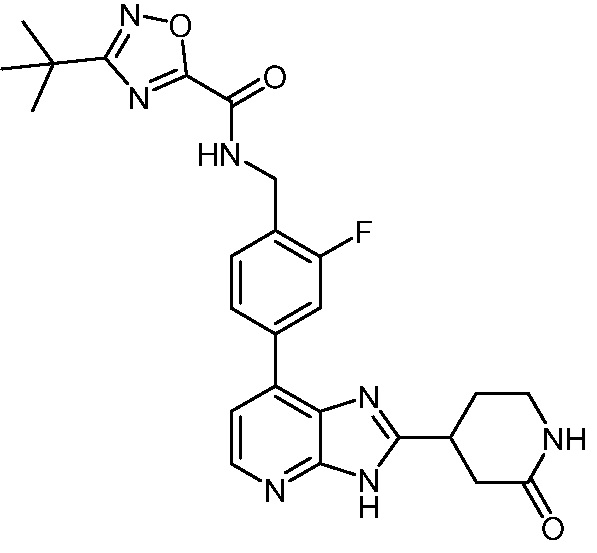
2-Фтор-4-[2-(2-оксопиперидин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (15,0 мг, 0,03 ммоль, 25,5% выход) получают с применением 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиперидин-2-она (30,0 мг, 0,12 ммоль, 1,0 экв.) и [4-[[(3-трет-бутил-1,2,4-оксадиазол-5-карбонил)амино]метил]-3-фторфенил]бороновой кислоты (38,4 мг, 0,12 ммоль, 1,0 экв.) с применением способа E из примера 12. ЖХВД: 95,0% чистота. МС: m/z=492,4 [M+H]+.
Пример 32. {2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}метанол (32)
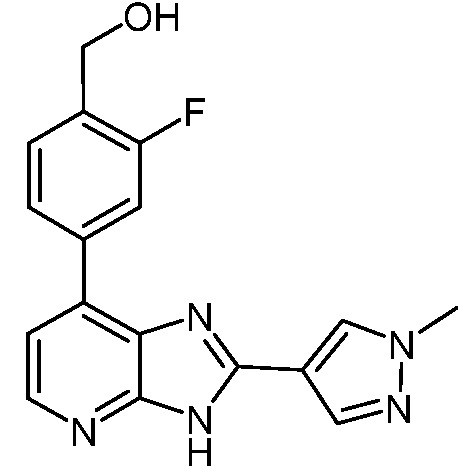
{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}метанол (60,0 мг, 0,19 ммоль, 51,6% выход) получают из 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (100,0 мг, 0,36 ммоль, 1 экв.) и (3-фтор-4-(гидроксиметил)фенил)бороновой кислоты (170,0 мг, 1,2 ммоль, 1,2 экв.) с применением способа D из примера 12. ЖХВД: 98,0% чистота. МС: m/z=324,3 [M+H]+.
Схема 7
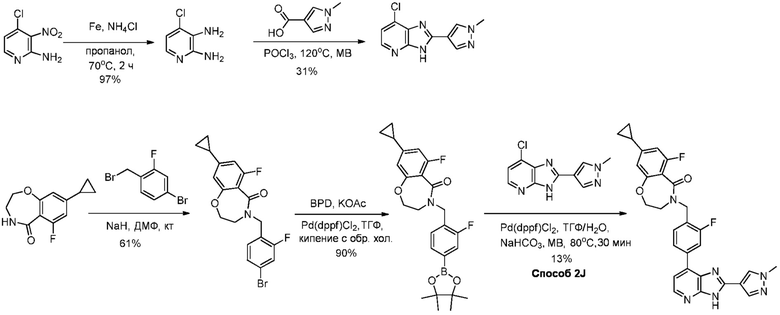
Пример 34. 8-Циклопропил-6-фтор-4-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (34)
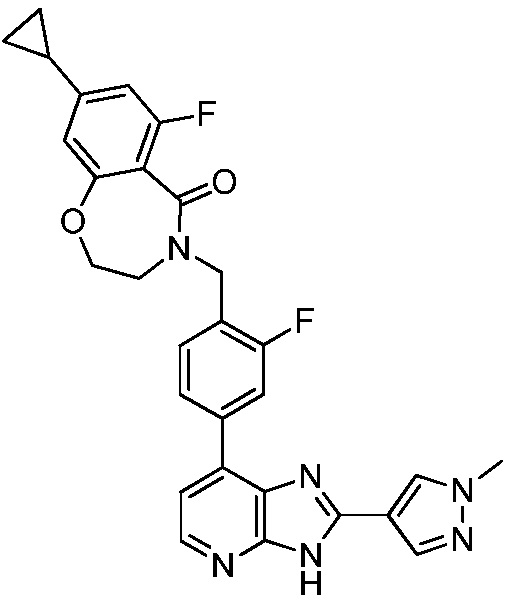
4-Хлорпиридин-2,3-диамин:
В 100-мл круглодонной колбе, 4-хлор-3-нитропиридин-2-амин (2 г, 11,52 ммоль, 1,00 эквив.) растворяют в пропаноле (20 мл) и воде (10 мл), туда добавляют порошок Fe (3,23 г, 57,84 ммоль, 5,02 эквив.) и NH4Cl (3,06 г, 57,21 ммоль, 4,96 эквив.) последовательно, при комнатной температуре. Полученную смесь перемешивают в течение 2 ч. при 70°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры и фильтруют через слой Целита. Фильтрат концентрируют при пониженном давлении с получением 4-хлорпиридин-2,3-диамина (1,6 г, 97%) в виде черного твердого вещества.
4-[7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил]-1-метил-1H-пиразол
В 30-мл герметично закрытой пробирке, 4-хлорпиридин-2,3-диамин (300 мг, 2,09 ммоль, 1,00 эквив.) и 1-метил-1H-пиразол-4-карбоновую кислоту (264 мг, 2,09 ммоль, 1,00 эквив.) смешивают в POCl3 (8 мл) при комнатной температуре. Смесь облучают микроволнами в течение 30 мин при 120°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, метанол в воде, от 0% до 50% градиент за 20 мин; определитель, УФ 254 нм. 4-[7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил]-1-метил-1H-пиразол (50 мг, 31%) получают в виде коричневого твердого вещества.
4-[(4-Бром-2-фторфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 50-мл круглодонной колбе, 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (400 мг, 1,81 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (8 мл), туда добавляют гидрид натрия (60% в масле, 144,8 мг, 3,62 ммоль, 2,00 эквив.) медленно при 0°C. Смесь перемешивают в течение 1 ч при комнатной температуре и затем снова охлаждают до 0°C и добавляют 4-бром-1-(бромметил)-2-фторбензол (577,7 мг, 2,16 ммоль, 1,19 эквив.). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 4 ч при комнатной температуре. После завершения реакции, ее гасят 20 мл воды, и смесь экстрагируют этилацетатом (3×30 мл). Объединенный органический слой сушат над сульфатом натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 10% до 60% градиент) с получением 4-[(4-бром-2-фторфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (450 мг, 61%) в виде белого твердого вещества. МС: m/z=408,1 [M+H]+.
8-Циклопропил-6-фтор-4-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 30-мл герметично закрытой пробирке, 4-[(4-бром-2-фторфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (200 мг, 0,49 ммоль, 1,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (149,8 мг, 0,59 ммоль, 1,20 эквив.), Pd(dppf)Cl2.CH2Cl2 (40,9 мг, 0,05 ммоль, 0,10 эквив.) и KOAc (96,1 мг, 0,98 ммоль, 2,00 эквив.) смешивают в диоксане (8 мл) при комнатной температуре. Полученную смесь перемешивают в течение 5 ч. при 90°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 30 мл воды и экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 8-циклопропил-6-фтор-4-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (200 мг, 90%) в виде желтого масла.
Способ 2J: 8-Циклопропил-6-фтор-4-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 30-мл герметично закрытой пробирке, продутой и имеющей инертную атмосферу азота, 8-циклопропил-6-фтор-4-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (200 мг, 0,44 ммоль, 1,00 эквив.), 4-[7-хлор-3H-имидазо[4,5-b]пиридин-2-ил]-1-метил-1H-пиразол (112,7 мг, 0,48 ммоль, 1,10 эквив.), карбонат натрия (98,3 мг, 0,93 ммоль, 2,11 эквив.) и Pd(dppf)Cl2.CH2Cl2 (35,9 мг, 0,04 ммоль, 0,10 эквив.) смешивают в тетрагидрофуране (18 мл) и воде(2 мл) при комнатной температуре. Реакционную смесь облучают микроволнами в течение 1 ч. при 90°C. После завершения реакции, реакцию гасят 15 мл воды, и полученную смесь экстрагируют этилацетатом (3×50 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм × 150 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3); от 33% до 46% градиент за 8 мин; определитель, УФ 254 нм. 8-циклопропил-6-фтор-4-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (30 мг, 13%) получают в виде беловатого твердого вещества. ЖХВД: 99,1% чистота. МС: m/z=527,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 8,44 (с, 1H), 8,37-8,16 (м, 3H), 8,14 (д, J=6,7 Гц, 1H), 7,53-7,51 (м, 2H), 6,92-6,73 (м, 1H), 6,68 (с, 1H), 4,86 (с, 2H), 4,43-4,13 (м, 2H), 3,93 (с, 3H), 3,71-3,51 (м, 2H), 2,01-1,95 (м, 1H),1,10-0,94 (м, 2H), 0,85-0,57 (м, 2H).
Схема 8
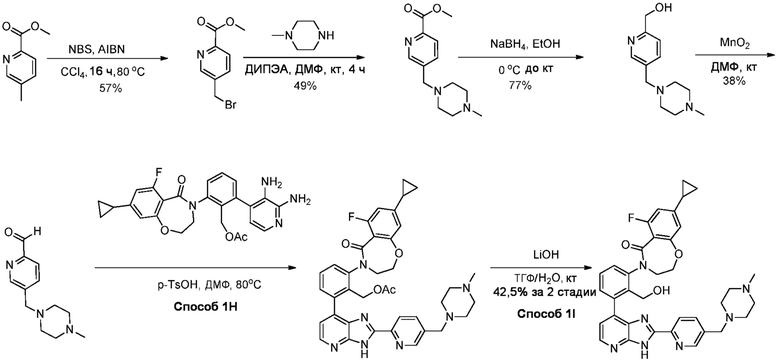
Пример 35. 8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (35)
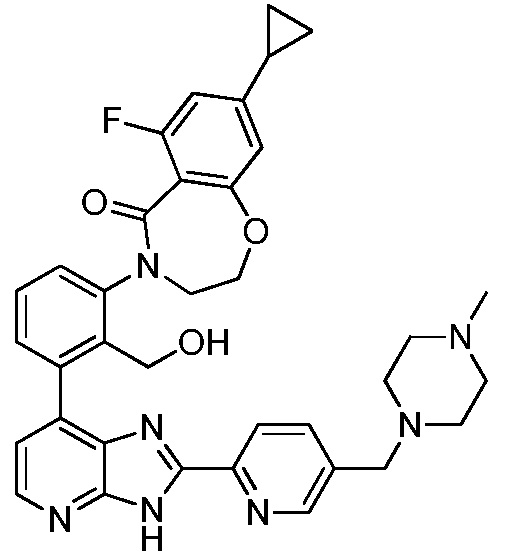
5-(Бромметил)пиридин-2-карбоксилат
В 500-мл круглодонная колба, NBS (14,13 г, 79,38 ммоль, 1,20 эквив.) и AIBN (217 мг, 1,32 ммоль, 0,02 эквив.) добавляют к раствору метила 5-метилпиридин-2-карбоксилата (10 г, 66,15 ммоль, 1,00 эквив.) в CCl4 (200 мл) при комнатной температуре. Полученный раствор перемешивают в течение 16 ч. при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 25% градиент) с получением метила 5-(бромметил)пиридин-2-карбоксилата (9,6 г, 57%) в виде желтого твердого вещества. МС: m/z=229,9 [M+H]+.
Метил 5-[(4-метилпиперазин-1-ил)метил]пиридин-2-карбоксилат
В 50-мл круглодонной колбе с магнитной мешалкой, метил 5-(бромметил)пиридин-2-карбоксилат (940 мг, 4,09 ммоль, 1,00 эквив.) и 1-метилпиперазин (449,6 мг, 4,49 ммоль, 1,10 эквив.) растворяют в АЦН (10 мл), туда добавляют ДИЭА (790,8 мг, 6,12 ммоль, 1,50 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 4 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением метила 5-[(4-метилпиперазин-1-ил)метил]пиридин-2-карбоксилата (500 мг, 49%) в виде коричневого твердого вещества.
[5-[(4-Метилпиперазин-1-ил)метил]пиридин-2-ил]метанол
В 25-мл круглодонной колбе, метил 5-[(4-метилпиперазин-1-ил)метил]пиридин-2-карбоксилат (1,00 г, 4,01 ммоль, 1,00 эквив.) растворяют в этаноле (5 мл) при 0°C. Затем медленно добавляют NaBH4 (455,2 мг, 12,03 ммоль, 3,00 эквив.) при 0°C. Полученную смесь перемешивают в течение 12 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 15 мл насыщ. раствора NH4Cl, и смесь экстрагируют этилацетатом (3×50 мл). Органические слои объединяют и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, метанол в воде, от 0% до 99% градиент за 15 мин; определитель, УФ 254 нм. [5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]метанол (720 мг, 77%) получают в виде белого твердого вещества.
5-[(4-Метилпиперазин-1-ил)метил]пиридин-2-карбальдегид
В 50-мл круглодонной колбе, MnO2 (5,89 г, 67,75 ммоль, 50,0 эквив.) добавляют к раствору [5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]метанола (300 мг, 1,36 ммоль, 1,00 эквив.) в ДМФ (20 мл) при комнатной температуре. Полученный раствор перемешивают в течение 12 ч при комнатной температуре. После завершения реакции, нерастворимые твердые вещества в реакционной смеси фильтруют, и фильтрат концентрируют при пониженном давлении с получением 5-[(4-метилпиперазин-1-ил)метил]пиридин-2-карбальдегида (120 мг, 38%) в виде белого твердого вещества.
8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
8-циклопропил-6-фтор-4-[2-(гидроксиметил)-3-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 60 мг (42,5% за две стадии) получают из [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата и [(4-метилпиперазин-1-ил)метил]пиридин-2-карбальдегида с применением способа 1H и 1I. ЖХВД: 97,7% чистота. МС: m/z=634,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,78 (с, 1H), 8,65 (д, J=5,6 Гц, 1H), 8,42 (д, J=6,6 Гц, 1H), 8,06 (д, J=6,8 Гц, 1H), 7,75-7,55 (м, 4H), 6,82-6,76 (м, 2H), 4,62-4,40 (м, 4H), 4,05-3,98 (м, 2H), 3,80 (с, 2H), 3,28-3,02 (м, 5H), 2,87 (с, 3H), 2,76-2,42 (м, 3H), 2,02-1,96 (м, 1H), 1,15-1,10 (м, 2H), 0,81-0,75 (м, 2H).
Схема 9
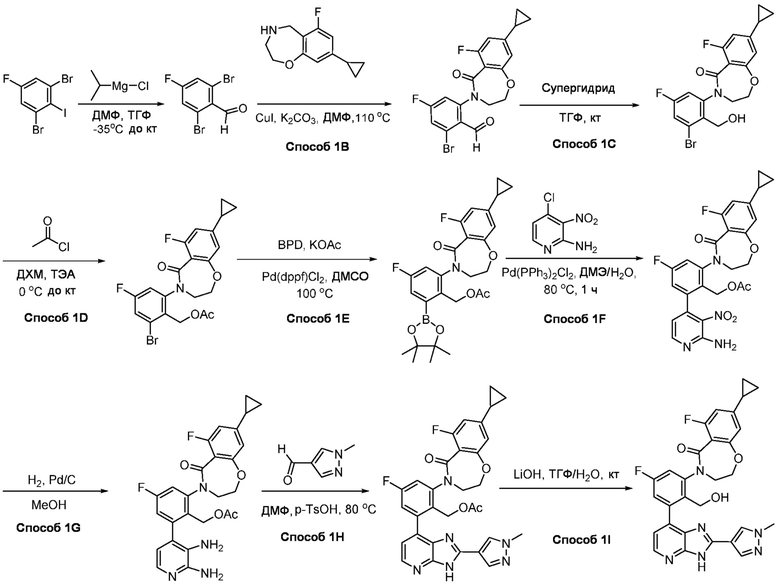
Пример 37. 8-Циклопропил-6-фтор-4-[5-фтор-2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (37)
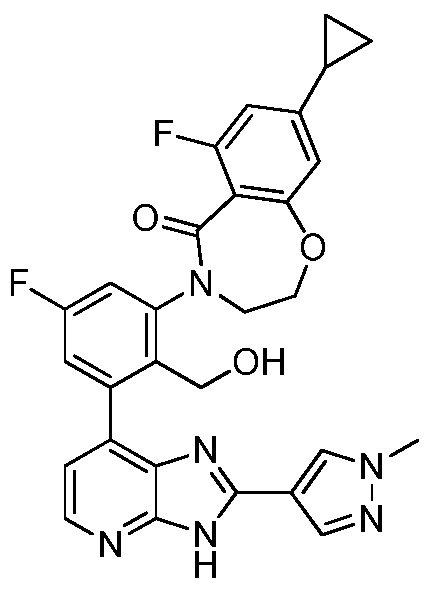
2,6-дибром-4-фторбензальдегид
В 100-мл круглодонной колбе, раствор 1,3-дибром-5-фтор-2-йодбензола (5,0 г, 13,2 ммоль) в безводном толуоле (30 мл) охлаждают до -35°C и добавляют раствор хлорид изопропилмагния в ТГФ (2,0M, 8,4 мл, 17,1 ммоль) по каплям в течение более 30 минут, сохраняя внутреннюю температуру ниже -25°C. Полученную смесь перемешивают в течение 1,5 ч. при -35°C. Затем безводный ДМФ (4,7 мл, 60,73 ммоль, 4,61 эквив.) добавляют по каплям при -35°C. Реакционную смесь медленно нагревают до комнатной температуры в течение более 1 ч и перемешивают при комнатной температуре в течение еще 1,5 ч. После завершения реакции, ее гасят добавлением 30 мл раствора хлороводорода (3M). Смесь экстрагируют этилацетатом (3×50 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 10% градиент) с получением 2,6-дибром-4-фторбензальдегида (1,8 г, 49%) в виде желтого твердого вещества.
8-Циклопропил-6-фтор-4-[5-фтор-2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
8-циклопропил-6-фтор-4-[5-фтор-2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 10 мг (1,8% за восемь стадий) получают из 2,6-дибром-4-фторбензальдегида, 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она, 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана, 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида с применением способа 1B, 1C, 1D, 1E, 1F, 1G, 1H и 1I. ЖХВД: 98,7% чистота. МС: m/z=543,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,51 (шс, 1H), 8,51-8,30 (м, 2H), 8,07 (с, 1H), 7,61-7,25 (м, 3H), 6,96-6,74 (м, 2H), 5,80 (шс, 1H), 4,52-4,49(м, 2H), 4,30-4,18(м, 2H), 3,92 (м, 5H), 1,98-1,97 (м, 1H), 1,10-0,97 (м, 2H), 0,85-0,74 (м, 2H).
Схема 10
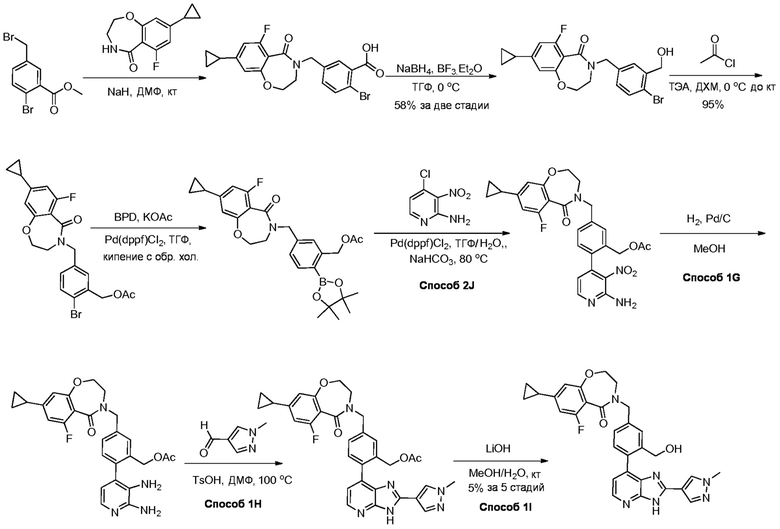
Пример 38. 8-Циклопропил-6-фтор-4-[[3-(гидроксиметил)-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (38)
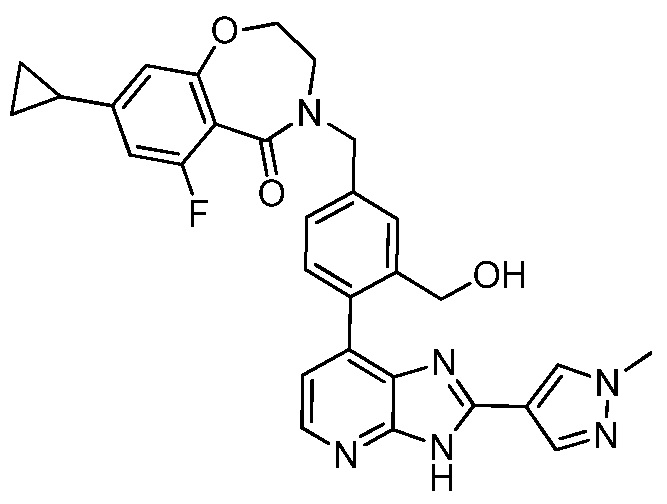
2-Бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]бензойная кислота
В 50-мл круглодонной колбе, гидрид натрия (60% в масле, 72,2 мг, 1,80 ммоль, 2,1 эквив.) добавляют к раствору 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (200 мг, 0,86 ммоль, 1,00 эквив.) в N,N-диметилформамиде (20 мл) при 0°C. Полученную смесь перемешивают в течение 1 ч. при 0°C и затем добавляют метил 2-бром-5-(бромметил)бензоат (306,3 мг, 0,94 ммоль, 1,10 эквив.). Реакционную смесь нагревают до КТ и перемешивают в течение 4 ч. После завершения реакции, ее гасят 20 мл воды. Значение pH смеси доводят до 4 с применением раствора хлороводорода (3M), и полученную смесь экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия b концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в ДХМ (от 1% до 20% градиент) с получением 2-бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]бензойной кислоты (550 мг, неочищенная) в виде желтого масла. МС: m/z=408,1 [M+H]+.
4-[[4-Бром-3-(гидроксиметил)фенил]метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 25-мл круглодонной колбе, NaBH4 (264 мг, 6,63 ммоль, 6,19 эквив.) и BF3.Et2O (472 мг, 3,16 ммоль, 2,95 эквив.) медленно добавляют к раствору 2-бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]бензойной кислоты (500 мг, 1,07 ммоль, 1,00 эквив.) в диметиловом эфире этиленгликоля (5 мл) при 0°C. Полученный раствор затем перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 20 мл H2O. Смесь экстрагируют этилацетатом (3×20 мл) и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 4-[[4-бром-3-(гидроксиметил)фенил]метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (200 мг, 58% за две стадии) в виде бесцветного масла. МС: m/z=420,0 [M+H]+.
[2-Бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]фенил]метилацетат
При 0°C, в 25-мл круглодонной колбе, 4-[[4-бром-3-(гидроксиметил)фенил]метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (200 мг, 0,43 ммоль, 1,00 эквив.) и ТЭА (144,4 мг, 1,36 ммоль, 3,12 эквив.) смешивают в дихлорметане (3 мл), туда добавляют ацетилхлорид (112,4 мг, 1,36 ммоль, 3,13 эквив.) по каплям. Полученный раствор затем перемешивают в течение 2 ч. при комнатной температуре. После завершения реакции, ее гасят добавлением 5 мл воды/льда. Смесь экстрагируют дихлорметаном (3×20 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением [2-бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]фенил]метилацетата (191 мг, 95%) в виде желтого твердого вещества. МС: m/z=462,2 [M+H]+.
[5-[(8-Циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]-2-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетат
В 10-мл герметично закрытой пробирке, продутой и содержащей атмосферу азота, [2-бром-5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]фенил]метилацетат (230 мг, 0,47 ммоль, 1,00 эквив.), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (198,4 мг, 0,74 ммоль, 1,60 эквив.), Pd(dppf)Cl2.CH2Cl2 (57,2 мг, 0,07 ммоль, 0,14 эквив.), KOAc (63,8 мг, 0,62 ммоль, 1,33 эквив.) смешивают в тетрагидрофуране (5 мл). Полученную смесь перемешивают в течение 12 ч. при 70°C. После завершения реакции, реакционную смесь разбавляют 30 мл воды и экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением [5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]-2-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетата (480 мг, неочищенный) в виде желтого масла. МС: m/z=510,2 [M+H]+.
8-Циклопропил-6-фтор-4-[[3-(гидроксиметил)-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
8-циклопропил-6-фтор-4-[[3-(гидроксиметил)-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 10 мг (5% за четыре стадии) получают из [5-[(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)метил]-2-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метилацетата, 4-хлор-3-нитропиридин-2-амина и 1-метил-1H-пиразол-4-карбальдегида с применением способа 2J, 1G, 1H и 1I. ЖХВД: 98,1% чистота. МС: m/z=539,1 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,34 (шс, 1H), 8,37-8,27 (м, 2H), 8,06 (с, 1H), 7,64 (с, 1H), 7,37-7,36 (м, 2H), 7,12-7,10 (м, 1H), 6,80-6,79 (м, 1H), 6,69 (с, 1H), 5,40 (с, 1H), 4,84 (с, 2H), 4,38 (с, 2H), 4,24 (с, 2H), 3,90 (с, 3H), 3,58-3,54 (м, 2H), 1,98-1,95 (м, 1H), 1,04-0,98 (м, 2H), 0,79-0,75 (м, 2H).
Схема 11
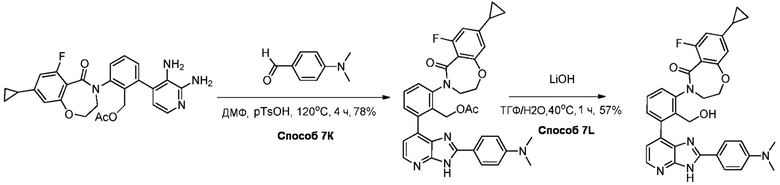
Пример 39. 8-Циклопропил-4-(3-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (39)
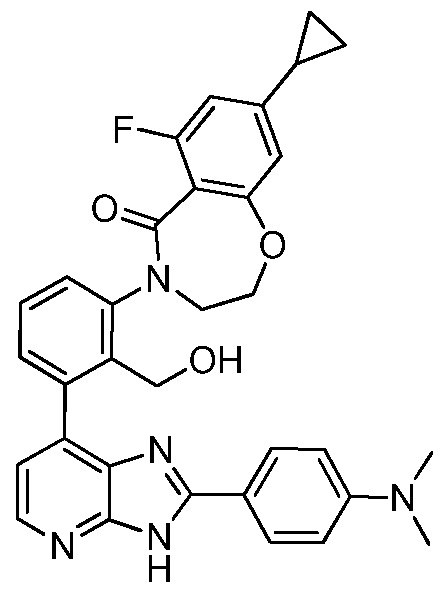
Способ 7K: [2-(8-Циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метилацетат
В 10-мл герметичной закрытой пробирке [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетат (90 мг, 0,19 ммоль, 1,00 эквив.) и 4-(диметиламино)бензальдегид (47,27 мг, 0,32 ммоль, 1,51 эквив.) растворяют в N,N-диметилформамиде (5 мл), туда медленно добавляют 4-метилбензол-1-сульфоновую кислоту (3,6 мг, 0,02 ммоль, 0,10 эквив.) при комнатной температуре. Полученную смесь перемешивают в течение 4 ч. при 120°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 20 мл H2O и экстрагируют этилацетатом (3×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метилацетата (90 мг, 78%) в виде желтого масла.
Способ 7L: 8-Циклопропил-4-(3-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
В 50-мл круглодонной колбе, LiOH (10,7 мг, 0,45 ммоль, 4,80 эквив.) добавляют к раствору [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метилацетата (90 мг, 0,09 ммоль, 1,00 эквив., 62,6%) в тетрагидрофуране (7 мл) и воде (4 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 1 ч. при 40°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл H2O и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка, XBridge BEH C18 OBD Prep Column, 5 мкм, 19 мм, 250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 53% до 63% градиент за 9 мин; определитель, УФ 254 нм. 8-циклопропил-4-(3-[2-[4-(диметиламино)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (30 мг, 57%) получают в виде беловатого твердого вещества. ЖХВД: 98,8% чистота. МС: m/z=564,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,44 (шс, 1H), 8,32 (д, J=5,1 Гц, 1H), 7,96 (д, J=9,0 Гц, 2H), 7,62-7,44 (м, 3H), 7,24-7,23 (м, 1H), 6,85-6,78 (м, 4H), 6,35 (шс, 1H), 4,50-4,33 (м, 3H), 4,22-4,18 (м, 1H), 3,96-3,95 (м, 2H), 2,99 (с, 6H), 2,01-1,98 (м, 1H), 1,04-1,02 (м, 2H), 0,79-0,77 (м, 2H).
Схема 12
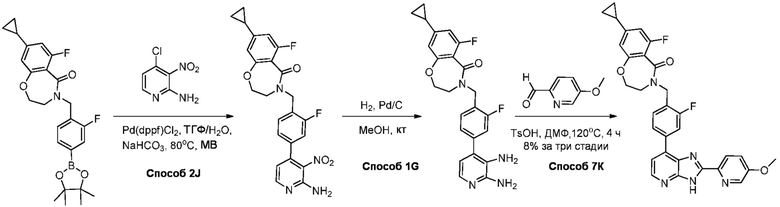
Пример 40. 8-Циклопропил-6-фтор-4-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (40)
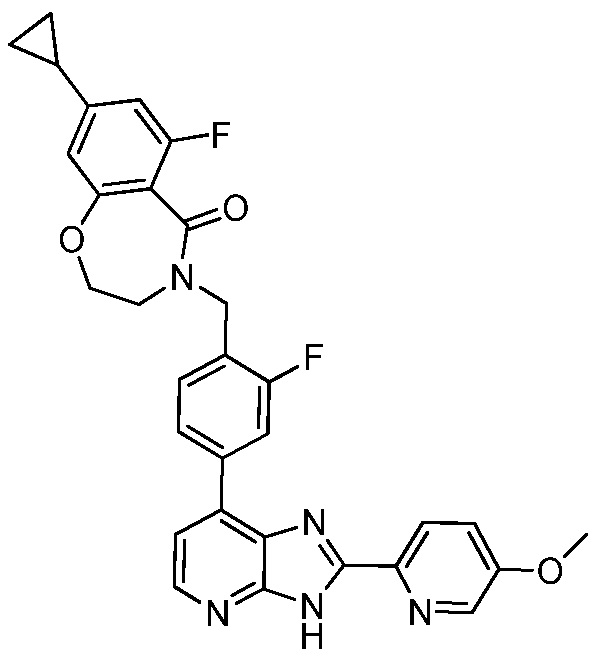
8-циклопропил-6-фтор-4-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 20 мг (8% за три стадии) получают из 8-циклопропил-6-фтор-4-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она, 4-хлор-3-нитропиридин-2-амина и 5-метоксипиридин-2-карбальдегида с применением способа 2J, 1G и 7K. ЖХВД: 95,8% чистота. МС: m/z=554,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,74 (шс, 1H), 8,47 (с, 1H), 8,39-8,35 (м, 3H), 8,28-8,25 (м, 1H), 7,64-7,54 (м, 3H), 6,83-6,80 (м, 1H), 6,69 (с, 1H), 4,88 (с, 1H), 4,23-4,19 (м, 2H), 3,94 (с, 3H), 3,63-3,59 (м, 2H), 2,01-1,92 (м, 1H), 1,05-1,00 (м, 2H), 0,78-0,70 (м, 2H).
Схема 13
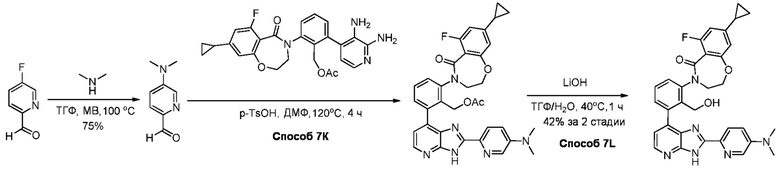
Пример 41. 8-циклопропил-4-(3-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (41)
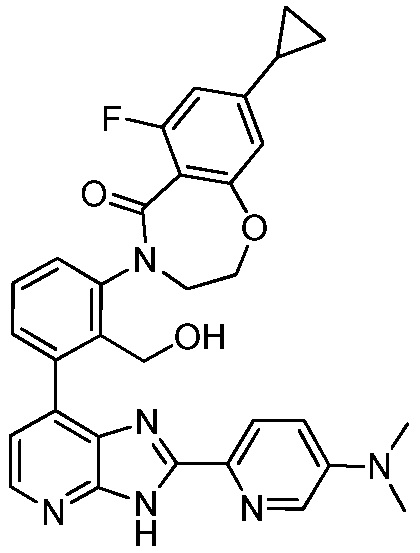
5-(Диметиламино)пиридин-2-карбальдегид:
В 10-мл герметично закрытой пробирке, 5-фторпиридин-2-карбальдегид (500 мг, 4,00 ммоль, 1,00 эквив.), гидрохлорид диметиламина (640 мг, 7,85 ммоль, 1,96 эквив.) и ДИЭА (3,1 г, 23,99 ммоль, 6,00 эквив.) растворяют в тетрагидрофуране (5 мл) при комнатной температуре. Полученный раствор затем облучают микроволнами в течение 1 ч. при 100°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 50 мл ДХМ и промывают водой (3×20 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением 5-(диметиламино)пиридин-2-карбальдегида (450 мг, 75%) в виде желтого твердого вещества.
8-циклопропил-4-(3-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
8-циклопропил-4-(3-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 30 мг (42% за две стадии) получают из [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата, 5-(диметиламино)пиридин-2-карбальдегида с применением способа 7K и 7L. ЖХВД: 95,1% чистота. МС: m/z=565,2 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,65 (шс, 1H), 8,37 (с, 1H), 8,36 (с, 1H), 8,07-7,96 (м, 1H), 7,69-7,45 (м, 3H), 7,29-7,21 (м, 2H), 6,86-6,78 (м, 2H), 6,08-6,07 (м, 1H), 4,49-4,47 (м, 2H), 4,40-4,33 (м, 1H), 4,24-4,20 (м, 1H), 3,97-3,96 (м, 2H), 3,10 (с, 6H), 2,07-2,00 (м, 1H), 1,05-1,03 (м, 2H), 0,78-0,70 (м, 2H).
Схема 14
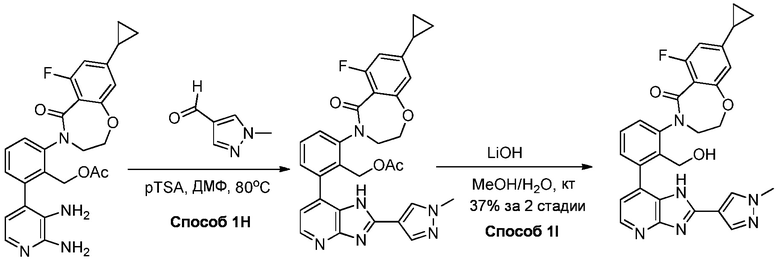
Пример 42. 8-Циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-1H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (42)
8-циклопропил-6-фтор-4-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-1H-имидазо[4,5-b]пиридин-7-ил]фенил]-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 20 мг (37% за две стадии) получают из [2-(8-циклопропил-6-фтор-5-оксо-2,3,4,5-тетрагидро-1,4-бензоксазепин-4-ил)-6-(2,3-диаминопиридин-4-ил)фенил]метилацетата, 1-метил-1H-пиразол-4-карбальдегида с применением способа 1H и 1I. ЖХВД: 97,0% чистота. МС: m/z=525,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,53 (шс, 1H), 8,42-8,38 (м, 2H), 8,08 (с, 1H), 7,60-7,52 (м, 1H), 7,48-7,40 (м, 2H), 7,22 (д, J=6,3 Гц, 1H), 6,85-6,75 (м, 2H), 6,00 (шс, 1H), 4,52-4,40 (м, 2H), 4,40-4,15 (м, 2H), 3,97-3,82 (м, 5H), 2,01-1,95 (м, 1H), 1,09-0,99 (м, 2H), 0,80-0,72 (м, 2H).
Схема 15
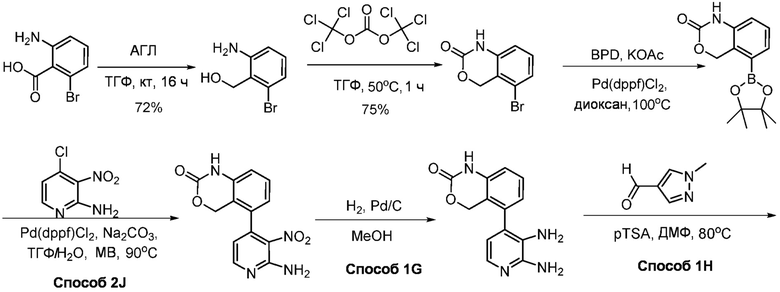
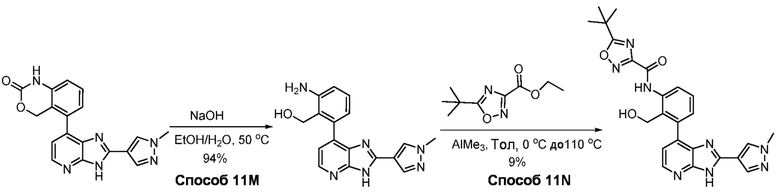
Пример 43. 5-трет-Бутил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид (43)
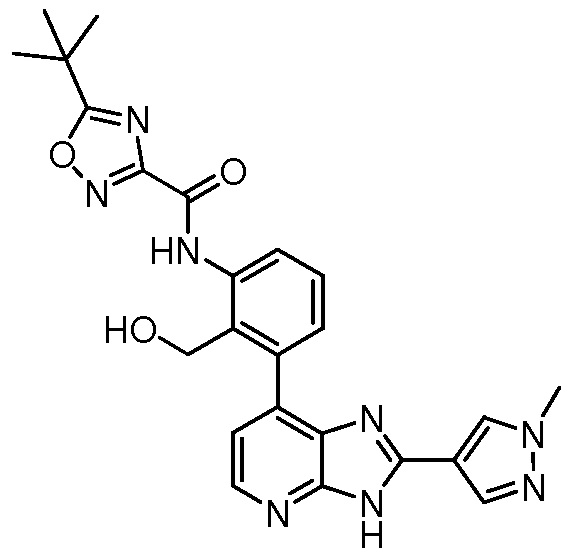
(2-Амино-6-бромфенил)метанол
В 1-л круглодонной колбе, 2-амино-6-бромбензойную кислоту (15 г, 69,43 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (300 мл), туда добавляют раствор LiAlH4 (7,906 г, 208,30 ммоль, 3,00 эквив.) в тетрагидрофуране (60 мл) по каплям при 0°C. Полученный раствор затем перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят добавлением NaSO4, 10 H2O (10 г). Полученную смесь затем фильтруют через слой Целита, и фильтрат концентрируют при пониженном давлении с получением (2-амино-6-бромфенил)метанола (12,6 г, 72%) в виде коричневого твердого вещества.
5-Бром-2,4-дигидро-1H-3,1-бензоксазин-2-он
В 1-л круглодонной колбе, продутой и содержащей инертную атмосферу азота, (2-амино-6-бромфенил)метанол (10,8 г, 49,89 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (450 мл) при комнатной температуре, туда медленно добавляют карбонат дитрихлорметила (6,48 г, 21,83 ммоль, 0,35 эквив.). Полученный раствор перемешивают в течение 1 ч. при 50°C. После завершения реакции, ее гасят добавлением 500 мл воды, и смесь экстрагируют этилацетатом (3×400 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом/петролейным эфиром (от 30% до 60% градиент) с получением 5-бром-2,4-дигидро-1H-3,1-бензоксазин-2-она (9 г, 75%) в виде желтого твердого вещества.
5-(Тетраметил-1,3,2-диоксаборолан-2-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он:
В 500-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 5-бром-2,4-дигидро-1H-3,1-бензоксазин-2-он (4,500 г, 18,75 ммоль, 1,00 эквив.) 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (6,013 г, 23,68 ммоль, 1,20 эквив.), Pd(dppf)Cl2.CH2Cl2 (1,611 г, 1,97 ммоль, 0,10 эквив.) и KOAc (2,905 г, 29,60 ммоль, 1,50 эквив.) смешивают в диоксане (150 мл). Полученную смесь перемешивают в течение 16 ч. при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением 5-(тетраметил-1,3,2-диоксаборолан-2-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-она (5,428 г, неочищенный) в виде коричневого твердого вещества, которое применяют на следующей стадии без дальнейшей очистки. МС: m/z =276,1 [M+H]+.
5-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2,4-дигидро-1H-3,1-бензоксазин-2-он
5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2,4-дигидро-1H-3,1-бензоксазин-2-он 380 мг (42% за четыре стадии) получают из 5-(тетраметил-1,3,2-диоксаборолан-2-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-она, 4-хлор-3-нитропиридин-2-амина и 1-метил-1H-пиразол-4-карбальдегида с применением способа 2J, 1G и 1H. МС: m/z=347,0 [M+H]+.
Способ 11M: [2-Амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанол
В 250-мл круглодонной колбе, 5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2,4-дигидро-1H-3,1-бензоксазин-2-он (380 мг, 1,04 ммоль, 1,00 эквив.) растворяют в этаноле (100 мл), туда добавляют раствор гидроксида натрия (2 г, 50,0 ммоль, 48,0 эквив.) в воде (100 мл) при комнатной температуре. Полученную смесь перемешивают в течение 2 ч. при 50°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и оставшийся раствор экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением [2-амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанола (330 мг, 94%) в виде желтого твердого вещества. МС: m/z=321,1 [M+H]+.
Способ 11N: 5-трет-Бутил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, [2-амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанол (110 мг, 0,33 ммоль, 1,00 эквив.) растворяют в толуоле (5 мл), туда добавляют a раствор AlMe3 (74,2 мг, 1,03 ммоль, 3,00 эквив.) в толуоле (0,5 мл) по каплям при 0°C. Полученную смесь перемешивают в течение 2 ч при комнатной температуре. Затем добавляют этил 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилат (68,1 мг, 0,34 ммоль, 1,00 эквив.). Реакционную смесь перемешивают в течение 16 ч. при 110°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, гасят 10 мл насыщ. раствора NH4Cl и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, метанол в воде, от 0% до 55% градиент за 10 мин; определитель, УФ 254 нм. 5-трет-бутил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид (15 мг, 9%) получают в виде желтого твердого вещества. ЖХВД: 99,2% чистота. МС: m/z=473,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,52 (шс, 1H), 10,94 (шс, 1H), 8,41 (с, 1H), 8,33 (д, J=4,2 Гц, 1H), 8,18 (с, 1H), 8,10 (с, 1H), 7,52 (т, J=6,0 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 7,27 (с, 1H), 5,95 (шс,1H), 4,52 (с, 2H), 3,91 (с, 3H), 1,46 (с, 9H).
Схема 16
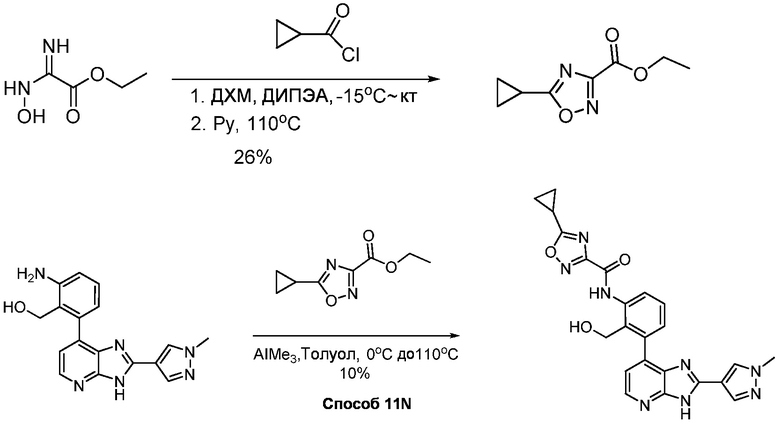
Пример 44. 5-Циклопропил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид (44)
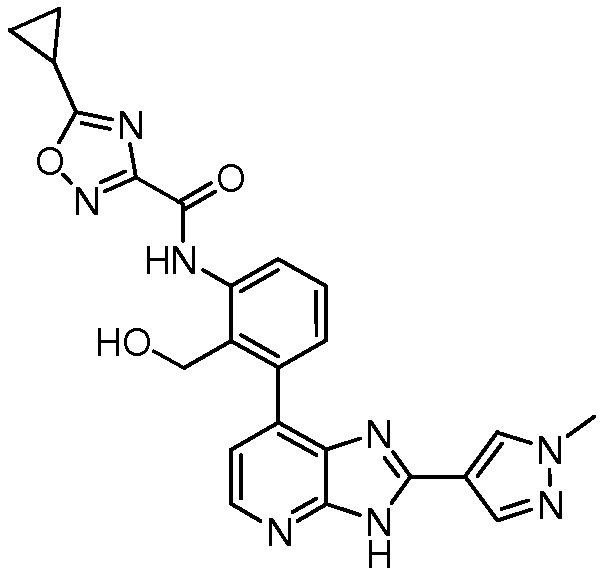
Этил 5-циклопропил-1,2,4-оксадиазол-3-карбоксилат
В 25-мл круглодонной колбе, этил [(Z)-N-гидроксикарбамимидоил]формиат (500 мг, 3,78 ммоль, 1,00 эквив.) и ДИЭА (978 мг, 7,57 ммоль, 2,00 эквив.) смешивают в дихлорметане (5 мл), туда добавляют хлорид циклопропанкарбонила (393 мг, 3,76 ммоль, 0,99 эквив.) по каплям при -15°C. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят 10 мл воды и смесь экстрагируют дихлорметаном (3×5 мл). Органические слои объединяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток затем повторно растворяют в пиридине (5 мл) при комнатной температуре, и полученный раствор перемешивают в течение 16 ч. при 110°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 10% градиент) с получением этил 5-циклопропил-1,2,4-оксадиазол-3-карбоксилата (180 мг,26%) в виде желтого масла. МС: m/z =183,0 [M+H]+.
5-Циклопропил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид
5-циклопропил-N-[2-(гидроксилметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-1,2,4-оксадиазол-3-карбоксамид 15 мг (10%) получают из 2-амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанола, этил 5-циклопропил-1,2,4-оксадиазол-3-карбоксилата с применением способа 11N. ЖХВД: 96,3% чистота. МС: m/z=457,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,24 (шс, 1H), 10,86 (шс, 1H), 8,41 (с, 1H), 8,33 (д, J=4,2 Гц, 1H), 8,18 (с, 1H), 8,10 (с, 1H), 7,52 (т, J=6,0 Гц, 1H), 7,26 (д, J=4,8 Гц, 1H), 7,18 (с, 1H), 5,95 (шс, 1H), 4,52 (с, 2H), 3,91 (с, 3H), 2,40-2,45 (м, 1H), 1,35-1,28 (м, 2H), 1,25-1,18 (м, 2H).
Схема 17:
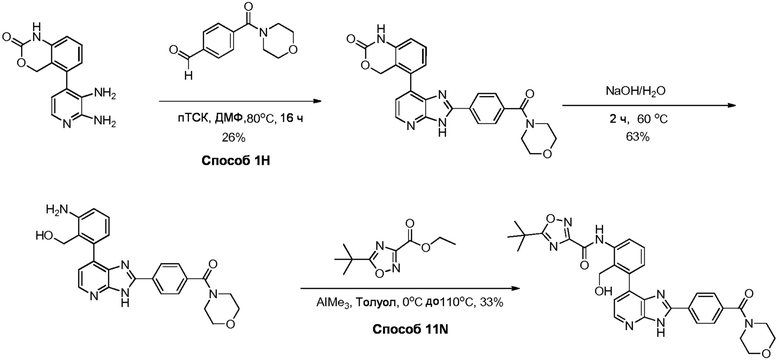 Пример 45. 5-трет-Бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-1,2,4-оксадиазол-3-карбоксамид (45)
Пример 45. 5-трет-Бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-1,2,4-оксадиазол-3-карбоксамид (45)
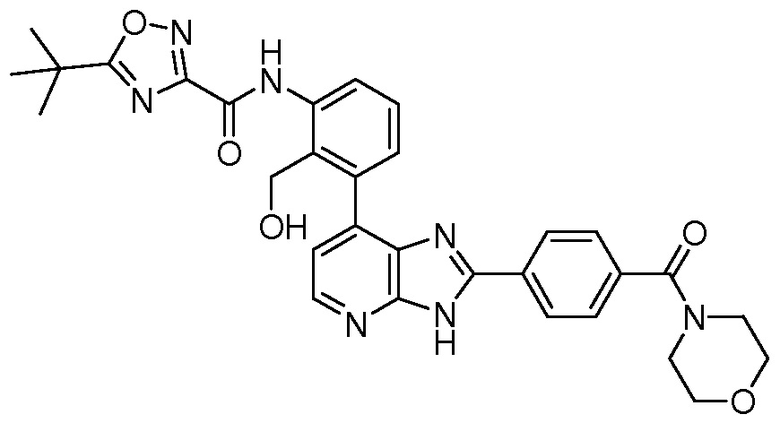
5-(2-[4-[(Морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он
5-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он 120 мг (26%) получают из 5-(2,3-диаминопиридин-4-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-она и 4-[(морфолин-4-ил)карбонил]бензальдегида с применением способа 1H. МС: m/z=456,0 [M+H]+.
[2-Амино-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанол
В 100-мл круглодонной колбе, 5-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он (120 мг, 0,25 ммоль, 1,00 эквив.) растворяют в этаноле (20 мл), туда добавляют раствор гидроксида натрия (105,4 мг, 2,63 ммоль, 10,00 эквив.) в воде (20 мл) при комнатной температуре. Полученный раствор перемешивают в течение 2 ч. при 60°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и оставшуюся смесь экстрагируют этилацетатом (5×15 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением [2-амино-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанола (70 мг, 63%) в виде желтого твердого вещества. МС: m/z=430,0 [M+H]+.
5-трет-Бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-1,2,4-оксадиазол-3-карбоксамид 45 мг (33%) получают из [2-амино-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанола, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата этила с применением способа 11N. ЖХВД: 95,2% чистота. МС: m/z=582,3 [M+H]+. 1H ЯМР (300 МГц, CD3OD): δ 8,49 (с, 1H), 8,34-8,25 (м, 3H); 7,64-7,56 (м, 3H); 7,38-7,32 (м, 2H); 4,64 (с, 2H); 3,78-3,33 (м, 8H); 1,53 (с, 9H).
Пример 46. 4-трет-Бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]бензамид (46)
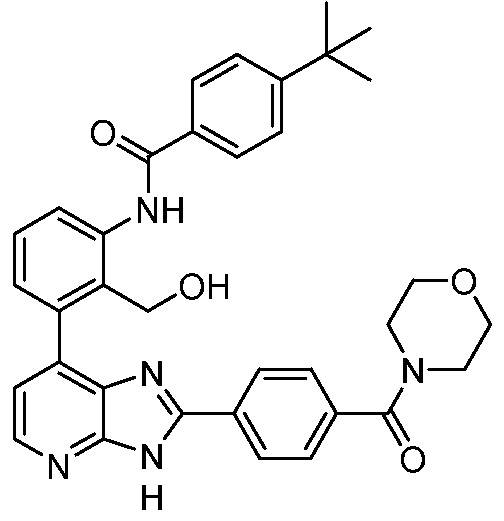
В 8 мл пробирке, [2-амино-6-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанол (43,0 мг, 0,10 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (3 мл), затем туда добавляют 4-трет-бутилбензойную кислоту (19,6 мг, 0,11 ммоль, 1,10 эквив.), ГОБТ (14,9 мг, 0,11 ммоль, 1,10 эквив.), EDCI (25,0 мг, 0,13 ммоль, 1,30 эквив.) и ДИЭА (19,4 мг, 0,15 ммоль, 1,50 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение ночи при комнатной температуре. После завершения реакции, ее гасят добавлением воды (5 мл), и полученную смесь экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, АЦН в воде, от 40% до 60% градиент за 20 мин; определитель, УФ 254 нм. 4-трет-бутил-N-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]бензамид (35 мг, 59%) получают в виде желтого твердого вещества. ЖХВД: 95,7% чистота. МС: m/z=590,2 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,45-8,36 (м, 1H), 8,08-8,07 (м, 2H), 7,90-7,87 (м, 2H), 7,45-7,26 (м, 5H), 7,20 (д, J=4,0 Гц, 1H), 6,99 (д, J=5,2 Гц, 1H), 6,89-6,82 (м, 1H), 5,18-5,09 (м, 2H), 3,89-3,41 (м, 8H), 1,30-1,20 (м, 9H).
Схема 18
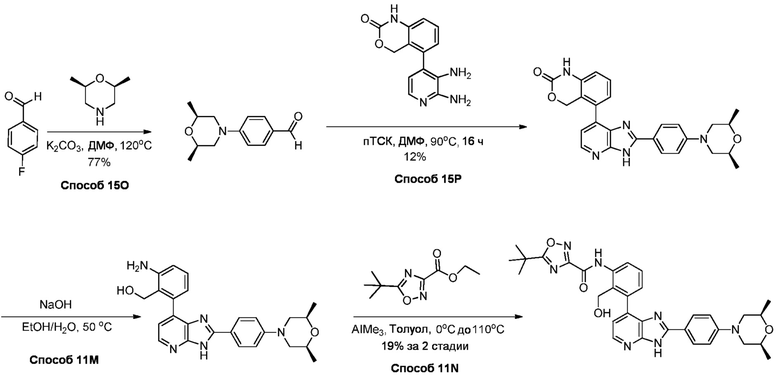
Пример 47. 5-трет-Бутил-N-[3-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-(гидроксиметил)фенил]-1,2,4-оксадиазол-3-карбоксамид (47)
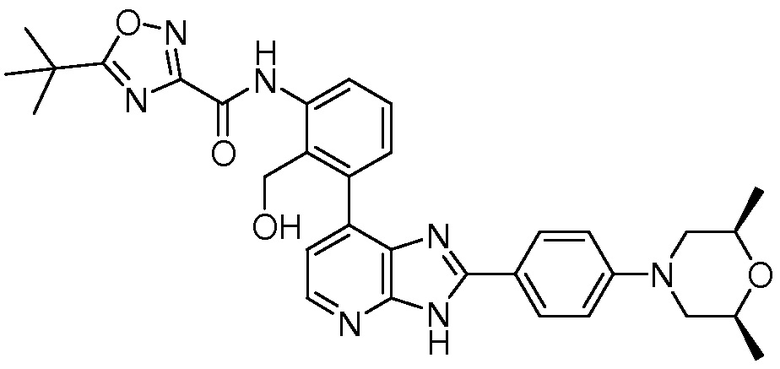
Способ 15O: 4-[(2R,6S)-2,6-диметилморфолин-4-ил]бензальдегид
В 100-мл круглодонной колбе, 4-фторбензальдегид (2 г, 16,11 ммоль, 1,00 эквив.) и (2R,6S)-2,6-диметилморфолин (1,86 г, 16,15 ммоль, 1,00 эквив.) смешивают в N,N-диметилформамиде (20 мл), туда добавляют карбонат калия (6,68 г, 48,3 ммоль, 3,00 эквив.) при комнатной температуре. Полученную смесь перемешивают в течение ночи при 120°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и затем разбавляют 50 мл H2O. Полученную смесь экстрагируют этилацетатом (3×50 мл) и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 10% градиент) с получением 4-[(2R,6S)-2,6-диметилморфолин-4-ил]бензальдегида (2,7 г, 77%) в виде желтого масла. МС: m/z=220,0 [M+H]+.
Способ 15P: 5-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он
В 30-мл герметично закрытой пробирке, 5-(2,3-диаминопиридин-4-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он (160 мг, 0,62 ммоль, 1,00 эквив.,), 4-[(2R,6S)-2,6-диметилморфолин-4-ил]бензальдегид (171 мг, 0,76 ммоль, 1,22 эквив.) и 4-метилбензол-1-сульфоновую кислоту (13,5 мг, 0,08 ммоль, 0,13 эквив.) смешивают в N,N-диметилформамидом (10 мл). Полученную смесь перемешивают в течение ночи при 90°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл H2O и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, АЦН в воде, от 0% до 35% градиент за 15 мин; определитель, УФ 254 нм. 5-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-он (35 мг, 12%) получают в виде желтого твердого вещества. МС: m/z=456,2 [M+H]+.
5-трет-Бутил-N-[3-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-(гидроксиметил)фенил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[3-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-(гидроксиметил)фенил]-1,2,4-оксадиазол-3-карбоксамид 10 мг (19% за 2 стадии) получают из 5-(2-[4-[(2R,6S)-2,6-диметилморфолин-4-ил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-она и этил 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 11M и 11N. ЖХВД: 98,5% чистота. МС: m/z=582,3 [M+H]+. 1H-ЯМР (400 МГц, CD3OD): δ 8,37-8,36 (м, 1H), 8,30-8,28 (м, 1H), 8,02-7,99 (м, 2H), 7,58-7,53 (м, 1H), 7,34-7,32 (м, 1H), 7,24-7,22 (м, 1H), 7,08-7,05 (м, 1H), 4,60(с, 2H), 3,793,70 (м, 4H), 2,46-2,40 (м, 2H), 1,51(с, 9H), 1,25 (м, 6H).
Схема 19
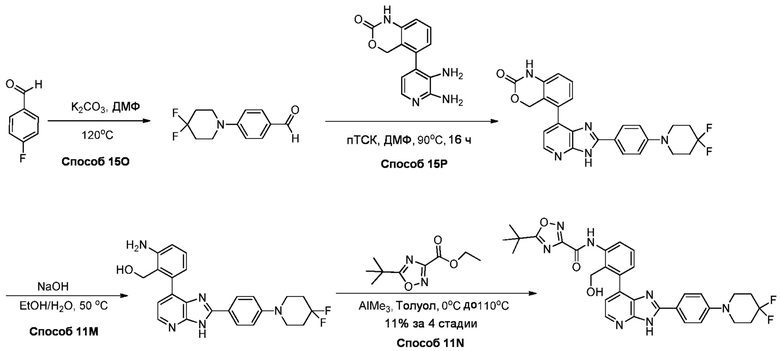
Пример 48. 5-трет-Бутил-N-(3-[2-[4-(4,4-дифторпиперидин-1-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-1,2,4-оксадиазол-3-карбоксамид (48)

5-трет-бутил-N-(3-[2-[4-(4,4-дифторпиперидин-1-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-(гидроксиметил)фенил)-1,2,4-оксадиазол-3-карбоксамид (6 мг, 11% за 4 стадии) получают из 4-фторбензальдегида, гидрохлорида 4,4-дифторпиперидина, 5-(2,3-диаминопиридин-4-ил)-2,4-дигидро-1H-3,1-бензоксазин-2-она и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 11M и 11N. ЖХВД: 97,4% чистота. МС: m/z=588,3 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,34-8,25 (м, 2H), 7,99-7,94 (м, 2H), 7,52 (т, J=6,0 Гц, 1H), 7,29 (д, J=4,2 Гц, 1H), 7,20 (с, 1H), 7,10-7,08 (м, 2H), 4,57 (с, 2H), 3,46-3,55 (м, 4H), 1,92-2,09 (м, 4H), 1,48 (с, 9H).
Схема 20
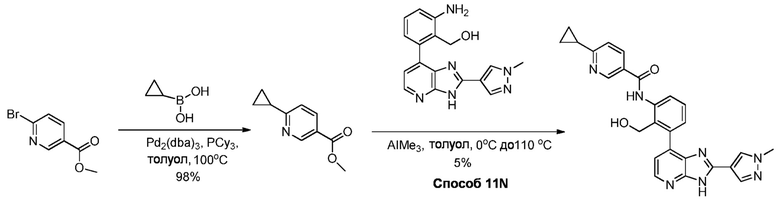
Пример 49. 6-Циклопропил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]пиридин-3-карбоксамид (49)
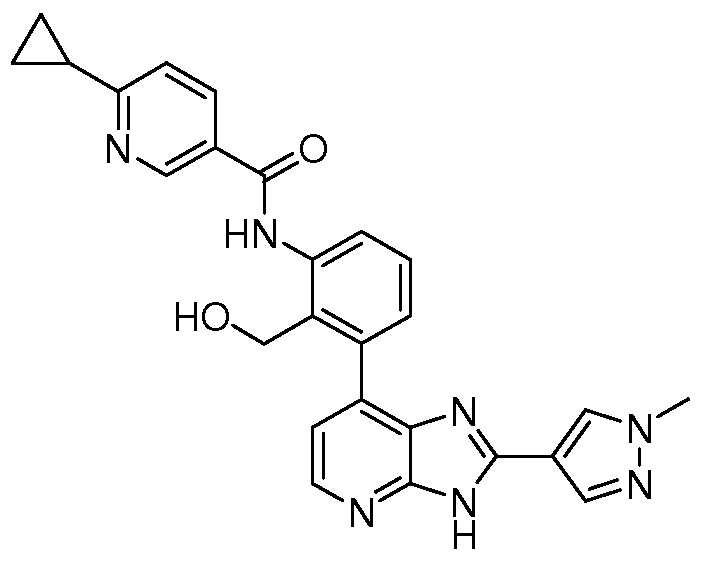
Метил 6-циклопропилпиридин-3-карбоксилат:
В 250-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 6-бромпиридин-3-карбоксилат (2 г, 9,26 ммоль, 1,00 эквив.), циклопропилбороновую кислоту (1 г, 11,64 ммоль, 1,26 эквив.), трициклогексилфосфан (778 мг, 2,77 ммоль, 0,30 эквив.), Pd2(dba)3.CHCl3 (958 мг, 0,93 ммоль, 0,10 эквив.) и карбонат калия (3,83 г, 27,71 ммоль, 2,99 эквив.) смешивают в смеси толуола и воды (10:1, 44 мл) при комнатной температуре. Полученную смесь перемешивают в течение ночи при 100°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры и фильтруют через слой Целита. Фильтрат концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 15% градиент) с получением метил 6-циклопропилпиридин-3-карбоксилата (1,6 г, 98%) в виде коричневого твердого вещества. МС: m/z=178,0 [M+H]+.
6-Циклопропил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]пиридин-3-карбоксамид
6-циклопропил-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]пиридин-3-карбоксамид (7,4 мг, 5%) получают из [2-амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанола и метил 6-циклопропилпиридин-3-карбоксилата с применением способа 11N. ЖХВД: 99,4% чистота. МС: m/z=466,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 9,03 (с, 1H), 8,55 (д, J=5,6 Гц, 1H), 8,47 (с, 1H), 8,34-8,31 (м, 1H), 8,26 (с, 1H), 8,04 (д, J=8,0 Гц, 1H), 7,64 (т, J=8,0 Гц, 1H), 7,56 (д, J=5,6 Гц, 1H), 7,48 (д, J=8,0 Гц, 1H), 7,42 (д, J=7,6 Гц, 1H), 4,59 (с, 2H), 4,03 (с, 3H), 2,29-2,22 (м, 1H), 1,31-1,11 (м, 4H).
Схема 21
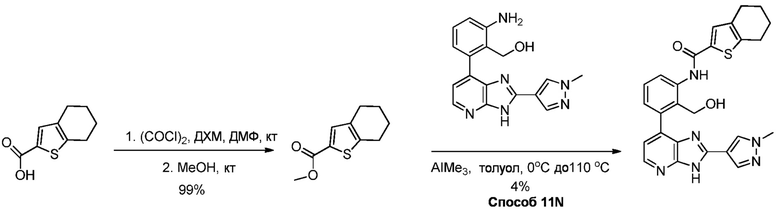 Пример 50. N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксамид (50)
Пример 50. N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксамид (50)
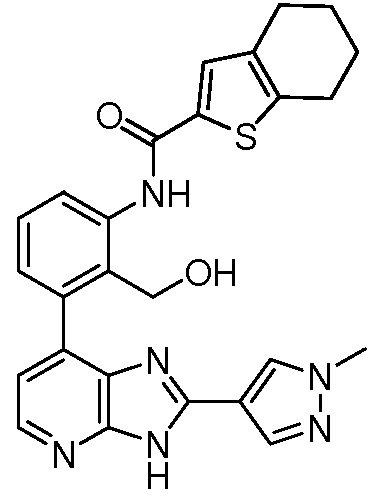
Метил 6-циклопропилпиридин-3-карбоксилат
В 10-мл круглодонной колбе с магнитной мешалкой, 4,5,6,7-тетрагидро-1-бензотиофен-2-карбоновую кислоту (50 мг, 0,27 ммоль, 1,00 эквив.) растворяют в дихлорметане (1 мл), туда добавляют щавелевый дихлорид (52 мг, 0,41 ммоль, 1,49 эквив.) по каплям при комнатной температуре. Полученный раствор перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением промежуточного хлорангидрида, который применяют сразу на следующей стадии. Промежуточный хлорангидрид, полученный выше, повторно растворяют в MeOH (5 мл) при 0°C. Полученный раствор перемешивают в течение 1 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток очищают преп. ТСХ, элюируя этилацетатом в петролейном эфире (1:1) с получением метил 4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксилата (54 мг, 99%) в виде желтого масла. МС: m/z=197,1 [M+H]+.
N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксамид
N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]-4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксамид 3,8 мг (4%) получают из [2-амино-6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанола, метил 4,5,6,7-тетрагидро-1-бензотиофен-2-карбоксилата с применением способа 11N. ЖХВД: 97,1% чистота. МС: m/z=485,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,45 (шс, 1H), 10,23 (с, 1H), 8,41-8,32 (м, 2H), 8,25-8,09 (м, 2H), 7,47-7,46 (м, 2H), 7,23-7,21 (м, 2H), 5,96 (с, 1H), 4,53 (с, 2H), 3,91 (с, 3H), 2,79-2,78 (м, 2H), 2,65-2,63 (м, 2H), 1,82-1,77 (м, 4H).
Схема 22
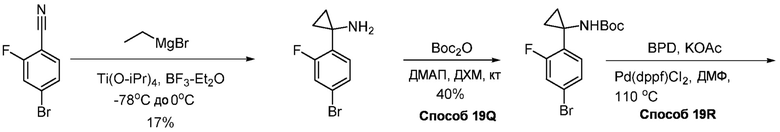
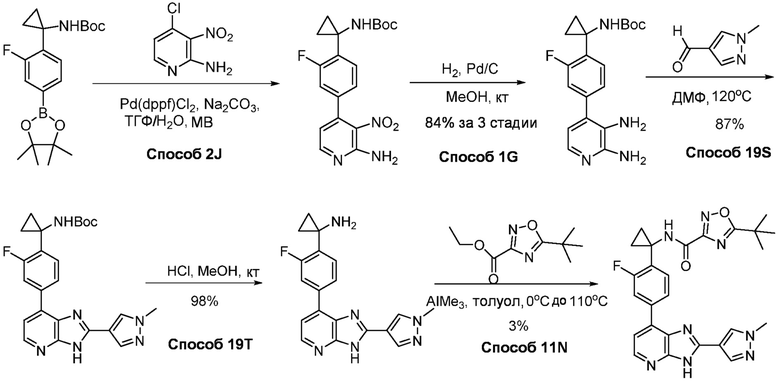
Пример 51. 5-трет-Бутил-N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид (51)
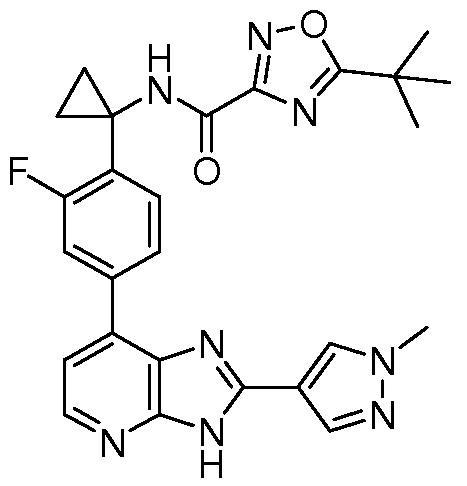
1-(4-Бром-2-фторфенил)циклопропан-1-амин
При -78°C, в 250-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 4-бром-2-фторбензонитрил (5,0 г, 25. ммоль, 1,00 эквив.) и Ti(Oi-Pr)4 (7,85 г, 27,62 ммоль, 1,10 эквив.) растворяют в простом эфире (50 мл), туда добавляют бромид этилмагния (7,260 г, 54,48 ммоль, 2,18 эквив.) по каплям. Полученную смесь перемешивают при -78°C в течение 10 мин, нагревают до комнатной температуры и перемешивают в течение 1 ч при комнатной температуре. Затем BF3.Et2O (6,25 мл, 5,99 ммоль, 0,24 эквив.) добавляют по каплям, и полученную смесь перемешивают в течение еще 2 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 30 мл раствор хлороводорода (1M) и смесь промывают этилацетатом (3×10 мл). Значение pH водного слоя доводят до 10 с применением раствора NaOH (2M) и полученную смесь экстрагируют EtOAc (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-(4-бром-2-фторфенил)циклопропан-1-амина (1 г, 17%) в виде желтого масла. МС: m/z=229,9[M+H]+.
Способ 19Q: трет-Бутил N-[1-(4-бром-2-фторфенил)циклопропил]карбамат
В 100-мл круглодонной колбе, 1-(4-бром-2-фторфенил)циклопропан-1-амин (950 мг, 4,13 ммоль, 1,00 эквив.) растворяют в дихлорметане (15 мл), затем туда добавляют ди-трет-бутилдикарбонат (1,13 г, 5,18 ммоль, 1,25 эквив.) и 4-диметиламинопиридин (25,3 мг, 0,21 ммоль, 0,05 эквив.) при комнатной температуре. Полученную смесь перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 5 мл H2O и экстрагируют этилацетатом (3×6 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 10% до 50% градиент) с получением трет-бутил N-[1-(4-бром-2-фторфенил)циклопропил]карбамата (0,55 г, 40%) в виде желтого твердого вещества. МС: m/z=273,8[M+H-56]+.
Способ 19R: трет-Бутил N-[1-[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]циклопропил]карбамат
В 50-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, трет-бутил N-[1-(4-бром-2-фторфенил)циклопропил]карбамат (450 мг, 1,36 ммоль, 1,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (520 мг, 2,05 ммоль, 1,50 эквив.), KOAc (270 мг, 2,75 ммоль, 2,02 эквив.) и Pd(dppf)Cl2.CH2Cl2 (111,7 мг, 0,14 ммоль, 0,10 эквив.) смешивают в N,N-диметилформамиде (6 мл). Полученную смесь перемешивают в течение ночи при 110°C. После завершения реакции, реакционную смесь концентрируют в вакууме для удаления ДМФ и затем разбавляют 50 мл ДХМ. Нерастворимые твердые вещества в смеси отфильтровывают, и фильтрат промывают насыщенным раствором соли (4×5 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением трет-бутил N-[1-[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]циклопропил]карбамата (0,516 г, неочищенный) в виде черного масла.
трет-Бутил N-[1-[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]циклопропил]
Трет-бутил N-[1-[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]циклопропил]карбамат 70 мг (84% за три стадии) получают из трет-бутил N-[1-[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]циклопропил]карбамата и 4-хлор-3-нитропиридин-2-амина с применением способа 2J и 1G. МС: m/z=359,0 [M+H]+.
Способ 19S: N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)карбамат
В 30-мл герметично закрытой пробирке, трет-бутил N-[1-[4-(2,3-диаминопиридин -4-ил)-2-фторфенил]циклопропил]карбамат (460 мг, 1,28 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (10 мл), туда добавляют 1-метил-1H-пиразол-4-карбальдегид (141 мг, 1,28 ммоль, 1,00 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 18 ч. при 120°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, ацетонитрил в воде, от 0% до 50% градиент в 20 мин; определитель, УФ 254 нм. Трет-бутил N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)карбамат (500 мг, 87%) получают в виде коричневого масла. МС: m/z=449,0 [M+H]+.
Способ 19T: 1-[2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропан-1-амин:
В 8-мл пробирке, трет-бутил N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)карбамат (500 мг, 1,11 ммоль, 1,00 эквив.) растворяют в растворе хлороводорода в метаноле (4M, 2 мл). Полученный раствор перемешивают в течение 1,5 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением 1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропан-1-амина (380 мг, 98%) в виде коричневого масла.
5-трет-Бутил-N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид 10 мг (3%) получают из 1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропан-1-амина и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 11N. ЖХВД: 95,9% чистота. МС: m/z=501,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,40 (шс, 1H), 9,72 (с, 1H), 8,46 (с, 1H), 8,29 (д, J=5,2 Гц, 1H), 8,25-8,02 (м, 3H), 7,78-7,65 (м, 1H), 7,50-7,49 (м, 1H), 3,95 (с, 3H), 1,41 (с, 9H), 1,33-1,32 (м, 4H).
Пример 52. 3-(трет-Бутокси)-N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)азетидин-1-карбоксамида (52)
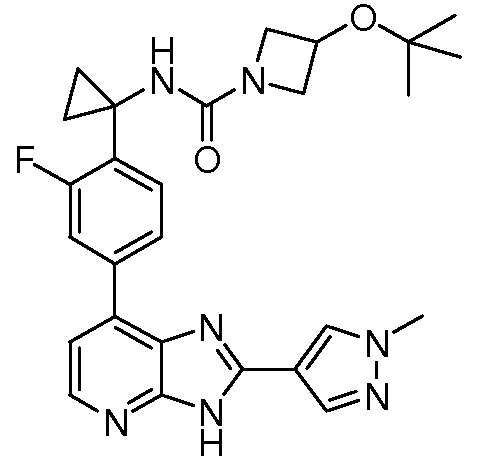
В 25-мл круглодонной колбе, 1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропан-1-амин (90 мг, 0,26 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (3 мл), затем туда добавляют трифосген (169 мг, 0,57 ммоль, 1,98 эквив.) и ДИЭА (222 мг, 1,72 ммоль, 5,98 эквив.) последовательно, при комнатной температуре. Полученный раствор затем перемешивают в течение 4 часов при комнатной температуре. После завершения реакции, ее гасят 3 мл H2O и полученную смесь экстрагируют этилацетатом (3×5 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением промежуточного изоцианата, который применяют сразу на следующей стадии. Остаток, полученный выше, повторно растворяют в тетрагидрофуране (3 мл), затем туда добавляют ДИЭА (222 мг, 1,72 ммоль, 5,98 эквив.) и 3-(трет-бутокси)азетидин (55,6 мг, 0,41 ммоль, 1,50 эквив.) при комнатной температуре. Смесь перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают преп-ЖХВД в следующих условиях: колонка, Gemini-NX 5u C18 110A, AXIA Packed, 150×21,2 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 32% до 40% градиент за 8 мин; определитель, УФ 220 нм. 3-(трет-бутокси)-N-(1-[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)азетидин-1-карбоксамид (10 мг, 8%) получают в виде белого твердого вещества. ЖХВД: 97,3% чистота. МС: m/z=504,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,50-8,15 (м, 3H), 7,95-7,65 (м, 2H), 7,55-7,25 (м, 2H), 4,55-4,51 (м, 1H), 4,12-4,08 (м, 2H), 4,02 (с, 3H), 3,73-3,68 (м, 2H), 1,31-1,29 (м, 2H), 1,27-1,20 (м, 2H), 1,19 (с, 9H).
Схема 23
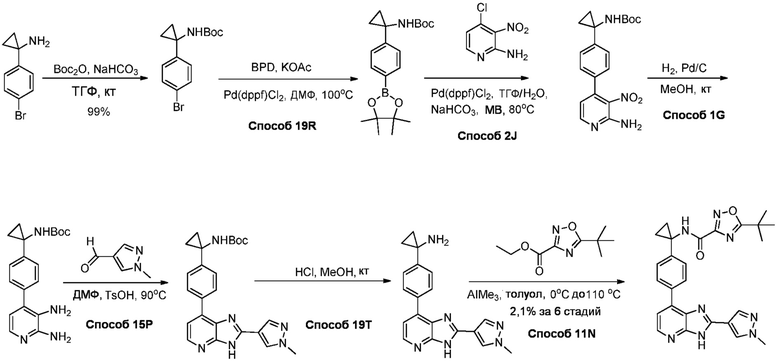
Пример 53. 5-трет-Бутил-N-(1-[4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид (53)
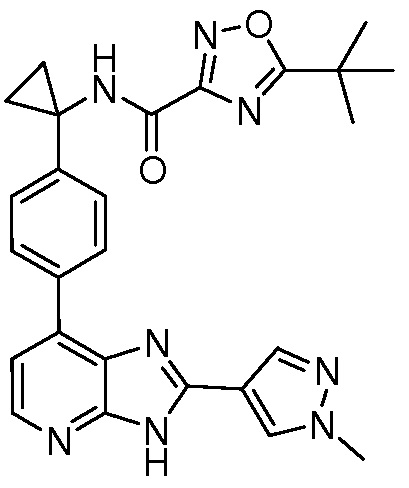
трет-Бутил N-[1-(4-бромфенил)циклопропил]карбамат
В 100-мл круглодонной колбе, 1-(4-бромфенил)циклопропан-1-амин (1 г, 4,48 ммоль, 1,00 эквив.) и ди-трет-бутилдикарбонат (3,1 г, 13,49 ммоль, 3,01 эквив.) смешивают в тетрагидрофуране (20 мл), туда добавляют раствор бикарбоната натрия (5 г, 59,5 ммоль, 13,29 эквив.) в воде (10 мл) при комнатной температуре. Полученный раствор перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь экстрагируют этилацетатом (3×10 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 10% до 50% градиент) с получением трет-бутил N-[1-(4-бромфенил)циклопропил]карбамата (1,47 г, 99%) в виде светло-желтого твердого вещества. МС: m/z =255,7 [M+H-56]+.
5-трет-Бутил-N-(1-[4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-(1-[4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]циклопропил)-1,2,4-оксадиазол-3-карбоксамид 22,6 мг (2,1% за 6 стадий) получают из трет-бутил N-[1-(4-бромфенил)циклопропил]карбамата, 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана, 4-хлор-3-нитропиридин-2-амина и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19R, 2J, 1G, 15P, 19T и 11N. ЖХВД: 99,9% чистота. МС: m/z=483,1 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,45-8,25 (м, 2H), 8,23-8,15 (м, 1H), 8,05-8,01 (м, 1H), 7,75 (с, 1H), 7,53-7,52 (м, 2H), 7,35-7,25 (м, 1H), 4,01 (с, 3H), 1,52 (с, 9H), 1,48 (с, 4H).
Схема 24
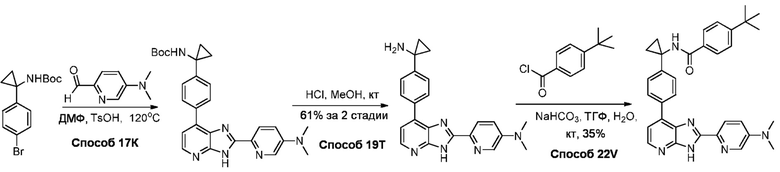
Пример 54. 4-трет-Бутил-N-[1-(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)циклопропил]бензамид (54)
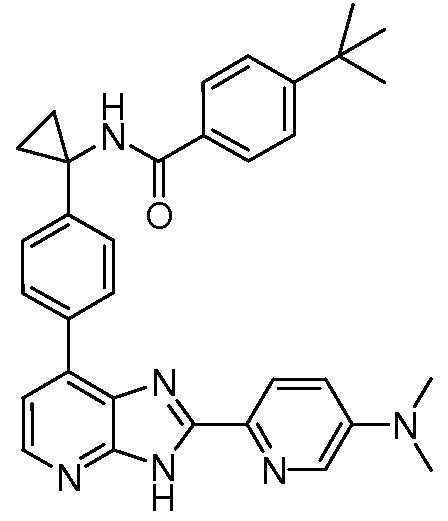
6-[7-[4-(1-Аминоциклопропил)фенил]-3H-имидазо[4,5-b]пиридин-2-ил]-N,N-диметилпиридин-3-амин
6-[7-[4-(1-аминоциклопропил)фенил]-3H-имидазо[4,5-b]пиридин-2-ил]-N,N-диметилпиридин-3-амин 78 мг (61% за 2 стадии) получают из трет-бутил N-[1-[4-(2,3-диаминопиридин-4-ил)фенил]циклопропил]карбамата и 5-(диметиламино)пиридин-2-карбальдегида с применением способа 7K и 19T. МС: m/z=371,1 [M+H]+.
Способ 22V: 4-трет-Бутил-N-[1-(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)циклопропил]бензамид
В 25 мл круглодонной колбе, 6-[7-[4-(1-аминоциклопропил)фенил]-3H-имидазо[4,5-b]пиридин-2-ил]-N,N-диметилпиридин-3-амин (78 мг, 0,19 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (4 мл), туда добавляют раствор бикарбонат натрия (106 мг, 1,26 ммоль, 5,99 эквив.) в воде (0,4 мл) при комнатной температуре. Затем медленно добавляют хлорид 4-трет-бутилбензоила (41 мг, 0,20 ммоль, 0,99 эквив.). Полученный раствор перемешивают в течение ночи при комнатной температуре. После завершения реакции, нерастворимые твердые вещества в реакционной смеси собирают фильтрацией, промывают метанолом (3×5 мл) и простым эфиром (2×5 мл). Полученные твердые вещества сушат в печи при пониженном давлении с получением 4-трет-бутил-N-[1-(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)циклопропил]бензамида (36 мг, 35%) в виде желтого твердого вещества. ЖХВД: 95,4% чистота. МС: m/z=531,2 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 9,38 (с, 1H), 8,57 (д, J=5,6 Гц, 1H), 8,48 (д, J=9,2 Гц, 1H), 8,21 (с, 1H), 7,95-7,85 (м, 4H), 7,75-7,68 (м, 1H), 7,60-7,52 (м, 1H), 7,45-7,35 (м, 4H), 3,12 (с, 6H), 1,36-1,26 (м, 4H), 1,25 (с, 9H).
Схема 25
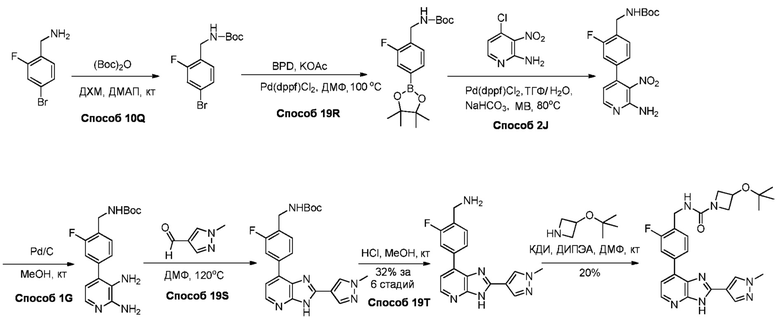
Пример 55. 3-(трет-Бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)азетидин-1-карбоксамид (55)
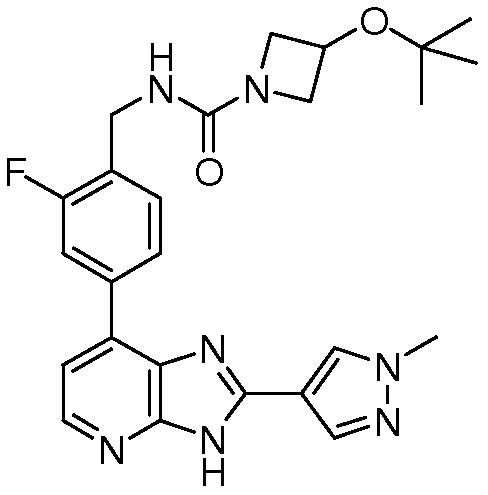
[2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин
[2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин 230 мг (32% за 6 стадий) получают из (4-бром-2-фторфенил)метанамина, ди-трет-бутилдикарбоната, 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана, 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида, 4-(дигидроксиборанил)бензойной кислоты и 3,3-диметилбутан-1-амина с применением способа 19Q, 19R, 2J, 1G, 19S и 19T. МС: m/z=323,0 [M+H]+.
Способ 23W: 3-(трет-Бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)азетидин-1-карбоксамид
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,31 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (5 мл), затем туда добавляют КДИ (100 мг, 0,62 ммоль, 1,99 эквив.) и ДИПЭА (200 мг, 1,55 ммоль, 4,99 эквив.) при комнатной температуре. Смесь перемешивают 1 ч при комнатной температуре и затем добавляют 3-(трет-бутокси)азетидин (60 мг, 0,46 ммоль, 1,50 эквив.). Полученную смесь перемешивают в течение 12 ч при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 15 мл этилацетатом и промывают насыщенным раствором соли (5×5 мл). Органическую фазу сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка, Gemini-NX 5u C18 110A, AXIA Packed, 150×21,2 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 25% до 50% градиент за 8 мин; определитель, УФ 254 нм. 3-(трет-бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)азетидин-1-карбоксамид (30 мг, 20%) получают в виде белого твердого вещества. ЖХВД: 98,3% чистота. МС: m/z=478,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,33 (шс, 1H), 8,46 (с, 1H), 8,29-8,21 (м, 2H), 8,14-8,13 (м, 2H), 7,57-7,45 (м, 2H), 7,00-6,95 (м, 1H), 4,55-4,45 (м, 1H), 4,47 (д, J=4,8 Гц, 2H), 4,04 (т, J=8 Гц, 2H), 3,95 (с, 3H), 3,63-3,60 (м, 2H), 1,13 (с, 9H)
Пример 56. 6-Циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)пиридин-3-карбоксамид (56)
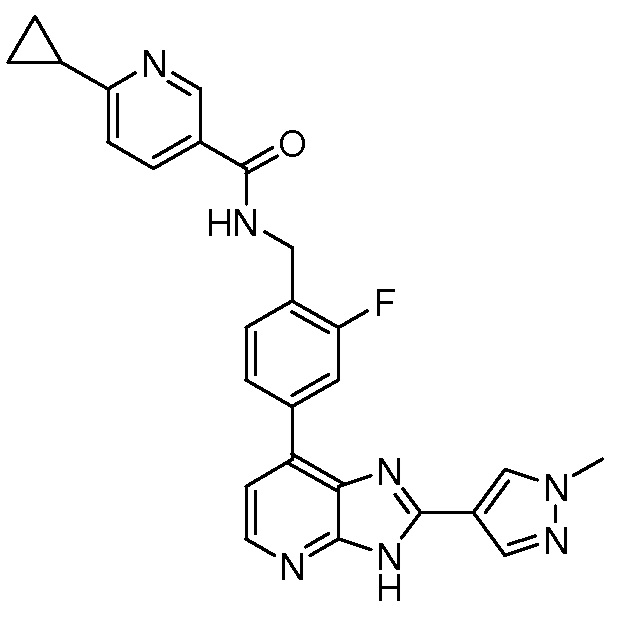
В 10-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,31 ммоль, 1,00 эквив.) и 6-циклопропилпиридин-3-карбоновую кислоту (60,7 мг, 0,37 ммоль, 1,20 эквив.) растворяют в N,N-диметилформамиде (2 мл), затем туда добавляют ГАТУ (176,9 мг, 0,47 ммоль, 1,50 эквив.) и ДИЭА (120,3 мг, 0,93 ммоль, 3,00 эквив.) последовательно, при комнатной температуре. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 5 мл воды, и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка, X Bridge C18, 19×150 мм, 5 мкм; подвижная фаза, ацетонитрил в воде (с 0,05% ТФК), от 30% до 70% градиент за 10 мин; определитель, УФ, 254 нм. 6-циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил] фенил]метил)пиридин-3-карбоксамид (20 мг, 13%) получают в виде белого твердого вещества. ЖХВД: 97,7% чистота. МС: m/z=468,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,39 (шс, 1H), 9,20-9,17 (м, 1H), 8,91 (д, J=2,0 Гц, 1H), 8,44 (с, 1H), 8,29-8,20 (м, 2H), 8,14-8,11 (м, 3H), 7,56-7,52 (м, 2H), 7,42 (д, J=8,0 Гц, 1H), 4,60 (с, 2H), 3,94 (с, 3H), 2,33-2,15 (м, 1H), 1,05-1,01 (м, 4H).
Схема 26
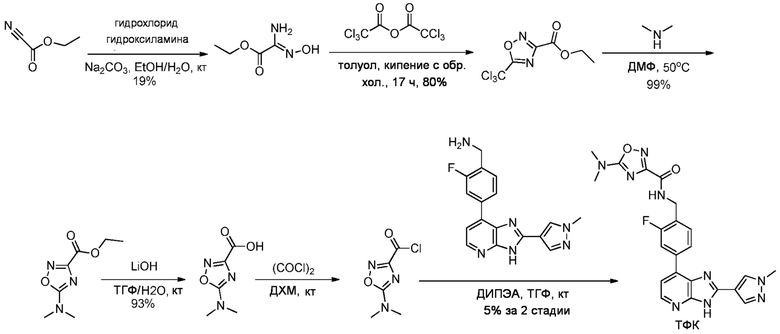
Пример 57. 2,2,2-Трифторацетат 5-(диметиламино)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-3-карбоксамид (57)
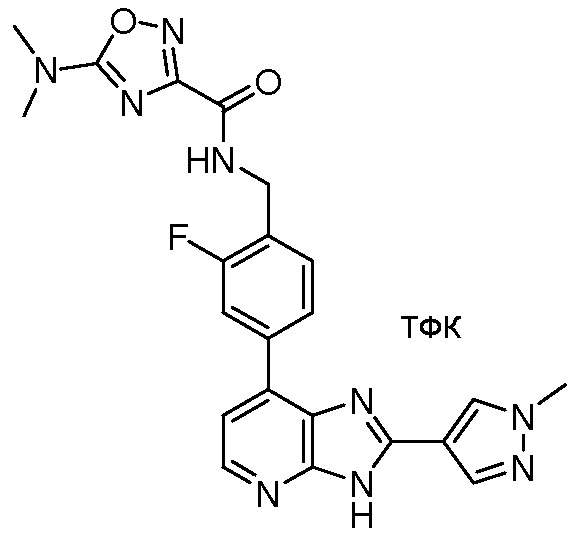
этил [(Z)-N-гидроксикарбамимидоил]формиат
В 250-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 2-этокси-2-оксоацетонитрил (5 г, 50,46 ммоль, 1,00 эквив.) и карбонат натрия (8 г, 75,48 ммоль, 1,50 эквив.) смешивают в смеси этанола (50 мл) и воды (30 мл), туда добавляют гидрохлорид гидроксиламина (5,2 г, 74,83 ммоль, 1,48 эквив.). Полученную смесь перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и оставшийся раствор экстрагируют дихлорметаном (3×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением этил [(Z)-N-гидроксикарбамимидоил]формиата (1,3 г, 19%) в виде беловатого твердого вещества. МС: m/z=133,0 [M+H]+.
Этил 5-(трихлорметил)-1,2,4-оксадиазол-3-карбоксилат
В 100-мл круглодонной колбе, 2,2,2-трихлорацетат трихлорацетила (695 мг, 2,25 ммоль, 1,00 эквив.) и этил [(Z)-N-гидроксикарбамимидоил]формиат (300 мг, 2,27 ммоль, 1,01 эквив.) растворяют в толуоле (5 мл) при комнатной температуре. Полученный раствор перемешивают в течение ночи при 110°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и затем остаток растворяют в 30 мл этилацетата и промывают насыщенным раствором соли (3×10 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением этил 5-(трихлорметил)-1,2,4-оксадиазол-3-карбоксилата (470 мг, 80%) в виде красного масла.
Этил 5-(диметиламино)-1,2,4-оксадиазол-3-карбоксилат
В 100-мл круглодонной колбе, этил 5-(трихлорметил)-1,2,4-оксадиазол-3-карбоксилат (330 мг, 1,27 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (5 мл), затем туда добавляют гидрохлорид диметиламина (124 мг, 1,52 ммоль, 1,20 эквив.) и ДИЭА (495 мг, 3,83 ммоль, 3,01 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 4 ч. при 50°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 20 мл H2O и экстрагируют этилацетатом (4×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением этил 5-(диметиламино)-1,2,4-оксадиазол-3-карбоксилата (220 мг, 99%) в виде красного масла. МС: m/z=186,1[M+H]+.
5-(Диметиламино)-1,2,4-оксадиазол-3-карбоновая кислота
В 100 мл круглодонной колбе, этил 5-(диметиламино)-1,2,4-оксадиазол-3-карбоксилат (214 мг, 1,02 ммоль, 1,00 эквив.) растворяют в смеси тетрагидрофурана (7 мл) и воды (4 мл), туда добавляют LiOH (155 мг, 6,47 ммоль, 6,32 эквив.) при комнатной температуре. Полученную смесь перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Значение рН оставшегося раствора доводят до 2 с применением раствора хлороводорода (1M) и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией с обращенной фазой с применением следующих условий: колонка, C18 силикагель; подвижная фаза, вода, 100% изократная; определитель, УФ 254 нм. 5-(диметиламино)-1,2,4-оксадиазол-3-карбоновую кислоту (150 мг, 93%) получают в виде желтого твердого вещества.
Хлорид 5-(диметиламино)-1,2,4-оксадиазол-3-карбонила
В 8 мл пробирке, щавелевый дихлорид (60,2 мг, 0,47 ммоль, 1,49 эквив.) по каплям добавляют к раствору 5-(диметиламино)-1,2,4-оксадиазол-3-карбоновой кислоты (50 мг, 0,32 ммоль, 1,00 эквив.) в дихлорметане (3 мл, 47,19 ммоль, 148,30 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением хлорида 5-(диметиламино)-1,2,4-оксадиазол-3-карбонила 56 мг (неочищенный) в виде белого твердого вещества, который применяют сразу на следующей стадии без дальнейшей очистки.
2,2,2-Трифторацетат 5-(диметиламино)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-3-карбоксамид
В 8 мл пробирке, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (103 мг, 0,32 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (2 мл), затем туда добавляют хлорид 5-(диметиламино)-1,2,4-оксадиазол-3-карбонила (56 мг, 0,32 ммоль, 1,00 эквив.) и ДИЭА (124 мг, 0,96 ммоль, 3,00 эквив.) последовательно, при комнатной температуре. Полученный раствор перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 10 мл ДХМ и промывают насыщенным раствором соли (3×3 мл). Органическую фазу отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge BEH C18 OBD Prep Column, 5 мкм, 19 мм 250 мм; подвижная фаза, ацетонитрил в воде (с 0,05% ТФК), от 26% до 36% градиент за 8 мин; определитель, УФ 254 нм. 2,2,2-Трифторацетат 5-(диметиламино)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-3-карбоксамида (9 мг, 5% за 2 стадии) получают в виде желтого твердого вещества. ЖХВД: 95,4% чистота. МС: m/z=462,0 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,46-8,45 (м, 2H), 8,27 (с, 1H), 7,81-7,75 (м, 2H), 7,69-7,64 (м, 1H), 7,57 (д, J=6,4 Гц, 1H), 4,73 (с, 2H), 4,04 (с, 3H), 3,21 (с, 6H).
Схема 27
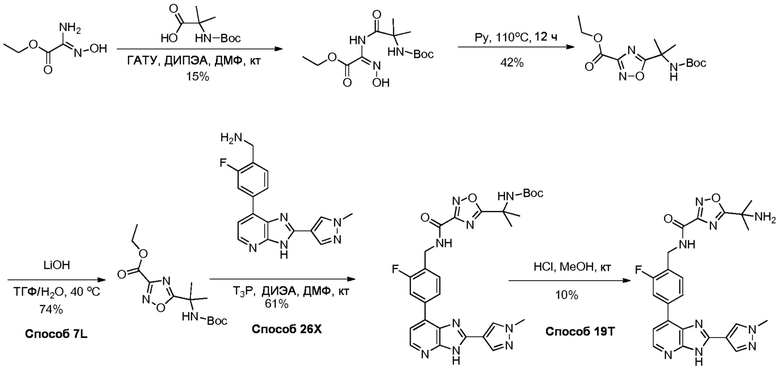
Пример 58. 5-(2-Аминопропан-2-ил)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (58)
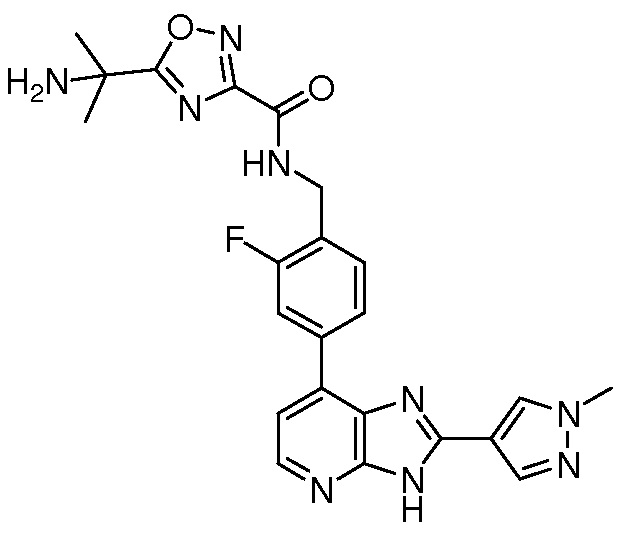
Этил (2E)-2-(2-[[(трет-бутокси)карбонил]амино]-2-метилпропанамидо)-2-(гидроксиимино)ацетат
В 50-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, этил [(Z)-N-гидроксикарбамимидоил]формиат (820 мг, 6,21 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (10 мл), затем туда добавляют ГАТУ (3,54 г, 9,31 ммоль, 1,50 эквив.), ДИЭА (2,4 г, 18,57 ммоль, 2,99 эквив.) и 2-[[(трет-бутокси)карбонил]амино]-2-метилпропановую кислоту (1,26 г, 6,20 ммоль, 1,00 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение ночи при комнатной температуре. После завершения реакции, ее гасят добавлением 10 мл воды, и полученную смесь экстрагируют дихлорметаном (3×15 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 10% до 50% градиент) с получением этил (2E)-2-(2-[[(трет-бутокси)карбонил]амино]-2-метилпропанамидо)-2-(гидроксиимино)ацетата (300 мг, 15%) в виде светло-желтого твердого вещества.
Этил 5-(2-[[(трет-бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоксилат
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, этил (2E)-2-(2-[[(трет-бутокси)карбонил]амино]-2-метилпропанамидо)-2-(гидроксиимино)ацетат (300 мг, 0,95 ммоль, 1,00 эквив.) растворяют в пиридине (10 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение ночи при 110°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 10% до 50% градиент) с получением этил 5-(2-[[(трет-бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоксилата (120 мг, 42%) в виде беловатого твердого вещества. МС: m/z=300,1 [M+H]+.
5-(2-[[(трет-Бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоновая кислота
5-(2-[[(трет-бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоновую кислоту 80 мг (74%) получают из этил 5-(2-[[(трет-бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоксилата с применением способа 7L. МС: m/z=272,0 [M+H]+.
Способ 26X: трет-Бутил N-(2-[3-[([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамоил]-1,2,4-оксадиазол-5-ил]пропан-2-ил)карбамат
В 8 мл пробирке, продутой и имеющей инертную атмосферу азота, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (55 мг, 0,17 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (1,5 мл), затем туда добавляют T3P (326 мг, инф эквив.), ДИЭА (133 мг, 1,03 ммоль, 6,03 эквив.) и 5-(2-[[(трет-бутокси)карбонил]амино]пропан-2-ил)-1,2,4-оксадиазол-3-карбоновую кислоту (70 мг, 0,26 ммоль, 1,51 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 1 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 5 мл воды, и смесь экстрагируют дихлорметаном (3×5 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением трет-бутил N-(2-[3-[([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамоил]-1,2,4-оксадиазол-5-ил]пропан-2-ил)карбамата (60 мг, 61%) в виде желтого масла.
5-(2-Аминопропан-2-ил)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид
5-(2-аминопропан-2-ил)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 5 мг (10%) получают из трет-бутил N-(2-[3-[([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамоил]-1,2,4-оксадиазол-5-ил]пропан-2-ил)карбамата с применением способа 19T. ЖХВД: 98,2% чистота. МС: m/z=476,3 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): δ 13,25 (шс, 1H), 9,58-9,54 (м, 1H), 8,45 (с, 1H), 8,29 (д, J=6,0 Гц, 2H), 8,14-8,12 (м, 2H), 7,54-7,49 (м, 2H),4,59 (д, J=6,0 Гц, 2H), 3,94 (с, 3H), 2,51-2,43 (м, 2H), 1,49 (м, 6H).
Пример 59. 5-Циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (59)
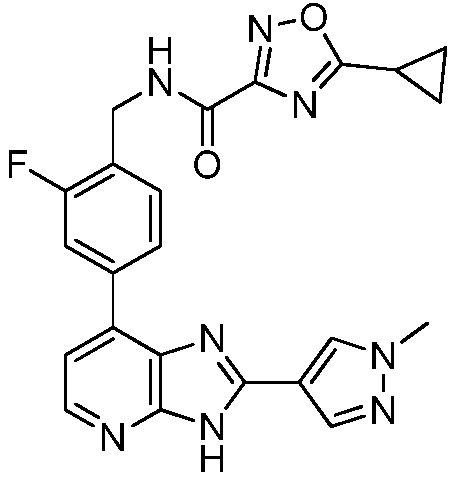
5-циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 15 мг (21%) получают из 5-циклопропил-1,2,4-оксадиазол-3-карбоновой кислоты, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамина с применением способа 26X. ЖХВД: 98,5% чистота. МС: m/z=459,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,17 (шс, 1H), 9,53-9,52 (м, 1H), 8,45 (с, 1H), 8,30-8,24 (м, 2H), 8,14-8,13 (м, 2H), 7,56-7,46 (м, 2H), 4,57 (д, J=5,6 Гц, 2H), 3,95 (с, 3H), 2,50-2,39 (м, 1H), 1,35-1,28 (м, 2H), 1,25-1,15 (м, 2H).
Схема 28

Пример 60. 3-(трет-Бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)циклобутан-1-карбоксамид (60)

Метил 3-(трет-бутокси)циклобутан-1-карбоксилат
D 30-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 3-гидроксициклобутан-1-карбоксилат (200 мг, 1,54 ммоль, 1,00 эквив.) и ди-трет-бутилдикарбонат (771,4 мг, 3,53 ммоль, 2,30 эквив.) смешивают в дихлорметане (10 мл), туда добавляют перхлорат магния (34,3 мг, 0,15 ммоль, 0,10 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч. при 40°C. После завершения реакции, ее гасят 10 мл воды и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ТСХ, элюируя этилацетатом в петролейном эфире (50%) с получением метил 3-(трет-бутокси)циклобутан-1-карбоксилата (200 мг, 70%) в виде желтого масла. МС: m/z=187,1 [M+H]+.
3-(трет-Бутокси)циклобутан-1-карбоновая кислота
3-(трет-бутокси)циклобутан-1-карбоновую кислоту 85 мг (70%) получают из метил 3-(трет-бутокси)циклобутан-1-карбоксилата с применением способа 7L. МС: m/z=173,0 [M+H]+.
3-(трет-Бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)циклобутан-1-карбоксамид
В 20-мл круглодонной колбе, продутой и содержащей атмосферу азота, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,31 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (5 мл), затем туда добавляют 3-(трет-бутокси)циклобутан-1-карбоновую кислоту (80 мг, 0,46 ммоль, 1,50 эквив.), ГАТУ (180 мг, 0,47 ммоль, 1,50 эквив.) и ДИЭА (240 мг, 1,86 ммоль, 6,00 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят 10 мл воды и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм, 250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 32% до 45% градиент за 9 мин; определитель, УФ 254 нм. 3-(трет-бутокси)-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)циклобутан-1-карбоксамид (20 мг, 13%) получают в виде белого твердого вещества. ЖХВД: 98,4% чистота. МС: m/z=477,2 [M+H]+. 1H ЯМР (300 МГц, CD3OD): δ 8,33-8,32 (м, 2H), 8,18 (с, 1H), 7,80-7,60 (м, 2H), 7,50 (т, J=7,6 Гц, 1H), 7,39 (д, J=5,2 Гц, 1H), 4,50 (с, 2H), 4,12-4,10 (м, 1H), 4,00 (с, 3H), 2,75-2,59 (м, 1H), 2,52-2,36 (м, 2H), 2,18 (м, 2H), 1,19 (с, 9H).
Схема 29
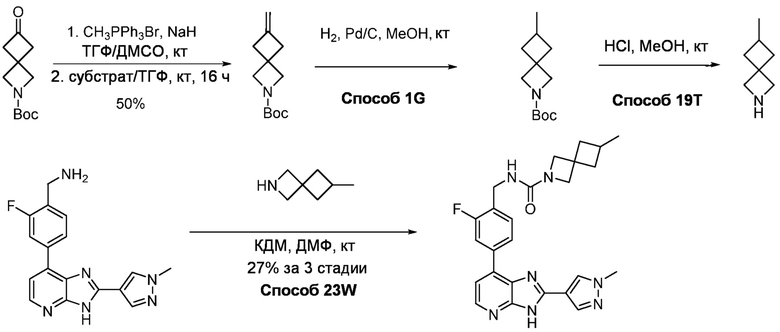
Пример 61. N-([2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-6-метил-2-азаспиро[3,3]гептан-2-карбоксамид
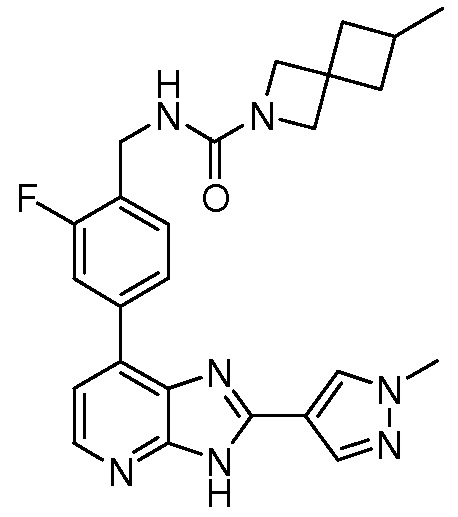
трет-Бутил N-(2-[3-[([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамоил]-1,2,4-оксадиазол-5-ил]пропан-2-ил)карбамат
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, гидрид натрия (60% в масле, 12,50 мг, 0,52 ммоль, 1,10 эквив.) суспендируют в тетрагидрофуране (5 мл), туда добавляют раствор бромида метилтрифенилфосфония (507,3 мг, 1,42 ммоль, 3,0 эквив.) в ДМСО (2 мл) по каплям при 0°C. Смесь нагревают до комнатной температуры и перемешивают в течение 2 ч. Затем раствор трет-бутил 6-оксо-2-азаспиро[3,3]гептан-2-карбоксилата (100 мг, 0,47 ммоль, 1,00 эквив.) в тетрагидрофуране (2 мл) добавляют при комнатной температуре. Полученную смесь перемешивают в течение еще 16 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 10 мл воды, и смесь экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 20% градиент) с получением трет-бутил 6-метилиден-2-азаспиро[3,3]гептан-2-карбоксилата (50 мг, 50%) в виде желтого твердого вещества.
N-([2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-6-метил-2-азаспиро[3,3]гептан-2-карбоксамид
N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-6-метил-2-азаспиро[3,3]гептан-2-карбоксамид 30 мг (27% за 3 стадии) получают из трет-бутил 6-метилиден-2-азаспиро[3,3]гептан-2-карбоксилата и [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамина с применением способа 1G, 19T и 23W. ЖХВД: 99,8% чистота. МС: m/z=460,1 [M+H]+. 1H ЯМР (300 МГц, CD3OD): δ 8,31-8,21 (м, 2H), 8,10 (с, 1H), 7,82-7,75 (м, 2H), 7,49 (т, J=7,8 Гц, 1H), 7,35 (шс, 1H), 4,42 (с, 2H), 3,95-3,94 (м, 5H), 3,83 (с, 2H), 2,37-2,13 (м, 3H), 1,78-1,73 (м, 2H), 1,04-1,02 (м, 3H).
Схема 30
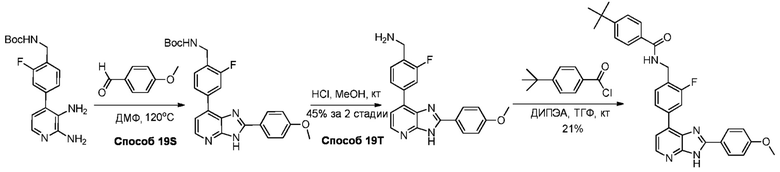
Пример 62. 4-трет-Бутил-N-([2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид (62)
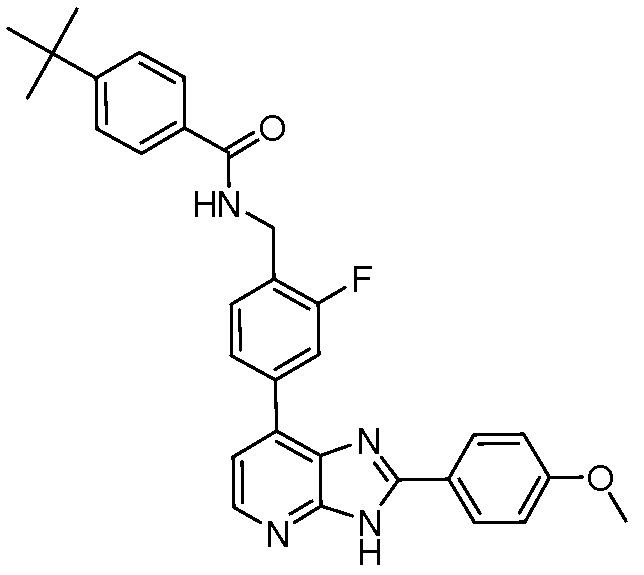
[2-Фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин
[2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин 200 мг (45% за 2 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата и 4-метоксибензальдегида с применением способа 19S и 19T. МС: m/z=349,0 [M+H]+.
4-трет-Бутил-N-([2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид
При 0°C, в 10 мл 3-горлой круглодонной колбе, продутой и содержащей инертную атмосферу азота, [2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,29 ммоль, 1,00 эквив.) и ДИЭА (185,5 мг, 1,44 ммоль, 5,00 эквив.) растворяют в тетрагидрофуране (2 мл), туда медленно добавляют хлорид 4-трет-бутилбензоил (67,7 мг, 0,34 ммоль, 1,20 эквив.). Полученный раствор перемешивают в течение 30 мин при 0°C. После завершения реакции, ее гасят 10 мл воды и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм, 250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 58% до 61% градиент за 11 мин; определитель, УФ 254 нм. 4-трет-бутил-N-([2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид 30 мг (21%) получают в виде белого твердого вещества. ЖХВД: 98,9% чистота. МС: m/z=509,0 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,54 (шс, 1H), 9,06-9,04 (м, 1H), 8,33-8,22 (м, 5H), 7,89-7,87 (м, 2H), 7,55-7,50 (м, 4H), 7,15-7,13 (м, 2H), 4,60 (с, 2H), 3,85 (с, 3H), 3,32-3,30 (м, 1H), 1,30 (с, 9H).
Пример 63. 4-Циклопропил-N-([2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид (63)
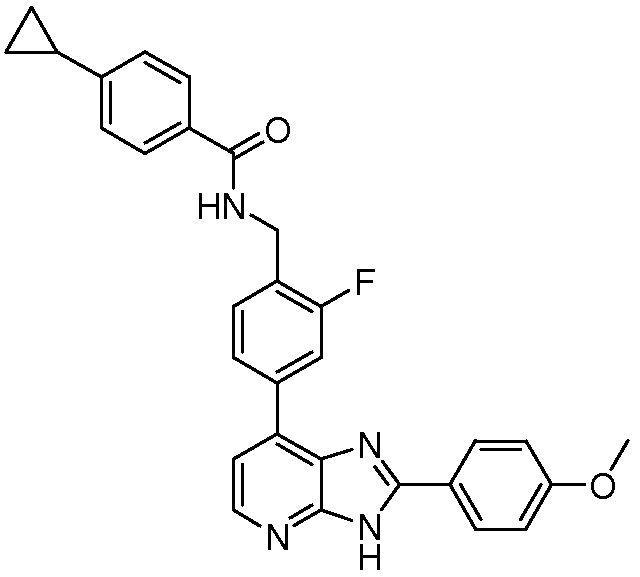
При -10°C, в 10 мл круглодонной колбе, продутой и содержащей инертную атмосферу азота, [2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,29 ммоль, 1,00 эквив.) и ДИЭА (185,5 мг, 1,44 ммоль, 5,00 эквив.) растворяют в тетрагидрофуране (2 мл), туда медленно добавляют хлорид 4-циклопропилбензоила (62,2 мг, 0,34 ммоль, 1,20 эквив.). Смесь перемешивают в течение 30 мин при -10°C. После завершения реакции, ее гасят 10 мл воды, и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм, 250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 20% до 50% градиент за 10 мин; определитель, УФ 254 нм. 4-циклопропил-N-([2-фтор-4-[2-(4-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид 30 мг (21%) получают в виде белого твердого вещества. ЖХВД: 97,4% чистота. МС: m/z=493,1 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,20 (шс, 1H), 9,03-9,00 (м, 1H), 8,34-8,22 (м, 5H), 7,84-7,82 (м, 2H), 7,55-7,51 (м, 2H), 7,19-7,13 (м, 4H), 4,60 (с, 2H), 3,85 (с, 3H), 2,02-1,95 (м, 1H), 1,04-0,99 (м, 2H), 0,77-0,74 (м, 2H).
Схема 31
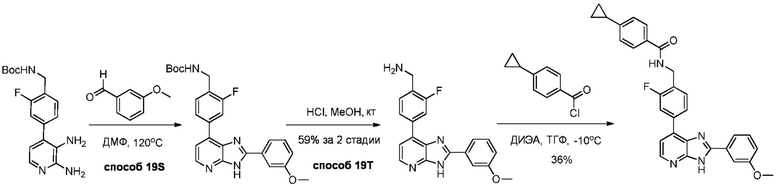
Пример 64. 4-Циклопропил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид (64)
[2-Фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин
[2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин 120 мг (59% за 2 стадии) получают из N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 3-метоксибензальдегида с применением способа 19S и 19T. МС: m/z=349,0 [M+H]+.
4-Циклопропил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид
При -10°C, в 10 мл круглодонной колбе, продутой и содержащей инертную атмосферу азота, [2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (60 мг, 0,17 ммоль, 1,00 эквив.) и ДИЭА (111 мг, 1,72 ммоль, 5,00 эквив.) растворяют в тетрагидрофуране (2 мл), туда медленно добавляют хлорид 4-циклопропилбензоила (37 мг, 0,41 ммоль, 1,20 эквив.). Полученный раствор перемешивают в течение 30 мин при -10°C. После завершения реакции, ее гасят 10 мл воды, и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: Колонка: X Bridge C18, 19*150 мм, 5 мкм; Подвижная фаза ацетонитрил в воде (с 0,05% ТФК) от 30% до 70% градиент за 10 мин. определитель, УФ 254 нм. 4-циклопропил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид 30 мг (36%) получают в виде белого твердого вещества. ЖХВД: 98,4% чистота. МС: m/z=493,1[M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,31 (шс, 1H), 9,04-9,01 (м, 1H), 8,46-8,41 (м, 3H), 7,88-7,82 (м, 4H), 7,59-7,47 (м, 3H), 7,19-7,11 (м, 3H), 4,60 (с, 2H), 3,87 (с, 3H), 2,02-1,95 (м, 1H), 1,02-1,01 (м, 2H), 0,75-0,74 (м, 2H).
Схема 32
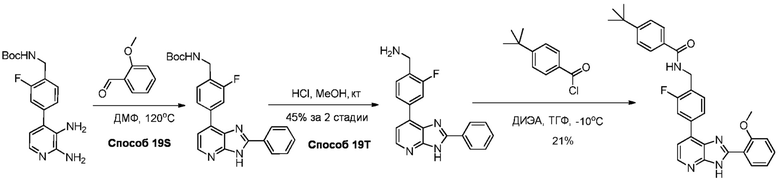
Пример 65. 4-Циклопропил-N-([2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид (65)
трет-Бутил N-([2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат
трет-бутил N-([2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат 120 мг (45% за 2 стадии) получают из N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 2-метоксибензальдегида с применением способа 19S и 19T. МС: m/z=349,0 [M+H]+.
4-Циклопропил-N-([2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид
При -10°C, в 10 мл круглодонной колбе, продутой и содержащей инертную атмосферу азота, [2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (100 мг, 0,29 ммоль, 1,00 эквив.) и ДИЭА (185 мг, 1,44 ммоль, 5,00 эквив.) растворяют в тетрагидрофуране (2 мл), туда медленно добавляют хлорид 4-циклопропилбензоила (62,22 мг, 0,34 ммоль, 1,20 эквив.). Смесь затем перемешивают в течение 30 мин при -10°C. После завершения реакции, ее гасят 10 мл воды, и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge C18 OBD Prep Column, 5 мкм, 19 мм, 250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 57% до 61% градиент за 10 мин; определитель, УФ 254 нм. 4-циклопропил-N-([2-фтор-4-[2-(2-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)бензамид 30 мг (21%) получают в виде белого твердого вещества. ЖХВД: 98,7% чистота. МС: m/z=509,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 12,88 (шс, 1H), 9,02-9,00 (м, 1H), 8,39-8,23 (м, 4H), 7,84-7,82 (м, 2H), 7,61-7,51 (м, 3H), 7,26-7,13 (м, 4H), 4,59 (с, 2H), 4,01 (с, 3H), 2,50-1,95 (м, 1H), 1,04-0,99 (м, 2H), 0,77-0,73 (м, 2H).
Схема 33
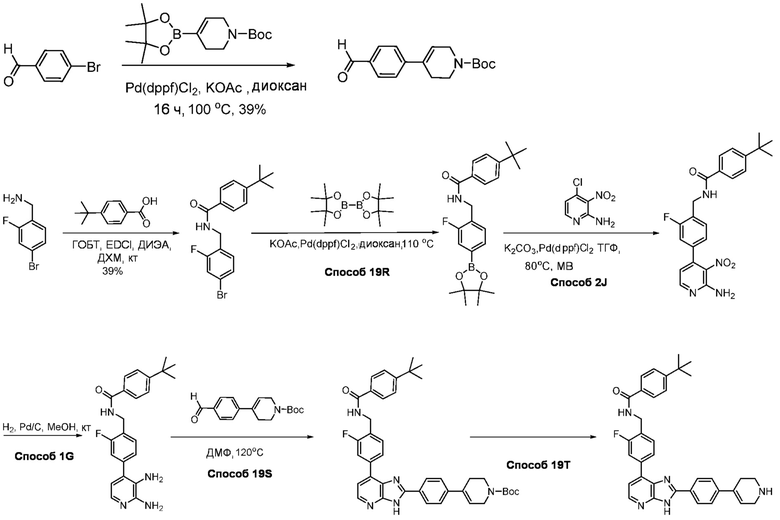
Пример 66. 4-трет-Бутил-N-[(2-фтор-4-[2-[4-(1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]бензамид (66)
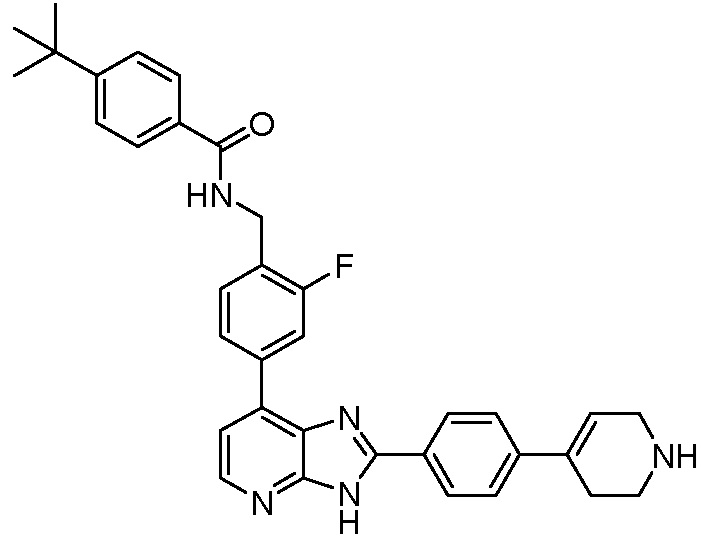
трет-Бутил 4-(4-формилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилат
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 4-бромбензальдегид (200 мг, 1,08 ммоль, 1,00 эквив.), трет-бутил 4-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридин-1-карбоксилат (501 мг, 1,62 ммоль, 1,50 эквив.), Pd(dppf)Cl2 (79 мг, 0,11 ммоль, 0,10 эквив.) и KOAc (212 мг, 2,16 ммоль, 2,00 эквив.) смешивают в диоксане (5 мл) при комнатной температуре. Полученную смесь перемешивают в течение 16 ч. при 100°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 5 мл воды и экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 30% градиент) с получением трет-бутил 4-(4-формилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата (120 мг, 39%) в виде белого твердого вещества.
N-[(4-Бром-2-фторфенил)метил]-4-трет-бутилбензамид
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, (4-бром-2-фторфенил)метанамин (1,000 г, 4,90 ммоль, 1,00 эквив.) растворяют в дихлорметане (20 мл), затем туда добавляют 4-трет-бутилбензойную кислоту (1,310 г, 7,35 ммоль, 1,50 эквив.), ГОБТ (993 мг, 7,35 ммоль, 1,50 эквив.), EDCI (1,409 г, 7,35 ммоль, 1,50 эквив.) и ДИЭА (1,267 г, 9,80 ммоль, 2,00 эквив.) последовательно, при комнатной температуре. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 10 мл воды, и смесь экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия and концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 30% градиент) с получением N-[(4-бром-2-фторфенил)метил]-4-трет-бутилбензамида (700 мг, 39%) в виде желтого твердого вещества.
4-трет-Бутил-N-[(2-фтор-4-[2-[4-(1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]бензамид
4-трет-бутил-N-[(2-фтор-4-[2-[4-(1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]бензамид 10 мг (2% за 5 стадий) получают из N-[(4-бром-2-фторфенил)метил]-4-трет-бутилбензамида, 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) и трет-бутил 4-(4-формилфенил)-1,2,3,6-тетрагидропиридин-1-карбоксилата с применением способа 19R, 2J, 1G, 19S и 19T. ЖХВД: 96,9% чистота. МС: m/z=560,3 [M+H]+. 1H ЯМР (400 МГц, CD3OD): δ 8,52 (с, 1H), 8,31 (д, J=8,4 Гц, 2H), 7,92-7,83 (м, 4H), 7,74-7,65 (м, 4H), 7,55 (д, J=8,4 Гц, 2H), 6,38 (с, 1H), 4,75 (с, 2H), 3,92-3,91 (м, 2H), 3,54-3,51(м, 2H), 2,90-2,89 (м, 2H), 1,37 (м, 9H).
Пример 67. 5-трет-Бутил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2-оксазол-3-карбоксамид (67)
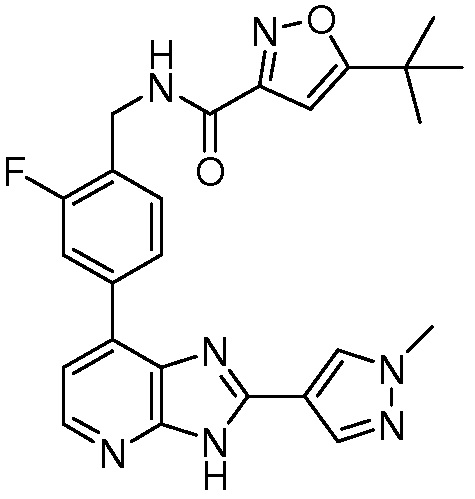
5-трет-бутил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2-оксазол-3-карбоксамид 20 мг (14%) получают из [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамина и 5-трет-бутил-1,2-оксазол-3-карбоновой кислоты с применением способа 26X. ЖХВД: 98,8% чистота. МС: m/z=474,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,40 (шс, 1H), 9,35-9,34 (м, 1H), 8,45 (с, 1H), 8,30-8,25 (м, 2H), 8,16-8,14 (м, 2H), 7,54-7,49 (м, 2H), 6,61 (с, 1H), 4,58-4,56 (м, 2H), 3,95 (с, 3H), 1,34 (с, 9H).
Пример 68. 5-Циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (68) (MSC2574688)

5-циклопропил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 15 мг (9,7% за 3 стадии) получают из 5 N-[(трет-бутокси)карбонил]-N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 4-[(морфолин-4-ил)карбонил]бензальдегида и 5-циклопропил-1,2,4-оксадиазол-3-карбоновой кислоты с применением способа 7K, 19T и 26X. ЖХВД: 98,2% чистота. МС: m/z=584,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,58-9,55 (м, 1H), 8,40-8,31 (м, 4H), 8,21 (д, J=4,0 Гц, 1H), 7,62-7,53 (м, 4H), 4,61-4,59 (м, 2H), 3,65-3,33 (м, 8H), 1,44 (с, 9H).
Схема 34
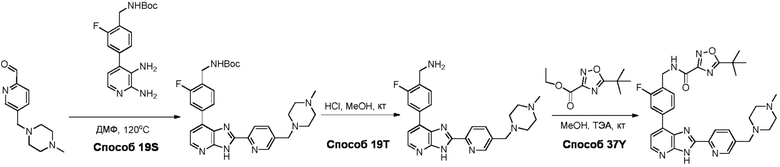
Пример 69. 5-трет-Бутил-N-[[2-фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид (69)
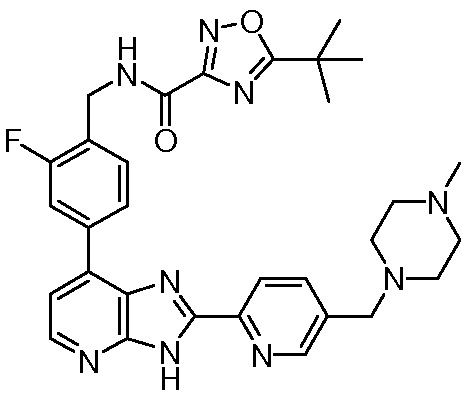
[2-Фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанамин
[2-фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанамин 100 мг (38% за 2 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата и 5-[(4-метилпиперазин-1-ил)метил]пиридин-2-карбальдегида с применением способа 19S и 19T. МС: m/z=432,1 [M+H]+.
Способ 37Y: 5-трет-Бутил-N-[[2-фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид:
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, [2-фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метанамин (80 мг, 0,19 ммоль, 1,00 эквив.) растворяют в метаноле (3 мл), затем туда добавляют этил 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилат (44 мг, 0,22 ммоль, 1,20 эквив.) и ТЭА (93,80 мг, 0,93 ммоль, 5,00 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 5 мл воды, и смесь экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка: Gemini-NX 5u C18 110A, AXIA Packed 150×21,2 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 30% до 60% градиент за 10 мин; определитель, УФ 254 нм. 5-трет-Бутил-N-[[2-фтор-4-(2-[5-[(4-метилпиперазин-1-ил)метил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид (10 мг, 9%) получают в виде белого твердого вещества. ЖХВД: 98,1% чистота. МС: m/z=584,5 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,84 (шс, 1H), 9,56 (т, J=6,3 Гц, 1H), 8,66 (с, 1H), 8,42-8,19 (м, 4H), 7,95-7,92 (м, 1H), 7,62-7,52 (м, 2H), 4,61-4,59 (м, 2H), 3,60 (с, 2H), 2,42-2,27 (м, 8H), 2,15 (с, 3H), 1,43 (с, 9H).
Схема 35
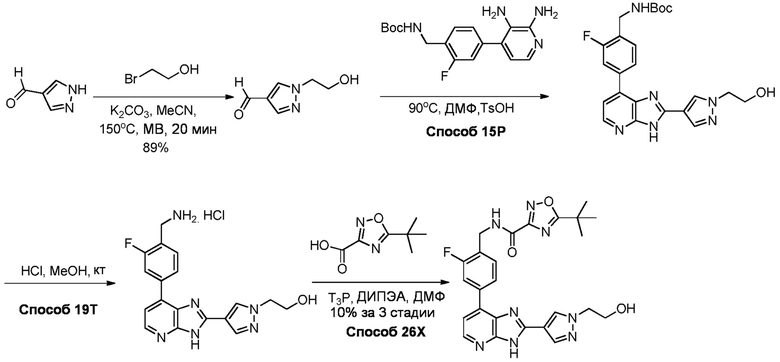
Пример 70. 5-трет-Бутил-N-[(2-фтор-4-[2-[1-(2-гидроксиэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил] фенил)метил]-1,2,4-оксадиазол-3-карбоксамид (70)
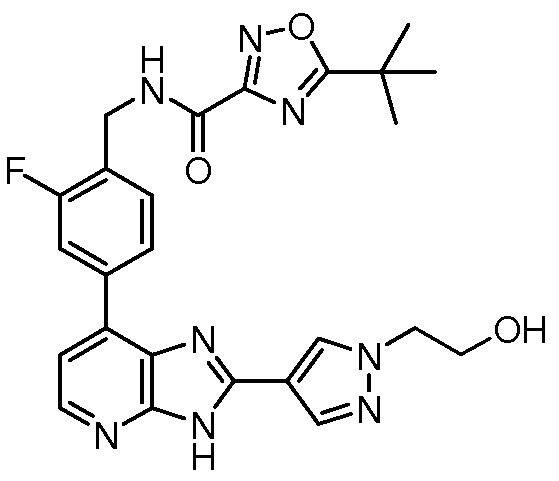
1-(2-Гидроксиэтил)-1H-пиразол-4-карбальдегид
В 30-мл герметично закрытой пробирке, 1H-пиразол-4-карбальдегид (500 мг, 5,20 ммоль, 1,00 эквив.), карбонат калия (1,08 мг, 7,80 ммоль, 1,50 эквив.) и 2-бромэтан-1-ол (775,3 мг, 6,20 ммоль, 1,19 эквив.) смешивают в CH3CN (10 мл) при комнатной температуре. Реакционную смесь затем облучают микроволнами в течение 40 мин при 150°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, фильтруют через слой Целита и фильтрат концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя дихлорметаном/метанолом (от 1% до 5% градиент) с получением 1-(2-гидроксиэтил)-1H-пиразол-4-карбальдегида (650 мг, 89%) в виде желтого твердого вещества. МС: m/z =140,8 [M+H]+.
5-трет-Бутил-N-[(2-фтор-4-[2-[1-(2-гидроксиэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[(2-фтор-4-[2-[1-(2-гидроксиэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 10 мг (10% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 1-(2-гидроксиэтил)-1H-пиразол-4-карбальдегида и 5-трет-бутил-1,2,4-оксадиазол-3-карбоновой кислоты с применением способа 15P, 19T и 26X. ЖХВД: 97,2% чистота. МС: m/z=505,1 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,56 (с, 1H), 8,48 (шс, 1H), 8,31(с, 1H), 7,77-7,58 (м, 4H), 4,75-4,74 (м, 2H), 4,38-4,34 (м, 2H), 3,96-3,95 (м, 2H), 1,49 (с, 9H).
Схема 36
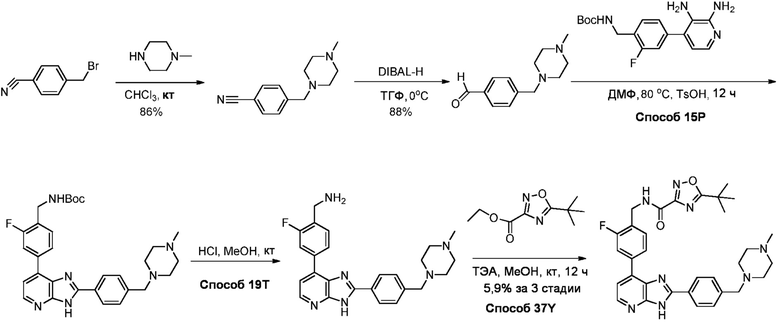
Пример 71. 5-трет-Бутил-N-[[2-фтор-4-(2-[4-[(4-метилпиперазин-1-ил)метил]фенил]-1H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид (71)
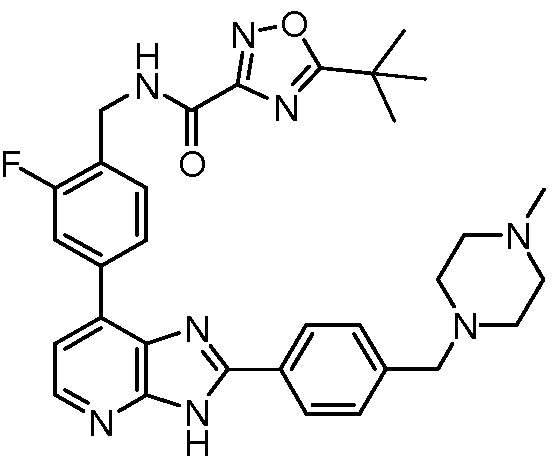
4-[(4-Метилпиперазин-1-ил)метил]бензонитрил
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-метилпиперазин (5 г, 47,42 ммоль, 1,72 эквив.) растворяют в хлороформе (50 мл), туда добавляют 4-(бромметил)бензонитрил (5,68 г, 27,52 ммоль, 1,00 эквив.) по каплям при 0°C. Полученную смесь затем перемешивают в течение 4 ч при комнатной температуре. После завершения реакции, ее гасят добавлением 10 мл воды, и смесь экстрагируют дихлорметаном (3×15 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 4-[(4-метилпиперазин-1-ил)метил]бензонитрила (5,1 г, 86%) в виде желтого твердого вещества. МС: m/z =215,1 [M+H]+.
4-[(4-Метилпиперазин-1-ил)метил]бензальдегид
В 50-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 4-[(4-метилпиперазин-1-ил)метил]бензонитрил (2 г, 8,83 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (20 мл), туда добавляют раствор DIBAL (1M в ТГФ, 14 мл, 141,2 ммоль, 16,0 эквив.) по каплям в течение более 5 мин при 0°C. Полученный раствор перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, ее гасят 5 мл воды и смесь экстрагируют дихлорметаном (3×50 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 4-[(4-метилпиперазин-1-ил)метил]бензальдегида (1,7 г, 88%) в виде желтого твердого вещества. МС: m/z =219,0 [M+H]+.
5-трет-Бутил-N-[[2-фтор-4-(2-[4-[(4-метилпиперазин-1-ил)метил]фенил]-1H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[[2-фтор-4-(2-[4-[(4-метилпиперазин-1-ил)метил]фенил]-1H-имидазо[4,5-b]пиридин-7-ил)фенил]метил]-1,2,4-оксадиазол-3-карбоксамид 10 мг (5,9% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 4-[(4-метилпиперазин-1-ил)метил]бензальдегида и метил 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15P, 19T и 37Y. ЖХВД: 98,8% чистота. МС: m/z=483,4 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,70 (шс, 1H), 9,57-9,54 (м, 1H), 8,38-8,30 (м, 2H), 8,24-8,22 (м, 3H), 7,61-7,49 (м, 4H), 4,61-4,59 (м, 2H), 3,54 (с, 2H), 2,51-2,50 (м, 8H), 2,16 (с, 3H), 1,44 (с, 9H).
Схема 37
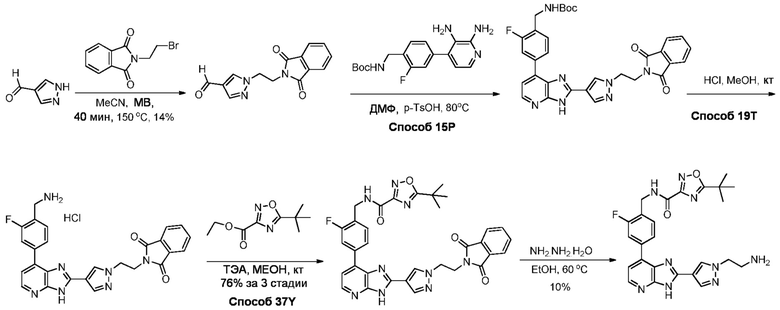
Пример 72. N-[(4-[2-[1-(2-аминоэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-5-трет-бутил-1,2,4-оксадиазол-3-карбоксамид (72)
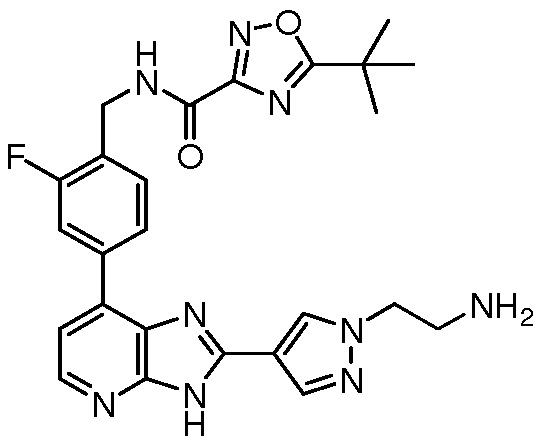
1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразол-4-карбальдегид
В 30 мл пробирке, 1H-пиразол-4-карбальдегид (2,0 г, 20,81 ммоль, 1,00 эквив.), 2-(2-бромэтил)-2,3-дигидро-1H-изоиндол-1,3-дион (6,3 г, 24,98 ммоль, 1,20 эквив.) и Cs2CO3 (13,5 г, 41,63 ммоль, 2,00 эквив.) смешивают в CH3CN (10 мл) при комнатной температуре. Полученную смесь облучают микроволнами в течение 40 мин при 150°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 50% градиент) с получением 1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразолe-4-карбальдегида (800 мг, 14%) в виде белого твердого вещества. МС: m/z =270,0 [M+H]+.
5-трет-Бутил-N-[[4-(2-[1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[[4-(2-[1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-3-карбоксамид 150 мг (76% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразол-4-карбальдегида и этил 5-трет-бутил-1,2,4- оксадиазол-3-карбоксилата с применением способа 19S, 19T и 37Y. МС: m/z=634,1 [M+H]+.
N-[(4-[2-[1-(2-аминоэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-5-трет-бутил-1,2,4-оксадиазол-3-карбоксамид
В a 10 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 5-трет-бутил-N-[[4-(2-[1-[2-(1,3-диоксо-2,3-дигидро-1H-изоиндол-2-ил)этил]-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-3-карбоксамид (120 мг, 0,19 ммоль, 1,00 эквив.) растворяют в этаноле (3 мл), туда добавляют гидрат гидразина (18,9 мг, 0,38 ммоль, 2,00 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 2 ч. при 60°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 5 мл воды и экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 5% до 20% градиент) с получением N-[(4-[2-[1-(2-аминоэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-5-трет-бутил-1,2,4-оксадиазол-3-карбоксамида (10 мг, 10%) в виде белого твердого вещества. ЖХВД: 99,3% чистота. МС: m/z=504,2 [M+H]+. 1H-ЯМР (400 МГц, CD3OD): δ 8,42 (с, 1H), 8,34 (д, J=5,2 Гц, 1H), 8,25(с, 1H), 7,88-7,86 (м, 2H), 7,64-7,60 (м,1H),7,43-7,41 (м, 1H),4,89 (с, 2H), 4,34 (т, J=6,0 Гц, 2H), 3,18-3,15 (м, 2H), 1,50 (с, 9H).
Пример 73. 5-трет-Бутил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (73)
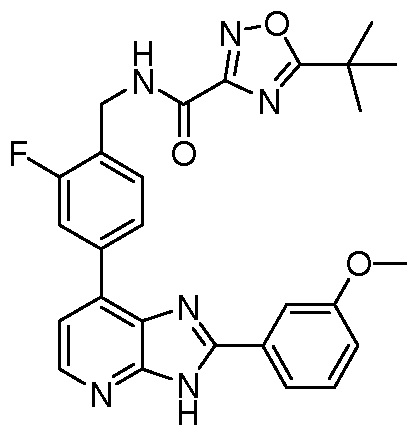
5-трет-бутил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 10 мг (3% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 3-метоксибензальдегида и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19S, 19T и 37Y. ЖХВД: 99,4% чистота. МС: m/z=501,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,55 (т, J=6,0 Гц, 1H), 8,36-8,35 (м, 2H), 8,21 (с, 1H), 7,93-7,88 (м, 2H), 7,86 (м, 3H), 7,55 (т, J=8,0 Гц, 1H), 7,48 (т, J=7,9 Гц, 1H), 4,61-4,59 (м, 2H), 3,87 (с, 3H), 1,43 (с, 9H).
Пример 74. 5-трет-Бутил-N-[(2-фтор-4-[2-[3-(трифторметокси)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид; трифторуксусная кислота (74)
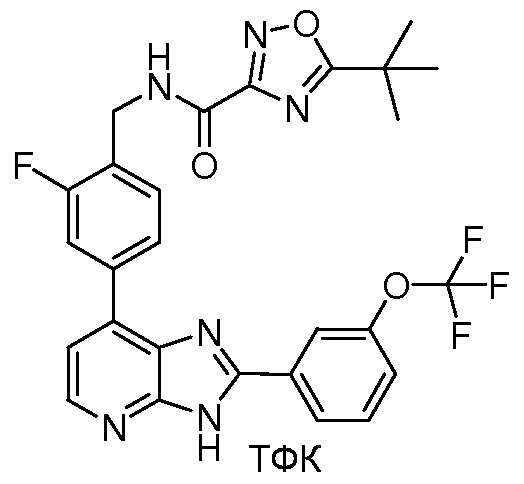
5-трет-бутил-N-[(2-фтор-4-[2-[3-(трифторметокси)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид; трифторуксусную кислоту 10 мг (4,8% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 3-(трифторметокси)бензальдегида, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19P, 19T и 37Y. ЖХВД: 99,6% чистота. МС: m/z=555,6 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,81 (шс, 1H), 9,54 (т, J=6,1 Гц, 1H), 8,43 (д, J=5,1 Гц,1H), 8,35-8,34 (м, 2H), 8,22 (д, J=13,1 Гц, 2H), 7,70 (т, J=8,0 Гц, 1H), 7,67-7,50 (м, 3H), 4,64-4,55 (м, 2H), 1,43 (с, 9H).
Схема 38
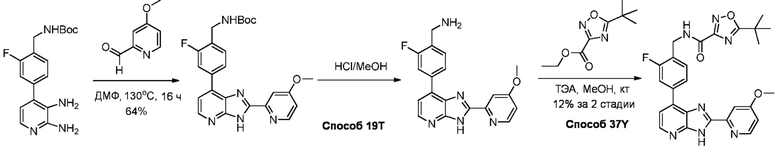
Пример 75. 5-трет-Бутил-N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (75)
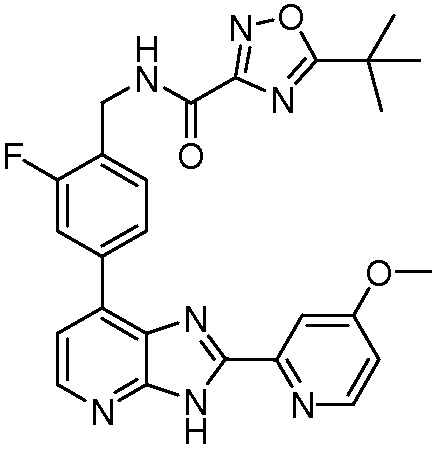
N-([2-Фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат
В 30 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамат (150 мг, 0,45 ммоль, 1,00 эквив.) и 4-метоксипиридин-2-карбальдегид (74 мг, 0,54 ммоль, 1,20 эквив.) растворяют в N,N-диметилформамиде (5 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч. при 130°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением трет-бутил N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамата (130 мг, 64%) в виде желтого твердого вещества. МС: m/z =450,2[M+H]+.
5-трет-Бутил-N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 15 мг (12% за 2 стадии) получают из трет-бутил N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамата и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19T и 37Y. ЖХВД: 99,3% чистота. МС: m/z=502,1 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,73 (д, J=6,6Гц, 1H), 8,66 (д, J=5,7 Гц 1H), 8,32 (д, J=2,6 Гц, 1H), 8,11-7,94 (м, 2H), 7,84 (д, J=5,7 Гц, 1H), 7,70 (т, J=7,8 Гц, 1H), 7,57-7,55 (м, 1H), 4,77 (с, 2H), 4,23 (с, 3H), 1,50 (с, 9H).
Схема 39
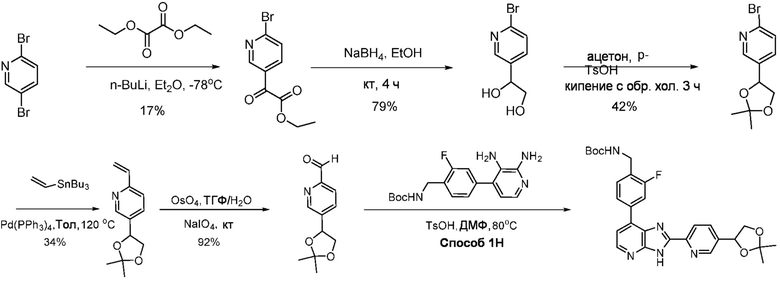
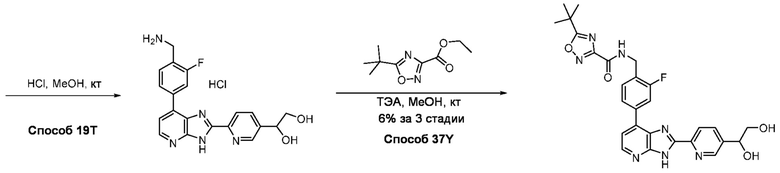
Пример 76. 5-трет-Бутил-N-[(4-[2-[5-(1,2-дигидроксиэтил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид (76)
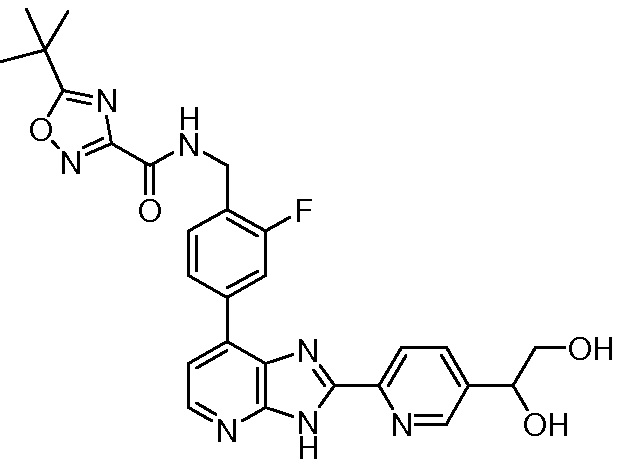
Этил 2-(6-бромпиридин-3-ил)-2-оксоацетат
При -78°C, в 500-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 2,5-дибромпиридин (10 г, 42,2 ммоль, 1,00 эквив.) растворяют в Et2O (200 мл), туда добавляют раствор n-BuLi (1M в ТГФ, 21,23 мл, 212,3 ммоль, 5,03 эквив.) по каплям. Полученный раствор перемешивают при -78°C в течение 1 ч под азотом и затем добавляют диэтилоксалат (8 мл, 38,32 ммоль, 0,91 эквив.) по каплям. Реакционную смесь перемешивают при -78°C в течение 10 мин, нагревают до 0°C и перемешивают в течение еще 2 ч. при 0°C. После завершения реакции, ее гасят 50 мл насыщ. раствора NH4Cl, и смесь экстрагируют ДХМ (2×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 20% градиент) с получением этил 2-(6-бромпиридин-3-ил)-2-оксоацетата (1,8 г, 17%) в виде желтого масла. МС: m/z =258,2 [M+H]+.
1-(6-Бромпиридин-3-ил)этан-1,2-диол
В 100-мл круглодонной колбе, этил 2-(6-бромпиридин-3-ил)-2-оксоацетат (1,8 г, 6,97 ммоль, 1,00 эквив.) растворяют в этаноле (20 мл), туда медленно добавляют NaBH4 (480 мг, 12,69 ммоль, 1,82 эквив.) при 0°C. Полученный раствор затем перемешивают в течение 4 ч при комнатной температуре. После завершения реакции, ее гасят 15 мл воды, и смесь экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-(6-бромпиридин-3-ил)этан-1,2-диола (1,2 г, 79%) в виде желтого твердого вещества. МС: m/z=218,0 [M+H]+.
2-Бром-5-(2,2-диметил-1,3-диоксолан-4-ил)пиридин
В 100-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(6-бромпиридин-3-ил)этан-1,2-диол (900 мг, 4,13 ммоль, 1,00 эквив.) растворяют в ацетоне (15 мл), туда добавляют п-толуолсульфонат пиридиния (320 мг, 5,51 ммоль, 1,33 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 3 ч. при 60°C. После завершения реакции, реакционную смесь разбавляют 45 мл дихлорметана и промывают 10 мл воды. Органический слой отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 2-бром-5-(2,2-диметил-1,3-диоксолан-4-ил)пиридина (450 мг, 42%) в виде желтого масла. МС: m/z =258,1 [M+H]+.
5-(2,2-диметил-1,3-диоксолан-4-ил)-2-этенилпиридин
В 25-мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 2-бром-5-(2,2-диметил-1,3-диоксолан-4-ил)пиридин (150 мг, 0,58 ммоль, 1,00 эквив.), трибутил(этенил)станнан (277 мг, 0,87 ммоль, 1,48 эквив.) и Pd(PPh3)4 (67 мг, 0,06 ммоль, 0,10 эквив.) смешивают в толуоле (5 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение ночи при 120°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток разбавляют 30 мл дихлорметана и промывают 10 мл воды. Органический слой отделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 5-(2,2-диметил-1,3-диоксолан-4-ил)-2-этенилпиридина (40 мг, 34%) в виде желтого масла. МС: m/z=206,0 [M+H]+.
5-(2,2-диметил-1,3-диоксолан-4-ил)-2-этенилпиридин
В 50-мл круглодонной колбе, 5-(2,2-диметил-1,3-диоксолан-4-ил)-2-этенилпиридин (300 мг, 1,46 ммоль, 1,00 эквив.) растворяют в смеси тетрагидрофурана (2 мл) и воды (0,4 мл), туда добавляют NaIO4 (1,25 г, 5,84 ммоль, 4,00 эквив.) и раствор OsO4 (17M в воде, 0,4 мл, 7,73 ммоль, 5,29 эквив.) при комнатной температуре. Полученную смесь затем перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 5 мл воды и экстрагируют этилацетатом (3×5 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 5-(2,2-диметил-1,3-диоксолан-4-ил)пиридин-2-карбальдегида (280 мг, 92%) в виде черного масла. МС: m/z=208,0[M+H]+.
5-трет-Бутил-N-[(4-[2-[5-(1,2-дигидроксиэтил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-[(4-[2-[5-(1,2-дигидроксиэтил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид 5,5 мг (6% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-(2,2-диметил-1,3-диоксолан-4-ил)пиридин-2-карбальдегида, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 1H, 19T и 37Y. ЖХВД: 98,3% чистота. МС: m/z=532,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,90 (шс, 1H), 9,54 (т, J=6,0 Гц, 1H), 8,72 (д, J=1,9 Гц, 1H), 8,45-8,33 (м, 2H), 8,22-8,19 (м, 2H), 8,01-7,97 (м, 1H), 7,69-7,50 (м, 2H), 4,71 (т, J=5,9 Гц, 1H), 4,60-4,59 (м, 2H), 3,66-3,45 (м, 4H), 1,43 (с, 9H).
Схема 40
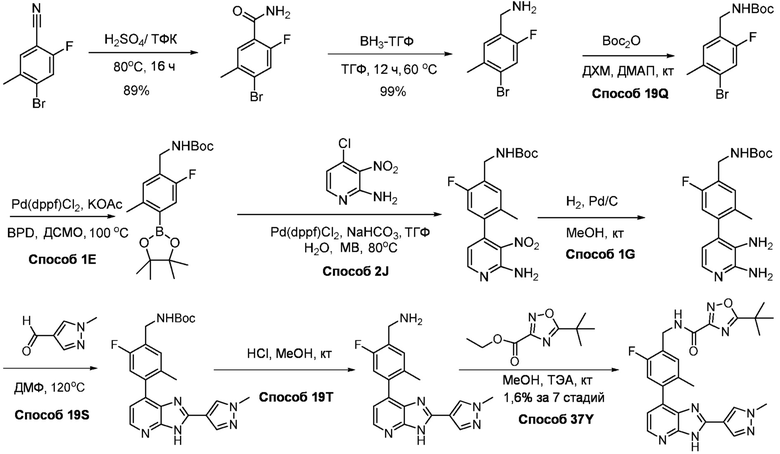
Пример 77. 5-трет-бутил-N-([2-фтор-5-метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид
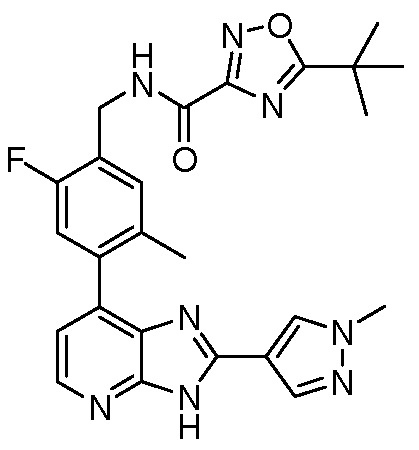
4-Бром-2-фтор-5-метилбензамид
В 100 мл круглодонной колбе, 4-бром-2-фтор-5-метилбензонитрил (5 г, 23,36 ммоль, 1,00 эквив.) растворяют в смесь серной кислоты (40 мл) и трифторуксусной кислоты (10 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение ночи при 80°C. После завершения реакции, ее разбавляют 200 мл воды/льда, что вызывает выпадение осадка. Полученный осадок собирают фильтрацией, промывают водой и сушат при пониженном давлении с получением 4-бром-2-фтор-5 метилбензамида (4,8 г, 89%) в виде белого твердого вещества. МС: m/z =232,1 [M+H]+.
5-(2,2-диметил-1,3-диоксолан-4-ил)-2-этенилпиридин
В 100-мл круглодонной колбе, 4-бром-2-фтор-5-метилбензамид (2,14 г, 9,22 ммоль, 1,00 эквив.) растворяют в ТГФ (920 мл), туда добавляют раствор BH3 (1M в ТГФ, 20,9 мл, 209 ммоль, 22,66 эквив.) при комнатной температуре. Полученный раствор перемешивают в течение ночи при 60°C. После завершения реакции, ее гасят медленным добавлением 5 мл раствора хлороводорода (6N) и значение pH полученной смеси доводят до 9 добавлением NaHCO3. Смесь экстрагируют этилацетатом (3×20 мл) и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением (4-бром-2-фтор-5-метилфенил)метанамина (2,0 г, 99%) в виде светло-желтого масла. МС: m/z =218,1 [M+H]+.
5-трет-бутил-N-([2-фтор-5-метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-([2-фтор-5-метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 15 мг (1,6% за 7 стадий) получают из (4-бром-2-фтор-5-метилфенил)метанамина, ди-трет-бутилдикарбоната, 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19Q, 1E, 2J, 1G, 19S, 19T и 37Y. ЖХВД: 99,8% чистота. МС: m/z=489,1 [M+H]+. 1H-ЯМР (400 МГц, CD3OD): δ 8,36-8,30 (м, 2H), 8,15 (с, 1H), 7,45-7,42 (м, 1H), 7,17-7,13 (м, 2H), 4,70 (с, 2H), 3,98 (с, 3H), 2,17 (с, 3H), 1,50 (с, 9H).
Пример 78. 5-трет-Бутил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]-5-метилфенил]метил)-1,2,4-оксадиазол-3-карбоксамид (78)
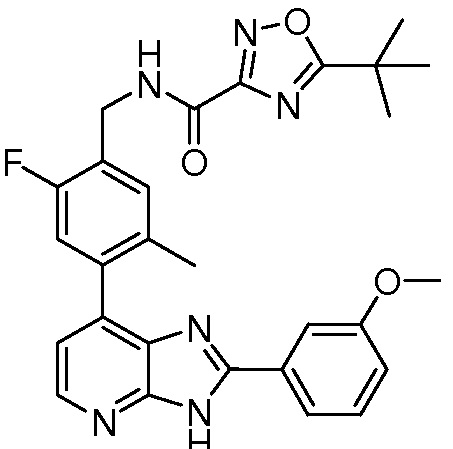
5-трет-бутил-N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]-5-метилфенил]метил)-1,2,4-оксадиазол-3-карбоксамид 15 мг (6% за 3 стадии) получают из трет-бутил N-([2-фтор-4-[2-(3-метоксифенил)-3H-имидазо[4,5-b]пиридин-7-ил]-5-метилфенил]метил)карбамата, 3-метоксибензальдегида, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15P, 19T и 37Y. ЖХВД: 98,2% чистота. МС: m/z=515,2 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,46-8,39 (м, 2H), 7,78-7,70 (м, 2H), 7,47-7,41(м, 2H), 7,20-7,18 (м, 2H), 7,12-7,08 (м, 1H), 4,71 (с, 2H), 3,88 (с, 3H), 2,2-2,17 (м, 3H), 1,52 (с, 9H).
Пример 79. 5-трет-Бутил-N-[(2-фтор-4-[2-[5-(4-метилпиперазин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид (79)
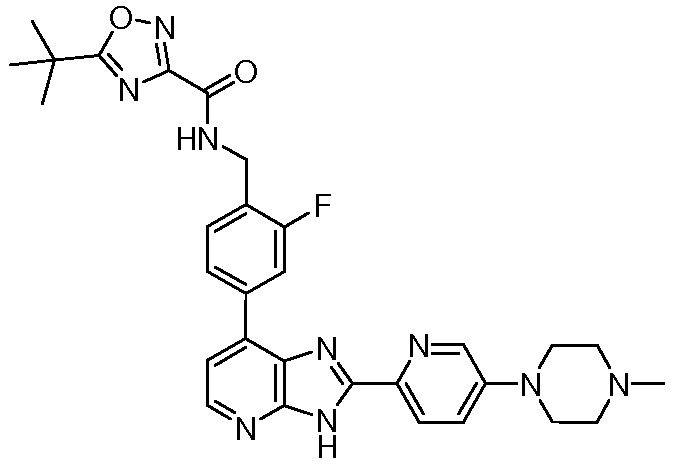
5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-метилпиперазин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 13 мг (7,2% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, 1-метилпиперазина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 99,1% чистота. МС: m/z=570,4 [M+H]+. 1H-ЯМР (400 МГц, CD3OD): δ 8,46 (с, 1H), 8,40 (с, 1H), 8,29 (д, J =8,8 Гц, 1H), 8,25-7,90 (м, 2H), 7,70-7,58 (м, 1H), 7,55-7,45 (м, 2H), 4,76 (с, 2H), 3,47-3,44 (м, 4H), 2,68-2,65 (м, 4H), 2,66 (с, 3H), 1,51 (с, 9H).
Пример 80. 5-трет-Бутил-N-[(2-фтор-4-[2-[5-(пирролидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид (80)

5-трет-бутил-N-[(2-фтор-4-[2-[5-(пирролидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 10 мг (4% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, пирролидина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 92,0% чистота. МС: m/z=541,4 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,42 (шс, 1H), 9,54 (с, 1H), 8,35-8,33 (м, 2H), 8,29-8,26 (м, 2H), 8,07 (с, 1H), 7,63-7,55 (м, 2H), 7,10-7,09 (м, 1H), 4,60-4,58 (м, 2H), 3,39-3,36 (м, 4H), 2,01-2,00 (м, 4H), 1,44 (с, 9H).
Пример 81. 5-трет-Бутил-N-[(4-[2-[5-(2,6-диметилморфолин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид (81)
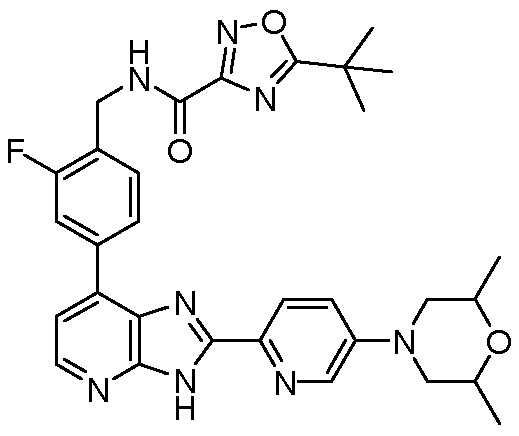
5-трет-бутил-N-[(4-[2-[5-(2,6-диметилморфолин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид 30 мг (13,8% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, 2,6-диметилморфолина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 97,8% чистота. МС: m/z=585,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,57 (с, 1H), 8,46-8,44 (м, 1H), 8,37-8,27 (м, 2H), 8,27-8,16 (м, 2H), 7,60-7,48 (м, 3H), 4,61-4,59 (м, 2H), 3,87-3,85 (м, 2H), 3,74-3,65 (м, 2H), 2,46-2,40 (м, 2H), 1,45 (с, 9H), 1,23-1,18 (м, 6H).
Пример 82. 5-трет-Бутил-N-[(4-[2-[5-(4,4-дифторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид (82)
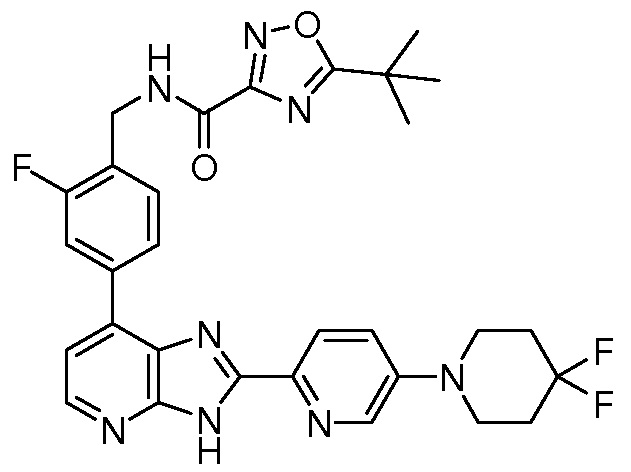
5-трет-бутил-N-[(4-[2-[5-(4,4-дифторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-3-карбоксамид 20 мг (12,3% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, гидрохлорида 4,4-дифторпиперидина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 96,5% чистота. МС: m/z=591,1 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,65 (шс, 1H), 9,59-9,48 (м, 1H), 8,50 (д, J=2,8 Гц, 1H), 8,39-8,11 (м, 4H), 7,64-7,48 (м, 3H), 4,61-4,59 (м, 2H), 3,59-3,57 (т, J=5,9 Гц, 4H), 2,10-2,06 (м, 4H), 1,43(с, 9H).
Пример 83. 5-трет-Бутил-N-[(2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид (83)
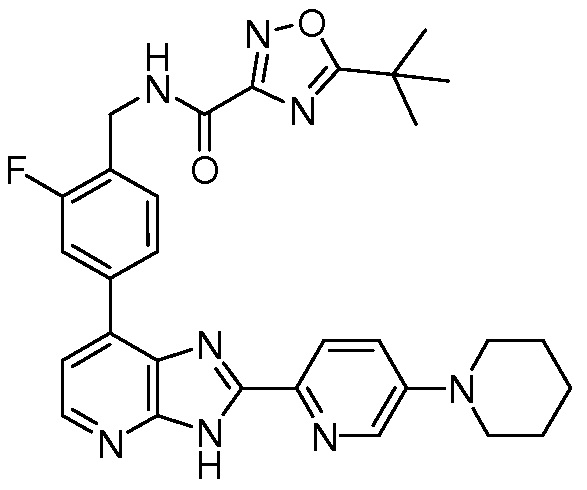
5-трет-бутил-N-[(2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 20 мг (7% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, пиперидина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 98,9% чистота. МС: m/z=555,2 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,57-9,54 (м, 1H), 8,43-8,36 (м, 2H), 8,26-8,11 (м, 3H), 7,60-7,45 (м, 3H), 4,61-4,59 (м, 2H), 3,40-3,39 (м, 4H), 1,63-1,59 (м, 6H), 1,43(с, 9H).
Пример 84. 5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-гидроксипиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид (84)
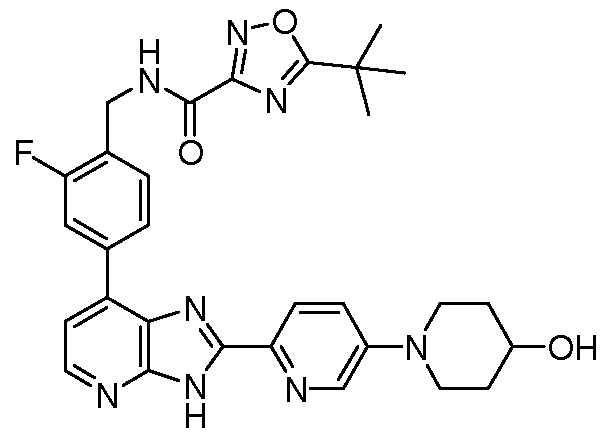
5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-гидроксипиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 18 мг (13% за 4 стадии) получают из 5-фторпиридин-2-карбальдегида, пиперидин-4-ола, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 15P, 19T и 37Y. ЖХВД: 96,7% чистота. МС: m/z=571,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 9,56 (т, J=6,0 Гц, 1H), 8,44-8,40 (м, 1H), 8,35-8,30 (м, 2H), 8,28-8,16 (м, 2H), 7,88 (м, 1H), 7,58-7,50 (м, 3H), 4,61-4,60 (м, 2H), 3,79-3,71 (м, 3H), 3,13-3,08 (м, 2H), 2,12-1,61 (м, 2H), 1,53-1,43 (м, 12H).
Пример 85. 5-трет-Бутил-N-[(2-фтор-4-[2-[5-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид; трифторуксусная кислота (85)
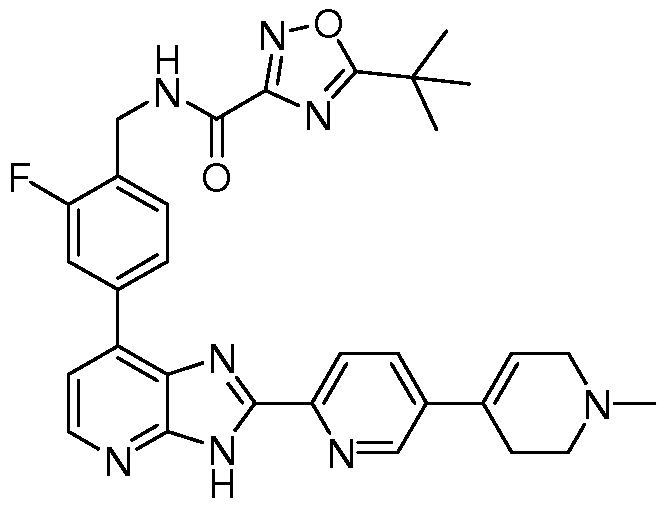
5-трет-бутил-N-[(2-фтор-4-[2-[5-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид; трифторуксусную кислоту 3 мг (0,8% за 4 стадии) получают из 5-бромпиридин-2-карбальдегида, 1-метил-4-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридина, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 1F, 15O, 19T и 37Y. ЖХВД: 96,0% чистота. МС: m/z=567,4 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,92 (с, 1H), 9,84 (шс, 1H), 9,55 (т, J=6,0 Гц, 1H), 8,95-8,88 (м, 1H), 8,48-8,28 (м, 3H), 8,26-8,09 (м, 2H), 7,68-7,51 (м, 2H), 6,51 (с, 1H), 4,61-4,59 (м, 2H), 3,92-3,91 (с, 2H), 3,44-3,31 (м, 3H), 2,90-2,89 (м, 4H), 1,44 (с, 9H).
Пример 86. 5-трет-Бутил-N-[(2-фтор-4-[2-[4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид; трифторуксусная кислота (86)
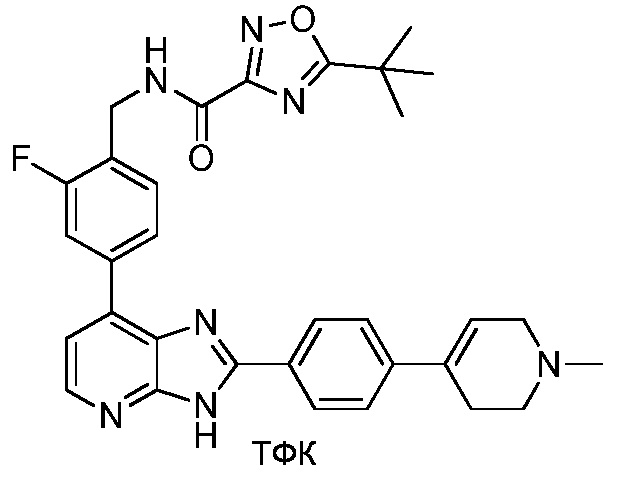
5-трет-бутил-N-[(2-фтор-4-[2-[4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид, соль трифторуксусной кислоты 5 мг (0,6% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 4-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)бензальдегида и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 15O, 19T и 37Y. ЖХВД: 96,2% чистота. МС: m/z=566,4 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,56 (т, J=5,6 Гц, 1H), 8,41-8,29 (м, 5H), 8,22-8,19 (м, 4H), 7,72 (д, J=8,4 Гц, 1H), 7,65-7,49 (м, 2H), 4,60 (д, J=4,1 Гц, 2H), 3,91 (с, 1H), 3,37 (с, 1H), 2,87-2,85 (м, 5H), 1,42 (с, 9H).
Пример 87. 5-трет-Бутил-N-([3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (87)
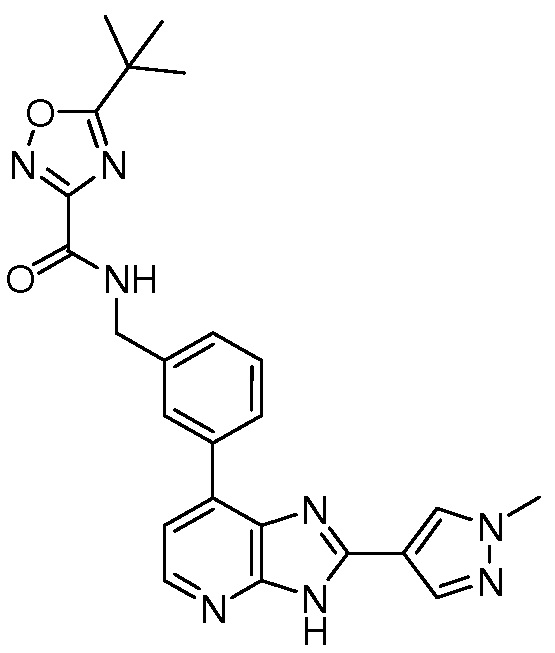
5-трет-бутил-N-([3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 31,4 мг (1,2% за 7 стадий) получают из (3-бромфенил)метанамина, ди-трет-бутилдикарбоната, 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида, 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19Q, 19R, 2J, 1G, 19S, 19T и 37Y. ЖХВД: 99,8% чистота. МС: m/z =557,1 [M+H]+. 1H-ЯМР (400 МГц, ДМСО): δ 13,33 (шс, 1H), 9,58-9,54 (м, 1H), 8,40-8,37 (м, 2H), 8,29-8,27 (м, 1H), 8,21-8,18 (м, 1H), 8,07 (с, 1H), 7,54-7,40 (м, 3H), 4,60-4,58 (м, 2H), 3,95 (с, 3H), 1,40 (с, 9H).
Схема 41
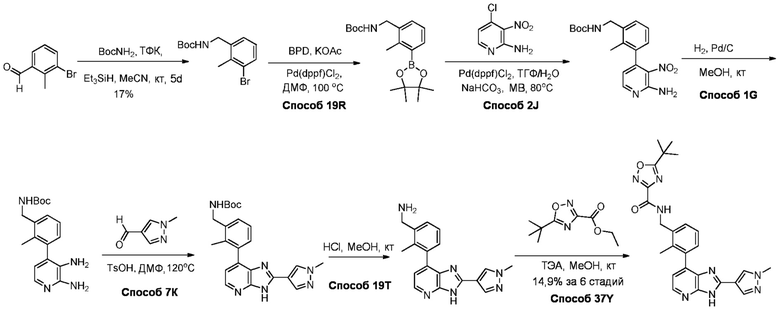
Пример 88. 5-трет-Бутил-N-([2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид (88)
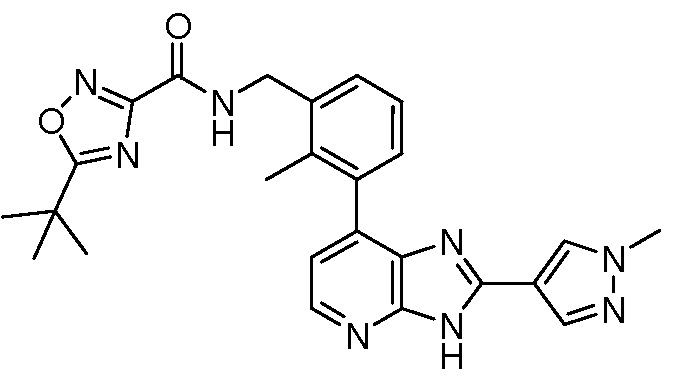
трет-Бутил N-[(3-бром-2-метилфенил)метил]карбамат
В 50 мл круглодонной колбе, 3-бром-2-метилбензальдегид (2 г, 10,0 ммоль, 0,34 эквив.) растворяют в ацетонитриле (24 мл), затем туда добавляют трет-бутилкарбамат (3,5 г, 29,88 ммоль, 1,00 эквив.), Et3SiH (3,5 г, 30,10 ммоль, 1,01 эквив.) и трифторуксусную кислоту (940 мг, 8,24 ммоль, 0,28 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 5 дней при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением трет-бутил N-[(3-бром-2-метилфенил)метил]карбамата (1,5 г, 17%) в виде желтого твердого вещества.
5-трет-Бутил-N-([2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид
5-трет-бутил-N-([2-метил-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-3-карбоксамид 40,5 мг (14,9% за 6 стадий) получают из (трет-бутил N-[(3-бром-2-метилфенил)метил]карбамата, 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида и 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19Q, 19R, 2J, 1G,7K, 19T и 37Y. ЖХВД: 98,2% чистота. МС: m/z=471,2 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,30 (шс, 1H), 12,55 (шс, 1H), 9,48 (т, J=6,0 Гц, 1H), 8,48-8,33 (м, 2H), 8,08-8,05 (м, 1H), 7,48-7,21 (м, 3H), 7,05-7,03(м, 1H), 4,56 (д, J=6,0 Гц, 2H), 3,92-3,89 (м, 3H), 2,14-2,13 (м, 3H), 1,45 (с, 9H).
Пример 89. 4-трет-Бутил-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]бензамид (89)
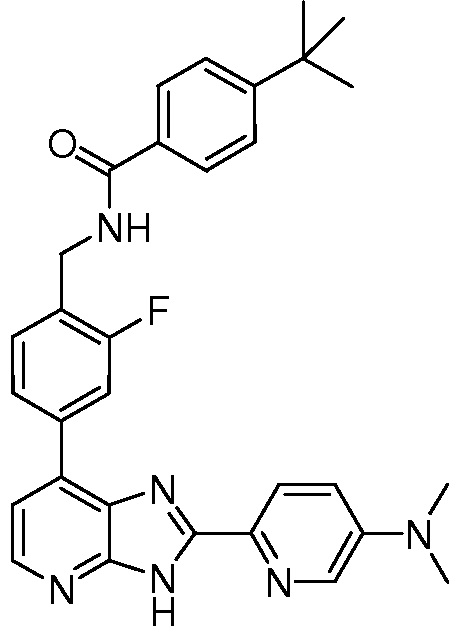
4-трет-бутил-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]бензамид 20 мг (7,3% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-(диметиламино)пиридин-2-карбальдегида, 4-трет-бутилбензоилхлорида с применением способа 7K, 19T и 22V. ЖХВД: 98,9% чистота. МС: m/z=523,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,48 (шс, 1H), 9,04 (т, J=5,8 Гц, 1H), 8,29-8,27 (м, 2H), 8,23-8,11 (м, 3H), 7,90-7,83 (м, 2H), 7,55-7,46 (м, 4H), 7,24-7,21 (м, 1H), 4,61-4,59 (м, 2H), 3,05 (с, 6H), 1,29 (с, 9H).
Пример 90. 3-(трет-Бутокси)-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]азетидин-1-карбоксамид (90)
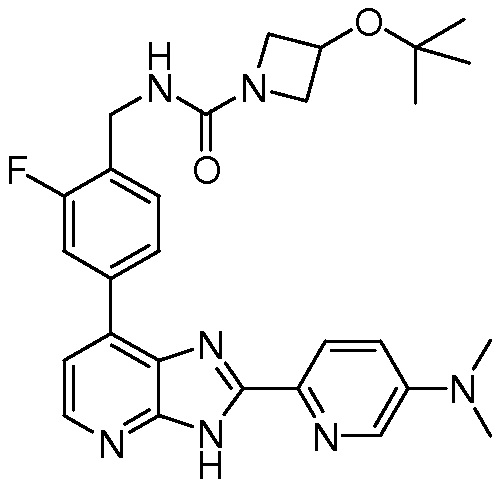
3-(трет-бутокси)-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]азетидин-1-карбоксамид 20 мг (14,0%) получают из (6-[7-[4-(аминометил)-3-фторфенил]-3H-имидазо[4,5-b]пиридин-2-ил]-N,N-диметилпиридин-3-амина и 3-(трет-бутокси)азетидина с применением способа 23W. ЖХВД: 97,5% чистота. МС: m/z=518,2 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,48 (с, 1H), 8,33 (т, J=5,4Гц, 1H), 8,23-8,20 (м, 3H), 8,12 (д, J=7,8 Гц, 1H), 7,55-7,47 (м, 2H), 7,29-7,25 (м, 1H), 6,94 (т, J=5,9Гц, 1H), 4,47 (т, J=6,3 Гц, 1H), 4,32-4,31 (м, 2H), 4,07-4,02 (м, 2H), 3,64-3,59 (м, 2H), 3,07 (с, 6H), 1,12 (с, 9H).
Схема 42
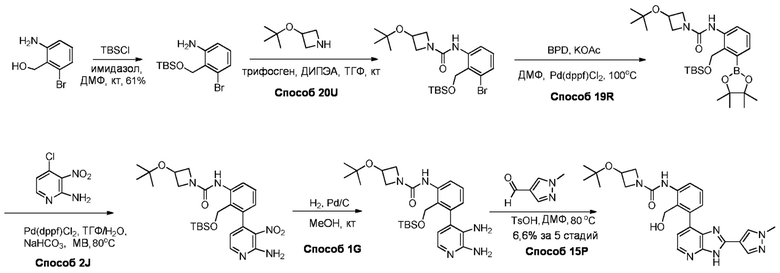
Пример 91. 3-(трет-Бутокси)-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]азетидин-1-карбоксамид (91)
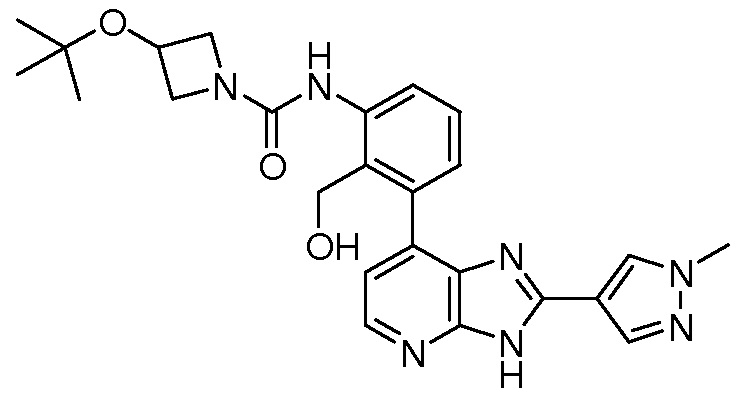
4-трет-Бутил-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]бензамид
При 0°C, в 100 мл круглодонной колбе, (2-амино-6-бромфенил)метанол (950 мг, 4,70 ммоль, 1,00 эквив.) и имидазол (1,01 г, 14,09 ммоль, 3,00 эквив.) растворяют в N,N-диметилформамиде (15 мл), туда добавляют TBSCl (1,49 г, 9,39 ммоль, 2,00 эквив.). Полученный раствор затем перемешивают в течение ночи при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток разбавляют 30 мл этилацетата. Смесь промывают насыщенным раствором соли (4×10 мл) и затем органическую фазу сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 25% градиент) с получением 3-бром-2-[[(трет-бутилдиметилсилил)окси]метил]анилина (0,95 г, 61%) в виде коричневого масла. МС: m/z =316,2 [M+H]+.
3-(трет-Бутокси)-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]азетидин-1-карбоксамид
3-(трет-бутокси)-N-[2-(гидроксиметил)-3-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]азетидин-1-карбоксамид 20 мг (6,6% за 5 стадий) получают из 3-бром-2-[[(трет-бутилдиметилсилил)окси]метил]анилина, 3-(трет-бутокси)азетидина, 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана), 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразолe-4-карбальдегида с применением способа 20U, 19R, 2J, 1G и 15P. ЖХВД: 96,1% чистота. МС: m/z=476,1 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,45 (шс, 1H), 8,59-8,25 (м, 3H), 8,22-8,01 (м, 1H), 7,98-7,85 (м, 1H), 7,49-7,31 (м, 1H), 7,15-7,14 (н, 1H), 7,05-7,03 (м, 1H), 5,85 (с, 1H), 4,65-4,55 (м, 1H), 4,42-4,41 (м, 2H), 4,25-4,15 (м, 2H), 3,91 (с, 3H), 3,85-3,65 (м, 2H), 1,15 (с, 9H).
Схема 43
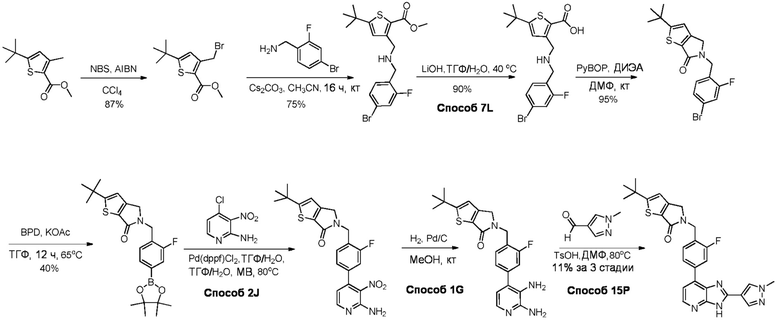
Пример 92. 2-трет-Бутил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он (92)
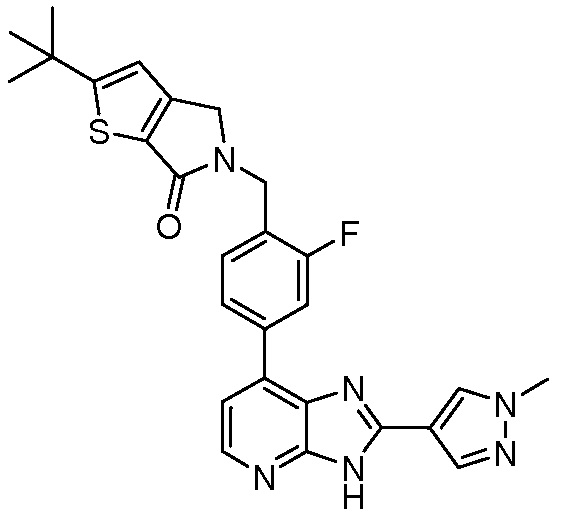
Метил 3-(бромметил)-5-трет-бутилтиофен-2-карбоксилат
В 100 мл круглодонной колбе, метил 5-трет-бутил-3-метилтиофен-2-карбоксилат (1,00 г, 4,71 ммоль, 1,00 эквив.) растворяют в CCl4 (40 мл), затем туда добавляют NBS (1,01 г, 5,67 ммоль, 1,20 эквив.) и AIBN (77,34 мг, 0,47 ммоль, 0,10 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч. при 90°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток разбавляют 30 мл этилацетатом. Смесь промывают насыщенным раствором соли (4×10 мл) и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении с получением метил 3-(бромметил)-5-трет-бутилтиофен-2-карбоксилата (1,2 г, 87%) в виде желтого масла.
Метил 3-([[(4-бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоксилат
В 50 мл круглодонной колбе, метил 3-(бромметил)-5-трет-бутилтиофен-2-карбоксилат (700 мг, 2,40 ммоль, 1,00 эквив.) растворяют в ацетонитриле (10 мл), затем туда добавляют (4-бром-2-фторфенил)метанамин (1,47 г, 7,21 ммоль, 3,00 эквив.) и Cs2CO3 (861,53 мг, 2,64 ммоль, 1,10 эквив.) при комнатной температуре. Полученную смесь затем перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением метил 3-([[(4-бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоксилата (750 мг, 75%) в виде желтого твердого вещества. МС: m/z =414,0 [M+H]+.
3-([[(4-Бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоновая кислота
3-([[(4-бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоновую кислоту 700 мг (90%) получают из метил 3-([[(4-бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоксилата с применением способа 7L.
3-([[(4-Бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоновая кислота
В 100 мл круглодонной колбе, 3-([[(4-бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоновую кислоту (700 мг, 1,46 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (10 мл), затем туда добавляют PyBOP (591,4 мг, 1,14 ммоль, 1,30 эквив.) и ДИЭА (339 мг, 2,62 ммоль, 3,00 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток разбавляют 30 мл этилацетатом. Смесь промывают насыщенным раствором соли (4×10 мл) и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 25% градиент) с получением 5-[(4-бром-2-фторфенил)метил]-2-трет-бутил-4H,5H,6H-тиено[2,3-c]пиррол-6-она (700 мг, 95%) в виде желтого твердого вещества. МС: m/z =381,2 [M+H]+.
3-([[(4-Бром-2-фторфенил)метил]амино]метил)-5-трет-бутилтиофен-2-карбоновая кислота
В 50 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 5-[(4-бром-2-фторфенил)метил]-2-трет-бутил-4H,5H,6H-тиено[2,3-c]пиррол-6-он (700 мг, 1,74 ммоль, 1,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (557,98 мг, 2,09 ммоль, 1,20 эквив.), KOAc (359,40 мг, 3,48 ммоль, 2,00 эквив.) и Pd(dppf)Cl2.CH2Cl2 (149,53 мг, 0,18 ммоль, 0,10 эквив.) смешивают в тетрагидрофуране (10 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч. при 70°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 2-трет-бутил-5-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-4H,5H,6H-тиено[2,3-c]пиррол-6-она (300 мг, 40%) в виде желтого твердого вещества.
2-трет-Бутил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он
2-трет-бутил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он 23 мг (11% за 3 стадии) получают из 2-трет-бутил-5-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-4H,5H,6H-тиено[2,3-c]пиррол-6-она, 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида с применением способа 2J, 1G и 15P. ЖХВД: 98,9% чистота. МС: m/z=501,1 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 8,45 (с, 1H), 8,30-8,29 (м, 2H), 8,17-8,14 (м, 2H), 7,47-7,44 (м, 2H), 7,05 (с, 1H), 4,81 (с, 2H), 4,38 (с, 2H), 3,95 (с, 3H), 1,39 (с, 9H).
Схема 44
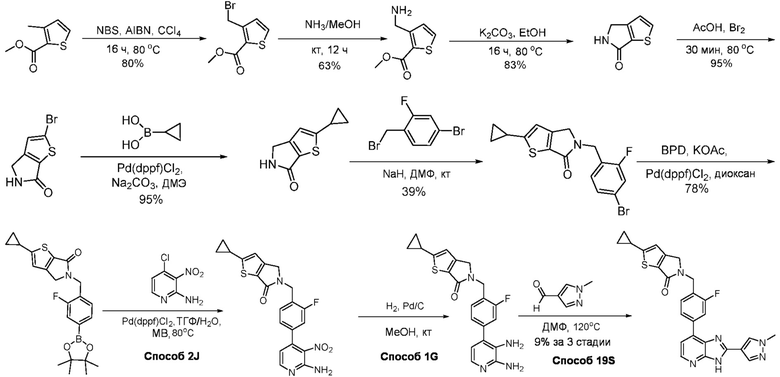
Пример 93. 2-Циклопропил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он (93)
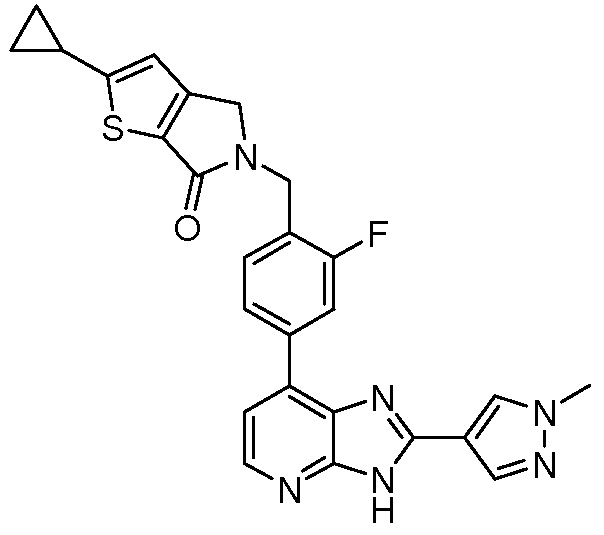
Метил 3-(бромметил)тиофен-2-карбоксилат
В 250 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 3-метилтиофен-2-карбоксилат (10 г, 64,02 ммоль, 1,00 эквив.) растворяют в CCl4 (120 мл), затем туда добавляют NBS (17,09 г, 96,03 ммоль, 1,50 эквив.) и AIBN (2,103 г, 12,81 ммоль, 0,20 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 16 ч. при 80°C. После завершения реакции, ее гасят 50 мл воды, и смесь экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 30% градиент) с получением метил 3-(бромметил)тиофен-2-карбоксилата (12 г, 80%) в виде желтого твердого вещества. МС: m/z =235,1 [M+H]+.
Метил 3-(аминометил)тиофен-2-карбоксилат
В 250 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 3-(бромметил)тиофен-2-карбоксилат (7 г, 29,77 ммоль, 1,00 эквив.) растворяют в растворе NH3 в метаноле (7N, 100 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением метил 3-(аминометил)тиофен-2-карбоксилата (3,2 г, 63%) в виде желтого твердого вещества. МС: m/z =172,0 [M+H]+.
4H,5H,6H-тиено[2,3-c]пиррол-6-он
В 500 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, метил 3-(аминометил)тиофен-2-карбоксилат (2,2 г, 12,85 ммоль, 1,0 эквив.) растворяют в метаноле (300 мл), туда добавляют карбонат калия (3,552 г, 25,70 ммоль, 2,0 эквив.) при комнатной температуре. Полученную смесь затем перемешивают в течение 16 ч. при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Остаток разбавляют 50 мл воды и экстрагируют этилацетатом (3×100 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 5% до 10% градиент) с получением 4H,5H,6H-тиено[2,3-c]пиррол-6-она (1,1 г, 62%) в виде белого твердого вещества.
2-Бром-4H,5H,6H-тиено[2,3-c]пиррол-6-он
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 4H,5H,6H-тиено[2,3-c]пиррол-6-он (1 г, 7,19 ммоль, 1,00 эквив.) растворяют в смеси воды (2 мл) и AcOH (10 мл), туда добавляют Br2 (1,72 г, 10,78 ммоль, 1,50 эквив.) по каплям при комнатной температуре. Полученный раствор перемешивают в течение 2 ч при комнатной температуре. После завершения реакции, реакционную смесь экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 5% до 10% градиент) с получением 2-бром-4H,5H,6H-тиено[2,3-c]пиррол-6-она 1,3 г (83%) в виде желтого твердого вещества. МС: m/z =218,0 [M+H]+.
2-Циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-он
В 30 мл герметично закрытой пробирке, продутой и содержащей инертную атмосферу азота, 2-бром-4H,5H,6H-тиено[2,3-c]пиррол-6-он (1,200 г, 5,50 ммоль, 1,00 эквив.), циклопропилбороновую кислоту (567 мг, 6,60 ммоль, 1,20 эквив.), Pd(dppf)Cl2 (403 мг, 0,55 ммоль, 0,10 эквив.) и карбонат калия (1,521 г, 11,01 ммоль, 2,00 эквив.) смешивают в диметиловом эфире этиленгликоля (15 мл) при комнатной температуре. Полученную смесь перемешивают в течение 30 мин при 80°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 60 мл этилацетата и промывают водой (3×10 мл). Органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 5% до 10% градиент) с получением 2-циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-она (950 мг, 95%) в виде желтого твердого вещества. МС: m/z =180,2 [M+H]+.
5-[(4-Бром-2-фторфенил)метил]-2-циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-он
При 0°C, в 100 мл круглодонной колбе, продутой и содержащей инертную атмосферу азота, 2-циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-он (1,000 г, 5,58 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (20 мл), туда медленно добавляют гидрид натрия (60% в масле, 245 мг, 6,13 ммоль, 1,10 эквив.). Смесь перемешивают при 0°C в течение 15 мин и затем добавляют 4-бром-1-(бромметил)-2-фторбензол (1,644 г, 6,14 ммоль, 1,10 эквив.). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, ее гасят 20 мл воды, и смесь экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 5-[(4-бром-2-фторфенил)метил]-2-циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-она (800 мг, 39%) в виде желтого твердого вещества. МС: m/z =366,1 [M+H]+.
2-Циклопропил-5-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-4H,5H,6H-тиено [2,3-c]пиррол-6-он
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 5-[(4-бром-2-фторфенил)метил]-2-циклопропил-4H,5H,6H-тиено[2,3-c]пиррол-6-он (800 мг, 2,18 ммоль, 1,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (832 мг, 3,28 ммоль, 1,50 эквив.), Pd(dppf)Cl2 (159,8 мг, 0,22 ммоль, 0,10 эквив.) и карбонат калия (603 мг, 4,37 ммоль, 2,00 эквив.) смешивают в диоксане (20 мл). Полученную смесь затем перемешивают в течение 16 ч. при 100°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 10% градиент) с получением 2-циклопропил-5-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-4H,5H,6H-тиено[2,3-c]пиррол-6-она (700 мг, 78%) в виде желтого твердого вещества.
2-Циклопропил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он
2-циклопропил-5-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-4H,5H,6H-тиено[2,3-c]пиррол-6-он 20 мг (9% за 3 стадии) получают из 2-циклопропил-5-[[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]-4H,5H,6H-тиено[2,3-c]пиррол-6-она, 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида с применением способа 2J, 1G и 19S. ЖХВД: 97,7% чистота. МС: m/z=485,1 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,41 (шс, 1H), 8,44 (с, 1H), 8,31-8,28 (м, 2H), 8,18-8,14 (м, 2H), 7,53-7,41 (м, 2H), 6,93 (с, 1H), 4,78 (с, 2H), 4,35 (с, 2H), 3,94 (с, 3H), 2,28-2,21 (м, 1H), 1,11-1,06 (м, 2H), 0,78-0,74 (м, 2H).
Схема 45
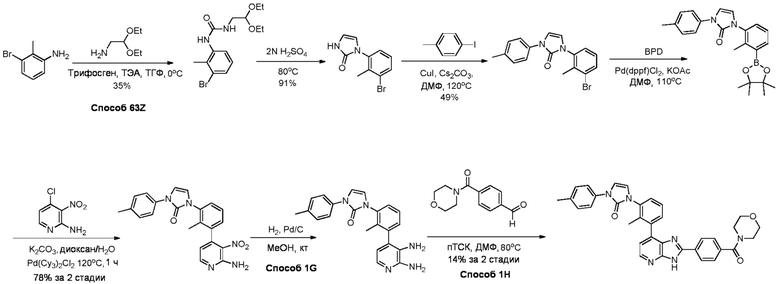
Пример 95. 1-[2-Метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (95)
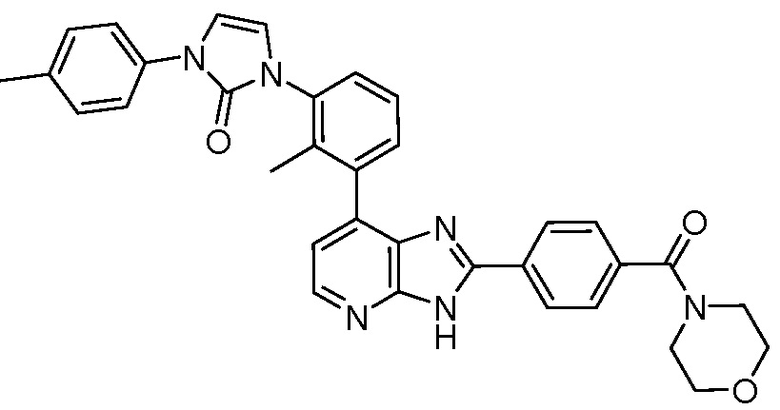
Способ 63Z: 1-(3-Бром-2-метилфенил)-3-(2,2-диэтоксиэтил)мочевина
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 3-бром-2-метиланилин (2,00 г, 10,75 ммоль, 1,00 эквив.) и ТЭА (2,24 мл, 3,00 эквив.) растворяют в тетрагидрофуране (25 мл), затем туда медленно добавляют трифосген (1,59 г, 5,36 ммоль, 0,50 эквив.) при 0°C. Полученный раствор перемешивают в течение 3 ч. при 0°C и затем добавляют 2,2-диэтоксиэтан-1-амин (1,72 г, 12,91 ммоль, 1,20 эквив.) и ТЭА (2,24 ml 3,00 эквив.) последовательно. Реакционную смесь затем перемешивают в течение еще 18 ч при комнатной температуре. После завершения реакции, ее гасят 10 мл воды, и смесь экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя ацетоном в петролейном эфире (от 10% до 50% градиент) с получением 1-(3-бром-2-метилфенил)-3-(2,2-диэтоксиэтил)мочевины (1,3 г, 35%) в виде белого твердого вещества. МС: m/z=345,2 [M+H]+.
1-(3-Бром-2-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(3-бром-2-метилфенил)-3-(2,2-диэтоксиэтил)мочевину (1,20 г, 3,48 ммоль, 1,00 эквив.) растворяют в растворе серной кислоты (2N, 10 мл). Полученный раствор затем перемешивают в течение 6 ч. при 80°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, и значение pH смеси доводят до 9 добавлением бикарбоната натрия. Полученную смесь экстрагируют этилацетатом (3×10 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-(3-бром-2-метилфенил)-2,3-дигидро-1H-имидазол-2-она (800 мг, 91%) в виде желтого твердого вещества. МС: m/z=253,0 [M+H]+.
1-(3-Бром-2-метилфенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(3-бром-2-метилфенил)-2,3-дигидро-1H-имидазол-2-он (300 мг, 1,19 ммоль, 1,00 эквив.), 1-йод-4-метилбензол (439,4 мг, 2,02 ммоль, 1,70 эквив.), (2-аминоэтил)диметиламин (62,7 мг, 0,71 ммоль, 0,60 эквив.), Cs2CO3 (656,5 мг, 2,02 ммоль, 1,70 эквив.) и CuI (56,4 мг, 0,30 ммоль, 0,25 эквив.) смешивают в диоксане (5 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 18 ч. при 120°C. После завершения реакции, реакционную смесь разбавляют 10 мл воды и экстрагируют этилацетатом (3×20 мл). Органические слои объединяют и сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 1-(3-бром-2-метилфенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (200 мг, 49%) в виде желтого масла. МС: m/z =343,2[M+H]+.
1-[2-Метил-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 10 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(3-бром-2-метилфенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (200,0 мг, 0,58 ммоль, 1,00 эквив.) 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (222,0 мг, 0,87 ммоль, 1,50 эквив.), Pd(dppf)Cl2 (42,6 мг, 0,06 ммоль, 0,10 эквив.) и KOAc (379,7 мг, 1,17 ммоль, 2,00 эквив.) смешивают в диоксане (5 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 18 ч. при 110°C. После завершения реакции, реакционную смесь разбавляют 5 мл воды и экстрагируют этилацетатом (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-[2-метил-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (250 мг, неочищенный) в виде коричневого масла.
1-[3-(2-Амино-3-нитропиридин-4-ил)-2-метилфенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-[2-метил-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (100,0 мг, 0,26 ммоль, 1,00 эквив.), 4-хлор-3-нитропиридин-2-амин (66,7 мг, 0,38 ммоль, 1,50 эквив.), Pd(PCy3)2Cl2 (35 мг, 0,05 ммоль, 0,18 эквив.) и Cs2CO3 (167,0 мг, 0,51 ммоль, 2,00 эквив.) смешивают в диоксане (5 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 18 ч. при 120°C. После завершения реакции, реакционную смесь разбавляют 5 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 1-[3-(2-амино-3-нитропиридин-4-ил)-2-метилфенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (80 мг, 78% за 2 стадии) в виде желтого твердого вещества. МС: m/z =402,2[M+H]+.
1-[2-Метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
1-[2-метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он 30 мг (14% за 2 стадии) получают из 1-[3-(2-амино-3-нитропиридин-4-ил)-2-метилфенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она, 4-[(морфолин-4-ил)карбонил]бензальдегида с применением способа 1G и 1H. ЖХВД: 98,2% чистота. МС: m/z =571,1 [M+H]+. 1H-ЯМР (400 МГц, CD3OD): δ 8,53 (с, 1H), 8,39-8,33 (м, 2H), 7,63-7,56 (м, 7H), 7,34-7,28 (м, 3H), 7,08 (с, 1H), 6,88 (с, 1H), 3,79-3,68 (м, 6H), 3,50-3,45 (м, 2H), 2,41 (с, 3H), 2,10 (с, 3H).
Схема 46
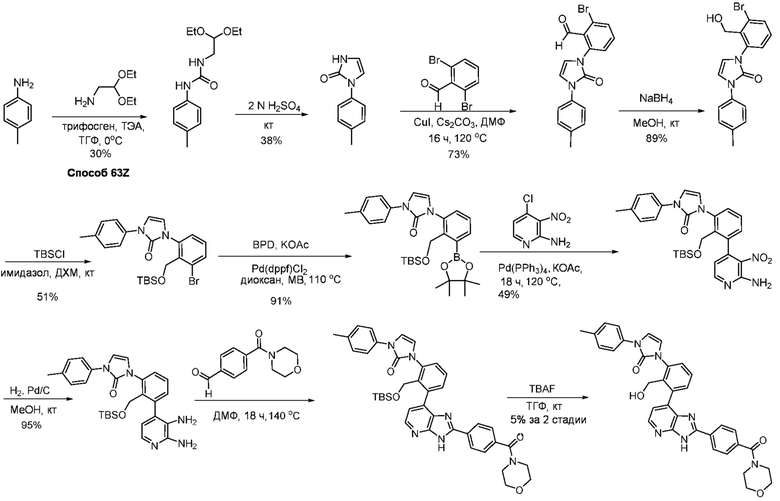
Пример 96. 1-[2-(Гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (96)
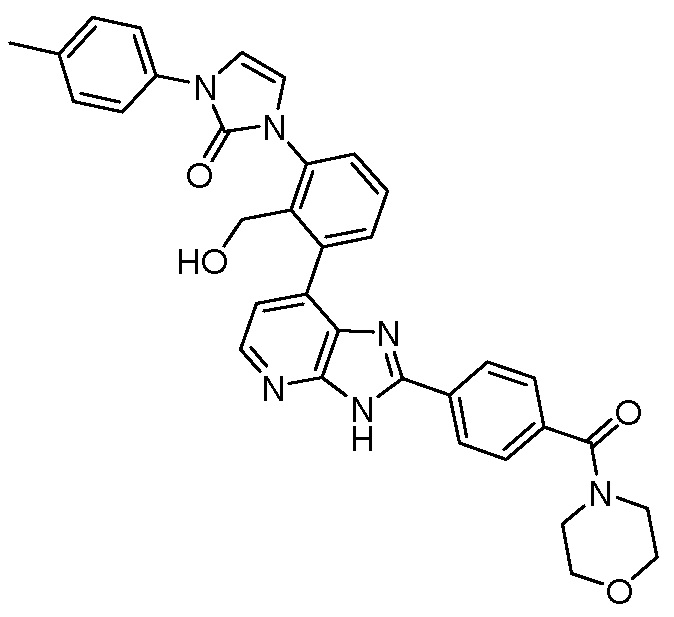
3-(2,2-диэтоксиэтил)-1-(4-метилфенил)мочевина
3-(2,2-диэтоксиэтил)-1-(4-метилфенил)мочевину 1,5 г (30%) получают из 4-метиланилина, 2,2-диэтоксиэтан-1-амина с применением способа 63Z. МС: m/z =267,2 [M+H]+.
1-(4-Метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 100 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 3-(2,2-диэтоксиэтил)-1-(4-метилфенил)мочевину (800 мг, 3,00 ммоль, 1,00 эквив.) растворяют в растворе серной кислоты (0,5N, 10 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 6 ч при комнатной температуре. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, и значение pH смеси доводят до 9 добавлением бикарбоната натрия. Полученную смесь экстрагируют этилацетатом (3×10 мл) и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она 200 мг (38%) в виде коричневого масла. МС: m/z =174,2 [M+H]+.
2-Бром-6-[3-(4-метилфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил]бензальдегид
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (200 мг, 1,15 ммоль, 1,00 эквив.), (2-аминоэтил) диметиламин (60,7 мг, 0,69 ммоль, 0,60 эквив.), 2,6-дибромбензальдегид (515,1 мг, 1,95 ммоль, 1,70 эквив.), Cs2CO3 (635,9 мг, 1,95 ммоль, 1,70 эквив.) и CuI (54,6 мг, 0,29 ммоль, 0,25 эквив.) смешивают в диоксане (5 мл). Полученную смесь затем перемешивают в течение 16 ч. при 120°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл воды и экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом дихлорметане (от 1% до 20% градиент) с получением 2-бром-6-[3-(4-метилфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил]бензальдегида (300 мг, 73%) в виде желтого твердого вещества. МС: m/z =357,0 [M+H]+.
1-[3-Бром-2-(гидроксиметил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 50 мл круглодонной колбе, 2-бром-6-[3-(4-метилфенил)-2-оксо-2,3-дигидро-1H-имидазол-1-ил]бензальдегид (200 мг, 0,56 ммоль, 1,00 эквив.) растворяют в метаноле (20 мл), туда медленно добавляют NaBH4 (40 мг, 1,00 ммоль, 1,79 эквив.) при 0°C. Полученную смесь затем перемешивают в течение 16 ч. при комнатной температуре. После завершения реакции, ее гасят 10 мл воды, и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-[3-бром-2-(гидроксиметил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (180 мг, 89%) в виде белого твердого вещества. МС: m/z =359,0 [M+H]+.
1-(3-Бром-2-[[(трет-бутилдиметилсилил)окси]метил]фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 50 мл круглодонной колбе, 1H-имидазол (113,7 мг, 1,67 ммоль, 2,00 эквив.) и 1-[3-бром-2-(гидроксиметил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (300 мг, 0,84 ммоль, 1,00 эквив.) растворяют в дихлорметане (10 мл), туда медленно добавляют TBSCl (188,8 мг, 1,25 ммоль, 1,50 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 18 ч. при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 1-(3-бром-2-[[(трет-бутилдиметилсилил)окси]метил]фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (200 мг, 51%) в виде белого твердого вещества. МС: m/z =472,2 [M+H]+.
1-(2-[[(трет-Бутилдиметилсилил)окси]метил]-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(3-бром-2-[[(трет-бутилдиметилсилил)окси]метил]фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (200 мг, 0,42 ммоль, 1,00 эквив.), 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (160,9 мг, 0,63 ммоль, 1,50 эквив.), Pd(dppf)Cl2 (30,9 мг, 0,04 ммоль, 0,10 эквив.) и KOAc (82,91 мг, 0,84 ммоль, 2,00 эквив.) смешивают в диоксане (10 мл) при комнатной температуре. Полученную смесь затем облучают микроволнами в течение 1 ч. при 100°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 1-(2-[[(трет-бутилдиметилсилил)окси]метил]-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (200 мг, 91%) в виде коричневого твердого вещества.
1-[3-(2-Амино-3-нитропиридин-4-ил)-2-[[(трет-бутилдиметилсилил)окси]метил]фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 10 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(2-[[(трет-бутилдиметилсилил)окси]метил]-3-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (100 мг, 0,19 ммоль, 1,00 эквив.), 4-хлор-3-нитропиридин-2-амин (50 мг, 0,29 ммоль, 1,50 эквив.), Pd(PPh3)4 (22 мг, 0,02 ммоль, 0,10 эквив.) и KOAc (37,7 мг, 0,38 ммоль, 2,00 эквив.) смешивают в диоксане (5 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 18 ч. при 120°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 20% градиент) с получением 1-[3-(2-амино-3-нитропиридин-4-ил)-2-[[(трет-бутилдиметилсилил)окси]метил]фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (50 мг, 49%) в виде желтого твердого вещества. МС: m/z =532,4 [M+H]+.
1-(2-[[(трет-Бутилдиметилсилил)окси]метил]-3-(2,3-диаминопиридин-4-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
1-(2-[[(трет-бутилдиметилсилил)окси]метил]-3-(2,3-диаминопиридин-4-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он 90 мг (95%) получают из 1-[3-(2-амино-3-нитропиридин-4-ил)-2-[[(трет-бутилдиметилсилил)окси]метил]фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она с применением способа 1G.
1-[2-Метил-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(2-[[(трет-бутилдиметилсилил)окси]метил]-3-(2,3-диаминопиридин-4-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (90 мг, 0,18 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (20 мл), туда добавляют 4-[(морфолин-4-ил)карбонил]бензальдегид (87 мг, 0,40 ммоль, 2,21 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 18 ч. при 140°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры, разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 20% градиент) с получением 1-(2-[[(трет-бутилдиметилсилил)окси]метил]-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (150 мг, неочищенный) в виде желтого твердого вещества. МС: m/z =701,4 [M+H]+.
1-[2-(Гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он
В 25 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 1-(2-[[(трет-бутилдиметил силил)окси]метил]-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил)-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-он (80 мг, 0,11 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (5 мл), туда добавляют TBAF (59,69 мг, 0,23 ммоль, 2,00 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 18 ч. при комнатной температуре. После завершения реакции, реакционную смесь концентрируют. Остаток разбавляют 10 мл воды и экстрагируют этилацетатом (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 15% градиент) с получением 1-[2-(гидроксиметил)-3-(2-[4-[(морфолин-4-ил)карбонил]фенил]-3H-имидазо[4,5-b]пиридин-7-ил)фенил]-3-(4-метилфенил)-2,3-дигидро-1H-имидазол-2-она (10 мг, 5% за 2 стадии) в виде белого твердого вещества. ЖХВД: 95,1% чистота. МС: m/z=587,2 [M+H]+. 1H-ЯМР (300 МГц, CD3OD): δ 8,45 (д, J=5,1 Гц, 1H), 8,24-8,22 (м, 2H), 7,67-7,51 (м, 7H), 7,33-7,26 (м, 3H), 7,02-6,96 (м, 2H), 4,42 (с, 2H), 3,83-3,57 (м, 6H), 3,56-3,35 (м, 2H), 2,35 (с, 3H).
Пример 97: (1-{4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)амид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (97)
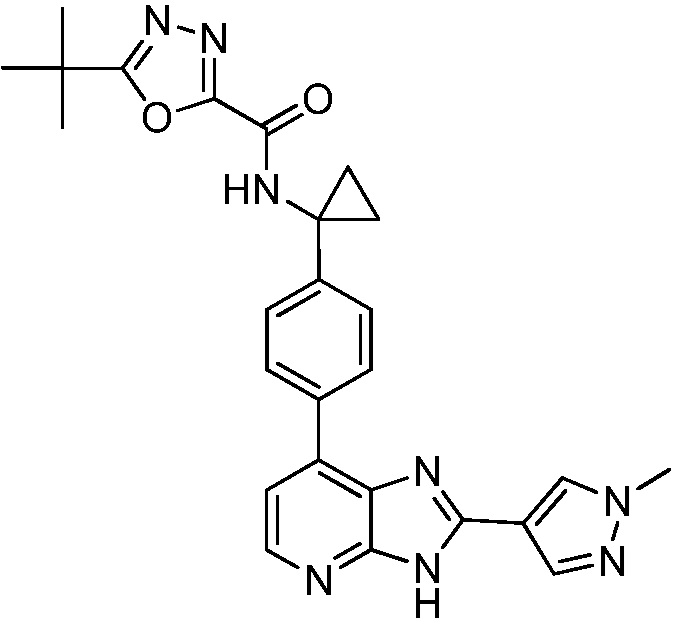
{1-[4-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}амид 5- трет- бутил-[1,3,4]оксадиазол-2-карбоновой кислоты
В 20 мл пробирку с мешалкой добавляют 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)циклопропанамин (150,00 мг; 0,58 ммоль; 1,00 экв.), 5-трет-бутил-1,3,4-оксадиазол-2-карбоновую кислоту (98,49 мг; 0,58 ммоль; 1,00 экв.), пропилфосфоновый ангидрид (50% в ДМФ) (0,43 мл; 0,72 ммоль; 1,25 экв.) и ДИПЭА (0,29 мл; 1,74 ммоль; 3,00 экв.) в ДХМ (5,00 мл; 78,00 ммоль; 134,76 экв.). Реакционную смесь перемешивают при КТ в течение ночи. К реакционной смеси добавляют 10 мл ДХМ, и реакционную смесь промывают 20 мл 2N водн. HCl, 20 мл 2N водн. NaOH и 20 мл насыщенным раствором соли. Органическую фазу сушат (Na2SO4), концентрируют и очищают флэш-хроматографией (KP-sil колонка, 25 г; 5-50% EtOAc/гексан 15 ОК). Концентрируют фракции продукта и сушат с получением 30 мг (13%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 82% чистота. МС: 412 [M+H]+
(1-{4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)амид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновая кислота
В 10 мл реакционную пробирку с мешалкой добавляют 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (20,00 мг; 0,07 ммоль; 1,00 экв.), {1-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}амид 5-трет-бутил-[1,3,4]оксадиазол-2-карбоновой кислоты (30,91 мг; 0,08 ммоль; 1,10 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (5,58 мг; 0,01 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют 1M фосфат калия, двухосновный (0,14 мл; 0,14 ммоль; 2,00 экв.), 1M ацетат натрия (0,14 мл; 0,14 ммоль; 2,00 экв.) и АЦН (1,00 мл; 19,15 ммоль; 280,24 экв.) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 110°C в течение 2 ч. Реакционную смесь охлаждают до КТ, фильтруют через целит и концентрируют при пониженном давлении. Остаток очищают флэш-хроматографией (10 г KP-sil колонка; 2-10% MeOH/CH2Cl2 15 ОК). Концентрируют фракции, содержащие продукт, при пониженном давлении, и сушат с получением 16 мг (49%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 94% чистота. МС: 483 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,31 (с, 1H), 10,08 (с, 1H), 8,41 (с, 1H), 8,28-8,20 (м, 3H), 8,11 (с, 1H), 7,43 (д, J=5,1 Гц, 1H), 7,41-7,35 (м, 2H), 3,93 (с, 3H), 1,41 (с, 9H), 1,38 (с, 4H).
Пример 98: (1-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)амид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (98)
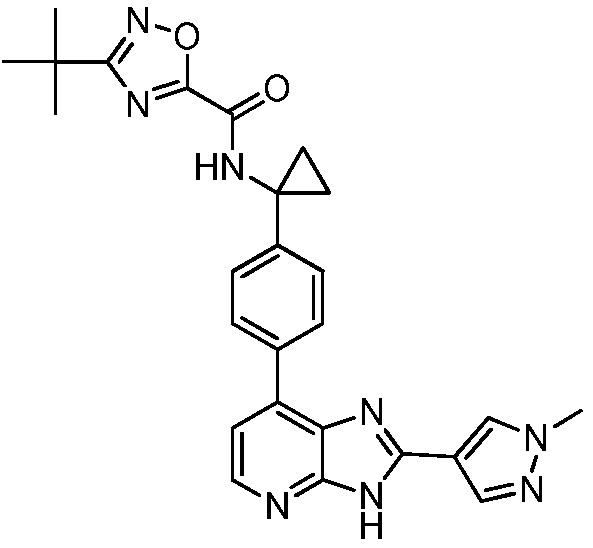
{1-[4-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}амид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновая кислота
Получают способом, аналогичным способу получения соединения 97 с применением 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)циклопропанамина (150,00 мг; 0,58 ммоль; 1,00 экв.), 3-трет-бутил-1,2,4-оксадиазол-5-карбоновой кислоты (98,49 мг; 0,58 ммоль; 1,00 экв.), пропилфосфонового ангидрида (0,43 мл; 0,72 ммоль; 1,25 экв.) и ДИПЭА (0,29 мл; 1,74 ммоль; 3,00 экв.) в ДХМ (5,00 мл; 78,00 ммоль; 134,76 экв.) с получением 108 мг (45%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 84% чистота. МС: 412 [M+H]+.
(1-{4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)амид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновая кислота
Получают способом, аналогичным способу получения соединения 97 с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (40,00 мг; 0,14 ммоль; 1,00 экв.), {1-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}амида 3-трет-бутил-[1,2,4]оксадиазол-5-карбоновой кислоты (67,44 мг; 0,16 ммоль; 1,20 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (11,16 мг; 0,01 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,27 мл; 0,27 ммоль; 2,00 экв.), 1M ацетата натрия (0,27 мл; 0,27 ммоль; 2,00 экв.) и АЦН (2,00 мл; 38,29 ммоль; 280,24 экв.) с получением 35 мг (53%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 94% чистота. МС: 483 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,31 (с, 1H), 10,14 (с, 1H), 8,41 (с, 1H), 8,28-8,20 (м, 3H), 8,12 (с, 1H), 7,44 (д, J=5,1 Гц, 1H), 7,41-7,36 (м, 2H), 3,94 (с, 3H), 1,41-1,37 (м, 13H).
Пример 99: 6-трет-Бутил-8-фтор-2-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-бензил}-2H-фталазин-1-он (99)
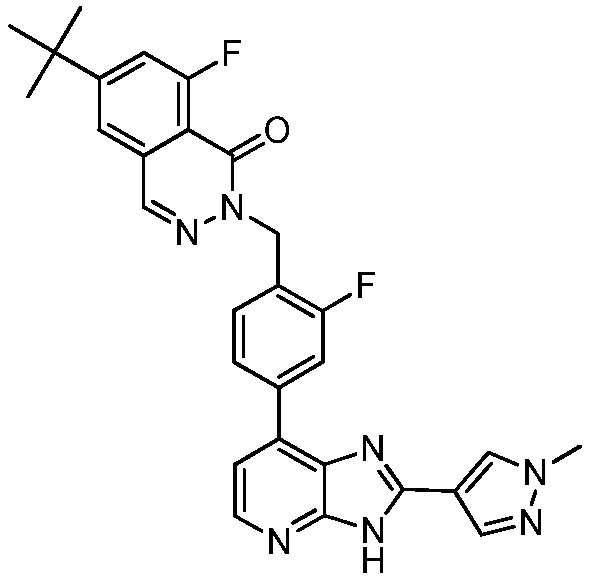
2-(4-Бром-2-фтор-бензил)-6- трет- бутил-8-фтор-2H-фталазин-1-он
В 20 мл реакционную пробирку с мешалкой добавляют 6-(трет-бутил)-8-фторфталазин-1(2h)-он (200,00 мг; 0,91 ммоль; 1,00 экв.), 4-бром-2-фторбензилбромид (267,63 мг; 1,00 ммоль; 1,10 экв.) и карбонат цезия (591,75 мг; 1,82 ммоль; 2,00 экв.) в АЦН (6,00 мл; 114,88 ммоль; 126,50 экв.). Реакционную пробирку герметично закрывают и нагревают до 80°C в течение ночи. Концентрируют и очищают флэш-хроматографией (KP-sil колонка, 10 г; 5-50% EtOAc/гексан 15 ОК). Концентрируют фракции продукта и сушат с получением 218 мг (59%) указанного в заголовке соединения в виде оранжевого твердого вещества. ЖХВД: 97% чистота. МС: 408 [M+H]+.
6- трет- Бутил-8-фтор-2-[2-фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]-2H-фталазин-1-он
В 10 мл пробирку с мешалкой добавляют 2-(4-бром-2-фторбензил)-6-трет-бутил-8-фтор-2H-фталазин-1-он (100,00 мг; 0,25 ммоль; 1,00 экв.), бис(пинаколато)диборон (124,71 мг; 0,49 ммоль; 2,00 экв.), продукт присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (25,42 мг; 0,02 ммоль; 0,10 экв.), дициклогексил-(2',4',6'-триизопропилбифенил-2-ил)фосфан (23,41 мг; 0,05 ммоль; 0,20 экв.) и ацетат калия (72,30 мг; 0,74 ммоль; 3,00 экв.). Пробирку герметично закрывают и ополаскивают Ar. Туда добавляют диоксан (2,00 мл; 23,47 ммоль; 95,59 экв.) через шприц. Реакционную смесь дегазируют Ar и затем нагревают до 65°C в течение ночи при перемешивании. Загружают сразу в 25 г KP-sil образец and очищают флэш-хроматографией (KP-sil, 25 г; 0%-50% EtOAc/гекс 15 ОК). Концентрируют фракции продукта и сушат на помпе с получением 106 мг (95%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 64% чистота. МС: 455 [M+H]+.
6- трет- Бутил-8-фтор-2-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-2H-фталазин-1-он
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (50,00 мг; 0,17 ммоль; 1,00 экв.), 6-трет-бутил-8-фтор-2-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]-2H-фталазин-1-она (96,99 мг; 0,21 ммоль; 1,25 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (13,95 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,34 мл; 0,34 ммоль; 2,00 экв.), 1M ацетата натрия (0,34 мл; 0,34 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 280,24 экв.) с получением 53 мг (59%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 97% чистота. МС: 526 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,40 (с, 1H), 8,51-8,40 (м, 2H), 8,31-8,21 (м, 2H), 8,16-8,07 (м, 2H), 7,81 (с, 1H), 7,73 (дт, J=13,3, 2,1 Гц, 1H), 7,51 (дд, J=5,3, 2,5 Гц, 1H), 7,41 (тд, J=8,0, 2,1 Гц, 1H), 5,42 (д, J=2,5 Гц, 2H), 3,32 (д, J=3,0 Гц, 2H), 1,36 (д, J=2,4 Гц, 9H).
Пример 100: 6-трет-Бутил-2-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-3,4-дигидро-2H-изохинолин-1-он (100)
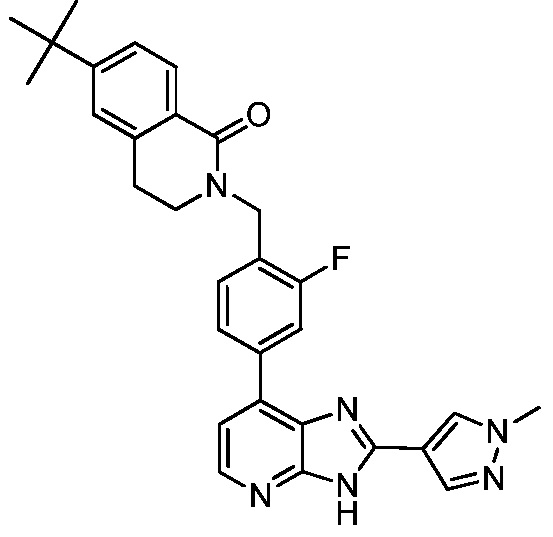
2-(4-Бром-2-фторбензил)-6- трет- бутил-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 99, с применением 6-трет-бутил-3,4-дигидроизохинолин-1(2h)-она (125,00 мг; 0,61 ммоль; 1,00 экв.), 4-бром-2-фторбензилбромида (181,22 мг; 0,68 ммоль; 1,10 экв.) и карбоната церия (0,05 мл; 0,68 ммоль; 1,10 экв.) в АЦН (5,00 мл; 95,73 ммоль; 155,68 экв.) с получением 58 мг (24%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 92% чистота. МС: 391 [M+H]+.
6- трет- Бутил-2-[2-фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 99, с применением 2-(4-бром-2-фторбензил)-6-трет-бутил-3,4-дигидро-2H-изохинолин-1-она (45,00 мг; 0,12 ммоль; 1,00 экв.), бис(пинаколато)диборона (58,56 мг; 0,23 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (11,93 мг; 0,01 ммоль; 0,10 экв.), дициклогексил-(2',4',6'-триизопропилбифенил-2-ил)фосфана (10,99 мг; 0,02 ммоль; 0,20 экв.) и ацетата калия (33,95 мг; 0,35 ммоль; 3,00 экв.) в диоксане (2,00 мл; 23,47 ммоль; 203,57 экв.) с получением 40 мг (79%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 88% чистота. МС: 438 [M+H]+.
6- трет- Бутил-2-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (25,00 мг; 0,09 ммоль; 1,00 экв.), 6-трет-бутил-2-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]-3,4-дигидро-2H-изохинолин-1-она (42,95 мг; 0,10 ммоль; 1,15 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (6,97 мг; 0,01 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,17 мл; 0,17 ммоль; 2,00 экв.), 1M ацетата натрия (0,17 мл; 0,17 ммоль; 2,00 экв.) и АЦН с получением 18 мг (41%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 99% чистота. МС: 509 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,40 (с, 1H), 8,44 (с, 1H), 8,33-8,24 (м, 2H), 8,17 (д, J=8,0 Гц, 1H), 8,13 (с, 1H), 7,86 (д, J=8,2 Гц, 1H), 7,56-7,52 (м, 1H), 7,49 (т, J=7,9 Гц, 1H), 7,41 (дд, J=8,3, 1,9 Гц, 1H), 7,33 (с, 1H), 4,83 (с, 2H), 3,94 (с, 3H), 3,62 (т, J=6,6 Гц, 2H), 3,03 (т, J=6,5 Гц, 2H), 1,30 (с, 9H).
Пример 101: N-{2-Метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}оксаламид (101)
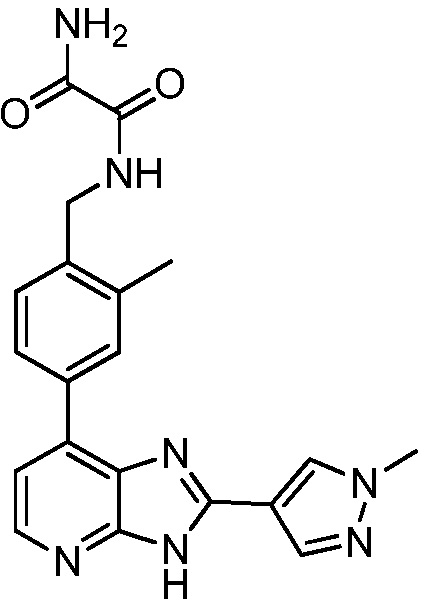
4-Бром-2-метилбензиламид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97, с применением (4-бром-2-метилфенил)метанамина (200,00 мг; 1,00 ммоль; 1,00 экв.), 3-трет-бутил-1,2,4-оксадиазол-5-карбоновой кислоты (170,10 мг; 1,00 ммоль; 1,00 экв.), 50% пропилфосфонового ангидрида в ДМФ (0,74 мл; 1,25 ммоль; 1,25 экв.), ДИПЭА (0,50 мл; 3,00 ммоль; 3,00 экв.) и ДХМ (8,00 мл; 124,80 ммоль; 124,85 экв.) с получением 161 мг (46%) указанного в заголовке соединения в виде бледно-желтого масла. ЖХВД: 100% чистота. МС: 353 [M+H]+.
2-Метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензиламид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 99, с применением 4-бром-2-метилбензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (160,00 мг; 0,45 ммоль; 1,00 экв.), бис(пинаколато)диборона (230,71 мг; 0,91 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (47,02 мг; 0,05 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (43,31 мг; 0,09 ммоль; 0,20 экв.) и ацетата калия (133,74 мг; 1,36 ммоль; 3,00 экв.) в диоксане (4,00 мл; 46,94 ммоль; 103,34 экв.) с получением 122 мг (67%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 66% чистота. МС: 400 [M+H]+.
N-{2-Метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}оксаламид
В 10 мл реакционную пробирку с мешалкой добавляют 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (60,00 мг; 0,20 ммоль; 1,00 экв.), 2-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (122,76 мг; 0,31 ммоль; 1,50 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (16,74 мг; 0,02 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают Ar. К реакционной смеси добавляют 1M фосфат калия, двухосновный (0,41 мл; 0,41 ммоль; 2,00 экв.), 1M ацетат натрия (0,41 мл; 0,41 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 233,54 экв.) через шприц. Реакционную пробирку дегазируют Ar и нагревают до 130°C в течение 1 ч. в микроволновом реакторе. Реакционную смесь фильтруют через целит и концентрируют. Очищают флэш-хроматографией (10 г KP-sil колонка; 2-10% MeOH/CH2Cl2 20 ОК). Концентрируют фракции продукта и сушат на помпе с получением 28 мг (35%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 100% чистота. МС: 390 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,30 (с, 1H), 9,22 (т, J=6,3 Гц, 1H), 8,43 (с, 1H), 8,25 (д, J=5,2 Гц, 1H), 8,18-8,09 (м, 3H), 8,08 (с, 1H), 7,84 (с, 1H), 7,45 (д, J=5,2 Гц, 1H), 7,32 (д, J=8,1 Гц, 1H), 4,39 (с, 2H), 3,94 (с, 3H), 2,42 (с, 3H).
Пример 102: N-(1-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)оксаламид (102)
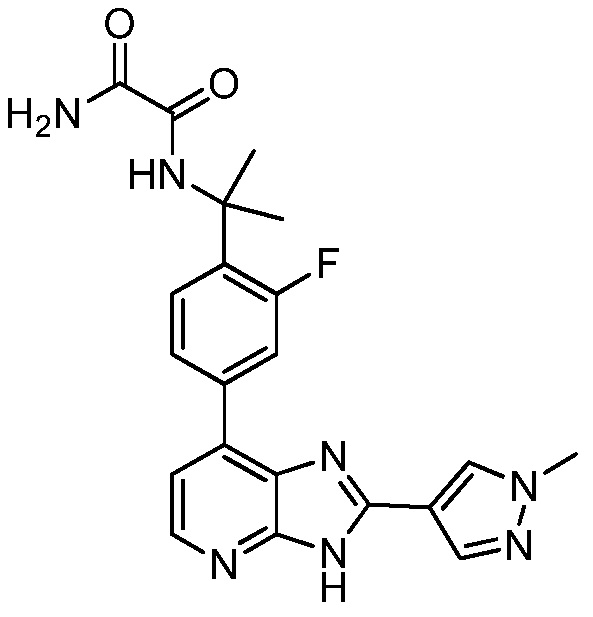
[1-(4-Бром-2-фторфенил)-1-метилэтил]амид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97, с применением 2-(4-бром-2-фторфенил)пропан-2-амина (200,00 мг; 0,86 ммоль; 1,00 экв.), 3-трет-бутил-1,2,4-оксадиазол-5-карбоновой кислоты (146,64 мг; 0,86 ммоль; 1,00 экв.), 50% пропилфосфонового ангидрида в ДМФ (0,64 мл; 1,08 ммоль; 1,25 экв.) и ДИПЭА (0,43 мл; 2,59 ммоль; 3,00 экв.) в ДХМ (8,00 мл; 124,80 ммоль; 144,83 экв.) с получением 132 мг (40%) указанного в заголовке соединения в виде беловатого твердого вещества. ЖХВД: 100% чистота. МС: 385 [M+H]+.
{1-[2-Фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1-метилэтил}амид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 99, с применением [1-(4-бром-2-фторфенил)-1-метилэтил]амид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (130,00 мг; 0,34 ммоль; 1,00 экв.), бис(пинаколато)диборона (171,83 мг; 0,68 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (35,02 мг; 0,03 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (32,26 мг; 0,07 ммоль; 0,20 экв.) и ацетата калия (99,61 мг; 1,01 ммоль; 3,00 экв.) в диоксане (3,00 мл; 35,21 ммоль; 104,06 экв.) с получением 125 мг (86%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 65% чистота. МС: 431 [M+H]+.
N-(1-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)оксаламид
Получают способом, аналогичным способу получения соединения 101, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (55,00 мг; 0,19 ммоль; 1,00 экв.), {1-[2-фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]-1-метилэтил}амида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (121,55 мг; 0,28 ммоль; 1,50 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (15,34 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,38 мл; 0,38 ммоль; 2,00 экв.), ацетата натрия (0,38 мл; 0,38 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 254,77 экв.) с получением 43 мг (54%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 100% чистота. МС: 422 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,32 (с, 1H), 8,53 (с, 1H), 8,46 (с, 1H), 8,28 (д, J=5,2 Гц, 1H), 8,23-7,95 (м, 4H), 7,81 (д, J=2,1 Гц, 1H), 7,54-7,42 (м, 2H), 3,94 (с, 3H), 1,75 (с, 6H).
Пример 103: 2-Метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (103)
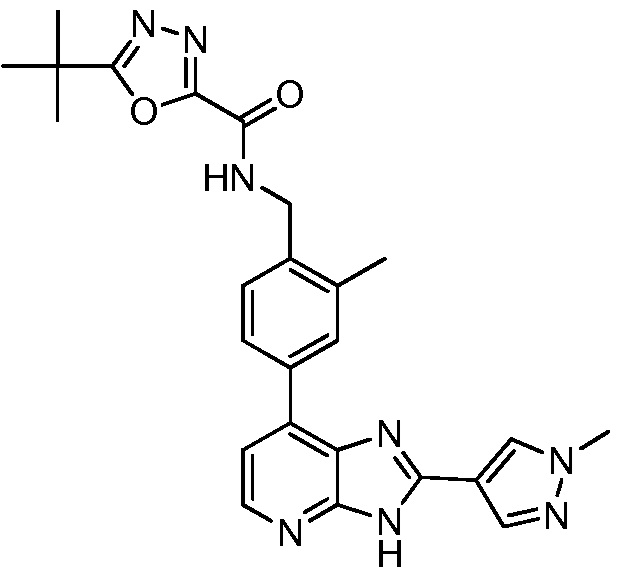
4-Бром-2-метилбензиламид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97, с применением (4-бром-2-метилфенил)метанамина (200,00 мг; 1,00 ммоль; 1,00 экв.), 5-трет-бутил-1,3,4-оксадиазол-2-карбоновой кислоты (170,10 мг; 1,00 ммоль; 1,00 экв.), 50% пропилфосфонового ангидрида в ДМФ (0,74 мл; 1,25 ммоль; 1,25 экв.) и ДИПЭА (0,50 мл; 3,00 ммоль; 3,00 экв.) в ДХМ (8,00 мл; 124,80 ммоль; 124,85 экв.) с получением 175 мг (50%) указанного в заголовке соединения в виде бледно-желтого масла. ЖХВД: 100% чистота. МС: 353 [M+H]+.
2-Метил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензиламид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 99, с применением 4-бром-2-метилбензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (170,00 мг; 0,48 ммоль; 1,00 экв.), бис(пинаколато)диборона (245,12 мг; 0,97 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (49,96 мг; 0,05 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (46,02 мг; 0,10 ммоль; 0,20 экв.) и ацетата калия (142,10 мг; 1,45 ммоль; 3,00 экв.) в диоксане (4,50 мл; 52,81 ммоль; 109,42 экв.) с получением 213 мг (111%) указанного в заголовке соединения в виде желтого масла. ЖХВД: 78% чистота. МС: 400 [M+H]+.
2-Метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (60,00 мг; 0,20 ммоль; 1,00 экв.), 2-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (122,76 мг; 0,31 ммоль; 1,50 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (16,74 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,41 мл; 0,41 ммоль; 2,00 экв.), 1M ацетата натрия (0,41 мл; 0,41 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 233,54 экв.) с получением 61 мг (63%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 96% чистота. МС: 471 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,30 (с, 1H), 9,79 (т, J=5,7 Гц, 1H), 8,41 (д, J=3,5 Гц, 1H), 8,30-8,23 (м, 1H), 8,20-8,11 (м, 2H), 8,09 (д, J=2,4 Гц, 1H), 7,48-7,39 (м, 2H), 4,55-4,50 (м, 2H), 3,94 (с, 3H), 2,45 (с, 3H), 1,40 (с, 9H).
Пример 104: (1-{2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)амид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (104)

[1-(4-Бром-2-фторфенил)-1-метилэтил]амид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97,1, с применением 2-(4-бром-2-фторфенил)пропан-2-амина (200,00 мг; 0,86 ммоль; 1,00 экв.), 5-трет-бутил-1,3,4-оксадиазол-2-карбоновой кислоты (146,64 мг; 0,86 ммоль; 1,00 экв.), 50% пропилфосфонового ангидрида в ДМФ (0,64 мл; 1,08 ммоль; 1,25 экв.) и ДИПЭА (0,43 мл; 2,59 ммоль; 3,00 экв.) в ДХМ (8,00 мл; 124,80 ммоль; 144,83 экв.) с получением 113 мг (34%) указанного в заголовке соединения в виде желтого твердого вещества. ЖХВД: 94% чистота. МС: 385 [M+H]+.
Получают способом, аналогичным способу получения соединения 99,2, с применением [1-(4-бром-2-фторфенил)-1-метилэтил]амида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (110,00 мг; 0,29 ммоль; 1,00 экв.), бис(пинаколато)диборона (145,39 мг; 0,57 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (29,63 мг; 0,03 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (27,29 мг; 0,06 ммоль; 0,20 экв.) и ацетата калия (84,29 мг; 0,86 ммоль; 3,00 экв.) в диоксане (3,00 мл; 35,21 ммоль; 122,99 экв.) с получением 123 мг (100%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 90% чистота. МС: 432 [M+H]+.
(1-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)амид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (55,00 мг; 0,19 ммоль; 1,00 экв.), {1-[2-фтор-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]-1-метилэтил}амид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (121,55 мг; 0,28 ммоль; 1,50 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (15,34 мг; 0,02 ммоль; 0,10 экв.) 1M фосфата калия, двухосновного (0,38 мл; 0,38 ммоль; 2,00 экв.), 1M ацетата натрия (0,38 мл; 0,38 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 254,77 экв.) с получением 49 мг (52%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 100% чистота. МС: 503 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,39 (с, 1H), 9,41 (с, 1H), 8,45 (с, 1H), 8,29 (д, J=5,4 Гц, 1H), 8,24-8,12 (м, 2H), 8,09 (дд, J=8,3, 1,9 Гц, 1H), 7,57 (т, J=8,7 Гц, 1H), 7,51 (д, J=5,3 Гц, 1H), 3,94 (с, 3H), 1,80 (с, 6H), 1,39 (с, 9H).
Пример 105: 3-Гидроксиметил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (105)
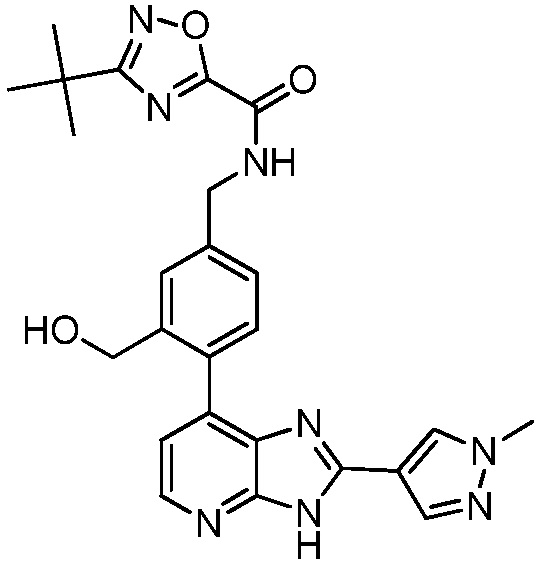
(1-Гидрокси-1,3-дигидробензо[c][1,2]оксаборол-5-илметил)амид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
В 20 мл реакционную пробирку с мешалкой добавляют 2,1-бензоксаборол-5-метанамин, 1,3-дигидро-1-гидрокси- (200,00 мг; 1,23 ммоль; 1,00 экв.), 3-трет-бутил-1,2,4-оксадиазол-5-карбоновую кислоту (261,02 мг; 1,53 ммоль; 1,25 экв.) и PyBrop (715,08 мг; 1,53 ммоль; 1,25 экв.). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют ДМФ (8,00 мл; 103,76 ммоль; 84,55 экв.) и n,n-диизопропилэтиламин (610,00 μl; 3,68 ммоль; 3,00 экв.). Реакционную смесь перемешивают при КТ в течение 12 ч, и затем выливают в 30 мл воды. Смесь экстрагируют 20 мл EtOAc (3×), сушат над безводным Na2SO4 и концентрируют. Очищают флэш-хроматографией (25 г 15 мкМ PF-Sil колонка, 2-10% MeOH/CH2Cl2 15 ОК. 40 мл/мин). Концентрируют фракции продукта и сушат с получением 180 мг (47%) указанного в заголовке соединения в виде бледно-желтого масла. ЖХВД: 95% чистота. МС: 316 [M+H]+.
3-Гидроксиметил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3- трет- бутил[1,2,4]оксадиазол-5-карбоновой кислоты
В 10 мл реакционную пробирку с мешалкой добавляют 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (60,00 мг; 0,20 ммоль; 1,00 экв.), (1-гидрокси-1,3-дигидро-бензо[c][1,2]оксаборол-5-илметил)амид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (96,88 мг; 0,31 ммоль; 1,50 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (16,74 мг; 0,02 ммоль; 0,10 экв.). Пробирку герметично закрывают и ополаскивают Ar. К реакционной смеси добавляют 1M фосфат калия, двухосновный (0,41 мл; 0,41 ммоль; 2,00 экв.), 1M ацетат натрия (0,41 мл; 0,41 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 233,54 экв.) через шприц. Реакционную пробирку дегазируют Ar и нагревают до 130°C в течение 1 ч в микроволновом реакторе. Реакционную смесь фильтруют через целит и концентрируют. Очищают ЖХВД. (Interchim преп. ЖХВД: C-18 (10 мкм), 30×150 мм, 0,1% NH4OH модифицированные подвижные фазы (A=вода, B=АЦН), Способ 35% АЦН изократный в течение 1 мин, затем перепад до 80% АЦН в течение более 12 мин при 60 мл/мин с получением 33 мг (33%) указанного в заголовке соединения в виде беловатого твердого вещества. ЖХВД: 100% чистота. МС: 487 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,37 (с, 1H), 9,98 (т, J=6,1 Гц, 1H), 8,38 (с, 1H), 8,28 (д, J=4,9 Гц, 1H), 8,06 (с, 1H), 7,63 (с, 1H), 7,43-7,27 (м, 2H), 7,09 (с, 1H), 5,37 (с, 1H), 4,55 (д, J=6,2 Гц, 2H), 4,38 (с, 2H), 3,90 (с, 3H), 1,37 (с, 9H).
Пример 106: 4-трет-Бутил-N-(1-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)бензамид (106)
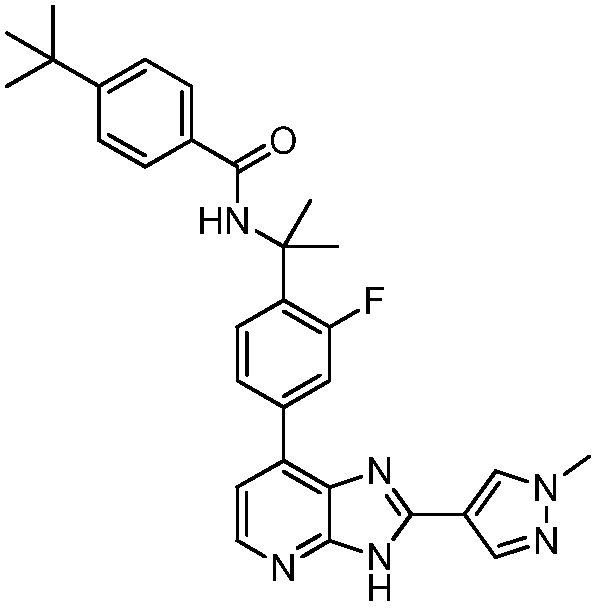
N-[1-(4-Бром-2-фторфенил)-1-метилэтил]-4- трет- бутилбензамид
В 20 мл реакционную пробирку с мешалкой добавляют 2-(4-бром-2-фторфенил)пропан-2-амин (150,00 мг; 0,65 ммоль; 1,00 экв.) и бикарбонат натрия (135,73 мг; 1,62 ммоль; 2,50 экв.), суспендированный в воде (0,15 мл; 8,33 ммоль; 12,88 экв.) и ТГФ (1,50 мл; 18,51 ммоль; 28,65 экв.). Охлаждают до 0°C. Добавляют 4-трет-бутилбензоилхлорид (129,22 мкл; 0,71 ммоль; 1,10 экв.) и медленно нагревают до КТ при перемешивании в течение ночи. Концентрируют при пониженном давлении и очищают с применением флэш-хроматографии (10 г KP-Sil колонка, 20-70% EtOAc/Гексан). Собирают фракции, содержащие желаемый продукт, концентрируют и сушат с получением 183 мг (72%) указанного в заголовке соединения в виде беловатого твердого вещества. ЖХВД: 100% чистота. МС: 393 [M+H]+.
4-(трет-бутил)-N-(2-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропан-2-ил)бензамид
Получают способом, аналогичным способу получения соединения 99, с применением N-[1-(4-бром-2-фторфенил)-1-метилэтил]-4-трет-бутилбензамида (100,00 мг; 0,25 ммоль; 1,00 экв.), бис(пинаколато)диборона (129,46 мг; 0,51 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (26,38 мг; 0,03 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (24,30 мг; 0,05 ммоль; 0,20 экв.) и ацетата калия (75,05 мг; 0,76 ммоль; 3,00 экв.) в диоксане (2,50 мл; 29,34 ммоль; 115,10 экв.) с получением 219 мг указанного в заголовке соединения в виде коричневого воска. ЖХВД: 75% чистота. МС: 440 [M+H]+.
4- трет- Бутил-N-(1-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}-1-метилэтил)бензамид
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (50,00 мг; 0,17 ммоль; 1,00 экв.), 4-трет-бутил-N-{1-[2-фтор-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]-1-метилэтил}бензамида (112,56 мг; 0,26 ммоль; 1,50 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (13,95 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,34 мл; 0,34 ммоль; 2,00 экв.), ацетата натрия (0,34 мл; 0,34 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 280,24 экв.) с получением 44 мг (50%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 97% чистота. МС: 511 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,37 (с, 1H), 8,46 (д, J=16,9 Гц, 2H), 8,27 (д, J=5,3 Гц, 1H), 8,17-8,09 (м, 2H), 8,05 (д, J=8,3 Гц, 1H), 7,79 (д, J=8,1 Гц, 2H), 7,56-7,43 (м, 4H), 3,93 (с, 3H), 1,79 (с, 6H), 1,30 (с, 9H).
Пример 107: 4-трет-Бутил-N-{2-метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид (107)
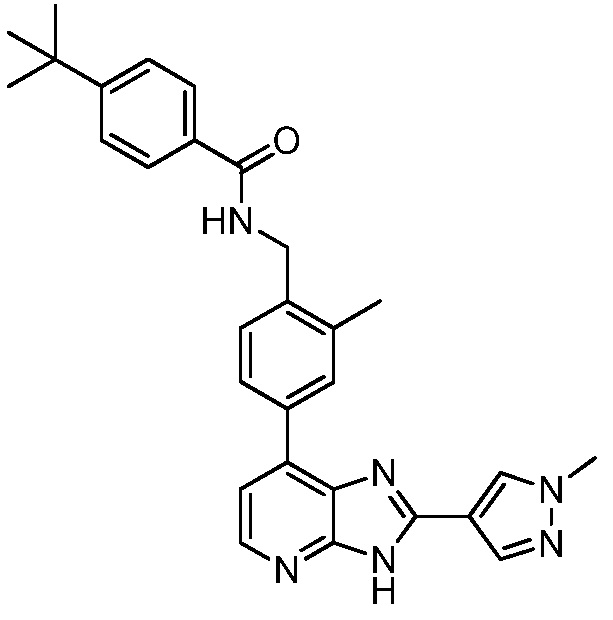
N-(4-Бром-2-метилбензил)-4- трет- бутилбензамид
Получают способом, аналогичным способу получения соединения 106, с применением (4-бром-2-метилфенил)метанамина (150,00 мг; 0,75 ммоль; 1,00 экв.) и бикарбоната натрия (157,45 мг; 1,87 ммоль; 2,50 экв.), суспендированного в воде (0,15 мл; 8,33 ммоль; 11,11 экв.) и ТГФ (1,50 мл; 18,51 ммоль; 24,70 экв.) с получением 179 мг (66%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 361 [M+H]+.
4- трет- Бутил-N-[2-метил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]бензамид
Получают способом, аналогичным способу получения соединения 99, с применением N-(4-бром-2-метилбензил)-4-трет-бутилбензамида (100,00 мг; 0,28 ммоль; 1,00 экв.), бис(пинаколато)диборона (140,96 мг; 0,56 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия(0)-хлороформа (28,73 мг; 0,03 ммоль; 0,10 экв.), дициклогексил(2',4',6'-триизопропилбифенил-2-ил)фосфана (26,46 мг; 0,06 ммоль; 0,20 экв.) и ацетата калия (81,72 мг; 0,83 ммоль; 3,00 экв.) в диоксане (2,50 мл; 29,34 ммоль; 105,71 экв.) с получением 195 мг (172%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 80% чистота. МС: 408 [M+H]+.
4- трет- Бутил-N-{2-метил-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (50,00 мг; 0,17 ммоль; 1,00 экв.), 4-трет-бутил-N-[2-метил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]бензамида (104,36 мг; 0,26 ммоль; 1,50 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (13,95 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,34 мл; 0,34 ммоль; 2,00 экв.), 1M ацетата натрия (0,34 мл; 0,34 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 280,24 экв.) с получением 42 мг (51%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 100% чистота. МС: 479 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,30 (с, 1H), 8,94 (т, J=5,8 Гц, 1H), 8,42 (с, 1H), 8,25 (д, J=5,5 Гц, 1H), 8,16 (д, J=8,0 Гц, 1H), 8,11 (д, J=12,0 Гц, 2H), 7,91-7,85 (м, 2H), 7,53-7,49 (м, 2H), 7,45 (д, J=5,3 Гц, 1H), 7,38 (д, J=8,1 Гц, 1H), 4,54 (д, J=5,8 Гц, 2H), 3,93 (с, 3H), 2,46 (с, 3H), 1,31 (с, 9H).
Пример 108: 4-трет-бутил-N-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-трифторметилбензил}бензамид (108)
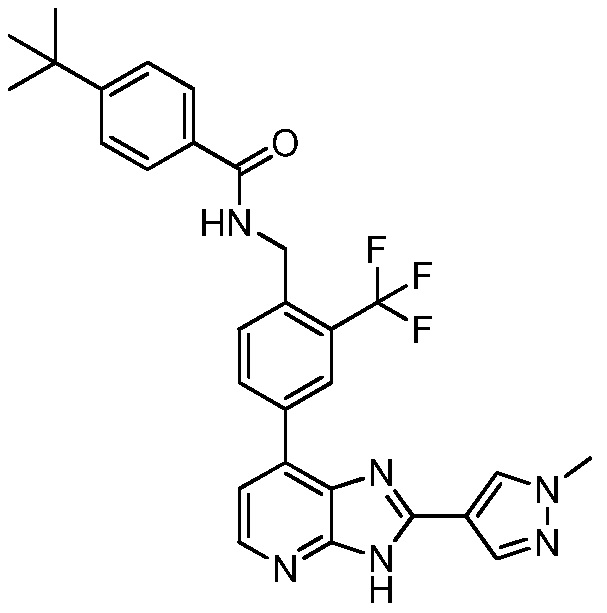
N-(4-Бром-2-трифторметилбензил)-4- трет- бутилбензамид
Получают способом, аналогичным способу получения соединения 106, с применением [4-бром-2-(трифторметил)фенил]метанамина (62,50 мкл; 0,39 ммоль; 1,00 экв.), бикарбоната натрия (82,67 мг; 0,98 ммоль; 2,50 экв.), суспендированного в воде (0,10 мл; 5,55 ммоль; 14,10 экв.) и ТГФ (1,00 мл; 12,34 ммоль; 31,36 экв.) с получением 114 мг (70%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 98% чистота. МС: 415 [M+H]+.
4- трет- Бутил-N-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-2-трифторметилбензил]бензамид
Получают способом, аналогичным способу получения соединения 99, с применением N-(4-бром-2-трифторметилбензил)-4-трет-бутилбензамида (110,00 мг; 0,27 ммоль; 1,00 экв.), бис(пинаколато)диборона (134,86 мг; 0,53 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия-хлороформа (27,49 мг; 0,03 ммоль; 0,10 экв.), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенила (25,32 мг; 0,05 ммоль; 0,20 экв.) и ацетата калия (78,18 мг; 0,80 ммоль; 3,00 экв.) в диоксане (2,00 мл; 23,47 ммоль; 88,40 экв.) с получением 150 мг (122%) указанного в заголовке соединения в виде коричневого твердого вещества. МС: 462 [M+H]+.
4- трет- Бутил-N-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-трифторметилбензил}бензамид
Получают способом, аналогичным способу получения соединения 97, с применением 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (50,00 мг; 0,17 ммоль; 1,00 экв.), 4-трет-бутил-N-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-2-трифторметилбензил]бензамида (102,43 мг; 0,22 ммоль; 1,30 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (13,95 мг; 0,02 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,34 мл; 0,34 ммоль; 2,00 экв.), 1M ацетата натрия (0,34 мл; 0,34 ммоль; 2,00 экв.) и АЦН (2,50 мл; 47,86 ммоль; 280,24 экв.) с получением 39 мг (43%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 97% чистота. МС: 533 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,43 (с, 1H), 9,15 (т, J=5,8 Гц, 1H), 8,82 (с, 1H), 8,57 (д, J=8,3 Гц, 1H), 8,39 (с, 1H), 8,31 (д, J=5,0 Гц, 1H), 8,12 (с, 1H), 7,91 (д, J=8,3 Гц, 2H), 7,67 (д, J=8,2 Гц, 1H), 7,58 (д, J=5,3 Гц, 1H), 7,54 (д, J=8,3 Гц, 2H), 4,74 (д, J=5,9 Гц, 2H), 3,95 (с, 3H), 1,32 (с, 9H).
Пример 109: 4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (109)
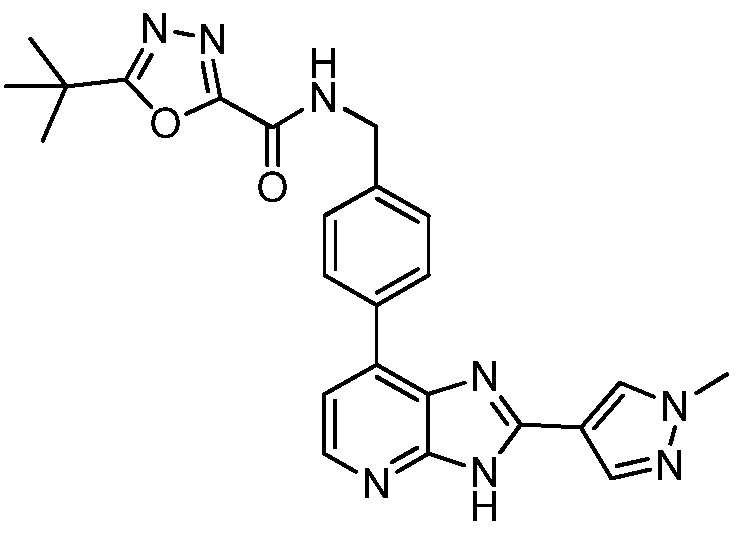
7-Хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
В 100 мл колбу под давлением с мешалкой добавляют 2-бром-7-хлор-3H-имидазо[4,5-b]пиридин (1500,00 мг; 6,45 ммоль; 1,00 экв.), пинаколовый эфир 1-метилпиразол-4-бороновой кислоты (1611,07 мг; 7,74 ммоль; 1,20 экв.) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (790,41 мг; 0,97 ммоль; 0,15 экв.). Колбу герметично закрывают и ополаскивают Ar. К реакционной смеси добавляют фосфат калия, двухосновный (12,91 мл; 12,91 ммоль; 2,00 экв.), ацетат натрия (12,91 мл; 12,91 ммоль; 2,00 экв.) и АЦН (40,00 мл; 765,84 ммоль; 118,69 экв.) через шприц. Реакционную колбу дегазируют Ar, герметично закрывают резьбовой тефлоновой герметичной крышкой и нагревают до 120°C в течение 2 ч. Реакционную смесь охлаждают до КТ и фильтруют через целит, промывая дихлорметаном. Концентрируют при пониженном давлении, и остаток очищают флэш-хроматографией (15 мкМ 200 г колонка с двуокисью кремния; 5-20% MeOH/CH2Cl2 10 ОК.). Концентрируют фракции, содержащие продукт, и сушат с получением 795 мг (53%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 98% чистота. МС: 234 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,55 (с, 1H), 8,46 (с, 1H), 8,17 (д, J=5,4 Гц, 1H), 8,13 (с, 1H), 7,32 (д, J=5,5 Гц, 1H), 3,94 (с, 3H).
4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин
Получают способом, аналогичным способу получения соединения 97, с применением 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (250,00 мг; 1,07 ммоль; 1,00 экв.), пинаколового эфира 4-аминометилфенилбороновой кислоты, hcl (374,96 мг; 1,39 ммоль; 1,30 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (87,38 мг; 0,11 ммоль; 0,10 экв.) 1M фосфата калия, двухосновного (3,21 мл; 3,21 ммоль; 3,00 экв.), 1M ацетата натрия (3,21 мл; 3,21 ммоль; 3,00 экв.) и АЦН (10,00 мл; 191,46 ммоль; 178,94 экв.) с получением 187 мг (57%) указанного в заголовке соединения в виде коричневого твердого вещества. ЖХВД: 74% чистота. МС: 305 [M+H]+.
4-[2-(1-Метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
В 10 мл реакционную пробирку с мешалкой добавляют 5-трет-бутил-1,3,4-оксадиазол-2-карбоновую кислоту (41,93 мг; 0,25 ммоль; 1,25 экв.), 4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (60,00 мг; 0,20 ммоль; 1,00 экв.) и pybop (153,89 мг; 0,30 ммоль; 1,50 экв.). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют ДМФ (2,50 мл; 32,42 ммоль; 164,47 экв.) и n,n-диизопропилэтиламин (98,00 мкл; 0,59 ммоль; 3,00 экв.). Реакционную смесь перемешивают при КТ в течение 12 ч. Добавляют 20 мл воды и переносят в делительную воронку. Экстрагируют 20 мл EtOAc (3×), дихлорметаном (1×) и промывают объединенные органические фазы насыщенным раствором соли, сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Очищают флэш-хроматографией (4 г PF-Si-HP 15 мкМ колонка; 5-10%% MeOH/CH2Cl2 15 об. колонки). Концентрируют фракции продукта и сушат с получением 38 мг (42%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 98% чистота. МС: 457 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,35 (с, 1H), 9,89 (т, J=6,2 Гц, 1H), 8,45 (с, 1H), 8,38-8,05 (м, 4H), 7,52 (д, J=8,1 Гц, 2H), 7,45 (д, J=5,2 Гц, 1H), 4,55 (д, J=6,3 Гц, 2H), 3,94 (с, 3H), 1,41 (с, 9H).
Пример 110: 4-трет-Бутил-N-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид (110)
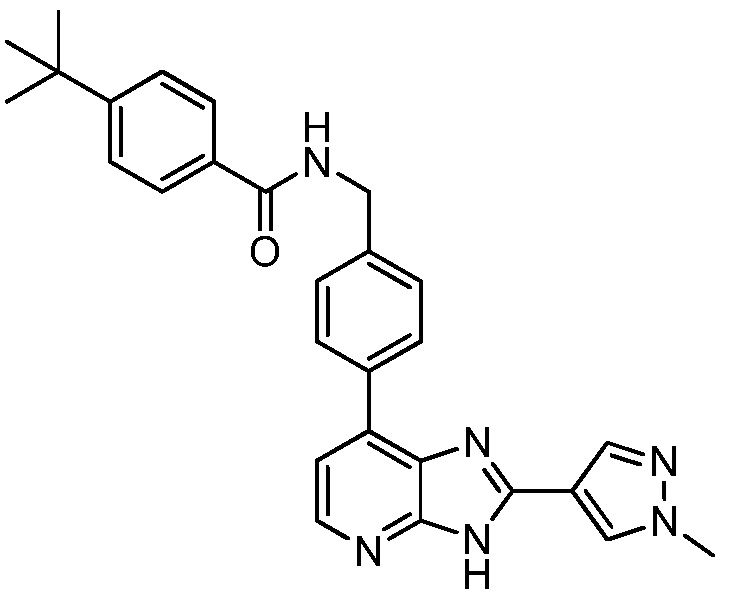
4- трет- Бутил-N-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]бензамид
Получают способом, аналогичным способу получения соединения 106, с применением пинаколового эфира 4-аминометилфенилбороновой кислоты, hcl (250,00 мг; 0,93 ммоль; 1,00 экв.), бикарбоната натрия (194,76 мг; 2,32 ммоль; 2,50 экв.), суспендированного в воде (0,40 мл; 22,20 ммоль; 23,94 экв.) и ТГФ (4,00 мл; 49,37 ммоль; 53,24 экв.) с получением 310 мг (85%) указанного в заголовке соединения в виде белого твердого вещества. МС: 394 [M+H]+.
4- трет- Бутил-N-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензил}бензамид
Получают способом, аналогичным способу получения соединения 97, с применением 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (30,00 мг; 0,13 ммоль; 1,00 экв.), 4-трет-бутил-N-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]бензамида (60,60 мг; 0,15 ммоль; 1,20 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (10,49 мг; 0,01 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,26 мл; 0,26 ммоль; 2,00 экв.), 1M ацетата натрия (0,26 мл; 0,26 ммоль; 2,00 экв.) и АЦН (1,50 мл; 38,29 ммоль; 298,24 экв.) с получением 22 мг (37%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 100% чистота. МС: 465 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,31 (с, 1H), 9,06 (т, J=6,0 Гц, 1H), 8,42 (с, 1H), 8,32-8,23 (м, 3H), 8,12 (с, 1H), 7,88 (д, J=8,3 Гц, 2H), 7,53-7,43 (м, 5H), 4,57 (д, J=6,0 Гц, 2H), 3,93 (с, 3H), 1,31 (с, 9H).
Пример 111: 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (111)
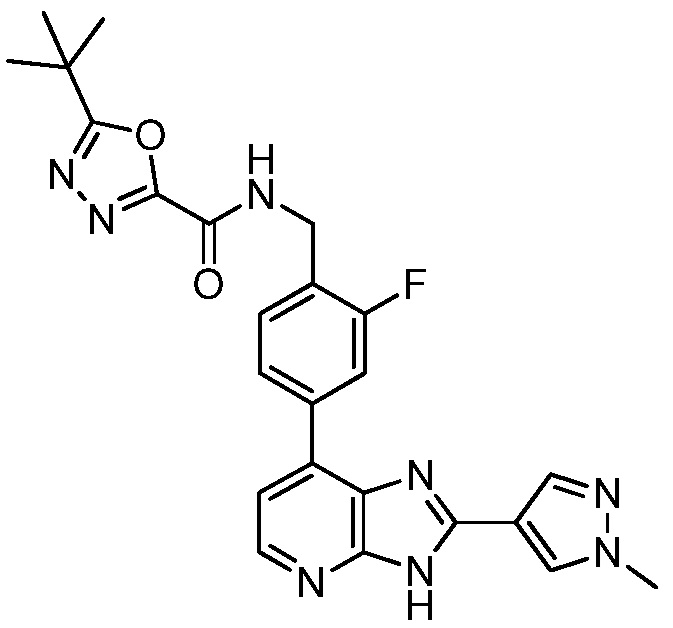
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин
Получают способом, аналогичным способу получения соединения 97, с применением 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (250,00 мг; 1,07 ммоль; 1,00 экв.), 4-(аминометил)-3-фторфенилбороновой кислоты, hcl (285,73 мг; 1,39 ммоль; 1,30 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (87,38 мг; 0,11 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (3,21 мл; 3,21 ммоль; 3,00 экв.), 1M ацетата натрия (3,21 мл; 3,21 ммоль; 3,00 экв.) и АЦН (10,00 мл; 191,46 ммоль; 178,94 экв.) с получением 118 мг (34%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 95% чистота. МС: 323 [M+H]+.
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5- трет- бутил[1,3,4]оксадиазол-2-карбоновой кислоты
Получают способом, аналогичным способу получения соединения 105, с применением 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (60,00 мг; 0,19 ммоль; 1,00 экв.), 5-трет-бутил-1,3,4-оксадиазол-2-карбоновой кислоты (38,01 мг; 0,22 ммоль; 1,20 экв.), PyBrop (112,81 мг; 0,24 ммоль; 1,30 экв.), ДМФ (3,00 мл; 38,91 ммоль; 209,03 экв.) и n,n-диизопропилэтиламина (92,53 мкл; 0,56 ммоль; 3,00 экв.) с получением 43 мг (49%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 475 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,40 (с, 1H), 9,86 (т, J=6,1 Гц, 1H), 8,44 (с, 1H), 8,32-8,23 (м, 2H), 8,19-8,11 (м, 2H), 7,59-7,51 (м, 2H), 4,59 (д, J=6,0 Гц, 2H), 3,94 (с, 3H), 1,40 (с, 9H).
Пример 112: 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (112)
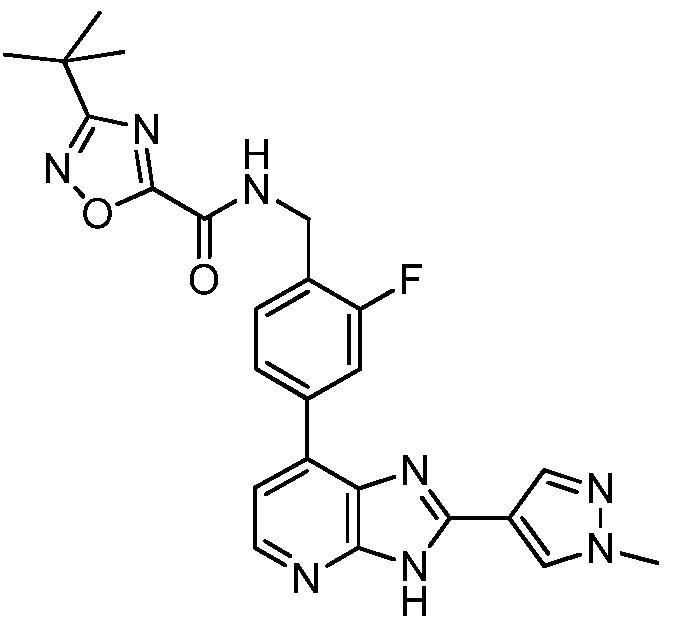
Получают способом, аналогичным способу получения соединения 105, с применением 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (60,00 мг; 0,19 ммоль; 1,00 экв.), 3-трет-бутил-1,2,4-оксадиазол-5-карбоновой кислоты (41,18 мг; 0,24 ммоль; 1,30 экв.), PyBrop (112,81 мг; 0,24 ммоль; 1,30 экв.), ДМФ (3,00 мл; 38,91 ммоль; 209,03 экв.) и n,n-диизопропилэтиламина (92,53 мкл; 0,56 ммоль; 3,00 экв.) с получением 20 мг (23%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 475 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 1H ЯМР (500 МГц, ДМСО-d6) δ 9,93 (с, 1H), 8,41 (с, 1H), 8,31-8,18 (м, 2H), 8,17-8,05 (м, 2H), 7,56 (т, J=8,1 Гц, 1H), 7,46 (д, J=5,4 Гц, 1H), 4,59 (с, 2H), 3,94 (с, 3H), 1,37 (с, 9H).
Пример 113: 4-трет-Бутил-N-(1-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)бензамид (113)

4- трет- Бутил-N-{1-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}бензамид
Получают способом, аналогичным способу получения соединения 106, с применением 1-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)циклопропанамина (200,00 мг; 0,77 ммоль; 1,00 экв.), бикарбоната натрия (162,08 мг; 1,93 ммоль; 2,50 экв.), суспендированного в воде (0,40 мл; 22,20 ммоль; 28,77 экв.) и ТГФ (4,00 мл; 49,37 ммоль; 63,97 экв.) с получением 71 мг (22%) указанного в заголовке соединения в виде белого твердого вещества. МС: 420 [M+H]+.
4- трет- Бутил-N-(1-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}циклопропил)бензамид
Получают способом, аналогичным способу получения соединения 97, с применением 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина (25,00 мг; 0,11 ммоль; 1,00 экв.), 4-трет-бутил-N-{1-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]циклопропил}бензамида (53,84 мг; 0,13 ммоль; 1,20 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (8,74 мг; 0,01 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,21 мл; 0,21 ммоль; 2,00 экв.), 1M ацетата натрия (0,21 мл; 0,21 ммоль; 2,00 экв.) и АЦН (1,00 мл; 19,15 ммоль; 178,94 экв.) с получением 28 мг (53%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 82% чистота. МС: 491 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,22 (с, 1H), 9,19 (с, 1H), 8,42 (с, 1H), 8,24 (т, J=7,4 Гц, 2H), 8,12 (с, 1H), 7,88 (д, J=8,3 Гц, 2H), 7,50 (д, J=8,3 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 7,06-7,00 (м, 1H), 6,64 (д, J=8,7 Гц, 1H), 3,93 (с, 3H), 1,36 (дд, J=12,0, 2,4 Гц, 4H), 1,31 (с, 9H).
Пример 114: 2-(3-Гидрокси-3-метилбутил)-5-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}-2,3-дигидроизоиндол-1-он (114)
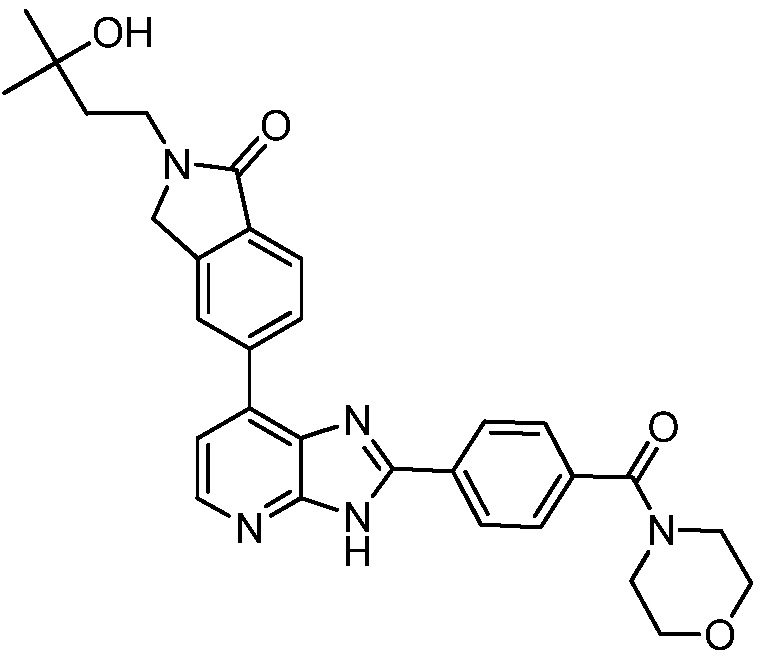
[4-(7-Бром-3H-имидазо[4,5-b]пиридин-2-ил)фенил]морфолин-4-илметанон
В 20 мл реакционную пробирку с мешалкой добавляют раствор 2,3-диамино-4-бромпиридина (500,00 мг; 2,66 ммоль; 1,00 экв.) и 4-(морфолин-4-карбонил)бензальдегида (612,15 мг; 2,79 ммоль; 1,05 экв.) в ДМФ (10,00 мл; 129,70 ммоль; 48,77 экв.). Туда добавляют моногидрат п-толуолсульфоновой кислоты (50,58 мг; 0,27 ммоль; 0,10 экв.), и реакционную смесь нагревают при 85°C в течение 12 ч. Реакционную смесь охлаждают до КТ и затем выливают в 20 мл насыщ. водн. NaHCO3 и переносят в делительную воронку. Экстрагируют этилацетатом (3×10 мл). Объединенные органические фазы промывают насыщ. водн. NaHCO3 (20 мл) и насыщенным раствором соли (20 мл), сушат над безводным Na2SO4 и концентрируют при пониженном давлении. Очищают флэш-хроматографией (50 г KP-NH колонка; 2-10% MeOH/CH2Cl2 15 ОК). Концентрируют фракции, содержащие продукт, и сушат с получением 240 мг (23%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 99% чистота. МС: 388 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 14,01 (с, 1H), 8,32 (д, J=7,9 Гц, 2H), 8,21 (д, J=5,3 Гц, 1H), 7,62 (д, J=8,0 Гц, 2H), 7,56 (д, J=5,3 Гц, 1H), 3,73-3,53 (м, 6H), 3,49-3,34 (м, 2H).
2-(3-Гидрокси-3-метилбутил)-5-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}-2,3-дигидроизоиндол-1-он
Получают способом, аналогичным способу получения соединения 97, с применением [4-(7-бром-3H-имидазо[4,5-b]пиридин-2-ил)фенил]морфолин-4-илметанона (30,00 мг; 0,08 ммоль; 1,00 экв.), 2-(3-гидрокси-3-метилбутил)-5-(тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-изоиндол-1-она (32,10 мг; 0,09 ммоль; 1,20 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (6,33 мг; 0,01 ммоль; 0,10 экв.), 1M фосфата калия, двухосновного (0,15 мл; 0,15 ммоль; 2,00 экв.), 1M ацетата натрия (0,15 мл; 0,15 ммоль; 2,00 экв.) и АЦН (1,50 мл; 28,72 ммоль; 370,70 экв.) с получением 14 мг (34%) указанного в заголовке соединения в виде беловатого твердого вещества. ЖХВД: 100% чистота. МС: 526 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,65 (с, 1H), 8,49 (д, J=8,1 Гц, 1H), 8,37 (д, J=8,1 Гц, 2H), 8,34 (д, J=5,1 Гц, 1H), 7,82 (д, J=7,9 Гц, 1H), 7,57 (д, J=8,0 Гц, 2H), 7,50 (д, J=5,1 Гц, 1H), 4,62 (с, 2H), 4,37 (с, 1H), 3,72-3,41 (м, 10H), 1,77-1,70 (м, 2H), 1,17 (с, 6H).
Пример 115: 6-трет-Бутил-2-(4-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}бензил)-3,4-дигидро-2H-изохинолин-1-он (115)
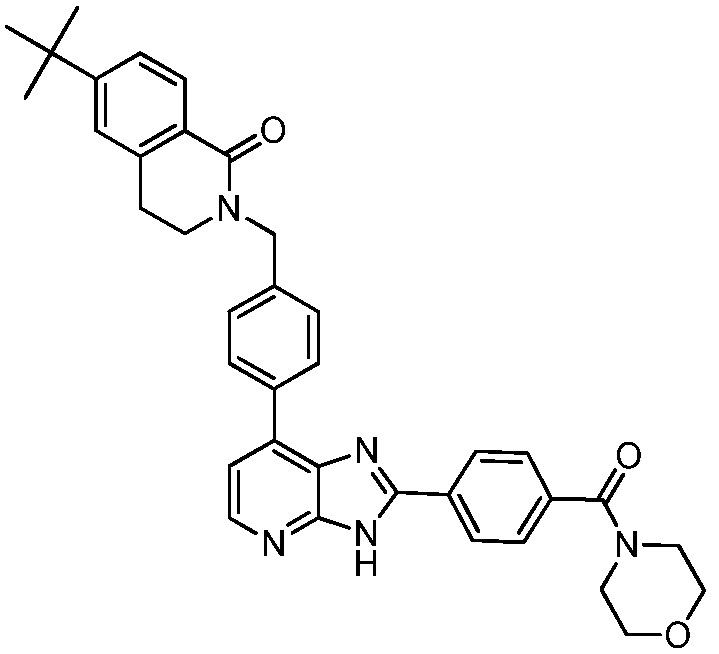
2-(4-Бромбензил)-6- трет- бутил-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 99, с применением 6-трет-бутил-3,4-дигидроизохинолин-1(2h)-она (125,00 мг; 0,61 ммоль; 1,00 экв.), 4-бромбензилбромида (169,05 мг; 0,68 ммоль; 1,10 экв.) и карбоната цезия (0,05 мл; 0,68 ммоль; 1,10 экв.) в АЦН (5,00 мл; 95,73 ммоль; 155,68 экв.) с получением 103 мг (45%) указанного в заголовке соединения в виде белого твердого вещества. МС: 373 [M+H]+.
6- трет- Бутил-2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензил]-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 99, с применением 2-(4-бромбензил)-6-трет-бутил-3,4-дигидро-2H-изохинолин-1-она (100,00 мг; 0,27 ммоль; 1,00 экв.), бис(пинаколато)диборона (136,42 мг; 0,54 ммоль; 2,00 экв.), продукта присоединения трис(дибензилиденацетон)дипалладия-хлороформа (27,80 мг; 0,03 ммоль; 0,10 экв.), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенила (25,61 мг; 0,05 ммоль; 0,20 экв.) и ацетата калия (79,08 мг; 0,81 ммоль; 3,00 экв.) в диоксане (2,00 мл; 23,47 ммоль; 87,39 экв.) с получением 55 мг (49%) указанного в заголовке соединения в виде фиолетового твердого вещества. ЖХВД: 82% чистота. МС: 420 [M+H]+.
6- трет- Бутил-2-(4-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}бензил)-3,4-дигидро-2H-изохинолин-1-он
Получают способом, аналогичным способу получения соединения 97, с применением [4-(7-бром-3H-имидазо[4,5-b]пиридин-2-ил)фенил]морфолин-4-илметанона (40,00 мг; 0,10 ммоль; 1,00 экв.), 6-трет-бутил-2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)бензил]-3,4-дигидро-2H-изохинолин-1-она (56,32 мг; 0,13 ммоль; 1,30 экв.), комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (8,44 мг; 0,01 ммоль; 0,10 экв.) 1M фосфата калия, двухосновного (0,21 мл; 0,21 ммоль; 2,00 экв.), 1M ацетата натрия (0,21 мл; 0,21 ммоль; 2,00 экв.) и АЦН (2,00 мл; 38,29 ммоль; 370,70 экв.) с получением 21 мг (34%) указанного в заголовке соединения в виде бежевого твердого вещества. ЖХВД: 94% чистота. МС: 600 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,43-8,35 (м, 3H), 8,34 (д, J=8,0 Гц, 2H), 7,89 (д, J=8,1 Гц, 1H), 7,59 (д, J=7,9 Гц, 2H), 7,56-7,46 (м, 3H), 7,42 (д, J=8,2 Гц, 1H), 7,32 (с, 1H), 4,81 (с, 2H), 3,77-3,58 (м, 6H), 3,57 (т, J=6,7 Гц, 2H), 3,47-3,35 (м, 2H), 3,01 (т, J=6,5 Гц, 2H), 1,30 (с, 9H).
Пример 116: 2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (116)
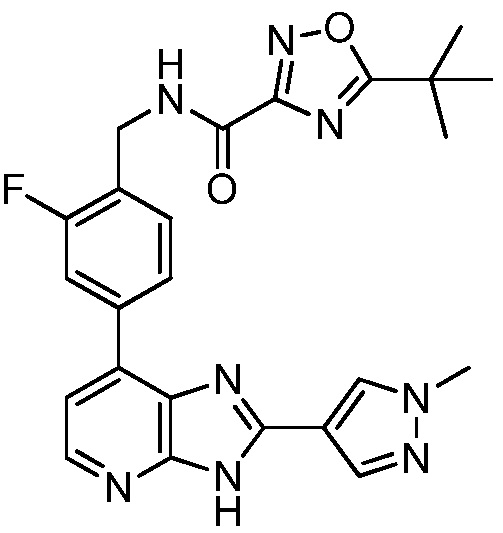
Получают способом, аналогичным способу получения соединения 105, с применением 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (75,00 мг; 0,23 ммоль; 1,00 экв.), натриевой соли 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (55,88 мг; 0,29 ммоль; 1,25 экв.), PyBrop (135,58 мг; 0,29 ммоль; 1,25 экв.), ДМФ (3,00 мл; 38,91 ммоль; 167,22 экв.) и n,n-диизопропилэтиламина (115,66 мкл; 0,70 ммоль; 3,00 экв.) с получением 65 мг (59%) указанного в заголовке соединения в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 475 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,40 (с, 1H), 9,54 (т, J=6,0 Гц, 1H), 8,45 (с, 1H), 8,31-8,23 (м, 2H), 8,20-8,10 (м, 2H), 7,56-7,49 (м, 2H), 4,59 (д, J=6,0 Гц, 2H), 3,95 (с, 3H), 1,44 (с, 9H).
Пример 118: 4-трет-Бутил-N-(2-фтор-4-{2-[4-(морфолин-4-карбонил)фенил]-3H-имидазо[4,5-b]пиридин-7-ил}бензил)бензамид (118)
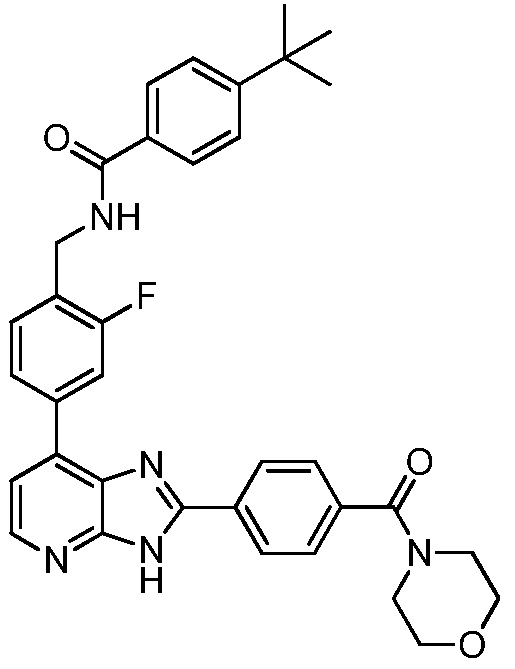
Получают способом, аналогичным способу получения соединения 114, с применением 4-трет-бутил-N-[4-(2,3-диаминопиридин-4-ил)-2-фторбензил]бензамида (50,00 мг; 0,13 ммоль; 1,00 экв.), 4-(морфолин-4-карбонил)бензальдегида (30,72 мг; 0,14 ммоль; 1,10 экв.), ДМФ (1,50 мл; 19,45 ммоль; 152,70 экв.) и моногидрата п-толуолсульфоновой кислоты (2,42 мг; 0,01 ммоль; 0,10 экв.) с получением 26 мг (34%) указанного в заголовке соединения в виде бледно-желтого твердого вещества. ЖХВД: 91% чистота. МС: 592 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,85 (с, 1H), 9,05 (т, J=5,9 Гц, 1H), 8,40 (д, J=5,2 Гц, 1H), 8,38-8,28 (м, 3H), 8,22 (д, J=8,2 Гц, 1H), 7,88 (д, J=8,3 Гц, 2H), 7,66-7,58 (м, 3H), 7,58-7,48 (м, 3H), 4,61 (д, J=5,7 Гц, 2H), 3,76-3,51 (м, 6H), 3,48-3,32 (м, 2H), 1,31 (с, 9H).
Пример 119: 2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (119)
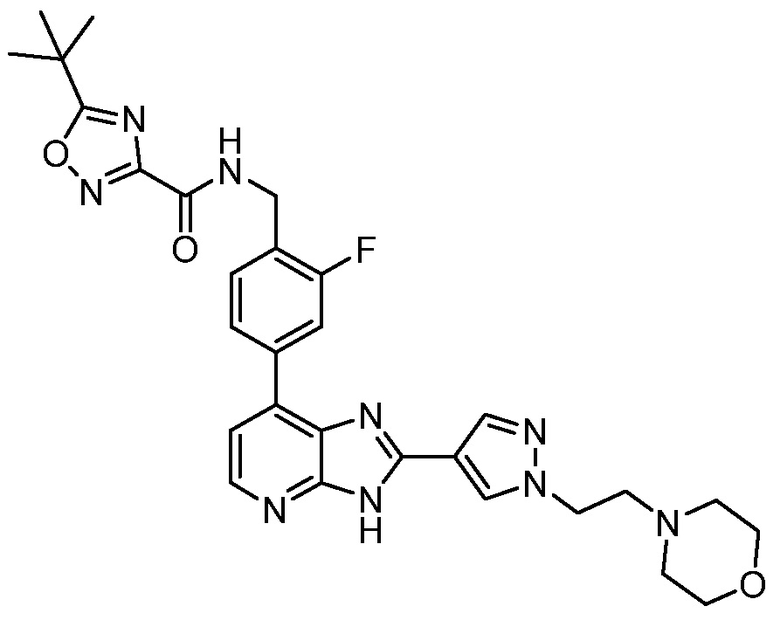
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (450,00 мг; 1,94 ммоль; 1,00 экв.), 4-{2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиразол-1-ил]этил}морфолин (713,59 мг; 2,32 ммоль; 1,20 экв.), дикарбонат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.), ацетат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.) и АЦН (10,00 мл; 191,46 ммоль; 98,91 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (237,12 мг; 0,29 ммоль; 0,15 экв.). Пробирку закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают до 120°C в течение 2 ч, затем охлаждают до КТ. Реакционную смесь фильтруют через целит и промывают MeOH/ДХМ. Растворитель выпаривают до коричневого остатка, который очищают флэш-хроматографией на колонке (Biotage, 0-20% MeOH/ДХМ, 55 г KPNH двуокись кремния). Указанное в заголовке соединение 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты получают в виде коричневого твердого вещества (544 мг, 100% выход). ЖХ-МС: 334,2 [M+2H]2+.
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин (100,00 мг; 0,30 ммоль; 1,00 экв.), [4-(аминометил)-3-фторфенил]бороновую кислоту (101,54 мг; 0,60 ммоль; 2,00 экв.), карбонат калия (166,12 мг; 1,20 ммоль; 4,00 экв.), воду (0,20 мл), ТГФ (2,00 мл) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (24,54 мг; 0,03 ммоль; 0,10 экв.). Пробирку закрывают крышкой и продувают N2 (г) 15 мин, затем нагревают до 140°C в течение 45 мин в микроволновой печи Biotage (высокая абсорбция) и охлаждают до КТ. Последующая ЖХ-МС показала целевую массу (423,1). Реакционную смесь фильтруют через целит, промывают ДХМ/MeOH и выпаривают до коричневого твердого вещества, которое подвергают флэш-хроматографии (Biotage, 0-20% MeOH/ДХМ, KPNH двуокись кремния) с получением желаемого целевого 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламина в виде коричневого твердого вещества (42,1 мг, 33,2% чистота). ЖХВД: 84,9% чистота. МС: 423,3 [M+2H]2+. 1H ЯМР (500 МГц, Метанол-d4): δ 8,44 (шс, 1H), 8,32 (шс, 1H), 8,20 (шс, 1H), 7,82 (м, 2H), 7,61 (т, 1H), 7,39 (шм, 1H), 4,38 (шт, 2H), 3,95 (шс, 2H), 3,67 (шс, 4H), 2,87 (шт, 2H), 2,52 (шс, 4H).
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (66,00 мг; 0,16 ммоль; 1,00 экв.), 5-трет-бутил[1,2,4]оксадиазол-3-карбоновую кислоту (34,64 мг; 0,20 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,50 мл; 1,12 ммоль; 7,12 экв.), ДИПЭА (0,08 мл; 0,47 ммоль; 3,00 экв.) и АЦН (0,50 мл; 9,57 ммоль; 61,13 экв.) объединяют и перемешивают под N2 (г) при КТ в течение ночи. Последующая ЖХ-МС показала полное превращение в продукт (1,404 мин, 575,3). Реакционную смесь концентрируют, и остаток подвергают препаративной ЖХВД (Interchim система; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиной кислоты в воде; подвижная фаза B: ацетонитрил) с получением 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты в виде бежевого твердого вещества (13,2 мг, 15% выход). ЖХВД: 100% чистота. ЖХ-МС: 574,3 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6): δ 9,54 (шс, 1H), 8,62 (шс, 1H), 8,32 (шс, 1H), 8,23 (шс, 1H), 8,10 (шм, 1H), 7,53 (шс, 2H), 4,59 (шс, 4H), 3,77 (шс, 4H), 3,50 (шс, 2H), 3,12 (шс, 4H), 1,43 (с, 9H).
Пример 120: 2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (120)
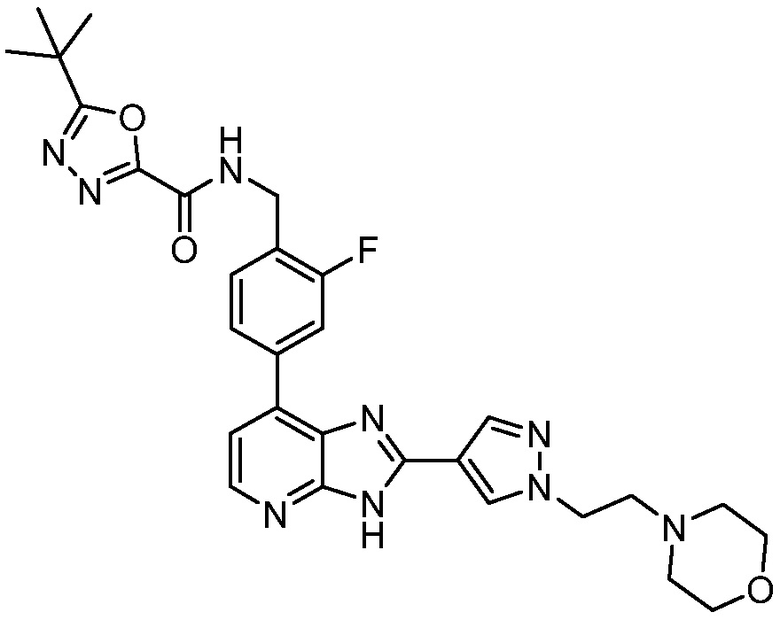
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (200,00 мг; 0,86 ммоль; 1,00 экв.), 4-{2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиразол-1-ил]этил}морфолин (317,15 мг; 1,03 ммоль; 1,20 экв.), дикарбонат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.), ацетат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.) и АЦН (4,30 мл; 82,33 ммоль; 95,69 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (105,39 мг; 0,13 ммоль; 0,15 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают до 120°C в течение 2 ч и затем охлаждают до КТ. Реакционную смесь фильтруют через целит, который промывают MeOH/ДХМ. Фильтрат концентрируют при пониженном давлении с получением коричневого остатка, который затем растворяют в ДХМ и подвергают флэш-хроматографии (Biotage, от 0 до 20% MeOH/ДХМ, KPNH двуокись кремния колонка) с получением 7-хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин в виде коричневого твердого вещества (220 мг, 77% чистота). ЖХ-МС: 334,1 [M+2H]2+. ЖХВД: 92,4% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 8,52 (шс, 2H), 8,16 (шм, 2H), 7,32 (шм, 1H), 3,91 (шт, 2H), 3,30 (шс, 4H), 2,75 шт, 2H), 2,44 (шс, 4H).
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин (100,00 мг; 0,30 ммоль; 1,00 экв.), [4-(аминометил)-3-фторфенил]бороновую кислоту (101,54 мг; 0,60 ммоль; 2,00 экв.), карбонат калия (166,12 мг; 1,20 ммоль; 4,00 экв.), воду (0,20 мл), ТГФ (2,00 мл) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (24,54 мг; 0,03 ммоль; 0,10 экв.). Реакционную смесь was продувают N2 (г) в течение 15 мин, затем нагревают до 140°C в течение 45 мин в микроволновой печи Biotage (высокая абсорбция) и охлаждают до КТ. Реакционную смесь фильтруют через целит, промывают ДХМ/MeOH и выпаривают до коричневого твердого вещества. Твердое вещество подвергают флэш-хроматографии (Biotage, 0-20% MeOH/ДХМ, 28 г KPNH двуокись кремния) с получением 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламина в виде коричневого твердого вещества (26,5 мг, 21% выход). ЖХ-МС: 422,2 [M+H]+. ЖХВД: 85% чистота.
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (36,00 мг; 0,09 ммоль; 1,00 экв.), 5-трет-бутил[1,3,4]оксадиазол-2-карбоновую кислоту (18,90 мг; 0,11 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,30 мл; 0,67 ммоль; 7,83 экв.), ДИПЭА (0,04 мл; 0,26 ммоль; 3,00 экв.) и АЦН (0,45 мл; 8,62 ммоль; 100,87 экв.) объединяют под N2 (г) и перемешивают при КТ в течение часа. Реакционную смесь подвергают препаративной ЖХВД (Interchim система; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиная кислота в воде; подвижная фаза B: ацетонитрил). Фракции объединяют, концентрируют и лиофилизируют с получением 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты в виде бежевого твердого вещества (42 мг, 86% выход). ЖХ-МС: 575,2 [M+2H]2+. ЖХВД: 95,5% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 7,70 (шс, 1H), 7,56 (шс, 1H), 7,49 (шс, 1H), 7,09 (д, 1H), 7,06 (м, 1H), 6,83 (шт, 1H), 6,65 (шм, 1H), 3,98 (шс, 2H), 3,89 (шс, 1H), 3,10 (шс, 2H), 2,85 (шс, 2H), 2,67 (шс, 2H), 2,32 (шс, 2H), 0,66 (с, 9H).
Пример 121: (4-трет-Бутилфенил)-(2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-ил)метанон (121)
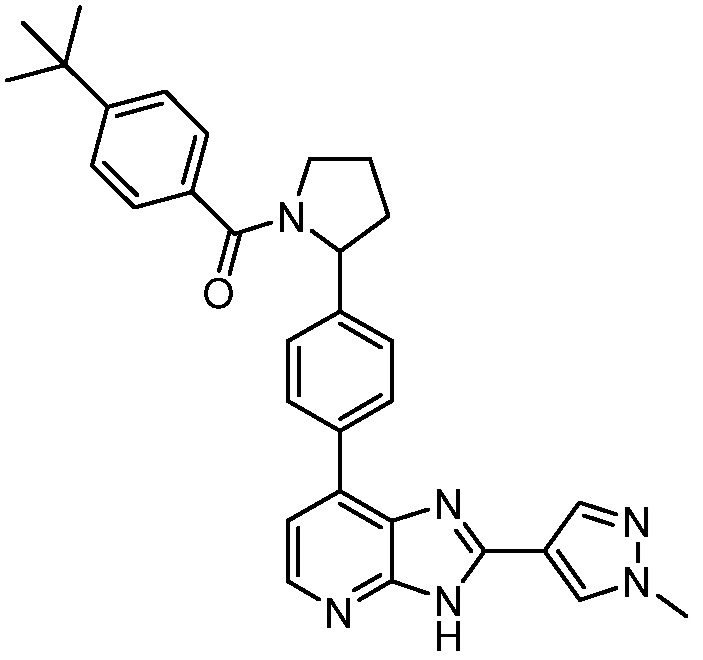
7-Хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
В микроволновую пробирку с мешалкой добавляют 2-бром-7-хлор-3H-имидазо[4,5-b]пиридин (0,40 г; 1,72 ммоль; 1,00 экв.), пинаколовый эфир 1-метилпиразол-4-бороновой кислоты (0,43 г; 2,06 ммоль; 1,20 экв.) под N2 (г), затем комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,21 г; 0,26 ммоль; 0,15 экв.), дикарбоната натрия (3,44 мл; 3,44 ммоль; 2,00 экв.), ацетата натрия (3,44 мл; 3,44 ммоль; 2,00 экв.) и АЦН (8,00 мл; 153,17 ммоль; 89,02 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают до 120°C в течение 2 часов, затем охлаждают до КТ. Реакционную смесь фильтруют через целит, и Целит промывают ДХМ/MeOH. Фильтрат концентрируют и подвергают флэш-хроматографии (Biotage, 55 г KPNH двуокись кремния, 0-20% MeOH/ДХМ). 7-Хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин выделяют в виде фиолетово-белого твердого вещества (402 мг, 100%). ЖХ-МС: 233,3 [MH]. ЖХВД: 100% чистота.
трет-Бутиловый эфир 2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-карбоновой кислоты
7-Хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (50,00 мг; 0,21 ммоль; 1,00 экв.), трет-бутиловый эфир 2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пирролидин-1-карбоновой кислоты (95,86 мг; 0,26 ммоль; 1,20 экв.), фосфат калия, двухосновный (0,43 мл; 0,43 ммоль; 2,00 экв.), ацетат натрия (0,43 мл; 0,43 ммоль; 2,00 экв.) и АЦН (2,00 мл) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (17,48 мг; 0,02 ммоль; 0,10 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин. Реакционную смесь затем нагревают до 110°C в течение 4 ч и затем охлаждают до КТ. Реакционную смесь фильтруют через целит и Целит промывают MeOH/ДХМ. Фильтрат концентрируют до коричневого масла, которое подвергают препаративной ЖХВД (Interchim система; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиная кислота в воде; подвижная фаза B: ацетонитрил). Более чистые фракции концентрируют и лиофилизируют с получением трет-бутилового эфира 2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-карбоновой кислоты в виде рыжевато-коричневого твердого вещества (62 мг, 65% выход). ЖХ-МС: 444,2 [MH]. ЖХВД: 87% чистота. 1H ЯМР (500 МГц, метанол-d4): δ 8,35 (с, 1H), 8,19 (с, 1H), 7,90 (шм, 1H), 7,68 (шм, 1H), 7,65 (м, 1H), 7,55 (м, 1H), 7,42 (м, 2H), 4,96 (шм, 2H), 4,00 (с, 3H), 3,64 (шм, 3H), 2,66 (шм, 2H), 1,48 (с, 4H), 1,26 (с, 5H).
2-(1-Метил-1H-пиразол-4-ил)-7-(4-пирролидин-2-ил-фенил)-3H-имидазо[4,5-b]пиридин
трет-Бутиловый эфир 2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-карбоновой кислоты (62,00 мг; 0,14 ммоль; 1,00 экв.), хлороводород (6,00 мл; 12,00 ммоль; 86,04 экв.) и метанол (1,20 мл; 29,62 ммоль; 212,40 экв.) объединяют под N2 (г), пробирку закрывают крышкой и реакционную смесь перемешивают при КТ в течение 3 ч. После этого ЖХ-МС показывает полное превращение в продукт. Растворитель выпаривают при пониженном давлении, и остаток очищают флэш-хроматографией на колонке (Biotage, 28 г KPNH двуокись кремния, 0-50% MeOH/этил ацетат). 2-(1-Метил-1H-пиразол-4-ил)-7-(4-пирролидин-2-ил-фенил)-3H-имидазо[4,5-b]пиридин получают в виде коричневого остатка (12,4 мг, 26% выход). ЖХ-МС: 345,1 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (500 МГц, Метанол-d4): δ 8,36 (шс, 2H), 8,19 (д, 2H), 8,07 (шс, 1H), 7,45 (шс, 2H), 7,35 (шс, 1H), 4,20 (шт, 2H), 3,23 (м, 2H), 3,07 (м, 2H), 2,23 (м, 1H).
(4-трет-Бутилфенил)-(2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-ил)метанон
2-(1-Метил-1H-пиразол-4-ил)-7-(4-пирролидин-2-ил-фенил)-3H-имидазо[4,5-b]пиридин (12,00 мг; 0,03 ммоль; 1,00 экв.), 4-трет-бутилбензоилхлорид (0,02 мл; 0,11 ммоль; 3,16 экв.), гидрокарбонат натрия (4,39 мг; 0,05 ммоль; 1,50 экв.), воду (0,01 мл; 0,56 ммоль; 15,93 экв.) и ТГФ (0,13 мл; 1,60 ммоль; 46,05 экв.) объединяют при 0°C (ледяная баня) и накрывают крышкой под N2 (г). Реакционную смесь нагревают до КТ в течение ночи. Реакционную смесь концентрируют и подвергают препаративной ЖХВД (Interchim system; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиная кислота в воде; подвижная фаза B: ацетонитрил). Чистые фракции концентрируют и лиофилизируют с получением (4-трет-бутил-фенил)-(2-{4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил}пирролидин-1-ил)метанона в виде желтого твердого вещества (17 мг, 100% выход). ЖХ-МС: 505,2 [M+H]+. ЖХВД: 95,4% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 7,65 (м, 2H), 7,15 (д, 2H), 7,09 (м, 2H), 5,76 (м, 6H), 4,56 (шт, 1H), 3,16 (шм, 2H), 2,93 (шм, 2H), 1,79 (м, 2H), 0,57 (с, 9H).
Пример 122: 2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-(тетрагидропиран-4-ил)-[1,3,4]оксадиазол-2-карбоновой кислоты (122)
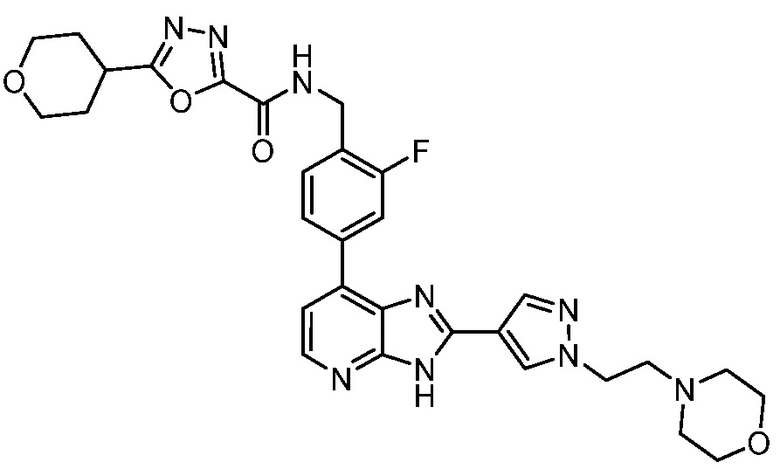
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (200,00 мг; 0,86 ммоль; 1,00 экв.), 4-{2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)пиразол-1-ил]этил}морфолин (317,15 мг; 1,03 ммоль; 1,20 экв.), дикарбонат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.), ацетат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.) и АЦН (4,30 мл; 82,33 ммоль; 95,69 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (105,39 мг; 0,13 ммоль; 0,15 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают до 120°C в течение 2 ч., затем охлаждают до КТ. Реакционную смесь фильтруют через целит, и слой Целита промывают MeOH/ДХМ. Фильтрат концентрируют с получением коричневого остатка, который растворяют в ДХМ и подвергают флэш-хроматографии (Biotage, от 0 до 20% MeOH/ДХМ, 55 г KPNH-двуокись кремния). Продукт элюируют 10% MeOH/ДХМ. 7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин получают в виде коричневого твердого вещества (255 мг, 77% выход). ЖХ-МС: 334,1 [M+H]+. ЖХВД: 92,4% чистота.
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (36,00 мг; 0,09 ммоль; 1,00 экв.), 5-трет-бутил[1,3,4]оксадиазол-2-карбоновую кислоту (18,90 мг; 0,11 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,30 мл; 0,67 ммоль; 7,83 экв.), ДИПЭА (0,04 мл; 0,26 ммоль; 3,00 экв.) и АЦН (0,45 мл; 8,62 ммоль; 100,87 экв.) объединяют под N2 (г) and перемешивают при КТ. Мутную коричневую смесь превращают в прозрачный коричневый раствор в течение часа. Реакционную смесь концентрируют и подвергают препаративной ЖХВД (Interchim system; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиная кислота в воде; подвижная фаза B: ацетонитрил). Чистые фракции концентрируют и лиофилизируют с получением 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламина в виде бежевого твердого вещества (41 мг, 83% выход). ЖХ-МС: 575,2 [M+H]+. ЖХВД: 98,0% чистота.
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-(тетрагидропиран-4-ил)-[1,3,4]оксадиазол-2-карбоновой кислоты
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (66,00 мг; 0,16 ммоль; 1,00 экв.), этиловый эфир 5-(тетрагидропиран-4-ил)-[1,3,4]оксадиазол-2-карбоновой кислоты (46,05 мг; 0,20 ммоль; 1,30 экв.), этилдиизопропиламин (0,10 мл; 0,63 ммоль; 4,00 экв.) и ацетонитрил (0,50 мл) объединяют и накрывают крышкой под N2 (г) и перемешивают при КТ в течение ночи. Реакционную смесь концентрируют и подвергают препаративной ЖХВД (Interchim system; 120 г C-18 двуокись кремния, подвижная фаза A: 0,1% муравьиная кислота в воде; подвижная фаза B: ацетонитрил). Более чистые фракции концентрируют и лиофилизируют с получением 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 5-(тетрагидропиран-4-ил)-[1,3,4]оксадиазол-2-карбоновой кислоты в виде светло-желтого твердого вещества (18,4 мг, 20% выход). ЖХ-МС: 602,3 [M+H]+. ЖХВД: 98,3% чистота. 1H ЯМР (500 МГц, Метанол-d4): δ 8,51 (шс, 1H), 8,37 (шм, 1H), 8,30 (шс, 1H), 7,87 (д, 1H), 7,80 (д, 1H), 7,47 (шм, 1H), 4,74 (шм, 3H), 4,01 (м, 2H), 3,92 (шм, 2H), 3,71 (шм, 2H), 2,06 (шм, 2H), 1,96 (кв, 2H), 1,38 (с, 9H).
Пример 124: 2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (124)
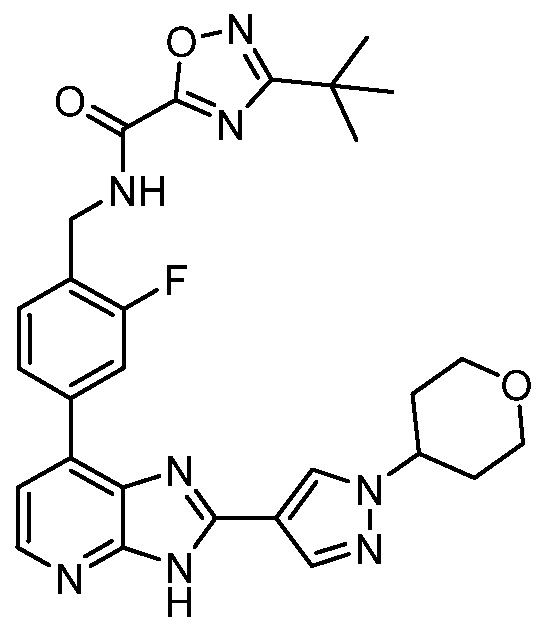
7-Хлор-2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (450,00 мг; 1,94 ммоль; 1,00 экв.), 1-(тетрагидропиран-4-ил)-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразол (646,13 мг; 2,32 ммоль; 1,20 экв.), дикарбонат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.), ацетат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.) и АЦН (10,00 мл; 191,46 ммоль; 98,91 экв.) объединяют под N2 (г) и затем добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (237,12 мг; 0,29 ммоль; 0,15 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин. Реакционную смесь нагревают до 120°C в течение 2 ч. и затем охлаждают до КТ. Реакционную смесь фильтруют через целит, который затем промывают MeOH/ДХМ. Фильтрат концентрируют до коричневого масла, которое дважды подвергают флэш-хроматографии (Biotage, от 0 до 20% MeOH/ДХМ, 55 г KPNH двуокись кремния) с получением 7-хлор-2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридина в виде коричневого твердого вещества (513 мг, 87% выход). ЖХ-МС: 304,1 [M+2H]2+. ЖХВД: 90,2% чистота.
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин
7-Хлор-2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин (120,00 мг; 0,40 ммоль; 1,00 экв.), гидрохлорид [4-(аминометил)-3-фторфенил]бороновой кислоты (162,31 мг; 0,79 ммоль; 2,00 экв.), дикарбонат калия (218,40 мг; 1,58 ммоль; 4,00 экв.), АЦН (2,00 мл; 38,29 ммоль; 96,93 экв.) и воду (0,20 мл; 11,10 ммоль; 28,10 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (32,26 мг; 0,04 ммоль; 0,10 экв.). Колбу закрывают крышкой и продувают N2(г) в течение 15 мин, затем нагревают до 120°C в микроволновой печи Biotage в течение 2 ч. (высокая абсорбция) и затем охлаждают до КТ. Реакционную смесь загружают непосредственно в KPNH двуокись кремния и подвергают флэш-хроматографии (Biotage system; 0-20% MeOH/ДХМ) с получением 2-фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламина в виде коричневого твердого вещества (134 мг, 87% выход). ЖХ-МС: 397 [M+2H]2+.
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (30,00 мг; 0,08 ммоль; 1,00 экв.), 3-трет-бутил[1,2,4]оксадиазол-5-карбоновую кислоту (18,60 мг; 0,11 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,30 мл; 0,66 ммоль; 7,83 экв.), этилдиизопропиламин (0,04 мл; 0,25 ммоль; 3,00 экв.) и ацетонитрил (0,50 мл) объединяют под N2 (г) и перемешивают при КТ в течение ночи. Реакционную смесь загружают в колонку Interchim и подвергают препаративной ЖХВД (Interchim, 120 г C-18 двуокись кремния, 0-100% 0,1% муравьиная кислота (водн.)/АЦН) с получением 2-фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты в виде бежевого твердого вещества (5 мг, 10% выход). ЖХ-МС: 545,3 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (ДМСО-d6): δ 9,96 (шс, 2H), 8,56 (шс, 2H), 8,33 (с, 1H), 8,22 (с, 1H), 7,60 (м, 1H), 7,53 (шс, 1H), 4,61 (шм, 2H), 4,56 (шм, 1H), 4,02 (д, 2H), 2,05 (шм, 6H), 1,36 (с, 9H).
Пример 125: 2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]тиадиазол-2-карбоновой кислоты (125)
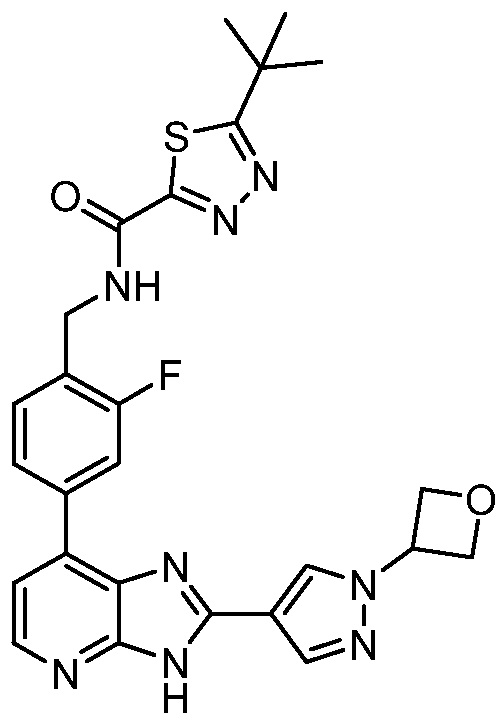
7-Хлор-2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (200,00 мг; 0,86 ммоль; 1,00 экв.), 1-оксетан-3-ил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразол (258,21 мг; 1,03 ммоль; 1,20 экв.), дикарбонат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.), ацетат натрия (1,72 мл; 1,72 ммоль; 2,00 экв.) и АЦН (4,30 мл; 82,33 ммоль; 95,69 экв.) объединяют под N2 (г), затем добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (105,39 мг; 0,13 ммоль; 0,15 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин. Реакционную смесь нагревают до 120°C в течение 2 часов и затем охлаждают до КТ. Реакционную смесь фильтруют через целит и фильтрат концентрируют с получением коричневого остатка, который растворяют в ДХМ и подвергают флэш-хроматографии (Biotage, от 0 до 20% MeOH/ДХМ, 55 г KPNH-двуокись кремния) с получением 7-хлор-2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина в виде коричневого твердого вещества (263 мг, 94% выход). ЖХ-МС: 276,0 [M+H]+. ЖХВД: 94,2% чистота.
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин
7-Хлор-2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (276,80 мг; 1,00 ммоль; 1,00 экв.), гидрохлорид [4-(аминометил)-3-фторфенил]бороновой кислоты (412,49 мг; 2,01 ммоль; 2,00 экв.), дикарбонат калия (555,04 мг; 4,02 ммоль; 4,00 экв.), ТГФ (10,00 мл; 123,43 ммоль; 122,94 экв.) и воду (1,00 мл; 55,51 ммоль; 55,29 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (81,99 мг; 0,10 ммоль; 0,10 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают в течение 2 ч. в микроволновой печи Biotage при 130°C (высокая абсорбция) и затем охлаждают до КТ. Смесь фильтруют через целит и Целит промывают MeOH/ДХМ. Фильтрат концентрируют с получением коричневого остатка, который подвергают флэш-хроматографии (Biotage, 55 г KPNH двуокись кремния, 0-20% MeOH/ДХМ) с получением 2-фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина в виде коричневого твердого вещества (298,3 мг, 82% выход). ЖХ-МС: 366,2 [M+2H]2+.
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]тиадиазол-2-карбоновой кислоты
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (40,00 мг; 0,11 ммоль; 1,00 экв.), натриевую соль 5-трет-бутил[1,3,4]тиадиазол-2-карбоновой кислоты (28,57 мг; 0,14 ммоль; 1,25 экв.), гексафторфосфат бром(трипирролидин-1-ил)фосфония (63,97 мг; 0,14 ммоль; 1,25 экв.), этилдиизопропиламин (0,05 мл; 0,33 ммоль; 3,00 экв.) и ДМФ (2,00 мл; 25,94 ммоль; 236,29 экв.) объединяют, накрывают крышкой под N2 (г) и перемешивают при КТ в течение ночи. Реакционную смесь загружают в колонку Interchim и подвергают препаративной ЖХВД (120 г C-18 двуокись кремния, 0-100% 0,1% муравьиная кислота (водн.)/АЦН) с получением 2-фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 5-трет-бутил[1,3,4]тиадиазол-2-карбоновой кислоты в виде бежевого твердого вещества (9 мг, 15% выход). ЖХ-МС: 533,2 [M+H]+. ЖХВД: 99,0% чистота. 1H ЯМР (ДМСО-d6) δ 9,80 (шм, 1H), 8,64 (с, 1H), 8,33 (с, 1H), 8,20 (м, 1H), 8,08 (м, 1H), 7,52 (m,2H), 5,73 (м, 1H), 4,98 (м, 3H), 4,63 (д, 2H), 3,03 (шм, 2H), 1,48 (с, 9H).
Пример 126: 2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (126)
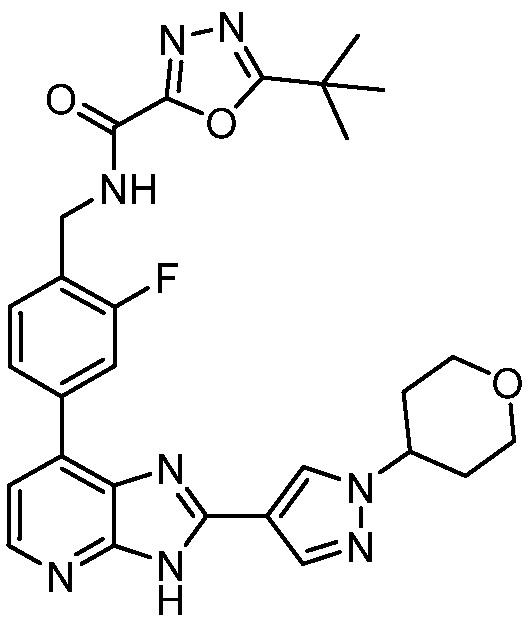
7-Хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (450,00 мг; 1,94 ммоль; 1,00 экв.), 1-(тетрагидропиран-4-ил)-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1H-пиразол (646,13 мг; 2,32 ммоль; 1,20 экв.), дикарбонат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.), ацетат натрия (3,87 мл; 3,87 ммоль; 2,00 экв.) и АЦН (10,00 мл; 191,46 ммоль; 98,91 экв.) объединяют под N2 (г) и затем добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (237,12 мг; 0,29 ммоль; 0,15 экв.). Колбу закрывают крышкой и затем продувают N2 (г) в течение 15 мин. Реакционную смесь нагревают до 120°C в течение 2 ч. и охлаждают до КТ. Реакционную смесь фильтруют через целит и слой промывают MeOH/ДХМ. Фильтрат концентрируют до коричневого масла, которое дважды подвергают флэш-хроматографии (Biotage, от 0 до 20% MeOH/ДХМ, 55 г KPNH двуокись кремния) с получением 7-хлор-2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридина в виде коричневого твердого вещества (513 мг, 87% выход). ЖХ-МС: 304,1 [M+H]+. ЖХВД: 90,2% чистота.
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин
7-Хлор-2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин (120,00 мг; 0,40 ммоль; 1,00 экв.), гидрохлорид [4-(аминометил)-3-фторфенил]бороновой кислоты (162,31 мг; 0,79 ммоль; 2,00 экв.), дикарбонат калия (218,40 мг; 1,58 ммоль; 4,00 экв.), АЦН (2,00 мл; 38,29 ммоль; 96,93 экв.) и воду (0,20 мл; 11,10 ммоль; 28,10 экв.) объединяют под N2 (г) и затем добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (32,26 мг; 0,04 ммоль; 0,10 экв.). Колбу закрывают крышкой и продувают N2 (г) в течение 15 мин, затем нагревают до 120°C в микроволновой печи Biotage в течение 2 ч. (высокая абсорбция) и затем охлаждают до КТ. Реакционную смесь загружают в 55 г KPNH двуокись кремния и подвергают флэш-хроматографии (Biotage system; 0-20% MeOH/ДХМ) с получением 2-фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламина в виде коричневого твердого вещества (134 мг, 87% выход). ЖХ-МС: 394,0 [M+2H]2+.
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (30,00 мг; 0,08 ммоль; 1,00 экв.), 5-трет-бутил[1,3,4]оксадиазол-2-карбоновую кислоту (18,60 мг; 0,11 ммоль; 1,30 экв.), этилдиизопропиламин (0,04 мл; 0,25 ммоль; 3,00 экв.) и ацетонитрил (0,50 мл) накрывают крышкой под N2 (г) и перемешивают при КТ в течение ночи. Реакционную смесь подвергают препаративной ЖХВД (Interchim, 120 г C-18 двуокись кремния, 0-100% 0,1% муравьиная кислота (водн.)/АЦН) с получением 2-фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты в виде бежевого твердого вещества (7,1 мг, 16% выход). ЖХ-МС: 545,3 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (ДМСО-d6): δ 9,88 (шс, 1H), 8,56 (с, 1H), 8,34 (с, 1H), 8,22 (с, 1H), 7,60 (шм, 2H),,54 (шс, 1H), 5,96 (с, 1H), 4,61 (м, 4H), 3,99 (м, 2H), 2,05 (шм, 4H), 1,37 (с, 9H).
Пример 127: 2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (127)
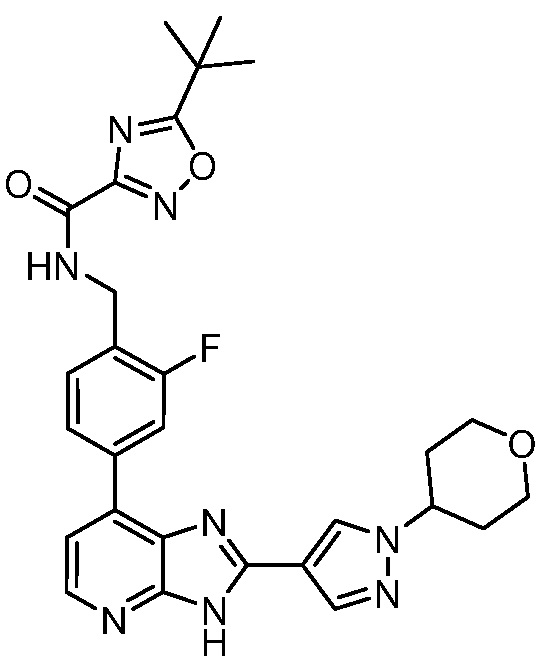
2-Фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (30,00 мг; 0,08 ммоль; 1,00 экв.), 5-трет-бутил[1,2,4]оксадиазол-3-карбоновую кислоту (18,60 мг; 0,11 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,30 мл; 0,66 ммоль; 7,83 экв.), этилдиизопропиламин (0,04 мл; 0,25 ммоль; 3,00 экв.) и ацетонитрил (0,50 мл) объединяют под N2 (г), покрывают крышкой и перемешивают при КТ в течение ночи. Реакционную смесь подвергают препаративной ЖХВД (Interchim, 120 г C-18 двуокись кремния, 0-100% 0,1% муравьиная кислота (водн.)/АЦН) с получением 2-фтор-4-{2-[1-(тетрагидропиран-4-ил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты в виде бежевого твердого вещества (19 мг, 42% выход). ЖХВД: 100% чистота. 1H ЯМР (ДМСО-d6): δ 9,53 (шт, 1H), 8,56 (с, 1H), 8,32 (м, 1H), 8,21 (с, 1H), 8,18 (шм, 1H), 8,10 (шм, 1H), 7,52 (м, 2H), 4,60 (шм, 2H), 9,55 (м, 1H), 4,01 (шд, 2H), 2,03 (шм, 6H), 1,43 (с, 9H).
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (40,00 мг; 0,11 ммоль; 1,00 экв.), 3-трет-бутил[1,2,4]оксадиазол-5-карбоновую кислоту (23,35 мг; 0,14 ммоль; 1,25 экв.), гексафторфосфат бром(трипирролидин-1-ил)фосфония (63,97 мг; 0,14 ммоль; 1,25 экв.), этилдиизопропиламин (0,05 мл; 0,33 ммоль; 3,00 экв.) и ДМФ (2,00 мл) объединяют при КТ, закрывают крышкой под N2 (г) и перемешивают в течение ночи. Реакционную смесь подвергают препаративной ЖХВД (Interchim, 120 г C-18 двуокись кремния, 0-100% 0,1% муравьиная кислота (водн.)/АЦН) с получением 2-фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты в виде белого твердого вещества (18,6 мг, 33% выход). ЖХ-МС: 517,3 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 9,94 (шм, 1H), 8,63 (с, 1H), 8,32 (шм, 2H), 8,19 (шс, 1H), 8,10 (шс, 1H), 7,59 (шт, 1H), 7,53 (шм, 1H), 5,72 (шм, 1H), 4,95 (шм, 3H), 4,61 (шм, 2H), 1,37 (с, 9H).
Пример 129: 5-(трет-бутил)-N-(2-фтор-4-(2-(1-(оксетан-3-ил)-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-3-карбоксамид (129)
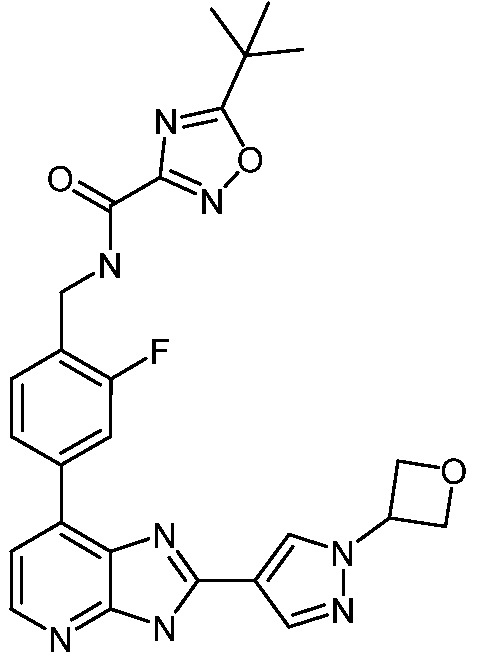
2-Фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (40,00 мг; 0,11 ммоль; 1,00 экв.), 5-трет-бутил[1,2,4]оксадиазол-3-карбоновую кислоту (23,35 мг; 0,14 ммоль; 1,25 экв.), гексафторфосфат бром(трипирролидин-1-ил)фосфония (63,97 мг; 0,14 ммоль; 1,25 экв.), этилдиизопропиламин (0,05 мл; 0,33 ммоль; 3,00 экв.) и ДМФ (2,00 мл; 25,94 ммоль; 236,29 экв.) объединяют при КТ и закрывают крышкой под N2 (г). Реакционную смесь перемешивают в течение ночи и затем подвергают препаративной ЖХВД (Interchim, 120 г C-18 двуокись кремния, 0-100% 0,1% ТФК (водн.)/АЦН) с получением 2-фтор-4-[2-(1-оксетан-3-ил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты в виде белого пушистого твердого вещества (26,5 мг, 27% выход). ЖХ-МС: 516,4 [MH]. ЖХВД: 98,9% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 9,53 (шм, 1H), 8,63 (с, 1H), 8,32 (с, 2H), 8,18 (шм, 1H), 8,10 (шм, 1H), 7,53 (шм, 2H), 5,72 (шм, 1H), 4,95 (шм, 4H), 4,60 (шм, 2H), 1,43 (с, 9H).
Пример 130: 4-[2-(1-Этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламид 4,5,6,7-тетрагидробензо[b]тиофен-2-карбоновой кислоты (130)
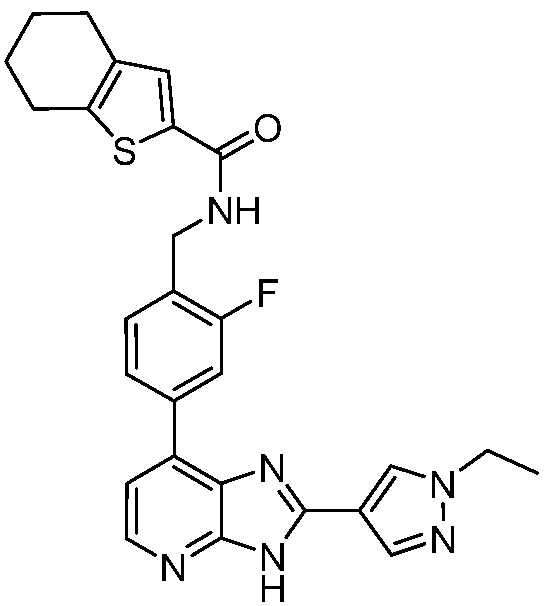
7-хлор-2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (2,15 ммоль; 1,00 экв.; 500,00 мг), 1-этил-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-1H-пиразол (2,58 ммоль; 1,20 экв.; 573,23 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,43 ммоль; 0,20 экв.; 351,29 мг). Пробирку герметично закрывают и ополаскивают Ar. К реакционной смеси добавляют карбонат калия (5,38 ммоль; 2,50 экв.; 743,15 мг), диоксан и воду через шприц. Реакционную пробирку дегазируют (вакуум, затем азот) и нагревают до 120°C в течение 2 ч в микроволнах. Реакционную смесь охлаждают до комнатной температуры, и катализатор удаляют фильтрацией. Фильтрат разбавляют 50 мл ETOAc, при этом образуется серое твердое вещество. Твердое вещество удаляют фильтрацией и сушат на фильтре. ЖХ-МС соответствует желаемому продукту. Получают 7-хлор-2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (126,00 мг; 0,46 ммоль). МС: m/z=248,7 [M+H]+.
(4-(2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил)метанамин
В 20 мл реакционную пробирку с мешалкой добавляют 7-хлор-2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (0,97 ммоль; 1,00 экв.; 240,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, HCl (1,26 ммоль; 1,30 экв.; 258,76 мг), комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,10 ммоль; 0,10 экв.; 79,13 мг) вместе с карбонатом калия (2,91 ммоль; 3,00 экв.; 401,75 мг). К твердому веществу добавляют диоксан (46,94 ммоль; 48,45 экв.; 4136,00 мг; 4,00 мл), затем воду (55,51 ммоль; 57,29 экв.; 1000,00 мг; 1,00 мл). Реакционную пробирку вакуумируют и затем дегазируют азотом. Смесь затем нагревают до 140°C в течение ночи в металлическом нагревательном блоке. Фильтруют с применением одного из 45-микронных фильтров для удаления катализатора. Реакционную смесь затем очищают на 75 г двуокиси кремния с применением градиента 0-10% MeOH/EtOAc для 10 ОК, затем повышают до 20% MeOH для 4 ОК, затем повышают до 50% MeOH/EtOAc, в этот момент желаемый продукт элюируют в виде широкого пика (254 нм). Объединяют соответствующие фракции и концентрируют досуха с получением 4-[2-(1-Этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламина (221,00 мг; 0,64 ммоль). МС: m/z=337 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,51 (д, J=6,7 Гц, 1H), 8,39-8,00 (м, 4H), 7,67 (т, J=8,0 Гц, 1H), 7,51 (шс, 1H), 4,26 (кв, J=7,5 Гц, 2H), 3,35 (с, 2H), 1,61-1,34 (м, 3H).
4-[2-(1-Этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламид 4,5,6,7-тетрагидробензо[b]тиофен-2-карбоновой кислоты
4-[2-(1-Этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламин (0,25 ммоль; 1,00 экв.; 120,00 мг) объединяют с 2,4,6-трипропил-[1,3,5,2,4,6]триоксатрифосфинаном 2,4,6-триоксидом (0,30 ммоль; 1,20 экв.; 190,70 мг; 0,19 мл) ДИПЭА (0,75 ммоль; 3,00 экв.; 96,83 мг; 0,12 мл) в ДХМ. Затем добавляют, и реакционную смесь перемешивают при КТ в течение 2 часов. Примечание: Растворимость исходного материала очень плохая в ДХМ. Добавляют несколько капель безводного ДМФ для растворения твердых веществ. Добавляют 20 мг и 100 мкл 2,4,6-трипропил-[1,3,5,2,4,6]триоксатрифосфинана 2,4,6-триоксида (0,30 ммоль; 1,20 экв.; 190,70 мг; 0,19 мл) и продолжают перемешивать в течение 5 часов. Реакционную смесь разбавляют 1 мл ДМСО, затем очищают на системе ISCO Puriflash на 125 г C18 с применением градиента 5-100% CH3CN/H2O (0,1% NH4OH). Фракции, содержащие желаемый продукт, замораживают, затем концентрируют досуха на лиофилизаторе с получением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 4,5,6,7-тетрагидробензо[b]тиофен-2-карбоновой кислоты (8,60 мг; 0,02 ммоль). МС: m/z=337,4 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,43 (с, 1H), 8,93 (с, 1H), 8,64-8,02 (м, 5H), 7,73-7,28 (м, 2H), 4,47-4,37 (м, 2H), 3,96 (с, 3H), 2,79-2,51 (м, 4H), 2,10-1,39 (м, 4H) 1,89-1,47 (м, 3H).
Пример 131: 5-трет-Бутил[1,2,4]оксадиазол-3-карбонов кислот 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фтор-бензиламид (131)
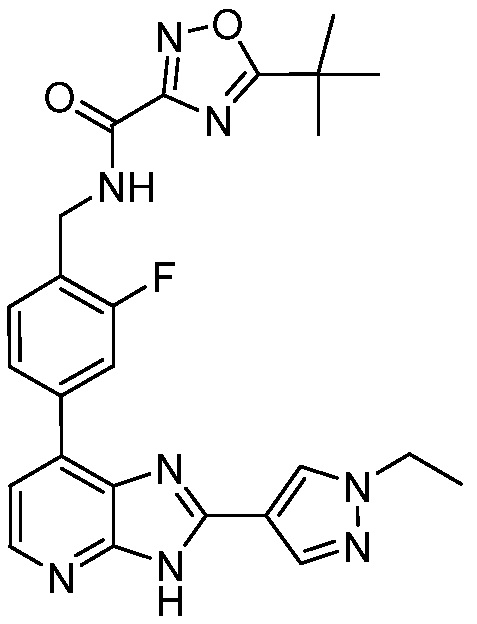
Указанное в заголовке соединение получают по методике, описанной для примера 130 с применением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламина (0,28 ммоль; 1,00 экв.; 95,00 мг), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинана 2,4,6-триоксида (0,34 ммоль; 1,20 экв.; 215,67 мг; 0,22 мл), ДИПЭА (0,85 ммоль; 3,00 экв.; 109,51 мг; 0,14 мл) и 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (0,34 ммоль; 1,20 экв.; 57,67 мг) 7 мг) с получением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (7,10 мг; 0,01 ммоль). МС: m/z=489,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,52 (с, 1H), 8,37 (с, 2H), 8,12 (д, J=37,0 Гц, 3H), 7,50 (т, J=8,0 Гц, 1H), 7,34 (с, 1H), 4,59 (с, 2H), 4,23 (кв, J=7,3 Гц, 2H), 1,73-1,16 (м, 12H).
Пример 132: N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-4,5,6,7-тетрагидробензо[b]тиофен-2-карбоксамид (132)
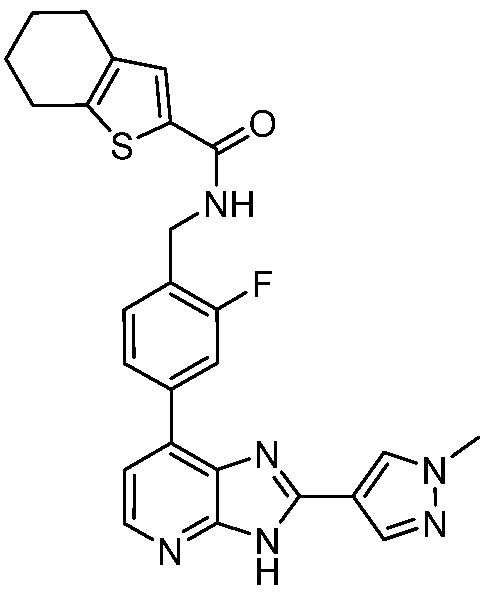
(4-(2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил)метанамин
В 20 мл реакционную пробирку с мешалкой добавляют 7-хлор-2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (0,50 ммоль; 1,00 экв.; 123,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, hcl (0,65 ммоль; 1,30 экв.; 132,62 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,05 ммоль; 0,10 экв.; 40,55 мг). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют фосфат калия, двухосновный (1,49 ммоль; 3,00 экв.; 1683,48 мг; 1,49 мл), ацетат натрия (1,49 ммоль; 3,00 экв.; 1,49 мл) и АЦН (191,46 ммоль; 385,54 экв.; 7860,00 мг; 10,00 мл) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 110°C в течение ночи. Реакционную смесь очищают непосредственно флэш-хроматографией (двуокись кремния; 2-10% MeOH/CH2Cl2) с получением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламин (100,00 мг; 0,24 ммоль). МС: m/z=337,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,46 (с, 1H), 8,40-8,03 (м, 4H), 7,69 (т, J=8,0 Гц, 1H), 7,54 (с, 1H), 3,97 (с, 3H), 3,91 (2, 2H), 3,32 (шс, 2H).
2-Фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 4,5,6,7-тетрагидробензо[b]тиофен-2-карбоновой кислоты
Указанное в заголовке соединение получают по методике, описанной для представленных выше аналогов с применением 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (0,22 ммоль; 1,00 экв.; 100,00 мг), 2,4,6-трипропил-[1,3,5,2,4,6]триоксатрифосфинана 2,4,6-триоксида (0,26 ммоль; 1,20 экв.; 165,83 мг; 0,17 мл), ДИПЭА (0,65 ммоль; 3,00 экв.; 84,20 мг; 0,11 мл), 2 мл ДХМ. Получают 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 4,5,6,7-тетрагидробензо[b]тиофен-2-карбоновую кислоту (12,10 мг; 0,02 ммоль). МС: m/z=486,5 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,40 (с, 1H), 8,93 (с, 1H), 8,65-8,07 (м, 5H), 7,73-7,28 (м, 2H), 4,47-4,37 (м, 2H), 3,96 (с, 3H), 2,79-2,51 (м, 4H), 2,10-1,39 (м, 4H).
Пример 133: 4-[2-(1-Этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламид 5-трет-бутилизоксазол-3-карбоновой кислоты (133)
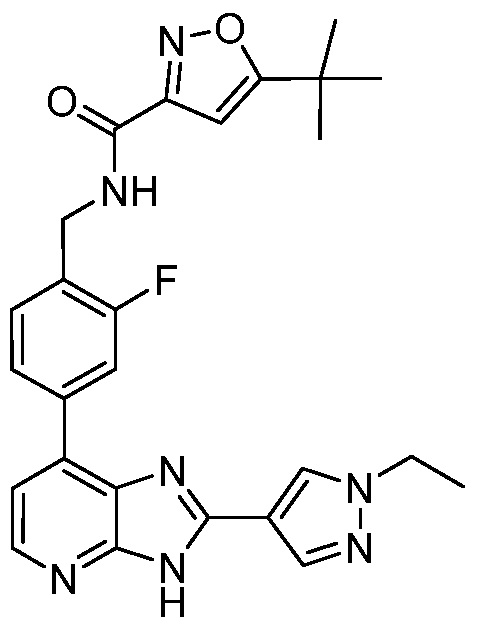
Указанное в заголовке соединение получают по методике, подобной той, которая описана для примера 130 с применением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламина (0,51 ммоль; 1,00 экв.; 171,00 мг), объединенного с ДИПЭА (1,53 ммоль; 3,00 экв.; 197,11 мг; 0,25 мл) и 5-трет-бутилизоксазол-3-карбоновой кислотой (0,61 ммоль; 1,20 экв.; 103,21 мг) в ДХМ. Затем добавляют ДИПЭА (1,53 ммоль; 3,00 экв.; 197,11 мг; 0,25 мл), затем 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,61 ммоль; 1,20 экв.; 388,21 мг; 0,39 мл) (T3P). Через 5 часов ЖХ-МС показывает около 15% желаемого продукта с остатками исходного материала. Реакцию гасят MeOH (2 мл), затем очищают непосредственно на системе с обращенной фазой Waters с применением градиента 5-95% CH3CN/H2O (0,1% гидроксид аммония) (4 инъекции по 1 мл каждая) с получением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутилизоксазол-3-карбоновой кислоты (2,80 мг; 0,01 ммоль). ЯМР имеет некоторые пики растворителя в алифатической области, чистой в других смыслах. Получают 3 мг (1%) указанного в заголовке соединения в виде. ЖХВД (Колонка): (процент площади)%. МС: m/z=487,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,53 (с, 1H), 8,35 (с, 2H), 8,23-8,09 (м, 3H), 7,49 (т, J=8,0 Гц, 1H), 7,31 (с, 1H), 4,60 (с, 2H), 4,40-4,28 (м, 2H), 1,73-1,16 (м, 9H), 1,02-0,75 (м, 3H).
Пример 134: 2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (134)
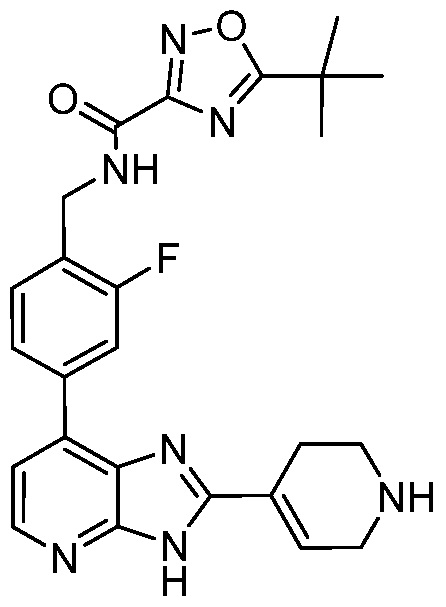
трет-Бутил эфир 4-[7-(4-{[(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,19 ммоль; 1,00 экв.; 120,00 мг) объединяют с ДХМ (156,01 ммоль; 831,50 экв.; 13250,00 мг; 5,00 мл) и затем обрабатывают ТФК (134,62 ммоль; 717,53 экв.; 15350,00 мг; 5,00 мл). Смесь перемешивают под азотом в течение 1,5 часов. ТСХ (5% MeOH/EtOAC) показала завершение реакции. Реакционную смесь затем концентрируют досуха и помещают на помпу в течение 24 часов с получением 2-фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (11,18 мг; 0,02 ммоль). МС: m/z=476,5 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4) δ 8,38 (д, J=5,2 Гц, 1H), 7,93 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,49 (д, J=5,2 Гц, 1H), 6,89 (дд, J=3,8, 2,1 Гц, 1H), 4,74 (с, 2H), 3,90-3,81 (м, 2H), 3,47-3,33 (м, 2 H), 3,03-2,85 (м, 2H), 1,51 (с, 9H).
Пример 135: 5-(трет-бутил)-N-(4-(2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,3,4-оксадиазол-2-карбоксамид (135)
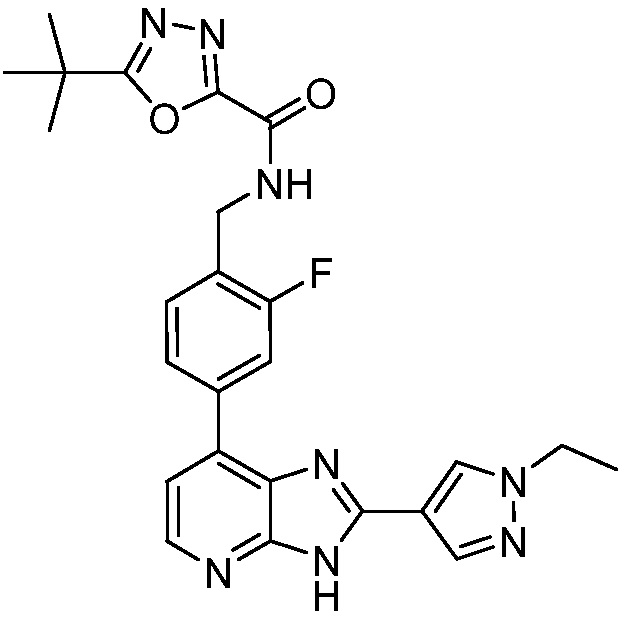
Указанное в заголовке соединение получают по методике, описанной для примера 130, с применением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламина (0,33 ммоль; 1,00 экв.; 110,00 мг), 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (0,39 ммоль; 1,20 экв.; 66,78 мг), ДИПЭА (0,98 ммоль; 3,00 экв.; 126,80 мг; 0,16 мл) и 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинана 2,4,6-триоксида (0,47 ммоль; 1,44 экв.; 300,00 мг; 0,30 мл) (T3P) с получением 4-[2-(1-этил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (24,10 мг; 0,05 ммоль) в виде белого твердого вещества. МС: m/z=489,5 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,21 (с, 1H), 9,53 (с, 1H), 8,37 (с, 2H), 8,12 (д, J=37,0 Гц, 3H), 7,51 (т, J=8,0 Гц, 1H), 7,33 (с, 1H), 4,55 (с, 2H), 4,21 (кв, J=7,3 Гц, 2H), 1,75-1,17 (м, 12H).
Пример 136: 3-(трет-бутил)-N-(2-фтор-4-(2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид (136)
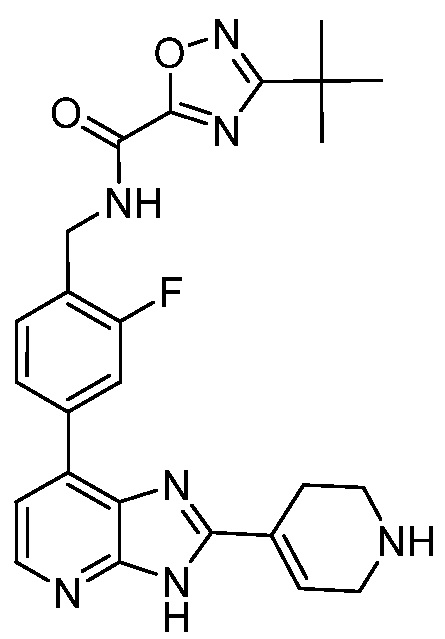
1 трет-бутил 4-(7-(4-((3-(трет-бутил)-1,2,4-оксадиазол-5-карбоксамидо)метил)-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат
трет-Бутиловый эфир 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,12 ммоль; 1,00 экв.; 51,00 мг) объединяют с 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислотой (0,14 ммоль; 1,20 экв.; 24,59 мг) в растворе ДИПЭА (0,36 ммоль; 3,00 экв.; 46,69 мг; 0,06 мл) в ДХМ. Затем добавляют 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,47 ммоль; 3,91 экв.; 300,00 мг; 0,30 мл) (T3P), и реакционную смесь перемешивают при КТ в течение 1 ч. Весь растворитель затем удаляют, и остаток растворяют в 5 мл ДМСО. Реакционную смесь затем очищают на 175 г C18 (15 микронов) колонке и с градиентом 20-100% CH3CN/H2O (0,1% гидроксид аммония) с получением трет-бутилового эфира 4-[7-(4-{[(3-трет-бутил[1,2,4]оксадиазол-5-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (13,00 мг; 0,02 ммоль) в виде белого твердого вещества. МС: m/z=576,6 [M+H]+.
3-(трет-Бутил)-N-(2-фтор-4-(2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид
трет-Бутиловый эфир 4-[7-(4-{[(3-трет-бутил[1,2,4]оксадиазол-5-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,04 ммоль; 1,00 экв.; 24,00 мг) объединяют с ТФК (2,00 мл) в ДХМ (31,20 ммоль; 831,50 экв.; 2650,00 мг; 2,00 мл). Смесь перемешивают при КТ в течение 2 часов. Весь растворитель затем удаляют, и остаток очищают на Waters-2 Prep System с применением градиента 20-80% CHeCN/воды (0,1% гидроксид аммония) в течение более 27 минут. Желаемый продукт элюируется в течение около 18 минут. Фракции, содержащие желаемый продукт (по результатам анализа ЖХ-МС) объединяют, затем концентрируют досуха на Genevac EZ-2 Plus с получением 2-фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (12,00 мг; 0,02 ммоль). МС: m/z=576,6 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4) δ 8,36 (с, 1H), 7,93 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,49 (д, J=5,2 Гц, 1H), 6,89 (дд, J=3,8, 2,1 Гц, 1H), 4,74 (с, 2H), 3,90-3,81 (м, 2H), 3,47-3,33 (м, 2 H), 3,01-2,88 (м, 2H), 1,49 (с, 9H).
Пример 137: трет-Бутил 4-(7-(4-((5-(трет-бутил)-1,2,4-оксадиазол-3-карбоксамидо)метил)-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил)-5,6-дигидропиридин-1(2H)-карбоксилат (137)
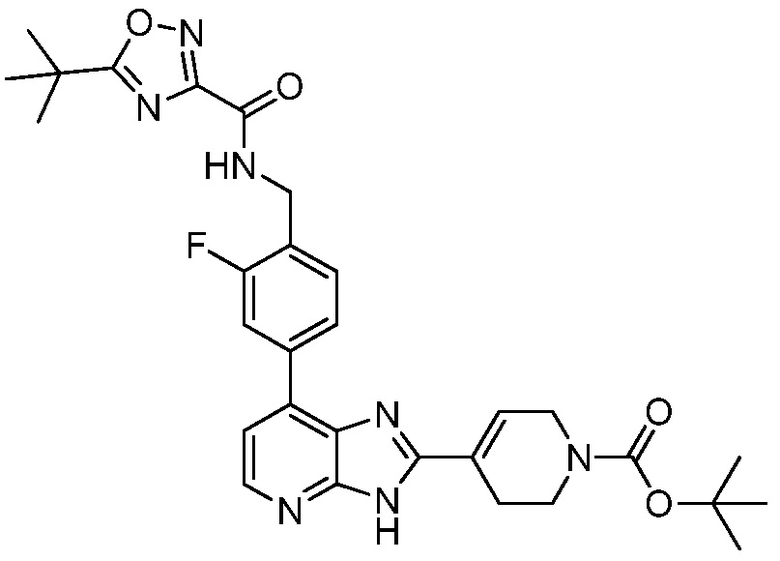
трет-Бутиловый эфир 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (4,30 ммоль; 1,00 экв.; 1000,00 мг), карбонат калия (12,91 ммоль; 3,00 экв.; 1783,57 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,43 ммоль; 0,10 экв.; 351,29 мг). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют диоксан (117,36 ммоль; 27,28 экв.; 10340,00 мг; 10,00 мл) и воду (55,51 ммоль; 12,90 экв.; 1000,00 мг; 1,00 мл) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 120°C в течение 2 ч в микроволновой печи. Охлаждают до комнатной температуры и фильтруют через целит, промывая дихлорметаном/MeOH 1:1 (всего 75 мл). Очищают флэш-хроматографией (SiO2 50 г; 2-10% MeOH/CH2Cl2 10 ОК.) Концентрируют фракции продукта и сушат на помпе. Продукт переносят дальше без дополнительной очистки. Получают трет-бутиловый эфир 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (1001,60 мг; 2,57 ммоль) в виде коричневого твердого вещества в качестве продукта. МС: m/z=335,8 [M+H]+.
трет-Бутилов эфир 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (1,33 ммоль; 1,00 экв.; 444,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, hcl (1,72 ммоль; 1,30 экв.; 354,15 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,13 ммоль; 0,10 экв.; 108,30 мг). Пробирку герметично закрывают и ополаскивают Ar. Реакционную пробирку дегазируют Ar и нагревают до 140°C в течение ночи. Очищают на 100 г SiO2 с применением градиента 0-100% 50%MeOH/EtOAC с получением трет-бутилового эфира 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (171,00 мг; 0,40 ммоль). МС: m/z=423,2 [M+H]+.
трет-Бутиловый эфир 4-[7-(4-{[(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
В 5 мл реакционную пробирку с мешалкой добавляют трет-бутиловый эфир 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,09 ммоль; 1,00 экв.; 40,00 мг), 5-трет-бутил[1,2,4]оксадиазол-3-карбоновую кислоту (0,11 ммоль; 1,20 экв.; 19,29 мг) и ДИПЭА (0,28 ммоль; 3,00 экв.; 36,62 мг; 0,05 мл). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют 2,4,6-трипропил-[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,11 ммоль; 1,20 экв.; 72,13 мг; 0,07 мл) через шприц. Реакционную смесь перемешивают при кт 1,5 ч. Реакционную смесь затем очищают на 175 г C18 (15 микрон) колонке с применением градиента 20-100% CH3CN/H2O (0,1% гидроксид аммония) в течение более 38 минут (соединение элюируется очень поздно при 100%) с получением трет-бутилового эфира 4-[7-(4-{[(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (110,00 мг; 0,18 ммоль). МС: m/z=576,3 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d) δ 8,39 (с, 1H), 8,28-7,86 (м, 2H), 7,62 (т, J=8,1 Гц, 1H), 7,42 (д, J=25,8 Гц, 2H), 6,87 (с, 1H), 4,82 (с, 2H), 4,29 (с, 1H), 3,75 (с, 2H), 2,91 (с, 1H), 2,35 (с, 1H), 1,66-1,49 (м, 18H).
Пример 138: 5-(трет-Бутил)-N-(4-(2-(3,6-дигидро-2H-пиран-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,3,4-оксадиазол-2-карбоксамид (138)
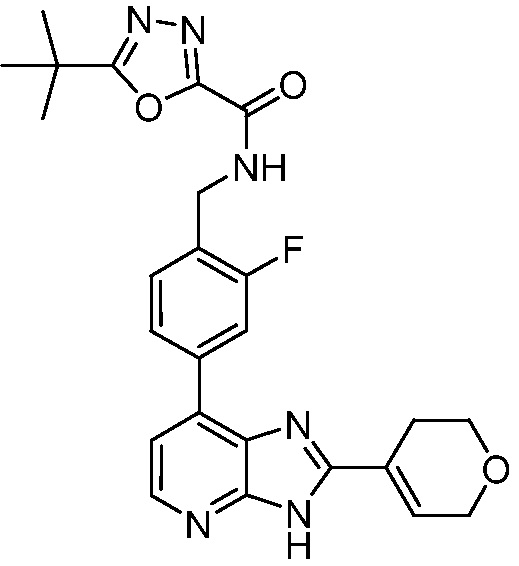
Указанное в заголовке соединение получают по методике, подобной той, которая описана для примера 139 с применением 7-хлор-2-(3,6-дигидро-2H-пиран-4-ил)-3H-имидазо[4,5-b]пиридина (0,31 ммоль; 1,00 экв.; 72,00 мг), (4-((5-(трет-бутил)-1,3,4-оксадиазол-2-карбоксамидо)метил)-3-фторфенил)бороновой кислоты (0,37 ммоль; 1,20 экв.; 117,72 мг), карбоната калия (1,22 ммоль; 4,00 экв.; 168,89 мг) и комплекса 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,03 ммоль; 0,10 экв.; 24,95 мг), диоксана (23,47 ммоль; 76,83 экв.; 2068,00 мг; 2,00 мл) и воды (27,75 ммоль; 90,85 экв.; 500,00 мг; 0,50 мл) с получением 4-[2-(3,6-дигидро-2H-пиран-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (11,00 мг; 0,02 ммоль.) МС: m/z=477,5 [M+H]+.
Пример 139: 2-Фтор-4-[2-(1-метил-1,2,3,6-тетрагидро-пиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (139)
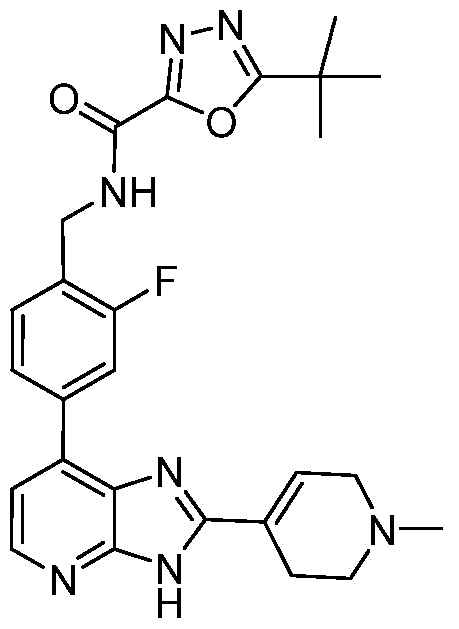
2-Фтор-4-[2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин
7-Хлор-2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин (0,85 ммоль; 1,00 экв.; 212,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, hcl (1,11 ммоль; 1,30 экв.; 227,63 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,09 ммоль; 0,10 экв.; 69,61 мг). Пробирку герметично закрывают и ополаскивают Ar. К реакционной смеси добавляют карбонат калия (1,70 ммоль; 2,00 экв.; 235,61 мг), диоксан (46,94 ммоль; 55,07 экв.; 4136,00 мг; 4,00 мл) и воду (55,51 ммоль; 65,12 экв.; 1000,00 мг; 1,00 мл) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 140°C в течение ночи. Реакционную смесь затем фильтруют через целит и очищают непосредственно на C18 с применением градиента 20-60% CH3CN/H2O (0,1% гидроксид аммония). Получают 2-фтор-4-[2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (51,00 мг; 0,14 ммоль.) МС: m/z=338,2 [M+H]+.
2-Фтор-4-[2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
2-Фтор-4-[2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (0,15 ммоль; 1,00 экв.; 51,00 мг) объединяют с 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислотой (0,18 ммоль; 1,20 экв.; 30,87 мг) в растворе ДИПЭА (0,45 ммоль; 3,00 экв.; 58,61 мг; 0,08 мл) в ДХМ. Затем добавляют 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,47 ммоль; 3,12 экв.; 300,00 мг; 0,30 мл) (T3P) и реакционную смесь перемешивают при КТ в течение 1 ч. Весь растворитель затем удаляют и остаток растворяют в 5 мл ДМСО. Реакционную смесь затем очищают на системе очистки с обращенной фазой Waters с применением градиента 10-60% CH3CN/H2O (0,1% гидроксид аммония). Получают 2-фтор-4-[2-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (10,70 мг; 0,02 ммоль) в виде белого твердого вещества. МС: m/z=248,7 [M+H]+.
Пример 140: 2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (140)
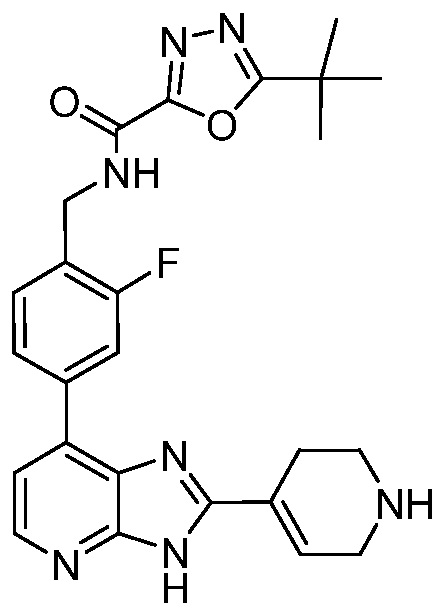
трет-Бутил 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат
2-Бром-7-хлор-3H-имидазо[4,5-b]пиридин (4,30 ммоль; 1,00 экв.; 1000,00 мг), карбонат калия (12,91 ммоль; 3,00 экв.; 1783,57 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,43 ммоль; 0,10 экв.; 351,29 мг). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют диоксан (117,36 ммоль; 27,28 экв.; 10340,00 мг; 10,00 мл) и воду (55,51 ммоль; 12,90 экв.; 1000,00 мг; 1,00 мл) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 120°C в течение 2 ч в микроволновой печи. Затем реакционную смесь выдерживают в течение ночи при КТ. Реакционную смесь затем фильтруют через целит, и фильтр промывают ДХМ/MeOH 1:1 (150 мл всего). Фильтрат концентрируют и загружают в 25 г KP-NH образец (способ сухой загрузки с 25 г SiO2). Очищают хроматографией на колонке (HP-Si 50 г; 2-10% MeOH/ДХМ 10 ОК.) Получают трет-бутиловый эфир 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (1001,60 мг; 2,57 ммоль) в виде коричневого твердого вещества в качестве продукта. МС: m/z=335,1 [M+H]+.
трет-бутил 4-(7-(4-(аминометил)-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат
трет-Бутиловый эфир 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (1,49 ммоль; 1,00 экв.; 500,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, HCl (1,94 ммоль; 1,30 экв.; 398,82 мг), карбонат калия (2,99 ммоль; 2,00 экв.; 412,80 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,15 ммоль; 0,10 экв.; 121,96 мг). Пробирку герметично закрывают и ополаскивают аргоном. К реакционной смеси добавляют диоксан (46,94 ммоль; 31,43 экв.; 4136,00 мг; 4,00 мл) и воду (55,51 ммоль; 37,17 экв.; 1000,00 мг; 1,00 мл) через шприц. Реакционную пробирку дегазируют аргоном и нагревают до 140°C в течение ночи. Очищают на 100 г SiO2 с применением градиента 0-100% 50%MeOH/EtOAc с получением трет-бутилового эфира 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (186,00 мг; 0,43 ммоль), который применяют без дополнительной очистки. МС: m/z=424,2 [M+H]+.
5-трет-Бутил 4-(7-(4-((5-(трет-бутил)-1,3,4-оксадиазол-2-карбоксамидо)метил)-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил)-3,6-дигидропиридин-1(2H)-карбоксилат
трет-Бутиловый эфир 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,12 ммоль; 1,00 экв.; 51,00 мг) объединяют с 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (0,14 ммоль; 1,20 экв.; 24,59 мг) в растворе ДИПЭА (0,36 ммоль; 3,00 экв.; 46,69 мг; 0,06 мл) в ДХМ. Затем добавляют 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,47 ммоль; 3,91 экв.; 300,00 мг; 0,30 мл) (T3P) и реакционную смесь перемешивают при КТ в течение 1 ч. Весь растворитель затем удаляют и остаток растворяют в 5 мл ДМСО. Продукт очищают хроматографией с обращенной фазой с применением 80 г C18 (30 микрон) и градиента 20-90% CH3CN/H2O (0,1% гидроксид аммония) с получением трет-бутилового эфира 4-[7-(4-{[(5-трет-бутил[1,3,4]оксадиазол-2-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (51,00 мг; 0,09 ммоль) в виде белого твердого вещества. МС: m/z=576,2 [M+H]+.
2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
трет-Бутиловый эфир 4-[7-(4-{[(5-трет-бутил[1,3,4]оксадиазол-2-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,02 ммоль; 1,00 экв.; 14,00 мг) объединяют с 4N HCl в диоксане (1,00 мл) в ДХМ (31,20 ммоль; 1425,43 экв.; 2650,00 мг; 2,00 мл). Смесь перемешивают при КТ в течение 1 ч. Продукт затем концентрируют досуха и очищают хроматографией с обращенной фазой с применением 80 г C18 (30 микрон) и градиента 20-90% CH3CN/H2O (0,1% гидроксид аммония) с получением 2-фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (3,2 мг, 0,01 ммоль) в виде белого твердого вещества. МС: m/z=576,6 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4) δ 8,36 (с, 1H), 7,93 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,49 (д, J=5,2 Гц, 1H), 6,89 (дд, J=3,8, 2,1 Гц, 1H), 4,73 (с, 2H), 3,89-3,80 (м, 2H), 3,46-3,31 (м, 2 H), 3,01-2,87 (м, 2H), 1,51 (с, 9H).
2-Фтор-4-[2-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты
4-(7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил)-1-метил-1H-пиридин-2-он (0,25 ммоль; 1,00 экв.; 64,00 мг), (4-((5-(трет-бутил)-1,3,4-оксадиазол-2-карбоксамидо)метил)-3-фторфенил)бороновую кислоту (0,29 ммоль; 1,20 экв.; 94,60 мг), карбонат калия (0,98 ммоль; 4,00 экв.; 135,73 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,02 ммоль; 0,10 экв.; 20,05 мг). Затем добавляют диоксан (117,36 ммоль; 478,02 экв.; 10340,00 мг; 2,00 мл) и воду (55,51 ммоль; 226,10 экв.; 1000,00 мг; 0,50 мл) и реакционную пробирку вакуумируют, затем повторно заполняют азотом три раза. Смесь затем нагревают до 140°C в течение ночи. Неочищенную реакционную смесь затем очищают непосредственно на 175 г 15 микрон C18 с применением градиента 5-95% CH3CN/H2O (0,1% гидроксид аммония). Фракции, содержащие желаемый продукт, объединяют и концентрируют досуха на роторном испарителе, затем сушат в высоком вакууме в течение 1 ч. Получают 2-фтор-4-[2-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,3,4]оксадиазол-2-карбоновой кислоты (3,60 мг; 0,01 ммоль) в виде темно-коричневого твердого вещества. МС: m/z=502,2 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d) δ 8,40 (с, 1H), 8,22 (д, J=20,0 Гц, 2H), 8,10-7,79 (м, 3H), 7,58-7,31 (м, 3H), 6,50 (с, 1H), 5,77-5,68 (м, 2H), 4,62-4,50 (м, 2H), 3,38 (с, 3H), 1,48 (с, 9H).
Пример 142: 2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-изопропил[1,3,4]оксадиазол-2-карбоновой кислоты (142)
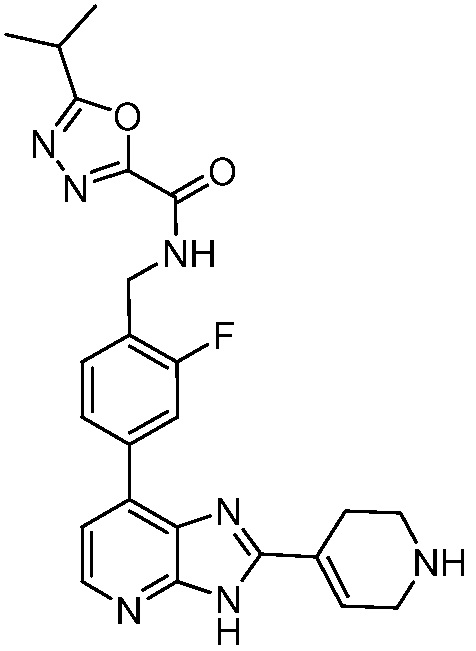
трет-Бутиловый эфир 4-[7-(3-фтор-4-{[(5-изопропил[1,3,4]оксадиазол-2-карбонил)амино]метил}фенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты
В 5 мл реакционную пробирку с мешалкой добавляют трет-бутиловый эфир 4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,14 ммоль; 1,00 экв.; 60,00 мг), описанной выше, 5-изопропил[1,3,4]оксадиазол-2-карбоновую кислоту (0,18 ммоль; 1,25 экв.; 27,65 мг) и pybrop (0,18 ммоль; 1,25 экв.; 82,56 мг). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют ДМФ (25,94 ммоль; 183,08 экв.; 1896,00 мг; 2,00 мл) и n,n-диизопропилэтиламин (0,43 ммоль; 3,00 экв.; 54,94 мг; 70,43 мкл). Реакционную смесь перемешивают при КТ в течение ночи. 1,5 мл ДМСО добавляют в реакционную смесь и этот продукт очищают с применением 175 г C18 (15 микрон) колонки и градиента 20-100% CH3CN/H2O (0,1% гидроксид аммония) с получением трет-бутилового эфира 4-[7-(3-фтор-4-{[(5-изопропил-[1,3,4]оксадиазол-2-карбонил)амино]метил}фенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (10,00 мг; 0,02 ммоль). МС: m/z=562,6 [M+H]+.
2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-изопропил[1,3,4]оксадиазол-2-карбоновой кислоты
трет-Бутиловый эфир 4-[7-(3-фтор-4-{[(5-изопропил[1,3,4]оксадиазол-2-карбонил)амино]метил}фенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (0,02 ммоль; 1,00 экв.; 13,00 мг) объединяют с ДХМ (156,01 ммоль; 7488,36 экв.; 13250,00 мг; 1,50 мл) и затем обрабатывают ТФК (134,62 ммоль; 6462,00 экв.; 15350,00 мг; 1,50 мл). Смесь перемешивают под азотом в течение 1,5 часов. Реакционную смесь затем очищают непосредственно на 55 г C18 с применением градиента 20-80% CH3CN/H2O (0,1% гидроксид аммония) с получением 2-фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 5-изопропил[1,3,4]оксадиазол-2-карбоновой кислоты (2,00 мг; 0,00 ммоль). МС: m/z=462,4 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4) δ 8,36 (с, 1H), 7,93 (с, 1H), 7,59 (т, J=7,9 Гц, 1H), 7,49 (д, J=5,2 Гц, 1H), 6,89 (дд, J=3,8, 2,1 Гц, 1H), 4,73 (с, 2H), 3,89-3,80 (м, 2H), 3,46-3,31 (м, 3H), 3,01-2,87 (м, 2H), 1,49-1,39 (м, 6H).
Пример 143: Диметиламид 4-[7-(4-{[(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (143)
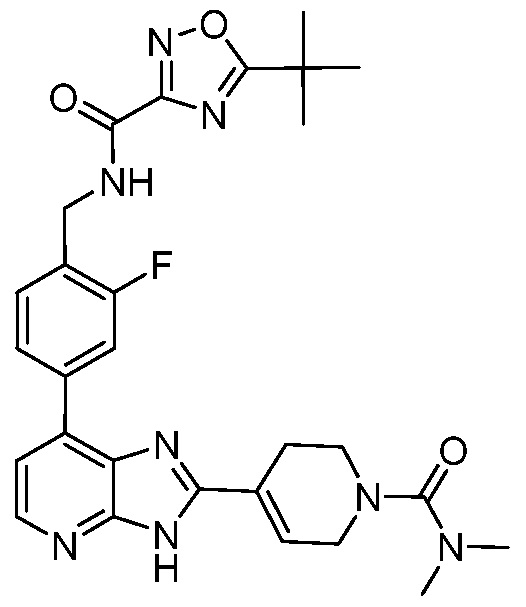
2-Фтор-4-[2-(1,2,3,6-тетрагидропиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (0,02 ммоль; 1,00 экв.; 11,20 мг) растворяют в ДХМ вместе с ДИПЭА (0,24 ммоль; 10,00 экв.; 30,44 мг; 0,04 мл). Затем добавляют диметилкарбамоилхлорид (0,04 ммоль; 1,50 экв.; 3,80 мг) одной порцией. Реакционную смесь затем перемешивают при КТ в течение 1 ч. Реакцию гасят насыщенным раствором бикарбоната натрия. Добавляют 10 мл ДХМ. Реакционную смесь встряхивают, затем фазы разделяют. Органическую (нижнюю) фазу удаляют пипеткой и затем объединяют и концентрируют досуха. Остаток растворяют в 5 мл ДМСО, затем очищают с применением C18 с обращенной фазой (10 микрон) с градиентом 5-95% MeOH в воде (0,1% гидроксид аммония) с получением диметиламида 4-[7-(4-{[(5-трет-бутил[1,2,4]оксадиазол-3-карбонил)амино]метил}-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (6,20 мг; 0,01 ммоль) в виде белого твердого вещества. МС: m/z=547,6 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,30 (с, 1H), 9,53 (с, 1H), 8,52-7,99 (м, 2H), 7,83-7,35 (м, 2H), 6,93 (с, 1H), 4,68-4,42 (м, 2H), 3,95 (с, 2H), 2,91-2,67 (м, 10H), 1,48 (с, 9H).
Пример 144: 3-(трет-Бутил)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)изоксазол-5-карбоксамид (144)
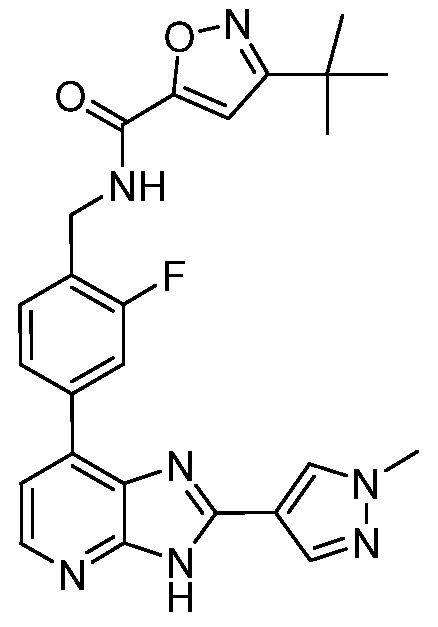
В сухой 40 мл реакционной пробирке объединяют 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (0,43 ммоль; 1,00 экв.; 200,00 мг), ДИПЭА (1,30 ммоль; 3,00 экв.; 168,40 мг; 0,22 мл) и ДХМ (78,00 ммоль; 179,60 экв.; 6625,00 мг; 5,00 мл). Затем к реакционной смеси по каплям добавляют хлорид 3-трет-бутилизоксазол-5-карбонила (0,48 ммоль; 1,10 экв.; 89,64 мг) через шприц, и реакционную смесь перемешивают при КТ в течение 1 часа. Реакцию гасят насыщенным раствором гидрокарбоната натрия (10 мл), затем разбавляют ДХМ (20 мл). Реакционную смесь закрывают крышкой и встряхивают, и фазы разделяют в течение 15 минут. Органическую (нижнюю) фазу собирают. Органическую фазу затем очищают на Biotage-2 с применением 100 г KPH SiO2 с применением градиента 0-15% MeOH в EtOAC в течение более 38 минут (соединение элюируется при 10% MeOH/EtOAC) с получением 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 3-трет-бутилизоксазол-5-карбоновой кислоты (194,00 мг; 0,40 ммоль) в виде белого твердого вещества при сушке. МС: m/z=474,5 [M+H]+. 1H ЯМР (400 МГц, Хлороформ-d) δ 8,40 (с, 1H), 8,22 (д, J=20,0 Гц, 2H), 8,10-7,79 (м, 2H), 7,58-7,31 (м, 3H), 6,50 (с, 1H), 4,82-4,70 (м, 2H), 4,05 (с, 3H), 1,49 (с, 9H).
Пример 145: 5-(трет-бутил)-N-(4-(2-(4-(диметиламино)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,2,4-оксадиазол-3-карбоксамид (145)
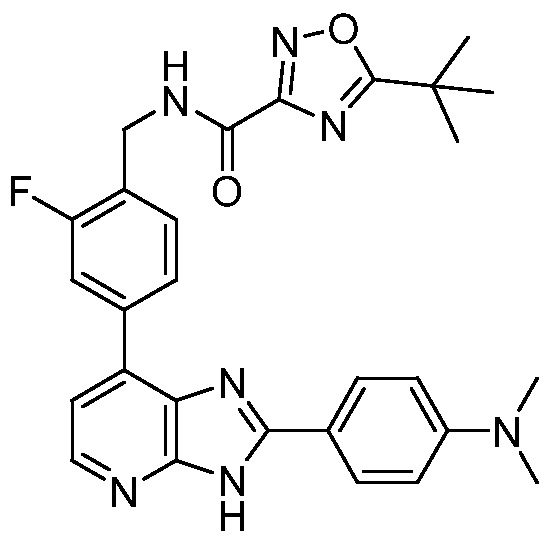
4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)-N,N-диметиланилин
4-Хлорпиридин-2,3-диамин (2,09 ммоль; 1,00 экв.; 300,00 мг), полифосфорную кислоту (12750,00 мг) и 4-диметиламинобензойную кислоту (2,51 ммоль; 1,20 экв.; 414,20 мг) нагревают при 130°C в течение ночи. Реакционную смесь выливают в воде/льде (50 мл) и pH доводят хлоридом аммония (18,69 ммоль; 8,95 экв.; 1000,00 мг) и NaOH (200,02 ммоль; 95,72 экв.; 8000,00 мг) до нейтрального. Добавляют еще гидроксид натрия отдельными гранулами так, чтобы температура водного раствора не превышала 50°C (охлаждают добавлением ледяных гранул время от времени). Продукт выпадает в осадок при pH=8 (лакмусовая бумага), и суспензию охлаждают при 5°C на льду в течение 30 мин, затем фильтруют на пластиковом фильтровальном устройстве. Осадок сушат в высоком вакууме с получением желаемого соединения [4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)фенил]диметиламина (582,00 мг; 2,13 ммоль) в виде рыжевато-коричневого аморфного твердого вещества. МС: m/z=273,1 [M+H]+.
4-(7-(4-(аминометил)-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил)-N,N-диметиланилин
В 20 мл реакционную пробирку с мешалкой добавляют [4-(7-бром-3H-имидазо[4,5-b]пиридин-2-ил)фенил]диметиламин (1,86 ммоль; 1,00 экв.; 589,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, hcl (2,23 ммоль; 1,20 экв.; 457,75 мг), карбонат калия (7,43 ммоль; 4,00 экв.; 1026,58 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,19 ммоль; 0,10 экв.; 151,65 мг). Затем добавляют диоксан (117,36 ммоль; 63,20 экв.; 10340,00 мг; 10,00 мл) и воду (55,51 ммоль; 29,89 экв.; 1000,00 мг; 1,00 мл) и реакционную пробирку вакуумируют, затем повторно наполняют азотом три раза. Смесь затем нагревают до 140°C в течение ночи. Реакционную смесь загружают непосредственно на 50 г SiO2 и очищают флэш-хроматографией (2-10% MeOH/CH2Cl2 15 ОК) с получением {4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]фенил}диметиламина (77,00 мг; 0,21 ммоль). МС: m/z=362,4 [M+H]+.
5-(трет-Бутил)-N-(4-(2-(4-(диметиламино)фенил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,2,4-оксадиазол-3-карбоксамид
В 5 мл реакционную пробирку с мешалкой добавляют {4-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]фенил}диметиламин (0,21 ммоль; 1,00 экв.; 77,00 мг), натриевую соль 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (0,27 ммоль; 1,25 экв.; 51,17 мг) и pybrop (0,27 ммоль; 1,25 экв.; 124,15 мг). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют ДМФ (12,97 ммоль; 60,88 экв.; 948,00 мг; 2,00 мл) и n,n-диизопропилэтиламин (0,64 ммоль; 3,00 экв.; 82,61 мг; 105,91 мкл). Реакционную смесь перемешивают при кт в течение ночи. 1 мл ДМФ удаляют на роторном испарителе, и реакционную смесь разбавляют ДХМ (20 мл). Промывают раствором бикарбоната (насыщ.), затем водой (2×). Органический слой концентрируют до около 2 мл на роторном испарителе, затем загружают на 25 г SiO2 и очищают флэш-хроматографией (0-10% MeOH/CH2Cl2). К полученному остатку добавляют MeOH (5 мл), образуется светло-желтое твердое вещество, которое собирают фильтрацией. Твердые вещества промывают три раза MeOH (5 мл каждый) и затем сушат на помпе с получением 4-[2-(4-диметиламинофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (41,30 мг; 0,08 ммоль) МС: m/z=514,5 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,51 (с, 1H), 8,48 (д, J=11,8 Гц, 1H), 8,17 (дд, J=25,2, 7,7 Гц, 4H), 7,58-7,21 (м, 2H), 6,83 (д, J=8,1 Гц, 2H), 4,59 (с, 2H), 3,00 (с, 6H), 1,47 (с, 9H).
Пример 146: 4-[2-(5-Диметиламинопиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (146)
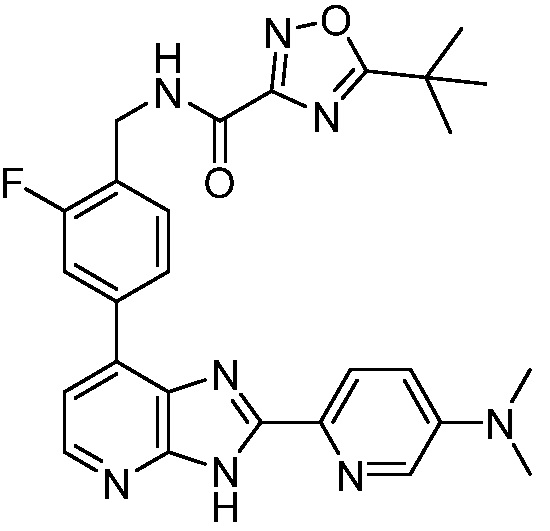
[6-(7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил)пиридин-3-ил]диметиламин
4-Хлорпиридин-2,3-диамин (1,39 ммоль; 1,00 экв.; 200,00 мг), полифосфорную кислоту (12750,00 мг) и 5-диметиламинопиридин-2-карбоновую кислоту (1,67 ммоль; 1,20 экв.; 277,78 мг) нагревают при 130°C в течение 2 дней. Реакционную смесь затем обрабатывают водой (50 мл). Затем применяют шпатель для разделения на части густого вязкого продукта и растворяют в воде. Затем добавляют немного льда и pH доводят хлоридом аммония (18,69 ммоль; 13,42 экв.; 1000,00 мг) и NaOH (200,02 ммоль; 143,58 экв.; 8000,00 мг) до нейтрального. Продукт выпадает в осадок при pH=8 (лакмусовая бумажка), и суспензию охлаждают при 5°C на льду в течение 30 мин, затем фильтруют на пластиковом фильтровальном устройстве. Осадок сушат в высоком вакууме с получением желаемого соединения [6-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)пиридин-3-ил]диметиламина (445,00 мг; 1,63 ммоль) в виде рыжевато-коричневого твердого вещества. Продукт переносят далее без очистки. МС: m/z=248,7 [M+H]+.
{6-[7-(4-Аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиридин-3-ил}диметиламин
[6-(7-Бром-3H-имидазо[4,5-b]пиридин-2-ил)пиридин-3-ил]диметиламин (1,40 ммоль; 1,00 экв.; 446,00 мг), 4-(аминометил)-3-фторфенилбороновую кислоту, hcl (1,68 ммоль; 1,20 экв.; 345,54 мг), карбонат калия (5,61 ммоль; 4,00 экв.; 774,93 мг) и комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (0,14 ммоль; 0,10 экв.; 114,47 мг). Затем добавляют диоксан (117,36 ммоль; 83,72 экв.; 10340,00 мг; 10,00 мл) и воду (55,51 ммоль; 39,60 экв.; 1000,00 мг; 1,00 мл), и реакционную пробирку вакуумируют, затем повторно заполняют азотом три раза. Смесь затем нагревают до 140°C в течение ночи. Загружают непосредственно в 50 г SiO2 и очищают хроматографией Biotage (2-10% MeOH/CH2Cl2 15 ОК). Концентрируют фракции продукта и сушат на помпе. Получают {6-[7-(4-аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиридин-3-ил}диметиламин (59,00 мг; 0,10 ммоль.) МС: m/z=363,2 [M+H]+.
4-[2-(5-Диметиламинопиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламид 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты
{6-[7-(4-Аминометил-3-фторфенил)-3H-имидазо[4,5-b]пиридин-2-ил]пиридин-3-ил}диметиламин (0,16 ммоль; 1,00 экв.; 59,00 мг), натриевая соль 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (0,20 ммоль; 1,25 экв.; 39,10 мг) и pybrop (0,20 ммоль; 1,25 экв.; 94,87 мг). Пробирку герметично закрывают и ополаскивают Ar. К этой смеси добавляют ДМФ (25,94 ммоль; 159,33 экв.; 1896,00 мг; 2,00 мл) и n,n-диизопропилэтиламин (0,49 ммоль; 3,00 экв.; 63,12 мг; 80,93 мкл). Реакционную смесь перемешивают при кт в течение ночи. Около 1 мл ДМФ удаляют на роторном испарителе, и реакционную смесь разбавляют ДХМ (20 мл). Промывают гидрокарбонатом натрия (насыщ.), затем водой (2×). Органический слой концентрируют до около 10 мл на роторном испарителе, затем пробуют очистить половину (5 мл) на 25 г SiO2 (15 микрон) флэш-хроматографией с применением градиента 0-10% MeOH/CH2Cl2 в течение более 38 минут, затем 10-20% в течение 10 минут, затем ополаскивают 40% MeOH/ДХМ в течение 5 мин). Этот продукт очищают с применением 30 мм×250 мм Sunfire OBD C18 колонки и градиента 5-95% CH3CN/H2O (0,1% гидроксид аммония) в течение более 25 минут с получением 4-[2-(5-диметиламинопиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламида 5-трет-бутил[1,2,4]оксадиазол-3-карбоновой кислоты (26,30 мг; 0,05 ммоль.) МС: m/z=514,2 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,53 (с, 1H), 8,42-8,12 (м, 4H), 7,56 (с, 2H), 7,27 (д, J=9,0 Гц, 1H), 4,61 (с, 2H), 3,08 (с, 6H), 1,44 (с, 9H).
Схема 47

Пример 148. 3-(трет-Бутил)-N-(4-(2-(5-(диметиламино)пиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,2,4-оксадиазол-5-карбоксамид (148)
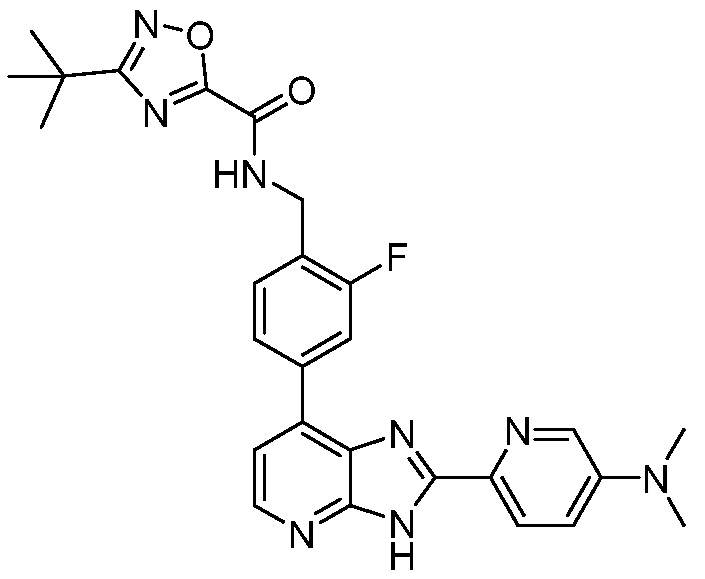
(4-((3-(трет-Бутил)-1,2,4-оксадиазол-5-карбоксамидо)метил)-3-фторфенил)бороновой кислоты
В реакционную колбу с магнитной мешалкой добавляют 3-трет-бутил-1,2,4-оксадиазол-5-карбоновую кислоту (4,56 г; 26,77 ммоль; 1,10 экв.), ДХМ (100,00 мл) и N,N-диизопропилэтиламин (16,96 мл; 97,36 ммоль; 4,00 экв.). Перемешиваемую суспензию затем обрабатывают 50% раствором в этилацетате 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинана 2,4,6-триоксида (23,20 мл; 36,51 ммоль; 1,50 экв.). Твердые вещества полностью не растворяются через 5 мин, поэтому добавляют ДМФ (15 мл). Реакционную смесь перемешивают при комнатной температуре и через 15 мин мутный раствор обрабатывают HCl солью 4-(аминометил)-3-фторфенилбороновой кислоты (5,00 г; 24,34 ммоль; 1,00 экв.) в виде твердого вещества. Перемешивание продолжают при КТ (pH=9). Через 3 ч добавляют еще 5,0 мл T3P (50% в этилацетате), и реакционную смесь перемешивают в течение трех дней. ЖХ-МС анализ через 3 дня не показал изменения. Реакционную смесь частично концентрируют, помещают в этилацетат (150 мл), промывают водой (3×50 мл) и насыщенным раствором соли (1×25 мл), сушат (Na2SO4), фильтруют и концентрируют с получением 4,27 г золотистого масла, которое очищают флэш-хроматографией (Biotage): 100 г колонка с применением 0-10% MeOH/ДХМ в течение 20 мин при скорости потока 50 мл/мин. Продукт элюируют ~16 мин. Фракции продукта объединяют, концентрируют и сушат с получением 3,32 г (43%) (4-((3-(трет-бутил)-1,2,4-оксадиазол-5-карбоксамидо)метил)-3-фторфенил)бороновой кислоты в виде золотистого масла. ЖХВД: 93% чистота. МС: 322 [M+H]+.
3-(трет-бутил)-N-(4-(2,3-диаминопиридин-4-ил)-2-фторбензил)-1,2,4-оксадиазол-5-карбоксамид
4-Бромпиридин-2,3-диамин (1,60 г; 8,51 ммоль; 1,00 экв.), [4-[[(3-трет-бутил-1,2,4-оксадиазол-5-карбонил)амино]метил]-3-фторфенил]бороновую кислоту (3,28 г; 10,21 ммоль; 1,20 экв.), комплекс 1,1'-бис(дифенилфосфино)ферроцен-дихлорида палладия(II) с дихлорметаном (694,92 мг; 0,85 ммоль; 0,10 экв.) и карбонат калия (4,70 г; 34,04 ммоль; 4,00 экв.) объединяют в микроволновой пробирке. Пробирку герметично закрывают и затем вакуумируют/повторно заполняют N2 (3×). Затем добавляют ТГФ/воду (5:1, 24 мл). Пробирку снова вакуумируют/повторно заполняют N2 (3×) и облучают микроволнами при 120 градусах Цельсия в течение 1 ч. ЖХ-МС показывает продукт как основной УФ пик (МСЭР+: 385) и отсутствие исходного материала. Реакционную смесь разбавляют водой (100 мл) и этилацетатом (100 мл), фильтруют через целит и частично концентрируют. Черный раствор разбавляют этилацетатом (50 мл) и затем снова фильтруют через целит. Полученные слои разделяют, и водный слой экстрагируют этилацетатом (2×30 мл). Объединенный слой этилацетата концентрируют на SiO2 и очищают на 100 г колонке Biotage с применением 80-100% этилацетата/гексана в течение более 10 мин со скоростью потока 50 мл/min. Фракции продукта объединяют, концентрируют и сушат с получением 2,08 г (64%) 3-(трет-бутил)-N-(4-(2,3-диаминопиридин-4-ил)-2-фторбензил)-1,2,4-оксадиазол-5-карбоксамида в виде рыжевато-коричневой хрупкой пены. ЖХВД: 98% чистота. МС: 385 [M+H]+.
3-(трет-Бутил)-N-(4-(2-(5-(диметиламино)пиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,2,4-оксадиазол-5-карбоксамид
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (150,00 мг; 0,39 ммоль; 1,00 экв.), 5-диметиламинопиридин-2-карбальдегид (73,25 мг; 0,49 ммоль; 1,25 экв.) и ДМФ (3,00 мл). Пробирку герметично закрывают, и полученный раствор перемешивают в течение 15 ч. при 120 градусах Цельсия. ЖХ-МС через 15 ч. показывает присутствие обоих исходных материалов в дополнение к продукту. Реакцию затем гасят добавлением воды (20 мл). Полученный раствор экстрагируют дихлорметаном (3×25 мл) и органические слои объединяют. В слое ДХМ содержатся твердые вещества, которые фильтруют и промывают ДХМ. ЖХ-МС ДХМ фильтрата показывает отсутствие продукта. Твердое вещество сушат в высоком вакууме с получением 62 мг (31%) 3-(трет-бутил)-N-(4-(2-(5-(диметиламино)пиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторбензил)-1,2,4-оксадиазол-5-карбоксамида (MSC2578488A-1) в виде желтого твердого вещества. ЖХВД: 100% чистота. МС: 515 [M+H]+ ион. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,46 (с, 1H), 9,92 (с, 1H), 8,36-8,20 (м, 4H), 7,63-7,55 (м, 2H), 7,29-7,26 (д, 1H), 4,63-4,61 (шс, 2H), 3,08 (с, 6H), 1,39 (с, 9H).
Пример 149. 3-(трет-Бутил)-N-(2-фтор-4-(2-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид (149)

В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (150,00 мг; 0,39 ммоль; 1,00 экв.), пиридин-3-карбальдегид (52,24 мг; 0,49 ммоль; 1,25 экв.) и ДМФ (3,00 мл; 38,77 ммоль; 99,34 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. Через 20 ч реакцию гасят добавлением воды (20 мл). Полученный раствор экстрагируют дихлорметаном (3×25 мл), и органические слои объединяют. ДХМ концентрируют, и остаток растворяют в ДМСО (2,0 мл) и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; модифицированные 0,1% муравьиной кислотой подвижные фазы (A=вода, B=АЦН); градиент 20-55%B в течение 15 мин при 60 мл/мин). Продукт элюируют при 47% АЦН. Фракции продукта объединяют и лиофилизируют с получением 28 мг 3-(трет-бутил)-N-(2-фтор-4-(2-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамида в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 472 [M+H]+ ион. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,95 (с, 1H), 9,93 (с, 1H), 9,45 (с, 1H), 8,75 (шс, 1H), 8,61 (д, 1H), 8,45 (д, 1H), 8,32 (д, 1H), 8,26 (д, 1H), 7,65 (м, 3H), 4,62 (с, 2H), 1,39 (с, 9H).
Пример 150. 3-(трет-бутил)-N-(2-фтор-4-(2-(пиридин-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид (150)
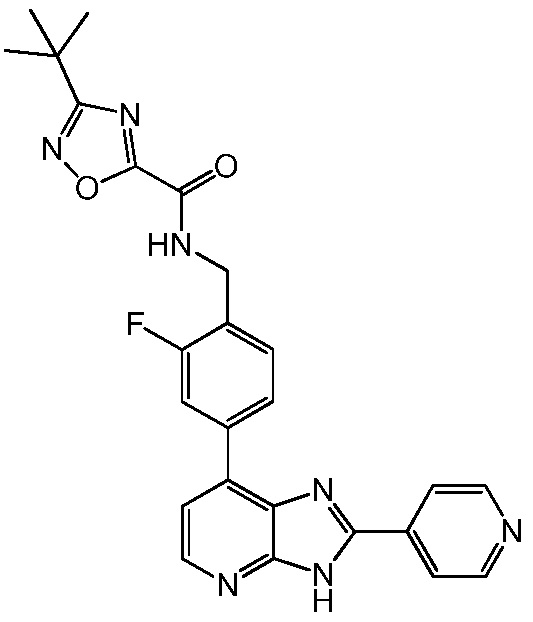
В 20 мл реакционную пробирку добавляют 4-(2,3-диамино-пиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (150,00 мг; 0,39 ммоль; 1,00 экв.), пиридин-4-карбальдегид (52,24 мг; 0,49 ммоль; 1,25 экв.) и ДМФ (3,00 мл; 38,77 ммоль; 99,34 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. Через 20 ч реакцию гасят добавлением воды (20 мл). Полученный раствор экстрагируют дихлорметаном (3×25 мл), и органические слои объединяют. ДХМ концентрируют, и остаток растворяют в ДМСО (2,0 мл) и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B= АЦН); градиент 20-55% B в течение более 15 мин при 60 мл/мин). Продукт элюируют при 45% АЦН. Фракции продукта объединяют и лиофилизируют с получением 5 мг (3%) 3-(трет-бутил)-N-(2-фтор-4-(2-(пиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамида в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 472 [M+H]+ ион. 1H ЯМР (400 МГц, ДМСО-d6) δ 9,95 (т, 1H), 8,80 (д, 2H), 8,47 (д, 1H), 8,29 (д, 1H), 8,22 (д, 3H), 7,63 (м, 2H), 4,63 (с, 2H), 1,39 (с, 9H).
Пример 151. 3-(трет-бутил)-N-(2-фтор-4-(2-(2-метоксипиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид (151)
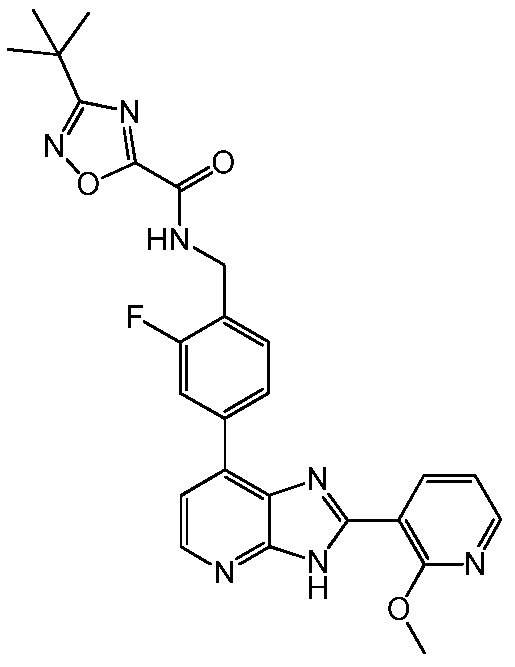
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (150,00 мг; 0,39 ммоль; 1,00 экв.), 2-метоксипиридин-3-карбальдегид (66,89 мг; 0,49 ммоль; 1,25 экв.) и ДМФ (3,00 мл; 38,77 ммоль; 99,34 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. Через 20 ч реакцию гасят добавлением воды (20 мл). Полученный раствор экстрагируют дихлорметаном (3×25 мл) и органические слои объединяют. ДХМ концентрируют и остаток растворяют в ДМСО (2,0 мл) и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 20-70% B в течение более 15 мин при 60 мл/мин). Продукт элюируют 68% АЦН. Фракции продукта объединяют и лиофилизируют с получением 16 мг (8%) 3-(трет-бутил)-N-(2-фтор-4-(2-(2-метоксипиридин-3-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамида в виде белого твердого вещества. ЖХВД: 98% чистота. МС: 502 [M+H]+ ион. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,07 (с, 1H), 9,93 (с, 1H), 8,63 (д, 1H), 8,45 (шс, 1H), 8,38 (шс, 1H), 8,32 (д, 1H), 8,24 (д,1H), 7,59 (м, 2H), 7,25 (т, 1H), 4,62 (д, 2H), 4,10 (с, 3H), 1,39 (с, 9H).
Пример 152. 3-(трет-Бутил)-N-(2-фтор-4-(2-(3-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамид (152)
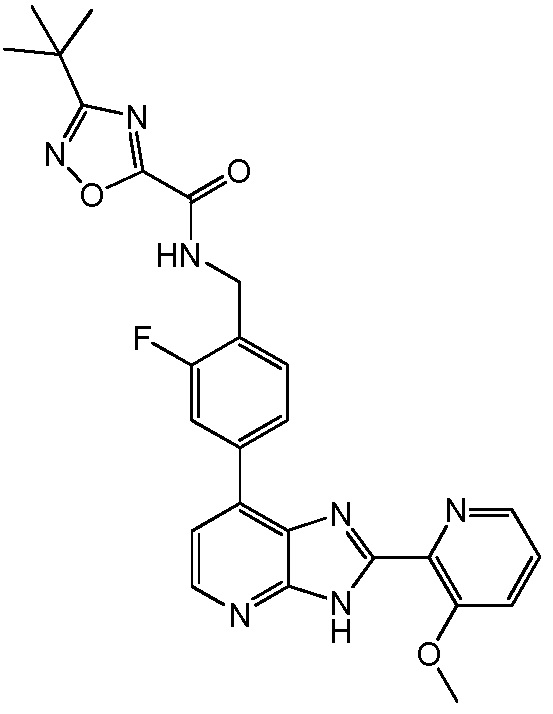
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (150,00 мг; 0,39 ммоль; 1,00 экв.), 3-метоксипиридин-2-карбальдегид (66,89 мг; 0,49 ммоль; 1,25 экв.) и ДМФ (3,00 мл; 38,77 ммоль; 99,34 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. Через 20 ч реакцию гасят добавлением воды (20 мл). Полученный раствор экстрагируют дихлорметаном (3×25 мл) и органические слои объединяют. ДХМ концентрируют, и остаток растворяют в ДМСО (2,0 мл) и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 20-55% B в течение боле 15 мин при 60 мл/мин). Продукт элюируют 47% АЦН. Фракции продукта объединяют и лиофилизируют с получением 36 мг (18%) 3-(трет-бутил)-N-(2-фтор-4-(2-(3-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1,2,4-оксадиазол-5-карбоксамида в виде белого твердого вещества. ЖХВД: 94% чистота. МС: 502 [M+H]+ ион. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,40 (с, 1H), 9,93 (т, 1H), 8,46 (м, 2H), 8,38 (шс, 1H), 8,22 (д, 1H), 7,75 (д, 1H), 7,66 (шс, 1H), 7,56 (м, 2H), 4,61 (д, 2H), 3,98 (с, 3H), 1,38 (с, 9H).
Схема 48
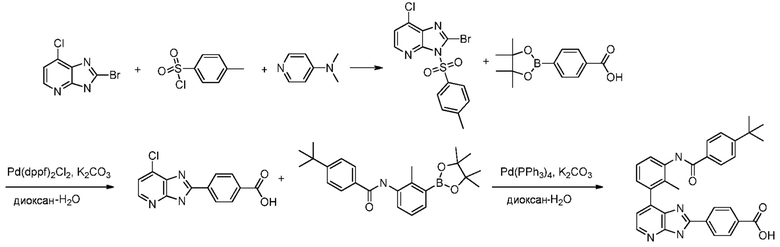
Пример 153. 4-{7-[3-(4-трет-Бутилбензоиламино)-2-метилфенил]-3H-имидазо[4,5-b]пиридин-2-ил}бензойная кислота (153)
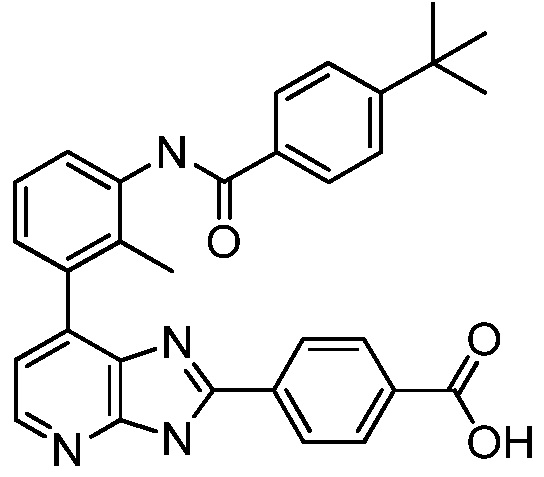
2-Бром-7-хлор-3-(толуол-4-сульфонил)-3H-имидазо[4,5-b]пиридин
В микроволновой пробирке, содержащей 2-бром-7-хлор-3H-имидазо[4,5-b]пиридин (150,00 мг; 0,65 ммоль; 1,00 экв.) и п-толуолсульфонилхлорид (141,47 мг; 0,74 ммоль; 1,15 экв.) в 1,2-дихлорэтане (2,00 мл) добавляют ДИПЭА (320,76 мкл; 1,94 ммоль; 3,00 экв.) и каталитическое количество ДМАП (3,94 мг; 0,03 ммоль; 0,05 экв.). Мутную смесь перемешивают при кт в течение 16 и концентрируют. 10 мл EtOH добавляют в остаток, фильтруют и сушат с получением указанного в заголовке соединения в виде беловатого твердого вещества. Дополнительную очистку не производят, и неочищенное промежуточное соединение используют непосредственно на следующей стадии.
4-(7-Хлор-3H-имидазо[4,5-b]пиридин-2-ил)бензойная кислота
В микроволновой пробирке, содержащей 2-бром-7-хлор-3-(толуол-4-сульфонил)-3H-имидазо[4,5-b]пиридин (100,00 мг; 0,26 ммоль; 1,00 экв.), 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бензойную кислоту (76,99 мг; 0,31 ммоль; 1,20 экв.) и дикарбонат калия (78,64 мг; 0,57 ммоль; 2,20 экв.) добавляют диоксан (6,00 мл; 93,89 ммоль; 363,02 экв.) и воду (1,50 мл; 111,02 ммоль; 429,26 экв.). Раствор продувают N2 в течение 1 мин, затем добавляют комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (21,12 мг; 0,03 ммоль; 0,10 экв.). Реакционную смесь перемешивают при 115°C в течение 1 ч, затем фильтруют через слой целита, концентрируют и применяют на следующей стадии без дальнейшей очистки.
4-{7-[3-(4- трет- Бутилбензоиламино)-2-метилфенил]-3H-имидазо[4,5-b]пиридин-2-ил}бензойная кислота
В микроволновой пробирке, содержащей 4-трет-бутил-N-[2-метил-3-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]бензамид (122,72 мг; 0,31 ммоль; 1,20 экв.), 4-(7-хлор-3H-имидазо[4,5-b]пиридин-2-ил)бензойную кислоту (71,16 мг; 0,26 ммоль; 1,00 экв.) в пропан-2-оле (6,00 мл; 78,48 ммоль; 301,83 экв.) и воде (1,80 мл; 99,92 ммоль; 384,30 экв.) добавляют дикарбонат калия (79,05 мг; 0,57 ммоль; 2,20 экв.). Реакционную смесь дегазируют в течение 1 мин, затем добавляют тетракис(трифенилфосфин)палладий(0) (45,07 мг; 0,04 ммоль; 0,15 экв.) (на твердой подложке 0,02 ммоль/г). Реакционную смесь перемешивают при 85°C в течение 24 ч, затем ее фильтруют через слой целита и подвергают препаративной ЖХВД (0,1% NH4OH в АЦН). Собранные фракции желаемого продукта лиофилизируют с получением указанного в заголовке соединения (7,5 мг, 5,7%) в виде белого твердого вещества. ЖХВД: 98%, ВУ=2,90 мин. МС: m/z=505 [M+H]+. 1H-ЯМР (ДМСО-D6) δ 9,91 (с, 1H), 8,46 (м, 1H), 8,31 (м, 2H), 8,13 (м, 2H), 8,02 (м, 2H), 7,54 (м, 3H), 7,36 (м, 1H), 7,27 (м, 1H), 7,19 (м, 1H), 2,07 (с, 3H), 1,25 (с, 9H).
Схема 49
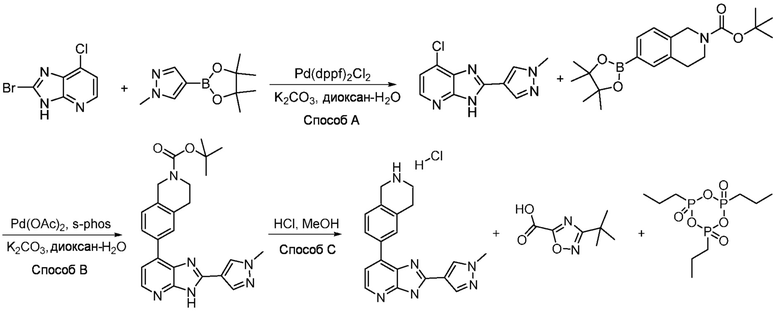
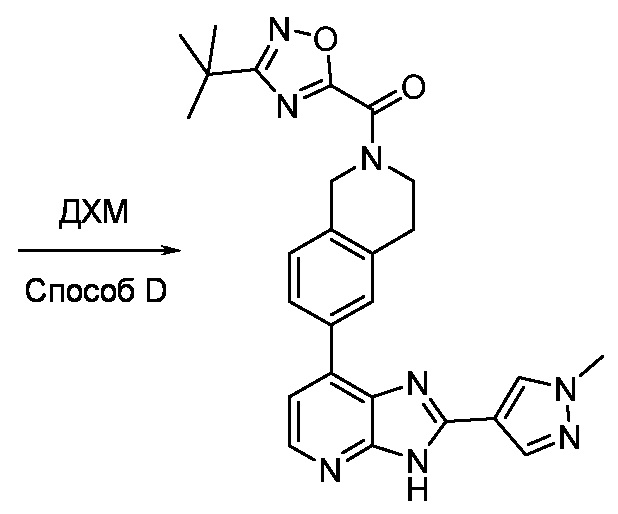
Пример 154. (3-трет-Бутил[1,2,4]оксадиазол-5-ил)-{6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-ил}метанон (154)
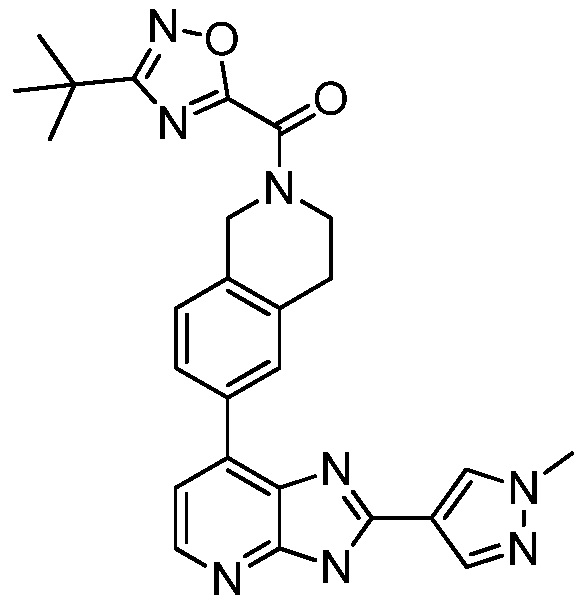
7-Хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (Способ F)
В микроволновой пробирке, содержащей 2-бром-7-хлор-3h-имидазо[4,5-b]пиридин (300,00 мг; 1,29 ммоль; 1,00 экв.), пинаколовый эфир 1-метилпиразол-4-бороновой кислоты (268,51 мг; 1,29 ммоль; 1,00 экв.), комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (105,39 мг; 0,13 ммоль; 0,10 экв.) и дикарбонат калия (535,07 мг; 3,87 ммоль; 3,00 экв.) добавляют диоксан (5,00 мл; 58,68 ммоль; 45,47 экв.) и воду (0,50 мл; 27,75 ммоль; 21,51 экв.). Пробирку вакуумируют и заполняют азотом. Реакционную смесь перемешивают при 130°C в течение 16 ч, затем ее фильтруют через слой Целита, концентрируют и применяют непосредственно на следующей стадии.
трет-Бутиловый эфир 6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (Способ G)
В микроволновой пробирке, содержащей концентрированный неочищенный 7-хлор-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (100,00 мг; 0,43 ммоль; 1,00 экв.) добавляют трет-бутиловый эфир 6-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты (230,64 мг; 0,64 ммоль; 1,50 экв.), ацетат палладия(II) (14,41 мг; 0,06 ммоль; 0,15 экв.), 2-дициклогексилфосфино-2',6'-диметоксибифенил (52,71 мг; 0,13 ммоль; 0,30 экв.), дикарбонат калия (130,13 мг; 0,94 ммоль; 2,20 экв.) в диоксане (4,00 мл; 35,21 ммоль; 82,27 экв.) и воде (1,00 мл; 41,63 ммоль; 97,28 экв.). Смесь перемешивают при 130°C в течение 24 ч, затем ее фильтруют через слой целита, сушат и переносят на следующую стадию.
Гидрохлорид 6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина (Способ H)
В круглодонной колбе, содержащей трет-бутиловый эфир 6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-карбоновую кислоту (184,25 мг; 0,43 ммоль; 1,00 экв.) добавляют метанол (6,00 мл) и хлороводород (1,10 мл; 4,28 ммоль; 10,00 экв.). Реакционную смесь перемешивают при кт в течение 16, затем ее концентрируют и применяют на следующей стадии.
(3- трет- Бутил[1,2,4]оксадиазол-5-ил)-{6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-ил}метанон (Способ I)
В круглодонной колбе, содержащей гидрохлорид 6-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-1,2,3,4-тетрагидроизохинолина (146,74 мг; 0,40 ммоль; 1,00 экв.) и 3-трет-бутил[1,2,4]оксадиазол-5-карбоновую кислоту (68,07 мг; 0,40 ммоль; 1,00 экв.) в ДХМ (3,00 мл; 46,80 ммоль; 117,00 экв.) добавляют ДИПЭА (0,53 мл; 3,20 ммоль; 8,00 экв.). После перемешивания в течение 10 мин медленно добавляют 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан, 2,4,6-триоксид (127,27 мг; 0,40 ммоль; 1,00 экв.). Смесь перемешивают в течение 30 мин, затем ее очищают основной преп. ЖХВД системой Waters (44% АЦН/H2O). Собранные фракции желаемого продукта лиофилизируют с получением указанного в заголовке соединения (52 мг, 26,7%) в виде белого твердого вещества. ЖХВД: 99%, ВУ=2,83 мин. МС: m/z=483 [M+H]+. 1H-ЯМР (ДМСО-D6) δ 8,43 (м, 1H), 8,08-8,25 (м, 3H), 7,51 (м, 1H), 4,91 (м, 2H), 4,0 (м, 5H), 3,07 (м, 2H), 1,38 (с, 9H).
Пример 155. (3-трет-Бутил[1,2,4]оксадиазол-5-ил)-{7-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-ил}метанон (155)
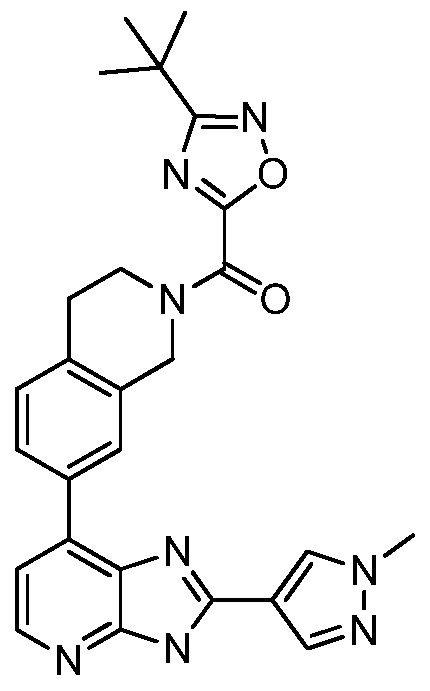
(3-трет-Бутил[1,2,4]оксадиазол-5-ил)-{7-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-3,4-дигидро-1H-изохинолин-2-ил}метанон получают из 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина, трет-бутилового эфира 7-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-карбоновой кислоты и 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты с применением способов G, H и I, в виде белого твердого вещества (50 мг, 35,7%). ЖХВД: 99%, ВУ=2,86 мин. МС: m/z=483 [M+H]+. 1H-ЯМР (ДМСО-D6) δ 8,0-8,44 (м, 4H), 7,37 (м, 2H), 5,0 (м, 2H), 3,92 (м, 5H), 3,01 (м, 2H), 1,38 (с, 9H).
Пример 156. (3-трет-Бутил[1,2,4]оксадиазол-5-ил)-{5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-1,3-дигидроизоиндол-2-ил}метанон (156)
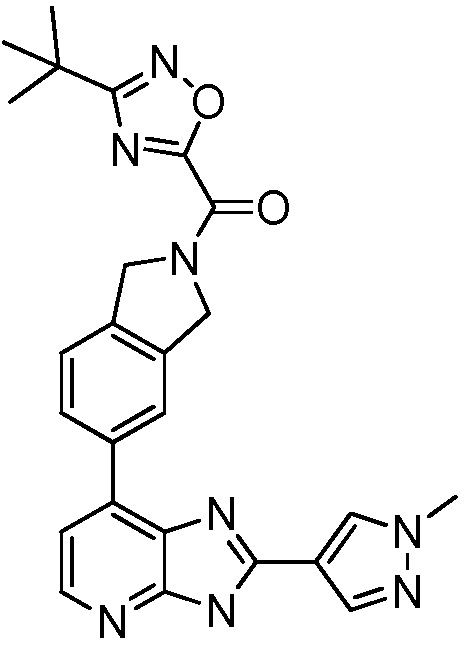
(3-трет-Бутил[1,2,4]оксадиазол-5-ил)-{5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-1,3-дигидроизоиндол-2-ил}метанон получают из 7-бром-2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридина, трет-бутил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)изоиндолин-2-карбоксилата и 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты с применением способов G, H и I в виде белого твердого вещества (14 мг, 24,7%). ЖХВД: 99%, ВУ=2,77 мин. МС: m/z=469 [M+H]+. 1H-ЯМР (ДМСО-D6) δ 8,25-8,47 (м, 4H), 8,19 (м, 1H), 7,53 (м, 1H), 7,49 (м, 1H), 5,29 (м, 2H), 5,0 (м, 2H), 4,0 (м, 3H), 1,48 (с, 9H). Эта смесь содержит два изомера.
Схема 50
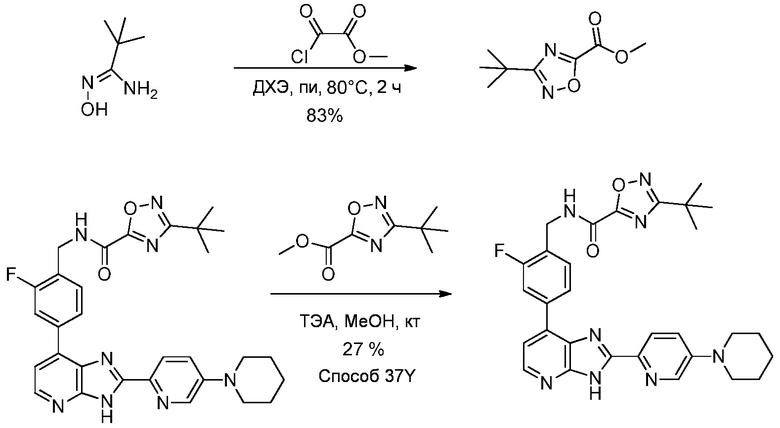
Пример 157. 3-трет-Бутил-N-[(2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид
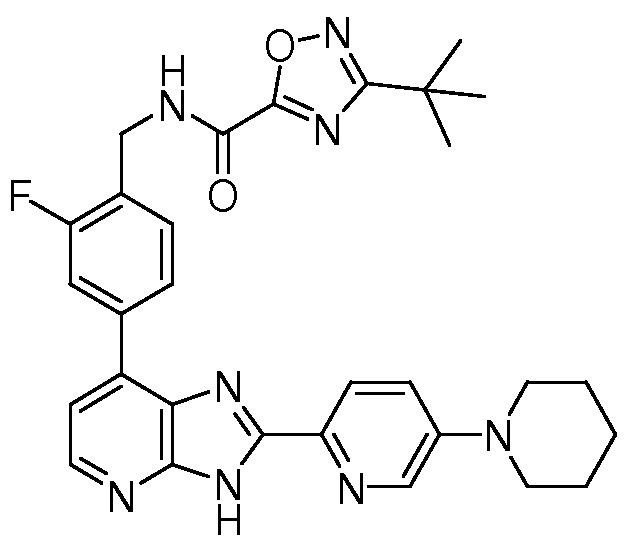
Метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилат: В 100 мл круглодонной колбе с магнитной мешалкой, (Z)-N-гидрокси-2,2-диметилпропимидамид (2 г, 16,36 ммоль, 1,00 эквив.) и пиридин (4,1 г, 51,83 ммоль, 3,17 эквив.) растворяют в ДХЭ (20 мл), туда добавляют метил 2-хлор-2-оксоацетат (2,3 г, 17,84 ммоль, 1,09 эквив.) по каплям при 0°C. Полученный раствор затем перемешивают в течение 2 ч. при 80°C. После завершения реакции, реакционную смесь разбавляют 40 мл раствора хлороводорода (2N) и экстрагируют дихлорметаном (3×40 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата в виде желтого масла (2,5 г, 83% выход). МС: m/z =185,0 [M+H]+.
3-трет-Бутил-N-[(2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид: 3-трет-бутил-N-[(2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид 13 мг (27%) получают из (2-фтор-4-[2-[5-(пиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метанамина и метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 37Y. ЖХВД: 98,9% чистота. МС: m/z=555,4 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,53 (шс, 1H), 9,92 (т, J=5,9 Гц, 1H), 8,45-8,27 (м, 3H), 8,25-8,15 (м, 2H), 7,65-7,43 (м, 3H), 4,60 (д, J=5,9 Гц, 2H), 3,32 (м, 4H), 1,69-1,59 (м, 6H), 1,37 (с, 9H).
Схема 51
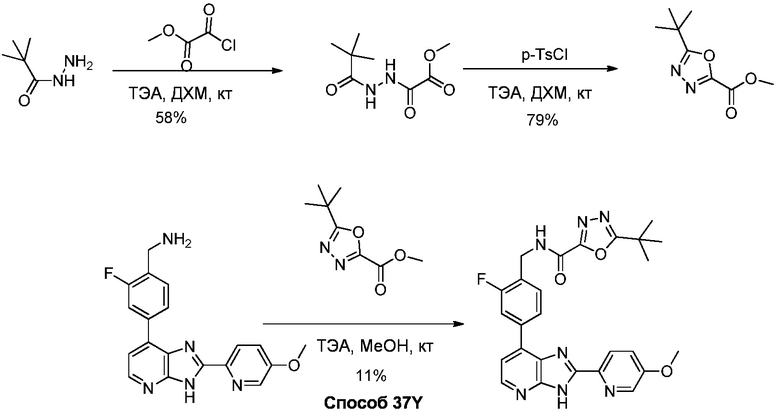
Пример 158. 5-трет-бутил-N-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,3,4-оксадиазол-2-карбоксамид
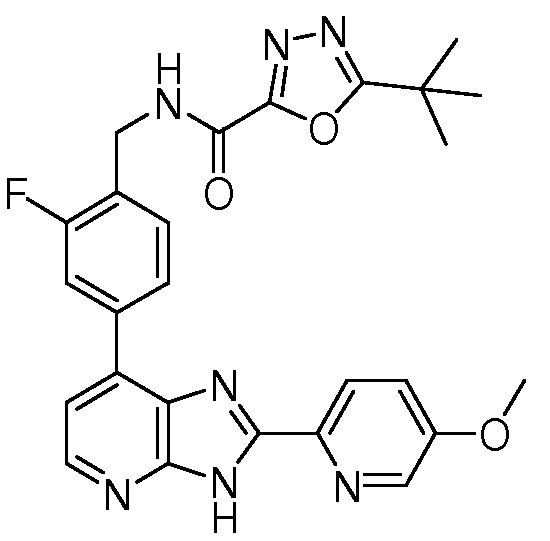
Метил 2-(2,2-диметилпропангидразидо)-2-оксоацетат: В 100 мл круглодонной колбе с магнитной мешалкой, 2,2-диметилпропангидразид (1,0 г, 8,61 ммоль, 1,00 эквив.) и ТЭА (1,132 г, 11,19 ммоль, 1,30 эквив.) растворяют в дихлорметане (20 мл), туда добавляют метил 2-хлор-2-оксоацетат (1,160 г, 9,47 ммоль, 1,10 эквив.) по каплям при 0°C. Полученную смесь нагревают до комнатной температуры и перемешивают в течение 16 ч при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 20 мл воды и экстрагируют дихлорметаном (3×40 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением метил 2-(2,2-диметилпропангидразидо)-2-оксоацетата в виде светло-желтого твердого вещества (1,01 г, 58%).
Метил 5-трет-бутил-1,3,4-оксадиазол-2-карбоксилат: В 100 мл круглодонной колбе с магнитной мешалкой, метил 2-(2,2-диметилпропангидразидо)-2-оксоацетат (900 мг, 4,45 ммоль, 1,0 эквив.) и ТЭА (585,5 мг, 5,79 ммоль, 1,30 эквив.) растворяют в дихлорметане (30 мл), туда добавляют 4-метилбензол-1-сульфонилхлорид (933,4 мг, 4,90 ммоль, 1,10 эквив.) медленно при 0°C. Полученный раствор нагревают до комнатной температуры и перемешивают в течение 12 ч при комнатной температуре. После завершения реакции, реакционную смесь разбавляют 10 мл воды и экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением метил 5-трет-бутил-1,3,4-оксадиазол-2-карбоксилата (650 мг, 79% выход) в виде желтого твердого вещества. МС: m/z =184,9 [M+H]+.
5-трет-бутил-N-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,3,4-оксадиазол-2-карбоксамид: 5-трет-бутил-N-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,3,4-оксадиазол-2-карбоксамид 10 мг (11%) получают из [2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамина и метил 5-трет-бутил-1,3,4-оксадиазол-2-карбоксилата с применением способа 37Y. ЖХВД: 97,7% чистота. МС: m/z=502,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,17 (шс, 1H), 9,90-9,87 (м, 1H), 8,48 (с, 1H), 8,38-8,36 (м, 2H), 8,32-8,29 (м,1H), 8,22-8,20 (м,1H), 7,51-7,64 (м, 3H), 4,64-4,60 (м, 2H), 3,98 (с, 3H), 1,48 (с, 9H).
Пример 159. 3-трет-бутил-N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-5-карбоксамид
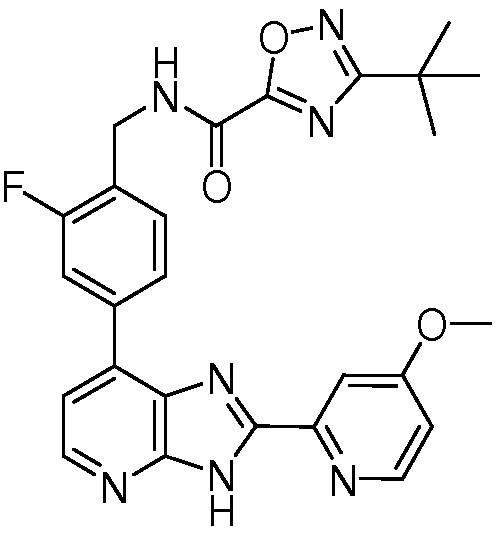
3-трет-бутил-N-([2-фтор-4-[2-(4-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-5-карбоксамид 10 мг (15% за три стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 4-метоксипиридин-2-карбальдегида и метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 15P, 19T и 37Y. ЖХВД: 95,1% чистота. МС: m/z=502,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,89 (шс, 1H), 9,94 (м, 1H), 8,60-8,58 (м, 1H), 8,43-8,42 (м, 1H), 8,30-8,20 (м, 2H), 7,90-7,89 (м, 1H), 7,63-7,59 (м, 2H), 7,18-7,16 (м, 1H), 4,62-4,60 (м, 2H), 3,96 (с, 3H), 1,36 (с, 9H).
Схема 52
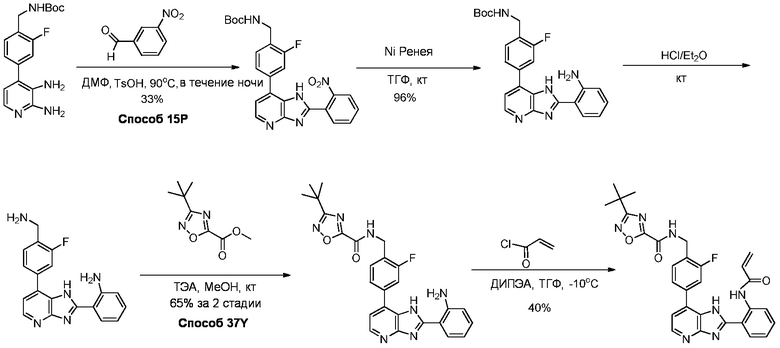
Пример 160. 3-трет-бутил-N-[(2-фтор-4-[2-[2-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид
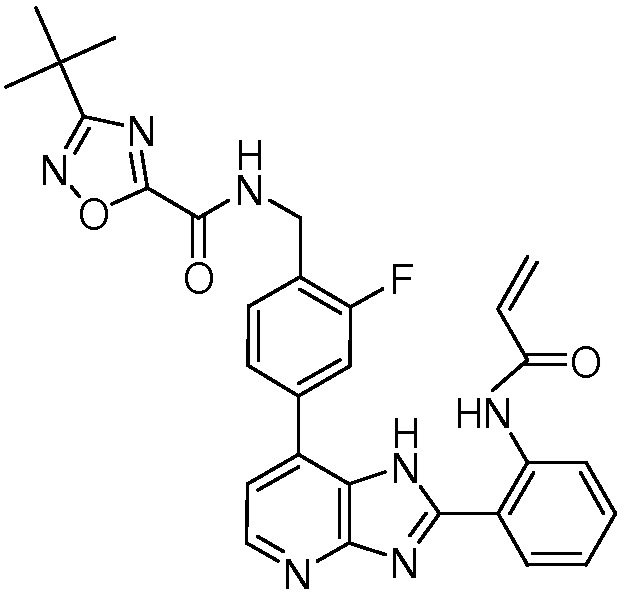
трет-Бутил N-([2-фтор-4-[2-(2-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат: трет-бутил N-([2-фтор-4-[2-(2-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат 100 мг (33%) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 2-нитробензальдегида с применением способа 15P. МС: m/z=464,2 [M+H]+.
трет-Бутил N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамат: в 25 мл круглодонной колбе с магнитной мешалкой, Ni Ренея (20 мг, 0,23 ммоль, 1,00 эквив.) добавляют к раствору трет-бутил N-([2-фтор-4-[2-(2-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамата (100 мг, 0,22 ммоль, 1,00 эквив.) в тетрагидрофуране (5 мл) в атмосфере азота при комнатной температуре. Реакционную колбу затем вакуумируют и ополаскивают водородом. Реакционную смесь гидрируют при комнатной температуре в течение 2 часов в атмосфере водорода с применением водородного баллона. После завершения реакции, реакционную смесь фильтруют через слой целита и концентрируют при пониженном давлении с получением трет-бутил N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамата (90 мг, 96%) в виде желтого масла. МС: m/z=434,2 [M+H]+.
2-[7-[4-(Аминометил)-3-фторфенил]-3H-имидазо[4,5-b]пиридин-2-ил]анилин): В 25 мл круглодонной колбе с магнитной мешалкой, трет-бутил N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамат (85 мг, 0,20 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (5 мл), туда добавляют раствор HCl в Et2O (4N, 30 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение 1 ч. при комнатной температуре. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением 2-[7-[4-(аминометил)-3-фторфенил]-3H-имидазо[4,5-b]пиридин-2-ил]анилина (80 мг, неочищенный) в виде желтого твердого вещества. МС: m/z=334,2 [M+H]+.
N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид: N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид 60 мг (65% за две стадии) получают из 2-[7-[4-(аминометил)-3-фторфенил]-3H-имидазо[4,5-b]пиридин-2-ил]анилина и метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 37Y. МС: m/z=486,3 [M+H]+.
3-трет-бутил-N-[(2-фтор-4-[2-[2-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид: В 25 мл круглодонной колбе, N-([4-[2-(2-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид (45 мг, 0,09 ммоль, 1,00 эквив.) и ДИЭА (12,6 мг, 0,10 ммоль, 1,05 эквив.) растворяют в тетрагидрофуране (5 мл), туда добавляют проп-2-еноилхлорид (8,8 мг, 0,10 ммоль, 1,05 эквив.) по каплям при -10°C. Полученный раствор затем перемешивают в течение 0,5 ч. при -10°C. После завершения реакции, реакционную смесь разбавляют 30 мл воды и экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп-ЖХВД в следующих условиях: колонка, S XBridge C18 OBD Prep Колонка, 5 мкм, 19 мм×250 мм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 52% до 62% градиент за 8 мин; определитель, УФ 254 нм. 3-трет-бутил-N-[(2-фтор-4-[2-[2-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид (20 мг, 40%) получают в виде желтого твердого вещества. ЖХВД: 95,9% чистота. МС: m/z=540,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,20 (шс,1H), 10,00-9,99 (м, 1H), 8,80-8,78 (м, 1H), 8,45-8,43 (м, 1H), 8,34-8,32 (м, 1H), 8,05-8,03(м, 2H), 7,64-7,50 (м, 3H), 7,3
Пример 161. 3-трет-бутил-N-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-5-карбоксамид
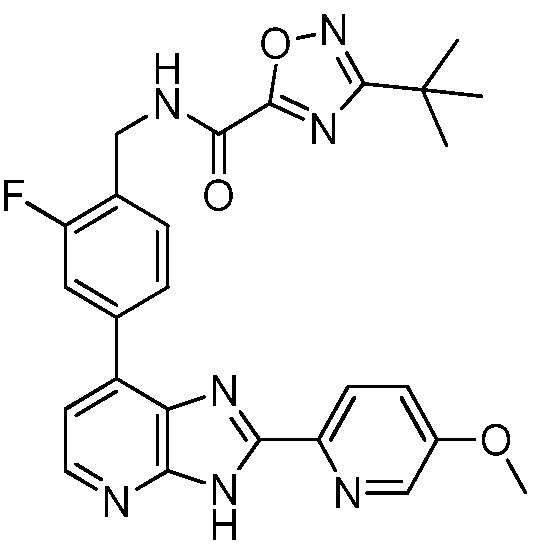
3-трет-Бутил-N-([2-фтор-4-[2-(5-метоксипиридин-2-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-1,2,4-оксадиазол-5-карбоксамид 23,4 мг (25% за 3 стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-метоксипиридин-2-карбальдегида, HCl в MeOH и метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 15P, 19T и 37Y. ЖХВД: 97,6% чистота. МС: m/z=502,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,75 (шс, 1H), 9,96-9,92 (м, 1H), 8,47 (с, 1H), 8,46-8,36 (м, 2H), 8,36-8,30 (м, 1H), 8,21 (д, J=8,0 Гц, 1H), 7,64-7,58 (м, 3H), 4,61 (д, J=6,0 Гц, 2H), 3,95 (с, 3H), 1,37 (с, 9H).
Схема 53
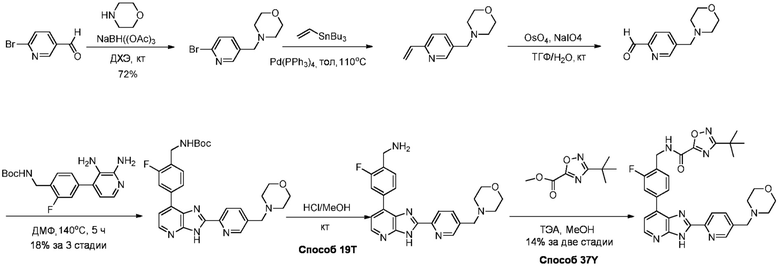
Пример 162. 3-трет-бутил-N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид
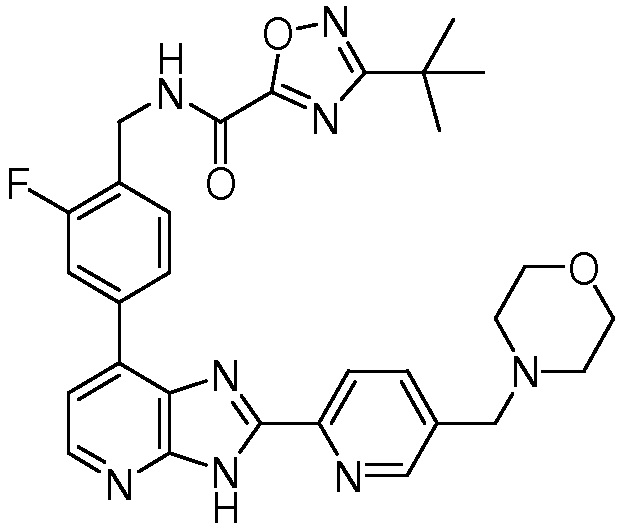
4-[(6-бромпиридин-3-ил)метил]морфолин: В 50 мл круглодонной колбе, 6-бромпиридин-3-карбальдегид (1,200 г, 6,45 ммоль, 1,00 эквив.) и морфолин (843 мг, 9,68 ммоль, 1,50 эквив.) растворяют в 1,2-дихлорэтане (15 мл), затем туда добавляют NaBH(OAc)3 (4,102 г, 19,35 ммоль, 3,00 эквив.) и уксусную кислоту (416 мг, 10,35 ммоль 1,07 эквив.) при 0°C. Полученный раствор нагревают до комнатной температуры и перемешивают в течение 5 ч. при комнатной температуре. После завершения реакции, ее гасят добавлением 20 мл насыщ. раствора бикарбоната натрия и значение pH полученной смеси доводят до 9 с применением раствора гидроксида натрия (1M). Смесь затем экстрагируют этилацетатом (3×30 мл), и органические слои объединяют, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 50% градиент) с получением 4-[(6-бромпиридин-3-ил)метил]морфолина (1,2 г, 72%) в виде светло-желтого твердого вещества.
4-[(6-этенилпиридин-3-ил)метил]морфолин: В 50 мл круглодонной колбе, продутой и имеющей инертную атмосферу азота, 4-[(6-бромпиридин-3-ил)метил]морфолин (256 мг, 1,00 ммоль, 1,00 эквив.), трибутил(этенил)станнан (748 мг, 2,24 ммоль, 1,52 эквив.) и Pd(PPh3)4 (181 мг, 0,14 ммоль, 0,10 эквив., 90%) смешивают в толуоле (6 мл) при комнатной температуре. Полученную смесь затем перемешивают в течение ночи при 110°C. После завершения реакции, реакционную смесь разбавляют водой (50 мл) и экстрагируют дихлорметаном (3×150 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением 4-[(6-этенилпиридин-3-ил)метил]морфолина (310 мг, неочищенный) в виде желтого масла. МС: m/z=205,0 [M+H]+.
5-(морфолин-4-илметил)пиридин-2-карбальдегид: В 25 мл круглодонной колбе, 4-[(6-этенилпиридин-3-ил)метил]морфолин (179,8 мг, 0,88 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (5 мл), затем туда добавляют NaIO4 (1300 мг, 5,77 ммоль, 4,00 эквив.) и суспензию OsO4 (284 мг, 1,18 ммоль, 1,27 эквив.) в воде (1 мл). Полученную смесь затем перемешивают в течение 2 дней при комнатной температуре. После завершения реакции, ее гасят добавлением 10 мл Na2S2O3, и смесь экстрагируют дихлорметаном (3×15 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 5-(морфолин-4-илметил)пиридин-2-карбальдегида (300 мг, неочищенный) в виде коричневого масла.
Трет-бутил N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-1H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамат: В 10 мл пробирке с магнитной мешалкой трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамат (135 мг, 0,41 ммоль, 1,08 эквив.) и 5-(морфолин-4-илметил)пиридин-2-карбальдегид (77 мг, 0,37 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (2 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 5 ч. при 140°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением трет-бутил N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-1H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамата (55 мг, 18% за 3 стадии) в виде желтого твердого вещества. МС: m/z=519,5 [M+H]+.
3-трет-бутил-N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид: 3-трет-бутил-N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид 5 мг (14% за две стадии) получают из трет-бутил N-[(2-фтор-4-[2-[5-(морфолин-4-илметил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамата, метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 19T и 37Y. ЖХВД: 98,9% чистота. МС: m/z=571,3 [M+H]+. 1H ЯМР (300 МГц, ДМСО-d6): 13,89 (шс, 1H), 9,94 (т, J=5,9 Гц, 1H), 8,72-8,64 (м, 1H), 8,45-8,16 (м, 4H), 7,96 (дд, J=8,1, 2,1 Гц, 1H), 7,63-7,59 (м, 2H), 4,61 (д, J=5,9 Гц, 2H), 3,64-3,55 (м, 6H), 2,41 (т, J=4,5 Гц, 4H), 1,37 (с, 9H).
Схема 54
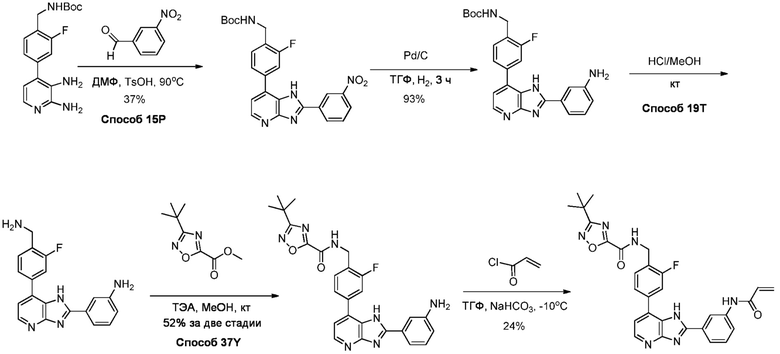
Пример 163. 3-трет-бутил-N-[(2-фтор-4-[2-[3-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид
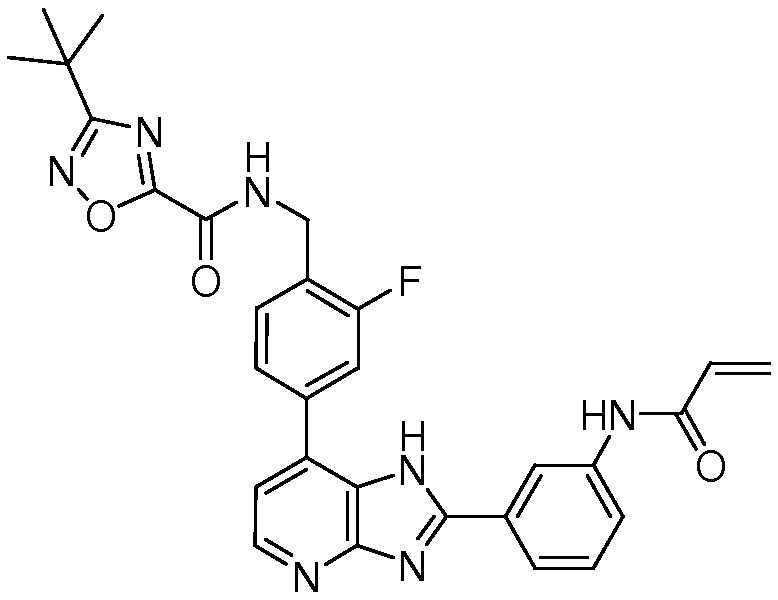
трет-Бутил N-([2-фтор-4-[2-(3-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат: трет-Бутил N-([2-фтор-4-[2-(3-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат 156 мг (37%) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата и 3-нитробензальдегида с применением способа 15P. МС: m/z=464,2 [M+H]+.
трет-бутил N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамат: При комнатной температуре, в 25 мл круглодонной колбе, трет-бутил N-([2-фтор-4-[2-(3-нитрофенил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)карбамат (120,0 мг, 0,26 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (6 мл), туда добавляют палладий на угле (10%, 27,5 мг, 0,03 ммоль, 0,10 эквив.) в атмосфере азота. Реакционную колбу затем вакуумируют и ополаскивают водородом. Реакционную смесь гидрируют при комнатной температуре в течение 3 часов в атмосфере водорода с применением водородного баллона. После завершения реакции, реакционную смесь фильтруют через слой целита и концентрируют при пониженном давлении с получением трет-бутил N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамата 105 мг (93%) в виде желтого твердого вещества. МС: m/z=434,0 [M+H]+.
N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид: N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид 70 мг (52% за две стадии) получают из трет-бутил N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)карбамата, HCl в MeOH и метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 19T и 37Y. МС: m/z=486,1 [M+H]+.
3-трет-бутил-N-[(2-фтор-4-[2-[3-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид: В 25 мл круглодонной колбе, N-([4-[2-(3-аминофенил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил]метил)-3-трет-бутил-1,2,4-оксадиазол-5-карбоксамид (60,0 мг, 0,12 ммоль, 1,00 эквив.) и ДИЭА (16,0 мг, 0,12 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (6 мл), туда добавляют проп-2-еноилхлорид (11,19 мг, 0,12 ммоль, 1,00 эквив.) по каплям при -10°C. Полученную смесь затем перемешивают в течение 1 ч. при -10°C. После завершения реакции, ее гасят добавлением 10 мл воды и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД с применением следующих условий: колонка, XBridge BEH130 Prep C18 OBD Column, 19*100 мм 5 мкм 13 нм; подвижная фаза, ацетонитрил в воде (с 10 мМ NH4HCO3), от 43% до 53% градиент за 9 мин; определитель, УФ 254 нм. 3-трет-бутил-N-[(2-фтор-4-[2-[3-(проп-2-енамидо)фенил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-5-карбоксамид (16 мг, 24%) получают в виде белого твердого вещества. ЖХВД: 99,2% чистота. МС: m/z=540,3 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,74 (шс, 1H), 10,41 (с, 1H), 9,98-9,95 (м, 1H), 8,40-8,38 (м, 1H), 8,28-8,25 (м, 1H), 8,18-8,17 (м, 2H), 7,96-7,94 (м, 2H), 7,63-7,51 (м, 3H), 6,53-6,46 (м, 1H), 6,33-6,28 (м, 1H), 5,82-5,79 (м, 1H), 4,62-4,61 (м, 2H), 1,53 (с, 9H).
Пример 164. 3-трет-бутил-N-[(4-[2-[5-(4,4-дифторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-5-карбоксамид
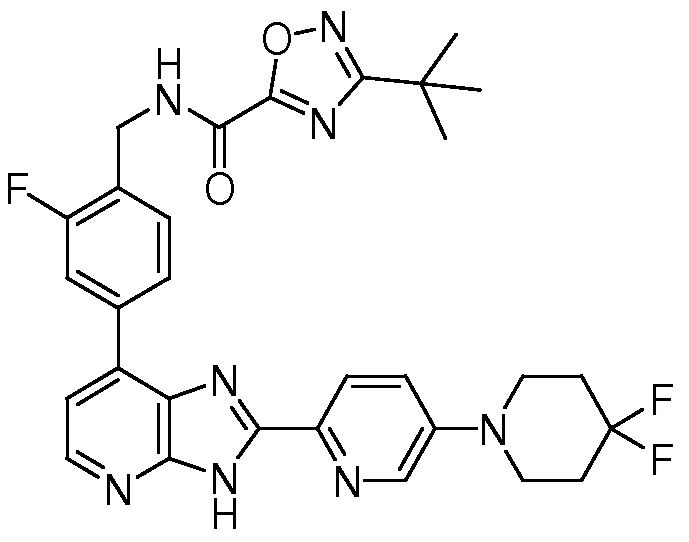
3-трет-бутил-N-[(4-[2-[5-(4,4-дифторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,2,4-оксадиазол-5-карбоксамид 7,4 мг (8%) получают из (4-[2-[5-(4,4-дифторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метанамина, метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 37Y. ЖХВД: 93,0% чистота. МС: m/z=591,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,61 (шс, 1H), 10,05-9,95 (м, 1H), 8,34 (с, 1H), 8,38-8,28 (м, 2H), 8,25-8,15 (м, 2H), 7,65-7,55 (м, 3H), 4,60 (д, J=6,0 Гц, 2H), 3,59-3,56 (м, 4H), 2,2,0-2,02 (м, 4H), 1,37 (с, 9H).
Схема 55
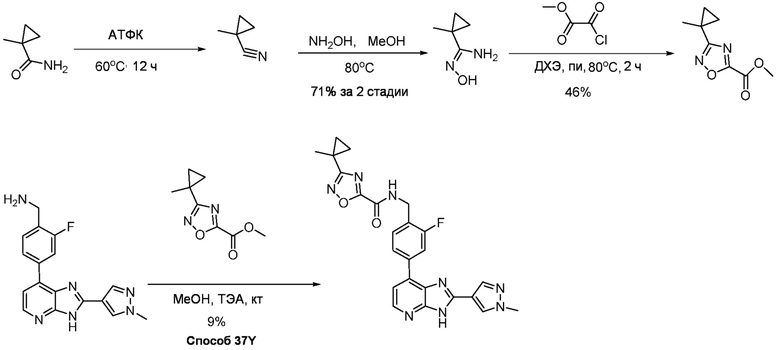
Пример 165. N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксамид
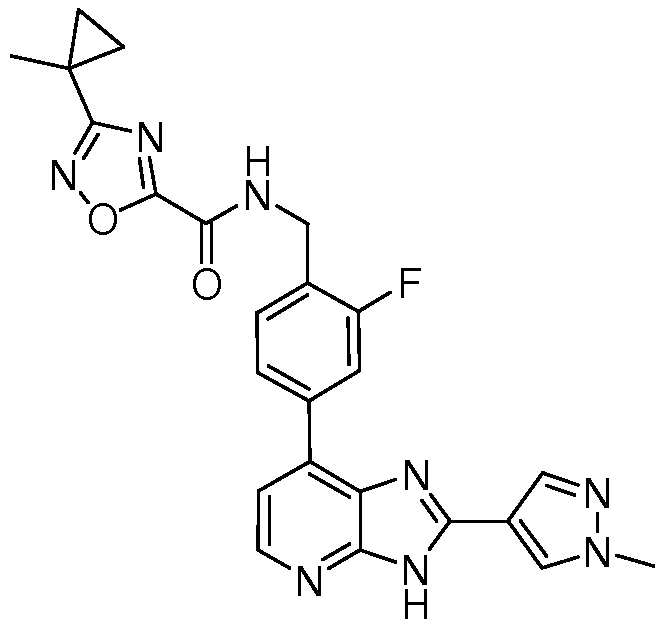
1-Метилциклопропан-1-карбoнитрил: В 30 мл герметично закрытой пробирке, 1-метилциклопропан-1-карбоксамид (800 мг, 8,07 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (20 мл), туда добавляют АТФК (8,4 г, 39,99 ммоль, 4,96 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 12 ч. при 60°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток растворяют в 5 мл воды. Значение pH полученной смеси доводят до 8 с применением насыщ. раствора бикарбоната натрия и смесь экстрагируют дихлорметаном (3×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 1-метилциклопропан-1-карбoнитрил (2 г, неочищенный) в виде желтого масла.
(Z)-N-гидрокси-1-метилциклопроп-1-карбоксимидамид: В 50 мл круглодонной колбе, 1-метилциклопропан-1-карбoнитрил (1,6 г, 0. 2 ммоль, 1,00 эквив.) растворяют в этаноле (20 мл), туда добавляют раствор гидроксиламина (1 г, 0,3 ммоль, 1,54 эквив.) в MeOH при комнатной температуре. Полученный раствор затем перемешивают в течение ночи при 80°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении с получением (Z)-N-гидрокси-1-метилциклопроп-1-карбоксимидамида (700 мг, 71% за 2 стадии) в виде желтого масла.
Метил 3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксилат: В 25 мл круглодонной колбе, (Z)-N-гидрокси-1-метилциклопроп-1-карбоксимидамид (544 мг, 4,77 ммоль, 1,00 эквив.) и пиридин (1,4 г, 17,70 ммоль, 3,71 эквив.) растворяют в ДХЭ (10 мл), туда добавляют метил 2-хлор-2-оксоацетат (853,4 мг, 6,97 ммоль, 1,46 эквив.) по каплям при 0°C. Полученную смесь перемешивают в течение 0,5 ч. при комнатной температуре и затем нагревают до 80°C и перемешивают в течение еще 2 ч. при 80°C. После завершения реакции, ее гасят 10 мл воды и смесь экстрагируют дихлорметаном (3×10 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением метил 3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксилата (400 мг, 46%) в виде желтого масла.
N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксамид: N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)-3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксамид 10 мг (9%) получают из [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамина, метила 3-(1-метилциклопропил)-1,2,4-оксадиазол-5-карбоксилата с применением способа 37Y. ЖХВД: 96,9% чистота. МС: m/z=473,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,39 (шс, 1H), 9,88-9,86 (м, 1H), 8,44 (с, 1H), 8,29-8,25 (м, 2H), 8,15-8,13 (м, 2H), 7,55-7,53 (м, 2H), 4,58-4,56 (м, 2H), 3,95 (с, 3H), 1,49 (с, 3H), 1,19-1,18 (м, 2H), 1,00-0,99 (м, 2H).
Схема 56
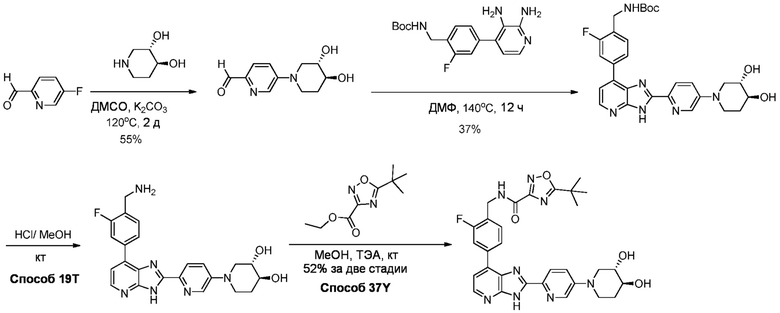
Пример 166. 3-трет-бутил-N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-5-карбоксамид
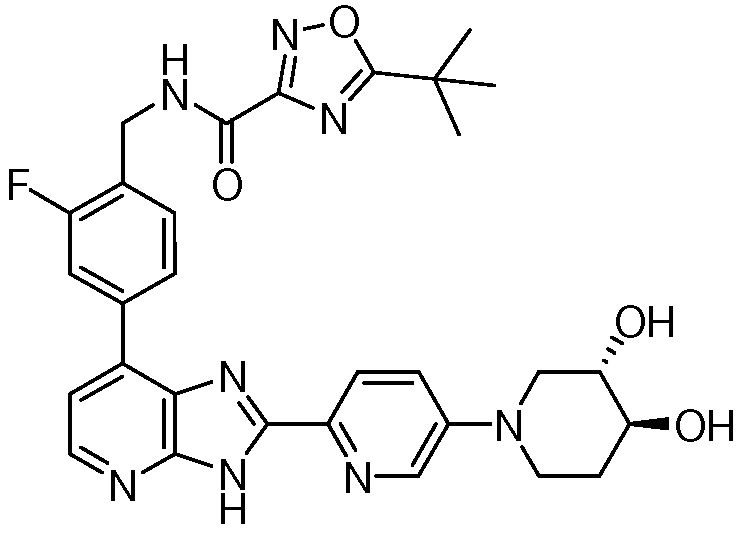
5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-карбальдегид: В 30 мл герметично закрытой пробирке, 5-фторпиридин-2-карбальдегид (300 мг, 2,28 ммоль, 1,00 эквив.) и (3S,4S)-пиперидин-3,4-диол (281 мг, 2,28 ммоль, 1,00 эквив.) растворяют в ДМСО (5 мл), туда добавляют карбонат калия (993 мг, 6,83 ммоль, 3,00 эквив.) при комнатной температуре. Полученную смесь затем перемешивают в течение 2 дней при 120°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток разбавляют 50 мл H2O. Полученную смесь экстрагируют этилацетатом (3×50 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметан (от 1% до 10% градиент) с получением 5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-карбальдегид (280 мг, 55%) в виде желтого масла. МС: m/z=223,0 [M+H]+.
N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]карбамат: В 20 мл пробирке, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамат (135 мг, 0,41 ммоль, 1,00 эквив.) и 5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-карбальдегид (95 мг, 0,43 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (3 мл) при комнатной температуре. Полученный раствор затем перемешивают в течение 12 ч. при 140°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении, и остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением трет-бутил N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]карбамата (80 мг, 37%) в виде желтого твердого вещества. МС: m/z=535,1 [M+H]+.
3-трет-бутил-N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-5-карбоксамид: 3-трет-бутил-N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]-1,2,4-оксадиазол-5-карбоксамид 29,1 мг (52% за две стадии) получают из трет-бутил N-[[4-(2-[5-[(3S,4S)-3,4-дигидроксипиперидин-1-ил]пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил)-2-фторфенил]метил]карбамата, метил 3-трет-бутил-1,2,4-оксадиазол-5-карбоксилата с применением способа 19T и 37Y. ЖХВД: 95,3% чистота. МС: m/z =587,3 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,54 (шс, 1H), 9,92 (т, J=6,0 Гц, 1H), 8,44-8,26 (м, 3H), 8,25-8,14 (м, 2H), 7,65-7,42 (м, 3H), 5,03 (д, J=4,1 Гц, 1H), 4,87 (д, J=4,0 Гц, 1H), 4,60 (д, J=5,9 Гц, 2H), 3,84-3,68 (м, 2H), 3,41-3,40 (м, 2H), 3,12-2,98 (м, 1H), 2,88-2,86 (м, 1H), 1,93 (д, J=13,1 Гц, 1H), 1,46-1,45 (м, 1H), 1,37 (с, 9H).
Схема 57

Пример 167. 5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид
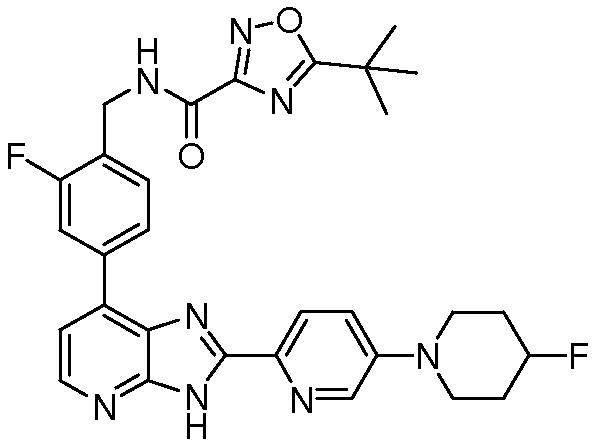
5-(4-фторпиперидин-1-ил)пиридин-2-карбальдегид: В 8 мл пробирке, 5-фторпиридин-2-карбальдегид (300 мг, 2,28 ммоль, 1,00 эквив.) и 4-фторпиперидин (243 мг, 2,24 ммоль, 0,98 эквив.) растворяют в N,N-диметилформамиде (3 мл), туда добавляют карбонат калия (993,6 мг, 6,83 ммоль, 3,00 эквив.) при комнатной температуре. Полученную смесь затем перемешивают в течение ночи при 120°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток разбавляют 50 мл H2O. Полученную смесь экстрагируют этилацетатом (3×50 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением 5-(4-фторпиперидин-1-ил)пиридин-2-карбальдегида 300 мг (63%) в виде коричневого твердого вещества. МС: m/z=209,0 [M+H]+.
трет-бутил N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамат: В 8 мл пробирке, трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамат (108 мг, 0,32 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (2 мл), туда добавляют 5-(4-фторпиперидин-1-ил)пиридин-2-карбальдегид (67,5 мг, 0,32 ммоль, 1,00 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 11 ч. при 140°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении и остаток очищают на колонке с силикагелем, элюируя метанолом в дихлорметане (от 1% до 10% градиент) с получением трет-бутил N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамата (150 мг, 71%) в виде коричневого твердого вещества. МС: m/z=521,2 [M+H]+.
5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид: 5-трет-бутил-N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 21,9 мг (20,3% за две стадии) получают из трет-бутил N-[(2-фтор-4-[2-[5-(4-фторпиперидин-1-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамата, этила 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 19T и 37Y. ЖХВД: 93,0% чистота. МС: m/z=573,2 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,58 (шс, 1H), 9,55 (м, 1H), 8,47 (с, 1H), 8,34-8,30 (м, 2H), 8,23-8,18 (м, 2H), 7,58-7,52 (м, 3H), 4,99-4,75 (м, 1H), 4,59 (д, J=6,0 Гц, 2H), 3,65-3,51 (м, 2H), 3,43-3,37 (м, 2H), 2,09-1,95 (м, 2H), 1,88-1,75 (м, 2H), 1,44 (с, 9H).
Схема 58
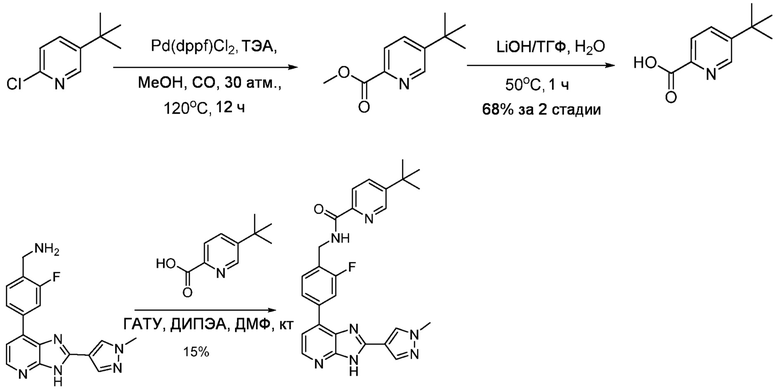
Пример 168. 5-трет-бутил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)пиридин-2-карбоксамид
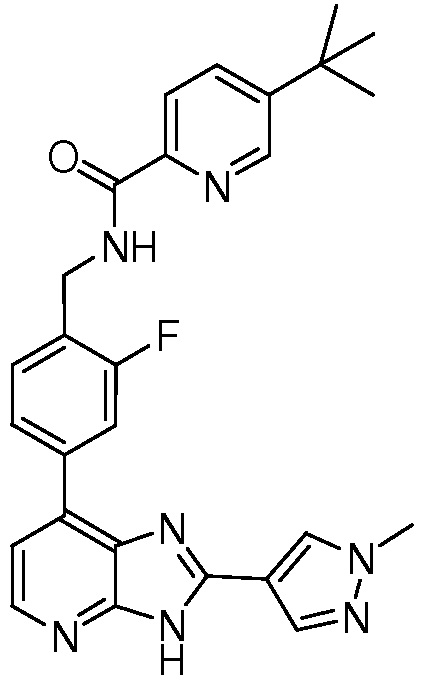
Метил 5-трет-бутилпиридин-2-карбоксилат: В 25 мл резервуаре под давлением, 5-трет-бутил-2-хлорпиридин (100 мг, 0,59 ммоль, 1,00 эквив.) растворяют в 10 мл MeOH, затем туда добавляют Pd(dppf)Cl2.CH2Cl2 (10 мг, 0,01 ммоль, 0,02 эквив.) и ТЭА (121 мг, 1,20 ммоль, 1,00 эквив.) при комнатной температуре. Полученную смесь продувают азотом в течение 5 минут, и затем помещают под давление окиси углерода 30 атм. при 120°C и перемешивают в течение 12 часов при 120°C. После завершения реакции, реакционную смесь охлаждают до комнатной температуры и фильтруют с удалением нерастворимого твердого вещества. Фильтрат концентрируют при пониженном давлении с получением метил 5-трет-бутилпиридин-2-карбоксилата (110 мг, неочищенный) в виде желтого твердого вещества. МС: m/z=194,0[M+H]+.
5-трет-бутилпиридин-2-карбоновая кислота: В 50 мл круглодонной колбе, метил 5-трет-бутилпиридин-2-карбоксилат (90 мг, 0,47 ммоль, 1,00 эквив.) растворяют в смеси тетрагидрофурана и воды (2:1, 3 мл), туда добавляют LiOH (40 мг, 1,67 ммоль, 3,59 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение 1 ч. при 50°C. После завершения реакции, реакционную смесь концентрируют при пониженном давлении. Значение рН оставшегося раствора доводят до 6 с применением раствора HCl (1M), и полученный раствор экстрагируют этилацетатом (3×30 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 5-трет-бутилпиридин-2-карбоновой кислоты (60 мг, 68% за 2 стадии) в виде желтого масла. МС: m/z=180,0[M+H]+.
5-трет-бутил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)пиридин-2-карбоксамид: В 50 мл круглодонной колбе, [2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метанамин (90 мг, 0,28 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (15 мл), затем туда добавляют 5-трет-бутилпиридин-2-карбоновую кислоту (60,3 мг, 0,34 ммоль, 1,21 эквив.), ГАТУ (176 мг, 0,46 ммоль, 1,66 эквив.) и ДИЭА (120 мг, 0,93 ммоль, 3,33 эквив.) последовательно, при комнатной температуре. Полученный раствор затем перемешивают в течение ночи при комнатной температуре. После завершения реакции, ее гасят добавлением воды (5 мл) и полученную смесь экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают преп. ЖХВД в следующих условиях: колонка, XBridge Shield RP18 OBD Column, 5 мкм, 19*150 мм; подвижная фаза, MeCN в воде (с 10 мМ NH4HCO3), от 40% до 57% градиент за 6 мин; определитель, УФ 254 нм 5-трет-бутил-N-([2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]фенил]метил)пиридин-2-карбоксамид (20 мг, 15%) получают в виде белого твердого вещества. ЖХВД: 95,5% чистота. МС: m/z=484,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,42 (шс, 1H), 9,35 (м, 1H), 8,73-8,72 (м, 1H), 8,44 (с, 1H), 8,27 (м, 2H), 8,13 (с, 2H), 8,02-8,00 (м, 2H), 7,48 (м, 2H), 4,64-4,62 (м, 2H), 3,94 (с, 3H), 1,36 (с, 9H).
Пример 169. 5-трет-бутил-N-[(2-фтор-4-[2-[5-(1-метилпиперидин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид
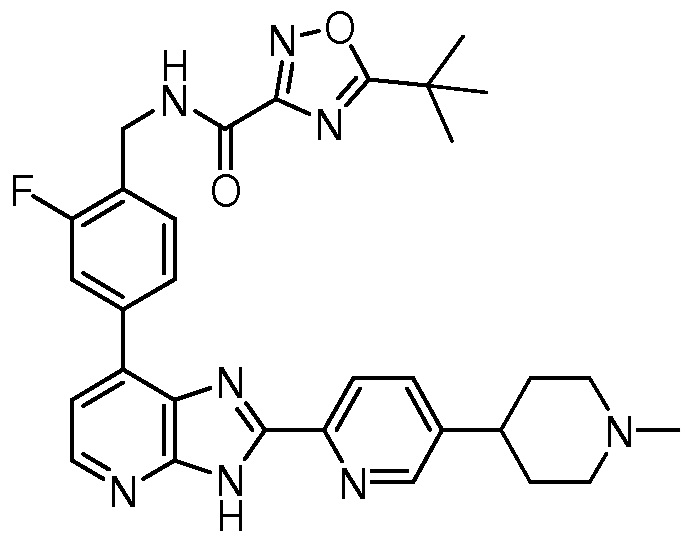
5-трет-бутил-N-[(2-фтор-4-[2-[5-(1-метилпиперидин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]-1,2,4-оксадиазол-3-карбоксамид 4,6 мг (6% за три стадии) получают из трет-бутил N-[(2-фтор-4-[2-[5-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]фенил)метил]карбамата, этила 5-трет-бутил-1,2,4-оксадиазол-3-карбоксилата с применением способа 1G, 19T и 37Y. ЖХВД: 98,0% чистота. МС: m/z=569,7 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 13,59 (шс, 1H), 9,55 (т, J=5,9 Гц, 1H), 8,67 (д, J=2,1 Гц, 1H), 8,67 (с, 1H), 8,41-8,33 (м, 4H), 8,00-7,81 (м, 1H), 8,00-7,81 (м, 1H), 7,70-7,41 (м, 2H), 4,68-4,50 (м, 2H), 3,04-2,78 (м, 2H), 2,77-2,56 (м, 1H), 2,21 (с, 3H), 2,10-1,86 (м, 2H), 1,90-1,63 (м, 4H), 1,43 (с, 9H).
Схема 59

Пример 170. 8-циклопропил-4-[(4-[2-[5-(2,3-дигидроксипропокси)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-метилфенил)метил]-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
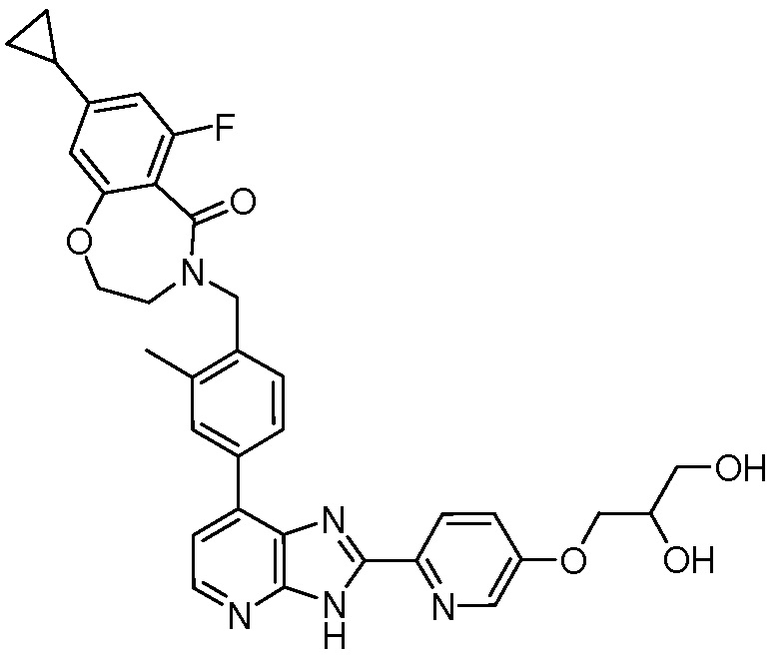
5-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]пиридин-2-карбальдегид: В 50 мл круглодонной колбе, 5-фторпиридин-2-карбальдегид (560 мг, 4,48 ммоль, 1,00 эквив.) и (2,2-диметил-1,3-диоксолан-4-ил)метанол (2,96 г, 22,40 ммоль, 5,00 эквив.) смешивают в ДХЭ (8,00 мл, 101,05 ммоль, 22,57 эквив.) при комнатной температуре. Полученный раствор затем перемешивают в течение ночи при 80°C. Когда реакция завершится, ее гасят добавлением насыщ. раствора NH4Cl (200 мл), и полученную смесь экстрагируют этилацетатом (3×150 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 400 мг (38%) 5-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]пиридин-2-карбальдегида в виде светло-желтого масла. МС: m/z=238,2 [M+H]+.
5-(2,3-дигидроксипропокси)пиридин-2-карбальдегид: 5-(2,3-дигидроксипропокси) пиридин-2-карбальдегид 160 мг (90%) получают из 5-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]пиридин-2-карбальдегида с применением способа 19T. МС: m/z=198,0 [M+H]+.
4-[(4-бром-2-метилфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он: В 100 мл круглодонной колбе с магнитной мешалкой, 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (540 мг, 2,44 ммоль, 1,00 эквив.) растворяют в N,N-диметилформамиде (10 мл), туда добавляют гидрид натрия (216 мг, 5,40 ммоль, 2,21 эквив., 60%) порциями при 0°C. Смесь перемешивают при 0°C в течение 10 мин и медленно добавляют 4-бром-1-(бромметил)-2-метилбензол (853,6 мг, 3,23 ммоль, 1,32 эквив.) при 0°C. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1 ч. при комнатной температуре. После завершения реакции, ее гасят добавлением 20 мл насыщ. раствора NH4Cl, и смесь экстрагируют этилацетатом (3×50 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 1% до 20% градиент) с получением 4-[(4-бром-2-метилфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (900 мг, 90%) в виде белого твердого вещества. МС: m/z=404,0 [M+H]+.
8-циклопропил-4-[(4-[2-[5-(2,3-дигидроксипропокси)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-метилфенил)метил]-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он: 8-циклопропил-4-[(4-[2-[5-(2,3-дигидроксипропокси)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-метилфенил)метил]-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 20 мг (16% за четыре стадии) получают из 4-[(4-бром-2-метилфенил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она, 4-хлор-3-нитропиридин-2-амина, 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана, 5-(2,3-дигидроксипропокси)пиридин-2-карбальдегида с применением способа 19R, 2J, 1G, 15P. ЖХВД: 97,6% чистота. МС: m/z=610,3 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 8,47 (д, J=2,9 Гц, 1H), 8,45-8,30 (м, 2H), 8,31-8,10 (м, 2H), 7,71-7,63 (м, 1H), 7,60-7,52 (м, 1H), 7,49-7,37 (м, 1H), 6,78-6,77 (м, 1H), 6,70 (с, 1H), 4,86 (с, 2H), 4,35-4,02 (м, 4H), 3,79-3,78 (м, 2H), 3,32-3,31 (м, 5H), 2,05-1,99 (м, 1H), 1,08-0,89 (м, 2H), 0,85-0,70 (м, 2H).
Схема 60
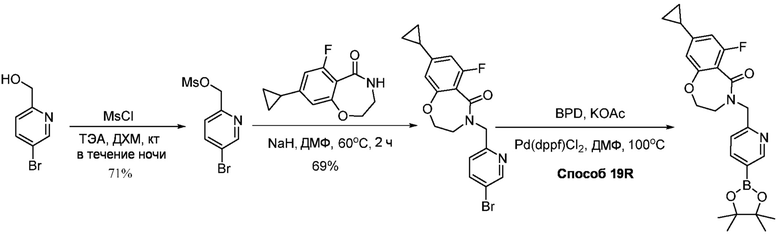
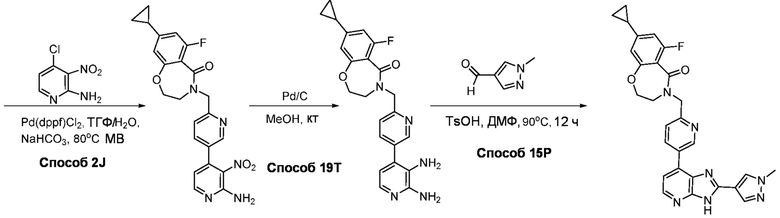
Пример 171. 8-циклопропил-6-фтор-4-([5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он
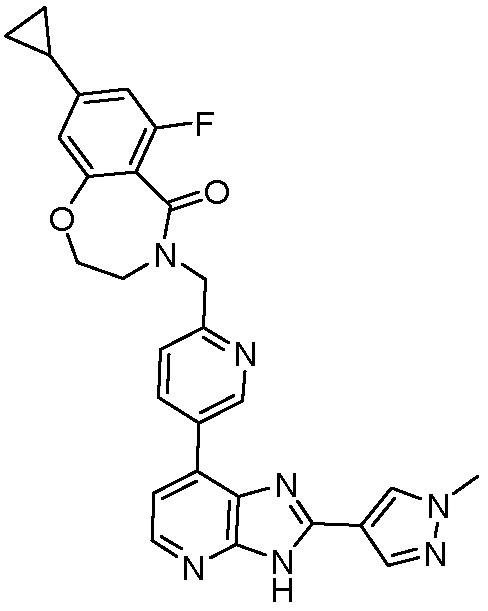
(5-бромпиридин-2-ил)метил метансульфонат: В 50 мл круглодонной колбе, (5-бромпиридин-2-ил)метанол (500 мг, 2,66 ммоль, 1,00 эквив.) и ТЭА (210 мг, 2,08 ммоль, 1,00 эквив.) растворяют в дихлорметане (10 мл), туда медленно добавляют метансульфонилхлорид (300 мг, 2,62 ммоль, 1,00 эквив.) при 0°C. Полученный раствор затем перемешивают в течение ночи при комнатной температуре. После завершения реакции, ее гасят 20 мл воды и полученную смесь экстрагируют дихлорметаном (3×20 мл). Органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении с получением (5-бромпиридин-2-ил)метил метансульфоната (500 мг, 71%) в виде желтого масла.
4-[(5-бромпиридин-2-ил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он: В 50 мл круглодонной колбе, 8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он (180 мг, 0,81 ммоль, 1,00 эквив.) растворяют в тетрагидрофуране (5 мл), туда добавляют гидрид натрия (60% в масле, 72 мг, 1,80 ммоль, 2,21 эквив.) порциями при 0°C. Полученную смесь перемешивают в течение 1 ч. при комнатной температуре и затем охлаждают до 0°C и добавляют (5-бромпиридин-2-ил)метил метансульфонат (360 мг, 1,35 ммоль, 1,66 эквив.). Реакционную смесь перемешивают в течение 2 ч. при 60°C. После завершения реакции, ее гасят добавлением 20 мл воды, и значение pH полученной смеси доводят до 4 с применением раствора хлороводорода (3M). Смесь экстрагируют этилацетатом (3×20 мл), и органические слои объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают на колонке с силикагелем, элюируя этилацетатом в петролейном эфире (от 5% до 30% градиент) с получением 4-[(5-бромпиридин-2-ил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она (220 мг, 69%) в виде белого твердого вещества. МС: m/z=391,1 [M+H]+.
8-циклопропил-6-фтор-4-([5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он: 8-циклопропил-6-фтор-4-([5-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]пиридин-2-ил]метил)-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-он 20 мг (17% за четыре стадии) получают из 4-[(5-бромпиридин-2-ил)метил]-8-циклопропил-6-фтор-2,3,4,5-тетрагидро-1,4-бензоксазепин-5-она, 4,4,5,5-тетраметил-2-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана, 4-хлор-3-нитропиридин-2-амина, 1-метил-1H-пиразол-4-карбальдегида с применением способа 19R, 2J, 1G и 15P. ЖХВД: 99,5% чистота. МС: m/z=510,2 [M+H]+. 1H-ЯМР (400 МГц, ДМСО-d6): δ 13,45 (шс, 1H), 9,52 (д, J=4,8 Гц, 1H), 8,72 (с, 1H), 8,48 (с, 1H), 8,33 (д, J=5,2 Гц, 1H), 8,16 (с, 1H), 7,70-7,35 (м, 2H), 6,83 (дд, J=11,4, 1,6 Гц, 1H), 6,80-6,51 (м, 1H), 4,93 (с, 2H), 4,30 (т, J=5,5 Гц, 2H), 3,95 (с, 3H), 3,69 (т, J=5,4 Гц, 2H).
Пример 172. 5-трет-бутил-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,3,4-оксадиазол-2-карбоксамид
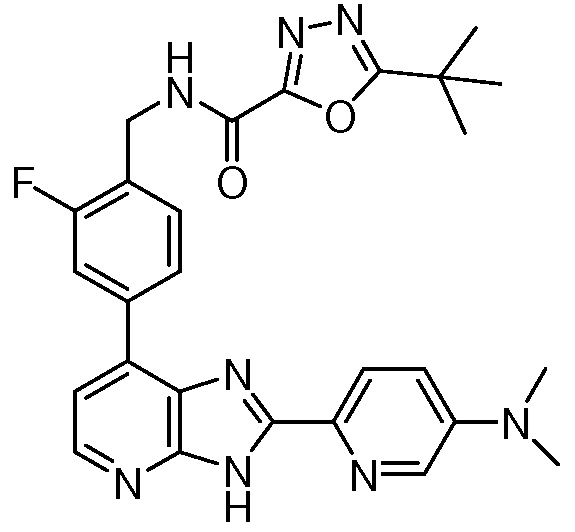
5-трет-бутил-N-[(4-[2-[5-(диметиламино)пиридин-2-ил]-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторфенил)метил]-1,3,4-оксадиазол-2-карбоксамид 8 мг (5,5% за три стадии) получают из трет-бутил N-[[4-(2,3-диаминопиридин-4-ил)-2-фторфенил]метил]карбамата, 5-(диметиламино)пиридин-2-карбальдегида и метил 5-трет-бутил-1,3,4-оксадиазол-2-карбоксилата с применением способа 15P, 19T и 37Y. ЖХВД: 98,1% чистота. МС: m/z=515,1 [M+H]+. 1H-ЯМР (300 МГц, ДМСО-d6): δ 9,87 (с, 1H), 8,49-8,25 (м, 2H), 8,25-8,01 (м, 3H), 7,66-7,39 (м, 2H), 7,36-7,06 (м, 1H), 4,59 (д, J=5,0 Гц, 2H), 3,06 (с, 6H), 1,40 (с, 9H).
Пример 173. N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1-(пиридин-3-ил)метанамин
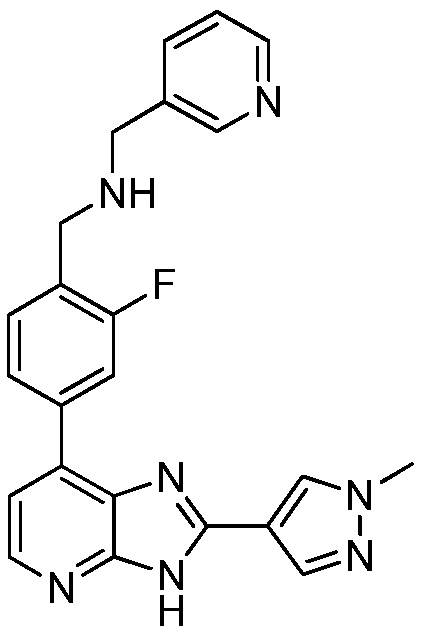
В реакционную пробирку добавляют гидрохлорид 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.), метанол (2 мл), пиридин-3-карбальдегид (7,12 мкл; 0,08 ммоль; 1,00 экв.) и ТЭА (31,74 мкл; 0,23 ммоль; 3,00 экв.). Реакционную смесь нагревают до 60°C и перемешивают в течение ночи. ЖХМС в 20 ч показывает завершение реакции. Реакционную смесь выливают в насыщенный NaHCO3 (10 мл) и экстрагируют этилацетатом (2×10 мл). Объединенные органические фазы концентрируют. Неочищенный продукт очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-50% B в течение более 15 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 3 мг (10%) N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-1-(пиридин-3-ил)метанамина в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 414 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4): δ 8,60 (с, 1H), 8,49 (с, 1H), 8,36 (м, 2H), 8,20 (с, 1H), 7,93 (д, 1H), 7,87 (шс, 1H), 7,65 (т, 1H), 7,49-7,39 (м, 2H), 4,02 (с, 3H), 3,99 (с, 2H), 3,94 (с, 2H).
Пример 174. N-(3,4-дифторбензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамин
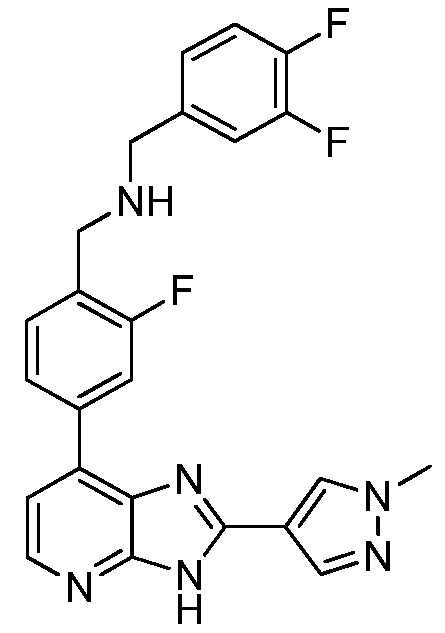
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в метаноле (2 мл) добавляют 3,4-дифтор-бензальдегид (8,39 мкл; 0,08 ммоль; 1,00 экв.) и ТЭА (31,74 мкл; 0,23 ммоль; 3,00 экв.). Реакционную смесь нагревают до 60°C и перемешивают в течение ночи. ЖХМС в 20 ч. показывает завершение реакции. Реакционную смесь выливают в насыщенный NaHCO3 (10 мл) и экстрагируют этилацетатом (2×10 мл). Объединенные органические фазы концентрируют. Неочищенный продукт очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 60% B в течение более 15 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 3 мг (9%) N-(3,4-дифторбензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамина в виде белого твердого вещества. ЖХВД: 92% чистота. МС: 449 [M+H]+. 1H ЯМР (400 МГц, Метанол-d4): δ 8,36 (шс, 2H), 8,21 (с, 1H), 7,89 (шс, 2H), 7,64 (т, 1H), 7,43 (шс, 1H), 7,35 (т, 1H), 7,30-7,16 (м, 2H), 4,03 (с, 3H), 3,93 (с, 2H), 3,83 (с, 2H).
Пример 175. N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-4-метилбензолсульфонамид
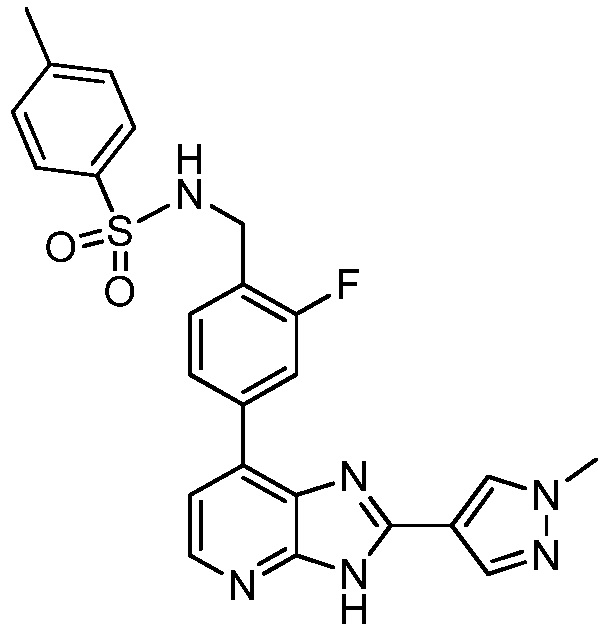
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в АЦН (2 мл) добавляют ДИПЭА (39,66 мкл; 0,23 ммоль; 3,00 экв.) и 4-метилбензолсульфонилхлорид (15,92 мг; 0,08 ммоль; 1,10 экв.). Реакционную смесь перемешивают при комнатной температуре. Реакционную смесь концентрируют, и полученное полутвердое вещество растирают с этилацетатом (3,0 мл). Фильтрация дает 26 мг N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)-4-метилбензолсульфонамида в виде беловатого твердого вещества после высокого вакуума. ЖХВД: 90% чистота. МС: 477 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,43 (с, 1H), 9,15 (шс, 2H), 8,47 (с, 1H), 8,30 (с, 1H), 8,21 (м, 2H), 8,16 (с, 1H), 8,10 (д, 1H), 7,73 (д, 2H), 7,51 (м, 2H), 7,39 (д, 2H), 4,10 (д, 2H), 3,97 (с, 3H), 2,36 (с, 3H).
Пример 176. N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамид
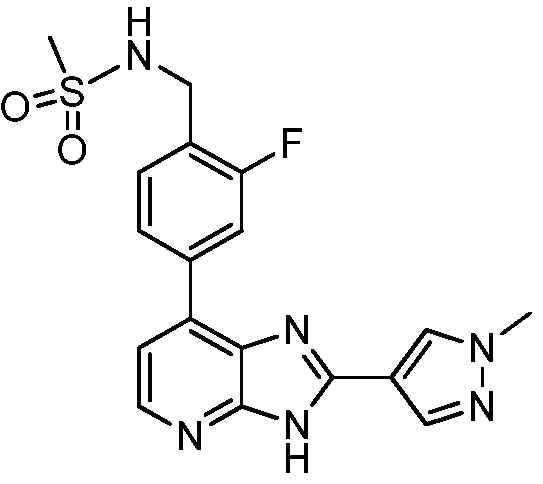
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в АЦН (2 мл) добавляют ДИПЭА (39,66 мкл; 0,23 ммоль; 3,00 экв.) и метанeсульфонилхлорид (8,81 мкл; 0,11 ммоль; 1,50 экв.). Реакционную смесь перемешивают при комнатной температуре. ЖХМС через 16 ч показывает завершение реакции. Реакционную смесь частично концентрируют и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-45% B в течение более 12 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 9 мг N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамида в виде белого твердого вещества. ЖХВД: 97% чистота. МС: 401 [M+H]+. 1H ЯМР (500 МГц, ДМСО-d6) δ 13,39 (с, 1H), 8,46 (с, 1H), 8,32-8,26 (м, 2H), 8,19 (д, 1H), 8,14 (с, 1H), 7,67 (т, 1H), 7,62 (т, 1H), 7,55 (д, 1H), 4,30 (д, 2H), 3,95 (с, 3H), 2,95 (с, 3H).
Пример 177. 1-(1-(цианометил)циклопропил)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамид
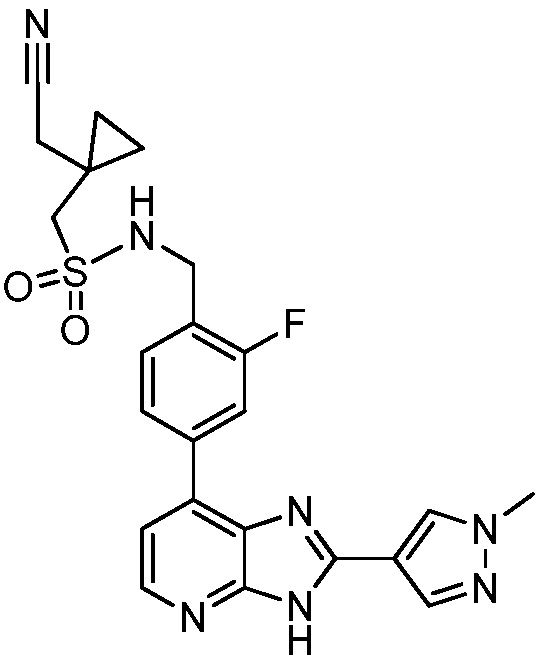
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в ДМФ (2 мл) добавляют ДИПЭА (39,66 мкл; 0,23 ммоль; 3,00 экв.) и (1-цианометилциклопропил)метансульфонилхлорид (22,05 мг; 0,11 ммоль; 1,50 экв.). Реакционную смесь перемешивают при комнатной температуре. ЖХМС в 2 ч показывает завершение реакции. Реакционную смесь частично концентрируют и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-50% B в течение более 10 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 23 мг (63%) 1-(1-(цианометил)циклопропил)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамида в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 480 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,41 (с, 1H), 8,47 (с, 1H), 8,31 (д, 2H), 8,21 (д, 1H), 8,16 (с, 1H), 7,89 (шс, 1H), 7,64 (т, 1H), 7,57 (шс, 1H), 4,32 (с, 2H), 3,97 (с, 3H), 3,22 (с, 2H), 2,85 (с, 2H), 0,82 (с, 2H), 0,71 (с, 2H).
Пример 178. 2-циклобутил-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)этансульфонамид
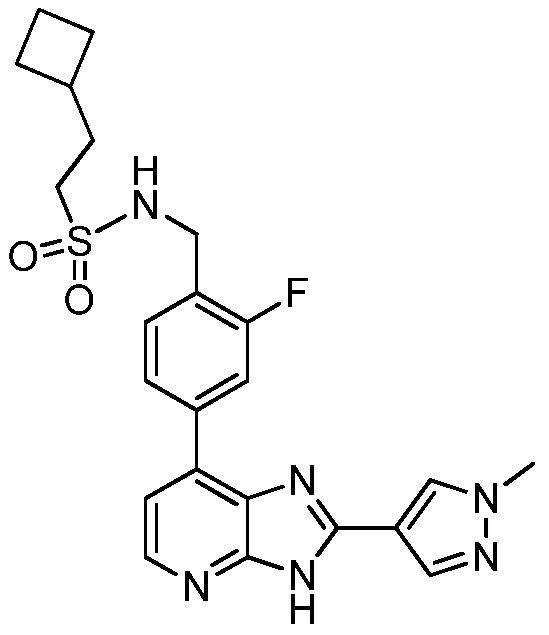
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в ДМФ (2 мл) добавляют ДИПЭА (39,66 мкл; 0,23 ммоль; 3,00 экв.) и 2-циклобутилэтансульфонилхлорид (20,80 мг; 0,11 ммоль; 1,50 экв.). Реакционную смесь перемешивают при комнатной температуре. ЖХМС в 2 ч показывает завершение реакции. Реакционную смесь частично концентрируют и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-55% B в течение более 12 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 7 мг (20%) 2-циклобутил-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)этансульфонамида в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 469 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,41 (с, 1H), 8,46 (с, 1H), 8,31 (м, 2H), 8,21 (д, 1H), 8,16 (с, 1H), 7,72 (шс, 1H), 7,62 (т, 1H), 7,56 (шс, 1H), 4,30 (с, 2H), 3,97 (с, 3H), 2,90 (т, 2H), 2,30 (м, 1H), 1,99 (шс, 2H), 1,75 (м, 4H), 1,55 (м, 2H).
Пример 179. 1-(1,1-диоксидотетрагидро-2H-тиопиран-3-ил)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамид
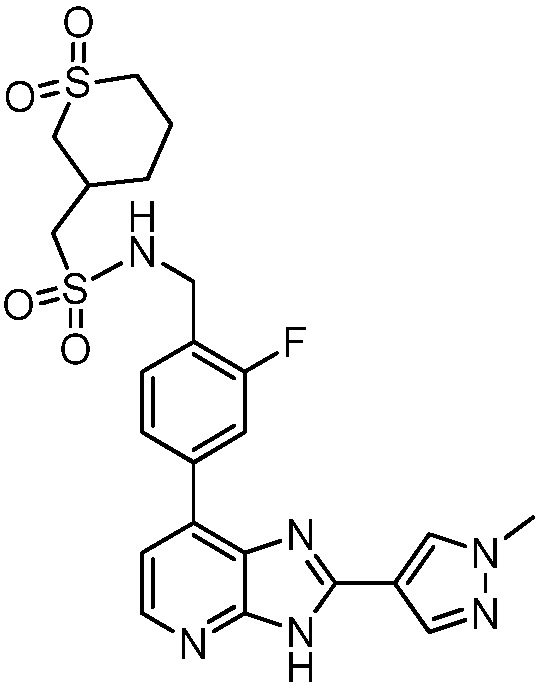
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в ДМФ (2 мл) добавляют ДИПЭА (39,66 мкл; 0,23 ммоль; 3,00 экв.) и (1,1-диоксогексагидро-1лямбда6-тиопиран-3-ил)метанeсульфонилхлорид (28,09 мг; 0,11 ммоль; 1,50 экв.). Реакционную смесь перемешивают при комнатной температуре. ЖХМС в 2 ч показывает завершение реакции. Реакционную смесь частично концентрируют и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-55% B в течение более 12 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 16 мг (40%) 1-(1,1-диоксидотетрагидро-2H-тиопиран-3-ил)-N-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)бензил)метансульфонамида в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 533 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,41 (с, 1H), 8,46 (с, 1H), 8,31 (м, 2H), 8,21 (д, 1H), 8,16 (с, 1H), 7,96 (т, 1H), 7,64 (т, 1H), 7,56 (д, 1H), 4,31 (д, 2H), 3,96 (с, 3H), 3,29-2,96 (м, 7H), 2,05 (м, 1H), 1,92 (м, 1H), 1,84 (м, 1H), 1,35 (м, 1H).
Пример 180. N-(3-(трет-бутил)бензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамин
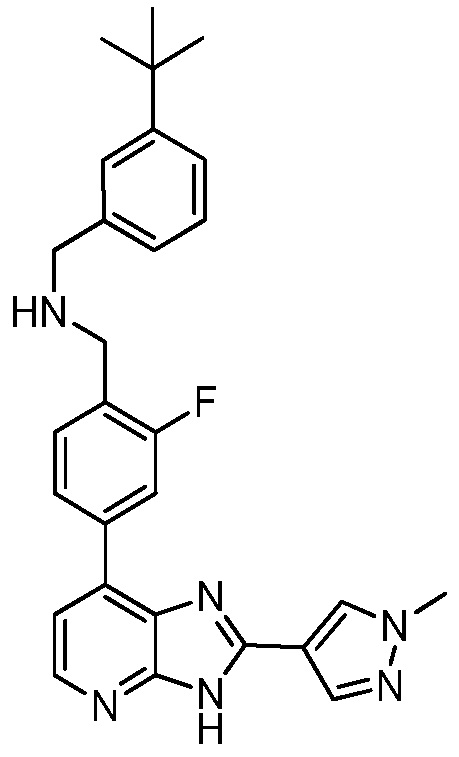
К раствору гидрохлорида 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (30,00 мг; 0,08 ммоль; 1,00 экв.) в ДХЭ (1,5мл) добавляют ДИПЭА (37,73 мкл; 0,23 ммоль; 3,00 экв.). Перемешиваемый раствор затем обрабатывают 3-трет-бутилбензальдегидом (12,31 мг; 0,08 ммоль; 1,00 экв.) в ДХЭ (0,5 мл), затем триацетоксиборгидридом натрия (24,13 мг; 0,11 ммоль; 1,50 экв.). Реакционную смесь перемешивают при комнатной температуре в атмосфере N2. Через 16 ч реакционную смесь разбавляют ДХМ (20 мл) и промывают насыщенным бикарбонатом натрия (2×10мл). Слой ДХМ сушат (MgSO4), фильтруют и концентрируют с получением 30 мг золотистой пленки. Неочищенный продукт повторно растворяют в ДМСО (2,0 мл) и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-55% B в течение более 15 мин при 60 мл/мин). Фракции продукта лиофилизируют с получением 11 мг (31%) N-(3-(трет-бутил)бензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамина в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 469 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,40 (с, 1H), 8,46 (с, 1H), 8,28 (м, 2H), 8,18 (м, 2H), 7,70 (т, 1H), 7,55 (шс, 1H), 7,42 (с, 1H), 7,30-7,23 (м, 2H), 7,19 (шс, 1H), 3,97 (с, 3H), 3,83 (с, 2H), 3,77 (с, 2H), 1,30 (с, 9H).
Пример 181. N-(4-(трет-бутил)бензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамин

В 8 мл реакционной пробирке с магнитной мешалкой гидрохлорид 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламина (2) (50,00 мг; 0,13 ммоль; 1,00 экв.) суспендируют в ДМФ (2,0 мл) и обрабатывают ДИПЭА (88,14 мкл; 0,51 ммоль; 4,00 экв.). Гомогенный перемешиваемый раствор затем нагревают при 75 градусах Цельсия и обрабатывают 4-трет-бутилбензилбромидом (28,73 мг; 0,13 ммоль; 1,00 экв.) в ДМФ (1,0 мл) в атмосфере азота. Реакционную смесь перемешивают при 75 градусах Цельсия. Через 3 ч. реакционную смесь частично концентрируют и очищают непосредственно преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 15-55% B в течение более 15 мин при 60 мл/мин). Фракции продукта лиофилизируют с получением 10 мг (17%) N-(4-(трет-бутил)бензил)-1-(2-фтор-4-(2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил)фенил)метанамина в виде белого твердого вещества. ЖХВД: 100% чистота. МС: 469 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6): δ 13,39 (с, 1H), 8,46 (с, 1H), 8,34-8,23 (м, 2H), 8,17 (м, 2H), 7,70 (т, 1H), 7,56 (шс, 1H), 7,40-7,26 (м, 4H), 3,96 (с, 3H), 3,82 (с, 2H), 3,73 (с, 2H), 1,29 (с, 9H).
Пример 182. 2-Фтор-4-(2-трифторметил-3H-имидазо[4,5-b]пиридин-7-ил)-бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
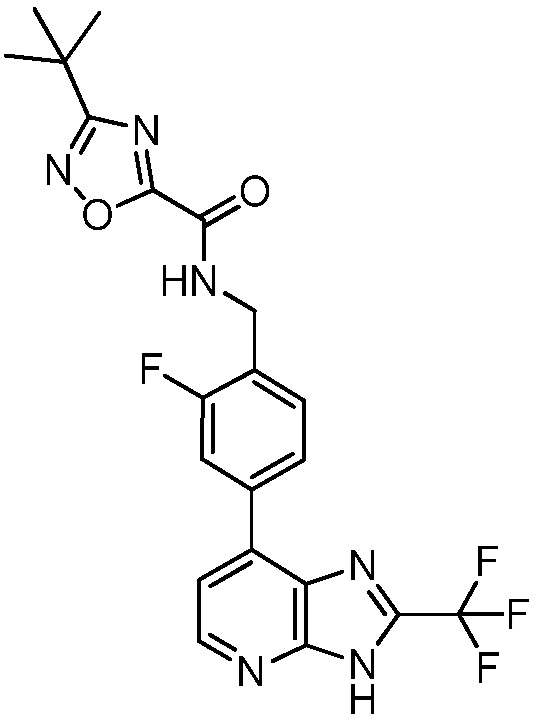
В 20 мл пробирку помещают 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (75,00 мг; 0,20 ммоль; 1,00 экв.), трифторуксусную кислоту (16,43 мкл; 0,21 ммоль; 1,10 экв.), диоксан (7,00 мл), ДИПЭА (136,30 мкл; 0,78 ммоль; 4,00 экв.) и 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (232,29 мкл; 0,39 ммоль; 2,00 экв.). Полученный раствор перемешивают в течение ночи при 110°C. ЖХМС в 20 ч. показала, что реакция не завершена. Добавляют еще трифторуксусную кислоту (16,43 мкл; 0,21 ммоль; 1,10 экв.) и 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (232,29 мкл; 0,39 ммоль; 2,00 экв.), и реакционную смесь снова перемешивают в течение ночи при 110°C. ЖХМС через 20 ч. показала завершение реакции. Реакционную смесь концентрируют, растворяют в ДМСО и очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 15-90% B в течение более 17 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 55 мг (61%) 2-фтор-4-(2-трифторметил-3H-имидазо[4,5-b]пиридин-7-ил)бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты в виде белого твердого вещества. ЖХВД: 92% чистота. МС: 463 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 14,93 (шс, 1H), 9,92 (с, 1H), 8,61 (с, 1H), 8,18 (м, 2H), 7,77 (шс, 1H), 7,64 (т, 1H), 4,62 (д, 2H), 1,38 (с, 9H).
Пример 183. 2-фтор-4-(2-изобутил-3H-имидазо[4,5-b]пиридин-7-ил)бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
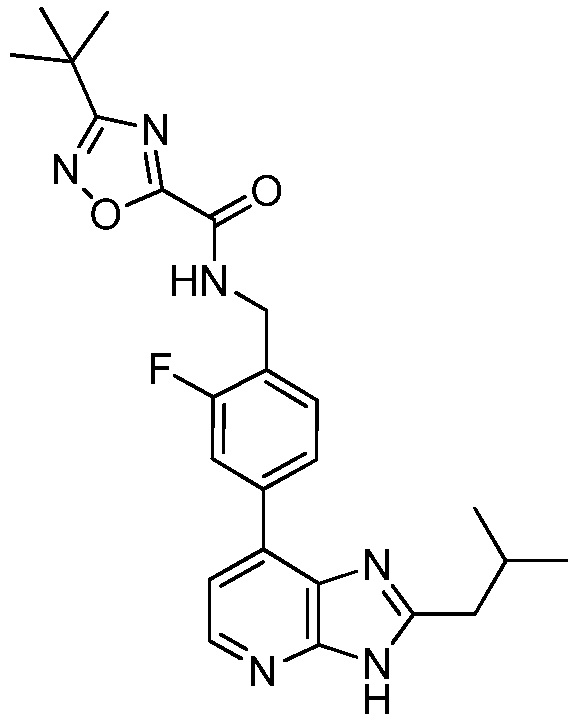
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (75,00 мг; 0,20 ммоль; 1,00 экв.), изовалеральдегид (0,02 мл; 0,20 ммоль; 1,00 экв.) и ДМФ (2,00 мл; 25,84 ммоль; 132,46 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. ЖХМС в 22 ч. показала полное превращение исходного материала в желаемый продукт. Реакционную смесь сразу загружают в SiO2 и очищают флэш-хроматографией (Biotage, SiO2, 80-100% этилацетат/гексан). Фракции продукта концентрируют, растворяют в ДМСО (2 мл) и очищают через преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 15-60% B в течение более 15 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 40,5 мг (46%) 2-фтор-4-(2-изобутил-3H-имидазо[4,5-b]пиридин-7-ил)бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты в виде светло-желтого твердого вещества. МС: 452 [M+H]+. ЖХВД: 97% чистота. 1H ЯМР (400 МГц, ДМСО-d6) δ 12,97 (с, 1H), 9,90 (т, 1H), 8,29 (д, 1H), 8,26 (дд, 1H), 8,12 (дд, 1H), 7,57 (т, 2H), 7,53 (д, 1H), 4,59 (д, 2H), 2,76 (д, 2H), 1,38 (с, 9H), 0,97 (д, 6H).
Пример 184. 2-Фтор-4-(2-изопропил-3H-имидазо[4,5-b]пиридин-7-ил) бензил 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
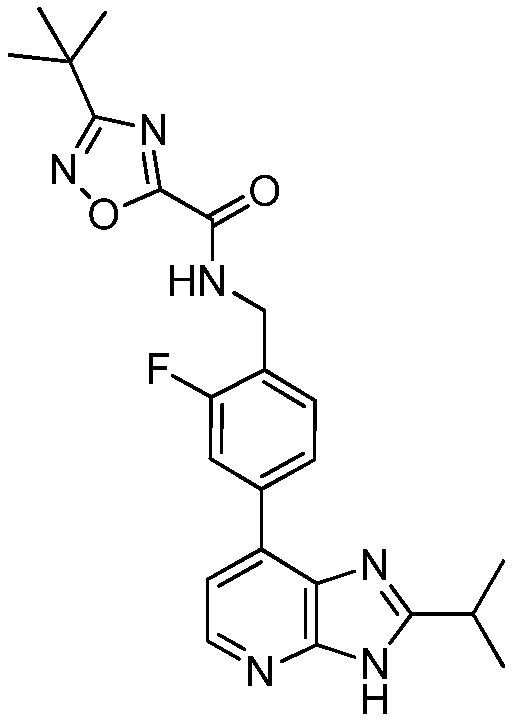
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (75,00 мг; 0,20 ммоль; 1,00 экв.), 2-метилпропиональдегид (14,07 мг; 0,20 ммоль; 1,00 экв.) и ДМФ (2,00 мл; 25,84 ммоль; 132,46 экв.). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. ЖХМС в 22 ч. показала незначительные количества исходного материала. Реакционную смесь охлаждают до комнатной температуры и затем гасят добавлением воды (10 мл). Смесь экстрагируют этилацетатом (3×20 мл) и объединенный органический слой сушат над Na2SO4, фильтруют и концентрируют. Неочищенный продукт растворяют в ДМСО (2 мл) и очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 15-60% B в течение более 15 мин при 60 мл/мин). Фракции продукта объединяют и лиофилизируют с получением 17 мг (20%) 2-фтор-4-(2-изопропил-3H-имидазо[4,5-b]пиридин-7-ил)бензила 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты виде беловатого твердого вещества. ЖХВД: 90% чистота. МС: 437 [M+H]+. 1H ЯМР (400 МГц, ДМСО-d6) δ 12,96 (с, 1H), 8,30 (д, 1H), 8,26 (дд, 1H), 8,15 (дд, 1H), 7,57 (т, 2H), 7,53 (д, 1H), 4,59 (д, 2H), 1,39 (д, 6H), 1,38 (с, 9H), 1,27 (с, 1H).
Пример 185. трет-Бутиловый эфир 5-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламино}-2,3-дигидропиридо[3,4-b][1,4]оксазин-1-карбоновой кислоты
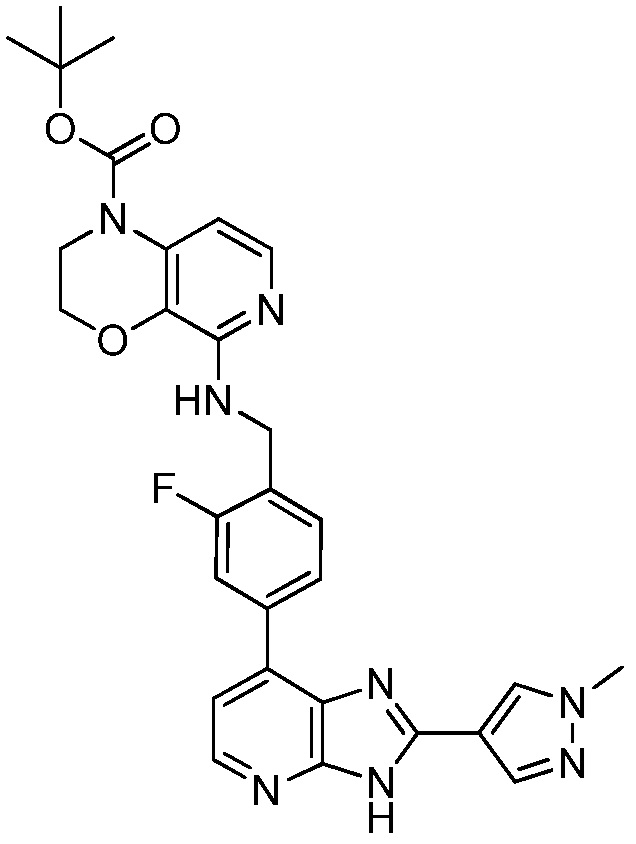
В микроволновую пробирку с мешалкой добавляют 2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламин (59,81 мг; 0,19 ммоль; 1,20 экв.), трет-бутиловый эфир 5-йод-2,3-дигидропиридо[3,4-b][1,4]оксазин-1-карбоновой кислоты (56,00 мг; 0,15 ммоль; 1,00 экв.), трет-бутоксид натрия (74,30 мг; 0,77 ммоль; 5,00 экв.), рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (9,63 мг; 0,02 ммоль; 0,10 экв.) и бис(дибензилиденацетон)палладий(0) (5,33 мг; 0,01 ммоль; 0,06 экв.). Пробирку вакуумируют и повторно заполняют азотом и добавляют сухой диоксан (2,00 мл). Реакционную смесь облучают в микроволновой печи в течение 1 ч при 120 градусах Цельсия и затем фильтруют через целит. Фильтрат концентрируют, растворяют в ДМСО (2 мл), и реакционную смесь очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-60% B в течение более 15 мин при 60мл/мин). Фракции продукта объединяют и лиофилизируют с получением 11,5 мг (13%) трет-бутилового эфира 5-{2-фтор-4-[2-(1-метил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламино}-2,3-дигидро-пиридо[3,4-b][1,4]оксазин-1-карбоновой кислоты в виде белого твердого вещества. МС: 558 [M+H]+. ЖХВД: 92% чистота. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,37 (с, 1H), 8,45 (с, 1H), 8,28 (м, 1H), 8,23 (д, J=11,8 Гц, 1H), 8,15 (с, 1H), 8,09 (д, J=8,2 Гц, 1H), 7,51 (д, 1H), 7,45 (т, J=6,4 Гц, 2H), 7,11 (м, 1H), 6,57 (м, 2H), 4,68 (д, J=5,3 Гц, 2H), 4,33 (с, 2H), 3,96 (с, 3H), 3,86 (с, 2H), 1,51 (с, 9H).
Пример 186. 2-Фтор-4-[2-((1R,2R)-2-фенилциклопропил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
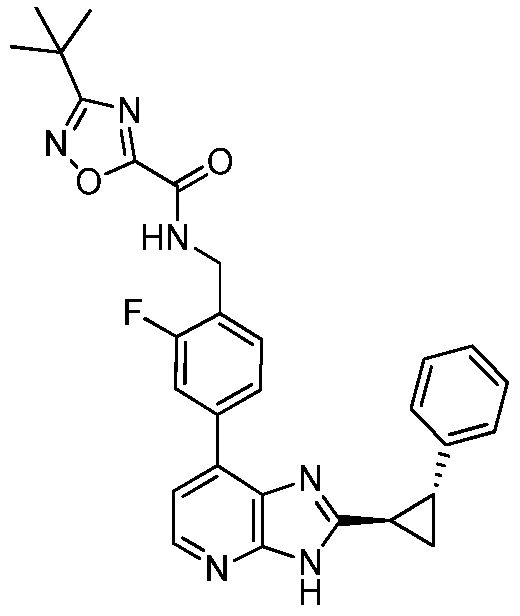
В 20 мл реакционную пробирку добавляют 4-(2,3-диаминопиридин-4-ил)-2-фторбензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты (75,00 мг; 0,20 ммоль; 1,00 экв.), циклопропанкарбоксальдегид, 2-фенил-, (1r,2r)- (28,52 мг; 0,20 ммоль; 1,00 экв.) и ДМФ (2,0 мл). Полученный раствор помещают в атмосферу азота и перемешивают в течение ночи при 130 градусах Цельсия. ЖХМС в 22 ч. показала полное превращение исходного материала в желаемый продукт. Реакционную смесь охлаждают до комнатной температуры, загружают непосредственно в SiO2 и очищают флэш-хроматографией (Biotage SiO2 колонка; градиент 50-100% EtOAc/Гексан в течение более 10 минут). Фракции продукта объединяют и концентрируют. Продукт затем растворяют в ДМСО (2 мл) и очищают преп. ЖХВД (Interchim P4250; 30×150 мм C-18 колонка; подвижные фазы, модифицированные 0,1% муравьиной кислоты (A=вода, B=АЦН); градиент 10-60% B в течение более 15 мин при 60мл/мин). Фракции продукта объединяют и лиофилизируют с получением 8 мг (8%) 2-фтор-4-[2-((1R,2R)-2-фенилциклопропил)-3H-имидазо[4,5-b]пиридин-7-ил]бензиламида 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты в виде белого твердого вещества. МС: 512 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (400 МГц, ДМСО-d6) δ 13,0 (с, 1H), 9,90 (м, 1H), 8,27 (д, 1H), 8,23 (дд, 1H), 8,13 (д, 1H), 7,57 (т, 1H), 7,52 (д, 1H), 7,33 (м, 2H), 7,27 (с, 1H), 7,24 (м, 1H), 7,21 (дт, 1H), 4,59 (д, 2H), 2,63 (м, 2H), 2,45 (с, 1H), 1,91 (м,, 1H), 1,69 (м, 1H), 1,38 (с, 9H).
Пример 187. 2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты
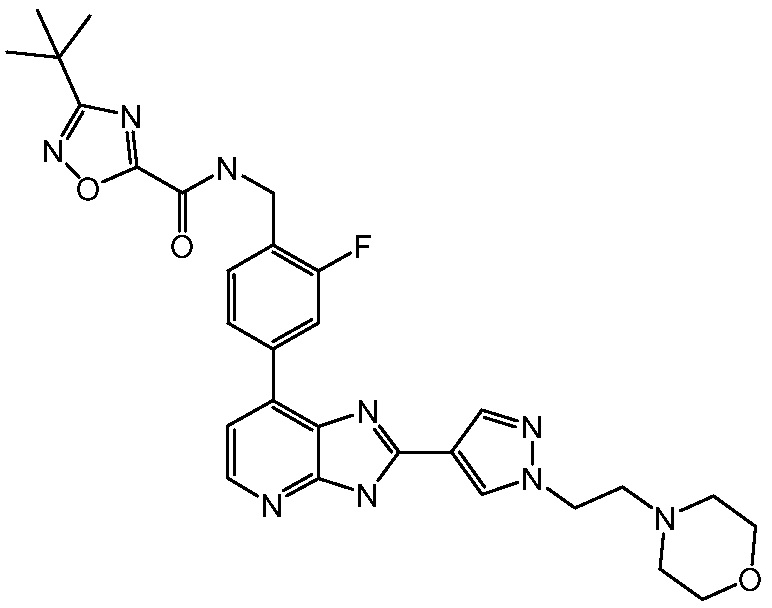
2-Фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламин (66,00 мг; 0,16 ммоль; 1,00 экв.), 3-трет-бутил[1,2,4]оксадиазол-5-карбоновую кислоту (34,64 мг; 0,20 ммоль; 1,30 экв.), 2,4,6-трипропил[1,3,5,2,4,6]триоксатрифосфинан 2,4,6-триоксид (0,50 мл; 1,12 ммоль; 7,12 экв.), ДИПЭА (0,08 мл; 0,47 ммоль; 3,00 экв.) и MeCN (0,50 мл; 9,57 ммоль; 61,13 экв.) объединяют под N2 (г) и перемешивают при комнатной температуре в течение ночи. После того, как ЖХМС покажет завершение реакции, смесь загружают в Interchim ЖХВД для очистки (0-100% 0,1% муравьиная кислота (водн.)/MeCN). Указанное в заголовке соединение 2-фтор-4-{2-[1-(2-морфолин-4-илэтил)-1H-пиразол-4-ил]-3H-имидазо[4,5-b]пиридин-7-ил}бензиламид 3-трет-бутил[1,2,4]оксадиазол-5-карбоновой кислоты выделяют в виде 15 мг бежевого твердого вещества (17% выход. ЖХ-МС: 567,2 [M+H]+. ЖХВД: 100% чистота. 1H ЯМР (500 МГц, Метанол-d4): δ 8,41 (шс, 1H), 8,33 (шс, 1H), 7,87 (д, 1H), 7,82 (шм, 1H), 7,66 (шм, 2H), 7,63 (шм, 1H), 7,50 (шс, 1H), 4,76 (с, 2H), 3,95 (шс, 4H), 1,67 (шм, 5H), 1,44 (с, 9H), 1,02 (шм, 4H).
Пример 188. 4-[2-(1-Циклобутил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламин
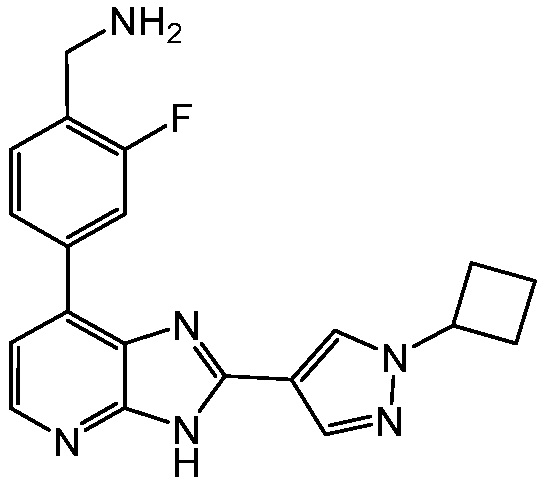
7-Хлор-2-(1-циклобутил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин (222,10 мг; 0,81 ммоль; 1,00 экв.), [4-(аминометил)-3-фторфенил]бороновую кислоту (274,19 мг; 1,62 ммоль; 2,00 экв.), дикарбонат калия (448,57 мг; 3,25 ммоль; 4,00 экв.) и MeCN (4,00 мл; 76,58 ммоль; 94,38 экв.) объединяют под N2 (г) и добавляют циклопентил(дифенил)фосфан; дихлорметан; дихлорпалладий; железо (66,26 мг; 0,08 ммоль; 0,10 экв.). Закрывают крышкой и дегазируют N2 (г) в течение 15 мин, затем нагревают до 130°C в микроволновой печи (Biotage, высокая абсорбция) в течение 2 часов, затем охлаждают до КТ. Фильтруют через целит, промывают метанолом и ДХМ и выпаривают растворитель, затем очищают флэш-хроматографией на колонке (Biotage, KPNH двуокись кремния, 0-20% MeOH/ДХМ) с получением желаемого продукта 4-[2-(1-циклобутил-1H-пиразол-4-ил)-3H-имидазо[4,5-b]пиридин-7-ил]-2-фторбензиламина в виде белого твердого вещества (161 мг, 55% выход).
ЖХ-МС: 362,1 [MH]. ЖХВД: 91,1% чистота. 1H ЯМР (500 МГц, ДМСО-d6): δ 13,2 (шм, 1H), 8,81 (с, 1H), 8,55 (с, 1H), 8,49 (с, 1H), 8,23 (с, 1H), 8,15 (шм, 1H), 7,57 (шм, 1H), 7,51 (шм, 1H), 7,45 (шм, 1H), 4,98 (шм, 3H), 4,51 (с, 1H), 4,23 (с, 1H), 2,57 (м, 4H), 2,45 (м, 2H).
Пример 189
Анализ A: Протокол микрофлюидного внеклеточного анализа подвижности для оценки активности против фермента ТКБ
Представленный ниже протокол описывает микрофлюидный внеклеточный анализ подвижности киназы для измерения специфической активности соединений в отношении фермента ТКБ. Механика платформы анализа наилучшим образом описана продавцом (Caliper Life Sciences, a PerkinElmer Company, Hopkinton, MA) на вебсайте со следующим URL:
http://caliperls.com/ или http://caliperls.com/apps/drug-discovery-and-pre-clinical-development/target-id-validation.htm.
Коротко, 2,5× исходные растворы полноразмерной человеческой ТКБ (08-080) от CarnaBio USA, Inc., Natick, MA, 1,6× АТФ и подходящий kinKDR пептидный субстрат (FITC-AHA-EEPLYWSFPAKKK-NH2; разработанный на месте) получают в киназном реакционном буфере, состоящем из 25 мМ MgCl2, 0,015% Brij-35 (30%), 100 мМ HEPES, pH 7,5 и 10 мМ ДТТ. 5 мкл ферментного буфера и 7,5 мкл АТФ/kinKDR смеси пептидного субстрата добавляют в Matrix (#115304) 384-луночные стерильные полипропиленовые планшеты (Thermo Fisher Scientific, Hudson, NH) с 125 нл серийно разведенных соединений, полученных в 100% ДМСО и инкубированных в течение 90 мин при 27°C. После инкубационного периода, реакции останавливают добавлением 60 мкл останавливающего буфера, содержащего 100 мМ HEPES, pH 7,5, 0,015% Brij-35 (30%), 0,277% Coating Reagent #3 (Caliper Life Sciences, Mountain View, CA), 5% ДМСО. Остановленные реакции отслеживают при -2 ф/д2, -3000 В/-700 В в планшетном ридере LabChip 3000 от Caliper Life Sciences, a PerkinElmer Company (Hopkinton, MA), и активность измеряют с применением внеклеточного анализа подвижности, измеряя разницу заряда/массы между субстратом и продуктом, возникающей в результате пептидного фосфорилирования. IC50 и эффективность определяют построением графика логарифма [ингибитор] к % активности в GeneData Screener (Basel, Switzerland).
Анализ B: Протокол микрофлюидного внеклеточного анализа подвижности для оценки активности против фермента ТКБ C481S
Представленный ниже протокол описывает микрофлюидный внеклеточный анализ подвижности киназы для измерения специфической активности соединений в отношении фермента ТКБ C481S. Механика платформы анализа наилучшим образом описана продавцом (PerkinElmer, Hopkinton, MA) на вебсайте со следующим URL: http://caliperls.com.
Коротко, 2,5× исходные растворы His-TEV-hsТКБ(328-659)(C481S) от Merck Serono Protein Purification Laboratory в Darmstadt, Germany (PCS, Q27/234), 1,6× АТФ и подходящий KinKDR пептидный субстрат (FITC-AHA-EEPLYWSFPAKKK-NH2; заказной органический синтез Tufts University Core Facility) получают в киназном реакционном буфере, состоящем из 25 мМ MgCl2, 0,015% Brij-35 (30%), 100 мМ HEPES, pH 7,5 и 10 мМ ДТТ.
5 мкл ферментного буфера и 7,5 мкл АТФ/kinKDR смеси пептидного субстрата добавляют в Matrix (#4315) 384-луночные стерильные плоскодонные полипропиленовые планшеты (Thermo Fisher Scientific, Hudson, NH) с 125 нл серийно разведенных соединений, полученных в 100% ДМСО и инкубированных в течение 90 мин при 25°C. После инкубационного периода, реакции останавливают добавлением 65 мкл останавливающего буфера, содержащего 100 мМ HEPES, pH 7,5, 0,015% Brij-35 (30%), 0,277% Coating Reagent #3 (Caliper Life Sciences, Mountain View, CA), 5% ДМСО. Остановленные реакции отслеживают при -2 ф/д2, -3000 В/-700 В в планшетном ридере LabChip 3000 от Caliper Life Sciences, a PerkinElmer Company (Hopkinton, MA), и активность количественно оценивают через измеренные вызванной лазером флуоресценции разницы заряда/массы между субстратом и продуктом, возникающей в результате пептидного фосфорилирования. IC50 и эффективность определяют построением графика логарифма [ингибитор] к % активности в GeneData Screener (Basel, Switzerland).
Анализ C: Анализ МКПК IC50
ТКБ является критической для медиирования подачи сигналов антиген-распознающего В-клеточного рецептора (BCR) после анти-IgM стимулирования. Основываясь на этом принципе, был разработан функциональный клеточный тест для определения эффективности соединений в отношении вызванной анти-IgM экспрессии CD69, нисходящего BCR сигнального события, в свежевыделенных мононуклеарных клетках периферийной крови (МКПК). В этом анализе, 90 мкл суспензии МКПК, содержащей 2,5×105 клеток предварительно обрабатывают 10 мкл тестируемого соединения в различных концентрациях в течение часа и затем инкубируют в течение ночи (приблизительно 16-18 часов) с 5 мкл 420 мкг/ил affiniPure F(ab´)2 фрагментом козьего анти-человеческого IgM Fc фрагмента на лунку (Dianova, каталожный №: 109-006-129). После инкубирования клетки промывают и иммуноокрашивают APC-меченым мушиным анти-человеческим CD69 (BD Biosciences; клон: FN50), PerCP-Cy5,5 меченым мышиным анти-человеческим CD19 (BD Biosciences; клон: SJ25C1) и FITC-меченным мышиным анти-человческим CD3 (BD Biosciences; клон: HIT3a) и фиксируют для проточного цитометрического анализа экспрессии CD69 на CD19 положительных клетках (B клетках). Процент CD69 экспрессирующих CD19 положительных клеток наносят на график в отношении к концентрациям тестируемых соединений с получением кривой концентрация-ответ и рассчитывают значение IC50 как показатель активности тестируемых соединений в анализе.
Анализ D: ELISA анализ выделения IL-1β в THP-1 клетках
В анализе измеряют выделение IL-1β человеческими THP-1 клетками после обработки ФМА и ЛПС в ответ на стимулирование BzATP для оценки активности P2X7 ингибиторов. THP-1 клетки (2×105 клеток/мл) в культуральной среде (RPMI1640 (Gibco, #22400-089)+10% HI-FBS (Gibco, #10082-147)+1% L-глутамина (Gibco, #25030)+1% Pen/Strep (Gibco, #15140) с добавлением 0,5 мкм ФМА (Sigma, # P8139) инкубируют в течение 30 мин при 37°C. В конце времени инкубирования клетки растирают и осторожно промывают в ФРФБ. Клетки затем повторно суспендируют до плотности 1,5×105 клеток/мл в культуральной среде с добавлением 10 нг/мл ЛПС (Sigma, # L5293). Суспензию клеток диспрергируют (40 мкл/лунку) в Corning 384-луночном планшете. Через 4 часа инкубирования при 37°C клетки обрабатывают 20 мкл тестируемых соединений в различных концентрациях. Планшет инкубируют в течение 30 мин при 37°C, и затем клетки обрабатывают 20 мкл 3,2 мМ BzATP (Sigma, #B6396) (0,8 мМ конечная концентрация). Планшет инкубируют в течение еще 30 мин при 37°C и затем подвергают центрифугированию (4 мин, 1000 об./мин). Надосадочную жидкость (60 мкл) из каждой лунки переносят в 384-матричный ПП планшет. Планшет затем хранят при 4°C (в течение ночи) или -20°C в течение более длительного времени. На следующий день уровни IL-1β измеряют с применением набора с человеческим IL-1β ELISA Kit (R&D systems, каталожный № DY201) и считывают с применением микропланшетного ридера SpectraMax Plus 384.
Анализ E: LCK биохимический анализ
Описанный ниже стандартный протокол описывает стандартный киназный анализ HotSpot, проведенный Reaction Biology Corporation в качестве услуги.
Субстрат (поли(EY) (Glu:Tyr (4:1)) и кофакторы получают в свежем реакционном буфере (20 мМ Hepes (pH 7,5), 10 мМ MgCl2, 2 мМ MnCl2, 1 мМ ЭГТК, 0,02% Brij35, 0,02 ммл АБС, 0,1 мМ Na3VO4, 2 мМ ДТТ, 2% ДМСО). К субстратному раствору затем добавляют фермент (LCK; рекомбинантный человеческий полноразмерный (Genbank Accession # NP_005347); C-концевой His-меченный, экспрессируется в клетках насекомых), и полученный раствор затем осторожно смешивают. Тестируемые соединения растворяют в ДМСО и затем переносят в киназную реакционную смесь с применением технологии обработки акустических жидкостей (Echo550; нанолитровый диапазон). Реакционную смесь инкубируют в течение 20 мин при КТ и затем обрабатывают 33P-АТФ для начала реакции. Через 2 часа инкубирования при КТ киназную активность определяют с применением P81 способа анализа вещества по степени его связывания с мембранным фильтром собственной разработки Reaction Biology Corporation.
Данные интерпретируют следующим образом:
(Анализ A)
(Анализ В)
(Анализ В)
(Анализ D)
% ингибирования LCK при тестируемой концентрации 1 мкМ
(Анализ E)
Пример 190. Фармацевтические препараты
(A) Флаконы для инъекций: Раствор 100 г активного ингредиента в соответствии с данным изобретением и 5 г двузамещенного фосфорнокислого натрия в 3 л бидистиллированной воды доводят до pH 6,5 с применением 2N хлористоводородной кислоты, фильтруют в стерильных условиях, переносят во флаконы для инъекций, лиофилизируют в стерильных условиях и герметично закрывают в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного ингредиента.
(B) Суппозитории: Смесь 20 г активного ингредиента в соответствии с данным изобретением плавят со 100 г соевого лецитина и 1400 г масла какао, выливают в формы и охлаждают. Каждый суппозиторий содержит 20 мг активного ингредиента.
(C) Раствор: Раствор готовят из 1 г активного ингредиента в соответствии с данным изобретением, 9,38 г NaH2PO4•2 H2O, 28,48 г Na2HPO4•12 H2O и 0,1 г хлорида бензалкония в 940 мл бидистиллированной воды. pH доводят до 6,8, и раствор доводят до 1 л и стерилизуют облучением. Этот раствор может применяться в форме глазных капель.
(D) Мазь: 500 мг активного ингредиента в соответствии с данным изобретением смешивают с 99,5 г вазелина в асептических условиях.
(E) Таблетки: Смесь 1 кг активного ингредиента в соответствии с данным изобретением, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния прессуют с получением таблеток по обычно методике так, чтобы каждая таблетка содержала 10 мг активного ингредиента.
(F) Таблетки в оболочке: Таблетки прессуют аналогично примеру E и затем по обычной методике наносят покрытие из сахарозы, картофельного крахмала, талька, трагаканта и красителя.
(G) Капсулы: 2 кг активного ингредиента в соответствии с данным изобретением помещают в твердые желатиновые капсулы по обычной методике так, чтобы каждая капсула содержала 20 мг активного ингредиента.
(H) Ампулы: Раствор 1 кг активного ингредиента в соответствии с данным изобретением в 60 л бидистиллированной воды стерильно фильтруют, переносят в ампулы, лиофилизируют в стерильных условиях и герметично закрывают в стерильных условиях. Каждая ампула содержит 10 мг активного ингредиента.
(I) Спрей для ингаляций: 14 г активного ингредиента в соответствии с данным изобретением растворяют в 10 л изотонического раствора NaCl, и раствор переносят в коммерчески доступные распыляющие контейнеры с помповым механизмом. Раствор может распыляться во рту или в носу. Одно распыление (около 0,1 мл) соответствует дозе около 0,14 мг.
Хотя здесь описано множество вариантов данного изобретения, очевидно, что основные примеры могут быть изменены с получением других вариантов, в которых применяются соединения и способы в соответствии с данным изобретением. Поэтому должно быть понятно, что объем данного изобретения определяется формулой изобретения, а не конкретными вариантам, которые представлены только в качестве примера.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ПОВЫШЕНИЯ АКТИВНОСТИ CFTR | 2015 |
|
RU2767460C2 |
| ИНГИБИТОРЫ МУТАЦИИ HER2 | 2022 |
|
RU2834124C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ И ОЧИСТКИ ГЕТЕРОАРИЛЬНЫХ СОЕДИНЕНИЙ | 2010 |
|
RU2557242C2 |
| СОЕДИНЕНИЯ ИМИДАЗОТРИАЗИНОНА | 2011 |
|
RU2603140C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ИНГИБИТОРЫ ТРАНСГЛУТАМИНАЗЫ 2 (TG2) | 2019 |
|
RU2781370C2 |
| Селективный ингибитор киназы JAK1 | 2020 |
|
RU2818002C2 |
| ИНГИБИТОРЫ mTOR КИНАЗЫ ДЛЯ ОНКОЛОГИЧЕСКИХ ПОКАЗАНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С mTOR/PI3K/AKT ПУТЕМ МЕТАБОЛИЗМА | 2009 |
|
RU2692796C2 |
| ИНГИБИТОРЫ mTOR КИНАЗЫ ДЛЯ ОНКОЛОГИЧЕСКИХ ПОКАЗАНИЙ И ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С mTOR/PI3K/AKT ПУТЕМ МЕТАБОЛИЗМА | 2009 |
|
RU2546658C2 |
| ИНГИБИТОРЫ АКТИВНОСТИ АКТ | 2010 |
|
RU2579513C2 |
Настоящее изобретение относится к соединению имидазопиридина формулы I и его фармацевтически приемлемым солям, структурные формулы которого приведены в формуле изобретения. Соединения имидазопиридина по изобретению предназначены в качестве ингибитора тирозинкиназы Брутона (BTK). 3 н.п. ф-лы, 5 табл., 190 пр.
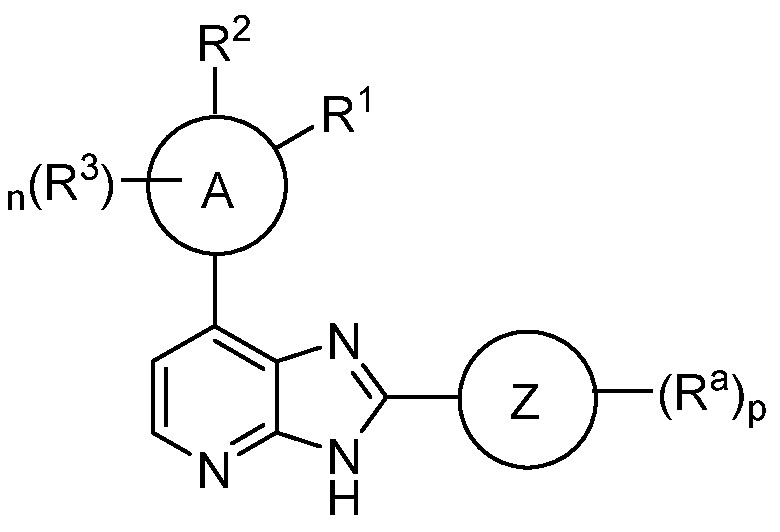
I
1. Соединение, выбранное из группы, состоящей из:
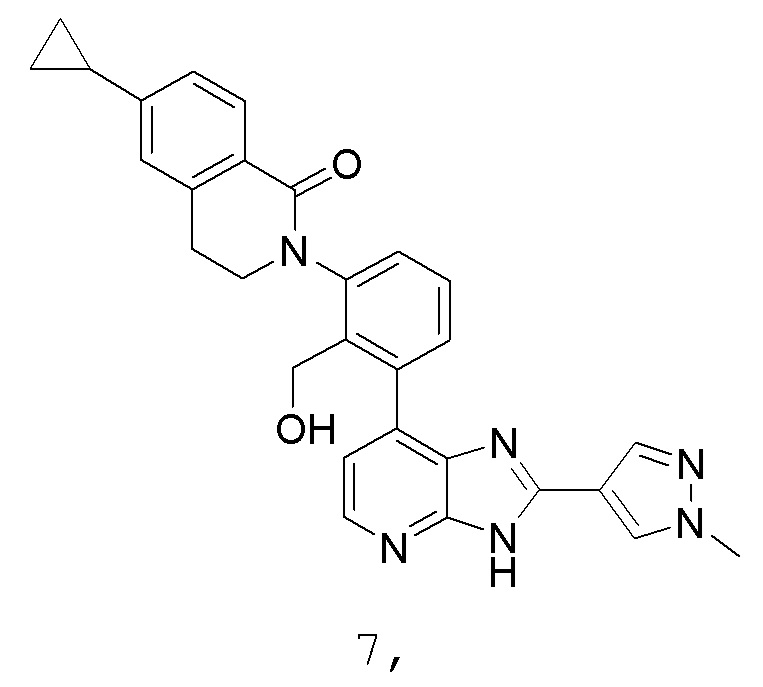
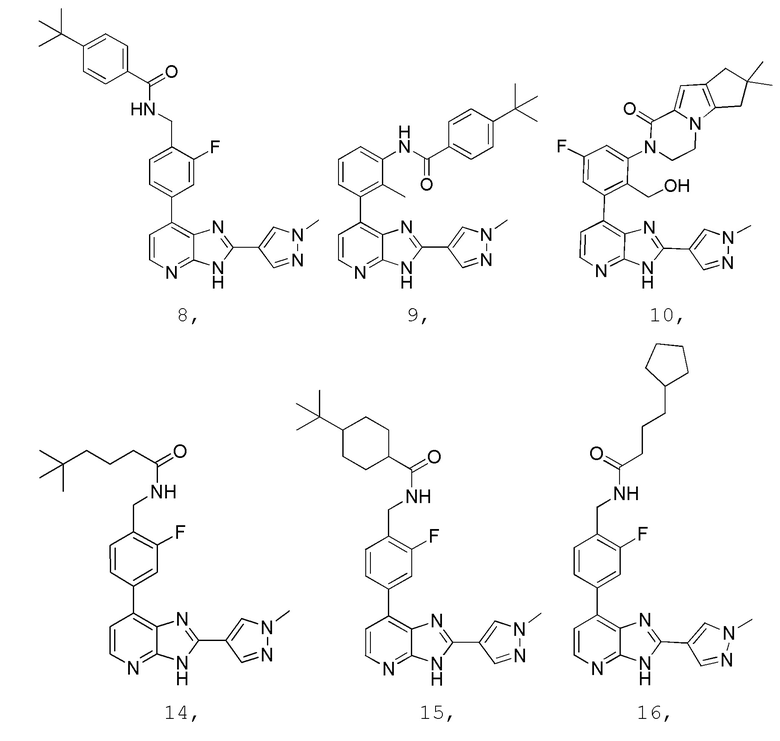
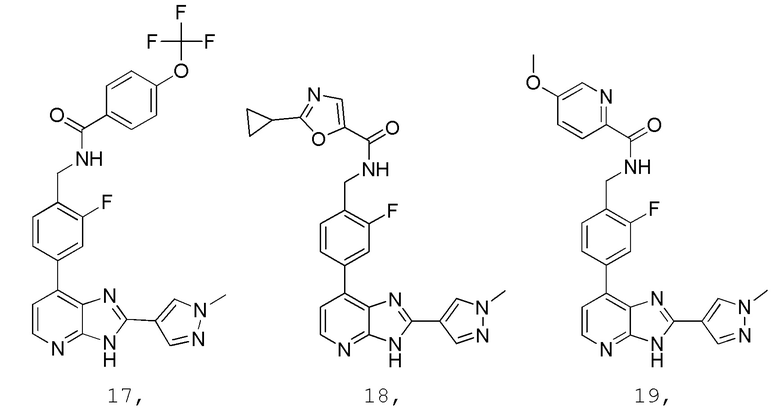
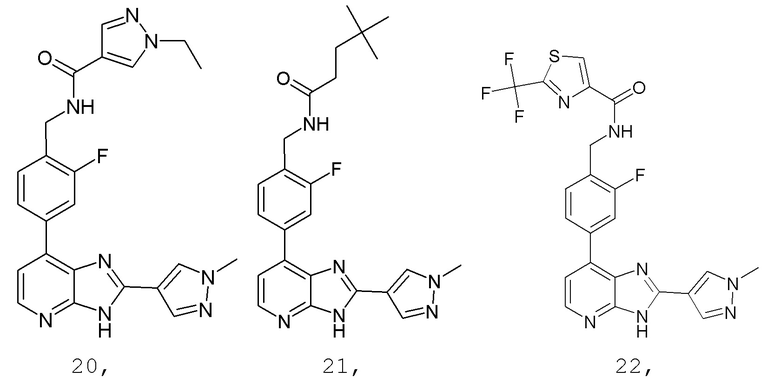
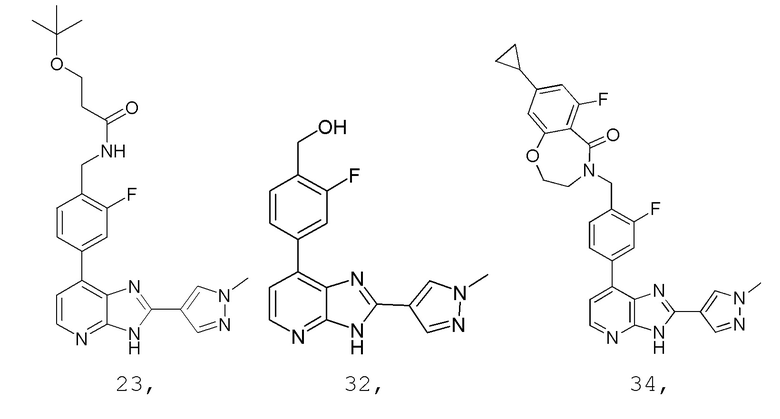
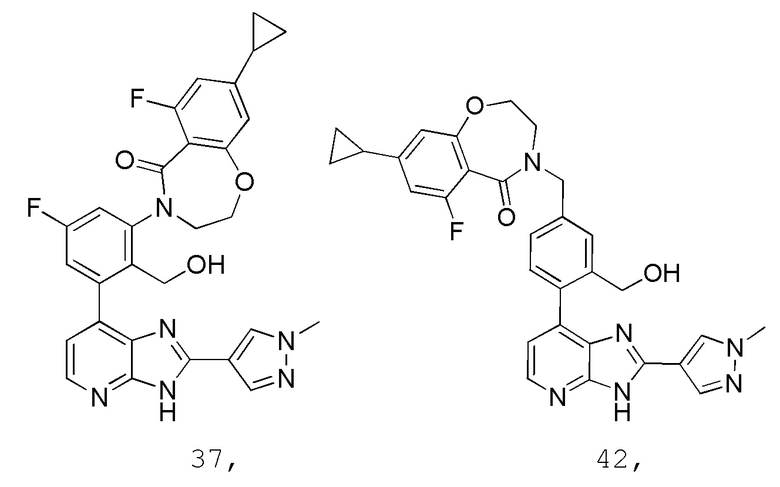
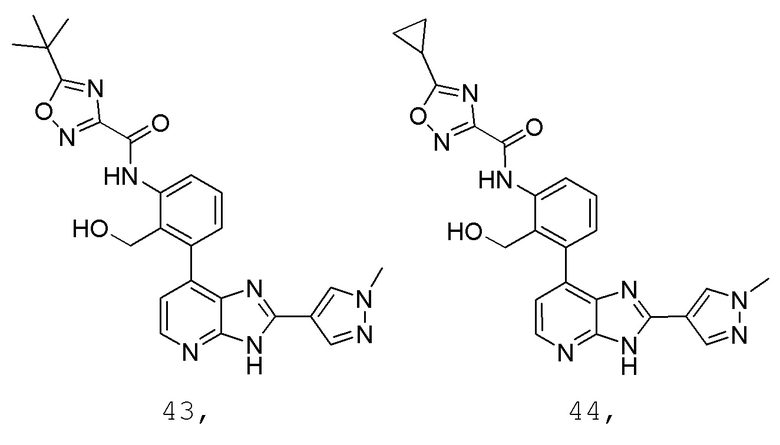
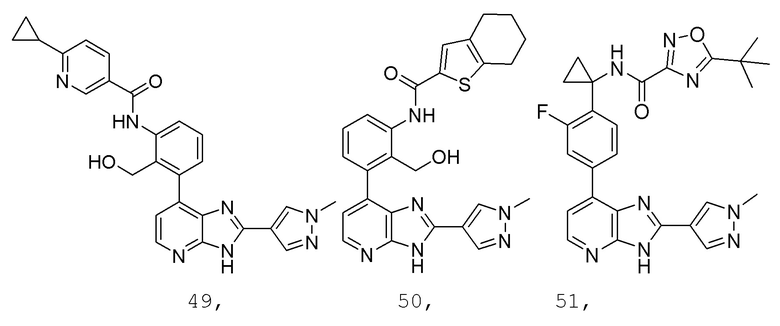
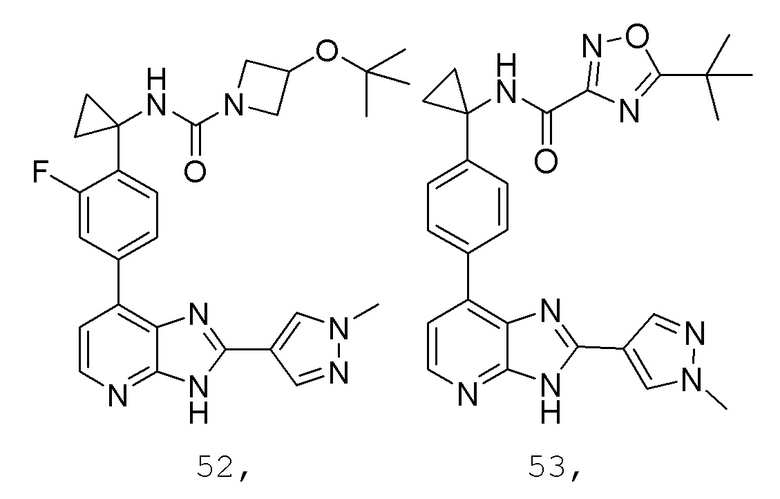
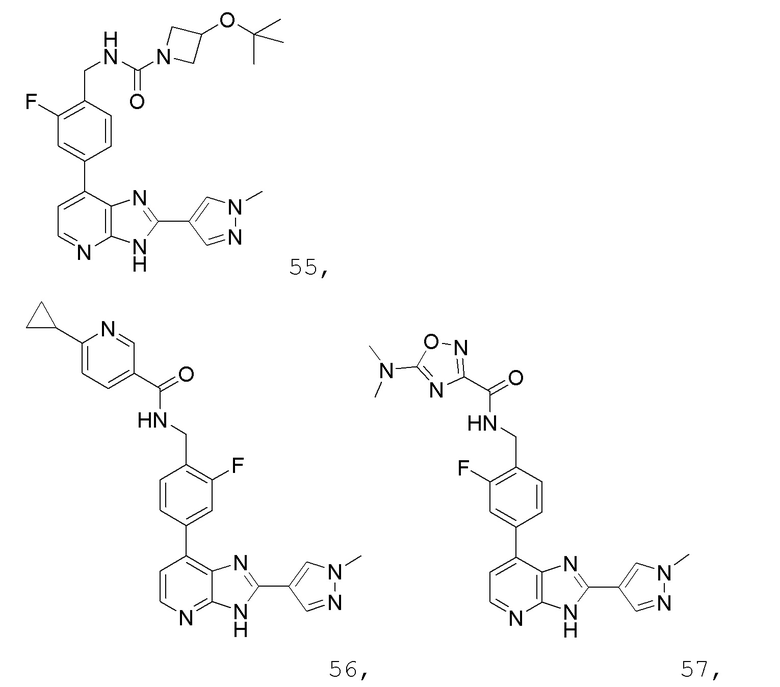
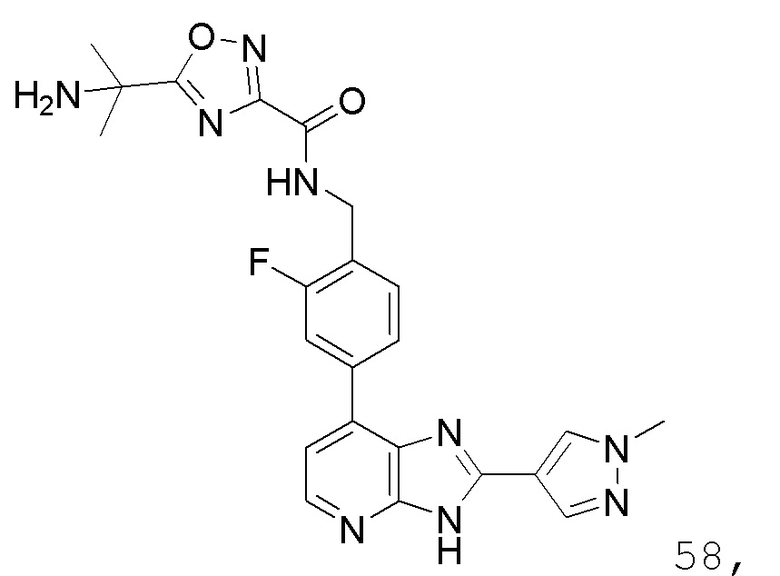
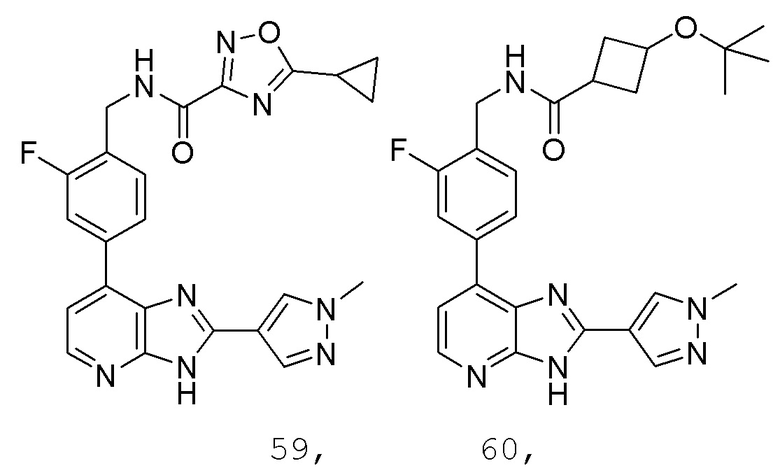
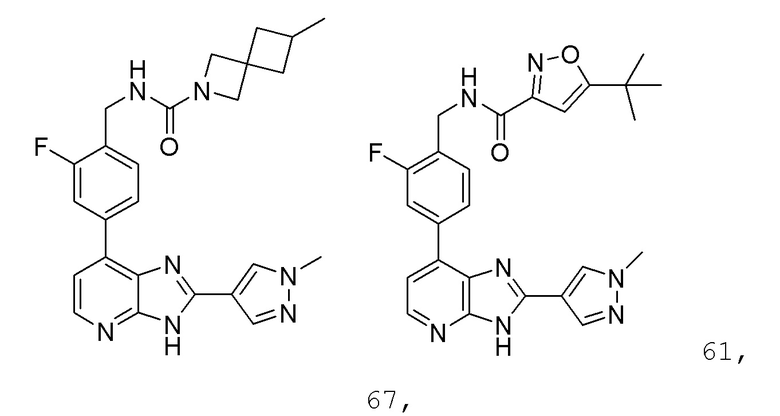
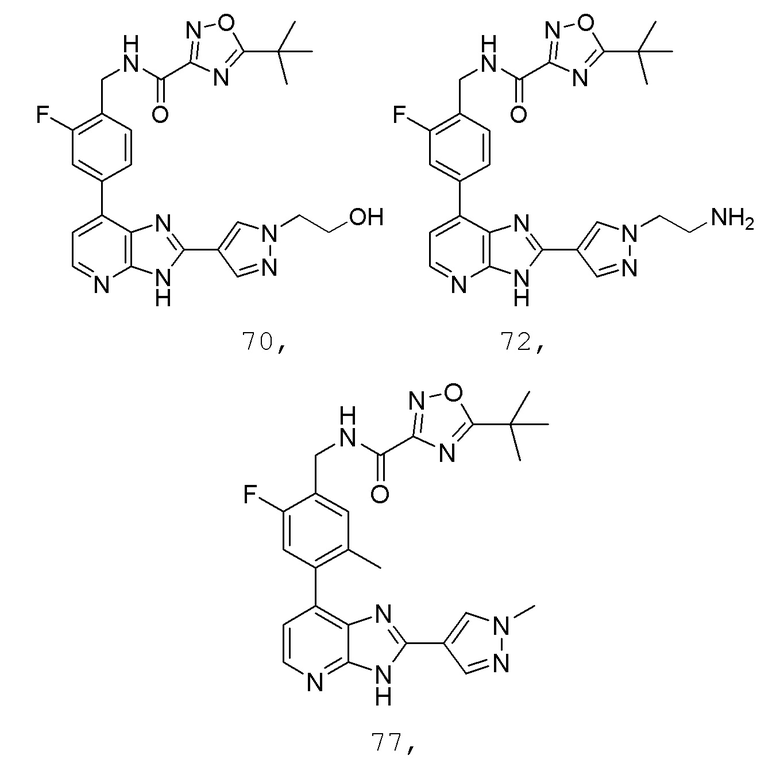
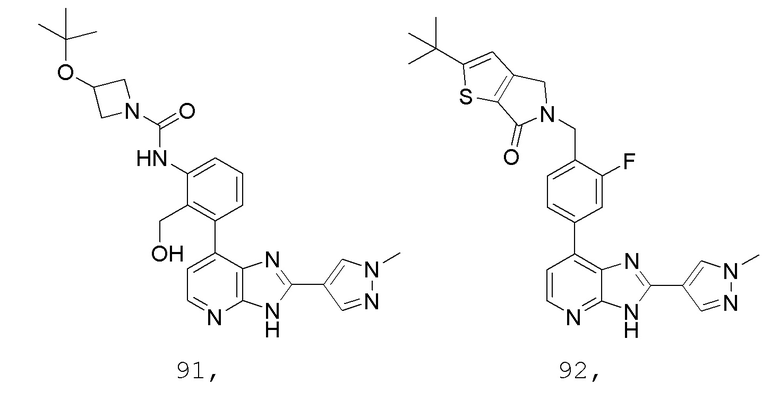
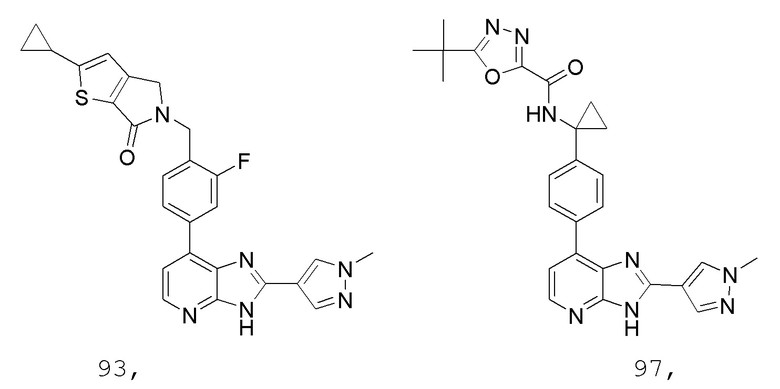
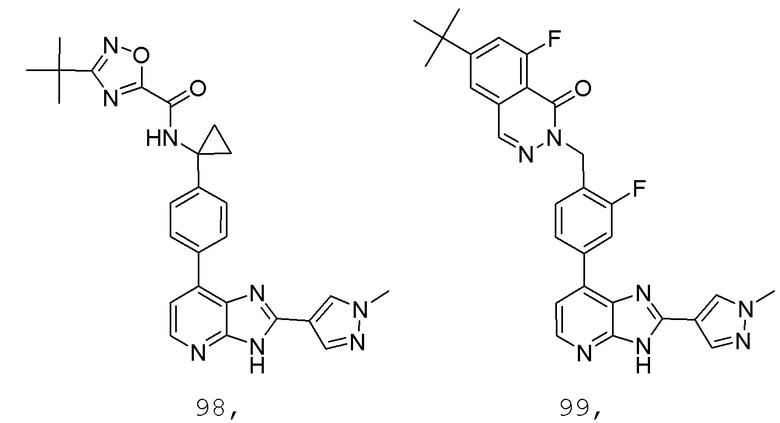
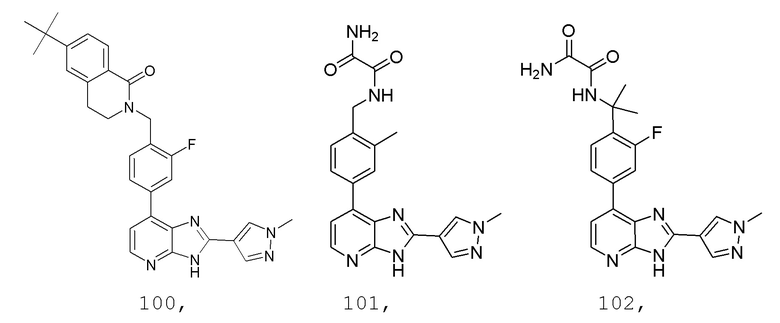
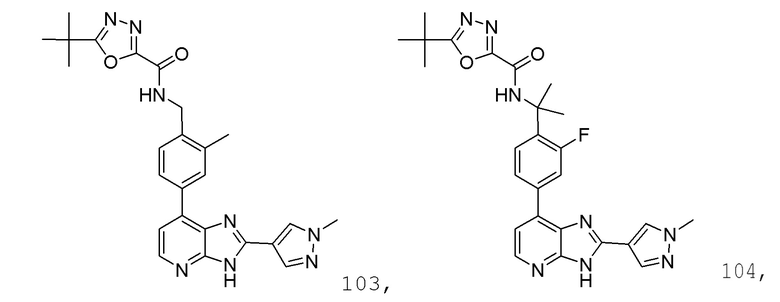
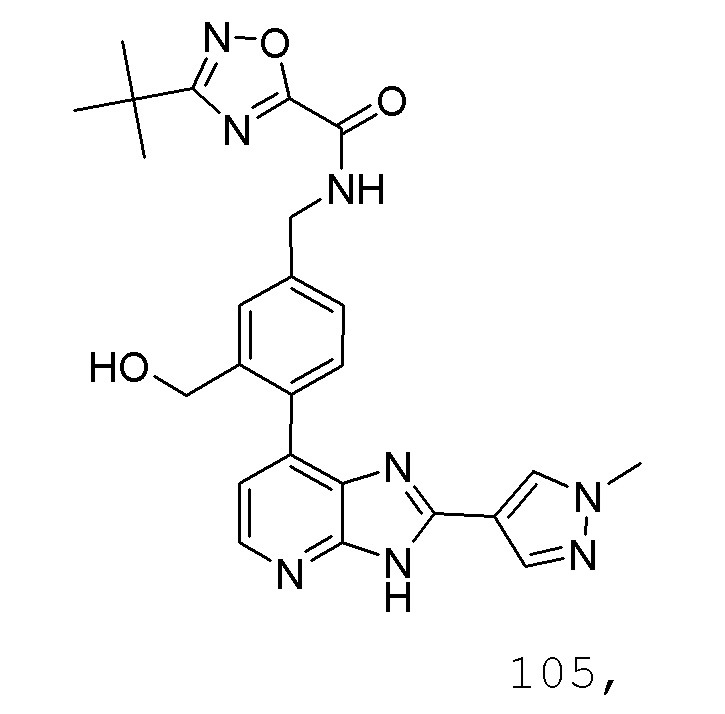
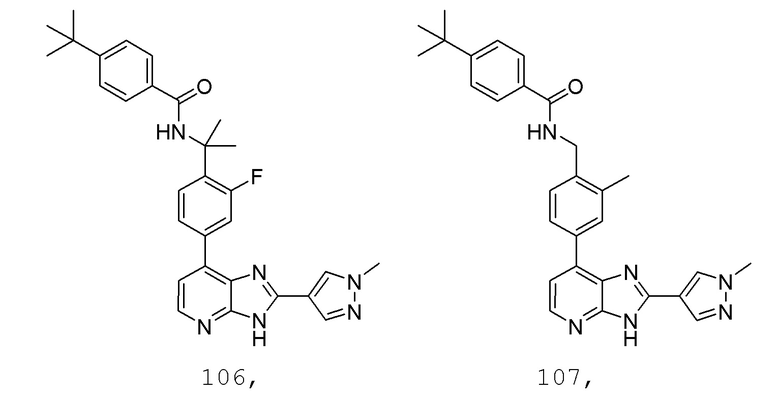
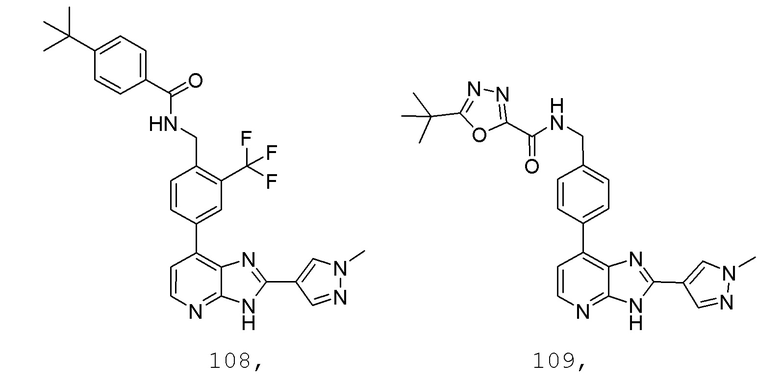
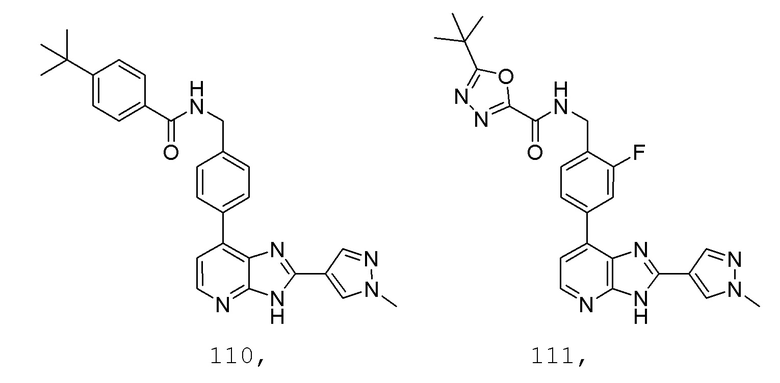
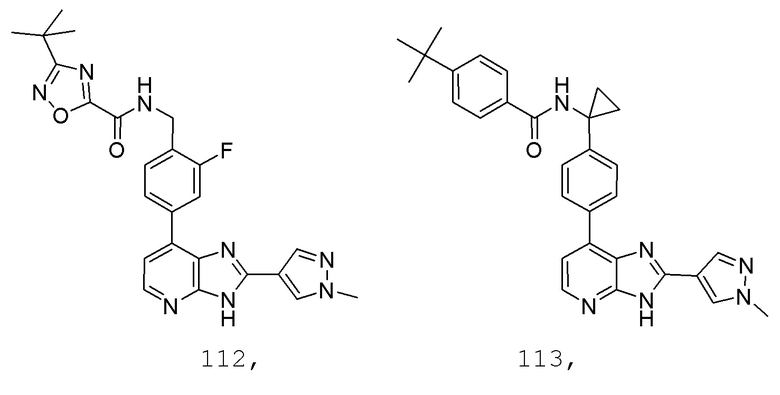
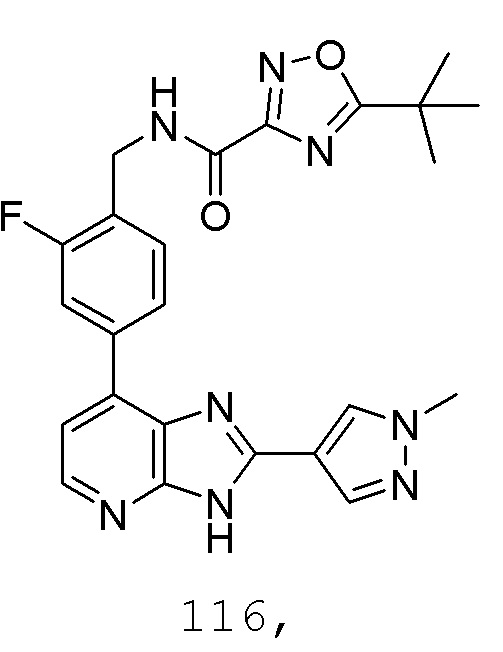
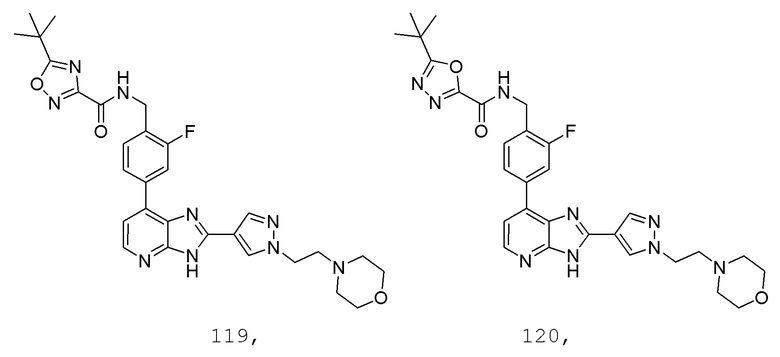
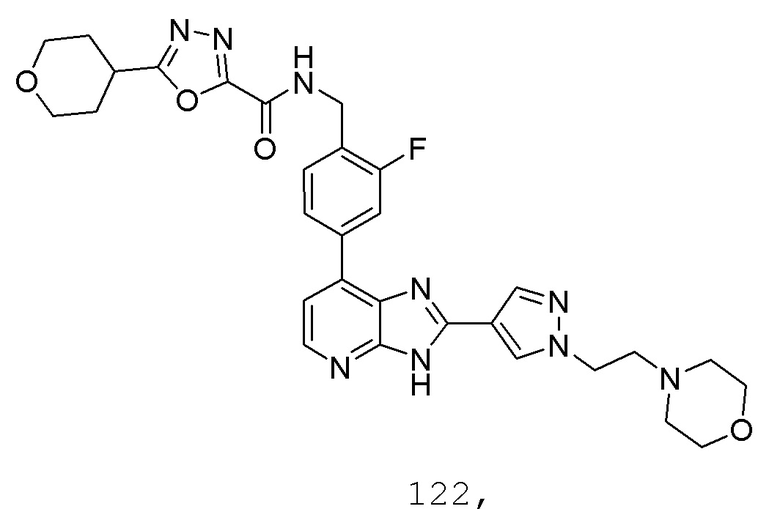
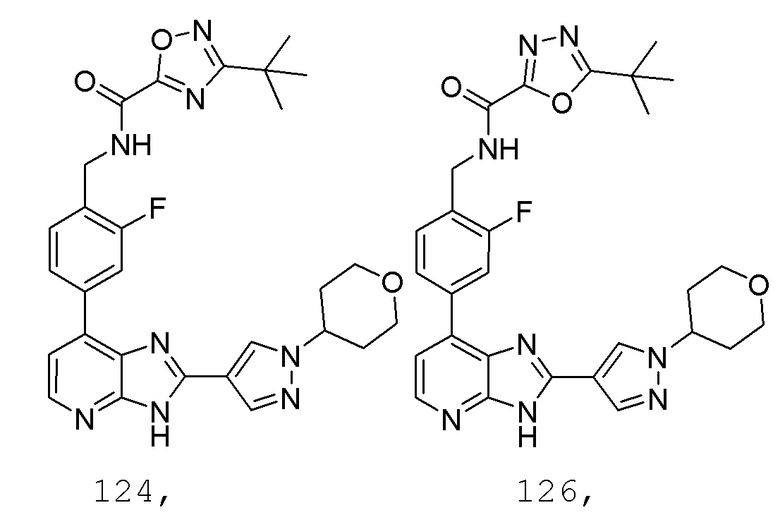
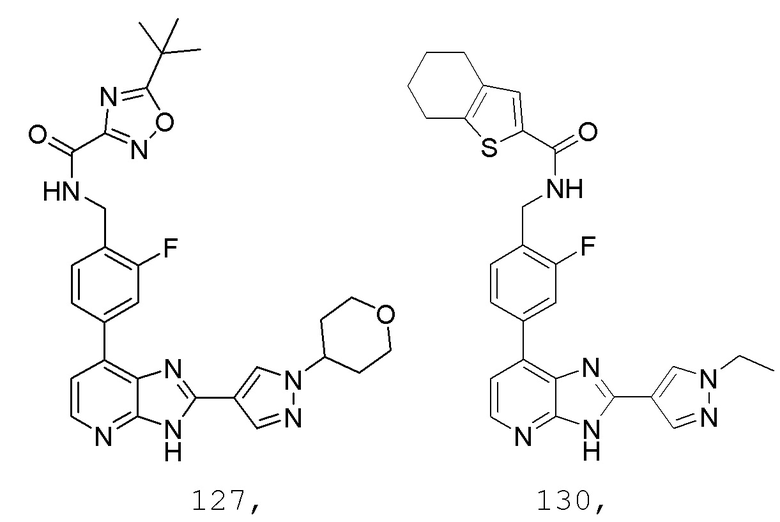
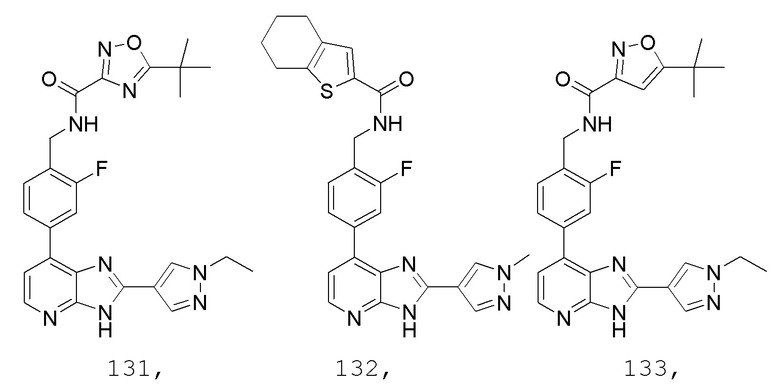
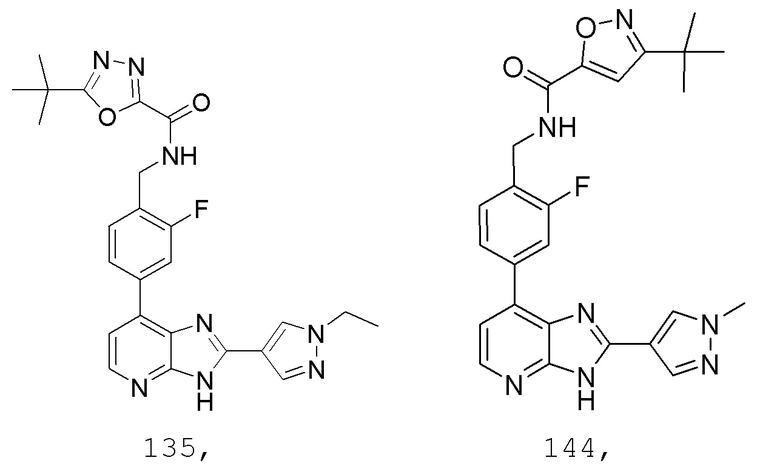
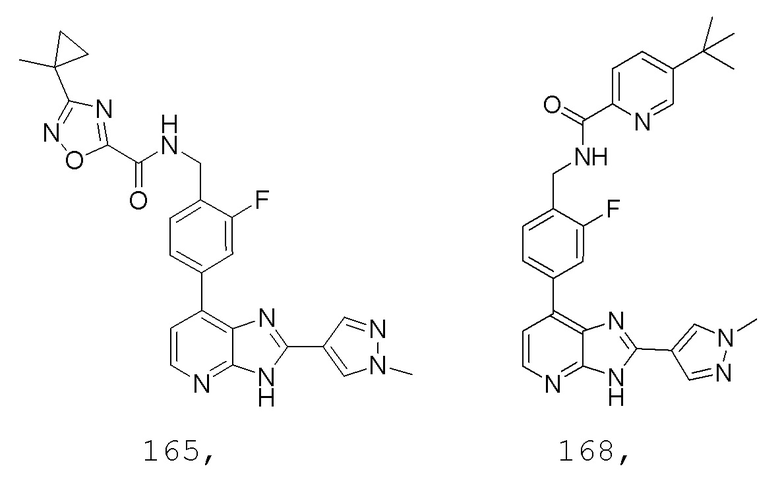
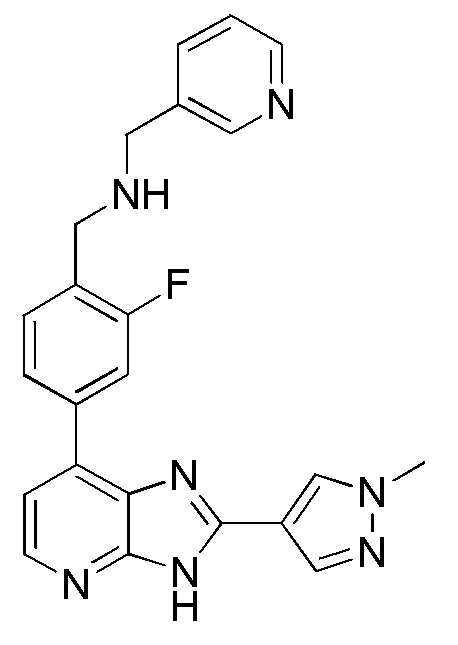 173,
173,
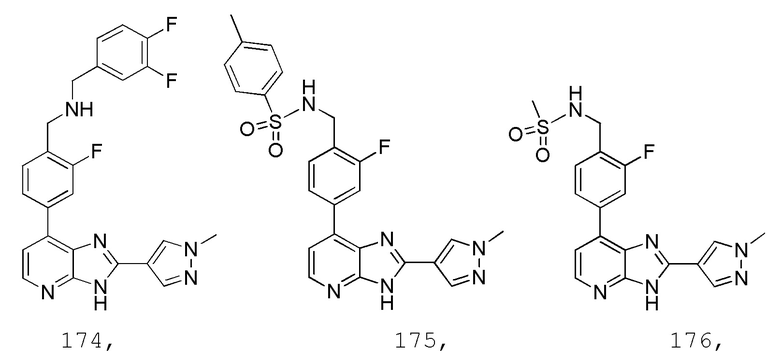

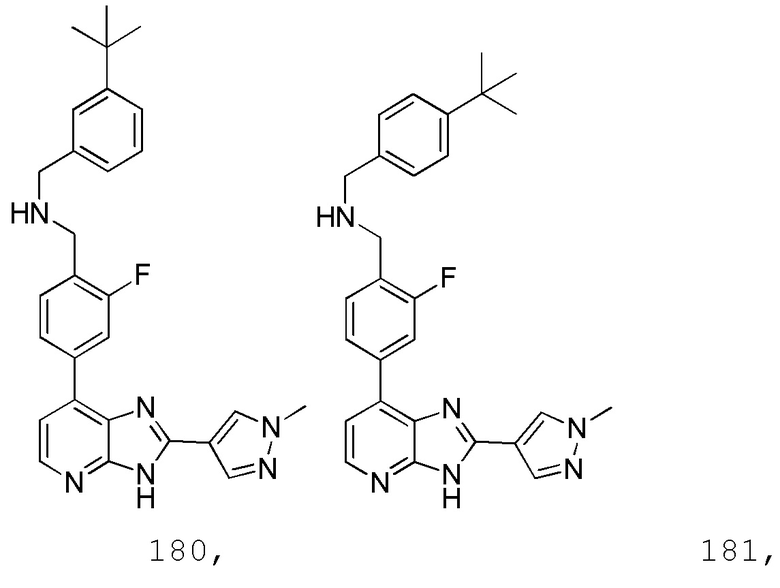
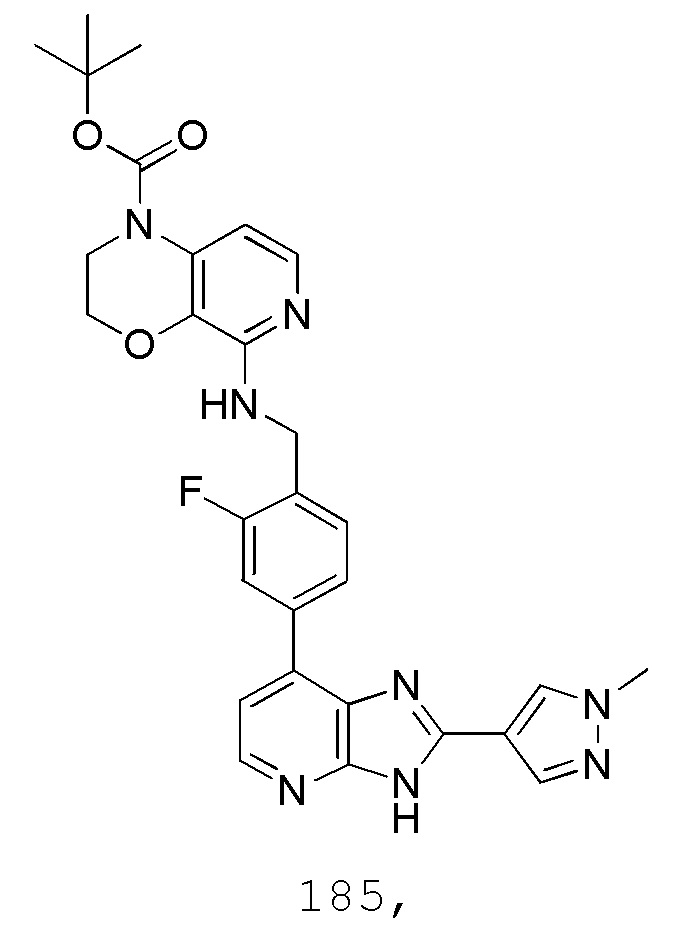
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, обладающая свойствами ингибитора тирозинкиназы Брутона (BTK), содержащая эффективное количество соединения по п.1 и фармацевтически приемлемый адъювант, носитель или наполнитель.
3. Способ ингибирования активности BTK или ее мутанта у пациента или в биологическом образце, включающий стадию введения указанному пациенту или контактирование указанного биологического образца с соединением по п.1 или его физиологически приемлемой солью.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ОБРАБОТКИ ОТВАЛЬНОГО СОЛЕВОГО ШЛАКА ПРИ ПЕРЕПЛАВЕ ВТОРИЧНЫХ ОТХОДОВ АЛЮМИНИЯ И АЛЮМИНИЕВЫХ СПЛАВОВ | 2010 |
|
RU2487180C2 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ULRIKA YNGVE et al.: "Imidazopyridine-based Inhibitors of Glycogen Synthase kinase | |||
Авторы
Даты
2021-02-02—Публикация
2015-10-06—Подача