Область изобретения
Изобретение относится к агонистам S1P1/EDG1 рецептора (липидактивируемый, сопряженный с G-белком, специфичный в отношении сфингозин-1-фосфата рецептор) формулы (I) и их применению в качестве активных ингредиентов при получении фармацевтических композиций. Изобретение также касается родственных аспектов, включающих способы получения соединений, фармацевтических композиций, содержащих соединение формулы (I), и их применение в качестве соединений, улучшающих сосудистую функцию, и в качестве иммуномодулирующих агентов, либо самостоятельно, либо в комбинации с другими активными соединениями или методами лечения. Кроме того, изобретение включает новые соединения формулы (II), которые являются промежуточными соединениями для получения соединений формулы (I).
Предпосылки создания изобретения
Человеческая иммунная система призвана защищать организм от посторонних микроорганизмов и субстанций, вызывающих инфекцию или болезнь. Комплексные регуляторные механизмы обеспечивают направленность иммунного ответа против внедрившейся субстанции или организма, но не направленного против хозяина. В некоторых случаях в таких контрольных механизмах нарушается регуляция, что может приводить к возникновению аутоиммунных ответов. Следствием неконтролируемого ответа на воспаление является серьезная опасность для органа, клетки, ткани или сустава. При современных методах лечения иммунная система в таких случаях в целом обычно подавляется, и способность организма реагировать на инфекцию также подвергается при этом серьезному риску. Типичные лекарства, применяемые в этом случае, включают азатиоприн, хлорамбуцил, циклофосфамид, циклоспорин или метотрексат. Кортикостероиды, которые ослабляют воспаление и подавляют иммунный ответ, могут вызывать побочные эффекты при длительном лечении. Нестероидные противовоспалительные препараты (НПВП) могут уменьшать боль и воспаление, однако, они также проявляют нежелательные побочные эффекты. Альтернативные методы лечения включают применение агентов, активирующих или блокирующих цитокиновую передачу сигнала.
Перорально активные соединения с иммуномодулирующими свойствами, без опасных иммунных ответов и с пониженными побочными эффектами значительно улучшают современные методы лечения воспалительных болезней.
В области трансплантации органов иммунный ответ хозяина должен быть супрессирован для предотвращения отторжения органа. Трансплантируемый орган реципиента может подвергаться риску частичного отторжения даже при использовании иммунодепрессивных лекарств. Отторжение чаще всего происходит в первые несколько недель после трансплантации, но случаи отторжения могут наступить также и после нескольких месяцев или даже лет после трансплантации. Комбинации вплоть до трех или четырех лекарственных препаратов, используемых вместе, максимально защищают от отторжения и при этом минимизируют побочные эффекты. Современные стандартные лекарства, используемые для лечения отторжения трансплантируемых органов, входят во взаимодействие с дискретным метаболизмом при активации Т-типа или В-типа лимфоцитов. Примерами таких лекарств служат циклоспорин, даклицумаб, вазиликсимаб, эверолимус или FK506, которые взаимодействуют с процессами цитокиновой секреции или передачи сигнала; азатиоприн или лефлуномид, которые ингибирует синтез нуклеотидов; или 15-деоксиспергуалин, являющийся ингибитором дифференцировки лейкоцитов.
Наилучшие результаты, полученные при иммуносупрессивной терапии крови, относятся к действию, оказываемому этими лекарственными препаратами; однако, генерализованная иммуносупрессия, которая достигается с помощью этих лекарств, ослабляет иммунную защиту организма против инфекции и злокачественных новообразований. Кроме того, стандартные иммуносупрессивные лекарства часто используются в больших дозах и могут быть причиной или ускорять повреждение органа.
Описание изобретения
Настоящее изобретение предлагает новые соединения формулы (I), которые являются агонистами для G белок-сопряженного рецептора S1P1/EDG1 и обладают сильнодействующим и продолжительным иммуномодулирующим эффектом, который достигается посредством сокращения числа циркулирующих и инфильтрацирующих Т- и В-лимфоцитов, без оказания при этом повреждающего воздействия на их созревание, память или экспансию. Сокращение циркуляции Т- и В-лимфоцитов в результате S1P1/EDG1 агонизма возможно в комбинации с наблюдаемым улучшением функции эндотелиального клеточного слоя, ассоциируемого с S1P1/EDG1 активацией, делает возможным применение таких соединений для лечения неконтролируемой воспалительной болезни и улучшения сосудистой функциональности.
Соединения по настоящему изобретению могут применяться самостоятельно или в комбинации со стандартными лекарствами, ингибирующими Т-клеточную активацию, предоставляя новую иммуномодулирующую терапию с пониженной предрасположенностью к инфекциям по сравнению со стандартной иммуносупрессивной терапией. Кроме того, соединения по настоящему изобретению могут применяться в комбинации с пониженными дозами лекарств, традиционно используемых в иммуносупрессивной терапии для предоставления иммуномодулирующей активности, что является очень важным, учитывая, с другой стороны, что снижение повреждения пересаженного органа ассоциируется с применением более высоких доз иммуносупрессивных лекарств. Результаты наблюдения по улучшению функции эндотелиального клеточного слоя, ассоциируемого с S1P1/EDG1 активацией, дополнительно свидетельствуют в пользу рассматриваемых соединений в связи с вызываемым ими улучшением сосудистой функции.
Нуклеотидная и аминокислотная последовательности для человеческого S1P1/EDG1 рецептора известна из области техники и публикаций, например, в: Hla, T., and Maciag, Т. J. Biol. Chem., 265 (1990). 9308-9313; WO 91/15583 (опубликован 17 октября 1991 г.); WO 99/46277 (опубликован 16 сентября 1999 г.). Потенциальная возможность и эффективность соединений формулы (I) исследовались с помощью GTPγS анализа для определения ЕС50 величин и посредством измерения циркулирующих лимфоцитов у крыс после орального введения, соответственно (см. в примерах).
Общие термины, используемые выше и далее, имеют в этом описании следующие значения, если не указано иначе.
При использовании множественной формы соединений, солей, фармацевтических композиций, болезней и им подобных терминов, имеется в виду также единичная форма соединения, соли или им подобных.
Любая ссылка, используемая выше и далее, на соединение формулы (I) подразумевает также ссылку на соли, в частности, фармацевтически приемлемые соли соединения формулы (I), как уместную и целесообразную.
Термин С1-5алкил, самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от одного до пяти. Примеры С1-5алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил и изопентил.
Аналогично, термин С1-4алкил, самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от одного до четырех. Примеры С1-4алкильных групп представляют собой метил, этил, н-пропил, изопропил, н-бутил и изобутил.
Аналогично, термин C1-3алкил, самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от одного до трех и представляет собой метил, этил, н-пропил или изопропил; предпочтительно, метил и этил.
Аналогично, термин С2-5алкил, самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от двух до пяти.
Аналогично, термин С2-4алкил, самостоятельно или в комбинации с другими группами, подразумевает насыщенные, разветвленные или линейные группы с числом атомов углерода от двух до четырех. Примеры С2-4алкила представляют собой этил, н-пропил, изопропил, н-бутил и изобутил.
Термин С1-4алкоксигруппа, самостоятельно или в комбинации с другими группами, подразумевает R-O-группу, где R обозначает С1-4алкил. Примеры С1-4алкоксигрупп представляют собой метоксигруппу, этоксигруппу, пропоксигруппу и изопропоксигруппу.
Термин С2-5алкоксигруппа, самостоятельно или в комбинации с другими группами, подразумевает R-O-группу, где R обозначает С2-5алкил. Примеры С2-5алкоксигрупп представляют собой этоксигруппу, пропоксигруппу, изопропоксигруппу, изобутоксигруппу и изопентоксигруппу.
Термин галоген подразумевает фтор, хлор, бром или йод, предпочтительно фтор или хлор, наиболее предпочтительно хлор.
Соли представляют собой предпочтительно фармацевтически приемлемые соли соединений формулы (I).
Термин "фармацевтически приемлемые соли" относится к нетоксичным, неорганическим или органическим кислотно- и/или основно-аддитивным солям, см., например: "Salt selection for basic drugs", Int. J. Pharm., (1986), 33, 201-217.
Соединения формулы (I) могут содержать один или более стерео- или асимметрических центров, таких, как один или более асимметрических атомов углерода. Заместители при двойной связи или кольце могут присутствовать в цис-(=Z-) или транс-(=Е-) форме, если не указано иначе. Соединения формулы (I) могут таким образом присутствовать в виде смеси стереоизомеров или, предпочтительно, в виде чистых стереоизомеров. Смеси стереоизомеров могут быть разделены с использованием методов, известных специалистам в области техники.
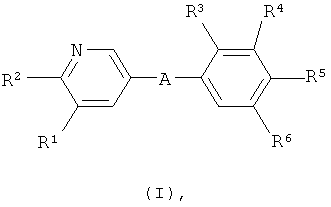
i) Изобретение относится к пиридин-3-ил производным формулы (I),
 ,
,
где
А представляет собой *-CONH-CH2-, *-CO-CH=CH-, *-СО-СН2СН2-,
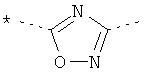 ,
, 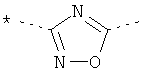 ,
, 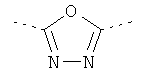 ,
,
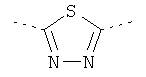 ,
, 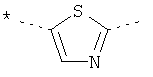 ,
, 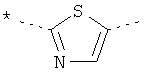 ,
,
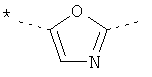 или
или 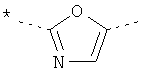
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I);
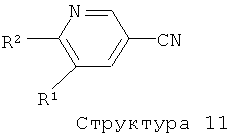
R1 представляет собой водород, С1-4алкил или хлор;
R2 представляет собой С1-5алкил или С1-4алкоксигруппу;
R3 представляет собой водород, С1-4алкил, С1-4алкоксигруппу или галоген;
R4 представляет собой водород, С1-4алкил, С1-4алкоксигруппу, галоген, трифторметил или трифторметоксигруппу;
R5 представляет собой 2,3-дигидроксипропил, ди-(гидроксиС1-4алкил)С1-4алкил, -CH2-(CH2)k-NHSO2R53, -(CH2)nCH(OH)-CH2-NHSO2R53, -CH2-(CH2)k-NHCOR54, -(CH2)nCH(OH)-CH2-NHCOR54, -CH2-(CH2)n-CONR51R52, -CO-NHR51, 1-(3-карбоксиазетидинил)-2-ацетил, 1-(2-карбоксипирролидинил)-2-ацетил, 1-(3-карбоксипирролидинил)-2-ацетил, 1-(3-карбоксиазетидинил)-3-пропионил, 1-(2-карбоксипирролидинил)-3-пропионил, 1-(3-карбоксипирролидинил)-3-пропионил, -(CH2)nCH(OH)-CH2-NR51R52, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -OCH2-(CH2)m-NR51R52, 2-[(азетидин-3-карбоновая кислота)-1-ил]этоксигруппу, 2-[(С1-5алкиловый эфир азетидин-3-карбоновой кислоты)-1-ил]этоксигруппу, 2-[(пирролидин-3-карбоновая кислота)-1-ил]этоксигруппу, 2-[(С1-5алкиловый эфир пирролидин-3-карбоновой кислоты)-1-ил]этоксигруппу, -OCH2-CH(OH)-CH2-NR51R52, 3-[(азетидин-3-карболовая кислота)-1-ил]-2-гидроксипропоксигруппу, 3-[(С1-5алкиловый эфир азетидин-3-карбоновой кислоты)-1-ил]-2-гидроксипропоксигруппу, 2-гидрокси-3-[(пирролидин-3-карбоновая кислота)-1-ил]пропоксигруппу, 2-гидрокси-3-[(С1-5алкиловый эфир пирролидин-3-карбоновой кислоты)-1-ил] пропоксигруппу, 2-гидрокси-3-[(пирролидин-2-карбоновая кислота)-1-ил]пропоксигруппу, 2-гидрокси-3-[(С1-5алкиловый эфир пирролидин-2-карбоновой кислоты)-1-ил]пропоксигруппу, -OCH2-(CH2)m-NHSO2R53, -OCH2-CH(OH)-CH2-NHSO2R53, -OCH2-(CH2)m-NHCOR54, -OCH2-CH(OH)-CH2-NHCOR54;
R51 представляет собой водород, С1-3алкил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидропропил, карбоксиметил, 1-(C1-5алкилкарбокси)метил, 2-карбоксиэтил или 2-(С1-5алкилкарбокси)этил;
R52 представляет собой водород, метил или этил;
R53 представляет собой C1-3алкил, метиламиногруппу, этиламиногруппу или диметиламиногруппу;
R54 представляет собой гидроксиметил, гидроксиэтил, аминометил, метиламинометил, диметиламинометил, аминоэтил, 2-метиламиноэтил, или 2-диметиламиноэтил;
k представляет собой целое число 1, 2 или 3;
m представляет собой целое число 1 или 2;
n представляет собой 0, 1 или 2; и
R6 представляет собой водород, С1-4алкил или галоген.
ii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 или
или  ,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I).
iii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 ,
,  ,
,  ,
,
 или
или  ,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I).
iv) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 ,
,  ,
,  или
или
 ,
,
в частности, А представляет собой
 ,
,  или
или  ,
,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I).
v) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 или
или  ,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I).
vi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 ,
,
где звездочка указывает на связь, через которую осуществляется соединение с пиридиновой группой формулы (I).
vii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой

viii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-vii), где R1 представляет собой С1-4алкил или хлор.
ix) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-vii), где R1 представляет собой С1-4алкил.
x) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-vi), где R1 представляет собой метил или этил.
xi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-vi), где R1 представляет собой метил.
xii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xi), где R1 представляет собой С1-5 алкил.
xiii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xi), где R2 представляет собой С2-4алкил.
xiv) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xi), где R2 представляет собой этил, н-пропил, изопропил или изобутил.
xv) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xi), где R2 представляет собой н-пропил или изобутил.
xvi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xi), где R2 представляет собой C1-4алкоксигруппу.
xvii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где по крайней мере один из R3, R4 и R6 представляет собой отличную от водорода группу.
xviii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой метил или метоксигруппу (в частности, метоксигруппу), а R4 и R6 представляют собой водород.
xix) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород.
xx) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород; и R4 представляет собой С1-4алкил или С1-4алкоксигруппу, а R6 представляет собой С1-4алкил или галоген.
xxi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород, R4 представляет собой С1-3алкил или метоксигруппу (в частности, метил, этил или метоксигруппу), и R6 представляет собой метил, этил, или галоген (в частности, хлор).
xxii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород, и R4 и R6 представляют собой метильную группу.
xxiii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород, R4 представляет собой метильную группу и R6 представляет собой этильную группу.
xxiv) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород, R4 представляет собой метоксигруппу и R6 представляет собой хлор.
xxv) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xvi), где R3 представляет собой водород, R4 представляет собой метильную группу и R6 представляет собой хлор.
xxvi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R5 представляет собой 2,3-дигидропропил, ди-(гидроксиС1-4алкил)С1-4алкил, -CH2-(CH2)k-NHSO2R53, -(CH2)nCH(OH)-CH2-NHSO2R53, -CH2-(CH2)k-NHCOR54, -(CH2)nCH(OH)-CH2-NHCOR54, -CH2-(CH2)n-CONR51R52, -CO-NHR51, -(CH2)nCH(OH)-CH2-NR51R52, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -ОСН2-(CH2)m-NR51R52, -OCH2-CH(OH)-CH2-NR51R52, -OCH2-(CH2)m-NHSO2R53, -OCH2-CH(OH)-CH2-NHSO2R53, -OCH2-(CH2)m-NHCOR54 или -ОСН2-СН(ОН)-CH2-NHCOR54.
xxvii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R представляет собой 2,3-дигидропропил, -CH2-(CH2)k-NR51R52, -CH2-(CH2)k-NHCOR54, -(CH2)nCH(OH)-CH2-NHCOR54, -CH2-(CH2)n-CONR51R52, -CO-NHR51, -(CH2)nCH(OH)-CH2-NR51R52, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -ОСН2-(CH2)m-NR51R52, -OCH2-CH(OH)-CH2-NR51R52, -OCH2-(CH2)m-NHCOR54 или -OCH2-CH(OH)-CH2-NHCOR54 (в частности, R5 представляет собой 2,3-дигидропропил, -CH2-(CH2)k-NR51R52, -CH2-(CH2)k-NHCOR54, -(CH2)nCH(OH)-CH2-NHCOR54, -CH2-(CH2)n-CONR51R52, -(CH2)nCH(OH)-CH2-NR51R52, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-гидрокси-3-метоксипропоксигруппу, -OCH2-(CH2)m-NR51R52, -ОСН2-СН(ОН)-CH2-NR51R52, -OCH2-(CH2)m-NHCOR54 или -OCH2-CH(OH)-CH2-NHCOR54).
xxviii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R5 представляет собой гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-(CH2)m-NR51R52, -ОСН2-СН(ОН)-СН2-NR51R52, -OCH2-(CH2)m-NHCOR54 или -OCH2-CH(OH)-CH2-NHCOR54.
xxix) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R5 представляет собой 3-гидрокси-2-гидроксиметилпропоксигруппу, 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR54 (в частности, R5 представляет собой 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR54, где R54 представляет собой гидроксиметил).
xxx) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R5 представляет собой -OCH2-CH(OH)-CH2-NHCOR54, где R54 представляет собой гидроксиметил.
xxxi) Другой вариант по изобретению относится к пиридин-3-ил производным согласно одному из вариантов i)-xxv), где R5 представляет собой 2,3-дигидроксипропоксигруппу.
xxxii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где
А представляет собой
 ,
,  ,
,  или
или  ,
,
в частности, А представляет собой
 ,
,  или
или  ,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I);
R1 представляет собой метил, этил или хлор (в частности, метил или этил);
R2 представляет собой н-пропил, изобутил или изопропоксигруппу (в частности, н-пропил или изобутил);
R3 представляет собой водород, метил или метоксигруппу (в частности, водород или метоксигруппу);
R4 представляет собой водород, метил, этил или метоксигруппу;
R5 представляет собой гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)-С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, -ОСН2-CH(OH)-СН2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54 (в частности, R5 представляет собой 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR54);
R54 представляет собой гидроксиметил, метиламинометил или 2-метиламиноэтил; и
R6 представляет собой водород, метил, этил или хлор;
где для настоящего варианта значения одного или более заместителей или групп могут быть заменены значением(ями), данным для названного заместителя(ей) или группы(групп) в одном из вариантов v)-vii), x), xi), xv), xvii)-xix), xxii)-xxv) и xxix)-xxxi).
xxxiii) Другой вариант по изобретению относится к пиридин-3-ил производным согласно варианту i), где А представляет собой
 ,
,  или
или  ,
,
в частности, А представляет собой
 или
или  ,
,
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I);
R1 представляет собой водород, С1-4алкил или хлор;
R2 представляет собой С1-5алкил или С1-4алкоксигруппу;
R3 представляет собой водород;
R4 представляет собой С1-4алкил или С1-4алкоксигруппу;
R5 представляет собой гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54;
R51 представляет собой водород, 2-гидроксиэтил или 2-гидрокси-1-гидроксиметилэтил (в частности, водород);
R52 представляет собой водород;
R54 представляет собой гидроксиметил; и
R6 представляет собой С1-4алкил или галоген;
где для настоящего варианта значения одного или более заместителей или групп могут быть заменены значением(ями), данным для названного заместителя(ей) или группы(групп) в одном из вариантов vi)-xvi), xxi)-xxv) и xxix)-xxxi).
xxxiv) Примеры пиридин-3-ил производных согласно формуле (I) выбирают из группы, включающей:
3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
N-(3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси} пропан-1,2-диол;
2-Гидрокси-N-(2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид;
N-(3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{4-[5-(5,6-Диизобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
N-(3-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
2-Гидрокси-N-(2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-3-метилфенокси}пропил)ацетамид;
N-(3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-(3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((R)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[3-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамида;
(S)-3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-(3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-((R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}-N-(2-гидрокси-этил)пропионамид;
(R)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол; и
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}пропионовую кислоту.
xxxv) В другом варианте примеры пиридин-3-ил производных согласно формуле (I) выбирают из группы, включающей:
(R)-3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
(S)-3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
N-((R)-3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(R)-3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
(S)-3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси} пропан-1,2-диола;
2-Гидрокси-N-((R)-2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид;
2-Гидрокси-N-((S)-2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид;
N-((R)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(R)-3-{4-[5-(5,6-Диизобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси} пропан-1,2-диол;
(S)-3-{4-[5-(5,6-Диизобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
N-((R)-3-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси} -2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
2-Гидрокси-N-((R)-2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-3-метилфенокси}пропил)ацетамид;
2-Гидрокси-N-((S)-2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-3-метилфенокси}пропил)ацетамид;
N-((R)-3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((R)-3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((R)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[3-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(S)-3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-((R)-3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-((R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}-N-(2-гидрокси-этил)пропионамид;
(R)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол; и
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил} пропионовую кислоту.
xxxvi) Следующий вариант по изобретению относится к новым пиридин-3-ил производным формулы (II)
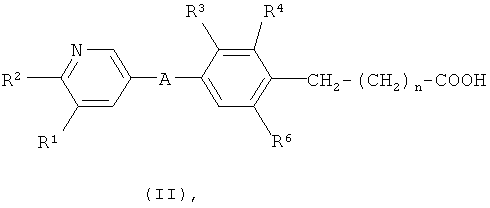
где A, R1, R2 и n имеют значения, указанные в п.1; R3 представляет собой водород; R4 представляет собой С1-4алкил или С1-4алкоксигруппу; и R6 представляет собой С1-4алкил или галоген.
Соединения формулы (I) и их фармацевтически приемлемые соли могут быть применены в качестве лекарственных средств, например, в форме фармацевтических композиций для энтерального и парентерального введения.
Приготовление фармацевтических композиций может быть осуществлено с использованием методов, известных любому специалисту в области техники (см., например: Mark Gibson, Editor, Pharmaceutical Preformulation and Formulation, IHS Health Group, Englewood, CO, USA, 2001; Remington, The Science and Practice of Pharmacy, 20th Edition, Philadelphia College of Pharmacy and Science) посредством введения соединений формулы (I) или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически полезными субстанциями, в лекарственно вводимую форму вместе с соответствующим, нетоксичным, инертным, фармацевтически приемлемым твердым или жидким веществом, используемым в качестве носителя, и, если необходимо, стандартными фармацевтическими наполнителями.
Фармацевтические композиции, включающие соединение формулы (I), применяются для профилактики и/или лечения болезней и заболеваний, ассоциируемых с активированной иммунной системой.
Такие болезни или заболевания выбирают из группы, включающей: отторжение пересаженных органов, тканей или клеток; болезни «трансплантат против хозяина», возникающие при трансплантации; аутоиммунные синдромы, включая ревматоидный артрит; системную красную волчанку; антифосфолипидный синдром; тироидит Хашимото; лимфотический тироидит; рассеянный склероз; тяжелую псевдопаралитическую миастению; диабет типа I; увеит (воспаление сосудистой оболочки глаза); эписклерит; склерит; болезнь Кавасаки, увеоритинит; задний увеит; увеит, связанный с болезнью Бехчета; синдром увеоменингита; аллергический энцефаломиелит; хроническую аллотрансплантатную васкулопатию; постинфекционные аутоиммунные болезни, включая ревматическую лихорадку и постинфекционный гломерулонефрит; воспалительные и гиперпролиферативные кожные болезни; псориаз; псориатический артрит; атопический дерматит; миопатию; миозит; остеомиелит; контактный дерматит; экзематозный дерматит; себоррейный дерматит; плоский лишай; пузырчатку; буллезную пузырчатку; врожденный буллезный эпидермолиз; крапивницу; ангиодему; васкулит; эритему; кожную эозинофилию; угри; склеродерму; гнездную алопецию; кератоконъюнктивит; хронический двухсторонний конъюнктивит; кератит; герпический кератит; эпителиальную дистрофию роговицы; лейкому роговицы; глазную пузырчатку; язву Мурена; язвенный керотит; склерит; офтальмопатию Гравса; синдром Вогта-Коунаги-Харада; саркоидоз; сенную лихорадку; обратимую обструктивную болезнь дыхательных путей; бронхиальную астму; аллергическую астму; врожденную астму; полученную извне астму; пылевую астму; хроническую или застарелую астму; позднюю астму и гипервосприимчивость дыхательных путей; бронхиолит; бронхит; эндометриоз; орхит; язву желудка; ишемические болезни кишечника; воспалительные болезни кишечника; некротический энтероколит; повреждения кишечного тракта, связанные с термальными ожогами; болезнь брюшины; проктит; эозинофильный гастроэнтерит; мастоцитоз; болезнь Крона; язвенный колит; сосудистые повреждения, вызванные ишемической болезнью и тромбозом; атеросклероз; тучное сердце; миокардит; инфаркт миокарда; синдром воспаленной аорты; общий упадок сил, вызванный вирусной болезнью; тромбоз сосудов; мигрень; ринит; экзему; интерстициальный нефрит; IgA-индуцированную нефропатию; синдром Гудрасчера; гемолитико-уремический синдром; диабетическую нефропатию; гломерулосклероз; гломерулонефрит; табулоинтерстициальный нефрит; интерстициальный цистит; дерматомиозит; синдром Гийена-Барре; болезнь Миньера; полиневрит; мультиплетный неврит; миелит; мононеврит; радикулопатию; гипертиоридизм; Базедову болезнь; тиротоксикоз; беспримесную красноклеточную аплазию; апластическую анемию; гипопластическую анемию; идиопатическую тромбоцитопеническую пурпуру; аутоиммунную гемолитическую анемию; аутоиммунную тромбоцитопению; агранулоцитоз; злокачественную анемию; мегалобластическую анемию; анеритроплазию; остеопороз; фиброидное легкое; идиопатическую интерстициальную пневмонию; дерматит; лейкодерму vulgaris; диффузную кератому vulgaris; фотоаллергическую чувствительность; кожную Т-клеточную лимфому; нодозный полиартрит; хорею Хантингтона; хорею Сиденхама; миокардоз; миокардит; склеродерму; гранулему Вегенера; синдром Шегрена; адипоз; эозинофильный фасцит; повреждения десен, периодонта, альвеольной соединительной ткани, зубной субстанции при лечении; мужскую очаговую алопецию или старческую алопецию; мускульную дистрофию; пиодерму; синдром Сезари; гипофизит; хроническую недостаточность надпочечников; болезнь Аддисона; ишемически-реперфузионное повреждение органов, имеющее место при хранении; эндотоксический шок; псевдомембранный колит; колит, вызываемый лекарством или радиацией; острую ишемическую почечную недостаточность; хроническую почечную недостаточность; рак легкого; злокачественность лимфоидного происхождения; острую или хроническую лимфотическую лейкемию; лимфому; энфизему легких; катаракту; сидероз; воспаление сетчатой оболочки глаза; старческую пятнистую дегенерацию; рубцевание стекловидного тела; щелочной ожог роговицы; дерматитную эритему; буллезный дерматит; цементный дерматит; воспаление десен; периодонтит; сепсис; панкреатит; болезнь периферийных артерий; карциогенез; твердые раковые опухоли; метастаз карциномы; гепербаропатию; аутоиммунный гепатит; первичный цирроз печени; склеротический холангит; частичную резекцию печени; острый некроз печени; цирроз; алкогольный цирроз; печеночную недостаточность; скоротечную печеночную недостаточность; скрытую печеночную недостаточность и "нацеленную на хроническую" печеночную недостаточность.
Предпочтительные болезни и заболевания, подлежащие лечению и/или профилактике с помощью соединений формулы (I), выбирают из группы, включающей отторжение пересаженных органов таких, как почка, печень, сердце, легкое, поджелудочная железа, роговица и кожа; болезни «трансплантат против хозяина», возникающие при трансплантации клеток спинного мозга; аутоиммунные синдромы, включающие ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника такие, как болезнь Крона и язвенный колит, псориаз, псориатический артрит, тироидит такой, как тироидит Хашимото, увеоретинит; атонические болезни такие, как ринит, конъюнктивит, дерматит; астму; диабет типа I; постинфекционные аутоиммунные болезни, включая ревматоидную лихорадку и постинфекционный гломерулонефрит; твердые виды рака и опухолевое метастазирование.
Особенно предпочтительные болезни или заболевания, подлежащие лечению и/или профилактике с помощью соединений формулы (I), выбирают из группы, включающей отторжение пересаженных органов таких, как почка, печень, сердце и легкое; болезнь «трансплантат против хозяина», возникающая при трансплантации клеток спинного мозга; аутоиммунные синдромы, включающие ревматоидный артрит, рассеянный склероз, псориаз, псориатический артрит, болезнь Крона и тироидит Хашимото; и атопический дерматит.
Настоящее изобретение относится также к способу профилактики или лечения болезни или заболевания, упомянутых в описании выше, заключающемуся во введении субъекту фармацевтически активного количества соединения формулы (I).
Кроме того, соединения формулы (I) также применяются в комбинации с одним или несколькими иммуномодулирующими агентами, используемыми для профилактики и/или лечения болезней или заболеваний, упомянутых в описании выше. Согласно предпочтительному варианту по изобретению, названные агенты выбираются из группы, включающей иммуносупрессанты, кортикостероиды, НПВП, цитотоксические лекарства, ингибиторы молекулярной адгезии, цитокины, ингибиторы цитокинов, антагонисты рецептора цитокина и рекомбинантные рецепторы цитокина.
Настоящее изобретение относится также к применению соединения формулы (I) для получения фармацевтической композиции, необязательно для применения в комбинации с одним или несколькими иммуномодулирующими агентами, используемыми для профилактики и/или лечения болезней или заболеваний, упомянутых в описании выше.
Соединения формулы (I) могут быть получены методами, приведенными ниже, методами, приведенными в примерах, или аналогичными методами. Оптимальные реакционные условия варьируются в зависимости от применяемых реагентов или растворителей, причем такие условия могут быть выбраны специалистом в области техники с помощью ряда оптимизирующих методик.
Соединения формулы (I) по настоящему изобретению могут быть получены согласно общей последовательности реакций, представленной ниже. Далее описаны только несколько из возможных синтетических путей, приводящих к соединениям формулы (I).
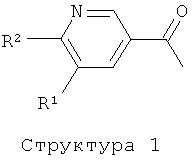
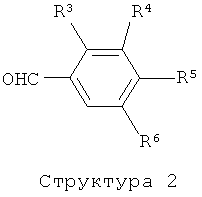
В случае, когда А представляет собой -СО-СН=СН-, соединения формулы (I) могут быть получены путем реакции соединения структуры (1) с соединением структуры (2) в присутствии основания или кислоты. Функциональные группы, присутствующие в остатках R3-R6, могут нуждаться во временной защите или могут быть даже введены на дополнительных стадиях, которые следуют за реакцией конденсации. Соединения формулы (I), где А представляет собой -СО-СН2-СН2-, могут быть получены с помощью реакции соединения формулы (I), где А представляет собой -СО-СН=СН-, с водородом в присутствии катализатора такого, как Pd/C, Pt/C, PtO2, и им подобного, в растворителе таком, как этанол, метанол, ТГФ, и им подобные, или в их смесях.
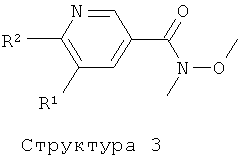
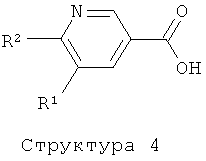
Соединение структуры (1) может быть получено реакцией соединения структуры (3) с метиловым реагентом Гриньяра или путем обработки соединения структуры (4) двумя эквивалентами метиллития в растворителе таком, как диэтиловый эфир, ТГФ и им подобные, в температурном интервале от -20 до 50°C. Амид Вайнреба структуры (3) получают обработкой соединения структуры (4) гидрохлоридом N,O-диметилгидроксиламина в присутствии конденсирующего реагента такого, как ЭДК, ДЦК и им подобных (литература: M.Mentzel, Н.М.R.Hoffmann, N-Methoxy-N-метил amides (Weinreb amides) in modern organic synthesis. Journal for Praktische Chemie/Chemiker-Zeitung, 339 (1997), 517-524; J.Singh, N.Satyamurthi, I.S.Aidhen, The growing synthetic utility of Weinreb's amide, Journal for Praktische Chemie (Weinheim, Germany), 342 (2000) 340-347; V.K.Khiestkin, D.G.Mazhukin, Recent advances in the application of N,O-dialkylhydroxylamins in organic chemistry. Current Organic Chemistry, 7 (2003), 967-993).
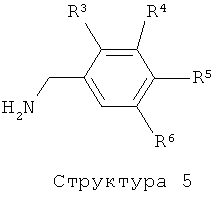
Соединения формулы (I), где А представляет собой -CO-NH-CH2-, могут быть получены путем конденсации соединения структуры (5) с соединением структуры (4) с использованием конденсирующего агента такого, как ЭДК, ДЦК, ТБТУ, РуБОФ, и подобного им, или посредством конденсации соединения структуры (5) с соответствующим хлорангидридом или бромангидридом кислоты соединения структуры (4).
Соединения формулы (I), представляющие собой производные 5-пиридин-3-ил-[1,2,4]оксадиазола, получают с помощью реакции соединения структуры (6) в растворителе таком, как диоксан, ТГФ, ксилол, толуол, бензол, пиридин, ДМФ, дихлорэтан, уксусная кислота, трифторуксусная кислота и им подобные, при комнатной или повышенной температурах в присутствии или отсутствие вспомогательных веществ таких, как кислоты (например, ТФК, уксусная кислота, HCl и им подобные), основания (например, NaH, NaOAc, Na2CO3, K2CO3, триэтилэтиламин и подобные им), тетраалкиламмонийные соли, или дегидратирующие агенты (например, оксалилхлорид, ангидрид карбоновой кислоты, POCl3, PCl5, P4O10 молекулярные сита, реагент Бургесса и т.д.) (литература, например: A.R.Gangloff, J.Litvak, E.J.Shelton, D.Sperandio, V.R.Wang, K.D.Rice, Tetrahedron Lett. 42 (2001), 1441-1443; T.Suzuki, K.Iwaoka, N.Imanishi, Y.Nagakura, K.Miyta, H.Nakahara, M.Ohta, T.Mase, Chem. Pharm. Bull. 47 (1999), 120-122; R.F.Poulain, A.L.Tartar, B.P.Deprez, Tetrahedron Lett. 42 (2001), 1495-1498; R.M.Srivastava, F.J.S.Oliveira, D.S.Machado, R.M.Souto-Maior, Synthetic Commun. 29 (1999), 1437-1450; E.O.John, J.M.Shreeve, Inorganic Chemistry 27 (1988), 3100-3104; B.Kaboudin, K.Navaee, Heterocycles 60 (2003), 2287-2292).
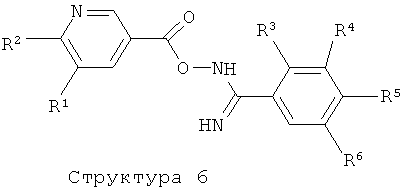
Соединения структуры (6) могут быть получены с помощью реакции соединения структуры (4) с соединением структуры (7) в растворителе таком, как ДМФ, ТГФ, ДХМ и им подобные, в присутствии или отсутствие одного или более конденсирующих агентов таких, как ТБТУ, ДЦК, ЭКД, ГБТУ, HOBt, КДИ и им подобных, и в присутствии или отсутствие основания такого, как триэтиламин, ДИПЭА, NaH, K2CO3 и т.п. (литература, например: A.Hamze, J.-F.Hernandez, P.Fulcrand, J.Martinez, J. Org. Chem., 68 (2003) 7316-7321; и литература, цитируемая выше).
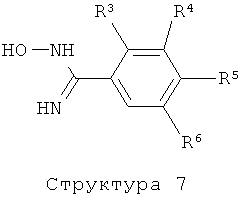
Соединения формулы (I), представляющие собой производные 3-пиридин-3-ил-[1,2,4]оксадиазола, получают аналогичным образом (литература: например: C.T.Brain, J.M.Paul, Y.Loong, P.J.Oakley, Tetrahedron Lett., 40 (1999) 3275-3278) с помощью реакции соединения структуры (8) с соединением структуры (9) и последующей циклизации соответствующего промежуточного гидроксиамидинового эфира.
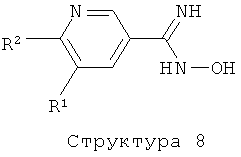
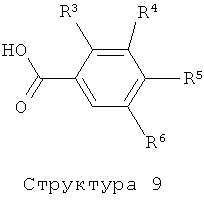
Соединения структуры (7) и (8) могут быть получены с помощью реакции соединения структуры (10) и (11), соответственно, с гидроксиламином или одной из его солей в растворителе таком, как метанол, этанол, пиридин и им подобные, в присутствии или отсутствие основания такого, как Na2CO3, K2CO3, трет-бутилат калия, триэтиламин и им подобные (литература: например, T.Suzuki, K.Iwaoka, N.Imanishi, Y.Nagakura, K.Miyta, H.Nakahara, M.Ohta, T.Mase, Chem. Pharm. Bull., 47 (1999), 120-122; J.Cui, D.Crich, D.Wink, M.Lam, A.L.Rheingold, D.A.Case, W.T.Fu, Y.Zhou, M.Rao, A.J.Olson, M.E.Johnson, Bioorg. Med. Chem., 11 (2003), 3379-3392; R.Miller, F.Lang, Z.J.Song, D.Zewge, WO 2004/035538 (Merck & Co., Inc., USA); B.Kaboudin, K.Navaee, Heterocycles, 60(2003), 2287-2292).
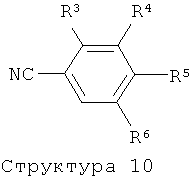
В зависимости от природы функциональных групп, присутствующих в остатках R3-R6 в структурах (2), (5), (6), (7), (9) и (10), эти функциональные группы могут нуждаться во временной защите. Подходящие защитные группы известны специалистам в области техники и включают, например: бензильную или триалкилсилильную группу для защиты спирта, кетальную группу для защиты диола, и т.д.. Эти защитные группы могут использоваться в соответствии со стандартными методами (см., например: T.W.Greene, P.G.M.Wuts, Protective Groups in Organic Synthesis, 3rd Edition, Wiley New York, 1991; P.J.Kocienski, Protecting Groups, Thieme Stuttgart, 1994). Альтернативно, нужные остатки R3-R6, в частности R5, могут быть также введены на поздних стадиях, которые следуют за конденсацией пиридиновых соединений структуры (1), (4), (8) или (11) с фенильными производными структуры (2), (5), (7), (9) или (10) с использованием соответствующего предшественника соединения структуры (2), (5), (7), (9) и (10). Фенильные соединения структуры (2), (5), (7), (9) и (10) или их предшественники либо коммерчески доступны, либо могут быть получены согласно методам, известным специалистам из области техники.
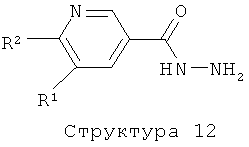
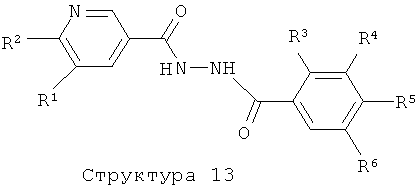
Соединения формулы (I), представляющие собой производные 2-пиридин-3-ил-[1,2,4]оксадиазола или 2-пиридин-3-ил-[1,3,4]тиадиазола, получают аналогично с помощью реакции соединения структуры (4) с гидразином (с использованием конденсирующего реагента такого, как ТБТУ, ДЦК, ЭКД, ГБТУ, HOBt, РуБОФ, КДИ и т.п) с образованием соединения структуры (12), которое затем вводят в реакцию конденсации с соединением структуры (9), получая соединение структуры (13). Соединение структуры (13) может также быть получено с использованием обратной реакционной последовательности, например, начиная с конденсации соединения структуры (9) с гидразином, а затем ввода в реакцию соответствующего промежуточного гидразида с соединением структуры (4). Дегидратация соединения структуры (13) с образованием нужного производного 2-пиридин-3-ил-[1,3,4]оксадиазола осуществляется путем обработки соединения структуры (13) с помощью такого реагента, как POCl3, CCl4 или CBr4 в комбинации с трифенилфосфином, P2O5, реагентом Бургесса и им подобными, в растворителе таком, как толуол, ацетонитрил, диоксан, ТГФ или CHCl3, в температурном интервале от 20 до 120°С с использованием или без использования микроволнового облучения (литература: например, M.A.Garcia, S.Martin-Santamaria, M.Cacho, F.Moreno de la Llave, M.Julian, A.Martinez, B.De Pascual-Teresa, A.Ramos, J. Med. Chem., 48 (2005) 4068-4075; С.Т.Brain, J.M.Paul, Y.Loong, P.J.Oakley, Tetrahedron Lett. 40 (1999) 3275-3278). Подобным же образом производные 2-пиридин-3-ил-[1,3,4]тиадизола получают циклизацией соединения структуры (13) с реагентом Лавессона, необязательно в комбинации с P2S5, в отсутствие или присутствии растворителя такого, как пиридин, толуол, ТГФ или ацетонитрил, при повышенных температурах с использованием или без использования микроволнового облучения (литература, например: A.A.Kiryanov, P.Sampson, A.J.Seed, J. Org. Chem., 66 (2001) 7925-7929).
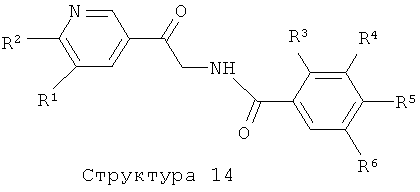
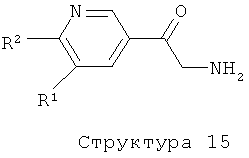
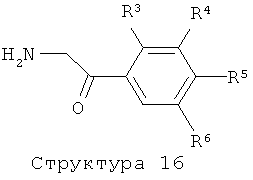
Соединения формулы (I), представляющие собой производные 5-пиридин-3-илоксазола или 5-пиридин-3-илтиазола, получают с помощью реакции соединения структуры (14) либо с POCl3, PCl5, I2 в комбинации с трифенилфосфином и триэтиламином, ангидридом трифторуксусной кислоты, реагентом Бургесса, в растворителе типа толуол, бензол, диоксан или ТГФ, при температурах в интервале от 20 до 120°С, либо с реагентом Лавессона, необязательно в комбинации с P2S5, в отсутствие или присутствии растворителя типа пиридина, толуола, ТГФ или ацетонитрила при повышенных температурах с использованием или без использования микроволнового облучения, как описано выше (литература, например: N.Sato, T.Shibata, M.Jitsuoka, T.Ohno, T.Takahashi, T.Hirohashi, T.Kanno, H.Iwaasa, A.Kanatani, T.Fukami, Takehiro, Bioorg. & Med. Chem. Lett., 14 (2004) 1761-1764). Соединения структуры (14) получают с помощью реакции соединения структуры (15) с соединением структуры (9). Аминокетонная структура (15) может быть получена из соединения структуры (1) методом, описанным в литературе (см., например: J.L.LaMattina, J.Heterocyclic Chem., 20 (1983) 533-538; M.Pesson, M.Antoine, P.Girard, J.L.Benichon, S.Chabassier, P. De Lajudie, S.Patte, F.Roquet, G.Montay, Eur. J. Med. Chem., 15 (1980) 263-268). Соединения формулы (I), представляющие собой производные 2-пиридин-3-илоксазола или 2-пиридин-3-илтиазола, получают аналогичным образом из соединения структуры (16) и соединения структуры (4).
Альтернативно, связи между пиридиновым или фенильным кольцом и центральным 5-членным гетероароматическим кольцом также могут быть образованы с использованием катализируемой палладием конденсации.
Методы, приводящие к превращению соединения структуры (4) в соединение структуры (11), или наоборот, известны специалистам в области техники.
Соединения структуры (4) могут быть получены посредством реакции эфира 5,6-дихлорникотиновой кислоты с алкильным реагентом Гриньяра в присутствии Fe(acac)3 в растворителе типа ТГФ, диоксана, ДМФ, N-МП или их комбинации, при температурах в интервале от -78 до 25°С (условия реакции Фюрстнера, литература, например: A.Fürstner, A.Leitner, M.Mendez, H.Krause J. Am. Chem. Soc., 124 (2002) 13856-13863; A.Fürstner, A.Leitner Angew. Chem., 114 (2002) 632-635). Условия реакции могут быть подобраны так, чтобы в качестве основного продукта был получен либо эфир 5-хлор-6-алкилникотиновой кислоты, либо эфир 5,6-диалкилникотиновой кислоты. Два атома хлора в эфире 5,6-дихлорникотиновой кислоты могут быть также замещены либо последовательно, либо в одну стадию двумя алк-1-енильными группами, которые могут быть одинаковыми или разными, посредством обработки эфира 5,6-дихлорникотиновой кислоты соответствующим алкенилбороновым производным в условиях проведения конденсации по Сузуки, известных специалистам в области техники. Полученный эфир 5,6-диалкенилникотиновой кислоты гидрируют далее до соответствующего эфира 5,6-диалкилникотиновой кислоты. Кроме того, в методике реакционные условия Фюрстнера и Сузуки могут быть использованы последовательно. Эфир 5,6-дихлорникотиновой кислоты может быть также обработан спиртом или алкоголятом при повышенных температурах с выходом на соответствующие эфиры 5-хлор-6-алкоксиникотиновой кислоты. Наконец, отщепление сложно-эфирной группы приводит к соединениям структуры (4).
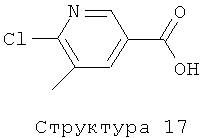
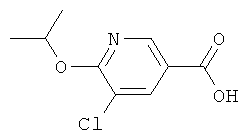
Альтернативно, соединения структуры (4), где R1 представляет собой метильную группу, могут быть получены из соединения структуры (17) посредством получения соответствующих эфиров 6-хлор-5-метилникотиновой кислоты методами, известными из уровня техники, с последующей дериватизацией, проведенной в реакционных условиях по Фюрснеру или Сузуки, как описано выше, и отщеплению сложно-эфирной группы. Соединение структуры (17) может быть получено из известного 6-хлор-3-формил-5-метилпиридина (см., например, EP-0702003) путем окисления формильной группы до карбоновой кислоты с использованием окислительных реагентов, хорошо известных из уровня техники, как, например, водная H2O2 в муравьиной кислоте, KMnO4, и т.п., в присутствии или отсутствие растворителя типа толуола, ТГФ, MeCN, ацетона, в температурном интервале от 0 до 120°С. Соединения структуры (11), где R1 представляет собой метильную группу, альтернативно могут быть получены, как описано выше, из соединений структуры (4), где R1 представляет собой метильную группу; или в соответствии с литературными методами (см., например: J.В.Paine III, J. Heterocyclic Chem., 1987, 351-355).
Когда соединения формулы (I) получают в виде смесей энантиомеров, энантиомеры могут быть разделены с использованием методов, известных из уровня техники, например, путем получения и разделения диастереоизомерных солей или с помощью ВЭЖХ на хиральной стационарной фазе такой, как Regis Whelk-O1(R,R) (10 мкм) колонка, Daicel ChiralCel OD-H (5-10 мкм) колонка, или Daicel ChiralPak IA (10 мкм) или AD-H (5 мкм) колонки. Типичные условия проведения ВЭЖХ состоят в применении смеси элюента A (EtOH, в присутствии или отсутствие амина такого, как NEt3, диэтиламин) и элюента Б (гексан), при скорости истечения от 0,8 до 150 мл/мин.
Экспериментальная часть
I) Химия
Следующие примеры иллюстрируют изобретение, не лимитируя его объема.
Все температуры измерены в °С. Соединения охарактеризованы с помощью 1H-ЯМР (300 МГц) или 13С-ЯМР (75 МГц) (Varian Oxford; химические сдвиги приведены в м. д. относительно используемого растворителя; мультиплеты: s = одиночный, d = дублет, t = триплет; р = пентлет, hex = гексет, hept = гептет, m = мультиплет, br = расширенный, константы сопряжения приведены в Гц); с помощью ЖХ-МС (Finnigan Navigator with HP 1100 Binary Pump and DAD, колонка: 4,6×50 мм, Zorbax SB-AQ, 5 мкм, 120 Å, градиент: 5-95% ацетонитрила в воде, 1 мин, с 0,04% трифторуксусной кислоты, скорость течения: 4,5 мл/мин), tR (время удерживания) приведено в мин (времена удерживания, помеченные * или в виде ЖХ-МС*, относятся к ЖХ, проводимой с использованием базовых условий, например, градиентным элюированием ацетонитрилом в воде, содержащей 13 мкМ гидроксида аммония, или другим образом установленных условий); с помощью ТСХ (ТСХ-пластины от фирмы Merck, Silica gel 60 F254); или температурой плавления. Соединения очищают с помощью препаративной ВЭХЖ (колонка: X-terra RP18, 50×19 мм, 5 мкм, градиент: 10-95% ацетонитрила в воде, содержащей 0,5% муравьиной кислоты) или с помощью СДЖХ (жидкостная хроматография среднего давления) (Labomatic MD-80-100 насос, Linear UVIS-201 детектор, колонка: 350×18 мм, Labogel-RP-18-5s-100, градиент: от 10% метанола в воде до 100% метанола). Рацематы могут быть разделены на энантиомеры с помощью препаративной ВЭЖХ (колонка: ChiralPaK AD 20×250 мм, 5 мкм, 15% EtOH в гексане).
Аббревиатуры (используемые в данном описании):
водн. - водный, БСА - бычий сывороточный альбумин, реагент Бургесса - гидроксид метоксикарбонилсульфамоиламмония, КХ - колоночная хроматография, СДИ - карбонилдиимидазол, ДЦК - дициклогексилкарбодиимид, ДХМ - дихлорметан, ДЭАД - диэтилдиазодикарбоксилат, ДИРЭА - диизопропилэтиламин, ДМЭ - 1,2-диметоксиэтан, ДМФ - диметилформамид, ДМСО - диметилсульфоксид, dppf - 1,1/-бис(дифенилфосфино)ферроцен, ЕА - этилацетат, ЭДК - N-(3-диметиламинопропил)-N'-этилкарбодиимид, эфир - диэтиловый эфир, EtOH - этанол, Fe(acac)3 - железо(III)ацетилацетоновый комплекс, ч - час(ы), ГБТУ - гексафторфосфат O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, ГОБТ - 1-гидроксибензотриазол, ВЭЖХ - высокоэффективная жидкостная хроматография, ВВ - условия высокого вакуума, реагент Лавессона - 2,4-бис(4-метокеифенил)-1,3,2,4-дитиадифосфетан-2,4-дисульфид, ЖХ-МС - жидкостная хроматография - масс-спектрометрия, MeCN - ацетонитрил, МеОН - метанол, мин - минута(ы), СДЖХ - жидкостная хроматография среднего давления, NaOAc - ацетат натрия, NEt3 - триэтиламин, N-MO - N-метилморфолин-N-оксид, N-МП - 1 -метил-2-пирролидон, ОАс - ацетат, орг. - органический, Ph - фенил, PPh3 - трифенилфосфин, преп. - препаративный, РуБОФ - гексафторфосфат бензотриазол-1-илокси-трис-пирролидинфосфония, рац - рацемический, кт - комнатная температура, насыщ. - насыщенный, SIP - сфингозин 1-фосфат, ТБМЭ - трет-бутилметиловый эфир, ТБТУ - тетрафторборат 2-(1Н-бензотриазол-1-ил)-1,2,3,3-тетраметилурония, трет - третичный, ТФК - трифторуксусная кислота, ТГФ - тетрагидрофуран, ТСХ - тонкослойная хроматография, tR - время удерживания.
Синтез промежуточных соединений
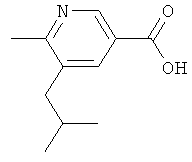
Никотиновая кислота 1
5,6-Дихлорникотиновую кислоту (1,95 г, 10 ммолей) добавляют к раствору KOtBu (2,28 г, 20 ммолей) в изопропаноле (20 мл). Смесь нагревают при температуре 80°С в течение 15 ч. Затем смесь разбавляют водой (60 мл) и подкисляют 1-молярным водным раствором НС1. Водный раствор экстрагируют эфиром (пять раз по 50 мл) и объединенные органические экстракты высушивают (Na2SO4), фильтруют и выпаривают, получая 5-хлор-6-изопропоксиникотиновую кислоту;
1H ЯМР (d6-ДМСО): δ 1,38 (d, J=6,2 Гц, 7 Н), 5,44 (гептет, J=6,2 Гц, 1 Н), 8,18 (d, J=2,1 Гц, 1 Н), 8,65 (d, J=2,1 Гц, 1 Н).
Никотиновая кислота 2
а) Суспензию 5,6-дихлорникотиновой кислоты (5,25 г, 27,3 ммолей) в толуоле (200 мл) нагревают до температуры 80°С и затем медленно обрабатывают ди-трет-бутилацеталем N,N-диметилформамида (20,0 г, 98,0 ммолей). При этом смесь приобретает слегка желтоватый цвет и прозрачность. Нагревание и перемешивание продолжают в течение 3 ч, после чего раствор охлаждают до КТ, разбавляют эфиром и промывают насыщенным водным раствором Na2CO3. Органическую фазу высушивают над MgSO4, фильтруют и растворитель выпаривают. Остаток очищают с помощью СДЖХ (SiO2), получая трет-бутиловый эфир 5,6-дихлорникотиновой кислоты (5,13 г).
1Н ЯМР (CDCl3): δ 1,62 (s, 9 Н), 8,30 (d, J=2,0 Гц, 1 Н), 8,83 (d, J=2,0 Гц, 1H).
б) К раствору трет-бутилового эфира 5,6-дихлорникотиновой кислоты (3,37 г, 13,6 ммолей), Fe(acac)3 (719 мг, 2,04 ммолей) и N-МП (1,95 мл, 20 ммолей) в ТГФ (300 мл) медленно добавляют раствор метилмагнийхлорида в ТГФ (3-молярный, 5,4 мл, 16,3 ммолей) при температуре -78°С. Коричневый раствор при этом становится мутным и черным. Перемешивание продолжают в течение 1 ч при температуре -75°С, после чего раствор нагревают до 0°С. После завершения реакции смесь вновь охлаждают до температуры -70°С. Следующую порцию метилмагнийбромида в ТГФ (3-молярный раствор, 5,4 мл, 16,3 ммолей) медленно добавляют при температуре -70°С. Темно-зеленую смесь медленно нагревают до температуры -20°С и осторожно гасят 0,7-нормальным водным раствором HCl (150 мл). Затем смесь экстрагируют эфиром (5 раз по 60 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют и выпаривают, получая сырой трет-бутиловый эфир 5-хлор-6-метилникотиновой кислоты в виде желтого масла (4,66 г);
ЖХ-МС: tR=1,03 мин, [M+1]+=228,22.
в) трет-Бутиловый эфир 5-хлор-6-метилникотиновой кислоты (3,09 г, 13,5 ммолей), Fe(асас)3 (719 мг, 2,04 ммолей) и N-МП (1,95 мл, 20 ммолей) растворяют в ТГФ (3-молярный раствор, 500 мл) и охлаждают до температуры -78°С. Затем медленно добавляют раствор изобутилмагнийбромида в ТГФ (2-молярный, 13,6 ммолей) при температуре -75°С. Коричневый раствор становится при этом мутным и желтым. Перемешивание раствора продолжают в течение 1 ч при температуре -75°С, после чего его медленно нагревают до КТ. После завершения реакции добавляют Fe(асас)3 (719 мг, 2,04 ммолей) и смесь вновь охлаждают до температуры -70°С. Следующую порцию метилмагнийбромида в ТГФ (2-молярный раствор, 13,6 ммолей) медленно добавляют при -70°С. Темно-зеленую смесь медленно нагревают до комнатной температуры и перемешивают в течение 15 ч. Затем смесь осторожно гасят 0,7-нормальным водным раствором HCl (150 мл) и экстрагируют этилацетатом (6 раз по 60 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют и выпаривают. Остаток очищают с помощью обращенно-фазовой СДЖХ, получая трет-бутиловый эфир 6-метил-5-изобутилникотиновой кислоты в виде черного масла (0,50 г);
ЖХ-МС: tR=0,84 мин, [M+1]+=250,14.
г) К трет-бутиловому эфиру 6-метил-5-изобутилникотиновой кислоты (0,50 г, 2 ммолей), растворенному в диоксане (20 мл), добавляют 4-нормальный раствор HCl в диоксане (30 мл), после чего смесь перемешивают в течение 3 ч. Растворитель затем выпаривают, получая гидрохлорид 6-метил-5-изобутилникотиновой кислоты (0,52 г);
ЖХ-МС: tR=0,54 мин; [M+1]+=194,29; 1H ЯМР (d6-ДМСО): δ 0,91 (d, J=6,5 Гц, 6 Н), 1,91 (гептет, J=6,5 Гц), 2,68 (d, J=7,3 Гц, 2 Н), 2,73 (s, 3 H), 8,47 (d, J=1,8 Гц, 1 Н), 8,90 (d, J=2,0 Гц, 1 Н).
Никотиновая кислота 3
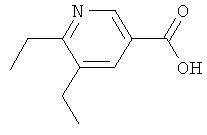
а) К раствору трет-бутилового эфира 5,6-дихлорникотиновой кислоты (5,00 г, 20,0 ммолей) и комплекса 2,4,6-тривинилциклотрибороксан/пиридин (9,700 мг, 40 ммолей) в диоксане (30 мл) добавляют 2-молярный водный раствор K2CO3 (6 мл), а затем Pd(PPh3)4 (620 мг, 0,38 ммолей) и PPh3 (620 мг, 3,8 ммолей). Смесь перемешивают при температуре 100°С в течение 2 ч, охлаждают до КТ и разбавляют эфиром (200 мл), а затем экстрагируют 1-молярным водным раствором NaOH (дважды по 50 мл) и рассолом (50 мл). Органическую фазу высушивают (Na2SO4), фильтруют и выпаривают. Остаток очищают с помощью ускоренной хроматографии (SiO2, этилацетат/гептан), получая трет-бутиловый эфир 5-хлор-6-винилникотиновой кислоты (4,0 г) в виде желтого масла;
ЖХ-МС: tR=1,05 мин, [M+1+CH3CN]+=281,36.
б) Смесь трет-бутилового эфира 5-хлор-6-винилникотиновой кислоты (2,0 г), Cs2CO3 (3,4 г), три(трет-бутил)фосфина (0,04 экв.), трис(дибензилиденацетон)-дипалладия (0,02 экв.) и 2,4,6-тривинилциклотрибороксан-пиридинового комплекса (2,0 г) в диоксане (30 мл) дегазируют и нагревают при температуре 100°С в течение 15 ч. Смесь затем охлаждают до КТ, разбавляют эфиром (200 мл) и экстрагируют 1-молярным водным раствором NaOH (дважды по 50 мл) и рассолом (50 мл). Органическую фазу высушивают (Na2SO4), фильтруют и выпаривают. Остаток очищают с помощью ускоренной хроматографии (SiO2, этилацетат/гептан), получая трет-бутиловый эфир 5,6-дивинилникотиновой кислоты (0,89 г) в виде масла.
ЖХ-МС: tR=1,01 мин, [M+1]+=232,04.
в) К раствору трет-бутилового эфира 5,6-дивинилникотиновой кислоты (890 мг, 3,8 ммолей) в ТГФ (20 мл), содержащем некоторое количество МеОН, добавляют Pd/C (100 мг, 10% Pd) и смесь перемешивают под давлением водорода (1 атм) при КТ в течение 3 ч. Катализатор отфильтровывают, а фильтрат выпаривают, после чего остаток очищают с помощью ускоренной хроматографии (SiO2, этилацетат/гептан), получая трет-бутиловый эфир 5,6-диэтилникотиновой кислоты (860 мг) в виде масла;
ЖХ-МС: tR=0,79 мин, [M+1]+=236,14.
г) Раствор трет-бутилового эфира 5,6-диэтилникотиновой кислоты (860 мг, 3,65 ммолей) в 6-нормальном водном растворе HCl (15 мл) перемешивают при температуре 65°C в течение 3 ч, после чего растворитель выпаривают. Остаток высушивают в высоком вакууме, получая гидрохлорид 5,6-диэтилникотиновой кислоты (923 мг) в виде масла;
ЖХ-МС: tR=0,50 мин, [М+1]+=180,05.
Никотиновая кислота 4
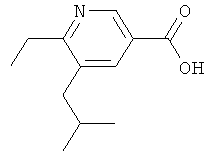
6-Этил-5-изобутилникотиновую кислоту получают аналогично получению никотиновой кислоты (3) из трет-бутилоъото эфира 5-хлор-6-винилникотиновой кислоты и 2,4,6-три-(2-метилпропенил)циклобороксан-пиридинового комплекса, используя методику, приведенную в публикации: F.Kerins, D.F.O'Shea, J. Org. Chem., 67 (2002) 4968-4971);
ЖХ-МС: tR=0,64 мин, [M+1]+=207,98.
Никотиновая кислота 5
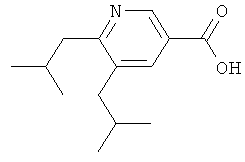
а) Раствор 5,6-дихлорникотиновой кислоты (5,0 г, 26 ммолей) в сухом EtOH (300 мл) и хлортриметилсилане (33 мл, 10 экв.) перемешивают при комнатной температуре в течение 16 ч. Затем растворитель выпаривают, остаток растворяют в эфире (200 мл) и промывают насыщенным водным раствором Na2CO3 (75 мл) и рассолом (50 мл). Органическую фазу высушивают над Na2SO4, фильтруют и выпаривают, получая этиловый эфир 5,6-дихлорникотиновой кислоты (5,8 г) в виде твердого вещества;
ЖХ-МС: tR=0,96 мин, [M+1]+=219,93.
б) К раствору этилового эфира 5,6-дихлорникотиновой кислоты (0,8 г, 3,6 ммолей) и 2,4,6-три-(2-метилпропенил)циклобороксан-пиридинового комплекса (1,78 г, 5,49 ммолей) в ДМЭ (20 мл) добавляют 2-молярный водный раствор K2CO3 (5 мл), а затем Pd(PPh3)4 (50 мг, 0,068 ммолей) и PPh3 (110 мг, 0,68 ммолей). Смесь перемешивают при температуре 100°С в течение 2 дней, после чего охлаждают до КТ и разбавляют эфиром (100 мл). Фазы затем разделяют и водную фазу экстрагируют эфиром (50 мл). Объединенные органические экстракты промывают 1-молярным водным раствором NaOH (дважды по 40 мл) и рассолом (40 мл), высушивают (Na2SO4), фильтруют и выпаривают. Сырой продукт очищают с помощью ускоренной хроматографии (SiO2, этилацетат/гептан), получая этиловый эфир 5,6-ди-(2-метилпропенил)никотиновой кислоты (52 мг) в виде бесцветного масла;
ЖХ-МС: tR=1,11 мин, [М+1]+=260,24.
в) Этиловый эфир 5,6-ди-(2-метилпропенил)никотиновой кислоты (52 мг, 0,3 ммолей) растворяют в ТГФ (10 мл), добавляют Pd/C (20 мг, 10% Pd) и смесь перемешивают под давлением водорода (1 атм) при комнатной температуре в течение 15 ч. Затем катализатор отфильтровывают и фильтрат выпаривают, получая этиловый эфир 5,6-диизобутилникотиновой кислоты (52 мг) в виде масла;
ЖХ-МС: tR=1,12 мин, [M+1]+=264,19.
г) Раствор этилового эфира 5,6-диизобутилникотиновой кислоты (52 мг, 0,2 ммолей) в 6-нормальном водном растворе HCl (2 мл) перемешивают при температуре 65°С в течение 15 ч, после чего смесь охлаждают до КТ и экстрагируют эфиром (дважды по 10 мл). Водную фазу выпаривают, и остаток высушивают в высоком вакууме, получая гидрохлорид 5,6-диизобутилникотиновой кислоты (0,12 г) в виде бесцветного твердого вещества;
ЖХ-МС: tR=0,73 мин; [M+1]+=236,40.
Никотиновая кислота 6
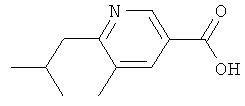
а) Оксихлорид фосфора (183 мл, 2 моля) нагревают при температуре 90°С и смесь коммерчески доступного 2-метил-2-бутеннитрила (73 г, 0,9 моля) и ДМФ (154 мл, 2 моля) медленно добавляют, поддерживая температуру в интервале от 100 до 110°С. Смесь затем перемешивают при температуре 110°С в течение 15 ч, охлаждают до КТ и разбавляют дихлорметаном (500 мл). После этого смесь охлаждают до 0°С и осторожно гасят водой (500 мл). Фазы затем разделяют и водную фазу экстрагируют дихлорметаном (общий объем 800 мл). Объединенные органические экстракты высушивают (Na2SO4), фильтруют и выпаривают. Остаток кристаллизуют из циклогексана, получая 6-хлор-3-формил-5-метилпиридин (28,3 г) в виде слегка желтых кристаллов;
ЖХ-МС: tR=0,76 мин, [M+1]+=156,14.
б) Раствор 6-хлор-3-формил-5-метилпиридина (10 г, 64 ммолей) в муравьиной кислоте (200 мл) охлаждают до 0°С и при этой же температуре добавляют 50%-ный раствор H2O2 в воде (9,6 мл, 360 ммолей). Смесь перемешивают при 0°С в течение 15 ч, осторожно разбавляют водой (200 мл) и экстрагируют дихлорметаном (8 раз по 100 мл). Объединенные органические экстракты промывают 1-молярным водным раствором HCl (100 мл) (контроль за оставшимся пероксидом), высушивают (MgSO4), фильтруют и выпаривают. Остаток высушивают, получая 6-хлор-5-метилникотиновую кислоту (9,56 г);
ЖХ-МС: tR=0,72 мин, [M+1]+=172,0.
в) Раствор 6-хлор-5-метилникотиновой кислоты (13,85 г, 80,75 ммолей) в сухом EtOH (200 мл), содержащем несколько капель H2SO4, перемешивают, нагревая с обратным холодильником в течение 2 дней. Затем раствор охлаждают до КТ, растворитель выпаривают, остаток растворяют в этилацетате (200 мл) и промывают насыщенным водным раствором Na2CO3 (дважды по 80 мл), 1-молярным водным раствором KHSO4 (дважды по 80 мл) и рассолом (50 мл). Органическую фазу высушивают над MgSO4, фильтруют и выпаривают, получая этиловый эфир 6-хлор-5-метилникотиновой кислоты (12,65 г) в виде твердого вещества;
ЖХ-МС: tR=0,92 мин; [M+1]+=200,10; 1H ЯМР (CDCl3): δ 1,43 (t, J=7,0 Гц, 3 Н), 2,46 (s, 3 H), 4,43 (q, J=7,3 Гц, 2 Н), 8,16 (m, 1 H), 8,84 (d, J=2,0 Гц, 1 Н).
г) К раствору этилового эфира 6-хлор-5-метилникотиновой кислоты (4,98 г, 24,9 ммолей), 2,4,6-три-(2-метилпропенил)циклобороксан-пиридинового комплекса (5,74 г, 17,7 ммолей, получают аналогично методу, приведенному в: F.Kerins, D.F.O'Shea, J. Org. Chem., 67 (2002) 4968-4971) и PPh3 (1,15 г, 4,4 ммолей) в ДМЭ (60 мл) добавляют 2-молярный водный раствор K2CO3 (20 мл). Смесь дегазируют и продувают N2, после чего добавляют Pd(PPh3)4 (460 мг, 0,4 ммолей). Затем смесь перемешивают при температуре 90°С в течение 20 ч, после чего охлаждают до КТ, разбавляют этилацетатом (150 мл) и промывают насыщенным водным раствором NaHCO3 (дважды по 50 мл). Органический экстракт высушивают над MgSO4, фильтруют и выпаривают. Сырой продукт очищают с помощью ускоренной хроматографии (SiO2, гептан/этилацетат), получая этиловый эфир 5-метил-6-(2-метилпропенил)никотиновой кислоты (3,98 г) в виде оранжевого масла;
ЖХ-МС: tR=0,72 мин, [М+1]+=220,15.
д) Этиловый эфир 5-метил-6-(2-метилпропенил)никотиновой кислоты (3,98 г, 18,2 ммолей) растворяют в ТГФ (100 мл) и МеОН (100 мл), добавляют Pd/C (500 мг 10% Pd) и смесь перемешивают под давлением водорода (1 атм) при КТ в течение 15 ч. Катализатор отфильтровывают и фильтрат выпаривают, получая этиловый эфир 6-изобутил-5-метилникотиновой кислоты (3,76 г) в виде бесцветного масла;
ЖХ-МС: tR=0,75 мин; [М+1]+=222,15; 1H ЯМР (CDCl3): δ 0,97 (d, J=6,8 Гц, 6 Н), 1,42 (t, J=7,3 Гц, 3 Н), 2,20 (гептет, J=6,8 Гц, 1Н), 2,38 (s, 3 H), 2,75 (d, J=7,0 Гц, 2 Н), 4.41 (q, J=7,3 Гц, 2 Н), 8,03 (d, J=1,8 Гц, 1 Н), 9,00 (d, J=2,0 Гц, 1 Н).
е) Раствор этилового эфира 6-изобутил-5-метилникотиновой кислоты (3,75 г, 16,95 ммолей) в 12,5%-ном водном растворе HCl (50 мл) перемешивают при температуре 65°С в течение 24 ч, после чего растворитель выпаривают. Остаток высушивают в высоком вакууме, получая гидрохлорид 6-изобутил-5-метилникотиновой кислоты (3,55 г) в виде белого порошка;
ЖХ-МС: tR=0,57 мин, [M+1]+=194,25.
Никотиновая кислота 7
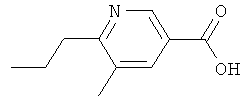
5-Метил-6-пропилникотиновую кислоту (1,85 г в виде гидрохлорида) получают аналогично получению никотиновой кислоты (6) из этилового эфира 6-хлор-5-метилникотиновой кислоты (2,0 г) и коммерчески доступной транс-1-пропен-1-илбороновой кислоты (1,3 г);
1Н ЯМР (d6-ДМСО): δ 0,96 (t, J=7,3 Гц, 3 Н), 1,72 (m, 2 H), 3,05 (t, J=7,5 Гц, 2 Н), 8,66 (m, 1 H), 8,86 (d, J=1,5 Гц, 1 Н).
Никотиновая кислота 8
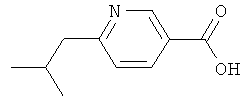
6-Изобутилникотиновую кислоту получают аналогично получению никотиновой кислоты (2) из коммерчески доступного этилового эфира 6-хлорникотиновой кислоты и изобутилмагнийхлорида;
ЖХ-МС: tR=0,52 мин, [M+1]+=180,30.
Никотиновая кислота 9
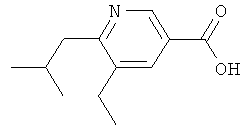
а) К раствору этилового эфира 5,6-дихлорникотиновой кислоты (2,40 г, 10,9 ммолей) и 2,4,6-трис-(2-метилпропенил)циклотрибороксан-пиридинового комплекса (2,02 г, 6,22 ммолей, полученного с использованием методики, приведенной в: F.Kerins, D.F.O'Shea, J. Org. Chem., 67 (2002) 4968-4971) в диоксане (40 мл) и 2-молярном водном растворе K2CO3 (10 мл) добавляют PPh3 (114 мг, 0,436 ммолей). Смесь дегазируют и продувают азотом, после чего добавляют Pd(PPh3)4 (160 мг, 0,218 ммолей). Затем смесь перемешивают при температуре 100°С в течение 1,5 ч, после чего добавляют еще одну порцию 2,4,6-трис-(2-метилпропенил)циклотрибороксан-пиридинового комплекса (1,01 г, 3,11 ммолей). Перемешивание продолжают при температуре 100°С в течение 3 ч, а затем смесь охлаждают до КТ, разбавляют эфиром, промывают 1-нормальным водным раствором NaOH и водой, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 9:1 и получая этиловый эфир 5-хлор-6-(2-метилпропенил)никотиновой кислоты (2,4 г) в виде масла; ЖХ-МС: tR=1,05 мин, [М+1]+=240,02. К раствору этого вещества в диоксане (40 мл) добавляют 2,4,6-тривинилциклотрибороксан-пиридинового комплекса (1,84 г, 7,63 ммолей), Ca2CO3 (4,62 г, 14,2 ммолей), а затем три-трет-бутилфосфин (88 мг, 0,436 ммолей). Смесь дегазируют и продувают азотом, после чего добавляют Pd2(dba)3 (200 мг, 0,218 ммолей). Затем смесь перемешивают при температуре 100°С в течение 16 ч, после чего добавляют еще одну порцию 2,4,6-тривинилциклотрибороксан-пиридинового комплекса (1,84 г, 7,63 ммолей) и Pd2(dba)3 (200 мг, 0,218 ммолей). Перемешивание продолжают при температуре 100°С в течение 24 ч, а затем смесь разбавляют этилацетатом, промывают 1-нормальным водным раствором NaOH, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 10:1 и получая первую порцию этилового эфира 6-(2-метилпропенил)-5-винилникотиновой кислоты. Кроме того, выделяют непрореагировавший этиловый эфир 5-хлор-6-(2-метилпропенил)никотиновой кислоты. Этот продукт вновь обрабатывают 2,4,6-тривинилциклотрибороксан-пиридиновым комплексом, как описано ранее. Обработка, очистка и объединение двух порций дает этиловый эфир 6-(2-метилпропенил)-5-винилникотиновой кислоты (1,37 г) в виде масла;
ЖХ-МС: tR=0,87 мин, [М+1]+=232,13.
б) К раствору этилового эфира 6-(2-метилпропенил)-5-винилникотиновой кислоты (1,37 г, 6,74 ммолей) в ТГФ (20 мл) добавляют Pd/C (100 мг, 10% Pd), a затем EtOH (20 мл). Смесь перемешивают под давлением водорода (1 атм) при КТ в течение 24 ч. Затем катализатор удаляют фильтрованием и фильтрат концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 4:1 и получая этиловый эфир 5-этил-6-изобутилникотиновой кислоты (970 мг) в виде бесцветного масла;
ЖХ-МС: tR=0,79 мин, [M+1]+=236,20; 1Н ЯМР (CDCl3): δ 0,97 (d, J=6,8 Гц, 6 Н), 1,27 (t, J=7,5 Гц, 3 Н), 1,42 (t, J=7,0 Гц, 3 Н), 2,17-2,28 (m, 1 H), 2,69-2,78 (m, 4 Н), 4,42 (q, J=7,0 Гц, 2 Н), 8,07 (s, 1 Н), 9,00 (s, 1 Н).
в) Раствор этилового эфира 5-этил-6-изобутилникотиновой кислоты (970 мг, 4,12 ммолей) в 25%-ном водном растворе HCl перемешивают при температуре 95°С в течение 8 ч. Растворитель выпаривают, а остаток высушивают в высоком вакууме, получая гидрохлорид 5-этил-6-изобутилникотиновой кислоты (1,15 г, предположительно в виде гидрата) в виде бесцветной смолы;
ЖХ-МС: tR=0,62 мин, [M+1]+=208,35.
Никотиновая кислота 10
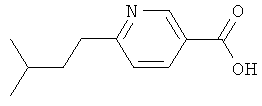
6-(3-Метилбутил)никотиновую кислоту получают реакцией трет-бутилового эфира 6-хлорникотиновой кислоты с 3-метилбутилмагнийбромидом в условиях реакции Фюрстнера, как описано при получении никотиновой кислоты (2);
ЖХ-МС: tR=0,58 мин, [M+1]+=194,30.
Никотиновая кислота 11
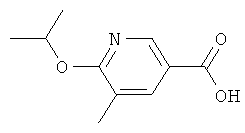
а) К раствору трет-бутилата калия (1,26 г, 11,3 ммолей) в изопропаноле (30 мл) добавляют 2,5-дибром-3-пиколин (2,89 г, 11,3 ммолей). Смесь перемешивают при температуре 80°С в течение 15 ч, после чего добавляют еще одну порцию трет-бутилата калия (2,53 г, 27,5 ммолей). Перемешивание продолжают при температуре 80°С в течение 24 ч, после чего смесь разбавляют насыщенным водным раствором NaHCO3. Смесь экстрагируют эфиром, органический экстракт высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 9:1 и получая 5-бром-2-изопропокси-3-метилпиридин (1,24 г) в виде бесцветного масла;
ЖХ-МС: tR=1,06 мин; [M+1]+=230,00; 1H ЯМР (CDCl3): δ 1,35 (d, J=6,3 Гц, 6 Н), 2,16 (s, 3 H), 5,27 (гептет, J=6,3 Гц, 1Н), 7,48 (d, J=1,5 Гц, 1 Н), 8,02 (d, J=2,0 Гц, 1 Н).
б) Раствор 5-бром-2-изопропокси-3-метилпиридина (1,24 г, 5,39 ммолей) и 2,4,6-тривинилциклотрибороксан-пиридинового комплекса (1,27 г, 5,26 ммолей) в диметоксиэтане (12 мл) и 2-молярном водном растворе K2CO3 (5 мл) дегазируют и продувают аргоном, после чего добавляют Pd(PPh3)4 (112 мг, 0,097 ммолей). Смесь перемешивают при температуре 80°С в течение 15 ч, после чего ее охлаждают до КТ, разбавляют эфиром (50 мл), промывают насыщенным водным раствором NaHCO3 (дважды по 30 мл), высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 9:1 и получая 2-изопропокси-3-метил-5-винилпиридин (703 мг) в виде бледно-желтого масла;
ЖХ-МС: tR=1,01 мин; [М+1]+=178,11.
в) К раствору 2-изопропокси-3-метил-5-винилпиридина (703 мг, 3,97 ммолей) в ацетоне (80 мл) добавляют MnO4 (1,60 г, 10,1 ммолей) и смесь перемешивают при комнатной температуре в течение 18 ч. Темно-коричневую суспензию фильтруют и прозрачный, бесцветный фильтрат выпаривают без досушивания, получая 6-изопропокси-5-метилникотиновой кислоты (1,06 г, в виде калиевой соли) в виде грязно-белого твердого вещества;
ЖХ-МС: tR=0,86 мин; [M+1]+=196,09; 1H ЯМР (D2O): δ 1,31 (d, J=6,3 Гц, 6 Н), 2,14 (s, 3 H), 5,15 (гептет, J=7,0 Гц, 1Н), 7,91 (s, 1 H), 8,34 (s, 1 H).
N-Гидрокси-6-изобутил-5-метилникотинамид
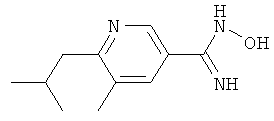
а) Раствор этилового эфира 6-изобутил-5-метилникотиновой кислоты (2,86 г, 12,9 ммолей) в 7-нормальном растворе NH3 в МеОН (80 мл) перемешивают при температуре 60°С в течение 20 ч, после чего растворитель удаляют в вакууме. Остаток высушивают, получая 6-изобутил-5-метилникотинамид (1,89 г) в виде желтого масла;
ЖХ-МС: tR=0,66 мин, [M+1]+=193,29; 1H ЯМР (D6-ДМСО): δ 0,91 (d, J=6,5 Гц, 6 H), 2,08-2,20 (m, 1 H), 2,32 (s, 3 H), 2,65 (d, J=7,3 Гц, 2 H), 7,43 (s, 1 H), 7,95 (s, 1 H), 8,01 (m, 1 H), 8,78 (s, 1 H).
б) К раствору 6-изобутил-5-метилникотинамида (1,89 г, 9,85 ммолей) в ДХМ (40 мл) и пиридине (2,83 г, 39,4 ммолей) добавляют порциями ангидрид ТФК (5,17 г, 24,6 ммолей) при 0°С. Смесь затем перемешивают при комнатной температуре в течение 24 ч, разбавляют ДХМ и промывают водой, а потом 4%-ным водным раствором лимонной кислоты и насыщенным водным раствором NaHCO3. Органический экстракт высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении 9:1 и получая 6-изобутил-5-метилникотинонитрил (1,35 г) в виде белого твердого вещества;
ЖХ-МС: tR=0,89 мин, [М+1]+=175,11.
в) К раствору трет-бутилата калия (3,04 г, 27,1 ммолей) в МеОН (60 мл) добавляют гидрохлорид гидроксиламина (1,62 г, 23,2 ммолей) при 0°С. К этой суспензии добавляют затем 6-изобутил-5-метилникотинонитрил (1,35 г, 7,75 ммолей). Смесь нагревают с обратным холодильником в течение 3 ч, охлаждают до КТ, фильтруют и фильтрат выпаривают без досушивания. Остаток суспендируют в небольшом количестве воды и затем экстрагируют этилацетатом. Органический экстракт концентрируют и высушивают в высоком вакууме, получая N-гидрокси-6-изобутил-5-метилникотинамид (1,53 г) в виде бледно-желтого масла;
ЖХ-МС: tR=0,68 мин, [M+1]+=208,22; 1H ЯМР (D6-ДМСО): δ 0,91 (d, J=6,8 Гц, 6 Н), 2,06-2,17 (m, 1 H), 2,29 (s, 3 H), 2,61 (d, J=7,0 Гц, 2 Н), 5,85 (s расширенный, 2 Н), 7,76 (s, 1 H), 8,60 (s, 1 H), 9,68 (s, 1 H).
N-Гидрокси-6-изопропокси-5-метилникотинамид
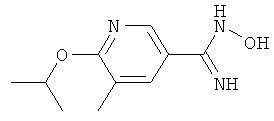
Названное в заголовке соединение получают аналогично получению N-гидрокси-6-изобутил-5-метилникотинамида из никотиновой кислота (11);
ЖХ-МС: tR=0,64 мин, [M+1]+=210,08.
4-Аллилокси-N-гидроксибензамидин
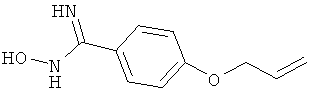
Названное в заголовке соединение получают аналогично получению 4-аллилокси-N-гидрокси-3,5-диметилбензамидина аллилированием коммерчески доступного 4-гидроксибензонитрила, за которым следует превращение нитрила в гидроксиамидин;
ЖХ-МС: tR=0,59 мин, [M+1]+=193,58.
4-Аллилокси-N-гидрокси-2-метилбензамидин
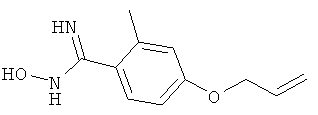
Названное в заголовке соединение получают аналогично получению 4-аллилокси-3-этил-N-гидрокси-5-метилбензамидина исходя из коммерчески доступного 4-гидрокси-2-метилбензальдегида;
ЖХ-МС: tR=0,62 мин, [M+1]+=207,10; 13С ЯМР (CDCl3): δ 20,72, 68,91, 104,72, 112,75, 116,45, 118,32, 118,53, 132,25, 134,19, 144,09, 161,71.
4-Аллилокси-N-гидрокси-2-метоксибензамидин
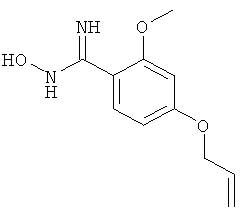
Названное в заголовке соединение получают из коммерчески доступного 4-гидрокси-2-метоксибензальдегида, используя литературные методики (ссылки, процитированные при синтезе 3-этил-4,N-дигидрокси-5-метилбензамидина);
ЖХ-МС: tR=0,64 мин; [M+1]+=223,24; 1H ЯМР (D6-ДМСО): δ 9,33 (s расширенный, 1Н), 7,30 (d, J=8,2 Гц, 1Н), 6,60 (d, J=2,3 Гц, 1Н), 6,50 (dd, J=2,3, 8,2 Гц, 1Н), 6,10-5,94 (m, 1Н), 5,50 (s, 2H), 5,40 (d, J=17,0 Гц, 1Н), 5,24 (d, J=10,6 Гц, 1Н), 4,57 (d, J=4,7 Гц, 2H), 3,76 (s, 3H).
4-Аллилокси-N-гидрокси-3-метоксибензамидин
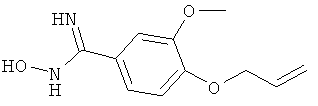
Названное в заголовке соединение получают аналогично получению 4-аллилокси-N-гидрокси-3,5-диметилбензамидина аллилированием коммерчески доступного 4-гидрокси-3-метоксибензонитрила с последующим превращением нитрила в гидроксиамидин;
ЖХ-МС: tR=0,59 мин, [M+1]+=223,18.
4-Аллилокси-3-бром-N-гидроксибензамидин
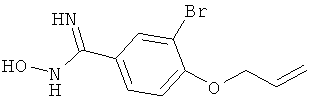
Названное в заголовке соединение получают аналогично получению 4-аллилокси-N-гидрокси-3,5-диметилбензамидина аллилированием коммерчески доступного 3-бром-4-гидроксибензонитрила с последующим превращением нитрила в гидроксиамидин;
ЖХ-МС: tR=0,68 мин, [M+1]+=270,96.
4-Аллилокси-3-хлор-N-гидрокси-5-метилбензамидин
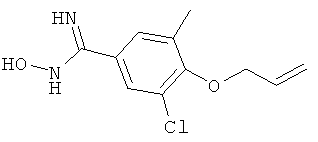
Названное в заголовке соединение получают аналогично получению 4-аллилокси-3-этил-N-гидрокси-5-метилбензамидина исходя из коммерчески доступного 3-хлор-4-гидрокси-5-метилбензальдегида;
ЖХ-МС: tR=0,69 мин, [М+1]+=241,10.
4-Аллилокси-N-гидрокси-3,5-диметилбензамидин
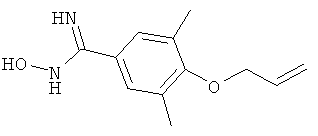
Названное в заголовке соединение получают аллилированием коммерчески доступного 4-гидрокси-3,5-диметилбензонитрила аллилбромидом в присутствии NaOH в изопропаноле при КТ. Нитрил затем превращают в гидроксиамидин, используя литературные методики (например: E.Meyer, A.C.Joussef, H.Gallardo, Synthesis, 2003, 899-905);
1H ЯМР (CD3OD): δ 7,27 (s, 2 Н), 6,10 (m, 1 Н), 5,42 (m, 1 Н), 5,26 (m, 1 Н), 4,31 (dt, J=5,6, 1,5 Гц, 2 Н), 2,29 (s, 6 Н).
4-Аллилокси-3-этил-N-гидрокси-5-метилбензамидин
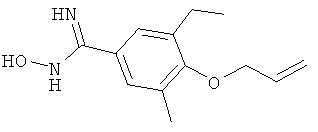
Названное в заголовке соединение получают аллилированием 3-этил-4-гидрокси-5-метилбензальдегида, который получают из 2-этил-6-метилфенола согласно литературным методикам (см.: 3-этил-4,N-дигидрокси-5-метилбензамидин). Альдегид затем превращают в соответствующий гидроксиамидин согласно литературным методикам (см.: 3-этил-4,N-дигидрокси-5-метилбензамидин);
ЖХ-МС: tR=0,72 мин; [M+1]+=235,09; 1H ЯМР (CD3OD): δ 7,31 (s, 1 Н), 7,29 (s, 1 Н), 6,10 (m, 1 Н), 5,43 (dd, J=17,0, 1,5 Гц, 1 Н), 5,27 (dd, J=10,3, 1,2 Гц, 1 Н), 4,81 (s расширенный, 3Н), 4,31 (d, J=5,6 Гц, 2 Н), 2,67 (q, J=7,6 Гц, 2 Н), 2,30 (s, 3 Н), 1,23 (t, J=7,6 Гц, 4 Н).
4-Аллилокси-3-хлор-N-гидрокси-5-метоксибензамидин
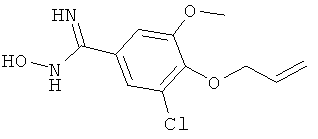
Названное в заголовке соединение получают аллилированием коммерчески доступного 3-хлор-4-гидрокси-5-метоксибензальдегида (см.: 4-аллилокси-3-этил-N-гидрокси-5-метилбензамидин). Альдегид затем превращают в соответствующий гидроксиамидин согласно литературным методикам (см.: 3-этил-4,Н-дигидрокси-5-метилбензамидин);
ЖХ-МС: tR=0,69 мин; [M+1]+=257,26.
4,N-Дигидрокси-3,5-диметилбензамидин
Названное в заголовке соединение получают из коммерчески доступного 4-гидрокси-3,5-диметилбензонитрила согласно литературным методикам (например: E.Meyer, A.C.Joussef, H.Gallardo, Synthesis, 2003, 899-905);
1Н ЯМР (CD3OD): δ 7,20 (s, 2H), 2,20 (s, 6H).
3-Этил-4,N-дигидрокси-5-метилбензамидин
Названное в заголовке соединение получают из коммерчески доступного 2-этил-6-метилфенола, следуя литературным методикам (см.: G.Trapani, A.Latrofa, M.Franco, C.Altomare, E.Sanna, M.Usala, G.Biggio, G.Liso, J. Med. Chem., 41 (1998) 1846-1854; A.K.Chakraborti, G.Kaur, Tetrahedron, 55 (1999) 13265-13268; E.Meyer, A.C.Joussef, H.Gallardo, Synthesis, 2003, 899-905);
ЖХ-МС: tR=0,55 мин; 1H ЯМР (d6-ДМСО): δ 9,25 (s расширенный, 1Н), 7,21 (s, 2H), 5,56 (s, 2H), 2,55 (q, J=7,6 Гц, 2H), 2,15 (s, 3H), 1,10 (t, J=7,6 Гц, 3Н).
3,5-Диэтил-4,N-дигидроксибензамидин
Названное в заголовке соединение получают из коммерчески доступного 2,6-диэтиланилина, следуя литературным методикам (G.G.Ecke, J.P.Napolitano, A.H.Filbey, A.J.Kolka, J. Org. Chem., 22 (1957) 639-642; и литературным источникам, цитируемым при получении 3-этил-4,N-дигидрокси-5-метилбензамидина);
ЖХ-МС: tR=60 мин; [M+1]+=209,46.
3-Хлор-4,N-дигидрокси-5-метоксибензамидин
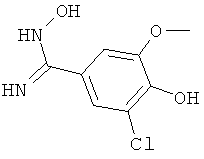
Названное в заголовке соединение получают из коммерчески доступного 3-хлор-4-гидрокси-5-метоксибензальдегида, используя литературные источники, цитируемые при получении 3-этил-4,Н-дигидрокси-5-метилбензамидина;
ЖХ-МС: tR=0,49 мин; [M+1]+=216,96; 1H ЯМР (D6-ДМСО): δ 3,84 (s, 3 H), 5,79 (s, 2 H), 7,22 (d, J=1,5 Гц, 1 Н), 7,27 (d, J=1,8 Гц, 1 Н), 9,52 (s, 1 H), 9,58 (s расширенный, 1 Н).
[4-(N-Гидроксикарбамимидоил)фенил]уксусная кислота
а) К раствору метил(4-цианофенил)ацетата (4,00 г, 27,8 ммолей) в МеОН (20 мл) добавляют гидрохлорид гидроксиламина (3,17 г, 45,7 ммолей) и NaHCO3 (3,84 г, 45,7 ммолей). Суспензию перемешивают при температуре 60°С в течение 18 ч, после чего ее фильтруют и фильтрат концентрируют. Остаток растворяют в ДХМ, промывают водой, затем рассолом, высушивают над MgSO4, фильтруют, концентрируют и остаток высушивают, получая метил [4-(N-гидроксикарбаимидоил)фенил]ацетат (3,67 г) в виде бесцветного масла;
ЖХ-МС: tR=0,50 мин, [M+1]+=209,05.
б) Раствор метил[4-(N-гидроксикарбаимидоил)фенил]ацетата (3,67 г, 17,6 ммолей) в 25%-ном водном растворе HCl (15 мл) перемешивают при температуре 65°С в течение 4 ч. Затем растворитель удаляют в вакууме, а остаток высушивают в высоком вакууме, получая [4-(N-гидроксикарбамимидоил)фенил]уксусную кислоту (3,80 г, предположительно, в виде гидрохлорида) в виде желтого твердого вещества;
ЖХ-МС: tR=0,34 мин, [М+1]+=195,05.
{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил] фенил} уксусная кислота
Названное в заголовке соединение получают исходя из никотиновой кислоты (6) и [4-(N-гидроксикарбамимидоил)фенил]уксусной кислоты аналогично получению соединения примера 13;
ЖХ-МС: tR=0,96 мин, [М+1]+=352,39.
трет-Бутиловый эфир 3-[2-этил-4-(N-гидроксикарбамимидоил)-6-метилфенил]пропионовой кислоты
а) К раствору 3-этил-4-гидрокси-5-метилбензойной кислоты (80,3 г, 0,446 моля) добавляют ДМФ (500 мл), KHCO3 (53,5 г, 0,535 моля), а затем бензилбромид (114,3 г, 0,668 моля). Смесь перемешивают при температуре 50°С в течение 18 ч, после чего ее охлаждают до КТ, разбавляют водой (250 мл) и экстрагируют ТБМЭ (дважды по 250 мл). Органические экстракты промывают водой, а затем концентрируют. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан/этилацетат в соотношении от 19:1 до 9:1 и получая бензиловый эфир 3-этил-4-гидрокси-5-метилбензойной кислоты (108,5 г) в виде бежевого твердого вещества;
1H ЯМР (CDCl3): δ 1,28 (t, J=7,5 Гц, 3 Н), 2,30 (s, 3 H), 2,68 (q, J=7,8 Гц, 2 Н), 5,24 (s, 1 H), 5,37 (s, 2 H), 7,33-7,45 (m, 3 H), 7,45-7,50 (m, 2 H), 7,77 (s, 1 H), 7,79 (s, 1 H).
б) К раствору бензилового эфира 3-этил-4-гидрокси-5-метилбензойной кислоты (97,5 г, 0,361 моля) и пиридина (57,1 г, 0,721 моля) в ДХМ (1000 мл) добавляют по каплям раствор ангидрида трифторметансульфоновой кислоты (122,1 г, 0,433 моля) в ДХМ (100 мл) при 0°С. После прибавления смесь перемешивают при комнатной температуре в течение 2 ч, после чего ее промывают 2-нормальным водным раствором HCl (500 мл), а затем водой (500 мл). Органический экстракт концентрируют и высушивают, получая 3-этил-5-метил-4-трифторметансульфонилоксибензойную кислоту (140,5 г) в виде оранжевого масла;
1H ЯМР: δ 1,30 (t, J=7,5 Гц, 3 Н), 2,46 (s, 3 H), 2,83 (q, J=7,5 Гц, 2 Н), 5,39 (s, 2 Н), 7,35-7,50 (m, 5 Н), 7,87 (s, 1 Н), 7,91 (s, 1 Н).
в) К раствору 3-этил-5-метил-4-трифторметансульфонилоксибензойной кислоты (10,0 г, 25 ммолей), трет-бутилакрилата (6,37 г, 50 ммолей), NEt3 (5,03 г, 50 ммолей) и DPPP (0,82 г, 2 ммолей) в ДМФ (100 мл) добавляют в атмосфере азота Pd(OAc)2 (0,45 г, 2 ммоля). Смесь перемешивают при температуре 115°С в течение 3 ч, после чего охлаждают до КТ и фильтруют через слой целита, остаток на фильтре промывают затем ТБМЭ (250 мл) и водой (500 мл) и промывные воды присоединяют к фильтрату. Слои разделяют и органический слой промывают водой (дважды по 500 мл), высушивают над MgSO4 и выпаривают без досушивания. К сырому продукту прибавляют EtOH (100 мл), при этом образуется вязкая суспензия. Твердое вещество собирают, промывают охлажденным льдом EtOH (10 мл) и получают бензиловый эфир 4-(2-трет-бутоксикарбонилвинил)-3-этил-5-метилбензойной кислоты (3,8 г) в виде грязно-белого твердого вещества.
г) К раствору бензилового эфира 4-(2-трет-бутоксикарбонилвинил)-3-этил-5-метилбензойной кислоты (10,0 г, 26 ммолей) в ТГФ (100 мл) в атмосфере азота добавляют Pd/C (0,5 г, 20% Pd). Смесь перемешивают при комнатной температуре в течение 48 ч под давлением водорода (1 бар). Катализатор отфильтровывают через слой целита и фильтрат концентрируют без досушивания, получая 4-(2-трет-бутоксикарбонилэтил)-3-этил-5-метилбензойную кислоту (7,64 г) в виде белого твердого вещества;
1H ЯМР: δ 1,29 (t, J=7,5 Гц, 3 Н), 1,49 (s, 9 Н), 2,36-2,41 (m, 2 Н), 2,74 (q, J=7,5 Гц, 2 Н), 2,99-3,05 (m, 2 Н), 7,77 (s, 1 Н), 7,80 (s, 1 Н).
д) К раствору 4-(2-трет-бутоксикарбонилэтил)-3-этил-5-метилбензойной кислоты (36,0 г, 123 ммолей) в изопропаноле (400 мл) добавляют ГОБТ (18,3 г, 135 ммолей), а затем ЭДК HCl (27,1 г, 142 ммолей). Смесь перемешивают при комнатной температуре в течение 1 ч, после чего добавляют водный раствор аммиака (69 мл, 25%-ный раствор). Перемешивание продолжают в течение 1 ч, после чего смесь разбавляют ДХМ (500 мл) и промывают полунасыщенным водным раствором NaHCO3 (трижды по 400 мл), а затем водой (400 мл). Органический экстракт высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт растирают с ТБМЭ (825 мл). Продукт в виде твердого вещества собирают, промывают дополнительной порцией ТБМЭ (50 мл) и высушивают в высоком вакууме, получая трет-бутиловый эфир 3-(4-карбамоил-2-этил-6-метилфенил)пропионовой кислоты (31,91 г) в виде белого твердого вещества.
е) К раствору трет-бутилового эфира 3-(4-карбамоил-2-этил-6-метилфенил)пропионовой кислоты (30,0 г, 103 ммолей) и NEt3 (31,3 г, 309 ммолей) в ДХМ (300 мл) медленно прибавляют ангидрид трифторуксусной кислоты (23,8 г, 113 ммолей). При этом температуру реакции из-за экзотермичности поддерживают ниже 5°С посредством охлаждения. После прибавления смесь перемешивают при комнатной температуре в течение 1 ч, затем промывают водой (дважды по 300 мл) и органический экстракт выпаривают без досушивания, получая трет-бутиловый эфир 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты (28,4 г) в виде бледно-желтого масла;
1H ЯМР: δ 1,25 (t, J=7,5 Гц, 3 Н), 1,48 (s, 9 H), 2,32-2,37 (m, 2 H), 2,38 (s, 3 H), 2,70 (q, J=7,5 Гц, 2 H), 2,95-3,02 (m, 2 H), 7,30 (s, 1 H), 7,34 (s, 1 H).
ж) Раствор трет-бутилового эфира 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты (37,0 г, 135 ммолей), гидрохлорида гидроксиламина (14,1 г, 203 ммолей) и NEt3 (27,4 г, 271 ммолей) в МеОН (400 мл) нагревают с обратным холодильником в течение 7 ч, после чего охлаждают до КТ. Растворитель выпаривают, остаток переносят в изопропилацетат (500 мл) и дважды промывают водой (500 мл). Органический экстракт высушивают над MgSO4, фильтруют, выпаривают и высушивают, получая трет-бутиловый эфир 3-[2-этил-4-(N-гидроксикарбамимидоил)-6-метилфенил]пропионовой кислоты (40,8 г) в виде бледно-желтого твердого вещества;
1Н ЯМР: δ 1,26 (t, J=7,5 Гц, 3 Н), 1,49 (s, 9 H), 2,33-2,41 (m, 5 H), 2,66-2,74 (m, 2 H), 2,93-3,01 (m, 2 H), 4,85 (s, 1 H), 7,28 (s, 2 H).
3-[2-Этил-4-(N-гидроксикарбамимидоил)-6-метилфенил]пропионовая кислота
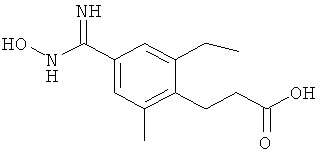
а) Этиловый эфир 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты получают аналогично получению трет-бутилового эфира 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты;
1H ЯМР (CDCl3): δ 1,21-1,31 (m, 6 H), 2,37 (s, 3 H), 2,41-2,47 (m, 2 H), 2,69 (q, J=7,5 Гц, 2 H), 2,99-3,05 (m, 2 H), 4,18 (q, J=7,0 Гц, 2 H), 7,30 (s, 1 H), 7,33 (s, 1 H).
б) Раствор этилового эфира 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты (55,0 г, 224 ммолей) в ТГФ (220 мл) и 1-нормальный водный раствор NaOH (220 мл) перемешивают при комнатной температуре в течение 2 ч, после чего его разбавляют водой (200 мл) и экстрагируют ДХМ (дважды по 200 мл). Водную фазу переносят в 32%-ный водный раствор HCl (50 мл) при температуре 15-30°С, при этом выпадает осадок. Продукт в виде твердого вещества собирают, промывают водой и высушивают в высоком вакууме, получая 3-(4-циано-2-этил-6-метилфенил)пропионовую кислоту (40,87 г) в виде бледно-коричневых кристаллов;
1Н ЯМР (D6-ДМСО): δ 1,17 (t, J=7,5 Гц, 3 H), 2,30-2,39 (m, 5 H), 2,67 (q, J=7,3 Гц, 2 H), 2,87-2,94 (m, 2 H), 7,47 (s, 2 H), 12,30 (s, 1 H).
в) К раствору 3-(4-циано-2-этил-6-метилфенил)пропионовой кислоты (10,0 г, 46,0 ммолей) в EtOH (80 мл) добавляют NEt3 (13,97 г, 138,1 ммолей), а затем гидрохлорид гидроксиламина (6,40 г, 92,1 ммолей). Смесь нагревают с обратным холодильником в течение 7 ч, после чего охлаждают до КТ. Растворитель затем удаляют в вакууме, остаток растворяют в 2-нормальном водном растворе HCl и доводят значение pH до 5 путем добавления 32%-ного водного раствора NaOH. Образовавшийся осадок собирают, промывают водой и высушивают в высоком вакууме при температуре 40°С в течение 18 ч, получая 3-[2-этил-4-(N-гидроксикарбамимидоил)-6-метилфенил]пропионовую кислоту (11,7 г) в виде бежевого кристаллического порошка;
ЖХ-МС: tR=0,60 мин, [М+1]+=251,09.
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}пропионовая кислота
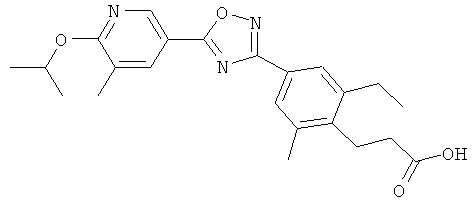
Названное в заголовке соединение получают из никотиновой кислоты (11) и 3-[2-этил-4-(N-гидроксикарбамимидоил)-6-метилфенил]пропионовой кислоты аналогично получению соединения примера 13;
ЖХ-МС: tR=1,15 мин, [М+1]+=410,10.
3-Этил-4-гидрокси-5-метилбензойная кислота
а) К охлажденному льдом раствору H2SO4 (150 мл) в воде (250 мл) добавляют 2-этил-6-метиланилин (15,0 г, 111 ммолей). Раствор обрабатывают льдом (150 г), после чего добавляют по каплям раствор NaNO2 (10,7 г, 155 ммолей) в воде (150 мл) и лед (50 г). Смесь перемешивают при температуре 0°С в течение 1 ч, добавляют 50%-ный водный раствор H2SO4 (200 мл) и перемешивание продолжают при КТ в течение 18 ч. Затем смесь экстрагируют ДХМ, органические экстракты высушивают над MgSO4 и выпаривают. Сырой продукт очищают с помощью колоночной хроматографии на силикагеле, элюируя смесью гептан: этилацетат в соотношении 9:1 и получая 2-этил-6-метилфенол (8,6 г) в виде масла малинового цвета;
ЖХ-МС: tR=0,89 мин; 1H ЯМР (CDCl3): δ 7,03-6,95 (m, 2H), 6,80 (t, J=7,6 Гц, 1H), 4,60 (s, 1H), 2,64 (q, J=7,6 Гц, 2H), 2,25 (s, 3Н), 1,24 (t, J=7,6 Гц, 3Н).
б) Раствор 2-этил-6-метилфенола (8,40 г, 61,7 ммолей) и гексаметилентетрамина (12,97 г, 92,5 ммолей) в уксусной кислоте (60 мл) и воде (14 мл) нагревают до температуры 115°С. Воду затем отгоняют при температуре 117°С и собирают в аппарате Дина-Старка. Затем водный сепаратор заменяют на обратный холодильник и смесь нагревают с ним в течение 3 ч. Смесь охлаждают до КТ, разбавляют водой (100 мл) и экстрагируют этилацетатом. Органический экстракт промывают насыщенным водным раствором NaHCO3, высушивают над MgSO4 и выпаривают. Оставшееся твердое вещество растворяют в этилацетате и обрабатывают гептаном, чтобы вызвать кристаллизацию. Твердое вещество собирают и высушивают, получая 3-этил-4-гидрокси-5-метилбензальдегид (3,13 г) в виде бесцветного кристаллического порошка,
1H ЯМР (CDCl3): δ 9,83 (s, 1Н), 7,58-7,53 (m, 2H), 5,30 (s расширенный, 1Н), 2,69 (q, J=7,6 Гц, 2H), 2,32 (s, 3H), 1,28 (t, J=7,6 Гц, 3Н).
в) К раствору 3-этил-4-гидрокси-5-метилбензальдегида (78,8 г, 0,48 моля) в ДМСО (585 мл) добавляют раствор дигидрата NaH2PO4 (17,3 г, 0,144 моля) в воде (160 мл) в течение 13 мин. Смесь перемешивают при комнатной температуре и добавляют раствор NaClO2 (65,17 г, 0,577 моля) в воде (160 мл), охлаждая при этом смесь на бане со льдом. Смесь перемешивают в течение 1 ч, после чего добавляют вторую порцию NaClO2 (43,44 г, 0,480 моля) в воде (100 мл), поддерживая температуру реакции в интервале от 25 до 40°С с помощью ледяной бани. Желтую суспензию перемешивают при комнатной температуре в течение 24 ч, затем ее подкисляют 32%-ным раствором HCl до pH 2-3, экстрагируют ТБМЭ (250 мл), органический экстракт промывают водой, и промывные воды экстрагируют ТБМЭ. Растворитель из объединенных органических экстрактов выпаривают, получая сырую 3-этил-4-гидрокси-5-метилбензойную кислоту (80,3 г) в виде желтого твердого вещества.
Гидразид 4-аллилокси-3,5-диметилбензойной кислоты
К раствору 4-аллилокси-3,5-диметилбензойной кислоты (см.: пат США 3262946) (5,26 г, 25,5 ммолей) в CHCl3 (75 мл) прибавляют тионилхлорид (7,5 мл) и смесь нагревают с обратным холодильником в течение 2 ч. Смесь затем выпаривают и остаток, растворенный в ДХМ (50 мл), переносят в охлажденный (0°С) 1-молярный раствор гидразина в ТГФ (75 мл) и ДХМ (250 мл). Затем смесь медленно нагревают до КТ в течение 15 ч, разбавляют эфиром (150 мл) и промывают 1-молярным водным раствором HCl (5 раз по 50 мл). Водные экстракты промывают эфиром (50 мл), органические фазы отделяют, а водные экстракты подщелачивают 33%-ным водным раствором КОН и экстрагируют ДХМ (5 раз по 50 мл). Органические экстракты затем высушивают (Na2SO4), фильтруют и выпаривают, получая названное в заголовке соединение (5,39 г) в виде белого твердого вещества;
ЖХ-МС: tR=0,71 мин; [M+1]+=221,20.
2,2-Диметил-[1,3]диоксан-5-илметиловый эфир метансульфоновой кислоты
Названное в заголовке соединение получают с использованием методов, приведенных в публикации: B.Xu, A.Stephens, G.Kirschenheuter, A.F.Greslin, X.Cheng, J.Sennelo, M.Cattaneo, M.L.Zighetti, A.Chen, S.-A.Kim, H.S.Kim, N.Bischofberger, G.Cook, K.A.Jacobson, J. Med. Chem., 45 (2002) 5694-5709.
Синтезы примеров
Пример 1
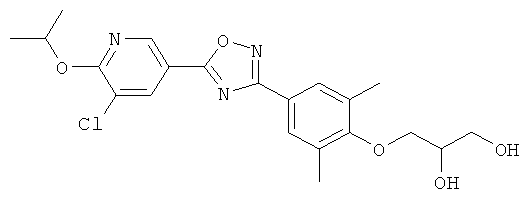
а) Раствор 5-хлор-6-изопропоксиникотиновой кислоты (202,9 мг, 0,94 ммолей), ТБТУ (332 мг, 1.04 ммолей), основания Хюнига (607 мг, 4,70 ммолей) и 4-аллилокси-N-гидрокси-3,5-диметилбензамидина (230 мг, 1,04 ммолей) в ДХМ (7 мл) перемешивают при комнатной температуре в течение 24 ч. Затем смесь разбавляют эфиром (150 мл), промывают 1-нормальным водным раствором HCl (дважды по 20 мл), 1-нормальным водным раствором KHSO4 (20 мл) и рассолом (20 мл), высушивают над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают с помощью СДЖХ на силикагеле, элюируя градиентом этилацетата в гептане и получая 4-аллилокси-N-гидрокси-3,5-диметилбензамидиновый эфир 5-хлор-6-изопропоксиникотиновой кислоты (258 мг) в виде белого порошка;
ЖХ-МС: tR=1,12 мин, [M+1]+=418,07.
б) Раствор 4-аллилокси-N-гидрокси-3,5-диметилбензамидинового эфира 5-хлор-6-изопропоксиникотиновой кислоты (200 мг, 0,48 ммолей) в диоксане (6 мл) перемешивают при температуре 90°С в течение 2 дней. Растворитель затем выпаривают, получая сырой 3-[3-(4-аллилокси-3,5-диметилфенил)-[1,2,4]оксадиазол-5-ил]-5-хлор-6-изопропоксипиридин (279 мг);
ЖХ-МС: tR=1,27 мин.
в) К раствору 3-[3-(4-аллилокси-3,5-диметилфенил)-[1,2,4]оксадиазол-5-ил]-5-хлор-6-изопропоксипиридина (191 мг, 0,48 ммолей) в ацетоне (10 мл) и воде (1 мл) добавляют N-MO (97 мг, 0,72 ммолей), а затем OsO4 (12 мг, 0,048 ммолей). Смесь перемешивают при температуре 45°С в течение 16 ч, после чего разбавляют 1-нормальным водным раствором KHSO4 и экстрагируют эфиром (трижды по 50 мл). Объединенные органические экстракты высушивают над Na2SO4, фильтруют и концентрируют. Образец (15 мг) сырого продукта (299 мг) очищают с помощью препаративной ТСХ, используя в качестве элюэнта смесь гептан:этилацетат в соотношении 1:2 и получая (RS)-3-{4-[5-(5-хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол (10,6 мг);
ЖХ-МС: tR=1,06 мин, [M+1]+=434,06.
Пример 2
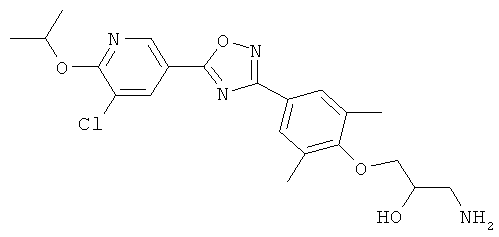
К раствору сырого (RS)-3-{4-[5-(5-хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диола (265 мг, 0,61 ммолей) в ТГФ (5 мл), добавляют основания Хюнига (158 мг, 1,22 ммолей), а затем метансульфонилхлорид (77 мг, 0,67 ммолей) при 0°С. После этого смесь перемешивают при комнатной температуре в течение 16 ч, добавляют 7-молярный раствор аммиака в МеОН (2 мл), перемешивают при температуре 65°С в течение 16 ч, после чего растворитель удаляют в вакууме, получая сырой (RS)-1-амино-3-{4-[5-(5-хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-2-ол;
ЖХ-МС: tR=0,92 мин. [M+1+CH3CN]+=474,44.
Пример 3
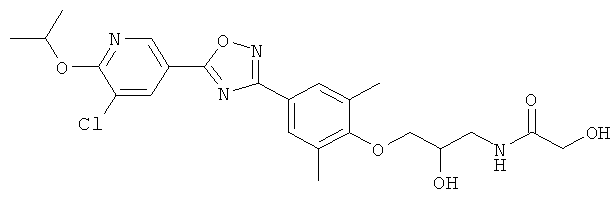
К раствору (RS)-1-амино-3-{4-[5-(5-хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-2-ола (313 мг, 0,6 ммоля) в ДХМ (10 мл) добавляют гликолевую кислоту (95 мг, 1,25 ммолей) и основание Хюнига (233 мг, 1,8 ммолей). Смесь охлаждают до 0°С и прибавляют ТБТУ (236 мг, 0,74 ммоля). Затем смесь перемешивают при температуре 0°С в течение 1 ч, затем при КТ в течение 16 ч, после чего разбавляют этилацетатом (250 мл), промывают 1-нормальным водным раствором NaOH (трижды по 25 мл), 1-нормальным водным раствором KHSO4 (25 мл) и рассолом (25 мл), высушивают над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают с помощью препаративной ВЭЖХ, получая N-((RS)-3-{4-[5-(5-хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}-2-гидроксипропил)-2-гидроксиацетамид (42 мг) в виде белого порошка;
ЖХ-МС: tR=1,06 мин; [M+1]+=491,48; 1H ЯМР (CD3OD): δ 1,45 (d, J=6,3 Гц, 6 Н), 2,38 (s, 6 H), 3,47 (dd, J=13,6, 7,3 Гц, 1 Н), 3,66 (dd, J=13,6, 4,5 Гц, 1 Н), 3,87 (m, 2 Н), 4,04 (s, 2 Н), 4,14 (m, 1 Н), 5,52 (m, 1 Н), 7,78 (s, 2 Н), 8,43 (s, 1 Н), 8,85 (s, 1 Н).
Пример 4
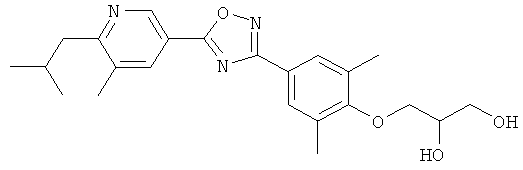
(RS)-3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,92 мин, [M+1]+=412,21.
Пример 5
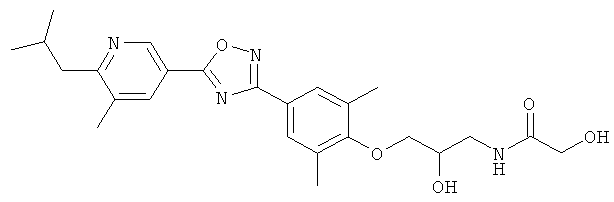
2-Гидрокси-N-((RS)-2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид получают аналогично получению соединения примеров 2 и 3;
ЖХ-МС: tR=0,89 мин, [M+1]+=469,57.
Пример 6
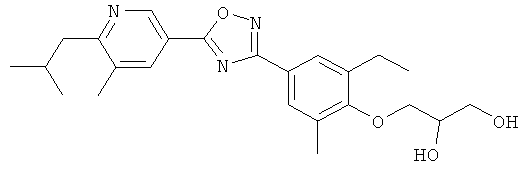
(RS)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,95 мин, [M+1]+=426,14.
Пример 7
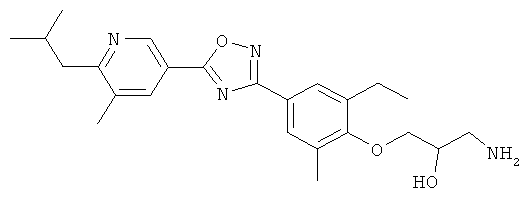
(RS)-1-Амино-3-{2-этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-2-ол получают аналогично получению соединения примера 2;
ЖХ-МС: tR=0,82 мин, [M+1]+=425,17.
Пример 8
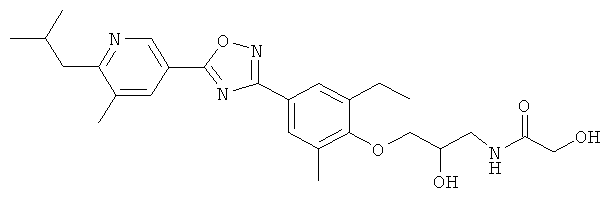
N-((RS)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид получают аналогично получению соединения примера 3;
ЖХ-МС: tR=0,91 мин, [M+1]+=483,21.
Пример 9
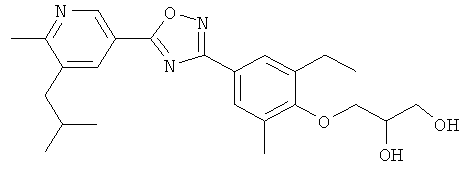
(RS)-3-{2-Этил-4-[5-(5-изобутил-6-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 1; ЖХ-МС: tR=0,96 мин, [М+1]+=426,12.
Пример 10
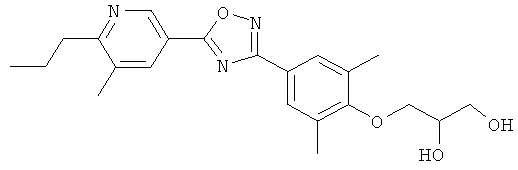
(RS)-3-{2,6-Диметил-4-[5-(5-метил-6-пропилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,87 мин, [M+1]+=398,54.
Пример 11
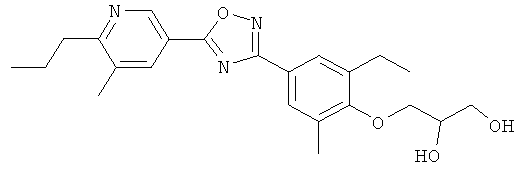
(RS)-3-{2-Этил-6-метил-4-[5-(5-метил-6-пропилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,91 мин, [М+1]+=412,56.
Пример 12
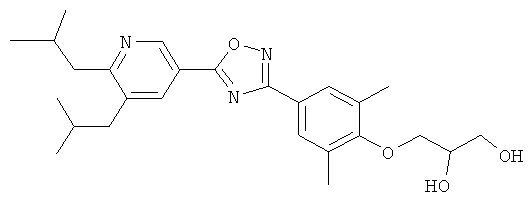
(RS)-3-{4-[5-(5,6-Диизобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=1,01 мин; [M+1]+=454,56.
Пример 13
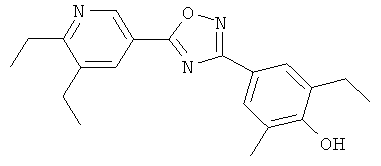
К раствору гидрохлорида 5,6-диэтилникотиновой кислоты (920 мг, 4,3 ммолей) и основания Хюнига (2,76 г, 21 ммолей) в ДХМ (50 мл) добавляют ТБТУ (1,785 г, 5,55 ммолей) и смесь перемешивают при комнатной температуре в течение 5 мин. Затем добавляют 3-этил-4,N-дигидрокси-5-метилбензамидин (1,14 г, 4,7 ммолей), после чего смесь перемешивают в течение 0,5 ч, разбавляют ДХМ, промывают насыщенным водным раствором NaHCO3, высушивают над MgSO4, фильтруют и концентрируют. Сырой 3-этил-4,N-дигидрокси-5-метилбензамидиновый эфир 5,6-диэтилникотиновой кислоты (ЖХ-МС: tR=0,79 мин) растворяют в диоксане (50 мл) и нагревают при температуре 100°С в течение 18 ч. Растворитель выпаривают и сырой продукт очищают с помощью ускоренной хроматографии на силикагеле, элюируя смесью гептан: этилацетат в соотношении 10:1 и получая 4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенол (0,42 г) в виде твердого вещества;
ЖХ-МС: tR=1,03 мин, [M+1]+=338,09.
Пример 14
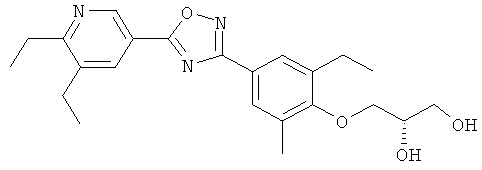
К раствору 4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенола (100 мг, 0,296 ммоля) в изопропаноле (10 мл) и 3-нормальном водном растворе NaOH (3 мл) добавляют (S)-3-хлор-1,2-пропандиол (98 мг, 0,89 ммоля). Смесь перемешивают при температуре 60°С в течение 24 ч, после чего добавляют еще одну порцию (S)-3-хлор-1,2-пропандиола (98 мг, 0,89 ммоля). Перемешивание продолжают при температуре 60°С в течение 2 дней. Затем смесь разбавляют этилацетатом и промывают насыщенным водным раствором NaHCO3. Органический экстракт высушивают над MgSO4, фильтруют и выпаривают. Сырой продукт очищают с помощью препаративной ТСХ, используя в качестве элюэнта смесь гептана с этилацетатом и получая (S)-3-{4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}пропан-1,2-диол (14 мг) в виде красного масла;
ЖХ-МС: tR=0,93 мин, [М+1]+=412,16.
Пример 15
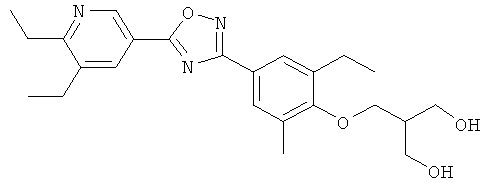
2-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфеноксиметил}пропан-1,3-диол получают в две стадии аналогично получению соединения примера 14 с использованием 2,2-диметил-[1,3]диоксан-5-илметилового эфира метансульфоновой кислоты в качестве алкилирующего агента. Полученный защищенный диол (32 мг) растворяют в ТГФ (5 мл) и воде (0,5 мл) и прибавляют ТФК (0,25 мл). Затем смесь перемешивают при комнатной температуре в течение 1 ч, разбавляют этилацетатом и промывают насыщенным водным раствором NaHCO3. Органическую фазу выпаривают и остаток очищают с помощью препаративной ТСХ, используя в качестве элюэнта смесь ДХМ/МеОН и получая 2-{4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфеноксиметил}пропан-1,3-диол;
ЖХ-МС: tR=0,95 мин, [M+1]+=426,09.
Пример 16
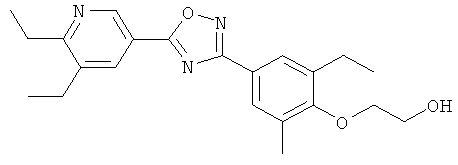
2-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}этанол получают аналогично получению соединения примера 14, используя бромэтанол в качестве алкилирующего агента;
ЖХ-МС: tR=1,01 мин; [M+1]+=382,17; 1Н ЯМР (CDCl3): δ 1,22-1,45 (m, 9 H), 2,42 (s, 3 H), 2,72-2,87 (m, 4 H), 2,96 (q, J=7,5 Гц, 2 Н), 4,00 (m, 5 H), 7,89 (s, 1 H), 7,90 (s, 1 H), 8,24 (s, 1 H), 9,21 (s, 1 H).
Пример 17
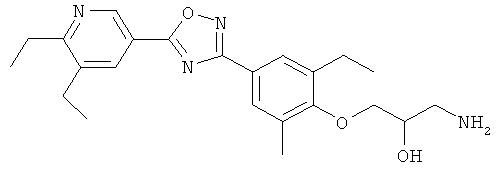
а) К раствору 4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенола (150 мг, 0,445 ммоля) в изопропаноле (10 мл) и 3-нормальном водном растворе NaOH (3 мл) добавляют эпихлоргидрин (164 мг, 1,78 ммолей). Смесь перемешивают при комнатной температуре в течение 20 ч. Затем смесь разбавляют этилацетатом и промывают насыщенным водным раствором NaHCO3. Органический экстракт высушивают над MgSO4, фильтруют и выпаривают. Сырой продукт очищают с помощью препаративной ТСХ, используя в качестве элюэнта смесь этилацетата с гептаном и получая (RS)-2,3-диэтил-5-[3-(3-этил-5-метил-4-оксиранилметоксифенил)-[1,2,4]оксадиазол-5-ил] пиридин (92 мг) в виде масла.
б) (RS)-2,3-Диэтил-5-[3-(3-этил-5-метил-4-оксиранилметоксифенил)-[1,2,4]оксадиазол-5-ил]пиридин (92 мг) растворяют в 7-нормальном растворе NH3 в МеОН (20 мл) и нагревают в склянке со шнековой крышкой при температуре 60°С в течение 15 ч. Затем смесь выпаривают, получая сырой (RS)-1-амино-3-{4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}пропан-2-ол (99 мг); ЖХ-МС: tR=0,80 мин, [M+1]+=411,09.
Пример 18
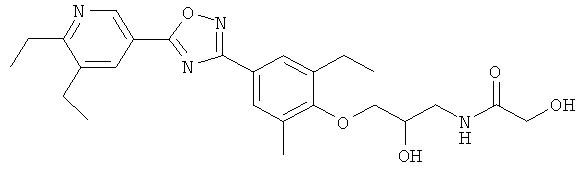
К раствору (RS)-1-амино-3-{4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}пропан-2-ола (99 мг, 0,24 ммолей), гликолевой кислоты (18,5 мг, 0,244 ммоля) и основания Хюнига (78 мг, 0,61 ммоля) в ДХМ (5 мл) добавляют РуБОФ (126,7 мг, 0,24 ммолей) и смесь перемешивают при комнатной температуре в течение 30 мин. Затем смесь разбавляют этилацетатом, промывают насыщенным водным раствором NaHCO3, высушивают над MgSO4, фильтруют и концентрируют. Сырой продукт очищают с помощью препаративной ТСХ, используя в качестве элюэнта смесь ДХМ:МеОН в соотношении 10:1 и получая N-((RS)-3-{4-[5-(5,6-диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид (90 мг) в виде масла;
ЖХ-МС: tR=0,88 мин, [М+1]+=469,25.
Пример 19
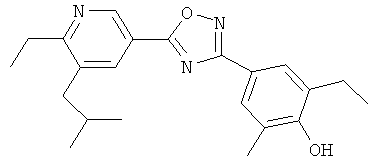
2-Этил-4-[5-(6-этил-5-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенол получают аналогично получению соединения примера 13;
ЖХ-МС: tR=1,09 мин, [M+1]+=366,19.
Пример 20
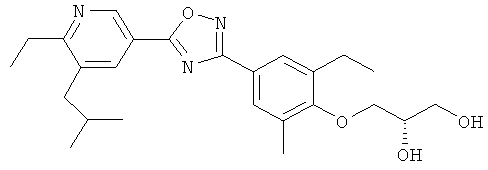
(S)-3-{2-Этил-4-[5-(6-этил-5-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 14; ЖХ-МС: tR=1,00 мин, [М+1]+=440,20.
Пример 21
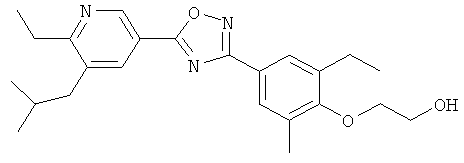
(S)-2-{2-Этил-4-[5-(6-этил-5-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}этанол получают аналогично получению соединения примера 16;
ЖХ-МС: tR=1,08 мин, [M+1]+=410,15.
Пример 22
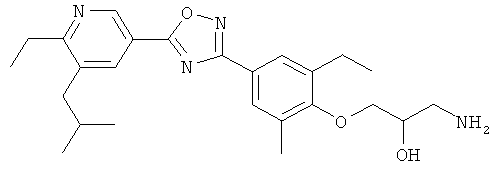
(RS)-1-Амино-3-{2-этил-4-[5-(6-этил-5-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-2-ол получают аналогично получению соединения примера 17;
ЖХ-МС: tR=0,85 мин, [M+1]+=439,17.
Пример 23
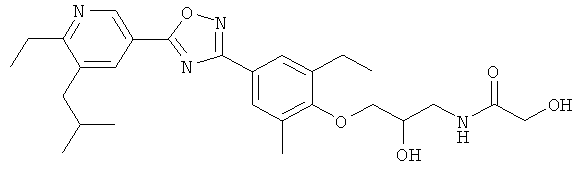
N-((RS)-3-{2-Этил-4-[5-(6-этил-5-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид получают аналогично получению соединения примера 18;
ЖХ-МС: tR=0,95 мин, [M+1]+=497,17.
Пример 24
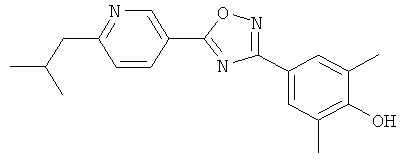
4-[5-(6-Изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенол получают аналогично получению соединения примера 13;
ЖХ-МС: tR=1,04 мин, [M+1]+=324,36.
Пример 25
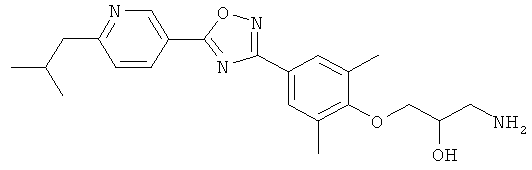
(RS)-1-Амино-3-{4-[5-(6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-2-ол получают аналогично получению соединения примера 17; ЖХ-МС: tR=0,8 мин.
Пример 26
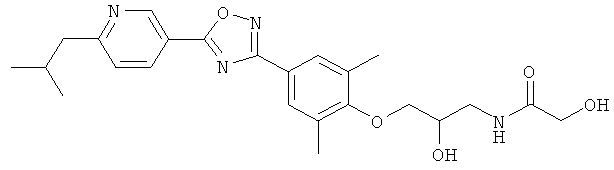
2-Гидрокси-N-((RS)-2-гидрокси-3-{4-[5-(6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид получают аналогично получению соединения примера 18;
ЖХ-МС: tR=0,89 мин, [M+1]+=455,48.
Пример 27
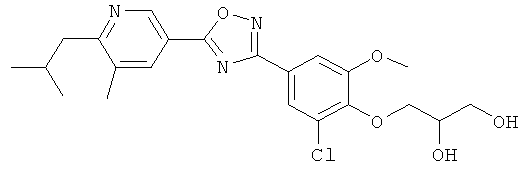
(RS)-3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,94 мин, [M+1]+=448,21.
Пример 28
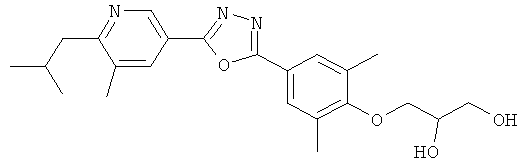
а) К раствору гидрохлорида 6-изобутил-5-метилникотиновой кислоты (50 мг, 0,22 ммолей), ДИПЭА (0,12 мл, 0,7 ммоля) и ТБТУ (97 мг, 0,30 ммолей) в ДХМ (5 мл) добавляют при 0°С гидразид 4-аллилокси-3,5-диметилбензойной кислоты (50,6 мг, 0,23 ммолей) и смесь перемешивают при температуре 0°С в течение 4 ч. Затем смесь разбавляют этилацетатом (15 мл) и промывают 1-молярным водным раствором NaH2PO4 (5 мл), 1-молярным водным раствором NaOH (5 мл) и водой (5 мл). Органическую фазу высушивают (MgSO4), фильтруют и выпаривают, получая N'-(4-аллилокси-3,5-диметилбензоил)гидразид 6-изобутил-5-метилникотиновой кислоты (85 мг); ЖХ-МС: tR=0,81 мин, [М+1]+=396,20.
б) Раствор N'-(4-аллилокси-3,5-диметилбензоил)гидразида 6-изобутил-5-метилникотиновой кислоты (89 мг, 0,224 ммоля) и реагента Бургесса (162 мг, 0,68 ммолей) в ТГФ (4 мл) нагревают в микроволновой печи при температуре 110°С в течение 6 мин. Затем смесь разбавляют этилацетатом (15 мл) и промывают 1-молярным водным раствором NaH2PO4 (5 мл), 1-молярным водным раствором NaOH (5 мл) и водой (5 мл). Органическую фазу высушивают (MgSO4), фильтруют и выпаривают, получая сырой 5-[5-(4-аллилокси-3,5-диметилфенил)-[1,3,4]оксадиазол-2-ил]-2-изобутил-3-метилпиридин (80 мг);
ЖХ-МС: tR=1,07 мин, [M+1]+=378,3.
в) (RS)-3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,3,4]оксадиазол-2-ил]-2,6-диметилфенокси}пропан-1,2-диол получают из 5-[5-(4-аллилокси-3,5-диметилфенил)-[1,3,4]оксадиазол-2-ил]-2-изобутил-3-метилпиридин аналогично получению соединения примера 1;
ЖХ-МС: tR=0,83 мин; [M+1]+=412,23; 1H ЯМР (D6-ДМСО): δ 0,94 (d, J=6,5 Гц, 6 Н), 2,19 (гептет, J=6,5 Гц, 1 Н), 2,36 (s, 6 H), 2,42 (s, 3 H), 2,73 (d, J=7,3 Гц, 2 Н), 3,50 (t, J=5,5 Гц, 2 Н), 3,76 (m, 1 H), 3,84 (m, 1 H), 3,89 (m, 1 H), 4,65 (t, J=5,5 Гц, 1 Н), 4,97 (d, J=5,0 Гц, 1 Н), 7,84 (s, 2 H), 8,24 (d, J=1,0 Гц, 1 Н), 9,05 (d, J=1,5 Гц, 1Н).
Пример 29
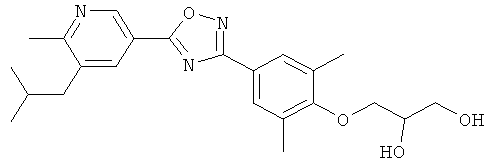
Исходя из никотиновой кислоты (2), (RS)-3-{4-[5-(5-изобутил-6-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 1;
ЖХ-МС: tR=0,93 мин; [М+1]+=412,18.
Примеры 30-34
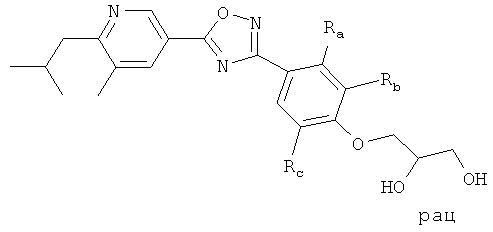
Соединения следующих примеров получают аналогично получению соединения примера 1, исходя из никотиновой кислоты (6).
Пример 34
1H ЯМР (CDCl3): δ 1,01 (d, J=6,8 Гц, 6 H), 2,18-2,31 (m, 1 H), 2,45 (s, 3 H), 2,46 (s, 3 H), 2,80 (d, J=7,3 Гц, 2 H), 3,82-3,96 (m, 2 H), 4,06-4,13 (m, 2 H), 4,15-4,23 (m, 1 H), 7,95 (d, J=0,8 Гц, 1 H), 8,09 (d, J=1,5 Гц, 1 H), 8,21 (s, 1 H), 9,19 (s, 1 H).
Примеры 35-39
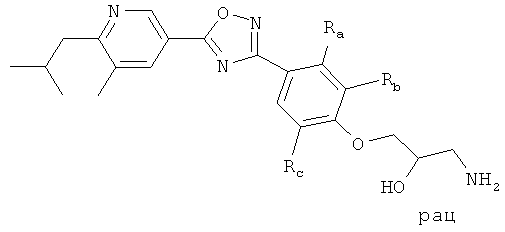
Соединения следующих примеров получают аналогично получению соединения примера 2.
Примеры 40-43
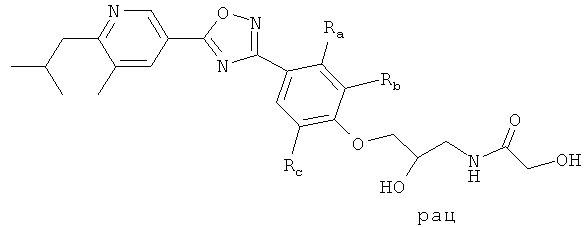
Соединения следующих примеров получают аналогично получению соединения примера 3.
Пример 40
1H ЯМР (CDCl3): δ 1,01 (d, J=6,5 Гц, 6 Н), 2,17-2,30 (m, 1 Н), 2,46 (s, 3 Н), 2,68 (s, 3 Н), 2,80 (d, J=7,3 Гц, 2 Н), 3,13-3,19 (m, 1 Н), 3,47-3,56 (m, 1 Н), 3,72-3,80 (m, 1 H), 3,99-4,08 (m, 2 H), 4,17-4,24 (m, 3 H), 6,85-6,90 (m, 2 H), 7,08 (t расширенный, J=5,5 Гц, 1 H), 8,06 (d, J=8,3 Гц, 1 H), 8,21 (s, 1 H), 9,20 (s, 1 H)
Пример 44
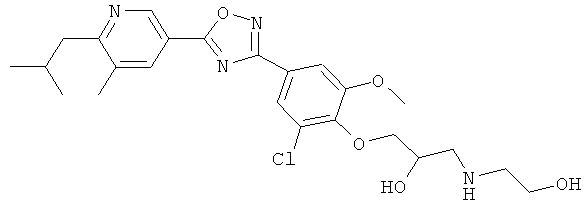
(RS)-1-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}-3-(2-гидрокси-этиламино)пропан-2-ол получают исходя из соединения примера 27 аналогично получению соединения примера 2 посредством реакции метансульфонилированного промежуточного соединения с этаноламином;
ЖХ-МС: tR=0,82 мин, [M+1]+=491,06; 1H ЯМР (CDCl3): δ 1,00 (d, J=6,5 Гц, 6 H), 2,18-2,29 (m, 1 H), 2,46 (s, 3 H), 2,79 (d, J=7,3 Гц, 2 H), 2,83-2,92 (m, 4 H), 3,68-3,73 (m, 2 H), 4,01 (s, 3 H), 4,04-4,16 (m, 2 H), 4,24-4,31 (m, 1 H), 7,64 (s, 1 H), 7,87 (s, 1 H), 8,21 (s, 1 H), 9,18 (s, 1 H).
Примеры 45 и 46
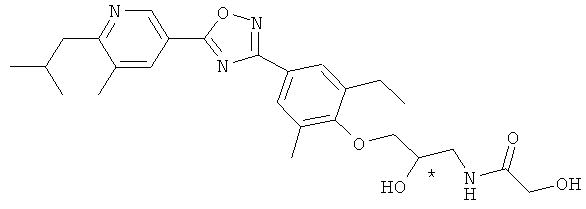
Рацемическое соединение, полученное в примере 8, разлагают на чистые энантиомеры с помощью препаративной ВЭЖХ, используя хиральную стационарную фазу (ChiralPak ADH 4,6×250 мм, 5 мкм, 20% EtOH, содержащий 0,1% диэтиламина в гептане, 40 мин, скорость истечение: 0,8 мл/мин).
Пример 47
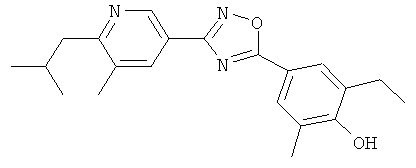
2-Этил-4-[3-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенол получают из N-гидрокси-6-изобутил-5-метилникотинамида и 3-этил-4-гидрокси-5-метилбензойной кислоты аналогично получению соединения примера 13;
ЖХ-МС: tR=1,02 мин, [M+1]+=352,09.
Примеры 48-53
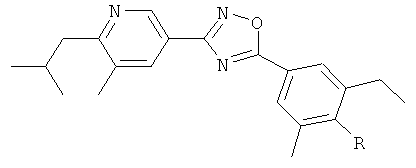
Исходя из примера 47, соединения следующих примеров получают аналогично получению предыдущих примеров.
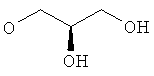
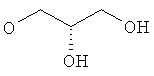
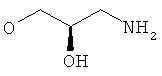
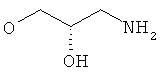
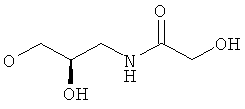
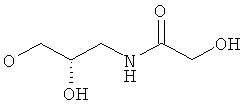
Пример 49
1H ЯМР (CDCl3): δ 1,00 (d, J=6,3 Гц, 6 Н), 1,33 (t, J=7,3 Гц, 3 Н), 2,17-2,27 (m, 2 Н), 2,43 (s, 6 Н), 2,79 (m, 4 Н), 2,90 (s расширенный, 1 Н), 3,82-4,01 (m, 4 Н), 4,15-4,24 (m, 1 Н), 7,93 (s, 1 Н), 7,94 (s, 1 Н), 8,18 (s, 1 Н), 9,15 (s, 1 Н).
Пример 53
1H ЯМР (CDCl3): δ 1,01 (d, J=6,5 Гц, 6 Н), 1,33 (t, J=7,3 Гц, 3 Н), 2,16-2,28 (m, 1 Н), 2,41 (s, 3 Н), 2,44 (s, 3 Н), 2,74-2,82 (m, 4 Н), 3,39 (s расширенный, 1 Н), 3,49-3,58 (m, 1 Н), 3,77-3,95 (m, 3 Н), 4,20-4,27 (m, 3 Н), 7,01 (s расширенный, 1 Н), 7,93 (s, 1 Н), 7,94 (s, 1 Н), 8,19 (s, 1 Н), 9,15 (s, 1 Н).
Пример 54
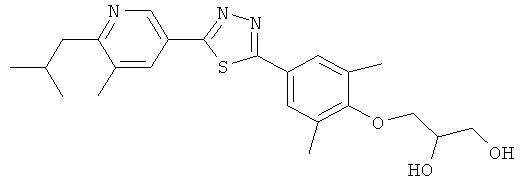
а) К раствору никотиновой кислоты (6) (50 мг, 0,218 ммолей) в ДХМ (5 мл) добавляют раствор ТБТУ (97 мг, 0,301 ммолей), а затем ДИПЭА (90 мг, 0,696 ммолей) в ДХМ (5 мл). Смесь перемешивают и охлаждают до 0°С, после чего добавляют гидразид 4-аллилокси-3,5-диметилбензойной кислоты (51 мг, 0,232 ммолей). Затем смесь перемешивают при температуре 0°С в течение 16 ч, после чего разбавляют этилацетатом (15 мл), промывают насыщенным водным раствором NaHCO3 (5 мл) и 1-молярным водным раствором NaOH (5 мл), высушивают над MgSO4, фильтруют, концентрируют и высушивают в вакууме, получая промежуточный гидразид;
ЖХ-МС: tR=0,81 мин, [М+1]=396,37. К раствору этого соединения в ТГФ (3 мл) добавляют реагент Лавессона (129 мг, 0,318 ммолей) и смесь нагревают в микроволновой печи при температуре 110°С в течение 5 мин. Затем смесь разбавляют этилацетатом (30 мл), промывают насыщенным водным раствором Na2CO3, высушивают над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают с помощью препаративной ТСХ, используя в качестве элюэнта ДХМ, содержащий 10% 7-нормального раствора NH3 в МеОН, и получая 5-[5-(4-аллилокси-3,5-диметилфенил)-[1,3,4]тиадиазол-2-ил]-2-изобутил-3-метилпиридин (67 мг) в виде желтого твердого вещества; ЖХ-МС: tR=1,04 мин, [M+1]+=394,10.
б) 5-[5-(4-Аллилокси-3,5-диметилфенил)-[1,3,4]тиадиазол-2-ил]-2-изобутил-3-метилпиридин обрабатывают OsO4, как описано на стадии в) примера 1, получая (RS)-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,3,4]тиадиазол-2-ил]-2,6-диметилфенокси} пропан-1,2-диол;
ЖХ-МС: tR=0,78 мин, [M+1]+=428,50; 1Н ЯМР (CDCl3): δ 1.01 (d, J=6,5 Гц, 6 Н), 2,17-2,28 (m, 1 H), 2,39 (s, 6 H), 2,43 (s, 3 H), 2,76 (d, J=7,3 Гц, 2 Н), 3,82-3,99 (m, 4 H), 4,14-4,21 (m, 1 H), 7,70 (s, 2 H), 8,13 (s, 1 H), 8,90 (s, 1 H).
Пример 55
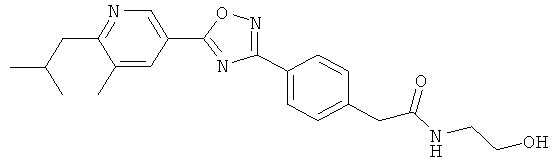
К раствору {4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенил}уксусной кислоты (50 мг, 142 мкмоля) в ДМФ (3 мл) добавляют ЭДК HCl (33 мг, 171 мкмоля), ГОБТ (23 мг, 171 мкмоля) и ДИПЭА (28 мг, 213 мкмоля). Смесь перемешивают при комнатной температуре в течение 5 мин, после чего добавляют этаноламин (10 мг, 157 мкмоля). Перемешивание продолжают при КТ в течение 72 ч. Затем смесь разбавляют этилацетатом, промывают водой и концентрируют. Сырой продукт очищают с помощью препаративной ТСХ, используя в качестве элюента ДХМ, содержащий 10% МеОН, и получая N-(2-гидрокси-этил)-2-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенил}ацетамид (26 мг) в виде белого твердого вещества;
ЖХ-МС: tR=0,82 мин, [М+1]+=395,15; 1H ЯМР (CDCl3): δ 1,01 (d, J=6,5 Гц, 6 Н), 2,19-2,29 (m, 1 H), 2,46 (s, 3 H), 2,53 (s расширенный, 1 Н), 2,80 (d, J=7,3 Гц, 2 Н), 3,44 (q, J=4,8 Гц, 2 Н), 3,69 (s, 2 H), 3,71-3,75 (m, 2 H), 5,96 (s расширенный, 1 Н), 7,46 (d, J=7,5 Гц, 2 Н), 8,18 (d, J=7,8 Гц, 2 Н), 8,17 (s), 8,19 (s), 8,22 (s, 1 H), 9,20 (s, 1 H).
Пример 56
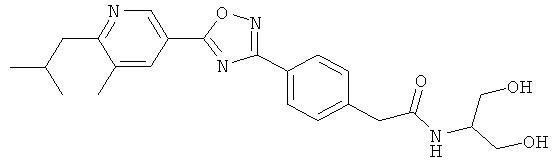
N-(2-Гидрокси-1-гидроксиметил-этил)-2-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенил}ацетамид получают аналогично получению соединения примера 55, используя 2-аминопропан-1,3-диол;
ЖХ-МС: tR=0,78 мин, [М+1]+=425,19.
Пример 57
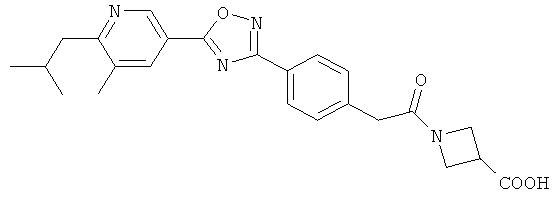
1-(2-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенил}ацетил)азетидин-3-карбоновую кислоту получают из {4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]фенил}уксусной кислоты и метилового эфира азетидин-3-карбоновой кислоты аналогично получению соединения примера 55; перемешивание этого продукта в 3-нормальном водном растворе NaOH с диоксаном при КТ в течение 20 ч дает нужное соединение;
ЖХ-МС: tR=0,60, [M+1]+=434,96.
Пример 58
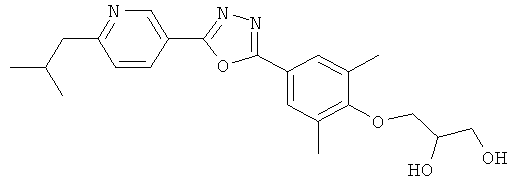
(RS)-3-{4-[5-(6-Изобутилпиридин-3-ил)-[1,3,4]оксадиазол-2-ил]-2,6-диметилфенокси}пропан-1,2-диол получают аналогично получению соединения примера 28 исходя из никотиновой кислоты (8);
ЖХ-МС: tR=0,85, [M+1]+=398,36.
Пример 59
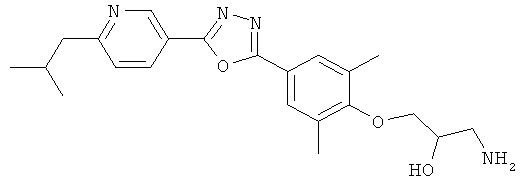
(RS)-1-Амино-3-{4-[5-(6-изобутилпиридин-3-ил)-[1,3,4]оксадиазол-2-ил]-2,6-диметилфенокси}пропан-2-ол получают из соединения примера 58 аналогично получению соединения примера 2;
ЖХ-МС: tR=0,75, [M+1]+=397,29.
Пример 60
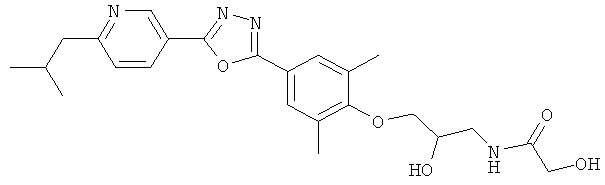
(RS)-2-Гидрокси-N-(2-гидрокси-3-{4-[5-(6-изобутилпиридин-3-ил)-[1,3,4]оксадиазол-2-ил]-2,6-диметилфенокси}пропил)ацетамид получают из соединения примера 59 аналогично получению соединения примера 3;
ЖХ-МС: tR=0,80, [M+1]+=455,19; 1H ЯМР (CD3OD): δ 0,97 (d, J=6,7 Гц, 6 Н), 2,06-2,20 (m, 1 H), 2,38 (s, 6 H), 2,76 (d, J=7,0 Гц, 2 Н), 3,38-3,57 (m, 1 H), 3,59-3,73 (m, 1 H), 3,78-3,94 (m, 2 H), 4,01 (s, 2 H), 4,05-4,16 (m, 1 H), 7,50 (d, J=7,9 Гц, 1 Н), 7,81 (s, 2 H), 8,41 (dd, J=8,2, 2,1 Гц, 1 Н), 9,16 (d, J=2,1 Гц, 1 Н).
Примеры 61-70
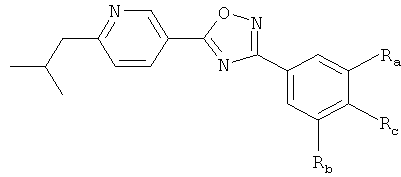
Соединения следующих примеров получают аналогично получению предыдущих примеров, исходя из никотиновой кислоты (8).
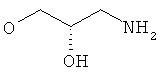
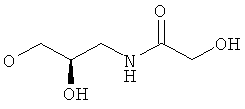
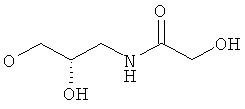
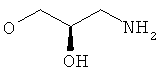



Пример 66
1H ЯМР (CDCl3): δ 0,99 (d, J=6,5 Гц, 6 Н), 1,33 (t, J=7,5 Гц, 3 Н), 2,15-2,26 (m, 1 Н), 2,40 (s, 3 Н), 2,72-2,83 (m, 4 Н), 3,49-3,58 (m, 1 Н), 3,78-3,94 (m, 3 Н), 4,17-4,26 (m, 3 Н), 6,98 (s расширенный, 1 Н), 7,34 (d, J=8,3 Гц, 1 Н), 7,88 (s, 1 Н), 7,89 (s, 1 Н), 8,39 (dd, J=8,0, 2,0 Гц, 1 Н), 9,37 (d. J=1,3 Гц, 1 Н).
Примеры 71-77
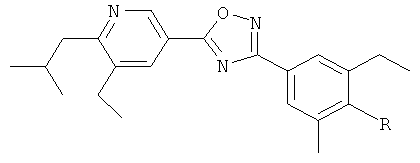
Соединения следующих примеров получают из никотиновой кислоты (9) и 3-этил-4,N-дигидрокси-5-метилбензамидина аналогично получению соединений предыдущих примеров.


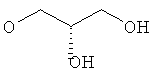
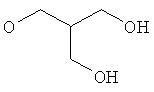
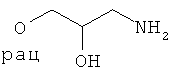
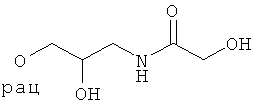
Пример 75
1H ЯМР (CDCl3): δ 1,01 (d, J=6,8 Гц, 6 Н), 1,33 (m, 6 Н), 2,15 (s расширенный, 1 Н), 2,22-2,34 (m, 2 Н), 2,42 (s, 3 Н), 2,73-2,85 (m, 4 Н), 3,51 (s, 1 Н), 3,96-4,09 (m, 5H), 7,89 (s, 1 Н), 7,92 (s, 1 Н), 8,25 (d, J=1,8 Гц, 1 Н), 9,21 (d, J=2,0 Гц, 1 Н).
Примеры 78-81
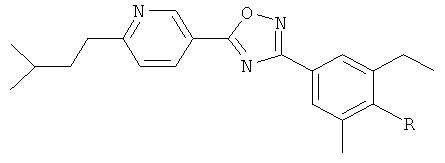
Соединения следующих примеров получают из никотиновой кислоты (10) и 3-этил-4,N-дигидрокси-5-метилбензамидина аналогично получению соединений предыдущих примеров.



Пример 81
1H ЯМР (CDCl3): δ 1,01 (d, J=6,0 Гц, 6 Н), 1,33 (t, J = 7,8 Гц, 3 Н), 1,67-1,77 (m, 2 Н), 2,14 (s расширенный, 1 Н), 2,27-2,35 (m, 1 Н), 2,42 (s, 3 Н), 2,77 (q, J=7,5 Гц, 2 Н), 2,93-2,99 (m, 2 Н), 3,99-4,09 (m, 5 Н), 7,86-7,91 (m, 3 Н), 7,94 (s, 1 Н), 8,79 (d, J=5,0 Гц, 1 Н).
Примеры 82-88
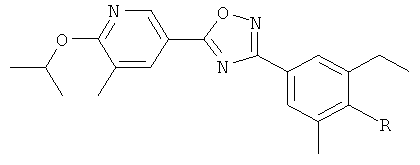
Соединения следующих примеров получают аналогично предыдущим примерам из никотиновой кислоты (11) и 3-этил-4,N-дигидрокси-5-метилбензамидина.
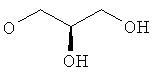
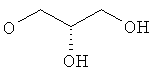
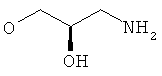
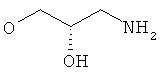
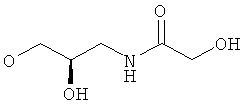
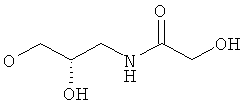
Пример 88
1H ЯМР (CDCl3): δ 1,32 (t, J=7,5 Гц, 3 Н), 1,42 (d, J=6,0 Гц, 6 Н), 2,28 (s, 3 Н), 2,39 (s, 3 Н), 2,75 (q, J=7,5 Гц, 2 Н), 3,41 (m, 1 Н), 3,48-3,58 (m, 1 Н), 3,76-3,93 (m, 3 Н), 4,17-4,25 (m, 3 Н), 5,43-5,52 (m, 1 Н), 7,03 (t расширенный, J=4,3 Гц, 1 Н), 7,85 (s, 1 Н), 7,87 (s, 1 Н), 8,14 (s, 1 Н), 8,84 (s, 1 H).
Пример 89
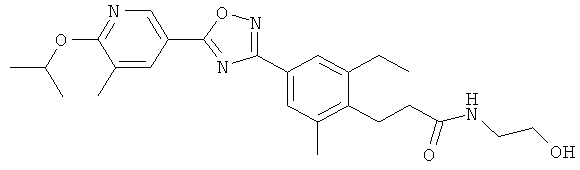
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}-N-(2-гидроксиэтил)пропионамид получают из 3-{2-этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}пропионовой кислоты аналогично получению соединения примера 55;
ЖХ-МС: tR=1,07, [M+1]+=453,23; 1H ЯМР (CDCl3): δ 1,31 (t, J=7,3 Гц, 3 Н), 1,42 (d, J=5,5 Гц, 6 Н), 2,28 (s, 3 Н), 2,38-2,48 (m, 5 Н), 2,53 (s расширенный, 1 Н), 2,77 (q, J=7,3 Гц, 2 Н), 3,06-3,14 (m, 2 Н), 3,42-3,50 (m, 2 Н), 3,71-3,79 (m, 2 Н), 5,42-5,52 (m, 1 Н), 5,89 (s расширенный, 1 Н), 7,82 (s, 1 Н), 7,85 (s, 1 Н), 8,15 (s, 1 H), 8,85 (s, 1 Н).
Примеры 90-92
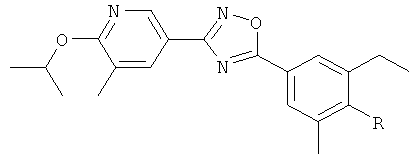
Соединения следующих примеров получают аналогично примеру 13 исходя из 3-этил-4-гидрокси-5-метилбензойной кислоты и N-гидрокси-6-изопропокси-5-метилникотинамида.


Пример 92
1Н ЯМР (CDCl3): δ 1,34 (t, J=7,5 Гц, 3 Н), 1,41 (d, J=6,0 Гц, 6 H), 2,03 (t, J=6,0 Гц, 1 Н), 2,27 (s, 3 H), 2,43 (s, 3 H), 2,70 (d, J=5,0 Гц, 1 Н), 2,79 (q, J=7,3 Гц, 2 Н), 3,82-3,99 (m, 4 H), 4,15-4,21 (m, 1 H), 5,41-5,49 (m, 1 H), 7,92 (s, 1 H), 7,96 (s, 1 H), 8,11 (s, 1 H), 8,79 (s, 1 H).
II) Биология
GTPγS анализ определения EC50 величин
Анализы GTPγS-связывания проводят в 96-ячеистых планшетах для титрования (Nunc, 442587) с конечным объемом 200 мкл, с использованием мембранных препаратов СНО клеток, экспрессирующих рекомбинантный человеческий S1P1 рецептор. Условия проведения анализа: 20 мМ Hepes (фирма Fluka, 54461), 100 мМ NaCl (фирма Fluka, 71378), 5 мМ MgCl2 (фирма Fluka, 63064), 0,1% БСА (фирма Calbiochem, 126609), 1 мкМ GDP (фирма Sigma, G-7127), 2,5% ДМСО (фирма Fluka, 41644), 50 pM 35S-GTPγS (фирма Amersham Biosciences, SJ1320), pH 7,4. Тестируемые соединения растворяют и разбавляют 100% ДМСО и предварительно инкубируют при комнатной температуре в течение 30 мин в 150 мкл названного выше буфера для анализа, в отсутствие 35S-GTPγS. После добавления 50 мкл 35S-GTPγS, анализируемую смесь инкубируют в течение 1 ч при комнатной температуре. Анализ останавливают посредством переноса реакционной смеси в Multiscreen планшет (Millipore, MAHFC1H60), используя коллектор клеток от фирмы Packard Biosciences, после чего планшеты промывают охлажденным льдом раствором 10 мМ Na2HPO4/NaH2PO4 (в соотношении 70%:30%), высушивают, герметизируют в нижнем отделе и после добавления 25 мкл MicroScint20 (Packard Biosciences, order# 6013621), герметизируют в верхней части. Мембранное связывание 35S-GTPγS измеряют с помощью TopCount от фирмы Packard Biosciences.
ЕС50 представляет собой концентрацию агониста, включающую 50% максимального специфического 35S-GTPγS связывания. Специфическое связывание определяется вычитанием неспецифического связывания из максимального связывания. Максимальное связывание представляет собой число импульсов в мин, связанных с Multiscreen планшетом в присутствии 10 мкМ S1P. Неспецифическое связывание представляет собой число связываний в отсутствие агониста при анализе.
Измерялась также агонистическая активность (ЕС50 величины) соединений примеров 62-92. Найденные ЕС50 величины расположены в интервале от 0,1 до 9410 нМ со средним значением 492 нМ. Агонистическая активность избранных соединений представлена в таблице 1.
Оценка эффективности в условиях in vivo
Эффективность соединений формулы (I) оценивалась измерением циркулирующих лимфоцитов после орального введения от 3 до 30 мг/кг соединения формулы (I) нормотензивным мужским особям крыс Wistar. Животные содержались в условиях с контролируемым климатом с 12-часовым свет/темнота-циклом и имели доступ к нормальной крысиной пище и питьевой воде. Кровь отбиралась перед и через 3, 6 и 24 ч после введения лекарства. Вся кровь подвергалась гематологическому анализу с использованием Advia Hematology system (Bayer Diagnostics, Zürich, Switzerland).
Все данные представлены как средние ±SEM. Статистические анализы проводились с помощью вариантного анализа (ANOVA) с использованием Statistica (StatSoft) и Student-Newman-Keuls метода для мультиплетных сравнений. Сводящаяся к нулю гипотеза отбрасывалась, когда p<0,05.
В виде примера в таблице 2 представлен эффект, оказываемый на лимфоциты, через 6 ч после введения 10 мг/кг некоторых соединений по настоящему изобретению нормотензивным мужским особям крыс Wistar по сравнению с группой животных, обрабатываемых только растворителем. Количество лимфоцитов через 6 ч после орального введения измерялось для 6 примерных соединений и составляло величину в пределах от -77% до -61% со средним значением -68%.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИДИН-2-ИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИММУНОМОДУЛИРУЮЩИХ АГЕНТОВ | 2009 |
|
RU2494099C2 |
| НОВЫЕ ТИОФЕНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АГОНИСТОВ S1P1/EDG1 РЕЦЕПТОРА | 2007 |
|
RU2442783C2 |
| ФЕНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИММУНОМОДУЛЯТОРОВ | 2007 |
|
RU2442780C2 |
| 2-МЕТОКСИ-ПИРИДИН-4-ИЛЬНЫЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2588141C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-4-ИЛА | 2010 |
|
RU2547098C2 |
| ПРОИЗВОДНЫЕ ПИРИДИН-4-ИЛА В КАЧЕСТВЕ ИММУНОМОДУЛИРУЮЩИХ АГЕНТОВ | 2007 |
|
RU2447071C2 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2563634C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТИОФЕНА В КАЧЕСТВЕ АГОНИСТОВ РЕЦЕПТОРА S1P1/EDG1 | 2007 |
|
RU2437877C2 |
| НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА | 2004 |
|
RU2346943C2 |
| ИНГИБИТОРЫ КАТЕХОЛ-О-МЕТИЛТРАНСФЕРАЗЫ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПСИХОТИЧЕСКИХ РАССТРОЙСТВ | 2011 |
|
RU2586974C2 |
Изобретение относится к пиридин-3-ил производным формулы (I)
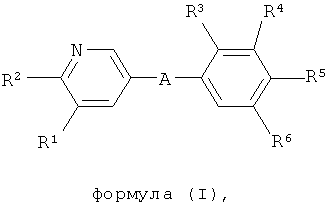
где А представляет собой *-CONH-CH2-, *-CO-CH=CH-, *-СО-CH2CH2-,
 ,
,  ,
,  или
или
 где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I); R1 представляет собой водород, С1-4алкил или хлор; R2 представляет собой С1-5алкил или C1-4алкоксигруппу; R3 представляет собой водород или С1-4алкил; R4 представляет собой водород, C1-4алкил, С1-4алкоксигруппу или галоген; R5 представляет собой -CH2-(CH2)n-CONR51R52, -CO-NHR51, 1-(3-карбоксиазетидинил)-2-ацетил, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-[(азетидин-3-карбоновая кислота)-1-ил]этоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54; R51 представляет собой водород, C1-3алкил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил или 2,3-дигидропропил; R52 представляет собой водород; R54 представляет собой гидроксиметил; n представляет собой 0 или 1; и R6 представляет собой водород, C1-4алкил или галоген; и соль такого соединения. Также изобретение описывает фармацевтическую композицию для профилактики или лечения болезней или заболеваний, ассоциированных с активированной иммунной системой, на основе соединения формулы I и применение данных соединений для получения данной фармацевтической композиции. Технический результат: получены и описаны новые соединения, которые особенно активны в качестве иммуномодулирующих агентов. 3 н. и 15 з.п. ф-лы, 92 прим., 2 табл.
где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I); R1 представляет собой водород, С1-4алкил или хлор; R2 представляет собой С1-5алкил или C1-4алкоксигруппу; R3 представляет собой водород или С1-4алкил; R4 представляет собой водород, C1-4алкил, С1-4алкоксигруппу или галоген; R5 представляет собой -CH2-(CH2)n-CONR51R52, -CO-NHR51, 1-(3-карбоксиазетидинил)-2-ацетил, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-[(азетидин-3-карбоновая кислота)-1-ил]этоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54; R51 представляет собой водород, C1-3алкил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил или 2,3-дигидропропил; R52 представляет собой водород; R54 представляет собой гидроксиметил; n представляет собой 0 или 1; и R6 представляет собой водород, C1-4алкил или галоген; и соль такого соединения. Также изобретение описывает фармацевтическую композицию для профилактики или лечения болезней или заболеваний, ассоциированных с активированной иммунной системой, на основе соединения формулы I и применение данных соединений для получения данной фармацевтической композиции. Технический результат: получены и описаны новые соединения, которые особенно активны в качестве иммуномодулирующих агентов. 3 н. и 15 з.п. ф-лы, 92 прим., 2 табл.
1. Соединение формулы (I)

где А представляет собой *-CONH-CH2-, *-СО-СН=СН-, *-СО-СН2СН2-,
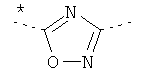 ,
, 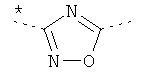 ,
,  или
или

где звездочки указывают на связь, через которую осуществляется соединение с пиридиновой группой формулы (I);
R1 представляет собой водород, С1-4алкил или хлор;
R2 представляет собой С1-5алкил или С1-4алкоксигруппу;
R3 представляет собой водород или С1-4алкил;
R4 представляет собой водород, С1-4алкил, С1-4алкоксигруппу или галоген;
R5 представляет собой -CH2-(CH2)n-CONR51R52, -CO-NHR51, 1-(3-карбоксиазетидинил)-2-ацетил, гидроксигруппу, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, 2-[(азетидин-3-карбоновая кислота)-1-ил]этоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54;
R51 представляет собой водород, C1-3алкил, 2-гидроксиэтил, 2-гидрокси-1-гидроксиметилэтил или 2,3-дигидропропил;
R52 представляет собой водород;
R54 представляет собой гидроксиметил;
n представляет собой 0 или 1; и
R6 представляет собой водород, С1-4алкил или галоген;
и соль такого соединения.
2. Соединение по п.1, где А представляет собой
 ;
;
и соль такого соединения.
3. Соединение по п.1 или 2, где R1 представляет собой С1-4алкил или хлор; и соль такого соединения.
4. Соединение по п.1 или 2, где R1 представляет собой С1-4алкил; и соль такого соединения.
5. Соединение по п.1 или 2, где R2 представляет собой С1-5алкил; и соль такого соединения.
6. Соединение по п.1 или 2, где R2 представляет собой н-пропил или изобутил; и соль такого соединения.
7. Соединение по п.1 или 2, где R2 представляет собой С1-4алкоксигруппу; и соль такого соединения.
8. Соединение по п.1 или 2, где R3 представляет собой водород; и соль такого соединения.
9. Соединение по п.1 или 2, где R3 представляет собой водород; и R4 представляет собой С1-4алкил или С1-4алкоксигруппу; и R6 представляет собой С1-4алкил или галоген; и соль такого соединения.
10. Соединение по п.1 или 2, где R3 представляет собой водород, R4 представляет собой C1-3алкил или метоксигруппу, и R6 представляет собой метил, этил, или галоген; и соль такого соединения.
11. Соединение по п.1 или 2, где R5 представляет собой -CH2-(СН2)n-CONR51R52, -CO-NHR51, гидроксигруппу, гидрокси С2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу,
-OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54; и соль такого соединения.
12. Соединение по п.1 или 2, где R5 представляет собой -СН2-(СН2)n-CONR51R52, -CO-NHR51, гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)-С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54; и соль такого соединения.
13. Соединение по п.1 или 2, где R5 представляет собой гидроксиС2-5алкоксигруппу, ди-(гидроксиС1-4алкил)С1-4алкоксигруппу, 2,3-дигидроксипропоксигруппу, -OCH2-CH(OH)-CH2-NR51R52 или -OCH2-CH(OH)-CH2-NHCOR54; и соль такого соединения.
14. Соединение по п.1 или 2, где R5 представляет собой 3-гидрокси-2-гидроксиметилпропоксигруппу, 2,3-дигидроксипропоксигруппу или -OCH2-CH(OH)-CH2-NHCOR54; и соль такого соединения.
15. Соединение по п.1, выбранное из группы, включающей:
3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропан-1,2-диол;
N-(3-{4-[5-(5-Хлор-6-изопропоксипиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{4-[5-(6-Изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси} пропан-1,2-диол;
2-Гидрокси-N-(2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси}пропил)ацетамид;
N-(3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{4-[5-(5,6-Диизобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2,6-диметилфенокси} пропан-1,2-диол;
N-(3-{4-[5-(5,6-Диэтилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-2-этил-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
2-Гидрокси-N-(2-гидрокси-3-{4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-3-метилфенокси}пропил)ацетамид;
N-(3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-(3-{2-Хлор-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метоксифенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((R)-3-{2-Этил-4-[5-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((S)-3-{2-Этил-4-[3-(6-изобутил-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((5)-3-{2-Этил-4-[5-(6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(S)-3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-(3-{2-Этил-4-[5-(5-этил-6-изобутилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
(R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}пропан-1,2-диол;
N-((R)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
N-((5)-3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенокси}-2-гидроксипропил)-2-гидроксиацетамид;
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}-N-(2-гидроксиэтил)пропионамид;
(R)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол;
(S)-3-{2-Этил-4-[3-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-5-ил]-6-метилфенокси}пропан-1,2-диол; и
3-{2-Этил-4-[5-(6-изопропокси-5-метилпиридин-3-ил)-[1,2,4]оксадиазол-3-ил]-6-метилфенил}пропионовую кислоту;
и соль такого соединения.
16. Фармацевтическая композиция для профилактики или лечения болезней или заболеваний, ассоциированных с активированной иммунной системой, включающая соединение по одному из пп.1-15 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
17. Соединение по одному из пп.1, 2 и 15, или его фармацевтически приемлемая соль, или фармацевтическая композиция по п.16 для применения в профилактике или лечении болезней или заболеваний, ассоциированных с активированной иммунной системой.
18. Применение соединения по одному из пп.1-15 или его фармацевтически приемлемой соли для получения фармацевтической композиции для профилактики или лечения болезней или заболеваний, ассоциированных с активированной иммунной системой.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| DE 10237883 A1, 04.03.2004 | |||
| HLA Т ET AL: "ABUNDANT TRANSCRIPT INDUCED IN DIFFERENTIATING HUMAN ENDOTHELIAL CELLS ENCODES A POLYPEPTIDE WITH STRUCTURAL SIMILARITIES TO G-PROTEIN-COUPLED RECEPTORS" JOURNAL OF BIOLOGICAL CHEMISTRY, AMERICAN SOCIETY OF BIOLOCHEMICAL BIOLOGISTS, BIRMINGHAM, US, vol.265, no.6, 5 1990-06-05, pages 9308-9313 | |||
| RU 96121181, 24.12.1998. | |||
Авторы
Даты
2012-06-27—Публикация
2007-09-06—Подача