Область применения
Изобретение относится к биотехнологии. Изобретение позволяет ускорить скрининг соединений, а также осуществлять поиск новых соединений с наибольшей активностью, являющихся потенциальными нейропротекторами.
Уровень исследований и знаний на настоящее время
Создание новых эффективных и безопасных фармакологических средств для повышения эффективности умственного труда в сложных условиях и коррекции патологий центральной нервной системы (ЦНС), включающих нейродегенеративные заболевания, особенно актуально в современную эпоху, которая характеризуется повышением влияния стрессогенных факторов на организм человека, а также ухудшением экологической обстановки во многих областях земного шара. Длительное психическое напряжение, сопряженное с указанными выше факторами, постоянно сопровождает многие современные сферы деятельности человека, несмотря на постоянное совершенствование их технического обеспечения, и приводит к повреждению и гибели нервных клеток. Развитие нейродегенеративных процессов в ЦНС также связано с различными патологиями, наследственной предрасположенностью и черепно-мозговыми травмами. Доля нейродегенеративных заболеваний в общей структуре заболеваемости возрастает при увеличении продолжительности жизни. Наиболее распространенными являются болезнь Альцгеймера и инсульты. Инсульты, по нашему мнению, могут быть отнесены к нейродегенеративным заболеваниям в связи с массовой гибелью клеток, в частности нейронов, в ЦНС. В настоящее время количество людей в мире, страдающих болезнью Альцгеймера, составляет по разным оценкам до 10 миллионов человек. По прогнозам, в случае, если ученые не найдут средство против этой болезни, уже через 25 лет от этого недуга будут страдать 22 миллиона жителей нашей планеты, а через 50 лет - примерно 45 миллионов. Сходная ситуация и с инсультами. Ежегодно в мире переносят инсульт около 6 миллионов человек, умирает 4,7 миллиона. В России в год регистрируется до 450 тысяч инсультов, причем большинство из них относится к тяжелой и средней степени тяжести. Лишь около 20% выживших больных могут вернуться к прежней работе.
Известны нейротрофины - семейство регуляторных белков нервной ткани, которые синтезируются нейронами и клетками нейроглии и способствуют дифференцировке и поддержанию жизнеспособности и функционирования периферических и центральных нейронов. При этом используются аутокринный и паракринный механизмы регуляции (Yuen et al, 1996). Во время эмбрионального развития нейротрофины способствуют выживанию периферических нейронов до и во время иннервации клеток-мишеней. Они функционируют так же, как физиологические сигналы выживания для центральных нейронов. При развитии нервной системы с помощью нейротрофинов регулируется выживаемость нейронов, то есть в зрелой нервной системе присутствуют те нейроны, которые в процессе развития нервной системы получили нейротрофины в надлежащем количестве от соответствующих клеток-мишеней. "Лишние" же нейроны удаляются по механизму программируемой клеточной гибели. Нейротрофины регулируют нейрональную дифференцировку, индуцируют ветвление дендритов (арборизацию) и рост аксонов (спрутинг) в направлении клеток-мишеней. В зрелой нервной системе нейротрофины регулируют как краткосрочную синаптическую передачу, так и долговременное потенцирование (LTP), участвуя, таким образом, в обеспечении пластичности нервной системы, необходимой для ее нормального функционирования.
Известен нейротрофин - фактор роста нервов (NGF). Основными мишенями для NGF, первого обнаруженного нейротрофина, являются холинергические нейроны переднего мозга, играющие значительную роль в таких функциях ЦНС как внимание, обучение, память; холинергические нейроны стриатума, вовлеченные в контроль движения; чувствительные нейроны и большинство нейронов симпатической нервной системы.
Известен нейротрофин - нейротрофический фактор мозга (BDNF). Выявленными мишенями для BDNF являются дофаминергические нейроны черной субстанции, холинергические нейроны переднего мозга, серотонинергические нейроны коры, ГАМК-ергические нейроны стриатума, гранулярные нейроны мозжечка; мотонейроны, нейроны ресничного ганглия; нейроны спинномозговых узлов.
Известен гептапептид Семакс (Met-Glu-His-Phe-Pro-Gly-Pro), синтезированный в Институте заявителя. Установлена эффективность использования Семакса в качестве нейропротекторного средства в остром периоде ишемического инсульта (Гусев и др., 1997). Семакс оказывает выраженное нейропротекторное действие, основными компонентами которого являются торможение глиальных реакций воспаления, улучшение трофического обеспечения мозга, торможение синтеза оксида азота и других реакций оксидантного стресса, а также иммуномодуляция. Индуцированные Семаксом цепи метаболических превращений взаимно усиливают и поддерживают друг друга, приводя к торможению большинства важных механизмов отсроченной смерти клеток (Скворцова и др., 1999).
Сопоставление клинической динамики в группе с применением Семакса и без нее обнаружило достоверное улучшение восстановительных процессов на фоне лечения Семаксом у больных со среднетяжелым и тяжелым инсультом. При ишемическом инсульте средней тяжести с преобладанием очаговых неврологических симптомов эффективность Семакса проявлялась с первых суток заболевания и выражалась в общей активизации больных и ускорении регресса очаговой симптоматики. У 88% больных, получавших Семакс, течение инсульта было регредиентным со стабильным регрессом неврологических нарушений, что значительно превышало аналогичный показатель в контрольной группе (55,2%). Под действием Семакса к концу острого периода инсульта у 84% больных констатировано хорошее восстановление функций, причем у 32% пациентов регресс очаговых симптомов был полным (Гусев и др., 1999). При тяжелом инсульте применение Семакса в первые часы и дни заболевания позволило достоверно ускорить регресс не только очаговых, но и общемозговых и вегетативных симптомов. У всех больных, поступивших в состоянии оглушения, к концу вторых суток вернулось ясное сознание. К пятым суткам инсульта у 80% больных расстройство сознания и менингеальные симптомы полностью исчезли. У 80% больных, получавших Семакс, определялось регредиентное течение заболевания против 62% в контроле. В группе с применением Семакса летальность при тяжелом инсульте составила 10%, тогда как в контрольной группе - 28,4%.
Известны первичные культуры эукариотических клеток, которые используются для скрининга соединений с различными свойствами [1].
Задача эффективного поиска и быстрого скрининга соединений с нейропротекторной активностью является в настоящее время чрезвычайно актуальной задачей. Актуальна также задача выявления соединений с нежелательными эффектами, особенно способствующих пролиферации глиальных клеток и их злокачественному перерождению.
Раскрытие изобретения
Анализ экспрессии генов нейротрофинов в глиальных клетках, полученных из мозга млекопитающих, под действием тестируемых соединений дает информацию относительно их нейропротекторных свойств.
Осуществление изобретения
Техническим результатом, достигаемым при реализации настоящего изобретения, является ускорение тестирования соединений с нейропротекторной активностью, выявление новых соединений с нейропротекторной активностью, оценка побочных эффектов тестированных соединений на клеточном уровне. Указанный технический результат достигается за счет оценки способности тестируемых фармакологических соединений стимулировать экспрессию нейротрофинов глиальными клетками, полученными из мозга млекопитающих.
Определение терминов
Под первичной нейрональной культурой понимается клеточная культура, выделенная из 16-17-дневных эмбрионов (Е16-17) крыс по стандартной методике [2].
Под первичной глиальной культурой понимается клеточная культура, выделенная из мозга крыс возраста 1-3 дня по стандартной методике [3].
Под нейропротекцией понимается способность фармакологического соединения предотвращать гибель нервных клеток.
Под пролиферацией понимается способность фармакологического соединения стимулировать деление клеток.
Примеры собственных экспериментов
Собственными исследованиями было установлено, что гептапептид последовательности (Met-Glu-His-Phe-Pro-Gly-Pro) (Семакс) обладает нейропротекторными свойствами (патенты РФ №2124365, №2251429) и применяется при лечении инсультов, заболевании, связанном с массовой гибелью нейронов в мозге человека.
Собственными исследованиями было показано, что нейроны, полученные из эмбрионального мозга млекопитающих в условиях культивирования in vitro, подвергаются гибели в основном по пути апоптоза. Применение пептида Семакс существенным образом замедляло этот процесс.
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1.
Проводили исследование способности пептида Семакс и его структурного природного аналога АКТГ (4-7) (Met-Glu-His-Phe) замедлять процесс гибели нейронов, полученных из мозга крысы, in vitro.
Первичные диссоциированные культуры нейронов базальных ядер переднего мозга крысы получали из 16-17-дневных эмбрионов (Е16-17) по стандартной методике [2]. Крыс линии Sprague-Dowly массой 200-300 г ссаживали в соотношении 1 самец - 3 самки после 18 ч вечера; следующий день после рассаживания считался первым днем беременности. Крыс умерщвляли методом углекислотной асфиксии (15 мин) и помещали на 1 мин в 80% раствор этанола в воде. Далее все операции проводили в асептических условиях при температуре 4-7°С. Выделенный из эмбриона мозг помещали в раствор Хэнкса и затем выделяли базальные ядра переднего мозга, освобождая ткань от оболочек. Выделенную ткань один раз промывали раствором Хэнкса и переносили в среду MEM/F12 (1:1), содержащую 20% эмбриональной сыворотки коровы и 2 мМ L-глутамин. Ткань механически диссоциировали на отдельные клетки с помощью пипетирования. Полученную клеточную суспензию два раза промывали средой с помощью центрифугирования (200 g). Клетки считали в гемоцитометре (камера Горяева) и засевали с плотностью 100 тыс.клеток/см на обработанные поли-L-лизином 12-луночные (или 24-луночные) планшеты в среде MEM/F12 (1:1), содержащей 6 г/л D-глюкозы, 2 мМ L-глутамин, 25 мг/л инсулина, 100 мг/л трансферрина, 20 нМ прогестерон, 100 нМ путресцин и 30 нМ селенит натрия. Культивирование клеток проводили в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% СО2 и 95% воздуха. Аналогичным образом получали первичные нейрональные культуры и из других отделов мозга эмбрионов крысы (гиппокамп, кора, мозжечок, средний мозг).
Культивирование первичных культур нейронов проводили в 12-луночных планшетах в 6 параллелях для каждого варианта. Соответствующие соединения, включая Семакс, добавляли в объеме 100 мкл сразу после прикрепления клеток к подложке, однократно. Выживаемость культивируемых нейронов через 7 дней культивирования оценивали путем подсчета цитохимически или иммуноцитохимически окрашенных клеток в 18 случайных полях каждой лунки. Холинергические нейроны визуализировали с помощью окраски на ацетилхолинестеразу. Культуры фиксировали 4% параформальдегидом 1 ч при комнатной температуре, промывали PBS и инкубировали 48 ч в 50 мМ ацетатном буфере (рН 5,0), содержащем 4 мМ ацетилхолин-иодид, 2 мМ CuSO4, 10 мМ глицин и 0,2 мМ этопропазин. Затем инкубационную среду отбирали, клетки промывали водой и на 1-2 мин добавляли 1,25% раствор Na2S. Среду отбирали и на 1-2 мин добавляли 1% раствор AgNO3. Среду отбирали и планшеты промывали водой. Полученные данные представлены в таблице 1.
Культивирование первичных культур нейронов
Полученные результаты свидетельствуют о существенном нейропротекторном эффекте Семакса (в 1,5-1,6 раза) по сравнению с контролем и фрагментом АКТГ(4-7). Важно отметить, что эффект пептида был сопоставим с эффектом нейротрофического фактора мозга, хорошо известного соединения, способного предотвращать гибель нервных клеток. Полученные результаты свидетельствуют о возможности использования первичной нейрональной культуры для тестирования фармакологических соединений с нейропротекторной активностью.
Пример 2.
Проводили исследование способности пептида Семакс замедлять процесс гибели дофаминергических нейронов в первичных нейрональных культурах, полученных из мозга крысы. Первичные диссоциированные культуры нейронов среднего мозга крысы получали из 15-16-дневных эмбрионов (Е15-16) по стандартной методике [2]. Крыс линии Sprague-Dowly массой 200-300 г ссаживали в соотношении 1 самец - 3 самки после 18 ч вечера; следующий день после рассаживания считался первым днем беременности. Крыс умерщвляли методом углекислотной асфиксии (15 мин) и помещали на 1 мин в 80% раствор этанола в воде. Далее все операции проводили в асептических условиях при температуре 4-7°С. Выделенный из эмбриона мозг помещали в раствор Хэнкса и затем выделяли базальные ядра переднего мозга, освобождая ткань от оболочек. Выделенную ткань один раз промывали раствором Хэнкса и переносили в среду MEM/F12 (1:1), содержащую 20% эмбриональной сыворотки коровы и 2 мМ L-глутамин. Ткань механически диссоциировали на отдельные клетки с помощью пипетирования. Полученную клеточную суспензию два раза промывали средой с помощью центрифугирования. Клетки считали в гемоцитометре (камера Горяева) и засевали с плотностью 100 тыс.клеток/см2 на обработанные поли-L-лизином 12-луночные (или 24-луночные) планшеты в среде MEM/F12 (1:1), содержащей 6 г/л D-глюкозы, 2 мМ L-глутамин, 25 мг/л инсулина, 100 мг/л трансферрина, 20 нМ прогестерон, 100 нМ путресцин и 30 нМ селенит натрия. Культивирование клеток проводили в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% СО2 и 95% воздуха.
Культивирование первичных культур нейронов проводили в 12-луночных планшетах в 6 параллелях для каждого варианта. Соответствующие соединения, включая Семакс, добавляли в объеме 100 мкл сразу после прикрепления клеток к подложке, однократно. Выживаемость культивируемых нейронов через 12 дней культивирования оценивали путем подсчета иммуноцитохимически окрашенных клеток в 18 случайных полях каждой лунки. Результаты приведены на фиг.1 Полученные результаты свидетельствуют о существенном нейропротекторном эффекте Семакса (в 4,5-5,0 раза) по сравнению с контролем. Полученные результаты подтверждают возможность использования первичной нейрональной культуры для тестирования фармакологических соединений с нейропротекторной активностью in vitro.
Пример 3.
Проводили исследование способности пептида Семакс оказывать влияние на пролиферацию глиальных клеток in vitro. Первичную культуру глиальных клеток получали согласно стандартной методике [3]. Крыс линии Sprague-Dowly или Вистар возраста 1-3 дня умерщвляли с помощью углекислотной асфиксии (15 мин) и помещали на 1 мин в 80% раствор этанола в воде. Далее все операции проводили в асептических условиях при температуре 4-7°С. Выделенный мозг помещали в раствор Хэнкса и затем выделяли базальные ядра переднего мозга, освобождая ткань от оболочек. Выделенную ткань один раз промывали раствором Хэнкса и переносили в среду MEM/F12 (1:1), содержащую 20% эмбриональной сыворотки коровы и 2 мМ L-глутамин. Ткань механически диссоциировали на отдельные клетки с помощью пипетирования. Полученную клеточную суспензию один раз промывали средой того же состава с помощью центрифугирования при 200 g. Клетки считали в гемацитометре (камера Горяева) и засевали с плотностью 200 тыс.клеток/см2 на обработанные поли-L-лизином культуральные флаконы площадью 75 см2. Культивирование клеток проводили в СО2-инкубаторе при 37°С в атмосфере, содержащей 5% СО2 и 95% воздуха в среде MEM/F12, содержащей 15% эмбриональной сыворотки коровы, 2 мМ L-глутамин, 100 мкг/мл гентамицина. Культуральную среду меняли каждые 3 дня. Пересев клеток проводили после образования монослоя в соотношении 1:3.
Для экспериментов использовали клетки, полученные в результате третьего пересева. Соответствующие соединения, включая Семакс, добавляли в объеме 100 мкл сразу после прикрепления клеток к подложке, однократно. Оценка пролиферации культивируемых глиальных клеток проводили через 24 час после добавления тестируемого соединения. Данные эксперимента представлены на фиг.2. Полученные результаты свидетельствуют об отсутствии достоверного влияния данного пептида на пролиферацию глиальных клеток. В качестве положительного контроля была использована эмбриональная сыворотка коровы.
Пример 4.
Проводили исследование способности пептида Семакс влиять на уровень экспрессии генов нейротрофинов в первичных культурах клеток глии. Клетки глии, выделенные, как описано в примере 2, после третьего пересева засевали на обработанные поли-L-лизином 4-луночные планшеты (диаметр лунки 6 см) в 5 мл среды DMEM, содержащей 15% эмбриональной сыворотки коровы, 2 мМ L-глутамин и 100 мкг/мл гентамицина, и после образования клеточного монослоя меняли среду на DMEM с 1% сыворотки и 2 мМ L-глутамином и 100 мкг/мл гентамицина. Через 48 ч в среду вносили 50 мкл стерильного раствора Семакса до указанной конечной концентрации или эквивалентный объем стерильной воды. В указанные промежутки времени культуральную среду отбирали и клетки промывали PBS (4°С). Тотальную РНК выделяли фенол-хлороформной экстракцией с использованием набора Promega RNAgents® Total RNA Isolation System («Promega», США), следуя методике и рекомендациям фирмы-производителя. После этанольного осаждения осадок РНК дважды промывали 70% этанолом и хранили при -70°С. Для удаления возможной примеси геномной ДНК образцы РНК растворяли в обработанной диэтилпирокарбонатом (DEPC) воде и инкубировали 1 ч при 37°С в присутствии ДНКазы, свободной от РНКаз. После дополнительной фенол-хлороформной экстракции РНК осаждали, промывали 70% этанолом, растворяли в обработанной DEPC воде и хранили при -70°С.
Для проведения обратной транскрипции отбирали 2 мкг тотальной РНК и проводили реакцию 1 ч при 37°С в 25 мкл среды, содержавшей 1 мкг oligo(dT)15 праймеров, 50 мМ Трис-НСl, 15 мМ (NH4)2SO4, 5 мМ MgCl2, 0,01% желатины, 0,01% Tween-20, 0,2 мг/мл BSA, 5% глицерина, 2 мкМ dNTPs, 30 ед. ингибитора РНКазы (Fermetas) и 50 U Moloney Murine Leukemia Virus (М-МLV)-обратной транскриптазы ("Синтол", Россия). После инкубации в течение 10 мин при 95°С образцы кДНК замораживали и хранили при -20°С. С полученными образцами кДНК проводили амплификацию, используя следующие праймеры и условия:
β-актин 5'-TTGTAACCACCTGGGACGATATGG-3'
5'-GATCTTGАТСТТСATGG TGCTAG-3'
94°С - 1 мин, 61°С - 1 мин, 72°С - 1 мин
bdnf 5'-CAGTGGAC ATGTCCGGTGGGACGGTC-3'
5'-TTCTTGGCAACGGCAACAAACCACAAC-3'
94°C - 1 мин, 72°C - 1 мин
ngf 5'-GGCGTACAGGCAGAACCGTACACAG-3'
5'-CCGTGGCTGTGGTCTTATCTCCAACCCACAC-3'
94°C - 1 мин, 72°C - 1 мин
Указанные праймеры приведены на фиг.3.
Амплификацию проводили в среде объемом 20 мкл, содержащей 2 мкл кДНК образца, 5 пмоль каждого праймера, причем один из каждой пары был мечен 32Р-αАТР с помощью Т4-полинуклеотидкиназы («Силекс», Россия), 5 мМ MgCl2, 200 мкМ dNTPs, 50 мМ Трис-НСl, 15 мМ (NH4)2SO4, 5 мМ MgCl2, 0,01% желатины, 0,01% Tween-20, 0,2 мг/мл BSA, 5% глицерина. После начальной денатурации в течение 5 мин при 94°С в реакционную смесь вводили 2,5 Ед. Taq-полимеразы («Силекс», Россия) и после 28 циклов (число циклов соответствовало линейной зависимости количества продукта от количества исходной кДНК) и последующей инкубации в течение 10 мин при 72°С продукты разделяли в 8% неденатурирующем полиакриламидном геле в присутствии бромистого этидия. Полосы, соответствующие продуктам амплификации, вырезали и определяли радиоактивность на сцинтилляционном счетчике "Mark-3" (Nuclear Chicago, США). Все образцы тестировались в трех параллелях. Полученные относительные количества продуктов для NGF и BDNF нормализовали по относительному количеству продукта для β-актина.
Данные экспериментов представлены на фиг.4. Полученные результаты свидетельствуют о существенной стимуляции экспрессии генов NGF (примерно в 5 раз) и BDNF (примерно в 8 раз) под действием данного пептида в первичных культурах глиальных клеток.
Литература
1. Freshney R. // Culture of Animal Cells: a Manual of Basic Technique. New-York: Wiley-Liss, 1994.-486 p.
2. Hefti F., Hartikka J. and J. S.-R. / In: A Dissection and Tissue Culture Manual of the Nervous System. Eds.: A. Shahar and J. de Vellis. - New-York: Wiley-Liss, 1989. - P.172-182.
3. Cole R. and de Vellis J. / In: A Dissection and Tissue Culture Manual of the Nervous System. Eds.: A. Shahar and J. de Vellis. - New-York: Wiley-Liss, 1989. - P.121-133.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СКРИНИНГА ФАРМАКОЛОГИЧЕСКИХ СОЕДИНЕНИЙ НА НЕЙРОПРОТЕКТОРНУЮ АКТИВНОСТЬ | 2009 |
|
RU2383615C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2251429C2 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией NGF для терапии нейродегенеративных заболеваний | 2023 |
|
RU2829363C1 |
| Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690498C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ТКАНЕВОЙ СТРУКТУРЫ СЕТЧАТКИ ГЛАЗА ЧЕЛОВЕКА | 2012 |
|
RU2486603C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690846C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2335296C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ЭМБРИОНАЛЬНЫХ НЕЙРОНОВ ЧЕЛОВЕКА ДЛЯ ЦИТОТРАНСФУЗИИ | 1998 |
|
RU2146932C1 |
| Способ оценки нейропротекторных свойств веществ in vitro и тест-система для его осуществления | 2016 |
|
RU2646446C1 |

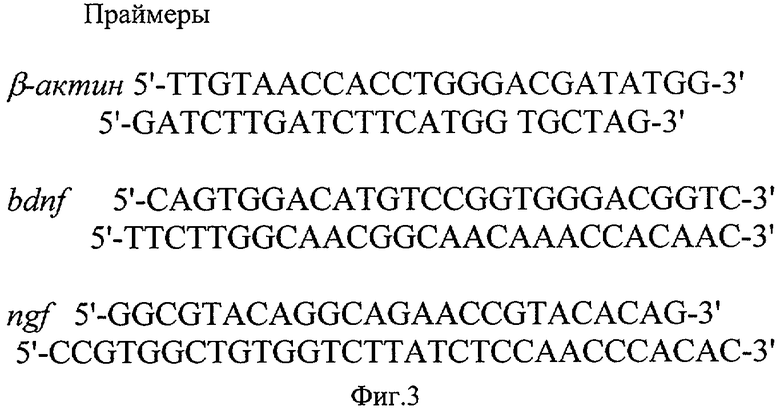

Изобретение относится к биотехнологии. Клетки глии выделяют, засеивают и культивируют клетки до образования монослоя. Затем клетки отбирают и промывают. Выделяют из них тотальную РНК, проводят обратную транскрипцию и амплификацию полученных кДНК. Проводят оценку экспрессии генов под действием тестируемого соединения. Изобретение позволяет ускорить скрининг соединений, а также осуществлять поиск новых соединений с наибольшей активностью, являющихся потенциальными нейропротекторами. 3 з.п. ф-лы, 1 табл., 4 ил.
1. Способ оценки экспрессии генов нейтрофинов под действием фармакологических соединений с нейропротекторной активностью, включающий выделение клеток глии, засев и культивирование клеток глии до образования монослоя, отбор и промывку клеток, выделение из них тотальной РНК, проведение обратной транскрипции, амплификацию полученных кДНК, оценку экспрессии генов под действием тестируемого соединения.
2. Способ по п.1, где тотальную РНК выделяли фенолхлороформной экстракцией.
3. Способ по п.1, где для удаления возможной примеси геномной ДНК образцы РНК растворяют в обработанной диэтилпирокарбонатом (DEPC) воде и инкубируют
1 ч при 37°С в присутствии ДНКазы, свободной от РНКаз.
4. Способ по п.1, где амплификацию полученных кДНК проводят, используя следующие праймеры и условия:
β-актин 5'-TTGTAACCACCTGGGACGATATGG-3'
5'-G ATCTTG ATCTTC ATGG TGCTAG-3'
94°C - 1 мин, 61°С - 1 мин, 72°С - 1 мин
bdnf 5'-CAGTGGACATGTCCGGTGGGACGGTC-3'
5'-TTCTTGGCAACGGCAACAAACCACAAC-3'
94°C - 1 мин, 72°С - 1 мин
ngf 5'-GGCGTACAGGCAGAACCGTACACAG-3'
5'-CCGTGGCTGTGGTCTTATCTCCAACCCACAC-3'
94°С - 1 мин, 72°С - 1 мин.
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА | 1997 |
|
RU2124365C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКОГО ИНСУЛЬТА И СПОСОБ ЛЕЧЕНИЯ | 2002 |
|
RU2251429C2 |
Авторы
Даты
2010-03-10—Публикация
2009-03-12—Подача