Область изобретения
Изобретение относится к области аналитических измерений и приборов, основанных на явлении электрохемилюминесценции. Особенно заявляемое устройство подходит для методов быстрой количественной диагностики вне пределов лаборатории, так называемый «анализ по месту лечения».
Область применения изобретения
В настоящее время существует общая потребность в быстрых, чувствительных и количественных диагностических технологиях. Подобные технологии представляют интерес для самых различных областей жизни, включая здравоохранение, исследование, сельское хозяйство, экологию, ветеринарию, а также некоторые области производства.
Улучшенная чувствительность, скорость, надежность, стабильность и низкие затраты на анализ - показатели, будучи достигнутыми в диагностических технологиях, могут найти применение и в других новых областях.
Очень высокая чувствительность может быть достигнута при помощи определенных диагностических устройств, но они, как правило, являются достаточно дорогими. С другой стороны, недорогие методы диагностики, такие как иммунохроматография, не отвечают определенным потребностям рынка. Любая технология, отвечающая запрашиваемым требованиям, займет важное место в будущей диагностике и будет иметь огромный рыночный потенциал.
На практике в диагностике существует ряд различных аналитических принципов: методы, основанные на радиоактивности, методы иммуноферментного анализа (ИФА), колориметрические методы и методы определения, основанные на флуоресценции и хемилюминесценции, включая анодную, а также индуцированную электронами высокой энергии или горячими электронами катодную электрохемилюминесценцию (ЭХЛ).
Электрохемилюминесценция (ЭХЛ), индуцированная электронами высокой энергии, детально описана в патенте US 6251690, Kulmala S., et al. Каждый из этих методов имеет свои особенности по отношению к таким параметрам, как чувствительность, надежность, стабильность, скорость и стоимость. В то же самое время различия в методах являются проявлением действия ограничений каких-то физических параметров или, с другой стороны, являются проявлением их преимуществ.
Так, основным недостатком применения метода, основанного на радиоактивных соединениях, с точки зрения безопасности и защиты окружающей среды, является то, что распад изотопа происходит в пределах определенного периода времени, приводя к дополнительным затратам на утилизацию радиоактивных отходов. Использование самых чувствительных методов диагностики ограничивается весьма сложной природой тестов и приборов и потребностями в экспертном выполнении анализов. Обычно сложность выполнения теста прямо пропорциональна стоимости приборов и теста. В контексте сложности приборов необходимо упомянуть анодный электрохемилюминесцентный прибор, который становится все более популярным. Инструмент представляет собой сложный лабораторный робот, в обращении с которым требуется компетентность, а сам процесс измерения является достаточно трудоемким (сложный подготовительный период, многократные промывки).
Все эти факторы увеличивают стоимость анализов, количество отходов и, следовательно, становятся практически невозможными для использования в небольших лабораториях, во врачебных кабинетах и т.д.
В целом, коммерчески выгодные методы основаны на принципах, где анализируемые вещества идентифицируют и измеряют в смесях так называемых меченых веществ. В измерениях, основанных на уникальных свойствах биологических молекул, как, например, в иммунохимическом методе анализа, определяемое вещество (Х) из смеси молекул может быть селективно отсорбировано твердой фазой, связанной с антителами, и далее связанные молекулы измеряют с другим меченым антителом, которое выборочно связывается с веществом (Х). Метка представляет собой радиоактивный изотоп, фермент, световое поглощение, флуоресцентные или фосфоресцирующие молекулы, определенные хелаты металлов, которые ковалентно связываются с антителом.
Альтернативно, очищенное вещество (Х) может быть промаркировано, и количество неизвестного немаркированного образца может быть измерено в реакции конкуренции. Определение ДНК и РНК также может быть основано на явлении селективного связывания (биоаффинность). Многие другие химические и биохимические анализы могут быть выполнены с использованием тех же самых принципов. Для того чтобы уменьшить стоимость и/или повысить точность измерений, в настоящее время существует тенденция измерения нескольких различных параметров образца одновременно. Одна из таких возможностей представляет собой использование флуоресцирующих или фосфоресцирующих (люминесцентных) меток при различных длинах волн и обладающих различной степенью продолжительности флуоресценции. Различные принципы измерения и методология, которые могут использоваться в иммунодиагностике, изложены в книге The Immunoassay Handbook, Edited by David Wild, Stockton Press Ltd., New York, 1994, on pages 1-618.
Известно, что наиболее пригодными для использования в качестве меток веществ являются органические соединения и хелаты металлов, возбуждение которых видимым светом или электрохимически приводит к образованию люминесценции, специфичной по отношению к метке. Эти методы являются очень чувствительными и подходящими для диагностических целей. Поскольку определяемая концентрация является экстремально низкой, существует также вероятность случайных нарушений измерений, таких как динамическое рассеяние или рассеяние на неоднородностях среды (Tyndall scattering), релеевское (Rayleigh) и рамановское (Raman) рассеяние могут нарушить использование флуоресценции среди других прочих вещей.
При измерении биологических соединений, после импульса возбуждения, почти всегда, без исключения, возникает быстро разряжающаяся фоновая флуоресценция. Фосфоресценция в растворе может быть использована только с хелатами ионов лантанида и специально синтезированными органическими соединениями. Недостаток методов возбуждения с фотолюминесцентными метками состоит в сложности приборов и высокой стоимости чувствительных оптических компонентов.
В целом, преимущество метода электрохемилюминесценции (ЭХЛ) состоит в низкой стоимости компонентов электрического возбуждения и в простоте строения оптических устройств. Если сравнивать с фотолюминесценцией, то можно избежать ряда существенных недостатков. Традиционные методы анодной электрохемилюминесценции с инертными металлическими электродами могут быть проведены с органическими люминофорами на относительно простых инструментах в безводных растворах. Между тем, в методах биоаффинности, в основном, используются водные растворы. Поскольку отобранные биологические образцы почти всегда хранятся в неорганических растворах, следовательно, система измерения должна работать в водных или по меньшей мере в мицеллярных водных условиях. Только весьма ограниченный ряд хелатов переходных металлов, используемых в качестве меток в анодной ЭХЛ, работает в водных или мицеллярных растворах.
До настоящего момента коммерчески наиболее используемым аналитическим методом являлся метод анодной ЭХЛ, применяющий производные хелата Ru(bpy)3 2+. Как известно из учебных изданий, мицеллярные композиции предрасположены к различным возмущающим эффектам, обусловленным неконтролируемой сложностью мицеллярного равновесия. Индуцируемая электронами высокой энергии или горячими электронами электрохемилюминесценция не зависит от мицелл и, таким образом, обладает множеством преимуществ перед анодной ЭХЛ. Этот метод может быть применен к иммунометодам и методам гибридизации ДНК (см., Blackburn, G., et al., 1991, Clin. Chem. 37: 1534-1539; Kenten, J., et al. 1992, Clin. Chem. 33: 873-879). Так, компания Roche Diagnostics Ltd использует магнитные частицы для переноса меченого вещества на золотой рабочий электрод в иммунологических исследованиях и в анализах ДНК или РНК (Massey; Richard J., et al. US 5746974; Leland; Jonathan K., et al. US 5705402). Между тем, использование магнитных латексных частиц во многих отношениях является достаточно сложным, и поэтому этот метод пригоден только для дорогостоящих лабораторных автоматических устройств (например, Elecsys 1010 и 2010), имеющих сложную и точную систему подачи жидкостей. Кроме того, массивный рабочий золотой электрод требует длительной очистки и предварительной обработки перед каждым анализом (Elecsys Service Manual, p.70).
Единственным недостатком метода ЭХЛ, индуцируемого электронами высокой энергии, является необходимость в длительной инкубации взаимодействующих молекул для установления их равновесия, которое необходимо для оптимизации аналитической точности в исследованиях биоаффинности. Согласно настоящему изобретению существенное усовершенствование функционирования прибора может быть достигнуто в результате установки тонкой пористой пленки на рабочем электроде, далее обозначенного как CIPF (сокращенное английское название)-устройство, описываемое в пунктах патентной формулы.
Краткое описание чертежей
Фиг.1. Схематическое изображение прибора, состоящего из проводника, изолятора и пористого слоя согласно изобретению. Электродная структура может состоять из проводника (1), изолятора (2) и пористой пленки (3). Структура обозначена как CIPF-прибор.
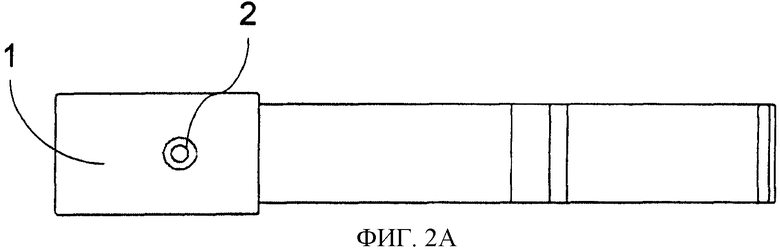
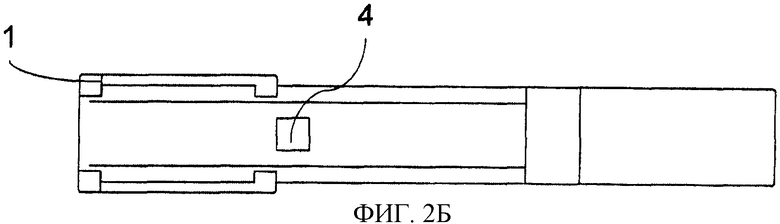
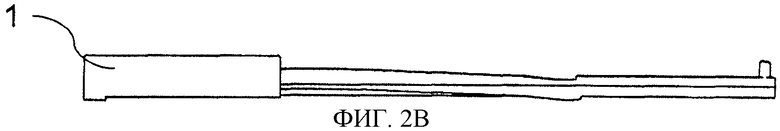
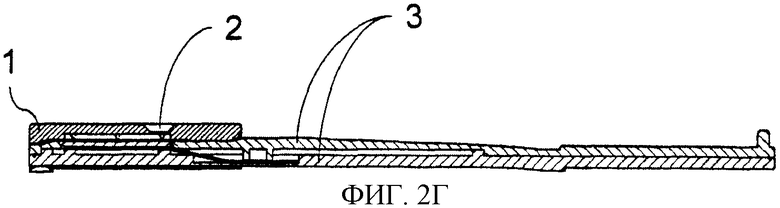
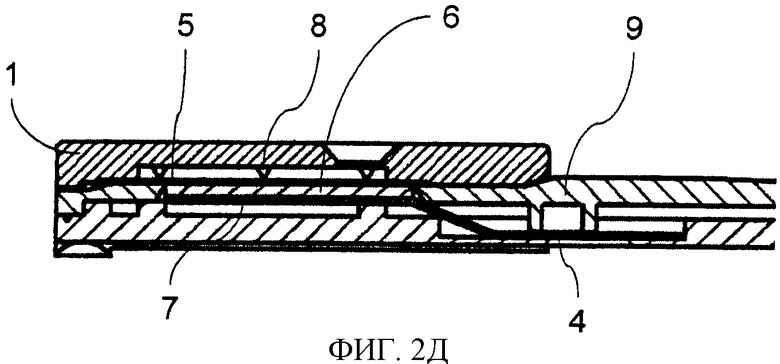
Фиг.2. Способ конструирования тест-стрипа для считывающего устройства катодной ЭХЛ согласно принципу CIPF-прибора. Электроны высокой энергии вводят посредством кремниевого (Si) чипа, покрытого изоляторной пленкой. Изображение также демонстрирует пористую пленку, прикрепленную к крышке, скользящей сверху. Структура выдвижной крышки и тест-стрипа сконструированы таким образом, чтобы в нижнем положении пористая пленка была присоединена к поверхности кремниевого (Si) чипа. Когда крышка скользит вверх, пористая пленка поднимается с поверхности катода и опять устанавливается напротив рычага (консоли) в верхнем положении. Фиг.2 также представляет образец структуры тест-стрипа. Тест-стрип состоит из подвижной крышки (1), которая при движении вдоль рукоятки (3) поднимается (9) и закрывается в самом конце рукоятки. Анализируемый образец наносят через отверстие (2). Под отверстием находится пористая пленка, которая располагается напротив кремниевого электрода (6) с острыми выступами (8). Ниже силикона находится металлический проводник (7), который посредством соединения (4) подключается к внешнему источнику тока.
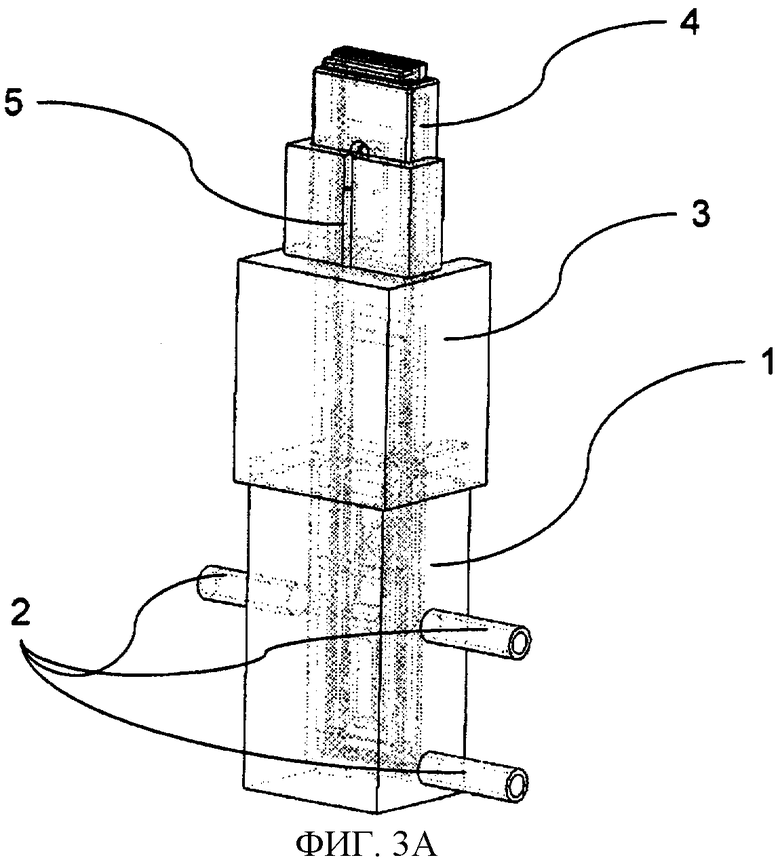
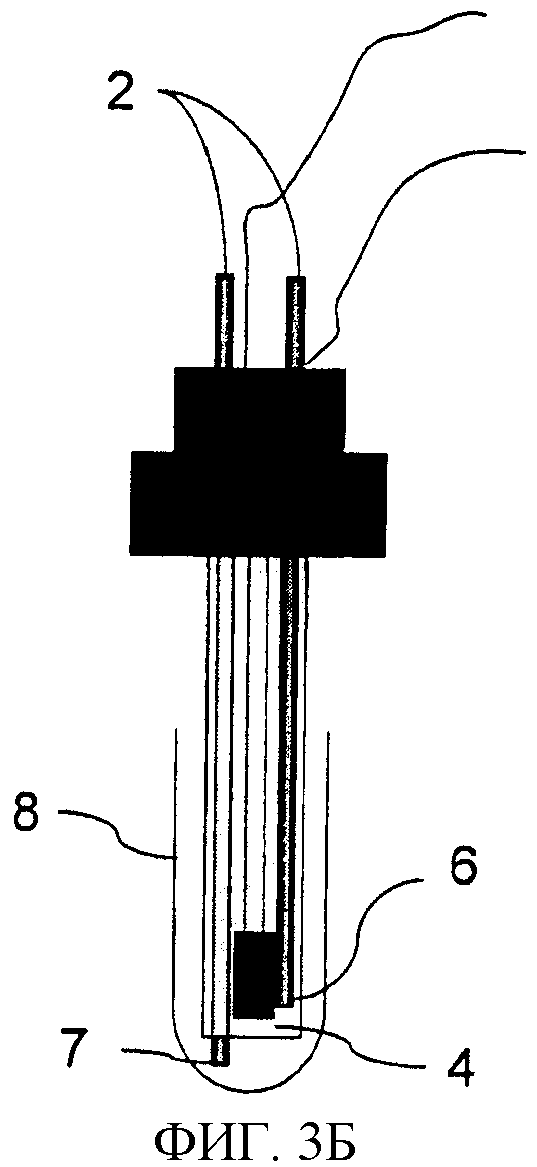
Фиг.3. Структура измерительной ячейки люминесцентного считывающего устройства. Фиг.3А. Тест-стрип (4) в ячейке (1) находится в позиции измерения. Вибрирующий движок (3) подсоединен к внешней стороне ячейки, куда также включен контакт тест-стрипа для электрического возбуждения. Фиг.3Б представляет устройство измерительной ячейки (8), предназначенной для однократного использования. Через соединительные элементы (2) происходит промывка. Промывающий или измеряющий раствор подается в измерительный модуль через токопроводящую стальную трубку (6), которая работает в качестве анода. Отсасывание раствора осуществляется при помощи другой трубки (7). Электрический контакт тестовой пластины (4) находится в верхней части пластины.
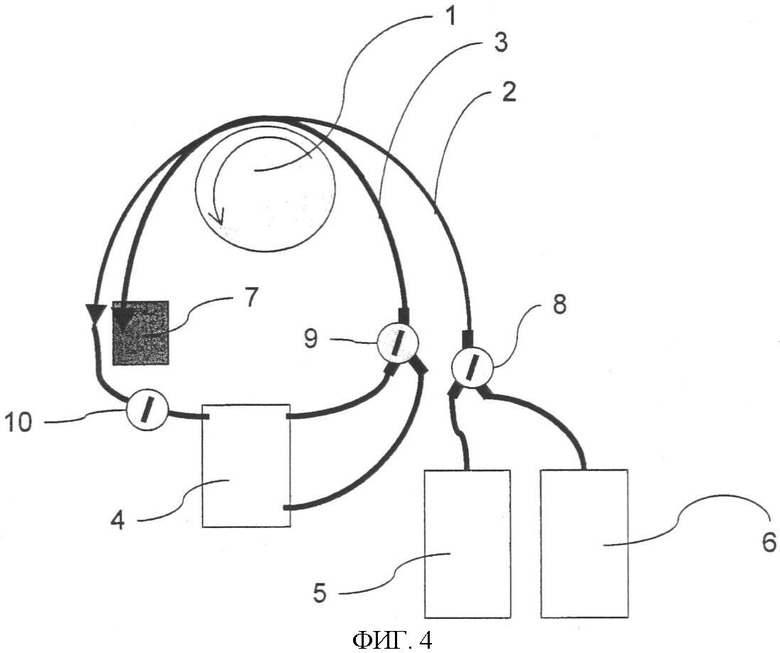
Фиг.4. Блок промывной установки для измерительной ячейки. Перистальтический насос (1) подает промывной раствор по трубкам (2) в ячейку (4). Тот же перистальтический насос с большей эффективностью отсасывает жидкость из верхней части ячейки по другим трубкам (3). Клапан (9) удаляет аспирацию из нижней или верхней части ячейки. Когда клапан (10) тонких трубок закрыт, отвод жидкости из ячейки может быть произведен из ее нижней части. Промывка модуля (6) осуществляется регулировкой клапана (8).
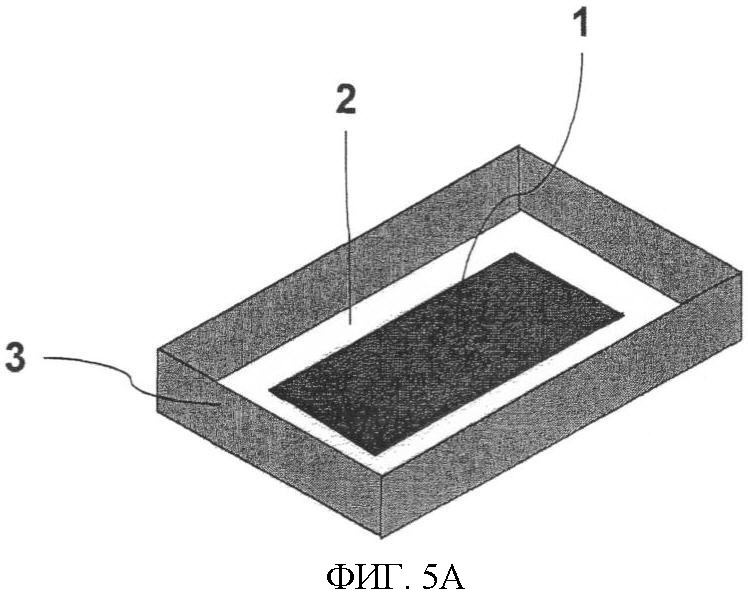
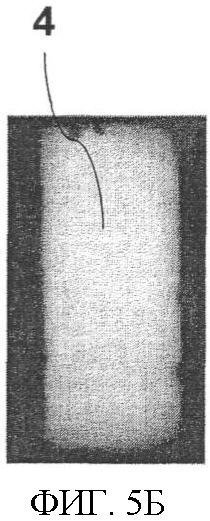
Фиг.5. Измерительная ячейка однократного применения, приспособленная для тест-стрипа. Фиг.5А: кремниевый электрод (1) подсоединен к проводящей рамке (3) с электроизоляционным материалом (2). Фиг.5Б демонстрирует, каким образом может быть получена люминесценция (4) со всей поверхности электрода.
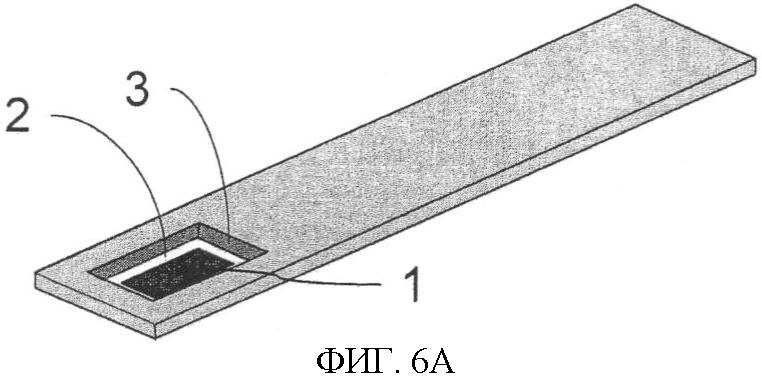
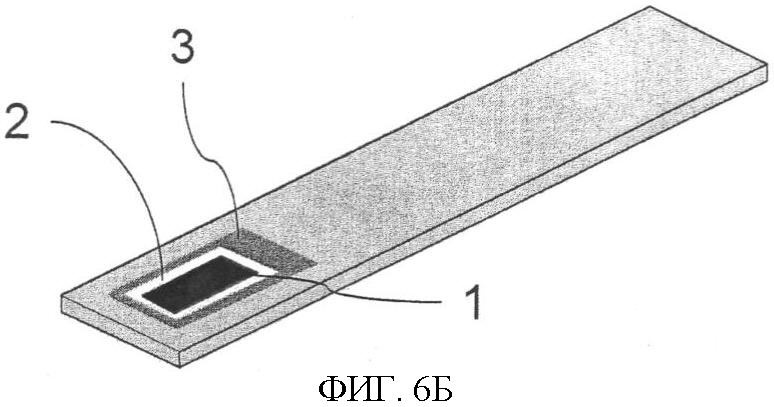
Фиг.6. Тест-стрип. Фиг.6А - тестовая пластина, вид сверху, и Фиг.6Б - тестовая пластина, вид снизу. Кремниевый электрод (1) с электроизоляционным материалом (2) устанавливается в тест-стрипе. Со стороны задней стенки тест-стрипа устанавливается прямой электрический контакт к катоду (1) и аноду (3).
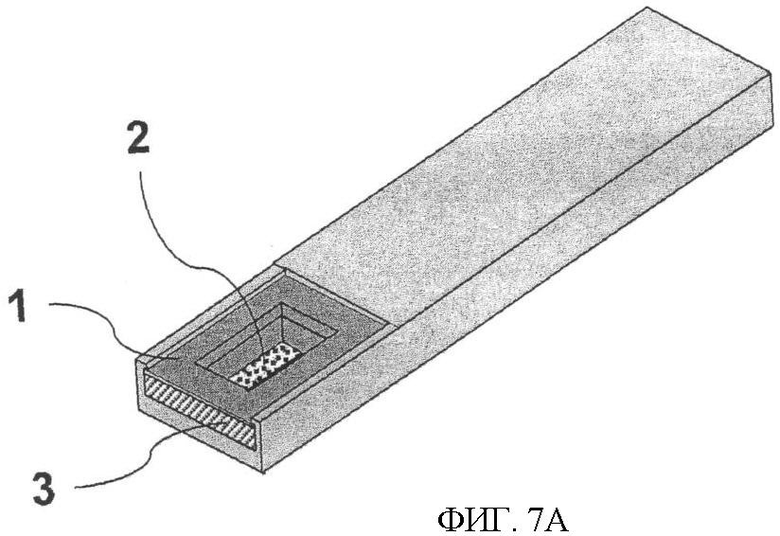
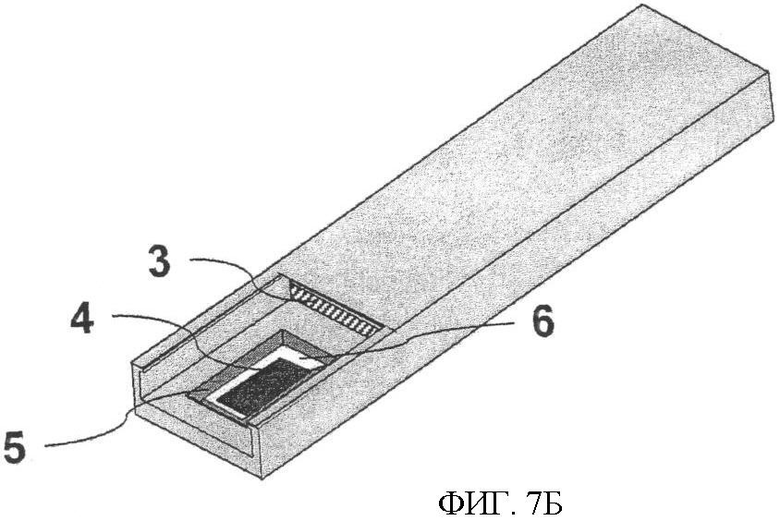
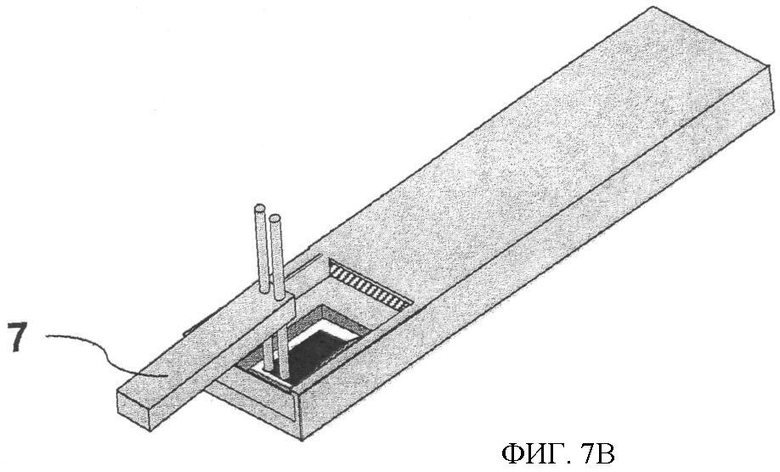
Фиг.7. Тест-стрип, где все необходимые реагенты находятся в высушенном состоянии, начало и конец реакции происходит под контролем. Фиг.7А представляет готовый к применению тест-стрип. В нижней части рамки (1) находится тонкая пористая пленка (2), содержащая все необходимые реагенты в высушенном состоянии. Пористая пленка, не прикасаясь к электроду, лежит на кремниевой поверхности. Ниже рамки вставлена конструкция из гибкого материала (3), действующая подобно пружине. Образец, нанесенный на пористую пленку (2), растворяет высушенные реагенты. Смещая рамку вниз, на силиконовом электроде начинается реакция, где пористая пленка устанавливается поверх силикона, а анализируемый образец растекается по поверхности пленки. После определенного времени реакцию останавливают поднятием рамки (1) вверх. Фиг.7Б - рамка (1, 3) опущена в тест-стрип после фиксированного времени реакции. Силиконовый электрод (4) присоединен к тест-стрипу посредством электроизоляционного материала (6), а анод (5) в то же самое время выполняет роль барьера для жидкости. Фиг.7 В - тест-стрип на стадии промывки. Посредством рукоятки (7) силиконовый электрод промывают до измерений ЭХЛ, если в этом есть необходимость.
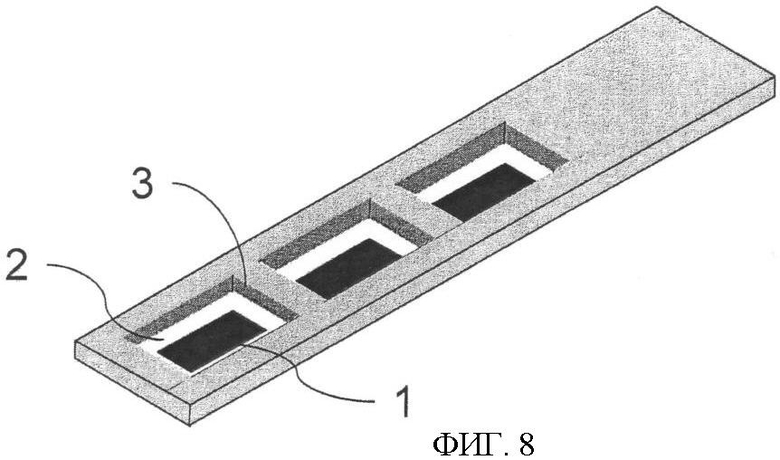
Фиг.8. Мультипараметрическая модель тест-стрипа. В конструкцию тест-стрипа может быть включено несколько зон реакции, которые могут работать в качестве позитивных и негативных контролей.
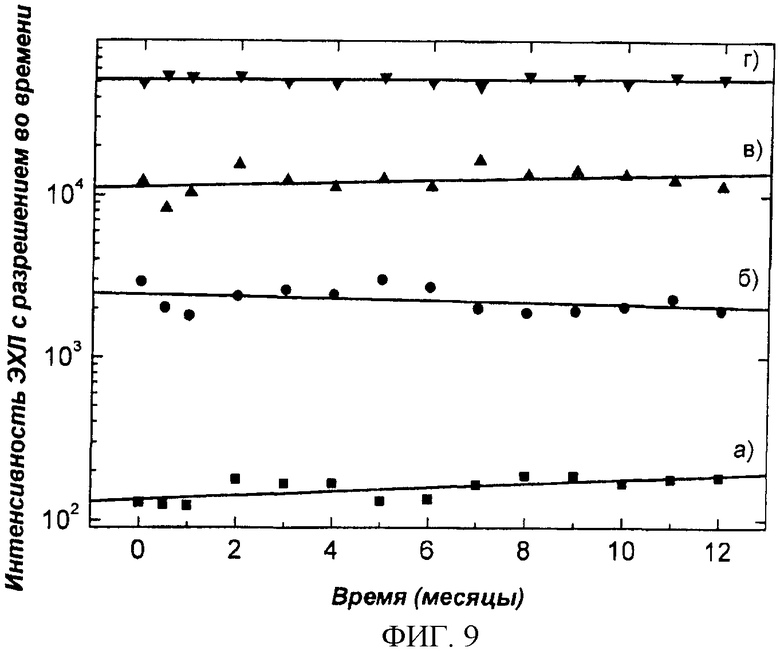
Фиг.9. Определение стабильности работы силиконовых чипов в течение года эксплуатации. Определение было проведено посредством гетерогенного иммунологического анализа на CIPF-приборе с люминесцентным считывающим устройством. В качестве образца для измерений использовали СРВ (С-реактивный белок), с концентрациями (a) 0, (б) 10, (в) 30 и (г) 100 нг/мл.
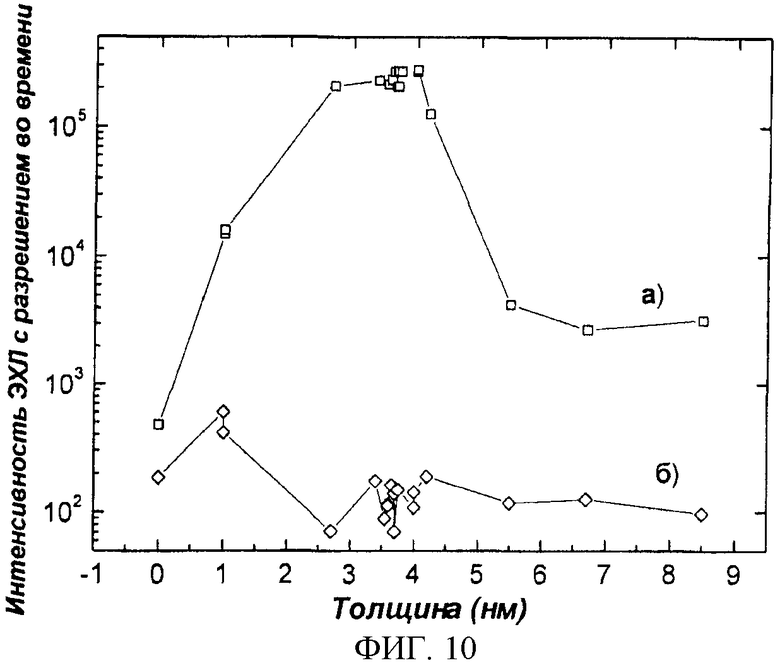
Фиг.10. Влияние толщины (нм) оксидного слоя силиконового чипа на интенсивность ЭХЛ, a) 10-7 M Tb(III) 2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол хелат; (б) контрольный раствор (используемый буфер).
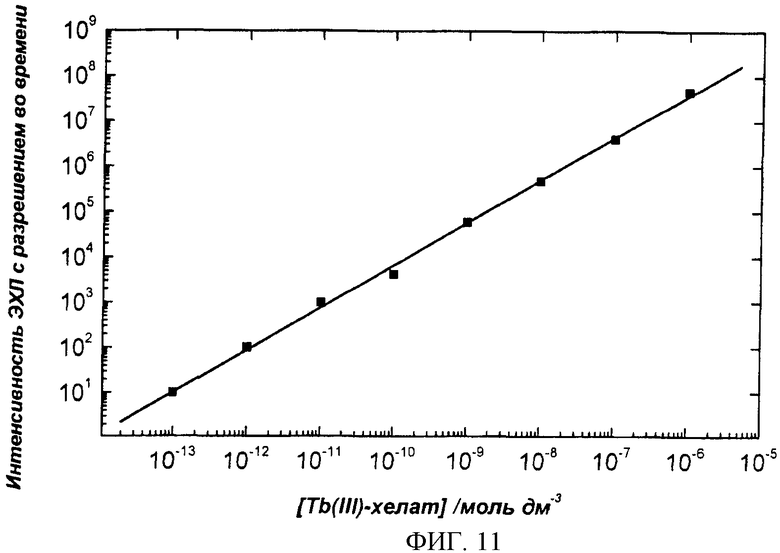
Фиг.11. Калибровочная кривая люминофорной метки, хелата тербия (Tb(III) 2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол). Измерения проводили на CIPF-устройстве с люминесцентным считывающим устройством.
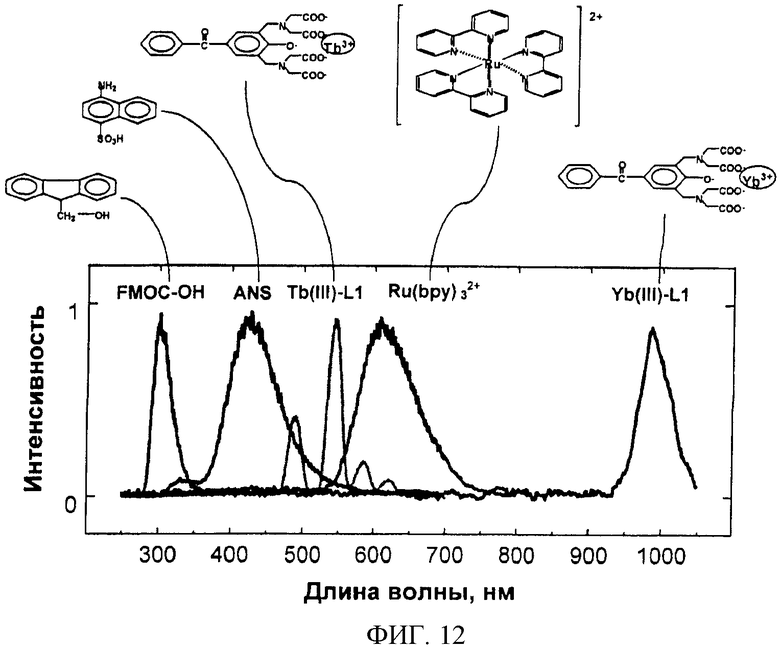
Фиг.12. Структура и спектр ЭХЛ различных люминофоров, пригодных для метки антител (ANS=4-амино-1-нафталинсульфонат, FMOC-OH=гидролизованный 9-флуоренилметилхлороформиат, хелат Tb(III)-L1=Tb(III)-2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол, хелат Ru(bpy)32+=Ru(II)-трис-(2,2'-бипиридин), хелат Yb(III)-L1=Yb(III)-2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол). Измерения проводили на CIPF-устройстве с люминесцентным считывающим устройством. Был сделан вывод, что во всех областях спектра (ультрафиолетовая, видимая и инфракрасная) исследованные метки являются эффективными.
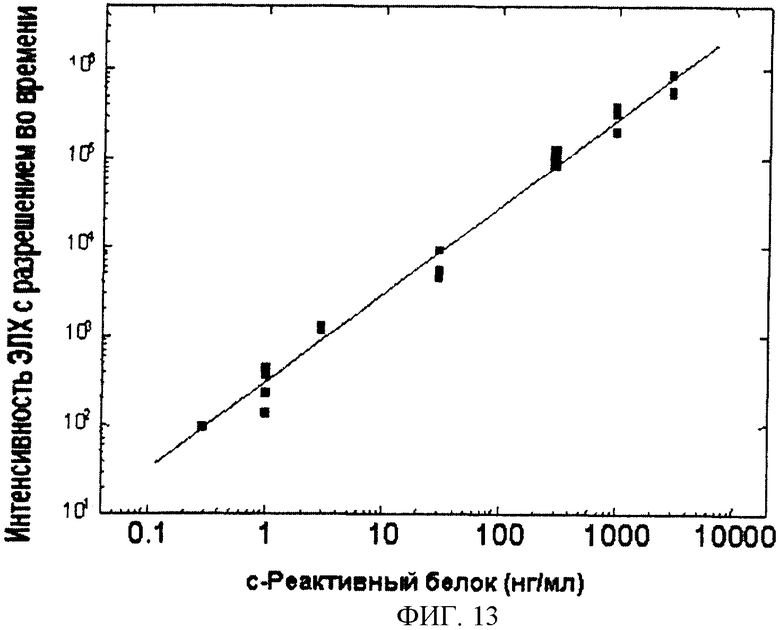
Фиг.13. Калибровочная кривая гетерогенного иммунологического анализа чСРБ (человеческий с-реактивный белок), в качестве измеряемого образца использовали растворы чистого чСРБ, (см. пример 2).
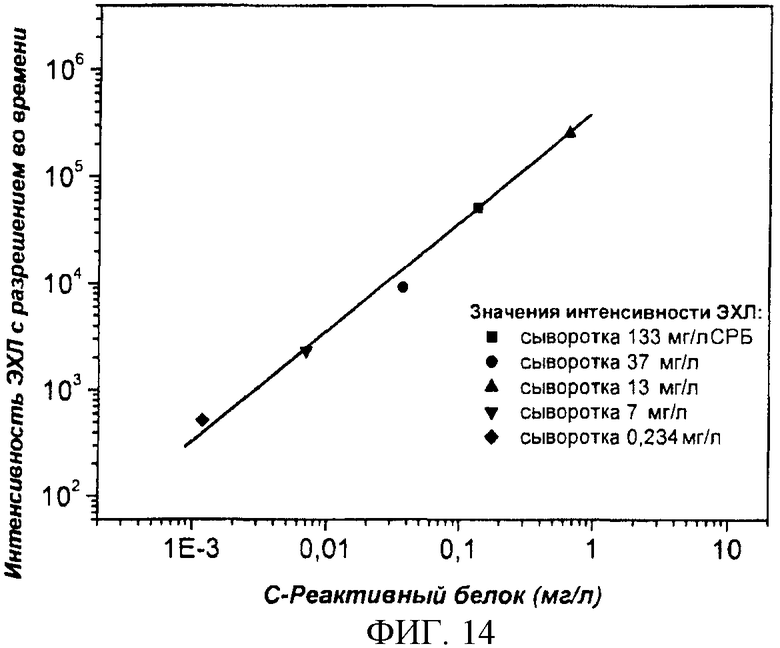
Фиг.14. Гетерогенный иммунологический анализ чСРБ, определение чСРБ проводили в образцах сыворотки (см. пример 3).
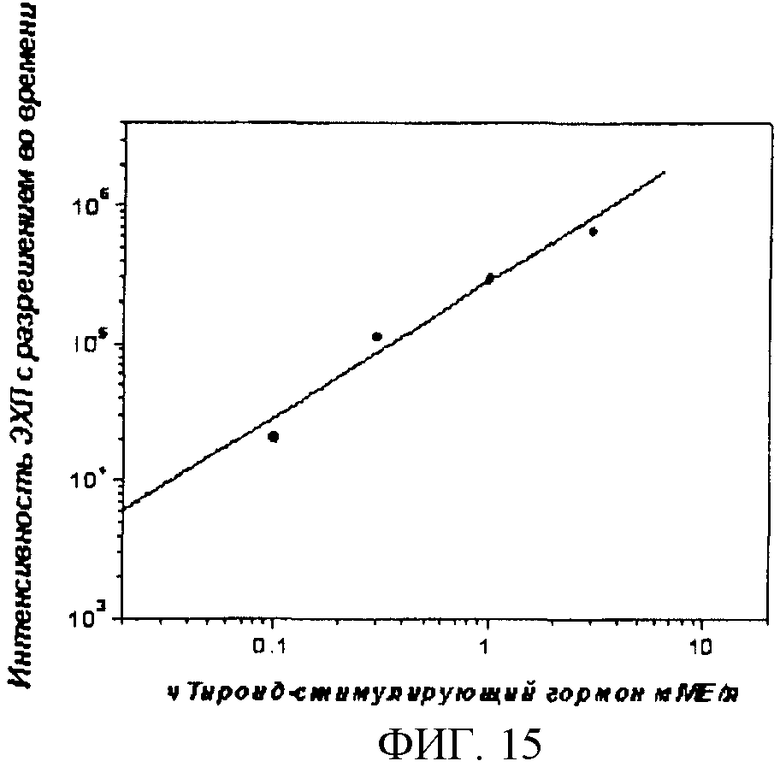
Фиг.15. Гомогенный иммунологический анализ чСРБ, в качестве анализируемого образца использовали растворы чистого чСРБ (см. пример 4).
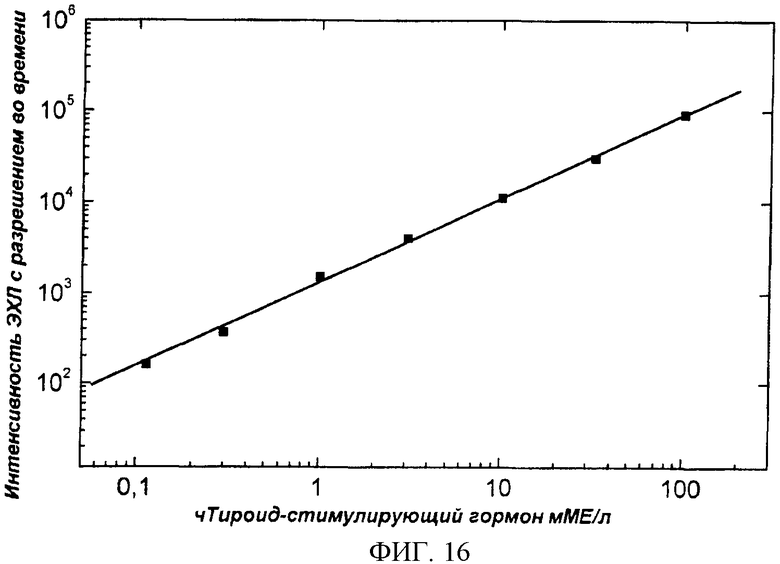
Фиг.16. Калибровочная кривая гетерогенного иммунологического анализа чТСГ (человеческий тироид-стимулирующий гормон), в качестве анализируемого образца использовали стандартные растворы чистого чТСГ (см. пример 5).
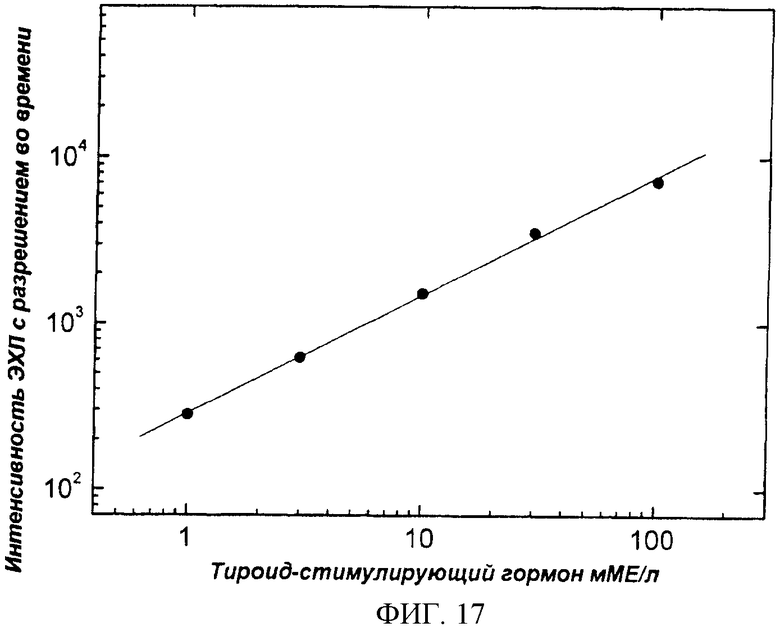
Фиг.17. Калибровочная кривая гетерогенного иммунологического анализа чТСГ в образцах сыворотки. В качестве стандартов использовали растворы чТСГ, приготовленные в сыворотке (см. пример 6).
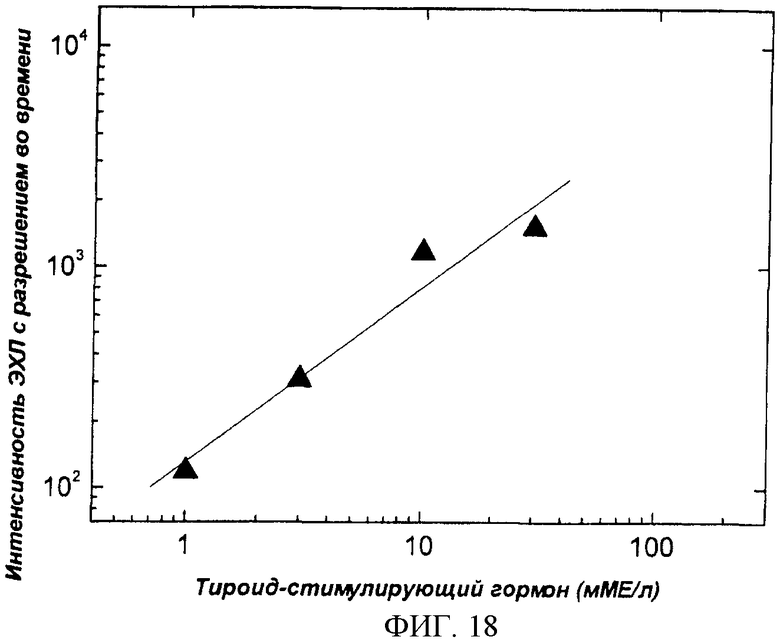
Фиг.18. Калибровочная кривая гетерогенного иммунологического анализа чТСГ. В качестве анализируемого образца использовали стандартные растворы чТСГ, приготовленные в гепанизированной цельной крови (см. пример 7). Измерения были проведены на CIPF-устройстве с люминесцентным считывающим устройством (см. фиг.9., пример 2).
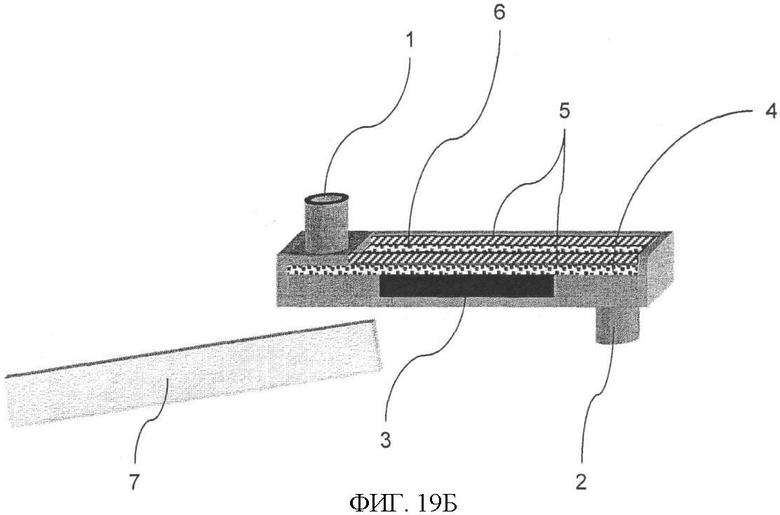
Фиг.19А демонстрирует применение проточной кюветы CIPF-устройства, где основанная на аффинности реакция может быть проведена на поверхности пористой пленки или на силиконовом катоде. Фиг.19Б: для более наглядного представления о приборе, одна часть (7) конструкции отсутствует (она изображена в отсоединенном состоянии). Пористая пленка (4) осуществляет перенос жидкости, более того, на ней могут быть высушены жидкие реагенты, например меченые антитела. Измерения ЭХЛ могут быть проведены непосредственно через пористую пленку (4). Образец наносят на поверхность пористой пленки, где начинается иммунореакция. В ячейку (6) вносят достаточное количество жидкости, необходимое для создания электролитического контакта между анодом (5) и силиконовым электродом (3). Промывка пористой пленки осуществляется через ввод жидкости (1) и отвод (2). Камера (6) может быть покрыта сверху крышкой с отверстием для внесения образцов.
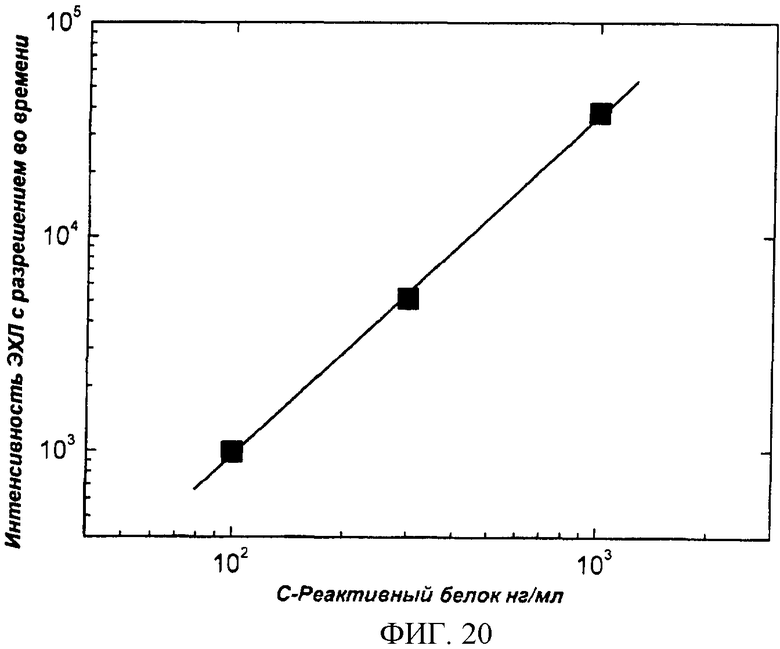
Фиг.20. Характерная калибровочная кривая гетерогенного иммунологического метода, измеряемым образцом являлся чСРБ (см. пример 8).
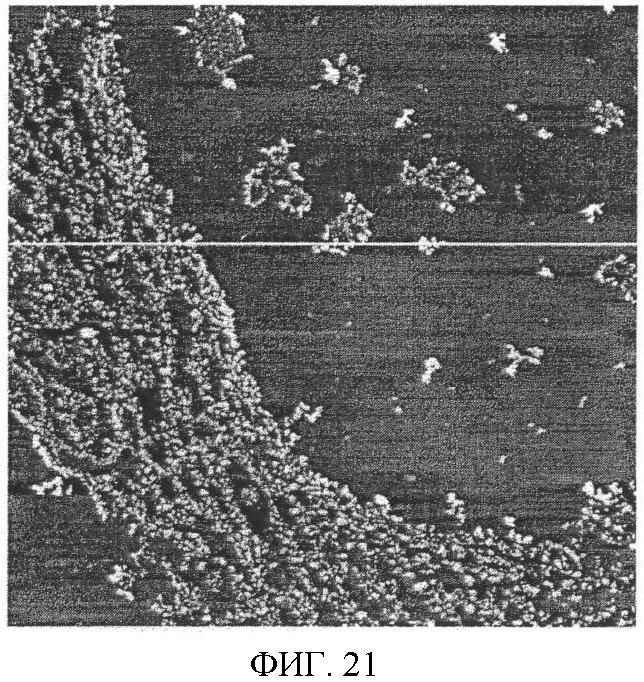
Фиг.21. Изображение контроля качества микрорельефа поверхности силиконового чипа после физической адсорбции антител, полученного методом атомно-силовой микроскопии.
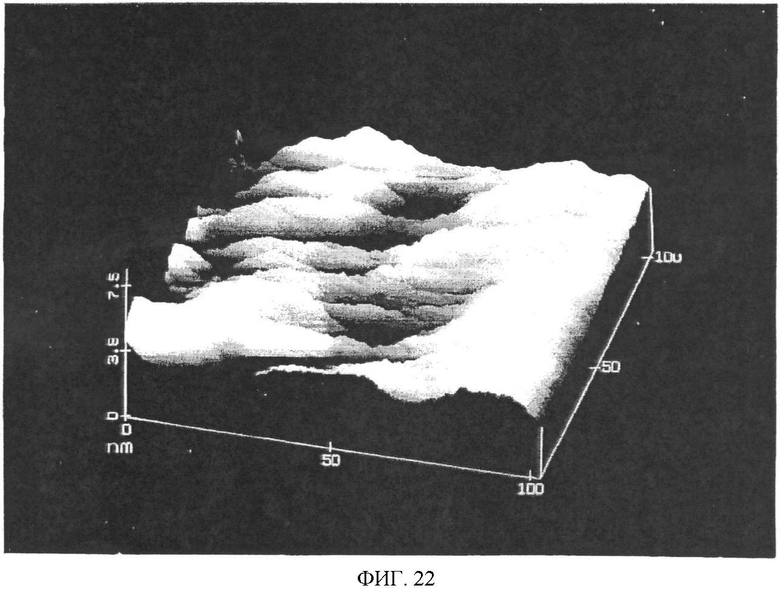
Фиг.22. Изображение микрорельефа поверхности полистирола, полученного методом атомно-силовой микроскопии. Шероховатость поверхности препятствует эффективному использованию метода атомно-силовой микроскопии в исследовании рельефа оболочки (см. пример 10).
Подробное описание изобретения
Согласно настоящему изобретению различные виды анализов могут быть выполнены одинаково хорошо как на простых и недорогих приборах, так и на сложных устройствах, описанных выше. Всякий раз, когда возникает необходимость в иммунологических исследованиях или в анализах ДНК, то они могут быть выполнены на CIPF-приборе. Более того, измеряющий прибор и измерительная ячейка заявляемого устройства являются достаточно дешевыми, что делает возможным его использование для проведения анализов вне стен лаборатории.
В этом изобретении пористая пленка представляет собой пористую проницаемую для жидкостей пленку с толщиной меньше 100 мкм, которая покрывает сверху ЭХЛ катод. Катодная ЭХЛ, отличная от анодной ЭХЛ, функционирует иначе, если сравнивать с общепринятой электрохимией, т.к. катод несет на своей поверхности тонкую изолирующую мембрану согласно патенту US 6645776 B (Kulmala et al.). Пористая пленка находится поверх изолирующей мембраны описываемого катода. Следовательно, согласно данному изобретению электрод содержит как минимум две пленки, одна из которых представляет собой изоляционную непроводящую электричество пленку, а сверху находится пористая пленка, толщина которой меньше 100 мкм. Пористая пленка является проводником электричества и, таким образом, отличается от вышеописанной изоляционной пленки, кроме того, отличается от материала электрода, описанного в патенте US 6645776 B. Ранее в анодной ЭХЛ применяли (US 4280815 A, Technicon; 5324457 A, Univ Texas Instruments; 6090545 A, Meso Scale Technologies) различные пористые материалы как для изготовления самого электрода, так и для его покрытия. Между тем пористый материл, рассматриваемый в данном изобретении, не является аналогом такового, описанного в вышеуказанном изобретении. Поскольку действие катодной ЭХЛ основано на других электрохимических принципах (одно из отличий: расстояние от электрода до зоны возбуждения), если сравнивать с анодной ЭХЛ, то в данном изобретении пористая пленка не работает в качестве электрода. Сравнивая с уже известными техническими решениями в данной области, расположение пористой пленки поверх электрода открывает новые неожиданные эксплутационные возможности прибора. Более того, посредством пористой пленки можно быстро и равномерно нанести образец на катод.
Настоящее изобретение в контексте катодной ЭХЛ раскрывает сущность работы (CIPF)-прибора, который включает в себя проводник, изолятор и пористую пленку. Для проведения анализов на этом устройстве могут быть использованы самые различные типы меток, как это было проиллюстрировано на фиг.8. Фиг.1 демонстрирует принцип работы CIPF-прибора. Прибор вводят в действие путем нанесения жидкого образца или буфера на поверхность пористой пленки для достижения жидкостного контакта, откуда образец или буфер распространяется на всей рабочей поверхности электрода. Было обнаружено, что прибор в равной степени может работать в качестве устройства для экспресс-иммуноанализа. Неожиданно было обнаружено, что метки могли быть активизированы на расстоянии до 100 мкм. Согласно заявляемому изобретению могут быть изготовлены недорогие, одноразовые CIPF-приборы, сенсоры и зонды, а также традиционные рабочие электроды могут быть заменены на одноразовые рабочие электроды. Тогда этапы промывки и уравновешивания, обычно требующие совершенной робототехники, могут быть устранены.
Данное изобретение представляет собой значительный вклад в усовершенствование уже существующих приборов и методов, которые получили общее название «анализ по месту лечения» (от английского Point-of-care-testing), делая возможным изготовление дешевых количественных экспресс-тестов, что было достигнуто путем соединения механизма ЭХЛ и принципа измерения, используя различные тонкие пористые пленки.
Известно, что различные пористые материалы могут быть использованы для переноса и фильтрования жидкостей в методах, основанных на иммунохроматографии (Hybritech Inc., см. Clinical Chemistry 31 (1985) 1427). Между тем эти методы, принцип действия которых полностью отличается от методов традиционной электрохимии, не являются количественными и не используются в контексте катодной ЭХЛ.
В микрофлюидальных системах или в методах, использующих микрообъемы, часто возникают проблемы, причинами которых являются различные физические явления: появление пузырьков воздуха, вредное воздействие тепловой диффузии, ламинарное движение, т.е. расслаивание жидкостей в пределах потока, а также поверхностное натяжение, вызываемое капиллярными явлениями. В данном изобретении наглядно продемонстрирован новый способ применения тонкой пористой пленки не только для целей фильтрования, но и как устройство для гомогенного равномерного распределения жидкости, что довольно просто можно сделать на гладких силиконовых электродах ЭХЛ, индуцируемой электронами. Более того, CIPF-устройство значительно упрощает подготовку образцов цельной крови и процедуру манипулирования при выполнении анализов на ЭХЛ оборудовании. Применение пористых пленок может полностью устранить или значительно сократить недостатки, существующие в подобных микрофлюидальных устройствах.
Изобретение описывает устройство, предназначенное для распределения анализируемых веществ и других реагентов на поверхности ЭХЛ рабочего электрода, где рабочий элемент электрода может быть использован в качестве приспособления для экспресс-тестов, основанных на иммунометодах и методах исследования ДНК.
Цель изобретения была достигнута посредством использования CIPF-прибора, в конструкцию которого была включена тонкая пористая пленка с толщиной менее 100 мкм в качестве гомогенизирующего эквалайзера потока жидкости и распределителя жидкости в микропроточных ячейках в методах биоаффинности, основанных на ЭХЛ, в отношении чего все характерные особенности изложены в пунктах формулы изобретения 1-10. В большей степени данное изобретение сосредоточено на тех методах и приборах, посредством которых катодная электрохемилюминесценция может быть произведена на практике. Еще одной характерной особенностью данного изобретения является то, что катодное возбуждение происходит в непосредственной близости от электрода. Присутствующая пористая пленка может быть установлена достаточно плотно к электроду, что невозможно сделать в случае других методов обнаружения. В качестве альтернативы, пористая пленка может быть смещена к электроду, для того чтобы запустить реакцию биоаффинности, а позже удалена до проведения измерений ЭХЛ. Между тем измерение может быть выполнено непосредственно и через некоторые пористые пленки. Метка может быть высушена на поверхности рабочего электрода или на пористой пленке, расположенной на электроде. Жидкостный контакт между пористой пленкой и рабочим электродом составляет меньше 100 мкм. Известно (но не в контексте применения для электрохемилюминесценции), что пористая пленка может быть присоединена к поверхностям либо путем образования ковалентных связей, или посредством адсорбции, подобные методы использовались, например, при изготовлении продукции компании Schleicher & Schuell Ltd.
Основной конструкцией данного изобретения является ЭХЛ рабочий электрод, изготовленный из токопроводящего материала, предпочтительнее всего из плоского силикона, который после этапа окисления покрывают тонкой изоляционной пленкой из алюминия или силикона в соответствии с патентом US 6251690 (Kulmala et al.). Толщина изоляционной пленки составляет 1-10 нм, предпочтительнее, чтобы толщина была 3-4 нм. Между тем силикон для изготовления электрода может быть рифленым или, в противном случае, морфология поверхности может быть модифицирована, для того чтобы улучшить жидкостный поток или его электрические характеристики. Размер силиконового чипа может варьироваться в зависимости от предполагаемого использования, предназначается ли это для измерения одного или нескольких образцов. Обычно размер силиконового чипа составляет 4×9 мм и толщина менее 1 мм. Силиконовый чип присоединяется к опорной структуре, чья форма, размер и материал, из которого она будет изготовлена, зависят от эксплуатационных требований используемого на тот момент измерительного прибора. Обычно опорную конструкцию изготавливают из пластмассы, которая является безвредной для окружающей среды и легко утилизируется. Силиконовый чип, находящийся на поверхности поддерживающей конструкции, покрывают пористой пленкой во влажном или сухом виде в зависимости от ее свойств.
Еще одной отличительной особенностью данного изобретения является то, что пористые пленки, которые покрывают поверхность электрода, являются микропористыми, и их толщина составляет менее 100 мкм. Исходные материалы для изготовления пленок являются коммерчески доступными из таких источников, как Millipore, MSI, Sartorius, Pall, Sigma и DuPont. Пористые пленки могут быть изотропными либо анизотропными. Технология их производства варьируется, и она может включать этапы сжатия или растяжения, поры могут быть изготовлены химическими или физическими способами, или, в случае анизотропных пористых пленок, посредством фазового перехода, также может быть использована агломерация микрочастиц. Выбор подходящего материала для пористых пленок достаточно широк и не ограничивается лишь политетрафторэтиленом, поливинилиденфтором, поликарбонатом, полисульфоном, нейлоном и эфирами целлюлозы. Подобные пленки и ряд других с различными размерами пор и толщины, с различными физико-химическими свойствами являются коммерчески доступными. Другими подходящими материалами для изготовления пористых пленок являются волокнистые композиции, такие как стекловолокно, фильтровальная бумага, тканевый фильтр.
Применение пористых пленок в CIPF-приборе дает существенное преимущество, если сравнивать с уже известными приборами, использующими методы биоаффинности. Посредством пористых пленок образцы могут быть нанесены равномерно, непосредственно на поверхность электрода, покрытого антителами. Пористая пленка может работать в качестве гомогенизирующего выравнивателя потоков жидкости, препятствовать: формированию пузырьков воздуха в микрофлюидальных системах (особая проблема для ЭХЛ), диффузии тепла, появлению нежелательных эффектов поверхностного натяжения и ламинарного течения и, таким образом, способна восстанавливать равновесие в микрофлюидальных микропроточных ячейках или в микрослойных ячейках.
В случае, когда пористая пленка является достаточно тонкой, менее 100 мкм в методах биоаффинности, основанных на ЭХЛ, реагирующие компоненты могут быть нанесены на пористую пленку, расположенную на электроде так, что пористая пленка вступает в жидкостной контакт с поверхностью электрода. В соответствии с заявляемым изобретением импульс возбуждения, исходящий от электрода, может активизировать молекулы метки в пористой пленке на значительно большем расстоянии, чем это предполагалось до сих пор (см. US 6251690, Kulmala S., et al.), т.е. в пористой пленке с толщиной до 100 мкм.
Поверхность электрода может быть покрыта антителами или молекулами ДНК, а присоединенные меченые молекулы активизируются под воздействием электрических импульсов. В случае пористой пленки, используемой для нанесения образцов и реагентов, она может быть удалена всякий раз, когда это необходимо или до начала измерений.
Образцы пациентов (плазма, сыворотка, цельная кровь, церебральная жидкость, моча и т.д.) также могут быть нанесены непосредственно на поверхность пористой пленки, высушены и, таким образом, законсервированы. Это одно из главных преимуществ заявляемого изобретения, которое позволит, например, упростить транспортировку образцов. В то же самое время, пористая пленка, содержащая образец, может быть вставлена в прибор с тем, чтобы быть функциональной частью CIPF-прибора, и концентрация образца будет измерена согласно заявляемому способу.
Поверхность электрода или пористой пленки, установленной вплотную к электроду, может быть покрыта посредством ранее известных методов активными антителами или антигенами высокой плотности. В соответствии с заявляемым изобретением электроды или поверхность пленки, устанавливаемой вплотную к электроду, могут быть покрыты пленкой Ленгмюра-Блоджетта (см. примеры).
Предпочтительнее в целях эффективного использования хранить CIPF приборы в сухом виде. В функциональное состояние приборы приводят, добавляя жидкий образец или буфер на поверхность пористой пленки и, таким образом, запуская реакцию биоаффинности между пористой пленкой и электродом.
В структуру CIPF-прибора, описываемого в настоящем изобретении, помимо опорной структуры, пористой пленки и электрода (CIPF) могут быть включены защитный экран и другие части, делающие прибор более практичным в использовании. Если анализируемое вещество находится в цельной крови, удаление кровяных клеток может быть выполнено при помощи специальных пористых пленок, как это было продемонстрировано в примерах. В состав прибора в соответствии с изобретением также входит электросоединение от рабочего электрода к механизмам возбуждения электронов и измерения люминесценции. Типичным для CIPF-прибора является то, что большое количество приборов может быть произведено на автоматизированной линии. Технология производства отдельных индивидуальных компонентов прибора и их монтаж, в основном, являются известными из предыдущего опыта производства подобных приборов.
Для изготовления электродов заявляемого прибора, в основном, использовали материалы с гладкой поверхностью. Очень важным для функционирования CIPF устройства является качество биоаффинных материалов, покрывающих электрод. Контроль их качества может быть основан непосредственно на предельно точном принципе туннелирования или/и атомарно-силовой микроскопии, например, может быть напрямую проанализировано покрытие из активных антител, что практически неосуществимо другими диагностическими методами, и, следовательно, возможность контроля качества в заявляемом изобретении имеет огромное значение, более того, подобным образом самые основные критерии качества диагностических методов будут выполнены. Качество обычного используемого покрытия из полистерена с нанесенными антителами не может быть проанализировано таким способом контроля, т.к. поверхность полистерена после литьевого формования является весьма неровной, чтобы провести идентификацию молекул на поверхности материала.
Быстрые количественные тесты, а также этапы, предшествующие определению, такие как предварительная обработка образцов цельной крови, могут быть значительно упрощены методами и приборами, заявляемыми в данном изобретении. Так, например, в заявляемом способе нет необходимости в обработке образцов цельной крови гепарином, предотвращающим ее свертывание. Пористая пленка с нанесенным анализируемым образцом также исключает контакт кровяных клеток с электродом, и, более того, пористая пленка с клетками крови может быть легко удалена, оставляя биоаффинно покрытый электрод экспонированным. Естественно, что обработанные гепарином образцы цельной крови также могут быть измерены на этом приборе и этим методом.
Рабочий электрод в катодной ЭХЛ (Аl, Si и т.д.) либо тонкая пористая пленка поверх рабочего электрода могут быть покрыты антителами. Если пористая пленка покрыта антителами/антигенами/РНК/ДНК, то измерения проводят без удаления пористой пленки, но если рабочий электрод покрыт анализируемым веществом, распознающим биомолекулы, то пористая пленка может быть удалена до начала этапа измерения ЭХЛ. В данном изобретении все измерения ЭХЛ предлагается предпочтительнее выполнять при помощи электрохемилюминесценции, активизируемой горячими электронами (US 6251690).
Согласно заявляемому изобретению существует несколько альтернативных подходов к использованию CIPF-приборов в зависимости от намеченного применения. Согласно данному изобретению существует типовой отдельный тест-стрип, куда вносят определяемое вещество. Пористая пленка распределяет образец на поверхности силиконового электрода, покрытого антителами. Образец растворяет меченые биоаффинные молекулы, высушенные на пористой пленке. Пористая пленка может быть прикреплена липкой лентой к скользящей крышке, которая находится поверх рабочего электрода, в процессе нанесения образца пипеткой и в течение инкубации, за которым следует выдвижение крышки до этапов промывки и измерения. После того как образец вносят в отверстие для образца, меченое высушенное антитело на пористой пленке растворяется и иммунореакция начинается на поверхности электрода, покрытого антителами. Пористая пленка функционирует в качестве гомогенизирующего распределителя жидкости, а также предотвращает нарушения, вызываемые пузырьками воздуха, и устраняет другие вышеуказанные проблемы в микрофлюидальных системах. Тест-стрип перемещается в измерительное устройство, где реакция биоаффинности завершается при встряхивании или без него. Встряхивание осуществляется электровибрационным двигателем, присоединенным к основной части измерительной ячейки. Турбулентность выполняется другими средствами устройства. После достижения необходимого уровня равновесия тест-стрип перемещают в измерительную ячейку, и в то же самое время тонкая пористая пленка поверх рабочего электрода движется плавно вверх, после чего рабочий электрод промывают и проводят измерения. В ЭХЛ системе встречный электрод может быть интегральной частью измерительной ячейки. Объем измерительной ячейки может составлять 50-500 мкл. Если гетерогенный метод биоаффинности/иммуноанализа включает промывку тест-стрипа, то гомогенный анализ включает только измерения ЭХЛ. Для промывки и измерения можно использовать раствор того же состава. Промывку измеряющей ячейки выполняют путем ее заполнения и аспирации. Подачу растворов в измерительную ячейку осуществляют при помощи насоса. После измерения ячейку ополаскивают. Клапан инструмента контролирует подвод промывного/измеряющего буфера или дистиллированной воды в ячейку. Более простые в исполнении портативные ЭХЛ приборы для экспресс-тестов не включают инструментальное манипулирование жидкостями, но тем не менее контейнеры с надлежащими растворами включены в тест-стрипы однократного применения.
ЭХЛ измерение в биоаффинных анализах, где тонкая пористая пленка (например, нитроцеллюлоза) покрыта/пропитана антителом, может быть выполнено на CIPF-устройстве, но тогда модифицированную измерительную ячейку и тест-стрип необходимо сравнивать с описанной выше моделью (устройство пленочного прибора). Поскольку реакция протекает в пористой пленке, тест-стрип сконструирован таким образом, что существует открытая крышка для промывки пористой пленки и измерительная ячейка большего размера, куда тест-стрип может быть вставлен.
Конструкция описанного выше пленочного реактора CIPF-устройства также может быть применена для более сложного лабораторного оборудования. Рабочий электрод может быть подсоединен к ячейке подобно микропроточной ячейке, а анод может быть покрыт с одной стороны проводящим материалом. ZnO стекло или ITO пленка (английское сокращение, пленка оксидов индия или олова), а также анод могут иметь сетчатую структуру, продемонстрированную на примере стальной сетки или тонкой стальной проволоки. Пористая пленка расположена между электродами в свободном или зафиксированном виде. Поскольку пористая пленка и вплотную присоединенный сверху встречный электрод превосходят длину рабочего электрода, то поток через ячейку будет выполнен путем присоединения трубок или установления штатива для пипеток микролитрового объема к перфорированному встречному электроду. Альтернативно, внутри жидкостного протока вся CIPF-конструкция или сенсор могут быть вмонтированы в пластмассовый корпус, подсоединенный к устройствам впрыскивания образца и промывки. Конструкция прибора может также включать анодный электрод, располагаемый вокруг рабочего катодного электрода. Также в случае гетерогенного анализа наиболее подходящим способом подачи раствора (образца, метки или промывки) является пористая пленка между электродами. Гомогенный анализ может быть выполнен аналогичным способом, поскольку нет необходимости в промывке. Также это обосновано тем фактом, что катодная ЭХЛ активизирует только метки, сконцентрированные биоаффинной реакцией на поверхности электрода (так называемый эффект близости).
Реагенты для биоаффинных меток могут быть высушены на пористой пленке, которая может быть изготовлена из любого материала, например поликарбоната или нитроцеллюлозы с толщиной менее 100 мкм. Для контроля качества покрытия электрода предпочтительней использовать атомарно-силовую микроскопию (АСМ). Рабочий электрод может быть покрыт антителами посредством физической адсорбции или образования ковалентной связи. Увеличение слоев антител в несколько раз может быть выполнено посредством метода Ленгмюра-Блоджетта (метод выращивания пленок) или Ленгмюра-Шафера.
Далее заявляемое изобретение поясняется примерами конкретного осуществления способа, диаграммами и схемами.
ПРИМЕР 1. Изготовление покрытых изоляционной пленкой электродов из силиконовых (Si) пластин посредством теплового окисления, разделения на слои и покрытия антителами.
Окисление силиконовых пластин. Si-пластины (удельное сопротивление составляет 0,01-0,023 Ω cм, p++ бор-легированные, ориентация<100>, толщина 525+/-25 мкм, производитель Okmetic Oy) были промыты и помещены в печь при температуре 700°C, где атмосфера состояла из 95% азота и 5% кислорода. Температура была повышена до 850°C, парциальное давление кислорода было увеличено до 10%. Через определенное время инкубации пластины промывали в потоке чистого азота в течение 30 мин. После понижения температуры в печи до 700°C в чистом азоте силиконовые пластины вынимали из печи.
Были получены следующие результаты в зависимости от времени окисления:
Толщину измеряли эллипсометром путем поляризации лазерного луча. В методах, использующих тонкую пленку, показатель преломления зафиксирован, и значение, равное 1,465, обычно используют для измерения окислов. Не отполированную сторону Si пластины фиксируют липкой лентой, защищающей поверхность. Далее силиконовую пластину разрезают на чипы при помощи дисковой пилы с алмазной режущей кромкой, контролируемой компьютером.
Наслоение антител на силиконовую пластину может быть выполнено, например, следующим образом: отсеченную пластину, еще покрытую защитной лентой, помещают отполированной поверхностью вниз в пластиковый сосуд с жидкостью, предназначенной для покрытия (50 мМ Трис, 0,05% NaN3, 0,9% NaCl, pH 7,8, антитело (анти-СРБ) 7,0 мкг/мл (Medix Biochemica Oy Ab анти-чCРБ, клон 6405, 1,0 мг/мл)). Объем жидкости для покрытия составлял 50 мл на пластину или 4,5 мкг антител/см2. Пластину оставляли на всю ночь в условиях высокой влажности, для этого ее переносили в насыщенный раствор следующего состава: 50 мМ Трис, 0,05% NaN3, 0,9% NaCl, 0,1% БСА (бычий сывороточный альбумин), 6% Д-сорбит, 1 мМ CaCl2*H2O, pH 7,8 (рН доводили HCl). Готовые силиконовые сенсоры высушивали при 30°C в течение 2,5 ч, герметически упаковывали и с адсорбирующими воду веществами помещали в холодильник на хранение. Когда происходит сборка тест-полосок, с силиконовых пластин удаляют защитную пленку и присоединяют к тест-полоске (фиг.2). Фиг.9 демонстрирует стабильность покрытого антителами CIPF-прибора при хранении. Фиг.10 представляет результаты исследования влияния толщины оксидного слоя на сигнал ЭХЛ. Фиг.11 представляет зависимость, обусловленную концентрацией хелатной метки, тербиума-2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенола, измеренного в свободном виде в растворе. На фиг.12 представлены спектры различных люминофоров, пригодных для метки антител, демонстрирующие, что измерения на CIPF-устройстве с люминесцентным считывающим устройством можно проводить во всех областях спектра (ультрафиолетовая, видимая и инфракрасная).
ПРИМЕР 2. Гетерогенный иммунологический анализ, представленный на примере измерения с-реактивного белка. Устройство тест-стрипа и измерительной ячейки находятся в соответствии с фиг.1 и 2.
СРБ-иммунологический анализ проводили на силиконовых чипах, изготовленных в соответствии с описанием в примере 1. Конструкция тест-стрипов соответствует схематическому изображению на фиг.1 и 2. Тест-стрипы, содержащие пористую пленку, использовали для измерений в ячейке и приборе, как показано на фиг.3А. Иммунологический анализ был основан на использовании пористой пленки в сочетании с детекцией ЭХЛ. В качестве альтернативы слегка модифицированные тест-стрипы можно использовать для измерений с одноразовыми измерительными ячейками, представленными на фиг.3Б.
Пористая пленка присоединена к выдвижной крышке тест-стрипа, содержащей высушенную метку. Пористая пленка из поликарбоната, внешние размеры которой составляли 7,00×12,0 мм (толщина 6-11 мкм, 1×105-6×108 пор/cм2, Whatman), была вставлена в акриловую рамку тех же размеров (3M 465, двухсторонняя акриловая лента без подложки); отверстие для силиконового чипа составляло 4,00×9,00 мм.
Высушивание метки в слое пористой пленки происходило следующим образом. Раствор (50 мМ Трис, 0,05% NaN3, 0,9% NaCl, 0,5% БСА, 0,05% бычий гамма-глобулин, 0,01% Твин 20, 1 мМ CaCl2*H2O, pH 7,7), содержащий меченное хелатом тербия (Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол хелат) антитело (Medix Biochemica Oy Ab анти-чСРБ, клон 6404, 2,22 мг/мл) с концентрацией 0,074 мг/мл раствора, пипеткой в объеме 0,5 мкл помещали в центр пористой пленки (12,0×7,00 мм), диаметр пятна составлял 2 мм и оставляли высушивать при комнатной температуре на всю ночь.
Стандартные образцы СРБ для иммуноанализа (концентрации 0,3, 1,0, 3,0, 10,0, 30,0, 100,0, 300,0, 1000,0, 3000,0 нг/мл) были приготовлены в пробирках путем разбавления коммерчески доступного СРБ (Scripps, № кат.C0124, 2,37 мг/мл) в растворе (50 мМ Трис, 0,05% NaN3, 0,9% NaCl, 0,5% БСА, 1 мM CaCl2·H2O, pH 7,7). 3,5 мкл образца горизонтально наносили на пористую пленку тест-стрипа (фиг.1), вследствие чего происходило растворение высушенной метки. Далее тест-стрип вертикально устанавливали в измерительном устройстве и образец инкубировали вместе с силиконом, покрытым пористой пленкой, в течение 5 мин при встряхивании вибрирующим мотором, расположенным в закрытой части измерительной ячейки. После инкубирования пористую пленку в рамке выдвигают, и в то же самое время тест-стрип поступает в промывную/измерительную ячейку. Ячейку 3 раза промывают путем заполнения и отсасывания комбинированным моющим/измеряющим раствором (50 мM Na2B4O7, 0,1% NaN3, 0,003% Твин 20, pH 7,9 доводили серной кислотой). Ячейку заполняют тем же раствором и измеряют ЭХЛ с параметрами f=10 Гр, Q=20 мкAs, время пульсации 250 мкс, 60 импульсов, U=25 В на люминесцентном приборе, описанном в патенте US 6251690. После измерения ячейку аспирируют и силиконовый стрип удаляют. До установки следующего силиконового стрипа ячейку промывают 3 раза моющим раствором и заполняют дистиллированной водой. Порядок промывки ячейки представлен на фиг.4. Стандартная кривая иммунологического метода измерения СРБ представлена на фиг.13.
ПРИМЕР 3. Измерение хелата тербия в измерительной ячейке, содержащей анод вокруг силиконового катода.
В изображении экспериментальной установки (фиг.5А) силиконовый электрод прикреплен ко дну лунки при помощи липкой ленты и заполнен до краев лунки полимеризующимся в ультрафиолете клеем (Loctite 322 или EPO-TEK OG 142). После полимеризации клея ленту удаляют. Ячейку заполняют моющим/измеряющим раствором, приведенным в примере 2, где концентрация хелата тербия составляла 10-3 моль/л, измеряют ЭХЛ (f=20 Гц, импульсное время 500 мс, U=67 В) и при помощи цифровой камеры делают фотографии. Фиг.5Б демонстрирует появление люминесценции на всей поверхности электрода.
ПРИМЕР 4. На фиг.3 показано, как электродный элемент может быть присоединен к пластиковой основе, облегчая образование электрического контакта к обоим электродам. Тест-стрип, изображение которого представлено на фиг.6А и 6Б, может быть также изготовлен по тому же принципу, который изложен в примере 2, и представлен на фиг.7. Добавление одного электродного элемента в тест-стрип может значительно улучшить технические характеристики прибора, позволяя проводить несколько анализов одновременно, часть из которых может быть использована для отрицательного и положительного контролей. Именно такой тест-стрип представлен на фиг.8.
ПРИМЕР 5. Гетерогенный иммунологический метод определения СРБ в образцах сыворотки.
Известные образцы сыворотки (нефелометрически измеренные в аккредитованной лаборатории) с концентрациями СРБ 133000, 37000, 13000, 7000, 234 нм/мл после разведения были измерены при помощи иммуноэлектрохемилюминесцентного анализа. Образцы были разбавлены в 100 раз раствором (50 мM Трис, 0,05% NaN3, 0,9% NaCl, 0,5% БСА, 1 мM CaCl2·H2O, pH 7,7 доводили при помощи HCl) и измерены. Результаты анализа представлены на фиг.14.
ПРИМЕР 6. Гомогенный иммунологический метод определения СРБ в стандартных растворах.
Гомогенный иммуноанализ СРБ проводили на CIPF-приборе, основанном на определении ЭХЛ, используя стандартные растворы и процедуру определения, описанные в примере 2, с единственной разницей, что измерительную ячейку не промывали, а сразу заполняли анализируемым раствором при помощи насоса и непосредственно проводили измерения. Результаты гомогенного иммуноанализа представлены на фиг.15.
ПРИМЕР 7. Гетерогенный иммунологический метод определения тироид-стимулирующего гормона(ТСГ) в стандартных образцах.
Процедура проведения гетерогенного чТСН иммуноанализа практически полностью соответствует описанию примера 2. Тест-стрип с силиконовым чипом был изготовлен в соответствии с примером 1. Раствор, содержащий антитело (MIT0406 MOAB анти-чТСГ, Medix Biotech Inc. USA), предназначенный для покрытия силиконового чипа, имел следующий состав: 0,1 M MES, 0,03 M H3BO3, 0,5 мM K-цитрат, 0,025% глутаральдегид, 0,05% бычий гаммаглобулин; концентрация антитела составляла 6,87 мг/мл раствора. Состав насыщающего раствора был следующим: 50 мМ Трис, 0,1% БСА, 0,1% NaN3, 0,1% Tween 20, pH 7,5 доводили H2SO4. Также антитело (моноклональный анти-чТСГ, клон 5404, 5,5 мг/мл, Medix Biochemica Oy Ab), меченное хелатом тербия (Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил]-4-бензолфенол), было высушено на пористой пленке тест-стрипа, как было описано выше.
Стандартные образцы ТСГ концентраций 0,1, 1,0, 3,0, 10,0, 30,0, и 100,0 мМЕ /л были приготовлены в пробирках разбавлением стандартного раствора ТСГ (Wallac, DELFIA; чТСГ-набор, концентрация ТСГ 324 мМЕ/мл) раствором следующего состава: 50 мM Трис, 0,05% NaN3, 0,9% NaCl, 0,5% БСА, 1 мM CaCl2·H2O, pH 7,7 доводили HCl). Промывка и измерение были выполнены, как показано в примере 2, за исключением времени инкубации, которое составило 15 мин при непрерывном встряхивании. Фиг.16. представляет калибровочную кривую иммуноанализа чТСГ.
ПРИМЕР 8. Гетерогенный иммуноанализ ТСГ в образцах сыворотки
Гетерогенный иммуноанализ ТСГ практически полностью соответствует проведению анализа СРБ в примере 2. Силиконовые чипы были изготовлены в соответствии с описанием в примере 1. Для покрытия силиконового чипа использовали раствор, содержащий антитело, следующего состава: 0,1 M MES, 0,03 M H3BO3, 0,5 мM K-цитрат, 0,025% глутаральдегид, 0,05% бычий гаммаглобулин, концентрация антитела 6,87 мг/мл (анти-чТСГ Medix Biotech Inc. USA) и композицию насыщенного раствора 50 мМ Трис (основа), 0,1% БСА, 0,1% NaN3, 0,1% Tween 20, pH 7,5 доводили H2SO4.
Стандартные образцы сыворотки с концентрацией ТСГ 1,0, 3,0, 10,0, 30,0 и 100,0 мМЕ/л) были приготовлены разбавлением стандартного раствора ТСГ (Scripps Laboratories, Inc., San Diego, USA) раствором сыворотки. Концентрация ТСГ в сыворотке составляла 0,45 мЕ/л. Промывку и измерение проводили согласно описанию в примере 2 за исключением времени инкубации, которое составило 15 мин при непрерывном встряхивании. Калибровочная кривая иммуноанализа чТСГ представлена на фиг.17.
ПРИМЕР 9. Гетерогенный иммуноанализ ТСГ в образцах цельной крови.
Гетерогенный иммуноанализ чТСГ был выполнен в соответствии с изложенным в примере 7. Стандарты цельной крови с концентрациями ТСГ 1,0, 3,0, 10,0 и 30,0 мМЕ/л были приготовлены разбавлением коммерческого раствора ТСГ (Scripps Laboratories, Inc., San Diego, USA) гепанизированной цельной кровью. Концентрация ТСГ в цельной крови составляла 0,5 мЕ/л. Промывка и измерение были выполнены в соответствии с описанием в примере 5. Калибровочная кривая иммуноанализа чТСГ в образцах цельной крови представлена на фиг.18.
ПРИМЕР 10. Иммуноанализ СРБ на покрытой антителом нитроцеллюлозной пористой пленке, используя силиконовые катоды.
Пористая пленка из нитроцеллюлозы (7×4 мм, Schleicher & Schuell, 12 мкм) была покрыта СРБ-антителом (10 мкг/мл) посредством инкубации в буферном растворе (50 мM Трис-HCl, pH 7,8, 0,05% NaN3, 0,9% NaCl) при комнатной температуре в течение ночи. После этого нитроцеллюлозу промывали насыщающим раствором (50 мM Трис-HCl, pH 7,8, 0,05% NaN3, 0,9% NaCl, 0,1% БСА, 6% Д-сорбит, 1 мM CaCl2) и оставляли в этом же растворе на всю ночь при комнатной температуре. После насыщения пористую пленку высушивали на фильтровальной бумаге.
После установки проточной ячейки в приборе (фиг.19) покрытую антителом нитроцеллюлозную пористую пленку присоединяли к ячейке и на ее поверхность наносили 50 мкл стандартного раствора СРБ. После инкубации (5 мин) пористую пленку в ячейке промывали 1 мл промывочного/измерительного раствора (50 мM боратный буфер, pH 7,9, 0,1% NaN3, 0,003% Твин-20) и затем на ее поверхность наносили 50 мкл антитела, меченного хелатом тербия. После инкубации (5 мин) пористую пленку промывали в ячейке 1 мл промывочного/измерительного раствора и измеряли ЭХЛ в 500 мкл промывочного/измерительного буфера (f=5 Гц, Q=20 мкAs, импульсное время 250 мкс, 500 импульсов, U=34,8 В). Типичная калибровочная кривая представлена на фиг.20.
ПРИМЕР 11. Покрытие электрода пленкой Ленгмюра-Блоджета (ЛБ) и молекулярное исследование поверхностей.
Эксперимент был проведен в обычной кювете Ленгмюра. Поверхностное натяжение было измерено чашечным методом Вильгельма с точностью до 0,2 мН/м. Белковые пленки изготавливали в соответствии с методом Nagagawa T. ((1991) Thin Solid Films, 202, 151 и Owaku, K., (1989) Thin Solid Films 180, 61). Готовые белковые пленки переносили на электродную пластину методом Ленгмюра-Шафера. В качестве белкового покрытия использовали мышиное моноклональное антитело к поверхностному антигену гепатита В. ЛБ пленки были сформированы на границе фаз вода/воздух, используя Трис-HCl буфер (10 мM, pH 8,2) и алкилированный полиэтиленимин (Aldrich, Germany).
Изображение атомарно-силового туннелирования покрытых пленкой ЛВ поверхностей было выполнено при помощи прибора Nanoscope II FM (осциллограф с наносекундным разрешением) (Digital Instruments). Инструмент работает в условиях постоянного напряжения (туннелирования) или в условиях постоянной девиации (атомарной силы). Снимки, которые являлись стабильными по меньшей мере в течение 30 мин, были зарегистрированы фильтрацией и двумерным преобразованием Фурье. Зарегистрированные округлые изображения с размерами 25×15 нм были идентифицированы как антитела. Поверхностная плотность составляла 1×1015 молекул/м-2. Сравнительные результаты эксперимента продемонстрированы на фиг.21 и 22.

Изобретение относится к области аналитических измерений. Устройство, которое состоит из проводника, изолятора и пористой пленки, имеет отношение к области электрохемилюминесценции, в частности к приборам, основанным на электрическом возбуждении меченых молекул с последующим измерением люминесценции, для количественного определения анализируемого вещества, особенно в биоаффинных исследованиях. Технический результат - оптимизация аналитической точности. 9 з.п. ф-лы, 22 ил.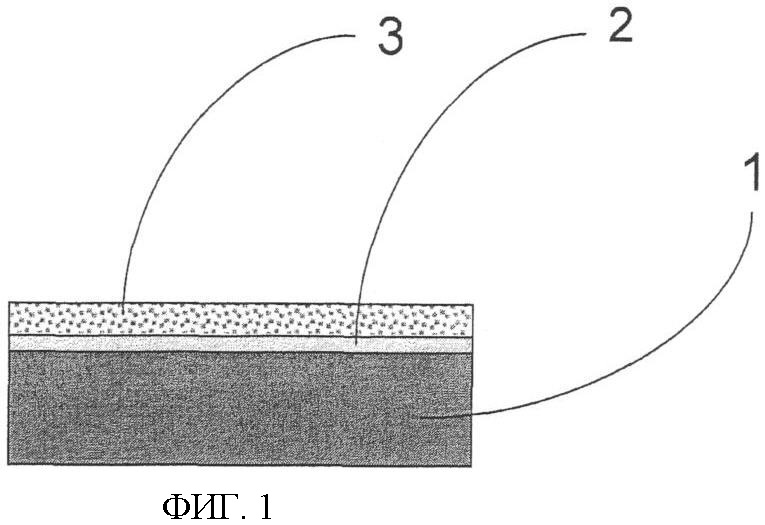
1. Электрохемилюминесцентное аналитическое устройство, где
рабочий электрод, который изготовлен из проводника или сильно легированного полупроводника, покрыт слоем электроизоляционного материала,
рабочий электрод устройства опирается на каркас, через который электрод может быть подсоединен к электронной системе возбуждения прибора, измеряющего люминесценцию,
в заявляемом устройстве рабочий электрод выполняет функцию катода,
пористая пленка с толщиной менее 100 мкм находится поверх электрода,
анализируемый образец наносится на поверхность пористой пленки,
образцу и другим реагентам, нанесенным на пористую пленку и/или катод, дается возможность прореагировать друг с другом,
после применения импульсов возбуждения анализируемый образец даст люминесцентный сигнал, который пропорционален количеству исследуемого анализируемого вещества.
2. Устройство по п.1, где рабочий катодный электрод изготовлен из кремния или алюминия, а его поверхность содержит оксидный слой.
3. Устройство по п.1, где оптимальная толщина пористой пленки на рабочем электроде составляет 1-20 мкм, пленка и электрод находятся в контакте посредством соединения растворителем в течение реакции биоаффинности и измерений электролюминесценции.
4. Устройство по п.1, где пористую пленку удаляют для выполнения измерений люминесценции.
5. Устройство по п.1, где либо поверхность рабочего электрода или пористая пленка в контакте с рабочим электродом, или их модуль могут быть покрыты биоаффинными молекулами, которые связываются с соответствующими анализируемыми молекулами.
6. Устройство по п.1, где специфически реагирующие молекулы находились на хранении в твердом или аморфном состоянии на поверхностях устройства до начала измерений.
7. Устройство по п.1, где
рабочий электрод формирует структурное основание тест-стрип прибора,
рабочий электрод и/или пористая пленка покрыта биоадсорбентом,
пористую пленку, содержащую высушенные меченые биомолекулы, вводят в контакт с рабочим электродом,
образец и/или раствор буфера наносят на пористую пленку для инициации реакции биоаффинности,
допускается продолжение реакции биоаффинности,
прекращение реакции биоаффинности,
удаление пористой пленки с поверхности рабочего электрода,
выполнение измерений электролюминесцентным прибором.
8. Устройство по п.1, где рабочий электрод покрыт пористой пленкой, которая может механически перемещаться.
9. Устройство по п.8, где первичное механическое усилие получено посредством гибкого материала.
10. Устройство по п.1, где контроль качества гладкого катодного рабочего электрода или контроль качества покрытия рабочего электрода выполняется, используя атомно-силовую и/или туннельную микроскопию.
| US 6251690 B1, 26.06.2001 | |||
| US 6645776 В1, 11.11.2003 | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| ЭЛЕКТРОЛЮМИНЕСЦЕНТНОЕ УСТРОЙСТВО НА ОСНОВЕ ПРОВОДЯЩИХ ПОЛИМЕРОВ | 1995 |
|
RU2089051C1 |
Авторы
Даты
2010-03-27—Публикация
2006-03-30—Подача