ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам анализа и устройствам, пригодным для детектирования электрохемилюминесценции. Изобретение применимо, в особенности, для быстрой количественной диагностики при децентрализованном анализе, когда требуются особенно дешевые материалы для электродов, ячейки, одноразовые диагностические чипы и кассеты.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В настоящее время существует настоятельная необходимость в быстрых, чувствительных и количественных технологиях диагностики. Такие технологии широко применимы в хозяйственном использовании, включая общественное здоровье, исследования, сельское хозяйство, охрана окружающей среды, ветеринарная медицина и отдельные отрасли промышленного производства. Повышение чувствительности, вымокая производительность, простота использования, надежность или снижение стоимости испытания являются факторами, которые, в случае реализации их в диагностических технологиях, могут найти применение в новых областях.
Очень высокая чувствительность может быть получена при использовании ряда диагностических приборов, но при высоких затратах. Ряд способов может быть сопоставим по цене, мало затратным, однако они не могут быть достаточно широко применимы в различных областях рынка. Технология, объединяющая требование высокой чувствительности с коммерческой осуществимостью и широким применением, в которой решены подобные требования, в будущем будет иметь важное место и большие возможности на рынке диагностики.
В настоящее время в приложениях диагностики используются различные методы анализа, т.е. радиоактивные метки, иммуносорбентный анализ с ферментной меткой, колориметрический анализ, и исследования, основанные на флуоресценции и хемилюминесценции, включая как анодную, так и электрохемилюминесценцию, индуцированную горячими электронами. Индуцированная горячими электронами электрохемилюминесценция (ЭХЛ) детально описана в патенте US 6251690 (Kulmala S., et al.). Каждый из этих методов имеет характерную совокупность уровня чувствительности, легкости использования, надежности, скорости и стоимости обслуживания, которые определяют положение на рынке. Различия в таких свойствах определяются физическими ограничениями методов. Например, недостатком многих приложений радиоактивного мечения является ослабление метки со временем в результате радиоактивного распада, а также исключительно высокая стоимость радиоактивных отходов как с точки зрения безопасности, так и с точки зрения окружающей среды. Применение многих чувствительных методик в децентрализованной диагностике ограничивается крайней сложностью испытаний и оборудования, поэтому измерения могут проводить только специалисты. Сложность измерений обычно прямо связана со стоимостью оборудования и/или испытания. Как пример, можно упомянуть, среди прочего, анодную электрохемилюминесценцию (АЭХЛ), которая стала коммерчески популярным методом исследования. Приборы, основанные на применении АЭХЛ, представляют собой лабораторных роботов со сложными особенностями использования, для которых требуются специальные знания; кроме того, процесс измерения включает неоднократные сложные этапы промывания и подготовки. Все упомянутые выше обстоятельства являются факторами, которые увеличивают стоимость измерений, увеличивают количество отходов и делают невозможным применить метод исследования к практическим нуждам децентрализованного анализа.
Коммерчески важные технологические приемы измерений основаны на идентификации и измерении аналитов в смесях с использованием так называемых маркировочных соединений. В измерениях, основанных на свойствах биологических молекул, таких как иммунологические исследования, измеряемый аналит (X) в смеси различных молекул может быть селективно присоединен к антителу в твердой фазе, а присоединенные молекулы могут быть измерены с помощью другого, также соединяющегося с (X) специфического антитела, снабженного маркером, т.е. помеченного подходящим маркирующим соединением. Примерами соединений-маркеров являются, но не ограничиваются ими, радиоактивные изотопы, ферменты, молекулы, которые поглощают свет, флуоресцируют или фосфоресцируют, хелаты некоторых металлов и т.д. Маркеры присоединяются к антителу посредством химической связи. Очищенное соединение (X) также можно маркировать и использовать для определения немаркированного (X) в неизвестном образце путем реакции сравнения. Методы измерения ДНК и РНК также основаны на селективности биологических свойств и их также можно измерять аналогичным образом. Ряд других химических и биохимических анализов можно выполнить таким же образом. В настоящее время все более желательно измерять одновременно несколько параметров от образца, чтобы снизить затраты и/или увеличить точность измерений. Одной из возможностей осуществить одновременное измерение является использование люминесцентных маркеров (флуоресцентных или фосфроресцентных) на разных длинах волн или имеющих различное время высвечивания. Разлиичные методы и стратегии измерений, которые могут быть использованы в иммунодиагностике, описаны в книге «Руководство по иммунному анализу» («The Immunoassay Handbook», ed. David Wild, Stockton Press Ltd., New York, 1994, с.1-618). Естественно, возможно измерить маркированные составы в растворах как таковые, т.е. анализируя только составы, когда они не использованы как маркеры.
Ранее было известно, что органические соединения и хелаты металлов, которые могут быть использованы в анализе в качестве соединений-маркеров, могут возбуждаться под действием света или электрохимически, так что может быть получена люминесценция, характерная для маркированных соединений. Однако, т.к. измеряемые концентрации очень малы, возникают специфические трудности. Использование флуоресценции может быть осложнено, помимо прочего, тиндалевским, рэлеевским или романовским рассеянием. При измерении биологических образцов после импульса возбуждения появляется, почти без ослабления, сильная, но короткоживущая флуоресценция подложки. В жидкой фазе используют в основном фосфоресценцию, только если ионы лантанидов используются с хелатами специально синтезированных органических молекул. Проблемой таких методик, основанных на долгоживушей фотолюминесценции маркированных соединений, является сложность и стоимость оборудования.
Вообще, особенными преимуществами ЭХЛ являются низкая стоимость электрического возбуждения и более простая структура (в сравнении с фотолюминесценцией), в которой не требуется сложной оптики возбуждения. Кроме того, можно избежать многих проблем фотолюминесценции, описанных выше. Обычная, так называемая анодная электохемилюминесценция, в которой используются электроды из инертных металлов, может быть получена на маркерах из органических люминофоров в неводных растворах с использованием относительно простого оборудования. Однако исследования биологических свойств, которые представляют основной коммерческий интерес, в большинстве случаев поводятся только в водных растворах. Образцы для исследований биологических свойств почти всегда представляют собой водные растворы, следовательно, измерительные приборы для маркеров должны работать в воде или, по меньшей мере, в мицеллярном водном растворе. Кроме того, хелаты лишь некоторых переходных металлов могут служить ЭХЛ-маркерами при анодной ЭХЛ в водных или мицеллярных водных растворах.
Поэтому с коммерческой точки зрения наиболее важным приложением анодной ЭХЛ в аналитической химии является технология, использующая производные хелатов Ru(bpy)3 2+ в качестве маркеров в мицеллярном водном растворе. Мицеллярные растворы всегда чувствительны к различным возмущающим факторам вследствие неконтролируемой сложности мицеллярного расновесия.
ЭХЛ, индуцированная горячими электронами, которая не зависит от мицелл, имеет, следовательно, значительные преимущества перед анодной ЭХЛ. Поэтому примеры для данного изобретения иллюстрируют, в основном, катодную ЭХЛ. Анодный метод также используется как в иммунном анализе, так и в исследованиях ДНК-гибридизации (Blackburn, G., et al., 1991, Clin.Chem. 37: 1534-1539; Kenten, J., et al. Clin.Chem. 33: 837-879). Этот метод коммерчески используется фирмой Roche Diagnostics. Лабораторный робот приводит в движение магнитные частицы, с помощью которых вещество-маркер для количественных измерений аналита переносится на позолоченный рабочий электрод, постоянно используемый для проведения иммунологических исследований и применений ДНК- и РНК-зондов (Massey; Richard J., et al. US 5746974; Leland; Jonathan K., et al. US 5705402). Повторная обработка магнитолатексных частиц во многих случаях затруднена, поэтому данный способ используют только для дорогостоящих лабораторных роботов (т.е. Elecsys 1010 и 2010), со сложным и точным устройством жидкостной обработки. Кроме того, постоянно работающий массивный золотой электрод нуждается в длительной очистке и предварительной обработке между последовательными анализами (Руководство по обслуживанию Elecsys, с.70).
Использование микрочастиц в электролюминесценции не обязательно оказывается оптимальным, так как в патенте US 5705402 показано, что возбуждение вещества-маркера происходит на поверхности микрочастицы, контактирующей с золотым электродом. Хотя микрочастицы малы (диаметр ок. 2800 нм), только очень малая часть поверхности сферической частицы может иметь контакт с электродом. Следовательно, только малая часть маркирующего вещества, переносимого микрочастицей, доступна для возбуждения. Рабочая эффективность далее уменьшается за счет плохой оптической прозрачности магнитного материала, содержащего частицы латекса, поэтому только часть фотонов может быть детектирована в направлении, противоположном оптически непрозрачному рабочему электроду. В этом направлении обычно располагают детектор в традиционных исследованиях. Обычная анодная ЭХЛ на основе традиционной электрохимии требует использования инертных металлов (т.е. платины или золота) или углерода в качестве рабочих электродов. Использование этих материалов для электродов ограничено, тем не менее, узким окном потенциала из-за пробоя воды (на аноде образуется кислород, на катоде - водород). Поэтому люминофоры, пригодные к использованию в качестве ЭХЛ-маркеров, не могут электрически возбуждаться обычным образом на этих традиционных инертных электродах, поскольку из-за ограниченного окна потенциала нельзя достичь достаточных потенциалов анода и катода, необходимых для реакций возбуждения. Также поэтому анодная ЭХЛ не может обеспечить одновременного возбуждения и/или обнаружить с разрешением во времени несколько различных маркеров, что необходимо для многопараметрического анализа. Анодная ЭХЛ подходит только для нужд очень больших централизованных лабораторий. Как результат крайней сложности и высокой стоимости измерительного прибора анодные прибор и метод не подходят в их известной форме для использования в сфере рынка децентрализованных анализов, т.е. по назначению врачей, в малых медицинских клиниках, или на дому у пациента.
В дополнение к обсуждавшимся выше проблемам, отдельным недостатком и для анодной ЭХЛ и катодной ЭХЛ при исследованиях биологических свойств является длительное время инкубирования, необходимое для достижения молекулами кинетического равновесия в реакции, что требуется для оптимальной точности анализа. Эта проблема может быть разрешена вполне удовлетворительно с помощью устройств с пористым диском (US 2009178924 (A1), Ala-Kleme, T. et al.) и проводником в качестве анода. Проблема электрохимии горячих электронов состоит в том, что неизвестен тип электрода, с помощью которого можно получить интегрированную на плоской поверхности систему анод/катод с одним и тем же материалом электродов и достичь, наконец, таких же хороших результатов как с оксидированным силиконом или катодами из алюминия. Проблема силикона и алюминия заключается в том, что чипы из интегрированных на плоской поверхности катода/анода, выполненные из этих материалов, не могут работать, поскольку маркеры могут возбуждаться лишь малым количеством первых импульсов возбуждения. После этого очень быстро формирующийся оксидный слой на аноде вскоре полностью перекроет прохождение тока через ячейку, а также во время формирования слоя оксида возникает твердотельная электролюминесценция высокой интенсивности (известная под названием гальванолюминесценция). Гальванолюминесценция, к сожалению, содержит также долгоживущие составляющие люминесценции, поэтому измерения электрохемилюминесценции с временным разрещением не могут быть использованы в случае хелатов лантанидов как маркеров. Можно уменьшить проблему путем защиты поверхности чипа с катодом/анодом из алюминия или силикона, но оказывается невозможным найти такой материал для электрода, который обеспечил бы успешное использование планарных чипов с катодом/анодом и возбуждением маркированных соединений в исследованиях биологических свойств.
В ходе создания чипа с катодом/анодом, в котором анодную часть чипа на стеклянном основании с электродом из алюминия предполагали покрыть углеродной пастой для предотвращения анодного окисления, к несчастью, и анодная, и катодная части были покрыты углеродной массой. Когда чипы были изготовлены, они были испытаны в измерениях, и к удивлению, Tb(III)-хелаты дали свет с высокой амплитудой электрических импульсов. Полагаем, что это было обусловлено электрохимией горячих электронов, даже при невозможности туннельной эмиссии в электродах из углерода и других проводников. Для сравнения мы попытались возбуждать также органические флуорофоры (8-гидрокси хинолон и 7-амино-4-метил кумарин), но ни одно из веществ не дало измеряемую ЭХЛ с электродами из углерода. Таким образом, возможно, мы обнаружили неизвестное прежде явление, связанное с электродами из углерода, которое подходит для электрического возбуждения хелатов тербия парой углеродных электродов. Фуллерены, углеродные нанотрубки и подобные образования в современных новых технологиях углерода были обнаружены только недавно, и химия углерода, возможно, таит множество еще неизвестных и неизученных областей. Описанное выше возбуждение может как-то быть обусловлено поверхностью электрода, находящегося в прямом контакте с ионами тербия, вместо возбуждения через лиганд. Можно также предположить, что газы, образующиеся на поверхности электродов (водород и кислород, особенно в их атомных формах), играют заметную роль в механизмах реакции. В любом случае, электрохемилюминесценция, представленная в данном изобретении, может быть эффективно использована в исследованиях биологических свойств, даже если механизмы реакции пока еще не ясны.
В соответствии с изобретением, можно изготавливать чипы с двумя электродами (электродом/электродом) - далее ЭЭ-чипы - для замены чипов с катодом/анодом. В ЭЭ-чипах не имеет значения, который из двух электродов на чипе используется как катод, а который как анод. Изготовление электродов из углеродной пасты методами печати, вероятно, является самым дешевым из возможных технологий производства электродов, вследствие чего данная инновация является прорывной с точки зрения одноразовых диагностических чипов на основе электрохемилюминесценции и кассет. Таким образом, высоко конкурентная технология электрохемилюминесценции (в сравнении с технологией электрохемилюминесценции, возбуждаемой горячими электронами) может быть осуществлена с использованием описанных в изобретении ЭЭ-чипов, которые значительно дешевле, чем чипы, используемые в катодной электрохемилюминесценции. Способы и устройства, которые делают это возможным, определены пунктами 1-10 патентной формулы.
Следует также заметить, что такая пара углеродных электродов, какая описана в данном изобретении, может быть изготовлена непосредственно на одной половине полимерной кассеты, после чего упомянутая половина сама по себе становится больше, чем обычный ЭЭ-чип. На верхней части этой половины могут происходить явления пневмоники, а также действия по извлечению, добавлению и фильтрации образцов, и добавление реагентов. Не требуется оптической прозрачности этой половины. А половина без углеродного электрода является, предпочтительно, полностью оптически прозрачной, но она также может содержать оптически прозрачную часть окна. Это окно также, при необходимости, может служить оптическим фильтром при соответствующем выборе материала.
ПЕРЕЧЕНЬ ФИГУР
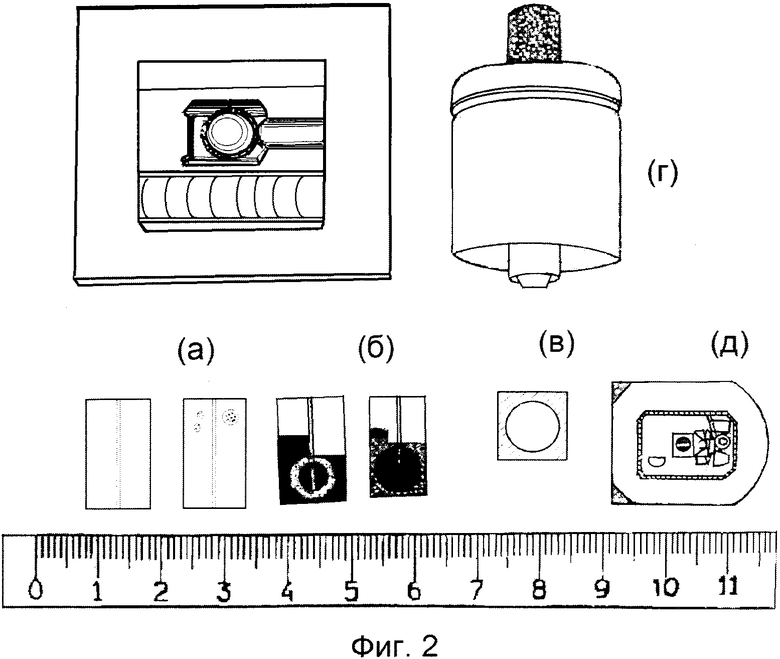
Фиг.1. Простой ЭЭ-чип. Основание - стекло размером 19 мм × 19 мм или пластиковый чип (1), к верхней части которого присоединены электроды (2) и (3) с помощью двусторонней ленты, нарисованной кистью или напечатанной. Поверх осушенных электродов наклеено кольцо (4), выполненное из листов адгезивного пластика путем перфорации; кольцо наклеено на чип с помощью его собственного адгезивного материала, таким образом, что образована область ячейки (5) с внутренним диаметром 7 мм. В ячейку можно пипетировать 80-150 мкл образца или другого раствора.
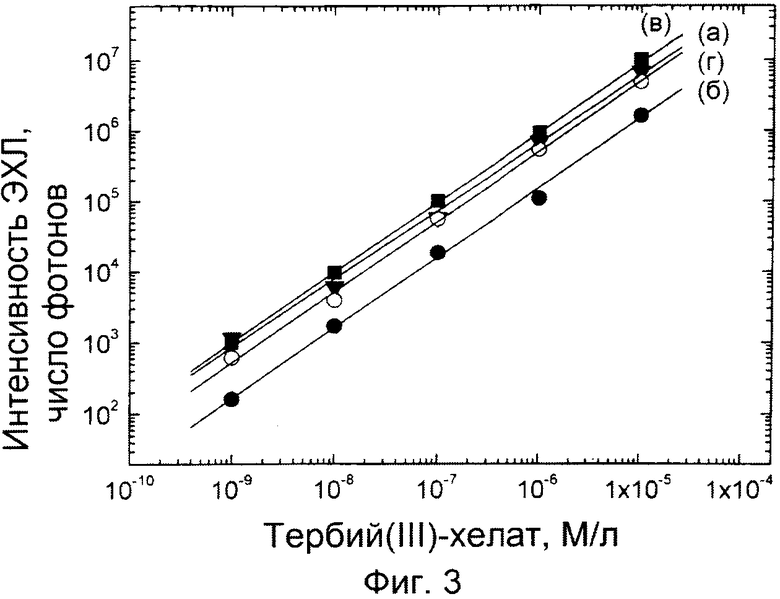
Фиг.2. Основания пластикового чипа (а); ЭЭ-чип, в котором углеродные электроды выполнены на верхней части слоя из алюминия или серебристой краски, так что поверхности электрических контактов электродов свободны от углеродной пасты (б); лента с защитной пленкой снизу от перфоратора (в); установка для перфорации квадратов из ленты и самоклеющихся меток (г); ЭЭ-чип в измерительной ячейке перед введением образца.
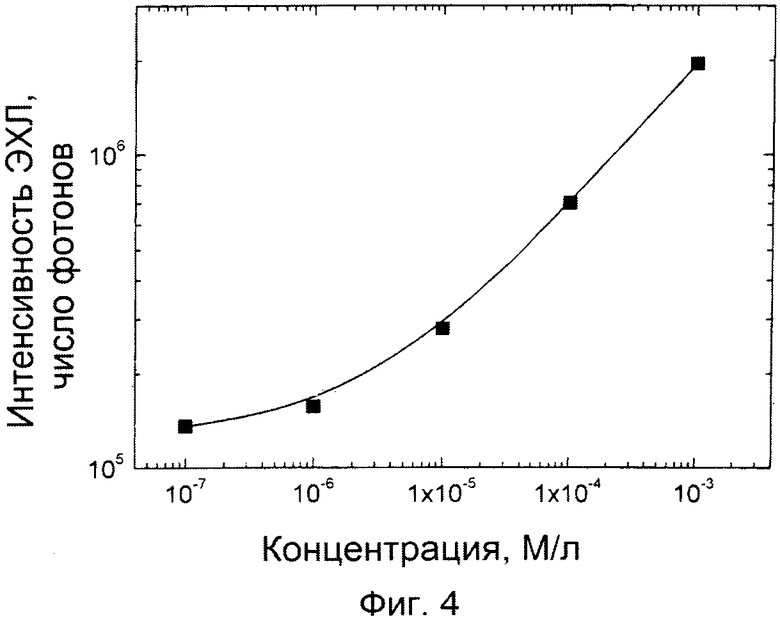
Фиг.3. Калибровочные кривые Tb(III)-хелатов для электродов из углеродной пасты, приготовленной различным образом, (а) электроды по примеру 2, (б) электроды по примеру (3), (в) электроды по примеру 4, и (г) электроды по примеру 5.
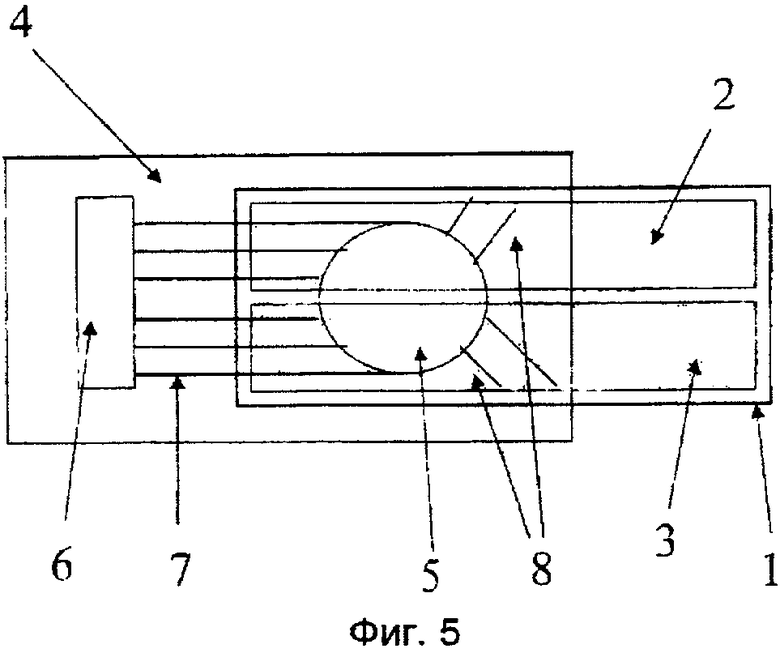
Фиг.4. Влияние персульфата на интенсивность электрохемилюминесценции.
Фиг.5. ПДМС-чип, соединенный с ЭЭ-чипом. (1) Основание, обычно выполненное из полимера, бумаги, картона или стекла или любой их комбинации; (2) и (3) идентичные углеродные электроды, которые могут быть различным образом покрыты (по выбору); (4) ПДМС-чип с камерой инкубирования и измерительной камерой (5) на нижней поверхности и открытая камера через чип для ввода образца и добавления реагента (6), микроканалы (7), ведущие в области инкубирования, и каналы отвода воздуха (8). ПДМС-чип и ЭЭ-чип прижаты друг к другу маленькими зажимами. Кассеты могли бы также быть хорошо склеены вместе, но для предотвращения возможной блокировки микроканалов использовано соединение зажимами. Вместо зажимов можно было бы также использовать пластиковую рамку для плотного удержания всех чипов.
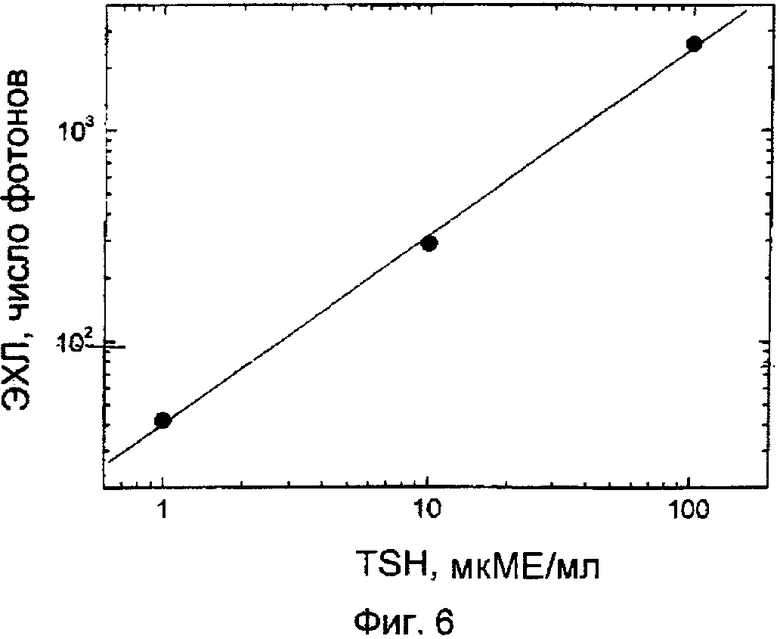
Фиг.6. Иммуноферментные исследования на кассете, образованной из ЭЭ-чипа и ПДМС-чипа.
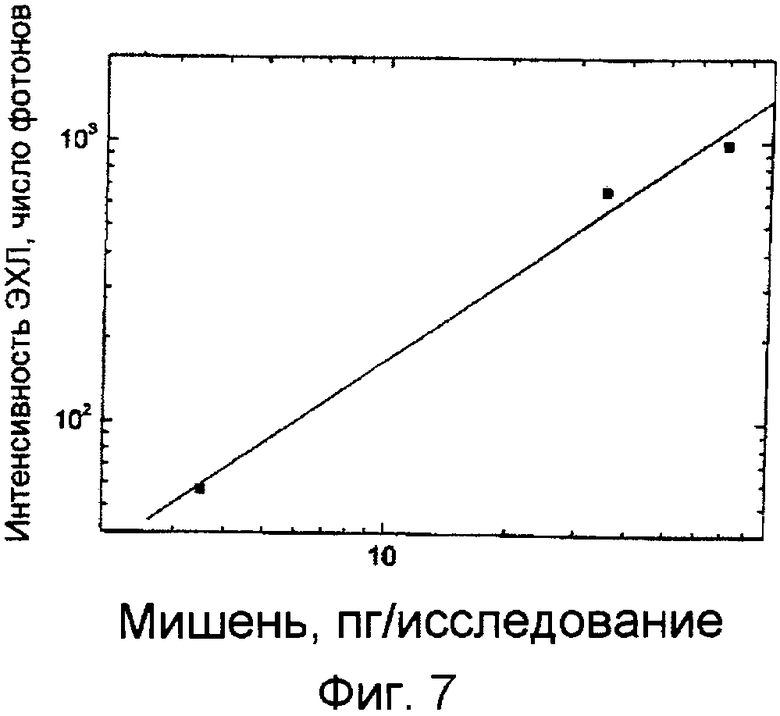
Фиг.7. Исследования гибридизации на ЭЭ-чипе.
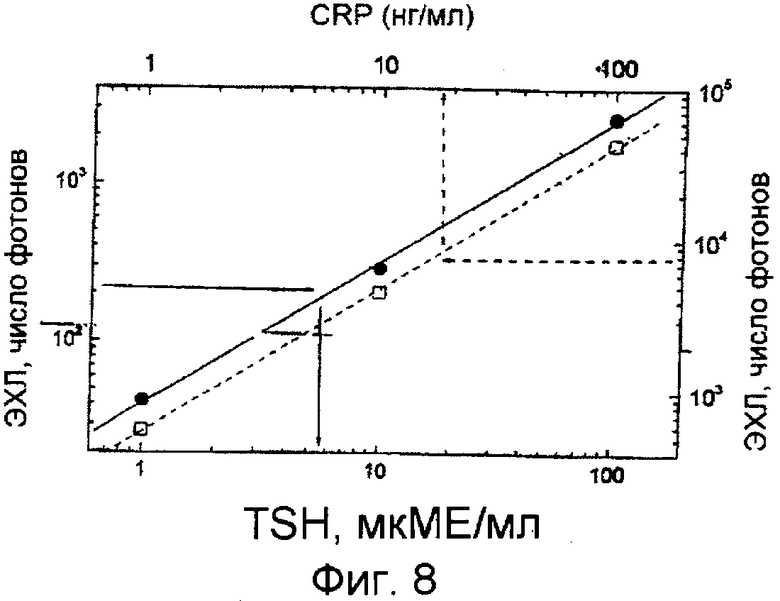
Фиг.8. Два одновременных иммуноферментных исследования на ЭЭ-чипе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение показывает, как простое и дешевое оборудование может быть использовано для различных анализов настолько же эффективно, как и описанные выше сложные средства, в котором иммунологические исследования или ДНК-гибридизация выполняются на одноразовом ЭЭ-чипе или с использованием также пористого слоя поверх ЭЭ-чипа. За счет этих средств и измерительный прибор и измерительная ячейка достаточно дешевы для нужд децентрализованного анализа.
Данное изобретение описывает различные пути получения ЭЭ ячеек поверх различных дешевых материалов. Эти материалы включают, среди прочих, различные виды пластика, полимеры, бумагу, бумагу с различными типами покрытий и картон. Материалы, подобные этим, легко соединить с системами микроанализа или кассетами, которые выполняют все другие необходимые функции, нужные для анализа. В массовом производстве, когда прилагают усилия для производства высококачественных товаров по низким ценам, способ печати является очень хорошим выбором способа производства. Электроды, описанные в настоящем изобретении, исключительно хорошо подходят для изготовления по технологии печати, что дает значительные преимущества в соревновании на рынке.
Ранее стало известно, что углеродные электроды могут быть использованы как одноразовые аноды в аспекте электрохемилюминесценции рутения (FI 981568 (А), Kulmala, S., et al.), но единичные углеродные аноды не могут быть использованы для возбуждения хелатов тербия. Специалист в данной области не мог представить, что путем замены электрода из платины в паре электродов из углерода и платины на электрод из углерода можно получить особенную электродную систему с особенным поведением, по крайней мере, когда электроды расположены на одном уровне и близко друг от друга (пока у нас нет опыта с другой геометрией). Пока у нас нет полной определенности в понимании того, возникает ли свет, когда электроды функционируют как катоды или аноды, или реакция является результатом комбинированного эффекта промежуточных звеньев при различных полярностях. Из экспериментальных результатов оказывается, что основная часть света, по меньшей мере, образуется у катода.
Настоящее изобретение представляет значительный вклад в область средств и способов, значимых для рынка децентрализованных анализов, и делает возможным дешевое, количественное и быстрое тестирование. Это достигается путем использования ЭЭ-ячеек либо в их простейшей форме, с гидрофобным кольцом, окружающим область ячейки, либо в качестве элемента, интегрированного в более сложную кассету для анализа.
Предметом изобретения являются способ и устройство для возбуждения маркеров в исследованиях биологических свойств либо прямо на поверхности ЭЭ-чипов, либо с помощью пористых слоев (пористых мембран) в устройстве с ЭЭ-чипом. Способ может быть использован в иммунохимических быстрых исследованиях и ДНК-зондах. Возможно также, что со временем какие-то другие маркеры, помимо хелатов тербия, можно будет возбуждать ЭЭ-чипами и способами, описанными в данном изобретении.
Изобретение включает устройство, основной частью которого является ЭЭ-чип. Поверхность электродов в ЭЭ-чипе может быть покрыта известным образом антителами или ДНК, и молекулы-маркеры, присоединенные к покрытию, могут возбуждаться электрическими импульсами. В соответствии с изобретением часть электрода (или поверхность пористого слоя (в опции), которая контактирует с частью электрода, может быть покрыта пленками Лэнгмюра-Блоджетта или другими легко изготавливаемыми пленками, которые создают особые преимущества.
Иногда заметные преимущества достигаются при использовании пористых мембран в исследованиях биологических свойств. С помощью пористого слоя образец однородно распределяется в комплексе из электрода с покрытием антителом. Пористый слой также функционирует как однородный компенсатор потока жидкости и предотвращает образование пузырьков в системах микропневмоники, температурную диффузию и поверхностные силы, а также исключает проблемы, обусловленные такими факторами, в ячейках с микропневмоникой микропотоков или в ячейках с микрослоями.
Пленки (пористые слои, пористые мембраны), иногда использованные в изобретении на поверхностях электродов, характеризуются микропористостью и толщиной менее 100 мкм. Эти виды материалов доступны из многих коммерческих источников, таких как Millipore, MSI, Sartorius, Pall, Sigma и DuPont. Мембраны могут быть как изотропными, так и анизотропными. Технология изготовления пленок может различаться и может содержать прессование или растяжение, поры могут быть сформированы либо химически, либо физически, в анизотропных пленках, путем фазового перехода. Подходящие материалы включают ПТФЭ, поливинилидин флюорид, поликарбонат, полисульфон, нейлон и эфиры целлюлозы. Они доступны из коммерческих источников, с различными размерами пор и толщиной, и различными физико-химическими свойствами. Волокнистые материалы, которые могут быть использованы, включают волокнистые фильтры, фильтровальную бумагу, фильтрующую ткань и др.
По производственным причинам ЭЭ-чипы лучше всего держать сухими. Затем устройства готовят к работе путем добавления жидкого образца или буферного раствора на ЭЭ-чипы или на пористый слой в чипах. Так достигаются условия, подходящие для реакций исследования биологических свойств либо прямо на электродах, или между мембраной и электродом.
Существует большое количество альтернативных опций для ЭЭ-чипов, которые описывают данное изобретение. Основной выбор состоит в прямом использовании достаточно проводящей углеродной пасты для изготовления электродов на чипе, который обычно является или пластиковым, бумажным или стеклянным чипом, или полоской, а наиболее типичным является изготовление методами печати. Если проводимость углеродной пасты недостаточна, можно выполнить высоко проводящий слой под углеродной пастой из так называемой серебристой краски или тонкий металлический слой, который затем покрывают углеродной пастой. Таким образом, для получения ЭХЛ достаточно уже относительно малых напряжений, если внутри пленки проводящей углеродной пасты, на большом расстоянии, не происходит падения потенциала.
ЭЭ-чипы обычно включаются как часть в кассеты для диагностики с помощью разных способов и с использованием лучших свойств различных материалов. Целью является подготовка частей кассеты, обычно сделанных из полимеров, например, каналов и ячеек, таким образом, чтобы после добавления реагентов в сухом виде, они бы обладали всеми необходимыми функциями для диагностических измерений, обычно одноразовые кассеты никогда не открывают во время использования или после него.
Далее изобретение иллюстрируют диаграммы, примеры и чертежи (без ограничения), относящиеся к примерам.
ПРИМЕР 1. Изготовление электродов ЭЭ-чипа таким образом, что в области ячейки материал электрода состоит только из углеродной пасты.
Пара электродов, показанная на фиг.1, была нанесена углеродной пастой (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA) поверх пластикового чипа размером 10×19 мм с использованием шаблона. Фланец высотой 0,2 мм и шириной 0,5 мм был оставлен в середине чипа при его изготовлении путем фрезерования, и этот фланец был использован в качестве резистора между электродами (фиг.2(б)). После высушивания углеродной пасты был нанесен наружный слой серебристой краской (Bison electro G-22, Bison Inc, Netherlands), и этот серебристый слой почти достиг области ячейки (фиг.2). Область ячейки формировали путем присоединения перфорированного куска тефлоновой ленты (Irpola Oy, Turku, Finland) или куска обычной перфорированной ленты (квадратной формы, в отличие от куска круглой формы, показанного на фиг.1, с отверстием в середине куска, имеющим внутренний диаметр 7 мм или 8 мм) у левого конца электрода, как показано на фиг.1. И Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелат, и Tb(III)-N|-изотиоцианатобензил)диэтилентриамин-N1,N2,N3,N4 тетраацетат хелат можно было возбудить и измерить с временным разрешением в этой ячейке. Значительно более высокая интенсивность достигается, тем не менее, с ЭЭ-чипами по примеру 2, с которыми соответствующие хелаты других лантанидов дали, однако, значительно более низкие интенсивности, чем тербий.
ПРИМЕР 2. Изготовление ЭЭ-чипа из серебристой краски, покрытой углеродной пастой.
Пара электродов, показанная на фиг.1, была нанесена серебристой краской (Bison electro G-22, Bison Inc, Netherlands) поверх пластикового чипа размером 10×19 мм с использованием шаблона. Фланец высотой 0,2 мм и шириной 0,5 мм был оставлен в середине чипа при его изготовлении путем фрезерования, и этот фланец был использован в качестве резистора между электродами. После высыхания серебристой краски (5 часов) поверх нее был нанесен покрывающий слой углеродной пасты (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA) и оставлен для высушивания при комнатной температуре на ночь. Область ячейки сформировали путем присоединения перфорированного куска тефлоновой ленты (Irpola Oy, Turku, Finland) или куска обычной перфорированной ленты к левому концу электрода, как показано на фиг.1. Калибровочная кривая Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата представлена на фиг.3 (а), открытые кружки. Измерительный инструмент состоял из счетчика фотонов Stanford Research SR400, генератора статических импульсов и электродной камеры из черного пластика с присоединенным трубчатым модулем канального фотоумножителя Perkin Elmer. При измерениях установлены следующие параметры: напряжение в импульсе -67В, заряд импульса 30 мкКл/имп, частота импульсов 20 Гц. Интенсивность ЭХЛ интегрирована по 100 импульсов возбуждения, время задержки 0,05 мс, окно измерения 6,0 мс. Использован буфер 0,05М тетраборат натрия, pH 9,2.
ПРИМЕР 3. Изготовление ЭЭ-чипа на бумаге и из углеродной пасты.
Вначале бумага для выпечки (не пропускающая жира) была покрыта серебристой краской ((Bison electro G-22, Bison Inc, Netherlands), после чего поверх серебра был нанесен слой углеродной пасты (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA). При покрытии использован шаблон для имитации шелкотрафаретной печати. После высыхания углеродной пасты при комнатной температуре в течение 2 часов, из бумаги были нарезаны полоски, подходящие для использования на основах (по фиг.2). Край бумаги у фланца на основании был покрыт углеродной пастой, чтобы серебро не имело прямого контакта с растворами электролитов. Окончательно бумага была прикреплена к пластиковому основанию двусторонней лентой (3M), бумажные кольца, образующие область ячейки, были прикреплены к чипу.
Калибровочная кривая Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата представлена на фиг.3 (б), сплошные кружки. Параметры измерений те же, что в примере 2.
ПРИМЕР 4. Изготовление ЭЭ-чипа из полосок металлической фольги, покрытых углеродной пастой.
Вначале изготовили пару электродов путем приклеивания полосок алюминиевой фольги поверх пластикового чипа размером 10×19 мм. Фланец высотой 0,2 мм (или, по выбору, высотой 0,3 мм или 0,4 мм) и шириной 0,5 мм был выполнен фрезерованием в середине чипа для выполнения функции резистора между электродами (фиг.1). Полоски алюминиевой фольги были покрыты углеродной пастой (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA), так что с правого края контактные области подпружиненных штифтов (которые подсоединяют чип к импульсному генератору устройства) оставались непокрытыми. Область ячейки была сформирована либо перфорированным куском тефлоновой ленты (Irpola Oy, Turku, Finland) или куском обычной перфорированной ленты на левом конце электрода соответственно фиг.1. Калибровочная кривая Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата представлена на фиг.3 (в), сплошные кружки. Подобные электроды могут быть выполнены также с использованием на первом этапе алюминиевых пластин, полученных путем осаждения паров, как в примере 8. Параметры измерений те же, что в примере 2.
ПРИМЕР 5. Изготовление ЭЭ-чипа из коммерчески доступных металлических наклеек (стикеров), покрытых углеродной пастой.
Вначале изготовили пару электродов путем приклеивания стикеров из медной фольги (Screen House, Turku, Finland) их собственным адгезивным слоем поверх пластикового чипа размером 10×19 мм. Фланец высотой 0,3 мм и шириной 0,5 мм был выполнен фрезерованием в середине полоски для выполнения функции резистора между электродами (фиг.1). Полоски медной фольги покрыли углеродной пастой (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA, USA), так что контактные области подпружиненных штифтов к импульсному генератору у правого края полоски остались непокрытыми. Область ячейки была сформирована присоединением или перфорированного куска тефлоновой ленты (Irpola Oy, Turku, Finland), или куска обычной перфорированной ленты у левого конца электрода соответственно фиг.1. Калибровочная кривая Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата представлена на фиг.3 (г), сплошные кружки. Подобные электроды могут быть выполнены также с использованием на первом этапе алюминиевых пластин, полученных путем осаждения паров, как в примере 8. Параметры измерений те же, что в примере 2.
ПРИМЕР 6. Влияние персульфата на интенсивность ЭХЛ.
Вначале изготовили достаточное количество ЭЭ-чипов по методике примера 2. При изучении влияния различных примесей на электрохемилюминесценцию было отмечено, что добавление персульфата увеличивает электрохемилюминесценцию. Это означает, с наибольшей вероятностью, что персульфат распадался в ходе реакции с образованием радикала серной кислоты. Известно, что радикалы серной кислоты приводят к хемилюминесценции ионов и хелатов Tb(III) в водном растворе (S. Kulmala et al., Anal.Chim.Acta 294 (1994) 13-25).
При дальнейшем изучении влияния концентрации персульфата калия на интенсивность сигнала было отмечено, что увеличение концентрации персульфата приводило к заметному усилению интенсивности ЭХЛ Tb(III) хелата (1×10-6 М Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол) в пределах всего исследованного диапазона концентраций (фиг.4).
Возможно, что увеличение интенсивности имеет место вплоть до наивысших количеств растворенного персульфата калия (около 50 мМ), а с персульфатом натрия можно достичь даже более высоких концентраций. Параметры измерений те же, что в примере 2.
ПРИМЕР 7. Влияние кислотной и базовой обработок.
При изучении стабильности электродов в условиях воздействия кислот и в базовых условиях было обнаружено, что работа электродов улучшалась при повторном использовании. Вследствие этого провели сравнение, в котором ЭЭ-чипы, изготовленные по методике, описанной в примере 2, инкубировали в течение 15 минут в одномолярном растворе едкого натра (1М NaOH), одномолярном растворе серной кислоты (1М H2SO4), или одномолярном растворе соляной кислоты (1М HCl). После инкубирования электроды промыли дистиллированной водой и провели измерения с использованием 1 мкМ Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата. Параметры измерений те же, что в примере 2. Результаты приведены ниже в таблице, и кислотная обработка, и базовая обработка отчетливо увеличили эффективность электродов.
ПРИМЕР 8. Иммуноферментное исследование с ЭЭ-чипом, образованным в целой ячейке с ПДМС чипом.
ПДМС чип был изготовлен отливкой из силиконового эластомера Sylgard 184 (отверждающий агент в пропорции 1:10), с использованием формы в чашке Петри. Влажный ПДМС дегазировали в вакууме и выдерживали в течение 2 часов при температуре 50°C. Отвержденный ПДМС отделили от формы и нарезали на части.
ПДМС чипы имели камеру для образца и подачи реагентов у левого края (часть 6 на фиг.5), в которой реагенты, необходимые для анализа биологических свойств, высушивались перед анализом. Камера ввода образца присоединялась посредством микроканалов (часть 7 на фиг.5) к объединенной камере инкубирования и измерения (часть 5 на фиг.5). За счет капиллярных сил и гидростатического давления жидкость перемешалась в камеру инкубирования/измерения, в то время как воздух выходил из камеры через микроканалы (часть 8 на фиг.5). Камера инкубирования/измерения имела миниатюрные опоры для поддержания камеры ПДМС чипа в постоянном размере и предотвращения ее сжатия. Высота камеры инкубирования/измерения составляла 0,35 мм, объем около 15 мкл, а общая толщина ПДМС чипа составляла 5 мм.
Вначале верхнюю поверхность стеклянных чипов (19,0 мм × 10,0 мм) подвергли короткой плазменной обработке. Затем в вакууме напылили слой алюминия толщиной около 0,3 мм через маску на стеклянные чипы, прикрепленные под маской; сформировали оба электрода чипа (2 и 3 на фиг.1). После этого алюминиевые электроды дополнительно покрыли углеродной пастой (Creative Materials 110-04 Carbon Ink, Tyngsboro, MA,USA), так что контактные области подпружиненных штифтов (к импульсному генератору) у правого края полоски остались непокрытыми.
В качестве модельного аналита использовали тиреотропный гормон человека TSH, в качестве первичного (захватывающего) антитела использован α-субблок, присоединяющий анти-TSH (МОАВ, лот: N-21310, номер по каталогу MIT0406, концентрация 6,87 мг/мл; Medix Inc, USA); в качестве вторичного (маркирующего) антитела использован β-субблок специфического анти-TSH (клон 5404, лот SPC099, концентрация 5,5 мг/мл, Medix Biochemica Oy Ab, Finland). Калибровочные стандарты для hTSH получены путем разведения из концентрированного маточного раствора Уоллака (DELFIA hTSH kit, 324 mIU/mL TSH).
Маркированное вторичное антитело (анти-TSH, клон 5404, 5,5 мг/мл, Medix Biochemica Oy Ab) было получено реакцией производных изоцианата Tb хелата Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелата с 80-кратным молярном избытке хелата и антитела. Реакция шла в течение ночи при pH 9,5. Маркированное антитело отделили в колонке диаметром 1 см, заполненной 5,5 см Сефадекса G-50 поверх 52 см Сефарозы 6В.
После высыхания углеродной пасты электроды были покрыты антителом в лунке, образованной лентой в области измерительной ячейки на ЭЭ-чипе, следующим образом: 150 мкл раствора, содержащего 30 мкг/мл захватывающего антитела (0,1 М MES, 0,2 М бората, 0,025% бычьего гамма-глобулина pH 6,5), добавили в камеру инкубирования и инкубировали в течение 3 часов в закрытых пластиковых емкостях с водой, содержащей азид, в нижней части под подставками. После покрытия область ячейки промыли промывочным раствором (0,05 М Трис-H2SO4 буфер, pH 7,75, 0,1% бычьего альбумина, 0,1% Tween 20, 0,1% NaN3).
0,2 М буфера натрия тетраборат (pH доведен до 7,8 с помощью H2SO4, 0,5% бычьего альбумина, 0,05% бычьего гамма-глобулина, 0,01% Tween 20 и 0,1% NaN3) был использован как буфер для иммуноферментных исследований и измерений. Сначала 25 мкл hTSH-стандарта добавили в 175 мкл иммуноферментного/измерительного буфера.
Смесь пипетировали в камеру ввода образца (часть 6, фиг.5), в которой уже находился маркер в сухом виде. Образец растворил маркер, и смесь под действием капиллярных сил и гидростатического давления перешла в камеру инкубирования/измерений (часть 5, фиг.5) по микроканалам (часть 7, фиг.5), в то время как воздух вышел из ячейки через другие микроканалы (часть 8, фиг.5).
Через 15 минут инкубирования измерили интенсивность ЭХЛ от каждой ПДМС-ЭЭ-кассеты с использованием измерительной аппаратуры, в составе лабораторного кулоностатического импульсного генератора, счетчика фотонов Stanford Research Instruments SR400, многоканальной пересчетной схемы Nulleus MCS-II и закрытого объема для измерения ячеек, выполненного из черного пластика, с трубчатым модулем канального фотоумножителя Perkin Elmer (амплитуда импульса -45В, заряд импульса 15 мкК/имп, частота импульсов 20 Гц; интенсивность ЭХЛ интегрирована по 200 импульсам возбуждения с временем задержки 0,05 мс и окном измерения 6,0 мс) Результаты измерения показаны на фиг.6.
ПРИМЕР 9. Исследование гибридизации на ЭЭ-чипах.
ЭЭ-чипы изготовлены из осажденного алюминия и углеродной пасты так же, как в примере 6. Область ячейки в чипах образована лентой таким же образом, как в примере 1. Определяемая последовательность состояла из 120 фрагментов нуклеотидов, которая одинакова для энтеро- и риновирусов человека.
Зонд 1 (TTA-GCC-GCA-TTC-AGG-GGG-CGA-AAA-AA-C6-NH2, MedProbe AB, Sweden), комплементарный к 5'-концу определяемой последовательности, был нанесен на электроды из углеродной пасты. Для покрытия аминогруппы (APTES) были добавлены в процессе силанизации с (3-аминопропил)триэтоксисиланом на электроды, покрытые слоем оксида. Полиаденильный хвост, 6-углеродная алифатическая углеродная цепочка и замыкающая аминогруппа были добавлены к 3'-концу зонда 1. Завершающая ковалентная связь была образована с помощью двойного реагента DSS (дисукцинимидил суберат), в соответствии с инструкциями производителя.
Второй зонд «Зонд 2» ((NH2)4-GA-AAC-ACG-GAC-ACC-CAA-AGT-A) был маркирован производной изотиосианата Tb хелата (Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол хелат) путем инкубирования зонда с 80-кратным избытком хелата в 0,5 М буфере карбонат натрия (pH 9,5) в течение ночи. После инкубирования маркированная проба была очищена на колонке Сефадекса G50 (NAP-5, колонка GE Healthcare).
Гибридизация была выполнена следующим образом. Образец ДНК, мультиплицированной в полимеразной цепной реакции RT-PCR (20 мкл, разведение 1:50, 1:100 и 1:1000), был денатурирован добавлением 180 мкл NaOH (50 ммоль/л) и инкубированием при 37°C в течение 5 минут. Образцы затем нейтрализовали добавлением 200 мкл нейтрализующего буфера (6 × SSC, 0,3% Tween 20, 20 ммоль/л лимонной кислоты). 10 мкл нейтрализованного образца и маркированной пробы 2 (0,6 нг/мкл, 50 ммоль/л Трис-HCl буфера pH 7,8, 600 ммоль/л NaCl, 1% Triton X 100 и 1% блокирующего реагента (Roche)) были перенесены в новую трубку для анализа. После смешивания 3,5 мкл смеси пипетировали на мембранную часть испытываемой полоски. После гибридизации (5 минут) мембрану удалили с силиконового электрода, трижды промыли ЭЭ-чип и измерили ЭХЛ. Диаграмма разведении образца показана на фиг.7.
Параметры измерений такие же, как в примере 8.
ПРИМЕР 10. Одновременное определение двух иммуноферментных аналитов на одном ЭЭ-чипе.
С-реактивный белок (CRP) и тиреотропный гормон (TSH) определяли одновременно, так что один из электродов покрыли антителом, захватывающим CRP, а другой - антителом, захватывающим TSH.
Электроды ЭЭ-чипа были покрыты захватывающим антителом в лунках прямоугольной формы, выполненных из ленты. Прямоугольные отверстия были выполнены в ленте скальпелем с использованием шаблона. Каждая из лунок покрывала немного большую область соответствующего электрода, чем круглая область ячейки, которая по окончании предварительной подготовки была выполнена добавлением другой ленты с круглым отверстием, как на фиг.1.
Оба антитела были одновременно нанесены на электрод, каждый в свою собственную лунку в ленте. Анти-TSH (анти-hTSH, MIT0406, Medix Biotech Inc., USA) был нанесен на электрод инкубированием антитела (25 мкг/мл, 150 мкл) в течение 2 часов при комнатной температуре в растворе, содержащем 0,1 М MES, 0,03 М Н3ВО3, 0,5 мМ цитрата калия, 0,025% глутаральдегида и 0,05% бычьего гамма-глобулина. После инкубирования лунку в ленте промыли трижды промывочным раствором (50 мМ Трис-HCl буфер pH 7,8 с 0,9% NaCl, 0,09% NaNs и 0,05% Tween 20). После промывания покрытый электрод насыщали путем инкубирования насыщающего раствора (50 мМ Трис-HCl pH 7,8 с 0,9% NaCl, 0,05% NaN3 и 0,1% BSA и 6% D-сорбитола) в лунке в ленте в течение 30 мин. После насыщения лунку в ленте удалили (одновременно с одним из покрытий из анти-CRP) из области электрода и сушили ЭЭ-чип при 30°C в течение 2,5 часов.
Подобным образом, анти-CRP был нанесен путем инкубирования (в лунку в ленте на другом электроде) антитела (20 мкг/мл, 150 мкл) в течение 2 часов при комнатной температуре с 50 мМ Трис-HCl буфера (pH 7,8 с 0,05% NaN3 и 0,9% NaCl). После инкубирования углубление в ленте трижды промыли промывочным раствором (50 мМ Трис-HCl буфер pH 7,8 с 0,9% NaCl, 0,09% NaN3 и 0,05% Tween 20). После промывания покрытый электрод насыщали путем инкубирования насыщающего раствора (50 мМ Трис-HCl pH 7,8 с 0,05% NaN3, 0,9% NaCl, 0,1% BSA и 6:%D-сорбитол и 1 мМ CaCl2) в лунке в ленте в течение 30 минут. После насыщения лунку в ленте удалили (одновременно с одним из этапов покрытия анти-TSH) из области электрода и ЭЭ-чип сушили при 30°C в течение 2,5 часов.
Маркированные антитела сушили на мембране следующим образом. Антитело анти-hCRP (74 мкг/мл, Medix Biochemica Oy Ab анти-hCRP клон 6404), маркированное Tb(III) хелатом (Tb-2,6-бис[N,N-бис(карбоксиметил)аминометил-4-бензоилфенол), и антитело анти-hTSH (80 мкг/мл, клон 5404, Medix Biochemica Oy Ab), маркированное тем же Tb(III) хелатом, растворили в 50 мМ Трис-HCl буфера (pH 7,7, 0,05% NaN3, 0,9% NaCl, 0,5% BSA, 0,05% бычьего гамма-глобулина 0,01% Tween 20, 1 мМ CaCl2×H2O). 0,5 мкл раствора антитело-буфер пикетировали в середину мембраны (10×10 мм, Nuclepore Membrane 112110, Whatman) и сушили в течение ночи при комнатной температуре в комнатной атмосфере.
Стандартные образцы hCRP, необходимые в иммуноферментном исследовании (содержание CRP 1, 10 и 100 нг/мл), были приготовлены в тестовых трубках путем разбавления стандартного раствора CRP (Scripps, кат. № С0124) 50 мМ Трис-HCl буфером (pH 7,7, 0,05% NaN3, 0,9% NaCl, 0,5% BSA, 1 мМ CaCl2×H2O). Аналогичным образом стандартные образцы TSH (1, 10 и 100 мIU/мл) были приготовлены разбавлением стандарта TSH (324 мIU/мл, Wallac, DELFIA hTSH kit) буфером 50 мМ Трис-HCl (pH 7,7, 0,05% NaNa, 0,9% NaCl).
Иммуноферментный анализ выполняли так, что исходно и ЭЭ-чип, и пористая мембрана были сухими. Мембрану приложили точно на верхнюю часть области ячейки ЭЭ-чипа, образованную лункой в ленте, и закрепили на месте лентой с другого конца. Начали иммуноферментный анализ с добавления 3,5 мкл обоих стандартов аналитов в середину пористой мембраны (CRP 0 нг/мл и TSH 0 мIU/мл; CRP 1 нг/мл и TSH 1 мIU/мл; CRP 10 нг/мл и TSH 10 мIU/мл; CRP 100 нг/мл и TSH 100 мIU/мл). После инкубирования в течение 10 мин при комнатной температуре мембрану удалили, область ячейки ЭЭ-чипа промыли промывочным буфером и добавили 80 мкл измерительного буфера (0,05 М Na2B4O7 b 2×10-4 М K2S2O8). Оба аналита были измерены таким образом, что первые 10 циклов возбуждения измеряли, когда анти-TSH - электрод работал как катод, затем изменяли полярность на другие 10 циклов, когда анти-CRP - электрод работал в качестве катода. Измерение повторили 5 раз и суммировали сигналы от обоих электродов. По результатам было установлено, что свет первично возникает на катоде, так как отклик TSH был получен от левого электрода, и видимо, такое двойное исследование работает, хотя не всегда имеет смысл измерять эти особенные составы, TSH и CRP, в одном образце. Результаты измерения представлены на фиг.8, параметры те же, что в примере 8.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО, СОСТОЯЩЕЕ ИЗ ПРОВОДНИКА, ИЗОЛЯТОРА, ПОРИСТОЙ ПЛЕНКИ, И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ АНАЛИТИЧЕСКИХ ИЗМЕРЕНИЙ, ОСНОВАННЫХ НА ЯВЛЕНИИ ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНЦИИ | 2006 |
|
RU2385455C2 |
| НОВЫЙ ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНТНЫЙ СОРЕАГЕНТ И СОДЕРЖАЩАЯ ЕГО ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНТНАЯ СИСТЕМА | 2022 |
|
RU2833869C2 |
| ГРАФИТОВЫЕ НАНОТРУБКИ В ЛЮМИНЕСЦЕНТНЫХ АНАЛИЗАХ И СПОСОБЫ ПРОВЕДЕНИЯ ТАКИХ АНАЛИЗОВ | 1997 |
|
RU2189043C2 |
| СПОСОБЫ ИЗМЕРЕНИЯ ЭЛЕКТРОХЕМИЛЮМИНЕСЦЕНТНЫХ ЯВЛЕНИЙ И ОПРЕДЕЛЕНИЯ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА И РЕАКТИВ | 1994 |
|
RU2116647C1 |
| ПРОТОЧНЫЕ ЯЧЕЙКИ И НАБОРЫ ДЛЯ СЕКВЕНИРОВАНИЯ | 2019 |
|
RU2823075C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ЛИЗИСА ВНУТРИГЛАЗНЫХ НОВООБРАЗОВАНИЙ | 2009 |
|
RU2409335C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ЛИЗИСА ВНУТРИГЛАЗНЫХ НОВООБРАЗОВАНИЙ | 2011 |
|
RU2463024C1 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ЛИЗИСА И ХИРУРГИЧЕСКОГО УДАЛЕНИЯ ВНУТРИГЛАЗНЫХ НОВООБРАЗОВАНИЙ | 2009 |
|
RU2406471C1 |
| СПОСОБ МНОГОАНАЛИТНОГО ИММУНОАНАЛИЗА С ИСПОЛЬЗОВАНИЕМ МИКРОЧАСТИЦ | 2007 |
|
RU2339953C1 |
| АНОД ДЛЯ КАЛИЙ-ИОННЫХ АККУМУЛЯТОРОВ | 2020 |
|
RU2731884C1 |
Изобретение относится к способам анализа и устройствам, пригодным для детектирования электрохемилюминесценции. Изобретение применимо, в особенности, для быстрой количественной диагностики при децентрализованном анализе, когда требуются особенно дешевые материалы для электродов, ячейки, одноразовые диагностические чипы и кассеты. Устройство для электрического возбуждения хелатов лантаноидов в растворах электролитов выполнено в виде электрохимической ячейки, содержащей чип с двумя электродами с функцией анода и катода. При этом в качестве хелатов лантаноидов выбраны хелаты тербия Tb(III), а электроды выполнены из углеродистой пасты или металла с покрытием из углеродистой пасты, на изолирующем материале, по технологиям печати, распыления или нанесения серебряной краской рисунка, выполненного под покрытие его углеродистой пастой после подсушивания рисунка, с одновременным формированием катода и анода или части анода как верхнего слоя углеродистой пасты с удельным сопротивлением, преимущественно, менее 1000 Ом·см. Техническим результатом является обеспечение высокой амплитудой электрических импульсов, а также повышение чувствительности. 3 з.п. ф-лы, 1 табл., 8 ил.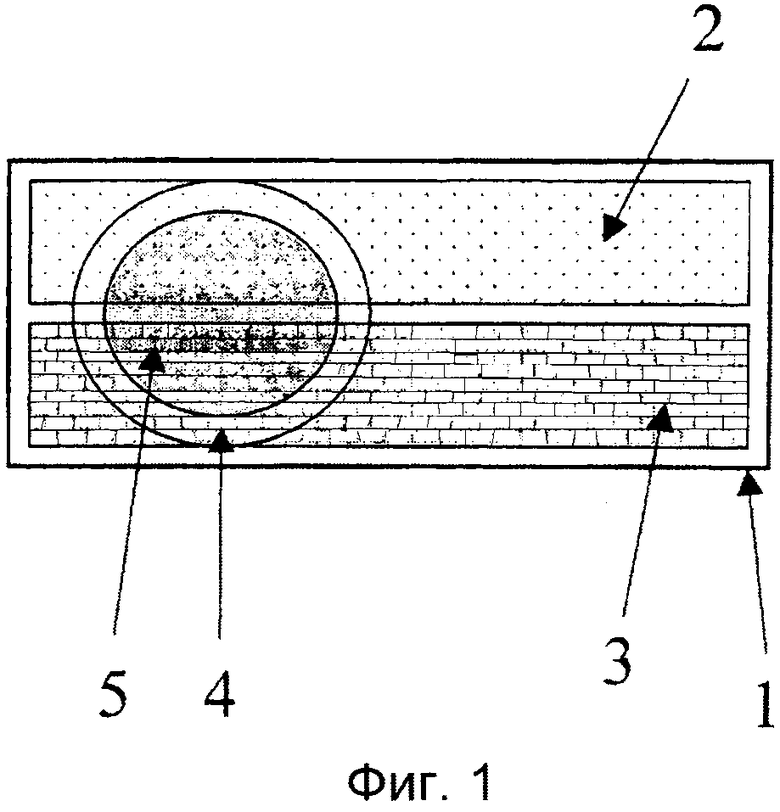
1. Устройство для электрического возбуждения хелатов лантаноидов в растворах электролитов, выполненное в виде электрохимической ячейки, содержащей чип с двумя электродами с функцией анода и катода, отличающееся тем, что в качестве хелатов лантаноидов выбраны хелаты тербия Tb(III), а электроды выполнены из углеродистой пасты или металла с покрытием из углеродистой пасты на изолирующем материале по технологиям печати, распыления или нанесения серебряной краской рисунка, выполненного под покрытие его углеродистой пастой после подсушивания рисунка, с одновременным формированием катода и анода или части анода как верхнего слоя углеродистой пасты с удельным сопротивлением, преимущественно, менее 1000 Ом·см.
2. Устройство по п. 1, отличающееся тем, что электроды выполнены с возможностью возбуждения хемилюминесценции хелатов тербия Tb(III) импульсами напряжения разной полярности.
3. Устройство по п. 1, отличающееся тем, что поверхность электродов обработана химическими веществами, включающими, преимущественно, гидрооксиды щелочных металлов и гидрооксиды щелочных редкоземельных металлов.
4. Устройство по п. 1, отличающееся тем, что поверхность электродов обработана кислотой из группы, включающей сернистую кислоту, хлористоводородную кислоту, фосфорную и уксусную кислоты.
| СПОСОБ ПРОИЗВОДСТВА КОНСЕРВОВ С ИСПОЛЬЗОВАНИЕМ СУШЕНОГО РАСТИТЕЛЬНОГО СЫРЬЯ | 2002 |
|
RU2217007C1 |
| СПОСОБ ПОЛУЧЕНИЯ РАССОЛА ДЛЯ ЭЛЕКТРОЛИЗА | 2007 |
|
RU2347746C2 |
| US 5308754 A 03.05.1994 | |||
| JP 0063196846 A 15.08.1988 | |||
| RU 2010124406 A 14.11.2008. | |||
Авторы
Даты
2015-11-20—Публикация
2011-06-10—Подача