Изобретение относится к полинуклеотидному кластеру из Rhodococcus, который содержит нуклеотидные последовательности, кодирующие полипептиды, которые обладают активностью нитрилгидратазы, вспомогательного белка Р15К, который активирует этот фермент, и транспортера кобальта, к микроорганизмам, которые трансформированы с помощью этого кластера и в которых нуклеотидные последовательности, кодирующие указанные белки, присутствуют в повышенном количестве, и к применению трансформированных микроорганизмов для получения амидов из нитрилов.
В литературе описано большое количество нитрилгидратаз (Synthetic applications of nitrile-converting enzymes; Martinkova, Ludmila; Mylerova, Veronika; Current Organic Chemistry, 7(13), 2003, cc.1279-1295). Уже с 1983 года нитрилгидратазы применяют для получения акриламида в количестве нескольких тонн в год. Этот биокаталитический процесс оказался конкурентоспособным с химическими процессами (Enzymic synthesis of acrylamide: a success story not yet over; Kobayashi, Michihiko; Nagasawa, Tom; Yamada, Trends in Biotechnology, 10(11), 1992, cc.402-408).
Кроме нитрилгидратаз, которые можно применять для превращения акрилонитрила, описаны также нитрилгидратазы, которые наиболее пригодны для превращения метакрилонитрила («A nitrile hydratase of Pseudonocardia thermophila and the genes encoding and manufacture of the enzyme for conversion of nitriles to amides» [нитрилгидратаза из Pseudonocardia thermophila и кодирующих генов и получение фермента для превращения нитрилов в амид] (ЕР 790310), 3-цианпиридин («A nitrile hydratase of Rhodococcus and its use in the manufacture of amides» [метод получения амидов с использованием нитрилгидратаз Rhodococcus] (WO 2002055670) или 2-гидроксинитрилов, таких как 2-гидрокси-4-метилтиобутиронитрил («A nitrile hydratase of Rhodococcus and its use in the manufacture of amides» [нитрилгидратаза из Rhodococcus и ее применение для производства амидов] (WO 2002070717) и «Enzymic conversion of α-hydroxynitriles to the corresponding α-hydroxyamides, acids or acid salts» [ферментативное превращение α-гидроксинитрилов в соответствующие α-гидроксиамиды, кислоты или кислотно-аддитивные соли] (WO 9832872)). В отличие от этого до настоящего времени не были известны нитрилгидратазы, которые можно применять для эффективного превращения 2-аминонитрилов. Хотя нитрилгидратаза из Rhodococcus sp. Cr4, например, высокоэффективно превращает 2-гидроксинитрилы, она совсем не обладает способностью превращать простой 2-аминонитрил, такой как аминоацетонитрил (WO 2002070717).
Ферментативное превращение аминонитрилов в соответствующие амиды представляет собой перспективный путь синтезирования аминокислот, поскольку 2-аминоамиды легко поддаются гидролизу (WO 2001060789). Этот процесс осуществляют в мягких условиях и с очень высокой степенью селективности, и он не сопровождается образованием побочных продуктов, таких как соли, которые накапливаются при химическом гидролизе.
В альтернативном варианте амиды можно превращать также в соответствующие соли или кислоты с помощью гидроксидов щелочных металлов или щелочноземельных металлов. Такой подход наиболее предпочтителен, когда используют гидроксид кальция для превращения 4-метилтио-α-гидроскибутирамида (МГА-амида), поскольку кальциевую соль МГА можно применять непосредственно в качестве пищевой добавки в виде формы продукта, который представляет собой альтернативу для метионина или МГА.
Однако для получения предназначенного для рынка продукта, такого как DL-метионин, недостаточно применять обладающий высокой активностью биокатализатор. Для повышения активности необходимо создать систему для экспрессии предназначенных для амплификации генов. Одним из возможных путей является гетерологичная экспрессия, например в Escherichia coli, Bacillus, Pseudomonas, Pichia, Sacharomyces или Aspergillus, поскольку эти микроорганизмы характеризуются быстрым ростом, позволяют достигать высокой плотности клеток и представляют собой пригодные молекулярно-биологические средства, которые обеспечивают очень высокие уровни экспрессии (Lee S.Y., High cell-density culture of Escherichia coli. TIBTECH 14, 1996, cc.98-105; Riesenberg D., Guthke R., High-cell-density cultivation of microorganisms. Appl Microbiol Biotechnol. 51, 1999, cc.422-430).
Известно, что необходимо осуществлять совместную экспрессию по меньшей мере трех генов для гетерологичной экспрессии нитрилгидратаз. В дополнение к двум структурным генам необходимо амплифицировать соответствующий вспомогательный белок как для зависимых от железа, так и для зависимых от кобальта ферментов (Nojiri M. и др., Functional expression of Nitrile hydratase in Escherichia coli: Requirement of a nitrile hydratase activator and a post-translational modification of a ligand cysteine. J Biochem 125, 1999, cc.696-704 и Over-production of stereoselective nitrile hydratase from Pseudomonas putida 5B in Escherichia coli: activity requires a novel downstream protein, Wu S.; Fallen, R. D.; Payne, M. S. Applied Microbiology and Biotechnology, 48(6), 1997, cc.704-708).
Помимо указанных трех генов наряду со структурными генами и вспомогательными генами белка в кластере генов Rhodococcus rhodochrous J1 был обнаружен еще один ген, кодирующий транспортер кобальта (Komeda, Hidenobu и др., A novel transporter involved in cobalt uptake. Proceedings of the National Academy of Sciences of the United States of America, 94(1), 1997, cc.36-41). Сверхэкспрессия как в Rhodococcus, так и в Е.coli приводит к повышенному поглощению ионов Со2+ из культуральной среды. Кроме того, установлено, что при совместной экспрессии транспортера кобальта и трех других белков оказывается возможным достигать такой же активности нитрилгидратазы при использовании концентрации Со в среде, существенно меньшей по сравнению с вариантом, когда экспрессируются только структурные гены и вспомогательный белок. Однако согласно данным, приведенным у Komeda и др., этот эффект достигается в Rhodococcus только при концентрациях менее 42 мкМ.
В ЕР 0362829 описана ферментация Rhodococcus rhodochrous в присутствии солей кобальта.
В основу изобретения была положена задача получить пригодные нитрилгидратазы, которые обладают высокой активностью и которые прежде всего обладают способностью превращать α-аминонитрилы в амиды.
В изобретении предложены следующие объекты:
1. Выделенные полинуклеотидные кластеры, выделенные из Rhodococcus, прежде всего из Rhodococcus opacus, которые содержат четыре нуклеотидные последовательности, которые кодируют четыре полипептида, аминокислотные последовательности которых в каждом случае по меньшей мере на 90% идентичны аминокислотным последовательностям, представленным в SEQ ID NO:2 - SEQ ID NO:5, причем полипептиды обладают активностью нитрилгидратазы, содержащей α-субъединицу и β-субъединицу, вспомогательного белка Р15К и транспортера кобальта.
2. Полинуклеотиды, выбранные из группы, включающей:
а) полинуклеотид, который представляет собой фрагмент, простирающийся от положения 1 до положения 708 нуклеотидной последовательности, представленной в SEQ ID NO:1 или комплементарной ей нуклеотидной последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют β-субъединицу нитрилгидратазы.
3. Полинуклеотиды, выбранные из группы, включающей:
а) полинуклеотид, который представляет собой фрагмент, простирающийся от положения 710 до положения 1327 нуклеотидной последовательности, представленной в SEQ ID NO:1 или комплементарной ей последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпункте а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпункте а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют α-субъединицу нитрилгидратазы.
4. Полинуклеотиды, выбранные из группы, включающей:
а) полинуклеотид, который представляет собой фрагмент, простирающийся от положения 1324 до положения 1737 нуклеотидной последовательности SEQ ID NO:1 или комплементарной ей последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации, где полинуклеотиды кодируют вспомогательный белок Р15К.
5. Полинуклеотиды, выбранные из группы, включающей:
а) полинуклеотид, который представляет собой фрагмент, простирающийся от положения 2076 до положения 3146 нуклеотидной последовательности SEQ ID NO:1 или комплементарной ей последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют белок, обладающий активностью транспортера кобальта.
6. Полипептид, указанный в подпункте 2) или 3), который содержит аминокислотные последовательности, представленные в SEQ ID NO:2 и SEQ ID NO:3, где полипептид обладает активностью нитрилгидратазы.
7. Полипептид, указанный в подпункте 4), который имеет аминокислотную последовательность, представленную в SEQ ID NO:6, где полипептид обладает активностью вспомогательного белка Р15 К.
8. Полипептид, указанный в подпункте 5), который имеет аминокислотную последовательность, представленную в SEQ ID NO:5, где полипептид обладает активностью транспортера кобальта.
9. Зонд или праймер, который содержит по меньшей мере 20 последовательно расположенных нуклеотидов из фрагмента, простирающегося от положения 1 до положения 1327 нуклеотидной последовательности SEQ ID NO:1 или ее комплементарной формы.
10. Зонд или праймер, который содержит по меньшей мере 20 последовательно расположенных нуклеотидов из фрагмента, простирающегося от положения 1324 до положения 1737 нуклеотидной последовательности SEQ ID NO:1 или ее комплементарной формы.
11. Зонд или праймер, который содержит по меньшей мере 20 последовательно расположенных нуклеотидов из фрагмента, простирающегося от положения 2076 до положения 3146 нуклеотидной последовательности SEQ ID NO:1 или ее комплементарной формы.
12. Выделенный полинуклеотид, указанный в подпунктах 2) и 3), который гибридизуется в строгих условиях с комплементом, простирающимся от положения 1 до положения 1327 SEQ ID NO:1, где строгие условия включают отмывку в 5xSSC при температуре от 50 до 68°С.
13. Выделенный полинуклеотид, указанный в подпункте 4), который гибридизуется в строгих условиях с комплементом, простирающимся от положения 1324 до положения 1737 SEQ ID NO:1, где строгие условия включают отмывку в 5xSSC при температуре от 50 до 68°С.
14. Выделенный полинуклеотид, указанный в подпункте 5), который гибридизуется в строгих условиях с комплементом, простирающимся от положения 2076 до положения 3146 SEQ ID NO:1, где строгие условия включают отмывку в 5xSSC при температуре от 50 до 68°С.
15. Векторы, которые содержат полинуклеотид(ы), выбранный(ые) из числа указанных в подпунктах 1)-5) и 12)-14), или в 2), 3) и 4) или в 5).
16. Вектор pUD15, имеющий нуклеотидную последовательность, представленную в SEQ ID No.24, которая содержит последовательности, указанные в подпунктах 2), 3) и 6) из SEQ ID NO:1, где стартовый кодон gtg заменен atg.
17. Вектор pUD16, имеющий нуклеотидную последовательность, представленную в SEQ ID NO:25, которая содержит последовательности, указанные в подпункте 5), где стартовый кодон ttg заменен atg.
18. Клетка-хозяин, трансформированная или трансфектированная путем введения полинуклеотида, указанного в подпунктах 1)-5) и 12)-14). Клетка-хозяин может представлять собой эукариотическую или прокариотическую клетку, в отношении которой известно, что ее экспрессионная система характеризуется требуемой стабильностью.
19. Клетка-хозяин, трансформированная путем введения вектора, указанного в подпунктах 15)-17).
20. Трансформированная клетка-хозяин, указанная в подпункте 18) или 19), где клетка-хозяин представляет собой бактерию семейства Enterobacteriaceae, прежде всего Escherichia.
Векторную ДНК можно интродуцировать в эукариотические или прокариотические клетки с помощью известных методов трансформации или трансфекции.
Понятия «трансформация», «трансфекция», «конъюгация» и «трансдукция» относятся к методам введения чужеродной ДНК, которые известны из существующего уровня техники.
Изобретение относится также к полинуклеотидам, которые практически состоят из полинуклеотидной последовательности, которую можно получать путем скрининга с использованием гибридизации соответствующего банка генов Rhodococcus opacus, который содержит полный ген или его фрагменты, с зондом, который содержит последовательности полинуклеотидов, предлагаемых в изобретении, из SEQ ID NO:1, или их фрагменты, и выделения указанной полинуклеотидной последовательности.
Полинуклеотиды, которые имеют последовательности, предлагаемые в изобретении, можно применять в качестве зондов гибридизации для РНК, кДНК и ДНК, для цели выделения полноразмерных нуклеиновых кислот или полинуклеотидов или генов, которые кодируют белки, предлагаемые в изобретении, или для выделения нуклеиновых кислот или полинуклеотидов или генов, последовательности которых имеют высокую степень сходства с последовательностями генов, предлагаемых в изобретении. Их можно применять также в качестве зондов для так называемых «наборов», «микронаборов» или «ДНК-чипов» для обнаружения и определения соответствующих полинуклеотидов или выведенных из них последовательностей, таких, например, как РНК или кДНК.
Полинуклеотиды, которые имеют последовательности, предлагаемые в изобретении, можно применять также в качестве праймеров, которые можно использовать в полимеразной цепной реакции (ПЦР) для получения ДНК из генов, которые кодируют белки, предлагаемые в изобретении.
Такие олигонуклеотиды, служащие в качестве зондов или праймеров, содержат по меньшей мере 25 или 30, предпочтительно по меньшей мере 20, наиболее предпочтительно по меньшей мере 15 последовательно расположенных нуклеотидов. Можно применять также олигонуклеотиды, состоящие по меньшей мере из 40 или 50 нуклеотидов. При необходимости можно применять олигонуклеотиды, состоящие по меньшей мере из 100, 150, 200, 250 или 300 нуклеотидов.
«Выделенный» означает выделенный из его естественного окружения.
Как правило, понятие «полинуклеотид» относится к полирибонуклеотидам и полидезоксирибонуклеотидам, причем это может относиться к модифицированной или немодифицированной РНК или ДНК.
Полинуклеотиды, предлагаемые в изобретении, включают полинуклеотиды, последовательность которых представлена в SEQ ID NO:1, или содержащиеся в ней фрагменты, а также полинуклеотиды, которые идентичны по меньшей мере на 90, 93, 95, 97 или 99% полинуклеотидам, имеющим последовательность, представленную в SEQ ID NO:1, или содержащиеся в ней фрагменты.
Понятие «полипептиды» обозначает пептиды или белки, которые содержат две или большее количество аминокислот, связанных пептидными связями.
Полипептиды, предлагаемые в изобретении, включают полипептиды, последовательности которых представлены в SEQ ID NO:2 - SEQ ID NO:4 и SEQ ID NO:6, а также полипептиды, которые по меньшей мере на 90% и наиболее предпочтительно по меньшей мере на 91, 95, 97 или 99% идентичны полипептидам, последовательности которых представлены в SEQ ID NO:2 - SEQ ID NO:4 и SEQ ID NO:6.
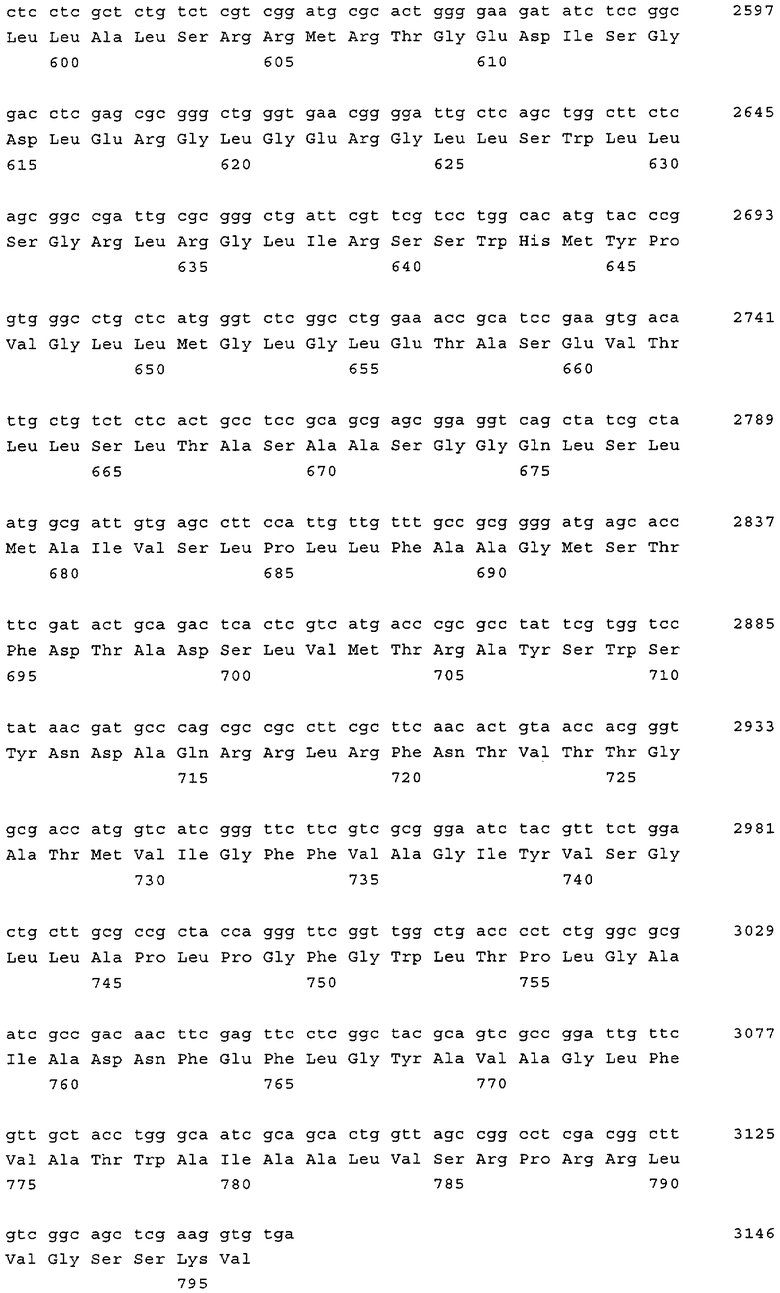
Полинуклеотидная последовательность, представленная в SEQ ID NO:1, включает несколько индивидуальных последовательностей, которые кодируют различные белки. Последовательности α-субъединицы и вспомогательного белка Р15К перекрываются.
Для получения активного белка гены, кодирующие α-субъединицу и β-субъединицу нитрилгидратазы, следует экспрессировать совместно.
SEQ ID NO:2 представляет собой аминокислотную последовательность β-субъединицы, a SEQ ID NO:3 представляет собой последовательность α-субъединицы белка, обладающего активностью нитрилгидратазы.
SEQ ID NO:2 представляет собой фрагмент, простирающийся от положения 1 до положения 708, а SEQ ID NO:3 представляет собой фрагмент, простирающийся от положения 710 до положения 1327 нуклеотидной последовательности, представленной в SEQ ID NO:1.
Аминокислотная последовательность так называемого вспомогательного белка Р15К представлена в SEQ ID NO:6, которая соответствует положениям от 1324 до 1737 нуклеотидной последовательности, представленной в SEQ ID NO:1.
Вспомогательный белок активирует нитрилгидратазу, и он должен присутствовать наряду с указанным ферментом в микроорганизме, который продуцирует нитрилгидратазу.
SEQ ID NO:4 представляет собой аминокислотную последовательность транспортера кобальта, и она является фрагментом нуклеотидной последовательности, представленной в SEQ ID NO:1, которая простирается от положения 2076 до положения 3146.
Программа PatentIN Version 3.1 интерпретирует стартовый кодон ttg в SEQ ID NO:4 как лейцин и интерпретирует стартовый кодон gtg в SEQ ID NO:6 как валин. Правильно считать, что стартовым кодоном является аминокислота метионин.
При создании изобретения было установлено, что нитрилгидратазная активность в Е.coli повышается во много раз при совместной экспрессии с транспортером кобальта. Это имеет место также в том случае, когда в среде используют высокие концентрации кобальта, которые на несколько порядков превышают концентрации, встречающиеся в естественных условиях. При создании изобретения неожиданно было установлено, что совместная экспрессия транспортера кобальта не приводит ни к какому отравлению организма, а только к слабому повышению чувствительности клеток к высокой концентрации кобальта в среде.
Для выделения кластера генов, предлагаемых в изобретении, как правило, сначала получают генную библиотеку рассматриваемого микроорганизма в Escherichia coli (E.coli). Получение генных библиотек описано в широко известных учебниках и справочниках. Следует упомянуть учебник Winnacker: Gene und Klone, Eine Einfuhrung in die Gentechnologie [Genes and clones, an introduction to recombinant DNA technology] (изд-во Verlag Chemie, Weinheim, Germany, 1990) или справочник Sambrook и др.: Molecular Cloning, A Laboratory Manual (изд-во Cold Spring Harbor Laboratory Press, 1989). Широко известной генной библиотекой является библиотека штамма Е.coli K-12 W3110, которую создали Kohara и др. (Cell 50, 1987, cc.495-508) в λ-векторах. У Bathe и др. (Molecular and General Genetics, 252:255-265, 1996) описана генная библиотека C.glutamicum ATCC13032, которая создана в штамме Е.coli K-12 NM554 (Raleigh и др., Nucleic Acids Research 16, 1988, cc.1563-1575) с использованием космидного вектора SuperCos I (Wah1 и др., Proceedings of the National Academy of Sciences USA, 84, 1987, cc.2160-2164).
Для получения библиотеки в Е.coli можно применять также такие плазмиды, как pBR322 (Bolivar, Life Sciences, 25, 1979, cc.807-818) или pUC9 (Vieira и др., Gene, 19, 1982, cc.259-268). В качестве хозяев можно применять, прежде всего, штаммы Е.coli, которые имеют дефекты, полученные в результате рестрикции и рекомбинации. Примером одного из таких штаммов является штамм DH5αmcr, описанный у Grant и др. (Proceedings of the National Academy of Sciences USA, 87, 1990, cc.4645-4649). Длинные клонированные с использованием космид ДНК-фрагменты можно затем субклонировать в обычных векторах, пригодных для секвенирования, и после этого секвенировать, например, с помощью метода, описанного у Sanger и др. (Proceedings of the National Academy of Sciences of the United States of America, 74, 1977, cc.5463-5467).
Полученные последовательности ДНК можно затем изучать с помощью известных алгоритмов или программ анализа последовательностей, таких как программы Staden (Nucleic Acids Research 14, 1986, cc.217-232), Marck (Nucleic Acids Research 16, 1988, cc.1829-1836) или программы GCG, разработанной Butler (Methods of Biochemical Analysis 39, 1998, cc.74-97).
Кодирующие последовательности ДНК, которые получают из последовательностей, представленных в SEQ ID NO:1, в результате вырожденности генетического кода также являются составной частью изобретения. Аналогично этому составной частью изобретения являются последовательности ДНК, которые гибридизуются с этими последовательностями или их фрагментами. Кроме того, в данной области известны консервативные аминокислотные замены, такие как замена в белках глицина аланином или аспарагиновой кислоты глутамовой кислотой, так называемые «смысловые мутации», которые не приводят к существенному изменению активности белка, т.е. являются функционально нейтральными. Кроме того, известно, что замены на N-конце и/или С-конце белка не приводят к существенному ухудшению функции белка или даже могут стабилизировать ее. Специалист в данной области может найти соответствующие указания, в частности, у Ben-Bassat и др. (Journal of Bacteriology 169, 1987, cc.751-757), O'Regan и др. (Gene 77, 1989, cc.237-251), Sahin-Toth и др. (Protein Sciences 3, 1994, cc.240-247) и у Hochuli и др. (Bio/Technology 6, 1988, cc.1321-1325) и в известных учебниках по генетике и молекулярной биологии.
Наконец, составной частью изобретения являются последовательности ДНК, которые получают с помощью полимеразной цепной реакции (ПЦР) с использованием праймеров, которые получают из SEQ ID NO:1. Такие олигонуклеотиды, как правило, состоят по меньшей мере из 15 нуклеотидов.
Специалист в данной области может найти инструкции для идентификации последовательностей ДНК с помощью гибридизации среди прочего в руководстве "The DIG System Users Guide for Filter Hybridization", опубликованном компанией Boehringer Mannheim GmbH (Маннгейм, Германия, 1993) и у Liebl и др. (International Journal of Systematic Bacteriology, 41, 1991, cc.255-260). Гибридизацию осуществляют в строгих условиях, т.е. когда образуются гибриды, которые представляют собой только те гибриды, в которых зонд и последовательность-мишень, т.е. полинуклеотиды, которые взаимодействуют с зондом, идентичны по меньшей мере на 90%. Известно, что на строгость гибридизации, в том числе на стадиях отмывки, можно влиять или оказывать определяющее воздействие путем вариации состава буфера, температуры и концентрации соли. Реакцию гибридизации предпочтительно осуществляют при строгости, существенно меньшей по сравнению со строгостью на стадиях отмывки (Hybaid Hybridisation Guide, изд-во Hybaid Limited, Teddington, UK, 1996).
Например, для реакции гибридизации можно использовать 5×SSC-буфер при температуре примерно 50-68°С. В этих условиях зонды можно гибридизовать также с полинуклеотидами, которые идентичны последовательности зонда менее чем на 70%. Такие гибриды являются менее стабильными и удаляются при отмывке в строгих условиях. Это можно осуществлять, например, путем понижения концентрации соли до 2×SSC и при необходимости затем до 0,5×SSC (The DIG System User's Guide for Filter Hybridisation, фирма Boehringer Mannheim, Маннгейм, Германия, 1995), при этом температуру устанавливают на уровне примерно 50-68°С. При необходимости можно понижать концентрацию соли до 0,1×SSC. Путем ступенчатого повышения температуры гибридизации от 50 до 68°C с интервалами примерно 1-2°С можно выделять полинуклеотидные фрагменты, которые идентичны, например, по меньшей мере на 90-95% последовательности используемого зонда. Дополнительные инструкции по гибридизации поступают в продажу в составе наборов (например DIG Easy Hyb, поставляемый фирмой Roche Diagnostics GmbH, Маннгейм, Германия, каталожный номер 1603558).
Специалист в данной области может найти инструкции для амплификации последовательностей ДНК с использованием полимеразной цепной реакции (ПЦР), в частности, в справочнике Gait: Oligonucleotide synthesis: A Practical Approach (изд-во IRL Press, Oxford, UK, 1984) и у Newton и Graham: PCR (изд-во Spektrum Akademischer Verlag, Heidelberg, Germany, 1994).
В целом подход заключается в том, что клонируют ген, который обладает высоким уровнем экспрессии, в векторе с небольшим количеством копий и клонируют гены, которые обладают более низким уровнем экспрессии, в векторе с большим количеством копий и/или с использованием сильного промотора. Клетки-хозяева трансформируют указанными векторами так, что они в каждом случае содержат по сравнению с исходным организмом по меньшей мере одну дополнительную копию нуклеотидных последовательностей, кодирующих образование нитрилгидратазы или других белков.
Было установлено, что предпочтительно осуществлять экспрессию гена, кодирующего транспортер кобальта, с низким уровнем, например, с использованием вектора с малым количеством копий, т.е. по меньшей мере на одну копию меньше, чем для полинуклеотидных последовательностей, которые кодируют α- и β-субъединицы и вспомогательный белок Р15К. Для достижения различной экспрессии этих генов можно использовать также промоторы с различной активностью.
Нуклеотиды, кодирующие α- и β-субъединицы, с одной стороны, и вспомогательный белок, с другой стороны, предпочтительно следует располагать совместно на одном векторе под контролем одного общего промотора или различных промоторов.
Полученные таким путем трансформированные или рекомбинантные микроорганизмы также являются составной частью изобретения.
Было установлено, что амплификация генов, кодирующих нитрилгидратазу, вспомогательный белок Р15К и транспортер кобальта в микроорганизмах приводит к повышению производства нитрилгидратазы или также к повышению активности нитрилгидратазы.
В контексте настоящего описания понятие «амплификация» обозначает повышение в микроорганизме внутриклеточной активности одного или нескольких ферментов, кодируемых соответствующей ДНК, за счет, например, увеличения количества копий гена или генов, использования более сильного промотора или гена, кодирующего соответствующий фермент с более высокой активностью, и при необходимости сочетания этих мер.
Для достижения сверхэкспресии можно подвергать мутации промоторную или регуляторную область или сайт связывания рибосом, расположенный против хода транскрипции относительно структурного гена. Таким же образом действуют кассеты экспрессии, встроенные против хода транскрипции относительно структурного гена. Кроме того, экспрессию можно повышать в процессе ферментативного получения аминокислот с помощью индуцибельных промоторов. Экспрессию можно повышать также с помощью увеличения жизни мРНК.
Кроме того, ферментативную активность можно повышать также путем ингибирования разложения обладающего ферментативной активностью белка. При этом гены или генные конструкции могут либо находиться в различном количестве копий в плазмидах, либо их интегрируют в хромосому и амплифицируют. В альтернативном варианте для достижения сверхэкспрессии рассматриваемых генов можно изменять состав среды и условия культивирования.
Как правило, используемые методы амплификации, прежде всего сверхэкспрессии, повышают активность или концентрацию соответствующего белка по меньшей мере на 10, 25, 50, 75, 100, 150, 200, 300, 400 или 500% и максимум вплоть до 1000 или 2000% по сравнению с белком дикого типа или активностью или концентрацией белка в микроорганизмах, которые не были трансформированы с помощью нуклеотидных последовательностей, предлагаемых в изобретении.
Изобретение относится также к созданию векторов, которые, как правило, автономно размножаются в выбранных штаммах-хозяевах, совместимых друг с другом, и которые содержат по меньшей мере нуклеотидные последовательности, указанные в подпунктах 2, 3 и 4, или нуклеотидную последовательность, указанную в подпункте 4.
Векторную ДНК можно интродуцировать в эукариотические или прокариотические клетки с помощью известных методов трансформации.
В качестве организмов-хозяев предпочтительно используют такие микроорганизмы, как Pseudomonas, Pichia, различные виды дрожжей, представителей семейств Saccaromyces, Aspergillus или Streptomyces, прежде всего Е.coli, для которых существуют экспрессионные системы. Можно применять также микроорганизмы рода Rhodococcus.
Изобретение относится также к способу получения нитрилгидратазы из Rhodococcus, прежде всего Rhodococcus opacus, или микроорганизмов, содержащих этот фермент, заключающемуся в том, что
а) трансформированный микроорганизм, который содержит сверхэкспрессируемый ген, имеющий нуклеотидные последовательности, указанные в п.п.1-4, подвергают ферментации в присутствии Со2+ в концентрации от 0,15 до 4 мМ (ммолей/л), в частности от 0,3 до 4 мМ, в условиях, которые обеспечивают образование нитрилгидратазы,
б) дают накопиться этому ферменту в микроорганизме, и
в) указанный фермент выделяют из клеток, или
г) собирают микроорганизмы и выделяют в виде покоящихся клеток, которые содержат фермент.
Полученная рекомбинантным путем нитрилгидратаза превращает α-аминонитрилы с активностью, составляющей >50 ед./мг биомассы в сухом состоянии.
Ферментацию предпочтительно осуществляют в присутствии Со2+ в концентрации от 0,5 до 3,5 мМ, в частности от 0,7 до 3 мМ, который предпочтительно добавляют к ферментативному бульону в виде растворимой соли.
Микроорганизмы, предлагаемые в изобретении, можно культивировать непрерывно или периодически с использованием периодического процесса (культивирование партий) или периодического процесса с подпиткой или периодического процесса с повторяющейся подпиткой. Обзор известных методов культивирования можно найти в учебнике Chmiel (Bioprozeβtechnik 1. Einführung in die Bioverfahrenstechnik [Bioprocess technology 1. Introduction to bioprocess technology] (изд-во Gustav Fischer Verlag, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen [Bioreactors and peripheral equipment] (изд-во Vieweg Verlag, Braunschweig-Wiesbaden, 1994)).
Предназначенная для использования культуральная среда предпочтительно должна быть адаптирована к конкретным штаммам.
Описания культуральных сред для различных микроорганизмов можно найти в справочнике "Manual of Methods for General Bacteriology", опубликованном Американским обществом бактериологии (Washington D.C., USA, 1981).
В качестве источников углерода можно применять сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, мелассы, крахмал и целлюлоза, масла и жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти субстанции можно применять индивидуально или в виде смесей.
В качестве источников азота можно применять азотсодержащие соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкость, полученную после замачивания зерен кукурузы до разбухания, соевую муку и мочевину, или неорганические соединения, такие как сульфат аммония, хлорид аммония, карбонат аммония и нитрат аммония. Источники азота можно применять индивидуально или в виде смесей.
В качестве источников фосфора можно использовать фосфорную кислоту, кислый фосфат калия или вторичный кислый фосфат калия или соответствующие содержащие натрий соли. Кроме того, культуральная среда может содержать соли металлов, такие как сульфат магния или сульфат железа, которые необходимы для роста. Наконец, можно применять такие необходимые для роста субстанции, как аминокислоты и витамины. Вышеуказанные субстанции можно добавлять в культуру в виде одноразовой добавки или добавлять соответствующим образом в процессе культивирования.
Для контроля значения pH культуральной среды можно применять соответственно либо основания, такие как гидроксид натрия, гидроксид калия, аммиак или аммиачную воду, либо кислоты, такие как фосфорная кислота или серная кислота. Для контроля пенообразования можно использовать противовспенивающие агенты, такие как полигликолевые эфиры жирной кислоты. Для поддержания стабильности плазмид можно добавлять соответствующие конкретной среде вещества, обладающие избирательным действием, такие, например, как антибиотики. Для поддержания аэробных условий в культуру вводят кислород и содержащие кислород газовые смеси, такие, например, как воздух. Температура культуральной среды, как правило, составляет от 10 до 40°С и предпочтительно от 10 до 30°С. Культивирование продолжают до тех пор, пока культура находится на логарифмической фазе роста. Как правило, эта цель достигается в течение периода времени от 10 до 70 ч.
Изобретение относится также к способу ферментативного получения амидов из нитрилов, который заключается в том, что:
а) превращают содержащее нитрильную группу соединение с использованием фермента из Rhodococcus, прежде всего Rhodococcus opacus, который обладает нитрилгидратазной активностью, и
б) при необходимости выделяют амид.
В одном из вариантов способа клетки собирают, промывают и вносят в виде суспензии в буфер при значении pH 5-9, в частности от 6,8 до 7,9. Концентрация покоящихся клеток, как правило, составляет 1-25%, в частности от 1,5 до 15% (масса во влажном состоянии/объем). Можно повышать проницаемость клеток с помощью физических или химических методов, например, с использованием толуола, как это описано у Wilms и др., J. Biotechnol., том 86, 2001, сс.19-30, так, чтобы предназначенные для превращения нитрильные соединения могли проникать через стенку клетки и образующиеся амиды могли выходить наружу.
Биокатализатор (катализатор в виде целых клеток) обладает выраженной стабильностью, что позволяет достигать концентраций, превышающих 100 г/л.
Для выделения нитрилгидратазы, предлагаемой в изобретении, из клеток, если необходимо очищать ее и применять для превращения нитрилов, можно использовать также известные методы.
Изобретение относится также к способу, отличающемуся тем, что соединения общих формул


в которых:
Х обозначает ОН, Н, алкил, имеющий от 1 до 4 атомов углерода, арил, или, прежде всего, NH2;
R обозначает Н, насыщенный алкильный радикал с разветвленной или неразветвленной цепью, имеющий от 1 до 12 атомов углерода, необязательно замещенный NH2,
алкенильные радикалы с разветвленной или неразветвленной цепью, имеющие от 1 до 12 атомов углерода, циклоалкильные группы, имеющие от 3 до 6 атомов углерода,
алкиленовые радикалы, замещенные алкилтиогруппой, где алкил в рассматриваемом случае представляет собой C1-С3алкильный радикал и алкилен представляет собой двухвалентный С3-С8алкиленовый радикал,
R' обозначает Н или алкил, имеющий от 1 до 3 атомов углерода,
R'' обозначает одноядерное или двухядерное ароматическое кольцо, имеющее от 6 до 12 атомов углерода, и которое необязательно замещено одной или двумя C1-С3алкильными группами или Cl или F, алкилнитрил, имеющий от 1 до 6 атомов углерода,
превращают в соответствующие амиды.
Предпочтительно превращают следующие нитрилы:
насыщенные мононитрилы:
ацетонитрил, пропионитрил, бутиронитрил, изобутиронитрил, валеронитрил, изовалеронитрил и капронитрил,
насыщенные динитрилы:
малонитрил, сукцинонитрил, глутаронитрил и адипонитрил,
ароматические незамещенные и замещенные мононитрилы и динитрилы:
бензонитрил, 2,6-дифторбензонитрил, изофталонитрил и терефталонитрил,
α-аминонитрилы:
α-аминопропионитрил, α-аминометилтиобутиронитрил, α-аминобутиронитрил, аминоацетонитрил, все нитрилы, являющиеся производными встречающихся в естественных условиях аминокислот, α-амино-3,3-диметилпропионитрил и α-амино-2,3-диметилпропионитрил,
нитрилы, содержащие карбоксильные группы:
циануксусная кислота
β-аминонитрилы:
3-аминопропионитрил,
ненасыщенные нитрилы:
акрилонитрил, метакрилонитрил, аллилцианид и кротонитрил,
α-гидроксинитрилы:
α-гидрокси-н-пропионитрил, α-гидрокси-н-бутиронитрил, α-гидроксиизобутиротитрил, α-гидрокси-н-гексанонитрил, α-гидрокси-н-гептонитрил, α-гидрокси-н-октанонитрил, α,γ-дигидрокси-β,β-диметилбутиронитрил, акролеинциангидрин, метакрилальдегидциангидрин, 3-хлорлактонитрил, 4-метилтио-α-гидроксибутиронитрил и α-гидрокси-α-фенилпропионил.
Концентрация подлежащего превращению нитрила в реакционном растворе не ограничена какими-либо определенными пределами.
Для того чтобы избежать ингибирования ферментативной активности субстратом, как правило, концентрацию нитрила поддерживают на уровне от 0,001 до 10 мас.%, предпочтительно от 0,1 до 2 мас.%, в пересчете на количество биокатализатора в виде массы клеток в сухом состоянии. Можно добавлять весь субстрат в начале реакции или субстрат можно добавлять непрерывно или периодически в процессе реакции.
Если растворимость нитрильного соединения в водной реакционной системе является слишком малой, то можно добавлять солюбилизатор.
Однако в альтернативном варианте реакцию можно осуществлять в двухфазной системе вода/органический растворитель.
Когда в качестве обладающего ферментативной активностью материала применяют клетки микроорганизма, то соотношение количества используемых клеток и субстрата предпочтительно составляет от 0,001 до 8 мас.% в пересчете на массу клеток в сухом состоянии.
Массу клеток в сухом состоянии определяют с помощью анализатора влажности МА45 Moisture Analyser (фирма Sartorius).
Можно также применять хорошо известные методы для иммобилизации выделенного фермента и последующего использования фермента в этой форме.
Реакцию, как правило, осуществляют при температурах от -5 до 50°С, в частности от 0 до 30°С, в течение периода времени от 0,1 до 100 ч.
Значение pH реакционной смеси, которое следует поддерживать, не ограничено конкретными значениями, если не ухудшается ферментативная активность. После реакции образовавшийся амид можно известным методом выделять из реакционного раствора и очищать.
Изобретение относится также к способу, с помощью которого амид или раствор, содержащий амид, выделяют, например, из клеточной биомассы и амид либо гидролизуют с получением соответствующей кислоты, либо превращают в соответствующие кислотно-аддитивные соли в присутствии гидроксидов щелочных металлов или щелочноземельных металлов. Предпочтительно МГА-амид гидролизуют с помощью гидроксида кальция и выделяют соответствующую кальциевую соль.
Примеры
Пример 1
Клонирование нитрилгидратазы из Rhodococcus opacus
Хромосомную ДНК Rhodococcus opacus расщепляли с помощью рестриктаз PinAI, PstI и XmaI (фирма Roche) и фрагменты разделяли на 0,8%-ом агарозном геле. Использовали стандартные методы (см., например у Sambrook и др: Molecular Cloning, A Laboratory Manual, изд-во Cold Spring Habor Laboratory Press, 1989) для осуществления Саузерн-блоттинга на несущей положительный заряд нейлоновой мембране (Hybond-N+, фирма Amersham). Гибридизацию осуществляли с использованием меченного с помощью DIG зонда согласно инструкциям производителя (фирма Roche). Зонды получали с помощью ПЦР с использованием вырожденных праймеров 1F и 1R и геномной ДНК в качестве матрицы. Праймеры получали из гомологичных областей β-субъединицы, причем эти области определяли путем сравнительного анализа последовательностей различных NНаз (нитрилгидратаз). Указанные последовательности получали из банков данных. Для выделения обнаруженного PinAI-фрагмента длиной примерно 2,2 т.п.н. расщепленные с помощью PinAI ДНК-фрагменты длиной от 2 до 2,5 т.п.н. очищали с помощью препаративного гель-электрофореза и встраивали путем лигирования в расщепленный с помощью XmaI вектор pUC18 (фирма Promega), и полученной в результате лигирования смесью трансформировали штамм Е.coli JM109 (фирма Promega). Позитивные трансформанты идентифицировали с помощью гибридизации колоний с использованием этого же зонда. Полученные таким путем клоны содержали вставку длиной 2206 нуклеотидов, содержащую ген β-субъединицы, и большую часть гена α-субъединицы нитрилгидратазы.
Для получения миссинг-последовательности вышеуказанный метод с применением праймеров 2F и 2R использовали для получения нового зонда, который гибридизуется с 3'-концом клонированного PinAI-фрагмента. PinAI-фрагмент, клонированный в pUC18, служил в качестве матрицы. До осуществления гибридизации с этим зондом прежде всего из описанной выше мембраны удаляли окрашивающие сигналы и первый зонд в соответствии с инструкциями производителя (фирма Roche). На этой мембране выявляли с использованием второго зонда полосу, соответствующую PstI размером примерно 2 т.п.н. Согласно описанному выше методу соответствующий ДНК-фрагмент клонировали в векторе pUC18, который расщепляли с помощью PstI, и продуктом трансформировали штамм Е.coli JM109; затем позитивные клоны идентифицировали с помощью гибридизации колоний. PstI-фрагмент состоял из 1883 нуклеотидов и содержал 3'-фрагмент гена α-субъединицы нитрилгидратазы, ген вспомогательного белка Р15К и 5'-фрагмент гена транспортера кобальта.
Для того чтобы клонировать ДНК-фрагмент, содержащий миссинг-последовательность гена транспортера кобальта, праймеры 3F и 3R и PstI-фрагмент, клонированные в pUC18, где этот фрагмент служил в качестве матрицы, использовали для получения нового зонда, который гибридизовался с 3'-концом клонированного PstI-фрагмента. Этот зонд использовали для обнаружения на этой же мембране полосы, соответствующей XmaI, длиной примерно 1,7 т.п.н., из которой предварительно удаляли окрашивающие сигналы и второй зонд. Соответствующий ДНК-фрагмент клонировали в векторе pUC18, который расщепляли с помощью XmaI, и продуктом трансформировали штамм Е.coli JM109; позитивные клоны идентифицировали с помощью гибридизации колоний. Для этой цели применяли зонд, который амплифицировали с использованием праймеров 4F и 3R. XmaI-фрагмент состоял из 1747 нуклеотидов и содержал 3'-фрагмент гена транспортера кобальта.
Непрерывная последовательность кластера генов, который содержит полинуклеотиды, кодирующие α- и β-субъединицы нитрилгидратазы, вспомогательный белок Р15К и транспортер кобальта, представлена в SEQ ID NO:1.
Пример 2
Конструирование экспрессионных векторов
Структурные гены клонировали в экспрессионном векторе, который, как известно, можно использовать для Е.coli, и в котором встроенные гены находились под контролем промотора рамнозы. Кроме того, встраивали второй промотор рамнозы. Для этой цели ген β-субъединицы амплифицировали с использованием праймеров 5F и 5R, которые обеспечивали встраивание сайтов расщепления, распознаваемыми рестриктазами NdeI, BamHI и HindIII. Второй промотор рамнозы амплифицировали с использованием праймеров 6F и 6R, которые обеспечивали встраивание сайтов расщепления, распознаваемых рестриктазами BamHI, NcoI и HindIII. Ген α-субъединицы амплифицировали с использованием праймеров 7F и 7R, которые обеспечивали встраивание сайтов расщепления, распознаваемых рестриктазами NcoI, KpnI и HindIII. Ген белка Р15К амплифицировали с использованием праймеров 8F и 8R, которые обеспечивали встраивание сайтов расщепления, распознаваемых рестриктазами KpnI и HindIII и замену стартового кодона GTG на ATG. Полученный таким путем экспрессионный вектор обозначили как pUD 15.
Рестрикционная карта представлена на фиг.1, а последовательность представлена в SEQ ID NO:24.
Ген транспортера кобальта клонировали в другом экспрессионном векторе Е.coli, в котором встроенные гены также находились под контролем промотора рамнозы. Для этого ген транспортера кобальта амплифицировали с использованием праймеров 9F и 9R, которые обеспечивали встраивание сайтов расщепления, распознаваемых рестриктазами NdeI и HindIII, и замену стартового кодона TTG на ATG. Полученный таким путем экспрессионный вектор обозначили как pUD 16.
Рестрикционная карта представлена на фиг.2, а последовательность представлена в SEQ ID NO:25.
Экспериментальными плазмидами трансформировали штамм Е.coli DSM 14459, который был депонирован в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ).
Праймеры:
Гены расположены на следующих сегментах:
Пример 3
Гетерологичная экспрессия нитрилгидратазы в штамме Е.coli DSM 14559
Штамм DSM 14559 был депонирован в связи с созданием патента DE 10155928.
Трансформированные с помощью pUD15 клетки выращивали при 37°С и при встряхивании в LB-среде (LB-бульон, приготовленный согласно Miller, VWR), которая содержала 1 мМ CoCl2 и 100 мкг ампициллина/мл. Клетки, трансформированные с помощью pUD15 и pUD16, выращивали аналогичным образом, среда дополнительно содержала 50 мкг хлорамфеникола/мл. Затем клетками трижды инокулировали такую же среду, чтобы ее оптическая плотность ОП600 достигала по меньшей мере 2. Через 12-16 ч основную культуру инокулировали таким количеством клеток, чтобы она имела ОП600 0,1. Хотя культуральная среда основной культуры соответствовала среде предварительной культуры, она дополнительно содержала 2 г/л L-рамнозы/л. Клетки собирали через 22 ч.
Пример 4
Определение ферментативной активности
Клетки выращивали согласно методу, описанному в примере 3, выделяли из культуральной среды центрифугированием и ресуспендировали в стандартном буфере (50 мМ калий-фосфатный буфер, pH 7,5). 50 мкл этой клеточной суспензии добавляли к 700 мкл стандартного буфера и для инициации реакции добавляли 250 мкл 200 мМ раствора нитрила в стандартном буфере. При этом концентрацию клеток в клеточной суспензии калибровали таким образом, чтобы 5-30% нитрила прореагировали в течение 10 мин при 20°С. После прохождения реакции в течение 10 мин при 20°С реакцию прекращали путем добавления 20 мкл фосфорной кислоты половинной крепости и клетки отделяли центрифугированием.
Под одной единицей активности (ед.) понимается количество фермента, которое превращает 1 мкмоль N-формилвалиннитрила в амид в течение одной минуты. Удельная активность представлена в виде количества ед. на мг биомассы в сухом состоянии (ед./мг СБМ).
Указанную характеристику измеряли с помощью анализатора влажности модели МА45 Moisture Analyser (фирма Sartorius).
Пример 5
Совместная экспрессия генов, кодирующих α-субъединицу, β-субъединиду нитрилгидратазы и белок р15К
Экспрессию осуществляли согласно методу, описанному в примере 3, с использованием трансформированного штамма Е.coli DSM 14459, который нес плазмиду pUD15. Удельная активность клеток составляла 23 ед./мг СБМ.
Пример 6
Совместная экспрессия генов, кодирующих α-субъединицу, β-субъединицу нитрилгидратазы, белок р15К и транспортер кобальта
Экспрессию осуществляли согласно методу, описанному в примере 3, с использованием трансформированного штамма Е.coli DSM 14459, несущего плазмиды pUD15 и pUD16. Удельная активность клеток составляла 81 ед./мг СБМ.
Пример 7
Субстратная специфичность
Осуществляли превращение различных нитрилов аналогично методу, описанному в примере 3, с использованием покоящихся клеток трансформированного штамма Е.coli DSM 14459, которые содержали плазмиду pUD15. Удельную активность, полученную с использованием N-формилвалиннитрила, принимали за 100%. Активности для других вариантов вычисляли в виде отношения к указанной активности. Результаты приведены на фиг.3.
Пример 8
Рост трансформированного штамма Е.coli DSM 14459 в присутствии солей Co2+
Трансформированные клетки штамма Е.coli DSM 14459, несущие либо только одну плазмиду pUD15, либо и pUD15, и pUD16, выращивали согласно методу, описанному в примере 3. При этом концентрацию кобальта в среде варьировали от 0,5 до 2 мМ. Через 24 ч измеряли оптическую плотность культур при 600 нм.
Было установлено, что даже высокие концентрации кобальта оказывают лишь слабое влияние на рост клеток.
Пример 9
Превращение метиониннитрила с использованием покоящихся трансформированных клеток штамма Е.coli DSM 14459, несущих плазмиду pUD15
Клетки штамма E.coli DSM14459, несущие плазмиду pUD15, выращивали и подвергали центрифугированию согласно методу, описанному в примере 3. 2,8 г клеток в пересчете на массу во влажном состоянии ресуспендировали в 47,2 мл 50 мМ калий-фосфатного буфера, pH 7,5, и непрерывно при 20°С при интенсивном перемешивании добавляли метиониннитрил с такой скоростью, чтобы концентрация не превышала 15 г/л в любой момент времени реакции. Значение pH поддерживали на постоянном уровне, составляющем 7,5. Мониторинг реакции осуществляли с помощью ЖХВР согласно методу, описанному в примере 4. Через 320 мин 9,1 г нитрила полностью превращались в 10,4 г амида. Это соответствовало концентрации 176 г/л.
Краткое описание чертежей
На фиг.1 показано:
плазмида pUD 15
На фиг.2 показано:
плазмида pUD 16
На фиг.3 показано:
Относительная удельная активность при превращении различных нитрилов в сравнении с активностью при превращении N-формилвалиннитрила.



























Изобретение относится к биотехнологии и представляет собой полинуклеотидный кластер из Rhodococcus, который содержит нуклеотидные последовательности, кодирующие полипептиды, которые обладают активностью нитрилгидратазы, вспомогательного белка Р15К, активирующего этот фермент, и транспортера кобальта. Изобретение позволяет ферментативно получать амиды из нитрилов с высокой степенью эффективности. 2 н. и 13 з.п. ф-лы, 3 ил.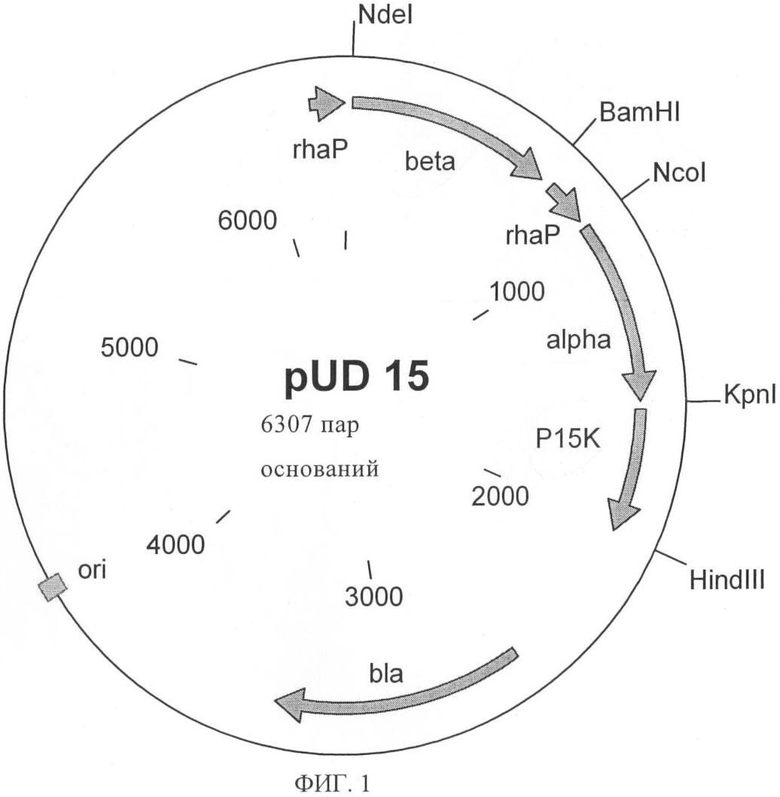
1. Выделенный полинуклеотидный кластер из Rhodococcus opacus, предназначенный для превращения нитрила в амид, который содержит четыре нуклеотидные последовательности, кодирующие четыре полипептида, при этом первый полипептид имеет последовательность, на 90% идентичную последовательности SEQ ID NO:2, и обладает активностью α-субъединицы нитрилгидратазы, второй имеет последовательность, на 90% идентичную последовательности SEQ ID NO:3, и обладает активностью β-субъединицы нитрилгидратазы, третий имеет последовательность, на 90% идентичную последовательности SEQ ID NO:4, и обладает активностью белка транспортера кобальта, а четвертый имеет последовательность, на 90% идентичную последовательности SEQ ID NO:6, и обладает активностью вспомогательного белка Р15К.
2. Полинуклеотид по п.1, выбранный из группы, включающей:
а) полинуклеотид, представляющий собой фрагмент, простирающийся от положения 1 до положения 708 нуклеотидной последовательности, представленной в SEQ ID NO:1, или комплементарной ей нуклеотидной последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют β-субъединицу нитрилгидратазы.
3. Полинуклеотид по п.1, выбранный из группы, включающей:
а) полинуклеотид, представляющий собой фрагмент, простирающийся от положения 710 до положения 1327 нуклеотидной последовательности, представленной в SEQ ID NO:1, или комплементарной ей нуклеотидной последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпункте а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпункте а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют α-субъединицу нитрилгидратазы.
4. Полинуклеотид по п.1, выбранный из группы, включающей:
а) полинуклеотид, представляющий собой фрагмент, простирающийся от положения 1324 до положения 1737 нуклеотидной последовательности SEQ ID NO: 1 или комплементарной ей последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют вспомогательный белок Р15К.
5. Полинуклеотид по п.1, выбранный из группы, включающей:
а) полинуклеотид, представляющий собой фрагмент, простирающийся от положения 2076 до положения 3146 нуклеотидной последовательности SEQ ID NO:1 или комплементарной ей последовательности,
б) полинуклеотид, имеющий нуклеотидную последовательность, которая соответствует последовательности, указанной в подпункте а), в пределах вырожденности генетического кода,
в) полинуклеотид, который гибридизуется в строгих условиях с последовательностями, комплементарными последовательностям, указанным в подпунктах а) или б), и
г) полинуклеотид, имеющий нуклеотидную последовательность, указанную в подпунктах а), б) или в), которая имеет функционально нейтральные смысловые мутации,
где полинуклеотиды кодируют белок, обладающий активностью транспортера кобальта.
6. Выделенный полинуклеотид по п.2, который гибридизуется в строгих условиях с комплементом, простирающимся от положения 1 до положения 1327 SEQ ID NO:1, где строгие условия включают отмывку в 5×SSC при температуре от 50 до 68°С.
7. Выделенный полинуклеотид по п.4, который гибридизуется в строгих условиях с комплементом, простирающимся от положения 1324 до положения 1737 SEQ ID NO:1, где строгие условия включают отмывку в 5×SSC при температуре от 50 до 68°С.
8. Выделенный полинуклеотид по п.5, который гибридизуется в строгих условиях с комплементом, простирающимся от положения 2036 до положения 3146 SEQ ID NO:1, где строгие условия включают отмывку в 5×SSC при температуре от 50 до 68°С.
9. Способ ферментативного получения амидов из нитрилов, который заключается в том, что:
а) превращают содержащее нитрильную группу соединение с использованием фермента из Rhodococcus, прежде всего Rhodococcus opacus, который получают в результате трансформации клеток микроорганизма вектором, включающим полинуклеотидный кластер по пп.1-8, их ферментации в условиях, которые обеспечивают образование фермента, сбора указанных клеток с выделением в виде покоящихся клеток или выделением из них указанного фермента, б) выделяют амид.
10. Способ по п.9, отличающийся тем, что применяют очищенный и при необходимости иммобилизованный фермент.
11. Способ по п.9, отличающийся тем, что применяют покоящиеся клетки, содержащие фермент.
12. Способ по одному или нескольким пп.9-11, отличающийся тем, что соединения общих формул


в которых Х обозначает ОН, Н, алкил, имеющий от 1 до 4 атомов углерода, прежде всего NH2;
R обозначает Н, насыщенный алкильный радикал с разветвленной или с неразветвленной цепью, имеющий от 1 до 12 атомов углерода, необязательно замещенный группой NH2,
алкенильные радикалы с разветвленной или с неразветвленной цепью, имеющие от 1 до 12 атомов углерода, или циклоалкильные группы, имеющие от 3 до 6 атомов углерода,
алкиленовые радикалы, замещенные алкилтиогруппой, где алкил в рассматриваемом случае представляет собой C1-С3алкильный радикал, и алкилен представляет собой двухвалентный С3-С8алкиленовый радикал,
R' обозначает Н или алкил, имеющий от 1 до 3 атомов углерода,
R'' обозначает одноядерное или двухъядерное ненасыщенное кольцо, имеющее от 6 до 12 атомов углерода, и которое необязательно замещено одной или двумя C1-C3алкильными группами или Cl, Br, F, одновалентный C1-C3алкилнитрил, имеющий от 1 до 6 атомов углерода, превращают в соответствующие амиды.
13. Способ по пп.9-11, отличающийся тем, что амид или содержащий амид раствор отделяют от биомассы клеток и амид гидролизуют с получением соответствующей кислоты.
14. Способ по пп.9-12, отличающийся тем, что амид или содержащий амид раствор отделяют от биомассы клеток и амид гидролизуют с использованием гидроксидов щелочного металла или гидроксидов щелочноземельного металла с получением солей соответствующей карбоновой кислоты.
15. Способ по п.14, отличающийся тем, что МГА-амид гидролизуют с помощью гидроксида кальция и выделяют кальциевую соль.
| WO 02070717 A2, 12.09.2002 | |||
| US 5789211 A, 04.08.1998 | |||
| СПОСОБ ПОЛУЧЕНИЯ АМИДА | 1992 |
|
RU2082761C1 |
| Устройство для наведения противовыбросового оборудования на устье фонтанирующей скважины | 1985 |
|
SU1266962A1 |
Авторы
Даты
2010-04-10—Публикация
2005-03-01—Подача