Настоящее изобретение относится к кодирующим нуклеотидным последовательностям гена ptsH и к способу ферментативного получения L-аминокислот, прежде всего L-лизина, с использованием коринебактерий, в которых усиливают ген ptsH.
Предпосылки создания изобретения
L-аминокислоты, прежде всего L-лизин, находят применение в медицине и в фармацевтической промышленности, но прежде всего в кормах для животных.
Известно, что L-аминокислоты получают ферментативным путем с использованием штаммов коринебактерий, прежде всего с использованием Corynebacterium glutamicum. Поскольку эти продукты имеют большое значение, постоянно ведется работа по совершенствованию способа их получения. Усовершенствования способа могут касаться технологических сторон процесса ферментации, таких как перемешивание и обеспечение кислородом, или состава питательных сред, например концентрации сахара в процессе ферментации, или переработки продукта, например, с помощью ионообменной хроматографии, или присущей самому микроорганизму продуктивности.
Для улучшения продуктивности этих микроорганизмов применяют методы мутагенеза, селекции и отбора мутантов. Таким путем получают штаммы, которые обладают устойчивостью к антиметаболитам, таким как аналог лизина S-(2-аминоэтил)цистеин, или которые являются ауксотрофами в отношении обладающих регуляторной функцией метаболитов и продуцируют L-лизин.
В течение ряда лет для улучшения продуцирующих L-аминокислоты штаммов Corynebacterium также применяют методы рекомбинантной ДНК, с помощью которых амплифицируют отдельные гены биосинтеза L-аминокислот и исследуют влияние на продуцирование L-аминокислот. Обзор работ в этой области можно найти среди прочего у Kinoshita ("Glutamic Acid Bacteria", Biology of Industrial Microorganisms, под ред. Demain и Solomon, изд-во Benjamin Cummings, London, Великобритания, 1985, 115-142), у Hilliger (BioTec 2, 40-44 (1991)), у Eggeling (Amino Acids 6, 261-272 (1994)), у Jetten и Sinskey (Critical Reviews in Biotechnology 15, 73-103 (1995)) и у Sahm и др. (Annuals of the New York Academy of Sciences 782, 25-39 (1996)).
Задача изобретения
Задачей изобретения является разработка новых подходов по усовершенствованию способа ферментативного получения L-аминокислот, прежде всего L-лизина.
Описание изобретения
L-аминокислоты, прежде всего L-лизин, находят применение в медицине, в фармацевтической промышленности и прежде всего в кормах для животных. Поэтому представляет большой интерес разработка нового более эффективного способа получения L-аминокислот, прежде всего L-лизина.
Если в дальнейшем упоминается L-лизин или лизин, то при этом подразумеваются не только сами эти основания, но и их соли, такие как моногидрохлорид лизина или сульфат лизина.
Объектом изобретения является выделенный из коринебактерий полинуклеотид, содержащий полинуклеотидную последовательность, выбранную из группы, включающей
а) полинуклеотид, идентичный по крайней мере на 70% полинуклеотиду, кодирующему полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 2,
б) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 70% аминокислотной последовательности, представленной в SEQ ID NO: 2,
в) полинуклеотид, комплементарный полинуклеотидам, указанным в подпункте а) или б), и
г) полинуклеотид, содержащий по крайней мере 15 последовательных пар оснований полинуклеотидной последовательности, указанной в подпункте а), б) или в).
Объектом изобретения также является полинуклеотид, который представляет собой реплицируемую в коринебактериях, предпочтительно рекомбинантную, ДНК.
Объектом изобретения также является полинуклеотид, который представляет собой РНК.
Объектом изобретения является также полинуклеотид, который предпочтительно представляет собой реплицируемую ДНК и который содержит:
(I) нуклеотидную последовательность, представленную в SEQ ID NO: 1, или
(II) по меньшей мере одну последовательность, которая соответствует последовательности, указанной в подпункте (I), в пределах вырожденности генетического кода, или
(III) по меньшей мере одну последовательность, которая гибридизуется с последовательностью, комплементарной последовательности, указанной в подпункте (I) или (II), и при необходимости
(IV) функционально нейтральные смысловые мутации в последовательности, указанной в подпункте (I).
Другими объектами изобретения являются следующие:
вектор, несущий указанный полинуклеотид, и
коринебактерии, служащие в качестве клеток-хозяев и содержащие указанный вектор.
Объектом изобретения являются также полинуклеотиды, которые практически представляют собой полинуклеотидную последовательность и которые могут быть получены путем скрининга с использованием гибридизации соответствующего банка генов, содержащего полный ген, который имеет полинуклеотидную последовательность, соответствующую SEQ ID NO: 1, с зондом, который имеет указанную полинуклеотидную последовательность, представленную в SEQ ID NO: 1, или ее фрагмент, и путем выделения указанной последовательности ДНК.
Полинуклеотидные последовательности по изобретению пригодны в качестве гибридизационных зондов для РНК, кДНК и ДНК для выделения полноразмерной кДНК, кодирующей компонент Н системы фосфотрансферазы (ptsH), и для выделения тех кДНК или генов, которые имеют высокую степень сходства с последовательностью гена компонента Н системы фосфотрансферазы.
Кроме того, полинуклеотидные последовательности по изобретению пригодны в качестве праймеров для получения с помощью полимеразной цепной реакции (ПЦР) ДНК генов, кодирующих компонент Н системы фосфотрансферазы.
Такие олигонуклеотиды, которые служат в качестве зондов или праймеров, включают по крайней мере 30, предпочтительно по крайней мере 20, наиболее предпочтительно по крайней мере 15 последовательных пар оснований. Также могут использоваться олигонуклеотиды, имеющие длину по крайней мере 40 или 50 пар оснований.
Понятие "выделенный" в контексте настоящего изобретения относится к какому-либо элементу, выделенному из его естественного окружения.
Понятие "полинуклеотид" в целом относится к полирибонуклеотидам и полидезоксирибонуклеотидам, которые могут представлять собой как немодифицированную РНК или ДНК, так и модифицированную РНК или ДНК.
Понятие "полипептиды" означает пептиды или протеины, содержащие две или более аминокислот, которые связаны пептидными связями.
Полипептиды по изобретению включают полипептид, последовательность которого представлена в SEQ ID NO: 2, прежде всего полипептиды, обладающие биологической активностью компонента Н системы фосфотрансферазы, а также полипептиды, идентичные полипептиду, последовательность которого представлена в SEQ ID NO: 2, по крайней мере на 70%, предпочтительно по крайней мере на 80% и наиболее предпочтительно по крайней мере на 90-95%, и обладающие указанной активностью.
Объектом изобретения является также способ ферментативного получения L-аминокислот, прежде всего L-лизина, с использованием коринебактерий, прежде всего таких, которые уже обладают способностью продуцировать L-аминокислоты и в которых усиливают, прежде всего сверхэкспрессируют, кодирующие нуклеотидные последовательности гена ptsH.
В контексте настоящего описания понятие "усиление" означает повышение в микроорганизме внутриклеточной активности одного или нескольких ферментов, кодируемых соответствующей ДНК, за счет, например, увеличения количества копий гена или генов, использования более сильного промотора или гена, кодирующего соответствующий фермент с высокой активностью, и при необходимости за счет сочетания этих мер.
Микроорганизмы, являющиеся объектом настоящего изобретения, могут продуцировать L-аминокислоты, прежде всего L-лизин, из глюкозы, сахарозы, лактозы, фруктозы, мальтозы, мелассы, крахмала, целлюлозы или из глицерина и этанола. Они могут включать представителей коринебактерий, прежде всего из рода Corynebacterium. В роде Corynebacterium следует прежде всего отметить вид Corynebacterium glutamicum, который, как известно специалистам, обладает способностью продуцировать L-аминокислоты.
Пригодными штаммами бактерий р. Corynebacterium, прежде всего вида Corynebacterium glutamicum, являются прежде всего следующие известные штаммы дикого типа:
Corynebacterium glutamicum ATCC 13032,
Corynebacterium acetoglutamicum ATCC 15806,
Corynebacterium acetoacidophilum ATCC 13870,
Corynebacterium thermoaminogenes FERM BP-1539,
Corynebacterium melassecola ATCC 17965,
Brevibacterium flavum ATCC 14067,
Brevibacterium lactofermentum ATCC 13869 и
Brevibacterium divaricatum ATCC 14020,
а также полученные из них мутанты, соответственно штаммы, продуцирующие L-лизин, такие как:
Corynebacterium glutamicum FERM-P 1709,
Brevibacterium flavum FERM-P 1708,
Brevibacterium lactofermentum FERM-P 1712,
Corynebacterium glutamicum FERM-P 6463,
Corynebacterium glutamicum PERM-P 6464 и
Corynebacterium glutamicum DSM 5715.
Авторам изобретения удалось выделить новый ген ptsH С. glutamicum, кодирующий компонент Н системы фосфотрансферазы.
Для выделения гена ptsH, а также других генов С. glutamicum сначала создают банк генов этого микроорганизма в Е.coli. Создание банка генов описано в широко известных учебниках и справочниках. В качестве примера можно назвать учебник Winnacker: Gene und Klone, Eine Einführung in die Gentechnologie (изд-во Chemie, Weinheim, Германия, 1990) или справочник Sambrook и др.: Molecular Cloning, A Laboratory Manual (изд-во Cold Spring Harbor Laboratory Press, 1989). Одним из широко известных банков генов является банк генов штамма Е.coli K-12 W3110, созданный Kohara и др. (Cell 50, 495-508 (1987)) в λ-векторах. У Bathe и др. (Molecular and General Genetics, 252: 255-265 (1996)) описан банк генов штамма С.glutamicum ATCC 13032, полученный с помощью космидного вектора SuperCos I (Wahl и др., Proceedings of the National Academy of Sciences USA, 84: 2160-2164 (1987)) в штамме Е.coli K-12 NM554 (Raleigh и др., Nucleic Acids Research 16, 1563-1575 (1988)). В свою очередь у Börmann и др. (Molecular Microbiology 6(3), 317-326 (1992)) описан банк генов штамма С.glutamicum ATCC 13032, полученный с использованием космиды рНС79 (Hohn и Collins, Gene 11, 291-298 (1980)). Для создания банка генов С.glutamicum в Е.coli могут быть использованы также такие плазмиды, как pBR322 (Bolivar, Life Sciences, 25, 807-818 (1979)) или pUC9 (Vieira и др., Gene, 19: 259-268, (1982)). В качестве хозяев могут быть использованы прежде всего такие штаммы Е.coil, которые имеют дефекты, полученные в результате рестрикции и рекомбинации. Примером такого штамма является штамм DH5αmcr, описанный у Grant и др. (Proceedings of the National Academy of Sciences USA, 87: 4645-4649 (1990)). Затем клонированные с помощью космид длинные фрагменты ДНК могут быть снова субклонированы в обычных пригодных для секвенирования ДНК векторах и после этого секвенированы, например, согласно методу, описанному у Sanger и др. (Proceedings of the National Academy of Sciences USA, 74: 5463-5467, (1977)).
Таким способом была получена новая кодирующая последовательность ДНК гена ptsH С.glutamicum, которая в виде SEQ ID NO: 1 является составной частью настоящего изобретения. Кроме того, из данной последовательности ДНК с использованием описанных выше методов была выведена аминокислотная последовательность соответствующего протеина. Выведенная аминокислотная последовательность продукта гена ptsH представлена в SEQ ID NO: 2.
Кодирующие последовательности ДНК, которые получают из SEQ ID NO: 1 на основе вырожденности генетического кода, также являются составной частью изобретения. Кроме того, в данной области известны консервативные замены аминокислот в протеинах, такие как замена глицина на аланин или аспарагиновой кислоты на глутаминовую кислоту, так называемые "смысловые мутации", которые не приводят к существенному изменению активности протеина, т.е. являются функционально нейтральными. Кроме того, известно, что изменения на N- и/или на С-конце протеина не оказывают существенного влияния на его функциональную активность или даже могут стабилизировать ее. Соответствующую информацию можно найти среди прочего у Ben-Bassat и др. (Journal of Bacteriology 169, 751-757 (1987)), у O'Regan и др. (Gene 77: 237-251 (1989)), у Sahin-Toth и др. (Protein Sciences 3: 240-247 (1994)), у Hochuli и др. (Bio/Technology 6: 1321-1325 (1988)), а также в известных учебниках по генетике и молекулярной биологии. Аминокислотные последовательности, которые могут быть получены соответствующим образом из SEQ ID NO: 2, и последовательности ДНК, кодирующие такие аминокислотные последовательности, также являются составной частью изобретения.
Равным образом составной частью изобретения являются последовательности ДНК, которые гибридизуются с последовательностью, представленной в SEQ ID NO: 1, или с частями последовательности, представленной в SEQ ID NO: 1. И, наконец, составной частью изобретения являются последовательности ДНК, которые могут быть созданы путем полимеразной цепной реакции (ПЦР) с использованием праймеров, полученных из SEQ ID NO: 1. Такие олигонуклеотиды, как правило, имеют длину по крайней мере 15 пар оснований.
Соответствующие рекомендации по идентификации последовательностей ДНК с помощью гибридизации можно найти, в частности, в справочнике "The DIG System Users Guide for Filter Hybridization" фирмы Boehringer Mannheim GmbH (Маннгейм, Германия, 1993) и у Liebl и др. (International Journal of Systematic Bacteriology, 41: 255-260 (1991)). Рекомендации касательно амплификации последовательностей ДНК с помощью полимеразной цепной реакции (ПЦР) можно найти среди прочего в справочнике Gait: Oligonucleotide synthesis: a practical approach (изд-во IRL Press, Oxford, Великобритания, 1984) и у Newton и Graham: PCR (изд-во Spektrum Akademischer Verlag, Heidelberg, Германия, 1994).
При создании изобретения было установлено, что в результате сверхэкспрессии гена ptsH может быть повышена эффективность синтеза коринебактериями L-аминокислот, прежде всего L-лизина.
Для достижения сверхэкспрессии может быть увеличено количество копий соответствующего гена или могут быть вызваны мутации в промоторной и регуляторной областях или сайте связывания рибосом, расположенном против хода транскрипции относительно структурного гена. Равным образом действуют кассеты экспрессии, встраиваемые против хода транскрипции относительно структурного гена. Кроме того, экспрессию можно дополнительно повышать в процессе ферментативного получения L-аминокислот с помощью индуцибельных промоторов. Экспрессия также может быть усилена за счет увеличения продолжительности жизни мРНК. Кроме того, ферментативная активность также может быть усилена путем ингибирования разложения протеинов ферментов. При этом гены или генные конструкции либо могут находиться в различном количестве копий в плазмидах, либо их интегрируют в хромосомы и амплифицируют. В альтернативном варианте сверхэкспрессия рассматриваемых генов также может быть достигнута путем изменения состава среды и условий культивирования.
Соответствующие рекомендации можно найти у Martin и др. (Bio/Technology 5, 137-146 (1987)), у Guerrero и др. (Gene 138, 35-41 (1994)), Tsuchiya и Morinaga (Bio/Technology 6, 428-430 (1988)), у Eikmanns и др. (Gene 102, 93-98 (1991)), в европейской заявке ЕР-В 0472869, в патенте US 4601893, у Schwarzer и Pühler (Bio/Technology 9, 84-87 (1991)), у Reinscheid и др. (Applied and Environmental Microbiology 60, 126-132 (1994)), у LaBarre и др. (Journal of Bacteriology 175, 1001-1007 (1993), в заявке WO 96/15246, у Malumbres и др. (Gene 134, 15-24 (1993)), в заявке JP-A-10-229891, у Jensen и Hammer (Biotechnology and Bioengineering 58, 191-195 (1998)), у Makrides (Microbiological Reviews 60: 512-538 (1996)) и в известных учебниках по генетике и молекулярной биологии.
Ген ptsH по изобретению может быть сверхэкспрессирован, например, с помощью плазмид.
В качестве таких плазмид могут быть использованы плазмиды, обладающие способностью реплицироваться в коринебактериях. Многочисленные известные плазмидные векторы, такие как pZ1 (Menkel и др., Applied and Environmental Microbiology 64: 549-554 (1989)), pEKEx1 (Eikmanns и др., Gene 102: 93-98 (1991)) или pHS2-1 (Sonnen и др., Gene 107: 69-74 (1991)), базируются на криптических плазмидах рНМ1519, pBL1 или pGA1. Равным образом могут быть использованы и другие плазмидные векторы, такие как векторы, базирующиеся на pCG4 (US 4489160), pNG2 (Serwold-Davis и др., FEMS Microbiological Letters 66, 119-124 (1990)) или pAG1 (US 5158891).
Кроме того, могут использоваться такие плазмидные векторы, с помощью которых можно применять способ амплификации гена путем интеграции в хромосому, как это описано, например, у Reinscheid и др. (Applied and Environmental Microbiology 60, 126-132 (1994)) применительно к дубликации, соответственно амплификации оперона hom-thrB. С помощью этого метода полноразмерный ген клонируют в плазмидном векторе, который может реплицироваться в определенном хозяине (обычно в Е.coli), но не в С.glutamicum. В качестве таких векторов могут использоваться, например, pSUP301 (Simon и др., Bio/Technology 1, 784-791 (1983)), pK18mob или pK19mob (Schäfer и др., Gene 145, 69-73 (1994)), pGEM-T (фирма Promega corporation, Мадисон, шт. Висконсин, США), pCR2.1-TOPO (Shuman, Journal of Biological Chemistry, 269: 32678-32684 (1994), US 5487993), pCR®Blunt (фирма Invitrogen, Groningen, Нидерланды; Bernard и др., Journal of Molecular Biology, 234: 534-541 (1993)) или pEM1 (Schrumpf и др., Journal of Bacteriology 173: 4510-4516 (1991)). Затем плазмидный вектор, содержащий подлежащий амплификации ген, переносят путем конъюгации или трансформации в соответствующий штамм С. glutamicum. Метод конъюгации описан, например, у Schäfer и др. (Applied and Environmental Microbiology 60, 756-759 (1994)). Методы трансформации описаны, например, у Thierbach и др. (Applied Microbiology and Biotechnology 29, 356-362 (1988)), у Dunican и Shivnan (Bio/Technology 7, 1067-1070 (1989)) и у Tauch и др. (FEMS Microbiological Letters 123, 343-347 (1994)). В результате гомологичной рекомбинации с помощью одного кроссинговера образовавшийся штамм содержит по крайней мере две копии рассматриваемого гена.
Еще одним объектом изобретения является способ ферментативного получения L-аминокислот, прежде всего L-лизина, согласно которому применяют штамм, трансформированный плазмидным вектором, который несет нуклеотидную последовательность гена, кодирующего компонент Н системы фосфотрансферазы.
Кроме того, для повышения эффективности синтеза L-аминокислот, прежде всего L-лизина, может оказаться предпочтительным наряду с геном ptsH дополнительно усиливать другие гены пути биосинтеза целевой L-аминокислоты, сверхэкспрессируя тем самым один или несколько ферментов, участвующих в соответствующем пути биосинтеза, в гликолизе, анаплеротическом обмене веществ или экспорте аминокислот.
Так, например, для получения L-лизина можно одновременно сверхэкспрессировать один или несколько генов, выбранных из группы, включающей
- ген dapA, кодирующий дигидродипиколинат-синтазу (ЕР-В 0197335),
- ген gap, кодирующий глицеральдегид-3-фосфатдегидрогеназу (Eikmanns и др., Journal of Bacteriology 174: 6076-6086 (1992)),
- ген tpi, кодирующий триозофосфатизомеразу (Eikmanns и др., Journal of Bacteriology 174: 6076-6086 (1992)),
- ген pgk, кодирующий 3-фосфоглицераткиназу (Eikmanns, Journal of Bacteriology 174: 6076-6086 (1992)),
- ген ptsM, кодирующий компонент М системы фосфоенолпируват-сахар-фосфотрансферазы (ptsM) (Lee и др., FEMS Microbiology Letters, 1-2, 137-145 (1994)),
- ген рус, кодирующий пируваткарбоксилазу (DE-A 19831609), и
- ген lysE, обеспечивающий экспорт лизина (DE-A 19548222).
Кроме того, для продуцирования L-аминокислот, прежде всего L-лизина, может оказаться целесообразным наряду с усилением гена ptsH одновременно ослаблять
- ген pck, кодирующий фосфоенолпируваткарбоксикиназу (DE 19950409.1 DSM 13047), и/или
- ген pgi, кодирующий глюкозо-6-фосфатизомеразу (US 09/396478, DSM 12969),
- ген рох, кодирующий пируватоксидазу (DE 19846499.1 DSM 13114).
Кроме того, для продуцирования L-аминокислот, прежде всего L-лизина, может оказаться целесообразным наряду со сверхэкспрессией гена ptsH исключить нежелательные побочные реакции (Nakayama: "Breeding of Amino Acid Producing Microorganisms", Overproduction of Microbial Products, под ред. Krumphanzl, Sikyta, Vanek, изд-во Academic Press, London, Великобритания, 1982).
Для продуцирования L-аминокислот, прежде всего L-лизина, созданные согласно изобретению микроорганизмы можно культивировать непрерывно или периодически с использованием периодического процесса (культивирование партий) или периодического процесса с подпиткой, либо периодического процесса с повторяющейся подпиткой. Обзор известных способов культивирования представлен в учебнике Chmiel (Bioprozesstechnik 1. Einführung in die Bioverfahrenstechnik (изд-во Gustav Fischer, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (изд-во Vieweg, Braunschweig/Wiesbaden, 1994)).
Используемая культуральная среда должна быть соответствующим образом адаптирована к требованиям конкретного штамма. Описания культуральных сред для различных микроорганизмов содержатся в справочнике "Manual of Methods for General Bacteriology" Американского общества бактериологии (Вашингтон, округ Колумбия, США, 1981). В качестве источника углерода могут быть использованы сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, крахмал и целлюлоза, масла и жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти вещества могут применяться по отдельности или в виде смеси. В качестве источника азота могут применяться органические азотсодержащие соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкость, образующаяся после замачивания зерен кукурузы до разбухания, соевая мука и мочевина, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота могут применяться по отдельности или в виде смеси. В качестве источника фосфора могут применяться фосфорная кислота, кислый фосфат калия или дикалийгидрофосфат, либо соответствующие натриевые соли. Кроме того, культуральная среда должна содержать соли металлов, такие как сульфат магния или сульфат железа, которые необходимы для роста. И, наконец, в дополнение к вышеназванным соединениям могут использоваться такие важные для роста вещества, как аминокислоты и витамины. Помимо этого в культуральную среду могут быть добавлены соответствующие предшественники. Вышеуказанные добавки могут быть введены в культуральную среду в виде одноразовой добавки или добавляться соответствующим образом в процессе культивирования.
Для контроля значения рН культуральной среды используют соответственно либо основания, такие как гидроксид натрия, гидроксид калия, аммиак, соответственно аммиачную воду, либо кислоты, такие как фосфорная кислота или серная кислота. Для контроля пенообразования добавляют антивспениватели, такие как полигликолевые эфиры жирных кислот. Для поддержания стабильности плазмид могут быть добавлены соответствующие конкретной среде вещества, обладающие избирательным действием, например антибиотики. Для поддержания аэробных условий в культуру вводят кислород или содержащие кислород газовые смеси, например воздух. Температура культуральной среды в норме составляет от 20°С до 45°С, предпочтительно от 25°С до 40°С. Культивирование продолжают до тех пор, пока не образуется максимальное количество L-лизина. Как правило, эта цель достигается за 10-160 ч.
Еще одним объектом изобретения в соответствии с этим является способ ферментативного получения L-аминокислот, прежде всего L-лизина, согласно которому осуществляют следующие стадии:
а) ферментацию с использованием продуцирующих L-аминокислоту коринебактерий, в которых усиливают, прежде всего сверхэкспрессируют, по крайней мере ген, кодирующий компонент Н системы фосфотрансферазы,
б) накопление L-аминокислоты в среде или в клетках бактерий и
в) выделение L-аминокислоты.
Анализ L-лизина можно проводить с помощью анионообменной хроматографии с последующей дериватизацией с обнаружением нингидрином согласно методу, описанному у Spackman и др. (Analytical Chemistry, 30, 1190 (1958)).
Способ по изобретению предназначен для ферментативного получения L-аминокислот, прежде всего L-лизина.
Примеры
Ниже настоящее изобретение проиллюстрировано на примерах его осуществления.
Пример 1
Создание геномного космидного банка генов штамма Corynebacterium glutamicum ATCC 13032
Хромосомную ДНК выделяли из штамма Corynebacterium glutamicum ATCC 13032 по методу, описанному у Tauch и др. (Plasmid 33: 168-179 (1995)), и частично расщепляли рестриктазой Sau3AI (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта Sau3AI: продукт №27-0913-02). Фрагменты ДНК дефосфорилировали щелочной фосфатазой креветки (ЩФК) (фирма Roche Molecular Biochemicals, Маннгейм, Германия, описание продукта ЩФК: продукт №1758250). ДНК космидного вектора SuperCos I (Wahl и др., Proceedings of the National Academy of Sciences USA 84: 2160-2164 (1987)), полученного от компании Stratagene (Ла Джолла, США, описание продукта, представляющего собой набор SuperCos I Cosmid Vector Kit: продукт №251301), расщепляли рестриктазой XbaI (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта XbaI: продукт №27-0948-02) и также дефосфорилировали щелочной фосфатазой креветки. Затем космидную ДНК расщепляли рестриктазой BamHI (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта BamHI: продукт №27-0868-04). Обработанную таким образом космидную ДНК смешивали с обработанной ДНК штамма АТСС 13032 и смесь обрабатывали ДНК-лигазой фага Т4 (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта ДНК-лигазы фага Т4: продукт №27-0870-04). Полученный в результате лигирования продукт встраивали затем в фаги с помощью наборов Gigapack II XL Packing Extract (фирма Stratagene, Ла Джолла, США, описание продукта, представляющего собой набор Gigapack II XL Packing Extract: продукт №200217). Для инфицирования штамма Е.coli NM554 (Raleigh и др., Nucleic Acid Research 16: 1563-1575 (1988)) клетки переносили в 10 мМ MgSO4 и смешивали с аликвотным количеством суспензии фага. Инфицирование и титрование космидного банка осуществляли в соответствии с методом, описанным у Sambrook и др. (Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)), при этом клетки высевали на LB-arap (Lennox, Virology, 1: 190 (1955)), содержащий 100 мкг/мл ампициллина. После инкубации в течение ночи при 37°С отбирали отдельные рекомбинантные клоны.
Пример 2
Выделение и секвенирование гена ptsH
Космидную ДНК из отдельной колонии выделяли с помощью набора Qiaprep Spin Miniprep Kit (продукт №27106, фирма Qiagen, Гильден, Германия) согласно инструкциям производителя и частично расщепляли рестриктазой Sau3AI (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта Sau3AI: продукт №27-0913-02). Фрагменты ДНК дефосфорилировали щелочной фосфатазой креветки (фирма Roche Molecular Biochemicals, Маннгейм, Германия, описание продукта ЩФК: продукт №1758250). После разделения с помощью гель-электрофореза выделяли фрагменты космиды, имеющие размеры в интервале от 1500 до 2000 пар оснований, с использованием набора QiaExII Gel Extraction Kit (продукт №20021, фирма Qiagen, Гильден, Германия). ДНК секвенирующего вектора pZero-1, полученного от компании Invitrogen (Гронинген, Нидерланды, описание продукта, представляющего собой набор Zero Background Cloning Kit: продукт №K2500-01), расщепляли рестриктазой BamHI (фирма Amersham Pharmacia, Фрейбург, Германия, описание продукта BamHI: продукт №27-0868-04). Встраивание фрагментов космиды в секвенирующий вектор pZero-1 путем лигирования осуществляли по методу, описанному у Sambrook и др. (Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)), при этом смесь ДНК инкубировали в течение ночи с лигазой фага Т4 (фирма Pharmacia Biotech, Фрейбург, Германия). Затем этот полученный в результате лигирования продукт встраивали путем электропорации (Tauch и др., FEMS Microbiol. Letters, 123: 343-347 (1994)) в штамм Е.coli DH5αmcr (Grant, Proceedings of the National Academy of Sciences USA, 87: 4645-4649 (1990)) и высевали на LB-агар (Lennox, Virology, 1: 190 (1955)), содержащий 50 мкг/мл зеоцина. Плазмиду выделяли из рекомбинантных клонов с помощью устройства Biorobot 9600 (продукт №900200, фирма Qiagen, Гильден, Германия). Секвенирование проводили с помощью дидезокси-метода на основе разрыва цепи, описанного у Sanger и др. (Proceedings of the National Academy of Sciences USA 74: 5463-5467 (1977)), с модификациями согласно Zimmermann и др. (Nucleic Acids Research, 18: 1067 (1990)). Использовали набор "RR dRhodamin Terminator Cycle Sequencing Kit" фирмы РЕ Applied Biosystems (продукт №403044, Вейтерштадт, Германия). Разделение с помощью гель-электрофореза и анализ результатов реакции секвенирования проводили в геле "Rotiphorese NF Akrylamid/Bisakrylamid" (29:1) (продукт №А124.1, фирма Roth, Карлсруэ, Германия) с использованием секвенатора типа "ABI Prism 377" фирмы РЕ Applied Biosystems (Вейтерштадт, Германия).
Полученные первичные данные о последовательностях затем обрабатывали с использованием пакета программ Staden (Nucleic Acids Research, 14: 217-231 (1986)), версия 97-0. Отдельные последовательности производных pZero-1 объединяли в непрерывную группу последовательностей. Компьютерный анализ кодирующей области проводили с использованием программы XNIP (Staden, Nucleic Acids Research, 14: 217-231 (1986)). Дальнейшие анализы проводили с помощью программы "BLAST search programs" (Altschul и др., Nucleic Acids Research, 25: 3389-3402 (1997)) на основе неизбыточного банка данных Национального центра биотехнологической информации (NCBI, Бетезда, шт. Мэриленд, США).
Полученная нуклеотидная последовательность представлена в SEQ ID NO: 1. Анализ нуклеотидной последовательности позволил выявить открытую рамку считывания длиной 267 пар оснований, которую обозначили как ген ptsH. Ген ptsH кодирует протеин, состоящий из 89 аминокислот.
Пример 3
Создание челночного вектора pEC-K18mob2ptsHexp для усиления гена ptsH в С. glutamicum
3.1. Клонирование гена ptsH в векторе pCR®Blunt II
Из штамма АТСС 13032 выделяли хромосомную ДНК согласно методу, описанному у Eikmanns и др. (Microbiology 140, 1817-1828 (1994)). На основе известной последовательности гена ptsH из С.glutamicum, полученной согласно примеру 2, выбирали следующие олигонуклеотиды для полимеразной цепной реакции:
ptsHexp1:
5'-АСС ACT GGT GCA АТС ТСС АТ-3';
ptsHexp2:
5'-ТТТ ACT CAG CGT САА GGT СС-3'.
Указанные праймеры были синтезированы фирмой ARK Scientific GmbH Biosystems (Дармштадт, Германия), а ПЦР проводили согласно стандартному методу, описанному у Innis и др. (PCR protocols. A guide to methods and applications, изд-во Academic Press (1990)) с использованием полимеразы Pwo фирмы Roche Diagnostics GmbH (Маннгейм; Германия). С помощью полимеразной цепной реакции с использованием указанных праймеров оказалось возможным амплифицировать фрагмент ДНК длиной 686 пар оснований, несущий ген ptsH с возможной промоторной областью. Последовательность ДНК амплифицированного фрагмента ДНК проверяли путем секвенирования.
Амплифицированный фрагмент ДНК встраивали путем лигирования с помощью набора Zero Blunt™ фирмы Invitrogen Corporation (Карлсбад, шт. Калифорния, США; каталожный номер К2700-20) в вектор pCR®Blunt II (Bernard и др., Journal of Molecular Biology, 234: 534-541 (1993)).
Затем полученный в результате лигирования продукт встраивали путем электропорации (Hanahan, DNA cloning. A practical approach, т.I, изд-во IRL Press, Oxford, Washington D.C., США (1985)) в штамм Е.coli ТОР10. Отбор несущих плазмиду клеток осуществляли путем посева полученного в результате трансформации продукта на LB-агар (Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), дополненный 25 мг/л канамицина. Из одного трансформанта выделяли плазмидную ДНК с помощью набора QIAprep Spin Miniprep Kit фирмы Qiagen и анализировали путем рестрикции с помощью рестриктазы EcoRI и последующего электрофореза на агарозном геле (0,8%-ном). Плазмиду обозначили как pCRB1-ptsHexp, и она представлена на фиг.1.
3.2. Конструирование челночного вектора pEC-K18mob2, способного реплицироваться в Е.coli и в С.glutamicum
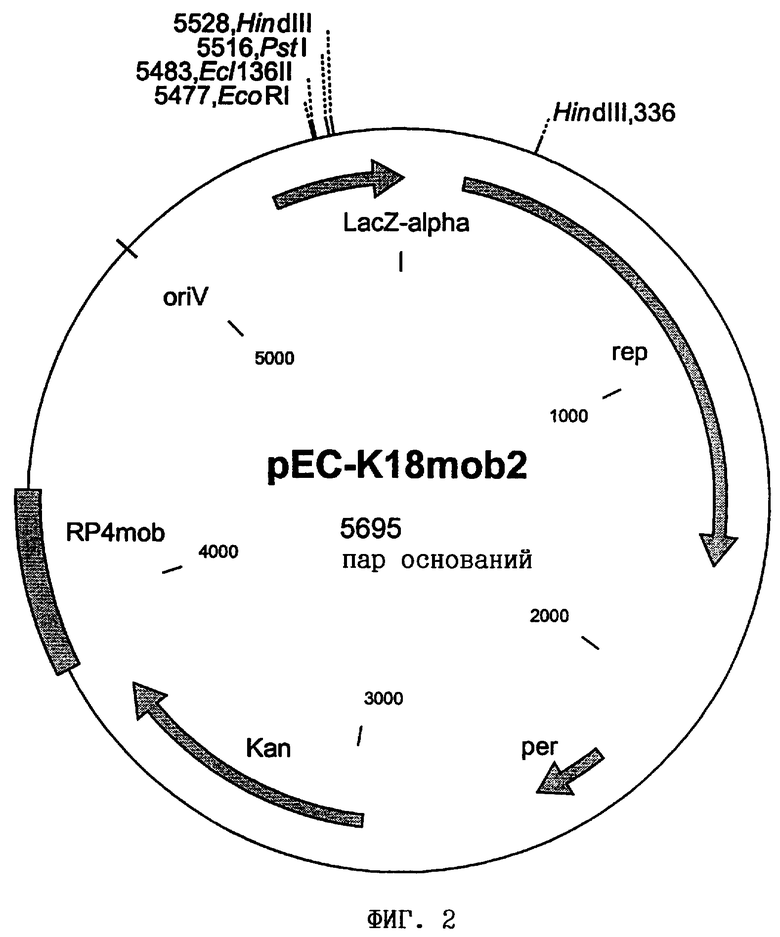
Челночный вектор, способный реплицироваться в Е.coli и в С.glutamicum, конструировали согласно известному методу. Этот вектор содержал область репликации rep из плазмиды pGA1, включая эффектор репликации per (US 5175108; Nesvera и др., Journal of Bacteriology 179, 1525-1532 (1997)), обусловливающий устойчивость к канамицину ген aph(3')-IIa транспозона Тn5 (Beck и др., Gene 19, 327-336 (1982)), область репликации oriV плазмиды pMB1 (Sutcliffe, Cold Spring Harbor Symposium on Quantitative Biology 43, 77-90 (1979)), фрагмент гена lacZα, включая промотор lac и множественный сайт клонирования (mcs) (Norrander и др., Gene 26, 101-106 (1983)), и область mob плазмиды RP4 (Simon и др., Bio/Technology 1: 784-791 (1983)). Сконструированным вектором трансформировали штамм Е.coli DH5αmcr (Hanahan, DNA cloning. A practical approach, т.I, изд-во IRL Press, Oxford, Washington D.C., США). Отбор несущих плазмиду клеток осуществляли путем посева полученного в результате трансформации продукта на LB-агар (Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.), дополненный 25 мг/л канамицина. Из одного трансформанта выделяли плазмидную ДНК с помощью набора QIAprep Spin Miniprep Kit фирмы Qiagen и анализировали путем рестрикции с помощью рестриктаз EcoRI и HindIII и последующего электрофореза на агарозном геле (0,8%-ном). Плазмиду обозначили как pEC-K18mob2, и она представлена на фиг.2.
В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ, Брауншвейг, Германия) был депонирован следующий микроорганизм:
- штамм С.glutamicum DSM 5715/pEC-K18mob2 под регистрационным номером DSM 13245.
3.3. Клонирование ptsH в челночном векторе pEC-K18mob2, способном реплицироваться в Е.coli и в С.glutamicum
Для клонирования гена ptsH в описанном в примере 3.2. челночном векторе pEC-K18mob2, способном реплицироваться в Е.coli и в С.glutamicum, плазмидную ДНК pEC-K18mob2 полностью расщепляли рестриктазами KpnI и XbaI и обрабатывали щелочной фосфатазой (щелочная фосфатаза, фирма Roche Diagnostics GmbH, Маннгейм, Германия).
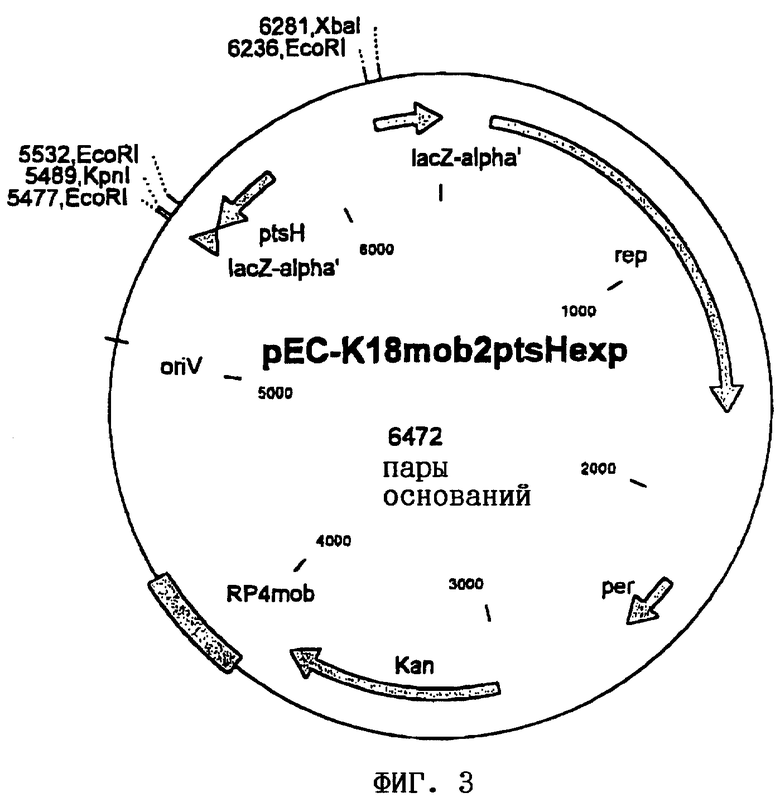
Вектор pCRB1-ptsHexp выделяли из штамма Escherichia coli Top10 и полностью расщепляли рестриктазами KpnI и XbaI и фрагмент гена ptsH длиной 788 пар оснований выделяли на 0,8%-ном агарозном геле (набор QIAquick Gel Extraction Kit фирмы Qiagen, Гильден, Германия). Затем фрагмент гена ptsH встраивали путем лигирования в вектор pEC-K18mob2 (лигаза фага Т4, фирма Roche Diagnostics GmbH, Маннгейм, Германия). Полученным в результате лигирования продуктом трансформировали штамм Е.coli DH5αmcr (Hanahan, DNA cloning. A practical approach, т.I, изд-во IRL Press, Oxford, Washington D.C., США). Отбор несущих плазмиду клеток осуществляли путем посева полученного в результате трансформации продукта на LB-агар (Sambrook и др., Molecular Cloning: A Laboratory Manual, 2-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), дополненный 25 мг/л канамицина. Из одного трансформанта выделяли плазмидную ДНК с использованием набора QIAprep Spin Miniprep Kit фирмы Qiagen (Гильден, Германия) и анализировали путем обработки рестриктазой EcoRI и последующего электрофореза на агарозном геле. Полученную плазмиду обозначили как pEC-K18mob2ptsHexp, и она представлена на фиг.3.
Штамм обозначили как Е.coli DH5αmcr/pEC-K18mob2ptsHexp, и он в соответствии с Будапештским договором был депонирован в виде чистой культуры 28 ноября 2000 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ, Брауншвейг, Германия) под регистрационным номером DSM 13878.
Пример 4
Трансформация штамма DSM 5715 плазмидой pEC-K18mob2ptsHexp
Штамм DSM 5715 трансформировали плазмидой pEC-K18mob2ptsHexp с помощью метода электропорации, описанного у Liebl и др. (FEMS Microbiological Letters, 53: 299-303 (1989)). Отбор трансформантов осуществляли на LBHIS-агаре, содержащем 18,5 г/л бульона, используемого для инфузии в мозг и сердце, 0,5М сорбит, 5 г/л бакто-триптона, 2,5 г/л экстракта бакто-дрожжей, 5 г/л NaCl и 18 г/л бакто-агара и дополненном 25 мг/л канамицина. Инкубацию проводили в течение 2 дней при 33°С.
Плазмидную ДНК из одного трансформанта выделяли обычными методами (Peters-Wendisch и др., Microbiology, 144, 915-927 (1998)), расщепляли с помощью рестриктазы EcoRI и затем плазмиду анализировали с помощью электрофореза на агарозном геле. Полученный штамм обозначили как DSM 5715/pEC-K18mob2ptsHexp.
Пример 5
Получение лизина
Созданный согласно примеру 4 штамм DSM 5715/pEC-K18mob2ptsHexp культивировали в питательной среде, пригодной для получения лизина, и определяли содержание лизина в надосадочной жидкости культуры.
Для этого штамм сначала инкубировали в течение 24 ч при 33°С на агаровой пластине, содержащей соответствующий антибиотик (агар со средой, используемой для инфузии в мозг и сердце, дополненной канамицином (25 мг/л)). Этой культурой, выращенной на агаровой пластине, инфицировали предварительную культуру (10 мл среды в колбе Эрленмейера объемом 100 мл), В качестве среды для предварительной культуры использовали полную среду CgIII.
Состав среды CgIII:
Значение рН доводили до 7,4.
Среду дополняли канамицином (25 мг/л). Предварительную культуру инкубировали в течение 16 ч при 33°С на шейкере при 240 об/мин. Этой предварительной культурой инфицировали основную культуру таким образом, чтобы начальная оптическая плотность ОП (660 нм) основной культуры составляла 0,05. В качестве среды для основной культуры использовали среду ММ.
Состав среды ММ:
ЖЗК (жидкость, образующаяся при замачивании
Значения рН ЖЗК, МОПС и раствора солей доводили до 7 с помощью аммиачной воды и эти растворы автоклавировали. Затем добавляли стерильные растворы субстрата и витаминов, а также безводный автоклавированный СаСО3.
Культивирование осуществляли в колбе Эрленмейера объемом 100 мл с дефлекторами, в которую помещали 10 мл среды. В среду добавляли канамицин (25 мг/л). Культивирование осуществляли при 33°С и 80%-ной относительной влажности воздуха.
Через 48 ч и 72 ч с помощью прибора типа Biomek 1000 (фирма Beckmann Instruments GmbH, Мюнхен) определяли ОП при длине волны 660 нм. Концентрацию образовавшегося лизина определяли с помощью анализатора аминокислот фирмы Eppendorf-BioTronik (Гамбург, Германия) с использованием ионообменной хроматографии и последующей дериватизации на колонках с обнаружением нингидрином.
В таблице 1 представлены результаты опыта.
На прилагаемых к описанию чертежах показано:
на фиг.1 - карта плазмиды pCRBl-ptsHexp,
на фиг.2 - карта плазмиды pEC-K18mob2,
на фиг.3 - карта плазмиды pEC-K18mob2ptsHexp.


Изобретение относится к биотехнологии. Для получения L-лизина осуществляют ферментацию с использованием продуцирующего L-лизин штамма коринебактерий, в котором усиливают полинуклеотид, содержащий полинуклеотидную последовательность, кодирующую компонент Н системы фосфотрансферазы. Полученный L-лизин выделяют. Заявленное изобретение позволяет повысить эффективность синтеза коринебактериями L-лизина. 5 н. и 11 з.п. ф-лы, 3 ил., 1 табл.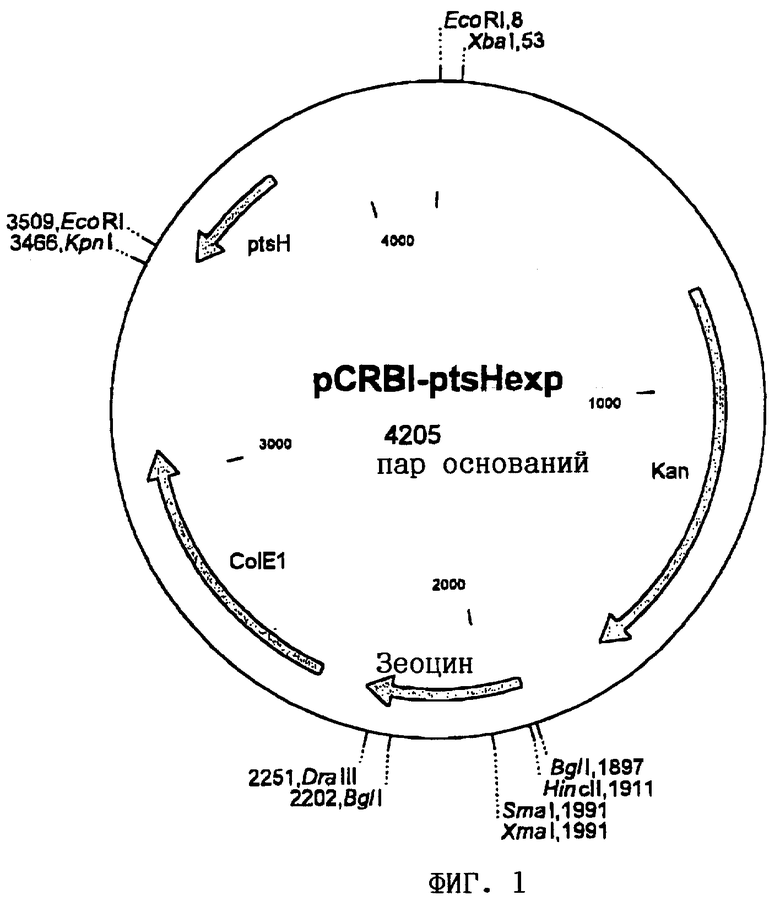
а) полинуклеотид, идентичный по крайней мере на 70% полинуклеотиду, кодирующему полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO:2,
б) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 70% аминокислотной последовательности, представленной в SEQ ID NO:2,
в) полинуклеотид, комплементарный полинуклеотидам, указанным в подпункте а) или б).
(I) нуклеотидную последовательность, представленную в SEQ ID NO:1, или
(II) по крайней мере одну последовательность, которая соответствует последовательности, указанной в подпункте (I), в пределах вырожденности генетического кода или
(III) по крайней мере одну последовательность, которая гибридизуется с последовательностью, комплементарной последовательности, указанной в подпункте (I) или (II) и при необходимости
(IV) функционально нейтральные смысловые мутации в последовательности, указанной в подпункте (I).
а) ферментацию с использованием продуцирующего L-лизин штамма коринебактерий, в которых усиливают, прежде всего сверхэкспрессируют, по крайней мере один из полинуклеотидов согласно п.1,
б) накопление L-лизина в среде или в клетках штамма и
в) выделение L-лизина.
ген dapA, кодирующий дигидродипиколинат-синтазу,
ген рус, кодирующий пируваткарбоксилазу,
ген tpi, кодирующий триозофосфатизомеразу,
ген gap, кодирующий глицеральдегид-3-фосфатдегидрогеназу,
ген ptsM, кодирующий компонент М системы фосфоенолпируват-сахар-фосфотрансферазы (ptsM),
ген pgk, кодирующий 3-фосфоглицераткиназу и
ген lysE, обеспечивающий экспорт лизина.
ген pck, кодирующий фосфоенолпируваткарбоксикиназу,
ген pgi, кодирующий глюкозо-6-фосфатизомеразу,
ген рох, кодирующий пируватоксидазу.
| SAFFEN DW et al., Sugar transport by the bacterial phosphotransferase system | |||
| J | |||
| Biol | |||
| Chem., 1987, nov | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| ЕР 0854189, 22.07.1998 | |||
| ЗЕМЛЕРОЙНАЯ МАШИНА3ClA^U.-V-= •--; ^1|1ЯЕН1Ш-1:.Ш'•" '^--.БИБЛИОТе-гиЧ J^ | 0 |
|
SU318663A1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА ПОСРЕДСТВОМ КУЛЬТИВИРОВАНИЯ ШТАММА БАКТЕРИЙ | 1992 |
|
RU2099424C1 |
Авторы
Даты
2006-01-27—Публикация
2001-01-12—Подача