Настоящее изобретение относится к кодирующим нуклеотидным последовательностям гена pck из коринебактерий и к способу ферментативного получения L-аминокислот, прежде всего L-лизина и L-треонина, за счет ослабления гена pck.
Предпосылки создания изобретения
Аминокислоты, прежде всего лизин и треонин, находят применение в кормах для животных, в пищевой промышленности, в фармацевтической промышленности и в медицине.
Известно, что эти вещества получают ферментативным путем с использованием штаммов коринебактерий, прежде всего с использованием Corynebacterium glutamicum. Поскольку эти продукты имеют большое значение, постоянно ведется работа по совершенствованию способа их получения. Усовершенствования способа могут касаться технологических сторон процесса ферментации, таких как перемешивание и обеспечение кислородом, или состава питательных сред, например концентрации сахара в процессе ферментации, или переработки продукта, например с помощью ионообменной хроматографии, или присущей самому микроорганизму продуктивности.
Для улучшения продуктивности этих микроорганизмов применяют методы мутагенеза, селекции и отбора мутантов. Таким путем получают штаммы, которые обладают устойчивостью к антиметаболитам или которые являются ауксотрофами в отношении обладающих регуляторной функцией продуктов обмена веществ и продуцируют целевую аминокислоту.
В течение ряда лет для улучшения продуцирующих L-аминокислоты штаммов Corynebacterium также применяют методы рекомбинантной ДНК.
Задача изобретения
Задачей изобретения является разработка новых подходов по усовершенствованию способа ферментативного получения аминокислот.
Описание изобретения
Аминокислоты, прежде всего L-лизин и L-треонин, находят применение в кормах для животных, в пищевой промышленности, в фармацевтической промышленности и в медицине. Поэтому представляет большой интерес разработка нового улучшенного способа получения этих продуктов.
Объектом изобретения является выделенный из коринебактерий полинуклеотид, содержащий полинуклеотидную последовательность, выбранную из группы, включающей
а) полинуклеотид, идентичный по крайней мере на 70% полинуклеотиду, кодирующему полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 2,
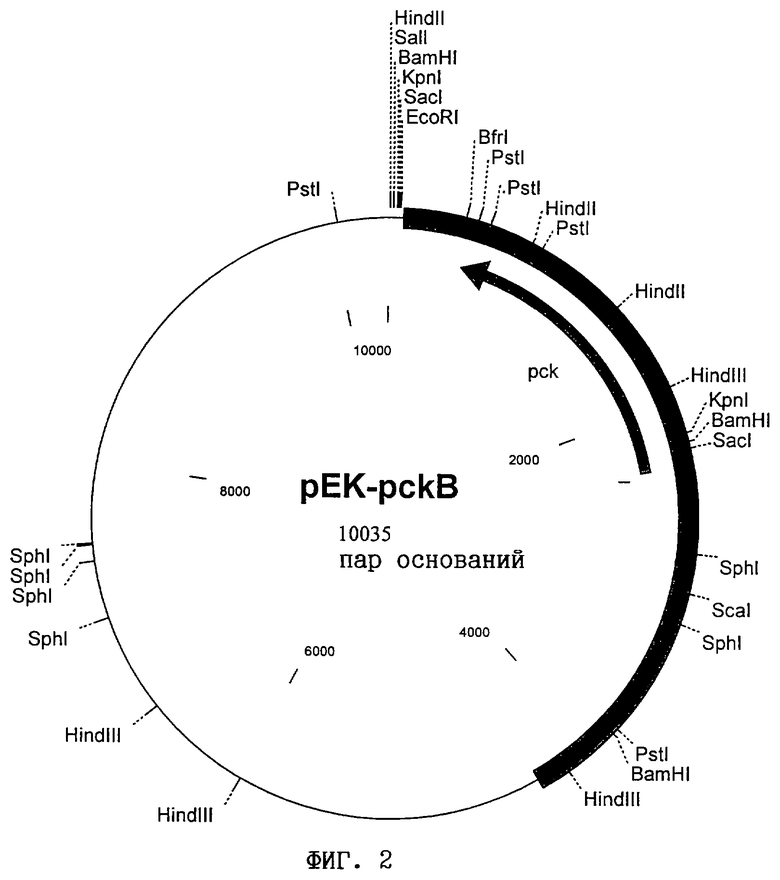
б) полинуклеотид, идентичный по крайней мере на 70% полинуклеотиду, который кодирует указанный полипептид и содержится в плазмиде pEK-pckA (фиг.1) или рЕК-pckB (фиг.2),
в) полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, идентичную по крайней мере на 70% аминокислотной последовательности, представленной в SEQ ID NO: 2,
г) полинуклеотид, комплементарный полинуклеотидам, указанным в подпунктах а), б) или в), и
д) полинуклеотид, содержащий по крайней мере 15 последовательных пар оснований полинуклеотидной последовательности, указанной в подпункте а), б), в) или г).
Объектом изобретения является также реплицируемая в коринеформных микроорганизмах, предпочтительно рекомбинантная, ДНК из Corynebacterium, которая содержит по крайней мере кодирующую нуклеотидную последовательность гена pck, представленную в SEQ ID NO: 1.
Объектом изобретения является также реплицируемая ДНК, содержащая
(I) нуклеотидную последовательность, представленную в SEQ ID NO: 1, или
(II) по крайней мере одну последовательность, которая соответствует последовательности, указанной в подпункте (I), в пределах вырожденности генетического кода, или
(III) по крайней мере одну последовательность, которая гибридизуется с последовательностью, комплементарной последовательности, указанной в подпункте (I) или (II), и/или необязательно
(IV) функционально нейтральные смысловые мутации в последовательности, указанной в подпункте (I).
Другими объектами изобретения являются следующие:
полинуклеотид, включающий нуклеотидную последовательность, представленную в SEQ ID NO: 1,
полинуклеотид, кодирующий полипептид, который содержит аминокислотную последовательность, представленную в SEQ ID NO: 2,
вектор, содержащий указанный полинуклеотид, прежде всего рЕК-pckA или рЕК-pckB, представленные на фиг.1 и 2,
и коринебактерии, служащие в качестве клеток-хозяев и несущие делецию Δpck.
Объектом изобретения являются также полинуклеотиды, которые практически представляют собой полинуклеотидную последовательность и которые могут быть получены путем скрининга с использованием гибридизации соответствующего банка гена, содержащего полный ген, который имеет полинуклеотидную последовательность, соответствующую SEQ ID NO: 1, с зондом, который имеет указанную полинуклеотидную последовательность, представленную в SEQ ID NO: 1, или ее фрагмент, и путем выделения указанной последовательности ДНК.
Полинуклеотидные последовательности по изобретению пригодны в качестве гибридизующих зондов для РНК, кДНК и ДНК для выделения полноразмерной кДНК, кодирующей фосфоенолпируваткарбоксикиназу, и для выделения тех кДНК или генов, которые имеют высокую степень сходства с последовательностью гена фосфоенолпируваткарбоксикиназы.
Кроме того, полинуклеотидные последовательности по изобретению пригодны в качестве праймеров для получения с помощью полимеразной цепной реакции (ПЦР) ДНК генов, кодирующих фосфоенолпируваткарбоксикиназу.
Такие олигонуклеотиды, которые служат в качестве зондов или праймеров, включают по крайней мере 30, предпочтительно по крайней мере 20, наиболее предпочтительно по крайней мере 15 последовательных пар оснований. Также могут использоваться олигонуклеотиды, имеющие длину по крайней мере 40 или 50 пар оснований.
Понятие "выделенный" относится к какому-либо элементу, выделенному из его естественного окружения.
Понятие "полинуклеотид" в целом относится к полирибонуклеотидам и полидезоксирибонуклеотидам, которые могут представлять собой как немодифицированную РНК или ДНК, так и модифицированную РНК или ДНК.
Понятие "полипептиды" относится к пептидам или протеинам, содержащим две или более аминокислот, которые связаны пептидными связями.
Полипептиды по изобретению включают полипептид, последовательность которого представлена в SEQ ID NO: 2, прежде всего полипептиды, обладающие биологической активностью протеина фосфоенолпируваткарбоксикиназы (ФЕП-карбоксикиназы), а также полипептиды, идентичные полипептиду, последовательность которого представлена в SEQ ID NO: 2, по крайней мере на 70%, предпочтительно идентичные по крайней мере на 80% и наиболее предпочтительно идентичные по крайней мере на 90-95% полипептиду, последовательность которого представлена в SEQ ID NO: 2, и обладающие указанной активностью.
Объектом изобретения является далее способ ферментативного получения L-аминокислот, прежде всего L-лизина и L-треонина, с использованием коринебактерий, прежде всего таких, которые уже обладают способностью продуцировать L-аминокислоты и в которых ослабляют, прежде всего экспрессируют с низким уровнем, кодирующую(-ие) нуклеотидную(-ые) последовательность(-и) гена pck.
Понятие "ослабление" в контексте настоящего описания означает понижение или подавление в микроорганизме внутриклеточной активности одного или нескольких ферментов (протеинов), кодируемых соответствующей ДНК, за счет, например, использования более слабого промотора или гена, соответственно аллеля, кодирующего соответствующий фермент с пониженной активностью, соответственно инактивирующего соответствующий фермент (протеин), и при необходимости за счет сочетания этих мер.
Микроорганизмы, являющиеся объектом настоящего изобретения, могут продуцировать L-аминокислоты, прежде всего лизин и треонин, из глюкозы, сахарозы, лактозы, фруктозы, мальтозы, мелассы, крахмала, целлюлозы или из глицерина и этанола. Они могут включать представителей коринебактерий, прежде всего из рода Corynebacterium. В роде Corynebacterium следует прежде всего отметить вид Corynebacterium glutamicum, который, как известно специалистам, обладает способностью продуцировать L-аминокислоты.
Пригодными штаммами бактерий р.Corynebacterium, прежде всего вида Corynebacterium glutamicum, являются, например, следующие известные штаммы дикого типа:
Corynebacterium glutamicum ATCC 13032,
Corynebacterium acetoglutamicum ATCC 15806,
Corynebacterium acetoacidophilum ATCC 13870,
Corynebacterium thermoaminogenes FERM BP-1539,
Corynebacterium melassecola ATCC 17965,
Brevibacterium flavum ATCC 14067,
Brevibacterium lactofermentum ATCC 13869 и
Brevibacterium divaricatum ATCC 14020,
а также полученные из них мутанты, соответственно штаммы, продуцирующие L-аминокислоты,
например, следующие штаммы, продуцирующие лизин:
Corynebacterium glutamicum FERM-P 1709,
Brevibacterium flavum FERM-P 1708,
Brevibacterium lactofermentum FERM-P 1712,
Corynebacterium glutamicum FERM-P 6463,
Corynebacterium glutamicum FERM-P 6464 и
Corynebacterium glutamicum DSM 5714,
или, например, следующие штаммы, продуцирующие L-треонин:
Corynebacterium glutamicum ATCC 21649,
Brevibacterium flavum ВВ69,
Brevibacterium flavum DSM 5399,
Brevibacterium lactofermentum FERM-BP 269,
Brevibacterium lactofermentum TBB-10,
Corynebacterium glutamicum MH20-22B-DR17.
Авторам изобретения удалось выделить новый ген pck из С. glutamicum, кодирующий фермент фосфоенолпируваткарбоксикиназу (ФЕП-карбоксикиназу) (КФ 4.1.1.49).
Для выделения гена pck, а также других генов из С. glutamicum сначала создают банк генов этого микроорганизма в Е. coli. Создание банка генов описано в широко известных учебниках и справочниках. В качестве примера можно назвать учебник Winnacker: Gene und Klone, Eine Einführung in die Gentechnologie (изд-во Chemie, Weinheim, Германия, 1990) или справочник Sambrook и др.: Molecular Cloning, A Laboratory Manual (Cold Spring Harbor Laboratory Press, 1989). Широко известным банком генов является банк генов штамма Е.coli K-12 W3110, созданный Kohara и др. (Cell 50, 495-508 (1987)) в λ-векторах. У Bathe и др. (Molecular and General Genetics, 252: 255-265 (1996)) описан банк генов штамма С. glutamicum ATCC 13032, полученный с помощью космидного вектора SuperCos I (Wahl и др., Proceedings of the National Academy of Sciences USA, 84: 2160-2164, (1987)) в штамме Е. coli К-12 NM554 (Raleigh и др., Nucleic Acids Research 16, 1563-1575, (1988)). В свою очередь у Börmann и др. (Molecular Microbiology 6(3), 317-326) описан банк генов штамма С.glutamicum ATCC 13032, полученный с использованием космиды рНС79 (Hohn и Collins, Gene 11, 291-298 (1980)).
Для создания банка генов С. glutamicum в Е. coli могут быть использованы также такие плазмиды, сответственно плазмидные векторы, как pBR322 (Bolivar, Life Sciences, 25, 807-818 (1979)), pUC9 (Viera и др., Gene, 19: 259-268, (1982)), pACYC177 (Chang и Cohen, Journal of Bacteriology 134, 1141-1156 (1978)) или pSC101 (Cohen и Chang, Journal of Bacteriology 132, 734-737 (1977)). В качестве хозяев прежде всего могут быть использованы такие штаммы Е. coli, которые имеют дефекты, полученные в результате рестрикции и рекомбинации.
Затем банк генов может быть встроен в индикаторный штамм путем трансформации (Hanahan, Journal of Molecular Biology 166, 557-580, 1983) или электропорации (Tauch и др., FEMS Microbiological Letters, 123: 343-347, 1994). Индикаторный штамм отличается тем, что он имеет мутацию в рассматриваемом гене, которая обусловливает обнаруживаемый фенотип. В объеме настоящего изобретения особый интерес представляет мутант Е.coli HG4, описанный у Goldie и Sanwal (Journal of Bacteriology 141, 1115-1121, 1980). Этот штамм имеет мутацию в гене pck, вследствие чего его рост на сукцинате как на единственном источнике углерода существенно замедляется. После трансформации с использованием вектора, несущего ген pck, рост на сукцинате может быть восстановлен.
Затем клонированные с помощью космид или других векторов длинные фрагменты ДНК могут быть субклонированы в известных плазмидных векторах в форме более коротких фрагментов. Таким путем ген по изобретению можно встроить в конкретный участок ДНК. Для этого используют известные плазмидные векторы, такие как pBR322 (Bolivar, Life Sciences, 25, 807-818 (1979)) или pSU-векторы, описанные у Bartolomé и др. (Gene 102, 75-78 (1991)). Однако предпочтительно используют бифункциональные ("челночные") векторы, которые способны реплицироваться в Escherichia coil и Corynebacterium glutamicum, такие как pZ1 (Menkel и др., Applied and Environmental Microbiology 64: 549-554 (1989)) или pEK0 (Eikmanns и др., Gene 102: 93-98 (1991)), что позволяет проводить исследования на обоих видах микроорганизмов. В качестве примера можно назвать плазмиды pEK-pckA (фиг.1) и рЕК-рскВ (фиг.2), которые сконструированы на основе плазмидного вектора pEK0 и несут предлагаемый ген pck.
Затем охарактеризованные таким образом фрагменты ДНК повторно клонируют в широко распространенных, пригодных для секвенирования ДНК векторах. В альтернативном варианте длинные фрагменты ДНК, клонированные в космидах, могут быть субклонированы непосредственно в векторах, предназначенных для секвенирования. Примерами таких, пригодных для секвенирования ДНК векторов, являются плазмида pGEM-5zf(-) или плазмида pGEM-5zf(+) фирмы Promega Corporation (руководство Promega Protocols and Application Guide, 2-е изд., часть Y981, Promega Corporation, Мэдисон, шт. Висконсин, США, 1991).
Методы секвенирования ДНК описаны среди прочего у Sanger и др. (Proceedings of the National Academy of Sciences USA, 74: 5463-5467, (1977)).
Затем полученные последовательности ДНК могут быть исследованы с помощью известных алгоритмов, соответственно программ анализа последовательностей, таких как программа, созданная Staden (Nucleic Acids Research 14, 217-232 (1986), программа GCG, созданная Butler (Methods of Biochemical Analysis 39, 74-97 (1998), алгоритм FASTA, разработанный Pearson и Lipman (Proceedings of the National Academy of Sciences USA, 85: 2444-2448, (1988)), или алгоритм BLAST, разработанный Altschul и др. (Nature Genetics 6, 119-129 (1994)), и сравнены со списками последовательностей, которые находятся в доступных научной общественности банках данных. Доступными научной общественности банками данных нуклеотидных последовательностей являются, например, банк данных Европейских лабораторий молекулярной биологии (European Molecular Biologies Laboratories) (EMBL, Гейдельберг, Германия) или банк данных Национального центра биотехнологической информации (National Center for Biotechnology Information) (NCBI, Бетезда, штат Мэриленд, США).
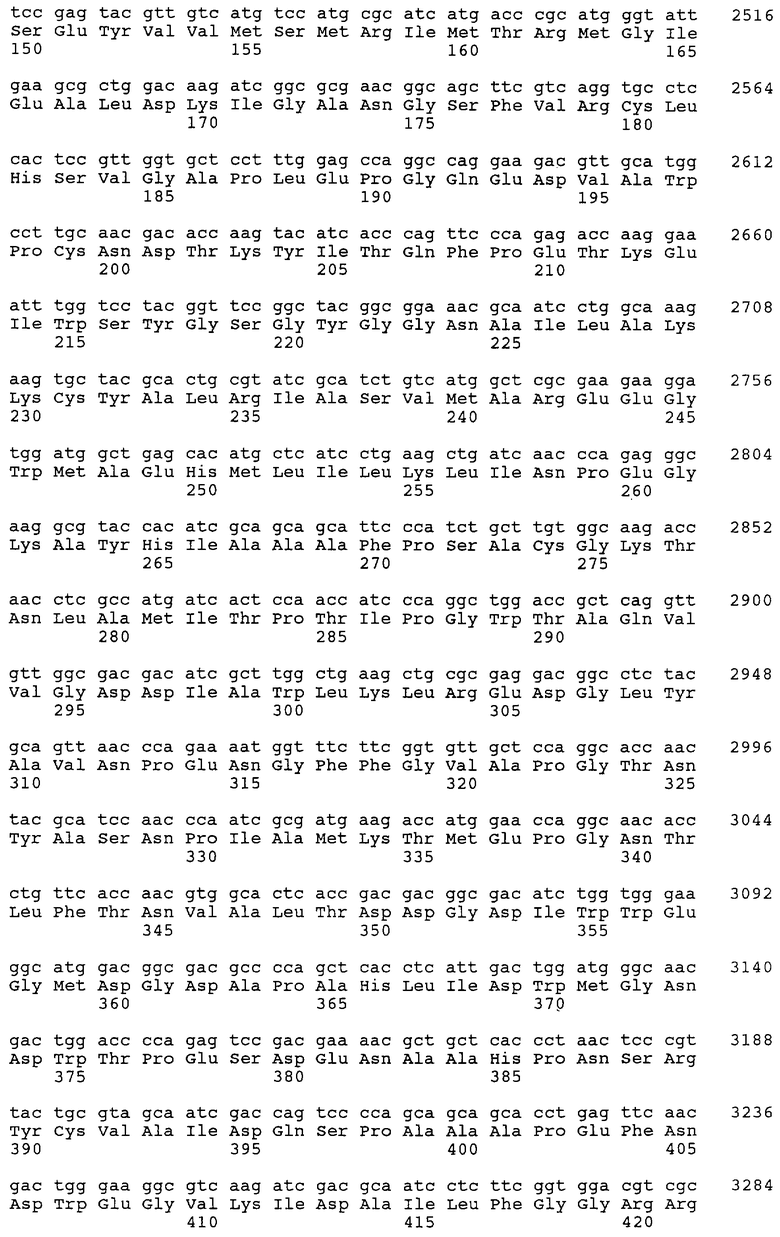
Таким способом была получена новая кодирующая последовательность ДНК гена pck С.glutamicum, которая в виде SEQ ID NO: 1 является составной частью настоящего изобретения. Кроме того, из данной последовательности ДНК с использованием описанных выше методов была выведена аминокислотная последовательность соответствующего протеина. Выведенная аминокислотная последовательность продукта гена pck представлена в SEQ ID NO: 2.
Кодирующие последовательности ДНК, которые получают из SEQ ID NO: 1 на основе вырожденности генетического кода, также являются составной частью изобретения. Составной частью изобретения также являются и последовательности ДНК, которые гибридизуются с SEQ ID NO: 1 или с частями SEQ ID NO: 1. Кроме того, составной частью изобретения являются последовательности ДНК, которые могут быть созданы на основе SEQ ID NO: 1 путем полимеразной цепной реакции (ПЦР) с использованием праймеров. Такие олигонуклеотиды, как правило, имеют длину по меньшей мере 15 пар оснований.
Соответствующие рекомендации по идентификации последовательностей ДНК с помощью гибридизации можно найти, в частности, в справочнике "The DIG System Users Guide for Filter Hybridization" фирмы Boehringer Mannheim GmbH (Маннгейм, Германия, 1993) и у Liebl и др. (International Journal of Systematic Bacteriology, 41: 255-260 (1991)). Рекомендации касательно амплификации последовательностей ДНК с помощью полимеразной цепной реакции (ПЦР) можно найти среди прочего в справочнике Gait: Oligonucleotide synthesis: a practical approach (IRL Press, Oxford, Великобритания, 1984) и у Newton и Graham: PCR (Spektrum Akademischer Verlag, Гейдельберг, Германия, 1994).
При создании изобретения было установлено, что в результате ослабления гена pck может быть повышена эффективность синтеза L-аминокислот, прежде всего лизина и треонина, коринебактериями.
Указанное ослабление может быть достигнуто за счет снижения или подавления либо экспрессии гена pck, либо каталитических свойств протеина фермента. При необходимости оба метода могут применяться совместно.
Снижение экспрессии гена может быть достигнуто путем соответствующего культивирования или путем генетической модификации (мутации) сигнальных структур, контролирующих экспрессию гена. Сигнальными структурами, контролирующими экспрессию гена, являются, например, репрессоры, активаторы, операторы, промоторы, аттенюаторы, сайты связывания рибосомы, инициирующий кодон и терминаторы. Соответствующая информация приведена, например, в WO 96/15246, у Boyd и Murphy (Journal of Bacteriology 170: 5949 (1988)), у Voskuil и Chambliss (Nucleic Acids Research 26: 3548 (1998)), у Jensen и Hammer (Biotechnology and Bioengineering 58: 191 (1998)), у Patek и др. (Microbiology 142: 1297 (1996)) и в известных учебниках по генетике и молекулярной биологии, таких как учебник Knippers ("Moleculare Genetik", 6-е изд., Georg Thieme Verlag, Stuttgart, Германия, 1995) или Winnacker ("Gene und Klone", VCH Verlagsgesellschaft, Weinheim, Германия, 1990).
Мутации, которые могут приводить к модификации или снижению каталитических свойств протеинов ферментов, известны, при этом в качестве примера можно упомянуть статьи Qiu и Goodman (Journal of Biological Chemistry 272: 8611-8617 (1997)), Sugimoto и др. (Bioscience Biotechnology and Biochemistry 61: 1760-1762 (1997)) и Möckel ("Die Threonindehydratase aus Corynebacterium glutamicum: Aufhebung der allosterischen Regulation und Struktur des Enzyms", Сообщения Исследовательского центра г. Юлих (Forschungszentrum Jülich), Jül-2906, ISSN 09442952, Юлих, Германия, 1994). Обзор публикаций можно найти в известных учебниках по генетике и молекулярной биологии, таких как учебник Hagemann ("Allgemeine Genetik", Gustav Fischer Verlag, Stuttgart, 1986).
Мутации, которые могут быть использованы для данной цели, представляют собой транзиции, трансверсии, инсерции и делеции. В зависимости от воздействия замены аминокислот на ферментативную активность мутации подразделяют на миссенс- и нонсенс-мутации. Инсерции или делеции по крайней мере одной пары оснований в гене приводят к мутациям "сдвига рамки", в результате которых происходит встраивание неправильных аминокислот или преждевременное прекращение трансляции. Делеции нескольких кодонов, как правило, приводят к полному нарушению ферментативной активности. Методы создания таких мутаций известны, при этом соответствующую информацию можно обнаружить в известных учебниках по генетике и молекулярной биологии, таких как учебник Knippers ("Moleculare Genetik", 6-е изд., изд-во Georg Thieme Verlag, Stuttgart, Германия, 1995), Winnacker ("Gene und Klone", изд-во VCH Verlagsgesellschaft, Weinheim, Германия, 1990) или Hagemann ("Allgemeine Genetik", изд-во Gustav Fischer Verlag, Stuttgart, 1986).
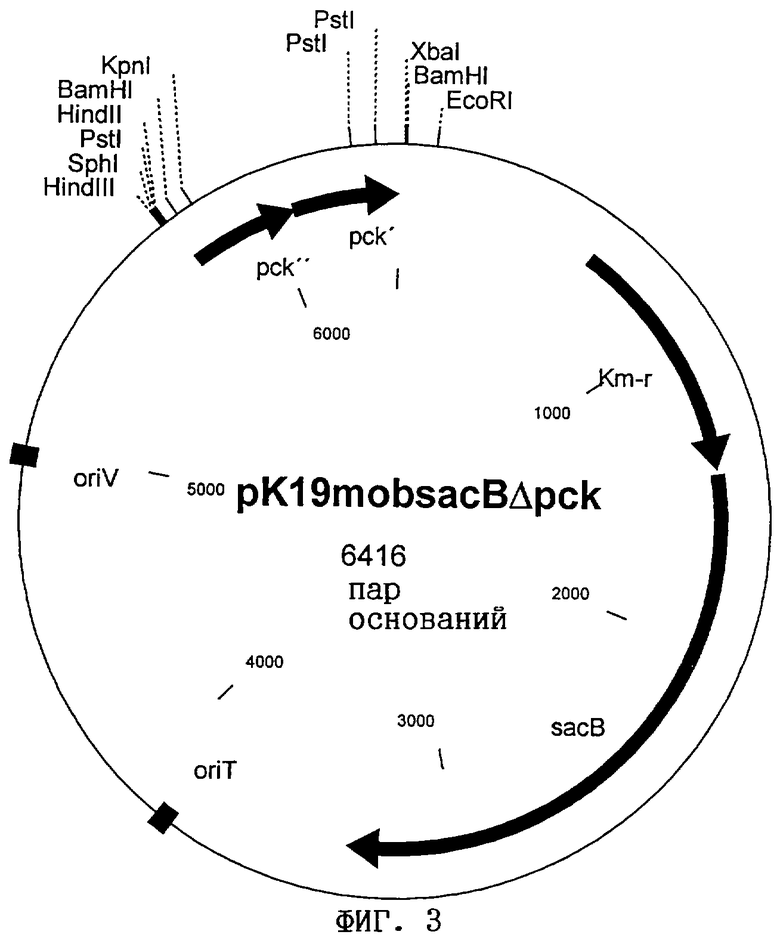
Примером мутантного гена pck является аллель Δpck, содержащийся в плазмиде pK19mobsacBΔpck (фиг.3). Аллель Δpck содержит лишь 5'- и 3'-фланкирующие последовательности гена pck; в нем отсутствует участок кодирующей области длиной 1071 пара оснований (деления). Этот аллель Δpck может быть встроен путем интеграционного мутагенеза в коринебактерии. Для этого может быть использована вышеупомянутая плазмида pK19mobsacBΔpck, которая не реплицируется в С.glutamicum. Переносом путем конъюгации или трансформации и гомологичной рекомбинации с помощью первого кроссинговера, приводящего к интеграции, и второго кроссинговера, приводящего к эксцизии (изъятию) соответствующего фрагмента, осуществляют встраивание аллеля Δpck в ген pck и достигают полной потери функции фермента в соответствующем штамме.
Соответствующая информация касательно интеграционного мутагенеза представлена, например, у Schwarzer и Pühler (Bio/Technology 9, 84-87 (1991)) или у Peters-Wendisch и др. (Microbiology 144, 915-927 (1998)).
Примерами продуцирующих аминокислоты штаммов коринебактерии с ослабленным геном pck являются продуцирующий лизин штамм МН20-22BΔpck и продуцирующий треонин штамм DM368-2Δpck.
Для продуцирования L-аминокислот может оказаться целесообразным наряду с ослаблением гена pck сверхэкспрессировать один или несколько ферментов, участвующих в конкретном пути биосинтеза.
Так, например, для продуцирования L-лизина можно
- одновременно сверхэкспрессировать ген dapA, кодирующий дигидродипиколинат-синтазу (ЕР-В 0197335), или
- одновременно амплифицировать фрагмент ДНК, обусловливающий устойчивость к S-(2-аминоэтил)цистеину (EP-A 0088166).
Для продуцирования L-треонина можно, например,
- одновременно сверхэкспрессировать ген hom, кодирующий гомосериндегидрогеназу (Peoples и др., Molecular Microbiology 2, 63-72 (1988)) или аллели homdr, соответственно homFBR (Archer и др., Gene 107, 53-59 (1991)); Reinscheid и др., Journal of Bacteriology 173, 3228-3230 (1991)), кодирующие "устойчивую в отношении обратной связи" гомосериндегидрогеназу.
Кроме того, для продуцирования L-аминокислот, прежде всего лизина и треонина, наряду с ослаблением гена pck может оказаться целесообразным исключить нежелательные побочные реакции (Nakayama: "Breeding of Amino Acid Producing Microorganisms", Overproduction of Microbial Products, под ред. Krumphanzl, Sikyta, Vanek, изд-во Academic Press, London, UK, 1982).
Для продуцирования аминокислот, прежде всего L-лизина и L-треонина, созданные согласно изобретению микроорганизмы можно культивировать непрерывно или периодически с использованием периодического процесса (культивирование партий) или периодического процесса с подпиткой либо периодического процесса с повторяющейся подпиткой. Обзор известных способов культивирования представлен в учебнике Chmiel (Bioprozesstechnik 1. Einführung in die Bioverfahrenstechnik (изд-во Gustav Fischer, Stuttgart, 1991)) или в учебнике Storhas (Bioreaktoren und periphere Einrichtungen (изд-во Vieweg, Braunschweig/Wiesbaden, 1994)).
Используемая культуральная среда должна быть соответствующим образом адаптирована к требованиям конкретного штамма. Описания культуральных сред для различных микроорганизмов содержатся в справочнике "Manual of Methods for General Bacteriology" Американского общества бактериологии (Washington D.C., США, 1981). В качестве источника углерода могут быть использованы сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, меласса, крахмал и целлюлоза, масла и жиры, такие как соевое масло, подсолнечное масло, арахисовое масло и кокосовое масло, жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота, спирты, такие как глицерин и этанол, и органические кислоты, такие как уксусная кислота. Эти вещества могут применяться по отдельности или в виде смеси. В качестве источника азота могут применяться органические азотсодержащие соединения, такие как пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкость, образующаяся после замачивания зерен кукурузы до разбухания, соевая мука и мочевина, или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота могут применяться по отдельности или в виде смеси. В качестве источника фосфора могут применяться фосфорная кислота, кислый фосфат калия или дикалийгидрофосфат либо соответствующие натриевые соли. Кроме того, культуральная среда должна содержать соли металлов, такие как сульфат магния или сульфат железа, которые необходимы для роста. И, наконец, в дополнение к вышеназванным соединениям могут использоваться такие важные для роста вещества, как аминокислоты и витамины. Помимо этого, в культуральную среду могут быть добавлены соответствующие предшественники. Вышеуказанные добавки могут быть введены в культуральную среду в виде одноразовой добавки или добавляться соответствующим образом в процессе культивирования.
Для контроля значения рН культуральной среды используют соответственно либо основания, такие как гидроксид натрия, гидроксид калия, аммиак, соответственно аммиачную воду, либо кислоты, такие как фосфорная кислота или серная кислота. Для контроля пенообразования добавляют антивспениватели, такие как полигликолевые эфиры жирных кислот. Для поддержания стабильности плазмид могут быть добавлены соответствующие конкретной среде вещества, обладающие избирательным действием, например антибиотики. Для поддержания аэробных условий в культуру вводят кислород или содержащие кислород газовые смеси, например воздух. Температура культуральной среды в норме находится в диапазоне от 20 до 45°С и предпочтительно от 25 до 40°С. Культивирование продолжают до тех пор, пока не образуется максимальное количество целевой L-аминокислоты. Как правило, эта цель достигается за 10-160 ч.
В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung für Mikroorganismen und Zellkulturen (DSMZ), Брауншвейг, Германия) был депонирован следующий микроорганизм:
- штамм Escherichia coli DH5α/pK19mobsacBΔpck под регистрационным номером DSM 13047.
Способ по изобретению предназначен для ферментативного получения L-аминокислот, прежде всего L-аспарагиновой кислоты, L-аспарагина, L-гомосерина, L-треонина, L-изолейцина и L-метионина, прежде всего L-лизина и L-треонина, с использованием коринебактерий.
Примеры
Ниже настоящее изобретение проиллюстрировано на примерах его осуществления.
Для этой цели среди прочего проводили опыты с использованием продуцирующего лизин штамма Corynebacterium glutamicum MH20-22B и продуцирующего треонин штамма Brevibacterium flavum DM3 68-2. В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung für Mikroorganismen und Zellkulturen (DSMZ), Брауншвейг, Германия) депонированы штамм MH20-22B под регистрационным номером DSM 5715 (ЕР-В 0435132) и штамм DM368-2 под регистрационным номером DSM 5399 (ЕР-В 0385940).
Пример 1
Выделение гена pck
Для выделения гена ФЕП-карбоксикиназы (pck) из С. glutamicum по известному методу (Sambrook и др.. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) создавали космидный банк гена на основе космиды рНС79 (Hohn и Collins, Gene 11, 291-298 (1980)). Для этого из штамма С.glutamicum ATCC 13032 выделяли хромосомную ДНК (Eikmanns и др., Microbiology 140, 1817-1828 (1994)) и частично расщепляли рестриктазой Sau3A. После встраивания полученного фрагмента в сайт рестрикции BamHI космиды рНС79 путем линирования полученный продукт упаковывали в протеиновую оболочку бактериофага лямбда и трансфектировали штамм Е. coli ED8654 (Murray и др., Molecular and General Genetics 150, 53-61 (1997)). Упаковку рекомбинантной космиды в протеиновую оболочку фага лямбда осуществляли согласно методу Sternberg и др. (Gene I, 255-280 (1979)), а трансфекцию штамма Е. coli ED8654 проводили согласно методу, описанному у Sambrook и др. (Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)). Из 30 полученных рекомбинантных клонов Е. coli выделяли соответствующую космиду (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) и подвергали рестрикционному анализу с использованием фермента HindIII. Оказалось, что 24 из общего числа исследованных космид имели вставки, причем размер вставок составлял приблизительно 35 т.п.н. В общей сложности объединяли 2200 клонов Е. coli, несущих космиды со вставкой, и из этой смеси выделяли ДНК космиды по известному методу (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)).
Для выделения гена pck из С. glutamicum космидным банком генов по известному методу (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) трансформировали мутантный штамм Е. coli HG4, имеющий дефектный ген ФЕП-карбоксикиназы (Goldie и Sanwal, Journal of Bacteriology 141, 1115-1121 (1980)). Мутант HG4 из-за наличия дефектного гена ФЕП-карбоксикиназы не обладал способностью расти на сукцинате как на единственном источнике углерода. После трансформации этого мутантного штамма космидным банком гена получали в общей сложности 1200 клонов. Среди них два клона обладали способностью расти на минимальной среде М9 (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)), содержащей сукцинат (0,4%) в качестве единственного источника углерода. После выделения из этих клонов соответствующей космиды (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) и повторной трансформации мутантного штамма Е. coli HG4 полученные клоны снова оказались способными расти на среде М9, содержащей сукцинат в качестве единственного источника углерода.
Для выделения меньшего фрагмента, несущего ген pck из С.glutamicum, две комплементарные космиды расщепляли рестриктазами Xhol, ScaI и Pvull и разделяли по известному методу (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) на 0,8%-ном агарозном геле в электрическом поле. С помощью электроэлюирования (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) из геля выделяли фрагменты размером приблизительно 3,0 т.п.н. и путем лигирования встраивали в SalI (расщепление рестриктазой XhoI), соответственно в обработанный полимеразой Кленова сайт рестрикции EcoRI (расщепление рестриктазами Scal и PvuII) вектора рЕК0 (Eikmanns и др., Gene 102, 93-98 (1991)). Полученным в результате лигирования продуктом трансформировали штамм Е. coli HG4 и полученные трансформанты снова исследовали в отношении их способности расти на сукцинате в качестве единственного источника углерода. Среди трансформантов, полученных в результате введения продуктов, полученных в результате PvuII-лигирования, было выявлено семь клонов, плазмиды которых обеспечивали способность мутанта HG4 расти на сукцинате. Из рекомбинантных штаммов выделяли соответствующую плазмиду и проводили рестрикционное картирование. Оказалось, что все семь плазмид имели одинаковую PvuII-вставку размером 4,3 т.п.н., при этом у трех она была ориентирована в одном направлении, а у четырех - в другом. В зависимости от ориентации вставки в векторе новые сконструированные плазмиды обозначили как рЕК-pckA и рЕК-pckB соответственно. Рестрикционные карты обеих плазмид представлены на фиг.1 и 2.
Пример 2
Секвенирование структурного гена pck и пограничных областей
Для секвенирования из рЕК-pckA по известному методу выделяли EcoRI - фрагмент (сайт рестрикции EcoRI из вектора рЕК0) длиной приблизительно 3,9 т.п.н. Выступающие концы фрагмента достраивали до получения гладких концов с помощью полимеразы Кленова (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor (1989)) и встраивали в сайт рестрикции EcoRV вектора pGEM-5Zf(+) (фирма Promega Corporation, Мэдисон, шт. Висконсин, США). Последовательность вставки полученной таким образом плазмиды секвенировали с помощью метода секвенирования на основе разрыва цепи, описанного у Sanger и др. (Proceedings of the National Academy of Sciences USA 74: 5463-5467 (1977)). Она представлена в SEQ ID NO: 1. Полученную нуклеотидную последовательность длиной 3935 пар оснований анализировали с помощью пакета программ HUSAR (версия 3.0) Немецкого центра исследования рака (Deutsches Krebsforschungszentrum, DKFZ, Гейдельберг, Германия). Анализ последовательности позволил выявить открытую рамку считывания длиной 1830 пар оснований, которая кодирует протеин, состоящий из 610 аминокислот.
Пример 3
Сверхэкспрессия гена pck
Путем электропорации с последующим отбором на BHI-агаровых пластинах (Liebl и др., FEMS Microbiological Letters 65, 299-304 (1989)), содержащих канамицин (50 мкг/мл), плазмиды рЕК-pckA и pEK-pckB встраивали в штамм Corynebacterium glutamicum АТСС 13032 и полученные штаммы обозначили как ATCC13032/pEK-pckA и ATCC13032/pEK-pckB соответственно. Оба эти штамма и исходный штамм культивировали в комплексной среде Луриа-Бертани (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)) и тестировали в отношении ФЕП-карбоксикиназной активности по методу, описанному у Bentle и Lardy (Journal of Biological Chemistry 251, 2916-2921 (1976)). Результаты анализа представлены в таблице 1, и они свидетельствуют о том, что ФЕП-карбоксикиназная активность обоих штаммов, несущих плазмиды рЕК-pckA, соответственно pEK-pckB, в 10-12 раз выше, чем у исходного штамма.
ФЕП-карбоксикиназная активность различных штаммов
Пример 4
Конструирование интеграционной плазмиды для делеционного мутагенеза гена pck
Для инактивации гена ФЕП-карбоксикиназы из вектора pEK-pckB (фиг.2) выделяли EcoRI- SacI - фрагмент гена pck и путем лигирования встраивали в вектор pGEM-7Zf(+) (фирма Promega Corporation, Мэдисон, шт.Висконсин, США). Из полученной плазмиды путем делеции удаляли внутренний HindII-HindIII-фрагмент гена pck длиной 1,07 т.п.н., а затем выделяли ген pck, имеющий делецию участка длиной 1,07 т.п.н., в виде BfrI-SacI-фрагмента и после достраивания выступающих концов лигировали с вектором pk19mobsacB (Schäfer и др., Gene 145, 69-73 (1994)), который не реплицируется в С. glutamicum. В сконструированной таким образом интеграционной плазмиде pk19mobsacBΔpck (фиг.3) 5'-область гена pck (350 пар оснований) непосредственно граничит с 3'-областью гена pck (340 пар оснований); в геноме обе области разделены участком длиной 1071 пара оснований. До этой стадии все операции по клонированию осуществляли с использованием в качестве хозяина штамма Е. coli DH5α.
Пример 5
Делеционный мутагенез гена pck в штамме МН20-22В, продуцирующем лизин
С помощью интеграционной плазмиды pK19mobsacBΔpck трансформировали штамм Е. coli S17-1 (Simon и др., Bio/Technology 1, 784-791 (1983)). С использованием этого штамма плазмиду можно перенести путем конъюгации в штамм Corynebacterium glutamicum (Schäfer и др., Journal of Bacteriology 172, 1663-1666 (1990)). В качестве реципиента при конъюгации использовали продуцирующий лизин штамм С.glutamicum MH20-22B (Schrumpf и др., Applied Microbiology and Biotechnology 37, 566-571 (1992)). Из конъюгата штаммов Е. coli S17-1/pK19mobsacBΔpck и С.glutamicum MH20-22B с помощью последующего отбора на агаровых пластинах со средой Луриа-Бертани, содержащей канамицин (25 мкг/мл) и налидиксовую кислоту (50 мкг/мл), получали несколько трансконъюгантов. Для отбора продуктов второй рекомбинации, которая должна привести к эксцизии (изъятию) вектора вместе с геном pck, эти трансконъюганты культивировали на комплексной среде Луриа-Бертани, не содержащей антибиотиков (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press (1989)), но дополненной 1% глюкозы, и затем высевали на такую же среду, дополненную 10% сахарозы. Ген sacB, присутствующий в векторе pK19mobsacB, кодирует фермент левансахаразу и обусловливает синтез левана из сахарозы. Поскольку леван является токсичным для С.glutamicum, то на содержащей сахарозу среде могут расти только те клетки С.glutamicum, которые утратили интеграционную плазмиду (Jäger и др., Journal of Bacteriology 174, 5462-5466 (1992)). 30 устойчивых к сахарозе клонов исследовали в отношении их чувствительности к канамицину. У 11 из испытанных клонов наряду с устойчивостью к сахарозе была выявлена также требуемая чувствительность к канамицину. В этих 11 клонах, таким образом, снова был удален векторный фон. Путем анализа с помощью полимеразной цепной реакции (ПЦР). определяли, была ли осуществлена требуемая делеция. Для этого выделяли хромосомную ДНК из колонии исходного штамма и из колоний 11 чувствительных к канамицину клонов. Для этого соответствующие колонии снимали с агаровых пластин с помощью зубочистки, суспендировали в 50 мкл Н2О и инкубировали в течение 5 мин при 95°С. Порции по 1 мкл полученного раствора использовали в качестве матрицы для ПЦР. В качестве праймеров использовали олигонуклеотиды, которые соответствовали области от нуклеотида 2136 до нуклеотида 2158 и от нуклеотида 3815 до нуклеотида 3793 в последовательности, представленной в SEQ ID NO: 1. Условия для ПЦР были следующими: предварительная денатурация: 150 с при 94°С; денатурация: 60 с при 94°С; гибридизация: 30 с при 60°С; амплификация: 120 с при 72°С; 30 циклов, окончательное удлинение: 240 с при 72°С. С учетом выбранного праймера в результате реакции с использованием ДНК исходного штамма ожидали получить ПЦР-продукт длиной 1,68 т.п.н. После ПЦР с использованием мутанта, имеющего делецию гена pck, ожидали получить ПЦР-продукт длиной 0,61 т.п.н. Для одного клона получали ПЦР-продукт длиной 0,61 т.п.н. Тем самым было подтверждено, что данный клон имел требуемую делецию внутреннего фрагмента гена pck длиной 1071 пара оснований. Клон обозначили как МН20-22В Δpck. В результате реакций с использованием остальных клонов обнаружили ПЦР-продукт длиной 1,68 т.п.н. Следовательно, в них вектор был удален таким образом, что вновь восстановилось исходное состояние генома.
Штамм MH20-22BΔpck и исходный штамм МН20-22В культивировали в комплексной среде Луриа-Бертани, дополненной 1% глюкозы, и проводили тестирование в отношении ФЕП-карбоксикиназной активности по методу, описанному у Bentle и Lardy (Journal of Biological Chemistry 251, 2916-2921 (1976)). Результаты анализа (таблица 2) свидетельствуют о том, что мутант МН20-22ВΔрск, в отличие от исходного штамма МН20-22В, более не проявляет ФЕП-карбоксикиназной активности.
ФЕП-карбоксикиназная активность различных штаммов
* количество в 3 нмоля/мин/мг протеина является пределом обнаружения.
Пример 6
Продуцирование L-лизина
Для исследования влияния инактивации гена ФЕП-карбоксикиназы на продуцирование лизина штамм МН20-22В (Schrumpf и др., Applied Microbiology and Biotechnology 37, 566-571 (1992)), а также негативный в отношении ФЕП-карбоксикиназы мутантный штамм МН20-22ВΔрск (пример 5) культивировали в комплексной среде Луриа-Бертани, дополненной 1% глюкозы, и обеими предварительными культурами инфицировали среду для ферментации CGXII (Keilhauer и др., Journal of Bacteriology 175: 5595-5603 (1993)) (5% инокулята, оптическая плотность при 600 нм приблизительно 0,5). Среда дополнительно содержала 3 мМ лейцин, поскольку оба штамма являются ауксотрофами в отношении лейцина. Каждый образец представлял собой 60 мл культуры, и их вносили в колбы Эрленмейера с дефлекторами объемом 500 мл. После культивирования в течение 24 ч при 28°С на ротационном шейкере типа Certomat S/50 (фирма В. Braun Biotech International, Мельзунген, Германия) при 120 об/мин определяли концентрацию выделившегося в среду лизина.
Концентрацию аминокислот определяли с помощью жидкостной хроматографии высокого разрешения (ЖХВР) (Jones и Gilligan, Journal of Chromatography, 266: 471-482 (1983)). Результаты оценки эффективности ферментации представлены в таблице 3.
Концентрация лизина в надосадочной жидкости культур штаммов МН20-22В и MH20-22BΔpck
Пример 7
Делеционный мутагенез гена pck в штамме DM368-2. продуцирующем треонин
Как и в случае продуцирующего лизин штамма МН20-22В, проводили конъюгацию штамма Е. coli S17-1/pK19mobsacBΔpck с продуцирующим треонин штаммом DM368-2 и последующий отбор по признаку успешного осуществления первой и второй рекомбинации (см. пример 5). Из 30 устойчивых к сахарозе клонов 14 оказались чувствительными к канамицину. В двух из этих клонов, обозначенных как DМ368-2ВΔрсk16 и DM368-2BΔpck18, было подтверждено с помощью описанного в примере 5 анализа на основе ПЦР наличие в гене pck делеции фрагмента длиной 1071 пара оснований.
Тест на ферментативную активность для исходного штамма DM368-2 и обоих имеющих pck-делецию штаммов DM368-2BΔpck16 и DM368-2ВΔpck18, который проводили аналогично примеру 5, показал, что у этих мутантов не удалось выявить наличия ФЕП-карбоксикиназной активности (таблица 4).
ФЕП-карбоксикиназная активность различных штаммов
* количество в 3 нмоля/мин/мг протеина является пределом обнаружения.
Пример 8
Продуцирование L-треонина
Аналогично экспериментам по оценке продуцирования L-лизина проводили сравнительное исследование по накоплению треонина в надосадочной жидкости культуры штамма DM368-2BΔpck16, имеющего дефектный ген ФЕП-карбоксикиназы, и исходного штамма DM368-2. Для этого оба штамма культивировали в комплексной среде Луриа-Бертани, дополненной 1% глюкозы, и этими предварительными культурами инфицировали среду для ферментации CGXII. После культивирования в течение 24 ч при 28°С на ротационном шейкере при 120 об/мин определяли концентрацию выделившегося в среду треонина.
Концентрацию аминокислот определяли с помощью жидкостной хроматографии высокого разрешения (см. выше). Результаты оценки эффективности ферментации представлены в таблице 5.
Концентрация треонина в надосадочной жидкости культур штаммов DM368-2 и DM368-2BΔpck16
Чертежи
На прилагаемых к описанию чертежах показано:
на фиг.1 - рестрикционная карта плазмиды рЕК-pckA;
на фиг.2 - рестрикционная карта плазмиды pEK-pckB и
на фиг.3 - рестрикционная карта плазмиды pK19mobsacBΔpck.
Данные о количестве пар оснований представляют собой приблизительные значения, которые находятся в пределах воспроизводимости.
Использованные на чертежах сокращения и обозначения имеют следующие значения:





Изобретение относится к биотехнологии. Описан полинуклеотид, кодирующий фосфоенолпаруваткарбоксикиназу и содержащий полинуклеотидную последовательность, выбранную из группы, включающей: а) полинуклеотид, идентичный содержащемуся в плазмиде pEK-pckA или pEK-pckB полинуклеотиду; б) полинуклеотид, кодирующий указанный полипептид, который содержит аминокислотную последовательность, идентичную, по крайней мере, на 90% аминокислотной последовательности, представленной в SEQ ID NO: 2; в) полинуклеотид, комплементарный полинуклеотидам, указанным в подпунктах а), б) или в), а также зонд для получения полинуклеотида. Использование данного изобретения в способе получения аминокислот позволяет увеличить эффективность способа. 2 н. и 4 з.п. ф-лы, 3 ил., 5 табл.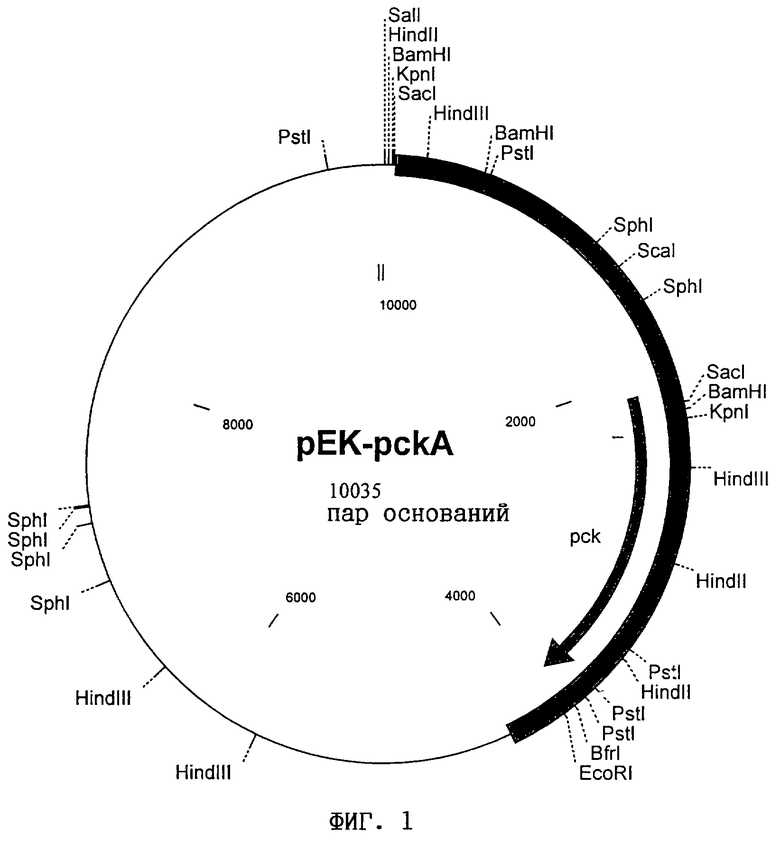
а) полинуклеотид, идентичный содержащемуся в плазмиде pEK-pckA (фиг.1) или в плазмиде pEK-pckB (фиг.2) полинуклеотиду,
б) полинуклеотид, кодирующий указанный полипептид, который содержит аминокислотную последовательность, идентичную, по крайней мере, на 90% аминокислотной последовательности, представленной в SEQ ID NO: 2,
в) полинуклеотид, комплементарный полинуклеотидам, указанным в подпунктах а) или б).
(I) нуклеотидную последовательность, представленную в SEQ ID NO: 1, или
(II) по крайней мере, одну последовательность, которая соответствует последовательности, указанной в подпункте (I), в пределах вырожденности генетического кода, или,
(III) по крайней мере, одну последовательность, которая гибридизуется при строгих условиях с последовательностью, комплементарной последовательности, указанной в подпункте (I) или (II), и/или при необходимости
(IV) функционально нейтральные смысловые мутации в последовательности, указанной в подпункте (I).
| Кристаллизатор | 1970 |
|
SU358940A1 |
| XIE DL et al., Biochim Biophys Acta, 1172(3), p.267-273, 20.03.1993 | |||
| RU 96115948, 20.05.1999. | |||
Авторы
Даты
2005-10-20—Публикация
2000-10-19—Подача