Область техники
Настоящее изобретение относится к гену, который кодирует синтетазу жирных кислот, и его использованию.
Уровень техники
Гены синтетаз жирных кислот, которые отвечают за синтез новых жирных кислот, у большинства организмов клонированы и тщательно изучены (например, непатентный документ 1: E. Schweizer et al., Microbiol. Mol. Biol. Rev., 68, 501-517 (2004)).
Известно, что у некоторых бактерий, грибов и животных так называемые многофункциональные ферменты “I типа”, такие как представленные ниже, катализируют серии реакций синтеза жирных кислот.
Тип Ia: (Грибы) AC-ER-DH-MPT/ACP-KR-KR-KS-PPT, α6β6 (β+α: приблизительно 3950 аминокислот). (Бактерии) AC-ER-DH-MPT-ACP-KR-KS-PPT, α6, структура, в которой субъединицы β и α синтетазы жирной кислоты (FAS) соединены «голова к хвосту» (α: приблизительно 3000 аминокислот).
Тип Ib: (Животные) KS-AT-DH-ER-KR-ACP-TE, α2 (α: приблизительно 2500 аминокислот). Вышеуказанные аббревиатуры означают следующее:
AC: ац(ет)илтрансфераза
AT: малонил/ацетилтрансфераза
MPT: малонил/палмитоилтрансфераза
KS: кетоацилсинтаза
KR: кетоацилредуктаза
DH: дегидратаза
ER: еноилредуктаза
ACP: белок-переносчик ацильной группы
TE: тиоэстераза
PPT: палмитоил/палмитоилтрансфераза.
У дрожжей Saccharomyces cerevisiae (также сокращенных ниже, как “S. cerevisiae”), синтез новых жирных кислот выполняет синтетаза жирных кислот (α6β6-комплекс, состоящий из β- субъединиц, кодируемых геном FAS1, и α-субъединиц, кодируемых геном FAS2) до 18 атомов углерода (стеариновая кислота). Кроме того, ELO1, ELO2 и ELO3 известны как гены элонгазы жирных кислот. Предполагают, что ELO1 отвечает за увеличение длины от C12-C16 цепей до C16-C18, ELO2 отвечает за увеличение длины C16-C18 цепей до C22 и ELO3 отвечает за увеличение длины C18-C24 цепей до C26.
В то же время тот факт, что в вырабатывающем липиды грибе Mortierella alpina (ниже также сокращенного, как “M. alpina”) мутантная цепь, обладающая сниженной активностью удлинения жирных кислот от пальмитиновой кислоты до стеариновой кислоты, может быть получена посредством обработки мутагенами (патентный документ 1: Патентная заявка Японии, опубликованная под номером 2001-245687), заставляет предположить, что, по меньшей мере, различные ферменты отвечают за синтез вплоть до пальмитиновой кислоты и за синтез от пальмитиновой кислоты до стеариновой кислоты.
Однако у гриба, вырабатывающего липиды, такого как M. Alpina, гены синтетаз жирных кислот, которые отвечают за синтез новых жирных кислот, ранее не были клонированы.
Описание изобретения
В свете вышесказанного существует необходимость в идентификации ферментов, синтезирующих жирные кислоты, которые отвечают за синтез новых жирных кислот в грибах, продуцирующих жирные кислоты, таких как M. Alpine, и генов, которые кодируют данные ферменты.
Авторы провели обширные исследования, в результате которых они успешно клонировали ген синтетазы жирных кислот, отвечающий за синтез новых жирных кислот, в липидпродуцирующем грибе M. Alpine, и что, в конечном итоге, привело к настоящему изобретению. Таким образом, изобретение относится к следующим полинуклеотидам, белкам, экспрессирующим векторам, трансформантам, способам получения продуктов питания и других продуктов, с применением подобных трансформантов, продуктов питания и других продуктов, полученных данными способами, и способов оценки и селекции тестируемых липидпродуцирующих грибов.
(1) Полинуклеотид, выбранный из любого из следующих от (a) до (h):
(a) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1;
(b) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO:2 или ее части;
(c) полинуклеотид, включающий полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO:3;
(d) полинуклеотид, включающий полинуклеотид, кодирующий белок, который состоит из аминокислотной последовательности SEQ ID NO:3, в которой одна или несколько аминокислот делетированы, замещены, встроены и/или добавлены и которая обладает активностью синтетазы жирных кислот;
(e) полинуклеотид, включающий полинуклеотид, кодирующий белок, обладающий идентичностью 60% или более с аминокислотной последовательностью SEQ ID NO:3, которая обладает активностью синтетазы жирных кислот;
(f) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(g) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:2 или ее части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; и
(h) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO:3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
(2) Полинуклеотид по вышеуказанному (1), который выбран из любого из следующих от (i) до (m):
(i) полинуклеотид, включающий полинуклеотид, кодирующий белок, который состоит из аминокислотной последовательности SEQ ID NO:3, в которой от одной до десяти аминокислот делетированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот;
(j) полинуклеотид, включающий полинуклеотид, кодирующий белок, обладающий идентичностью 90% или более с аминокислотной последовательностью SEQ ID NO:3, и который обладает активностью синтетазы жирных кислот;
(k) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(l) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:2 или ее части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; и
(m) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO:3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
(3) Полинуклеотид по вышеуказанному (1), включающий полинуклеотид, который состоит из нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1.
(4) Полинуклеотид по вышеуказанному (1), включающий полинуклеотид, который состоит из нуклеотидной последовательности SEQ ID NO:1.
(5) Полинуклеотид по вышеуказанному (1), включающий полинуклеотид, который состоит из нуклеотидной последовательности SEQ ID NO:2.
(6) Полинуклеотид по вышеуказанному (1), включающий полинуклеотид, который кодирует белок, состоящий из аминокислотной последовательности SEQ ID NO:3.
(7) Полинуклеотид по любому из вышеуказанного (1)-(6), который представляет собой ДНК.
(8) Белок, кодируемый полинуклеотидом по любому из вышеуказанного (1)-(7).
(8a) Белок, который включает аминокислотную последовательность SEQ ID NO:3.
(8b) Белок, который включает аминокислотную последовательность SEQ ID NO:3, в которой одна или несколько аминокислот делетированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот.
(8c) Белок, обладающий идентичностью 60% или более с аминокислотной последовательностью SEQ ID NO:3, и обладающий активностью синтетазы жирных кислот.
(9) Вектор, включающий полинуклеотид по любому из вышеуказанных (1)-(7).
(9a) Вектор по вышеуказанному (9), который включает экспрессирующую кассету, включающую следующие компоненты от (a) до (c):
(a) промотор, который можно транскрибировать в клетке-хозяине;
(b) полинуклеотид по любому из вышеуказанных (1)-(7), который соединен с промотором; и
(c) сигнал, функционирующий внутри клетки-хозяина в связи с терминацией транскрипции и полиаденилированием молекулы РНК.
(9b) Вектор по вышеуказанному (9), где клетка-хозяин является липидпродуцирующим грибом (например, M. alpina) или дрожжами (например, S. cerevisiae).
(10) Трансформированный организм, имеющий внедренный в него полинуклеотид, по любому из вышеуказанных (1)-(7).
(11) Трансформированный организм, имеющий внедренный в него вектор по вышеуказанному (9).
(12) Трансформированный организм по вышеуказанному (11), обладающий увеличенной способностью образования жирных кислот благодаря внедрению вектора по вышеуказанному (9).
(13) Трансформированный организм по любому из вышеуказанных (10)-(12), где организм является грибом, продуцирующим жирные кислоты.
(14) Трансформированный организм по вышеуказанному (13), где грибом, продуцирующим жирные кислоты, является Mortierella alpina.
(15) Способ получения липидов или жирных кислот с использованием трансформированного организма по любому из вышеуказанных (10)-(14).
(16) Способ получения пищевого продукта, лекарственного средства или промышленного материала с использованием трансформированного организма по любому из вышеуказанных (10)-(14).
(16a) Способ получения по вышеуказанному (16), где пищевой продукт является пищей, содержащей масла и жиры.
(17) Пищевой продукт, лекарственное средство или промышленный материал, полученный вышеуказанным способом (16).
(17a) Вышеуказанные пищевой продукт или промышленный материал (17), где пищевой продукт является пищевым продуктом, содержащим масла и жиры.
(18) Способ оценки способности образования жирных кислот тестируемыми липидпродуцирующими грибами, который включает использование праймера или зонда, сконструированных на основе нуклеотидной последовательности гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1.
(18a) Способ селекции липидпродуцирующих грибов, обладающих увеличенной способностью образования жирных кислот, посредством вышеуказанного способа (18).
(18b) Способ получения масла и жира с использованием липид-продуцирующих грибов, отобранных вышеуказанным способом (18a).
(19) Способ оценки способности образования жирных кислот тестируемыми липидпродуцирующими грибами, включающий культивирование тестируемых липидпродуцирующих грибов и измерение уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1.
(19a) Способ селекции липидпродуцирующих грибов, обладающих увеличенной способностью образования 16-углеродных жирных кислот, включающий оценивание тестируемых липидпродуцирующих грибов посредством вышеуказанного способа (19), и отбор липидпродуцирующих грибов, имеющих высокий уровень экспрессии гена синтетазы жирных кислот.
(19b) Способ получения масла и жира, включающий использование липидпродуцирующих грибов, отобранных вышеуказанным способом (19a).
(20) Способ селекции липидпродуцирующих грибов, включающий: культивирование контрольных липидпродуцирующих грибов и тестируемых липидпродуцирующих грибов, измерение уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1 в каждом липидпродуцирующем грибе, и отбор тестируемых липидпродуцирующих грибов, которые экспрессируют ген в более высокой степени, чем контрольные липидпродуцирующие грибы.
(21) Способ селекции липидпродуцирующих грибов, включающий: культивирование контрольных липидпродуцирующих грибов и тестируемых липидпродуцирующих грибов, количественное определение вышеуказанного белка (8) в каждом липидпродуцирующем грибе, и выбор тестируемого липидпродуцирующего гриба, содержащего более высокое количество белка, чем контрольные липидпродуцирующие грибы. То есть способ селекции липидпродуцирующих грибов, включающий стадии культивирования множества липидпродуцирующих грибов, количественное определение вышеуказанного белка (8) в каждом липидпродуцирующем грибе, и выбор среди них тестируемого липидпродуцирующего гриба, содержащего большое количество белка.
Полинуклеотиды по изобретению, которые используют для трансформирования организмов, таких как липидпродуцирующие грибы (например, M. alpina) и дрожжи, пригодны для использования в производстве пищевых продуктов, косметики, лекарственных средств (например, препаратов наружного кожного применения), мыла и т.п.
Жирные кислоты можно эффективно получать посредством способа получения липидов или жирных кислот по изобретению. Кроме того, посредством применения нуклеотидов по изобретению для трансформирования дрожжей и других организмов можно получать липиды или жирные кислоты, имеющие высокое содержание 16-углеродных жирных кислот (например, пальмитиновая кислота, пальмитолеиновая кислота). Таким образом, настоящее изобретение является целесообразным для увеличения способности продуцирования подобных жирных кислот.
Посредством применения липидпродуцирующих грибов, которые были протестированы и отобраны с применением способов оценки и селекции липидпродуцирующих грибов по изобретению, можно эффективно производить масла и липиды необходимого состава (например, масла и липиды, имеющие высокое содержание 16-углеродных жирных кислот).
Краткое описание чертежей
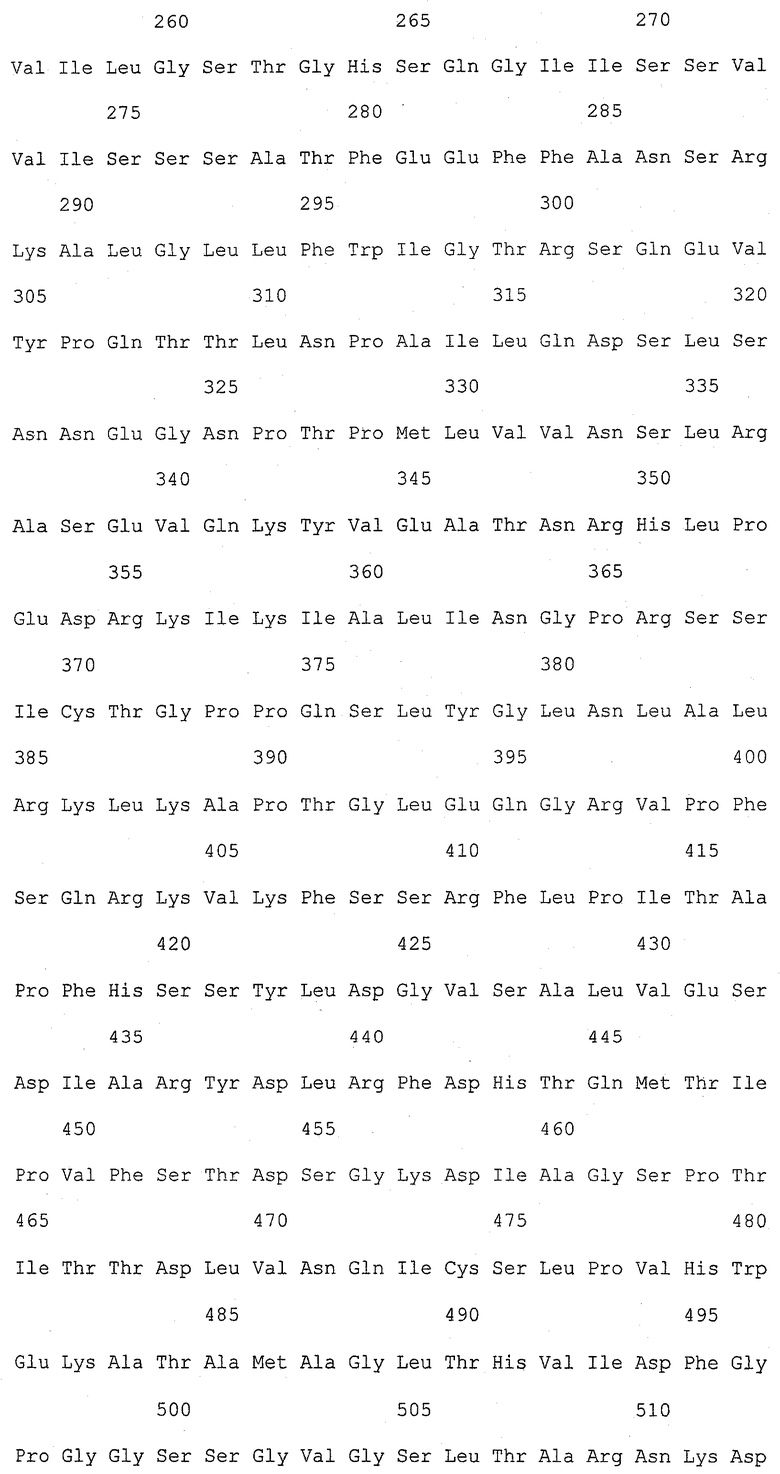
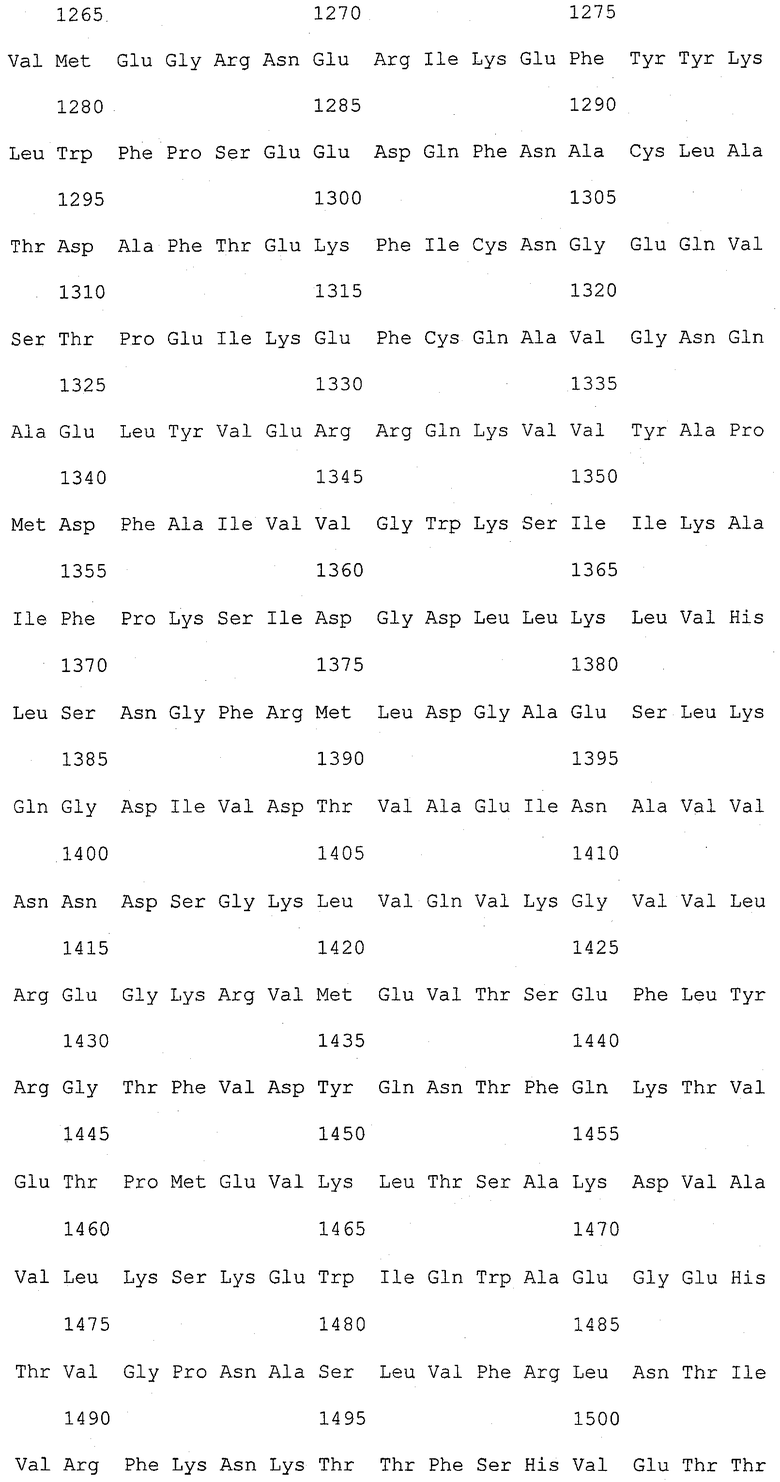
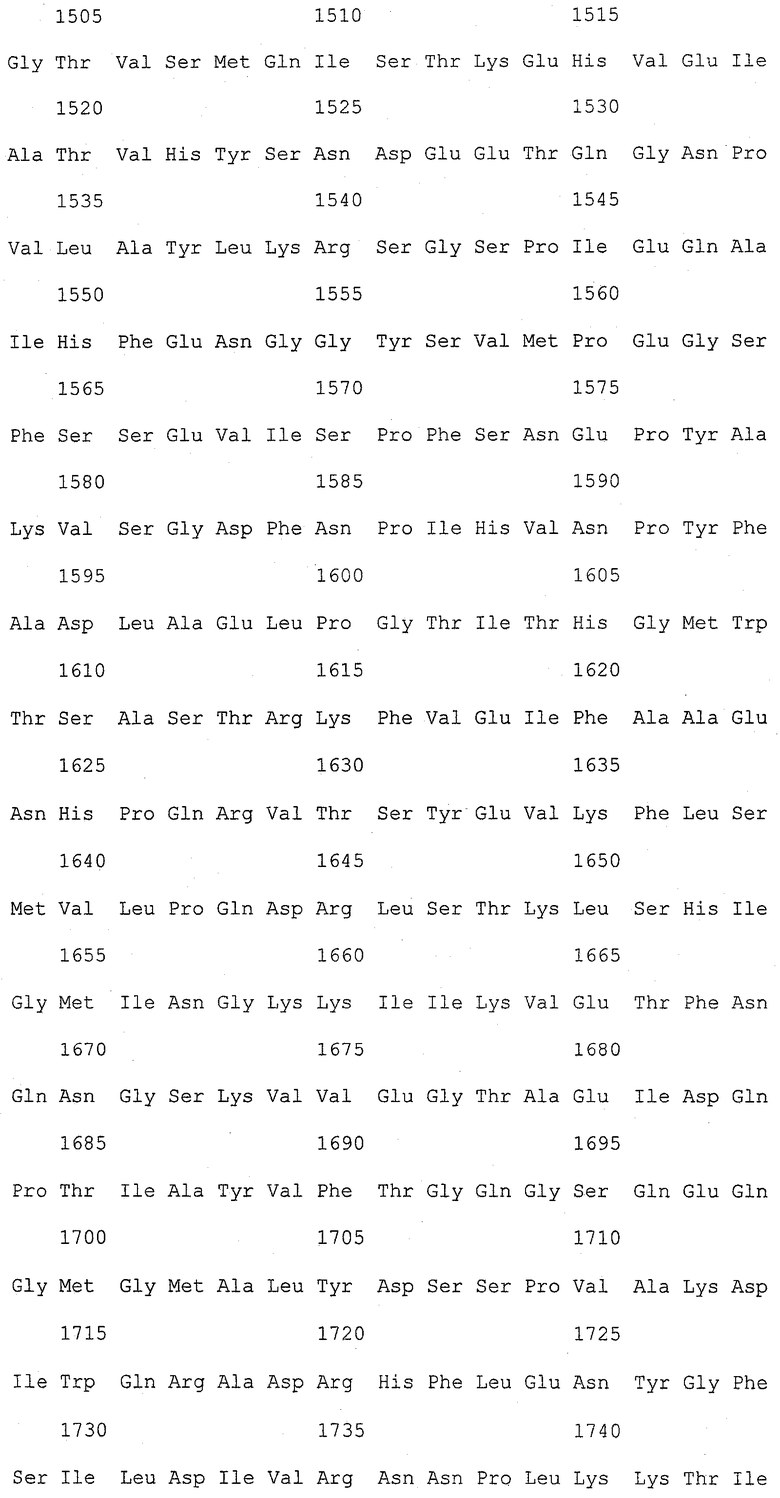
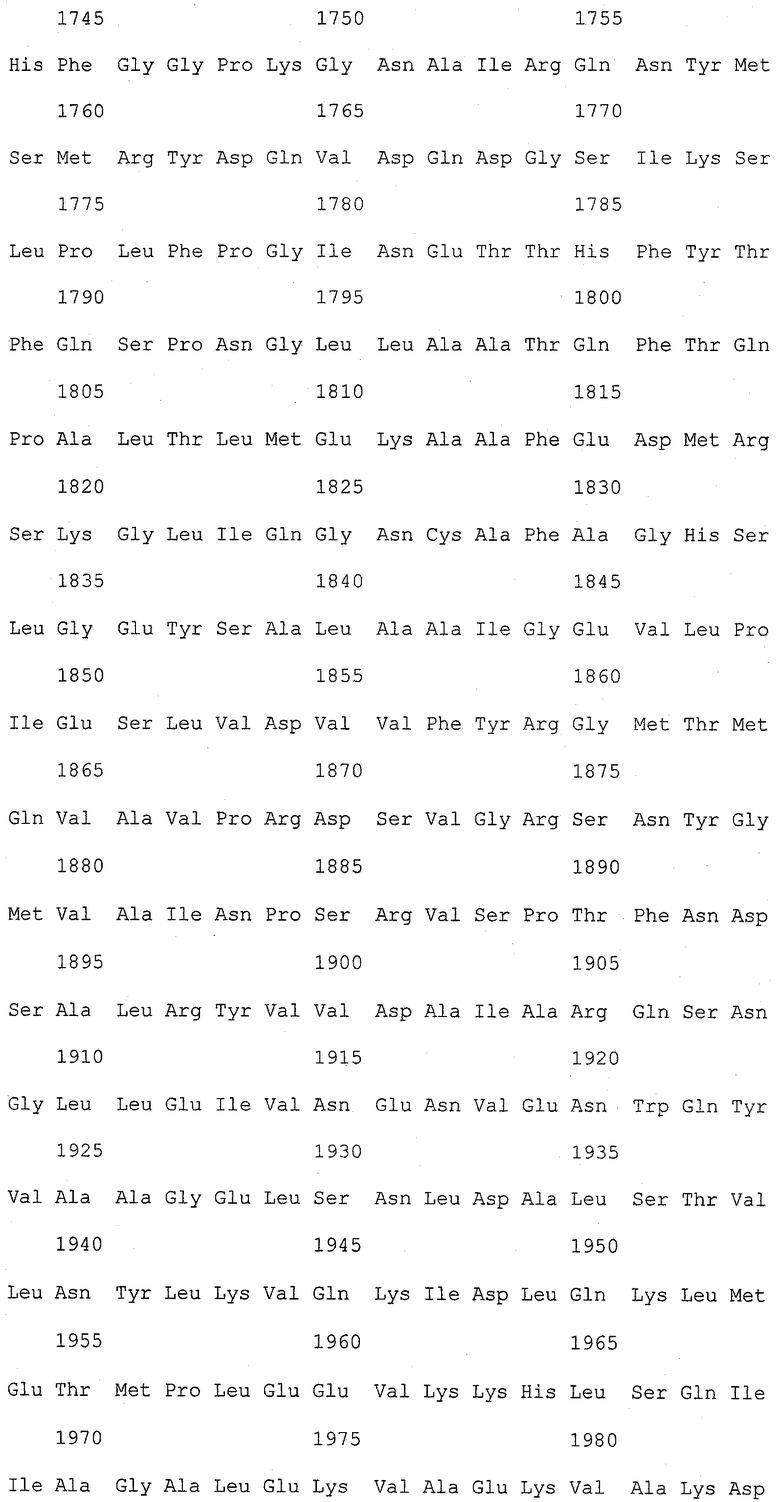
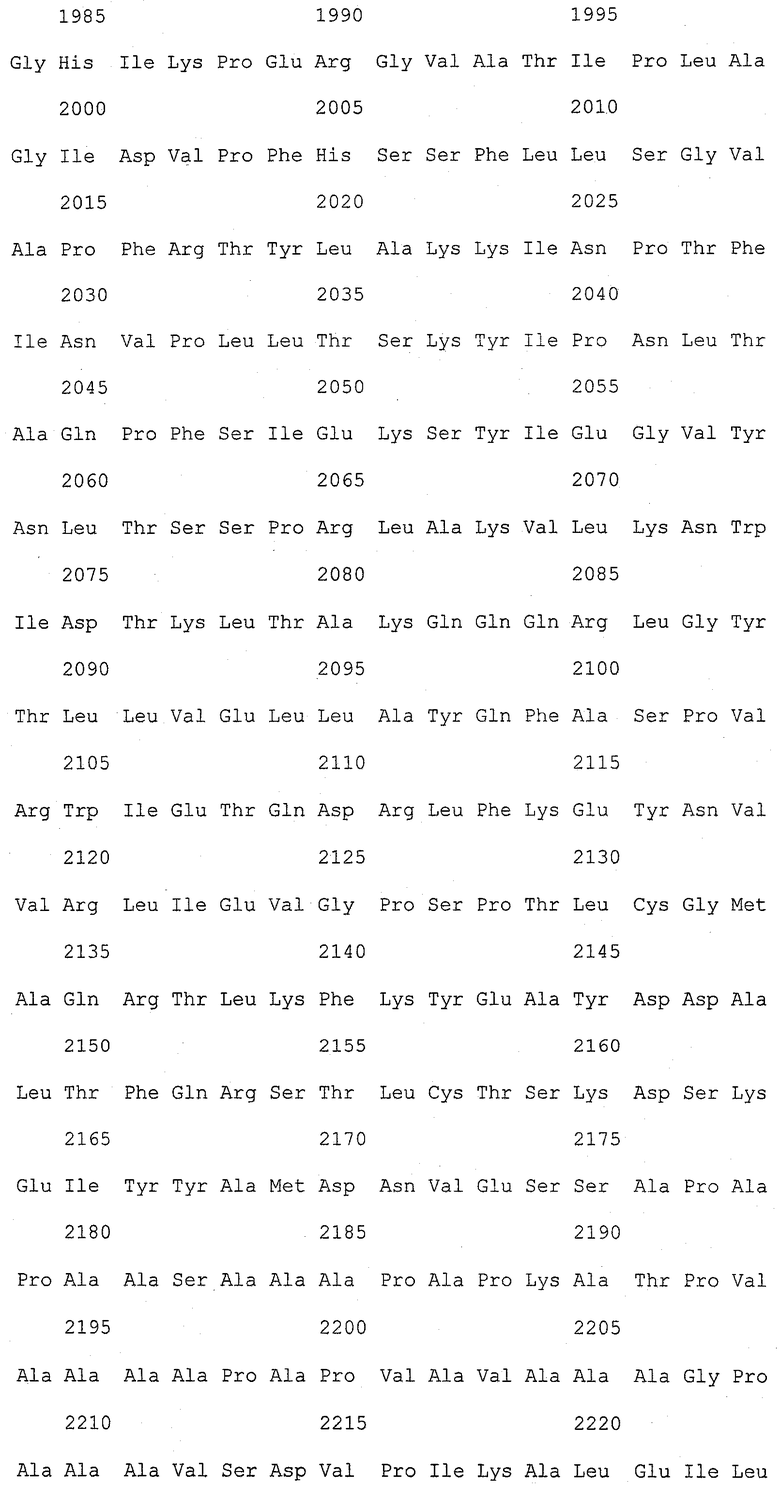
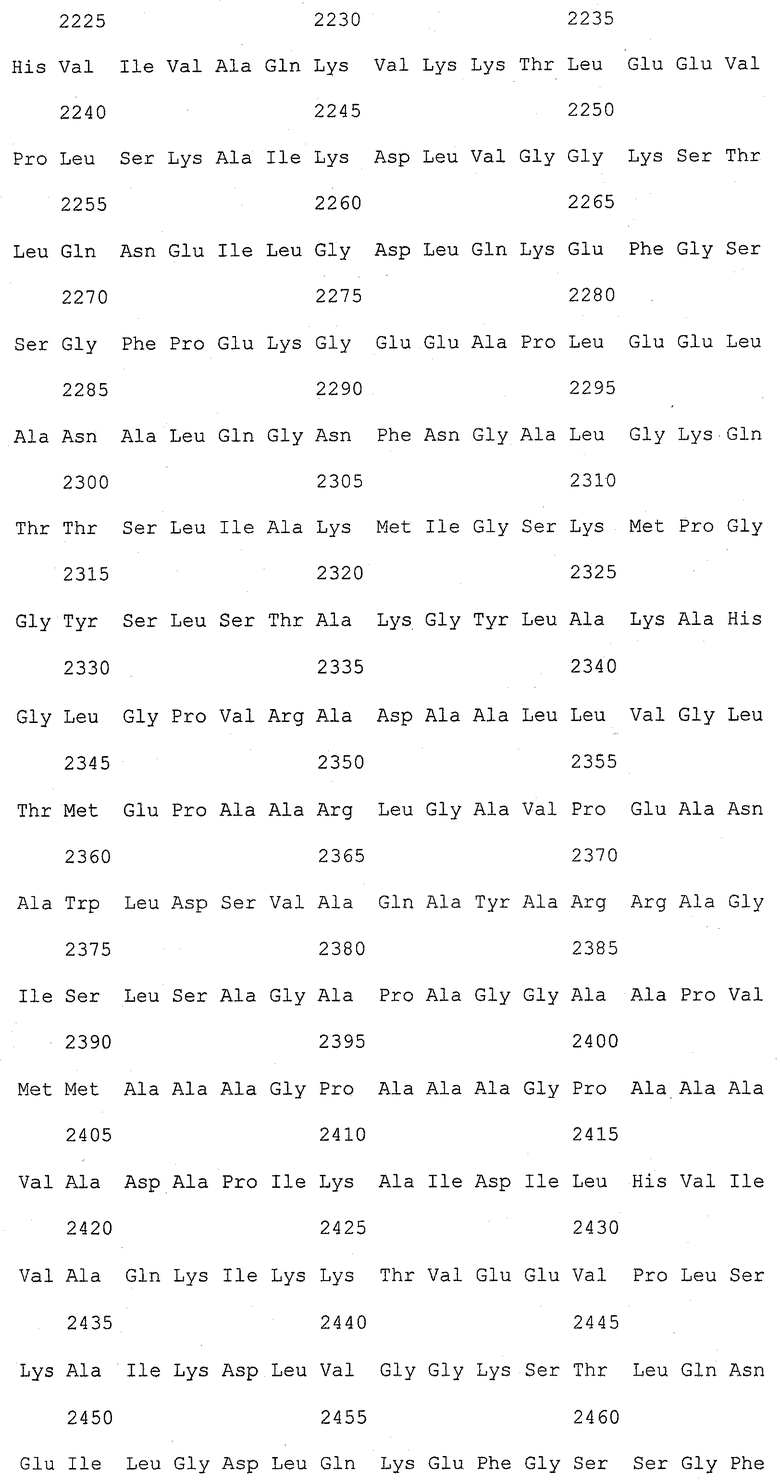
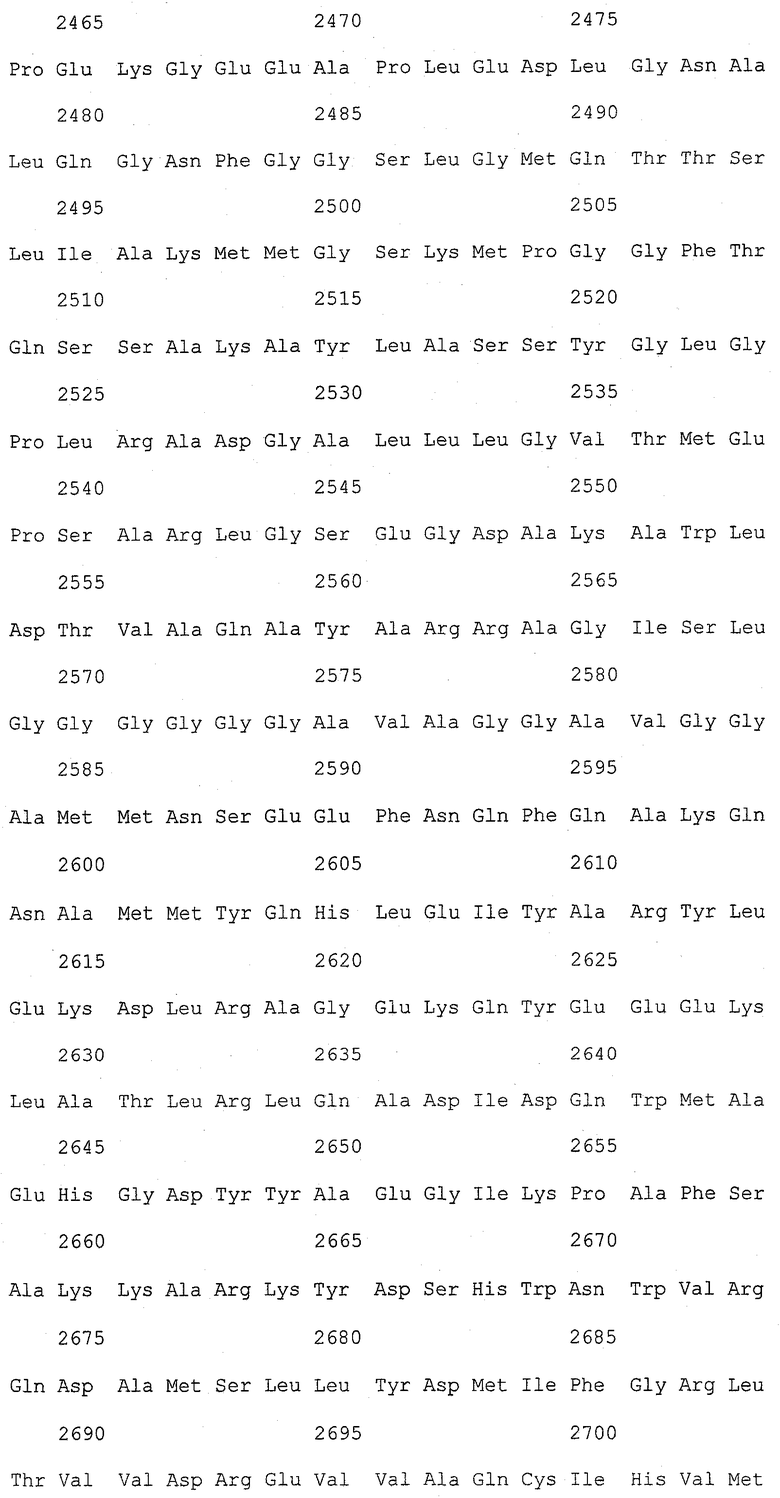
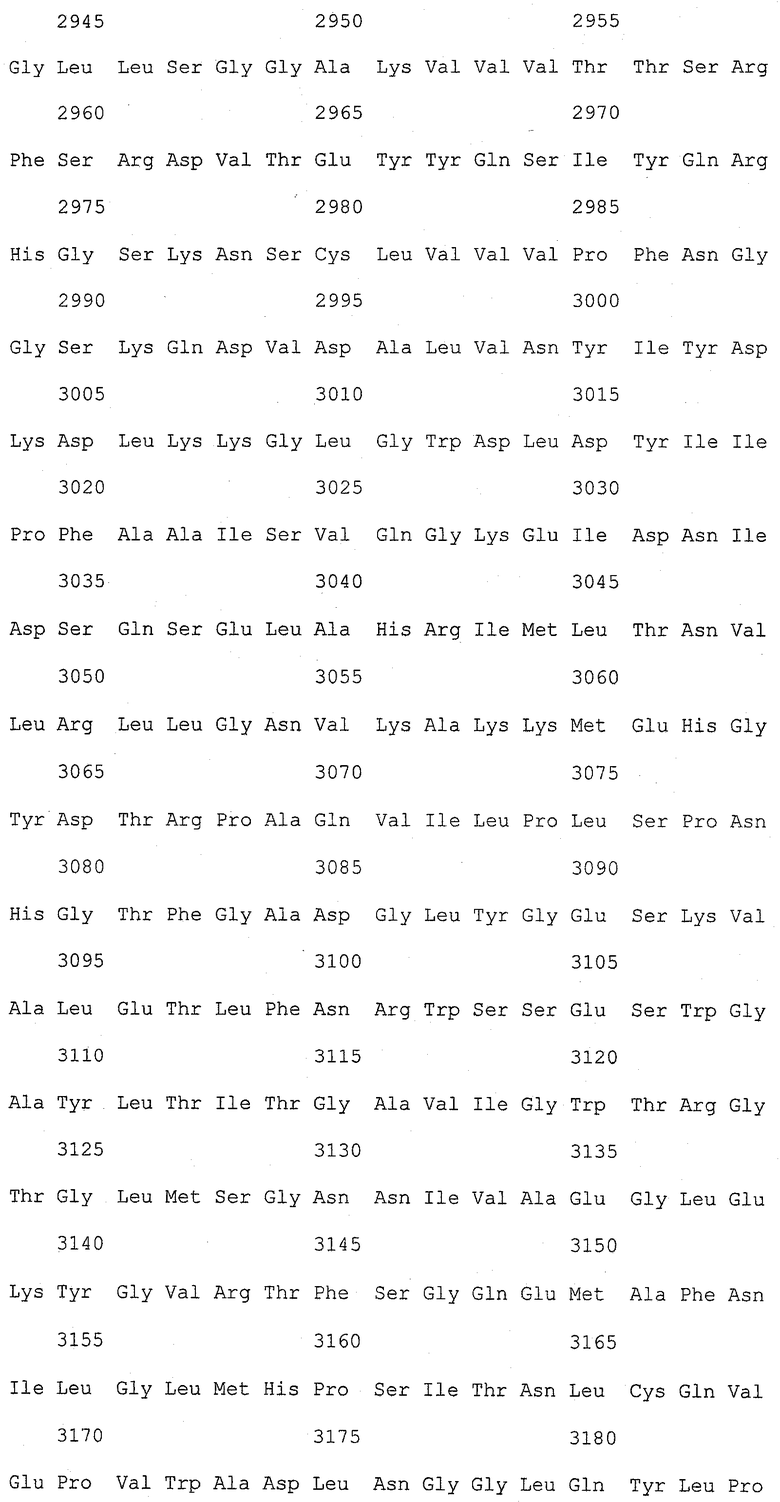
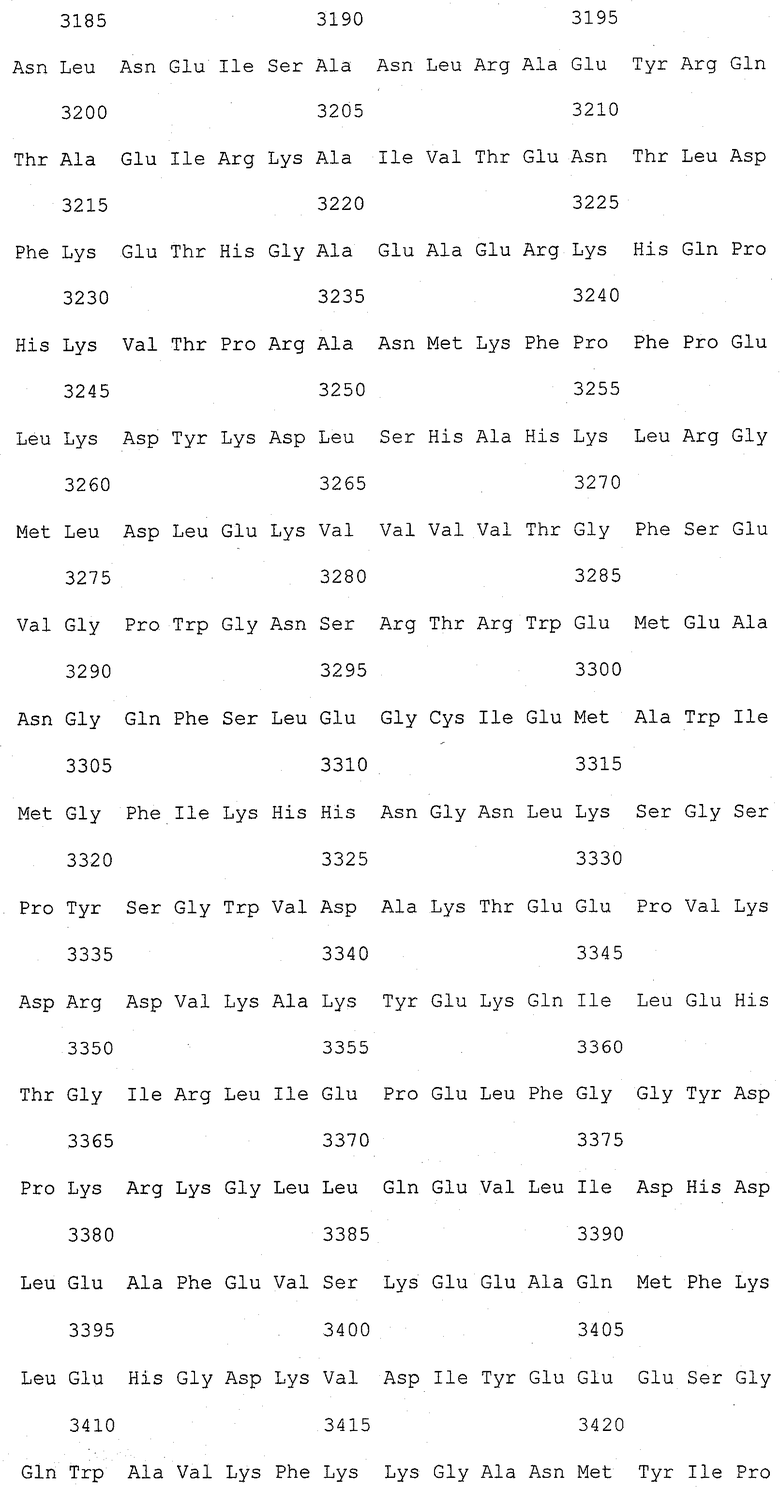
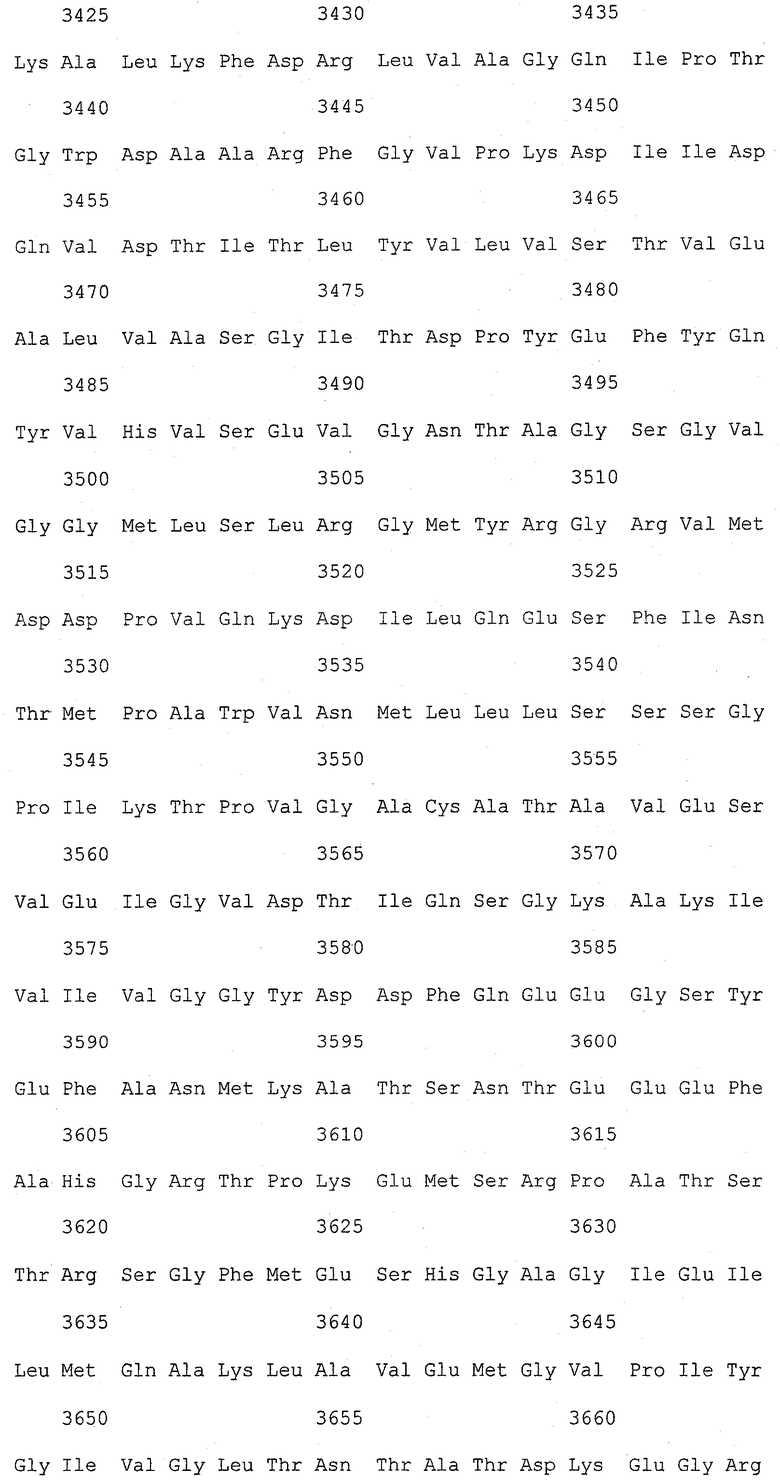
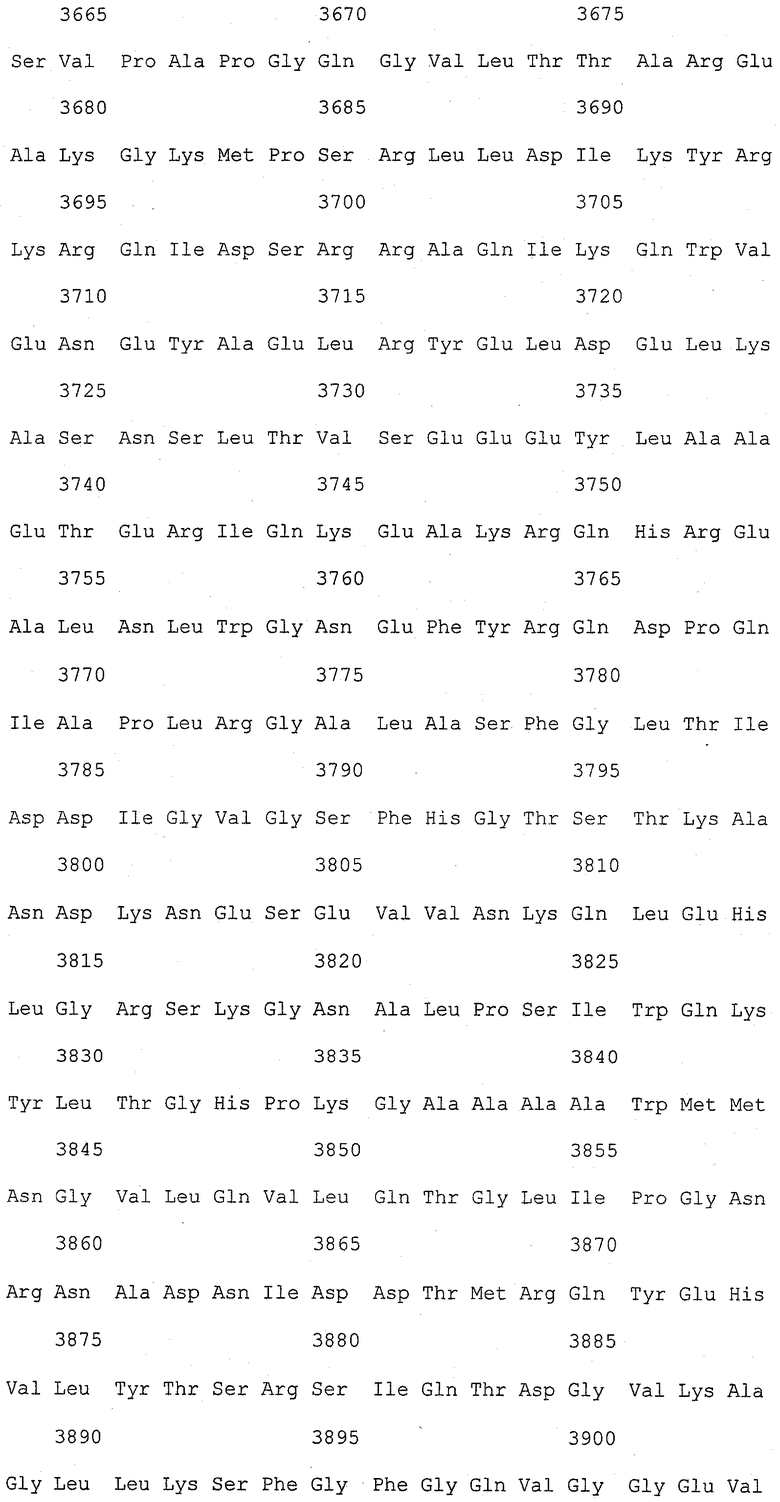
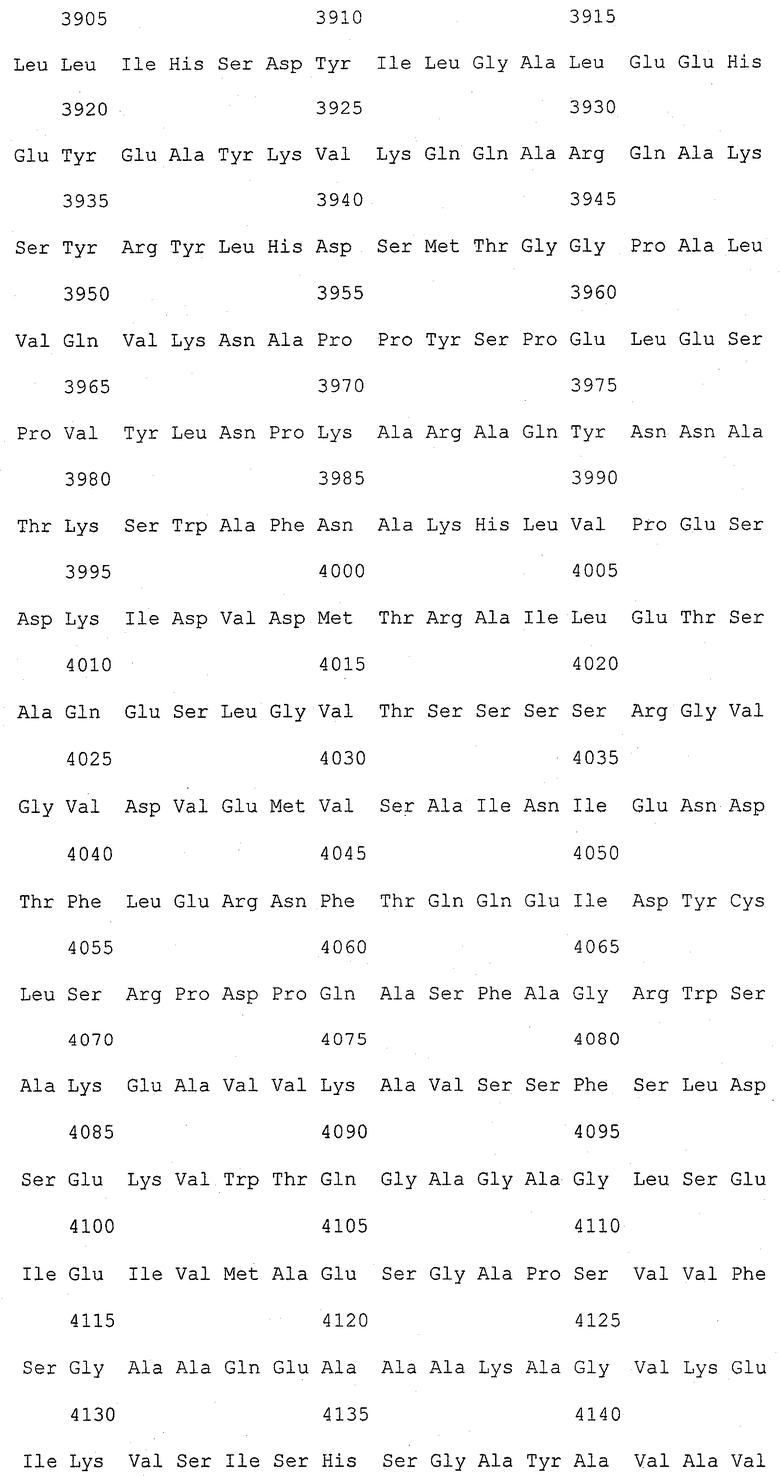
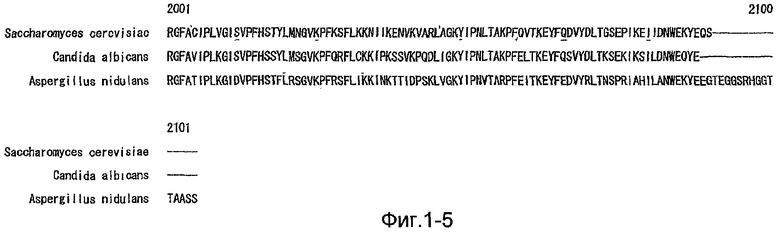
На фиг.1 (от 1-1 до 1-5) представлен ряд аминокислотных последовательностей для известных белков FAS1 (от Saccharomyces cerevisiae, Candida albicans и Aspergillus nidulans).
Лучший вариант выполнения изобретения
Как детально показано в описанных ниже примерах по изобретению, авторы впервые успешно клонировали полноразмерную кДНК синтетазы жирных кислот штамма 1S-4 M. alpina, который является липидпродуцирующим грибом. Кроме того, они получили основную последовательность геномной ДНК синтетазы жирных кислот штамма 1S-4 M. alpina (SEQ ID NO:2) и предполагаемую аминокислотную последовательность для данной синтетазы жирных кислот (SEQ ID NO:3). Данные ДНК и фермент могут быть получены с применением, например, технологий, указанных в нижеописанных примерах по изобретению, известных технологий генной инженерии и известных технологий синтеза. Полинуклеотиды синтетазы жирных кислот, представленные в настоящем изобретении, при использовании для трансформации организмов, таких как липидпродуцирующие грибы или дрожжи, целесообразны для производства масел и липидов с такими трансформированными липидпродуцирующими грибами (например, M. alpina) или дрожжами и для производства пищевых продуктов, лекарственных средств (например, препаратов наружного кожного применения), промышленных материалов (таких материалов, как для косметики, мыла) и т.п., для которых используют данные масла и липиды.
1. Полинуклеотиды по изобретению
Таким образом, в одном из аспектов изобретение относится к следующим полинуклеотидам:
(a) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности с положениями от 1 до 12486 из SEQ ID NO:1;
(b) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO:2 или ее части;
(c) полинуклеотид, включающий полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO:3;
(d) полинуклеотид, включающий полинуклеотид, кодирующий белок, который состоит из аминокислотной последовательности SEQ ID NO:3, в которой одна или несколько аминокислот делетированы, замещены, встроены и/или добавлены и который обладает активностью синтетазы жирных кислот;
(e) полинуклеотид, включающий полинуклеотид, кодирующий белок, обладающий идентичностью 60% или более с аминокислотной последовательностью SEQ ID NO:3, и обладающий активностью синтетазы жирных кислот;
(f) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(g) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:2 или ее части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; и
(h) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO:3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
Как используют в настоящем документе, термин “полинуклеотид” относится к ДНК или РНК.
Как используют в настоящем документе, “часть ДНК, состоящая из нуклеотидной последовательности SEQ ID NO:2”, включает, например, часть нуклеотидной последовательности SEQ ID NO:2, относящейся к экзону.
“Полинуклеотид, который гибридизуется при строгих условиях” относится в настоящем документе к полинуклеотиду, который получен, например, посредством гибридизации колоний, гибридизации бляшек или гибридизации по Саузерну, используя в качестве зонда весь полинуклеотид или часть, состоящий из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с позициями от 1 до 12486 SEQ ID NO:1 и нуклеотидной последовательности SEQ ID NO:2,
или полинуклеотид, состоящий из нуклеотидной последовательности, кодирующий аминокислотную последовательность SEQ ID NO:3. Применяемый способ гибридизации может быть способом, описанным, например, в Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Vol.3 (Cold Spring Harbor, Laboratory Press 2001) или в Ausubel: Current Protocols in Molecular Biology (John Wiley & Sons, 1987-1997).
Как используют в настоящем документе, “строгие условия” могут относиться к условиям низкой строгости, условиям средней строгости и условиям высокой строгости. “Условия низкой строгости” включают, например, 5× SSC, 5× раствор Денхарда, 0,5% SDS и 50% формамид при 32°C. “Условия средней строгости” включают, например, 5× SSC, 5× раствор Денхарда, 0,5% SDS и 50% формамид при 42°C. “Условия высокой строгости” включают, например, 5× SSC, 5× раствор Денхарда, 0,5% SDS и 50% формамид при 50°C. Предполагают, что в данных условиях ДНК, имеющую высокую гомологию, получают более эффективно при более высокой температуре. К строгим условиям гибридизации относятся множество факторов, включая температуру, концентрацию пробы, длину пробы, ионную силу, время и концентрацию солей, и специалисты в данной области могут, соответствующим образом, выбрать данные факторы для реализации соответствующих строгих условий.
Примером коммерческого набора, который можно использовать для гибридизации, является набор AlkPhos Direct Labeling Reagents (Amersham Pharmacia Biotech). В соответствии с протоколом, который входит в комплект набора, после инкубации с меченым зондом в течение ночи мембрану промывают первым отмывочным буфером, содержащим 0,1% (м/о) SDS, при 55°C, вслед за чем гибридизационную ДНК можно детектировать.
Другие полинуклеотиды, которые можно гибридизировать, включают ДНК, имеющую идентичность приблизительно 60% или выше, приблизительно 70% или выше, 71% или выше, 72% или выше, 73% или выше, 74% или выше, 75% или выше, 76% или выше, 77% или выше, 78% или выше, 79% или выше, 80% или выше, 81% или выше, 82% или выше, 83% или выше, 84% или выше, 85% или выше, 86% или выше, 87% или выше, 88% или выше, 89% или выше, 90% или выше, 91% или выше, 92% или выше, 93% или выше, 94% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше, 99% или выше, 99,1% или выше, 99,2% или выше, 99,3% или выше, 99,4% или выше, 99,5% или выше, 99,6% или выше, 99,7% или выше, 99,8% или выше или 99,9% или выше с ДНК SEQ ID NO:1 (или нуклеотидной последовательностью с положениями от 1 до 12486 из SEQ ID NO:1), ДНК SEQ ID NO:2 или ДНК, кодирующей аминокислотную последовательность SEQ ID NO:3, что определяют посредством программного обеспечения поиска гомологии, такого как FASTA или BLAST, используя заданные по умолчанию параметры.
Идентичность между аминокислотными последовательностями или нуклеотидными последовательностями можно определять, используя алгоритм BLAST от Karlin и Altschul (Proc. Natl. Acad. Sci. USA, 872264-2268 (1990); Proc. Natl. Acad. Sci. USA, 90: 5873 (1993)). Разработаны программы, названные BLASTN и BLASTX, основанные на алгоритме BLAST (Altschul SF, et al., J. Mol. Biol. 215: 403 (1990)). Если нуклеотидную последовательность анализируют, применяя BLASTN, устанавливают параметры, например, балл = 100 и длина слова = 12. Если нуклеотидную последовательность анализируют, применяя BLASTX, устанавливают параметры, например, балл = 50 и длина слова = 3. Если применяют программы BLAST и Gapped BLAST, используют параметры, заданные по умолчанию для соответствующей программы.
Вышеуказанные полинуклеотиды по изобретению можно получать посредством известных технологий генной инженерии или известных технологий синтеза.
2. Белки по изобретению и полинуклеотиды, которые кодируют данные белки
В другом аспекте изобретение относится к белкам, которых кодируют вышеуказанные полинуклеотиды от (a) до (h).
В еще одном аспекте изобретение относится к:
(a) белку, который включает аминокислотную последовательность SEQ ID NO:3;
(b) белку, который включает аминокислотную последовательность SEQ ID NO:3, в которой одна или несколько аминокислоты аминокислот делетированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот.
(с) белку, имеющему идентичность 60% или более с аминокислотной последовательностью SEQ ID NO:3, и который обладает активностью синтетазы жирных кислот.
В еще одном другом аспекте изобретение относится к полинуклеотиду, который включает нуклеотидную последовательность, кодирующую вышеуказанный белок.
Вышеуказанный белок (b) или (c) является, как правило, вариантом природного белка с последовательностью SEQ ID NO:3 и может быть получен искусственно с использованием технологии сайтспецифического мутагенеза, описанной, например, в Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Vol.3 (Cold Spring Harbor Laboratory Press, 2001); Ausubel, Current Protocols in Molecular biology (John Wiley & Sons, 1987-1997); Nuc. Acids. Res., 10, 6487 (1982); Proc. Natl. Acad. Sci. USA, 79, 6409 (1982); Gene, 34, 315 (1985); Nuc. Acids. Res., 13, 4431 (1985); или Proc. Natl. Acad. Sci. USA, 82, 488 (1985).
В подробном обозначении “белок, который состоит из аминокислотной последовательности SEQ ID NO:3, в которой одна или несколько аминокислот делетированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот”, представлен белками, которые состоят из аминокислотной последовательности, в которой от 1 до 500, от 1 до 100, от 1 до 90, от 1 до 80, 1 до 70, от 1 до 60, от 1 до 50, от 1 до 40, от 1 до 39, от 1 до 38, от 1 до 37, от 1 до 36, от 1 до 35, от 1 до 34, от 1 до 33, от 1 до 32, от 1 до 31, от 1 до 30, от 1 до 29, от 1 до 28, от 1 до 27, от 1 до 26, от 1 до 25, от 1 до 24, от 1 до 23, от 1 до 22, от 1 до 21, от 1 до 20, от 1 до 19, от 1 до 18, от 1 до 17, от 1 до 16, от 1 до 15, от 1 до 14, от 1 до 13, от 1 до 12, от 1 до 11, от 1 до 10, от 1 до 9, от 1 до 8, от 1 до 7, от 1 до 6 (от 1 до нескольких), от 1 до 5, от 1 до 4, от 1 до 3, 1 или 2, или 1 аминокислотный остаток в аминокислотной последовательности SEQ ID NO:3 делетирован, замещен, встроен и/или добавлен и который обладает активностью синтетазы жирных кислот. Меньшее количество вышеуказанных делетированных, замещенных, встроенных и/или добавленных аминокислотных остатков, как правило, более предпочтительно. Данные белки представлены белками, имеющими аминокислотную последовательность приблизительно с 60% или выше, приблизительно 70% или выше, 71% или выше, 72% или выше, 73% или выше, 74% или выше, 75% или выше, 76% или выше, 77% или выше, 78% или выше, 79% или выше, 80% или выше, 81% или выше, 82% или выше, 83% или выше, 84% или выше, 85% или выше, 86% или выше, 87% или выше, 88% или выше, 89% или выше, 90% или выше, 91% или выше, 92% или выше, 93% или выше, 94% или выше, 95% или выше, 96% или выше, 97% или выше, 98% или выше, 99% или выше, 99,1% или выше, 99,2% или выше, 99,3% или выше, 99,4% или выше, 99,5% или выше, 99,6% или выше, 99,7% или выше, 99,8% или выше или 99,9% или выше идентичностью аминокислотной последовательностью SEQ ID NO:3, и обладающими активностью синтетазы жирных кислот. Более высокая процентная идентичность, как правило, более предпочтительна. Активность синтетаз жирных кислот можно измерять, например, с помощью способа, описанного в James K Stoops et al., J.B.C. 253, 4464-4475 (1978).
Делеция, замена, инсерция и/или добавление одного или нескольких аминокислотных остатков в аминокислотную последовательность белка по изобретению означает, что один или несколько аминокислотных остатков делетирован, замещен, встроен и/или добавлен в любое одно или несколько положений в той же последовательности. Любые два или более типов изменений среди делеций, замен, инсерций и/или добавлений могут происходить параллельно.
Примеры взаимозаменяемых аминокислотных остатков даны ниже. Взаимозаменяемыми являются аминокислотные остатки, относящиеся к одной группе.
Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминомасляная кислота, метионин, o-метилсерин, трет-бутилглицин, трет-бутилаланин, циклогексилаланин;
Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота, 2-аминооктандиовая кислота;
Группа C: аспарагин, глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминомасляная кислота, 2,3-диаминопропионовая кислота;
Группа E: пролин, 3-гидроксипролин, 4-гидроксипролин;
Группа F: серин, треонин, гомосерин; и
Группа G: фенилаланин, тирозин.
Белок по изобретению также можно получать посредством способа химического синтеза, такого как способ Fmoc (флуоренилметилоксикарбонильный способ) или tBoc способ (трет-бутилоксикарбонильный способ). Кроме того, для химического синтеза можно использовать синтезатор пептидов, доступный, например, от Advanced ChemTech, PerkinElmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive и Shimadzu Corporation.
3. Вектор по изобретению и трансформанты, в которые вводили вектор
В дополнительном аспекте изобретение относится к экспрессирующему вектору, который включает полинуклеотид по изобретению. Экспрессирующий вектор по изобретению включает один из следующих полинуклеотидов:
(a) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1;
(b) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO:2 или ее части;
(c) полинуклеотид, включающий полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO: 3;
(d) полинуклеотид, включающий полинуклеотид, кодирующий белок, который состоит из аминокислотной последовательности SEQ ID NO:3, в которой одна или несколько аминокислот делетированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот;
(e) полинуклеотид, включающий полинуклеотид, кодирующий белок, обладающий идентичностью 60% или более с аминокислотной последовательностью SEQ ID NO:3, и который обладает активностью синтетазы жирных кислот;
(f) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO:1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(g) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO:2 или его части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; или
(h) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO:3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
Вектор по изобретению, как правило, включает экспрессирующую кассету, включающую в качестве компонентов следующее: (i) промотор, который может транскрибироваться в клетке-хозяине; (ii) полинуклеотид, любой из вышеописанных от (a) до (h), который соединен с промотором; и (iii) сигнал, функционирующий внутри клетки-хозяина в связи с терминацией транскрипции и полиаденилированием молекулы РНК. Вектор, сконструированный таким образом, вводят в клетку-хозяина. Клетки-хозяева, пригодные для использования, в изобретении представлены липидпродуцирующими грибами и дрожжами.
Штаммы грибов, упомянутые, например, в Mycotaxon, Vol.XLIV, № 2, pp.257-265 (1992), можно использовать в качестве липидпродуцирующих грибов. Наглядные примеры включают микроорганизмы, относящиеся к виду Mortierella, такие как следующие микроорганизмы, относящиеся к подвиду Mortierella: Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, и Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS219,35, CBS224,37, CBS250,53, CBS343,66, CBS527,72, CBS528,72, CBS529,72, CBS608,70 и CBS754,68; и следующие микроорганизмы, относящиеся к подвиду Micromucor: Mortierella isabellina CBS194,28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308 и IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112,08, CBS212,72, IFO7825, IFO8184, IFO8185 и IFO8287, и Mortierella vinacea CBS236,82. Особенно предпочтительным является Mortierella alpina.
Наглядные примеры дрожжей включают Saccharomyces cerevisiae NBRC1951, NBRC1952, NBRC1953 и NBRC1954. Данные клетки-хозяева, которые трансформированы вектором по изобретению, способны очень эффективно вырабатывать, в частности, жирные кислоты, имеющие 16 атомов углерода.
Вектор, используемый для введения в липидпродуцирующие грибы, представлен, но не в качестве ограничивающего примера, pDura5 (Appl. Microbiol. Biotechnol., 65, 419-425, (2004)).
Вектор, используемый для введения в дрожжи, может быть вектор с множеством копий (YEp вектор), вектор с одной копией (YCp вектор) или вектор с интеграцией в хромосому (YIp вектор). Примером известного YEp вектора является YEp24 (J. R. Broach et al., Experimental Manipulation of Gene Expression (Academic Press, New York; 1983), 83), примером YCp вектора является YCp50 (M. D. Rose et al., Gene 60: 237 (1987)), и примером YIp вектора является YIp5 (K. Struhl et al., Proc. Natl. Acad. Sci. USA, 76: 1035 (1979)). Все из перечисленных являются легко доступными.
Для регуляции генной экспрессии в клетке-хозяине можно использовать любую комбинацию промоторов и терминаторов при условии, что они функционируют в клетке-хозяине. Например, при использовании липидпродуцирующих грибов можно использовать промотор гена гистона H4.1 или промотор гена глицеральдегид 3-фосфатдегидрогеназы.
Примеры селективных маркеров, которые можно использовать во время трансформации, включают ауксотрофные маркеры (ura5, niaD), маркеры резистентности к лекарственным средствам (гигромицин, зеоцин), генетицинрезистентные гены (G418r), медь-резистентные гены (CUP1) (Marin et al., Proc. Natl. Acad. Sci. USA, 81, 337 (1984)), и церуленинрезистентные гены (fas2m, PDR4) (соответственно Junji Inokoshi et al., Biochemistry, 64, 660 (1992) и Hussain et al., Gene, 101: 149 (1991)).
Для трансформации клетки-хозяина можно использовать общеизвестный способ. В случае липидпродуцирующих грибов примеры пригодных способов включают электропорацию (Mackenzie D.A., et al., Appl. Environ. Microbiol. 66, 4655-4661 (2000)) и способ бомбардировки частицами (способ описан в опубликованной патентной заявке Японии, № 2005-287403, под названием “Способ селекции липидпродуцирующих грибов”). В случае дрожжей наглядные, неограничивающие примеры пригодных способов включают электропорацию, сферопластный способ (Proc. Natl. Acad. Sci. USA, 75: 1929 (1978)), способ с ацетатом лития (J. Bacteriology, 153: 163 (1983)) и способы, описанные в Proc. Natl. Acad. Sci. USA, 75: 1929 (1978) и в Methods in Yeast Genetics, 2000 Edition: A Cold Spring Harbor Laboratory Course Manual.
Более конкретно, в случае липидпродуцирующих грибов среду Чапека-Докса засевают клетками-хозяевами и культивируют в течение 2 недель при 28°C для формирования спор. Споры затем собирают и вводят в них ген посредством способа бомбардировки частицами (описанном в опубликованной патентной заявке Японии, № 2005-287403, под названием “Способ селекции липидпродуцирующих грибов”) или ему подобного способа. Следующим этапом споры, включающие внедренный ген, помещают в стандартную среду с агаром, содержащую антибиотик или что-либо подобное для использования в качестве селективного маркера, или, если используют ауксотрофный маркер, в среде с агаром отсутствует питательный субстрат, используемый в качестве маркера, для того чтобы получить трансформант. Альтернативно, в случае дрожжей, клетки-хозяева культивируют в стандартной питательной среде (например, среда YEPD, описанная в Genetic Engineering, Vo1.1 (Plenum Press, New York; 1979), p.117), так чтобы оптическая плотность среды при 600 нм (OD600) находилась между 1 и 6. Культивируемые клетки затем собирают центрифугированием, отмывают и подвергают предобработке ионами щелочных металлов, предпочтительно ионами лития в концентрации приблизительно от 1 до 2 M. Клетки оставляют приблизительно при 30°C в течение приблизительно 60 минут, затем клетки оставляют вместе с ДНК для внедрения (приблизительно от 1 до 20 мкг) приблизительно при 30°C в течение приблизительно 60 минут. Полиэтиленгликоль, предпочтительно полиэтиленгликоль, имеющий молекулярную массу приблизительно 4000 дальтон, добавляют до конечной концентрации приблизительно от 20% до 50%. Клетки оставляют в состоянии покоя приблизительно при 30°C в течение приблизительно 30 минут, затем нагревают приблизительно при 42°C в течение приблизительно 5 минут. Предпочтительно, конечную клеточную суспензию отмывают стандартной питательной средой, добавляют предварительно установленное количество свежей стандартной питательной среды и оставляют приблизительно при 30°C в течение приблизительно 60 минут. Полученную в результате культуру засевают на стандартную среду с агаром, содержащую антибиотик или что-либо подобное для использования в качестве селективного маркера, или, если используют ауксотрофный маркер, в среде с агаром отсутствует питательный субстрат, используемый в качестве маркера, для того чтобы получить трансформант. Другие общеизвестные технологии клонирования можно найти, например, в Sambrook & Russell, Molecular Cloning: A Laboratory Manual, Vol.3 (Cold Spring Harbor Laboratory Press, 2001) и Methods in Yeast Genetics: A Laboratory Manual (Cold Spring Harbor Laboratory Press; Cold Spring Harbor, NY).
4. Способ получения липидов или жирных кислот по изобретению
В еще одном дополнительном аспекте изобретение относится к способу получения липидов или жирных кислот с использованием вышеописанных трансформированных липидпродуцирующих грибов или дрожжей.
Как используют в настоящем документе, “липид” относится к простым липидам, содержащим, например, соединение, состоящее из жирной кислоты и спирта, соединенных эфирной связью (например, глицерид) или его аналогам (например, эфир холестерина), сложным липидам, дополнительно содержащим, например, фосфорную кислоту, аминокислоту или сахар, связанный с частью простого липида, и липидным производным, которые являются продуктами гидролиза липидов и не растворимы в воде.
“Масла и жиры” относятся в настоящем документе к эфирам глицерина и жирным кислотам (глицеридам).
“Жирные кислоты” относятся в настоящем документе к алифатическим монокарбоновым кислотам (карбоновые кислоты, имеющие единственную карбоксильную группу, в которой атомы углерода связаны друг с другом в виде цепи) с общей формулой RCOOH (R является алкильной группой). Жирные кислоты включают насыщенные жирные кислоты, не имеющие двойных связей в углеводородной цепи, и ненасыщенные жирные кислоты, которые содержат двойные связи.
Липид или жирную кислоту по изобретению можно выделить из клеток, трансформированных по настоящему изобретению, следующим способом. В случае трансформированного организма (например, липидпродуцирующих грибов или дрожжей) после завершения культивирования культивируемые клетки собирают общепринятым способом, таким как центрифугирование или фильтрация. Клетки тщательно промывают и предпочтительно высушивают. Высушивание можно выполнять посредством лиофилизации, высушиванием на воздухе или им подобным способами. Высушенные клетки разрушают таким способом, как Дино-милл или ультразвуком, затем предпочтительно подвергаются экстракционной обработке с органическими растворителями в струе азота. Органические растворители, которые можно использовать, включают эфир, гексан, метанол, этанол, хлороформ, дихлорметан и петролейный эфир. Альтернативно, хорошие результаты можно также получить альтернативной экстракцией метанолом и петролейным эфиром или экстракцией с использованием хлороформ-метанол-водной однослойной системы в качестве растворителя. Липид, содержащий жирную кислоту, можно получить посредством отделения органического растворителя от экстракта под вакуумом.
Отделение жирной кислоты от вышеуказанного липида, содержащего жирную кислоту, в условиях смеси жирных кислот или смеси эфиров жирных кислот может быть выполнено посредством концентрации и отделения в соответствии с общепринятым способом (например, способ с добавлением мочевины, способ разделения с охлаждением, колоночная хроматография).
С использованием способа производства липидов или жирных кислот по изобретению можно эффективно получать жирные кислоты посредством увеличения содержания жирной кислоты в клетках. Альтернативно, если в качестве клетки-хозяина применяют дрожжевые клетки, можно получать липиды или жирные кислоты, имеющие высокое содержание 16-углеродных насыщенных или ненасыщенных жирных кислот (например, пальмитиновая кислота или пальмитолеиновая кислота), которые, в частности, являются полезными, если существует необходимость в получении таких жирных кислот в большом количестве и/или с высокой эффективностью.
Липиды или жирные кислоты, полученные таким образом, можно использовать в соответствии со стандартными способами в таких областях, как производство липидсодержащих пищевых продуктов, лекарственных средств (например, препаратов наружного кожного применения), промышленных материалов (начальных материалов для косметики, мыла и т.п.).
В качестве пояснения вследствие того, что пальмитолеиновая кислота является жирной кислотой, которая присутствует в концентрации, по меньшей мере, приблизительно 10% в секрете сальных желез человека и предположительно играет большую роль в обновлении кожного жира, ее можно использовать посредством включения в кожную косметику для предотвращения старения кожи или в лекарственных препаратах наружного кожного применения. Например, у пациента, имеющего кожное заболевание, такое как экзема, несмотря на возраст пациента, регенерация кожных покровов может быть активизирована посредством добавления пальмитолеиновой кислоты. Таким образом, липид или жирная кислота, полученные способом для производства липидов или жирных кислот по изобретению, можно с успехом применять в производстве косметики и лекарственных средств (например, препараты наружного кожного применения), изготовленных для таких целей, как предотвращение старения кожи или для регенерации кожных покровов.
Таким образом, в еще одном аспекте изобретение относится к способу получения пищевых продуктов, косметики, лекарственных средств, мыла или тому подобных продуктов посредством использования трансформированных липидпродуцирующих грибов или трансформированных дрожжей по изобретению. Данный способ включает стадию образования липидов или жирных кислот с использованием трансформированных липидпродуцирующих грибов или трансформированных дрожжей по изобретению. Пищевые продукты, косметика, лекарственные средства, мыло или тому подобные продукты, содержащие липиды или жирные кислоты, которые были получены, произведены стандартным способом. Таким образом, пищевые продукты, косметика, лекарственные средства, мыло или тому подобные продукты, полученные посредством способа по изобретению, содержат липиды или жирные кислоты, образованные с применением трансформированных липидпродуцирующих грибов или трансформированных дрожжей по изобретению. Кроме того, изобретение также относится к пищевым продуктам, косметике, лекарственным средствам, мылу или тому подобным продуктам, полученным посредством данного способа.
Форма косметического продукта (композиции) или лекарственного средства (композиции) по изобретению не является предметом для какого-либо конкретного ограничения. Можно применять любую пригодную форму, такую как раствор, паста, гель, твердое вещество или порошок. Косметические композиции или композиции лекарственных средств по изобретению можно использовать, например, в косметических препаратах или препаратах наружного кожного применения, таких как масла, лосьоны, крема, эмульсии, гели, шампуни, ополаскиватели для волос, кондиционеры для волос, лаки для ногтей, основы, губные помады, пудра для лица, маски для лица, мази, духи, порошки, одеколоны, зубные пасты, мыло, аэрозоли и чистящие пенки; и в средствах, замедляющих старение кожи и улучшающих ее состояние, средствах, предотвращающих дерматит и улучшающих состояние кожи, средствах для ванны, лекарственных средствах для роста волос, кожных сыворотках, солнцезащитных кремах и средствах, уменьшающих резаные раны, растрескавшуюся кожу, грубую и сухую кожу и улучшающих их состояние.
Косметические композиции по изобретению могут также необязательно включать другие масла и жиры и/или краски, ароматизаторы, консерванты, поверхностно-активные вещества, пигменты и антиоксиданты и т.д. Соотношение, в котором данные ингредиенты могут быть включены соответствующим образом, устанавливает специалист в данной области в соответствии с предполагаемой целью (например, масла и жиры можно включать в композицию в соотношении от 1 до 99,99% мас., предпочтительно от 5 до 99,99% мас., и более предпочтительно от 10 до 99,95% мас.). Композиции лекарственных средств по изобретению (например, препараты наружного кожного применения) могут необязательно включать другие фармацевтически активные ингредиенты (например, противовоспалительные ингредиенты) или вспомогательные ингредиенты (например, увлажняющие ингредиенты, ингредиенты-носители). Например, наглядные примеры других общеизвестных ингредиентов в косметике или препаратах наружного кожного применения включают лекарственные препараты от угревой сыпи, средства от перхоти и зуда, антиперспиранты, средства от ожогов, средства от клещей и вшей, смягчители кератина, лекарственные препараты от ксеродермы, противовирусные средства и средства, усиливающие впитывание в кожу.
Примеры пищевых продуктов по изобретению включают в себя диетические добавки, продукты здорового питания, функциональные продукты питания, детские пищевые продукты, модифицированное молоко для младенцев, модифицированное молоко для недоношенных детей и гериатрические пищевые продукты. В данном определении “пищевые продукты” относятся, в общем, к пероральным продуктам, которые являются твердыми веществами, растворами, жидкостями или их смесями.
“Диетические добавки” относятся к пищевым продуктам, обогащенным специальными питательными ингредиентами. “Продукты здорового питания” относятся к пищевым продуктам, рассматриваемым как полезные или благоприятные для здоровья и включающим диетические добавки, натуральные пищевые продукты и диетические пищевые продукты. “Функциональные продукты питания” относятся к пищевым продуктам для восполнения питательных ингредиентов, которые выполняют регуляторные функции в организме и являются синонимом пищевым продуктам специального здорового пользования. “Детские пищевые продукты” относятся к пищевым продуктам, которые дают детям приблизительно до 6-летнего возраста. “Гериатрические пищевые продукты” относятся к пищевым продуктам, которые обрабатывают таким образом, чтобы они легче переваривались и абсорбировались в отличие от необработанных пищевых продуктов. “Модифицированное молоко для младенцев” относится к молочным детским смесям, которые дают детям до приблизительно 1 года жизни. “Модифицированное молоко для недоношенных детей” относится к молочным детским смесям, которые дают недоношенным детям приблизительно до 6 месяцев после рождения.
Примеры детских смесей данных пищевых продуктов включают встречающиеся в природе пищевые продукты, такие как мясо, рыба и орехи (пищевые продукты, обработанные маслами и жирами); пищевые продукты, к которым масла и жиры добавляют во время приготовления, такие как китайская еда, макаронные супы и супы-лапша; пищевые продукты, полученные с использованием масел и жиров, в качестве теплообменной среды, такие как во фритюре, пищевые продукты глубокой жарки, жаренный тофу, жареный рис, пончики и сладкая жареная японская закуска, известная как каринто; пищевые продукты на основе масла или жира или приготовленные пищевые продукты, полученные посредством добавления масел и жиров во время приготовления, такие как масло, маргарин, майонез, салатная заправка, шоколад, макароны быстрого приготовления, карамель, печенье, булочки, пирожные и мороженое; и пищевые продукты, которые на конечном этапе обрызгивают или покрывают маслом или жиром, такие как рисовые крекеры окаки, твердое печенье и булочки, наполненные фасолевой начинкой, известные как анпан. Однако пищевые продукты по изобретению не ограничены пищевыми продуктами, содержащими масла и жиры, и также включают, например, хлеб, лапшу, рис, сладости (леденцы, жевательная резинка, жевательная карамель, высушенные спрессованные леденцы, японские сладости), сельскохозяйственные пищевые продукты, такие как тофу, и приготовленные пищевые продукты, сделанные из тофу; сброженные пищевые продукты, такие как саке, медицинский раствор, рисовое вино (мирин), уксус, соевый соус и мисо; пищевые продукты, полученные от животноводства, такие как йогурт, ветчина, бекон и сосиски; морские продукты, такие как прессованная рыбная паста (камабоко), жареные пищевые продукты на основе рыбы, известные как рыбные пирожные агетен и ханпен; и также фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки и чай.
Пищевые продукты по изобретению альтернативно могут быть в форме лекарственных препаратов, таких как капсулы; или в приготовленных формах, таких как сыпучие пищевые продукты, полуусвояемые диетические продукты, элементные диетические продукты, энергетические напитки и энтеральные пищевые продукты, полученные посредством смешивания масла и жира по изобретению вместе с ингредиентами, такими как белки, углеводы, жиры, микроэлементы, витамины, эмульгаторы и вкусовые добавки.
5. Способы определения способности к образованию жирных кислот тестируемых липидпродуцирующих грибов для селекции липидпродуцирующих грибов по изобретению
В дополнительных аспектах изобретение относится к (i) способу оценки способности выработки жирных кислот тестируемыми липидпродуцирующими грибами, включающему использование праймера или зонда, сконструированных на основании нуклеотидной последовательности гена синтетазы жирных кислот, имеющей нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1; (ii) cпособу оценки способности выработки жирных кислот тестируемыми липидпродуцирующими грибами, включающему стадии культивирования тестируемых липидпродуцирующих грибов и измерения уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1; и (iii) способу селекции липидпродуцирующих грибов, включающему стадии культивирования контрольных липидпродуцирующих грибов и тестируемых липидпродуцирующих грибов, измерения уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1 в каждом липидпродуцирующем грибе, и выбора тестируемого липидпродуцирующего гриба, который экспрессирует ген в более высокой степени, чем контрольные липидпродуцирующие грибы. Нуклеотидную последовательность SEQ ID NO:2 можно использовать вместо нуклеотидной последовательности с позициями от 1 до 12486 SEQ ID NO:1.
Общие методики выполнения данного способа оценки известны в области изобретения и включают такие, которые описаны, например, в WO 01/040514 и опубликованной патентной заявке Японии № H8-205900. Способ оценки в кратком изложении описан ниже.
Во-первых, получают геном тестируемого липид-продуцированного гриба. Выделение выполняют любым известным методом, таким как привлечение в использование коммерческого набора; например, DNeasy Plant Kit (QIAGEN). Затем используют праймер или зонд, сконструированные на основе нуклеотидной последовательности гена синтетазы жирных кислот, имеющей нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1 или SEQ ID NO:2 (предпочтительна нуклеотидная последовательность с положениями от 1 до 12486 SEQ ID NO:1) для определения присутствует ли в геноме тестируемого липидпродуцирующего гриба, который получили, данный ген целиком или конкретная нуклеотидная последовательность гена. Для конструирования праймера или зонда можно использовать известные технологии.
Для детекции гена или его специфической нуклеотидной последовательности можно использовать известные технологии. Например, используя в качестве одного праймера полинуклеотид, включающий часть или всю специфическую нуклеотидную последовательность или полинуклеотид, включающий нуклеотидную последовательность, комплементарную специфической нуклеотидной последовательности, и используя в качестве другого праймера полинуклеотид, включающий часть или всю нуклеотидную последовательность выше или ниже по направлению от специфической нуклеотидной последовательности или полинуклеотид, включающий нуклеотидную последовательность, комплементарную указанной нуклеотидной последовательности выше или ниже по направлению, амплифицируют нуклеиновую кислоту липидпродуцирующего гриба посредством способа полимеразной цепной реакции (ПЦР), определяют наличие или отсутствие амплифицируемого продукта и определяют молекулярные массы любых таких продуктов. Количество нуклеотидов в полинуклеотидах, используемых в качестве праймеров, как правило, составляет, по меньшей мере, 10 пн, и предпочтительно от 15 до 25 пн. Количество нуклеотидов в части полинуклеотида между праймерами, как правило, должно быть от 300 до 2000 пн.
Условия реакции для ПЦР способа не являются предметом какого-либо конкретного ограничения. Например, можно использовать условия внутри следующих интервалов: температура денатурации от 90 до 98°C; температура отжига от 40 до 60°C; температура элонгации от 60 до 75°C; количество циклов 10 или более. Полученный в результате продукт реакции можно разделить с помощью такого способа, как агарозный электрофорез в геле, и можно определить молекулярные массы продукта амплификации. Применяя данный способ, рассчитывают и оценивают способность липидпродуцирующих грибов вырабатывать жирные кислоты на основании того, являются ли молекулярные массы продуктов амплификации достаточно большими, чтобы содержать молекулу ДНК в конкретном участке. Вышеуказанную способность можно еще более точно предсказать и оценить посредством анализа нуклеотидной последовательности продуктов амплификации.
Кроме того, в практическом осуществлении изобретения посредством культивирования тестируемых липидпродуцирующих грибов и измерения уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1, также возможно оценить способность образования жирных кислот тестируемых липидпродуцирующих грибов. Это может быть выполнено посредством культивирования тестируемых липидпродуцирующих грибов и количественного определения мРНК или белкового продукта гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO:1. Количественное определение мРНК или белка может быть выполнено с применением известных технологий. Например, мРНК можно количественно определить посредством нозерн-гибридизации или количественной ОТ-ПЦР, и белок можно количественно определить посредством вестерн-блоттинга (Current Protocols in Molecular Biology, John Wiley & Sons, 1994-2003).
Кроме того, пригодные липидпродуцирующие грибы можно выбирать посредством культивирования тестируемых липидпродуцирующих грибов, измерения уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1, и выбора тестируемых липид-продуцирующих грибов, имеющих уровень экспрессии гена синтетазы жирных кислот, который находится в соответствии с необходимой способностью образования жирных кислот. Альтернативно, можно культивировать контрольные липидпродуцирующие грибы и тестируемые липидпродуцирующие грибы, измерять уровень экспрессии гена в каждом липидпродуцирующем грибе, сравнивать уровни экспрессии контрольных липидпродуцирующих грибов и тестируемых липидпродуцирующих грибов и выбирать необходимый тестируемый липидпродуцирующий гриб. Конкретным образом, пригодные липидпродуцирующие грибы можно выбрать посредством культивирования контрольных липидпродуцирующих грибов и тестируемых липидпродуцирующих грибов, измерения уровней экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1 в каждом липидпродуцирующем грибе, и выбора тестируемого липидпродуцирующего гриба, который экспрессирует ген в более высокой степени, чем контрольные липидпродуцирующие грибы.
Альтернативно, необходимые липидпродуцирующие грибы можно выбрать посредством культивирования тестируемых липидпродуцирующих грибов и выбора липидпродуцирующего гриба, который имеет высокую или низкую способность образования жирных кислот или в котором ген синтетазы жирных кислот, содержащий нуклеотидную последовательность с позициями от 1 до 12486 SEQ ID NO:1, показывает высокую или низкую активность синтетазы жирных кислот. В подобных случаях липидпродуцирующие грибы, в которые введен вышеописанный вектор по изобретению, липидпродуцирующие грибы, в которых подавлена экспрессия вышеописанного полинуклеотида (ДНК) по изобретению, липидпродуцирующие грибы, которые были подвержены мутагенной обработке, и липидпродуцирующие грибы, которые мутировали спонтанно, можно использовать в качестве тестируемых липидпродуцирующих грибов или контрольных липидпродуцирующих грибов. Способность выработки жирных кислот можно измерять, используя способ количественного определения уровня жирных кислот внутри грибных клеток, и активность синтетазы жирных кислот можно измерять, используя способ, описанный в James K. Stoops et al.: J.B.C. 253, 4464-4475 (1978).
Таким образом, вследствие того что посредством изобретения можно оценить способность выработки жирных кислот липидпродуцирующими грибами (например, M. alpina) и выбрать необходимые липидпродуцирующие грибы (например, липидпродуцирующие грибы, имеющие высокую способность образования жирных кислот, или липидпродуцирующие грибы, имеющие высокое содержание жирных кислот на клетку), можно эффективно производить жиры и масла необходимой композиции.
Кроме того, уровень экспрессии гена синтетазы жирных кислот можно использовать в качестве индикатора для таких целей, как исследование условий культивирования для эффективного проведения производства жирных кислот и контроль процесса культивирования.
ПРИМЕРЫ
Примеры, представленные ниже, более полно описывают настоящее изобретение, но не предназначены для ограничения объема изобретения.
EST анализ
В 100 мл среды (1,8% глюкозы, 1% дрожжевого экстракта, pH 6,0) засевали штамм 1S-4 M. alpina и прекультивировали в течение 3 суток при 28°C. Следующим этапом, 5 литров среды (1,8% глюкозы, 1% соевого порошка, 0,1% оливкового масла, 0,01% адеканола, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O, pH 6,0) помещали в 10-литровый биореактор (Able Co., Токио), затем в него помещали весь объем вышеуказанной прекультуры и насыщали воздухом при перемешивании в течение 8 суток при 300 об/мин, 1 vvm и 26°C. Глюкозу в количествах, соответствующих 2%, 2% и 1,5%, добавляли в культуры на 1, 2 и 3 день культивирования соответственно. Клетки собирали на различных этапах на 1, 2, 3, 6 и 8 день культивирования и выделяли тотальную РНК посредством гуанидингидрохлоридного способа с CsCl. Для получения очищенной поли(A)+РНК из тотальной РНК использовали набор Oligotex-dT30 Super mRNA Purification Kit (Takara Bio). Библиотеку кДНК для каждого этапа конструировали с использованием набора ZAP-кДНК Gigapack III Gold Cloning Kit (Stratagene) и выполняли одностадийный анализ последовательности (8000 клонов × 5 этапов) с 5'-конца кДНК.
Поиск гомологов FAS
Нуклеотидную последовательность, полученную таким образом, искали в известных гомологичных генах синтетаз жирных кислот с помощью BLAST. В результате были обнаружены две нуклеотидных последовательности, имеющие максимально высокую гомологичность с частями α субъединицы синтетазы жирных кислот Schizosaccharomyces pombe (GB Accession № BAB62032; ген FAS2). Данные последовательности имели общие детали и, возможно, происходят от одного гена. Последовательность получили в результате совокупности совпадающих нуклеотидов от 12262 до 12920 на SEQ ID NO:1 (кДНК). Однако гомологов гена FAS1 обнаружить не удалось.
Получение частичной последовательности гомолога FAS1
Так как вышеуказанным анализом гомолог FAS1 не обнаружили, был выполнен сравнительный анализ известных аминокислотных последовательностей белка FAS1 (GB № P07149 от Saccharomyces cerevisiae; GB № P34731 от Candida albicans; GB № AAB41494 от Aspergillus nidulans) (фиг.1). На основании последовательностей (1) и (2) консервативного домена:
Последовательность (1): QGSQEQGMGM (SEQ ID NO:4)
Последовательность (2): ATQFRQPALT (SEQ ID NO:5),
были сконструированы следующие вырожденные праймеры:
F1h-f: CARGGNWSNCARGARCARGGNATGGGNATG (SEQ ID NO:6)
F1h-r: GTNARNGCNGGYTGNGTRAAYTGNGTNGC (SEQ ID NO:7).
кДНК M. alpina 1S-4 синтезировали из тотальной РНК, полученной посредством вышеописанного анализа EST, с использованием гексамерных рендом-праймеров и набора для ОТ-ПЦР SuperScript Fast Strand System (Invitrogen). Используя кДНК M. alpina 1S-4 в качестве матрицы, проводили 30 реакционных циклов ПЦР - каждый цикл состоял из 1 минуты при 94°C, 1 минуты при 50°C и 1 минуты при 72°C - с полимеразой ExTaq (Takara Bio), с образованием, таким образом, фрагментов ДНК длиной приблизительно 300 п.н. Полученные фрагменты ДНК клонировали TA-способом с помощью набора TA Cloning Kit (Invitrogen), и плазмиду, полученную таким образом, назвали pCR-MaFAS1-1. Затем определяли нуклеотидную последовательность. В этом месте посредством BLAST анализа выявлена высокая степень гомологии с частью β-субъединицы синтетазы жирных кислот.
Скрининг библиотеки кДНК
Из библиотеки кДНК следующим образом были отобраны гомологи FAS1 и гомологи FAS2. Для скрининга использовали систему DIG Labeling System (Roche). Используя плазмиду pCR-MaFAS1-1 в качестве матрицы, для гомологов FAS1 создали пробу, меченную DIG, с использованием праймера F1-1f: 5'-GCTCTGTATGACTCTTCCCCC-3' (SEQ ID NO:8) и праймера F1-1r: 5'-GCCAAAAGACCGTTGGGTGAC-3' (SEQ ID NO:9).
Пробу для гомологов FAS2 создали, используя кДНК штамма 1S-4 M. Alpina в качестве матрицы, и с праймерами F2-1f: 5'-GGTGCAGGAGCGGGACTGAGTG-3' (SEQ ID NO:10) и F2-1r: 5'-CGCATTTGCAACCGCAACCGCG-3' (SEQ ID NO:11) посредством проведения 30 циклов реакции - каждый цикл состоял из 1 минуты при 94°C, 1 минуты при 55°C и 1 минуты при 72°C - с полимеразой ExTaq (Takara Bio). Полученные фрагменты ДНК длиной приблизительно 170 п.н. клонировали ТА-способом с помощью набора TOPO-TA Cloning Kit (Invitrogen), и плазмиду, полученную в результате, назвали pCR-MaFAS2-1. Пробу, меченную DIG, создавали с помощью ПЦР с использованием в качестве матрицы плазмиду pCR-MaFAS2-1 и праймеров F2-1f и F2-1r.
С использованием данных проб проводили скрининг кДНК библиотеки. С пробой для гомологов FAS1 положительные клоны не были получены.
Однако при использовании пробы для гомологов FAS2 удалось получить несколько положительных клонов. Наиболее большой клон включал последовательность, которая соответствовала нуклеотидам от 7861 до 12920 (5060 п.н.) SEQ ID NO:1 (кДНК). Данный клон назвали как плазмиду pBSMAFAS2-1. Однако при сравнении с известным геном FAS2 было обнаружено, что он не включал полноразмерный ген.
Создание геномной библиотеки
Штамм 1S-4 M. alpina засевали в 100 мл жидкой среды (1% глюкозы, 0,5% дрожжевого экстракта, pH 6,0) и культивировали при встряхивании при 28°C в течение 4 суток. Клетки собирали посредством фильтрации с использованием фильтра и выделяли геномную ДНК с помощью CTAB способа.
Полученную таким образом геномную ДНК (приблизительно 200 мкг) частично разрезали с помощью фермента рестрикции Sau3AI таким образом, чтобы разрезанные фрагменты ДНК в основной массе были близки по длине к 20 т.п.н. Полученные в результате фрагменты ДНК центрифугировали в градиенте плотности сахарозы от 10% до 40% (ротор, SW28 (Beckman), 25000 об/мин, 10°C, 24 часа) и разделяли с использованием Automatic Liquid Charger (Advantec) и Micro Tube Pump (Eyela) на фракции по 1 мл. Фракции, близкие по длине к 20 т.п.н., очищали. Из полученных таким образом фрагментов ДНК получали геномную библиотеку с использованием набора λBlueSTAR/BamHI Vector Kit (Novagen).
Скрининг геномной библиотеки
Гомологи FAS1 и гомологи FAS2 отбирали из геномной библиотеки тем же способом, что и в вышеприведенном примере (скрининг кДНК библиотеки). Как результат были получены клоны, которые были положительны как с пробой для FAS1 гомологов, так и с пробой для FAS2 гомологов. Часть нуклеотидной последовательности вставки для данного клона (15539 п.н. SEQ ID NO:2 (генома)) была секвенирована.
При сравнении аминокислотных последовательностей известных FAS1 белка и FAS2 белка предположили, что нуклеотиды от 1062 до 1064 (ATG) SEQ ID NO:2 (генома) действуют как инициирующий кодон. Также было сделано заключение, что гомологи FAS1 и гомологи FAS2 кодируют один полипептид.
Клонирование полноразмерной кДНК
В первую очередь, используя в качестве матрицы кДНК штамма 1S-4 M. Alpina, праймер F1-2f: ATGACTACCGCACAGTCCAACTTGACC (SEQ ID NO:12) и праймер F1-1r, проводили 30 циклов ПЦР - каждый цикл состоял из 10 секунд при 98°C и 15 минут при 68°C с использованием LATaq (Takara Bio). Полученный в результате фрагмент ДНК приблизительно в 5,4 т.п.н. клонировали с использованием набора TOPO-TA Cloning Kit (Invitrogen) с получением плазмиды под названием pCR-MAFAS-1. Нуклеотидную последовательность вставки проверили и обнаружили соответствие нуклеотидам от 1 до 5435 SEQ ID NO:1 (кДНК). ДНК разрезали с помощью фермента рестрикции EcoRI, и полученный фрагмент в 5,4 т.п.н. лигировали с сайтом EcoRI вектора pBluescriptII SK+. Был выбран продукт, в котором нуклеотид № 1 SEQ ID NO:1 (кДНК) находился со стороны SacI поликлонального сайта в векторе pBluescriptII SK+. Полученную в результате плазмиду назвали pBS-MAFAS-1.
Следующим этапом фрагмент ДНК длиной 2 т.п.н., полученный посредством рестрикции плазмиды pBS-MAFAS2-1 с ферментами рестрикции ApaI и EcoRV, присоединяли к сайтам ApaI и EcoRV вектора pBluescript II SK+. Полученную в результате плазмиду назвали pBS-FAS-2. Далее, используя в качестве матрицы кДНК штамма 1S-4 M. Alpina, праймер F1-3f: TGTCTTGAAGAGCAAGGAGTGG (SEQ ID NO:13) и праймер F2-2r: GCGTAGTAGTCGCCGTGCTCAGCCATC (SEQ ID NO:14), проводили десять циклов реакции - каждый цикл состоял из 2 минут при 92°C, за которыми следовали 10 секунд при 92°C, 30 секунд при 55°C и 8 минут при 68°C, затем двадцать циклов реакции - каждый цикл состоял из 10 секунд при 92°C, 30 секунд при 55°C и 8 минут плюс 10 секунд при 68°C, с использованием ДНК полимеразы Pfu Turbo (Stratagene). Полученный в результате фрагмент ДНК приблизительно в 3,6 т.п.н. клонировали в вектор pCR4 Blunt-TOPO с использованием набора Zero Blunt TOPO PCR Cloning Kit (Invitrogen) и полученную в результате плазмиду назвали pCR-MAFAS-5. Фрагмент ДНК длиной 3,1 т.п.н., полученный посредством рестрикции плазмиды pCR-MAFAS-5 с помощью ферментов рестрикции EcoRV и SpeI, лигировали с фрагментом ДНК длиной 4,9 т.п.н., полученным посредством рестрикции плазмиды pBS-MAFAS-2 с помощью ферментов рестрикции EcoRV и SpeI. Полученную в результате плазмиду назвали pBS-MAFAS-3.
Кроме того, фрагмент ДНК длиной 2,6 т.п.н., полученный посредством рестрикции pBS-MAFAS2-1 с помощью фермента рестрикции EcoRV, лигировали с фрагментом ДНК, полученным посредством рестрикции плазмиды pBS-MAFAS-3 с помощью фермента рестрикции EcoRV. Подтвердили, что встроенный фрагмент ДНК ориентирован в правильном направлении с получением, таким образом, плазмиды pBS-MaFAS.
Плазмида pBS-MaFAS включала ДНК, имеющую нуклеотидную последовательность SEQ ID NO:1, и, как предполагали, включала полную длину кДНК гомолога FAS от M. alpina 1S-4. CDS являлась последовательностью нуклеотидов от 1 до 12489, и ORF являлась последовательностью нуклеотидов от 1 до 12486 SEQ ID NO:1. Чистая аминокислотная последовательность представлена в SEQ ID NO:3 (белок).
Аминокислотная последовательность при сравнении с известными генами синтетаз жирных кислот обладала структурой синтетаз жирных кислот известных грибов, в которых β и α- субъединицы связаны по типу голова-к-хвосту. Однако степень гомологии с I типом синтетаз жирных кислот бактериального происхождения, для которых показана сходная структура, была низкой. При сравнении аминокислотной последовательности данного белка с аминокислотными последовательностями синтетаз жирных кислот, полученных от грибов, в которых β-субъединица и α- субъединица объединены, сходство было приблизительно 50%. В нем было два повтора мотива, состоявшего из 165 аминокислот, представляющего собой часть консервативной последовательности (COG4982) 3-оксоацил-[ацил-белка-носителя].
Кроме того, при сравнении геномной последовательности, полученной ранее, данный ген имел 7 интронов. В SEQ ID NO:2, было 8 экзонов: нуклеотиды от 1062 до 1304, нуклеотиды от 2140 до 2679, нуклеотиды от 2778 до 4724, нуклеотиды от 4823 до 7027, нуклеотиды от 7115 до 7243, нуклеотиды от 7339 до 7497, нуклеотиды от 7582 до 10668 и нуклеотиды от 10772 до 14947; и 7 интронов: нуклеотиды от 1305 до 2139, нуклеотиды от 2680 до 2777, нуклеотиды от 4725 до 4822, нуклеотиды от 7028 до 7114, нуклеотиды от 7244 до 7338, нуклеотиды от 7498 до 7581, и нуклеотиды от 10669 до 10771.
Конструкция экспрессирующего вектора для дрожжей Saccharomyces cerevisiae
Плазмиду pBS-MaFAS расщепляли с помощью фермента рестрикции ApaI и затем достраивали "липкие концы" с помощью набора ДНК Blunting Kit (Takara Bio). Далее выполняли рестрикцию с ферментом рестрикции EcoRI, с образованием фрагмента ДНК длиной приблизительно 13 т.п.н. Данный фрагмент ДНК расщепляли ферментом рестрикции BamHI, затем достраивали "липкие концы" и впоследствии лигировали с вектором pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995), расщепленным ферментом рестрикции EcoRI, конструируя, таким образом, плазмиду pYE-MaFAS.
Анализ жирных кислот в высокоэкспрессирующих дрожжах MaFAS
Два штамма, выбранных случайно среди трансформантов, полученных посредством трансформации дрожжевого штамма S. cerevisiae EH1315 (Appl. Microbiol. Biotechnol., 30, 515-520, 1989) плазмидой pYE-MaFAS, были названы штаммом MaFAS-1 и штаммом MaFAS-2. Кроме того, один штамм, выбранный случайно среди трансформантов, полученных посредством трансформации дрожжевого штамма S. cerevisiae EH1315 вектором pYE22m, использовали в качестве контроля (штамм C-1). Одну платиновую петлю каждого из данных штаммов засевали в 10 мл жидкой среды SC-Trp или в 10 мл жидкой среды YPD и культивировали при 30°C в течение 2 суток. Затем клетки собирали посредством разделения методом центрифугирования и лиофилизировали. Жирные кислоты в клетках были преобразованы в их метильные эфиры посредством способа с применением соляной кислоты и метанола и выделены с гексаном. Затем гексан отобрали и выполнили газохроматографический анализ. Результаты представлены в таблице 1.
Состав жирных кислот дрожжевых клеток, выращенных в различных средах
кислот (%)
В штамме C-1 соотношение 18-углеродных жирных кислот стеариновой кислоты и олеиновой кислоты было выше, чем соотношение 16-углеродных жирных кислот, тогда как соотношение 16-углеродных жирных кислот пальмитиновой кислоты и пальмитолеиновой кислоты было выше в штамме MaFAS-1 и штамме MaFAS-2, которые имели высокую экспрессию MaFAS.
Конструкция экспрессирующего вектора в липидпродуцирующих грибах Mortierella alpina
Плазмиду pBlueHpt (опубликованное издание Японии № 2005-287403) расщепляли с помощью NcoI и BamHI, и затем MCS1-F и MCS1-R, в которых 5'-конец был фосфорилирован, соединяли и вставляли в плазмиду с образованием плазмиды pBlueHptMCS.
MCS1-F:5'-catggatcctctagactgcaggcatgcaagcttctcga (SEQ ID NO:15)
MCS1-R:5'-ctaggagatctgacgtccgtacgttcgaagagctctag (SEQ ID NO:16)
Плазмиду pDura5 (Appl. Microbiol. Biotechnol., 65, 419-425, (2004)) расщепляли ферментом рестрикции BamHI и затем достраивали "липкие концы", после чего проводили полулигирование. Затем полученную плазмиду расщепляли ферментом рестрикции XbaI и затем достраивали "липкие концы", после чего проводили полулигирование. Далее полученную плазмиду расщепляли ферментом рестрикции HindIII и затем достраивали "липкие концы", после чего проводили полулигирование. После рестрикции полученной плазмиды с помощью EcoRI, вставляли фрагмент, имеющий длину приблизительно 1,7 т.п.н., полученный посредством рестрикции плазмиды pBlueHptMCS с помощью EcoRI. Выбирали плазмиду, имеющую промотор гена гистона H4.1, вставленную в той же ориентации, и обозначали ее, как плазмидный вектор pDura5MCS.
Плазмиду pBS-MaFAS расщепляли ферментом рестрикции ApaI и затем достраивали "липкие концы" с использованием набора DNA Blunting Kit (Takara Bio). Затем продукт расщепляли ферментом рестрикции XbaI с получением фрагмента ДНК приблизительно 13 т.п.н. Данный фрагмент ДНК расщепляли ферментом рестрикции HindIII, затем достраивали "липкие концы", после чего лигировали его с вектором pDura5MCS, расщепленным ферментом рестрикции XbaI, конструируя, таким образом, плазмиду pDura5-MaFAS.
Трансформация липидпродуцирующих грибов M. alpina
Используя плазмиду pDura5-MaFAS, выполняли трансформацию посредством способа бомбардировки частицами с применением в качестве клетки-хозяина штамма Δura-3, нуждающегося в урациле, полученного из M. alpina в соответствии со способом патентного документа (способ селекции липидпродуцирующих грибов). Для селекции трансформантов использовали SC среду с агаром (0,5% азотистые основания дрожжей, аминокислоты и сульфат аммония (Difco), 0,17% сульфат аммония, 2% глюкоза, 0,002% аденин, 0,003% тирозин, 0,0001% метионин, 0,0002% аргинин, 0,0002% гистидин, 0,0004% лизин, 0,0004% триптофан, 0,0005% треонин, 0,0006% изолейцин, 0,0006% лейцин, 0,0006% фенилаланин, 2% агар).
Два из полученных трансформанта обозначили как FAS-3 штамм и FAS-4 штамм. Один случайно выбранный штамм, в который был введен pDura5, обозначили как C-2 штамм. Данные штаммы засевали в жидкую среду, содержащую 2% глюкозу и 1% дрожжевой экстракт, и культивировали при встряхивании при 28°C. На 3 сутки культивирования добавляли 20% раствор глюкозы в количестве, соответствующем 1/20-й жидкой культуры. На 4 сутки некоторые из клеток собирали и лиофилизировали. Жирные кислоты из клеток были преобразованы в соответствующие метильные эфиры, затем выделены с гексаном. Гексан отобрали и выполнили газохроматографический анализ, таким образом, определяя количественное содержание жирных кислот на клетку. Результаты представлены в таблице 2.
Содержание жирных кислот (%) на клетку
При сравнении со штаммом C-2, количество жирных кислот на клетку было увеличено в штаммах FAS-3 и FAS-4.
Применимость в производственных условиях
Настоящее изобретение применяется для повышения продуктивности жирных кислот, для производства необходимых жирных кислот и/или для производства любого из нижеперечисленного, которое содержит необходимые жирные кислоты: пищевые продукты, косметику, препараты для наружного кожного применения и/или мыла.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ГОМОЛОГ АЦИЛ-СОА-СИНТЕТАЗЫ, И ЕГО ПРИМЕНЕНИЕ | 2011 |
|
RU2528248C2 |
| НОВЫЕ ГЕНЫ АТФ:ЦИТРАТЛИАЗЫ | 2008 |
|
RU2534560C2 |
| ГОМОЛОГИ ФОСФАТАЗЫ ФОСФАТИДНОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2507264C2 |
| БЕЛОК, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ СТИМУЛЯЦИИ ЭЛОНГАЦИИ ЦЕПЕЙ ЖИРНЫХ КИСЛОТ, КОДИРУЮЩИЙ ЕГО ГЕН И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2556375C1 |
| НОВАЯ ЛИЗОФОСФОЛИПИД-АЦИЛТРАНСФЕРАЗА | 2010 |
|
RU2534559C2 |
| НОВАЯ АЦЕТИЛ-COA-КАРБОКСИЛАЗА | 2010 |
|
RU2551779C2 |
| НОВЫЕ ГЕНЫ АЦИЛТРАНСФЕРАЗЫ ЛИЗОФОСФАТИДНОЙ КИСЛОТЫ | 2008 |
|
RU2507263C2 |
| КОМПОЗИЦИИ ЖИРНЫХ КИСЛОТ, ИМЕЮЩИЕ НОВУЮ ПРОПОРЦИЮ ЖИРНЫХ КИСЛОТ | 2008 |
|
RU2496881C2 |
| ГЛИЦЕРОЛ-3-ФОСФАТАЦИЛТРАНСФЕРАЗА | 2010 |
|
RU2499835C1 |
| ГЕНЫ ДИАЦИЛГЛИЦЕРОЛ-АЦИЛТРАНСФЕРАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2010 |
|
RU2514655C2 |
































Изобретение относится к области биохимии. Описана синтетаза жирных кислот с последовательностью, приведенной в описании. Определена последовательность полинуклеотида, кодирующая указанную синтетазу. Представлен вектор, содержащий указанный полинуклеотид. Кроме того, описан трансформированный микробный организм, содержащий указанный вектор или полинуклеотид. Трансформированный микробный организм используется для продуцирования жирных кислот. Предложен способ получения липида или жирной кислоты, включающий культивирование клеток трансформанта с последующим выделением липида или жирной кислоты из указанных клеток. Описан способ оценки способности образования жирных кислот, основанный на измерении уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность указанного полинуклеотида. Также представлен способ селекции микробных липидпродуцирующих организмов, в основе которого лежит сравнение уровней экспрессии указанного гена в контрольном и тестируемом микробном организме. Изобретение позволяет получить жирные кислоты с высоким выходом продукта. 9 н. и 8 з.п. ф-лы, 5 ил., 2 табл.
1. Полинуклеотид, выбранный из любого из следующих от (a) до (f), который подлежит использованию для экспрессии синтетазы жирных кислот:
(a) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO: 1;
(b) полинуклеотид, включающий полинуклеотид, состоящий из нуклеотидной последовательности SEQ ID NO: 2 или ее части, которая кодирует функциональную часть синтетазы жирных кислот;
(c) полинуклеотид, включающий полинуклеотид, кодирующий белок, имеющий аминокислотную последовательность SEQ ID NO: 3;
(d) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO: 1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(e) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 2 или ее части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; и
(f) полинуклеотид, включающий полинуклеотид, который гибридизуется при строгих условиях с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO: 3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
2. Полинуклеотид по п.1, который выбран из любого из следующих от (g) до (k):
(g) полинуклеотид, включающий полинуклеотид, кодирующий белок, который состоит из аминокислотной последовательности SEQ ID NO: 3, в которой от одной до десяти аминокислот делегированы, замещены, встроены и/или добавлены, и который обладает активностью синтетазы жирных кислот;
(h) полинуклеотид, включающий полинуклеотид, кодирующий белок, обладающий идентичностью 90% или более с аминокислотной последовательностью SEQ ID NO: 3, и который обладает активностью синтетазы жирных кислот;
(i) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO: 1, и который кодирует белок, обладающий активностью синтетазы жирных кислот;
(j) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности SEQ ID NO: 2 или ее части, и который кодирует белок, обладающий активностью синтетазы жирных кислот; и
(k) полинуклеотид, включающий полинуклеотид, который гибридизуется при условиях высокой строгости с полинуклеотидом, состоящим из нуклеотидной последовательности, комплементарной нуклеотидной последовательности полинуклеотида, кодирующего белок, состоящий из аминокислотной последовательности SEQ ID NO: 3, и который кодирует белок, обладающий активностью синтетазы жирных кислот.
3. Полинуклеотид по п.1, включающий полинуклеотид, который состоит из нуклеотидной последовательности с положениями от 1 до 12486 SEQ ID NO: 1.
4. Полинуклеотид по п.1, включающий полинуклеотид, который состоит из нуклеотидной последовательности SEQ ID NO: 2.
5. Полинуклеотид по п.1, включающий полинуклеотид, который кодирует белок, состоящий из аминокислотной последовательности SEQ ID NO: 3.
6. Полинуклеотид по любому из пп.1-5, который представляет собой ДНК.
7. Белок, кодируемый полинуклеотидом по любому из пп.1-6, который используется для синтеза жирной кислоты.
8. Вектор, включающий полинуклеотид по любому из пп.1-6, который используется для экспрессии синтетазы жирных кислот.
9. Трансформированный микробный организм, имеющий внедренный в него полинуклеотид по любому из пп.1-6, который используется для получения жирных кислот.
10. Трансформированный микробный организм, имеющий внедренный в него вектор по п.8, который используется для получения жирных кислот.
11. Трансформированный микробный организм по п.10, обладающий увеличенной способностью образования 14-и углеродных и 16-и углеродных жирных кислот благодаря внедрению вектора по п.8.
12. Трансформированный микробный организм по любому из пп.9-11, где организм является грибом, продуцирующим жирные кислоты.
13. Трансформированный микробный организм по п.12, где грибом, продуцирующим жирные кислоты, является Mortierella alpina.
14. Способ получения липида или жирной кислоты, включающий:
культивирование клеток трансформированного организма по любому из пп.9-13;
сбор культивированных клеток; и
выделение липида или жирной кислоты из собранных клеток.
15. Способ оценки способности образования жирных кислот тестируемыми липид-продуцирующими грибами, включающий:
культивирование тестируемых липид-продуцирующих грибов; и измерение уровня экспрессии гена синтетазы жирных кислот с использованием праймера или зонда, сконструированных на основе нуклеотидной последовательности гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO: 1.
16. Способ оценки способности образования жирных кислот тестируемыми липид-продуцирующими грибами, включающий:
культивирование тестируемых липид-продуцирующих грибов и измерение уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO: 1.
17. Способ селекции липид-продуцирующих грибов, включающий:
культивирование контрольных липид-продуцирующих грибов и тестируемых липид-продуцирующих грибов, измерение уровня экспрессии гена синтетазы жирных кислот, имеющего нуклеотидную последовательность с положениями от 1 до 12486 SEQ ID NO: 1 в каждом липид-продуцирующем грибе, и отбор тестируемого липид-продуцирующего гриба, который экспрессирует ген в более высокой степени, чем контрольные липид-продуцирующие грибы.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| SINGH N et al | |||
| Yeast fatty acid synthase: structure to function relationship | |||
| Biochemistry, 1985 Nov 5; 24(23):6598-602, abstract | |||
| КОЛЬМАН Я., РЕМ К.Г | |||
| Наглядная биохимия | |||
| / Под ред | |||
| к.х.н | |||
| Решетова П.Д | |||
| и др | |||
| - М.: Мир, 2000. | |||
Авторы
Даты
2012-03-10—Публикация
2007-05-08—Подача